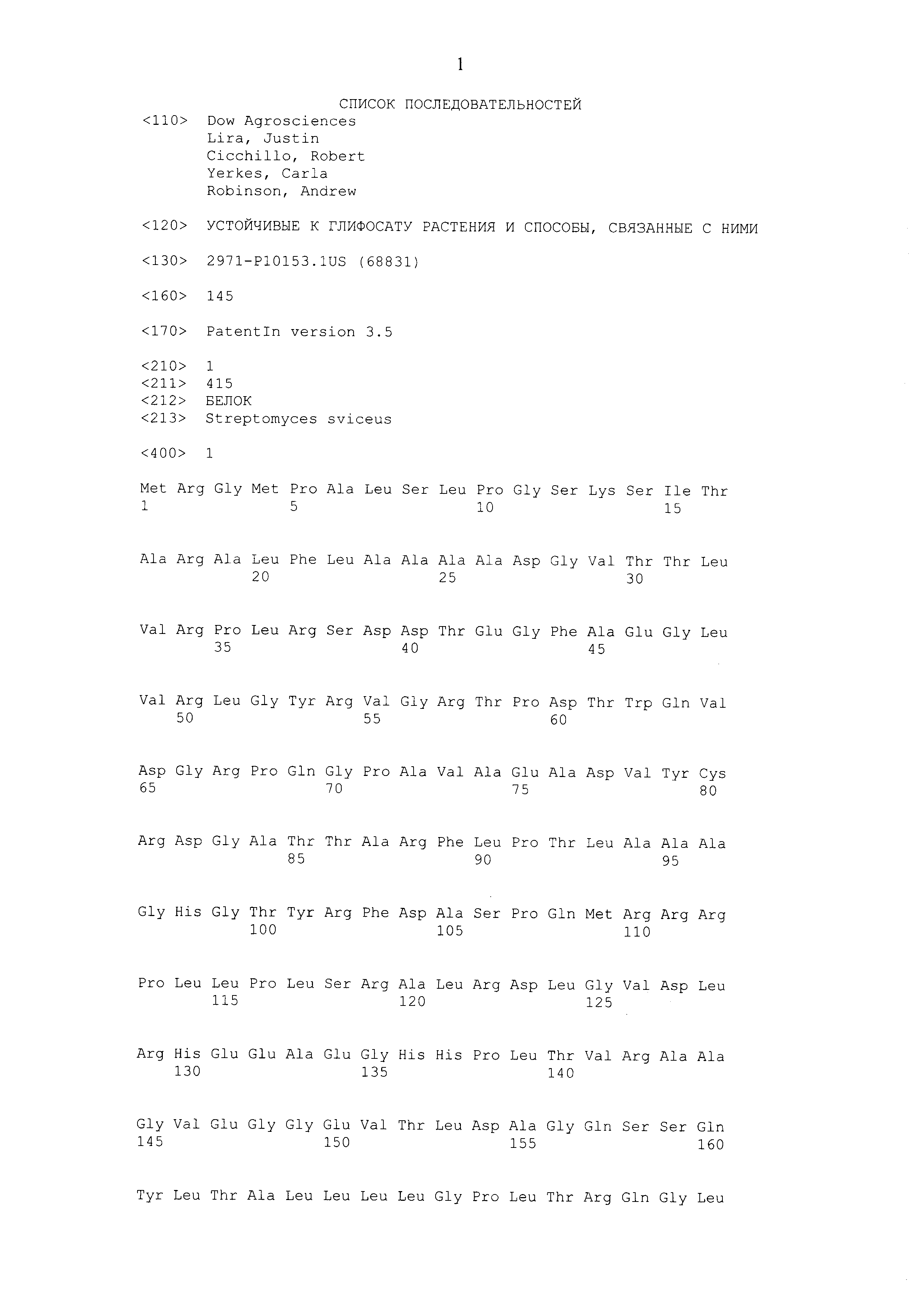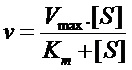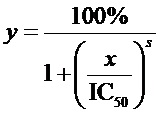Результат интеллектуальной деятельности: УСТОЙЧИВЫЕ К ГЛИФОСАТУ РАСТЕНИЯ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ
Вид РИД
Изобретение
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по временной патентной заявке США с серийным номером № 61/593555, поданной 1 февраля 2012 года, и также по временной патентной заявке США с серийным номером № 61/625222, поданной 17 апреля 2012 года.
ПОЛОЖЕНИЕ В СООТВЕТСТВИИ С 37 C.F.R. § 1.821(c) или (e) - СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДОСТАВЛЕННЫЙ В КАЧЕСТВЕ ТЕКСТОВОГО ФАЙЛА ASCII
В соответствии с 37 C.F.R. § 1.821(c) или (e), файл, содержащий текстовую версию ASCII списка последовательностей, предоставлен совместно с настоящей заявкой.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к биотехнологии растений. Конкретные варианты осуществления относятся к новым полипептидам, вовлеченным в метаболизм N-(фосфонометил)глицина и к нуклеиновым кислотам, кодирующим такие полипептиды. Конкретные варианты осуществления относятся к растениям, частям растений и клеткам растений, которые содержат указанные выше полипептиды и/или нуклеиновые кислоты.
УРОВЕНЬ ТЕХНИКИ
Виды сорных растений давно являются проблемой на возделываемых полях. Хотя борьба с сорняками может быть трудоемкой работой, она упростилась благодаря доступности эффективных уничтожающих сорняки химических гербицидов. Повсеместное применение гербицидов, совместно с усовершенствованными сортами сельскохозяйственных растений и удобрениями для них, внесло значительный вклад в "зеленую революцию" в сельском хозяйстве. В частности, пригодными являются гербициды, которые обладают широким спектром гербицидной активности. К сожалению, гербициды широкого спектра, как правило, обладают вредоносным эффектом на сельскохозяйственные культуры, подвергнутые воздействию гербицида. Одним способом преодоления этой проблемы является получение сельскохозяйственных культур, устойчивых к гербициду широкого спектра.
Одним примером гербицида широкого спектра является N-фосфонометилглицин, также известный как глифосат. Глифосат широко используется фермерами по всему миру для борьбы с сорняками перед посевом культуры, например, при нулевой обработке почвы. Кроме того, глифосат является эффективным средством для борьбы с сорняками и самосевными растениями между циклами производства или чередованием культур. Глифосат не переносится в почву после применения и он повсеместно считается одним из наиболее безопасных для окружающей среды и широкоэффективных химических гербицидов, доступных для применения в сельском хозяйстве.
Глифосат уничтожает растения путем ингибирования каскада шикимовой кислоты. Этот каскад приводит к биосинтезу ароматических соединений, включая аминокислоты, витамины и гормоны растений. Глифосат блокирует конденсацию фосфоенолпировиноградной кислоты (PEP) и 3-фосфошикимовой кислоты в 5-енолпирувил-3-фосфошикимовую кислоту путем связывания и ингибирования активности фермента 5-енолпирувилшикимат-3-фосфатсинтазы, обычно обозначаемой как "EPSP-синтаза" и "EPSPS".
К сожалению, неизвестны сельскохозяйственные культуры, которые естественным образом устойчивы к глифосату, и, таким образом, применимость этого гербицида для борьбы с сорняками в сельскохозяйственных культурах ограничена. Одним из способов получения устойчивых к глифосату сельскохозяйственных культур является введение гена, кодирующего гетерологичную устойчивую к глифосату форму гена EPSPS, в культурное растение с использованием способов генной инженерии. С использованием химического мутагенеза были получены устойчивые к глифосату формы EPSPS в бактериях, и гетерологичные гены были введены в растения с получением устойчивых к глифосату растений. См., например, Comai et al. (1983) Science 221:370-71. Гетерологичные гены EPSPS можно сверхэкспрессировать в сельскохозяйственных культурах с получением желаемого уровня устойчивости.
Указанные выше примеры из уровня техники и ограничения, связанные с ними, являются иллюстративными, но не исключающими. Другие ограничения уровня техники станут понятными специалистам в данной области при прочтении описания.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем описании описаны выделенные полипептиды, обладающие по меньшей мере 90% идентичностью с SEQ ID NO: 1, и нуклеиновые кислоты, кодирующие полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1 (например, SEQ ID NO: 2-4). Также описаны растения, части растений, органы растений, семена растений и клетки растений, содержащие гетерологичный полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1.
Некоторые варианты осуществления включают растение, часть растения, орган растения, семя растения и/или клетку растения, содержащие гетерологичную нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1. В конкретных примерах гетерологичная нуклеиновая кислота содержит нуклеотидную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с SEQ ID NO: 2 или SEQ ID NO: 3. Некоторые варианты осуществления включают растение, часть растения, орган растения, семя растения и/или клетку растения, содержащие гетерологичную нуклеиновую кислоту, которая гибридизуется с другой нуклеиновой кислотой, обладающей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости. В конкретных примерах растение, часть растения, орган растения, семя растения и/или клетка растения, содержащие гетерологичную нуклеиновую кислоту, которая гибридизуется с другой нуклеиновой кислотой, имеющей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости, содержит полипептид, кодируемый гетерологичной нуклеиновой кислотой, которая сообщает устойчивость к глифосату (или увеличивает устойчивость к глифосату) растению, части растения, органу растения, семени растения и/или клетке растения.
В следующих вариантах осуществления изобретение относится к способам получения растения, части растения, органа растения, семени растения и/или клетки растения, которые являются устойчивыми к глифосату, включающим: трансформацию растения, части растения, органа растения, семени растения и/или клетки растения нуклеиновой кислотой, кодирующей полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1; и экспрессию нуклеиновой кислоты так, чтобы получить полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1.
Другие варианты осуществления включают векторы, содержащие нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1. Конкретные примеры включают векторы, содержащие нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 95% идентичностью с SEQ ID NO: 1. Например, вектор может содержать последовательность нуклеиновой кислоты, обладающую по меньшей мере 90% идентичности с SEQ ID NO: 2 или SEQ ID NO: 3.
Конкретные варианты осуществления включают устойчивые к глифосату растения и клетки растений, экспрессирующие гетерологичный полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1.
Дополнительные варианты осуществления включают способы борьбы с сорняками на поле или возделываемой посевной площади с устойчивыми к глифосату растениями, где такой способ может включать: посев растения или семени растения, содержащих нуклеиновую кислоту, кодирующую гетерологичный полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, на поле или возделываемой посевной площади; и внесение на поле или возделываемую посевную площадь достаточного количества глифосата для борьбы с сорняками на поле без существенного повреждения растения.
В некоторых вариантах осуществления изобретение относится к способным к регенерации клеткам для применения в тканевой культуре растений, устойчивых к глифосату. Такая тканевая культура может быть способна регенерировать растения, обладающие физиологическими и морфологическими характеристиками указанных выше устойчивых к глифосату растений, а также регенерировать растения, имеющие по существу тот же генотип, что и у устойчивых к глифосату растений. Способные к регенерации клетки в таких тканевых культурах могут представлять собой, например, зародыши, протопласты, клетки меристемы, каллюс, пыльцу, листья, пыльники, корни, корневые кончики, цветки, семена, стручки и стебли. Конкретные варианты осуществления относятся к растениям, способным регенерировать из тканевой культуры в соответствии с вышеуказанным.
В некоторых вариантах осуществления изобретение относится к клеткам, которые не регенерируют с образованием растений, например, для применения для получения линий клеток растений, устойчивых к глифосату. В других вариантах осуществления изобретение относится к растениям, частично содержащим такие клетки.
В определенных вариантах осуществления настоящее изобретение относится к применению множества гербицидов к сельскохозяйственным культурам, посеянным на возделываемой посевной площади. Поверхностное внесение глифосата в дополнение к нескольким гербицидам обладает преимуществом, состоящим в различных гербицидных свойствах, так что обеспечивается борьба с сорняками с усовершенствованной комбинацией универсальности и экономичности. Например, отдельные гербициды могут иметь различный срок действия на возделываемой посевной площади; т.е. некоторые гербициды могут оставаться и быть эффективными в течение относительно длительного периода времени после их внесения на площадь, в то время как другие гербициды могут быстро разлагаться на другие и/или неактивные соединения. Усовершенствованная система использования гербицидов в соответствии с конкретными вариантами осуществления позволяет использовать глифосат и несколько гербицидов так, чтобы растениевод мог адаптировать выбор конкретных гербицидов для применения в конкретной ситуации.
В других вариантах осуществления настоящее изобретение относится к способам и композициям для получения и применения растения, которое является устойчивым более чем к одному гербициду или классу или подклассу гербицидов, как описано ниже. В конкретных вариантах осуществления предусматривается растение, которое является устойчивым как к глифосату, так и по меньшей мере к одному другому гербициду (или классу или подклассу гербицидов) или химическому реагенту (или классу или подклассу химических реагентов) (например, фунгициды, инсектициды, регуляторы роста растений и т.п.). Такие растения могут быть применимы, например, в способах, включающих обработку сельскохозяйственных культур несколькими гербицидами. Таким образом, изобретение относится к устойчивым к гербицидам растениям, которые выдерживают обработку гербицидом или комбинацией гербицидов (включая комбинацию гербицидов, каждый из которых действует посредством отличающегося механизма гербицидной активности) или которые выдерживают обработку комбинацией по меньшей мере одного гербицида и по меньшей мере одного другого химического реагента. Таким образом, в настоящем описании описаны усовершенствованные способы выращивания сельскохозяйственных культур, в которых осуществляется селективная борьба с сорняками.
Устойчивое к гербицидам растение в соответствии с некоторыми вариантами осуществления может включать молекулу нуклеиновой кислоты, которая кодирует гетерологичный полипептид, который сообщает устойчивость к глифосату, и молекулу нуклеиновой кислоты, кодирующую полипептид, который сообщает устойчивость к 2,4-дихлорфеноксиуксусной кислоте (2,4-D). В соответствии с представленными выше абзацами, предусматриваются растения, которые содержат по меньшей мере третью молекулу нуклеиновой кислоты, кодирующую полипептид, сообщающий растению признак, выбранный из группы, состоящей из признака устойчивости к гербицидам; признака устойчивости к насекомым; агрономического признака; признака устойчивости к заболеванию; признака модифицированной жирной кислоты; и признака сниженного содержания фитатов.
В некоторых примерах устойчивое к гербицидам растение содержит гетерологичную молекулу нуклеиновой кислоты, кодирующую полипептид, который сообщает устойчивость к глифосату, и молекулу нуклеиновой кислоты, кодирующую полипептид, который сообщает устойчивость к глюфосинату. Некоторые примеры включают устойчивое к гербицидам растение, содержащее молекулу нуклеиновой кислоты, кодирующую полипептид, сообщающий растению признак, выбранный из группы, состоящей из признака устойчивости к гербицидам; признака устойчивости к насекомым; агрономического признака; признака устойчивости к заболеванию; признака модифицированной жирной кислоты; и признака сниженного содержания фитатов.
В конкретных примерах устойчивое к гербицидам растение содержит гетерологичную молекулу нуклеиновой кислоты, кодирующую полипептид, который сообщает устойчивость к глифосату, и молекулу нуклеиновой кислоты, кодирующую полипептид, который сообщает устойчивость к гербициду, который ингибирует ацетолактатсинтазу (ALS) (Lee et al. (1988) EMBO J. 7:1241), также известный как фермент синтаза ацетогидроксикислот (AHAS) фермент (Miki et al. (1990) Theor. Appl. Genet. 80:449). Некоторые примеры включают устойчивое к гербицидам растение, содержащее молекулу нуклеиновой кислоты, кодирующую полипептид, сообщающий растению признак, выбранный из группы, состоящей из признака устойчивости к гербицидам; признака устойчивости к насекомым; агрономического признака; признака устойчивости к заболеванию; признака модифицированной жирной кислоты; и признака сниженного содержания фитатов.
В некоторых вариантах осуществления нуклеиновую кислоту можно комбинировать (или "пакетировать") в растении с любой молекулой нуклеиновой кислоты, например, но не ограничиваясь этим, для обеспечения дополнительной устойчивости к глифосату или другому гербициду, для обеспечения устойчивости к отдельным насекомым или заболеваниям, для обеспечения улучшения питания, для обеспечения улучшенных агрономических характеристик и для обеспечения белка или другого продукта, пригодного в кормах, продуктах питания, в промышленных способах применения, фармацевтических способах применения и/или в других применениях. Примеры включают пакетирование двух или более представляющих интерес нуклеиновых кислот в геноме растения. Такое "пакетирование генов" можно осуществлять посредством общепринятого разведения растений с использованием двух или более трансгенных объектов, трансформации растения конструкцией, которая содержит представляющие интерес последовательности, повторной трансформации трансгенного растения или добавления новых признаков посредством направленного встраивания способом гомологичной рекомбинации. Конкретные примеры такого набора включают любую из следующих комбинаций: нуклеиновая кислота dgt-28; нуклеиновая кислота Cry34Ab1; нуклеиновая кислота Cry35Ab1; нуклеиновая кислота Cry1F; нуклеиновая кислота Cry1Ac; нуклеиновая кислота aad-12; нуклеиновая кислота aad-1; нуклеиновая кислота pat; и нуклеиновая кислота DSM-2.
В дополнение к иллюстративным аспектам и вариантам осуществления, описанным выше, дополнительные аспекты и варианты осуществления станут очевидными путем изучения представленного ниже описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
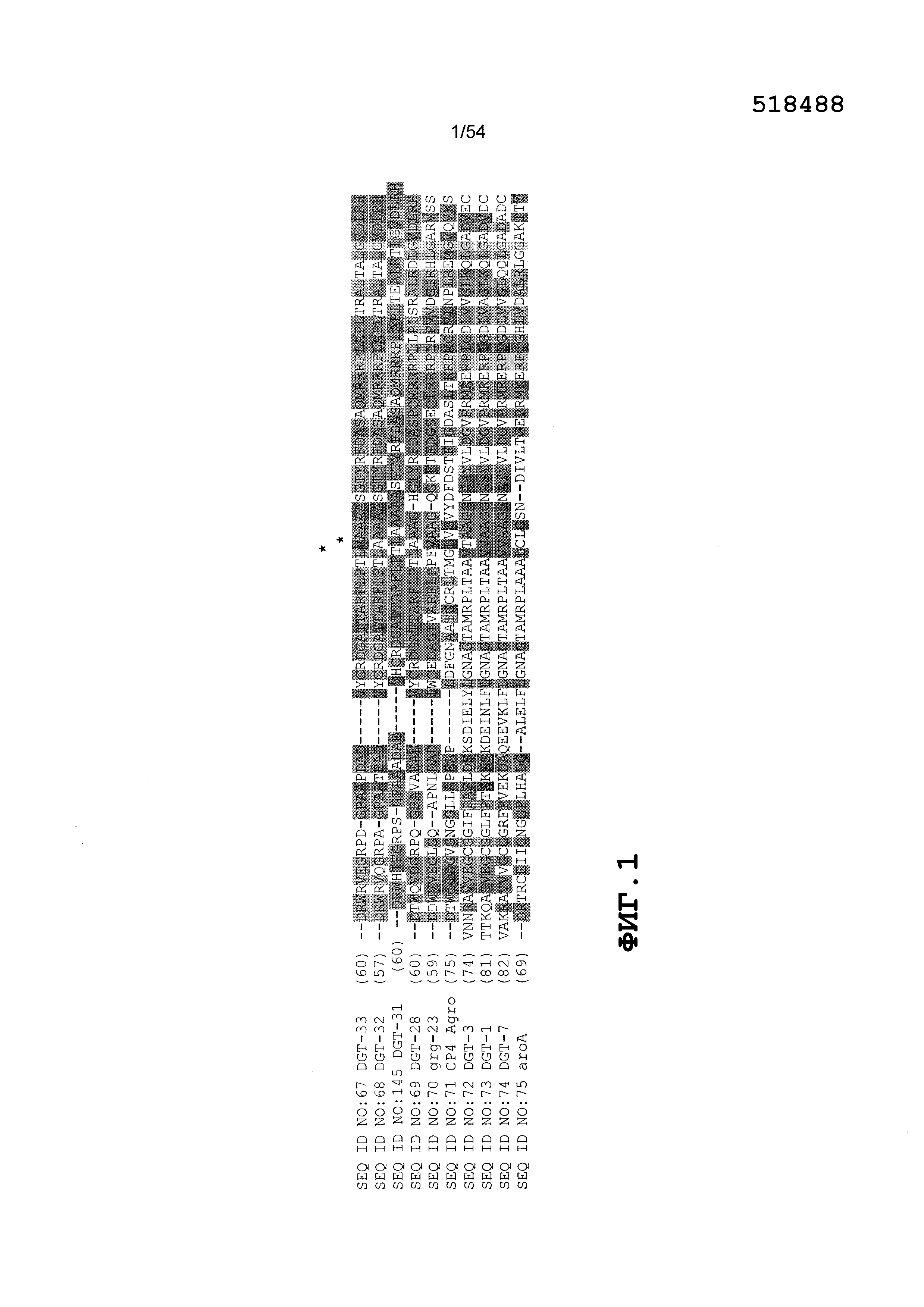
На Фиг. 1 представлено частичное выравнивание последовательностей иллюстративных ферментов EPSP-синтаз (т.е., DGT-28, DGT-32, DGT-33 и других). Все три из этих иллюстративных ферментов DGT обладают общим консервативным аланином в положении аминокислоты 96 фермента EPSP-синтазы aroA. Положение этой аминокислоты указано звездочкой, и аминокислотный остаток подчеркнут.
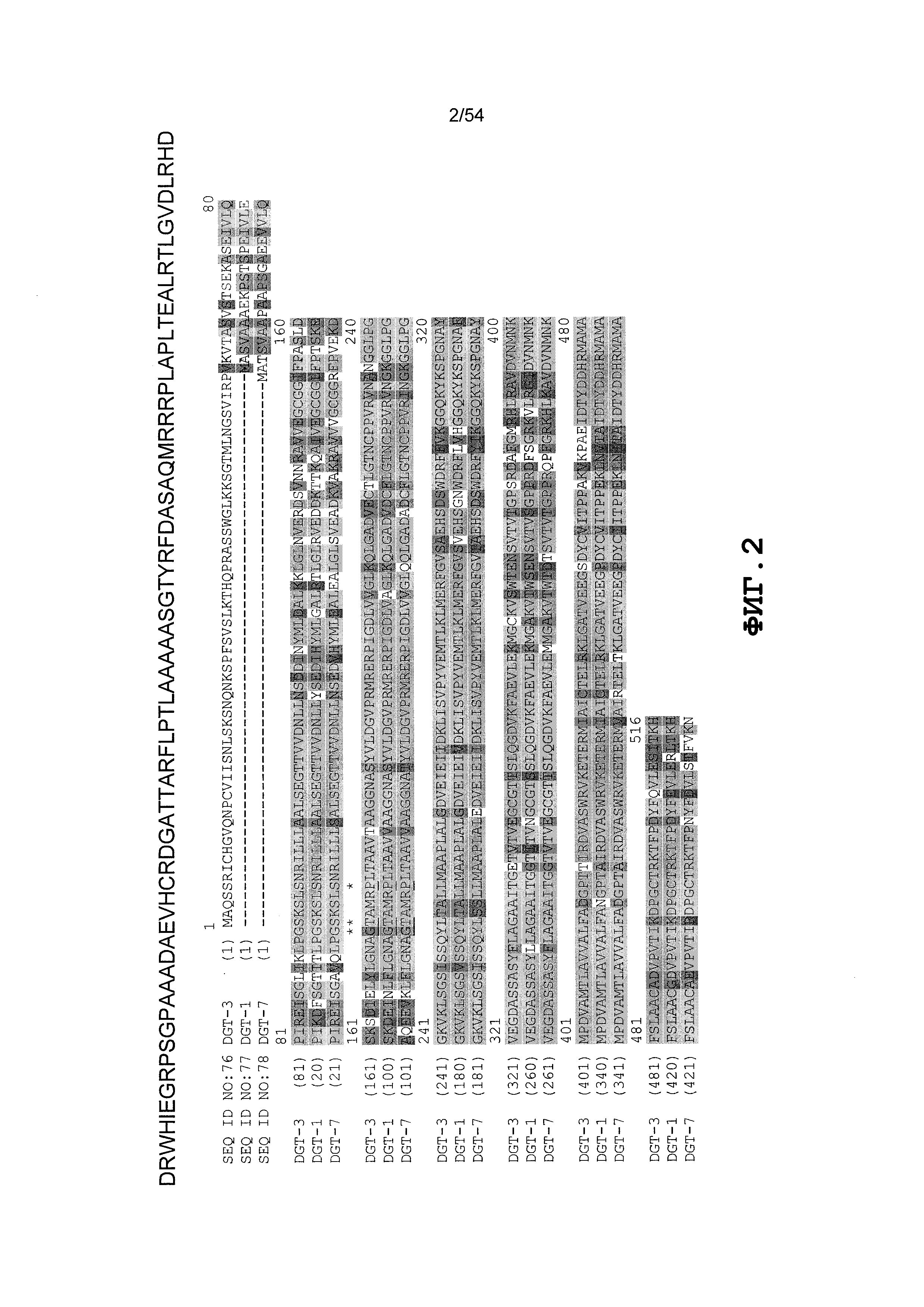
Фиг. 2 включает выравнивание иллюстративных ферментов DGT (т.е. DGT-1, DGT-3 и DGT-7). Положение мутантного аминокислотного остатка, который был изменен с глицина на аланин, указано первой звездочкой. Положение второго мутантного аминокислотного остатка, который был изменен с треонина на изолейцин, указано второй звездочкой. Положение третьего мутантного аминокислотного остатка, который был изменен с пролина на серин, указано третьей звездочкой.
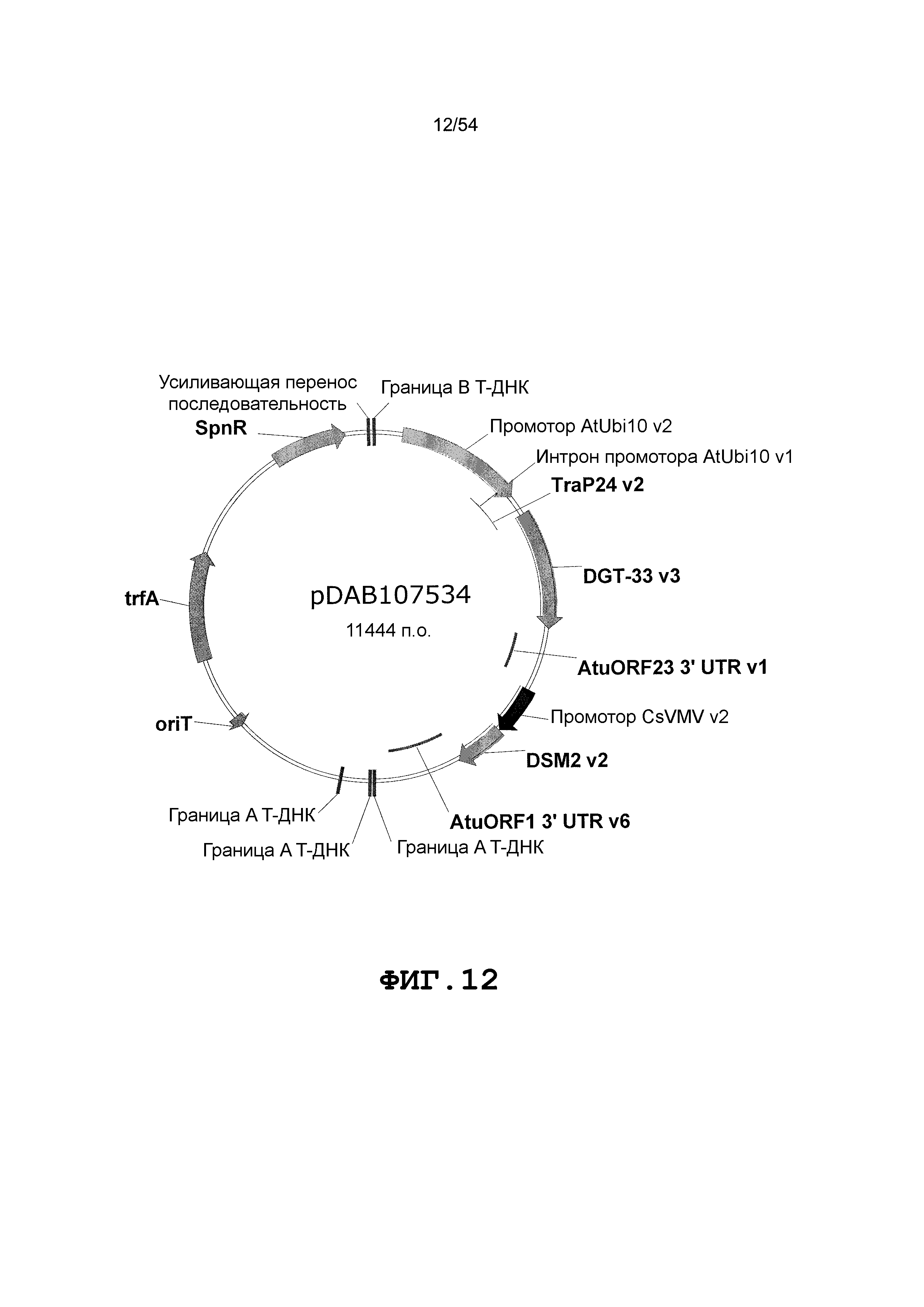
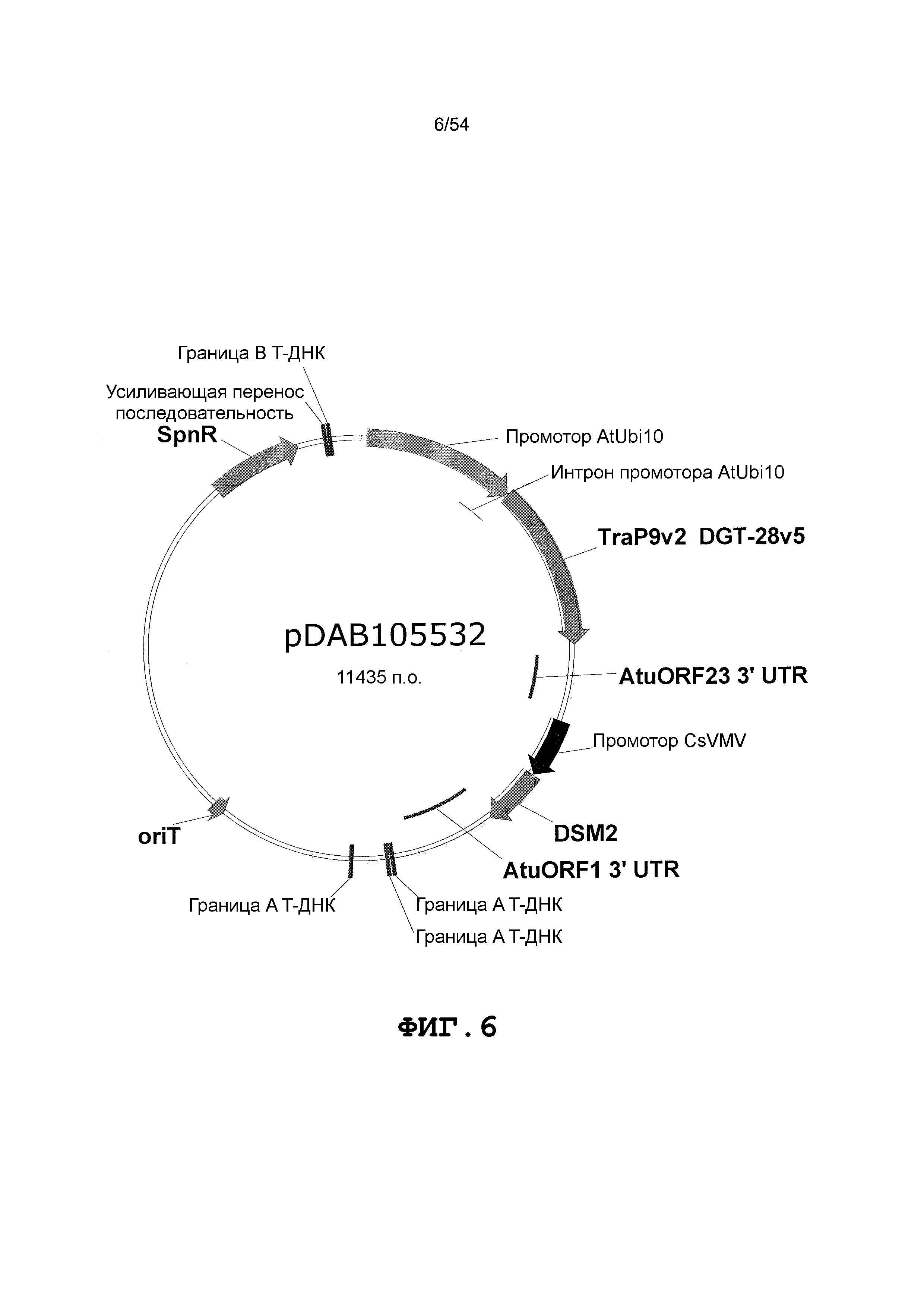
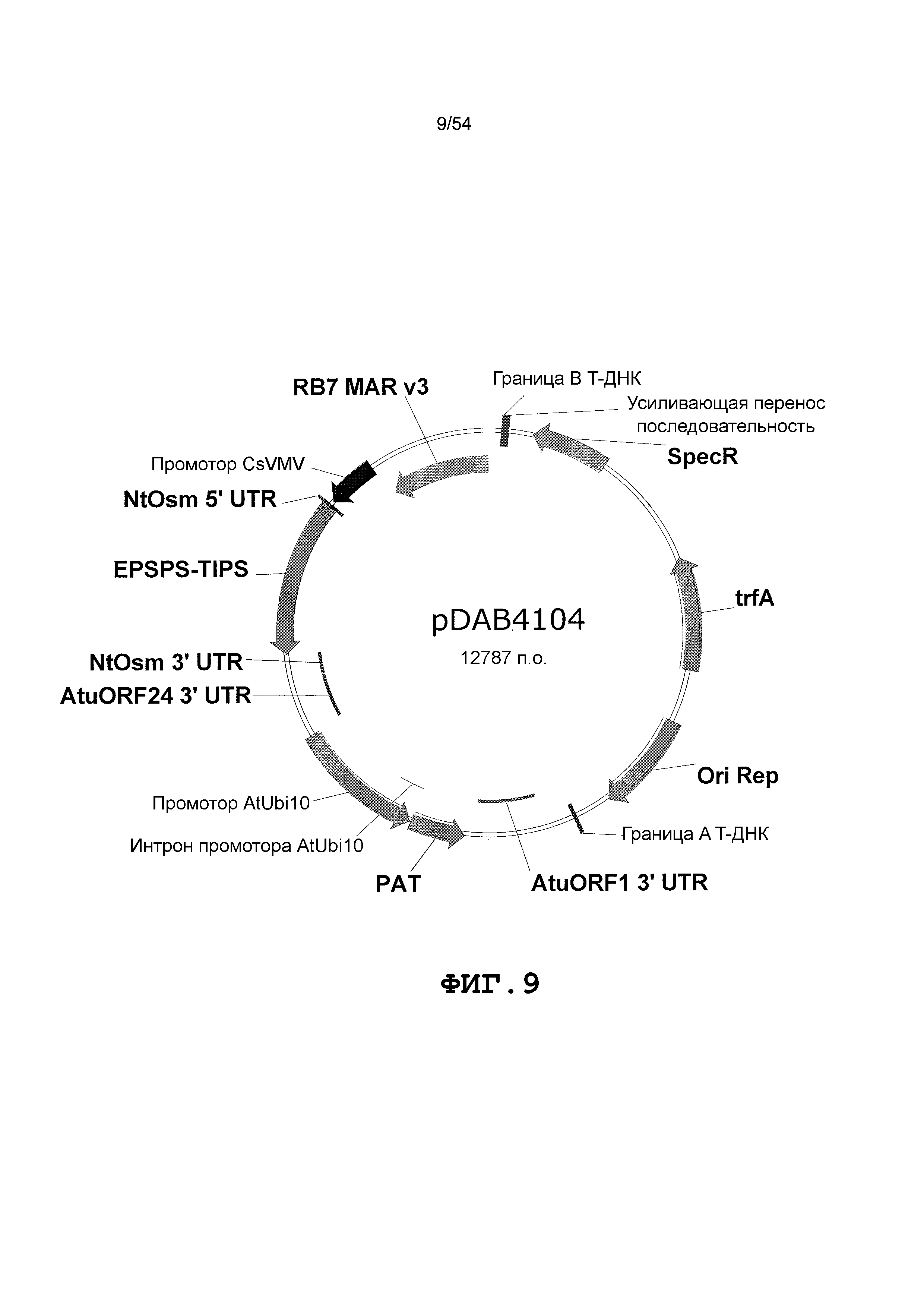
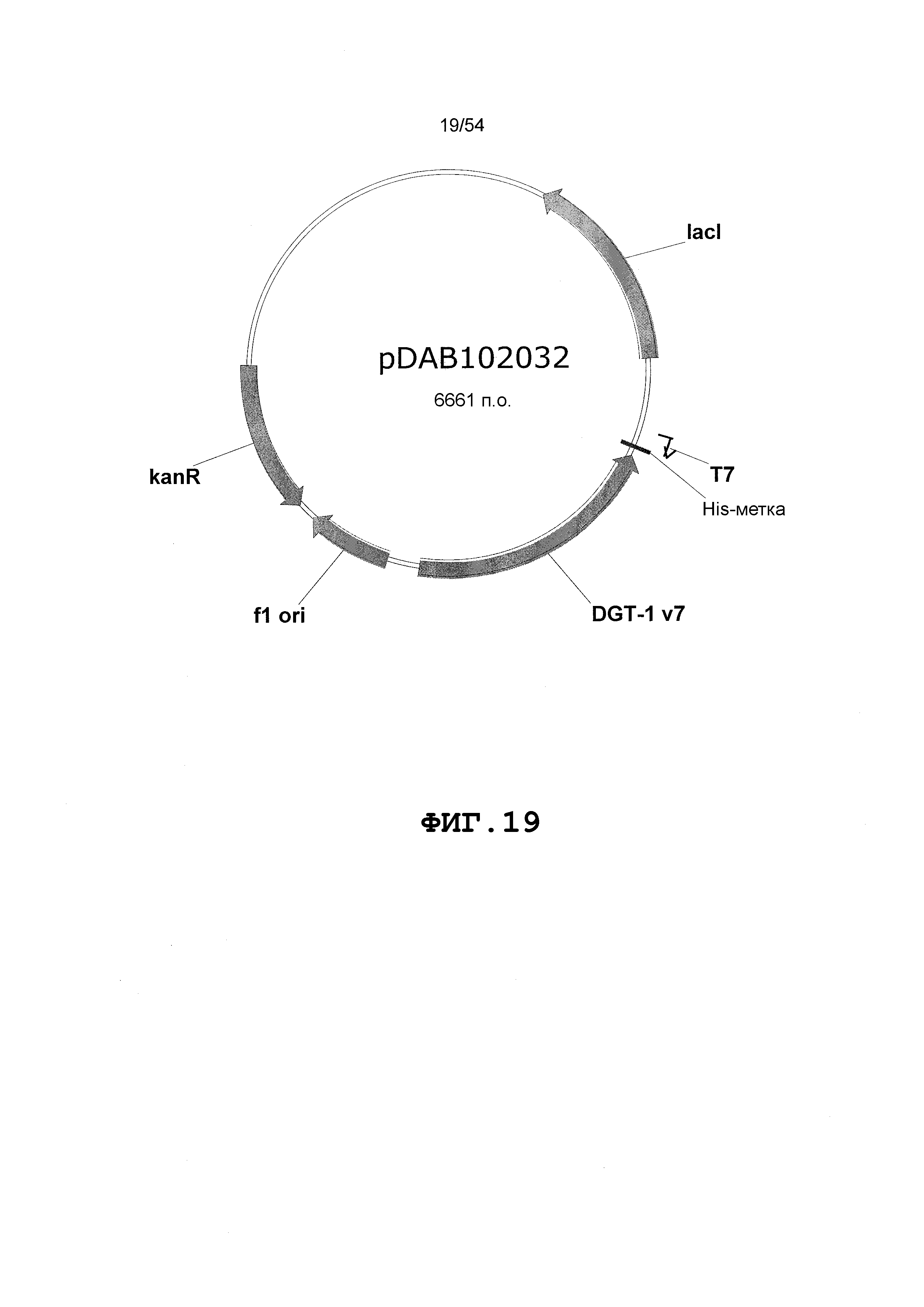
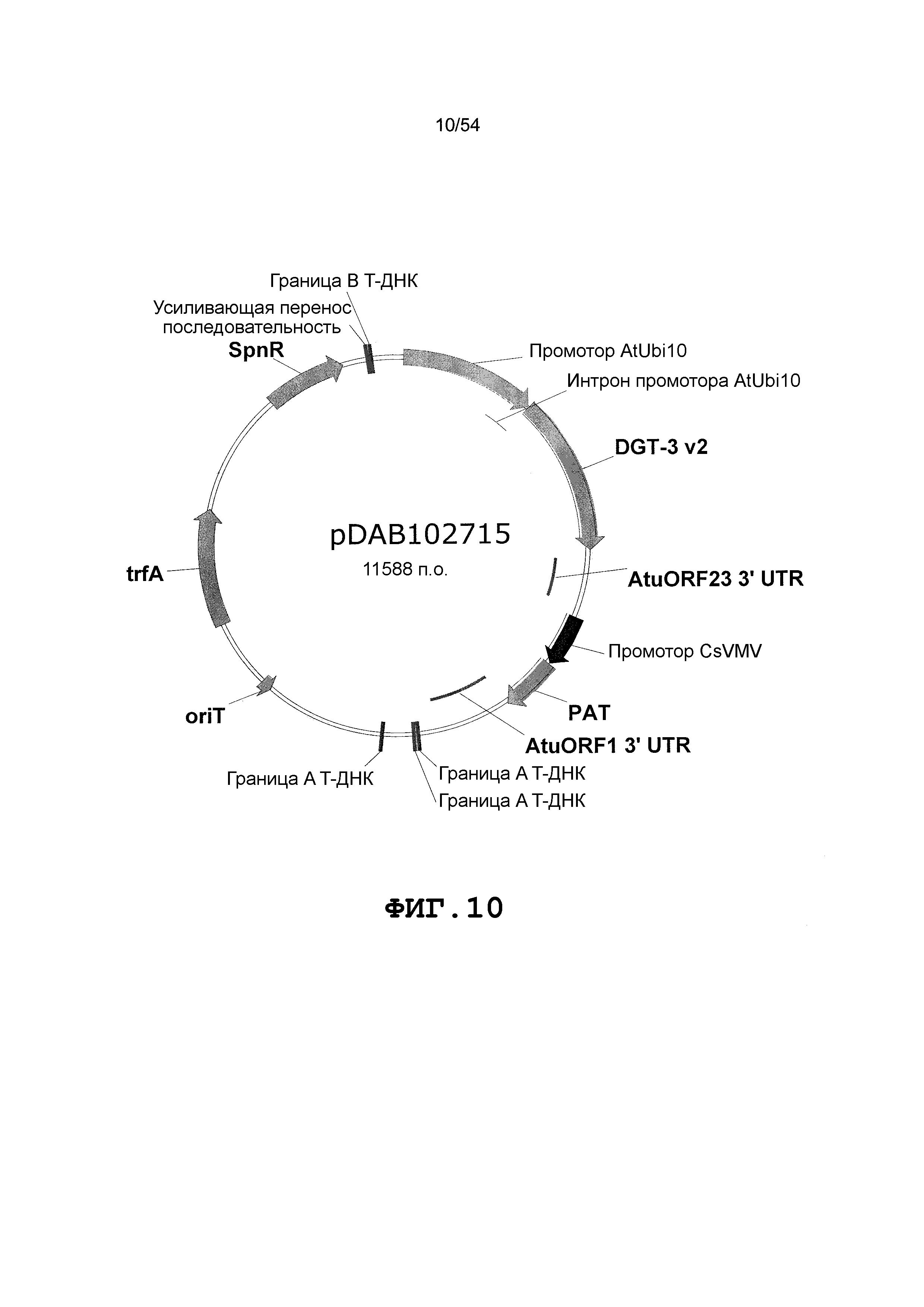
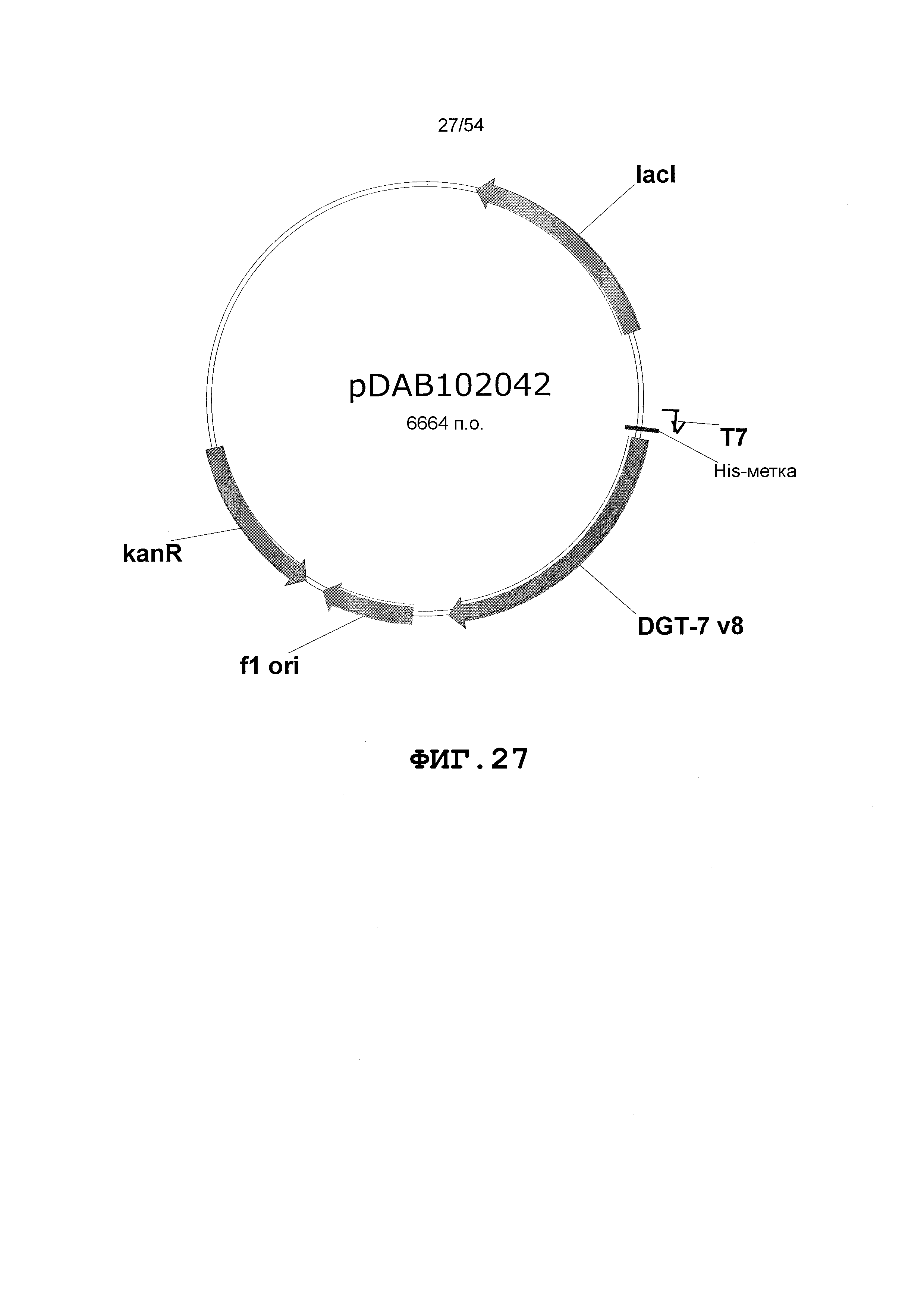
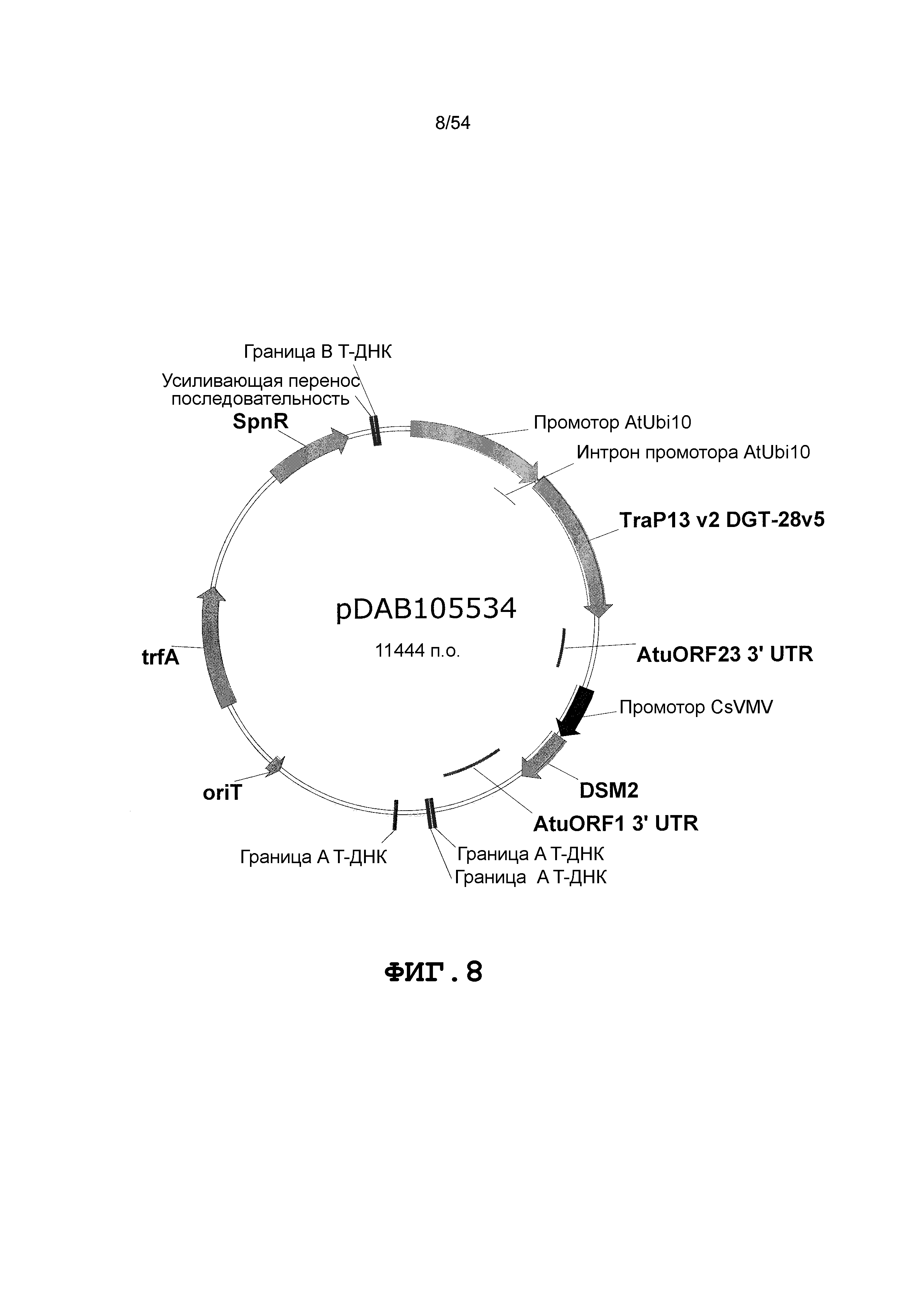
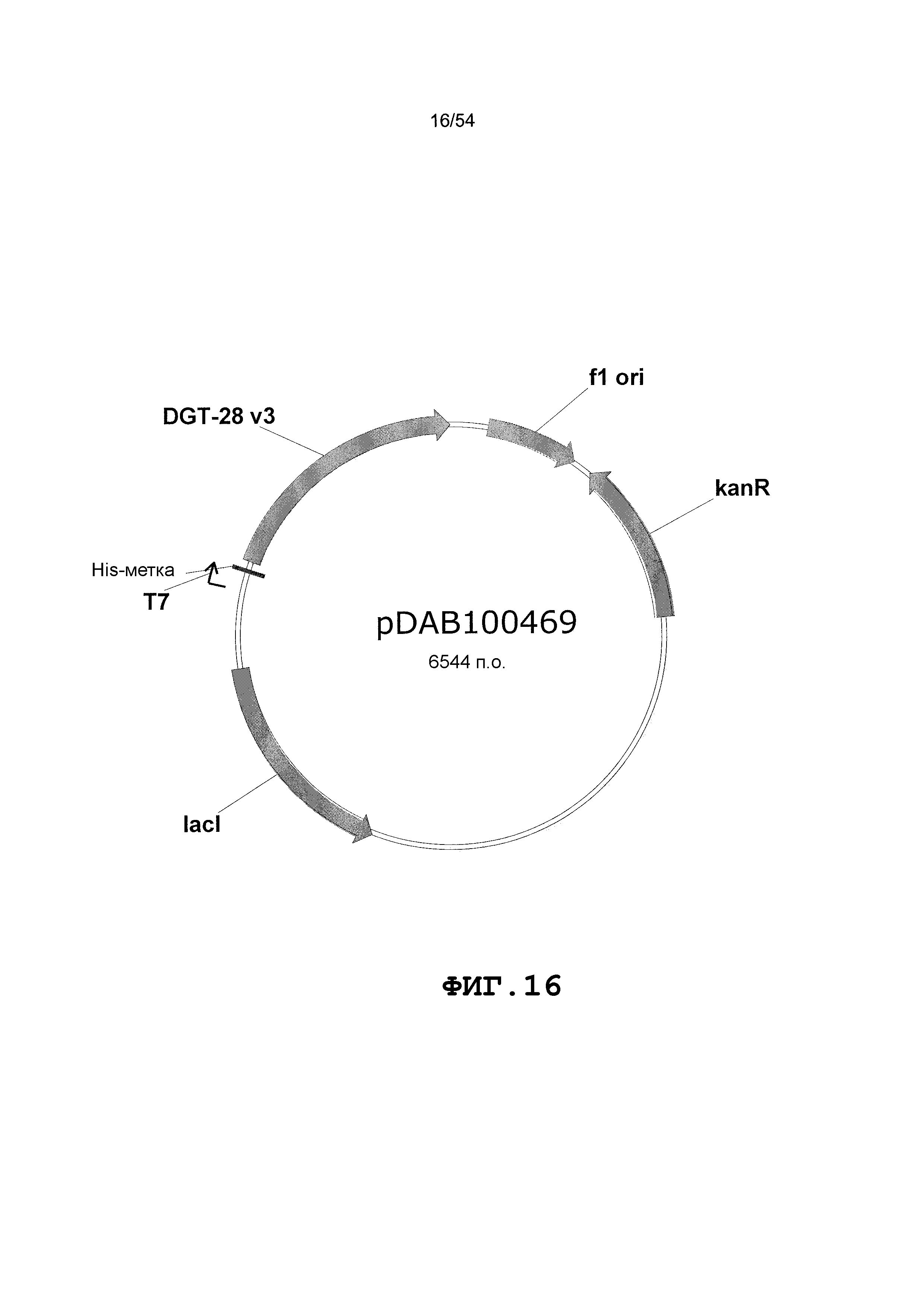
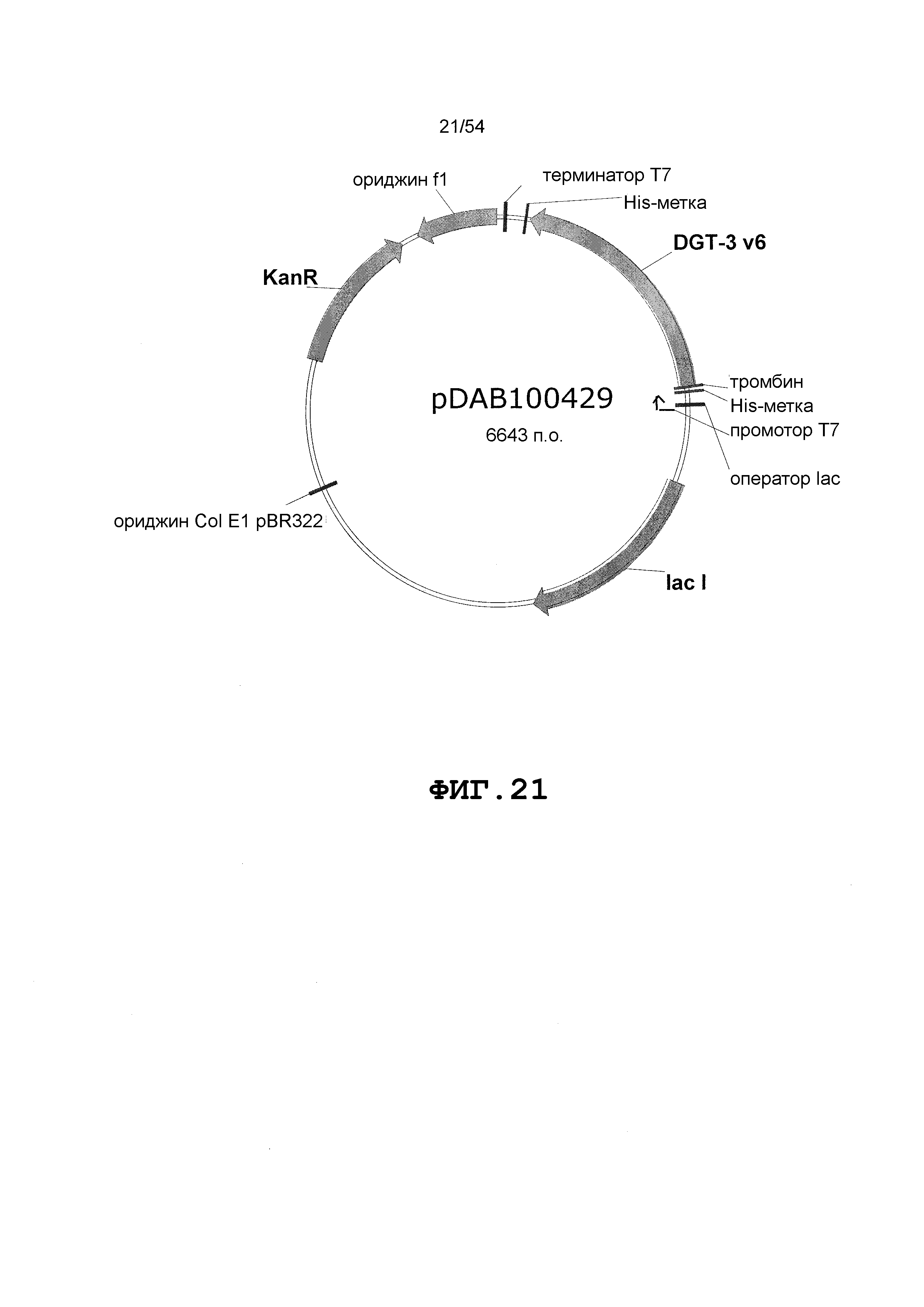
Фиг. 3-30 включают карты различных иллюстративных плазмид: pDAB107527 (Фиг. 3); pDAB105530 (Фиг. 4); pDAB105531 (Фиг. 5); pDAB105532 (Фиг. 6); pDAB105533 (Фиг. 7); pDAB105534 (Фиг. 8); pDAB4104 (Фиг. 9); pDAB102715 (Фиг. 10); pDAB107532 (Фиг. 11); pDAB107534 (Фиг. 12); pDAB102785 (Фиг. 13); pDAB100445 (Фиг. 14); pDAB102946 (Фиг. 15); pDAB100469 (Фиг. 16); pDAB102028 (Фиг. 17); pDAB102029 (Фиг. 18); pDAB102032 (Фиг. 19); pDAB102034 (Фиг. 20); pDAB100429 (Фиг. 21); pDAB100442 (Фиг. 22); pDAB100430 (Фиг. 23); pDAB102036 (Фиг. 24); pDAB102038 (Фиг. 25); pDAB102040 (Фиг. 26); pDAB102042 (Фиг. 27); pDAB107712 (Фиг. 28); pDAB107713 (Фиг. 29) и pDAB107714 (Фиг. 30).
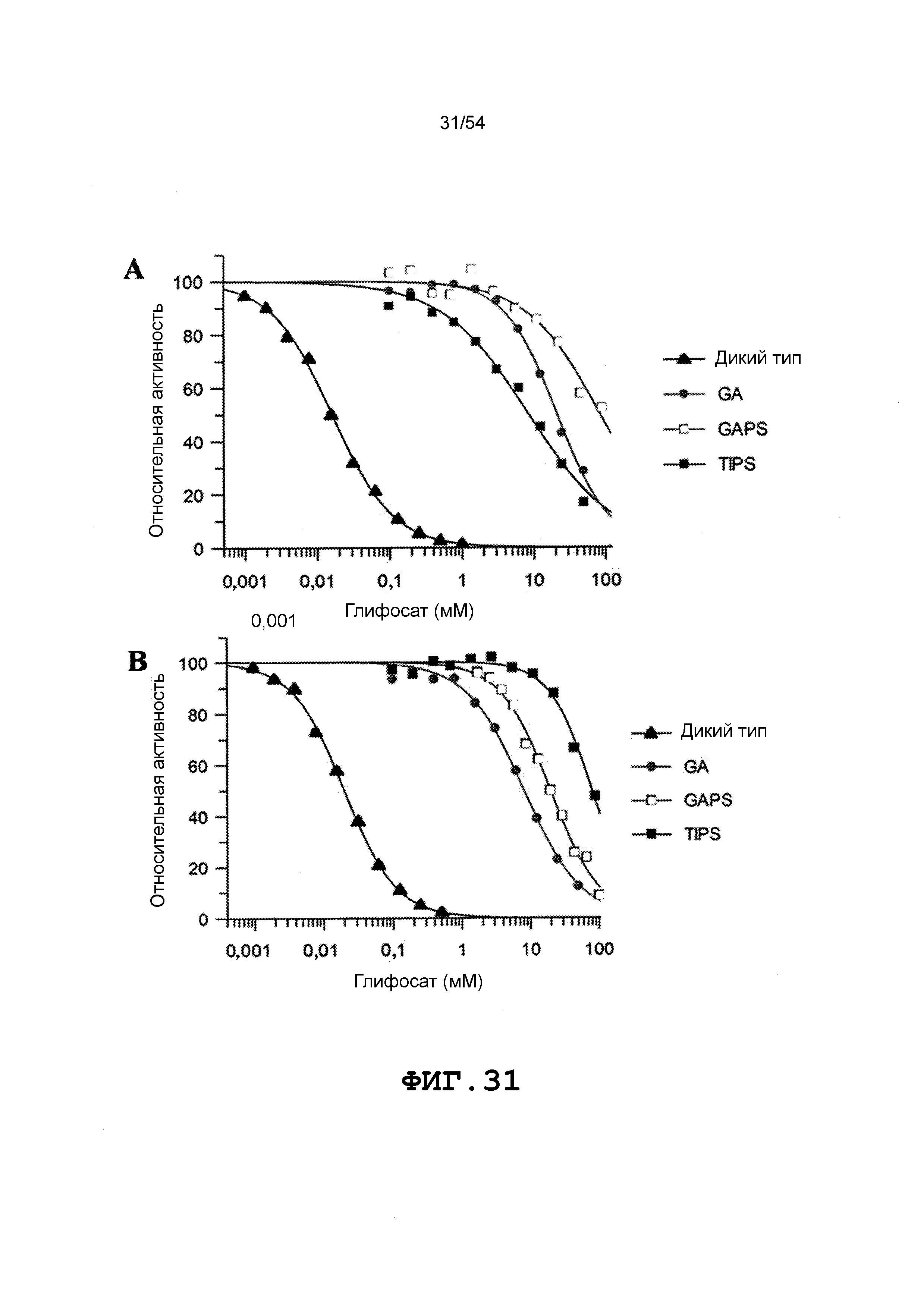
Фиг. 31 включает величины IC50, полученные после внесения различных мутаций в DGT-1 (A) и DGT-7 (B) с использованием 1 мМ PEP. Для кривых IC50 как Фиг. 31(A), так и Фиг. 31(B), закрашенные треугольники соответствуют дикому типу, закрашенные круги соответствуют мутантам GA, незакрашенные квадраты соответствуют мутантам GAPS, и закрашенные квадраты соответствуют мутантам TIPS.
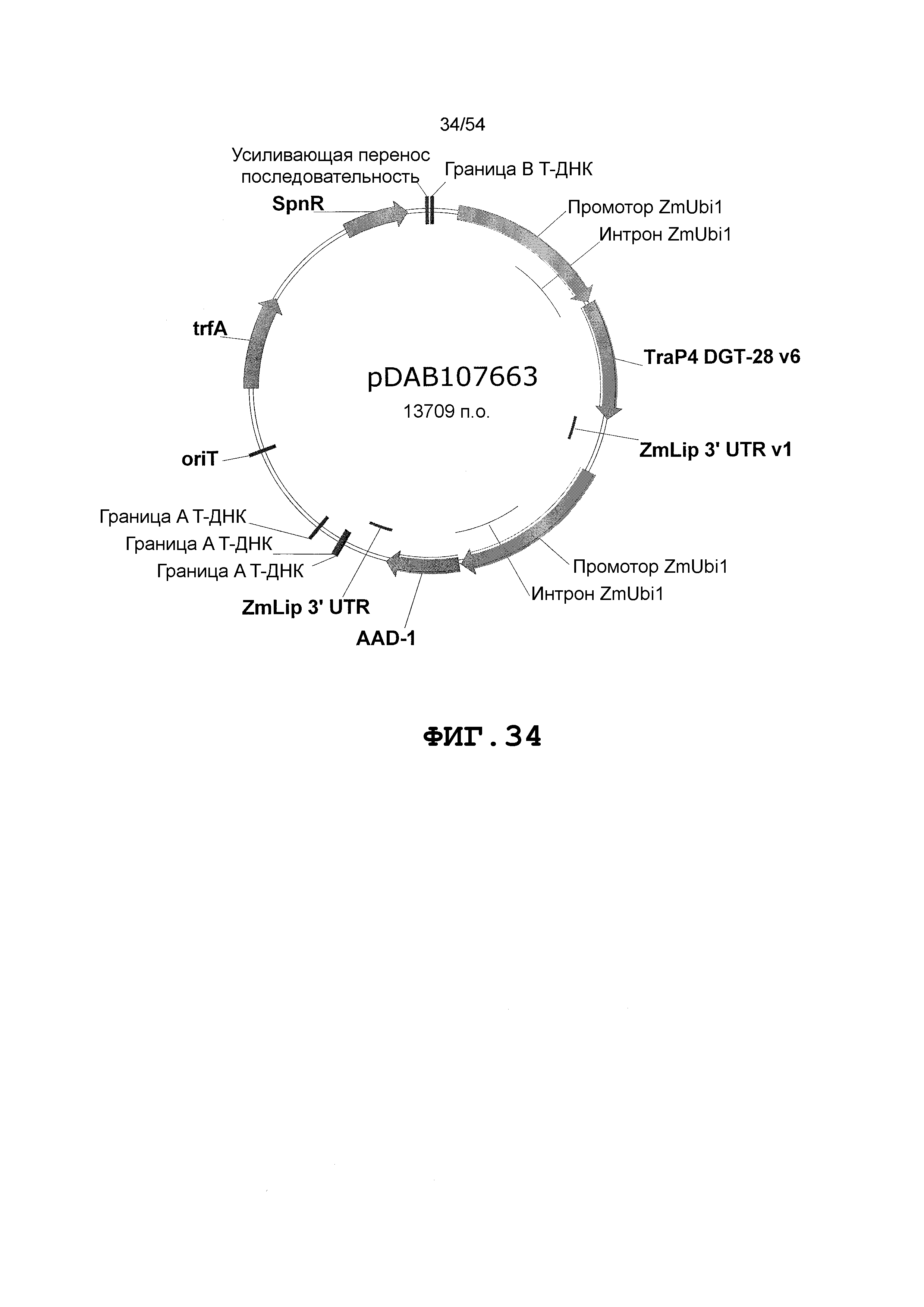
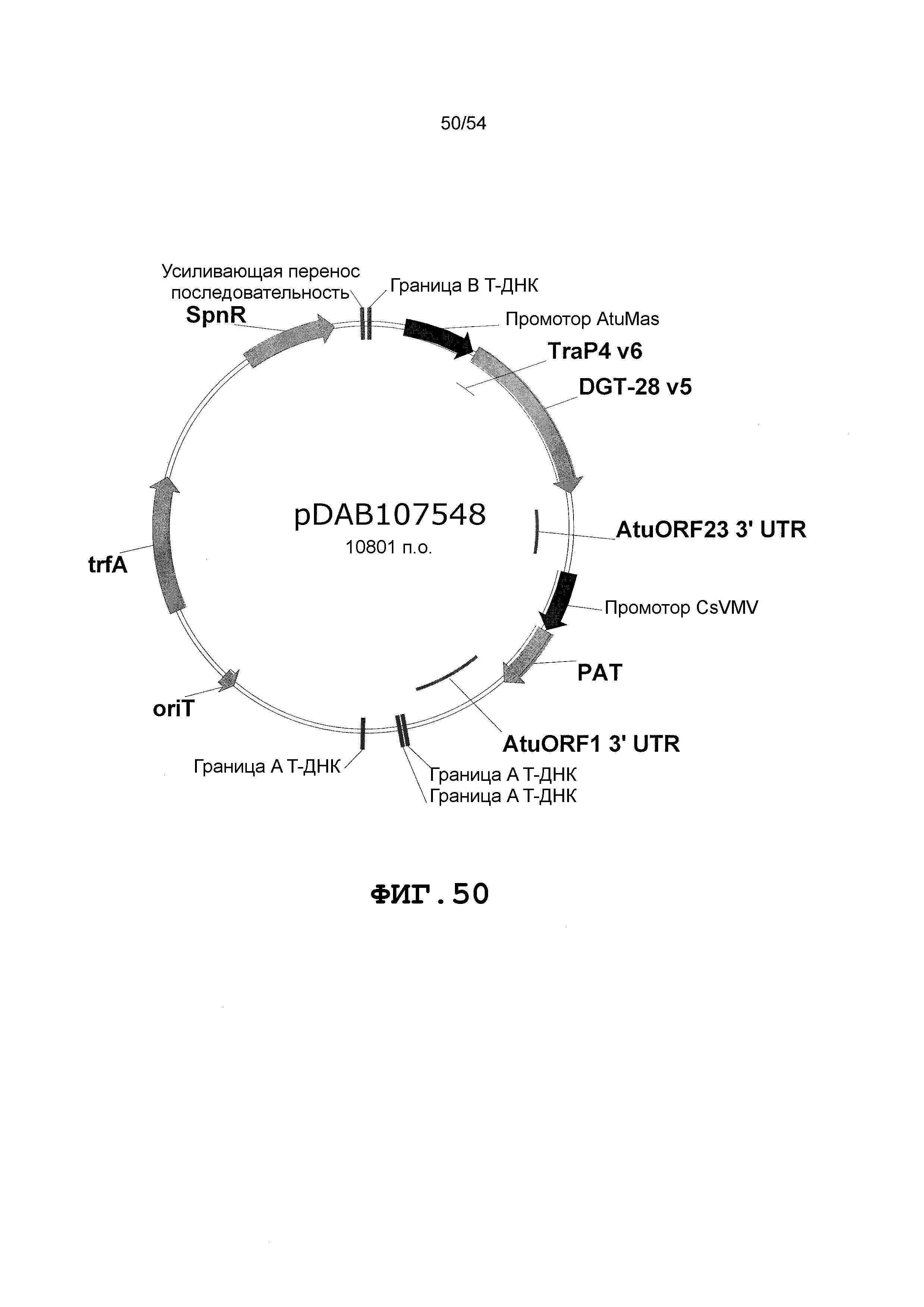
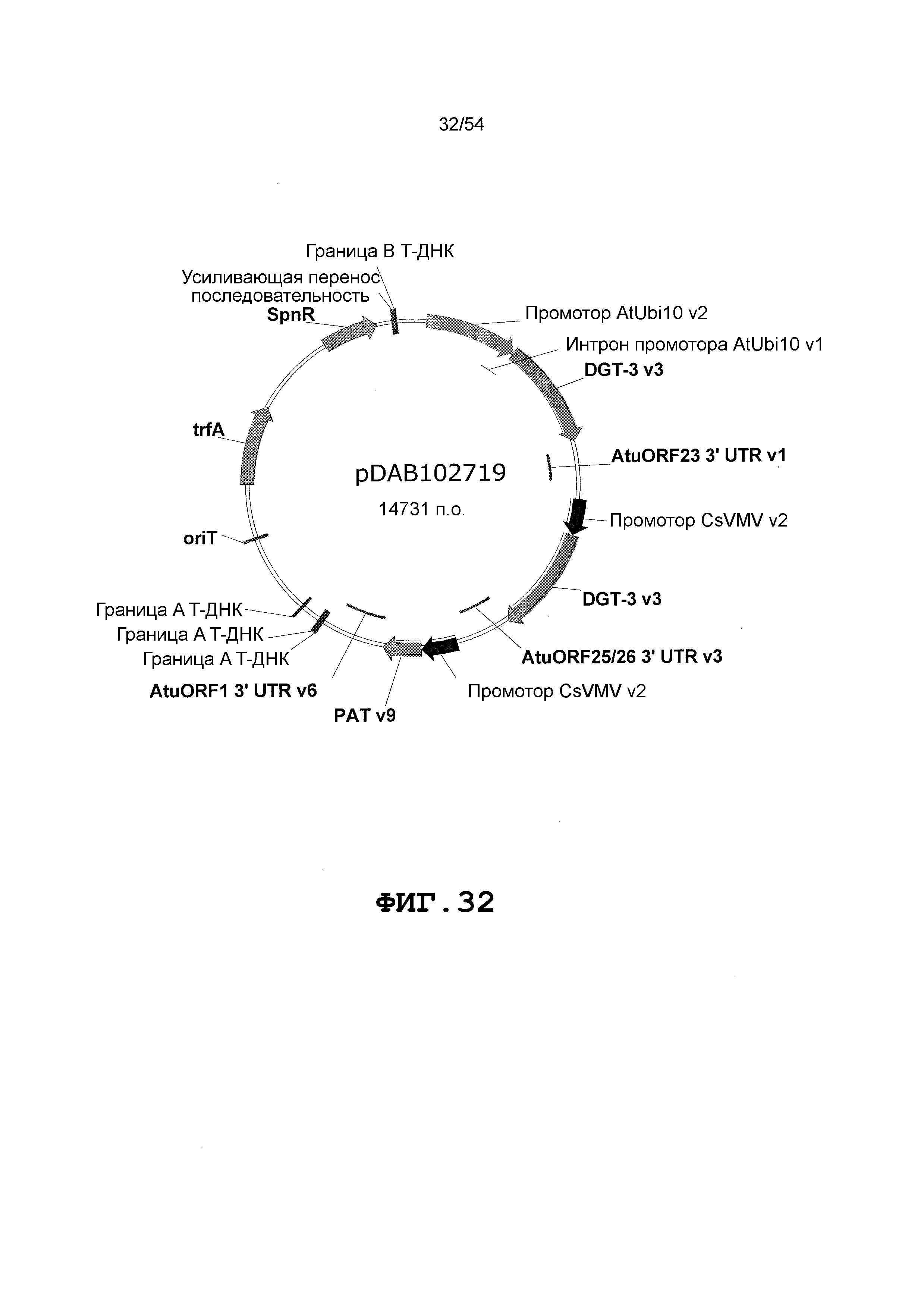
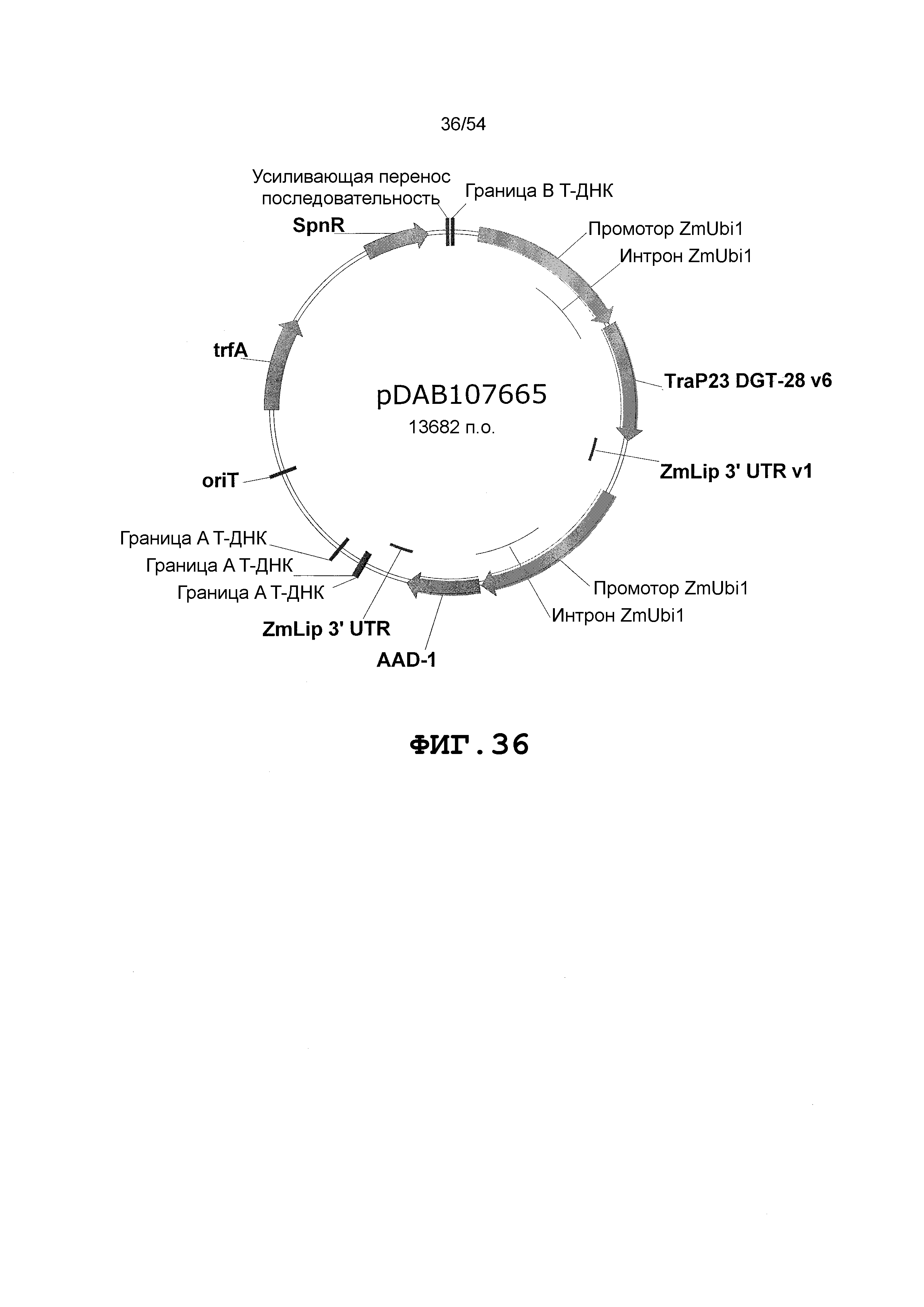
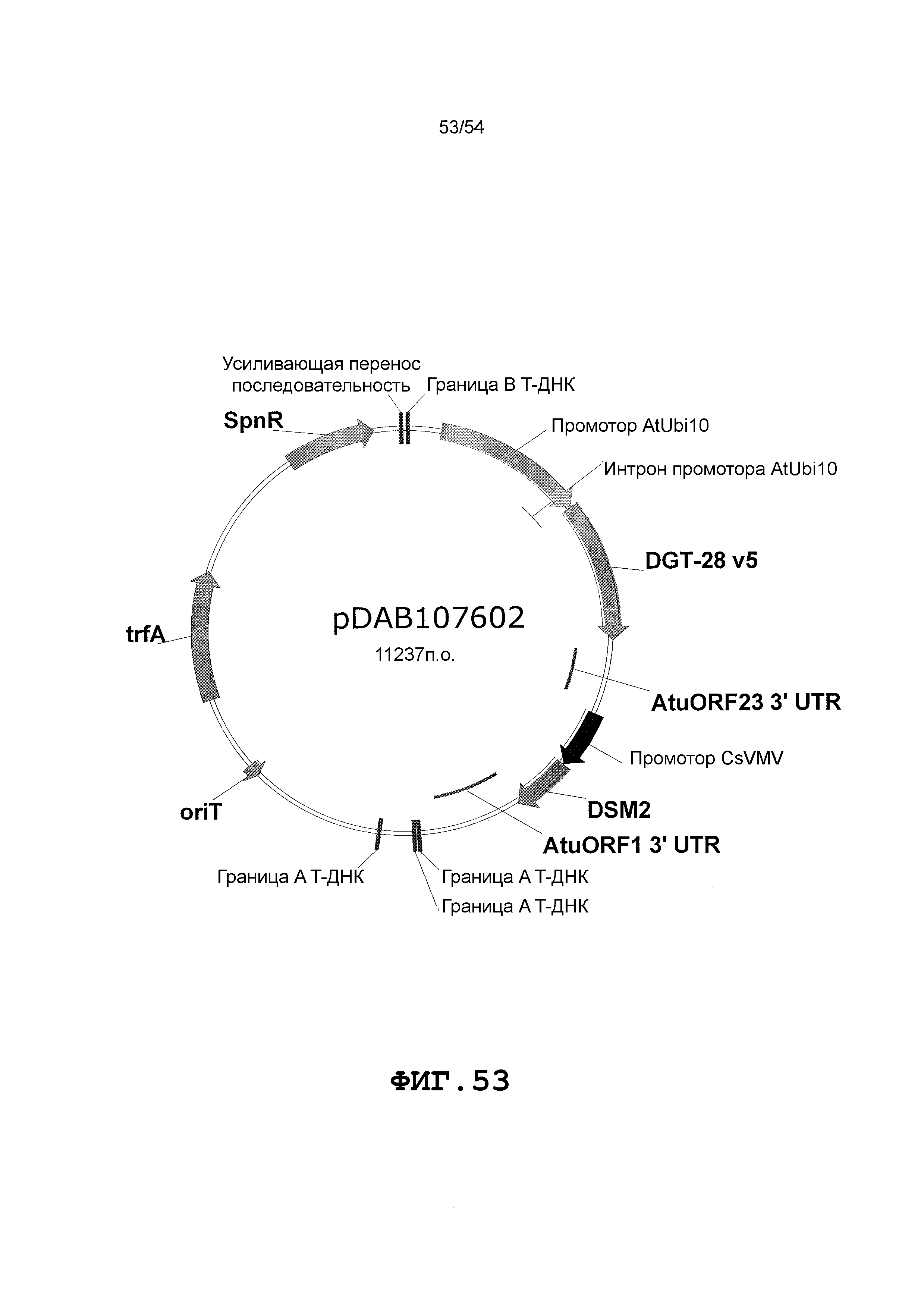
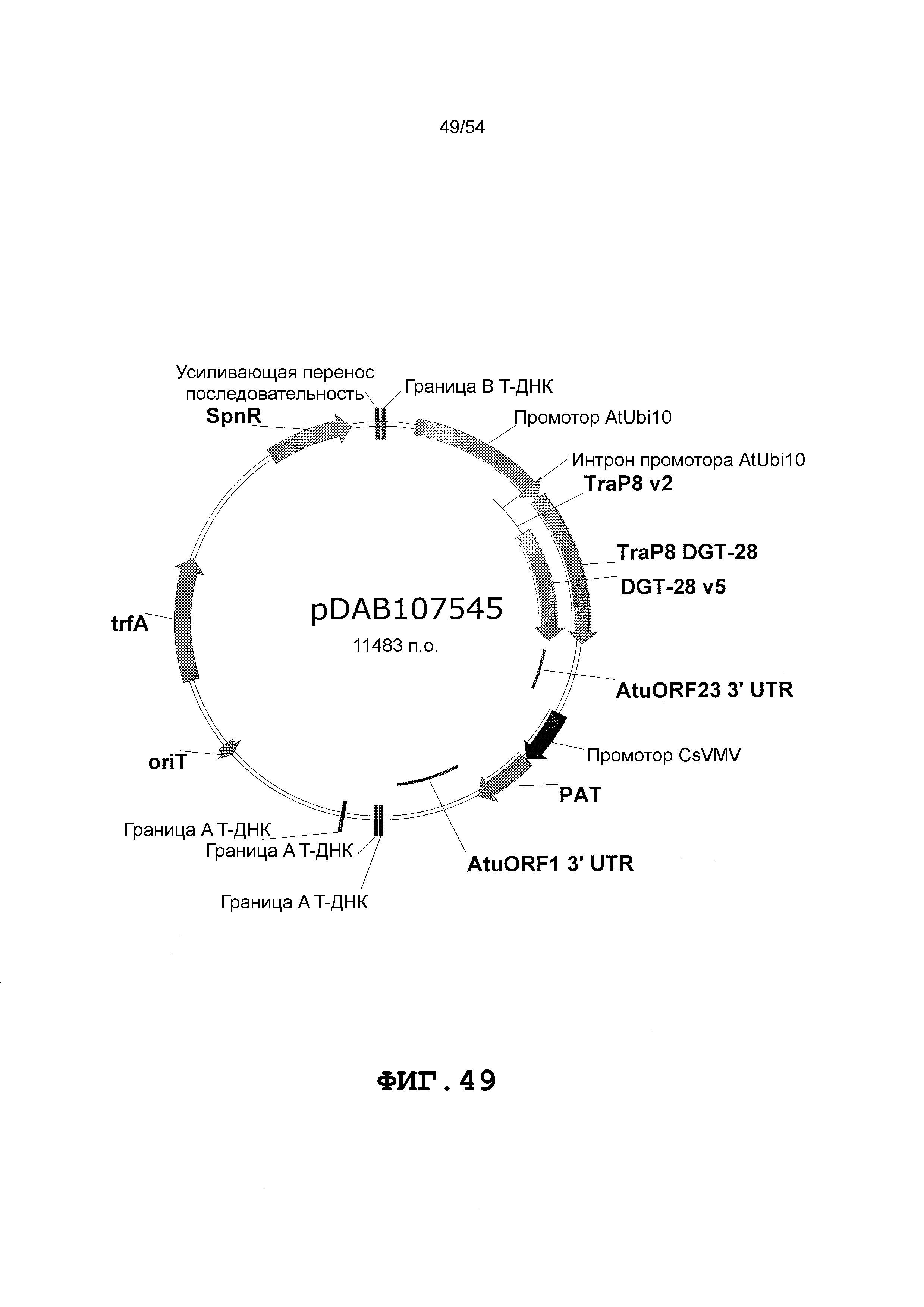
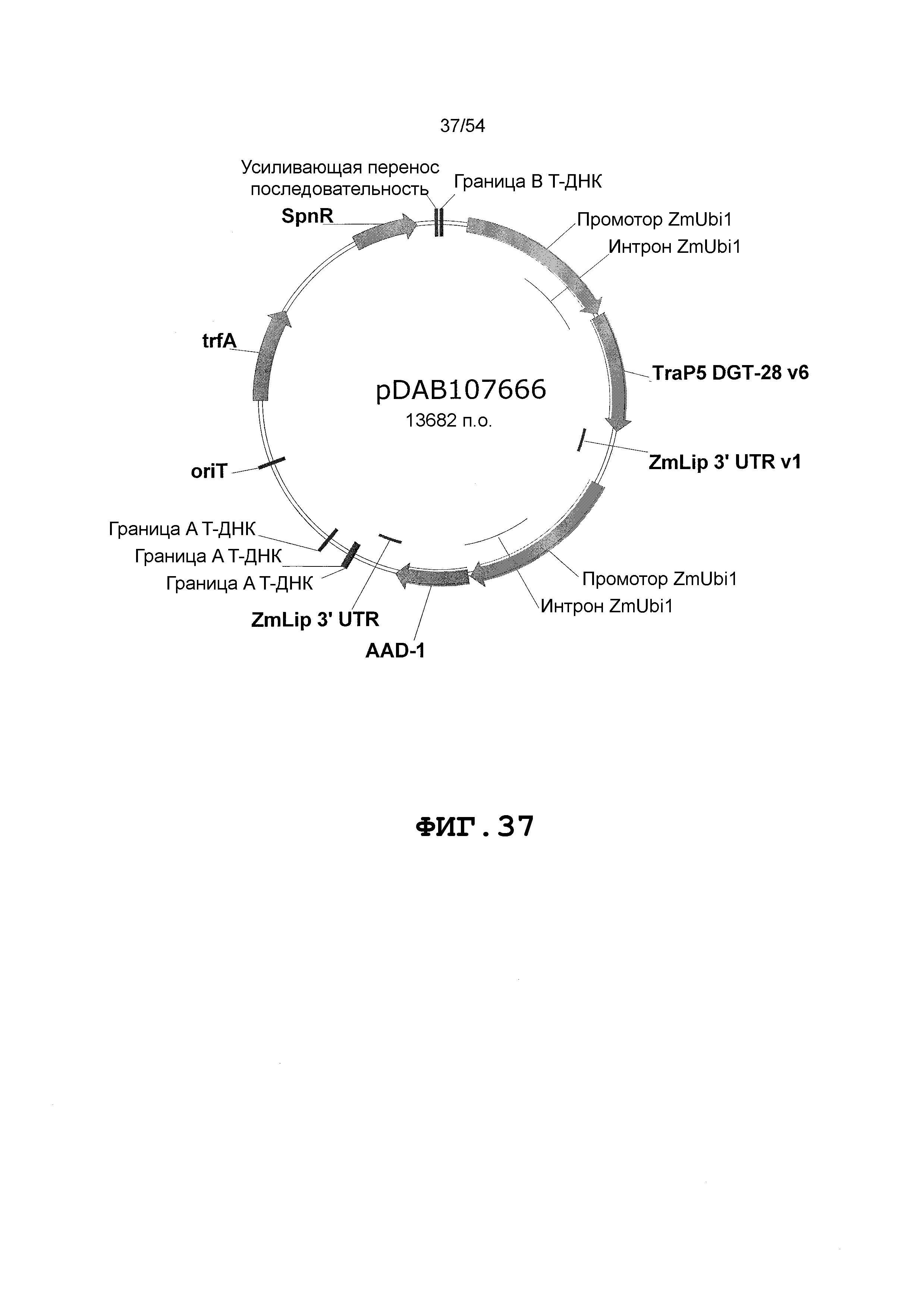
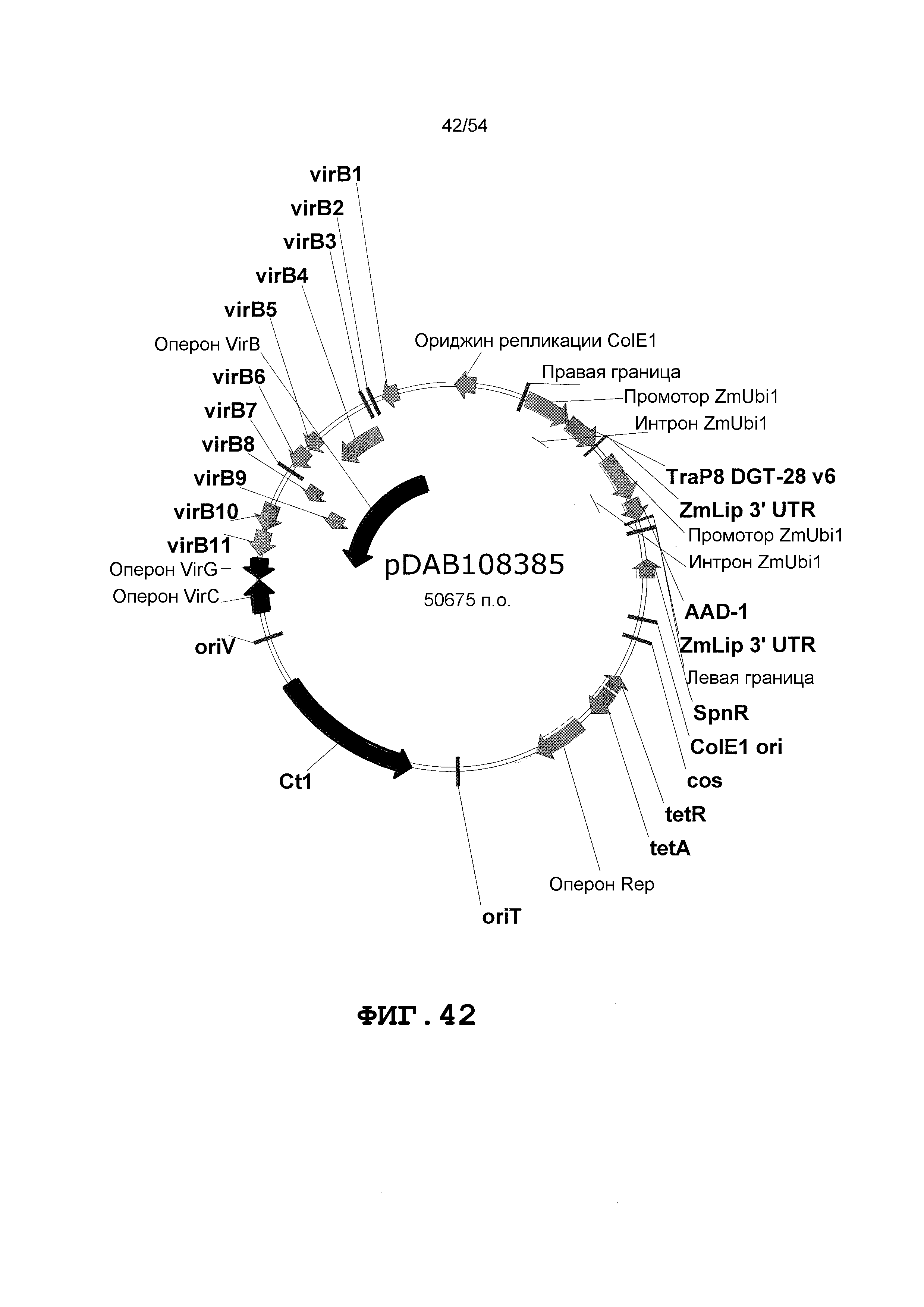
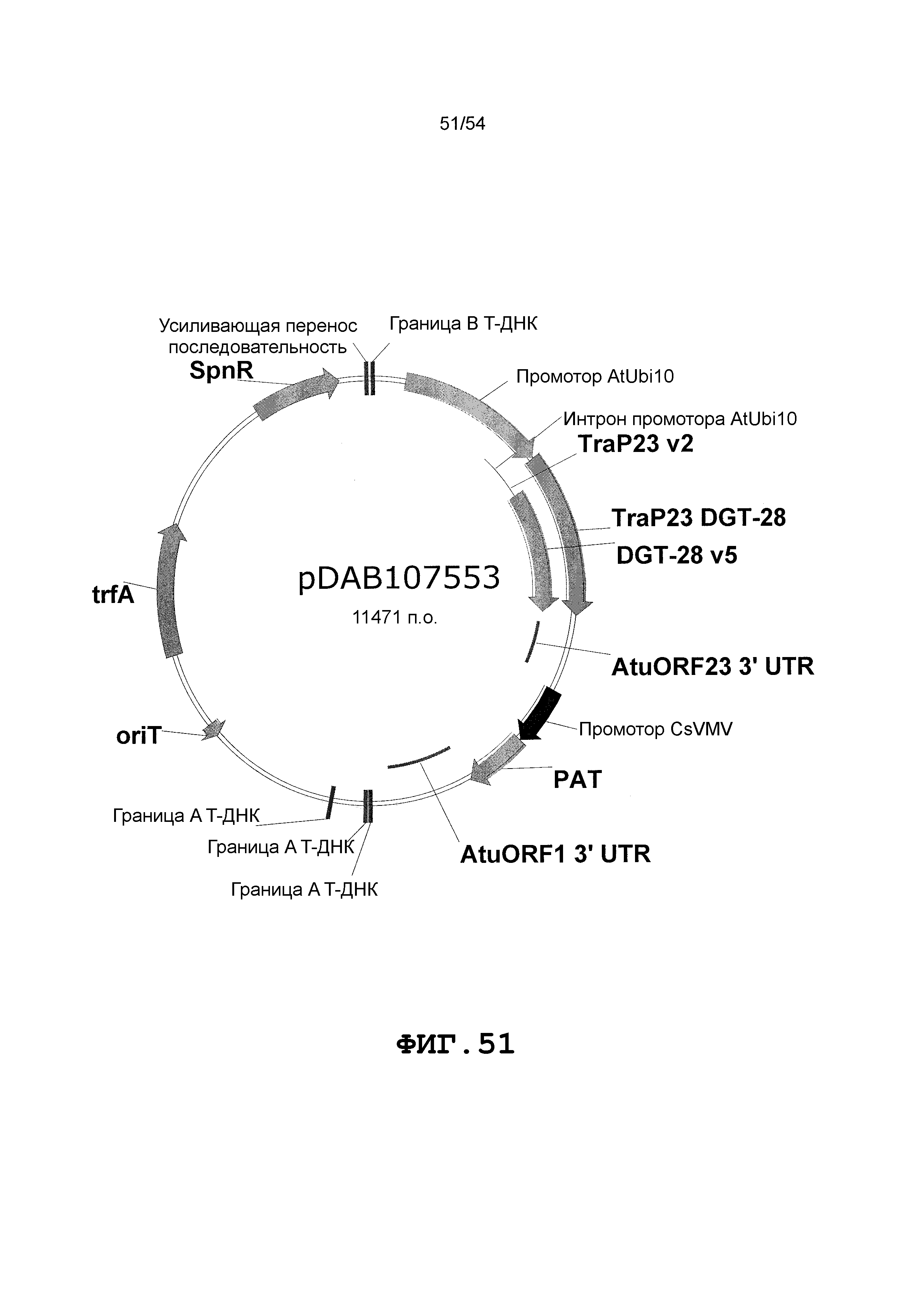
Фиг. 32-46 включают карты различных иллюстративных плазмид: pDAB102719 (Фиг. 32); pDAB102718 (Фиг. 33); pDAB107663 (Фиг. 34); pDAB107664 (Фиг. 35); pDAB107665 (Фиг. 36); pDAB107666 (Фиг. 37); pDAB109812 (Фиг. 38); pDAB101556 (Фиг. 39); pDAB107698 (Фиг. 40); pDAB108384 (Фиг. 41); pDAB108385 (Фиг. 42); pDAB108386 (Фиг. 43); pDAB108387 (Фиг. 44); pDAB102716 (Фиг. 45); pDAB102717 (Фиг. 46); pDAB110828 (Фиг. 47); pDAB110827 (Фиг. 48); pDAB107545 (Фиг. 49); pDAB107548 (Фиг. 50); pDAB107553 (Фиг. 51); pDAB102792 (Фиг. 52); pDAB107602 (Фиг. 53); и pDAB107533 (Фиг. 54).
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор
В настоящем описании описаны новые полипептиды, вовлеченные в метаболизм N-(фосфонометил)глицина, и нуклеиновые кислоты, кодирующие такие полипептиды. В некоторых примерах такой полипептид сообщает (или увеличивает) устойчивость к глифосату в клетке растения, где полипептид гетерологично экспрессируется, например, без неблагоприятного влияния на связывание EPSP-синтазы с ее природным субстратом фосфоенолпируватом (PEP).
II. Термины
Чтобы дополнительно пояснить объем настоящего изобретения, предоставлены следующее конкретные определения, термины и сокращения.
Если конкретно не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в данной области. Если не очевидно из контекста, в котором находится термин, термин в форме единственного числа включает множественное число, и подразумевают, что термины во множественном числе включают единственное число. Таким образом, элемент или компонент в форме единственного числа являются неограничивающими в отношении количества экземпляров (т.е. случаев) элемента или компонента. Когда в настоящем описании предусматриваются диапазоны числовых величин (например, "менее чем приблизительно X", "менее чем X" и "например, X1… и X2"), подразумевают, что диапазоны включают все величины и диапазоны величин, включенные в предоставленный диапазон, как если бы эти включенные величины и диапазоны были явно перечислены.
Как используют в рамках изобретения, термины "содержащий", "включающий," "имеющий" и "содержащий" и их варианты являются открытыми (т.е. неисключающими). Например, композиция или способ, которые включают перечень элементов, необязательно ограничиваются только этими элементами. Такая композиция или способ могут включать (или могут не включать) другие элементы, явно не указанные или не присущие композиции или способу. Кроме того, если явно не указано иное, "или" используют во включающем (а не исключающем) значении. Например, условие "A или B" удовлетворяется любым из следующих: A является истинным (или присутствует) и B является ложным (или отсутствует); A является ложным (или отсутствует) и B является истинным (или присутствует); и как A, так и B, являются истинными (или присутствуют).
Растение: как используют в рамках изобретения, термин "растение" включает целое растение и любого потомка, клетку, ткань или часть растения. Термин "части растений" включает любую часть(и) растения, включая, например, но не ограничиваясь этим: семена (включая зрелое семя и незрелое семя); черенок растения; клетку растения; культуру клеток растения; орган растения (например, пыльцу, эмбрионы, цветки, плоды, побеги, листья, корни, стебли и эксплантаты). Ткань растения или орган растения могут представлять собой семя, протопласт, каллюс или любую другую группу клеток растений, которые организованы в структурный или функциональный элемент. Клетка растения или культура тканей могут быть способны регенерировать растение, имеющее физиологические и морфологические характеристики растения, из которого были получены клетка или ткань, и регенерировать растение, имеющее по существу тот же генотип, что и у растения. В противоположность этому, некоторые клетки растений не способны регенерировать с образованием растений. Регенерируемые клетки в клетке растения или тканевой культуры могут представлять собой эмбрионы, протопласты, клетки меристемы, каллюс, пыльцу, листья, пыльники, корни, корневые кончики, столбики початка, цветки, зерна, колосья, початки, пленку зерна или цветоножки.
Части растений включают пожинаемые части и части, пригодные для размножения растений-потомков. Части растений, пригодные для размножения, включают, например, но не ограничиваясь ими: семя; плод; черенок; проросток; клубень и корневище. Пожинаемая часть растения может представлять собой любую часть растения, включая, например, но не ограничиваясь ими: цветок; пыльцу; проросток; клубень; лист; стебель; плод; семя и корень.
Клетка растения представляет собой структурный и физиологический элемент растения, содержащий протопласт и клеточную стенку. Клетка растения может быть в форме выделенной отдельной клетки или совокупности клеток (например, рыхлый каллюс и культивируемая клетка), и она может быть частью более высоко организованного элемента (например, ткань растения, орган растения и растение). Таким образом, клетка растения может представлять собой протопласт, продуцирующую гаметы клетку, или клетку или группу клеток, которые регенерируют в целое растение. По существу, в вариантах осуществления, описанных в настоящем описании, семя, которое содержит множество клеток растений и способно регенерировать в целое растение, считают "клеткой растения".
Резистентность/устойчивость к гербицидам: при указании на растения, которые являются резистентными или устойчивыми к глифосату, подразумевают, что применение некоторого количества глифосата к растению не оказывает значительного влияния или не уничтожает растение, где растение дикого типа того же вида значительно повреждалось и/или погибало бы при использовании этого количества глифосата. Растение может быть естественным образом устойчивым к конкретному гербициду или растению можно сообщать устойчивость к гербициду с помощью способов генной инженерии, например, таких как селекция; генетическая трансформация и/или внесение трансгена в геном растения. "Устойчивое к глифосату растение" относится к растению, содержащему полипептид или молекулу нуклеиновой кислоты, которые сообщают устойчивость к гербициду, когда их предоставляют гетерологичному растению или другому организму, экспрессирующему их (т.е. делают растение или другой организм устойчивыми к гербициду).
Растение, которое является резистентным или устойчивым к глифосату, может демонстрировать некоторый минимальный эффект от применения глифосата к растению. Например, может происходить изменение нормального роста и развития растения, где растение может проявлять признаки или симптомы, которые ассоциированы со стрессом или заболеванием. Такой минимальный эффект вследствие применения глифосата к растениям, которые являются резистентными или толерантными к глифосату, отличается от неблагоприятного эффекта, который является результатом применения глифосата к растениям, которые чувствительны к глифосату. Специалист в данной области может различить растения, которые являются устойчивыми к глифосату, и растения, которые являются чувствительными к глифосату. Применение глифосата к растениям, содержащим нуклеиновую кислоту, которая сообщает устойчивость к глифосату, приводит к значительно меньшему эффекту, чем применение того же количества глифосата к растению того же вида, которое не содержит молекулу нуклеиновой кислоты, которая сообщает устойчивость к глифосату.
Растение, которое является устойчивым к гербициду или другому химическому реагенту, демонстрирует увеличенную устойчивость по сравнению с соответствующим контрольным растением. Повреждение вследствие гербицида или другой химической обработки можно оценивать посредством оценки любого параметра роста или благополучия растения. Такие параметры известны специалистам в данной области и их выбор осуществляется, исходя из мнения квалифицированного специалиста. Повреждение растения можно оценивать путем визуального исследования и/или посредством статистического анализа одного или нескольких подходящего параметра(ов) роста или благополучия растения в индивидуальном растении или группе(ах) растений. Таким образом, повреждение можно оценивать путем оценки параметров, включающих, например и не ограничивающихся ими: высоту растения; массу растения; цвет листьев; длину листьев; цветение; способность к размножению; выметывание пестичных столбиков; выход и продукцию семян. Повреждение также можно оценивать путем оценки времени, прошедшего до конкретной стадии развития (например, выметывание пестичных столбиков, цветение и сбрасывание пыльцы), или времени, пошедшего до тех пор, пока растение не восстановится после обработки конкретным химическим реагентом и/или гербицидом.
При проведении оценки повреждений, конкретным степеням повреждения можно приписывать величины так, чтобы можно было проводить статистический анализ или количественные сравнения. Использование диапазонов величин для описания конкретных степеней повреждения известно в данной области, и можно использовать любой походящий диапазон или шкалу. Например, можно присваивать показатели повреждения гербицидом (также называемые показателями устойчивости). Таким образом, на устойчивость к гербициду могут указывать другие оценки на этой школе, где соответствующее контрольное растение (или группа контрольных растений) проявляет статистически более низкий показатель по шкале в ответ на обработку гербицидом, чем группа рассматриваемых растений.
Повреждение, вызываемое гербицидом или другим химическим реагентом, можно оценивать в различные моменты времени после обработки растения гербицидом. Часто, повреждение оценивают приблизительно в момент времени, когда контрольное растение проявляет максимальное повреждение. Иногда повреждение оценивают после периода времени, на протяжении которого контрольное растение, которое не было обработано гербицидом или другим химическим реагентом, выросло и/или развилось на поддающемся измерению уровне по сравнению с размером или стадией, при которых проводили обработку. Повреждение можно оценивать в любой из множества подходящих периодов времени, например, через 12 часов; через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и/или 14 суток; через 3 и/или 4 недели или более, после того, как рассматриваемое растение обработали гербицидом. Является пригодным любой момент времени оценки при условии, что он позволяет обнаружение различий в ответ на обработку исследуемого и контрольного растений.
Гербицид не вызывает "значительного повреждения" растения, либо когда он не имеет эффекта на растение, либо когда он имеет некоторый эффект на растение, после которого растение впоследствии восстанавливается, либо когда он имеет эффект на растение, который является вредоносным, но который уравновешивается, например, воздействием конкретного гербицида на сорняки. Таким образом, например, сельскохозяйственная культура может "не повреждаться значительно" гербицидом или другой обработкой, если растение проявляет менее чем приблизительно 25%, менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10%, менее чем приблизительно 9%, менее чем приблизительно 8%, менее чем приблизительно 7%, менее чем приблизительно 6%, менее чем приблизительно 5%, менее чем приблизительно 4%, менее чем приблизительно 3%, менее чем приблизительно 2% или менее чем приблизительно 1% снижение по меньшей мере одного подходящего параметра, который указывает на здоровье и/или продуктивность растения, по сравнению с соответствующим контрольным растением (например, необработанное растение того же вида). В конкретных вариантах осуществления растение является устойчивым к гербициду или другому химическому реагенту, если оно демонстрирует повреждение по сравнению с соответствующим контрольным растением, которое является меньшим, чем повреждение, которое проявляет контрольное растение, по меньшей мере на 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 90%, 100%, 150%, 200%, 250%, 300%, 400%, 500%, 600%, 700%, 800%, 900%, или 1000% или более. Сельскохозяйственная культура, на которую гербицид или другая обработка не оказывает значительного влияния, может проявлять снижение по меньшей мере одного параметра, однако это снижение является временным, и растение полностью восстанавливается в пределах, например, приблизительно 1 недели, приблизительно 2 недель, приблизительно 3 недель, приблизительно 4 недель или приблизительно 6 недель. В конкретных вариантах осуществления растение, которое является устойчивым к гербициду или другому химическому реагенту, может быть характеризовано тем, что применение гербицида или другого химического реагента не оказывает существенного влияние на растение.
Подходящие параметры, которые указывают на здоровье и/или продуктивность растения, включают, например, но не ограничиваясь ими: высоту растения; вес растения; длину листа; время, прошедшее до конкретной стадии развития; цветение; выход и продукцию семян. Оценку параметра можно проводить путем визуального исследования и/или посредством статистического анализа параметра. После оценки в рассматриваемом растении и контрольном растении, можно проводить сравнение так, чтобы определить, повреждается или не повреждается ли рассматриваемое растение гербицидом или другой обработкой.
Соответствующие контрольные растения, которые можно использовать для определения устойчивости к гербициду (или другому химическому реагенту), включают растения того же вида, которые не содержат предполагаемую гетерологичную нуклеиновую кислоту и/или полипептид, сообщающие устойчивость к гербициду, и растения, которые содержат предполагаемую гетерологичную нуклеиновую кислоту и/или полипептид, сообщающие устойчивость к гербициду, но которые не обработаны гербицидом.
Гербицид: "гербицид" представляет собой химическое вещество, которое вызывает временное или постоянное повреждение растения. Неограничивающие примеры гербицидов приведены и более подробно рассмотрены в настоящем описании. Гербицид может включаться в растение или в его клетки, или он может действовать на растение или его клетки без включения. "Активный ингредиент" представляет собой химическое вещество в гербицидном составе, которое ответственно за фитотоксичность состава. Активные ингредиенты в коммерческих гербицидных составах, как правило, обозначают как активный ингредиент на товарной этикетке. Информация товарных этикеток доступна от U.S. Environmental Protection Agency, и она обновляется в сети Интернет на oaspub.epa.gov/pestlabl/ppls.own. Информация товарных этикеток также доступна в сети Интернет на www.cdms.net.
При использовании в отношении гербицида, термин "эквивалент кислоты" относится к уровню или количеству относительно гербицидно активной исходной кислоты.
Выделенный: "выделенный" биологический компонент (такой как нуклеиновая кислота или полипептид) по существу отделен, продуцирован отдельно или очищен от других биологических компонентов в клетке организма, в которой компонент встречается в природе (т.е. других хромосомных и внехромосомных ДНК и РНК, и белков), при осуществлении химического или функционального изменения компонента (например, нуклеиновая кислота может быть выделена из хромосомы путем разрушения химических связей, соединяющих нуклеиновую кислоту с остальной ДНК в хромосоме). Молекулы нуклеиновых кислот и белки, которые являются "выделенными", включают молекулы нуклеиновых кислот и белки, очищенные стандартными способами очистки. Термин также охватывает нуклеиновые кислоты и белки, полученные путем рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновых кислот, белки и пептиды.
Нуклеиновая кислота: термины "полинуклеотид", "нуклеиновая кислота" и "молекула нуклеиновой кислоты" используют в настоящем описании взаимозаменяемо, и они охватывают одну нуклеиновую кислоту; несколько нуклеиновых кислот; фрагмент, вариант или производное нуклеиновой кислоты; и конструкцию нуклеиновой кислоты (например, матричная РНК (мРНК) и плазмидная ДНК (пДНК)). Полинуклеотид или нуклеиновая кислота могут содержать нуклеотидную последовательность полноразмерной последовательности кДНК или ее фрагмент, включая нетранслируемые 5′- и/или 3′-последовательности и кодирующую последовательность(и). Полинуклеотид или нуклеиновая кислота могут состоять из любого полирибонуклеотида или полидезоксирибонуклеотида, которые могут включать немодифицированные рибонуклеотиды или дезоксирибонуклеотиды или модифицированные рибонуклеотиды или дезоксирибонуклеотиды. Например, полинуклеотид или нуклеиновая кислота могут состоять из одноцепочечной и двухцепочечной ДНК; ДНК, которая представляет собой смесь одноцепочечной и двухцепочечной областей; одноцепочечной и двухцепочечной РНК; и РНК, которая представляет собой смесь одноцепочечной и двухцепочечной областей. Гибридные молекулы, содержащие ДНК и РНК, могут быть одноцепочечными, двухцепочечными, или они могут представлять собой смесь одноцепочечных и двухцепочечных областей. Указанные выше термины также включают химически, ферментативно и метаболически модифицированные формы полинуклеотида или нуклеиновой кислоты.
Понятно, что конкретная ДНК также относится к комплементарной ей ДНК, последовательность которую определяют в соответствии с правилами спаривания дезоксирибонуклеотидных оснований.
Как используют в рамках изобретения, термин "ген" относится к нуклеиновой кислоте, которая кодирует функциональный продукт (РНК или полипептид/белок). Ген может включать регуляторные последовательности, предшествующие (5′-некодирующие последовательности) и/или следующие после (3′-некодирующие последовательности) последовательности, кодирующей функциональный продукт.
Как используют в рамках изобретения, термин "кодирующая последовательность" относится к последовательности нуклеиновой кислоты, которая кодирует конкретную аминокислотную последовательность. "Регуляторная последовательность" относится к нуклеотидной последовательности, расположенной выше (например, 5′-некодирующие последовательности), внутри или ниже (например, 3′-некодирующие последовательности) кодирующей последовательности, которая влияет на транскрипцию, процессинг или стабильность РНК, или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности включают, например, но не ограничиваются ими: промоторы; лидерные последовательности трансляции; интроны; распознаваемые участки для полиаденилирования; участки процессинга РНК; связывающее эффектор участки и структуры стебель-петля.
Как используют в рамках изобретения, термин "вырожденность кодонов" относится к избыточности генетического кода, которая обеспечивает варьирование конкретной нуклеотидной последовательности без влияния на аминокислотную последовательность кодируемого полипептида. Поскольку каждый кодон состоит из трех нуклеотидов, и нуклеотиды, составляющие ДНК, ограничены четырьмя конкретными основаниями, существует 64 возможных комбинации нуклеотидов, 61 из которых кодируют аминокислоты (остальные три кодона кодируют сигналы, завершающие трансляцию). В результате многие аминокислоты обозначаются более чем одним кодоном. Например, аминокислоты аланин и пролин кодируются четырьмя триплетами, серин и аргинин - шестью, в то время как триптофан и метионин кодируются только одним триплетом. "Генетический код", который демонстрирует, какие кодоны кодируют какие аминокислоты, общеизвестен в данной области. Его вырожденность позволяет основаниям ДНК варьировать в широком диапазоне без изменения аминокислотной последовательности белков, кодируемых ДНК.
В некоторых вариантах осуществления в рамках настоящего изобретения, при конструировании кодирующей последовательности для увеличенной экспрессии в клетке-хозяине ген конструируют так, чтобы частота использования кодонов им достигала частоты предпочтительного использования кодонов клеткой-хозяином. Таким образом, термин "кодон-оптимизированный" относится к генам или кодирующим последовательностям нуклеиновых кислот для трансформации различных хозяев, где кодоны в гене или кодирующей последовательности изменены так, чтобы они отражали типичное использование кодонов в организме-хозяине без изменения полипептида, кодируемого нуклеиновой кислоты. Например, такая оптимизация включает замену по меньшей мере одного, более чем одного, значительного количества и/или всех кодонов в гене или кодирующей последовательности одним или более кодонами, которые более часто используются в генах этого организма.
Многие организмы проявляют предпочтение к использованию конкретных кодонов для кодирования вставки конкретной аминокислоты в растущую пептидную цепь. Отличия в преимущественном использовании кодонов или предпочтении кодонов между организмами обеспечиваются вырожденностью генетического кода и документально подтверждены для многих организмов. Предпочтение кодонов часто коррелирует с эффективностью трансляции матричной РНК (мРНК), которая, как полагают, в свою очередь зависит, среди прочих, от свойств транслируемых кодонов и доступности конкретных молекул транспортной РНК (тРНК). Распространенность отдельных тРНК в клетке, как правило, отражает кодоны, наиболее часто используемые для синтеза пептидов. Таким образом, гены можно адаптировать или конструировать для оптимальной экспрессии гена в данном организме на основе оптимизации кодонов.
Учитывая большое количество последовательностей генов, доступных для широкого множества видов животных, растений и микроорганизмов, является возможным вычисление относительных частот использования кодонов. Таблицы использования кодонов являются общедоступными, например, в базе данных "Codon Usage Database", доступной через Интернет на kazusa.или.jp/codon/, и эти таблицы можно адаптировать рядом способов. См. Nakamura et al. (2000) Nucl. Acids Res. 28:292. C использованием таблицы использования кодонов специалист в данной области может использовать частоты, соответствующие данному виду, в любой данной полипептидной последовательности, для конструирования и продуцирования синтетического фрагмента нуклеиновой кислоты кодон-оптимизированной кодирующей области, которая кодирует полипептид, но в которой используются кодоны, оптимальные для данного вида.
Предпочтение кодонов отражается средним составом оснований в кодирующих белок областях. Например, в организмах, имеющих геномы с относительно низким содержанием G+C, используется больше кодонов, имеющих A или T в третьем положении синонимичных кодонов, в то время как в организмах, имеющих более высокое содержание G+C, используется больше кодонов, имеющих G или C в третьем положении. Кроме того, полагают, что присутствие "второстепенных" кодонов в мРНК может снизить абсолютную скорость трансляции этой мРНК, особенно когда относительная распространенность заряженной тРНК, соответствующей второстепенному кодону, является низкой. Продолжением этого рассуждения является то, что уменьшение скорости трансляции индивидуальными второстепенными кодонами может быть по меньшей мере аддитивным для множества второстепенных кодонов. Таким образом, мРНК, имеющие высокое относительное содержание второстепенных кодонов, может соответственно иметь низкие скорости трансляции. Эта скорость может соответственно отражаться низкими уровнями кодируемого белка.
Предпочтение кодонов можно вычислять в качестве частоты, при которой один кодон используется относительно кодонов для всех аминокислот. Альтернативно предпочтение кодонов можно вычислять в качестве частоты, при которой один кодон используется для кодирования конкретной аминокислоты, относительно всех других кодонов для этой аминокислоты (синонимичных кодонов).
Термин "процентная идентичность" (или "% идентичность") относится к взаимосвязи между двумя или более полипептидными последовательностями (или полинуклеотидными последовательностями), при определении путем сравнения последовательностей. Процентная идентичность может выражать степень родства последовательностей между полипептидными (или полинуклеотидными) последовательностями, которую можно определять путем сопоставления цепей таких последовательностей. Как правило, идентичность относится к точному соответствию нуклеотида к нуклеотиду или аминокислоты к аминокислоте в двух полинуклеотидных или полипептидных последовательностях, соответственно. Процентная идентичность двух последовательностей, либо последовательностей нуклеиновой кислоты, либо аминокислотных последовательностей, представляет собой количество точных совпадений между двумя выравниваемыми последовательностями, деленое на длину более короткой последовательностей и умноженное на 100. См. Russell and Barton (1994) J. Mol. Biol. 244:332-50.
Способы выравнивания последовательностей нуклеиновых кислот и аминокислотных последовательностей и определения идентичности известны в данной области и включают, например, но не ограничиваясь ими, способы, описанные в: Computational Molecular Biology (1988) (Lesk, A. M., Ed.) Oxford University, NY; Biocomputing: Informatics and Genome Projects (1993) (Smith, D. W., Ed.) Academic, NY; Computer Analysis of Sequence Data, Part I (1994) (Griffin, A. M., and Griffin, H. G., Eds.) Humania, NJ; Sequence Analysis in Molecular Biology (1987) (von Heinje, G., Ed.) Academic, NY; и Sequence Analysis Primer (1991) (Gribskov, M. and Devereux, J., Eds.) Stockton, NY. Способ определения процентной идентичности между двумя последовательностями может включать предоставление нуклеотидной последовательности мРНК или гена и/или предоставление или установление аминокислотной последовательности, кодируемой ей, и сравнение последовательности(ей) со второй нуклеотидной и/или аминокислотной последовательностью. Геномные последовательности также можно определять и сравнивать таким образом.
Кроме того, способы выравнивания последовательностей нуклеиновых кислот и аминокислотных последовательностей и определения идентичности включены в различные общедоступные компьютерные программы. Выравнивание последовательностей и вычисление идентичности можно проводить, например, с использованием программы AlignX™ пакета программ Vector NTI (Invitrogen, Carlsbad, CA) или программы MegAlign™ биоинформатического вычислительного пакета программ LASERGENE™ (DNASTAR™ Inc., Madison, WI). Множественное выравнивание последовательностей можно проводить с использованием способа Clustal™, который охватывает несколько разновидностей алгоритма выравнивания, включая Clustal™ V и Clustal™ W (Higgins and Sharp (1989) CABIOS 5:151-3; Higgins et al. (1992) Comput. Appl. Biosci. 8:189-91). Для множественных выравниваний в Clustal™ V, величины по умолчанию, которые можно использовать, включают ШТРАФ ЗА ДЕЛЕЦИЮ=10 и ШТРАФ ЗА ПРОДОЛЖЕНИЕ ДЕЛЕЦИИ=10. Параметры по умолчанию для множественного выравнивания в Clustal™ W включают (ШТРАФ ЗА ДЕЛЕЦИЮ=10, ШТРАФ ЗА ПРОДОЛЖЕНИЕ ДЕЛЕЦИИ=0,2, приостановка расходящихся последовательностей (%)=30, вес транзиции ДНК=0,5, весовая матрица белков=Gonnet Series, весовая матрица ДНК=IUB). Параметры по умолчанию для попарного выравнивания и вычисления процентной идентичности между белковыми последовательностями, которые можно использовать в способе Clustal™, представляют собой KTUPLE=1, ШТРАФ ЗА ДЕЛЕЦИЮ=3, ОКНО=5 и СОХРАНЕНИЕ ДИАГОНАЛЕЙ=5. Для нуклеиновых кислот, эти параметры по умолчанию могут представлять собой KTUPLE=2, ШТРАФ ЗА ДЕЛЕЦИЮ=5, ОКНО=4 и СОХРАНЕНИЕ ДИАГОНАЛЕЙ=4. После выравнивания последовательностей с использованием программы Clustal™, можно получить "процентную идентичность" путем изучения таблицы "расстояний между последовательностями" в той же программе.
В некоторых вариантах осуществления нуклеиновая кислота кодирует полипептид, обладающий идентичностью последовательности (по сравнению с эталонным полипептидом; например, полипептид DGT), например, но не ограничиваясь этим: по меньшей мере приблизительно 55%; по меньшей мере приблизительно 60%; по меньшей мере приблизительно 65%; по меньшей мере приблизительно 70%; по меньшей мере приблизительно 75%; по меньшей мере приблизительно 80%; по меньшей мере приблизительно 85%; по меньшей мере приблизительно 90%; и по меньшей мере приблизительно 95%, и он имеет ту же функцию, что и у эталонного полипептида, или сходную с ним функцию. Таким образом, любой целочисленный процент идентичности от, например, 55% до 100% может быть пригодным для описания конкретных нуклеиновых кислот в рамках настоящего изобретения, например, но не ограничиваясь этим: 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99%. Определенные фрагменты нуклеиновых кислот не только обладают указанной выше идентичностью последовательностей, но также они могут кодировать полипептид, имеющий, например, но не ограничиваясь этим: по меньшей мере 50 аминокислот; по меньшей мере 100 аминокислот; по меньшей мере 150 аминокислот; по меньшей мере 200 аминокислот и по меньшей мере 250 аминокислот. Конкретные варианты осуществления включают нуклеиновую кислоту, обладающую по меньшей мере приблизительно 90% идентичностью с SEQ ID NO: 1 (например, по меньшей мере приблизительно 89% идентичностью; по меньшей мере приблизительно 90% идентичностью; по меньшей мере приблизительно 91% идентичностью; по меньшей мере приблизительно 92% идентичностью; по меньшей мере приблизительно 93% идентичностью; по меньшей мере приблизительно 94% идентичностью; по меньшей мере приблизительно 95% идентичностью; по меньшей мере приблизительно 96% идентичностью; по меньшей мере приблизительно 97% идентичностью; по меньшей мере приблизительно 98% идентичностью; по меньшей мере приблизительно 99% идентичностью; и по меньшей мере приблизительно 99,5% идентичностью).
Термин "программное обеспечение для анализа последовательностей" относится к компьютерному алгоритму или программе, которые пригодны для анализа нуклеотидных или аминокислотных последовательностей. "Программное обеспечение для анализа последовательностей" может быть коммерчески доступным или независимо разработанным. Неограничивающие примеры программного обеспечения для анализа последовательностей включают: пакет программ GCG (Wisconsin Package Version 9,0, Genetics Computer Group (GCG), Madison, WI); BLASTP™, BLASTN™ и BLASTX™ (Altschul et al. (1990) J. Mol. Biol. 215:403-10); DNASTAR™ (DNASTAR™, Inc. Madison, WI); Sequencher™ (Gene Codes Corporation, Ann Arbor, MI); и программу FASTA™, включающую алгоритм Смита-Ватермана (Pearson (1994) Comput. Methods Genome Res. [Proc. Int. Symp.], Meeting Date 1992 (Suhai and Sandor, Eds.), Plenum: New York, NY, pp. 111-20). Когда программное обеспечение для анализа последовательностей использовали для анализа нуклеотидной или аминокислотной последовательности в рамках настоящего изобретения, представленные результаты анализа были получены с использованием параметров по умолчанию указанной программы, если нет иных указаний. Как используют в рамках изобретения, термин "параметры по умолчанию" относится к набору величин или параметров, которые первоначально загружаются программой для анализа последовательностей, когда ее первоначально запускают.
Гибридизация: нуклеиновую кислоту, содержащую всю нуклеотидную последовательность или ее часть, можно использовать в качестве зонда, который селективно "гибридизуется" с нуклеотидными последовательностями, присутствующими в популяции клонированных фрагментов геномной ДНК или фрагментов кДНК (например, геномные библиотеки или библиотеки кДНК выбранного организма), которые обладают значительным уровнем идентичности последовательности с последовательностью зонда. Зонд для гибридизации может представлять собой фрагмент геномной ДНК; фрагмент плазмидной ДНК; фрагмент кДНК; фрагмент РНК; амплифицированный способом ПЦР фрагмент ДНК; олигонуклеотид; или другой полинуклеотид, и зонд может быть меченным поддающейся обнаружению группой (например, 32P), или любым другим поддающимся обнаружению маркером. Таким образом, например, но не ограничиваясь этим, зонд для гибридизации может быть получен путем мечения синтетического олигонуклеотида, который специфично гибридизуется с нуклеиновой кислотой в рамках настоящего изобретения (например, нуклеиновая кислота, обладающая по меньшей мере приблизительно 90% идентичностью с SEQ ID NO: 1). Способы получения зондов для гибридизации и конструирования библиотек кДНК и геномных библиотек известны в данной области. Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. Обширное руководство по гибридизации нуклеиновых кислот может быть найдено в Sambrook et al. (1989), выше; и Ausubel et al. (1997) Short Protocols in Molecular Biology, Third Edition, Wiley, NY, New York, pp. 2-40.
В некоторых вариантах осуществления, гибридизацию нуклеиновых кислот (например, с амплифицированной ДНК) можно использовать для идентификации присутствия трансгенного объекта в образце. Молекулы нуклеиновых кислот или их фрагменты способны "специфично гибридизоваться" с другой молекулой нуклеиновой кислоты в определенных обстоятельствах. В некоторых примерах нуклеиновая кислота специфично гибридизуется в жестких условиях с нуклеиновой кислотой-мишенью. Как используют в рамках изобретения, две молекулы нуклеиновой кислоты называют способными специфично гибридизоваться друг с другом, если две молекулы способны образовывать антипараллельную двухцепочечную структуру нуклеиновой кислоты в жестких (например, высокой жесткости) условиях.
Нуклеиновую кислоту называют "комплементарной" другой молекуле нуклеиновой кислоты, если две молекулы нуклеиновой кислоты проявляют полную комплементарность последовательностей. Как используют в рамках изобретения, нуклеиновые кислоты называют проявляющими "полную комплементарность", когда каждый нуклеотид одной из молекул комплементарен нуклеотиду другой. Молекулы, которые проявляют полную комплементарность, как правило, гибридизуются друг с другом с достаточной стабильностью, чтобы обеспечивался их отжиг друг с другом в общепринятых условиях "высокой жесткости". Общепринятые условия высокой жесткости описаны Sambrook et al. (1989), выше.
Две молекулы называют проявляющими "минимальную комплементарность", если они могут гибридизоваться друг с другом с достаточной стабильностью, чтобы позволить им оставаться в состоянии отжига по меньшей мере в общепринятых условиях "низкой жесткости". Общепринятые условия низкой жесткости также описаны Sambrook et al. (1989), выше. Чтобы молекула нуклеиновой кислоты служила в качестве праймера или зонда, она должна проявлять только минимальную комплементарность последовательности, чтобы она быть способной образовывать стабильную двухцепочечную структуру в конкретном используемом растворителе и в конкретных используемых концентрациях соли.
Факторы, которые влияют на жесткость гибридизации, хорошо известны специалистам в данной области и включают, например: температуру; pH; ионную силу и концентрацию органических растворителей (например, формамид и диметилсульфоксид). Как известно специалистам в данной области, жесткость гибридизации возрастает при более высокой температуре, более низкой ионной силе и более низких концентрациях растворителя. Жесткие условия также можно обеспечивать добавлением дестабилизаторов, таких как формамид.
Термин "жесткие условия" или "условия жесткости" определяют в отношении гибридизации одной нуклеиновой кислоты с другой нуклеиновой кислотой-мишенью (т.е. с молекулой нуклеиновой кислоты, содержащей конкретную представляющую интерес нуклеотидную последовательность) посредством конкретной процедуры гибридизации, рассмотренной в Sambrook et al. (1989), выше (9.52-9.55). Также см. Sambrook et al. (1989), 9.47-9.52 и 9.56-9.58.
В частности, во многих применениях он относится к условиям промываний после гибридизации, где факторы включают ионную силу и температуру промывочного раствора. Для гибридов ДНК-ДНК температура плавления (Tm) может быть приблизительно установлена из уравнения:
|
где M представляет собой молярность одновалентных катионов, %GC представляет собой процент гуанозиновых и цитозиновых нуклеотидов в ДНК, %form представляет собой процент формамида в растворе для гибридизации, и L представляет собой длину гибрида в парах оснований. Meinkoth and Wahl (1984) Anal. Biochem. 138:267-84.
Tm представляет собой температуру (при конкретной ионной силе и pH), при которой 50% комплементарной последовательности-мишени гибридизуется с абсолютно соответствующим зондом. Tm снижается приблизительно на 1°C для каждого 1% несовпадающих оснований. Таким образом, для гибридизации Tm, гибридизацию и/или условия промывания можно корректировать для последовательностей с желаемой идентичностью. Например, если требуется гибридизация последовательностей с 90% идентичностью, Tm можно снизить на 10°C (при конкретной ионной силе и pH). Жесткие условия можно выбирать, например, так, чтобы они были приблизительно на 5°C ниже температуры плавления (Tm) конкретной последовательности и комплементарной ей последовательности при определенной ионной силе и pH. Однако в условиях высокой жесткости может использоваться гибридизация и/или промывание при температуре на 1, 2, 3 или 4°C ниже Tm; в условиях умеренной жесткости может использоваться гибридизация и/или промывание при температуре на 6, 7, 8, 9, или 10°C ниже Tm; в условиях низкой жесткости может использоваться гибридизация и/или промывание при температуре на 11-20°C ниже Tm.
В некоторых примерах жесткие условия представляют собой условия, в которых концентрация соли составляет менее чем приблизительно 1,5 M Na+ (например, приблизительно от 0,01 до 1,0 M Na+) при pH 7,0-8,3, и температура составляет по меньшей мере приблизительно 30°C для коротких нуклеиновых кислот (например, от 10 до 50 нуклеотидов в длину) и по меньшей мере приблизительно 60°C для длинных зондов (например, более 50 нуклеотидов в длину). Иллюстративные условия низкой жесткости включают гибридизацию с буферным раствором из 30-35% формамида, 1,0 M NaCl, 0,1% додецилсульфата натрия (SDS) при 37°C, и промывание в 1X-2X SSC (20X SSC=3,0 M NaCl/0,3 M трицитрате натрия) при 50-55°C. Иллюстративные условия умеренной жесткости включают гибридизацию в 40-45% формамиде, 1,0 M NaCl, 0,1% SDS при 37°C, и промывание в 0,5X-1X SSC при 55-60°C. Иллюстративные условия высокой жесткости включают гибридизацию в приблизительно 50% формамиде, приблизительно 1,0 M соли Na, приблизительно 0,1% SDS при приблизительно 37°C, и промывание приблизительно в 0,1X SSC при приблизительно 60-65°C.
Как используют в рамках изобретения, термин "полипептид" включает один полипептид, множество полипептидов и их фрагменты. Этот термин относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин "полипептид" относится к любой цепи или цепям из двух или более аминокислот, и он не относится к конкретной длине или размеру продукта. Таким образом, определение "полипептид" включает пептиды, дипептиды, трипептиды, олигопептиды, белок, аминокислотную цепь и любой другой термин, используемый для обозначения цепи или цепи из двух или более аминокислот, и указанные выше термины используют взаимозаменяемо с термином "полипептид" в рамках настоящего изобретения. Полипептид может быть выделенным из природного биологического источника или он может быть продуцирован с помощью рекомбинантной технологии, однако конкретный полипептид не обязательно транслируется с конкретной нуклеиновой кислоты. Полипептид может быть получен любым подходящим способом, включая, например, но не ограничиваясь этим, химический синтез.
Эндогенный и гетерологичный: как используют в рамках изобретения, термин "нативный" относится к форме полинуклеотида, гена или полипептида, которая встречается в природе с ее собственными регуляторными последовательностями, при их наличии. Термин "эндогенный" относится к нативной форме полинуклеотида, гена или полипептида в его природном положении в организме или в геноме организма.
В противоположность этому, термин "гетерологичный" относится к полинуклеотиду, гену или полипептиду, которые обычно не встречаются в их положении в эталонном (хозяйском) организме. Например, гетерологичная нуклеиновая кислота может представлять собой нуклеиновую кислоту, которая обычно встречается в эталонном организме в отличающемся геномном положении. В качестве дополнительного примера, гетерологичная нуклеиновая кислота может представлять собой нуклеиновую кислоту, которая обычно не встречается в эталонном организме. Организм хозяина, содержащий гетерологичный полинуклеотид, ген или полипептид, можно получать путем внесения гетерологичного полинуклеотида, гена или полипептида в организм хозяина. В конкретных примерах гетерологичный полинуклеотид содержит нативную кодирующую последовательность или ее часть, которые повторно вводят в являющийся их источником организм в форме, которая отличается от соответствующего нативного полинуклеотида. В конкретных примерах, гетерологичный ген содержит нативную кодирующую последовательность или ее часть, которые повторно вводят в являющийся их источником организм в форме, которая отличается от соответствующего нативного гена. Например, гетерологичный ген может включать нативную кодирующую последовательность, являющуюся частью химерного гена, включающей ненативные регуляторные области, который повторно вводят нативному хозяину. В конкретных примерах гетерологичный полипептид представляет собой нативный полипептид, который повторно вводят в являющийся его источником организм в форме, которая отличается от соответствующего нативного полипептида.
Гетерологичный ген или полипептид могут представлять собой ген или полипептид, которые содержат функциональный полипептид или последовательность нуклеиновой кислоты, кодирующие функциональный полипептид, который является слитым с другими генами или полипептидом с образованием химерного или слитого полипептида или кодирующего его гена. Гены и белки конкретных вариантов осуществления включают конкретно проиллюстрированные полноразмерные последовательности и части, сегменты, фрагменты (включая непрерывные фрагменты и внутренние и/или концевые делеции по сравнению с полноразмерными молекулами), варианты, мутанты, химеры и слитые конструкции этих последовательностей.
Модификация: как используют в рамках изобретения, термин "модификация" может относиться к изменению конкретного эталонного полинуклеотида, которое приводит к сниженной, по существу устраненной или устраненной активности полипептида, кодируемого эталонным полинуклеотидом. Модификация также может относиться к изменению эталонного полипептида, которое приводит к сниженной, по существу устраненной или устраненной активности эталонного полипептида. Альтернативно термин "модификация" может относиться к изменению эталонного полинуклеотида, которое приводит к увеличенной или усиленной активности полипептида, кодируемого эталонным полинуклеотидом, а также к изменению эталонного полипептида, которое приводит к увеличенной или усиленной активности эталонного полипептида. Изменения, такие как указанные выше изменения, можно вносить любым из нескольких способов, хорошо известных в данной области, включая, например, но не ограничиваясь этим: удаление части эталонной молекулы; внесение мутации в эталонную молекулу (например, посредством спонтанного мутагенеза, посредством случайного мутагенеза, посредством мутагенеза с помощью генов-мутаторов или посредством мутагенеза с помощью транспозона); замену части эталонной молекулы; встраивание элемента в эталонную молекулу; подавление экспрессии эталонной молекулы; изменение клеточного положения эталонной молекулы; изменение состояния эталонной молекулы (например, путем метилирования эталонного полинуклеотида и путем фосфорилирования или убиквитинилирования эталонного полипептида); удаление кофактора эталонной молекулы; введение антисмысловой РНК/ДНК, нацеленной на эталонную молекулу; введение интерферирующей РНК/ДНК, нацеленной на эталонную молекулу; химическую модификацию эталонной молекулы; ковалентную модификацию эталонной молекулы; облучение эталонной молекулы УФ-излучением или рентгеновским излучением; гомологичную рекомбинацию, которая изменяет эталонную молекулу; митотическую рекомбинацию, которая изменяет эталонную молекулу; замену промотора эталонной молекулы; и/или комбинации любых из указанных выше.
При определении того, какие нуклеотиды или аминокислотные остатки можно модифицировать в конкретном примере, указания могут быть найдены путем сравнения последовательности эталонного полинуклеотида или полипептида с гомологичными (например, гомологичными дрожжевыми или бактериальными) полинуклеотидами или полипептидами, и максимизации количества модификаций, внесенных в области высокой гомологии (консервативные области) или консенсусные последовательности.
Производное и вариант: термин "производное", как используют в рамках изобретения, относится к модификации иллюстративной последовательности в рамках настоящего изобретения. Такие модификации включают замену, вставку и/или делецию одного или нескольких оснований кодирующей последовательности в рамках настоящего изобретения, которые сохраняют, немного изменяют или повышают функцию кодирующей последовательности в сельскохозяйственных культурах. Такие производные может без труда определять специалист в данной области, например, но не ограничиваясь этим, с использованием способов компьютерного моделирования для прогнозирования и оптимизации структуры последовательности. Термин "производное", таким образом, также включает гетерологичные нуклеиновые кислоты, содержащие последовательность, обладающую значительной идентичностью последовательности с иллюстративной последовательностью в рамках настоящего изобретения, так что они могут иметь такую же, немного измененную или увеличенную функциональность для применения для экспрессии DGT-28 в сельскохозяйственной культуре.
Как используют в рамках изобретения, термин "вариант" относится к полипептиду, отличающемуся от иллюстративного полипептида в рамках настоящего изобретениям вставками, делециями, мутациями и/или заменами аминокислот, которые можно вносить с использованием, например, но не ограничиваясь ими, способами рекомбинантных ДНК. При определении того, какие аминокислотные остатки можно заменять, добавлять или удалять в эталонной аминокислотной последовательности, указания могут быть найдены путем сравнения последовательности конкретного эталонного полипептида с последовательностью гомологичных полипептидов и минимизации количества изменений аминокислотной последовательности, внесенных в области высокой гомологии (консервативные области), или путем замены аминокислот консенсусной последовательностью. Вариант полипептида может иметь замещенные аминокислоты, и, тем не менее, сохранять функциональную активность эталонного полипептида. "Варианты" генов содержат нуклеотидную последовательность, которая кодирует тот же полипептид, что и эталонной ген, или эквивалентный полипептид, который обладает активностью, эквивалентной или сходной с эталонным полипептидом.
В некоторых вариантах осуществления для получения вариантов белков можно использовать варианты генов, и для получения вариантов белков можно использовать рекомбинантных хозяев. Например, можно конструировать варианты генов и белков, которые содержат последовательно расположенные остатки (аминокислотные или нуклеотидные) любой иллюстративной последовательности в рамках настоящего изобретения. Вариант гена или белка может иметь, например, но не ограничиваясь этим: 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292 и 293 последовательно расположенных остатков (аминокислотных или нуклеотидных), которые соответствуют сегменту (того же размера) в проиллюстрированной последовательности. Сегменты аналогичных размеров, особенно сегменты консервативных областей, также можно использовать в качестве зондов и/или праймеров.
Специалистам в данной области понятно, что многие уровни идентичности последовательностей являются пригодными для идентификации полипептидов (например, одного вида), которые обладают той же или сходной функцией или активностью, что и эталонный полипептид. В некоторых вариантах осуществления вариант полипептида, обладающий идентичностью последовательности (по сравнению с эталонным полипептидом; например, полипептидом DGT-28), например, но не ограничиваясь этим: по меньшей мере приблизительно 55%; по меньшей мере приблизительно 60%; по меньшей мере приблизительно 65%; по меньшей мере приблизительно 70%; по меньшей мере приблизительно 75%; по меньшей мере приблизительно 80%; по меньшей мере приблизительно 85%; по меньшей мере приблизительно 90%; и по меньшей мере приблизительно 95%, обладает той же или сходной функцией, что и у эталонного полипептида.
Стратегии моделирования и конструирования вариантов генов и белков, которые содержат последовательно расположенные остатки конкретной молекулы, можно определять путем получения и исследования структуры представляющего интерес белка (например, 3-D (трехмерные) координаты атомов из кристаллической структуры и/или молекулярной модели). В некоторых примерах стратегия может быть направлена на определенные сегменты белка, которые являются идеальными для модификации, такие как экспонированные на поверхности сегменты, но не внутренние сегменты, которые вовлечены в сворачивание белка и необходимы для целостности 3-D структуры. Патент США № 5605793, например, относится к способам обеспечения дополнительного молекулярного разнообразия с использованием повторной сборки ДНК после случайной или сфокусированной фрагментации. Это может называться "шаффлингом" генов, который, как правило, вовлекает смешение фрагментов (желаемого размера) двух или более различных молекул ДНК, с последующими повторяющимися раундами ренатурации. Этот процесс может повышать активность белка, кодируемого рассматриваемым геном. Результатом может быть химерный белок, имеющий увеличенную активность, измененную субстратную специфичность, увеличенную устойчивость к ферментам, измененную стереоспецифичность или другие характеристики.
Аминокислотная "замена" может быть результатом замены одной аминокислоты в эталонной последовательности другой аминокислотой, имеющей сходные структурные и/или химические свойства (т.е. консервативная аминокислотная замена), или она может быть результатом замены одной аминокислоты в эталонной последовательности другой аминокислотой, имеющей отличающиеся структурные и/или химические свойства (т.е. неконсервативная аминокислотная замена). Аминокислоты могут быть отнесены к следующим структурным и/или химическим классам: неполярные; незаряженные полярные; основные и кислые. Таким образом, "консервативные" аминокислотные замены можно вносить, исходя из сходства полярности, заряда, растворимости, гидрофобности, гидрофильности или амфипатической природы вовлеченных остатков. Например, неполярные (гидрофобные) аминокислоты включают глицин, аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; незаряженные (нейтральные) полярные аминокислоты включают серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Альтернативно "неконсервативные" аминокислотные замены можно вносить путем выбора отличий в полярности, заряде, растворимости, гидрофобности, гидрофильности или амфипатической природе любой из этих аминокислот. "Вставки" или "делеции" могут находиться в пределах диапазона изменений, структурно или функционально допустимых для рекомбинантных белков.
В некоторых вариантах осуществления вариант белка является "укороченным" в отношении эталонного полноразмерного белка. В некоторых примерах укороченный белок сохраняет функциональную активность эталонного белка. Под "укороченным" белком подразумевают, что часть белка может быть отщеплена, например, в то время как укороченный белок сохраняет и проявляет желаемую активность после расщепления. Расщепление может быть осуществлено любыми из различных протеаз. Более того, эффективно расщепленные белки можно получать с использованием способов молекулярной биологии, где основания ДНК, кодирующие часть белка, удаляют из кодирующей последовательности либо путем расщепления эндонуклеазами рестрикции, либо другими способами, доступными квалифицированному специалисту. Укороченный белок может экспрессироваться в гетерологичной системе, например, E.coli, бакуловирусах, вирусных системах на основе растений и дрожжах. Укороченные белки, сообщающие устойчивость к гербицидам, можно подтверждать с использованием гетерологичной системы, экспрессирующей белок, в биоанализе устойчивости к гербицидам, как описано в настоящем описании. В данной области хорошо известно, что укороченные белки могут быть успешно получены так, чтобы они сохраняли функциональную активность полноразмерного эталонного белка. Например, белки Bt можно использовать в укороченной (коровый белок) форме. См., например, Hofte and Whiteley (1989) Microbiol. Rev. 53(2):242-55; и Adang et al. (1985) Gene 36:289-300.
В некоторых случаях, особенно для экспрессии в растениях, может быть преимущественным использование укороченных генов, которые экспрессируют укороченные белки. Укороченные гены могут кодировать полипептид, составляющий, например, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% полноразмерного белка.
Варианты генов и белков, которые сохраняют функцию эталонной последовательности, на основе которой их конструируют, могут быть определены специалистом в данной области, например, путем анализа рекомбинантных вариантов в отношении активности. Если такой анализ активности известен и охарактеризован, тогда определение функциональных вариантов требует только стандартного экспериментирования.
Конкретные изменения "активного центра" фермента можно вносить так, чтобы они влияли на присущую ему функциональность в отношении активности или стереоспецифичности. См. Muller et. al. (2006) Protein Sci. 15(6):1356-68. Например, известную структуру tauD используют в качестве модельной диоксигеназы для определения остатков активного центра, когда она связана с ее собственным субстратом таурином. См. Elkins et al. (2002) Biochemistry 41(16):5185-92. Дополнительная информация, касающаяся оптимизации последовательностей и конструктивной осуществимости активных центров ферментов, может быть найдена в Chakrabarti et al. (2005) Proc. Natl. Acad. Sci. USA 102(34):12035-40.
Различные структурные свойства и трехмерные признаки белка можно изменять без отрицательного влияния на активность/функциональность белка. Можно вносить консервативные аминокислотные замены, которые не оказывают отрицательно влияния на активность и/или трехмерную конфигурацию молекулы ("допустимые" замены). Также можно конструировать варианты белков, которые отличаются на уровне последовательности от эталонного белка, но которые сохраняют ту же или сходную общую необходимую трехмерную структуру, распределение поверхностного заряда и т.п. См., например, патент США 7058515; Larson et al. (2002) Protein Sci. 11:2804-13; Crameri et al. (1997) Nat. Biotechnol. 15:436-8; Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-51; Stemmer (1994) Nature 370:389-91; Stemmer (1995) Bio/Technology 13:549-53; Crameri et al. (1996) Nat. Med. 2:100-3; и Crameri et al. (1996) Nat. Biotechnol. 14: 315-9.
Также можно проводить компьютерное конструирование 5′ или 3′ UTR (например, синтетические шпильки), которые пригодны для применения в экспрессирующей конструкции (например, экспрессирующей конструкции DGT-28) и его можно использовать для конструирования элементов в нуклеиновых кислотах некоторых вариантов осуществления в рамках настоящего изобретения. Компьютерное моделирование и UTR и способы компьютерного моделирования для применения в предсказании/оценке производных 5′- и 3′-UTR включают, например, но не ограничиваются ими: MFoLd™ версии 3.1 (доступную от Genetics Corporation Group, Madison, WI; см. Zucker et al. "Algorithms and Thermodynamics for RNA Secondary Structure Prediction: A Practical Guide", RNA Biochemistry and Biotechnology, 11-43, J. Barciszewski & B.F.C. Clark, eds., NATO ASI Series, Kluwer Academic Publishers, Dordrecht, NL, 1999; Zucker et al. (1999) J. Mol. Biol. 288:911-40; Zucker et al. "RNA Secondary Structure Prediction," Current Protocols in Nucleic Acids Chemistry, S. Beaucage, D.E. Bergstrom, G.D. Glick, и R.A. Jones eds., John Wiley & Sons, New York, 11.2.1-11.2.10, 2000); и COVE™ (структурный анализ РНК с использованием ковариационных моделей (стохастические контекстно-независимые грамматические способы)) v.2.4.2 (Eddy and Durbin (1994) Nucl. Acids Res. 22:2079-88), которая свободно распространяется в виде исходного текста и которую можно загрузить путем доступа к web-сайту genetics.wustl.edu/eddy/software/; и FOLDALIGN™ (см. Gorodkin et al. (1997) Nicleic Acid Res. 25(18):3724-32, и Gorodkin et al. (1997) Proceedings International Conference on Intelligent Systems for Molecular Biology ISMB International Conference on Intelligent Systems for Molecular Biology 5:120-123), также свободно распространяемую и доступную для загрузки с web-сайта, foldalign.ku.dk/software/index.html.
Промотор: термин "промотор" относится к последовательности ДНК, способной контролировать экспрессию нуклеиновой кислоты, кодирующей последовательность или функциональную РНК. Например, контролируемая кодирующая последовательность расположена с 3′-стороны от промоторной последовательности. Промотор может происходить полностью из его нативного гена, промотор может содержать различные элементы, происходящие из различных промоторов, встречающихся в природе, или даже промотор может содержать синтетические сегменты ДНК. Специалистам в данной области понятно, что различные промоторы могут контролировать экспрессию гена в различных тканях или типах клеток, или на различных стадиях развития, или в ответ на различные условия окружающей среды или физиологические условия. Примеры всех из указанных выше промоторов известны, и их используют в данной области для контроля экспрессии гетерологичных нуклеиновых кислот. Промоторы, которые могут направлять экспрессию гена в большинстве типов клеток в большинство моментов времени, обычно называют "конститутивными промоторами". Более того, в то время как специалисты данной области предпринимали попытки (в большинстве случаев успешно) определить точные границы регуляторных последовательностей, стало понятно, что фрагменты ДНК различной длины могут иметь идентичную промоторную активность. Промоторную активность конкретной нуклеиновой кислоты можно анализировать с использованием способов, известных специалистам в данной области.
Функционально связанный: термин "функционально связанный" относится к ассоциации последовательностей нуклеиновой кислоты на одной нуклеиновой кислоте, где функция одной из последовательностей нуклеиновых кислот находится под влиянием другой. Например, промотор функционально связан с кодирующей последовательностью, когда промотор способен осуществлять экспрессию этой кодирующей последовательности (например, кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующая последовательность может быть функционально связана с регуляторной последовательностью в смысловой или антисмысловой ориентации.
Экспрессия: термин "экспрессия", как используют в рамках изобретения, может относиться к транскрипции и стабильному накоплению смысловой (мРНК) или антисмысловой РНК, происходящей из ДНК. Экспрессия также может относиться к трансляции мРНК в полипептид. Как используют в рамках изобретения, термин "сверхэкспрессия" относится к экспрессии, которая превышает эндогенную экспрессию указанного гена или родственного гена. Таким образом, гетерологичный ген "сверхэкспрессируется", если его экспрессия превышает экспрессию аналогичного эндогенного гена.
Трансформация: как используют в рамках изобретения, термин "трансформация" относится к переносу и встраиванию нуклеиновой кислоты или ее фрагмента в организм хозяина, который приводит к генетически стабильному наследованию. Организмы-хозяева, содержащие трансформированную нуклеиновую кислоту, называют "трансгенными", "рекомбинантными" или "трансформированными" организмами. Известные способы трансформации включают, например: трансформацию, опосредуемую Agrobacterium tumefaciens или A. rhizogenes; трансформацию с фосфатом кальция; трансформацию с полибреном; слияние протопластов; электропорацию; ультразвуковые способы (например, сонопорация); трансформацию с помощью липосом; микроинъекцию; трансформацию "голой" ДНК; трансформацию плазмидными векторами; трансформацию вирусными векторами; биолистическую трансформацию (бомбардировка микрочастицами); опосредуемую карбидом кремния WHISKERS трансформацию; направленный поток аэрозоля; и опосредуемую PEG трансформацию.
Введенный: как используют в рамках изобретения, термин "введенный" (в контексте введения нуклеиновой кислоты в клетку) включает трансформацию клетки, а также скрещивание растения, содержащего нуклеиновую кислоту, со вторым растением, так чтобы второе растение содержало нуклеиновую кислоту, которое можно проводить с использованием общепринятых способов разведения растений. Такие способы разведения известны в данной области. Для обсуждения способов разведения растений, см. Poehlman (1995) Breeding Field Crops, 4th Edition, AVI Publication Co., Westport CT.
Для введения нуклеиновой кислоты в растение можно использовать способы обратного скрещивания. Этот способ используют в течение десятилетий для внесения признаков в растения. Пример описания обратного скрещивания (и других методологий скрещивания растений) может быть найден, например, в Poelman (1995), выше; и Jensen (1988) Plant Breeding Methodology, Wiley, New York, NY. В иллюстративном протоколе обратного скрещивания исходное представляющее интерес растение ("рекуррентное родительское растение") скрещивают со вторым растением ("нерекуррентное родительское растение"), которое содержит нуклеиновую кислоту, подлежащую введению. Затем полученное от этого скрещивания потомство вновь скрещивают с рекуррентным родительским растением, и процесс повторяют до тех пор, пока не получат преобразованное растение, где в преобразованном растении восстановлены по существу все из желаемых морфологических и физиологических характеристик рекуррентного растения, в дополнение к нуклеиновой кислоте из нереккурентного растения.
Плазмида/вектор: Термины "плазмида" и "вектор", как используют в рамках изобретения, относятся к внехромосомному элементу, который может содержать один или несколько ген(ов), который не является частью центрального метаболизма клетки. Плазмиды и векторы, как правило, представляют собой замкнутые двухцепочечные молекулы ДНК. Однако, плазмиды и векторы могут представлять собой линейные и замкнутые нуклеиновые кислоты, из одно- или двухцепочечной ДНК или РНК, и они могут происходить из любого источника, в котором ряд нуклеотидных последовательностей связан или рекомбинирован в уникальную конструкцию, которая способна ввести промоторный фрагмент и кодирующую последовательность ДНК вместе с соответствующей 3′-нетранслируемой последовательностью в клетку. Например, плазмиды и векторы могут содержать автономно реплицирующиеся последовательности, последовательности для встраивания в геном и/или фаговые или нуклеотидные последовательности.
III. DGT-28 и последовательности, кодирующие DGT-28
Некоторые варианты настоящего изобретения относятся к выделенному полипептиду, обладающему по меньшей мере 90% идентичностью (например 89%, по меньшей мере 90%, меньшей мере 91%, меньшей мере 92%, меньшей мере 93%, меньшей мере 94%, меньшей мере 95%, меньшей мере 96%, меньшей мере 97%, меньшей мере 98% и меньшей мере 99% идентичностью) с SEQ ID NO: 1. Такой полипептид обозначают в настоящем описании как полипептид DGT-28. Некоторые варианты осуществления настоящего изобретения относятся к нуклеиновой кислоте, кодирующей полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1. Конкретные примеры такой нуклеиновой кислоты обозначают в настоящем описании как нуклеиновая кислота "dgt-28". Нуклеиновые кислоты Dgt-28 могут быть пригодными в любом из широкого множества применений (например, внесение устойчивости к глисофату), при которых в клетке растения является желательным модифицированный метаболизм глифосата.
Конкретные примеры нуклеиновых кислот dgt-28, предоставленные в настоящем описании для иллюстративных целей, представляют собой SEQ ID NO: 2 и 3. Таким образом, некоторые варианты осуществления относятся к нуклеиновой кислоте, содержащей нуклеотидную последовательность, обладающую по меньшей мере приблизительно 80% идентичностью последовательности (например, 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% и по меньшей мере 99% идентичностью) с SEQ ID NO: 2 или SEQ ID NO: 3, где нуклеиновая кислота кодирует полипептид, обладающий по меньшей мере приблизительно 90% идентичностью с SEQ ID NO: 1. Конкретные примеры нуклеиновых кислот dgt-28 включают нуклеиновые кислоты, которые специфично гибридизуются с нуклеиновой кислотой, обладающей SEQ ID NO: 2 или SEQ ID NO: 3 в жестких условиях (например, условиях высокой жесткости).
В некоторых вариантах осуществления предусматриваются кодон-оптимизированные нуклеиновые кислоты dgt-28. Например, для обеспечения высокой экспрессии гетерологичного гена в растении, может быть желательным моделирование и переконструирование гена так, чтобы он более эффективно экспрессировался в клетке растения. Эта стратегия может быть особенно желательной в обстоятельствах, где бактериальный ген конструируют так, чтобы он экспрессировался в клетке растения.
Таким образом, некоторые примеры в рамках настоящего изобретения относятся к оптимизированному для растения гену, кодирующему белок DGT-28, и к способам его моделирования, для получения последовательности ДНК, которая может оптимально экспрессироваться в двудольных или однодольных растениях, и в которой модификации последовательности не препятствуют трансляции или транскрипции. Моделирование оптимизированного гена, кодирующего dgt-28, для экспрессии того же белка DGT-28 как в однодольных, так и в двудольных растениях, проиллюстрировано в настоящем описании путем переконструирования кодирующей белок области этого гена для оптимальной экспрессии. Иллюстративные оптимизированные для растений нуклеиновые кислоты dgt-28 в рамках настоящего изобретения включают SEQ ID NO: 2 и SEQ ID NO: 3.
При конструировании гена, кодирующего белок DGT-28, для экспрессии в двудольных или однодольных растениях (например, хлопке, каноле, табаке, кукурузе, сое, пшенице и рисе), можно определять предпочтение кодонов будущего растения(ий)-хозяина, например, с использованием общедоступных баз данных о последовательности ДНК для поиска информации о распределении кодонов в геномах растений или кодирующих белок областях генов различных растений.
При конструировании кодирующих областей в нуклеиновой кислоте для экспрессии в растении, необходимо определять основные кодоны ("первого выбора"), предпочитаемые растением, а также кодоны второго, третьего, четвертого и т.д. выбора предпочтительных кодонов, когда существует множество вариантов для выбора. Затем можно конструировать новую последовательность ДНК, которая кодирует аминокислотную последовательность того же пептида (например, белка DGT-28), однако новая последовательность ДНК отличается от исходной последовательности ДНК посредством замены кодонов растения (первого предпочтения, второго предпочтения, третьего предпочтения или четвертого предпочтения и т.д.), чтобы задавать аминокислоту в каждом положении в аминокислотной последовательности.
Затем новую последовательность можно анализировать в отношении участков ферментов рестрикции, которые могут быть образованы путем модификаций. Идентифицированные участки можно далее модифицировать путем замены кодонов на предпочтительные кодоны первого, второго, третьего или четвертого выбора. Другие участки в последовательности, которые могут влиять на транскрипцию или трансляцию представляющего интерес гена, представляют собой структуры стебель-петля, области соединения экзон:интрон (5′ или 3′), сигналы присоединения поли-A и сигналы терминации РНК-полимеразы; эти участки можно удалять путем замены кодонов растений. Последовательность можно далее анализировать и модифицировать для уменьшения частоты дублетов TA или CG. В дополнение к дублетам, блоки последовательности G или C, которые имеют более шести остатков, которые являются одинаковыми, могут влиять на транскрипцию или трансляцию последовательности. Таким образом, эти блоки можно модифицировать путем замены кодонов первого или второго выбора, например, на следующий предпочтительный для выбора кодон.
SEQ ID NO: 2 (dgt-28 (v5)) была оптимизирована для экспрессии в двудольных растениях. SEQ ID NO: 3 (dgt-28 (v6)) была оптимизирована для экспрессии в однодольных растениях. Использование кодонов в этих синтетических последовательностях было выбрано на основе предпочтительного использования кодонов; т.е. продукты экспрессии в каждом случае кодируются кодонами, являющимися предпочтительными для использования в однодольных или двудольных растениях, и вредоносные последовательности и излишние участки рестрикции удаляют для увеличения эффективности транскрипции/трансляции полипептида DGT-28 и для упрощения стадий манипулирования ДНК.
Аналогично, молекула нуклеиновой кислоты SEQ ID NO: 4 (dgt-28 (v1)) была оптимизирована для увеличения экспрессии в Escherichia coli. Использование кодонов в SEQ ID NO: 4 было выбрано на основе предпочтительного использования кодонов в E.coli; экспрессируемый белок кодируется кодонами, являющимися предпочтительными для использования в E.coli. Во время последующего моделирования вредоносные последовательности и излишние участки рестрикции были удаления для повышения эффективности транскрипции/трансляции кодирующей DGT-28 последовательности и для упрощения стадий манипулирования ДНК. Таким образом, экспрессия DGT-28 с нуклеиновой кислоты, содержащей SEQ ID NO: 4, в E.coli может приводить к устойчивой экспрессии белка, например, для ферментативной охарактеризации DGT-28.
После оптимизации (например, оптимизации для растения) последовательность ДНК моделируют на бумаге или in silico, реальные молекулы ДНК можно синтезировать в лаборатории так, чтобы их последовательность точно соответствовала смоделированной последовательности. Такие синтетические молекулы нуклеиновых кислот можно клонировать или подвергать иным манипуляциям в точности так, как если бы они происходили из природных или нативных источников.
Нуклеиновую кислоту в рамках настоящего изобретения можно клонировать в вектор для трансформации в прокариотические или эукариотические клетки для репликации и/или экспрессии. Векторы могут представлять собой прокариотические векторы; например, плазмиды, или челночные векторы, векторы насекомых или эукариотические векторы. Нуклеиновую кислоту в рамках настоящего изобретения также можно клонировать в экспрессирующий вектор, например, для введения в клетку растения. В определенных применениях может быть предпочтительным наличие векторов, которые являются функциональными в E.coli (например, продукция белка для индукции антител, анализ последовательности ДНК, конструирование вставок, получение некоторых количеств нуклеиновых кислот).
Для экспрессии белка DGT-28 в клетке нуклеиновую кислоту, кодирующую белок, обычно субклонируют в экспрессирующий вектор, который содержит промотор для контроля транскрипции. Подходящие бактериальные и эукариотические промоторы хорошо известны в данной области и описаны, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual (2nd ed. 1989; 3rd ed., 2001); Kriegler, Gene Transfer и Expression: A Laboratory Manual (1990); и Current Protocols in Molecular Biology (Ausubel et al., выше). Бактериальные экспрессирующие системы для экспрессии нуклеиновой кислоты в рамках настоящего изобретения доступны, например, в E.coli, Bacillus sp. и Salmonella (Palva et al., Gene 22:229-235 (1983)). Наборы для таких экспрессирующих систем являются коммерчески доступными. Эукариотические экспрессирующие системы для клеток млекопитающих, дрожжей и клеток насекомых хорошо известны специалистам в данной области и также являются коммерчески доступными.
Конкретный экспрессирующий вектор, используемый для переноса генетической информации в клетку, выбирают с учетом предполагаемого применения белка DGT-28 (например, экспрессия в растениях, животных, бактериях, грибах и простейших). Стандартные экспрессирующие векторы для бактерий и животных известны в данной области и подробно описаны, например, в публикации патента США 20050064474A1 и международных публикациях патентов WO 05/084190, WO05/014791 и WO03/080809. Для получения бактериальных клеточных линий, которые экспрессируют большие количества белка, который затем можно очищать с использованием стандартных способов, можно использовать стандартные способы трансфекции.
Выбор промотора, используемого для контроля экспрессии нуклеиновой кислоты в рамках настоящего изобретения, зависит от конкретного применения. Ряд промоторов, которые контролируют экспрессию гена в растении, можно использовать в вариантах осуществления в рамках настоящего изобретения. Такие промоторы можно выбирать из конститутивных, химически регулируемых, индуцибельных и предпочтительных для семян промоторов. Например, сильный конститутивный промотор, пригодный для клетки-хозяина, можно использовать для экспрессии и очистки белков DGT-28. Неограничивающие примеры промоторов растений включают промоторные последовательности, происходящие из убиквитина-10 A. thaliana (ubi-10) (Callis, et al., 1990, J. Biol. Chem., 265:12486-12493); маннопинсинтазы A. tumefaciens (Δmas) (Petolino et al., патент США № 6730824); и/или вируса мозаики прожилок маниоки (CsVMV) (Verdaguer et al., 1996, Plant Molecular Biology 31:1129-1139).
Конститутивные промоторы включают, например, коровый промотор 35S вируса мозаики цветной капусты (Odell et al. (1985) Nature 313:810-812); промотор актина риса (McElroy et al. (1990) Plant Cell 2:163-171); промотор убиквитина кукурузы (патент США № 5510474; Christensen et al. (1989) Plant Mol. Biol. 12:619-632 и Christensen et al. (1992) Plant Mol. Biol. 18:675-689); промотор pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); промотор ALS (патент США № 5659026); промотор гистонов кукурузы (Chabouté et al. Plant Molecular Biology, 8:179-191 (1987)) и т.п.
Диапазон доступных совместимых с растениями промоторов включает тканеспецифические и индуцибельные промоторы. Индуцибельный регуляторный элемент представляет собой элемент, который способен прямо или непрямо активировать транскрипцию одной или нескольких последовательностей ДНК или генов в ответ на индуцирующий агент. В отсутствие индуцирующего агента последовательности ДНК или гены не транскрибируются. Как правило, белковый фактор, который специфично связывается с индуцибельным регуляторным элементом для активации транскрипции, присутствует в неактивной форме, которая затем прямо или непрямо преобразуется в активную форму индуцирующим агентом. Индуцирующий агент может представлять собой химический агент, такой как белок, метаболит, регулятор роста, гербицид или фенольное соединение или физиологический стрессовый фактор, обусловливаемый прямо нагреванием, холодом, солью или токсическими элементами, или непрямо путем действия патогена или болезнетворного агента, такого как вирус. Как правило, белковый фактор, который специфично связывается с индуцибельным регуляторным элементом, активируя транскрипцию, присутствует в неактивной форме, которая затем прямо или непрямо преобразуется в активную форму индуцирующим агентом. Клетка растения, содержащая индуцибельный регуляторный элемент, может быть подвергнута воздействию индуцирующего агента путем применения извне индуцирующего агента к клетке или растению, такого как распыление, полив, нагревание или сходные способы.
В вариантах осуществления в рамках настоящего изобретения можно использовать любой индуцибельный промотор. См. Ward et al. Plant Mol. Biol. 22: 361-366 (1993). Индуцибельные промоторы включают, например, но не ограничиваются этим: промоторы рецептора экдизона (патент США № 6504082); промоторы из системы ACE1, которые отвечают на медь (Mett et al. PNAS 90: 4567-4571 (1993)); ген In2-1 и In2-2 из кукурузы, который отвечает на антидоты бензолсульфонамидных гербицидов (патент США № 5364780; Hershey et al., Mol. Gen. Genetics 227: 229-237 (1991) и Gatz et al., Mol. Gen. Genetics 243: 32-38 (1994)); репрессор Tet из Tn10 (Gatz et al., Mol. Gen. Genet. 227: 229-237 (1991); промоторы из гена стероидного гормона, транскрипционная активность которого индуцируется глюкокортикостероидным гормоном, Schena et al., Proc. Natl. Acad. Sci. U.S.A. 88: 10421 (1991) и McNellis et al., (1998) Plant J. 14(2):247-257; промотор GST кукурузы, который активируется гидрофобными электрофильными соединениями, которые используют в качестве предвсходовых гербицидов (см. патент США № 5965387 и публикацию международной патентной заявки № WO 93/001294); и промотор PR-1a табака, который активируется салициловой кислотой (см. Ono S, Kusama M, Ogura R, Hiratsuka K., "Evaluation of the Use of the Tobacco PR-1a Promoter to Monitor Defense Gene Expression by the Luciferase Bioluminescence Reporter System", Biosci Biotechnol Biochem. 2011 Sep 23; 75(9):1796-800). Другие представляющие интерес химически регулируемые промоторы включают индуцируемые тетрациклином и репрессируемые тетрациклином промоторы (см., например, Gatz et al., (1991) Mol. Gen. Genet. 227:229-237, и патенты США № 5814618 и 5789156).
Другие представляющие интерес регулируемые промоторы включают отвечающий на холод регуляторный элемент или регуляторный элемент теплового шока, транскрипция которого может осуществляться в ответ на воздействие холода или тепла, соответственно (Takahashi et al., Plant Physiol. 99:383-390, 1992); промотор гена алкогольдегидрогеназы (Gerlach et al., PNAS USA 79:2981-2985 (1982); Walker et al., PNAS 84(19):6624-6628 (1987)), индуцируемый анаэробными условиями; индуцируемый светом промотор, происходящий из гена rbcS гороха или гена psaDb гороха (Yamamoto et al. (1997) Plant J. 12(2):255-265); индуцируемый светом регуляторный элемент (Feinbaum et al., Mol. Gen. Genet. 226:449, 1991; Lam and Chua, Science 248:471, 1990; Matsuoka et al. (1993) Proc. Natl. Acad. Sci. USA 90(20):9586-9590; Orozco et al. (1993) Plant Mol. Bio. 23(6):1129-1138); индуцируемый гормонами растений регуляторный элемент (Yamaguchi-Shinozaki et al., Plant Mol. Biol. 15:905, 1990; Kares et al., Plant Mol. Biol. 15:225, 1990) и т.п. Индуцибельный регуляторный элемент также может представлять собой промотор гена In2-1 или In2-2 кукурузы, который отвечает на антидоты бензолсульфонамидных гербицидов (Hershey et al., Mol. Gen. Gene. 227:229-237, 1991; Gatz et al., Mol. Gen. Genet. 243:32-38, 1994), и репрессор Tet транспозона Tn10 (Gatz et al., Mol. Gen. Genet. 227:229-237, 1991).
Индуцируемые стрессом промоторы включают индуцируемые стрессовым воздействием соли/воды промоторы, такие как P5CS (Zang et al. (1997) Plant Sciences 129:81-89); индуцируемые холодом промоторы, такие как cor15a (Hajela et al. (1990) Plant Physiol. 93:1246-1252), cor15b (Wilhelm et al. (1993) Plant. Mol. Biol. 23:1073-1077), wsc120 (Ouellet et al. (1998) FEBS Lett. 423-324-328), ci7 (Kirch et al. (1997) Plant Mol. Biol. 33:897-909) и ci21A (Schneider et al. (1997) Plant Physiol. 113:335-45); индуцируемые засухой промоторы, такие как Trg-31 (Chaudhary et al (1996) Plant Mol. Biol. 30:1247-57) и rd29 (Kasuga et al. (1999) Nature Biotechnology 18:287-291); осмотически индуцируемые промоторы, такие как Rab17 (Vilardell et al. (1991) Plant Mol. Biol. 17:985-93) и осмотин (Raghothama et al. (1993) Plant Mol. Biol. 23:1117-28); индуцируемые нагреванием промоторы, такие как белки теплового шока (Barros et al. (1992) Plant Mol. 19:665-75; Marrs et al. (1993) Dev. Genet. 14:27-41), smHSP (Waters et al. (1996) J. Experimental Botany 47:325-338); и индуцируемый тепловым шоком элемент из промотора убиквитина петрушки (WO 03/102198). Другие индуцируемые стрессовым воздействием промоторы включают rip2 (патент США № 5332808 и публикация США № 2003/0217393) и rd29a (Yamaguchi-Shinozaki et al. (1993) Mol. Gen. Genetics 236:331-340). Определенные промоторы индуцируются нанесением раны, включая промотор pMAS Agrobacterium (Guevara-Garcia et al. (1993) Plant J. 4(3):495-505) и промотор ORF13 Agrobacterium (Hansen et al., (1997) Mol. Gen. Genet. 254(3):337-343).
Предпочтительные для ткани промоторы можно использовать для нацеливания усиленной транскрипции и/или экспрессии на конкретную ткань растения. Примеры этих типов промоторов включают промоторы с предпочтительной для семян экспрессией, такой как экспрессия, обеспечиваемая промотором фазеолина (Bustos et al.1989. The Plant Cell Vol. 1, 839-853), и геном глобулина-1 кукурузы, Belanger, et al. 1991 Genetics 129:863-972. Для двудольных растений предпочтительные для семян промоторы включают, но не ограничиваются ими, промоторы β-фазеолина бобов, напина, β-конглицинина, лектина сои, круциферина и т.п. Для однодольных растений предпочтительные для семян промоторы включают, но не ограничиваются ими, промоторы 15-кДа зеина кукурузы, 22-кДа зеина, 27-кДа зеина, γ-зеина, waxy, shrunken 1, shrunken 2, глобулина 1, и т.д. Предпочтительные для семян промоторы также включают промоторы, которые контролируют экспрессию генов предпочтительно в конкретных тканях в семенах, например, такие как предпочтительный для эндосперма промотор γ-зеина, криптический промотор из табака (Fobert et al. 1994. T-DNA tagging of a seed coat-specific cryptic promoter in tobacco. Plant J. 4: 567-577), промотор P-гена из кукурузы (Chopra et al. 1996. Alleles of the maize P gene with distinct tissue specificities encode Myb-homologous proteins with C-terminal replacements. Plant Cell 7:1149-1158, Erratum in Plant Cell 1997, 1:109), промотор глобулина-1 из кукурузы (Belenger и Kriz.1991. Molecular basis for Allelic Polymorphysm of the maize Globulin-1 gene. Genetics 129: 863-972), и промоторы, которые обеспечивают экспрессию в семенной оболочке или пленке кукурузных зерен, например, специфичный к перикарпию промотор глутаминсинтетазы (Muhitch et al., 2002. Isolation of a Promoter Sequence From the Glutamine Synthetase1-2 Gene Capable of Conferring Tissue-Specific Gene Expression in Transgenic Maize. Plant Science 163:865-872).
В дополнение к промотору, экспрессирующий вектор обычно содержит элемент транскрипции или экспрессирующую кассету, которая содержит все дополнительные элементы, требуемые для экспрессии нуклеиновой кислоты в клетках-хозяевах, либо прокариотических, либо эукариотических. Таким образом, типичная экспрессирующая кассета содержит промотор, функционально связанный, например, с последовательностью нуклеиновой кислоты, кодирующей белок, и сигнальные последовательности, требуемые, например, для эффективного полиаденилирования транскрипта, терминации транскрипции, участков связывания рибосом или терминации трансляции. Дополнительные элементы кассеты могут включать, например, энхансеры и гетерологичные сигналы сплайсинга.
Также могут быть включены другие компоненты вектора, также в зависимости от предполагаемого применения гена. Примеры включают селективные маркеры, направляющие или регуляторные последовательности, последовательности для транспорта пептида, такие как оптимизированная последовательность для транспорта пептида (см. патент США № 5510471), стабилизирующие последовательности, такие как RB7 MAR (см. Thompson and Myatt, (1997) Plant Mol. Biol., 34: 687-692 и WO9727207) или лидерные последовательности, интроны и т.д. Общее описание и примеры экспрессирующих векторов растений и репортерных генов могут быть найдены в Gruber, et al., "Vectors for Plant Transformation", Methods in Plant Molecular Biology and Biotechnology, Glick et al eds; CRC Press pp. 89-119 (1993).
Выбор подходящего экспрессирующего вектора зависит от хозяина и способа введения экспрессирующего вектора в хозяина. Экспрессирующая кассета может включать на 3′-конце представляющей интерес гетерологичной нуклеотидной последовательности область терминации транскрипции и трансляции, являющуюся функциональной в растениях. Область терминации может быть нативной для представляющей интерес последовательности ДНК или она может происходить из другого источника. Походящие области терминации доступны из Ti-плазмиды A. tumefaciens, такие как области терминации октопинсинтазы и нопалинсинтазы (nos) (Depicker et al., Mol. and Appl. Genet. 1:561-573 (1982) и Shaw et al. (1984) Nucleic Acids Research vol. 12, No. 20 pp7831-7846(nos)); также см. Guerineau et al. Mol. Gen. Genet. 262:141-144 (1991); Proudfoot, Cell 64:671-674 (1991); Sanfacon et al. Genes Dev. 5:141-149 (1991); Mogen et al. Plant Cell 2:1261-1272 (1990); Munroe et al. Gene 91:151-158 (1990); Ballas et al. Nucleic Acids Res. 17:7891-7903 (1989); Joshi et al. Nucleic Acid Res. 15:9627-9639 (1987).
Экспрессирующая кассета может содержать 5′-лидерную последовательность. Такая лидерная последовательности может действовать, усиливая трансляцию. Лидерные последовательности трансляции известны в данной области и включают, в качестве примера, лидерные последовательности пикорнавирусов, лидерную последовательность EMCV (5′-некодирующая область вируса энцефаломиокардита), Elroy-Stein et al. Proc. Nat. Acad. Sci. USA 86:6126-6130 (1989); лидерные последовательности потивирусов, например, лидерная последовательность TEV (вирус гравировки табака) Carrington and Freed, Journal of Virology, 64:1590-1597 (1990), лидерную последовательность MDMV (вирус карликовой мозаики кукурузы), Allison et al., Virology 154:9-20 (1986); связывающий тяжелую цепь иммуноглобулина человека белок (BiP), Macejak et al. Nature 353:90-94 (1991); нетранслируемую лидерную последовательность из мРНК белка оболочки вируса мозаики люцерны (AMV РНК 4), Jobling et al. Nature 325:622-625 (1987); лидерную последовательность вируса табачной мозаики (TMV), Gallie et al. (1989) Molecular Biology of РНК, pages 237-256; и лидерную последовательность вируса хлоротической крапчатости кукурузы (MCMV) Lommel et al. Virology 81:382-385 (1991). Также см. Della-Cioppa et al. Plant Physiology 84:965-968 (1987).
Конструкция также может содержать последовательности, которые усиливают трансляцию и/или стабильность мРНК, такие как интроны. Примером такого интрона является первый интрон гена II варианта гистона H3.III Arabidopsis thaliana. Chaubet et al. Journal of Molecular Biology, 225:569-574 (1992).
В случаях, когда являются желательными направление продукта экспрессии гетерологичной нуклеотидной последовательности в конкретную органеллу, в частности, пластиду, амилопласт или в эндоплазматическую сеть, или секреция на поверхности клетки или внеклеточно, экспрессирующая кассета, кроме того, может содержать кодирующую последовательность транзитного пептида. Такие транзитные пептиды хорошо известны в данной области и включают, но не ограничиваются ими, транзитный пептид для белка-переносчика ацильных групп, малой субъединицы RUBISCO, EPSP-синтазы растений и Helianthus annuus (см. Lebrun et al. патент США 5510417), транзитный пептид хлоропластов Zea mays Brittle-1 (Nelson et al. Plant Physiol. 117(4):1235-1252 (1998); Sullivan et al. Plant Cell 3(12):1337-48; Sullivan et al., Planta (1995) 196(3):477-84; Sullivan et al., J. Biol. Chem. (1992) 267(26):18999-9004) и т.п. Кроме того, в данной области известны химерные транзитные пептиды хлоропластов, такие как оптимизированный транзитный пептид (см. патент США № 5510471). Дополнительные транзитные пептиды хлоропластов были описаны ранее в патентах США № 5717084; 5728925. Специалисту в данной области будет хорошо понятно, что доступно множество возможностей для экспрессии продукта в конкретной органелле. Например, последовательность альфа-амилазы ячменя часто используют для экспрессии в эндоплазматической сети. Rogers, J. Biol. Chem. 260:3731-3738 (1985).
Специалисту в данной области будет понятно, что использование технологий рекомбинантных ДНК может улучшить контроль экспрессии трансфицированных молекул нуклеиновой кислоты путем манипулирования, например, количеством копий молекул нуклеиновой кислоты в клетке-хозяине, эффективностью, с которой эти молекулы нуклеиновых кислот транскрибируются, эффективностью, с которой полученные транскрипты транслируются, и эффективностью посттрансляционных модификаций. Кроме того, промоторную последовательность можно модифицировать способами генной инженерии для повышения уровня экспрессии по сравнению с нативным промотором. Рекомбинантные способы, пригодные для контроля экспрессии молекул нуклеиновой кислоты, включают, но не ограничиваются ими, стабильное встраивание молекул нуклеиновой кислоты в одну или несколько хромосом клетки-хозяина, добавление стабилизирующих вектор последовательностей в плазмиды, замены или модификации сигналов контроля транскрипции (например, промоторы, операторы, энхансеры), замены или модификации сигналов контроля трансляции (например, участки связывания рибосом, последовательности Шайна-Дальгарно или последовательности Козака), модификацию молекул нуклеиновой кислоты так, чтобы они соответствовали использованию кодонов клеткой-хозяином, и делецию последовательностей, которые дестабилизируют транскрипты.
В векторы для трансформации могут быть включены репортерные или маркерные гены для селекции трансформированных клеток или тканей или частей растений или растений. Примеры селективных маркеров включают селективные маркеры, которые сообщают устойчивость к антиметаболитам, таким как гербициды или антибиотики, например, дигидрофолатредуктаза, которая сообщает устойчивость к метотрексату (Reiss, Plant Physiol. (Life Sci. Adv.) 13:143-149, 1994; также см. Herrera Estrella et al., Nature 303:209-213, 1983; Meijer et al., Plant Mol. Biol. 16:807-820, 1991); неомицинфосфотрансфераза, которая сообщает устойчивость к аминогликозидам неомицину, канамицину и паромицину (Herrera-Estrella, EMBO J. 2:987-995, 1983 и Fraley et al. Proc. Natl. Acad. Sci USA 80:4803 (1983)); гигромицинфосфотрансфераза, которая сообщает устойчивость к гигромицину (Marsh, Gene 32:481-485, 1984; также см. Waldron et al., Plant Mol. Biol. 5:103-108, 1985; Zhijian et al., Plant Science 108:219-227, 1995); trpB, которая позволяет клеткам утилизировать индол вместо триптофана; hisD, которая позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci., USA 85:8047, 1988); манноза-6-фосфатизомераза, которая позволяет клеткам утилизировать маннозу (WO 94/20627); орнитиндекарбоксилаза, которая сообщает устойчивость к ингибитору орнитиндекарбоксилазы 2-(дифторметил)-DL-орнитину (DFMO; McConlogue, 1987, Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.); и дезаминаза из Aspergillus terreus, которая сообщает устойчивость к бластицидину S (Tamura, Biosci. Biotechnol. Biochem. 59:2336-2338, 1995).
Дополнительные селективные маркеры включают, например, мутантную ацетолактатсинтазу, которая сообщает устойчивость к имидазолинону или сульфонилмочевине (Lee et al., EMBO J. 7:1241-1248, 1988), мутантную psbA, которая сообщает устойчивость к атразину (Smeda et al., Plant Physiol. 103:911-917, 1993) или мутантную протопорфириногеноксидазу (см. патент США № 5767373), или другие маркеры, сообщающие устойчивость к гербициду, такому как глюфосинат. Примеры подходящих генов селективных маркеров включают, но не ограничиваются ими, гены, кодирующие устойчивость к хлорамфениколу (Herrera Estrella et al., EMBO J. 2:987-992, 1983); стрептомицину (Jones et al., Mol. Gen. Genet. 210:86-91, 1987); спектиномицину (Bretagne-Sagnard et al., Transgenic Res. 5:131-137, 1996); блеомицину (Hille et al., Plant Mol. Biol. 7:171-176, 1990); сульфонамиду (Guerineau et al., Plant Mol. Biol. 15:127-136, 1990); бромксинилу (Stalker et al., Science 242:419-423, 1988); глифосату (Shaw et al., Science 233:478-481, 1986); фосфинотрицину (DeBlock et al., EMBO J. 6:2513-2518, 1987) и т.п.
Одной из возможностей для использования селективного гена является ДНК, кодирующая устойчивость к глюкосинату, и в одном варианте осуществления ей может быть фосфинотрицинацетилтрансфераза (pat), оптимизированный для кукурузы ген pat или ген bar под контролем промотора вируса мозаики прожилок маниоки. Эти гены сообщают устойчивость к биалафосу. (См. Wohlleben et al., (1988) Gene 70: 25-37); Gordon-Kamm et al., Plant Cell 2:603; 1990; Uchimiya et al., BioTechnology 11:835, 1993; White et al., Nucl. Acids Res. 18:1062, 1990; Spencer et al., Theor. Appl. Genet. 79:625-631, 1990; и Anzai et al., Mol. Gen. Gen. 219:492, 1989). Версией гена pat является оптимизированный для кукурузы ген pat, описанный в патенте США № 6096947.
Кроме того, можно использовать маркеры, которые облегчают идентификацию клетки растения, содержащей полинуклеотид, кодирующий маркер. Являются пригодными поддающиеся оценке или скринингу маркеры, где присутствие последовательности обеспечивает поддающийся измерению продукт, и продукт может продуцироваться без разрушения клетки растения. Примеры включают β-глюкуронидазу или ген uidA (GUS), который кодирует фермент, для которого известны различные хромогенные субстраты (например, патенты США 5268463 и 5599670); хлорамфениколацетилтрансферазу (Jefferson et al. The EMBO Journal vol. 6 No. 13 pp. 3901-3907) и щелочную фосфатазу. В предпочтительном варианте осуществления используемым маркером является бета-каротин или провитамин A (Ye et al., Science 287:303-305-(2000)). Ген используют для усиления питания риса, однако в данном случае его вместо этого используют в качестве поддающегося скринингу маркера, и присутствие этого гена, связанного с представляющим интерес геном, обнаруживают по обеспечиваемому золотистому цвету. В отличие от случая, когда ген используют для усиления питания растения, меньшее количество белка является достаточным для целей маркировки. Другие поддающиеся скринингу маркеры включают, как правило, гены антоцианина/флавоноида (см. обсуждение в Taylor and Briggs, The Plant Cell (1990)2:115-127), включая, например, ген R-локуса, который кодирует продукт, который регулирует продукцию антоцианиновых пигментов (красный цвет) в тканях растения (Dellaporta et al., Chromosome Structure and Function, Kluwer Academic Publishers, Appels and Gustafson eds., pp. 263-282 (1988)); гены, которые контролируют биосинтез флавоноидных пигментов, такие как ген C1 кукурузы (Kao et al., Plant Cell (1996) 8: 1171-1179; Scheffler et al. Mol. Gen. Genet. (1994) 242:40-48) и ген C2 кукурузы (Wienand et al., Mol. Gen. Genet. (1986) 203:202-207); ген B (Chandler et al., Plant Cell (1989) 1:1175-1183), ген p1 (Grotewold et al, Proc. Natl. Acad. Sci USA (1991) 88:4587-4591; Grotewold et al., Cell (1994) 76:543-553; Sidorenko et al., Plant Mol. Biol. (1999)39:11-19); гены локуса bronze (Ralston et al., Genetics (1988) 119:185-197; Nash et al., Plant Cell (1990) 2(11): 1039-1049), среди прочих.
Следующие примеры подходящих маркеров включают ген голубого флуоресцентного белка (CYP) (Bolte et al. (2004) J. Cell Science 117: 943-54 и Kato et al. (2002) Plant Physiol. 129: 913-42), ген желтого флуоресцентного белка (PHIYFP™ от Evrogen; см. Bolte et al. (2004) J. Cell Science 117: 943-54); ген lux, который кодирует люциферазу, присутствие которой можно обнаруживать с использованием, например, рентгеновской пленки, сцинтилляционного измерения, флуоресцентной спектрофотометрии, низкоуровневых видеокамер, камер с устройством подсчета фотонов или многолуночной люминометрии (Teeri et al. (1989) EMBO J. 8:343); ген зеленого флуоресцентного белка (GFP) (Sheen et al., Plant J. (1995) 8(5):777-84); и DsRed2, где клетки растений, трансформированные маркерным геном, имеют красный цвет, и, таким образом, их селекцию можно проводить визуально (Dietrich et al. (2002) Biotechniques 2(2):286-293). Дополнительные примеры включают ген β-лактамазы (Sutcliffe, Proc. Natl. Acad. Sci. U.S.A. (1978) 75:3737), который кодирует фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген xylE (Zukowsky et al., Proc. Natl. Acad. Sci. U.S.A. (1983) 80:1101), который кодирует катехолдиоксигеназу, которая может конвертировать хромогенные катехолы; ген α-амилазы (Ikuta et al., Biotech. (1990) 8:241); и ген тирозиназы (Katz et al., J. Gen. Microbiol. (1983) 129:2703), который кодирует фермент, способный окислять тирозин до DOPA и допахинона, который в свою очередь конденсируется с образованием легко обнаруживаемого соединения меланина. Очевидно, что множество таких маркеров доступно и известно специалисту в данной области.
IV. Клетки и организмы, содержащие DGT-28
В некоторых вариантах осуществления предусматриваются клетка и/или организм (например, клетка растения или растение), которые содержат гетерологичный полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1. В конкретных вариантах осуществления предусматриваются клетка и/или организм, которые содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1; например, нуклеиновую кислоту dgt-28. Некоторые варианты осуществления включают клетку и/или организм, содержащие гетерологичную нуклеиновую кислоту, которая гибридизуется с другой нуклеиновой кислотой, обладающей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости.
Клетка растения, часть растения и/или растение могут быть генетически модифицированы так, чтобы они содержали гетерологичный полипептид (например, белок DGT-28) и/или гетерологичную нуклеиновую кислоту (например, нуклеиновая кислота, кодирующая dgt-28) любым из нескольких способов введения гетерологичной молекулы, известных в данной области. В конкретных вариантах осуществления в рамках настоящего изобретения гетерологичную молекулу вводят в клетку растения, часть растения и/или растение способом, выбранным, например, но не ограничиваясь этим, из: трансформации и селективного разведения (например, разведение путем обратного скрещивания).
Любой вид растения или любую клетку можно генетически модифицировать так, чтобы они содержали гетерологичный полипептид и/или нуклеиновую кислоту в рамках настоящего изобретения. В некоторых вариантах осуществления клетка растения генетически модифицирована так, что она не способна регенерировать с образованием растения. В некоторых вариантах осуществления растения, которые являются генетически модифицированными в соответствии с настоящим изобретением (например, клетки растения-хозяина) включают, но не ограничивается ими, высшее растение, двудольное растение, однодольное растение, потребляемое растение, сельскохозяйственную культуру и растение, используемое для получения масла (например, растение масличной культуры). Такие растения включают, например, но не ограничиваются ими: люцерну; сою; хлопок; рапс (канола); лен; кукурузу; рис; брахиарию; пшеницу; сафлор; сорго; сахарную свеклу; подсолнечник; табак и травы (например, рулонный газон). В конкретных примерах генетически модифицированная клетка растения или растение в рамках настоящего изобретения включают, например, но не ограничиваясь ими: Brassica napus; горчицу индийскую (Brassica juncea); горчицу эфиопскую (Brassica carinata); репу (Brassica rapa); капусту (Brassica oleracea); Glycine max; Linum usitatissimum; Zea mays; Carthamus tinctorius; Helianthus annuus; Nicotiana tabacum; Arabidopsis thaliana, бразильский орех (Betholettia excelsa); клещевину обыкновенную (Ricinus communis); кокос (Cocus nucifera); кориандр (Coriandrum sativum); Gossypium spp.; арахис (Arachis hypogaea); хохобу (Simmondsia chinensis); масличную пальму (Elaeis guineeis); оливу (Olea eurpaea); Oryza sativa; тыкву (Cucurbita maxima); ячмень (Hordeum vulgare); сахарный тростник (Saccharum officinarum); Triticum spp. (включая Triticum durum и Triticum aestivum); и ряску (Lemnaceae sp.). В некоторых вариантах осуществления растение может иметь конкретный генетический фон, например, как у элитных культиваров, культиваров дикого типа и коммерчески различимых сортов.
Нуклеиновые кислоты, введенные в клетку растения, можно использовать для сообщения желаемых признаков по существу любому растению. Можно конструировать широкое множество растений или систем клеток растений для желаемых физиологических и агрономических характеристик, описанных в настоящем описании, с использованием нуклеиновой кислоты, кодирующей полипептид DGT, и различных способов трансформации. В вариантах осуществления в рамках настоящего изобретения могут быть использованы любые из многих способов трансформации растений (и продукции генетически модифицированных растений), которые известны в данной области. Разработаны многочисленные способы трансформации растений, включая протоколы биологической и физической трансформации для двудольных растений, а также однодольных растений (См., например, Goto-Fumiyuki et al. (1999) Nat. Biotechnol. 17:282-6; Miki et al. (1993) Methods in Plant Molecular Biology and Biotechnology (Glick, B. R. and Thompson, J. E., Eds.), CRC Press, Inc., Boca Raton, FL, pp. 67-88). Кроме того, векторы и способы культивирования in vitro для трансформации клеток и тканей растений и регенерации растений описаны, например, в Gruber et al. (1993), выше, pp. 89-119.
Способы трансформации растений, доступные для введения нуклеиновой кислоты в клетку растения-хозяина, включают, например, но не ограничиваясь этим: трансформацию разоруженной T-ДНК с использованием Agrobacterium tumefaciens или A. rhizogenes в качестве агента для трансформации; трансфекцию с помощью фосфата кальция; трансформацию с помощью полибрена; слияние протопластов; электропорацию (D’Halluin et al. (1992) Plant Cell 4:1495-505); ультразвуковые способы (например, сонопорация); трансфекцию с помощью липосом; микроинъекцию; контактирование с "голой" ДНК; контактирование с плазмидными векторами; контактирование с вирусными векторами; биолистические способы (например, бомбардировка частицами ДНК (см., например, Klein et al. (1987) Nature 327:70-3) и бомбардировку микрочастицами (Sanford et al. (1987) Part. Sci. Technol. 5:27; Sanford (1988) Trends Biotech. 6:299, Sanford (1990) Physiol. Plant 79:206; и Klein et al. (1992) Biotechnology 10:268); опосредуемую карбидом кремния WHISKERS трансформацию (Kaeppler et al. (1990) Plant Cell Rep. 9:415-8); трансформацию с помощью наночастиц (см., например, публикацию патента США № US2009/0104700A1); направленный поток аэрозоля; и опосредуемый полиэтиленгликолем (PEG) захват. В конкретных примерах гетерологичную нуклеиновую кислоту можно вводить прямо в геномную ДНК клетки растения.
Широко используемый способ введения экспрессирующего вектора в растение основан на природной системе трансформации Agrobacterium. Horsch et al. (1985) Science 227:1229. A. tumefaciens и A. rhizogenes являются патогенными для растений почвенными бактериями, известными тем, что они пригодны для генетической трансформации клеток растений. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, содержат гены, ответственные за генетическую трансформацию растения. Kado (1991) Crit. Rev. Plant. Sci. 10:1. Детали, касающиеся векторных систем Agrobacterium и способов опосредуемого Agrobacterium переноса генов, также доступны, например, в Gruber et al., выше, Miki et al., выше, Moloney et al. (1989) Plant Cell Reports 8:238, и в патентах США № 4940838 и 5464763.
Если для трансформации используют Agrobacterium, ДНК, подлежащую встраиванию, клонируют в специальные плазмиды; либо в промежуточный вектор, либо в бинарный вектор. Промежуточные векторы не могут реплицироваться в Agrobacterium самостоятельно. Промежуточный вектор можно переносить в A. tumefaciens с помощью плазмиды-помощника (конъюгация). Супербинарная система Japan Tobacco является примером такой системы (рассмотрено в Komari et al. (2006) Methods in Molecular Biology (K. Wang, ed.) No. 343; Agrobacterium Protocols, 2nd Edition, Vol. 1, Humana Press Inc., Totowa, NJ, pp.15-41; и Komori et al. (2007) Plant Physiol. 145:1155-60). Бинарные векторы могут реплицироваться как в E.coli, так и в Agrobacterium. Бинарные векторы содержат ген селективного маркера и линкер или полилинкер, которые заключены между правой и левой пограничными областями T-ДНК. Их можно трансформировать прямо в Agrobacterium (Holsters, 1978). Agrobacterium содержат плазмиду, содержащую область vir. Плазмида Ti или Ri также содержит область vir, необходимую для переноса T-ДНК. Область vir необходима для переноса T-ДНК в клетку растения. Могут содержаться дополнительные T-ДНК.
Функции вирулентности Agrobacterium tumefaciens-хозяина определяют встраивание T-цепи, содержащей конструкцию и соседний маркер, в ДНК клетки растения, когда клетка инфицируется бактериями с использованием бинарного T-ДНК-вектора (Bevan (1984) Nuc. Acid Res. 12:8711-21) или процедуры сокультивирования (Horsch et al. (1985) Science 227:1229-31). Как правило, систему трансформации Agrobacterium используют для модификации способами инженерии двудольных растений. Bevan et al. (1982) Ann. Rev. Genet. 16:357-84; Rogers et al. (1986) Methods Enzymol. 118:627-41. Систему трансформации Agrobacterium также можно использовать для трансформации, а также для переноса, нуклеиновых кислот в однодольные растения и клетки растений. См. патент США № 5591616; Hernalsteen et al. (1984) EMBO J. 3:3039-41; Hooykass-Van Slogteren et al. (1984) Nature 311:763-4; Grimsley et al. (1987) Nature 325:1677-9; Boulton et al. (1989) Plant Mol. Biol. 12:31-40; и Gould et al. (1991) Plant Physiol. 95:426-34.
Генетическое манипулирование с рекомбинантным хозяином в рамках настоящего изобретения можно проводить с использованием стандартных генетических способов и скрининга, и его можно проводить в любой клетке-хозяине, которая пригодна для генетического манипулирования. В некоторых вариантах осуществления рекомбинантная клетка-хозяин может представлять собой любой организм-хозяин или микроорганизм-хозяин, пригодные для генетической модификации и/или рекомбинантной экспрессии генов. В некоторых вариантах осуществления рекомбинантным хозяином может быть растение. Стандартные способы рекомбинантных ДНК и молекулярного клонирования, используемые в рамках настоящего изобретения, хорошо известны в данной области и описаны, например, но не ограничиваясь этим, в: Sambrook et al. (1989), выше; Silhavy et al. (1984) Experiments with Gene Fusions, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; и Ausubel et al. (1987) Current Protocols in Molecular Biology, Greene Publishing Assoc. и Wiley-Interscience, New York, NY.
После введения нуклеиновой кислоты в клетку растения, клетку растения можно выращивать и после появления дифференцирующейся ткани, такой как побеги и кори, можно получать зрелые растения. В некоторых вариантах осуществления можно получать множество растений. Методологии регенерации растений известны средним специалистам в данной области, и могут быть найдены, например, в: Plant Cell and Tissue Culture, 1994, Vasil and Thorpe Eds. Kluwer Academic Publishers и в: Plant Cell Culture Protocols (Methods in Molecular Biology 111, 1999 Hall Eds Humana Press). Генетически модифицированные растения, описанные в настоящем описании, можно культивировать в ферментационной среде или выращивать в подходящей среде, такой как почва. В некоторых вариантах осуществления подходящей средой для роста высших растений может быть любая среда для роста растений, включая, но не ограничиваясь ими, почву, песок, любую среду в форме частиц, которая поддерживает рост корней (например, вермикулит, перлит, и т.д.) или гидропонную культуру, а также подходящее освещение, воду и питательные вещества, которые способствуют росту высшего растения.
Трансформированные клетки растений, которые получены любым из описанных выше способов трансформации, можно культивировать для регенерации целого растения, которое обладает трансформированным генотипом, и, таким образом, желаемым фенотипом. Такие способы регенерации основаны на манипулировании с определенными фитогормонами в среде для роста тканевой культуры, как правило, они основаны на биоцидном и/или гербицидном маркере, который введен вместе с желаемыми нуклеотидными последовательностями. Регенерация растений из культивируемых протопластов описана в Evans, et al., "Protoplasts Isolation and Culture", Handbook of Plant Cell Culture, pp. 124-176, Macmillian Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, pp. 21-73, CRC Press, Boca Raton, 1985. Регенерацию также можно осуществлять из каллюса, эксплантатов, органов, пыльцы, зародышей или частей растения. Такие способы регенерации описаны, главным образом, в Klee et al. (1987) Ann. Rev. of Plant Phys. 38:467-486.
В других вариантах осуществления клетки растений, которые являются трансформированными, не способны к регенерации с образованием растения. Такие клетки можно использовать, например, для разработки линии клеток растения, имеющих соответствующий фенотип, например, устойчивость к гербициду.
Трансформированную клетку растения, каллюс, ткань или растение можно идентифицировать и выделять путем выбора или скрининга модифицированного способами инженерии растительного материала в отношении признаков, кодируемых маркерными генами, присутствующими на трансформирующей ДНК. Например, селекцию можно проводить путем выращивания модифицированного способами инженерии растительного материала на средах, содержащих ингибиторное количество антибиотика или гербицида, к которым трансформированная генная конструкция сообщает устойчивость. Кроме того, трансформированные растения и клетки растений также можно идентифицировать путем скрининга видов активности или любых выявляемых визуально маркерных генов (например, гены β-глюкуронидазы, люциферазы или gfp), которые могут присутствовать в рекомбинантных конструкциях нуклеиновых кислот. Такие методологии селекции и скрининга хорошо известны специалистам в данной области.
Трансгенное растение, содержащее гетерологичную молекулу в рамках настоящего изобретения, можно получать путем селективного разведения, например, путем полового скрещивания первого родительского растения, содержащего молекулу, и второго родительского растения, тем самым получая множество растений первого потомства. Затем можно отбирать растение первого потомства, которое является устойчивым к селективному маркеру (например, глифосат, устойчивость к которому может быть сообщена растению-потомку с помощью гетерологичной молекулы в рамках настоящего изобретения). Затем растение первого потомства можно подвергать самоопылению, тем самым получая растения второго потомства. Затем можно отбирать растение второго потомства, которое является устойчивым к селективному маркеру. Кроме того, эти стадии могут включать обратное скрещивание растения первого потомства или растения второго потомства с растением второго потомства или растением третьего потомства.
Также должно быть понятно, что два различных трансгенных растения также можно скрещивать с получением потомства, которое содержит два независимо сегрегирующих дополнительных экзогенных гена. Самоопыление соответствующего потомка может обеспечить растения, которые являются гомозиготными по обоим дополнительным экзогенным генам. Также предусматривается обратное скрещивание с родительским растением и ауткроссинг с нетрансгенным растением, как в случае вегетативного размножения. Другие способы разведения, широко используемые для различных признаков и культуры, известны в данной области. Разведение путем обратного скрещивания используют для переноса генов для просто наследуемого признака с высокой наследуемостью в желаемый гомозиготный культивар или инбредную линию, которые являются рекуррентным родительским растением. Ожидается, что полученное растение будет иметь признаки рекуррентного растения (например, культивара) и желаемый признак, перенесенной из донорного растения. После первоначального скрещивания особи, обладающие фенотипом донорного растения, отбирают и многократно скрещивают (подвергают обратному скрещиванию) с рекуррентным родительским растением. Ожидается, что полученное родительское растение будет обладать признаками рекуррентного родительского растения (например, культивара) и желаемым признаком, перенесенным из донорного растения.
Нуклеиновую кислоту также можно вводить в заданную область генома растения посредством гомологичной рекомбинации. Способы стабильного встраивания полинуклеотидной последовательности в конкретный участок хромосомы клетки растения посредством гомологичной рекомбинации описаны в данной области. Например, сайт-специфическое встраивание, как описано в публикации патентной заявки США № 2009/0111188 A1 вовлекает использование рекомбиназ или интеграз для опосредования введения донорной полинуклеотидной последовательности в хромосомную мишень. Кроме того, в международной патентной заявке № WO 2008/021207 описана опосредуемая цинковыми пальцами гомологичная рекомбинация для стабильного встраивания одной или нескольких донорных полинуклеотидных последовательностей в конкретные области генома. Рекомбиназы, такие как FLP/FRT, как описано в патенте США № 6720475, или CRE/LOX, как описано в патенте США № 5658772, можно использовать для стабильного встраивания полинуклеотидной последовательности в конкретный участок хромосомы. Наконец, использование мегануклеаз для нацеливания донорных полинуклеотидов в конкретную хромосомную область описано в Puchta et al., PNAS USA 93 (1996) pp. 5055-5060).
Другие различные способы сайт-специфического встраивания в клетки-растений являются общеизвестными и применимыми (Kumar et al., Trends in Plant Sci. 6(4) (2001) pp. 155-159). Более того, для применения в растениях можно использовать системы для сайт-специфической рекомбинации, которые были идентифицированы в нескольких прокариотических и низших эукариотических организмах. Примеры таких систем включают, но не ограничиваются ими; систему рекомбиназ R/RS из плазмиды pSR1 дрожжей Zygosaccharomyces rouxii (Araki et al. (1985) J. Mol. Biol. 182: 191-203), и систему Gin/gix фага Mu (Maeser and Kahlmann (1991) Mol. Gen. Genet. 230: 170-176).
В некоторых вариантах осуществления гетерологичную нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, необязательно можно комбинировать с другой нуклеиновой кислотой в клетке-хозяине и/или организме-хозяине. Например, в определенных вариантах осуществления гетерологичную нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, можно комбинировать или "пакетировать" с другой нуклеиновой кислотой, которая обеспечивает дополнительную резистентность или устойчивость к глифосату или другому гербициду, и/или с другой нуклеиновой кислотой, которая обеспечивает резистентность к отдельным насекомым или заболеваниям и/или усиление питания, и/или улучшенные агрономические характеристики, и/или с другой нуклеиновой кислотой, которая обеспечивает белки или другие продукты, пригодные в кормах, продуктах питания, промышленных, фармацевтических или других применениях. "Пакетирование" двух или более представляющих интерес последовательностей нуклеиновой кислоты в геноме растения можно осуществлять, например, общепринятыми способами разведения растений с использованием двух или более трансгенных объектов, трансформации растения конструкцией(ями), которая содержит нуклеиновые кислоты, повторной трансформации трансгенного растения или добавления новых признаков посредством направленного встраивания способом гомологичной рекомбинации.
Нуклеиновые кислоты, которые могут быть "пакетированы" с гетерологичной нуклеиновой кислотой, кодирующей полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, включают, например, но не ограничиваются ими:
Гены или кодирующие последовательности (например, i-РНК), которые сообщают устойчивость к паразитам или заболеваниям
(A) Гены устойчивости к заболеваниям растений. Защита растений часто активируется специфическим взаимодействием между продуктом гена устойчивости к заболеванию (R) в растении и продуктом соответствующего гена авирулентности (Avr) в патогене. Сорт растения можно трансформировать клонированным геном устойчивости для конструирования растений, которые являются устойчивыми к конкретным патогенным штаммам. Примеры таких генов включают ген Cf-9 томата для устойчивости к Cladosporium fulvum (Jones et al., 1994 Science 266:789), ген Pto томата, который кодирует протеинкиназу, для устойчивости к Pseudomonas syringae pv. tomato (Martin et al., 1993 Science 262:1432), и ген RSSP2 Arabidopsis для устойчивости к Pseudomonas syringae (Mindrinos et al., 1994 Cell 78:1089).
(B) Белок Bacillus thuringiensis, его производное или синтетический полипептид, смоделированный на его основе, такой как нуклеотидная последовательность гена Bt δ-эндотоксина (Geiser et al., 1986 Gene 48:109), и гена вегетативного инсектицидного белка (VIP) (см., например, Estruch et al. (1996) Proc. Natl. Acad. Sci. 93:5389-94). Более того, молекулы ДНК, кодирующие гены δ-эндотоксина, можно приобретать от American Type Culture Collection (Rockville, Md.) под номерами доступа ATCC 40098, 67136, 31995 и 31998.
(C) Лектин, такой как нуклеотидные последовательности нескольких генов манноза-связывающих лектинов Clivia miniata (Van Damme et al., 1994 Plant Molec. Biol. 24:825).
(D) Связывающий витамин белок, такой как авидин и гомологи авидина, которые пригодны в качестве ларвацидов против вредных насекомых. См. патент США № 5659026.
(E) Ингибитор фермента, например, ингибитор протеазы или ингибитор амилазы. Примеры таких генов включают ингибитор цистеиновой протеазы риса (Abe et al., 1987 J. Biol. Chem. 262:16793), ингибитор I протеазы табака (Huub et al., 1993 Plant Molec. Biol. 21:985) и ингибитор α-амилазы (Sumitani et al., 1993 Biosci. Biotech. Biochem. 57:1243).
(F) Специфичный к насекомым гормон или феромон, такой как экдистероидный и ювенильный гормон, их варианты, миметик на их основе или их антагонист или агонист, такой как бакуловирусная экспрессия клонированного ювенильного гормона эстеразы, инактиватора ювенильного гормона (Hammock et al., 1990 Nature 344:458).
(G) Специфичный к насекомым пептид или нейропептид, который при экспрессии нарушает физиологию пораженного паразита (J. Biol. Chem. 269:9). Примеры таких генов включают рецептор диуретического гормона насекомых (Regan, 1994), аллостатин, идентифицированный в Diploptera punctata (Pratt, 1989) и специфические для насекомых паралитические нейротоксины (патент США № 5266361).
(H) Специфический для насекомых яд, продуцируемый змеями, пчелами и т.д., такой как инсектотоксический пептид скорпиона (Pang, 1992 Gene 116:165).
(I) Фермент, ответственный за гипераккумуляцию монотерпенов, сесквитерпенов, стероидов, гидроксамовой кислоты, фенилпропаноидного производного или другой небелковой молекулы с инсектицидной активностью.
(J) Фермент, вовлеченный в модификацию, в том числе посттрансляционную модификацию, биологически активной молекулы; например, гликолитический фермент, протеолитический фермент, липолитический фермент, нуклеаза, циклаза, трансаминаза, эстераза, гидролаза, фосфатаза, киназа, фосфорилаза, полимераза, эластаза, хитиназа и глюканаза, как природный, так и синтетический. Примеры таких генов включают ген callas (опубликованная заявка PCT WO93/02197), кодирующие хитиназу последовательности (которые могут быть получены, например, из ATCC под номерами доступа 3999637 и 67152), хитиназу анкилостома табака (Kramer et al., 1993 Insect Molec. Biol. 23:691), и ген полиубиквитина ubi4-2 петрушки (Kawalleck et al., 1993 Plant Molec. Biol. 21:673).
(K) Молекула, которая стимулирует передачу сигнала. Примеры таких молекул включают нуклеотидные последовательности для клонов кДНК кальмодулина фасоли золотистой (Botella et al., 1994 Plant Molec. Biol. 24:757) и нуклеотидную последовательность клона кДНК кальмодулина кукурузы (Griess et al., 1994 Plant Physiol. 104:1467).
(L) Пептид с гидрофобным моментом. См. патенты США № 5659026 и 5607914; в последнем из которых описаны синтетические противомикробные пептиды, которые сообщают устойчивость к заболеванию.
(M) Мембранная пермеаза, образующий канал белок или блокатор каналов, такой как аналог литического пептида цекропина-β (Jaynes et al., 1993 Plant Sci. 89:43), который сообщает трансгенным растениям табака устойчивость к Pseudomonas solanacearum.
(N) Вирусный инвазивный белок или комплексный токсин, происходящий из него. Например, накопление белков вирусной оболочки в трансформированных клетках растений сообщает устойчивость к вирусной инфекции и/или развитию заболевания, обусловленного вирусом, из которого происходит ген белка оболочки, а также родственными вирусами. Опосредуемая белком оболочки устойчивость была сообщена трансформированным растениям против вируса мозаики люцерны, вируса мозаики огурца, вируса полосатости табака, вируса X картофеля, вируса Y картофеля, вируса гравировки табака, вируса погремковости табака и вируса табачной мозаики. См., например, Beachy et al. (1990) Ann. Rev. Phytopathol. 28:451.
(O) Специфическое к насекомым антитело или иммунотоксин, происходящий из него. Таким образом, антитело, нацеленное на критическую метаболическую функцию в кишечнике насекомого, может инактивировать затрагиваемый фермент, вызывая гибель насекомого. Например, в Taylor et al. (1994) Abstract #497, Seventh Int’l. Symposium on Molecular Plant-Microbe Interactions показана ферментативная инактивация трансгенного табака посредством продукции одноцепочечных фрагментов антител.
(P) Вирус-специфическое антитело. См., например, Tavladoraki et al. (1993) Nature 266:469, где показано, что трансгенные растения, экспрессирующие рекомбинантные гены антител, защищены от вирусной атаки.
(Q) Останавливающий развитие белок, продуцируемый в природе патогеном или паразитом. Таким образом, эндо-α-1,4-D-полигалактуроназы грибов способствуют колонизации грибов и высвобождению питательных веществ растений с помощью солюбилизирующей клеточную стенку растения гомо-α-1,4-D-галактуроназы (Lamb et al., 1992) Bio/Technology 10:1436. Клонирование и охарактеризация гена, который кодирует ингибирующий эндополигалактуроназу белок бобов, описано в Toubart et al. (1992 Plant J. 2:367).
(R) Останавливающий развитие белок, продуцируемый в природе растением, такой как инактивирующий рибосомы ген ячменя, который обеспечивает увеличенную устойчивость к грибковым заболеваниям (Longemann et al., 1992). Bio/Technology 10:3305.
(S) РНК-интерференция, в которой молекулу РНК используют для ингибирования экспрессии гена-мишени. В одном примере молекула РНК является частично или полностью двухцепочечной молекулой, которая запускает подавляющий ответ, что приводит к расщеплению дцРНК на малые интерферирующие РНК, которые затем встраиваются в направленный комплекс, который разрушает гомологичную мРНК. См., например, Fire et al., патент США 6506559; Graham et al. 6573099.
Гены, которые сообщают устойчивость к гербицидам
(A) Гены, кодирующие резистентность или устойчивость к гербициду, который ингибирует точку роста или меристему, такому как имидазалиноновый, сульфонанилидный гербицид или гербицид на основе сульфонилмочевины. Иллюстративные гены в этой категории кодируют мутантный фермент ALS (Lee et al., 1988 EMBO J. 7:1241), который также известен как фермент AHAS (Miki et al., 1990 Theor. Appl. Genet. 80:449).
(B) Один или несколько дополнительных генов, кодирующих резистентность или устойчивость к глифосату, обеспечиваемую мутантными генами синтазы EPSP и aroA или метаболической инактивацией с помощью генов, таких как GAT (глифосатацетилтрансфераза) или GOX (глифосатоксидаза), и других фосфоносоединений, таких как глюфосинат (гены pat и bar; DSM-2), и арилоксифеноксипропионовые кислоты и циклогександионы (гены, кодирующие ингибитор ACC-азы). См., например, патент США № 4940835, в котором описана нуклеотидная последовательность формы EPSP, которая может сообщать устойчивость к глифосату. Молекулу ДНК, кодирующую мутантный ген aroA, можно получать из ATCC под номером доступа 39256, и нуклеотидная последовательность мутантного гена описана в патенте США № 4769061. В патентной заявке Европы № 0 333 033 и патенте США № 4975374 описаны нуклеотидные последовательности генов глутаминсинтетазы, которые сообщают устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидная последовательность гена фосфинотрицинацетилтрансферазы предоставлена в заявке Европы № 0 242 246. В De Greef et al. (1989) Bio/Technology 7:61 описано получение трансгенных растений, которые экспрессируют химерные гены bar, кодирующие активность фосфинотрицинацетилтрансферазы. Иллюстративные гены, сообщающие устойчивость к арилоксифеноксипропионовым кислотам и циклогександионам, таким как сетоксидим и галоксифор, представляют собой гены Accl-S1, Accl-S2 и Accl-S3, описанные Marshall et al. (1992) Theor. Appl. Genet. 83:435.
(C) Гены, кодирующие резистентность или устойчивость к гербициду, который ингибирует фотосинтез, такому как триазин (гены psbA и gs+) и бензонитрил (ген нитрилазы). В Przibilla et al. (1991) Plant Cell 3:169 описано использование плазмид, кодирующих мутантные гены psbA, для трансформации Chlamydomonas. Нуклеотидные последовательности для генов нитрилазы описаны в патенте США № 4810648, и молекулы ДНК, содержащие эти гены, доступны под номерами доступа ATCC 53435, 67441 и 67442. Клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу, описаны Hayes et al. (1992) Biochem. J. 285:173.
(D) Гены, кодирующие резистентность или устойчивость к гербицидам, которые связываются с гидроксифенилпируватдиоксигеназами (HPPD) - ферментами, которые катализируют реакцию, в которой пара-гидроксифенилпируват (HPP) преобразуется в гомогенисат. Они включают гербициды, такие как изоксазолы (EP418175, EP470856, EP487352, EP527036, EP560482, EP682659, патент США № 5424276), в частности изоксафлутол, который представляет собой селективный гербицид для кукурузы, дикетонитрилы (EP496630, EP496631), в частности, 2-циано-3-циклопропил-1-(2-SO2CH3-4-CF3фенил)пропан-1,3-дион и 2-циано-3-циклопропил-1-(2-SO2CH3-4-2,3Cl2фенил)пропан-1,3-дион, трикетоны (EP625505, EP625508, патент США № 5506195), в частности сулькотрион и пиразолинаты. Ген, который продуцирует избыток HPPD в растениях, может обеспечить устойчивость или резистентность к таким гербицидом, включая, например, гены, описанные в патентах США № 6268549 и 6245968 и публикации патентной заявки США № 20030066102.
(E) Гены, кодирующие резистентность или устойчивость к феноксиауксиновым гербицидам, таким как 2,4-дихлорфеноксиуксусная кислота (2,4-D) и которые также могут сообщать резистентность или устойчивость к арилоксифеноксипропионатным (AOPP) гербицидам. Примеры таких генов включают ген фермента α-кетоглутарат-зависимой диоксигеназы (aad-1), описанный в патенте США № 7838733.
(F) Гены, кодирующие резистентность или устойчивость к феноксиауксиновым гербицидам, таким как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и которые также могут сообщать резистентность или устойчивость к пиридилоксиауксиновым гербицидам, таким как флуроксипир или триклопир. Примеры таких генов включают ген фермента α-кетоглутарат-зависимой диоксигеназы (aad-12), описанный в WO 2007/053482 A2.
(G) Гены, кодирующие резистентность или устойчивость к дикамбе (см., например, публикацию патента США № 20030135879).
(H) Гены, обеспечивающие резистентность или устойчивость к гербицидам, которые ингибируют протопорфириногеноксидазу (PPO) (см. патент США № 5767373).
(I) Гены, обеспечивающие резистентность или устойчивость к триазиновым гербицидам (таким как атразин) и гербицидам на основе производных мочевины (таким как диурон), которые связываются с коровыми белками реакционных центров фотосистемы II (PS II) (См. Brussian et al., (1989) EMBO J. 1989, 8(4): 1237-1245.
ГЕНЫ, КОТОРЫЕ СООБЩАЮТ ИЛИ ВНОСЯТ ВКЛАД В ДОПОЛНИТЕЛЬНЫЙ ЦЕННЫЙ ПРИЗНАК
(A) Модифицированный метаболизм жирных кислот, например, путем трансформации кукурузы или Brassica антисмысловым геном или стеароил-ACP-десатуразой для увеличения содержания стеариновой кислоты в растении (Knultzon et al., 1992) Proc. Nat. Acad. Sci. USA 89:2624.
(B) Сниженное содержание фитатов
(1) Введение кодирующего фитазу гена, такого как ген фитазы Aspergillus niger (Van Hartingsveldt et al., 1993 Gene 127:87), усиливает разрушение фитатов, добавляя больше свободного фосфата трансформированному растению.
(2) Можно вводить ген, который уменьшает содержание фитатов. В кукурузе это можно осуществлять, например, путем клонирования, а затем повторного введения ДНК, ассоциированной с одним аллелем, который ответственен за мутанты кукурузы, характеризующиеся низкими уровнями фитиновой кислоты (Raboy et al., 1990 Maydica 35:383).
(C) Модифицированный состав углеводов, обеспечиваемый, например, путем трансформации растений геном, кодирующим фермент, который изменяет характер ветвления крахмала. Примеры таких ферментов включают, ген фруктозилтрансферазы Streptococcus mucus (Shiroza et al., 1988) J. Bacteriol. 170:810, ген левансукразы Bacillus subtilis (Steinmetz et al., 1985 Mol. Gen. Genet. 200:220), ген α-амилазы Bacillus licheniformis (Pen et al., 1992 Bio/Technology 10:292), гены инвертазы томата (Elliot et al., 1993), ген амилазы ячменя (Sogaard et al., 1993 J. Biol. Chem. 268:22480), и фермент II, разветвляющий крахмал эндосперма кукурузы (Fisher et al., 1993 Plant Physiol. 102:10450).
Различные анализы можно использовать применительно к молекуле нуклеиновой кислоты определенных вариантов осуществления настоящего изобретения. Описанные далее способы являются пригодными в различных ситуациях, и в одном варианте осуществления они пригодны для обнаружения молекулы нуклеиновой кислоты и/или полипептида, кодируемого в клетке растения. Например, присутствие молекулы можно определять различными путями, в том числе с использованием праймера или зонда для последовательности, анализа ELISA для обнаружения кодируемого белка, вестерн-блоттинга для обнаружения белка или нозерн- или саузерн-блоттинга для обнаружения РНК или ДНК. Можно использовать ферментативные анализы для обнаружения фермента DGT-28. Кроме того, антитело, которое может обнаруживать присутствие белка DGT-28, можно получать с использованием известных в данной области методик. Также для обнаружения присутствия или экспрессии рекомбинантной конструкции в конкретных органах или тканях растения можно использовать дополнительные способы, такие как гибридизация in situ, окрашивание ферментов и иммунное окрашивание. Трансген можно селективно экспрессировать в некоторых тканях растения и на некоторых стадиях развития, или трансген можно экспрессировать во всех тканях растения, по существу в продолжение всего жизненного цикла. Однако также применим любой комбинаторный способ экспрессии.
Саузерн-анализ представляет собой широко используемый способ обнаружения, где ДНК расщепляют с помощью ферментов рестрикции и фракционируют на агарозном геле для разделения ДНК по молекулярной массе, а затем переносят на нейлоновые мембраны. Затем ее гибридизуют с фрагментом-зондом, который является радиоактивно меченным посредством 32P (или другими метками для зондов) и промывают в растворе SDS.
Аналогично, в нозерн-анализе используется сходный протокол, где РНК расщепляют эндонуклеазами рестрикции и фракционируют на агарозном геле для разделения РНК по молекулярной массе, а затем переносят на нейлоновые мембраны. Затем ее гибридизуют с фрагментом-зондом, который является радиоактивно меченным посредством 32P (или других меток для зондов) и промывают в растворе SDS. Анализ РНК (например, мРНК), выделенной из представляющих интерес тканей, может указывать на относительные уровни экспрессии. Как правило, если мРНК присутствует или количество мРНК увеличилось, можно предположить, что соответствующий трансген экспрессируется. Нозерн-анализ или другие протоколы для анализа мРНК можно использовать для определения уровней экспрессии введенного трансгена или нативного гена.
В вестерн-анализе вместо выделения ДНК/РНК представляющий интерес белок экстрагируют и наносят на акриламидный гель. Затем белок переносят способом блоттинга на мембрану и контактируют с веществом для мечения. См. например, Hood et al., "Commercial Production of Avidin from Transgenic Maize; Characterization of Transformants, Production, Processing, Extraction and Purification" Molecular Breeding 3:291-306 (1997); Towbin et al, (1979) "Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications" Proc. Natl. Acad. Sci. USA 76(9): 4350-4354; Renart et al. "Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure" Proc. Natl. Acad. Sci. USA 76(7): 3116-3120.
Нуклеиновые кислоты в рамках настоящего изобретения или их сегменты можно использовать для конструирования праймеров для амплификации способом ПЦР. При проведении амплификации способом ПЦР, может допускаться определенная степень несоответствия между праймером и матрицей. Мутации, инсерции и делеции можно вносить в данный праймер способами, известными специалисту в данной области.
Другим примером способа обнаружения является способ пиросеквенирования, как описано Winge (Innov. Pharma. Tech. 00:18-24, 2000). В этом способе конструируют олигонуклеотид, который перекрывается с соседней геномной ДНК и точкой присоединения ДНК-вставки. Олигонуклеотид гибридизуют с одноцепочечным продуктом ПЦР из представляющей интерес области (один праймер во встроенной последовательности и один во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК-полимеразы, ATP, сульфурилазы, люциферазы, апиразы, аденозин-5′-фосфосульфата и люциферина. DNTP добавляют по отдельности, и встраивание приводит к световому сигналу, который измеряют. Световой сигнал указывает на присутствие вставки трансгена/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения на одно или несколько оснований.
Для применения для обнаружения последовательности описаны молекулярные маяки. В кратком изложении, конструируют олигонуклеотидный зонд FRET, который перекрывает область соединения фланкирующей геномной ДНК и ДНК-вставки. Уникальная структура зонда FRET приводит к тому, что он содержит вторичную структуру, которая удерживает флуоресцентную часть и осуществляющую гашение часть близко друг к другу. Зонд FRET и праймеры для ПЦР (один праймер в последовательности ДНК-вставки и один во фланкирующей геномной последовательности) подвергают циклическим реакциям в присутствии термостабильной полимеразы и dNTP. После успешной амплификации способом ПЦР, гибридизация зонда(ов) FRET с последовательностью-мишенью приводит к удалению вторичной структуры зонда и пространственному разделению флуоресцентной части и осуществляющей гашение части. Флуоресцентный сигнал указывает на присутствие последовательности фланкирующей геномной ДНК/вставки трансгена вследствие успешной амплификации и гибридизации.
Анализ с гидролизом зонда, также известный как TAQMAN® (Life Technologies, Foster City, Calif.), представляет собой способ обнаружения и количественного определения присутствия последовательности ДНК. В кратком изложении, олигонуклеотидные зонды FRET конструируют так, чтобы один олигонуклеотид находился в трансгене, а другой находился во фланкирующей последовательности для специфичного обнаружения трансгенного объекта. Зонд FRET и праймеры для ПЦР (один праймер в последовательности ДНК-вставки и один во фланкирующей геномной последовательности) подвергают циклической реакции в присутствии термостабильной полимеразы и dNTP. Гибридизация зонда FRET приводит к расщеплению и освобождению флуоресцентной части от осуществляющей гашение части на зонде FRET. Флуоресцентный сигнал указывает на присутствие фланкирующей последовательности/последовательности трансгенной вставки вследствие успешной амплификации и гибридизации.
ELISA, или твердофазный иммуноферментный анализ, известен с 1971 года. Как правило, антигенами, солюбилизированными в буфере, покрывают пластмассовую поверхность. Когда добавляют сыворотку, антитела могут связываться с антигеном на твердой фазе. Присутствие или отсутствие этих антител может быть продемонстрировано, когда они конъюгированы с ферментом. Добавление соответствующего субстрата выявит некоторое количество связанного конъюгата, которое можно количественно определить. Обычный анализ ELISA представляет собой анализ, в котором используются биотинилированные поликлональные антитела (против белка) и конъюгат с щелочной фосфатазой. Например, ELISA, используемый для количественного определения уровней лакказы, может представлять собой сэндвич-анализ антитела, в котором используются поликлональные антитела кролика, полученные коммерчески. Антитело конъюгируют с щелочными фосфатазами для обнаружения. В другом примере в анализе ELISA для обнаружения трипсина или трипсиногена используются биотинилированные поликлональные антитела против трипсина или против трипсиногена и конъюгат стрептавидин-щелочная фосфатаза.
Определенные варианты осуществления относятся к способам проведения скрещиваний с использованием растения согласно варианту осуществления настоящего изобретения в качестве по меньшей мере одного родительского растения. Например, конкретные варианты осуществления относятся к гибридному растению F1, имеющему в качестве одного или обоих родительских растений любое из растений, проиллюстрированных в настоящем описании. Другие варианты осуществления относятся к семенам, продуцированным такими гибридами F1. Другие варианты осуществления относятся к способу получения гибридных семян F1 путем скрещивания проиллюстрированного растения с отличающимся растением (например, инбредным родительским растением) и сбора полученных гибридных семян. Другие варианты осуществления относятся к проиллюстрированному растению, которое представляет собой либо женское родительское растение, либо мужское родительское растение. Характеристики полученных растений могут быть улучшены путем тщательного изучения родительских растений.
V. Устойчивость к глифосату, опосредуемая DGT-28
Полипептиды, обладающие по меньшей мере 90% идентичностью последовательности с SEQ ID NO: 1, могут обладать ферментативной активностью EPSPS. Таким образом, полипептиды, обладающие по меньшей мере 90% идентичностью с SEQ ID NO: 1, нуклеиновые кислоты, кодирующие полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1 (например, SEQ ID NO: 2-4), и нуклеиновые кислоты, которые гибридизуются с нуклеиновой кислотой, обладающей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости, можно использовать в некоторых вариантах осуществления для сообщения устойчивости к глифосату клетке или организму (например, клетке растения или растению). Предоставление растения или клетки растения, которые являются устойчивыми к гербицидным составам глифосата, может быть пригодным в различных применениях, где клетки растения, обладающие такой устойчивостью, могут выдерживать воздействие достаточного количества глифосата, который используется для борьбы по меньшей мере с некоторыми сорняками на возделываемой посевной площади.
Глифосат, композиция, содержащая N-(фосфонометил)глицин, представляет собой широко используемый компонент в гербицидах. Глифосат, как правило, составляют в качестве соли в водном жидком концентрате, твердом концентрате, эмульсии или микроэмульсии. Глифосат можно наносить на растения поверхностно, начиная с их прорастания, на протяжении различных стадий развития растения.
Устойчивые к глифосату сорта растений, используемые в комбинации с гербицидными составами глифосата, стали стандартной программой для борьбы с сорняками при производстве сельскохозяйственных культур в США и по всему миру. Основным преимуществом для растениеводов в использовании признака устойчивости к глифосату является то, что он обеспечивает простое и удобное внесение глифосата, послевсходового гербицида широкого спектра, для борьбы с нежелательными растениями и травами (т.е. "сорняками") с превосходной безопасностью для культуры и меньшей зависимостью от внесения предпосадочных гербицидов. Другая польза включает лучшую приспособляемость к системам нулевой обработки почвы и ограниченной подготовки почвы. Устойчивые к глифосату культуры обеспечивают расширенные возможности для борьбы с сорняками, и они обеспечивают значительное упрощение, снижение стоимости и большую универсальность практики борьбы с сорняками. Растениеводы сообщали о том, что они проводили меньшее количество выездов на поля для внесения гербицидов, а также делали меньше выездов для обработки, что сохраняет топливо и уменьшает эрозию почвы. Таким образом, устойчивые к глифосату культуры снижают экологические риски гербицидов, и в то же время увеличивают эффективность необходимой химической борьбы с сорняками.
Таким образом, некоторые варианты осуществления в рамках настоящего изобретения относятся к селективной борьбе с сорняками на возделываемой посевной площади, содержащей растение, содержащее полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, и/или нуклеиновую кислоту, которая гибридизуется с нуклеиновой кислотой, имеющей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости, где растение обладает увеличенной устойчивостью к глифосату по сравнению с растением того же вида, которое не содержит полипептид и/или нуклеиновую кислоту(ы). В некоторых примерах способ, предусматриваемый в рамках настоящего изобретения, включает нанесение достаточного количества гербицидного глифосата на листья культуры и сорняки для контроля роста сорняков.
Конкретные варианты осуществления в рамках настоящего изобретения предусматривают способ уничтожения или борьбы с сорняками или нежелательным разрастанием на возделываемой посевной площади, содержащей культуру (например, растение, содержащее полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, нуклеиновую кислоту, кодирующую полипептид, обладающий по меньшей мере 90% идентичностью с SEQ ID NO: 1, и/или нуклеиновую кислоту, которая гибридизуется с нуклеиновой кислотой, имеющей SEQ ID NO: 2 или SEQ ID NO: 3, в условиях высокой жесткости). В некоторых примерах способ включает внесение глифосата на культуру и/или возделываемую посевную площадь; например, нанесение некоторого количества глифосата на листву сельскохозяйственной культуры, и одновременно на сорняки, растущие вблизи таких растений, где это количество является достаточным для обеспечения борьбы с сорняками или нежелательным разрастанием, в то время как сельскохозяйственная культура остается по существу неповрежденной.
Композицию глифосата можно применять к растениям во вносимых дозах, достаточных для обеспечения желаемых биологических результатов, например, для контроля роста сорняков без значительного повреждения устойчивых к глифосату сельскохозяйственных культур. Эти вносимые дозы обычно выражают как количество глифосата на единицу обрабатываемой площади, например, в граммах на гектар (г/га). То, что представляет собой "значительный эффект", варьирует в зависимости от стандартов и практики лиц, которые исследуют, разрабатывают, выпускают на рынок и применяют композиции, и выбор уровней применения композиции, которые обладают значительной эффективностью, находятся в пределах квалификации специалистов в данной области.
В определенных примерах количество композиции глифосата, вносимого на единицу площади для обеспечения 85% борьбы с сорняками, измеряемой по уменьшению роста или смертности, используют для определения уровня внесения. Выбор количества уровней внесения гербицида глифосата, достаточных для борьбы с сорняками на возделываемой посевной площади, находится в пределах квалификации ученого-агронома. Специалистам в данной области, аналогично, будет понятно, что индивидуальные условия посева, погоды и выращивания, а также конкретные активные ингредиенты и их весовое соотношение в композиции, могут влиять на степень гербицидной эффективность в конкретном применении.
В некоторых вариантах осуществления водную композицию глифосата можно наносить на ткани листьев растений для уничтожения или контроля роста широкого множества нежелательных растений, включая однолетние и многолетние травы и виды широколистных сорняков, путем нанесения на ткани листьев растений водных композиций глифосата. Относительное количество глифосата, присутствующего в предусматриваемой гербицидной композиции (например, концентрат в форме твердых частиц, жидкий концентрат, готовая к применению композиция и композиция баковой смеси) может варьировать в зависимости от многих факторов, включая, например, вид сорняков, с которым осуществляют борьбу, и способ внесения. Однако, в общем, концентрация глифосата, и необязательно поверхностно-активного вещества и/или некоторого другого адъюванта или добавки (как описано в настоящем описании), используемых в гербицидной композиции, является достаточной для борьбы с сорняками на возделываемой посевной площади.
Композицию гербицидного спрея можно использовать в виде водного раствора или дисперсии, независимо от того, изготавливают ли композицию в готовом для применения виде или получена ли она путем дальнейшего разбавления жидкого концентрата глифосата или добавления воды к концентрату глифосата в форме твердых частиц. Однако, термин "водный", как используют в рамках изобретения, включает композиции, содержащие небольшое количество неводного растворителя при условии, что основным присутствующим растворителем является вода. Композиции гербицидного спрея можно наносить на листья растений, подлежащих обработки, посредством любого из подходящих способов, которые хорошо известны специалистам в данной области, включая способы авиационного внесения и внесения в почву (например, штанговый опрыскиватель, ручной опрыскиватель и веревочный фитиль).
В некоторых примерах композицию жидкого концентрата составляют так, чтобы она включала глифосат в концентрации по меньшей мере приблизительно 50 грамм, по меньшей мере приблизительно 75 грамм, или по меньшей мере приблизительно 100, 125, 150, 175, 200, 225, 250, 275, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690 или 700 грамм (эквивалент кислоты или э.к.) на литр или больше. Диапазон концентраций глифосата может составлять, например, от приблизительно 50 до приблизительно 680 грамм (э.к.) на литр (г/л), от приблизительно 100 до приблизительно 600 г/л, от приблизительно 250 до приблизительно 600 г/л, и от приблизительно 360 до приблизительно 540 г/л.
При выражении в качестве весового процента на основе общей массы концентрата глифосата, жидкий концентрат может содержать, например, по меньшей мере приблизительно 10 масс.% глифосата (э.к.), по меньшей мере приблизительно 15 масс.%, и по меньшей мере приблизительно 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 62, 63, 64, 65, 66, 67 или 68 масс.%, или более. Диапазон концентраций глифосата может составлять, например, от приблизительно 10 масс.% до приблизительно 70 масс.% э.к., от приблизительно 20 масс.% до приблизительно 68 масс.%, или от приблизительно 25 масс.% до приблизительно 45 масс.%.
Если глифосат вносят в качестве готовой к применению композиции, концентрация глифосата может составлять, например, от приблизительно 1 масс.% до приблизительно 3 масс.% э.к., и от приблизительно 1 масс.% до приблизительно 2 масс.%.
Композиции спрея можно составлять для внесения, например, по меньшей мере приблизительно 1 галлона (3,8 л) композиции спрея на акр, по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 галлонов (75,7 л) на акр и более. Распыляемый объем композиции спрея может находиться в диапазоне, например, от приблизительно 1 галлона (3,8 л) до приблизительно 100 галлонов (378,5 л) на акр, от приблизительно 2 галлонов (7,6 л) до приблизительно 40 галлонов (151,41 л) на акр, и от приблизительно 2 галлонов (7,6 л) до приблизительно 5 галлонов (18,9 л) на акр для авиационного внесения, и от приблизительно 5 галлонов (18,9 л) до приблизительно 20 галлонов (75,7 л) на акр для внесения в почву.
В некоторых примерах можно использовать состав жидкого концентрата, имеющий водную фазу, где глифосат присутствует в основном в форме соли, и неводную фазу, необязательно содержащую второй гербицидно активный ингредиент, который является относительно нерастворимым в воде. Такие составы могут включать, например, эмульсии (включая макроэмульсии и микроэмульсии, типы "вода-в-масле", "масло-в-воде" и "вода-в-масле-в-воде"), суспензии и суспоэмульсии. Неводная фаза в определенных случаях может содержать микроинкапсулированный компонент (например, микроинкапсулированный гербицид). В составах, имеющих неводную фазу, концентрация глифосата, э.к., в композиции в целом, тем не менее, может находиться в конкретных иллюстративных диапазонах, указанных в настоящем описании для составов водного концентрата.
Подходящие солевые формы глифосата, которые можно использовать в соответствии с любым из составов, включают, например, соли щелочных металлов, например, соли натрия и калия, соли аммония, соли диаммония, такие как диметиламмоний, соли алкиламина, например, соли диметиламина и изопропиламина, соли алканоламина, например, соли этаноламина, соли алкилсульфония, например, соли триметилсульфония, соли сульфоксония и их смеси или комбинации. Примеры коммерчески составов глифосата включают, но не ограничиваются ими: GLYPHOMAX™, GLYPHOMAX™ XRT, GLYPHOMAX™ PLUS, DURANGO™, ROUNDUP™ ULTRA, ROUNDUP™ ULTRAMAK, ROUNDUP™ CT, ROUNDUP™ EXTRA, ROUNDUP™ BIOACTIVE, ROUNDUP™ BIOFORCE, RODEO™, POLARIS™, SPARK™, ACCORD™ SP, ACCORD™ XRT и ACCORD™ CONCENTRATE, все из которых содержат глифосат в качестве его соли изопропиламмония (IPA); ROUNDUP™ DRY и RIVAL™, которые содержат глифосат в качестве его соли аммония; ROUNDUP™ GEOFORCE, состав натрий глифосата; TOUCHDOWN™, состав соли глифосата-тримезия, TOUCHDOWN™ IQ, состав соли глифосата-диаммония, TOUCHDOWN™ TOTAL IQ, состав глифосата калия, и ROUNDUP™ WEATHERMAX, состав глифосата калия. Составы глифосата могут включать антидоты, поверхностно-активные вещества и/или адъюванты.
Если желательно, пользователь может смешивать один или несколько адъювантов с композицией глифосата и водой для разведения при получении состава для применения. Такие адъюванты могут включать дополнительное поверхностно-активное вещество и/или неорганическую соль (например, сульфат аммония) с целью дальнейшего усиления гербицидной эффективности.
Если желательно, пользователь также может использовать соответствующие антидоты в составе глифосата, чтобы дополнительно защитить растения и/или обеспечить перекрестную устойчивость к дополнительным гербицидам. Антидоты представляют собой химические вещества, которые уменьшают фитотоксичность гербицидов для сельскохозяйственных культур благодаря физиологическому или молекулярному механизму, без снижения их эффективности борьбы с сорняками. Антидоты, как правило, действуют, усиливая иммунную систему растения путем активации/экспрессии cP450. Иллюстративные антидоты включают, например, но не ограничиваются ими: беноксакор, клоквинтоцет, циометринил, дихлормид, дициклонон, диэтолат, фенхлоразол, фенклорим, флуразол, флуксофеним, фурилазол, изоксадифен, мефенпир, мефенат, нафталиновый ангидрид и оксабетринил.
Антидоты можно использовать для защиты крупносеменных посевных культур, например, но не ограничиваясь ими, кукурузы, сорго обыкновенного и риса влажного посева, от включаемых предпосадочных или вносимых до прорастания гербицидов семейств тиокарбамата и хлорацетанилида. Также разработаны антидоты для защиты зимних зерновых культур, таких как пшеница, от послевсходового внесения гербицидов на основе арилоксифеноксипропионата и сульфонилмочевины. Применение антидотов для защиты кукурузы и риса от гербицидов на основе сульфонилмочевины, имидазолинона, циклогександиона, изоксазола и трикетона, также является общепринятым.
Активаторы растений (новый класс соединений, которые защищают растения путем активации их механизмов защиты), также можно использовать в вариантах осуществления в рамках настоящего изобретения. Иллюстративные активаторы растений включают ацибензолар и пробеназол.
Варианты осуществления настоящего изобретения далее определены в представленных ниже примерах. Следует понимать, что эти примеры приведены только в качестве иллюстрации. Из представленного выше обсуждения и этих примеров квалифицированный специалист может установить неотъемлемые характеристики настоящего изобретения, и, без отклонения от его сущности и объема, может внести различные изменения и модификации в варианты осуществления изобретения, чтобы адаптировать их к различным способам применения и условиям. Таким образом, различные модификации вариантов осуществления изобретения, в дополнение к вариантам осуществления, представленным и описанным в настоящем описании, будут очевидными специалистам в данной области из представленного выше описания. Подразумевается, что такие модификации также входят в объем прилагаемой формулы изобретения. Нижеследующее предоставлено в качестве иллюстрации и не предназначено для ограничения объема изобретения.
ПРИМЕРЫ
Пример 1: Материалы и способы
Варианты осуществления настоящего изобретения далее описаны в представленных ниже примерах, которые предоставлены в качестве иллюстрации и не предназначены для ограничения изобретения никоим образом.
Одна мутация аминокислоты (G96A) в ферменте 5-енолпирувилшикимат-3-фосфатсинтазе (EPSP-синтаза) Escherichia coli может приводить к нечувствительности к глифосату (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)). Хотя эта мутация сообщает устойчивость к глифосату, также известно, что она неблагоприятно влияет на связывание EPSP-синтазы с ее природным субстратом фосфоенолпируватом (PEP). Изменение в результате этого эффективности связывания субстрата может привести к тому, что мутантный фермент будет непригодным для обеспечения устойчивости растений к глифосату.
Базу данных Genbank NCBI подвергали скринингу in silico в отношении белковых и полинуклеотидных последовательностей EPSP-синтазы, которые естественным образом содержат аланин в положении в ферменте EPSP-синтазе, аналогичном положению мутации G96A, которая была внесена в версию фермента из E.coli (Padgette et al., (1991); Eschenburg et al., (2002); Priestman et al., (2005); Haghani et al., (2008)).
Одним ферментом, который был идентифицирован в качестве содержащего природный аланин в этом положении, был DGT-28 (GENBANK ACC NO: ZP_06917240.1) из Streptomyces sviceus ATCC29083. Дополнительное изучение данных in silico выявило три других уникальных фермента Streptomyces с более высокой гомологией с DGT-28; DGT-31 (GENBANK ACC NO: YP_004922608.1); DGT-32 (GENBANK ACC NO: ZP_04696613); и DGT-33 (GENBANK ACC NO: NC_010572). Каждый из этих ферментов содержит природный аланин в положении в ферменте EPSP-синтазе, аналогичном положению мутации G96A, которая была внесена в версию фермента из E.coli. Фиг. 1.
Поскольку белки EPSP-синтазы из различных организмов имеют различную длину, нумерация мутации для версии фермента EPSP-синтазы из E.coli не обязательно соответствует нумерации мутации для ферментов EPSP-синтаз из других организмов. Эти идентифицированные ферменты EPSP-синтазы ранее не были охарактеризованы в отношении устойчивости к глифосату или аффинности к субстрату PEP. Более того, эти ферменты EPSP-синтазы представляют собой новый класс ферментов EPSP-синтаз и они не содержат никаких мотивов последовательности, которые использовались для охарактеризации ранее описанного класса I (происходящие из растений последовательности, дополнительно описанные в патенте США № RE39247), II (происходящие из бактерий последовательности, дополнительно описанные в патенте США № RE39247) и III (происходящие из бактерий последовательности, дополнительно описанные в международной патентной заявке WO 2006/110586) ферментов EPSP-синтаз.
Новые ферменты DGT-28, DGT-31, DGT-32 и DGT-33 охарактеризовывали в отношении устойчивости к глифосату и аффинности к субстрату PEP путем сравнения с ферментами EPSP-синтазами класса I. Следующие ферменты класса I; DGT-1 из Glycine max, DGT-3 из Brassica napus (GENBANK ACC NO: P17688) и DGT-7 из Triticum aestivum (GENBANK ACC NO: EU977181) были взяты для сравнения. Ферменты EPSP-синтазы класса I и их мутантные варианты синтезировали и оценивали. Мутация, внесенная в ферменты EPSP-синтазы растений, состояла из мутации глицина на аланин, внесенной в фермент EPSP-синтазу в положении, сходном с положением мутации G96A из версии фермента из E.coli. Кроме того, мутации треонина на изолейцин и пролина на серин вносили в эти ферменты EPSP-синтазы класса I в аналогичных положениях с положениями аминокислоты 97 (T на I) и аминокислоты 101 (P на S) в EPSP-синтазе E.coli, как описано в Funke et al., (2009).
На Фиг. 1 представлено выравнивание неполных последовательностей DGT-28, DGT-31, DGT-32 и DGT-33 с другими ферментами EPSP-синтазами. Все четыре фермента DGT имеют консервативный аланин в положении аминокислоты 96 EPSP-синтазы aroA. Положение этой аминокислоты указано звездочкой, и аминокислотный остаток подчеркнут.
На Фиг. 2 представлено выравнивание ферментов DGT-1, DGT-3 и DGT-7. Положение аминокислотного остатка, в котором была внесена мутация с глицина на аланин, указано первой звездочкой. Положение аминокислотного остатка, в котором была внесена мутация с треонина на изолейцин, указано второй звездочкой. Положение третьего аминокислотного остатка, в котором была внесена мутация с пролина на серин, указано третьей звездочкой. Эти мутации вносили в различные версии DGT-1, DGT-3 и DGT-7. Различные версии (v1, v2, v3… vN) генов, которые содержат мутации, более подробно описаны ниже.
Пример 2: Оптимизация последовательности для экспрессии в растениях и бактериях
Оптимизация для растений. Предпочтение кодонов для двудольных и однодольных (кукуруза) растений вычисляли как частоту, при которой один кодон используется относительно кодонов для всех аминокислот. Таблица 1. Альтернативно предпочтение кодонов можно вычислять как частоту, при которой один кодон используют для кодирования конкретной аминокислоты относительно всех других кодонов для этой аминокислоты (синонимичные кодоны). При конструировании кодирующих областей для экспрессии в растениях, определяли основные ("первого выбора") кодоны, предпочитаемые растением, а также кодоны второго, третьего, четвертого и т.д. выбора предпочтительных кодонов, когда существовало множество возможностей для выбора.
Анализ кодирующей последовательности DGT-28 из S. sviceus выявил присутствие нескольких мотивов последовательности, которые, как полагали, были неблагоприятными для оптимальной экспрессии в растениях, а также композиции неоптимальных кодонов для экспрессии в двудольных и однодольных растениях.
|
|
Для конструирования оптимизированных для растения генов, кодирующих белок DGT-28, конструировали последовательности ДНК для кодирования аминокислотных последовательностей с использованием избыточного генетического кода на основе таблицы предпочтения кодонов, составленной из кодирующих белок последовательностей для конкретных растений-хозяев. В таблице 1, столбцы D и I, представлено распределение (в % использовании всех кодонов этой аминокислоты) синонимичных кодонов для каждой аминокислоты, встречающихся в кодирующих областях однодольных (кукуруза) растений. В столбцах E и J представлены распределения (в % использовании всех кодонов для этой аминокислоты) синонимичных кодонов для каждой аминокислоты, встречающихся в кодирующих областях двудольных растений. Некоторые синонимичные кодоны для некоторых аминокислот встречаются только редко в генах растений (например, CGG). Обычно кодон считался редко используемым, если он соответствовал приблизительно 10% или менее случаев кодирования соответствующей аминокислоты в генах любого типа растений (указанный как DNU в столбцах C и H таблицы 1). Для уравновешивания распределения оставшихся выбираемых кодонов для аминокислоты, вычисляли средневзвешенное представление для каждого кодона с использованием формулы:
|
где C1 представляет собой рассматриваемый кодон, и %C2, %C3 и т.д. соответствуют средним значениям для двудольных растений % величин оставшихся кодонов (средние % величины для соответствующих кодонов взяты из столбцов C и H), представленных в таблице 1.
Средневзвешенная % величина для каждого кодона приведена в столбцах C и H таблицы 1.
С использованием указанной выше методики была сконструирована новая последовательность ДНК, которая фактически кодирует аминокислотную последовательность белка DGT-28, для оптимальной экспрессии в двудольных растениях с использованием сбалансированного распределения кодонов для часто используемых кодонов, встречающихся в генах двудольных растений. Вторую последовательность ДНК, которая фактически кодирует аминокислотную последовательность белка DGT-28, конструировали для оптимальной экспрессии в однодольных растениях с использованием сбалансированного распределения кодонов для часто используемых кодонов, встречающихся в генах однодольных растений. Две новых последовательности ДНК отличались от исходных последовательностей ДНК, кодирующих dgt-28, заменой кодонов растения (первого предпочтения, второго предпочтения, третьего предпочтения или четвертого предпочтения) для обеспечения соответствующей аминокислоты в каждом положении в аминокислотной последовательности белка.
Конструирование оптимизированных для растений последовательностей ДНК начинали путем обратной трансляции белковой последовательности DGT-28 (номер доступа Genbank №: ZP_06917240.1). SEQ ID NO: 1 подвергали обратной трансляции с использованием таблицы предпочтительных кодонов для двудольных растений, составленной на основе таблицы 1, столбцы E и J. Вторую обратную трансляцию SEQ ID NO: 1 осуществляли с использованием таблицы предпочтения кодонов для однодольных растений, составленной на основе таблицы 1; столбцы D и I.
Затем первоначальные подвергнутые обратной транскрипции последовательности модифицировали путем компенсации замен кодонов (при сохранении общего средневзвешенного представления кодонов) для удаления или добавления участков распознавания ферментами рестрикции, удаления высокостабильных внутрицепочечных вторичных структур и удаления других последовательностей, которые могут быть неблагоприятными для манипуляций при клонировании или экспрессии модифицированного способами инженерии гена в растениях. Затем последовательность ДНК повторно анализировали в отношении участков распознавания ферментами рестрикции, которые могли быть сформированы путем модификаций. Идентифицированные участки далее модифицировали путем замены соответствующих кодонов предпочтительными кодонами первого, второго, третьего или четвертого выбора. Другие участки в последовательностях, которые могут влиять на транскрипцию или трансляцию представляющего интерес гена, включают участки соединения экзон:интрон (5′ или 3′), сигналы присоединения поли-A, и сигналы терминации для РНК-полимеразы. Модифицированные последовательности далее анализировали и далее модифицировали для уменьшения частоты дублетов TA или CG, и для увеличения частоты дублетов TG или CT. В дополнение к этим дублетам, блоки последовательности, которые имеют более чем приблизительно шесть последовательно расположенных остатков [G+C] или [A+T], могут влиять на транскрипцию или трансляцию последовательности. Таким образом, эти блоки последовательности также модифицировали путем замены кодонов первого или второго выбора и т.д. другими предпочтительными для выбора кодонами. Редко используемые кодоны не включали в значительной степени в конструкцию гена, и их использовали по существу только при необходимости для удовлетворения различных критериев конструирования, а не для композиции кодонов (например, добавление или удаление участков распознавания ферментами рестрикции).
Вновь сконструированная оптимизированная для двудольных растений полинуклеотидная последовательность dgt-28 v5 приведена в SEQ ID NO: 2. Вновь сконструированная оптимизированная для однодольных растений полинуклеотидная последовательность dgt-28 v6 приведена в SEQ ID NO: 3; эта последовательность была немного модифицирована путем включения аланина во втором положении аминокислоты для внесения участка для фермента рестрикции. Полученные последовательности ДНК обладают более высокой степенью разнообразия кодонов, желаемой композицией оснований, они содержат стратегически расположенные участки распознавания ферментами рестрикции и лишены последовательностей, которые могут препятствовать транскрипции гена или трансляции мРНК-продукта.
Синтез фрагментов ДНК, включающих SEQ ID NO: 2 и SEQ ID NO: 3, которые содержат дополнительные последовательности, такие как стоп-кодоны 6 рамок (стоп-кодоны, расположенные во всех шести рамках считывания, которые добавлены к 3′-концу кодирующей последовательности), и 5′-участок рестрикции для клонирования, проводился коммерческими поставщиками (DNA2.0, Menlo Park, CA). Затем синтетическую молекулу нуклеиновой кислоты клонировали в экспрессирующие векторы и трансформировали в растения или бактерии, как описано в примерах ниже.
Сходные стратегии оптимизации кодонов использовали для конструирования dgt-1, dgt-3 v2 (G173A), dgt-3 v3 (G173A; P178S), dgt-3 v4 (T174I; P178S), dgt-7 v4 (T168I; P172S), dgt-32 v3, dgt-33 v3 и dgt-33 v3. Кодон-оптимизированные версии этих генов приведены в качестве SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 144, соответственно.
Оптимизация для бактерий. Конструировали новую последовательность ДНК, кодирующую белок DGT-28 SEQ ID NO: 1, которая оптимизирована для экспрессии в клетках Escherichia coli. Конструирование оптимизированной для E.coli последовательности ДНК начинали путем обратной трансляции белковой последовательности SEQ ID NO: 1 с использованием запатентованного протокола оптимизации кодонов от GeneArt (Regensburg, Германия). Исходную последовательность модифицировали путем компенсации изменений кодонов (при сохранении общего средневзвешенного представления) для удаления или добавления участков распознавания ферментами рестрикции, и для удаления высокостабильных внутрицепочечных вторичных структур и других последовательностей, которые могут быть неблагоприятными для манипуляций при клонировании или экспрессии модифицированного способами инженерии гена. Примером такой неблагоприятной последовательности, которую стремились избегать в кодирующей области, является последовательность связывания 16S рибосомной РНК ("последовательность Шайна-Дальгарно"), такая как AGGAGG, которая может кодировать, например, две последовательно расположенных аминокислоты аргинина, но которая также может служить в качестве внутригенного (и, таким образом, нежелательного) сигнала инициации трансляции. Предпочтительная для E.coli последовательность ДНК dgt-28 (dgt-28 v1), которая кодирует белок SEQ ID NO: 1, приведена в качестве SEQ ID NO: 4.
Для облегчения клонирования и для обеспечения эффективной инициации трансляции 5′-концевую последовательность для распознавания ферментом рестрикции NdeI помещали выше инициирующего трансляцию кодона ATG. Также для облегчения клонирования и для обеспечения надлежащей терминации трансляции на 3′-конце кодирующей области были включены основания, кодирующие два стоп-кодона трансляции TAA и участок распознавания ферментами рестрикции XhoI. Синтез фрагмента ДНК, содержащего SEQ ID NO: 4, проводился коммерчески поставщиком GeneArt™.
Сходные стратегии оптимизации кодонов для E.coli использовали для конструирования dgt-1 v5, dgt-1 v6 (G112A), dgt-1 v7 (G112A; P117S), dgt-1 v8 (T113I; P117S), dgt-3 v6 (G105A), dgt-3 v7 (G105A; P112S), dgt-3 v8 (T106I; P112S), dgt-7 v5, dgt-7 v6 (G113A), dgt-7 v7 (G113A; P117S), dgt-7 v8 (T114I; P117S), dgt-32 v5 и dgt-33 v5. Версии последовательностей dgt-1, dgt-3 и dgt-7 модифицировали путем удаления нацеливающей на хлоропласты последовательности. Кодон-оптимизированные для E.coli версии этих генов приведены в качестве SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, соответственно.
Пример 3: Векторы для бактериальной экспрессии генов устойчивости к глифосату
Конструирование экспрессирующего dgt-28 вектора pET для экспрессии E.coli. Для испытания in vitro оптимизированную для E.coli последовательность гена dgt-28 v1 (SEQ ID NO: 4) синтезировали и клонировали в GeneArt™ в целях синтеза и клонирования. Синтезированную последовательность гена dgt-28 v1 клонировали в экспрессирующий вектор pET28 через добавленные участки рестрикции Nde I и Xho I. В полученную конструкцию вносили N-концевую 6X His-метку и ее обозначили как pDAB100445. Фиг. 14.
Сайт-направленный мутагенез dgt-28 v1. Сайт-направленный мутагенез проводили в dgt-28 v1 для оценки роли аланина в положении 84 в обеспечении устойчивости к глифосату. Этот природный аланин подвергали мутации на глицин для определения того, может ли изменение снизить устойчивость фермента к глифосату или аффинность к PEP. Этот аминокислотный остаток был выбран, поскольку он соответствует мутации G96A, которая была внесена в EPSP-синтазу E.coli, как описано ранее.
Для проведения мутагенеза использовали набор Quick Change II™ от Stratagene™ (Santa Clara, CA). Реакции ПЦР проводили в соответствии с протоколом QuickChange™ с использованием pDAB100445 (dgt-28 v1) в качестве матричной ДНК. Конструкцию, содержащую мутантную последовательность гена dgt-28 v2, обозначили как pDAB102946 (Фиг. 15) и подтвердили путем секвенирования ДНК. Чтобы осуществить переключение аминокислот, конструировали следующие праймеры:
DGT28 MutF (SEQ ID NO: 25; 5′ gATgTTTATTgCCgTgATggTggAACCACCgCACgTTTTC).
DGT28 MutR (SEQ ID NO: 26; 5′ gAAAACgTgCggTggTTCCACCATCACggCAATAAACATC).
Второй раунд мутагенеза осуществляли на dgt-28 v2 в попытках дальнейшего снижения его устойчивости к глифосату. Вторую мутацию T172A вносили в уже мутантный dgt-28 v2. Реципрокная мутация аланина на треонин в этом положении EPSP-синтазы ранее была описана в Haghani et al., (2008), где она приводила к нечувствительности к глифосату. Окончательным результатом было получение двойного мутанта A84G, T172A, который был обозначен как dgt-28 v3. Реакции ПЦР проводили в соответствии с протоколом QuickChange™ с использованием pDAB102946 (dgt-28 v2) в качестве ДНК-матрицы. Конструкция, содержащая мутантную последовательность гена dgt-28 v3, была обозначена как pDAB100469 (Фиг. 16). Следующие праймеры использовали для внесения мутации T172A:
DGT28 Mut2F (SEQ ID NO: 27; 5′ gggTCCgCTggCACgTCAgggTCTgCgTATTCg).
DGT28 Mut2R (SEQ ID NO: 28; 5′ CgAATACgCAgACCCTgACgTgCCAgCggACCCAgCAgC).
Дополнительные конструкции, экспрессирующий вектор pET для экспрессии в E.coli. Для испытания in vitro, последовательности генов dgt-1 v5, dgt-1 v6, dgt-1 v7, dgt-1 v8, dgt-3 v6, dgt-3 v7, dgt-3 v8, dgt-7 v5, dgt-7 v6, dgt-7 v7, dgt-7 v8, dgt-32 v5 и dgt-33 v5 синтезировали и клонировали (GeneArt™). Синтезированные гены клонировали в экспрессирующий вектор pET28. Полученные конструкции были обозначены как pDAB102028 (Фиг. 17) содержащая dgt-1 v5, pDAB102029 (Фиг. 18), содержащая dgt-1 v6, pDAB102032 (Фиг. 19), содержащая dgt-1 v7, pDAB102034 (Фиг. 20) содержащая dgt-1 v8, pDAB100429 (Фиг. 21), содержащая dgt-3 v6, pDAB100442 (Фиг. 22), содержащая dgt-3 v7, pDAB100430 (Фиг. 23), содержащая dgt-3 v8, pDAB102036 (Фиг. 24) содержащая dgt-7 v5, pDAB102038 (Фиг. 25), содержащая dgt-7 v6, pDAB102040 (Фиг. 26), содержащая dgt-7 v7 и pDAB102042 (Фиг. 27), содержащая dgt-7 v8.
Клонирование DGT-32 и DGT-33. Для испытания in vitro следующие оптимизированные для растений гены: dgt-32 v3 и dgt-33 v3 амплифицировали из бинарных векторов pDAB107532 (Фиг. 11) и pDAB107534 (Фиг. 12), соответственно. Использовали следующие наборы праймеров:
pMALDGT32F (SEQ ID NO: 29; catatgaccgttattgaaattccggg), и
pMALDGT32R (SEQ ID NO: 30; gatatcctattattaacgaccttccag) для dgt-32, и pMALDGT33F (SEQ ID NO: 31; catatgggtgcagttaccgttattga),
pMALDGT33R (SEQ ID NO: 32; gatatcctattattatgcctgcggac) для dgt-33.
Затем амплифицированные последовательности субклонировали в pMAL-c5X так, чтобы каждый ген был слит в рамке считывания с кодирующей последовательностью для malE. Конечные экспрессирующие конструкции представляли собой pDAB107713 (Фиг. 29), содержащую dgt-32 v3, и pDAB107714 (Фиг. 30), содержащую dgt-33 v3.
Пример 4: Биохимический анализ кинетики ферментов in vitro
Сверхэкспрессия и очистка рекомбинантных ферментов DGT. Рекомбинантные белки DGT сверхэкспрессировали в клетках Rosetta2™ (DE3) (Novagen™, Madison, WI) с помощью конструкций, описанных выше. Одну колонию использовали для инокуляции 50-мл заквасочных культур в LB, содержавшем хлорамфеникол (25 мкг/мл) и канамицин (50 мкг/мл), которые культивировали в течение ночи при 37°C. Ночные культуры использовали для инокуляции 1 л LB, содержавшего хлорамфеникол (25 мкг/мл) и канамицин (50 мкг/мл). Культуры выращивали при 37°C до O.D.600=0,6, а затем помещали на баню с ледяной водой на 10 минут. Экспрессию белков-мишеней обеспечивали добавлением IPTG до конечной концентрации 500 мкМ.
Индукции позволяли протекать в течение ночи при 20°C, а затем проводили сбор путем центрифугирования при 8000 об./мин. в течение 20 минут. Клеточные осадки хранили при -80°C до тех пор, пока они не понадобятся для очистки. Все стадии очистки проводили при 4°C. Клеточные осадки из 1-л культур ресуспендировали в 20-30 мл буфера A (50 мМ HEPES pH 7,5, 150 мМ KCl, 2 мМ DTT, 1 мМ EDTA, 20 мМ имидазол и 5% глицерин). Затем добавляли коктейль ингибиторов протеаз COMPLETE™ (1 таблетка/50 мл, Roche, Indianapolis, IN) и лизоцим (1 мг/мл, Sigma-Aldrich, St. Louis, MO) и суспензию перемешивали в течение 20 минут. Лизис клеток проводили с использованием Branson™ Sonifier™ 250 (3 импульса × 60 секунд) с последующим удалением клеточного дебриса центрифугированием при 16000 об./мин. в течение 45 минут.
Ферменты DGT очищали до однородности посредством одной стадии аффинной хроматографии с использованием иммобилизованных металлов (IMAC) с использованием предварительной колонки HisTrap FF объемом 5 мл. Колонку уравновешивали в буфере A и образец наносили в том же буфере. Затем колонку промывали 10 объемами колонки буфера A, а затем проводили элюирование в 0-100% линейном градиенте буфера B (50 мМ HEPES pH 7,5, 200 мМ KCl, 2 мМ DTT, 1 мМ EDTA, 500 мМ имидазол и 5% глицерин) в 25 объемах колонки. Фракции, содержавшие белок-мишень, исходя из анализа SDS-PAGE, концентрировали до 2,5 мл с использованием устройства для ультрацентрифугирования Millipore с пороговым значением молекулярной массы 10 кДа (MWCO). Очищенные ферменты DGT подвергали замене буфера с использованием колонок PD-10 (GE Healthcare) на 50 мМ HEPES pH 7,5, 150 мМ KCl, 2 мМ DTT и 5% глицерин, а затем концентрировали до ~1 мл. Образцы, как правило, разбавляли 1:50 и спектр в УФ-видимой области регистрировали в диапазоне 240-700 на спектрофотометре УФ-видимой области Cary50™ Bio. Затем теоретический коэффициент экстинкции использовали для вычисления концентрации белка на основе поглощения при 280 нм (ExPASy, Geneva, Швейцария).
Экспрессия и очистка рекомбинантных слитых конструкций DGT-32 и DGT-33. Ферменты DGT-32 и DGT-33 конструировали так, чтобы они содержали слитую мальтозную метку на N-конце фермента. Клетки Escherichia coli, трансформированные pDAB107712 (Фиг. 28), pDAB107713 и pDAB107714, выделяли и подтверждали. Одну колонию каждого бактериального штамма использовали для инокуляции 50 мл среды LB, содержавшей 100 мкг/мл карбенициллина и 25 мкг/мл хлорамфеникола. Заквасочную культуру выращивали в течение ночи при 37°C, а затем использовали для инокуляции 600 мл среды LB, дополненной 0,2% глюкозой, 100 мкг/мкл карбенициллина и 25 мкг/мкл хлорамфеникола. Культуры выращивали при 37°C до OD600=0,4, и в это время добавляли IPTG до конечной концентрации IPTG 50 мкМ. Культуры индуцировали в течение 15 часов при 18°C. На следующие сутки культуры собирали центрифугированием при 8000 об./мин. в течение 20 минут для осаждения клеток. Клеточную массу хранили при -80°C до тех пор, пока она не понадобилась для очистки.
Замороженные осадки ресуспендировали в 20-30 мл буфера A (50 мМ HEPES pH 7,5, 100 мМ KCl, 1 мМ EDTA, 5% глицерин и 1 мМ DTT) с 1 таблеткой ингибитора протеаз (Roche Complete). После полной ресолюбилизации осадка добавляли 1 мг/мл лизоцима и образец перемешивали при 4°C в течение 15-20 минут. После инкубации с лизоцимом образец переносили в 50-мл центрифужную пробирку и помещали на лед. Затем образец обрабатывали ультразвуковым излучением в течение интервалов, составляющих 1 минуту с последующим охлаждением в течение 4 минут. Эту стадию повторяли еще два раза, всего проводя три цикла обработки ультразвуковым излучением. Клеточный дебрис удаляли центрифугированием при 16500 об./мин. в течение 45 минут и супернатант загружали в 50-мл петлю для инжекции. Неочищенный лизат наносили на колонку с амилозой, промывали 7 объемами колонки буфера A и элюировали в 100% буфере B (буфер A и 10 мМ мальтоза). Белок-мишень объединяли и концентрировали до 2,5 мл с использованием Centricon с MWCO 30 кДа. Очищенный белок подвергали замене буфера на 50 мМ HEPES, pH 7,5, 100 мМ KCl и 5% глицерин с использованием колонки для гель-фильтрации PD-10. Концентрацию белка определяли с помощью анализа Брэдфорд с использованием BSA в качестве стандарта. Чистый белок замораживали в жидком азоте и хранили при -80°C.
Охарактеризация in vitro кинетики ферментов DGT растений и бактерий. Активность ферментов в случае фермента DGT дикого типа (WT) и мутантных DGT измеряли по продукции неорганического фосфата (Pi) с помощью модифицированной методики, описанной Lanzetta et al. (1979) Anal. Bioch. 100:95-7. Анализы проводили в формате 96-луночного планшета всего в 50 мкл на устройстве для считывания планшетов Spectra-Max 190 (Molecular Devices, Sunnyvale, CA). Типичные образцы для анализа содержали 50 мМ HEPES pH 7,5, 150 мМ KCl, 2 мМ DTT и 1 мМ S3P. Концентрации PEP и глифосата варьировали, как указано. Глифосат приобретали от Sigma в качестве свободной кислоты и его ресуспендировали в ddH2O. Глифосат солюбилизировали добавлением KOH до тех пор, пока значение pH не становилось нейтральным. Анализы начинали добавлением фермента DGT в концентрациях, которые варьировали между 0,01-1 мкМ. Реакции завершали добавлением 235 мкл смеси 3:1 малахитовый зеленый: раствор молибдата аммония. После завершения развития окраски (~1 минута), регистрировали изменение поглощения при 660 нм и количество образовавшегося Pi вычисляли из стандартной кривой. Контрольные реакции без фермента использовали для внесения поправки на фоновое поглощение. При использовании этого способа обнаружения высокие концентрации PEP (>2 мМ) и глифосата (>30 мМ) обеспечивают значительный уровень фонового поглощения. Данные приводили в соответствие с уравнением Михаэлеса-Ментен, которое позволяло определение Km и Vmax (уравнение 3), в то время как IC50 определяли из уравнения 4, где y представляет собой относительную активность и s представляет собой коэффициент Хилла. Данные анализировали с использованием программного обеспечения GraFit™ версии 5 (Erithacus Software Limited, Horley, Великобритания).
|
Величина IC50 для конкурентного ингибитора изменяется, в зависимости от концентрации субстрата, таким образом, величины IC50 в таблице 2 были получены при 1 мМ PEP и при 60 мкм PEP (оценка внутриклеточных концентраций PEP растениях). Следует сравнивать только величины IC50, измеренные при одной и той же концентрации PEP (определение Km для DGT-32 и DGT-33 проводили при 100 мкМ PEP). Кроме того, величины IC50 для высоко устойчивых ферментов нельзя было точно определить способом Lanzetta и, таким образом, их оценивали, исходя из относительной активности.
Кинетика DGT растений. Два фермента с немутантными нативными последовательностями, DGT-1 v5 и DGT-7 v5, исследовали сначала для установления исходных параметров для чувствительности к глифосату. Оба белка имели величины Km в отношении PEP (~70 мкм) и они были чувствительными к глифосату с величинами IC50 ~20 мкм (таблица 2) при 1 мМ PEP. Как было выявлено для DGT-1 v6, DGT-3 v6 и DGT-7 v6, одна точковая мутация с G на A значительно увеличивала устойчивость к глифосату (величины IC50 8-21 мМ), но также увеличивала Km для PEP в ~8 раз. Двойная мутация (GAPS) для всех происходящих из растений DGT (DGT-1 v7, DGT-3 v7 и DGT-7 v7), также повышала устойчивость к глифосату, однако вновь приводила к значительному увеличению Km в отношении PEP. Таблица 2. Мутанты TIPS (DGT-1 v8, DGT-3 v8 и DGT-7 v8) были устойчивыми к умеренным концентрациям глифосата (3-6 мМ), но, в противоположность мутантам GA и GAPS, уровни Km оставались близкими к уровням белков дикого типа 60-200 мкМ. На Фиг. 31 представлены сдвиги устойчивости к глифосату для DGT-1 (A) и DGT-7 (B) при внесении указанных мутаций. Концентрацию PEP сохраняли на уровне 1 мМ для экспериментов, в которых были получены данные, представленные на Фиг. 31, что, вероятно, привело к повышенной IC50 (>80 мМ) для DGT-7 v8. Дальнейшие действия проводили для определения того, изменяют ли более низкие уровни PEP относительную устойчивость к глифосату. Физиологически значимые уровни PEP находятся в диапазоне 5-60 мкМ. В случае 60 мкМ PEP, величина IC50 была значительно снижена (3,6 мМ), что указывает на то, что на первоначальное определение влиял избыток PEP, как и ожидалось, исходя из кинетики Михаэлеса-Ментен, и как указано в таблице 2.
На Фиг. 31 представлены величины IC50, полученные после внесения различных мутаций в DGT-1 (A) и DGT-7 (B) с использованием 1 мМ PEP. Для обеих кривых IC50, A и B, закрашенные треугольники соответствуют дикому типу, закрашенные круги соответствуют мутантам GA, незакрашенные квадраты соответствуют мутантам GAPS и закрашенные квадраты соответствуют мутантам TIPS.
|
Кинетика бактериальных DGT. Среди бактериальных ферментов DGT-28 v1 обладает наиболее благоприятными общими параметрами кинетики (увеличенные величины IC50 и kcat/Km). Фермент был устойчивым к глифосату в концентрациях >80 мМ и проявлял каталитическую эффективность 1,32×105 M-1 с-1. Мутация A→G в DGT-28 v2 снижала IC50 до 2,17 мМ (при 60 мкМ PEP) и обеспечивала небольшое увеличение Km в отношении PEP (161 мкМ). Этот мутантный фермент сохраняет высокую каталитическую эффективность, выявленную для DGT-28 v1. Даже со сниженной IC50 этот мутантный фермент пригоден для обеспечения устойчивости к глифосату в растениях в определенных применениях. Данные указывают на то, что в этом новом классе EPSP-синтаз аланин не является единственным фактором, определяющим устойчивость к глифосату. Для исследования других возможных определяющих факторов конструировали дополнительный вариант DGT-28 v3 (двойной мутант A84G T172A). Этот фермент обладал сниженной устойчивостью к глифосату с величиной IC50 5,15 мМ (при 60 мкМ PEP). Снижение IC50 в случае DGT-28 v3 сопровождалось снижением в 200 раз каталитической эффективности, что указывает на то, что вторая мутация привела к непредусмотренным эффектам (таблица 2). Гомологи DGT-28 v1 с более высокой идентичностью (~75% идентичностью аминокислот), DGT-32 и DGT-33, имели низкие Km в отношении PEP (~114-139 мкМ), однако каталитическая эффективность была в 100 раз более низкой, чем у DGT-28 v1. Это падение каталитической эффективности, вероятно, является следствием слияния со связывающим мальтозу белком (MBP). Ферменты также являются нечувствительными к глифосату, обладая величинами IC50 более 50 мМ. В результате этих анализов in vitro, которые показали, что различные ферменты DGT обеспечивали устойчивость к глифосату, ферменты DGT исследовали в растениях.
Пример 5: Клонирование векторов для трансформации растений
Конструирование бинарного вектора для растений. Для конструирования исходных векторов, содержащих полинуклеотидную последовательность для транзитного пептида хлоропластов, слитую в рамке считывания с dgt-28, использовали стандартные способы клонирования. Исходные векторы, содержавшие транзитный пептид (TraP), слитый с dgt-28, собирали с использованием технологии In-Fusion™ Advantage Technology (Clontech, Mountain View, CA). В результате слияния первая аминокислота метионин удалилась из dgt-28. Каждый из транзитных пептидов TraP4 v2 (SEQ ID NO: 33), TraP5 v2 (SEQ ID NO: 34), TraP8 v2 (SEQ ID NO: 35), TraP9 v2 (SEQ ID NO: 36), TraP12 v2 (SEQ ID NO: 37) и TraP13 v2 (SEQ ID NO: 38) был синтезирован в DNA2.0 (Menlo Park, CA) и его подвергали слиянию с 5′-концевым фрагментом dgt-28, вплоть до и включая уникальный участок распознавания эндонуклеазы рестрикции AccI.
Бинарные плазмиды, которые содержали различные экспрессирующие кассеты для TraP и dgt-28, контролировались промотором убиквитина 10 Arabidopsis thaliana (AtUbi10 v2; Callis, et al., (1990) J. Biol. Chem., 265: 12486-12493), и они были фланкированы 3′-нетранслируемой областью двадцать третей открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3′ UTR v1; патент США № 5428147).
Собранные экспрессирующие кассеты для TraP и dgt-28 модифицировали способами инженерии с использованием технологии Gateway® Technology (Invitrogen, Carlsbad, CA) и трансформировали в растения с помощью опосредуемой Agrobacterium трансформации растений. Эндонуклеазы рестрикции получали от New England BioLabs (NEB; Ipswich, MA) и для лигирования ДНК использовали ДНК-лигазу T4 (Invitrogen). Реакции Gateway проводили с использованием смеси ферментов Gateway® LR Clonase® (Invitrogen) для сборки одного исходного вектора в один конечный вектор, который содержал кассету селективного маркера с промотором вируса мозаики прожилок маниоки (CsVMV v2; Verdaguer et al., (1996) Plant Mol. Biol., 31: 1129-1139) - DSM-2 (патент США App. No. 2007/086813) - 3′-нетранслируемую область первой открытой рамки считывания Agrobacterium tumefaciens (AtuORF1 3′ UTR v6; Huang et al., (1990) J. Bacteriol. 172:1814-1822). Получение плазмид проводили с использованием набора NucleoSpin® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или набора Plasmid Midi Kit (Qiagen) в соответствии с инструкциями поставщиков. Фрагменты ДНК выделяли с использованием набора для экстракции из геля QIAquick™ Gel Extraction Kit (Qiagen) после электрофореза на Tris-ацетатном агарозном геле.
Колонии всех собранных плазмид сначала подвергали скринингу рестрикционным расщеплением ДНК, полученной по минипрепаративной методике. Плазмидную ДНК выбранных клонов секвенировали у коммерческого поставщика, осуществляющего секвенирование (Eurofins™ MWG Operon, Huntsville, AL). Данные о последовательности собирали и анализировали с использованием программного обеспечения Sequencher™ (Gene Codes Corp., Ann Arbor, MI).
Следующие бинарные конструкции экспрессируют различные слитые последовательности генов TraP:dgt-28: pDAB107527 (Фиг. 3) содержит TraP4 v2:dgt-28 v5 (SEQ ID NO: 79); pDAB105530 (Фиг. 4) содержит TraP5 v2: dgt-28 v5 (SEQ ID NO: 80); pDAB105531 (Фиг. 5) содержит TraP8 v2: dgt-28 v5 (SEQ ID NO: 81); pDAB105532 (Фиг. 6) содержит TraP9 v2: dgt-28 v5 (SEQ ID NO: 82); pDAB105533 (Фиг. 7) содержит TraP12 v2: dgt-28 v5 (SEQ ID NO: 83); и pDAB105534 (Фиг. 8) содержит TraP13 v2: dgt-28 v5 (SEQ ID NO: 84). Последовательность dgt-28 v5 в pDAB105534 была модифицирована, где первый кодон (gca) был заменен на (gct).
Конструирование дополнительного бинарного вектора для растений. Стратегии клонирования, сходные со стратегиями клонирования, описанными выше, использовали для конструирования бинарных плазмид, которые содержат dgt-31, dgt-32, dgt-33, dgt-1, dgt-3 и dgt-7.
Гены микробного происхождения: dgt-31, dgt-32 и dgt-33 подвергали слиянию с транзитными пептидами хлоропластов, отличающимися от описанных ранее. Использовали следующие транзитные пептиды хлоропластов: TraP14 v2 (SEQ ID NO: 39), TraP23 v2 (SEQ ID NO: 40), TraP24 v2 (SEQ ID NO: 41). pDAB107532 (Фиг. 11) содержит dgt-32 v3, слитый с TraP14 v2 (SEQ ID NO: 42), pDAB107534 (Фиг. 12) содержит dgt-33 v3, слитый с TraP24 v2 (SEQ ID NO: 43) и pDAB1017533 (Фиг. 54) содержит dgt-31 v1, слитый с TraP23 v2 (SEQ ID NO: 143). Экспрессирующие кассеты dgt контролировались промотором убиквитина 10 Arabidopsis thaliana (промотор v2 AtUbi10) и их фланкировала 3′-нетранслируемая область двадцать третьей открытой рамки считывания Agrobacterium tumefaciens (AtuORF23 3′ UTR v1). Также в бинарном векторе присутствовала маркерная кассета DSM-2, содержавшая промотор вируса мозаики прожилок маниоки (CsVMV v2) - DSM-2 - 3′-нетранслируемую область первой открытой рамки считывания Agrobacterium tumefaciens (AtuORF1 3′ UTR v6).
Конструировали дополнительные бинарные векторы, где dgt-31 v3, dgt-32 v3 и dgt-33 v3 были слиты с ранее описанными последовательностями транзитных пептидов хлоропластов. Например, последовательность v2 TraP8 подвергают слиянию с dgt-31 v3, dgt-32 v3 и dgt-33 v3, и клонируют в бинарные векторы, как описано выше.
Конструировали бинарные векторы, содержащие гены класса I (dgt-1, dgt-3 и dgt-7). Следующие бинарные векторы конструировали и трансформировали в растения: pDAB4104 (Фиг. 9), который содержит последовательность dgt-1 v4, как описано в публикации патентной заявки США № 2011/0124503, которая фланкируется последовательностями осмотина Nicotiana tabacum, как описано в публикации патентной заявки США № 2009/0064376; pDAB102715 (Фиг. 10); pDAB102716 (Фиг. 45); pDAB102717 (Фиг. 46) и pDAB102785 (Фиг. 13). Различные транзитные пептиды хлоропластов TraP, которые подвергали слиянию с dgt-28, dgt-31, dgt-32 и dgt-33, не добавляли к генам класса I, поскольку эти происходящие из растений последовательности обладают нативными транзитными пептидами хлоропластов растений. Эти векторы более подробно описаны в таблице 3.
|
Пример 6: Трансформация в Arabidopsis и селекция
Трансформация Arabidopsis thaliana. Arabidopsis трансформировали с использованием способа погружения цветка от Clough and Bent (1998). Выбранную колонию Agrobacterium, содержавшую одну из бинарных плазмид, описанных выше, использовали для инокуляции одной или нескольких 100-мл предварительный культур среды YEP, содержавшей спектиномицин (100 мг/л) и канамицин (50 мг/л). Культуру инкубировали в течение ночи при 28°C при постоянном встряхивании при 225 об./мин. Клетки осаждали при приблизительно 5000×g в течение 10 минут при комнатной температуре, и полученный супернатант отбрасывали. Клеточный осадок осторожно ресуспендировали в 400 мл среды для погружения, содержавшей: 5% (масс./об.) сахарозу, 10 мкг/л 6-бензиламинопурина и 0,04% Silwet™ L-77. Растение возрастом приблизительно 1 месяц погружали в среду на 5-10 минут при осторожном встряхивании. Растения клали набок и покрывали прозрачными или непрозрачными пластиковыми мешками на 2-3 часа, а затем располагали вертикально. Растения выращивали при 22°C со световым периодом 16 часов на свету/8 часов в темноте. Приблизительно через 4 недели после погружения семена собирали.
Селекция трансформированных растений. Свежесобранным семенам T1 [содержащие экспрессирующие кассеты dgt и DSM-2] позволяли высохнуть в течение 7 суток при комнатной температуре. Семена T1 высевали в лотки для прорастания размером 26,5×51 см, в каждый из которых добавляли аликвоту массой 200 мг стратифицированных семян T1 (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% раствора агарозы и которые хранили при 4°C в течение 2 суток, чтобы выполнить требования состояния покоя, и обеспечить синхронное прорастание семян.
Sunshine Mix LP5 покрывали мелкоизмельченным вермикулитом и орошали инфильтрацией раствором Хогланда до влажного состояния, а затем ему позволяли дренироваться под действием силы тяжести. Каждую аликвоту стратифицированных семян объемом 40 мл высевали равномерно на вермикулит с помощью пипетки и накрывали увлажняющими купольными камерами на 4-5 суток. Купольные камеры удаляли за 1 сутки до первоначальной селекции трансформантов с использованием послевсходового распыления глюфосината (селекция по котрансформированному гену DSM-2).
Через семь суток после посева (DAP) и снова через 11 DAP, на растения T1 (стадии семядоли и 2-4-листьев, соответственно) распыляли 0,2% раствор гербицида Liberty (200 г.а.и./л (g ai/L) глюфосината, Bayer Crop Sciences, Kansas City, MO) в распыляемом объеме 10 мл/лоток (703 л/га) с использованием наконечника для пневматического распыления DeVilbiss для доставки эффективного количества 280 г.а.и./га глюфосината на внесение. Выжившие растения (активно растущие растения) идентифицировали через 4-7 суток после последнего распыления и пересаживали по отдельности в 3-дюймовые горшки (7,6 см), подготовленные со средой для пересадки в горшки (Metro Mix 360). Пересаженные растения выращивали в теплице (22±5°C, 50±30% RH, 14 ч на свету: 10 ч в темноте, минимум 500 мкЕ/м2с1 природный свет + дополнительный свет). Для выживших растений T1 проводили молекулярный подтверждающий анализ для подтверждения того, что ген устойчивости к глифосату стабильно встроился в геном растений.
Молекулярное подтверждение. Подтверждали присутствие трансгенов dgt-28 и DSM-2 в геноме растений Arabidopsis, которые были трансформированы pDAB107527, pDAB105530, pDAB105531, pDAB105532, pDAB105533 или pDAB105534. Присутствие этих полинуклеотидных последовательностей подтверждали посредством анализа гидролиза зондов, ПЦР экспрессирующих гены кассет (также описанная как ПЦР элементов транскрипции растений ПЦР - PTU ПЦР), анализа с использованием саузерн-блоттинга и анализов с количественной ПЦР с обратной транскрипцией.
Растения Arabidopsis T1 первоначально подвергали скринингу посредством анализа гидролиза зондов, аналогично TAQMAN™, для подтверждения присутствия трансгенов DSM-2 и dgt-28. Трансгенные объекты подвергали скринингу посредством ПЦР экспрессирующих гены кассет для определения того, встроилась ли экспрессирующая dgt кассета полностью в геном без перестройки. Данные, полученные в этих исследованиях, использовали для определения количества копий трансгена и идентификации отдельных трансгенных объектов в Arabidopsis для самоопыления и перехода к поколению T2. Развившиеся растения T2 Arabidopsis также подвергали скринингу с помощью анализа гидролиза зондов для подтверждения присутствия и оценки количества копий генов DSM-2 и dgt в геноме растений. Наконец, анализ с использованием саузерн-блоттинга использовали для подтверждения оцененного количества копий на подгруппе растений T1 Arabidopsis.
Сходные анализы использовали для подтверждения присутствия трансгена dgt-1 из растений, трансформированных pDAB4101, присутствия трансгена dgt-32 из растений, трансформированных pDAB107532, присутствия трансгена dgt-33 из растений, трансформированных pDAB107534, присутствия трансгена dgt-3 из растений, трансформированных pDAB102715, присутствия трансгена dgt-3 из растений, трансформированных pDAB102716, присутствия трансгена dgt-3 из растений, трансформированных pDAB102717, и присутствия трансгена dgt-7 из растений, трансформированных pDAB102785.
Анализ гидролиза зондов. Количество копий определяли в растениях T1 и T2 Arabidopsis с использованием анализа гидролиза зондов, описанного ниже. Растения с различными количествами трансгенов идентифицировали и выращивали для последующих анализов устойчивости к глифосату.
Образцы тканей собирали в 96-луночные планшеты и лиофилизировали в течение 2 суток. Мацерацию ткани проводили с помощью распылителя для тканей KLECO™ и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани геномную ДНК выделяли в высокопроизводительном формате с использованием набора Biosprint™ 96 Plant kit (Qiagen™, Germantown, MD) в соответствии с предложенным изготовителем протоколом. Геномную ДНК количественно определяли с помощью набора Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до приблизительно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического устройства для обработки жидкостей BIOROBOT3000™ (Qiagen, Germantown, MD). Определение количества копий трансгена с помощью анализа гидролиза зондов проводили способом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для DSM-2, dgt-28 и внутреннего эталонного гена, TAFII15 (Genbank ID: NC 003075; Duarte et al., (201) BMC Evol. Biol., 10:61).
Для амплификации смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) приготавливали в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,1 мкм каждого праймера для DSM-2 и dgt-28, 0,4 мкм каждого праймера для TAFII15 и 0,2 мкм каждого зонда. Таблица 4. Двухстадийную реакцию амплификации проводили с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler™ выпуска 1.5 с использованием модуля относительного количественного определения, и он был основан на способе ΔΔCt. Для этого в каждый анализ включали образец геномной ДНК из калибратора единичной копии и известный контроль с 2 копиями. Результаты количества копий в скрининге гидролиза зондов определяли для трансгенных растений T1 и T2 Arabidopsis.
|
Подтверждение встраивания dgt-28 с помощью анализа с использованием саузерн-блоттинга. Анализ с использованием саузерн-блоттинга использовали для определения характера встраивания встроенного фрагмента ДНК с T-цепью и идентификации трансгенных объектов, которые содержали dgt-28. Данные получали, чтобы продемонстрировать встраивание и целостность трансгенных вставок в геноме Arabidopsis. Данные саузерн-блоттинга использовали для идентификации простого встраивания интактной копии ДНК с T-цепью. Детальный анализ с использованием саузерн-блоттинга проводили с использованием амплифицированного способом ПЦР зонда, специфичного к экспрессирующей кассете гена dgt-28. Гибридизация зонда с геномной ДНК, расщепленной специфическими ферментами рестрикции, идентифицировала фрагменты геномной ДНК с конкретной молекулярной массой, профили которых использовали для идентификации полноразмерных трансгенных объектов T1 с простой вставкой для развития в следующее поколение.
Образцы тканей собирали в 2-мл конические пробирки (Eppendorf™) и лиофилизировали в течение 2 суток. Мацерацию ткани проводили с помощью распылителя для тканей KLECO™ и вольфрамовых гранул. После мацерации ткани геномную ДНК выделяли с использованием методики выделения CTAB. Геномную ДНК далее очищали с использованием набора Qiagen™ Genomic Tips kit. Геномную ДНК количественно определяли с помощью набора для анализа ДНК Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до 4 мкг для подходящей концентрации.
Для каждого образца 4 мкг геномной ДНК тщательно расщепляли ферментом рестрикции SwaI (New England Biolabs, Beverley, MA) и инкубировали при 25°C в течение ночи, а затем к реакционной смеси добавляли NsiI и инкубировали при 37°C в течение 6 часов. Расщепленную ДНК концентрировали посредством преципитации с помощью Quick Precipitation Solution™ (Edge Biosystems, Gaithersburg, MD) в соответствии с предлагаемым изготовителем протоколом. Затем геномную ДНК ресуспендировали в 25 мкл воды при 65°C в течение 1 часа. Ресуспендированные образцы наносили на 0,8% агарозный гель, приготовленный в 1X TAE и подвергнутый электрофорезу в течение ночи при 1,1 В/см в 1X буфере TAE. Затем гель подвергали денатурации (0,2 M NaOH/0,6 M NaCl) в течение 30 минут и нейтрализации (0,5 M Tris-HCl (pH 7,5)/1,5 M NaCl) в течение 30 минут.
Перенос фрагментов ДНК на нейлоновые мембраны проводили путем пассивного пропитывания через гель 20X раствором SSC в течение ночи обработанной мембраны для переноса IMMOBILON™ NY+ (Millipore, Billerica, MA) с использованием впитывающего листа из хроматографической бумаги и бумажных полотенец. После переноса мембрану кратковременно промывали 2X SSC, поперечно сшитым с STRATALINKER™ 1800 (Stratagene, LaJolla, CA), и подвергали термической обработке в вакууме при 80°C в течение 3 часов.
Блоты инкубировали с раствором для предгибридизации (Perfect Hyb plus, Sigma, St. Louis, MO) в течение 1 часа при 65°C в стеклянных вращающихся флаконах с использованием инкубатора для гибридизации модели 400 (Robbins Scientific, Sunnyvale, CA). Зонды получали из фрагмента ПЦР, содержавшего всю кодирующую последовательность. Ампликон ПЦР очищали с использованием набора для экстракции из геля QIAEX™ II и метили α32P-dCTP с помощью набора для мечения Random RT Prime IT™ labeling kit (Stratagene, La Jolla, CA). Блоты гибридизовали в течение ночи при 65°C с денатурированным зондом, добавленным прямо в буфер для гибридизации до приблизительно 2 миллионов импульсов счета на блот на мл. После гибридизации блоты последовательно промывали при 65°C посредством 0,1X SSC/0,1% SDS в течение 40 минут. Наконец, блоты экспонировали на экранах для визуализации фосфора с длительным свечением и визуализировали с использованием системы для визуализации Molecular Dynamics Storm 860™.
Анализы с использованием саузерн-блоттинга, проведенные в этом исследовании, использовали для определения количества копий и подтверждения того, что выбранные трансгенные объекты содержали трансген dgt-28 в геноме Arabidopsis.
Подтверждение экспрессирующей кассеты с геном dgt-28 с помощью анализа с использованием ПЦР. Присутствие гена экспрессирующей кассеты с геном dgt-28 в трансгенных объектах растений T1 выявляли с помощью ПЦР по конечной точке. Для обнаружения использовали праймеры (таблица 5), специфичные к промотору v2 AtUbi10 и областям 3′UTR v1 AtuORF23 экспрессирующей кассеты для гена dgt-28.
|
Для реакций ПЦР требовался стандартный трехстадийный протокол циклирования ПЦР для амплификации экспрессирующей ген кассеты. Все реакции ПЦР проводили с использованием следующих условий ПЦР: 94°C в течение трех минут, а затем 35 циклов при 94°C в течение тридцати секунд, 60°C в течение тридцати секунд и 72°C в течение трех минут. Реакции проводили с использованием набора для ПЦР EX-TAQ™ (TaKaRa Biotechnology Inc. Otsu, Shiga, Япония) в соответствии с инструкциями изготовителя. После последнего цикла реакционную смесь инкубировали при 72°C в течение 10 минут. Для определения размера ампликона ПЦР использовали электрофорез с агарозным гелем с TAE. Ампликоны ПЦР ожидаемого размера указывали на присутствие на то, что в геноме трансгенных объектов Arabidopsis присутствовала экспрессирующая полноразмерный ген кассета.
Относительное подтверждение транскрипции dgt-28 с помощью анализа с использованием количественной ПЦР с обратной транскрипции. Образцы тканей растений с трансгенным dgt-28 собирали в 96-луночные планшеты и замораживали при 80°C. Мацерацию ткани проводили с помощью распылителя для тканей KLECO™ и вольфрамовых гранул (Environ Metal INC., Sweet Home, Oregon). После мацерации ткани выделяли тотальную РНК в высокопроизводительном формате с использованием набора Qiagen™ Rneasy 96 kit (Qiagen™, Germantown, MD) в соответствии с предложенным изготовителем протоколом, который включал необязательную обработку ДНК-азой I на колонке. За этой стадией следовала дополнительная обработка ДНК-азой I (Ambion™, Austin, TX) элюированной тотальной РНК. Синтез кДНК проводили с использованием тотальной РНК в качестве матрицы с помощью набора High Capacity cDNA Reverse Transcription™ kit (Applied Biosystems, Austin, TX) в соответствии с предложенной изготовителем методикой с добавлением олигонуклеотида TVN. Количественное определение экспрессии проводили с помощью анализа гидролиза зондов, и его осуществляли с помощью ПЦР с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы разрабатывали для dgt-28 и внутреннего эталонного гена "неизвестный белок" (номер доступа Genbank: AT4G24610) с использованием программного обеспечения LIGHTCYCLER® Probe Design Software 2.0. Для амплификации приготавливали смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) при 1X конечной концентрации в моноплексной реакционной смеси объемом 10 мкл, содержащей 0,4 мкМ каждого праймера, и 0,2 мкМ каждого зонда. Таблица 6.
|
Проводили двухстадийную реакцию амплификации с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали в трех экземплярах и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Реакцию обратной транскрипции минус-цепи проводили для каждого образца, чтобы убедиться, что отсутствовала контаминация гДНК. Анализ данных ПЦР в реальном времени проводили на основе способа ΔΔCt. Этот анализ использовали для определения относительной экспрессии dgt-28 в трансгенных объектах Arabidopsis, которые были определены как гемизиготные и гомозиготные. Относительные уровни транскрипции мРНК dgt-28 находились в диапазоне от 2,5 раз до 207,5 раз превышающем внутренний контроль. Эти данные указывают на то, что растения с трансгенным dgt-28 содержали функциональную экспрессирующую кассету для гена dgt-28, и растения были способны транскрибировать трансген dgt-28.
Анализ с использованием вестерн-блоттинга. DGT-28 выявляли в образцах листьев, полученных из трансгенных растений Arabidopsis thaliana. Экстракты растений из трансгенных растений dgt-28 и белковых стандартов DGT-28 инкубировали с буфером для образца NUPAGE® LDS (Invitrogen, Carlsbad, CA), содержавшим DTT, при 90°C в течение 10 минут и разделяли с помощью электрофореза в предварительно залитом акриламидном геле. Затем белки подвергали электропереносу на нитроцеллюлозную мембрану с использованием протокола изготовителя. После блокирования с помощью WESTERNBREEZE® Blocking Mix (Invitrogen) белок DGT-28 выявляли с помощью антисыворотки против DGT-28, а затем антителом козы против фосфатазы кролика. Обнаруженный белок визуализировали с помощью хемилюминесцентного субстрата BCIP/NBT Western Analysis Reagent (KPL, Gaithersburg, MD). Получение интактного белка DGT-28 с помощью вестерн-блоттинга показало, что растения с трансгенным dgt-28, которые анализировали, экспрессировали белок DGT-28.
Пример 7: Устойчивость к глифосату
На трансгенные растения T1 Arabidopsis, содержавшие трансген dgt-28, распыляли различные дозы глифосата. Повышенные дозы использовали в этом исследовании для определения относительных уровней устойчивости (105, 420, 1680 или 3360 г.э.к/га (g ae/ha)). Типичной 1X используемой дозой глифосата, которая осуществляет борьбу с нетрансформированными Arabidopsis, является 420 г.э.к./га. Составы глифосата с добавлением сульфата аммония наносили на растения T1 с помощью гусеничного опрыскивателя, откалиброванного на уровне 187 л/га. Растения T1 Arabidopsis, которые использовали в этом исследовании, варьировали только по количеству копий трансгена dgt-28. Растения T1 Arabidopsis с низким количеством копий dgt-28 подвергали самоопылению и использовали для получения растений T2. В таблице 7 представлено сравнение растений с трансгенным dgt-28, проведенное для гена устойчивости к глифосату, dgt-1 и контролей дикого типа. В таблице 8 представлено сравнение dgt-32 и dgt-33, проведенное для генов устойчивости к глифосату, dgt-1 и контролей дикого типа. В таблице 9 представлено сравнение новых бактериальных ферментов EPSP-синтаз с ферментами EPSP-синтазами класса I и контролями при количестве глифосата 1680 г.э.к./га.
Результаты селекции с глифосатом Arabidopsis растений с трансформированным dgt-28. Сначала проводили селекцию трансформантов T1 Arabidopsis относительно исходных нетрансформированных семян с использованием схемы селекции с глюфосинатом. Для каждой конструкции T1 анализировали три плоских лотка или 30000 семян. Растения T1, отобранные, как описано выше, подвергали молекулярной охарактеризации и репрезентативные растения с различным количеством копий пересаживали в индивидуальные горшки и на них распыляли различные дозы коммерческого глифосата, как описано ранее. Ответ этих растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные, представленные в таблице, демонстрируют индивидуальные растения, проявляющие небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Для каждой конструкции, использованной для трансформации Arabidopsis, представлено арифметическое среднее значение и стандартное отклонение. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (c.v. Columbia) служили в качестве чувствительного к глифосату контроля.
Уровень ответа растений варьировал. Это варьирование может быть связано с тем фактом, что каждое растение соответствует независимому трансгенному объекту и, таким образом, количество копий представляющего интерес гена варьирует от растения к растению. Было отмечено, что некоторые растения, которые содержали трансген, не были устойчивыми к глифосату; тщательный анализ для определения того, экспрессировали ли эти растения трансген, не был проведен. Вероятно, что присутствие высокого количества копий трансгена в растениях T1 Arabidopsis приводило к подавлению трансгена или другим эпигенетическим эффектам, которые приводили к чувствительности к глифосату, несмотря на присутствие трансгена dgt-28.
Среднее значение для повреждения в общей популяции при дозе глифосата 1680 г.э.к./га представлено в таблице 9, чтобы продемонстрировать значимое различие между растениями, трансформированными dgt-3, dgt-7, dgt-28, dgt-32 и dgt-33, против контролей dgt-1 и контролей дикого типа.
Устойчивость, обеспечиваемая новыми бактериальными EPSP-синтазами, варьировала в зависимости от конкретного фермента. DGT-28, DGT-32 и DGT-33 неожиданно обеспечили значительную устойчивость к глифосату. Гены dgt сообщали устойчивость к гербициду индивидуальным растениям T1 Arabidopsis для всех исследованных транзитных пептидов. По существу, использование дополнительных транзитных пептидов хлоропластов (т.е. TraP8 - dgt-32 или TraP8 - dgt-33) может обеспечить защиту от глифосата с уровнями повреждения, сходными с уровнями повреждения, сообщенными для данной обработки.
|
|
|
|
|
|
|
dgt-28 в качестве селективного маркера. Использование dgt-28 в качестве селективного маркера с глифосатом в качестве агента для селекции исследуют с помощью трансформированных растений Arabidopsis, описанных выше. Приблизительно 50 семян Arabidopsis поколения T4 (гомозиготные по dgt-28) добавляют приблизительно к 5000 семенам дикого типа (чувствительным к глифосату). Семена проращивают и на проростки распыляют дозу глифосата для осуществления селекции. Сравнивают несколько обработок глифосатом; в каждом лотке проводят либо одно, либо два внесения глифосата по одной из следующих схем обработки: 7 DAP (суток после посева), 11 DAP или 7, а затем 11 DAP. Поскольку все растения также содержат ген устойчивости к глюфосинату в том же векторе для трансформации, выбранные содержащие dgt-28 растения можно прямо сравнивать с содержащими DSM-2 или pat растениями, отобранными с помощью селекции с глюфосинатом.
Обработки глифосатом осуществляют с помощью наконечника распылителя DeVilbiss™, как описано ранее. Трансгенные растения, содержащие dgt-28, идентифицируют как "устойчивые" или "чувствительные" через 17 DAP. Обработка 26,25-1680 г.э.к./га глифосата, используемая через 7 и 11 суток после посева (DAP), демонстрирует эффективную селекцию трансгенных растений Arabidopsis, которые содержат dgt-28. Чувствительные и устойчивые растения подсчитывают и выявляют, что количество устойчивых к глифосату растений коррелирует с исходным количеством трансгенных семян, содержащих трансген dgt-28, которые были посеяны. Эти результаты указывают на то, что dgt-28 можно эффективно использовать в качестве альтернативного селективного маркера для популяции трансформированных Arabidopsis.
Наследуемость. Растения T1 Arabidopsis с подтвержденными трансгенными объектами подвергали самоопылению с получением семян T2. Эти семена исследовали в испытании по качеству потомства путем применения гербицида Ignite™, содержащего глюфосинат (200 г.э.к./га), к 100 случайным сибсам T2. Каждое индивидуальное растение T2 пересаживали в 7,5-см квадратные горшки перед применением спрея (гусеничный опрыскиватель при скорости внесения 187 л/га). Семьи T1 (растения T2) сегрегировали согласно ожидаемой модели 3 устойчивых: 1 чувствительный для доминантно наследуемого единичного локуса с наследованием по менделевскому типу, при определении с помощью критерия хи-квадрат (P>0,05). Процент семейств T1, которые сегрегировали согласно ожидаемому менделевскому типу наследования, проиллюстрирован в таблице 10, и он демонстрирует, что признак dgt-28 передается поколению T2 по менделевскому типу наследования. Семена собирали от 5-15 индивидуальных растений T2 (семена T3). Двадцать пять сибсов T3 из каждого из 3-4 случайно выбранных семейств T2 исследовали в испытании по качеству потомства, как описано выше. Данные показали отсутствие сегрегации и, таким образом, продемонстрировали, что dgt-28 и dgt-3 стабильно встраиваются в хромосому и наследуются по менделевскому типу по меньшей мере в трех поколениях.
|
Данные для T2 Arabidopsis. Растения второго поколения (T2) выбранных трансгенных объектов T1 Arabidopsis, которые содержали низкие количества копий трансгена dgt-28, далее охарактеризовывали в отношении устойчивости к глифосату. Глифосат вносили, как описано ранее. Ответ растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные представляли в качестве гистограммы для индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации Arabidopsis. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве чувствительного к глифосату контроля. В поколении T2 для каждого трансгенного объекта были доступны гемизиготные и гомозиготные растения и, таким образом, они были включены для каждой исследованной дозы глифосата. Гемизиготные растения содержат два различных аллеля в локусе по сравнению с гомозиготными растениями, которые содержат два одинаковых аллеля в локусе. В поколении T2 ожидается вариабельность ответа на глифосат в связи с отличиями в дозировке генов в случае гемизиготных растений по сравнению с гомозиготными растениями. Вариабельность ответа на глифосат отражена в стандартном отклонении и диапазоне ответа.
В поколении T2 как трансгенные объекты с одной копией, так и трансгенные объекты с множеством копий dgt-28, охарактеризовывали в отношении устойчивости к глифосату. В пределах трансгенного объекта, растения с одной копией продемонстрировали сходные уровни устойчивости к глифосату. Характеристические данные для трансгенного объекта T2 с одной копией представлены в таблице 11. Трансгенные объекты, включающие dgt-28, связанный с TraP5 v2, не обеспечили надежной устойчивости к глифосату по сравнению с конструкциями dgt-28, которые содержали другие транзитные пептиды TraP. Однако конструкции dgt-28 TraP5 обеспечили низкий уровень устойчивости к глифосату по сравнению с нетрансформированным контролем Columbia. Существовали случаи, когда было показано, что трансгенные объекты, которые содержат две или более копий dgt-28, являются более чувствительными к повышенным дозам глифосата (данные не представлены). Это увеличение чувствительности к глифосату является сходным с данными, ранее описанными для растений T1, которые также содержали высокое количество копий трансгена dgt-28. Вероятно, что присутствие высоких количеств копий трансгена в растениях Arabidopsis приводит к подавлению трансгена или другим эпигенетическим эффектам, которые привели к чувствительности к глифосату, несмотря на присутствие трансгена dgt-28.
Эти трансгенные объекты включали dgt-28, связанный с TraP5 v2 (pDAB105530), TraP12 v2 (pDAB105533) и TraP13 v2 (pDAB105534).
В дополнение к dgt-28, трансгенные объекты T2 Arabidopsis, трансформированные dgt-3, представлены в таблице 12. Как описано для трансгенных объектов dgt-28 в таблице 11, таблица с данными содержит репрезентативный трансгенный объект, который является характеристикой ответа на глифосат для каждой конструкции. Для охарактеризации dgt-3 конструкции, содержащие одну PTU (единица трансформации растения) с геном dgt-3, контролируемым промотором AtUbi10 (pDAB102716, Фиг. 45 и pDAB102715, Фиг. 10) сравнивали с конструкциями с тем же геном, содержащими 2 PTU гена (pDAB102719, Фиг. 32; pDAB102718, Фиг. 33). В конструкциях, которые содержали 2 PTU, использовался промотор AtUbi10 для контроля одной копии гена и промотор CsVMV для контроля другой копии. Использование двойной PTU было предназначено для сравнения растений с трансгенным dgt-3 с растениями с трансгенным dgt-28, которые содержали две копии трансгена. Данные продемонстрировали, что трансгенные объекты T2 с одной копией dgt-3 только с одной PTU были более чувствительными к глифосату, чем исследованные трансгенные объекты с одной копией dgt-28, но были более устойчивыми, чем нетрансформированный контроль. Семейства T1, содержавшие 2 PTU гена dgt-3, обеспечили более высокий уровень видимой устойчивости к глифосату по сравнению с конструкциями с 1 PTU. В обоих случаях семьи T1 сравнивали с dgt-1 и контролями дикого типа. Данные T2 демонстрируют, что dgt-28 обеспечивает надежную устойчивость в качестве трансгенных объектов с одной копией.
|
|
|
|
|
|
Данные для T3 Arabidopsis. Растения третьего поколения (T3) выбранных трансгенных объектов T2 Arabidopsis, которые содержали низкие количества копий трансгена dgt-28, далее охарактеризовывали в отношении устойчивости к глифосату. Двадцать пять растений на линию подвергали селекции с глюфосинатом, как описано ранее, и линии с каждой исследованной конструкцией не сегрегировали по гену селективного маркера. Глифосат вносили, как описано ранее. Ответ растений представлен в значениях % видимого повреждения через 2 недели после обработки (WAT). Данные представляли в качестве гистограммы индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации Arabidopsis. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве контроля чувствительности к глифосату.
|
|
|
|
|
Селекция трансформированных растений. Свежесобранным семенам T1 [ген dgt-31, dgt-32 и dgt-33 v1] позволяли высохнуть при комнатной температуре, и их транспортировали в Индианаполис для исследования. Семена T1 высевали в лотки для прорастания размером 26,5×51 см (T.O. Plastics Inc., Clearwater, MN), в каждый из которых помещали аликвоты массой 200 мг стратифицированных семян T1 (~10000 семян), которые предварительно были суспендированы в 40 мл 0,1% растворе агарозы и хранились при 4°C в течение 2 суток, чтобы выполнить требования состояния покоя, и обеспечить синхронное прорастание семян.
Sunshine Mix LP5 покрывали мелкоизмельченным вермикулитом и орошали инфильтрацией раствором Хогланда до влажного состояния, а затем ему позволяли дренироваться под действием силы тяжести. Каждую аликвоту стратифицированных семян объемом 40 мл высевали равномерно на вермикулит с помощью пипетки и накрывали увлажняющими купольными камерами (KORD™ Products, Bramalea, Ontario, Канада) на 4-5 суток. Купольные камеры удаляли после прорастания семян перед первоначальной селекцией трансформантов с использованием послевсходового распыления глюфосината (селекция по котрансформированному гену dsm -2).
Через шесть суток после посева (DAP) и вновь через 10 DAP, на растения T1 (стадия семядоли и 2-4 листьев, соответственно) распыляли 0,1% раствор гербицида Ignite™ (280 г.а.и./л глюфосината, Bayer Crop Sciences, Kansas City, MO) в объеме распыления 10 мл/лоток (703 л/га) с использованием наконечника для пневматического распыления DeVilbiss™ для доставки эффективного количества 200 г.а.и./га глюфосината на внесение. Выжившие растения (активно растущие растения) идентифицировали через 4-7 суток после последнего распыления. Выжившие растения пересаживали по отдельности в 3-дюймовые горшки (7,6 см), подготовленные со средой для пересадки в горшки (Metro Mix 360™). Растения выращивали в теплице в течение по меньшей мере 1 суток перед взятием образцов тканей для анализа количества копий.
Проводили взятие образцов растений T1 и выполняли анализ количества копий гена dgt-31, dgt-32 и dgt-33 v1. Затем растения T1 распределяли на внесение различных доз глифосата так, чтобы для каждой дозы внесения существовал диапазон копий. Для Arabidopsis, 26,25 г.э.к./га глифосата является эффективной дозой, чтобы различить чувствительные растения и растения с существенными уровнями устойчивости. Повышенные дозы использовали для определения относительного уровня устойчивости (105, 420, 1680 или 3360 г.э.к./га). В таблице 15 представлены сравнения, проведенные для dgt-1.
Все внесения гербицида глифосата проводили с помощью гусеничного опрыскивателя в распыляемом объеме 187 л/га. Использованный глифосат представлял собой коммерческий состав соли с диметиламином Durango (480 г.э.к./л, Dow AgroSciences, LLC). Растения T1 с низким количеством копий, которые проявляли устойчивость либо к глюфосинату, либо к глифосату, далее оценивали в поколении T2.
Первые трансформации Arabidopsis проводили с использованием dgt-31, dgt-32 и dgt-33 v1. Трансформантов T1 сначала отбирали из исходных нетрансформированных семян с использованием схемы селекции с глюфосинатом. Три плоских лотка или 30000 семян анализировали в отношении каждой конструкции T1. Частоту трансформации вычисляли и результаты для конструкций T1 dgt-31, dgt-32 и dgt-33 приведены в таблице 14.
|
Затем растения T1, отобранные, как описано выше, пересаживали в отдельные горшки, и на них распыляли различные дозы коммерческого глифосата. В таблице 15 сравнивается ответ dgt-31, dgt-32 и dgt-33 v1 и контрольных генов на сообщение устойчивости к глифосату трансформантам Arabidopsis T1. Ответ представлен в значениях % видимого повреждения 2 WAT. Данные представлены в качестве индивидуальных растений, проявляющих небольшое повреждение или отсутствие повреждения (<20%), умеренное повреждение (20-40%) или тяжелое повреждение (>40%). Арифметическое среднее значение и стандартное отклонение представлены для каждой обработки. Диапазон индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированные Arabidopsis дикого типа (cv. Columbia) служили в качестве чувствительного к глифосату контроля. Ген DGT-31 (v1) с транзитным пептидом TraP23 сообщал небольшую устойчивость к гербицидам индивидуальным растениям T1 Arabidopsis по сравнению с отрицательным контролем, однако с транзитным пептидом TraP23 ген проявлял увеличенную устойчивость. Как DGT-32, так и DGT-33, продемонстрировали надежную устойчивость к глифосату при исследованных дозах с TraP23 и с их соответствующими отличающимися транзитными пептидами хлоропластов (TraP14 и TraP24 соответственно). При данной обработке уровень ответа растений значительно варьировал, что может быть связано с тем фактом, что каждое растение соответствует независимому трансгенному объекту и, таким образом, количество копий представляющего интерес гена варьирует от растения к растению. Важно отметить, что при каждой исследованной дозе глифосата существовали индивидуальные растения, которые были более устойчивыми, чем другие. Среднее значение общего повреждения популяции по дозе представлено в таблице 15, чтобы продемонстрировать значимое отличие между растениями, трансформированными dgt-31, dgt-32 и dgt-33 v1, против dgt-1 v1 или контролей дикого типа.
|
|
|
|
Пример 8: dgt-32 и dgt-33 в качестве селективных маркеров
dgt-32 и dgt-33 v1 используют в качестве селективных маркеров с глифосатом в качестве агента для селекции. Характеристики этих маркеров анализируют с помощью трансформированных Arabidopsis. Приблизительно 50 семян Arabidopsis поколения T4 (гомозиготный по dgt-32 и dgt-33 v1) добавляют приблизительно к 5000 семенам дикого типа (чувствительные). Сравнивают несколько обработок глифосатом; в каждом лотке проводят либо одно, либо два внесения глифосата по одной из следующих схема обработки: 7 DAP, 11 DAP или 7, а затем 11 DAP. Поскольку все растения также содержат ген dsm-2 в том же векторе для трансформации, dgt-32 и dgt-33, отобранные с помощью глифосата, можно прямо сравнивать с dsm-2, отобранные с помощью глюфосината.
Обработки осуществляют с помощью наконечника распылителя DeVilbiss™. Растения идентифицируют как устойчивые или чувствительные через 17 DAP. Обработка 26,25-280 г.э.к./га 2,4-D, проведенная через 7 и 11 суток после посева (DAP), является в равной степени эффективной в отношении частоты отбора. Эти результаты указывают на то, что dgt-32 и dgt-33 v1 можно эффективно использовать в качестве селективного маркера.
Наследуемость. Различные трансгенные объекты T1 Arabidopsis подвергают самоопылению с получением семян T2. Эти семена исследовали в испытании по качеству потомства путем применения IGNITE™ (200 г.э.к./га), к 100 случайным сибсам T2. Каждое индивидуальное растение T2 пересаживали в 7,5-см квадратные горшки перед применением спрея (гусеничный опрыскиватель при скорости внесения 187 л/га). Определяли семьи T1 (растения T2), которые сегрегировали согласно ожидаемой модели 3 устойчивых: 1 чувствительный для доминантно наследуемого единичного локуса с наследованием по менделевскому типу, при определении с помощью критерия хи-квадрат (P>0,05).
Семена собирали от 5-15 индивидуальных растений T2 (семена T3). Двадцать пять сибсов T3 из каждого из 3-4 случайно выбранных семейств T2 исследовали в испытании по качеству потомства, как описано выше. Данные, демонстрирующие отсутствие сегрегации, продемонстрировали, что каждый из dgt-32 и dgt-33 v1 стабильно встраиваются в хромосому и наследуются по менделевскому типу по меньшей мере в трех поколениях.
Дополнительная охарактеризация устойчивости к гербицидам линий T3 DGT. Поколение T3 семян Arabidopsis является стратифицированным, и его высевают в лотки для селекции. Трансформированную контрольную линию, содержащую dgt-1 и нетрансформированный контроль, высевают аналогичным образом. Проростки переносят в индивидуальных 3-дюймовых горшках в теплицу. На все растения проводят распыление с использованием гусеничного опрыскивателя, установленного на 187 л/га. Распыление на растения проводят в диапазоне доз глифосата 420-3360 г.э.к./га (Durango™ DMA, Dow AgroSciences). Все применяемые дозы составляют в воде. Каждую обработку воспроизводят 4 раза и растения оценивают через 7 и 14 суток после обработки.
Пример 9: трансформация дополнительных сельскохозяйственных культур
Сою трансформируют dgt-28, dgt-31, dgt-32 и/или dgt-33 (с транзитным пептидом хлоропластов или без него) для обеспечения высоких уровней устойчивости к гербициду глифосату, с использованием способа, известного специалистам в данной области, например, по существу тех же способов, которые были ранее описаны в примере 11 или примере 13 международной публикации патента PCT № WO 2007/053482.
Хлопок трансформируют dgt-28, dgt-31, dgt-32 и/или dgt-33 (с транзитным пептидом хлоропластов или без него) для обеспечения высоких уровней устойчивости к гербициду глифосату с использованием способа, известного специалистам в данной области, например, по существу тех же способов, которые были ранее описаны в примере 14 патента США 7838733, или примере 12 международной публикации патента PCT № WO 2007/053482.
Канолу трансформируют dgt-28, dgt-31, dgt-32 и/или dgt-33 (с транзитным пептидом хлоропластов или без него) для обеспечения высоких уровней устойчивости к гербициду глифосату с использованием способа, известного специалистам в данной области, например, по существу тех же способов, которые были ранее описаны в примере 26 патента США 7838733 или примере 22 международной публикации патента PCT № WO 2007/053482.
Пример 10: трансформация кукурузы
Конструкции ДНК для трансформации кукурузы. Стандартные способы клонирования, как описано выше, использовали для конструирования бинарных векторов для применения в опосредуемой Agrobacterium tumefaciens трансформации кукурузы. В таблице 16 приведены векторы, которые конструировали для трансформации кукурузы. Следующие элементы генов использовали в векторах, которые содержали dgt-28: промотор убиквитина 1 Zea mays (ZmUbi1; патент США № 5510474) использовали для контроля кодирующей последовательности dgt-28, которая фланкируется 3′-нетранслируемой областью липазы Zea mays (ZmLip 3′UTR; патент США № 7179902), кассета селективного маркера состоит из промотора убиквитина 1 Zea mays, который использовали для контроля кодирующей последовательности aad-1 (патент США № 7838733), которая фланкируется 3′-нетранслируемой областью липазы Zea mays. Кодирующая последовательность aad-1 сообщает устойчивость к феноксиауксиновым гербицидам, таким как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и к арилоксифеноксипропионатным (AOPP) гербицидам.
Конструкции dgt-28 конструировали в качестве стандартных бинарных векторов и векторов супербинарной системы Agrobacterium (Japan Tobacco, Tokyo, JP). Стандартные бинарные векторы включают pDAB107663, pDAB107664, pDAB107665 и pDAB107665. Векторы супербинарной системы Agrobacterium включают pDAB108384, pDAB108385, pDAB108386 и pDAB108387.
Получали дополнительные конструкции, которые содержат репортерный ген желтого флуоресцентного белка (yfp; патентная заявка США 2007/0298412). pDAB109812 содержит кассету репортерного гена yfp, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью per5 Zea mays (Zm per5 3′UTR; патент США № 7179902), кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника (SCBV; патент США № 5994123), который используется для контроля экспрессии aad-1 и фланкируется 3′-нетранслируемой областью липазы Zea mays. pDAB101556 содержит кассету yfp, которая контролируется промотором убиквитина 1 Zea и фланкируется 3′-нетранслируемой областью per5 Zea mays, кассета селективного маркера состоит из промотора убиквитина 1 Zea mays, который используется для экспрессии aad-1 и фланкируется 3′-нетранслируемой областью липазы Zea mays. pDAB107698 содержит кассету dgt-28, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью липазы Zea mays, кассету yfp, которая контролируется промотором убиквитина 1 Zea mays и фланкируется 3′-нетранслируемой областью per5 Zea mays, кассета селективного маркера состоит из промотора палочковидного вируса сахарного тростника, который используют для контроля экспрессии aad-1 и который фланкируется 3′-нетранслируемой областью липазы Zea mays. Все три из этих конструкций представляют собой стандартные бинарные векторы.
|
Стерилизация початков и выделение зародышей. Для получения незрелых зародышей кукурузы растения инбредной линии B104 Zea mays выращивали в теплице и подвергали самоопылению и опылению сибсами для получения початков. Початки собирали приблизительно через 9-12 суток после опыления. В день эксперимента початки подвергали поверхностной стерилизации путем погружения в 20% раствор гипохлорита натрия (5%) и встряхивания в течение 20-30 минут, а затем ополаскивали три раза стерильной водой. После стерилизации незрелые зиготические зародыши (1,5-2,4 мм) в асептических условиях отрезали от початка и случайным образом распределяли в микроцентрифужные пробирки, содержавшие жидкую среду для инфицирования (основная питательная среда LS, 4,43 г/л; раствор витаминов N6 [1000X], 1,00 мл/л; L-пролин, 700,0 мг/л; сахароза, 68,5 г/л; D(+) глюкоза, 36,0 г/л; 10 мг/мл 2,4-D, 150 мкл/л). Для данного набора экспериментов использовали объединенные зародыши трех початков.
Инициация культуры Agrobacterium:
Исходные культуры в глицерине Agrobacterium, содержавших бинарные векторы для трансформации, описанные выше, наносили штрихами на чашки с минимальной средой AB, содержавшие соответствующие антибиотики, и выращивали при 20°C в течение 3-4 суток. Единичную колонию отбирали и наносили штрихами на чашки с YEP, содержавшие те же антибиотики, и инкубировали при 28°C в течение 1-2 суток.
Культивирование и сокультивирование Agrobacterium. Колонии Agrobacterium отбирали из чашки с YEP, суспендировали в 10 мл среды для инфицирования в 50-мл одноразовой пробирке, и плотность клеток доводили до OD600 нм 0,2-0,4 с использованием спектрофотометра. Культуры Agrobacterium помещали на ротационное устройство для встряхивания при 125 об./мин., комнатная температура, в то время как проводили отделение зародышей. Незрелые зиготические зародыши размером 1,5-2,4 мм выделяли из стерилизованных зерен кукурузы и помещали в 1 мл среды для инфициирования) и промывали один раз этой средой. В каждую пробирку добавляли суспензию Agrobacterium (2 мл) и пробирки помещали на платформу устройства для встряхивания на 10-15 минут. Зародыши переносили на среду для сокультивирования (соли MS, 4,33 гм/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™, 3,00 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/L; DMSO, 100 мкМ), ориентированный щитком зародыша вверх и инкубировали при 25°C, при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 3 суток.
Отбор каллюсов и регенерация предполагаемых трансгенных объектов. После периода сокультивирования зародыши переносили в среду покоя (соли MS, 4,33 г/л; L-пролин, 700,0 5; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л) без агента селекции и инкубировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 и при 25°C в течение 3 суток.
Эксперименты по выявлению ответа на дозировку в виде ингибирования роста показали, что концентрации глифосата 0,25 мМ и более были достаточными для ингибирования роста клеток нетрансформированной линии кукурузы B104. Зародыши переносили в среду для селекции 1, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; L-пролин, 700,0 мг/л; миоинозитол, 100,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™ 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л) и инкубировали либо в темноте и/либо при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7-14 суток при 28°C.
Пролиферирующие эмбриогенные каллюсы переносили на среду для селекции 2, содержавшую 1,0 мМ глифосат (соли MS, 4,33 г/л; L-пролин, 700,0 мг/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,500 г/л; ферментативный гидролизат казеина 100,0 мг/л; 30 мМ Dicamba-KOH, 3,3 мг/л; сахароза, 30,0 г/л; Gelzan™ 2,30 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 15,0 мг/л; карбенициллин, 250,0 мг/л; R-галоксифоп-кислота 0,1810 мг/л), и инкубировали либо в темноте и/либо при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 14 суток при 28°C. Эта стадия селекции позволяла трансгенному каллюсу далее пролиферировать и дифференцироваться. Период селекции каллюсов длился от трех до четырех недель.
Пролиферирующие эмбриогенные каллюсы переносили в среду PreReg, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; L-пролин, 350,0 мг/л; MES [(2-(н-морфолино)этансульфоновая кислота), свободная кислота] 0,250 г/л; ферментативный гидролизат казеина 50,0 мг/л; NAA-NaOH 0,500 мг/л; ABA-EtOH 2,50 мг/л; BA 1,00 мг/л; сахароза, 45,0 г/л; Gelzan™ 2,50 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 8,5 мг/мл AgNo3, 1,00 мг/л; карбенициллин, 250,0 мг/л) и культивировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7 суток при 28°C.
Эмбриогенные каллюсы с похожими на побеги почками переносили в среду для регенерации, содержавшую 0,5 мМ глифосат (соли MS, 4,33 г/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100,0 мг/л; сахароза, 60,0 г/л; Gellan Gum G434™ 3,00 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; карбенициллин, 125,0 мг/л) и культивировали при освещении в течение 24 часов с интенсивностью света 50 мкмоль м-2 с-1 в течение 7 суток.
Небольшие проростки с первичными корнями переносили в среду для укоренения (соли MS, 4,33 г/л; модифицированные витамины MS [1000X], 1,00 мл/л; 1,2,3,5/4,6-гексагидроксициклогексан, 100 мг/л; сахароза, 60,0 г/л; Gellan Gum G434™ 3,00 г/л; карбенициллин, 250,0 мг/л) в лотки для растений и инкубировали при 16/8 ч свет/темнота при интенсивности света 140-190 мкмоль м-2 с-1 в течение 7 суток при 27°C. Предполагаемые трансгенные проростки анализировали в отношении количества копий трансгена с использованием протоколов, описанных выше, и переносили в почву.
Молекулярное подтверждение присутствия трансгенов dgt-28 и aad-1 в растениях кукурузы. Присутствие полинуклеотидных последовательностей dgt-28 и aad-1 подтверждали с помощью анализов гидролиза зондов. Выделенные растения кукурузы T0 сначала подвергали скринингу с помощью анализа гидролиза зондов, аналогичного TAQMAN™, для подтверждения присутствия трансгенов aad-1 и dgt-28. Данные, полученные в этих исследованиях, использовали для определения количества копий трансгенов, и их использовали для селекции трансгенных объектов кукурузы для обратного скрещивания и перехода к поколению T1.
Образцы тканей собирали в 96-луночные планшеты, мацерацию ткани проводили с помощью распылителя для тканей KLECO™ и гранул из нержавеющей стали (Hoover Precision Products, Cumming, GA) в буфере Qiagen™ RLT. После мацерации ткани геномную ДНК выделяли в высокопроизводительном формате с использованием набора Biosprint™ 96 Plant kit (Qiagen™, Germantown, MD) в соответствии с предложенным изготовителем протоколом. Геномную ДНК количественно определяли с помощью набора Quant-IT™ Pico Green DNA assay kit (Molecular Probes, Invitrogen, Carlsbad, CA). Количественно определенную геномную ДНК доводили до приблизительно 2 нг/мкл для анализа гидролиза зондов с использованием автоматического устройства для обработки жидкостей BIOROBOT3000™ (Qiagen, Germantown, MD). Определение количества копий трансгена с помощью анализа гидролиза зондов проводили способом ПЦР в реальном времени с использованием системы LIGHTCYCLER®480 (Roche Applied Science, Indianapolis, IN). Анализы были разработаны для aad-1, dgt-28 и внутреннего эталонного гена инвертазы (номер доступа Genbank №: U16123.1) с использованием программного обеспечения LIGHTCYCLER® Probe Design Software 2.0. Для амплификации смесь LIGHTCYCLER®480 Probes Master mix (Roche Applied Science, Indianapolis, IN) приготавливали в 1X конечной концентрации в мультиплексной реакционной смеси объемом 10 мкл, содержащей 0,4 мкм каждого праймера для aad-1 и dgt-28 и 0,2 мкМ каждого зонда (таблица 17).
Двухстадийную реакцию амплификации проводили с удлинением при 60°C в течение 40 секунд с получением данных флуоресценции. Все образцы анализировали и для анализа каждого образца использовали усредненные величины значения порогового цикла (Ct). Анализ данных ПЦР в реальном времени проводили с использованием программного обеспечения LightCycler™ выпуска 1.5 с использованием модуля относительного количественного определения, и он основан на способе ΔΔCt. Контроли включали образец геномной ДНК из калибратора единичной копии и известный контроль с 2 копиями, которые были включены в каждый анализ. В таблице 18 приведены результаты анализа гидролиза зондов.
|
|
Пример 11: Устойчивость к гербицидам в кукурузе с трансформированным dgt-28
Трансформированным объектам Zea mays (T0) с dgt-28 позволяли акклиматизироваться в теплице и их выращивали до тех пор, пока растения не переносили из культуры ткани в условия выращивания в теплице (т.е. 2-4 новых нормального вида листьев появились из завитков). Растения выращивали при 27°C в условиях 16 часов на свету:8 часов в темноте в теплице. Затем растения обрабатывали коммерческими составами Durango DMA™ (содержащими гербицид глифосат) с добавлением 2% масс./об. сульфата аммония. Внесение гербицида осуществляли с помощью гусеничного опрыскивателя с объемом распыления 187 л/га, высота распыления 50 см. На растения T0 проводили распыление диапазона доз глифосата 280-4480 г.э.к./га глифосата, который способен значительно повреждать нетрансформированные листья кукурузы. Летальную дозу определяют как дозу, которая вызывает >95% повреждение растений инбредной линии B104.
Результаты для растений кукурузы T0 с dgt-28 продемонстрировали, что обеспечивалась устойчивость к дозам глифосата вплоть до 4480 г.э.к./га. Для поколения T0 использовали определенный тип среды. Минимальное замедление роста и общий рост трансформированных растений по сравнению с нетрансформированными контролями продемонстрировали, что dgt-28 обеспечивает надежную устойчивость к глифосату, когда он связан с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23.
Выбранные растения T0 подвергали самоопылению или обратному скрещиванию для дальнейшей охарактеризации в следующем поколении. На 100 выбранных линий dgt-28, содержащих растения T1, распыляли 140-1120 г.э.к./га глюфосината или 105-1680 г.э.к./га глифосата. Как ген селективного маркера, так и ген устойчивости к глифосату конструируют на одной и той же плазмиде. Таким образом, если с помощью селекции отбирают один ген устойчивости к гербициду путем распыления гербицида, полагают, что присутствуют оба гена. Через 14 DAT подсчитывают устойчивые и чувствительные растения для определения процента линий, которые сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении с помощью анализа хи-квадрат. Эти данные демонстрируют, что dgt-28 наследуется в качестве стойкого гена устойчивости к глифосату в однодольных видах. Увеличенные дозы глифосата применяют к выжившим растениям T1 или F1 для дальнейшей охарактеризации устойчивости и защиты, которая обеспечивается геном dgt-28.
Устойчивость к гербицидам после всходов в трансформированной dgt-28 кукурузе T0. Трансгенные объекты T0 с dgt-28, связанным с TraP4, TraP5, TraP8 и TraP23, получали путем трансформации Agrobacterium, и им позволяли акклиматизироваться в условиях камеры для контроля роста до тех пор, пока 2-4 новых нормального вида листа не появится из завитка. Растениям присваивали индивидуальные идентификационные номера и проводили взятие образцов для анализа количества копий как dgt-28, так и aad-1. На основе анализа количества копий растения отбирали для анализа экспрессии белков. Растения пересаживали в более крупные горшки с новой средой для роста и выращивали при 27°C в условиях 16 часов на свету:8 часов в темноте в теплице. Затем остальные растения, для которых не проводили взятие образцов в отношении экспрессии белков, обрабатывали коммерческими составами Durango DMA™ (глифосат) с добавлением 2% масс./об. сульфата аммония. Обработки распределяли так, чтобы каждая группа растений включала трансгенные объекты T0 с различным количеством копий. Внесение гербицида осуществляли с помощью гусеничного опрыскивателя с объемом распыления 187 л/га, высота распыления 50 см. На растения T0 распыляли диапазон доз глифосата 280-4480 г.э.к./га глифосата, способных значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяют как дозу, которая вызывает >95% инбредной линии B104. Линия B104 являлась генетическим фоном для трансформантов.
Результаты для растений кукурузы T0 dgt-28 демонстрируют, что обеспечивалась устойчивость к глифосату в дозе вплоть до 4480 г.э.к./га. Таблица 19. Минимальная задержка роста и общий рост трансформированных растений по сравнению с нетрансформированными контролями продемонстрировали, что dgt-28 обеспечивает надежную защиту от глифосата, когда он связан с TraP5, TraP8 и TraP23.
|
|
Анализ экспрессии белка с помощью стандартного ELISA продемонстрировал средний диапазон белка DGT-28 12,6-22,5 нг/см2 среди исследованных конструкций.
Подтверждение устойчивости к глифосату в поколении F1 в условиях теплицы. Растения T0 с единичной копией, на которые не проводили распыление, подвергали скрещиванию с нетрансформированной фоновой линией B104 для дальнейшей охарактеризации в следующем поколении. В поколении T1 устойчивость к глифосату оценивали для подтверждения наследования гена dgt-28. Для растений T1 гербицид Assure II™ (35 г.э.к./га квизалофоп-метил) вносили на стадии роста V1 для селекции по белку AAD-1. Как ген селективного маркера, так и ген устойчивости к глифосату, конструировали на одной и той же плазмиде. Таким образом, если путем селекции отбирают один ген, полагают, что присутствуют оба гена. Через 7 DAT, устойчивые и чувствительные растения подсчитывали, и нулевые растения удаляли из популяции. Эти данные демонстрируют, что dgt-28 (v1) наследуется в качестве стойкого гена устойчивости к глифосату в однодольных видах. Взятие образцов растений проводили для охарактеризации белка DGT-28 с помощью стандартного ELISA и уровня транскрипта РНК. На устойчивые растения распыляли 560-4480 г.э.к./га глифосата, как описано ранее. Данные демонстрируют надежную устойчивость в случае dgt-28, связанного с транзитными пептидами хлоропластов TraP4, TraP5, TraP8 и TraP23 вплоть до 4480 г.э.к./га глифосата. Таблица 20.
|
|
Данные экспрессии белка демонстрируют диапазон среднего уровня белка DGT-28 42,2-88,2 нг/см2 среди исследованных трансгенных объектов T1 и конструкций, что доказывает экспрессию белка в поколении T1.
Охарактеризации кукурузы dgt-28 в полевых условиях. Трансгенные объекты T1 с одной копией были отосланы в полевую местность для получения как гибридных гемизиготных, так и инбредных гомозиготных семян для дополнительной охарактеризации. Гибридные семена получали путем скрещивания трансгенных объектов T1 в линии кукурузы для трансформации B104 с инбредной линией 4XP811 с получением популяций гибридов, сегрегирующих 1:1 (гемизиготные:нулевые) по трансгенному объекту. Полученные семена транспортировали в 2 отдельных района. Всего пять трансгенных объекта с одной копией на конструкцию высевали в каждой области по рандомизированной полной блочной схеме в трех экземплярах. Поля организовывали так, чтобы внесение глифосата происходило на стадии роста V4 и чтобы внесение для отдельных групп растений происходило на стадии роста V8. В качестве отрицательного контроля использовали общеизвестный гибрид 4XP811/B104.
Экспериментальные грядки обрабатывали 184 г.э.к./га Assure II™ (106 г.а.и./л квизалофоп-метил) для устранения нулевых сегрегирующих растений. Все участники эксперимента сегрегировали 1:1 (чувствительные:устойчивые) (p=0,05) в отношении внесения Assure II™. Среди выбранных устойчивых растений для каждого трансгенного объекта проводили взятие образцов для количественного определения белка DGT-28 с помощью стандартного ELISA.
Растения, устойчивые к квизалофопу-метилу, обрабатывали коммерческим гербицидом Durango DMA™ (480 г.э.к./л глифосат) с добавлением 2,5% масс./об. сульфата аммония на стадиях роста либо V4, либо V8. Внесение гербицида проводили с помощью штангового опрыскивателя, откалиброванного для доставки 187 л/га, высота распыления 50 см. На растения проводили распыление диапазона доз глифосата, составляющего 1120-4480 г.э.к./га глифосата, способных значительно повреждать нетрансформированные линии кукурузы. Летальную дозу определяют как доза, которая обеспечивает >95% повреждение инбредной линии 4XP811. Визуальную оценку повреждений проводили в отношении процента видимого хлороза, процента некроза, процента ингибирования роста и общего видимого повреждения через 7, 14 и 21 DAT (суток после обработки). Оценки сравнивали с необработанными контролями для каждой линии и отрицательными контролями.
Данные о видимых повреждениях для всех случаев оценки продемонстрировали надежную устойчивость к вплоть до 4480 г.э.к./га Durango DMA™ в обоих районах и временах внесения. Предоставлены репрезентативные трансгенные объекты для внесения на стадии V4 из одного района, и они согласуются с другими трансгенными объектами, временем внесения и областями. Таблица 21. Один трансгенный объект на основе конструкции, содержащей dgt-28, связанный с TraP23 (pDAB107665), был устойчивым к селекции Assure II™ в отношении белка AAD-1, однако был чувствительным ко всем внесенным дозам глифосата.
|
|
Дополнительную оценку проводили во время репродуктивной стадии роста для дозы 4480 г.э.к./га глифосата. Визуальная оценка метелок, времени опыления и налива початков была сходной с необработанными контролями для каждой линии для всех конструкций, времени внесения и областей. Результаты количественного определения для белка DGT-28 продемонстрировали диапазон средней экспрессии белка 186,4-303,0 нг/см2. Данные демонстрируют надежную устойчивость кукурузы с трансформированным dgt-28 в полевых условиях на протяжении репродуктивных стадий роста к вплоть до 4480 г.э.к./га глифосата. Данные также продемонстрировали обнаружение и функцию белка DGT-28 на основе результатов устойчивости к распылению.
Подтверждение наследуемости и устойчивости кукурузы dgt-28 в гомозиготном состоянии. Семена T1S2 сеяли в тепличных условиях, как описано ранее. Те же пять линий с одной копией, которые были охарактеризованы в полевых условиях, охарактеризовывали в гомогенном состоянии. Растения выращивали до стадии роста V3 и распределяли на три дозы глифосата в диапазоне 1120-4480 г.э.к./га глифосата (Durango DMA™) и четыре реплики на обработку. Внесение проводили с помощью гусеничного опрыскивателя, как описано ранее, и составление проводили в 2,0% масс./об. сульфата аммония. Использование сульфата аммония служило в качестве контроля без обработки для каждой линии. Визуальную оценку проводили через 7 и 14 суток после обработки, как описано ранее. Данные продемонстрировали надежную устойчивость к вплоть до 4480 г.э.к./га глифосата для всех исследованных трансгенных объектов. Таблица 22.
|
|
Линия из pDAB107665, которая не была устойчивой в полевых условиях, продемонстрировала отсутствие устойчивости к глифосату и, таким образом, это согласовывалось с данными наблюдения в поле (данные не представлены). За исключением одной ранее упомянутой линии, все реплики, которые были обработаны глифосатом из линий, не были чувствительными к глифосату. Таким образом, данные демонстрируют наследуемость для гомогенной популяции кукурузы с dgt-28 по менделевскому типу. Экспрессия белка DGT-28 с помощью стандартного ELISA продемонстрировала диапазон средней экспрессии белка 27,5-65,8 нг/см2 среди трансгенных объектов с одной копией, которые были устойчивыми к глифосату. Данные демонстрируют функциональный белок и стабильность белка DGT-28 среди поколений.
Пример 12: Использование устойчивости к послевсходовому внесению глифосата в качестве селективного маркера
Как описано ранее, трансформированные растения T0 перемещали из культуры тканей в теплицу и акклиматизировали. Исследованные трансгенные объекты включали dgt-28, связанный с транзитными пептидами хлоропластов TraP5, TraP8 и TraP23. Было продемонстрировано, что эти растения T0 обеспечили надежную устойчивость к вплоть до 4480 г.э.к./га глифосата, и контроль в виде нетрансформированных растений осуществляли при концентрации глифосата только 280 г.э.к./га. Эти данные демонстрируют, что dgt-28 можно использовать в качестве селективного маркера с использованием концентрации глифосфата в диапазоне 280-4480 г.э.к./га.
Некоторое количество семян из фиксированных линий кукурузы, которые содержат трансген dgt-28, добавляют к некоторому количеству нетрансформированных семян кукрурузы. Семена высевают и позволяют им расти до стадии развития V1-V3, и в это время на проростки распыляют выбранную дозу глифосата в диапазоне 280-4480 г.э.к./га. Через 7-10 суток чувствительные и устойчивые растения подсчитывают и количество устойчивых к глифосату растений коррелирует с исходным количеством трансгенных семян, содержащих трансген dgt-28, которые высевают.
Пример 13: Пакетирование генов в кукурузе dgt-28
Белок AAD-1 используют в качестве селективного маркера в трансформированной кукурузе dgt-28 для целей исследования. Ген aad-1 также можно использовать в качестве признака устойчивости к гербицидам в кукурузе для обеспечения надежной устойчивости к 2,4-D при внесении в культуру на стадии вплоть до V8. Четыре трансгенных объекта на основе конструкций pDAB107663 (TraP4::dgt-28), pDAB107664 (TraP8::dgt-28) и pDAB107666 (TraP5::dgt-28) охарактеризовывали в отношении устойчивости при внесении из баковой смеси глифосата и 2,4-D. Исследование по охарактеризации проводили для семян F1 в условиях теплицы. Внесение проводили с помощью гусеничного опрыскивателя, как описано ранее, в следующих дозах: 1120-2240 г.э.к./га глифосата (селективные для гена dgt-28), 1120-2240 г.э.к./га 2,4-D (селективные для гена aad-1), или вносили баковую смесь двух гербицидов в двух описанных дозах. Растения оценивали через 7 и 14 DAT. Результаты распыления для внесения гербицидов в дозе 2240 г.э.к./га представлены в таблице 23.
|
Результаты подтверждают, что dgt-28 можно успешно пакетировать с aad-1, таким образом, увеличивая спектр гербицидов, которые можно применять к представляющей интерес культуре (глифосат + феноксиуксусная кислота для dgt-28 и aad-1, соответственно). Для получения сельскохозяйственной культуры, где трудно осуществлять борьбу с широколистными сорняками или существуют устойчивые биотипы сорняков, пакетирование можно использовать в качестве средства для борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные как агротехнические, так и потребительские, признаки также можно пакетировать с геном dgt-28 в кукурузе и других растениях.
Пример 14: Трансформация других сельскохозяйственных культур
Дополнительные сельскохозяйственные культуры трансформируют с использованием известных способов. Для опосредуемой Agrobacterium трансформации ржи, см., например, Popelka JC, Xu J, Altpeter F., "Generation of rye with low transgene copy number after biolistic gene transfer and production of (Secale cereale L.) plants instantly marker-free transgenic rye," Transgenic Res. 2003 Oct; 12(5):587-96.). Для опосредуемой Agrobacterium трансформации сорго см., например, Zhao et al., "Agrobacterium-mediated sorghum transformation," Plant Mol Biol. 2000 Dec; 44(6):789-98. Для опосредуемой Agrobacterium трансформации ячменя, см., например, Tingay et al., "Agrobacterium tumefaciens-mediated barley transformation", The Plant Journal, (1997) 11: 1369-1376. Для опосредуемой Agrobacterium трансформации пшеницы, см., например, Cheng et al., "Genetic Transformation of Wheat Mediated by Agrobacterium tumefaciens", Plant Physiol. 1997 Nov;115(3):971-980. Для опосредуемой Agrobacterium трансформации риса, см., например, Hiei et al., "Transformation of rice mediated by Agrobacterium tumefaciens", Plant Mol. Biol. 1997 Sep;35(1-2):205-18.
Другие (не через Agrobacterium) способы трансформации используют для трансформации dgt-28, dgt-32 или dgt-33, например, в кукурузу (Zea mays), пшеницу (Triticum spp.), рис (Oryza spp. и Zizania spp.), ячмень (Hordeum spp.), хлопок (Abroma augusta и Gossypium spp.), сою (Glycine max), сахарную и столовую свеклу (Beta spp.), сахарный тростник (Arenga pinnata), томат (Lycopersicon esculentum и другие spp., Physalis ixocarpa, Solanum incanum и другие spp. и Cyphomandra betacea), картофель (Solanum tuberosum), сладкий картофель (Ipomoea batatas), рожь (Secale spp.), перец (Capsicum annuum, chinense и frutescens), салат-латук (Lactuca sativa, perennis и pulchella), капусту (Brassica spp.), сельдерей (Apium graveolens), баклажан (Solanum melongena), арахис (Arachis hypogea), сорго (Sorghum spp.), люцерну (Medicago sativa), морковь (Daucus carota), бобы (Phaseolus spp. и другие роды), овес (Avena sativa и strigosa), горох (Pisum, Vigna и Tetragonolobus spp.), подсолнечник (Helianthus annuus), тыквы крупноплодной (Cucurbita spp.), огурца (Cucumis sativa), табака (Nicotiana spp.), арабидопсиса (Arabidopsis thaliana), травы рулонного газона (Lolium, Agrostis, Poa, Cynodon и другие роды), клевера (Trifolium), вики (Vicia).
Устойчивость к глифосату, сообщаемая dgt-28, dgt-32 и dgt-33 увеличивает пригодность гербицида глифосата для применения во время сезона во многих сельскохозяйственных системах лиственных и вечнозеленых древесных пород. Устойчивые к гербициду глифосату древесные породы увеличивают универсальность применения этих гербицидов сверху без угрозы повреждений. Таким образом, dgt-28, dgt-32 и/или dgt-33 трансформируют в древесные породы: ольху (Alnus spp.), ясень (Fraxinus spp.), виды осины и тополя (Populus spp.), бук (Fagus spp.), березу (Betula spp.), вишню (Prunus spp.), эвкалипт (Eucalyptus spp.), гикори (Carya spp.), клена (Acer spp.), дуба (Quercus spp.) и сосны (Pinus spp.).
Устойчивость к гербициду глифосату повышает применимость гербицида глифосата для селективной борьбы с сорняками в декоративных и плодоносных видах. Таким образом, dgt-28, dgt-32 и/или dgt-33 трансформируют в декоративные и плодоносные виды: розу (Rosa spp.), ясенец (Euonymus spp.), петунию (Petunia spp.), бегонию (Begonia spp.), рододендрон (Rhododendron spp.), яблоню лесную или яблоню (Malus spp.), грушу (Pyrus spp.), персиковое дерево (Prunus spp.) и бархатцы (Tagetes spp.).
Пример 15: Пакетирование с другими признаками
Трансгенные культуры, содержащие признаки устойчивости к насекомым (IR) распространены среди растений кукурузы, сои и хлопка по всей Северной Америке и использование этих признаков расширяется во всем мире. Коммерческие трансгенные культуры, сочетающие в себе признаки устойчивости к насекомым и устойчивости к гербицидам (HT), разрабатываются многими компаниями по производству семян. Они включают признаки Bacillus thuringiensis (например, токсины Bt, приведенные на web-сайте lifesci.sussex.ac.uk, 2006), признаки устойчивости к насекомым, не являющиеся Bt, и любые или все из признаков HT, упомянутых выше. Возможность борьбы с множеством обусловленных паразитами проблем с помощью признаков IR является ценной концепцией коммерческого продукта. Однако удобство этой концепции продукта ограничивается, если борьба с сорняками и борьба с насекомыми независимы друг от друга.
Dgt-28, dgt-31, dgt-32 или dgt-33, отдельно или пакетированные с одним или несколькими дополнительными признаками HT, пакетируют с одним или несколькими дополнительными агротехническими признаками (например, устойчивость к насекомым, устойчивость к грибам или устойчивость к стрессовым воздействиям и т.д.) (см. www.isb.vt.edu), либо посредством общепринятого разведения, либо совместно в качестве в качестве нового трансгенного объекта. Признак(и) IR пакетируют с dgt-28, dgt-31, dgt-32 или dgt-33. При получении кодирующей последовательности признака IR, добавляют элементы экспрессии (например, промотор, интрон, 3′UTR, и т.д.) и признак IR пакетируют в молекуле с dgt-28, dgt-31, dgt-32 или dgt-33 способами рекомбинантных ДНК.
Признаки IR включают: Cry1F (патенты США № 5126133; 5188960; 5691308; 6096708; 6573240 и 6737273), Cry1A(c) (патенты США № 6114138; 5710020; 6251656 и 6229004), Cry1F и Cry1A(c) в качестве тройного набора с любым из dgt-28, dgt-31, dgt-32, или dgt-33, Cry34Ab(1) (патенты США № 7323556; 7897342; 7888495; 7875430; 7932033; 7956246; 6340593), Cry35 Ab(1) (патенты США № 6340593; 7323556; 7897342; 7888495; 7875430; 7932033; 7956246), и/или Cry35Ab(1) и Cry 34Ab(1) в качестве тройного набора с dgt-28, dgt-31, dgt-32 и/или dgt-33.
Преимущества включают улучшенную борьбу с сорняками, обеспечиваемую dgt-28, dgt-31, dgt-32 или dgt-33, и описанную в предыдущих примерах, объединенную со способностью контролировать вредных насекомых и/или другие агрономические стрессовые воздействия. Растения, содержащие такие признаки, пакетированные с dgt-28, dgt-31, dgt-32 и/или dgt-33, обеспечивают полный агрономический комплект, состоящий в улучшенном качестве сельскохозяйственной культуры со способностью к универсальному и экономичному контролю любого количества агрономических проблем. Комбинированные признаки IR и HT являются применимыми в большинстве агрономических и садоводческих/декоративных культур и лесоводстве.
Комбинацию dgt-28, dgt-31, dgt-32 или dgt-33, и соответствующей устойчивости к гербицидам и устойчивости к насекомым, обеспечиваемой любым из ряда генов IR, как Bt, так и не Bt, можно использовать для сельскохозяйственных культур, приведенных в настоящем описании. Использования любых из различных коммерческих гербицидов, приведенных в настоящем описании, в таких культурах стало возможным с помощью трансформации dgt-28, dgt-31, dgt-32 или dgt-33 и пакетирования их с соответствующим признаком HT или признаком IR, либо с помощью общепринятого разведения, либо с помощью генетической инженерии. Конкретные вносимые дозы гербицидов, репрезентативные для этих химических веществ, определяются ярлыками для гербицидов, собранными в книге CPR (Crop Protection Reference) или сходном сборнике, ярлыками, собранными интерактивно (например, cdms.net/manuf/manuf.asp), или любыми коммерческими или академическими руководствами по защите сельскохозяйственных культур, такими как Crop Protection Guide от Agriliance (2005).
Пример 16: Признак DGT, пакетированный с признаком AAD, в любой культуре
Путем пакетирования признака dgt с признаком aad (например, aad-1, описанный в патенте США 7838733; или aad-12, описанный в международной публикации патента PCT № WO 2007/053482 A2), либо посредством общепринятого разведения, либо вместе в качестве нового трансгенного события, повышается эффективность борьбы с сорняками, универсальность и способность контролировать смену сорняков и развитие устойчивости к гербицидам.
Трансформация культур aad-1 позволяет растениеводу селективно применять арилоксиалканоатные гербициды в однодольных культурах. Такие однодольные культуры будут иметь более высокий предел безопасности феноксиауксина. Кроме того, феноксиауксины можно селективно применять в двудольных культурах, трансформированных aad-1. Трансформация культур aad-12 позволяет растениеводу селективно использовать пиридилоксиауксиновые и арилоксиалканоатные гербициды в двудольных культурах для борьбы с сорными видами. Путем пакетирования dgt-28, dgt-31, dgt-32 или dgt-33 с признаками aad-1 или aad-12, растениеводы обеспечивают более широкий спектр гербицидов для борьбы с сорняками. Более того, использование комбинаций гербицидов приводит к большей универсальности для борьбы с устойчивостью к гербицидам в сорных видах.
Следующие возможности борьбы с сорняками предоставляются для растения, где признак dgt и признак aad пакетированы в любой однодольной или двудольной сельскохозяйственной культуре:
A. Глифосат применяют в стандартной послевсходовой вносимой дозе (420-2160 г.э.к./га, например, 560-1120 г.э.к./га) для борьбы с большинством травяных и широколистных видов сорняков. Признаки dgt могут обеспечить устойчивость при этих внесенных дозах глифосата. Для борьбы с устойчивыми к глифосату широколистными сорняками, такими как Conyza Canadensis, или сорняками, которые от природы трудно контролировать с помощью глифосата (например, Commelina spp), 280-2240 г.э.к./га (например, 560-1120 г.э.к./га) 2,4-D применяют последовательно, в баковой смеси или в качестве предварительной смеси с глифосатом для обеспечения дополнительного контроля. Как aad-1, так и aad-12 обеспечивают устойчивость к 2,4-D. Кроме того, aad-12 обеспечивает устойчивость к пиридилоксиауксиновым гербицидам, таким как триклопир и флуроксипир. Пиридилоксиауксиновые гербициды используют для борьбы с устойчивыми к глифосату широколистными сорняками, такими как Conyza canadensis и Commelina spp. Для триклопира, внесенные дозы, как правило, находятся в диапазоне 70-1120 г.э.к./га, например, 140-420 г.э.к./га. Для флуроксипира внесенные дозы, как правило, находятся в диапазоне 35-560 г.э.к./га, например, 70-280 г.э.к./га.
B. Глифосат применяют в стандартной послевсходовой вносимой дозе (420-2160 г.э.к./га, например, 560-1120 г.э.к./га) для борьбы с большинством травяных и широколистных сорных видов. Для борьбы с устойчивыми к глифосату видами трав, такими как Lolium rigidum или Eleusine indica, 10-200 г.э.к./га (например, 20-100 г.э.к./га) квизалофопа вносят последовательно, в баковой смеси или в качестве предварительно смеси с глифосатом для обеспечения эффективного контроля. Aad-1 обеспечивает устойчивость к квизалофопу. Размещение последовательно aad-1 в комбинации с dgt-28, dgt-31, dgt-32 или dgt-33 в сельскохозяйственных видах приводит к культурам, которые являются устойчивыми к гербицидам, описанным выше.
C. Глифосат является эффективным для борьбы с видами трав, отличными от широколистных сорных видов. Пакетированные признаки Aad-1 и dgt-28, dgt-32 или dgt-33 позволяют внесение эффективных против трав доз глифосата (105-840 г.э.к./га, например, 210-420 г.э.к./га). Затем вносят 2,4-D (в дозе 280-2240 г.э.к./га, например, 560-1120 г.э.к./га) последовательно, в качестве баковой смеси или в качестве предварительной смеси с эффективными против трав дозами глифосата для обеспечения необходимой борьбы с широколистными сорняками. Гербицид AOPP, такой как квизалофоп в дозе 10-200 г.э.к./га (например, 20-100 г.э.к./га и 20-35 г.э.к./га), используют для более надежного контроля травяных сорняков и/или для замедления развития устойчивых к глифосату трав. Низкая доза глифосата также обеспечивает некоторую пользу для борьбы с широколистными сорняками; однако основной контроль осуществляется 2,4-D.
D. Аналогично, пакетированные признаки aad-12 и dgt-28, dgt-31, dgt-32 или dgt-33 позволяют внесение эффективных против трав доз глифосата (105-840 г.э.к./га, например, 210-420 г.э.к./га). Затем вносят 2,4-D (в дозе 280-2240 г.э.к./га, например, 560-1120 г.э.к./га) последовательно, в баковой смеси или в качестве предварительной смеси с эффективными против трав дозами глифосата для обеспечения необходимого контроля широколистных сорняков. Триклопир и флуроксипир, используемые в дозах, упомянутых выше, также являются приемлемыми компонентами в режиме обработки. Низкая доза глифосата также обеспечивает некоторую пользу для борьбы с широколистными сорняками; однако основной контроль осуществляют 2,4-D, триклопир или флуроксипир.
Применению одного или нескольких коммерческих арилоксиауксиновых гербицидов отдельно или в комбинации (последовательно или независимо) способствует трансформация aad-12 в культуры. Аналогично применению одного или нескольких коммерческих феноксиауксиновых гербицидов отдельно или в комбинации (последовательно или независимо) с одним или несколькими коммерческими гербицидами AOPP способствует aad-1. Пакетирование любого из этих признаков с dgt-28, dgt-31, dgt-32 или dgt-33 позволяет более надежный контроль сорных видов. Конкретные дозы других гербицидов, репрезентативных для этих химических веществ, определены на этикетках гербицидов, собранных в книге CPR (Crop Protection Reference) или сходном сборнике, этикетках, собранных интерактивно (например, cdms.net/manuf/manuf.asp) или любых коммерческих или академических руководствах по защите культур, таких как Crop Protection Guide from Agriliance (2005).
Пример 17: Признак DGT, пакетированный с признаком AHAS, в любой сельскохозяйственной культуре
Признаки, кодирующие устойчивость к имидазолиноновым гербицидам (AHAS) в настоящее время присутствуют в ряде сельскохозяйственных культур, выращиваемых в Северной Америке, включая, но не ограничиваясь ими, кукурузу, рис, подсолнечник и пшеницу. В настоящее время разрабатываются дополнительные устойчивые к имидазолинону культуры (например, хлопок и сахарная свекла). Многие имидазолиноновые гербициды (например, имазамокс, имазетапир, имазаквин и имазапик) в настоящее время селективно используются в различных общепринятых сельскохозяйственных культурах. Применению имазетапира, имазамокса и неселективного имазапира способствуют с помощью признаков устойчивости к имидазолинонам, таким как AHAS. HTC для устойчивости к имидазолинонам в настоящее время имеют преимущество, состоящее в том, что они не являются трансгенными. Этот класс химических веществ также имеет значительную остаточную активность в почве, таким образом, он способен обеспечить борьбу с сорняками, которая распространяется за пределы времени внесения, в отличие от систем на основе глифосата или глюфосината. Однако спектр сорняков, контролируемых имидазолиноновыми гербицидами, не является настолько широким, как у глифосата (Agriliance, 2003). Кроме того, имидазолиновые гербициды обладают механизмом действия (ингибирование ацетолактатсиснтазы, ALS), к которому у многих сорняков развилась устойчивость (Heap I (2004). The international survey of herbicide resistant weeds, available at www.weedscience.com).
Dgt-28, dgt-31, dgt-32 или dgt-33 пакетируют с признаком устойчивости к имидазолинонам, либо посредством общепринятого разведения, либо совместно в качестве нового объекта трансформации, и улучшают эффективность борьбы с сорняками, универсальность и способность контролировать смену сорняков и развитие устойчивости к гербицидам.
Следующие возможности для борьбы с сорняками предоставляются для растения, где признак dgt и признак устойчивости к имидазолинону пакетированы в любой однодольной или двудольной сельскохозяйственной культуре:
A. Имазетапир вносят в стандартной послевсходовой вносимой дозе (35-280 г.э.к./га, например, 70-140 г.э.к./га) для борьбы с многими травяными и широколистными сорными видами.
i) Устойчивые к ингибиторам ALS широколистные сорняки, такие как Amaranthus rudis, Ambrosia trifida, Chenopodium album (среди прочих, Heap, 2004) контролируют с помощью баковой смеси глифосата в дозе 420-2160 г.э.к./га, например, 560-1120 г.э.к./га.
ii) Широколистные виды, по своей природе более устойчивые к имидазолиноновым гербицидам, такие как Ipomoea spp. контролируют с помощью баковой смеси глифосата в дозе 420-2160 г.э.к./га, например, 560-1120 г.э.к./га.
iii) Устойчивые к ингибиторам ALS травяные сорняки, такие как Sorghum halepense и Lolium spp., контролируют с помощью баковой смеси глифосата в дозе 420-2160 г.э.к./га, например, 560-1120 г.э.к./га.
iv) По своей природе устойчивые травяные сорные виды (например, Agropyron repens) контролируют с помощью баковой смеси глифосата в дозе 420-2160 г.э.к./га, например, 560-1120 г.э.к./га.
Использованию любого из различных коммерческих имидазолиноновых гербицидов или глифосатных гербицидов отдельно или в множестве комбинаций способствует трансформация dgt-28, dgt-31, dgt-32 или dgt-33 и пакетирование с любым признаком устойчивости к имидазолинону, либо с помощью общепринятых способов разведения, либо с помощью генной инженерии. Конкретные дозы гербицидов, репрезентативные для этих химических веществ, определяются ярлыками для гербицидов, собранными в книге CPR (Crop Protection Reference) или сходном сборнике, ярлыками, собранными интерактивно (например, cdms.net/manuf/manuf.asp), или любыми коммерческими или академическими руководствами по защите сельскохозяйственных культур, такими как Crop Protection Guide от Agriliance (2005).
Пример 18: Трансформация сои
Трансгенную сою (Glycine max), содержащую стабильно встроенный трансген dgt-28, получали путем опосредуемой Agrobacterium трансформации эксплантатов семядольного узелка сои. Для инициации трансформации использовали разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28.
Опосредуемую Agrobacterium трансформацию осуществляли с использованием модифицированной методики половины семядольного узла Zeng et al. (Zeng P., Vadnais D.A., Zhang Z., Polacco J.C., (2004), Plant Cell Rep., 22(7): 478-482). В кратком изложении, семена сои (cv. Maverick) проращивали на базальной среде и семядольные узлы выделяли и инфицировали Agrobacterium. Среды для закладки побегов, удлинения побегов и укоренения дополняли цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Селекцию с помощью гербицида использовали для ингибирования роста нетрансформированных побегов. Выбранные побеги переносили в среду для укоренения в целях развития корней, а затем переносят в почвенную смесь для акклиматизации проростков.
Терминальные листки выбранных проростков обрабатывали поверхностно (способ окрашивания листьев) гербицидом для скрининга предполагаемых трансформантов. Подвергнутые скринингу проростки переносили в теплицу, позволяли им акклиматизироваться, а затем листья окрашивали гербицидом для повторного подтверждения устойчивости. Проводили взятие образцов этих предполагаемых трансформированных растений T0 и использовали молекулярный анализ для подтверждения присутствия гербицидного селективного маркера и трансгена dgt-28. Растениям T0 позволяли самоопыляться в теплице с получением семян T1.
Для получения дополнительных трансгенных растений сои можно использовать второй способ трансформации сои. Разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28, используют для инициации трансформации.
Опосредуемую Agrobacterium трансформацию проводили с использованием модифицированной методики половины семени Paz et al. (Paz M., Martinez J., Kalvig A., Fonger T., и Wang K., (2005) Plant Cell Rep., 25: 206-213). В кратком изложении, зрелые семена сои стерилизовали в течение ночи с помощью газообразного хлора и пропитывали стерильной H2O за двадцать часов до опосредуемой Agrobacterium трансформации растений. Семена разрезали пополам путем продольного разреза вдоль рубчика семени для разделения семени и удаления оболочки семени. Эмбриональную ось вырезали и любые осевые побеги/почки удаляли из семядольного узелка. Полученные эксплантаты половин семян инфицировали Agrobacterium. Среды для закладки побегов, удлинения побегов и укоренения дополняли цефотаксимом, тиментином и ванкомицином для удаления Agrobacterium. Селекцию с помощью гербицида использовали для ингибирования роста нетрансформированных побегов. Выбранные побеги переносили в среду для укоренения в целях развития корней, а затем переносили в почвенную смесь для акклиматизации проростков.
Проводили взятие образцов этих предполагаемых трансформированных растений T0 и использовали молекулярный анализ для подтверждения присутствия гербицидного селективного маркера и трансгена dgt-28. Несколько трансгенных объектов идентифицировали в качестве содержащих трансгены. Эти растения T0 использовали для дальнейшего анализа, и им позволяли самоопылиться в теплице с получением семян T1.
Подтверждение наследуемости dgt-28 в поколении T1. Наследуемость белка DGT-28 в поколении T1 оценивали одним из двух способов. Первый способ включал посев семян T1 на среду Metro-mix и применение 411 г.э.к./га Ignite™ 280 SL к проросшим растениям на стадии роста 1-го трилистника. Второй способ состоял в гомогенизации семян в 8 репликах с использованием шаровой опоры и Genogrinder. Затем использовали тест-полоски ELISA для обнаружения белка PAT в целях выявления наследуемых трансгенных объектов, поскольку селективный маркер находился на той же плазмиде, что и dgt-28. Для любого способа, если одно растение было устойчивым к глюфосинату или было выявлено с помощью тест-полоски ELISA для PAT, трансгенный объект демонстрировал наследуемость в поколении T1.
Всего пять конструкций подвергали скринингу на наследуемость, как описано ранее. Плазмиды содержали dgt-28, связанный с TraP4, TraP8 и TraP23. Трансгенные объекты среди конструкций продемонстрировали 68% наследуемость белка PAT::DGT-28 в поколении T1.
Устойчивость к послевсходовому гербициду в трансформированной dgt-28 сое T1. Семена трансгенных объектов T1, для которых ранее описанными способами скрининга была определена наследуемость, высевали в среду Metro-mix в условиях теплицы. Растения выращивали до тех пор, пока 1-ый трилистник не раскрывался полностью, и обрабатывали 411 г.э.к./га Ignite™ 280 SL для селекции гена pat, как описано ранее. Устойчивым растениям из каждого трансгенного объекта присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку, когда имелось достаточно растений. Эти растения сравнивали с табаком Petite havana дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растение проводили распыление в диапазоне 560-4480 г.э.к./га Durango™, соль диметиламина (DMA). Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидаются некоторый вариабельный ответ вследствие отличий в зиготности.
|
|
Защита с помощью dgt-28 от увеличенных доз глифосата в поколении T2. Испытание по качеству потомства проводили для 45 растений из от двух до пяти линий T2 с dgt-28 на конструкцию. Гомозиготные линии были выбраны на основе анализа зиготности, проведенного для предшествующего поколения. Семена сеяли, как описано ранее. Затем на растения распыляли 411 г.э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT подсчитывали устойчивые и чувствительные растения.
Для конструкций, содержавших TraP4, связанный с dgt-28 (pDAB107543 и pDAB107548), девять из двенадцати исследованных линий не сегрегировали, тем самым подтверждая гомогенность линий в поколении T2. Линии, содержавшие TraP8, связанный с dgt-28 (pDAB107545), продемонстрировали две из четырех линий без сегрегирующих растений и продемонстрировали менделевский тип наследования по меньшей мере до второго поколения сои с dgt-28. Проводили взятие образцов тканей устойчивых растений и белок DGT-28 количественно определяли стандартными способами ELISA. Данные продемонстрировали диапазон среднего количества белка DGT-28 32,8-107,5 нг/см2 для несегрегирующих исследованных линий T2. Линии с конструкцией pDAB107553 (TraP23::dgt-28) ранее не подвергали селекции с глюфосинатом, и ответ на дозу глифосата использовали как в качестве испытания на гомогенность, так и в качестве испытания на устойчивость к повышенным дозам глифосата. Реплики линий с конструкцией pDAB107553 были устойчивыми к дозам в диапазоне 560-4480 г.э.к./га глифосата, и, таким образом, было подтверждено, что они являются гомогенной популяцией и наследование происходило по меньшей мере в двух поколениях.
Дозы Durango DMA в диапазоне 560-4480 г.э.к./га глифосата применяли к сое на стадии 2-3 трехлистников, как описано ранее. Визуальные данные о повреждениях через 14 DAT подтвердили результаты устойчивости, которые были продемонстрированы в поколении T1.
|
|
|
Пример 19: Трансформация риса посредством dgt-28
В иллюстративном способе трансгенный рис (Oryza sativa), содержащий стабильно встроенный трансген dgt-28, получают с помощью опосредуемой Agrobacterium трансформации стерилизованных семян риса. Для инициации трансформации используют разоруженный штамм Agrobacterium, содержащий бинарный вектор, включающий функциональный dgt-28.
Культуральную среду доводят до pH 5,8 с помощью 1 M KOH и загущают с помощью 2,5 г/л Phytagel (Sigma-Aldrich, St. Louis, MO). Эмбриогенные каллюсы культивируют в чашках Петри размером 100×20 мм, содержащих 30 мл полутвердой среды. Проростки риса выращивают на 50 мл среды в боксах MAGENTA. Суспензии клеток поддерживают в 125-мл конических колбах, содержащих 35 мл жидкой среды и центрифугируют при 125 об./мин. Индукцию и поддержание эмбриогенных культур проводят в темноте при 25-26°C, и регенерацию растений и культивирование цельных растений проводят в освещенной комнате со световым периодом 16 ч (Zhang et al. 1996).
Индукцию и поддержание эмбриогенного каллюса проводят на модифицированной базальной среде NB, как описано ранее (Li et al. 1993), где среда адаптирована так, чтобы она содержала 500 мг/л глутамина. Суспензионные культуры инициируют и поддерживают в жидкой среде SZ (Zhang et al. 1998) с включением 30 г/л сахарозы вместо мальтозы. Осмотическая среда (NBO) состоит из среды NB с добавлением 0,256 M каждого из маннита и сорбита. Селекцию устойчивого к гербицидам каллюса проводят на среде NB, дополненной соответствующим селективным гербицидным агентом, в течение 3-4 недель. Предварительную регенерацию проводят на среде (PRH50) состоящей из среды NB с 2,4-дихлорфеноксиуксусной кислотой (2,4-D), 1 мг/л α-нафталинуксусной кислоты (NAA), 5 мг/л абсцизовой кислоты (ABA) и селективным гербицидом, в течение 1 недели. Регенерацию проростков осуществляют путем культивирования на среде для регенерации (RNH50), содержащей среду NB, содержащую 2,4-D, 0,5 мг/л NAA и селективный гербицид, до тех пор, пока предполагаемые трансгенные побеги не регенерируют. Побеги переносят на среду для укоренения с основными солями Мурасиге-Скуга в половинной концентрации и витаминами B5 Гамборга, дополненную 1% сахарозой и селективным гербицидом.
Зрелые высушенные семена Oryza sativa L. japonica cv. Taipei 309 стерилизуют, как описано в Zhang et al. 1996. Эмбриогенные ткани индуцируют путем культивирования стерильных зрелых семян риса на среде NB в темноте. Первичный каллюс диаметром приблизительно 1 мм удаляют из щитка зародыша и используют для инициации суспензии клеток в жидкой среде SZ. Затем суспензии поддерживают так, как описано в Zhang 1996. Происходящие из суспензии эмбриогенные ткани извлекают из жидкой культуры через 3-5 суток после предшествующего субкультивирования и помещают на осмотическую среду NBO для формирования круга размером приблизительно 2,5 см на чашке Петри и культивируют в течение 4 ч перед бомбардировкой. Через от шестнадцати до двадцати часов после бомбардировки ткани переносят из среды NBO на селективную среду NBH50, контролируя, чтобы подвергнутая бомбардировке поверхность была направлена вверх, и инкубируют в темноте в течение 14-17 суток. Затем вновь образованный каллюс отделяют от исходных подвергнутых бомбардировке эксплантатов и помещают рядом на ту же среду. После дополнительных 8-12 суток, относительно компактный непрозрачный каллюс визуально идентифицируют и переносят в предрегенерационную среду PRH50 на 7 суток в темноте. Затем растущий каллюс, который становится более компактным и непрозрачным, субкультивируют в среде для регенерации RNH50 в течение периода 14-21 суток при световом периоде 16 ч. Регенерирующие побеги переносят в боксы MAGENTA, содержащие среду 1/2 MSH50. Множество растений, регенерировавших из одного эксплантата, считают сибсами, и их обрабатывают как одну независимую линию растений. Растение оценивают как положительное по гену dgt-28, если оно образует толстые белые корни и энергично растет на среде 1/2 MSH50. После того, как ростки достигают верха боксов MAGENTA, их переносят в почву в 6-см горшках при 100% влажности на неделю, а затем переносят в камеру для выращивания со световым периодом в течение 14 ч при 30°C и в темноте при 21°C на 2-3 недели, перед пересадкой в 13-см горшки в теплице. Семена собирают и сушат при 37°C в течение одной недели перед хранением при 4°C.
Анализ T0 риса с dgt-28. Пересаженные трансформанты риса, полученные путем трансформации с помощью Agrobacterium, пересаживали в среду и акклиматизировали к условиям теплицы. Проводили взятие образцов всех растений для обнаружения с помощью ПЦР dgt-28 и результаты демонстрируют двадцать два положительных в ПЦР трансгенных объекта для pDAB110827 (TraP8::dgt-28) и минимум шестнадцать положительных в ПЦР трансгенных объекта для pDAB110828 (TraP23::dgt-28). Саузерн-анализ dgt-28 для положительных в ПЦР трансгенных объектов продемонстрировал простые (1-2 копия) трансгенные объекты для обеих конструкций. Экспрессия белка в выбранных трансгенных объектах T0 продемонстрировала, что экспрессия белка DGT-28 находится в диапазоне ниже уровней обнаружения 130 нг/см2. Выбранные трансгенные объекты T0 с конструкцией pDAB110828 обрабатывали 2240 г.э.к./га Durango DMA™, как описано ранее, и оценивали через 7 и 14 суток после обработки. Данные продемонстрировали надежную устойчивость к вносимой дозе глифосата. Всем положительным в ПЦР растениям позволяли продуцировать семена T1 для дальнейшей охарактеризации.
Наследуемость Dgt-28 в рисе. Испытание по качеству потомства для 100 растений проводили на четырех линиях T1 с dgt-28 из конструкции pDAB110827, содержащей транзитный пептид хлоропластов TraP8. Семена высевали в горшки, заполненные средой. Затем на все растения распыляли 560 г.э.к./га Durango DMA™ для селекции по гену dgt-28, как описано ранее. Через 7 DAT, подсчитывали устойчивые и чувствительные растения. Две из четырех исследованных линии для каждой конструкции сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), как определяли с помощью анализа с использованием критерия хи-квадрат. Dgt-28 представляет собой наследуемый ген устойчивости к глифосату в множестве видов.
Устойчивость к послевсходовому гербициду в трансформированном dgt-28 рисе T1. Устойчивым растениям T1 из каждого трансгенного объекта, использованного в испытании по качеству потомства, присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку. Эти растения сравнивали с рисом kitaake дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растения проводили распыление в диапазоне 560-2240 г.э.к./га Durango DMA™. Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидаются некоторый вариабельный ответ вследствие отличий в зиготности.
Результаты распыления демонстрируют через 7 DAT (сутки после обработки) минимальное вегетативное повреждение при повышенных дозах глифосата (данные не представлены).
|
Выявление белка DGT-28 проводили для всех реплик из всех четырех исследованных линий T1, полученных с помощью pDAB110827. Данные продемонстрировали средние диапазоны белка DGT-28 20-82 нг/см2 и 21-209 нг/см2 для гемизиготных и гомозиготных реплик, соответственно. Эти результаты продемонстрировали стабильную экспрессию белка до поколения T1 и устойчивость риса с dgt-28 к вплоть до 2240 г.э.к./га глифосата после внесения 560 г.э.к./га глифосата, использованного для селекции.
Пример 20: Трансформация травы рулонного газона посредством dgt-28
Опосредуемую Agrobacterium tumefaciens генетическую трансформацию трансгена dgt-28 в полевице болотной обеспечивают с помощью эмбриогенного каллюса, полученного из семян (cv. Penn-A-4). См. "Efficiency of Agrobacterium tumefaciens-mediated turfgrass (Agrostis stolonifera L) transformation" (Luo et. al., 2004).
Клетки каллюса инфицируют штаммом A. tumefaciens, содержащим супербинарный вектор, который содержит трансген устойчивости к гербицидам (например, dgt-28, dgt-31, dgt-32 или dgt-33), контролируемый специфическим для однодольных растений промотором. Общая эффективность стабильной трансформации находится в диапазоне от 18% до 45%. Саузерн-блоттинг и генетический анализ подтверждают встраивание гена в геном полевицы болотной и нормальную передачу и стабильную экспрессию трансгена в поколении T1. Все независимые трансгенные объекты включают от одной до трех копий трансгена и большинство из них (60-65%) включают только одну копию трансгена без наблюдаемых перестроек.
Зрелые семена вылущивают с помощью шлифовальной бумаги и подвергают поверхностной стерилизации в 10% (об./об.) отбеливателе Clorox™ (6% гипохлорит натрия) с 0,2% (об./об.) Tween 20 (полисорбат 20) при энергичном встряхивании в течение 90 мин. После промывания пять раз в стерильной дистиллированной воде, семена помещают на среду для индукции каллюса (базальные соли и витамины MS, 30 г/л сахарозы, 500 мг/л гидролизата казеина, 6,6 мг/л 3,6-дихлор-o-анисовой кислоты (дикамба), 0,5 мг/л 6-бензиламинопурина (BAP) и 2 г/л Phytagel. pH среды доводят до 5,7, а затем автоклавируют при 120°C в течение 20 мин).
Чашки для культивирования, содержащие приготовленные эксплантаты семян, держат в темноте при комнатной температуре в течение 6 недель. Проводят визуальную селекцию эмбриогенных каллюсов и их субкультивируют на свежей среде для индукции каллюса в темноте при комнатной температуре в течение 1 недели перед сокультивированием.
За одни сутки до опосредуемой Agrobacterium инфекции, эмбриогенный каллюс разделяют на фрагменты размером 1-2-мм и помещают на среду для индукции каллюса, содержащую 100 мкМ ацетосирингон. Затем на каждый фрагмент каллюса наносят аликвоту объемом 10 мкл суспензии Agrobacterium (OD=1,0 при 660 нм), которая содержит трансген dgt-28, dgt-31, dgt-32 или dgt-33, а затем проводят сокультивирование в течение 3 суток в темноте при 25°C. Затем каллюс переносят и культивируют в течение 2 недель на среде для индукции каллюса с 125 мг/л цефотаксима и 250 мг/л карбенициллина для подавления роста бактерий.
Селекцию трансгенных растений проводят, когда каллюс переносят на среду для индукции каллюса, содержащую 250 мг/л цефотаксима и гербицид. Материал каллюса поддерживают на этой среде в течение 8 недель с интервалом селекции субкультуры 3 недели. Процесс селекции проводят при комнатной температуре в темноте.
Для регенерации растений сначала трансгенные объекты с устойчивым к гербицидам каллюсом перемещают на среду для регенерации (базальная среда MS, 30 г/л сахарозы, 100 мг/л миоинозитола, 1 мг/л BAP и 2 г/л Phytagel), дополненную цефотаксимом и гербицидом для селекции. Эти каллюсы поддерживают в темноте при комнатной температуре в течение 1 недели, а затем перемещают на свет на 2-3 недели для развития побегов.
Развившиеся побеги отделяют и переносят на не содержащую гормонов среду для регенерации, содержащую гербицид и цефотаксим, для обеспечения роста корней при поддержании селективного давления и подавлении любых оставшихся клеток Agrobacterium. Затем проростки с хорошо развившимися корнями (3-5 недель) переносят на почву и выращивают либо в теплице, либо на поле.
Трансгенные растения поддерживают на открытом воздухе в изолированном питомнике (3-6 месяцев) до момента зимнего солнцестояния в декабре. Затем яровизированные растения переносят в теплицу и держат при 25°C при световом периоде 16/8 ч и окружают нетрансгенными контрольными растениями, которые физически изолируют трансгенные растения от других источников пыльцы. Трансгенные растения начинают цвести через 3-4 недели после перемещения обратно в теплицу. Эти растения подвергают ауткроссингу с пыльцой из окружающих контрольных растений. Семена, собранные с каждого индивидуального трансгенного растения, проращивают в почве при 25°C, и растения T1 выращивают в теплице для дальнейшего анализа.
Другие травы трансформируют посредством dgt-28 в соответствии с описанным протоколом, включая мятник однолетний (Poa annua), гречку заметную, полевицу, бермудскую траву, пырей, бородатую траву, брахиарию, костер, просо дикое (Agrostis capillaries), бизоную траву, канареечник, аксонопус, эремохлою змеехвостую, овсяницу красную (Festuca rubra commutate), ползучий сорняк, полевицу болотную (Agrostis stolonifera), тонконог пирамидальный (Koeleria macrantha), паспалум расширенный, овсяницу, фестулолиум, овсяницу жестковатую/овсяницу овечью (Festuca ovina), пастбищную траву, аиру голубую, джонсонову траву, полевичку, смеси (травы для лошадей, пастбищные травы, и т.д.), дикие травы, ежу сборную, райграсс пастбищный (Lolium perenne), полевицу белую, костер униольный, однолетний и многолетний плевел, овсяницу красную волосовидную (Festuca rubra trichophylla), мятлик луговой (Poa pratensis), августинову траву, ползучую красную овсяницу (Festuca rubra rubra), суданскую траву, просо прутьевидное, овсяницу высокую (Festuca arundinacea), луговик дернистый (Deschampsia caespitosa), траву газонного рулона, пырей ползучий и цойсию.
Пример 21: Трансформация Brassica spp. посредством признака DGT
Ген dgt-28, dgt-31, dgt-32 или dgt-33, сообщающий устойчивость к глифосату, используют для трансформации Brassica napus сорта Nexera™ 710 путем опосредуемой Agrobacterium трансформации.
Семена Brassica napus подвергают поверхностной стерилизации с помощью 10% коммерческого отбеливателя в течение 10 минут и ополаскивают 3 раза стерильной дистиллированной водой. Затем семена помещают на половину концентрации базальной среды MS (Murashige and Skoog, 1962) и поддерживают в режиме роста при 25°C и световом периоде 16 часов на свету/8 часов в темноте.
Сегменты гипокотиля (3-5 мм) вырезают из проростков в возрасте 5-7 суток и помещают на среду для индукции каллюса K1D1 (среда MS с 1 мг/л кинетина и 1 мг/л 2,4-D) на 3 суток в качестве предварительной обработки. Затем сегменты переносят на чашку Петри и обрабатывают штаммом Agrobacterium tumefaciens, содержащим конструкцию, содержащую dgt-28. Agrobacterium tumefaciens выращивают в течение ночи при 28°C в темноте на устройстве для качания при 150 об./мин., а затем ресуспендируют в культуральной среде.
После обработки в течение 30 мин сегментов гипокотиля посредством Agrobacterium, эти сегменты помещают обратно на среду для индукции каллюса на 3 суток. После сокультивирования сегменты помещают в K1D1TC (среда для индукции каллюса, содержащая 250 мг/л карбенициллина и 300 мг/л тиментина) на одну неделю для восстановления. Альтернативно сегменты помещают прямо на селективную среду K1D1H1 (указанная выше среда с гербицидом). Карбенициллин и тиментин представляют собой антибиотики, используемые для уничтожения Agrobacterium. Селективный агент обеспечивает рост трансформированных клеток.
Образцы каллюса из выделенных трансгенных объектов трансформации исследуют с помощью ПЦР. Образцы, которые являются положительными в отношении присутствия dgt-28, dgt-31, dgt-32 или dgt-33 в исследовании, подтверждают и переносят на среду для регенерации. Затем сегменты гипокотиля каллюса помещают на среду для регенерации побегов B3Z1H1 (среда MS, 3 мг/л бензиламинопурина, 1 мг/л зеатина, 0,5 г/л MES [2-(N-морфолино)этансульфоновая кислота], 5 мг/л нитрата серебра, селективный гербицид, карбенициллин и тиментин). Через 3 недели побеги начинают регенерировать. Сегменты гипокотиля вместе с побегами переносят на среду B3Z1H3 (среда MS, 3 мг/л бензиламинопурина, 1 мг/л зеатина, 0,5 г/л MES [2-(N-морфолино)этансульфоновая кислота], 5 мг/л нитрата серебра, селективный гербицид, карбенициллин и тиментин) в течение других 3 недель.
Побеги вырезают из сегментов гипокотиля и переносят на среду для удлинения побегов MESH10 (MS, 0,5 г/л MES, селективный гербицид, карбенициллин, тиментин) на 2-4 недели. Удлиненные побеги культивируют для индукции корней на MSI.1 (MS с 0,1 мг/л индолмасляной кислотой). После развития у растения корневой системы, растения пересаживают в почву. Растения подвергают акклиматизации в контролируемых условиях окружающей среды в Conviron™ в течение 1-2 недель, а затем переносят в теплицу.
Трансформированные растения T0 подвергают самоопылению в теплице с получением семян T1. На растения T0 и потомков T1 распыляют диапазон концентраций гербицида глифосата для установления уровня защиты геном dgt-28, dgt-31, dgt-32 или dgt-33.
Пример 22: Трансформация табака посредством dgt-28
Фрагменты листьев табака (cv. Petit Havana) трансформировали с использованием Agrobacterium tumefaciens, содержащих трансген dgt-28. Единичные колонии, содержащие плазмиду, которая содержит трансген dgt-28, инокулировали в 4 мл среды YEP, содержащей спектиномицин (50 мкг/мл) и стрептомицин (125 мкг/мл) и инкубировали в течение ночи при 28°C на устройстве для встряхивания при 190 об./мин. Затем культуру семян объемом 4 мл использовали для инокуляции 25-мл культуры с той же средой в 125-мл колбе с перегородками Erlenmeyer. Эту культуру инкубировали при 28°C при встряхивании при 190 об./мин. до тех пор, пока она не достигала OD600 ~1,2. Затем десять мл суспензии Agrobacterium помещали в стерильные чашки Petri× 60×20 мм.
Свежеразрезанные фрагменты листьев (0,5 см2) из растений, выращенных в асептических условиях на среде MS (Phytotechnology Labs, Shawnee Mission, KS,) с 30 г/л сахарозы в PhytaTrays™ (Sigma, St. Louis, MO), погружали в 10 мл ночной культуры Agrobacterium на несколько минут, промакивали насухо на стерильной фильтровальной бумаге, а затем помещали на ту же среду с добавлением 1 мг/л индолуксусной кислоты и 1 мг/л 6-бензиламинопурина. Через трое суток фрагменты листьев сокультивированные с Agrobacterium, содержащими трансген dgt-28, переносили в то же среду с 5 мг/л Basta™ и 250 мг/л цифотаксима.
Через 3 недели индивидуальные проростки T0 переносили в среду MS с 10 мг/л Basta™ и 250 мг/л цефотаксима на дополнительные 3 недели перед пересадкой в почву и переносом в теплицу. Выбранным растениям T0 (идентифицированные с использованием протоколов молекулярного анализа, описанного выше) позволяли самоопылиться и собирали семена из капсул, когда они полостью высыхали. Проростки T1 подвергали скринингу в отношении зиготности и экспрессии репортерного гена (как описано ниже) и идентифицировали отдельные растения, содержащие трансген dgt-28.
Растения переносили в теплицу путем смывания агара с корней, пересадки в почву в 13,75-см квадратных горшках, помещения горшков в мешок Ziploc® (SC Johnson & Son, Inc.), добавления на дно мешка водопроводной воды, и помещения их под непрямой свет в теплице при 30°C на одну неделю. Через 3-7 суток мешки открывали, растения опыляли и позволяли им расти в открытом мешке до тех пор, пока растения не акклиматизируются в теплице, после чего мешок удаляли. Растения выращивали в обычных условиях теплой теплицы (27°C днем, 24°C ночью, день 16 часов, минимальный природный + дополнительный свет = 1200 мкЕ/м2с1).
Перед размножением проводили взятие образцов растений T0 для анализа ДНК в целях определения количества копий вставки dgt-28 с помощью ПЦР в реальном времени. Свежую ткань помещали в пробирки и лиофилизировали при 4°C в течение 2 суток. После того, как ткань полностью высыхала, в пробирку помещали вольфрамовые гранулы (Valenite) и образцы подвергали сухому измельчению в течение 1 минуты с использованием шаровой мельницы Kelco. Затем выполняли стандартную методику выделения ДНК DNeasy™ (Qiagen, DNeasy 69109). Затем аликвоту выделенной ДНК окрашивали с помощью Pico Green (Molecular Probes P7589) и считывали на флуориметре (BioTek™) с известными стандартами до концентрации концентрация в нг/мкл. Всего 100 нг тотальной ДНК использовали в качестве матрицы. Реакцию ПЦР проводили в термоциклере 9700 Geneamp™ (Applied Biosystems) путем воздействия на образцы 94°C в течение 3 минут и 35 циклов из 94°C в течение 30 секунд, 64°C в течение 30 секунд, и 72°C в течение 1 минуты и 45 секунд, а затем 72°C в течение 10 минут. Продукты ПЦР анализировали с помощью электрофореза на 1% агарозном геле, окрашенном EtBr, и подтверждали с помощью саузерн-блоттинга.
От пяти до десяти положительных в ПЦР трансгенных объектов с 1-3 копиями гена dgt-28 из 3 компонентов, включающих различные последовательности транзитных пептидов хлоропластов (TraP4, TraP8 и TraP23) регенерировали и переносили в теплицу.
Для всех положительных в ПЦР растений проводили взятие образцов для количественного определения белка DGT-28 с помощью стандартного ELISA. Обнаружение белка DGT-28 проводили во всех положительных в ПЦР растениях, и была отмечена тенденция к увеличению концентрации белка при увеличении количества копий dgt-28.
Наследуемость aad-12 (v1) в табаке. Испытание по качеству потомков проводили для 100 растений в пяти линиях T1 с dgt-28 на конструкцию. Конструкции содержали одну из следующих последовательностей транзитного пептида хлоропластов: TraP4, TraP8 или TraP23. Семена стратифицировали, сеяли и пересаживали в основном так, как в описанной выше методике для Arabidopsis, за исключением того, что нулевые растения не удаляли путем первоначальной селекции перед пересадкой. Затем на все растения распыляли 280 г.э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT подсчитывали резистентные и чувствительные растения.
Четыре из пяти исследованных линий для каждой конструкции сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении в анализе с использованием критерия хи-квадрат. Dgt-28 представляет собой наследуемый ген устойчивости к глифосату в множестве видов.
Устойчивость к послевсходовым гербицидам в трансформированных посредством dgt-28 растениях табака T1. Устойчивым растениям T1 из каждого трансгенного объекта, использованного в испытании по качеству потомства, присваивали уникальные идентификационные обозначения и проводили взятие их образцов для анализа зиготности гена dgt-28. Данные о зиготности использовали для распределения 2 гемизиготных и 2 гомозиготных реплик на каждую вносимую дозу глифосата, с получением всего 4 реплик на обработку. Эти растения сравнивали с табаком Petite havana дикого типа. На все растения проводили распыление с помощью гусеничного опрыскивателя, установленного на 187 л/га. На растения проводили распыление в диапазоне 560-2240 г.э.к./га Durango DMA™. Для всех внесений составление проводили в воде с добавлением 2% масс./об. сульфата аммония (AMS). Растения оценивали через 7 и 14 суток после обработки. Растениям присваивали оценку повреждения в отношении общего видимого замедления роста, хлороза и некроза. Поколение T1 является сегрегирующим, так что ожидаются некоторый вариабельный ответ вследствие отличий в зиготности.
Результаты распыления демонстрируют через 7 DAT (сутки после обработки) минимальное вегетативное повреждение при повышенных дозах глифосата (данные не представлены). Через 14 DAT, данные видимого повреждения демонстрируют увеличенное повреждение в случае трансгенных объектов с одной копией конструкции, содержащей TraP4, по сравнению с трансгенными объектами с одной копией конструкций с TraP8 и TraP23. Таблица 27.
|
|
Эти результаты продемонстрировали устойчивость dgt-28 к вплоть до 4480 г.э.к./га глифосата, а также отличия в устойчивости, обеспечиваемые последовательностями транзитных пептидов хлоропластов, связанными с геном dgt-28.
Защита посредством Dgt-28 от повышенных уровней глифосата в поколении T2. Испытание по качеству потомков для 25 растений проводили для от двух до трех линий T2 с dgt-28 на конструкцию. Гомозиготные линии были выбраны, исходя из анализов зиготности, проведенных для предшествующего поколения. Семена стратифицировали, высевали и пересаживали, как описано ранее. Затем на все растения распыляли 280 г.э.к./га Ignite 280 SL для селекции по селективному маркеру pat, как описано ранее. Через 3 DAT устойчивые и чувствительные растения подсчитывали. Все линии, исследованные в отношении каждой конструкции, не сегрегировали, тем самым, подтверждая гомогенные линии в поколении T2 и демонстрируя менделевское наследование на протяжении по меньшей мере двух поколений dgt-28 в табаке.
Дозы Durango DMA™ в диапазоне 420-3360 г.э.к./га глифосата применяли к табаку на стадии 2-3 листьев, как описано ранее. Данные о видимом повреждении через 14 DAT подтвердили результаты устойчивости, которые были продемонстрированы в поколении T1. Результаты для листьев из линий с двумя копиями из конструкции, содержавшей TraP4, продемонстрировали сходную устойчивость с устойчивостью линий с одной копией TraP8 и TraP23 (данные не представлены).
|
|
Данные демонстрируют надежную устойчивость табака dgt-28 к вплоть до 3360 г.э.к./га глифосата на протяжении двух поколений по сравнению с нетрансформированным контролем.
Проводили взятие образцов выбранных растений из каждого трансгенного объекта перед применением глифосата для анализа белка DGT-28 с помощью стандартного ELISA для DGT-28. Данные продемонстрировали среднюю экспрессию белка DGT-28 в простых (1-2 копия) линиях среди конструкций в диапазоне 72,8-114,5 нг/см2. Данные демонстрируют, что dgt-28 экспрессирует белок в поколении T2 трансформированного табака и данные устойчивости подтверждают функциональный белок DGT-28.
Пакетирование с dgt-28 для увеличения спектра гербицидов в табаке (cv. Petit Havana). Гомозиготные растения dgt-28 (pDAB107543 и pDAB107545) и aad-12 v1 (pDAB3278) (см. PCT/US2006/042133 для последнего) в обоих случаях подвергали реципрокному скрещиванию и собирали семена F1. Семена F1, полученные при двух реципрокных скрещиваниях каждого гена, стратифицировали и обрабатывали. 6 реплик от каждого скрещивания обрабатывали 1120 г.э.к./га глифосата (селективный для гена dgt-28), 1120 г.э.к./га 2,4-D (селективный для гена aad-12), или баковой смесью двух гербицидов в описанных дозах. Растения оценивали через 14 DAT. Результаты распыления представлены в таблице 29.
|
Результаты подтверждают, что dgt-28 можно успешно пакетировать с aad-12 (v1), таким образом, увеличивая спектр гербицидов, которые можно применять для представляющей интерес сельскохозяйственной культуры (глифосат + феноксиуксусная кислота для dgt-28 и aad-12, соответственно). При производстве сельскохозяйственных культур, где существуют трудно контролируемые широколистные сорняки или устойчивые биотипы сорняков, пакетирование можно использовать в качестве средства для борьбы с сорняками и защиты представляющей интерес сельскохозяйственной культуры. Дополнительные агротехнические и потребительские признаки также можно пакетировать с геном dgt-28.
Пример 23: Устойчивость к глифосату в пшенице
Получение бинарных векторов, кодирующих DGT-28. Бинарные векторы, содержащие кассеты для экспрессии DGT-28 и селекции по PAT конструировали и собирали с использованием навыков и способов, общеизвестных в данной области. Каждая экспрессирующая кассета DGT-28 содержала промотор, 5′-нетранслируемую область и интрон из гена убиквитина (Ubi) из Zea mays (Toki et al Plant Physiology 1992, 100 1503-07), за которой следовала кодирующая последовательность, состоящая последовательности из одного из четырех транзитных пептидов (TraP4, TraP8, TraP23 или TraP5), слитых с 5′-концом синтетической версии гена 5-енолпирувилшикимат-3-фосфатсинтазы (DGT-28), кодон-оптимизированной для экспрессии в растениях. Экспрессирующая кассета DGT-28 завершалась 3′-нетранслируемой областью (UTR), содержащей последовательность терминации транскрипции и участок полиаденилирования гена липазы (Vp1) из Z. mays (Paek et al., Mol Cells 1998 30;8(3) 336-42). Кассета для селекции PAT содержала промотор, 5′-нетранслируемую область и интрон из ген актина (Act1) из Oryza sativa (McElroy et al., The Plant Cell 1990 2(2) 163-171), за которой следовала синтетическая версия гена фосфинотрицинцетилтрансферазы (PAT), выделенного из Streptomyces viridochromogenes, которая была кодон-оптимизированной для экспрессии в растениях. Ген PAT кодирует белок, который сообщает устойчивость к ингибиторам глутаминсинтетазы, включая фосфинотрицин, глюфосинат и биалафос (Wohlleben et al Gene 1988, 70(1), 25-37). Кассета для селекции завершалась 3′-UTR, содержащей терминатор транскрипции и участки полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al, Plant Physiology 1993 101 (4), 1395-1396).
Кассету для селекции синтезировали в коммерческой компании, осуществляющей синтез генов (GeneArt, Life Technologies), и ее клонировали в допустимый для Gateway бинарный вектор. Экспрессирующие кассеты с DGT-28 субклонировали в pDONR221. Полученный клон ENTRY использовали в реакции LR Clonase II (Invitrogen, Life Technologies) с допустимым для Gateway бинарным вектором, кодирующим экспрессирующую кассету для фосфинотрицинацетилтрансферазы (PAT). Колонии всех собранных плазмиды подвергали первоначальному скринингу путем рестрикционного расщепления очищенной ДНК с использованием эндонуклеаз рестрикции, полученных от New England BioLabs (NEB; Ipswich, MA) и Promega (Promega Corporation, WI). Получение плазмидной ДНК проводили с использованием QIAprep Spin Miniprep Kit (Qiagen, Hilden) или Pure Yield Plasmid Maxiprep System (Promega Corporation, WI), в соответствии с инструкциями поставщиков. Плазмидную ДНК выбранных клонов секвенировали с использованием протокола циклического секвенирования ABI Sanger Sequencing и Big Dye Terminator v3.1 (Applied Biosystems, Life Technologies). Данные о последовательности объединяли и анализировали с использованием программного обеспечения Sequencher™ (Gene Codes Corporation, Ann Arbor, MI).
Каждый из полученных четырех бинарных экспрессирующих клонов: pDAS000122 (TraP4-DGT28), pDAS000123 (TraP8-DGT28), pDAS000124 (TraP23-DGT28) и pDAS000125 (TraP5-DGT28) трансформировали в штамм EHA105 Agrobacterium tumefaciens.
Получение трансгенных объектов пшеницы с эспрессирующей dgt-28 конструкцией. Трансгенные растения пшеницы, экспрессирующие от одной до четырех экспрессирующих DGT-28 конструкций, получали путем опосредуемой Agrobacterium трансформации с использованием донорной линии пшеницы Bobwhite MPB26RH в соответствии с протоколом, сходным с Wu et al. Transgenic Research 2008, 17:425-436. Предполагаемые трансгенные объекты T0 подвергали селекции по устойчивости к фосфинотрицину (PPT) - фенотипу, сообщаемому селективным маркером PAT, и переносили в почву. Растения T0 выращивали в условиях изоляции в теплице и получали семена T1. В целом, было получено приблизительно 45 независимых трансгенных объектов T0 для каждой экспрессирующей конструкции DGT-28.
Устойчивость к глифосату трансгенных объектов пшеницы T0 с dgt-28. Трансгенным объектам T0 позволяли акклиматизироваться в теплице и их выращивали до тех пор, пока не появятся 2-4 новых нормального вида листа из завитка (т.е. растения переносили из условий культуры ткани в условиях выращивания в теплице). Растения выращивали при 25°C при дополнительном освещении в течение 12 часов в теплице до созревания. Первоначальный скрининг устойчивости к глифосату и анализы Taqman проводили на растениях T1, выращенных в тех же условиях, которые были описаны ранее. Данные позволяли дальнейшую охарактеризацию наследуемых трансгенных объектов T1. Шесть трансгенных объектов T1 с низким числом копий (1-2 копии) и два трансгенных объекта T1 с множеством числом копий повторно сажали в условиях теплицы и выращивали до стадии 3 листьев. На растения T1 распыляли коммерческий состав глифосата (Durango DMA™) в диапазоне 420-3360 г.э.к./га, который способен значительно повреждать нетрансформированные линии пшеницы. При внесении включали добавление 2% масс./об. сульфата аммония. Летальную дозу определяют как доза, которая вызывает >75% повреждение нетрансформированного контроля Bob White MPB26RH. Вносили гербицид.
В этом примере внесение глифосата использовали как для определения сегрегации гена dgt-28 в поколении T1, так и для демонстрации устойчивости к увеличенным уровням глифосата. Ответ растений представлен в значениях шкалы видимого повреждения через 21 сутки после обработки (DAT). Данные представляли в качестве гистограммы индивидуальных растений, проявляющих менее чем 25% видимое повреждение (4), 25%-50% видимое повреждение (3), 50%-75% видимое повреждение (2) и более чем 75% повреждение (1). Арифметическое среднее значение и стандартное отклонение представлены для каждой конструкции, использованной для трансформации пшеницы. Диапазон оценки индивидуального ответа также указан в последнем столбце для каждой дозы и трансформации. Нетрансформированная пшеница дикого типа (c.v. Bob White MPB26RH) служила в качестве чувствительного к глифосату контроля. В поколении T1 гемизиготные и гомозиготные растения были доступны для исследования каждого трансгенного объекта и, таким образом, они были включены для каждой исследованной дозы глифосата. Гемизиготные растения содержат половину дозы гена гомозиготных растений, таким образом, можно ожидать вариабельность ответа на глифосат в поколении T1.
Результаты для растений пшеницы T1 с dgt-28 продемонстрировали, что устойчивость к глифосату достигалась при дозах вплоть до 3360 г.э.к./га с помощью транзитных пептидов хлоропластов TraP4, TraP5, TraP8 и TraP23. Таблица 30. Данные представлены для трансгенного объекта T1 с низким числом копий, однако они являются репрезентативными для популяций в случае каждой конструкции.
|
|
Через 21 DAT, устойчивые и чувствительные растения подсчитывают для определения процента линий, которые сегрегировали в качестве единого локуса, доминантного менделевского признака (3R:1S), при определении в анализе с использованием критерия хи-квадрат. Таблица 31. Эти данные демонстрируют, что dgt-28 наследуется в качестве гена надежной устойчивости к глифосату в видах однодольных растений.
|
Молекулярное подтверждение трансгенных растений T0 в отношении встраивания T-ДНК, кодирующей DGT-28. Геномную ДНК экстрагировали из лиофилизированного материала листьев всех предполагаемых растений пшеницы T0. Свежесобранную ткань листьев быстро замораживали в жидком азоте и лиофилизировали в течение 24 ч в Labconco Freezone 4,5® (Labconco, Kansas City, MO) при -40°C и под давлением 133×10-3 мБар. Лиофилизированный материал подвергали экстракции ДНК с использованием набора DNeasy® Plant DNA Extraction Mini kit (Qiagen) в соответствии с инструкциями изготовителя.
ДНК из каждого растения T0 исследовали в отношении присутствия-отсутствия осуществляющего перенос штамма Agrobacterium tumefaciens и в отношении количества встроенных копий T-ДНК, кодирующей DGT-28. Анализ присутствия-отсутствия штамма A. tumefaciens проводили с использованием дуплексного анализа Taqman® qPCR для амплификации эндогенного гена убиквитина (прямой и обратный праймеры и зонд):
5′ GCGAAGATCCAGGACAAGGA 3′ (SEQ ID NO: 85; прямо праймер),
5′ CTGCTTACCGGCAAAGATGAG 3′ (SEQ ID NO: 86; обратный праймер),
5′ TTCCCCCGGACCAGCAGCGT 3′ (SEQ ID NO: 87; зонд),
из генома пшеницы, и virC из pTiBo542:
5′ CCGACGAGAAAGACCAGCAA 3′ (SEQ ID NO: 88; прямой праймер),
5′ CTTAAGTTGTCGATCGGGACTGT 3′ (SEQ ID NO: 89; обратный праймер),
5′ TGAGCCTCTCGTCGCCGATCACAT 3′ (SEQ ID NO: 90; зонд).
Количество встроенных копий T-ДНК оценивали с использованием дуплексного анализа Taqman® qPCR в соответствии с методикой Livak and Schmittgen (Methods 2001 25:402-8). В анализе амплифицировали эндогенный однокопийный ген пуроиндолина-b (Pinb) в D-геноме гексапроидной пшеницы (Gautier et al Plant Science 2000 153, 81-91):
5′ ATTTTCCATTCACTTGGCCC 3′ (SEQ ID NO: 91; прямой праймер),
5′ TGCTATCTGGCTCAGCTGC 3′ (SEQ ID NO: 92; обратный праймер),
5′ ATGGTGGAAGGGCGGTTGTGA 3′ (SEQ ID NO: 93; зонд),
и область промотора актина (Act1), присутствующую на T-ДНК:
5′ CTCCCGCGCACCGATCTG 3′ (SEQ ID NO: 94; прямой праймер),
5′ CCCGCCCCTCTCCTCTTTC 3′ (SEQ ID NO: 95; обратный праймер),
5′ AAGCCGCCTCTCGCCCACCCA 3′ (SEQ ID NO: 96; зонд).
Растения, в которых не амплифицировался продукт virC и из которых амплфицировались правильные продукты с помощью праймеров к эндогенному убиквитину и промотору актина риса, классифицировали как трансгенные. Количество встроенной T-ДНК оценивали, исходя из 2ΔΔc(T), в соответствии с Livak and Schmittgen (Methods 2001 25:402-8). В целом, приблизительно 95% всех растений T0 имели по меньшей мере одну встроенную копию T-ДНК. Таблица 32.
|
Разработка анализов зиготности с помощью ПЦР для отслеживания наследования трансгенов. Последовательности, фланкирующие участки встраивания T-ДНК, идентифицировали путем расщепления очищенной геномной ДНК восемью эндонуклеазами рестрикции с последующим лигированием двухцепочечных адапторов, специфичных к выступающим концам, создаваемым эндонуклеазами рестрикции. После лигирования адапторов проводили ПЦР с биотинилированным праймером либо к 3′-концу, либо к 5′-концу T-ДНК, кодирующей DGT-28, и праймера к каждому адаптору. Продукты ПЦР иммобилизовывали и очищали на гранулах Ampure Solid Phase Reversible Immobilization (SPRI) (Agencourt Bioscience Corporation, Beckman Coulter Company). Затем проводили гнездовую ПЦР и продукты амплификации секвенировали способом Сенгера с использованием химических реагентов BigDye® v3.1 (Applied Biosystems) на автоматизированной платформе для капиллярного электрофореза ABI3730xl®. Анализ последовательности, проведенный с использованием программного обеспечения Sequencher (GeneCodes, Ann Arbor, MI), использовали для получения (когда это было возможно) консенсусной последовательности. Полученную консенсусную последовательность и отдельные последовательности использовали в качестве последовательностей запроса в BlastN против собранных контигов последовательностей полного генома для подвергнутых проточной сортировке плеч хромосом пшеницы сорта Chinese Spring (www.wheatgenome.org) для определения хромосом, в которых происходило встраивание T-ДНК и для обеспечения конструирования праймеров с субгеномной специфичностью для разработки анализов зиготности с помощью ПЦР.
Для каждого трансгенного объекта разрабатывали два анализа ПЦР, чтобы обеспечить отслеживание наследования трансгена в последующих поколениях. Первый анализ (в дальнейшем в настоящем описании обозначаемый как внешняя-внешняя ПЦР) конструировали для амплификации сквозь участок встраивания T-ДНК. Амплификацию с субгеномной специфичностью в этом анализе обеспечивали с использованием открытой-внешней ПЦР с праймерами, сконструированными так, чтобы они располагались на предпоследнем основании (которое содержало фосфортиоатную связь) на протяжении варьированной нуклеотидной последовательности, которые различали заданный локус и дублированные (как гомологичные, так и паралогичные) копии локуса где-либо в геноме пшеницы. Второй анализ (в дальнейшем в настоящем описании обозначаемый как внутренняя-внешняя ПЦР) разрабатывали для амплификации с T-ДНК на эндогенную последовательность. В этом анализе использовали один из праймеров из анализа внешней-внешней ПЦР и сконструированный праймер к 3′- или 5′-концу T-ДНК, кодирующих DGT-28. Праймеры для ПЦР конструировали так, чтобы они имели от 18 до 27 нуклеотидов в длину и имели температуру плавления от 60 до 65°C, оптимально 63°C. Анализы как с помощью внешней-внешней, так и внутренней-внешней ПЦР проводили в объеме реакции 25 мкм с 0,2 мМ dNTP, 1x Phusion буфере для ПЦР (New England BioLabs), 1,5 мМ MgCl2, 0,5 Е ДНК-полимеразы Hotstart Phusion (New England BioLabs), 25 нг очищенной геномной ДНК и 0,4 мкМ каждого праймера. Условия циклирования в ПЦР представляли собой 98°C в течение 30 с, затем (98°C в течение 10 с, 65°C в течение 20 с, 72°C в течение 60 с) на протяжении 40 циклов. Зиготность трансгенных растений устанавливали, как показано в таблице 33.
|
|
|
Фенотипическая оценка трансгенных растений T1 в отношении устойчивости к глифосату. Для определения того, проявляют ли трансгенные объекты с экспрессирующими конструкциями для DGT-28 устойчивость к глифосату, растения T1, происходящие из индивидуальных трансгенных объектов, фенотипически оценивали в условиях изоляции в теплице. Проводили два фенотипических скрининга. В первом (предварительном) скрининге, трансгенные объекты (с достаточным количеством семян T1 для обоих фенотипических скринингов) оценивали в отношении устойчивости к глюфосинату и глифосату для подтверждения экспрессии DGT-28 и для установления рангового порядка для устойчивости к гербициду среди трансгенных объектов. Во втором (детальном) скрининге, выбранные трансгенные объекты оценивали в отношении устойчивости к глифосату при различных уровнях дозы спрея для установления уровня устойчивости к гербициду, сообщаемой трансгенными объектами и между экспрессирующими конструкциями для DGT-28.
Двенадцать семян T1 на выбранный трансгенный объект и три реплики (по 12 семян в каждом) нетрансформированных растений донорной линии пшеницы Bobwhite MPB26RH высевали в 85-мм горшки и выращивали до стадии 2 листов в условиях хорошего полива при 25°C с дополнительным освещением, обеспечивающим световой период 12 часов. Горшки располагали случайным образом для устранения средовых эффектов во время анализа данных. Подвергнутые скринингу трансгенные объекты приведены в таблице 34. На стадии 2 листов на все растения T1 и первую реплику из 12 нетрансформированных донорных растений пшеницы распыляли глюфосинат в дозе 420 г.а.и./га. Растения визуально исследовали через четверо суток и репрезентативные растения, охватывающие диапазон фенотипических ответов, использовали для разработки оценочной шкалы от 0 до 6. Таблица 35.
|
|
|
|
|
|
|
|
Затем каждое растение в испытании оценивали по оценочной шкале, причем оценивающее лицо проводило оценку "вслепую" в отношении генотипа растений для устранения предвзятости оценки. Через пять суток после оценки с глюфосинатом, на все растения T1 и первую и вторую реплики нетрансформированных донорных растений пшеницы распыляли глифосат в дозе 420 г.а.и./га. На оставшуюся третью реплику донорной линии пшеницы (всего 12 растений) распыление не проводили. Растения визуально исследовали через 7, 14 и 21 суток после распыления. Оценочную шкалу, охватывающую диапазон фенотипических ответов, разрабатывали для каждого момента времени и использовали для оценки во всем испытании. В каждый момент времени оценивающее лицо проводило оценку "вслепую" в отношении генотипа растений. Оценочная шкала через 7 суток после распыления имела диапазон от 0 до 7 (таблица 36), и от 1 до 4 через 14 и 21 сутки после распыления (таблица 37). Также для каждого растения регистрировали длину растения, количество отростков от корня и морфологические аномалии через 14 суток после распыления глифосата. Растения с замедленным прорастанием и плохим укоренением исключали из последующих анализов.
|
|
|
Анализ ответа на глюфосинат не выявил четких фенотипических различий между нетрансформированными донорными растениями пшеницы, на которые проводили распыление, и нетрансформированными донорными растениями, на которые не проводили распыления (данные не представлены). Вследствие этого, устойчивость трансгенных объектов к глюфосинату нельзя было достоверно оценить. Напротив, анализ ответа на глифосат через 21 сутки после распыления выявил четкое фенотипическое различие между нетрансформированными донорыми растениями, на которые проводили и не проводили распыления. Таблица 38. Таким образом, анализ устойчивости к глифосату среди трансгенных объектов был основан на показателях ответа, полученных через 21 сутки после распыления. Трансгенный объект считали проявляющим устойчивость к глифосату, когда 4 или более из 12 растений T1 для этого трансгенного объекта имели показатель ответа, превышающий или равный 3. Эти критерии были основаны на ожидании того, что каждый трансгенный объект может сегрегироваться 1:2:1 (гомозиготные с наличием: гемизиготные: гомозиготные с отсутствием) в отношении трансгена в поколении T1 и для обеспечения идентификации трансгенных объектов со слабой экспрессией DGT28. Трансгенные объекты ранжировали по наблюдаемой устойчивости к глифосату с использованием произвольной совокупной оценки, вычисленной для индивидуальных устойчивых растений. Совокупный показатель вычисляли из показателей ответа через 14 и 21 сутки и длину растения, количество отростков от корня и морфологические аномалии регистрировали через 14 суток после распыления.
|
В целом, 67 из 92 подвергнутых скринингу трансгенных объектов продемонстрировали доказательства устойчивости к глифосату. Таблица 39. Согласно оценке, шесть трансгенных объектов имеют ≤3 встроенных копий трансгена и два трансгенных объекта, которые согласно оценке имеют 4 или более встроенных трансгенов, отбирали для каждого из экспрессирующих векторов для DGT-28 для включения во второй (детальный) фенотипический скрининг.
|
|
|
|
|
Детальный фенотипический скрининг. Четыре реплики из 12 семян T1 на выбранный трансгенный объект и восемь реплик (по 12 семян в каждой) нетрансформированной донорной линии пшеницы Bobwhite MPB26RH высевали в 85-мм горшки и выращивали до стадии 2 листов в условиях хорошего полива при 25°C с дополнительным освещением, обеспечивающим 12-часовой световой период. Горшки располагали случайным образом для устранения средовых эффектов во время анализа данных. Подвергнутые скринингу трансгенные объекты приведены в таблице 40. На стадии 2 листов регистрировали длину растения и количество листьев для каждого растения перед распылением глифосата. На первую, вторую, третью и четвертую реплики растений T1 для каждого отобранного трансгенного объекта и нетрансформированной донорной линии пшеницы проводили распыление в дозе 420, 840, 1680 и 3360 г.а.и./га, соответственно. На пятую, шестую, седьмую и восьмую реплики нетрансформированной донорной линии пшеницы (всего 48 растений) распыление не проводили. Через 7, 14 и 21 суток после распыления растения оценивали в отношении длины растений, количества листьев и фенотипического ответа на глифосат с использованием оценочной шкалы в таблице 37. Также регистрировали какие-либо морфологические аномалии. Для оценки оценивающее лицо проводило оценку "вслепую" в отношении генотипа растения и распыляемой дозы для предотвращения предвзятости оценки. Растения с замедленным прорастанием и плохим укоренением (критерии: длина растения <6 см) при оценке перед распылением были исключены из последующих анализов.
|
|
|
Анализ ответа на глифосат через 7, 14 и 21 суток после распыления выявил четкое фенотипическое различие между подвергнутыми распылению и не подвергнутыми распылению трансформированными донорными растениями пшеницы. Это отличие было максимальным через 21 сутки и его наблюдали для всех доз глифосата. Таблица 41. Для оценки устойчивости трансгенных объектов к глифосату при каждой дозе, нулевые растения T1 (т.е. растения, не содержащие трансгена) исключали из последующих анализов. Растения T1 с показателем ответа, составляющим менее трех, через 21 сутки после распыления, считали имеющими нулевой генотип. Дисперсионный анализ (ANOVA) на основе устойчивых фенотипов выявил значимый эффект для экспрессирующей конструкции DGT-28, трансгенного объекта и распыляемой дозы глифосата. Таблица 42. Однако критерии множественного сравнения не выявили убедительной биологической интерпретации источника этих отличий вследствие ограниченного диапазона показателей ответа (т.е. с 1 по 4; таблица 40), использованных для регистрации фенотипа индивидуальных растений. Как правило, восемь независимых трансгенных объектов, исследованных для каждой экспрессирующей конструкции DGT-28, продемонстрировали сходную устойчивость к глифосату при каждой распыляемой дозе, что указывает на то, что все четыре трансгена DGT-28 обеспечивали доминантный фенотип и что одной копии было достаточно для сообщения устойчивости к глифосату. Каждая из экспрессирующих конструкций DGT-28 выявила эффективную устойчивость по меньшей мере к 3360 г.а.и./га глифосата.
|
|
Молекулярное подтверждение присутствия T-ДНК в устойчивых к глифосату растениях T1. Анализы зиготности с использованием ПЦР, разработанные в примере 2, использовали для подтверждения наличия T-ДНК, кодирующей DGT-28, в устойчивых к глифосату растениях T1, сохраненных для продукции семян T2 (см. пример 6). В целом исследования зиготности способом ПЦР проводили для 104 растений T1, для 89% из которых было подтверждено, что они содержат по меньшей мере одну копию трансгена. Таблица 43. Эти результаты подтвердили, что наблюдаемая устойчивость к глифосату сообщалась присутствием T-ДНК, кодирующей DGT-28.
|
|
Получение семян T2 для устойчивых к глифосату трансгенных объектов. Приблизительно восемь устойчивых к глифосату растений T1 сохраняли после фенотипического скрининга для 32 трансгенных объектов, которые были отобраны для включения в детальный фенотипический скрининг (таблица 40). Растения переносили в горшки размером 200 мм и выращивали в условиях хорошего полива при 25°C с дополнительным освещением, обеспечивающим световой период 12 часов. Колоски каждого растения по отдельности помещали в мешок перед цветением для предотвращения ауткроссинга.
Хотя аспекты настоящего изобретения были описаны в определенных вариантах осуществления, их можно далее модифицировать в пределах сущности и объема настоящего изобретения. Таким образом, подразумевается, что настоящая заявка охватывает любые изменения, применения или доработку вариантов осуществления изобретения с использованием его общих принципов. Кроме того, подразумевается, что настоящая заявка охватывает такие отклонения от настоящего изобретения, которые соответствуют известной или обычной практике в области, к которой эти варианты осуществления относятся, и которые входят в пределы прилагаемой формулы изобретения.