Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pET40CmAP/OmpF, кодирующая гибридный бифункциональный полипептид CmAP/OmpF со свойствами высокоактивной щелочной фосфатазы CmAP и порообразующего мембранного белка OmpF, и рекомбинантный штамм E. coli Rosetta (DE3)/pET40CmAP/OmpF - продуцент гибридного бифункционального полипептида CmAP/OmpF
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по оптимизированной технологии новый гибридный бифункциональный полипептид CmAP/OmpF со свойствами высокоактивной щелочной фосфатазы морской бактерии Cobetia marina и высокоспецифичного к антителам больных псевдотуберкулезом порина Yersinia pseudotuberculosis, который может быть использован для улучшения диагностической тест-системы псевдотуберкулеза.
Псевдотуберкулез, или экстраинтестинальный иерсиниоз, относится к числу широко распространенных инфекций, что, в первую очередь, обусловлено высокой адаптационной способностью такого возбудителя, как Y. pseudotuberculosis [Г.П. Сомов, Н.Н. Беседнова, Ф.Ф. Антоненко. Псевдотуберкулез. М.: Медицина, 2001, 256 с.]. Порины, или интегральные порообразующие белки наружной мембраны бактерий, как поверхностные антигены представляют собой молекулы-мишени для системы врожденного иммунитета макроорганизма, которые активируют факторы немедленной защиты и участвуют в формировании специфического иммунного ответа, направленного на освобождение от патогена. Особенности структуры и поверхностная локализация в клетке обуславливают участие поринов в осуществлении динамической связи между бактериями и окружающей средой.
Из бактерии Y. pseudotuberculosis (штамм 512, серовар IB) был выделен белок - порин, названный иерсинином, относящийся к термозависимым порообразующим белкам наружной мембраны грамотрицательных бактерий, ассоциированным с пептидогликаном [О.Д. Новикова, Г.М. Фролова и др. Конформационная стабильность и иммунохимические свойства иерсинина - основного белка внешней мембраны псевдотуберкулезного микроба // Биоорган. химия. 1989. Т. 15. С. 763-772]. При иммунизации экспериментальных животных этим белком была получена специфическая антисыворотка с высоким титром. В ряду поверхностных белков иерсинин принадлежит к числу иммунодоминантных антигенов наружной мембраны псевдотуберкулезного микроба. Показано, что при иммунизации как крупных, так и мелких лабораторных животных в сыворотке крови обнаруживаются антитела к иерсинину. При естественном развитии заболевания у людей антитела к порину преобладают. Иерсинин реагирует не только с антисыворотками к бактериям всех 6-ти сероваров Y. pseudotuberculosis, но и с антисыворотками к бактериям других видов иерсиний.
На основе этих результатов разработан иммуноферментный метод (ИФА) для диагностики псевдотуберкулеза с использованием иерсинина в качестве диагностического антигена [О.Ю. Портнягина, О.Д. Новикова и др. Бактериальные порины как перспективные антигены для диагностики и вакцинопрофилактики инфекционных заболеваний // Вестник ДВО РАН, 2004. №3, с. 35-44; RU 2339952 С1, 27.11.2008]. Данная диагностическая тест-система отличается от коммерческого диагностикума на основе типоспецифических липополисахаридов тем, что в сыворотках больных обнаруживаются антитела ко всем вариантам возбудителя псевдотуберкулеза. Высокая чувствительность тест-системы позволяет выявлять развитие инфекционного процесса на ранних стадиях (7-10 дней от начала проявления клинических признаков).
Известно, что ИФА диагностика на основе типоспецифических антигенов требует долговременной подготовки и многочисленных затрат на коммерческие антитела. Такого рода проблемы можно решить при помощи заявляемой конструкции бифункционального белка CmAP/OmpF, обладающего свойствами высокоактивной щелочной фосфатазы морской бактерии CmAP и OmpF порина Y. pseudotuberculosis, высокочувствительного по отношению к антителам к возбудителю псевдотуберкулеза.
Методами молекулярного клонирования установлены структуры порина OmpF [GenBank, код доступа AY855840] и щелочной фосфатазы морской бактерии Cobetia marina ВКМ В-2021 Д (CmAP) [GenBank, код доступа ABD92772]. Описаны методы получения высокоактивной рекомбинантной щелочной фосфатазы морской бактерии CmAP [RU 2447151 С1, 10.04.2012] и рекомбинантного порина OmpF в виде телец включения в клетках Е. coli с последующим его рефолдингом и очисткой [Хоменко В.А., Портнягина О.Ю., Новикова О.Д. и др. Выделение и характеристика рекомбинантного OmpF-подобного порина из наружной мембраны Yersinia pseudotuberculosis // Биоорган. химия. 2008. №2. С. 1-8].
Задача изобретения - конструирование рекомбинантного штамма-продуцента Е. coli, несущего такую экспрессирующую конструкцию (плазмиду), которая позволит получать в препаративных количествах целевой продукт - высокоочищенный недеградированный гибридный бифункциональный полипептид CmAP/OmpF в водорастворимой форме с сохранением как антигенной активности OmpF порина Y. pseudotuberculosis, так и ферментативных свойств высокоактивной щелочной фосфатазы морской бактерии CmAP, используемой для цветной визуализации поринсвязанных комплексов в иммуноферментном методе диагностики иерсиниоза на разных стадиях развития инфекционного процесса.
Поставленная задача решена путем конструирования рекомбинантной плазмидной ДНК pET40CmAP/OmpF, кодирующей химерный полипептид CmAP/OmpF, и рекомбинантного штамма Е. coli Rosetta (DE3)/pET40CmAP/OmpF, обеспечивающих индуцируемый синтез с высоким и стабильным выходом активного растворимого бифункционального белка CmAP/OmpF, обладающего свойствами высокоактивной щелочной фосфатазы морской бактерии CmAP и высокочувствительного OmpF порина Y. pseudotuberculosis.
Технический результат заявленного изобретения - получение растворимого активного гибридного бифункционального полипептида CmAP/OmpF со свойствами высокоактивной щелочной фосфатазы CmAP и высокочувствительного OmpF порина Y. pseudotuberculosis с высокими выходом и уровнем очистки.
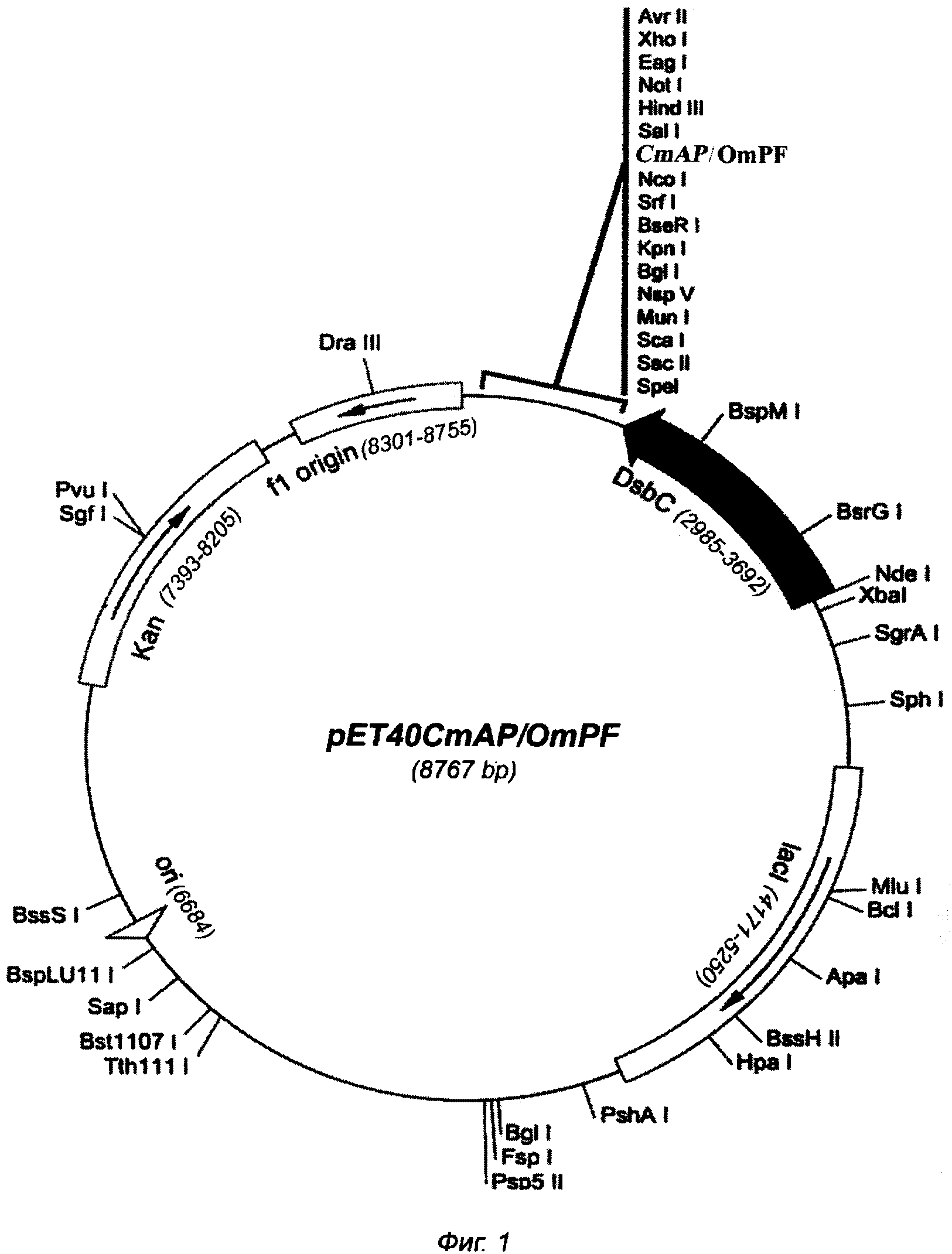
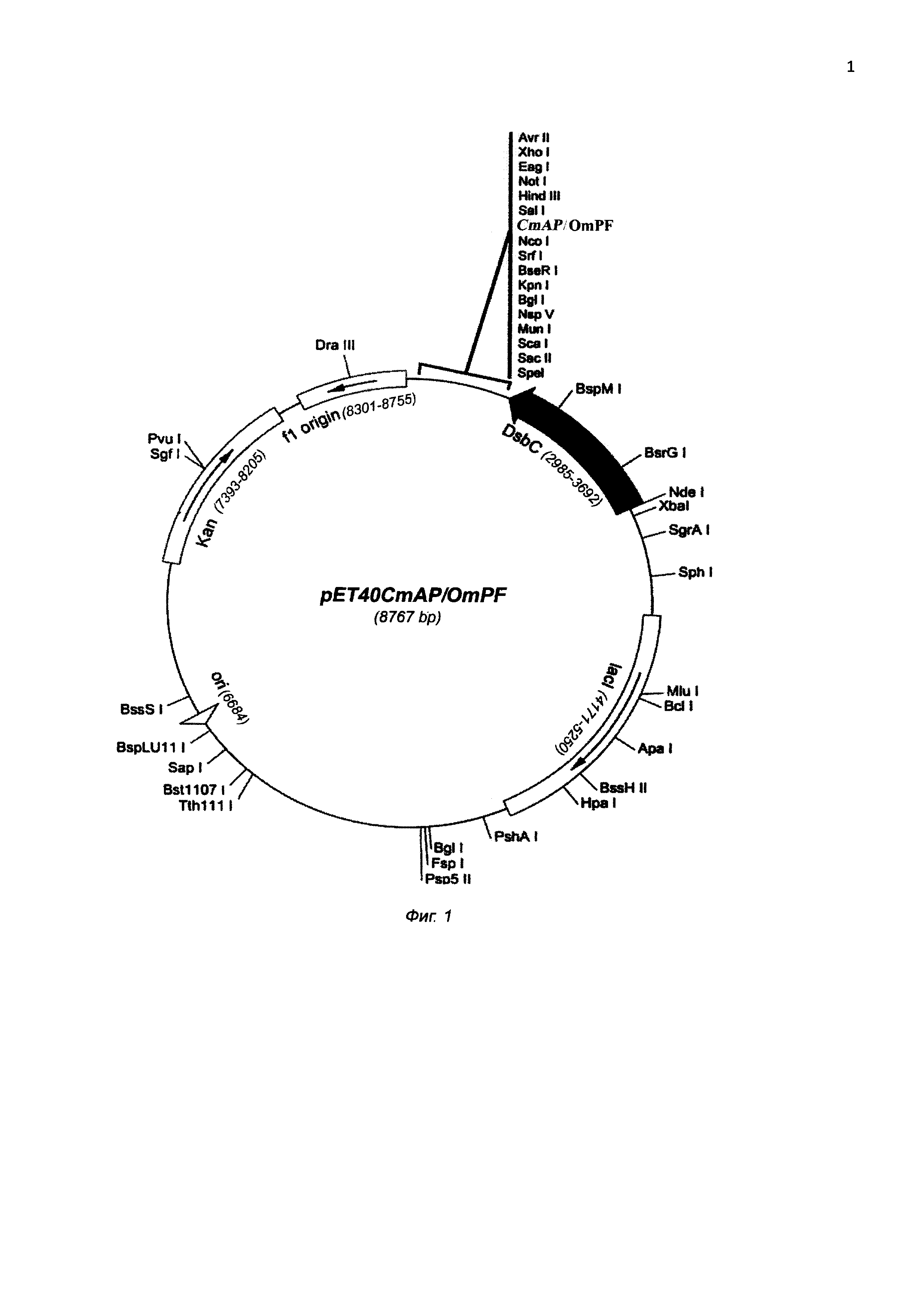
Плазмида pET40CmAP/OmpF имеет 8767 пар оснований (п.о.) и характеризуется наличием NcoI/SalI-фрагмента плазмиды pET-40b(+) (Novagen), или последовательности фрагмента ДНК размером 2577 п.о., содержащего химерный ген, начинающий трансляцию со щелочной фосфатазы CmAP (N-конец) и заканчивающийся порином OmpF с С-концевой части молекулы рекомбинантного белка, соединенным со щелочной фосфатазой гибким линкером (G4S)3.
На фиг. 1 представлена физическая карта плазмиды pET40CmAP/OmpF и область плазмиды, ответственная за экспрессию гибридного белка CmAP/OmpF. Нуклеотидная последовательность фрагмента плазмиды pET40CmAP/OmpF, фланкированная сайтами NcoI и SalI, содержит последовательность структурного гена CmAP, соответствующую открытой рамке считывания для зрелого белка CmAP, последовательность соединяющего линкера (G4S)3 и последовательность структурного гена OmpF, соответствующую открытой рамке считывания для белка OmpF (SEQ ID NО: 1).
Рекомбинантный штамм Е. coli Rosetta (DE3)/pET40CmAP/OmpF получен трансформацией клеток Е. coli Rosetta (DE3) (Novagen) плазмидой pET40CmAP/OmpF с использованием традиционной генно-инженерной технологии [Sambrook J., Fritsch E.F., Maniatis Т. Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989].
Рекомбинантный штамм Е. coli Rosetta (DE3)/pET40CmAP/OmpF характеризуется следующими признаками.
Культурально-морфологические признаки
Клетки штамма образуют крупные круглые с ровными краями, выпуклые колонии до 5 мм в диаметре, поверхность колоний гладкая, консистенция слизистая. Пигмент не накапливается. Грамотрицательные, спор не образуют, капсулы не имеют. Колонии хорошо растут на простых питательных средах (LB). При росте в жидких средах образуют интенсивную ровную муть.
Физико-биологические признаки
Рекомбинантный штамм Е. coli Rosetta (DE3)/pET40CmAP/OmpF видотипичен по своим биохимическим свойствам. Штамм не обладает желатиназной активностью, не ферментирует лизин; расщепляет глюкозу, лактозу, маннит, сахарозу до кислоты и газа. Имеет мутацию в гене lac, обеспечивающую контроль уровня экспрессии, а также трансляцию редких кодонов. Оптимальной для роста является температура 37°С, а для продукции белка CmAP/OmpF -16°С.
Устойчивость к антибиотикам
Клетки штамма характеризуются устойчивостью к хлорамфениколу (34 мкг/мл) и канамицину (25 мкг/мл).
Патогенность и токсичность
Рекомбинантный штамм Е. coli Rosetta (DE3)/pET400CmAP/OmpF не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -20°С.
Способ получения гибридного бифункционального белка CmAP/OmpF заключается в следующем: клетки штамма Е. coli Rosetta (DE3)/pET40CmAP/OmpF культивируют в жидкой питательной среде LB в течение 18 ч при 16°С, затем бактериальные клетки осаждают центрифугированием, суспензию клеток дезинтегрируют в буфере, далее экстракт центрифугируют, затем надосадочную жидкость помещают на колонку с Ni-сефарозой (GE Healthcare), далее элюируют белок с 0,5 М имидазолом, затем белковый элюат помещают на колонку с ионообменной смолой для удаления имидазола и получения активной фракции целевого белка. Выход рекомбинантного гибридного бифункционального белка CmAP/OmpF составляет не менее 10 мг рекомбинантного белка из 1 л культуры с удельной активностью щелочной фосфатазы не менее 1000 ед/мг белка и свойствами OmpF порина Y. pseudotuberculosis, характерными для природного аналога.
Рекомбинантный гибридный бифункциональный белок CmAP/OmpF имеет молекулярную массу 127,5 кДа, включая плазмидный шаперон DsbC с молекулярной массой 32,5 кДа, широкий диапазон значений температуры (25-37°С) и pH 7,5-9,5 для проявления фосфатазной активности и антигенных свойств порина OmpF. Плазмидный шаперон Dsb не дает существенного вклада в функциональную способность обеих частей химеры CmAP/OmpF, поэтому этап его удаления из рекомбинантного белка с помощью энтерокиназы по предусмотренному генетической конструкцией сайту рестрикции не обязателен.
Рекомбинантный гибридный бифункциональный полипептид CmAP/OmpF успешно апробирован в ИФА тест-системах при связывании с антителами к поринам иерсиний в мышиных антисыворотках к рекомбинантному порину OmpF, а также в сыворотках крови больных иерсиниозом независимо от серологического варианта возбудителя Y. pseudotuberculosis. Использование ИФА тест-системы на основе бифункционального порина CmAP/OmpF позволит обеспечить высокий уровень дифференциальной диагностики иерсиниозов от других острых кишечных инфекций со сходными клиническими признаками как на ранних (первая неделя), так и поздних стадиях (вторая - четвертая неделя) развития инфекционного процесса.
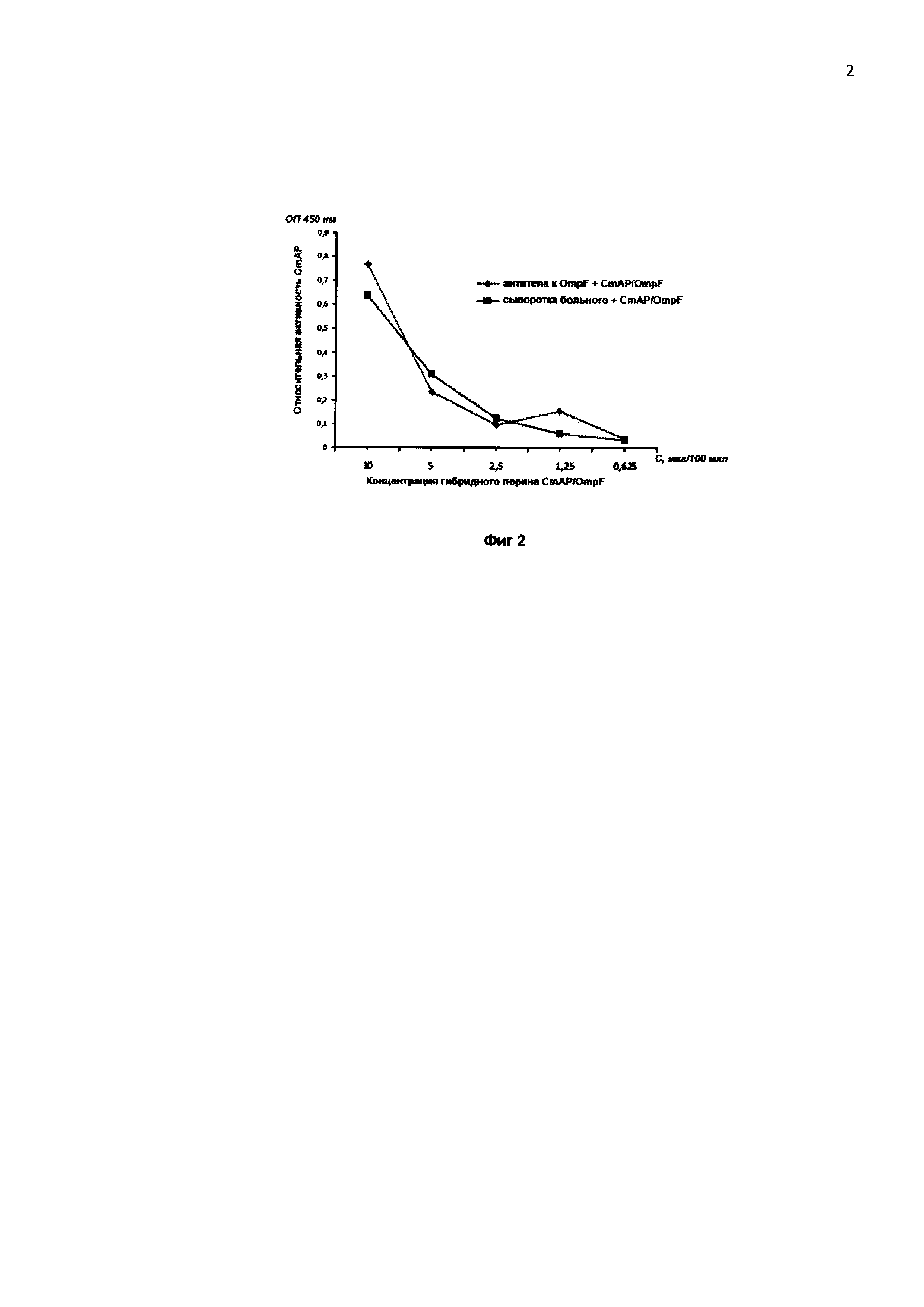
На фиг. 2 представлены результаты ИФА, проведенного на микропланшете (Costar), сенсибилизированном антителами из мышиной антисыворотки к рекомбинантному порину OmpF и антителами из сывороток крови больных иерсиниозом с применением гибридного бифункционального полипептида CmAP/OmpF, полученного от рекомбинантного штамма Е. coli Rosetta (DE3)/pET40 CmAP/OmpF. Уровень аффинности рекомбинантного гибридного бифункционального полипептида CmAP/OmpF к специфическим антителам определяли по концентрации поринсвязанных комплексов, измеренной в единицах активности щелочной фосфатазы CmAP.
Использование порина в составе гибридного бифункционального полипептида CmAP/OmpF с активностью щелочной фосфатазы позволяет сократить ИФА на две стадии по сравнению с процедурой, которая требовалась раньше (иммобилизация белка и использование вторых антител).
Существенными преимуществами вышеописанного способа получения гибридного бифункционального полипептида CmAP/OmpF являются:
- использование рекомбинантного штамма-продуцента Е. coli Rosetta (DE3)/pET40CmAP/OmpF, что позволяет получать при биосинтезе большое количество высокоактивного бифункционального гибридного белка CmAP/OmpF;
- использование несложной двухстадийной хроматографической очистки рекомбинантного белка, что позволяет получить чистый гибридный полипептид CmAP/OmpF за короткое время и с большим выходом.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pET40CmAP/OmpF
Рекомбинантную плазмиду pET40CmAP/OmpF, содержащую химерный ген, кодирующий полноразмерную щелочную фосфатазу CmAP и полноразмерный порин Y. pseudotuberculosis OmpF, соединяющиеся через гибкий линкер (G4S)3, фланкированный сайтами рестрикции NcoI и SalI, конструируют на основе коммерческой плазмиды рЕТ-40b(+) (Novagen).
Фрагмент ДНК, содержащий химерный ген гибридного полипептида CmAP/OmpF, получают в два этапа. На первом этапе проводят полимеразную цепную реакцию с использованием плазмиды 40Pho в качестве матрицы для получения гена щелочной фосфатазы CmAP и праймеров X-PhoN_F и Pho40X-SacI-R, где X-PhoN_F - праймер, специфичный по отношению к N-концевой последовательности CmAP, включающий сайт для рестриктазы NcoI; Pho40X-SacI-R - обратный праймер, специфичный по отношению к С-концевой последовательности CmAP, включающий полинуклеотид, кодирующий линкер (G4S)3 и сайт рестрикции SacI:
X-PhoN_F: 5'-TATTCCATGGCAGAGATCAAGAATGTCATTCTGAT-3'
Pho40X-SacI-R: 5'-TTAAGAGCTCAGAACCACCACCACCAGAACCACCACCACCA
GAACCACCACCACCCTTCGCTACCACTGTCTTCAGATACTGTCCT-3'.
Данную реакцию проводят в следующих условиях: 10× Encycio буфер, 50× смесь полимераз Encyclo («Encyclo PCR kit», Евроген, Москва), 50× смесь dNTP (10 mM каждого), смесь праймеров (5 μM каждого), 20 нг ДНК. Процесс амплификации состоит из следующих стадий: 30 циклов ПЦР (15 с - 95°С, 1 мин 30 с - 72°С) и инкубация 10 мин при 72°С. После амплификации ПЦР-продукт очищают электрофоретически в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами NcoI и SacI в оптимальном буфере (Fermentas) в течение 3 ч, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1) [Sambrook J. et. al. Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989]. В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, pH 5,2 и 1/2 объема изопропилового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 14000 об/мин в течение 20 мин, осадок промывают 75% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл деионизованной воды.
2 мкг плазмидной ДНК рЕТ-40b(+) обрабатывают рестриктазами NcoI и SacI в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент гена CmAP и векторную часть плазмиды рЕТ-40b(+) сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток Е. coli Rosetta (DE3). Трансформанты высевают на LB-агар, содержащий 25 мкг/мл канамицина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают плазмидную ДНК pET40CmAP, содержащую последовательность CmAP с линкером (G4S)3 на С-концевой части.
На втором этапе проводят амплификацию гена OmpF белка с использованием геномной ДНК грамотрицательной бактерии Y. pseudotuberculosis и пары праймеров, несущих сайты рестриктаз SacI и SalI:
OmpF40-Sac-dir: 5'-TTAAGAGCTCCGAAATCTATAACAAAGATGGCAACA-3'
OmpF40-Sal-rev: 5'-TTAAGTCGACTTAGAACTGATAAACCAAGCCAAC-3'
Для создания конструкции pET40CmAP/OmpF полученный ген порина OmpF и 2 мкг плазмидной ДНК pET40CmAP обрабатывают рестриктазами SacI и SalI в соответствии с методикой, описанной выше, и очищают в 1% геле легкоплавкой агарозы. Очищенные ПЦР-фрагменты OmpF и векторную часть плазмиды pET40CmAP сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции к лигазе (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток Е. coli Rosetta (DE3). Трансформанты высевают на LB-агар, содержащий 25 мкг/мл канамицина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают ДНК, содержащую необходимые последовательности генов CmAP и OmpF, представляющую собой плазмиду pET40CmAP/OmpF размером 8767 п.о. (фиг. 1).
Пример 2. Получение рекомбинантного штамма Е. coli Rosetta (DE3)/pET40CmAP/OmpF - продуцента гибридного бифункционального полипептида CmAP/OmpF
Рекомбинантный штамм-продуцент Е. coli Rosetta (DE3)/pET40CmAP/OmpF получают путем трансформации клеток штамма Е. coli Rosetta (DE3) рекомбинантной плазмидой pET40CmAP/OmpF. Ночную культуру (0,5 мл LB) рекомбинантного штамма-продуцента гибридного бифункционального полипептида CmAP/OmpF помещают в пятилитровую колбу с жидкой средой MX, содержащей на литр 10 г бактотриптона, 7,5 г бактодрожжевого экстракта, 70 г сорбитола, до 10 мМ MgCl2, 4 мл глицерина, 12 г KH2PO4, 25 мг/мл канамицина, pH 7,7, культивируют на шейкере при 200 об/мин при температуре 37°С в течение 3-4 ч до оптической плотности 0,6-0,8 (OD 600 нм), затем проводят процедуру «heat shock» нагреванием при 42°С в течение 30 мин, после чего охлаждают и добавляют индуктор экспрессии IPTG до конечной концентрации 0,2 мМ, далее инкубируют при 16°С в течение 18 ч.
Для определения продуктивности штамма водные клеточные экстракты анализируют электрофорезом в 12,5% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в растворимой клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика гибридного бифункционального полипептида CmAP/OmpF
Рекомбинантный штамм-продуцент гибридного бифункционального полипептида CmAP/OmpF - Е. coli Rosetta (DE3)/pET40CmAP/OmpF инкубируют в пятилитровой колбе в жидкой среде MX, содержащей на литр 10 г бактотриптона, 7,5 г бактодрожжевого экстракта, 70 г сорбитола, до 10 мМ MgCl2, 4 мл глицирина, 12 г KH2PO4, 25 мг/мл канамицина, pH 7,7, на шейкере при 200 об/мин 18 ч при 16°С. Бактериальные клетки осаждают на проточной центрифуге при 5000 об/мин в течение 10 мин. Суспензию клеток дезинтегрируют ультразвуком в 20 мл буфера А (0,05 М трис-HCl, pH 8,5, 0.01% NaN3) 5 раз в течение 30 с, охлаждая во льду. Затем суспензию центрифугируют при 10000 об/мин в течение 30 мин. Надосадочную жидкость собирают и помещают на колонку с Ni-сефарозой (GE Healthcare). Элюцию белка проводят 0,5 М имидазолом в буфере А. Фракцию с элюированным белком помещают на колонку с ионообменной смолой MonoQ (GE Healthcare), предварительно уравновешенную буфером А. Элюцию белка проводят буфером В (25 мМ Tris-HCl, pH 8,5), градиенте соли NaCl (0-0,5 М), фракции с активностью щелочной фосфатазы собирают.
Выход рекомбинантного белка составляет 10 мг из 1 л культуры.
Идентификацию полученного рекомбинантного полипептида проводят по первым 10 аминокислотам на автоматическом секвенаторе. Секвенирование препарата рекомбинантного белка, выделенного из клеток штамма Е. coli Rosetta (DE3)/pET40CmAP/OmpF, показало, что N-концевой составляющей химерного белка CmAP/OmpF является аминокислотная последовательность Ala-Glu-Ile-Lys-Asn-Val-Ile-Leu-Met-Ile, соответствующая первым 10 аминокислотам щелочной фосфатазы CmAP.
Ферментативную активность гибридного полипептида CmAP/OmpF определяют по расщеплению пара-нитрофенилфосфата (п-НФФ). Стандартная инкубационная смесь в объеме 500 мкл содержит 15 мМ п-НФФ, 1 М диэтаноламина (ДЭА), pH 10,3; либо 2 мМ п-НФФ, 0,1 М трис-HCl, 0,2 М KCl, pH 9,5-10,0 и фермент. После 30 мин инкубации при 37°С реакцию останавливают добавлением 2 мл 0,5 М NaOH. Количество образовавшегося в процессе ферментативной реакции п-нитрофенола (п-НФ) определяют спектрофотометрически при длине волны 400 нм. За единицу активности щелочной фосфатазы принимают количество фермента, катализирующего освобождение 1 мкМ п-НФ (ε400 нм = 18600) в течение 1 мин инкубации. Удельную активность выражают в единицах активности фермента на 1 мг белка. Концентрацию белка в растворе определяют по методу Брэдфорда.
Антигенную активность пориновой части гибридного полипептида CmAP/OmpF определяют методом ИФА по уровню аффинности к специфическим антителам к порину OmpF (фиг. 2). В лунки микропланшета, сенсибилизированного мышиной поликлональной специфической сывороткой к рекомбинантному порину OmpF и сыворотками крови больных иерсиниозом, добавляют раствор гибридного бифункционального полипептида CmAP/OmpF, полученного от рекомбинантного штамма Е. coli Rosetta (DE3)/pET40 CmAP/OmpF, в концентрациях от 1 до 100 мкг/мл. Уровень аффинности рекомбинантного гибридного бифункционального полипептида CmAP/OmpF к специфическим антителам определяют по концентрации CmAP/OmpF-связанных комплексов, измеренной в единицах активности щелочной фосфатазы CmAP.
Полученные данные по характеристике и функциональной активности продукта экспрессии искусственного химерного гена гибридного бифункционального полипептида CmAP/OmpF в клетках рекомбинантного штамма Е. coli Rosetta (DE3)/pET40CmAP/OmpF свидетельствуют о соответствии антигенной активности исследуемого полипептида таковой его природного аналога - порина OmpF, применяемого в ИФА диагностике псевдотуберкулеза, или экстраинтестинального иерсиниоза.
Как следует из приведенных примеров, авторы получают активный рекомбинантный гибридный бифункциональный полипептид CmAP/OmpF со свойствами высокоактивной щелочной фосфатазы морской бактерии CmAP и высокоспецифичного порина грамотрицательной бактерии Y. pseudotuberculosis с высоким выходом при относительно простой и надежной технологии.
Заявленное изобретение позволяет:
- с помощью использования рекомбинантного штамма-продуцента Е. coli Rosetta (DE3)/pET40CmAP/OmpF получать путем биосинтеза большое количество растворимого активного гибридного бифункционального полипептида CmAP/OmpF;
- использование металлоаффинной и ионообменной хроматографий при очистке рекомбинантного белка из водного экстракта клеток рекомбинантного штамма-продуцента позволяет получать гибридный бифункциональный полипептид CmAP/OmpF с чистотой не менее 98% в качестве аналога природного иммуногенного порина Y. pseudotuberculosis OmpF, связывающийся со специфическими к порину антителами, конъюгированный ферментной меткой, применяемого для проведения ИФА при диагностике псевдотуберкулеза, или экстраинтестиального иерсиниоза.