Результат интеллектуальной деятельности: СУХИЕ ПОРОШКОВЫЕ КОМПОЗИЦИИ В ВИДЕ ЧАСТИЦ, КОТОРЫЕ СОДЕРЖАТ ДВА ИЛИ БОЛЕЕ АКТИВНЫХ ИНГРЕДИЕНТА, ДЛЯ ЛЕЧЕНИЯ ОБСТРУКТИВНЫХ ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
[1] Настоящее изобретение относится к органическим соединениям и их применению в качестве фармацевтических препаратов, более конкретно к сухим порошковым композициям, которые содержат высушенные распылением частицы, которые содержат комбинации фиксированных доз двух или более активных ингредиентов, которые пригодны для лечения обструктивных или воспалительных заболеваний дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких (COPD).
Уровень техники настоящего изобретения
[2] Активные фармацевтические ингредиенты (API), пригодные для лечения респираторных заболеваний, обычно составляют для введения посредством ингаляции с помощью портативных ингаляторов. Двумя наиболее популярными видами портативных ингаляторов являются дозирующие ингаляторы под давлением (pMDI) и ингаляторы сухого порошка (DPI).
[3] Значительное большинство ингаляторов сухого порошка зависят от дыхательного усилия пациента, прилагаемого для флюидизирования и диспергирования частиц препарата. Обычно принято считать, что для того, чтобы препарат эффективно осаждался в легких, аэродинамический диаметр частиц должен лежать между 1 мкм и 5 мкм. В результате, API, как правило, микронизируют для получения тонкодисперсных частиц с масс-медианным диаметром (определяемым посредством лазерной дифракции) в данном диапазоне размеров. К сожалению, тонкодисперсные микронизированные частицы препарата обычно проявляют низкие качества в отношении текучести порошка, флюидизации и диспергирования. Текучесть порошка или "сыпучесть порошка" представляет собой способность порошка течь. Она важна с точки зрения дозирования частиц препарата на единичные дозы, как из резервуара, так и в заранее упакованные контейнеры для единичных доз (например, капсулы или блистеры). Флюидизация порошка, которая представляет собой включение порошка в воздушный поток во время дыхания пациента, воздействует на доставляемую из ингалятора дозу. Наконец, диспергирование порошка представляет собой разрушение агломератов порошка до исходных частиц препарата. Плохое диспергирование порошка отрицательно воздействует на распределение по аэродинамическому размеру частиц, и, в конечном счете, на доставку API в легкие.
[4] В предлагаемых в настоящее время на рынке продуктах реализовано два подхода к улучшению текучести, флюидизации и диспергирования тонкодисперсных частиц препарата.
[5] Первый подход использует контролируемую агрегацию неразбавленного препарата для образования легко слипающихся гранул. Агрегаты формируются в ротационных смесителях с результирующим распределением с большим размером частиц, что обеспечивает требуемые текучие свойства, нужные для точного дозирования и улучшенной флюидизации порошка. В устройстве TURBUHALER™ (Astra-Zeneca) диспергирование агрегатов происходит посредством турбулентного смешивания. Энергии диспергирования при оптимальных скоростях вдоха достаточно для преодоления сил сцепления между частицами, удерживающими микронизированные частицы вместе. Поскольку диспергирование порошка существенно зависит от энергии, необходимой для разрушения агрегатов, качество аэрозоля гранулированных композиций обычно проявляет сильную зависимость от скорости вдоха пациента. В одном исследовании общее отложение в легких для гранулированного будесонида составило 28%, когда пациентов просили дышать через устройство TURBUHALER™ быстро, и 15%, когда их просили дышать через устройство TURBUHALER™ слабее (смотри Borgstrom L, Bondesson E, Moren F et al: Lung deposition of budesonide inhaled via TURBUHALER: a comparison with terbutaline sulphate in normal subjects, European Respiratory Journal, 1994, 7, 69-73).
[6] Второй подход использует бинарную упорядоченную смесь, содержащую тонкодисперсные частицы препарата, смешенные с крупными частицами носителя. Чаще всего в качестве носителя используют моногидрат α-лактозы, и он, как правило, имеет размер частиц между 30 и 90 мкм. В большинстве сухих порошковых композиций частицы препарата представлены в низких концентрациях, причем типичным является отношение препарата к носителю, равное 1:67,5 (вес/вес). Микронные кристаллы проявляют силы притяжения, в первую очередь обусловленные ван-дер-ваальсовыми, электростатическими и капиллярными силами, на которые влияют размер, форма и химические свойства (например, поверхностная энергия) кристалла. К сожалению, силы сцепления между кристаллами препарата и носителем труднопредсказуемы и могут различаться для разных препаратов в комбинации фиксированных доз. Во время ингаляции частицы препарата диспергируются с поверхности частиц носителя энергией потока вдыхаемого воздуха. Большие частицы носителя воздействуют в первую очередь на ротоглотку (т.е. область глотки, расположенную в задней части рта), тогда как маленькие частицы препарата проникают в легкие.
[7] Основным требованием к однородности смешивания в упорядоченной смеси является достаточное взаимодействие частиц препарата и носителя для предотвращения разделения. К сожалению, это может уменьшить легочное отложение препарата вследствие плохого диспергирования препарата из носителя. Среднее отложение в легких для препаратов в упорядоченных смесях составляет, как правило, 10-30% от измеренной дозы. Недостаточное направленное воздействие на легкие, наблюдаемое в упорядоченных смесях, приводит к большому отложению в ротоглотке, к возможности локальных побочных действий и к повышенной вариабельности. Наблюдаемая высокая вариабельность доставки в легкие является результатом вариабельности в инерционной импакции в ротоглотке, что является следствием свойств порошка и анатомических различий между субъектами. Средняя вариабельность в легочной дозе для микронизированных композиций смесей частиц препарата составляет, как правило, между приблизительно 30% и 50% (смотри Olsson B, Borgstrom L: Oropharyngeal deposition of drug aerosols from inhalation products. Respiratory Drug Delivery, 2006, страницы 175-182). Она еще ухудшается, когда доставка аэрозоля зависит от максимальной скорости вдоха пациента.
[8] Вышеупомянутые проблемы становятся особенно существенными при составлении фармацевтических продуктов, содержащих два или более активных ингредиента в комбинации фиксированных доз.
[9] Это проиллюстрировано в опубликованном недавно исследовании Taki et al, Respiratory Drug Delivery 2006, страницы 655-657. В данном исследовании измеряли распределения по аэродинамическому размеру частиц двух активных ингредиентов SERETIDE™, а именно салметерола ксинафоата (SX) и флутиказона пропионата (FP), как функции скорости потока в каскадном импакторе ANDERSEN™ (ACI). Две исследованные композиции SERETIDE™, S100 и S500, соответствуют разным количествам ингаляционного кортикостероида (ICS) флутиказона пропионата, т.е. 100 мкг и 500 мкг. Дозу длительно действующего β2-агониста (LABA) салметерола ксинафоата поддерживали постоянной и равной 72,5 мкг. Распределение по аэродинамическому размеру частиц (aPSD) значительно различалось для двух активных ингредиентов в смешанной композиции (смотри таблицу 1). Кроме того, aPSD оказалось существенно различным для двух композиций. Масс-медианные аэродинамические диаметры (MMAD) лежали в диапазоне от 1,8 мкм до 3,6 мкм, геометрические стандартные отклонения от 1,7 до 3,9. Отношение двух активных ингредиентов во фракции тонкодисперсных частиц (FPF<3мкм и FPF<5мкм) также значительно различалось при двух исследованных скоростях потока. Следовательно, свойства адгезии между препаратами и носителем значительно различались для каждого активного ингредиента, а также между композициями. Номинальное отношение SX/FP (вес/вес) в S100 составляло 0,725, и 0,145 в S500. Отношение SX/FP в доле тонкодисперсных частиц, обычно обогащенной компонентом FP, значительно отличается от номинального отношения. Отношение SX/FP изменяется от +3,5% до -28% от номинальных отношений доз при изменении скорости потока и соотношения компонентов смеси. Наблюдаемые отличия, вероятно, являются результатом отличий в распределении по размеру частиц API и отличий в отношениях доз, которые могут проистекать от недостаточного смешивания. Кроме того, один API может иметь более низкое сродство к носителю, и может выделяться в композиции на любой стадии производственного процесса. Поглощение влаги также может отличаться для двух API, что ведет к отличиям в слипании при хранении. Все приведенные факторы совокупно существенно увеличивают сложность процесса разработки и общую вариабельность в доставке препарата.
|
[10] Для преодоления проблемы составления множества активных ингредиентов в одной смеси известны устройства (например, устройство GEMINI из WO 05/14089), которые включают в себя два отдельных блистера, каждый из которых содержит индивидуальную смесь препаратов, которые затем задействуют одновременно. Хотя такие варианты устройств для комбинированной терапии могут минимизировать возможные взаимодействия между активными ингредиентами и компонентами устройства, они никак не помогают решению других свойственных лактозным смесям проблем направленного воздействия препарата и вариабельности. Следовательно, имеет место потребность в улучшенных композициях, которые преодолеют проблемы дозирования, связанные со смесями множества активных ингредиентов, и которые обеспечат улучшения постоянства доз и направленного воздействия на легкие. Особенно острой является потребность в API с сильно различающимися физико-химическими свойствами (например, растворимостью), когда подбор общего растворителя для конструирования частиц является проблематичным.
[11] В настоящее время обнаружено, что ингаляционные сухие порошковые композиции, которые содержат два или более активных ингредиента и при этом имеют требуемые свойства флюидизации и диспергирования частиц препарата, могут быть получены посредством включения активных ингредиентов внутрь высушенных распылением ингаляционных частиц.
Сущность изобретения
[12] В первом аспекте настоящее изобретение относится к сухой порошковой композиции для ингаляции, содержащей высушенные распылением частицы, которые содержат ядро из первого активного ингредиента в по существу кристаллической форме, которое покрыто слоем второго активного ингредиента в по существу аморфной форме, который диспергирован в фармацевтически приемлемом гидрофобном эксципиенте.
[13] Первый активный ингредиент, второй активный ингредиент и гидрофобный эксципиент являются по существу фазово-разделенными в высушенных распылением частицах.
[14] Такая композиция, содержащая частицы, которые таким образом структурированы или "сконструированы", устраняет значительные различия в распределении по аэродинамическому размеру частиц и в доле тонкодисперсных частиц, которые имеют место, когда те же активные ингредиенты составляют в виде упорядоченных смесей. Частицы также проявляют улучшенное направленное воздействие на легкие (например, более высокую эффективность доставки в легкие, уменьшенное орофарингеальное и системное отложение) и улучшенное постоянство доз (благодаря уменьшенным межиндивидуальной вариабельности и зависимости от скорости потока) по отношению к стандартным лактозным смесям и гранулированным композициям.
[15] Активные ингредиенты могут представлять собой любые активные фармацевтические ингредиенты, применяемые для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD. Подходящие активные ингредиенты включают длительно действующие β2-агонисты, такие как салметерол, формотерол, индакатерол и их соли, мускариновые атнагонисты, такие как тиотропий и гликопирроний и их соли, и кортикостероиды, включая будесонид, циклезонид, флутиказон и мометазон и их соли. Подходящие комбинации включают (формотерола фумарат и будесонид), (салметерола ксинафоат и флутиказона пропионат), (салметерола ксинафоат и тиотропия бромид) и (индакатерола малеат и гликопиррония бромид).
[16] Обычно нежелательным считается присутствие доменов аморфного препарата в кристаллических микронизированных препаратах для ингаляции. Аморфные домены термодинамически нестабильны и могут со временем превращаться в стабильный кристаллический полиморф. Процесс рекристаллизации часто приводит к укрупнению микронизированных частиц препарата и снижению качества аэрозоля. Аморфные домены с более высокой энергией могут также проявлять большую растворимость, более быстрое растворение и сниженную химическую стабильность по сравнению с кристаллическим препаратом. В результате, общепринятой практикой является стремление к уменьшению аморфного содержимого в микронизированных частицах препарата, и компании прикладывают большие усилия, для того чтобы "улучшить" порошки, уменьшив аморфное содержимое.
[17] Сушка распылением представляет собой способ получения сухого порошка из жидкости или дисперсии в жидкости посредством быстрого высушивания с помощью горячего газа. К ее принципиальным преимуществам для получения сконструированных частиц для ингаляции относится способность к быстрому получению сухого порошка и к управлению свойствами частиц, включая размер, строение, плотность и состав поверхности. Процесс высушивания является очень быстрым (порядка миллисекунд). В результате наиболее активные фармацевтические ингредиенты, которые растворены в жидкой фазе, оседают в виде аморфных твердых веществ, поскольку у них нет времени на кристаллизацию.
[18] Для комбинации фиксированных доз обычной практикой является стремление найти общий растворитель, в котором растворимы оба препарата. Составление двух препаратов в одной аморфной фазе приводит к возможным проблемам несовместимости. Один из препаратов, вероятно, обладает улучшенной физической и химической стабильностью, тогда как другой обладает пониженной стабильностью.
[19] При разработке аэрозольных композиций, содержащих комбинации фиксированных доз двух или более препаратов, не всегда возможно определить растворитель, в котором каждый из препаратов является смешивающимся или несмешивающимся. Следовательно, для составления комбинаций фиксированных доз данных препаратов может оказаться необходимым высушить распылением сложную дисперсию одного препарата в растворе и другого в суспензии. Это приводит к образованию кристаллических и аморфных доменов в высушенном распылением продукте препарата. Было неожиданно обнаружено, что могут быть получены стабильные композиции, содержащие такие кристаллические и аморфные домены препарата. Посредством включения гидрофобного эксципиента, которое эффективно сконцентрировано на границе раздела частиц, также становится возможным регулировать поверхностную энергию и строение высушенных распылением частиц, что приводит к уменьшению силы сцепления между частицами и повышению качества аэрозоля.
[20] В частицы может быть включен третий активный ингредиент или в качестве дополнительного нерастворимого кристаллического активного ингредиента, или в качестве дополнительного аморфного активного ингредиента. Третий активный ингредиент может быть выбран, например, из бронходилататоров, противовоспалительных средств и их смесей, в частности β2-агонистов, мускариновых атнагонистов, стероидов, двойных β2-агонистов-мускариновых атнагонистов, ингибиторов PDE4, агонистов A2A, блокаторов кальция и их смесей. Подходящие тройные комбинации включают (салметерола ксинафоат, флутиказона пропионат и тиотропия бромид), (индакатерола малеат, мометазона фуроат и гликопиррония бромид) и (индакатерола ацетат, мометазона фуроат и гликопиррония бромид).
[21] Во втором аспекте настоящее изобретение относится к способу получения сухой порошковой композиции высушенных распылением частиц, которые содержат первый активный ингредиент и второй активный ингредиент, причем данный способ включает стадии:
(a) получения исходного материала, содержащего второй активный ингредиент, растворенный в фазе растворителя, гидрофобный эксципиент и кристаллические частицы первого активного ингредиента, причем указанные кристаллические частицы являются по существу нерастворимыми в упомянутой фазе растворителя; и
(b) сушки распылением упомянутого исходного материала для получения композиции, причем указанные частицы содержат ядро из первого активного ингредиента в по существу кристаллической форме, которое покрыто слоем второго активного ингредиента в по существу аморфной форме, который диспергирован в фармацевтически приемлемом гидрофобном эксципиенте.
[22] В предпочтительном варианте осуществления фаза растворителя представляет собой воду или смесь этанола и воды.
[23] В третьем аспекте настоящее изобретение относится к способу лечения обструктивного или воспалительного заболевания дыхательных путей, который включает введение субъекту, нуждающемуся в этом, эффективного количества вышеупомянутой сухой порошковой композиции. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[24] В четвертом аспекте настоящее изобретение относится к применению вышеупомянутой сухой порошковой композиции в производстве лекарственного препарата для лечения обструктивного или воспалительного заболевания дыхательных путей. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[25] В пятом аспекте настоящее изобретение относится к вышеупомянутой сухая порошковой композиции для применения в лечении обструктивного или воспалительного заболевания дыхательных путей. Данное обструктивное или воспалительное заболевание дыхательных путей может представлять собой астму или COPD.
[26] В шестом аспекте настоящее изобретение относится к системе доставки, которая содержит ингалятор, который содержит вышеупомянутую сухую порошковую композицию.
[27] Седьмой аспект настоящего изобретения содержит любые два или более вышеизложенных аспекта, варианта осуществления или признака.
Термины
[28] Термины, используемые в данном описании, имеют следующие значения:
[29] "Активный ингредиент" или "препарат", как применяется в настоящем описании, обозначает активный ингредиент фармацевтического препарата, также известный как активный фармацевтический ингредиент (API).
[30] "Аморфный", как применяется в настоящем описании, относится к состоянию, в котором материал не имеет дальнего порядка на молекулярном уровне и, в зависимости от температуры, может проявлять физические свойства твердого тела или жидкости. Как правило, такие материалы не дают четких картин рентгеновской дифракции и, проявляя свойства твердого тела, более формально описываются как жидкость. При нагревании происходит изменение со свойств твердого тела на свойства жидкости, которое характеризуется фазовым переходом, как правило второго порядка ("стеклование").
[31] "Кристаллический", как применяется в настоящем описании, соответствует твердой фазе, в которой материал имеет регулярную упорядоченную внутреннюю структуру на молекулярном уровне и дает четкую картину рентгеновской дифракции с определенными пиками. Такие материалы при достаточном нагреве также проявляют свойства жидкости, но превращение из твердого тела в жидкость характеризуется фазовым переходом, как правило первого рода ("точка плавления"). В контексте настоящего изобретения кристаллический активный ингредиент обозначает активный ингредиент с кристалличностью, составляющей более чем 85%. В определенных вариантах осуществления кристалличность может составлять более чем 90%. В других вариантах осуществления кристалличность может составлять более чем 95%.
[32] "Доставляемая доза" или "DD", как применяется в настоящем описании, соответствует показателю доставки сухого порошка из ингаляторного устройства после приведения в действие или диспергирования из отделения для порошка. DD определяют как отношение дозы, доставленной ингаляторным устройством, к номинальной или измеренной дозе. DD является экспериментально определяемым параметром и может определяться с применением установки in vitro устройства, которое воспроизводит дозирование пациенту. Иногда ее также называют испущенной дозой (ED).
[33] "Содержание тонкодисперсных частиц" или "FPF", как применяется в настоящем описании, обозначает массу активных ингредиентов с аэродинамическим размером, меньшим определенного минимального по отношению к номинальной дозе. Например, FPF<3,3мкм соответствует процентной доле от номинальной дозы частиц, которые имеют аэродинамический размер менее чем 3,3 мкм. Значения FPF определяют с применением каскадной импакции, или в каскадном импакторе ANDERSEN™, или в каскадном импакторе NEXT GENERATION IMPACTOR™. Для того чтобы минимизировать межиндивидуальную вариабельность и улучшить направленное воздействие на легкие, предпочтительно, чтобы содержание тонкодисперсных частиц, меньших чем 3,3 мкм, (FPF<3,3мкм) составляло более чем 40% вес/вес от номинальной дозы.
[34] "Комбинация фиксированных доз", как применяется в настоящем описании, соответствует фармацевтическому продукту, который содержит два или более активных ингредиента, которые составлены вместе в единичной лекарственной форме, доступной в определенных фиксированных дозах.
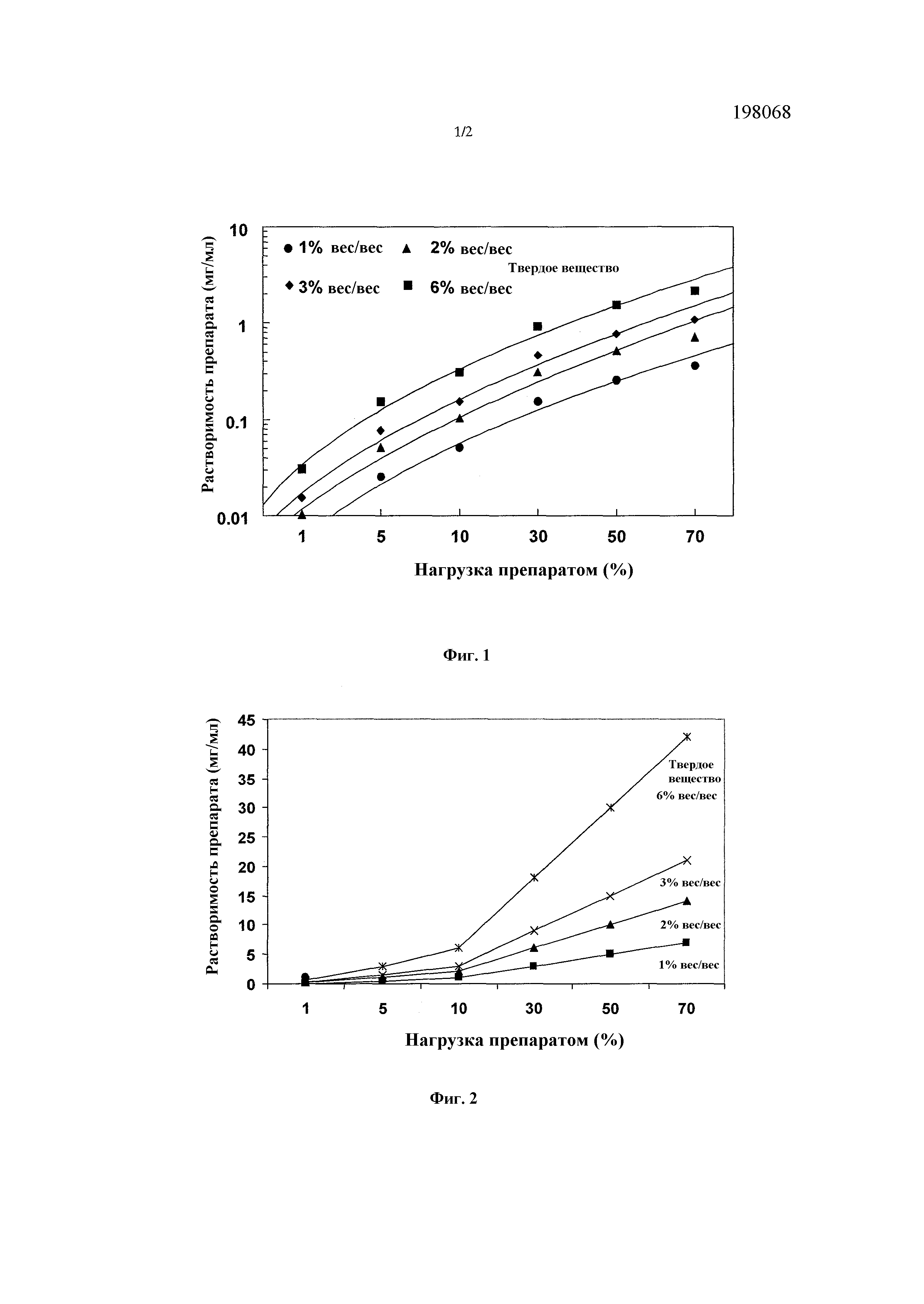
[35] "Масс-медианный диаметр", или "MMD", или "x50", как применяется в настоящем описании, обозначает медианный диаметр множества частиц, как правило в полидисперсной популяции частиц, т.е. имеющей диапазон размеров частиц. Значения MMD, как приводятся в настоящем описании, определяются посредством лазерной дифракции (Sympatec Helos, Clausthal-Zellerfeld, Германия), если иное не указано в контексте. В определенных вариантах осуществления настоящего изобретения частицы ингаляционного лекарственного препарата имеют MMD, составляющий от 1 до 10 микрон.
[36] "Масс-медианный аэродинамический диаметр" или "MMAD", как применяется в настоящем описании, относится к медианному аэродинамическому размеру множества частиц, как правило в полидисперсной популяции. "Аэродинамический диаметр" представляет собой диаметр сферы единичной плотности, имеющей ту же скорость осаждения, обычно в воздухе, что и порошок, и поэтому он подходит для того, чтобы характеризовать аэрозолированный порошок или другую композицию диспергированных частиц или частиц с точки зрения их осаждения. MMAD определяют в настоящем описании посредством каскадной импакции. В одном или нескольких вариантах осуществления порошок настоящего изобретения имеет масс-медианный аэродинамический диаметр от приблизительно 1 мкм до 5 мкм, как например от приблизительно 1,5 мкм до приблизительно 4,0 мкм или от приблизительно 2,0 мкм до 4,0 мкм. Вообще, если частицы слишком большие, то меньше частиц проникнет глубоко в легкое. Если частицы слишком малы, большая процентная доля частиц может выйти при выдохе. В определенных вариантах осуществления настоящего изобретения частицы ингаляционного лекарственного препарата имеют MMAD от 1 до 5 микрон.
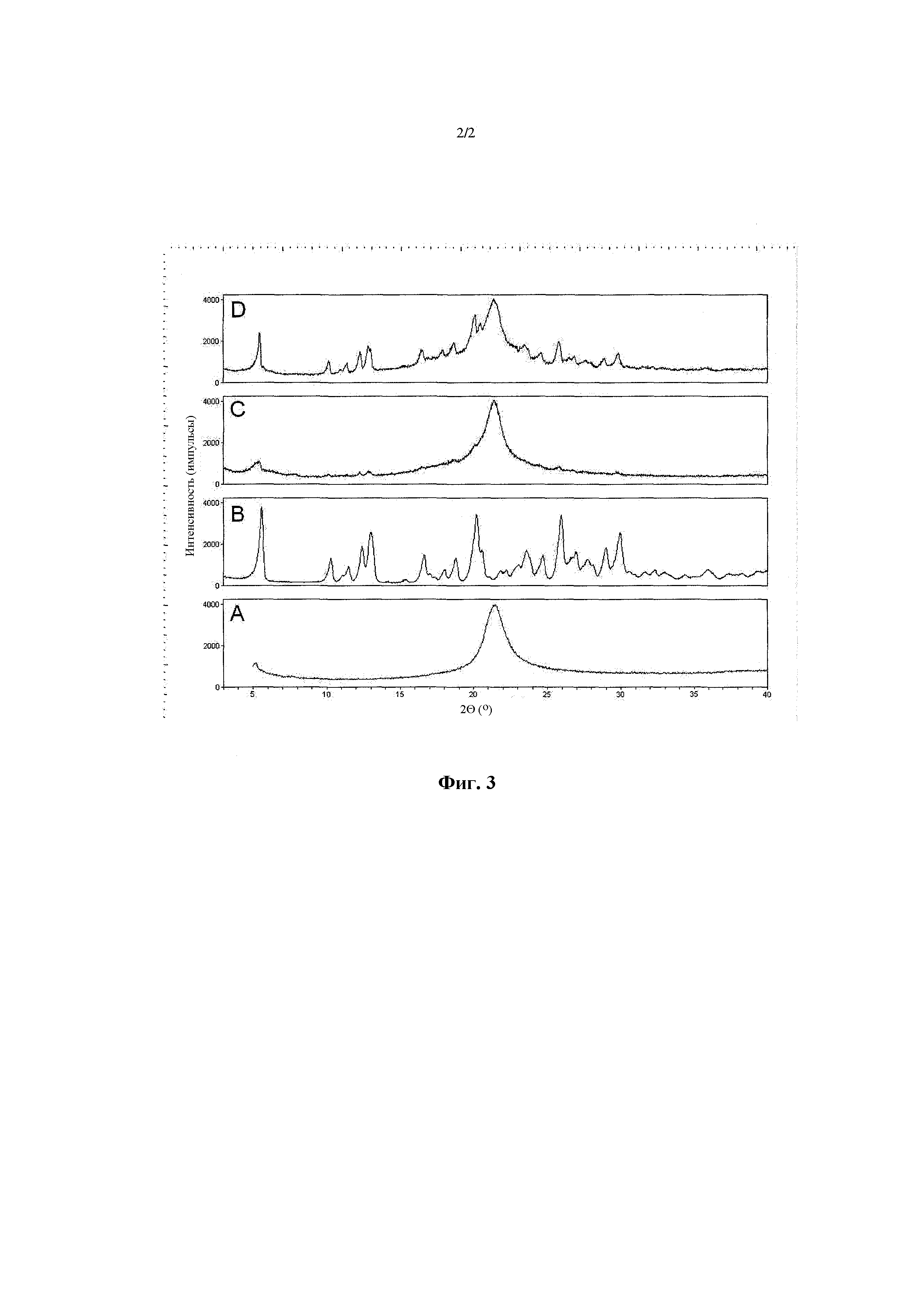
[37] "Складчатый", как применяется в настоящем описании, обозначает имеющий многочисленные морщины или складки, т.е. изборожденный складками или морщинами.
[38] "Складчатость", как применяется в настоящем описании, представляет собой меру шероховатости поверхности сконструированной частицы. Для целей настоящего изобретения складчатость вычисляют из определенной площади поверхности, получаемой из измерений методом БЭТ, истинной плотности, получаемой из гелиевой пикномерии, и отношения поверхности к объему, получаемого посредством лазерной дифракции (Sympatec), а именно:
Складчатость=(SSA∙ρtrue)/Sv,
где Sv=6/D32, где D32 представляет собой средний диаметр на основании единичной площади поверхности. Ожидается, что повышение шероховатости поверхности уменьшит силы сцепления между частицами и улучшит направленное воздействие аэрозоля на легкие. Ожидается, что улучшенное направленное воздействие на легкие уменьшит межиндивидуальную вариабельность и уровень препарата в ротоглотке и системной циркуляции. В одном или нескольких вариантах осуществления складчатость Sv составляет от 3 до 20, например от 5 до 10.
[39] "Нерастворимый", как применяется в настоящем описании, обозначает имеющий растворимость в растворителе, равную менее чем 1 мг/мл. В определенных вариантах осуществления настоящего изобретения растворимость, например активного ингредиента, может составлять менее чем 0,1 мг/мл, или, предпочтительно, менее чем 0,01 мг/мл.
[40] "Растворимый", как применяется в настоящем описании, обозначает имеющий растворимость в растворителе, равную 1 мг/мл или более. В определенных вариантах осуществления настоящего изобретения растворимость, например активного ингредиента, может составлять более чем 10 мг/мл, или, предпочтительно, более чем 20 мг/мл.
[41] Следует понимать, что на протяжении настоящего описания изобретения и в нижеследующей формуле изобретения предполагается, если иное не требуется контекстом, что слово "содержать" или его варианты, такие как "содержит" или "содержащий", включают указанное число или стадию или группу чисел или стадий, но не исключают какое-либо другое число или стадию или группу чисел или стадий.
[42] Полное раскрытие всех патентов Соединенных Штатов и международных патентных заявок, упомянутых в настоящем описании изобретения к патенту, полностью включено посредством ссылки в настоящее описание для всех целей.
Подробное описание чертежей
[43] Сухая порошковая композиция настоящего изобретения может быть описана со ссылкой на прилагаемые чертежи. На данных чертежах:
[44] Фигура 1 представляет собой график требуемой растворимости препарата для "нерастворимого" API для достижения общей растворенной доли менее чем 5% вес/об в исходном материале как функции от нагрузки препаратом и содержания твердого вещества. Ожидается, что растворимый препарат превратится в аморфное твердое вещество в высушенных распылением частицах.
[45] Фигура 2 представляет собой график требуемой растворимости препарата для "растворимого" API для полного смешивания в исходном материале как функции от вариаций нагрузки препаратом и содержания твердого вещества.
[46] Фигура 3 демонстрирует картины широкоугольной порошковой рентгеновской дифракции: (a) высушенной распылением композиции основы, содержащей DSPC:CaCl2 в соотношении 2:1 моль/моль; (b) микронизированного кристаллического индакатеролового API (QAB149); (c) высушенной распылением композиции, содержащей 6% вес/вес индакатерола (QAB149) и 2% вес/вес гликопирролата (NVA237); (d) высушенной распылением композиции, содержащей 45% индакатерола (QAB149) и 15% гликопирролата (NVA237). Порошковые картины продуктов высушенной распылением комбинации фиксированных доз иллюстрируют, что два препарата и гидрофобный эксципиент являются фазово-разделенными в отдельных доменах: индакатерол присутствует в кристаллической форме, гликопирролат присутствует в виде аморфного твердого тела, и DSPC присутствует в фосфолипидной гелевой фазе.
Подробное описание изобретения
[47] Настоящее изобретение касается сухих порошковых композиций для ингаляции, содержащих высушенные распылением частицы. Эти высушенные распылением частицы содержат комбинации фиксированных доз двух или более активных ингредиентов, которые подходят для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD.
[48] В одном аспекте или варианте осуществления высушенные распылением частицы содержат первый активный ингредиент, который имеет по существу кристаллическую форму, второй активный ингредиент в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем данные три материала являются по существу фазово-разделенными в высушенных распылением частицах. Данные частицы можно, следовательно, описать как "структурированные" или "сконструированные".
[49] Активные ингредиенты могут представлять собой любые активные фармацевтические ингредиенты, которые пригодны для лечения обструктивных или воспалительных заболеваний дыхательных путей, в частности астмы и COPD. Их можно выбирать, например, из бронходилататоров, противовоспалительных средств и их смесей, в частности β2-агонистов, мускариновых атнагонистов, стероидов, двойных β2-агонистов-мускариновых атнагонистов, ингибиторов PDE4, агонистов A2A, блокаторов кальция и их смесей.
[50] Подходящие активные ингредиенты включают β2-агонисты. Подходящие β2-агонисты включают арформотерол (например, тартрат), альбутерол/сальбутамол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности сульфат), AZD3199, бамбутерол, BI-171800, битолтерол (например, мезилат), кармотерол, кленбутерол, этантерол, фенотерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности гидробромид), флербутерол, формотерол (например, рацемат или один диастереомер, такой как R,R-диастереомер, или его соль, в особенности фумарат или фумарата дигидрат), GSK-159802, GSK-597901, GSK-678007, индакатерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности малеат, ацетат или ксинафоат), LAS100977, метапротеренол, милветерол (например, гидрохлорид), наминтерол, олодатерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности гидрохлорид), PF-610355, пирбутерол (например, ацетат), прокатерол, репротерол, салмефамол, салметерол (например, рацемат или один энантиомер, такой как R-энантиомер, или его соль, в особенности ксинафоат), тербуталин (например, сульфат) и вилантерол (или его соль, в особенности трифенатат). В некоторых предпочтительных вариантах осуществления β2-агонист представляет собой β2-агонист сверхдлительного действия, такой как индакатерол, или, возможно, кармотерол, LAS-100977, милветерол, олодатерол PF-610355 или вилантерол.
[51] В предпочтительном варианте осуществления один из активных ингредиентов представляет собой индакатерол (т.е. (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он) или его соль. Он является агонистом β2-адренорецептора, который имеет особенно большую продолжительность действия (т.е. свыше 24 часов) и малую продолжительность начала действия (т.е. приблизительно 10 минут). Данное соединение получают посредством способов, описанных в международных патентных заявках WO 2000/75114 и WO 2005/123684. Оно способно к образованию солей присоединения кислоты, в частности фармацевтически приемлемых солей присоединения кислоты. Фармацевтически приемлемые соли присоединения кислоты соединения формулы I включают соли неорганических кислот, например галогенводородных кислот, таких как фтористоводородная кислота, соляная кислота, бромистоводородная кислота или йодистоводородная кислота, азотной кислоты, серной кислоты, фосфорной кислоты; и органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, бензойная кислота, о-гидроксибензойная кислота, п-гидроксибензойная кислота, п-хлорбензойная кислота, дифенилуксусная кислота, трифенилуксусная кислота, 1-гидроксинафталин-2-карбоновая кислота, 3-гидроксинафталин-2-карбоновая кислота, алифатические гидроксикислоты, такие как молочная кислота, лимонная кислота, винная кислота или яблочная кислота, дикарбоновые кислоты, такие как фумаровая кислота, малеиновая кислота или янтарная кислота, и сульфоновые кислоты, такие как метансульфоновая кислота или бензолсульфоновая кислота. Эти соли могут быть получены из данного соединения посредством известных способов образования солей. Предпочтительной солью (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она является малеат. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ацетат. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ксинафоат. Другие полезные соли включают гидросукцинат, фумарат, гиппурат, мезилат, гидросульфат, гидротартрат, гидрохлорид, гидробромид, формат, эзилат, тозилат, гликолят и гидромалонат, которые, как соли ацетат и ксинафоат, раскрыты в международной патентной заявке WO 2008/000839 вместе с соответствующими способами их получения.
[52] Подходящие активные ингредиенты включают мускариновые атнагонисты или противомускариновые средства. Подходящие мускариновые атнагонисты включают аклидиний (например, бромид), BEA-2108 (например, бромид), BEA-2180 (например, бромид), CHF-5407, дарифенацин (например, бромид), даротропий (например, бромид), гликопирролат (например, рацемат или один энантиомер или его соль, в особенности бромид), декспирроний (например, бромид), iGSK-202405, GSK-203423, GSK-573719, GSK-656398, ипратропий (например, бромид), LAS35201, LAS186368, отилоний (например, бромид), окситропий (например, бромид), оксибутинин, PF-3715455, PF-3635659, пирензепин, реватропат (например, гидробромид), солифенацин (например, сукцинат), SVT-40776, TD-4208, теродилин, тиотропий (например, бромид), толтеродин (например, тартрат) и троспий (например, хлорид). В некоторых предпочтительных вариантах осуществления мускариновые атнагонисты представляют собой длительного действующие мускариновые антагонисты, такие как даротропия бромид, гликопирролат или тиотропия бромид.
[53] В предпочтительном варианте осуществления один из активных ингредиентов представляет собой соль гликопиррония. Соли гликопиррония включают гликопиррония бромид, также известный как гликопирролат, о котором известно, что он является эффективным противомускариновым средством. Более конкретно, он ингибирует связывание ацетилхолина с мускариновыми рецепторами M3, посредством этого ингибируя бронхоконстрикцию. Гликопирролат представляет собой четвертичную соль аммония. Подходящими противоионами являются фармацевтически приемлемые противоионы, включая, например, фторид, хлорид, бромид, йодид, нитрат, сульфат, фосфат, формат, ацетат, трифторацетат, пропионат, бутират, лактат, цитрат, тартрат, малат, малеат, сукцинат, бензоат, п-хлорбензоат, дифенилацетат или трифенилацетат, о-гидроксибензоат, п-гидроксибензоат, 1-гидроксинафталин-2-карбоксилат, 3-гидроксинафталин-2-карбоксилат, метансульфонат и бензолсульфонат. Гликопирролат может быть получен с применением способов, описанных в патенте Соединенных штатов US 2956062. Он имеет два стереогенных центра и, следовательно, существует в виде четырех изомерных форм, а именно (3R,2'R)-, (3S,2'R)-, (3R,2'S)- и (3S,2'S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния бромид, как описано в описании изобретения к патентам Соединенных штатов US 6307060 и US 6613795. Когда веществом препарата сухой порошковой композиции является гликопирролат, он может представлять собой одну или несколько из данных изомерных форм, в особенности изомер 3S,2'R, изомер 3R,2'R или изомер 2S,3'R, таким образом включая отдельные энантиомеры, смеси диастереомеров или рацематы, в особенности (3S,2'R/3R,2'S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния бромид. R,R-гликопирролат также известен как декспирроний.
[54] Подходящие активные ингредиенты включают бифункциональные активные ингредиенты, такие как двойные β2-агонисты-мускариновые атнагонисты. Подходящие двойные β2-агонисты-мускариновые атнагонисты включают GSK-961081 (например, сукцинат).
[55] Подходящие активные ингредиенты включают стероиды, например кортикостероиды. Подходящие стероиды включают будесонид, беклометазон (например, дипропионат), бутиксокорт (например, пропионат), CHF5188, циклезонид, дексаметазон, флунизолид, флутиказон (например, пропионат или фуроат), GSK-685698, GSK-870086, LAS40369, метилпреднизолон, мометазон (например, фуроат), преднизолон, рофлепонид и триамцинолон (например, ацетонид). В некоторых предпочтительных вариантах осуществления стероид представляет собой длительно действующие кортикостероиды, такие как будесонид, циклезонид, флутиказон или мометазон.
[56] В предпочтительном варианте осуществления один из активных ингредиентов представляет собой мометазон (т.е. (11β,16α)-9,21-дихлор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метилпрегна-1,4-диен-3,20-дион, альтернативно обозначаемый как 9α,21-дихлор-16α-метил-1,4-прегнадиен-11β,17α-диол-3,20-диона 17-(2'-фуроат)) или его соль, например мометазона фуроат и мометазона фуроата моногидрат. Мометазона фуроат и его получение описаны в US 4472393. Его применение в лечении астмы описано в US 5889015. Его применение в лечении других респираторных заболеваний описано в US 5889015, US 6057307, US 6057581, US 6677322, US 6677323 и US 6365581.
[57] Фармацевтически приемлемые сложные эфиры, ацетали и соли вышеуказанных терапевтических средств являются предполагаемыми. Определение подходящих сложных эфиров, ацеталей или солевой формы осуществляют по продолжительности действия и данным о переносимости/безопасности. Кроме того, выбор API может быть важен с точки зрения выбора терапевтических средств с соответствующими физическими свойствами (например, растворимостью) для получения вариантов осуществления настоящего изобретения.
[58] Подходящие комбинации включают содержащие β2-агонист и кортикостероид, например (кармотерол и будесонид), (формотерол и беклометазон), (формотерола фумарат и будесонид), (формотерола фумарата дигидрат и мометазона фуроат), (формотерола фумарат и циклезонид), (индакатерола малеат и мометазона фуроат), (индакатерола ацетат и мометазона фуроат), (индакатерола ксинафоат и мометазона фуроат), (милветерола гидрохлорид и флутиказон), (олодатерола гидрохлорид и флутиказона фуроат), (олодатерола гидрохлорид и мометазона фуроат), (салметерола ксинафоат и флутиказона пропионат), (вилантерола трифенатат и флутиказона фуроат) и (вилантерола трифенатат и мометазона фуроат); β2-агонист и мускариновый антагонист, например (формотерол и аклидиния бромид), (индакатерол и даротропий), (индакатерола малеат и гликопирролат); (индакатерола малеат и GSK573719), (милветерола гидрохлорид и гликопирролат), (милветерола гидрохлорид и тиотропия бромид), (олодатерола гидрохлорид и гликопирролат), (олодатерола гидрохлорид и тиотропия бромид), (салметерола ксинафоат и тиотропия бромид), (вилантерола трифенатат и даротропий), (вилантерола трифенатат и гликопирролат), (вилантерола трифенатат и GSK573719) и (вилантерола трифенатат и тиотропия бромид); и мускариновый антагонист и кортикостероид, например (гликопирролат и мометазона фуроат) и (гликопирролат и циклезонид); или двойной β2-агонист-мускариновый антагонист и кортикостероид, например (GSK-961081 сукцинат и мометазона фуроат), (GSK-961081 сукцинат и мометазона фуроата моногидрат) и (GSK-961081 сукцинат и циклезонид).
[59] Высушенные распылением частицы сухой порошковой композиции настоящего изобретения могут содержать три активных ингредиента. В подходящих вариантах осуществления третий активный ингредиент в этих частицах является по существу кристаллическим. В других подходящих вариантах осуществления третий активный ингредиент в этих частицах является по существу аморфным и смешан с аморфной фазой второго активного ингредиента.
[60] Подходящие тройные комбинации включают содержащие β2-агонист, мускариновый антагонист и кортикостероид, например (салметерола ксинафоат, флутиказона пропионат и тиотропия бромид), (индакатерола малеат, мометазона фуроат и гликопирролат) и (индакатерола ацетат, мометазона фуроат и гликопирролат).
[61] Активные ингредиенты могут существовать в континууме твердых состояний в диапазоне от полностью аморфного до полностью кристаллического. Для целей настоящего изобретения активный ингредиент находится в по существу кристаллической форме, когда он имеет кристалличность, составляющую более чем 85%. В определенных вариантах осуществления кристалличность может составлять более чем 90%. В других вариантах осуществления кристалличность может составлять более чем 95%, например более чем 99%.
[62] Первый активный ингредиент является по существу кристаллическим. Первый активный ингредиент должен также быть по существу нерастворимым в растворителе, который используют для получения исходного материала, который высушивают распылением для образования частиц. Для целей настоящего изобретения первый активный ингредиент имеет растворимость, равную менее чем приблизительно 1 мг/мл, например менее чем 0,05 мг/мл. В определенных вариантах осуществления первый активный ингредиент имеет растворимость, равную менее чем 0,01 мг/мл, например менее чем 0,005 мг/мл. Предлагаемые пределы растворимости вводятся исходя из потребности минимизировать процентную долю препарата, который растворяется в фазе растворителя и затем остается в виде аморфного твердого вещества в высушенном распылением порошке.
[63] Второй активный ингредиент, который является растворимым в растворителе, который высушивают распылением, присутствует в высушенных распылением частицах в по существу аморфной форме. Следует заметить, что второй активный ингредиент находится в данной форме, когда образуются частицы. Второй активный ингредиент может иметь по существу аморфную или по существу кристаллическую форму при приеме активного ингредиента. Физическая форма второго активного ингредиента и размер частиц данного ингредиента не имеют значения при получении исходного материала, поскольку второй активный ингредиент является растворенным в растворителе. Быстрое высушивание, обеспечиваемое распылительной сушилкой, вынуждает второй активный ингредиент принять по существу аморфную форму. Первый активный ингредиент сохраняет свою кристаллическую форму во время процесса высушивания, поскольку он является по существу нерастворимым в растворителе, который применяют в исходном материале.
[64] Для целей настоящего изобретения активный ингредиент находится в по существу аморфной форме, когда он имеет кристалличность, составляющую менее чем 15%. В определенных вариантах осуществления кристалличность может составлять менее чем 10%. В других вариантах осуществления кристалличность может составлять менее чем 5%, например менее чем 2% или менее чем 1%.
[65] Для целей настоящего изобретения в композицию включен гидрофобный эксципиент. С помощью тщательного контроля композиции и способа можно добиться того, чтобы поверхность высушенных распылением частиц содержала главным образом гидрофобный эксципиент. Предполагаются поверхностные концентрации, превышающие 70%. В определенных вариантах осуществления поверхность содержит более чем 90% гидрофобного эксципиента или более чем 95% гидрофобного эксципиента, например более чем 98% гидрофобного эксципиента или более чем 99% гидрофобного эксципиента.
[66] В некоторых предпочтительных вариантах осуществления гидрофобный эксципиент облегчает улучшение строения складчатых частиц. Это означает, что строение частиц является морщинистым и складчатым, а не гладким. Это означает, что внутренняя и/или внешняя поверхность частиц ингаляционного лекарственного препарата по меньшей мере частично является складчатой. Эта складчатость пригодна для обеспечения постоянства доз и направленного воздействия препарата посредством улучшения флюидизации и диспергируемости порошка. Без ограничения какой-либо теорией, повышение складчатости частиц приводит к уменьшению сил сцепления между частицами в результате невозможности частиц сблизиться на расстояние действия ван-дер-ваальсовых сил. Уменьшения сил сцепления достаточно, для того чтобы существенно улучшить флюидизацию и диспергирование порошка в скоплениях складчатых частиц.
[67] Складчатость частиц может быть повышена с помощью порообразующего средства, такого как перфлуброн, во время их производства, или посредством контроля за композицией и/или способом для получения складчатых частиц.
[68] Гидрофобный эксципиент может иметь различные формы, что зависит, по меньшей мере до некоторой степени, от состава и предполагаемого применения сухой порошковой композиции. Подходящие фармацевтически приемлемые гидрофобные эксципиенты могут, в общем, быть выбраны из группы, состоящей из длинноцепочечных фосфолипидов, гидрофобных аминокислот и пептидов, и мыл длинноцепочечных жирных кислот.
[69] Фосфолипиды как натурального, так и синтетического происхождения могут использоваться в различных количествах. Когда фосфолипиды присутствуют, их количество, как правило, достаточно для обеспечения пористой покрывающей матрицы фосфолипидов. Если они присутствуют, содержание фосфолипидов обычно лежит в диапазоне от приблизительно 40 до 99% вес/вес лекарственного препарата, например от 70% до 90% вес/вес лекарственного препарата. Высокая процентная доля эксципиента также обусловлена высокой активностью и поэтому, как правило, малыми дозами активных ингредиентов. При условии, что в высушенных распылением частицах не присутствует частица носителя, эксципиенты также служат в качестве объемобразующих агентов в композиции, обеспечивающих эффективную доставку низкодозовых терапевтических средств. В некоторых вариантах осуществления также желательно поддерживать низкой нагрузку препаратом, для того чтобы обеспечивать контроль свойств частиц посредством состава поверхности и строения частиц. Это обеспечивает достижение сравнимых физической стабильности и качества аэрозоля между моно и комбинационными частицами.
[70] Минимальная масса заполнения тонкодисперсного порошка, которая может быть приемлемо заполнена коммерчески с относительным стандартным отклонением, составляющим менее чем 3%, составляет приблизительно 0,5 мг. Напротив, требуемая легочная доза активных ингредиентов может составлять только 0,01 мг, и обычно составляет приблизительно 0,2 мг или менее. Следовательно, требуются значительные количества эксципиента. В тех случаях, когда препараты менее активны, становится возможным уменьшить требуемое содержание эксципиентов, хотя сохранение концентрации эксципиента высокой позволяет контролировать состав поверхности и строение частиц, свойства, которые считаются существенными для достижения эквивалентной эффективности между монокомпонентной композицией и композицией комбинации фиксированных доз. Следует помнить, однако, что низкая нагрузка препаратом повышает возможность растворения для кристаллического активного ингредиента в растворителе, высушиваемом распылением. Следует прикладывать усилия для минимизации растворения кристаллического активного ингредиента до возможной степени.
[71] Обычно к совместимым фосфолипидам относятся те, у которых фазовый переход гель-жидкий кристалл происходит выше чем при приблизительно 40º C, как например выше чем при 60º C, или выше чем при приблизительно 80º C. Включаемые фосфолипиды могут представлять собой относительно длинноцепочечные (например, C6-C22) насыщенные фосфолипиды. Типичные фосфолипиды, применяемые в раскрытых стабилизированных препаратах включают, но без ограничения, фосфатидилхолины, такие как дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC) и гидрированные яичные или соевые фосфатидилхолины (например, E-100-3, S-100-3, доступные от Lipoid KG, Ludwigshafen, Германия). Природные фосфолипиды являются, предпочтительно, гидрированными с низким йодным числом (<10).
[72] Фосфолипиды можно необязательно объединять с холестерином для модификации текучести фосфолипидных ацильных цепей.
[73] Длинноцепочечные фосфолипиды можно необязательно объединять с двухвалентным металлическим ионом (например, кальцием, магнием). Такой двухвалентный металлический ион уменьшает гидратацию головной группы, тем самым повышая температуру фазового перехода гель-жидкий кристалл фосфолипида, и способность порошков смачиваться жидкостью на легочной выстилке. Молярные отношение поливалентного катиона к фосфолипиду может составлять по меньшей мере приблизительно 0,05:1, как например от приблизительно 0,05:1 до 0,5:1. В одном или нескольких вариантах осуществления молярное отношение поливалентный катион:фосфолипид составляет 0,5:1. Без ограничения какой-либо теорией предполагается, что двухвалентный металлический ион связывается с фосфатными группами на цвиттер-ионной фосфатидилхолиновой головной группе, вытесняя в процессе молекулы воды. Молярные отношения металлического иона к фосфолипиду, превышающие 0,5, могут приводить к свободным металлическим ионам, не связанным с фосфатными группами. Это может значительно повысить гигроскопичность получаемого сухого порошка и не является предпочтительным. Когда поливалентный металлический ион представляет собой кальций, он может иметь форму хлорида кальция. Хотя металлические ионы, такие как кальций, часто включают с фосфолипидами, они не необходимы, и их применение может быть проблематичным, когда в композиции присутствуют другие ионы (например, фосфат, который может осаждать ионы кальция в виде фосфата кальция). При возникновении проблем совместимости преимущественным может быть применение солей Mg2+, поскольку они, как правило, имеют значения Ksp, которые на три-четыре порядка величины выше, чем у солей Ca2+.
[74] Гидрофобный эксципиент может также содержать мыла длинноцепочечных жирных кислот. Длина алкильных цепей составляет обычно 14-22 атомов углерода в длину, причем предпочтительными являются насыщенные алкильные цепи. Мыла жирных кислот могут использовать одновалентные (например, Na+, K+) или двухвалентные противоионы (например, Ca2+, Mg2+). В частности, предпочтительными мылами жирных кислот являются стеарат натрия и стеарат магния. Растворимость мыл жирных кислот может возрастать выше точки Крафта. Калиевые соли жирных кислот обычно имеют самую низкую температуру Крафта и более высокую растворимость в воде при заданной температуре. Кальциевые соли, как ожидается, имеют самую низкую растворимость. Мыла гидрофобных жирных кислот обеспечивают воскоподобное покрытие на частицах. Предполагаемая нагрузка в высушенных распылением частицах аналогична фосфолипидам, подробно рассмотренным ранее.
[75] Гидрофобный эксципиент может также содержать гидрофобные аминокислоты, пептиды или белки. В частности, предпочтительной являются аминокислота лейцин и ее олигомеры дилейцин и трилейцин. Также предполагаются белки, такие как человеческий сывороточный альбумин. Трилейцин является особенно предпочтительным, поскольку его профиль растворимости и другие физико-химические свойства (например, поверхностная активность, log P) облегчают создание частиц со структурой ядро-оболочка, в которых трилейцин контролирует свойства поверхности и строение получаемых частиц.
[76] Сухая порошковая композиция настоящего изобретения может дополнительно содержать один или несколько эксципиентов.
[77] Аморфная фаза может необязательно содержать дополнительные стеклообразующие эксципиенты, выбранные так, чтобы повышать температуру стеклования Tg и время релаксации аморфной фазы. Предпочтительные стеклообразующие материалы выбирают из сахаров (например, сахарозы, трегалозы, лактозы), сахарных спиртов (например, маннита), аминокислот/пептидов (например, лейцина) и солей/буферов (например, цитрата натрия, малеата натрия). В частности, предпочтительными стеклообразующими эксципиентами являются имеющие Tg>100ºC (например, цитрат натрия, инулин и трегалоза). Растворимые в воде стеклообразующее эксципиенты выбирают так, что они быстро диффундировали из границы раздела во время процесса высушивания, что позволяет обогатить поверхность частиц гидрофобным эксципиентом. В таких частицах свойства частиц в значительной степени определяются составом поверхности/строением. Поверхность данных частиц содержит более чем 70% вес/вес гидрофобного эксципиента, чаще более чем 90% вес/вес или 95% вес/вес. Строение частиц (неровности или поры) и способность создавать частицы со структурой ядро-оболочка определяются составом исходного материала и его способностью к высыханию, характеризуемой числами Пекле каждого компонента, на протяжении всего процесса высушивания.
[78] Количество требуемого стеклообразующего эксципиента определяется температурами стеклования стабилизируемого вещества препарата и стеклообразующего стабилизирующего средства. Целью является достижение Tg для продукта препарата, составляющей по меньшей мере 80ºC. Для определения количества стеклообразующего эксципиента, требуемого для достижения данной цели, можно использовать уравнение Фокса, а именно:
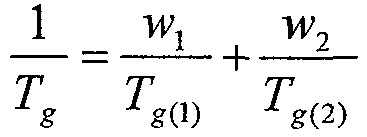 ,
,
[79] где w1 и w2 представляют собой весовые доли препарата и стеклообразующего эксципиента соответственно. Следует быть осторожным с цитратом натрия, чтобы избежать осаждения с двухвалентными ионами, которые могут присутствовать в гидрофобных образующих оболочку эксципиентах. В таких случаях предпочтительным может быть применение трегалозы или инулина. Таблица 2 предлагает список обычных стеклообразующих материалов и типичные для сухих материалов значения Tg.
|
[80] В одном или нескольких вариантах осуществления сухой порошковой композиции настоящего изобретения эксципиент может дополнительно или альтернативно включать добавки для дополнительного повышения стабильности или биосовместимости композиции. Например, предполагаются различные соли, буферы, хелаторы и маскирующие вкус средства. Применение данных добавок ясно специалистам в данной области техники, и конкретные количества, отношения и типы средств могут быть определены экспериментально без проведения лишних экспериментов.
[81] В одном или нескольких вариантах осуществления сухую порошковую композицию настоящего изобретения получают посредством двухстадийного способа.
[82] На первой стадии данного способа получения сухой порошковой композиции высушенных распылением частиц, которые содержат первый активный ингредиент и второй активный ингредиент, получают исходный материал, который содержит второй активный ингредиент, растворенный в фазе растворителя, гидрофобный эксципиент и кристаллические частицы первого активного ингредиента. Кристаллические частицы первого активного ингредиента являются по существу нерастворимыми в фазе растворителя, для того чтобы минимизировать присутствие первого активного ингредиента в аморфной фазе.
[83] Выбор растворителя зависит от физико-химических свойств активных ингредиентов. Пригодные для выбора растворители включают воду, этанол, смесь этанол/вода, ацетон, дихлорметан, диметилсульфоксид и другие растворители класса 3, как определено в рекомендациях ICH Q3C, например в ICH Topic Q3C (R4) Примеси: руководство по остаточным растворителям (ссылка European Medicines Agency CPMP/ICH/283/95, февраль 2009 г.).
[84] В некоторых предпочтительных вариантах осуществления первый активный ингредиент является слаборастворимым в воде, так что подходящими растворителями являются вода и вода, смешанная с этанолом. Когда первый активный ингредиент представляет собой индакатерол, растворитель предпочтительно представляет собой воду.
[85] В соответствии с фигурой 1 растворимость API, требуемая для достижения доли растворенного первого активного ингредиента, равной 5% вес/вес или менее, повышается с повышением нагрузки препаратом и содержания твердого вещества в исходном материале для сушки распылением. При предпочтительных нагрузках препаратом (т.е. <30%) растворимость препарата должна составлять менее чем 1 мг/мл, предпочтительно менее чем 0,01 мг/мл.
[86] Растворимость первого активного ингредиента в исходном материале для сушки распылением может быть уменьшена посредством уменьшения температуры исходного материала. Как показывает опыт, растворимость уменьшается в два раза на каждые 10ºC снижения температуры. Следовательно, можно ожидать, что переход от комнатной температуры к условиям охлаждения уменьшит растворимость приблизительно в 4 раза.
[87] В некоторых случаях может использоваться добавление солей, которые "высолят" активный ингредиент, для того чтобы дополнительно расширить ряд нерастворимых активных ингредиентов, которые могут быть получены в контексте настоящего изобретения. Также может оказаться возможным изменить pH или добавить общие ионы для активных ингредиентов с ионизируемыми группами, для того чтобы ограничить растворимость в соответствии с принципом Ле Шателье.
[88] Также следует помнить о природе соли, поскольку ее можно использовать для изменения физико-химических свойств, в частности растворимости, активного ингредиента.
[89] Первый активный ингредиент предпочтительно микронизирован с применением, например, известных в области техники способов уменьшения размера, таких как способы механической микронизации, размола на струйной мельнице, мокрого размола, криогенного измельчения, ультразвуковой обработки, гомогенизации под высоким давлением, микрофлюидизации и кристаллизации, для того чтобы облегчить его растворение в водной жидкости.
[90] Распределение по размеру частиц первого активного ингредиента используется для достижения однородности в распыленных каплях во время сушки распылением. При определении посредством лазерной дифракции (Sympatec) x50 (медианный диаметр) должен составлять менее чем 3,0 мкм, предпочтительно менее чем 2,0 мкм или даже 1,0 мкм. Фактически, предполагается включение нерастворимых наночастиц (x50<1000 нм или 200 нм). x90 должен составлять менее чем 7 мкм, предпочтительно менее чем 5 мкм, предпочтительно менее чем 4 мкм или даже 3 мкм. Для наночастиц x90 должен составлять менее чем приблизительно 1000 нм.
[91] В предпочтительных вариантах осуществления сухой порошковой композиции нагрузка препаратом для первого активного ингредиента может составлять менее чем 30% вес/вес, предпочтительно менее чем 10% вес/вес. При содержании препарата менее чем приблизительно 30% вес/вес физический свойства и качество аэрозоля порошка определяются гидрофобным эксципиентом на границе раздела и складчатым строением частиц, независимо от того, два или три препарат включено в частицу.
[92] В вариантах осуществления, в которых два или более активных ингредиента по существу нерастворимы в воде, может оказаться предпочтительным, чтобы они имели сходное исходное распределение по размеру частиц, так что распределение по аэродинамическому размеру частиц и картина отложения в легких были схожими для активных ингредиентов в монокомпозициях.
[93] В предпочтительных вариантах осуществления растворимость в воде второго активного ингредиента составляет более чем 1 мг/мл, предпочтительно более чем 10 мг/мл или 30 мг/мл (смотри фигуру 2). Следует заметить, что повышенное содержание твердого вещества помогает добиваться того, чтобы первый активный ингредиент (который по существу нерастворим в воде) не растворялся в водной фазе исходного материала, но это также налагает дополнительные ограничения в том, что растворимость второго активного ингредиента должна быть высокой. Достижение требуемой физической формы для обоих активных ингредиентов может потребовать компромисса в отношении содержания твердого вещества и нагрузки препаратом или даже качества аэрозоля и массы заполнения блистера. Присутствие аморфного активного ингредиента может также потребовать добавления эксципиента, для того чтобы стабилизировать аморфную фазу.
[94] В предпочтительных вариантах осуществления исходный материал состоит из микронизированных кристаллов первого активного ингредиента, диспергированных в непрерывной фазе эмульсии типа масло-в-воде, а второй активный ингредиент растворен в непрерывной фазе.
[95] Дисперсная масляная фаза служит в качестве порообразующего средства для повышения складчатости частиц в высушенном распылением продукте препарата. Подходящие порообразующие средства включают различные фторированные масла, включая перфлуброн, перфтордекалин и перфтороктилэтан. Капли эмульсии стабилизируются монослоем длинноцепочечного фосфолипида, который служит в качестве гидрофобного эксципиента в высушенных распылением частицах.
[96] Эмульсию можно получать, в начале диспергируя гидрофобный эксципиент в горячей дистиллированной воде (например, 70ºC) с применением подходящей механической мешалки с большими сдвиговыми усилиями (например, мешалки ULTRA-TURRAX T-25) при 8000 об/мин в течение 2-5 минут. Если гидрофобный эксципиент представляет собой фосфолипид, можно добавлять двухвалентный металл, например хлорид кальция, для уменьшения гидратации головной группы, как рассмотрено выше. Затем добавляют по каплям при перемешивании фтороуглеводород. Затем полученную эмульсию фтороуглеводорода в воде можно обрабатывать с помощью гомогенизатора высокого давления для уменьшения размера частиц. Как правило, эмульсию подвергают двум-пяти отдельным проходам при 8000-20000 psi для получения капель с медианным диаметром менее чем 600 нм. Второй активный ингредиент и другие растворимые в воде эксципиенты растворяют в непрерывной фазе эмульсии. Первый активный ингредиент, предпочтительно в микронизированной форме, добавляют в непрерывную фазу эмульсии и перемешивают и/или гомогенизируют до тех пор, пока он не будет диспергирован, и не образуется суспензия. При сушке оболочка из гидрофобных фосфолипидов образуется на поверхности частиц. Растворимый в воде препарат и стеклообразующие эксципиенты диффундируют через распыленные капли. В итоге масляная фаза улетучивается через поры с получением высушенных распылением частиц и складчатого строения частиц. Кристаллический препарат, аморфный препарат и фосфолипид являются по существу фазово-разделенными в высушенных распылением частицах, причем поверхность частиц состоит главным образом из гидрофобного фосфолипидного эксципиента. Объемная доля дисперсной фазы составляет обычно от 0,03 до 0,5, причем предпочтительными являются значения между 0,1 и 0,3.
[97] В предпочтительных вариантах осуществления исходный материал имеет водную основу, однако ингаляционные порошки лекарственного препарата настоящего изобретения можно также получать с применением органических растворителей или систем биорастворителей. Системы этанол/вода являются особенно подходящими в качестве средства регулирования растворимости одного или нескольких материалов, содержащих частицы.
[98] Кроме того, может оказаться возможным составить два исходных материала (т.е. диспергировать первый активный ингредиент в воде и растворить гидрофобный эксципиент и второй активный ингредиент в этаноле) и затем объединить два исходных материала с помощью сдвоенной форсунки для жидкости для получения одного исходного материала к моменту высушивания.
[99] Важно минимизировать растворимость первого API, для того чтобы предотвратить образование аморфного препарата, который может оказывать негативное воздействие на долговременную стабильность. Второй API составляют/обрабатывают так, чтобы он был аморфным. В этом случае может оказаться выгодным стабилизировать аморфную фазу. Предполагаются эксципиенты, которые повышают Tg (таблица 2).
[100] При наличии сухой порошковой композиции важно контролировать содержание влаги в продукте препарата. Для препаратов, которые не являются гидратами, содержание влаги в порошке составляет, предпочтительно, менее чем 5%, более часто менее чем 3% или даже 2% вес/вес. Низкое содержание влаги важно для поддержания высокой температуры стеклования (Tg) для аморфной фазы, содержащей второй активный ингредиент. Содержание влаги, однако, должно быть достаточно высоким для того, чтобы гарантировать, что порошок не будет проявлять значительных электростатических сил притяжения. Содержание влаги в высушенных распылением порошках определяют посредством титрования по Карлу Фишеру.
[101] При том, что предпочтительные варианты осуществления описывают способы производств, в которых используются исходные материалы на основе воды, кристаллы с аморфным покрытием настоящего изобретения можно также получать с применением органических растворителей или систем биорастворителей.
[102] В одном варианте осуществления микронизированный кристаллический препарат A диспергирован в органическом растворителе, в котором данный препарат имеет низкую растворимость, и в котором растворимы препарат B и гидрофобный эксципиент. Получаемый исходный материал затем сушат распылением для получения кристаллов препарата A, покрытых аморфным слоем препарата B и гидрофобного эксципиента. Предпочтительной смесью растворителей является смесь этанол/вода. Отношение этанола к воде можно изменять, для того чтобы изменять растворимость эксципиента и препаратов.
[103] Кроме того, может оказаться возможным составить два исходных материала (т.е. диспергировать нерастворимый в воде препарат в воде и растворить гидрофобный эксципиент и препарат в этаноле) и затем объединить два исходных материала в сдвоенной форсунке для жидкости для получения одного исходного материала к моменту высушивания.
[104] На второй стадии способа настоящего изобретения исходный материал, полученный на первой стадии, сушат распылением для получения сухой порошковой композиции настоящего изобретения. Получаемые высушенные распылением частицы содержат ядро из первого активного ингредиента в по существу кристаллической форме, второй активный ингредиент в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем эти три материала являются по существу фазово-разделенными в высушенных распылением частицах.
[105] Сушка распылением можно осуществлять с применением обычного оборудования, применяемого для получения высушенных распределением частиц для применения в фармацевтических препаратах, которые вводят посредством ингаляции. Коммерчески доступные распылительные сушилки включают производимые Büchi Ltd. и Niro Corp.
[106] Свойства поверхности и строения частиц регулируются посредством регулирования растворимости и коэффициента диффузии компонентов в исходном материале. Поверхностно-активные гидрофобные эксципиенты (например, трилейцин, фосфолипиды, мыла жирных кислот) могут концентрироваться на границе раздела, улучшая флюидизацию и диспергируемость порошка, в то же время обеспечивая повышенную шероховатость поверхности частиц.
[107] Как правило, исходный материал распыляют в поток теплого фильтрованного воздуха, который выпаривает растворитель и переносит высушенный продукт в коллектор. Из использованного воздуха затем извлекают растворитель. Рабочие параметры распылительной сушилки, такие как температура на входе и на выходе, скорость подачи, давление распыления, скорость потока сухого воздуха и конфигурация распылителя, можно регулировать, для того чтобы получать требуемые размер частиц, содержание влаги и выход продукции получаемых сухих частиц. Выбор соответствующего устройства и условий работы находится в компетенции специалиста в данной области техники с учетом сведений, приведенных в настоящем описании, и может быть осуществлен без проведения лишних экспериментов. Типичными параметрами являются следующие: температура входящего воздуха между приблизительно 60°C и приблизительно 170°C, как например между 80°C и 120°C; температура выходящего воздуха между приблизительно 40°C и приблизительно 120°C, как например между приблизительно 50°C и 80°C; скорость подачи между приблизительно 3 мл/мин и приблизительно 15 мл/мин; поток всасываемого воздуха приблизительно 300 л/мин; и скорость распыляющего потока воздуха между приблизительно 25 л/мин и приблизительно 50 л/мин. Содержание твердого вещества в исходном материале для сушки распылением, как правило, лежит в диапазоне от 0,5% вес/вес до 20% вес/вес, как например от 1,0% вес/вес до 10% вес/вес. Данные параметры, однако, изменяются в зависимости от типа применяемого оборудования и свойств используемой системы растворителей. В любом случае, применение данных и аналогичных способов делает возможным образование частиц с диаметрами, подходящими для отложения аэрозоля в легком.
[108] В определенных вариантах осуществления порообразующее средство не требуется для достижения искомых флюидизации и диспергируемости порошка. В одном таком варианте осуществления кристаллы первого активного ингредиента диспергируют в водной фазе, содержащей растворенный гидрофобный эксципиент и второй активный ингредиент. В данном варианте осуществления складчатость поверхности частиц определяется содержанием плохо растворимого гидрофобного эксципиента и условиями сушки распылением. Например, гидрофобный эксципиент трилейцин является поверхностно-активным и имеет ограниченную растворимость в воде. Как таковое, оно стремится присутствовать в высокой концентрации на поверхности раздела воздух/вода в распыляемых каплях. Во время процесса сушки гидрофобный трилейцин осаждается раньше других компонентов в растворе, образуя наружный слой поверхности распыляемых капель. Строение/складчатость оболочки затем определяется реологическими свойствами трилейцинового наружного слоя и кинетикой высушивания. Получаемая оболочка может быть похожа на изюм. Складчатый слой гидрофобного трилейцина, присутствующего на границе раздела частиц, улучшает флюидизацию и диспергируемость порошка получаемых частиц лекарственного препарата.
[109] В одном варианте осуществления фосфолипид, такой как длинноцепочечный фосфатидилхолин, вводят в исходный материал в форме липосом (т.е. отсутствует дисперсная масляная фаза). Строение получаемых частиц определяется растворимостью фосфолипида и условиями сушки распылением, как рассмотрено выше для трилейцина.
[110] На первой или второй стадии может быть добавлено порообразующее средство, для того чтобы увеличить складчатость поверхности частиц, получаемых на третьей стадии. Это улучшает характеристики частиц в отношении флюидизации и диспергируемости.
[111] Настоящее изобретение предлагает сухую порошковую композицию, которая содержит вышеупомянутые высушенные распылением частицы.
[112] Сухая порошковая композиция может содержать от 0,1% до 30% вес/вес первого активного ингредиента, от 0,1% до 30% второго активного ингредиента и необязательно от 0,1% до 30% третьего активного ингредиента.
[113] Частицы сухой порошковой композиции настоящего изобретения могут иметь масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, например между 1,5 и 4 микронами.
[114] Частицы сухой порошковой композиции настоящего изобретения могут иметь масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, например составляющий от 1 до 3 микрон.
[115] Частицы сухой порошковой композиции настоящего изобретения могут иметь складчатость, составляющую более чем 1,5, например от 1,5 до 20, от 3 до 15 или от 5 до 10.
[116] Для того чтобы минимизировать межиндивидуальную вариабельность отложений в легких, частицы сухой порошковой композиции настоящего изобретения могут иметь содержание тонкодисперсных частиц, выраженное в виде процентной доли частиц <3,3 мкм от номинальной дозы (FPF<3,3мкм), составляющее более чем 40%, предпочтительно более чем 50%, но особенно более чем 60%. предполагается отложение в легких вплоть до 50-60% от номинальной дозы (60-80% от доставляемой дозы).
[117] Доля тонкодисперсных частиц сухой порошковой композиции настоящего изобретения, имеющих диаметр менее чем 4,7 мкм (т.е. FPF<4,7мкм) может составлять более чем 50%, например между 40% и 90%, особенно между 50% и 80%. Это минимизирует межиндивидуальную вариабельность, связанную с орофарингеальной фильтрацией.
[118] Составление обоих компонентов активных ингредиентов в одной частице препарата полезно для того, чтобы обеспечить постоянство распределения по аэродинамическому размеру частиц, и в частности FPF<3,3мкм, для обоих препаратов в данной композиции. Кроме того, распределения по аэродинамическому размеру частиц оказываются одинаковыми для моносоединений и их комбинаций.
[119] Различия в FPF<3,3мкм для двух API в сконструированных частицах должно составлять менее чем 10%, предпочтительно менее чем 5%, например менее чем 1%.
[120] Различия в FPF<3,3мкм для двух API в сконструированных комбинационных частицах по отношению к препаратам в соответствующих монокомпозициях должно составлять менее чем 15%, например менее чем 10% или менее чем 5%.
[121] Вариабельность в доле частиц сухой порошковой композиции настоящего изобретения с d2Q менее чем 500 (выраженная как средняя вариабельность) может составлять менее чем 20%, например менее чем 10%, особенно менее чем 5% в пределах диапазона падения давления в ингаляторе сухого порошка от 2 кПа до 6 кПа. d2Q является мерой инерционной импакции.
[122] Массовое отношение активных ингредиентов во фракции тонкодисперсных частиц (т.е. массовое отношение первого активного ингредиента ко второму активному ингредиенту в номинальной дозе) может лежать в пределах 10%, предпочтительно в пределах 5%, от отношения номинальных доз препаратов. В высушенных распылением частицах сухой порошковой композиции настоящего изобретения отношение двух активных ингредиентов неизменно во фракциях тонкодисперсных частиц, поскольку активные ингредиенты вместе составлены в одну частицу.
[123] В одном варианте осуществления настоящее изобретение предлагает сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес первого активного ингредиента, который по существу нерастворим в воде, от 0,1% до 30% растворимого в воде второго активного ингредиента в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем эти три материала являются по существу фазово-разделенными в высушенных распылением частицах, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5. Необязательно, в высушенные распылением частицы может быть включен третий активный ингредиент или в кристаллической, или в аморфной форме. В другом варианте осуществления настоящее изобретение предлагает сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес индакатерола или его соли, от 0,1% до 30% аморфного гликопирролата и фармацевтически приемлемый гидрофобный эксципиент, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5.
[124] При составлении лекарственных препаратов могут быть включены различные эксципиенты для повышения их стабильности, биосовместимости или других характеристик. Можно включать, например, соли, буферы, хелаторы и маскирующие вкус средства. Применение данных добавок ясно средним специалистам в данной области техники, и конкретные количества, отношения и типы средств могут быть определены экспериментально без проведения лишних экспериментов.
[125] Настоящее изобретение предлагает также единичную лекарственную форму, содержащую контейнер, содержащий сухую порошковую композицию настоящего изобретения.
[126] В одном варианте осуществления настоящее изобретение направлено на единичную лекарственную форму, содержащую контейнер, содержащий сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес первого активного ингредиента, находящегося в по существу кристаллической форме, от 0,1% до 30% второго активного ингредиента в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем эти три материала являются по существу фазово-разделенными в высушенных распылением частицах, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5. Необязательно, в высушенные распылением частицы может быть включен третий активный ингредиент, или в кристаллической, или в аморфной форме. В другом варианте осуществления настоящее изобретение направлено на единичную лекарственную форму, содержащую контейнер, содержащий сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес кристаллического индакатерола или его соли, от 0,1% до 30% аморфного гликопирролата и фармацевтически приемлемый гидрофобный эксципиент, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 10 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5.
[127] Примеры контейнеров включают, но без ограничения, капсулы, блистеры или укупорочные системы контейнеров, выполненные из металла, полимера (например, пластика, эластомера), стекла или тому подобного.
[128] Контейнер может быть вставлен в аэрозолизирующее устройство. Контейнер может иметь подходящие форму, размер и материал для вмещения сухой порошковой композиции и для обеспечения пригодного для использования состояния сухой порошковой композиции. Например, капсула или блистер могут содержать стенку, которая содержит материал, который не реагирует неблагоприятным образом с сухой порошковой композицией. Кроме того, стенка может содержать материал, который позволяет открыть капсулу, для того чтобы дать возможность аэрозолировать сухую порошковую композицию. В одном или нескольких вариантах стенка содержит один или несколько материалов из желатина, гидроксипропилметилцеллюлозы (HPMC), HPMC с добавлением полиэтиленгликоля, гидроксипропилцеллюлозы, агара, алюминиевой фольги или тому подобного.
[129] Применение блистеров фольга/фольга является особенно предпочтительным, в связи с тем, что по меньшей мере второй активный ингредиент сухой порошковой композиции настоящего изобретения находится в по существу аморфной форме. Выбор подходящей фольги для блистера лежит в пределах компетенции специалиста в данной области техники с учетом сведений, приведенных в настоящем описании. Свойства используемой фольги будут определяться влагопроницаемостью шва и пригодностью материала для формирования блистера соответствующих размера и формы. В одном варианте осуществления порошки помещают в блистеры фольга/фольга с массой наполнения между 0,5 и 10 мг.
[130] Сухие порошковые композиции настоящего изобретения применяют для лечения обструктивных или воспалительных заболеваний дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких.
[131] Соответственно, настоящее изобретение предлагает способ лечения обструктивного или воспалительного заболевания дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких, который содержит введение субъекту, нуждающемуся в этом, эффективного количества вышеупомянутой сухой порошковой композиции. Например, в одном или нескольких вариантах осуществления субъекту вводят сухую порошковую композицию, содержащую от 0,1% до 30% вес/вес первого активного ингредиента в по существу кристаллическом препарате, который покрыт складчатым слоем, содержащим от 0,1% до 30% второго активного ингредиента в по существу аморфной форме, который диспергирован в гидрофобном эксципиенте, причем частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 10 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость Sv, составляющую более чем 1,5.
[132] Настоящее изобретение также относится к применению вышеупомянутой сухой порошковой композиции в производстве лекарственного препарата для лечения обструктивного или воспалительного заболевания дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких.
[133] Настоящее изобретение предлагает также вышеупомянутую сухую порошковую композицию для применения в лечении обструктивного или воспалительного заболевания дыхательных путей, в особенности астмы и хронического обструктивного заболевания легких.
[134] Лечение заболевания в соответствии с настоящим изобретением может представлять собой симптоматическое или профилактическое лечение или и то, и другое. Обструктивные или воспалительные заболевания дыхательных путей, к которым применимо настоящее изобретение, включают астму любого типа или происхождения, включая как эндогенную (неаллергическую) астму, так и экзогенную (аллергическую) астму. Также следует понимать, что лечение астмы включает лечение субъектов, например имеющих возраст менее 4 или 5 лет, которые проявляют симптомы свистящих хрипов, и которые диагностированы или могут быть диагностированы как "свистящие дети", известная категория пациентов, вызывающая большое беспокойство у медиков и в настоящее время часто идентифицируемая как астматики с начальной или ранней стадией заболевания. (Для удобства данное особое астматическое состояние называют "синдромом свистящего дыхания у детей".)
[135] Профилактическая эффективность лечения астмы доказывается снижением частоты или тяжести симптоматических приступов, например острых астматических или бронхоконстрикторных приступов, улучшением функции легких или улучшением гиперреактивности дыхательных путей. Она также может быть доказана снижением необходимости другой симптоматической терапии, т.е. терапии, предназначенной для ограничения или устранения симптоматического приступа при его возникновении, например противовоспалительными средствами (например, кортикостероидом) или бронхорасширяющими средствами. Профилактическая активность в отношении астмы может, в частности, проявляться у пациентов, страдающих "утренним погружением". "Утреннее погружение" является известным астматическим синдромом, обычным для значительного числа астматиков и характеризующимся астматическим приступом, например, между 4 и 6 часами утра, то есть в то время, которое обычно существенно отдалено от любой предшествующей используемой симптоматической астматической терапии.
[136] Другие воспалительные или обструктивные заболевания и состояния дыхательных путей, к которым применимо настоящее изобретение, включают острый респираторный дистрессовый синдром у взрослых (ARDS), хроническое обструктивное заболевание легких или дыхательных путей (COPD или COAD), включая хронический бронхит или одышку, связанные с ними, эмфизему, а также обострение гиперреактивности дыхательных путей вследствие терапии другим препаратом, в частности терапии другим ингаляционным препаратом. Настоящее изобретение также применимо для лечения бронхитов любого типа или происхождения, включая, например, острый, арахиновый, катаральный, крупозный, хронический или гнойный бронхит. Другие обструктивные или воспалительные заболевания дыхательных путей, к которым применимо настоящее изобретение, включают пневмокониоз (воспалительное часто встречающееся заболевание легких, часто сопровождающееся обструкцией дыхательных путей, как хронической, так и острой, возникающей вследствие многократного вдыхания пыли) любого типа или происхождения, включая, например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз.
[137] Сухая порошковая композиция настоящего изобретения особенно полезна для лечения астмы и COPD.
[138] Настоящее изобретение предлагает также систему доставки, включающую ингалятор и сухую порошковую композицию настоящего изобретения.
[139] В одном варианте осуществления настоящее изобретение направлено на систему доставки, включающую ингалятор и сухую порошковую композицию для ингаляции, содержащую высушенные распылением частицы, которые содержат ядро из первого активного ингредиента в по существу кристаллической форме, второй активный ингредиент в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент. Первый активный ингредиент, второй активный ингредиент и гидрофобный эксципиент являются по существу фазово-разделенными в данных высушенных распылением частицах.
[140] В предпочтительном варианте осуществления частицы содержат от 0,1% до 30% вес/вес первого активного ингредиента, который находится в по существу кристаллической форме, от 0,1% до 30% второго активного ингредиента в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5.
[141] В другом варианте осуществления настоящее изобретение направлено на систему доставки, включающую ингалятор и сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес первого активного ингредиента, который находится по существу кристаллической форме, от 0,1% до 30% второго активного ингредиента в по существу аморфной форме и фармацевтически приемлемый гидрофобный эксципиент, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5.
[142] В еще одном варианте осуществления настоящее изобретение направлено на систему доставки, включающую ингалятор и сухую порошковую композицию, содержащую высушенные распылением частицы, содержащие от 0,1% до 30% вес/вес кристаллического индакатерола или его соли, от 0,1 % до 30% аморфного гликопирролата и фармацевтически приемлемый гидрофобный эксципиент, причем данные частицы имеют масс-медианный диаметр (MMD), составляющий от 1 до 5 микрон, масс-медианный аэродинамический диаметр (MMAD), составляющий от 1 до 5 микрон, и складчатость, составляющую более чем 1,5. [QVA149]
[143] Подходящие ингаляторы включают ингаляторы сухого порошка (DPI). Некоторые такие ингаляторы включают ингаляторы, в которых сухой порошок хранится в капсуле, и пациент загружает одну или несколько капсул в устройство перед использованием. Другие ингаляторы сухого порошка включают ингаляторы, в которые загружают магазин капсул. Другие ингаляторы сухого порошка включают ингаляторы, в которые загружают блистерную упаковку, содержащую несколько доз порошка. В связи с аморфными свойствами по меньшей мере одного из активных ингредиентов настоящих частиц ингаляционного лекарственного препарата, предпочтительным для лекарственного препарата, содержащего такие частицы, является предварительное упаковывание в блистеры фольга/фольга, например в виде картриджа, стрипа или колеса.
[144] Предпочтительные ингаляторы сухого порошка включают многодозовые ингаляторы сухого порошка, такие как ингаляторы DISKUS™ (GSK, описан в US 6536427), DISKHALER™ (GSK, описан в WO 97/25086), GEMINI™ (GSK, описан в WO 05/14089), GYROHALER™ (Vectura, описан в WO 05/37353), PROHALER™ (Valois, описан в WO 03/77979) и TWISTHALER™ (Merck, описан в WO 93/00123, WO 94/14492 и WO 97/30743).
[145] Предпочтительные однодозовые ингаляторы сухого порошка включают ингаляторы AEROLIZER™ (Novartis, описан в US 3991761) и BREEZHALER™ (Novartis, описан в WO 05/113042). Они обычно менее сложны в эксплуатации, чем многие многодозовые ингаляторы сухого порошка.
[146] Предпочтительные однодозовые блистерные ингаляторы, которые некоторые пациенты находят более простыми и более удобными для использования для доставки лекарственных средств, требующих введения раз в день, включают ингалятор, описанный Nektar Therapeutics в WO 08/51621 и WO 09/117112.
[147] Ингаляторы сухого порошка с резервуаром обычно не являются предпочтительными для порошков настоящего изобретения вследствие возможных проблем со стабильностью, связанных с аморфным активным ингредиентом (ингредиентми).
[148] Однодозовые капсульные ингаляторы сухого порошка обычно не являются предпочтительными для пациентов с астмой, или если обращение с капсулой вызывает затруднения, или если полная масса порошка, требующая доставки (как правило от 1 до 2 мг), ниже, чем обычно требуется для таких ингаляторов.
[149] Особенно предпочтительными ингаляторами являются многодозовые ингаляторы сухого порошка, в которых энергия для флюидизирования и диспергирования порошка прикладывается пациентом (т.е. "пассивные" MD-DPI). Порошки настоящего изобретения флюидизируются и диспергируются эффективно при низких пиковых скоростях вдоха (PIF). В результате, наблюдаемые небольшие изменения в диспергировании порошка в зависимости от PIF эффективно уравновешиваются повышением инерционной импакции, которое имеет место при повышении PIF, что приводит к независимому от скорости потока отложению в легких. Отсутствие зависимости от скорости потока, наблюдаемое для порошков настоящего изобретения, приводит к уменьшению общей межиндивидуальной вариабельности. Подходящие блистерные пассивные многодозовые ингаляторы включают устройства DISKUS™ (GSK), GYROHALER™ (Vectura), DISKHALER™ (GSK), GEMINI™ (GSK) и PROHALER™ (Valois).
[150] Некоторые пациенты могут предпочитать использовать "активный" многодозовый ингалятор сухого порошка, в котором энергия для флюидизирования и диспергирования порошка предоставляется ингалятором. Подходящие ингаляторы такого типа включают ингаляторы сухого порошка с повышенным давлением, как раскрыто, например, в WO 96/09085, WO00/072904, WO00/021594 и WO 01/043530, и ингаляторы ASPIRAIR™ (Vectura). Другие активные устройства могут включать доступные от MicroDose Technologies Inc., такие как устройство, описанное в патентной публикации Соединенных штатов № 20050183724. Предпочтительными будут устройства, которые не только равномерно диспергируют порошки с помощью активного компонента устройства (например, сжатого воздуха, мешалки), но также стандартизируют профиль дыхания, так чтобы создавать обратную зависимость от скорости потока (т.е. повышают отложение в легких при уменьшении PIFR), что является обычным для активных DPI.
[151] Дополнительные варианты осуществления и характерные признаки частично изложены в нижеследующем описании и частично станут понятны специалистам в данной области техники после изучения данного описания изобретения, или могут быть обнаружены при практическом осуществлении настоящего изобретения.
[152] Настоящее изобретение далее проиллюстрировано нижеследующими примерами, которые не следует рассматривать как ограничивающие.
Примеры
Пример 1
Получение сухой порошковой композиции, содержащей высушенные распылением частицы, которые содержат формотерол и будесонид
[153] Сухую порошковую композицию, содержащую высушенные распылением частицы, которые содержат формотерола фумарат и будесонид, получали посредством двухстадийного производственного процесса.
[154] На первой стадии 1,38 г дистеароилфосфатидилхолина (DSPC) (Genzyme Pharmaceuticals, Cambridge, MA, США) и 119,6 мг хлорида кальция (J T Baker) диспергировали в 164 г горячей деионизированной воды (T=70°C) с применением мешалки с большими сдвиговыми усилиями ULTRA-TURRAX™ (модель T-25) при 10000 об/мин в течение приблизительно 1 минуты. Затем полученную дисперсию DSPC/CaCl2 охлаждали в ледяной бане. При перемешивании добавляли 98 мг микронизированного формотерола фумарата (Industriale Chimica s.r.i, Италия). Формотерол имеет растворимость в воде, равную приблизительно 1 мг/мл, и как таковой растворяется в водной фазе. Затем полученную дисперсию формотерол/DSPC/CaCl2 пропускали 2 раза через гомогенизатор высокого давления (гомогенизатор высокого давления AVESTIN EMULSIFLEX-C5™, Оттава, Канада) при 20000 фунтов на квадратный дюйм (psi). 1,45 г микронизированного кристаллического будесонида (Industriale Chimica s.r.i, Италия) диспергировали в водной фазе, и полученную дисперсию дополнительно 3 раза пропускали через гомогенизатор высокого давления при 20000 psi.
[155] На второй стадии полученный исходный материал сушили распылением в распылительной минисушилке BÜCHI B-191™ (Büchi, Flawil, Швейцария). Состав сухих компонентов исходного материала приведен в таблице 3 ниже. Использовали следующие условия распыления: общая скорость потока = 28 SCFM, температура на входе = 85°C, температура на выходе = 57°C, насос подачи = ~2 мл∙мин-1, давление распылителя = 60 psig, скорость потока распылителя = 34 см (ротаметр).
|
[156] Свободнотекучий белый порошок собирали с применением циклонного сепаратора. Геометрический диаметр сконструированных частиц измеряли с применением лазерной дифракции (SYMPATEC HELOS™ H1006, Clausthal-Zellerfeld, Германия), обнаружив, что объемно-взвешенный средний диаметр (VMD) равен 2,1 мкм. Анализ с помощью сканирующей электронной микроскопии (SEM) продемонстрировал, что порошки представляют собой небольшие морщинистые частицы с высокой шероховатостью поверхности. Отсутствовали признаки отдельных кристаллов препарата будесонида на пяти SEM-изображениях, полученных для каждого коллектора. Составные частицы содержат микронизированные кристаллы кристаллического будесонида, покрытые аморфным слоем формотерола фумарата и DSPC/CaCl2. При производстве данного порошка не использовали порообразующее средство.
Пример 2
Получение сухих порошковых композиций, содержащих высушенные распылением частицы, которые содержат комбинации фиксированных доз микронизированных кристаллов индакатерола малеата, покрытых аморфным гликопирролатом и фосфолипидом
[157] В данном примере ингаляционные сухие порошки, содержащие индакатерола малеат, гликопирролат и эксципиенты (дистеароилфосфатидилхолин (DSPC), хлорид кальция и трегалозу), получали посредством сушки распылением эмульсионного исходного материала.
[158] Исходный материал получали посредством смешивания приготовленных по отдельности эмульсии основы и добавляемого раствора препарата.
[159] Эмульсию основы получали посредством эмульгирования перфтороктилбромида (PFOB, перфлуброн) в водной дисперсии DSPC, содержащей растворенный CaCl2. Использовали двухстадийный способ, в котором грубую эмульсию получали с помощью мешалки с большими сдвиговыми усилиями ULTRA-TURRAX™, за чем следовала гомогенизация посредством гомогенизатора AVESTIN C-50™. Получаемая эмульсия основы представляла собой стабильную эмульсию типа масло-в-воде с медианным размером капель эмульсии в диапазоне 0,20-0,40 мкм.
[160] Добавляемый раствор препарата получали посредством суспендирования микронизированных кристаллов индакатерола малеата в воде с применением мешалки с большими сдвиговыми усилиями ULTRA-TURRAX™, затем растворения гликопирролата в водной среде. В тех эмульсиях, в которых использовали трегалозу в качестве стеклообразующего средства, весовое отношение трегалозы к гликопирролату составляло 2:1 вес/вес.
[161] Исходный материал получали посредством смешивания соответствующих количеств эмульсии основы и добавляемого раствора препарата для получения раствора с содержанием твердого вещества, равным 3% вес/об, и объемной долей PFOB, равной приблизительно 0,2. Таким образом, готовый исходный материал состоял из водного раствора (непрерывная фаза) гликопирролата, трегалозы и хлорида кальция с двумя дискретными фазами: микронизированными кристаллами индакатерола малеата и каплями эмульсии, стабилизированными с помощью DSPC.
[162] Конфигурация распылительной сушилки включает один двойной жидкостный распылитель, камеру сушки, циклонный сепаратор, адаптор, изолирующий клапан и коллектор емкостью 1 л в рубашке для регулирования температуры. Параметры сушки распылением, использованные для получения порошков ингаляционного лекарственного препарата, приведены в таблице 4:
|
[163] Во время сушки распыление перистальтический насос подавал исходную жидкость в распылитель, создавая тонкодисперсный аэрозоль капель жидкости. Предварительно нагретый сухой воздух подавали в камеру сушки и смешивали с каплями, что приводило к образованию твердых частиц, содержащих микронизированные кристаллы индакатерола малеата, покрытые складчатым слоем аморфного гликопирролата и DSPC. Частицы собирали с выходом приблизительно 60% с применением циклонного сепаратора. Номинальные составы высушенных распылением порошков представлены в таблице 5.
|
где
1 Представляет собой индакатерол 6,0% вес/вес
2 Представляет собой гликопирролат 1,0% или 2,0% вес/вес
3 Отношение DSPC:CaCl2 составляло 2:1 моль:моль
4 pH доводили до pH 5,0 с помощью NaOH
Пример 3
Физико-химические свойства сухой порошковой композиции, содержащей высушенные распылением частицы, которые содержат комбинации фиксированных доз индакатерола малеата и гликопирролата
[164] В данном примере измеряли физико-химические свойства (например, строение, исходный размер частиц) порошков, полученных в соответствии с примером 2.
[165] Для качественного определения строения высушенных распылением частиц использовали сканирующую электронную микроскопию (SEM). Образцы закрепляли на кремниевых пластинах, которые затем закрепляли на двусторонней углеродной ленте на алюминиевом столике для SEM. Закрепленные порошки затем покрывали напылением смеси золото:палладий в устройстве для ионного напыления DENTON™ в течение 60-90 секунд при 75 мторр и 42 мА, получая покрытие толщиной приблизительно 150 Å. Изображения получали с помощью сканирующего электронного микроскопа PHILIPS™ XL30 ESEM™, работающего в режиме глубокого вакуума, с применением детектора Everhart-Thornley для захвата вторичных электронов для построения изображений. Ускоряющее напряжение устанавливали равным 20 кВ, применяя источник LaB6. Рабочее расстояние составляло между 5 и 6 мм.
[166] На SEM-изображениях порошков индакатерол/гликопирролат (лоты A2, A3, A4, A5) видны признаки значительной пористости, особенности эмульсионного способа сушки распылением. Качественная оценка подтверждает, что частицы, составленные с трегалозой, имеют большие размеры при использованных условиях сушки.
[167] Исходные распределения по размеру частиц определяли с применением лазерной дифракции. Образцы порошков подвергали измерениям с применением анализатора размера частиц SYMPATEC HELOS, оснащенного микродозатором ASPIROS и модулем для диспергирования сухого порошка RODOS (Sympatec GmbH, Clausthal-Zellerfeld, Германия). Для анализа образцов использовали следующие параметры: масса образца приблизительно 10 мг, запускающая оптическая концентрация (Copt) приблизительно 1% и рабочее давление 4 бара. Данные собирали в течение времени измерения, равного 10 секундам. Распределения по размеру частиц рассчитывали с помощью программного обеспечения прибора с применением модели Фраунгофера. Перед проведением измерений над образцами определяли пригодность системы посредством измерения исходного распределения по размеру частиц эталонного стандарта из карбида кремния, поставляемого Sympatec GmbH.
[168] MMD (x50) основанных на трегалозе порошков (2,8 мкм) оказался приблизительно на 1 мкм больше, чем у порошков, получаемых без трегалозы (от 1,7 до 1,8 мкм).
Пример 4
Качество аэрозоля сухих порошковых ингаляционных композиций, содержащих высушенные распылением частицы, которые содержат комбинации фиксированных доз индакатерола малеата и гликопирролата, доставляемых посредством пассивного ингалятора сухого порошка
[169] Эффективность доставки в легкие типичных сухих порошковых композиций, содержащих высушенные распылением частицы, которые содержат комбинации фиксированных доз индакатерола малеата и гликопирролата, полученных в соответствии с примером 2, характеризовали посредством заполнения порошком блистера фольга/фольга и диспергирования порошка с помощью ингалятора сухого порошка, описанного в международной патентной заявке WO 08/51621, т.е. портативного пассивного ингалятора сухого порошка с блистером с единичными дозами, разработанного Novartis (San Carlos, CA, США).
[170] Распределение по аэродинамическому размеру частиц (aPSD) получаемой дозы аэрозоля определяли с применением NEXT GENERATION IMPACTOR™ при скоростях потока, равных 35 л/мин и 47 л/мин, соответствующих падениям давления в ингаляторе 4 кПа и 6 кПа соответственно. Следует заметить, что для настоящих целей скорость потока и падение давления связаны через сопротивление потоку ингалятора и используются взаимозаменяемо. Распределение по массе каждого активного ингредиента на ступенях каскадного импактора определяли с применением ВЭЖХ-анализа.
[171] Показатели аэрозоля, определенные для типичной порошковой композиции (лот A2), имеющей теоретический состав порошка 6% индакатерола (7,8% малеата), 2% гликопирролата (2,5%), 83,8% DSPC и 5,9% CaCl2, представлены в таблице 6.
|
[172] Таблица 6 представляет масс-медианный аэродинамический диаметр (MMAD) и FPF<3,3мкм для каждого компонента препарата при двух различных скоростях потока, примерно соответствующих удобному и усиленному способам ингаляции. При заданной скорости потока значения MMAD и FPF<3,3мкм в значительной степени совпадают (различия составляют менее чем 2%). Это подтверждает, что два лекарственных вещества были эффективно составлены в одну частицу.
[173] Это отличается от комбинаций фиксированных доз, содержащих смеси микронизированных препаратов, в которых часто наблюдаются значительные различия в доле тонкодисперсных частиц для каждого активного ингредиента в результате различных адгезионных свойств с крупными лактозными частицами носителя.
[174] Ожидается, что композиции настоящего изобретения приведут к значительным улучшениям в направленном воздействии на легкие и постоянстве доз по отношению к продаваемым в настоящее время ингаляторам на основе смесей или агломератов микронизированного препарата.
[175] В отношении направленного воздействие на легкие наилучшим коррелятом для общего отложения в легких оказалось содержание частиц, меньших чем приблизительно 3 мкм. На основании данного показателя предполагается, что общее отложение в легких будет составлять приблизительно 60% от доставляемой дозы. Улучшенное направленное воздействие на легкие снижает требуемую номинальную дозу, в то же время значительно уменьшая орофарингеальное отложение. Ожидается, что это уменьшит возможность оппортунистических инфекций (например, кандидиаза или пневмонии) у пациентов с астмой/COPD, которые возникают из-за применения кортикостероидов. Улучшенное направленное воздействие может также приводить к пониженным системным концентрациям препарата, когда лекарственный препарат является биодоступным перорально (например, индакатерол).
[176] В отношении улучшенного постоянства доз ожидается, что высушенные распылением порошки настоящего изобретения улучшат постоянство доз одним или несколькими способами из: (a) уменьшения вариабельности, связанной с орофарингеальной фильтацией; (b) уменьшения вариабельности, связанной с дыхательными движениями пациента, в частности вариаций пиковой скорости вдоха; (c) уменьшения вариабельности в комбинации фиксированных доз, связанной с различиями в адгезионных свойствах двух препаратов с носителем.
[177] Общее отложение в легких как функция вариаций скорости потока (Q) зависит не только от распределения частиц аэрозоля по аэродинамическому размеру, но также от вариаций в инерционной импакции, которые имеют место при изменениях скорости потока. Другими словами, ожидается, что для заданного aPSD легочная доза уменьшится, если скорость потока возрастает. Для того чтобы достичь независимости от скорости потока in vivo, важно достичь равновесия между этими двумя противоположными факторами. Простым способом учесть зависимость легочной дозы от обеих переменных, т.е. предельного диаметра аэродинамического размера частиц d и скорости потока Q, является выражение aPSD через предельную величину содержания тонкодисперсных частиц, которая включит в себя обе переменные. Предполагая, что орофарингеальные потери в большей степени определяются инерционной импакцией, предельная величина для легочной дозы может быть выражена через параметр импакции, d2Q. Для того чтобы обозначить диапазон ингаляторов, был выбран определенный предельный d2Q, равный 500 мкм2∙л/мин, на основании того факта, что наилучшее соответствие отложению в легких обнаружено для фракции частиц с аэродинамическим размером, составляющим менее чем 3 мкм, и среднее сопротивление ингалятора, как правило, тестируют при скорости потока, равной приблизительно 60 л/мин.
[178] процентное отклонение FPFd2Q<500 при переходе от 35 л/мин к 47 л/мин составило 4,6% для индакатерола и 8,1% для гликопирролата. Следовательно, составление в виде сконструированного порошка существенно уменьшает наблюдаемую зависимость предполагаемой легочной дозы от скорости потока, тогда как, например, общее отложение в легких для будесонида из PULMICORT™ TURBUHALER™ уменьшается от 28% до 15% при переходе от усиленного к удобному способу ингаляции. Это согласуется с тем, что наблюдается клинически для монотерапий с помощью сконструированных частиц (смотри Duddu et al: Improved lung delivery from a passive dry powder inhaler using an engineered PulmoSphere™ powder. Pharm Res. 2002, 19:689-695).
[179] Ожидается, что наблюдаемое высокое содержание тонкодисперсных частиц приведет к доставке в легкие у пациентов, составляющей >60% доставляемой дозы. Ожидается, что это в свою очередь уменьшит вариабельность in vivo в легочной дозе до приблизительно 10-20%. Это можно сравнить с 30-50% для стандартных смесей микронизированных препаратов (смотри Olsson B, Borgstrom L: Oropharyngeal deposition of drug aerosols from inhalation products. Respiratory Drug Delivery 2006, pp. 175-182).
[180] Составление двух активных веществ в одну сконструированную частицу практически устраняет вариабельность, связанную с различиями в адгезионных свойствах между препаратом и носителем. Это делает возможной эффективную доставку двух активных ингредиентов к двум различным мишеням на одной и той же клетке.
Пример 5
Исследование порошковой рентгеновской дифракции сухих порошковых композиций, содержащих высушенные частицы, содержащие микронизированные кристаллы индакатерола малеата, покрытые пористым слоем аморфного гликопирролата и фосфолипида
[181] Высушенные распылением частицы, содержащие комбинации фиксированных доз индакатерола малеата и гликопирролат получали с применением способа, описанного в примере 2 (таблица 7). Отношение индакатерола малеата к гликопирролату составляло 3:1 в обеих композициях. Концентрацию каждого активного ингредиента выражали в чистом основании. Также получали композицию основы (лот V1). Данная композиция содержит DSPC:CaCl2 в отношении 2:1 моль:моль.
|
[182] Картины рентгеновской порошковой дифракции (XRPD) исследованных порошков (смотри фигуру 3) получали с применением системы рентгеновской порошковой дифракции SHIMADZU XRD-6000™ с графитовым монохроматором и сцинтилляционным детектором (Shimadzu Corporation, Япония). Образцы сканировали в диапазоне 2θ от 3° до 40° при 0,4° 2θ/мин с шагом 2θ 0,02° с применением источника излучения Cu с длиной волны, равной 1,54 Å, работающего при 40 кВ и 40 мА. В данной работе использовали щели расходимости 0,5°, рассеяния 0,5° и приемную 0,3 мм. Подготавливали один образец каждого материала посредством упаковывания нерасфасованного порошка в хромированный медный держатель для образцов и получали от такого образца одно измерение. Во время сбора данных камеру с регулируемыми условиями на рентгеновском приборе продували сухим газом N2.
[183] Фигура 3 изображает картины широкоугольной рентгеновской порошковой дифракции двух композиций комбинаций фиксированных доз индакатерола и гликопирролата. Для сравнения представлены картины рентгеновской порошковой дифракции (высококристаллического) сырья индакатерола и плацебо-композиции (DSPC:CaCl2). Оба порошка с комбинацией фиксированных доз демонстрируют дифракционные пики, которые указывают на присутствие кристаллического индакатерола, как видно из соответствия положений пиков данных композиций с пиками в порошковой картине индакатерольного API. Порошковая картина каждой композиции также имеет широкий заметный пик при 2θ 21,3º, который возникает от DSPC. Кроме этого пика все остальные пики можно отнести к индакатеролу, что указывает на то, что гликопирролат является аморфным. Таким образом, порошковые картины обеих композиций указывают на то, что два препарата присутствуют в разделенных фазах, причем индакатерол является кристаллическим, а гликопирролат является аморфным. Кроме того, DSPC присутствует в качестве гелевой фазы с характерным для нее дифракционным пиком. Следовательно, два препарата и гидрофобный эксципиент эффективно разделены фазово по своим доменам в высушенных распылением частицах.
Пример 6
Воздействие добавления стеклообразующего стабилизирующего эксципиента на химическую стабильность сухих порошковых композиций, содержащих кристаллический индакатерола малеат, аморфный гликопирролат и гидрофобный эксципиент (DSPC или лейцин)
[184] Ряд композиций, содержащих комбинации фиксированных доз индакатерола малеата и гликопирролата, представлен в таблице 8. Есть две основные группы композиций. В первой группе композиций используется DSPC в качестве гидрофобного эксципиента и эмульсионного исходного материала. Во второй группе используется лейцин в качестве гидрофобного эксципиента без эмульсионной фазы. Эмульсионные композиции получают посредством сушки распылением основного исходного материала, содержащего диспергированные кристаллы индакатерола малеата в субмикронной эмульсии PFOB в воде, в которой капли эмульсии стабилизированы DSPC:CaCl2 в отношении 2:1 моль:моль. Гликопирролат растворен в непрерывной фазе эмульсии и присутствует в виде аморфного твердого вещества в высушенных распылением частицах. В композиции C3 добавлено 20 мМ натрий-малеатного буфера (pH 5,7) к основной DSPC композиции. Повышение pH уменьшает растворимость индакатерола, тем самым ограничивая аморфные формы индакатерола. Малеат натрия также служит в качестве стеклообразующего стабилизирующего средства, улучшающего физическую и химическую стабильность аморфной фазы. Композиция C4 содержит добавленную трегалозу, альтернативный стеклообразующий стабилизирующий эксципиент. Композиция C5 содержит трегалозу и регулятор pH. Композиция C6 служит для изучения комбинаций фиксированных доз, содержащих высокие концентрации гликопирролата. Композиции C9 и C10 представляют собой основанные на лейцине композиции, содержащие соответственно цитрат тринатрия и трегалозу в качестве стеклообразующих стабилизирующих средств. DSPC-содержащие композиции получали, создавая для начала субмикронную эмульсию перфлуброна в воде с помощью гомогенизатора AVESTIN C-50™. Объемное содержание перфлуброна в эмульсии составляло 0,12 об/об. Гликопирролат и эксципиенты растворяли в непрерывной фазе эмульсии, и микронизированный индакатерола малеат диспергировали в непрерывной фазе эмульсии. Общее содержание твердого вещества составляло 5% вес/об. Основанные на лейцине исходные материалы получали посредством растворения эксципиентов и гликопирролата в воде. Затем к охлажденному раствору добавляли микронизированный индакатерол и диспергировали с помощью мешалки с большими сдвиговыми усилиями ULTRA TURRAX™. Исходный материал для сушки распылением имел содержание твердого вещества, равное 2,0% вес/об. Композиции сушили распылением на лабораторной распылительной сушилке. Оборудование распылительной сушилки включает двойной жидкостной распылитель, камеру сушки, циклонный сепаратор и коллектор емкостью 1 л в рубашке для регулирования температуры. Для сушки распылением были заданы следующие условия: температура на входе = 97±3°C, температура на выходе = 60±3°C, температура коллектора = 60±3°C, скорость потока сухого воздуха = 600±10 л/мин, скорость воздушного потока распылителя = 25±2 л/мин, скорость подачи жидкости = 10,0±0,5 мл/мин. Данные условия сушки распылением давали высушенные распылением частицы с целевой плотностью утряски, равной приблизительно 0,05 г/мл.
|
[185] Наличие растворенного индакатерола приводит к аморфному индакатеролу в продукте высушенного распылением препарата. Аморфный индакатерол менее стабилен химически, имеет повышенную степень гидролиза и образования энантиомеров при хранении. Наличие аморфного гликопирролата может также усиливать деградацию, поскольку аморфный гликопирролат может придавать пластичность материалу аморфного индакатерола. Высушенные распылением композиции, содержащие индакатерол, можно эффективно стабилизировать к химической деградации посредством минимизации растворенной доли посредством изменений в способе (например, понижения температуры исходного материала, повышения содержания твердого вещества в исходном материале или смешивания распылением частиц с высоким содержанием индакатерола с частицами, содержащими только эксципиенты. Альтернативно, аморфную фазу можно стабилизировать посредством добавления стеклообразующего стабилизирующего эксципиента.
[186] Химическую стабильность композиций таблицы 8 определяли посредством обращенно-фазной ВЭЖХ. Присутствие стеклообразующего стабилизирующего эксципиента (например, трегалозы, малеата натрия, цитрата тринатрия) было необходимо для эффективной стабилизации аморфной фазы в высушенных распылением частицах индакатерол/гликопирролат. После 3 месяцев хранения нерасфасованного порошка, упакованного в пакеты из многослойной фольги, при 40ºC/относительной влажности (RH) 75%, была отмечена только минимальная химическая деградация композиций, содержащих малеат натрия. Общее содержание энантиомеров индакатерола для C3 и C5 оставалось ниже 0,5%, тогда как общее содержание продуктов гидролиза индакатерола оставалось ниже 0,1%. В тех же самых композициях не наблюдали деградацию гликопирролата за 3 месяца при 40ºC/75% RH. Напротив, композиция C2 без добавления стеклообразующего средства имела содержание энантиомеров более чем 3% и общий гидролиз более чем 0,4% после 3 месяцев при 40ºC/75% RH. Ограниченную химическую деградацию также наблюдали для основанных на лейцине композиций (например, C10), в которых содержание энантиомеров индакатерола оставалось менее чем 0,75%, и общее содержание продуктов гидролиза менее чем 0,4%. Физические изменения в высушенных распылением частицах при хранении отмечены не были.
[187] Следовательно, было неожиданно обнаружено, что существует возможность сконструировать высушенные распылением частицы, в которых присутствуют три разделенные фазы (домены), которые остаются физически и химически стабильными при хранении. К ним относятся на первый взгляд несовместимые кристаллическая и аморфная фазы двух различных лекарственных веществ и гелевая фаза гидрофобного эксципиента.
Пример 7
Получение комбинации фиксированных доз, содержащей индакатерола малеат, мометазона фуроат и гликопирролат
[188] Состав продукта комбинации фиксированных доз, содержащего индакатерола малеат, мометазона фуроат и гликопирролат подробно представлен в таблице 9.
|
[189] Высушенный распылением порошок получают посредством эмульсионного способа сушки распылением, описанного ранее в примере 2. Индакатерола малеат и мометазона фуроат диспергируют в виде микронизированных кристаллов в непрерывной фазе субмикронной эмульсии перфлуброна в воде. Гликопирролат растворяют в непрерывной фазе данной эмульсии. Непрерывная фаза состоит из 20 мМ натрий-малеатного буфера (pH 5,5), получаемого из малеиновой кислоты и гидроксида натрия. Эмульсионный исходный материал имеет объемную долю дисперсной фазы 0,18. Капли стабилизируют с помощью монослоя дистеароилфосфатидилхолина (DSPC) и хлорида кальция. Отношение DSPC:хлорид кальция составляет 2:1 моль:моль. Общее содержание твердого вещества в исходном материале составляет 4,0%.
[190] Сложный эмульсионный исходный материал, содержащий капли субмикронной эмульсии, два диспергированных API, один растворенный API и буфер (стеклообразующее стабилизирующее средство), сушат распылением на портативной системе для сушки распылением в соответствии с условиями, приведенными в таблице 4. Получаемый порошок состоит из частиц, содержащих кристаллический индакатерол и мометазон, покрытые аморфным гликопирролатом и DSPC/CaCl2. Физико-химические и аэрозольные свойства высушенного распылением порошка определяются полым и пористым строением частиц и низкой поверхностной энергией, обеспечиваемой гидрофобным эксципиентом DSPC, которое сконцентрировано на границе раздела частиц.
[191] Различные признаки и варианты осуществления настоящего изобретения, упоминаемые в отдельных разделах выше, относятся, в соответствующих случаях, к другим разделам, mutatis mutandis. Следовательно, признаки, определенные в одном разделе, могут быть объединены с признаками, определенными в других разделах в соответствующих случаях.
[192] Специалисты в данной области техники обнаружат или смогут найти с применением только лишь обычных экспериментов множество эквивалентов конкретных вариантов осуществления настоящего изобретения, описанных в настоящем документе. Предполагается, что такие эквиваленты охватываются нижеследующей формулой изобретения.