Результат интеллектуальной деятельности: СОЛЬ ПРОИЗВОДНОГО ПИРРОЛИДИН-3-ИЛ-УКСУСНОЙ КИСЛОТЫ И ЕЕ КРИСТАЛЛЫ
Вид РИД
Изобретение
Область техники
[0001] Настоящее изобретение относится к соли производного пирролидин-3-ил-уксусной кислоты, обладающей ингибирующей активностью в отношении пути фракталкин-СХ3СR1, и ее кристаллам.
Предпосылки изобретения
[0002] Хемокины являются основными факторами, обуславливающими миграцию клеток; они регулируют проникновение лимфоцитов в ткани путем стимулирования движения клетки и активации адгезии молекул. Различают четыре класса хемокинов, которые обозначаются как СС, СХС, С и СХ3С, на основании последовательностей их первых двух цистеиновых остатков.
[0003] Фракталкин является единственным хемокином, относящимся к группе СХ3С; его структуре и функциям присущи отличительные особенности, которые не встречаются у других хемокинов. Фракталкин связывается с рецептором CX3CR1, что может способствовать прочной адгезии без посредничества селектина или интегрина даже при наличии физиологического кровотока. Это означает, что система фракталкин-СХ3СR1 опосредует многостадийный механизм инфильтрации с участием селектина или интегрина путем всего лишь одностадийной реакции.
[0004] Экспрессия фракталкина на эндотелиальных клетках сосудов индуцируется воспалительными цитокинами TNF и IL-1. С другой стороны, CX3CR1 экспрессируется на моноцитах, практически всех NK клетках и некоторых Т клетках, но не экспрессируется на нейтрофилах. Поэтому система фракталкин-СХ3СR1 считается в высшей степени эффективным механизмом для передвижения иммунных клеток на эндотелиальные клетки поврежденных тканей или в ткани.
[0005] В отношении взаимосвязи система фракталкин-СХ3CR1 и патологии предполагается, что система фракталкин-СХ3CR1 участвует в развитии и патологических состояниях аутоиммунных заболеваний, таких как ревматоидный артрит, воспалительное заболевание кишечника, волчаночный нефрит, рассеянный склероз (Непатентный литературный источник 1). В частности, в отношении воспалительного заболевания кишечника сообщалось, что экспрессия фракталкина усиливается на воспалительных участках тканей толстой кишки пациентов и что CX3CR1 играет важную роль в проникновении иммунных клеток в ткани толстой кишки (Непатентный литературный источник 2).
[0006] Антитела, описанные в Патентном литературном источнике 1, и низкомолекулярные соединения, описанные в Патентных литературных источниках 2-6, уже известны как ингибиторы фракталкина.
[0007] Кроме того, сообщается, что соединения, описанные в Патентном литературном источнике 7, полезны в качестве антагонистов рецептора CCR2, но отличаются от таких ингибиторов в целевом семействе хемокинов.
Список использованной литературы
Патентная литература
[0008]
Патентный литературный источник 1: Открытая публикация японской патентной заявки №2002/-345454
Патентный литературный источник 2: WO 2006/107257
Патентный литературный источник 3: WO 2006/107258
Патентный литературный источник 4: WO 2008/039138
Патентный литературный источник 5: WO 2008/039139
Патентный литературный источник 6: WO 2009/120140
Патентный литературный источник 7: Открытая публикация патентной заявки США №2010/0210633
Непатентная литература
[0009]
Непатентный литературный источник 1: Umehara et al., "Fractalkine in Vascular Biology", Arterioscler. Thromb. Vasc. Biol., Vol. 24, pp. 34-40, 2004
Непатентный литературный источник 2: Kobayashi et al., "Exclusive Increase of CX3CR1_CD28_CD4_T Cells in Inflammatory Bowel Disease and Their Recruitment as Intraepithelial Lymphocytes", Inflamm. Bowel. Dis., Vol. 13, pp. 837-846, 2007
Сущность изобретения
Техническая проблема
[0010] Целью настоящего изобретения является обнаружить соединение, обладающее ингибиторной активностью в отношении пути фpaктaлкин-CX3CR1.
Кроме того, поскольку физические свойства соединения, его соли и их кристаллов и их аморфных форм, используемых в качестве фармацевтических продуктов, в большой степени влияют на биоактивность лекарства, чистоту активного фармацевтического ингредиента, предписываемую лекарственную форму и т.п., в процессе разработки фармацевтического продукта необходимо исследовать, какая из форм вышеупомянутого соединения, соли, кристалла или аморфной формы является предпочтительной в качестве фармацевтического продукта. Таким образом, другой целью настоящего изобретения является обнаружить соль соединения, их кристаллы и их аморфные формы, которые пригодны в качестве активных фармацевтических ингредиентов.
Решение проблемы
[0011] Данными изобретателями обнаружено, что соединение (1), представленное следующей формулой, а именно 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусная кислота, обладает ингибиторной активностью в отношении пути фракталкин-СХ3CR1. Кроме того, данными изобретателями выделены различные типы солей органических карбоновых кислот и соединения (1), их кристаллов и их аморфных форм; ими определены физические свойства или их формы, и ими проведены различные исследования этих типов, в результате чего в настоящем изобретении была обнаружена соль органической карбоновой кислоты, ее кристалл и ее аморфная форма, которые пригодны в качестве активного фармацевтического ингредиента, тем самым завершая настоящее изобретение.
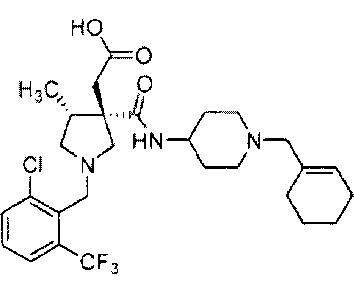
[0012] В частности, настоящее изобретение относится к:
1) соли органической карбоновой кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты;
2) соль согласно п. 1) выше, которая характеризуется тем, что органическая карбоновая кислота представляет собой L-миндальную кислоту;
3) соль согласно п. 1) выше, которая характеризуется тем, что органическая карбоновая кислота представляет собой L-молочную кислоту;
4) кристалл соли органической карбоновой кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты;
5) кристалл согласно п. 4) выше, который характеризуется тем, что органическая карбоновая кислота представляет собой L-миндальную кислоту;
6) кристалл согласно п. 4) выше, который характеризуется тем, что органическая карбоновая кислота представляет собой L-молочную кислоту;
7) кристалл согласно п. 5) выше, который характеризуется тем, что он имеет дифракционный пик при угле дифракции (2θ±0,2°), равном 7,2°, при анализе методом рентгеновской порошковой дифрактометрии;
8) кристалл согласно п. 7) выше, который характеризуется тем, что он имеет дополнительные дифракционные пики при углах дифракции (2θ±0,2°), равных 14,4° и 15,7°, при анализе методом рентгеновской порошковой дифрактометрии;
9) кристалл согласно п. 8) выше, который характеризуется тем, что он имеет дополнительные дифракционные пики при углах дифракции (2θ±0,2°), равных 10,3° и 23,5°, при анализе методом рентгеновской порошковой дифрактометрии;
10) кристалл согласно п. 9) выше, который характеризуется тем, что он имеет дополнительные дифракционные пики при углах дифракции (2θ±0,2°), равных 12,9°, 14,9°, 17,2°, 20,1° и 24,7°, при анализе методом рентгеновской порошковой дифрактометрии;
11) кристалл согласно п. 5) выше, который характеризуется тем, что он имеет пики при химических сдвигах (м.д.), равных 14,1, 52,9, 75,2, 144,7 и 174,0, в твердотельном спектре ЯМР 13С;
12) кристалл (А) согласно п. 6) выше, который характеризуется тем, что он имеет дифракционный пик при угле дифракции (2θ±0,2°), равном 6,9°, при анализе методом рентгеновской порошковой дифрактометрии;
13) кристалл (А) согласно п. 12) выше, который характеризуется тем, что он имеет дополнительные дифракционные пики при углах дифракции (2θ±0,2°), равных 15,7° и 17,1°, при анализе методом рентгеновской порошковой дифрактометрии;
14) кристалл (В) согласно п. 6) выше, который характеризуется тем, что он имеет дифракционный пик при угле дифракции (2θ±0,2°), равном 6,8°, при анализе методом рентгеновской порошковой дифрактометрии; и
15) кристалл (В) согласно п. 14) выше, который характеризуется тем, что он имеет дополнительные дифракционные пики при углах дифракции (2θ±0,2°), равных 13,7° и 16,8°, при анализе методом рентгеновской порошковой дифрактометрии;
Полезные результаты изобретения
[0013] Согласно настоящему изобретению можно получить соль органической карбоновой кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты, которая пригодна в качестве активного фармацевтического ингредиента, и ее кристалл.
Краткое описание графических материалов
[0014]
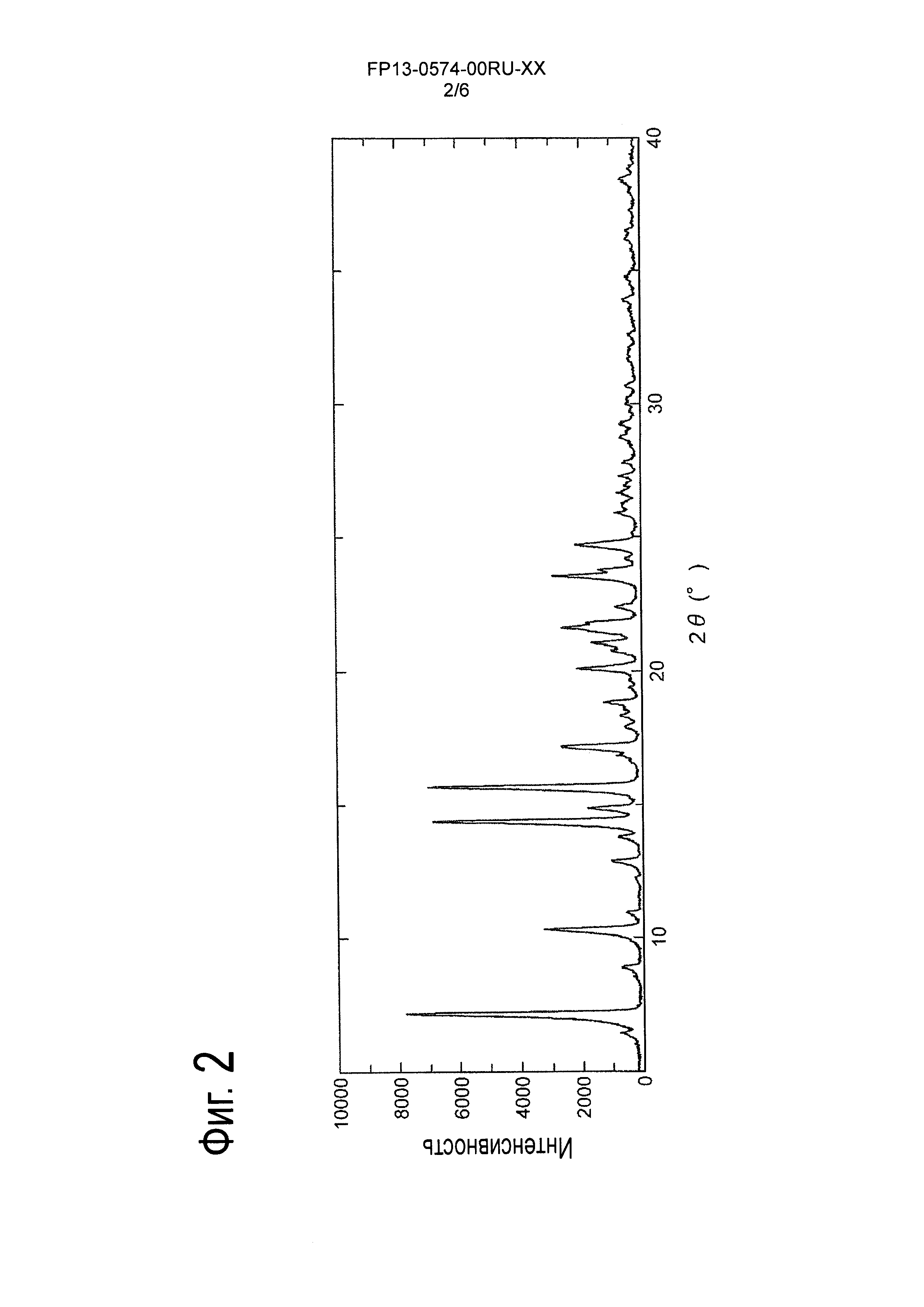
[Фигура 1] На Фигуре 1 показан твердотельный спектр ЯМР 13С кристалла соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты.
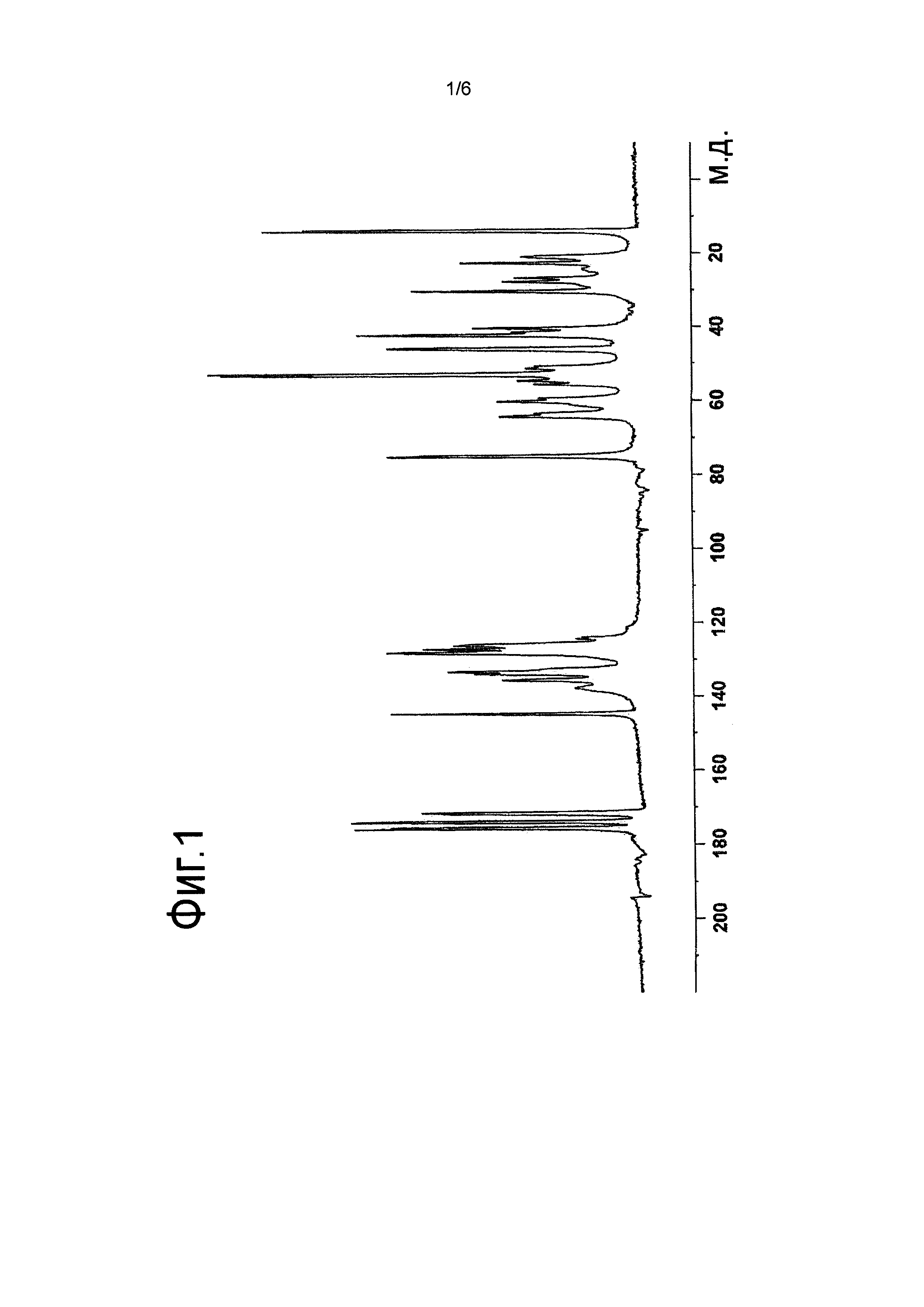
[Фигура 2] На Фигуре 2 показана дифракционная картина, полученная методом рентгеновской порошковой дифракции, кристалла соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты. По оси абсцисс показан угол дифракции 26, по оси ординат указана интенсивность пика.
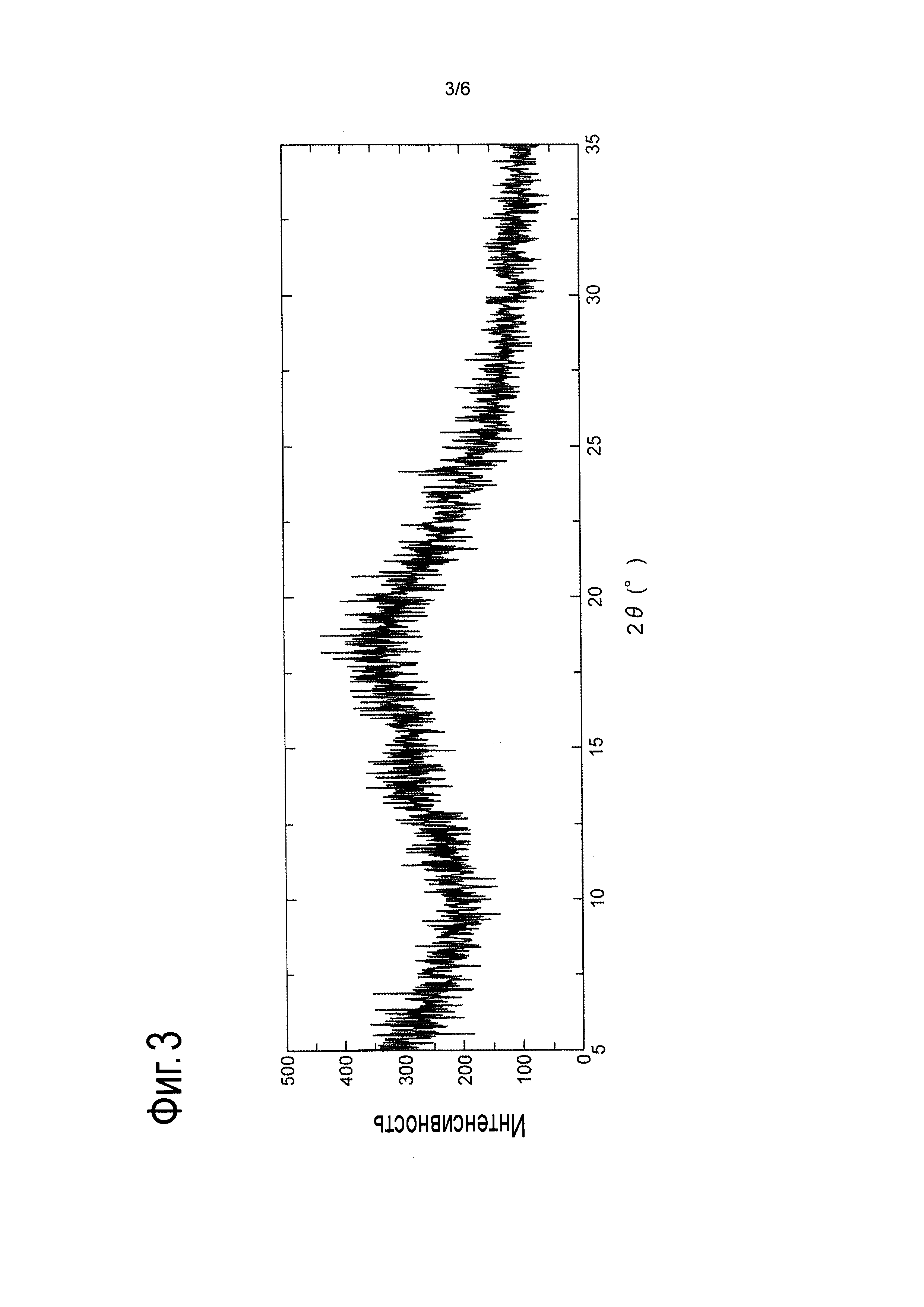
[Фигура 3] На Фигуре 3 показана дифракционная картина, полученная методом рентгеновской порошковой дифракции, аморфной формы соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты. По оси абсцисс показан угол дифракции 29, по оси ординат указана интенсивность пика.
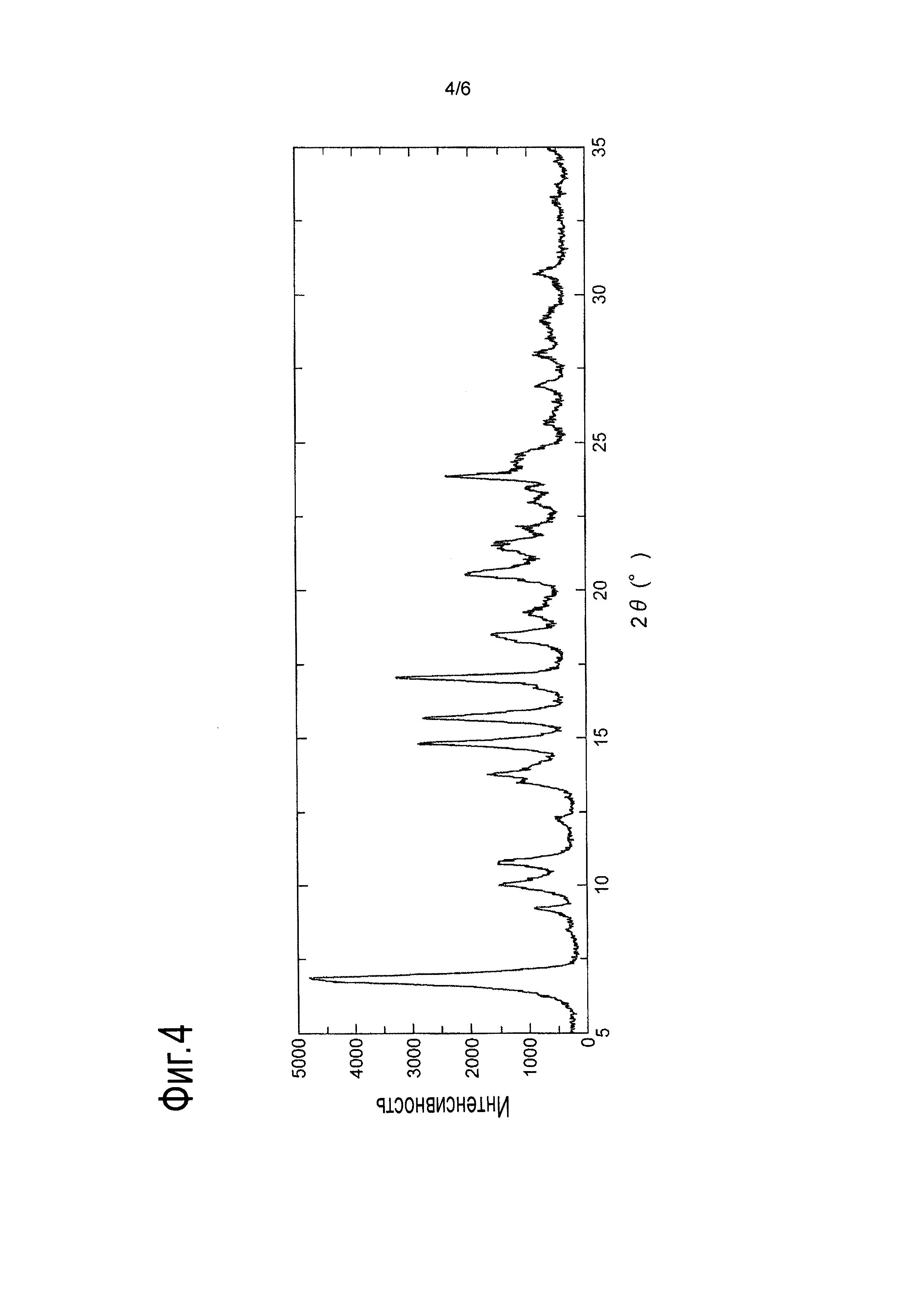
[Фигура 4] На Фигуре 4 показана дифракционная картина, полученная методом рентгеновской порошковой дифракции, кристалла (А) сольвата L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты. По оси абсцисс показан угол дифракции 2θ, по оси ординат указана интенсивность пика.
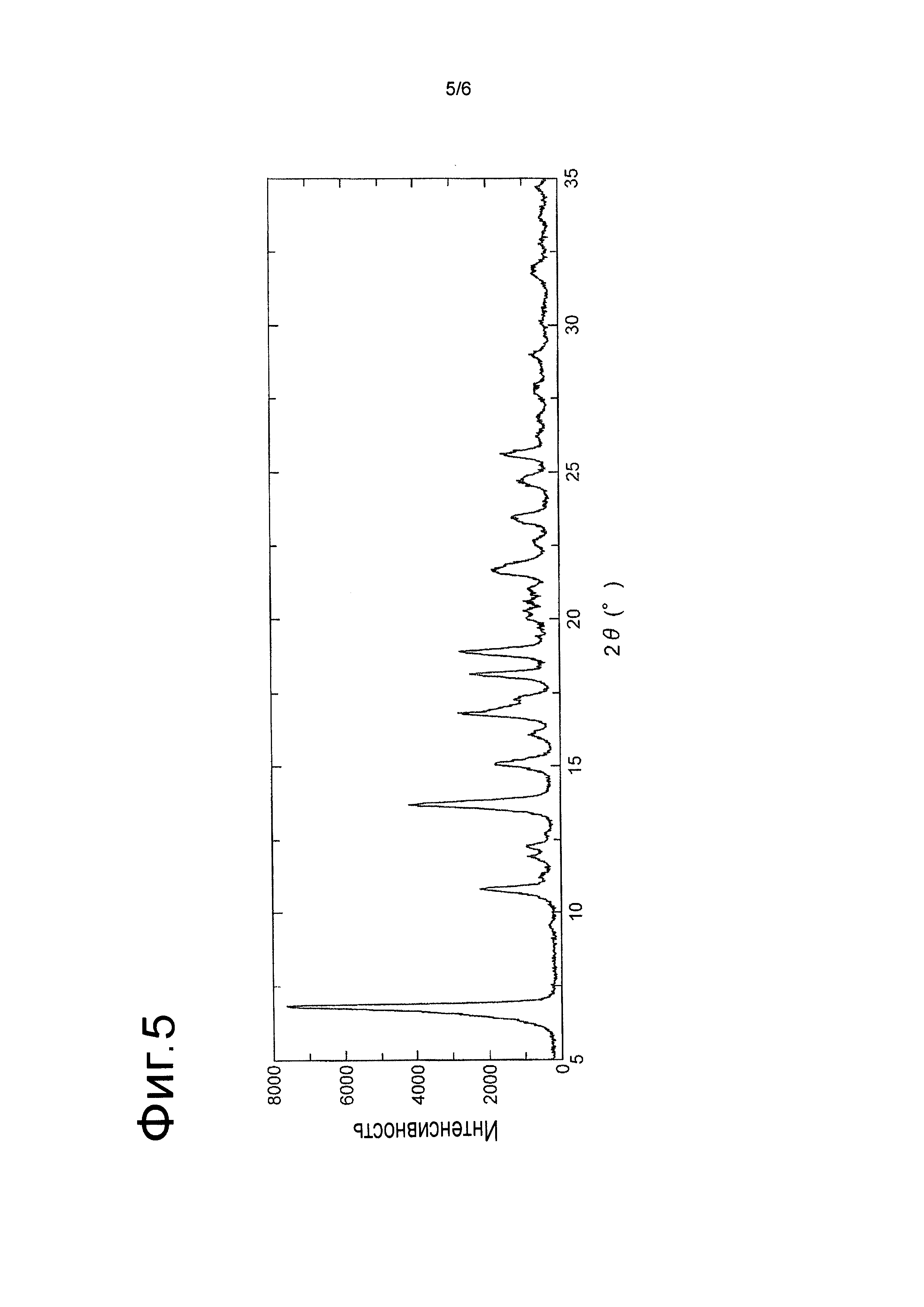
[Фигура 5] На Фигуре 5 показана дифракционная картина, полученная методом рентгеновской порошковой дифракции, кристалла (В) сольвата L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты. По оси абсцисс показан угол дифракции 2θ, по оси ординат указана интенсивность пика.
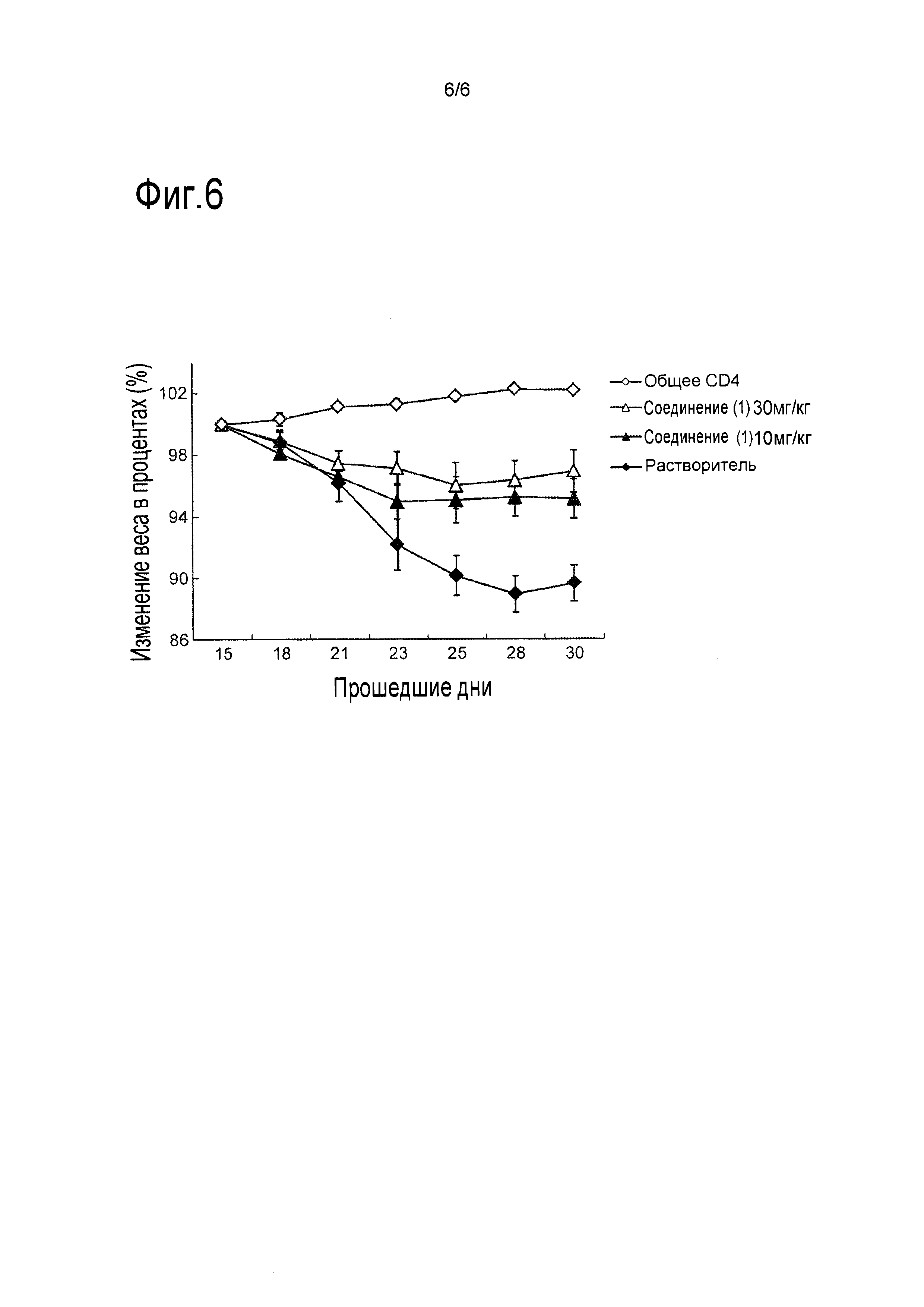
[Фигура 6] Фигура 6 представляет собой графики, показывающие эффект угнетения снижения веса при применении 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты на модели колита с переносом Т-клеток. По абсциссе отложено количество прошедших дней, при условии что день, когда СD4-позитивные CD45RB-высоко позитивные клетки (5×105 клеток/мышь), отобранные из селезенки мыши BALB/c, были внутривенно введены мыши SCID, считается днем 0.
Описание вариантов осуществления
[0015] Подробно будут описаны соль органической карбоновой кислоты и соединения (1) настоящего изобретения, ее кристалл, ее аморфная форма и способы ее получения.
[0016] Соединение (1), а именно 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусную кислоту, можно получить, основываясь на описании упоминаемого ниже Примера получения 1.
[0017] В настоящем описании соль органической карбоновой кислоты и соединения (1) означает фармацевтически приемлемую соль, и это - соль, которая содержит одну органическую карбоновую кислоту, выбранную из группы, состоящей из уксусной кислоты, янтарной кислоты, глутаровой кислоты, бензойной кислоты, коричной кислоты, яблочной кислоты, щавелевой кислоты, гликолевой кислоты, малеиновой кислоты, винной кислоты, диацетилвинной кислоты, фумаровой кислоты, лимонной кислоты, малоновой кислоты, L-молочной кислоты, L-миндальной кислоты и т.п., и соединение формулы (1). Термин "соль", используемый в данном контексте, означает соединение, полученное в результате реакции соединения (1) с органической карбоновой кислотой, имеющее химически возможное эквивалентное число, где соединение состоит из положительно заряженной части основания молекул соединения (1) и отрицательно заряженной части органической карбоновой кислоты.
[0018] Примеры соли органической карбоновой кислоты включают соль уксусной кислоты, соль янтарной кислоты, соль глутаровой кислоты, соль бензойной кислоты, соль коричной кислоты, соль яблочной кислоты, соль щавелевой кислоты, соль гликолевой кислоты, соль малеиновой кислоты, соль винной кислоты, соль диацетилвинной кислоты, соль фумаровой кислоты, соль лимонной кислоты, соль малоновой кислоты, соль L-молочной кислоты и соль L-миндальной кислоты. Предпочтительные примеры соли органической карбоновой кислоты включают соль щавелевой кислоты, соль гликолевой кислоты, соль L-молочной кислоты и соль L-миндальной кислоты, и более предпочтительные примеры включают соль L-молочной кислоты и соль L-миндальной кислоты.
[0019] Соль органической карбоновой кислоты и соединения (1) может также представлять собой сольват. В настоящем описании сольват соли органической карбоновой кислоты и соединения (1) означает твердое вещество, образовавшееся из соли органической карбоновой кислоты и соединения (1) вместе с молекулами растворителя. Примеры сольватов включают: сольват, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с растворителем - кетоном, таким как ацетон, метилэтилкетон или циклогексанон; сольват, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с растворителем - сложным эфиром, таким как этилацетат или метилацетат; сольват, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с растворителем - простым эфиром, таким как 1,2-диметоксиэтан или метил-трет-бутиловый эфир; сольват, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с растворителем-спиртом, таким как метанол, этанол, 1-пропанол или изопропанол; сольват, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с полярным растворителем, таким как 1-метил-2-пирролидон, N,N-диметилформамид или диметилсульфоксид; и гидрат, образовавшийся из соли органической карбоновой кислоты и соединения (1) вместе с водой.
[0020] Соль органической карбоновой кислоты и соединения (1) или ее сольват могут иметь кристаллическую или аморфную форму. Предпочтительные конкретные примеры соли органической карбоновой кислоты и соединения (1) или ее сольвата включают соль L-миндальной кислоты и соединения (1) и сольват соли L-миндальной кислоты и соединения (1).
[0021] Если предпочтительные формы соли органической карбоновой кислоты и соединения (1) или ее сольвата конкретно описаны далее, то предпочтительные конкретные примеры включают следующие кристаллы.
[0022] Предпочтительные конкретные их примеры включают:
(a) кристалл соли L-миндальной кислоты и соединения (1), отличающийся тем, что он имеет дифракционные пики при анализе методом рентгеновской порошковой дифрактометрии [угол дифракции (2θ±0,2°)] при углах, например, равных
(1) 7,2°,
(2) 10,3°,
(3) 12,9°,
(4) 14,4°,
(5) 14,9°,
(6) 15,7°,
(7) 17,2°,
(8) 20,1°,
(9) 23,5° и
(10) 24,7°,
где дифракционные пики при углах, равных 7,2°, 10,3°, 14,4°, 15,7° и 23,5°, и, среди прочего, дифракционные пики при углах, равных 7,2°, 14,4° и 15,7°, и, в частности, дифракционный пик при угле, равном 7,2°, является пиком, характерным для настоящего кристалла, или
кристалл соли L-миндальной кислоты и соединения (1), отличающийся тем, что он имеет пики при химических сдвигах (м.д.), равных 14,1, 52,9, 75,2, 144,7 и 174,0 в твердотельном спектре ЯМР 13С;
(b) кристалл (А) сольвата соли L-молочной кислоты и соединения (1), отличающийся тем, что он имеет дифракционные пики при анализе методом рентгеновской порошковой дифрактометрии [угол дифракции (2θ±0,2°)] при углах, например, равных
(1) 6,9°,
(2) 9,2°,
(3) 10,0°,
(4) 10,8°,
(5) 13,8°,
(6) 14,8°,
(7) 15,7°,
(8) 17,1°,
(9) 20,5° и
(10) 23,8°,
где дифракционные пики при углах, равных 6,9°, 14,8°, 15,7°, 17,1° и 23,8°, и, среди прочего, дифракционные пики при углах, равных 6,9°, 15,7° и 17,1°, и, в частности, дифракционный пик при угле, равном 6,9°, является пиком, характерным для настоящего кристалла, и
(с) кристалл (В) сольвата соли L-молочной кислоты и соединения (1), отличающийся тем, что он имеет дифракционные пики при анализе методом рентгеновской порошковой дифрактометрии [угол дифракции (2θ±0,2°)] при углах, например, равных
(1) 6,8°,
(2) 10,8°,
(3) 13,7°,
(4) 15,1°,
(5) 16,8°,
(6) 18,1°,
(7) 18,9°,
(8) 23,5°,
(9) 24,7° и
(10) 25,6°,
где дифракционные пики при углах, равных 6,8°, 13,7°, 16,8°, 18,1° и 18,9°, и, среди прочего, дифракционные пики при углах, равных 6,8°, 13,7° и 16,8°, и, в частности, дифракционный пик при угле, равном 6,8°, является пиком, характерным для настоящего кристалла.
[0023] Описанные выше характеристические пики в методе рентгеновской порошковой дифрактометрии являются однозначно определяемыми для каждого кристалла соли L-миндальной кислоты и соединения (1), кристалла сольвата (А) соли L-молочной кислоты и соединения (1) и кристалла сольвата (В) соли L-молочной кислоты и соединения (1).
[0024] В общем случае, если говорить об угле дифракции (2θ) в методе рентгеновской порошковой дифрактометрии, в результате возможной ошибки в пределах ±0,2°, необходимо учитывать, что описанные выше значения угла дифракции включают численные значения в пределах примерно ±0,2°. Соответственно, не только кристалл, у которого угол дифракции пика в методе рентгеновской порошковой дифрактометрии совершенно совпадает с таковым у кристалла настоящего изобретения, но также и кристалл, у которого угол дифракции пика совпадает с таковым у кристалла настоящего изобретения с ошибкой, составляющей примерно ±0,2°, включен в объем настоящего изобретения. Поэтому, например, фраза "имеет дифракционный пик при угле дифракции (2θ±0,2°), равном 7,2°" используется в настоящем описании в значении "имеет дифракционный пик при угле дифракции (2θ), равном от 7,0° до 7,4°." Аналогичный подход применяется к другим случаям, относящимся к углу дифракции (2θ) в методе рентгеновской порошковой дифрактометрии.
[0025] Описанные выше характеристические пики в твердотельном спектре ЯМР 13С являются однозначно определяемыми в твердотельном спектре ЯМР 13С кристалла соли L-миндальной кислоты и соединения (1).
[0026] Описание "имеет пики при химических сдвигах (м.д.), равных 14,1, 52,9, 75,2, 144,7 и 174,0" используется в настоящем описании в значении "твердотельный спектр ЯМР 13С снимали при обычных условиях измерения или в условиях, в значительной степени совпадающих с таковыми, описанными в настоящем описании, и в результате спектр демонстрирует пики, в значительной степени совпадающие с таковыми при химических сдвигах (м.д.), равных 14,1, 52,9, 75,2, 144,7 и 174,0."
[0027] Для того чтобы определить, демонстрирует ли спектр "в значительной степени совпадающие пики", в общем случае в результате возможной ошибки в пределах ±0,5 м.д. при измерении величин химических сдвигов (м.д.) в твердотельном спектре ЯМР 13С, необходимо учитывать, что описанное выше значение химического сдвига включает численные значения в пределах примерно ±0,5 м.д. Соответственно, кристалл, у которого химический сдвиг в твердотельном спектре ЯМР 13С совершенно совпадает с таковым у кристалла настоящего изобретения, а также кристалл, у которого химический сдвиг совпадает с таковым у кристалла настоящего изобретения с ошибкой, составляющей примерно ±0,5, включен в объем настоящего изобретения. Поэтому, например, фраза "имеет пик при химическом сдвиге (м.д.), равном 14,1" используется в настоящем описании в значении "имеет пик при химическом сдвиге (м.д.), равном от 13,6 до 14,6." Аналогичный подход применяется к другим случаям, относящимся к химическому сдвигу в твердотельном спектре ЯМР 13С.
[0028] Далее будут подробно описаны способы получения соли L-миндальной кислоты соединения (1), ее кристалла, ее аморфной формы и ее сольвата. Следует отметить, что другие соли органических карбоновых кислот и соединения (1), их кристаллы и их аморфные формы или их сольваты также можно получать согласно способам, подробно описанным ниже, или эквивалентными им способами. В частности, при получении сольвата соли органической карбоновой кислоты и соединения (1) необходимо добавлять растворитель, соответствующий требуемому сольвату.
[0029] [Способ получения соли L-миндальной кислоты и соединения (1)]
Соль L-миндальной кислоты и соединения (1) можно получать обычным способом получения соли органической карбоновой кислоты. А именно соль L-миндальной кислоты и соединения (1) можно получать, например, следующим образом: L-миндальную кислоту, предварительно растворенную в растворителе, непосредственно добавляют к соединению (1); или соединение (1) растворяют в растворителе, по мере необходимости, при нагревании, а затем предварительно растворенную в растворителе L-миндальную кислоту добавляют к полученному раствору, после чего полученную смесь перемешивают при комнатной температуре или при охлаждении в охлаждающей бане в течение от примерно нескольких минут до 50-60 часов, или после добавления смесь выдерживают при комнатной температуре или при охлаждении в охлаждающей бане в течение от примерно нескольких минут до 50-60 часов. Иным образом соль L-миндальной кислоты и соединения (1) можно также получать непосредственно добавляя растворитель к соединению (1) и L-миндальной кислоте, и затем растворяя их в растворителе. Таким способом получения соль L-миндальной кислоты и соединения (1) можно также получать в виде кристалла или в аморфной форме.
[0030] Примеры растворителя, используемого в данном способе, включают один растворитель и растворитель, смешанный из двух или более растворителей, которые выбирают из группы, состоящей из: растворителей - алкилкетонов, таких как ацетон или метилэтилкетон; этилацетат; гексан; ацетонитрил; растворителей - простых эфиров, таких как диэтиловый эфир, метил-трет-бутиловый эфир или 1,2-диметоксиэтан; растворителей-спиртов, таких как метанол, этанол, 1-пропанол, изопропанол или т-бутиловый спирт; или воды. Более предпочтительные примеры растворителей включают ацетон, метилэтилкетон, этилацетат, ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), этанол/метил-трет-бутиловый эфир (в объемном соотношении 1:12), и изопропанол/метил-трет-бутиловый эфир (в объемном соотношении 1,5:8-1,5:13,5).
[0031] Кроме того, количество используемого растворителя можно подбирать подходящими образом, при условии, что количество растворителя, в котором при нагревании растворяются соединение (1) и L-миндальная кислота, является нижним пределом, и количество растворителя, в котором выход солей снижается незначительно, является верхним пределом. Отношение объема растворителя к массе соединения (1) предпочтительно равно, например, от 5 до 100 (об./масс.); и при использовании в качестве растворителя ацетона, метилэтилкетона, этилацетата, ацетона/метил-трет-бутилового эфира (в объемном соотношении 1:1), этанола/метил-трет-бутилового эфира (в объемном соотношении 1:12), изопропанола/метил-трет-бутилового эфира (в объемном соотношении 1,5:8-1,5:13.5) или подобных им, отношение объема растворителя к массе соединения (1) более предпочтительно равно, например, от 5 до 20 (об./масс.).
[0032] Температуру, при которой соединение (1) и L-миндальная кислота растворяются в растворителе, можно определять, по мере необходимости, в зависимости от используемого растворителя. Температура предпочтительно находится в интервале, например, от температуры кипения используемого растворителя до 15°C, и более предпочтительно, например, от 15°C до 100°C.
[0033] Если изменять применяемую скорость охлаждения, то могут образовываться кристаллы различной формы (полиморфные формы). Следовательно, принимая во внимание влияние на качество, размер зерна и т.п. кристалла, охлаждение желательно проводить при изменяемой по мере необходимости скорости охлаждения; охлаждение можно проводить предпочтительно со скоростью охлаждения, равной, например, от 5°C до 40°C/час, и более предпочтительно со скоростью охлаждения, например, от 15°C до 25°C/час. Кроме того, конечную температуру кристаллизации можно определять, по мере необходимости, в зависимости от выхода, качества и т.п. кристалла, и она предпочтительно равна, например, от -25°C до 30°C.
[0034] При кристаллизации кристаллов можно добавлять или не добавлять кристалл-затравку (кристалл соли L-миндальной кислоты и соединения (1)). Температура, при которой добавляют кристалл-затравку, особым образом не ограничивается, и предпочтительно она равна, например, от 0°C до 60°C.
[0035] Выкристаллизовавшийся кристалл отделяют путем обычной операции фильтрования, и отфильтрованный кристалл затем промывают растворителем, по мере необходимости, и полученный кристалл затем сушат, таким образом получая интересующий кристалл. Предпочтительные примеры растворителей, используемых для промывки кристалла, включают ацетон, метилэтилкетон, этилацетат, метил-трет-бутиловый эфир, ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), ацетон/изопропилацетат (в объемном соотношении 1:9), и изопропанол/метил-трет-бутиловый эфир (в объемном соотношении 1:10); и более предпочтительные примеры растворителей включают этилацетат, метил-трет-бутиловый эфир, изопропанол/метил-трет-бутиловый эфир (в объемном соотношении 1:10), ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), и ацетон/изопропилацетат (в объемном соотношении 1:9).
[0036] Далее еще подробно описаны способ получения кристалла соли L-миндальной кислоты и соединения (1) и способ сушки кристалла. Следует отметить, что кристаллы других солей органических карбоновых кислот и соединения (1) или кристаллы их сольватов также можно получать и высушивать согласно способам, подробно описанным ниже, или эквивалентными им способами.
[0037] [Способ кристаллизации кристалла соли L-миндальной кислоты и соединения (1)]
Кристалл соли L-миндальной кислоты и соединения (1) можно кристаллизовать следующим образом: после получения соединения (1) согласно Примеру получения 1, L-миндальную кислоту, предварительно растворенную в растворителе, непосредственно добавляют к соединению (1); или соединение (1) растворяют в растворителе, по мере необходимости, при нагревании, а затем предварительно растворенную в растворителе L-миндальную кислоту добавляют к полученному раствору, после чего смесь перемешивают при комнатной температуре или при охлаждении в охлаждающей бане в течение от примерно нескольких минут до 50-60 часов, или после добавления смесь выдерживают при комнатной температуре или при охлаждении в охлаждающей бане в течение от примерно нескольких минут до 50-60 часов, согласно вышеописанному [способ получения соли L-миндальной кислоты и соединения (1)]. Иным образом такой кристалл соли L-миндальной кислоты и соединения (1) можно также получать, непосредственно добавляя растворитель к соединению (1) и L-миндальной кислоте и растворяя их в растворителе. Альтернативно, после получения соли L-миндальной кислоты и соединения (1) ее затем растворяют в растворителе с целью кристаллизации кристалла.
[0038] Способ рекристаллизации соли L-миндальной кислоты и соединения (1) подробно описан ниже.
Соль L-миндальной кислоты и соединения (1), используемая при кристаллизации, может иметь аморфную форму или представлять собой кристалл (включая кристалл, содержащий множество кристаллических полиморфных форм), это также может быть их смесь.
[0039] Предпочтительные примеры растворителя, используемого при кристаллизации, включают один растворитель и растворитель, смешанный из двух или более растворителей, которые выбирают из группы, состоящей из ацетона, этилацетата, изопропилацетата, изобутилацетата, гексана, гептана, ацетонитрила, метил-трет-бутилового эфира, тетрагидрофурана, этанола, 1-пропанола, изопропанола, диметилсульфоксида и воды; и его более предпочтительные примеры включают этилацетат, диметилсульфоксид/изопропилацетат/гептан (в объемном соотношении 3:2:10), и диметилсульфоксид/изопропилацетат (в объемном соотношении 1:8-1:16), диметилсульфоксид/изопропанол/метил-трет-бутиловый эфир (в объемном соотношении 3:3:2-3:2:25), и диметилсульфоксид/ацетон/изопропилацетат (в объемном соотношении 1,70:3:25), и диметилсульфоксид/ацетон/гептан (в объемном соотношении 1,65:3:25), и диметилсульфоксид/этилацетат/гептан (в объемном соотношении 2,0:10:10).
[0040] Кроме того, количество используемого растворителя можно подбирать подходящими образом, при условии, что количество растворителя, в котором при нагревании растворяется соль L-миндальной кислоты и соединения (1), является нижним пределом, и количество растворителя, в котором выход кристаллов снижается незначительно, является верхним пределом.
Отношение объема растворителя к массе соединения (1) предпочтительно равно, например, от 5 до 100 (об./масс.); и при использовании в качестве растворителя этилацетата, диметилсульфоксида/изопропилацетата/гептана (в объемном соотношении 3:2:10), диметилсульфоксида/изопропилацетата (в объемном соотношении 1:8-1:16), диметилсульфоксида/изопропанола/метил-трет-бутилового эфира (в объемном соотношении 3:3:2-3:2:25), диметилсульфоксида/ацетона/изопропилацетата (в объемном соотношении 1,70:3:25), диметилсульфоксида/ацетона/гептана (в объемном соотношении 1,65:3:25), диметилсульфоксида/этилацетата/гептана (в объемном соотношении 2,0:10:10) или подобных им, отношение объема растворителя к массе соединения (1) более предпочтительно равно, например, от 5 до 40 (об./масс.).
[0041] Температуру, при которой соль L-миндальной кислоты и соединения (1) растворяется при нагревании в растворителе, можно определять, по мере необходимости, в зависимости от используемого растворителя. Температура предпочтительно находится в интервале, например, от 15°C до температуры кипения используемого в кристаллизации растворителя, и более предпочтительно, например, от 40°C до 100°C. Если изменять применяемую скорость охлаждения, то могут образовываться кристаллы различной формы (полиморфные формы). Следовательно, принимая во внимание влияние на качество, размер зерна и т.п. кристалла, охлаждение желательно проводить при изменяемой по мере необходимости скорости охлаждения; охлаждение можно проводить предпочтительно со скоростью охлаждения, равной, например, от 5°C до 40°C/час, и более предпочтительно со скоростью охлаждения, например, от 15°C до 25°C/час. Кроме того, конечную температуру кристаллизации можно определять, по мере необходимости, в зависимости от выхода, качества и т.п. кристалла, и она предпочтительно равна, например, от -25°C до 30°C.
[0042] При кристаллизации кристаллов можно добавлять или не добавлять кристалл-затравку (кристалл соли L-миндальной кислоты и соединения (1)). Температура, при которой добавляют кристалл-затравку, особым образом не ограничивается, и предпочтительно она равна, например, 60°C или ниже, более предпочтительно, например, от 0°C до 60°C, и еще предпочтительнее, например, от 15°C до 60°C.
[0043] Выкристаллизовавшийся кристалл отделяют путем обычной операции фильтрования, и отфильтрованный кристалл затем по мере необходимости промывают растворителем, и полученный кристалл затем сушат, таким образом получая интересующий кристалл. Предпочтительные примеры растворителей, используемых для промывки кристалла, включают ацетон, метилэтилкетон, этилацетат, метил-трет-бутиловый эфир, ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), изопропанол/метил-трет-бутиловой эфир (в объемном соотношении 1:10), и ацетон/изопропилацетат (в объемном соотношении 1:4-1:9); и их более предпочтительные примеры включают этилацетат, метил-трет-бутиловый эфир, ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), изопропанол/метил-трет-бутиловой эфир (в объемном соотношении 1:10), и ацетон/изопропилацетат (в объемном соотношении 1:9).
[0044] [Способ сушки кристалла соли L-миндальной кислоты и соединения (1)]
Как описано выше, отделенный при операции фильтрования кристалл можно по мере необходимости сушить, выдерживая на воздухе, или нагреванием. Время, необходимое для операции сушки представляет собой время, необходимое для того, чтобы остаточное содержание растворителя стало меньше, чем заранее заданное содержание, и его можно при необходимости определять в зависимости от количества продукта, устройства сушилки, температуры сушки и т.п. Кроме того, такую сушку также можно проводить либо при наличии воздухообмена или под разреженным давлением. Степень разрежения давления можно определять при необходимости в зависимости от количества продукта, устройства сушилки, температуры сушки и т.п. После завершения операции сушки полученный кристалл можно также по мере необходимости оставлять на воздухе.
[0045] Далее подробно описаны способ получения аморфной формы соли L-миндальной кислоты и соединения (1) и способ сушки аморфной формы. Следует отметить, что аморфные формы других солей органических карбоновых кислот и соединения (1) или аморфные формы их сольватов также можно получать и высушивать согласно способам, подробно описанным ниже, или эквивалентными им способами.
[0046] [Способ получения аморфной соли L-миндальной кислоты и соединения (1)]
Аморфную форму соли соединения (1) и L-миндальной кислоты можно получать обычными способами получения аморфной формы. А именно, аморфную форму можно получать следующим образом: соединение (1) растворяют в растворителе, по мере необходимости, при нагревании, и к этому добавляют L-миндальную кислоту, после чего полученную смесь перемешивают или выдерживают в течение от примерно нескольких минут до 50-60 часов, а затем отгоняют растворитель под пониженным давлением. Иным образом аморфную форму можно также получать, непосредственно добавляя растворитель к соединению (1) и L-миндальной кислоте и растворяя их в растворителе, а затем отгонять растворитель под пониженным давлением. Альтернативно, аморфную форму можно получать лиофилизацией таким образом полученной соли L-миндальной кислоты и соединения (1).
Примеры растворителя, используемого в данном способе, включают один растворитель и растворитель, смешанный из двух или более растворителей, которые выбирают из группы, состоящей из: растворителей - алкилкетонов, таких как ацетон или метилэтилкетон; этилацетат; гексан; ацетонитрил; растворителей - простых эфиров, таких как диэтиловый эфир, метил-трет-бутиловый эфир или 1,2-диметоксиэтан; растворителей - спиртов, таких как метанол, этанол, 1-пропанол, изопропанол или т-бутиловый спирт; или воды. Более предпочтительные примеры растворителей включают ацетон, метилэтилкетон, этилацетат, ацетон/метил-трет-бутиловый эфир (в объемном соотношении 1:1), этанола/метил-трет-бутилового эфира (в объемном соотношении 1:12), и изопропанол/метил-трет-бутиловый эфир (в объемном соотношении 1,5:8-1,5:13,5).
[0047] Кроме того, количество используемого растворителя можно подбирать подходящими образом, при условии, что количество растворителя, в котором при нагревании растворяются соединение (1) и L-миндальная кислота, является нижним пределом, и количество растворителя, в котором выход солей снижается незначительно, является верхним пределом. Отношение объема растворителя к массе соединения (1) предпочтительно равно, например, от 5 до 100 (об./масс.); и при использовании в качестве растворителя ацетона, метилэтилкетона, этил ацетата, ацетона/метил-трет-бутилового эфира (в объемном соотношении 1:1), этанола/метил-трет-бутилового эфира (в объемном соотношении 1:12), изопропанол/метил-трет-бутиловой эфир (в объемном соотношении 1,5:8-1,5:13.5) или подобных им, отношение объема растворителя к массе соединения (1) более предпочтительно равно, например, от 5 до 20 (об./масс.).
[0048] Температуру, при которой соединение (1) и L-миндальную кислоту растворяют в растворителе, при необходимости можно выбирать в зависимости от используемого растворителя из температур, при которых соединение (1) и органическая карбоновая кислота растворяются в растворителе. Температура предпочтительно находится в интервале, например, от 15°C до температуры кипения используемого растворителя, и более предпочтительно, например, от 15°C до 100°C.
[0049] Аморфную форму соли L-миндальной кислоты и соединения (1) можно получать, отгоняя растворитель под пониженным давлением из полученного таким образом раствора. Кроме того, хорошо растворимую аморфную форму соли L-миндальной кислоты и соединения (1) можно получить лиофилизацией соли L-миндальной кислоты и соединения (1), используя один растворитель или растворитель, смешанный из двух или более растворителей, которые выбирают из группы, состоящей из растворителей-спиртов, таких как этанол, 1-пропанол, изопропанол или т-бутиловый спирт, растворителей - простых эфиров, таких как диоксан, полярных растворителей, таких как диметилсульфоксид, и воды, или предпочтительно используя, например, воду, т-бутиловый спирт, диоксан или диметилсульфоксид.
[0050] [Способ сушки аморфной соли L-миндальной кислоты и соединения (1)]
Полученную таким образом аморфную форму можно по мере необходимости сушить, выдерживая на воздухе, или нагреванием. Время, необходимое для операции сушки представляет собой время, необходимое для того, чтобы остаточное содержание растворителя стало меньше, чем заранее заданное содержание, и его можно при необходимости определять в зависимости от количества продукта, устройства сушилки, температуры сушки и т.п. Кроме того, такую сушку также можно проводить либо при наличии воздухообмена или под разреженным давлением. Степень разрежения давления можно определять при необходимости в зависимости от количества продукта, устройства сушилки, температуры сушки и т.п. После завершения операции сушки полученную аморфную форму можно также по мере необходимости оставлять на воздухе.
[0051] Соль органической карбоновой кислоты и соединения (1) обладает ингибирующей активностью в отношении пути фракталкин-СХ3СR1 и пригодна в качестве активного ингредиента терапевтического средства при воспалительных заболеваниях кишечника, таких как язвенный колит или болезнь Крона.
[0052] Если соль органической карбоновой кислоты и соединения (1) используют качестве фармацевтического средства, ее можно принимать перорально или парентерально, например, в качестве терапевтического средства при воспалительных заболеваниях кишечника, таких как язвенный колит или болезнь Крона, которые вызываются фракталкином-СХ3СR1. Доза фармацевтического средства по настоящему изобретению в общем бывает разной в зависимости от симптомов, возраста, пола, веса тела и т.п., и ее количество может быть достаточным для того, чтобы вызвать желаемое действие. Например, если субъект представляет собой взрослого человека, фармацевтическое средство вводят в дозе, равной примерно от 0,1 до 5000 мг (предпочтительно от 0,5 до 1000 мг, и более предпочтительно от 1 до 600 мг) в день, в течение одного или нескольких дней, за один прием, или дозу делят на 2-6 приемов в день.
[0053] Соль органической карбоновой кислоты и соединения (1) можно включать в составы традиционными способами, и примеры лекарственных форм включают составы для перорального введения (такие как таблетки, гранулы, порошки, капсулы и сиропы), инъекции (для внутривенного введения, внутримышечного введения, подкожного введения и внутрибрюшинного введения), и наружные составы (такие как составы для всасывания через кожу (такие как мази и пластыри), офтальмологические препараты, назальные препараты и суппозитории).
[0054] При получении твердого препарата для перорального введения по мере необходимости к соли органической карбоновой кислоты и соединения (1) добавляют вспомогательное вещество, связующее, разрыхлитель, смазывающее вещество, красящее вещество и т.п., и получают таблетированное, гранулированное, порошкообразное средство или капсулу согласно традиционным способам. Кроме того, на таблетированное, гранулированное, порошкообразное средство, капсулу и т.п. при необходимости можно наносить пленочное покрытие.
[0055] Примеры вспомогательного вещества включают лактозу, кукурузный крахмал и кристаллическую целлюлозу; примеры связующего включают гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу; примеры разрыхлителя включают карбоксиметилцеллюлозу кальция и кроскармеллозу натрия; примеры смазывающего вещества включают стеарат магния и стеарат кальция; примеры красящего вещества включают оксид титана; и примеры пленкообразователя включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и метилцеллюлозу, но, разумеется, примеры этих добавок не ограничены вышеперечисленным.
[0056] Твердый препарат, такой как таблетированное, гранулированное или порошкообразное средство, может включать соль органической карбоновой кислоты и соединения (1) в количестве, в общем случае равном, например, массовой доле от 0,001% до 99,5%, и предпочтительно массовой доле от 0,001% до 90%.
[0057] При производстве средства для инъекций (для внутривенного введения, внутримышечного введения, подкожного введения и внутрибрюшинного введения), их можно получать путем добавления при необходимости регуляторов pH, буферных растворов, суспендирующих средств, солюбилизирующих средств, антиоксидантов, консервантов (антисептиков), регулирующее тоничность средство и т.п. к соли органической карбоновой кислоты и соединения (1) и обработки традиционными способами. Лиофилизированные препараты, которые необходимо растворять перед употреблением, можно также приготовить лиофилизацией. Инъекции можно осуществлять, например, внутривенно, подкожно и внутримышечно.
[0058] Примеры регуляторов pH и буферных растворов включают в себя органические кислоты или неорганические кислоты и/или их соли, примеры суспендирующих средств включают в себя метилцеллюлозу, полисорбат 80 и карбоксиметилцеллюлозу натрия, примеры солюбилизирующих средств включают в себя полисорбат 80 и полиоксиэтиленсорбитанмонолаурат, примеры антиоксидантов включают в себя α-токоферол; примеры консервантов включают в себя метилпараоксибензоат и этилпараоксибензоат, и примеры регулирующих тоничность средств включают в себя глюкозу, натрия хлорид и маннит, но вспомогательные вещества, разумеется, не ограничены вышеупомянутыми примерами.
[0059] Эти средства для инъекций могут обычно содержать массовую долю от 0,000001 до 99,5%, предпочтительно массовую долю от 0,00001 до 90% и т.п. соли органической карбоновой кислоты и соединения (1).
[0060] При получении средства для внешнего применения, материал-основу добавляют к соли органической карбоновой кислоты и соединения (1), и при необходимости к ним добавляют, например, вышеописанные консервант, стабилизатор, регулятор pH, антиоксидант красящее вещество, а затем, согласно традиционному способу получают, например, препарат для чрескожного введения (мазь, пластырь и т.п.), глазные капли, капли в нос, свечи и т.п.
[0061] В качестве применяемого материала основы можно применять различные типы исходных материалов, широко используемых в фармацевтических продуктах, лекарственных квази-препаратах, косметических продуктах и т.п. В частности, примеры материала основы включают в себя исходные материалы, такие как масла животного и растительного происхождения, минеральное масло, сложноэфирное масло, воски, эмульгатор, высшие спирты, жирные кислоты, силиконовое масло, поверхностно-активное вещество, фосфолипиды, спирты, многоатомные спирты, водорастворимые полимеры, глинистые минералы и очищенную воду.
[0062] Эти средства для наружного применения могут обычно содержать массовую долю от 0,000001 до 99,5%, предпочтительно массовую долю от 0,00001 до 90% и т.п. соли органической карбоновой кислоты и соединения (1). Пример
[0063] Далее настоящее изобретение будет подробно описано с примерами получения и примерами. Однако не предполагается, что настоящее изобретение ограничивается этими примерами.
[0064] Пример получения 1
Получение 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
[0065] Пример получения 1а
Бензил-(2Е)-бут-2-еноат
Кротоновую кислоту (70 г, 812 ммоль) растворяли в N,N-диметилформамиде (467 мл), охлаждали на ледяной бане в атмосфере азота и добавляли карбонат калия (61,6 г, 447 ммоль). К реакционной смеси по каплям за 20 минут добавляли бензилбромид (91,7 мл, 772 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат и фильтровали через целит. Отфильтрованный раствор в этилацетате промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушили над сульфатом магния, фильтровали и концентрировали под пониженным давлением, получая указанное в заголовке соединение (142 г, выход: 99,4%).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 1,87-1,90 (3Н, m), 5,17 (2Н, s), 5,87-5,92 (1Н, m), 6,98-7,07 (1Н, m), 7,26-7,39 (5H, m).
[0066] Пример получения 1b
Бензил-(3RS,4SR)-1-бензил-4-метилпирролидин-3-карбоксилат
Бензил-(2Е)-бут-2-еноат, полученный в Примере получения 1a (20,5 г, 116 ммоль) растворяли в дихлорметане (5 мл) и смесь охлаждали на ледяной бане при перемешивании. Добавляли трифторуксусную кислоту (257 мкл, 3,47 ммоль) и к реакционной жидкости по каплям за 15 минут добавляли N-(метоксиметил)-N-(триметилсилилметил)бензиламин (33,1 г, 139 ммоль) таким образом, чтобы температура внутри не превышала 62°C, при этом проводили промывку дихлорметаном (25 мл). Реакционную жидкость выдерживали, пока она не нагрелась до комнатной температуры, а затем перемешивали в течение 15 часов. Реакционную жидкость концентрировали и очищали с помощью колоночной хроматографии на силикагеле (растворитель для элюирования: этилацетат/гептан) с получением указанного в названии соединения (38 г).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 1,14 (3Н, d, J=6 Гц), 2,18-2,22 (1H, m), 2,48-2,65 (2Н, m), 2,75-2,85 (2Н, m), 2,90-2,94 (1Н, m), 3,54-3,66 (2H, m), 5,13 (2H, s), 7,20-7,40 (10H, m).
[0067] Пример получения 1с
Бензил-(3RS,4SR)-1-бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-карбоксилат
Бензил-(3RS,4SR)-1-бензил-4-метилпирролидин-3-карбоксилат, полученный в Примере получения 1b (30 г, 97,4 ммоль), растворяли в тетрагидрофуране (300 мл) и охлаждали до -70°C при перемешивании в атмосфере азота. По каплям за 20 минут добавляли 1,11 М раствор диизопропиламида лития/н-гексан-тетрагидрофуране (105 мл, 116 ммоль) таким образом, чтобы температура не превышала -64,3°C. Смесь перемешивали при -70°C в течение 1 часа, и по каплям за 10 минут добавляли тетрагидрофуран (30 мл) и трет-бутилбромацетат (26,6 г, 136 ммоль) таким образом, чтобы температура не превышала -60°C. Реакционную смесь перемешивали при -70°C еще один час, и затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Немедленно после этого реакционную смесь разбавляли водой и добавляли этилацетат. Органический слой промывали соляным раствором и 5 н. водным раствором соляной кислоты, а затем сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали с помощью силикагельной колоночной хроматографии (растворитель для элюирования: этилацетат/гептан). Остаток дополнительно очищали с помощью колоночной хроматографии с NH-силикагелем (растворитель для элюирования: гептан/этилацетат = 98/2) с получением указанного в названии соединения (6 г, выход: 14,5%).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 0,86 (3Н, d, J=6 Гц), 1,34 (9Н, s), 2,05-2,15 (2Н, m), 2,53 (1Н, d, J=17 Гц), 2,91-3,00 (3Н, m), 3,28 (1Н, d, J=10 Гц), 3,59-3,72 (2Н, m), 5,08-5,16 (2Н, m), 7,19-7,39 (10Н, m).
18,1 г указанного в названии соединения получали таким же способом, как тот, что описан выше.
[0068] Пример получения 1d
1,3-Дибензил-(3RS,4SR)-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-1,3-дикарбоксилат
Бензил-(3RS,4SR)-1-бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилгарролидин-1,3-дикарбоксилат, полученный таким же образом, что и в Примере получения 1 с (11,7 г, 27,6 ммоль) растворяли в дихлорметане (117 мл), и по каплям к реакционной жидкости за 20 минут добавляли бензил хлорформиат (23,7 мл, 166 ммоль) таким образом, чтобы температура внутри не превышала 22°C. Смесь перемешивали при комнатной температуре в течение 12 часов, а затем растворитель отгоняли. Остаток очищали с помощью колоночной хроматографии с NH-силикагелем (растворитель для элюирования: этилацетат/гептан) с получением указанного в названии соединения (9,1 г, выход: 70,5%).
1Н-ЯМР (400 МГц, CDCl3) δ ppm; 0,84-0,90 (3Н, m), 1,32-1,46 (9Н, m), 2,09-2,16 (1Н, m), 2,21-2,27 (1H, m), 3,04-3,14 (2H, m), 3,33-3,38 (1H, m), 3,60-3,68 (1H, m), 4,32 (1H, t, J=12 Гц), 5,07-5,20 (4H, m), 7,26-7,36 (10H, m).
Анализ с помощью ВЭЖХ;
(Аналитические условия 1) Колонка: CHIRALPAK AD-H (произведено компанией Daicel Chemical Industries, Ltd.) (диаметр 0,46 см × 15 см), элюент: гексан/этанол = 95/5 (об./об.), расход: 1 мл/мин, детектирование: УФ (210 нм)
(Результат анализа) Полученное соединение, указанное в заголовке, анализировали в условиях анализа 1, при этом наблюдали пик при времени удерживания, равном 8,56 минуты и пик при времени удерживания, равном 10,85 минуты.
Указанное в заголовке соединение, полученное отдельно, анализировали с использованием хиральной колонки, отличающейся от указанной выше. (Аналитические условия 2) Колонка: CHIRALPAK IA (произведено компанией Daicel Chemical Industries, Ltd.) (диаметр 0,46 см × 15 см), элюент: гексан/этанол = 95/5 (об./об.), расход: 1 мл/мин, детектирование: УФ (210 нм)
(Результат анализа) Полученное соединение, указанное в заголовке, анализировали в условиях анализа 2, при этом наблюдали пик при времени удерживания, равном 6,78 минуты и пик при времени удерживания, равном 8,20 минуты.
[0069] Пример получения 1е
(3S,4R)-3-[2-(трет-Бутокси)-2-оксоэтил]4-метилпирролидин-3-карбоновая кислота
1,3-Дибензил-(3RS,4SR)-3-[2-(трет-Бутокси)-2-оксоэтил]-4-метилпирролидин-1,3-дикарбоксилат, полученный в Примере получения 1d (9,1 г), оптически разделяли многократными прогонами при следующих двух типах условий А или В. Оптическое разделение с помощью ВЭЖХ;
(Условия фракционирования А) Колонка: CHIRALPAK AD-H (произведено компанией Daicel Chemical Industries, Ltd.) (диаметр 2 см × 25 см), элюент: гексан/этанол = 85/15 (об./об.), расход: 8-10 мл/мин.
(Условия фракционирования В) Колонка: CHIRALPAK IA (произведено компанией Daicel Chemical Industries, Ltd.) (диаметр 3 см×25 см), элюент: гексан/этанол = 95/5 (об./об.), расход: 22 мл/мин.
Пик при более коротком времени удерживания фракционировали и полученные три партии затем анализировали при следующих аналитических условиях.
Анализ с помощью ВЭЖХ;
(Аналитические условия) Колонка: CHIRALPAK AD-H (произведено компанией Daicel Chemical Industries, Ltd.) (диаметр 0,46 см × 15 см), элюент: гексан/этанол = 95/5 (об./об.), расход: 1 мл/мин, детектирование: УФ (210 нм)
(Результат анализа) Время удерживания составляло от 9,0 минут до 9,3 минуты, и энантиомерный избыток составил >99% э.и. для всех партий.
Три партии объединили, полученную хиральную форму (4,04 г) растворили в метаноле (121 мл), добавили 10% Pd/C (0,77 г) и атмосферу заменили на газ водород. Смесь перемешивали при комнатной температуре в течение 13 часов и затем перемешивали, добавив теплую воду (30-40°C, 122 мл), выпавшее в осадок твердое вещество растворилось. После того, как Pd/C отфильтровали, растворитель отогнали и сушили, получая указанное в заголовке соединение (2,1 г).
1Н-ЯМР (400 МГц, D2O) δ ppm; 0,97 (3Н, d, J=7 Гц), 1,42 (9Н, s), 2,15-2,22 (1Н, m), 2,30 (1H, d, J=17 Гц), 2,93 (1H, d, J=17 Гц), 3,04 (1H, t, J=12 Гц), 3,18 (1H, d, J=12 Гц), 3,49 (1H, dd, J=8,12 Гц), 4,03 (1H, d, J=12 Гц).
Каждый химический сдвиг указывает на величину, которая скорректирована относительно химического сдвига пика остаточного растворителя в тяжелой воде, установленного на 4,79.
[0070] Пример получения 1f
(3S,4R)-1-Бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-карбоновая кислота
Смесь (3R*,4S*)-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-карбоновой кислоты, полученной в Примере получения 1е (1,8 г, 7,4 ммоль), бензальдегида (1,51 мл, 14,8 ммоль), уксусной кислоты (0,635 мл, 11,1 ммоль), триацетоксиборогидрида натрия (3,14 г, 14,8 ммоль) и метанола (35 мл) нагревали при 40°C в течение 38 часов и 30 минут. Реакционную смесь концентрировали и полученный остаток очищали колоночной хроматографией на силикагеле (октадецилсиликагель (ODS), растворитель для элюирования: вода/метанол), получая указанное в заголовке соединение, обозначенное как Партия А (584 мг) и Партия В (708 мг).
1Н-ЯМР (400 МГц, CDCl3) of Lot А δ ppm; 1,02 (3Н, d, J=7 Гц), 1,38 (9H, s), 2,14 (1H, d, J=17 Гц), 2,15-2,28 (1H, br), 2,97 (1H, d, J=17 Гц), 3,10-3,42 (3Н, m), 4,00-4,10 (1H, m), 4,30-4,40 (1H, br), 4,46 (1H, d, J=12 Гц), 7,45-7,53 (5H, m).
1Н-ЯМР of Lot B: identical to ЯМР of Lot A.
[0071] Пример получения 1g
трет-Бутил-4-[(3S,4R)-1-бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-амид]пиперидин-1-карбоксилат
трет-Бутил4-аминопиперидин-1-карбоксилат (849 мг, 4,24 ммоль), триэтиламин (1,18 мл, 8,48 ммоль) и РуВОР (2,21 г, 4,24 ммоль) добавляли к раствору (3R*,4S*)-1-бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-митилпирролидин-3-карбоновой кислоты, полученной способом, сходным со способом в Примере получения 1f (942 мг, 2,83 ммоль), в N,N-диметилформамиде (20 мл), и затем перемешивали при комнатной температуре на протяжении ночи. К реакционной жидкости добавляли этилацетат, и ее промывали 1 н. водным раствором гидроксида натрия и соляным раствором. Затем сушили над безводным сульфатом магния и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (растворитель для элюирования: гептан/этилацетат), получая указанное в заголовке соединение (1,33 г, выход: 91,1%).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 0,92 (3Н, d, J=7 Гц), 1,20-1,40 (2Н, m), 1,40 (9Н, s), 1,48 (9Н, s), 1,78-1,88 (1Н, m), 1,92-1,98 (1H, m), 1,96 (1H, d, J=16 Гц), 2,03-2,09 (1H, m), 2,36 (1H, d, J=10 Гц), 2,58-2,68 (2H, m), 2,89-2,95 (2H, m), 3,10 (1H, d, J=16 Гц), 3,59 (1H, d, J=10 Гц), 3,66 (2H, s), 3,83-4,00 (3H, m), 7,23-7,35 (5H, m), 8,65 (1H, d, J=7 Гц).
МС(ионизация электрораспылением (ESI)) масса/заряд: 538,2 (M+Na)+.
[0072] Пример получения 1h
трет-Бутил-4-[(3S,4R)-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-амид]пиперидии-1-карбоксилат
20%-ный гидроксид палладия (724 мг) добавляли к раствору трет-бутил-4-[(3R*,4S*)-1-бензил-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-амидо]пиперидин-1-карбоксилата, полученного в Примере получения 1g (1,33 г, 2,58 ммоль), в метаноле (30 мл), а затем перемешивали в атмосфере водорода в течение ночи. Реакционную жидкость отфильтровывали и концентрировали под пониженным давлением, получая указанное в заголовке соединение (1,04 г, выход: 94,7%).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 0,92 (3Н, d, 1=7 Гц), 1,20-1,52 (2Н, m), 1,41 (9Н, s), 1,43 (9Н, s), 1,80-2,10 (5Н, m), 2,00 (1Н, d, J=16 Гц), 2,55-2,61 (1Н, m), 2,80-3,06 (2Н, m), 2,92 (1H, d, J=10 Гц), 3,12 (1Н, d, J=16 Гц), 3,35 (1Н, d, J=9 Гц), 3,70 (1Н, d, J=10 Гц), 3,80-4,00 (3Н, m), 8,30 (1Н, d, J=7 Гц).
MC(ESI) масса/заряд: 426,1 (М+Н)+.
[0073] Пример получения 1i
трет-Бутил-4-[(3S,4R)-3-[2-(трет-бутокси)-2-оксоэтил]-1-{[2-хлор-6-(трифторметил)фенил]метил)-4-метилпирролидин-3-амид]пиперидин-1-карбоксилат
2-(Бромметил)-1-хлор-3-(трифторметил)бензол (443 мг, 1,62 ммоль) и карбонат калия (244 мг) добавляли к раствору трет-бутил4-[3R*,4S*)-3-[2-(трет-бутокси)-2-оксоэтил]-4-метилпирролидин-3-амидо]пиперидин-1-карбоксилата, полученного в Примере получения 1h (345 мг, 0,811 ммоль) в N,N-диметилформамиде (безводном) (10 мл), а затем перемешивали при 45°C в течение шести часов и при 40°C в течение двух дней. К реакционной жидкости добавляли этилацетат, и ее промывали 1 н. водным раствором гидроксида натрия и соляным раствором. Затем сушили над безводным сульфатом магния и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (растворитель для элюирования: гептан/этилацетат), получая указанное в заголовке соединение (320 мг, выход: 63,8%).
1Н-ЯМР (400 МГц, CDCl3) δ (ppm): 0,92 (3Н, d, J=7 Гц), 1,13-1,18 (2Н, m), 1,39 (9Н, s), 1,49 (9Н, s), 1,53-1,65 (1Н, m), 1,76-1,86 (1Н, m), 1,98 (1Н, d, J=16 Гц), 2,02-2,10 (1Н, m), 2,51 (1Н, d, J=10 Гц), 2,60-2,80 (3Н, m), 2,88 (1Н, t, J=10 Гц), 3,12 (1H, d, J=16 Гц), 3,53 (1Н, d, J=10 Гц), 4,094,25 (5Н, m), 7,38 (1Н, t, J=8 Гц), 7,63 (2Н, d, J=8 Гц), 7,96 (1Н, d, J=8 Гц).
MC(ESI) масса/заряд: 640,2 (M+Na)+.
[0074] Пример получения 1j
2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-4-метил-3-[пиперидин-4-ил]карбамоил}пирролидин-3-ил]уксусная кислота
Трифтоуксусную кислоту (8 мл) добавляли к раствору трет-бутил-4-[(3R*,4S*)-3-[2-(трет-бутокси)-2-оксоэтил]-1-{[2-хлор-6-(трифторметил)фенил]метил}-4-метилпирролидин-3-амидо]пиперидин-1-карбоксилата, полученного в Примере получения li (320 мг, 0,518 ммоль) в дихлорметане (безводном) (8 мл) на льду, а затем перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрировали под пониженным давлением, и остаток очищали колоночной хроматографией на ODS (растворитель для элюирования: вода/метанол), получая смесь, содержащую указанное в заголовке соединение (344 мг).
1Н-ЯМР (400 МГц, CD3OD) δ (ppm): 0,83 (3Н, d, J=5 Гц), 1,43-1,63 (2Н, m), 1,76-1,89 (1Н, m), 1,92-2,00 (1Н, m), 2,03-2,19 (2Н, m), 2,55-2,68 (2Н, m), 2,91-3,10 (4Н, m), 3,25-3,36 (2Н, m), 3,45-3,59 (1Н, m), 3,75-4,18 (3Н, m), 7,41-7,76 (3Н, m).
MC(ESI) масса/заряд: 462,3 (М+Н)+.
[0075] Пример получения 1k
2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусная кислота
Циклогекс-1-ен-1-карбальдегид (423 мкл, 3,73 ммоль), уксусную кислоту (300 мкл) и триацетоксиборогидрид натрия (789 мг, 3,73 ммоль) добавляли к раствору смеси 2-[(3R*,4S*)-1-{[2-хлор-6-(трифторметил)фенил]метил}-4-метил-3-[(пиперидин-4-ил)карбамоил]пирролидин-3-ил]уксусной кислоты, полученной способом Примера получения 1j (344 мг, 0,745 ммоль), в тетрагидрофуране (безводном) (10 мл), и затем перемешивания на протяжении ночи. К реакционной жидкости добавляли воду и метанол, а затем концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на ODS (растворитель для элюирования: вода/метанол). Очищенный продукт растворяли в дихлорметане, суспендировали путем добавления гексана и концентрировали, получая указанное в заголовке соединение (180 мг, выход: 43,4%).
1Н-ЯМР (400 МГц, CD3OD) δ (ppm): 0,89 (3Н, d, J=7 Гц), 1,23-1,38 (2Н, m), 1,44-1,82 (6Н, m), 1,82-1,96 (1Н, m), 1,96-2,25 (5Н, m), 2,30-2,45 (2Н, m), 2,55-2,68 (2Н, m), 2,92-3,20, (5Н, m), 3,54 (1Н, d, J=10 Гц), 3,64-3,78 (1H, m), 3,95 (1H, d, J=10 Гц), 4,05 (1Н, d, J=10 Гц), 5,76 (1H, s), 7,47-7,52 (1H, m), 7,72 (1H, d, J=7 Гц), 7,77 (1H, d, J=8 Гц).
MC(ESI) масса/заряд: 578,3 (M+Na)+
[0076] Пример 1
Получение кристалла соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
Раствор L-миндальной кислоты в этилацетате (20 мг/мл) добавляли в количестве 1407 мкл (1 эквивалент) к 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоте (102,8 мг), и затем полученный смешанный раствор подвергали ультразвуковой обработке, после чего смешанный раствор перемешивали с помощью магнитной мешалки при комнатной температуре. После перемешивания смешанного раствора в течение ночи в растворе обнаружили осадок, который отфильтровывали, промывали этилацетатом и затем сушили, получая указанный в заголовке кристалл (49,3 мг).
1Н-ЯМР (600 МГц, CD3OD) δ (ppm): 0,90 (3Н, d, J=7 Гц), 1,58-1,64 (2Н, m), 1,64-1,76 (4Н, m), 1,82-1,89 (1H, m), 1,97-2,07 (3Н, m), 2,08-2,14 (2Н, m), 2,19 (1Н, d, J=17 Гц), 2,15-2,23 (1Н, m), 2,62 (1Н, d, J=10 Гц), 2,67 (1Н, dd, J=10, 7 Гц), 2,72-2,84 (2Н, m), 3,00 (1Н, dd, J=10, 10 Гц), 3,10 (1Н, d, J=17 Гц), 3,25-3,32 (2Н, m), 3,43 (2Н, s), 3,53 (1Н, d, J=10 Гц), 3,77-3,85 (1H, m), 3,98 (1Н, d, J=13 Гц), 4,07 (1H, d, J=13 Гц), 4,91 (1H, s), 5,91 (1Н, brds), 7,23 (1Н, t, J=7 Гц), 7,29 (2H, dd, J=7,7 Гц), 7,46 (2H, d, J=7 Гц), 7,51 (1H, dd, J=8,8 Гц), 7,73 (1H, d, J=8 Гц), 7,79 (1H, d, J=8 Гц).
[0077] Твердотельный спектр ЯМР 13С кристалла соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты, полученного описанным выше способом, измеряли при следующих условиях.
[Условия измерения]
Используемый прибор: AVANCE 400 (изготовитель-компания BRUKER)
Температура при измерениях: комнатная температура (22°C)
Стандартное вещество: глицин (внешний стандарт: 176,03 м.д.)
Измеряемое ядро: 13С (100,6248425 МГц)
Частота следования импульсов: 6 секунд
Импульсный режим: Измерения в режиме TOSS
Измеренный твердотельный спектр ЯМР 13С показан на Фигуре 1, а химический сдвиг указан ниже.
13С-ЯМР (100 МГц, твердое тело) δ (м.д.): 13,8, 14,1, 21,0, 22,8, 24,3, 26,8, 27,8, 30,5, 40,5, 41,6, 42,4, 46,0, 50,9, 51,4, 52,9, 53,3, 54,7, 55,7, 59,5, 60,3, 63,6, 64,4, 75,2, 124,0, 124,4, 126,2, 127,2, 128,1, 133,3, 133,9, 135,5, 137,8, 144,7, 171,5, 174,0, 175,5, 175,8.
[0078] Кристалл соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты, полученный описанным выше способом, помещали на держатель образца рентгеновского порошкового дифрактометра, а затем анализировали при следующих условиях измерения. Дифракционная картина, полученная методом рентгеновской порошковой дифракции, показана на Фигуре 2.
[0079]


[0080] Пример 2
Получение аморфной формы соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
Соль L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролиин-3-ил]уксусной кислоты (53,61 мг) взвешивали и затем помещали в стакан объемом 200 мл, а затем в стакан добавляли трет-бутиловый спирт (tBA) (20 мл) и воду (4 мл). Круглодонную колбу (колбу-сборник) объемом 100 мл вращали, погрузив в этанол, охлаждаемый сухим льдом. В колбу по каплям добавляли образец раствора и после этого замораживали. После замораживания всего количества раствора образца, отверстие колбы закрывали протирочной салфеткой и выполняли сублимационную сушку. Таким образом получали 48,60 мг указанной в заголовке аморфной формы.
1Н-ЯМР (600 МГц, CD3OD) δ (ppm): 0,90 (3Н, d, J=7 Гц), 1,58-1,64 (2Н, m), 1,64-1,76 (4Н, m), 1,82-1,90 (1H, m), 1,98-2,07 (3Н, m), 2,08-2,15 (2Н, m), 2,15-2,23 (1H, m), 2,19 (1Н, d, J=17 Гц), 2,62 (1Н, d, J=10 Гц), 2,67 (1H, dd, J=10, 7 Гц), 2,74-2,85 (2H, m), 3,00 (1H, dd, J=10, 10 Гц), 3,10 (1H, d, J=17 Гц), 3,25-3,33 (2H, m), 3,44 (2H, s), 3,53 (1H, d, J=10 Гц), 3,78-3,85 (1H, m), 3,98 (1H, d, J=13 Гц), 4,07 (1H, d, J=13 Гц), 4,91 (1H, s), 5,91 (1H, brds), 7,23 (1H, t, J=7 Гц), 7,29 (2H, dd, J=7,7 Гц), 7,46 (2H, d, J=7 Гц), 7,51 (1H, dd, J=8,8 Гц), 7,73 (1H, d, J=8 Гц), 7,79 (1H, d, J=8 Гц).
Аморфную форму, полученную описанным выше способом, помещали на держатель образца рентгеновского порошкового дифрактометра, а затем анализировали при условиях измерения, описанных в Примере 1. Дифракционная картина, полученная методом рентгеновской порошковой дифракции, показана на Фигуре 3.
[0081] Пример 3
Получение кристалла сольвата (А) соли L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
Раствор L-молочной кислоты в этилацетате (10 мг/мл) добавляли в количестве 1296 мкл (1 эквивалент) к 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоте (81,38 мг), и затем полученный раствор подвергали ультразвуковой обработке, после чего реакционный раствор перемешивали с помощью магнитной мешалки при комнатной температуре. После того, как в растворе обнаружили осадок, его отфильтровывали, промывали этилацетатом и затем сушили, получая указанный в заголовке кристалл (78,93 мг).
Кристалл сольвата соли L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты, полученный описанным выше способом, помещали на держатель образца рентгеновского порошкового дифрактометра, а затем анализировали при условиях измерения, описанных в Примере 1. Дифракционная картина, полученная методом рентгеновской порошковой дифракции, показана на Фигуре 4.
[0082] Пример 4
Получение кристалла сольвата (В) соли L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
Раствор L-молочной кислоты в метилэтилкетоне (10 мг/мл) добавляли в количестве 1318 мкл (1 эквивалент) к 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоте (79,99 мг), и затем полученный раствор подвергали ультразвуковой обработке, после чего реакционный раствор перемешивали с помощью магнитной мешалки при комнатной температуре. После того, как в растворе обнаружили осадок, его отфильтровывали, промывали метилэтилкетоном и затем сушили, получая указанный в заголовке кристалл (67,56 мг).
Кристалл сольвата соли L-молочной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты, полученный описанным выше способом, помещали на держатель образца рентгеновского порошкового дифрактометра, а затем анализировали при условиях измерения, описанных в Примере 1. Дифракционная картина, полученная методом рентгеновской порошковой дифракции, показана на Фигуре 5.
[0083] Пример 5
Получение кристалла соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
L-миндальную кислоту (60,2 мг), растворенную в смешанном растворителе из ацетона (0,5 мл) и метил-трет-бутилового эфира (0,5 мл), по каплям добавляли к 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоте (230 мг, содержание: 200 мг), растворенной в смешанном растворителе из ацетона (0,75 мл) и метил-трет-бутилового эфира (0,75 мл), а затем полученную смесь промывали смешанным растворителем из ацетона (0,25 мл) и метил-трет-бутилового эфира (0,25 мл). Реакционную смесь перемешивали при комнатной температуре в течение двух суток. После чего полученный кристалл отфильтровывали и затем промывали ацетоном/метил-трет-бутиловым эфиром (в объемном соотношении 1:1) (0,4 мл×3) метил-трет-бутиловым эфиром (0,4 мл×3), получая таким образом 223,0 мг указанного в заголовке кристалла (выход: 88%) в виде белого кристалла.
[0084] Пример 6
Перекристаллизация соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
Диметилсульфоксид (1,65 мл) и ацетон (2,0 мл) добавляли к кристаллу соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}4-метилпирролидин-3-ил]укусной кислоты (1,00 г) и кристалл растворяли в этой смеси, нагревая ее при 60°C. Далее к полученному раствору добавляли диметилсульфоксид (0,05 мл) и ацетон (1,0 мл). К полученному раствору добавляли изопропилацетат (10 мл) и после завершения добавления полученный раствор нагревали при 45°C. Затем в реакционный раствор дополнительно вносили изопропилацетат (15 мл) при 45°C. Полученный раствор охлаждали до -20°C, и затем полученный кристалл отфильтровывали и промывали смешанным растворителем ацетон/изопропилацетат (в объемном отношении 1:9,5 мл) и полученное затем сушили при нормальной температуре, получая таким образом 907,1 мг указанного в заголовке кристалла (выход: 90,7%) в виде белого кристалла.
[0085] Пример 7
Рентгеновская кристаллография соли L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-([1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты
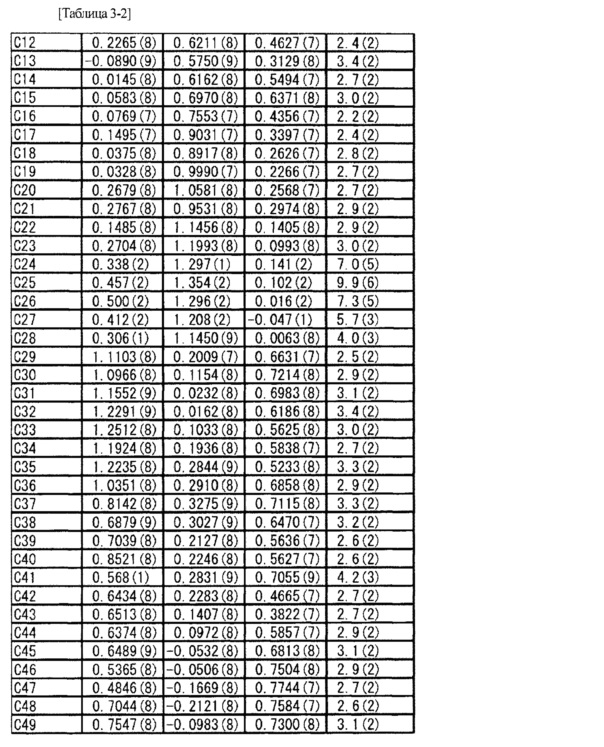
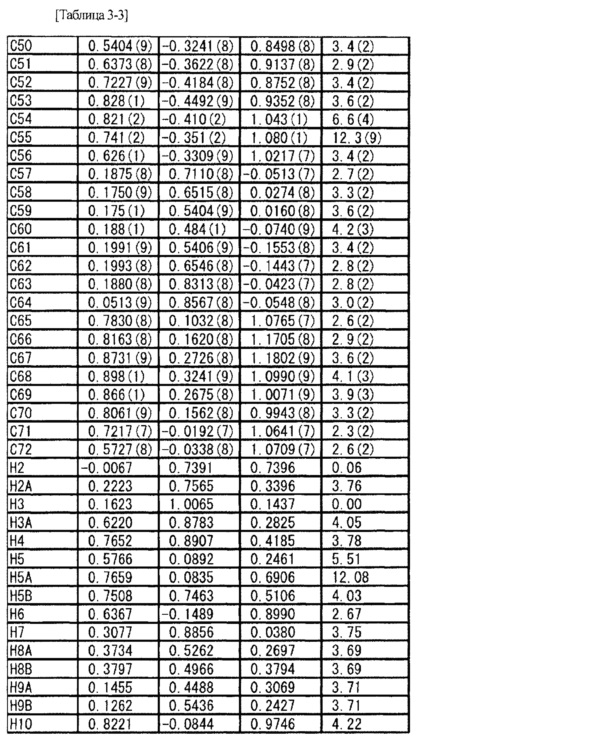
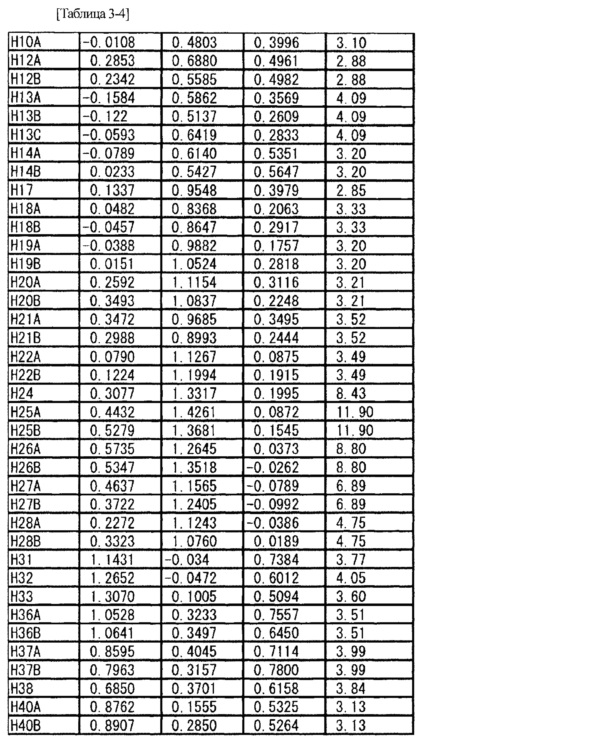
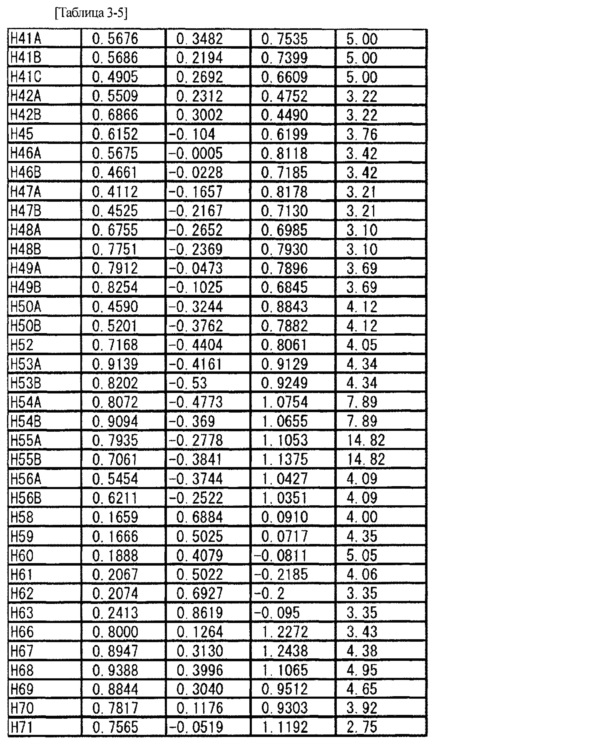
Соль L-миндальной кислоты и 2-[(3S,4R)-1-{[2-хлор-6-(трифторметил)фенил]метил}-3-{[1-(циклогекс-1-ен-1-илметил)пиперидин-4-ил]карбамоил}-4-метилпирролидин-3-ил]уксусной кислоты (5,28 мг) взвешивали в стеклянной ампуле и в ампулу добавляли метанол (1,0 мл) таким образом, чтобы вышеупомянутое соединение растворилось в метаноле. Стеклянную ампулу помещали внутрь стеклянной ампулы большего размера, заполненной соответствующим количеством этилацетата, и внешнюю ампулу затем герметично закрывали крышкой (метод диффузии паров). Через три недели было найдено, что внутри стеклянной ампулы вырос кристалл. Используя полученный одиночный кристалл (0,50×0,20×0,10 мм), проводили рентгеновскую дифракцию на приборе R-AXIS RAPID II (Rigaku Corporation). Кристаллографические данные и результаты структурного анализа показаны в Таблице 2, а данные атомных координат показаны в Таблице 3. Из результатов определяли абсолютную конфигурацию указанного в заголовке соединения.
[0086]


[0087]
[0088]
[0089]
[0090]
[0091]
[0092] Следующие примеры испытаний были проведены с целью исследования фармакологического действия соединения (1).
[0093] (Пример исследования 1) Ингибирование миграции клеток в исследовании фракталкин-стимулированного хемотаксиса
(1) Методика
Ингибирующее действие иллюстративного соединения фракталкин-стимулированной миграции клеток исследовали, используя СХ3СR-трансфектированные В300 клетки.
После уравновешивания пластины Transwell (24-луночные кластеры, размер пор: 5 мкм, произведено компанией Corning Incorporated), в нижние лунки вносили раствор фракталкина (0,3 нМ, произведено компанией R&D Systems, Inc.). CX3CR1-экспрессирующие В300 клетки, которые предварительно инкубировали с исследуемым соединением (0,001, 0,003, 0,01 или 0,03 мкМ) в течение 30 минут, помещали в лунки верхнего отсека, и затем инкубировали в условиях 5% CO2 в течение 3,5 часов при 37°C. Число клеток, мигрировавших в нижние лунки, оценивали, используя CellTiter (произведено компанией Promega Corporation).
Степень ингибирования, оказываемого исследуемым соединением на фракталкин-стимулированную миграцию клеток, рассчитывали по следующей формуле, где [А] является числом мигрировавших клеток в присутствии как фракталкина, так и исследуемого соединения, [В] является числом мигрировавших клеток в присутствии фракталкина и в отсутствие исследуемого соединения, и [С] является числом мигрировавших клеток в отсутствие как фракталкина, так и исследуемого соединения; 50%-ную ингибирующую концентрацию (IC50) рассчитывали на основании степени ингибирования.
Степень ингибирования (%)=[1-{(А-С)/(В-С)}]×100
[0094] (2) Результаты
Значение IC50 соединения (1), полученное в результате данного примера исследования, составляло 4 нМ.
[0095] (Пример исследования 2) Уменьшение интенсивности потери веса на модели колита с переносом Т-клеток.
(1) Методика
Путем использования модели, основанной на SCID мышах с индуцированным колитом, в которой путем инъекции вводили СD4-положительные клетки с высоким содержанием CD45RB, выделенные из спленоцитов мыши BALB/c, причем эффективность иллюстративных соединений оценивали по изменениям в потере веса. Эксперимент проводили в течение 31 дня. В День 1, SCID мышам внутривенно вводили CD4-положительные клетки с высоким содержанием CD45RB, выделенные из селезенки мыши BALB/c (5×105 клеток/мышь). Начиная с Дня 16 по 31, иллюстративное соединение перорально один раз в день вводили SCID мышам, после чего измеряли вес тела всех мышей в День 19, 22, 24, 26, 29 и 31.
Эффективность оценивали по изменениям веса на День 19, 22, 24, 26, 29 или 31. Изменение веса тела (%) определяли по приведенной ниже формуле, где [А] представляет собой вес тела в День 16, и [В] представляет собой вес тела в каждый день измерения веса тела (День 19, 22, 24, 26, 29 или 31).
изменение веса тела (%)=В/А×100
[0096] (2) Результаты
Результаты приведены на Фигуре 6. Ось абсцисс на фигурах показывает число прошедших дней, где Днем 0 считают день, в который мышам SCID производят внутривенное введение CD4-положительные клетки с высоким содержанием CD45RB, выделенные из селезенки мыши BALB/c (5×105 клеток/мышь).