Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
Настоящее изобретение относится к композициям на основе липидов, в частности к композициям на основе липида/поверхностно-активного вещества для перорального введения связанных с циклофилином неиммуносупрессорных циклоспоринов, в частности композициям, содержащим алиспоривир в качестве активного средства.
В РСТ/ЕР 2004/009804, WO 2005/021028 или WO 2006/071619 описаны неиммуносупрессорные циклоспорины, которые связаны с циклофилином и для которых было обнаружено, что они обладают ингибирующим действием на вирус гепатита С (HCV). Алиспоривир (Debio-025) представляет собой ингибитор циклофилина (Cyp), и его способ действия в качестве средства против HCV заключается в ингибировании белков хозяина, в частности циклофилина А, которые непосредственно вовлечены в репликацию HCV.
Циклоспорины умеренно растворимы в воде и, таким образом, их трудно составлять в коммерчески доступные составы. Предконцентраты микроэмульсий, такие как составы на основе липида/поверхностно-активного вещества, состоящие из гидрофильной фазы, липофильной фазы и слаборастворимых в воде лекарственных средств, таких как циклоспорин А, описаны, например, в патентной заявке Великобритании №2222770 А (равноценной DE-A-3930928).
Предоставление лекарственных форм, которые могут содержать циклоспорины в достаточно высокой концентрации для обеспечения подходящего применения и получения соответствующей экспозиции у людей, представляет дополнительную трудность формулирования циклоспоринов. Кроме того, перенасыщенные составы, как правило, являются нежелательными вследствие их непредсказуемой стабильности.
Сущность изобретения
Неожиданно выявлено, что в зависимости от состава содержание воды, варьирующее от 2% до 15% по массе композиции, является необходимым для получения термодинамически стабильных, неперенасыщенных составов алиспоривира с высокой нагрузкой лекарственного средства приблизительно от 15 приблизительно до 20% по массе композиции.
В соответствии с настоящим изобретением был обнаружен особенно стабильный предконцентрат. Конкретно фармацевтические композиции на основе липида/поверхностно-активного вещества со слаборастворимыми в воде лекарственными средствами, такими как алиспоривир, содержащие высокую нагрузку лекарственного средства приблизительно от 15 приблизительно до 20% по массе композиции, получают с использованием воды приблизительно от 2% приблизительно до 15% по массе композиции. В противоположность тому, как указано в данной области, такие композиции при практическом осуществлении можно получать как содержащие воду в качестве основного компонента.
Настоящее изобретение относится к фармацевтической композиции на основе липида/поверхностно-активного вещества, содержащей алиспоривир, несущую среду, содержащую липофильный компонент, поверхностно-активное вещество, гидрофильный компонент и воду.
Алиспоривир может находиться в аморфной или кристаллической форме и может включать любые его фармацевтически приемлемые соли или сложные эфиры.
Фармацевтические композиции по настоящему изобретению предпочтительно предназначены для перорального введения, но могут быть подходящими для буккального, легочного, местного, ректального или вагинального введения.
В дополнительном аспекте настоящего изобретения описан предконцентрат, такой как состав на основе липида/поверхностно-активного вещества, содержит алиспоривир, липофильный компонент, поверхностно-активное вещество, гидрофильный компонент и воду.
Фармацевтическая композиция в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества, содержит активное средство, как определено в настоящем описании, и способно образовывать коллоидные структуры при разбавлении водной средой, например водой или желудочными соками. Коллоидные структуры предпочтительно представляют собой капли жидкости, где капли жидкости находятся в диапазоне размера эмульсии или диапазоне размера микроэмульсии.
В другом аспекте настоящее изобретение относится к содержащей алиспоривир фармацевтической композиции для введения нуждающемуся в этом индивидууму, где фармацевтическая композиция находится в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества.
В дополнительном аспекте настоящее изобретение относится к эмульсии или микроэмульсии, содержащей алиспоривир в качестве активного средства, несущую среду, которая содержит липофильный компонент, поверхностно-активное вещество, гидрофильный компонент и воду.
Коллоидные структуры микроэмульсии или эмульсии образуются спонтанно или по существу спонтанно, когда компоненты композиции по изобретению приводят в контакт с водной средой, например, простым встряхиванием рукой в течение короткого периода времени, например в течение 10 секунд. Композиции по изобретению являются кинетически стабильными, например, в течение по меньшей мерее 15 минут, или до 4 часов, или даже до 24 часов, или дольше.
Краткое описание чертежей
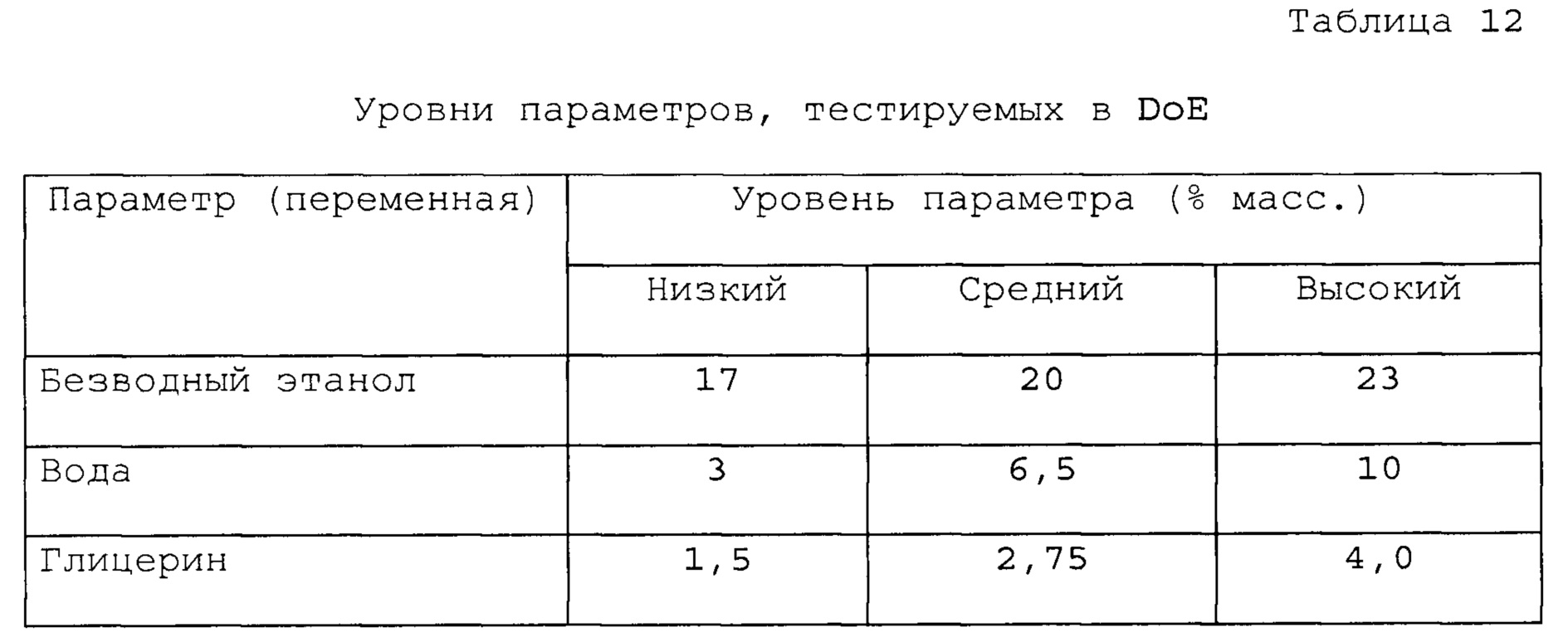
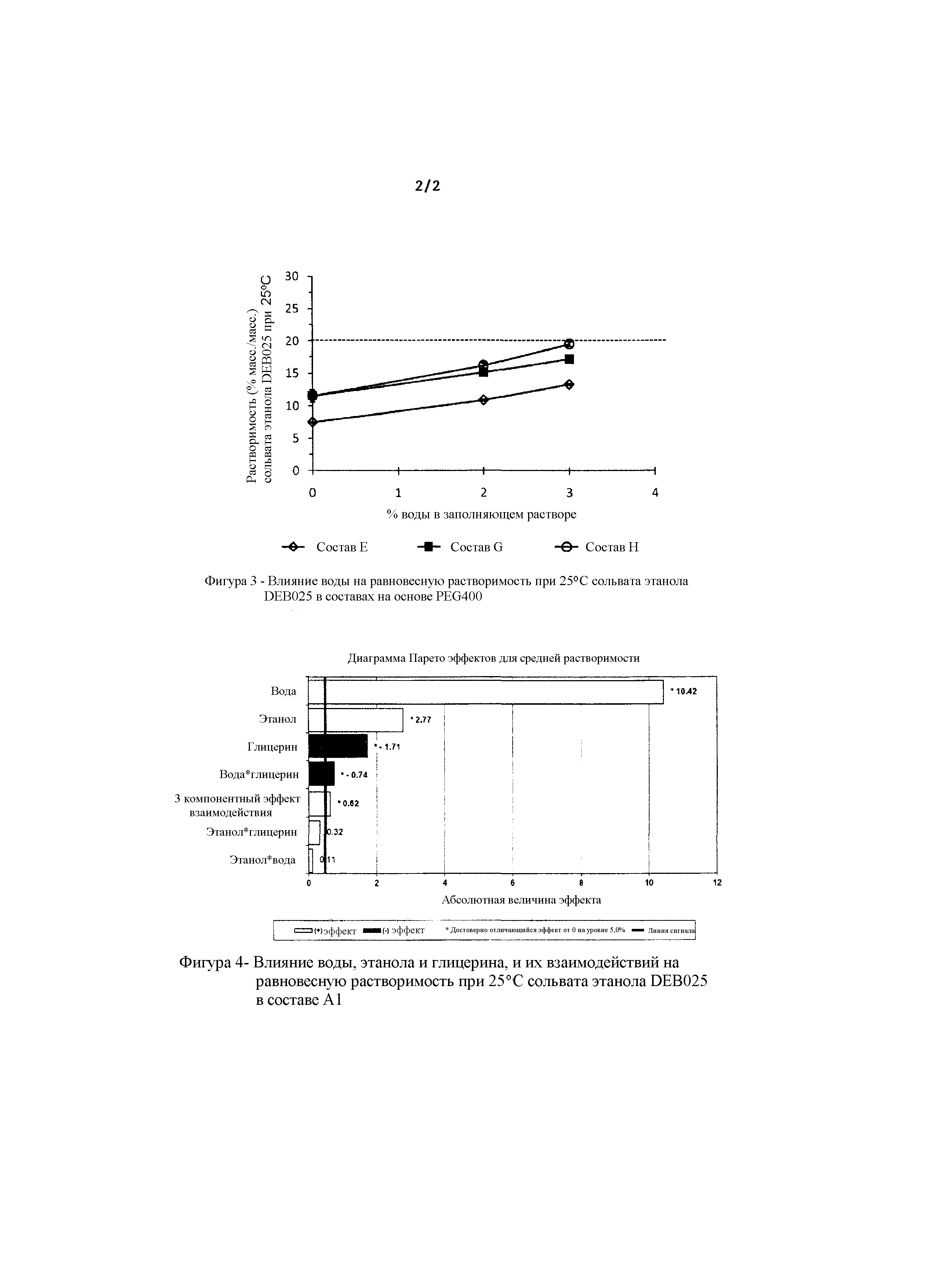
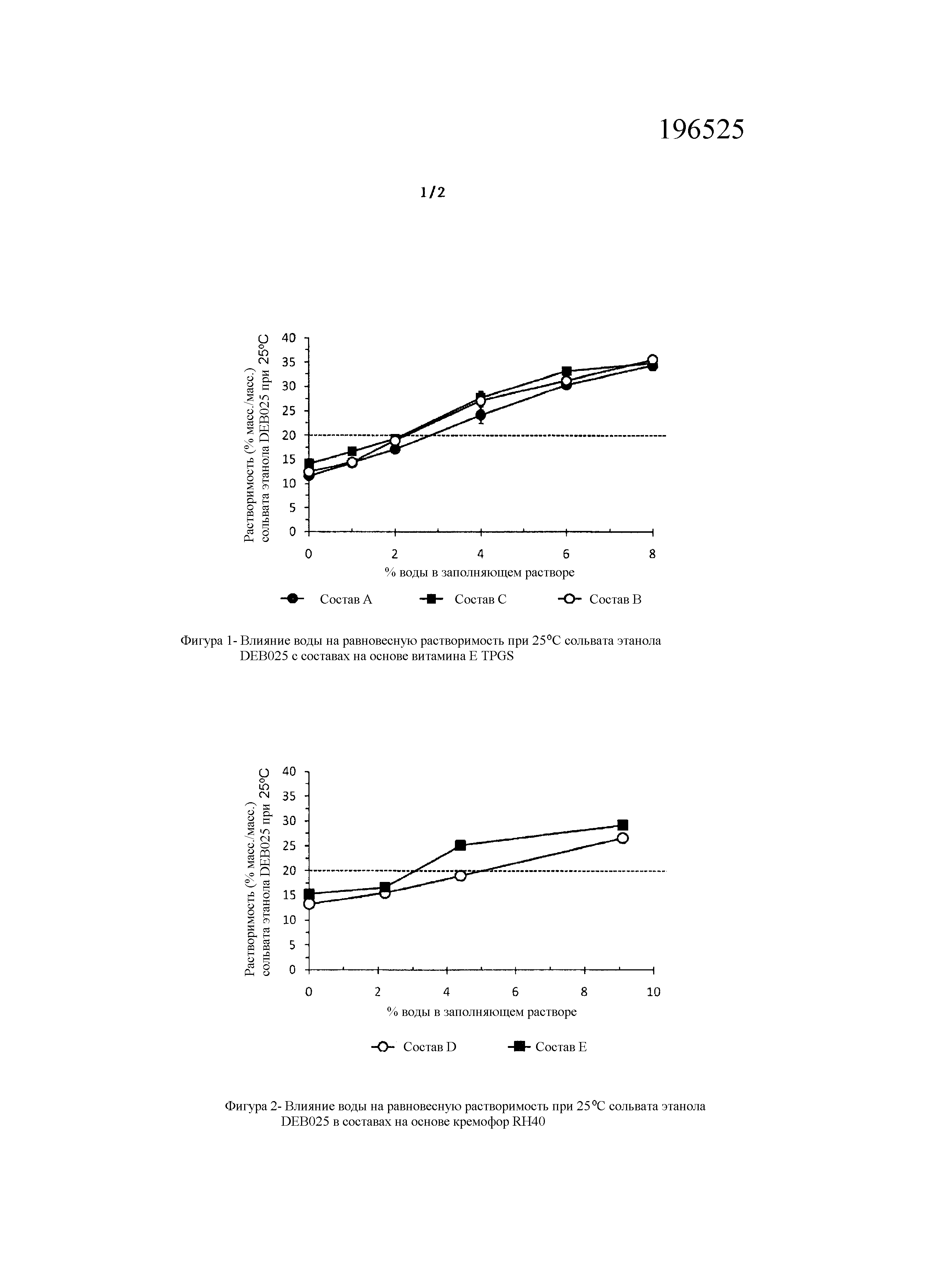
Фигуры 1, 2 и 3 представляют собой графики, которые иллюстрируют влияние воды на равновесную растворимость различных составов, содержащих алиспоривир в соответствии с примерами.
На фигуре 4 представлено влияние воды, этанола и глицерина, и их взаимодействий на равновесную растворимость сольвата этанола DEB025 в составе в соответствии с примером А1.
Подробное описание изобретения
Липофильный компонент содержит одно или более липофильных веществ. Гидрофильный компонент содержит одно или более гидрофильных веществ. Поверхностно-активное вещество содержит одно или более поверхностно-активных веществ.
Композиции по изобретению могут содержать ряд добавок, включая антиоксиданты, противомикробные средства, ингибиторы ферментов, стабилизаторы, консерванты, ароматизаторы, подсластители и дополнительные компоненты, такие как компоненты, описанные в Fiedler Н.Р. "Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete", Editio Cantor, D-7960 Aulendorf, 5th revised and expanded edition (2002). Эти добавки подходящим способом растворяют в несущей среде.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества, для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент,
3) поверхностно-активное вещество,
4) гидрофильный компонент и
5) воду в количестве приблизительно от 2% приблизительно до 15% по массе композиции, предпочтительно приблизительно от 4% приблизительно до 10% по массе композиции.
Липофильный компонент выбран из группы, состоящей из сложных моноэфиров глицерина и C6-C14 жирных кислот, смеси моно- и диглицеридов C6-C18 жирных кислот, сложных диэфиров глицерина и C6-C18 жирных кислот, триглицерида жирных кислот со средней длиной цепи, сложных моноэфиров глицерина и C16-C18 жирных кислот, смешанных моно-, ди-, триглицеридов, ацетилированных моноглицеридов (С18), сложных моноэфиров пропиленгликоля и жирных кислот, сложных моно- и диэфиров пропиленгликоля и жирных кислот, диэфиров пропиленгликоля, пропиленгликольмоноацетата и пропиленгликольдиацетата, переэтерифицированных этоксилированных растительных масел, сложных эфиров сорбитана и жирных кислот, этерифицированных соединений жирной кислоты и первичных спиртов, триацетата глицерина или (1,2,3)-триацетина, ацетилтриэтилцитрата, трибутилцитрата или ацетилтрибутилцитрата, сложных эфиров полиглицерина и жирных кислот, простого эфира PEG и жирного спирта, жирных спиртов и жирных кислот, токоферола и его производных (например, ацетата), фармацевтически приемлемых масел, простых эфиров или сложных эфиров алкиленполиола, углеводородов, сложных эфиров этиленгликоля, сложных эфиров пентаэритриола и жирных кислот и простых эфиров полиалкиленгликоля.
Поверхностно-активное вещество выбрано из группы, состоящей из продуктов реакции природного или гидрогенизированного касторового масла и этиленоксида, сложных эфиров полиоксиэтиленсорбитана и жирных кислот, сложных эфиров полиоксиэтилена и жирных кислот, сополимеров и блок-сополимеров или полоксамеров полиоксиэтилена-полиоксипропилена, моноэфиров полиоксиэтилена насыщенной С10-С22 жирной кислоты, алкиловых простых эфиров полиоксиэтилена, алкилсульфатов и алкилсульфонатов натрия и алкиларилсульфонатов натрия, растворимых в воде сложных эфиров токоферилполиэтиленгликоля и янтарной кислоты (TPGS), сложных эфиров полиглицерина и жирных кислот, простых эфиров или сложных эфиров алкиленполиола, сложных эфиров полиэтиленгликольглицерина и жирных кислот, стеролов и их производных, переэтерифицированных полиоксиэтилированных глицеридов каприловой-каприновой кислоты, сложных эфиров сахаров и жирных кислот, PEG простых эфиров и стеролов, диоктилнатрийсульфосукцината, фосфолипидов, солей жирных кислот, сульфатов и сульфонатов жирных кислот, солей ацилированных аминокислот, среднецепочечных или длинноцепочечных, например C6-C18, алкиламмонийных солей.
Гидрофильный компонент выбран из группы, состоящей из сложных эфиров полиэтиленгликольглицерина и C6-C10 жирных кислот, N-алкилпирролидона, бензилового спирта, триэтилцитрата, полиэтиленгликолей, этанола, транскутола (С2Н5-[О-(СН2)2]2-ОН), гликофурола (также известного как простой эфир тетрагидрофурфурилового спирта и полиэтиленгликоля), 1,2-пропиленгликоля, диметилизосорбида (арласолв), триэтиленгликоля, этилацетата, глицерина, сорбита и этиллактата.
Гидрофильный компонент также может представлять собой, но не обязательно должен им являться, растворитель для лекарственного вещества. Гидрофильные компоненты с амфифильной природой могут функционировать как совместные поверхностно-активные вещества, несмотря на то что их, как правило, не рассматривают в качестве поверхностно-активных веществ вследствие их способности дополнительно уменьшать поверхностное натяжение ниже уровня, получаемого с поверхностно-активными веществами. Как правило, гидрофильные компоненты, которые также являются совместными поверхностно-активными веществами для алиспоривира, включают, например, этанол, глицерин или сорбит, предпочтительно этанол или глицерин.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, как определено выше, и где вода содержится в количестве приблизительно от 4 приблизительно до 5% по массе композиции.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей алиспоривир в количестве приблизительно от 19% приблизительно до 20% по массе композиции, и вода содержится в количестве приблизительно от 4% приблизительно до 5% по массе композиции.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей алиспоривир в количестве приблизительно от 19% приблизительно до 20% по массе композиции, воду в количестве приблизительно от 2% приблизительно до 15%, предпочтительно приблизительно от 2% приблизительно до 5% по массе композиции и гидрофильный компонент в количестве приблизительно от 5% приблизительно до 25%, предпочтительно подходящие гидрофильные компоненты включают, например, этанол и/или полиэтиленгликоль.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества, для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент,
3) поверхностно-активное вещество,
4) полиэтиленгликоль и
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества, для перорального введение, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент,
3) поверхностно-активное вещество,
4) гидрофильный компонент и полиэтиленгликоль и
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме предконцентрата, такого как состав на основе липида/поверхностно-активного вещества, для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 19% приблизительно до 20% по массе композиции,
2) липофильный компонент,
3) поверхностно-активное вещество,
4) этанол и
5) воду в количестве приблизительно от 4% приблизительно до 5% по массе композиции.
Композиции по настоящему изобретению содержат гидрофильный компонент или гидрофильную фазу.
Подходящие гидрофильные соединения или компоненты включают:
1) Сложные эфиры полиэтиленгликольглицерина и С6-С10 жирных кислот
Сложный эфир жирных кислот может включать сложные моно- и/или ди-, и/или триэфиры жирных кислот. Он необязательно включает насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C8-С10. Полиэтиленгликоли могут содержать, например, от 5 до 10 [СН2-СН2-О] звеньев, например 7 звеньев. Конкретно подходящий сложный эфир жирной кислоты представляет собой полиэтиленгликоль(7)глицерилмонококоат, который является коммерчески доступным, например, под товарным наименованием Cetiol® НЕ, например, от Henkel KGaA. Cetiol® НЕ имеет D. (20°) 1,05, кислотное число менее 5, число омыления приблизительно 95, гидроксильное число приблизительно 180 и йодное число менее 5 (Н. Fiedler, loc. cit., vol 1, page 410) или Lipestrol E-810.
2) N-алкилпирролидон
Особенно подходящим является, например, N-метил-2-пирролидон, например, как коммерчески доступный под товарным наименованием Pharmasolve™, например, от International Specialty Products (ISP). N-метилпирролидон характеризуется следующими дополнительными характеризующими параметрами: молекулярная масса 99,1, D.25 1,027-1,028, чистота (как % площади GC) (включая изомеры метила) не менее 99,85% (Н. Fiedler, loc. cit., vol 2, page 1303, информация производителя).
3) Бензиловый спирт
Это соединение является коммерчески доступным, например, от Merck, или его можно получать перегонкой бензилхлорида с карбонатом калия или натрия. Бензиловый спирт характеризуется следующими дополнительными характеризующими параметрами: молекулярная масса 108,14, D. 1,043-1,049, nD 1,538-1,541. (Н. Fiedler, loc. cit., vol 1, page 301; Handbook of Pharmaceutical Excipients, 3rd edition loc. cit., page 41).
4) Триэтилцитрат
Это соединение можно получать, этерифицируя лимонную кислоту и этанол. Триэтилцитрат является коммерчески доступным, например, под товарным наименованием Citroflex®2, или фармацевтической категории под наименованием TEC-PG/N, например, от Morflex Inc. Особенно подходящим является триэтилцитрат, молекулярная масса которого составляет 276,3, удельная плотность 1,135-1,139, показатель преломления 1,439-1,441, вязкость (25°) 35,2 мПа⋅с, содержание (безводная основа) 99,0-100,5%, содержание воды не более 0,25% (Fiedler, Н.P., loc. cit., vol 1, page 446; "Handbook of Pharmaceutical Excipients", loc. cit., page 573).
5) Полиэтиленгликоли, например полиэтиленгликоль 400 (PEG400), полиэтиленгликоль 300 (PEG300).
6) Этанол
Другие подходящие гидрофильные соединения включают транскутол (С2Н5-[О-(СН2)2]2-ОН), гликофурол (также известный как простой эфир тетрагидрофурфурилового спирта и полиэтиленгликоля), 1,2-пропиленгликоль, диметилизосорбид (арласолв), триэтиленгликоль, этилацетат и этиллактат.
Гидрофильный компонент может составлять от 5 до 60% по массе композиции по изобретению, например от 10 до 50%, предпочтительно от 10 до 40% по массе, более предпочтительно приблизительно от 10 приблизительно до 30% по массе, наиболее предпочтительно приблизительно 20% по массе.
Гидрофильный компонент может содержать один компонент или смесь двух или более гидрофильных компонентов. Соотношение основного гидрофильного компонента к гидрофильному совместно используемому компоненту, как правило, составляет приблизительно от 0,5:1 приблизительно до 2:1.
Композиции по изобретению содержат липофильный компонент или липофильную фазу. Липофильный компонент предпочтительно характеризуется низким значением HLB менее 10, например до 8.
Подходящие липофильные компоненты включают:
1) Сложные моноэфиры глицерина и C6-C14 жирных кислот
Эти соединения можно получать этерификаций глицерина растительным маслом с последующей молекулярной перегонкой. Моноглицериды, пригодные для использования в композициях по изобретению, включают как симметричные (т.е. β-моноглицериды), так и асимметричные моноглицериды (α-моноглицериды). Они также включают как однородные глицериды (в которых компонент жирных кислот состоит преимущественно из одной жирной кислоты), так и смешанные глицериды (т.е. в которых жирнокислый компонент состоит из различных жирных кислот). Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C8-C14. Особенно подходящими являются моноглицериды каприловой или лауриновой кислоты, которые являются коммерчески доступными, например, под товарными наименованиями Imwitor® 308 или Imwitor® 312 соответственно, например, от Sasol. Например, Imwitor® 308 содержит по меньшей мере 80% моноглицеридов, и он характеризуется следующими дополнительными характеризующими параметрами: свободный глицерин не более 6%, кислотное число не более 3, число омыления 245-265, йодное число не более 1, содержание воды не более 1%. Как правило, он содержит 1% свободного глицерина, 90% моноглицеридов, 7% диглицеридов, 1% триглицеридов (Н. Fiedler, loc. cit., volume 1, page 906). Дополнительный пример представляет собой Capmul MCM С8 от Abitec Corporation.
2) Смеси моно- и диглицеридов C6-C18 жирных кислот
Эти соединения могут включать как симметричные (т.е. β-моноглицериды и α,α1-диглицериды), так и асимметричные моно- и диглицериды (т.е. α-моноглицериды и α,β-диглицериды) и их ацетилированные производные. Они также включают как однородные глицериды (в которых жирнокислый компонент состоит преимущественно из одной жирной кислоты), так и смешанные глицериды (т.е. в которых жирнокислый компонент состоит из различных жирных кислот) и любые их производные с молочной или лимонной кислотой. Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от С8-С10. Особенно подходящими являются смешанные моно- и диглицериды каприловой и каприновой кислоты, такие как коммерчески доступные, например, под товарным наименованием Imwitor® 742 или Imwitor 928, например, от Sasol. Например, Imwitor® 742 содержит по меньшей мере 45% моноглицеридов, и он характеризуется следующими дополнительными характеризующими параметрами: свободный глицерин не более 2%, кислотное число не более 2, число омыления 250-280, йодное число не более 1, содержание воды не более 2% (Н. Fiedler, loc. cit., vol 1, page 906). Другие подходящие смеси содержат моно-/диглицериды каприловой/каприновой кислоты в глицерине, такие как известные и коммерчески доступные, например, под товарным наименованием Capmul® MCM, например, от Abitec Corporation. Capmul® МСМ характеризуется следующими дополнительными характеризующими параметрами: кислотное число не более 2,5, альфа-моно (в виде олеата) не менее 80%, свободный глицерин не более 2,5%, йодное число не более 1, распределение по длине макромолекулярных цепей: капроновая кислота (С6) не более 3%, каприловая кислота (С8) не менее 75%, каприновая кислота (С10) не менее 10%, лауриновая кислота (С12) не более 1,5%, влажность (по Карлу Фишеру) не более 0,5% (информация производителя). Подходящие примеры моно-/диглицеридов с дополнительной дериватизацией молочной или лимонной кислотой представляют собой такие, как представленные на рынке под товарными наименованиями Imwitor 375, 377 или 380 от Sasol. Кроме того, жирнокислый компонент может содержать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C16-C18. Подходящий пример представляет собой Tegin® О (глицерилолеат), характеризующийся следующими дополнительными характеризующими параметрами: содержание моноглицерида 55-65%, перекисное число не более 10, содержание воды не более 1%, кислотное число не более 2, йодное число 70-76, число омыления 158-175, свободный глицерин не более 2%, (информация производителя).
3) Сложные диэфиры глицерина и C6-C18 жирных кислот
Эти соединения могут включать симметричные (т.е. α,α1-диглицериды) и асимметричные диглицериды (т.е. α,β-диглицериды) и их ацетилированные производные. Они также могут включать как однородные глицериды (в которых жирнокислый компонент преимущественно состоит из одной жирной кислоты), так и смешанные глицериды (т.е. в которых жирнокислый компонент состоит из различных жирных кислот) и любые их ацетилированные производные. Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи от C6-C18, например С6-C16, например C8-С10, например C8. Особенно подходящими являются каприловые диглицериды, которые являются коммерчески доступными, например, под товарным наименованием Sunfat® GDC-S, например, от Taiyo Kagaku Co., Ltd. Кислотное число Sunfat® GDC-S составляет приблизительно 0,3, содержание диглицерида приблизительно 78,8% и содержание моноэфира приблизительно 8,9.
4) Триглицерид среднецепочечных жирных кислот
Эти соединения могут включать триглицериды насыщенной жирной кислоты, содержащей от 6 до 12, например от 8 до 10 атомов углерода. Подходящие триглицериды среднецепочечной жирной кислоты являются такими, которые известны и коммерчески доступны под товарными наименованиями Acomed®, Myritol®, Captex®, Neobee®M 5 F, Miglyol®810, Miglyol®812, Miglyol®818, Mazol®, Sefsol®860, Sefsol®870, где Miglyol®812 является наиболее предпочтительным. Miglyol®812 представляет собой фракционированное кокосовое масло, содержащее триглицериды каприловой-каприновой кислоты и имеющее молекулярную массу приблизительно 520 Дальтон. Композиция жирной кислоты = С6 не более приблизительно 3%, C8 приблизительно от 50 до 65%, С10 приблизительно от 30 до 45%, C12 не более 5%, кислотное число приблизительно 0,1, число омыления приблизительно от 330 до 345, йодное число не более 1. Miglyol®812 является доступным от Condea. Neobee®M 5 F представляет собой фракционированный триглицерид каприловой-каприновой кислоты, получаемый из кокосового масла, кислотное число не более 0,2, число омыления приблизительно от 335 до 360, йодное число не более 0,5, содержание воды не более 0,15%, D.20 0,930-0,960, nD20 1,448-1,451 (информация производителя). Neobee®M 5 F является доступным от Stepan Europe. Дополнительный пример представляет собой Miglyol 829, дополнительно содержащий сложные эфиры с янтарной кислотой.
5) Сложные моноэфиры глицерина и C16-C18 жирных кислот
Эти соединения можно получать этерификацией глицерина растительным маслом с последующей молекулярной перегонкой. Пригодные для использования в композициях по изобретению моноглицериды включают как симметричные (т.е. β-моноглицериды), так и асимметричные моноглицериды (α-моноглицериды). Они также включают как однородные глицериды (в которых жирнокислый компонент состоит преимущественно из одной жирной кислоты), так и смешанные глицериды (т.е. в которых жирнокислый компонент состоит преимущественно из различных жирных кислот). Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C16-C18. Подходящие примеры включают GMOrphic от Eastman, Rylo MG20 перегнанный моноглицерид от Danisco Ingredients, или Monomuls 90-018 от Henkel. Например, GMOrphic®-80 (глицерилмоноолеат) характеризуется следующими дополнительными характеризующими параметрами: содержание моноглицерида не менее 94%, содержание С18:1 не менее 75%, перекисное число не более 2,5, С18:2+С18:3 не более 15%, С16:0+С18:0+С20:0 не более 10%, содержание воды не более 2%, кислотное число не более 3, йодное число 65-75, число омыления 155-165, свободный глицерин не более 1%, гидроксильное число 300-330 (информация производителя).
6) Смешанные моно-, ди- и триглицериды
Эти соединения могут включать смешанные моно-, ди-, триглицериды, которые являются коммерчески доступными под товарным наименованием Maisine® от Gattefosse. Они представляют собой продукты переэтерификации кукурузного масла и глицерина. Такие продукты преимущественно состоят из моно-, ди- и триглицеридов линолевой и олеиновой кислот совместно с незначительными количествами моно-, ди- и триглицеридов пальмитиновой и стеариновой кислот (где кукурузное масло само по себе состоит из приблизительно 56% по массе линолевой кислоты, 30% олеиновой кислоты, компонентов приблизительно 10% пальмитиновой и приблизительно 3% стеариновой кислот). Физические характеристики являются следующими: свободный глицерин не более 10%, моноглицериды приблизительно 40%, диглицериды приблизительно 40%, триглицериды приблизительно 10%, содержание свободной олеиновой кислоты приблизительно 1%. Дополнительные физические характеристики являются следующими: кислотное число не более 2, йодное число 85-105, число омыления 150-175, содержание неорганических кислот = 0. Содержание жирных кислот для Maisine® составляет, как правило: пальмитиновая кислота приблизительно 11%, стеариновая кислота приблизительно 2,5%, олеиновая кислота приблизительно 29%, линолевая кислота приблизительно 56%, другие приблизительно 1,5% (Н. Fiedler, loc. cit., volume 2, page 1079; информация производителя).
Смешанные моно-, ди-, триглицериды предпочтительно содержат смеси моно-, ди- и триглицеридов от С8 до С10 или С12-20 жирных кислот, в частности смешанные моно-, ди- и триглицериды C16-18 жирных кислот. Жирнокислый компонент смешанных моно-, ди- и триглицеридов может содержать остатки насыщенных и ненасыщенных жирных кислот. Однако предпочтительно они преимущественно состоят из остатков ненасыщенных жирных кислот, в частности остатков C18 ненасыщенных жирных кислот. Подходящие смешанные моно-, ди-, триглицериды содержат по меньшей мере 60%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 85% по массе моно-, ди- и триглицеридов C18 ненасыщенных жирных кислот (например, линоленовой, линолевой и олеиновой кислоты). Подходящие смешанные моно-, ди-, триглицериды содержат по меньшей мере 20%, например приблизительно 15% или 10% по массе или менее, моно-, ди- и триглицеридов насыщенных жирных кислот (например, пальмитиновой и стеариновой кислоты). Смешанные моно-, ди- и триглицериды предпочтительно преимущественно состоят из моно- и диглицеридов, например, моно- и диглицериды составляют по меньшей мере 50%, более предпочтительно по меньшей мере 70% от общей массы липофильной фазы или липофильного компонента. Более предпочтительно моно- и диглицериды составляют по меньшей мере 75% (например, приблизительно 80% или 85%) по массе липофильного компонента. Предпочтительно моноглицериды составляют приблизительно от 25 приблизительно до 50% от общей массы липофильного компонента смешанных моно-, ди-, триглицеридов. Более предпочтительно содержание моноглицеридов составляет приблизительно от 30 приблизительно до 40% (например, от 35 до 40%). Предпочтительно диглицериды составляют приблизительно от 30 приблизительно до 60% от общей массы липофильного компонента смешанных моно-, ди-, триглицеридов. Более предпочтительно содержание диглицеридов составляет приблизительно от 40 приблизительно до 55% (например, от 48 до 50%). Триглицериды соответственно составляют по меньшей мере 5%, но менее приблизительно 25% от общей массы липофильного компонента смешанных моно-, ди-, триглицеридов. Более предпочтительно содержание триглицеридов составляет приблизительно от 7,5 приблизительно до 15% (например, приблизительно от 9 до 12%). Смешанные моно-, ди-, триглицериды можно получать смешиванием отдельных моно-, ди- или триглицеридов в подходящей относительной пропорции. Однако обычно они содержат продукты переэтерификации растительных масел глицерином, например миндального масла, арахисового масла, оливкового масла, персикового масла, пальмового масла или предпочтительно кукурузного масла, подсолнечного масла или сафлорового масла и наиболее предпочтительно кукурузного масла. Такие продукты переэтерификации, как правило, получают, как описано в GB 2257359 или WO 94/09211. При получении мягких желатиновых капсул предпочтительно сначала удаляют некоторое количество глицерина для получения "партии продукта, по существу не содержащего глицерин". Очищенные продукты переэтерификации кукурузного масла и глицерина представляют собой, особенно подходящие смешанные моно-, ди- и триглицериды, далее в настоящем описании обозначаемые как "очищенное масло", и их получают способами, описанными в описании патента Великобритании GB 2257359 или международной патентной публикации WO 94/09211.
7) Ацетилированные моноглицериды (С18)
Эти соединения могут включать, например, Myvacet 9-45.
8) Сложные моноэфиры пропиленгликоля и жирных кислот
Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C8-C12. Особенно подходящим является сложный моноэфир пропиленгликоля каприловой и лауриновой кислоты, такой как коммерчески доступный, например, под товарными наименованиями Sefsol® 218, Capryol®90 или Lauroglycol®90, например, от Nikko Chemicals Co., Ltd. или Gattefosse, или Capmul PG-8 от Abitec Corporation. Например, Lauroglycol®90 характеризуется следующими дополнительными характеризующими параметрами: кислотное число не более 8, число омыления 200-220, йодное число не более 5, содержание свободного пропиленгликоля не более 5%, содержание сложного моноэфира не менее 90% (Н. Fiedler, loc. cit., vol 2, page 1025, информация производителя), Sefsol® 218 характеризуется следующими дополнительными характеризующими параметрами: кислотное число не более 5, гидроксильное число 220-280.
9) Сложные моно- и диэфиры пропиленгликоля и жирных кислот
Эти соединения могут включать Lauroglycol FCC и Capryol PGMC.
10) Сложные диэфиры пропиленгликоля
Сложные диэфиры пропиленгликоля и жирных кислот, такие как пропиленгликольдикаприлат (который является коммерчески доступным под товарным наименованием Miglyol® 840, например, от Sasol, Н. Fiedler, loc. cit, volume 2, page 1130) или Captex 200 от Abitec Corporation.
11) Пропиленгликольмоноацетат и пропиленгликольдиацетат
12) Переэтерифицированные этоксилированные растительные масла
Эти соединения могут включать переэтерифицированные этоксилированные растительные масла, такие как масла, получаемые при реагировании различных природных растительных масел (например, кукурузного масла, маисового масла, касторового масла, косточкового масла, миндального масла, арахисового масла, оливкового масла, соевого масла, подсолнечного масла, сафлорового масла и пальмового масла или их смесей) с полиэтиленгликолями, средняя молекулярная масса которых составляет от 200 до 800, в присутствии подходящего катализатора. Эти способы описаны в описании патента США US 3288824, переэтерифицированное этоксилированное кукурузное масло является особенно предпочтительным.
Переэтерифицированные этоксилированные растительные масла известны и являются коммерчески доступными под товарным наименованием Labrafil® (Н. Fiedler, loc. cit. vol 2, page 994). Примеры представляют собой Labrafil® М 2125 CS (получаемый из кукурузного масла, и кислотное число которого составляет менее приблизительно 2, число омыления от 155 до 175, значение HLB от 3 до 4 и йодное число от 90 до 110), и Labrafil® М 1944 CS (получаемый из косточкового масла, и кислотное число которого составляет приблизительно 2, число омыления от 145 до 175 и йодное число от 60 до 90). Также можно использовать Labrafil® М 2130 CS (который представляет собой продукт переэтерификации C12-18глицерида и полиэтиленгликоля и температура плавления которого составляет приблизительно от 35 до 40°С, кислотное число менее приблизительно 2, число омыления от 185 до 200 и йодное число менее приблизительно 3). Предпочтительное переэтерифицированное этоксилированное растительное масло представляет собой Labrafil® М 2125 CS, который можно получать, например, от Gattefosse, Saint-Priest Cedex, France.
13) Сложные эфиры сорбитана и жирных кислот
Такие сложные эфиры могут включать, например, сложные моноэфиры сорбитана и С12-18 жирных кислот, или сложные триэфиры сорбитана С12-18 жирных кислот, являются коммерчески доступными под товарным наименованием Span®, например, от Uniqema. Особенно предпочтительный продукт этого класса представляет собой, например, Span® 20 (сорбитан монолаурат) или Span® 80 (сорбитан моноолеат) (Fiedler, loc. cit., 2, p. 1571; Handbook of Pharmaceutical Excipients, loc. cit., page 511).
14) Этерифицированные соединения жирной кислоты и первичных спиртов
Эти соединения могут включать этерифицированные соединения жирной кислоты, содержащей от 8 до 20 атомов углерода, и первичного спирта, содержащего от 2 до 3 атомов углерода, например изопропилмиристат, изопропилпальмитат, этиллинолеат, этилолеат, этилмиристат и т.д., где этерифицированное соединение линолевой кислоты и этанола является особенно предпочтительным, а также изопропилмирист и изопропилпальмитат.
15) Триацетат глицерина или (1,2,3)-триацетин
Можно получать этерификацией глицерина уксусным ангидридом. Триацетат глицерина является коммерчески доступным, например, как Priacetin® 1580 от Unichema International, или как триацетин Eastman™ от Eastman, или от Courtaulds Chemicals Ltd. Триацетат глицерина характеризуется следующими дополнительными характеризующими параметрами: молекулярная масса 218,03, D.20,3 1,159-1,163, nD20 1,430-1,434, содержание воды не более 0,2%, вязкость (25°) 17,4 мПа⋅с, кислотное число не более 0,1, число омыления приблизительно 766-774, содержание триацетина не менее 97%. (Н. Fiedler, loc. cit. vol 2, page 1720; Handbook of Pharmaceutical Excipients, loc. cit., page 534, информация производителя).
16) Ацетилтриэтилцитрат
Это соединение можно получать этерификацией лимонной кислоты и этанола с последующим ацетилированием уксусным ангидридом соответственно. Ацетилтриэтилцитрат является коммерчески доступным, например, под товарным наименованием Citroflex® А-2, например, от Morflex Inc.
17) Трибутилцитрат или ацетилтрибутилцитрат
18) Сложные эфиры полиглицерина и жирных кислот
Эти соединения содержат, например, от 2 до 10, например 6 глицериновых звеньев. Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C8-C18. Особенно подходящим является, например, Plurol Oleique СС497 от Gattefosse с числом омыления 133-155 и числом омыления 196-244. Дополнительные подходящие сложные эфиры полиглицерина и жирных кислот включают диглицерилмоноолеат (DGMO) и Hexaglyn-5-O, которые известны и являются коммерчески доступными, например, от Nikko Chemicals Co., Ltd.
19) Простой эфир PEG и жирного спирта
Это соединение может включать Brij 30™ полиоксиэтилен(4)лауриловый эфир.
20) Жирные спирты и жирные кислоты
Жирные кислоты можно получать гидролизом различных животных и растительных жиров или масел, таких как оливковое масло, с последующим выделением жидких кислот. Жирнокислый/спиртовой компонент может включать насыщенные и моно- или ди- ненасыщенные жирные кислоты/спирты с длинной цепи, например, от C6-C20. Особенно подходящими являются, например, олеиновая кислота, олеиловый спирт, линолевая кислота, каприновая кислота, каприловая кислота, капроновая кислота, тетрадеканол, додеканол или деканол. Олеиловый спирт является коммерчески доступным под товарным знаком HD-Eutanol® V, например, от Henkel KGaA. Олеиловый спирт характеризуется следующими дополнительными характеризующими параметрами: кислотное число не более 0,1, гидроксильное число приблизительно 210, йодное число приблизительно 95, число омыления не более 1, D.20 приблизительно 0,849, nD20 1,462, молекулярная масса 268, вязкость (20°) приблизительно 35 мПа⋅с (информация производителя). Олеиновая кислота характеризуется следующими дополнительными характеризующими параметрами: молекулярная масса 282,47, D.20 0,895, nD20 1,45823, кислотное число 195-202, йодное число 85-95, вязкость (25°) 26 мПа⋅с (Н. Fiedler, loc. cit., volume 2, page 1236; "Handbook of Pharmaceutical Excipients", 2nd Edition, Editors A. Wade and P.J. Weller (1994), Joint publication of American Pharmaceutical Assoc., Washington, USA and The Pharmaceutical Press, London, England, page 325).
21) Токоферол и его производные (например, ацетат)
Эти соединения могут включать Coviox Т-70, Copherol 1250, Copherol F-1300, Covitol 1360 и Covitol 1100.
22) Фармацевтически приемлемые масла
Альтернативно, липофильный компонент содержит, например, фармацевтически приемлемое масло предпочтительно с ненасыщенным компонентом, такое как растительное масло.
23) Простые или сложные эфиры алкиленполиолов
Эти соединения могу включать С3,5алкилентриолы, в частности простые или сложные эфиры глицерина. Подходящие простые или сложные эфиры С3,5алкилентриолов включают смешанные простые или сложные эфиры, т.е. компоненты, содержащие другие ингредиенты на основе простых или сложных эфиров, например продукты переэтерификации сложных эфиров С3-5алкилентриолов с другими моно-, ди- или полиолами. Особенно подходящими простыми или сложными эфирами алкиленполиолов являются смешанные сложные эфиры С3-5алкилентриолов/поли(С2-4алкилен)гликоля и жирных кислот, в частности смешанные сложные эфиры глицерина/полиэтилен- или полипропиленгликоля и жирных кислот.
Особенно подходящие простые или сложные эфиры алкиленполиолов включают продукты, получаемые переэтерификацией глицеридов, например триглицеридов, поли(С2-4алкилен)гликолями, например полиэтиленгликолями и необязательно глицерином. Такие продукты переэтерификации, как правило, получают спиртовым гидролизом глицеридов, например триглицеридов, в присутствии поли(С2-4алкилен)гликоля, например полиэтиленгликоля и необязательно глицерина (т.е. проводят переэтерификацию глицерида до полиалкиленгликоль/глицеринового компонента, т.е. посредством гликолиза/глицеролиза полиалкиленов).
Как правило, такую реакцию проводят, подвергая взаимодействию указанные компоненты (глицерид, полиалкиленгликоль и необязательно глицерин) при повышенной температуре в атмосфере инертного газа при непрерывном помешивании.
Предпочтительные глицериды представляют собой триглицериды жирных кислот, например триглицериды (С10-22 жирных кислот), включая природные и гидрогенизированные масла, в частности растительные масла. Подходящие растительные масла включают, например, оливковое, миндальное, арахисовое, кокосовое, пальмовое, соевое масла и масло зародышей пшеницы, и в частности природные или гидрогенизированные масла, обогащенные остатками сложных эфиров (С12-18 жирных кислот). Предпочтительные полиалкиленгликолевые вещества представляют собой полиэтиленгликоли, в частности полиэтиленгликоли с молекулярной массой приблизительно от 500 приблизительно до 4000, например приблизительно от 1000 приблизительно до 2000.
Подходящие простые или сложные эфиры алкиленполиолов включают смеси сложных эфиров С3-5алкилентриолов, например сложные моно-, ди- и триэфиры в различном относительном количестве, и сложные моно- и диэфиры поли(С2-4алкилен)гликоля совместно с незначительными количествами свободного С3-5алкилентриола и свободного поли(С2-5алкилен)гликоля. Как указано выше, предпочтительный алкилентриоловый фрагмент представляет собой глицерил, предпочтительные полиалкиленгликолевые фрагмента включают полиэтиленгликоль, в частности с молекулярной массой приблизительно от 500 приблизительно до 4000, и предпочтительные фрагменты жирных кислот представляют собой остатки сложных эфиров С10-22 жирных кислот, в частности остатки сложных эфиров насыщенных С10-22 жирных кислот.
Особенно подходящие простые или сложные эфиры алкиленполиолов включают продукты переэтерификации природного или гидрогенизированного растительного масла и полиэтиленгликоля и необязательно глицерина или композиции, содержащие или состоящие из сложных моно-, ди- и триэфиров глицерина и С10-22 жирных кислот и сложных моно- и диэфиров полиэтиленгликоля и С10-22 жирных кислот (необязательно совместно, например, с незначительными количествами свободного глицерина и свободного полиэтиленгликоля).
Предпочтительные растительные масла, полиэтиленгликоли или полиэтиленгликолевые фрагменты и фрагменты жирных кислот, как они определены выше, приведены выше в настоящем описании. Особенно подходящие простые или сложные эфиры алкиленполиолов, как описано выше, для применения в настоящем изобретении включают такие, как коммерчески доступные под товарным наименованием Gelucire®, например, от Gattefosse, в частности продукты:
a) Gelucire® 33/01, который имеет tпл. = приблизительно 33-37°С и число омыления приблизительно 230-255,
b) Gelucire® 39/01, tпл. = приблизительно 37,5-41,5°С, число омыления = приблизительно 225-245,
c) Gelucire® 43/01, tпл. = приблизительно 42-46°С, число омыления = приблизительно 220-240.
Все указанные выше продукты от (а) до (с) имеют кислотное число не более 3. Композиции по изобретению могут включать смеси таких простых или сложных эфиров.
24) Углеводороды
Эти соединения могут включать, например, сквален, доступный, например, от Nikko Chemicals Co., Ltd.
25) Сложные эфиры этиленгликоля
Эти соединения могут включать Monthyle® (моностеарат этиленгликоля), доступный, например, от Gattefosse.
26) Сложные эфиры пентаэритриола и жирных кислот и простые эфиры полиалкиленгликоля
Эти соединения могут включать, например, пентаэритритдиолеат, пентаэритритдистеарат, пентаэритритмонолаурат, простой эфир пентаэритрита и полигликоля и пентаэритритмоностеарат, а также сложные эфиры пентаэритрита и жирных кислот (Fiedler, loc. cit, 2, p. 1288-1290, включенной в настоящий документ посредством ссылки).
Некоторые из липофильных компонентов, например (1-3, 5-6, 8-9, 12-13, 19), проявляют свойства, подобные поверхностно-активным веществам, и могут также называться совместными поверхностно-активными веществами.
Липофильный компонент предпочтительно составляет от 5 до 85% по массе композиции по изобретению, например от 10 до 85%, предпочтительно от 15 до 60% по массе, более предпочтительно приблизительно от 15 приблизительно до 40% по массе.
Композиции по настоящему изобретению предпочтительно содержат одно или более поверхностно-активных веществ для уменьшения междуфазного натяжения, таким образом обеспечивая термодинамическую стабильность.
Поверхностно-активные вещества могут представлять собой комплексные смеси, содержащие побочные продукты или непрореагировавшие исходные продукты, используемые при их получении, например поверхностно-активные вещества, получаемые полиоксиэтилированием, могут содержать другой побочный продукт, например полиэтиленгликоль. Предпочтительно значение гидрофильно-липофильного баланса (HLB) комплексных смесей или каждого поверхностно-активного вещества составляет от 8 до 17, в частности от 10 до 17. Значение HLB предпочтительно представляет собой среднее значение HLB.
Подходящие поверхностно-активные вещества включают:
1) Продукты реакции природного или гидрогенизированного касторового масла и этиленоксида
Природное или гидрогенизированное касторовое масло можно подвергать взаимодействию с этиленоксидом в молярном отношении приблизительно от 1:35 приблизительно до 1:60 с необязательным удалением полиэтиленгликолевого компонента из продуктов. Различные такие поверхностно-активные вещества являются коммерчески доступными. Особенно подходящие поверхностно-активные вещества включают полиэтиленгликоль-гидрогенизированные касторовые масла, доступные под товарным наименованием Cremophor®, Cremophor® RH 40, число омыления которого составляет приблизительно от 50 до 60, кислотное число менее приблизительно 1, содержание воды (по Фишеру) менее приблизительно 2%, nD60 приблизительно 1,453-1,457 и HLB приблизительно 14-16, и Cremophor® RH 60, число омыления которого составляет приблизительно 40-50, кислотное число менее приблизительно 1, йодное число менее приблизительно 1, содержание воды (по Фишеру) приблизительно 4,5-5,5%, nD60 приблизительно 1,453-1,457 и HLB приблизительно от 15 до 17.
Особенно предпочтительный продукт этого класса представляет собой Cremophor® RH40. Другие пригодные продукты этого класса являются доступными под товарными наименованиями Nikkol® (например, Nikkol® НСО-40 и НСО-60), Mapeg® (например, Mapeg® CO-40h), Incrocas® (например, Incrocas® 40), Tagat® (например, сложные эфиры полиоксиэтиленглицерина и жирных кислот, например, Tagat® RH 40) и Simulsol OL-50 (PEG-40 касторовое масло, число омыления которого составляет приблизительно от 55 до 65, кислотное число не более 2, йодное число от 25 до 35, содержание воды не более 8% и HLB приблизительно 13, доступное от Seppic). Эти поверхностно-активные вещества дополнительно описаны в Fiedler loc. cit.
Другие подходящие поверхностно-активные вещества этого класса включают полиэтиленгликолькасторовые масла, такие как доступные под товарным наименованием Cremophor® EL, молекулярная масса которого оставляет (определяемую методом паровой осмометрии) приблизительно 1630, число омыления приблизительно от 65 до 70, кислотное число приблизительно 2, йодное число приблизительно от 28 до 32 и nD25 приблизительно 1,471.
2) Сложные эфиры полиоксиэтиленсорбитана и жирных кислот
Эти соединения могут включать сложные моно- и трилауриловые, пальмитиловые, стеариловые и олеиловые эфиры известного и коммерчески доступного типа продукта под товарным наименованием Tween® (Fiedler, loc. cit. p. 1754) от Uniqema, включая продукты:
Tween® 20 [полиоксиэтилен(20)сорбитан монолаурат],
Tween® 21 [полиоксиэтилен(4)сорбитан монолаурат],
Tween® 40 [полиоксиэтилен(20)сорбитан монопальмитат],
Tween® 60 [полиоксиэтилен(20)сорбитан моностеарат],
Tween® 65 [полиоксиэтилен(20)сорбитан тристеарат],
Tween® 80 [полиоксиэтилен(20)сорбитан моноолеат],
Tween® 81 [полиоксиэтилен(5)сорбитан моноолеат] и
Tween® 85 [полиоксиэтилен(20)сорбитан триолеат].
Особенно предпочтительные продукты этого класса представляют собой Tween® 20 и Tween® 80.
3) Сложные эфиры полиоксиэтилена
Эти соединения могут включать сложные эфиры полиоксиэтилена и стеариновой кислоты известного и коммерчески доступного типа продукта под товарным наименованием Myrj® от Uniqema (Fiedler, loc. cit., 2, p. 1166). Особенно предпочтительный продукт этого класса представляет собой Myrj® 52 с D25 приблизительно 1,1, температурой плавления приблизительно от 40 до 44°С, значением HLB приблизительно 16,9, кислотным числом приблизительно от 0 до 1 и числом омыления приблизительно от 25 до 35.
4) Сополимеры и блок-сополимеры полиоксиэтилена и полиоксипропилена или полоксамеры
Эти соединения могут включать известный и коммерчески доступный тип продукта под товарными наименованиями Pluronic® и Emkalyx® (Fiedler, loc. cit., 2, p. 1329). Особенно предпочтительный продукт этого класса представляет собой Pluronic® F68 (полоксамер 188) от BASF, температура плавления которого составляет приблизительно 52°С и молекулярная масса приблизительно от 6800 до 8975. Дополнительный предпочтительный продукт этого класса представляет собой Synperonic® РЕ L44 (полоксамер 124) от Uniqema.
5) Сложные моноэфиры полиоксиэтилена насыщенной С10-С22 жирной кислоты
Эти соединения могут включать замещенные C18, например, гидроксижирной кислотой, например, сложным эфиром PEG и 12-гидроксистеариновой кислотой, например PEG приблизительно, например, 600-900, например 660 Дальтон ММ, например, Solutol® HS 15 от BASF, Ludwigshafen, Germany. Согласно технической аннотации от BASF MEF 151Е (1986) содержит приблизительно 70% полиэтоксилированного 12-гидроксистеарата по массе и приблизительно 30% по массе неэтерифицированного полиэтиленгликолевого компонента. Solutol HS 15 имеет число гидрирования от 90 до 110, число омыления от 53 до 63, кислотное число не более 1, и максимальное содержание воды 0,5% по массе.
6) Простые эфиры полиоксиэтиленалкилов
Эти соединения могут включать простые эфиры полиоксиэтиленгликоля С12-С18спиртов, например полиоксил 2-, 10-или 20-цетиловый эфир, или полиоксил 23-лауриловый эфир, или полиоксил 20-олеиловый эфир, или полиоксил 2-, 10-, 20- или 100-стеариловый эфир, такие как известные и доступные, например, под торговой маркой Brij® от Uniqema. Особенно предпочтительный продукт этого класса представляет собой, например, Brij® 35 (полиоксил 23-лауриловый эфир) или Brij® 98 (полиоксил 20-олеиловый эфир) (Fiedler, loc. cit., 1, pp. 259; Handbook of Pharmaceutical Excipients, loc. cit., page 367). Аналогично подходящие продукты включают полиоксиэтилен-полиоксипропиленалкиловые эфиры, например полиоксиэтилен-полиоксипропиленовые эфиры С12-С18 спиртов, например полиоксиэтилен-20-полиоксипропилен-4-цетиловый эфир, который является известным и коммерчески доступным под торговой маркой Nikkol РВС® 34, например, от Nikko Chemicals Co., Ltd. (Fiedler, loc. cit., vol. 2, pp. 1210). Простые эфиры полиоксипропилена и жирных кислот, например Acconon® Е, также являются подходящими.
7) Алкилсульфаты и алкилсульфонаты натрия и алкиларилсульфонаты натрия
Эти соединения могут включать лаурилсульфат натрия, который является также известным как додецилсульфат натрия и коммерчески доступным, например, под товарным наименованием Texapon K12® от Henkel KGaA.
8) Растворимые в воде сложные эфиры токоферилполиэтиленгликоля и янтарной кислоты (TPGS)
Эти соединения могут включать такие, число полимеризации которых составляет приблизительно 1000, например, доступные от Eastman Fine Chemicals Kingsport, Texas, USA, или доступные от Cognis.
9) Сложные эфиры полиглицерина и жирных кислот
Эти соединения могут включать такие, как содержащие, например, от 10 до 20, например 10 глицериновых звеньев. Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от C8-C18. Особенно подходящим является, например, декаглицерилмонолаурат или декаглицерилмономиристат, такой как известный и коммерчески доступный под торговой маркой Decaglyn® 1-L или Decaglyn® 1-М, или Decaglyn 1-O соответственно, например, от Nikko Chemicals С., Ltd (Fiedler, loc. cit., vol. 2, pp. 1359).
10) Простые или сложные эфиры алкиленполиолов
Эти соединения могут включать простые или сложные эфиры С3-5алкилентриолов, в частности глицерина. Подходящие простые или сложные эфиры С3-5алкилентриолов включают смешанные простые или сложные эфиры, т.е. компоненты, включающие другие ингредиенты простых или сложных эфиров, например продукты переэтерификации сложных эфиров С3-5алкилентриолов с другими моно-, ди- или полиолами. Особенно подходящими простыми или сложными эфирами алкиленполиолов являются смешанные сложные эфиры С3-5алкилентриолов/поли(С2-4алкилен)гликоля и жирных кислот, в частности смешанные сложные эфиры глицерина/полиэтиленгликоля или полипропиленгликоля и жирных кислот.
Особенно подходящие простые или сложные эфиры алкиленполиолов включают продукты, получаемые переэтерификацией глицеридов, например триглицеридов, поли(С2-4алкилен)гликолями, например полиэтиленгликолями и необязательно глицерином.
Такие продукты переэтерификации, как правило, получают спиртовым гидролизом глицеридов, например триглицеридов, в присутствии поли(С2-4алкилен)гликоля, например полиэтиленгликоля и необязательно глицерина (т.е. проводят переэтерификацию из глицерида до полиалкиленгликоль/глицериновый компонент, т.е. путем гликолиза/глицеролиза полиалкиленов). Как правило, такую реакцию проводят, подвергая взаимодействию указанные компоненты (глицерид, полиалкиленгликоль и необязательно глицерин) при повышенной температуре в атмосфере инертного газа при постоянном перемешивании.
Предпочтительные глицериды представляют собой триглицериды жирных кислот, например триглицериды (С10-22 жирных кислот), включая природные и гидрогенизированные масла, в частности растительные масла. Подходящие растительные масла включают, например, оливковое, миндальное, арахисовое, кокосовое, пальмовое, соевое масла и масло зародышей пшеницы, и в частности природные или гидрогенизированные масла, обогащенные остатками сложных эфиров (С12-18 жирных кислот).
Предпочтительные полиалкиленгликолевые вещества представляют собой полиэтиленгликоли, в частности полиэтиленгликоли с молекулярной массой приблизительно от 500 приблизительно до 4000, например приблизительно от 1000 приблизительно до 2000.
Подходящие простые или сложные эфиры алкиленполиолов включают смеси сложных эфиров С3-5алкилентриолов, например сложных моно-, ди- и триэфиров в различном относительном количестве, и сложные моно- и диэфиры поли(С2-4алкилен)гликолей совместно с незначительными количествами свободного С3-5алкилентриола и свободного поли(С2-5алкилен)гликоля. Как указано выше, предпочтительный алкилентриоловый фрагмент представляет собой глицерил, предпочтительные полиалкиленгликолевые фрагменты включают полиэтиленгликоль, в частности, с молекулярной массой приблизительно от 500 приблизительно до 4000, и предпочтительные фрагменты жирных кислот представляют собой остатки сложных эфиров С10-22 жирных кислот, в частности остатки сложных эфиров насыщенных С10-22 жирных кислот.
Особенно подходящие простые или сложные эфиры алкиленполиолов включают продукты переэтерификации природного или гидрогенизированного растительного масла и полиэтиленгликоля и необязательно глицерина, или композиции, содержащие или состоящие из сложных моно-, ди- и триэфиров глицерина и С10-22 жирных кислот и сложных моно- и диэфиров полиэтиленгликоля и С10-22 жирных кислот (необязательно совместно, например, с незначительными количествами свободного глицерина и свободного полиэтиленгликоля).
Предпочтительные растительные масла, полиэтиленгликоли или полиэтиленгликолевые фрагменты и фрагменты жирных кислот, как они определены выше, приведены выше в настоящем описании.
Особенно подходящие простые или сложные эфиры алкиленполиолов, как описано выше, для применения в настоящем изобретении включают такие, как коммерчески доступные под товарным наименованием Gelucire®, например, от Gattefosse, в частности продукты:
a) Gelucire® 44/14, tпл. = приблизительно 42,5-47,5°С, число омыления = приблизительно 79-93,
b) Gelucire® 50/13, tпл. = приблизительно 46-51°С, число омыления = приблизительно 67-81.
Указанные выше продукты от а) до b) имеют кислотное число не более 2.
Простые или сложные эфиры алкиленполиола с йодным числом не более 2 являются, как правило, предпочтительными. Композиции по изобретению могут содержать смеси таких простых или сложных эфиров.
Продукты Gelucire® представляют собой инертные полутвердые воскообразные вещества с амфифильными свойствами. Их классифицируют по их температуре плавления и их значению HLB. В основном продукты Gelucire® представляют собой насыщенные полигликолизированные глицериды, получаемые полигликолизом природных гидрогенизированных растительных масел с полиэтиленгликолями. Они состоят из смеси моно-, ди- и триглицеридов и сложных моно- и диэфиров жирных кислот и полиэтиленгликоля. Особенно подходящим является Gelucire® 44/14, номинальная температура плавления которого составляет 44°С и HLB 14. Его получают взаимодействием гидрогенизированного масла пальмовых косточек и/или гидрогенизированных пальмовых масел с полиэтиленгликолем 1500. Он состоит из приблизительно 20% моно-, ди- и триглицеридов, 72% сложных моно- и диэфиров жирных кислот и полиэтиленгликоля 1500 и 8% свободного полиэтиленгликоля 1500. Распределение жирных кислот в Gelucire® 44/14 является следующим: 4-10 С8, 3-9 С10, 40-50 C12, 14-24 C14, 4-14 C16, 5-15 C18. Gelucire® 44/14 характеризуется следующими дополнительными характеризующими параметрами: кислотное число не более 2, йодное число не более 2, число омыления 79-93, гидроксильное число 36-56, перекисное число не более 6, примеси щелочных металлов не более 80, содержание воды не более 0,50, содержание свободного глицерина не более 3, содержание моноглицеридов 3,0-8,0. (Н. Fiedler, loc. cit., vol 1, page 773; информация производителя).
11) Сложные эфиры полиэтиленгликольглицерина и жирных кислот
Сложный эфир жирной кислоты может включать сложный моно- и/или ди-, и/или триэфир жирной кислоты. Жирнокислый компонент может включать насыщенные и ненасыщенные жирные кислоты с длиной цепи, например, от С12-С18. Полиэтиленгликоли могут, например, содержать от 10 до 40 [СН2-СН2-О] звеньев, например 15 или 30 звеньев. Особенно подходящим является полиэтиленгликоль(15)глицерилмоностеарат, который является коммерчески доступным, например, под товарным наименованием TGMS®-15, например, от Nikko Chemicals Co., Ltd. Другие подходящие сложные эфиры глицерина и жирных кислот включают полиэтиленгликоль(30)глицерилмоностеарат, который является коммерчески доступным, например, под товарным наименованием Tagat® О, например, от Goldschmidt (Н. Fiedler, loc. cit., vol. 2, p. 1502-1503), и Tagat O2 (полиэтиленгликоль(20)глицеролмоноолеат, а также Tagat L (полиэтиленгликоль(30)глицеролмонолаурат) и Tagat L2 (полиэтиленгликоль(20)глицеролмонолаурат), например, все от Goldschmidt (Н. Fiedler, loc. cit., vol. 2, p. 1650). Дополнительный подходящий сложный эфир полиэтиленгликольглицерина и жирной кислоты представляет собой Tagat ТО.
12) Стеролы и их производные
Эти соединения могут содержать холестеролы и их производные, в частности фитостеролы, например продукты, содержащие ситостерин, кампестерин или стигмастерин, и их этиленоксидные аддукты, например соевые стеролы и их производные, например полиэтиленгликолевые стеролы, например полиэтиленгликолевые фитостеролы или полиэтиленгликолевые соевые стеролы. Полиэтиленгликоли могут содержать, например, от 10 до 40 [СН2-СН2-О] звеньев, например 25 или 30 звеньев. Особенно подходящим является полиэтиленгликоль(30)фитостерол, который является коммерчески доступным, например, под товарным наименованием Nikkol BPS®-30, например, от Nikko Chemicals Co., Ltd. Дополнительно подходящим является полиэтиленгликоль(25)соевый стерол, который является коммерчески доступным, например, под товарным наименованием Generol® 122 Е 25, например, от Henkel (Н. Fiedler, loc. cit., vol. 1, p. 779).
13) Переэтерифицированные полиоксиэтилированные глицериды каприловой-каприновой кислоты
Эти соединения могут содержать такие, которые являются коммерчески доступными под товарным наименованием Labrasol®, например, от Gattefosse. Labrasol® имеет кислотное число не более 1, число омыления 90-110 и йодное число не более 1 (Н. Fiedler, loc. cit., vol 2, page 995).
14) Сложные эфиры сахаров и жирных кислот
Эти соединения могут включать соединения С12-С18 жирных кислот, например монолаурат сахарозы, например Ryoto L-1695®, который является коммерчески доступным, например, от Mitsubishi-Kasei Food Corp., Tokyo, Japan.
15) Простые эфиры PEG и стерола
Эти соединения могут включать такие, как содержащие, например, от 5 до 35 [СН2-СН2-О] звеньев, например от 20 до 30 звеньев, например Solulan® С24, который является коммерчески доступным, например, от Amerchol.
16) Диоктилнатрийсульфосукцинат
Это соединение является коммерчески доступным под торговой маркой Aerosol ОТ®, например, от American Cyanamid Co. (Fiedler, loc. cit., 1, p. 164), или ди[2-этилгексил]сукцинат (Fiedler, loc. cit., volume 1, p. 574).
17) Фосфолипиды
Эти соединения могут включать, в частности, лецитины (Fiedler, loc. cit, volume 2, p. 910, 1030). Подходящие лецитины включают, в частности, соевые лецитины.
18) Соли жирных кислот, сульфаты и сульфонаты жирных кислот
Эти соединения могут включать соединения, например, С6-C18, жирных кислот, сульфаты и сульфонаты жирных кислот, такие как известные и коммерчески доступные, например, от Fluka.
19) Соли ацилированных аминокислот
Эти соединения могут включать соединения С6-С18ацилированных аминокислот, например лауроилсаркозинат натрия, который является коммерчески доступным, например, от Fluka.
20) Среднецепочечные или длинноцепочечные алкилы, например С6-С18аммонийные соли
Эти соединения могут включать С6-С18ацилированные аминокислоты, например бромид цетилтриметиламмония, который является коммерчески доступным, например, от Е. Merck AG.
Поверхностно-активное вещество может составлять от 5 до 90% по массе композиции по изобретению, предпочтительно от 10 до 85% по массе, более предпочтительно от 15 до 60% по массе.
Следует понимать, что некоторые поверхностно-активные вещества могут также действовать как гидрофильный компонент и некоторые гидрофильные компоненты могут также действовать как поверхностно-активные вещества.
Определенные варианты осуществления композиций по изобретению включают добавки, например антиоксиданты, противомикробные средства, ингибиторы ферментов, стабилизаторы, консерванты, ароматизаторы, подсластители и другие компоненты, такие как описанные у Fiedler Н.Р., loc. cit.
Эти добавки или ингредиенты могут составлять приблизительно от 0,05 до 5% по массе от общей массы композиции. Противомикробные средства, ингибиторы ферментов, стабилизаторы или консерванты, как правило, содержатся приблизительно от 0,05 до 1% по массе от общей массы композиции. Подсластители или ароматизирующие средства, как правило, содержатся приблизительно до 2,5 или 5% по массе от общей массы композиции.
В другом аспекте изобретение относится к способу получения диспергируемой, предпочтительно спонтанно диспергируемой фармацевтической композиции, содержащей алиспоривир, который включает доведение алиспоривира и несущей среды, содержащей (1) липофильный компонент, (2) поверхностно-активное вещество, (3) гидрофильный компонент и (4) воду, до состояния тщательно перемешанной смеси.
Несущую среду можно получать отдельно до доведения активного средства до состояния тщательно перемешанной смеси с несущей средой. Альтернативно два или более компонентов несущей среды можно смешивать с активным средством.
Спонтанно диспергируемая или диспергируемая фармацевтическая композиция предпочтительно представляет собой предконцентрат, такой как состав на основе липида/поверхностно-активного вещества, как определено в настоящем описании.
Спонтанно диспергируемая или диспергируемая фармацевтическая композиция предпочтительно спонтанно или по существу спонтанно образует микроэмульсию/эмульсию м/в (масло-в-воде) при разбавлении водной средой, такой как вода до разбавления от 1:1 до 1:300, например от 1:1 до 1:70, в частности от 1:10 до 1:70, более конкретно, например, 1:10, или желудочными соками пациента после перорального введения/применения.
В другом аспекте изобретение относится к способу получения фармацевтической композиция, содержащей алиспоривир, где способ включает:
i) доведение алиспоривира и носителя, содержащего (1) липофильный компонент, (2) поверхностно-активное вещество, (3) гидрофильный компонент и (4) воду, до состояния тщательно перемешанной смеси с получением спонтанно диспергируемой или диспергируемой фармацевтической композиции,
Указанный выше способ может необязательно дополнительно включать этап
(ii) разбавления спонтанно диспергируемой или диспергируемой фармацевтической композиции в водной среде с получением микроэмульсии/эмульсии.
Как указано выше, активное средство, в частности алиспоривир, может содержаться в количестве по массе приблизительно до 30% по массе композиции, например приблизительно 20% по массе. Активное средство предпочтительно содержится в количестве приблизительно от 15 приблизительно до 25% по массе композиции, более предпочтительно в количестве приблизительно от 15% приблизительно до 20% по массе композиции.
Гидрофильный компонент может составлять приблизительно от 5% приблизительно до 45% по массе композиции по изобретению, например приблизительно от 5% приблизительно до 40%, предпочтительно приблизительно от 5% приблизительно до 30% по массе, более предпочтительно приблизительно от 10% приблизительно до 25% по массе.
Композиция по изобретению предпочтительно содержит приблизительно от 5% приблизительно до 45% гидрофильного компонента по массе. Таким образом, особенно подходящая композиция содержит гидрофильный компонент приблизительно от 5% приблизительно до 45% по массе, например этанол, полиэтиленгликоль 400 или триэтилцитрат, простой моноэтиловый эфир диэтиленгликоля или пропиленгликоль.
Липофильный компонент предпочтительно составляет приблизительно от 5% приблизительно до 45% по массе композиции по изобретению, например приблизительно от 10% приблизительно до 35%, предпочтительно приблизительно от 15% приблизительно до 20% по массе.
Композиция по изобретению предпочтительно содержит приблизительно от 5% приблизительно до 45% липофильного компонента по массе. Таким образом, особенно подходящая композиция содержит в качестве липофильного компонента приблизительно от 5% приблизительно до 45% по массе, например, среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов или олеиновой кислоты.
Поверхностно-активное вещество может составлять приблизительно от 5% приблизительно до 70% по массе композиции по изобретению, предпочтительно приблизительно от 20% приблизительно до 45% по массе, более предпочтительно приблизительно от 20% приблизительно до 40% по массе.
Композиция по изобретению предпочтительно содержит приблизительно от 5% приблизительно до 70% поверхностно-активного вещества по массе. Таким образом, особенно подходящая композиция содержит поверхностно-активное вещество приблизительно от 5% приблизительно до 45% по массе. Подходящие поверхностно-активные вещества включают, например, гидроксистеарат макроголглицерина, каприлокапроил макрогол-8 глицериды, витамин Е сукцинат полиэтиленгликоля или глицерилкаприлат.
Вода может содержаться в количестве приблизительно от 2% приблизительно до 15% по массе композиции по изобретению, предпочтительно приблизительно от 3% приблизительно до 10% по массе, более предпочтительно приблизительно от 4% приблизительно до 5% по массе, например приблизительно 5% по массе.
Относительная пропорция активного средства(в), липофильного компонента(ов), поверхностно-активного вещества(в), гидрофильного компонента(ов) и воды предпочтительно может приводить к образованию коллоидной системы, которая находится в области "эмульсии" на стандартной трехмерной графической диаграмме. Таким образом, композиции будут высокостабильными и способными переходить в эмульсию при добавлении к водной среде.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент содержится в количестве приблизительно от 5 приблизительно до 45% по массе, предпочтительно приблизительно от 15% приблизительно до 20% по массе и где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты,
3) поверхностно-активное вещество,
4) гидрофильный компонент,
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент содержится в количестве приблизительно от 5% приблизительно до 45% по массе, предпочтительно приблизительно от 15% приблизительно до 20% по массе и где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты,
3) поверхностно-активное вещество, где поверхностно-активное вещество содержится в количестве приблизительно от 5% приблизительно до 45% по массе и где поверхностно-активное вещество выбрано из группы, состоящей из гидроксистеарата макроголглицерина, каприлокапроила макрогол-8 глицеридов, витамин Е сукцината полиэтиленгликоля и глицерилкаприлата,
4) гидрофильный компонент,
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент содержится в количестве приблизительно от 5% приблизительно до 45% по массе, предпочтительно приблизительно от 15% приблизительно до 20% по массе и где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты,
3) поверхностно-активное вещество, где поверхностно-активное вещество содержится в количестве приблизительно от 5% приблизительно до 45% по массе и где поверхностно-активное вещество выбрано из группы, состоящей из гидроксистеарата макроголглицерина, каприлокапроила макрогол-8 глицеридов, витамин Е сукцината полиэтиленгликоля и глицерилкаприлата,
4) гидрофильный компонент, где гидрофильный компонент содержится в количестве приблизительно от 5% приблизительно до 45% по массе, приблизительно от 5% приблизительно до 30% по массе, более предпочтительно приблизительно от 10% приблизительно до 25% по массе и где гидрофильный компонент выбран из группы, состоящей из этанола, полиэтиленгликоля, триэтилцитрата, простого моноэтилового эфира диэтиленгликоля и пропиленгликоля,
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент содержится в количестве приблизительно от 5% приблизительно до 45% по массе, предпочтительно приблизительно от 15% приблизительно до 20% по массе и где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты,
3) поверхностно-активное вещество, где поверхностно-активное вещество содержится в количестве приблизительно от 5% приблизительно до 45% по массе и где поверхностно-активное вещество выбрано из группы, состоящей из гидроксистеарата макроголглицерина, каприлокапроила макрогол-8 глицеридов, витамин Е сукцината полиэтиленгликоля и глицерилкаприлата,
4) гидрофильный компонент, где гидрофильный компонент содержится в количестве приблизительно от 5% приблизительно до 45% по массе, приблизительно от 5% приблизительно до 30% по массе, более предпочтительно приблизительно от 10% приблизительно до 25% по массе и где гидрофильный компонент выбран из группы, состоящей из этанола, полиэтиленгликоля, триэтилцитрата, простого моноэтилового эфира диэтиленгликоля и пропиленгликоля,
5) воду в количестве приблизительно от 3% приблизительно до 6% по массе композиции, предпочтительно приблизительно от 4% приблизительно до 5% по массе композиции,
необязательно содержащей совместное поверхностно-активное вещество отличное от этанола, предпочтительно глицерин в количестве приблизительно до 5% по массе композиции, предпочтительно приблизительно от 1,5% приблизительно до 4% по массе композиции.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 15% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты,
3) поверхностно-активное вещество, где поверхностно-активное вещество выбрано из группы, состоящей из гидроксистеарата макроголглицерина, каприлокапроила макрогол-8 глицеридов, витамин Е сукцината полиэтиленгликоля и глицерилкаприлата,
4) гидрофильный компонент, где гидрофильный компонент выбран из группы, состоящей из этанола и полиэтиленгликоля,
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
В предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количестве приблизительно от 19% приблизительно до 20% по массе композиции,
2) липофильный компонент, где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов и сорбитана моноолеата, в количество приблизительно от 5% приблизительно до 45% по массе, предпочтительно приблизительно 15% по массе,
3) поверхностно-активное вещество, где поверхностно-активное вещество выбрано из группы, состоящей из каприлокапроила макрогол-8 глицеридов и витамин Е сукцината полиэтиленгликоля, в количестве приблизительно от 5 приблизительно до 45%, предпочтительно приблизительно 40% по массе,
4) гидрофильный компонент, где гидрофильный компонент выбран из группы, состоящей из этанола и полиэтиленгликоля, в количестве приблизительно от 10% приблизительно до 25% по массе, предпочтительно приблизительно 20% по массе,
5) воду в количестве приблизительно от 2% приблизительно до 10% по массе композиции.
Активный ингредиент может содержаться в количестве по массе композиции приблизительно от 15% приблизительно до 30%, например в количестве по массе приблизительно от 15% приблизительно до 20%, 19% приблизительно до 20%, например 15%, 16%, 17%, 18%, 19% или 20%.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей алиспоривир в количестве приблизительно от 5% приблизительно до 15% по массе композиции, например в количестве по массе приблизительно от 5% приблизительно до 10%, например приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9% или приблизительно 10%.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей алиспоривир в количестве приблизительно от 5% приблизительно до 15% по массе композиции, и гидрофильный компонент, где гидрофильный компонент содержится в количестве приблизительно от 5 приблизительно до 45% по массе, приблизительно от 5% приблизительно до 30% по массе, более предпочтительно приблизительно от 10% приблизительно до 25% по массе, и где гидрофильный компонент выбран из группы, состоящей из этанола, полиэтиленгликоля, триэтилцитрата, простого моноэтилового эфира диэтиленгликоля и пропиленгликоля, и где, когда алиспоривир содержится в количестве 10% и гидрофильный компонент представляет собой этанол или пропиленгликоль, композиция не содержит 41% полиэтиленгликольгидрогенизированного касторового масла.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, содержащей:
1) алиспоривир в количество приблизительно от 5% приблизительно до 15% по массе композиции,
2) липофильный компонент, где липофильный компонент содержится в количестве приблизительно от 5 приблизительно до 45% по массе, предпочтительно приблизительно от 15% приблизительно до 20% по массе и где липофильный компонент выбран из группы, состоящей из среднецепочечных триглицеридов, моно-, ди-, триглицеридов кукурузного масла, сорбитана моноолеата, линолеоила макроголглицеридов и олеиновой кислоты
3) поверхностно-активное вещество, где поверхностно-активное вещество сдержится в количестве приблизительно от 5 приблизительно до 45% по массе и где поверхностно-активное вещество выбрано из группы, состоящей из гидроксистеарата макроголглицерина, каприлокапроила макрогол-8 глицеридов, витамин Е сукцината полиэтиленгликоля и глицерилкаприлата,
4) гидрофильный компонент, где гидрофильный компонент содержится в количестве приблизительно от 5 приблизительно до 45% по массе, приблизительно от 5% приблизительно до 30% по массе, более предпочтительно приблизительно от 10% приблизительно до 25% по массе и где гидрофильный компонент выбран из группы, состоящей из этанола, полиэтиленгликоля, триэтилцитрата, простого моноэтилового эфира диэтиленгликоля и пропиленгликоля.
Когда композиция по изобретению, как определено выше, представляет собой предконцентрат микроэмульсии, ее можно объединять с водой или водной растворяющей средой для получения микроэмульсии/эмульсии. Эмульсию или микроэмульсию можно вводить энтерально, например перорально, например, в форме капсулы или пригодного для питья раствора, который можно принимать перорально и проглатывать.
Когда композиция по изобретению представляет собой предконцентрат, такой как состав на основе липида/поверхностно-активного вещества, предпочтительно используют единицу дозирования состава предконцентрата для заполнения оболочки перорально вводимых капсул. Оболочки капсул могут представлять собой мягкие или твердые оболочки капсул, например, выполненные из желатина. Каждая единица дозирования соответственно содержит приблизительно от 0,1 приблизительно до 200 мг активного средства, например приблизительно 0,1 мг, приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 25 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 150 мг или приблизительно 200 мг активного средства. Такие стандартные лекарственные формы являются подходящими для введения от 1 до 5 раз в сутки в зависимости от конкретной цели терапии, фазы терапии и т.п.
Композиции, как определено выше, могут находиться в форме пригодного для питья раствора и могут содержать воду или любую другую водную систему, например фруктовый сок, молоко и т.п., для обеспечения, например, коллоидной системы, подходящей для питья, например, с разбавлением приблизительно от 1:10 приблизительно до 1:100.
Фармацевтические композиции по изобретению могут обладать особенно предпочтительными свойствами при пероральном введении, например, в отношении однородности и высокого уровня биодоступности, получаемых в стандартных испытаниях по оценке биодоступности. Такие испытания проводят на животных, например крысах или собаках, или здоровых добровольцах хроматографическими способами, например ВЭЖХ.
Композиции по изобретению, например, такие как описанные в примерах далее в настоящем описании, могут проявлять хорошие показатели стабильности, на что указывают стандартные испытания стабильности, например обладать стабильностью при хранении до одного, двух или трех лет и даже дольше. Одна группа композиций по изобретению, которые способны образовывать водные эмульсии при добавлении к воде, может являться высокостабильной.
Для композиций по изобретению показаны особенно предпочтительные свойства при пероральном введении, например, в отношении однородности и высоких уровней биодоступности, получаемые в стандартных испытаниях по оценке биодоступности.
Фармакокинетические параметры, например всасываемость лекарственного вещества, и измеряемая, например, как уровни в крови, также неожиданно становятся более предсказуемыми, и проблемы введения, связанные с неоднородным всасыванием, можно устранять или уменьшать. Кроме того, фармацевтически композиции являются эффективными в средах, содержащих поверхностно-активные вещества биологического происхождения или тензидные вещества, например соли желчных кислот, содержащиеся в желудочно-кишечном тракте. Таким образом, фармацевтические композиции по настоящему изобретению полностью диспергируются в водных системах, содержащих такие природные тензиды, и, таким образом, способны образовывать in situ эмульсионные или микроэмульсионные системы и/или системы на основе микрочастиц, которые являются стабильными. Функция фармацевтических композиций при пероральном введение по существу не изменяется и/или не снижается при относительном содержании или отсутствии солей желчных кислот в любой конкретный момент времени или для любого конкретного пациента. Композиции по настоящему изобретению также могут уменьшать вариабельность ответной реакции на дозу у конкретного пациента или у различных пациентов.
Оптимальную дозу активного средства для введения конкретному пациенту следует тщательно подбирать. Может быть целесообразным оценивать уровни активного средства в сыворотке крови радиоиммунологическим анализом, анализом на основе моноклональных антител или другими подходящими общепринятыми способами. Дозирования алиспоривира, как правило, находятся в диапазоне приблизительно от 100 приблизительно до 1600 мг в сутки, например приблизительно от 200 мг приблизительно до 1200 мг в сутки для взрослого массой 75 килограмм, предпочтительно приблизительно от 400 мг приблизительно до 1200 мг, где оптимальное дозирование составляет приблизительно от 800 приблизительно до 1200 мг в сутки.
Фармацевтические композиции, как определено в настоящем описании, предпочтительно составлены в виде стандартной лекарственной формы, например, посредством наполнения ими оболочек перорально вводимых капсул. Оболочки капсул могут представлять собой мягкие или твердые оболочки капсул на основе желатина или НРМС (гидроксипропилметилцеллюлозы) или оболочки капсул из ингредиентов растительного происхождения. В случае если фармацевтическая композиция находится в виде стандартной лекарственной формы, каждая единица дозирования соответственно содержит приблизительно от 50 и приблизительно до 400 мг активного средства, например приблизительно 50 мг, приблизительно 100 мг, приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг. Такие стандартные лекарственные формы являются подходящими для введения один или более раз в сутки в зависимости от конкретной цели терапии, фазы терапии и т.п.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, как определено выше, для применения в качестве лекарственного средства предпочтительно при лечении инфицированного вирусом гепатита С пациента, и где алиспоривир необходимо вводить в количестве приблизительно от 400 приблизительно до 600 мг дважды в сутки.
В другом аспекте настоящее изобретение относится к фармацевтической композиции предпочтительно в форме состава на основе липида/поверхностно-активного вещества для перорального введения, как определено выше, для применения в качестве лекарственного средства предпочтительно при лечении инфицированного вирусом гепатита С пациента, и где (i) алиспоривир вводят во время начальной фазы в количестве приблизительно 600 мг дважды в сутки, (ii) с последующим введением алиспоривира во время второй фазы в количестве 600 мг или приблизительно 800 мг один раз в сутки.
Как применяют в настоящем описании, термин "приблизительно", если из контекста не следует иное, используют для обозначения диапазона + или - 10%.
Как применяют в настоящем описании, термин "по массе", если из контекста не следует иное, используют для обозначения по массе композиции, например, процента по массе композиции. Как применяют в настоящем описании, термин "по массе" в отношении смеси, такой как смеси гидрофильных компонентов, липофильных компонентов или поверхностно-активных веществ, если из контекста не следует иное, используют для обозначения суммы масс соответствующих компонентов смеси по массе композиции.
В другом аспекте настоящее изобретение относится к способу лечения индивидуума, страдающего нарушением, поддающимся лечению алиспоривиром, включающему введение терапевтически эффективного количества фармацевтической композиции по изобретению нуждающемуся в таком лечении индивидууму.
В дополнительном аспекте настоящее изобретение относится к использованию алиспоривира для получения фармацевтической композиции для лечения индивидуума, страдающего нарушением, поддающимся лечению алиспоривиром.
Эффективность всех фармацевтических композиций по настоящему изобретению можно наблюдать в стандартных клинических испытаниях, например, при известных показателях дозирования активного средства, обеспечивающего эквивалентные уровни в крови активного средства, например, с использованием дозирования в диапазоне от 100 мг до 1200 мг активного средства в сутки для млекопитающего массой 75 килограмм, например, взрослого, и на общепринятой модели на животных. Увеличенную биодоступность активного средства, обеспеченную композициями, можно наблюдать в стандартных испытаниях на животных и в клинических испытаниях, например, как описано выше.
Фармацевтические композиции по настоящему изобретению особенно пригодны для лечения и предотвращения инфекций вирусом гепатита С или нарушений, вызванных HCV у пациента, рассеянного склероза, наследственной миодистрофии Ульриха и ишемии.
Следующие ниже неограничивающие примеры иллюстрируют дополнительные аспекты изобретения и представляют собой предпочтительные варианты осуществления изобретения.
Пример 1
В этом примере (и примерах 2-3) описаны способы получения составов на основе липидов с высокой лекарственной нагрузкой алиспоривиром (DEB025) (≥19% масс.) и проиллюстрированы способы увеличения равновесной растворимости сольвата этанола DEB025 выше исследуемой нагрузки лекарственного средства таким составом посредством добавления воды.
Исходный раствор составов DEB025, представленный в таблице 1 (составы А1-А3) и таблице 2 (составы А-С), получали, как указано ниже. Твердые или полутвердые эксципиенты нагревали на водяной бане при 50°С и хорошо перемешивали перед этапом диспергирования. Определенное количество каждого эксципиента взвешивали в стеклянном флаконе с последующим добавлением этанола. Эксципиенты перемешивали при комнатной температуре до получения гомогенного раствора. Затем соответствующее количество аморфной формы DEB025 добавляли в стеклянные флаконы, содержащие подготовленный носитель, и перемешивали с использованием магнитной мешалки при комнатной температуре до полного растворения лекарственного вещества (прозрачный светлый желтый раствор без видимых частиц лекарственного средства). Исходный раствор затем разливали на аликвоты в небольшие стеклянные флаконы (2 г) с последующим добавлением небольшого количества сольвата этанола DEB025 (от 60 до 120 мг). Для не содержащих этанол составов во флаконы добавляли аморфную форму DEB025. Флаконы помещали при 25°С и перемешивали с использованием магнитной мешалки до получения избытка твердого лекарственного средства, определяемого как сольват этанола DEB025 или аморфная форма DEB025 (для не содержащих этанол композиций) (по меньшей мере 24 часа). Дополнительное количество сольвата этанола DEB025 или аморфной формы DEB025 (от 60 до 120 мг) добавляли в эти флаконы, в которых наблюдали прозрачный раствор после уравновешивания. Эти флаконы повторно уравновешивали до тех пор, пока не наблюдали избыток лекарственного средства. В конце супернатант из этих суспензий фильтровали и анализировали ВЭЖХ на содержание DEB025.
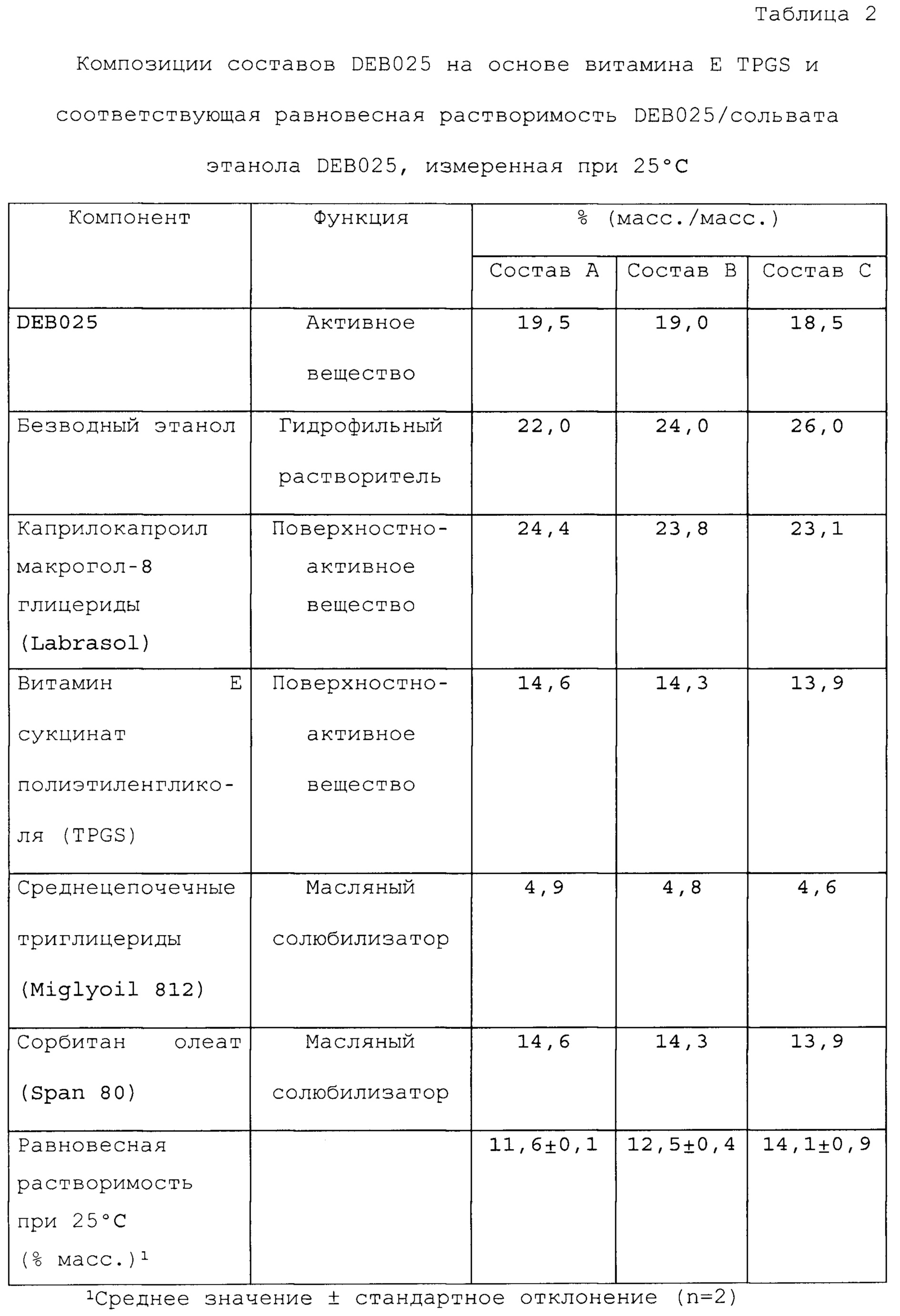
Влияние воды на равновесную растворимость сольвата этанола DEB025 оценивали добавлением воды в концентрациях, как указано на фигуре 1, к 2 г аликвотам исходных растворов, указанных в таблице 2. Затем во флакон добавляли небольшое количество сольвата этанола DEB025 (приблизительно 10 мг) и измеряли равновесную растворимость сольвата этанола DEB025 при 25°С, как описано выше.
Пример 2
DEB025 (аморфную форму) формулировали с композициями, указанными в таблице 3 (составы D1, D и Е), и измеряли равновесную растворимость сольвата этанола DEB025 при 25°С в зависимости от содержания воды (фигура 2). Получение составов и измерения растворимости проводили, как описано в примере 1.
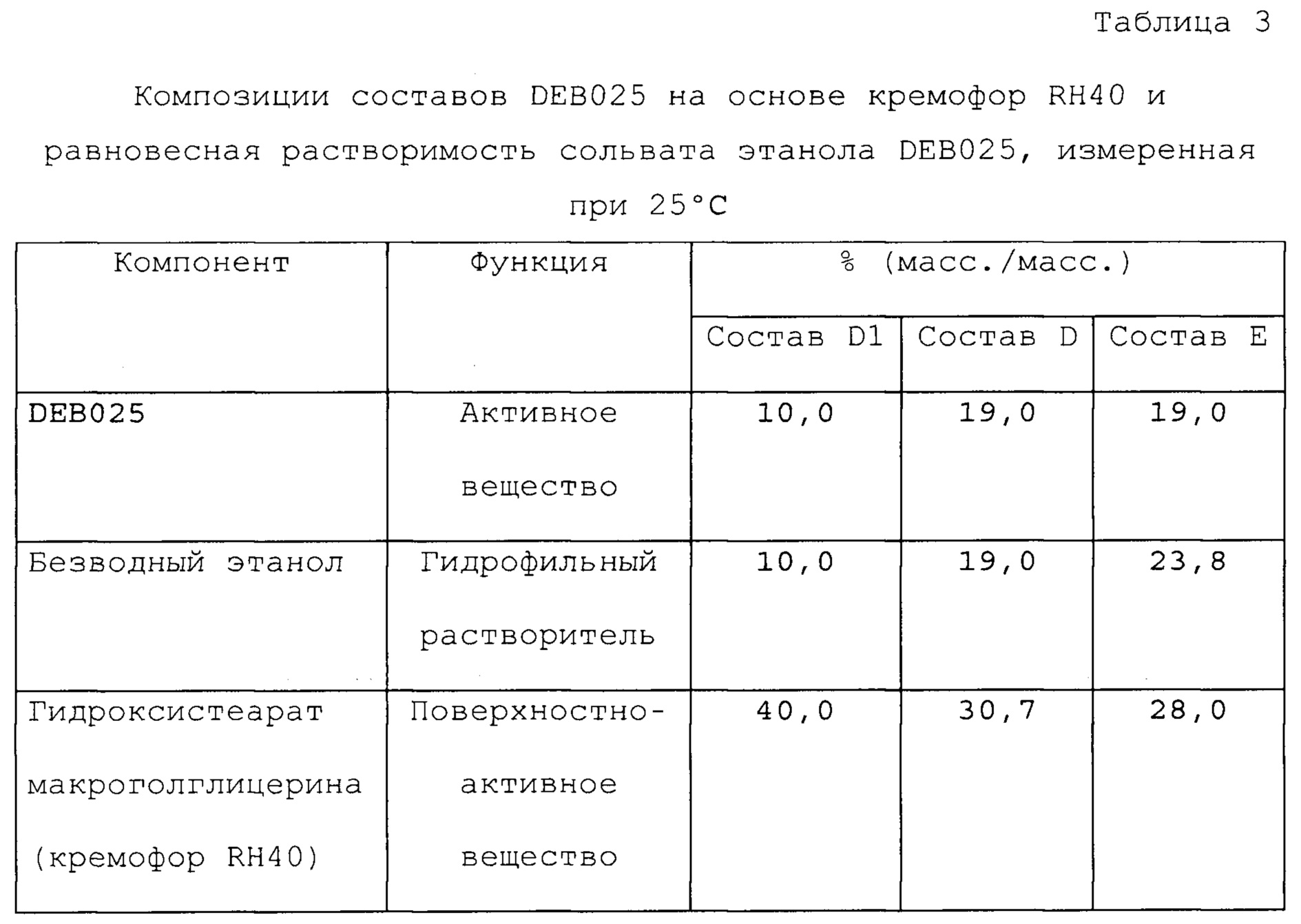
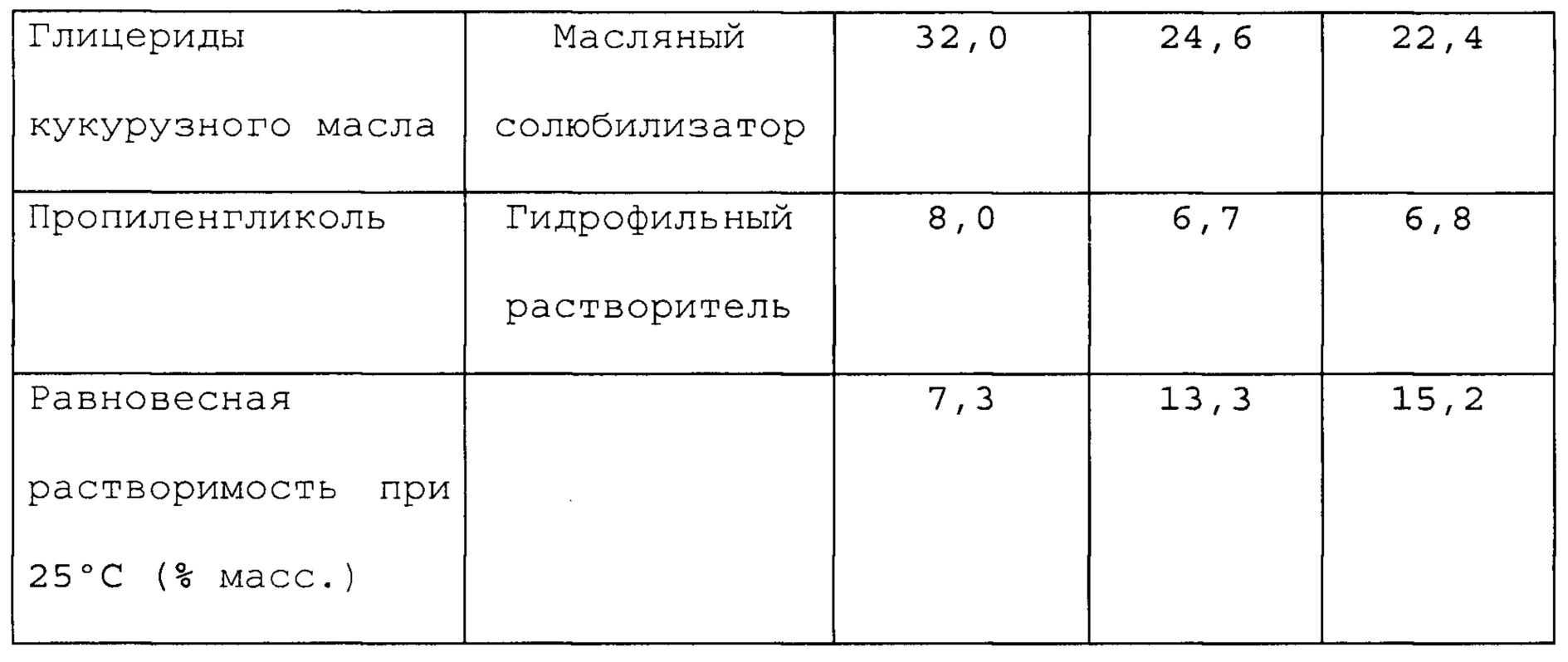
Пример 3
DEB025 (аморфную форму) формулировали с композициями, указанными в таблице 4 (составы F-H), и измеряли равновесную растворимость сольвата этанола DEB025 при 25°С в зависимости от содержания воды (фигура 3). Получение составов и измерения растворимости проводили, как описано в примере 1.
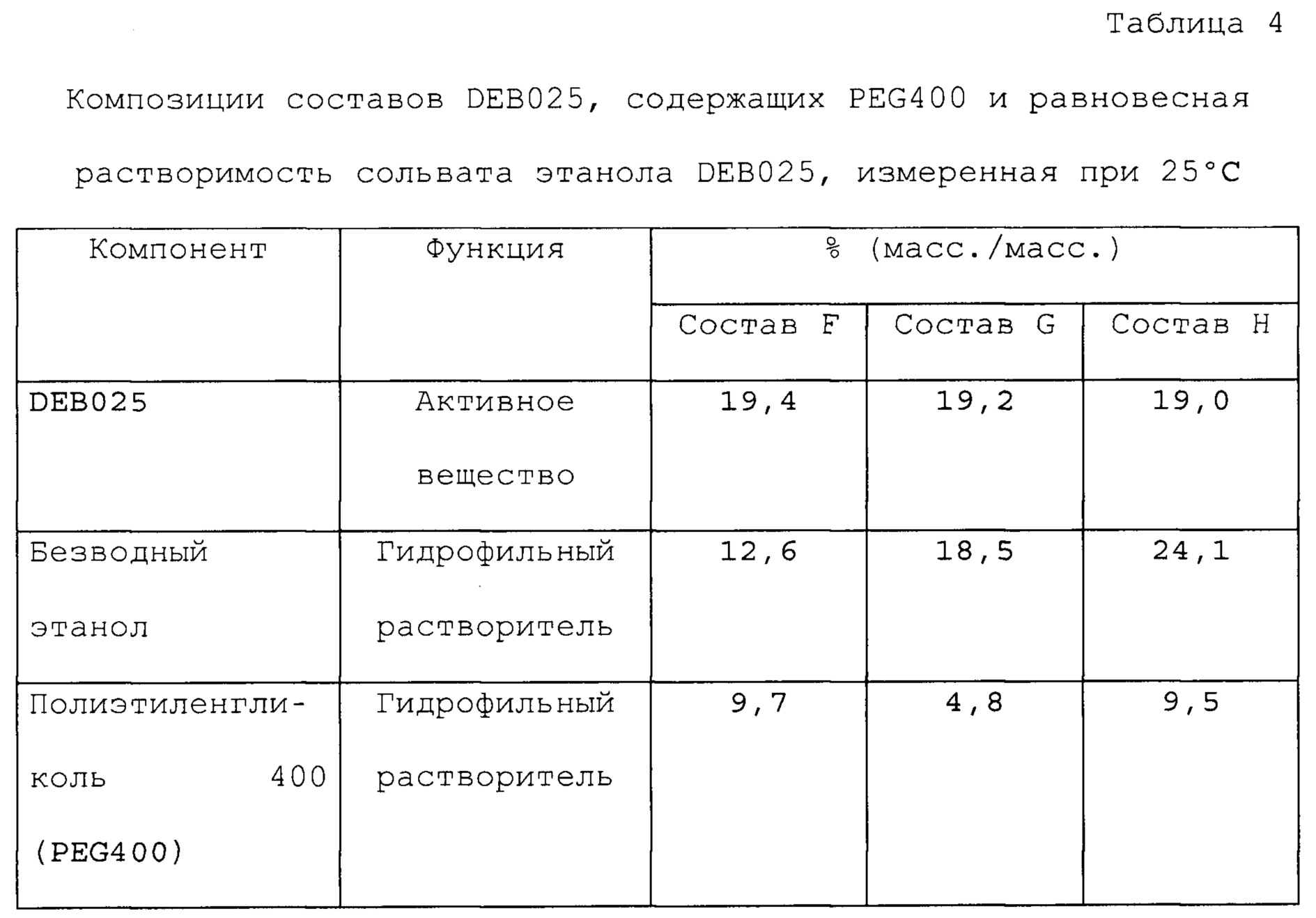
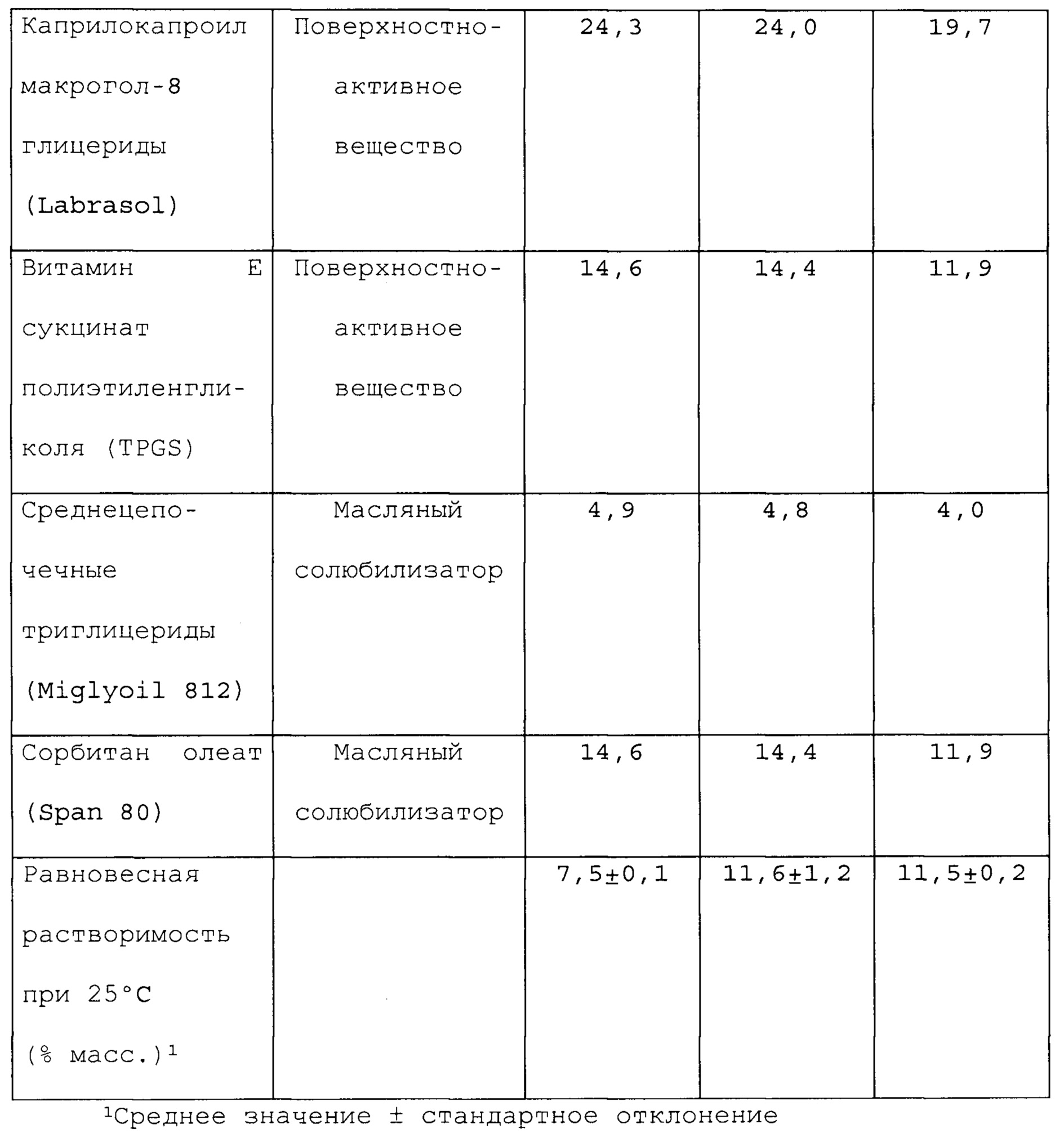
Пример 4
В этом примере (и примере 5) проиллюстрированы составы DEB025, предназначенные для инкапсулирования в 200 мг мягкие желатиновые капсулы. Составы заполняющего раствора получали, как описано в примере 1. Равновесную растворимость сольвата этанола DEB025 в заполняющем растворе, имитирующем получаемую капсулу, измеряли при 20°С в присутствии воды и глицерина (общепринятого пластификатора, используемого при получении мягких желатиновых капсул) при конечных концентрациях (% масс.), указанных в таблице 5.
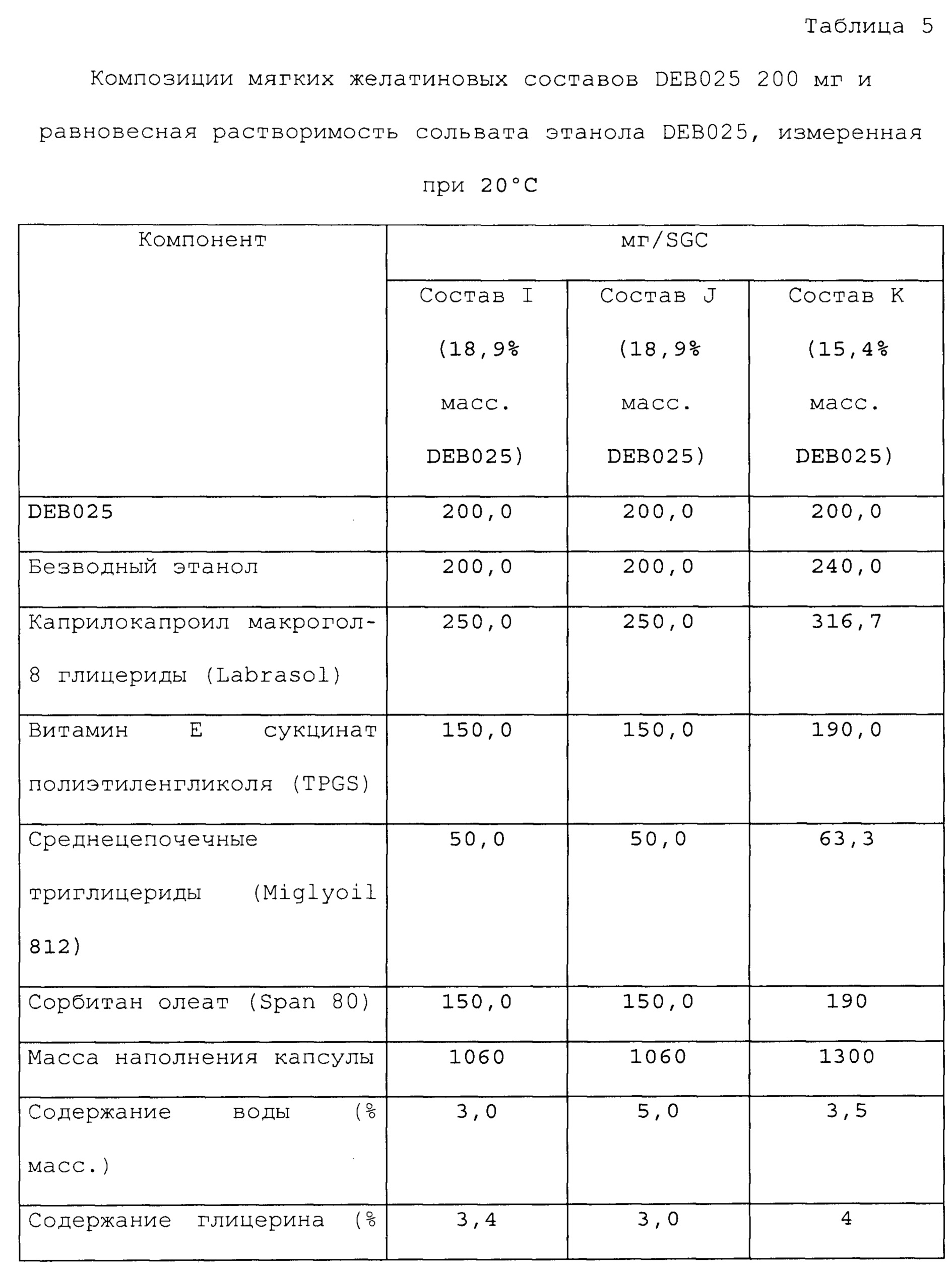
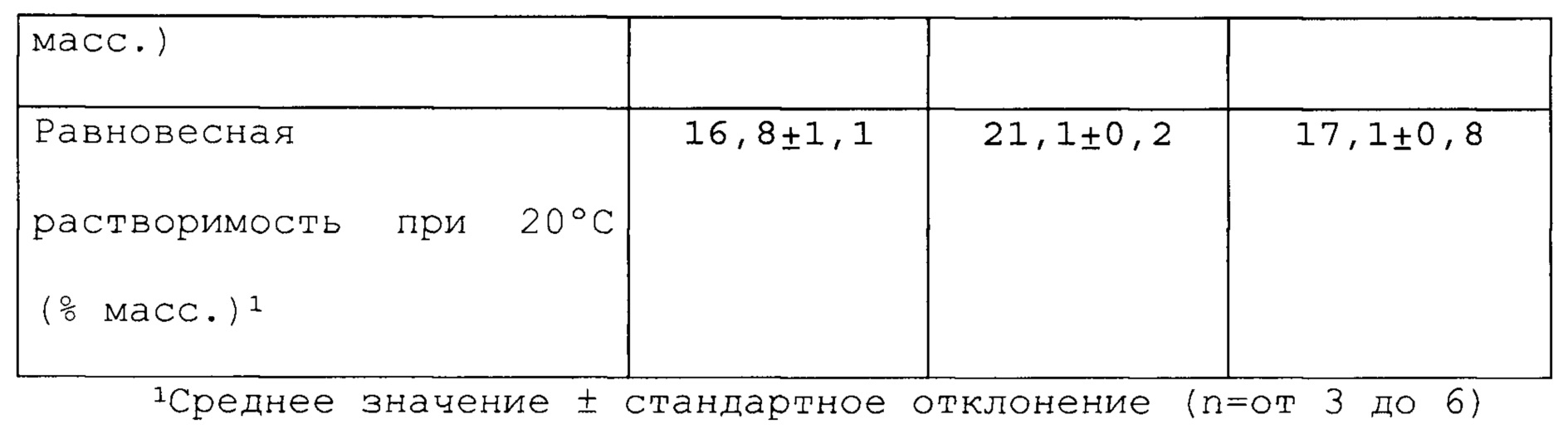
Пример 5
В этом примере проиллюстрированы составы DEB025 (19% масс.) с высокой нагрузкой лекарственного средства, содержащие PEG400, предназначенные для инкапсулирования в 200 мг мягкие желатиновые капсулы. Составы заполняющего раствора получали, как описано в примере 1. Равновесную растворимость сольвата этанола DEB025 в заполняющем растворе, имитирующем получаемую капсулу, измеряли при 20°С, как описано в примере 4.
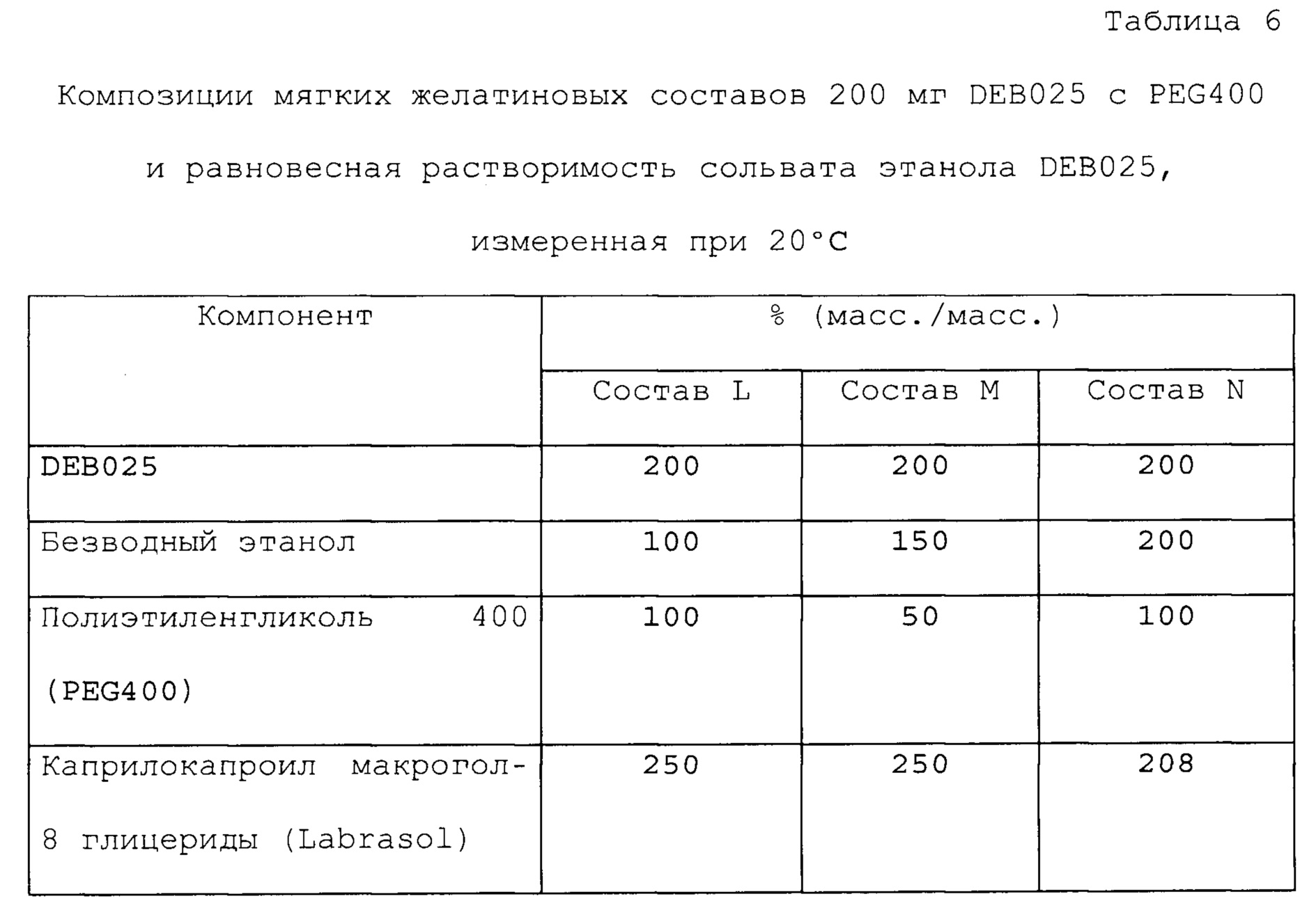
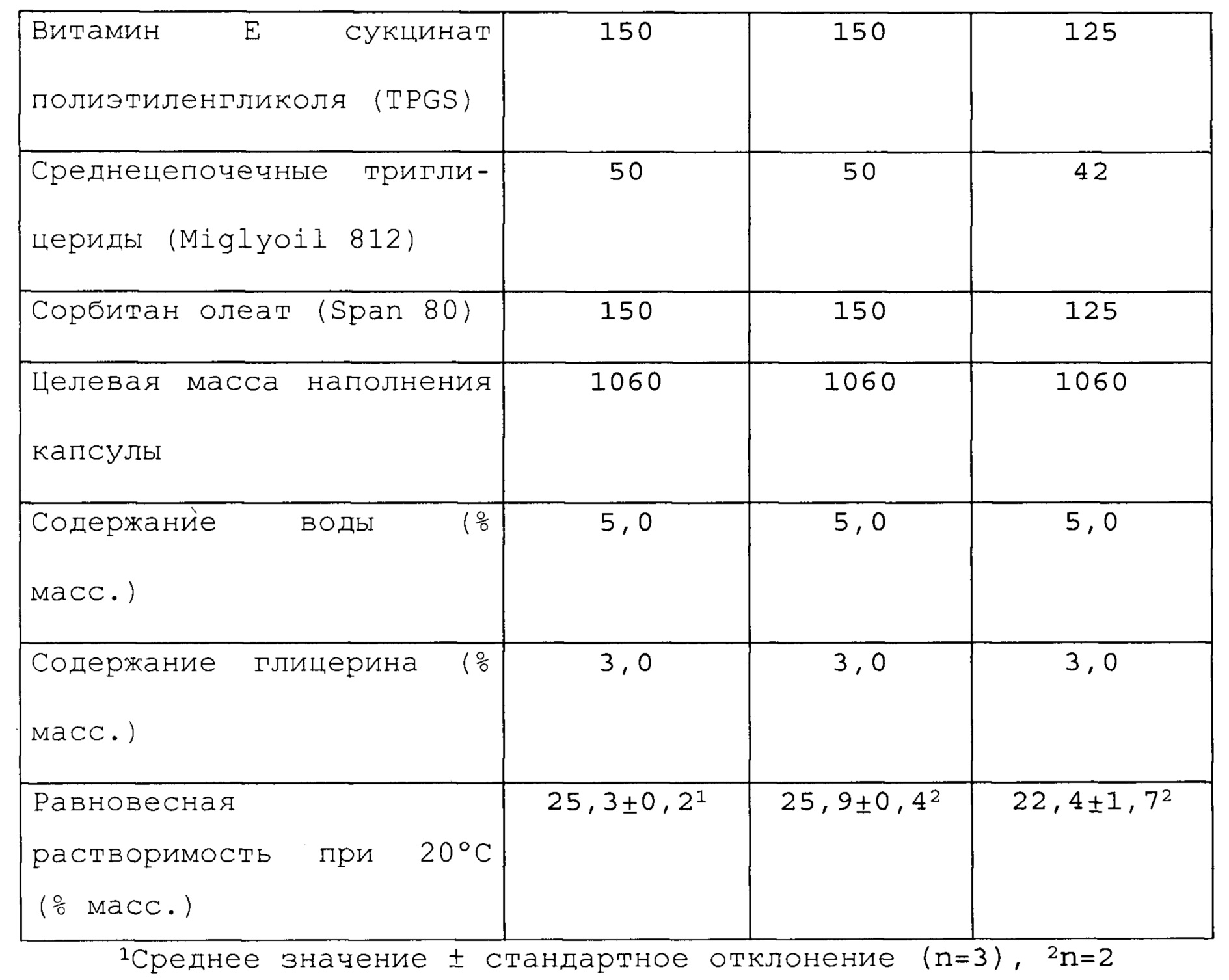
Пример 6
В этом примере проиллюстрированы составы DEB025 со сниженным содержанием этанола (≤5%), предназначенные для инкапсулирования в мягкие желатиновые капсулы или для помещения во флаконы (таблицы 7-9). Составы заполняющего раствора получали, как описано в примере 1. Равновесную растворимость сольвата этанола DEB025 или аморфного DEB025 (для не содержащих этанол составов) измеряли в составе при 21±2°С, как описано в примере 1.
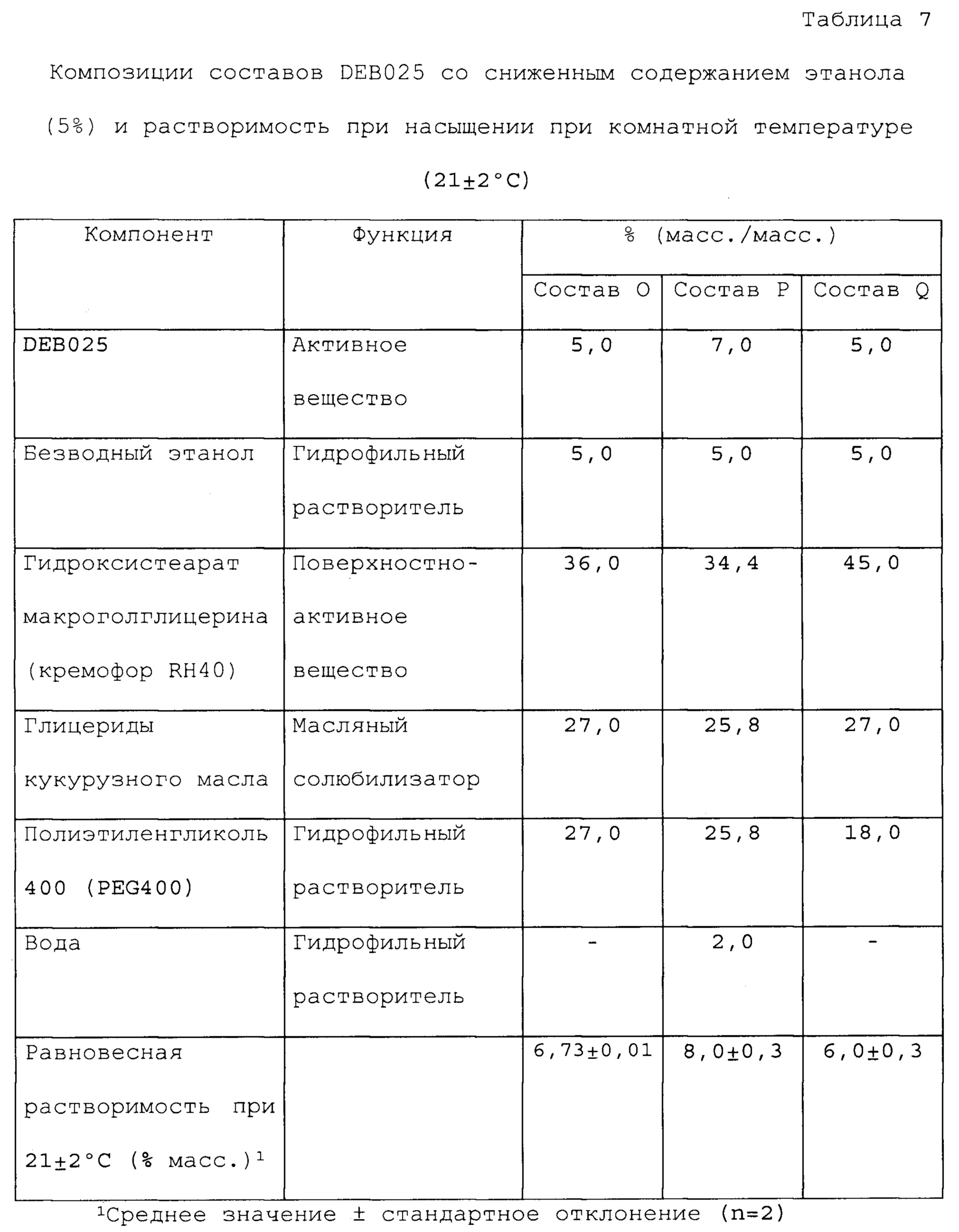
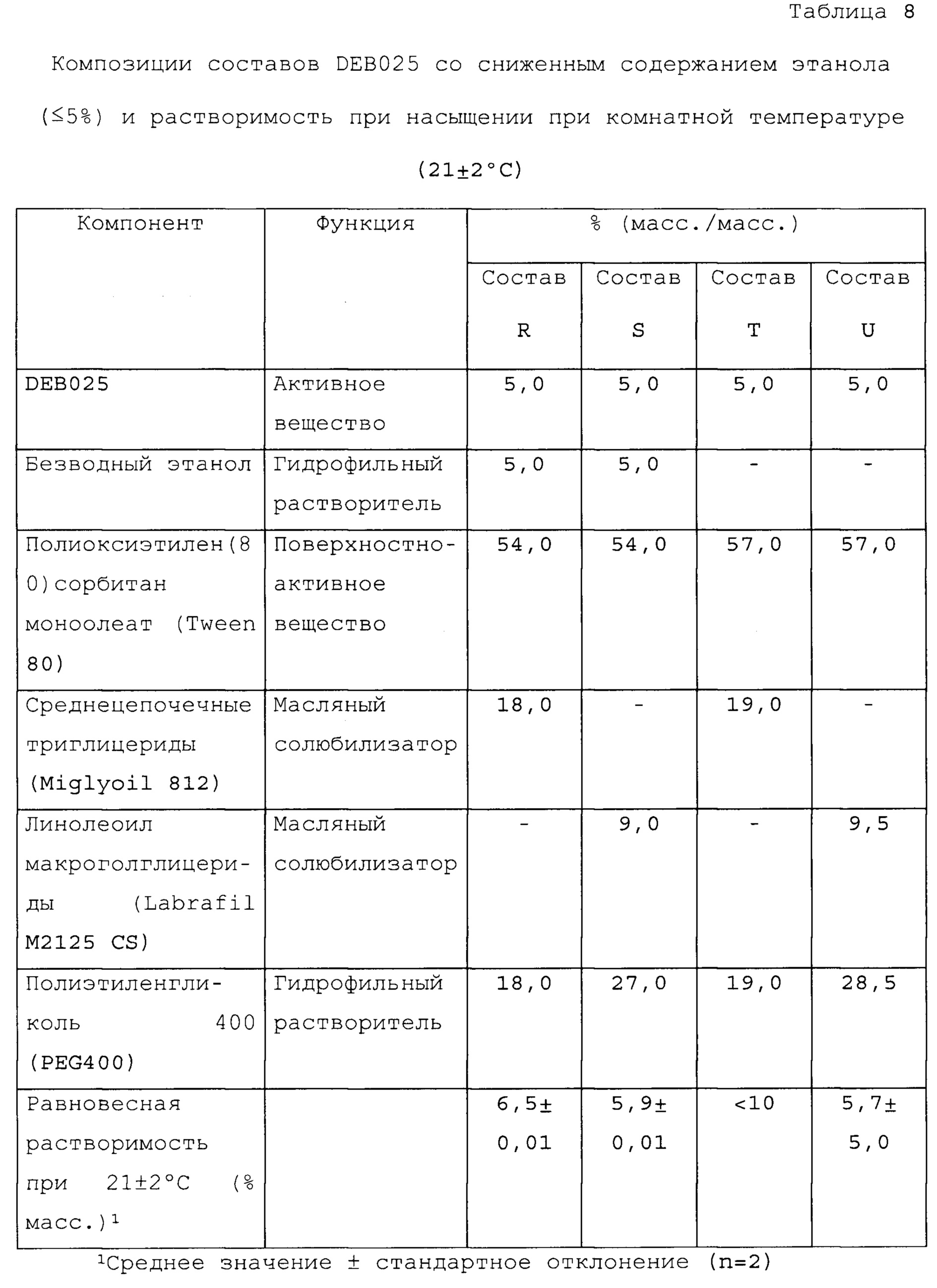
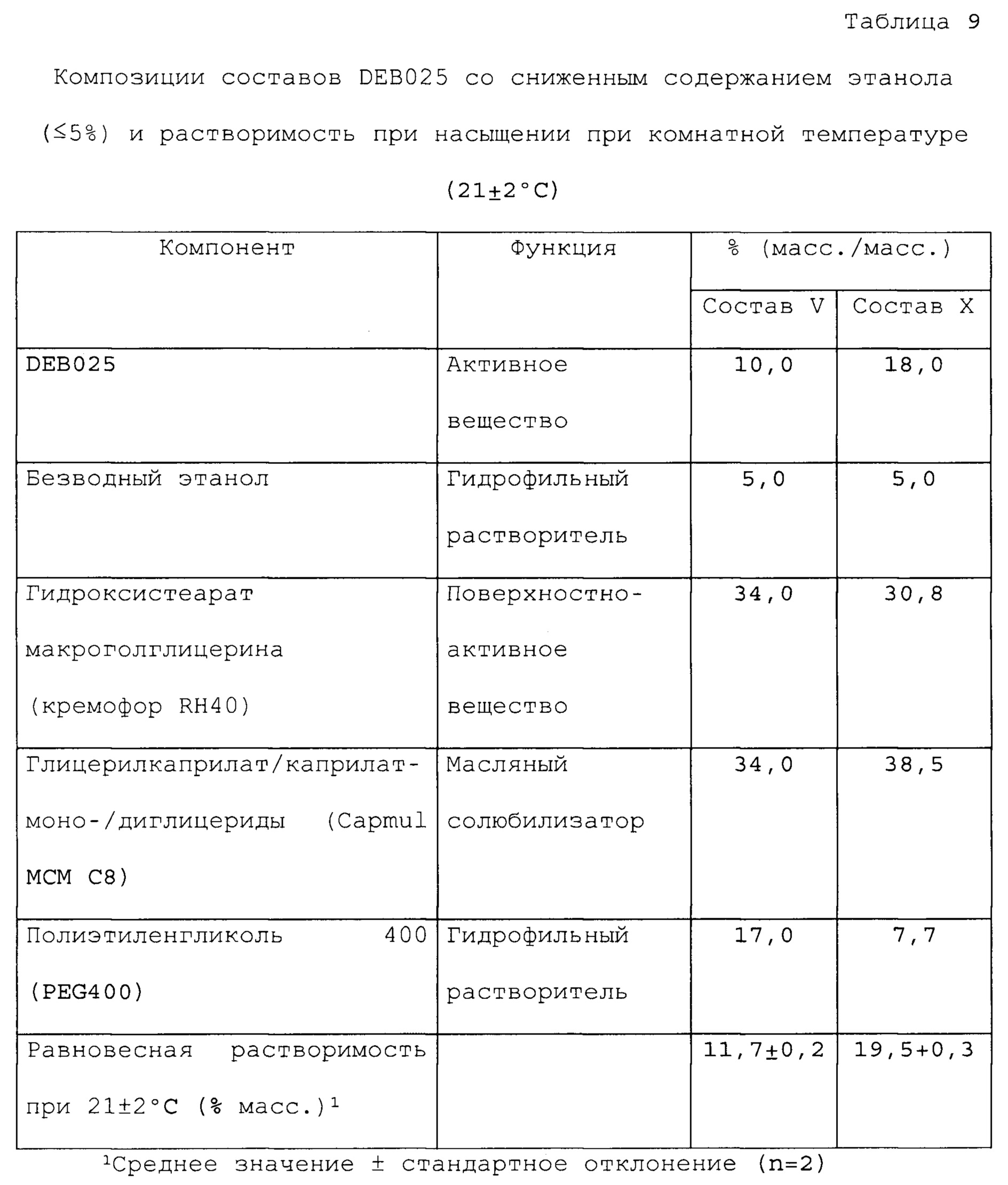
Пример 7
В этом примере предоставлены составы, содержащие приблизительно 20% DEB025 и которые предназначены в качестве раствора (состав О), в качестве промежуточного соединения для инкапсулирования в мягкие желатиновые капсулы (состав Р), в качестве конечной композиции в мягких желатиновых капсулах (состав Q).
Способ получения вещества наполнения для 10 г 20% составов DEB025 (состав О) проводили, как указано ниже:
- растворяют 2 г Debio 025 в 2 г этанола, помещают его в ультразвуковую ванну до полного растворения.
- Добавляют 2,5 г макрогола глицеринкаприлокапрата (Labrasol®).
- Добавляют 0,5 г среднецепочечных триглицеридов (Labrafac® WL1349).
- Добавляют 1,5 г сорбитана олеата (Montane® 80).
- Добавляют 1,5 г предварительно подогретого альфа-токоферола сукцината (TPGS) PEG.
- Перемешивают его рукой или с помощью вихревой мешалки в течение приблизительно 30 сек.
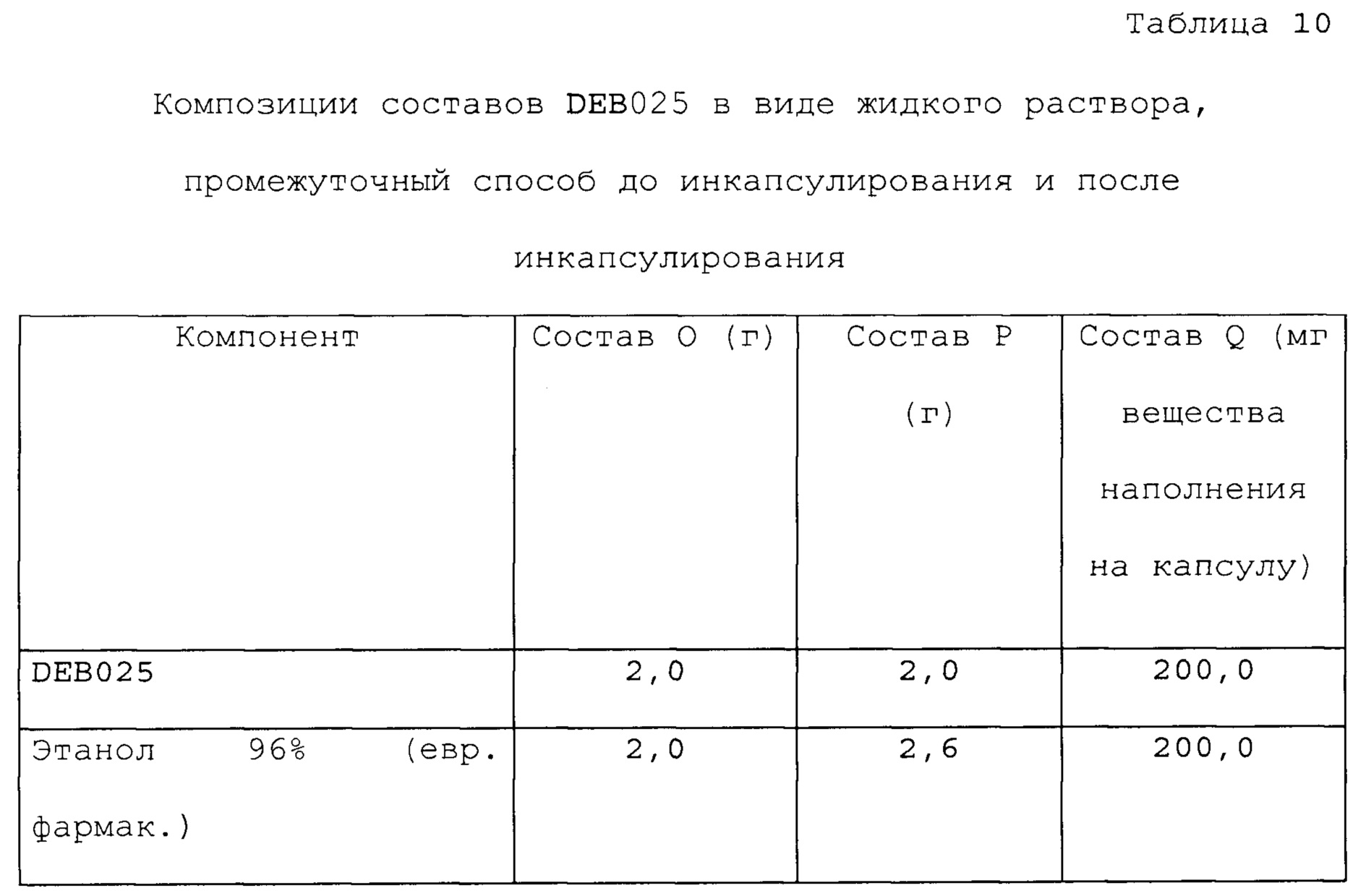
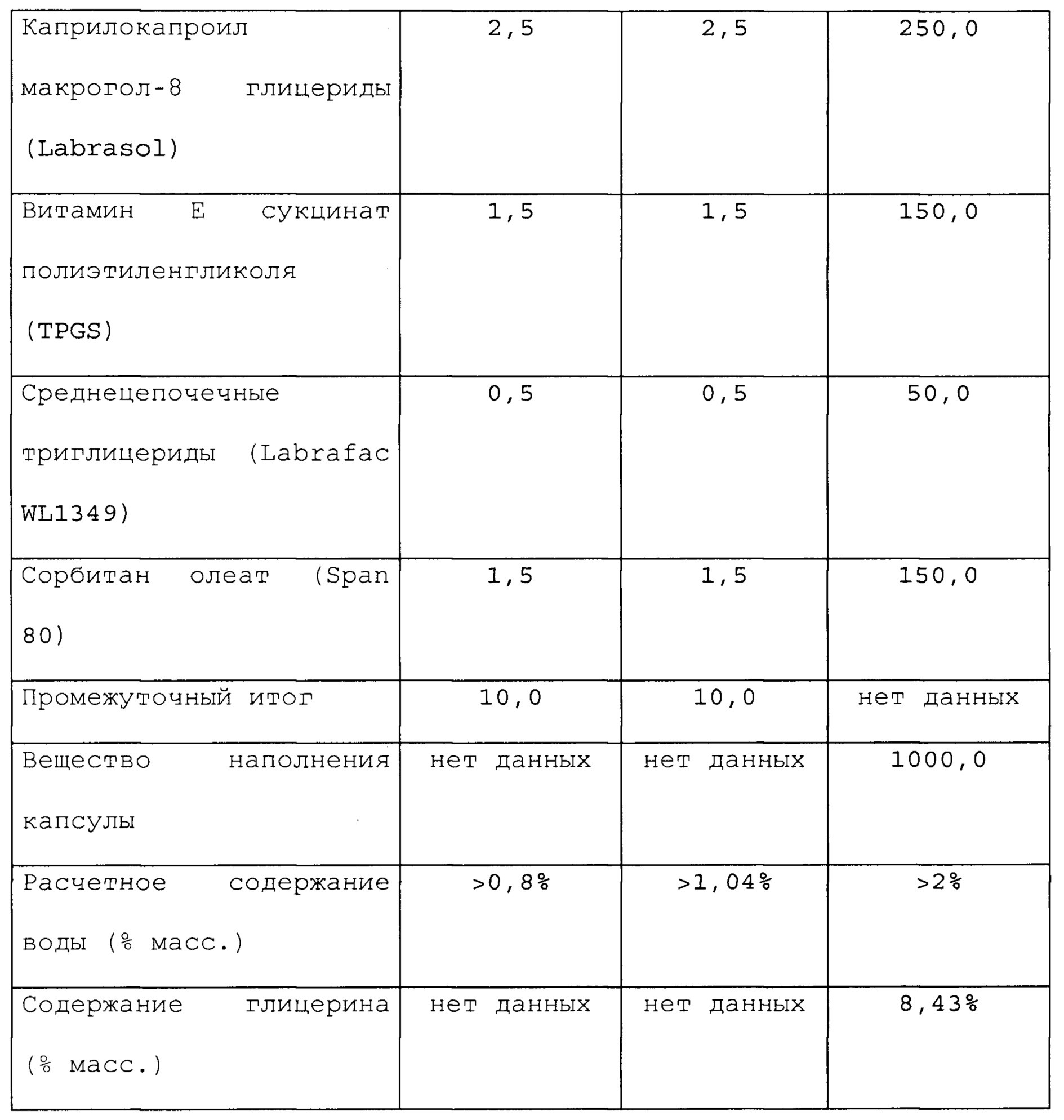
Для состава О после разбавления 200 мг в 200 мл воды размер капель являлся стабильным в течение 2 часов (t0 308 нм PI 0,08, t2h: 291 нм PI 0,06). Устройство Zetasizer 3000.
Пример 8
В этом примере проиллюстрированы составы 10% и 30% DEB025, описанные как жидкие растворы. (Состав R и S).
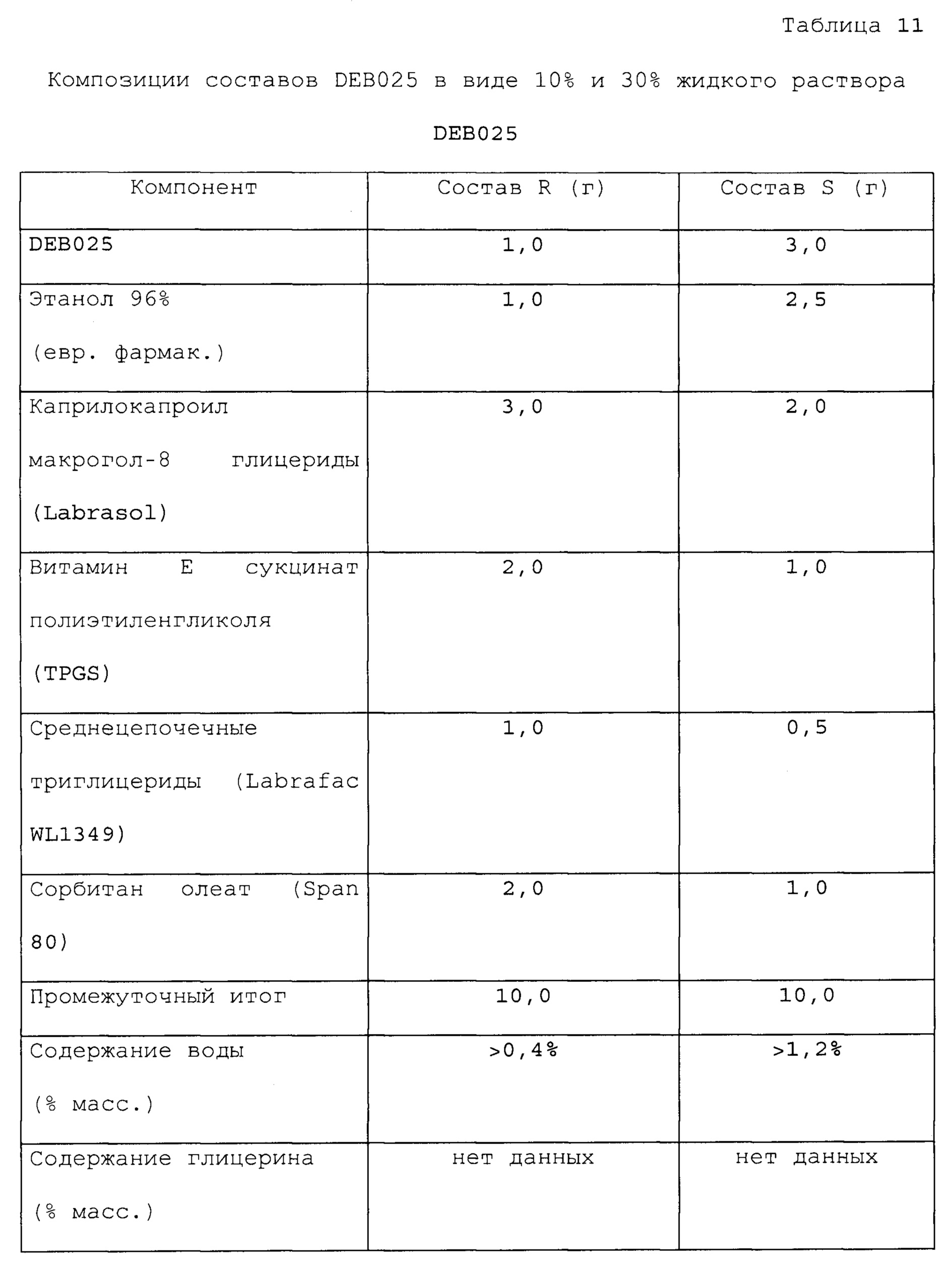
Пример 9
В этом примере проиллюстрировано влияние воды, глицерина и этанола и их возможных взаимодействий на равновесную растворимость сольвата этанола DEB025 в составе А1 (композиции, указанной в примере 1) при 20°С.
Полный 23 факторный план экспериментов (DoE) проводили как включающий 3 переменных (вода, глицерин и этанол), каждое вещество тестировали при 2 уровнях (высоком и низком) с 4 точками, используемыми в качестве центральных точек, всего 12 измерений. В таблице 12 показаны уровни каждого параметра, тестируемого в DoE, и на фигуре 4 представлена соответствующая диаграмма Парето эффектов для средней растворимости.