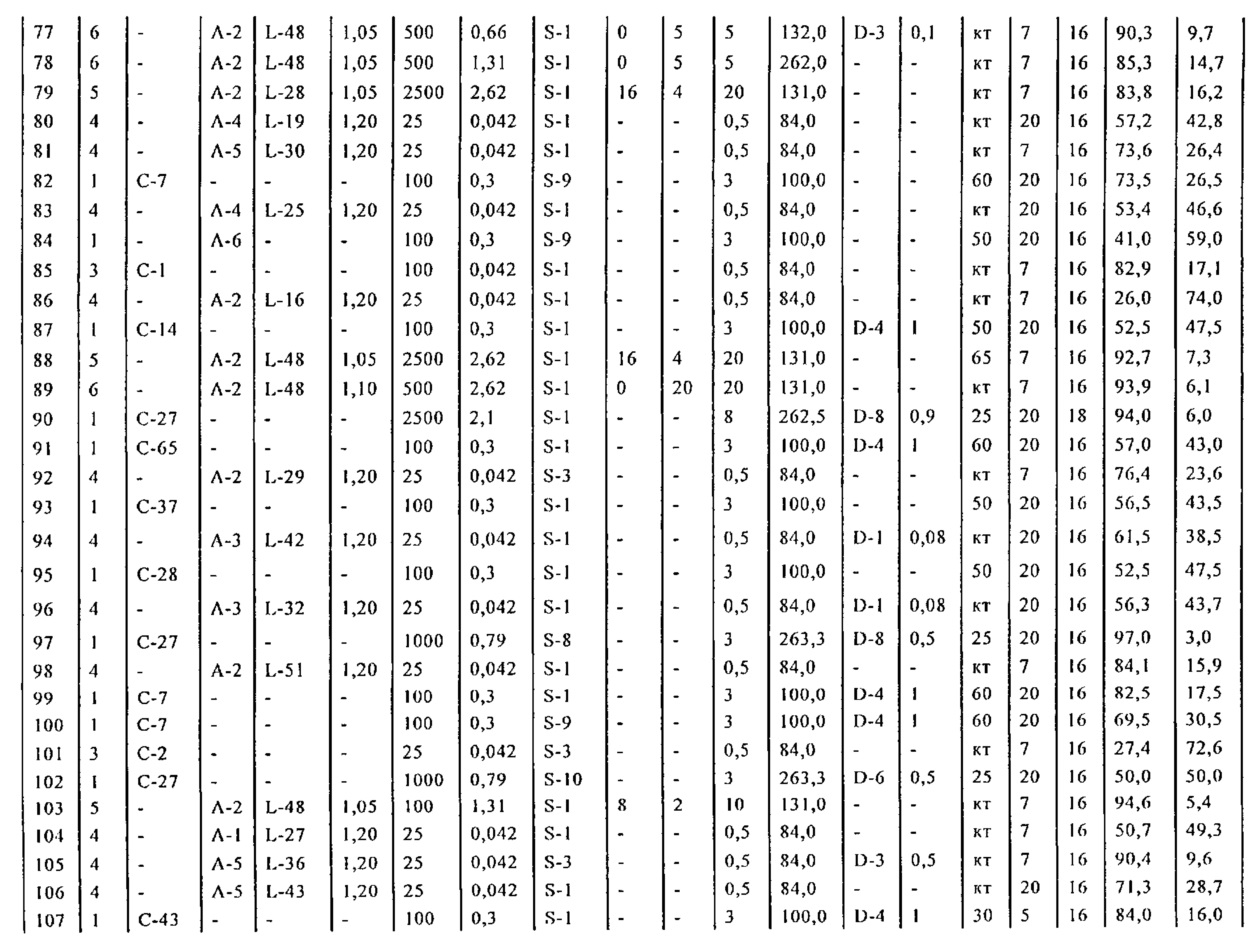
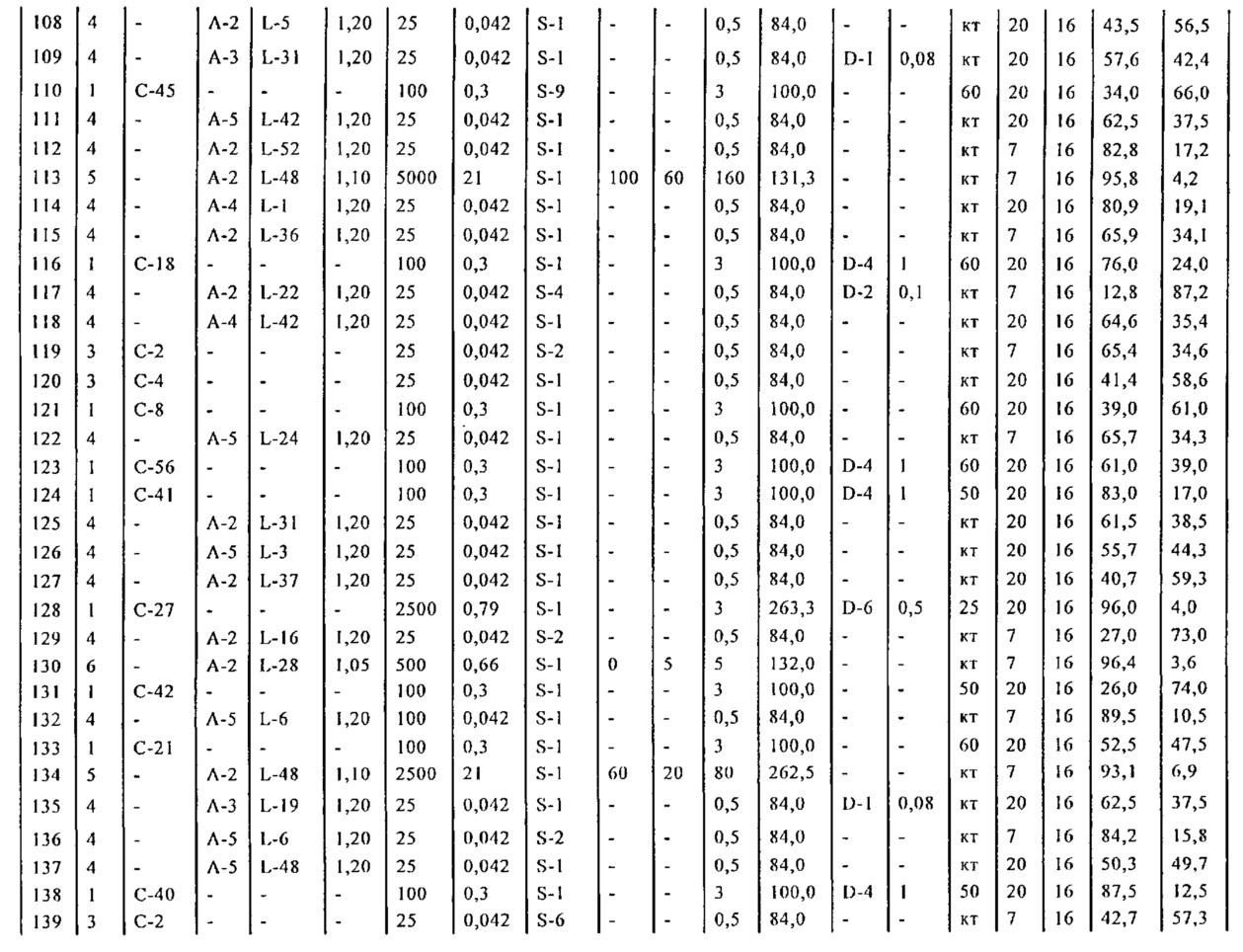
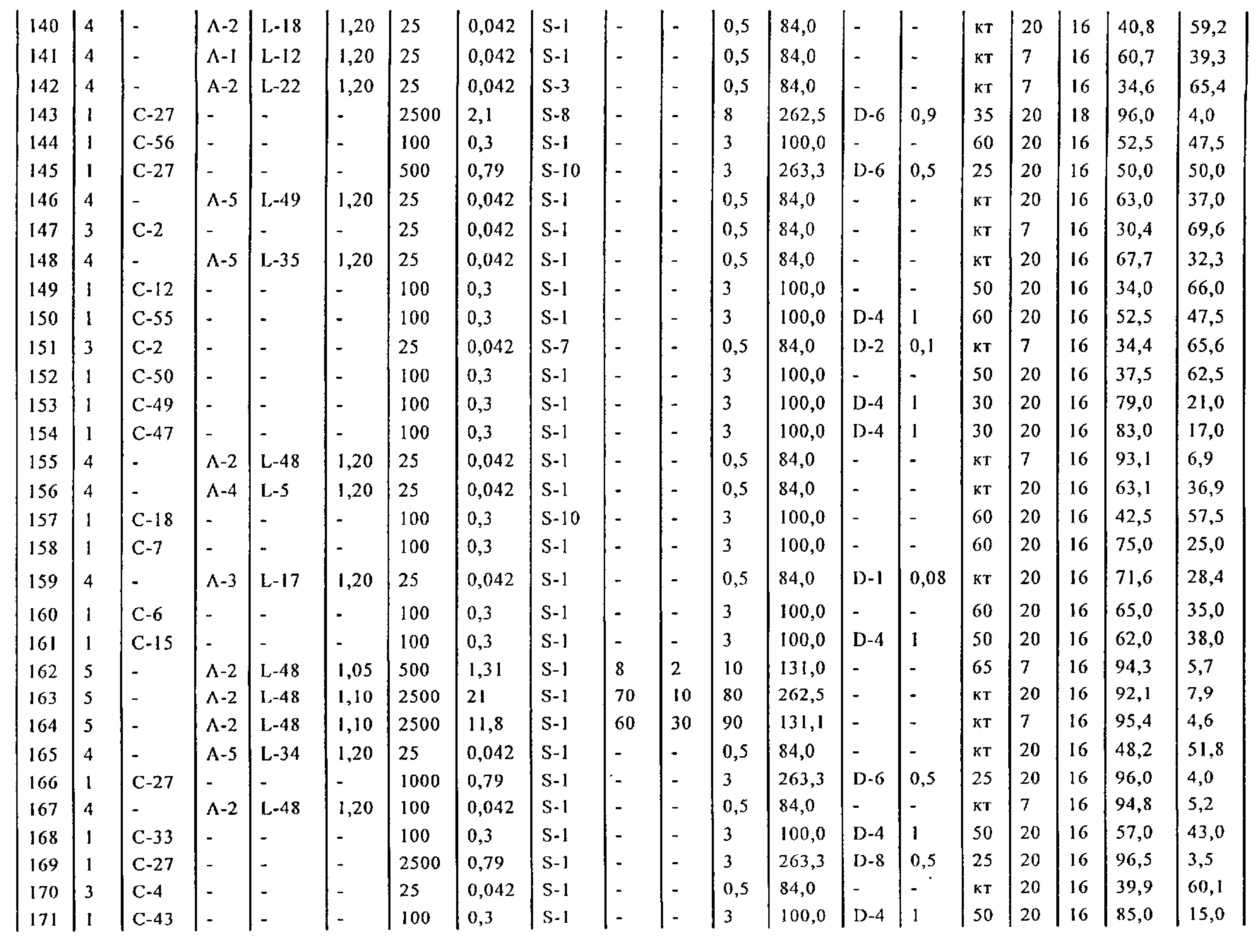
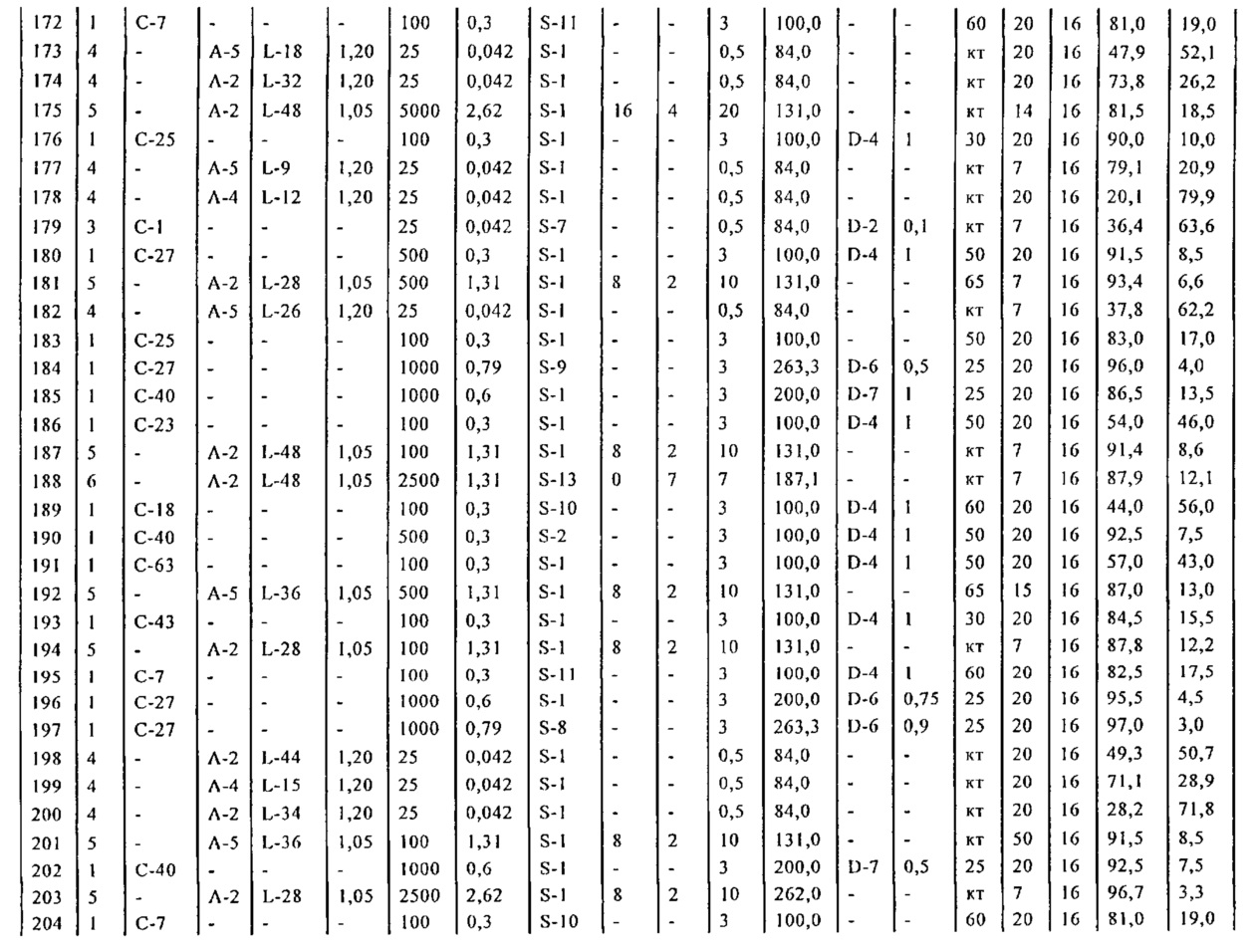
Результат интеллектуальной деятельности: СПОСОБ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-БИФЕНИЛ-4-ИЛ-2-МЕТИЛПЕНТАНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Настоящее изобретение относится к новому способу получения ингибиторов NEP или их пролекарств, в частности, ингибиторов NEP, содержащих в качестве каркаса γ-амино-δ-бифенил-α-метилалкановую кислоту или сложный эфир кислоты.
Эндогенные атриальные натрийуретические пептиды (ANP), также называемые атриальными натрийуретическими факторами (ANF), обладают диуретическим, натрийуретическим и сосудорасширяющим действиями на млекопитающих. Природные пептиды ANF метаболически инактивируются, в частности разрушающим ферментом, который, как было обнаружено, соответствует ферменту нейтральной эндопептидазы (NEP, ЕС 3, 4, 24, 11), также ответственному, например, за метаболическую инактивацию энкефалинов.
Из предшествующего уровня техники известны биарилзамещенные производные фосфоновой кислоты, которые полезны в качестве ингибиторов нейтральной эндопептидазы (NEP), например, в качестве ингибиторов ANF-разрушающего фермента у млекопитающих, для пролонгирования и потенциирования диуретических, натрийуретических и сосудорасширяющих свойств ANF у млекопитающих путем ингибирования их разрушения до менее активных метаболитов. Таким образом, ингибиторы NEP особенно полезны для лечения состояний и нарушений, ответственных за ингибирование нейтралэндопептидазы (ЕС 3, 4, 24, 11), особенно сердечно-сосудистых нарушений, таких как гипертензия, почечная недостаточность, включая отеки и удержание солей, отек легких и застойную сердечную недостаточность.
Способы получения ингибиторов NEP являются известными. В патенте US 5217996 описаны биарилзамещенные производные амида 4-аминобутановой кислоты, которые полезны в качестве ингибиторов нейтралэндопептидазы (NEP), например, в качестве ингибиторов ANF-разрушающего фермента у млекопитающих. В патенте US 5217996 описано получение этилового эфира N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты. Для получения указанного соединения этиловый эфир N-трет-бутоксикарбонил-(4R)-(п-фенилфенилметил)-4-амино-2-метил-2-бутеновой кислоты гидрируют в присутствии палладия на угле. Основным недостатком указанного процесса является то, что стадия гидрирования является не очень селективной, и приводит к получению этилового эфира N-трет-бутоксикарбонил-(4S)-(п-фенилфенилметил)-4-амино-2-метилбутановой кислоты в виде смеси диастереомеров 80:20. Более того, способ получения этилового эфира N-трет-бутоксикарбонил-(4R)-(п-фенилфенилметил)-4-амино-(2)метил(2)-бутеновой кислоты требует D-тирозина в качестве исходного материала, который не является природной аминокислотой и не является легко доступным.
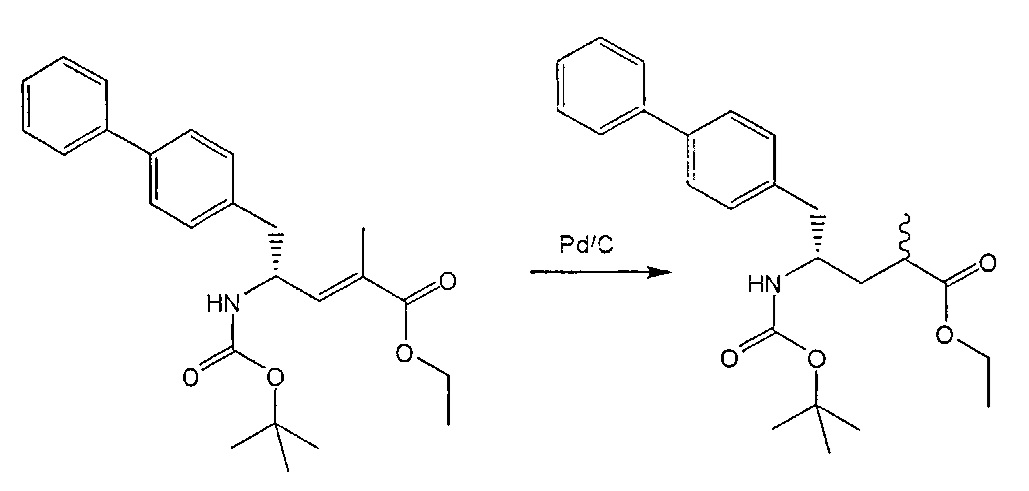
Следовательно, целью настоящего изобретения является обеспечение альтернативной реакционной методики получения соединения этилового эфира N-трет-бутоксикарбонил(4S)-(п-фенилфенилметил)-4-амино-2-метилбутановой кислоты или его соли, предпочтительно реакционной методики, которая позволит избежать описанных выше недостатков способа, известного из предшествующего уровня техники.
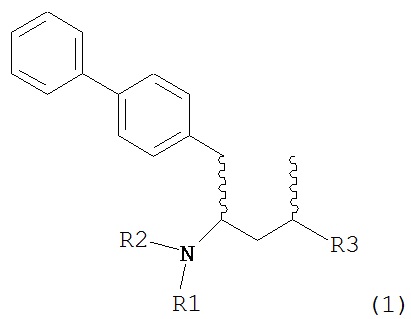
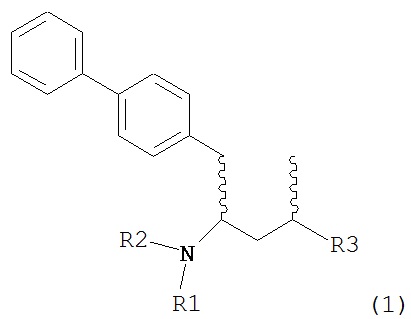
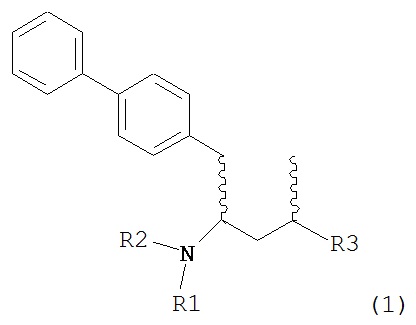
Другим объектом настоящего изобретения является обеспечение альтернативной стадии гидрирования в способе получения ингибиторов NEP или их пролекарств. В частности, объектом является обеспечение альтернативного способа получения соединений формулы (1) или их солей:
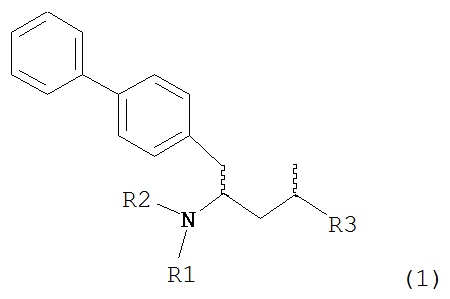
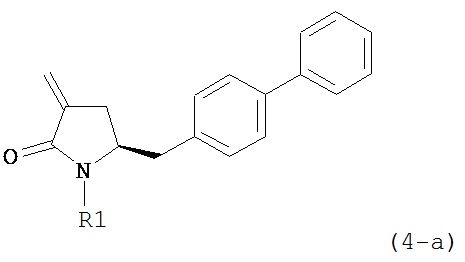
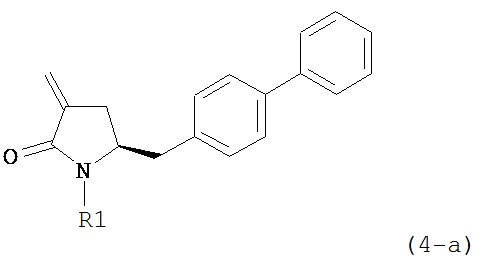
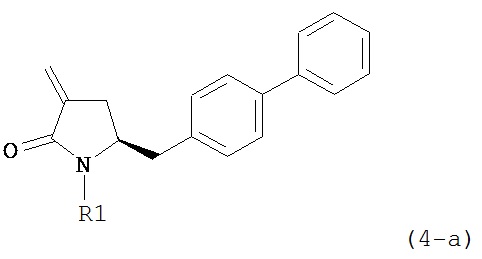
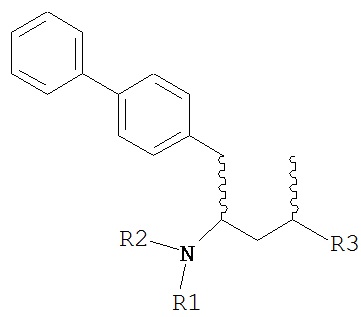
где R1 и R2, независимо друг от друга, представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно карбоксильную группу или алкиловый эфир. Соединения формулы (1) могут использоваться в качестве промежуточных соединений для получения ингибиторов NEP или их пролекарств, в частности ингибиторов NEP, содержащих в качестве каркаса γ-амино-δ-бифенил-α-метилалкановую кислоту или сложный эфир кислоты, предпочтительно этиловый эфир N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты, например, как описано в статье Journal of Medicinal Chemistry, 1995, 38, с.1689.
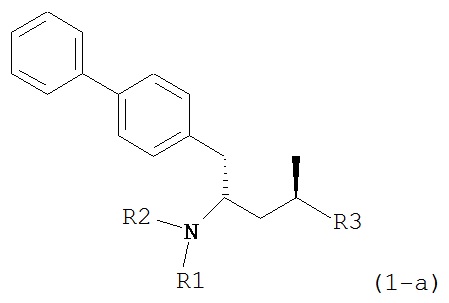
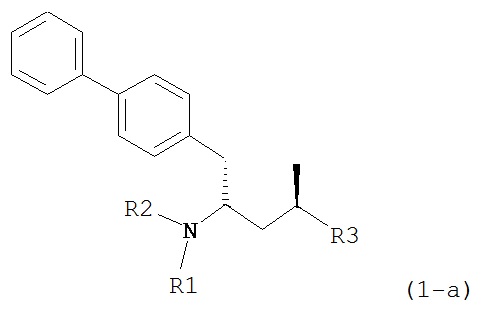
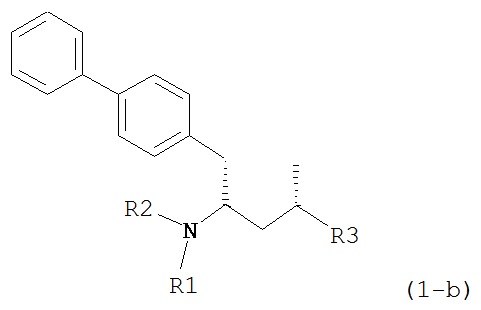
Другим объектом является обеспечение способа получения соединений формул (1-a) и (1-b) или их солей, где R1, R2 и R3 являются такими, как здесь определено, с высокодиастереомерным соотношением. Предпочтительно, объектом является обеспечение способа получения диастереомерного соотношения соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солей по крайней мере 80:20, более предпочтительно по крайней мере 90:10, наиболее предпочтительно соотношения (1-a) к (1-b) по крайней мере 99:1. Также объектом является обеспечение способа, в котором соединения формулы (1-b) или их соли могут быть полностью удалены, и соединения формулы (1-a) или их соли могут быть получены в чистой форме.
 ,
,
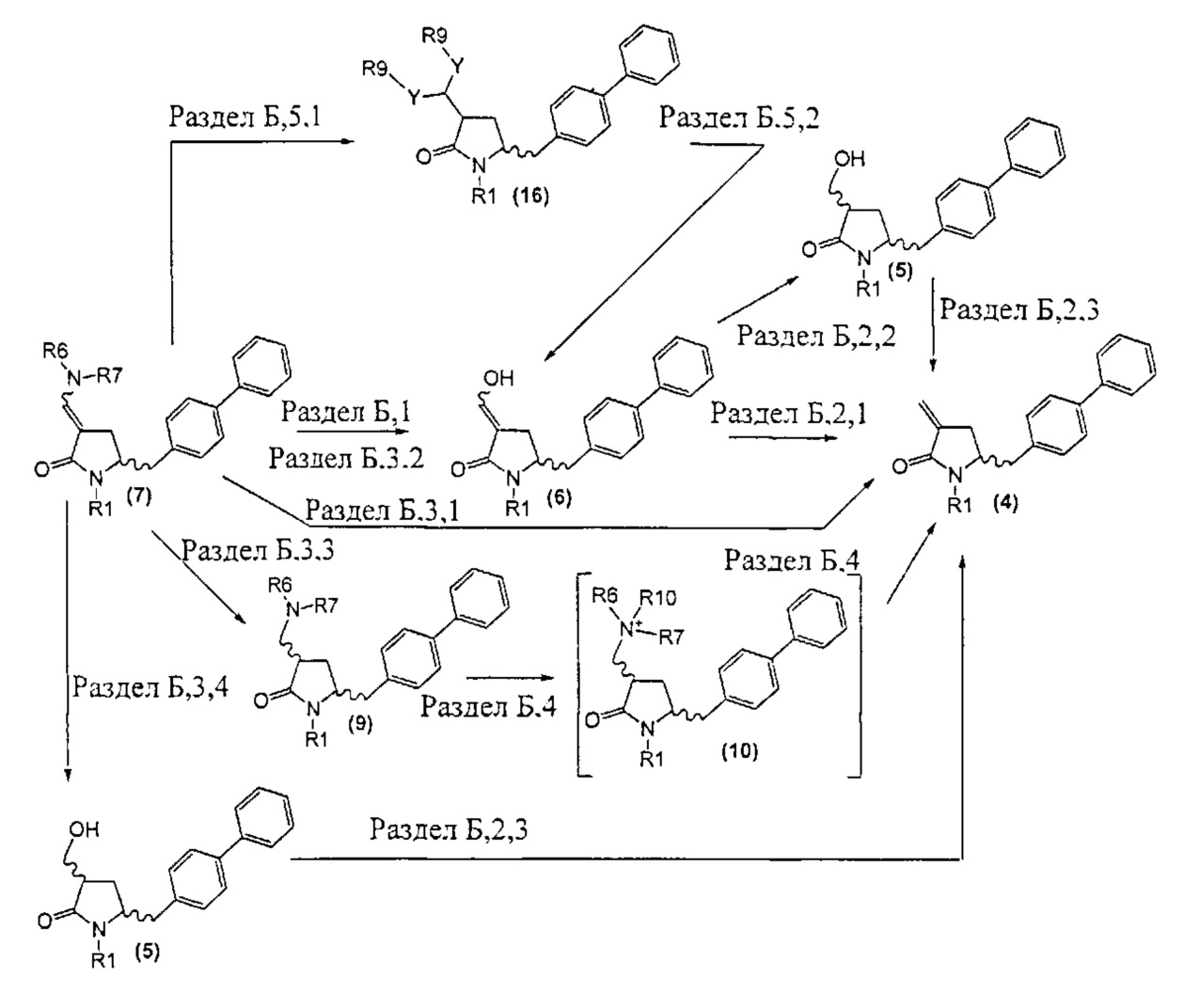
Новые способы в соответствии с настоящим изобретением для получения соединений формулы (1) или их солей, как здесь определено, представлены на схеме 1.
Схема 1
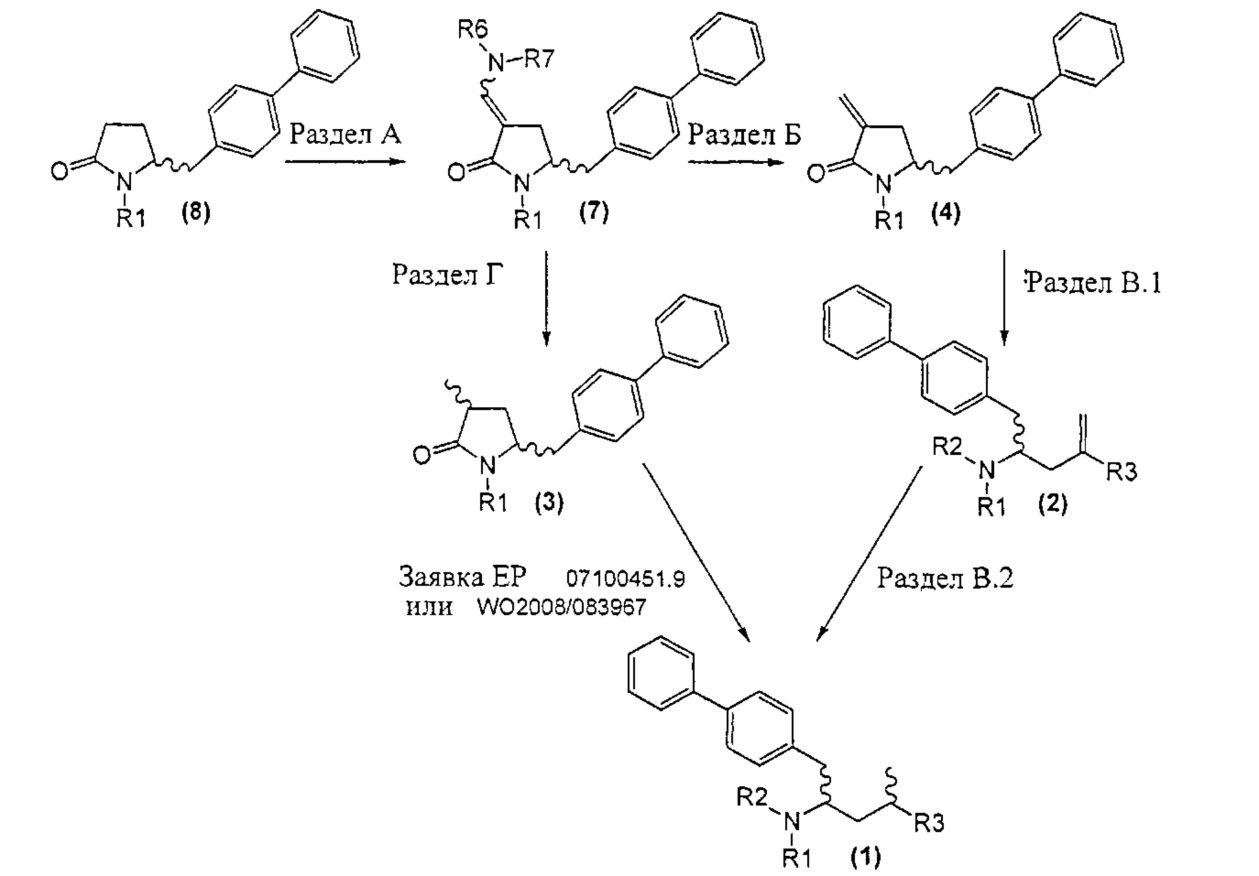
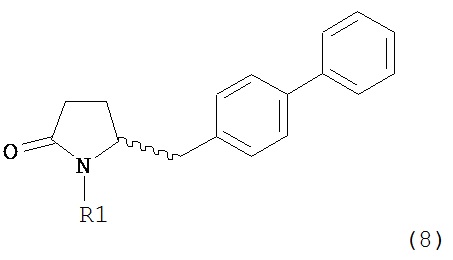
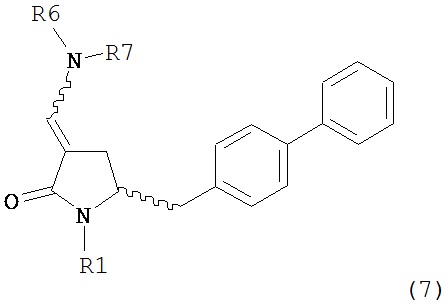
А именно, соединение формулы (8) превращают в соединение формулы (7) или его соль, где R1 представляет собой водород или защитную группу для азота, способом, описанным в разделе А. Затем соединение формулы (7) или его соль, как описано выше, превращают в соединение формулы (1) или его соль способами 1 или 2, где
- способ 1 включает:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (4),
б) любой один из способов раздела В для превращения соединения (4) в соединение (2), и
в) любой один из способов раздела В для превращения соединения (2) в соединение (1);
- способ 2 включает:
а) любой один из способов раздела Г для превращения соединения (7) в соединение (3), и
б) превращение соединения формулы (3) в соединение (1), например, как описано в заявке на патент EP 07100451,9 или международной заявке на патент WO 2008/083967.
Как описано далее, разделы А, Б, В и Г как таковые являются также предпочтительными вариантами осуществления настоящего изобретения.
Раздел А: Получение соединения формулы (7)
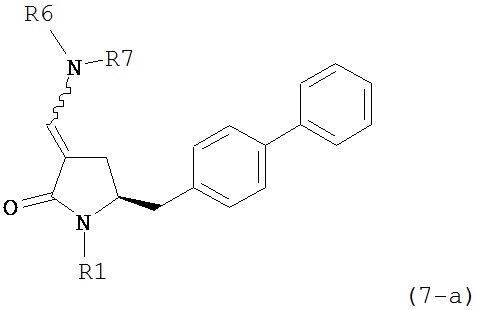
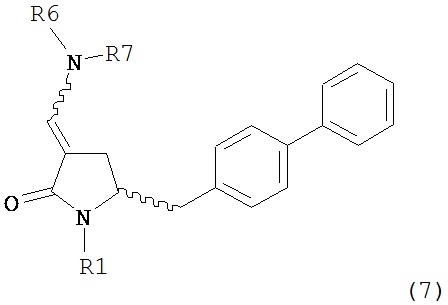
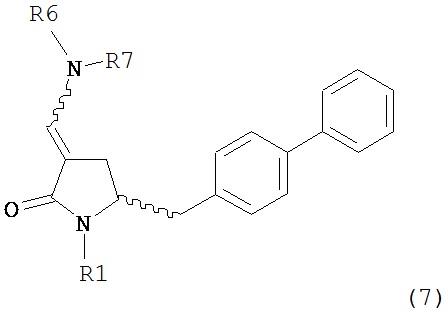
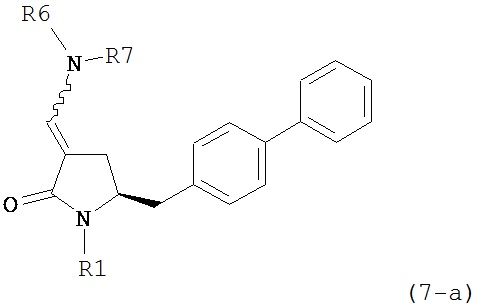
В одном варианте осуществления настоящее изобретение относится к способу получения соединения формулы (7) или его соли:
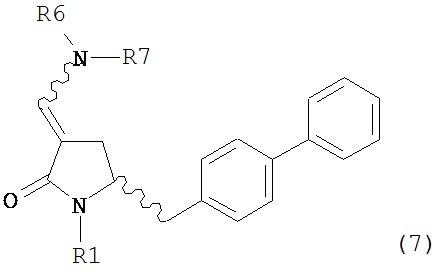
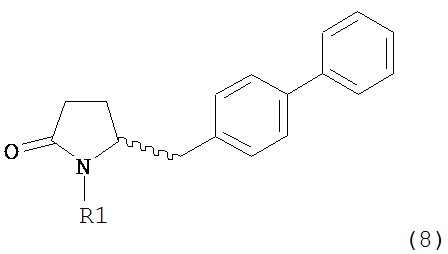
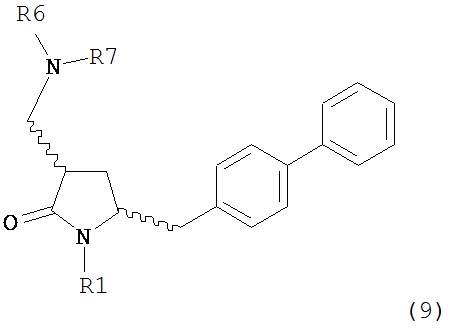
где R1 представляет собой водород или защитную группу для азота, и R6 и R7, независимо, представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, причем указанный способ включает реакцию соединения формулы (8) или его соли:
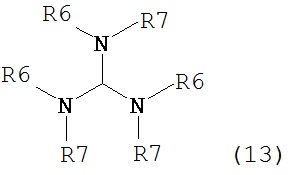
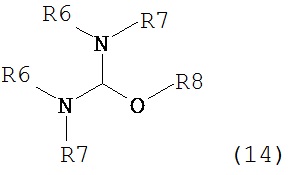
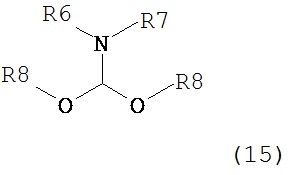
где R1 представляет собой водород или защитную группу для азота с амином формулы (13), (14) или (15) или их смесями:
 ,
, 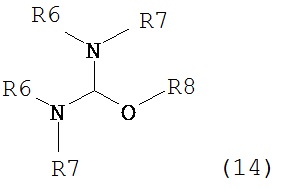 ,
, 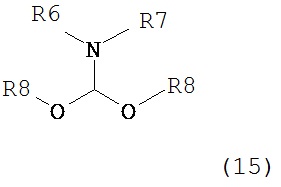 ,
,
где каждый R6 и каждый R7 независимо представляет собой алкильную группу, арильную группу, арилалкилую группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, и каждый R8 независимо представляет собой алкильную группу, арильную группу или арилалкильную группу, с получением соединения формулы (7).
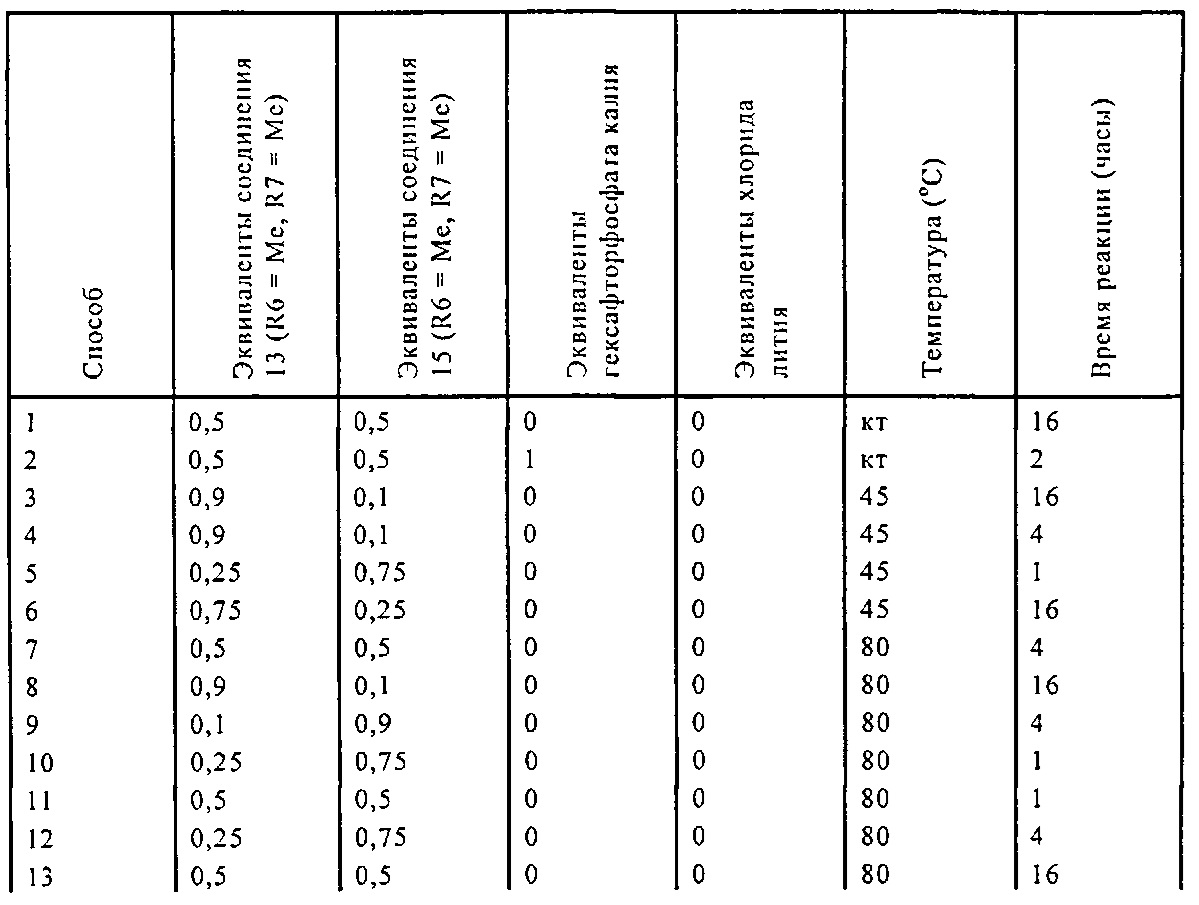
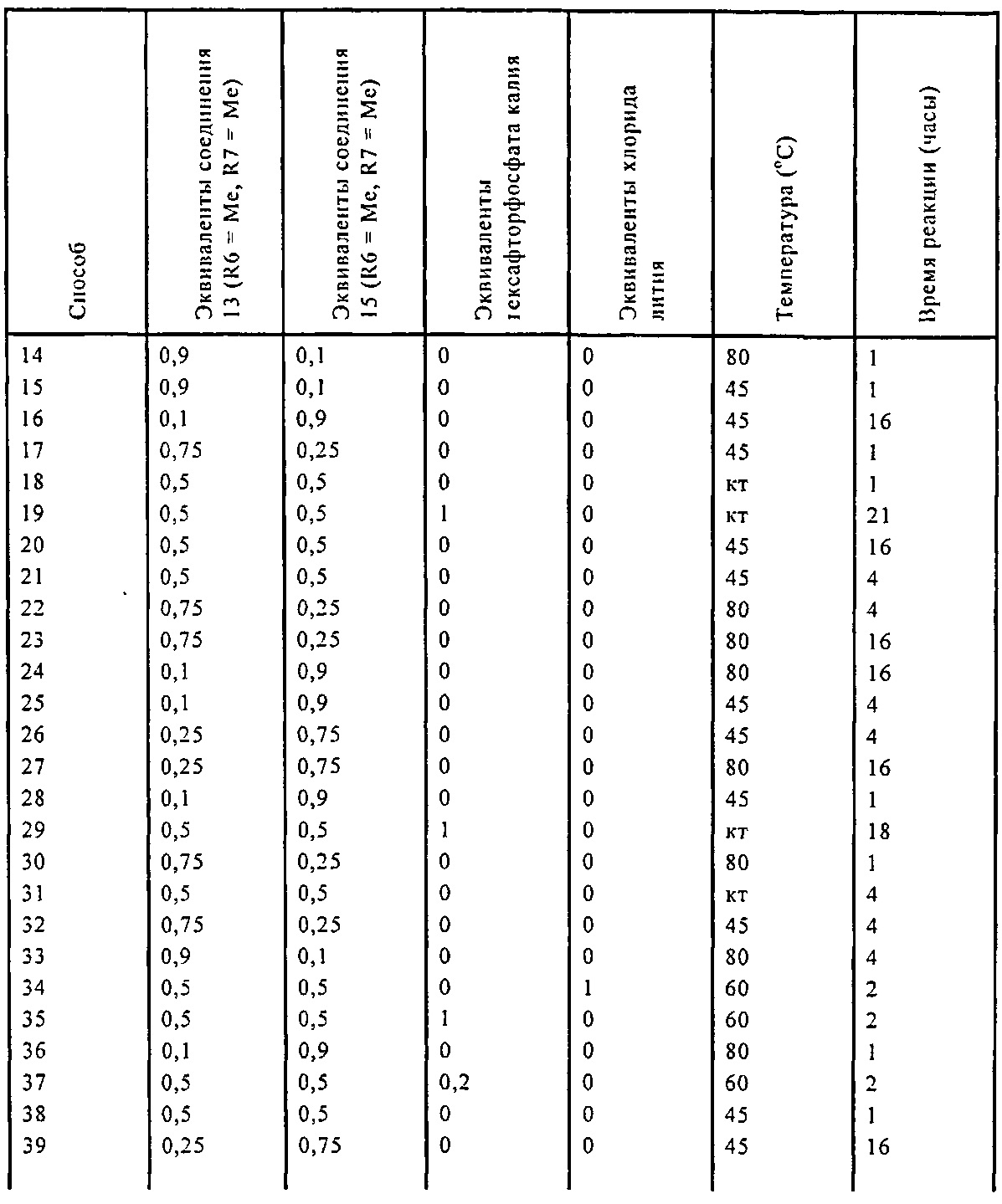
Реакция получения енамина формулы (7) может протекать без растворителя или в любом инертном растворителе, предпочтительно в апротонном растворителе, таком как галогенированные углеводороды, такие как метиленхлорид; простые эфиры, такие как ТГФ, диметоксиэтан или диоксан; или ароматические растворители, такие как бензол, хлорбензол, толуол, фенилэтан или ксилол или их смеси. Предпочтительно растворитель представляет собой толуол или ТГФ. Обычно, реакция может проводиться при температуре от 0°C до температуры кипения, предпочтительно от 0 до 200°C, более предпочтительно от 20 до 140°C, еще более предпочтительно от 40 до 100°C, наиболее предпочтительно от 60 до 90°C.
Предпочтительные примеры аминов формул (13), (14) и (15) включают реагент Бредерека {трет-бутоксибис(диметиламино)метан), трет-бутоксибис(диэтиламино)метан, метоксибис(диметиламино)метан, трет-пентоксибис(диметиламино)метан, трис(диметиламино)метан, трис(диэтиламино)метан и N,N-диметилформамиддиметилацеталь (DMFDMA), N,N-диметилформамиддиэтилацеталь, N,N-диметилформамиддиизопропилацеталь, N,N-диметилформамидди-трет-бутилацеталь, N,N-диметилформамидди-трет-пентоксиацеталь или их смеси.
В одном варианте осуществления амин формулы (14) предпочтительно представляет собой реагент Бредерека или трет-пентоксибис(диметиламино)метан. В другом варианте осуществления, амин формулы (13) предпочтительно представляет собой трис(диметиламино)метан. В другом варианте осуществления, амин формулы (15) предпочтительно представляет собой N,N-диметилформамидди-трет-бутилацеталь или N,N-диметилформамидди-трет-пентоксиацеталь. Амин формул (13), (14) или (15) или их смеси могут использоваться в количестве от 1.0 до 10 эквивалентов, предпочтительно от 3 до 10 эквивалентов, наиболее предпочтительно от 3 до 6 эквивалентов, например, 3 эквивалента. Необязательно, может присутствовать спирт, предпочтительно алкиловый спирт, такой как 1-бутанол, 2-бутанол, трет-бутанол или 2-метил-2-бутанол. Обычно, спирт может использоваться в количестве от 1,0 до 10 эквивалентов, предпочтительно от 3 до 10 эквивалентов, более предпочтительно от 3 до 6 эквивалентов, например, 3 эквивалента. В одном варианте осуществления, спирт может использоваться с соединением (13) для получения соединения (14) и/или соединения (15) in situ.
Эти амины могут приобретаться из коммерческих источников, таких как Aldrich, Fluka или Acros, или могут быть получены в соответствии со способами, известными из предшествующего уровня техники, например, как описано в источниках Adv. Synth. Catal., 2004, 346, с.1081; Encyclopedia of Reagents for Organic Synthesis, 2007, DOI: 10,1002/9780470842898.rb350.pub2; Tetrahedron Lett., 1983, 25, c.285; Encyclopedia of Reagents for Organic Synthesis, 2007, DOI: 10,1002/047084289X.rt403; Synlett, 2006, 809; Recueil des travaux chimiques des Pays-Bas, 1969, 88, c.289; J. Org. Chem., 1985, 50, c.3573; J. Org. Chem., 1980, 45, c.3986; Chem. Ber., 1968, 101, c.1885; J. Chem. Soc., Perkin Trans. 2, 1985, c.1669; Angew. Chem., Int. Ed., 1962, 1, c.331; Chem. Ber., 1968, 101, c.41; Chem. Ber., 1968, 101, c.51; Liebigs Ann. Chem., 1972, 762, c.62; Science of Synthesis, 2005, 22, c. 795; J. Am. Chem. Soc, 1961, 83, c.2588 или в J. Org. Chem., 1962, 27, с.3664, или в соответствии со способом, описанным в разделе Е настоящего изобретения.
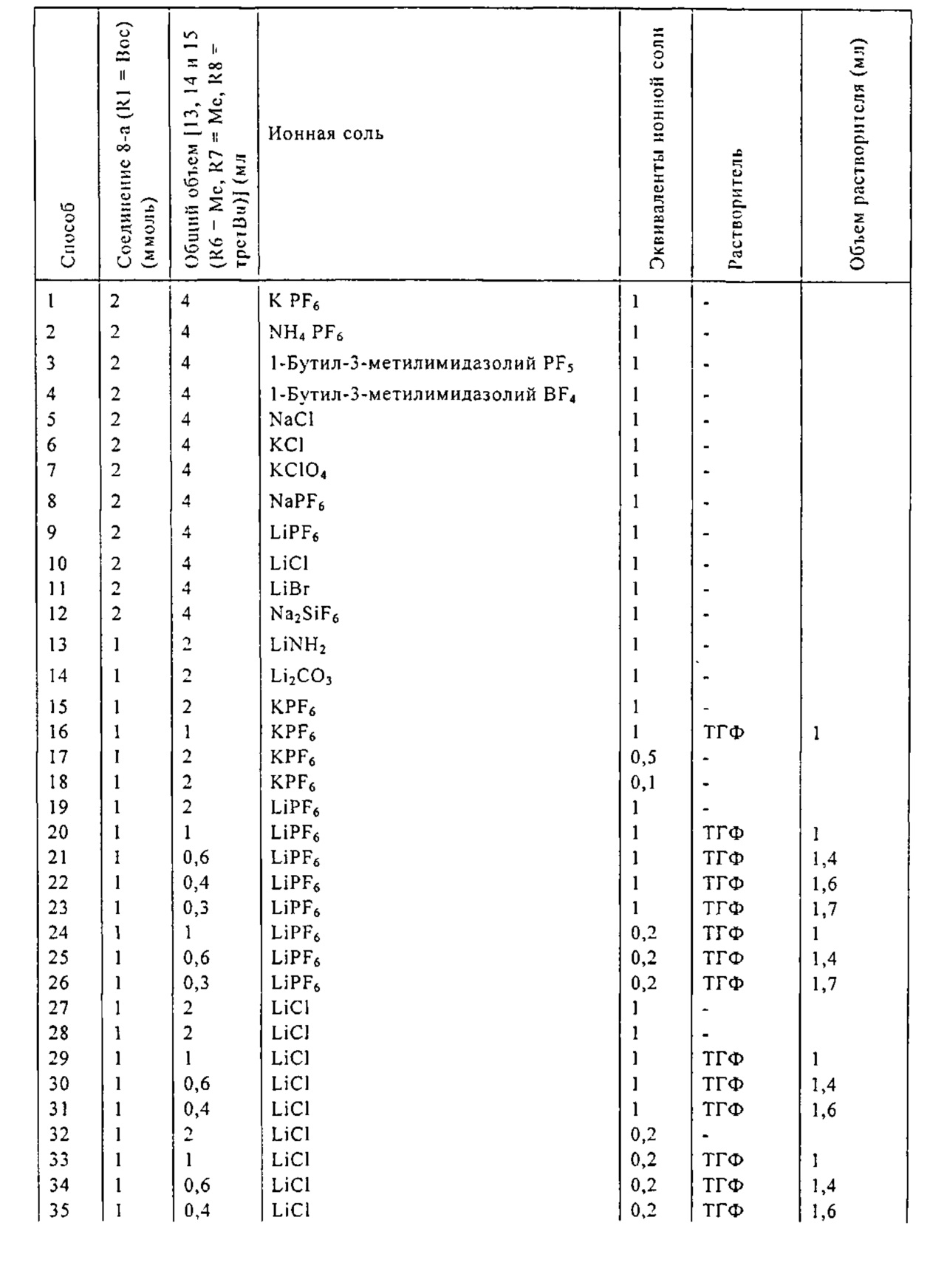
В одном варианте осуществления, превращение соединения формулы (8) в соединение формулы (7), как описано выше, осуществляют в присутствии соли, например, соли щелочного металла (например, соли лития, натрия или калия), соли щелочноземельного металла (например, соли магния или кальция) или соли аммония, где противоионом является, например, галогенид, карбонат, амин, перхлорат, гексафторфосфат или гексафторсиликат. В частности, соль выбрана из гексафторфосфата лития (LiPF6), гексафторфосфата натрия (NaPF6), гексафторфосфата калия (KPF6), гексафторфосфата аммония (NH4PF6), хлорида лития (LiCl), бромида лития (LiBr), хлорида натрия (NaCl), хлорида калия (KCl), хлорида магния (MgCl2), перхлората калия (KClO4), гексафторсиликата натрия (Na2SiF6), амида лития (LiNH2) и карбоната лития (Li2CO3). Соль также может быть ионной жидкостью, такой как тетрафторборат 1-бутил-3-метилимидазолия или гексафторфосфат 1-бутил-3-метилимидазолия. В одном варианте осуществления, соль представляет собой гексафторфосфат лития, хлорид лития, хлорид магния или гексафторфосфат калия.
В другом варианте осуществления, превращение соединения формулы (8) в соединение формулы (7), как описано выше, осуществляют в присутствии соли, как описано выше, и амина. Обычно амин представляет собой вторичный амин, такой как вторичный амин формулы HNR6R7, где R6 и R7 независимо являются такими, как определено выше для соединений формулы 13, 14 или 15. В частности, амин представляет собой дифениламин, диизопропиламин, диметиламин или имидазол. Необязательно, основание может добавляться к амину формулы HNR6R7 с получением соединений формулы M-NR6R7, где М представляет собой щелочной металл (например, литий, натрий, калий) или щелочноземельный металл (например, магний, кальций), и R6 и R7 независимо являются такими, как определено выше. В частности, М представляет собой щелочной металл, такой как литий. В одном варианте осуществления, основание представляет собой LHMDS, и амин представляет собой дифениламин.
В другом варианте осуществления, превращение соединения формулы (8) в соединение формулы (7), как описано выше, осуществляют в присутствии соли, как описано выше, и краун-эфира. В частности, соль представляет собой гексафторфосфат калий, и краун-эфир представляет собой 18-краун-6.
Обычно в описанных выше вариантах осуществления соль может использоваться в каталитическом или стехиометрическом количестве относительно соединения формулы (8). В частности, соль может использоваться в количестве, например, от 0,1 до 2 эквивалентов, в частности от 0,5 до 2 эквивалентов, таком как от 1 до 2 эквивалентов.
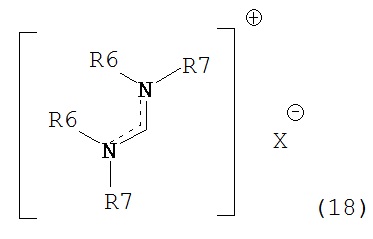
В предпочтительном случае, подходящие реагенты для получения соединения формулы (7) или его соли из соединения формулы (8) или его соли, включают реакцию соединения формулы (7) с соединением, полученным смешением соединения формулы (18):
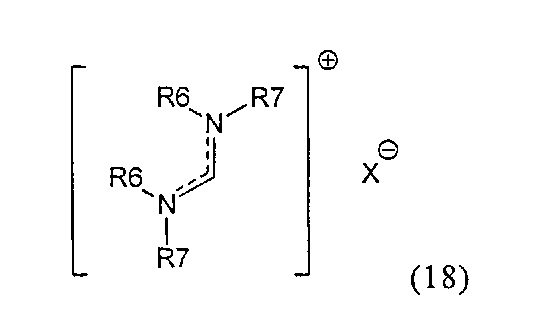
где R6 и R7, независимо, являются такими, как определено выше, с алкоголятом формулы M-OR8,
где
X представляет собой анион, например, галогенид (например, хлорид, бромид, йодид), анион серной кислоты (например, трифторметансульфоновая кислота, метансульфоновая кислота, 4-толуолсульфоновая кислота), анион алкилсульфата (например, метилсульфат), тетрагалогенметалят, например, тетрахлорметалят (например, тетрахлорманганат, тетрахлоралюминат), гексафторфосфат, гексафтопантимонат, тетрафторборат, перхлорат, алкоксид, например, R8O-, где R8 является таким, как определено выше (например, трет-бутоксид, феноксид), карбоксилат, трибромид.
М представляет собой щелочной металл (например, литий, натрий, калий, в частности натрий, калий) или щелочноземельный металл (например, магний, кальций).
R8 является таким, как определено выше.
R8O представляет собой алкоксигруппу.
Реакция может осуществляться без растворителя или в любом инертном растворителе, как определено выше.
В предпочтительном случае добавляли алкоголят формулы M-OR8, необязательно в растворителе, например, инертном растворителе, таком как тетрагидрофуран, метилтетрагидрофуран, толуол, алканы (такие как гептан, гексан) или их смеси, к соединению формулы (18), необязательно в инертном растворителе. M-OR8 обычно используют в диапазоне от 0,5 до 1,5 эквивалентов, более предпочтительно в диапазоне от 0,8 до 1,2 эквивалентов.
Обычно смесь перемешивают, обычно при температуре от 0°C до температуры кипения, предпочтительно от 0 до 120°C, более предпочтительно от 20 до 80°C.
Смесь подвергают реакции с соединением формулы (S) или его солью, с получением соединения формулы (7) или его соли.
В предпочтительном случае смесь может использоваться в количестве от 1,0 до 10 эквивалентов, предпочтительно от 3 до 10 эквивалентов, более предпочтительно от 3 до 6 эквивалентов, таком как 3 эквивалента. Обычно, эквиваленты используют относительно соединения формулы (18). Обычно, реакция может проводиться при температуре от 0°C до температуры кипения, предпочтительно от 0 до 120°C, более предпочтительно от 20 до 80°C.
В одном варианте осуществления, смесь алкоголята формулы M-OR8 и соединения формулы (18), необязательно в описанном выше растворителе, которая может быть получена как описано выше, подвергают реакции с соединением формулы (8). Смесь может добавляться к соединению (8) в количестве от 1,0 до 10 эквивалентов, в частности от 3 до 10 эквивалентов, таком как от 3 до 6 эквивалентов, в частности 3 эквивалента. Когда количество алкоголята M-OR8 и соединения формулы (18) не является эквимолярным количеством, эквиваленты смеси, использующиеся в отношении соединения (8), являются относительными количеству соединения (18). Обычно, реакцию, включающую смесь алкоголята формулы M-OR8 и соединения формулы (18), необязательно в описанном выше растворителе, проводят при температуре от 0°C до температуры кипения, в частности от 0 до 120°C, такой как от 20 до 80°C.
Соединение формулы (7) необязательно может быть выделено в виде остатка для удаления летучих веществ из смеси. Дистиллят может содержать амин формул (13), (14) или (15) или их смеси. Когда твердое вещество присутствует после образования соединения формулы (7), оно необязательно может быть удалено, например, фильтрацией, до дистилляции. Твердое вещество может содержать соединение формулы (18).
В другом предпочтительном случае, соединение формулы (18), необязательно в присутствии алкоголята формулы R8O-M, может быть обработано солью формулы MIX', которая частично или полностью заменяет анионный противоион (X) соединений формулы (18) на анионный противоион (X'), где X' является таким, как описано выше для X, и M1 представляет собой щелочной металл (например, литий, натрий или калий), щелочноземельный металл (например, магний или кальций) или аммоний, для получения соединений формулы (18').
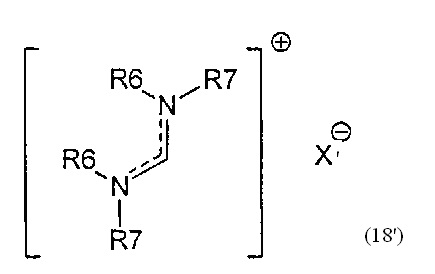
Подходящие реагенты для этого обмена включают соли щелочного металла (такие как тетрафторборат или гексафторфосфат лития, натрия или калия, метилсульфат натрия, перхлорат натрия), соли щелочноземельного металла (такие как перхлорат магния или кальция), соли аммония (такие как тетрафторборат или гексафторфосфат аммония). Предпочтительно используются соли гексафторфосфата или соли тетрафторбората, более предпочтительно используются гексафторфосфат аммония или тетрафторборат аммония или тетрафторборат натрия. Наиболее предпочтительно используются соли гексафторфосфата, предпочтительно гексафторфосфат аммония. Относительно анионного противоиона (X), анионный противоион (X') подходящих реагентов может использоваться в каталитических или стехиометрических количествах.
Смесь, полученная после такого обмена, может использоваться как таковая, поскольку смесь содержит соединения (18) и (18'), и необязательно R8O-M. Альтернативно, анион формулы (X) может быть выделен из смеси, например, фильтрацией, так что смесь будет содержать соединение (18') и необязательно соединение R8O-M.
Кроме того, соединения формулы (18) или (18') или их смеси являются подходящими реагентами в целях настоящего изобретения. Соединения формулы (18'), независимо, определены в соответствии с соединениями формулы (18).
Как таковое, в предпочтительном случае, соединение формулы (8) превращают в соединение формулы (7) реакцией с соединением формулы (18) и алкоголятом формулы R8O-M, необязательно в присутствии соединения формулы (18'). Кроме того, в предпочтительном случае, соединение формулы (8) превращают в соединение формулы (7) реакцией с соединением формулы (18) и алкоголятом формулы R8O-M, необязательно в присутствии соединения формулы (18') и амина формул (13), (14) или (15) или их смесей.
Необязательно, соединение формулы (8) может быть превращено в соединение формулы (7) реакцией с соединением формулы (18) и алкоголятом формулы R8O-M, необязательно в присутствии соединения формулы (18') и амина формул (13), (14) или (15) или их смесей, в присутствии амина, обычно формулы HNR6R7, где R6 и R7 независимо являются такими, как определено выше. В частности, амин представляет собой дифениламин, диизопропиламин, диметиламин или имидазол. Необязательно, основание может добавляться к амину формулы HNR6R7 с получением соединений формулы M-NR6R7, где М представляет собой щелочной металл (например, литий, натрий, калий) или щелочноземельный металл (например, магний, кальций), и R6 и R7 независимо являются такими, как определено выше. В частности, М представляет собой щелочной металл, такой как литий. В одном варианте осуществления, основание представляет собой LHMDS, и амин представляет собой дифениламин.
Соединения формул (18) или (18') могут быть получены из коммерческих источников, таких как Aldrich и Fluka, или могут быть получены способами, известными из предшествующего уровня техники, например, как описано в статьях J. Chem. Soc., Perkin Trans. 1, 2001, с.1586; J. Chem. Soc., Perkin Trans. 1, 1987, c.845; Synthesis, 1977, c.273; Science of Synthesis, 2005, 22, c.221; Synthesis Communications, 1983, c.785; Recueil des travaux chimiques des Pays-Bas, 1969, 88, c.289; Chem. Res. Chinese U., 2005, 21, c.177; Chem. Ber., 1993, 126, c.1859; Synthetic Communications, 1998, 28, c.1223; J. Org. Chem., 1965, c.2464; J. Org. Chem., 1970, 35, c.1542; Liebigs Ann. Chem., 1972, 762, c.62; J. Am. Chem. Soc., 1961, 83, c.2588; J. Org. Chem., 1962, 27, c.3664 или J. Chem. Soc., 1949, с.3319, или в соответствии со способами, описанными в разделе Е настоящего изобретения.
Соединения формулы R8O-M могут быть получены из коммерческих источников, таких как Aldrich, BASF, Chemetall GmbH, или могут быть получены способами, известными специалисту в данной области техники.
Предпочтительны следующие условия:
Для соединений формул (18) или (18'), R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце. Наиболее предпочтительно, R6 представляет собой алкил. Еще более предпочтительно R6 представляет собой метил или этил, и R7 представляет собой метил или этил. X предпочтительно представляет собой хлорид, метилсульфат, тетрафторборат или гексафторфосфат. Наиболее предпочтительно, X представляет собой хлорид или гексафторфосфат. В предпочтительном случае соединения формул (18) или (18') предпочтительно представляют собой хлорид N,N,N,N-тетраметилформамидиния или N,N,N,N-тетраэтилформамидиния, гексафторфосфат N,N,N,N-тетраметилформамидиния или N,N,N,N-тетраэтилформамидиния.
Для соединений формулы R8O-M, R8 предпочтительно представляет собой алкил, наиболее предпочтительно трет-бутил или амилат. М предпочтительно представляет собой щелочной металл, наиболее предпочтительно натрий или калий. Далее, предпочтительно, когда R8O-M представляет собой трет-бутоксид натрия (NaOCMe3) или трет-бутоксид калия (KOCMe3) или амилат натрия (NaOCMe2Et) или амилат калия (KOCMe2Et). Наиболее предпочтительно, когда R8O-M представляет собой трет-бутоксид калия или амилат натрия.
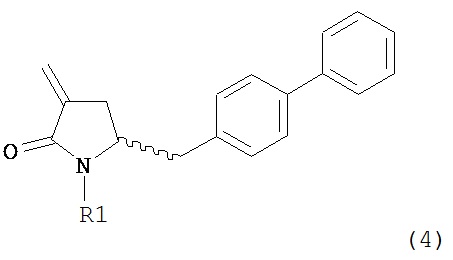
Раздел Б: Получение соединения формулы (4)
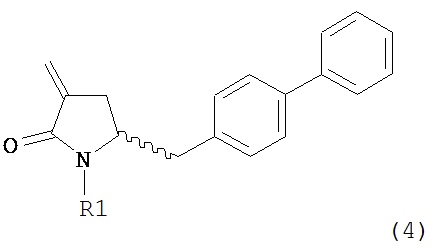
Способы настоящего изобретения превращения соединения формулы (7), как здесь определено, в соединение формулы (4), как здесь определено, приведены на схеме 2.
Схема 2
Настоящее изобретение таким образом относится к превращению соединения формулы (7) как здесь описано в соединение формулы (4) как здесь описано любым одним из способов 1-9, где:
способ 1 включает:
а) любой один из способов раздела Б,1 для превращения соединения (7) в соединение (6), и
б) любой один из способов раздела Б,2,1 для превращения соединения (6) в соединение (4);
метод 2 включает:
а) любой один из способов раздела Б,1 для превращения соединения (7) в соединение (6),
б) любой один из способов раздела Б,2,2 для превращения соединения (6) в соединение (5), и
в) любой один из способов раздела Б,2,3 для превращения соединения (5) в соединение (4);
способ 3 включает любой один из способов раздела Б,3,1 для превращения соединения (7) в соединение (4);
способ 4 включает:
а) любой один из способов раздела Б,3,2 для превращения соединения (7) в соединение (6), и
б) любой один из способов раздела Б,2,1 для превращения соединения (6) в соединение (4);
способ 5 включает:
а) любой один из способов раздела Б,3,2 для превращения соединения (7) в соединение (6),
б) любой один из способов раздела Б,2,2 для превращения соединения (6) в соединение (5), и
в) любой один из способов раздела Б,2,3 для превращения соединения (5) в соединение (4);
способ 6 включает:
а) любой один из способов раздела Б,3,3 для превращения соединения (7) в соединение (9),
б) любой один из способов раздела Б,4 для превращения соединения (9) в соединение (10), и
в) любой один из способов раздела Б,4 для превращения соединения (10) в соединение (4);
способ 7 включает:
а) любой один из способов раздела Б,3,4 для превращения соединения (7) в соединение (5), и
б) любой один из способов раздела Б,2,3 для превращения соединения (5) в соединение (4);
метод 8 включает:
а) любой один из способов раздела Б,5,1 для превращения соединения (7) в соединение (16),
б) любой один из способов раздела Б,5,2 для превращения соединения (16) в соединение (6),
в) любой один из способов раздела Б,2,2 для превращения соединения (6) в соединение (5), и
г) любой один из способов раздела Б,2,3 для превращения соединения (5) в соединение (4);
способ 9 включает:
а) любой один из способов раздела Б,5,1 для превращения соединения (7) в соединение (16),
б) любой один из способов раздела Б,5,2 для превращения соединения (16) в соединение (6), и
в) любой один из способов раздела Б,2,1 для превращения соединения (6) в соединение (4);
предпочтительно превращение соединения формулы (7) как здесь описано в соединение формулы (4) как здесь описано осуществляют в соответствии со способами 1, 4 или 6; в частности, способами 1 или 4.
Как описано далее, разделы Б,1, Б,2,1, Б,2,2, Б,2,3, Б,3,1, Б,3,2, Б,3,3, Б,3,4, Б,4, Б,5,1 и Б,5,2 как таковые также являются предпочтительными вариантами осуществления настоящего изобретения.
Раздел Б,1:
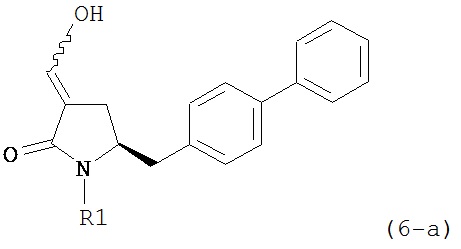
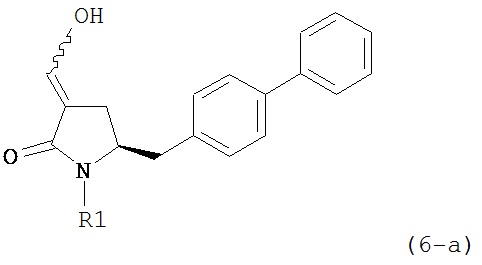
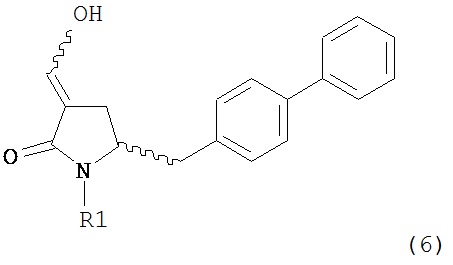
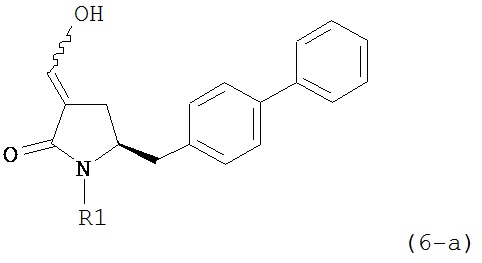
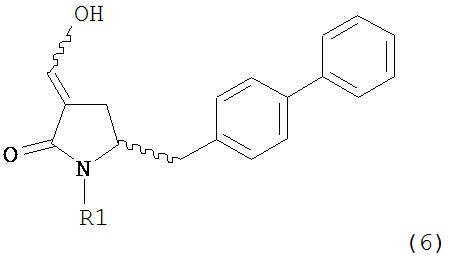
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6) или его таутомера:
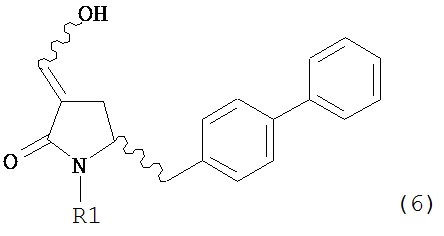
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (7) или его соли:
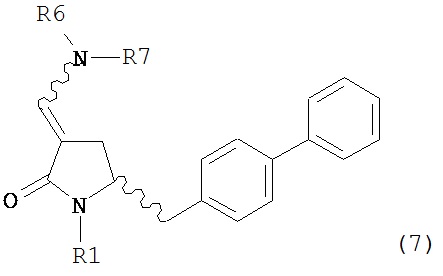
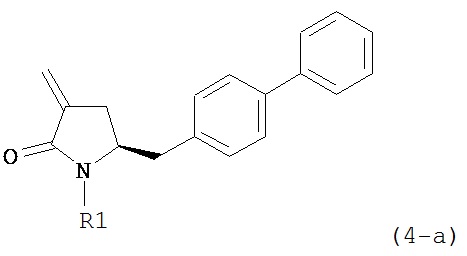
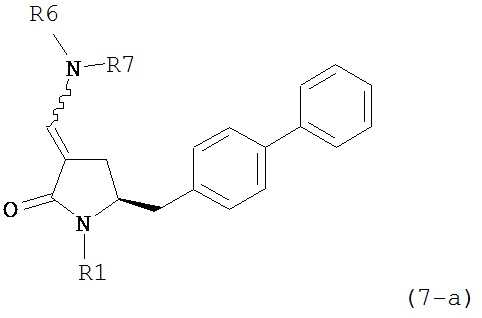
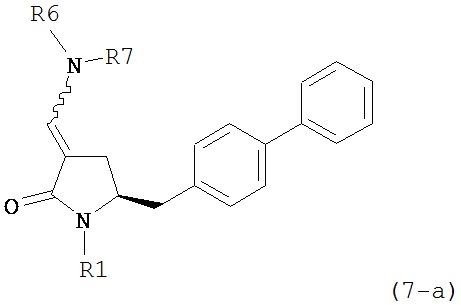
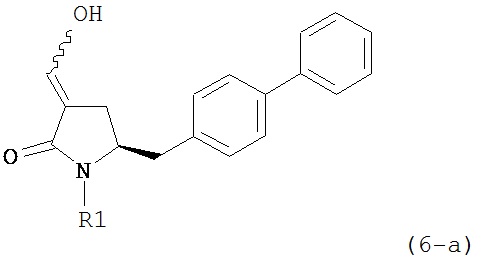
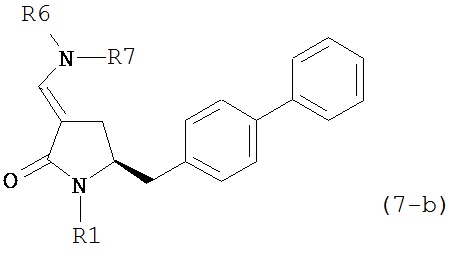
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, кислотой с получением соединения формулы (6), предпочтительно формулы (6-а). В предпочтительном варианте осуществления, исходное соединение формулы (7) или его соль соответствует формуле (7-а) или его соли:
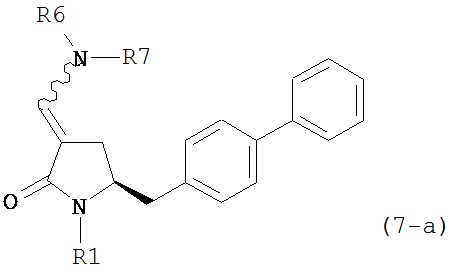 ,
,
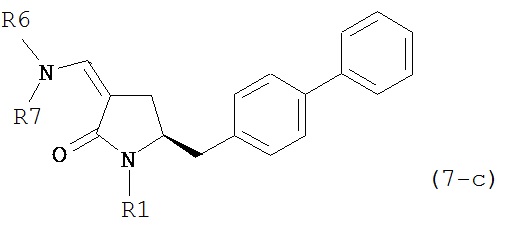
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, более предпочтительно исходное соединение формулы (7) соответствует формулам (7b) или (7с) или их солям, наиболее предпочтительно соответствует формуле (7-b) или его соли:
 ,
,
 ,
,
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце.
Соединение формулы (6) или его соль, предпочтительно формулы (6-а), или его таутомер, которое получают описанным выше способом, может быть выделено или использоваться в виде раствора для последующего превращения, например, превращения в соединение формулы (4) или его соль, как здесь определено.
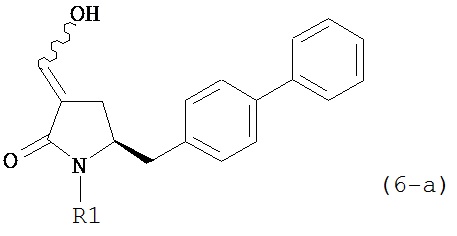
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6-а) или его таутомера:
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (7-а) или его соли:
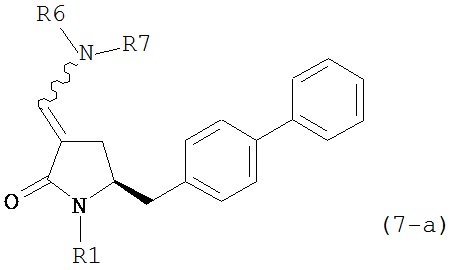
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, кислотой с получением соединения формулы (6-а). В предпочтительном варианте осуществления, исходное соединение формулы (7-а) или его соль соответствует формуле (7-b), как определено выше.
Предпочтительными примерами кислоты являются водные минеральные кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота. Наиболее предпочтительной является водная серная кислота. Предпочтительно, количество кислота используют такое, чтобы значение pH реакционной смеси составляло от 1 до 7, более предпочтительно значение pH составляло от 2 до 5, наиболее предпочтительно значение pH составляло от 2 до 3. Растворитель может использоваться, предпочтительно такой, что он смешивается или частично смешивается с водой, например, ацетонитрил. Необязательно может добавляться катализатор фазового перехода, такой как галогенид тетра-н-бутиламмония, например, бромид тетра-н-бутиламмония.
Обычно реакция может проводиться при температуре от -20 до 30°C, предпочтительно от -20 до 20°C, более предпочтительно от -10 до 10°C, наиболее предпочтительно от 0 до 10°C.
Раздел Б,2:
Раздел Б,2,1:
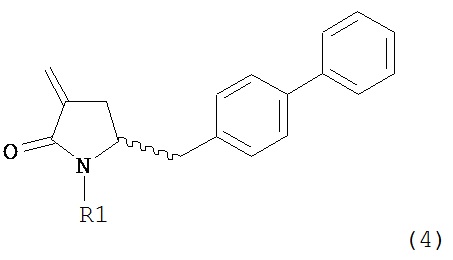
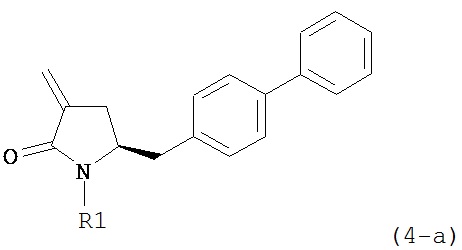
В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (4):
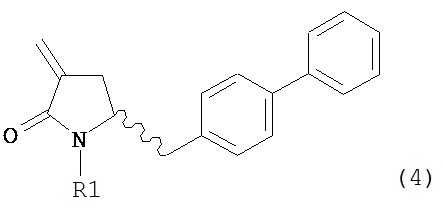
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (6) или его соли или таутомера:
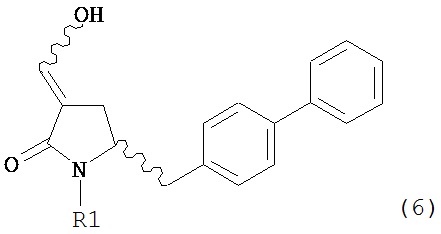
где R1 представляет собой водород или защитную группу для азота,
восстанавливающим агентом, предпочтительно в форме альдегида, с получением соединения формулы (4). В предпочтительном варианте осуществления, исходное соединение формулы (6) или его соль соответствует формуле (6-а):
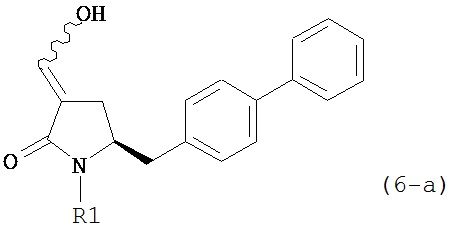 ,
,
или его соли, где R1 представляет собой водород или защитную группу для азота.
В предпочтительном варианте осуществления, соединение формулы (6-а) или его соль или таутомер:
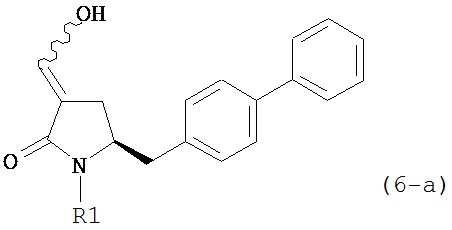
где R1 представляет собой водород или защитную группу для азота,
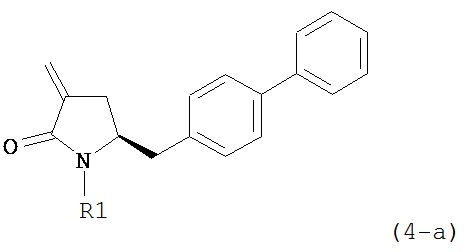
обрабатывают восстанавливающим агентом, предпочтительно в форме альдегида, с получением соединения формулы (4-а) или его соли:
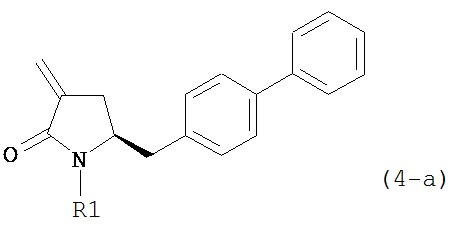
где R1 представляет собой водород или защитную группу для азота.
Восстанавливающий агент обычно представляет собой альдегид, более предпочтительно неенолизируемый альдегид, еще более предпочтительно арилальдегид, такой как бензальдегид, или тригалогенацетальдегид, такой как хлораль, еще более предпочтительно формальдегид, такой как мономерный формальдегид (полученный, например, 'крекингом' параформальдегида), 1,3,5-триоксан, параформальдегид или водный раствор формальдегида (например, 37% раствор в воде).
Предпочтительно, восстановление соединения формулы (6) или его соли, предпочтительно формулы (6-а) или его соли осуществляют при значении pH от 7, более предпочтительно при значении pH от 7 до 14, наиболее предпочтительно при значении pH от 10 до 11. Основание используют для поддержания значения pH от 7. Подходящими основаниями являются слабые основания или сильные основания или их смеси. Предпочтительно, основание представляет собой карбонат щелочного металла, такой как карбонат калия или гидроксид щелочного металла, такой как гидроксид натрия. Наиболее предпочтительно основание представляет собой карбонат калия. В предпочтительном варианте осуществления, восстановление осуществляют в двухфазной смеси воды и органического растворителя, предпочтительно в присутствии катализатора фазового перехода, такого как гидроксид тетрабутиламмония.
Раздел Б.2.2:
В конкретном варианте осуществления, обработка соединения формулы (6) или его соли, как определено выше, восстанавливающим агентом, предпочтительно водородом, и катализатором переходного металла (например, палладиевым катализатором), например, как описано в разделе Б,3,3, приводит к получению соединения формулы (5) или его соли:
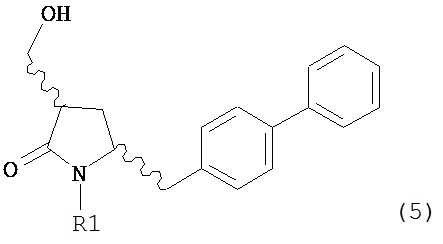 ,
,
где R1 представляет собой водород или защитную группу для азота,
или приводит к получению смеси соединений формул (4) и (5).
В другом конкретном варианте осуществления, обработка соединения формулы (6-а) или его соли как определено выше восстанавливающим агентом, предпочтительно водородом, и катализатором переходного металла (например, палладиевым катализатором), например, как описано в разделе Б,3,3, приводит к получению соединения формулы (5-а) или его соли:
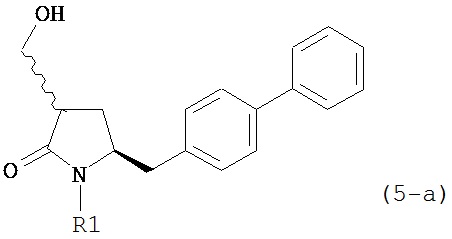 ,
,
где R1 представляет собой водород или защитную группу для азота, предпочтительно формулы (5-b):
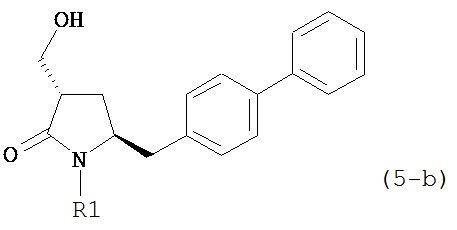 ,
,
или приводит к получению смеси соединений формул (4-а) и (5-а), предпочтительно смеси соединений формул (4-а) и (5-b).
Раздел Б,2,3:
Раздел Б,2,3,1:
В другом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (4):
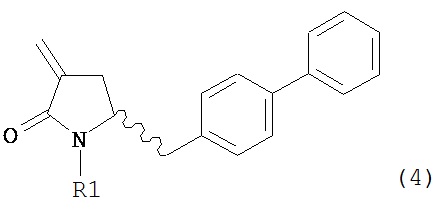
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) обработку соединения формулы (5) или его соли:
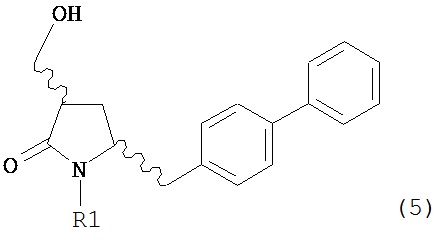
где R1 представляет собой водород или защитную группу для азота, OH-активирующим агентом с получением соединения формулы (11):
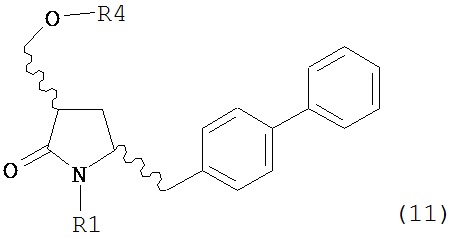
или его соли, где R1 представляет собой водород или защитную группу для азота и R4 представляет собой OH-активирующую группу; и
б) реакцию соединения формулы (11) или его соли с основанием с получением соединения формулы (4).
Стадии а) и б) как таковые также являются вариантом осуществления настоящего изобретения.
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-a):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) обработку соединения формулы (5-a) или его соли:
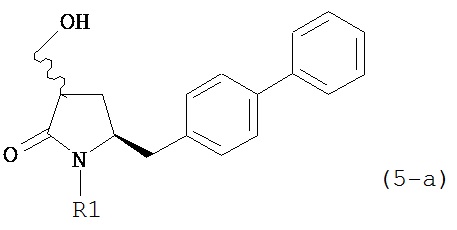
где R1 представляет собой водород или защитную группу для азота, OH-активирующим агентом с получением соединения формулы (11-a):
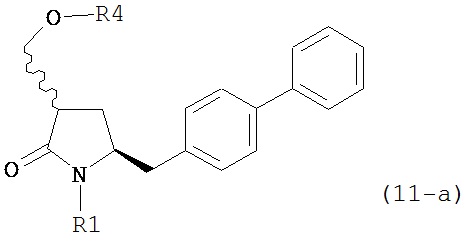
или его соли, где R1 представляет собой водород или защитную группу для азота и R4 представляет собой OH-активирующую группу; и
б) реакцию соединения формулы (11-а) или его соли с основанием с получением соединения формулы (4-а).
Стадии а) и б) как таковые также являются предпочтительным вариантом осуществления настоящего изобретения.
Раздел Б,2,3,2:
В предпочтительном варианте осуществления, превращение OH-группы соединения формулы (5) или его соли, предпочтительно формулы (5-а), в OH-активированную группу осуществляют в присутствии основания. В соответствии с этим предпочтительным вариантом осуществления, активация OH-группы и последующее отщепление OH-активированной группы осуществляют in situ с получением соединения формулы (4) или его соли, предпочтительно формулы (5-а); то есть без выделения OH-активированного соединения формулы (11) или его соли, предпочтительно формулы (11-а).
В более предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (5-а) или его соли:

где R1 представляет собой водород или защитную группу для азота,
OH-активирующим агентом в присутствии основания с получением соединения формулы (4-а).
В описанных выше способах (разделы Б,2,3,1 и Б,2,3,2), OH-активирующий агент представляет собой любой реагент, который может превращать гидроксильную группу в уходящую группу. Примерами подходящих OH-активирующих агентов являются сульфонирующие агенты, такие как метансульфонил- или толуолсульфонилгалогениды, например, метансульфонилхлорид или толуолсульфонилхлорид. Предпочтительное основание, например, представляет собой амин, такой как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 2,6-лутидин, диизопропилэтиламин, гидрид металла, такой как гидрид натрия или калия, или основания, такие как бис(триметилсилил)амид лития, натрия или калия и бутиллитий.
Превращение соединения формулы (5), предпочтительно формулы (5-а) или его солей в соединение формулы (4), предпочтительно формулы (4-а) или его солей может осуществляться описанными выше способами, для смеси соединений (4) и (5), предпочтительно смеси соединений (4-а) и (5-а) или их солей, как показано на схеме 3.
Схема 3
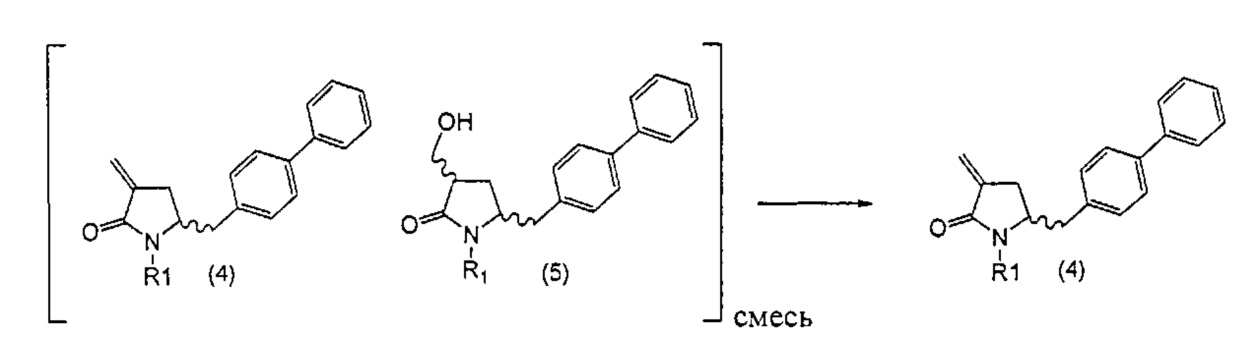
Раздел Б,2,3,3:
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему
а) обработку соединения формулы (5) или его соли:

где R1 представляет собой водород или защитную группу для азота,
OH-активирующим агентом с получением соединения формулы (11):
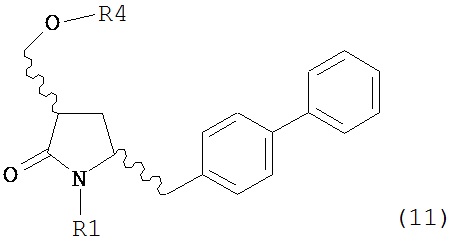
или его соли, где R1 представляет собой водород или защитную группу для азота и R4 представляет собой OH-активирующую группу; и
б) превращение соединения формулы (11) или его соли в соединение формулы (12):
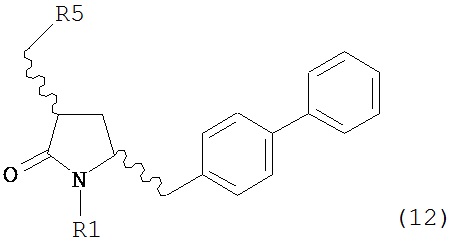
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; и
в) реакцию соединения формулы (12) или его соли с основанием с получением соединения формулы (4).
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) обработку соединения формулы (5-а) или его соли:

где R1 представляет собой водород или защитную группу для азота,
OH-активирующим агентом в присутствии основания с получением соединения формулы (11-а):

или его соли, где R1 представляет собой водород или защитную группу для азота и R4 представляет собой OH-активирующую группу; и
б) превращение соединения формулы (11-а) или его соли в соединение формулы (12-а):
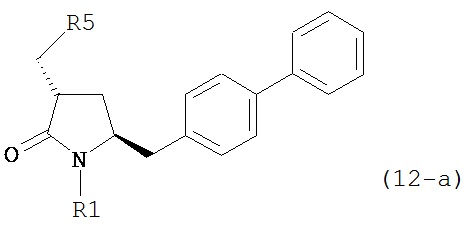
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; и
в) реакцию соединения формулы (12-а) или его соли с основанием с получением соединения формулы (4-а).
Превращение -OR4 группы соединения формул (11) или (11-а) в уходящую группу является хорошо известной специалисту в данной области техники реакцией, например, как описано в книге Richard С. Larock, "Comprehensive Organic Transformations: A Guide to Functional Groups Preparations", 2-ое издание, Wiley-VCH Verlag GmbH, 2000, в частности, как описано в соответствующих главах; например, это может осуществляться с использованием галогенида металла, такого как галогенид щелочного металла или галогенид щелочноземельного металла. В одном варианте осуществления галогенид металла представляет собой, например, йодид натрия.
Предпочтительными уходящими группами являются галоген, такой как бром или йод.
Предпочтительными примерами основания на стадии в) являются основания амина, например, триэтиламин.
В одном варианте осуществления, превращение соединения формулы (12), предпочтительно формулы (12-а), в соединение формулы (4), предпочтительно формулы (4-а), осуществляют в присутствии реагента, который может изменять идентичность R1. В одном варианте осуществления, соединение формулы (12-а), где R1=Н и R5=I, обрабатывают основанием (например, триэтиламином) и реагентом ди-трет-бутилдикарбонатом с получением соединения формулы (4-а), где R1=Boc.
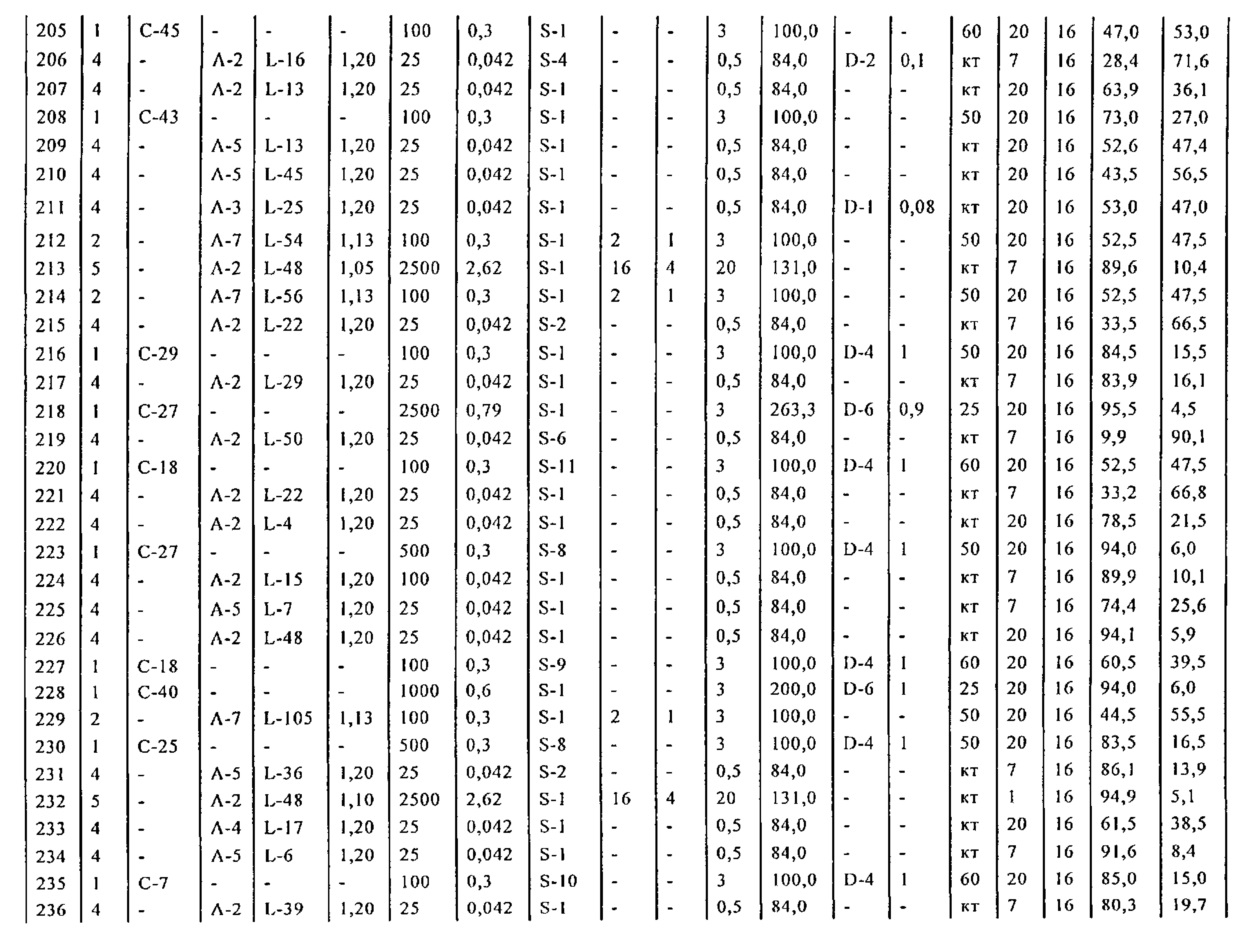
Раздел Б,2,3,4:
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) превращение соединения формулы (5) или его соли:

где R1 представляет собой водород или защитную группу для азота, в соединение формулы (12):

или его соль, где R1 представляет собой водород или защитную группу для азота, и R5 представляет собой уходящую группу; и
б) реакцию соединения формулы (12) или его соли с основанием с получением соединения формулы (4).
Стадии а) и б) как таковые также являются вариантом осуществления настоящего изобретения.
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) превращение соединения формулы (5-а) или его соли:

где R1 представляет собой водород или защитную группу для азота, в соединение формулы (12-a):
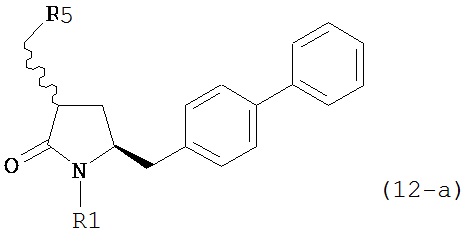
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; и
б) реакцию соединения формулы (12-а) или его соли с основанием с получением соединения формулы (4-а).
Превращение гидроксильной группы соединения формул (5) или (5-а) в уходящую группу является реакцией, хорошо известной специалисту в данной области техники, например, как описано в книге С. Larock, "Comprehensive Organic Transformations: A Guide to Functional Groups Preparations", 2-oe издание, Wiley-VCH Verlag GmbH, 2000, в частности, как описано в соответствующих главах; например, это может осуществляться с использованием PPh3 и I2.
Раздел Б,3:
Раздел Б,3,1:
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (7):
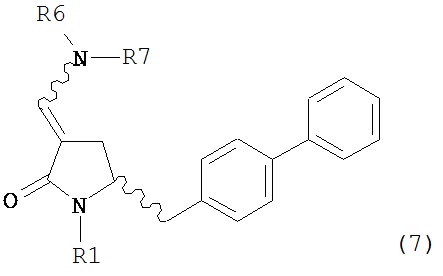
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
восстанавливающим агентом с получением соединения формулы (4), предпочтительно формулы (4-а). В предпочтительном варианте осуществления, исходное соединение формулы (7) или его соль соответствует формуле (7-а) или его соли, как описано выше; более предпочтительно, исходное соединение соответствует формулам (7-b) или (7-с) или их солям, как описано выше, наиболее предпочтительно, исходное соединение соответствует формуле (7-b) или его солям, как определено выше.
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (7-а):
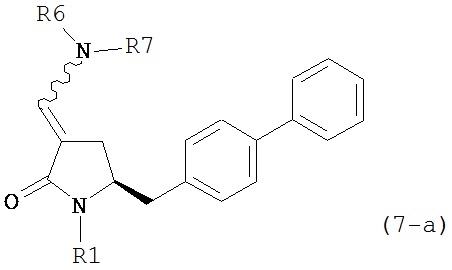
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
восстанавливающим агентом с получением соединения формулы (4-а). В предпочтительном варианте осуществления, исходное соединение формулы (7) или его соль соответствует формулам (7-b) или (7-с) или их солям, как определено выше, предпочтительно формуле (7-b).
Предпочтительными восстанавливающими агентами являются гидриды, такие как боргидриды щелочного металла, например, боргидрид натрия, боргидрид лития, боргидрид калия, боргидрид кальция, триацетоксиборгидрид натрия, боргидрид тетраметиламмония или триацетоксиборгидрид, и гидриды щелочного металла, например, литийалюмогидрид, L-Selectride®, K-Selectride®, N-Selectride® или диизобутилалюмогидрид. Предпочтительными восстанавливающими агентами являются триацетоксиборгидрид натрия и диизобутилалюмогидрид; более предпочтительно диизобутилалюмогидрид; наиболее предпочтительно диизобутилалюмогидрид в ТГФ. Предпочтительно, реакция протекает в эфирном растворителе, таком как ТГФ, диметоксиэтан или диоксан; предпочтительно растворитель представляет собой ТГФ. Обычно реакция может проводиться при температуре от -78 до 30°C, предпочтительно от -20 до 25°C, более предпочтительно от 15 до 25°C.
Раздел Б,3,2:
В другом варианте осуществления, обработка соединения формулы (7) или его соли, как определено выше, восстанавливающим агентом, предпочтительно водородом, и катализатором переходного металла (например, палладиевым катализатором), например, как описано в разделе Б,3,3, может приводить к получению соединения формулы (6) или его соли, как определено выше, или может приводить к получению смеси соединений формул (4) и (6).
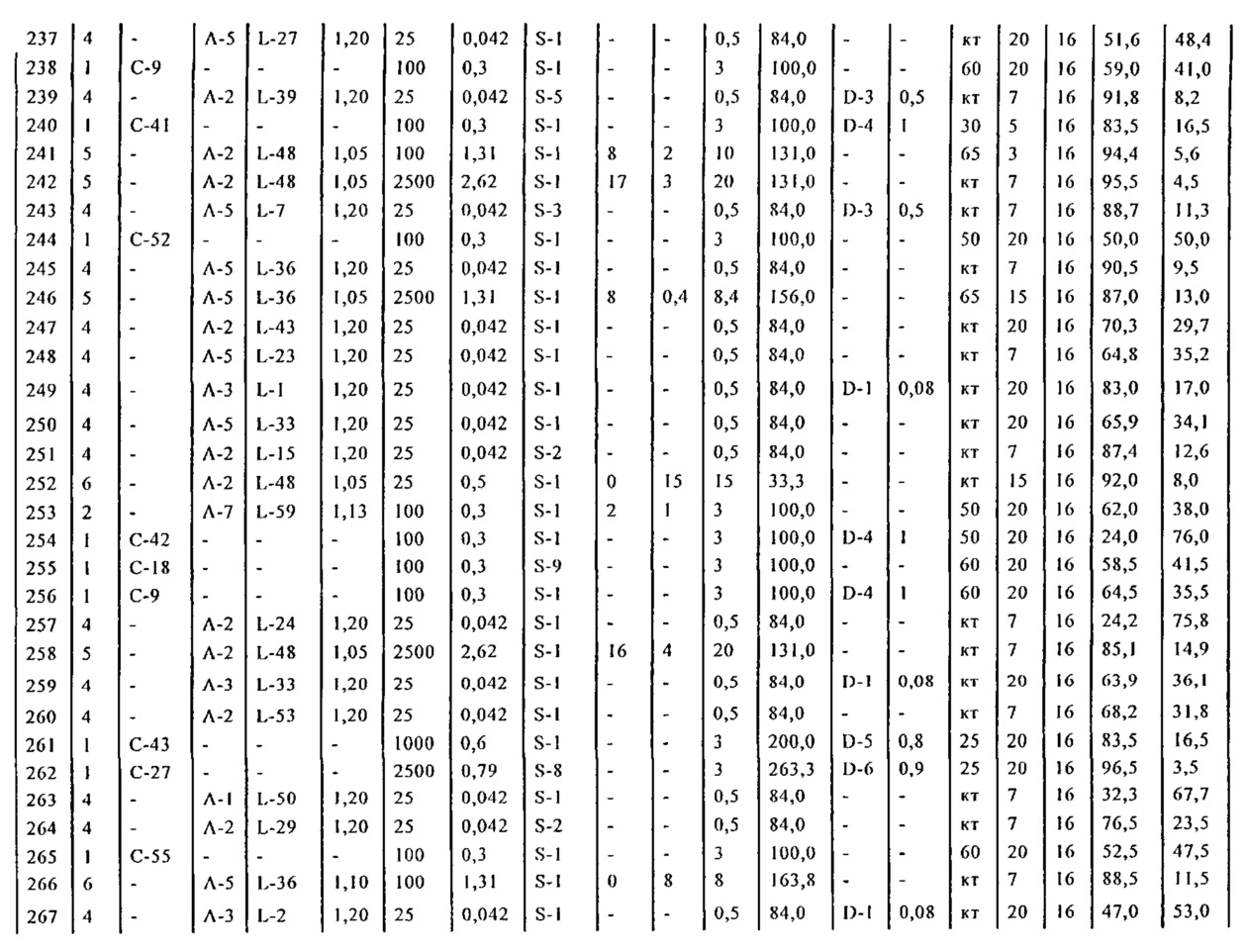
В другом варианте осуществления, обработка соединения формулы (7-а) или его соли, как определено выше, восстанавливающим агентом приводит к получению соединения формулы (6-а) или его соли, как определено выше, или приводит к получению смеси соединений формул (4-а) и (6-а).
Раздел Б,3,3:
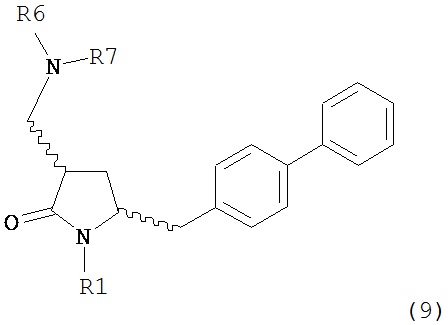
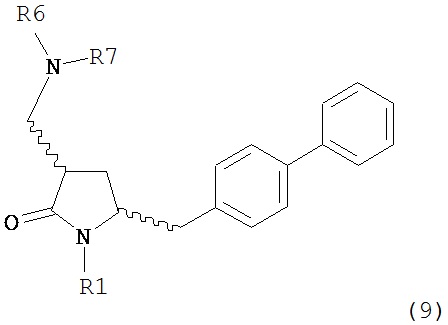
В другом варианте осуществления, обработка соединения формулы (7) или его соли, как определено выше, восстанавливающим агентом, предпочтительно водородом, и катализатором переходного металла может приводить к получению соединения формулы (9) или его соли:
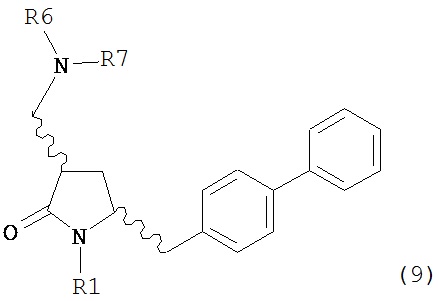
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, или может приводить к получению смеси соединений формул (4) и (9).
В другом варианте осуществления, обработка соединения формулы (7-а) или его соли, как определено выше, восстанавливающим агентом, предпочтительно водородом, и катализатором переходного металла приводит к получению соединения формулы (9-а) или его соли:
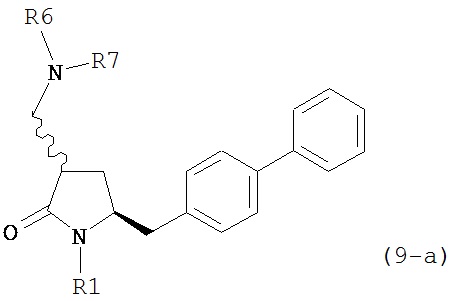
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце. В одном варианте осуществления, соединение формулы (9-а) или его соль соответствует формуле (9-b):
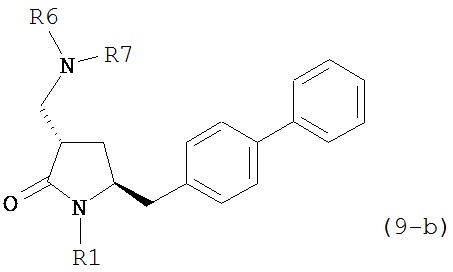
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце. В другом варианте осуществления, соединение формулы (9-а) или его соль соответствует формуле (9-с):
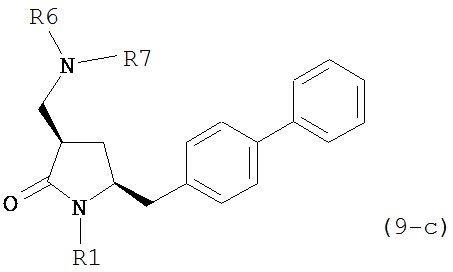
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце.
В одном варианте осуществления, восстановление соединения формулы (7) или его соли, предпочтительно формулы (7-а), протекает в водороде в присутствии катализатора переходного металла, где переходный металл выбран из группы 9 или 10 периодической таблицы. Следовательно, катализатор переходного металла включает, например, кобальт (Co), родий (Rh), иридий (Ir), никель (Ni), палладий (Pd) и/или платину (Pt). Восстановление может осуществляться в условиях гетеро- или гомогенного гидрирования, предпочтительно в условиях гетерогенного гидрирования. В частности, переходный металл выбран из Pt, Pd или Ir; где переходный металл необязательно может дополнительно содержать, например, серу или свинец. Примеры таких соединений с переходными металлами являются Pd(S), Pd(Pb) или Pt(S). В частности, катализатор переходного металла включает переходный металл на твердом носителе. Содержание переходного металла на твердом носителе составляет, например, от 1% до 10% вес. Твердыми носителями являются, например, уголь, оксиды металла (например, оксид алюминия, оксид циркония, оксид титана или диоксид кремния/оксид алюминия), сульфаты (например, сульфат бария) или карбонаты (например, карбонат кальция и карбонат бария). В одном варианте осуществления, катализатор переходного металла может содержать воду, например, от 0 мас.% до 61 мас.% содержания воды.
В одном варианте осуществления, гидрирование протекает в присутствии основания, такого как основания амина (например, триэтиламин) или оснований щелочного металла (например, карбонат цезия или карбонат калия).
В частности, переходный металл представляет собой палладий, и твердый носитель представляет собой, например, уголь, оксиды металла (например, оксид алюминия, оксид циркония, оксид титана или диоксид кремния/оксид алюминия), карбонаты (например, карбонат кальция и карбонат бария) или сульфаты (например, сульфат бария).
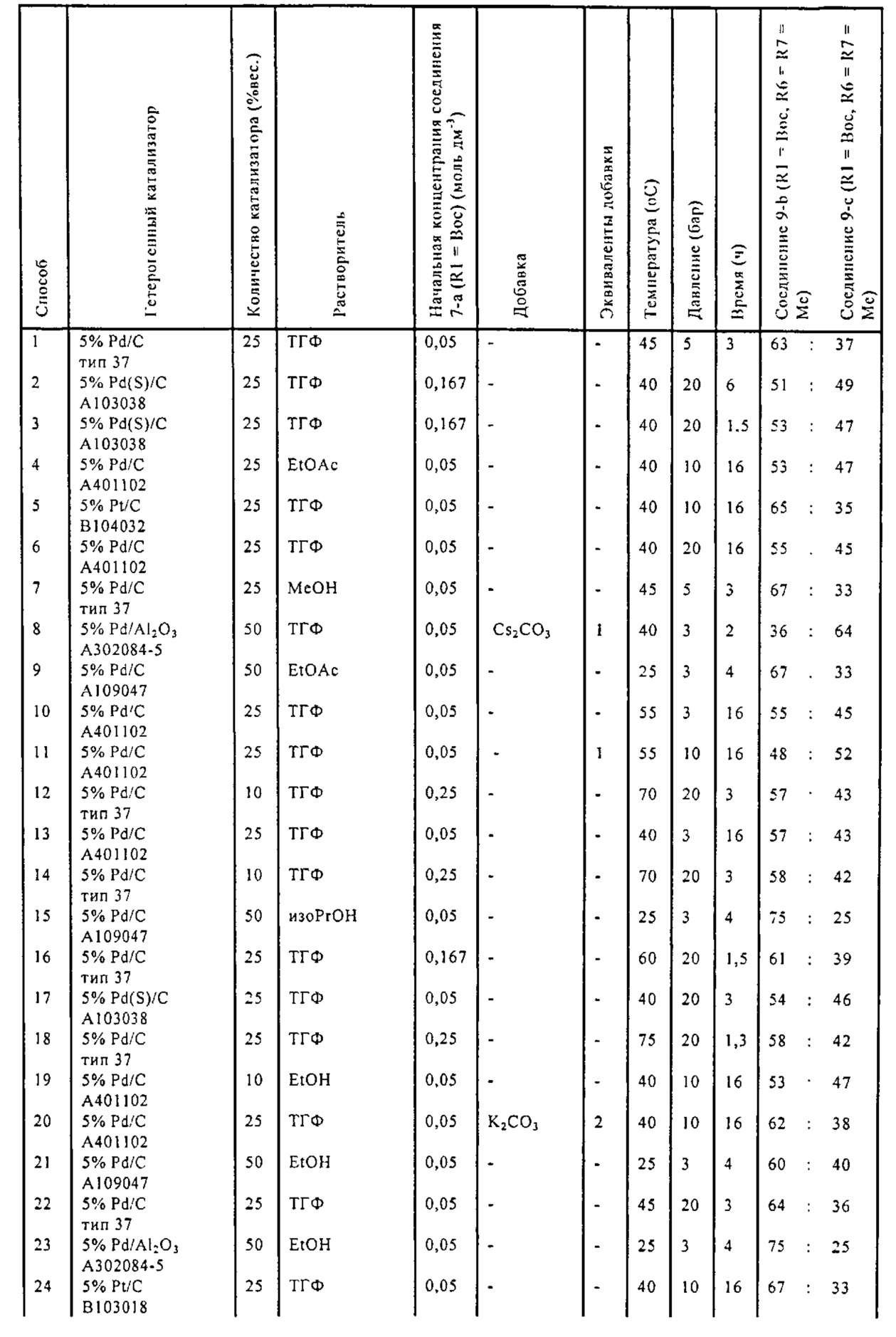
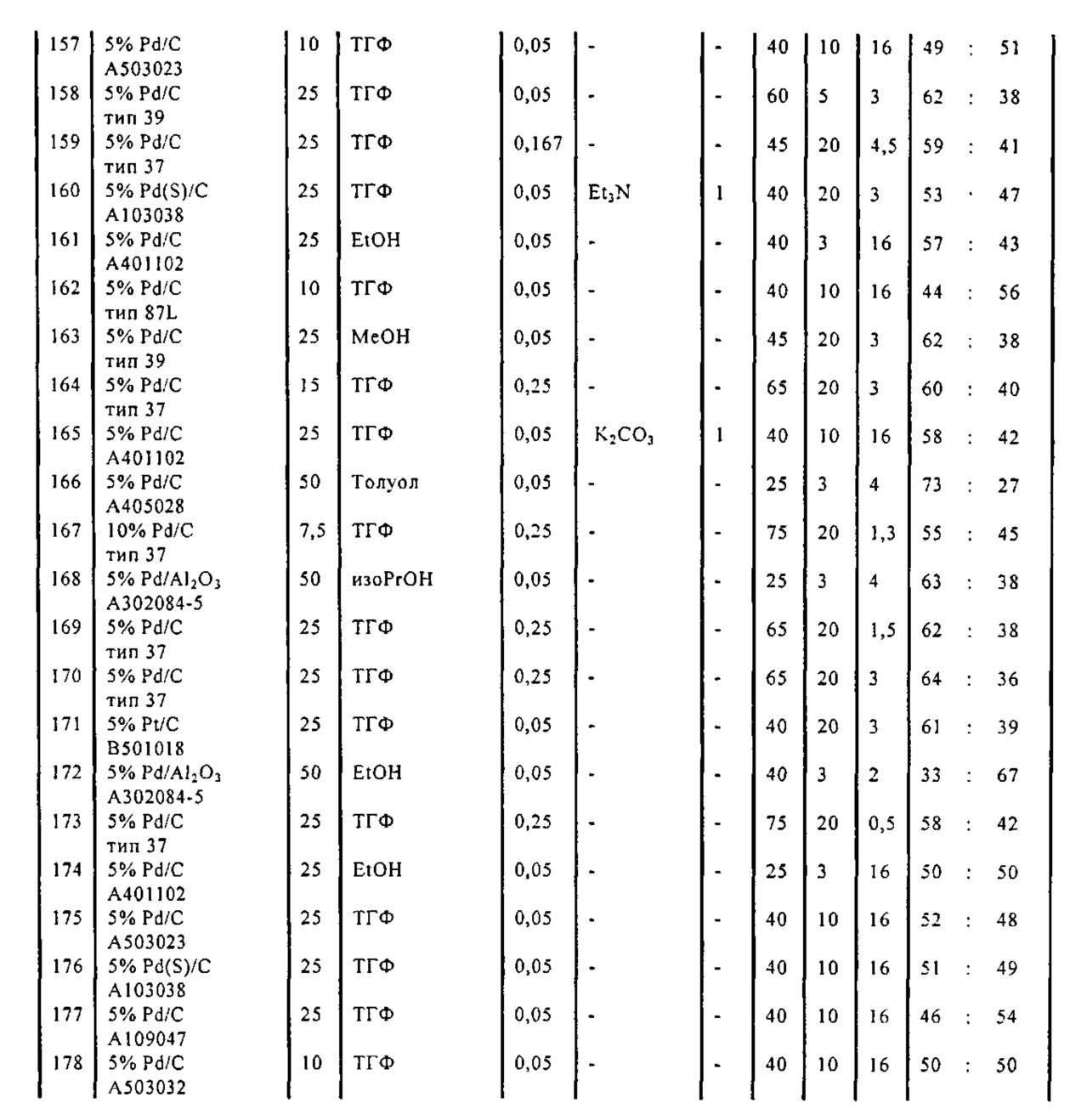
В одном варианте осуществления, катализатор переходного металла представляет собой Pd катализатор, выбранный из группы, состоящей из палладия на угле, такого как 1% Pd/C (например, 1% Pd/C типа 39), 3% Pd/C (например, 3% Pd/C типа 39), 5% Pd/C (например, 5% Pd/C А401102-5, 5% Pd/C А401102, 5% Pd/C A109047, 5% Pd/C A405028, 5% Pd/C A405032, 5% Pd/C A405038, 5% Pd/C A503023, 5% Pd/C A503032, 5% Pd/C A503038, 5% Pd/C A102023, 5% Pd/C A102038, 5% Pd/C типа 374, 5% Pd/C типа 398, 5% Pd/C типа 37, 5% Pd/C типа 87L, 5% Pd/C типа 487, 5% Pd/C типа 39, 5% Pd/C типа 394, 5% Pd/C типа 487 (порошок), 5% Pd/C типа 472 (порошок), 5% Pd/C типа 87L (порошок), 5% Pd/C типа 5R394, 5% Pd/C типа 5R338 или 5% Pd(S)/C [например, 5% Pd(S)/C А103038]), или 10% Pd/C (например, 10% Pd/C типа 374, 10% Pd/C типа 394, 10% Pd/C типа 87L или 10% Pd/C типа 37); палладия на оксиде алюминия, такого как 5% Pd/Al2O3 (например, 5% Pd/Al2O3 А302084-5 или 5% Pd/Al2O3 А302011); палладия на карбонате кальция, такого как 5% Pd/CaCO3 (например, 5% Pd/CaCO3 А303060 или 5% Pd/CaCO3 типа 405) или 5% Pd(Pb)/CaCO3 (например, 5% Pd(Pb)/CaCO3 А 305060); палладия на оксиде титана, такого как 5% Pd/TiO2 (например, 5% Pd/TiO2 С6944); палладия на сульфате бария, такого как 5% Pd/BaSO4 (например, 5% Pd/BaSO4 А 308053); палладия на оксиде циркония, такого как 5% Pd/ZrO2 (например, 5% Pd/ZrO2 С7140); и палладия на диоксиде кремния/оксиде алюминия, такого как 5% Pd/SiO2/Al2O3 (например, 5% Pd/SiO2/Al2O3 С7078 или 5% Pd/SiO2/Al2O3 С7079); которые являются коммерчески доступными, например, от Johnson Matthey.
В другом варианте осуществления, катализатор переходного металла представляет собой Pt катализатор, такой как платина на угле, например, 5% Pt/C (например, 5% Pt/C В103032, 5% Pt/C В103018, 5% Pt/C В103014, 5% Pt/C B104032, 5% Pt/C В 501032, 5% Pt/C B109032 или 5% Pt/C B501018) или 5% Pt(S)/C (например, 5% Pt(S)/C В106032); которые являются коммерчески доступными, например, от Johnson Matthey.
В другом варианте осуществления, катализатор переходного металла представляет собой 1 г катализатор, такой как иридий на угле, например, 5% Ir/C (например, 5% Ir/C С-7750) или на карбонате кальция, например, 5% Ir/СаСО3 (например, 5% Ir/СаСО3 типа 30); которые являются коммерчески доступными, например, от Johnson Matthey.
Количество катализатора переходного металла на субстрате, обычно используемого в способе, может составлять в диапазоне от 1 до 75 вес.%, предпочтительно от 10 до 50 вес.%, более предпочтительно от 20 до 50 вес.%.
Могут использоваться растворители, известные из предшествующего уровня техники. Предпочтительными растворителями являются, например, спиртовые растворители (например, метанол, этанол или изопропанол), растворители простых эфиров (например, тетрагидрофуран, метилтетрагидрофуран или тетрагидрофуран/вода), ароматические растворители (например, толуол) или сложноэфирные растворители (например, этилацетат или изопропилацетат). В одном варианте осуществления растворитель представляет собой этанол или тетрагидрофуран. Количество используемого растворителя может быть таким, чтобы концентрация субстрата находилась в диапазоне от 0,01 до 1 М, такая как 0,05 М, в частности, от 0,1 до 0,5 М или от 0,1 до 0,3 М.
Гидрирование обычно осуществляют при температуре от 20°C до 100°C, в частности от 25°C до 75°C, такой как от 30°C до 75°C, от 45°C до 75°C, от 25°C до 65°C или от 25°C до 55°C. Используют давление водорода обычно в диапазоне от 1 бар до 40 бар, такое как от 3 бар до 30 бар, в частности от 5 бар до 30 бар, от 3 бар до 20 бар или от 3 бар до 10 бар.
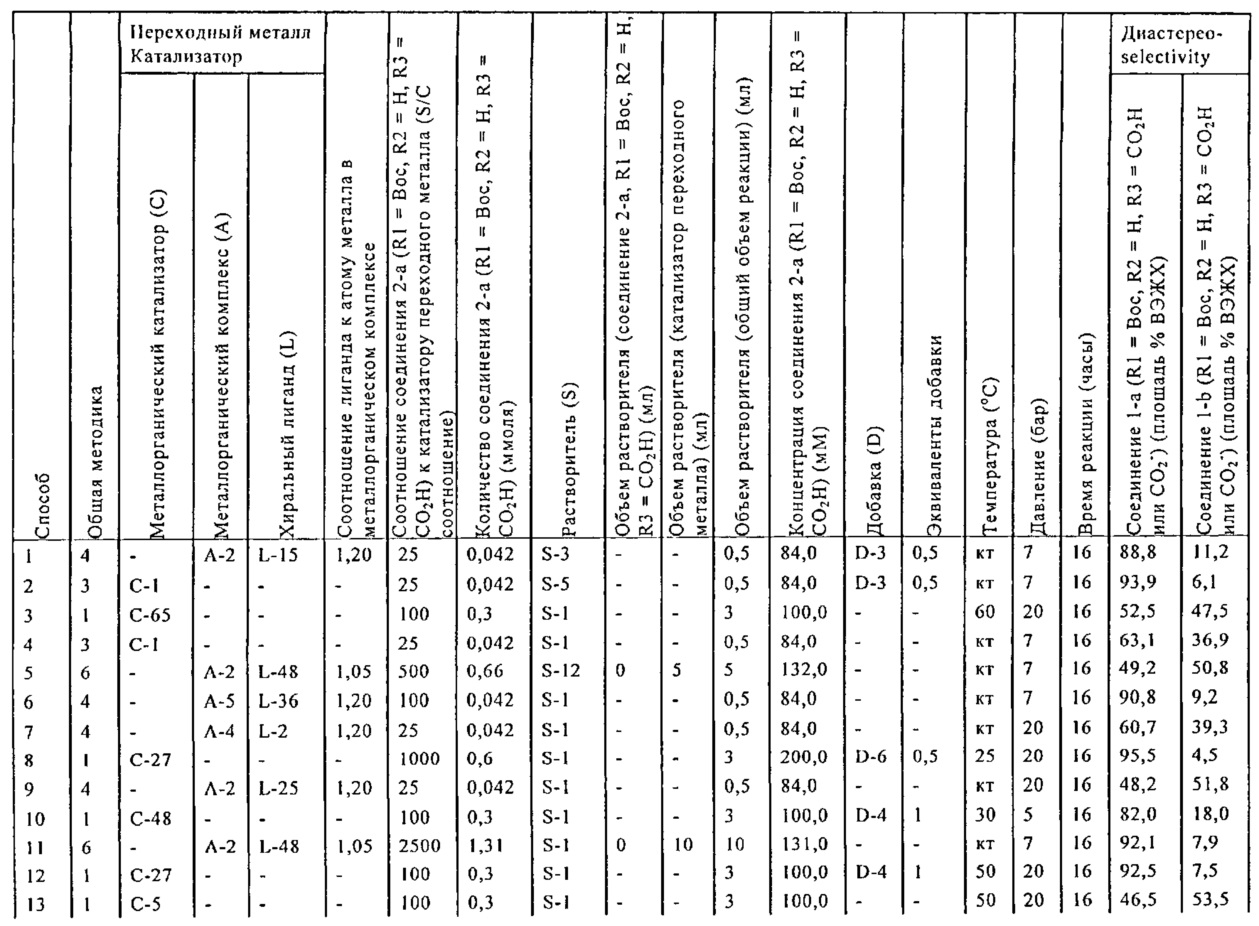
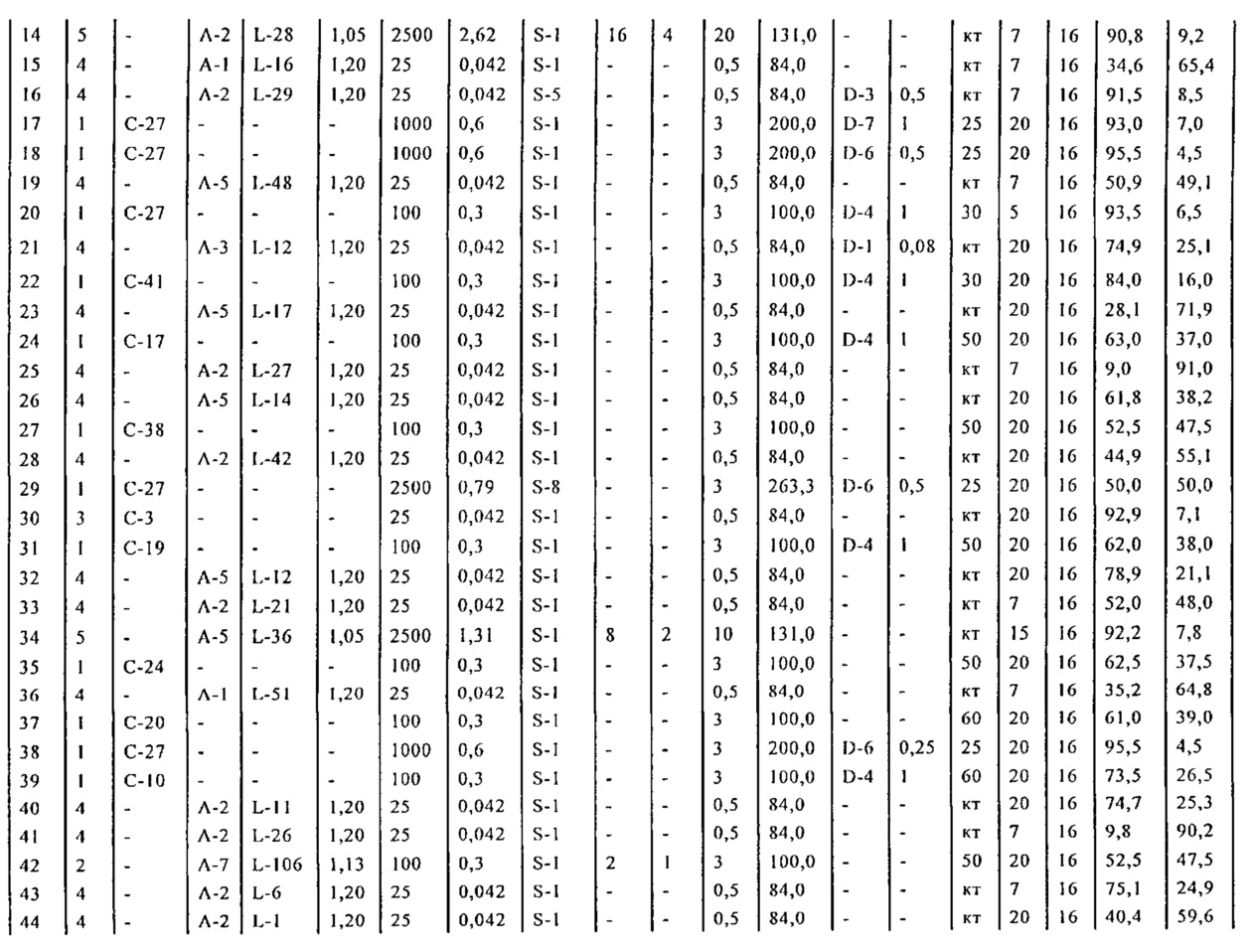
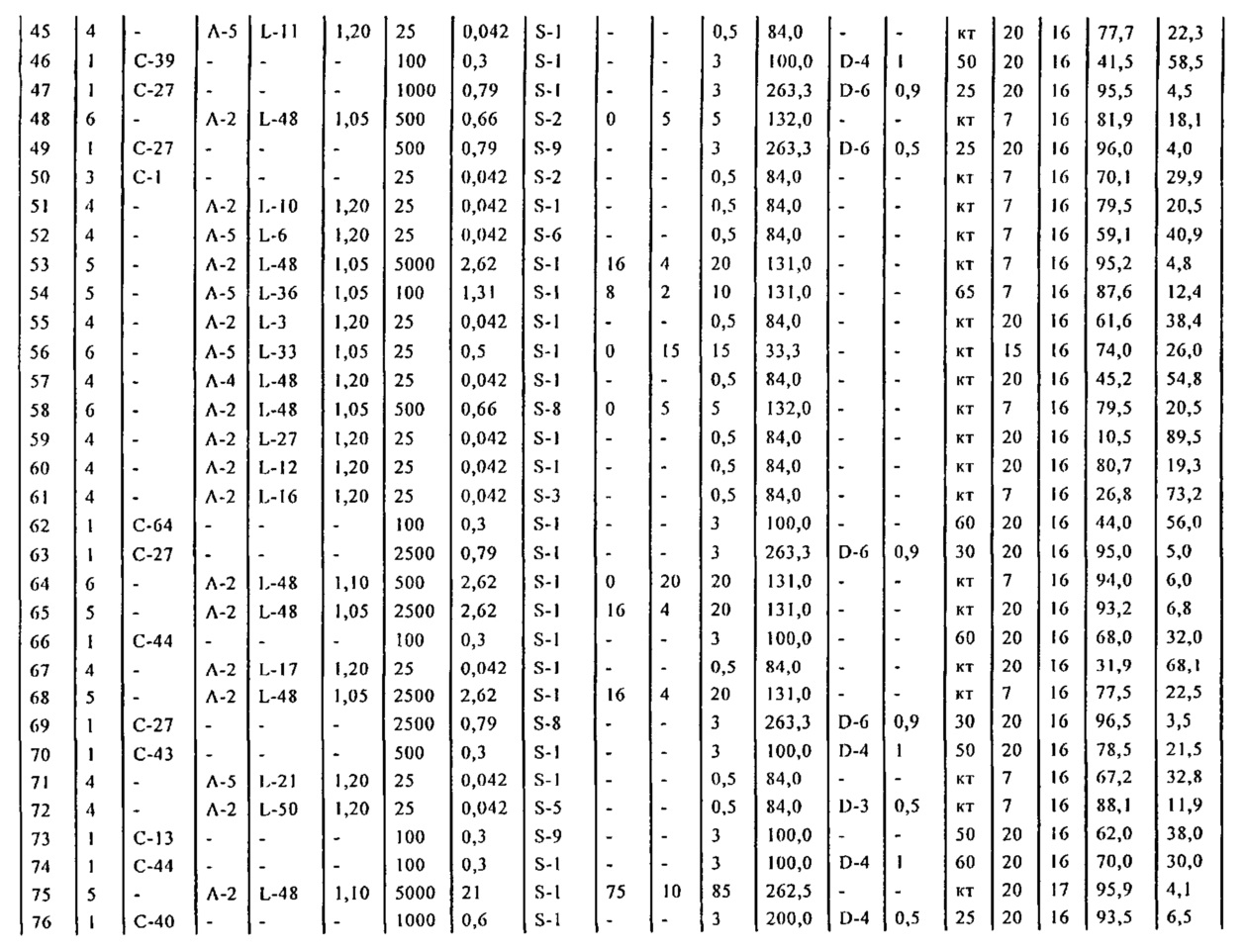
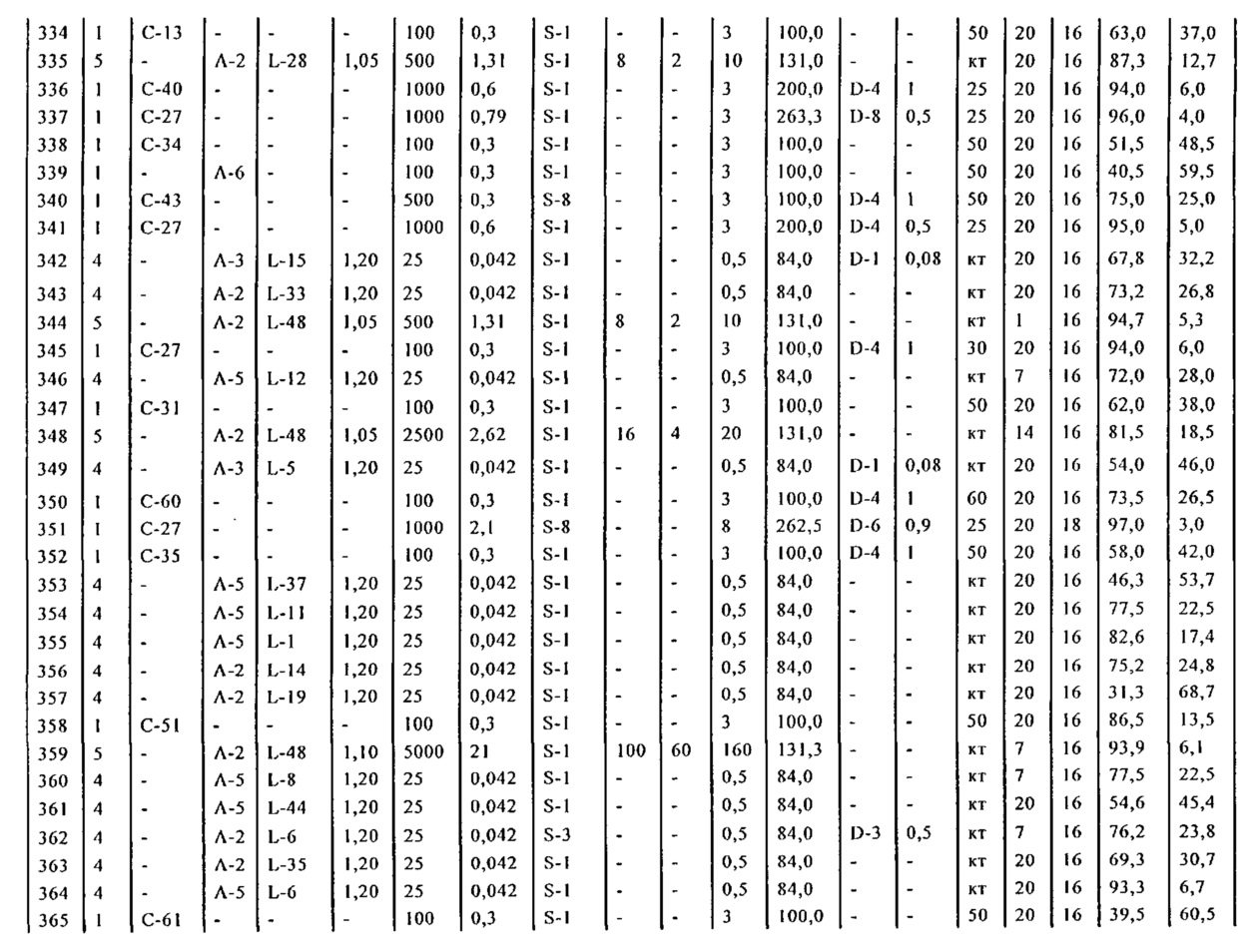
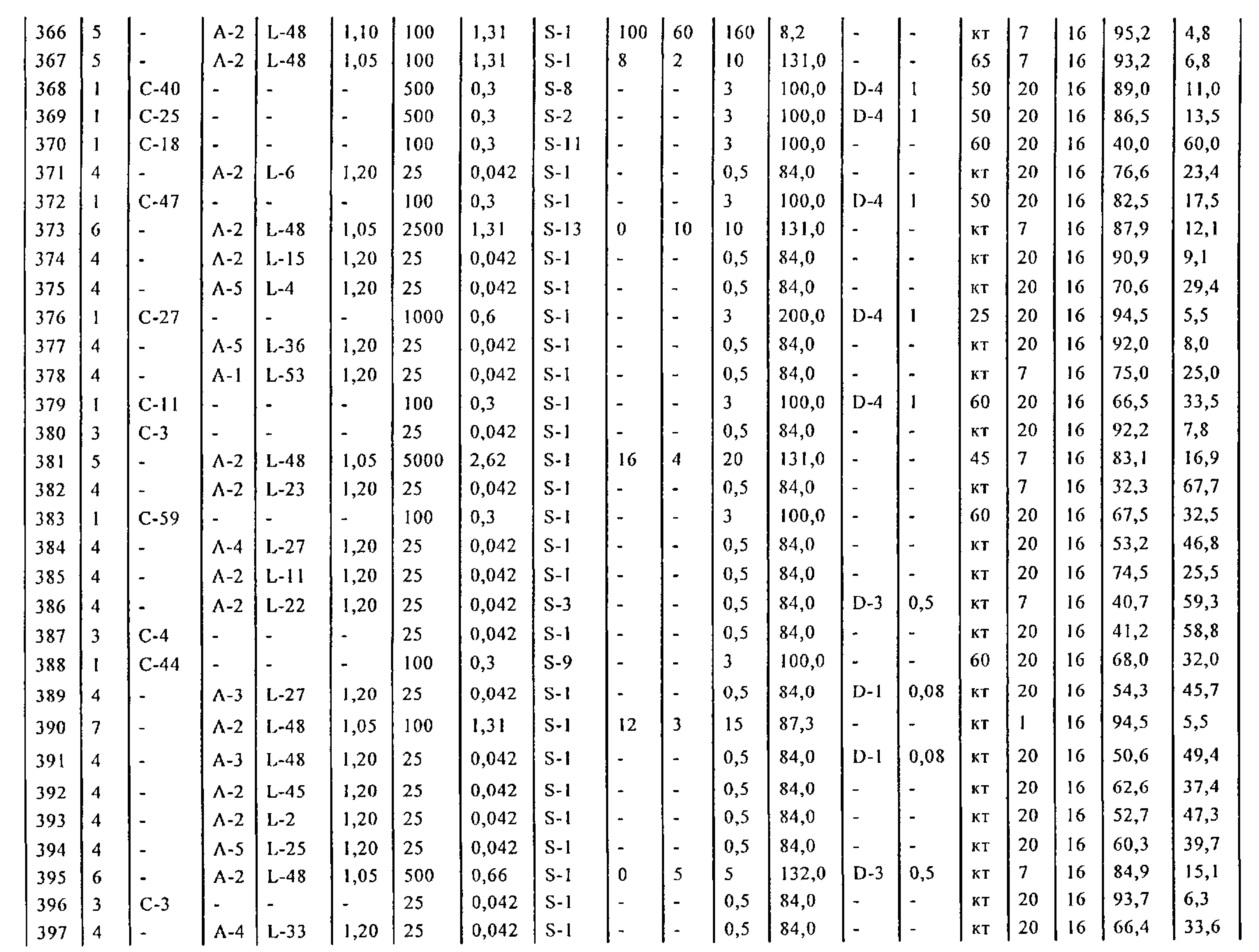
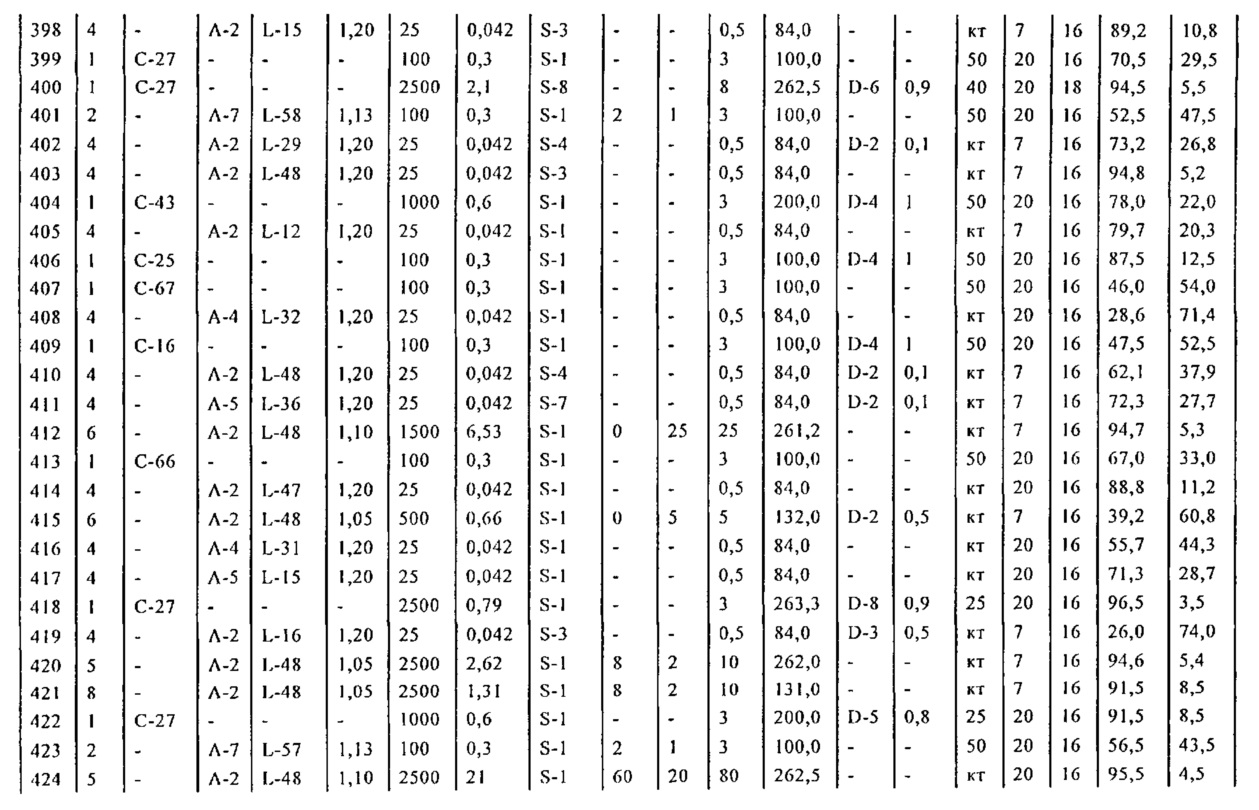
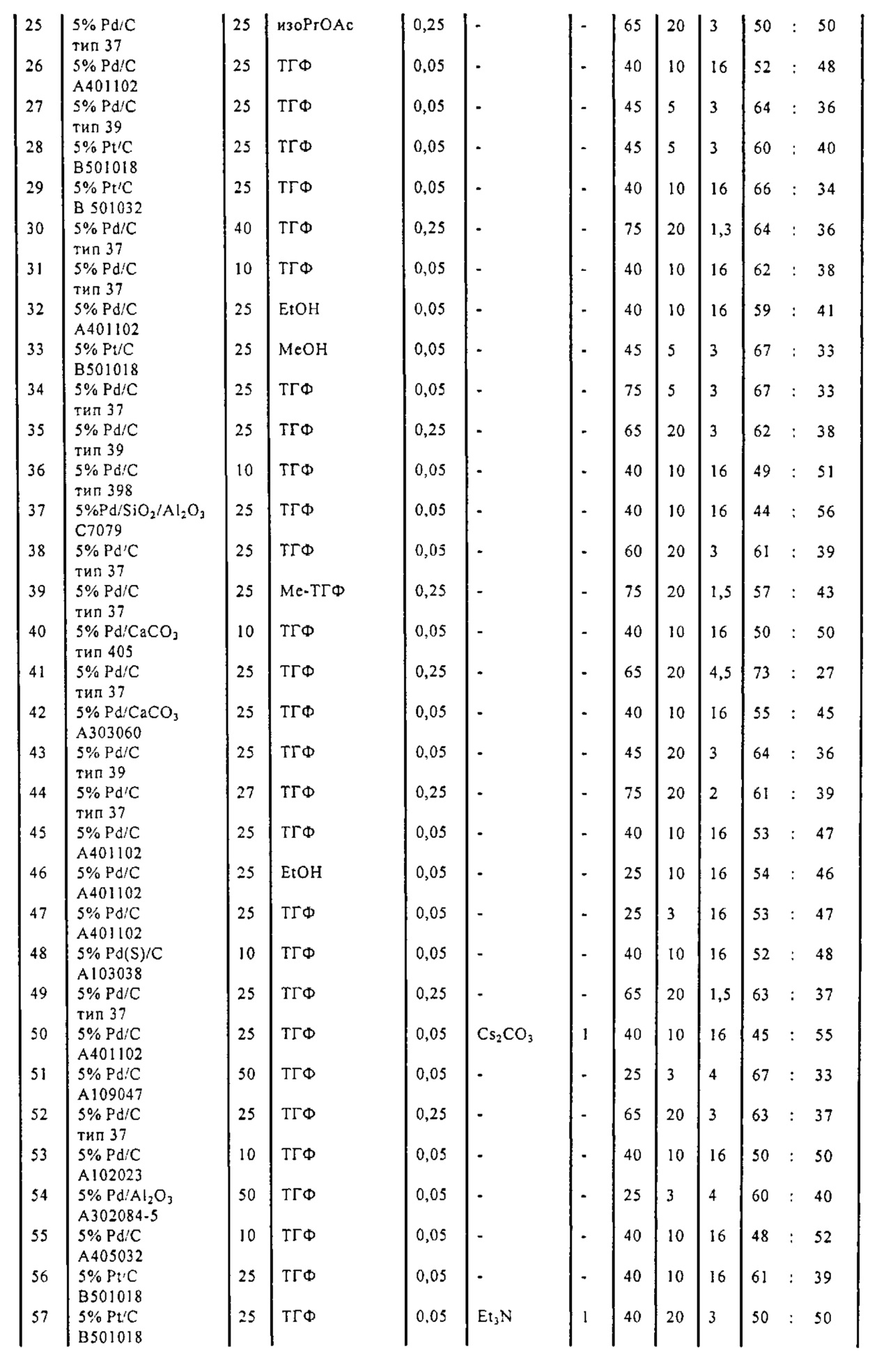
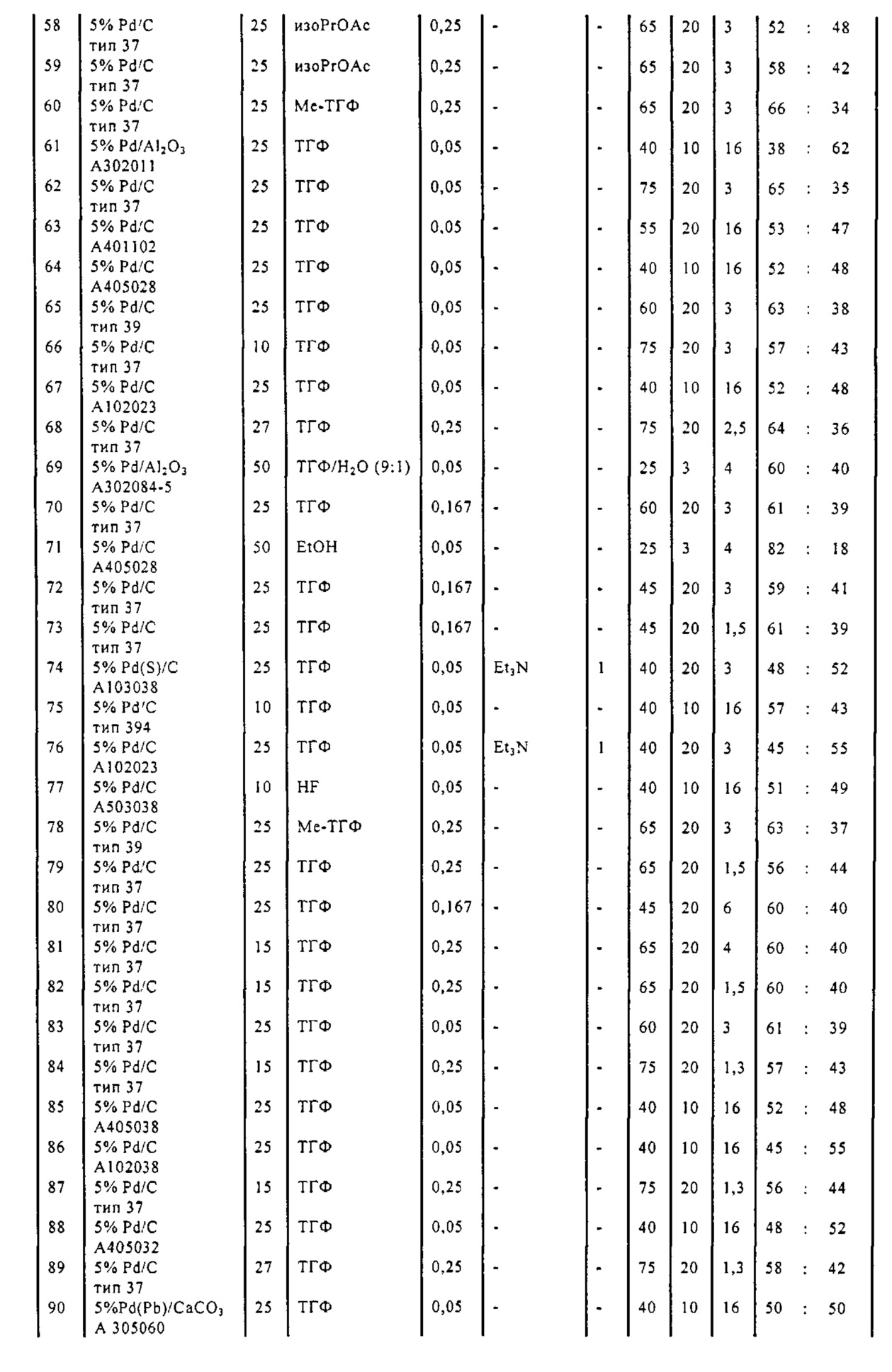
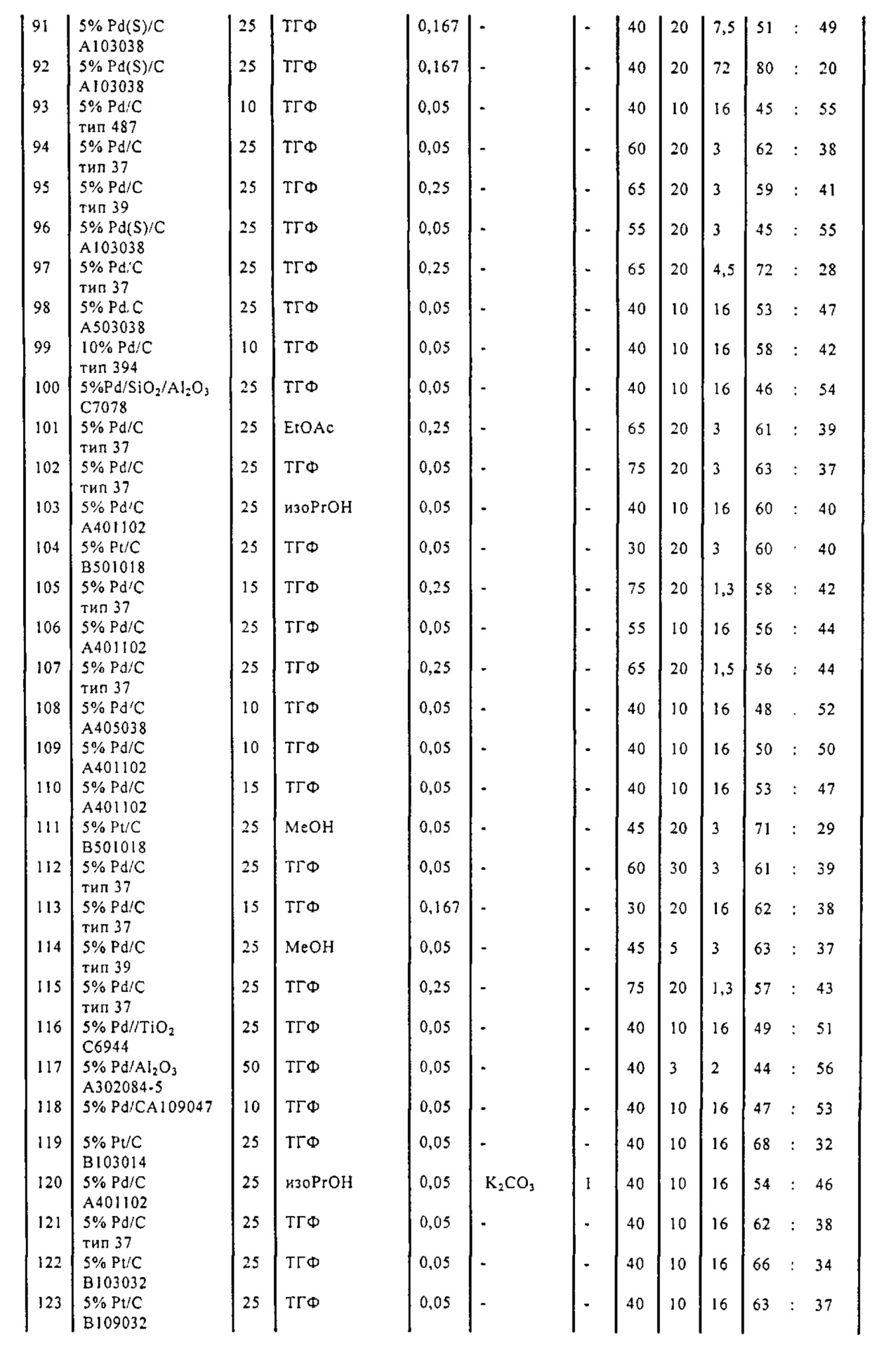
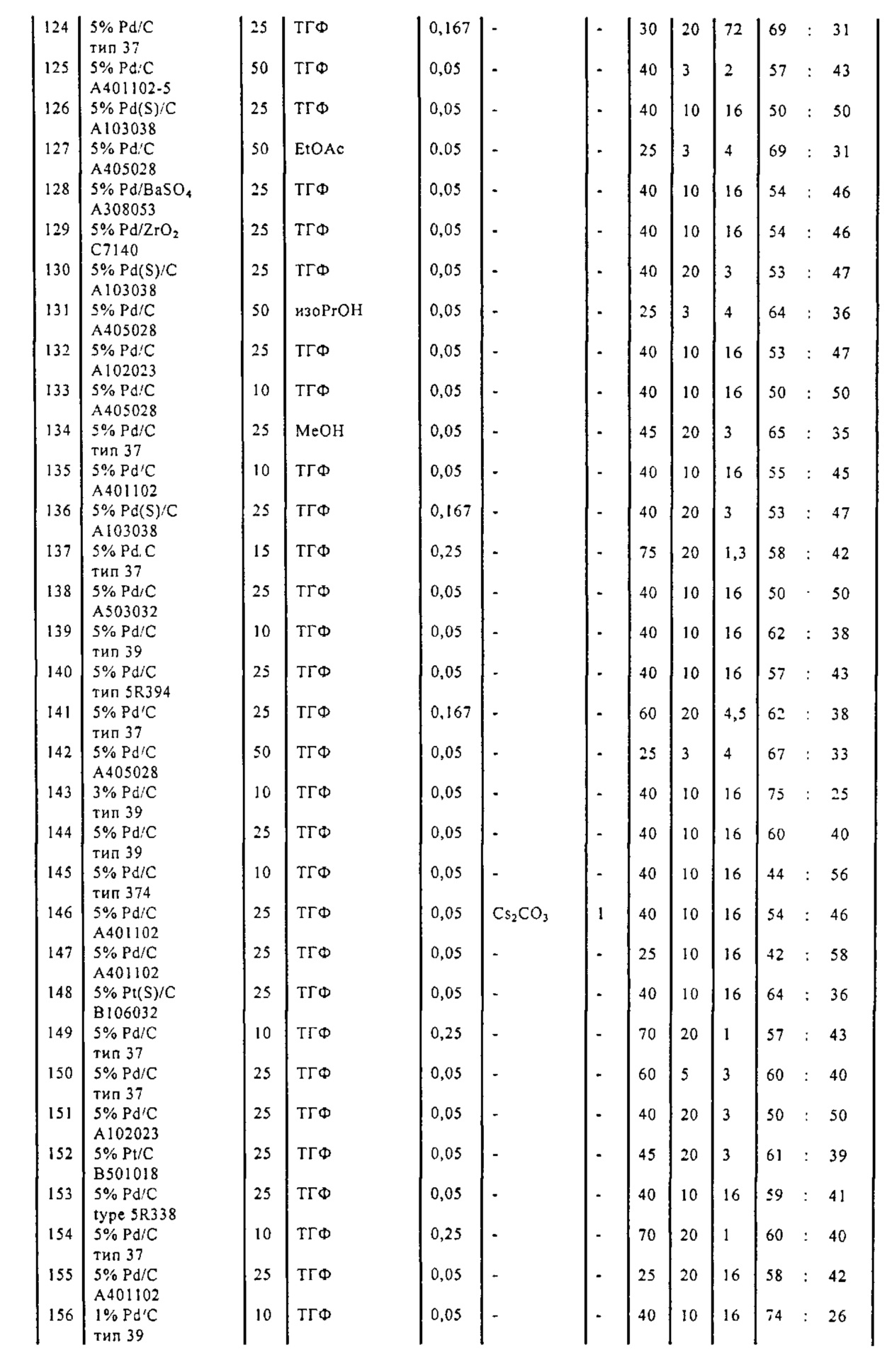
В описанной выше реакции гидрирования может быть важна стереохимия. Так, другим объектом является обеспечение способа получения соединений формул (9-b) и (9-c) или их солей, как определено выше, где молярное соотношение соединений формулы (9-b) или их солей, к соединениям формулы (9-c) или их солям составляет по крайней мере 50 к 50, в частности, по крайней мере 60 к 40, такое как по крайней мере 71 к 29, в частности, по крайней мере 82 к 18. В частности, эта цель может достигаться с помощью катализатора переходного металла, такого как Pd или Pt катализатор; например: палладия на угле, такого как 5% Pd/C (например, 5% Pd/C А401102-5, 5% Pd/C А401102, 5% Pd/C A109047, 5% Pd/C A503038, 5% Pd/C A405028, 5% Pd/C A405038, 5% Pd/C A503023, 5% Pd/C A102023, 5% Pd/C типа 37, 5% Pd/C типа 39, 5% Pd/C типа 394, 5% Pd/C типа 87L), 5% Pd(S)/C [например, 5% Pd(S)/C A103038], 5% Pd/C типа 5R394 или 5% Pd/C типа 5R338), 10% Pd/C (например, 10% Pd/C типа 394 или 10% Pd/C типа 37), 1% Pd/C (например, 1% Pd/C типа 39) или 3% Pd/C (например, 3% Pd/C типа 39); палладия на сульфате бария, такого как 5% Pd/BaSO4 (например, 5% Pd/BaSO4 А 308053); палладия на оксиде алюминия, такого как 5% Pd/Al2O3 (например, 5% Pd/Al2O3 А302084-5); палладия на карбонате кальция, такого как 5% Pd/CaCO3 (например, 5% Pd/CaCO3 А303060); палладия на оксиде циркония, такого как 5% Pd/ZrO2 (например, 5% Pd/ZrO2 С7140); или платины на угле, например, 5% Pt/C (например, 5% Pt/C В103032, 5% Pt/C В103018, 5% Pt/C В103014, 5% Pt/C B104032, 5% Pt/C В501032, 5% Pt/C B109032 или 5% Pt/C B501018) или 5% Pt(S)/C (например, 5% Pt(S)/C B106032); которые являются коммерчески доступными, например, от Johnson Matthey.
Так, другим объектом является обеспечение способа получения соединений формул (9-b) и (9-с) или их солей, как определено выше, где молярное соотношение соединений формулы (9-c) или их солей к соединениям формулы (9-b) или их солям составляет по крайней мере 50 к 50, в частности, по крайней мере 67 к 33. В частности, эта цель может достигаться с помощью катализатора переходного металла, такого как Pd или Pt катализатор; например: палладия на угле, такого как 5% Pd/C (например, 5% Pd/C А401102-5, 5% Pd/C А401102, 5% Pd/C А109047, 5% Pd/C A405028, 5% Pd/C A405032, 5% Pd/C A405038, 5% Pd/C A503023, 5% Pd/C A503032, 5% Pd/C A102023, 5% Pd/C A102038, 5% Pd/C типа 374, 5% Pd/C типа 398, 5% Pd/C типа 87L или 5% Pd/C типа 487), 10% Pd/C (например, 10% Pd/C типа 87L) или 5% Pd(S)/C [например, 5% Pd(S)/C A103038]; палладия на оксиде алюминия, такого как 5% Pd/Al2O3 (например, 5% Pd/Al2O3 А302084-5 или 5% Pd/Al2O3 А302011); палладия на карбонате кальция, такого как 5% Pd/CaCO3 (например, 5% Pd/CaCO3 типа 405) или 5% Pd(Pb)/CaCO3 (например, 5% Pd(Pb)/CaCO3 А305060); палладия на оксиде титана, такого как 5% Pd/TiO2 (например, 5% Pd/TiO2 С6944); палладия на диоксиде кремния/оксиде алюминия, такого как 5% Pd/SiO2/Al2O3 (например, 5% Pd/SiO2/Al2O3 С7078 или 5% Pd/SiO2/Al2O3 С7079); или платины на угле, например, 5% Pt/C (например, 5% Pt/C В501018); которые являются коммерчески доступными, например, от Johnson Matthey.
Раздел Б,3,4:
В одном варианте осуществления, обработка соединения формулы (7) или его соли, как определено выше, восстанавливающим агентом, предпочтительно гидридным восстанавливающим агентом, например, как описано в разделе Б,3,1 или как описано в статье J. Chem. Soc., Perkin Trans 1, 1996, (11), с.1131, может приводить к получению соединения формулы (5) или его соли:
 ,
,
где R1 представляет собой водород или защитную группу для азота,
или приводить к получению смеси соединений формул (4) и (5).
В другом варианте осуществления, обработка соединения формулы (7-а) или его соли, как определено выше, восстанавливающим агентом приводит к получению соединения формулы (5-а) или его соли, как определено выше, предпочтительно формулы (5-b) или его соли, или приводит к получению смеси соединений формул (4-а) и (5-а), предпочтительно смеси соединений формул (4-а) и (5-b).
Раздел Б,3,5:
В другом варианте осуществления, обработка соединения формулы (7) или его соли, как определено выше, восстанавливающим агентом, например, как описано в разделах Б,3,1-Б,3,4, может приводить к получению смеси соединений формул (5) и (6) или их солей, смеси соединений формул (5) и (9) или их солей, смеси соединений формул (6) и (9) или их солей, или смеси соединений формул (5), (6) и (9) или их солей; где каждая смесь может далее содержать соединение формулы (4) или его соль, как определено выше. В предпочтительном варианте осуществления, обработка соединения формулы (7-а) или его соли, как определено выше, восстанавливающим агентом может приводить к получению смеси соединений формул (5-а) и (6-а) или их солей, смеси соединений формул (5-а) и (9-а) или их солей, смеси соединений формул (6-а) и (9-а) или их солей, или смеси соединений формул (5-а), (6-а) и (9-а) или их солей; где каждая смесь далее может включать соединение формулы (4-а) или его соль, как определено выше.
Раздел Б,4:
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4) или его соли:

где R1 представляет собой водород или защитную группу для азота, включающему реакцию соединения формулы (9) или его соли:
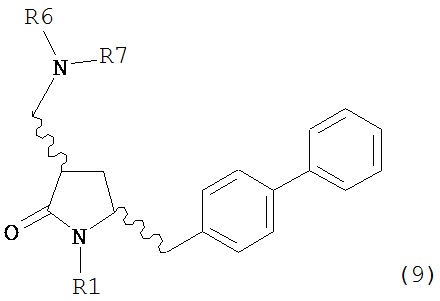
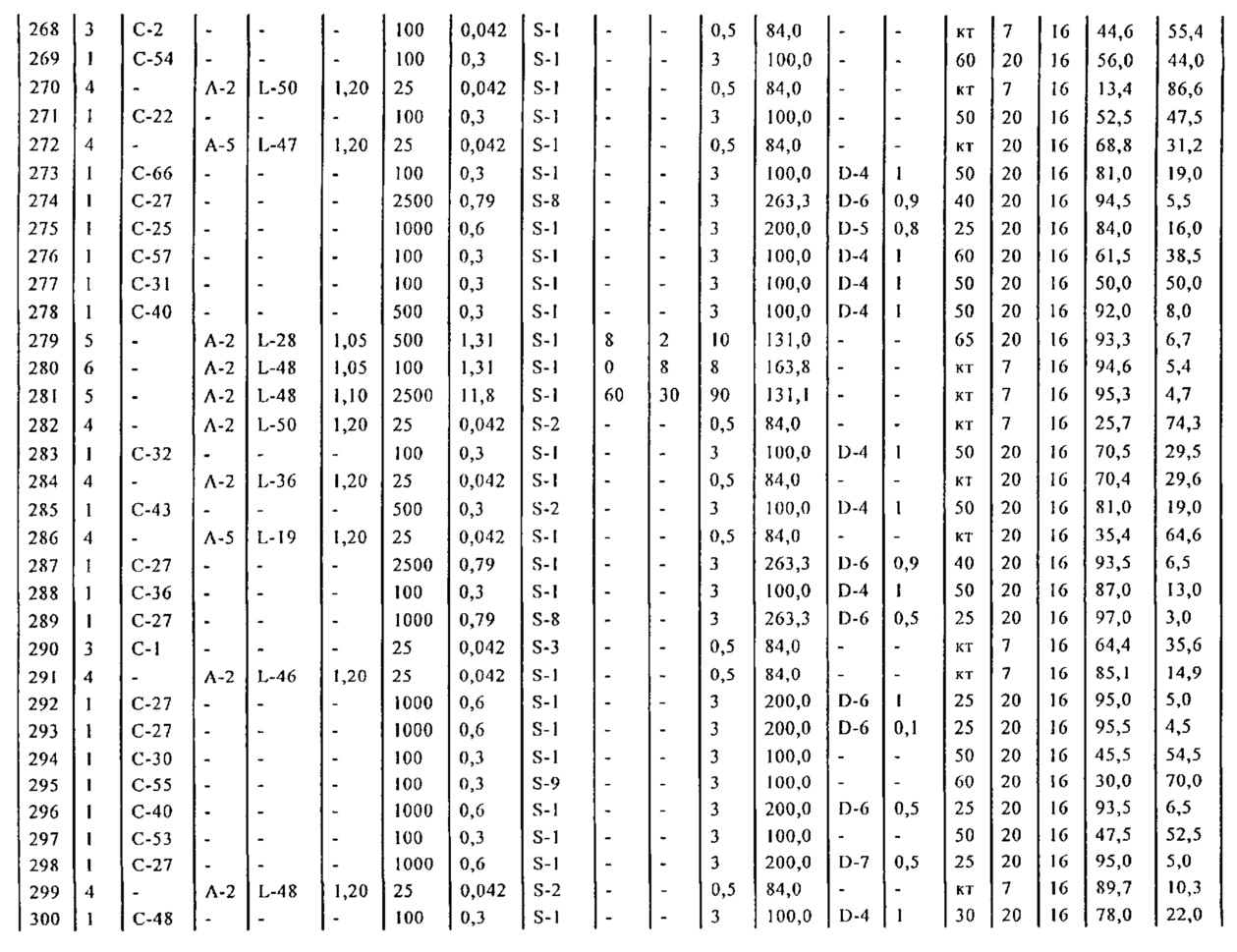
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с кватернизирующим агентом и основанием с получением соединения формулы (4).
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а) или его соли:

где R1 представляет собой водород или защитную группу для азота, включающему реакцию соединения формулы (9-а) или его соли:
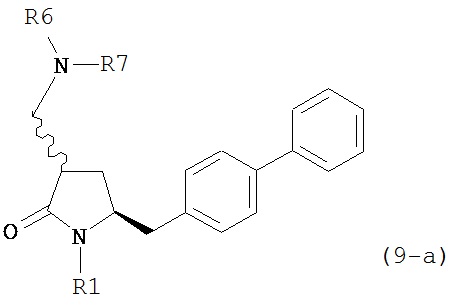
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с кватернизирующим агентом и основанием с получением соединения формулы (4).
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4) или его соли:

где R1 представляет собой водород или защитную группу для азота,
включающему:
а) реакцию соединения формулы (9) или его соли:
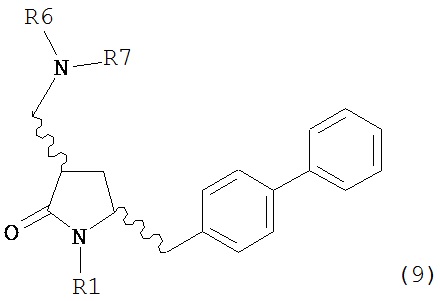
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
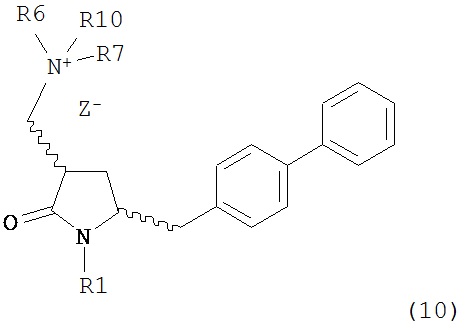
с кватеринизирующим агентом с получением соединения формулы (10) или его соли:
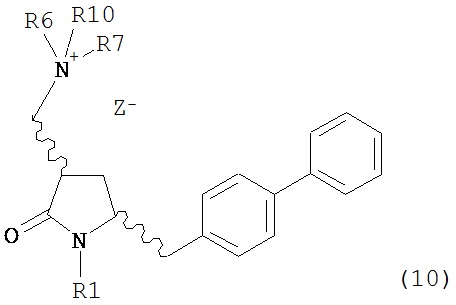
где R1 представляет собой водород или защитную группу для азота, R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, Z- представляет собой галогенид (например, йодид, бромид, хлорид), алкилсульфат (например, метилсульфат) или сульфониловый эфир (например, трифлат) и R10 представляет собой водород, алкил или арил; и
б) реакцию соединения формулы (10) или его соли с основанием с получением соединения формулы (4).
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (4-а) или его соли:

где R1 представляет собой водород или защитную группу для азота, включающему:
а) реакцию соединения формулы (9-а) или его соли:
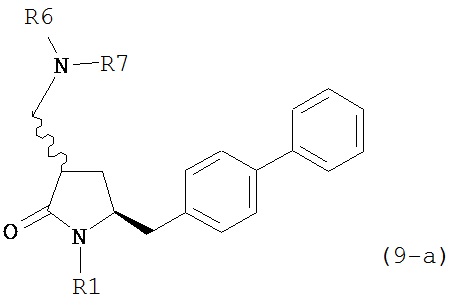
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщеннымили ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с кватеринизирующим агентом с получением соединения формулы (10-а) или его соли:
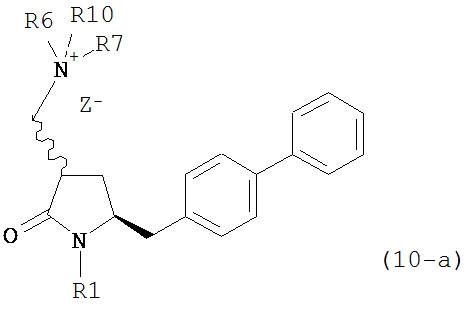
где R1 представляет собой водород или защитную группу для азота, R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, Z- представляет собой галогенид (например, йодид, бромид, хлорид), алкилсульфат (например, метилсульфат) или сульфониловый эфир (например, трифлат) и R10 представляет собой водород, алкил или арил; и
б) реакцию соединения формулы (10-а) или его соли с основанием с получением соединения формулы (4-а).
Стадии а) и б) как таковые также являются предпочтительными вариантами осуществления настоящего изобретения.
Термин кватеринизирующий агент относится к любому агенту, который способен превратить третичный амин в четвертичный амин, например, алкилгалогенид (такой как метилйодид, метилбромид, метилхлорид, этилхлорид, этилбромид или этилйодид), диалкилсульфат (такой как диметилсульфат), сульфонат (такой как 4-метилсульфонилтолуол и метилтрифлат) или соединение формулы (R10)3O+Z-, где R10 представляет собой алкил (такой как метил или этил), и Z- представляет собой тетрафторборат или гексафторфосфат. Более предпочтительно, алкилирующий реагент представляет собой метилйодид или диметилсульфат.
Предпочтительными основаниями на стадии б) являются, например, амины, такие как триэтиламин, пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Также предпочтительными является ионное основание, такое как карбонат щелочного металла (например, карбонат натрия, карбонат калия и карбонат цезия), гидрид щелочного металла (например, NaH), гидрокарбонат щелочного металла (например, NaHCO3). Более предпочтительно основание представляет собой NaHCO3.
Реакция для превращения соединения формулы (9) в соединение формулы (4) предпочтительно 'постадийна' в том смысле, что соединение (9) кватернизируют, и затем обрабатывают основанием.
Раздел Б,5:
Раздел Б,5,1:
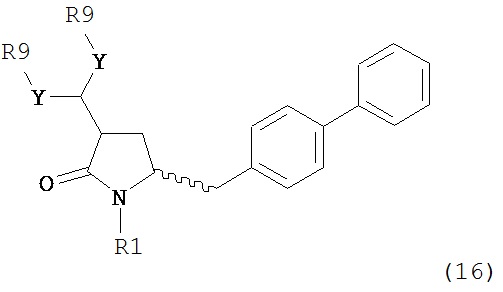
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (16):
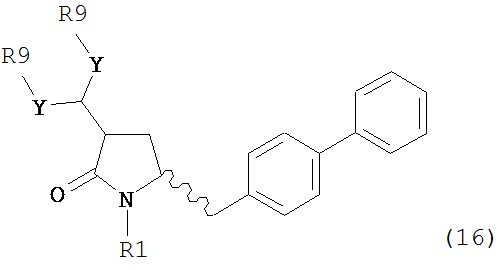
или его соли,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют от 4- до 7-, предпочтительно 5-6-членное ацетальное кольцо,
включающему обработку соединения формулы (7):
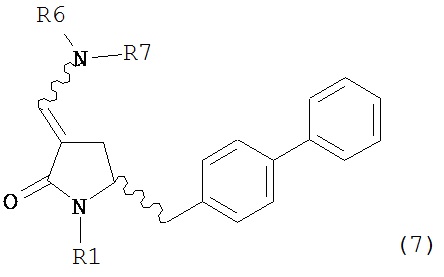
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
ацетальобразующим агентом с получением соединения формулы (16).
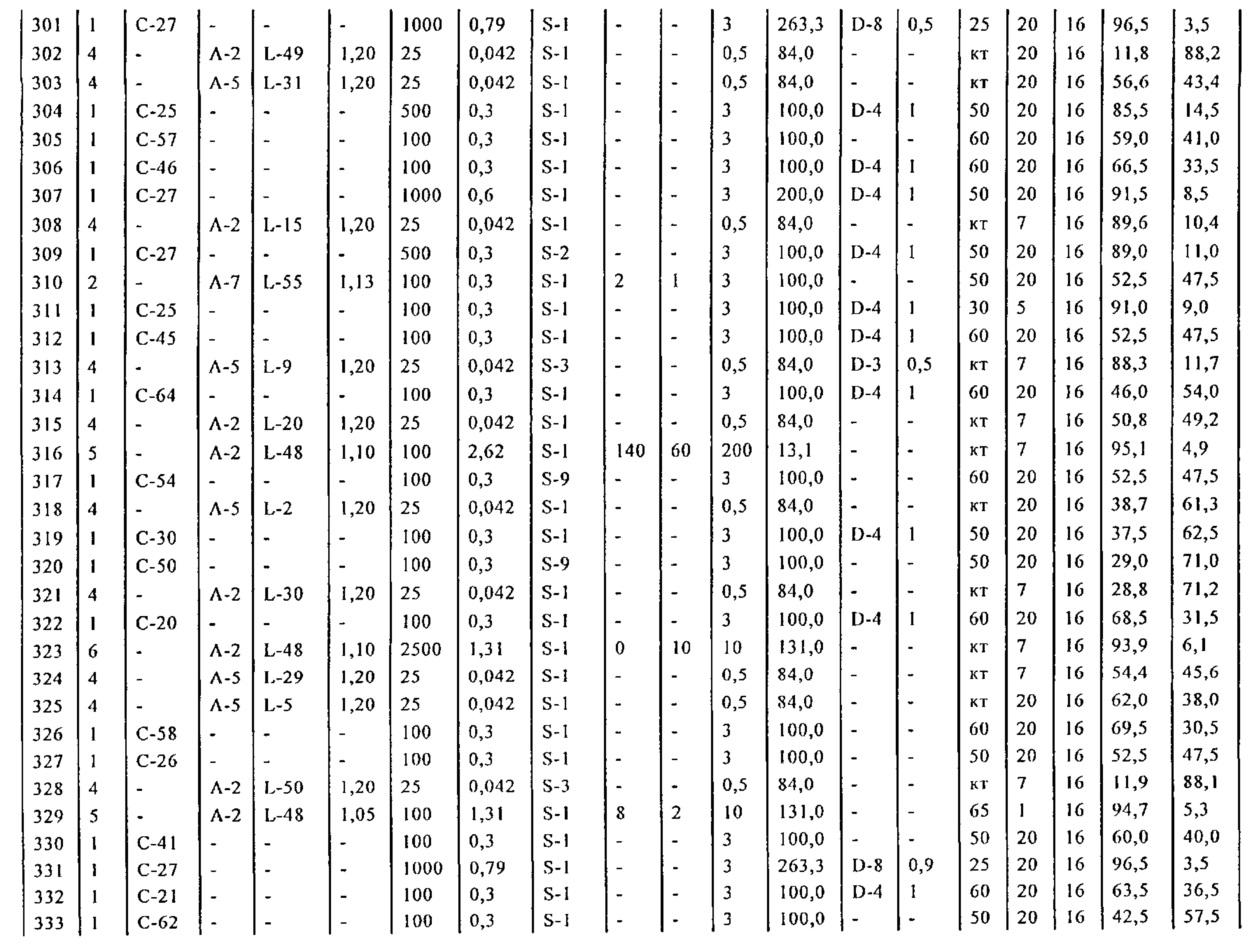
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (16-а):
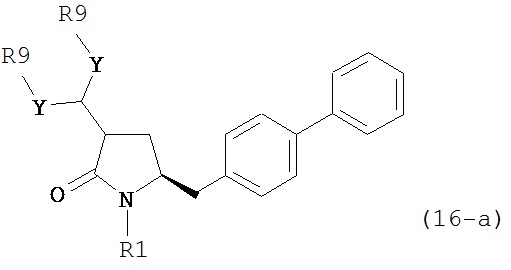
или его соли, где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
включающему обработку соединения формулы (7-а):
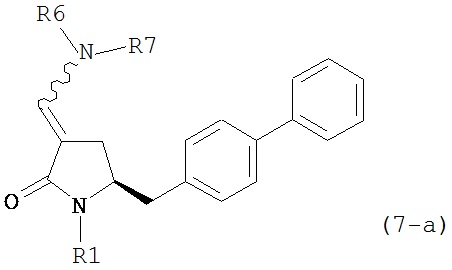
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
ацетальобразующим агентом с получением соединения формулы (16-а). В предпочтительном варианте осуществления, исходное соединение формулы (7-а) или его соль соответствует формулам (7b) или (7с) или их солям, как определено выше, предпочтительно формуле (7-b).
Предпочтительными "ацетальобразующими" агентами являются спирты (например, метанол, этанол, изопропанол), диол (например, этиленгликоль, 1,3-пропандиол) или триалкилортоформиат (например, диметилортоформиат). Обычно реакцию осуществляют в присутствии кислоты, например, кислоты Бренстеда (такой как хлористоводородная кислота, серная кислота) или сульфоновой кислоты (такой как 4-толуолсульфоновая кислота). Кислоты на смолах, таких как Amberlyst-15®, также являются подходящими кислотами. Условия, в которых кислота образуется in situ (например, ацетилхлорид), также являются подходящими. Предпочтительно, кислоту используют в каталитических количествах. Предпочтительно используется минеральная кислота, такая как хлористоводородная кислота, предпочтительно в присутствии спирта, предпочтительно метанола или этанола. Другие примеры предпочтительных "ацетальобразующих" реагентов описаны, например, в соответствующих главах стандартных ссылок, таких как P.G.М. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007.
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (16):

или его соли,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное тиоацетальное кольцо,
включающему обработку соединения формулы (7):
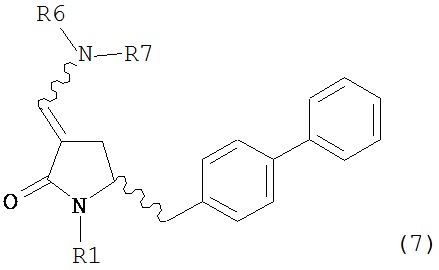
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
тиоацетальобразующим агентом с получением соединения формулы (16).
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (16-а):

или его соли, где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное тиоацетальное кольцо,
включающему обработку соединения формулы (7-а):
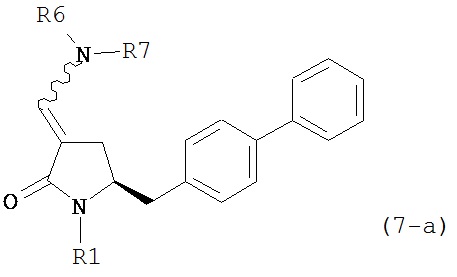
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с тиоацетальобразующим агентом с получением соединения формулы (16-а). В предпочтительном варианте осуществления, исходное соединение формулы (7-а) или его соль соответствует формулам (7b) или (7с) или их солям, как определено выше, предпочтительно формуле (7-b).
Предпочтительными "тиоацетальобразующими" агентами являются тиолы (например, метантиол, этантиол, тиофенол) или дитиол (например, 1,2-этандитиол, 1,3-пропандитиол). Обычно реакцию осуществляют в присутствии кислоты, например, кислоты Бренстеда (такой как хлористоводородная кислота), кислоты Льюиса (такой как трифторид бора или тетрахлорид титана) или кислоты на твердом носителе (таком как Amberlyst-15®). Условия, в которых кислота образуется in situ (например, комплекс диметилсульфид-бром) также являются подходящими. Предпочтительно кислота используется в каталитических количествах. Другие примеры предпочтительных "тиоацетальобразующих" реагентов описаны, например, в соответствующих главах стандартных источников, таких как книга P.G.М. Wins и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007.
Раздел Б,5,2:
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6) или его таутомера:
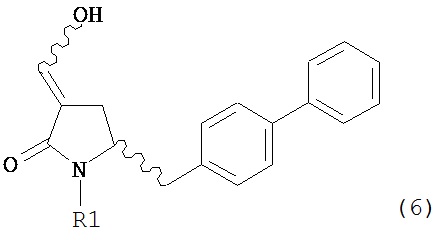
или его соли, где R1 представляет собой водород или защитную группу для азота,
включающему удаление ацетальной группы в соединении формулы (16) или его соли:

где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
с получением соединения формулы (6).
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6-а) или его таутомера:
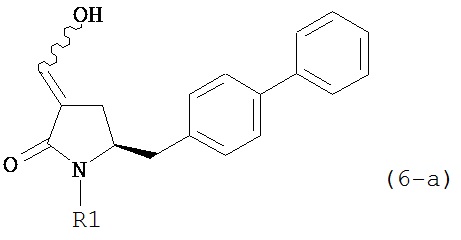
или его соли, где R1 представляет собой водород или защитную группу для азота,
включающему удаление ацетальной группы в соединении формулы (16-а) или его соли,

где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
с получением соединения формулы (6-а).
Подходящие условия для удаления ацетальной группы включают гидролиз, например, использование кислоты в присутствии воды. Подходящие кислоты включают кислоты Бренстеда (такие как хлористоводородная кислота, уксусная кислота, трифторуксусная кислота, щавелевая кислота), кислоты Льюиса (такие как трихлорид железа), сульфоновые кислоты (такие как 4-толуолсульфоновая кислота), или условия, которые приводят к получению кислоты in situ (например, йод), как определено выше. Другие условия включают гидрирование (например, Pd/C) [например, арилалкил, такой как в случаях, когда R9 представляет собой арилалкил] или основание (такое как гидроксид натрия или карбонат калия [например, диацетилацетали, такие как в случаях, когда R9 представляет собой ацетильную группу, например, алкилацетильную группу [R9=-С(=O)алкил], такое как метилацетил [R9=-С(=O)CH3]. Другие примеры предпочтительных агентов для удаления ацетальных групп описаны, например, в соответствующих главах стандартных источников, таких как книга P.G.М. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007.
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6) или его таутомера:
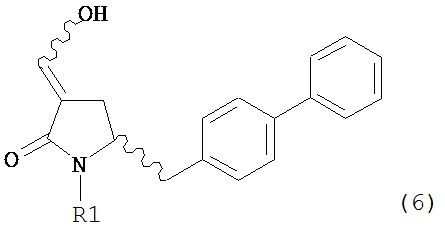
или его соли, где R1 представляет собой водород или защитную группу для азота,
включающему удаление тиоацетальной группы в соединении формулы (16) или его соли:

где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное тиоацетальное кольцо,
с получением соединения формулы (6).
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (6-а) или его таутомера:

или его соли, где R1 представляет собой водород или защитную группу для азота,
включающему удаление ацетальной группы в соединении формулы (16-а) или его соли:

где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
с получением соединения формулы (6-а).
Это удаление тиоацетальной группы проводят предпочтительно обработкой кислотой Льюиса или окислением. Кислоты Льюиса (такие как перхлорат серебра, трихлорид железа) или окисляющие агенты {такие как йод, 2,3-дихлор-5,6-дициано-n-бензохинон (DDQ), пероксиды, [бис(трифторацетокси)йод]бензол или алкилирующие агенты (такие как метилйодид в присутствии воды) или соли ртути(II) (такие как дихлорид ртути, перхлорат ртути, оксид ртути)}. Другие примеры предпочтительных агентов для удаления тиоацетальных групп описаны, например, в соответствующих главах стандартных источников, таких как книга P.G.М. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007.
Раздел В: Превращение соединения формулы (7) в соединение формулы (1) через соединение формулы (2)
Способы в соответствии с настоящим изобретения превращения соединения формулы (7), как здесь определено, в соединение формулы (1), как здесь определено, приведены на схеме 4.
Схема 4
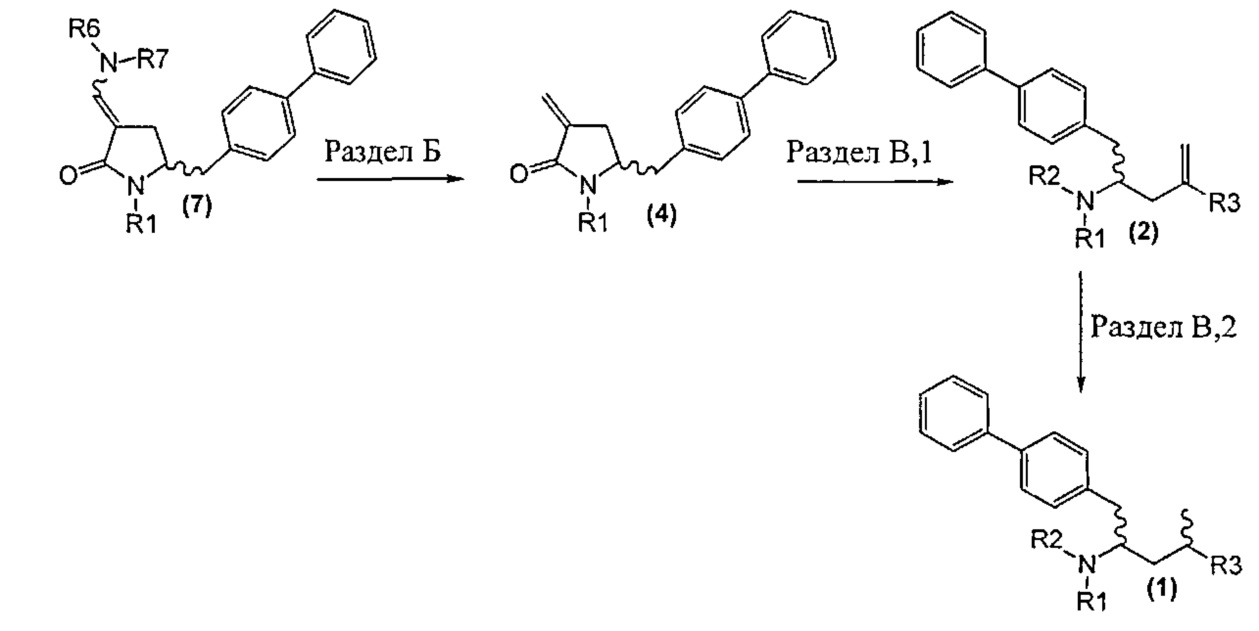
Так, в другом варианте осуществления настоящее изобретение относится к способу превращения соединения формулы (7), как здесь описано, в соединение формулы (1), как здесь описано, включающему:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (4),
б) любой один из способов раздела В,1 для превращения соединения (4) в соединение (2), и
в) любой один из способов раздела В,2 для превращения соединения (2) в соединение (1).
Как описано далее, разделы В,1 и В,2 как таковые также являются предпочтительными вариантами осуществления настоящего изобретения.
Раздел В,1: Раскрытие кольца соединения формулы (4)
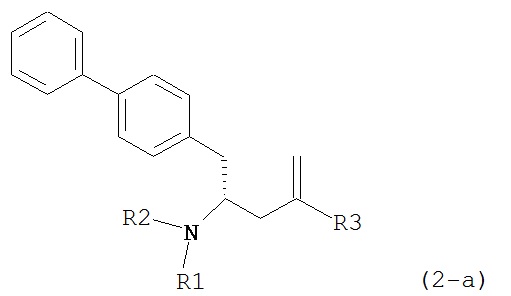
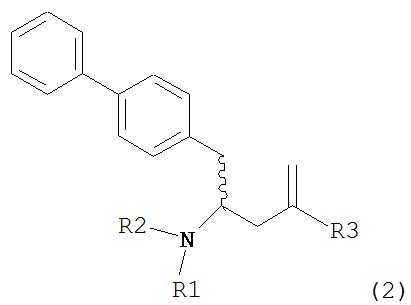
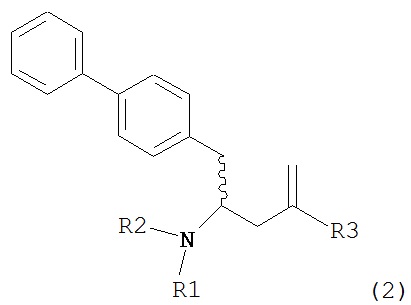
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (2):
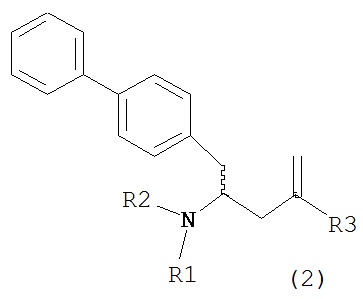
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, включающему реакцию соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, с лактамным агентом для раскрытия кольца с получением соединения формулы (2).
В предпочтительном варианте осуществления, соединение формулы (4-а):

или его соль,
где R1 представляет собой водород или защитную группу для азота, обрабатывают лактамным агентом для раскрытия кольца с получением соединения формулы (2-а):
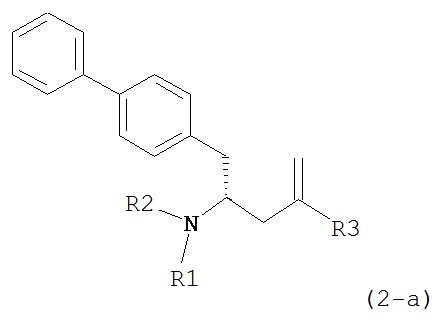
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу.
Примерами лактамных агентов для раскрытия кольца являются нуклеофильные основания, такие как гидроксиды щелочного металла (например, гидроксид натрия или гидроксид лития), нейтральные соединения, такие как гидропероксиды (такие как гидропероксид лития) и кислоты. Кислотами являются, например, кислоты Льюиса или Бренстеда, минеральные кислоты, такие как серная, перхлорная и хлористоводородная кислота, сульфоновые кислоты, такие как пара-толуолсульфоновая кислота или кислоты на полимере, таком как Amberlyst®. Предпочтительно, хлористоводородная кислота используется в качестве лактамного агента для раскрытия кольца. Предпочтительно кислоты используют в присутствии воды или спирта (такого как метанол или этанол). Лактамный агент для раскрытия кольца может использоваться каталитически или стехиометрически. Предпочтительно, лактамный агент для раскрытия кольца используется в количестве от 1 до 10 эквивалентов.
Раздел В,2: Восстановление соединения формулы (2)
Объект настоящего изобретения относится к способу получения соединения формулы (1):
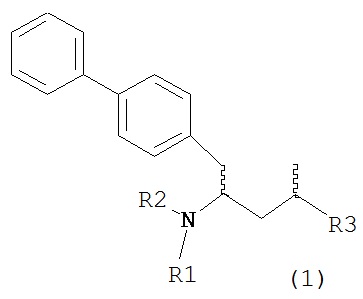
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, включающую восстановление соединения формулы (2):
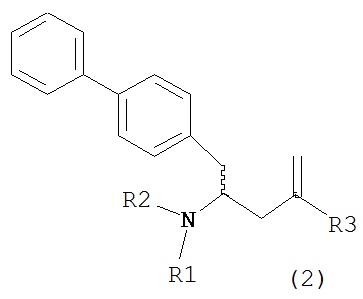
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, с получением соединения формулы (1). В частности, R3 представляет собой карбоксильную группу, этиловый эфир или метиловый эфир.
Предпочтительно, соединение формулы (2-а) или его соль:
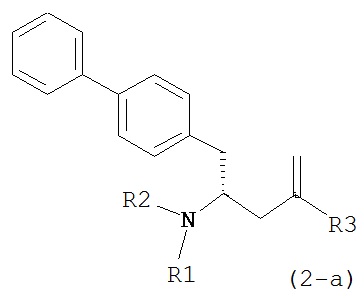 ,
,
где R1, R2 и R2 являются такими, как определено выше, используют в качестве исходного соединения. Если соединение (2-а) или его соль используют в качестве исходного соединения, соединения формулы (1-а):
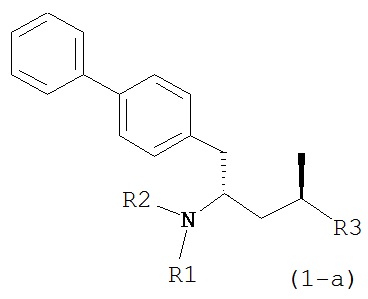 ,
,
и формулы (1-b):
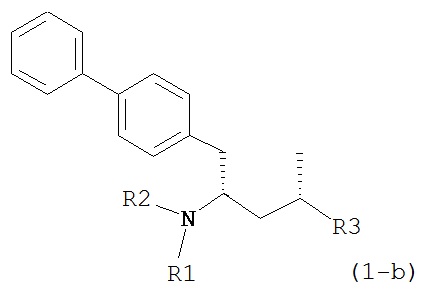
или их соли, где R1, R2 и R3 являются такими, как определено выше, могут быть получены. В предпочтительном варианте осуществления R1=Boc и/или R2=H. В другом предпочтительном варианте осуществления, R3=CO2H или CO2Et или CO2- (карбоксилат). Наиболее предпочтительно R3=CO2H.
В частности, группа R3 соединений формулы (1) или (2), предпочтительно формулы (1-а) или (2-а), представляет собой CO2H, CO2Et или CO2Me.
В одном варианте осуществления, соли соединений формул (1-а) или (1-b) образуются (например, R3=CO2-) в условиях, применяемых в соответствии с настоящим изобретением. Эти соли затем необязательно могут подвергаться гидролизу с получением свободной кислоты. Предпочтительными солями являются соли щелочных металлов (Li, Na, K) или амины (например, диизопропилэтиламин, триэтиламин).
В предпочтительном варианте осуществления, восстановление соединения формулы (2) или его соли, предпочтительно формулы (2-а), протекает в атмосфере водорода в присутствии катализатора переходного металла, предпочтительно в присутствии катализатора переходного металла, включающего металлоорганический комплекс и хиральный лиганд. Восстановление может осуществляться в условиях гетеро- или гомогенного гидрирования, предпочтительно в условиях гомогенного гидрирования. В одном варианте осуществления, гетеро- или гомогенное гидрирование осуществляют в присутствии основания, такого как основания амина (например, триэтиламин, изоPr2EtN или 1,4-диазабицикло[2.2.2]октан) или основания щелочного металла (например, LiOH, NaOH или KOH). В одном варианте осуществления, гетерогенное гидрирование осуществляют в присутствии щелочного металла, в частности, в спиртовом растворителе (например, изоPrOH, EtOH, МеОН); например, KOH в этаноле. В другом варианте осуществления, гидрирование, в частности гомогенное гидрирование, осуществляют в присутствии кислоты, такой как метансульфоновая кислота или тетрафторборная кислота.
Обычно, гетерогенное гидрирование осуществляют в присутствии катализатора переходного металла, где переходный металл выбран из группы 9 или 10 периодической таблицы. Следовательно, катализатор переходного металла включает, например, кобальт (Co), родий (Rh), иридий (Ir), никель (Ni), палладий (Pd) и/или платину (Pt). В частности, катализатор переходного металла представляет собой Pt, Pd или Rh на твердом носителе, таком как уголь. В одном варианте осуществления катализатор переходного металла представляет собой Pd на угле.
Гетерогенное гидрирование обычно осуществляют в растворителе, таком как простые эфирные растворители (например, ТГФ), сложноэфирные растворители (например, изопропилацетат) или спиртовые растворители (например, изопропанол, этанол или метанол); в частности изопропилацетат и этанол.
Обычно, гомогенное гидрирование осуществляют в присутствии катализатора переходного металла, где переходный металл выбран из группы 7, 8 или 9 периодической таблицы. Следовательно, катализатор переходного металла включает, например, переходный металл марганец (Mn), рений (Re), железо (Fe), рутений (Ru), осмий (Os), кобальт (Co), родий (Rh) и/или иридий (Ir).
В предпочтительном варианте осуществления, катализатор переходного металла включает металлоорганический комплекс и хиральный лиганд.
Металлоорганический комплекс включает переходный металл, выбранный из группы 7, 8 или 9 периодической таблицы, например, переходный металл родий, иридий или рутений, в частности, родий или рутений. Металлоорганический комплекс, содержащий родий, является особенно подходящим.
Металлоорганические комплексы могут включать один атом переходного металла. В предпочтительных вариантах осуществления комплекс может включать два или более атомов переходного металла, необязательно включающих связь металл-металл. В предпочтительном варианте осуществления два атома металла связаны через два галогенида. Обычно, металлоорганический комплекс включает один или несколько атомов переходного металла и подходящие ахиральные лиганды.
Подходящими ахиральными лигандами для металлоорганического комплекса обычно являются σ-донорные лиганды, σ-донорные/π-акцепторные лиганды или σ,π-донорные/π-акцепторные лиганды. Примерами подходящих ахиральных лигандов являются среди прочего моноксид углерода, галогениды (например, Cl, I или Br), фосфины [например, трициклогексилфосфин (PCy3)], алкенилы (например, cod, nbd, 2-металлил), алкинилы, арилы (например, пиридин, бензол, п-цимен), карбонилы (например, acac, трифторацетат или диметилформамид) и их смеси.
Примерами предпочтительных ахиральных лигандов для металлоорганического комплекса являются: норборнадиен (nbd), циклооктадиен (cod), пиридин (pyr), цимен, в частности п-цимен, и йодид.
Примерами металлоорганических комплексов являются: металлоорганический комплекс рутения, такой как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2]; металлоорганический комплекс родия, такой как [Rh(nbd)2BF4] или [Rh(cod)2]BF4; или металлоорганический комплекс иридия, такой как [(Cy3P)Ir(pyr)]Cl, [Ir(cod)2]BArF или [Ir(cod)2Cl]2; в частности [Ru(cod)(2-металлил)2], [Ru(cod)(OOCCF3)2] или [RuI2(п-цимен)]2; в частности [Rh(NBD)2]BF4, [Ru(COD)(OOCCF3)2] или [RuCl2(п-цимен)2].
В одном варианте осуществления металлоорганический комплекс представляет собой [Rh(nbd)2]BF4 {=Бис(норборнадиен)родия(I) тетрафторборат}.
В другом варианте осуществления, металлоорганический комплекс представляет собой [RuI2(п-цимен)]2 (=дийод(п-цимен)рутения(II) димер):
Обычно, термин "хиральный лиганд" включает любой лиганд, который подходит для построения хиральных металлоорганических комплексов, и который включает хиральный центр. Катализатор переходного металла включает металлоорганический комплекс и хиральный лиганд. Хиральный лиганд включает, например, хиральный фосфин и/или хиральный ферроцен. В частности, хиральный ферроцен включает Ср (циклопентадиенильную) группу, которая замещена хиральной группой, такой как хиральный амин, хиральный фосфин или хиральный алкил, например, как здесь описано.
В первом варианте осуществления, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 96 к 4, наиболее предпочтительно по крайней мере 99 к 1.
В одном варианте осуществления, катализатор переходного металла включает металлоорганический комплекс и хиральный лиганд, такой как лиганд Fenphos, лиганд Josiphos, лиганд Mandyphos, лиганд Walphos, лиганд Taniaphos, лиганд Phospholane, лиганд Atropisomer, лиганд BoPhoz, лиганд QUINAPHOS или их смеси; в частности хиральный лиганд выбран из группы, состоящей из лиганда Fenphos, лиганда Josiphos, лиганда Mandyphos, лиганда Walphos, лиганда Taniaphos, лиганда Phospholane, лиганда Atropisomer или их смесей.
Лиганды Josiphos, лиганды Walphos, лиганды Taniaphos, лиганды Mandyphos, лиганды Fenphos, лиганды Phospholane, лиганды Atropisomer и лиганды BoPhoz имеют формулы:
Josiphos:
Walphos:
Taniaphos:
Mandyphos:
Fenphos:
Atropisomer:
Phospholane:
где R, R' и R'', например, являются такими, как описано в источниках WO 2006/003196, ЕР-В1-612758, WO 2006/017045, WO 2006/117369, WO 2007/116081, WO 2006/075166, WO 2008/101868, WO 2006/117369, WO 2004/099226, EP 0967015, WO 2004099226, EP 0967015, Chem. Eur. J., 2002, 8, с.843, WO 2005/108409, WO 2005/056568, EP 1582527, US 5171892, J. Am. Chem. Soc, 1991, 113, с.8518, WO 9315091, EP 398132, EP 646590, WO 9521151, ЕР 612758, ЕР 564406, WO 2002/002578, Chem. Rev., 2003, 103 (8), с.3029 и указанных в них ссылках, и в частности как описано здесь в примерах.
BoPhoz:
где R8 и R9, например, являются такими, как описано в статьях: Boaz, N.W.; Debenham, S.D.; Mackenzie, E.В.; Large, S.E. Org. Lett. 2002, 4, c. 2421; Boaz, N.W.; Debenham, S.D.; Large, S.E.; Moore, M.K. Tetrahedron: Asymmetry, 2003, 14, c.3575; Jia, X.; Li, X.; Lam, W.S.; Kok, S.H.L.; Xu, L.; Lu, G.; Yeung, C.-H.; Chan, A.S.C. Tetrahedron: Asymmetry, 2004, 15, c.2273 и Boaz, N.W.; Large, S.E.; Ponasik, J.A., Jr.; Moore, M.K.; Barnette, Т.; Nottingham, W.D. Org. Process Res. Dev., 2005, 9, c.472; Chem. Rev., 2003, 103 (8), c.3029. В частности R8 и R9 представляют собой:
R8=Me, R9=Ph (=MeBoPhoz);
R8=Me, R9=n-фторфенил (=n-фторфенил-MeBoPhoz);
R8=Me, R9=3,5-дифторфенил (=3,5-F2C6H3-MeBoPhoz);
R8=Bn, R9=3,5-дифторфенил (=3,5-F2C6H3-BnBoPhoz);
R8=Me, R9=(R)-бинол {=(R)-BINOL-MeBoPhoz};
R8=Me, R9=(S)-бинол {=(S)-BINOL-MeBoPhoz};
R8=Me, R9=n-СF3фенил (=n-СF3фенил-MeBoPhoz);
R8=Bn, R9=Ph (=Bn-BoPhoz);
R8=Me, R9=циклогексил (=Cy-MeBoPhoz);
R8=Me, R9=n-фторфенил (=п-F-MeBoPhoz);
R8=(S)-фенэтил, R9=Ph {(S)-фенэтил-BoPhoz};
R8=(R)-фенэтил, R9=Ph {(S)-фенэтил-BoPhoz};
R8=(S)-фенэтил, R9=Me {(S)-фенэтил-MeBoPhoz}; и
R8=(R)-фенэтил, R9=Me {(R)-фенэтил-MeBoPhoz};
где BINOL обозначает 2,2'-дигидрокси-1,1'-динафтил.
(R)-N-Метил-N-дифенилфосфино-1-[(S)-2-дифенилфосфино)ферроценил]этиламин (=(R)MeBoPhoz)
(S)-N-Метил-N-дифенилфосфино-1-[(R)-2-(дифенилфосфино)ферроценил]этиламин (=(S)MeBoPhoz)
1-(R)-N-Ди(3,5-дифторфенил)фосфин-N-бензил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-3,5-F2C6H3-BnBoPhoz
1-(R)-N-Дициклогексилфосфин-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-Cy-MeBoPhoz
1-(R)-N-Дифенилфосфино-N-[(R)-1-фенилэтил]-1-[(S)-2-дифенилфосфино]ферроценилэтиламин=(R)-Фенэтил-(R)-BoPhoz
1-(R)-N-Дифенилфосфино-N-[(R)-1-фенилэтил]-1-[(R)-2-дифенилфосфино]ферроценилэтиламин=(R)-Фенэтил-(S)-BoPhoz
1-(R)-N-Ди(4-фторфенил)фосфин-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-4-F-C6H4-MeBoPhoz
1-(R)-N-Ди[(R)-1-фенилзтил]-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-Фенэтил-(R)-MeBoPhoz
1-(R)-N-[(R)-2,2'-Дигидрокси-1,1'-динафтил]-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-BINOL-(R)-MeBoPhoz
1-(R)-N[(S)-2,2'-Дигидрокси-1,1'-динафтил]-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(S)-BINOL-(R)-MeBoPhoz
1-(R)-N-Ди(4-фторфенил)фосфин-N-метил-1-[(S)-дифенилфосфино]ферроценил]этиламин=(R)-п-F-MeBoPhoz
Лиганды QuinaPhos имеют формулы:
 или
или 
где R и R', например, являются такими, как описано в статьях G. Francio, F. Faraone, W. Leitner, Angew. Chem. Int. Ed., 39, 1428 (2000), 39, c.1428; Chem. Rev., 2003, 103 (8), 3029, например, R представляют собой Ph и R' представляют собой нафтил. В частности, подходящими лигандами QuinaPhos являются, например, (Ra,Sc)-1Np-QUINAPHOS или (Sa,Rc)-1Np-QUINAPHOS.
Примерами подходящих хиральных лигандов являются:
Примеры лигандов Mandyphos:
|
|
|
|
(αR,αR)-2,2'-Бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис(дифенилфосфино)ферроцен (=Mandyphos SL-M001-1)
(αR,αR)-2,2'-бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис(дициклогексилфосфино)ферроцен (=Mandyphos SL-M002-1)
(αR,αR)-2,2'-Бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис[ди(бис-(3,5-трифторметил)фенил)фосфино]ферроцен (=Mandyphos SL-M003-1)
(αR,αR)-2,2'-Бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис[ди(3,5-диметил-4-метоксифенил)фосфино]ферроцен (=Mandyphos SL-M004-1)
(αS,αS)-2,2'-Бис(α-N,N-диметиламинофенилметил)-(R,R)-1,1'-бис[ди(3,5-диметил-4-метоксифенил)фосфино]ферроцен (=Mandyphos SL-M004-2)
(αR,αR)-2,2,'-Бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис[ди(3,5-диметилфенил)фосфино]ферроцен (=Mandyphos SL-M009-1)
(1R,1'R)-1,1'-Бис[бис(3,5-трет-бутил-4-метоксифенил)фосфино]-2,2'-бис[(R)-(диметиламино)фенилметил]ферроцен (=Mandyphos SL-M010-1)
(αR,αR)-2,2,'-Бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис[ди-(2-метилфенил)фосфино]ферроцен (=Mandyphos SL-M012-1)
Примеры лигандов Josiphos:
|
|
|
|
|
|
|
|
|
|
|
|
|

(R)-1-[(S)-2-Дифенилфосфино)ферроценил]этилди-трет-бутилфосфин (=Josiphos SL-J002-1)
(R)-1-[(S)-2-Дициклогексилфосфино)ферроценил]этилдициклогексилфосфин (=Josiphos SL-J003-1)
(R)-1-[(S)-2-(Дифенилфосфино)ферроценил]этилди(3,5-ксилил)фосфин (=Josiphos SL-J005-1)
(S)-1-[(R)-2-(Дифенилфосфино)ферроценил]этилди(3,5-ксилил)фосфин (=Josiphos SL-J005-2)
(R)-1-[(S)-2-Ди-(3,5-бис(трифторметил)фенил)фосфино)ферроценил]этилдициклогексилфосфин (=Josiphos SL-J006-1)
(S)-1-[(S)-2-Ди-(3,5-бис(трифторметил)фенил)фосфино)ферроценил]этилдициклогексилфосфин (=Josiphos SL-J006-2)
(R)-1-[(S)-2-Ди-(3,5-бис(трифторметил)фенил)фосфино)ферроценил]этилди(3,5-диметилфенил)фосфин (=Josiphos SL-J008-1)
(R)-1-[(S)-2-Дициклогексилфосфино)ферроценил]этилди-трет-бутилфосфин (=Josiphos SL-J009-1)
(R)-1-[(S)-2-Ди(4-трифторметилфенил)фосфино)ферроценил]этилди-трет-бутилфосфин (=Josiphos SL-J011-1)
(R)-1-[(SP)-2-[Бис(4-метокси-3,5-диметилфенил)фосфино]ферроценил}этилди-трет-бутилфосфин (=Josiphos SL-J013-1)
(R)-1-[(S)-2-бис(2-метилфенил)фосфино)ферроценил]этилди(трет-бутил)фосфин (=Josiphos SL-J211-1)
(R)-1-[(S)-2-диэтилфосфино)ферроценил]этилди(трет-бутил)фосфин (=Josiphos SL-J301-1)
(R)-1-[(S)-2-диэтилфосфино)ферроценил]этилди-(2-метилфенил)фосфин (=Josiphos SL-J302-1)
(R)-1-[(S)-2-бис(4-трифторметилфенил)фосфино)ферроценил]этилбис(4-трифторметил)фосфин (=Josiphos SL-J403-1)
(R)-1-[(S)-2-бис(3,5-диметилфенил)фосфино)ферроценил]этилбис(3,5-диметилфенил)фосфин (=Josiphos SL-J408-1)
(R)-1-[(S)-2-бис(3,5-диметилфенил)фосфино)ферроценил]этилбис[бис-(3,5-трифторметил)фенил]фосфин (=Josiphos SL-J412-1)
(R)-1-[(S)-2-бис(2-метоксифенил)фосфино)ферроценил]этилбис(2-метоксифенил)фосфин (=Josiphos SL-J430-1)
(R)-1-[(S)-2-бис(2-изопропоксифенил)фосфино)ферроценил]этилбис(3,5-диметилфенил)фосфин (=Josiphos SL-J431-1)
(R)-1-[(S)-2-ди(трет-бутил)фосфино)ферроценил]этилбис(3,5-диметилфенил)фосфин (=Josiphos SL-J501-1)
(R)-1-[(S)-2-диэтилфосфино)ферроценил]этилбис(2-метилфенил)фосфин (=Josiphos SL-J503-1)
(R)-1-[(S)-2-циклогексилфосфино)ферроценил]этилбис(2-метилфенил)фосфин (=Josiphos SL-J504-1)
(S)-1-[(R)-2-циклогексилфосфино)ферроценил]этилбис(2-метилфенил)фосфин (=Josiphos SL-J504-2)
(R)-1-[(S)-2-ди-трет-бутилфосфино)ферроценил]этилдициклогексилфосфин (=Josiphos SL-J505-1)
(S)-1-[(R)-2-ди(трет-бутил)фосфино)ферроценил]этилбис(2-метилфенил)фосфин (=Josiphos SL-J505-2)
(R)-1-[(S)-2-ди(трет-бутил)фосфино)ферроценил]этилбис(4-трифторметил)фосфин (=Josiphos SL-J506-1)
Примеры лигандов Walphos:
|

|
|
|

|
SL-W008-2:
(R)-1-[(R)-2-(2-Дифенилфосфинофенил)ферроценил]этилди(бис-3,5-трифторметилфенил)фосфин (=Walphos SL-W001-1)
(S)-1-[(S)-2-(2-Дифенилфосфинофенил)ферроценил]этилди(бис-3,5-трифторметилфенил)фосфин (=Walphos SL-W001-2)
(R)-1-[(R)-2-(2'-Дифенилфосфинофенил)ферроценил]этилдициклогексилфосфин (=Walphos SL-W003-1)
(R)-1-[(R)-2-{2'-Ди(3,5-диметил-4-метоксифенил)фосфинофенил}ферроценил]этилди(бис-3,5-трифторметилфенил)фосфин (=Walphos SL-W005-1)
(R)-1-[(R)-2-(2'-Дифенилфосфинофенил)ферроценил]этилди(3,5-ксилил)фосфин (=Walphos SL-W006-1)
(R)-1-[(R)-2-(2'-Дициклогексилфосфинофенил)ферроценил]этилди(бис-(3,5-трифторметил)фенил)фосфин (=Walphos SL-W008-1)
(S)-1-[(S)-2-(2'-Дициклогексилфосфинофенил)ферроценил]этилди(бис-(3,5-трифторметил)фенил)фосфин (=Walphos SL-W008-2)
(R)-1-[(R)-2-(2-Ди-(3,5-ксилил)фосфинофенил)ферроценил]этилди(3,5-ксилил)фосфин (=Walphos SL-W009-1)
(R)-1-[(R)-2-(2'-(Дифенилфосфинофенил)ферроценил]этилди(трет-бутил)фосфин (=Walphos SL-W012-1)
(R)-1-{(R)-2-[4',5'-Диметокси-2'-(дифенилфосфино)фенил]ферроценил}этилди(бис-(3,5-трифторметил)фенил)фосфин (=Walphos SL-W021-1)
(R)-1-{(R)-2-[2'-Бис(2-метоксифенил)фосфинофенил]ферроценил}этилди(бис-(3,5-трифторметил)фенил)фосфин (=Walphos SL-W024-1)
Примеры лигандов Fenphos:
|

|

|

|
|
|
(R)-(S)-1-(Диметиламиноэт-1-ил)-2-дифурилфосфино-3-дифенилфосфиноферроцен (=Fenphos SL-F055-1)
(R)-(S)-1-(Диметиламиноэт-1-ил)-2-диэтилфосфино-3-бис(2-метоксифенил)фосфиноферроцен (=Fenphos SL-F056-1)
(R)-(S)-1-(Диметиламиноэт-1-ил)-2-бис(3,5-диметил-4-метоксифенил)фосфино-3-дициклогексилфосфиноферроцен (=Fenphos SL-F061-1)
(R)-(S)-1-(Диметиламиноэт-1-ил)-2-бис(4-трифторметилфенил)фосфино-3-дициклогексилфосфиноферроцен (=Fenphos SL-F062-1)
(Rc)-(Sp)-(Se)-1,1'-Бис[2-(1-N,N-диметиламиноэтил)-1-ферроценил]фенилфосфиноферроцен (=Fenphos SL-F131-1)
(Rc)-(Sp)-(Se)-1-{[2-(1-N,N-Диметиламиноэтил)-1-ферроценил]фенилфосфино}-2-{[2-(1-N,N-диметиламиноэтил)-1-ферроценил]изопропилфосфино}ферроцен (=Fenphos SL-F132-1)
(Rc)-(Sp)-(Se)-1-{[2-(1-N,N-Диметиламиноэтил)-1-ферроценил]фенилфосфино}-2-{[2-(1-N,N-диметиламиноэтил)-1-ферроценил]циклогексилфосфино}ферроцен (=Fenphos SL-F133-1)
(Rc)-(Sp)-(Se)-1,1'-Бис[2-(1-N,N-диметиламиноэтил)-1-ферроценил]циклогексилфосфиноферроцен (=Fenphos SL-F134-1)
(Rc)-(Sp)-(Se)-1,1'-Бис[2-(1-N,N-диметиламиноэтил)-1-ферроценил]изопропилфосфиноферроцен (=Fenphos SL-F135-1)
(Rc)-(Sp)-(Se)-1-{[2-(1-N,N-Диметиламиноэтил)-1-ферроценил]фенилфосфино}-1'-{ди[бис-(3,5-трифторметил)фенил]фосфино}ферроцен (=Fenphos SL-F355-1)
(Rc)-(Sp)-(Se)-1-{[2-(1-N,N-Диметиламиноэтил)-1-ферроценил]фенилфосфино}-1'(дициклогексилфосфино)ферроцен (=Fenphos SL-F356-1)
(Rc)-(Sp)-(Se)-1-{[2-(1-N,N-Диметиламиноэтил)-1-ферроценил]циклогексилфосфино}-1'(дициклогексилфосфино)ферроцен (=Fenphos SL-F365-1)
Примеры лигандов Atropisomer:
|

|
(R)-(+)-(6,6i-Диметоксибифенил-2,2'-диил)-бис(дифенилфосфин) (=Atropisomer SL-A101-1)
(S)-(6,6'-Диметоксибифенил-2,2'-диил)-бис[бис(3,5-ди-трет-бутил-4-метоксифенил)фосфин) (=Atropisomer SL-A109-2)
(S)-(6,6'-Диметоксибифенил-2,2'-диил)бис(диизопропилфосфин) (=Atropisomer SL-A 116-2)
(R)-(6,6'-Диметоксибифенил-2,2'-диил)бис(дициклобутилфосфин) (=Atropisomer SL-A 118-1)
Примеры лигандов Taniaphos:
|
(1S)-Дифенилфосфино-2-[(R)-α-(N,N-диметиламино)-о-дифенилфосфинофенил)метил]ферроцен (=Taniaphos SL-T001-1)
(1R)-Дифенилфосфино-2-[(S)-α-(N,N-диметиламино)-о-дифенилфосфинофенил)метил]ферроцен (=Taniaphos SL-T001-2)
(R)-1-Бис(4-метокси-3,5-диметилфенил)фосфино-2-{(R)-(диметиламино)-[2-(бис(4-метокси-3,5-диметилфенил)фосфино)фенил]метил}ферроцен (=Taniaphos SL-T003-1)
(S)-1-Дифенилфосфино-2-[(S)-гидрокси-[2-(дифенилфосфино)фенил]метил]ферроцен (=Taniaphos SL-T021-2)
Примеры фосфолановых лигандов:
|
2-[(2'R,5'R)-2',5'-диметилфосфолано]-1-[(R)-дифенилфосфино]ферроцен (=Phospholane SL-P051-1)
1,2-Бис[(2S,5S)-2,5-диметилфосфолано]этан (=Phospholane SL-P104-2)
1,2-Бис[(2R,5R)-2,5-диэтилфосфолано]бензол (=Phospholane SL-P102-1)
(R,R,R,R)-2,3-Бис(2,5-диметилфосфоланил)бензо[b]тиофен (=Phospholane SL-P005-1)
Примерами других подходящих хиральных лигандов являются:
|

|
|
SL-A132-2:
(S)-(6,6'-Диметилбифенил-2,2,-диил)бис(дициклогексилфосфин) (=Atropisomer SL-A132-2).
Другим подходящим лигандом является лиганд BDPP как определено далее, в частности (S,S)-BDPP.
Получение лиганда (S)-C4-TunaPhos описано в статье J. Org. Chem., 2000, 65, с.6223 (пример 4). Лиганд (R)-(+)-BINAP может быть получен из коммерческих источников, таких как Aldrich. Лиганды BoPhoz и QUINAPHOS являются коммерчески доступными от Johnson Matthey plc (London, Великобритания). Все другие описанные выше лиганды (Mandyphos, Josiphos, Walphos, и т.д.) являются коммерчески доступными от Solvias AG (Basel, Швейцария).
В частности, подходящими хиральными лигандами являются, например:
SL-M004-1, SL-M004-2, SL-M002-1, SL-M003-1, SL-M009-1, SL-M0010-1, SL-M012-1, SL-J005-1, SL-J505-1, SL-J005-2, SL-J008-1, SL-J009-1, SL-J013-1, SL-J211-1, SL-J301-1, SL-J403-1, SL-J408-1, SL-J412-1, SL-J430-1, SL-J431-1, SL-J501-1, SL-J503-1, SL-J504-1, SL-J505-2, SL-J506-1, SL-F131-1, SL-F132-1, SL-F133-1, SL-F134-1, SL-F135-1, SL-F355-1, SL-F356-1, SL-F365-1, SL-T001-1, SL-T001-2, SL-T003-1, SL-T021-2, (S,S)-BDPP, (R)-MeBoPhoz, (S)-MeBoPhoz, (R)-3,5-F2C6H3-BnBoPhoz, (R)-Cy-MeBoPhoz, (R)-фенэтил-(R)-BoPhoz, (R)-фенэтил-(S)-BoPhoz, SL-W001-1, SL-W005-1, SL-W009-1, SL-W012-1, SL-W024-1, SL-W008-1, SL-A101-1, SL-A109-1, SL-A109-2, SL-A118-1, SL-A116-2, SL-A132-2, SL-P102-1, SL-P005-1, SL-P104-2, (Ra,Sc)1Np-QUINAPHOS} и/или (Sa,Rc)1Np-QUINAPHOS}.
Особенно подходящими хиральными лигандами являются, например:
(R)-Cy-MeBoPhoz; (R)-фенэтил-(S)-BoPhoz; SL-A101-1; SL-A109-2; SL-А116-2; SL-A118-1; SL-A132-2; SL-F131-1; SL-F132-1; SL-F133-1; SL-F134-1; SL-F135-1; SL-F355-1; SL-F356-1; SL-F365-1; SL-J005-2; SL-J505-1; SL-J008-1; SL-J013-1; SL-J301-1; SL-J403-1; SL-J408-1; SL-J430-1; SL-J431-1; SL-J501-1; SL-J504-1; SL-J504-2; SL-J505-2; SL-J506-1; SL-M002-1; SL-M003-1; SL-M004-1; SL-М009-1; SL-M010-1; SL-P051-1; SL-T001-1; SL-T001-2; SL-T003-1; SL-T021-2; (S,S)-BDPP; SL-W001-1; SL-W005-1; SL-W008-1; SL-W008-2; SL-W009-1; SL-W012-1; SL-W021-1 и/или SL-W024-1.
Другими особенно подходящими лигандами являются, например:
SL-A101-1; SL-F131-1; SL-F132-1; SL-F356-1; SL-J505-1; SL-J008-1; SL-J504-2; SL-J505-2; SL-M010-1; SL-P051-1; (S,S)-BDPP; SL-W001-1; SL-W005-1; SL-W008-1; SL-W009-1; SL-W012-1; SL-W021-1.
Подходящими комбинациями металлоорганического комплекса и хирального лиганда являются, например:
- металлоорганический комплекс родия и лиганд Fenphos, Walphos, Josiphos или Phospholane; в частности [Rh(nbd)2]BF4 и лиганд Fenphos, Walphos, Josiphos или PhanePhos; такой как Rh(nbd)2]BF4 и SL-W005-1, SL-W008-1, SL-F356-1, SL-J008-1, SL-P051-1, SL-W009-1, SL-W001-1, SL-W012-1, SL-W021-1, SL-J505-2 или SL-J504-2; в частности, Rh(nbd)2]BF4 и SL-W008-1, SL-J008-1, SL-P051-1, SL-J505-2 или SL-J504-2;
- металлоорганический комплекс рутения и лиганд Atropisomer, Mandyphos или Fenphos; в частности [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2] и лиганд Atropisomer, Mandyphos, BDPP, Josiphos или Fenphos; такой как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2] и SL-A101-1, SL-M010-1, (S,S)-BDPP, SL-J505-1, SL-F131-1, SL-F132-1 или SL-F134-1; или
- металлоорганический комплекс иридия и лиганд Fenphos, Walphos или Josiphos; в частности [Ir(cod)Cl]2 и лиганд Fenphos, Walphos или Josiphos; такой как [Ir(cod)Cl]2 и SL-F356-1, SL-W024-1 или SL-J504-1.
При использовании этих комбинаций восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их солей, где молярное соотношение соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 96 к 4, наиболее предпочтительно по крайней мере 99 к 1.
Во втором варианте осуществления, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-b) или их солей к соединениям формулы (1-а) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 91 к 9.
В одном варианте осуществления, катализатор переходного металла включает металлоорганический комплекс и хиральный лиганд, такой как лиганд Fenphos, лиганд Josiphos, лиганд Mandyphos, лиганд Walphos, лиганд Taniaphos, Phospholane, лиганд Atropisomer, лиганд BoPhoz, лиганд QUINAPHOS или их смеси; в частности хиральный лиганд выбран из группы, состоящей из лиганда Josiphos, лиганда Mandyphos, лиганда Walphos, лиганда Taniaphos, лиганда Atropisomer, лиганда QUINAPHOS или их смесей.
Подходящими хиральными лигандами являются, например:
SL-A132-2, SL-W008-2, SL-A109-2, SL-A109-2, SL-T021-2, SL-T003-1, SL-М003-1, SL-A101-1, SL-J002-1, SL-J504-1, SL-T001-1, SL-J501-1, SL-W008-1, SL-J301-1, SL-F356-1, SL-M004-2, SL-M012-1, SL-J013-1, SL-J211-1, SL-W009-1, SL-J412-1, SL-W012-1, SL-J009-1, SL-J503-1, SL-J506-1, SL-J431-1, SL-J430-1 или (Ra,Sc)1Np-QUINAPHOS; в частности SL-W008-2, SL-J504-1, SL-W009-1, SL-J412-1, SL-J503-1.
Комбинациями металлоорганического комплекса и хирального лиганда являются, например:
- металлоорганический комплекс родия и лиганд Atropisomer, Walphos, Taniaphos, Josiphos, Mandyphos или Quinaphos; такой как [Rh(nbd)2]BF4 или [Rh(cod)2]BF4 и лиганд Atropisomer, Walphos, Taniaphos, Josiphos, Mandyphos или Quinaphos; в частности [Rh(nbd)2]BF4 и SL-W008-2, SL-J504-1, SL-W009-1, SL-J41201 или SL-J503-1;
- металлоорганический комплекс рутения и лиганд Atropisomer, Taniaphos, Mandyphos, Walphos, Josiphos или Fenphos; такой как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2], [RuI2(п-цимен)]2 или [Ru(cod)(OOCCF3)2] и лиганд Atropisomer, Taniaphos, Mandyphos, Walphos, Josiphos или Fenphos. Еще более предпочтительно, [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2], [RuI2(п-цимен)]2 или [Ru(cod)(OOCCF3)2] и SL-A109-2, SL-T021-2, SL-M003-1, SL-W008-1, SL-J301-1, SL-F356-1, SL-M004-2, SL-M012-1, SL-J002-1, SL-J013-1, SL-J211 или SL-J503-1; или
- металлоорганический комплекс иридия и лиганд Walphos или Josiphos; в частности [Ir(cod)Cl]2 и лиганд Walphos или Josiphos; такой как [Ir(cod)Cl]2 и SL-W009-1, SL-W012-1 или SL-J009-1.
При использовании этих комбинаций восстановление соединения формулы (2-а) или его соли приводит к получению композиции, содержащей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-b) или их солей к соединениям формулы (1-а) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 91 к 9.
В третьем варианте осуществления, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 97 к 3, наиболее предпочтительно по крайней мере 99 к 1.
В одном варианте осуществления, катализатор переходного металла включает переходный металл, выбранный из группы 8 или 9, такой как родий, рутений или иридий, и хиральный лиганд выбран из группы, состоящей из лиганда BoPhoz, лиганда BINAP, лиганда BINOL, лиганда Phospholane, лиганда PhanePhos, лиганда P-Phos, лиганда QuinaPhos, лиганда ProPhos, лиганда BDPP, лиганда DIOP, лиганда DIPAMP, лиганда DuanPhos, лиганда NorPhos, лиганда BINAM, лиганда CatAsium, лиганда SimplePHOX, лиганда РНОХ, лиганда ChiraPhos, лиганда Ferrotane, лиганда ВРЕ, лиганда TangPhos, лиганда JafaPhos, лиганда DuPhos, лиганда Binaphane и их смесей.
Лиганды BoPhoz имеют описанные выше формулы, в частности (R)-4-F-C6H4-MeBoPhoz, (R)-BINOL-(R)-MeBoPhoz, (R)-MeBoPhoz, (R)-п-F-MeBoPhoz, (R)-фенэтил-(R)-MeBoPhoz, (S)-BINOL-(R)-MeBoPhoz или (S)-MeBoPhoz.
Лиганды QUINAPHOS имеют описанные выше формулы, в частности (Ra,Sc)-1Np-QUINAPHOS или (Sa,Rc)-1Np-QUINAPHOS.
(S)-2-(1-Нафтил)-8-дифенилфосфино-1-(R)-3,5-диокса-4-фосфациклогепта[2,1-а; 3,4-а']динафтален-4-ил)-1,2-дигидрохинолин=(Ra,Sc)-1Np-QUINAPHOS
(R)-2-(1-Нафтил)-8-дифенилфосфино-1-(S)-3,5-диокса-4-фосфациклогепта[2,1-а; 3,4-а']динафтален-4-ил)-1,2-дигидрохинолин=(Sa,Rc)-1Np-QUINAPHOS
Лиганды BINAP имеют формулы:
где R, например, является таким, как описано в статье R. Noyori, Н. Takaya, Acc. Chem. Res., 1990, 23, с.345, например, R представляет собой фенил (=BINAP) или толил (=Tol-BINAP). В частности, подходящими лигандами BINAP являются (R)-BINAP, (R)-Tol-BINAP, (S)-BINAP или (S)-Tol-BINAP.
(R)-2,2'-Бис(ди-п-толилфосфино)-1,1'-бинафтален=(R)-Tol-BINAP
(S)-2,2'-Бис(ди-п-толилфосфино)-1,1'-бинафтален=(S)-Tol-BINAP
(R)-2,2'-Бис(дифенилфосфино)-1,1-бинафтален=(R)-BINAP
(S)-2,2'-Бис(дифенилфосфино)-1,1'-бинафтален=(S)-BINAP
Лиганды BINOL имеют формулы:
где R, например, является таким, как описано в статьях Noyori, R.; Tomino, I.; Tanimoto, Y.; Nishizawa, M.J. Am. Chem. Soc, 1984, 106, c.6709; Noyori, R.; Tomino, I.; Yamada,. M.; Nishizawa, M.J. Am. Chem. Soc., 1984, 106, c.6717, например, представляет собой фенил (=BINOL). В частности, подходящими лигандами BINOL являются, например, (R)-BINOL или (S)-BINOL.
Лиганды PhanePhos имеют формулу:
где Ar, например, является таким, как описано в статье K. Rossen, P.J. Pye, R.A. Reamer, N.N. Tsou, R.P. Volante, P.J. Reider J. Am. Chem. Soc., 1997, 119, с.6207, например, Ar представляет собой Ph (=PhanePhos), 4-Ме-C6H4 (=Tol-PhanePhos), 4-MeO-C6H4 (An-PhanePhos), 3,5-Me2-C6H3 (=Xyl-Phanephos) или 3,5-Me2-4-МеО-C6H2 (=MeO-Xyl-Phanephos). В частности, подходящими лигандами PhanePhos являются, например, (R)-PhanePhos, (R)-Xyl-PhanePhos, (S)-Xyl-PhanePhos, (S)-PhanePhos, (R)-An-PhanePhos, (R)-MeO-Xyl-PhanePhos или (R)-Tol-PhanePhos.
(R)-4,12-Бис(дифенилфосфино)-[2,2]-парациклопентан=(R)-PhanePhos
(S)-4,12-Бис(дифенилфосфино)-[2,2]-парациклопентан=(S)-PhanePhos
(R)-4,12-Бис(ди(3,5-ксилил)фосфино)-[2,2]-парациклопентан=(R)-Xyl-PhanePhos
(S)-4,12-Бис(ди(3,5-ксилил)фосфино)-[2,2]-парациклопентан=(S)-Xyl-PhanePhos
(R)-4,12-Бис(ди(п-толил)фосфино)-[2,2]-парациклопентан=(R)-Tol-PhanePhos
(R)-4,12-Бис(ди(п-метоксифенил)фосфино)-[2,2]-парациклопентан=(R)-An-PhanePhos
(R)-4,12-Бис(ди(п-метокси-3,5-диметилфенил)фосфино)-[2,2]-парациклопентан=(R)-MeO-Xyl-PhanePhos
Лиганды P-Phos имеют формулы:
 или
или 
где Ar, например, является таким, как описано в статье С.-С. Pai, С.-W. Lin, С.-С. Lin, С.-С. Chen, A.S.С. Chan, W.Т. Wong, J. Am. Chem. Soc., 2000, 122, с.11513, например, Ar представляет собой Ph (=P-Phos), 4-Me-C6H4 (=Tol-P-Phos), 4-МеО-C6H4 (An-P-Phos), 3,5-Me2-C6H3 (=Xyl-P-Phos) или 3,5-Ме2-4-МеО-C6H2 (=MeO-Xyl-P-Phos). В частности, подходящими лигандами P-Phos являются, например, (R)-P-Phos, (R)-Xyl-P-Phos, (S)-P-Phos или (S)-Xyl-P-Phos.
(R)-2,2',6,6'-Тетраметокси-4,4'-бис(дифенилфосфино)-3,3'-бипиридин=(R)-P-Phos
(S)-2,2',6,6'-Тетраметокси-4,4'-бис(дифенилфосфино)-3,3'-бипиридин=(S)-P-Phos
(R)-2,2',6,6'-Тетраметокси-4,4'-бис(ди(3,5-ксилил)фосфино)-3,3'-бипиридин=(R)-Xyl-P-Phos
(S)-2,2',6,6'-Тетраметокси-4,4'-бис(ди(3,5-ксилил)фосфино)-3,3'-бипиридин=(S)-Xyl-P-Phos
Лиганды ProPhos имеют формулы:
 или
или 
где R и R', например, являются такими, как описано в статье Fryzuk, М.D.; Bosnich, В.J. Am. Chem. Soc, 1978, 100, с.5491, например, R' представляет собой Me и R представляет собой Ph. В частности, подходящими лигандами ProPhos являются, например, (R)-ProPhos.
(R)-1,2-Бис(дифенилфосфино)пропан=(R)-ProPhos
Лиганды BDPP имеют формулы:
 или
или 
где R, например, является таким, как описано в статье Bakos, J.; Toth, I.; Marko', L.J. Org. Chem., 1981, 46, c.5427, например, R представляет собой Ph. В частности, подходящими лигандами BDPP являются, например, (R,R)-BDPP или (S,S)-BDPP.
(2R,4R)-2,4-Бис(дифенилфосфино)пентан=(R,R)-BDPP
(2S,4S)-2,4-Бис(дифенилфосфино)пентан=(S,S)-BDPP
Лиганды DIOP имеют формулы:
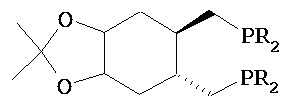 или
или 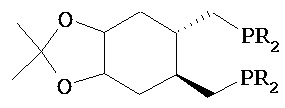
где R, например, является таким, как описано в статьях Kagan, Н.В.; Dang, Т.P. Chem. Commun. 1971, с.481; Kagan, Н.В.; Dang, Т.P.J. Am. Chem. Soc., 1972, 94, с.6429, например, R представляет собой Ph. В частности, подходящими лигандами DIOP являются, например, (S,S)-DIOP или (R,R)-DIOP.
(4R,5R)-4,5-Бис(дифенилфосфинометил)-2,2-диметил-1,3-диоксолан=(R,R)-DIOP
(4S,5S)-4,5-Бис(дифенилфосфинометил)-2,2-диметил-1,3-диоксолан=(S,S)-DIOP
Лиганды DIP AMP имеют формулы:
 или
или 
где R и R', например, являются такими, как описано в статье Knowles, W.S. Acc. Chem. Res., 1983, 16, с.106, например, R представляет собой Ph и R' представляет собой анизил. В частности, подходящим лигандом DIP AMP является, например, (R,R)-DIPAMP.
(R,R)-1,2-Этандиилбис[(2-метоксифенил)фенилфосфин]=(R,R)-DIPAMP
Лиганды DuanPhos имеют формулы:
 или
или 
где R, например, является таким, как описано в международной заявке на патент PCT/US02/35788, например, R представляет собой трет-бутил. В частности, подходящим лигандом DuanPhos является, например, (R,R)-DuanPhos.
(1R,1'R,2S,2'S)-2,2'-Ди-трет-бутил-2,3,2',3'-тетрагидро-1Н,1'Н-(1,1')диизофосфиндолил=(R,R)-DuanPhos
Лиганды NorPhos имеют формулы:
 или
или 
где R, например, является таким, как описано в статье Brunner, Н.; Pieronczyk, W.; Schoenhammer, В.; Streng, К.; Bernal, I.; Korp, J. Chem. Ber., 1981, 114, с.1137, например, R представляет собой Ph. В частности, подходящими лигандами NorPhos являются, например, (R,R)-NorPhos или (S,S)-NorPhos.
(2R,3R)-2,3-Бис(дифенилфосфино)бицикло[2,2,1]гепт-5-ен=(R,R)-NorPhos
(2S,3S)-2,3-Бис(дифенилфосфино)бицикло[2,2,1]гепт-5-ен=(S,S)-NorPhos
Лиганды BINAM имеют формулы:
 или
или 
где R, например, является таким, как описано в статье F.-Y. Zhang, С.-С. Pai, A.S.С. Chan J. Am. Chem. Soc, 1998, 120, с.5808, например, R представляет собой PR'2, где R', например, представляет собой Ph. В частности, подходящими лигандами BINAM являются, например, (R)-BINAM-P или (S)-BINAM-P.
(R)-N,N'-Бис(дифенилфосфино)-1,1'-бинафтил-2,2'-диамин=(R)-BINAM-P
(S)-N,N'-Бис(дифенилфосфино)-1,1'-бинафтил-2,2'-диамин=(S)-BINAM-P
Лиганды CatASium имеют формулы:
где R, R' и R'', например, являются такими, как описано в статьях Holz, J.; Monsees, A.; Jiao, Н.; You, J.; Komarov, I.V.; Fischer, C.; Drauz, K.; Borner, A.J. Org. Chem., 2003, 68, cc.1701-1707; Holz, J.; Zayas, O.; Jiao, H.; Baumann, W.; Spannenberg, A.; Monsees, A.; Riermeier, Т.H.; Almena, J.; Kadyrov, R.; Borner, A. Chem. Eur. J, 2006, 12, cc.5001-5013, например, R представляет собой Me, R' представляет собой Ph, R'' представляет собой бензил и G представляет собой О, NMe, N(Me)N(Me). В частности, подходящими лигандами CatAsium являются, например, (R)-CatASium М, (S)-CatASium М, (R)-CatASium MN, (S)-CatASium MN, (R)-CatASium D или (R)-CatASium MNN.
N-Бензил-(3R,4R)-бис(дифенилфосфино)пирролидин=(R)-CatASium D
2,3-Бис[(2R,5R)-2,5-диметилфосфолано]малеиновый ангидрид=(R)-CatASium M
2,3-Бис[(2R,5R)-2,5-диметилфосфолано]-N-метилмалеимид=(R)-CatASium MN
4,5-Бис[(2R,5R)-2,5-диметилфосфолано]-1,2-дигидро-1,2-диметил-3,6-пиридазиндион=(R)-CatASium MNN
2,3-Бис[(2S,5S)-2,5-диметилфосфолано]малеиновый ангидрид=(S)-CatASium M
2,3-Бис[(2S,5S)-2,5-диметилфосфолано]-N-метилмалеимид=(S)-CatASium MN
Лиганды SimplePHOX имеют формулы:
 или
или 
где R и R', например, являются такими, как описано в статье S. Smidt, F. Menges, A. Pfaltz, Org. Lett., 2004, 6, с.2023, например, R представляет собой циклогексил и R' представляет собой трет-бутил. В частности, подходящим лигандом SimplePHOX является, например, (S)-Cy-третBu-SimplePHOX.
(S)-4-трет-бутил-2-(2-(дициклогексилфосфиноокси)пропан-2-ил)-4,5-дигидрооксазол=(S)-Cy-третBu-SimplePHOX
Лиганды РНОХ имеют формулы:
 или
или 
где R и R', например, являются такими, как описано в статье A. Lightfoot, P. Schnider, A. Pfaltz, Angew. Chem. In. Ed., 1998, 37, с.2897, например, R представляет собой Ph и R' представляет собой изоPr. В частности, подходящим лигандом PHOX является, например, (S)-изоPr-PHOX.
(S)-4-трет-Бутил-2-[2-(дифенилфосфино)фенил]-2-оксазолин=(S)-изоPr-РНОХ
Лиганды ChiraPhos имеют формулы:
 или
или 
где R, например, является таким, как описано в статье Fryzuk, М.В.; Bosnich, В.J. Am. Chem. Soc, 1977, 99, с.6262; Fryzuk, М.В.; Bosnich, В.J. Am. Chem. Soc, 1979, 101, с.3043, например, R представляет собой Ph. В частности, подходящим лигандом ChiraPhos является, например, (S,S)-ChiraPhos.
(2S,3S)-(-)-Бис(дифенилфосфино)бутан=(S,S)-Chiraphos
Лиганды Ferrotane имеют формулу:
где R, например, является таким, как описано в статье Berens, U.; Burk, М.J.; Gerlach, A.; Hems, W. Angew. Chem., Int. Ed. Engl. 2000, 39, c.1981, например, R представляет собой метил или этил, предпочтительно этил. В частности, подходящим лигандом ferrotane является, например, (S,S)-Et-Ferrotane.
1,1'-Бис[(2S,4S)-2,4-диэтилфосфотано)ферроцен=(S,S)-Et-Ferrotane
Лиганды BPE имеют формулы:
где R, например, является таким, как определено в статье Burk, М.J. Acc. Chem. Res, 2000, 33, с.363, например, R представляет собой Me или Ph. В частности, подходящими лигандами ВРЕ являются, например, (S,S)-Me-BPE или (S,S)-Ph-BPE.
2,2-Бис[(2S,5S)-2,5-диметилфосфолано]этан=(S,S)-Me-BPE
2,2-Бис[(2S,5S)-2,5-дифенилфосфолано]этан=(S,S)-Ph-BPE
Лиганды TangPhos имеют формулы:
где R, например, является таким, как описано в статье Tang, W.; Zhang, X. Angew. Chem., Int. Ed. Engl, 2002, 41, c.1612, например, R представляет собой трет-бутил. В частности, подходящим лигандом TangPhos является, например, (S,S,R,R)-TangPhos.
(1S,1S',2R,2R')-1,1'-Ди-трет-бутил-(2,2')-дифосфолан=(S,S,R,R)-TangPhos
Лиганды JafaPhos имеют формулу:
где R и R', например, являются такими, как описано в статье Jendralla, Н.; Paulus, Е. Synlett (Е.J. Corey Special Issue), 1997, с.471, например, R представляет собой Ph и R' представляет собой изопропил. В частности, подходящим лигандом JafaPhos является, например, (R)-JafaPhos.
[(R)-1,1'-Бис(дифенилфосфино)-2,2'-бис(N,N-диизопропиламидо)ферроцен]=(R)-JafaPhos
Лиганды DuPhos имеют формулы:
 или
или 
где R, например, является таким, как описано в статье Burk, М.J. Асс. Chem. Res, 2000, 33, с.363, например, R представляет собой Me. В частности, подходящим лигандом DuPhos является, например, (R)-MeDuPhos.
1,2-Бис[(2R,5R)-2,5-диметилфосфолано]бензол=(R)-MeDuPhos
Лиганды Binaphane имеют формулы:
 или
или 
например, как описано в статье Xiao D, Zhang Z, Zhang X., Org Lett., 1999, Nov 18; 1(10), c.1679. В частности, подходящим лигандом Binaphane является, например, (R)-Binaphane.
(R,R)-1,2-Бис[(R)-4,5-дигидро-3Н-бинафто(1,2-с:2',1'-е)фосфепино]бензол=(R)-Binaphane
Другие подходящие хиральные лиганды и хиральные группы описаны, например, в статье Tang, W и Zhang, X, Chem. Rev., 2003, 103 (8), с.3029 и приведенных в ней ссылках.
Описанные выше лиганды являются коммерчески доступными от Johnson Matthey plc (London, Великобритания) и/или от Solvias AG (Basel, Швейцария).
В одном варианте осуществления, катализатор переходного металла включает, например:
- переходный металл родий и хиральный лиганд, такой как лиганд P-Phos, PhanePhos, Phospholane, BoPhoz, DIOP, BINAP, CatAsium, TangPhos, JafaPhos, DuPhos, BPE, Ferrotane, BINAM, DuanPhos, NorPhos, BDPP, ProPhos, DIPAMP, ChiraPhos или лиганд Binaphane. Например, катализатор переходного металла включает переходный металл родий и хиральный лиганд, такой как SL-P104-2, SL-P102-1, SL-P005-1, (R)-P-Phos, (S)-P-Phos, (S)-PhanePhos, (R)-PhanePhos, (R)-An-PhanePhos, (R)-MeO-Xyl-PhanePhos, (R)-Xyl-PhanePhos, (R)-Tol-PhanePhos, (S)-MeBoPhoz, (S,S)-DIOP, (R,R)-DIOP, (S)-BINAP, (S)-Tol-BINAP, (R)-CatASium M, (S)-CatASium M, (R)-CatASium MN, (S)-CatASium MN, (R)-CatASium D, (R)-CatASium MNN, (S,S,R,R)-TangPhos, (R)-JafaPhos, (R)-MeDuPhos, (S,S)-Me-BPE, (S,S)-Ph-BPE, (S,S)-Et-Ferrotane, (S)-BINAM-P, (R)-BINAM-P, (R,R)-DuanPhos, (R,R)-NorPhos, (S,S)-NorPhos, (R,R)-BDPP, (S,S)-BDPP, (R)-ProPhos, (R,R)-DIPAMP, (S,S)-ChiraPhos или (R)-Binaphane. Особенно подходящими катализаторами переходного металла являются, например: [Rh(COD)(SL-P104-2)]O3SCF3, [Rh(COD)(SL-P102-1)]BF4, [Rh(COD)(SL-P005-l)]BF4, [Rh(COD)(SL-P102-1)]O3SCF3, [(R)-P-Phos Rh(COD)]BF4, [(S)-P-Phos Rh(COD)]BF4, [(R)-PhanePhos Rh(COD)]BF4, [(S)-PhanePhos Rh(COD)]BF4, [(R)-Xyl-PhanePhos Rh(COD)]BF4, [(S)-MeBoPhoz Rh(COD)]BF4, [(S,S)-DIOP Rh(COD)]BF4, [(S)-BINAP Rh(COD)]BF4, [(R)-CatASium M Rh(COD)]BF4, [(S)-CatASium M Rh(COD)]BF4, [(R)-CatASium MN Rh(COD)]BF4, [(S)-CatASium MN Rh(COD)]BF4, [(R)-CatASium D Rh(COD)]BF4, [(S,S,R,R)-TangPhos Rh(COD)]BF4, [(R)-JafaPhos Rh(COD)]BF4, [(R)-MeDuPhos Rh(COD)]BF4, [(S,S)-Me-BPE Rh(COD)]BF4, [(S,S)-Ph-BPE Rh(COD)]BF4, [(S,S)-Et-Ferrotane Rh(COD)]BF4, [(R)-An-PhanePhos Rh(COD)]BF4, [(R)-CatASium MNN Rh(COD)]BF4, [(S)-Tol-BINAP Rh(COD)]BF4, [(S)-BINAM-P Rh(COD)]BF4, [(R)-BINAM-P Rh(COD)]BF4, [(R,R)-DuanPhos Rh(COD)]BF4, [(R)-Binaphane Rh(COD)]BF4, [(R,R)-NorPhos Rh(COD)]BF4, [(S,S)-NorPhos Rh(COD)]BF4, [(R,R)-BDPP Rh(COD)]BF4, [(S,S)-BDPP Rh(COD)]BF4, [(R,R)-DIOP Rh(COD)]BF4, [(R)-ProPhos Rh(COD)]BF4, [(R,R)-DIPAMP Rh(COD)]BF4, [(S,S)-ChiraPhos Rh(COD)]BF4, [(R)-MeO-Xyl-PhanePhos Rh(COD)]BF4 или [(R)-Tol-PhanePhos Rh(COD)]BF4; в частности [Rh(COD)(SL-P102-1)]BF4, [Rh(COD)(SL-P005-1)]BF4, [Rh(COD)(SL-P102-1)]O3SCF3, [(R)-PhanePhos Rh(COD)]BF4, [(R)Xyl-PhanePhos Rh(COD)]BF4, [(S,S)-DIOP Rh(COD)]BF4, [(S)-BINAP Rh(COD)]BF4, [(R)-CatASium M Rh(COD)]BF4, [(R)-CatASium MN Rh(COD)]BF4, [(S)-CatASium MN Rh(COD)]BF4, [(S,S,R,R)-TangPhos Rh(COD)]BF4, [(S,S)-Me-BPE Rh(COD)]BF4, [(S,S)-Ph-BPE Rh(COD)]BF4, [(R)-An-PhanePhos Rh(COD)]BF4, [(R)-CatASium MNN Rh(COD)]BF4, [(S)Tol-BINAP Rh(COD)]BF4, [(S)-BINAM-P Rh(COD)]BF4, [(R,R)-DuanPhos Rh(COD)]BF4, [(R)-Binaphane Rh(COD)]BF4, [(S,S)-NorPhos Rh(COD)]BF4, [(R,R)-BDPP Rh(COD)]BF4, [(S,S)-BDPP Rh(COD)]BF4, [(R,R)-DIOP Rh(COD)]BF4, [(R)-ProPhos Rh(COD)]BF4, [(R,R)-DIPAMP Rh(COD)]BF4, [(S,S)-ChiraPhos Rh(COD)]BF4, [(R)-MeO-Xyl-PhanePhos Rh(COD)]BF4 или [(R)-Tol-PhanePhos Rh(COD)]BF4; такой как [Rh(COD)(SL-P102-1)]BF4, [Rh(COD)(SL-P005-1)]BF4, [(R)PhanePhos Rh(COD)]BF4, [(R)Xyl-PhanePhos Rh(COD)]BF4, [(R)CatASium M Rh(COD)]BF4, [(R)CatASium MN Rh(COD)]BF4, [(S,S,R,R)TangPhos Rh(COD)]BF4, [(S,S)Ph-BPE Rh(COD)]BF4, [(R)An-PhanePhos Rh(COD)]BF4, [(R,R)DuanPhos Rh(COD)]BF4, [(S,S)NorPhos Rh(COD)]BF4 или [(R)MeO-Xyl-PhanePhos Rh(COD)]BF4;
- переходный металл рутений и хиральный лиганд, такой как лиганд BoPhoz, BINAP, BINOL, PhanePhos, P-Phos или QUINAPHOS. Например, катализатор переходного металла включает переходный металл рутений и хиральный лиганд, такой как (R)-4-F-C6H4-MeBoPhoz, (R)-BINAP, (R)-BINOL-(R)-MeBoPhoz, (R)-MeBoPhoz, (R)-p-F-MeBoPhoz, (R)-PhanePhos, (11)-фенэтил-(R)-MeBoPhoz, (R)-P-Phos, (R)-Tol-BINAP, (R)-Xyl-PhanePhos, (R)-Xyl-P-Phos, (Ra,Sc)1Np-QUINAPHOS, (S)-BINAP, (S)-BINOL-(R)-MeBoPhoz, (S)-P-Phos, (S)-Xyl-PhanePhos, (S)-Xyl-P-Phos или (Sa,Rc)1Np-QUINAPHOS. Особенно подходящими катализаторами переходного металла являются, например: [(R)-4-F-C6H4-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-BINAP RuCl(бензол)]Cl, [(R)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-MeBoPhoz RuCl(бензол)]Cl, [(R)-п-F-MeBoPhoz RuCl(Бензол)]Cl, [(R)-PhanePhos RuCl2(dmf)2], [(R)-фенэтил-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-P-Phos RuCl(бензол)]Cl, [(R)-Tol-BINAP RuCl(бензол)]Cl, [(R)-Xyl-PhanePhos RuCl2(dmf)2], [(R)-Xyl-P-Phos RuCl2(dmf)2], [(Ra,Sc)1Np-QUINAPHOS RuCl2(dmf)2], [(S)-BINAP RuCl(бензол)]Cl, [(S)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(S)-P-Phos RuCl(бензол)]Cl, [(S)-Xyl-PhanePhos RuCl2(dmf)2], [(S)-Xyl-P-Phos RuCl2(dmf)2], [(Sa,Rc)1Np-QUINAPHOS RuCl2(dmf)2], [(R)-P-Phos Ru(acac)2], [(R)-Xyl-P-Phos Ru(acac)2] или [(R)-Xyl-P-Phos RuCl(бензол)]Cl; в частности, [(R)-4-F-C6H4-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-BINAP RuCl(бензол)]Cl, [(R)-MeBoPhoz RuCI(Бензол)]Cl, [(R)-n-F-MeBoPhoz RuCl(бензол)]Cl, [(R)-PhanePhos RuCl2(dmf)2], [(R)-фенэтил-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-P-Phos RuCl(бензол)]Cl, [(R)-Tol-BINAP RuCl(бензол)]Cl, [(R)-Xyl-P-Phos RuCl2(dmf)2], [(S)-BINAP RuCl(бензол)]Cl, [(S)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(S)-P-Phos RuCl(бензол)]Cl, [(S)-Xyl-PhanePhos RuCl2(dmf)2], [(Sa,Rc)1Np-QUINAPHOS RuCl2(dmf)2], [(R)-P-Phos Ru(acac)2], [(R)-Xyl-P-Phos Ru(acac)2] или [(R)-Xyl-P-Phos RuCl(бензол)]Cl; или
- переходный металл иридий и хиральный лиганд, такой как лиганд P-Phos, BoPhoz, SimplePHOX или РНОХ. Например, катализатор переходного металла включает переходный металл иридий и хиральный лиганд, такой как (S)-P-Phos, (S)-Xyl-P-Phos, (S)-MeBoPhoz, (R)-MeBoPhoz, (S)-Cy-TpeTBu-SimplePHOX или (S)-изоPr-PHOX. Особенно подходящими катализаторами переходного металла являются, например: [(S)-P-Phos Ir(COD)]Cl, [(S)-Xyl-P-Phos Ir(COD)]Cl, [(S)-MeBoPhoz Ir(COD)]Cl, [(R)-MeBoPhoz Ir(COD)]Cl, [(S)-Cy-третBu-simplePHOX Ir(COD)]BArF или [(S)-изоPr-PHOX Ir(COD)]BArF.
При использовании этих комбинаций, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 80 к 20, более предпочтительно по крайней мере 97 к 3, наиболее предпочтительно по крайней мере 99 к 1.
В четвертом варианте осуществления, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-b) или их солей к соединениям формулы (1-а) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 70 к 30, более предпочтительно по крайней мере 76 к 24.
В одном варианте осуществления, катализатор переходного металла включает, например:
- переходный металл родий и хиральный лиганд, такой как лиганд PhanePhos, BoPhoz, JafaPhos, CatASium, ВШАМ или NorPhos. Например, катализатор переходного металла включает переходный металл родий и хиральный лиганд, такой как (S)-PhanePhos, (S)-MeBoPhoz, (R)-JafaPhos, (S)-CatASium M, (R)-BINAM-P или (R,R)-Norphos. Особенно подходящими катализаторами переходного металла являются, например: [(S)-PhanePhos Rh(COD)]BF4, [(S)-MeBoPhoz Rh(COD)]BF4, [(R)-JafaPhos Rh(COD)]BF4, [(S)-CatASium M Rh(COD)]BF4, [(R)-BINAM-P Rh(COD)]BF4 или [(R,R)-NorPhos Rh(COD)]BF4;
- переходный металл рутений и хиральный лиганд, такой как лиганд PhanePhos, P-Phos, BINOL, QUINAPHOS, BoPhoz или BINAP. Например, катализатор переходного металла включает переходный металл рутений и хиральный лиганд, такой как (S)-Xyl-PhanePhos, (S)-Xyl-P-Phos, (R)-BINOL-(R)-MeBoPhoz, (Ra,Sc)1Np-QUINAPHOS или (R)-Tol-BINAP. Особенно подходящими катализаторами переходного металла являются, например, [(S)Xyl-PhanePhos RuCl2(dmf)2], [(S)Xyl-P-Phos RuCl2(dmf)2], [(R)BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(Ra,Sc)1Np-QUINAPHOS RuCl2(dmf)2] или [(R)Tol-BINAP RuCl(бензол)]Cl; или
- переходный металл иридий и хиральный лиганд, такой как лиганд P-Phos или BoPhoz, например, (S)-Xyl-P-Phos или (S)-MeBoPhoz. Особенно подходящими катализаторами переходного металла являются, например, [(S)-Xyl-P-Phos Ir(COD)]Cl или [(S)-MeBoPhoz Ir(COD)]Cl.
При использовании этих комбинаций восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-b) или их солей к соединениям формулы (1-а) или их солям составляет по крайней мере 55 к 45, предпочтительно по крайней мере 70 к 30, более предпочтительно по крайней мере 76 к 24.
В пятом предпочтительном варианте осуществления, восстановление соединения формулы (2-а) или его соли приводит к получению композиции, включающей соединения формул (1-а) и (1-b) или их соли, где молярное соотношение соединений формулы (1-а) или их солей к соединениям формулы (1-b) или их солям составляет по крайней мере 88 к 12, предпочтительно по крайней мере 90 к 10, более предпочтительно по крайней мере 99 к 1.
Раздел Г: Превращение соединения формулы (7) в соединение формулы (1) через соединение формулы (3)
Способы в соответствии с настоящим изобретением для превращения соединения формулы (7), как здесь описано, в соединение формулы (3), как здесь описано, представлены на схеме 5.
Схема 5
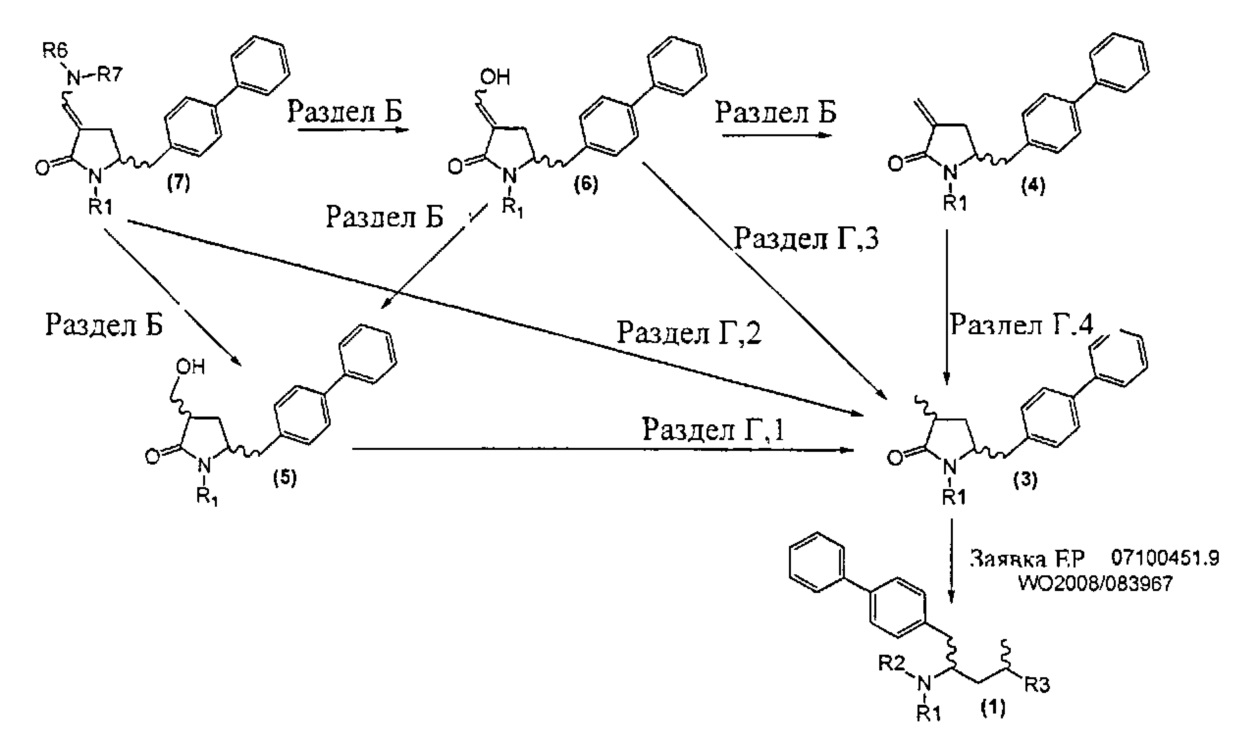
Так, в другом варианте осуществления настоящее изобретение относится к превращению соединения формулы (7), как здесь описано, в соединение формулы (3), как здесь описано, по любому из способов 1-5, где
способ 1 включает:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (5), и
б) любой один из способов раздела Г,1 для превращения соединения (5) в соединение (3);
способ 2 включает любой один из способов раздела Г,2 для превращения соединения (7) в соединение (3);
способ 3 включает:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (6),
б) любой один из способов раздела Б для превращения соединения (6) в соединение (5), и
в) любой один из способов раздела Г,1 для превращения соединения (5) в соединение (3);
способ 4 включает:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (6), и
б) любой один из способов раздела Г,3 для превращения соединения (6) в соединение (3);
способ 5 включает:
а) любой один из способов раздела Б для превращения соединения (7) в соединение (6),
б) любой один из способов раздела Б для превращения соединения (6) в соединение (4), и
в) любой один из способов раздела Г,4 для превращения соединения (4) в соединение (3);
в частности способами 1, 2, 4 или 5; особенно способом 5.
Как описано далее, разделы Г,1, Г,2, Г,3 и Г,4 также являются предпочтительными вариантами осуществления настоящего изобретения.
Раздел Г,1: Превращение соединения формулы (5) в соединение формулы (3)
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (3):
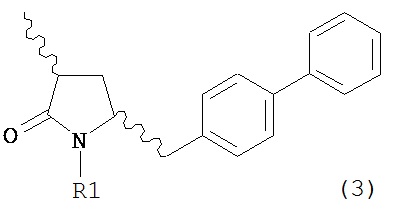
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) превращение соединения формулы (5) или его соли:
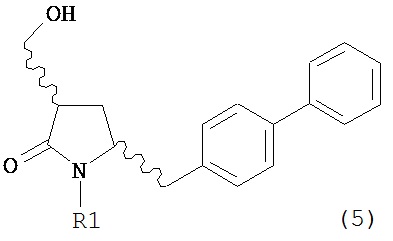
где R1 представляет собой водород или защитную группу для азота, в соединение формулы (12):
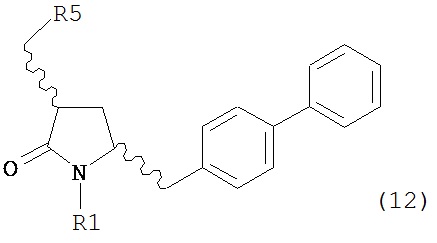
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; и
б) реакцию соединения формулы (12) или его соли с восстанавливающим агентом с получением соединения формулы (3).
Стадии а) и б) как таковые также составляют вариант осуществления настоящего изобретения.
В предпочтительном варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (3-а):
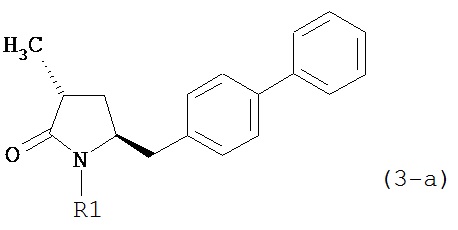
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему:
а) превращение соединения формулы (5-b) или его соли:
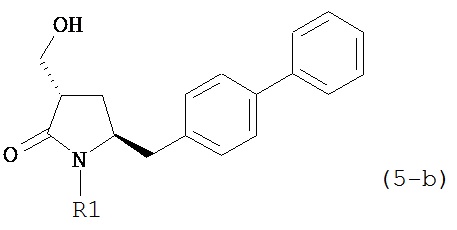
где R1 представляет собой водород или защитную группу для азота, в соединение формулы (12-b):
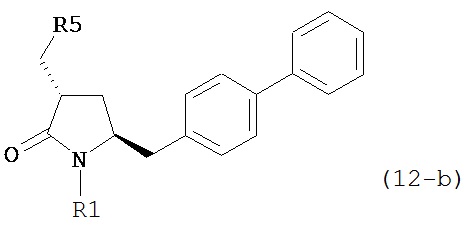
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; и
б) реакцию соединения формулы (12-b) или его соли с восстанавливающим агентом с получением соединения формулы (3).
Обычные восстанавливающие агенты хорошо известны из предшествующего уровня техники и могут быть обнаружены, например, в соответствующих главах стандартных источниках, таких как книга P.G.М. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-oe издание, Wiley, New Jersey, 2007, и включают:
- гидриды (например, литийалюмогидрид, боргидрид натрия, цианоборгидрид натрия), металлы (например, цинк, дихлорид олова, гидрид трибутилолова, литий), гидрирование (например, водород и катализатор гидрирования, такой как Pd/C, например, как описано в разделе Б,3,3) [особенно когда R5=галогенид],
- гидриды (например, литийалюмогидрид, боргидрид натрия, диизобутилалюмогидрид) или гидрид трибутилолова - йодид натрия, [особенно когда R5=сульфонат].
Обычно, эти способы работают как с галогенидами, так и с сульфонатами.
Стадии а) и б) как таковые также составляют предпочтительный вариант осуществления настоящего изобретения.
Превращение OH-группы в уходящую группу и последующая обработка восстанавливающим агентом являются хорошо известными специалисту в данной области техники реакциями, например, как описано в книге Richard С. Larock, "Comprehensive Organic Transformations: A Guide to Functional Group Preparations", 2-ое издание, Wiley-VCH Verlag GmbH, 2000, в частности, как описано в ее соответствующих главах. Предпочтительными уходящими группами являются галоген, такой как бром или йод, или сульфонатная группа, такая как тозилат, мезилат или трифлат. Предпочтительными восстанавливающими агентами являются, например, гидриды (LiAlH4, NaBH4) и водород в присутствии катализаторов гидрирования (например, Pd/C) [см. раздел Б,3,3 выше].
Раздел Г,2: Превращение соединения формулы (7) в соединение формулы (3)
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (3):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (7):
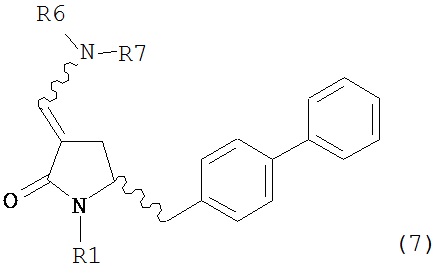
или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
восстанавливающим агентом с получением соединения формулы (3) или его соли, где R1 представляет собой водород или защитную группу для азота, предпочтительно формул (3-а) или (3-b), более предпочтительно формулы (3-а):

 .
.
В предпочтительном варианте осуществления, исходное соединение формулы (7) или его соль имеет формулу (7-а) или его соль, как определено выше; более предпочтительно, исходное соединение имеет формулы (7b) или (7с) или их соли, как определено выше.
Предпочтительными восстанавливающими агентами являются, например, водород в присутствии катализаторов гетерогенного гидрирования, например, палладий или платина на твердом носителе, например, на угле, оксиде алюминия, карбонате бария или карбонате кальция, в частности на угле, алюминие или карбонате бария. Предпочтительно, используются палладий на угле (Pd/C) или палладий на карбонате кальция (Pd/СаСО3) с содержанием свинца (известный как катализатор Линдлара), в частности палладий на угле (Pd/C).
В предпочтительном варианте осуществления восстановление соединения формулы (7-а) или его соли приводит к получению композиции, включающей соединения формул (3-а) и (3-b) или их соли, где молярное соотношение соединений формулы (3-а) или их солей к соединениям формулы (3-b) или их солям составляет по крайней мере 88 к 12, предпочтительно по крайней мере 90 к 10, более предпочтительно по крайней мере 99 к 1.
Раздел Г,3: Превращение соединения формулы (6) в соединение формулы (3)
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (3):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему обработку соединения формулы (6):
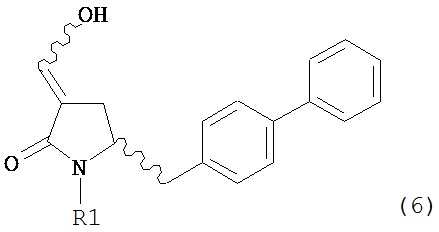
или его соли, где R1 представляет собой водород или защитную группу для азота,
восстанавливающим агентом, например, как описано в разделе Б,3,3, с получением соединения формулы (3) или его соли, где R1 представляет собой водород или защитную группу для азота, предпочтительно формул (3-а) или (3-b), как здесь определено, более предпочтительно формулы (3-а), как здесь определено.
В предпочтительном варианте осуществления, исходное соединение формулы (6) или его соль имеет формулу (6-а) или его соль, как здесь определено.
В предпочтительном варианте осуществления, восстановление соединения формулы (6-а) или его соли приводит к получению композиции, включающей соединения формул (3-а) и (3-b) или их соли, где молярное соотношение соединений формулы (3-а) или их солей к соединениям формулы (3-b) или их солям составляет по крайней мере 88 к 12, предпочтительно по крайней мере 90 к 10, более предпочтительно по крайней мере 99 к 1.
Раздел Г,4: Восстановление соединения формулы (4)
В другом варианте осуществления, настоящее изобретение относится к способу получения соединения формулы (3):
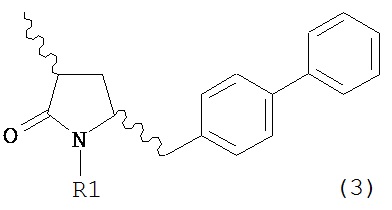
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающему восстановление соединения формулы (4):
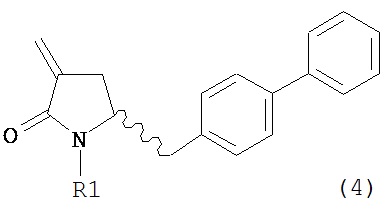
или его соли,
где R1 представляет собой водород или защитную группу для азота, с получением соединения формулы (3).
Предпочтительно, соединение формулы (4-а) или его соль:
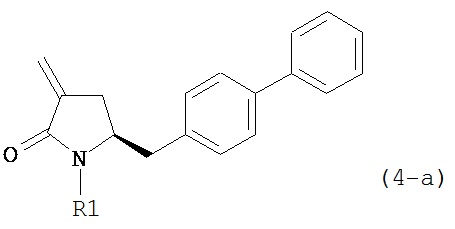
где R1 представляет собой водород или защитную группу для азота, используют в качестве исходного соединения. Если соединение (4-а) или его соль используют в качестве исходного соединения, могут быть получены соединения формулы (3-а) и формулы (3-b) как здесь определено.
Предпочтительно R1 представляет собой BOC.
В предпочтительном варианте осуществления, восстановление соединения формулы (4) или его соли проводят в водороде в присутствии катализатора переходного металла, предпочтительно в присутствии катализатора переходного металла и хирального лиганда. Восстановление может проводиться в условиях гетеро- или гомогенного гидрирования, предпочтительно в условиях гомогенного гидрирования.
В одном варианте осуществления, восстановление соединения формулы (4) или его соли проводят в условиях гетерогенного гидрирования.
Обычно, гетерогенное гидрирование осуществляют в присутствии катализатора переходного металла, где переходный металл выбран из группы 9 или 10 периодической таблицы. Следовательно, катализатор переходного металла включает, например, кобальт (Co), родий (Rh), иридий (Ir), никель (Ni), палладий (Pd) и/или платину (Pt). В частности, катализатор переходного металла представляет собой Pt, Pd или Rh, предпочтительно на твердом носителе, таком как уголь. В одном варианте осуществления катализатор переходного металла представляет собой Pt на угле (Pt/C) или Pd на угле (Pd/C).
Гетерогенное гидрирование соединения формулы (4) или его соли приводит к получению композиции, включающей соединения формул (3-а и (3-b) или их соли, где молярное соотношение соединений формулы (3-b) или их солей к соединениям формулы (3-а) или их солям составляет по крайней мере 67 к 33, предпочтительно по крайней мере 85 к 15.
Гетерогенное гидрирование обычно осуществляют в растворителе, таком как простые эфирные растворители (например, ТГФ), сложноэфирные растворители (например, изопропилацетат) или спиртовые растворители (например, изопропанол, этанол или метанол); в частности спиртовой или простой эфирный растворитель, такой как этанол или изопропилацетат. В одном вариант осуществления, Pd/C используют с этанолом или изопропилацетатом в качестве растворителя. В другом варианте осуществления, Pt/C используют с изопропилацетатом в качестве растворителя.
Обычно, гомогенное гидрирование осуществляют в присутствии катализатора переходного металла, где переходный металл выбран из группы 8 или 9 периодической таблицы. Следовательно, катализатор переходного металла включает, например, переходный металл железо (Fe), рутений (Ru), осмий (Os), кобальт (Co), оРдий (Rh) и/или иридий (Ir).
В предпочтительном варианте осуществления, катализатор переходного металла включает металлоорганический комплекс и необязательно хиральный лиганд.
Металлоорганический комплекс включает переходный металл, выбранный из группы 8 или 9 периодической таблицы, например, переходный металл родий, иридий или рутений, в частности родий или рутений. Металлоорганические комплексы могут включать один атом переходного металла. В предпочтительных вариантах осуществления комплексы могут включать два или более атомов переходного металла, необязательно включающих связь металл-металл. В предпочтительном варианте осуществления два атома металла связаны через два галогенида. Обычно, металлоорганический комплекс включает один или несколько атомов переходного металла и подходящие ахиральные лиганды.
Подходящими ахиральными лигандами для металлоорганического комплекса обычно являются σ-донорные лиганды, σ-донорные/π-акцепторные лиганды или σ,π-донорные/π-акцепторные лиганды. Примерами подходящих ахиральных лигандов являются, среди прочего, моноксид углерода, галогениды (например, Cl, I или Br), фосфины [например, трициклогексилфосфин (PCy3)], алкенилы (например, cod, nbd, 2-металлил), алкинилы, арилы (например, пиридин, бензол, п-цимен), карбонилы (например, асас, трифторацетат или диметилформамид) и их смеси.
Примерами предпочтительных ахиральных лигандов для металлоорганического комплекса являются: норборнадиен (nbd), циклооктадиен (cod), пиридин (pyr), цимен, в частности п-цимен, и йодид
Примерами металлоорганических комплексов являются: металлоорганический комплекс рутения, такой как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2]; металлоорганический комплекс родия, такой как [Rh(nbd)2BF4] или [Rh(cod)2]BF4; или металлоорганический комплекс иридия, такой как [(Cy3P)Ir(pyr)]Cl или [Ir(cod)2Cl]2; в частности [Ru(cod)(2-металлил)2], [Ru(cod)(OOCCF3)2] или [RuI2(п-цимен)]2; в частности [Rh(NBD)2]BF4, [Ru(COD)(OOCCF3)2] или [RuCl2(п-цимен)2].
Катализатор переходного металла включает металлоорганический комплекс и хиральный лиганд. Хиральный лиганд включает, например, хиральный фосфин и/или хиральный ферроцен. В частности, хиральный ферроцен включает Ср-лиганд, который замещен хиральной группой, такой как хиральный амин, хиральный фосфин или хиральный алкил, например, как здесь описано.
Подходящими хиральными лигандами являются, например, лиганд Atropisomer (например, SL-A101-2), лиганд Fenphos (например, SL-F115-1), лиганд Mandyphos (например, SL-M004-2), лиганд Walphos (например, SL-W008-1), лиганд Josiphos (например, SL-J504-1 или SL-J002-2) или их смеси. Лиганды Atropisomer, лиганды Fenphos, лиганды Mandyphos, лиганды Walphos и лиганды Josiphos имеют формулы, описанные в разделе В,2.
Подходящими комбинациями металлоорганического комплекса и хирального лиганда являются, например:
- металлоорганический комплекс родия и лиганд Fenphos или Walphos; в частности [Rh(nbd)2]BF4 и SL-F115-1 или SL-W008-1; или
- металлоорганический комплекс рутения и лиганд Atropisomer, Mandyphos или Josiphos; в частности [RuI2(п-цимен)]2 или [Ru(COD)(OOCCF3)2 и SL-А101-2, SL-M004-2, SL-J504-1 или SL-J002-2.
В одном варианте осуществления, восстановление соединения формулы (4-а) или его соли приводит к получению композиции, включающей соединения формул (3-а) и (3-b) или их соли, где молярное соотношение соединений формулы (3-а) или их солей к соединениям формулы (3-b) или их солям составляет по крайней мере 88 к 12, предпочтительно по крайней мере 90 к 10, более предпочтительно по крайней мере 99 к 1.
В другом варианте осуществления восстановление соединения формулы (4-а) или его соли приводит к получению композиции, включающей соединения формул (3-а) и (3-b) или их соли, где молярное соотношение соединений формулы (3-а) или их солей к соединениям формулы (3-b) или их солям составляет по крайней мере 53 к 47, предпочтительно по крайней мере 71 к 29, более предпочтительно по крайней мере 82 к 18.
Альтернативными комбинациями металлоорганического комплекса и хирального лиганда являются, например:
- металлоорганический комплекс родия и лиганд Fenphos или Walphos; в частности [Rh(nbd)2]BF4 и SL-W008-1.
В другом варианте осуществления, восстановление соединения формулы (4-а) или его соли приводит к получению композиции, включающей соединения формул (3-а) и (3-b) или их соли, где молярное соотношение соединений формулы (3-b)или их солей к соединениям формулы (3-а) или их солям составляет по крайней мере 73 к 27.
Раздел Д:
В описанных выше способах участвуют некоторые новые и заявленные соединения. Следовательно, другими объектами настоящего изобретения являются представленные ниже соединения.
Соединение формулы (2):
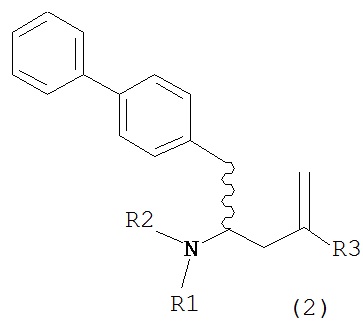
или его соль,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно имеющее конфигурацию формулы (2-а):
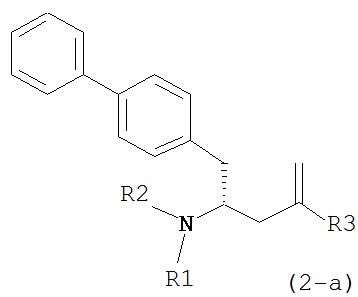 .
.
В предпочтительном варианте осуществления формул (2) или (2-а), R1 представляет собой BOC и/или R2 представляет собой Н.
В предпочтительном варианте осуществления формул (2) или (2-а), R3 представляет собой CO2H.
Соединение формулы (4):
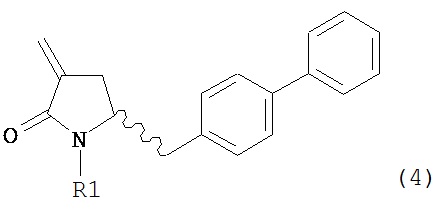
или его соль,
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (4-а):
 .
.
В предпочтительном варианте осуществления формул (4) или (4-а), R1 представляет собой ВОС или Piv.
Соединение формулы (5) или его соль:
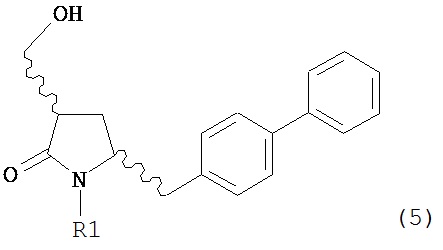 ,
,
где R1 представляет собой водород или защитную группу для азота, предпочтительно формул (5-а), (5-b) или (5-с), более предпочтительно (5-b):
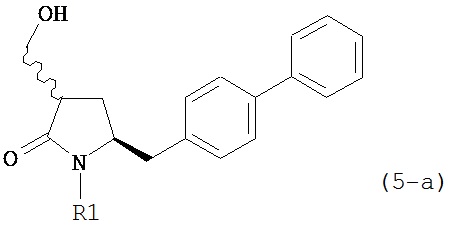 ,
,
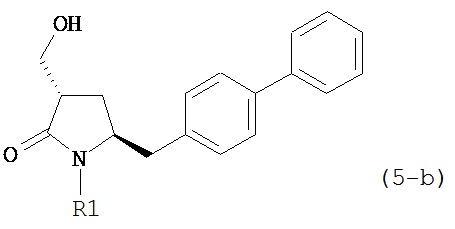 ,
,
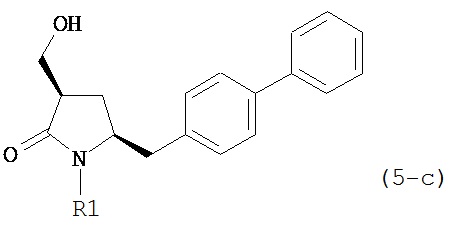 .
.
В предпочтительном варианте осуществления формул (5), (5-а), (5-b) или (5-с), R1 представляет собой BOC.
Соединение формулы (б) или его таутомер:
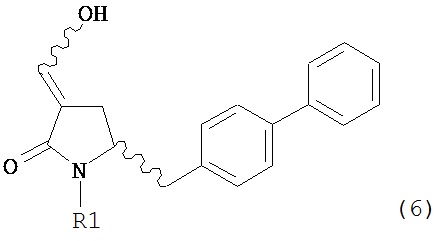
или его соль,
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (6-а):
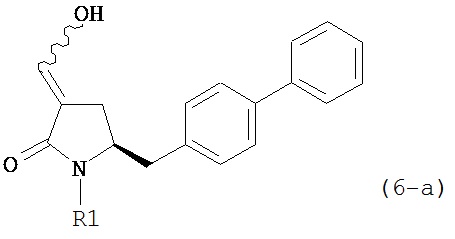 .
.
В предпочтительном варианте осуществления формул (6) или (6-а), R1 представляет собой BOC или Piv.
Соединение формулы (7) или его соль:
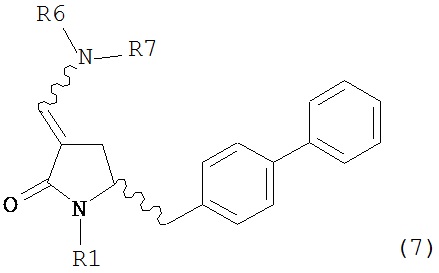
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющее конфигурацию формулы (7-а), (7-b) или (7-с), более предпочтительно (7-b):
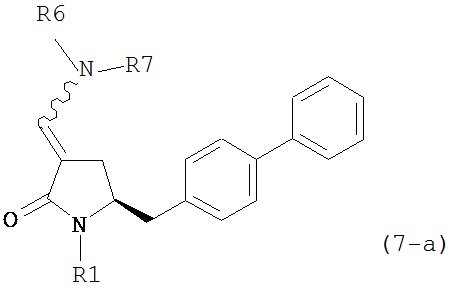
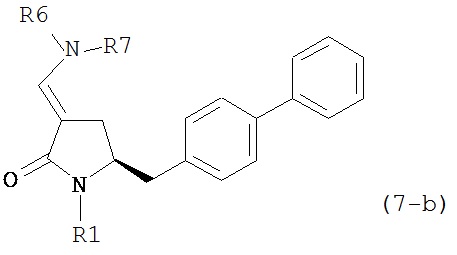 ,
,
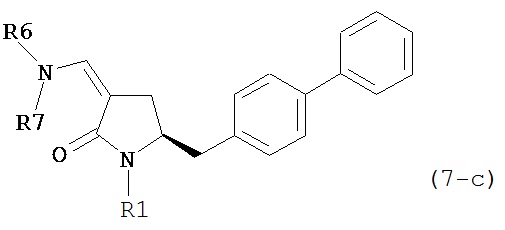 .
.
В предпочтительном варианте осуществления формул (7), (7-а) или (7-b), R1 представляет собой BOC или Piv.
В предпочтительном варианте осуществления формул (7), (7-а) или (7-b), R6 представляет собой метил или этил и/или R7 представляет собой метил или этил.
Соединение формулы (9-а) или его соль:
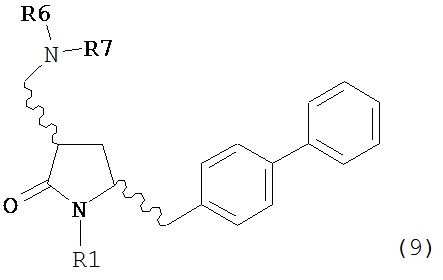
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, или вместе представляют собой алкиленовую группу, предпочтительно имеющее конфигурацию формулы (9-а) (9-b) или (9-с), более предпочтительно (9-b):
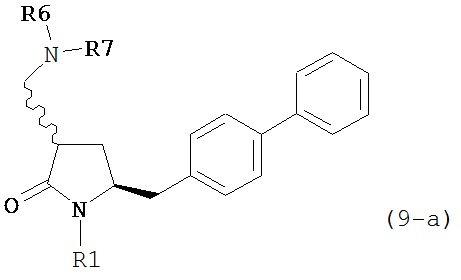
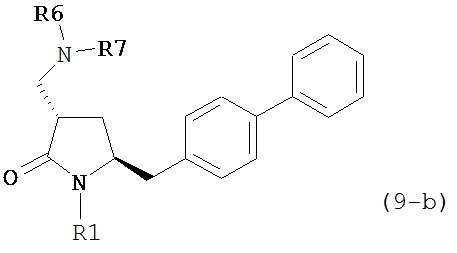 ,
,
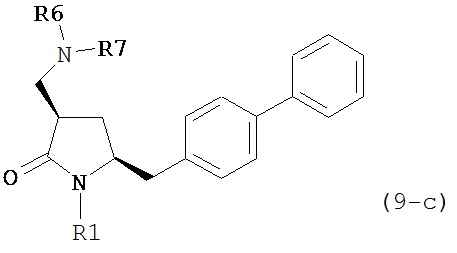 .
.
В предпочтительном варианте осуществления формул (9), (9-а), (9-b) или (9-с), R1 представляет собой Boc.
В предпочтительном варианте осуществления формул (9), (9-а), (9-b) или (9-е), R6 представляет собой метил и R7 представляет собой метил.
Соединение формулы (10) или его соль:
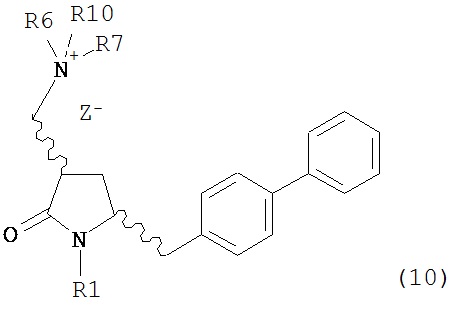
где R1 представляет собой водород или защитную группу для азота, R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, Z- представляет собой галогенид (например, йодид, бромид, хлорид), алкилсульфат (например, метилсульфат) или сульфониловый эфир (например, трифлат) и R10 представляет собой водород, алкил или арил; предпочтительно имеющее конфигурацию формулы (10-а), (10-b) или (10-c), более предпочтительно (10-b):

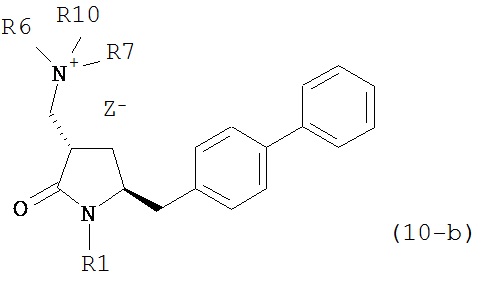 ,
,
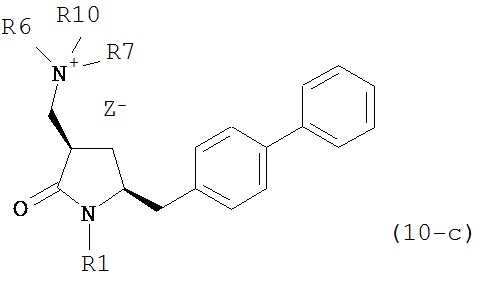 .
.
В предпочтительном варианте осуществления формул (10), (10-а), (10-b) или (10-с), R1 представляет собой Boc.
В предпочтительном варианте осуществления формул (10), (10-а), (10-b) или (10-b), R6 представляет собой метил, R7 представляет собой метил и/или R10 представляет собой метил.
Соединение формулы (11):
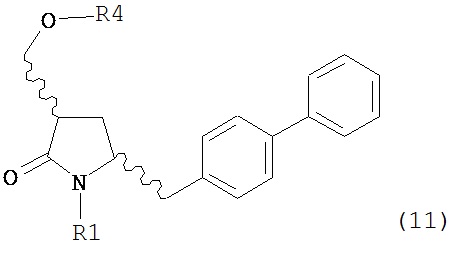
или его соль, где R1 представляет собой водород или защитную группу для азота и R4 представляет собой ОН-активирующую группу, предпочтительно имеющее конфигурацию формулы (11-а), (11-b) или (11-c), более предпочтительно (11-b):
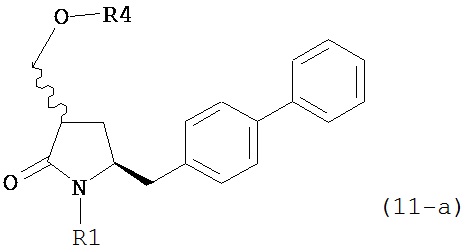
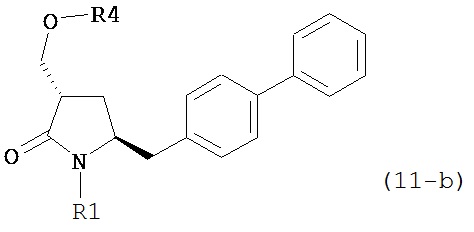
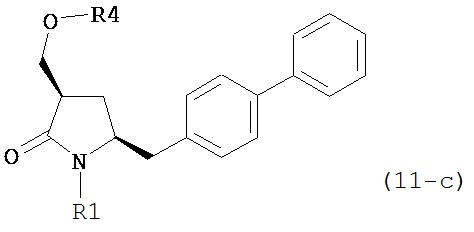 .
.
В предпочтительном варианте осуществления формул (11), (11-а), (11-b) или (11-с), R1 представляет собой Boc.
В предпочтительном варианте осуществления формул (11), (11-а), (11-b) или (11-c), R4 представляет собой мезилат.
Соединение формулы (12):
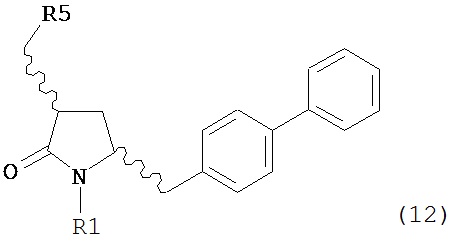
или его соль, где R1 представляет собой водород или защитную группу для азота и R5 представляет собой уходящую группу; предпочтительно формул (12-а), (12-b) или (12-е), более предпочтительно (12-b):
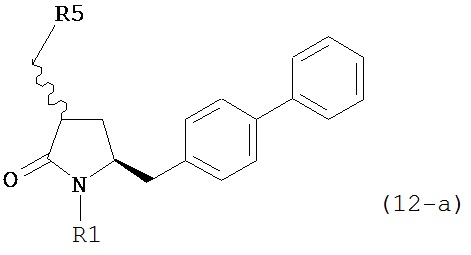 ,
,
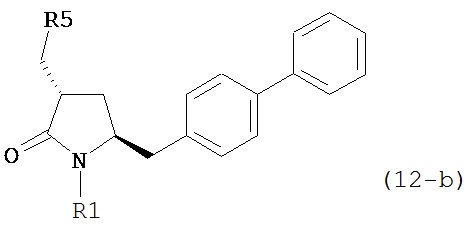 ,
,
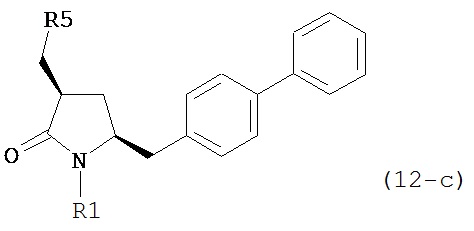 .
.
В предпочтительном варианте осуществления формул (12), (12-а), (12-b) или (12-c), R1 представляет собой Boc.
В предпочтительном варианте осуществления формул (12), (12-а), (12-b) или (12-c), R5 представляет собой галогенид, предпочтительно бромид или йодид.
Соединение формулы (16):

или его соль,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой O или S, и каждый R9 независимо представляет собой алкил, арил, арилалкил или ацетил,
предпочтительно имеющее конфигурацию формулы (16-а):
 .
.
В предпочтительном варианте осуществления формул (16) или (16-а), R1 представляет собой Boc.
В предпочтительном варианте осуществления формул (16) или (16-а), R9 представляет собой метил или этил.
В предпочтительном варианте осуществления формул (16) или (16-а), Y представляет собой кислород.
Общие термины:
Общие определения, используемые выше и ниже, если не определено иное, имеют следующие значения:
Термин "сложноэфирная группа" включает любой сложный эфир карбоксильной группы, обычно известный из предшествующего уровня техники; например, группы -COOR, где R выбран из группы, состоящей из: C1-6алкила, такого как метил, этил или трет-бутил, C1-6алкокси C1-6алкила, гетероциклила, такого как тетрагидрофуранил, C6-10арилокси C1-6алкила, такого как бензилоксиметил (ВОМ), силила, такого как триметилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил, циннамила, аллила, C1-6алкила, который моно-, ди- или тризамещен галогеном, силилом, цианогруппой или C1-6арилом, где арильное кольцо является незамещенным или замещено одним, двумя или тремя остатками, выбранными из группы, состоящей из C1-7алкила, C1-7алкоксигруппы, галогена, нитрогруппы, цианогруппы и CF3; или C1-2алкила, замещенного 9-флуоренилом. В предпочтительном варианте осуществления, "сложноэфирная группа" представляет собой -COOR, где R представляет собой C1-6алкильный остаток. В частности, R представляет собой метил или этил.
Термин "защитная группа для азота" включает любую группу, которая способна обратимо защитить азотную группу, предпочтительно амино- и/или амидогруппу. Предпочтительно защитная группа для азота представляет собой защитную группу для амина и/или защитную группу для амида. Подходящие защитные группы для азота обычно используют в пептидной химии, и они описаны, например, в соответствующих главах стандартных ссылок, таких как книги J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York, 1973, P.G.M. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007, "The Peptides"; T.3 (под ред.: E. Gross и J. Meienhofer), Academic Press, London and New York, 1981, и "Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, 4-ое издание, Т.15/I, Georg Thieme Verlag, Stuttgart, 1974.
Предпочтительные защитные группы для азота обычно включают:
C1-C6-алкил, предпочтительно C1-C4-алкил, более предпочтительно C1-C2-алкил, наиболее предпочтительно C1-алкил, который моно-, ди- или тризамещен триалкилсилилС1-C7алкокси (например, триметилсилилэтокси) арилом, предпочтительно фенилом, или гетероциклической группой, предпочтительно пирролидинилом, где арильное кольцо или гетероциклическая группа является незамещенной или замещена одним или несколькими, например, двумя или тремя остатками, например, выбранными из группы, состоящей из C1-C7алкила, гидроксигруппы, C1-C7-алкоксигруппы, C2-C8-алканоилоксигруппы, галогена, нитрогруппы, цианогруппы и CF3; арил-C1-C2-алкоксикарбонилом (предпочтительно фенил-С1-С2-алкоксикарбонилом, например, бензилоксикарбонилом); C1-C10алкенилоксикарбонилом; C1-C6алкилкарбонилом (например, ацетилом или пивалоилом); C6-C10арилкарбонилом; C1-C6алкоксикарбонилом (например, трет-бутоксикарбонилом); C6-C10арилC1-C6алкоксикарбонилом; аллилом или циннамилом; сульфонилом или сульфенилом; сукцинимидильной группой, силилом, например, триарилсилилом или триалкилсилилом (например, триэтилсилил).
Примерами предпочтительных защитных групп для азота являются ацетил, бензил, кумил, бензгидрил, тритил, бензилоксикарбонил (Cbz), 9-флуоренилметилоксикарбонил (Fmoc), бензилоксиметил (ВОМ), пивалоилоксиметил (РОМ), трихлопентоксикарбонил (Troc), 1-адамантилоксикарбонил (Adoc), аллил, аллилоксикарбонил, триметилсилил, трет-бутилдиметилсилил, триэтилсилил (TES), триизопропилсилил, триметилсилилэтоксиметил (SEM), трет-бутоксикарбонил (BOC), трет-бутил, 1-метил-1,1-диметилбензил, (фенил)метилбензол, пиридинил и пивалоил. Наиболее предпочтительными защитными группами для азота являются ацетил, бензил, бензилоксикарбонил (Cbz), триэтилсилил (TES), триметилсилилэтоксиметил (SEM), трет-бутоксикарбонил (ВОС), пирролидинилметил и пивалоил.
Примерами более предпочтительных защитных групп для азота являются пивалоильные, пирролидинилметильные, трет-бутоксикарбонильные, бензильные и силильные группы, особенно силильные группы формулы SiR11R12R13, где R11, R12 и R13 независимо друг от друга представляют собой алкил или арил. Предпочтительными примерами R11, R12 и R13 являются метил, этил, изопропил, трет-бутил и фенил.
Особенно предпочтительными защитными группами для азота являются пивалоил и трет-бутоксикарбонил (BOC).
Алкил, определенный как радикал или часть радикала, представляет собой линейную или разветвленную (один или, если необходимо и возможно, несколько раз) углеродную цепь, и особенно представляет собой C1-C7алкил, предпочтительно C1-C4-алкил.
Термин "C1-C7" обозначает группу, содержащую до и включая максимально 7, особенно до и включая максимально 4 атома углерода, причем указанная группа является разветвленной (один или несколько раз) или линейной, и присоединенной через терминальный или нетерминальный атом углерода.
Циклоалкил, например, представляет собой C3-C7-циклоалкил и, например, представляет собой циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Циклопентил и циклогексил являются предпочтительными.
Алкоксигруппа, например, представляет собой C1-C7-алкоксигруппу и, например, представляет собой метоксигруппу, этоксигруппу, н-пропилоксигруппу, изопропилоксигруппу, н-бутилоксигруппу, изобутилоксигруппу, втор-бутилоксигруппу, трет-бутилоксигруппу, а также включает соответствующие пентилокси-, гексилокси- и гептилоксирадикалы. C1-C4алкоксигруппа является предпочтительной.
Алканоил, например, представляет собой C2-C8-алканоил и, например, представляет собой ацетил [-С(=O)Ме], пропионил, бутирил, изобутирил или пивалоил. C2-C5-Алканоил является предпочтительным, особенно ацетил.
Гало или галоген предпочтительно представляет собой фтор, хлор, бром или йод, наиболее предпочтительно, хлор, бром или йод.
Галогеналкил, например, представляет собой галоген-C1-C7алкил и в частности галоген-C1-C4алкил, такой как трифторметил, 1,1,2-трифтор-2-хлорэтил или хлорметил. Предпочтительный галоген-C1-C7алкил представляет собой трифторметил.
Алкенил может быть линейным или разветвленным алкилом, содержащим двойную связь, и включающим предпочтительно от 2 до 12 атомов C, причем от 2 до 10 атомов C являются особенно предпочтительными. Особенно предпочтительным является линейный C2-C4алкенил. Некоторыми примерами алкильных групп являются этил и изомеры пропила, бутила, пентила, гексила, гептила, октила, нонила, децила, ундецила, додецила, тетрадецила, гексадецила, октаацила и эйкозила, каждый из которых содержит двойную связь. Особенно предпочтительным является аллил.
Алкилен представляет собой бивалентный радикал, полученный из C1-C7алкила, и особенно представляет собой C2-C7-алкилен или C2-C7-алкилен и, необязательно, может прерываться одним или несколькими, например, вплоть до трех раз, О, NR14 или S, где R14 представляет собой алкил, каждый из которых может быть незамещенным или замещенным, одним или несколькими заместителями, независимо выбранными, например, из C1-C7-алкила, C1-C7-алкокси-C1-C7-алкила или C1-C7-алкоксигруппы.
Алкенилен представляет собой бивалентный радикал, полученный из C2-C7алкенила, и может прерываться одним или несколькими, например, вплоть до трех раз О, NR14 или S, где R14 представляет собой алкил, и является незамещенным или замешен одним или несколькими, например, вплоть до трех раз заместителями, предпочтительно независимо выбранными из заместителей, описанных выше для алкилена.
Арил как радикал или часть радикала представляет собой, например, C6-C10арил, и предпочтительно представляет собой моно- или полициклическую, особенно моноциклическую, бициклическую или трициклическую арильную группу, содержащую от 6 до 10 атомов углерода, предпочтительно фенил, и которая может быть незамещенной или замещена одним или несколькими заместителями, независимо выбранными, например, из C1-C7-алкила, С1-С7-алкокси-C1-C7-алкила или C1-C7алкоксигруппы.
Термин арилалкил обозначает арил-C1-C7-алкил, где арил является таким, как здесь определено, и представляет собой, например, бензил.
Термин карбоксил обозначает -CO2H.
Арилокси обозначает арил-О-, где арил является таким, как определено выше.
Незамещенный или замещенный гетероциклил представляет собой моно- или полициклическую, предпочтительно моно-, би- или трициклическую, наиболее предпочтительно моно-, ненасыщенную, частично насыщенную, насыщенную или ароматическую кольцевую систему, содержащую предпочтительно от 3 до 14 (более предпочтительно от 5 до 14) атомов в кольце и один или несколько, предпочтительно 1-4 гетероатома, независимо выбранных из азота, кислорода, серы, S(=O)- или S-(=O)2, и является незамещенным или замещен одним или несколькими, например, вплоть до трех раз заместителями, предпочтительно независимо выбранными из предпочтительных заместителей, выбранных из группы, состоящей из галогена, C1-C7-алкила, галоген-C1-C7-алкила, C1-C7-алкоксигруппы, галоген-C1-C7-алкоксигруппы, такой как трифторметоксигруппа и C1-C7-алкокси-C1-C7--алкоксигруппа. Когда гетероциклил представляет собой ароматическую циклическую систему, она также обозначает гетероарил.
Ацетил представляет собой -C(=O)C1-C7алкил, предпочтительно - С(=O)Ме.
Силил представляет собой -SiRR'R'', где R, R' и R'' независимо друг от друга представляют собой C1-C7алкил, арил или фенил-C1-C4алкил.
Сульфонил представляет собой (незамещенный или замещенный) C1-C7-алкилсульфонил, такой как метилсульфонил, (незамещенный или замещенный) фенил- или нафтил-C1-C7-алкилсульфонил, такой как фенилметансульфонил, или (незамещенный или замещенный) фенил- или нафтилсульфонил; где в случае наличия более одного заместителя, например, 1-3 заместителя, заместители независимо выбраны из цианогруппы, галогена, галоген-C1-C7алкила, галоген-C1-C7-алкилокси- и C1-C7-алкилоксигруппы. Особенно предпочтительным является C1-C7-алкилсульфонил, такой как метилсульфонил, и (фенил- или нафтил)-C1-C7-алкилсульфонил, такой как фенилметансульфонил.
Сульфенил представляет собой (незамещенный или замещенный) C6-C10арил-C1-C7-алкилсульфенил или (незамещенный или замещенный) C6-C10арилсульфенил, где в случае наличия более одного заместителя, например, 1-3 заместителя, заместители независимо выбраны из нитрогруппы, галогена, галоген-C1-C7алкила и C1-C7-алкилоксигруппы.
"Гетерогенный" катализатор как здесь используется обозначает катализатор на носителе, обычно, хотя не обязательно, веществе, содержащем неорганический материал, например, пористый материал, такой как уголь, оксид кремния и/или оксид алюминия. В одном варианте осуществления, гетерогенный катализатор представляет собой катализатор гидрирования, в частности катализаторы, описанные в разделе Г,4.
"Гомогенный" катализатор как здесь используется обозначает катализатор, который не нанесен на носитель. В одном варианте осуществления, гомогенный катализатор представляет собой катализатор гидрирования, в частности катализаторы, описанные в разделе Г,4.
Термин "катализатор переходного металла" обозначает металлоорганический катализатор, металлоорганический комплекс или металлоорганический комплекс и хиральный лиганд. Катализаторы переходного металла в частности представляют собой катализаторы, описанные в разделах В,1, Б,3,3 и Г,4.
Термин "металлоорганический комплекс" обозначает комплексы, полученные из переходного металла и одного или нескольких (например, вплоть до четырех) ахиральных (нехиральных) лигандов; например, металлоорганические комплексы рутения, такие как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2]; металлоорганические комплексы родия, такие как [Rh(nbd)2BF4] или [Rh(cod)2]BF4; или металлоорганические комплексы иридия, такие как [(Cy3P)Ir(pyr)]Cl или [Ir(cod)2Cl]2.
Термин "металлоорганический катализатор" обозначает катализаторы, полученный из переходного металла и одного или нескольких (например, вплоть до четырех) хиральных лигандов.
Термин "лиганд" обозначает любое соединение, ахиральное или хиральное, которое может образовывать комплекс с переходным металлом. Хиральный и ахиральный лиганды в частности являются такими, как описано в разделе В, 1.
Термин "катализатор" обозначает любое вещество, которое ускоряет скорость химической реакции при снижении энергии активации химической реакции.
Термин "порошок" обозначает катализатор с водой, содержащий от 0 до 30 мас.%.
Термин "соотношение субстрата к катализатору" (S/C) обозначает молярное соотношение исходных соединений или их солей к "катализатору переходного металла".
Термин "хиральный" обозначает молекулы, которые имеют свойство не-супернакладываться на их зеркальные отображения, тогда как термин "ахиральный" обозначает молекулы, которые являются наложенными на их зеркальные отображения.
Термин "таутомер" в частности обозначает енольный таутомер пирролидин-2-оновой группы соединений настоящего изобретения. Дополнительно, термин "таутомер" также относится в частности к альдегидному таутомеру соединений настоящего изобретения, например, соединений формулы (6), где такие соединения могут существовать в енольной или альдегидной форме или их смесях.
В формулах настоящего изобретения термин " " при C-sp3 представляет собой ковалентную связь, где стереохимия связи не определена. Это обозначает, что термин "
" при C-sp3 представляет собой ковалентную связь, где стереохимия связи не определена. Это обозначает, что термин " " при C-sp3 включает (S)-конфигурацию, а также (R)-конфигурацию соответствующего хирального центра. Более того, смеси также включены, например, смеси энантиомеров, такие как рацематы, в настоящее изобретение.
" при C-sp3 включает (S)-конфигурацию, а также (R)-конфигурацию соответствующего хирального центра. Более того, смеси также включены, например, смеси энантиомеров, такие как рацематы, в настоящее изобретение.
В формулах настоящего изобретения термин " " приа C-sp2 представляет собой ковалентную связь, где стереохимия или геометрия связи не определена. Это обозначает, что термин "
" приа C-sp2 представляет собой ковалентную связь, где стереохимия или геометрия связи не определена. Это обозначает, что термин " "при C-sp2 включает цис-(Z)-конфигурацию, а также транс(Е)-конфигурацию соответствующей двойной связи. Кроме того, смеси также включены, например, смеси изомеров по двойной связи, в настоящее изобретение.
"при C-sp2 включает цис-(Z)-конфигурацию, а также транс(Е)-конфигурацию соответствующей двойной связи. Кроме того, смеси также включены, например, смеси изомеров по двойной связи, в настоящее изобретение.
Соединения настоящего изобретения могут содержать один или несколько асимметричных центров. Предпочтительные абсолютные конфигурации являются такими, как указано здесь конкретно.
В формулах настоящего изобретения термин " " при C-sp3 указывает абсолютную стереохимию, (R)- или (S)-.
" при C-sp3 указывает абсолютную стереохимию, (R)- или (S)-.
В формулах настоящего изобретения термин " " при C-sp3 указывает абсолютную стереохимию, (R)- или (S)-.
" при C-sp3 указывает абсолютную стереохимию, (R)- или (S)-.
В формулах настоящего изобретения термин " " показывает связь Csp3-Csp3 или связь Csp2-Csp2.
" показывает связь Csp3-Csp3 или связь Csp2-Csp2.
Соли особенно представляют собой фармацевтически приемлемые соли или обычно соли любых описанных здесь промежуточных соединений, где соли не исключаются по химическим причинам, понятным специалисту в данной области техники. Они могут быть получены с солеобразующими группами, такими как основные или кислотные группы, которые могут существовать в дисоциированной форме по крайней мере частично, например, в диапазоне pH от 4 до 10 в водных растворах, или могут быть выделены особенно в твердой, особенно кристаллической форме.
Такие соли образуются, например, в виде кислотных аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединений или любых описанных здесь промежуточных соединений с основным атомом азота (например, имино или амино), особенно фармацевтически приемлемые соли. Подходящими неорганическими кислотами являются, например, галогенсодержащие кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновая, фосфоновая, сульфоновая или сульфаминовая кислоты, например, уксусная кислота, пропионовая кислота, молочная кислота, фумаровая кислота, янтарная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, бензойная кислота, метан- или этансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталенсульфоновая кислота, 1,5-нафталендисульфоновая кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота, или другие органические протонные кислоты, такие как аскорбиновая кислота.
В присутствии отрицательно заряженных радикалов, таких как карбоксирадикал или сульфорадикал, соли также могут быть образованы с основаниями, например, соли с металлом или аммонием, такие как соли с щелочным металлом или щелочноземельным металлом, например, соли натрия, калия, магния или кальция, или соли аммония с аммиаком или подходящими органическими аминами, такими как третичные моноамины, например, триэтиламин или три(2-гидроксиэтил)амин, или с гетероциклическими основаниями, например, N-этилпиперидином или N,N'-диметилпиперазином.
Когда основная группа и кислотная группа присутствуют в одной молекуле, любые описанные здесь промежуточные соединения также могут образовывать внутренние соли.
В целях выделения или очистки любых описанных здесь промежуточных соединений также возможно использование фармацевтически неприемлемых солей, например, пикратов или перхлоратов.
Ввиду близкой связи соединений и промежуточных соединений в свободной форме и в форме их солей, включая соли, которые могут использоваться в качестве промежуточных соединений, например, для очистки или идентификации соединений или их солей, любая ссылка на "соединения" и "промежуточные соединения'' выше и далее подразумевает также одну или несколько его солей, или смесь свободного соединения, промежуточного соединения или исходного материала и одной или нескольких их солей, каждый из которых включает также любой сольват или соль любого одного или нескольких из них, если это является подходящим и удобным и если конкретно не указано иное. Могут быть получены различные кристаллические формы, и поэтому они также включены.
Где используется множественное число для соединений, исходных материалов, промежуточных соединений, солей, фармацевтических препаратов, заболеваний, нарушений и им подобных, также подразумевается одно (предпочтительно) или несколько отдельных соединений, солей, фармацевтических препаратов, заболеваний, нарушений или им подобных, когда используется форма единственного числа, это подразумевает включение множественного или предпочтительно единственного числа.
Любые лактамы в соответствии с настоящим изобретением или их соли, где R1 представляет собой водород, могут быть превращены в соответствующий защищенный лактам или его соль, где R1 представляет собой защитную группу для азота, как определено выше, стандартными способами органической химии, известными специалисту в данной области техники, в частности, обычными способами защиты азотной группы, описанными в книгах J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York, 1973, P.G.M. Wuts и Т.W. Greene, "Greene's Protective Groups in Organic Synthesis', 4-ое издание, Wiley, New Jersey, 2007 и Richard C. Larock, "Comprehensive Organic Transformations: A Guide to Functional Group Preparations", 2-ое издание, Wiley-VCH Verlag GmbH, 2000, в частности, в соответствующих их главах.
Аналогично, любые лактамы в соответствии с настоящим изобретением или их соли, где R1 представляет собой защитную группу для азота, могут быть преобразованы в соответствующий лактам или его соль, где R1 представляет собой водород, стандартными способами органической химии, известными специалисту в данной области техники, в частности, обычными способами защиты азотной группы, описанными в указанных выше книгах, в частности, в соответствующих разделах.
Раздел Е: Примеры
Следующие примеры служат для иллюстрации изобретения без ограничения его объема, тогда как с другой стороны, они представляют предпочтительные варианты осуществления реакционных стадий, промежуточных соединений и/или способа настоящего изобретения.
Сокращения:
|
При ссылке на данные ЯМР могут использоваться следующие сокращения: s, синглет; d, дуплет; t, триплет; q, квартет; квинт., квинтет; m, мультиплет.
Пример 1: Метилсульфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me)

Смесь N,N-диметилформамида (7,31 г) и диметилсульфата (12,60 г) нагревали при 60°C в течение 4 ч. Затем добавляли диметиламин в ТГФ (100 мл, 2 М раствор) и толуол (15 мл), и полученную смесь перемешивали при кипении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, и фазы разделяли. Нижний слой промывали три раза безводным трет-бутилметиловым эфиром с получением метилсульфата N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me). 1Н ЯМР (C6D6), 7,95 (1Н), 3,70 (3H), 3,32 (6Н), 3,29 (6Н).
Пример 2: пара-Толуолсульфонат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me)
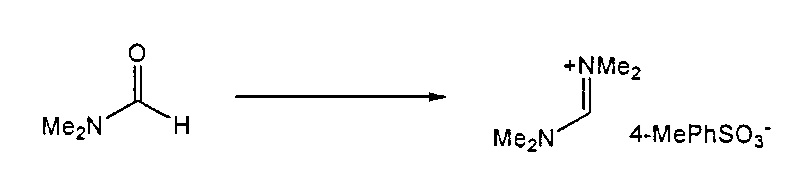
Смесь n-толуолсульфонилхлорида (20,0 г) и диметилформамида (38,3 г) выдерживали в течение 2 ч при комнатной температуре. Смесь затем перемешивали при 120°C в течение 2 ч. Смесь затем охлаждали до комнатной температуры, и осадки удаляли фильтрацией. Маточный раствор разбавляли ацетоном, и смесь охлаждали до 0°C. Фильтрация приводила к получению пара-толуолсульфоната N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) в виде белых кристаллов. 1Н ЯМР (D2O), 7,65-7,60 (2Н), 7,39 (1H), 7,30-7,25 (2Н), 3,14 (6Н), 3,05 (6Н), 2,31 (3Н).
Рентгеновская структура полученных кристаллов показана на фигуре 1.
Кристаллические данные [записано при 100 (2) К]
|
|
Пример 3: Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me)
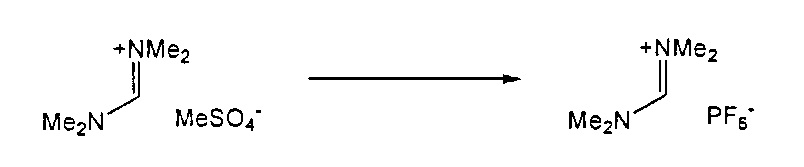
Метилсульфат N,N,N',N'-тетраметилформамидиния (3 г) добавляли в воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли в охлажденный раствор гексафторфосфата аммония (4,6 г) в воде (25 мл). Полученный осадок затем собирали фильтрацией. Осадок промывали холодной водой (2×10 мл) и затем диэтиловым эфиром (10 мл). Сушка в вакууме приводила к получению гексафторфосфата N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) в виде белого твердого вещества. 1Н ЯМР (ДМСО-d6), 7,90 (1Н), 3,26 (6Н), 3,14 (6Н).
Пример 4: Метилсульфат N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=ЕО
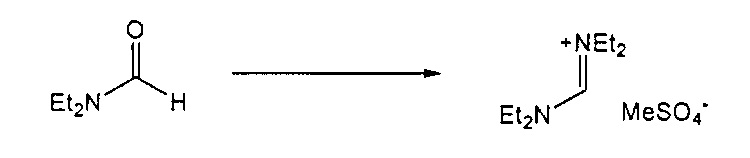
Смесь N,N-диэтилформамида (30 г) и диметилсульфата (37,5 г) нагревали при 50°C в течение 4 ч. Затем добавляли смесь диэтиламина (32,6 г) и толуола (20 мл), и полученную смесь перемешивали при кипении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, и фазы разделяли. Нижний слой промывали десять раз диэтиловым эфиром с получением метилсульфата N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=Et). 1H ЯМР (ДМСО-d6), 7,26 (1Н), 3,51 (8Н), 3,42 (3Н), 1,24 (12Н) ppm.
Пример 5: Тетрафторборат N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=Et)
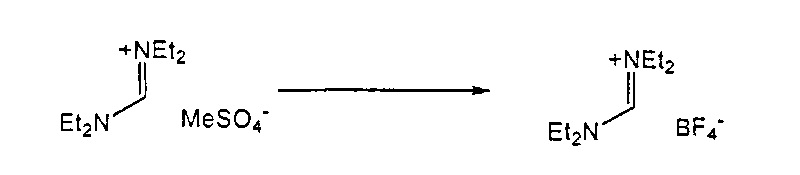
Метилсульфат N,N,N',N'-тетраэтилформамидиния (4 г) добавляли в воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли к охлажденному раствору тетрафторбората аммония (3,15 г) в воде (25 мл). Смесь затем экстрагировали дихлорметаном. Удаление дихлорметана приводило к получению тетрафторбората N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=Et) в виде белого твердого вещества. 1Н ЯМР (ДМСО-d6), 7,80 (1Н), 3,70-3,40 (8Н), 1,40-1,33 (12Н).
Рентгеновская структура полученных кристаллов показана на фигуре 2.
Кристаллические данные [записанные при 100(2) K]
|
|
Пример 6: Гексафторфосфат N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=Et)
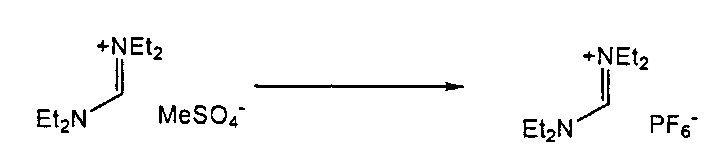
Метилсульфат N,N,N',N'-тетраэтилформамидиния (4 г) добавляли в воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли к охлажденному раствору гексафторфосфата аммония (4,9 г) в воде (25 мл). Полученный осадок собирали фильтрацией. Осадок затем промывали холодной водой (2×10 мл), и затем диэтиловым эфиром (10 мл). Сушка в вакууме приводила к получению гексафторфосфата N,N,N',N'-тетраэтилформамидиния (соединение 18, R6=Et, R7=Et) в виде желтого твердого вещества. 1Н ЯМР (ДМСО-d6), 7,92 (1Н), 3,85-3,54 (8Н), 1,45-1,38 (12Н).
Пример 7: Метилсульфат 1-пирролидин-1-илметиленпирролидиния (соединение 18, R6/R7=пирролидинил)
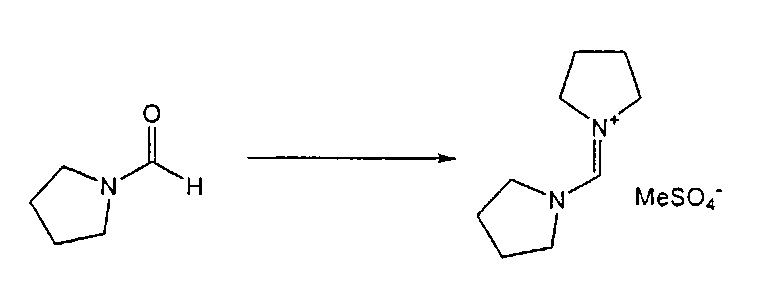
Смесь N-формилпирролидина (100 г) и диметилсульфата (126 г) нагревали при 80°C в течение 4 ч. Затем добавляли смесь пирролидина (71 г) и толуола (100 мл), и полученную смесь перемешивали при кипении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, и фазы разделяли. Нижний слой концентрировали в вакууме и обрабатывали диэтиловым эфиром. Осадок собирали фильтрацией и перекристаллизовывали, используя этилацетат, с получением метилсульфата 1-пирролидин-1- илметиленпирролидиния (соединение 18, R6/R7=пирролидинил). 1Н ЯМР (ДМСО-d6), 8,28 (1H), 3,90-3,85 (4Н), 3,68-3,62 (4Н), 3,38 (3Н), 1,99-1,90 (4Н), 1,86-1,77 (4Н).
Пример 8: Гексафторфосфат 1-пирролидин-1-илметиленпирролидиния (соединение 18, R6/R7=пирролидинил)
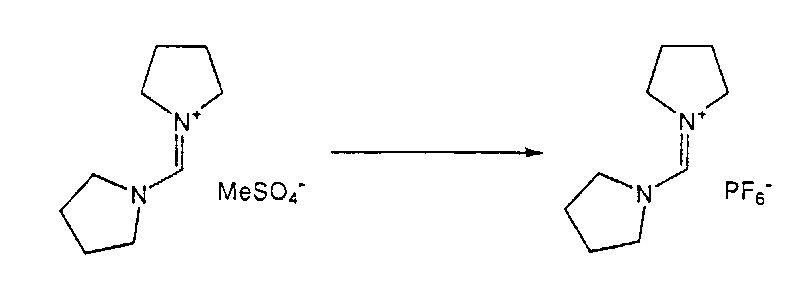
Метилсульфат 1-пирролидин-1-илметиленпирролидиния (5 г) добавляли в воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли к охлажденному раствору гексафторфосфата аммония (6,2 г) в воде (25 мл). Полученный осадок собирали фильтрацией. Осадок промывали холодной водой (2×10 мл) и затем диэтиловым эфиром (10 мл). Сушка в вакууме приводила к получению гексафторфосфата 1-пирролидин-1-илметиленпирролидиния (соединение 18, R6/R7=пирролидинил) в виде белого твердого вещества. tпл 229-231°C. 1Н ЯМР (ДМСО-d6), 8,25 (1Н), 3,91-3,83 (4Н), 3,67-3,60 (4Н), 1,99-1,90 (4Н), 1,86-1,77 (4Н).
Пример 9: Хлорид N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr)

Смесь оксихлорида фосфора (10,58 г) и диэтилового эфира (50 мл) перемешивали при 0°C в течение 10 мин. Затем по каплям добавляли диизопропилформамид (8,91 г) в диэтиловом эфире (20 мл) в течение 10 мин. Полученную смесь затем перемешивали при комнатной температуре в течение 30 мин. Полученный осадок оставляли, и супернатант удаляли. Затем к смеси добавляли дихлорметан (60 мл). Затем по каплям добавляли диизопропиламин (6,98 г) в дихлорметане (20 мл) при 0°C в течение 10 мин. Смесь затем нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Добавляли диэтиловый эфир (30 мл), и полученный осадок удаляли фильтрацией. Маточный раствор концентрировали в вакууме. Добавляли ацетон (30 мл), и смесь отфильтровывали. Маточный раствор затем концентрировали в вакууме, и затем перекристаллизовывали из диэтилового эфира (30 мл) с получением хлорида N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr). 1Н ЯМР (ДМСО-d6), 7,49 (1Н), 4,15-3,95 (4Н), 1,33 (12Н), 1,31 (12Н).
Пример 10: Гексафторфосфат N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr)

Смесь N,N-диизопропилформамида (10 г) в безводном дихлорметане (40 мл) добавляли к раствору оксихлорида фосфора (11,8 г) в дихлорметане (100 мл) при -78°C. Полученную смесь перемешивали в течение 30 мин при -78°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Смесь затем охлаждали до 0°C. К этой смеси по каплям добавляли раствор диизопропиламина (10,9 мл) и триэтиламина (10,7 мл) в дихлорметане (50 мл) в течение 30 мин. Реакционную смесь затем оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Смесь затем концентрировали в вакууме. Добавляли воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли к охлажденному раствору гексафторфосфата аммония (14,9 г) в воде (25 мл). Полученный осадок собирали фильтрацией. Осадок промывали холодной водой (2×10 мл), и затем диэтиловым эфиром (10 мл). Материал сушили в вакууме, и затем перекристаллизовывали из ацетона с получением гексафторфосфата N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr) в виде бесцветного твердого вещества. 1H ЯМР (ДМСО-d6), 7,48 (1Н), 4,15-4,00 (4Н), 1,36-1,29 (24Н).
Пример 11: Тетрафторборат N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr)
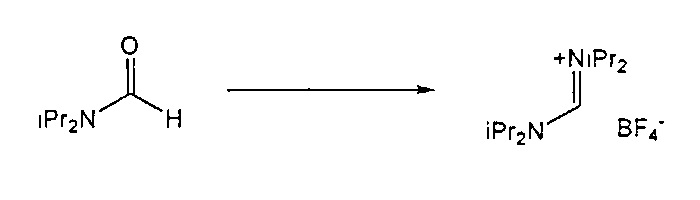
Смесь N,N-диизопропилформамида (10 г) в безводном дихлорметане (40 мл) добавляли к раствору оксихлорида фосфора (11,9 г) в дихлорметане (100 мл) при -78°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Смесь затем охлаждали до 0°C. К этой смеси по каплям добавляли раствор диизопропиламина (7,8 г) и триэтиламина (10,8 мл) в дихлорметане (50 мл) в течение 30 мин. Реакционную смесь затем оставляли медленно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь промывали водным раствором гидроксида натрия (20 мл, 2 М) и насыщенным раствором тетрафторбората натрия (13,2 г) и экстрагировали дихлорметаном. Органический слой сушили (MgSO4) и затем концентрировали в вакууме. Остаток переносили в ацетон. Добавление смеси диэтилового эфира и пентана (4:1, 20,5 мл) с последующей фильтрацией приводило к получению тетрафторбората N,N,N',N'-тетраизопропилформамидиния (соединение 18, R6=изоPr, R7=изоPr). 1Н ЯМР (ДМСО-d6), 7,48 (1Н), 4,15-3,95 (4Н), 1,35-1,30 (24Н).
Пример 12: Гексафторфосфат диизопропил(пиперидин-1-илметилиден)аммония (соединение 18, R6=изоPr, R7=пиперидинил)

Смесь N,N-диизопропилформамида (5 г) в безводном дихлорметане (40 мл) добавляли к раствору оксихлорида фосфора (5,9 г) в дихлорметане (100 мл) при -78°C. Полученную смесь перемешивали в течение 30 мин при -78°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение 2 ч. Смесь затем охлаждали до 0°C. К этой смеси по каплям добавляли раствор пиперидина (3,3 г) и триэтиламина (3,92 г) в дихлорметане (50 мл) в течение 30 мин. Реакционную смесь затем оставляли медленно нагреваться до комнатной температуры, и перемешивали в течение 2 ч. Смесь затем концентрировали в вакууме. Затем добавляли воду (25 мл), и полученную смесь охлаждали до 0°C. Эту смесь затем добавляли к охлажденному раствору гексафторфосфата аммония (6,3 г) в воде (25 мл). Осадок собирали фильтрацией. Осадок промывали холодной водой (2×10 мл) и затем диэтиловым эфиром (10 мл). Материал сушили в вакууме, и затем перекристаллизовывали из ацетона с получением гексафторфосфата диизопропил(пиперидин-1-илметилиден)аммония (соединение 18, R6=изоPr, R7=пиперидинил) в виде бесцветного твердого вещества. tпл 239-240°C. 1Н ЯМР (ДМСО-d6), 7,83 (1Н), 4,30-3,80 (2Н), 3,64-3,59 (4Н), 1,63-1,71 (6Н), 1,30-1,24 (12Н).
Рентгеновская структура полученных кристаллов показана на фигуре 3.
Кристаллические данные [записанные при 100(2) K]
|
Пример 13: Трис(морфолино)метан (соединение 13, R6/R7=морфолино)
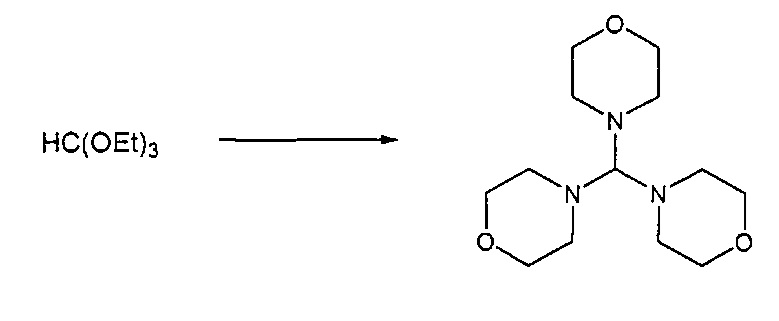
Смесь триэтилортоформиата (62,2 г), морфолина (54,5 г) и ледяной уксусной кислоты (1,26 г) перемешивали при 180°C в течение 5 ч. В это время образующийся этанол непрерывно удаляли дистилляцией. Реакционную смесь оставляли охлаждаться до комнатной температуры в течение ночи. Полученный осадок отфильтровывали и промывали гептаном. Твердое вещество перекристаллизовывали, используя толуол с получением трис(морфолино)метана, соединение 13 (R6/R7=морфолин). 1Н ЯМР (CDCl3), 3,66-3,60 (12Н), 3,26 (1Н), 2,80-2,70 (12Н).
Пример 14: Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me), трет-бутоксибис(диметиламино)метан (соединение 14, R6=Me, R7=Me, R8=третBu) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu)
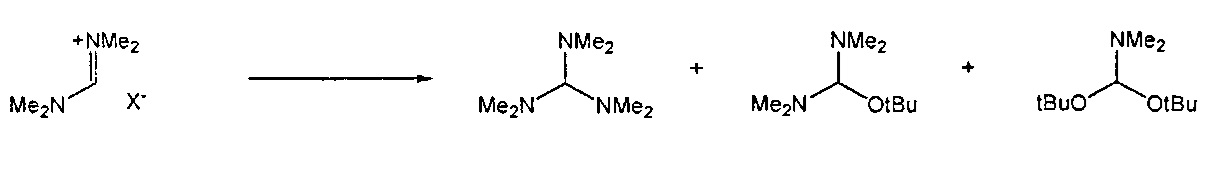
Способ 1
Метилсульфат N,N,N',N'-тетраметилформамидиния (5 г) (полученный в соответствии с примером 1, X=MeSO4) добавляли к раствору трет-бутоксида калия в ТГФ (23,6 мл, 1 М). Смесь затем перемешивали в течение 1 ч при 60°C. Реакционную смесь затем отфильтровывали в атмосфере аргона. Маточный раствор затем концентрировали в вакууме с получением остатка (1,60 г), содержащего соединения 13, 14 и 15 (R6=Me, R7=Me, R8=третBu). 1Н ЯМР (C6D6): 1,08, 1,16, 1,24, 2,29, 2,33, 3,02, 4,06, 5,00. Относительные количества соединения 13 (R6=Me; R7=Me), соединения 14 (R6=Me, R7=Me, R8=третBu), соединения 15 (R6=Me, R7=Me, R8=Me) определяли объединением сигналов при 3,02, 4,06 и 5,00 ppm, соответственно.
Способ 2
пара-Толуолсульфонат N,N,N',N'-тетраметилформамидиния (500 мг) (полученный в соответствии с примером 2, X=4-MePhSO3) добавляли к раствору трет-бутоксида калия в ТГФ (1,8 мл, 1 М). Смесь затем перемешивали в течение 1 ч при 50°C. Реакционную смесь затем отфильтровывали в атмосфере аргона. Маточный раствор затем концентрировали в вакууме с получением остатка, содержащего соединения 13, 14 и 15 (R6=Me, R7=Me, R8=третBu).
Способ 3
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (500 мг) (полученный в соответствии с примером 3, X=PF6) добавляли к раствору трет-бутоксида калия в ТГФ (2 мл, 1 М). Смесь затем перемешивали в течение 1 ч при 50°C. Реакционную смесь затем отфильтровывали в атмосфере аргона. Маточный раствор затем концентрировали в вакууме с получением остатка, содержащего соединения 13, 14 и 15 (R6=Me, R7=Me, R8=третBu).
Пример 15: Трис(диэтиламино)метан (соединение 13, R6=Et, R7=Et). трет-бутоксибис(диэтиламино)метан (соединение 14, R6=Et, R7=Et, R8=третBu) N,N-диэтилформамидди-трет-бутилацеталь (соединение 15, R6=Et, R7=Et, R8=третBu)
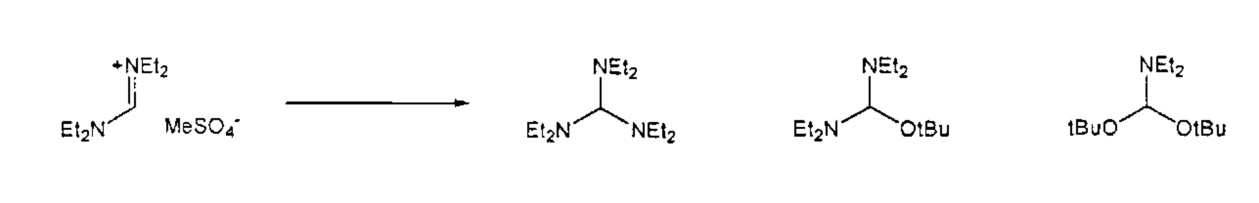
Способ 1
Метилсульфат N,N,N',N'-тетраэтилформамидиния (5 г) (полученный в соответствии с примером 4, X=MeSO4) добавляли к раствору трет-бутоксида калия в ТГФ (18,7 мл, 1 М). Полученную смесь затем перемешивали в течение 1 ч при 60°C. Реакционную смесь отфильтровывали в атмосфере аргона, и маточный раствор затем концентрировали в вакууме с получением остатка (1,31 г), содержащего соединения 13, 14 и 15 (R6=Et, R7=Et, R8=третBu). 1Н ЯМР (C6D6): 0,55-0,59, 0,81-0,85, 0,98-1,06, 1,19, 1,24, 2,46-2,52, 2,64-2,80, 3,04-3,09, 3,80, 4,56, 5,18. Относительные количества соединения 13 (R6=Et; R7=Et), соединения 14 (R6=Et, R7=Et, R8=третBu), соединения 15 (R6=Et, R7=Et, R8=третBu) определяли объединением сигналов при 3,80, 4,56 и 5,18 ppm, соответственно.
Способ 2
Тетрафторборат N,N,N',N'-тетраэтилформамидиния (500 мг) (полученный в соответствии с примером 5, X=BF4) добавляли к раствору трет-бутоксида калия в ТГФ (2,05 мл, 1 М). Смесь затем перемешивали в течение 1 ч при 50°C. Реакционную смесь затем отфильтровывали в атмосфере аргона. Маточный раствор затем концентрировали в вакууме с получением остатка, содержащего соединения 13, 14 и 15 (R6=Et, R7=Et, R8=третBu).
Способ 3
Гексафторфосфат N,N,N',N'-тетраэтилформамидиния (500 мг) (полученный в соответствии с примером 6, X=PF6) добавляли к раствору трет-бутоксида калия в ТГФ (1,66 мл, 1 М). Смесь затем перемешивали в течение 1 ч при 50°C. Реакционную смесь затем отфильтровывали в атмосфере аргона. Маточный раствор затем концентрировали в вакууме с получением остатка, содержащего соединения 13, 14 и 15 (R6=Et, R7=Et, R8=третBu).
Пример 16-1: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
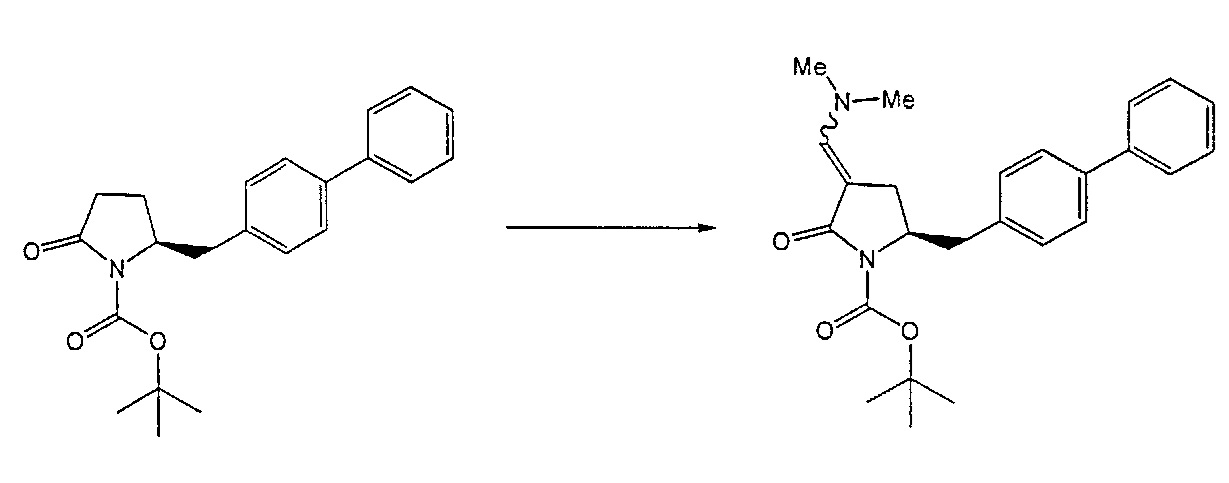
Способ 1
Смесь 1 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Вос) и 0,7 мл трис(диметиламин)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) в толуоле (5 мл) нагревали в течение 16 ч при 115°C. Смесь концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 2
К 1 г трет-бутилового эфира (S)-2-Бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) в растворе 5 мл толуола добавляли 3 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) и 1 мл трет-бутанола. Смесь перемешивали при 80°C в течение 24 ч с получением после концентрирования досуха чистого трет-бутипового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 3
К смеси 200 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Вос) и 0,49 мл трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) добавляли трет-бутанол (0,21 мл). Смесь перемешивали при 80°C в течение 24 ч с получением после концентрирования досуха трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 4
К смеси 200 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Вос) и 0,49 мл трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) добавляли изобутиловый спирт (0,21 мл). Смесь перемешивали при 80°C в течение 24 ч с получением после концентрирования досуха трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 5
К смеси 200 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 0,49 мл трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) добавляли изопропиловый спирт (0,17 мл). Смесь перемешивали при 80°C в течение 24 ч с получением после концентрирования досуха трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 6
К смеси 200 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 0,49 мл трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) добавляли диметоксиэтан (0,2 мл). Смесь перемешивали при 80°C в течение 24 ч с получением после концентрирования досуха трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 7
Трет-бутанол (0,67 г) добавляли к 1,65 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058), и полученную смесь перемешивали в течение 1 ч при 80°C. Добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Вос) (1,00 г), и полученную смесь нагревали при 80°C в течение 8 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Азеотропная дистилляция с толуолом приводила к получению трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 8
1 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) добавляли к 10 г смеси, содержащей соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et) (полученной в соответствии с примером 36, способ 1) и нагревали при 80°C. Через 2 часа реакция завершалась, и смесь концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 9
Метилсульфат N,N,N',N'-тетраметилформамидиния (302 мг) (полученный в соответствии с примером 1) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,14 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь перемешивали при 60°C в течение 3 ч. Смесь затем охлаждали до комнатной температуры, и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 10
пара-Толуолсульфонат N,N,N',N'-тетраметилформамидиния (1,93 г) (полученный в соответствии с примером 2) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,69 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь перемешивали при 60°С в течение 10 ч. Смесь затем охлаждали до комнатной температуры, и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 11
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (1,75 г) (полученный в соответствии с примером 3) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,69 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры, и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 12
К 10 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) в 75 мл 1,2-диметоксиэтана добавляли 17,8 мл трет-бутоксибис(диметиламино)метана (соединение-14, R6=Me, R7=Me, R8=третBu) (Fluka #20425), и смесь перемешивали в течение ночи при 75°C. Смесь концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, Rl=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 13
Смесь трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1 г) и смесь, содержащую соединения 13, 14 и 15 (R6=Me, R7=Me, R8=третBu) (полученную в соответствии с примером 14, способ 1) нагревали при 80°C в течение 4 ч. Смесь затем охлаждали до комнатной температуры, и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 14
Смесь 10 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 52 г трет-бутоксибис(диметиламино)метана (соединение 14, R6=Me, R7=Me, R8=третBu) нагревали при 80°C в течение 4 часов. Смесь концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 15
Смесь 2 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 8,7 мл метоксибис(диметиламин)метана (соединение 14, R6=Me, R7=Me, R8=Me) (Fluka #64875) нагревали при 80°C в течение 40 часов. Смесь затем концентрировали в вакууме. Остаток растворяли в изопропилацетате и пропускали через кизельгель. Фильтрат концентрировали с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 16
Смесь 1 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 1,2 мл N,N-диметилформамиддиизопропилацеталя (соединение 15, R6=Me, R7=Me, R8=изоPr) (Aldrich #178535) нагревали при 105°C в течение ночи. Добавляли еще порцию N,N-диметилформамиддиизопропилацеталя (соединение 15, R6=Me, R7=Me, R8=изоPr), и смесь перемешивали в течение 2 дней при 105°C. Смесь затем концентрировали с получением трет-бутилового эфира (R)-5-бифенил-4- илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 17
К 0,2 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) в растворе 0,7 мл тетрагидрофурана добавляли 0,4 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) и 0,17 мл трет-бутанола. Смесь перемешивали при 80°C в течение 8 ч с получением после концентрирования досуха трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 18
Смесь 1 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 3,4 мл N,N-диметилформамидди-трет-бутилацеталя (соединение 15, R6=Me, R7=Me, R8=третBu) (Aldrich #358800) нагревали при 50°C в течение ночи. Смесь затем концентрировали с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 19
7 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) добавляли к 5,6 г смеси, содержащей соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et) (полученной в соответствии с примером 36, способ 2), и нагревали при 85°C. Полученную смесь перемешивали при этой температуре в течение 48 ч. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 20
7 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) добавляли к 7,5 г смеси, содержащей соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et) (полученной в соответствии с примером 36, способ 2), и нагревали при 85°C. Полученную смесь перемешивали при этой температуре в течение 48 ч. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1 -карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ
Способ 21
7 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) добавляли к 11,3 г смеси, содержащей соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et) (полученной в соответствии с примером 36, способ 2), и нагревали при 85°C. Полученную смесь перемешивали при этой температуре в течение 24 ч. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 22
7 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) добавляли к 18,8 г смеси, содержащей соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et) (полученной в соответствии с примером 36, способ 2), и нагревали при 85°C. Полученную смесь перемешивали при этой температуре в течение 24 ч. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 23
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (350 мг) (полученный в соответствии с примером 3) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при комнатной температуре. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь нагревали при 55°C. Смесь затем перемешивали при этой температуре в течение 3 ч. Смесь затем охлаждали до комнатной температуры, и разбавляли добавлением 5 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 24
Метилсульфат N,N,N',N'-тетраметилформамидиния (302 мг) (полученный в соответствии с примером 1) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1 -карбоновой кислоты (соединение 8-а, R1=Boc) (302 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 25
пара-Толуолсульфонат N,N,N',N'-тетраметилформамидиния (1,9 г) (полученный в соответствии с примером 2) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,7 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1 -карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Способ 26
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (1,75 г) (полученный в соответствии с примером 3) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,7 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ (пример 16-1, способы 1-26)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 16-2: Обработка/очистка трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) может использоваться непосредственно из реакции или может быть при необходимости очищен. Эта необязательная стадия очистки может осуществляться для удаления, например, растворителей, реагентов и/или продуктов, полученных из указанных реагентов.
Способ 1
Раствор соединения 7-а (R1=Boc; R6=Me; R7=Me) (0,2 г в 2 мл изопропилацетата) получали в соответствии с примером 16-1, способ 14. Добавляли активированный уголь (около 50 мг), и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь отфильтровывали и концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 2
Раствор соединения 7-а (R1=Boc; R6=Me; R7=Me) (0,2 г в 2 мл изопропилацетата) получали в соответствии с примером 16-1, способ 14. Добавляли активированный уголь (около 50 мг), и смесь перемешивали при кипении с обратным холодильником в течение 1 ч. Смесь отфильтровывали и концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 3
Раствор соединения 7-а (R1=Boc; R6=Me; R7=Me) (0,2 г в 2 мл изопропилацетата) получали в соответствии с примером 16-1, способ 14. Смесь пропускали через слой целита. Фильтрат затем концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 4
Раствор соединения 7-а (R1=Boc; R6=Me; R7=Me) (0,2 г в 2 мл изопропилацетата) получали в соответствии с примером 16-1, способ 14. Смесь пропускали через слой кизельгеля. Фильтрат затем концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 5
11 г соединения 7-а (R1=Boc; R6=Me; R7=Me), полученного в соответствии с примером 16-1, способ 14, растворяли в 15 мл изопропилацетата. Смесь пропускали через слой кизельгеля и промывали изопропилацетатом (5×20 мл). Фильтрат концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 6
9 г соединения 7-а (R1=Boc; R6=Me; R7=Me), полученного в соответствии с примером 16-2, способ 5, добавляли в толуол (50 мл). Растворитель затем удаляли в вакууме. Добавляли еще порции толуола (3×50 мл), и растворитель затем удаляли в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me), что подтверждено данными ВЭЖХ. Спектроскопические данные такие, как описано в примере 16-2, способ 7.
Способ 7
9 г соединения 7-а (R1=Boc; R6=Me; R7=Me), полученного в соответствии с примером 16-2, способ 6, добавляли в гептан (15 мл). Растворитель удаляли в вакууме. Этилацетат (5 мл) и смесь нагревали до 50°C. Добавляли гептан (10 мл). Смесь затем охлаждали до комнатной температуры, затем концентрировали в вакууме с получением соединения 7-а (R1=Boc; R6=Me; R7=Me). Спектроскопические данные для соединения 7-b (R1=Boc; R6=Me; R7=Me): Rf 0,49 (этилацетат). δН (400 МГц; ДМСО) 1,48 (9Н), 2,63 (2Н), 2,79 (1Н), 2,93 (6Н), 3,06 (1Н), 4,19 (1Н), 6,96 (1Н), 7,32 (3Н), 7,44 (2Н), 7,63 (4Н); m/z (ES+) 407,1 ([МН+, 71%), 351 (100), 307 (41).
Метод ВЭЖХ (пример 16-2, методы 1-7)
Колонка: X-BRIDGE С18; 150 х 3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 17: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет-(Е/Z)-илиден]-2-оксопирролидин-1 -карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et)
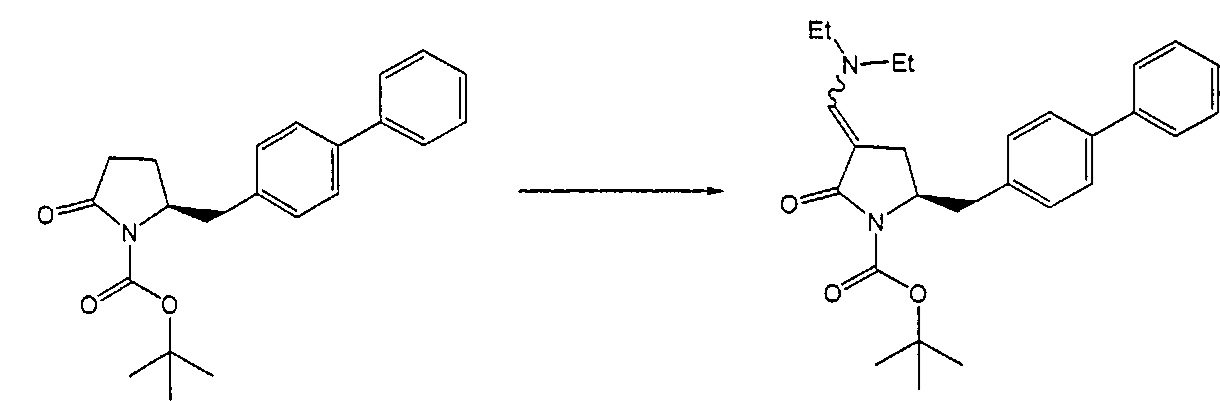
Способ 1
Смесь трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1,41 г) трет-бутоксибис(диэтиламино)метана (соединение 14, R6=Et, R7=Et, R8=третBu) (3,76 г, полученный в соответствии с примером 15) нагревали при 80°C в течение 1 ч. Смесь затем разбавляли 10 мл изопропилацетата и отфильтровывали через силикагель. Фильтрат затем концентрировали в вакууме, и затем азеотропно отгоняли с ксилолом (3×10 мл), толуолом (3×10 мл), изопропилацетатом (3×10 мл) и диэтиловым эфиром (3×10 мл). Материал сушили в вакууме с получением 1,54 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Rf 0,41 (этилацетат). δН (400 МГц, C6D6) 0,59 (6Н), 1,63 (9Н), 2,37 (2Н), 2,44 (4Н), 2,59 (1Н), 3,50 (1Н), 4,46 (1Н), 7,10-7,29 (6Н), 7,42-7,45 (4Н).
Способ 2
Метилсульфат N,N,N',N'-тетраэтилформамидиния (1,91 г, полученный в соответствии с примером 4) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,69 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 3
Тетрафторборат N,N,N',N'-тетраэтилформамидиния (347 мг, полученный в соответствии с примером 5) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,14 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 4
Гексафторфосфат N,N,N',N'-тетраэтилформамидиния (430 мг, полученный в соответствии с примером 6) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,14 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 5
Гексафторфосфат N,N,N',N'-тетраэтилформамидиния (430 мг) (полученный в соответствии с примером 6) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при комнатной температуре. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь нагревали при 55°C. Смесь затем перемешивали при этой температуре в течение 3 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 5 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 6
Метилсульфат N,N,N',N'-тетраэтилформамидиния (1,9 г) (полученный в соответствии с примером 4) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,7 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диэтиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 7
Гексафторфосфат N,N,N',N'-тетраэтилформамидиния (430 мг) (полученный в соответствии с примером 6) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 8
Тетрафторборат N,N,N',N'-тетраэтилформамидиния (347 мг) (полученный в соответствии с примером 5) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Способ 9
Тетрафторборат N,N,N',N'-тетраэтилформамидиния (347 мг) (полученный в соответствии с примером 5) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг) и гексафторфосфат аммония (около 1 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et). Спектроскопические данные такие, как описано в примере 17, способ 1.
Пример 18: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-пирролидин-1-илмет-(Е/Z]-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6/R7=пирролидинил)
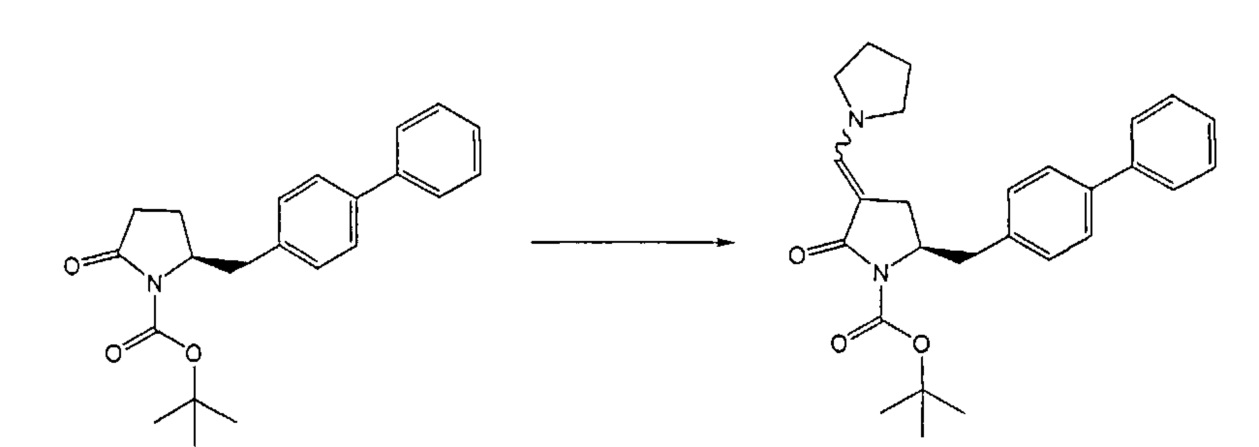
Способ 1
Смесь метилсульфата 1-пирролидин-1-илметиленпирролидиния (18,5 г, полученный в соответствии с примером 7) и трет-бутоксида калия (6,3 г) в толуоле (40 мл) перемешивали в течение 1 ч. Добавляли трет-бутиповым эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (5 г), и смесь нагревали до 80°C. Через 1,5 ч смесь охлаждали до комнатной температуры, разбавляли изопропилацетатом и отфильтровывали через силикагель с получением соединения 7-а, R1=Boc, R6/R7=пирролидинил. Очистка хроматографией (изопропилацетат) приводила к получению трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-пирролидин-1-ил-мет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6/R7=пирролидинил). Rf 0,32 (этилацетат). δH (400 МГц, ДМСО) 1,50 (9Н), 1,80 (4Н), 2,62 (1Н), 2,71 (1Н), 2,82 (1H), 3,06 (1H), 3,46 (4Н), 4,19 (1Н), 7,19 (1Н), 7,34 (2Н), 7,36 (1Н), 7,46 (2Н), 7,62 (2Н), 7,65 (2Н). m/z (ES+) 433 ([МН]+, 100%), 377 (64), 333 (36).
Способ 2
Смесь гексафторфосфата 1-пирролидин-1-илметиленпирролидиния (424 мг, полученный в соответствии с примером 8) и трет-бутоксида калия (1 M в ТГФ, 1,1 мл) перемешивали в течение 1 ч при 50°С. Добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (0,1 г), и смесь нагревали до 60°С. Через 1,5 ч смесь охлаждали до комнатной температуры, разбавляли изопропилацетатом и отфильтровывали через силикагель с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-пирролидин-1-илмет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6/R7=пирролидинил). Спектроскопические данные такие, как описано в примере 18, способ 1.
Способ 3
Смесь метилсульфата 1-пирролидин-1-илметиленпирролидиния (380 мг, полученный в соответствии с примером 7) и трет-бутоксида натрия (0,1 мл) в толуоле перемешивали в течение ночи. Добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь нагревали до 80°C. Через 4 ч смесь охлаждали до комнатной температуры и концентрировали в вакууме с получением соединения 7-а, R1=Boc, R6/R7=пирролидинил. Спектроскопические данные такие, как описано в примере 18, способ 1.
Способ 4
Гексафторфосфат 1-пирролидин-1-илметиленпирролидиния (424 мг) (полученный в соответствии с примером 8) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при комнатной температуре. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь нагревали при 55°C. Смесь затем перемешивали при этой температуре в течение 3 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 5 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-пирролидин-1-ил-мет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6/R7=пирролидинил). Спектроскопические данные такие, как описано в примере 18, способ 1.
Способ 5
Гексафторфосфат 1-пирролидин-1-илметиленпирролидиния (424 мг) (полученный в соответствии с примером 8) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (1,1 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Смесь затем охлаждали до комнатной температуры. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (100 мг), и смесь затем перемешивали в течение ночи. Смесь затем концентрировали в вакууме с получением трет-бутилового эфира ((R)-5-бифенил-4-илметил-3-[1-пирролидин-1-ил-мет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-a, R1=Boc, R6/R7=пирролидинил). Спектроскопические данные такие, как описано в примере 18, способ 1.
Пример 19: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диизопропиламиномет-(Е)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=изоPr, R7=изоPr)
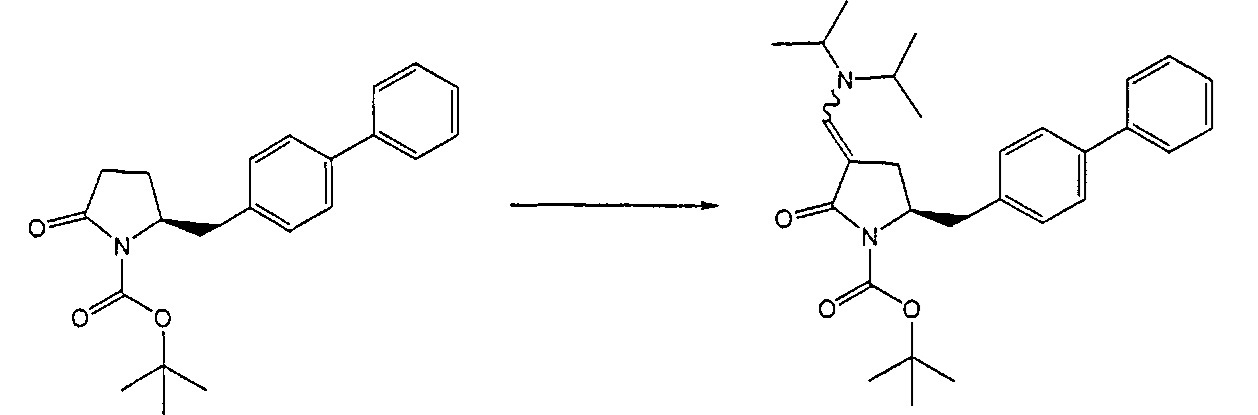
Способ 1
1 М раствор трет-бутоксида калия в ТГФ (11,7 мл) добавляли к, гексафторфосфату диизопропил(пиперидин-1-илметилиден)аммония (5 г, полученный в соответствии с примером 12). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1 -карбоновой кислоты (соединение 8-а, R1=Boc) (1 г) к реакционной смеси, и полученную смесь перемешивали в течение 1 ч при комнатной температуре. Смесь разбавляли изопропилацетатом и отфильтровывали через силикагель. Остаток концентрировали в вакууме, затем очищали колоночной хроматографией (этилацетат) с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диизопропиламиномет-(Е)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=изоPr, R7=изоPr). Rf 0,55 (этилацетат). 1Н ЯМР (ДМСО-d6), 7,65-7,62 (2Н), 7,61-7,58 (2Н), 7,47-7,42 (2Н), 7,37-7,31 (1Н), 7,29-7,25 (2Н), 7,01 (1Н), 4,28-4,20 (1Н), 3,84-3,70 (2Н), 3,07-3,01 (1Н), 2,82-2,73 (1Н), 2,71-2,63 (1Н) 2,49-2,44 (1Н), 1,49 (9Н), 1,13-1,08 (12Н).
Способ 2
Тетрафторборат N,N,N',N'-тетраизопропилформамидиния (2,13 г, полученный в соответствии с примером 11) добавляли к 1 М раствору трет-бутоксида калия в ТГФ (5,69 мл). Полученную смесь затем перемешивали в течение 1 ч при 50°C. Затем добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (500 мг), и смесь перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры и разбавляли добавлением 10 мл изопропилацетата. Смесь затем отфильтровывали через силикагель и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диизопропиламиномет-(Е)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=изоPr, R7=изоPr). Спектроскопические данные такие, как описано в примере 19, способ 1.
Пример 20: (R)-5-Бифенил-4-илметил-3-[1-диметиламиномет-(Е/Z)-илиден]-1-(2,2-диметилпропионил)пирролидин-2-он (соединение 7-а. R1=Piv, R6=Me, R7=Me)
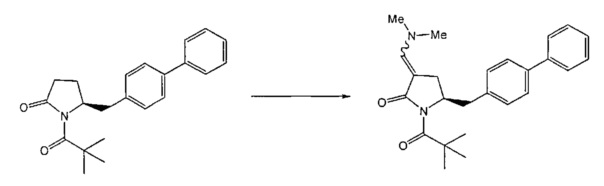
Смесь (S)-5-бифенил-4-илметил-1-(2,2-диметилпропионил)пирролидин-2-она (соединение 8-а, R1=Piv) (1,0 г, 3 ммоля) и трет-бутоксибис(диметиламино)метана (соединение 14, R6=Me, R7=Me, R8=третBu) (Fluka #20425) (5,5 г) перемешивали при 80°C в течение 17 ч. Смесь затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток затем растворяли в изопропилацетате и отфильтровывали через кизельгель. Фильтрат концентрировали в вакууме с получением (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-1-(2,2-диметилпропионил)пирролидин-2-она (соединение 7-а, R1=Piv, R6=Me, R7=Me). δН (400 МГц; ДМСО) 1,31 (9Н), 2,57 (1Н), 2,70 (1Н), 2,81 (1H) 2,98 (6Н), 3,00 (1Н), 4,40 (1Н), 7,06 (1Н), 7.33 3), 7,45 (2Н), 7,60 (2Н), 7,65 (2Н). m/z (ES+) 391 ([МН]+, 100%).
Пример 21: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc)
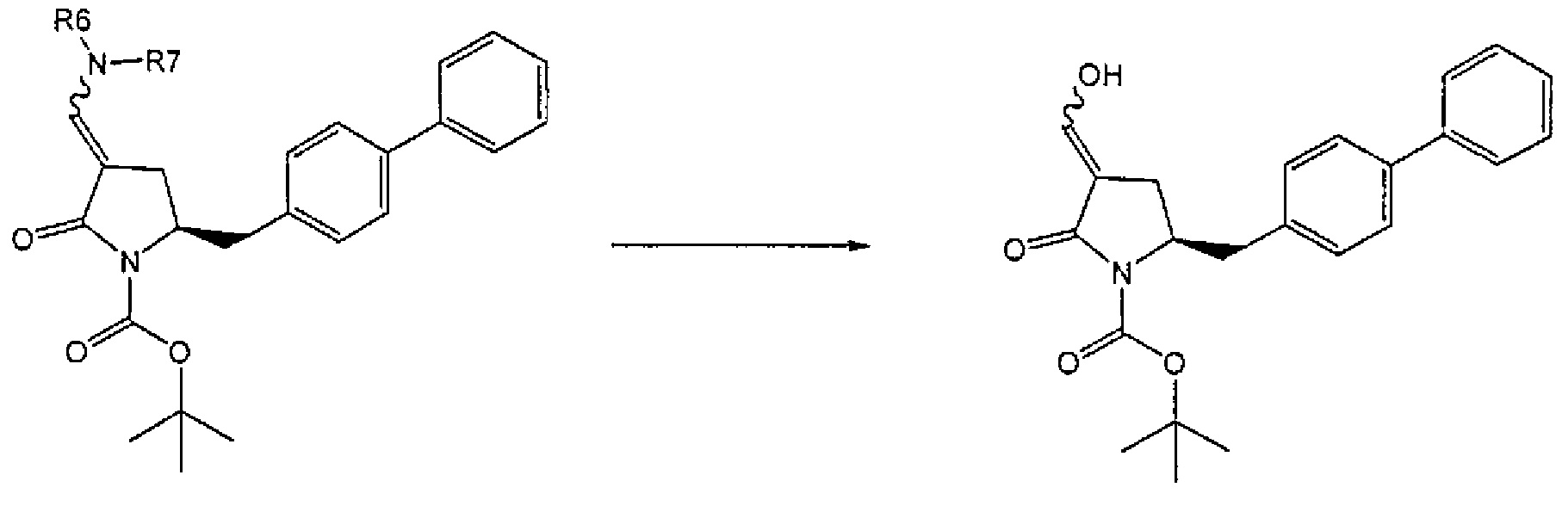
Способ 1
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) (1 г, 2,5 ммоля) растворяли в ТГФ (5 мл) и охлаждали до 0°C. Добавляли водн. раствор хлористоводородной кислоты (37%; 0,2 мл), затем воду (2,1 мл). Смесь перемешивали при комнатной температуре в течение 1,5 ч. Фазы разделяли, и органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc). δН (400 МГц, ДМСО) 1,51 (9Н), 2,40 (1H), 2,50 (1H), 2,67 (1H), 3,11 (1Н), 4,34 (1Н), 7,26 (3Н), 7,42 (2Н), 7,58 (4Н), 10,27 (1Н); 5Н (400 МГц; CDCl3) 1,53, 1,76-1,80, 1,88-1,96, 2,27-2,33, 2,35-2,43, 2,49-2,61, 2,80-2,86, 3,00-3,11, 3,16-3,21, 3,51-3,54, 3,65-3,70, 4,25-4,36, 7,15-7,20, 7,26-7,30, 7,34-7,39, 7,46-7,53, 9,74 (0,4 Н), 9,75 (0,2 Н), 10,86 (0,4 Н). m/z (+) 380 ([МН]+, 5%), 324 (100).
Способ 2
трет-Бутиловый, эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1 -карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et) (1 г) растворяли в ТГФ (6,9 мл) и охлаждали до 10-15°C. Добавляли раствор концентрированной серной кислоты (0,09 мл) в воде (3 мл). Смесь перемешивали при комнатной температуре в течение 1,5 ч. Фазы разделяли, и водную фазу экстрагировали изопропилацетатом. Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc). Rf 0,49 (этилацетат). Спектроскопические данные такие, как описано в примере 21, способ 1.
Способ 3
трет-Бутиловый, эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Et, R7=Et) (32,5 г) растворяли в ТГФ (190 мл) при 60°C. Смесь затем охлаждали до 10-15°C. Добавляли водный раствор 1 М серной кислоты (96 мл) в течение 30 мин, получая раствор со значение pH 2. Смесь перемешивали при комнатной температуре в течение 0,5 ч. Фазы разделяли, и органическую фазу промывали 1 М раствором карбоната калия (50 мл). Фазы разделяли. Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением трет-бутнловото эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc). Rf 0,49 (этилацетат). Спектроскопические данные такие, как описано в примере 21, способ 1.
Пример 22: Енольная форма: (R)-5-бифенил-4-илметил-1-(2,2-диметилпропионил)-3-[1-гидроксимет-(Е,Z)-илиден]пирролидин-2-он (соединение 6-а, R1=Piv)

трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1 -карбоновой кислоты (соединение 7-а, R1=Piv, R6=Me, R7=Me) (927 мг) растворяли в ТГФ (5 мл) и охлаждали до 10°C. Добавляли хлористоводородную кислоту (1 М; 2,6 мл), затем воду (2,1 мл). Смесь перемешивали при комнатной температуре в течение 17 ч. Смесь разбавляли этилацетатом (5 мл), и фазы разделяли. Органическую фазу промывали водой, насыщенным раствором хлорида натрия, затем сушили (MgSO4). Концентрировали в вакууме с получением (R)-5-бифенил-4-илметил-1-(2,2-диметилпропионил)-3-[1-гидроксимет-(E,Z)-илиден]пирролидин-2-она (соединение 6-а, R1=Piv). δН (400 МГц; ДМСО) 1,31 (9Н), 2,43 (1H), 2,50 (2Н), 3,01 (1Н), 4,53 (1Н), 7,28 (2Н), 7,35 (1H), 7,45 (2Н), 7,61 (2Н), 7,64 (2Н); m/z (ES+) 364 ([МН]+, 100%).
Пример 23: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc)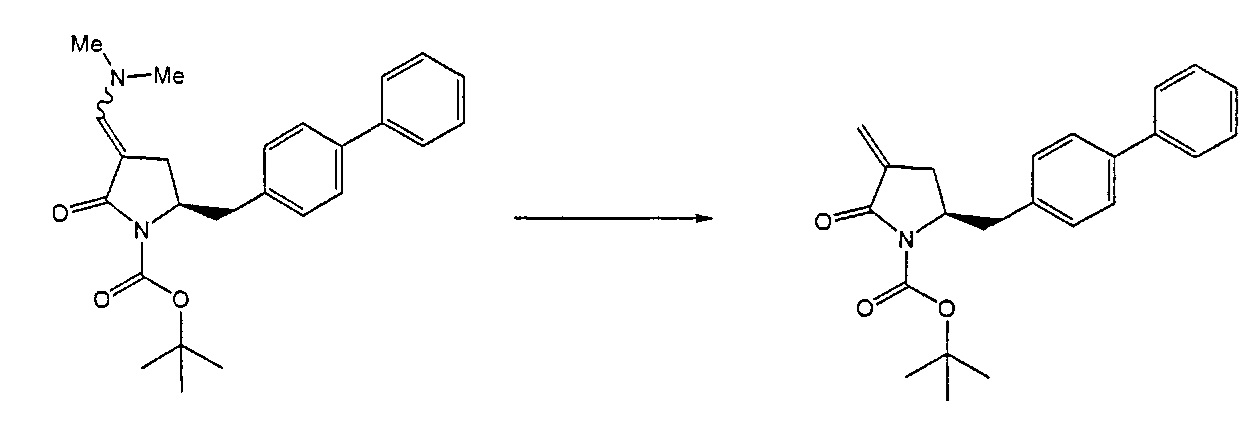
Способ 1
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) (7 г) добавляли к ТГФ (210 мл), и полученную смесь охлаждали до -78°C. Добавляли диизобутилалюмогидрид (109 мл, 103 ммоля; 0,95 М в ТГФ) в течение 1,5 ч. К смеси затем добавляли соль Рошеля (430 мл; 1,2 М в воде), и смесь тщательно перемешивали. Добавляли этилацетат (400 мл), и фазы разделяли. Органическую фазу концентрировали в вакууме. Полученный остаток растворяли в этилацетате (20 мл) и промывали насыщенным раствором хлорида натрия (20 мл). Фазы разделяли. Органическую фазу затем концентрировали в вакууме. Добавляли диэтиловый эфир (50 мл), отфильтровывали, и фильтрат концентрировали с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc).
Сырой трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) необязательно может быть очищен колоночной хроматографией, элюируя смесью 3:1 гептан/этилацетат. 1Н ЯМР: δН (400 МГц, CDCl3) 1,62 (9Н), 2,56 (1Н), 2,60 (1Н), 2,70 (1Н), 3,26 (1Н), 4,43 (1Н), 5,45 (1Н), 6,17 (1Н), 7,26 (2Н), 7,34 (1Н), 7,44 (2Н), 7,54 (2Н), 7,57 (2Н); m/z (-ESI) 381 ([MNa]+, 7%), 364 ([МН]+, 12), 308 (100), 264 (10).
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) является кристаллическим твердым веществом, и может характеризоваться простым анализом кристаллов с помощью рентгеновских лучей и рентгеновской дифракцией на порошке. Образец рентгеновской дифракции показал следующие интервалы плоскости внутри решетки (средние значения 2θ в [°] указаны с пределом ошибки ±0,2): 2θ в [°]: 4,7, 9,3, 10,5, 13,3, 13,9, 15,3, 16,9, 18,0, 18,6, 19,6, 20,9, 21,8, 22,9, 23,3, 27,5, 28,1, 30,7, 34,9. Наиболее интенсивные сигналы в образце рентгеновской дифракции показали следующие интервалы плоскости внутри решетки (средние значения 2θ в [°] указаны с пределом ошибки ±0,2): 2θ в [°]: 4,6, 10,5, 13,3, 13,9, 16,9, 18,6, 19,6, 20,9. Данные получены с помощью дифрактометра Bruker D8 Advance с помощью облучения Cu-Kα.
Рентгеновская структура полученных кристаллов показана на фигуре 4. Отдельный кристалл для этого определения получен из смеси метанол/вода в качестве растворителя.
Кристаллические данные записано при 100 (2) K]
|
Способ 2
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(R)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) (100 мг, 0,25 ммоля) добавляли к ТГФ (0,5 мл) при 0°C. Затем добавляли триацетоксиборгидрид натрия (111 мг, 0,50 ммоля). Смесь перемешивали в течение 1 ч, затем перемешивали при комнатной температуре в течение ночи. Добавляли воду (5 мл), и затем экстрагировали толуолом. Органическую фазу сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 23, способ 1.
Пример 24: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc)
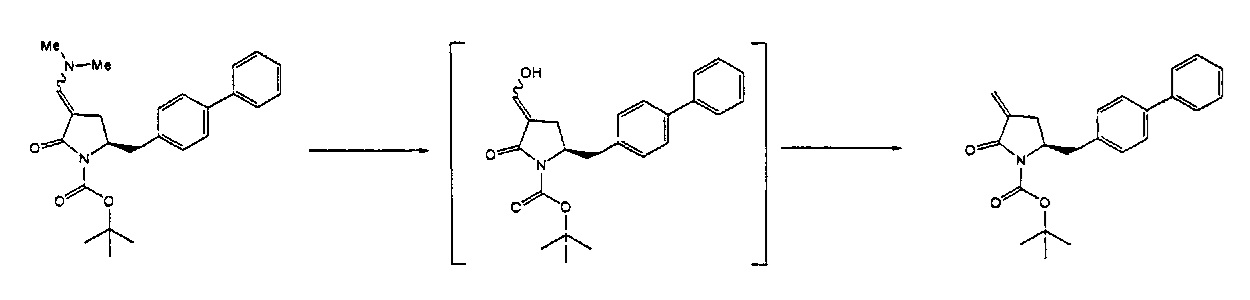
Способ 1
Сырой трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) (67,5 г) растворяли в ТГФ (340 мл) и охлаждали до 0°C. Добавляли хлористоводородную кислоту (37%; 13,1 мл), затем воду (143,4 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Фазы разделяли. К органической фазе добавляли раствор формальдегида (37% в воде; 138 мл). Добавляли порциями карбонат калия (31,8 г) в течение 4 ч. Добавляли 1% раствор гидроксида тетра-н-бутиламмония (14,2 мл), затем раствор гидроксида натрия (30% в воде) до значения pH 10,5. Смесь перемешивали в течение 2 ч. Фазы разделяли. Органическую фазу промывали водой (100 мл) и бисульфитом натрия (20 г). Добавляли толуол (100 мл) и раствор хлорида натрия (20%; 50 мл). Фазы разделяли. Органическую фазу экстрагировали раствором хлорида натрия (20%; 50 мл), сушили (Na2SO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) (63 г). Материал может быть перекристаллизован следующим образом: сырой трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) (58,4 г) растворяли в метаноле (525 мл) при 50°C. Добавляли воду (175 мл), и смесь охлаждали до 0°C. Твердое вещество собирали фильтрацией, и остаток на фильтре промывали смесью метанола (53 мл) и воды (18 мл). Твердое вещество затем сушили в вакууме, получая трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 23.
Способ 2
Сырой трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) (66,7 г) растворяли в ТГФ (340 мл) и охлаждали до 10°C. Добавляли серную кислоту (96%; 6,9 мл), затем воду (152 мл). Смесь перемешивали при комнатной температуре в течение 0,5 ч. Фазы разделяли. Органическую фазу добавляли к раствору формальдегида (37% в воде; 138 мл). Добавляли 1% раствор гидроксида тетра-н-бутиламмония (14,2 мл). Добавляли порциями карбонат калия (27,8 г) в течение 0,5 ч. Добавляли раствор гидроксида натрия (15,1 г) в течение 3 ч, поддерживая значение pH 10,5. Фазы разделяли. Органическую фазу промывали водой (100 мл), затем раствором бисульфита натрия (21,4 г). Добавляли толуол (100 мл) и раствор хлорида натрия (50 мл). Фазы разделяли. Органическую фазу экстрагировали раствором хлорида натрия (20%; 50 мл), сушили (Na2SO4) и концентрировали в вакууме с получением трет-бутилого эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) (63 г). Материал может быть перекристаллизован следующим образом: сырой трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) (58,4 г) растворяли в метаноле (525 мл) при 50°C. Добавляли воду (175 мл), и смесь охлаждали до 0°C. Твердое вещество собирали фильтрацией, и остаток на фильтре промывали смесью метанола (53 мл) и воды (18 мл). Твердое вещество затем сушили в вакууме, получая трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 23.
Метод ВЭЖХ (пример 24)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C. Время удерживания:
|
Пример 25: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и трет-бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc)
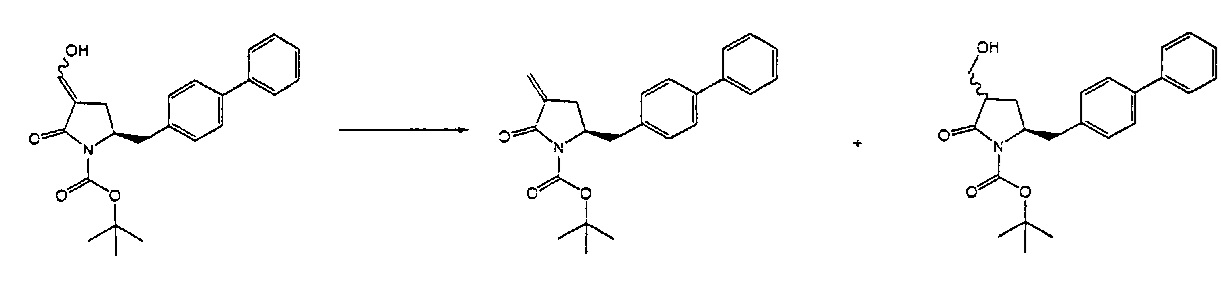
Способ 1
2,0 г сырого трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в 10 мл ТГФ подвергали реакции с 5,0 г 37% водн. раствором формальдегида и 0,7 г карбоната натрия. Через 1 ч перемешивания при комнатной температуре водную фазу удаляли. Органическую фазу разбавляли толуолом, промывали водой и концентрировали досуха с получением маслянистого остатка. Его затем подвергали хроматографии на силикагеле (100 г силикагеля Merck), элюируя смесью 1:1 этил- и изопропилацетата для разделения трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc).
Спектроскопические данные для трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) описаны в примере 23.
Спектроскопические данные для трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc): δН (400 МГц, ДМСО) 1,51 (9Н), 1,89 (1Н), 1,98 (1Н), 2,55 (1Н), 2,85 (1Н), 3,50-2,62 (2Н), 4,24-4,30 (1Н), 4,45 (1Н), 7,28-7,34 (3Н), 7,41-7,45 (2Н), 7,58-7,63 (4Н); m/z (ES+) 382 ([МН]+, 9%), 326 (100), 282 (12).
Способ 2
1 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к ТГФ (2,5 мл) при комнатной температуре. Затем добавляли 37% раствор формальдегида (1,3 мл). Затем порциями добавляли карбонат калия (0,28 г), и полученную смесь затем перемешивали в течение 72 ч при комнатной температуре. Затем добавляли воду (1 мл) и раствор бисульфита натрия (0,5 мл). Фазы разделяли, и органическую фазу сушили (MgSO4). Смесь концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и 20% (соединение 5-а, R1=Boc) (по данным ЯМР). Спектроскопические данные описаны в примере 25, способ 1.
Способ 3
7,4 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc), растворенного в 50 мл ТГФ, смешивали вместе с 4,4 г 37% водн. раствора формальдегида, 0,13 г 40%) раствора гидроксида тетрабутиламмония и 40 мл 1 М раствора карбоната калия. Через 1 ч перемешивания при 40°C две фазы разделяли. Органическую фазу разбавляли 50 мл толуола и концентрировали в вакууме до объема около 20 мл. Остаток снова разбавляли 85 мл толуола. Добавляли 2,4-диазабициклоундецен, затем 0,42 г метансульфонилхлорида. Через 1 ч при комнатной температуре добавляли 10 мл воды, и смесь подкисляли несколькими каплями серной кислоты. Водную фазу удаляли, органическую фазу промывали 10 мл воды и концентрировали в вакууме досуха. Остаток растворяли в 100 мл метанола при 50°C и насыщали при той же температуре 25 мл воды. Суспензию затем охлаждали до 0°C, отфильтровывали, промывали 12 мл смеси метанол/вода 2:1 и сушили в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 4
Смесь раствора карбоната калия в воде (1 М, 2,3 мл), раствора гидроксида тетрабутиламмония (40%, 0,01 мл) и раствора формальдегида (37% в воде, 0,32 мл) добавляли к трет-бутиловому эфиру (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc). Полученную смесь быстро перемешивали и нагревали до 50°С. Через 4 ч смесь охлаждали до комнатной температуры и концентрировали в вакууме. Rf (этилацетат): 0,77 (соединение 4-а, R1=Boc); 0,44 (соединение 5-а, R1=Boc). Спектроскопические данные описаны в примере, 25, способ 1.
Способ 5
К раствору трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в ТГФ (3,8 г) (полученный в соответствии с примером 21, способ 3) добавляли карбонат калия (2,8 г в 20 мл воды), раствор гидроксида тетрабутиламмония (40%, 0,03 г) и раствор формальдегида (37% в воде, 2,2 мл) с получением раствора со значением pH 11. Смесь затем перемешивали в течение 2 ч при 45°C. Смесь затем охлаждали до комнатной температуры, и фазы разделяли. Органическую фазу разбавляли толуолом (20 мл) и промывали раствором бисульфита натрия (20 мл, 40%), и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу затем сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 6
К раствору трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в ТГФ (3,8 г) (полученный в соответствии с примером 21, способ 3) добавляли карбонат калия (2,8 г в 20 мл воды), раствор гидроксида тетрабутиламмония (40%, 0,03 г) и хлораль (4,4 г) с получением раствора со значением pH 11. Смесь затем перемешивали в течение 2 ч при 45°C. Смесь затем охлаждали до комнатной температуры, и фазы разделяли. Органическую фазу разбавляли толуолом (20 мл), и промывали раствором бисульфита натрия (20 мл, 40%) и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу затем сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 7
К раствору трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в ТГФ (3,8 г) (полученный в соответствии с примером 21, способ 3) добавляли водный раствор карбоната калия (0,2 мл, 1 М), раствор гидроксида тетрабутиламмония (40%, 0,07 г) и раствор формальдегида (37% в воде, 2,2 мл) с получением раствора со значением pH 8. Смесь затем перемешивали в течение 2 ч при 45°C. Смесь затем охлаждали до комнатной температуры, и фазы разделяли. Органическую фазу разбавляли толуолом (20 мл) и промывали раствором бисульфита натрия (20 мл, 40%) и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу затем сушили (MgSO4) и концентрировали в вакууме с получением трет-6утлового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 8
К раствору трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в ТГФ (3,8 г) (полученный в соответствии с примером 21, способ 3) добавляли 1 М водный раствор формиата натрия (20 мл), раствор гидроксида тетрабутиламмония (40%, 0,07 г) и раствор формальдегида (37% в воде, 2,2 мл) с получением раствора со значением pH 7. Смесь затем перемешивали в течение 4 ч при 45°C. Смесь затем охлаждали до комнатной температуры, и фазы разделяли. Органическую фазу разбавляли толуолом (20 мл) и промывали раствором бисульфита натрия (20 мл, 40%) и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу затем сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 9
К раствору трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в ТГФ (3,8 г) (полученный в соответствии с примером 21, способ 3) добавляли 1 М водный раствор ацетата натрия (20 мл), раствор гидроксида тетрабутиламмония (40%, 0,07 г) и раствор формальдегида (37% в воде, 2,2 мл) с получением раствора со значением pH 8. Смесь затем перемешивали в течение 4 ч при 45°C. Смесь затем охлаждали до комнатной температуры, и фазы разделяли. Органическую фазу разбавляли толуолом (20 мл) и промывали раствором бисульфита натрия (20 мл, 40%) и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу затем сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 25, способ 1.
Способ 10
К смеси 3,79 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в тетрагидрофуране (0,4 М раствор) добавляли карбонат калия (20 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (0,07 мл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (2,2 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (20 мл). Органическую фазу затем промывали раствором бисульфита натрия (20 мл, 40 вес.% в воде), и затем насыщенным раствором хлорида натрия (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 11
К смеси 3,79 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в тетрагидрофуране (0,4 М раствор) добавляли карбонат калия (20 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (0,07 мл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (2,2 мл, 37 вес.% в воде). Значение pH смеси доводили до pH 14 добавлением раствора гидроксида натрия (1 M в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (20 мл). Органическую фазу затем промывали раствором бисульфита натрия (20 мл, 40 вес.% в воде), и затем насыщенным раствором хлорида натрия (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 12
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли гидрокарбонат натрия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем насыщенным раствором хлорида натрия (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 13
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли карбонат цезия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем насыщенным раствором хлорида натрия (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 14
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли карбонат натрия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем насыщенным раствором хлорида натрия (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 15
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 16
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). Затем добавляли диметилсульфоксид (1 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 17
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). Затем добавляли 1-метил-2-пирролидинон (1 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 18
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). Затем добавляли 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон (1 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 19
К смеси 200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) в тетрагидрофуране (2 мл) добавляли формальдегид (0,12 мл, 37 вес.% в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Значение pH смеси доводили до pH 9 добавлением раствора карбоната калия (1 M в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 20
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к ацетонитрилу (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 21
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к ацетону (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли толуолом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 22
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/2)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к трет-бутанолу (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,12 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Смесь разбавляли водой (5 мл) и этилацетатом (5 мл). Фазы разделяли. Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 23
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,10 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли этилацетатом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 24
200 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к тетрагидрофурану (2 мл). К смеси добавляли карбонат калия (1,05 мл, 1 М раствор в воде) и гидроксид тетрабутиламмония (3,5 мкл, 40 вес.% в воде). Затем к смеси добавляли формальдегид (0,16 мл, 37 вес.% в воде). Полученную смесь перемешивали в течение 2 ч при 45°C. Фазы разделяли. Органическую фазу разбавляли этилацетатом (5 мл). Органическую фазу затем промывали раствором бисульфита натрия (5 мл, 40 вес.% в воде) и затем водой (5 мл). Отделенную органическую фазу затем сушили (MgSO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ (пример 25. способы 1-24)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 26: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc)
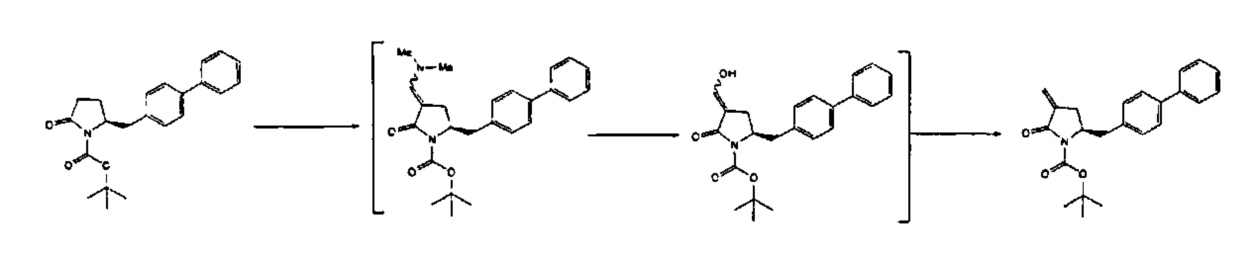
50 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и 261 г реагента Бредерека (соединение 14, R6=Me, R7=Me, R8=третBu) перемешивали при 80°C в течение 24 ч и концентрировали в вакууме с получением 67,5 г вязкого остатка. Остаток растворяли в 340 мл ТГФ и смешивали с 13,1 мл 37% хлористоводородной кислоты в 143 мл воды. Через 1 ч перемешивания при комнатной температуре нижнюю водную фазу удаляли, и добавляли 150,2 г 37% водного раствора формальдегида, затем добавляли 30 г карбоната калия порциями при 20-25°C. Через 3 часа перемешивания водную фазу удаляли. Оставшуюся органическую фазу разбавляли 100 мл толуола, промывали 50 мл насыщенного раствора хлорида натрия и концентрировали в вакууме с получением 58,4 г вязкого остатка. Остаток растворяли в 525 мл метанола при 50°C, и насыщали при этой температуре 175 мл воды. Полученную суспензию охлаждали до 0°C, отфильтровывали для сбора кристаллов, промывали 60 мл смеси метанол/вода 2:1 и сушили в вакууме с получением белых кристаллов трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 23.
Метод ВЭЖХ (пример 26)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 27: (R)-5-Бифенил-4-илметил-1-(2,2-диметилпропионил)-3-метиленпирролидин-2-он (соединение 4-а, R1=Piv)
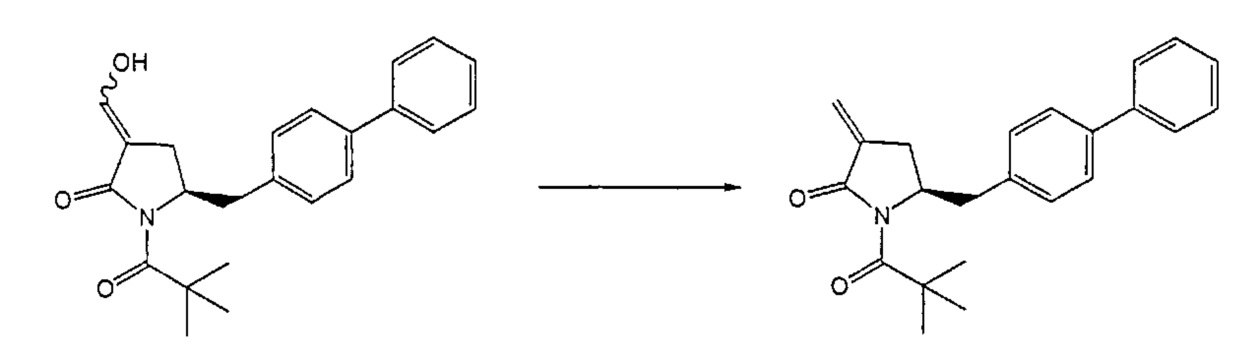
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Piv) (680 мг) растворяли в ТГФ (3,5 мл) при комнатной температуре. Добавляли раствор формальдегида (1,8 мл, 37% в воде), затем порциями добавляли карбонат калия (388 мг). Смесь затем перемешивали в течение 70 ч. Последовательно добавляли воду (1 мл) и раствор бисульфита натрия (0,5 мл). Фазы разделяли, и органическую фазу сушили (MgSO4). Сырой материал очищали хроматографией (гептан/этилацетат, 10:1) с получением (R)-5-бифенил-4-илметил-1-(2,2-диметилпропионил)-3-метиленпирролидин-2-она (соединение 4-а, R1=Piv). δН (400 МГц, ДМСО) 1,34 (9Н), 2,55-2,64 (2Н), 2,70 (1Н), 3,26 (1Н), 4,59 (1H), 5,55 (1Н), 5,98 (1Н), 7,26 (2Н), 7,34 (1Н), 7,44 (2Н), 7,53-7,58 (4Н). m/z (ES+) 348 ([МН]+, 100%).
Пример 28: (R)-5-Бифенил-4-илметил-3-метиленпирролидин-2-он (Соединение 4-а, R1=Н)
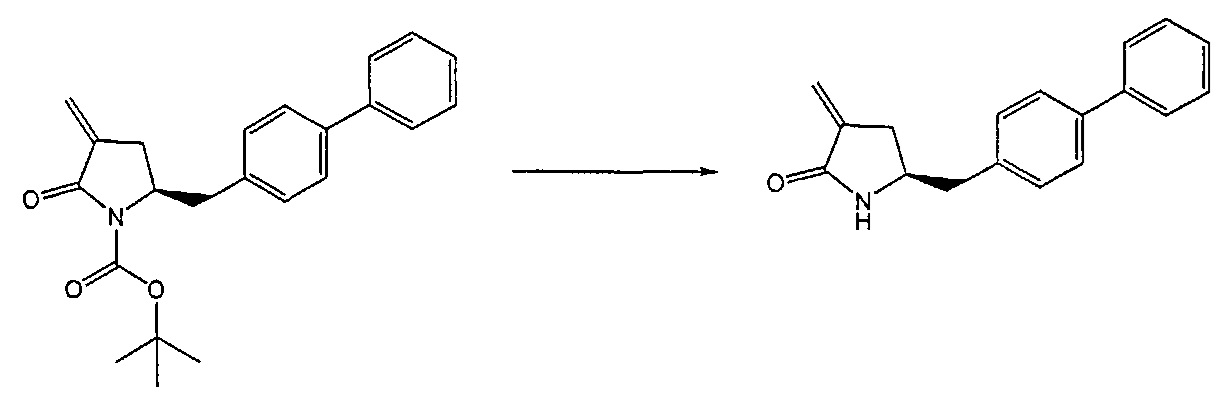
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) (509 мг) растворяли в дихлорметане (10 мл). Смесь охлаждали до 0°C и добавляли трифторуксусную кислоту (0,5 мл). Смесь затем перемешивали в течение 2 ч, затем экстрагировали насыщенным раствором карбоната натрия (20 мл). Фазы разделяли. Органическую фазу сушили (MgSO4) и концентрировали с получением (R)-5-бифенил-4-илметил-3-метиленпирролидин-2-она (соединение 4-а, R1=Н). δH (400 МГц, ДМСО) 2,47 (1Н), 2,68 (1Н), 2,74 (1Н), 2,87 (1H), 3,87 (1Н), 5,22 (1Н), 5,64 (1Н), 7,33 (3Н), 7,45 (2Н), 7,60 (2Н), 7,65 (2Н), 8,32 (1Н); m/z (+) 264 ([МН]+, 100%); m/z (+ESI) 264 ([МН]+, 100%).
(R)-5-Бифенил-4-илметил-3-метиленпирролидин-2-он (соединение 4-а, R1=Н) представляет собой кристаллическое вещество, и может характеризоваться рентгеновской дифракцией на порошке. Образец рентгеновской дифракции показал следующие интервалы плоскости внутри решетки (средние значения 2θ в [°] указаны с пределом ошибки ±0,2): 2θ в [°]:7,1, 13,3, 13,7, 14,5, 16,6, 17,7, 18,2, 19,4, 21,4, 22,5, 23,6, 24,0, 26,5, 27,6, 29,1, 29,9. Данные получены с помощью дифрактометра Bruker D8 Advance с помощью облучения Cu-Kα.
Метод ВЭЖХ (пример 28)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза А (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 29: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а. R1=Boc, R9=Me, R9=Me, Y=О)
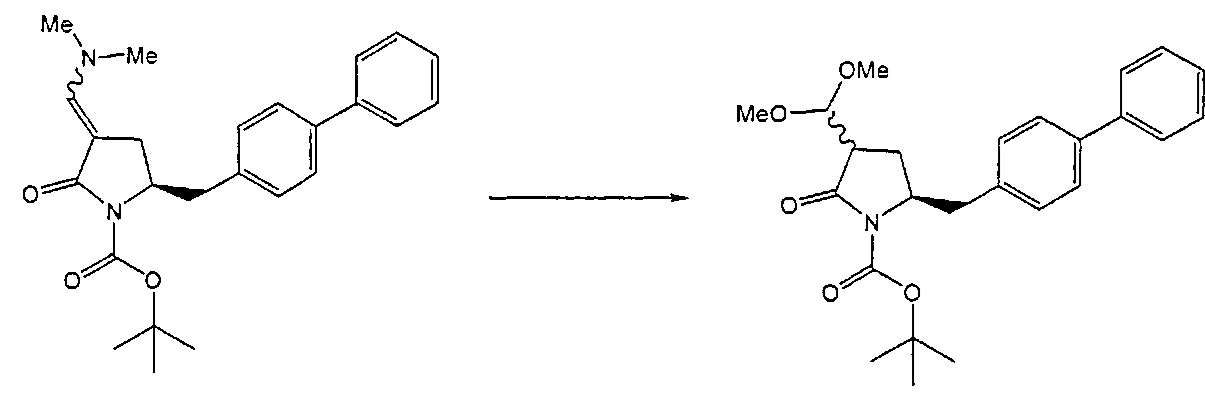
1,1 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) растворяли в 12 мл метанола. Добавляли HCl в метаноле (полученный с помощью подводящей трубки газообразного HCl в метанол; определение содержания HCl осуществляли по весу) до достижения значения pH 2. Полученный желтый раствор перемешивали в течение 4 часов, затем гасили добавлением 10% водного раствора карбоната натрия с получением значения pH выше 7. После экстракции дихлорметаном объединенные органические фазы сушили сульфатом натрия, отфильтровывали и упаривали досуха. Полученное желтое масло очищали колоночной хроматографией с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-a, R1=Boc, R9=Me, R9=Me) в виде смеси диастереомеров 88:12 [соотношение (3S)-:(3R)-диастереометров, соответственно]. 1H ЯМР (CDCl3): Данные для смеси диастереомеров: 1,62, 1,64, 1,89, 2,02, 2,26, 2,40, 2,69, 2,81, 2,92, 3,14, 3,20, 3,39, 3,44, 3,47, 3,52, 4,29, 4,40, 4,69, 7,27-7,39, 7,46, 7,56-7,62. Соотношение диастереомеров определяли сложением пар сигналов 3,39 ppm и 3,44 ppm (основной и минорный диастереомер, соответственно) или 3,47 ppm и 3,52 ppm (основной и минорный диастереомер, соответственно).
трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=Me, R9=Me) в виде смеси диастереомеров 88:12 [соотношение диастереомеров (3S):(3R), соответственно] может быть перекристаллизован из трет-бутилметилового эфира с получением трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=Me, R9=Me).
Рентгеновская структура полученных кристаллов показана на фигуре 5a.
Кристаллические данные [записаны при 120(2) K]
|
трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=Me, R9=Me) в виде смеси диастереомеров 88:12 [соотношение (3S)-:(3R)-диастереомеров, соответственно] может быть перекристаллизован из смеси этилацетат/гептан с получением трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-a, R1=Boc, R9=Me, R9=Me).
Рентгеновская структура полученных кристаллов показана на фигуре 5b.
Кристаллические данные [записаны при 100(2) K]
|
Пример 30: Йодид ((3R/S,5S)-5-бифенил-4-илметил-1-трет-бутоксикарбонил-2-оксопирролидин-3-илметил)триметиламмония (соединение 10-a, R1=Boc, R6=Me, R7=Me, R10=Me)
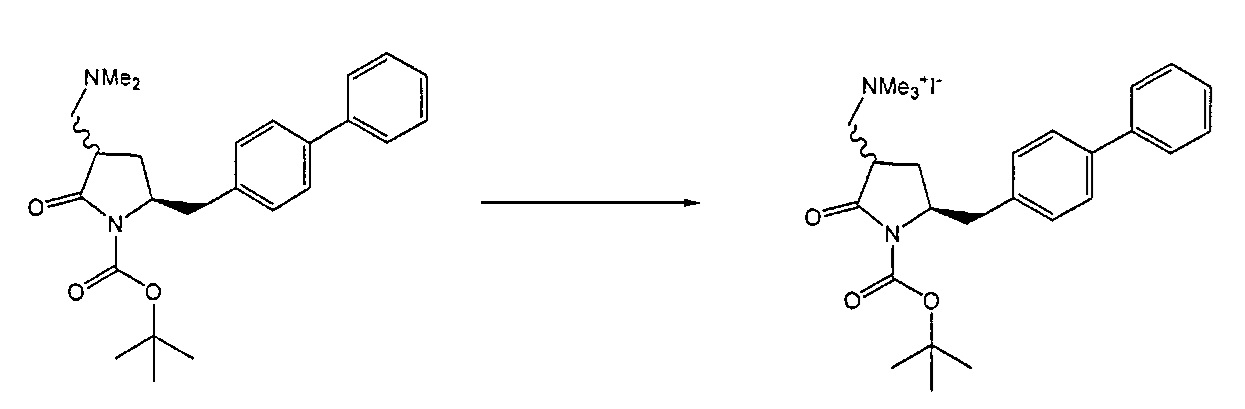
трет-Бутиловый эфир (3R/S,5S)-бифенил-4-илметил-3-диметиламинометил-2-оксопирролидин-1-карбоновой кислоты (соединение 9-a, R1=Boc, R6=Me, R7=Me) (108 мг) (соотношение диастереомеров (3S):(3R) 85:15 в соответствии с анализом ЯМР) разбавляли 4 мл метанола, и затем добавляли 328 мкл метилйодида. Реакционную смесь затем перемешивали при комнатной температуре в течение 17 ч. Смесь затем концентрировали досуха с получением йодида ((3R/S,5S)-5-бифенил-4-илметил-1-трет-бутоксикарбонил-2-оксопирролидин-3-илметил)триметиламмония (соединение 10-а, R1=Boc, R6=Me, R7=Me, R10=Me). 1H ЯМР (ДМСО): 1,51 (9H), 1,98 (1H), 2,18 (1H), 3,00 (1H), 3,08 (1H), 3,13 (9H), 3,38-3,43 (2H), 3,72 (1H), 4,25 (1H), 7,38 (1H), 7,42 (2H), 7,48 (2H), 7,67 (4H). m/z: 423 ([M]+, 100%). ИК (раствор в CH2Cl2, ν/см-1): 3040; 1781; 1742; 1724; 1487; 1371; 1298; 1277; 1150; 985. На основе данных ЯМР соотношение диастереомеров (3S):(3R) составляет 85:15.
Пример 31: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-a, R1=Boc)
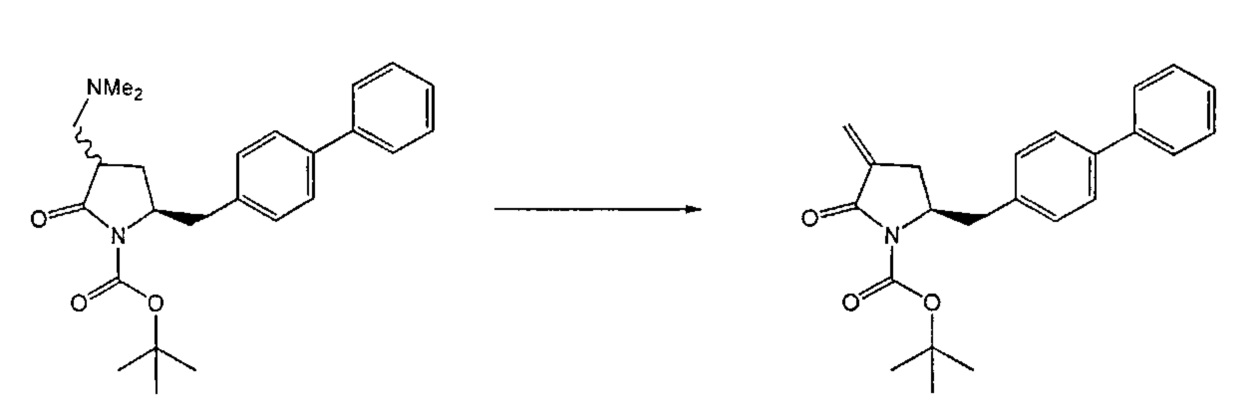
Сырой трет-бутиловый эфир (3R/S,5S)-бифенил-4-илметил-3-диметиламинометил-2-оксопирролидин-1-карбоновой кислоты (соединение 9-а, R1=Boc, R6=Me, R7=Me) (13,8 г) разбавляли 40 мл метанола, и затем добавляли 16,9 мл метилйодида. Реакционную смесь затем перемешивали при комнатной температуре в течение ночи, и затем концентрировали досуха. Затем к остатку добавляли 30 мл насыщенного раствора NaHCO3 и 15 мл дихлорметана. Полученную эмульсию перемешивали при комнатной температуре в течение 10 ч. Органический слой затем отделяли, промывали водой, сушили MgSO4, отфильтровывали и концентрировали в вакууме. Остаток очищали колоночной хроматографией (пентан/трет-бутилметиловый эфир = 8:2 к 7:3) с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-a, R1=Boc). Спектроскопические данные описаны в примере 23.
Метод ВЭЖХ (пример 31)
Колонка: X-BRIDGE C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 32: (R)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановая кислота (соединение 2-a, R1=Boc, R2=Н, R3=CO2H)
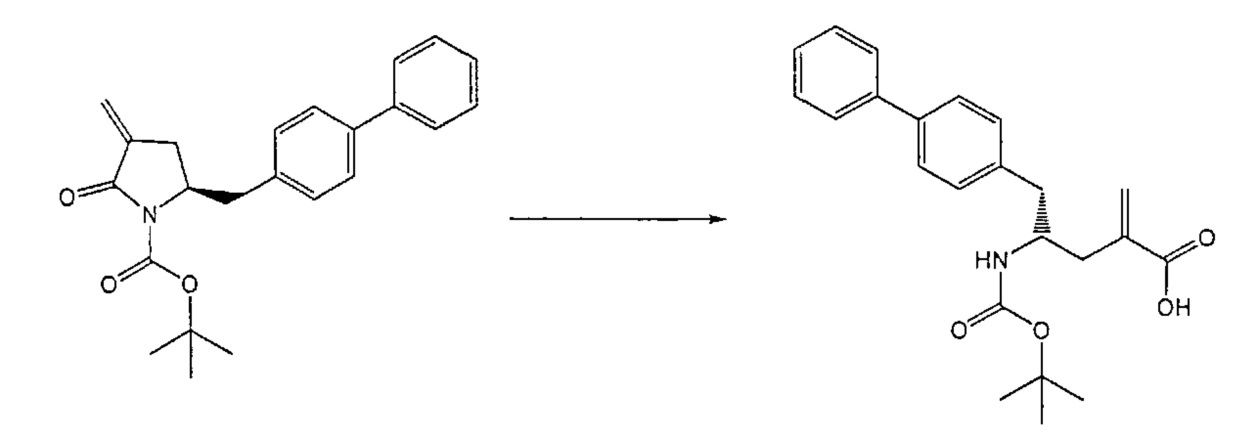
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-a, R1=Boc) (27,7 г) растворяли в ТГФ (270 мл) при комнатной температуре. Добавляли бромид тетрабутиламмония (0,24 г), затем воду (10 мл). Смесь затем охлаждали до 10°C. Добавляли раствор гидроксида лития (7,3 г) в воде (92 мл) в течение 2 ч. Добавляли фосфорную кислоту (37 г, 85%) до pH 3. Фазы затем разделяли. Органическую фазу разбавляли толуолом (100 мл) и промывали насыщенным раствором хлорида натрия. Фазы разделяли. Органическую фазу затем концентрировали в вакууме. Остаток растворяли в ацетонитриле (350 мл) при 80°C и азеотропно перегоняли. Добавляли еще ацетонитрил (150 мл), и смесь охлаждали до 0°C. Твердое вещество собирали фильтрацией и сушили с получением (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-a, R1=Boc, R2=Н, R3=CO2H) (25,7 г). δH (400 МГц, ДМСО) 1,30 (9Н), 2,29 (1Н), 2,50 (1Н), 2,75 (2Н), 3,91 (8Н), 5,62 (1Н), 6,09 (1H), 6,66 (1Н), 7,28 (2Н), 7,33 (1Н), 7,44 (2Н), 7,56 (2Н), 7,63 (2Н).
(R)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановая кислота (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) представляет собой кристаллическое твердое вещество. Образец рентгеновской дифракции показал следующие интервалы плоскости внутри решетки (средние значения 2θ в [°] указаны с пределом ошибки ±0,2): 2θ в [°]:4,4, 6,2, 8,6, 9,0, 9,9, 12,5, 13,4, 13,8, 14,1, 16,0, 17,8, 18,4, 19,3, 20,8, 21,7, 22,2, 23,1, 24,6, 25,0, 25,7, 27,6. Наиболее интенсивные сигналы в образце рентгеновской дифракции показали следующие интервалы плоскости внутри решетки (средние значения 2θ в [°] указаны с пределом ошибки ±0,2): 2θ в [°]:4,3, 6,2, 8,6, 9,9, 12,5, 13,4, 16,0, 17,8, 18,4, 19,3. Данные получены с помощью дифрактометра Bruker D8 Advance с помощью облучения Cu-Kα.
Метод ВЭЖХ (пример 32)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 33: (R)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановая кислота (соединение 2-а, R1=Boc, R2=Н, R3=СО2Н)
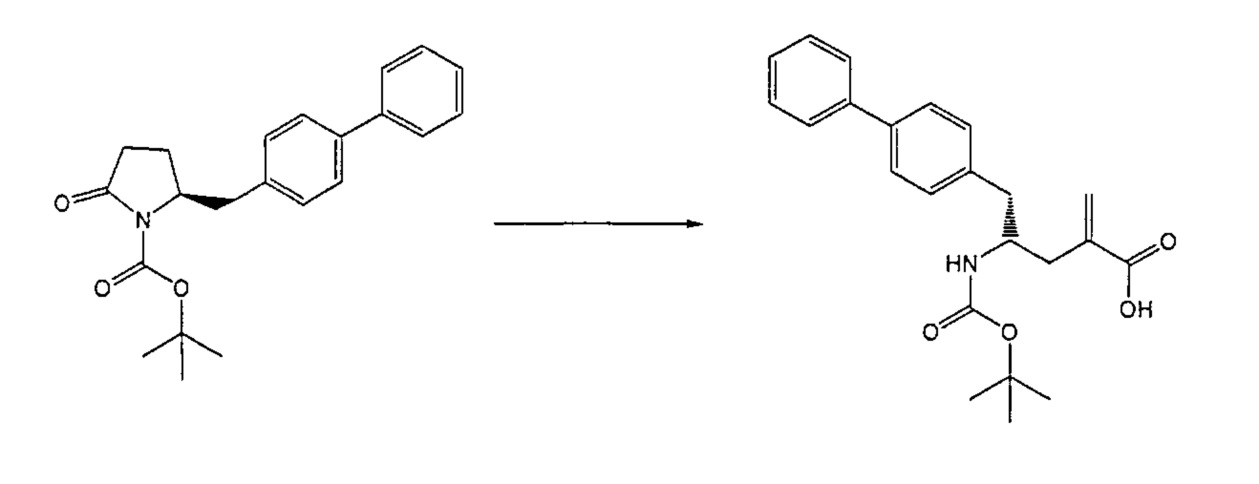
210 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-a, R1=Boc) добавляли к 1285 г (2000 мл) смеси, содержащей соединения формулы 13, 14, 15 (где R6=Me, R7=Me, R8=третBu) при комнатной температуре. Раствор нагревали до 80-85°C и перемешивали в течение 15 ч. Раствор концентрировали в вакууме (90°C, 30 мбар) с получением остатка. (Собранный дистиллят, содержащий соединения формулы 13, 14, 15 (где R6=Me, R7=Me, R8=третBu), может быть необязательно повторно использован в последующих реакциях, если это возможно). Остаток растворяли в 1430 мл тетрагидрофурана. Затем добавляли 37,8 г серной кислоты, разбавленной в 638 мл воды. Смесь затем интенсивно перемешивали при 10-15°C. В это время значение pH поддерживали в диапазоне pH 2-3 добавлением при необходимости еще порций серной кислоты. Через 1 ч нижнюю водную фазу удаляли, и оставшуюся органическую фазу промывали около 6 г насыщенного раствора карбоната калия. Затем добавляли 1194 г раствора карбоната калия (1М раствор), затем 3,94 г раствора гидроксида тетрабутиламмония (40%) и 133 г водного раствора формальдегида (37%). Эту смесь нагревали при 40-45°C и перемешивали интенсивно в течение 2 часов. Затем водную фазу удаляли. К оставшейся органической фазе добавляли 300 мл воды. Затем добавляли 97 г раствора сульфита натрия (40%), поддерживая температуру ниже 40°C. После этого водную фазу удаляли, и заменяли 600 мл свежей воды. ТГФ удаляли дистилляцией (рубашка 50°C, 100-200 мбар) с получением белой суспензии. Добавляли 1500 мл толуола при 50°C. Снова нижнюю водную фазу удаляли, и оставшуюся органическую фазу промывали около 200 мл воды. Последний частично концентрировали в вакууме для удаления всей воды азеотропной дистилляцией, пока дистиллят не заместится свежим толуолом. После этого добавляли 54 г диазабициклоундецена (DBU), а также 17 г метансульфонилхлорида, осторожно при 20-25°C. Через один час перемешивания добавляли около 300 мл воды, затем 1,4 г концентрированной серной кислоты для понижения значения pH до 6-7. Водную фазу удаляли, и оставшуюся органическую фазу промывали 300 мл воды. Добавляли 600 мл воды, и растворитель удаляли дистилляцией при пониженном давлении с получением белой суспензии. Затем добавляли около 1500 мл ТГФ, затем 57 г гидроксида лития, растворенного в 300 мл воды. Смесь перемешивали интенсивно при 10-15°C в течение 2 часов. Затем осторожно добавляли 100 г фосфорной кислоты (58%) для доведения значения pH до 3-4. Затем добавляли около 300 мл толуола, и водную фазу удаляли. Полученную органическую фазу промывали 200 мл насыщенного раствора хлорида натрия и концентрировали до половины начального объема в вакууме. Остаток разбавляли 300 мл ТГФ и отфильтровывали. ТГФ затем заменяли ацетонитрилом дистилляцией, поддерживая объем постоянным при дистилляции в вакууме. После удаления большей части ТГФ, целевой продукт перекристаллизовывали, получая тонкую суспензию. Ее охлаждали до 0°C, и твердое вещество извлекали фильтрацией. Его сушили в вакууме при 50°C с получением (11)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-a, R1=Boc, R2=Н, R3=CO2H). Спектроскопические данные описаны в примере 32.
Метод ВЭЖХ (пример 33)
Колонка: X-BRIDGE С18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60±2°C.
Время удерживания:
|
Пример 34: трет-Бутиловый эфир (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-a, R1=Boc) и трет-бутиловый эфир (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc)
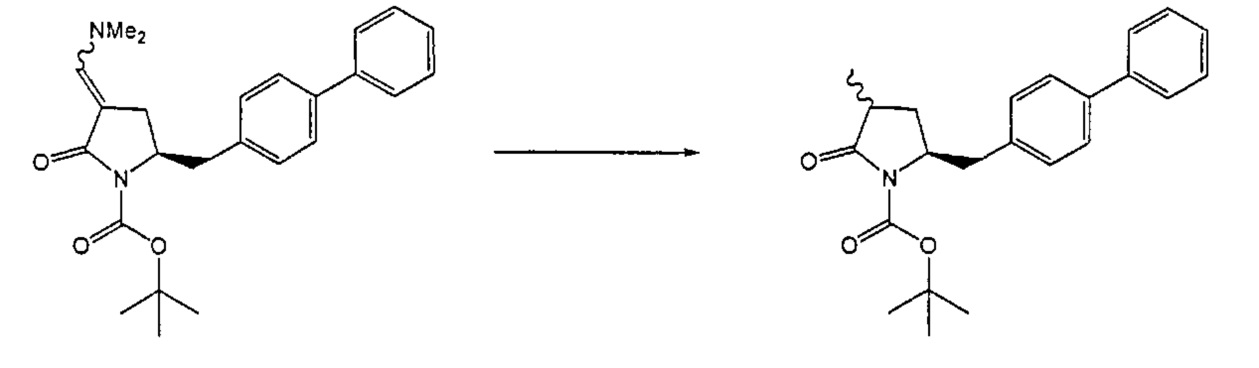
Способ 1
1,3 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) растворяли в 40 мл этилацетата. После добавления 0,3 г 10% Pd/C (Engelhard 4505) систему насыщали несколько раз водородом, и затем перемешивали при 20°C и 4 бар водорода в течение 5 дней. Полученную реакционную смесь отфильтровывали через cellflock и концентрировали досуха с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 33:67 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 2
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к тетрагидрофурану с получением концентрации субстрата 0,05 М. К смеси добавляли триэтиламин (1 эквивалент). Затем к смеси добавляли 5% Pd/C А102023 (25 вес.%). Смесь затем помещали в атмосферу водорода при 20 бар. Смесь перемешивали при 40°C в течение 3 ч. Смесь затем отфильтровывали для удаления катализатора и концентрировали при пониженном давлении. Диастереомерное соотношение составляло 39:61 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Общая методика (способы 3-8)
трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к тетрагидрофурану, метанолу или изопропилацетату при комнатной температуре с получением концентрации субстрата 0,05 М, 0,167 М или 0,25 М. Затем к смеси добавляли гетерогенный катализатор (25 мас.% относительно соединения 7-а). Смесь затем помещали в атмосферу водорода при 20 бар. Смесь перемешивали при 40°C, 45°C, 55°C или 65°C в течение 1,5 или 3 ч. Смесь затем отфильтровывали для удаления катализатора и концентрировали при пониженном давлении.
Способ 3
Катализатор: 5% Pd(S)/C А103038; Тетрагидрофуран; 0,05 М; 55°C; 3 ч. Диастереомерное соотношение 29:71 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 4
Катализатор: 5% Pd/C типа 39; Метанол; 0,05 М; 55°C; 3 ч. Диастереомерное соотношение 42:58 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 5
Катализатор: 5% Pd(S)/C А103038; Тетрагидрофуран; 0,167 М; 40°C; 1,5 ч. Диастереомерное соотношение 14:86 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 6
Катализатор: 5% Pd(S)/C А103038; Тетрагидрофуран; 0,167 М; 40°C; 3 ч. Диастереомерное соотношение 21:79 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 7
Катализатор: 5% Pd/C типа 37; Изопропилацетат; 0,167 М; 65°C; 3 ч. Диастереомерное соотношение 34:66 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 8
Катализатор: 5% Pd/C типа 39; Тетрагидрофуран; 0,25 М; 65°C; 3 ч. Диастереомерное соотношение 39:61 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 9
1,3 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этилацетату (40 мл) при комнатной температуре. К смеси добавляли 0,3 г 10% палладия на угле (Engelhard 4505) и воду (0,3 мл). Смесь затем помещали в атмосферу водорода при 4 бар. Смесь перемешивали при комнатной температуре и давлении 4 бар водорода в течение 4 дней. Смесь затем отфильтровывали для удаления катализатора и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией (этилацетат/гексан, 70:30) с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 67:33 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 10
1,3 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этилацетату (40 мл) при комнатной температуре. К смеси добавляли 0,3 г катализатора Линдлара (от Aldrich). Смесь затем помещали в атмосферу водорода при 2 бар. Смесь перемешивали при комнатной температуре и давлении водорода 2 бар в течение 3 дней. Смесь затем отфильтровывали для удаления катализатора, и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией (этилацетат/гексан, 70:30) с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 99,2:0,8 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 11
1,3 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этилацетату (40 мл) при комнатной температуре. К смеси добавляли 0,3 г 10% палладия на угле (Engelhard 4505). Смесь затем помещали в атмосферу водорода при 2 бар. Смесь перемешивали при комнатной температуре и давлении водорода 2 бар в течение 3 дней. Смесь затем отфильтровывали для удаления катализатора, и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией (этилацетат/гексан, 70:30) с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 88,8:11,2 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 12
1,3 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этилацетату (40 мл) при комнатной температуре. К смеси добавляли 0,3 г 10% палладия на угле (Engelhard 4505) и одну каплю водного раствора гидроксида натрия. Смесь затем помещали в атмосферу водорода при 4 бар. Смесь перемешивали при комнатной температуре и давлении 4 бар водорода в течение 4 дней. Смесь затем отфильтровывали для удаления катализатора и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией (этилацетат/гексан, 70:30) с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 76:24 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ 1 (пример 34, способы 1, 9, 10, 11 и 12)
Колонка: X-BRIDGE C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); Подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 10 мин (70% Б), 11 мин (70% Б), 13 мин (80% Б), 16 мин (80%) Б), 16,1 мин (20% Б), 19 мин 20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 55±2°C.
Время удерживания:
|
Метод ВЭЖХ 2 (пример 34, способы 1, 9, 10, 11 и 12)
Колонка: Chiralpak AD-RH, 150×2,6 мм, 5,0 мкм. Подвижная фаза A (пода); Подвижная фаза Б (ацетонитрил). Изократно: 0 мин (80% Б); 15 мин (80% Б). Скорость потока: 0,5 мл мин-1. Длина волны: 210 нм.
Время удерживания:
|
Метод ВЭЖХ 3 (пример 34, способы 2-8)
Колонка: AD-RH Chiralpak; 150×4,6 мм. Подвижная фаза A (вода); подвижная фаза Б (ацетонитрил). Изократно: 0 мин (20% Б); 15 мин (20% Б). Скорость потока: 0,5 мл мин-1. Длина волны 210 нм. Температура колонки 40°C.
Время удерживания:
|
Пример 35: Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me), трет-бутоксибис(диметиламино)метан (соединение 14, R6=Me, R7=Me,. R8=третBu) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu)
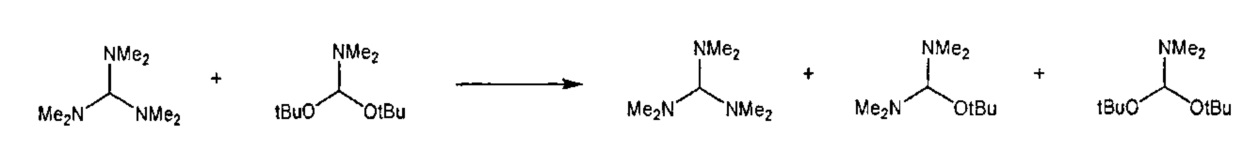
Способ 1
Смесь 1,01 г N,N-диметилформамидди-трет-бутилацеталя (соединение 15, R6=Me, R7=Me, R8=третBu) (Aldrich #358800) и 0,73 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) перемешивали при комнатной температуре в течение ночи. Полученную смесь охлаждали до комнатной температуры, получая раствор, содержащий соединения 13, 14 и 15 (R6=Me, R7=Me, R8=Me), что определено данными ЯМР (спектроскопические данные описаны в примере 14, способ 1).
Способ 2
Смесь 1,01 г N,N-диметилформамидди-трет-бутилацеталя (соединение 15, R6=Me, R7=Me, R8=третBu) (Aldrich #358800) и 0,73 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) нагревали при 45°C в течение 4 ч. Полученную смесь охлаждали до комнатной температуры, получая раствор, содержащий соединения 13, 14 и 15 (R6=Me, R7=Me, R8=Me), что определено данными ЯМР (спектроскопические данные описаны в примере 14, способ 1).
Способ 3
Смесь 1,01 г N,N-диметилформамидди-трет-бутилацеталя (соединение 15, R6=Me, R7=Me, R8=третBu) (Aldrich #358800) и 0,73 г трис(диметиламино)метана (соединение 13, R6=Me, R7=Me) (Aldrich, #221058) нагревали при 80°C в течение 1 ч. Полученную смесь охлаждали до комнатной температуры, получая раствор, содержащий соединения 13, 14 и 15 (R6=Me, R7=Me, R8=Me), что определено данными ЯМР (спектроскопические данные описаны в примере 14, способ 1).
Пример 36: Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me), трет-пентоксибис(диметиламино)метан (соединение 14, R6=Me, R7=Me, R8=CMe2Et) и N,N-диметилформамидди-трет-пентоксиацеталь (соединение 15, R6=Me, R7=Me, R8=CMe2Et)
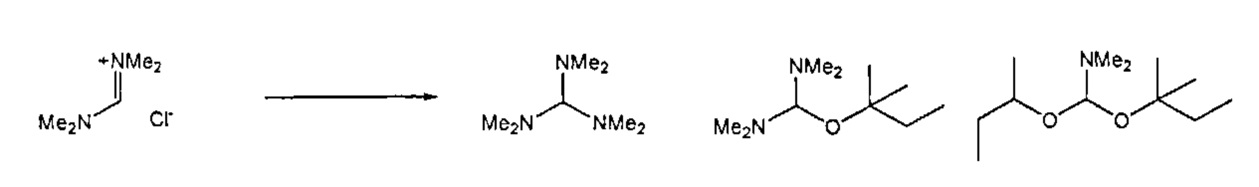
Способ 1
57,5 г хлорида N,N,N,N-тетраметилформамидиния добавляли к 93 г 40% раствора амилата натрия в толуоле. Полученную смесь перемешивали при комнатной температуре в течение 48 ч. Смесь затем отфильтровывали, и остаток промывали толуолом (22 г) с получением раствора, содержащего соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et). Образец фильтрата концентрировали в вакууме. 1Н ЯМР (C6D6): 0,81-0,84, 0,92-0,98, 1,02, 1,10, 1,20, 1,30-1,34, 1,47-1,62, 2,29, 2,33, 3,02, 4,06, 5,02. Относительные количества соединения 13 (R6=Me; R7=Me), соединения 14 (R6=Me, R7=Me, R8=третBu), соединения 15 (R6=Me, R7=Me, R8=Me) определяли сложением сигналов при 3,02, 4,06 и 5,02 ppm, соответственно.
Способ 2
41 г хлорида N,N,N,N-тетраметилформамидиния добавляли к 67 г 40% раствора амилата натрия в толуоле. Полученную смесь перемешивали при комнатной температуре в течение 48 ч. Смесь отфильтровывали, и остаток промывали толуолом (2×10 мл). Смесь затем разбавляли до общего объема 100 мл с получением раствора, содержащего соединения 13, 14 и 15 (R6=Me, R7=Me, R8=CMe2Et). Спектроскопические данные описаны в примере 36, способ 1.
Пример 37: Диизопропилэтиламмонийная соль (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н,  )
)
1 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) добавляли к этанолу (10 мл). Затем добавляли диизопропилэтиламин (0,454 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь затем концентрировали в вакууме с получением диизопропилэтиламмонийной соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н,  . 1Н ЯМР (ДМСО-d16): 0,95-0,98 (15H), 1,04 (3H), 1,32 (9Н), 1,36 (1Н), 1,74 (1Н), 2,38-2,49 (3H), 2,67 (2Н), 2,99 (2Н), 3,66 (1H), 6,29 и 6,70 (1Н), 7,23-7,25 (2Н), 7,33-7,37 (1H), 7,42-7,46 (2Н), 7,55-7,57 (2Н), 7,62-7,64 (2Н).
. 1Н ЯМР (ДМСО-d16): 0,95-0,98 (15H), 1,04 (3H), 1,32 (9Н), 1,36 (1Н), 1,74 (1Н), 2,38-2,49 (3H), 2,67 (2Н), 2,99 (2Н), 3,66 (1H), 6,29 и 6,70 (1Н), 7,23-7,25 (2Н), 7,33-7,37 (1H), 7,42-7,46 (2Н), 7,55-7,57 (2Н), 7,62-7,64 (2Н).
Пример 38: Триэтиламмонийная соль (2R,4S)-5-бифенил-4-ил-4-трет-бУтоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н,  )
)
1 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) добавляли к этанолу (10 мл). Затем добавляли триэтиламин (0,264 мл), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь затем концентрировали в вакууме с получением триэтиламмонийной соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н,  ). 1Н ЯМР (ДМСО-d6): 0,95 (9 Н), 1,04 (3H), 1,32 (9Н), 1,36 (1Н), 1,74 (1Н), 2,38-2,50 (7H), 2,67 (2Н), 3,65 (1Н), 6,29 и 6,70 (1H), 7,23-7,25 (2H), 7,33-7,37 (1H), 7,43-7,48 (2H), 7,55-7,57 (2H), 7,62-7,64 (2Н).
). 1Н ЯМР (ДМСО-d6): 0,95 (9 Н), 1,04 (3H), 1,32 (9Н), 1,36 (1Н), 1,74 (1Н), 2,38-2,50 (7H), 2,67 (2Н), 3,65 (1Н), 6,29 и 6,70 (1H), 7,23-7,25 (2H), 7,33-7,37 (1H), 7,43-7,48 (2H), 7,55-7,57 (2H), 7,62-7,64 (2Н).
Пример 39: Натриевая соль (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, 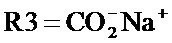 )
)
1 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (R1=Boc, R2=Н, R3=CO2H) добавляли к этанолу (10 мл). Затем добавляли метоксид натрия (141 мг), и смесь перемешивали при комнатной температуре в течение 30 минут. Смесь затем концентрировали в вакууме с получением натриевой соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, 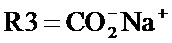 ). 1Н ЯМР (ДМСО-d6): 0,91 (3H), 1,29 (1H), 1,34 (9Н), 1,61 (1H), 2.12 (1H), 2,68-2,81 (2Н), 3,60 (1Н), 7,25-7,27 (2Н), 7,32-7,36 (1Н), 7,43-7,47 (2Н), 7,55-7,57 (2Н), 7,64-7.66 (2Н), 7,76 (1Н).
). 1Н ЯМР (ДМСО-d6): 0,91 (3H), 1,29 (1H), 1,34 (9Н), 1,61 (1H), 2.12 (1H), 2,68-2,81 (2Н), 3,60 (1Н), 7,25-7,27 (2Н), 7,32-7,36 (1Н), 7,43-7,47 (2Н), 7,55-7,57 (2Н), 7,64-7.66 (2Н), 7,76 (1Н).
Пример 40: (2R,4S)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановая кислота (соединение 1-а, R1=Boc, R2=Н, R3=CO2H), (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановая кислота (соединение 1-b, R1=Boc, R2=Н, R3=CO2H)
Способ 1
20 мг (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) добавляли к этанолу (400 мкл). Затем добавляли 10% палладий на угле (2 мг, 50% воды, тип Degussa E101 NE/W). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали этанолом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2H). 1Н ЯМР (CDCl3): 1,11-1,16, 1,21 и 1,33, 1,39-1,53, 1,70-1,92, 2,32-2,81, 3,72-3,97, 4,44-4,50, 6,41 и 6,56, 7,16-7,49, 10,84.
Способ 2
20 мг (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) добавляли к изопропилацетату (400 мкл). Затем добавляли 10% палладий на угле (2 мг, 50% воды, тип Degussa E101 NE/W). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2H). Спектроскопические данные описаны в примере 40, способ 1.
Способ 3
20 мг (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) добавляли к изопропилацетату (400 мкл). Затем добавляли 10% платины на угле (2 мг). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=H, R3=CO2H). Спектроскопические данные описаны в примере 40, способ 1.
Способ 4
20 мг (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н. R3=CO2H) добавляли к изопропилацетату (400 мкл). Затем добавляли 5% родия на угле (2 мг). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2H). Спектроскопические данные описаны в примере 40, способ 1.
Пример 41: Калиевая соль (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K)
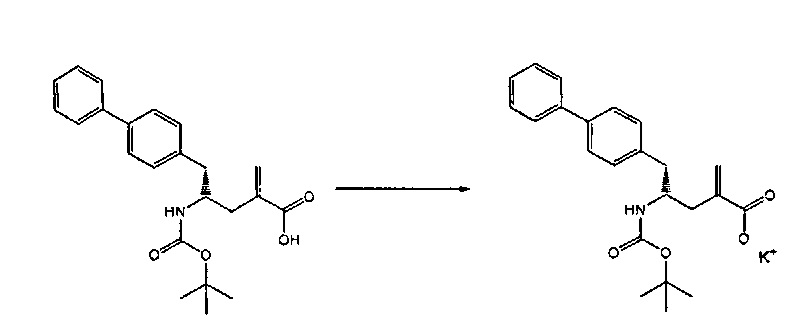
500 мг (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) добавляли к этанолу (5 мл) при комнатной температуре. К смеси добавляли 2,6 мл 0,5 М раствора гидроксида калия в этаноле в течение 5 минут. Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Растворитель затем удаляли при пониженном давлении. К смеси добавляли толуол (10 мл). Растворитель затем удаляли при пониженном давлении с получением калиевой соли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K). 1Н ЯМР (ДМСО): 1,35 (9Н), 2,24-2,37 (2Н), 2,67-2,84 (2Н), 3,69-3,80 (1Н), 5,04 (1Н), 5,79 (1H), 7,12-7,17, 7,23-7,35, 7,42-7,46, 7,54-7,57, 7,62-7,67.
Пример 42: Калиевая соль (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2K) и калиевая соль (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2K)
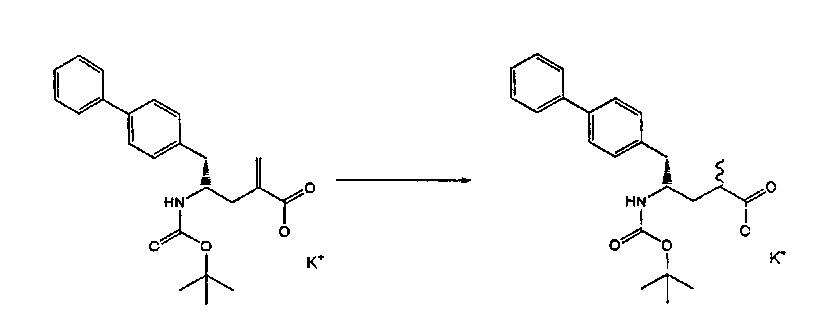
Способ 1
100 мг калиевой соли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K) (полученной в соответствии с методикой примера 42) добавляли к этанолу (1 мл). Затем добавляли 10% палладий на угле (10 мг, 50% воды, тип Degussa E101 NE/W). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали этанолом (2×1 мл). Смесь затем концентрировали в вакууме с получением калиевой соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2K) и калиевой соли (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2K). 1Н ЯМР (CDCl3): 1,06-1,12, 1,31-1,36, 1,80-,193, 2,25-2,49, 2,62-2,92, 3,74-4,08, 4,81 и 5,27, 6,20 и 6,54, 7,24-7,57.
Способ 2
100 мг калиевой соли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K) (полученной в соответствии с методикой примера 42) добавляли к изопропилацетату (1 мл). Затем добавляли 10% палладий на угле (10 мг, 50% воды, тип Degussa E101 NE/W). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×1 мл). Смесь затем концентрировали в вакууме с получением калиевой соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2K) и калиевой соли (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2K). Спектроскопические данные описаны в примере 42, способ 1.
Способ 3
100 мг калиевой соли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K) (полученной в соответствии с методикой примера 42) добавляли к изопропилацетату (1 мл). Затем добавляли 10% платины на угле (10 мг). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×1 мл). Смесь затем концентрировали в вакууме с получением калиевой соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2K) и калиевой соли (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2K). Спектроскопические данные описаны в примере 42, способ 1.
Способ 4
100 мг калиевой соли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2K) (полученной в соответствии с методикой примера 42) добавляли к изопропилацетату (1 мл). Затем добавляли 5% родия на угле (10 мг). Смесь помещали в атмосферу водорода при давлении окружающей среды. Смесь перемешивали при комнатной температуре и давлении в течение ночи. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×1 мл). Смесь затем концентрировали в вакууме с получением калиевой соли (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2K) и калиевой соли (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=H, R3=CO2K). Спектроскопические данные описаны в примере 42, способ 1.
Пример 43: (2R,4S)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановая кислота (соединение 1-а, R1=Boc, R2=Н, R3=CO2H, (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановая кислота (соединение 1-b, R1=Boc, R2=Н, R3=CO2H, соль (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н,  ) или соль (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н,
) или соль (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н,  )
)
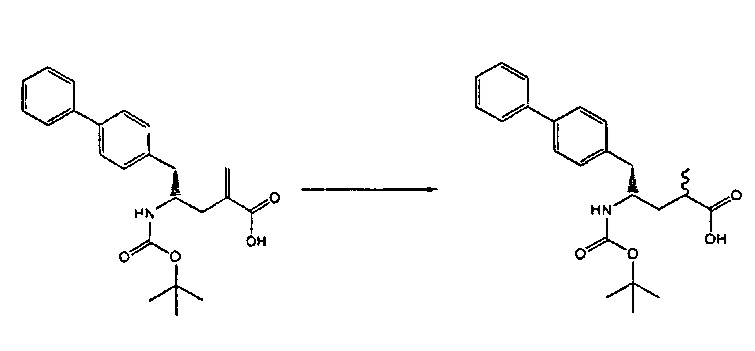 и/или
и/или 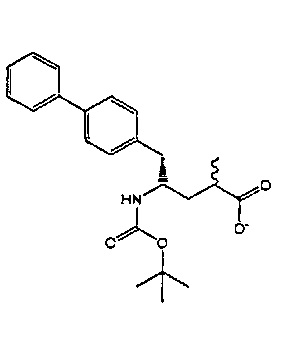
Общая методика 1
Смесь металлоорганического катализатора (C) и (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) добавляли к растворителю (S) (объем и название растворителя приведены в таблице примера 43) до достижения концентрации соединения 2-а (R1=Boc, R2=Н, R3=CO2H), приведенной в таблице примера 43, и соотношения S/C, приведенного в таблице примера 43.
Необязательно и в соответствии с таблицей примера 43, добавка (D) может добавляться на этой стадии. Название и количество добавки приведено в таблице примера 43. Количество добавки используют относительно молей (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H).
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Летучие примеси удаляли при пониженном давлении, и полученный остаток анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-а, R1=Boc, R2=Н,  ) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н,  ).
).
Общая методика 2
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к смеси металлоорганического комплекса (А) и хирального лиганда (L). Смесь перемешивали в течение 0,5 ч при комнатной температуре. Затем добавляли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановую кислоту (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) в растворителе (объем и название растворителя приведено в таблице примера 43). Конечная концентрация соединения 2-а (R1=Boc, R2=Н, R3=CO2H) приведена в таблице примера 43. Соотношение S/C приведено в таблице примера 43. Соотношение хирального лиганда на атом металла в металлоорганическом комплексе приведено в таблице примера 43.
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Летучие примеси удаляли при пониженном давлении, и полученный остаток анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-а, R1=Boc, R2=Н, 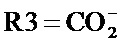 ) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н, 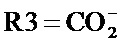 ).
).
Общая методика 3
(R)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановую кислоту (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) в растворителе (S) (0,244 мл, название растворителя приведено в таблице примера 43) добавляли в сосуд, содержащий металлоорганический катализатор (С). Добавляли другой растворитель (название приведено в таблице примера 43) с получением конечной концентрации соединения 2-a ((R1=Boc, R2=Н, R3=CO2H), приведенной в таблице примера 43. Соотношение S/C приведено в таблице примера 43.
Необязательно и в соответствии с таблицей примера 43, добавка (D) может добавляться на этой стадии. Название и количество добавки приведено в таблице примера 43. Количество добавки используют относительно молей (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H).
Смесь затем перемешивали при температуре и давлении, указанных в таблице примера 43 в течение времени, также указанного в таблице примера 43.
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-а, R1=Boc, R2=Н, 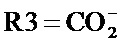 ) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н, 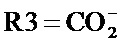 ).
).
Общая методика 4
Металлоорганический комплекс (А) и хиральный лиганд (L) добавляли к смеси этанола (0,041 мл) и дихлорэтана (0,135 мл). Смесь перемешивали в течение 0.5 ч. Растворитель затем удаляли при пониженном давлении. (R)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановую кислоту (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) в растворителе (S) (0,244 мл, название растворителя приведено в таблице примера 43) добавляли в сосуд, содержащий металлоорганический комплекс (А) и хиральный лиганд (L). Добавляли другой растворитель (название приведено в таблице примера 43) с получением конечной концентрации соединения 2-а (R1=Boc, R2=Н, R3=CO2H), показанной в таблице примера 43. Соотношение S/C приведено в таблице примера 43. Соотношение хирального лиганда и атома металла в металлоорганическом комплексе приведено в таблице примера 43.
Необязательно и в соответствии с таблицей примера 43, добавка (D) может добавляться на этой стадии. Название и количество добавки приведено в таблице примера 43. Количество добавки используют относительно молей (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H).
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-а, R1=Boc, R2=Н, R3=CO2-) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=H, 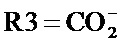 ).
).
Общая методика 5
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к смеси металлоорганического комплекса (А) и хирального лиганда (L) в сосуд А. Смесь перемешивали в течение 15 мин при комнатной температуре.
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоте (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) в сосуд Б.
Содержимое сосуда A и сосуда Б переносили в сосуд В (пустой). Конечная концентрация соединения 2-а (R1=Boc, R2=Н, R3=CO2H) приведена в таблице примера 43. Соотношение S/C приведено в таблице примера 43. Соотношение хирального лиганда к атому металла в металлоорганическом комплексе приведено в таблице примера 43.
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-а, R1=Boc, R2=Н, 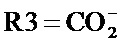 ) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-b, R1=Boc, R2=Н, 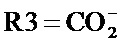 ).
).
Общая методика 6
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к смеси металлоорганического комплекса (А) и хирального лиганда (L) в сосуд А. Смесь перемешивали в течение 0,5 ч при комнатной температуре.
Смесь переносили в сосуд Б, содержащий (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) и необязательно (как показано в таблице примера 43),4-диазобицикло[2.2.2]октан (количество приведено в таблице примера 43). Количество 1,4-диазобицикло[2.2.2]октана использовали относительно молей (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H). Конечная концентрация соединения 2-а (R1=Boc, R2=Н, R3=CO2H) приведена в таблице примера 43. Соотношение S/C указано в таблице примера 43. Соотношение хирального лиганда к атому металла в металлоорганическом комплексе приведено в таблице примера 43.
Необязательно и в соответствии с таблицей примера 43, метансульфоновая кислота может добавляться на этой стадии в сосуд Б. Количество метансульфоновой кислоты используют относительно молей (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H) и указано в таблице примера 43.
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-а, R1=Boc, R2=Н, 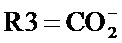 ) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н, 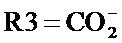 ).
).
Общая методика 7
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к смеси металлоорганического комплекса (А) и хирального лиганда (L) в сосуд А. Водород (1 бар) использовали для сосуда А, и смесь перемешивали в течение 5 мин пои комнатной температуре.
Растворитель (объем и название растворителя приведено в таблице примера 43) добавляли к (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоте (соединение 2-а, R1=Boc, R2=Н, R3=СО2Н) в сосуд Б.
Содержимое сосуда A и сосуда Б переносили в сосуд В (пустой). Конечная концентрация соединения 2-а (R1=Boc, R2=Н, R3=СО2Н) указана в таблице примера 43. Соотношение S/C указано в таблице примера 43. Соотношение хирального лиганда к атому металла в металлоорганическом комплексе указано в таблице примера 43.
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-а, R1=Boc, R2=Н, 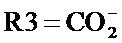 ) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н, 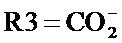 ).
).
Общая методика 8
Растворитель (S) (объем и название растворителя приведено в таблице примера 43) добавляли к смеси металлоорганического комплекса (А) и хирального лиганда (L) в сосуде А. Смесь перемешивали в течение 15 мин при комнатной температуре.
Растворитель (объем и название растворителя приведено в таблице примера 43) добавляли к (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоте (соединение 2-а, R1=Boc, R2=Н, R3=СО2Н) в сосуде Б. Смесь нагревали при 70°C в течение 0,5 ч.
Содержимое сосуда A и сосуда Б переносили в сосуд В (пустой). Конечная концентрация соединения 2-а (R1=Boc, R2=Н, R3=CO2H) указана в таблице примера 43. Соотношение S/C указано в таблице примера 43. Соотношение хирального лиганда к атому металла в металлоорганическом комплексе указано в таблице примера 43.
Водород затем может вводиться в сосуд, содержащий смесь (температура, время и давление приведены в таблице примера 43).
Сырые реакционные растворы анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) или (соединение 1-а, R1=Boc, R2=Н, 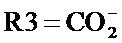 ) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н,
) к (соединение 1-b, R1=Boc, R2=Н, R3=СО2Н) или (соединение 1-b, R1=Boc, R2=Н, 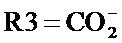 ).
).
Метод ВЭЖХ 1 (Реакции осуществляли в соответствии с примером 43, общие методики 1 или 2)
Колонка: Chiralpak QD-AX; 150×4,6 мм; 5 мкм. Подвижная фаза A: метанол, 0,05% AcOH (об.), 0,01% NH4OAc (масс/об.). Изократно: 0 мин (100% А); 15 мин (100% А). Скорость потока 0,8 мл мин-1. Длина волны: 254 нм. Температура колонки: комнатная (20-25°C).
Время удерживания:
|
Метод ВЭЖХ 2 (Реакции осуществляли в соответствии с примером 43, общие методики 3, 4, 5, 6, 7 или 8)
Колонка: Chiralpak QD-AX; 150×4,6 мм; 5 мкм. Подвижная фаза A: метанол, 0,05% AcOH (об.), 0,01% NH4OAc (масс/об.). Изократно: 0 мин (100% А); 20 мин (100% А). Скорость потока: 0,8 мл мин-1. Длина волны: 220 нм. Температура колонки: 25°C.
Время удерживания:
|
|
|
|
|
|
|
|
Для примера 43 используются следующие сокращения:
Металлоорганический катализатор (C)
С-1 = [Rh(COD)(SL-P005-1)]BF4=[Rh(COD)(L-38)]BF4
С-2 = [Rh(COD)(SL-P102-1)]O3SCF3=[Rh(COD)(L-40)]O3SCF3
С-3 = [Rh(COD)(SL-P102-1)]BF4=[Rh(COD)(L-40)]BF4
C-4 = [Rh(COD)(SL-P104-2)]O3SCF3=[Rh(COD)(L-41)]O3SCF3
C-5 = [(S)MeBoPhoz Rh(COD)]BF4=[(L-55)Rh(COD)]BF4
C-6 = [(R)4-F-C6H4-MeBoPhoz Ru(бензол)Cl]Cl=[(L-60)Ru(бензол)Cl]Cl
C-7 = [(R)Фенэтил-(R)-MeBoPhoz Ru(бензол)Cl]Cl=[(L-61)Ru(бензол)Cl]Cl
C-8 = (R)BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl=[L-62)Ru(бензол)Cl]Cl
C-9 = [(S)BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl=[(L-63)Ru(бензол)Cl]Cl
C-10 = [(R)MeBoPhoz RuCl(Бензол)]Cl=[(L-54)RuCl(Бензол)]Cl
C-11 = [(R)n-F-MeBoPhoz RuCl(Бензол)]Cl=[(L-64)RuCl(Бензол)]Cl
C-12 = [(S)MeBoPhoz Ir(COD)]Cl=[(L-55)Ir(COD)]Cl
C-13 = [(R)MeBoPhoz Ir(COD)]Cl=[(L-54)Ir(COD)]Cl
C-14 = [(R,R)BDPP Rh(COD)]BF4=[(L-65)Rh(COD)]BF4
C-15 = [(S,S)BDPP Rh(COD)]BF4=[(L-66)Rh(COD)]BF4
C-l6 = [(R)Binam-P Rh(COD)]BF4=[(L-67)Rh(COD)]BF4
C-17 = [(S)Binam-P Rh(COD)]BF4=[(L-68)Rh(COD)]BF4
C-l8 = [(R)Tol-BINAP RuCl(бензол)]Cl=[(L-69)RuCl(бензол)]Cl
C-19 = [(S)Tol-Binap Rh(COD)]BF4=[(L-70)Rh(COD)]BF4
C-20 = [(R)Binap RuCl(бензол)]Cl=[(L-71)(бензол)]Cl
C-21 = [(S)Binap RuCl(бензол)]Cl=[(L-72)(бензол)]Cl
C-22 = [(S)BINAP Rh(COD)]BF4=[(L-72)Rh(COD)]BF4
C-23 = [(R)Binaphane Rh(COD)]BF4=[(L-73)Rh(COD)]BF4
C-24 = [(S,S)Me-BPE Rh(COD)]BF4=[(L-74)Rh(COD)]BF4
C-25 = [(S,S)Ph-BPE Rh(COD)]BF4=[(L-75)Rh(COD)]BF4
C-26 = [(R)CatASium D Rh(COD)]BF4=[(L-76)Rh(COD)]BF4
C-27 = [(R)CatASium M Rh(COD)]BF4=[(L-77)Rh(COD)]BF4
C-28 = [(R)CatASium MN Rh(COD)]BF4=[(L-78)MN Rh(COD)]BF4
C-29 = [(R)CatASium MNN Rh(COD)]BF4=[(L-79)MNN Rh(COD)]BF4
C-30 = [(S)CatASium M Rh(COD)]BF4=[(L-80)M Rh(COD)]BF4
C-31 = [(S)CatASium MN Rh(COD)]BF4=[(L-81)Rh(COD)]BF4
C-32 = [(S,S)ChiraPhos Rh(COD)]BF4=[(L-82)Rh(COD)]BF4
C-33 = [(R,R)DIOP Rh(COD)]BF4=[(L-83)Rh(COD)]BF4
С-34 = [(S,S)DIOP Rh(COD)]BF4=[(L-84)Rh(COD)]BF4
C-35 = [(R,R)DIPAMP Rh(COD)]BF4=[(L-85)Rh(COD)]BF4
C-36 = [(R,R)DuanPhos Rh(COD)]BF4=[(L-86)Rh(COD)]BF4
C-37 = [(R)MeDuPhos Rh(COD)]BF4=[(L-87)Rh(COD)]BF4
C-38 = [(S,S)Et-Ferrotane Rh(COD)]BF4=[(L-88)Rh(COD)]BF4
C-39 = [(R,R)NorPhos Rh(COD)]BF4=[(L-89)Rh(COD)]BF4
C-40 = [(S,S)NorPhos Rh(COD)]BF4=[(L-90)Rh(COD)]BF4
C-41 = [(R)PhanePhos Rh(COD)]BF4=[(L-91)Rh(COD)]BF4
C-42 = [(S)PhanePhos Rh(COD)]BF4=[(L-92)Rh(COD)]BF4
C-43 = [(R)Xyl-PhanePhos Rh(COD)]BF4=[(L-92)Rh(COD)]BF4
C-44 = [(R)Xyl-PhanePhos RuCl2(dmf)2]=[(L-93)RuCl2(dmf)2]
C-45 = [(S)Xyl-PhanePhos RuCl2(dmf)2]=[(L-94)RuCl2(dmf)2]
C-46 = [(R)PhanePhos RuCl2(dmfb]=[(L-91)RuCl2(dmf)2]
C-47 = [(R)An-PhanePhos Rh(COD)]BF4=[(L-96)Rh(COD)]BF4
C-48 = [(R)MeO-Xyl-PhanePhos Rh(COD)]BF4=[(L-97)Rh(COD)]BF4
C-49 = [(R)Tol-PhanePhos Rh(COD)]BF4=[(L-95)Rh(COD)]BF4
C-50 = [(S)изоPr-PHOX Ir(COD)]BArF=[(L-98)Ir(COD)]BArF
C-51 = [(S)Cy-третBu-SIMPLEPHOX Ir(COD)]BArF=[(L-99)Ir(COD)]BArF
C-52 = [(R)P-Phos Rh(COD)]BF4=[(L-100)Rh(COD)]BF4
C-53 = [(S)P-Phos Rh(COD)]BF4=[(L-101)Rh(COD)]BF4
C-54 = [(R)Xyl-P-Phos RuCl2(dmf)2]=[(L-102)RuCl2(dmf)2]
C-55 = [(S)Xyl-P-Phos RuCl2(dmf)2]=[(L-103)RuCl2(dmf)2]
C-56 = [(S)P-Phos RuCl(бензол)]Cl=[(L-101)RuCl(бензол)]Cl
C-57 = [(R)P-Phos RuCl(бензол)]Cl=[(L-100)RuCl(бензол)]Cl
C-58 = [(R)P-Phos Ru(acac)2]=[(L-100)Ru(acac)2]
C-59 = [(R)Xyl-P-Phos Ru(acac)2]=[(L-102)Ru(acac)2]
C-60 = [(R)Xyl-P-Phos RuCl(бензол)]Cl=[(L-102)RuCl(бензол)]Cl
C-61 = [(S)P-Phos Ir(COD)]Cl=[(L-101)Ir(COD)]Cl
C-62 = [(S)Xyl-P-Phos Ir(COD)]Cl=[(L-103)Ir(COD)]Cl
C-63 = [(R)ProPhos Rh(COD)]BF4=[(L-104)Rh(COD)]BF4
C-64 = [(Ra,Sc)1Np-QUINAPHOS RuCl2(dmf)2]=[(L-105)RuCl2(dmf)2]
C-65 = [(Sa,Rc)1Np-QUINAPHOS RuCl2(dmf)2]=[(L-106)RuCl2(dmf)2]
C-66 = [(S,S,R,R)TangPhos Rh(COD)]BF4=[(L-107)Rh(COD)]BF4
C-67 = [(R)-JafaPhos Rh(COD)]BF4=[(L-108)Rh(COD)]BF4
Металлоорганический комплекс (A)
A-1 = [Ir(COD)Cl]2
А-2 = [Rh(NBD)2]BF4
А-3 = [Ru(COD)(2-металлил)2]
А-4 = [Ru(COD)(OOCCF3)2]
А-5 = [RuI2(п-цимен)]2
А-6 = [(Cy3P)Ir(pyr)]Cl
А-7 = [Rh(COD)2]BF4
Хиральный лиганд (L)
L-1 = Atropisomer SL-A101-1
L-2 = Atropisomer SL-A109-2
L-3 = Atropisomer SL-A116-2
L-4 = Atropisomer SL-A118-1
L-5 = Atropisomer SL-A132-2
L-6 = FenphosSL-F131-1
L-7 = Fenphos SL-F132-1
L-8 = Fenphos SL-F133-1
L-9 = Fenphos SL-F134-1
L-10 = Fenphos SL-F135-1
L-11 = Fenphos SL-F355-1
L-12 = Fenphos SL-F356-1
L-13 = Fenphos SL-F365-1
L-14 = Josiphos SL-J005-2
L-15 = Josiphos SL-J008-1
L-16 = Josiphos SL-J009-1
L-17 = Josiphos SL-J013-1
L-l8 = Josiphos SL-J211-1
L-19 = Josiphos SL-J301-1
L-20 = Josiphos SL-J403-1
L-21 = Josiphos SL-J408-1
L-22 = Josiphos SL-J412-1
L-23 = Josiphos SL-J430-1
L-24 = Josiphos SL-J431-1
L-25 = Josiphos SL-J501-1
L-26 = Josiphos SL-J503-1
L-27 = Josiphos SL-J504-1
L-28 = Josiphos SL-J504-2
L-29 = Josiphos SL-J505-2
L-30 = Josiphos SL-J506-1
L-31 = Mandyphos SL-M002-1
L-32 = Mandyphos SL-M003-1
L-33 = Mandyphos SL-M004-1
L-34 = Mandyphos SL-M004-2
L-35 = Mandyphos SL-M009-1
L-36 = Mandyphos SL-M010-1
L-37 = Mandyphos SL-M012-1
L-38 = Phospholane SL-P005-1
L-39 = Phospholane SL-P051-1
L-40 = Phospholane SL-P102-1
L-41 = Phospholane SL-P104-2
L-42 = Taniaphos SL-T001-1
L-43 = Taniaphos SL-T001-2
L-44 = Taniaphos SL-T003-1
L-45 = Taniaphos SL-T021-2
L-46 = Walphos SL-W001-1
L-47 = Walphos SL-W005-1
L-48 = Walphos SL-W008-1
L-49 = Walphos SL-W008-2
L-50 = Walphos SL-W009-1
L-51 = Walphos SL-W012-1
L-52 = Walphos SL-W021-1
L-53 = Walphos SL-W024-1
L-54 = (R)-MeBophoz
L-55 = (S)-MeBoPhoz
L-56 = (R)-3,5-F2C6H3-BnBoPhoz
L-57 = (R)-Cy-MeBoPhoz
L-58 = (R)-Фенэтил-(R)-BoPhoz
L-59 = (R)-Фенэтил-(S)-BoPhoz
L-60 = (R)-4-F-C6H4-MeBoPhoz
L-61 = (R)-Фенэтил-(R)-MeBoPhoz
L-62 = (R)-BINOL-(R)-MeBoPhoz
L-63 = (S)-BINOL-(R)-MeBoPhoz
L-64 = (R)-п-F-MeBoPhoz
L-65 = (R,R)-BDPP
L-66 = (S,S)-BDPP
L-67 = (R)BINAM-P
L-68 = (S)-BINAM-P
L-69 = (R)-Tol-BINAP
L-70 = (S)-Tol-BINAP
L-71 = (R)-BINAP
L-72 = (S)-BINAP
L-73 = (R)-Binaphane
L-74 = (S,S)-Me-BPE
L-75 = (S,S)-Ph-BPE
L-76 = (R)-CatASium D
L-77 = (R)-CatASium M
L-78 = (R)-CatASium MN
L-79 = (R)-CatASium MNN
L-80 = (S)-CatASium M
L-81 = (S)-CatASium MN
L-82 = (S,S)-ChiraPhos
L-83 = (R,R)-DIOP
L-84 = (S,S)-DIOP
L-85 = (R,R)-DIPAMP
L-86 = (R,R)-DuanPhos
L-87 = (R)-MeDuPhos
L-88 = (S,S)-Et-Ferrotane
L-89 = (R,R)-NorPhos
L-90 = (S,S)-NorPhos
L-91 = (R)-PhanePhos
L-92 = (S)-PhanePhos
L-93 = (R)-Xyl-PhanePhos
L-94 = (S)-Xyl-PhanePhos
L-95 = (R)-Tol-PhanePhos
L-96 = (R)-An-PhanePhos
L-97 = (R)-MeO-Xyl-PhanePhos
L-98 = (S)-изоPr-PHOX
L-99 = (S)-Cy-третBu-SIMPLEPHOX
L-100 = (R)-P-Phos
L-101 = (S)-P-Phos
L-102 = (R)-Xyl-P-Phos
L-103 = (S)-Xyl-P-Phos
L-104 = (R)-ProPhos
L-105 = (Ra,Sc)-1Np-QUINAPHOS
L-106 = (Sa,Rc)-1Np-QUINAPHOS
L-107 = (S,S,R,R)TangPhos
L-108 = (R)-JafaPhos(=(R)-(+)-1,1'-Бис(дифенилфосфино)-2,2'-бис(N,N-диизопропиламидо)ферроцен)
Растворитель (S) S-1: этанол
S-2: метанол
S-3: этанол/изопропанол (1:1)
S-4: этанол/трифторэтанол/2-метилтетрагидрофуран (48:47:5)
S-5: этанол/изопропанол (18:1)
S-6: трифторэтанол/этанол (1:1)
S-7: 2-метилтетрагидрофуран/этанол (5:95)
S-8: изопропанол
S-9: дихлорэтан
8-10: этилацетат
S-11: тетрагидрофуран
8-12: 2-метилтетрагидрофуран
8-13: этанол/вода (7:3)
Добавка (D)
D-1: Эферат тетрафторборной кислоты
D-2: Метансульфоновая кислота
D-3: 1,4-Диазобицикло[2.2.2]октан
D-4: Триэтиламин
D-5: Этоксид калия
D-6: Диизопропилэтиламин
D-7: 1,1,3,3-Тетраметилгуанидин
D-8: Метоксид натрия
Пример 44: (2R,4S)-5-Бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановая кислота (соединение 1-а, R1=Boc, R2=Н, R3=CO2H)
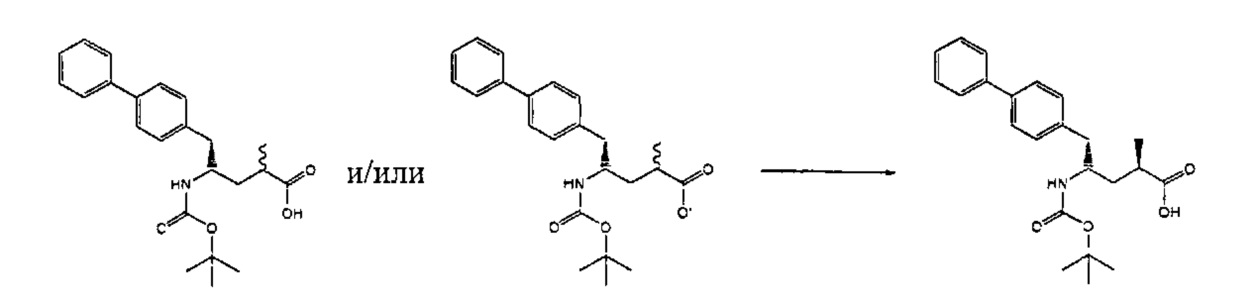
Для данной реакции после времени реакции, указанного в таблице примера 43, растворитель может быть необязательно удален, например, при пониженном давлении. Остаток затем может использоваться для дальнейших превращений.
Способ 1
Этанол (1,2 мл) добавляли к концентрату реакционной смеси, полученному в примере 43, способ 351 (240 мг). Смесь нагревали при кипении с обратным холодильником. Добавляли воду (0,6 мл) и уксусную кислоту (43 мкл). Смесь охлаждали до 0°C и перемешивали при этой температуре в течение 1 ч. Твердое вещество собирали фильтрацией и промывали смесью этанол-вода (2 мл, 2:1). Твердое вещество затем сушили в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H). Соотношение диастереомеров 99,8:0,2 (соединение 1-а, R1=Boc, R2=Н, R3=CO2H: соединение 1-а, R1=Boc, R2=Н, R3=CO2H) по данным ВЭЖХ.
Способ 2
Изопропилацетат (1,5 мл) добавляли к концентрату реакционной смеси, полученной в примере 43, способ 351 (240 мг). Добавляли лимонную кислоту (145 мг), растворенную в воде (1,3 мл). Фазы разделяли. Органическую фазу промывали водой (1,5 мл). Фазы затем разделяли. Органическую фазу затем концентрировали в вакууме с получением (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2H). Соотношение диастереомеров 97,7:2,3 (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н: соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) по данным ВЭЖХ.
Необязательно материал, полученный из общих методик 1 и 2, может быть далее и повторно перекристаллизован, например, в соответствии с общей методикой 3.
Способ 3
Смесь 174 мг (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н), полученной в примере 44, способ 2, в изопропилацетате (350 мкл) нагревали с получением раствора. Добавляли гептан (700 мкл). Смесь охлаждали до 0°C и перемешивали при этой температуре в течение 1 ч. Твердое вещество собирали фильтрацией и промывали смесью изопропилацетат:гептан (1 мл, 1:2). Твердое вещество затем сушили в вакууме с получением (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H). Соотношение диастереомеров 99,9:0,1 (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н: соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) по данным ВЭЖХ.
Осуществление реакций в соответствии со способами 1, 2 или 3 является независимым с добавлением, например, основания в ходе реакции примера 41. Реакции, проведенные без основания, также далее могут быть обработаны в соответствии со способами, описанными в способах 1, 2 или 3. Альтернативно, они могут осуществляться в соответствии со способами, описанными в международной заявке на патент WO 2008/031567, например, в примерах 2 или 3)
Метод ВЭЖХ (реакции осуществляли в соответствии с примером 44, способы 1, 2 или 3)
Колонка: Daicel QN-AX; 150×4,6 мм; 5 мкм. Подвижная фаза A: метанол-этанол (1:1), 0,1% AcOH (об.), 0,1% NH4OAc (мас./об.). Изократно: 0 мин (100% А); 20 мин (100% А). Скорость потока: 0,5 мл мин-1. Длина волны: 254 нм. Температура колонки: 10°C.
Время удерживания:
|
Пример 45: трет-Бутиловый эфир (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутиловый эфир (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc)
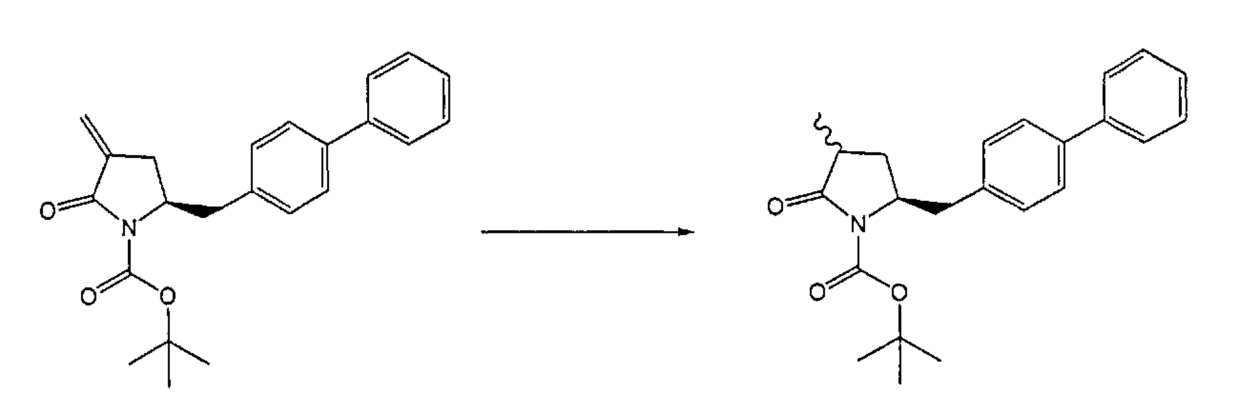
Способ 1
Этанол (1 мл) добавляли к смеси 100 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и 10% палладия на угле (10 мг, 50% воды, тип Degussa E101 NE/W). Водород подводили к смеси. Смесь перемешивали при комнатной температуре и давлении в течение 24 ч. Смесь затем отфильтровывали через целит и промывали этанолом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 20:80 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ. Спектроскопические данные описаны в международной заявке на патент WO/2008/083967, например, в примерах 14 и 18.
Способ 2
Изопропилацетат (1 мл) добавляли к смеси 100 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и 10% палладия на угле (10 мг, 50% воды, тип Degussa Е101 NE/W). Водород подводили к смеси. Смесь перемешивали при комнатной температуре и давлении в течение 24 ч. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 15:85 (соединение 3-а, R1=Boc): соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ. Спектроскопические данные описаны в международной заявке на патент WO/2008/083967, например, в примерах 14 и 18. Способ 3
Изопропилацетат (1 мл) добавляли к смеси 100 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и 10% платины на угле (10 мг). Водород (давление окружающей среды) подводили к смеси. Смесь перемешивали при комнатной температуре и давлении в течение 4 ч. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 33:67 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ. Спектроскопические данные описаны в международной заявке на патент WO/2008/083967, например, в примерах 14 и 18.
Способ 4
Изопропилацетат (1 мл) добавляли к смеси 100 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) и 10% родия на угле (10 мг). Водород (давление окружающей среды) подводили к смеси. Смесь перемешивали при комнатной температуре и давлении в течение 50 ч. Смесь затем отфильтровывали через целит и промывали изопропилацетатом (2×0,5 мл). Смесь затем концентрировали в вакууме с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Диастереомерное соотношение 21:79 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ. Спектроскопические данные описаны в международной заявке на патент WO/2008/083967, например, в примерах 14 и 18.
Метод ВЭЖХ 1 (Способы 1-4)
Колонка: AD-RH Chiralpak; 150×4,6 мм. Подвижная фаза A (вода); подвижная фаза Б (ацетонитрил). Изократно: 0 мин (20% Б); 15 мин (20% Б). Скорость потока: 0,5 мл мин-1. Длина волны 210 нм. Температура колонки: 40°C.
Время удерживания:
|
Метод ВЭЖХ 2 (Способы 1-4)
Колонка: Zorbax SB-C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,01 М KH2PO4 в воде); подвижная фаза Б (ацетонитрил). Градиент: 0 мин (30% Б); 10 мин (80% Б); 15 мин (80% Б); 15,1 мин (30% Б); 18 мин (30% Б). Скорость потока: 1,0 мл мин-1. Длина волны: 210 нм. Температура 50°C.
Время удерживания:
|
Пример 46: трет-Бутиловый эфир (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутиловый эфир (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc)
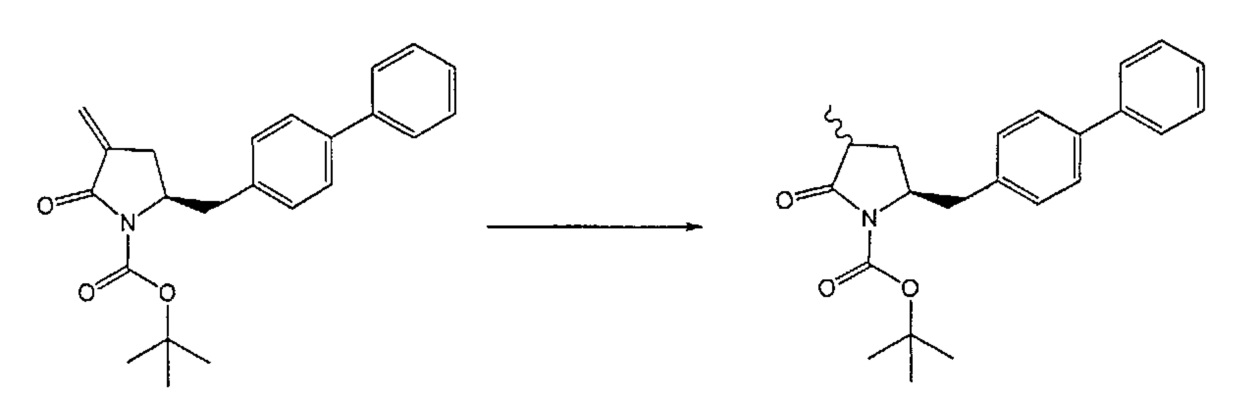
Общая методика для способов 1-7
К смеси 0,5 ммоля трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) в метаноле или этаноле (5 мл) при комнатной температуре добавляли раствор металлоорганического комплекса (S/C соотношение 50 или 100) и хирального лиганда (1,1 эквив. на атом металла в металлоорганическом комплексе) в метаноле или этаноле (5 мл). Использовали давление водорода 20 бар в течение 20 ч при комнатной температуре. Растворитель затем удаляли в вакууме с получением соответствующего продукта. Образцы анализировали с помощью ВЭЖХ для определения соотношения трет-бутилового эфира (3R, 5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) к трет-бутиловому эфиру (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc). Спектроскопические данные описаны в международной заявке на патент WO/2008/083967, например, в примерах 14 и 18.
Способ 1
Хиральный лиганд {(S)-(-)-(6,6'-диметоксибифенил-2,2'-диил)-бис(дифенилфосфин)=(S)-Ph-MeOBIPHEP=SL-A101-2}; металлоорганический комплекс {димер дихлор(п-цимен)рутений(II)}; этанол. Диастереомерное соотношение 82:18 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 2
Хиральный лиганд {(αS,α8)-2,2'-бис(α-N,N-диметиламинофенилметил)-(R,R)-1,1'-бис[ди(3,5-диметил-4-метоксифенил)фосфино]ферроцен = (S)-(R)-NMe2-P(3,5-Me-4-MeOPh)2-Mandyphos = SL-M004-2}; металлоорганический комплекс {димер дихлор(п-цимен)рутений(II)}; этанол. Диастереомерное соотношение 82:18 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 3
Хиральный лиганд {(R)-1-[(S)-2-дициклогексилфосфино)ферроценил]этилди-(2-метилфенил)фосфин=(R)-(S)-Cy2PF-P°Tol2=SL-J504-1}; металлоорганический комплекс {димер дихлор(п-цимен)рутений(II)}; метанол. Диастереомерное соотношение 53:47 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 4
Хиральный лиганд {(R,R)-2,2''-бис[(S)-1-(диарилфосфино)этил]-1,1''-биферроцен = SL-F115-1}; металлоорганический комплекс {тетрафторборат бис(норборнадиен)родий(I)}; метанол. Диастереомерное соотношение 71:29 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 5
Хиральный лиганд {(S-1-[(R)-2-дифенилфосфиноферроценил]этилди-трет-бутилфосфин = (S)-(R)-PPF-PтретBu2 = SL-J002-2}; металлоорганический комплекс {бис(трифторацетокси)(1,5-циклооктадиен)рутений(II)}; метанол. Диастереомерное соотношение 56:44 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 6
Хиральный лиганд {(R)-1-[(R)-2-(2'-дициклогексилфосфинофенил)ферроценил]этилди(бис-(3,5-трифторметил)фенил)фосфин = (R)-(R)-cy2PPhFCHCH3P(3,5-CF3Ph)2 = SL-W008-1-1}; металлоорганический комплекс {тетрафторборат бис(норборнадиен)родий(I)}; метанол. Диастереомерное соотношение 27:73 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Способ 7
Хиральный лиганд {(S-1-[(R)-2-дифенилфосфиноферроценил]этилди-трет-бутилфосфин = (S)-(R)-PPF-PтретBu2 = SL-J002-2}; металлоорганический комплекс {димер дихлор(п-цимен)рутений(II)}; метанол. Диастереомерное соотношение 61:39 (соединение 3-а, R1=Boc: соединение 3-b, R1=Boc), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ (Способы 1-7)
Колонка: Gemini C6 Phenyl; 150×3,0 мм; 3,0 мкм. Подвижная фаза A (0,01 М KH2PO4 в воде); подвижная фаза Б (метанол). Градиент: 0 мин (40% Б); 5 мин (70% Б); 12 мин (70% Б); 13 мин (80% Б); 21 мин (80% Б); 21,1 мин (40% Б); 25 мин (40% Б). Скорость потока: 0,7 мл мин-1. Длина волны: 210 нм. Температура 50°C.
Время удерживания:
|
Пример 47: трет-Бутиловый эфир (3R/S,5S)-бифенил-4-илметил-3-диметиламинометил-2-оксопирролидин-1-карбоновой кислоты (соединение 9-а, R1=Boc, R6=Me, R7=Me)
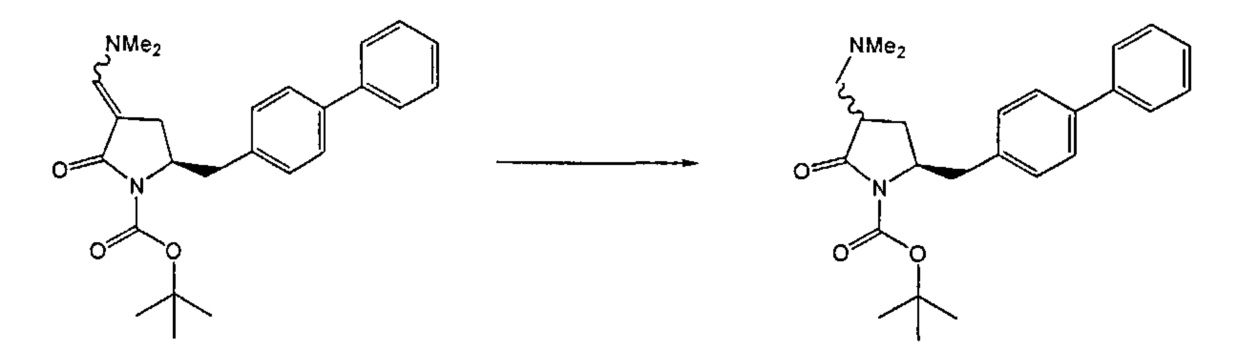
Общая методика способов 1-178
Растворитель добавляли в сосуд, содержащий трет-бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) с получением конечной концентрации, указанной в таблице примера 47 (способы 1-178).
Необязательно и в соответствии с таблицей добавка может добавляться на этой стадии. Название и количество добавки указано в таблице примера 47 (способы 1-178). Количество добавки использовали относительно молей трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me).
Затем добавляли катализатор. Тип и количество используемого катализатора указаны в таблице примера 47 (способы 1-178).
Водород применяли к сосуду, содержащему смесь, под давлением, указанным в таблице примера 47 (способы 1-178). Смесь затем перемешивали при температуре и давлении, указанных в таблице примера 47 (способы 1-178) в течение времени, также указанного в таблице примера 47 (способы 1-178).
Спектроскопические данные: 1Н ЯМР (ДМСО). Соединение 9-b (R1=Boc, R6=Me, R7=Me): 7,66 (m, 4Н), 7,47 (t, J=7,8, 2H); 7,39-7,26 (m, 3H); 4,25 (m, 1H); 3,04 (dd, J=3,7, 13,1, 1H); 2,91 (m, 1H); 2,6 (m, 1H); 2,46 (dd, J=4,1, 12,2, 1H); 2,27 (m, 1H); 2,08 (s, 6H); 1,95 (m, 1H); 1,78 (m, 1H); 1,51 (s, 9H). Соединение 9-c (R1=Boc, R6=Me, R7=Me) отдельные сигналы при 1,51, 1,62, 2,08, 2,17, 3,28 ppm.
|
|
|
|
|
|
Метод ВЭЖХ (Пример 47, способы 1-178)
Колонка: X-BRIDGE; 75×4,6 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); подвижная фаза Б (ацетонитрил). Градиент: 0 мин (40% Б); 1 мин (40% Б); 15 мин (70% Б); 18 мин (70% Б); 19 мин (40% Б); 20 мин (40% Б). Скорость потока: 1 мл мин-1. Длина волны: 254 нм. Температура колонки: 10°C.
Время удерживания
|
Соединение 3-а (R1=Boc) и соединение 3-b (R1=Boc): 14,9 мин
Пример 48: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc)
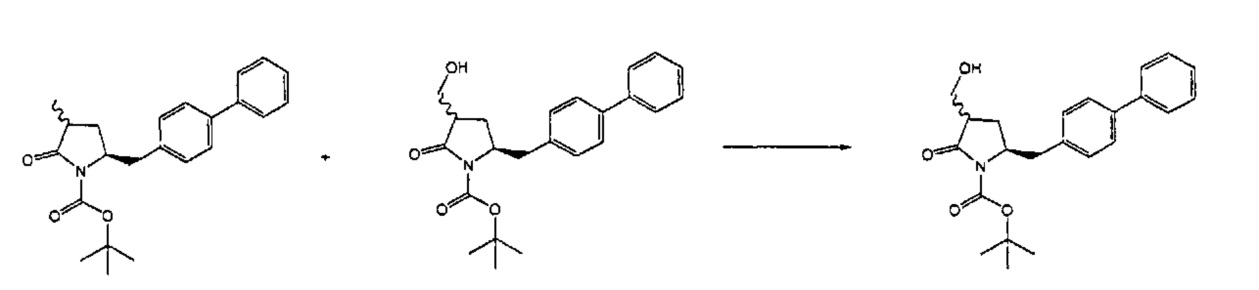
Остаток, полученный в примере 69, содержащий трет-бутиловый эфир (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc), трет-бутиловый эфир (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc) и трет-бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc) очищали колоночной хроматографией, элюируя смесью этил ацетат-гептан (1:1) с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc) в виде смеси 62:38 (3S,5S):(3R,5S) диастереоизомеров, соответственно, что определено по данным ЯМР. 1Н ЯМР (ДМСО): 1,49-1,51, 1,67-1,72, 1,81-1,85, 1,93-2,04, 2,56-2,63, 2,72-2,77, 2,81-2,85, 3,03-3,06, 3,28-3,32, 3,46-3,52, 3,57-3,63, 4,17-4,27, 4,72-4,74, 4,94-4,96, 7,30-7,36, 7,43-7,46, 7,62-7,66.
Пример 49: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил)
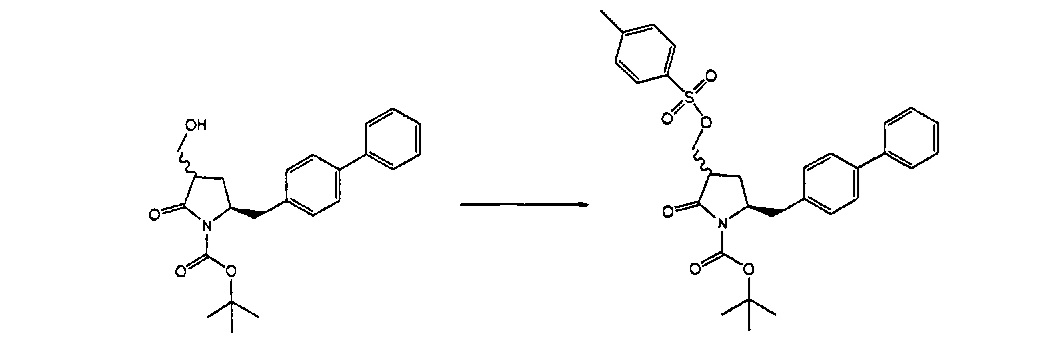
Способ 1
20 мг трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc) (полученный в соответствии с примером 48) добавляли к хлороформу (5 мл) при комнатной температуре. К смеси добавляли триэтиламин (11 мкл). Затем к смеси добавляли ангидрид 4-толуолсульфоновой кислоты (20,5 мг). Смесь затем перемешивали в течение 20 ч при комнатной температуре. Летучие примеси удаляли при пониженном давлении, и полученный сырой материал очищали колоночной хроматографией, элюируя смесью гептан-этилацетат (2:1) с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил) в виде смеси 69:31 диастереоизомеров, что определено по данным ЯМР. 1Н ЯМР (CDCl3): 1,51-1,53, 1,67-1,80, 2,08-2,17, 2,36, 2,64-2,79, 3,01 и 3,33, 3,89-4,16, 4,20-4,36, 7,15-7,69.
Способ 2
100 мг трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc) (полученный в соответствии с примером 48) добавляли к хлороформу (3 мл) при комнатной температуре. К смеси добавляли триэтиламин (110 мкл). Затем к смеси добавляли ангидрид 4-толуолсульфоновой кислоты (128 мг). Смесь затем перемешивали в течение 20 ч при комнатной температуре. К смеси добавляли этилацетат (2 мл). Смесь промывали насыщенным раствором гидрокарбоната натрия (2×1 мл). Органическую фазу сушили (MgSO4) и концентрировали при пониженном давлении. Очистка колоночной хроматографией, элюирование смесью гептан-этилацетат (2:1) приводили к получению трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил). LC-MS (+ES): 480 ([МН-С4Н8]+, 100%), 553 ([MNH4]+, 55), 1088 ([2M+NH4]+ 20).
Пример 50: [трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты]гексафторфосфат калия (соединение 7-а, R1=Boc, R6=Me, R7=Me)
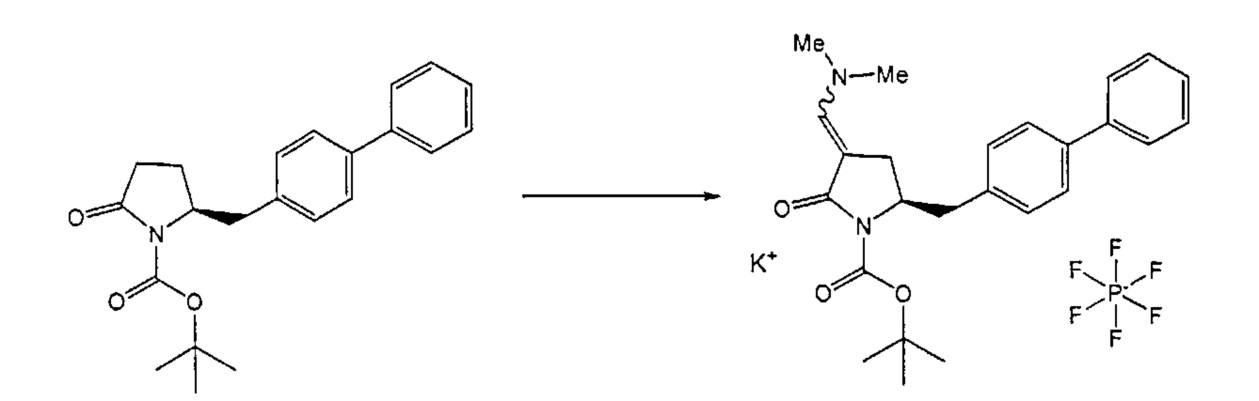
Раствор трет-бутоксид калия (16 мл, 0,5 М в тетрагидрофуране) добавляли к 2,46 г гексафторфосфата N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) (полученный в соответствии с примером 3). Полученную смесь нагревали при 60°C и перемешивали при этой температуре в течение 1 ч. Полученную смесь охлаждали до комнатной температуры. К смеси добавляли 1 г трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc). Полученную смесь перемешивали в течение 20 ч при комнатной температуре. Смесь затем разбавляли водой (20 мл) и толуолом (20 мл). Фазы затем разделяли. Органическую фазу промывали насыщенным раствором карбоната натрия (2×20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (MgSO4) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией, элюируя 40% этилацетата в гексане. К остатку после концентрирования добавляли диэтиловый эфир, и полученное твердое вещество собирали фильтрацией и сушили. 1Н ЯМР (CDCl3): 1,57-1,59, 2,57-2,63, 2,68-2,71, 2,79-2,84, 3,00, 3,24-3,28, 4,30-4,34, 7,17, 7,30-7,60. 19F ЯМР (CDCl3): -74,9 ppm.
Рентгеновская структура полученных кристаллов показана на фигуре 6. Отдельный кристалл для этого определения получали из трет-бутилметилового эфира в качестве растворителя.
Кристаллические данные [записано при 120(2) K]
|
|
Пример 51: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
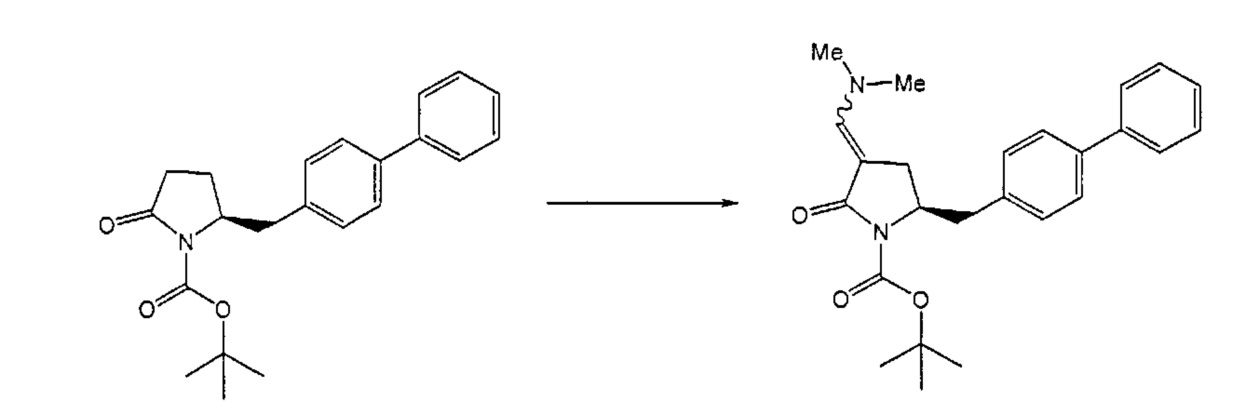
Общая методика способов 1-35
трет-Бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (количество в ммолях указано в таблице примера 51 (способы 1-35)) добавляли к ионной соли (название и количество указаны в таблице примера 51 (способы 1-35)). Необязательно добавляли растворитель (объем и название указаны в таблице примера 51 (способы 1-35)). Добавляли реагент Бредерека [трис(диметиламино)метан (соединение 13, R6=Me, R7=Me), трет-бутоксибис(диметиламино)метан (соединение 14, R6=Me, R7=Me, R8=третBu) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu)] (объем указан в таблице примера 51 (способы 1-35)). Смесь затем перемешивали при комнатной температуре в течение 3 ч с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
|
|
Способ 36
трет-Бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (2 ммоля) добавляли к гексафторфосфату калия (1 эквив.) и 18-краун-6 (1 эквив.). Добавляли реагент Бредерека [трис(диметиламино)метан (соединение 13, R6=Me, R7=Me), трет-бутоксибис(диметиламино)метан (соединение 14, R6=Me, R7=Me, R8=третBu) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu)] (4 мл). Смесь затем перемешивали при комнатной температуре в течение 3 ч с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Пример 52: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
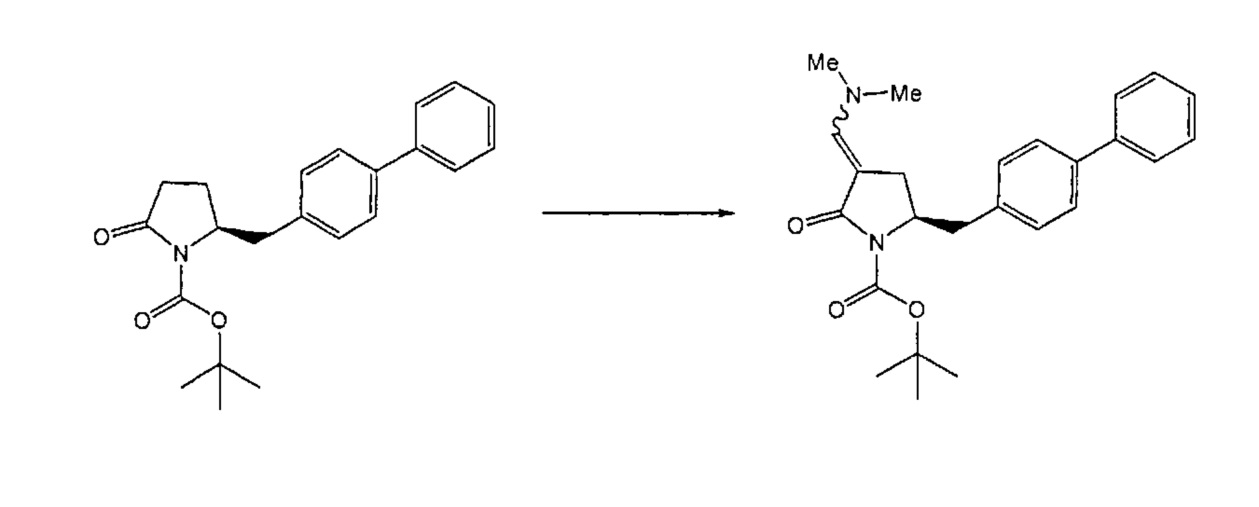
Способ 1
Смесь трет-бутоксида лития (2,8 эквив., 2,8 ммоля, 1 М раствор в ТГФ) и гексафторфосфата N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) (3 эквив., 3 ммоля) перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры. Смесь затем разбавляли тетрагидрофураном до общего объема 5 мл. Затем к смеси добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1 эквив., 1 ммоль). Смесь затем перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. К смеси добавляли этилацетат (20 мл). Фазы разделяли, и органическую фазу промывали насыщенным раствором карбоната натрия (2×20 мл) и насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Способ 2
Смесь трет-бутоксида лития (2,8 эквив., 2,8 ммоля, 1 М раствор в ТГФ) и хлорида N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) (3 эквив., 3 ммоля) перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры. Смесь затем разбавляли тетрагидрофураном до общего объема 5 мл. Затем к смеси добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1 эквив., 1 ммоль). Смесь затем перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. К смеси добавляли этилацетат (20 мл). Фазы разделяли, и органическую фазу промывали насыщенным раствором карбоната натрия (2×20 мл) и насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Способ 3
Смесь трет-бутоксида калия (2,8 эквив., 2,8 ммоля, 1 М раствор в ТГФ) и хлорида N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) (3 эквив., 3 ммоля) перемешивали при 60°C в течение 1 ч. Смесь затем охлаждали до комнатной температуры. Смесь затем разбавляли тетрагидрофураном до общего объема 5 мл. Затем к смеси добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-a, R1=Boc) (1 эквив., 1 ммоль) и хлорид лития (1 эквив., 1 ммоль). Смесь затем перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. К смеси добавляли этилацетат (20 мл). Фазы разделяли, и органическую фазу промывали насыщенным раствором карбоната натрия (2×20 мл) и насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Пример 53: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
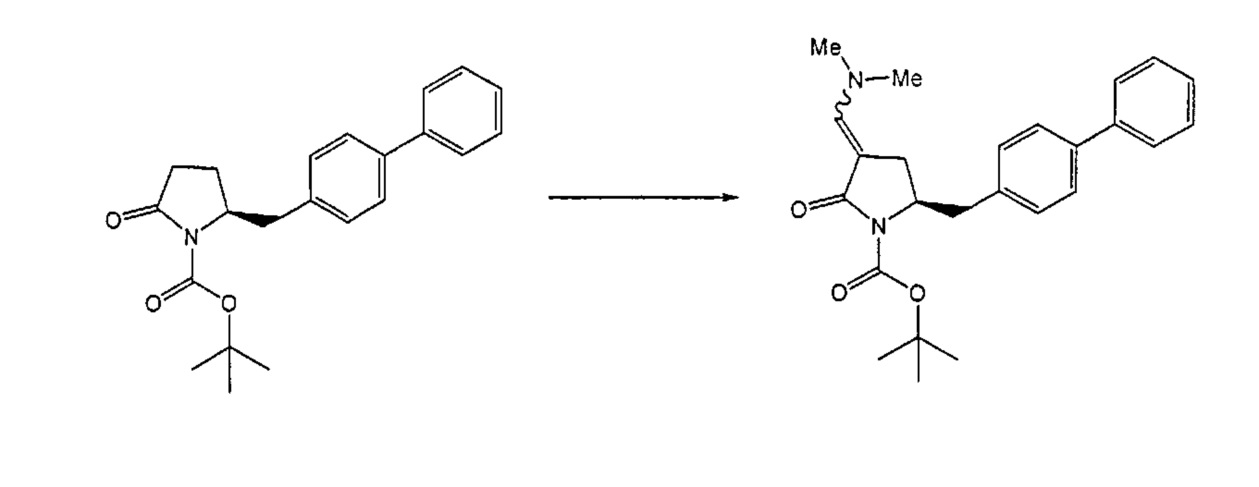
Способ 1
351 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1 эквив., 1 ммоль) и гексафторфосфат лития (1 эквив.) добавляли к тетрагидрофурану (10 мл). К смеси добавляли N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu) (3 эквив.) и диметиламин (0,5 эквив.). Смесь перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. Затем добавляли этилацетат (20 мл). Смесь промывали насыщенным раствором карбоната натрия (2×20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Общая методика способов 2-6
351 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) (1 эквив., 1 ммоль) и гексафторфосфата лития (1 эквив.) добавляли к тетрагидрофурану (10 мл). К смеси добавляли трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (1,5 эквив., 2 эквив. или 3 эквив.) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu), диизопропиламин или дифениламин (1 эквив., 1,5 эквив., 3 эквив. или 4 эквив.). Смесь перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. Затем добавляли этилацетат (20 мл). Смесь промывали насыщенным раствором карбоната натрия (2×20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-a, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Способ 2
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (1,5 эквив.); N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu) (1.5 эквив.).
Способ 3
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (3 эквив.); диизопропиламин (3 эквив.).
Способ 4
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (3 эквив.); дифениламин (3 эквив.).
Способ 5
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (2 эквив.); дифениламин (4 эквив.).
Способ 6
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (3 эквив.); дифениламин (1 эквив.).
Пример 54: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
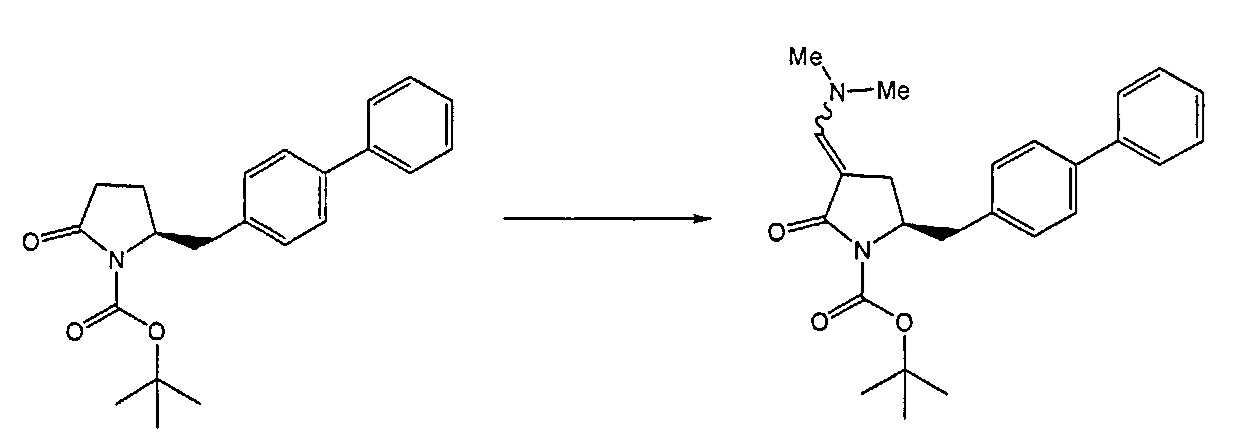
Общая методика способов 1-8
351 мг трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me) (0,1 или 1 эквив.) растворяли в 10 мл растворителя (тетрагидрофуран, 1% диоксана в тетрагидрофуране, 5% диоксана в тетрагидрофуране, 20% диоксана в тетрагидрофуран, диоксан или тетрагидрофуран, содержащий 50 мол.% N,N,N',N'-тетраметилэтилендиамина). К смеси добавляли 520 мкл трис(диметиламино)метан (соединение 13, R6=Me, R7=Me). Затем к смеси добавляли трет-бутанол (1 эквив. или 3 эквив.). Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Летучие примеси затем удаляли при пониженном давлении. К смеси добавляли этилацетат (20 мл). Смесь затем промывали насыщенным раствором карбоната натрия (2×20 мл) и затем насыщенным раствором хлорида натрия. Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0.27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Способ 1
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 1 эквив.; трет-бутанол (3 эквив.); растворитель: тетрагидрофуран.
Способ 2
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 1 эквив.; трет-бутанол (1 эквив.); растворитель: тетрагидрофуран.
Способ 3
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (1 эквив.); Растворитель: 1% диоксана в тетрагидрофуране.
Способ 4
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (1 эквив.); растворитель: 5% диоксана в тетрагидрофуране.
Способ 5
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (1 эквив.); растворитель: 10% диоксана в тетрагидрофуране.
Способ 6
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (1 эквив.); растворитель: 20% диоксана в тетрагидрофуране.
Способ 7
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (1 эквив.); растворитель: диоксан.
Способ 8
Гексафторфосфат N,N,N',N'-тетраметилформамидиния (соединение 18, R6=Me, R7=Me): 0,1 эквив.; трет-бутанол (3 эквив.); Растворитель: тетрагидрофуран, содержащий 50 мол.% N,N,N',N'-тетраметилэтилендиамина.
Пример 55 трет-Бутиловый эфир: (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
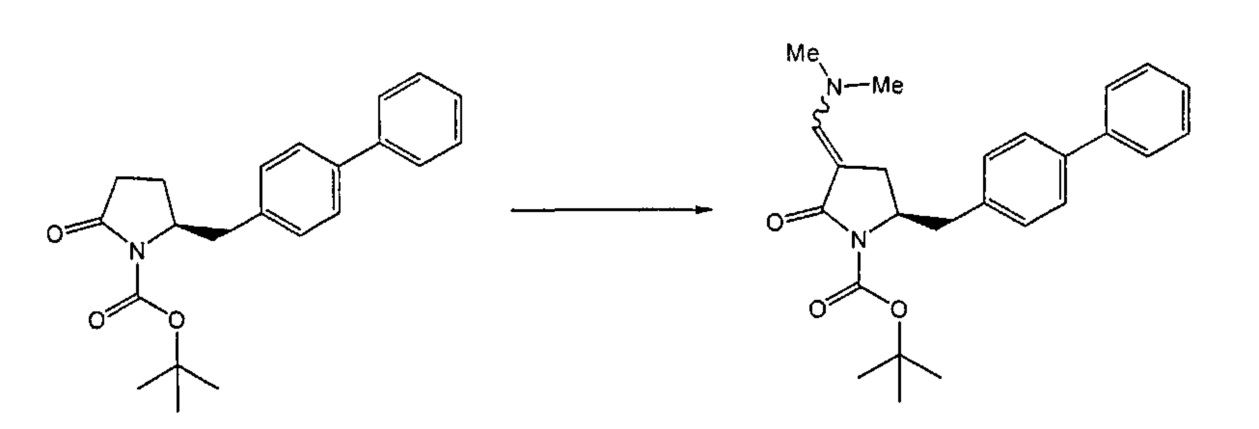
Общая методика способов 1-3
351 мг (1 ммоль) трет-бутилового эфира (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-а, R1=Boc) и хлорида магния (0,1, 1 или 2 эквив.) добавляли к тетрагидрофурану (10 мл). Смесь перемешивали при комнатной температуре. Добавляли трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (3 эквив.) и трет-бутанол (3 эквив.). Смесь перемешивали при комнатной температуре в течение 3 ч. Летучие примеси удаляли при пониженном давлении. Добавляли этилацетат (2×20 мл). Смесь промывали насыщенным раствором карбоната натрия (2×20 мл) и насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Способ 1
Хлорид магния (0,1 эквив.).
Способ 2
Хлорид магния (1 эквив.).
Способ 3
Хлорид магния (2 эквив.).
Пример 56: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me)
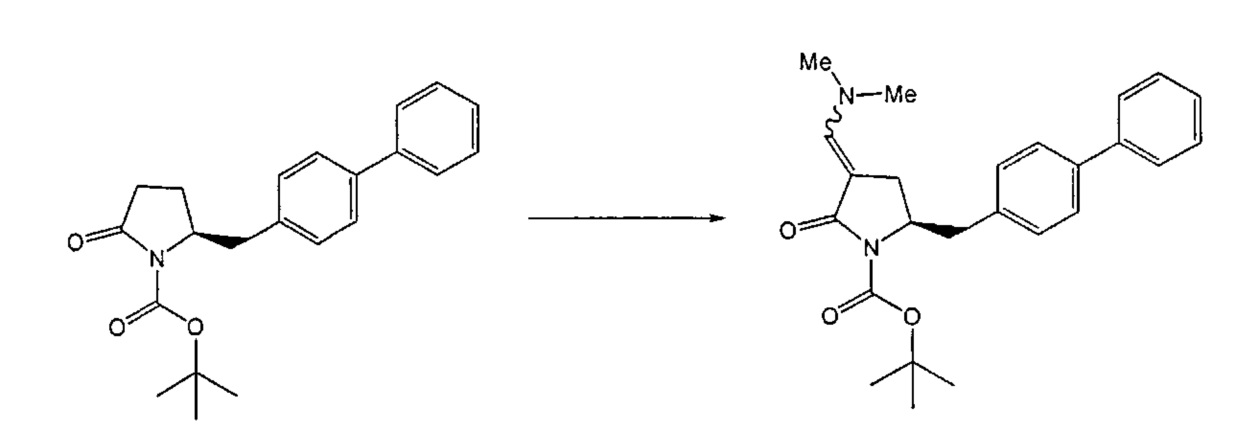
LHMDS (1 М раствор в ТГФ, 2 мл, 2 ммоля) добавляли к смеси дифениламина (340 мг, 2 ммоля) и гексафторфосфата N,N,N',N'-тетраметилформамидиния (492 мг, 2 ммоля) в тетрагидрофуране (2 мл). Смесь затем перемешивали при комнатной температуре в течение 0,5 ч. Смесь разбавляли добавлением тетрагидрофурана (5 мл). Затем к смеси добавляли трет-бутиловый эфир (S)-2-бифенил-4-илметил-5-оксопирролидин-1-карбоновой кислоты (соединение 8-a, R1=Boc) (351 мг, 1 ммоль). Смесь перемешивали в течение 15 мин при комнатной температуре. Летучие примеси удаляли при пониженном давлении. К смеси добавляли этилацетат (20 мл). Смесь промывали насыщенным раствором карбоната натрия (2×20 мл) и насыщенным раствором хлорида натрия (20 мл). Органическую фазу сушили (Na2CO3) и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) или его соли. Растворы анализировали с помощью ТСХ (50% этилацетата в гексане). RF 0,21 (соль соединения 7-а, R1=Boc, R6=Me, R7=Me); RF 0,27 (соединение 7-а, R1=Boc, R6=Me, R7=Me); RF 0,68 (соединение 8-a, R1=Boc).
Пример 57: (S)-1-Бензил-5-бифенил-4-илметилпирролидин-2-он (соединение 8-а, R1=бензил)
2,51 г (S)-5-бифенил-4-илметилпирролидин-2-она (соединение 8-а, R1=Н) и гидрида натрия (312 мг, 13 ммолей) при перемешивании добавляли к тетрагидрофурану. Добавляли бензилбромид (1,43 мл), и полученную смесь перемешивали в течение 4 ч. Летучие примеси удаляли при пониженном давлении. К смеси добавляли этилацетат (50 мл). Органическую фазу промывали насыщенным раствором карбоната натрия (2×40 мл) и насыщенным раствором хлорида натрия (40 мл). Органическую фазу сушили (Na2SO4) и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией (60% этилацетата в гексане) с получением (S)-1-бензил-5-бифенил-4-илметилпирролидин-2-она (соединение 8-а, R1=бензил). 1Н ЯМР (ДМСО): 1,6-1,9 (2Н), 2,1 (2Н), 2,6 (1Н), 3,0 (1Н), 3,5-3,7 (1Н), 4,2 (1Н), 4,8 (1Н), 7,1-7,7 (14Н).
Пример 58: Трис(диметиламино)метан (соединение 13. R6=Me. R7=Me). трет-бутоксибис(диметиламино)метан (соединение 14, R6=Me. R7=Me. R8=третBu) и N,N-диметилформамидди-трет-бутилацеталь (соединение 15, R6=Me, R7=Me, R8=третBu)
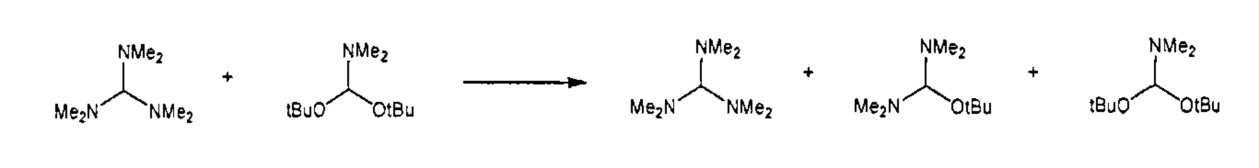
Общая методика способов 1-39
Трис(диметиламино)метан (соединение 13, R6=Me, R7=Me) (0,1 эквив. или 0,25 эквив. или 0,5 эквив. или 0,75 эквив. или 0,9 эквив.) добавляли к N,N-диметилформамидди-трет-бутилацеталю (соединение 15, R6=Me, R7=Me, R8=третBu) (0,1 эквив. или 0,25 эквив. или 0,5 эквив. или 0,75 эквив. или 0,9 эквив.) при комнатной температуре. Необязательно к смеси добавляли гексафторфосфат калия (0 эквив. или 0,2 эквив. или 1 эквив.). Необязательно к смеси добавляли хлорид лития (0 эквив. или 1 эквив.). Полученную смесь затем перемешивали при комнатной температуре или при повышенной температуре (45°C или 60°C или 80°C) в течение указанного времени (1 ч или 2 ч или 4 ч или 16 ч или 18 ч или 21 ч) с получением смеси трис(диметиламино)метана (соединение 13, R6=Me, R7=Me), трет-бутоксибис(диметиламино)метана (соединение 14, R6=Me, R7=Me, R8=третBu) и N,N-диметилформамидди-трет-бутилацеталя (соединение 15, R6=Me, R7=Me, R8=третBu). Спектроскопические данные описаны в примере 14, способ 1.
|
|
Пример 59: Метиловый эфир (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me)
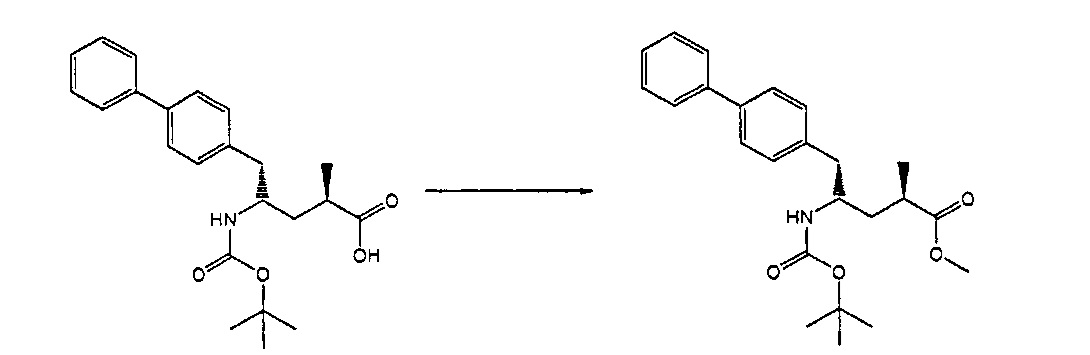
2 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H), полученной в соответствии с примером 2 международной заявки на патент WO/2008/031567, добавляли к 2,55 г карбоната цезия. Затем добавляли диметилформамид (4 мл). Затем добавляли метилйодид (0,55 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (10 мл) и изопропилацетат (10 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×10 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (15 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением метилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me). 1Н ЯМР (CDCl3): 1,18 (3H), 1,41 (9Н), 1,51 (1H), 1,95 (1Н), 2,66 (1Н), 2,85 (2Н), 3,70 (ЗН), 3,94 (1Н), 4,36 (1H), 7,25 (2Н), 7,35 (1H), 7,45 (2Н), 7,53 (2Н), 7,59 (2Н).
Пример 60: Метиловый эфир (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me) и метиловый эфир (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Me)
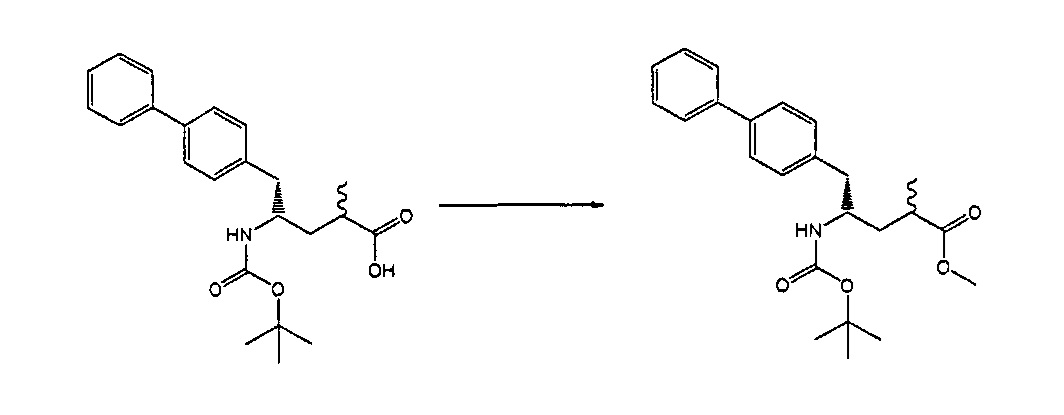
2 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2H), соотношение диастереомеров 80:20, соответственно, полученные в соответствии с примером 3 международной заявки на патент WO/2008/031567, добавляли к 2,55 г карбоната цезия. Затем добавляли диметилформамид (4 мл). Затем добавляли метилйодид (0,55 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (10 мл) и изопропилацетат (10 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×10 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (15 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением метилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me) и метилового эфира (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me) в виде смеси диастереомеров 80:20, соответственно. 1Н ЯМР (CDCl3): 1,17-1,20, 1,25-1,26, 1,41, 1,46-1,63, 1,76-1,85, 1,92-1,99, 2,51-2,59, 2,61-2,71, 2,76-2,85, 3,70, 3,83-3,99, 4,09-4,40, 7,25-7,28, 7,33-7,37, 7,43-7,47, 7,53-7,55, 7,59-7,61. Соотношение диастереомеров 80:20 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me: соединение 1-b, R1=Boc, R2=Н, R3=CO2Me) сложением сигналов при 1,76-1,85 (соединение 1-b, R1=Boc, R2=Н, R3=CO2Me) и 1,92-1,99 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me).
Пример 61: Метиловый эфир (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Me)
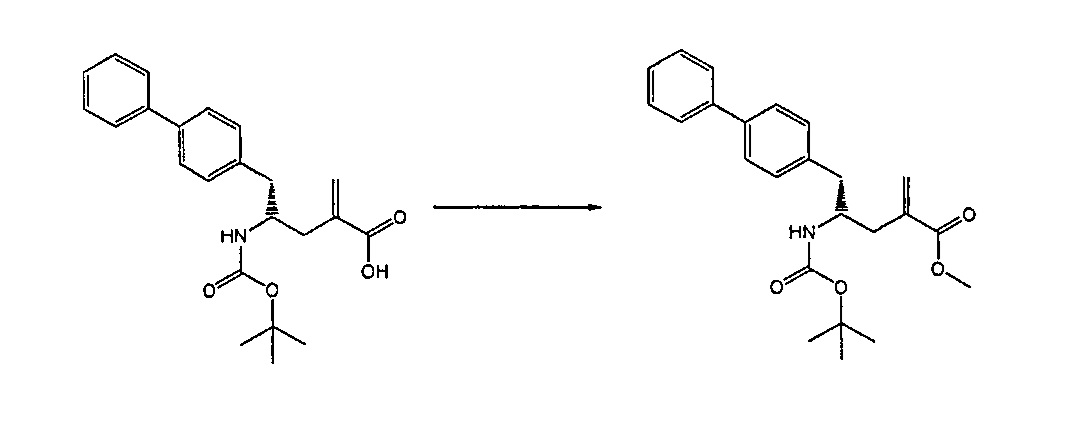
30 г (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2H), полученной в соответствии с примером 33, добавляли к 38,4 г карбоната цезия. Затем добавляли диметилформамид (50 мл). Затем добавляли метилйодид (8,26 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (1200 мл) и изопропилацетат (120 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×120 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (180 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением метилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Me). 1Н ЯМР (CDCl3): 1,40 (9Н), 2,38 (1H), 2,61 (1Н), 2,86 (1Н), 2,91 (1Н), 3,78 (3H), 4,07 (1Н), 4,52 (1Н), 5,64 (1Н), 6,25 (1Н), 7,29 (2Н), 7,35 (1Н), 7,45 (2Н), 7,55 (2Н), 7,59 (2Н).
Пример 62: Этиловый эфир (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et)
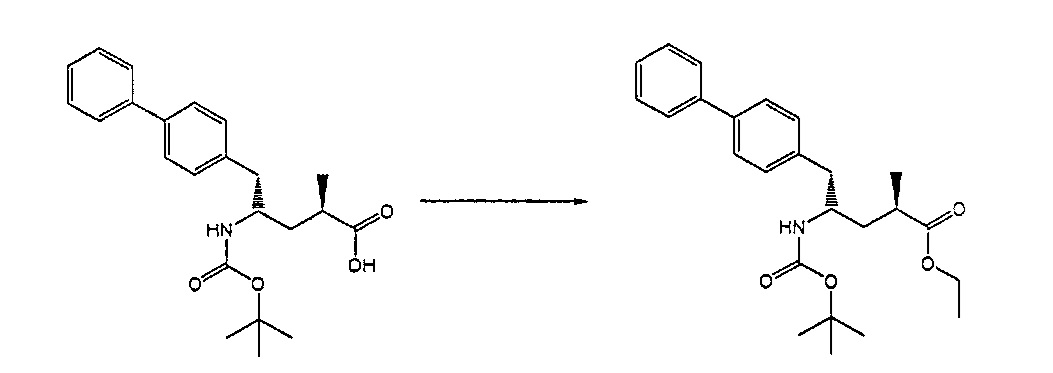
2 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н), полученной в соответствии с примером 2 международной заявки на патент WO/2008/031567, добавляли к 2,55 г карбоната цезия. Затем добавляли диметилформамид (4 мл). Затем добавляли этилйодид (0,55 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (10 мл) и изопропилацетат (10 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×10 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (15 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением этилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et). 1Н ЯМР (CDCl3): 1,18 (3H), 1,27 (3H), 1,42 (9Н), 1,49 (1H), 1,95 (1Н), 2,62 (1Н), 2,85 (2Н), 3,94 (1Н), 4,16 (2Н), 4,36 (1H), 7,26 (2Н), 7,35 (1Н), 7,45 (2Н), 7,55 (2Н), 7,59 (2Н).
Пример 63: Этиловый эфир (2R,4S)-5-6ифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и этиловый эфир (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et)
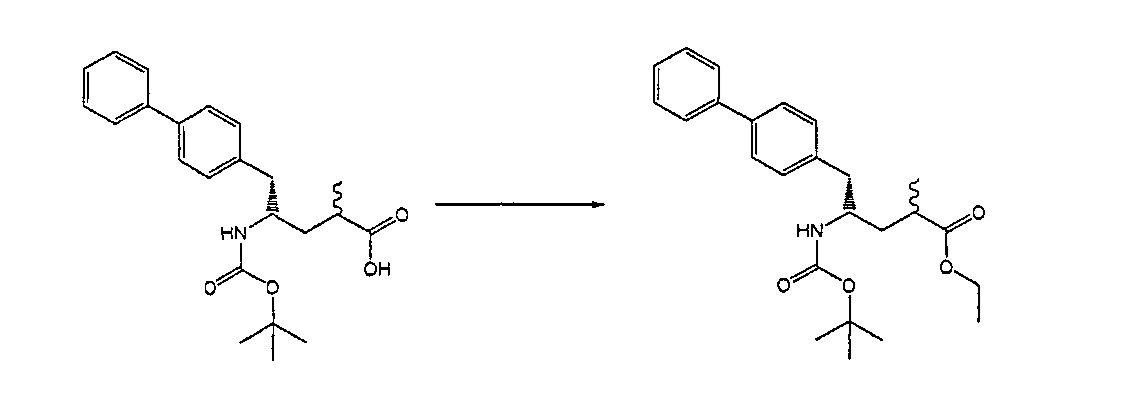
2 г (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н) и (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=СО2Н), соотношение диастереомеров 80:20, соответственно, полученных в соответствии с примером 3 международной заявки на патент WO/2008/031567, добавляли к 2,55 г карбоната цезия. Затем добавляли диметилформамид (4 мл). Затем добавляли этилйодид (0,55 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (10 мл) и изопропилацетат (10 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×10 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (15 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением этилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и этилового эфира (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) в виде смеси диастереомеров 80:20, соответственно. 1 НЯМР (CDCl3): 1,16-1,20, 1,25-1,29, 1,42, 1,47-1,52, 1,56-1,62, 1,76-1,84, 1,92-1,98, 2,48-2,57, 2,58-2,67, 2,77-2,88, 3,77-4,01, 4,10-4,18, 4,32-4,41, 7,26-7,28, 7,33-7,37, 7,43-7,47, 7,53-7,55, 7,59-7,60. Соотношение диастереомеров 80:20 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et: соединение 1-b, R1=Boc, R2=Н, R3=CO2Et) сложением сигналов при 1,76-1,84 (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et) и 1,92-1,98 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et).
Пример 64: Этиловый эфир (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et)
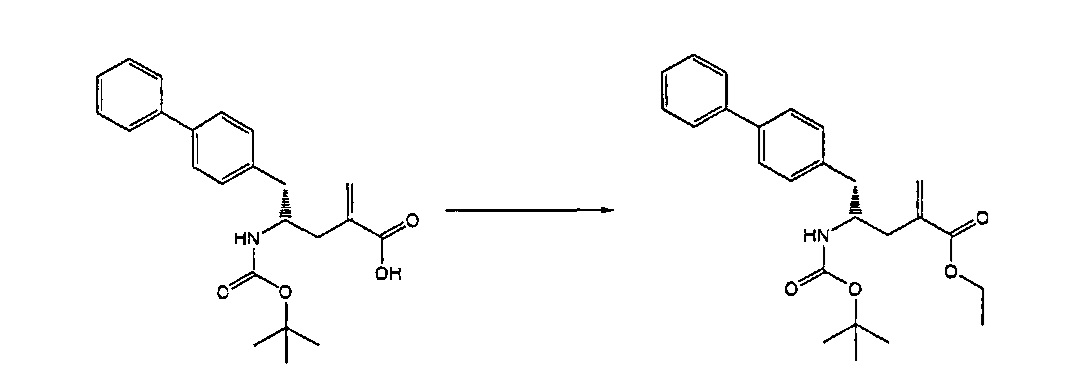
30 г (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=СО2Н), полученной в соответствии с примером 33, добавляли к 38,4 г карбоната цезия. Затем добавляли диметилформамид (50 мл). Затем добавляли этилйодид (8,26 мл), и смесь перемешивали в течение 16 ч при комнатной температуре. Добавляли воду (1200 мл) и изопропилацетат (120 мл). Фазы разделяли. Водную фазу промывали изопропилацетатом (2×120 мл). Объединенные органические фазы промывали 20% водным раствором хлорида натрия (180 мл), и затем сушили (MgSO4). Смесь концентрировали при пониженном давлении с получением этилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et). 1Н ЯМР (CDCl3): 1,31 (3H), 1,40 (9Н), 2,37 (1Н), 2,59 (1H), 2,84 (1H), 2,93 (1Н), 4,06 (1Н), 4,24 (2Н), 4,56 (1Н), 5,62 (1H), 6,25 (1H), 7,29 (2Н), 7,35 (1Н), 7,45 (2Н), 7,54 (2Н), 7,59 (2Н).
Пример 65: Этиловый эфир (2R,4S)-5-бинил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и этилового эфира (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et)
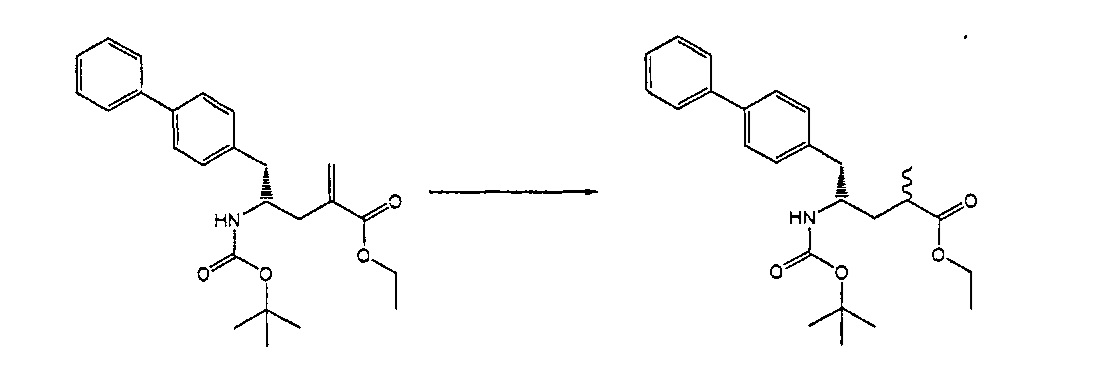
Способ 1
409 мг этилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et) добавляли к этанолу (9 мл) в сосуд А. Добавляли 14,9 мг [Rh(NBD)2]BF4 и 39,6 мг (R)-1-[(R)-2-(2'-дициклогексилфосфинофенил)ферроценил]этилди(бис-(3,5-трифторметил)фенил)фосфина (= Walphos SL-W008-1) к этанолу (3 мл) в сосуд Б. Содержимое сосуда Б перемешивали в течение 0,5 ч при комнатной температуре. Содержимое сосуда А и сосуда Б затем переносили в сосуд В. Сосуд В насыщали водородом (20 бар), и затем помещали в атмосферу водорода при 20 бар. Смесь перемешивали в течение 16 ч. Летучие примеси удаляли при пониженном давлении. Остаток анализировали с помощью ВЭЖХ для определения соотношения этилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) к этиловому эфиру (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et). Диастереомерное соотношение 50,2:49,8 (соединение 1-а, R1=Boc, R2=Н, R3=COEt: соединение 1-b, R1=Boc, R2=Н, R3=COEt), что подтверждено данными ВЭЖХ.
Способ 2
409 мг этилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et) добавляли к этанолу (9 мл) в сосуд А. Добавляли 17,4 мг [Ru(COD)(CF3CO2)2] и 44,2 мг (αR,αR)-2,2'-бис(α-N,N-диметиламинофенилметил)-(S,S)-1,1'-бис[ди(3,5-диметил-4-метоксифенил)фосфино]ферроцен (= Mandyphos SL-M004-1) к дихлорэтану (3 мл) в сосуд Б. Содержимое сосуда Б перемешивали в течение 0,5 ч при 50°C. Летучие примеси удаляли из смеси сосуда Б при пониженном давлении. Затем в сосуд Б добавляли этанол (3 мл). Содержимое сосуда А и сосуда Б затем переносили в сосуд В. Сосуд В насыщали водородом (20 бар), и затем помещали в атмосферу водорода при 20 бар. Смесь перемешивали в течение 16 ч. Летучие примеси удаляли при пониженном давлении. Остаток анализировали с помощью ВЭЖХ для определения соотношения этилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) к этиловому эфиру (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et). Диастереомерное соотношение 25,5:74,5 (соединение 1-а, R1=Boc, R2=Н, R3=COEt: соединение 1-b, R1=Boc, R2=Н, R3=COEt), что подтверждено данными ВЭЖХ.
Общая методика (пример 65, способы 3-12)
Металлоорганический комплекс (А) и хиральный лиганд (L) добавляли к смеси этанола (0,041 мл) и дихлорэтана (0,135 мл). Соотношение хирального лиганда к атому металла в металлоорганическом комплексе составляло 1,20:1. Соотношение S/C составляло 25. Смесь перемешивали в течение 0,5 ч. Растворитель затем удаляли. Добавляли (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановую кислоту (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et) в этаноле или дихлорэтане (0,244 мл) в сосуд, содержащий металлоорганический комплекс (А) и хиральный лиганд (L). Добавляли еще растворитель с получением конечной концентрации соединения 2-а (R1=Boc, R2=Н, R3=СО2Н) 84 мМ.
Водород при 20 бар применяли к сосуду, содержащему смесь. Смесь перемешивали при давлении 20 бар водорода и при комнатной температуре в течение 16 часов.
Растворы реакционных смесей анализировали с помощью ВЭЖХ для определения соотношения (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et).
Способ 3
Хиральный лиганд {(2S,4S)-2,4-бис(дифенилфосфино)пентан = (S,S)-BDPP}; металлоорганический комплекс {бис(трифторацетокси)(1,5-циклооктадиен)рутений(II)}; растворитель: этанол. Диастереомерное соотношение 85:15 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 4
Хиральный лиганд {(R)-1-[(S)-2-ди-трет-бутилфосфино)ферроценил]этилдициклогексилфосфин = SL-J505-1}; металлоорганический комплекс {бис(трифторацетокси)(1,5-циклооктадиен)рутений(II)}; растворитель: этанол. Диастереомерное соотношение 71:29 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 5
Хиральный лиганд {(1S)-дифенилфосфино-2-[(R)-α-(N,N-диметиламино)-o-дифенилфосфинофенил)метил]ферроцен = SL-T001-1}; металлоорганический комплекс {бис(трифторацетокси)(1,5-циклооктадиен)рутений(II)}; растворитель: этанол. Диастереомерное соотношение 70:30 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 6
Хиральный лиганд {(R)-1-[(S)-2-(дифенилфосфино)ферроценил]этилди(3,5-ксилил)фосфин = SL-J005-1}; металлоорганический комплекс {бис(трифторацетокси)(1,5-циклооктадиен)рутений(II)}; растворитель: этанол. Диастереомерное соотношение 67:33 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 7
Хиральный лиганд {(S)-(-)-(6,6'-диметоксибифенил-2,2'-диил)бис(дифенилфосфин) = (S)-Ph-MeOBIPHEP=SL-A101-2}; металлоорганический комплекс {[Ir(COD)2}BArF}; растворитель: дихлорэтан. Диастереомерное соотношение 63:37 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) : (соединение 1-b, R1=Boc, R2=H, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 8
Хиральный лиганд {(S)-1-[(R)-2-(дифенилфосфино)ферроценил]этилди(3,5-ксилил)фосфин = SL-J005-2}; металлоорганический комплекс (бис(норборнадиен)родия(I)тетрафторборат}; растворитель: этанол. Диастереомерное соотношение 58:42 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) : (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 9
Хиральный лиганд {(R)-1-[(R)-2-(2-дифенилфосфинофенил)ферроценил]этилди(бис-3,5-трифторметилфенил)фосфин = SL-W001-1}; металлоорганический комплекс (бис(норборнадиен)родия(I)тетрафторборат}; растворитель: этанол. Диастереомерное соотношение 31:69 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 10
Хиральный лиганд {(S)-1-[(S)-2-(2'-дициклогексилфосфинофенил)ферроценил]этилди(бис-(3,5-трифторметил)фенил)фосфин = SL-W008-2}; металлоорганический комплекс {бис(норборнадиен)родия(I) тетрафторборат}; растворитель: этанол. Диастереомерное соотношение 16:84 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 11
Хиральный лиганд {(R)-1-[(S)-2-дифенилфосфино)ферроценил]этилди-трет-бутилфосфин = SL-J002-1}; металлоорганический комплекс {бис(норборнадиен)родия(I)тетрафторборат}; растворитель: этанол. Диастереомерное соотношение 2:98 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Способ 12
Хиральный лиганд {(R)-1-[(S)-2-диэтилфосфино)ферроценил]этилди(трет-бутил)фосфин = SL-J301-1}; металлоорганический комплекс {бис(норборнадиен)родия(I)тетрафторборат}; Растворитель: этанол. Диастереомерное соотношение 5:95 ((соединение 1-а, R1=Boc, R2=Н, R3=CO2Et): (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ (пример 65, способы 1-12)
Колонка: Chiralcel OJ-RH; 150×4,6 мм; 5 мкм. Подвижная фаза A (вода); подвижная фаза Б (ацетонитрил). Изократно: 0 мин (60% Б); 15 мин (60% Б). Скорость потока: 0,8 мл мин-1. Длина волны 254 нм. Температура колонки: 10°C.
Время удерживания:
|
Пример 66: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc)
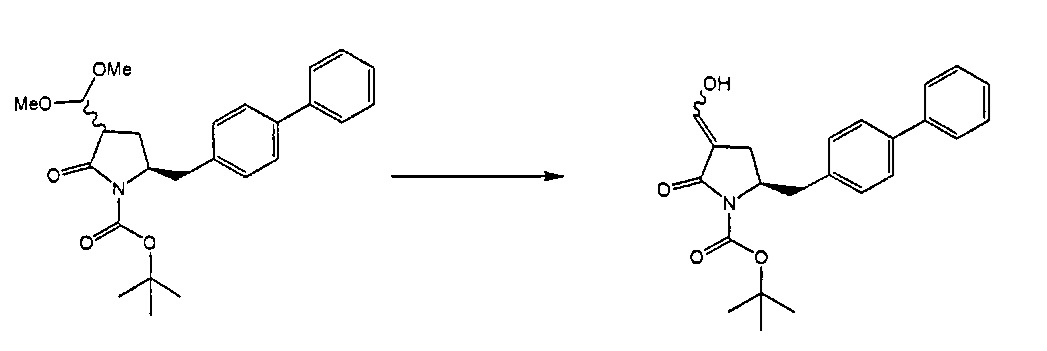
0,05 г трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-диметоксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=Me, R9=Me, Y=О) растворяли в 1 мл ацетона в атмосфере аргона. Затем добавляли 15 мг воды и 40 мг амберлиста 15. Смесь перемешивали в течение 3 дней, затем отфильтровывали и концентрировали в вакууме с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc), что подтверждено данными ВЭЖХ.
Метод ВЭЖХ
Колонка: X-BRIDGE C18; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1%) NH3 (32%) в воде); подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 210 или 254 нм. Температура 60°C.
Время удерживания
|
Пример 67: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-(бисбутилсульфанилметил)-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=нBu, R9=нBu, Y=S)
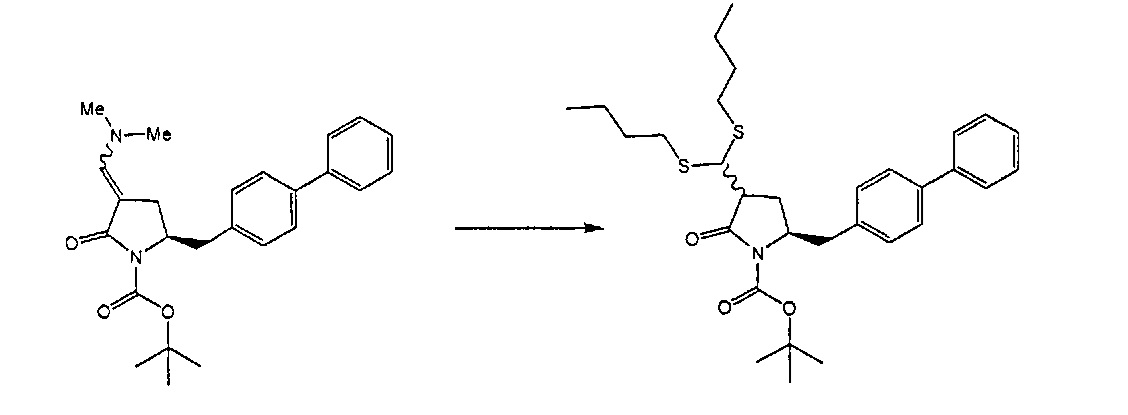
0,5 г трет-бутилового эфира 5-бифенил-4-илметил-3-[1-диметиламиномет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к 5 мл н-бутан-1-тиола. После добавления 0,2 г n-толуолсульфоновой кислоты смесь перемешивали в течение 6 дней при 25°C, затем нагревали при 60°C в течение 16 часов. Смесь затем гасили добавлением 5 мл 8% водного раствора бикарбоната, и весь оставшийся н-бутан-1-тиол отгоняли при пониженном давлении при 40°C. Водную фазу экстрагировали 3 раза по 5 мл этилацетата, и объединенную органическую фазу упаривали досуха при 40°C при пониженном давлении. Остаток очищали колоночной хроматографией (гептан: этилацетат 75:25) с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-(бисбутилсульфанилметил)-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=нBu, R9=нBu, Y=S). Соотношение C-3 диастереомеров определяли как 70:30 ((3S,5S): (3R,5S) диастереомеры, соответственно). 1H ЯМР (CDCl3): Данные для смеси диастереомеров: 0,86-0,96 (6Н), 1,32-1,47 (4Н), 1,50-1,68 (4Н), 1,62 (9Н), 1,94-2,30 (2Н), 2,48-2,74 (4Н), 2,80-2,89 (2Н), 3,10-3,16 (1H), 3,55-3,59 (1Н, минорный стереоизомер), 4,23-4,31 (1Н, минорный стереоизомер), 4,30 (1Н), 4,38 (1H, минорный стереоизомер), 4,43-4,47 (1H), 7,27-7,30 (2Н), 7,32-7,40 (1H), 7,44-7,50 (2Н), 7,56-7,65 (4Н).
Пример 68: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc)
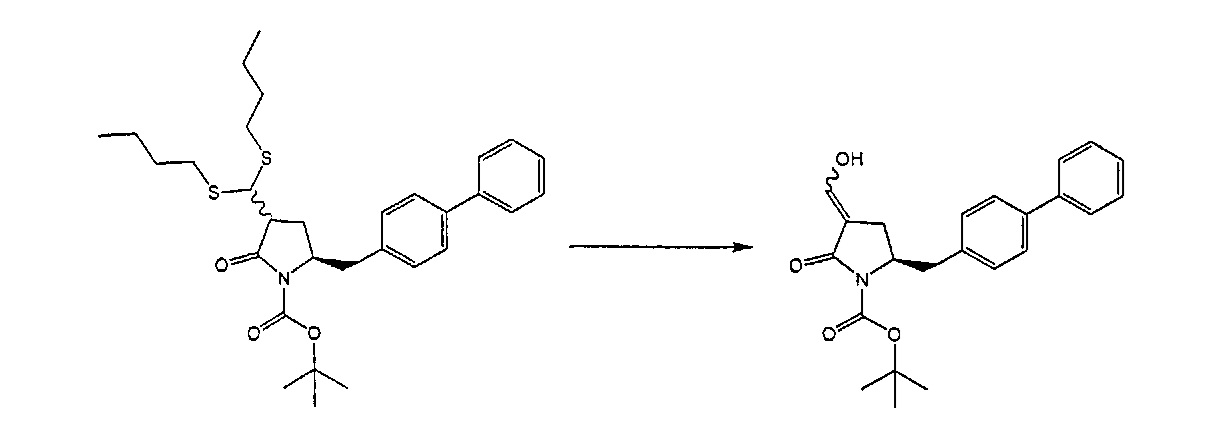
0,101 г (0,19 ммоля) трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-(бисбутилсульфанилметил)-2-оксопирролидин-1-карбоновой кислоты (соединение 16-а, R1=Boc, R9=нBu, R9=нBu, Y=S) растворяли в смеси 1,6 мл ацетонитрила и 0,4 мл воды. После добавления 0,115 г HgCl2 0,048 г карбоната кальция суспензию перемешивали в течение ночи. К смеси добавляли диэтиловый эфир (10 мл) и 18% водн. раствор хлорида аммония (5 мл). Смесь затем отфильтровывали, и фазы разделяли. Органическую фазу промывали водой и насыщенным раствором хлорида натрия, и затем концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc). Материал анализировали с помощью ВЭЖХ (метод ВЭЖХ примера 66).
Пример 69: трет-Бутиловый эфир (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc) и трет-бутиловый эфир (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-b, R1=Boc)
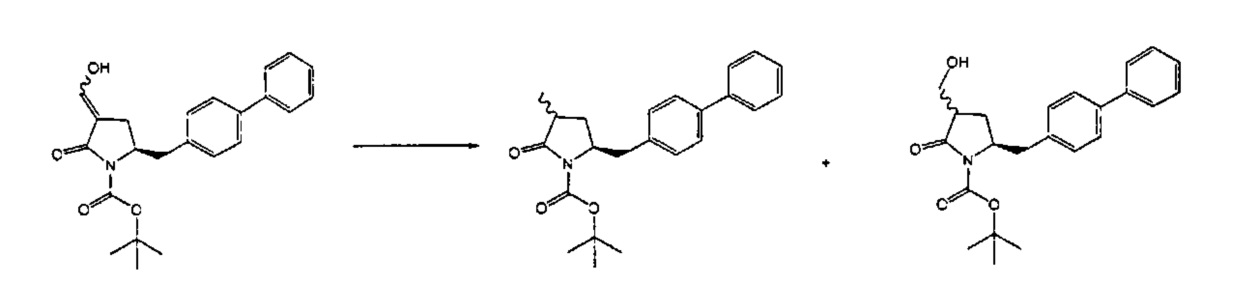
0,24 г трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к смеси этилацетата (10,8 мл) и метанола (1,2 мл) при 22°C. К смеси добавляли 0,1 г 10% палладия на угле (Engelhard 4505) с водой (0,3 мл). Смесь насыщали водородом, и затем перемешивали при 22°C и давлении водорода 4 бар в течение пяти дней. Смесь затем отфильтровывали через Cellflock и концентрировали при пониженном давлении с получением трет-бутилового эфира (3R,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-а, R1=Boc), трет-бутилового эфира (3S,5S)-5-бифенил-4-илметил-3-метил-2-оксопирролидин-1-карбоновой кислоты (соединение 3-a, R1=Boc) и трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc), что подтверждено данными ВЭЖХ. Условия ВЭЖХ приведены в примере 66 и примере 71.
Пример 70: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc)
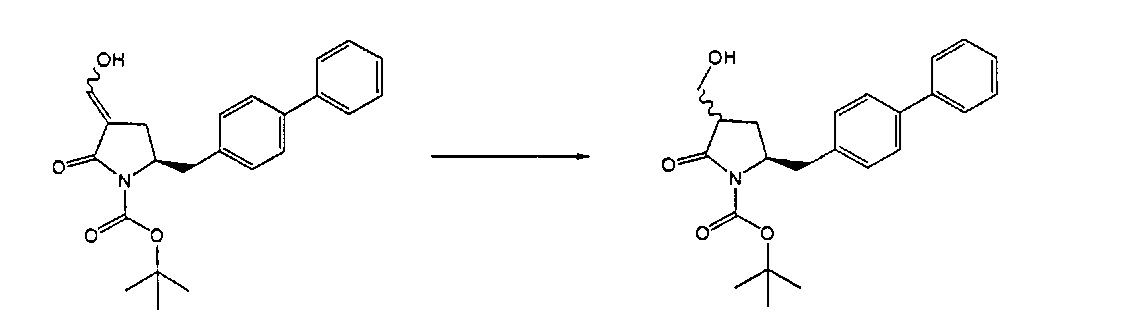
99 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc) добавляли к смеси толуола (0,25 мл) и воды (0,25 мл) при комнатной температуре. Затем добавляли бромид тетрабутиламмония (19,7 мг). Смесь затем охлаждали до 0°C. Затем добавляли боргидрид натрия (20,8 мг), и полученную смесь перемешивали при 0°C в течение 1 ч. Смесь затем нагревали до комнатной температуры и перемешивали в течение ночи. Затем к смеси добавляли воду (10 мл) и толуол (10 мл). Фазы разделяли. Органическую фазу промывали водой (10 мл), сушили (MgSO4) и концентрировали в вакууме с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc), что определено по данным LC-MS. m/z (+ESI): 266 (10%), 282 (2), 310 (20), 326 (100), 366 (15), 382 ([MH+], 8). 1Н ЯМР (ДМСО): 1,22-1,52, 1,59-1,65, 1,80-1,87, 1,94-2,03, 2,10-2,18, 2,57-2,89, 3,02-3,11, 3,15-3,30, 3,34-3,44, 3,46-3,66, 3,67-3,79, 3,82-3,93, 4,16-4,38, 4,63-4,69, 4,72-4,77, 4,93-5,00, 5,14-5,27, 5,40-5,63, 5,66-5,78, 6,23-6,29, 6,63-6,29, 6,63-6,67, 7,12-7,20, 7,23-7,37, 7,43-7,47, 7,55-7,68.
Пример 71: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc)
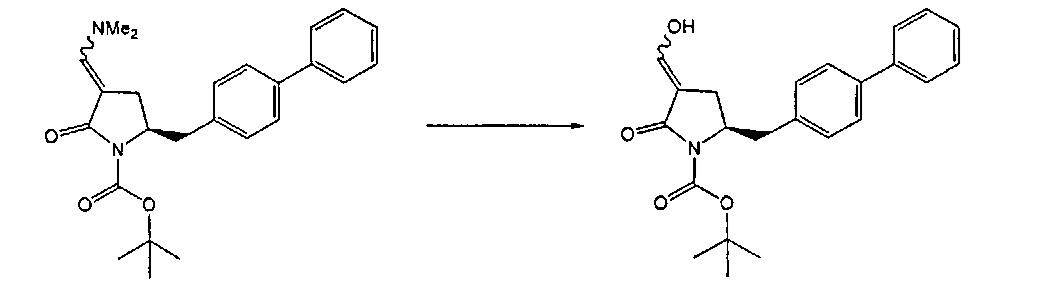
Способ 1
100 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этанолу (0,5 мл). К смеси добавляли 160 мг карбоната цезия. К смеси добавляли 30 мг палладия на угле (10% нагрузка, 50% воды, Degussa E101 NE/W). Водород подсоединяли к смеси. Смесь затем перемешивали при комнатной температуре и давлении в течение ночи. Катализатор затем отфильтровывали, и смесь концентрировали при пониженном давлении. Остаток анализировали с помощью ВЭЖХ для определения трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(Е/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc).
Способ 2
189 мг трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-диметиламиномет-(E/Z)-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 7-а, R1=Boc, R6=Me, R7=Me) добавляли к этанолу (0,5 мл). К смеси добавляли 108 мкл 2,6-лутидина. К смеси добавляли 57 мг палладия на угле (10% нагрузка, 50% воды, Johnson Matthey тип 39). Водород подсоединяли к смеси. Смесь затем перемешивали при комнатной температуре и давлении в течение ночи. Катализатор затем отфильтровывали, и смесь концентрировали при пониженном давлении. Остаток анализировали с помощью ВЭЖХ для определения трет-бутилового эфира (R)-5-бифенил-4-илметил-3-[1-гидроксимет-(E/Z-илиден]-2-оксопирролидин-1-карбоновой кислоты (соединение 6-а, R1=Boc).
Метод ВЭЖХ 1 (пример 71)
Колонка: Zorbax Extend C18; 150×4,6 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); подвижная фаза Б (ацетонитрил); подвижная фаза В (метанол). Градиент: 0 мин (5% Б; 50% В); 1 мин (5% Б; 50% В); 5 мин (5% Б; 75% В); 15 мин (5% Б; 75% В); 15,1 мин (5% Б; 50% В); 18 мин (5% Б; 50% В). Скорость потока: 1,2 мл мин-1. Длина волны: 254 нм. Температура колонки: 10°C.
Время удерживания:
|
Метод ВЭЖХ 2 (пример 71)
Колонка: X-BRIDGE; 150×3,0 мм; 3,5 мкм. Подвижная фаза A (0,1% NH3 (32%) в воде); подвижная фаза Б (ацетонитрил). Градиент: 0 мин (20% Б); 3 мин (40% Б); 5 мин (40% Б); 7 мин (50% Б); 11 мин (50% Б); 13 мин (80% Б); 16 мин (80% Б); 16,1 мин (20% Б); 20 мин (20% Б). Скорость потока: 1,4 мл мин-1. Длина волны: 254 нм. Температура колонки: 60°C.
Время удерживания
|
|
Пример 72: Этиловый эфир (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и этиловый эфир (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et)
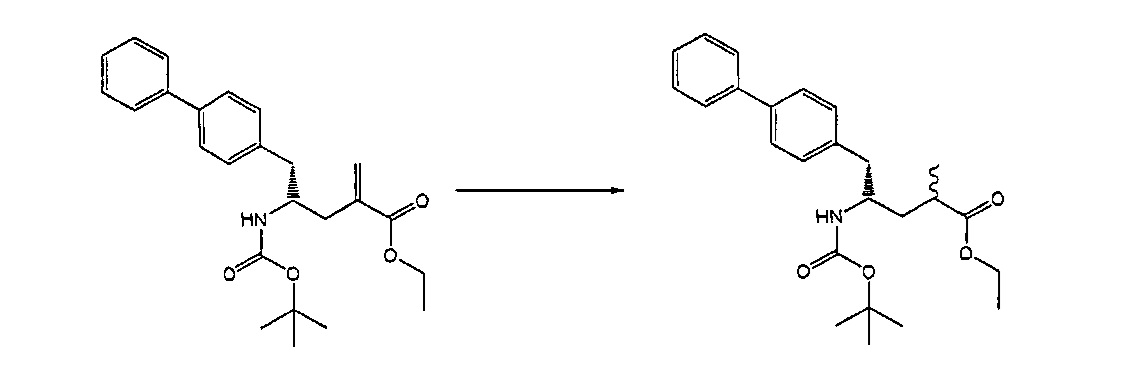
500 мг этилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Et) добавляли к этанолу (5 мл) при комнатной температуре. Затем к смеси добавляли триэтиламин (170 мл). Затем добавляли 50 мг палладия на угле (10%, 50% воды, Degussa E101 NE/W). Водород при давлении окружающей среды подсоединяли к смеси. Смесь затем перемешивали в течение ночи при комнатной температуре и давлении. Смесь затем отфильтровывали и концентрировали при пониженном давлении с получением этилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et) и этилового эфира (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Et). Спектроскопические данные описаны в примере 63. Соотношение диастереомеров 70:30 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Et: соединение 1-b, R1=Boc, R2=Н, R3=CO2Et), что подтверждено данными ВЭЖХ (метод ВЭЖХ описан в примере 65).
Пример 73: Метиловый эфир (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me) и метиловый эфир (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Me)
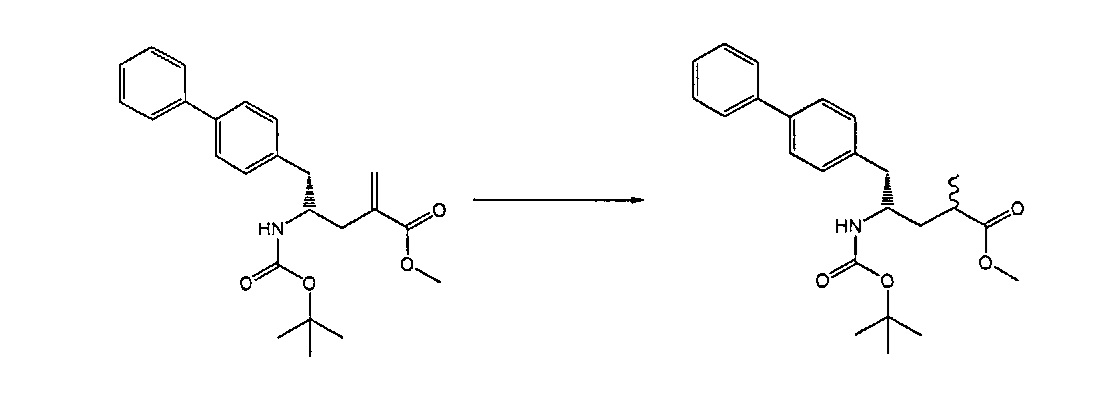
500 мг метилового эфира (R)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метиленпентановой кислоты (соединение 2-а, R1=Boc, R2=Н, R3=CO2Me) добавляли к этанолу (5 мл) при комнатной температуре. Затем к смеси добавляли триэтиламин (176 мл). Затем добавляли 50 мг палладия на угле (10%, 50% воды, Degussa Е101 NE/W). Водород при давлении окружающей среды подсоединяли к смеси. Смесь затем перемешивали в течение ночи при комнатной температуре и давлении. Смесь затем отфильтровывали и концентрировали при пониженном давлении с получением метилового эфира (2R,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me) и метилового эфира (2S,4S)-5-бифенил-4-ил-4-трет-бутоксикарбониламино-2-метилпентановой кислоты (соединение 1-b, R1=Boc, R2=Н, R3=CO2Me). Спектроскопические данные описаны в примере 60. Соотношение диастереомеров 66:34 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me: соединение 1-b, R1=Boc, R2=Н, R3=CO2Me) путем сложения сигналов при 1,76-1,85 (соединение 1-b, R1=Boc, R2=Н, R3=CO2Me) и 1,92-1,99 (соединение 1-а, R1=Boc, R2=Н, R3=CO2Me).
Пример 74: трет-Бутиловый эфир (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил) и трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc)
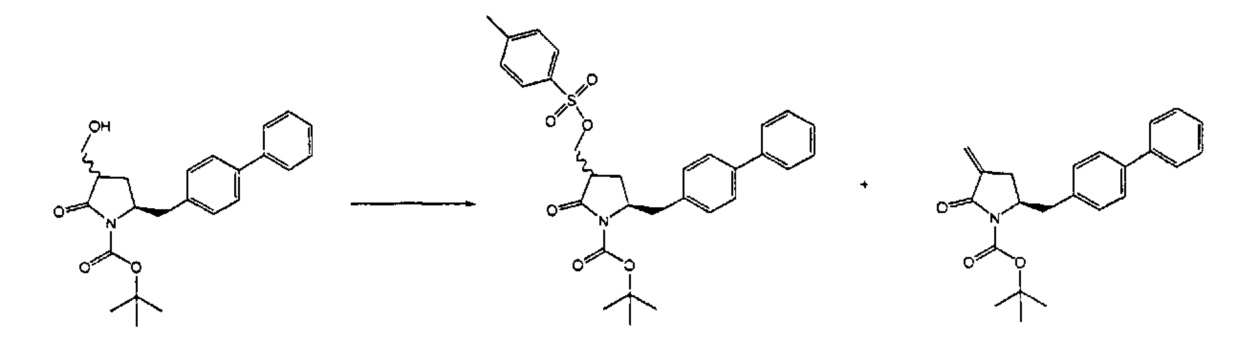
20 мг трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-3-гидроксиметил-2-оксопирролидин-1-карбоновой кислоты (соединение 5-а, R1=Boc) (полученный в соответствии с примером 48) добавляли к хлороформу (5 мл) при комнатной температуре. К смеси добавляли триэтиламин (11 мл). Затем к смеси добавляли ангидрид 4-толуолсульфоновой кислоты (20,5 мг). Смесь затем перемешивали в течение 20 ч при кипении с обратным холодильником. Добавляли этилацетат (1 мл) и воду (1 мл). Фазы разделяли. Органическую фазу концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией, элюируя смесью гептан-этилацетат (1:1), с получением трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил) и трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные для трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил) описаны в примере 49, способ 1. Спектроскопические данные для трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc) описаны в примере 23, способ 1.
Пример 75: (3R/S,5S)-5-Бифенил-4-илметил-3-йодметилпирролидин-2-он (соединение 12-а, R1=Н, R5=I)
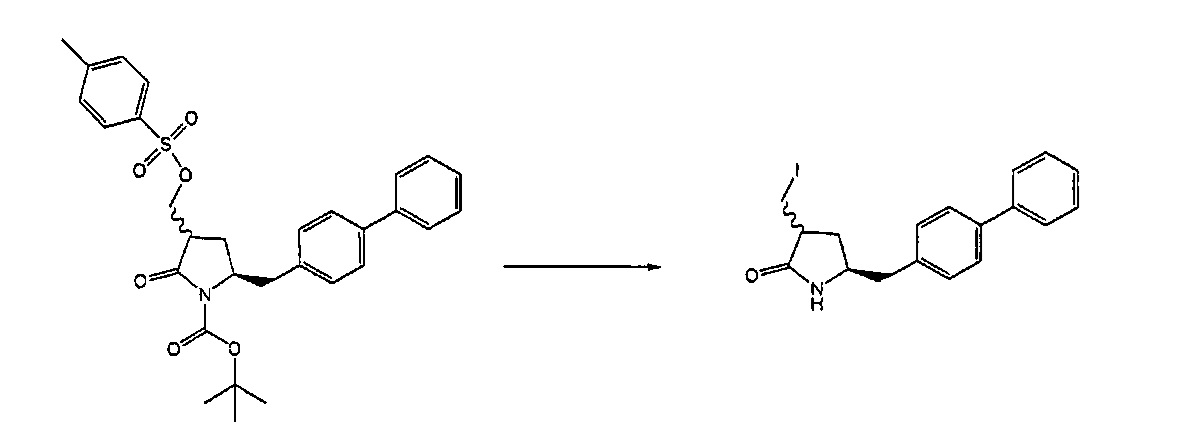
122 мг трет-бутилового эфира (3R/S,5S)-5-бифенил-4-илметил-2-оксо-3-(толуол-4-сульфонилоксиметил)пирролидин-1-карбоновой кислоты (соединение 11-а, R1=Boc, R4=тозил), полученного в соответствии с примером 49, способ 2, добавляли к ацетонитрилу (3 мл). Затем к смеси добавляли йодид натрия (105 мг). Полученную смесь нагревали при кипении с обратным холодильником в течение ночи. Смесь затем концентрировали при пониженном давлении. Очистка колоночной хроматографией, элюируя смесью этилацетат-гептан (1:1), приводила к получению (3R/S,5S)-5-бифенил-4-илметил-3-йодметилпирролидин-2-она (соединение 12-а, R1=Н, R5=I). 1Н ЯМР (CDCl3): 2,13 (2Н), 2,69 (2Н), 2,82 (1H), 3,28 (1H), 3,35 (1H), 3,85 (1H), 5,84 (1H), 7,17 (2Н), 7,28 (1H), 7,37 (2Н), 7,49 (4Н).
Пример 76: трет-Бутиловый эфир (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc)
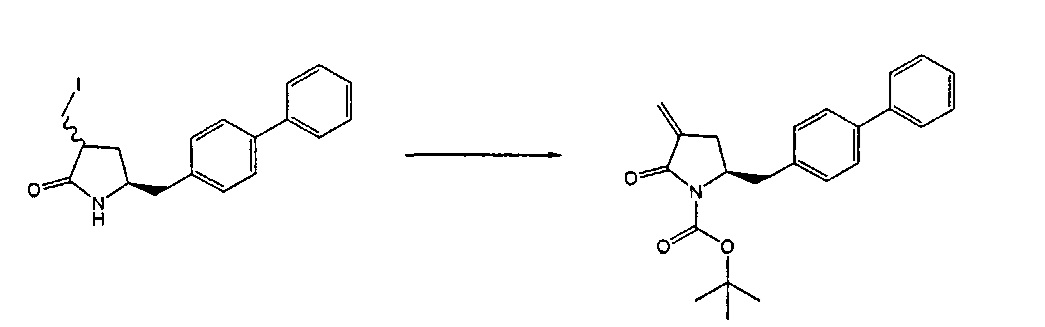
5 мг (3R/S,5S)-5-бифенил-4-илметил-3-йодметилпирролидин-2-она (соединение 12-а, R1=Н, R5=I) добавляли к толуолу (1 мл). Затем к смеси добавляли 4-(диметиламино)пиридин (0,1 мг) и триэтиламин (1 мкл). Смесь нагревали при 70°C. Затем к смеси добавляли ди-трет-бутилдикарбонат (2 мг). Смесь перемешивали в течение 1 ч при 70°C. Смесь концентрировали при пониженном давлении. Добавляли этилацетат (1 мл) и воду (1 мл). Фазы разделяли. Органическую фазу концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-5-бифенил-4-илметил-3-метилен-2-оксопирролидин-1-карбоновой кислоты (соединение 4-а, R1=Boc). Спектроскопические данные описаны в примере 23, способ 1.
Пример 77: (3R,5S)-5-Бифенил-4-илметил-3-метилпирролидин-2-он (соединение 3-а, R1=Н) и (3S,5S)-5-бифенил-4-илметил-3-метилпирролидин-2-он (соединение 3-b, R1=H)

4 мг (3R/S,5S)-5-бифенил-4-илметил-3-йодметилпирролидин-2-она (соединение 12-а, R1=Н, R5=I) добавляли к этанолу (1 мл) при комнатной температуре. Затем к смеси добавляли триэтиламин (5 мл). Затем добавляли 0,4 мг палладия на угле (10%, 50% воды, Degussa Е101 NE/W). Водород при давлении окружающей среды присоединяли к смеси. Смесь затем перемешивали в течение ночи при комнатной температуре и давлении. Смесь затем отфильтровывали и концентрировали при пониженном давлении с получением (3R,5S)-5-бифенил-4-илметил-3-метилпирролидин-2-она (соединение 3-а, R1=Н) и (3S,5S)-5-бифенил-4-илметил-3-метилпирролидин-2-она (соединение 3-b, R1=Н). Соотношение диастереомеров 22:88 (соединение 3-а, R1=Н к соединению 3-b, R1=Н), что определено данными ЯМР. Спектроскопические данные для соединения 3-а (R1=Н) описаны в примере 6 международной заявки на патент WO/2008/083967. Спектроскопические данные для соединения 3-b (R1=Н) описаны в примере 47 международной заявки на патент WO/2008/083967.
Предпочтительные варианты осуществления:
Вариант осуществления 1:
Способ получения соединения формулы (7) или его соли:
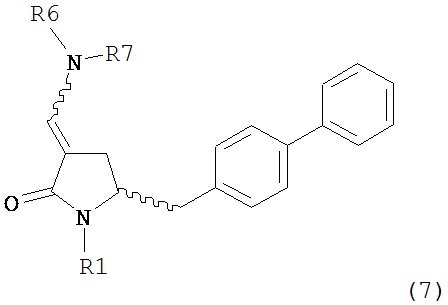
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
включающий реакцию соединения формулы (8) или его соли:
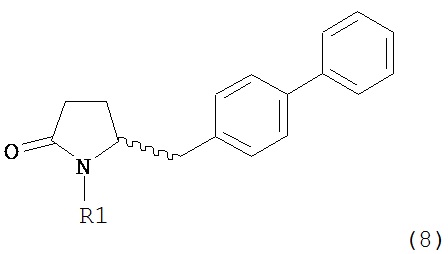
где R1 представляет собой водород или защитную группу для азота,
- с амином формул (13), (14) или (15):
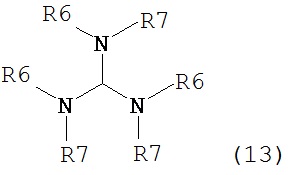 ,
, 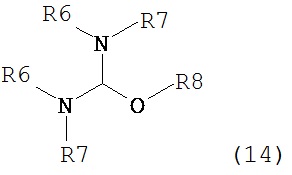 ,
, 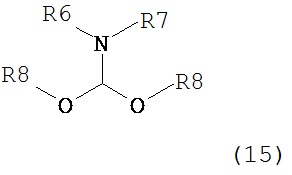
и необязательно солью, такой как соль щелочного металла, соль щелочноземельного металла, соль аммония или ионная жидкость;
- или с соединением, полученным смешением соединения формулы (18):
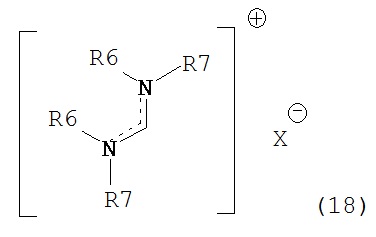
с алкоголятом формулы M-O-R8, и необязательно обработку указанного соединения солью M1X';
- или с их смесями;
где
каждый R6 и каждый R7 независимо представляет собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, и каждый R8 независимо представляет собой алкильную группу, арильную группу или арилалкильную группу;
X и X' независимо представляют собой анион, например, галогенид, анион сульфоновой кислоты, анион алкилсульфата, тетрагалогенметалят, такой как тетрахлорметалят, гексафторфосфат, гексафторантимонат, тетрафторборат, перхлорат, алкоксид R8-O-, где R8 является таким, как определено выше, карбоксилат или трибромид;
M представляет собой щелочной металл или щелочноземельный металл; и
M1 представляет собой щелочной металл, щелочноземельный металл или аммоний;
с получением соединения формулы (7).
Вариант осуществления 2:
Способ получения соединения формулы (6) или его таутомера:
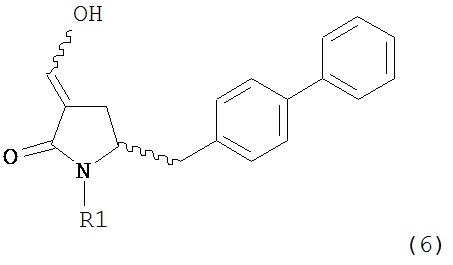
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, кислотой с получением соединения формулы (6).
Вариант осуществления 3:
Способ получения соединения формулы (4):
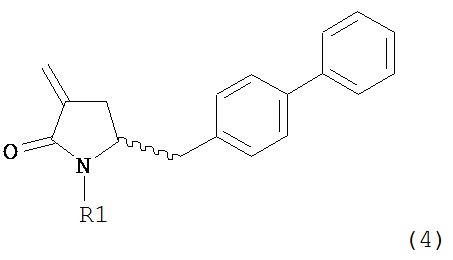
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (6) или его соли или таутомера:

где R1 представляет собой водород или защитную группу для азота, восстанавливающим агентом, предпочтительно в форме альдегида, с получением соединения формулы (4).
Вариант осуществления 4:
Способ получения соединения формулы (5) или его соли:
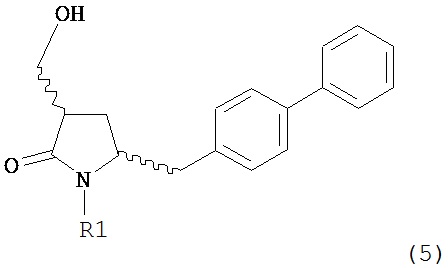 ,
,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (6) или его соли или таутомера:

где R1 представляет собой водород или защитную группу для азота, восстанавливающим агентом с получением соединения формулы (5).
Вариант осуществления 5:
Способ получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий:
a) обработку соединения формулы (5) или его соли:
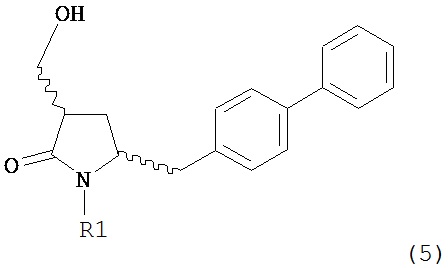
где R1 представляет собой водород или защитную группу для азота, ОН-активирующим агентом с получением соединения формулы (11):
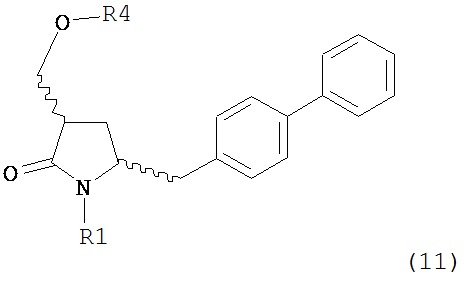
или его соли, где R1 представляет собой водород или защитную группу для азота, и R4 представляет собой ОН-активирующую группу; и
б) реакцию соединения формулы (11) или его соли с основанием с получением соединения формулы (4).
Вариант осуществления 6:
Способ получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий:
обработку соединения формулы (5) или его соли:

OH-активирующей группой в присутствии основания.
Вариант осуществления 7:
Способ получения соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, восстанавливающим агентом с получением соединения формулы (4).
Вариант осуществления 8:
Способ получения соединения формулы (6):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
восстанавливающим агентом с получением соединения формулы (6).
Вариант осуществления 9:
Способ получения соединения формулы (9) или его соли:
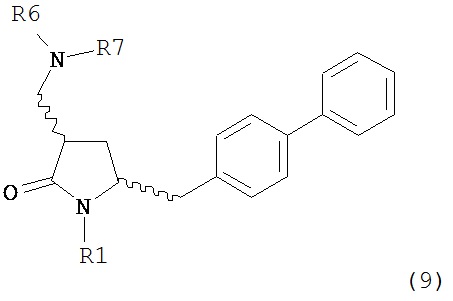
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
включающий восстановление восстанавливающим агентом двойной связи в соединении формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с получением соединения формулы (9).
Вариант осуществления 10:
Способ в соответствии с вариант осуществления 9, где реакцию восстановления осуществляют с помощью водорода в присутствии катализатора переходного металла, где переходный металл выбран из группы 9 или 10 периодической таблицы, такой как Pd, Pt или Ir; и необязательно в присутствии основания.
Вариант осуществления 11:
Способ в соответствии с вариантом осуществления 10, где катализатор выбран из:
палладия на угле, палладия на оксиде алюминия, палладия на карбонате кальция, палладия на оксиде титана, палладия на сульфате бария, палладия на оксиде циркония, палладия на диоксиде кремния/оксиде алюминия, платины на угле, иридия на угле и иридия на карбонате кальция.
Вариант осуществления 12:
Способ получения соединения формулы (5) или его соли:
 ,
,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, восстанавливающим агентом.
Вариант осуществления 13:
Способ получения соединения формулы (4) или его соли:

где R1 представляет собой водород или защитную группу для азота, включающий реакцию соединения формулы (9) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с кватернизирующим агентом и основанием с получением соединения формулы (4).
Вариант осуществления 14:
Способ получения соединения формулы (4) или его соли:

где R1 представляет собой водород или защитную группу для азота, включающий:
а) реакцию соединения формулы (9) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
с кватернизирующим агентом с получением соединения формулы (10) или его соли:
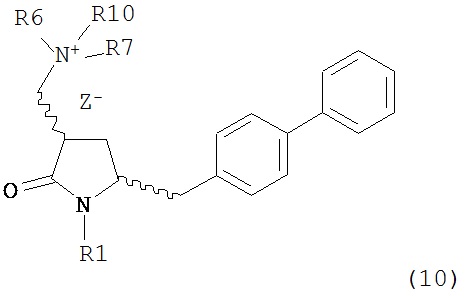
где R1 представляет собой водород или защитную группу для азота, R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, Z- представляет собой галогенид (например, йодид, бромид, хлорид), алкилсульфат (например, метилсульфат) или сульфониловый эфир (например, трифлат), и R10 представляет собой водород, алкил или арил; и
б) реакцию соединения формулы (10) или его соли с основанием с получением соединения формулы (4).
Вариант осуществления 15:
Способ получения соединения формулы (16):
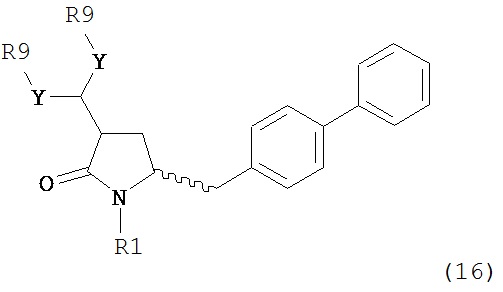
или его соли,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
включающий обработку соединения формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
ацетальобразующим агентом с получением соединения формулы (16).
Вариант осуществления 16:
Способ получения соединения формулы (16):

или его соли,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
включающий обработку соединения формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
тиоацетальобразующим агентом с получением соединения формулы (16).
Вариант осуществления 17:
Способ получения соединения формулы (6) или его таутомера:

или его соли, где R1 представляет собой водород или защитную группу для азота,
включающий удаление ацетальной группы в соединении формулы (16) или его соли:

где R1 представляет собой водород или защитную группу для азота, Y представляет собой кислород, и каждый R9 независимо представляет собой алкил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-7-, предпочтительно 5- или 6-членное ацетальное кольцо,
с получением соединения формулы (6).
Вариант осуществления 18:
Способ получения соединения формулы (6) или его таутомера:

или его соли, где R1 представляет собой водород или защитную группу для азота,
включающий удаление тиоацетальной группы в соединении формулы (16) или его соли:

где R1 представляет собой водород или защитную группу для азота, Y представляет собой серу, и каждый R9 независимо представляет собой алкил, арил, арилалкил (например, бензил) или ацетил, или оба R9 вместе образуют 4-1-, предпочтительно 5- или 6-членное ацетальное кольцо,
с получением соединения формулы (6).
Вариант осуществления 19:
Способ получения соединения формулы (2):
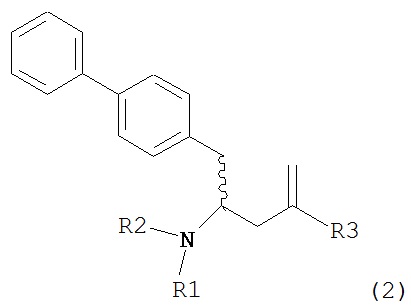
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу,
включающий реакцию соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, с агентом для раскрытия лактамного кольца с получением соединения формулы (2).
Вариант осуществления 20:
Способ получения соединения формулы (1):
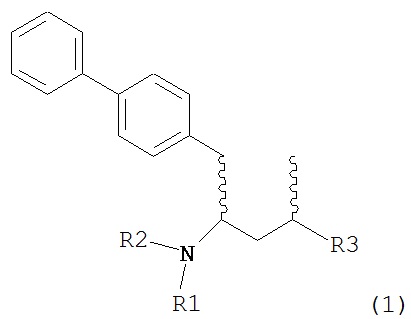
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, включающий восстановление соединения формулы (2):
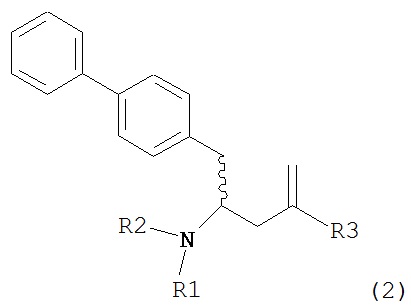
или его соли,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, с получением соединения формулы (1).
Вариант осуществления 21:
Способ в соответствии с вариантом осуществления 20, в котором реакцию восстановления осуществляют водородом в присутствии катализатора переходного металла, необязательно в присутствии основания или кислоты.
Вариант осуществления 22:
Способ в соответствии с вариантом осуществления 22, в котором катализатор переходного металла включает металлоорганический комплекс, содержащий переходный металл, выбранный из группы 7, 8 или 9 периодической таблицы, и хиральный лиганд.
Вариант осуществления 23:
Способ в соответствии с вариантом осуществления 22, в котором металлоорганический комплекс выбран из группы, состоящей из [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2], [Ru(cod)(OOCCF3)2], [Rh(nbd)2BF4], [Rh(cod)2]BF4 [(Cy3P)Ir(pyr)]Cl, [Ir(COD)2]BArF и [Ir(cod)2Cl]2; предпочтительно [Rh(NBD)2]BF4 или [RuCl2(п-цимен)2].
Вариант осуществления 24:
Способ в соответствии с вариантами осуществления 22 или 23, в котором хиральный лиганд выбран из лиганда Fenphos, лиганда Josiphos, лиганда Mandyphos, лиганда Walphos, лиганда Taniaphos, лиганда Phospholane, лиганда Atropisomer, лиганда BoPhoz, лиганда QUINAPHOS или их смесей; в частности, хиральный лиганд выбран из группы, состоящей из лиганда Fenphos, лиганда Josiphos, лиганда BDPP, лиганда Mandyphos, лиганда Walphos, лиганда Taniaphos, лиганда Phospholane, лиганда Atropisomer и их смесей.
Вариант осуществления 25:
Способ по любому из вариантом осуществления 22-24, в котором хиральный лиганд выбран из BoPhoz (R)-Cy-MeBoPhoz; BoPhoz (R)-фенэтил-(S)-BoPhoz; Atropoisomer SL-A101-1; Atropoisomer SL-A109-2; SL-A116-2; Atropoisomer SL-A118-1; Atropoisomer SL-A132-2; Fenphos SL-F131-1; Fenphos SL-F132-1; Fenphos SL-F133-1; Fenphos SL-F134-1; Fenphos SL-F135-1; Fenphos SL-F355-1; Fenphos SL-F356-1; Fenphos SL-F365-1; Josiphos SL-J005-2; SL-J505-1; Josiphos SL-J008-1; Josiphos SL-J013-1; Josiphos SL-J301-1; Josiphos SL-J403-1; Josiphos SL-J408-1; Josiphos SL-J430-1; Josiphos SL-J431-1; Josiphos SL-J501-1; Josiphos SL-J504-1; Josiphos SL-J504-2; Josiphos SL-J505-2; Josiphos SL-J506-1; Mandyphos SL-M002-1; Mandyphos SL-M003-1; Mandyphos SL-M004-1; Mandiphos SL-M009-1; Mandiphos SL-M010-1; Phospholane SL-P051-1; Taniaphos SL-T001-1; Taniaphos SL-T001-2; Taniaphos SL-T003-1; Taniaphos SL-T021-2; (S,S)-BDPP; Walphos SL-W001-1; Walphos SL-W005-1; Walphos SL-W008-1; Walphos SL-W008-2; Walphos SL-W009-1; Walphos SL-W012-1; Walphos SL-W021-1 или Walphos SL-W024-1.
Вариант осуществления 26:
Способ в соответствии с вариантом осуществления 22, в котором металлоорганический комплекс включает родий, и где хиральный лиганд выбран из лиганда Fenphos, Walphos, Josiphos или Phospholane; в частности [Rh(nbd)2]BF4 и лиганд Fenphos, Walphos, Josiphos или PhanePhos; такой как Rh(nbd)2]BF4 и Walphos SL-W005-1, Walphos SL-W008-1, Fenphos SL-F356-1, Josiphos SL-J008-1, Phospholane SL-P051-1, Walphos SL-W009-1, Walphos SL-W001-1, Walphos SL-W012-1, Walphos SL-W021-1, Josiphos SL-J505-2 или Josiphos SL-J504-2; в частности, Rh(nbd)2]BF4 и Walphos SL-W008-1, Josiphos SL-J008-1, Phospholane SL-P051-1, Josiphos SL-J505-2 или Josiphos SL-J504-2.
Вариант осуществления 27:
Способ в соответствии с вариантом осуществления 22, в котором металлоорганический комплекс и хиральный лиганд выбран из:
- металлоорганического комплекса рутения и лиганда Atropisomer, Mandyphos или Fenphos; в частности [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2] и лиганд Atropisomer, Mandyphos, BDPP, Josiphos или Fenphos; такой как [RuI2(п-цимен)]2, [Ru(cod)(2-металлил)2] или [Ru(cod)(OOCCF3)2] и Atropisomer SL-A101-1, Mandyphos SL-M010-1, (S,S)-BDPP, Josiphos SL-J505-1, Fenphos SL-F131-1, Fenphos SL-F132-1 или Fenphos SL-F134-1; или
- металлоорганического комплекса иридия и лиганда Fenphos, Walphos или Josiphos; в частности [Ir(cod)Cl]2 и лиганд Fenphos, Walphos или Josiphos; такой как [Ir(cod)Cl]2 и Fenphos SL-F356-1, Walphos SL-W024-1 или Josiphos SL-J504-1.
Вариант осуществления 28:
Способ в соответствии с вариантом осуществления 21, в котором катализатор переходного металла включает переходный металл, выбранный из группы 7, 8 или 9 периодической таблицы, такой как родий, рутений или иридий, и хиральный лиганд.
Вариант осуществления 29:
Способ в соответствии с вариантом осуществления 28, в котором хиральный лиганд представляет собой лиганд BoPhoz, лиганд BINAP, лиганд BINOL, лиганд Phospholane, лиганд PhanePhos, лиганд P-Phos, лиганд QuinaPhos, лиганд ProPhos, лиганд BDPP, лиганд DIOP, лиганд DIP AMP, лиганд DuanPhos, лиганд NorPhos, лиганд ВШАМ, лиганд CatAsium, лиганд SimplePHOX, лиганд РНОХ, лиганд ChiraPhos, лиганд Ferrotane, лиганд ВРЕ, лиганд TangPhos, лиганд JafaPhos, лиганд DuPhos, лиганд Binaphane или их смеси.
Вариант осуществления 30:
Способ в соответствии с вариантом осуществления 28, в котором катализатор переходного металла включает переходный металл родий и хиральный лиганд, выбранный из лиганда Phospholane, P-Phos, PhanePhos, BoPhoz, DIOP, BINAP, CatAsium, TangPhos, JafaPhos, DuPhos, BPE, Ferrotane, BINAM, DuanPhos, NorPhos, BDPP, ProPhos, DIPAMP, ChiraPhos и Binaphane, такой как SL-P104-2, SL-P102-1, SL-P005-1, (R)-P-Phos, (S)-P-Phos, (S)-PhanePhos, (R)-PhanePhos, (R)-An-PhanePhos, (R)-MeO-Xyl-PhanePhos, (R)-Xyl-PhanePhos, (R)-Tol-PhanePhos, (S)-MeBoPhoz, (S,S)-DIOP, (R,R)-DIOP, (S)-BINAP, (S)-Tol-BINAP, (R)-CatASium M, (S)-CatASium M, (R)-CatASium MN, (S)-CatASium MN, (R)-CatASium D, (R)-CatASium MNN, (S,S,R,R)-TangPhos, (R)-JafaPhos, (R)-MeDuPhos, (S,S)-Me-BPE, (S,S)-Ph-BPE, (S,S)-Et-Ferrotane, (S)-BINAM-P, (R)-BINAM-P, (R,R)-DuanPhos, (R,R)-NorPhos, (S,S)-NorPhos, (R,R)-BDPP, (S,S)-BDPP, (R)-ProPhos, (R,R)-DIPAMP, (S,S)-ChiraPhos или (R)-Binaphane.
Вариант осуществления 31:
Способ в соответствии с вариантами осуществления 28 или 30, в котором катализатор переходного металла выбран из [Rh(COD)(SL-P104-2)]O3SCF3, [Rh(COD)(SL-P102-l)]BF4, [Rh(COD)(SL-P005-1)]BF4, [Rh(COD)(SL-P102-1)]O3SCF3, [(R)-P-Phos Rh(COD)]BF4, [(S)-P-Phos Rh(COD)]BF4, [(R)-PhanePhos Rh(COD)]BF4, [(S)-PhanePhos Rh(COD)]BF4, [(R)-Xyl-PhanePhos Rh(COD)]BF4, [(S)-MeBoPhoz Rh(COD)]BF4, [(S,S)-DIOP Rh(COD)]BF4, [(S)-BINAP Rh(COD)]BF4, [(R)-CatASium M Rh(COD)]BF4, [(S)-CatASium M Rh(COD)]BF4, [(R)-CatASium MN Rh(COD)]BF4, [(S)-CatASium MN Rh(COD)]BF4, [(R)-CatASium D Rh(COD)]BF4, [(S,S,R,R)-TangPhos Rh(COD)]BF4, [(R)-JafaPhos Rh(COD)]BF4, [(R)-MeDuPhos Rh(COD)]BF4, [(S,S)-Me-BPE Rh(COD)]BF4, [(S,S)-Ph-BPE Rh(COD)]BF4, [(S,S)-Et-Ferrotane Rh(COD)]BF4, [(R)-An-PhanePhos Rh(COD)]BF4, [(R)-CatASium MNN Rh(COD)]BF4, [(S)-Tol-BINAP Rh(COD)]BF4, [(S)-BINAM-P Rh(COD)]BF4, [(R)-BINAM-P Rh(COD)]BF4, [(R,R)-DuanPhos Rh(COD)]BF4, [(R)-Binaphane Rh(COD)]BF4, [(R,R)-NorPhos Rh(COD)]BF4, [(S,S)-NorPhos Rh(COD)]BF4, [(R,R)-BDPP Rh(COD)]BF4, [(S,S)-BDPP Rh(COD)]BF4, [(R,R)-DIOP Rh(COD)]BF4, [(R)-ProPhos Rh(COD)]BF4, [(R,R)-DIPAMP Rh(COD)]BF4, [(S,S)-ChiraPhos Rh(COD)]BF4, [(R)-MeO-Xyl-PhanePhos Rh(COD)]BF4 или [(R)-Tol-PhanePhos Rh(COD)]BF4; в частности [Rh(COD)(SL-P102-1)]BF4, [Rh(COD)(SL-P005-1)]BF4, [Rh(COD)(SL-P102-1)]O3SCF3, [(R)-PhanePhos Rh(COD)]BF4, [(R)Xyl-PhanePhos Rh(COD)]BF4, [(S,S)-DIOP Rh(COD)]BF4, [(S)-BINAP Rh(COD)]BF4, [(R)-CatASium M Rh(COD)]BF4, [(R)-CatASium MN Rh(COD)]BF4, [(S)-CatASium MN Rh(COD)]BF4, [(S,S,R,R)-TangPhos Rh(COD)]BF4, [(S,S)-Me-BPE Rh(COD)]BF4, [(S,S)-Ph-BPE Rh(COD)]BF4, [(R)-An-PhanePhos Rh(COD)]BF4, [(R)-CatASium MNN Rh(COD)]BF4, [(S)Tol-BINAP Rh(COD)]BF4, [(S)-BINAM-P Rh(COD)]BF4, [(R,R)-DuanPhos Rh(COD)]BF4, [(R)-Binaphane Rh(COD)]BF4, [(S,S)-NorPhos Rh(COD)]BF4, [(R,R)-BDPP Rh(COD)]BF4, [(S,S)-BDPP Rh(COD)]BF4, [(R,R)-DIOP Rh(COD)]BF4, [(R)-ProPhos Rh(COD)]BF4, [(R,R)-DIPAMP Rh(COD)]BF4, [(S,S)-ChiraPhos Rh(COD)]BF4, [(R)-MeO-Xyl-PhanePhos Rh(COD)]BF4 или [(R)-Tol-PhanePhos Rh(COD)]BF4; в частности [Rh(COD)(SL-P102-1)]BF4, [Rh(COD)(SL-P005-1)]BF4, [(R)PhanePhos Rh(COD)]BF4, [(R)Xyl-PhanePhos Rh(COD)]BF4, [(R)CatASium M Rh(COD)]BF4, [(R)CatASium MN Rh(COD)]BF4, [(S,S,R,R)TangPhos Rh(COD)]BF4, [(S,S)Ph-BPE Rh(COD)]BF4, [(R)An-PhanePhos Rh(COD)]BF4, [(R,R)DuanPhos Rh(COD)]BF4, [(S,S)NorPhos Rh(COD)]BF4 или [(R)MeO-Xyl-PhanePhos Rh(COD)]BF4.
Вариант осуществления 32:
Способ в соответствии с вариантом осуществления 28, в котором катализатор переходного металла включает:
- переходный металл рутений и хиральный лиганд, выбранный из лиганда BoPhoz, BINAP, BINOL, PhanePhos, P-Phos и QUINAPHOS; такой как (R)-4-F-C6H4-MeBoPhoz, (R)-BINAP, (R)-BINOL-(R)-MeBoPhoz, (R)-MeBoPhoz, (R)-p-F-MeBoPhoz, (R)-PhanePhos, (R)-фенэтил-(R)-MeBoPhoz, (R)-P-Phos, (R)-Tol-BINAP, (R)-Xyl-PhanePhos, (R)-Xyl-P-Phos, (Ra,Sc)1Np-QUINAPHOS, (S)-BINAP, (S)-BINOL-(R)-MeBoPhoz, (S)-P-Phos, (S)-Xyl-PhanePhos, (S)-Xyl-P-Phos или (Sa,Rc)1Np-QUINAPHOS; или
- переходный металл иридий и хиральный лиганд, выбранный из лиганда Р-Phos, BoPhoz, SimplePHOX и РНОХ; такой как (S)-P-Phos, (S)-Xyl-P-Phos, (S)-MeBoPhoz, (R)-MeBoPhoz, (S)-Cy-третBu-SimplePHOX или (S)-изоPr-PHOX.
Вариант осуществления 33:
Способ в соответствии с вариантами осуществления 28 или 32, в котором катализатор переходного металла выбран из [(R)-4-F-C6H4-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-BINAP RuCl(бензол)]Cl, [(R)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-MeBoPhoz RuCl(бензол)]Cl, [(R)-п-F-MeBoPhoz RuCl(бензол)]Cl, [(R)-PhanePhos RuCl2(dmf)2], [(R)-фенэтил-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-P-Phos RuCl(бензол)]Cl, [(R)-Tol-BINAP RuCl(бензол)]Cl, [(R)-Xyl-PhanePhos RuCl2(dmf)2], [(R)-Xyl-P-Phos RuCl2(dmf)2], [(Ra,Sc)1Np-QUINAPHOS RuCl2(dmf)2], [(S)-BINAP RuCl(бензол)]Cl, [(S)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(S)-P-Phos RuCl(бензол)]Cl, [(S)-Xyl-PhanePhos RuCl2(dmf)2], [(S)-Xyl-P-Phos RuCl2(dmf)2], [(Sa,Rc)1Np-QUINAPHOS RuCl2(dmf)2], [(R)-P-Phos Ru(acac)2], [(R)-Xyl-P-Phos Ru(acac)2] или [(R)-Xyl-P-Phos RuCl(бензол)]Cl; в частности, [(R)-4-F-C6H4-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-BINAP RuCl(бензол)]Cl, [(R)-MeBoPhoz RuCl(бензол)]Cl, [(R)-п-F-MeBoPhoz RuCl(бензол)]Cl, [(R)-PhanePhos RuCl2(dmf)2], [(R)-фенэтил-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(R)-P-Phos RuCl(бензол)]Cl, [(R)-Tol-BINAP RuCl(бензол)]Cl, [(R)-Xyl-P-Phos RuCl2(dmf)2], [(S)-BINAP RuCl(бензол)]Cl, [(S)-BINOL-(R)-MeBoPhoz Ru(бензол)Cl]Cl, [(S)-P-Phos RuCl(бензол)]Cl, [(S)-Xyl-PhanePhos RuCl2(dmf)2], [(Sa,Rc)1Np-QUINAPHOS RuCl2(dmf)2], [(R)-P-Phos Ru(acac)2], [(R)-Xyl-P-Phos Ru(acac)2], [(R)-Xyl-P-Phos RuCl(бензол)]Cl, [(S)-P-Phos Ir(COD)]Cl, [(S)-Xyl-P-Phos Ir(COD)]Cl, [(S)-MeBoPhoz Ir(COD)]Cl, [(R)-MeBoPhoz Ir(COD)]Cl, [(S)-Cy-третBu-simplePHOX Ir(COD)]BArF или [(S)-изоPr-PHOX Ir(COD)]BArF.
Вариант осуществления 34:
Способ получения соединения формулы (3):
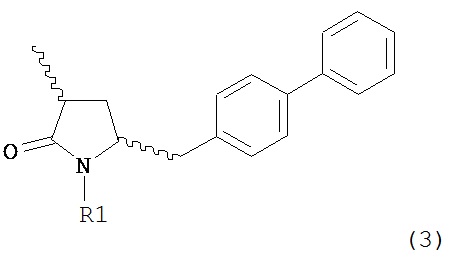
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий:
a) превращение соединения формулы (5) или его соли:

где R1 представляет собой водород или защитную группу для азота, в соединение формулы (12):
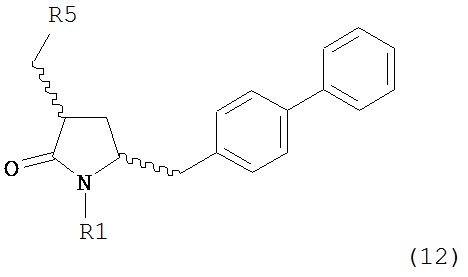
или его соль, где R1 представляет собой водород или защитную группу для азота, и R5 представляет собой уходящую группу; и
б) реакцию соединения формулы (12) или его соли с восстанавливающим агентом с получением соединения формулы (3).
Вариант осуществления 35:
Способ получения соединение формулы (3):
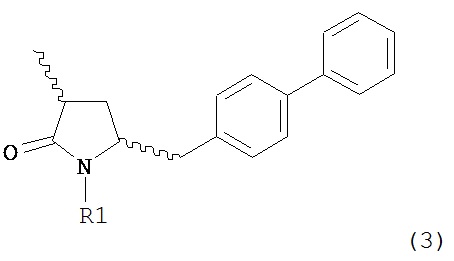
или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (7):

или его соли, где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце,
восстанавливающим агентом с получением соединения формулы (3) или его соли, где R1 представляет собой водород или защитную группу для азота.
Вариант осуществления 36:
Способ получения соединения формулы (3):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий обработку соединения формулы (6):

или его соли, где R1 представляет собой водород или защитную группу для азота,
восстанавливающим агентом с получением соединения формулы (3) или его соли, где R1 представляет собой водород или защитную группу для азота.
Вариант осуществления 37:
Способ получения соединения формулы (3):

или его соли,
где R1 представляет собой водород или защитную группу для азота, включающий восстановление соединения формулы (4):

или его соли,
где R1 представляет собой водород или защитную группу для азота, с получением соединения формулы (3).
Вариант осуществления 38:
Способ превращения соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющего конфигурацию формулы (7-a):
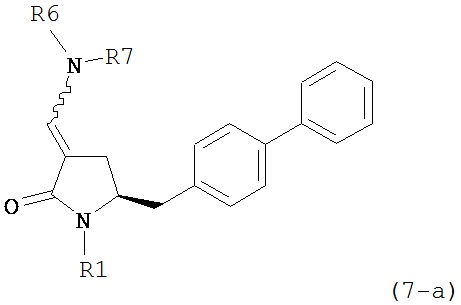 ,
,
в соединение формулы (4) или его соль:

где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (4-a):
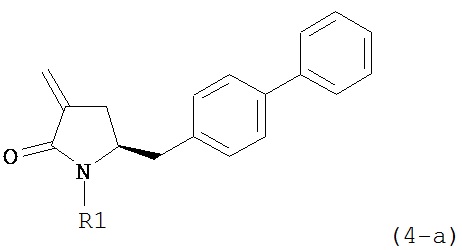 ,
,
любым одним из способов 1-9:
где
способ 1 включает:
a) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 2, и
б) превращение соединения формулы (6) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 3; способ 2 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 2,
б) превращение соединения формулы (6) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 4, и
в) превращение соединения формулы (5) в соединение формулы (4) в соответствии со способами, определенными в вариантах осуществления 5 или 6;
способ 3 включает превращение соединения формулы (7) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 7;
способ 4 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 8, и
б) превращение соединения формулы (6) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 3;
способ 5 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 8,
б) превращение соединения формулы (6) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 4, и
в) превращение соединения формулы (5) в соединение формулы (4) в соответствии со способами, определенными в вариантах осуществления 5 или 6;
способ 6 включает:
а) превращение соединения формулы (7) в соединение формулы (9) в соответствии со способом, определенным в варианте осуществления 9, и
б) превращение соединения формулы (9) в соединение формулы (4) в соответствии со способами, определенными в вариантах осуществления 13 или 14;
способ 7 включает:
а) превращение соединения формулы (7) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 12, и
б) превращение соединения формулы (5) в соединение формулы (4) в соответствии со способами, определенными в вариантах осуществления 5 или 6;
способ 8 включает:
а) превращение соединения формулы (7) в соединение формулы (16) в соответствии со способом, определенным в варианте осуществления 15,
б) превращение соединения формулы (16) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 17,
в) превращение соединения формулы (6) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 4, и
г) превращение соединения формулы (5) в соединение формулы (4) в соответствии со способами, определенными в вариантах осуществления 5 или б;
способ 9 включает:
а) превращение соединения формулы (7) в соединение формулы (16) в соответствии со способами, определенными в вариантах осуществления 15 или 16,
б) превращение соединения формулы (16) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 17, и
в) превращение соединения формулы (6) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 3;
предпочтительно в соответствии со способами 1, 4 или 6; в частности способом 1 или 4.
Вариант осуществления 39:
Способ превращения соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющего конфигурацию формулы (7-a):
 ,
,
в соединение формулы (2) или его соль:
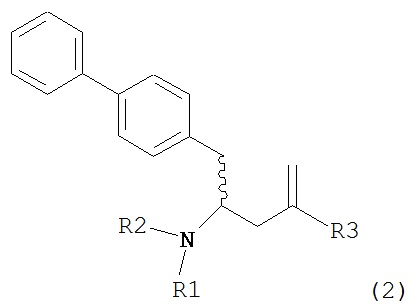
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно имеющее конфигурацию формулы (2-a):
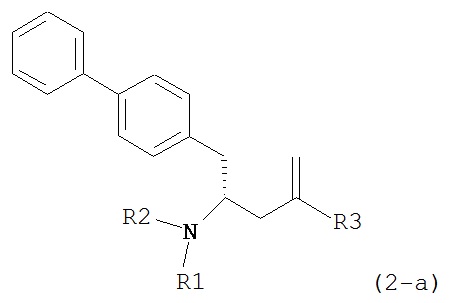 ,
,
включающий стадии:
а) превращение соединения формулы (7) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 38, и
б) превращение соединения формулы (4) в соединение формулы (2) в соответствии со способом, определенным в варианте осуществления 19.
Вариант осуществления 40:
Способ в соответствии с вариантом осуществления 39, в котором соединение формулы (7) получено в соответствии с вариантом осуществления 1.
Вариант осуществления 41:
Способ превращения соединения формулы (4) или его соли:

где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющего конфигурацию формулы (4-a):
 ,
,
в соединение формулы (1) или его соль:

где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно карбоксильную группу или алкиловый эфир, предпочтительно имеющее конфигурацию формулы (1-a):
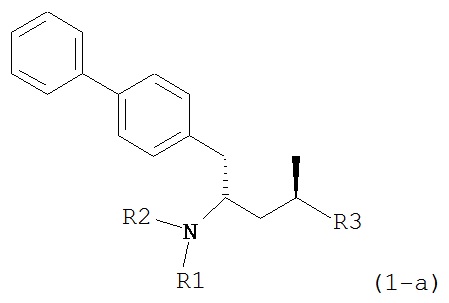 ,
,
включающий стадии:
а) превращение соединения формулы (4) в соединение формулы (2) в соответствии со способом, определенным в варианте осуществления 19, и
б) превращение соединения формулы (2) в соединение формулы (1) в соответствии со способом, определенным в варианте осуществления 20.
Вариант осуществления 42:
Способ в соответствии с вариантом осуществления 24, в котором соединение формулы (4) получено в соответствии со способом, определенным в варианте осуществления 38.
Вариант осуществления 43:
Способ превращения соединения формулы (8) или его соли:

где R1 представляет собой водород или защитную группу для азота, в соединение формулы (1) или его соль:

где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно карбоксильную группу или алкиловый эфир, предпочтительно имеющее конфигурацию формулы (1-a):
 ,
,
включающий стадии:
а) превращение соединения формулы (8) в соединение формулы (7) в соответствии со способом, определенным в варианте осуществления 1,
б) превращение соединения формулы (7) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 38, и
в) превращение соединения формулы (4) в соединение формулы (1) в соответствии со способом, определенным в варианте осуществления 41.
Вариант осуществления 44:
Способ превращения соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющего конфигурацию формулы (7-a):
 ,
,
в соединение формулы (6) или его соль:

где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (6-a):
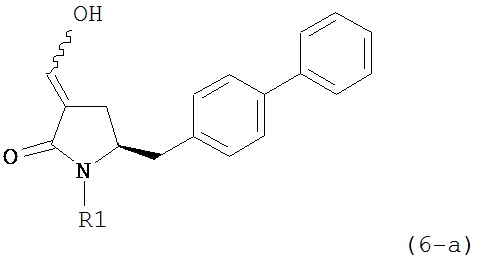
в соответствии со способами 1 или 2:
способ 1 включает превращение соединения формулы (7) в соединение формулы (6) в соответствии со способами, определенными в вариантах осуществления 2 или 8;
способ 2 включает:
а) превращение соединения формулы (7) в соединение формулы (16) в соответствии со способами, определенными в вариантах осуществления 15 или 16, и
б) превращение соединения формулы (16) в соединение формулы (6) в соответствии со способами, определенными в вариантах осуществления 17 или 18;
в частности в соответствии со способом 1.
Вариант осуществления 45:
Способ превращения соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющего конфигурацию формулы (7-а):
 ,
,
в соединение формулы (5) или его соль:
 ,
,
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (5-b):
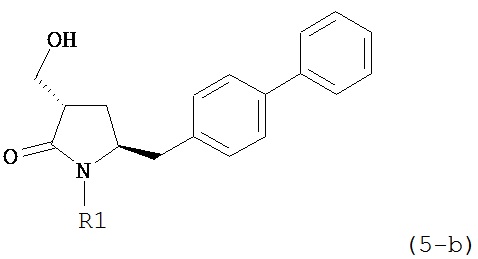 ,
,
любым одним из способоы 1 или 3:
способ 1 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способами, определенными в вариантах осуществления 2 или 8, и
б) превращение соединения формулы (6) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 4;
способ 2 включает превращение соединения формулы (7) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 12;
способ 3 включает:
а) превращение соединения формулы (7) в соединение формулы (16) в соответствии со способами, определенными в вариантах осуществления 15 или 16,
б) превращение соединения формулы (16) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 17, и
в) превращение соединения формулы (6) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 4.
Вариант осуществления 46:
Способ превращения соединения формулы (7) или его соли:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным, и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющего конфигурацию формулы (7-b):
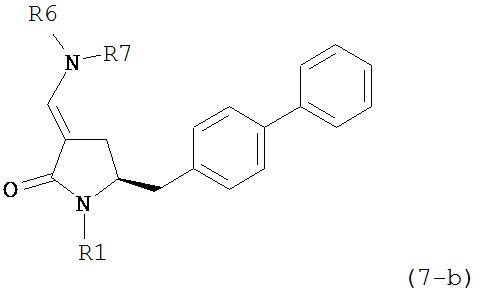 ,
,
в соединение формулы (3) или его соль:
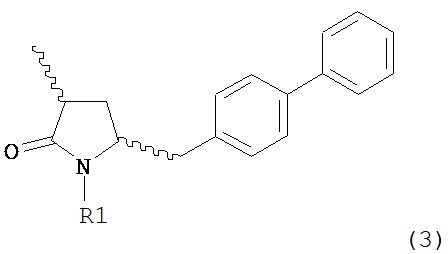
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (3-а):
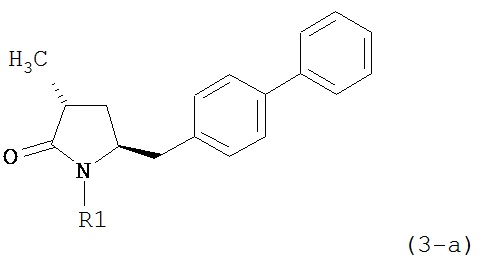
любым одним из способов 1-4:
способ 1 включает:
а) превращение соединения формулы (7) в соединение формулы (5) в соответствии со способом, определенным в варианте осуществления 45, и
б) превращение соединения формулы (5) в соединение формулы (3) в соответствии со способом, определенным в варианте осуществления 34;
способ 2 включает превращение соединения формулы (7) в соединение формулы (3) в соответствии со способом, определенным в варианте осуществления 35;
способ 3 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 44, и
б) превращение соединения формулы (6) в соединение формулы (3) в соответствии со способом, определенным в варианте осуществления 36;
способ 4 включает:
а) превращение соединения формулы (7) в соединение формулы (6) в соответствии со способом, определенным в варианте осуществления 44,
б) превращение соединения формулы (6) в соединение формулы (4) в соответствии со способом, определенным в варианте осуществления 3, и
в) превращение соединения формулы (4) в соединение формулы (3) в соответствии со способом, определенным в варианте осуществления 37;
в частности в соответствии со способом 2 или способом 4.
Вариант осуществления 47:
Способ в соответствии с вариантом осуществления 46, в котором соединение формулы (7) получено в соответствии со способом, определенным в варианте осуществления 1.
Вариант осуществления 48:
Соединение формулы (2):

или его соль,
где R1 и R2 независимо друг от друга представляют собой водород или защитную группу для азота, и R3 представляет собой карбоксильную группу или сложноэфирную группу, предпочтительно имеющее конфигурацию формулы (2-а):
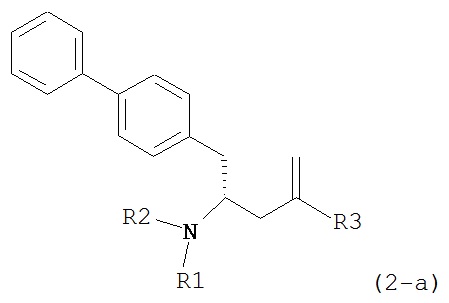 .
.
Вариант осуществления 49:
Соединение формулы (4):

или его соль,
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (4-а):
 .
.
Вариант осуществления 50:
Соединение формулы (5) или его соль:
 ,
,
где R1 представляет собой водород или защитную группу для азота, предпочтительно формул (5-а), (5-b) или (5-c), более предпочтительно формулы (5-b):
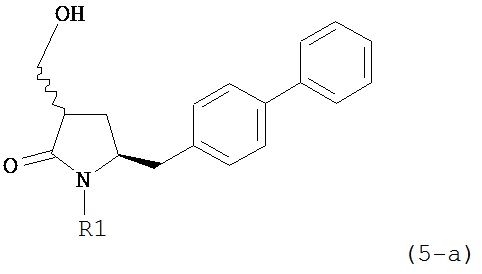 ,
,
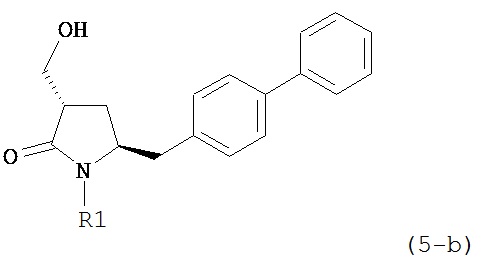 ,
,
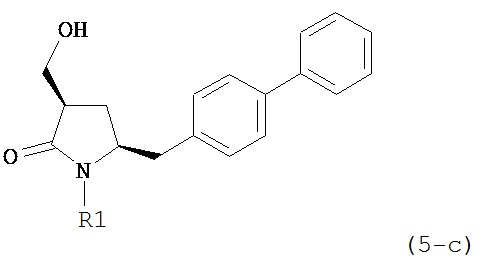 .
.
Вариант осуществления 51:
Соединение формулы (6) или его таутомер:

или его соль,
где R1 представляет собой водород или защитную группу для азота, предпочтительно имеющее конфигурацию формулы (6-a):
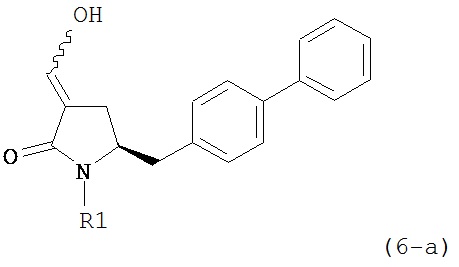 .
.
Вариант осуществления 52:
Соединение формулы (7) или его соль:

где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, предпочтительно имеющее конфигурацию формул (7-a), (7-b) или (7-c), более предпочтительно формулы (7-b):
 ,
,
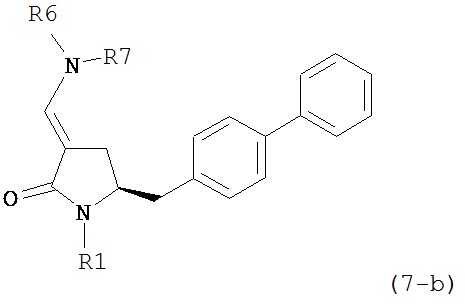 ,
,
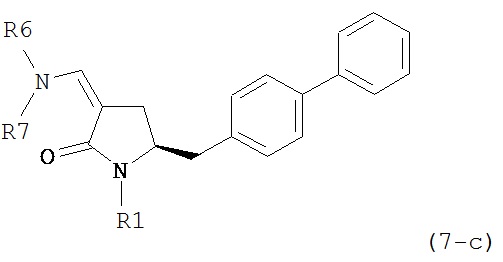 .
.
Вариант осуществления 53:
Соединение формулы (9-a) или его соль:
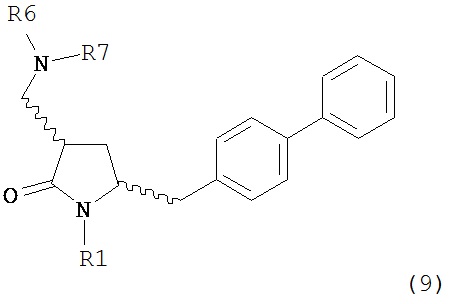
где R1 представляет собой водород или защитную группу для азота, и R6 и R7 независимо представляют собой алкильную группу, или вместе представляют собой алкиленовую группу, предпочтительно имеющее конфигурацию формул (9-a), (9-b) или (9-c), более предпочтительно формулы (9-b):
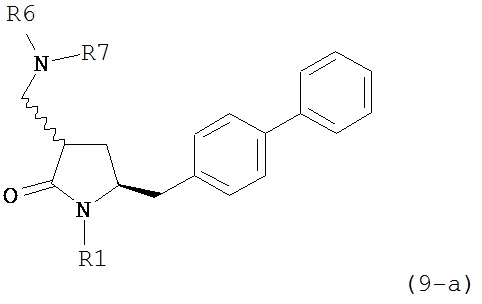
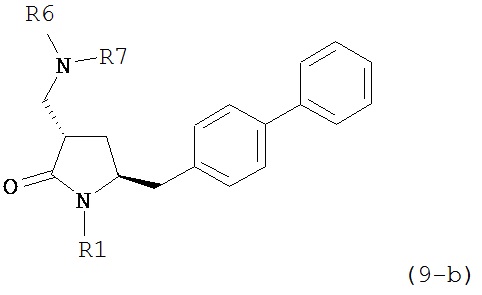 ,
,
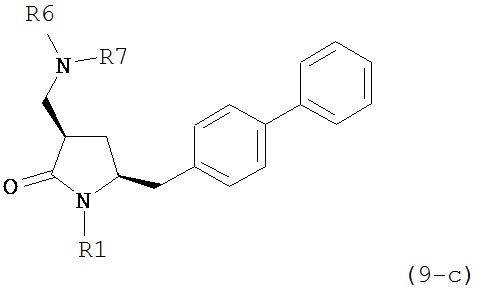 .
.
Вариант осуществления 54:
Соединение формулы (10) или его соль:
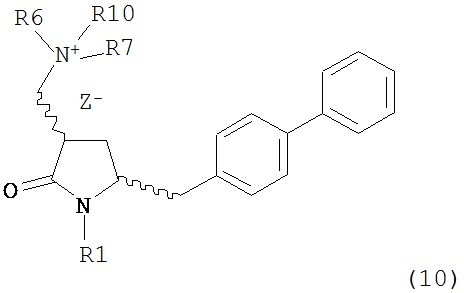
где R1 представляет собой водород или защитную группу для азота, R6 и R7 независимо представляют собой алкильную группу, арильную группу, арилалкильную группу, циклоалкильную группу, или R6 и R7 образуют цикл вместе с атомом азота, к которому они присоединены, где цикл может быть насыщенным или ненасыщенным и необязательно может содержать один или несколько гетероатомов, таких как азот, кислород или сера, где цикл содержит от 3 до 8, например, от 4 до 7 атомов в кольце, Z' представляет собой галогенид (например, йодид, бромид, хлорид), алкилсульфат (например, метилсульфат) или сульфониловый эфир (например, трифлат), и R10 представляет собой водород, алкил или арил; предпочтительно имеющее конфигурацию формул (10-a), (10-b) или (10-c), более предпочтительно формулы (10-b):
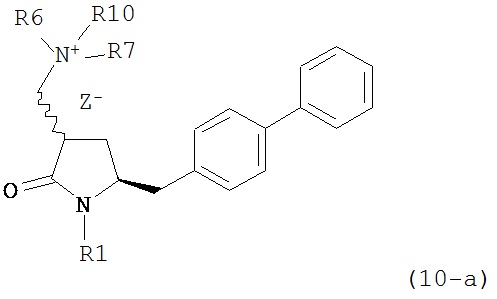
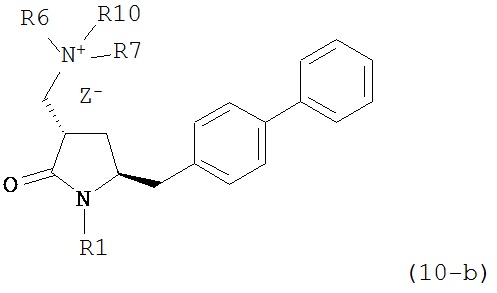 ,
,
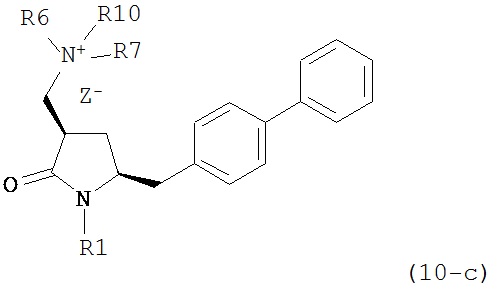 .
.
Вариант осуществления 55:
Соединение формулы (11):
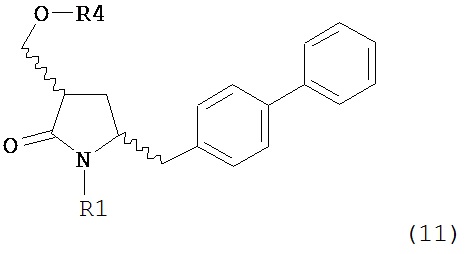
или его соль, где R1 представляет собой водород или защитную группу для азота, и R4 представляет собой ОН-активирующую группу, предпочтительно имеющее конфигурацию формул (11-a), (11-b) или (11-c), более предпочтительно формулы (11-b):
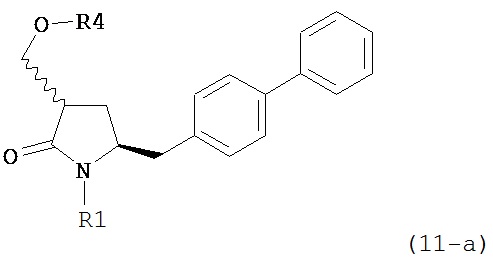
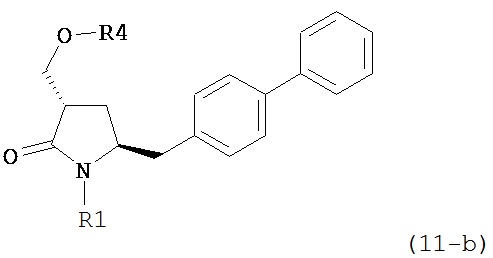
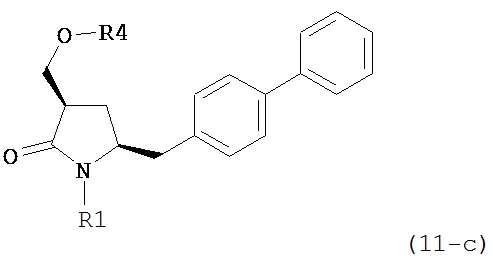 .
.
Вариант осуществления 56:
Соединение формулы (12):
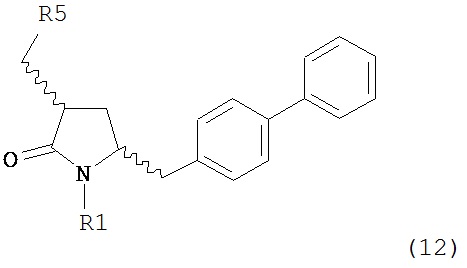
или его соль, где R1 представляет собой водород или защитную группу для азота, и R5 представляет собой уходящую группу; предпочтительно формул (12-a), (12-b) или (12-c), более предпочтительно формулы (12-b):
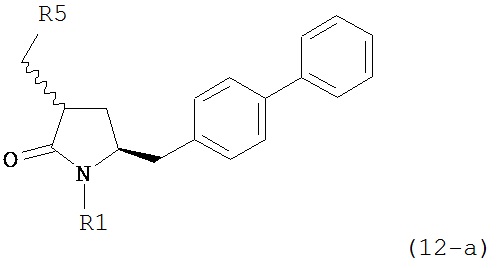 ,
,
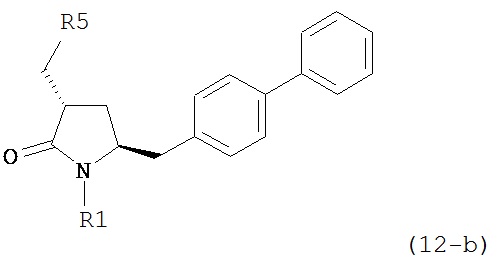 ,
,
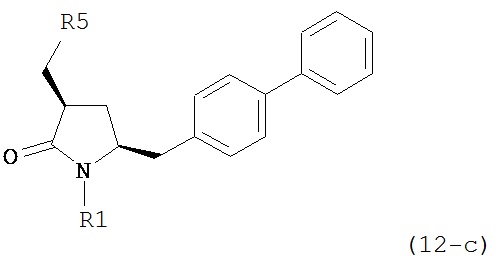 .
.
Вариант осуществления 57:
Соединение формулы (16):

или его соль,
где R1 представляет собой водород или защитную группу для азота, Y представляет собой O или S, и каждый R9 независимо представляет собой алкил, арил, арилалкил или ацетил,
предпочтительно имеющее конфигурацию формулы (16-a):
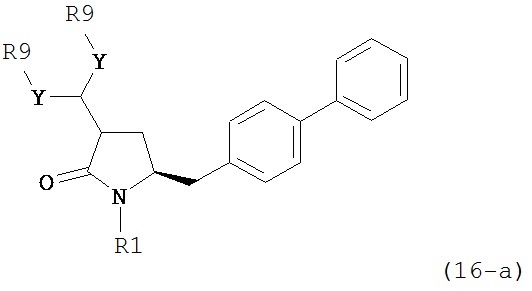 .
.
Вариант осуществления 58:
Применение соединения по любому из вариантов осуществления 48-57 для получения NEP-ингибитора или его пролекарства, такого как ингибитор NEP или его пролекарство, включающий в качестве каркаса γ-амино-δ-бифенил-α-метилалкановую кислоту или сложный эфир кислоты.
Вариант осуществления 59:
Применение в соответствии с вариантом осуществления 58, в котором NEP-ингибитор представляет собой N-(3-карбокси-1-оксопропил)-(4S)-п-фенилфенилметил)-4-амино-(2R)-метилбутановую кислоту или ее соль или пролекарство.
Вариант осуществления 60:
Применение в соответствии с вариантом осуществления 58, в котором пролекарство NEP-ингибитора представляет собой этиловый эфир N-(3-карбоксил-1-оксопропил)-(4S)-(п-фенилфенилметил)-4-амино-(2R)-метилбутановой кислоты или его соль.