Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ИНГИБИТОРА АРОМАТАЗЫ ДЛЯ ЛЕЧЕНИЯ ГИПОГОНАДИЗМА И РОДСТВЕННЫХ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Это изобретение относится к способу повышения уровней тестостерона и лечению гипогонадизма и родственных заболеваний с помощью ингибитора ароматазы 4,4’-[фтор-(1Н-1,2,4-триазол-1- ил)метилен]бисбензонитрила. Кроме того, настоящее изобретение относится к способу повышения уровней тестостерона и лечения гипогонадизма и родственных заболеваний с помощью ингибитора ароматазы 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при конкретном режиме дозирования. Изобретение также относится к фармацевтическим композициям, включающим указанный ингибитор ароматазы 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил, необязательно, в комбинации с другими активными ингредиентами. Кроме того, настоящее изобретение относится к фармацевтическим наборам, включающим указанные фармацевтические композиции вместе с инструкциями по их применению.
УРОВЕНЬ ТЕХНИКИ
Фермент ароматаза (CYP 19) в высокой степени экспрессирует в жировой ткани, где этот фермент превращает тестостерон в эстрадиол. У страдающего полнотой или ожирением человека избыток жировой ткани объясняют избыточной активностью ароматазы, которая, в свою очередь, приводит к более высоким уровням эстрадиола, как у мужчин, так и у женщин. У страдающих полнотой или ожирением мужчин относительный избыток эстрадиола может возвращаться в гипоталамо-гипофизарную систему, подавляя секрецию гонадотропина и, в силу этого, подавляя продукцию тестикулярного тестостерона, а также сперматогенез. Таким образом, тяжелая степень ожирения связана с относительным дефицитом андрогена у мужчин. Это состояние могут называть ОНН, или гипогонадотропным гипогонадизмом при ожирении, или гипогонадотропным гипогонадизмом у мужчин, страдающих ожирением.
Согласно данным Национального исследования здоровья населения и просвещения в области питания США, за период 1999-2002 годы 27,5% мужчин старше 20 лет в США имели индекс массы тела (BMI) выше 30 кг/м2. Ожидается, что частота случаев ожирения будет продолжать увеличиваться и в США, и в развитых и развивающихся странах по всему миру. При одном исследовании 160 мужчин, которым было рекомендовано терапевтическое или хирургическое лечение ожирения, гипогонадотропный гипогонадизм присутствовал суммарно у 36% пациентов. В этом исследовании, частота случаев гипогонадотропного гипогонадизма возрастала линейно с 7,4% для пациентов с величиной BMI 30-35 кг/м2 до 59,2% для пациентов с величиной BMI выше 50 кг/м2 [Hofstra, et al., 2008]. Исходя из частоты случаев ожирения можно приблизительно оценить, что вследствие гипогонадотропного гипогонадизма могут иметь андрогенный дефицит до 1,5 миллиона мужчин в США и 1 миллион мужчин в Европе.
Многочисленные последствия дефицита тестостерона включают симптомы пониженного либидо, уменьшения спонтанных эрекций, пониженной фертильности, потери волосяного покрова и снижения потребности в бритье, низкой минеральной плотности костной ткани, повышенного риска переломов, уменьшения мышечной массы и мышечной силы и повышения утомляемости мышц [Bhasin, et al., 2006]. Кроме того, более поздние исследования показали, что дефицит тестостерона у пожилых мужчин и мужчин, страдающих ожирением, связан также с метаболическими нарушениями, включающими резистентность к инсулину, непереносимость глюкозы и липидные нарушения, что способствует повышенной частоте возникновения метаболического синдрома и, вероятно, повышает риск возникновения сердечно-сосудистого заболевания. В одном исследовании, до 15% мужчин, страдающих диабетом, имели очевидный гипогонадизм (тестостерон <300 нг/дл или <8 нмоль/л) и до 50% имели уровень тестостерона в нижнем диапазоне нормальных значений (<12 нмоль/л или <450 нг/дл) [Kapoor, et al., 2006 and 2007]. Была установлена взаимосвязь между низкими уровнями тестостерона и факторами риска возникновения различных сердечно-сосудистых заболеваний. Недавние эпидемиологические исследования также обнаружили зависимость между смертностью от сердечно-сосудистых заболеваний и низким уровнем тестостерона [Maggio et al., 2009].
Рекомендации по лечению гипогонадизма у мужчин разработаны несколькими организациями, включающими Общество эндокринологов США, которое заявляет, что "для мужчин с симптоматикой андрогенного дефицита, которые имеют низкие уровни тестостерона, рекомендуется терапия тестостероном, для того чтобы вызвать и поддерживать у пациентов вторичные половые признаки и улучшить их половую функцию, хорошее самочувствие, увеличить мышечную массу и мышечную силу и минеральную плотность костной ткани" [Bhasin, et al., 2006]. Заместительная терапия тестостероном обычно рекомендуется в форме внутримышечного или трансдермального введения в качестве стандартного лечения мужчин с документально подтвержденным гипогонадизмом (тестостерон <300 нг/дл, сопровождаемый симптомами низкого уровня тестостерона), и эта терапия может нормализовать либидо, мышечную массу и мышечную силу [Bhasin, et al., 2006]. Кроме того, заместительная терапия тестостероном улучшает состояние резистентности к инсулину у мужчин с гипогонадизмом [Naharci, et al.,. 2007].
Помимо полноты и ожирения и связанной с ними избыточной активностью ароматазы, другие причины гипогонадизма у мужчин включают первичную тестикулярную недостаточность, которая может быть обусловлена внутренними нарушениями в организме или может быть приобретенной в результате травмы, инфекции и химиотерапии или лучевой терапии, и вторичную недостаточность с угнетением гонадотропинов, которая может быть следствием стресса, сопутствующих заболеваний или гипоталамо-гипофизарных расстройств.
Применяемые в настоящее время при дефиците тестостерона терапии представляют собой ограниченный выбор. Большинство гипогонадных мужчин подвергают лечению путем внутримышечных инъекций тестостерона каждые 2-4 недели, что обычно требует визита в медицинское учреждение к лечащему врачу. Некоторые мужчины выбирают тестостероновые гели или пластыри, которые обычно применяют ежедневно. Мужчины с гипогонадотропным гипогонадизмом, желающие восстановить фертильность, могут быть подвергнуты лечению путем внутримышечных или подкожных инъекций хорионического гонадотропного гормона (HCG) или гонадотропинов. При заместительной терапии тестостероном возникает ряд осложнений, которые могут включать гинекомастию в результате избыточного превращения экзогенного тестостерона в эстрадиол, инфертильность в результате подавления гонадотропинов, перемены настроения вследствие подъема и падения уровня тестостерона после внутримышечных инъекций, и раздражение в месте инъекции или месте применения лекарственной формы. Избыток тестостерона может приводить к полицитемии (эритроцитозу), гипертрофии предстательной железы, приступам апноэ во сне и ухудшению состояния при сердечной недостаточности, а также к агрессивности. Общество эндокринологов США рекомендует "воздерживаться от проведения терапии тестостероном в случае пациентов с раком грудной железы или раком предстательной железы, с пальпируемым узлом в предстательной железе или ее уплотнением или с уровнем простатического специфического антигена большим чем 3 нг/мл, без дополнительного урологического обследования, с эритроцитозом (гематокрит >50%), с повышенной вязкостью крови, с нелечеными приступами обструктивного апноэ во время сна, с тяжелыми симптомами со стороны нижних мочевыводящих путей, с количеством баллов по Международной шкале симптомов нарушения простаты (IPSS) [Barry, et al., 1992] большим чем 19, или с сердечной недостаточностью III или IV степени", и обращает внимание на то, что "мужчины, получающие лечение тестостероном, должны подвергаться постоянному контролю на основе стандартизированного плана" [Bhasin, et al., 2006].
Пероральная андрогенная терапия обычно противопоказана в связи с пресистемными воздействиями на печень, которые значительно снижают липопротеин высокой плотности (HDL), повышают тромбообразующие факторы и часто вызывают нарушения функции печени. Эти воздействия андрогенов на печень также ограничивают в настоящее время клиническое применение селективных модуляторов андрогенового рецептора (SARM).
Некоторые имеющиеся в продаже ингибиторы ароматазы также были испытаны на эффективность при лечении гипогонадных мужчин в ряде небольших исследований с целью подтверждения правильности такого подхода. Летрозол, вводимый в дозах 2,5 мг еженедельно, повышал общее содержание тестостерона до области нормальных значений, подавлял общий эстрадиол и повышал содержание лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH) у 12 мужчин, страдающих гипогонадотропным гипогонадизмом [de Boer, et al., 2005, Loves, et al., 2008]. При этом фиксированном интервале дозирования, уровень свободного тестостерона возрастал выше области нормальных значений у приблизительно половины пациентов. Другие исследователи оценили воздействия ингибиторов ароматазы (летрозола [de Boer, et al., 2005, Lapauw, et al., 2009, Loves, et al., 2008], CGS 20267 [Trunet, et al., 1993] и анастрозола [Medras, et al., 2007]) при исследованиях в отсутствие контрольных групп.
Одним существенным недостатком всех проводимых до настоящего времени клинических исследований является то, что используемые в исследованиях ингибиторы ароматазы анастрозол и летрозол создавались для лечения гормонально зависимых типов рака, таких как рак молочной железы у женщин в постклимактерическом периоде, и, вероятно, поэтому они не являются оптимальными для лечения гипогонадизма у пациентов мужского пола, в частности, с точки зрения оптимальных доз и режима дозирования и возможных побочных эффектов. В настоящее время, дозы и режимы дозирования, опробованные при клинических испытаниях, составляют 2,5 мг или 1 мг соответствующего ингибитора ароматазы еженедельно при лечении гипогонадизма, что соответствует дозам, применяемым при адъювантном лечении женщин в постклимактерическом периоде на ранней стадии рака молочной железы с положительной реакцией на рецептор гормона, но не является схемой лечения, оптимизированной для гипогонадизма.
И, действительно, фармакокинетические и фармакодинамические исследования доступных ингибиторов ароматазы на мужчинах с гипогонадизмом показали, что, например, летрозол при еженедельной дозе 2,5 мг приводил в результате к избыточным уровням свободного тестостерона у приблизительно половины пациентов [Loves, et al., 2008]. К настоящему времени еще не проводились исследования с целью всесторонней оценки воздействия ингибиторов ароматазы на уровни тестостерона и способов реального достижения нормализации уровней тестостерона у мужчин с гипогонадизмом.
Таким образом, необходимы оптимизированные схемы лечения, обеспечивающие облегчение связанных с дефицитом тестостерона симптомов гипогонадизма с минимальными побочными эффектами. Создание ингибитора ароматазы, специально предназначенного для пациентов мужского пола с пониженными уровнями тестостерона, позволило бы использовать новый подход для недостаточно целенаправленного в настоящее время лечения этого заболевания.
Помимо клинически опробованных нестероидных ингибиторов ароматазы анастрозола, летрозола и фадрозола, которые рекомендованы для лечения гормонально зависимого рака молочной железы путем ежедневного введения доз в миллиграммовом диапазоне, в патентах и в научной литературе описаны некоторые другие ингибиторы ароматазы. Одним из этих соединений является ингибитор ароматазы 4,4'-[фтор-(1Н-1,2,4-триазол-1- ил)метилен]бисбензонитрил, также известный как 4-[а-4-цианофенил)-а-фтор-1-(1,2,4-триазолил)метил]бензонитрил или CGP47645, впервые описанный в 1992 году [патентные документы ЕР 490 816 и US 5637605], имеющий следующую структурную формулу
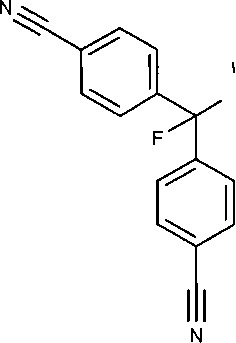
Ингибитор CGP47645 представляет собой фторпроизводное летрозола с пролонгированным периодом действия. Предварительные in-vitro и in-vivo эксперименты с этим соединением на крысах и обезьянах показали одинаковую в 10 раз более высокую активность ингибирования ароматазы по сравнению с летрозолом, и продемонстрировали возможность применения схемы лечения с некаждодневным дозированием. Введение раз в неделю 3 мг/кг CGP47645 рассматривали как эффективную дозу, позволяющую достигать медикаментозной стерилизации взрослых самцов крыс [Batzl-Hartraann et al., 1994]. Был сделан вывод, что период полувыведения CGP47645 является достаточно длительным для поддержания эффективности эндокринного действия, подобного эффекту овариэктомии, при схеме дозирования один раз в неделю [Bhatnagar et al., 1996]. Однако дополнительные исследования этого лекарственного соединения не проводились, а потенциальная возможность его применения для лечения гормонально-зависимых типов рака или других заболеваний, таких как эндометриоз, никогда не исследовалась.
В настоящее время, в США и большинстве других стран не существует схем перорального фармакологического лечения, опробованных для лечения гипогонадизма и/или дефицита тестостерона у страдающих ожирением пациентов мужского пола. Как изложено выше, на данный момент, инъекции тестостерона, хорионического гонадотропного гормона (HCG) или гонадотропина являются единственным вариантом выбора для этих пациентов. Поэтому, для этой группы людей в медицине существует важная неудовлетворенная на данный момент потребность в разработке фармакологического лечения, которое облегчало бы связанные с дефицитом тестостерона расстройства и симптомы.
В частности, была бы чрезвычайно востребована пероральная терапия, которая нормализует общий тестостерон, но значительно не увеличивает местное воздействие андрогенов на печень. Кроме того, было бы желательно иметь в наличии схему лечения, которая позволяет достигать более физиологического замещения тестостерона.
В результате обсуждения всех проблем и неблагоприятных факторов, связанных с известными на настоящий момент вариантами лечения гипогонадизма и дефицита тестостерона у пациентов мужского пола, в частности, гипогонадотропного гипогонадизма у страдающих ожирением или полнотой мужчин, было бы весьма полезно создать новый вариант лечения, у которого отсутствуют упомянутые выше недостатки и который реально приводит к облегчению или, по меньшей мере, улучшению состояния этих пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, в первом аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона.
В одном варианте осуществления, указанный пациент мужского пола страдает полнотой или ожирением.
Во втором аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения гипогонадизма у пациента мужского пола.
В третьем аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения гипогонадизма у страдающего полнотой или ожирением пациента мужского пола.
В четвертом аспекте, настоящее изобретение относится к соединению 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения гипогонадотропного гипогонадизма у пациента мужского пола.
В дополнительном аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения гипогонадотропного гипогонадизма у страдающего полнотой или ожирением пациента мужского пола.
В дополнительном аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для повышения, предпочтительно для нормализации уровней тестостерона у пациента мужского пола с гипогонадизмом или гипогонадотропным гипогонадизмом, предпочтительно у страдающего полнотой или ожирением пациента мужского пола с гипогонадизмом или гипогонадотропным гипогонадизмом.
В дополнительном аспекте, настоящее изобретение относится к соединению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, которое применяют для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, где соединение приготавливают в форме, включающей от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, и соединение вводят в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней.
В дополнительном аспекте, настоящее изобретение относится к применению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для приготовления лекарственного средства для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона.
В дополнительном аспекте, настоящее изобретение относится к применению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для приготовления лекарственного средства для повышения предпочтительно нормализации уровней тестостерона у страдающего полнотой или ожирением пациента мужского пола с гипогонадотропным гипогонадизмом.
Дополнительный аспект настоящего изобретения относится к применению 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для приготовления лекарственного средства для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, где соединение приготавливают в форме, включающей от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, и соединение вводят в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней.
В дополнительном аспекте, настоящее изобретение относится к пероральной фармацевтической композиции, включающей от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, необязательно, в комбинации с одним или более фармацевтически приемлемыми вспомогательными веществами.
Согласно дополнительному аспекту изобретения, предлагается фармацевтический набор, включающий (i) такую фармацевтическую композицию, включающую 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил, необязательно, в комбинации с одним или более фармацевтически приемлемыми вспомогательными веществами; вместе с (ii) инструкциями по применению указанной фармацевтической композиции для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, в частности, для лечения гипогонадизма у пациента мужского пола, предпочтительно страдающего полнотой или ожирением пациента мужского пола.
В дополнительном аспекте, настоящее изобретение относится к способу лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, включающему введение указанному пациенту эффективного количества 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)-метилен]бисбензонитрила.
Согласно дополнительному аспекту изобретения, предлагается способ лечения гипогонадизма, включающий введение пациенту мужского пола, если он в этом нуждается, эффективного количества 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила.
Доза может составлять от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг, и может вводиться при режиме дозирования, характеризующемся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней.
УСЛОВНЫЕ СОКРАЩЕНИЯ
В тексте заявки на изобретение далее будут использоваться следующие условные сокращения :
|
|
PD фармакодинамика
|
РК фармакокинетика
|
ОПРЕДЕЛЕНИЯ
В тесте этого описания и пунктах формулы изобретения, которые следуют далее, следующие термины имеют следующие значения, если явным образом не указано иначе.
Используемые в изобретении термины "включающий" и "содержащий" имеют открытое неограничивающее значение.
Когда для соединений, солей и других подобных веществ применяют форму множественного числа, то в этом случае она также включает в себя соединение, соль или другое подобное вещество в единственном числе.
Используемые в изобретении формы слов в единственном числе и такие выражения, как "по меньшей мере, один" и "один или более", являются взаимозаменяемыми.
Используемый в изобретении термин "или" обычно включает в себя "и/или", если из контекста однозначно не явствует иное.
Кроме того, перечисление в тексте изобретения области числовых значений путем указания конечных значений для этой области включает все числа, находящиеся внутри этой области (например, область числовых значений 1-5 включает 1, 1,5, 2, 2,75, 3, 3,80, 4, 5, и так далее).
Термин "ингибитор ароматазы" обозначает соединение, которое предотвращает образование эстрогенов из их метаболических предшественников путем ингибирования фермента ароматазы.
Используемый в изобретении термин "соединение" относится к 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрилу, также известному, как 4-[α-4-цианофенил)-α-фтор-1-(1,2,4-триазолил)метил]бензонитрил или CGP47645, впервые описанному в 1992 году в патентных документах ЕР 490 816 и US 5637605, содержание которых приводится в описании этого изобретения путем ссылки на них.
Соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил представляет собой кристаллическое соединение с четкой эндотермой плавления при 169,5°С. Кристаллический порошок негигроскопичен и плохо растворим в воде.
4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил (CGP47645) является высоко специфичным и эффективным ингибитором ароматазы, который, как было упомянуто выше, характеризуется более продолжительным периодом полувыведения у людей, чем периодом полураспада летрозола (Femara®), выпускаемого промышленностью ингибитора ароматазы, по отношению к которому ингибитор CGP47645 является структурно родственным. In vitro эксперименты с человеческой плацентарной микросомальной ароматазой продемонстрировали величину IС50=6 нМ. Пероральное введение CGP47645 крысам давало величину периода полувыведения ТЧ 75 часов. Воздействие, выражаемое как AUC, было пропорцианальным величине вводимой дозы. В двух различных ароматаза-зависимых экспериментальных моделях ингибирования вызванной андростендионом гипертрофии шейки матки у крыс и ингибирования вызванного с помощью DMBA роста опухоли молочной железы у крыс, величина ED50 составляла 0,003 мг/кг и 0,01 мг/кг соответственно. Эти результаты позволили сделать вывод о том, что активность CGP47645 в качестве ингибитора ароматазы приблизительно в 10 раз выше активности летрозола.
Следует иметь в виду, что используемый в изобретении термин "соединение" охватывает все без исключения изомеры (например, энантиомеры, стереоизомеры, диастереомеры, ротомеры, таутомеры) или любую смесь изомеров, пролекарства и любые фармацевтически приемлемые соли присоединения указанного соединения, если не заявлено иное.
Термин "уровень тестостерона" в контексте настоящего изобретения относится либо к уровню общего тестостерона, либо к уровню свободного тестостерона, измеренных в сыворотке крови. В одном варианте осуществления, термин "уровень тестостерона" относится к уровню общего тестостерона в сыворотке крови. "Общий тестостерон" включает тестостерон, который связан с глобулином, связывающим половые гормоны (SHBG), и, в силу этого, он не является биодоступным, и тестостерон, который либо является свободным, либо слабосвязанным с другими белками (не-SHBG-связанный). Уровни свободного или биодоступного тестостерона могут быть вычислены из уровней общего тестостерона и SHBG. Предпочтительно уровни тестостерона определять утром, между 6 и 12 часами, в качестве "утренних уровней тестостерона". Уровни тестостерона и SHBG могут быть определены с помощью простых анализов крови, проводимых в лаборатории.
Термин "пациент мужского пола, нуждающийся в повышении уровней тестостерона" обозначает особь мужского пола, имеющую уровни общего тестостерона в сыворотке ниже 450 нг/дл или ниже 12 нмоль/л. В одном варианте осуществления, термин "пациент мужского пола, нуждающийся в повышении уровней тестостерона" обозначает особь мужского пола, имеющую уровни общего тестостерона в сыворотке ниже 400 нг/дл или ниже 350 нг/дл, или ниже 10 нмоль/л. В одном варианте осуществления, термин "пациент мужского пола, нуждающийся в повышении уровней тестостерона" обозначает особь мужского пола, имеющую уровни общего тестостерона в сыворотке ниже 300 нг/дл или ниже 8 нмоль/л.
В другом варианте осуществления, термин "пациент мужского пола, нуждающийся в повышении уровней тестостерона" обозначает особь мужского пола, имеющую, вне зависимости от уровней тестостерона, повышенные уровни общего эстрадиола в сыворотке (и/или повышенные уровни общего эстрона и/или сульфата эстрона и/или эстриола в сыворотке). Повышенные уровни эстрадиола в контексте настоящего изобретения означают уровни эстрадиола, которые выше верхней границы нормы (ULN) при соответствующем стандартизированном анализе.
Используемый в изобретении термин "страдающий полнотой пациент" относится к пациенту с индексом массы тела (BMI), равным или большим чем 25 кг/м2 и меньшим чем 30 кг/м2, рассчитанным из данных по массе тела и росту пациента.
Используемый в изобретении термин "страдающий ожирением пациент" относится к пациенту с индексом массы тела (BMI), равным или большим чем 30 кг/м2, рассчитанным из данных по массе тела и росту пациента.
Индекс массы тела (BMI), показатель, который сравнивает массу и рост, на основе которого людей относят к страдающим полнотой (предшествующей ожирению стадии), когда их BMI составляет от 25 кг/м2 до 30 кг/м2, и к страдающим ожирением, когда их BMI больше чем 30 кг/м2.
Используемый в изобретении термин "гипогонадизм" относится к субъектам, имеющим уровень общего тестостерона меньше чем 400 нг/дл, в конкретных вариантах осуществления, меньше чем 350 нг/дл, и в дополнительных вариантах осуществления, меньше чем 300 нг/дл. В качестве варианта, термин "гипогонадизм" относится к субъектам, имеющим уровень общего тестостерона меньше чем 12 нмоль/л, в конкретных вариантах осуществления, меньше чем 10 нмоль/л, и в дополнительных вариантах осуществления, меньше чем 8 нмоль/л. В одном варианте осуществления, термин "гипогонадизм" относится к особи мужского пола, имеющей утренние уровни общего тестостерона ниже 300 нг/дл или ниже 8 нмоль/л.
Термин "гипогонадотропный пациент" относится к пациенту с неприемлемо низкими уровнями гонадотропинов. В частности, пациент с "неприемлемо низкими уровнями гонадотропинов" определяется как пациент с (i) уровнями лютеинизирующего гормона (LH) ≤ ULN при соответствующем стандартизированном анализе, (ii) с уровнями фолликулстимулирующего гормона (FSH) ≤ ULN, и (iii) с уровнем эстрадиола внутри или выше области нормальных значений (определяемых как ≥ LLN при стандартизированном анализе).
В другом варианте осуществления, "гипогонадотропный пациент" может иметь определенные выше "неприемлемо низкие уровни гонадотропинов" и нормальную гипоталамическую/гипофизарную функцию, в том числе (i) уровни пролактина в области нормальных значений, (ii) уровни тиреостимулирующего гормона (TSH) в области нормальных значений и (iii) уровни ферритина в области нормальных значений.
Термин "гипогонадотропный гипогонадизм" или "пациент с гипогонадотропным гипогонадизмом" относится к субъекту мужского пола, страдающему от определенного в описании изобретения гипогонадизма и являющемуся гипогонадотропным, в соответствии с приведенным в описании изобретения определением.
Термин "ожирение при гипогонадотропном гипогонадизме" или "страдающий ожирением гипогонадотропный пациент мужского пола с гипогонадизмом" или "гипогонадотропный гипогонадизм у страдающих ожирением мужчин" относится к субъекту мужского пола, страдающему определенным в описании изобретения ожирением, страдающему определенным в описании изобретения гипогонадизмом и являющемуся гипогонадотропным в соответствии с приведенным в описании изобретения определением. В одном варианте осуществления, такой пациент определяется как субъект, удовлетворяющий следующим критериям: (а) имеющий индекс массы тела (BMI) ≥30 кг/м2, (b) имеющий утренний уровень общего тестостерона в сыворотке ниже 400 нг/дл, предпочтительно ниже 350 нг/дл и более предпочтительно ниже 300 нг/дл, и (с) имеющий неприемлемо низкий уровень гонадотропинов, определенный выше в описании изобретения, и (d) имеющий нормальную гипоталамическую/гипофизарную функцию, определенную выше в описании изобретения.
Термин "полнота при гипогонадотропном гипогонадизме" или "страдающий полнотой гипогонадотропный пациент мужского пола с гипогонадизмом" или "гипогонадотропный гипогонадизм у страдающих полнотой мужчин" относится к субъекту мужского пола, страдающему определенной в описании изобретения полнотой, страдающему определенным в описании изобретения гипогонадизмом и являющемуся гипогонадотропным в соответствии с приведенным в описании изобретения определением. В одном варианте осуществления, такой пациент определяется как субъект, удовлетворяющий следующим критериям: (а) имеющий индекс массы тела (BMI), равный или больший чем 25 кг/м2 и меньший чем 30 кг/м2, (b) имеющий утренний уровень общего тестостерона в сыворотке ниже 400 нг/дл, предпочтительно ниже 350 нг/дл и более предпочтительно ниже 300 нг/дл, и (с) имеющий неприемлемо низкий уровень гонадотропинов, определенный выше в описании изобретения, и (d) имеющий нормальную гипоталамическую/гипофизарную функцию, определенную выше в описании изобретения.
Используемый в изобретении термин "нормализация уровней тестостерона" означает повышение уровней общего тестостерона в сыворотке, предпочтительно уровней утреннего общего тестостерона в сыворотке, до более чем 300 нг/дл или более чем 8 нмоль/л. В одном варианте осуществления, термин означает повышение уровней общего тестостерона в сыворотке, предпочтительно уровней утреннего общего тестостерона в сыворотке, до более чем 400 нг/дл, до более чем 450 нг/дл или до более чем 8 нмоль/л.
Используемый в изобретении термин "повышение уровней тестостерона" означает повышение уровня утреннего общего тестостерона в сыворотке после введения соединения согласно изобретению по меньшей мере на 10% по сравнению с уровнем тестостерона до введения соединения. В конкретных вариантах осуществления, термин "повышение уровней тестостерона" означает повышение уровня утреннего общего тестостерона в сыворотке после введения терапевтически эффективного количества соединения пациенту мужского пола согласно изобретению по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70% или даже выше, по сравнению с уровнем тестостерона до введения соединения.
Термин "лечение гипогонадизма" относится к лечению заболевания гипогонадизмом, где заболевание определяется так, как в водной части описания изобретения. В одном аспекте, термин "лечение гипогонадизма" включает лечение пациентов с пониженными уровнями тестостерона в сыворотке.
Используемый в изобретении термин "режим дозирования, характеризующийся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней" относится к режиму дозирования, при котором активное соединение может вводиться один раз каждый 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 21, 26, 27, 28, 29, 30 .., 35, 42, 49, 56, 57, 58, 59, 60 дней. Этот термин включает, например, режимы дозирования, характеризующиеся (i) периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней, (ii) периодичностью дозирования от приблизительно одного раза каждые 2 дня до приблизительно одного раза каждые 40 дней или 6 недель, (iii) периодичностью дозирования от приблизительно одного раза каждые 5 дней до приблизительно одного раза в месяц или приблизительно одного раза каждые 4 недели или приблизительно одного раза каждые 30 дней, (iv) периодичностью дозирования от приблизительно одного раза в неделю или приблизительно одного раза каждые 7 дней до приблизительно одного раза каждые 3 недели или приблизительно одного раза каждые 20 дней, или (ν) периодичностью дозирования от приблизительно одного раза в неделю или приблизительно одного раза каждые 7 дней до приблизительно одного раза в две недели или одного раза каждые 10 дней.
В этом контексте, термин "приблизительно" может иметь значение от "плюс/минус 1 день" для режима дозирования один раз каждые 3 дня до "плюс/минус 10 дней" для режима дозирования один раз каждые 60 дней. Режим дозирования "приблизительно один раз каждые 3 дня" относится к режиму дозирования одной дозы, вводимой каждые 3 дня плюс/минус 1 день; режим дозирования "приблизительно один раз в неделю" относится к режиму дозирования одной дозы, вводимой каждые 7 дней плюс/минус 2 дня; режим дозирования "приблизительно один раз в две недели" относится к режиму дозирования одной дозы, вводимой каждые 14 дней плюс/минус 3 дня; режим дозирования "приблизительно один раз каждые 4 недели" относится к режиму дозирования одной дозы, вводимой каждые 28 дней плюс/минус 4 дня; режим дозирования "приблизительно один раз в месяц" относится к режиму дозирования одной дозы, вводимой каждые 30 дней плюс/минус 4 дня; режим дозирования "приблизительно один раз каждые 5 недель" относится к режиму дозирования одной дозы, вводимой каждые 35 дней плюс/минус 5 дней; и режим дозирования "приблизительно один раз каждые 6 недель" относится к режиму дозирования одной дозы, вводимой каждые 4 2 дня плюс/минус 6 дней.
Используемый в изобретении термин "приблизительно" в отношении конкретной дозы лекарственного средства может обозначать отклонение дозы лекарственного средства в пределах плюс/минус 10% по массе, предпочтительно плюс/минус 5% по массе или менее, от номинальной дозы лекарственного средства. Например, номинальная доза приблизительно в 0,01 мг активного ингредиента может содержать от 0,009 до 0,011 мг, предпочтительно от 0,0095 до 0,0105 активного ингредиента в одной дозе, в то время как номинальная доза приблизительно в 5,0 мг активного ингредиента может содержать от 4,5 до 5,5 мг, предпочтительно от 4,75 до 5,25 активного ингредиента в одной дозе.
Используемый в изобретении термин "период полувыведения" лекарственного средства относится к периоду времени, требующемуся для того, чтобы концентрация лекарственного средства в сыворотке или плазме снизилась на половину, in vivo, например, в результате разложения и/или клиренса или удаления под воздействием природных механизмов. Если экспериментально определяют концентрацию лекарственного средства в образцах плазмы, взятых в различные и следующие друг за другом моменты времени после введения лекарственного средства, то этот параметр называют "кажущимся периодом полувыведения" и обозначают как 14. Методы фармакокинетического исследования и определения периода полувыведения лекарственного средства хорошо известны специалистам в этой области. Фармакокинетические параметры, такие как "кажущийся период полувыведения" ТЧ и площадь под кинетической кривой (AUC), могут быть определены из кривой графической зависимости концентрации лекарственного средства в плазме или сыворотке от времени. В частности, могут применяться следующие фармакокинетические определения:
|
Значения клиренса из других жидкостей организма могут быть обозначены путем использования соответствующих нижних индексов, например, CLb относится к клиренсу из крови, a CLu обозначает клиренс несвязанного лекарственного средства из плазмы. Если клиренс относится к экстраваскулярной дозе и параметр биодоступности не известен, то тогда обозначение должно быть CL/F.
|
Период полувыведения, связанный с предельным наклоном (λζ) полулогарифмической кривой концентрация-время [время].
Концентрация лекарственного средства в образцах плазмы и/или сыворотки может быть определена рядом различных методов, например, методами высокоэффективной жидкостной хроматографии (ВЭЖХ) или жидкостной хроматографии/тандемной масс-спектрометрии (LC-MS/MS). В одном варианте осуществления, концентрацию 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в плазме определяют валидационным методом LC-MS/MS с нижним пределом количественных колебаний (LLOQ) при 0,1 нг/мл или лучшем. В другом варианте осуществления, концентрацию 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в плазме человека определяют валидационным методом LC-MS/MS с нижним пределом количественных колебаний (LLOQ) при 0,025 нг/мл.
Используемый в изобретении термин "приблизительно" в отношении конкретного значения кажущегося периода полувыведения может обозначать отклонение от конкретно указанной величины кажущегося периода полувыведения в диапазоне плюс/минус 20% по массе, предпочтительно плюс/минус 15% по массе или менее. В одном варианте осуществления, термин "приблизительно" в отношении конкретного значения кажущегося периода полувыведения может обозначать отклонение от "плюс/минус 2 дня" для кажущегося периода полувыведения приблизительно 14 дней до "плюс/минус 5 дней" для кажущегося периода полувыведения приблизительно 30 дней. Кажущийся период полувыведения приблизительно 20 дней может относиться к кажущемуся периоду полувыведения 20 дней "плюс/минус 3 дня", кажущийся период полувыведения приблизительно 25 дней может относиться к кажущемуся периоду полувыведения 25 дней "плюс/минус 4 дня", и кажущийся период полувыведения приблизительно 30 дней может относиться к кажущемуся периоду полувыведения 30 дней "плюс/минус 5 дней".
Используемый в изобретении термин "период лечения" относится к продолжительности периода времени, в течение которого соединение вводят пациенту. Фраза "период лечения по меньшей мере приблизительно два месяца" может означать, что соединение будут вводить непрерывно (в соответствии с режимом дозирования) в течение по меньшей мере 2 месяцев, но, также вероятно, в течение более длительного срока, например, непрерывно в течение по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11 и более месяцев. Обычно, период лечения может также превышать временной период в 12 месяцев, то есть соединение может быть предназначено для непрерывного длительного лечения. Однако, при ряде обстоятельств, может быть целесообразным использовать более короткие периоды лечения или лечение с периодическим прерыванием и возобновлением.
Используемый в изобретении термин "приблизительно" в отношении конкретной продолжительности периода лечения означает "плюс/минус 5 дней" для каждого месяца лечения, то есть период лечения "приблизительно два месяца" может относиться к периоду лечения два месяца плюс/минус 10 дней, период лечения "приблизительно три месяца" может относиться к периоду лечения два месяца плюс/минус 15 дней, и так далее.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящее время известно, что ингибитор ароматазы 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил позволяет реально оказывать лечебное воздействие на пациентов мужского пола, нуждающихся в повышении уровней тестостерона, в частности, пациентов мужского пола, страдающих полнотой или ожирением и/или страдающих гипогонадизмом, в частности, гипогонадотропным гипогонадизмом.
Фермент ароматаза катализирует превращение эндогенного тестостерона в эстрадиол и, кроме того, этот фермент, в частности, присутствует в избыточной жировой ткани. Повышенные уровни эстрадиола в сыворотке могут ингибировать секрецию гипофизарного лютеинизирующего гормона (LH) и, в силу этого, понижать уровень тестостерона в сыворотке. Введение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, высокоселективного ингибитора ароматазы, приводит к зависящему от дозы снижению превращения тестостерона в эстрон, сульфат эстрона и эстрадиол, и, в силу этого, к повышению уровней эндогенного тестостерона.
В то время как традиционные методы лечения гипогонадизма основываются на введении дополнительного тестостерона или введении хорионического гонадотропного гормона (HCG) или гонадотропинов, введение 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила ингибирует превращение тестостерона под воздействием ароматазы, в частности, превращение местного тестостерона под воздействием ароматазы в жировой ткани, в частности, целенаправленно у страдающих полнотой или ожирением пациентов. Так как дефицит тестостерона у мужчин, особенно, у страдающих полнотой или ожирением мужчин, часто ассоциируется с метаболическими нарушениями, включающими резистентность к инсулину, отсутствие толерантности к глюкозе, и липидными нарушениями, способствующими повышенной заболеваемости метаболическим синдромом, диабетом II типа и сердечно-сосудистыми заболеваниями, то считается, что введение 4,4'-[фтор-(1Н-1,2,4- триазол-1-ил)метилен]бисбензонитрила особенно благотворно воздействует на эту группу пациентов.
Соответственно, введение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила позволяет повысить эффективность лечения страдающих полнотой или ожирением пациентов мужского пола с подтвержденным гипогонадотропным гипогонадизмом в результате ингибирования превращения тестостерона в эстроген во всех местах организма, особенно, в жировой ткани. Считается, что введение оказывает особенно благотворное действие, если пациенты страдают от одного или более нарушений, выбранных из резистентности к инсулину, отсутствия толерантности к глюкозе и дислипидемии. Повышение уровней тестостерона путем введения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила считают особенно эффективным для повышения чувствительности к инсулину, усиления метаболизма глюкозы и/или улучшения липидного профиля у этой группы пациентов.
В частности, считается, что введение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила эффективно повышает чувствительность к инсулину у страдающего полнотой или ожирением пациента мужского пола с гипогонадотропным гипогонадизмом путем нормализации уровней тестостерона. Кроме того, полагают, что лечение согласно изобретению повышает чувствительность к инсулину с улучшенным контролем гликемии (определяемым более низкими уровнями глюкозы после приема пищи, более низким уровнем HbAl), что предотвращает развитие диабета из преддиабета, способствует снижению массы телесного жира и улучшает массу нежировых тканей.
Кроме того, считается, что введение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила предотвращает, улучшает или излечивает другие состояния, связанные с гипогонадизмом, включающие, но этим не ограничивая, пониженное либидо, уменьшения спонтанных эрекций, эректильную дисфункцию, сниженную фертильность, потерю волосяного покрова, снижение потребности в бритье, упадок сил, утомляемость, плохое самочувствие, депрессивное состояние, изменения настроения, низкую минеральную плотность костной ткани, повышенный риск переломов, пониженную мышечную массу, пониженную мышечную силу, повышенную массу жировых отложений в области живота, ограниченную работоспособность организма и риски сердечно-сосудистых заболеваний.
Введение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила согласно изобретению также' считается полезным, когда пациент мужского пола нуждается в увеличении мышечной массы и мышечной силы, когда пациент нуждается в нормализации состава тканей тела, когда пациент нуждается в снижении массы отлагаемого в области живота жира (оцениваемой по обхвату талии и/или по отношению обхвата талии к обхвату бедер), когда пациент нуждается в усилении половой функции и полового влечения, когда пациент нуждается в повышении фертильности, и/или когда пациент нуждается в увеличении минеральной плотности костной ткани.
4,4'-[Фтор-(1Н-1, 2,4-триазол-1-ил)метилен]бисбензонитрил является мощным и селективным ингибитором ароматазы. Были определены значения IС50 и Κi при ингибировании ароматазы в микросомальной фракции человеческой плаценты и было показано, что соединение представляет собой конкурентоспособный ингибитор с величиной IC50, составляющей приблизительно 6,2 нМ [Batzl-Hartmann et al., 1994].
Токсикологические исследования 4,4'-[фтор-(1H-I,2,4-триазол-1-ил)метилен]бисбензонитрила на самках и самцах собак показали, что не существует существенной разницы (AUC и Сmах) между воздействиями на самцов и воздействиями на самок собак. Значения Тmах изменялись в интервале от 1 часа до 24 часов после введения дозы. Обычно, вариабельность уровней Сmах для животных одного вида была небольшой. Обычно, после перорального дозирования раз в неделю 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в течение 4 или 22 недель, среднее значение продолжительности воздействия соединения на плазму было аналогично продолжительности воздействия, наблюдаемой после разовой дозы при всех исследуемых уровнях доз, что указывало на отсутствие явления аккумуляции лекарственного средства. Для самцов и самок собак увеличение продолжительности воздействия (AUC и Сmах) было обычно пропорционально увеличению дозы после разовой дозы и многократных доз 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при всех исследуемых уровнях доз. Кроме того, измерение уровней тестостерона в сыворотке самцов собак после 1, 4 и 12 недель дозирования показало резкое повышение уровней тестостерона при всех уровнях дозирования, демонстрируя тем самым перспективность 4, 41 -[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила.
На людях соединение сначала изучали, используя протокол увеличивающейся разовой дозы на женщинах-добровольцах, с целью оценки безопасности и переносимости (смотрите пример 3), а затем проводили исследование всасывания, распределения, метаболизма и выведения (ADME) 14С-4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (пример 4) с целью определения периода полувыведения лекарственного средства в тканях. Первое исследование показало, что медиана значений Ттах достигалась в течение 1 часа после приема внутрь, и что период полувыведения был чрезвычайно длительным, приблизительно 25 дней, при дозах выше 0,01 мг. При исследовании всасывания, распределения, метаболизма и выведения у женщин в постменопаузе, соединение аккумулировалось в жировой ткани со скоростью в 1-3 раза более высокой, чем при воздействии на плазму, при аналогичном клиренсе. В связи с тем, что избыточная активность ароматазы у страдающих полнотой или ожирением гипогонадотропных мужчин с гипогонадизмом возникает, в основном, в жировой ткани, считается, что 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил имеет идеальный фармакокинетический профиль распределения для оптимального подавления активности ароматазы. Предполагается, что подавление активности ароматазы в жировой ткани приводит к снижению уровня эстрадиола в сыворотке, повышению уровней лютеинизирующего гормона и фолликулостимулирующего гормона и повышению уровня тестостерона в сыворотке.
Проводимое исследование 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для лечения страдающих ожирением гипогонадотропных пациентов мужского пола с гипогонадизмом продемонстрировало эффективность этой новой схемы лечения конкретно для этой группы пациентов (пример 5).
Считается, что эффективное количество 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для лечения страдающих полнотой или ожирением гипоганадотропных пациентов мужского пола с гипогонадизмом составляет от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг, предпочтительно от приблизительно 0,001 мг до приблизительно 1,0 мг, более предпочтительно от приблизительно 0,005 мг до приблизительно 0,5 мг, наиболее предпочтительно от приблизительно 0,01 мг до приблизительно 0,1 мг, от приблизительно 0, 005 мг до менее чем 0,05 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила на одну дозу. В одном варианте осуществления, считается, что эффективная доза составляет больше чем 0,0005 мг, 0,001 мг, 0,005 мг или 0,01 мг, но меньше чем 2,0 мг, 1,0 мг, 0,5 мг, 0,1 мг или 0,05 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе. В альтернативном варианте осуществления, считается, что эффективная доза составляет от приблизительно 0,005 мг до менее чем 0,01 мг.
В другом варианте осуществления, считается, что можно ачинать лечение с определенной ударной дозы 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, и затем оценивать ответную реакцию тестостерона после введения разовой дозы например, через 1, 2, 3, 4, 5 или 6 дней или даже более чем б ней после введения разовой дозы), и затем корректировать следующую дозу в соответствии со схемой лечения (например, уточную дозу, еженедельную дозу или месячную дозу) в сторону увеличения или уменьшения, учитывая быструю ответную реакцию тестостерона. В одном варианте осуществления изобретения, ударная доза 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила составляет 0,3 мг и затем 0,1 мг в неделю.
Настоящее изобретение раскрывает оптимизированную схему лечения, обеспечивающую облегчение симптомов гипогонадизма, вызываемых дефицитом тестостерона, с дополнительными положительными эффектами лечения для пациента. Создание ингибитора ароматазы, специально предназначенного для гипогонадных пациентов мужского пола, позволяет применять новый подход при лечении этого заболевания. Настоящее изобретение, в частности, адресовано страдающим полнотой или ожирением гипогонадотропным гипогонадным пациентам мужского пола со связанными симптомами и расстройствами.
Соответственно, настоящее изобретение относится к применению соединения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при лечении пациента мужского пола, нуждающегося в повышении уровней тестостерона. В одном варианте осуществления, настоящее изобретение относится к применению соединения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при лечении страдающего ожирением или полнотой пациента мужского пола.
В одном варианте осуществления, настоящее изобретение относится к применению соединения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при лечении гипогонадизма у пациента мужского пола, предпочтительно гипогонадотропного гипогонадизма у пациента мужского пола, наиболее предпочтительно гипогонадотропного гипогонадизма у страдающего полнотой или ожирением пациента мужского пола.
Кроме того, настоящее изобретение относится к применению соединения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при лечении пациента мужского пола, нуждающегося в повышении уровней тестостерона, где соединение приготавливают в форме, включающей от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила на одну дозу, и соединение вводят в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней.
В контексте настоящего изобретения, формулировку "применение соединения 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при лечении (...)" следует истолковывать либо как "соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил, которое применяют для лечения (...)", либо как "применение соединения 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)-метилен]бисбензонитрила для приготовления лекарственного средства для лечения (...)". Обе формулировки в равной степени характеризуют объем изобретения.
В одном варианте осуществления, пациентом является человек мужского пола, предпочтительно страдающий полнотой или ожирением человек мужского пола. Наиболее предпочтительным является лечение гипогонадизма и связанных состояний у страдающих полнотой или ожирением пациентов мужского пола; однако, в соответствующих случаях, может быть также предусмотрено лечение других пациентов мужского пола, нуждающихся в повышении уровней тестостерона.
В одном варианте осуществления, пациент мужского пола, нуждающийся в повышении уровней тестостерона, страдает гипогонадизмом, предпочтительно гипогонадотропным гипогонадизмом. В частности, настоящее изобретение относится к лечению гипогонадотропного гипогонадизма у страдающих ожирением или полнотой людей мужского пола.
В одном варианте осуществления, настоящее изобретение относится к применению соединения в упомянутой выше группе пациентов для повышения, предпочтительно, нормализации уровней тестостерона. В частности, рассматривается повышение, предпочтительно, нормализация уровней тестостерона у страдающего полнотой или ожирением пациента мужского пола с гипогонадотропным гипогонадизмом.
Низкая концентрация тестостерона в сыворотке является основанием для предположения о наличии или взаимосвязи с метаболическим синдромом и диабетом II типа, в частности, у страдающих полнотой или ожирением мужчин.
Соответственно, в одном варианте осуществления, настоящее изобретение относится к применению соединения для предотвращения или лечения одного или более расстройств, выбранных из метаболического синдрома, диабета II типа, ожирения и сердечно-сосудистого заболевания, у упомянутых выше пациентов, предпочтительно у пациентов, страдающих гипогонадизмом или гипогонадотропным гипогонадизмом, предпочтительно у страдающих полнотой или ожирением пациентов с гипогонадизмом или гипогонадотропным гипогонадизмом.
В другом варианте осуществления, настоящее изобретение относится к применению соединения для предотвращения или лечения одного или более расстройств, выбранных из резистентности к инсулину, отсутствия толерантности к глюкозе и дислипидемии, у упомянутых выше пациентов, предпочтительно у пациентов, страдающих гипогонадизмом или гипогонадотропным гипогонадизмом, предпочтительно у страдающих полнотой или ожирением пациентов с гипогонадизмом или гипогонадотропным гипогонадизмом.
В дополнительном варианте осуществления, настоящее изобретение относится к применению соединения для повышения чувствительности к инсулину и/или усиления метаболизма глюкозы и/или улучшения липидного профиля у упомянутых выше пациентов, предпочтительно у пациентов, страдающих гипогонадизмом или гипогонадотропным гипогонадизмом, предпочтительно у страдающих полнотой или ожирением пациентов с гипогонадизмом или гипогонадотропным гипогонадизмом.
Кроме того, настоящее изобретение относится к применению соединения для предотвращения или лечения одного или более расстройств, выбранных из группы, состоящей из пониженного либидо, уменьшений спонтанных эрекций, эректильной дисфункции, сниженной фертильности, потери волосяного покрова, снижения потребности в бритье, упадка сил, утомляемости, плохого самочувствия, депрессивного состояния, изменений настроения, низкой минеральной плотности костной ткани, повышенного риска переломов, пониженной мышечной массы, пониженной мышечной силы, повышенной массы жировых отложений в области живота и ограниченной работоспособности организма, где пациент нуждается в повышении уровней тестостерона. В частности, пациент страдает гипогонадизмом или гипогонадотропным гипогонадизмом, предпочтительно полнотой или ожирением с гипогонадотропным гипогонадизмом.
В дополнительных вариантах осуществления изобретения, относящихся к описанному в изобретении применению соединения, соединение используют в форме, включающей от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4'-[фтор-( 1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе. Например, соединение может быть использовано в форме, включающей приблизительно 0,0005 мг, приблизительно 0,001 мг, приблизительно 0,005 мг, приблизительно 0,006 мг, приблизительно 0,007 мг, приблизительно 0,008 мг, приблизительно 0,009 мг, приблизительно 0,01 мг, приблизительно 0,015 мг, приблизительно 0,02 мг, приблизительно 0,025 мг, приблизительно 0,03 мг, приблизительно 0,035 мг, приблизительно 0,04 мг, приблизительно 0,45 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг, приблизительно 0,09 мг, приблизительно 0,1 мг, приблизительно 0,15 мг, приблизительно 0,2 мг, приблизительно 0,25 мг, приблизительно 0,3 мг, приблизительно 0,35 мг, приблизительно 0,4 мг, приблизительно 0,4 5 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг или, самое большее, приблизительно 2 мг или 5 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе. Например, соединение может быть использовано в форме, включающей приблизительно 0,1 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе. В одном варианте осуществления, соединение используют в форме, включающей приблизительно 0,01 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе.
В частности, соединение используется в форме, включающей от приблизительно 0,0005 мг до приблизительно 0,5 мг 4,4'-[фтор-( 1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, предпочтительно в форме, включающей от приблизительно 0,001 мг до приблизительно 1,0 мг, более предпочтительно от приблизительно 0,005 мг до приблизительно 0,5 мг, наиболее предпочтительно от приблизительно 0,01 мг до приблизительно 0,1 мг или от приблизительно 0,005 мг до менее чем 0,05 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе.
В одном варианте осуществления, соединение должно быть введено в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от одной дозы, вводимой приблизительно один раз в день, предпочтительно один раз в неделю или один раз в две недели, до одной дозы, вводимой приблизительно один раз каждые 60 дней. В одном варианте осуществления, настоящее изобретение относится к применению соединения в соответствии с режимом дозирования с периодичностью дозирования одна доза, вводимая приблизительно один раз в день, приблизительно один раз каждые два 2 дня, приблизительно один раз каждые 5 дней, приблизительно один раз в неделю, приблизительно один раз в две недели, приблизительно один раз каждые 3 недели, приблизительно один раз каждые 4 недели, приблизительно один раз в месяц и приблизительно один раз каждые 6 недель, предпочтительно приблизительно один раз в неделю или один раз в две недели.
В дополнительных вариантах осуществления изобретения, относящихся к применению соединения, соединение применяют в любой описанной выше форме, включающей от приблизительно 0,0005 мг до приблизительно 1,0 мг в одной дозе, при этом введение осуществляют в соответствии с режимом дозирования, характеризующимся периодичностью дозирования, выбранной из приблизительно одного раза в день, приблизительно одного раза в каждые два дня, приблизительно одного раза в неделю, приблизительно одного раза каждые 10 дней, приблизительно одного раза в две недели, приблизительно одного раза каждые 4 недели, приблизительно одного раза в месяц и приблизительно одного раза каждые 6 недель. В частности, соединение применяют в форме, включающей от приблизительно 0,01 мг до приблизительно 0,1 мг 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, например, включающей приблизительно 0,01 мг, приблизительно 0,02 мг, приблизительно 0,03 мг, приблизительно 0,04 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг или приблизительно 0,09 мг в одной дозе, предпочтительно 0,1 мг в одной дозе, вводимой в соответствии с режимом дозирования, характеризующимся периодичностью дозирования приблизительно один раз в неделю или один раз в две недели, или приблизительно один раз каждые 4 недели, или приблизительно один раз в месяц.
В некоторых вариантах осуществления, соединение следует вводить периодично. В этих вариантах осуществления, соединение, например, дозу, которая включает от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, вводят пациенту в течение по меньшей мере одного дня, и, необязательно, затем вводят дополнительные дозы в соответствии с описанным выше режимом дозирования, например, при режиме дозирования, характеризующемся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней, и затем периодом отсутствия дозирования в течение от приблизительно одного дня до приблизительно 6 месяцев или больше, например, в течение приблизительно одного дня, приблизительно двух дней, приблизительно одной недели, приблизительно 10 дней, приблизительно двух недель, приблизительно 4 недель, приблизительно одного месяца, приблизительно 6 недель, приблизительно 2 месяцев, приблизительно 3 месяцев, приблизительно 4 месяцев, приблизительно 5 месяцев или приблизительно 6 месяцев.
В одном аспекте изобретения, соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил применяют для перорального введения.
В другом аспекте изобретения, соединение 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил при введении пациенту характеризуется кажущимся периодом полувыведения, составляющим по меньшей мере приблизительно 14 дней, по меньшей мере приблизительно 20 дней и по меньшей мере приблизительно 25 дней. В одном варианте осуществления, соединение даже может характеризоваться кажущимся периодом полувыведения, составляющим по меньшей мере приблизительно 30 дней или даже по меньшей мере 35 дней. В другом варианте осуществления, соединение может характеризоваться кажущимся периодом полувыведения, составляющим приблизительно от 22 до 2 9 дней. В другом варианте осуществления, соединение может характеризоваться кажущимся периодом полувыведения, составляющим приблизительно от 23 до 27 дней. Этот чрезвычайно длительный период полувыведения у людей был продемонстрирован в примерах 3 и 4. Полученные результаты были совершенно неожиданными, принимая во внимание результаты ранее проведенных экспериментов на крысах, в соответствии с которыми период полувыведения составлял приблизительно одну неделю [Batzl-Hartmann et al., 1994 and Bhatnagar et al., 1996] . Этот неожиданный чрезвычайно длительный период полувыведения соединения в случае людей и позволяет создать конкретную схему дозирования изобретения.
В одном варианте осуществления изобретения, соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил следует вводить определяемому в описании изобретения пациенту в течение периода лечения, составляющего по меньшей мере приблизительно два месяца, предпочтительно по меньшей мере приблизительно три месяца. В другом варианте осуществления, введение описанного в изобретении соединения может продолжаться даже дольше и применяться для непрерывного лечения.
Кроме того, настоящее изобретение относится к способу лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, включающему введение указанному пациенту эффективного количества 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила.
Кроме того, изобретение относится к способу лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, включающему введение указанному пациенту эффективного количества 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в дозе от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно в дозе от приблизительно 0,0005 мг до приблизительно 2,0 мг при режиме дозирования, характеризующемся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней.
В одном варианте осуществления, указанный пациент мужского пола страдает ожирением. В другом варианте осуществления, указанный пациент мужского пола страдает полнотой. В другом варианте осуществления, способ применяют для лечения гипогонадизма или гипогонадотропного гипогонадизма. В частности, способ лечения применяют для лечения гипогонадизма у страдающего полнотой или ожирением пациента мужского пола, предпочтительно для лечения гипогонадотропного гипогонадизма у страдающего полнотой или ожирением пациента мужского пола.
Указанный пациент мужского пола, нуждающийся в повышении уровней тестостерона, может также нуждаться в предотвращении или лечении одного или более расстройств, выбранных из метаболического синдрома, диабета II типа, ожирения и сердечно-сосудистого заболевания. В дополнительном варианте осуществления, указанный пациент нуждается в предотвращении или лечении одного или более расстройств, выбранных из резистентности к инсулину, отсутствия толерантности к глюкозе и дислипидемии. В частности, пациент нуждается в повышении чувствительности к инсулину, или нуждается в усилении метаболизма глюкозы, или нуждается в улучшении липидного профиля.
Указанный пациент мужского пола, нуждающийся в повышении уровней тестостерона, может также нуждаться в предотвращении или лечении одного или более расстройств, выбранных из группы, состоящей из пониженного либидо, уменьшений спонтанных эрекций, эректильной дисфункции, сниженной фертильности, потери волосяного покрова, снижения потребности в бритье, упадка сил, утомляемости, плохого самочувствия, депрессивного состояния, изменений настроения, низкой минеральной плотности костной ткани, повышенного риска переломов, пониженной мышечной массы, пониженной мышечной силы, повышенной массы жировых отложений в области живота и ограниченной работоспособности организма.
В дополнительном варианте осуществления, указанный пациент мужского пола, нуждающийся в повышении уровней тестостерона и/или страдающий гипогонадизмом, нуждается в увеличении мышечной массы и мышечной силы, нуждается в нормализации состава тканей тела, нуждается в снижении массы отлагаемого в области живота жира, нуждается в усилении половой функции и полового влечения, нуждается в повышении фертильности или нуждается в увеличении минеральной плотности костной ткани.
Кроме того, изобретение относится к способу лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, включающему введение указанному пациенту эффективного количества 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, где введение соединения повышает уровень тестостерона по меньшей мере на 10% по сравнению с уровнем тестостерона до введения соединения. В дополнительном варианте осуществления, введение соединения нормализует уровни тестостерона.
Все описанные выше варианты осуществления для применения соединения 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила для лечения одного из упомянутых выше заболеваний могут использоваться с соответствующими изменениями в упомянутом выше способе лечения соответствующих заболеваний с помощью этого соединения.
Соответственно, эффективное количество 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила может составлять от приблизительно 0,0005 мг до приблизительно 5,0 мг в одной дозе, от приблизительно 0, 0005 мг до приблизительно 2,0 мг в одной дозе, от приблизительно 0,001 мг до приблизительно 1,0 мг в одной дозе или от приблизительно 0, 005 мг до приблизительно 0,5 мг в одной дозе, например, 0,001 мг, приблизительно 0,005 мг, приблизительно 0,006 мг, приблизительно 0,007 мг, приблизительно 0,008 мг, приблизительно 0,009 мг, приблизительно 0,01 мг, приблизительно 0,015 мг, приблизительно 0,02 мг, приблизительно 0,025 мг, приблизительно 0,03 мг, приблизительно 0,035 мг, приблизительно 0,04 мг, приблизительно 0,45 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг, приблизительно 0,09 мг, приблизительно 0,1 мг, приблизительно 0,15 мг, приблизительно 0,2 мг, приблизительно 0,25 мг, приблизительно 0,3 мг, приблизительно 0,35 мг, приблизительно 0,4 мг, приблизительно 0,45 мг, приблизительно 0,5 мг в одной дозе. В частности, эффективное количество 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила составляет приблизительно 0,01 мг в одной дозе.
Эффективное количество 4 , 4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, выбранное из от приблизительно 0,0005 мг до приблизительно 5,0 мг в одной дозе, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг в одной дозе, может быть введено в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней или от приблизительно одного раза в неделю до приблизительно одного раза в месяц.
Более конкретно, эффективное количество 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила от приблизительно 0, 0005 мг до приблизительно 5,0 мг в одной дозе, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг в одной дозе, более предпочтительно от приблизительно 0,01 мг до приблизительно 0,1 мг в одной дозе, может быть введено в соответствии с режимом дозирования, характеризующимся периодичностью дозирования, выбранной из приблизительно одного раза в неделю, одного раза каждые два дня, одного раза в неделю, приблизительно одного раза каждые 10 дней, приблизительно одного раза в две недели, приблизительно одного раза каждые 4 недели, приблизительно одного раза в месяц и приблизительно одного раза каждые 6 недель. Эффективное количество 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила от приблизительно 0,01 мг до приблизительно 0,1 мг в одной дозе (например, приблизительно 0,01 мг, приблизительно 0,02 мг, приблизительно 0,03 мг, приблизительно 0,04 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг или приблизительно 0,09 мг в одной дозе) может быть введено в соответствии с режимом дозирования, характеризующимся периодичностью дозирования приблизительно один раз в неделю или один раз в две недели или один раз каждые 4 недели или один раз в месяц.
В другом варианте осуществления, соединение при введении в соответствии с способом лечения изобретения характеризуется кажущимся периодом полувыведения, составляющим по меньшей мере приблизительно 14 дней, предпочтительно по меньшей мере приблизительно 20 дней, более предпочтительно по меньшей мере приблизительно 25 дней и наиболее предпочтительно по меньшей мере приблизительно 30 дней.
В дополнительном варианте осуществления, изобретение относится к способу лечения определяемого в описании изобретения пациента мужского пола, нуждающегося в повышении уровней тестостерона, включающему введение указанному пациенту разовой дозы 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, где указанная доза приводит к повышению эффективной концентрации тестостерона в крови в течение периода времени от 3 до 30 дней. В частности, концентрация тестостерона в сыворотке повышается по меньшей мере на 10% по сравнению с концентрацией тестостерона в сыворотке до введения соединения.
Соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил может применяться в различных лекарственных формах, таких как парентеральные формы (например, водные или масляные суспензии) или пероральные формы (например, таблетки, порошки, капсулы, гранулы, водные или масляные суспензии). Предпочтительно применять соединение в пероральной лекарственной форме, вводимой в соответствии с описанным режимом дозирования. Однако лекарственная форма с замедленным высвобождением или депонируемые лекарственные формы или трансдерсальные лекарственные формы могут также быть использованы для введения соединения.
Таким образом, согласно дополнительному варианту осуществления изобретения, предлагается пероральная фармацевтическая композиция, включающая от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, необязательно, в комбинации с одним или более фармацевтически приемлемыми вспомогательными веществами.
В одном варианте осуществления, фармацевтическая композиция включает от приблизительно 0,001 мг до приблизительно 1,0 мг, предпочтительно от приблизительно 0,005 мг до приблизительно 0,5 мг более предпочтительно от приблизительно 0,01 мг до приблизительно 0,1 мг, например, приблизительно 0,02 мг, приблизительно 0,03 мг, приблизительно 0,04 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг или приблизительно 0,09 мг, наиболее предпочтительно приблизительно 0,01 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе.
Для приготовления фармацевтических композиций изобретения, к компонентам композиции могут быть добавлены инертные фармацевтически приемлемые вспомогательные вещества, которые могут быть либо твердыми, либо жидкими веществами. Твердые лекарственные формы включают порошки, таблетки, диспергируемые гранулы, капсулы и облатки.
Твердое фармацевтически приемлемое вспомогательное вещество может представлять собой одно или более веществ, которые могут выполнять функции носителей, разбавителей, ароматизаторов, солюбилизаторов, скользящих веществ, суспендирующих средств, связующих и/или средств, способствующих распаду таблетки; вспомогательным веществом может быть также инкапсулирующий материал.
В порошках, тонко измельченное твердое вспомогательное вещество используют в смеси с тонко измельченным активным компонентом. В таблетках, активный компонент смешивают с вспомогательным веществом, обладающим необходимыми связующими свойствами, в соответствующих пропорциях и прессуют в таблетку с требуемой формой и размером.
Подходящие вспомогательные вещества включают карбонат магния, стеарат магния, тальк, лактозу, моногидрат лактозы, сахар, пектин, декстрин, крахмал, трагакантовую камедь, микрокристаллическую целлюлозу, метилцеллюлозу, натрия карбоксиметилцеллюлозу, кукурузный крахмал, коллоидный безводный диоксид кремния, диоксид титана, легкоплавкий воск, масло какао и другие подобные вещества.
Предполагается, что термин "композиция" включает смесь активного компонента (активных компонентов) с инкапсулирующим материалом в качестве носителя, образующим капсулу, в которой активное соединение (вместе или без других носителей) окружено носителем, который, таким образом, связан с активным соединением. Аналогичным образом, термин "композиция" включает и облатки. Таблетки, порошки, облатки и капсулы могут применяться в качестве твердых лекарственных форм, используемых для перорального введения.
Жидкие формы композиций включают растворы, суспензии и эмульсии. Стерильные водные или водно-пропиленгликолевые растворы активных соединений могут быть приведены в качестве примера жидких лекарственных форм, используемых для парентерального введения. Жидкие композиции могут быть также приготовлены в водно-полиэтиленгликолевом растворе. Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих окрашивающих веществ, ароматизаторов, стабилизаторов и загустителей, если в этом есть необходимость. Водные суспензии для перорального применения могут быть приготовлены путем диспергирования тонко измельченного активного компонента в воде вместе с вязким веществом, таким как синтетические камеди, смолы, метилцеллюлоза, натрия карбоксиметилцеллюлоза и другие суспендирующие средства, известные в фармацевтике.
Фармацевтическая композиция может находиться в виде дозированной лекарственной формы. В такой форме, композицию разделяют на разовые дозы, содержащие соответствующие количества активного компонента (активных компонентов). Дозированная лекарственная форма может представлять собой расфасованный лекарственный препарат, упаковку, содержащую дискретные количества лекарственных препаратов, например, упакованные таблетки, капсулы и порошки во флаконах или ампулах. Дозированная лекарственная форма может также представлять собой капсулу, облатку или таблетку, или она может представлять собой соответствующее число любых этих расфасованных форм.
В дополнительном варианте осуществления, изобретение относится к описанной выше пероральной фармацевтической композиции, которая при введении пациенту характеризуется кажущимся периодом полувыведения 4,4’-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, составляющим по меньшей мере приблизительно 14 дней, предпочтительно по меньшей мере приблизительно 20 дней, более предпочтительно по меньшей мере приблизительно 25 дней и наиболее предпочтительно по меньшей мере приблизительно 30 дней. В одном варианте осуществления, соединение может даже характеризоваться кажущимся периодом полувыведения, составляющим по меньшей мере приблизительно 30 дней. В другом варианте осуществления, соединение может даже характеризоваться кажущимся периодом полувыведения, составляющим по меньшей мере приблизительно от 22 до 29 дней.
В другом варианте осуществления, изобретение относится к набору, содержащему: (i) фармацевтическую композицию, включающую описанное в изобретении соединение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила, вместе с (ii) инструкциями по введению указанной фармацевтической композиции для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, в частности, для лечения гипогонадизма или гипогонадотропного гипогонадизма у пациента мужского пола, предпочтительно страдающего полнотой или ожирением пациента мужского пола. В этих инструкциях должен подробно объясняться режим дозирования вводимого соединения, который подробно описывается ниже.
В дополнительном варианте осуществления, изобретение относится к набору, содержащему: (i) фармацевтическую композицию, включающую от приблизительно 0,0005 мг до приблизительно 5,0 мг, предпочтительно от приблизительно 0,0005 мг до приблизительно 2,0 мг, предпочтительно от приблизительно 0,001 мг до приблизительно 1,0 мг, более предпочтительно от приблизительно 0,005 мг до приблизительно 0,5 мг, наиболее предпочтительно от приблизительно 0,01 мг до приблизительно 0,1 мг или от приблизительно 0,005 мг до менее чем 0,01 мг 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в одной дозе, вместе с (ii) инструкциями по введению указанной фармацевтической композиции. В этих инструкциях должен подробно объясняться режим дозирования вводимого соединения, который подробно описывается ниже.
В дополнительном варианте осуществления, описанный в изобретении набор включает инструкции, в которых заявляется, что фармацевтическая композиция предназначена для лечения пациента мужского пола, нуждающегося в повышении уровней тестостерона, в частности, для лечения гипогонадизма или гипогонадотропного гипогонадизма у пациента мужского пола, предпочтительно страдающего полнотой или ожирением пациента мужского пола. В частности, в инструкциях заявляется, что фармацевтическая композиция должна вводиться в соответствии с режимом дозирования, характеризующимся периодичностью дозирования от приблизительно одного раза в день до приблизительно одного раза каждые 60 дней, предпочтительно выбранным из режима дозирования, характеризующегося периодичностью дозирования приблизительно один раз каждые 2 дня, приблизительно один раз каждые 5 дней, приблизительно один раз в неделю, приблизительно один раз в две недели, приблизительно один раз каждые 3 недели, приблизительно один раз каждые 4 недели, приблизительно один раз в месяц и приблизительно один раз каждые 6 недель, предпочтительно приблизительно один раз в неделю или один раз в две недели.
В другом варианте осуществления, инструкции набора представляют собой либо вкладываемый листок с текстом, либо напечатанный текст на упаковке фармацевтической композиции.
Это изобретение дополнительно иллюстрируется приведенными далее примерами, которые не следует считать в качестве ограничений для изобретения.
ПРИМЕРЫ
Пример 1. Получение 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила
В этом примере описывается способ синтеза 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (также известного как 4-[α-4-цианофенил)-α-фтор-1-l,2,4-триазолил)метил]бензонитрил или CGP47645), раскрытый в патентном документе Lang et al., U.S. Patent No. 5637605:
Раствор 0,8 ммоль гексаметилдисилазана калия в 1,6 мл толуола разбавляют с помощью 5 мл THF и после охлаждения до -78°С добавляют раствор 190 мг 4-[а-(4-цианофенил)-1-(1,2,4-триазолил)метил]бензонитрила (смотрите патентный документ ЕР-А-236 940, Ex. 20а) в 3 мл THF. После перемешивания в течение 1 часа при этой же температуре, к темно-красному раствору добавляют по каплям 301 мг N-фтор-диметилсахаринсултама в 3 мл THF. После выдержки в течение еще 1,5 часов при -78°С, реакционную смесь нагревают до комнатной температуры в течение 1 часа и выливают в насыщенный раствор хлорида аммония в воде и затем экстрагируют метиленхлоридом. Сушка над хлоридом магния и концентрирование путем испарения растворителя дает неочищенный продукт, который очищают флэш-хроматографией (SiO2, гексан/этилацетат 9:1, 4:1 до 1:1). ТСХ (SiO2, СНСl3/метанол 9:1, Rf=0,85); ИК (КВr) : 2220 см-1; 1H-ЯМР (CDCl3) : δ (ppm)=7,46 и 7,76 (8Н, м), 8,07 (1Н, с), 8,16 (1Н, с).
Содержание всей информации, относящейся к получению 4-[а-4-цианофенил)-α-фтор-1-l,2,4-триазолил)метил]бензонитрила, раскрытой в патентном документе Lang et al., U.S. Patent No. 5376669, приводится в описании настоящего изобретения путем ссылки на этот патентный документ.
Приведенный выше параграф относится к патентному документу ЕР-А-236 940, пример 20а. Эквивалентом патентного документа ЕР- 236 940 в США является патентный документ Bowman, U.S. Patent No. 4749713. В примере 20 (а) патентного документа ЕР-А-236 940 (эквивалентного документа U.S. Patent No. 4749713) сообщается, что 4-[1-(1,2,4-триазолил)метил]бензонитрил подвергают взаимодействию с третбутоксидом калия и 4-фторбензонитрилом в соответствии с методикой примера 2 патентного документа U.S. Patent No. 4749713 с получением 4-[а-(4-цианофенил)-1-(1,2,4-триазолил)метил]бензонитрила с температурой плавления 181°С-183°С.
В соответствии с методикой примера 2 патентного документа U.S. Patent No. 4749713, суспензию третбутоксида калия (61,6 г) в диметилформамиде (500 мл) перемешивают и охлаждают до -10°С (баня с солью и льдом) и добавляют раствор 4-(1-имидазолилметил)бензонитрила (45,6 г) в диметилформамиде (250 мл), но так чтобы температура реакции оставалась ниже 0°С. Полученный раствор перемешивают при 0°С в течение 0,5 часа и затем добавляют раствор 4-фторбензонитрила (38,3 г) в диметилформамиде (100 мл) при поддержании температуры реакции ниже 5°С. Через 0,75 часа, реакционную смесь нейтрализуют до рН 7 путем добавления достаточного количества 3 N хлористоводородной кислоты, и затем удаляют большую часть растворителей при пониженном давлении. Остаток разбавляют водой (500 мл), и неочищенный продукт экстрагируют этилацетатом (3 × 200 мл). Затем объединенные экстракты подвергают обработке 3Ν хлористоводородной кислотой (3 × 150 мл) и, после промывки кислотных растворов этилацетатом (100 мл), раствор подщелачивают (рН 8) с помощью 6Ν гидроксида аммония и продукт снова экстрагируют этилацетатом (3 × 150 мл). Объединенные экстракты сушат (MgSO4) , обесцвечивают путем обработки активированным углем и затем испаряют с получением неочищенного 4-[а-(4-цианофенил)-1-имизазолилметил]бензонитрила в виде масла. Этот материал растворяют в изопропаноле (250 мл) , и подогретый раствор перемешивают с янтарной кислотой (14,4 г). После разбавления диэтиловым эфиром (100 мл) и перемешивания при температуре окружающей среды, отделяют полусукцинатную соль. Соль отфильтровывают, промывают небольшим количеством холодного изопропанола и затем сушат на воздухе с получением 4-[а-(4-цианофенил)-1-имидазолилметил]бензонитрила полусукцината с температурой плавления 14 9°С-150°С. Полуфумаратная соль имеет температуру плавления 157°С-158°С.
Содержание всей информации, относящейся к получению 4-[а-(4-цианофенил)-1-(1,2,4-триазолил)метил]бензонитрила, раскрытой в патентном документе Bowman, Ü. S. Patent No. 4749713, приводится в описании настоящего изобретения путем ссылки на этот патентный документ.
Пример 2: Лекарственные формы 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (CGP47645)
4,4'-[Фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрил (CGP47645) приготавливают в форме жестких желатиновых капсул, представляющих собой лекарственную форму с мгновенным высвобождением для перорального введения. Лекарственной формой является твердая розовая непрозрачная желатиновая капсула, содержащая беловато-желтоватый порошок, с размером 1 или 3. Готовят капсулы, содержащие 0,1 мг, 0,5 мг или 1,0 мг CGP47645 в твердой желатиновой капсуле. Вспомогательными веществами, используемыми для приготовления твердых желатиновых капсул, являются лактоза, микрокристаллическая целлюлоза, кукурузный (маисовый) крахмал, натрия гликолят крахмала, стеарат магния, коллоидный диоксид кремния. Все вспомогательные вещества удовлетворяют требованиям соответствующих фармакопейных документов (Ph. Eur., NF). Твердые желатиновые капсулы расфасовывают во флаконы из полиэтилена высокой плотности с индукционной герметизацией алюминиевой фольгой, снабженные завинчивающимися крышками с функцией защиты от детей.
Твердые желатиновые капсулы, содержащие CGP47645, приготавливают следующим способом. Взвешивают в соответствующих количествах требуемые вспомогательные вещества для получения конечной композиции, указанные в таблице 2 ниже, и соответствующее количество лекарственного средства CGP47645. Затем в подходящую емкость загружают приблизительно 50% кукурузного крахмала, добавляют лекарственное вещество, затем оставшиеся 50% кукурузного крахмала, для того чтобы лекарственное вещество находилось между двумя слоями кукурузного крахмала. Смешивание и просеивание этой смеси дает премикс лекарственного вещества (DS). Смешивают остальные вспомогательные вещества (микрокристаллическую целлюлозу, подвергнутую распылительной сушке лактозу, натрия гликолят крахмала и коллоидный диоксид кремния [Aerosil® 200]) и просеивают и переносят в подходящую емкость. Затем премикс лекарственного вещества добавляют в емкость, содержащую просеянные вспомогательные вещества, и смесь перемешивают. И наконец, предварительно просеянный стеарат магния добавляют к смеси, содержащей премикс лекарственного вещества, и эту смесь снова перемешивают с получением конечной смеси. Конечной смесью заполняют твердые желатиновые капсулы.
В следующей таблице 2 приведен состав твердых желатиновых капсул, содержащих 0,1 мг, 0,5, 1 мг и 10 мг CGP47645.
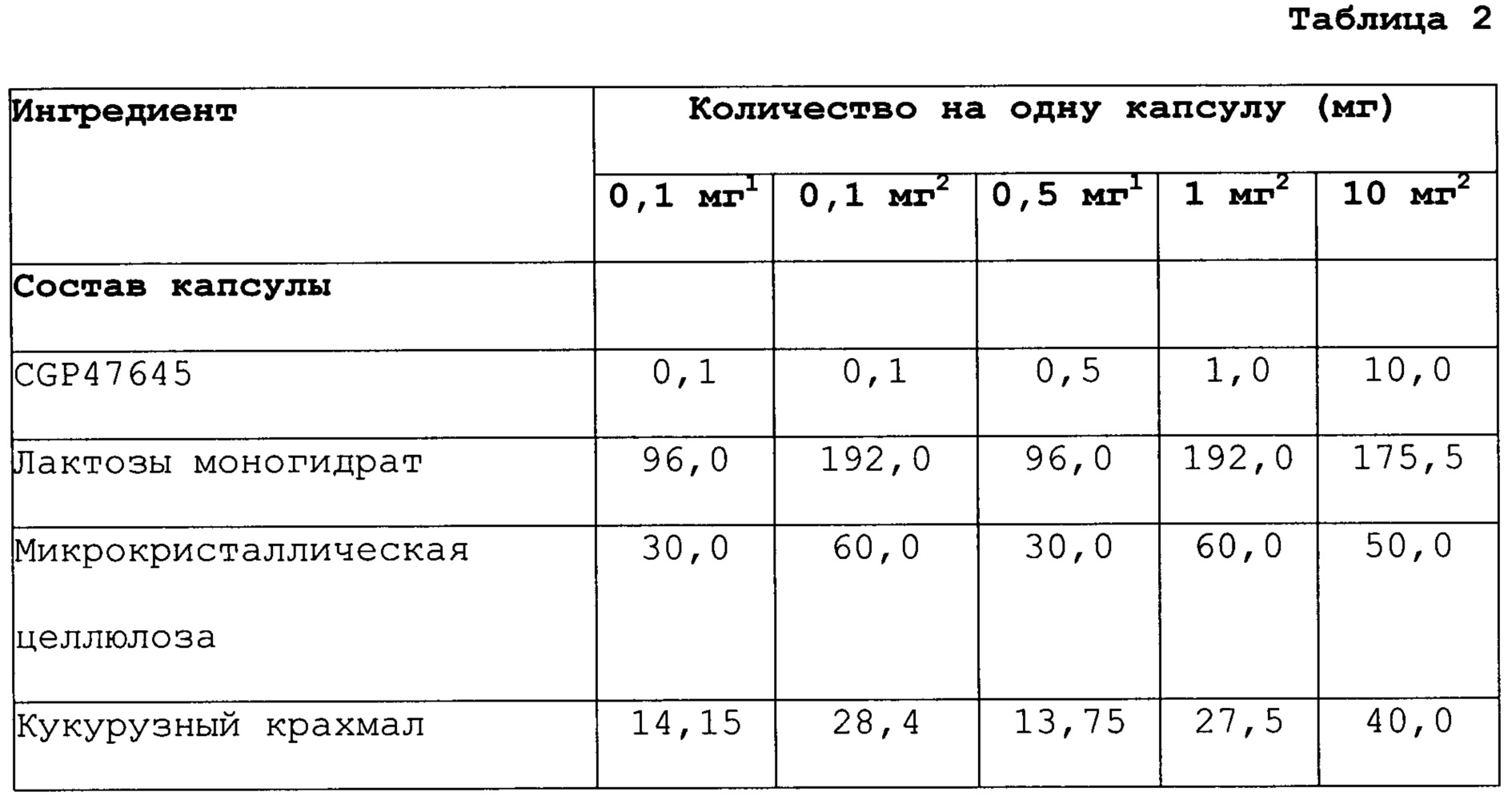
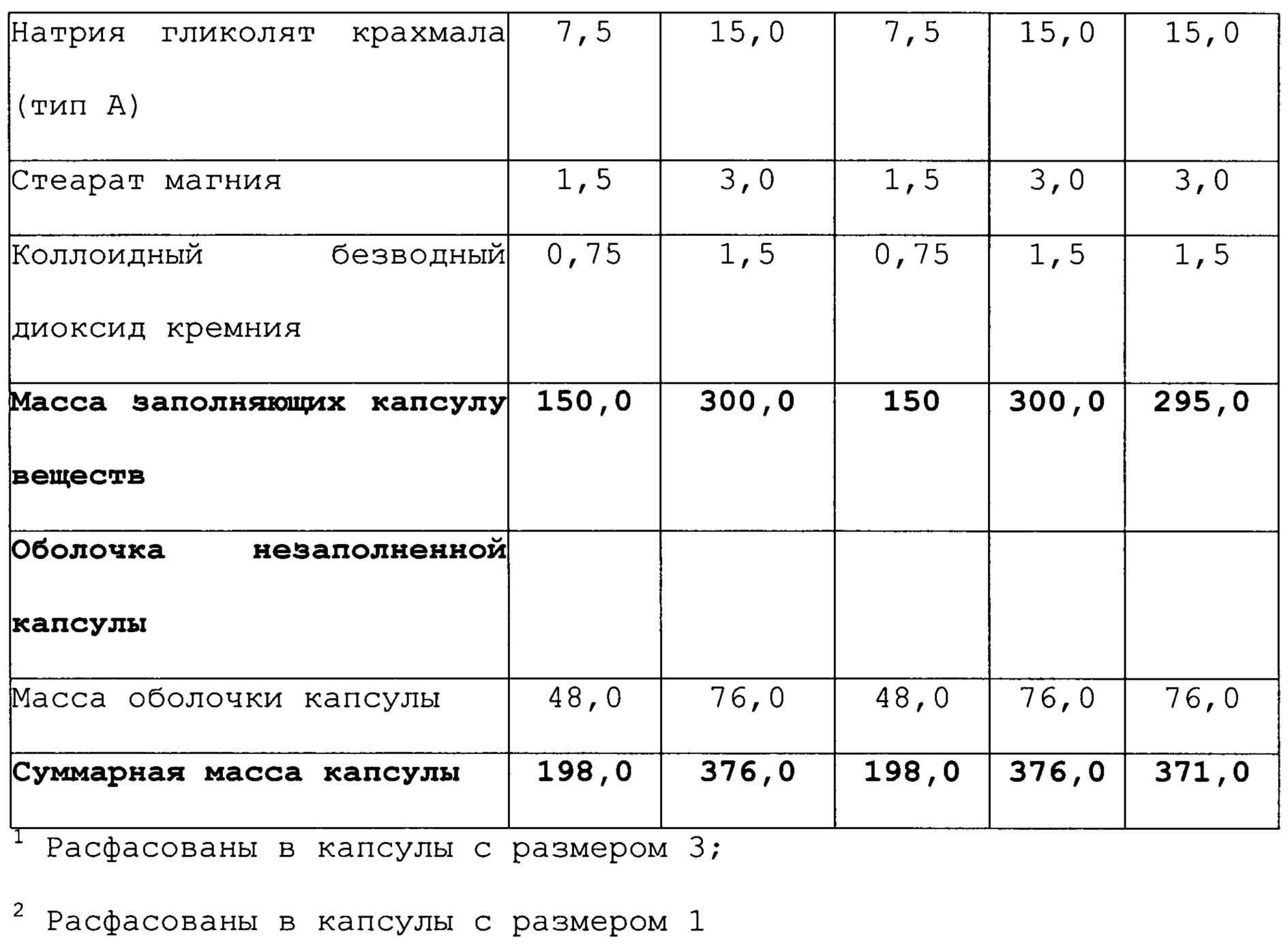
Пример 3: Исследование 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (CGP47645) при увеличении его разовой дозы
Это исследование представляло собой рандомизированное двойное слепое плацебо-контролируемое и активное вещество-контролируемое исследование с увеличением разовой дозы в случае женщин в предклимактерическом и постклимактерическом периоде для оценки безопасности и переносимости, фармакокинетических и фармакодинамических эффектов разовых доз 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (CGP47645). Насчитывалось 8 групп по 8 женщин в постклимактерическом периоде в каждой, рандомизированных 6:2, CGP47645: плацебо, которые получали разовые дозы CGP47645, начиная с дозы 0,01 мг и заканчивая 20 мг, при которой достигалась граница области токсикологического воздействия. Пациентки получали либо твердые желатиновые капсулы, содержащие 0,1 мг, 1 мг и 10 мг лекарственного вещества, либо соответствующие совпадающие по внешнему виду капсулы с плацебо. Для двух групп с самым низким уровнем дозирования, капсулы, содержащие 0,1 мг лекарственного средства, использовали путем ресуспендирования для приготовления пероральных растворов CGP47645 для введения доз 0,01 мг и 0,03 мг (группа 1 и 2).
Токсическая минимальная доза (MTD) не достигалась. Единственная группа из 8 женщин в пременопаузе без потенциальной способности к деторождению (группа № 9) получала CGP47645 0,1 мг или плацебо, рандомизированная 6:2, и одна последняя группа получала летрозол 2,5 мг в качестве группы с внутренним положительным контролем для изучения фармакодинамики. В таблице 3 приведены фармакокинетические параметры на основе предварительного анализа кривых "концентрация-время", полученных при этом исследовании.
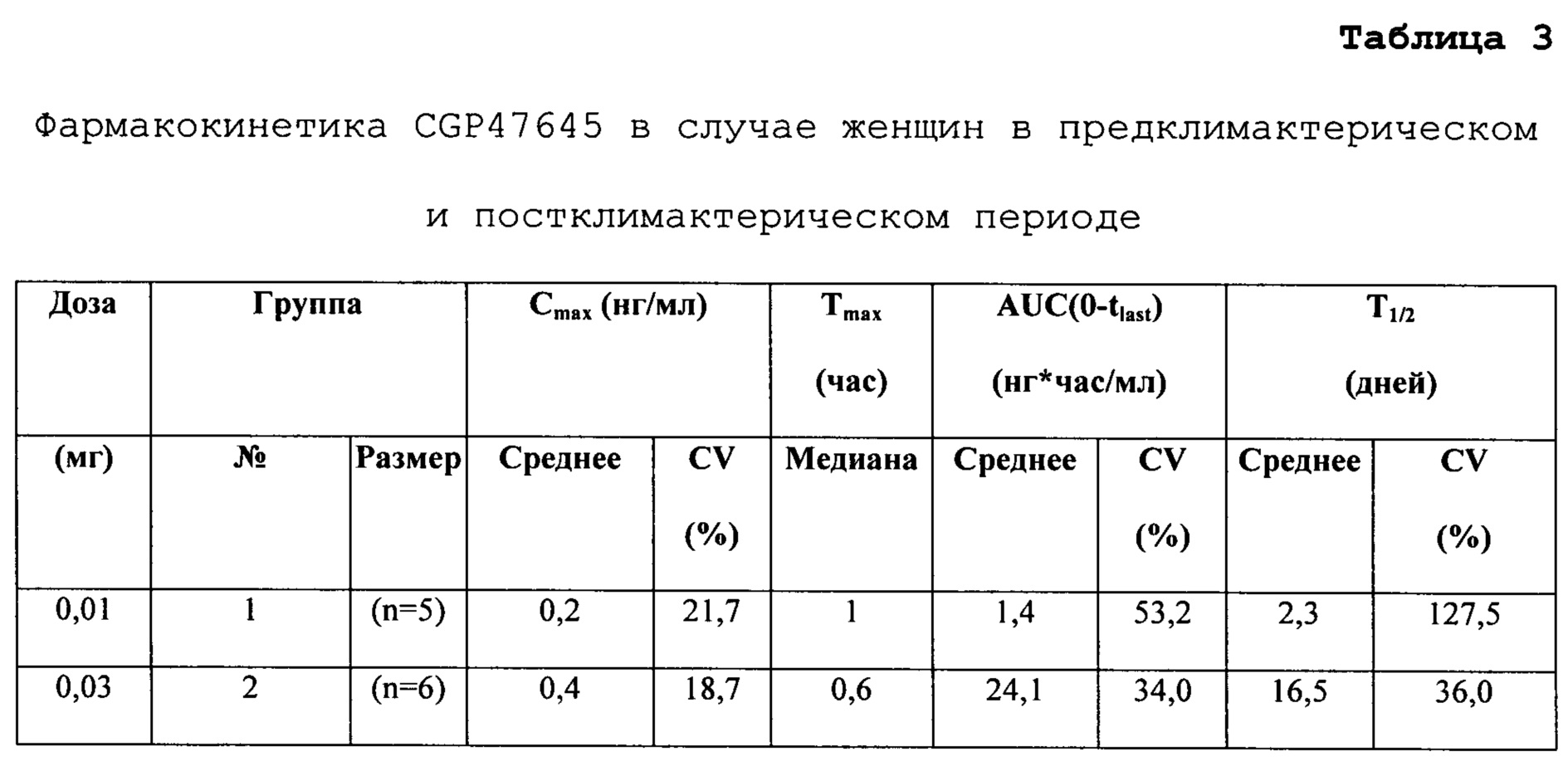
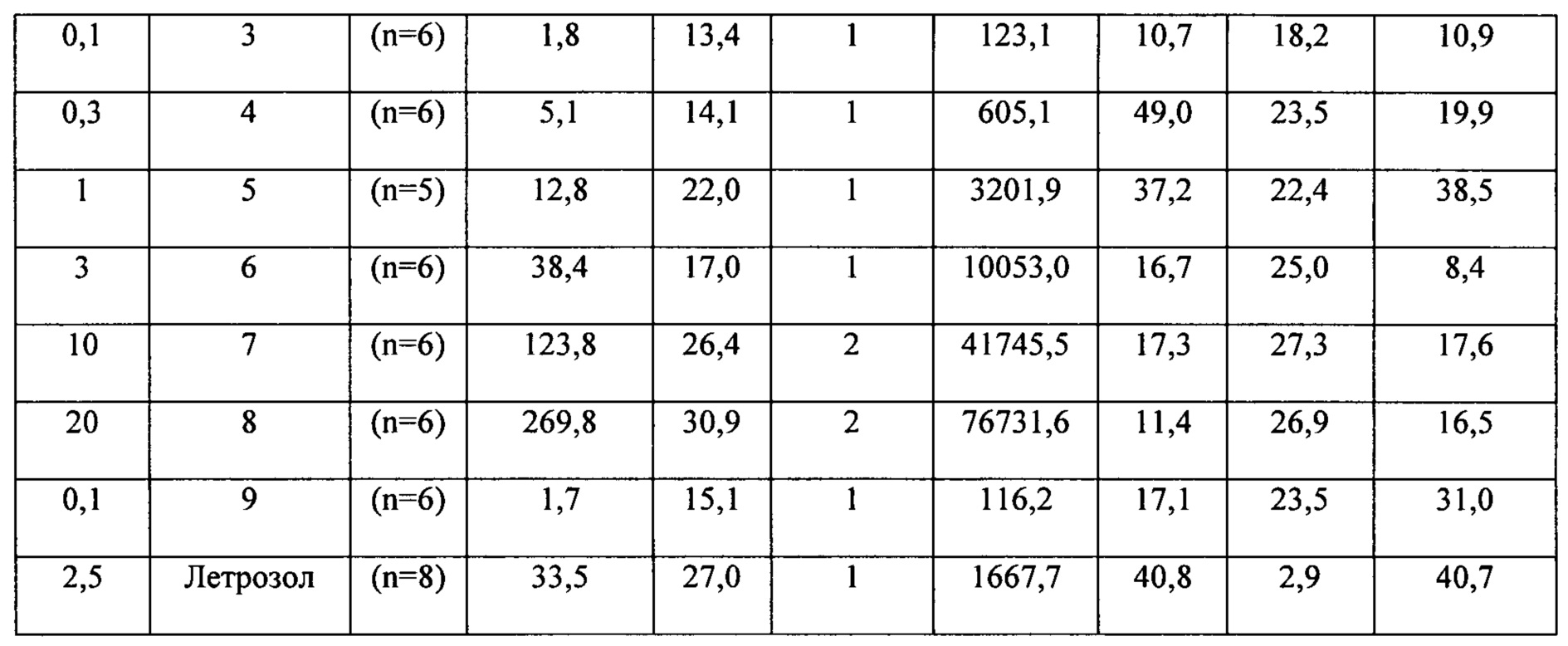
Ингибитор CGP47645 характеризовался пропорциональной дозе фармакокинетикой и зависимым от дозы ингибированием эстрона, эстрона сульфата и эстрадиола. Для женщин в постклимактерическом и предклимактерическом периоде никаких различий в фармакокинетике для CGP47645 не наблюдалось. CGP47645 быстро всасывается со значениями Тmах 0,5-2 часа, медиана Тmах достигается в течение 1 часа после приема препарата. Как величина Сmах, так и величина AUC, возрастали пропорционально с ростом дозы. CGP47645 характеризовался низкой вариабельностью между пациентами, составляющей 10-30%, и совершенно неожиданно длительным периодом полувыведения, составляющим от 23 до 27 дней.
У женщин в постклимактерическом периоде, исследование продемонстировало доказательства эффективности параметров фармакодинамики при подавлении эстрона, которая, по меньшей мере, была равна эффективности летрозола уже при дозах CGP47645 0,1 мг и 0,3 мг. У женщин в постклимактерическом периоде, самая низкая разовая доза, при которой наблюдалось временное подавление эстрогена, составляла 0,01 мг, а самая низкая разовая доза, при которой наблюдалось максимальное подавление эстрогена у женщин в постклимактерическом периоде, определенная с помощью методов хемилюминесценции или радиоиммуного анализа, составляла 0,1 мг. Не наблюдалось ингибирование других ферментов, участвующих в синтезе или метаболизме стероидных гормонов, в частности, не было никаких изменений в уровнях андрогенов, прогестерона, альдостерона, кортизола, адренокортикотропного гормона или 17-кето или 17-ОН стероидов в образцах мочи, собранных за 24 часа. Окончательный анализ индивидуальных данных по плотности костной ткани и Т-показателя, определенных методом двухэнергетической рентгеновской абсорбциометрии, показал, что существенные изменения в плотности костной ткани отсутствуют в зависимости от времени для субъектов группы, которые получили дозу 3 мг или меньше CGP47645, или для субъектов группы, которые получали 2,5 мг летрозола. В случае субъектов группы, получавших 10 мг и 2 0 мг дозы, наблюдалось небольшое, но клинически значимое снижение плотности костной ткани в поясничном отделе позвоночника, но не в бедре, на 6-м месяце приема по сравнению с исходным уровнем.
Пример 4: Фармакокинетика для разовой пероральной дозы 1 мг 14С-4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила в случае здоровых женщин в постклимактерическом периоде исследование всасывания, распределения, метаболизма и выведения
Исследование представляло собой открытое исследование всасывания, распределения, метаболизма и выведения разовой дозы в одной группе из 8 здоровых женщин в постклимактерическом периоде. Подвергавшиеся исследованию субъекты получали 1 мг CGP47645, меченного 10 микрокюри 14C-CGP47645. Доза препарата в 1 мг CGP47645 была выбрана в качестве предположительной терапевтически подходящей дозы на основе информации по всасыванию, распределению, метаболизму и выведению у животных и доступной информации по дозам в случае других ингибиторов ароматазы. Дизайн исследования состоял из 28-дневного периода скрининга, одного первоначального визита к врачу-исследователю (1-й день), периода госпитализации, начиная с поступления в 1-й день и до выписки на 7-й день, 2 визитов амбулаторных больных для сдачи крови для проведения фармакокинетических исследований на 14-й день (±1) и 21-й день (±1) , 2 визитов для отбора образцов жировой ткани и визита для контрольного обследования безопасности лечения для субъекта в конце периода исследования через 6 месяцев.
Основная цель данного исследования заключалась в оценке распределения CGP47645 в жировой ткани в области живота в качестве показателя целенаправленного воздействия на периферические ткани, и в оценке возможности существования метаболита с более длительным значением Тц, а также в выяснении метаболического профиля, и получении информации о маршрутах экскреции и балансе массы. Образцы жировой ткани собирали в соответствии с протоколом разреженного отбора проб, при котором у каждого субъекта 2 раза брали на анализ жировую ткань, при этом у каждого субъекта биопсию проводили в разное время.
Было обнаружено, что однократное пероральное введение 1 мг 14C-CGP47645 является безопасным и хорошо переносится. После однократного перорального введение 1 мг 14C-CGP47645 здоровым женщинам в постклимактерическом периоде, фармакокинетику CGP47645 можно охарактеризовать быстрым и почти полным поглощением с последующим быстрым снижением концентрации в плазме, что позволяет сделать предположение об обширном распределении CGP47645 в тканях. За этим следовала длительная конечная фаза с низкими, но стабильными концентрациями в плазме длительностью более 4000 часов после введения дозы. Конечный период полувыведения составлял, по оценкам, примерно 28 дней. Профили зависимостей концентрации от времени позволяют предположить, что достигается быстрое равновесие для CGP47645 между тканью и кровью с последующим медленным выделением CGP47645 из крови, которое является лимитирующей стадией клиренса CGP47645. Это находит отражение в параллельных концевых наклонах кривых для плазмы и жировой ткани, то есть скорости выведения CGP47645 из плазмы и из ткани являются одинаковыми.
Примерно 84% от общей радиоактивности, выводимой из организма через 6 дней, выводились почками, из которой только 16% лекарственного средства выделялось в неизменном виде. В плазме не было обнаружено никаких метаболитов, и 14C-CGP47645 был единственным радиоактивным соединением, обнаруживаемым во всех проанализированных образцах плазмы. Профили кривых концентраций 14C-CGP47645 в плазме от времени определяли с помощью жидкостного сцинтилляционного счетчика [LSC] , и исходный CGP47645, измеренный методом жидкостной хроматографии-масс-спектрометрии [LC-MS], был практически аналогичным, что затем и дало возможность предположить отсутствие метаболита (метаболитов) в плазме. Тем не менее, очевидно, что основным механизмом выведения 14C-CGP47645 является метаболизм с последующим выведением почками. Выявленные в моче три основные метаболита представляли собой карбинольное производное и два глюкуронида CGP47645. Свойства метаболитов были сопоставимы для образцов мочи, взятых в различные моменты времени, что позволяет предположить, что образование метаболитов являлось лимитирующей стадией.
В целом, фармакокинетика 14C-CGP47645 может быть охарактеризована быстрым всасыванием с последующим быстрым снижением концентраций в плазме, что позволяет сделать вывод об обширном распределении в ткани. Период конечного полувыведения исходного лекарственного средства оценивался приблизительно в 28 дней.
Пример 5: Исследование способности 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила при пероральном введении либо повышать, либо нормализовать уровни тестостерона у страдающих ожирением мужчин с гипогонадотропным гипогонадизмом
Это открытое исследование по подбору дозы с последующим двойным слепым рандомизированным исследованием с параллельной группой с целью оценки безопасности, переносимости и фармакодинамики при 12-ти недельном лечении с помощью 4,4'-[фтор-(1Н-1,2,4-триазол-1-ил)метилен]бисбензонитрила (CGP47645) страдающих ожирением мужчин с гипогонадотропным гипогонадизмом. Исследование состоит из 2 частей, при этом первая часть представляет собой открытое исследование, для того чтобы наилучшим образом определить соответствующий уровни дозы для использования во второй части исследования, которая представляет собой рандомизированное двойное слепое плацебо-контролируемое исследование. В исследовании оценивается безопасность и переносимость CGP47645, и определяется способность низкой дозы CGP47645 при еженедельном интервале дозирования нормализовать уровни тестостерона и улучшать чувствительность к инсулину у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин в сравнении с плацебо.
Дизайн исследования: Как указано выше, это состоящее из двух частей исследование страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин, в котором первая часть является открытым нерандомизированным исследованием в одной группе пациентов для определения соответствующего дозирования. После того, как все пациенты успешно завершают 4 недельное лечение, они продолжают лечение в течение суммарно до 12 недель. Затем проводят вторую часть исследования в виде рандомизированного двойного слепого плацебо-контролируемого исследования в параллельной группе в течение 12 недельного лечения с промежуточным анализом после 4 недель лечения. В случае обеих частей исследования осуществляется скрининг в течение до 28 дней, в первый день, в период 12 недельного лечения (11 еженедельных доз), а затем в течение 3-месячного периода наблюдения.
Период скрининга используется для оценки пригодности пациентов для исследования и для уменьшения запрещенных препаратов для пациентов. Субъекты, которые удовлетворяют критериям включения/исключения при скрининге, допускаются для проведения исходных испытаний. Субъекты поступают в центр проведения клинического исследования в ночь перед пероральным испытанием на толерантность к глюкозе (OGTT) для обеспечения поддержания состояния голодания. Аналогично, ночью пациенты в стационаре проходят пероральные испытания на толерантность к глюкозе (OGTT) во все запланированные дни. После введения первой дозы собирают в течение 24 часов данные по фармакокинетике (РК), фармакодинамике (PD) и по безопасности лекарственного средства. Субъекты возвращаются в центр проведения клинического исследования за 1-2 дня до каждого из следующих 10 визитов с целью дозирования и оценки фармакодинамических параметров для крови в первой части исследования и до 72 часов до каждого визита с целью дозирования во второй части исследования. По завершении 12 недельного периода лечения, пациентов просят возвращаться в центр проведения клинического исследования примерно раз в 6 недель в течение 3 месяцев для последующих оценок безопасности лекарственного средства. Оценка безопасности включает в себя медицинские осмотры, снятие электрокардиограмм, анализ основных показателей состояния организма, стандартные клинические лабораторные анализы (гематологический, биохимический и анализ мочи), мониторинг побочных эффектов и серьезных побочных эффектов. Оценки фармакокинетики и фармакодинамики (половых стероидов) осуществляют на основании различных причин в течение всего периода исследования, и эти данные собирают в то же самое время во всех случаях, когда планируются обе оценки в течение одного и того же визита.
Доза в 0,01 мг CGP47645, вводимая один раз в неделю, была выбрана в качестве исходной дозы, принимая во внимание крайне длительный период полураспада CGP4 7 645, составляющий приблизительно 22-29 дней в случае сыворотки и потенциально даже более длительный период в случае жировой ткани, ее линейный фармакокинетический профиль, минимальную вариабельность между пациентами. Фармакокинетическое моделирование было использовано для определения влияния частоты введения дозы и величины дозы на установившейся режим воздействия. В качестве оптимального подхода для первоначальной оценки было выбрано дозирование, составляющее один раз в неделю. Модель использовалась для оценки дозы CGP47645, требующейся для нормализации тестостерона у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин, и потенциального воздействия ударной дозы. Фармакодинамические оценки также основываются на минимальной дозе (0,01 мг) в случае женщин, продемонстрировавших наличие фармакодинамических эффектов при исследовании возрастания разовой дозы (пример 3).
Таким образом, для первой части исследования было принято решение начинать с 0,01 мг в качестве ударной дозы, оценивать ответную реакцию тестостерона на 5 или 6 день после введения разовой дозы, и корректировать следующую еженедельную дозу в направлении увеличения или уменьшения на основе быстрой ответной реакции тестостерона. Ожидается, что еженедельная поддерживающая доза не будет превышать 0,5 мг. В течение по меньшей мере первых 4 недель лечения, уровни половых стероидов субъекта измеряются до последующего дозирования. Последующая доза корректируется на основе предшествующей ответной реакции.
В случае второй части, представляющей собой слепое исследование, коррекция дозы основывалась на клинических разборах и/или алгоритме, как для CGP47645, так и для плацебо (на основании полученных результатов в первой части). Для второй части исследования был выбран режим фиксированной дозы, состоящий из начальной дозы 0,3 мг с последующим еженедельным дозированием 0,1 мг.
В случае первой части, представляющей собой определение диапазона доз в качестве раздела проводимых испытаний, если уровни тестостерона находятся в пределах нормы, то на 2-й неделе вводят 1/5 ударной дозы CGP47645 (0,002 мг) или плацебо. Если свободный тестостерон выше нормы, то на 2-й неделе доза будет составлять 1/10 (0,001 мг) ударной дозы. Если свободный тестостерон ниже нормы, то на 2-й неделе доза будет составлять 1/2 ударной дозы (0, 005 мг). Последующие еженедельно дозы корректируют с полулогарифмической кратностью до достижения нормализации уровней свободного тестостерона.
Исследование лекарственного средства: Капсулы (размер 1) , содержащие 1 мг CGP47645, и капсулы (размер 3), содержащие 0,1 мг CGP47645, для перорального приема, описанные в примере 2; более низкие дозы для этого исследования получают путем разбавления в растворе.
Группа субъектов исследования: В общей сложности около 44 субъектов рандомизированы для участия в исследовании. Субъекты представляют собой взрослых пациентов мужского пола, удовлетворяющих критериям ожирения с гипогонадотропным гипогонадизмом (ОНИ), которые прошли скрининговую оценку, соответствуют критериям "включения в исследование/исключения из исследования" и предоставили свое письменное согласие. Для первой части требуется приблизительно около 14 пациентов, в то время как для второй части требуется до 30 пациентов, рандомизированных в группу лечения активным веществом и в группу лечения плацебо в соотношении 1:1.
К критериям включения относятся:
1. Мужчины, которые отвечают критериям ожирения, гипогонадотропного гипогонадизма, определяемые как:
a. Пациенты с индексом массы тела (BMI) ≥30 кг/м2
b. Пациенты с утренним уровнем общего тестостерона в сыворотке <300 нг/дл, по меньшей мере, в двух отдельных случаях в ходе скрининга и/или начальных периодов
c. Пациенты с неприемлемо низкими уровнями гонадотропинов при скрининге, дающим в результате низкий уровень тестостерона:
i. Лютеинизирующий гормон (LH) < верхней границы нормы
ii. Фолликулостимулирующий гормон (FSH) < верхней границы
нормы
iii. Эстрадиол в пределах или выше нормы (определяемый с помощью унифицированного анализа как ^ нижней границы нормы)
d.Нормальная гипоталамическая/гипофизарная функция, в том числе :
i. Пролактин: в пределах нормального диапазона
ii. Тиреотропный гормон (TSH): в пределах нормального диапазона
iii. Ферритин: в пределах нормального диапазона
2. Пациенты согласны использовать барьерный метод контрацепции (например, презерватив) в течение всего срока исследования и, по меньшей мере, в течение 3 месяцев после их последнего посещения с целью участия в процедурах исследования, чтобы предотвратить воздействия соединения на их половых партнеров.
К критериям исключения относятся пациенты с гипогонадизмом, но не связанным с ожирением или не являющимся результатом других основных причин, и пациенты с серьезными заболеваниями важных органов (например, заболеваниями почек или печени).
Основная цель данного исследования заключается в предоставлении доказательств того, что еженедельные введения низких доз CGP47645 нормализуют уровни тестостерона у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин. Кроме того, необходимо было изучить фармакодинамическое действие CGP47645 на чувствительность к инсулину (на основе оценки индекса инсулинорезистентности) у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин.
Дополнительные цели этого исследования включают оценку безопасности и переносимости CGP47645 у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин, оценки фармакодинамического воздействия CGP47645 на метаболизм глюкозы, инсулина и липидов, а также на состав тканей тела у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин, и определение фармакокинетики CGP47645 у страдающих ожирением гипогонадотропных гипогонадных (ОНН) мужчин.
Оценки и экспертизы: в ходе исследования должны быть проведены следующие оценки :
1. Исходные, демографические и административные оценки
Критерии включения/исключения; соответствующий анамнез заболевания/текущие медицинские показания
Демография
- Медицинский осмотр, включающий пальпацию предстательной железы
- Международная шкала оценки простатических симптомов (IPSS)
- Скрининг на гепатит, скрининг на ВИЧ
Тест на присутствие алкоголя, тест на присутствие наркотиков
- Пролактин, ферритин и тиреотропный гормон (TSH)
* Введение лекарственного средства: каждый раз, когда вводят исследуемое лекарственное средство
* Информация по завершению исследования
* Комментарии
2. Оценки безопасности и переносимости
* Измерения жизненно важных функций и тела
Высота тела (используют для расчета индекса массы тела)
* Масса тела*
* Температура тела
* Артериальное давление и частота пульса
* Оценки ЭКГ
* Гематология, химический анализ крови, анализ мочи
* простатический специфический антиген (PSA)
* Побочные эффекты: от момента первого введение исследуемого лекарственного средства до завершения исследования. Побочные эффекты, имевшие место до начала исследования, но после подписания формы информированного согласия, регистрируются в истории болезни/индивидуальной регистрационной карте текущих медицинских показаний.
* Серьезные побочные эффекты: с момента подписания формы информированного согласия до 30 дней после завершения исследования
Сопутствующие лекарственные средства/основные методы немедикаментозного лечения: Смотрите критерии включения в исследование и сопутствующие лекарственные средства по поводу требований к регистрации для разрешенных и запрещенных во время исследования лекарственных средств.
3. Фармакокинетические оценки крови: фармакокинетические данные необходимо собирать по несколько раз в фазе лечения в процессе исследования. Фармакокинетические оценки также необходимо собирать каждые 6 недель в течение последующего периода оценки безопасности лекарственного средства. Предполагается, что окончательная фармакокинетическая оценка должна быть проведена на 24-й неделе/при завершении скрининга, при этом возможен сбор дополнительных проб, если после указанного времени в крови обнаруживаются клинически значимые уровни CGP47645.
4. Фармакодинамические оценки (должны быть проведены в одно и то же время суток в каждый день отбора проб)
* Половые гормоны:
* Тестостерон (общий)
* Эстрадиол (общий)
* Глобулин связывающие половые гормоны (SHBG)
* Биодоступный тестостерон
* Дигидротестостерон (DHT)
Примечание: Свободный тестостерон и свободный эстрадиол рассчитывается из уровней общего тестостерона/эстрадиола и SHBG
* Лютеинизирующий гормон (LH), фолликулостимулирующий гормон (FSH) и ингибины А и В
* Анализ спермы для подсчета и подвижности сперматозоидов, только в том случае, если исследование является открытым для невазэктомированных мужчин
Состав тканей тела (определяемый с помощью двухэнергетической рентгеновской абсорбциометрии)
* Измерения тела
* Масса тела (с расчетом индекса массы тела)
* Обхват талии и бедер (с расчетом соотношения талии и бедер)
* Пероральный тест на толерантность к глюкозе: забор крови за 10 минут до начало нагрузки глюкозой, 0 минут (минут до начало нагрузки глюкозой) , 15, 30, 60, 90, 120 и 180 минут после нагрузки глюкозой.
* Глюкоза
* Инсулин
Индекс инсулинорезистентности (НОМА-IR) и количественный контрольный индекс чувствительности к инсулину (QUICKI, рассчитываемый из данных уровней инсулина и глюкозы натощак)
HBAlc (являются частью лабораторных анализов на безопасность лекарственного препарата)
* Параметры липидов, полученные натощак (липопротеины низкой плотности, липопротеины высокой плотности, триглицериды)
* Биомаркеры костной ткани: С-концевой телопептид (CTxl), остеокальцин, костная щелочная фосфатаза и проколлагенный тип lN-пропептида (PINP)
Оценка функции мышц методом определения способности восхождения по лестнице
* Анкетирование по поводу качества жизни: шкала симптомов старения мужчин (AMS)
Методы анализа - анализ эффективности и фармакодинамический анализ:
Первая часть представляет собой фазу открытого поиска дозы. Основным критерием эффективности является демонстрация в конце 4-ой недели первой части того, что у субъектов, которые получили соответствующую дозу, могут быть нормализованы уровни общего и свободного тестостерона и эстрадиола.
Основной целью второй части исследования является оценка влияния нормализации тестостерона с помощью CGP47645 на чувствительность к инсулину. Данные по первичной переменной эффективности/первичной фармакодинамической переменной, индексу инсулинорезистентности, преобразуют в логарифмическую форму, как для исходных значений, так и для значений, полученных в процессе лечения, и проводят их анализ на основе ковариационного анализа для каждого момента времени в период лечения в качестве переменной классификации, и исходных данных в качестве независимой переменной. Точечные оценки и 95% доверительные интервалы различий при лечении получают ковариационным анализом.
Количественный контрольный индекс чувствительности к инсулину (QUICKI) получают аналогичным образом. Оценивают корреляцию между изменениями уровня тестостерона и изменениями значений индекса инсулинорезистентности (НОМА-IR) или значений количественного контрольного индекса чувствительности к инсулину (QUICKI).
Вторичные переменные эффективности/фармакодинамические переменные, включающие уровни половых гормонов, уровни глюкозы натощак и после приема пищи (AUC и пик), уровень инсулина после приема пищи, HBAlc, уровень липидов натощак, массу тела, отношение обхвата талии к обхвату бедер, уровень лютеинизирующего гормона (LH), уровень фолликулостимулирующего гормона (FSH), уровни ингибина А и В и оценку функции мышц методом определения способности восхождения по лестнице подвергают анализу аналогичным образом. Может быть проведено, в случае необходимости, логарифмическое преобразование данных. Для дистрибутирования данных, требующих для анализа непараметрический подход, используется критерий суммы рангов Уилкоксона.
Данные по биомаркерам костной ткани, С-концевому телопептиду (CTxl), остеокальцину, костной щелочной фосфатазе и проколлагенному типу lN-пропептида (PINP), а также данные по анализу спермы и данные анкетирования по качеству жизни обрабатываются с помощью описательной статистики.
Предварительные результаты первоначального 12-ти недельного лечения, открытой части исследования по нахождению величины дозы: 14 страдающих ожирением гипогонадных мужчин получали еженедельно пероральные дозы от 0,003 мг до 5 мг CGP47645. Например, пациенты получали еженедельно пероральные дозы 0,1 мг в одной дозе, 0,3 мг в одной дозе, от 0,01 мг до 0,03 мг в одной дозе, от 0,003 мг до 0,3 мг в одной дозе, от 0,003 мг до 1 мг в одной дозе, от 0,1 мг до 0,3 мг в одной дозе, от 0,01 мг до 1 мг в одной дозе, от 0,2 мг до 1 мг в одной дозе, от 0,3 мг до 1 мг в одной дозе, от 0,1 мг до 3 мг в одной дозе или от 1 мг до 5 мг в одной дозе. Дозы корректировали с точки зрения нормализации уровня тестостерона, и если кумулятивные воздействия приближались к наибольшим воздействиям исследуемых разовых доз (20 мг) у женщин в постклимактерическом периоде, то дозирование прекращалось в течение последующих 12 недель. Все субъекты хорошо переносили CGP47645 без частых побочных эффектов, при отсутствии тяжелых побочных эффектов и отсутствии синдромов отмены лекарственного средства. Предварительный анализ показывает, что уровень тестостерона (измеряемый методом радиоиммунного анализа) во время лечения возрастал индивидуально у всех мужчин в пределах нормы и, в среднем, в пределах нормы. Предварительные результаты указывают, что среднее изменение тестостерона от исходного уровня до уровня на 12-й неделе составляло приблизительно в 2 раза (от 250±22,3 нг/дл до 550+191,8 нг/дл). На основании дополнительного предварительного анализа, уровень эстрадиола в сыворотке (измеряемый методом жидкостной хроматографии-масс-спектрометрии) понижался приблизительно на 30-50% (среднее изменение от исходного уровня до 12-й недели составляет от 24±4,9 пг/мл до 18±9,4 пг/мл), но не окончательно подавлялся (нижний предел определения 2 пг/мл), согласно высокочувствительному методу жидкостной хроматографии-масс-спектрометрии.
ЦИТИРУЕМАЯ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
* Barry MJ, Fowler FJ, O'leary MP et al., (1992). The American Urological Association Symptom Index for benign prostatic hyperplasia. Journal of Urology, 148:154 9-1557.
Bathnagar, et al., (1996), Pharmacology of Nonsteroidal Aromatase Inhibitors, in "Hormone-dependent cancer" By Jorge R. Pasgualini, Benita S. Katzenellenbogen, Published by Informa Health Care, 1996, ISBN 0824796977, pp. 155-168.
* Batzl-Hartmann et al., (1994) Pharmacological Profile of CGP47645, a new nonsteroidal aromatase inhibitor with a long duration of action. In: Rao et al., eds. Proceedings of the XVI International Cancer Congress, Bologna: Monduzzi Editore, 1994: 3041-3047.
* Bhasin S, Cunningham GR, Hayes FJ, Matsumoto AM, Snyder PJ, Swerdloff RS and Montori VM (2006). Testosterone Therapy in Adult Men with Androgen Deficiency Syndromes: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism, 91:1995-2010.
* de Boer H, Verschoor L, Ruinemans-Koerts J and Jansen M (2005). Letrozole normalizes serum testosterone in severely obese men with hypogonadotropic hypogonadism. Diabetes, Obesity and Metabolism, 7: 21 1-215.
* EP 490 816 и US 5637605.
* Hofstra J, Loves S, van Wageningen B, Ruinemans-Koerts J, Janssen H and de Boer H (2008). High prevalence of hypogonadotropic hypogonadism in men referred for obesity treatment. Netherlands journal of medicine, 66: 103-109.
* Kapoor D, Aldred H, Clark S, Channer KS and Jones TH (2007). Clinical and Biochemical Assessment of Hypogonadism in Men With Type 2 Diabetes. Diabetes Care, 30: 91 1-917.
* Kapoor D, Goodwin E, Channer KS, Jones TH (2006). Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol. 2006 Jun;154(6):899-906.
* Lapauw B, T'Sjoen G, Mahmoud A, Kaufman JM and Ruige JB (2009). Short-term aromatase inhibition: effects on glucose metabolism and serum leptin levels in young and elderly men. European Journal of Endocrinology, 160: 397-402.
Loves S, Ruinemans-Koerts J and de Boer H (2008). Letrozole once a week normalizes serum testosterone in obesity-related male hypogonadism. European Journal of Endocrinology, 158: 741-747.
* Maggio M, Basaría S (2009). Welcoming low testosterone as a cardiovascular risk factor. International Journal of Impotence Research 21: 261-264.
* Medras M, Jozkov Pawel and Slowinska-Lisowska M (2007). Serum, Seminal Plasma, and Sperm Count Monitoring During Treatment of Idiopathic Gynecomastia With an Aromatase Inhibitor. The Endocrinologist, 17: 302-305.
* Naharci Ml, Pinar M, Bolu Ε and Olgun A (2007). Effect of testosterone on insulin sensitivity in men with idiopathic hypogonadotropic hypogonadism. Endocrine Practice, 13: 629-635.
- Trunet PF, Mueller PH, Bhatnagar AS, Dickes I, Monnet G and White G (1993) . Open Dose-Finding Study of a New Potent and Selective Nonsteroidal Aromatase Inhibitor, CGS 20 267, in Healthy Male Subjects. The Journal of Clinical Endocrinology & Metabolism, 77: 319-232.
Различные характерные черты и варианты осуществления настоящего изобретения, упоминаемые выше в конкретных разделах описания, могут использоваться, если в этом есть необходимость, с соответствующими изменениями в других разделах. Следовательно, характерные черты, указанные в одном разделе, могут быть объединены с характерными чертами, указанными в других разделах, если в этом есть необходимость.
Для специалистов в этой области является очевидным или они могут указать, не проводя дополнительно какого-либо обычного эксперимента, много эквивалентов для конкретных описанных вариантов осуществления изобретения. Предполагается, что такие эквиваленты входят в объем следующих далее пунктов формулы изобретения.

