Результат интеллектуальной деятельности: ПЕГИЛИРОВАННЫЕ ЛИПОСОМЫ ДЛЯ ДОСТАВКИ КОДИРУЮЩЕЙ ИММУНОГЕН РНК
Вид РИД
Изобретение
Настоящая заявка испрашивает приоритет предварительной заявки на патент США № 61/529,878, которая была подана 31 августа 2011 г, полное содержание которой во всех аспектах включено в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области невирусной доставки РНК для иммунизации.
УРОВЕНЬ ТЕХНИКИ
Доставка нуклеиновых кислот для иммунизации животных являлась целью в течение нескольких лет. Испытывались различные подходы, включая применение ДНК или РНК, вирусных или невирусных векторов доставки (или даже без вектора доставки, в «голой» вакцине), реплицирующихся или нереплицирующихся векторов или вирусных или невирусных векторов.
Остается потребность в дополнительных и усовершенствованных вакцинах из нуклеиновых кислот и, в частности, в усовершенствованных путях доставки вакцин из нуклеиновых кислот.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с изобретением иммунизация нуклеиновой кислотой достигается доставкой РНК, инкапсулированной внутрь липосомы. РНК кодирует представляющий интерес иммуноген. Липосома включает пегилированный липид, т.е., липид модифицирован ковалентным присоединением полиэтиленгликоля. ПЭГ обеспечивает липосомы покрытием, которое может обеспечить благоприятные фармакокинетические характеристики, например, он может увеличить устойчивость и предотвратить неспецифическое всасывание липосом. Заявители обнаружили, что длина ПЭГ может воздействовать на экспрессию in vivo инкапсулированной РНК, и, таким образом, в изобретении используются липосомы, которые содержат ПЭГ, имеющий среднюю молекулярную массу более 3 кДа, но меньше, чем 11 кДа. ПЭГ с молекулярной массой меньше 1 кДа (например, 500 или 750 Да) не образует устойчивые липосомы, и липосомы, образованные с ПЭГ в диапазоне 1-3 кДа, проявили более низкую эффективность в экспериментах по изучению иммуногенности (см. ниже).
Таким образом, изобретение относится к липосоме, внутрь которой инкапсулирована РНК, кодирующая представляющий интерес иммуноген, причем липосома содержит по меньшей мере один липид, который включает полиэтиленгликолевую составляющую, так что полиэтиленгликоль присутствует на наружной поверхности липосомы, причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 1 кДа. Эти липосомы пригодны для доставки in vivo РНК в клетку позвоночного, и поэтому они могут применяться в качестве компонентов в фармацевтических композициях для иммунизации индивидов против различных заболеваний.
Изобретение также относится к способу получения содержащей РНК липосомы, включающему стадию смешивания РНК с одним или несколькими липидами, в таких условиях, чтобы липиды образовывали липосому, в которой инкапсулирована РНК, причем по меньшей мере один липид включает полиэтиленгликолевую составляющую, которая становится расположенной на наружной поверхности липосомы в течение выполнения способа, и причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 1 кДа.
Липосома
В изобретении используются липосомы, внутрь которых инкапсулирована кодирующая иммуноген РНК. Таким образом, РНК (как в натуральном вирусе) отделена от любой внешней среды. Было обнаружено, что инкапсуляция внутрь липосомы защищает РНК от переваривания РНКазой. Липосомы могут включать некоторое количество наружной РНК (например, на их поверхности), но по меньшей мере половина РНК (а в идеале она вся) инкапсулирована в ядре липосомы. Инкапсуляция внутрь липосом отличается, например, от комплексов липид/РНК, описанных в ссылке 1, где РНК смешивается с предварительно образованными липосомами.
Различные амфифильные липиды могут образовывать бислои с водной средой для инкапсуляции содержащего РНК водного ядра в качестве липосомы. Эти липиды могут иметь анионную, катионную или цвиттерионную гидрофильную головную группу. Образование липосом из анионных фосфолипидов было описано еще в 1960-е годы, а катионные образующие липосомы липиды исследовали с 1990-х годов. Некоторые фосфолипиды являются анионными, тогда как другие являются цвиттерионными, а еще одни являются катионными. Подходящие классы фосфолипидов включают без ограничения фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины и фосфатидилглицерины, и некоторые полезные фосфолипиды перечислены в таблице 1. Полезные катионные липиды включают без ограничения диолеоилтриметиламмонийпропан (DOTAP), 1,2-дистеарилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметил-3-аминопропан (DLenDMA); дополнительные полезные катионные липиды описаны в ссылках 2 и 3. Цвиттерионные липиды включают без ограничения цвиттерионные липиды с ацильной группой и цвиттерионные липиды с группами простого эфира. Примерами полезных цвиттерионных липидов являются DPPC, DSPC, DOPC, додецилфосфохолин, 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE) и 1,2-дифитаноил-sn-глицеро-3-фосфоэтаноламин (DPyPE). Липиды могут быть насыщенными или ненасыщенными. Предпочтительно использование по меньшей мере одного ненасыщенного липида для получения липосом. Если ненасыщенный липид имеет два «хвоста», то оба «хвоста» могут быть ненасыщенными, или он может иметь один насыщенный «хвост» и один ненасыщенный «хвост». Липид может включать стероидную группу в одном «хвосте», например, как в RV05.
Таким образом, в одном варианте осуществления изобретение относится к липосоме, имеющей липидный бислой, инкапсулирующий водное ядро, причем: (i) липидный бислой содержит по меньшей мере один липид, который включает полиэтиленгликолевую составляющую, так что полиэтиленгликоль присутствует на наружной поверхности липосомы, причем средняя молекулярная масса полиэтиленгликоля составляет более 3 кДа, но меньше, чем 11 кДа; и (ii) водное ядро включает РНК, которая кодирует иммуноген.
Липосомы по изобретению могут быть образованы из одного липида или из смеси липидов. Смесь может содержать (i) смесь анионных липидов, (ii) смесь катионных липидов, (iii) смесь цвиттерионных липидов, (iv) смесь анионных липидов и катионных липидов, (v) смесь анионных липидов и цвиттерионных липидов, (vi) смесь цвиттерионных липидов и катионных липидов или (vii) смесь анионных липидов, катионных липидов и цвиттерионных липидов. Аналогичным образом, смесь может содержать и насыщенные, и ненасыщенные липиды. Например, смесь может содержать DSPC (цвиттерионный, насыщенный), DlinDMA (катионный, ненасыщенный), и/или DMG (анионный, насыщенный). Когда используется смесь липидов, то не все составляющие липиды в смеси должны быть амфифильными, например, один или несколько амфифильных липидов могут быть смешаны с холестерином.
Когда липосома по изобретению образована из смеси липидов, то предпочтительно, чтобы доля этих липидов, которые являются пегилированными, как описано здесь, составляла меньше, чем 10% от общего количества липидов, например, от 0,5 до 5%, от 1 до 4%, или примерно 2%. Например, ниже показаны липосомы, в которых 2% общего количества липидов составляет ПЭГ-DMG. Остальная часть может быть получена, например, их холестерина (например, 35-50% холестерина) и/или катионного липида (например, 30-70%) и/или DSPC (например, 5-15%). Такие смеси используются ниже. Эти процентные величины представляют собой моль проценты.
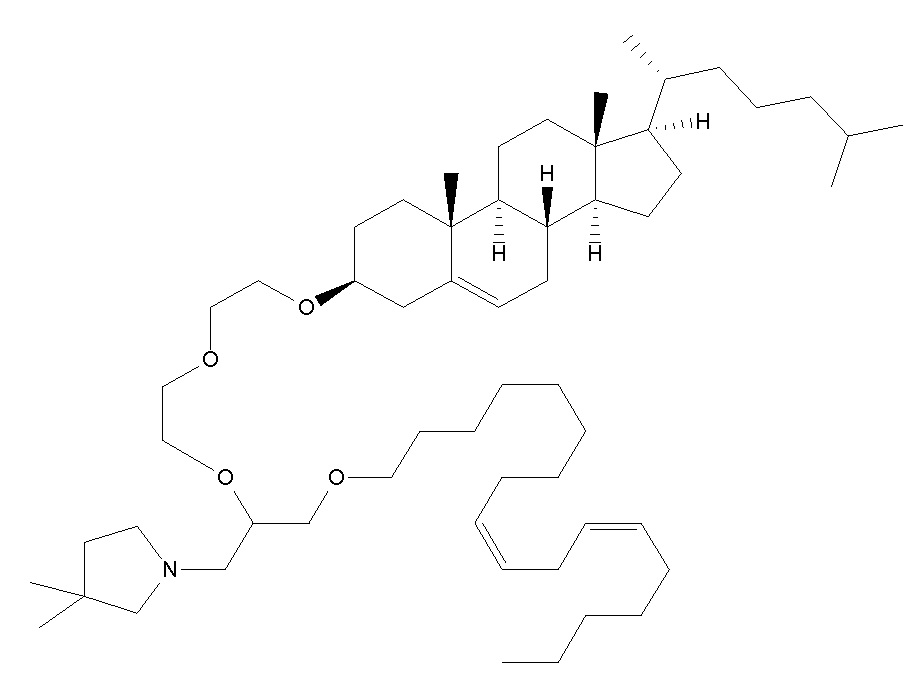
Таким образом, липосома может быть образована из катионного липида (например, DlinDMA, RV05), цвиттерионного липида (например, DSPC, DPyPE), холестерина и пегилированного липида. Смесь DSPC, DlinDMA, ПЭГ-DMG и холестерина используется в примерах, а также несколько других смесей.
По меньшей мере один липид внутри липосомы включает полиэтиленгликолевую составляющую. Липосомы, которые включают эти пегилированные липиды, имеют ПЭГ, ориентированный так, чтобы он присутствовал по меньшей мере на наружной поверхности липосомы (но некоторое количество ПЭГ может быть также подвержено воздействию внутренней среды липосомы, т.е., водного ядра). Эта ориентация может быть достигнута прикреплением ПЭГ к соответствующей части липида. Например, в амфифильном липиде ПЭГ следовало бы прикрепить к гидрофильной головке, поскольку именно эта головка ориентируется в сторону обращенной к воде наружной поверхности липидного бислоя. Пегилирование такого типа может быть достигнуто ковалентным присоединением ПЭГ к липиду, например, с использованием таких технологий как технологии, описанные в ссылках 4 и 5.
Таким образом, пегилированные липиды содержат ПЭГ, имеющий структуру:
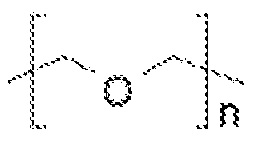
где n обозначает молекулярную массу для ПЭГ выше 3 кДа, но меньше, чем 11 кДа, например, 69 или более, или от 70 до 240, или примерно 113 для пегилирования 5 кДа.
Составляющая ПЭГ может заканчиваться -O-метильной группой, и, таким образом, пегилированный липид может содержать:
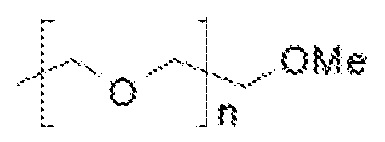
Поэтому, включающий присоединение к азоту в головной группе липида, пегилированный липид, используемый в настоящем изобретении, может содержать:
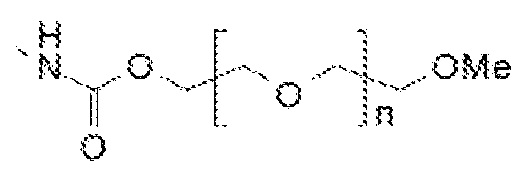
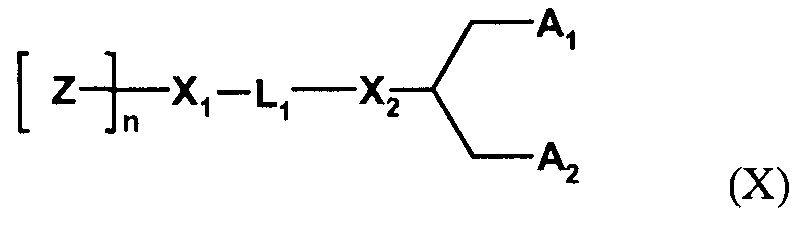
Один пригодный пегилированный липид для использования в изобретении представляет собой ПЭГ-DMG, используемый в примере. Могут использоваться другие пегилированные липиды, например, липиды формулы (X):
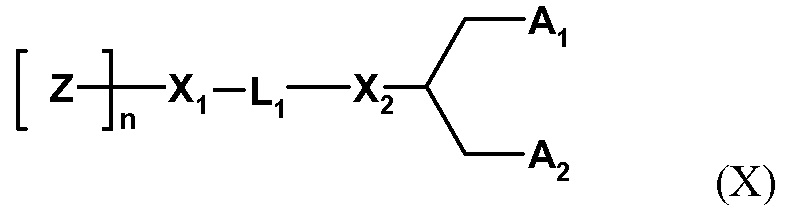
где Z обозначает компонент гидрофильной головной группы, выбранный из ПЭГ и полимеров на основе поли(оксазолина), поли(этиленоксида), поли(винилового спирта), поли(глицерина), поли(N-винилпирролидона), поли[N-(2-гидроксипропил)метакриламида] и поли(аминокислот), причем полимер может быть линейным или разветвленным, и причем полимер может быть необязательно замещенным;
Z полимеризирована n субъединицами;
n обозначает среднечисловую степень полимеризации от 10 до 200 единиц Z (и может оптимизироваться для различных групп Z);
L1 обозначает необязательно замещенный C1-10 алкиленовый или C1-10 гетероалкиленовый линкер, включающий ноль, один или два из простого эфира (например, -O-), сложного эфира (например, -C(O)O-), сукцината (например, -O(O)C-CH2-CH2-C(O)O-)), карбамата (например, -OC(O)-NR'-), карбоната (например, -OC(O)O-), (например, -NRC(O)NR'-), амина (например, -NR'-), амида (например, -C(O)NR'-), имина (например, -C(NR')-), тиоэфира (например, -S-), ксантана (например, -OC(S)S-) и фосфодиэфира (например, -OP(O)2O-), где R' независимо выбран из -H, -NH-, -NH2, -O-, -S-, фосфата или необязательно замещенного C1-10 алкилена;
X1 и X2 независимо выбраны из углерода или гетероатома, выбранного из - NH-, -O-, -S- или фосфата;
A1 и A2 независимо выбраны из C6-30 алкила, C6-30 алкенила и C6-30 алкинила, где A1 и A2 могут быть одинаковыми или различными, или A1 и A2 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный стероид.
Липосома по изобретению обычно включает большое число ПЭГ составляющих, которые могут быть одинаковыми или различными. Средняя молекулярная масса ПЭГ в липосоме по изобретению составляет более 3 кДа, но меньше, чем 11 кДа, например, от 3,5 до 9 кДа, от 4 до 7,5 кДа, от 4,5 до 6 кДа, от 4,8 до 5,5 кДа или 5 кДа. Таким образом, ПЭГ может представлять собой ПЭГ, который общеизвестен как «ПЭГ 5000» или «ПЭГ 5k». В некоторых вариантах осуществления изобретение не охватывает липосомы, которые содержат конъюгированный с ПЭГ липид, в котором ПЭГ имеет среднюю молекулярную массу 8 кДа; в некоторых вариантах осуществления изобретение не включает липосомы, которые содержат конъюгированный с ПЭГ липид, в котором ПЭГ имеет среднюю молекулярную массу от 7,9 до 8,1 кДа.
ПЭГ обычно содержит линейные полимерные цепи, но в некоторых вариантах осуществления ПЭГ может содержать разветвленные полимерные цепи.
В некоторых вариантах осуществления ПЭГ может представлять собой замещенный ПЭГ, например, в котором один или несколько атомов углерода в полимере замещен одним или несколькими алкильными, алкокси, ацильными или арильными группами.
В некоторых вариантах осуществления ПЭГ может включать coполимерные группы, например, один или несколько пропиленовых мономеров, для образования ПЭГ полипропиленового полимера.
В качестве альтернативы пегилированию, липид может быть модифицирован ковалентным присоединением составляющей, отличной от ПЭГ. Например, в некоторых вариантах осуществления липид может включать полифосфазен. В некоторых вариантах осуществления липид может включать поли(винилпирролидон). В некоторых вариантах осуществления липид может включать поли(акриламид). В некоторых вариантах осуществления липид может включать поли(2-метил-2-оксазолин). В некоторых вариантах осуществления липид может включать поли(2-этил-2-оксазолин). В некоторых вариантах осуществления липид может включать фосфатидилполиглицерин. В некоторых вариантах осуществления липид может включать поли[N-(2-гидроксипропил)метакриламид]. В некоторых вариантах осуществления липид может включать полиалкиленэфирный полимер, отличный от ПЭГ.
Липосомы обычно делятся на три группы: мультиламеллярные везикулы (MLV); мелкие униламеллярные везикулы (SUV); и крупные униламеллярные везикулы (LUV). MLV имеют множественные бислои в каждой везикуле, образующие несколько отдельных водных компартментов. SUV и LUV имеют один бислой, инкапсулирующий водное ядро; SUV обычно имеют диаметр ≤50 нм, и LUV имеют диаметр >50 нм. Липосомы по изобретению представляют собой в идеале LUV с диаметром в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм.
Липосома по изобретению может представлять собой часть композиции, содержащей множество липосом, и липосомы внутри множества могут иметь диапазон диаметров. Для композиции, содержащей популяцию липосом с различными диаметрами: (i) по меньшей мере 80% по числу липосом должны иметь диаметры в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм, и/или (ii) средний диаметр (по интенсивности, например, Z-средний) популяции находится в идеале в диапазоне 60-180 нм и предпочтительно в диапазоне 80-160 нм. Диаметры внутри множества в идеале должны иметь индекс полидисперсии <0,2. Ожидается, что комплексы липосомы/РНК согласно ссылке 1 имеют диаметр в диапазоне 600-800 нм и имеют высокую полидисперсность.
Технологии получения пригодных липосом хорошо известны в данной области техники, например, см. ссылки 6-8. Один полезный способ описан в ссылке 9 и включает смешивание (i) этанолового раствора липидов, (ii) водного раствора нуклеиновой кислоты и (iii) буфера, с последующим смешиванием, уравновешиванием, разбавлением и очисткой. Предпочтительные липосомы по изобретению могут быть получены этим способом смешивания.
Для получения липосом с желательным диаметрами, смешивание можно выполнять, используя способ, при котором два потока подачи водного раствора РНК объединяются в одной зоне с одним потоком этанольного раствора липида, все с одинаковой скоростью потока, например, в микрожидкостном канале, как описано ниже.
РНК
Липосомы по изобретению включают молекулу РНК, которая (в отличии siРНК (малой интерферирующей РНК), как в ссылке 4) кодирует иммуноген. После введения частиц in vivo, РНК высвобождается из частиц и транслируется внутрь клетки для обеспечения иммуногена in situ.
РНК является +-нитевой, и поэтому она может транслироваться клетками без необходимости каких-либо промежуточных стадий репликации, таких как обратная транскрипция. Она может также связываться с рецепторами TLR7, экспрессируемыми иммунными клетками, посредством этого, инициируя адъювантный эффект.
Предпочтительные +-нитевые РНК являются самореплицирующимися. Самореплицирующаяся молекула РНК (репликон) может при доставке в клетку позвоночного даже без каких-либо белков привести к продукции множественных дочерних РНК путем транскрипции из нее самой (через антисмысловую копию, которую она генерирует из нее самой). Таким образом, самореплицирующаяся молекула РНК представляет собой обычно молекулу +-нити, которая может быть непосредственно транслирована после доставки в клетку, и эта трансляция обеспечивает РНК-зависимую РНК-полимеразу, которая затем продуцирует и антисмысловые, и смысловые транскрипты из доставленной РНК. Таким образом, доставленная РНК ведет к продукции множественных дочерних РНК. Эти дочерние РНК, а также коллинеарные субгеномные транскрипты могут сами транслироваться для обеспечения экспрессии in situ кодированного иммуногена или могут быть транскрибированы для обеспечения дополнительных транскриптов с таким же смыслом как доставлен, которые транслируются для обеспечения экспрессии иммуногена in situ. Общим результатом этой последовательности транскрипций является огромная амплификация ряда внесенных РНК репликона, и, таким образом, кодированный иммуноген становится основным полипептидным продуктом клеток.
Одна подходящая система для достижения саморепликации представляет собой использование РНК репликона на основе альфавируса. Эти +-нитевые репликоны транслируются после доставки в клетку для получения репликазы (или репликазы-транскриптазы). Репликаза транслируется в виде полипротеина, который ауторасщепляется для обеспечения репликационного комплекса, который создает геномные --нитевые копии +-нитевой доставленной РНК. Эти --нитевые транскрипты могут сами быть транскрибированы для получения дополнительных копий +-нитевой материнской РНК, а также для получения субгеномного транскрипта, который кодирует иммуноген. Таким образом, трансляция субгеномного транскрипта ведет к экспрессии in situ иммуногена инфицированной клеткой. Подходящие алфавирусные репликоны могут использовать репликазу из вируса Синдбис, вируса леса Семлики, вируса восточного лошадиного энцефалита, вируса Венесуэльского лошадиного энцефалита (VEEV) и т.д. Могут использоваться последовательности мутантных вирусов или вирусов дикого типа, например, в репликонах использовался аттенуированный мутант TC83 VEEV [10].
Таким образом, предпочтительная самореплицирующаяся молекула РНК кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК из самореплицирующейся молекулы РНК и (ii) иммуноген. Полимераза может представлять собой репликазу альфавируса, например, содержащую один или несколько альфавирусных белков nsP1, nsP2, nsP3 и nsP4.
В то время как натуральные альфавирусные геномы кодируют структурные белки вириона в дополнение к неструктурному полипротеину репликазы, предпочтительно, чтобы самореплицирующаяся молекула РНК по изобретению не кодировала альфавирусные структурные белки. Таким образом, предпочтительная самореплицирующаяся РНК может вести к продукции собственных копий геномной РНК в клетке, но не к продукции содержащих РНК вирионов. Неспособность продуцировать эти вирионы означает, что, в отличие от алфавируса дикого типа, сама самореплицирующаяся молекула РНК не может сохраняться в инфекционной форме. Альфавирусные структурные белки, которые необходимы для сохранения в вирусах дикого типа, отсутствуют в самореплицирующихся РНК по изобретению, и их место занимают ген(-ы), кодирующие представляющий интерес иммуноген, с тем, чтобы субгеномный транскрипт кодировал иммуноген, а не структурные белки вириона альфавируса.
Таким образом, самореплицирующаяся молекула РНК, полезная для изобретения, может иметь две открытые рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует иммуноген. В некоторых вариантах осуществления РНК может иметь дополнительные (например, находящиеся ниже по ходу транскрипции) открытые рамки считывания, например, для кодирования дополнительных иммуногенов (см. ниже) или для кодирования дополнительных полипептидов.
Самореплицирующаяся молекула РНК может иметь 5'-последовательность, которая совместима с кодированной репликазой.
Самореплицирующиеся молекулы РНК могут иметь различные длины, но они обычно имеют длину 5000-25000 нуклеотидов, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов. Таким образом, РНК длиннее, чем наблюдаемая при доставке миРНК.
Молекула РНК, полезная для изобретения, может иметь 5'-кэп (например, 7-метилгуанозин). Этот кэп может усилить трансляцию РНК in vivo.
5'-Нуклеотид молекулы РНК, полезной для изобретения, может иметь группу трифосфата на 5' конце. В кэппированной РНК она может быть связана с 7-метилгуанозином через мостик 5'-к-5'. Трифосфат на 5' конце может усиливать связывание RIG-I и, таким образом, может стимулировать адъювантные эффекты.
Молекула РНК может иметь поли-A хвост на 3' конце. Она может также включать последовательность, отвечающую за распознавание поли-A полимеразы (например, AAUAAA) около ее 3' конца.
Молекула РНК, полезная для изобретения, обычно является однонитевой. Однонитевые РНК могут в целом инициировать адъювантный эффект связыванием с TLR7, TLR8, геликазами РНК и/или PKR. РНК, доставленная в двухнитевой форме (dsРНК), может связываться с TLR3, и этот рецептор может также запускаться dsРНК, которая образуется или во время репликации однонитевой РНК, или внутри вторичной структуры однонитевой РНК.
Молекула РНК, полезная для изобретения, может быть для удобства получена транскрипцией in vitro (IVT). При IVT может использоваться матрица (кДНК), созданная и распространенная в форме плазмиды в бактерии, или созданная синтетически (например, способами генной инженерии в виде синтеза генов и/или полимеразной цепной реакции (ПЦР)). Например, ДНК-зависимая РНК-полимераза (такая как РНК-полимеразы бактериофага T7, T3 или SP6) может использоваться для транскрипции РНК с ДНК-матрицы. При необходимости, могут использоваться соответствующие реакции кэппирования и поли-присоединения (хотя Поли-A репликонов обычно кодируется в пределах ДНК-матрицы). Эти РНК-полимеразы могут иметь жесткие требования к нуклеотиду(-ам) с 5'-конца, и в некоторых вариантах осуществления эти требования должны соответствовать требованиям кодированных репликаз для обеспечения того, чтобы IVT-транскрибированная РНК могла эффективно функционировать в качестве субстрата для ее самокодирующихся репликаз.
Как обсуждается в ссылке 11, самореплицирующаяся РНК может включать (в дополнение к любой структуре 5'-кэпа) один или несколько нуклеотидов, имеющих модифицированное нуклеооснование. Например, самореплицирующиеся РНК могут включать одно или несколько модифицированных пирмидиновых нуклеооснований, таких как псевдоуридинновые и/или 5-метилцитозиновые остатки. Однако в некоторых вариантах осуществления РНК не включает модифицированные нуклеооснования и может не включать модифицированные нуклеотиды, т.е., все нуклеотиды в РНК являются стандартными A, C, G и U рибонуклеотиды (за исключением, любой структуры 5'-кэпа, которая может включать 7'-метилгуанозин). В других вариантах осуществления РНК может включать 5'-кэп, содержащий 7'-метилгуанозин, и первые 1, 2 или 3 рибонуклеотида 5'-конца могут быть метилированы в положении 2' рибозы.
РНК, используемая в изобретении, в идеале включает только фосфодиэфирные связи между нуклеозидами, но в некоторых вариантах осуществления она может содержать фосфорамидатные, фосфортиоатные и/или метилфосфонатные связи.
В идеале, липосома включает менее 10 различных видов РНК, например, 5, 4, 3 или 2 различных вида; наиболее предпочтительно, липосома включает один вид РНК, т.е., все молекулы РНК в липосоме имеют одинаковую последовательность и одинаковую длину.
Количество РНК на липосому может варьироваться. Число отдельных молекул самореплицирующейся РНК на липосому составляет обычно ≤50, например, <20, <10, <5 или 1-4 на липосому.
Иммуноген
Молекулы РНК, используемые в изобретении, кодируют полипептидный иммуноген. После введения липосомы РНК транслируется in vivo, и иммуноген может вызвать иммунный ответ у реципиента. Иммуноген может вызвать иммунный ответ на бактерию, вирус, гриб или паразит (или в некоторых вариантах осуществления на аллерген; и в других вариантах осуществления на опухолевой антиген). Иммунный ответ может включать реакцию антител (обычно включающую IgG) и/или клеточно-опосредованный иммунный ответ. Полипептидный иммуноген обычно вызывает иммунный ответ, который распознает соответствующий бактериальный, вирусный, грибковый или паразитарный (или алергенный или опухолевой) полипептид, но в некоторых вариантах осуществления полипептид может действовать в качестве мимотопа для вызова иммунного ответа, который распознает бактериальный, вирусный, грибковый или паразитарный сахарид. Иммуноген обычно представляет собой поверхностный полипептид, например, адгезин, гемагглютинин, оболочечный гликопротеин, спайковый гликопротеин и т.д.
Молекула РНК может кодировать один полипептидный иммуноген или множество полипептидов. Множественные иммуногены могут быть представлены в виде одного полипептидного иммуногена (слитого полипептида) или в виде отдельных полипептидов. Если иммуногены экспрессируются в виде отдельных полипептидов из репликона, то один или несколько из них могут быть обеспечены находящимся выше по ходу транскрипции IRES или дополнительным вирусным промоторным элементом. Альтернативно, множественные иммуногены могут быть экспрессированы из полипротеина, который кодирует отдельные иммуногены, слитые с короткой аутокаталитической протеазой (например, белка вируса ящура 2A), или в виде интеинов.
В отличие от ссылок 1 и 12, РНК кодирует иммуноген. Во избежание сомнений, изобретение не охватывает РНК, которая кодирует люциферазу светляков, или которая кодирует слитый белок β-галактозидазы E.coli, или которая кодирует зеленый флуоресцентный белок (GFP). Такие полипептиды могут использоваться в качестве маркеров, или даже в контексте генной терапии, но изобретение относится к доставке РНК для вызова системы иммунологического ответа. Таким образом, иммуноген также сам не является белком, который подается для дополнения или замещения дефективного белка хозяина (в качестве генной терапии). РНК также не является полностью РНК мышиного тимуса.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на одну из этих бактерий:
Neisseria meningitidis: полезные иммуногены включают без ограничения мембранные белки, такие как адгезины, аутотранспортеры, токсины, белки приобретения железа и фактор H связывающий белок. Комбинация трех полезных полипептидов описана в ссылке 13.
Streptococcus pneumoniae: полезные полипептидные иммуногены описаны в ссылке 14. Они включают без ограничения субъединицу фимбрии RrgB, предшественник бета-N-ацетилгексозаминидазы (spr0057), spr0096, Общий стрессовый белок GSP-781 (spr2021, SP2216), серин/треонинкиназу StkP (SP1732) и пневмококковый поверхностный адгезин PsaA.
Streptococcus pyogenes: полезные иммуногены включают без ограничения полипептиды, описанные в ссылках 15 и 16.
Moraxella catarrhalis.
Bordetella pertussis: Полезные коклюшные иммуногены включают без ограничения коклюшный токсин или токсоид (PT), нитевидный гемагглютинин (FHA), пертактин и агглютиногены 2 и 3.
Staphylococcus aureus: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 17, такие как гемолизин, esxA, esxB, связывающий феррихром белок (sta006) и/или липопротеин sta0l1.
Clostridium tetani: типичный иммуноген представляет собой столбнячный токсоид.
Cornynebacterium diphtheriae: типичный иммуноген представляет собой дифтерийный токсоид.
Haemophilus influenzae: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылках 18 и 19.
Pseudomonas aeruginosa
Streptococcus agalactiae: полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 15.
Chlamydia trachomatis: Полезные иммуногены включают без ограничения PepA, LcrE, ArtJ, DnaK, CT398, OmpH-подобный, L7/L12, OmcA, AtoS, CT547, Eno, HtrA и MurG {например, как описано в ссылке 20. LcrE [21] и HtrA [22] представляют собой два предпочтительных иммуногена.
Chlamydia pneumoniae: Полезные иммуногены включают без ограничения полипептиды, описанные в ссылке 23.
Helicobacter pylori: Полезные иммуногены включают без ограничения CagA, VacA, NAP и/или уреазу [24].
Escherichia coli: Полезные иммуногены включают без ограничения иммуногены, происходящие из энтеротоксигенной E. coli (ETEC), энтероагрегативной E. coli (EAggEC), диффузно сцепляющейся E. coli (DAEC), энтеропатогенной E. coli (EPEC), внекишечной патогенной E. coli (ExPEC) и/или энтерогеморрагической E. coli (EHEC). Штаммы ExPEC включают уропатогенную E.coli (UPEC) и связанную с менингитом/сепсисом E.coli (MNEC). Полезные полипептидных иммуногенов UPEC описаны в ссылках 25 и 26. Полезные иммуногены MNEC описаны в ссылке 27. Полезный иммуноген для нескольких типов E.coli является AcfD [28].
Bacillus anthracis
Yersinia pestis: Полезные иммуногены включают без ограничения те, которые описаны в ссылках 29 и 30.
Staphylococcus epidermis
Clostridium perfringens или Clostridium botulinums
Legionella pneumophila
Coxiella burnetii
Brucella, такая как B.abortus, B.canis, B.melitensis, B.neotomae, B.ovis, B.suis, B.pinnipediae.
Francisella, такая как F.novicida, F.philomiragia, F.tularensis.
Neisseria gonorrhoeae
Treponema pallidum
Haemophilus ducreyi
Enterococcus faecalis или Enterococcus faecium
Staphylococcus saprophyticus
Yersinia enterocolitica
Mycobacterium tuberculosis
Rickettsia
Listeria monocytogenes
Vibrio cholerae
Salmonella typhi
Borrelia burgdorferi
Porphyromonas gingivalis
Klebsiella
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на один из этих вирусов:
Orthomyxovirus: Полезные иммуногены могут быть из вируса A, B или C, такие как гемагглютинин, нейраминидаза или матричные белки M2. Когда иммуноген представляет собой гемагглютинин вируса гриппа, то он может быть из любого подтипа, например, H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 или H16.
Вирусы Paramyxoviridae: Вирусные иммуногены включают без ограничения те, которые происходят из пневмовирусов (например, респираторный синцитиальный вирус, RSV), рубулавирусов (например, вирус эпидемического паротита), парамиксовирусов (например, вирус парагриппа), метапневмовирусов и морбилливирусов (например, вирус кори).
Poxviridae: Вирусные иммуногены включают без ограничения те, которые происходят из ортопоксивируса, таких как Variola vera, включая без ограничения Variola major и Variola minor.
Picornavirus: Вирусные иммуногены включают без ограничения те, которые происходят из пикорнавирусов, таких как энтеровирусы, риновирусы, гепаранвирусы, кардиовирусы и афтовирусы. В одном варианте осуществления энтеровирус представляет собой полиовирус, например, полиовирус типа 1, типа 2 и/или типа 3. В другом варианте осуществления энтеровирус представляет собой EV71 энтеровирус. В другом варианте осуществления энтеровирус представляет собой вирус коксаки или вирус B.
Bunyavirus: Вирусные иммуногены включают без ограничения те, которые происходят из Orthobunyavirus, таких как вирус калифорнийского энцефалита, из флебовируса, такого как вирус лихорадки Рифтовой долины, или из Nairovirus, такого как вирус Крымской-Конголезской геморрагической лихорадки.
Heparnavirus: Вирусные иммуногены включают без ограничения те, которые происходят из гепарнавируса, такого как вирус гепатита A (HAV).
Filovirus: Вирусные иммуногены включают без ограничения те, которые происходят из филовируса, такого как вирус Эбола (включая эболавирус Заира, Берега Слоновой Кости, Рестона или Судана) или Марбургский вирус.
Togavirus: Вирусные иммуногены включают без ограничения те, которые происходят из Togavirus, такие как Rubivirus, Alphavirus или Arterivirus. Он включает вирус краснухи.
Flavivirus: Вирусные иммуногены включают без ограничения те, которые происходят из флавивируса, такого как вирус клещевого энцефалита (TBE), вирус денге (типов 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус Кьясанурского леса, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус русского весенне-летнего энцефалита, вирус энцефалита Повассан.
Pestivirus: Вирусные иммуногены включают без ограничения те, которые происходят из пестивируса, такого как вирус бычьей вирусной диареи (BVDV), вирус классической свиной лихорадки (CSFV) или вирус болезни Бордера (BDV).
Hepadnavirus: Вирусные иммуногены включают без ограничения те, которые происходят из гепаднавируса, такого как вирус гепатита B. Композиция может включать поверхностный антиген вируса гепатита B (HBsAg).
Другие вирусы гепатита: Композиция может включать иммуноген из вируса гепатита C, вирус гепатита дельта, вирус гепатита E или вирус гепатита G.
Rhabdovirus: Вирусные иммуногены включают без ограничения те, которые происходят из рабдовируса, такие как лиссавирус (например, вирус бешенства) и везикуловирус (VSV).
Caliciviridae: Вирусные иммуногены включают без ограничения те, которые происходят из Calciviridae, такие как вирус Норфолк (норовирус) и вирусы, подобные Норфолк, такие как гавайский вирус и вирус Снежных Гор.
Coronavirus: Вирусные иммуногены включают без ограничения те, которые происходят из коронавируса SARS (тяжелого острого респираторного синдрома), вируса птичьего инфекционного бронхита (IBV), вируса мышиного гепатита (MHV) и вируса свиного трансмиссивного гастроэнтерита (TGEV). Коронавирусный иммуноген может представлять собой спайковый полипептид.
Retrovirus: Вирусные иммуногены включают без ограничения те, которые происходят из онковируса, лентивируса (например, ВИЧ-1 или ВИЧ-2) или спумавируса.
Reovirus: Вирусные иммуногены включают без ограничения те, которые происходят из ортореовируса, ротавируса, орбивируса или колтивируса.
Parvovirus: Вирусные иммуногены включают без ограничения те, которые происходят из парвовируса B19.
Herpesvirus: Вирусные иммуногены включают без ограничения те, которые происходят из человеческого герпесвируса, такие как, только в качестве примера, вирусы простого герпеса (HSV) (например, HSV 1 и 2 типа), вирус опоясывающего лишая (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), человеческий герпесвирус 6 (HHV6), человеческий герпесвирус 7 (HHV7) и человеческий герпесвирус 8 (HHV8).
Papovaviruses: Вирусные иммуногены включают без ограничения те, которые происходят из вирусов папилломы и вирусов полиомы. (Человеческий) вирус папилломы может относиться к серотипу 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 или 65, например, из одного или нескольких серотипов 6, 11, 16 и/или 18.
Adenovirus: Вирусные иммуногены включают те, которые происходят из аденовируса серотипа 36 (Ad-36).
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на вирус, который инфицирует рыбу, такой как: вирус инфекционной анемии лососевых (ISAV), вирус болезни поджелудочной железы лососевых (SPDV), вирус инфекционного пенкреонекроза (IPNV), вирус канального сомика (CCV), вирус рыбьей лимфоцистозной болезни (FLDV), вирус инфекционного гематопоэтического некроза (IHNV), герпесвирус карпа кои, пикорна-подобный вирус лососевых (также известный как пикорна-подобный вирус атлантического лосося), вирус атлантического лосося (LSV), ротавирус атлантического лосося (ASR), вирус «клубничной» болезни форели (TSD), вирус опухоли кижуча (CSTV) или вирус вирусной геморрагической септицемии (VHSV).
Грибковые иммуногены могут доставляться из возбудителей дерматофитозов, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme; или из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, виды Encephalitozoon, Septata intestinalis и Enterocytozoon bieneusi; менее часто встречающимися являются виды Brachiola, виды Microsporidium, виды Nosema, виды Pleistophora, виды Trachipleistophora, виды Vittaforma, Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, виды Malassezia, виды Fonsecaea, виды Wangiella, виды Sporothrix, виды Basidiobolus, виды Conidiobolus, виды Rhizopus, виды Mucor, виды Absidia, виды Mortierella, виды Cunninghamella, виды Saksenaea, виды Alternaria, виды Curvularia, виды Helminthosporium, виды Fusarium, виды Aspergillus, виды Penicillium, виды Monolinia, виды Rhizoctonia, виды Paecilomyces, виды Pithomyces и виды Cladosporium.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на паразит из рода Plasmodium, такой как P. falciparum, P.vivax, P.malariae или P.ovale. Таким образом, изобретение может применяться для иммунизации против малярии. В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на паразит из семейства Caligidae, в частности, паразит из родов Lepeophtheirus и Caligus, например, морские вши, такие как Lepeophtheirus salmonis или Caligus rogercresseyi.
В некоторых вариантах осуществления иммуноген вызывает иммунный ответ на: аллергены пыльцы (аллергены пыльцы деревьев, трав, сорняков); аллергены насекомых или паукообразных (ингаляционные, слюнные и содержащиеся в яде аллергены, например, клещевые аллергены, аллергены тараканов и мелких двукрылых насекомых, аллергены яда перепончатокрылых); аллергены шерсти и перхоти животных (например, собак, кошек, лошадей, крыс, мышей и т.д.) и пищевые аллергены (например, глиадин). Важными аллергенами пыльцы деревьев и трав являются те, которые происходят из таксономических отрядов Fagales, Oleales, Pinales и платановых включая без ограничения, березу (Betula), ольху (Alnus), орех (Corylus), граб (Carpinus) и оливу (Olea), кедр (Cryptomeria и Juniperus), платан (Platanus), отряда Poales, включая травы родов Lolium, Phleum, Poa, Cynodon, Dactylis, Holcus, Phalaris, Secale и Sorghum, отрядов Asterales и Urticales, включая травы родов Ambrosia, Artemisia и Parietaria. Другими важными ингаляционными аллергенами являются аллергены из клещей домашней пыли рода Dermatophagoides и Euroglyphus, амбарных клещей, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены из тараканов, мелких двукрылых насекомых и блох, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, и аллергены от млекопитающих, таких как кошка, собака и лошадь, аллергены яда, такие как происходящие от ужаления или укусов насекомых, таких как насекомые из таксономического отряда Hymenoptera, включая пчел (Apidae), ос (Vespidea) и муравьев (Formicoidae).
В некоторых вариантах осуществления иммуноген представляет собой опухолевой антиген, выбранный из: (a) раково-семенниковых антигенов, таких как NY-ESO-1, SSX2, SCP1, а также полипептидов семейства RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые могут применяться, например, для воздействие на меланому, опухоли легких, головы и шеи, NSCLC (немелкоклеточный рак легких), молочных желез, желудочно-кишечного транкта и мочевого пузыря; (b) мутированных антигенов, например, p53 (связанного с различными сόлидными опухолями, например, колоректальным раком, раком легких, головы и шеи), p21/Ras (связанного, например, с меланомой, раком поджелудочной железы и колоректальным раком), CDK4 (связанного, например, с меланомой), MUM1 (связанного, например, с меланомой), каспазы-8 (связанной, например, с раком головы и шеи), CIA 0205 (связанного, например, с раком мочевого пузыря), HLA-A2-R1701, бета катенина (связанных, например, с меланомой), TCR (связанного, например, с T-клеточной неходжкинской лимфомой), BCR-abl (связанного, например, с хроническим миелогенным лейкозом), триозефосфатизомеразу, KIA 0205, CDC-27 и LDLR-FUT; (c) сверхэкспрессированных антигенов, например, галектина 4 (связанного, например, с колоректальным раком), галектина 9 (связанного, например, с болезнью Ходжкина), протеиназы 3 (связанного, например, с хроническим миелогенным лейкозом), WT 1 (связанного, например, с различными лейкозами), угольной ангидразы (связанной, например, с почечным раком), альдолазы A (связанной, например, с раком легких), PRAME (связанного, например, с меланомой), HER-2/neu (связанного, например, с раком молочных желез, легких и яичников), маммаглобина, альфа-фетопротеина (связанного, например, с гепатомой), KSA (связанного, например, с колоректальным раком), гастрина (связанного, например, с раком поджелудочной железы и желудка), белка каталитического компонента теломеразы, MUC-1 (связанного, например, с раком молочных желез и яичников), G-250 (связанного, например, с почечно-клеточной карциномой), p53 (связанного, например, с раком молочных желез и ободочной кишки) и карциноэмбрионального антигена (связанного, например, с раком молочных желез, раком легких и раковыми опухолями желудочно-кишечного тракта, такими как колоректальный рак); (d) общих антигенов, например, антигенов дифференциации меланомы-моноцитов, таких как MART-1/Melan A, gp100, MC1R, стимулирующего меланоциты гормонального рецептора, тирозиназы, связанного с тирозиназой белка-1/TRP1 и связанного с тирозиназой белка-2/TRP2 (связанного, например, с меланомой); (e) связанных с предстательной железой антигенов, таких как PAP, PSA, PSMA, PSH-P1, PSM-P1, PSM-P2, связанного например, с раком предстательной желез; (f) идиотипов иммуноглобулина (связанных, например, с миеломой и B-клеточными лимфомами). В определенных вариантах осуществления опухолевые иммуногены включают без ограничения p15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барра, EBNA, антигены человеческого вируса папилломы (HPV), включая E6 и E7, антигены вирусов гепатита B и C, антигены человеческого T-клеточного лимфотропного вируса, TSP-180, p185erbB2, pl80erbB-3, c-met, mn-23Hl, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, бета-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68/KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (белок, связывающий Mac-2/белок, связанный с циклофилином C), TAAL6, TAG72, TLP, TPS и тому подобные.
Фармацевтические композиции
Липосомы по изобратению полезны в качестве компонентов в фармацевтических композициях для иммунизации индивидов против различных заболеваний. Эти композиции обычно включают фармацевтически приемлемый носитель в дополнение к липосомам. Полное обсуждение фармацевтически приемлемых носителей можно найти в ссылке 31.
Фармацевтическая композиция по изобретению может включать одну или несколько мелкомолекулярных иммунопотенциаторов. Например, композиция может включать агонист TLR2 (например, Pam3CSK4), агонист TLR4 (например, фосфат аминоалкилглюкозаминида, такой как E6020), агонист TLR7 {например, имиквимод), агонист TL8 (например, резиквимод) и/или агонист TLR9 (например, IC31). Любой такой агонист в идеале имеет молекулярную массу <2000 Да. В некоторых вариантах осуществления такие агонист(-ы) также инкапсулируются с РНК внутрь липосом, но в других вариантах осуществления они не инкапсулированы.
Фармацевтические композиции по изобретению могут включать липосомы в обычной воде (например, в воде для инъекций) или в буфере, например, фосфатном буфере, Трис буфере, боратном буфере, сукцинатном буфере, гистидиновом буфере или цитратном буфере. Буферные соли обычно включаются в диапазоне от 5 до 20 мМ.
Фармацевтические композиции по изобретению могут иметь pH от 5,0 до 9,5, например, от 6,0 до 8,0.
Композиции по изобретению могут включать соли натрия (например, хлорид натрия) для придания тоничности. Концентрация 10±2 мг/мл NaCl составляет обычно, например, примерно 9 мг/мл.
Композиции по изобретению могут включать хелаторы ионов металлов. Они могут продлевать устойчивость РНК путем удаления ионов, которые могут ускорить гидролиз сложного фосфодиэфира. Таким образом, композиция может включать одно или несколько соединений из EDTA, EGTA, BAPTA, этилентриаминпентауксусную кислоту и т.д. Такие хелаторы обычно присутствуют в концентрации от 10 до 500 мкМ, например, 0,1 мМ. Цитрат, такой как цитрат натрия, также может действовать в качестве хелатора, в то же время также преимущественно обеспечивая буферную активность.
Фармацевтические композиции по изобретению могут иметь осмоляльность от 200 мОсм/кг до 400 мОсм/кг, например, от 240 до 360 мОсм/кг или от 290 до 310 мОсм/кг.
Фармацевтические композиции по изобретению могут включать один или несколько консервантов, таких как тиомерсал или 2-феноксиэтанол. Предпочтительны композиции, не содержащие ртуть, и могут быть получены вакцины, не содержащие консерванты.
Фармацевтические композиции по изобретению являются предпочтительно стерильными.
Фармацевтические композиции по изобретению являются предпочтительно непирогенными, например, содержащими <1 EU (эндотоксиновую единицу, стандартный показатель) на дозу, и предпочтительно <0,1 EU на дозу.
Фармацевтические композиции по изобретению предпочтительно не содержат глютен.
Фармацевтические композиции по изобретению могут быть получены в стандартной лекарственной форме. В некоторых вариантах осуществления стандартная доза может иметь объем от 0,1 до 1,0 мл, например, примерно 0,5 мл.
Композиции могут быть получены в виде препаратов для инъекций в виде или растворов, или суспензий. Композиция может быть получена для внутрилегочного введения, например, ингалятором, с использованием мелкого спрея. Композиция может быть получена для назального, ушного или глазного введения, например, в виде спрея или капель. Обычно применяются инъекционные препараты для внутримышечного введения.
Композиции содержат иммунологически эффективное количество липосом, а также при необходимости другие компоненты. Под «иммунологически эффективным количеством» подразумевается, что введение этого количества индивиду или в одной дозе, или в виде части серии доз, эффективно для лечения или профилактики. Это количество варьируется в зависимости от состояния здоровья и физического состояния подлежащего лечению индивида, возраста, таксаномной группы подлежащего лечению индивида (например, нечеловекообразной обезьяны, примата и т.д.), способности иммунной системы индивида синтезировать антитела, желаемой степени защиты, состава вакцины, оценки медицинской ситуации лечащим врачом и других релевантных факторов. Ожидается, что это количество будет укладываться в относительно широкий диапазон, который может быть определен посредством обычных испытаний. Содержание липосом и РНК в композициях по изобретению в целом выражается в пересчете на содержание РНК на дозу. Предпочтительная доза содержит ≤100 мкг РНК (например, от 10 до 100 мкг, такая как 10 мкг, 25 мкг, 50 мкг, 75 мкг или 100 мкг). Хотя проявление может наблюдаться при гораздо более низких уровнях (например, ≤1 мкг/дозу, ≤100 нг/дозу, ≤10 нг/дозу, ≤1 нг/дозу), предпочтительна минимальная доза 0,1 мкг.
Изобретение также относится к устройству подачи (например, шприцу, небулайзеру, распылителю, ингалятору, трансдермальной системе и т.д.). содержащему фармацевтическую композицию по изобретению. Это устройство может применяться для введения композиции позвоночному индивиду.
Липосомы по изобретению не содержат рибосомы.
Способы лечения и медицинского применения
В отличие от частиц, описанных в ссылке 12, липосомы и фармацевтические композиции по изобретению предназначены для применения in vivo для вызова иммунного ответа на представляющий интерес иммуноген.
Изобретение относится к способу стимуляции иммунного ответа у позвоночного, включающему стадию введения эффективного количества липосомы или фармацевтической композиции по изобретению. Иммунный ответ является предпочтительно защитным и предпочтительно вовлекает антитела и/или клеточноопосредованный иммунитет. Способ может вызвать вторичный иммунный ответ.
Изобретение также относится к липосоме или фармацевтической композиции по изобретению для применения в способе вызова иммунного ответа у позвоночного.
Изобретение также относится к применению липосомы по изобретению при получении лекарственного средства для вызова иммунного ответа у позвоночного.
Путем вызова иммунного ответа у позвоночного с помощью этих видов применения и способов, позвоночного можно защитить против различных заболеваний и/или инфекций, например, против бактериальных и/или вирусных заболеваний, как осуждается выше. Липосомы и композиции являются иммуногеннными и предпочтительнее представляют собой вакцинные композиции. Вакцины по изобретению могут быть или профилактическими (т.е., для предотвращения инфекции), или терапевтическими (т.е., для лечения инфекции), но обычно являются профилактическими.
Позвоночное представляет собой предпочтительно млекопитающее, такое как человека или крупное ветеринарное млекопитающее (например, лошади, крупный рогатый скот, оленей, коз, свиней). Когда вакцина предназначена для профилактического применения, то человек представляет собой предпочтительно ребенка (например, ребенка в возрасте от 1 до 3 лет или ребенка в возрасте до года) или подростка; когда вакцина предназначена для терапевтического применения, то человек представляет собой предпочтительно подростка или взрослого человека. Вакцину, предназначенную для детей, можно также вводить взрослым людям, например, для оценки безопасности, дозировки, иммуногенности и т.д.
Вакцины, полученные в соответствии с изобретением, могут применяться для лечения и детей, и взрослых. Таким образом, возраст человека-пациента может быть меньше 1 года, меньше 5 лет, составлять от 1 до 5 лет, от 5 до 15 лет, от 15 до 55 лет или по меньшей мере 55. Предпочтительными пациентами для введения вакцин являются пожилые люди [например, в возрасте ≥50 лет, ≥60 лет, и предпочтительно, ≥65 лет), люди молодого возраста (например, ≤5 лет), госпитализированные пациенты, медицинские работники, военнослужащие и армейский персонал, беременные женщины, пациенты с хроническими заболеваниями или пациенты с иммунодефицитом. Однако вакцины пригодны не только исключительно для этих групп и могут применяться шире в популяции.
Композиции по изобретению в целом вводятся пациенту непосредственно. Прямая доставка может осуществляться парентеральной инъекцией (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно, интрадермально или в интерстициальное пространство ткани; в отличие от ссылки 1, в настоящем изобретении инъекция в язык обычно не применяется). Альтернативные пути доставки включают ректальный, пероральный (например, таблетка, спрей), буккальный, сублингвальный, вагинальный, топический, трансдермальный или чрескожный, интраназальный, глазной, ушной, легочный или другой трансмукозальный путь введения. Интрадермальное и внутримышечное представляют собой два предпочтительных пути введения. Инъекция может осуществляться через иглу (например, иглу для подкожных инъекций), но альтернативно может применяться безыгольная инъекция. Обычная внутримышечная доза составляет 0,5 мл.
Изобретение может применяться для вызова системного и/или мукозального иммунитета, предпочтительно для вызова усиленного системного и/или мукозального иммунитета.
Дозировка может представлять собой однодозовую схему или многодозовую схему. Множественные дозы можно применять в схеме первичной иммунизации и/или в схеме повторной иммунизации. В многодозовой схеме различные дозы могут вводиться одинаковым или различными путями, например, парентеральным - первичная и мукозальным - повторная, мукозальным - первичная, и парентеральным - повторная и т.д. Множественные дозы обычно вводятся с интервалом, составляющим по меньшей мере 1 неделю {например, примерно 2 недели, примерно 3 недели, примерно 4 недели, примерно 6 недель, примерно 8 недель, примерно 10 недель, примерно 12 недель, примерно 16 недель, т.д.). В одном варианте осуществления множественные дозы можно вводить приблизительно через 6 недель, 10 недель и 14 недель после рождения, например, в возрасте 6 недель, 10 недель и 14 недель, как часто применяется в Расширенной программе по иммунизации («EPI») Всемирной Организации Здравоохранения. В альтернативном варианте осуществления две первичные дозы вводят с интервалом, составляющим примерно два месяца, например, с интервалом, составляющим примерно 7, 8 или 9 недель, с последующим введением одной или нескольких вторичных доз, спустя период т примерно 6 месяцев до 1 года после второй первичной дозы, например, примерно через 6, 8, 10 или 12 месяцев после второй первичной дозы. В дополнительном варианте осуществления вводят три первичные дозы с интервалом, составляющим примерно два месяца, например, с интервалом, составляющим примерно 7, 8 или 9 недель, с последующим введение одной или несколько вторичных доз, спустя от примерно 6 месяцев до 1 года после введения третьей первичной дозы, например, примерно через 6, 8, 10 или 12 месяцев после третьей первичной дозы.
Формула (X)
Соединения формулы (X) содержит головную группу гидрофильного полимера, связанную с липидной составляющей. Они могут быть описаны как «скрытые липиды», и они имеют формулу:
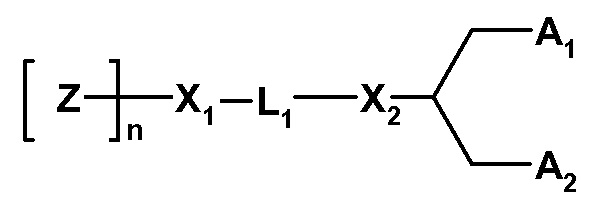
где Z обозначает компонент в виде гидрофильной головной группы, выбранной из ПЭГ и полимеров на основе поли(оксазолина), поли(этиленоксида), поли(винилового спирта), поли(глицерина), поли(N-винилпирролидона), поли[N-(2-гидроксипропил)метакриламида] и поли(аминокислот), где полимер может быть линейным или разветвленным, и где полимер может быть необязательно замещенным;
где Z полимеризирован n субъединицами;
n обозначает среднечисловую степень полимеризации от 10 до 200 единиц Z, где n оптимизировано для различных типов полимеров;
L1 обозначает необязательно замещенный C1-10 алкиленовый или C1-10 гетероалкиленовый линкер, включающий ноль, один или два из простого эфира (например, -O-), сложного эфира (например, -C(O)O-), сукцината (например, -O(O)C-CH2-CH2-C(O)O-)), карбамата (например, -OC(O)-NR'-), карбоната (например,, -OC(O)O-), мочевины (например, -NRC(O)NR'-), амина (например, -NR'-), амида (например, -C(O)NR'-), имина (например, -C(NR')-), тиоэфира (например, -S-), ксантана (например, -OC(S)S-) и сложного фосфодиэфира (например, -OP(O)2O-),
где R' независимо выбран из -H, -NH-, -NH2, -O-, -S-, фосфата или необязательно замещенного C1-10 алкилена;
X1 и X2 независимо выбраны из углерода или гетероатома, выбранного из -NH-, -O-, -S- или фосфата;
A1 и A2 независимо выбраны из C6-30 алкила, C6-30 алкенила и C6-30 алкинила, где A1 и A2 могут быть одинаковыми или различными, или A1 и A2 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный стероид.
В одном варианте осуществления соединение формулы (X) имеет формулу (Χ')
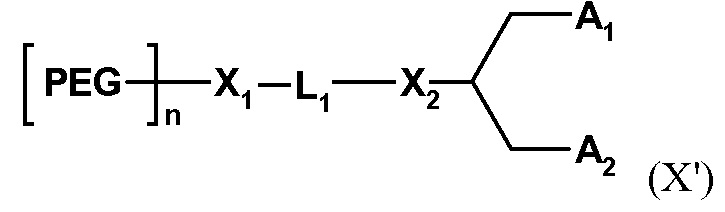
где PEG обозначает субъединицу поли(этиленгликоля), причем ПЭГ может быть линейным или разветвленным;
n обозначает среднечисловую степень полимеризации от 70 до 240 единиц ПЭГ;
L1 обозначает необязательно замещенный C1-10 гетероалкиленовый линкер, содержащий один или два из простого эфира, сложного эфира, сукцината, карбамата, карбоната, мочевины, амина, амида, имина, тиоэфира, ксантана и сложного фосфодиэфира;
X1 и X2 обозначают кислород;
A1 и A2 независимо выбраны из C6-30 алкила, C6-30 алкенила и C6-30 алкинила, где A1 и A2 могут быть одинаковыми или различными, или где A1 и A2 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный стероид.
В некоторых вариантах осуществления изобретения, где липид имеет формулу X', изобретение не включает липиды, где n обозначает среднечисловую степень полимеризации 200 единиц ПЭГ. В других вариантах осуществления, где липид имеет формулу X', изобретение не включает липиды, где n обозначает среднечисловую степень полимеризации от 190 до 210 единиц ПЭГ. В других вариантах осуществления, где липид имеет формулу X', изобретение не включает липиды, где n обозначает среднечисловую степень полимеризации выше 150 единиц ПЭГ или выше 130 единиц ПЭГ. В некоторых вариантах осуществления по изобретению, где липид имеет формулу X', изобретение не включает липиды, в которых n обозначает среднечисловую степень полимеризации от 10 до 200 единиц ПЭГ. В некоторых вариантах осуществления изобретение не включает липосомы, которые включают липид, имеющий формулу X'.
Липиды формул (X) и (Χ') при включении в состав с катионными липидами для образования липосом могут увеличить продолжительность существования липосомы in vivo (например, в крови). Они могут защищать поверхность липосомы и, посредством этого, снижать опсонизацию белками крови и захват макрофагами. Дополнительные подробности содержатся в ссылках 32 и 33. В одном варианте осуществления липид содержит группу, выбранную из ПЭГ (иногда именуемого поли(этиленоксидом)) и полимеров на основе поли(оксазолина), поли(винилового спирта), поли(глицерина), поли(N-винилпирролидона), поли[N-(2-гидроксипропил)метакриламида] и поли(аминокислот).
Пригодные пегилированные липиды для использования с изобретением включают конъюгаты полиэтиленгликоля-диацилглицерина или полиэтиленгликоля-диацилгликамида (ПЭГ-ДАГ), включает те, которые содержат группу диалкилглицерина или диалкилгликамида, имеющую длину алкильной цепи, независимо включающую от примерно C4 до примерно C40 насыщенных или ненасыщенных атомов углерода. Группа диалкилглицерина или диалкилгликамида может дополнительно включать одну или несколько замещенных алкильных групп. Пегилированный липид может быть выбран из ПЭГ-дилаурилглицерина, ПЭГ-димиристилглицерина (каталог #GM-020 из каталога NOF (Новых масел и жиров)), ПЭГ-дипальмитоилглицерина, ПЭГ-дистерилглицерина, ПЭГ-дилауриламида, ПЭГ-димиристилгликамида, ПЭГ-дипальмитоилгликамида и ПЭГ-дистерилгликамида, ПЭГ-холестерина (1-[8'-(Холест-5-ен-3[бета]-окси)карбоксамидо-3',6'-диоксаоктанил]карбамоил-[омега]-метил-поли(этиленгликоль), ПЭГ-ДМБ (простой эфир (3,4-Дитетрадекоксилбензил-[омега]-метил-поли(этиленгликоля), 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-5000] (каталог #880210P от компании Avanti Polar Lipids).
Химические термины и определения
Галоген
Термин «галоген» (или «гало») включает фтор, хлор, бром и йод.
Алкил, алкилен, алкенил, алкинил, циклоалкил т.д.
Термины «алкил», «алкилен», «алкенил» и «алкинил» используются в настоящем описании для обозначения и прямо-, и разветвленноцепочечных ациклических форм. Их циклические аналоги именуются циклоалкилом и т.д.
Термин «алкил» включает одновалентные, прямые или разветвленные, насыщенные, aциклические гидрокарбильные группы. В одном варианте осуществления алкил представляет собой C1-10 алкил, в другом варианте осуществления C1-6 алкил, в другом варианте осуществления C1-4 алкил, такой как метильная, этильная, н-пропильная, изопропильная или трет-бутиьная группы.
Термин «циклоалкил» включает одновалентные, насыщенные, циклические гидрокарбильные группы. В одном варианте осуществления циклоалкил представляет собой C3-10 циклоалкил, в другом варианте осуществления C3-6 циклоалкил, такой как циклопентил и циклогексил.
Термин «алкокси» означает алкил-O-.
Термин «алкенил» включает одновалентные, прямые или разветвленные, ненасыщенные, aциклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную двойную связь, и, в одном варианте осуществления, не имеющие межуглеродные тройные связи. В одном варианте осуществления алкенил представляет собой C2-10 алкенил, в другом варианте осуществления C2-6 алкенил, в другом варианте осуществления C2-4 алкенил.
Термин «циклоалкенил» включает одновалентные, частично ненасыщенные, циклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную двойную связь, и, в одном варианте осуществления, не имеющие межуглеродные тройные связи. В одном варианте осуществления циклоалкенил представляет собой C3-10 циклоалкенил, в другом варианте осуществления C5-10 циклоалкенил, например, циклогексенил или бензоциклогексил.
Термин «алкинил» включает одновалентные, прямые или разветвленные, ненасыщенные, aциклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную тройную связь, и в одном варианте осуществления не имеющие межуглеродные двойные связи. В одном варианте осуществления алкинил представляет собой C2-10 алкинил, в другом варианте осуществления C2-6 алкинил, в другом варианте осуществления C2-4 алкинил.
Термин «циклоалкинил» включает одновалентные, частично ненасыщенные, циклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную тройную связь, и в одном варианте осуществления не имеющие межуглеродные двойные связи. В одном варианте осуществления циклоалкинил представляет собой C3-10 циклоалкенил, в другом варианте осуществления C5-10 циклоалкинил.
Термин «алкилен» включает двухвалентные, прямые или разветвленные, насыщенные, aциклические гидрокарбильные группы. В одном варианте осуществления алкилен представляет собой C1-10 алкилен, в другом варианте осуществления C1-6 алкилен, в другом варианте осуществления C1-4 алкилен, такой как метиленовые, этиленовые, н-пропиленовые, изопропиленовые или трет-бутиленоые группы.
Термин «алкенилен» включает двухвалентные, прямые или разветвленные, ненасыщенные, aциклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную двойную связь, и в одном варианте осуществления не имеющие межуглеродные тройные связи. В одном варианте осуществления алкенилен представляет собой C2-10 алкенилен, в другом варианте осуществления C2-6 алкенилен, в другом варианте осуществления C2-4 алкенилен.
Термин «алкинилен» включает двухвалентные, прямые или разветвленные, ненасыщенные, aциклические гидрокарбильные группы, имеющие по меньшей мере одну межуглеродную тройную связь, и в одном варианте осуществления не имеющие межуглеродные двойные связи. В одном варианте осуществления алкинилен представляет собой C2-10 алкинилен, в другом варианте осуществления C2-6 алкинилен, в другом варианте осуществления C2-4 алкинилен.
Гетероалкил т.д.
Термин «гетероалкил» включает алкильные группы, в которых до шести атомов углерода, в одном варианте осуществления до пяти атомов углерода, в другом варианте осуществления до четырех атомов углерода, в другом варианте осуществления до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q, N, P(O)r или Si (а предпочтительно, O, S(O)q или N), при условии, что остается по меньшей мере один из алкильных атомов углерода. Гетероалкильная группа может быть C-связанной или гетеро-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или через O, S(O)q, N, P(O)r или Si.
Термин «гетероциклоалкил» включает циклоалкильные группы, в которых до шести атомов углерода, в одном варианте осуществления до пяти атомов углерода, в другом варианте осуществления до четырех атомов углерода, в другом варианте осуществления до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из циклоалкильных атомов углерода. Примеры гетероциклоалкильных групп включают оксиранил, тиаранил, азиридинил, оксетанил, тиатанил, азетидинил, тетрагидрофуранил, тетрагидротиофенил, пирролидинил, тетрагидропиранил, тетрагидротиопиранил, пиперидинил, 1,4-диоксанил, 1,4-оксатианил, морфолинил, 1,4-дитианил, пиперазинил, 1,4-азатианил, оксепанил, тиепанил, азепанил, 1,4-диоксепанил, 1,4-оксатиепанил, 1,4-оксаазепанил, 1,4-дитиепанил, 1,4-тиеазепанил и 1,4-диазепанил. Гетероциклоалкильная группа может быть C-связанной или N-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или атом азота.
Термин «гетероалкенил» включает алкенильные группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из алкенильных атомов углерода. Гетероалкенильная группа может быть C-связанной или гетеро-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или через O, S(O)q или N.
Термин «гетероциклоалкенил» включает циклоалкенильные группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из циклоалкенильных атомов углерода. Примеры гетероциклоалкенильных групп включают 3,4-дигидро-2H-пиранил, 5-6-дигидро-2H-пиранил, 2H-пиранил, 1,2,3,4-тетрагидропиридинил и 1,2,5,6-тетрагидропиридинил. Гетероциклоалкенильная группа может быть C-связанной или N-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или через атом азота.
Термин «гетероалкинил» включает алкинильные группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из алкинильных атомов углерода. Гетероалкинильная группа может быть C-связанной или гетеро-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или через O, S(0)q или N.
Термин «гетероциклоалкинил» включает циклоалкинильные группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из циклолалкинильных атомов углерода. Гетероциклоалкинильная группа может быть C-связанной или N-связанной, т.е., она может быть связана с остальной частью молекулы через атом углерода или через атом азота.
Термин «гетероалкилен» включает алкиленовые группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из алкиленовых атомов углерода.
Термин «гетероалкенилен» включает алкениленовые группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из алкениленовых атомов углерода.
Термин «гетероалкинилен» включает алкиниленовые группы, в которых до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, независимо заменены O, S(O)q или N, при условии, что остается по меньшей мере один из алкиниленовых атомов углерода.
Арил
Термин «арил» включает одновалентные, ароматические, циклические гидрокарбильные группы, такие как фенил или нафтил (например, 1-нафтил или 2-нафтил). В целом, арильные группы могут представлять собой моноциклические или полициклические конденсированные кольцевые ароматические группы. Предпочтительным арилом является C6-C14 арил.
Другими примерами арильных групп являются одновалентные производные ацеантрилена, aцeнафтилена, ацефенантрилена, антрацена, азулена, хризена, коронена, флуорантена, флуорена, as-индацена, s-индацена, индена, нафталина, овалена, перилена, феналена, фенантрена, пицена, плеиадена, пирена, пирантрена и рубицена.
Термин «арилалкил» означает алкил, замещенный арильной группой, например, бензил.
Термин «арилен» включает двухвалентные ароматические, циклические гидрокарбильные группы, такие как фенилен. В целом, ариленовые группы могут представлять собой моноциклические или полициклические конденсированные кольцевые ароматические группы. Предпочтительным ариленом является C6-C14 арилен. Другими примерами ариленовых групп являются двухвалентные производные ацеантрилена, aceнафтилена, ацефенантрилена, антрацена, азулена, хризена, коронена, флуорантена, флуорена, as-индацена, s-индацена, индена, нафталина, овалена, перилена, феналена, фенантрена, пицена, плеиадена, пирена, пирантрена и рубицена.
Гетероарил
Термин «гетероарил» включает одновалентные, гетероароматические, циклические гидрокарбильные группы, дополнительно содержащие один или несколько гетероатомов, независимо выбранных из O, S, N и NN, где RN определен ниже (и в одном варианте осуществления представляет собой H или алкил (например, C1-6 алкил)).
В целом, гетероарильные группы могут представлять собой моноциклические или полициклические (например, бициклические) конденсированные кольцевые гетероароматические группы. В одном варианте осуществления гетероарильные группы содержат 5-13 кольцевых членов (предпочтительно, 5-10 членов) и 1, 2, 3 или 4 кольцевых гетероатомов, независимо выбранных из O, S, N и NRN. В одном варианте осуществления гетероарильная группа может быть 5-, 6-, 9- или 10-членной, например, 5-членной моноциклической, 6-членной моноциклической, 9-членной бициклической с конденсированными кольцами или 10-членной бициклической с конденсированными кольцами.
Моноциклические гетероароматические группы включают гетероароматические группы, содержащие 5-6 кольцевых членов, и 1, 2, 3 или 4 гетероатомов, выбранных из O, S, N или NRN.
В одном варианте осуществления 5-членные моноциклические гетероарильные группы содержат 1 кольцевой член, который представляет собой группу -NRN-, атом -O- или атом -S-, и необязательно 1-3 кольцевых члена (например, 1 или 2 кольцевых члена), которые представляют собой атомы =N- (где остальные 5 кольцевых члена представляют собой атомы углерода).
Примерами 5-членных моноциклических гетероарильных групп являются пирролил, фуранил, тиофенил, пиразолил, имидазолил, изоксазолил, оксазолил, изотиазолил, тиазолил, 1,2,3-тиазолил, 1,2,4-тиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-тиадиазолил, пиридил, пиримидинил, пиридазинил, пиразинил, 1,3,5-триазинил, 1,2,4-триазинил, 1,2,3-триазинил и тетразолил.
Примерами 6-членных моноциклических гетероарильных групп являются пиридинил, пиридазинил, пиримидинил и пиразинил.
В одном варианте осуществления 6-членные моноциклические гетероарильные группы содержат 1 или 2 кольцевых члена, которые представляют собой атомы =N- (где остальные 6 кольцевых члена представляют собой атомы углерода).
Бициклические гетероароматические группы включают гетероароматические группы с конденсированными кольцами, содержащие 9-13 кольцевых членов, и 1, 2, 3, 4 или более гетероатомов, выбранных из O, S, N или NRN.
В одном варианте осуществления 9-членные бициклические гетероарильные группы содержат 1 кольцевой член, который представляет собой группу -NRN-, атом -O- или атом -S-, и необязательно 1-3 кольцевых члена (например, 1 или 2 кольцевых члена), которые представляют собой атомы =N- (где остальные из 9 кольцевых членов представляют собой атомы углерода).
Примерами 9-членных конденсированных кольцевых бициклических гетероарильных групп являются бензофуранил, бензотиофенил, индолил, бензимидазолил, индазолил, бензотиазолил, пирроло[2,3-b]пиридинил, пирроло[2,3-c]пиридинил, пирроло[3,2-c]пиридинил, пирроло[3,2-b]пиридинил, имидазо[4,5-b]пиридинил, имидазо[4,5-c]пиридинил, пиразоло[4,3-d]пиридинил, пиразоло[4,3-c]пиридинил, пиразоло[3,4-c]пиридинил, пиразоло[3,4-b]пиридинил, изоиндолил, индазолил, пуринил, индолинил, имидазо[1,2-а]пиридинил, имидазо[1,5-а]пиридинил, пиразоло[1,2-а]пиридинил, пирроло[1,2-b]пиридазинил и имидазо[1,2-c]пиримидинил.
В одном варианте осуществления 10-членные бициклические гетероарильные группы содержат 1-3 кольцевых члена, которые представляют атомы =N- (где остальные из 10 кольцевых членов представляют собой атомы углерода).
Примерами 10-членных конденсированных кольцевых бициклических гетероарильных групп являются хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил, фталазинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил, 1,5-нафтиридинил, 2,6-нафтиридинил, 2,7-нафтиридинил, пиридо[3,2-d]пиримидинил, пиридо[4,3-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиридо[2,3-d]пиримидинил, пиридо[2,3-b]пиразинил, пиридо[3,4-b]пиразинил, пиримидо[5,4-d]пиримидинил, пиразино[2,3-b]пиразинил и пиримидо[4,5-d]пиримидинил.
Термин «гетероарилалкил» означает алкил, замещенный гетероарильной группой.
Термин «гетероарилен» включает двухвалентные гетероароматические, циклические гидрокарбильные группы, дополнительно содержащие один или несколько гетероатомов, независимо выбранных из O, S, N и NN, где RN определен ниже (и в одном варианте осуществления представляет собой H или алкил (например, C1-6 алкил)). В целом, гетероариленовые группы могут представлять собой моноциклические или полициклические (например, бициклические) конденсированные кольцевые гетероароматические группы. В одном варианте осуществления гетероариленовые группы содержат 5-13 кольцевых членов (предпочтительно, 5-10 членов) и 1, 2, 3 или 4 кольцевых гетероатома, независимо выбранных из O, S, N и NRN. В одном варианте осуществления гетероариленовая группа может быть 5, 6, 9 или 10-членной, например, 5-членной моноциклической, 6-членной моноциклической, 9-членной бициклической с конденсированными кольцами или 10-членной бициклической с конденсированными кольцами. Термин «гетероарилен» включает двухвалентные производные каждой из обсужденных выше гетероарильных групп.
Термины «арил», «ароматический», «гетероарил» и «гетероароматический» также включают группы, которые являются частично восстановленными. Таким образом, например, «гетероарил» включает конденсированные соединения, в которых одно из колец было восстановленным в насыщенное кольцо (например, 1,2,3,4-тетрагидро-1,8-нафтиридин-2-ил).
Общие положения
Пока нет иных указаний, когда на комбинации групп в настоящем описании делается ссылка как на одну составляющую, например, арилалкил, последняя указанная группа содержит атом, которым составляющая присоединена к остальной молекуле.
Когда делается ссылка на атом углерода алкильной группы или другой группы, заменяемой O, S(O)q, N или P(O)r, то предполагается следующее:
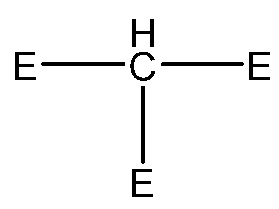 заменена
заменена 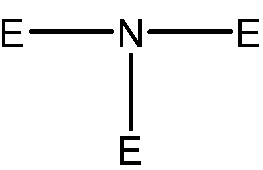 или
или 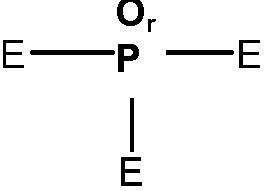 (где Е не может обозначать H);
(где Е не может обозначать H);
группа -CH= заменена -N= или -P(O)r=;
группа =C-H заменена =N или =P(O)r; или
группа -CH2- заменена -O-, -S(O)q-, - NN- или -P(O)rRN-, где RN обозначает H или необязательно замещенный C1-6 алкил, C1-6 гетероалкил, C3-6 циклоалкил, C3-6 гетероциклоалкил, C2-6 алкенил, C2-6 гетероалкенил, C3-6 циклоалкенил, C3-6 гетероциклоалкенил, фенил или гетероарил, содержащие 5 или 6 кольцевых членов. RN обозначает предпочтительно H, C1-6 алкил или C3-6 циклоалкил.
q равно независимо 0, 1 или 2. В одном варианте осуществления q=0.
r равно независимо 0 или 1. В одном варианте осуществления r=0.
Когда делается ссылка на атом углерода, замененный Si, то предполагается, что атом углерода обменивается на атом кремния, но что в остальном связи остаются такими же. Таким образом, например, -CH2- заменяется -SiH2-; -CH= заменяется -SiH= и ≡C-H заменяется ≡Si-H.
Для разъяснения, в отношении указанных выше содержащих гетероатом групп (таких как гетероалкил т.д.), где указано количество атомов углерода, например, C3-6 гетероалкил, предполагается, что группа на основе C3-6 алкила, в которой один или несколько из 3-6 атомов углерода цепи заменены O, S(0)q или N. Соответственно, C3-6 гетероалкильная группа содержала бы, например, менее чем 3-6 атомов углерода цепи. В качестве другого примера, пиридильная группа классифицировалась бы как C6 гетероарильная группа, даже несмотря на то, что она содержит 5 атомов углерода.
Замещение
Группы соединений по изобретению {например, алкильная, циклоалкильная, алкоксильная, алкенильная, циклоалкенильная, алкинильная, алкиленовая, алкениленовая, гетероалкильная, гетероциклоалкильная, гетероалкенильная, гетероциклоалкенильная, гетероалкинильная, гетероалкиленовая, гетероалкениленовая, арильная, арилалкильная, арилгетероалкильная, гетероарильная, гетероарилалкильная или гетероарилгетероалкильная группы т.д.) могут быть замещенными или незамещенными, в одном варианте осуществления незамещенными. Обычно, замещение включает понятийную замену атома водорода группой заместителя, или двух атомов водорода в случае замещения =O.
При замещении, в целом имеется от 1 до 5 заместителей на каждой группе, в одном варианте осуществления от 1 до 3 заместителей, в одном варианте осуществления 1 или 2 заместителя, в одном варианте осуществления 1 заместитель. Один вариант осуществления включает более чем один заместитель на том же атоме, например, ацетальную группу.
В одном варианте осуществления заместитель(-и) представляет собой независимо Sub1 или Sub2 (в одном варианте осуществления Sub2), где:
Sub1 обозначает независимо галоген, тригалогенметил, тригологенэтил, -NO2, -CN, -N+(Rs)2O-, -CO2H, -CO2Rs, -SO3H, -SORs, -SO2Rs, -SO3Rs, -OC(=O)ORs, -C(=O)H, -C(=O)Rs, -OC(=O)Rs, =O, -NRs2, -C(=O)NH2, -C(=O)NRs2, -N(Rs)C(=O)ORs, -N(Rs)C(=O)NRs2, -OC(=O)NRs2, -N(Rs)C(=O)Rs, -C(=S)NRs2, -NRSC(=S)Rs, -SO2NRs2, -NRsSO2Rs, -N(RS)C(=S)NRs2, -N(Rs)SO2NRs2, -Rs или -ZSRs, где:
Zs обозначает независимо O, S или NRs;
Rs обозначает независимо H или C1-6 алкил, C1-6 гетероалкил, -(Alka)fC3-6циклоалкил, -(Alka)fC3-6гетероциклоалкил, C2-6алкенил, C2-6гетероалкенил, -(Alka)fC3-6циклоалкенил, -(Alka)fC3-6гетероциклоалкенил, C2-6алкинил, C2-6гетероалкинил, -(Alka)fC6-14арил, -(Alka)fC6-14арил или -(Alka)fгетероарил (причем гетероарил содержит 5-13 кольцевых членов), где
f = 0 или 1;
Alka обозначает C1-6алкилен или C1-6гетероалкилен; и
Rs сам является необязательно замещенным (в одном варианте осуществления незамещенным) 1-3 заместителями Sub2;
Sub2 обозначает независимо галоген, тригалогенметил, тригалогенэтил, -NO2, -CN, -N+(C1-6алкил)2O-, -CO2H, -CO2C1-6алкил, -SO3H, -SOC1-6алкил, -SO2C1-6алкил, -SO3C1-6алкил, -OC(=O)OC1-6алкил, -C(=O)H, -C(=O)C1-6алкил, -OC(=O)C1-6алкил, =O, -N(C1-6алкил)2, -C(=O)NH2, -C(=O)N(C1-6алкил)2, -N(C1-6алкил)С(=O)O(C1-6алкил), -N(C1-6алкил)C(=O)N(C1-6алкил)2, -OC(=O)N(C1-6алкил)2, -N(C1-6алкил)C(=O)C1-6алкил, -C(=S)N(C1-6алкил)2, -N(C1-6алкил)C(=S)C1-6алкил, -SO2N(C1-6алкил)2, -N(C1-6алкил)SO2C1-6алкил, -N(C1-6алкил)C(=S)N(C1-6алкил)2, -N(C1-6алкил)SO2N(C1-6алкил)2, -C1-6алкил, -C1-6гетероалкил, -C3-6циклоалкил, -C3-6гетероциклоалкил, -C2-6алкенил, -C2-6гетероалкенил, -C3-6циклоалкенил, -C3-6гетероциклоалкенил, -C2-6алкинил, -C2-6гетероалкинил, -C6-14арил, -C5-13гетероарил, -Zt-C1-6алкил, -Zt-C3-6циклоалкил, -Zt-C2-6алкенил, -Zt-C3-6циклоалкенил или -Zt-C2-6алкинил; и
Zt обозначает независимо O, S, NH или N(C1-6алкил).
Хотя Rs в Sub1 может быть необязательно замещен 1-3 заместителями Sub2, Sub2 является незамещенным. Однако в одном варианте осуществления Rs является незамещенным.
В одном варианте осуществления Rs обозначает H или C1-6алкил, необязательно замещенный 1-3 заместителями Sub2.
В одном варианте осуществления, Sub2 обозначает независимо галоген, тригалогенметил, тригалогенэтил, -NO2, -CN, -N+(C1-6алкил)2O-, -CO2H, -SO3H, -SOC1-6алкил, -SO2C1-6алкил, -C(=O)H, -C(=O)C1-6алкил, =O, -N(C1-6алкил)2, -C(=O)NH2, -C1-6алкил, -C3-6циклоалкил, -C3-6гетероциклоалкил, -Zt-C1-6алкил или -Zt-C3-6циклоалкил.
В одном варианте осуществления, где замещенная группа является aциклической (например, алкил, гетероалкил, алкенил т.д.), то Sub1 не обозначает -Rs, и Sub2 не обозначает -C1-6алкил, -C1-6гетероалкил, -C2-6алкенил, -C2-6гетероалкенил, -C2-6алкинил или -C2-6гетероалкинил.
Когда группа, кроме Sub2, имеет по меньшей мере 2 положения, которые могут быть замещены, то группа может быть замещена обоими концами алкиленовой, алкениленовой, алкиниленовой, гетероалкиленовой, гетероалкениленовой или гетероалкиниленовой цепи (в одном варианте осуществления содержащей от 1 до 6 атомов, в другом варианте осуществления от 3 до 6 атомов, и в еще одном варианте осуществления 3 или 4 атома) для образования циклической составляющей. Эта цепь необязательно замещена 1-3 заместителями Sub2. В одном варианте осуществления эта цепь не замещена. Таким образом, термины необязательно замещенный «циклоалкил», «циклоалкенил», «циклоалкинил», «гетероциклоалкил», «гетероциклоалкенил», «гетероциклоалкинил», «арил» и «гетероарил» включают конденсированные соединения. Например, «необязательно замещенный циклоалкил» включает соединения, в которых два циклоалкильных кольца конденсированы, а «необязательно замещенный гетероарил» включает соединения, в которых гетероциклоалкильное кольцо конденсировано с ароматическим кольцом (например, 5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил).
Когда группа, кроме Sub2, имеет атом, который может быть дважды замещен, этот атом может быть замещен обоими концами алкиленовой, алкениленовой, алкиниленовой, гетероалкиленовой, гетероалкениленовой или гетероалкиниленовой цепи (в одном варианте осуществления содержащей от 2 до 8 атомов, в дополнительном варианте осуществления от 3 до 6 атомов и в еще одном варианте осуществления 4 или 5 атомов) для образования циклической составляющей. Эта цепь необязательно замещена 1-3 заместителями Sub2. В одном варианте осуществления эта цепь не замещена. Таким образом, термины необязательно замещенный «циклоалкил», «циклоалкенил», «циклоалкинил», «гетероциклоалкил», «гетероциклоалкенил», «гетероциклоалкинил», «арил» и «гетероарил» включают спиро-соединения.
Для разъяснения, когда группа имеет гетероатом, то заместитель может быть связан с гетероатомом. Так, например, «необязательно замещенный гетероалкил» включает -CH2-N(Sub1)-CH2-, -CH(Sub1)-NH-CH2- и -CH(Sub1)-N(Sub1)-CH2- и т.д.
Термины с модификатором
Когда перечню предшествует модификатор, то следует понимать, что он относится к каждому из соединений в перечне. Например, фраза «необязательно замещенная C3-20-гетероциклоалкильная, C3-20-гетероциклоалкенильная, C3-20-гетероциклоалкинильная или C5-20-гетероарильная группа» означает, что каждое из четырех соединений в перечне, а именно, C3-20-гетероциклоалкильная группа, C3-20-гетероциклоалкенильная группа, C3-20-гетероциклоалкинильная группа и C6-20-гетероарильная группа, может быть необязательно замещенной.
Когда группа характеризуется первым модификатором, а затем позднее та же группа характеризуется следующим модификатором, то это означает, что группа характеризуется одновременно обоими модификаторами. Например, если группа описана как «C3-20-гетероциклоалкинильная» (первый модификатор) группа и затем позднее та же группа описана как «C5-16» (следующий модификатор) группа, то это обозначает C5-16 гетероциклоалкинильную группу.
Стероиды
Используемый в настоящем описании термин «стероид» относится к любой группе, содержащей следующую структуру (причем эта структура именуется здесь «стероидный скелет»).
Исключительно в целях иллюстрации, стероидный скелет изображен выше как полностью насыщенный. Однако термин "стероид" также предназначен для охвата случаев, где в стероидном скелете имеется ненасыщение. Например, термин стероид охватывает группу, которая содержит полностью ненасыщенный основной скелет (кольцевую систему с максимальным числом некумулированных двойных связей), 15H-циклопента[α]фенантрен:
Термин "стероид" также охватывает группу, которая содержит частично ненасыщенный стероидный скелет.
Термин "стероид" также охватывает «секо-» производные стероидного скелета, т.е., группы, в которых было осуществлено расщепление кольца; «нор-» и «гомо-» производные стероидного скелета включают сужение и расширение кольца, соответственно (см. Systemic Nomenclature of Organic Chemistry (Системную номенклатуру органической химии), под редакцией D. Hellwinkel, опубликованную издательством Springer, 2001, ISBN: 3-540-41138-0, стр. 203 в отношении «секо-» и стр. 204 в отношении «нор-» и «гомо-»). Однако в одном варианте осуществления такие секо-производные не охватываются термином «стероид». В другом варианте осуществления, такие нор-производные не охватываются термином «стероид». В другом варианте осуществления такие гомо-производные не охватываются термином «стероид». Так, в одном варианте осуществления такие секо-, нор- и гомо-производные не охватываются термином «стероид».
Термин "стероид" также охватывает случаи, когда один или несколько атомов углерода в структуре меченого стероидного скелета заменены гетероатомом. В одном таком варианте осуществления до шести атомов углерода, в одном варианте осуществления до пяти атомов углерода, в другом варианте осуществления до четырех атомов углерода, в другом варианте осуществления до трех атомов углерода, в другом варианте осуществления до двух атомов углерода, в другом варианте осуществления один атом углерода, каждый, заменены независимо O, S(O)q, N, P(O)r или Si (и предпочтительно O, S(O)q или N). Однако в одном варианте осуществления термин «стероид» содержит соединение, в котором «стероидный основной скелет» не содержит гетероатомы.
Стероидная кольцевая система пронумерована в соответствии с представленным ниже условным обозначением.
Термин стероид охватывает стерины, стероидные гормоны, желчные кислоты и соли желчных кислот. Стерин представляет собой любой стероид с гидроксильной группой в положении 3 A-кольца
Ненасыщение
В соответствии со стандартным использованием, положение омега-3 относится к третьей связи от (метильного) конца цепи; положение омега-6 относится к шестой связи от (метильного) конца цепи, и положение омега-9 относится к девятой связи от (метильного) конца цепи.
Общие положения
Пока нет иных указаний, при реализации настоящего изобретения используются обычные способы химии, биохимии, молекулярной биологии, иммунологии и фармакологии в пределах компетентности в данной области техники. Такие технологии полностью описаны в литературе. См., например, ссылки 34-40, и т.д.
Термин «содержащие» охватывает «включающие», а также «состоящие», например, композиция, «содержащая» X, может состоять исключительно из X или может включать нечто дополнительное, например, X+Y.
Термин «примерно» в отношении числовой величины x является необязательным и означает, например, x±10%.
Выражение «по существу» не исключают «полностью», например, композиция, которая «по существу не содержит» Y, может совсем не содержать Y. При необходимости, слова «по существу» могут быть опущены из определения по изобретению.
Ссылки на заряд, на катионы, на анионы, на цвиттерионы и т.д. принимаются при pH 7.
TLR3 обозначает Толл-подобный рецептор 3. Он представляет собой единственный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR3 включают поли(I:C). «TLR3» представляет собой утвержденное название по HGNC (Комитета по номенклатуре генов человека) для гена, кодирующего этот рецептор, и его индивидуальным HGNC ID (идентификатором по HGNC) является HGNC:11849. RefSeq последовательность (эталонная последовательность) для человеческого гена TLR3 представляет собой GI:2459625.
TLR7 представляет собой Толл-подобный рецептор 7. Он представляет собой единственный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR7 включают, например, имиквимод. «TLR7» представляет собой утвержденное название по HGNC для гена, кодирующего этот рецептор, и его индивидуальным идентификатором HGNC ID является HGNC:15631. RefSeq последовательность для человеческого гена TLR7 представляет собой GI:67944638.
TLR8 представляет собой Толл-подобный рецептор 8. Он представляет собой единственный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR8 включают, например, ресиквимод. «TLR8» представляет собой утвержденное название по HGNC для гена, кодирующего этот рецептор, и его индивидуальным индификатором HGNC ID является HGNC:15632. RefSeq последовательность для человеческого гена TLR8 представляет собой GI:20302165.
Семейство RIG-I-подобных рецепторов («RLR») включает различные РНК-геликазы, которые играют ключевые роли во врожденной иммунной системе [41]. RLR-1 (также известный как RIG-I или ген I, индуцируемый ретиноевой кислотой) имеет два рекрутирующих каспазу домена около его N-конца. Утвержденное HGNC название для гена, кодирующего RLR-1 геликазу, представляет собой «DDX58» (для DEAD (Asp-Glu-Ala-Asp) box полипептида 58), и его индивидуальным HGNC ID является HGNC:19102. RefSeq последовательность для человеческого гена RLR-1 представляет собой GI:77732514. RLR-2 (также известный как MDA5 или связанный с дифференциацией меланомы гена 5) также имеет два домена рекрутирования каспазы около его N-конца. Утвержденным HGNC названием для гена, кодирующего RLR-2 геликазу, является «IFIH1» (для интерферона, индуцированного доменом 1 геликазы C) и индивидуальным идентификатором HGNC ID является HGNC:18873. RefSeq последовательность для человеческого гена RLR-2 представляет собой GI:27886567. RLR-3 (также известный как LGP2 или лаборатория генетики и физиологии 2) не имеет доменов рекрутирования каспазы. Утвержденное HGNC название для гена, кодирующего RLR-3 геликазу, представляет собой «DHX58» (для DEXH (Asp-Glu-X-His) box полипептида 58), и индивидуальным идентификатором HGNC ID является HGNC:29517. Последовательность RefSeq для человеческого гена RLR-3 представляет собой GI:149408121.
PKR представляет собой двухцепочечную РНК-зависимую протеинкиназу. Она играет ключевую роль во врожденной иммунной системе. «EIF2AK2» (для эукариотического фактора 2-альфа инициации трансляции киназы 2) представляет собой утвержденное HGNC название для гена, кодирующего этот фермент, и его индивидуальным идентификатором HGNC ID является HGNC:9437. Последовательность RefSeq для человеческого гена PKR представляет собой GI:208431825.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показан гель с окрашенной РНК. Полосы показывают (1) маркеры, (2) «голый» репликон, (3) репликон после обработки РНКазой, (4) репликон, инкапсулированный в липосому, (5) липосому после обработки РНКазой, (6) липосому, обработанную РНКазой, затем подвергнутую экстракции фенолом/хлороформом.
На фиг.2 показан гель с окрашенной РНК. Полосы показывают (1) маркеры, (2) «голый» репликон, (3) репликон, инкапсулированный в липосому, (4) липосому, обработанную РНКазой, затем подвергнутую экстракции фенолом/хлороформом.
На фиг.3 показана экспрессия белка (в виде относительных световых единиц, RLU) в 1, 3 и 6 день после доставки РНК в липосомы ПЭГ с различными величинами длины: 1 кДа (треугольники); 2 кДа (кружки); 3 кДа (квадраты).
На фиг.4 показана экспрессия белка в 1, 3 и 6 день после доставки РНК в виде упакованного в вирион репликона (квадраты), в виде «голой» РНК (ромбы) или в липосомы (+ = 0,1 мкг, x = 1 мкг).
На фиг.5 показаны log10 титров F-специфического IgG у мышей BALB/c. У 5 групп величины длины ПЭГ составляли слева направо 1, 2, 3, 5 или 10 кДа. Кружки показывают титры через 2 недели после 1 инъекции; треугольники показывают титры через 2 недели после 2 инъекции; чертами показаны средние величины по двум титрам.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
РНК репликоны
Ниже используются различные репликоны. Обычно они основаны на геноме альфавируса с неструктурными белками из вируса венесуэльского лошадиного энцефалита (VEEV), сигналом упаковки из VEEV и 3' UTR (нетранслируемой областью) из вируса Синдбис или мутантного VEEV. Репликон имеет длину примерно 10 т.п.н. и имеет поли-A хвост.
ДНК плазмиды, кодирующая репликоны альфавируса (называемые: pT7-mVEEV-FL.RSVF или A317; pT7-mVEEV-SEAP или A306; pSP6-VCR-GFP или A50), служила в качестве матрицы для синтеза РНК in vitro. Репликоны содержат генетические элементы альфавируса, требуемые для репликации РНК, но не содержат те, которые кодируют генные продукты, необходимые для сборки частиц; структурные белки вместо этого замещаются представляющим интерес белком (или репортером, таким как SEAP или GFP, или иммуногеном, таким как белок F полной длины RSV), и, таким образом, репликоны неспособны индуцировать генерирование инфекционных частиц. Промотор бактериофага (T7 или SP6) выше по ходу транскрипции от кДНК альфавируса содействует синтезу РНК репликона in vitro, и рибозим вируса гепатита D (HDV), находящийся непосредственно выше по ходу транскрипции от поли(A)-хвоста, генерирует правильный 3'-конец посредством его активности саморасщепления.
После линеаризации плазмидной ДНК, находящейся ниже по ходу транскрипции от рибозима HDV, подходящей рестрикционной эндонуклеазой, прерванные транскрипты синтезировали in vitro, используя ДНК-зависимую полимеразу РНК, происходящую из бактериофага T7 или SP6. Транскрипции выполняли в течение 2 часов при 37°C в присутствии 7,5 мМ (РНК полимераза T7) или 5 мМ (РНК полимераза SP6) каждого из нуклеозидтрифосфатов (ATP, CTP, GTP и UTP), следуя инструкциям, предоставленным производителем (Ambion). После транскрипции матричную ДНК расщепляли ДНКазой TURBO DNase (Ambion). РНК репликона осаждали LiCl и ресуспендировали в не содержащей нуклеазу воде. Некэппированную РНК подвергали посттранскрипционному кэппированию кэппирующим ферментом вируса коровьей оспы (VCE), используя систему кэппирования ScriptCap m7G Capping System (Epicentre Biotechnologies), как указано в руководстве для пользователя; репликонам, кэппированным таким образом, присваивают префикс «v», например, vA317 представляет собой репликон A317, кэппированный VCE. Постранскрипционно кэппированную РНК осаждали LiCl и ресуспендировали в не содержащей нуклеазу воде. Концентрацию образцов РНК, определенную измерением OD260нм-целости транскриптов in vitro, подтверждали денатурирующим электрофорезом в агарозном геле.
Инкапсуляция в липосомы
РНК инкапсулировали в липосомы, полученные по существу способом ссылок 9 и 42. Вкратце, липиды растворяли в этаноле, репликон РНК растворяли в буфере, и их смешивали с буфером с последующим уравновешиванием. Смесь разбавляли буфером, затем фильтровали. Полученный продукт содержал липосомы с высокой эффективностью инкапсуляции. Липосомы получали из 10% DSPC (цвиттерионного), 40% DlinDMA (катионного), 48% холестерина и 2% ПЭГ-конъюгированного DMG. Эти пропорции относятся к % моль во всей липосоме.
DlinDMA (l,2-дилинолеилокси-N,N-диметил-3-аминопропан) синтезировали с использованием процедуры ссылки 4. DSPC (l,2-Диастеароил-sn-глицеро-3-фосфохолин) закупали у компании Genzyme. Холестерин получали у компании Sigma-Aldrich. ПЭГ-конъюгированный DMG (1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль), аммониевую соль), DOTAP (хлорид 1,2-диолеил-3-триметиламмоний-пропана) и DC-chol (гидрохлорид 3β-[N-(N',N'-диметиламиноэтан)-карбамоил]холестерина) были получены от компании Avanti Polar Lipids.
В некоторых липосомах использовали альтернативные катионные липиды вместо DlinDMA, например, RV05 или RV17:
|
В целом, восемь различных способов использовали для получения липосом в соответствии с изобретением. В тексте они именуют способами от (A) до (H), и они отличаются главным образом в отношении стадий фильтрации и TFF. Детали способов следующие.
(A) Получали свежие основные растворы липидов в этаноле. Отвешивали 37 мг DlinDMA, 11,8 мг DSPC, 27,8 мг холестерина и 8,07 мг ПЭГ-DMG 2000 и растворяли в 7,55 мл этанола. Свежеприготовленный основной раствор липидов осторожно встряхивали при 37°C в течение примерно 15 мин для образования однородной смеси. Затем 755 мкл основного раствора добавляли к 1,245 мл этанола для получения 2 мл рабочего основного раствора липидов. Это количество липидов использовали для образования липосом с 250 мкг РНК. 2 мл рабочего раствора РНК также получали из основного раствора ~1 мкг/мкл в 100 мМ цитратного буфера (pH 6). Три стеклянных флакона емкостью 20 мл (с якорями магнитных мешалок) споласкивали раствором RNase Away (Molecular BioProducts) и промывали большим количеством воды MilliQ перед использованием для удаления РНКаз из флаконов. Один из флаконов использовали для рабочего раствора РНК, а другие для сбора смесей липидов и РНК (как описано ниже). Рабочие растворы липидов и РНК нагревали при 37°C в течение 10 мин перед загрузкой в шприцы объемом 3 см3 с Люэровскими переходниками. 2 мл цитратного буфера (pH 6) загружали в другой шприц объемом 3 см3. Шприцы, содержащие РНК и липиды, соединяли с T-образным смесителем (PEEK™ с соединением с внутренним диаметром 500 мкм, Idex Health Science), используя трубки из FEP (фторированного этилена-пропилена; все трубки из FEP имеют внутренний диаметр 2 мм × наружный диаметр 3 мм, поставляемые компанией Idex Health Science). Выпуск из T-образного смесителя также представлял собой трубку из FEP. Третий шприц, содержащий цитратный бфер, соединяли с отдельным отрезком трубки из FEP. Затем все шприцы приводили в действие при скорости потока 7 мл/мин, используя шприцевой насос. Выпуски трубок располагали для сбора смесей в стеклянный флакон емкостью 20 мл (при перемешивании). Якорь магнитной мешалки извлекали, и раствору этанола/воды давали возможность уравновеситься при комнатной температуре в течение 1 часа. 4 мл смеси загружали в шприц емкостью 5 см3, который соединяли с отрезком трубки из FEP, а в другой шприц емкостью 5 см3, соединенный с равным отрезком трубки из FEP, загружали равное количество 100 мМ цитратного буфера (pH 6). Эти два шприца приводили в действие со скоростью потока 7 мл/мин, используя шприцевой насос, и конечную смесь собирали в стеклянный флакон емкостью 20 мл (при перемешивании). Затем смесь, собранную в результате второй стадии смешивания (липосомы), пропускали через мембрану Mustang Q (анионообменную подложку, которая связывает и удаляет анионные молекулы, полученную от компании Pall Corporation). Перед пропусканием липосом, 4 мл 1M NaOH, 4 мл 1M NaCl и 10 мл 100 мМ цитратного буфера (pH 6) последовательно пропускали через мембрану Mustang. Липосомы согревали в течение 10 мин при 37°C перед пропусканием через мембрану. Затем липосомы концентрировали до 2 мл и диализировали против 10-15 объемов 1× PBS (солевого раствора с фосфатным буфером), используя TFF перед извлечением конечного продукта. Систему TFF и половолоконные фильтрационные мембраны закупали у компании Spectrum Labs и использовали в соответствии с инструкциями производителя. Использовали полисульфоновые половолоконные фильтрационные мембраны с размером пор, обеспечивающим отсечку частиц с молекулярной массой от 100 кД, и площадью поверхности 8 см2. Для экспериментов in vitro и in vivo составы разбавляли до требуемой концентрации РНК 1× PBS.
(B) В качестве способа (A), за исключением того, что после покачивания, 226,7 мкл основного раствора добавляли к 1,773 мл этанола для получения 2 мл основного раствора липидов, таким образом, модифицируя отношение липид:РНК.
(C) В качестве способа (B), за исключением того, что фильтрацию через мембрану Mustang опускали, так что липосомы поступали из стеклянного флакона емкостью 20 мл на диализ TFF.
(D) В качестве способа (C), за исключением того, что при TFF использовали поливолоконные мембраны из полиэфирсульфона (PES) (номер детали P-Cl-100E-100-01N) с размером пор, обеспечивающим отсечку частиц с молекулярной массой от 100 кД, и площадью поверхности 20 см2.
(E) В качестве способа (D), за исключением того, что использовали мембрану Mustang, как в способе (A).
(F) В качестве способа (A), за исключением того, что фильтрацию через мембрану Mustang опускали, так что липосомы поступали из стеклянного флакона емкостью 20 мл на диализ TFF.
(G) В качестве способа (D), за исключением того, что 4 мл рабочего раствора РНК получали из основного раствора ~1 мкг/мкл в 100 мМ цитратного буфера (pH 6). Затем таким же образом готовили четыре стеклянных флакона емкостью 20 мл. Два из них использовали для рабочего раствора РНК (2 мл в каждом флаконе), а другие для сбора смесей липидов и РНК, как в способе (C). Вместо использования T-образного смесителя, шприцы, содержащие РНК и липиды, соединяли с чипом капельного соединения Mitos Droplet junction Chip (стеклянного микрожидкостного устройства, полученного от компании Syrris, № детали 3000158), используя трубки из PTFE (внутренний диаметр 0,03 дюйма (0,076 мм) × наружный диаметр 1/16 дюйма (~0,16 мм)), используя четырехходовой гребенчатый разъем (Syrris). Два потока РНК и один поток липида обеспечивали шприцевым насосом, и смешивание этанола и водной фазы проводили в X-образном соединении (100 мкм × 105 мкм) чипа. Скорость течения всех трех потоков поддерживали на уровне 1,5 мл/мин, следовательно, отношение скорости всего водного к этанольному потоку составило 2:1. Выпуск трубки помещали для сбора смесей а стеклянный флакон емкостью 20 мл (при перемешивании). Якорь магнитной мешалки извлекали и раствору этанол/вода давали возможность уравновеситься до комнатной температуры в течение 1 ч. Затем смесь загружали в шприц объемом 5 см3, который насаживали на другой отрезок трубки из PTFE; в другой шприц объемом 5 см3 с равным отрезком трубки из PTFE, загружали равный объем 100 мМ цитратного буфера (pH 6). Эти два шприца приводили в действие при скорости потока 3 мл/мин с использованием шприцевого насоса, и конечную смесь собирали в стеклянный флакон емкостью 20 мл (при перемешивании). Затем липосомы концентрировали до 2 мл и диализировали против 10-15 объемов 1× PBS, используя TFF, как в способе (D).
(H) В качестве способа (A), за исключением того, что готовили 2 мл рабочего основного раствора липидов смешиванием 120,9 мкл основного раствора липидов с 1,879 мл этанола. Также, после смешивания в T-образном смесителе липосом из флакона емкостью 20 мл загружали диализную кассету Pierce Slide-A-Lyzer Dialysis Cassette (Thermo Scientific, сверхпрочная, емкость 0,5-3 мл) и диализировали против 400-500 мл 1× PBS в течение ночи при 4°C в автоклавированном пластиковом контейнере перед извлечением конечного продукта.
После образования липосом, процентную долю инкапсулированной РНК и концентрацию РНК можно определить набором реагентов РНК Quant-iT RiboGreen (Invitrogen), соблюдая инструкции производителя, с использованием стандарта рибосомальной РНК, поставляемого в наборе, для построения стандартной кривой. Например, липосомы разбавляют в 10 или 100 раз в 1× TE буфере (из набора) перед добавлением красителя. Отдельно, липосомы разбавляли в 10 или 100 раз в 1× TE буфере, содержащем 0,5% Triton X, перед добавлением красителя (для разрушения липосом и, таким образом, для анализа общего содержания РНК). После этого в каждый раствор добавляли равное количество красителя, и затем ~180 мкл каждого раствора после добавления красителя загружали в двух повторениях в 96-луночный планшет для культуры ткани. Флуоресценцию (возбуждение 485 нм, эмиссия 528 нм) считывали на микропланшетном ридере. Образование липосом может дозироваться in vivo на основании инкапсулированного количества РНК.
Было показано, что инкапсуляция в липосомы защищает РНК от переваривания РНКазой. В экспериментах использовали 3,8 mAU (микро условных единиц оптической плотности) РНКазы на 1 мкг РНК, инкубировали в течение 30 минут при комнатной температуре. РНКазу инактивировали Протеиназой K при 55°C в течение 10 минут. Затем смесь 1:1 об./об. образца к смеси 25:24:1 об./об./об. фенол:хлороформ:изоамиловый спирт добавляли к экстракту РНК из липидов в водную фазу. Образцы смешивали в вихревой мешалке в течение нескольких секунд и затем помещали в центрифугу на 15 минут при 12000 об/мин. Водную фазу (содержащую РНК) удаляли и использовали для анализа РНК. Перед загрузкой (400 нг РНК на лунку) все образцы инкубировали с загружающим формальдегид красителем, денатурировали в течение 10 минут при 65°C и охлаждали до комнатной температуры. Маркеры Ambion Millennium использовали для аппроксимации молекулярной массы конструкции РНК. Гель обрабатывали при 90 Вольт. Гель окрашивали, используя 0,1% SYBR золотой, в соответствии с инструкциями производителя, в воде покачиванием при комнатной температуре в течение 1 часа. На фиг.1 показано, что РНКаза полностью переваривает РНК в отсутствие инкапсуляции (полоса 3). РНК не выявляема после инкапсуляции (полоса 4), и изменение не наблюдается, если эти липосомы обрабатываются РНКазой (полоса 4). После того как обработанные РНКазой липосомы были подвергнуты экстракции фенолом, видна непереваренная РНК (полоса 6). Даже через 1 неделю при 4°C была видна РНК без какой-либо фрагментации (фиг.2, стрелка). Экспрессия белка in vivo была неизменной после 6 недель при 4°C и одного цикла замораживания-оттаивания. Таким образом, инкапсулированная в липосомы РНК является устойчивой.
Экспрессия репортерного гена
Для оценки экспрессии РНК in vivo, репортерный фермент (SEAP; секретируемая щелочная фосфатаза) кодировали в репликон, а не в иммуноген. Уровни экспрессии измеряли в сыворотках, разбавленных 1:4 в разбавляющем буфере 1× Phospha-Light, используя субстрат хемилюминесцентной щелочной фосфатазы. Мышам BALB/c в возрасте 8-10 (5/группу) внутримышечно инъецировали в 0 день 50 мкл на конечность 0,1 мкг или 1 мкг дозы РНК. Такой же вектор вводили без липосом (в не содержащем РНКазу 1× PBS) в количестве 1 мкг. Тестировали также репликоны, упакованные в вирион. Упакованные в вирион репликоны, используемые в настоящем изобретении (именуемые «VRP»), получали способами ссылки 43, где репликон альфавируса происходит из мутантного VEEV или химеры, происходящей из генома VEEV, в который методом инженерии включен 3' UTR вируса Синдбис, и сигналом упаковки вируса Синдбис (PS), упаковывали совместной электропорацией их в клетки BHK с дефективными хелперными РНК, кодирующими капсид вируса Синдбис и гены гликoпротеина.
Как показано на фиг.4, инкапсуляция увеличивает уровни SEAP примерно на Ѕ log при дозе 1 мкг, и на 6 день экспрессия от инкапсулированной дозы 0,1 мкг совпадала с уровнями, наблюдавшимся при инкапсулированной дозе 1 мкг. К 3 дню уровни экспрессии превышали те, которые были достигнуты VRP (квадраты). Таким образом, экспрессия SEAP увеличивалась, когда РНК включали в состав липосом, относительно контроля «голой» РНК, даже в 10 раз меньшей дозе. Экспрессия была также выше относительно контроля VRP, но кинетики экспрессии очень различались (см. фиг.4). Доставка РНК электропорацией привела к увеличенной экспрессии относительно «голого» контроля, но уровни были ниже чем с липосомами.
Для оценки того, был ли вызван эффект, наблюдавшийся в группах липосом, просто липосомными компонентами, или он был связан с инкапсуляцией, репликон вводили в инкапсулированной форме (с двумя различными протоколами очистки, 0,1 мкг РНК) или смешивали с липосомами после их образования (неинкапсулированный «липоплекс», 0,1 мкг РНК), или в виде «голой» РНК (1 мкг). Липоплекс давал самые низкие уровни экспрессии, показывая, что инкапсуляция существенна для выраженной экспрессии.
Дополнительные эксперименты SEAP показали ясную дозозависимую реакцию in vivo, при экспрессии, наблюдавшейся после доставки лишь 1 нг РНК. Дополнительные эксперименты, сравнивающие экспрессию из инкапсулированных и «голых» репликонов, указали на то, что 0,01 мкг инкапсулированной РНК были эквивалентны 1 мкг «голой» РНК. В дозе 0,5 мкг РНК инкапсулированный материал давал в 12 раз более высокую экспрессию на 6 день; в дозе 0,1 мкг уровни были в 24 раза выше на 6 день.
Вместо того, чтобы учитывать средние уровни в группе, также исследовали отдельных животных. В то время как несколько животных не реагировали на «голые» репликоны, инкапсуляция исключала не реагирующих животных.
Экспрессия иммуногенов in vivo
Для оценки иммуногенности in vivo репликон конструировали для экспрессии белка F полной длины из респираторного синцитиального вируса (RSV). Его доставляли «голыми» (1 мкг), инкапсулированными в липосомы (0,1 или 1 мкг) или упакованными в вирионы (106 МЕ; «VRP») в 0 и 21 день. Липосомы отчетливо усиливали иммуногенность, и РНК вызывает активную реакцию CD8 T-клеток. В дополнительных экспериментах сравнивали титры F-специфического IgG у мышей, получавших VRP, 0,1 мкг инкапсулированной в липосомы РНК или 1 мкг инкапсулированной в липосомы РНК. Инкапсулированная в липосомы РНК вызывает по существу такую же величину иммунного ответа как величина, наблюдавшаяся при доставке вириона.
Дополнительное исследование подтвердило, что 0,1 мкг инкапсулированной в липосомы РНК давало гораздо более высокие реакции IgG против F (через 15 дней после второй дозы), чем 0,1 мкг доставленной ДНК, и еще более иимуногенную, чем 20 мкг плазмидной ДНК, кодирующей антиген F, доставляемый электропорацией.
Для исследования иммуногенности F-белка RSV получали самореплицирующийся репликон «vA317», который кодирует F-белок RSV. Его вводили мышам BALB/c, 4 или 8 животных на группу, двусторонними внутримышечными вакцинациями (50 мкл на конечность) в 0 и 21 день с 1 мкг репликона отдельно или в составе липосом, полученных с DLinDMA, как описано выше. ПЭГ-DMG в этих липидах включал ПЭГ-2000. Для сравнения, «голую» плазмидную ДНК (20 мкг), экспрессирующую такой же антиген RSV-F, доставляли, или используя электропорацию, или липосомами (0,1 мкг ДНК). Четырех мышей использовали в качестве интактной контрольной группы. Сыворотку собирали для анализа антител в 14 и 36 дни. Селезенки забирали у мышей на 49 день для анализа T-клеток.
Титры F-специфического сывороточного IgG (GMT) были следующими, представляющими данные для 4 различных РНК-содержащих препаратов липосом, для сравнения, ДНК-содержащих липосом:
|
Таким образом, липосомные препаративные формы значительно увеличивали иммуногенность относительно контролей «голой» РНК, по данным определения увеличенных титров F-специфического IgG (а также частот T-клеток; данные не показаны). Плазмидная ДНК, составленная с липосомами или доставленная «голой» с использованием электропорации, была значительно менее иммуногенной, чем составленная с липосомами самореплицирующаяся РНК.
Бόльшая длина ПЭГ
Для сравнения воздействия длины ПЭГ на иммуногенность in vivo, получали два различных набора липосом, используя способ (H), либо с 150 мкг РНК, либо без РНК (для получения пустых липосом). Использовали две различных липидные смеси, обе имеющие 40% DlinDMA, 10% DSPC, 48% холестерина и 2% ПЭГ-DMG, но в этих двух композициях использовали или ПЭГ 2000, или ПЭГ 5000. РНК репликон представлял собой vA375, кодирующий поверхностный слитый гликoпротеин RSV.
В следующей таблетке показан размер липосом (Z-средняя молекулярная масса и индекс полидисперсности) и % инкапсуляции РНК в каждой:
|
Липосомы вводили мышам BALB/c (10 на группу) двусторонней внутримышечной инъекцией (50 мкл на конечность) в 0 и 21 дни. Дозы составляли 0,01, 0,03, 0,1, 0,3 или 1 мкг. Титры F-специфического сывороточного IgG и PRNT60 (GMT) были следующими, через 2 недели после первой или второй инъекции:
|
|
Включение ПЭГ 5000 вызывает более высокие F-специфические титры, чем ПЭГ 2000, после введения двух доз 0,1 (в 1,6 раза), 0,3 (в 1,5 раза) или 1 мкг (в 2,4 раза) РНК. Статистический анализ (T-критерий) показал, что F-специфические титры (2wp2) статистически различались (P<0,05) между группами ПЭГ 5000 и ПЭГ 2000 группами при дозах 0,01, 0,1, 0,3 и 1 мкг РНК. ПЭГ 5000 дал более высокие нейтрализующие титры (в 2,4 раза) при дозе 1 мкг РНК, P<0,05.
Аналогичные сравнительные эксперименты выполняли с репликоном vA317. Липосомы получали способом (H) с 40% DlinDMA, 10% DSPC, 48% холестерина и 2% ПЭГ-DMG (либо ПЭГ 2000, либо ПЭГ 5000). Их характеристики были следующими:
|
Мышам BALB/c, по 8 на группу, путем двусторонних внутримышечных вакцинаций (50 на конечность) в 0 и 21 дни с «голой» (1 мкг) или инкапсулированной в липосомы РНК (0,1 мкг). Сыворотку собирали на 14 и 35 дни, и селезенки забирали на 49 день.
Титры F-специфического сывороточного IgG (GMT) были следующие через 2 недели после первой или второй инъекции:
|
Средние точные частоты положительных в отношении F-специфического цитокина T-клеток (CD4+ или CD8+) были следующими, причем показаны только цифры, которые статистически значимо превышали ноль (специфические для пептидов RSV F51-66, F164-178, F309-323 в отношении CD4+, или для пептидов F85-93 и F249-258 в отношении CD8+):
|
Таким образом, титры F-специфического IgG увеличились в 2,5 раза (2wp1) и в 3 раза (2wp2) увеличением молекулярной массы головной группы ПЭГ от 2000 до 5000. Наблюдалось также положительное воздействие на T-клеточные реакции.
Эффект молекулярной массы ПЭГ до 10 кДа
Мышей BALB/c использовали для исследования воздействия различных молекулярных масс ПЭГ в диапазоне от 1 до 10 кДа. Пять групп получали две дозы (в 0 и 21 дни) 0,1 мкг РНК, кодирующей F-белок RSV (репликон vA375) в липосомах, образованных из катионного липида DLinDMA и ПЭГ-DMG различной молекулярной массы (1 кДа, 2 кДа, 3 кДа, 5 кДа, 10 кДа). Титры F-специфического IgG измеряли через 14 дней после первой и второй доз, и результаты показаны на фиг.5. Данные показывают, что молекулярные массы ПЭГ 2, 3, 5 и 10 кДа обеспечивают по существу одинаковые титры в обе точки времени, и все они лучше, чем наблюдавшиеся при ПЭГ с молекулярной массой 1 кДа.
Контрольные животные получали липосомы DLinDMA с ПЭГ 2 кДа-DMG, но не РНК. У этих животных проявился титр анти-F IgG, который также увеличился после второй дозы (но на гораздо более низких уровнях, чем у животных, получавших инкапсулированную РНК). Образцы сыворотки у этой группы не проявили неспецифическую реакцию на покрытых gp140 или PBS планшетах ELISA.
Сывороточные цитокины измеряли через 5 часов после инъекций липосом. В целом, ни у одной из мышей не наблюдали реакции IL-1β или TNF-α, и реакции IL-12/p70, IL-6, IL-10, IFN-γ и IP-10 были эквивалентными для всех молекулярных масс ПЭГ. Реакция KC/GRO была значительно ниже у мышей, которые получали липосомы с ПЭГ-DMG 5 кДа или 10 кДа, чем липосомы без пегилирования.
Исследования ПЭГ5000 с RSV
Для настоящего исследования использовали четыре различных репликона, причем все кодирующие гликопротеин дикого типа F полной длины RSV с делетированным слитым пептидом. Репликон vA372 образован остановленной транскрипцией. 3'-Конец репликона vA142 образован опосредованным рибозимом расщеплением. В vA368 экспрессия белка запускается внутренним сайтом входа в рибосому (IRES) EV71. В vA369 экспрессия репликона запускается IRES EMCV.
Липосомы образовывали с 40% катионного липида RV17, 10% DSPC, 49,5% холестерина, 0,5% ПЭГ DMG 5000 и получали с использованием способа (H) при размере партии РНК 175 мкг.
Мыши BALB/c, по 7 животных на группу, получали двусторонние внутримышечные вакцинации (50 мкл на конечность) в 0 и 21 дни с использованием:
Группа 1: самореплицирующаяся РНК (vA372, 1,0 мкг), включенная в состав липосом;
Группа 2: самореплицирующаяся РНК (vA142, 1,0 мкг), включенная в состав липосом;
Группа 3: VRP, содержащий РНК vA142 (1×106 МЕ);
Группа 4: самореплицирующаяся РНК (vA368, 1,0 мкг), включенная в состав липосом;
Группа 5: VRP, содержащий РНК vA368 (1×106 МЕ);
Группа 6: самореплицирующаяся РНК (vA369, 1,0 мкг), включенная в состав липосом;
Группа 7: VRP, содержащий РНК vA369 (1×106 МЕ);
Группа 8: Интактный контроль (4 животных).
Образцы сыворотки брали для анализа антител на 0, 20, 35 дни. Селезенки забирали на 35 день для анализа T-клеток.
Титры F-специфического сывороточного IgG и титры нейтрализации (GMT) были следующие:
|
|
Таким образом, все четыре репликона были иммуногенными, и каждый вызывал выработку сывороточных F-специфических IgG антител после первой вакцинации, причем вторая вакцинация эффективно вызывала вторичный иммунный ответ. Нейтрализующие RSV антитела выявляли после второй вакцинации. Аналогичные титры антител после второй вакцинации индуцировались репликоном, в котором 3'-конец был образован опосредованным рибозимом расщеплением (vA142), и репликоном, в котором 3' конец был образован остановленной транскрипцией (vA372). Экспрессия F антигена, проводимого в действие EV71 или EMCV, не усиливала реакцию антител на репликон (vA368 или vA369 в сравнении с vA142). Аналогичным образом, T-клеточные реакции (не показано) не дифференцировали репликоны, в которых 3'-конец был образован опосредованным рибозимом расщеплением (vA142), или остановленной транскрипцией (vA372), и не проявляли благоприятный эффект на экспрессию F антигена, запускаемую EV71 или EMCV (vA238 или vA369 в сравнении с vA142).
Репликон vA142 также тестировали у хлопковых хомяков (Sigmodon hispidis), используя липосомы, образованные из:
(a) 40% DlinDMA, 10% DPSC, 48% холестерина и 2% ПЭГ-DMG 2000, полученные способом (D) при размере партии РНК 175 мкг;
(b) 40% RV17, 10% DSPC, 49,5% холестерина и 0,5% ПЭГ-DMG 5000, полученные способом (H) при размере партии РНК 200 мкг;
(c) 40% RV05, 30% DLoPE (18:2 PE), 28% холестерина и 2% ПЭГ-DMG 2000, полученные способом (H) при размере партии РНК 200 мкг.
Хлопковые хомяки, 4-8 животных на группу, получали внутримышечные вакцинации (100 мкл в одну конечность) в 0 и 21 дни при:
Группа 1: самореплицирующаяся РНК (vA142, 1 мкг, RSV-F), включенная в состав липосом (a);
Группа 2: самореплицирующаяся РНК (vA142, 0,1 мкг, RSV-F), включенная в состав липосом (a);
Группа 3: самореплицирующаяся РНК (vA142, 1 мкг, RSV-F), включенная в состав липосом (b);
Группа 4: самореплицирующаяся РНК (vA142, 0,1 мкг, RSV-F), включенная в состав липосом (b);
Группа 5: самореплицирующаяся РНК (vA142, 1 мкг, RSV-F), включенная в состав липосом (c);
Группа 6: самореплицирующаяся РНК (vA142, 0,1 мкг, RSV-F), включенная в состав липосом (c);
Группа 7: VRP (1×106 МЕ), экспрессирующие поверхностный полноразмерный F гликoпротеин RSV дикого типа;
Группа 8: вакцина белка F субъединицы RSV (5 мкг) с гидроксидом алюминия в качестве адъюванта;
Группа 9: интактный контроль (3 животных).
Всех хлопковых хомяков (кроме группы 9) вакцинировали 5 мкг F субъединицы + гидроксидом алюминия на 49 день (через четыре недели после второй вакцинации).
Сыворотку брали для анализа антител в 0, 21, 35, 49, 64 дни.
Ниже представлены сывороточные титры F-специфического сывороточного IgG (GMT):
|
Ниже представлены титры нейтрализующих RSV антител:
|
Вакцинация белком не повышала титры антител у хлопковых хомяков, предварительно вакцинированных белком, но она обеспечивала большое повышение титров у хлопковых хомяков, предварительно вакцинированных РНК. В большинстве случаев титры нейтрализующих антител к RSV в сыворотке после двух вакцинаций РНК с последующей вакцинацией белком были равны титрам, вызванным двумя или тремя последовательными вакцинациями белком с адъювантом.
Иммуногенность CMV
Липосомы использовали для доставки РНК репликонов, кодирующих гликoпротеин цитомегаловируса (CMV). Репликон «vA160» кодирует гликoпротеины H и L (gH/gL) полной длины, тогда как репликон «vA322» кодирует растворимую форму (gHsol/gL). Эти два белка находятся под контролем отдельных субгеномных промоторов в одном репликоне; совместное введение двух отдельных векторов, одного кодирующего gH и одного кодирующего gL не дало благоприятных результатов.
Мышам BALB/c, по 10 на группу, проводили двусторонние внутримышечные вакцинации (по 50 мкл на конечность) в 0, 21 и 42 дни VRP, экспрессирующими gH/gL (1×106 МЕ), VRP, экспрессирующими gHsol/gL (1×106 МЕ), и PBS в качестве контролей. Две тестируемые группы получали 1 мкг репликона vA160 или vA322, включенного в состав липосом (40% DlinDMA, 10% DSPC, 48% холестерина, 2% ПЭГ-DMG 2000; полученных способом (D), но при размере партии РНК 150 мкг).
Липосомы vA160 имели Zav (Z-средний) диаметр 168 нм, pdI (индекс полидисперсности) 0,144 и инкапсуляцию 87,4%. Липосомы vA322 имели Zav диаметр 162 нм, pdI 0,131 и инкапсуляцию 90%.
Репликоны были способны экспрессировать два белка из одного вектора.
Образцы сыворотки брали для иммунологического анализа на 63 день (3wp3). Ниже представлены титры антител, нейтрализующих CMV (обратная величина разведения сыворотки, продуцирующая уменьшение на 50% числа положительных вирусных очагов на лунку, относительно контролей):
|
Таким образом, РНК, экспрессирующая либо полноразмерный, либо растворимую форму комплекса CMV gH/gL, вызывала высокие титры нейтрализующих антител, по данным анализа эпителиальных клеток. Средние титры, вызываемые инкапсулированными в липосомы РНК, были по меньшей мере такими же высокими, как для соответствующих VRP.
Повторные эксперименты подтвердили, что репликон был способен экспрессировать два белка из одного вектора. Репликон РНК давал титр 3wp3 11457, по сравнению с 5516 при VRP.
В дополнительных экспериментах использовали другие репликоны в дополнение к vA160, и использовали более длинный ПЭГ в липосомах. Репликон vA526 экспрессирует пентамерный комплекс CMV (gH-gL-UL128-UL130-UL-131) под контролем трех субгеномных промоторов: первый стимулирует экспрессию gH; второй стимулирует экспрессию gL; третий стимулирует экспрессию полипротеина UL128-2A-UL130-2A-UL131, который содержит два сайта расщепления 2A тремя генами UL. Репликон vA527 экспрессирует пентамерный комплекс CMV через три субгеномных промотера и два IRES: первый субгеномный промотор стимулирует экспрессию gH; второй субгеномный промотор стимулирует экспрессию gL; третий субгеномный промотор стимулирует экспрессию UL128; UL130 находится под контролем IRES EMCV; UL131 находится под контролем IRES EV71. Эти три репликона доставляли липосомой (полученной способом (H), при размере партии 150 мкг; 40% DlinDMA, 10% DSPC, 48% холестерина, 2% ПЭГ DMG 5000) или VRP.
Мышам BALB/c, 10 группам из 10 животных, проводили двусторонние внутримышечные вакцинации (50 мкл на конечность) в 0, 21 и 42 дни следующим образом:
Группа 1: VRP, экспрессирующий gH FL/gL (1×106 МЕ);
Группа 2: пентамерный, 2A VRP (1×105 МЕ);
Группа 3: пентамерный, 2A VRP (1×106 МЕ);
Группа 4: пентамерный, IRES VRP (1×105 МЕ);
Группа 5: самореплицирующаяся РНК vA160 (1 мкг), включенная в состав липосом;
Группа 6: самореплицирующаяся РНК vA526 (1 мкг), включенная в состав липосом;
Группа 7: самореплицирующаяся РНК vA527 (1 мкг), включенная в состав липосом;
Группа 8: самореплицирующаяся РНК vA160 (1 мкг), включенная в состав катионной наноэмульсии;
Группа 9: самореплицирующаяся РНК vA526 (1 мкг), включенная в состав катионной наноэмульсии;
Группа 10: самореплицирующаяся РНК vA527 (1 мкг), включенная в состав катионной наноэмульсии.
Образцы сыворотки брали для иммунологического анализа в 21 (3wp1), 42 (3wp2) и 63 (3wp3) дни.
Ниже представлены сывороточные титры нейтрализующих CMV антител в 21, 42 и 63 дни:
|
Таким образом, самореплицирующуюся РНК можно использовать для экспрессии множественных антигенов из одного вектора и для вызова активного и специфического иммунного ответа. Репликон может экспрессировать пять антигенов (пентамерный комплекс CMV (gH-gL-UL128-UL130-UL-131) и вызывать активный иммунный ответ. Самореплицирующаяся РНК, доставляемая в липосомах с PEG5000, была способна вызвать высокие титры нейтрализующего антитела, по данным анализа на эпителиальных клетках, во все анализированные точки времени (3wp1, 3wp2 и 3wp3). Эти ответы превосходили соответствующие VRP и катионные наноэмульсии.
Следует понимать, что изобретение было описано только в качестве примера, и в него могут быть внесены изменения, оставаясь в пределах объема и сущности изобретения.
|
|
|
ССЫЛКИ