Результат интеллектуальной деятельности: Способ получения метилэтилкетона
Вид РИД
Изобретение
Изобретение относится к области основного органического синтеза, а именно к способу получения метилэтилкетона (МЭК) путем газофазной каталитической конденсации ацетона с метанолом.
Метилэтилкетон широко используется как растворитель различных лакокрасочных материалов и клеев, а также нашел широкое применение в процессах депарафинизации смазочных масел и обезмасливания парафинов. МЭК используется в качестве сырья при получении метилизопропилкетона, 2,3-бутандиона; оксима метилэтилкетона, предотвращающего образование пленок при хранении красок. Используется для получения этилакриловой и изомерных метилкротоновых кислот, антиоксидантов резин, для пластификации производных нитроцеллюлозы, используемых в производстве бездымных порохов, находит применение как растворитель для пленочных покрытий таблеток и капсул лекарств, как реагент и экстрагент во многих фармацевтических производствах. Пероксид метилэтилкетона является инициатором полимеризации ненасыщенных полиэфиров в производстве армированных пластиков.
Метилэтилкетон получают преимущественно путем гидратации н-бутиленов с последующим дегидрированием образующегося бутанола-2 [Kirk-Othmer Encyclopedia of Chemical Technology (4th Edition). John Wily & Sonc Inc 1991-1998, vol. 14, p. 489-490]. Известны несколько вариантов осуществления процесса. Традиционно бутанол-2 получают сернокислотной гидратацией бутан-бутиленовой фракции в относительно мягких условиях: на первой стадии в результате сульфирования олефинов образуется 2-бутилсульфат, на второй стадии в результате гидролиза бутилсульфата образуется бутанол-2. Недостатками сернокислотной гидратации является обилие вредных трудно утилизируемых отходов в виде загрязненной кислыми гудронами серной кислоты; высокая коррозионная активность среды и высокие энергозатраты, связанные с необходимостью концентрирования серной кислоты. Для того чтобы избежать проблем, связанных с сернокислотной гидратацией, был разработан одностадийный процесс прямой гидратации бутенов с использованием твердых кислотных катализаторов [US 2579601], в том числе сульфокатионитов [US 4476333]. Прямая гидратация требует меньших капитальных затрат, но ограничена низкой конверсией бутенов за один проход (5-15%).
Разновидностью способа кислотной гидратации является процесс, в котором серную кислоту заменяют на уксусную. В этом случае промежуточным продуктом является вторбутилацетат [RU 2206560]. В этом способе получения МЭК отходов меньше, чем в сернокислотном. Однако вторбутилацетатный способ требует больших капитальных вложений и текущих затрат из-за коррозионных свойств водной уксусной кислоты.
Известны несколько вариантов дегидрирования 2-бутанола. Обычно дегидрирование проводят в газовой фазе с использованием катализаторов на основе оксида цинка [GB 665376, US 2835706, US 2885442], или меди [US 5723679, DE 1026739, GB 1269167], или бронзы [US 4075128,], или сплавов железа [GB 779350], или благородных металлов 8-й группы Периодической системы [GB 1264460, GB 1269167] при температуре 250°C - 500°C при давлении немного выше атмосферного. Процесс требует подвода тепла и сопровождается дезактивацией катализатора. Необходима периодическая регенерация катализатора, что усложняет организацию процесса и увеличивает капитальные затраты.
Известен способ окислительного дегидрирования 2-бутанола. Процесс осуществляют при 500°C при добавлении в исходную смесь кислорода на серебряном катализаторе [RU 2233701]. Известен способ осуществления процесса с использованием медь-цинковых катализаторов при более низкой температуре [SU 960160]. Процесс окислительного дегидрирования не ограничен термодинамическим равновесием, позволяет получать более высокую конверсию исходного спирта, но селективность снижается за счет образования продуктов глубокого окисления.
Известен способ получения МЭК, в котором в качестве окислителя вместо кислорода используют перекись водорода [RU 2169726]. Для повышения селективности процесс окисления осуществляют в присутствии титаносиликатов со струтктурой MEL и MFI [RU 2323203]. Однако использование перекиси водорода делает конечный продукт дороже.
По аналогии с Waker-Hoechst процессом в патентах US 3236897 и US 3215743 предложено получать МЭК путем прямого окисления н-бутенов в водном растворе, содержащем в качестве катализатора хлориды палладия и меди. Однако в этом случае в качестве побочных продуктов получаются бутиральдегид и большое количество хлорбутанонов (до 25%).
В изобретениях [US 4720474, RU 700973, R U822417, RU 1669109] было предложено использовать в качестве обратимого окислителя вместо хлорида меди гетерополикислоты (ГПК). Эта каталитическая система не содержала ионов хлора и потому обеспечивала полное отсутствие хлорорганических соединений в продуктах реакции. Избирательность системы достигала 95-98%, а активность в реакции окисления олефинов в 100 раз превышала активность хлоридной системы (PdCl2+CuCl2). Однако катализатор Pd-ГПК нельзя было признать вполне устойчивым ни в отношении палладия, ни в отношении ГПК. Низкая стабильность такого катализатора оказалась его главным недостатком. Было предпринято много попыток стабилизировать палладий в катализаторе (Pd+ГПК), однако все они по разным причинам оказались неприемлемыми для технологии.
Известен способ получения МЭК из ацетальдегида и этилена SU 1328345. Однако высокая стоимость исходного сырья делает невозможным использование этого способа на практике.
Известен способ получения метилэтилкетона изомеризацией изомасляного альдегида [US 3384668, SU 825491]. Способ остался нереализованным в промышленности, вероятно, из-за ограниченной доступности сырья и его высокой стоимости.
Известен способ совместного получения метилэтилкетона и фенола [US 5304684]. Этот способ разрабатывался как альтернатива кумольному процессу получения фенола, поскольку образующийся по кумольной технологии сопутствующий продукт, ацетон, имеет ограниченный спрос. Замена ацетона на метилэтилкетон позволила бы сбалансировать рынок фенола и ацетона. Однако получение и разложение гидроперекиси вторбутилбензола протекает с меньшей избирательностью, чем получение и разложение гидроперекиси кумола. Наряду с МЭК и фенолом образуются карбоновые кислоты, их эфиры, альдегиды, непредельные кетоны, смолы. Побочные продукты удаляют щелочью, что существенно ухудшает экологию производства.
Потребительские свойства метилэтилкетона по многим параметрам превосходят свойства ацетона. Однако его мировое потребление составляет лишь только 15-20% от потребления ацетона, что связано с существенно более высокими затратами на получение МЭК (цена МЭК в ~2 раза выше цены ацетона) и широкой доступностью ацетона. Разработка технологии получения МЭК из ацетона позволила бы решить две задачи: вывести избыток ацетона с рынка и сделать более доступным метилэтилкетон.
Известен способ синтеза метилэтилкетона, основанный на реакции альфа-метилирования ацетона метанолом [Б.А. Болотов, В.Л. Клюев. Парофазная конденсация метанола и ацетона на медно-титановых катализаторах // Журнал Прикладной Химии. - 1971 - Т. 44. - В. 10 - С. 2280-2283]. Химическая сущность этого способа заключается в дегидроконденсации ацетона и метанола или, другими словами, в алкилировании (метилировании) ацетона в α-положение к карбонильной группе. Процесс осуществляют в парогазовой фазе при относительно мягких условиях: при атмосферном давлении, температуре до 300°C в присутствии катализатора, содержащего от 15 до 80 мас.% меди на оксиде титана. Наибольший выход по метилэтилкетону наблюдался при 60 мас.% содержании меди, среди катализаторов с содержанием меди 15, 45, 60 и 80 мас.%. Для достижения приемлемой конверсии ацетона процесс осуществляют при большом времени контакта - 23 секунды, однако выход метилэтилкетона на пропущенный ацетон не превышал 24%, а селективность превращения ацетона в метилэтилкетон не превышала 68%. Дальнейшего развития работа не получила, что может быть связано с низкой активностью катализатора. Поскольку авторы не имели возможности следить за изменением активности катализатора в ходе опыта и измеряли характеристики превращения на основе анализа состава конденсированных жидких продуктов, наработанных в ходе опыта, то естественно предположить, что низкая активность катализатора могла быть связана с быстрой дезактивацией катализатора. Наши исследования, представленные ниже, подтвердили это предположение.
Способ получения МЭК из ацетона и метанола [Б.А. Болотов, В.Л. Клюев. Парофазная конденсация метанола и ацетона на медно-титановых катализаторах // Журнал Прикладной Химии. - 1971 - Т. 44. - В. 10 - С. 2280-2283] по своей сущности наиболее близок к настоящему изобретению и может быть выбран в качестве прототипа. Согласно прототипу газофазный процесс метилирования ацетона (250-300°C) проводят на медьсодержащем катализаторе. Основным недостатком этого способа является низкая производительность и низкая стабильность катализатора.
Изобретение решает задачу увеличения эффективности процесса.
Технический результат - увеличение времени межрегенерационного пробега катализатора в несколько раз, а следовательно, и увеличение и количества метилэтилкетона, получаемого с единицы объема реактора.
Задача решается способом получения метилэтилкетона, который осуществляют взаимодействием исходной парогазовой смеси ацетона и метанола с использованием медьсодержащего катализатора, с введением в исходную реакционную смесь водорода.
Способ осуществляют в газовой фазе при температуре 150-350°C. Водород вводят в количестве не менее 0,1 об.%. В качестве медьсодержащего катализатора применяют Cu/SiO2 или Cu/MgO/SiO2.
Получение метилэтилкетона осуществляют при добавлении в исходную реакционную смесь водорода. В качестве исходных реагентов выступают ацетон и метанол. Исходную смесь ацетона с метанолом в соотношениях от 1:1 до 1:10 смешивают с водородом и пропускают через слой медьсодержащего гетерогенного катализатора. Реакционная смесь может быть разбавлена газом-разбавителем. В качестве газа-разбавителя используют один или смесь из нижеперечисленных газов: азот, и/или любой инертный газ, и/или углекислый газ. В газ-разбавитель может быть добавлен водород в любых количествах, предпочтительно не более 30 об.%. Даже небольшое содержание водорода в исходной реакционной смеси существенно снижает степень дезактивации катализатора и увеличивает его межрегенерационный пробег.
Оптимальная температура, которую необходимо поддерживать в реакторе, должна обеспечивать проведение процесса в газовой фазе. Обычно реакцию ведут при температуре 150-350°C. Важным параметром является время контакта реакционной смеси с катализатором. Этот параметр варьируется от 0.1 до 20 секунд, предпочтительно использовать 0,3-5 секунд.
Данный способ позволяет применять любой из известных медьсодержащих (или содержащих оксид меди) катализаторов, как массивных, так и на носителе, полученных с использованием любой неорганической или органической соли меди и любого из известных носителей: оксид алюминия, оксиды щелочноземельных металлов, металлосиликаты аморфные, металлосиликаты кристаллические, силикалит, мезопористые силикаты и металлосиликаты, силикагель, стеклотканные материалы, углеродные и полимерные носители. Катализаторы могут иметь в своем составе промоторы из ряда щелочных, щелочноземельных и ряда переходных металлов в количествах от 0.1 до 10.0 мас. % от количества меди. Содержание меди в катализаторе может лежать в пределах от 1 до 50 мас. %, предпочтительно, в пределах 3-30 мас. % от массы катализатора. Большое количество меди в катализаторе, с одной стороны, увеличивает его активность, но, с другой стороны, приводит к непроизводительному расходу метанола на реакцию паровой конверсии, приводящую к образованию оксидов углерода.
Таким образом, существенным и основным отличием заявленного способа синтеза метилэтилкетона путем конденсации ацетона с метанолом является наличие водорода в исходной реакционной смеси. Добавление водорода в исходную смесь позволяет увеличить время межрегенерационного пробега катализатора в несколько раз, а следовательно, и увеличить количество продукта, получаемого с единицы объема реактора. Введение водорода в реакционную смесь поддерживает катализатор в восстановленном состоянии. Положительный эффект добавки водорода наиболее ярко проявляется при проведении процесса на катализаторе с низким содержанием меди. Поэтому дополнительным положительным эффектом добавки водорода в реакционную смесь является возможность уменьшения содержания меди в катализаторе и уменьшения загрузки катализатора в реактор, а также повышение селективности процесса.
Сущность изобретения иллюстрируется следующими примерами.
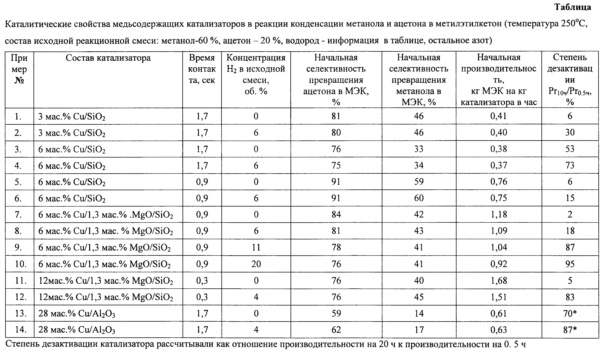
Каталитические свойства медьсодержащих катализаторов в реакции метилирования ацетона в метилэтилкетон (примеры №1-14) представлены в таблице.
Пример 1. Сравнительный
70 мл/мин смеси метанола (60 об.%) и ацетона (20 об.%) в азоте (20 об.%) пропускают через слой катализатора (навеска 1 г) при температуре 250°C в течение 10 часов. Катализатор имеет состав: 3 мас. % Cu и 97 мас. % SiO2. Состав реакционной смеси определяют путем отбора проб непосредственно из парогазового потока с последующим анализом органических компонентов на пламенно-ионизационном детекторе, неорганических компонентов на двух детекторах по теплопроводности. Органические компоненты реакционной смеси разделяют на капиллярной колонке DB-1701. Полученная смесь содержит непрореагировавшие ацетон и метанол, метилэтилкетон, а также побочные продукты - диметиловый эфир, диэтилкетон, метилизопропилкетон, этилизопропилкетон, метилизобутилкетон, изопропанол, бутанол-2, 3-метил,2-бутанол и т.п. При анализе водорода, азота, монооксида углерода, диоксида углерода и воды пробу разделяют на отдельные компоненты с помощью насадочных колонок с цеолитом СаА (молекулярное сито 5А) и с адсорбентом Porapak R.
В качестве характеристики активности используют производительность (Pr) по метилэтилкетону:
Pr (кг метилэтилкетона/кг катализатора в ч)=(NМК⋅MМК)⋅60/m;
где: NМК - общий поток реакционной смеси на выходе из реактора, моль/мин;
MМК - молекулярная масса метилэтилкетона, г/моль;
m - масса загруженного в реактор катализатора, г.
Селективность (S) превращения ацетона/метанола в метилэтилкетон вычисляют по формуле:
S(%)=100⋅NМК/(NК°-NК);
где: NМК - поток метилэтилкетона, моль/мин;
NК° - поток входящего исходного реагента, моль/мин;
NК - поток выходящего исходного реагента, моль/мин.
В качестве параметра, характеризующего стабильность работы катализатора, используют отношение производительности по метилэтилкетону через 10 ч работы катализатора к начальной производительности, отнесенной на 30 минут (Pr10 ч/Pr0.5 ч), выраженной в процентах.
В таблице представлена информация о начальной производительности и селективности превращения ацетона и метанола в метилэтилкетон, а также параметр, характеризующий стабильность работы катализатора. Видно, что через 10 часов производительность катализатора по метилэтилкетону сильно снижается и составляет всего 6% от начальной активности.
Пример 2
Процесс ведут аналогично примеру 1 с тем отличием, что часть азота замещают водородом. В целом исходная реакционная смесь содержит 6 об.% водорода. Результаты тестирования катализатора представлены в таблице. Видно, что по сравнению с примером 1 стабильность работы катализатора значительно выросла. На 10 часов работы производительность составляла 30% от первоначальной производительности, при этом остальные характеристики превращения в первом приближении практически не поменялись.
Пример 3. Сравнительный
Процесс ведут аналогично примеру 1 с тем отличием, что содержание меди в катализаторе увеличено до 6 мас.%. Результаты тестирования представлены в таблице. Видно, что стабильность работы катализатора с ростом в нем содержания меди повышается, но при этом снижается селективность превращения ацетона на 5% и метанола на 13%.
Пример 4
Процесс ведут аналогично примеру 3 с тем отличием, что исходная газовая смесь метанола, ацетона и газа-разбавителя содержит 6 об.% водорода. Результаты тестирования представлены в таблице. Видно, что добавление в исходную реакционную смесь водорода привело к увеличению стабильности работы катализатора. В течение 10 часов производительность по метилэтилкетону снижается на 27%, в то время как в примере 3 без добавления водорода производительность снижается почти в 2 раза.
Пример 5. Сравнительный
Процесс ведут аналогично примеру 3 с тем отличием, что время контакта реакционной смеси с катализатором уменьшают с 1,7 секунд до 0,9 секунд. Снижение времени контакта сопровождается ускорением дезактивации катализатора и заметным увеличением селективности. Если при времени контакта 1.7 секунд (пример №3) за десять часов производительность составляла 53% от первоначальной, то при времени контакта 0.9 секунд в настоящем примере всего 6%.
Пример 6
Процесс ведут аналогично примеру 5 с тем отличием, что в исходную реакционную смесь добавляют 6 об.% водорода. Результаты тестирования каталитических свойств представлены в таблице. Видно, что добавление водорода повышает стабильность работы катализатора. Производительность на 10 часов работы возрастает с 6 до 15% от начальной производительности по метилэтилкетону.
Пример 7. Сравнительный
Процесс ведут аналогично примеру 6 с тем отличием, что в катализатор дополнительно вводят 1,3 мас. % MgO. Результаты тестирования представлены в таблице. Видно, что введение в катализатор магния приводит к росту его производительности по метилэтилкетону в 1.6 раза при снижении селективности превращения метанола на 17%, а ацетона на 7%. Обладая более высокой активностью, катализатор и быстрее дезактивируется. Через 10 часов работы остается лишь только 2% от начальной производительности по метилэтилкетону.
Пример 8
Процесс ведут аналогично примеру 7 с тем отличием, что в исходную смесь добавляют 6 об.%. водорода. Результаты тестирования каталитических свойств представлены в таблице. Видно, что при введении в исходную реакционную смесь водорода начальные характеристики работы катализатора изменяются незначительно, в то время как остаточная производительность через 10 часов работы увеличивается в 9 раз: с 2% до 18% от начальной производительности по метилэтилкетону.
Пример 9
Процесс ведут аналогично примеру 7 с тем отличием, что в исходную смесь добавляют 11 об.% водорода. Результаты тестирования представлены в таблице. Видно, что введение в исходную реакционную смесь водорода сопровождается небольшим снижением производительности и селективности превращения ацетона в метилэтилкетон (главным образом за счет превращения ацетона в изопропанол), но при этом существенно вырастает стабильность работы катализатора. Остаточная производительность через 10 часов работы увеличивается с 2% до 87% от начальной производительности по метилэтилкетону.
Пример 10.
Процесс ведут аналогично примеру 7 с тем отличием, что в исходную смесь добавляют 20 об.% водорода. Результаты представлены в таблице. Видно, что увеличение концентрации водорода в исходной смеси сопровождается дальнейшим снижением производительности и селективности превращения ацетона в метилэтилкетон, но при этом активность катализатора в течение 10 часов его работы в первом приближении практически не меняется. Снижение производительности не превышает 5% от первоначальной величины.
Пример 11. Сравнительный
Процесс ведут аналогично примеру 7 с тем отличием, что содержание меди в катализаторе увеличивают в 2 раза с 6 мас. % до 12 мас. %, а время контакта реакционной смеси с катализатором уменьшают в 3 раза - с 0.9 секунд до 0,3 секунд. Результаты представлены в таблице. Видно, что увеличение содержания меди и уменьшение времени контакта приводят к небольшому снижению селективности, росту производительности в 1.4 раза, при этом стабильность работы катализатора остается низкой: по истечении 10 часов производительность не превышает 5% от начальной производительности по метилэтилкетону.
Пример 12
Процесс ведут аналогично примеру 10 с тем отличием, что в исходную смесь добавляют 4 об.% водорода. Результаты представлены в таблице. Видно, что увеличение концентрации водорода в исходной смеси сопровождается существенным ростом стабильности работы катализатора. Производительность по метилэтилкетону на 10 часов работы увеличивается более чем в 16 раз с 5% до 83% от начальной производительности. Все остальные параметры, характеризующие превращение ацетона и метанола в метилэтилкетон, практически не изменяются.
Пример 13. Сравнительный
Процесс ведут аналогично примеру 1 с тем отличием, что вместо катализатора 3 мас.% Cu/SiO2 используют катализатор 28 мас.% Cu/Al2O3. Результаты представлены в таблице. Видно, что замена носителя при увеличении содержания меди приводит к существенному снижению селективности превращения в метилэтилкетон как ацетона, так и метанола. При этом даже без подачи водорода стабильность работы катализатора относительно высока. В течение 10 часов активность катализатора не изменяется. И только при увеличении времени работы катализатора до 20 часов наблюдается снижение производительности по метилэтилкетону до 70% от начальной производительности.
Пример 14
Процесс ведут аналогично примеру 13 с тем отличием, что в исходную смесь добавляют 4 об.% водорода. Результаты представлены в таблице. Видно, что увеличение концентрации водорода в исходной смеси сопровождается существенным ростом стабильности работы катализатора. Производительность по метилэтилкетону на 20 часов работы заметно увеличивается с 70% до 87% от начальной производительности. Все остальные параметры, характеризующие превращение ацетона и метанола в метилэтилкетон, остаются на близком уровне.