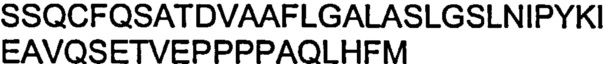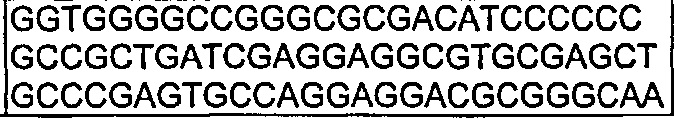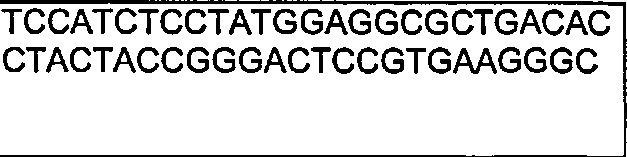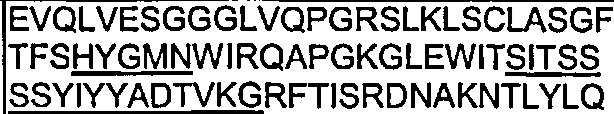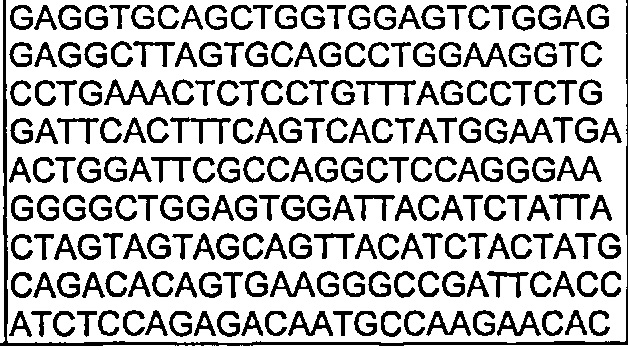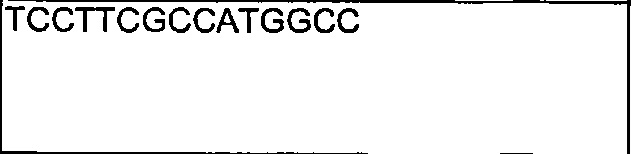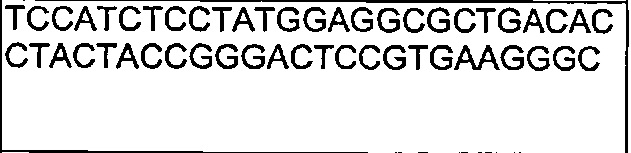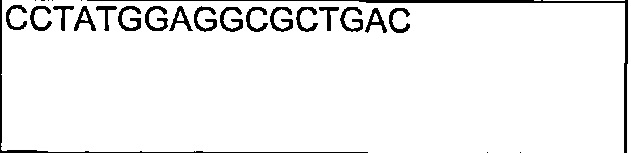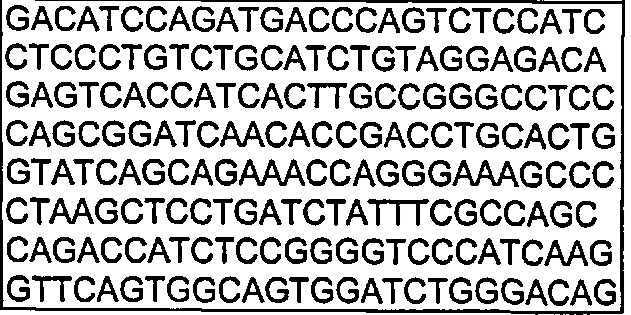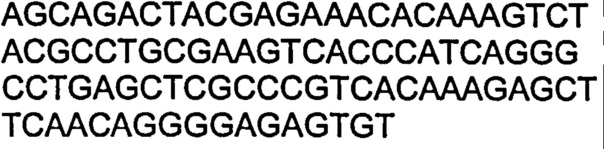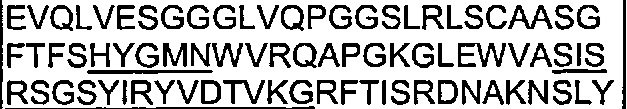Результат интеллектуальной деятельности: АНТИТЕЛА ПРОТИВ NOTCH1
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против Notch1. Настоящее изобретение кроме того относится к способам применения таких антител в лечении рака.
ПРЕДШЕСТВУЩИЙ УРОВЕНЬ ТЕХНИКИ
Рецепторы Notch контролируют в многоклеточных организмах нормальные рост, дифференцировку и гибель клеток через путь сигнализации, который запускается протеолизом, индуцированным лигандом (Bray, Nat. Rev. Mol. Cell Biol. 7(9):678-689, 2006). Зрелый гетеродимер Notch, после расщепления в сайте S1 фурин-подобной протеазой, поддерживается в автоингибированном состоянии околомембранной негативной регуляторной областью (NRR), состоящей из трех повторов Lin12/Notch (LNR-A, B, C) и домена гетеродимеризации (HD). Домен HD разделяется на N-концевую (HD1) и C-концевую (HD2) части посредством расщепления в сайте S1. Через неясный механизм связывание лигандов семейства Delta/Serrate/Lag-2 (DSL) с N-концевой областью с повтором EGF снимает это ингибирование и индуцирует два последовательных дополнительных расщепления в S2 около C-концевой области HD-2 и S3 в пределах трансмембранного домена в Notch, которые катализируются металлопротеиназой типа ADAM и гамма-секретазой соответственно (Gordon, W.R., et al, Nature Structural & Molecular Biology, 2007, volume 14, 295-300). Последнее расщепление высвобождает внутриклеточный домен Notch (NotchICD), позволяя ему транслоцироваться в ядро и активировать транскрипцию генов-мишеней.
В клетках млекопитающих есть четыре известных рецептора Notch. Notch1-4 имеет широкие перекрывающиеся паттерны экспрессии в эмбриональных и взрослых тканях и выполняет неизбыточные роли во время спецификации гематопоэтических стволовых клеток, развития Т-клеток, спецификации клеток кишечных крипт и развития сосудов. Приобретенные нарушения с участием специфичных рецепторов Notch1 связывали с раковыми заболеваниями, такими как T-клеточный острый лимфобластный лейкоз (T-ALL), рак молочной железы и рак легкого. Кроме того, активированный Notch1 является мощным индуктором лейкоза в мышиных моделях и сверхэкспрессируется в различных солидных опухолях, включая немелкоклеточный рак легкого, рак молочной железы и рак яичника.
Более 50% пациентов с T-ALL имеют мутации в рецепторе Notch1, некоторые из них приводят к конститутивному расщеплению рецептора и продукции NotchICD частично из-за гиперчувствительности Notch1 к лиганду или лиганд-независимой активации, вызванной изменениями в или около автоингибирующего домена NRR. Данные мутации классифицируют на 3 главных класса. Мутации класса 1 представляют собой замены одиночных аминокислот и маленькие делеции в рамке считывания или вставки в HD1. Мутации класса 2 представляют собой более длинные вставки в дистальной области HD2, которые перемещают сайт расщепления металлопротеиназой S2 за пределы автоингибирующего домена NRR. Мутации класса 3, также именуемые мутациями околомембранного удлинения (JME), происходят в результате больших вставок, которые вытесняют NRR из клеточной мембраны.
Для терапевтических целей при раковом заболевании разрабатываются несколько стратегий для ингибирования Notch сигнализации. Одним подходом является блокирование протеолитического высвобождения внутриклеточного Notch из мембраны путем обработки ингибиторами гамма-секретазы (GSI). Несмотря на то, что GSI дошли до клинического применения, они не могут различать индивидуальные рецепторы Notch и вызывают кишечную токсичность, приписываемую к ингибированию как Notch1, так и Notch2. В данной области до сих пор имеется потребность в новой терапии против Notch1 для лечения ракового заболевания при обеспечении ослабленных побочных эффектов, в частности, кишечной токсичности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении согласно настоящему изобретению предложены антитела, которые связываются с Notch1, имеющие вариабельную область тяжелой цепи, имеющую область CDR1 (гипервариабельная область 1), область CDR2 и область CDR3 из вариабельной области тяжелой цепи, содержащей SEQ ID NO: 71.
В другом воплощении согласно настоящему изобретению предложены антитела, которые связываются с Notch1, имеющие вариабельную область легкой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области легкой цепи, содержащей SEQ ID NO: 97.
Согласно настоящему изобретению также предложены антитела, которые связываются с Notch1, имеющие:
1) вариабельную область тяжелой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области тяжелой цепи, содержащей SEQ ID NO: 71 и
2) вариабельную область легкой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области легкой цепи, содержащей SEQ ID NO: 97.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 71. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, как изложено в SEQ ID NO: 71.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 97. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области легкой цепи, как изложено в SEQ ID NO: 97.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 111. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, как изложено в SEQ ID NO: 111.
Также предложены антитела, имеющие аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 113. Кроме того, предложены антитела, имеющие аминокислотную последовательность легкой цепи, как изложено в SEQ ID NO: 113.
В другом воплощении согласно изобретению предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 71; и аминокислотную последовательность вариабельной области легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 97. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, как изложено в SEQ ID NO: 71; и аминокислотную последовательность вариабельной области легкой цепи, как изложено в SEQ ID NO: 97.
В другом воплощении согласно изобретению предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 111; и аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 113. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, как изложено в SEQ ID NO: 111; и аминокислотную последовательность легкой цепи, как изложено в SEQ ID NO: 113.
В другом воплощении согласно изобретению предложены антитела, которые связываются с человеческим Notch1, где данные антитела связываются с эпитопом, имеющим по меньшей мере 8 аминокислотных остатков, выбранных из Asn 1461, Lys 1462, Val 1463, Cys 1464, Leu 1466, Leu 1580, Tyr 1621, Gly 1622, Met 1670, Asp 1671, Val 1672, Arg 1673, Leu 1707, Ala 1708, Leu 1710, Gly 1711, Ser 1712, Leu 1713, Pro 1716 и Lys 1718.
В другом воплощении согласно настоящему изобретению предложены антитела, которые связываются с Notch1, имеющие вариабельную область тяжелой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области тяжелой цепи, содержащей SEQ ID NO: 115.
В другом воплощении согласно настоящему изобретению предложены антитела, которые связываются с Notch1, имеющие вариабельную область легкой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области легкой цепи, содержащей SEQ ID NO: 129.
Согласно настоящему изобретению также предложены антитела, которые связываются с Notch1, имеющие:
1) вариабельную область тяжелой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области тяжелой цепи, содержащей SEQ ID NO: 115 и
2) вариабельную область легкой цепи, имеющую область CDR1, область CDR2 и область CDR3 из вариабельной области легкой цепи, содержащей SEQ ID NO: 129.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 115. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, как изложено в SEQ ID NO: 115.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 129. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области легкой цепи, как изложено в SEQ ID NO: 129.
Также предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 149. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, как изложено в SEQ ID NO: 149.
Также предложены антитела, имеющие аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 151. Кроме того, предложены антитела, имеющие аминокислотную последовательность легкой цепи, как изложено в SEQ ID NO: 151.
В другом воплощении согласно изобретению предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность вариабельной области тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 115; и аминокислотную последовательность вариабельной области легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 129. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную, последовательность вариабельной области тяжелой цепи, как изложено в SEQ ID NO: 115; и аминокислотную последовательность вариабельной области легкой цепи, как изложено в SEQ ID NO: 129.
В другом воплощении согласно изобретению предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 149; и аминокислотную последовательность легкой цепи, которая является по меньшей мере на 90% идентичной SEQ ID NO: 151. Кроме того, предложены антитела, которые связываются с Notch1, имеющие аминокислотную последовательность тяжелой цепи, как изложено в SEQ ID NO: 149; и аминокислотную последовательность легкой цепи, как изложено в SEQ ID NO: 151.
В другом воплощении согласно изобретению предложены антитела, которые связываются с человеческим Notch1, где данные антитела связываются с эпитопом, имеющим по меньшей мере 8 аминокислотных остатков, выбранных из Asp 1458, Asn 1461, Val 1463, Cys 1464, Leu 1466, Leu 1580, Met 1581, Pro 1582, Tyr 1621, Gly 1622, Arg 1623, Asp 1671, Val 1672, Arg 1673, Gly 1674, Leu 1710, Gly 1711, Ser 1712, Leu 1713, Asn 1714, Ile 1715, Pro 1716 и Lys 1718.
В другом воплощении согласно изобретению предложены антитела, которые демонстрируют большее ингибирование активации Notch1 мутантного рецептора Notch1 по сравнению с ингибированием активации Notch1 нативного рецептора Notch1. Кроме того, предложено то, что мутантный рецептор Notch1 имеет мутацию в негативной регуляторной области (NRR). В другом воплощении мутация в NRR выбрана из группы, состоящей из мутации класса 1, класса 2 и класса 3. В другом воплощении мутация в NRR ассоциирована с клетками, имеющими ненормальную активацию Notch1. Кроме того, предложено то, что клетки представляют собой клетки T-клеточного острого лимфобластного лейкоза (T-ALL). Также предложено то, что клетки T-ALL выбраны из группы, состоящей из клеток HPB-ALL, ALL-SIL, CCRF-CEM, MOLT-4 и DND-41.
Также предложены антитела, которые связываются с Notch1 и конкурируют за связывание с Notch1 с любым из описанных здесь антител.
В другом воплощении согласно изобретению предложены антитела, которые связываются с Notch1, где данные антитела имеют изотип IgA, IgD, IgE, IgG или IgM. Кроме того, предложены антитела, которые связываются с Notch1, где изотипом является IgG, и где подклассом является IgG1, IgG2, IgG3 или IgG4, или происходящий из него. Также предложены антитела, которые связываются с Notch1, где подкласс происходит от IgG1.
В другом воплощении согласно изобретению предложены нуклеиновые кислоты, которые кодируют любое из описанных здесь антител, или которые кодируют любую из тяжелых цепей и/или легких цепей описанных здесь антител. Например, в одном воплощении согласно изобретению предложены нуклеиновые кислоты, имеющие последовательность, как изложено в SEQ ID NO: 112. В другом воплощении согласно изобретению предложены нуклеиновые кислоты, имеющие последовательность, как изложено в SEQ ID NO: 114. В другом воплощении согласно изобретению предложены нуклеиновые кислоты, имеющие последовательность, как изложено в SEQ ID NO: 150. В другом воплощении согласно изобретению предложены нуклеиновые кислоты, имеющие последовательность, как изложено в SEQ ID NO: 152.
В другом воплощении согласно изобретению предложен вектор, содержащий любую из описанных здесь нуклеиновых кислот. В другом воплощении согласно изобретению предложены клетки-хозяева, содержащие любой из описанных здесь векторов. В другом воплощении согласно изобретению предложен способ получения любого из описанных здесь антител, включающий культивирование любых описанных здесь клеток-хозяев и выделение антител из культуральных сред. В другом воплощении согласно изобретению предложены клетки-хозяева, которые рекомбинантно продуцируют любое из описанных здесь антител. В одном воплощении выделяют любую из описанных здесь клеток-хозяев.
В другом воплощении согласно настоящему изобретению предложены фармацевтические композиции, содержащие любое из описанных здесь антител и фармацевтически приемлемые носители. В другом воплощении согласно изобретению предложены способы лечения расстройств у субъектов, нуждающихся в этом, включающие введение данным субъектам любого из описанных здесь антител или фармацевтических композиций. Согласно изобретению кроме того предложены способы лечения расстройств, которые ассоциированы с ненормальной активацией Notch1 у субъектов, нуждающихся в этом, включающие введение данным субъектам любого из описанных здесь антител или фармацевтических композиций. В другом воплощении согласно изобретению предложены способы лечения расстройств, таких как T-клеточный острый лимфобластный лейкоз (T-ALL), немелкоклеточный рак легкого (NSCLC), рак молочной железы и рак толстой кишки, у субъектов, нуждающихся в этом, включающий введение данным субъектам любого из описанных здесь антител или фармацевтических композиций. Согласно изобретению кроме того предложен способ лечения расстройств у субъектов, нуждающихся в этом, включающий введение субъектам любого из описанных здесь антител или фармацевтических композиций в комбинации с одним или более чем одним терапевтическим агентом.
В другом воплощении согласно изобретению предложено любое из раскрытых здесь антител для применения в терапии. В другом воплощении согласно изобретению предложено применение любого из раскрытых здесь антител для изготовления лекарственных средств для терапии. В другом воплощении согласно изобретению предложено любое из раскрытых здесь антител для применения в лечении расстройств, которые ассоциированы с ненормальной активацией Notch1, у субъектов, нуждающихся в этом. В другом воплощении согласно изобретению предложено любое из раскрытых здесь антител для применения в лечении таких расстройств, как T-клеточный острый лимфобластный лейкоз (T-ALL), немелкоклеточный рак легкого (NSCLC), рак молочной железы и рак толстой кишки, у субъектов, нуждающихся в этом.
В другом воплощении согласно изобретению предложены антитела, которые связываются с человеческим, мышиным Notch1 и Notch1 яванского макака (далее «макак»), но не связываются с человеческим Notch2. В другом воплощении согласно изобретению предложены антитела, которые связываются с человеческим, мышиным Notch1 или Notch1 макака, но не связываются с человеческим или мышиным Notch3.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
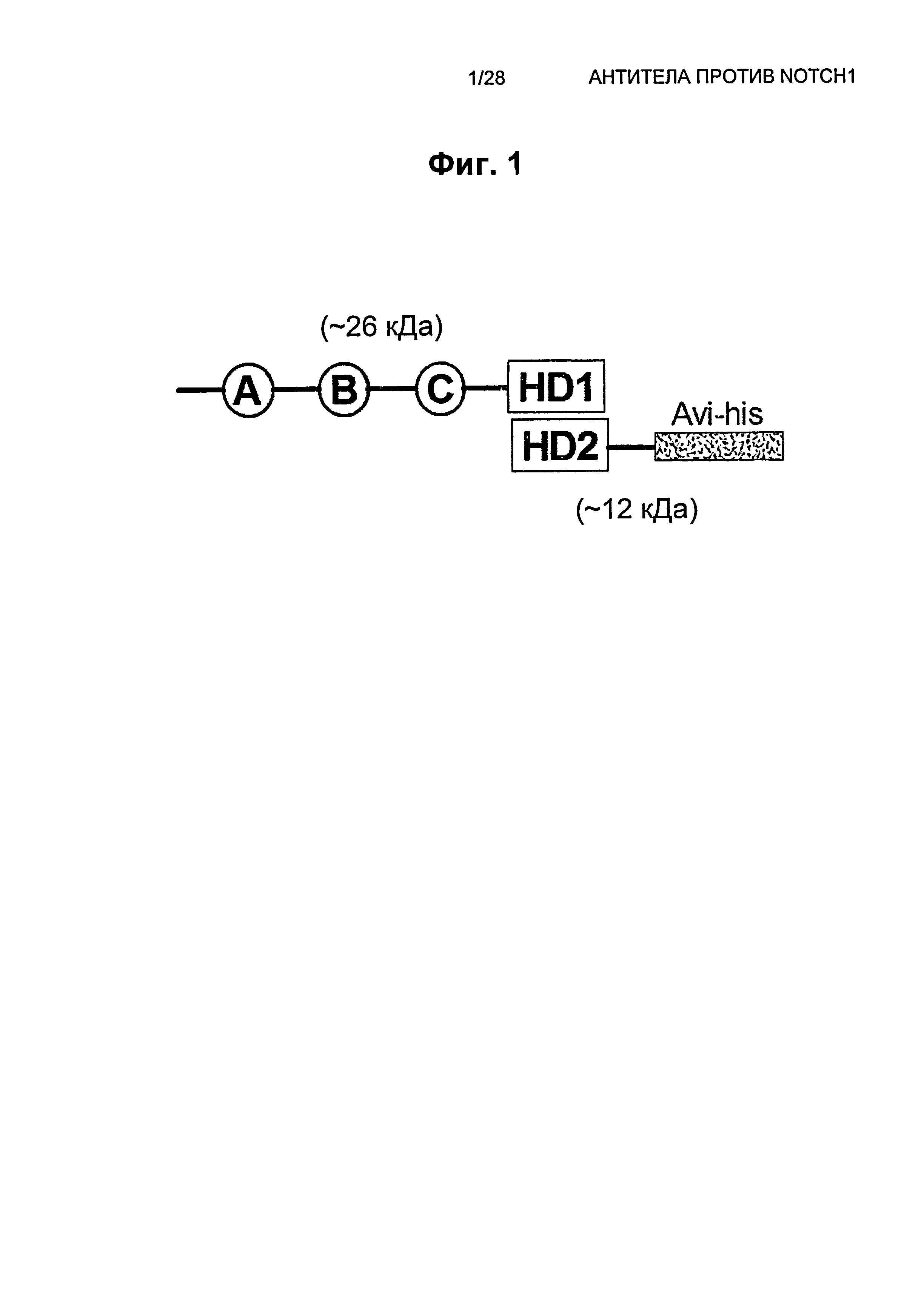
На Фиг.1 показана схематическая диаграмма рекомбинантного, расщепленного по S1, гетеродимерного белкового иммуногена NRR Notch1 с метками Avi и His.
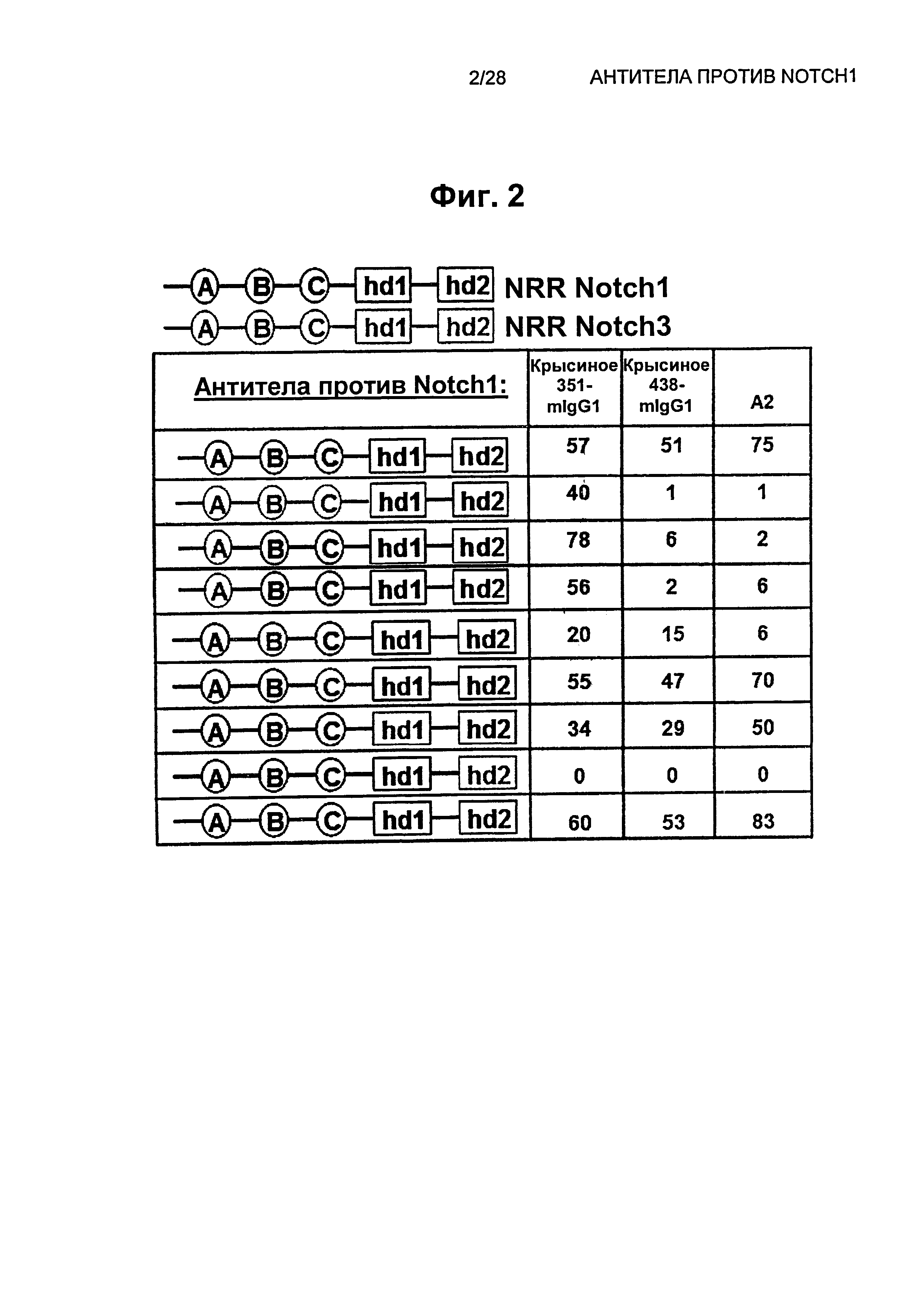
На Фиг.2 показаны рекомбинантные человеческие химерные конструкции, на основе доменов NRR Notch1 и NRR Notch3 для картирования эпитопов антител против Notch1: крысиного 351-mIgG1, крысиного 438-mIgG1 и A2.
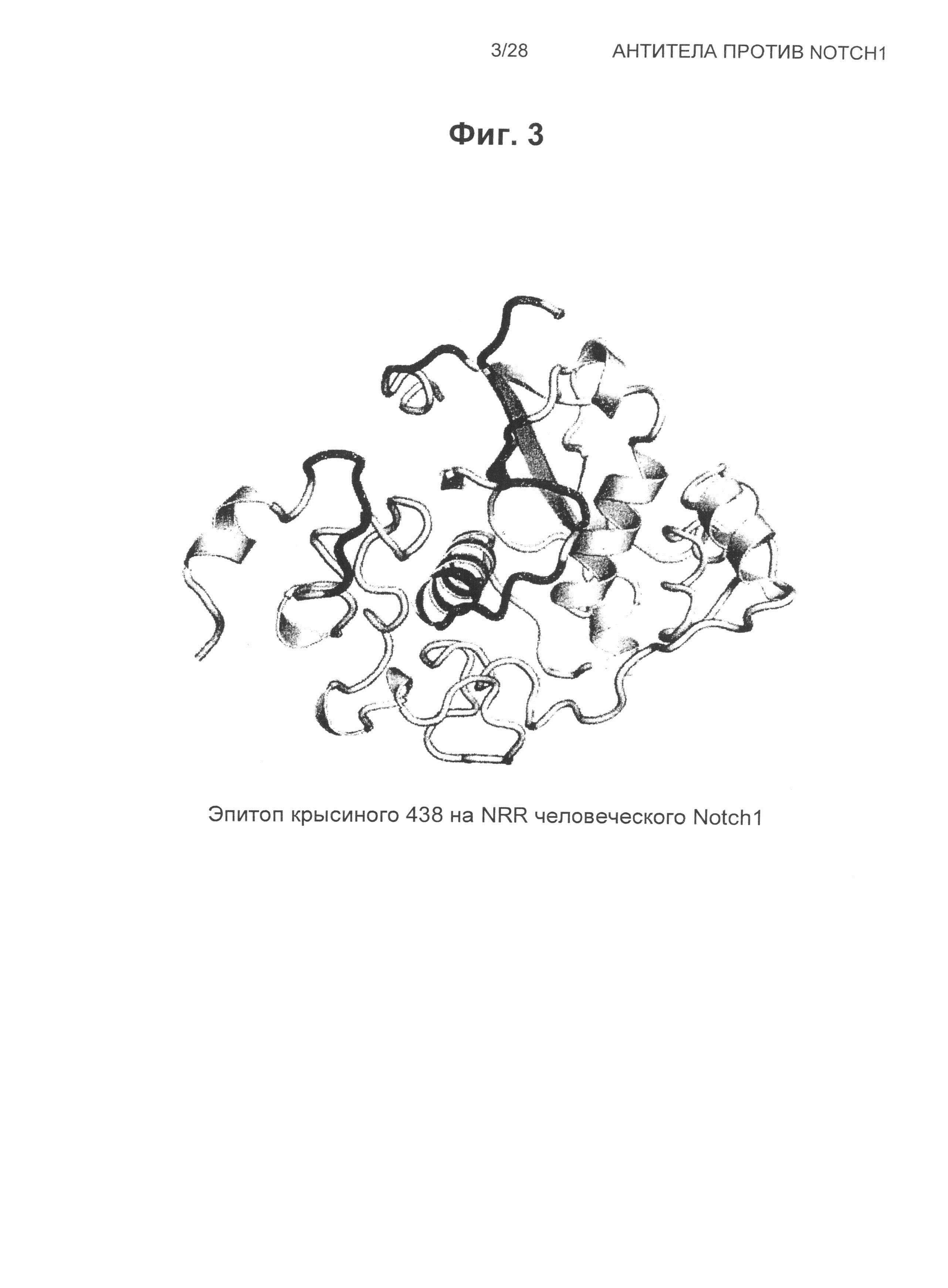
На Фиг.3 показана структура эпитопа крысиного антитела 438 на человеческом NRR Notch1.
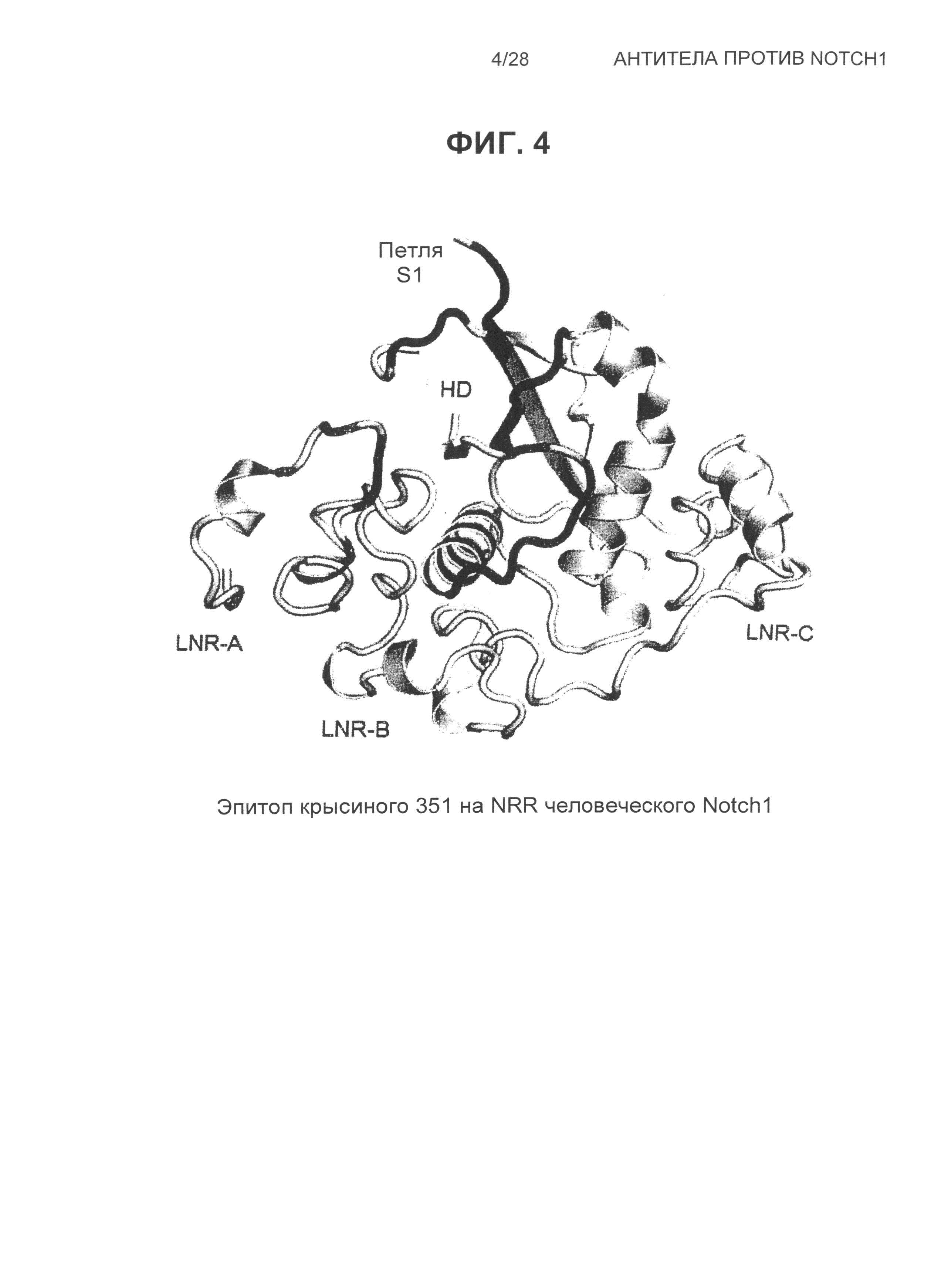
На Фиг.4 показана структура эпитопа крысиного антитела 351 на человеческом NRR Notch1
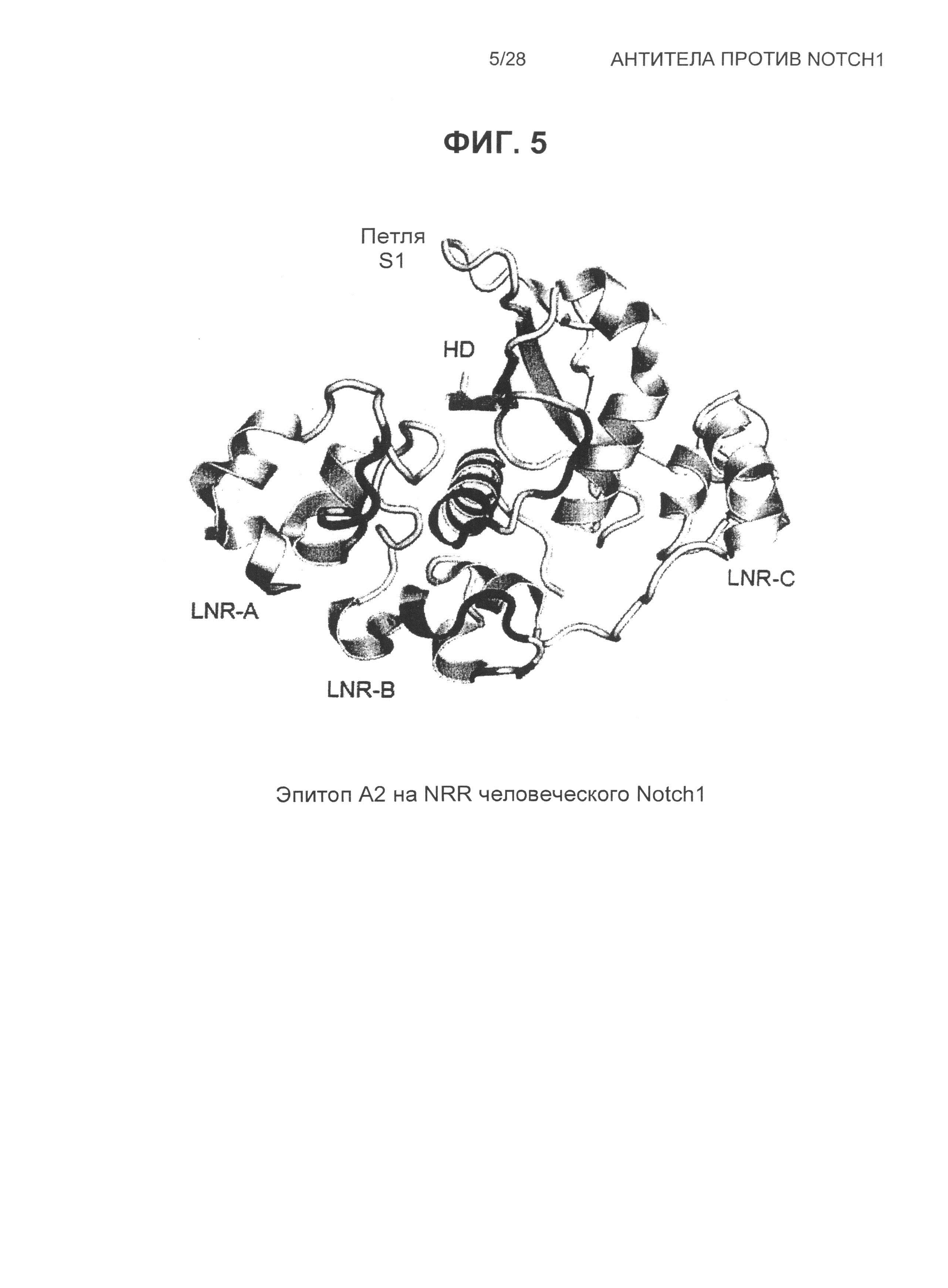
На Фиг.5 показана структура эпитопа A2 на человеческом NRR Notch1.
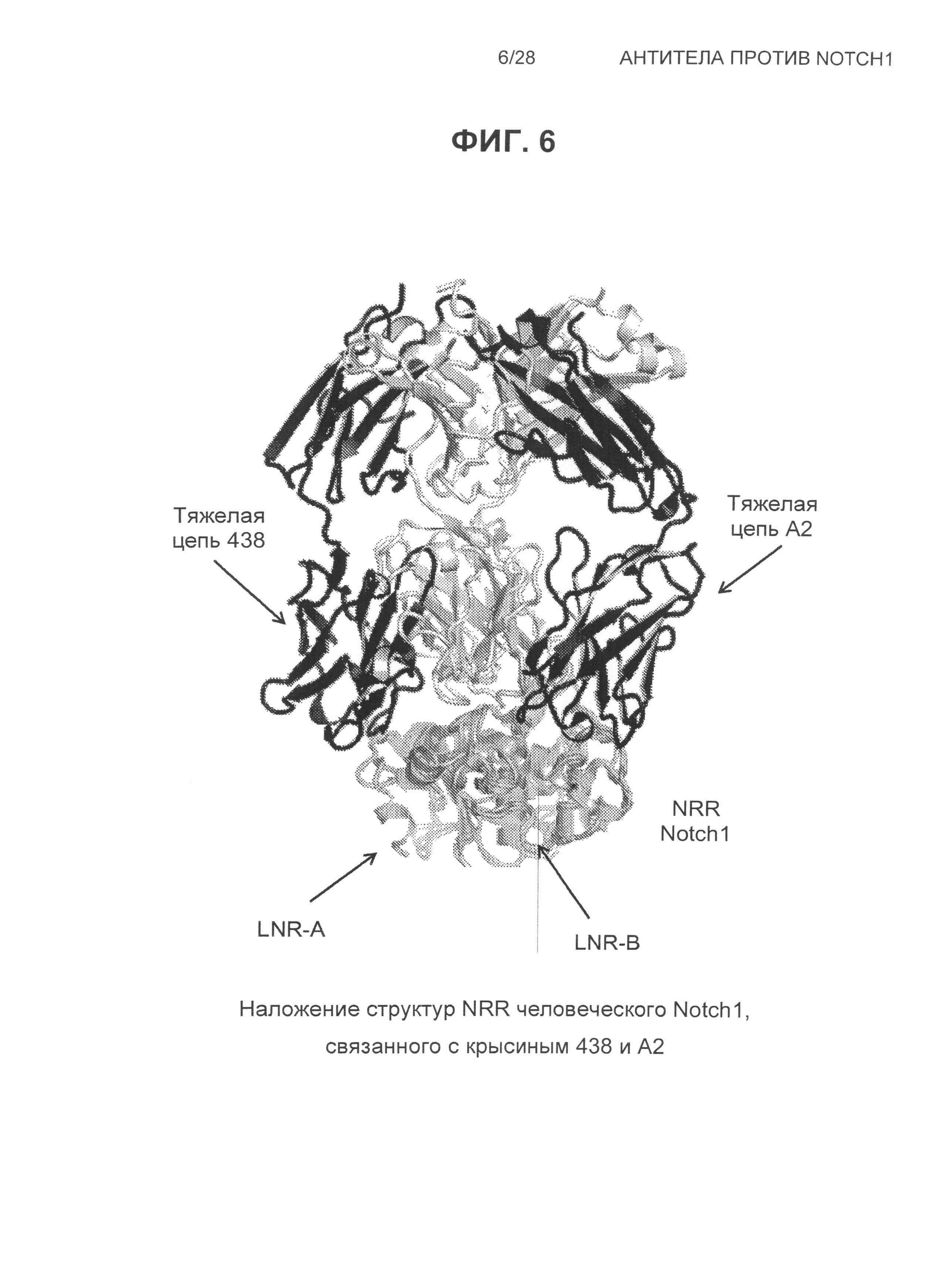
На Фиг.6 показано наложение структур NRR Notch1, связанного с антителами: крысиным 438 и A2.
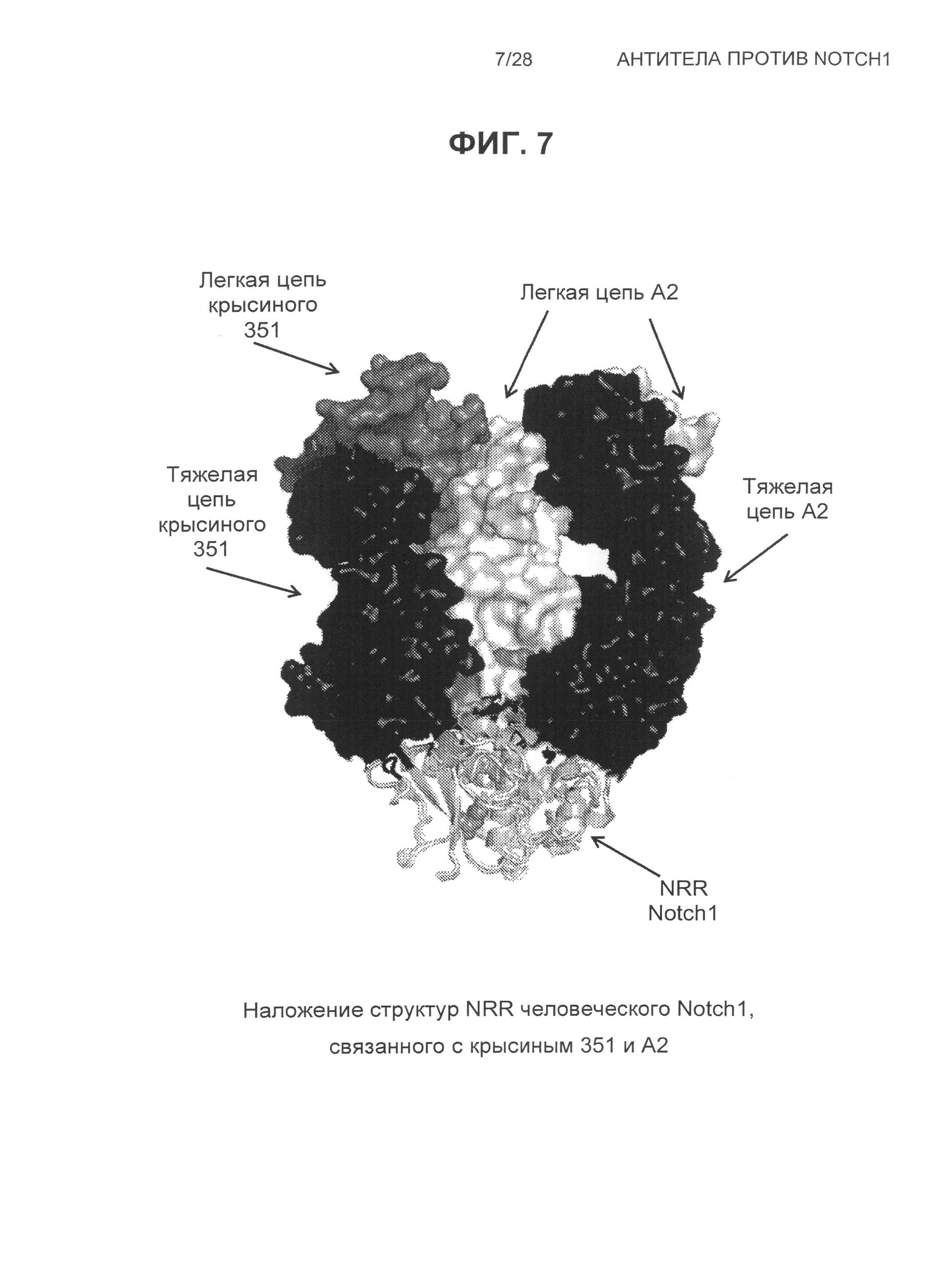
На Фиг.7 показано наложение структур NRR Notch1 (показана в виде лент), связанного с антителами: крысиным 351 и A2 (показаны в виде молекулярных поверхностей).
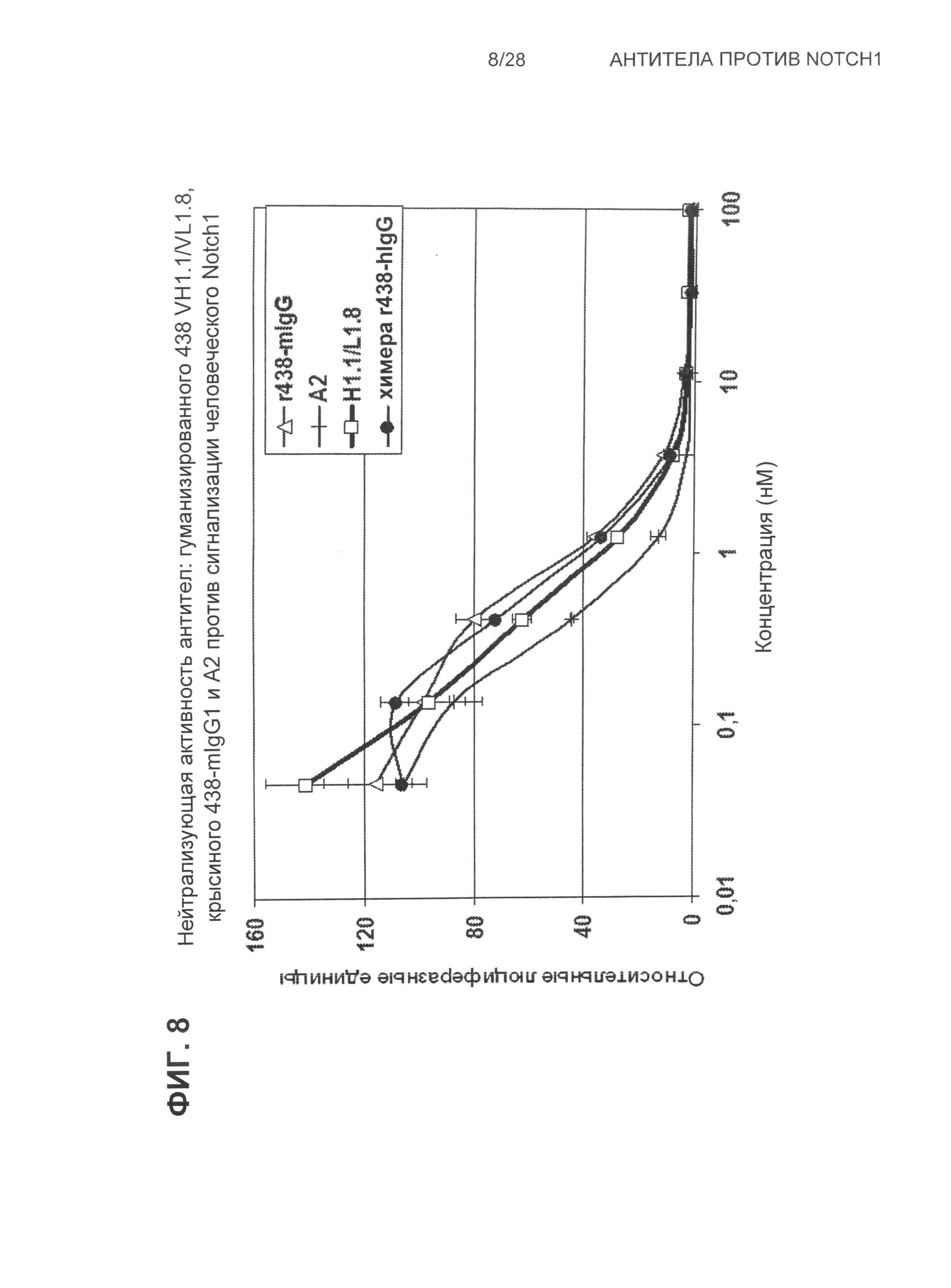
На Фиг.8 показана нейтрализующая активность антител: гуманизированного 438 VH1.1/VL1.8, крысиного 438-mIgG1 и A2 против сигнализации, зависимой от Notch1, в человеческих Notch1-репортерных клетках.
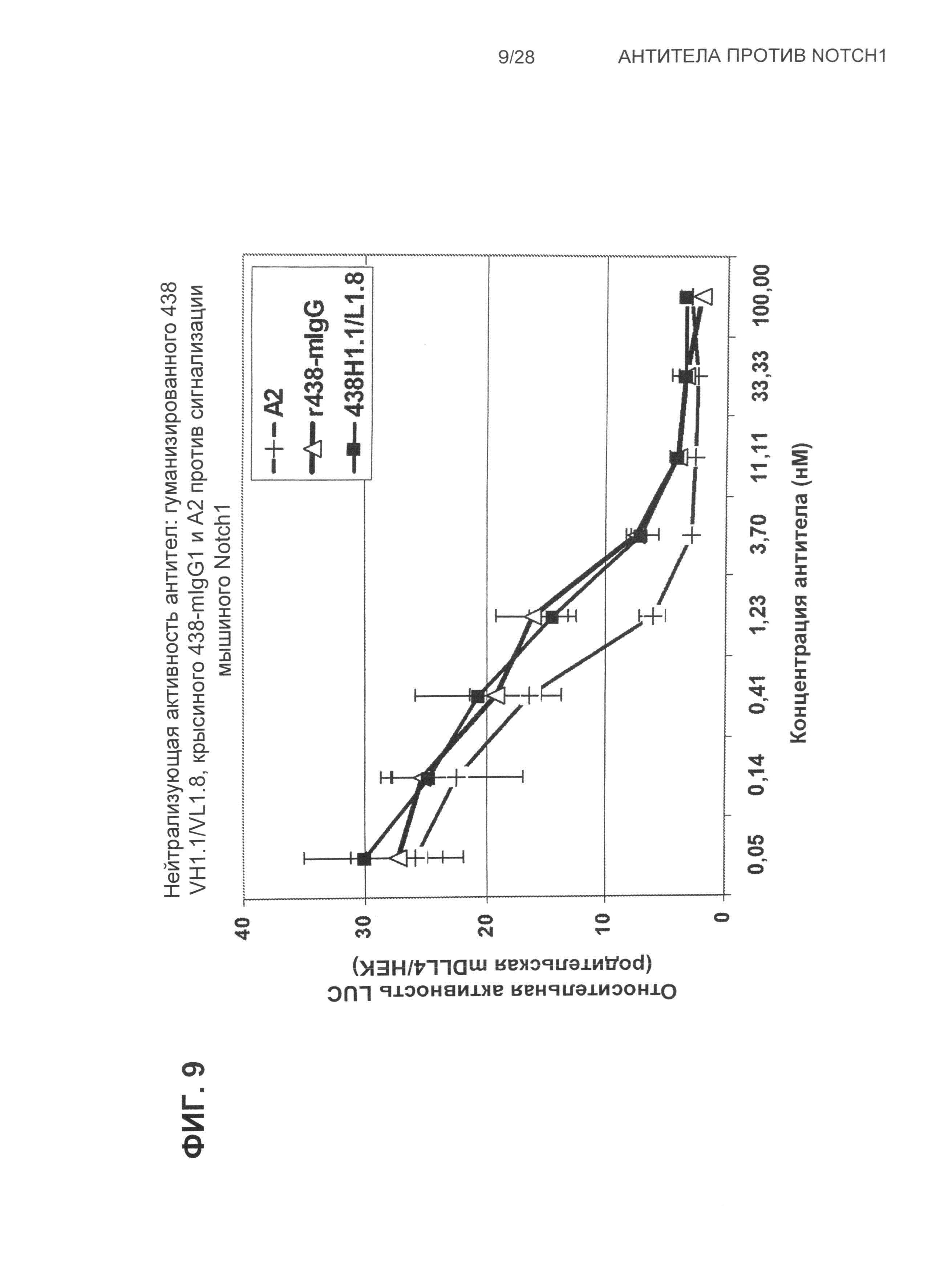
На Фиг.9 показана нейтрализующая активность антител: гуманизированного 438 VH1.1/VL1.8, крысиного 438-mIgG1 и A2 против сигнализации, зависимой от Notch1, в мышиных Notch1-репортерных клетках.
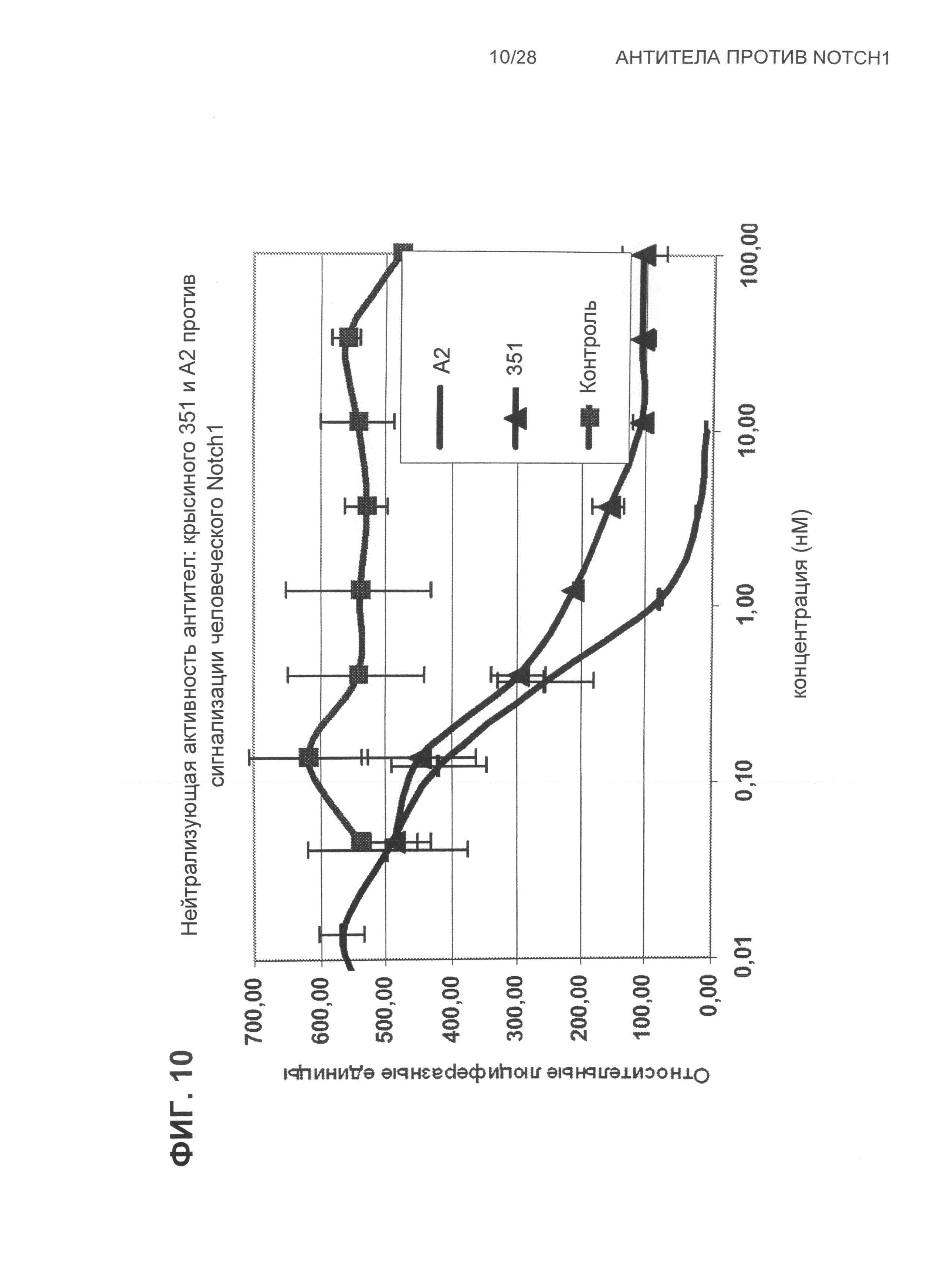
На Фиг.10 показана нейтрализующая активность антител: крысиного 351 и A2 против человеческой Notch1 сигнализации м.
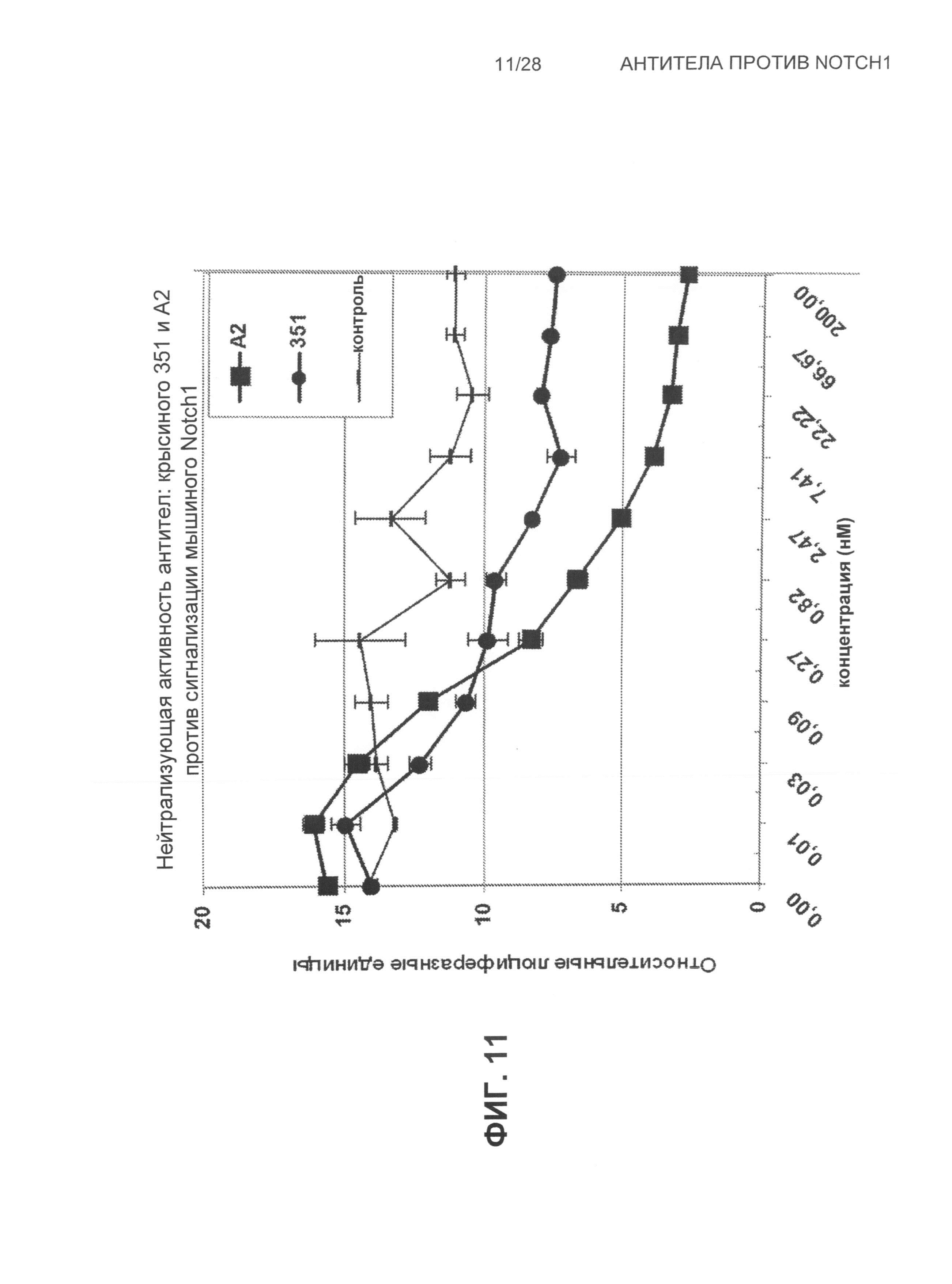
На Фиг.11 показана нейтрализующая активность антител: крысиного 351 и А2 против мышиной Notch1 сигнализации.
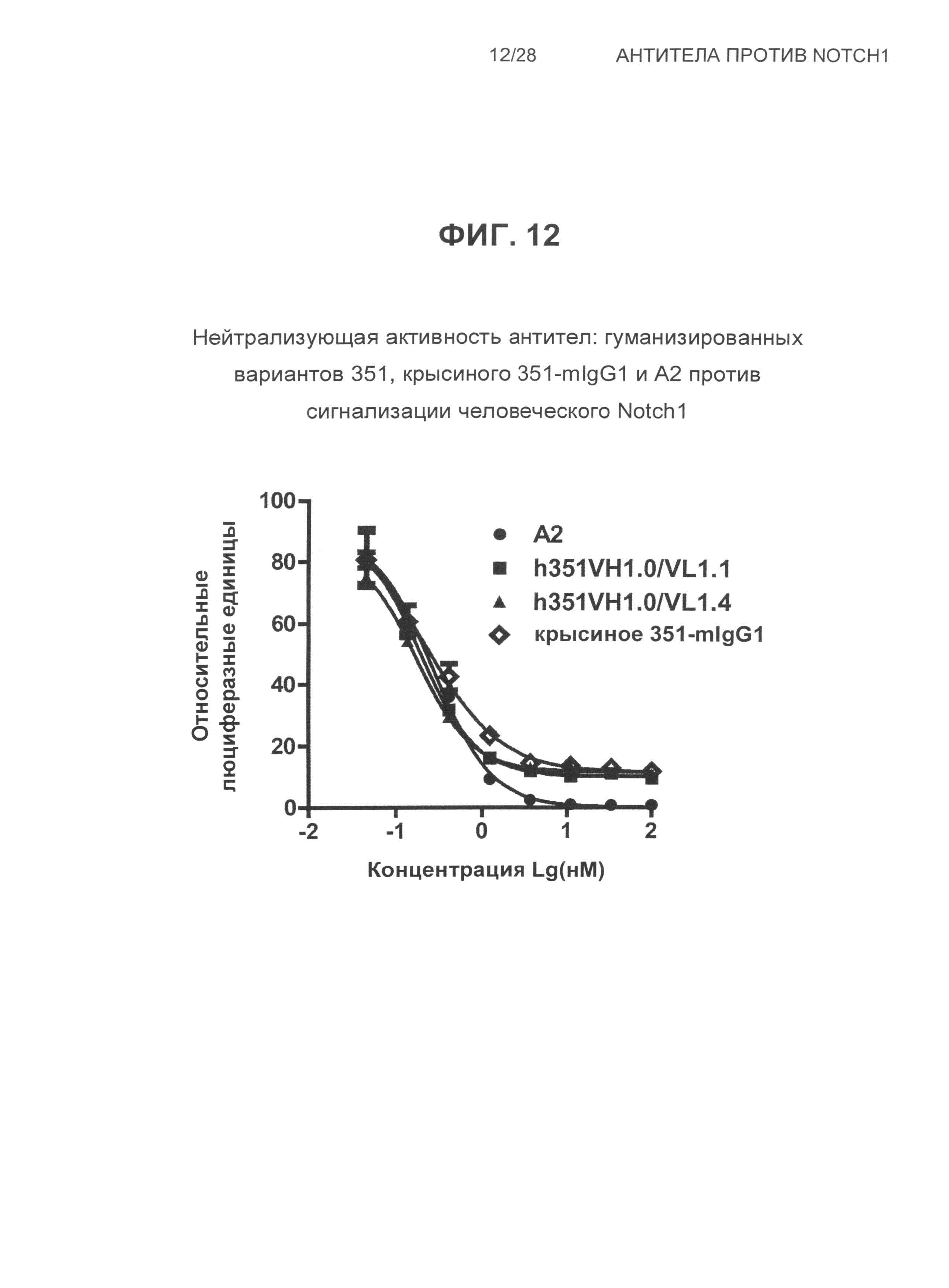
На Фиг.12 показана нейтрализующая активность антител: гуманизированных вариантов 351, крысиного 351-mIgG1 и А2 против сигнализации, зависимой от Notch1, в человеческих Notch1-репортерных клетках.
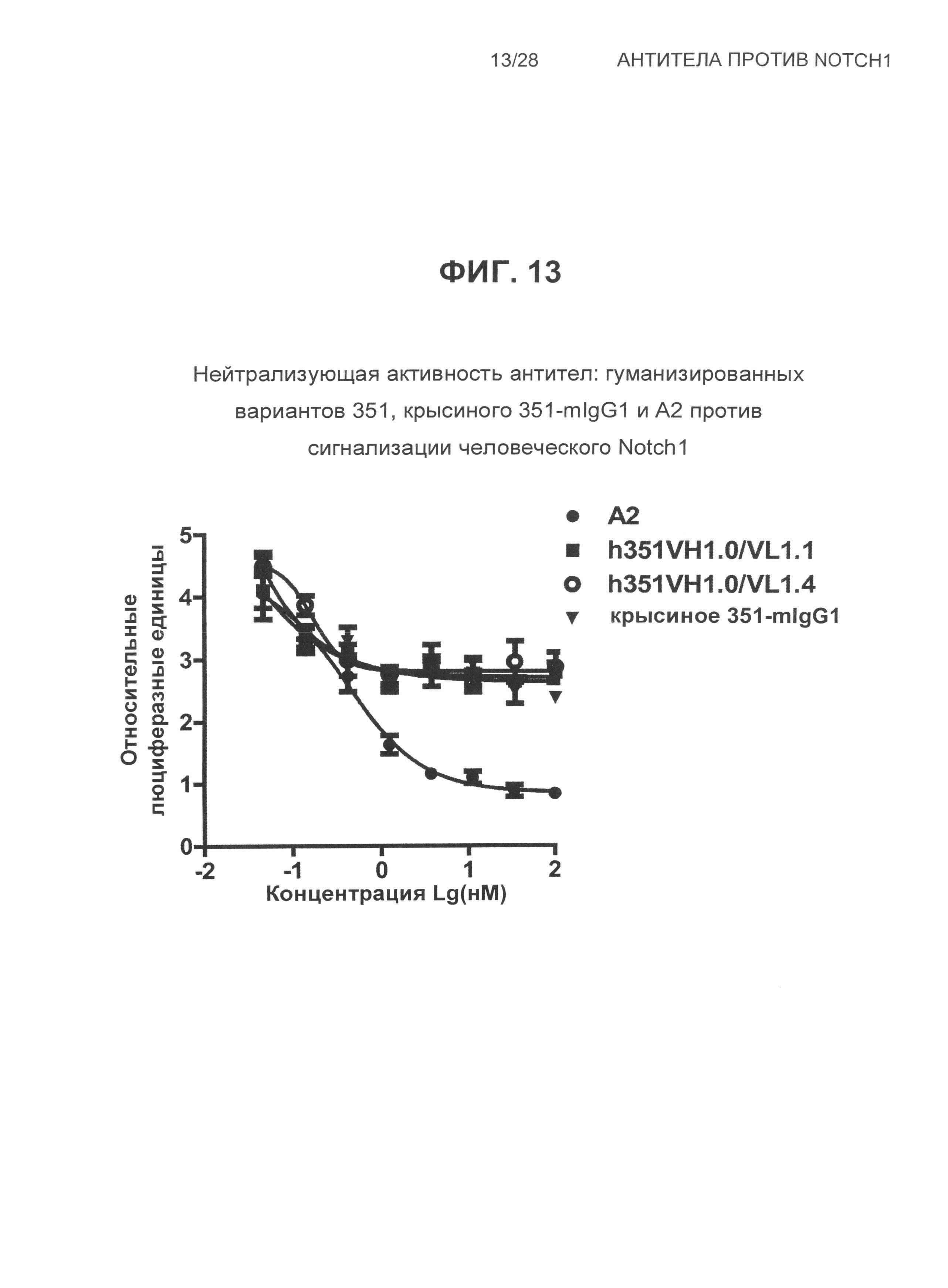
На Фиг.13 показана нейтрализующая активность антител: гуманизированных вариантов 351, крысиного 351-mIgG1 и А2 против сигнализации, зависимой от Notch1, в мышиных Notch1-репортерных клетках.
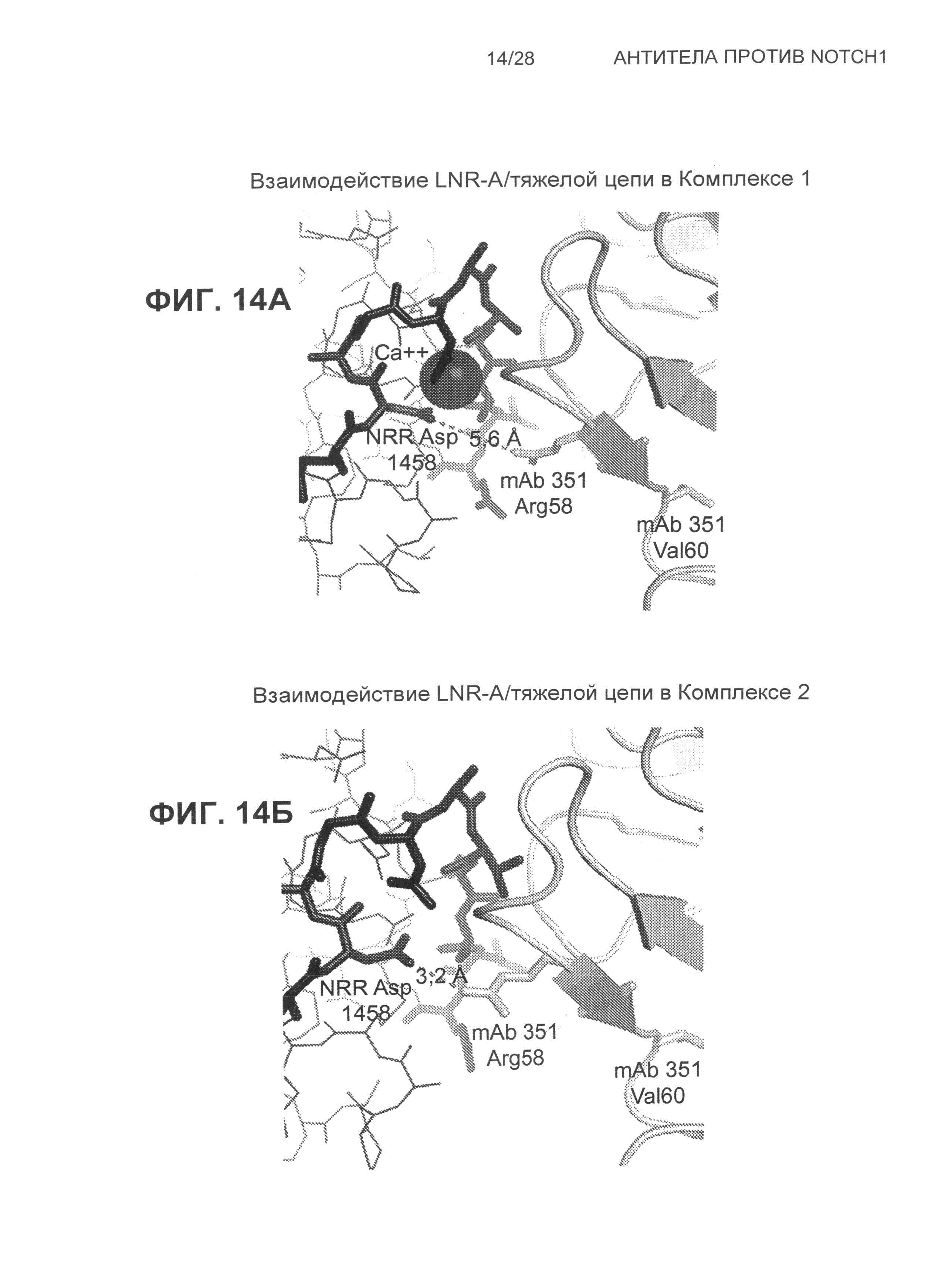
На Фиг.14А и 14Б показаны структуры поверхности взаимодействия между крысиным 351 и NRR Notch1 в области LNR-A.
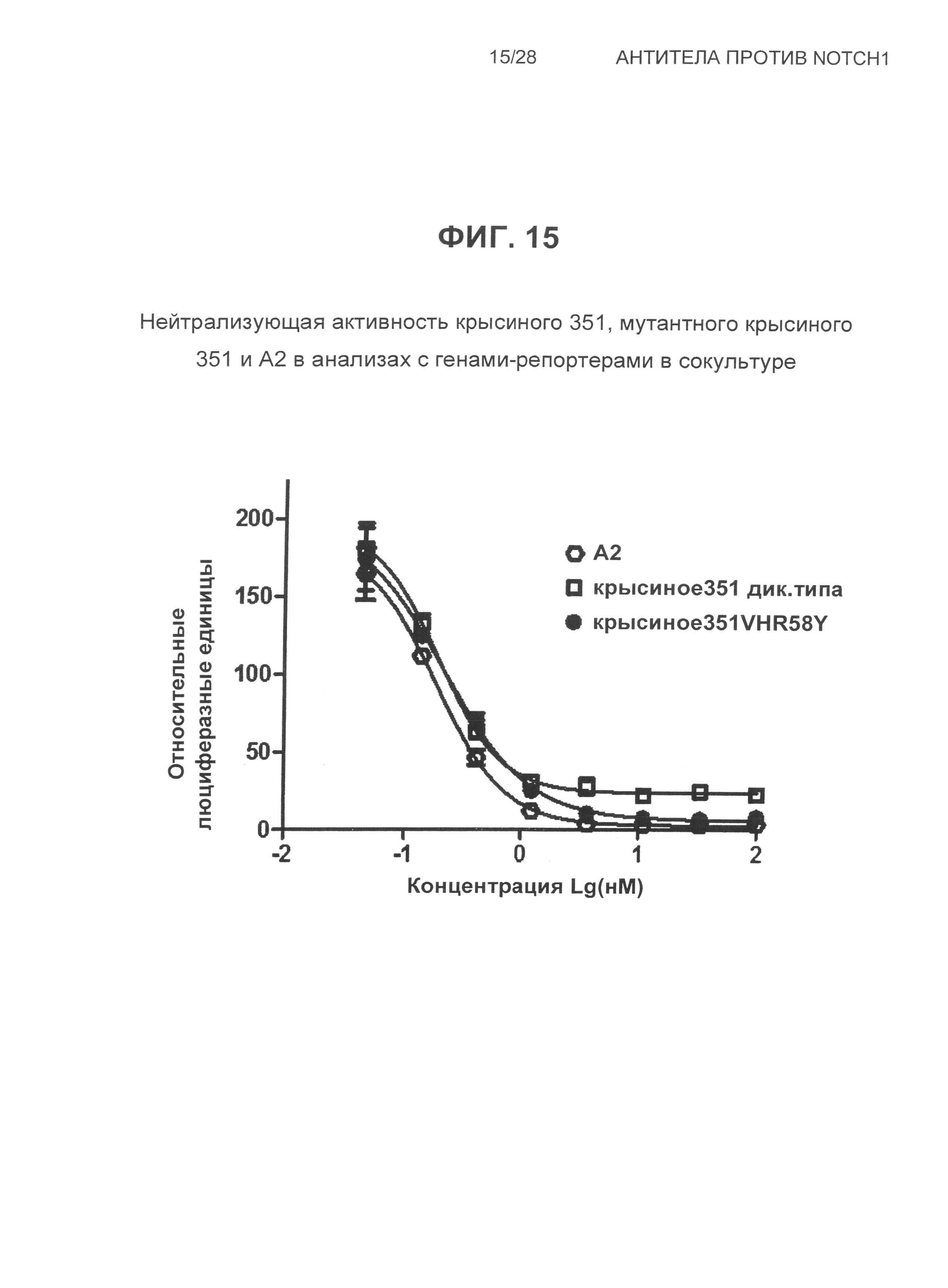
На Фиг.15 показана, нейтрализующая активность крысиного 351, мутантного крысиного 351 и A2 в анализах сокультуры с репортерными генами.
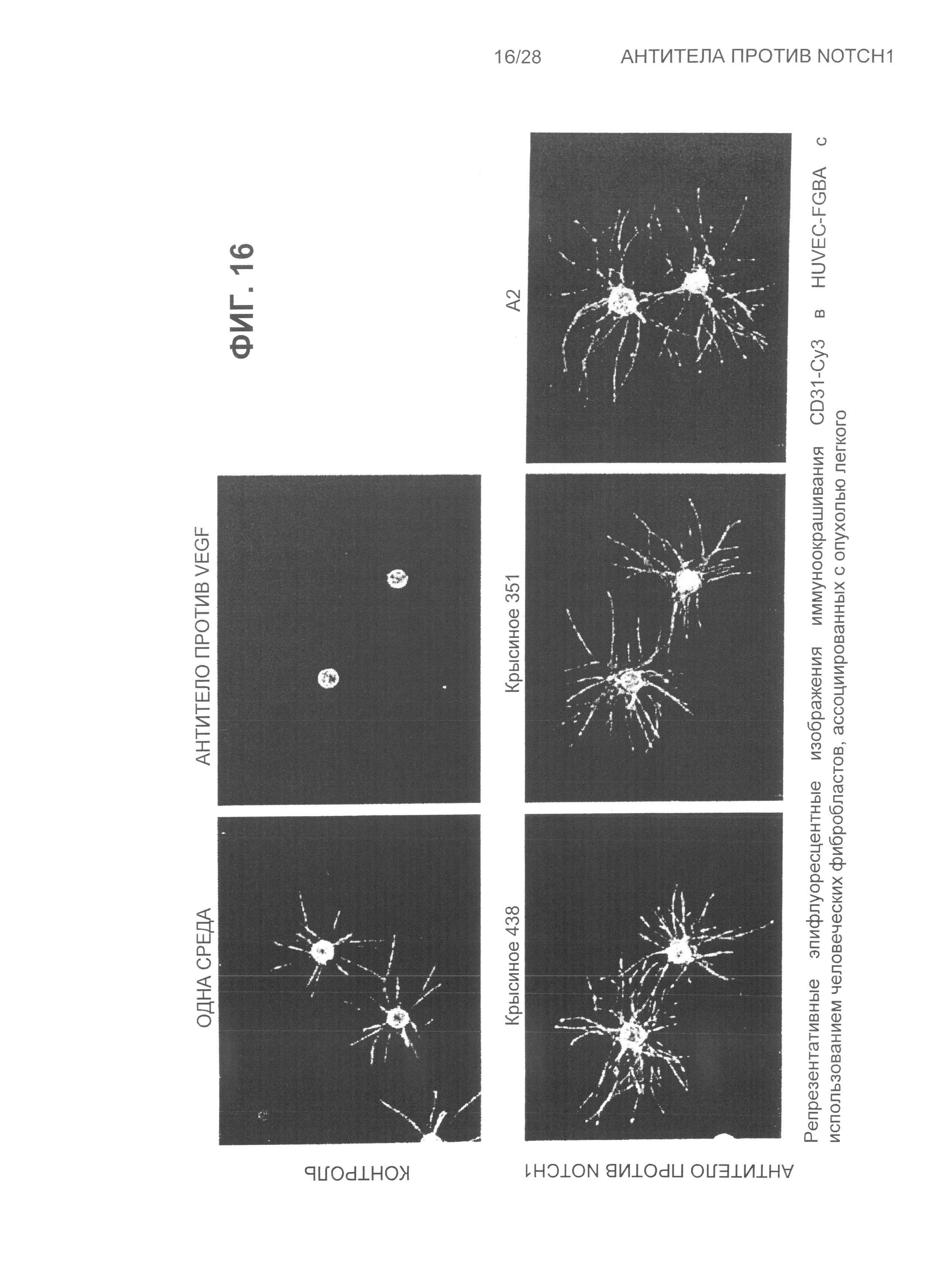
На Фиг.16 показаны репрезентативные эпифлуоресцентные изображения иммуноокрашивания CD3-Cy3 отростков HUVEC (эндотелиальные клетки пупочной вены человека) на 10-е сутки обработки крысиным 438, крысиным 351, A2, одной контрольной средой и антителом против VEGF (фактор роста эндотелия сосудов).
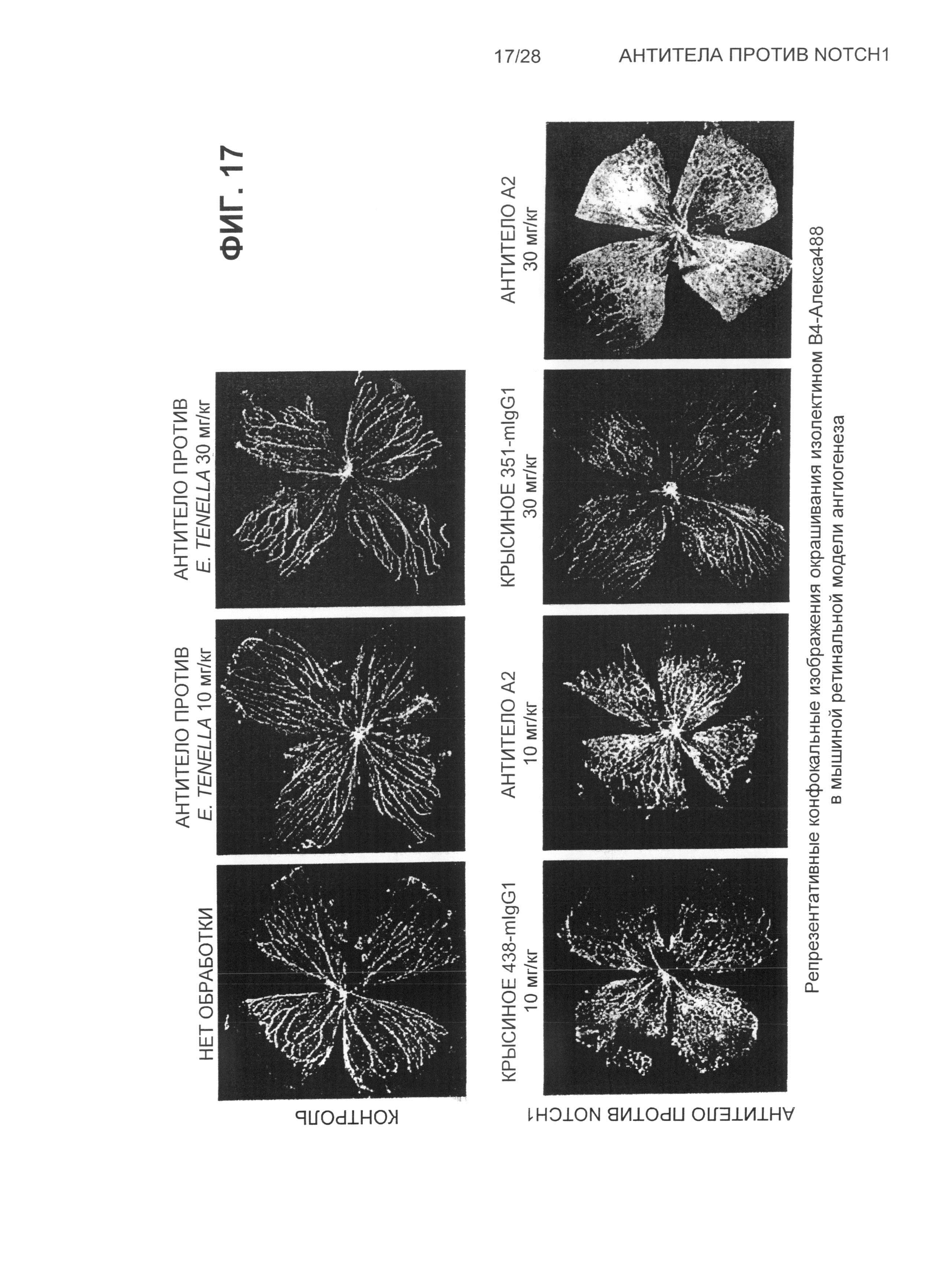
На Фиг.17 показаны репрезентативные конфокальные изображения окрашивания изолектином B4-Алекса488 в мышиной ретинальной модели ангиогенеза после обработки антителами: крысиным 438-mIgG1, крысиным 351-mIgG1 и A2, контрольным антителом против E.tenella и при отсутствии обработки.
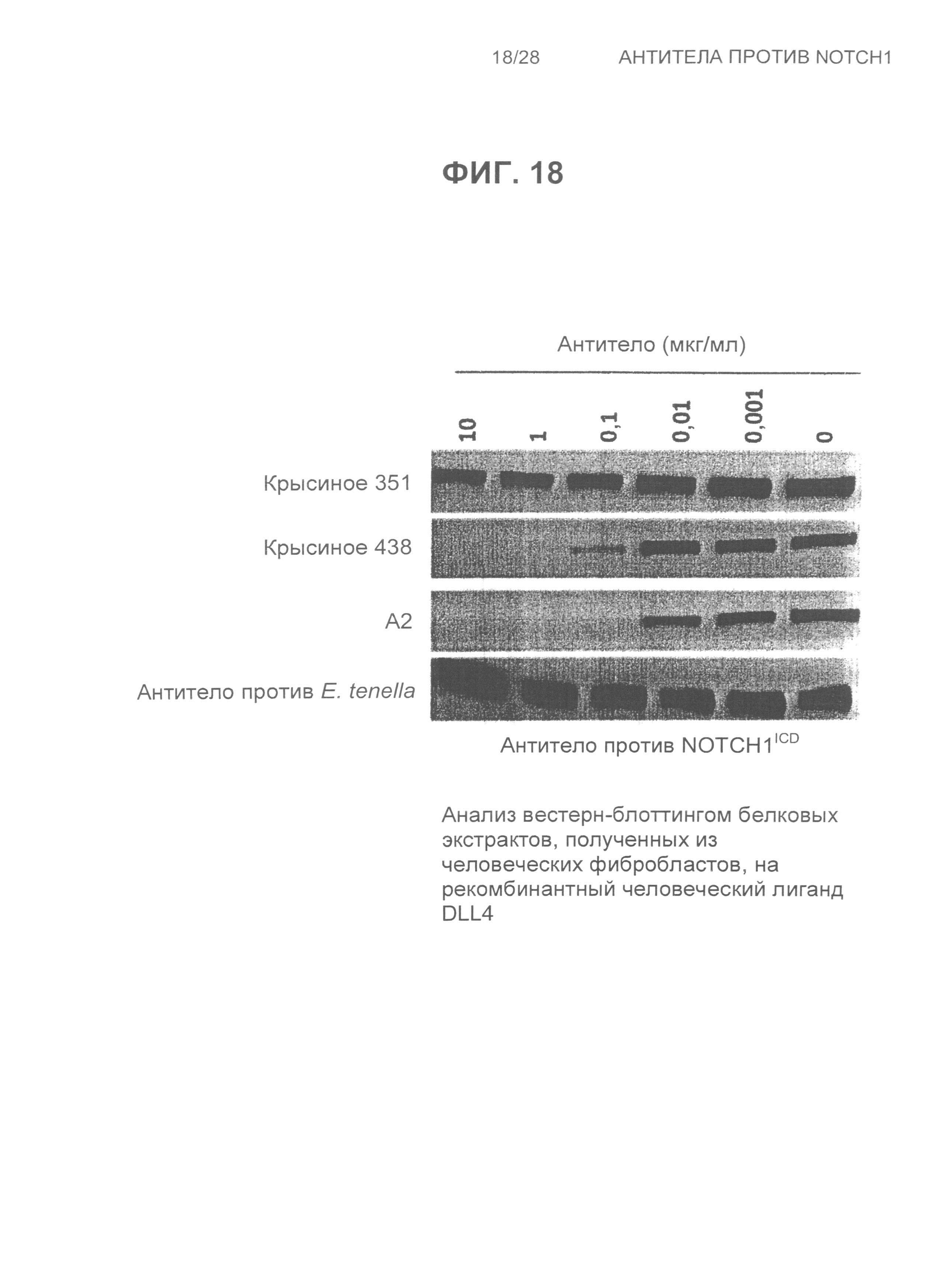
На Фиг.18 показан анализ вестерн-блоттингом белковых экстрактов, полученных из человеческих фибробластов CCD1076SK, высаженных на чашках на рекомбинантном человеческом лиганде DLL4 и обработанных возрастающими концентрациями крысиного 351, крысиного 438, A2 и контрольного антитела против E.tenella.
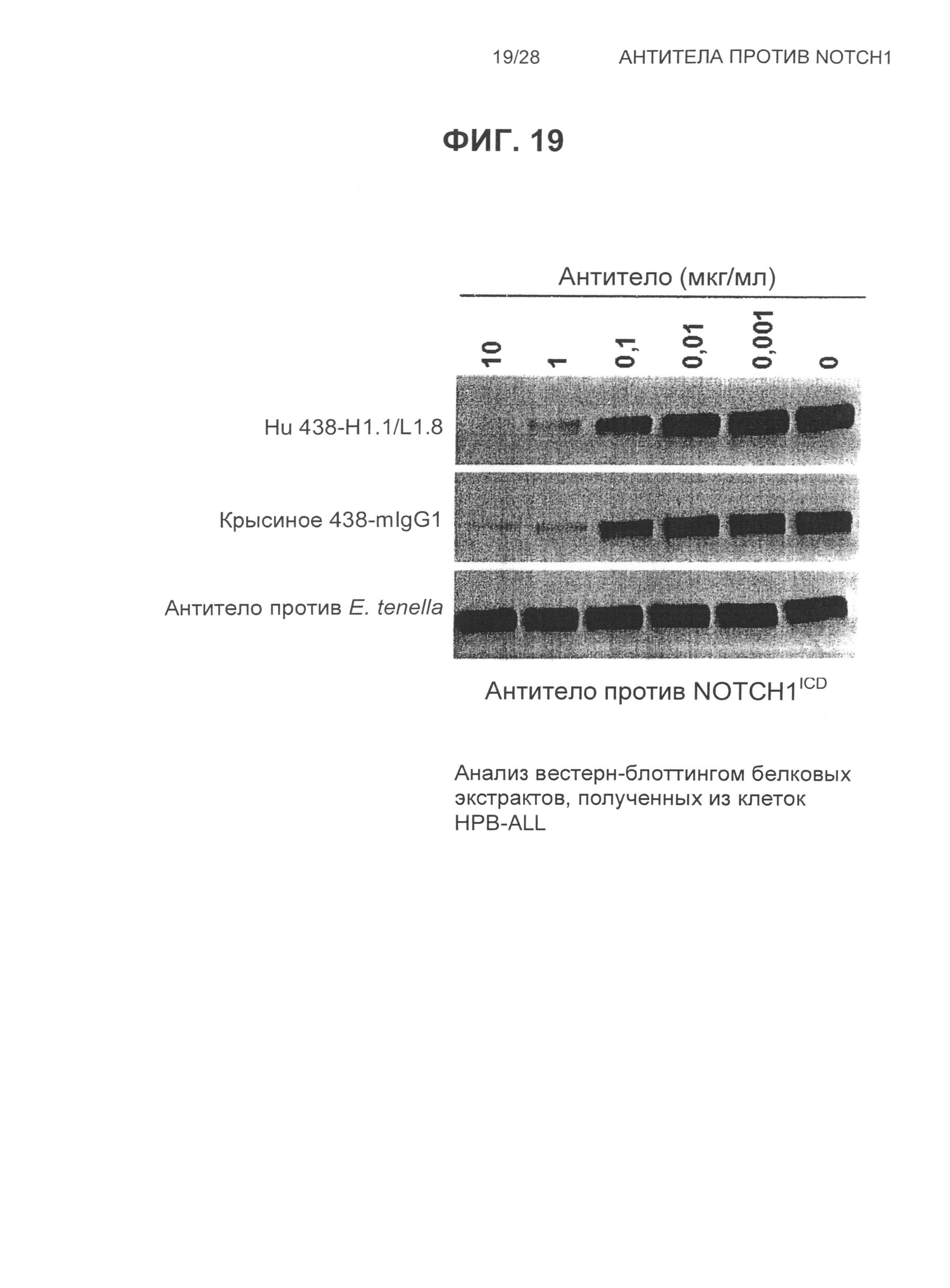
На Фиг.19 показан анализ вестерн-блоттингом белковых экстрактов, полученных из клеток HBP-ALL, обработанных возрастающими концентрациями гуманизированного 438 VH1.1/VL1.8, крысиного 438-mIgG1 и контрольного антитела против E.tenella.
На Фиг.20 показан анализ вестерн-блоттингом белковых экстрактов, полученных из линий клеток T-ALL, обработанных возрастающими концентрациями крысиного 351-mIgG1, крысиного 438-mIgG1, А2 и контрольного антитела против E.tenella.
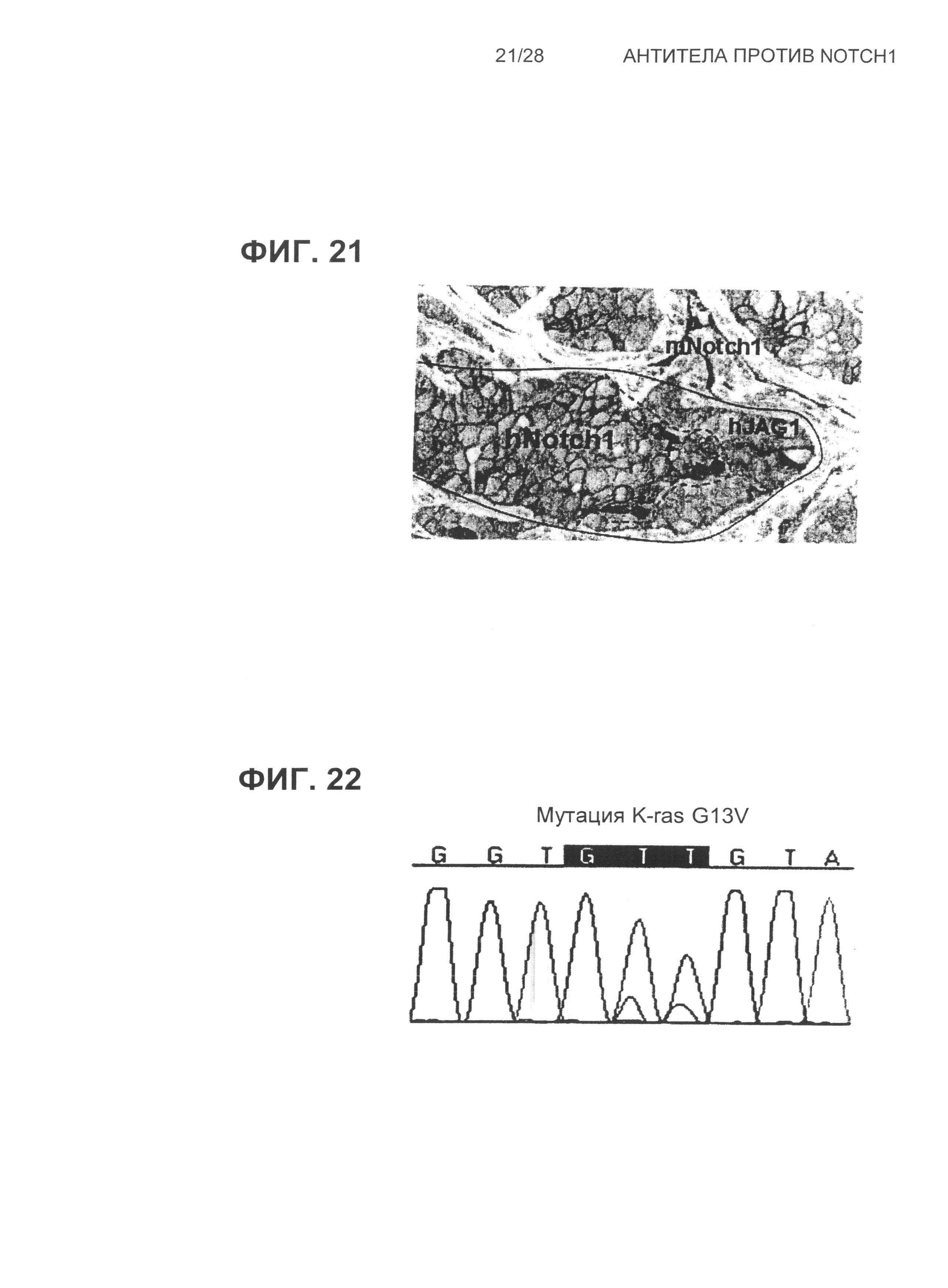
На Фиг.21 показана иммуногистохимическая детекция рецепторов Notch1 и лиганда Jagged1 в ксенотрансплантате 37622A1, происходящем от пациента с NSCLC.
На Фиг.22 продемонстрирована хроматограмма, показывающая то, что ксенотрансплантат 37622A1, происходящий от пациента с NSCLC, обладал мутацией G13V в человеческом гене K-ras.
На Фиг.23 показан анализ вестерн-блоттингом белковых, экстрактов, полученных из ксенотрансплантатов 37622A1, происходящих от пациента с NSCLC, обработанных крысиным 438-mIgG1, A2 и контрольным антителом против E.tenella.
На Фиг.24 показан анализ вестерн-блоттингом белковых экстрактов, полученных из ксенотрансплантатов 87393A1, происходящих от пациента с NSCLC, обработанных антителами: крысиным 351-mIgG1 и контрольным против E.tenella.
На Фиг.25 показана иммуногистохимическая детекция экспрессии инволюкрина в ксенотрансплантатах 87393A1, происходящих от пациента с NSCLC, после обработки антителами: крысиным 351-mIgG1 и контрольным против E.tenella.
На Фиг.26 показан анализ вестерн-блоттингом экспрессии инволюкрина в ксенотрансплантатах 87393A1, происходящих от пациента с NSCLC, после обработки антителами: крысиным 351-mIgG1 и контрольным против E.tenella.
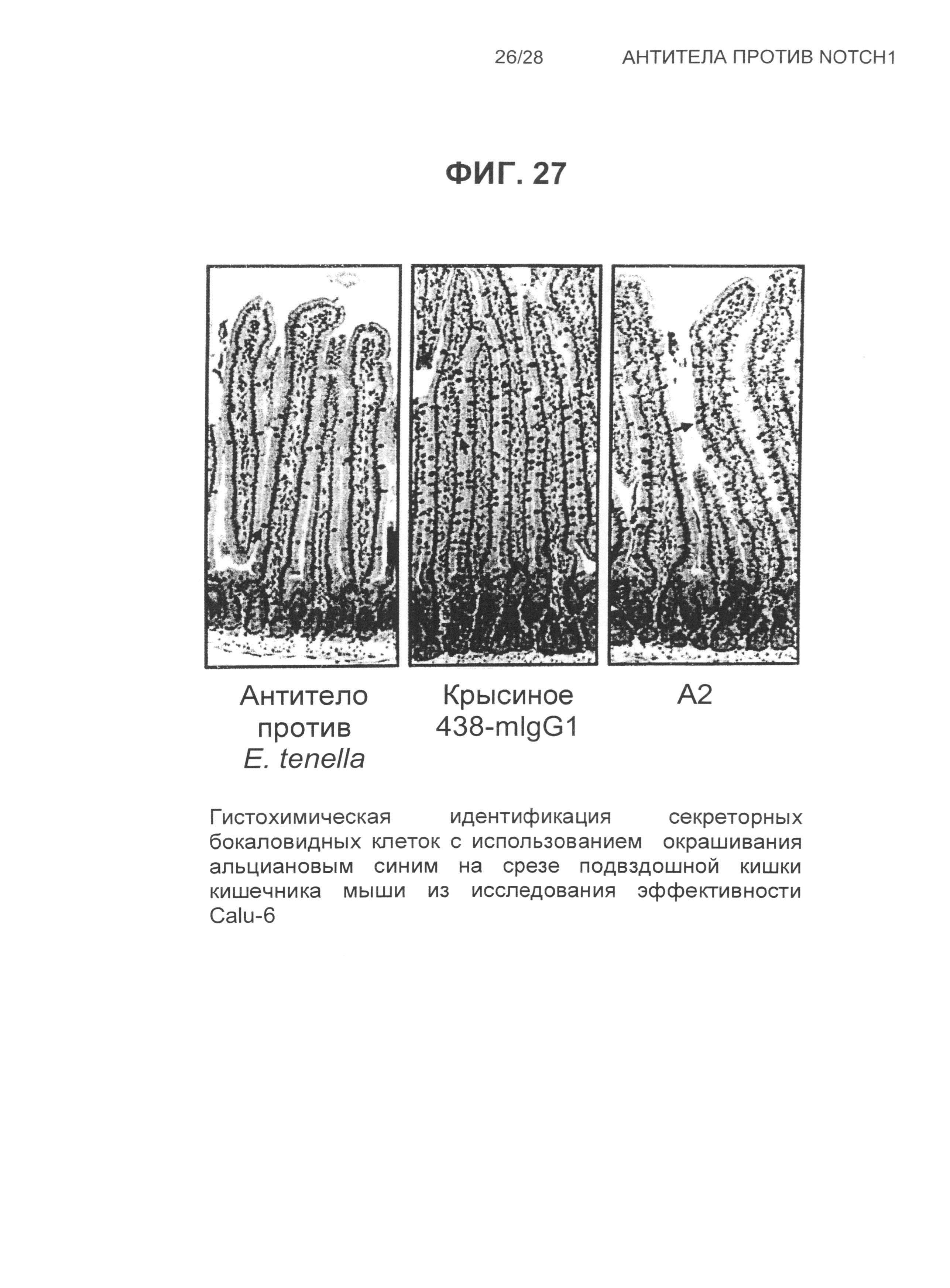
На Фиг.27 показана гистохимическая идентификация секреторных бокаловидных клеток с использованием окрашивания альциановым синим на срезе подвздошной кишки кишечника мыши из исследования эффективности Calu-6, при обработке антителами: крысиным 438-mIgG1, A2 и контрольным против E.tenella.
На Фиг.28 показана иммуногистохимия антителом против Ki67 на криптах кишечника мыши из исследования эффективности Calu-6, при обработке антителами: крысиным 438-mIgG1, A2 и контрольным против E.tenella.
На Фиг.29 показана иммуногистохимия антителом против Ki67 на криптах кишечника мыши из исследования эффективности на полученном от пациента ксенотрансплантате 87393А1, при обработке антителами: крысиным 351-mIgG1 и контрольным против E.tenella.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к выделенным антителам, в частности к человеческим, гуманизированным, химерным и крысиным моноклональным антителам, которые связываются с Notch1. Кроме того, согласно настоящему изобретению предложены выделенные антитела, которые демонстрируют более сильное ингибирование активации Notch1 мутантного рецептора Notch1 по сравнению с ингибированием активации Notch1 нативного рецептора Notch1. Согласно изобретению предложены выделенные антитела и способы получения таких антител и фармацевтических композиций, содержащих данные антитела. Настоящее изобретение кроме того относится к иммуноконъюгатам и биспецифичным молекулам, содержащим.такие антитела. Данное изобретение также относится к способам применения антител для ингибирования активации Notch1 и лечения различных заболеваний, относящихся к ненормальному росту клеток, таких как рак (например T-клеточный острый лимфобластный лейкоз (T-ALL), немелкоклеточный рак легкого (NSCLC), рак толстой кишки, рак молочной железы и рак яичника.
Общие методики
Если не указано иначе, способы и методики по настоящему изобретению обычно проводятся согласно традиционным способам, хорошо известным в данной области, и как описано в различных общих и более конкретных ссылках, которые процитированы и обсуждаются во всем настоящем описании изобретения, если не указано иначе. Смотрите, например, Sambrook et al. Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates (1992) и Harlow and Lane Antibodies: A Laboratory Manual Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1990), которые включены сюда посредством ссылки.
Определения
Термины «Notch1» или «Notch-1» относятся к нативным, вариантам, изоформам и видам гомологов человеческого белка Notchl. Нативный человеческий белок Notchl, например, составлен из лидерного пептида, большой повторяющейся области, подобной эпидермальному фактору роста (EGF), трех повторов Lin12, N-концевого домена гетеродимеризации (HD-1), C-концевого домена гетеродимеризации (HD-2), трансмембранной (TM) последовательности и внутриклеточного домена (Notch1ICD). Номером доступа NCBI (Национальный центр биотехнологической информации)/GenBank полноразмерного человеческого Notch1 является NM_017617.2.
Фразы «негативная регуляторная область Notch1» или «NRR Notch1» в том виде, как они здесь используются, если не указано иное, относятся к любой нативной или синтетической полипептидной области Notch1, состоящей из трех доменов Lin12 и аминокислотной последовательности или последовательностей, расположенных между тремя доменами Lin12, плюс к доменам Notch1: HD1 и HD2. В одном воплощении «NRR Notch1» включает три домена Lin12 и два домена тетеродимеризацииь HD-1 и HD-2, где домены Notch1: HD-1 и HD-2 являются ковалентно связанными и еще не расщепленными фурин-подобной протеазой (до расщепления по S1). В другом воплощении «NRR Notch1» включает три домена Lin12 и два домена гетеродимеризации HD-1 и HD-2, где домены HD-1 и HD-2 нековалентно связаны (после расщепления по S1). В одном аспекте данного воплощения сайт S2 в пределах домена HD-2 не был расщеплен металлопротеазами типа ADAM. В другом конкретном аспекте данного воплощения сайт S2 в пределах домена HD-2 расщепляется или уже был расщеплен металлопротеазами типа ADAM. (Gordon, W.R., et. al, Nature Structural & Molecular Biology, 2007, volume 14, 295-300).
«Антитело» представляет собой молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. Данный термин, в том виде, как он здесь используется, охватывает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (например антигенсвязывающие части) (такие как Fab, Fab’, F(ab’)2, Fv), одноцепочечные (ScFv) и доменные антитела, такие как антитела акул и верблюдов), слитые белки, содержащие часть в виде антитела (такую как доменные антитела), и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или его подкласс), и антитело не должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константных доменов тяжелых цепей антитела, иммуноглобулины можно приписывать к разным классам. Существуют пять главных классов (изотипов) иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно подразделить на подклассы, например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Структуры, субъедниц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
Подразумевается, что термин «выделенное антитело» в том виде, как он здесь используется, относится к антителу, которое по существу не содержит других антител, имеющих другие антигенные специфичности (например выделенное антитело, которое специфично связывается с Notch1, по существу не содержит антител, которые специфично связываются с антигенами, отличными от Notch1). Выделенное антитело, которое специфично связывается с Notch1, может, однако, иметь перекрестную реактивность с другими антигенами, такими как молекулы Notch-1 из других видов. Кроме того, выделенное антитело может по существу не содержать другого клеточного материала и/или химических реактивов.
Термин «моноклональное антитело» в том виде, как он здесь используется, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в малых количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта.
«Гуманизированное» антитело относится к формам антител, не являющихся человеческими (например мышиных), которые предствляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab’, F(ab’)2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося человеческим. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело-реципиент), в котором остатки из области, определяющей комплементарность (CDR), реципиента заменены остатками из CDR вида, не являющегося человеком (антитело-донор), такого как мышь, крыса или кролик, имеющей желательную специфичность, аффинность и эффективность. В некоторых случаях остатки каркасной области Fv (FW) человеческого иммуноглобулина заменены соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированное антитело может содержать остатки, которые не обнаруживаются ни в антителе-реципиенте, ни в импортированных последовательностях CDR или каркаса, но включаются для дальнейшего уточнения и оптимизации эффективности антитела. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и типично двух вариабельных доменов, в которых все или по существу все области CDR соответстуют областям CDR иммуноглобулина, не являющегося человеческим, и все или по существу все области FW представляют собой области FW консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также будет содержать по меньшей мере часть константной области или домена иммуноглобулина (Fc), типично часть константной области или домена человеческого иммуноглобулина. Другие формы гуманизированных антител имеют одну или более чем одну CDR (L-CDR1, L-CDR2, L-CDR3, H-CDR1, H-CDR2 или H-CDR3), которая изменена по отношению к исходному антителу, которая также именуется одна или более чем одна CDR, «происходящая из» одной или более чем одной CDR из исходного антитела.
Подразумевается, что «человеческое антитело» или «полностью человеческое антитело» включают антитела, имеющие вариабельные области, в которых как каркасные, так и CDR области происходят из последовательностей человеческого иммуноглобулина зародышевой линии. Кроме того, если антитело содержит константную область, данная константная область также происходит из последовательностей человеческого иммуноглобулина зародышевой линии. Человеческие антитела по данному изобретению могут включать аминокислотные остатки, не кодируемые последовательностями человеческого иммуноглобулина зародышевой линии (например мутации, введенные случайным или сайт-направленным мутагенезом in vitro, или посредством соматической мутации in vivo). Данное определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид человеческой тяжелой цепи или по меньшей мере один полипептид человеческой легкой цепи. Человеческие антитела могут быть получены с использованием разных методик, известных в данной области.
Подразумевается, что термин «химерное антитело» относится к антителам, в которых последовательности вариабельной области происходят от одного вида, и последовательности константной области происходят от другого вида, как, например, антитело, в котором последовательности вариабельной области происходят из мышиного антитела, и последовательности константной области происходят из человеческого антитела.
Термин «рекомбинантное антитело» в том виде, как он здесь используется, включает все антитела, которые получают, экспрессируют, создают или выделяют способами генной инженерии. Такие рекомбинантные антитела имеют вариабельные области, в которых каркасные и CDR области происходят из последовательностей иммуноглобулинов зародышевой линии. Однако в определенных воплощениях такие рекомбинантные антитела можно подвергать мутагенезу in vitro (или, при использовании животного, трансгенного в отношении последовательностей Ig - соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, происходя от и имея родство с последовательностями VH и VL зародышевой линии, могут не существовать в природе в пределах репертуара антител зародышевой линии in vivo.
Фразы «антитело, распознающее антиген» и «антитело, специфичное в отношении антигена», используются здесь взаимозаменяемо с термином «антитело, которое специфично связывается с антигеном».
Как известно в данной области, термин «область Fc» используется для определения C-концевой области тяжелой цепи иммуноглобулина (CH2+CH3). «Область Fc» может представлять собой нативную последовательность области Fc или вариант области Fc.
«Нативная последовательность области Fc» содержит аминокислотную последовательность, идентичную аминокислотной последовательности области Fc, обнаруженной в природе. «Вариант области Fc» содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности нативной последовательности области Fc за счет по меньшей мере одной аминокислотной модификации, тем не менее сохраняет по меньшей мере одну функцию нативной последовательности области Fc.
Термины «рецептор Fc» или «FcR» используются для описания рецептора, который связывается с областью Fc антитела. Например, FcR может представлять собой нативную последовательность человеческого FcR. Кроме того, FcR может представлять собой FcR, который связывается с антителом IgG (гамма рецептор), и включает рецепторы подклассов FcγRI, FcγRII, FcγRIII и FcγRIV, включая аллельные варианты данных рецепторов и формы, подвергнувшиеся альтернативному сплайсингу. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют аналогичные аминокислотные последовательности, которые отличаются главным образом в их цитоплазматических доменах. Активирующий рецептор FcγRIIA содержит в его цитоплазматическом домене иммунорецепторный активирующий мотив на основе тирозина (ITAM). Как будет понятно специалистам в данной области, ингибирующий рецептор FcγRIIB содержит в его цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM). FcR часто рассматривались в обзорах, и они являются хорошо известными специалистам в данной области. Другие FcR, включая FcR, которые предстоит идентифицировать в будущем, охватываются здесь термином «FcR». Данный термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод и продленный период полувыведения IgG.
Термин «связывается» относится к аффинности между двумя молекулами, например, антигеном и антителом. Фраза антитело, которое «специфично связывается с Notch1», относится к предпочтительному связыванию антитела с антигеном Notch1 в образце, содержащем многочисленные разные антигены, с по меньшей мере 100-кратным или предпочтительно 1000-кратным различием в KD.
Термин «высокая аффинность» относится к антителу, имеющему KD 1×10-6 M или менее, более предпочтительно имеющему KD 1×10-8 M или менее. Аффинность можно измерять, например, с использованием поверхностного плазмонного резонанса.
«Эпитоп» включает любую белковую детерминанту, способную к специфичному связыванию с иммуноглобулином или рецептором Т-клетки. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи сахаров, и обычно имеют специфичные трехмерные структурные характеристики, а также специфичные характерстики заряда.
Подразумевается, что термин «kon» в том виде, как он здесь используется, относится к скорости образования или скорости ассоциации конкретного взаимодействия антитело-антиген, тогда как подразумевается, что термин «koff» в том виде, как он здесь используется, относится к скорости разрушения или скорости диссоциации конкретного взаимодействия антитело-антиген. Подразумевается, что термин «KD» в том виде, как он здесь используется, относится к равновесной константе диссоциации, которая получается из отношения koff к kon (т.е. koff/kon) и выражается в виде молярной концентрации (M). Значения KD для антител можно определять с использованием способов, прочно установившихся в данной области. Одним способом для определения KD антитела является применение поверхностного плазмонного резонанса, типично с использованием биосенсорной системы, такой как система Biacore®.
Термины «полипептид», «олигопептид», «пептид» и «белок» используются здесь взаимозаменяемо для отнесения к цепям аминокислот любой длины, предпочтительно к относительно коротким (например 10-100 аминокислот). Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может прерываться звеньями, не являющимися аминокислотами. Понятно, что полипептиды могут встречаться в виде одиночных цепей или ассоциированных цепей.
Как известно в данной области, термин «полинуклеотид» или «нуклеиновая кислота», используемый здесь взаимозаменяемо, относится к цепям нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в цепь ДНК- или РНК-полимеразой.
Термин «вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела либо одной, либо в комбинации. Как известно в данной области, каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FW), соединенных тремя областями, определяющими комплементарность (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в тесной близости посредством FW и, с CDR из другой цепи, содействуют образованию антигенсвязывающего сайта антител.
«CDR» вариабельного домена представляет собой аминокислотные остатки в пределах вариабельной области, которые идентифицированы согласно определениям Kabat, Chothia, сочетанию и Kabat, и Chothia, AbM, контактным и/или конформационным определениям, или любому способу определения CDR, хорошо известному в данной области. CDR антитела могут быть идентифицированы как гипервариабельные области, исходно определенные Kabat et al. Смотрите, например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C. Положения CDR также могут быть идентифицированы как структурная петля, первоначально описанная Chothia с соавторами. Смотрите, например, Chothia et al., 1989, Nature 342:877-883. Другие подходы для идентификации CDR включают «определение AbM», которое представляет собой компромисс между Kabat и Chothia и производится с использованием программы для моделирования антител AbM (на сегодняшний день Accelrys®) от Oxford Molecular, или «контактное определение» CDR на основе наблюдаемых контактов с антигенами, изложенное в MacCallum et al., 1996, J. Mol. Biol., 262:732-745. В другом подходе, именуемом здесь как «конформационное определение» CDR, положения CDR можно идентифицировать как остатки, которые делают энтальпический вклад в связывание антигена. Смотрите, например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166. Тем не менее, другие определения границы CDR могут строго не следовать одному из приведенных выше подходов, но все же будут перекрываться по меньшей мере с частью CDR по Kabat, несмотря на то, что они могут быть укороченными или удлиненными в свете предсказания и экспериментальных открытий того, что конкретные остатки или группы остатков, или даже целые CDR не оказывают значимого влияния на связывание антигена. Термин «CDR» в том виде, как он здесь используется, может относиться к CDR, определенным посредством любого подхода, известного в данной области, включая комбинации подходов. В используемых здесь способах могут применяться CDR, определенные согласно любому из данных подходов. Для любого данного воплощения, содержащего более чем одну CDR, CDR могут быть определены согласно любому из определений Kabat, Chothia, расширенному, AbM, контактному и/или конформационному.
«Константная область» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела либо одной, либо в комбинации.
«Клетка-хозяин» включает индивидуальную клетку или культуру клеток, которая может быть или была реципиентом вектора(ров) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и данное потомство не обязательно может быть полностью идентичным (по морфологии или по набору геномной ДНК) с исходной родительской клеткой из-за природной, случайной или преднамеренной мутации. Клетка-хозяин включает клетки, трансфицированные in vivo полинуклеотидом(дами) по настоящему изобретению.
Термин «вектор» в том виде, как он здесь используется, означает конструкцию, которая способна доставлять и, предпочтительно, экспрессировать один или более чем один интересующий ген или последовательность в клетку-хозяина. Примеры векторов включают, но не ограничиваются, вирусными векторами, экспрессионными векторами в виде голой ДНК или РНК, плазмидными, космидными или фаговыми векторами, экспрессионными векторами в виде ДНК или РНК, ассоциированной с катионными конденсирующими агентами, экспрессионными векторами в виде ДНК или РНК, инкапсулированной в липосомах, и определенными эукариотическими клетками, такими как клетки-продуценты.
Термин «последовательность контроля экспрессии» в том виде, как он здесь используется, означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательностью контроля экспрессии может быть промотор, такой как конститутивный или индуцибельный промотор, или энхансер. Последовательность контроля экспрессии связана функциональным образом с последовательностью нуклеиновой кислоты, подлежащей транскрипции.
Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» в том виде, как он здесь используется, включает любое вещество, которое, при объединении с активным ингредиентом, позволяет ингредиенту сохранять биологическую активность и не вызывает реакцию иммунной системы субъекта. Примеры включают, но не ограничиваются, любым из стандартных фармацевтических носителей, такими как раствор фосфатно-солевого буфера, вода, эмульсии, такие как эмульсия типа «масло в воде», и разными типами увлажнителей. Предпочтительными разбавителями для аэрозольного или парентерального введения являются фосфатно-солевой буферный раствор (PBS) или нормальный (0,9%-ный) физиологический раствор. Композиции, содержащие такие носители, готовят в виде препарата хорошо известными традиционными способами.
«Индивидуум» или «субъект» представляет собой млекопитающее, более предпочтительно человека. Млекопитающие также включают, но не ограничиваются, сельскохозяйственными животными, спортивными животными, домашними животными, приматами, лошадьми, собаками, кошками, мышами и крысами.
«Выделенный белок», «выделенный полипептид» или «выделенное антитело» представляет собой белок, полипептид или антитело, которое, благодаря его происхождению или источнику получения, (1) не ассоциировано с компонентами, ассоциированными с ним в природе, которые сопровождают его в его нативном состоянии, (2) не содержит других белков из того же самого вида, (3) экспрессируется клеткой из другого вида или (4) не встречается в природе. Таким образом, полипептид, который синтезируется химически или синтезируется в клеточной системе, отличной от клетки, из которой он происходит в природе, будет «выделенным» из компонентов, с которыми он ассоциирован в природе. Белок также можно сделать по существу не содержащим компонентов, ассоциированных с ним в природе, посредством выделения с использованием методик очистки белка, хорошо известных в данной области.
Рецептор Notch1
кДНК человеческого Notch1 кодирует белок из 2556 аминокислотных остатков, состоящий из лидерного пептида, 36 EGF-подобных повторов, негативной регуляторной области (NRR), трансмембранной (TM) последовательности и внутриклеточного домена (Notch1ICD).
Антитела против Notch1, которые связываются с NRR
В пределах рассмотрения настоящего изобретения находится то, что антитела, которые связываются с доменом Notch1 с высокой аффинностью, могут снижать трансдукцию сигнала Notch1 и, следовательно, могут демонстрировать биологическую активность in vitro и in vivo по отношению к ингибированию роста раковых клеток, в частности, T-клеточного острого лимфобластного лейкоза (T-ALL), немелкоклеточного рака легкого (NSCLC), рака молочной железы, рака толстой кишки и рака яичника. Такие антитела можно получать, следуя общим способам, известным обычным специалистам в данной области. В одном воплощении такие антитела можно получать посредством иммунизации крысы иммуногеном, с последующим клонированием антител, генерированных таким образом, посредством гибридомы и анализированием клонированных антител целым рядом анализов. Например, твердофазный иммуноанализ ELISA (твердофазный иммуноферментный анализ), иммуноосаждение, BIAcore, FACS (флуоресцентная сортировка клеток) и вестерн-блоттинг находятся среди многих анализов, которые можно использовать для идентификации антитела, которое специфично реагирует с Notch1. Аффинность связывания антител в отношении Notch1, отобранных согласно анализу ELISA, можно измерять на установке поверхностного плазмонного резонанса Biacore®.
Антитела против Notch1 по текущему изобретению можно получать любыми другими способами, известными в данной области, отличными от описанных в приведенном выше абзаце. Путь и схема иммунизации животного-хозяина обычно соответствуют установившимся и традиционным методикам стимуляции и получения антител, как здесь описано далее. Общие методики получения человеческих и мышиных антител известны в данной области и/или описаны здесь.
Антитела против Notch1, генерированные методиками гибридомы
В пределах рассмотрения настоящего изобретения находится то, что любым субъектом-млекопитающим, включая людей или их клетки, продуцирующие антитела, можно манипулировать для того, чтобы они служили в качестве основы для получения линий клеток гибридомы млекопитающего, включая человека. Типично животному-хозяину внутрибрюшинно, внутримышечно, перорально, подкожно, внутриподошвенно и/или внутрикожно инокулируют определенное количество иммуногена, включая то, которое здесь описано.
Гибридомы можно получать из лимфоцитов и сделанных бессмертными миеломных клеток, используя общую методику гибридизации соматических клеток Kohler, B. и Milstein, C. (1975) Nature 256:495-497 или модифицированную по Buck, D.W., et al., In Vitro, 18:377-381 (1982). Гибридомы, которые можно использовать в качестве источника антител, охватывают все производные, потомство клеток родительских гибридом, которые продуцируют моноклональные антитела, специфичные в отношении Notch1 или его части.
Гибридомы, которые продуцируют такие антитела, можно выращивать in vitro или in vivo с использованием известных методик. Моноклональные антитела можно выделять из культуральных сред или жидкостей тела традиционными методиками очистки иммуноглобулинов.
Гуманизация антител против Notch1, генерированных иммунизацией животного-хозяина
В пределах рассмотрения настоящего изобретения находится то, что антителами против Notch1 по изобретению, где данные антитела получены иммунизацией животного-хозяина, можно манипулировать разными способами для улучшения их биологической активности и фармацевтических свойств. Одним способом такой манипуляции является гуманизация.
Способы гуманизации антител хорошо известны обычным специалистам в данной области. В общем, имеется четыре основные стадии для гуманизации моноклонального антитела. Ими являются: (1) определение нуклеотидной и предсказываемой аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи исходного антитела, (2) конструирование гуманизированного антитела, т.е. решение того, какую каркасную область антитела использовать во время процесса гуманизации, (3) реальные методологии/методики гуманизации и (4) трансфекция и экспрессия гуманизированного антитела.
В литературе был описан целый ряд молекул «гуманизированных» антител, содержащих антигенсвязывающий сайт, происходящий из иммуноглобулина, не являющегося человеческим, включая химерные антитела, имеющие V области грызунов или модифицированные V области грызунов и ассоциированные с ними CDR, слитые с человеческими константными доменами; CDR грызунов, пересаженные в человеческую поддерживающую каркасную область (FR) до слияния с подходящим константным доменом человеческого антитела; и CDR грызунов, поддерживаемые рекомбинантно 1 сконструированными каркасными областями грызунов. Такие «гуманизированные» молекулы конструируют для минимизации нежелательного иммунологического ответа в отношении молекул антител грызунов против человеческих эпитопов, который ограничивает продолжительность и эффективность терапевтических применений данных группировок у реципиентов-людей.
Человеческие антитела против Notch1
В пределах рассмотрения настоящего изобретения находится то, что полностью человеческие антитела против Notch1 можно получать посредством применения имеющихся в продаже мышей, которые были подвергнуты генетической модификации для экспрессии конкретных белков человеческих иммуноглобулинов. Для получения гуманизированных или человеческих антител также можно использовать трансгенных животных, которые сконструированы для получения более желательного (например полностью человеческое антитело) или более надежного иммунного ответа. Примерами таких технологий являются Xenomouse™ от Abgenix, Inc. (Fremont, CA) и HuMAb-Mouse®, и TC Mouse™ от Medarex, Inc. (Princeton, NJ).
Также в пределах рассмотрения настоящего изобретения находится то, что полностью человеческие антитела против Notch1 можно получать рекомбинантно, следуя общим способам технологии фагового дисплея, как будет совершенно очевидно специалистам в данной области. В качестве альтернативы, технологию фагового дисплея можно использовать для получения человеческих антител и фрагментов антител in vitro из репертуаров генов вариабельных (V) доменов иммуноглобулинов от иммунизированных доноров.
Для получения человеческих антител из антител грызунов также можно использовать перетасовку генов, где человеческое антитело имеет аналогичные аффинности и специфичности относительно исходного антитела грызунов. Несмотря на то, что приведенное выше обсуждение относится к гуманизированным и человеческим антителам, общие обсуждавшиеся принципы применимы для адаптации антител для применения, например, у собак, кошек, приматов, лошадиных и коровьих. Один или более чем один аспект гуманизации антитела, описанный здесь, можно объединять, например, пересадку CDR, мутацию каркаса и мутацию CDR.
Сконструированные и модифицированные антитела против Notch1, полученные посредством генной инженерии
В общем, антитела можно получать посредством генной инженерии, помещая последовательности ДНК желательного антитела в экспрессионные векторы с последующей трансфекцией и экспрессией в клетках-хозяевах, включающих, но не ограничивающихся, клетками E.coli, клетками COS обезьян, клетками яичника китайского хомяка (СНО) или миеломными клетками, которые в противном случае не продуцируют иммуноглобулиновый белок. Также можно использовать другие клетки-хозяева, такие как трансгенные растительные клетки или трансгенные клетки, продуцирующие молоко.
Антитело также можно модифицировать посредством генной инженерии. Например, ДНК константных областей человеческих тяжелых и легких цепей можно использовать вместо гомологичных мышиных последовательностей ДНК мышиного антитела или посредством ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности полипептида, не являющегося иммуноглобулином. Аналогичным образом, можно получать «химерные» или «гибридные» антитела, которые имеют специфичность связывания описанного здесь моноклонального антитела против Notch1.
Вариабельные области антител также можно модифицировать пересадкой CDR. Поскольку последовательности CDR преимущественно отвечают за большинство взаимодействий антитело-антиген, можно экспрессировать рекомбинантные антитела, которые имитируют свойства специфичных антител, встречающихся в природе, посредством конструирования экспрессионных векторов, которые включают последовательности CDR из специфичного встречающегося в природе антитела, пересаженные на последовательности каркаса из другого антитела с другими свойствами.
Соответственно, другой аспект изобретения относится к выделенному моноклональному антителу, содержащему вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3, как здесь описано, и вариабельную, область легкой цепи,, содержащую последовательности CDR1, CDR2 и CDR3, как здесь описано. Таким образом, такие антитела содержат последовательности CDR VH и VL описанных здесь моноклональных антител, тем не менее, могут содержать другие последовательности каркаса из данных антител. Такие последовательности каркаса могут быть получены из общедоступных баз данных ДНК или опубликованных ссылок, которые включают последовательности генов антител зародышевой линии.
Другим типом модификации вариабельной области является мутирование аминокислотных остатков в пределах областей CDR1, CDR2 и/или CDR3 VH и/или VL для улучшения, посредством этого, одного или более чем одного свойства связывания (например аффинности) интересующего антитела. Можно проводить сайт-направленный мутагенез или ПЦР (полимеразная цепная реакция)-опосредованный мутагенез для введения мутации(ций), и эффект на связывание антитела или другое интересующее функциональное свойство можно оценивать с использованием анализов in vitro или in vivo, как здесь описано. Типично вводятся консервативные модификации (как будет обсуждаться ниже). Мутации могут быть аминокислотными заменами, присоединениями или делециями. Кроме того, типично модифицируют не более чем один, два, три, четыре или пять остатков в пределах области CDR.
Картирование эпитопов
Эпитопы связывания моноклональных антител на антигене можно картировать целым рядом способов, в зависимости от типа взаимодействий антиген-антитело.
Если антитело связывается с единичным эпитопом в антигене, состоящим из последовательных аминокислотных остатков, на связывание которого обычно не влияют конформационные изменения антигена, эпитоп связывания называется линейным эпитопом. Определение аминокислотной последовательности линейного эпитопа можно осуществлять посредством применения методик, хорошо известных в данной области. Нелинейный эпитоп, который составлен из нескольких последовательных прерывающихся отрезков или из несмежных остатков, которые объединяются посредством сворачивания антигена до его нативной структуры, известен как конформационный эпитоп.
Картирование конформационных эпитопов зависит от взаимодействия антитела с антигеном в его нативной конформации. Целый ряд методик, хорошо известных в данной области, является полезным в определении конформационных эпитопов. Например, сокристаллизация комплекса антиген-антитело, дифракция рентгеновских лучей и структурный анализ дают прямую визуализацию взаимодействия антиген-антитело. При объединении с мутагенезом аминокислот данные методики могут давать мощное доказательство и живую картину в отношении эпитопов, связываемых антителом. Эпитоп или набор эпитопов, с которыми связывается каждое из антител против Notch1, можно определять согласно приведенным выше способам картирования или другим, общеизвестным в данной области.
Консервативные замены
Антитело также можно модифицировать рекомбинантно посредством консервативной замены одного или более чем одного аминокислотного остатка антитела или посредством одной или более чем одной делеции или присоединения аминокислот к остатку данного антитела. Вставки аминокислотной последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности одного или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком или антитело, слитое с эпитопной меткой. Другие вставочные варианты молекулы антитела включают слияние с N- или C-концом антитела фермента или полипептида, который увеличивает период полувыведения антитела в системе кровообращения.
Варианты с заменой имеют по меньшей мере один удаленный аминокислотный остаток в антителе и другой остаток, вставленный на его место. Наиболее интересные сайты для мутагенеза, приводящего к заменам, включают гипервариабельные области, но также рассматриваются изменения в FR.
Антитела против Notch1 с созревшей аффинностью
Данное изобретение включает воплощения с созревшей аффинностью. Например, антитела с созревшей аффинностью можно получать методиками, известными в данной области (такими как Marks et al. (1992) Bio/Technology, 10:779-783; Barbas et al. (1994) Proc Nat. Acad. Sci, USA 91:3809-3813; Schier et al. (1995) Gene, 169:147-155; Yelton et al. (1995) J. Immunol., 155:1994-2004; Jackson et al. (1995) J. Immunol., 154(7):3310-9; Hawkins et al. (1992) J. Mol. Biol., 226:889-896 и публикация PCT № WO 2004/058184). Такие способы можно использовать для корректировки аффинности антитела и для характеризации CDR.
Посттрансляционная модификация антител против Notch1
Антитела также можно модифицировать посттрансляционными модификациями, включающими, но не ограничивающимися, гликозилированием разными сахарами, ацетилированием и фосфорилированием, посредством методик, хорошо известных в данной области.
Другие способы посттрансляционной модификации включают применение методик связывания, известных в данной области, включающих, но не ограничивающихся, ферментативными способами, окислительным замещением и хелатированием. Модификации можно использовать, например, для присоединения меток для иммуноанализа.
Антитела против Notch1 с модифицированной константной областью
В некоторых воплощениях изобретения антитело содержит модифицированную константную область, как, например, константную область, которая является иммунологически инертной или частично инертной, например, не запускает лизис, опосредованный комплементом, не стимулирует зависимую от антитела клеточно-опосредованную цитотоксичность (ADCC) или не активирует микроглию; или имеет пониженные активности (по сравнению с немодифицированным антителом) в любом одном или более чем одном из следующего: запуск лизиса, опосредованного комплементом, стимуляция зависимой от антитела клеточно-опосредованной цитотоксичности (ADCC) или активация микроглии. Для достижения оптимального уровня и/или комбинации эффекторных функций можно использовать различные модификации константной области. Смотрите, например, Morgan et al., Immunology 86:319-324 (1995); Lund et al., J. Immunology 157:4963-9 157:4963-4969 (1996); Idusogie et al., J. Immunology 164:4178-4184 (2000); Tao et al., J. Immunology 143: 2595-2601 (1989) и Jefferis et al., Immunological Reviews 163:59-76 (1998).
В некоторых воплощениях антитело содержит константную область тяжелой цепи человеческого IgG1, содержащую следующие мутации: L234A/L235A/G237A в нижней шарнирной области, приводящие к значительно пониженным активностям ADCC и CDC (цитотоксичность, зависимая от комплемента). Смотрите, например, US 20090155256.
Модификации в пределах области Fc типично можно использовать для изменения одного или более чем одного функционального свойства антитела, такого как период полувыведения в сыворотке, фиксация комплемента, связывание с рецептором Fc и/или антиген-зависимая клеточная цитотоксичность. Кроме того, антитело по изобретению может быть модифицировано химически (например к антителу может быть присоединена одна или более чем одна химическая группировка) или модифицировано для изменения его картины гликозилирования, опять-таки для изменения одного или более чем одного функционального свойства антитела.
Другой описанной здесь модификацией антител, которая рассматривается изобретением, является ПЭГилирование. Антитело может быть ПЭГилировано, например, для увеличения биологического (например сывороточного) периода полувыведения антитела. Для ПЭГилирования антитела антитело или его фрагмент типично подвергают взаимодействию с полиэтиленгликолем (ПЭГ), таким как реакционноспособное сложноэфирное или альдегидное производное ПЭГ, при условиях, в которых одна или более чем одна группа ПЭГ присоединяется к антителу или его фрагменту. Типично ПЭГилирование проводится посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой ПЭГ (или аналогичным реакционноспособным водорастворимым полимером). Подразумевается, что термин «полиэтиленгликоль» в том виде, как он здесь используется, охватывает любую из форм ПЭГ, которую использовали для дериватизации других белков, такую как моно (C1-C10) алкокси- или арилокси-полиэтиленгликоль, или полиэтиленгликоль-малеимид. В определенных случаях антитело, подлежащее ПЭГилированию, представляет собой негликозилированное антитело. Способы ПЭГилирования белков известны в данной области и могут применяться к антителам по настоящему изобретению.
Слитый белок
Изобретение также охватывает слитые белки, содержащие один или более чем один фрагмент или область из антител или полипептидов по данному изобретению. В одном воплощении предложен слитый белок, который содержит по меньшей мере 10 смежных аминокислот вариабельной области легкой цепи и/или по меньшей мере 10 аминокислот вариабельной области тяжелой цепи антител по настоящему изобретению. В других воплощениях предложен слитый полипептид, который содержит по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 смежных аминокислот вариабельной области легкой цепи и/или по меньшей мере примерно 10, по меньшей мере примерно 15, по меньшей мере примерно 20, по меньшей мере примерно 25 или по меньшей мере примерно 30 смежных аминокислот вариабельной области тяжелой цепи. В другом воплощении слитый полипептид содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи антител по настоящему изобретению. В другом воплощении слитый полипептид содержит одну или более чем одну CDR антител по настоящему изобретению. Для целей данного изобретения слитый белок содержит одно или более чем одно антитело и другую аминокислотную последовательность, к которой оно не присоединено в нативной молекуле, например, гетерологичную последовательность или гомологичную последовательность из другой области. Типичные гетерологичные последовательности включают, но не ограничиваются, «меткой», такой как метка FLAG или метка 6His.
Слитый полипептид можно создавать способами, известными в данной области, например, синтетически или посредством генной инженерии.
Биспецифичные молекулы
Антитело по изобретению, его антигенсвязывающие части можно дериватизировать или связывать с другой функциональной молекулой, например, другим пептидом или белком (например другим антителом или лигандом для рецептора) с получением биспецифичной молекулы, которая связывается с по меньшей мере двумя разными сайтами связывания или молекулами-мишенями. Антитело по изобретению на самом деле может быть дериватизировано или связано с более чем одной другой функциональной молекулой с получением мультиспецифичных молекул, которые связываются с более чем двумя разными сайтами связывания и/или молекулами-мишенями; также подразумевается, что такие мультиспецифичные молекулы охватываются термином «биспецифичная молекула» в том виде, как он здесь используется. Для создания биспецифичной молекулы по изобретению антитело по изобретению можно функционально связывать (например посредством химического присоединения, генетического слияния, нековалентной ассоциации или иначе) с одной или более чем одной другой связывающей молекулой, такой как другое антитело, фрагмент антитела, пептид или связывающий миметик, так что в результате образуется биспецифичная молекула.
Одноцепочечные антитела
Антитело по изобретению может быть одноцепочечным антителом (scFv), в котором вариабельные области (область Fv) тяжелой и легкой цепи были соединены гибким линкером с образованием одной полипептидной цепи, которая образует антигенсвязывающую область. Такие одноцепочечные антитела можно получать слиянием ДНК, кодирующей пептидный линкер между ДНК, кодирующими два полипептида вариабельных доменов (VL и VH). Образующиеся полипептиды могут сворачиваться обратно на самих себя с образованием антигенсвязывающих мономеров, или они могут образовать мультимеры (например димеры, тримеры или тетрамеры), в зависимости от длины гибкого линкера между двумя вариабельными доменами (Kortt et al. (1997) Prot. Eng. 10:423; Kortt et al. (2001) Biomol. Eng. 18:95-108). Путем объединения разных полипептидов, содержащих VL и VH, можно получать мультимерные scFvs, которые связываются с разными эпитопами (Kriangkum et al. (2001) Biomol. Eng. 18:31-40). Одноцепочечные антитела можно получать с использованием разных методик, известных в данной области.
Иммуноконъюгаты
Антитело по изобретению может быть иммуноконъюгатом или конъюгатами антитело-лекарственное средство (ADC). Иммуноконъюгаты объединяют специфичность связывания моноклональных антител с эффективностью химиотерапевтических агентов.
Полинуклеотиды. кодирующие антитела против Notch1
Согласно изобретению также предложены выделенные полинуклеотиды, кодирующие антитела и пептиды по изобретению, векторы, и клетки-хозяева, содержащие данный полинуклеотид.
В одном аспекте согласно изобретению предложены композиции, такие как фармацевтическая композиция, содержащие любой из полинуклеотидов по изобретению. В некоторых воплощениях композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий антитело по изобретению. В другом воплощении композиция содержит экспрессионный вектор, содержащий полинуклеотид, кодирующий любое из антител или полипептидов по изобретению.
В другом аспекте согласно изобретению предложен способ получения любого из описанных здесь полинуклеотидов.
Полинуклеотиды, комплементарные любым таким последовательностям, также охватываются настоящим изобретением. Полинуклеотиды могут быть одноцепочечными (кодирующими или антисмысловыми) или двухцепочечными и могут представлять собой молекулы ДНК (геномной, кДНК (комплементарной ДНК) или синтетической) или РНК. Молекулы РНК включают молекулы гяРНК (гетерогенная ядерная РНК), которые содержат интроны и соответствуют молекуле ДНК один к одному, и молекулы мРНК (матричная РНК), которые не содержат интроны. В пределах полинуклеотида по настоящему изобретению могут, но не обязательно присутствуют дополнительные кодирующие или некодирующие последовательности, и полинуклеотид может, но не обязательно является связанным с другими молекулами и/или веществами подложки.
Полинуклеотиды могут содержать нативную последовательность (т.е. эндогенную последовательность, которая кодирует антитело или его часть) или могут содержать вариант такой последовательности. Варианты полинуклеотидов содержат одну или более чем одну замену, присоединение, делецию и/или вставку, так, что иммунореактивность кодируемого полипептида не уменьшается по отношению к нативной иммунореактивной молекуле. Влияние на иммунореактивность кодируемого полипептида обычно можно оценивать, как здесь описано. Варианты предпочтительно демонстрируют по меньшей мере примерно 70%-ную идентичность, более предпочтительно по меньшей мере примерно 80%-ную идентичность, еще более предпочтительно, по меньшей мере примерно 90%-ную идентичность и наиболее предпочтительно по меньшей мере примерно 95%-ную идентичность с полинуклеотидной последовательностью, которая кодирует нативное антитело или его часть.
Говорят, что две полинуклеотидные или полипептидные последовательности являются «идентичными», если последовательность нуклеотидов или аминокислот в двух последовательностях является одинаковой при выравнивании для максимального соответствия.
Обычным специалистам в данной области будет понятно, что, в результате вырожденности генетического кода, существует много нуклеотидных последовательностей, которые кодируют полипептид, как здесь описано. Некоторые из данных полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые отличаются из-за различий в использовании кодонов, конкретно рассматриваются настоящим изобретением. Кроме того, аллели генов, содержащие приведенные здесь полинуклеотидные последовательности, находятся в пределах объема настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменяются в результате одной или более чем одной мутации, такой как делеция, присоединение и/или замена нуклеотидов. Образующиеся в результате мРНК и белок могут, но не обязательно имеют измененную структуру или функцию. Аллели могут быть идентифицированы с использованием стандартных методик (таких как гибридизация, амплификация и/или сравнение с последовательностями из базы данных).
Полинуклеотиды по данному изобретению можно получать с использованием химического синтеза, способов генной инженерии или ПЦР (полимеразная цепная реакция).
Для получения полинуклеотидов с использованием способов генной инженерии полинуклеотид, содержащий желательную последовательность, можно вставлять в подходящий вектор, и вектор, в свою очередь, можно вводить в подходящую клетку-хозяина для репликации и амплификации. Подходящие клонирующие векторы можно конструировать согласно стандартным методикам или можно выбирать из большого числа клонирующих векторов, доступных в данной области. В то время как выбранный клонирующий вектор может варьировать согласно клетке-хозяину, намеченной для применения, полезные клонирующие векторы обычно будут иметь способность к саморепликации, могут обладать единственной мишенью для конкретной эндонуклеазы рестрикции и/или могут нести гены маркера, который можно использовать при отборе клонов, содержащих вектор.
Экспрессионные векторы обычно, представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклотид согласно изобретению. Подразумевается, что экспрессионный вектор должен быть реплицируемым. в клетках-хозяевах либо в виде эписом, либо в виде интегральной части хромосомной ДНК. Компоненты вектора обычно могут включать, но не ограничиваются, одним или более чем одним из следующих: сигнальная последовательность; репликатор; один или более чем один маркерный ген; подходящие элементы контроля транскрипции (такие как промоторы, энхансеры и терминатор).
Векторы, содержащие интересующие полинуклеотиды, можно вводить в клетку-хозяина любым из целого ряда подходящих способов, включающих электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE (диэтиламиноэтил)-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфекцию (например когда вектор представляет собой инфекционный агент, такой как вирус осповакцины). Выбор векторов или полинуклеотидов для введения часто будет зависеть от характеристик клетки-хозяина.
Согласно изобретению также предложены клетки-хозяева, содержащие любой из описанных здесь полинуклеотидов. С целью выделения генов, кодирующих интересующее антитело, полипептид или белок, можно использовать любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК. Подходящие клетки-хозяева, не являющиеся клетками млекопитающих, включают прокариот (таких как E.coli или B.subtillis) и дрожжей (таких как S.cerevisae, S.pombe или K.lactis). Предпочтительно клетки-хозяева экспрессируют кДНК с уровнем примерно в 5 раз большим, более предпочтительно в 10 раз большим, даже более предпочтительно в 20 раз большим, чем уровень экспрессии соответствующего интересующего эндогенного антитела или белка, в случае их присутствия, в клетках-хозяевах.
Фармацевтические композиции
В другом аспекте согласно настоящему изобретению предложена композиция, например, фармацевтическая композиция, содержащая одно моноклональное антитело или комбинацию моноклональных антител или их антигенсвязывающую часть(ти) по настоящему изобретению, приготовленная в виде препарата совместно с фармацевтически приемлемым носителем. Такие композиции могут включать одно антитело или комбинацию (например двух или более чем двух разных) антител, или иммуноконъюгатов, или биспецифичных молекул по изобретению. Например, фармацевтическая композиция по изобретению может содержать комбинацию антител (или иммуноконъюгатов, или биспецифичных молекул), которые связываются с разными эпитопами на антигене-мишени или которые имеют взаимодополняющие активности.
Фармацевтические композиции по изобретению также можно вводить в комбинированной терапии, например, объединенными с другими агентами. Например, комбинированная терапия может включать антитело против Notch1 по настоящему изобретению, объединенное с по меньшей мере одним другим противовоспалительным, противораковым агентом или иммунодепрессантом. Примеры терапевтических агентов, которые можно использовать в комбинированной терапии, описаны с большими подробностями ниже в разделе по применениям антител по изобретению.
Термин «фармацевтически приемлемый носитель» в том виде, как он здесь используется, включает все и любые растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотоничные агенты и агенты, задерживающие поглощение, и тому подобное, которые являются физиологически совместимыми. Типично носитель подходит для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например посредством инъекции или инфузии). В зависимости от пути введения, активное соединение, т.е. антитело, его антигенсвязывающая часть, иммуноконъюгат или биспецифичная молекула, может быть покрыто веществом для защиты соединения от действия кислот или других природных условий, которые могут инактивировать соединение.
В определенных воплощениях антитела по настоящему изобретению могут присутствовать в нейтральной форме (включая цвиттерионные формы) или в виде положительно или отрицательно заряженных соединений. В некоторых случаях антитела могут образовать комплекс с противоионом с образованием фармацевтически приемлемой соли. Таким образом, фармацевтические соединения по изобретению могут включать одну или более чем одну фармацевтически приемлемую соль.
Термин «фармацевтически приемлемая соль» относится к соли, которая сохраняет желательную биологическую активность родительского соединения (например антитела) и не дает нежелательные токсикологические эффекты (смотрите, например, Berge, S.M., et al. (1977) J. Pharm. Sci. 66:1-19). Например, термин «фармацевтически приемлемая соль» включает комплекс, содержащий одно или более чем одно антитело и один или более чем один противоион, где противоионы происходят из фармацевтически приемлемых неорганических и органических кислот и оснований.
Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включают соли, происходящие из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромистоводородная, йодистоводородная, фосфористая и тому подобное, а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенил-замещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и тому подобное. Соли присоединения основания включают соли, происходящие из щелочноземельных металлов, таких как натрий, калий, магний, кальций и тому подобное, а также из нетоксичных органических аминов, таких как N,N’-дибензилэтилендиамин, N-метилглкжамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, прокаин и тому подобное.
Кроме того, фармацевтически приемлемые неорганческие основания включают ионы металлов. Ионы металлов включают, но не ограничиваются, подходящими солями щелочных металлов, солями щелочноземельных металлов и другими физиологически приемлемыми ионами металлов. Соли, происходящие из неорганических оснований, включают соли алюминия, аммония, кальция, кобальта, никеля, молибдена, ванадия, марганца, хрома, селена, олова, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, рубидия, натрия и цинка, и в их обычных валентностях.
Фармацевтически приемлемые соли присоединения кислоты антител по настоящему изобретению могут быть получены из следующих кислот, включающих, без ограничения, муравьиную, уксусную, ацетамидобензойную, аскорбиновую, борную, пропионовую, бензойную, камфорную, угольную, цикламиновую, дегидрохолевую, малоновую, эдетовую, этилсерную, фендизоевую, метафосфорную, янтарную, гликолевую, глюконовую, молочную, яблочную, винную, дубильную, лимонную, азотную, аскорбиновую, глюкуроновую, малеиновую, фолевую, фумаровую, пропионовую, пировиноградную, аспарагиновую, глутаминовую, бензойную, соляную, бромистоводородную, йодистоводородную, лизин, изолимонную, трифторуксусную, памоевую, пропионовую, антраниловую, мезиловую, оротовую, щавелевую, щавелевоуксусную, олеиновую, стеариновую, салициловую, аминосалициловую, кремниевую, п-гидроксибензойную, никотиновую, фенилуксусную, миндальную, эмбоновую, сульфоновую, метансульфоновую, фосфорную, фосфоновую, этансульфоновую, этандисульфоновую, аммиак, бензолсульфоновую, пантотеновую, нафталинсульфоновую, толуолсульфоновую, 2-гидроксиэтансульфоновую, сульфаниловую, серную, азотную, азотистую, сложный монометиловый эфир серной кислоты, циклогексиламиносульфоновую, β-гидроксимасляную, глицин, глицилглицин, глутаминовую, какодилат, диаминогексановую, камфорсульфоновую, глюконовую, тиоциановую, оксоглутаровую, пиридоксаль-5-фосфат, хлорфеноксиуксусную, ундекановую, N-ацетил-L-аспарагиновую, галактаровую и галактуроновую кислоты.
Фармацевтически приемлемые органические основания включают следующие: триметиламин, диэтиламин, N,N’-дибензилэтилендиамин, хлорпрокаин, холин, дибензиламин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин), прокаин, циклические амины, четвертичные катионы аммония, аргинин, бетаин, кафеин, клемизол, 2-этиламиноэтанол, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этандиамин, бутиламин, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, этилглюкамин, глюкамин, глюкозамин, гистидин, гидрабамин, имидазол, изопропиламин, метилглюкамин, морфолин, пиперазин, пиридин, пиридоксин, неодимий, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтиламин, трипропиламин, триэтаноламин, трометамин, метиламин, таурин, холат, 6-амино-2-метил-2-гептанол, 2-амино-2-метил-1,3-пропандиол, 2-амино-2-метил-1-пропанол, алифатические моно- и дикарбоновые кислоты, фенил-замещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты, стронций, трицин, гидразин, фенилциклогексиламин, 2-(N-морфолино)этансульфоновая кислота, бис(2-гидроксиэтил)амино-трис(гидроксиметил)метан, N-(2-ацетамидо)-2-аминоэтансульфоновая кислота, 1,4-пиперазиндиэтансульфоновая кислота, 3-морфолино-2-гидроксипропансульфоновая кислота, 1,3-бис[трис(гидроксиметил)метиламино]пропан, 4-морфолинпропансульфоновая кислота, 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота, 2-[(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]этансульфоновая кислота, N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота, 4-(N-морфолино)бутансульфоновая кислота, 3-(N,N-бис[2-гидроксиэтил]амино)-2-гидроксипропансульфоновая кислота, 2-гидрокси-3-[трис(гидроксиметил)метиламино]-1-пропансульфоновая кислота, 4-(2-гидроксиэтил)пиперазин-1-(2-гидроксипропансульфоновая кислота), пиперазин-1,4-бис(2-гидроксипропансульфоновой кислоты) дигидрат, 4-(2-гидроксиэтил)-1-пиперазинпропансульфоновая кислота, N,N-бис(2-гидроксиэтил)глицин, N-(2-гидроксиэтил)пиперазин-N’-(4-бутансульфоновая кислота), N-[трис(гидроксиметил)метил]-3-аминопропансульфоновая кислота, N-трис(гидроксиметил)метил-4-аминобутансульфоновая кислота, N-(1,1-диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновая кислота, 2-(циклогексиламино)этансульфоновая кислота, 3-(циклогексиламино)-2-гидрокси-1-пропансульфоновая кислота, 3-(циклогексиламино)-1-пропансульфоновая кислота, N-(2-ацетамидо)иминодиуксусная кислота, 4-(циклогексиламино)-1-бутансульфоновая кислота, N-[трис(гидроксиметил)метил]глицин, 2-амино-2-(гидроксиметил)-1,3-пропандиол и трометамол.
Фармацевтическая композиция по изобретению также может включать фармацевтически приемемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеина гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и тому подобное; (2) растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), лецитин, пропилгаллат, альфа-токоферол и тому подобное; и (3) агенты, хелатирующие металлы, такие как лимонная кислота, этилендиаминтетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобное.
Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях по изобретению, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное) и их подходящие смеси, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Подходящую текучесть можно поддерживать, например, посредством применения веществ покрытия, таких как лецитин, посредством поддержания требующегося размера частиц в случае дисперсий или посредством применения поверхностно-активных веществ.
Данные композиции также могут содержать адъюванты, такие как консерванты, увлажнители, эмульгаторы и диспергенты. Предупреждение присутствия микроорганизмов может быть обеспечено как методиками стерилизации, приведенными выше, так и включением различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и тому подобного. Также может быть желательным включение в композиции изотонических агентов, таких как сахара, хлорид натрия и тому подобное. Кроме того, пролонгированное поглощение инъецируемой фармацевтической формы может осуществляться посредством включения агентов, которые задерживают поглощение, таких как моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий для немедленного приема. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области. За исключением случаев, когда любые традиционные среды или агент являются несовместимыми с активным соединением, рассматривается их применение в фармацевтических композициях по изобретению. В композиции также могут быть включены вспомогательные активные соединения.
Терапевтические композиции типично должны быть стерильными и стабильными при условиях изготовления и хранения. Композицию можно готовить в виде препарата в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и тому подобное) и их подходящие смеси. Подходящая; текучесть может поддерживаться, например, применением покрытия, такого как лецитин, поддержанием требующегося размера частиц в случае дисперсии и применением поверхностно-активных веществ. Во многих случаях, будет предпочтительным включение в композицию изотоничных агентов, например, сахаров, полиспиртов, таких как маннит, сорбит или хлорид натрия. Пролонгированное поглощение инъецируемых композиций может осуществляться включением в композицию агента, который задерживает поглощение, например, моностеаратных солей и желатина.
Стерильные инъецируемые растворы можно получать включением активного соединения в требующемся количестве в подходящем растворителе с одним или с комбинацией ингредиентов, перечисленных выше, как требуется, с последующей стерилизующей микрофильтрацией. Обычно дисперсии получают включением активного соединения в стерильный носитель, который содержит базовую дисперсионную среду и другие требующиеся ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, способы получения включают, но не ограничиваются, вакуумной сушкой и сублимационной сушкой (лиофилизацией), которые дают порошок активного ингредиента плюс любого дополнительного желательного ингредиента из его раствора, ранее подвергнутого стерилизующей фильтрации.
Количество активного ингредиента, которое можно объединять с веществом носителя для получения единичной лекарственной формы, будет варьировать, в зависимости от субъекта, которого лечат, и конкретного способа введения. Количество активного ингредиента, которое можно объединять с веществом носителя для получения единичной лекарственной формы, обычно будет представлять собой то количество композиции, которое дает терапевтический эффект. Обычно из ста процентов данное количество будет варьировать от примерно 0,01 процента до примерно девяносто девяти процентов активного ингредиента, предпочтительно от примерно 0,1 процента до примерно 70 процентов, наиболее предпочтительно от примерно 1 процента до примерно 30 процентов активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Схемы дозировки корректируют для обеспечения оптимального желательного ответа (например терапевтического ответа). Например, можно вводить один болюс, в течение определенного времени можно вводить несколько раздельных доз, или доза может быть пропорционально уменьшена или увеличена, в соответствии с потребностями терапевтической ситуации. Особенно полезно готовить парентеральные композиции в стандартной лекарственной форме для легкости введения и однородности дозировки. Термин «стандартная лекарственная форма» в том виде, как он здесь используется, относится к физически дискретным единицам, приспособленным в качестве единичных дозировок для субъектов, подлежащих лечению; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желательного терапевтического эффекта, в ассоциации с требующимся фармацевтическим носителем. Спецификация стандартных лекарственных форм по изобретению продиктована и непосредственно зависит от (а) уникальных характеристик активного соединения и конкретного терапевтического эффекта, которого нужно добиться, и (б) ограничений, присущих области приготовления такого активного соединения для лечения чувствительности у индивидуумов.
Для введения антитела дозировка варьирует от примерно 0,0001 до 100 мг/кг и более типично от 0,01 до 5 мг/кг массы тела хозяина. Например, дозировки могут составлять 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела или находиться в пределах интервала от 1 до 10 мг/кг. Типичная схема лечения включает введение один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз в месяц, один раз каждые 3 месяца или один раз каждые 3-6 месяцев. Схемы дозировки для антитела против Notch1 по изобретению включают, например, 1 мг/кг массы тела или 3 мг/кг массы тела посредством внутривенного введения, причем антитело дается с использованием одной из следующих схем дозировки: (1) шесть дозировок каждые четыре недели, затем каждые три месяца; (2) каждые три недели; (3) 3 мг/кг массы тела один раз с последующими 1 мг/кг массы тела каждые три недели.
В некоторых способах два или более чем два моноклональных антитела с разными специфичностями связывания вводят одновременно, причем в данном случае дозировка каждого введенного антитела попадает в указанные интервалы. Антитело обычно вводят в многочисленных ситуациях. Интервалы между одиночными дозировками могут составлять, например, неделю, месяц, каждые три месяца или год. Интервалы также могут быть нерегулярными, как будет показано измерениями уровней антитела к антигену-мишени в крови пациента. В некоторых способах дозировку корректируют для достижения концентрации антитела в плазме примерно от 1 до 1000 мкг/мл и в некоторых способах - примерно от 25 до 300 мкг/мл.
В качестве альтернативы, антитело можно вводить в виде препарата замедленного высвобождения, причем в данном случае требуется менее частое введение. Дозировка и частота варьируют, в зависимости от периода полувыведения антитела у пациента. В общем, человеческие антитела демонстрируют самый длительный период полувыведения, после них следуют гуманизированные антитела, химерные антитела и антитела, не являющиеся человеческими. Дозировка и частота введения могут варьировать в зависимости от того, является ли лечение профилактическим или терапевтическим. При профилактических применениях вводят относительно низкие дозировки относительно нечасто в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца их жизни. При терапевтических применениях иногда требуется относительно высокая дозировка через относительно короткие интервалы времени, пока не ослабнет или не завершится развитие заболевания, и предпочтительно пока пациент не продемонстрирует частичное или полное облегчение симптомов заболевания. Затем пациенту можно вводить профилактическую схему.
Реальные уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьировать так, чтобы получать количество активного ингредиента, которое является эффективным для достижения желательного терапевтического ответа в отношении конкретного пациента, композиции и способа введения, не будучи токсичным для пациента. Выбранный уровень дозировки будет зависеть от целого ряда фармакокинетических факторов, включая активность конкретных применяемых композиций по настоящему изобретению или их сложного эфира, соли или амида, пути введения, времени введения, скорости экскреции конкретного применяемого соединения, продолжительности лечения, других лекарственных средств, соединений и/или веществ, используемых в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общее состояние здоровья и предыдущую медицинскую историю пациента, которого лечат, и подобные факторы, хорошо известные в области медицины.
«Терапевтически эффективная дозировка» антитела против Notch по, изобретению «предпочтительно приводит к уменьшению тяжести симптомов заболевания, увеличению частоты и продолжительности периодов без симптомов заболевания или предупреждению ухудшения или потери трудоспособности из-за поражения заболеванием. Например, в отношении лечения Notch1-позитивных опухолей, «терапевтически эффективная дозировка» предпочтительно ингибирует рост клеток или рост опухоли по меньшей мере примерно на 20%, более предпочтительно по меньшей мере примерно на 40%, даже более предпочтительно по меньшей мере примерно на 60% и еще более предпочтительно по меньшей мере примерно на 80% относительно субъектов, не подвергавшихся лечению. Способность соединения ингибировать рост опухоли можно оценивать в животной модельной системе, предсказывающей эффективность в человеческих опухолях. В качестве альтернативы, данное свойство композиции можно оценивать, исследуя способность соединения к ингибированию, причем такое ингибирование in vitro можно исследовать анализами, известными квалифицированному практику. Терапевтически эффективное количество терапевтического соединения может уменьшать размер опухоли или иным способом облегчать симптомы у субъекта. Обычный специалист в данной области смог бы определить такие количества на основе таких факторов, как размер субъекта, тяжесть симптомов субъекта и конкретная выбранная композиция или путь введения.
Композицию по настоящему изобретению можно вводить посредством одного или более чем одного пути введения с использованием одного или более чем одного из ряда способов, известных в данной области. Как будет понятно специалисту, путь и/или способ введения будет варьировать, в зависимости от желаемых результатов. Пути введения антител по изобретению включают внутривенный, внутримышечный, внутрикожный, внутрибрюшинный, подкожный, спинальный или другие парентеральные пути введения, например, посредством инъекции или инфузии. Фраза «парентеральное введение» в том виде, как она здесь используется, означает способы введения, отличные от энтерального и местного введения, обычно посредством инъекции, и включает, без. ограничения, внутивенную, внутримышечную, внутриартериальную, подоболочечную, внутрикапсульную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную,, подпаутинную, внутрипозвоночечную, эпидуральную и надчревную инъекцию и инфузию.
В качестве альтернативы, антитело или его антигенсвязывающую часть по изобретению можно вводить посредством непарентерального пути, такого как местный, эпидермальный путь введения или путь введения через слизистую оболочку, например, интраназально, перорально, вагинально, ректально, подъязычно или местно.
Активные соединения можно готовить с носителями, которые будут защищать соединение против быстрого высвобождения, как, например, в виде препарата с контролируемым высвобождением, включая импланты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы получения таких препаратов запатентованы или обычно известны специалистам в данной области. Смотрите, например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Применение и способы по изобретению
Антитела, в частности человеческие антитела, композиции антител и способы по настоящему изобретению имеют многочисленные диагностические и терапевтические применения in vitro и in vivo, включающие диагностику и лечение расстройств, опосредованных Notch1. Например, данные молекулы можно вводить в клетки в культуре, in vitro или ex vivo, или человеческим субъектам, например, in vivo для лечения, предупреждения и для диагностики ряда расстройств. Подразумевается, что термин «субъект» в том виде, как он здесь используется, включает человека и животных, не являющихся человеком. Животные, не являющиеся человеком, включают всех позвоночных, например, млекопитающих и немлекопитающих, таких как приматы, не являющиеся человеком, овцы, собаки, кошки, коровы, лошади, курицы, земноводные и пресмыкающиеся. Предпочтительные субъекты включают пациентов-людей, имеющих расстройства, опосредованные активностью Notch1. Данные способы являются особенно подходящими для лечения пациентов-людей, имеющих расстройство, ассоциированное с ненормальной экспрессией или активацией Notch1. При введении антител к Notch1 совместно с другим агентом обоих можно вводить в любом порядке или одновременно.
Принимая во внимание специфичное связывание антител по изобретению с Notch1, антитела по изобретению можно использовать для специфичной детекции экспрессии Notch1 на поверхности клеток и, кроме того, можно использовать для очистки Notch1 посредством иммуноаффинной очистки.
Кроме того, антитела, композиции антител и способы по настоящему изобретению можно использовать для лечения субъекта с ненормальной экспрессией Notch1, например, при раковом заболевании. В одном конкретном воплощении раковое заболевание представляет собой T-клеточный острый лимфобластный лейкоз (T-ALL). В другом конкретном воплощении раковое заболевание представляет собой немелкоклеточный рак легкого (NSCLC), рак молочной железы, рак толстой кишки или рак яичника.
Другие типы ненормальной экспрессии Notch1, которые можно лечить посредством антител по изобретению, включают, например, мезотелиому, гепатобилиарную опухоль (печеночных и желчных протоков), первичную или вторичную опухоль ЦНС (центральная нервная система), первичную или вторичную опухоль мозга, рак легкого (NSCLC и SCLC), рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, меланому кожи или внутриглазную меланому, рак прямой кишки, рак анальной области, рак желудка, рак желудочно-кишечной системы (желудка, толстой кишки и двенадцатиперстной кишки), рак матки, карцинома фаллопиевых труб, карцинома эндомерия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркома мягкой ткани, рак уретры, рак пениса, рак простаты, рак яичка, хронический или острый лейкоз, хронический миелоидный лейкоз, лимфоцитарные лимфомы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечной лоханки, неоплазмы центральной нервной системы (ЦНС), первичная лимфома ЦНС, неходжкинская лимфома, опухоли оси позвоночника, глиома ствола мозга, аденома гипофиза, рак коры надпочечников, рак желчного пузыря, множественная миелома, холангиокарцинома, фибросаркома, нейробластома, ретинобластома или комбинация одного или более чем одного из приведенных выше раковых заболеваний.
Подходящие пути введения композиций антитела (например человеческих моноклональных антител, мультиспецифичных и биспецифичных молекул и иммуноконъюгатов) по изобретению in vivo и in vitro хорошо известны в данной области и могут быть выбраны обычными специалистами. Например, композиции антитела можно вводить посредством инъекции (например внутривенной или подкожной). Подходящие дозировки используемых молекул будут зависеть от возраста и массы субъекта и концентрации и/или препарата композиции антитела.
Человеческие антитела против Notch1 по изобретению можно вводить совместно с одним или более чем одним другими терапевтическими агентами, например, с цитотоксическим агентом, радиотоксическим агентом или иммунодепрессантом. Антитело можно связывать с агентом (в виде иммунокомплекса) или можно вводить отдельно от агента. В последнем случае (раздельное введение) антитело можно вводить до, после или одновременно с агентом, или можно вводить совместно с другими известными терапиями, например, с противораковой терапией, например, радиацией. Антитело и агент могут быть приготовлены для одновременного, последовательного или раздельного введения. Такие терапевтические агенты включают, среди прочих, антинеопластические агенты, такие как доцетаксел, доксорубицин (адриамицин), цисплатин, блеомицина сульфат, кармустин, хлорамбуцил и циклофосфамидгидроксимочевину, которые, сами по себе, эффективны лишь в концентрациях, которые являются токсичными или субтоксичными для пациента. Цисплатин можно вводить внутривенно в количестве 100 мг/дозу один раз каждые четыре недели, и адриамицин вводится внутривенно в количестве от 60 до 75 мг/мл дозы один раз в каждые 21 сутки. Совместное введение человеческих антител против Notch1 по настоящему изобретению с химиотерапевтическими агентами дает два противораковых агента, которые действуют через разные механизмы, что дает цитотоксический эффект в отношении человеческих опухолевых клеток.
Наборы
В пределах объема настоящего изобретения также находятся наборы, содержащие композиции антитела по изобретению (например человеческие антитела, биспецифичные или мультиспецифичные молекулы, или иммуноконъюгаты) и инструкции для применения. Набор может кроме того содержать один или более чем один дополнительный реактив, такой как иммунодепрессантный реактив, цитотоксический агент или радиотоксический агент, или одно или более чем одно дополнительное антитело по изобретению (например человеческое антитело, имеющее дополняющую активность, которое связывается в антигене Notch1 с эпитопом, отличным от первого человеческого антитела).
Соответственно, пациентам, которых лечат композициями антитела по изобретению, можно дополнительно вводить (до, одновременно с или после введения человеческого антитела по изобретению) другой терапевтический агент, такой как цитотоксический или радиотоксический агент, который усиливает или увеличивает терапевтический эффект человеческих антител.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами, которые не следует истолковывать как дополнительно ограничивающие. Содержание всех графических материалов и всех ссылок, патентов и опубликованных патентных заявок, процитированных во всей данной заявке, прямо включено в нее посредством ссылки.
ПРИМЕРЫ
Пример 1
Получение рекомбинантных человеческих и мышиных иммуногенов - белка Notch1
А. Экспрессия и очистка человеческих и мышиных белков NRR Notch1
Конструкции кДНК, кодирующие область NRR Notch1, аминокислоты SEQ ID 2 для человеческого Notch1 и аминокислоты SEQ ID 6 для мышиного Notch1, показанные в Таблице 1, с сигнальным пептидом на N-конце и меткой Avi и His6 на C-конце, клонировали в экспрессионный вектор pSMED2. Данные конструкции временно трансфицировали в клетки COS или клетки яичника китайского хомяка (CHO), и секретированный белок в кондиционированных средах анализировали на SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия). После процессинга в сайте расщепления S1 N-концевая ~26 кДа (LNR-A, B; C и HD1) и C-концевая ~12 кДа (HD2 и метка Avi_His) части домена NRR Notch1 остаются ассоциированными посредством нековалентных взаимодействий с образованием гетерод и мерного комплекса, как показано на Фиг.1. Определяли, что процессинг по S1 NRR Notch1 составляет примерно 50% или менее в образцах, полученных из клеток CHO.
Для усиления процессинга в сайте расщепления S1 экспрессионную конструкцию NRR Notch1 трансфицировали в клетки CHO-PACE (Harrison et, al, Semin Hematol. 1998 Apr; 35 (2 Suppl 2):4-10), и отбирали стабильные линии клеток с наивысшей экспрессией и полным процессингом NRR Notch1. Культуру данных линий клеток увеличивали в объеме для сбора кондиционированных сред (CM), из которых очищали белки NRR Notch1.
Концентрированную СМ CHO-PFCE загружали на 27 мл колонку Qiagen Ni-NTA Superflow, которую уравновешивали PBS (фосфатно-солевой буферный раствор) при скорости тока 1 мл/мин при 4°C. После загрузки колонку промывали 10 объемами колонки (CV) PBS, с последующими 10 CV буфера А (300 мМ NaCl, 50 мМ Na2HPO4, pH 8,0) и с последующими 10 CV 4% буфера Б (500 мМ имидазол, 300 мМ NaCl, 50 мМ Na2HPO4, pH 8,0). Человеческий Notch1 Avi_His элюировали с использованием линейного градиента до 100% буфера Б за 10 CV. Фракции, содержащие человеческий Notch1 Avi_His объединяли, фильтровали и диализировали до состояния, когда они не содержали кальция и магния PBS (CMF). Белок дополнительно очищали двумя циклами гель-фильтрации на тандемных колонках Superdex-200 и Superdex-75 (общий CV равен 600 мл), уравновешенных с TBS (физиологический раствор, буферизированный TRIS) плюс 1 мМ CaCl2, 0,1 мМ ZnCl2. Анализ SDS-PAGE очищенных человеческого и мышиного белков NRR_Avi_His метка Notch1 показывает, что более 90% очищенного белка было правильно расщеплено на N-концевой и C-концевой пептиды NRR Notch1 предсказываемых размеров. Анализ по рассеянию света (SEC-MALS) очищенного человеческого и мышиного белков NRR Notch1 показал на гель-фильтрационной колонке при нативных условиях пик с ожидаемой молекулярной массой 40 кДа, указывающий на правильное образование интактного гетеродимера NRR Notch1.
Б. Экспрессия и очистка слитого белка NRR Notch1 макака-Fc
Конструкцию кДНК, кодирующую область NRR Notch1 макака, аминокислоты SEQ ID 10 для Notch1 макака показаны в Таблице 1, с сигнальным пептидом на N-конце и фрагментом Fc человеческого IgG1 на C-конце, клонировали в экспрессионный вектор pSMED2. Данную конструкцию временно сотрансфицировали в клетки 293 (Invitrogen) с растворимой конструкцией, сверхэкспрессируемой в PACE (Harrison et, al, Semin Hematol. 1998 Apr; 35 (2 Suppl 2):4-10) для обеспечения полного процессинга области NRR Notch1 макака. От трансфицированных клеток отбирали кондиционированную среду, и слитый белок NRR Notch1 макака-Fc очищали посредством аффинной очистки на белке A. Очищенный белок затем диализировали в TBS, содержащий 1 мМ CaCl2. Анализ SDS-PAGE показал два полипептидных фрагмента с ожидаемыми размерами 12 кДа (HD1) и 37 кДа (HD2+Fc), с 95%-ной чистотой белкового препарата. Аналитическая SEC (гель-фильтрация) при нативных условиях показала одиночный пик с молекулярной массой примерно 50 кДа, представляющий собой гетеродимер из двух описанных выше фрагментов с минимальным количеством агрегатов (меньше 1%) в препарате.
В Таблице 1 ниже приведены аминокислотные и нуклеотидные последовательности областей NRR человеческого, мышиного Notch1 и Notch1 макака.
|
|
|
|
|
|
|
Пример 2
Получение, клонирование и гуманизация крысиных ингибирующих антител против Notch1
А. Иммунизация и получение гибридомы
Человеческие и мышиные иммуногены, описанные в Примере 1, совместно инъецировали крысам Спраг-Доули для получения гибридом. Крыс Спраг-Доули иммунизировали подкожными инъекциями смеси, содержащей по 20 мкг каждого из человеческого и мышиного рекомбинантного белка NRR_Avi_His Notch1 в полном адъюванте Фрейнда. Иммунизации повторяли с 2-недельными интервалами в течение 12 недель. Образцы сыворотки, отобранные на сутки 0, 35, 49 и 63 после 1-ой инъекции, тестировали на активность как титр циркулирующего антитела против Notch1 посредством твердофазного иммуноферментного анализа (ELISA), как описано ниже.
При достижении оптимальных титров, крысе, имеющей оптимальный, титр антитела, за 4 суток до того, как она должна быть умерщвлена для отбора, спленоцитов, внутривенно (хвостовая вена) инъецировали конечную дозу белковой смеси. Общие спленоциты (2×10E08) от крысы сливали с мышиной миеломной линией клеток P3X63.Ag8.653 (2,5×10E07) с использованием ПЭГ (полиэтиленгликоль) 4000. Слитые клетки высаживали на 96-луночные планшеты (0,2 мл/лунку) и подвергали селекции с HAT (гипоксантин-аминоптерин-тимидин) (RPMI 1640, содержащая 5×10E-04 M гипоксантина, 1,6×10E-05 M тимидина, 4×10E-04 M аминоптерина и 20% FCS (фетальная телячья сыворотка), инактивированной нагреванием).
Через четырнадцать суток после слияния супернатанты гибридом отбирали и тестировали на присутствие крысиных IgG, которые демонстрируют активность связывания с человеческим и/или мышиным рекомбинантным белком NRR Notch1 и полноразмерным Notch1, экспрессируемым на поверхности клеток U-2 OS, посредством ELISA, как описано ниже. Супернатанты, которые демонстрировали активность связывания с мишенями Notch1, далее тестировали на их способность блокировать активность сигнализации, опосредованной Notch1, в анализе с геном-репортером, как описано ниже. Отобранные клоны, блокирующие Notch1 сигнализацию, затем субклонировали для дальнейшего анализа.
Б. Скрининг и отбор антител, специфичных в отношении Notch1
1. ELISA связывания рекомбинантного белка
Супернатанты из культур гибридом сначала подвергали скринингу на связывание с рекомбинантными человеческим и мышиным иммуногенами посредством ELISA. Очищенными человеческим или мышиным белками NRR_Avi_His метка Notch1 покрывали 96-луночные планшеты ELISA hi-bound от CoStar в 100 мкл PBS с Mg/Ca в концентрации 1 мкг/мл в течение ночи. Планшеты промывали PBS-Mg/Ca и блокировали в течение 1 часа 1% BSA (бычий сывороточный альбумин) в PBS-Mg/Ca. Блокирующий раствор декантировали с планшета, и наносили на планшет супернатанты культуры гибридомы. После инкубации при комнатной температуре в течение 1 часа, планшеты вновь промывали PBS-Mg/Ca перед нанесением вторичного антитела, конъюгированного с HRP (пероксидаза хрена), разведенного (1:20000) в блокирующем буфере. Когда тестируемым первичным антителом был крысиный IgG, вторичное антитело представляло собой антитело козы против Fc IgG крысы (Bethyl Biotech); и когда первичным антителом был мышиный IgG, вторичное антитело представляло собой антитело козы против Fc IgG мыши (Thermal Scientific).
Через 1 час инкубации с вторичным антителом, планшеты вновь промывали, как описано выше, и добавляли раствор субстрата ТМВ (тетраметилбензидин). Давали реакции развиваться в течение 10 минут перед добавлением останавливающего раствора, 0,18 М H2SO4. Измеряли поглощение (О.П. - оптическая плотность) при 450 нм, и данные откладывали на графике и анализировали посредством программ Microsoft Excel и Graphpad-Prizm. Антитела, демонстрирующие активность связывания с NRR человеческого и/или мышиного Notch1, отбирали для дальнейшего ELISA на основе клеток, как описано ниже.
2. ELISA на основе клеток
Супернатанты от клонов, демонстрирующих позитивное связывание с иммуногенами в ELISA на основе рекомбинантного NRR Notch1, описанные выше, затем подвергали скринингу на связывание с Notch1 поверхности клетки в ELISA на основе клеток. Клетки U-2 OS, стабильно сверхэкспрессирующие полноразмерный человеческий или мышиный белок Notch1 на поверхности клетки, переносили в 96-луночные планшеты (белые непрозрачные, BD/VWR) в количестве 50000 клеток на лунку за сутки до анализа ELISA. На сутки ELISA культуральные среды удаляли из лунок, и на планшет наносили последовательно разведенные (1:3 в блокирующем буфере) растворы антител или супернатанты культуры гибридомы. Планшеты инкубировали при комнатной температруре в течение 2 часов перед промывкой PBS-Mg/Ca. Затем наносили вторичное антитело, конъюгированное с HRP, и инкубировали с клетками в течение 1 часа, как описано выше для ELISA рекомбинантного белка. Планшеты промывали PBS-Mg/Ca перед проявкой набором для проявки Pico-Chemiluminescent (Thermal Scientific), и измерения хемилюминисценции проводили согласно инструкциям изготовителя. Построение данных на графике и анализы проводили посредством программ Microsoft Excel и Graphpad-Prizm. Эти данные использовали в скрининге, клонов гибридом и, характеризации родительских крысиных и гуманизированных антител, как описано в Примерах, приведенных ниже.
3. Анализы с геном-репортером
Супернатанты от клонов, демонстрирующих позитивное связывание с иммуногенами, затем подвергали скринингу на нейтрализующую активность в анализах на основе совместного культивирования с генами-репортерами (RGA) человеческого и мышиного Notch1. Результаты скрининга использовали для отбора первичных клонов.
Репортерные клетки с человеческим Notch1 трипсинизировали и отбирали из культурального планшета в полные среды МакКоя 5A (среда МакКоя 5A с 10% FBS и пенициллином, стрептомицином, Invitrogen) и подсчитывали. Делали подходящие разведения клеток такой же средой для получения 3000 клеток/лунку в общем объеме 80 мкл/лунку на 96-луночном культуральном планшете (белый непрозрачный, BD/VWR) в присутствии последовательно разведенных (1:3 в полных средах МакКоя 5А) растворов антител или супернатантов культуры гидридом. Смесь клеток и разведений антитела инкубировали на планшетах в инкубаторе для культуры клеток (37°C, 5% CO2) в течение 1 ч перед добавлением в каждую лунку 15000/лунку человеческих клеток DLL4-HEK293. После добавления клеток hDLL4-HEK293 планшеты дополнительно инкубировали в течение 20 ч в инкубаторе, и для измерения активности люциферазы светляка и люциферазы Renilla внутреннего контроля использовали систему анализа Dual-Glo Luciferase (Promega) согласно инструкциям изготовителя. Данные откладывали на графике и анализировали с использованием программы Microsoft Excel и Graphpad-Prism. Анализ на основе совместной культуры с геном-репортером мышиного Notch1 проводили, как описано для анализа на основе совместной культуры гена-репортера человеческого Notch1, за исключением того, что совместно культивировали 20000 клеток/лунку репортерных клеток мышиного Notch1 с 40000 клеток/лунку мышиных клеток DLL4-HEK293.
В. Клонирование и секвенирование
Первичные клоны с подтвержденным связыванием с поверхностью клетки или нейтрализующими активностями, такие как клоны 438 и 351, дополнительно описанные ниже, субклонировали. Из субклонов экстрагировали РНК, и получали последовательности ДНК вариабельной области из экспрессируемых антител посредством клонирования ПЦР-ОТ (полимеразная цепная реакция с обратной транскриптазой), как описано ниже.
От одного до пяти миллионов субклонированных гибридомных клеток гомогенизировали для выделения общей РНК посредством набора QIAGEN RNAeasy Mini. Затем получали кДНК первой нити с использованием набора SuperScript III RT (Invitrogen). Затем получали двухцепоченые кДНК вариабельных областей IgG против Notch1 и амплифицировали посредством ПЦР с использованием праймеров из константных областей тяжелой цепи крысиного IgG (IgG1, 2a, 2b) и легкой цепи (каппа или лямбда), как описано ниже. Условия циклов ПЦР: 1 цикл при 95°C в течение 1 мин; 25 циклов при 95°C в течение 1 мин; 63°C в течение 1 мин и 72°C в течение 1 мин. Полученные в результате продукты ПЦР-ОТ клонировали в клонирующий вектор TOPO-Blunt (Invitrogen) и секвенировали традиционными способами.
кДНК вариабельной (V) области из родительского крысиного 438 и родительского крысиного 351 антител (далее «крысиное 438» и «крысиное 351» соответственно) субклонировали в экспрессионные векторы млекопитающих, где крысиную вариабельную тяжелую цепь (VH) сливали в рамке считывания с мышиным IgG1 (mIgG1), и крысиную вариабельную легкую цепь (VL) сливали с мышиной каппа. Аналогичным образом, для получения химерных антител с крысиной V областью и человеческой константной областью IgG, крысиный VH сливали в рамке считывания с человеческим IgG1 (hIgG1), и VL - с человеческой каппа соответственно. Соответствующие химерные антитела получали из данных конструкций посредством временной трансфекции в клетках COS, и их связывание и нейтрализующие активности подтверждали в анализах.
Очищенные химерные антитела с крысиной вариабельной-мышиной константной областью (далее «крысиное 438-mIgG1» и «крысиное 351-mIgG1») далее характеризовали в ряду анализов in vitro и in vivo, включая связывание с рекомбинантным антигеном и мишенью на поверхности клетки, ингибирование активности Notch1 в анализах RGA и ангиогенеза и ингибирование роста опухоли в мышиных моделях, как описано в Примерах, приведенных ниже. Лидирующие антитела, крысиное 438 и крысиное 351 были отобраны на основе данных исследований. В Таблице 2 перечислены аминокислотные последовательности, и последовательности; нуклеиновых кислот разных областей вариабельных областей крысиного 438 и крысиного 351 и дополнительных клонов 90, 132, 132 (A12/G11) и 137.
|
|
|
|
|
|
|
|
Г. Гуманизация крысиного 438 и крысиного 351 fynbntkf
Крысиное 438 и крысиное 351 гуманизировали и далее совершенствовали для получения гуманизированных моноклональных антител 438 и 351 (далее «гуманизированное 438» и «гуманизированное 351» соответственно). В качестве константной области для антител: гуманизированного 438 и гуманизированного 351 использовали константную область тяжелой цепи человеческого IgG1 с 3 мутациями в нижней шарнирной области (L234A/L235A/G237A), которые инактивируют эффекторные функции hIgG1, и константную область человеческой легкой цепи каппа. Гуманизацию вариабельных областей крысиного 438 и крысиного 351 проводили с использованием стратегии пересадки CDR.
В Таблице 3 приведены аминокислотные последовательности и последовательности нуклеиновых кислот разных областей вариантов гуманизированного 438 и гуманизированного 351. После тестирования было определено, что лидирующим гуманизированным вариантом 438 является VH1.1/VL1.8. Гуманизированное 438 VH1.1/VL1.8 имеет вариабельную тяжелую цепь, как изложено в SEQ ID NO: 71, и вариабельную легкую цепь, как изложено в SEQ ID NO: 97. Для гуманизированных вариантов 438 области CDR для вариантов VH 1.0 и 1.1 являются одинаковыми, и области CDR для вариантов VL 1.0, 1.1, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 1.10 и 1.11 являются одинаковыми. После тестирования было определено, что лидирующим гуманизированным вариантом 351 является VH1.0/VL1.1. Гуманизированное 351 VH1.0/VL1.1 имеет вариабельную тяжелую цепь, как изложено в SEQ ID NO: 115, и вариабельную легкую цепь, как изложено в SEQ ID NO: 129. Для гуманизированных вариантов 351 области CDR для вариантов VL 1.0, 1.1, 1.3, 1.4, 1.5, 1.6 и 1.7 являются одинаковыми.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кДНК, содержащие человеческий акцепторный каркас, DP54 для тяжелой цепи и DPK9 для легкой цепи, с релевантными последовательностями донорных CDR, синтезировали посредством GeneArt, AG. Синтезированные кДНК продукты субклонировали и сливали в рамке считывания с константной областью человеческого IgG1-3m для тяжелой цепи или человеческой каппа для легкой цепи в экспрессионных векторах млекопитающих, pSMED2 и pSMN2 соответственно. Выравнивание VH и VL человеческого акцепторного каркаса, крысиного 438 и гуманизированных вариантов 438, наряду с крысиным 351 и гуманизированными вариантами 351 показано в Таблице 4 ниже. CDR по схеме Kabat подчеркнуты. Для VH 351 и VL 351 текст строчными буквами в каркасной области указывает различие в остатках между крысиным 351 и гуманизированными вариантами 351.
Существует значительная гомология между человеческим акцепторным каркасом и каркасом вариабельной области крысиного 438 - 78% для VH и 61% для VL. Также существует значительная гомология между человеческим акцепторным каркасом и вариабельными областями крысиного 351 - 76% для VH и 61% для VL.
|
|
Во время гуманизации пересадка CDR на антитела может приводить к потере активности исходного антитела. Различия в каркасной области могут объяснять измененную конформацию полученных в результате гуманизированных антител 438 и гуманизированных антител 351, и для восстановления активности и эпитопа связывания в человеческий акцепторный каркас вводили избранные обратные мутации для соответствия с исходным антителом. В Таблице 5 показаны выбранные обратные мутации в человеческом акцепторном каркасе для остатков крысиного 438 и крысиного 351 в соответствующих положениях для оптимизации активности и эпитопа связывания.
|
|
Пример 3
Характеристики ингибирующих антител против Notch1
А. Экспрессия и связывание с Notch1
Относительные выходы экспрессии гуманизированных вариантов 438 и гуманизированных вариантов 351 тестировали в анализе временной экспрессии в клетках COS. Как показано в Таблице 6, целый ряд гуманизированных вариантов 438, включая гуманизированное 438 VH1.1/VL1.8, и целый ряд гуманизированных вариантов 351, включая гуманизированное 351 VH1.07VL1.1, демонстрировали значительные выходы.
|
Общие уровни экспрессии IgG в кондиционированных средах измеряли посредством количественного ELISA (твердофазный иммуноферментный анализ) IgG, как описано в Примере 2. В Таблице 7 показаны значения EC50 (нМ), рассчитанные из ELISA на связывание с Notch1 поверхности клетки для гуманизированных вариантов 438 и крысиного 438, наряду с гуманизированными вариантами 351 и крысиным 351.
Данные демонстрируют то, что многочисленные варианты гуманизированного 438, включая гуманизированное 438 VH1.1/VL1.8, являются сходными с крысиным 438 в связывании с полноразмерным человеческим Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS. Кроме того, в Таблице 7 показано, что как гуманизированное 438 VH1.1/VL1.8, так и VH1.1/VL1.3, полностью сохраняли перекрестную реактивность крысиного 438 с мышиным Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS.
Данные дополнительно демонстрируют то, что гуманизированные 351 VH1.07VL1.1 и VH1.1/VL1.4 являются сходными с крысиным 351 в связывании с полноразмерным человеческим Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS. В Таблице 7 кроме того показано, что гуманизированные 351 VH1.07VL1.1 и VH1.1/VL1.4 полностью сохраняли перекрестную реактивность крысиного 351 с мышиным Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS.
|
|
Б. Конкурентный ELISA
Проводили конкурентный ELISA между гуманизированными вариантами 438 и биотинилированным крысиным 438, наряду с гуманизированными вариантами 351 и биотинилированным крысиным 351, на рекомбинантных или экспрессируемых на клеточной поверхности полноразмерных человеческих Notch1. Аналогично тому, как описано для рекомбинантного белка или ELISA на основе клеток, 96-луночные планшеты для культуры клеток либо покрывали белком NRR-Avi_His Notch1 (планшеты Hi-bound Costar), либо в них высевали клетки U-2 OS, экспрессирующие полноразмерный Notch1 (планшет для культуры клеток, Costar), соответственно. На планшет наносили последовательно разведенные (1:3 в блокирующем буфере) растворы антител или кондиционированные среды культуры клеток в присутствии 0,8 нМ биотинилированного крысиного антитела 438 или биотинилированного крысиного антитела 351.
После инкубации в течение 2 часов планшеты промывали, как описано выше, и наносили стрептавидин, конъюгированный с HRP (Southern Biotech), разведенный 1:5000 в блокирующем буфере. Давали инкубироваться со стрептавидином в течение 30 мин до того, как планшеты вновь промывали и проявляли с раствором ТМВ в течение 10 минут. Развивающуюся реакцию тормозили добавлением 0,18 М H2SO4, и измеряли поглощение при 450 нМ. Построение данных на графике и анализы проводили с использованием программ Microsoft Excel и Graphpad-Prizm.
В Таблице 8 показаны значения EC50 (нМ) конкуретного ELISA гуманизированных вариантов 438 с биотинилированным крысиным антителом 438 за связывание с иммуногеном - NRR рекомбинантного человеческого Notch1. Данные показывают, что многочисленные гуманизированные варианты 438, включая гуманизированное 438 VH1.1/VL1.8, имели значения EC50, аналогичные немеченому крысиному 438 в конкурентном ELISA. Это демонстрирует то, что гуманизированные варианты 438, а также немеченое крысиное 438 конкурируют с биотинилированным крысиным 438 за связывание с иммуногеном - NRR Notch1. Данные результаты показывают, что гуманизированные варианты 438 связываются с тем - же самым или с аналогичным эпитопом на иммуногене, что и крысиное антитело 438.
В Таблице 8 дополнительно показаны значения EC50 (нМ) конкурентного ELISA гуманизированных вариантов 438 с биотинилированным крысиным антителом 438 за связывание с полноразмерным человеческим Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS. Данные показывают, что многочисленные гуманизированные варианты 438, включая гуманизированное 438 VH1.1/VL1.8, имели значения EC50, аналогичные немеченому крысиному 438 в конкурентном ELISA. Это демонстрирует то, что гуманизированные варианты 438, а также немеченое крысиное 438, конкурируют с биотинилированным крысиным 438 за связывание с полноразмерным человеческим Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS. Данные результаты показывают, что гуманизированные варианты 438 связываются с тем же самым или с аналогичным эпитопом на полноразмерном человеческом Notch1, экспрессируемом на клеточной поверхности клеток U-2 OS, что и крысиное антитело 438.
|
В Таблице 9 показаны значения EC50 (нМ) конкурентного ELISA гуманизированных вариантов 351 и биотинилированного крысиного антитела 351 за связывание с полноразмерным человеческим Notch1, экспрессируемым на клеточной поверхности клеток U-2 OS. Данные показывают, что многочисленные варианты гуманизированного 351, включая гуманизированное 351 VH1.0/VL1.1, имели значения EC50, аналогичные немеченому, крысиному, 351 в конкурентном ELISA. Это демонстрирует то, что гуманизированные варианты 351, а также немеченое крысиное 351, конкурируют с биотинилированным крысиным 351 за связывание с полноразмерным человеческим Notch1, зкспрессируемым на клеточной поверхности. Данные результаты показывают, что гуманизированные варианты 351 связываются с тем же самым или аналогичным эпитопом на полноразмерном человеческом Notch1, экспрессируемом на клеточной поверхности клеток U-2 OS, что и крысиное антитело 351.
|
В. Специфичность связывания с другими гомологами человеческого Notch
Другие члены семейства рецепторов Notch играют важные роли в биологических процессах. Например, недостаточность Notch2 приводит к смерти на эмбриональной стадии в мышиных моделях. Напротив, недостаточность Notch3 приводит лишь к умеренному фенотипу в дистальных артериях, и недостаточность Notch4 не приводит к детектируемому фенотипу в мышиных моделях. Ближайшими гомологами области NRR Notch1 являются Notch2 и Notch3 (~50% гомологии), и Notch4 является более отдаленным гомологом (34% гомологии). Перекрестная реактивность антител против Notch1 с другими членами семейства Notch, особенно с Notch2, может приводить к нежелательным эффектам у пациентов. Следовательно, оценивали потенциальную перекрестную реактивность антител: крысиного 438 и гуманизированного 438, наряду с крысиным 351 и гуманизированным 351 с другими членами семейства Notch.
Экспрессионные конструкции, кодирующие области NRR человеческого Notch2 и Notch3, слитые с фрагментом Fc человеческого IgG1, стабильно вводили в клетки CHO-PACE. Собирали кондиционированные среды от данных клеток, экспрессирующих слияния NRR-Fc. NRR человеческого Notch2-Fc и NRR человеческого и мышиного Notch3-Fc очищали аффинной хроматографией на белке A с последующей гель-фильтрацией (SEC). Очищенные препараты диализировали в TBS с 1 мМ CaCl2, и они были проанализированы аналитической SEC, как имеющие чистоту более 99%.
Как показано в Таблице 10, крысиное 438 не имело детектируемого связывания со слитым белком NRR человеческого Notch2-Fc. Кроме того, в Таблице 10 показано, что гуманизированные варианты 438 не имели детектируемого связывания с полноразмерным человеческим Notch3, экспрессируемым на клеточной поверхности U-2 OS, демонстрируя то, что 438 не имело перекрестной реактивности с Notch3.
|
Как показано в Таблице 11, гуманизированное 351 VH1.0/VL1.1 не имело детектируемого связывания со слитым белком NRR человеческого Notch2-Fc и с обоими из слитых белков: NRR человеческого и мышиного Notch3-Fc. Однако гуманизированное 351 VH1.0/VL1.1 перекрестно реагировало с NRR человеческого, мышиного Notch1 и NRR Notch1 макака.
|
Г. Аффинность связывания с NRR человеческого Notch1
Кинетические константы взаимодействий антител против NRR Notch1 определяли посредством поверхностного плазмонного резонанса (Biacore® Т100, Biacore Inc., Piscataway, NJ). В проточных ячейках чипа СМ5 иммобилизировали приблизительно 10000 резонансных единиц (RU) антитела против человеческого IgG-Fc (Biacore®) в 10 мМ глицине, pH 5,0 при 10 мкл/мин в течение 600 секунд. 10 мкг/мл гуманизированных вариантов 438 против Notch1 и гуманизированных вариантов 351, разведенных в TBS с 1 мМ CaCl2, захватывали при скорости тока 10 мкл/мин. Ассоциацию четырех концентраций рекомбинантного белка NRR_Avi_His человеческого Notch1 (от 3,7 до 100 нМ) и нулевой концентрации (проточный буфер) при 100 мкл/мин записывали в течение 3 минут в TBS с 1 мМ CaCl2. Диссоциацию комплексов измеряли в течение 10 минут. Поверхность чипа регенерировали инъецированием 3 М MgCl2 с 3 мМ EGTA (этиленгликольтетрауксусная кислота) в течение 60 секунд при 10 мкл/мин. Кривые, полученные после вычитания сигналов контроля и буфера, аппроксимировали к модели связывания Лангмюра 1:1 посредством программы для оценки Biacore® Т100 (Biacore®).
Определяли аффинность связывания выбранных гуманизированных вариантов 438, гуманизированных вариантов 351 и антитела А2 (Wu, Y. et al., Nature 464:1052-1057, 2010) с человеческим белком NRR Notch1, и она показана в Таблице 12. Кинетический анализ посредством Biacore показал аналогичные скорости ka (ассоциации) и kd (диссоциации) для выбранных гуманизированных вариантов 438, включая VH1.1/VL1.8 и VH1.1/VL1.3, по сравнению с антителом A2.
Кинетический анализ посредством Biacore дополнительно показал более высокие скорости ka (ассоциации) и kd (диссоциации) для крысиного 351 и выбранных гуманизированных вариантов 351, включая VH1.0/VL1.1 и VH1.1/VL1.4, по сравнению с антителом A2. Несмотря на то, что полученные в результате значения KD для крысиного 351 и выбранных гуманизированных вариантов 351 были аналогичными, продемонстрированные различия в скоростях ka (ассоциации) и kd (диссоциации) могут играть роль в отличных нейтрализующих активностях против сигнализации, зависимой от Notch1, описанных в Примерах, приведенных ниже.
|
Г. Тепловая стабильность
Тепловая стабильность белка или домена белка положительно коррелирует со стабильностью белка или домена белка. Более высокая точка плавления белка или домена белка часто обеспечивает улучшенную технологичность и более длительный срок хранения. Дифференциальную. сканирующую калориметрию (ДСК) использовали для оценки тепловой стабильности гуманизированных вариантов 438 и крысиного 438-mIgG1. Образцы белка разводили в PBS до 0,3 мг/мл в объеме 250 мкл. В качестве контрольного образца использовали соответствующий пустой буфер для приготовления препарата. Оба образца тщательно дегазировали с использованием MicroCal ThermoVac Sample Degassing and Thermostat (Microcal, Inc., Northampton, MA), с установкой 8°C. Образцы дозировали в подходящие ячейки MicroCal VP-DSC Capillary Cell MicroCalorimeter (MicroCal, Inc., Northampton, MA). Образцы уравновешивали в течение 4 минут при 15°C и затем сканировали вплоть до 100°C при скорости 100°C в час. Выбирали период фильтрования 20 секунд. Необработанные данные корректировали на исходный уровень, и концентрацию белка нормировали. Программу Origin (OriginLab Corporation, Northampton, MA) использовали для аппоксимации данных к модели MN2-State с подходящим числом переходов.
Как показано в Таблице 13 ниже, все гуманизированные варианты 438 имели более высокую термостабильность, продемонстрированную по более высокой точке плавления, в их области Fab (для всех выше 77°C) по сравнению с крысиным 438-mIgG1.
|
Пример 4
Идентификация на NRR Notch1 эпитопов связывания ингибирующих антител против Notch1
А. Химерные конструкции с заменой доменов
Как описано в Примере 3, гуманизированные варианты 438 и гуманизированные варианты 351 не имели перекрестной реактивности с белком Notch3. Для картирования эпитопов антител против Notch1: крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 были получены химерные конструкции с заменой доменов для NRR Notch1 и Notch3. Экспрессионные конструкции, кодирующие химеру области NRR человеческого Notch3-Notch1 (здесь именуемую Notch3-1) с C-концевым слиянием с Fc (фрагмент Fc человеческого IgG1), индивидуально трансфицировали в CHO-PACE, и получали стабильные пулы, экспрессирующие каждую химеру. Для очистки химерного слитого белка кондиционированные среды от каждого стабильного пула наносили на колонку аффинной хроматографии с белком A, с последующей гель-фильтрацией (SEC). Очищенные препараты затем диализировали в TBS с 1 мМ CaCl2 и анализировали на аналитической SEC. На Фиг.2 показаны химерные конструкции с заменой доменов рекомбинантных человеческих NRR Notch1 и NRR Notch3 для картирования эпитопов крысиного 351-mIgG1, крысиного 438-mIgG1 и A2. Как показано на Фиг.2, рекомбинантные химерные белки NRR состоят из разных доменов Notch3 (показаны серым) и Notch1 (показаны черным), слитых с человеческим Fc (не показан).
Относительные эффективности связывания крысиного 438-mIgG1 и крысиного 351-mIgG1 с химерами с заменой доменов NRR Notch3-1 тестировали посредством технологии Biacore® SPR (поверхностный плазмонный резонанс), и определяли эффективность связывания тестируемого антитела в относительных резонансных единицах (RU). Связывание крысиного 438-mIgG1 и крысиного 351-mIgG1 с химерами NRR Notch3-1 определяли поверхностным плазмонным резонансом (Biacore® 3000, BIAcore Inc., Piscataway, NJ). В проточных ячейках чипа CM5 иммобилизировали приблизительно 10000 RU каждого из антитела (козы) против мышиного IgG и IgG козы в качестве контроля в 10 мМ глицине, pH 5,0 при 10 мкл/мин в течение 600 секунд. Крысиное 438-mIgG1 и крысиное 351-mIgG1 антитела, разведенные до 1 мкг/мл в HBS-P с 0,1 мМ CaCl2, захватывали при 10 мкл/мин в течение 300 секунд. Приблизительный захват для каждого антитела составлял 150 RU (ответ 1). Затем на захваченные крысиное 438-mIgG1 и крысиное 351-mIgG1 антитела инъецировали 10 мкг/мл химер NRR Notch 3-1 при 10 мкл/мл в течение 300 секунд в том же самом буфере, и измеряли захваченное NRR Notch 3-1 (ответ 2). Диссоциация комплексов после каждого цикла достигалась с использованием 10 мМ Ac, pH 1,5 при 30 мкл/мин в течение 20 секунд.
Как показано на Фиг.2, профиль связывания эпитопов крысиного 438-mIgG1 и крысиного 351-mIgG1 с доменами NRR Notch1 является отличным от профиля связывания A2 с доменами NRR Notch1. Более конкретно, связывание A2 с NRR является более зависимым от домена LNR-B, чем связывание крысиного 438-mIgG1. Кроме того, связывание крысиного 351-mIgG1 с NRR Notch1 является менее зависимым от доменов LNR-A и LNR-B по сравнению с A2. Различия в профилях связывания с доменами, в сочетании с более подробной информацией по различиям в контактных остатках в NRR Notch1 и отличной ориентации NRR Notch1 в ассоциации в крысиным 438-mIgG1 и A2, выявленной по структурам сокристаллов, описанных ниже, демонстрирует то, что крысиное 438-mIgG1 взаимодействует с NRR Notch1 другим способом, чем A2.
Б. Рентгеновский кристаллографический анализ
Крысиное 438 и крысиное 351 экспрессировали и очищали, как описано выше в Примере 2. Fab (антигенсвязывающий фрагмент) получали из крысиного 438 и крысиного 351 с использованием набора для получения Fab от Pierce (иммобилизированный папаин), № продукта 44685. Крысиное 438 и крысиное 351 инкубировали с иммобилизированным папаином в течение 24 часов при 37°. Fab очищали обессоливанием с использованием колонки Zeba (Pierce), уравновешенной с 50 мМ Tris, pH 8.0. Fab собирали в проточной фракции из колонки Q FF, уравновешенной с 50 мМ Tris, pH 8.0.
Полученный в результате фрагмент Fab смешивали с человеческим белком NRR Notch1 в молярном соотношении 1:1,2 с добавлением 0,9 мМ CaCl2 и инкубировали на льду в течение 30 минут до очистки на гель-фильтрационной колонке S200, уравновешенной с 25 мМ Tris, pH 8.0, 150 мМ NaCl и 0,9 мМ CaCl2. Фракции из преобладающего пика, содержащего комплекс Fab:NRR, объединяли и концентрировали до 11 мг/мл с использованием концентратора Vivaspin HY (Sartorius) с порогом отсечения 10 кДа. Комплекс Fab:NRR кристаллизовали с использованием способа висячей капли посредством диффузии в парах.
Для крысиного 438 для получения кристаллов требовался ограниченный протеолиз комплекса с использованием химотрипсина. Комплекс сперва смешивали с химотрипсином до конечной концентрации 2 мкг/мл и затем объединяли с равным объемом раствора лунки, состоящего из 100 мМ какодилата натрия, pH 5,5,14-20% ПЭГ 8000 (полиэтиленгликоль 8000), 100-200 мМ ацетата кальция. Кристаллы появлялись в пределах недели и продолжали расти в течение 3 недель. Для крысиного 351 комплекс объединяли с равным объемом раствора лунки, состоящего из 20% ПЭГ 3350, 200 мМ сульфата натрия. Кристаллы появлялись через одну неделю и продолжали расти в течение 3 недель.
Кристаллы криозащищали посредством вихревого движения через раствор лунки с добавлением 25% глицерина. Рентгеновские данные получали на SER-CAT пучке излучения 22 ВМ для крысиного 438 и 22ID для крысиного 351 на Advanced Photon Source и перерабатывали до разрешения 2,6 Ангстрем с использованием программного пакета HKL-2000 (HKL Software). Структуру определяли посредством молекулярного замещения с использованием программного обеспечения Phaser. Модели поиска брали из pdb id 3L95 для NRR Notch1, 2HRP для тяжелой цепи и 1×gp для легкой цепи крысиного 438, и 1 BM3 для тяжелой цепи и 3L95 для легкой цепи крысиного 351. Полученную в результате модель вновь строили и уточняли с использованием программ Coot и BUSTER (Global Phasing, Ltd.), включая мягкие ограничения NCS (некристаллографическая симметрия). Структуру подтверждали с использованием программы MolProbity. Остатки, участвующие во взаимодействиях, определяли с использованием программ Pymol и PISA.
Структурный вид эпитопа крысиного 438 на NRR человеческого Notch1 показан на Фиг.3, эпитоп крысиного 351 на NRR человеческого Notch1 показан на Фиг.4. Аналогичный рентгеновский кристаллографический анализ осуществляли с использованием опубликованных данных для антитела A2, и на Фиг.5 показан структурный вид эпитопа A2 на NRR человеческого Notch1. Для Фиг.3-5 аминокислотные остатки в пределах 3,8 Ангстрем антитела показаны черным цветом. В Таблице 14 ниже приведены остатки, участвующие во взаимодействиях антитела с NRR Notch1 для крысиного 438, крысиного 351 и А2.
Данные показывают, что крысиное 438 и А2 связываются с перекрывающимися, но отличными поверхностями в пределах NRR Notch1 Оба эпитопа включают центральный домен HD. Крысиное 438 и А2 взаимодействуют с LNR-A, однако, крысиное 438 взаимодействует с большей поверхностью. Только крысиное 438 взаимодействует с областью петли S1, и только А2 взаимодействует с LNR-B. Более конкретно, данные показывают, что крысиное 438 связывается с остатками Asn 1461, Lys 1462, Val 1463, Cys 1464, Leu 1466, Leu 1580, Tyr 1621, Gly 1622, Met 1670, Asp 1671, Val 1672, Arg 1673, Leu 1707, Ala 1708, Leu 1710, Gly 1711, Ser 1712, Leu 1713, Pro 1716 и Lys 1718 NRR человеческого Notch1
Данные также показывают, что крысиное 351 и А2 связываются с перекрывающимися, но отличными поверхностями в пределах NRR Notch1 В частности, только крысиное 351 взаимодействует с областью петли S1, и только А2 взаимодействует с LNR-B. И крысиное 351, и А2 заимодействуют с LNR-A, однако, крысиное 351 взаимодействует с отличным поднабором аминокислот LNR-A. Более конкретно, данные показывают, что крысиное 351 связывается с остатками Asp 1458, Asn 1461, Val 1463, Cys 1464, Leu 1466, Leu 1580, Met 1581, Pro 1582, Tyr 1621, Gly 1622, Arg 1623, Asp 1671, Val 1672, Arg 1673, Gly 1674, Leu 1710, Gly 1711, Ser 1712, Leu 1713, Asn 1714, lie 1715, Pro 1716, Lys 1718 NRR человеческого Notch1
Рентгеновская кристаллическая структура отатков крысиного 438 и крысиного 351, связывающихся с NRR Notch1, была дополнительно проанализирована с использованием программы PISA. Данные показывают, что крысиное 438 формировало сильные электростатические взаимодействия (солевые мостики) с остатками Lys1718 и Arg1673. Остатками NRR Notch1, которые образовали водородные связи с крысиным антителом 438, были Asn1461, Asp1671, Arg1673, Leu1713, Lys1718, Cys1464, Ala1708 и Ser1712. Остатками NRR Notch1, которые вносили вклад в более чем 40 Ангстрем2 площади скрытой поверхности при образовании комплекса с крысиным антителом 438, были Arg1673, Val1463, Lys1462, Gly1622, Asp1671 при взаимодействии с тяжелой цепью и Leu1466, Lys1718, Gly1711, Cys1464, Pro1716 и Val1463 при взаимодействии с легкой цепью. Из идентифицированных остатков крысиное 438 связывается с NRR человеческого Notch1 по меньшей мере по остаткам Asn 1461, Val 1463, Lys 1462, Asp 1671, Arg 1673, Leu 1713 и Lys 1718.
Данные показывают, что крысиное 351 образует сильные электростатические взаимодействия (солевые мостики) с остатками Asp 1458 и Arg 1673. Остатками NRR Notch1, которые образовали водородные связи с крысиным антителом 351 были Asp 1458, Val 1463, Cys 1464, Ser 1465, Tyr 1621, Asp 1671, Val 1672, Arg 1673, Gly 1711, Ser 1712, Leu 1713 и Asn 1714. Остатками NRR Notch1, которые вносят вклад в более чем 40 Ангстрем2 площади скрытой поверхности при образовании комплекса с крысиным 351, были Val 1463, Cys 1464, Leu 1466, Gly 1711, Asn 1714, Pro 1716 и Lys 1718 при взаимодействии с легкой цепью и Asn 1461, Leu 1580, Asp 1671 и Arg 1673 при взаимодействии с тяжелой цепью. Из идентифицированных остатков крысиное 351 связывается с NRR человеческого Notch1 по меньшей мере по остаткам Asp 1458, Val 1463, Tyr 1621, Asp 1671, Val 1672, Arg 1673, Ser 1712 и Leu 1713. Кроме того, A2 не взаимодействует с остатками Asp1458, Val 1463, Tyr 1621, Asp 1671, Val 1672, Arg 1673, Ser 1712 и Leu 1713.
|
|
|
На Фиг.6 показано наложение структур NRR человеческого Notch1, связанного с антителами - крысиным 438 и A2; NRR человеческого Notch1 показана внизу. Тяжелые цепи крысиного 438 и A2 показаны черным, и легкие цепи, показанные серым, расположены между двумя тяжелыми цепями. Как показано на Фиг.6, ориентация антител - крысиного 438 и A2 относительно NRR повернута почти на 180 градусов, так что N-конец легкой цепи крысиного 438 направлен к LNR-A, тогда как легкая цепь A2 направлена к LNR-C (в задней области NRR Notch1). Это помещает тяжелые цепи на противоположные стороны двух легких цепей, если смотреть от NRR. Тяжелая цепь A2, следовательно, находится на противоположной стороне легкой цепи от петли S1.
На Фиг.7 показано наложение структур NRR человеческого Notch1 (показаны в виде лент), связанного с антителами - крысиным 351 и А2 (показаны в виде поверхностей молекул). Тяжелые цепи крысиного 351 и A2 показаны черным. Легкая цепь крысиного 351 показана темно-серым, и легкая цепь A2 показана светло-серым. На Фиг.7 показано, что антитела - крысиное 351 и A2 связываются в противоположных ориентациях, подтверждая их ассоциацию с уникальными эпитопами.
Пример 5
Функциональные характеристики ингибирующих антител против Notch1 в анализах на основе клеток
А. Обработка EDTA в анализе с геном-репортером Notch1
В отсутствие лиганда гетеродимерный рецептор Notch1, расщепленный по S1, остается неактивным в клеточной мембране. Домены NRR Notch1 принимают автоингибирующую конформацию путем скрытия сайта расщепления 2 (S2), таким образом, предотвращая доступ к металлопротеазам. Домены NRR Notch1 ассоциируют посредством нековалентных взаимодействий, которые стабилизируются двухвалентными катионами, такими как кальций. Однако ингибирующие взаимодействия доменов NRR Notch1 можно разрушать хелатирующим агентом EDTA. Хелатирование кальция EDTA приводит к быстрому отделению внеклеточного домена от клеточной мембраны, и является достаточным для активации Notch1 сигнализации (Rand et al., Mol. Cell. Biol. 20(5):1825-35, 2000).
Для определения того, стабилизируют ли ингибирующие антитела против Notch1 NRR Notch1 в неактивной конформации при хелатировании двухвалентных катионов, клетки-репортеры Notch1 (смотрите раздел Б ниже) предынкубировали с антителами: крысиным 438-mIgG1, крысиным 351-mIgG1 или А2 и контрольным антителом против E.tenella и затем обрабатывали 5 мМ EDTA. Клетки-репортеры человеческого Notch1 переносили в 96-луночные планшеты с белыми стенками в количестве 40000 клеток на лунку и культивировали в течение ночи в среде МакКоя 5А, 10% FBS (фетальная телячья сыворотка), пенициллин/стрептомицин/глутамине. Среду удаляли отсасыванием и заменяли средой, содержащей антитела: крысиное 438-mIgG1, крысиное 351-mIgG1 или A2 и контрольное антитело против E.tenella в концентрации 0; 0,01; 0,1; 1; 10 и 30 мкг/мл, на 1 час при комнатной температуре. После 1-часовых предобработок антителами в ячейки добавляли EDTA в конечной концентрации 5 мМ и проводили инкубацию при 37°C в 5% CO2 в течение 6 часов. Для измерения активностей репортеров на основе люциферазы светляка 8×CSL (индуцируемой Notch1) и люциферазы Renilla (конститутивной) использовали Dual-Glo Luciferase Assay System (Promega). Показатели люминисценции от люциферазы светляка делили на показатели люминисценции от люциферазы Renilla для расчета уровней Notch1 сигнализации. Из каждой обработки рассчитывали среднее значение 3 повторений и откладывали на графике вместе со стандартными отклонениями.
В Таблице 15 показан анализ с геном-репортером Notch1, проведенный с возрастающими концентрациями антител: крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 и контрольным антителом против E.tenella в присутствии хелатирующего агента EDTA и в отсутствие лиганда. Данные показывают то, что добавление одного EDTA к линии клеток-репортеров Notch1 стимулирует активацию гена-репортера на основе люциферазы светляка (смотрите условие при обработке 0 мкг/мл). Как и ожидалось, контрольное антитело против E.tenella не ингибировало Notch1 сигнализацию. Напротив, предобработка клеток возрастающими концентрациями каждого из антител: крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 ингибировала активацию гена-репортера люциферазы светляка в присутствии EDTA. дозозависимым образом. При концентрациях 1 мкг/мл, 10 мкг/мл и 30 мкг/мл отношения люминисценции от люциферазы светляка к люминисценции от люциферазы Renilla при обработках крысиным 351-mIgG1, крысиным 438-mIgG1 и A2 были значимо меньшими, чем при обработке контрольным антителом против E.tenella, указывая на ингибирование Notch1 сигнализации.
|
Б. Создание линии клеток для анализа с геном-репортером Notch1 в сокультуре
Ингибирующую активность антител против Notch1: гуманизированного 438 и гуманизированного 351 тестировали в анализе с геном-репортером Notch1 в сокультуре, описанном в Примере 2. Антитела: гуманизированное 438 и гуманизированное 351 предынкубировали с клетками-репортерами Notch1 и затем. совместно культивировали с клетками DLL4-HEK293 для активации Notch1 сигнализации или с родительскими клетками HEK293 в качестве, контроля.
Для получения линии клеток-репортеров Notch1 проводили ряд из трех последовательных стабильных трансфекций в линии клеток человеческой остеосаркомы U-2 OS (ATCC (Американская коллекция типовых культур), Manassas, VA). Для первой трансфекций использовался вектор для экспрессии полноразмерного человеческого Notch1 или мышиного Notch1 на основе каркаса pCMV6-Entry-Myc-Flag (Origene), и в обоих случаях были подтверждены правильные последовательности ДНК вставок Notch1. После трансфекций трансфекционным реактивом TransIT-LT1 (Mirus, Madison, WI) клетки U-2 OS подвергали селекции в G418, и выделяли клональные линии. Во-вторых, клоны U-2 OS, стабильно экспрессирующие Notch1, повторно трансфицировали вектором pGL4.27 [luc2P/minP/Hygro] (Promega, Madison, WI), содержащим восемь тандемных копий последовательности энхансера CSL (CGTGGGAAAAT), подвергали селекции в гигромицине Вив G418, и выделяли клональные линии. Репортерная конструкция люциферазы светляка 8×CSL отвечает на активированную Notchl сигнализацию (например, смотрите Jeffries et al., Mol. Cell. Biol. 22(11):3927-3941, 2002). В третьих, клетки U-2 OS Notchl-pGL4.27 повторно трансфицировали вектором pGL4.74 [hRluc/TK] (Promega) и линейным пуромициновым маркером (Clontech, Mountain View, CA), подвергали селекции в пуромицине, гигромицине B и G418, и выделяли клональные линии. Вектор pGL4.74 кодировал ген люциферазы Renilla, который конститутивно экспрессируется от промотора HSV-TK и служит в качестве внутреннего контроля. Тройную стабильно трансфицированную линию U-2 OS (именуемую здесь «клетки-репортеры Notch1») поддерживали в среде МакКоя 5A (Gibco, Grand Island, NY), содержащей 10% FBS, 1X пенициллин, стрептомицин/L-глутамин (Gibco), 0,25 мг/мл G418 сульфат, 0,3 мг/мл гигромицин B и 0,001 мг/мл пуромицин.
Для получения клеток, экспрессирующих лиганд, клетки HEK293 (ATCC) трансфицировали векторами для экспрессии человеческого DLL4 или мышиного DLL4. Оба вектора были основаны на каркасе pCMV6-AC-HA-His (Origene, Rockville, MD), и в них были вставлены правильные последовательности ДНК DLL4. После трансфекций клетки HEK293 подвергали селекции в 0,5 мг/мл G418, и клональные линии выделяли, размножали и анализировали на экспрессию DLL4. Клоны с высокой экспрессией DLL4 и высокой индукцией репортерной активности Notch1 в клетках U-2 OS использовали для анализа ингибирующего действия антител против Notch1.
Для нормирования сигналов (именуемого здесь «отношение F/R») показатели люминисценции от люциферазы светляка делили на внутренний контроль - показатели люциферазы Renilla. Для расчета кратности индукции Notch1 сигнализации, отношения F/R, полученные из анализов с репортером в сокультуре DLL4-HEK293, делили на отношения F/R от сокультур родительских HEK293 и называли относительной люциферазной единицей (RLU) или активностью.
Титрование гуманизированного 438 VH1.1/VL1.8 и А2 в анализах в сокультуре с репортером человеческого и мышиного Notch1 продемонстрировало мощное ингибирование Notch1 сигнализации дозозависимым способом. На Фиг.8 и 9 показана нейтрализующая активность антител: гуманизированного 438 VH1.1/VL1.8 и крысиного 438 против Notch1-зависимой сигнализации в клетках-репортерах человеческого и мышиного Notch1 соответственно. Гуманизированное 438 VH1.1/VL1.8 демонстрировало эквивалентную нейтрализующую активность относительно нейтрализующей активности крысиного 438 в анализах с репортерами как зависимой от человеческого Notch1, так и зависимой от мышиного Notch1 сигнализации. Следовательно гуманизированное 438 VH1.1/VL1.8 полностью сохраняло нейтрализующую активность крысиного 438.
Значения IC50 (полумаксимальная ингибирующая концентрация) (нМ) крысиного 438-mIgG1 и гуманизированных вариантов 438 рассчитывали из ингибирования Notch1-зависимой сигнализации из анализов в сокультуре с геном-репортером Notch1, как представлено в Таблице 16 ниже. Гуманизированное 438 VH1.1/VL1.8 демонстрировало наиболее значимый уровень ингибирования и против сигнализации человеческого, и против сигнализации мышиного Notch1, что представлено наименьшими значениями IC50 среди всех гуманизированных вариантов 438.
|
Ингибирующее действие антител против Notch1 - крысиного 351 и A2 в анализе с репортером на сокультуре исследовали путем добавления возрастающих концентраций антитела в интервале от примерно 0,01 нМ до 200 нМ. Для расчета процента (%) ингибирования в сокультурах, обработанных антителом против Notch1, RLU от обработок возрастающими концентрациями антитела делили на значение от необработанного контроля с использованием формулы: (1-(обработанные/необработанные)*100).
Титрование антителами - крысиным 351 и A2 в анализах с репортерами человеческого и мышиного Notch1 в сокультуре продемонстрировало уникальную нейтрализующую активность крысиного 351 против Notch1 сигнализации. Как показано на Фиг.10, 11 ив Таблице 17, как крысиное 351, так и A2 ингибировали Notch1 сигнализацию дозозависимым способом и имели аналогичные значения IC50, рассчитанные из анализов с репортером Notch1 в сокультуре. На Фиг.10 и в Таблице 17 показано, что A2 достигало максимального ингибирования (плато ингибирования) Notch1 сигнализации на уровне примерно 100% в анализах с репортером человеческого Notch1 в сокультуре, когда концентрации антитела превышали значение IC50 более чем в 20 раз. В отличие от этого, крысиное 351 достигало максимального ингибирования, составляющего лишь 85%, которое было меньше, чем максимальное ингибирование, наблюдаемое для A2. Крысиное 351 не могло достигать 100%-ного максимального ингибирования, даже когда концентрации антитела были в 250 раз больше значения IC50. На Фиг.11 и в Таблице 17 показано, что аналогичные результаты наблюдались для анализов с репортером мышиного Notch1 в сокультуре. A2 достигало максимального ингибирования Notch1 сигнализации, составляющего примерно 86%, в анализах с репортером мышиного Notch1 в сокультуре. В отличие от этого, крысиное 351 достигало максимального ингибирования, составляющего лишь примерно 55%, что меньше, чем 86%-ное максимальное ингибирование, наблюдаемое для A2.
|
На Фиг.12 и 13 показана нейтрализующая активность гуманизированных вариантов 351 и крысиного 351-mIgG1 в репортерных анализах как сигнализации, зависимой от человеческого Notch1, так и сигнализации, зависимой от мышиного Notch1, соответственно. В Таблице 18 приведены значения IC50 (нМ) гуманизированных вариантов 351, крысиного 351-mIgG1 и A2, рассчитанные из данных по ингибированию Notch1-зависимой сигнализации из анализов с геном-репортером Notch1 в сокультуре. Данные показывают, что гуманизированное 351 VH1.0/VL1.1 демонстрировало профиль нейтрализующей активности, который является аналогичным профилю крысиного 351-mIgG1 и крысиного 351. Гуманизированное 351 VH1.0/VL1.1 достигало максимального уровня ингибирования Notch1 сигнализации примерно ~87,4%, что меньше, чем максимальное ингибирование, наблюдаемое для A2.
|
|
Пример 6
Структурная и функциональная основа для нейтрализующей активности клона 351
Ca2+, связанный в каждом из доменов LNR-A, B и C NRR Notch1, требуется для поддержания целостности структуры NRR Notch1. Удаление Ca2+, например, путем добавления EDTA в среды клеток, экспрессирующих Notch1, приводит к дестабилизации структуры NRR Notch1. Это приводит к экспонированию в NRR Notch1 сайта расщепления металлопротеиназой S2 и к активации Notchl сигнализации (Rand et al., Mol. Cell. Biol. 20(5):1825-35, 2000).
Структура сокристалла Fab крысиного 351 с NRR человеческого Notch1 имеет четыре независимых комплекса в одном кристалле. Однако только один из четырех комплексов содержал ожидаемый ион Ca2+, связанный с LNR-A. На Фиг.14A показано взаимодействие крысиного 351 и NRR человеческого Notch1 в области LNR-A комплекса 1. В данной структуре отрицательно заряженный остаток в NRR Notch1, Asp1458, имел ионное взаимодействие с кальцием, присутствующим в структуре. На Фиг.14Б показано взаимодействие крысиного 351 и NRR человеческого Notch1 в области LNR-A комплекса 2. Комплекс 2 представляет собой репрезентативное изображение Комплексов 2-4. В Комплексах 2-4 Asp 1458 NRR человеческого Notch1, вместо наличия ионного взаимодейтвия с кальцием, образовал солевой мостик с положительно заряженным остатком, Arg 58, в CDR2 VH крысиного 351. Это показало, что положительно заряженный Arg 58 крысиного 351 конкурирует с положительно заряженным Ca2+ за связывание с отрицательно заряженным Asp1458 NRR человеческого Notch1.
Для того, чтобы продемонстрировать значимость положительно, заряженного остатка Arg58 в функциональных свойствах крысиного 351, получали мутантные крысиные антитела 351-mIgG1, в которых Arg 58 в VH мутировали до нейтрального остатка, Tyr, (а также Arg 58-Tyr в комбинации с Val 60-Ala или Arg). Мутантные крысиные антитела 351-mIgG1 тестировали в репортерных анализах по ингибированию Notch1 сигнализации, и результаты показаны на Фиг.15 и в Таблице 19. Как показано, крысиное 351 достигало лишь примерно 87%-ного максимального ингибирования, тогда как мутантное крысиное 351-mIgG1 и A2 достигали большего максимального ингибирования ~95% и ~98% соответственно.
|
Пример 7
Действие ингибирующих антител против Notch1 на прорастание эндотелиальных клеток, ангиогенез и васкуляризацию
А. Оценка ингибирующих антител против Notchl in vitro
Действие ингибирующих антител против Notch1 на ангиогенез исследовали в модели отрастания эндотелиальных клеток in vitro с использованием анализа на основе шариков из фибринового геля (FGBA) человеческих эндотелиальных клеток пупочной вены (HUVEC) (также именуемого здесь HUVEC-FGBA). Модифицированную версию HUVEC-FGBA проводили по существу как описано Nakatsu, et al. (Microvasc. Res. 66 (2):102-112, 2003), за исключением того, что фибробласты, ассоциированные с первичной опухолью легкого человека (LTAF) заменяли на фибробласты кожи Detroit 551. Отростки HUVEC исследовали через 10-15 суток после добавления фибробластов.
Ткань человеческой опухоли легкого (образец 87852A1; Asterand, Detroit, MI) механически и ферментативно дезинтегрировали. Клетки просеивали через 40 мкм фильтр с получением суспензии одиночных клеток. Жизнеспособные клетки выделяли после обработки буфером для лизиса красных кровяных клеток (Roche, Indianapolis, IN), и магнитного отделения от мертвых клеток (Miltenyi Biotec, Auburn, CA). Получали фибробласты, ассоциированные с, первичной опухолью легкого, и поддерживали их в среде RPMI, содержащей 20% FBS.
HUVEC-FGBA, содержащие LTAF, обрабатывали антителами: крысиным 438, крысиным 351 или A2. Также включали контрольные обработки: одну среду (необработанные) и ингибитор против VEGF (фактор роста эндотелия сосудов) AVASTIN (Genentech, So. San Francisco, CA). На Фиг.16 показаны репрезентативные эпифлуоресцентные изображения иммуноокрашивания CD31-Cy3 отростков HUVEC, обаботанных крысиным 438, крысиным 351 и A2, на сутки 10. Было продемонстрировано увеличение отрастания HUVEC и длины сосудов при обработке крысиным 438 и крысиным 351 по сравнению с контролем в виде одной среды (необработанные). В отличие от этого, обработка ингибитором против VEGF AVASTIN полностью предотвращала отрастание HUVEC. Таким образом, ингибирование Notch1 сигнализации крысиным 438 и крысиным 351 дерегулировало ангиогенез способом, отличным от ингибиторов против VEGF, таких как AVASTIN.
Кроме того, в Таблице 20 показано, что крысиное 438 и крысиное 351 увеличивали среднее число точек ветвления отростка на шарик по сравнению с контрольным антителом против E.tenella в HUVEC-FGBA на сутки 6 и сутки 12 обработки. Однако действие крысиного 351 на среднее число точек ветвления на шарик был меньше на сутки 6 по сравнению с крысиным 438 и A2. К суткам 12 и крысиное 438, и крысиное 351, а также A2 индуцировали аналогичное число точек ветвления на шарик. Во время ангиогенеза активная Notch1 сигнализация негативно регулирует число эндотелиальных верхушечных клеток и, таким образом, модулирует уровни ветвления и отрастания (Hellstrom, М. et al., Nature 445 (7129):776-780, 2007).
|
|
Б. Оценка ингибирующих антител против Notch1 in vivo
Действие ингибирующих антител против Notch1 далее исследовали в анализе ангиогенеза и васкуляризации на мышах in vivo. Сетчатка новорожденных является хорошо охарактеризованной моделью ангиогенеза, и ее использовали для исследования роли пути Notch в данном процессе. В сетчатке мыши, начиная с рождения, имеется обширный ангиогенез. Как и в человеческой сетчатке, сосудистая система берет начало от зрительного нерва и распространяется с образованием сети сосудов, которые затем дают отростки меньшего порядка с образованием вторичной сети. Генетическая и фармакологическая манипуляция с Notch сигнализацией продемонстрировала, что правильная Notch сигнализация требуется для ангиогенеза в сетчатке новорожденных (Hellstrom, М. et al., Nature 445(7129):776-780, 2007).
Беременных мышей CD-1 содержали индивидуально и регулярно отслеживали на предмет рождения потомства. В том, что касается крысиного 438-mIgG1, мышатам на 1 и 3 сутки после рождения дозировали либо 10 мг/кг контрольного антитела против E.tenella, 10 мг/кг крысиного 438-mIgG1, либо 10 мг/кг A2. В том, что касается крысиного 351-mIgG1, мышатам на 1 и 3 сутки после рождения дозировали либо 30 мг/кг контрольного антитела против E.tenella, 30 мг/кг крысиного 351-mIgG1, либо 30 мг/кг A2.
На 5 сутки после рождения мышат умерщвляли, глаза отбирали и фиксировали в.течение ночи в 2%-ном формальдегиде. Наследующие сутки глаза переносили в PBS (фосфатно-солевой буферный раствор), и выделяли сетчатки. Для окрашивания сетчаток изолектин B4 (Sigma, St. Louis, MO) конъюгировали с красителем алекса 488 посредством набора для мечения, (Invitrogen, Carlsbad, CA) и использовали в концентрации 15 мг/мл в PBS с 10% сыворотки козы, 1% Triton X-100, 0,1% азида натрия и 0,1 мМ каждого из CaCl2, MgCl2 и MnCl2. Сетчатки промывали 5 раз в PBS с 1% Triton X-100, 0,1% азида натрия и 0,1 мМ каждого из CaCl2, MgCl2 и MnCl2, и последний раз в PBS с 0,1% азида натрия и 0,1 мМ каждого из CaCl2, MgCl2 и MnCl2. Сетчатки вырезали, монтировали с Fluormount-G (EMS, Hatfield, PA) и осматривали на конфокальном микроскопе Zeiss LSM510 (Carl Zeiss Microimaging, LLC, Thornwood, NY). На Фиг.17 показаны репрезентативные конфокальные изображения окрашивания изолектином B4-алекса 488 в мышиной ретинальной модели ангиогенеза после обработки крысиным 438-mIgG1, крысиным 351-mIgG1 и A2. Также включали контроли с антителом против E.tenella и без обработки.
Как показано на Фиг.17, сетчатка от мышат в группе обработки крысиным 438-mIgG1 имела отличную сосудистую систему по сравнению с сетчатками от мышат в контрольных группах, обработанных антителом против Е.tenella, и без обработки. Это указывает на то, что крысиное антитело 438-mIgG1 нарушало ангиогенез in vivo. В частности, сетчатки из группы обработки крысиным 438-mIgG1 демонстрировали более обширную сосудистую систему, аналогично тому, что ранее было описано после генетической и фармакологической манипуляции Notch сигнализацией (Hellstrom, M. et al., Nature 445 (7129):776-780, 2007). Это указывает на то, что ингибирование Notch1 сигнализации крысиным 438-mIgG1 прямо влияло на ангиогенез в мышиной сетчатке новорожденных.
Кроме того, на Фиг.17 показано, что сетчатка от мышат в группе обработки крысиным 351-mIgG1 имела аналогичную сосудистую систему по сравнению с сетчатками от мышат в контрольных группах, обработанных антителом против Е.tenella, и без обработки. В отличие от этого, сетчатка из группы A2 демонстрировала более обширную сосудистую систему, аналогично тому, что ранее было описано после генетической и фармакологической манипуляции Notch сигнализацией (Hellstrom, M. et al., Nature 445 (7129):776-780, 2007): Это демонстрирует то, что, в отличие от A2, крысиное антитело 351-mIgG1 значительно не нарушало мышиный антиогенез in vivo, или что потенциальное действие крысиного 351-mIgG1 на мышиную сосудистую систему не наблюдался в выбранный момент времени или с протестированной схемой дозировки.
Пример 8
Действие ингибирующих антител против Notch1 на клеточные линии, имеющие нативный и мутантные рецепторы Notch1
А. Действие ингибирующих антител против Notch1 на активацию Notch1 в клеточной линии человеческих фибробластов CCD1076SK, имеющих нативные рецепторы Notch1
Notch1 сигнализация активируется связыванием лиганда, которое индуцирует конформационные изменения во внеклеточных доменах NRR Notch1, посредством этого экспонируя сайты расщепления металлопротеазой и гамма-секретазой. Протеолиз приводит к высвобождению внутриклеточного домена Notch1 (Notch1ICD), транскрипционного активатора, из клеточной мембраны. Активацию Notch1 и высвобождение Notch1ICD исследовали посредством анализа вестерн-блоттингом белковых экстрактов, полученных из клеточной линии человеческих фибробластов CCD1076SK, которые высаживали на чашки с рекомбинантным человеческим лигандом DLL4, обработанных возрастающими концентрциями антител: крысиного 438, крысиного 351 или A2, или контрольным антителом против E.tenella в течение 24 часов. Высвобожденные молекулы Notch1ICD, начинающиеся с остатка валина, детектировали антителом D3B8 (против Notch1ICD) (Cell Signaling Technology, Danvers, MA).
Для активации Notch1 сигнализации фибробласты кожи CCD1076SK культивировали в присутствии лиганда DLL4. Шестилуночные плашеты покрывали 2 мкг/мл рекомбинантного человеческого DLL4 (R&D Systems, Minneapolis, MN) в 1X DPBS (фосфатно-солевой буферный раствор, модифицированный по Дульбекко), содержащем CaCl2 и MgCl2. 2×10E6 фибробластов кожи CCD1076SK в среде DMEM (среда Игла, модифицированная по Дульбекко), содержащей 10% FBS, добавляли в лунки, покрытые рекомбинантным человеческим DLL4, в присутствии 0; 0,001; 0,01; 0,1; 1 и 10 мкг/мл антител: крысиного 438, крысиного 351, A2 и контрольного антитела против E.tenella. Клетки инкубировали с антителами с течение 24 часов при 37°C в 5% CO2. Клетки лизировали в 1% NP40, 0,5% дезоксихолате натрия, 5 мМ EDTA,0,25 М NaCl, 0,025 M Tris-HCl, pH 7,5, содержащем полную мини протеазную ингибиторную смесь (Roche) и 0,4 мМ PMSF, (фенилметилсульфонилфторид). Экстракты разделяли посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) на 7,5%-ном полиакриламидном геле и переносили на нитроцеллюлозную бумагу с использованием системы преноса iBlot Gel (Invitrogen). Высвобожденные молекулы Notch1ICD, начинающиеся с остатка валина, детектировали антителом против Notch1ICD и, в качестве контроля загрузки, применяли антитело против бета-актина, используя стандартные методики вестерн-блоттинга. Денситометрический анализ проводили на пленках, которые сканировали калиброванным денситометром BioRad GS-800 и анализировали программой Quantity One в версии 4.6.9 (BioRad). Уровни Notch1ICD нормировали в каждом образце к контролю - бета-актину и затем сравнивали с необработанным контролем.
Как показано на Фиг.18, титрование крысиного 438 мощно ингибировало активацию Notch1 дозозависимым образом, на что указывают уровни высвобожденного детектированного Notch1ICD. Дополнительно на Фиг.18 и в Таблице 21 титрование крысиного 351 вплоть до 10 мкг/мл продемонстрировало меньшее ингибирование активации Notch1 нативного рецептора Notch1 по сравнению с A2, на что указывают уровни детектированного высвобожденного Notch1ICD. При всех концентрациях и, в частности, начиная с 0,1 мкг/мл, крысиное 351 демонстрировало более высокие уровни высвобожденного Notch1ICD по сравнению с A2.
|
|
Б. Действие ингибирующих антител против Notch1 на активацию Notch1 в линии клеток T-клеточного острого лимфобластного лейкоза (T-ALL), имеющих мутантные рецепторы Notch1
Сообщается о конститутивной активации Notch1 и высвобождении внутриклеточного домена Notch1 (Notch1ICD) у поднабора пациентов с T-клеточным острым лимфобластным лейкозом (T-ALL) и в линиях клеток T-ALL, которые имеют мутации в пределах домена NRR рецептора Notch1 (Weng et al., Science 306:269-271, 2004). Данные мутации классифицируются на 3 главных класса. Мутации класса 1 представляют собой замены одиночных аминокислот и маленькие делеции в рамке считывания или вставки в HD1. Мутации класса 2 представляют собой более длинные вставки в дистальной области HD2, которые перемещают сайт расщепления металлопротеазой S2 за пределы автоингибирующего домена NRR. Мутации класса 3, также именуемые мутациями околомембранного удлинения (JME), вытесняют NRR из клеточной мембраны.
Протестированные линии клеток T-ALL с мутациями рецептора Notch1 класса 1 включают клетки HPB-ALL с мутацией лейцина до пролина в аминокислоте 1575 (L1575P), клетки ALL-SIL с мутацией лейцина до пролина в аминокислоте 1594 (L1594P), клетки MOLT-4 с мутацией лейцина до пролина в аминокислоте 1601 (L1601P) и клетки DND-41 с составными мутациями класса 1 лейцина до пролина в положении аминокислоты 1594 и аспарагиновой кислоты до валина в положении аминокислоты 1610 (L1594P/D1610V). Линия клеток CCRF-CEM имеет мутацию класса 2 и обладает вставкой из 12 аминокислот в положении 1595. Линия клеток Jurkat имеет JEM мутацию класса 3, при которой 17 аминокислот вставлены в положении 1740.
Активацию Notch1 и высвобождение Notch1ICD исследовали посредством анализа вестерн-блоттингом белковых экстрактов, полученных из линий клеток T-ALL, обработанных возрастающими концентрациями антител: крысиного 438-mIgG1, гуманизированного 438 VH1.1/VL1.8, крысиного 351-mIgG1 или A2 и контрольного антитела против E.tenella. Высвобожденные молекулы Notch1ICD, начинающиеся с остатка валина, специфично детектировали антителом D3B8 (против Notch1ICD).
Вместо фибробластов CCD1076SK, как описано выше, использовали следующие линии клеток T-ALL: HPB-ALL, ALL-SIL, CCRF-CEM, MOLT-4, DND-41 и Jurkat. Поскольку клетки T-ALL обладают конститутивно высвобождаемым Notch1ICD, не требовалось экзогенного лиганда DLL4. Суспензионные культуры 2×10Е6 клеток T-ALL смешивали с 0; 0,001; 0,01; 0,1; 1 и 10 мкг/мл антител: крысиного 438-mIgG1, гуманизированного 438 VH1.1/VL1.8, крысиного 351-mIgG1 или A2 и контрольного антитела против E.tenella в среде RPMI 1640, содержащей 10% FBS, пенициллин/стрептомицин/глутамин. Клетки инкубировали с антителами в течение 24 часов при 37°C в 5% CO2. Клетки собирали центрифугированием, и среду удаляли отсасыванием. Осадки клеток лизировали в 1% NP40, 0,5% дезоксихолате натрия, 5 мМ EDTA, 0,25 М NaCl, 0,025 М Tris-HCl, pH 7,5, содержащем полную мини протеазную ингибиторную смесь (Roche). Экстракты разделяли посредством SDS-PAGE на 7,5%-ном полиакриламидном геле и переносили на нитроцеллюлозную бумагу с использованием системы преноса iBlot Gel (Invitrogen). Высвобожденные молекулы Notch1ICD, начинающиеся с остатка валина, детектировали антителом против Notch1ICD и, в качестве контроля загрузки, применяли антитело против бета-актина, используя стандартные методики вестерн-блоттинга. Денситометрический анализ проводили на пленках, которые сканировали калиброванным денситометром BioRad GS-800 и анализировали программой Quantity One в версии 4.6.9 (BioRad). Уровни Notch1ICD нормировали в каждом образце к бета-актину и затем сравнивали с необработанным контролем.
Как показано на Фиг.19, обработка клеток HBP-ALL возрастающими концентрациями крысиного 438-mIgG1 и гуманизированного 438 VH1.1/VL1.8 значительно ингибировала конститутивную активацию Notch1, на что указывают детектированные уровни высвобожденного Notch1ICD. Таким образом, мутация лейцина до пролина в положении 1575 не влияла на способность антител: крысиного 438-mIgG1 и гуманизированного 438 VH1.1/VL1.8 ингибировать активацию Notch1. Это согласуется с Таблицей 14, демонстрирующей то, что крысиное антитело 438 не взаимодействует с аминокислотой в положении 1575 в структуре сокристалла NRR дикого типа-антитело.
Как показано на Фиг.20 и в Таблице 22, обработка линий клеток T-ALL: HPB-ALL, ALL-SIL,, CCRF-CEM, MOLT-4 и DND-41 возрастающими концентрациями крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 ингибировала активацию Notch1 дозозависимым способом, на что указывает пониженная детекция. высвобожденного Notch1ICD посредством вестерн-блоттинга и денситометрического анализа. В отличие от этого, обработка клеток Jurkat возрастающими концентрациями крысиного 351-mIgG1 и A2 не могла ингибировать активацию Notch1, на что указывает детекция высвобожденного NotchICD посредством анализа вестерн-блоттингом. Как и ожидалось, контрольное антитело против E.tenella не демонстрировало влияния на уровни высвобожденного Notch1ICD в любой из линий клеток T-ALL.
Антитела: крысиное 438-mIgG1, крысиное 351-mIgG1 и A2 аналогично ингибировали активацию Notch1 и высвобождение Notch1ICD в определенных линиях клеток T-ALL с мутациями NRR класса 1 (клетки HPB-ALL с L1575P, клетки ALL-SIL с L1594P, клетки MOLT-4 с L1601P и клетки DND-41 с составными мутациями класса 1 L1594P/D1610V) и класса 2 (линия клеток CCRF-CEM со вставкой из 12 аминокислот в положении 1595), и крысиное 351-mIgG1 и A2 не могли ингибировать расщепление рецептора Notch1 и высвобождение Notch1ICD в клетках Jurkat с мутацией JEM класса 3. Кроме того, крысиное 351-mIgG1 демонстрировало более сильное ингибирование активации Notch1 мутантного рецептора Notch1, как показано на Фиг.20 и в Таблице 22, по сравнению с ингибированием активации Notch1 нативного рецептора Notchl крысиным 351, как показано на Фиг.18 и в Таблице 21.
|
|
В. Действие ингибирующих антител против Notch1 на.жизнеспособность линии клеток Т-клеточного острого лимфобластного лейкоза (T-ALL), имеющих мутантные рецепторы Notch1
Действие антител против Notch1 на клетки HBP-ALL дополнительно анализировали с использованием индикатора жизнеспособности клеток MTS (Promega, Madison, WI) для определения процента жизнеспособных клеток после обработки. Реактив MTS превращался в продукт, который можно измерять по оптической плотности при 490 нанометрах (О.П. 490 нм), метаболически активными живыми, но не мертвыми клетками. Клетки HBP-ALL (1×10E4 клеток/лунку) в среде RPMI 1640, содержащей 10% FBS, пенициллин/стрептомицин/глутамин, инкубировали с 0; 0,47; 1,88; 7,5 и 30 мкг/мл антител: гуманизированного 438 VH1.1/VL1.8, крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 и контрольным антителом против E.tenella в течение 7 суток и затем анализировали с реактивом MTS согласно инструкциям изготовителя.
В Таблице 23 показан анализ жизнеспособности с MTS обработок ингибирующими антителами против Notch1 клеток HBP-ALL возрастающей концентрацией антител: крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 и контрольного антитела против E.tenella. В результате, клетки HBP-ALL, обработанные возрастающими концентрациями крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 вплоть до 30 мкг/мл демонстрировали меньшие уровни превращенного реактива MTS при О.П. 490 нм, чем обработки контрольным антителом против E.tenella. Это указывает на то, что при обработке крысиным 438-mIgG1, крысиным 351-mIgG1 и A2 присутствовало меньше клеток в результате повышенной гибели клеток и/или пониженной пролиферации.
|
|
Аналогичные результаты наблюдали для гуманизированного 438 VH1.1/VL1.8, как показано в Таблице 24, которая иллюстрирует анализ с MTS обработок клеток HPB-ALL возрастающими концентрациями ингибирующих антител против Notch1: гуманизированным 438 VH1.1/VL1.8, крысиным 438-mIgG1 и контрольным антителом против E.tenella. Таким образом, помимо ингибирования активации Notch1, гуманизированные антитела 438 VH1.1A/L1.8 также ингибировали рост раковых клеток с мутацией в домене NRR Notch1, обычной характеристикой у пациентов с T-ALL.
|
|
Для демонстрации активности in vitro мутантных крысиных антител 351, клетки HPB-ALL обрабатывали возрастающей концентрацией одного из антител: крысиного 351-mIgG1, крысиного 351(R58Y)-mIgG1, крысиного 351(R58Y/V60A)-mIgG1, гуманизированного 438 VH1.1A/L1.8, А2, либо контрольным антителом против E.tenella. В Таблице 25 показан анализ с MTS обработок ингибирующими антителами против Notchl и полученые в их результате значения IC50. И крысиное 351(R58Y)-mIgG1, и крысиное 351(R58Y/V60A)-mIgG1 антитела ингибировали рост HPB-ALL, но способом, который является более сходным с гуманизированным 438 VH1.1A/L1.8, чем с крысиным антителом 351-mIgG1 дикого типа, при определении по их значениям IC50. Таким образом, остаток Arg 58 в крысином 351-mIgG1 способствовал его мощной ингибирующей активности против рецептора Notch1 с мутантной NRR.
|
|
Пример 9
Действие ингибирующих антител против Notch1 на рост in vivo ксенотрансплантатов человеческих опухолей
А. Соиммуногистохимия Notch1 и Jagged 1
Действие ингибирующих антител против Notch1 тестировали в доклинических моделях с экспрессией Notch1 как в ксенотрансплантированной опухоли, так и в клетках стромы хозяина для того, чтобы максимизировать их потенциальную эффективность. Для идентификации доклинической модели, которая экспрессирует Notch1 и один из его лигандов, Jagged 1, проводили иммуногистохимию с использованием антител против Notch1 и против Jagged 1 на ксенотрансплантате, происходящем от пациента (PDX) с немелкоклеточным раком легкого (NSCLC) 37622A1, именуемом далее «37622A1 NSCLC PDX». Фрагмент ткани из 37622A1 NSCLC PDX фиксировали в формалине и заливали в парафин (FFPE) с использованием стандартных гистологических методик. Нарезали срезы FFPE толщиной пять микрометров, освобождали их от воска и гидратировали дистиллированной водой. Антигены извлекали в цитратном буфере, рН 6,0, в автоклаве. Эндогенную пероксидазу блокировали 0,3% H2O2 в течение 15 минут.Срезы инкубировали с набором для блокировки белка DAKO в течение 20 минут.Эндогенный биотин блокировали набором для блокирования авидина/биотина (Vector). На срезы на 1 час при (комнатной, температуре наносили разведение 1:50 кроличьего антитела против Notch1 (ab52627; Abeam). Антитело против кроличьего IgG-биотин (JacksonImmuno) наносили на срезы:на 30 минут при комнатной температуре. Добавляли к срезам на 30, минут при комнатной температуре стрептавидин-HRP (пероксидаза хрена). Для развития окраски использовали DAB (диаминобензидин) в течение 5 минут. Срезы нагревали при 98° в течение 10 минут в цитратном буфере, pH 6,0, для разрушения связавшихся первичного антитела против Notch1 и вторичного антитела против кроличьего IgG из первой реакции. Срезы блокировали в наборе для блокировки белка DAKO в течение 20 минут и инкубировали с разведением 1:100 кроличьего антитела против Jagged 1 (Santa Cruz) в течение 2 часов при комнатной температуре. Полимер антитело против кроличьего IgG-HRP (DAKO) наносили на 30 минут при комнатной температуре. Для развития окраски использовали субстрат ImmPACT VIP в течение 7 минут. Срезы подвергали краткому контрастному окрашиванию в гематоксилине Мейера, дегидратировали, обесцвечивали и покрывали покровными стеклами.
Как показано на Фиг.21, 37622A1 NSCLC PDX имел гетерогенную экспрессию человеческого рецептора Notch1 (слева от пунктирной линии) и человеческого лиганда Jagged 1 (справа от пунктирной линии) в кластерах опухолевых клеток (ограниченных сплошной линией). Ядерный Notch1ICD (стрелки) также детектировали на границе между опухолевыми клетками с человеческим Notch1 и человеческим Jagged 1, указывая на активную Notch1 сигнализацию. В пределах стромы мыши мышиный Notch1 также детектировали в сосудистой системе, ассоциированной с PDX, что согласуется с предыдущим открытием того, что Notch1 сигнализация регулирует ангиогенез в мышиной неонатальной сетчатке. Картина экспрессии Notch1 и Jagged 1 в 37622A1 NSCLC PDX показала то, что он является релевантной моделью для исследования эффектов антител против Notch1 in vivo.
При NSCLC K-ras является часто мутируемым онкогеном, который стимулирует рост опухоли. Таким образом, ген K-ras из 37622A1 NSCLC PDX секвенировали для определения того, содержал ли он K-ras дикого типа или мутантный. Геномную ДНК выделяли из фрагмента 37622A1 NSCLC PDX с использованием набора PrepGEM согласно инструкциям изготовителя (ZyGEM, Solana Beach, CA). Последовательности ДНК K-ras, амплифицировали KOD полимеразой (EMD Chemicals, Gibbstown, NJ) с использованием прямых и обратных праймеров. Условия циклов ПЦР: 1 цикл при 75°C в течение 15 минут, 1 цикл при 95°C в течение 5 минут, 1 цикл при 96°C в течение 1 минуты и 35 циклов при 96°C в течение, 15 секунд, 60°C в течение 15 секунд, 72°C в течение 40 секунд и 1 цикл при 72°C в течение 1 минуты и 20 секунд. Амплифицированный ПЦР-продукт из 496 пар оснований очищали набором QIAquick PCR Purification (Qiagen, Valencia, CA), и секвенирование ДНК проводили набором для секвенирования BigDye Terminator v1.1 Cycle (ABI, Foster City, CA) согласно инструкциям производителя.
Как показано на Фиг.22, анализ последовательности ДНК показал, что 37622A1 NSCLC PDX обладает мутацией глицина до валина (кодируется последовательностью ДНК GTT) по аминокислоте 13 (G13V) в человеческом гене K-ras.
Б. Исследования по ингибированию роста in vivo для ксенотрансплантатов NSCLC
У иммунодефицитных мышей исследовали действие ингибирующих антител против Notch1 на рост in vivo ксенотрансплантатов человеческой опухоли, которые получали из фрагментов свежерезецированных опухолей NSCLC, полученных согласно подходящим разрешенным процедурам (Asterand). Ксенотрансплантаты, происходящие от пациента с NSCLC 87393A1, и ксенотрансплантаты, происходящие от пациента с NSCLC 37622A (именуемые далее «87393А1 NSCLC PDX» и «37622А NSCLC PDX» соответственно), пассировали in vivo в виде фрагментов от животного к животному у самок NOD-SCID и голых (Nu/Nu) мышей соответственно.
При достижении опухолями объема от 200 до 400 мм3 их классифицировали по стадиям для обеспечения однородности размера опухолей среди разных групп обработки до введения антител против Notchl и контрольного антитела против E.tenella. Модели 37622A1 NSCLC PDX в.б. (внутрибрюшинно) дозировали 10 мг/кг антител: крысиного 438-mIgG1, A2 и контрольного антитела против E.tenella один раз в неделю в течение 3 недель. Модели 87393A1 NSCLC PDX в.б. дозировали 20 мг/кг крысиного 351-mIgG1 и контрольного антитела против E.tenella два раза в неделю в течение 4 недель. Опухоли измеряли по меньшей мере один раз в неделю, и их объем рассчитывали по формуле: объем опухоли (мм3) = 0,5 × (ширина опухоли2)(длина опухоли). Средние объемы опухолей (± SEM (стандартная ошибка среднего)) для каждой группы обработки рассчитывали от 8-11 животных и сравнивали с обработанными контролем.
В Таблице 26 показана эффективность антител: крысиного 438-mIgG1 и A2 в ксенотрансплантатах, происходящих от пациента с NSCLC 37622A1 с мутацией G13V в K-ras по сравнению с контрольным антителом против E.tenella. Ингибирование роста PDX 37622A1 посредством крысиного 438-mIgG1 указывает на то, что NSCLC с активированным Notch1 и/или мутациями в онкогене K-ras может быть чувствительным к ингибиторам пути Notch1.
|
В Таблице 27 показана эффективность крысиного 351-mIgG1 в 87393A1 NSCLC PDX по сравнению с контрольным антителом против E.tenella. Обработка крысиным 351-mIgG1 приводила к 29%-ному ингибированию роста опухоли по сравнению с опухолями, обработанными контрольным антителом против E.tenella, в сутки 28.
|
Для подтверждения того, что активация Notch1 была ингибирована, проводили анализ вестерн-блоттингом с использованием антитела D3B8 (против Notch1ICD) на белковых экстрактах, полученных из ксенотрансплантатов, в конце исследования. В конце исследования отбирали ксенотрансплантаты из модели 37622A NSCLC PDX, обработанной крысиным 438-mIgG1, A2 и контрольным антителом против E.tenella, и ксенотрансплантаты из модели 87393А1 NSCLC PDX, обработанной крысиным 351-mIgG1 и контрольным антителом против E.tenella. Опухолевую ткань лизировали в 1% NP40, 0,5% дезоксихолате натрия, 5 мМ EDTA, 0,25 M NaCl, 0,025 M Tris-HCl, pH 7,5, содержащем полную мини протеазную ингибиторную смесь (Roche). Экстракты разделяли посредством SDS-PAGE на 7,5%-ном полиакриламидном геле и переносили на нитроцеллюлозную бумагу с использованием системы преноса iBlot Gel (Invitrogen). Высвобожденные молекулы Notch1ICD, начинающиеся с остатка валина, детектировали антителом D3B8 (против Notch1ICD), и общие уровни C-концевого домена Notch1 детектировали D1E11 (против Notch1) (Cell Signaling Technologies) с использованием стандартных методик вестерн-блоттинга. β-Актин показан в качестве контроля загрузки.
На Фиг.23 показан анализ вестерн-блоттингом белковых экстрактов, полученных из 37622A NSCLC PDX, обработанного крысиным 438-mIgG1 и A2. Детекцию высвобожденного Notch1ICD наблюдали в опухолях, обработанных контрольным антителом против E.tenella, но не в опухолях, обработанных крысиным 438-mIgG1, что указывает на ингибирование активации Notch1. На Фиг.24 показан анализ вестерн-блоттингом белковых экстрактов, полученных из 87393A1 NSCLC PDX, обработанного антителами: крысиным 351-mIgG1 и контрольным против E.tenella. Детекцию, высвобожденного Notch1ICD наблюдали в опухолях, обработанных контрольным;антителом, против E.tenella, но не в опухолях, обработанных крысиным 351-mIgG1, что указывает на ингибирование активации Notch1.
Клиническая информация от донора исходного образца 87393A1 NSCLC PDX указывала то, что опухоль пациента представляла собой инвазивную слабо дифференцированную плоскоклеточную карциному легкого. Инволюкрин представляет собой маркер дифференцировки плоских клеток в опухолях легкого (Said, J.W., et. al., Laboratory Investigation, 1983, volume 49, 563-568). Для определения того, имело ли ингибирование активации Notch1 влияние на дифференцировку опухолевых клеток 87393A1 NSCLC PDX, анализировали экспрессию инволюкрина посредством иммуногистохимии и анализа вестерн-блоттингом. На Фиг.25 и 26 показаны иммуногистохимия и анализ вестерн-блоттингом инволюкрина опухолей, обработанных крысиным 351-mIgG1 и контрольным антителом против E.tenella соответственно. Ингибирование активации Notch1 в 87393A1 NSCLC PDX приводило к повышенным уровням экспрессии инволюкрина, что продемонстрировано иммуногистохимией и анализом вестерн-блоттингом. Таким образом, помимо уменьшения размера опухоли, обработка против Notch1 также усиливала дифференцировку опухолевых клеток.
Для определения того, влияло ли ингибирование активации Notch1 на массу тела, мышей взвешивали во время исследований по эффективности in vivo. В Таблице 28 показано, что средние массы тела мышей (минус массы опухолей) по ходу исследования в группах, обработанных крысиным 351-mIgG1 и контрольным антителом против E.tenella не были значимо отличными в 87393A1 NSCLC PDX.
|
В. Исследования по ингибированию роста in vivo для ксенотрансплантатов HPB-ALL
Аналогичные эксперименты in vivo, что и проведенные с 37622A1 NSCLC PDX и 87393A1 NSCLC PDX, описанные выше, проводили с линией клеток HPB-ALL с мутантным Notch1. Для получения ксенотрансплантатов самкам голых мышей (Nu/Nu) подкожно имплантировали 8×10E6 клеток HPB-ALL в 50% Matrigel (BD Biosciences). При достижении опухолями объема от 200 до 400 мм3 опухоли классифицировали по стадиям для обеспечения однородности массы опухолей среди разных групп обработки до введения антител против Notch1 и контрольного антитела D16A. Модели HPB-ALL п.к. (подкожно) дозировали 20 мг/кг антител: крысиного 438-mIgG1, крысиного 351-mIgG1, A2 или D16A два раза в неделю в течение 2 недель. Опухоли измеряли по меньшей мере один раз в неделю, и их объем рассчитывали по формуле: объем опухоли (мм3) = 0,5 × (ширина опухоли2)(длина опухоли). Средние массы опухолей (±SEM) для каждой группы обработки рассчитывали от 8-11 животных и сравнивали с обработанными контролем.
В Таблице 29 показана эффективность антител: крысиного 438-mIgG1, крысиного 351-mIgG1 и A2 в ксенотрансплантатах HPB-ALL с мутацией L1575P в NRR Notch1. Данные демонстрируют то, что и обработка крысиным 438-mIgG1, и обработка крысиным 351-mIgG1 ингибировали рост клеток HPB-ALL in vivo по сравнению с контрольным антителом D16A, таким образом, замедляя рост опухоли.
|
|
Г. Исследования по ингибированию роста in vivo для ксенотрансплантатов NSCLC Calu-6
Аналогичные эксперименты, что и проведенные выше с клетками HPB-ALL для исследований in vivo, проводили с линией клеток NSCLC Calu-6. Ксенотрансплантаты Calu-6 исходно получали в самках голых мышей (Nu/Nu) из 2×10E6 культивируемых in vitro клеток в 50% Matrigel (BD Biosciences), и затем их последовательно пассировали in vivo в виде фрагментов опухоли от животного к животному. При достижении опухолями объема от 200 до 400 мм3 опухоли классифицировали по стадиям для обеспечения однородности размера опухолей среди разных групп обработки до введения антител против Notch1 и контрольного антитела. Модели Calu-6 в.б. дозировали 3,10 и 30 мг/кг антител: крысиного 438-mIgG1 или A2 или 10 мг/кг контрольного антитела против E.tenella 2 раза в неделю в течение 2 недель. Опухоли измеряли по меньшей мере один раз в неделю, и их объем рассчитывали по формуле: объем (мм3) = 0,5 × (шириналопухоли2)(длина опухоли). Средние объемы опухолей (± SEM) для каждой группы обработки рассчитывали от 8-11 животных» и сравнивали с обработанным контролем.
Модель Calu-6 была выбрана, так как ранее было продемонстрировано, что она отвечает на ингибиторы пути Notch, такие как антитела против DLL4 (Ridgeway et al., Nature 444:1083-1087, 2006) и A2. В Таблице 30 показана эффективность крысиного 438-mIgG1 и A2 в модели рака легкого Calu-6. Обработка 3 мг/кг, 10 мг/кг и 30 мг/кг крысиного 438-mIgG1 приводила к дозозависимому уменьшению роста опухоли. Однако эффективое (>50%) уменьшение роста ксенотрансплантатов Calu-6 происходило только при дозе 30 мг/кг, которая была в 3 раза выше, чем доза, требующаяся для ингибирования роста 37622A1 PDX до аналогичного уровня.
|
Для определения того, влияет ли ингибирование Notch1 сигнализации на массу тела, мышей взвешивали на протяжении исследований по эффективности in vivo. В Таблице 31 показано, что по ходу исследования средние массы тела мышей (минус массы опухолей) в группах, обработанных антителами: крысиным 438-mIgG1 и A2 и контрольным против E.tenella, не были значимо отличными.
|
Д. Исследования по ингибированию роста in vivo для ксенотрансплантатов рака молочной железы
Исследовали действие гуманизированного 438 VH1.1/VL1.8 на рост in vivo в моделях ксенотрансплантатов с тройным негативным раком молочной железы, Sum149 и MDA-MB-231. Бестимусных самок мышей (Nu/Nu, 6-8-недельные) приобретали в Charles River Laboratories и содержали в специфичных беспатогенных условиях согласно руководствам Международной ассоциации по оценке и аккредитации ухода за лабораторными животными. Животным давали стерильную пищу для грызунов и воду без ограничений.
Клетки для имплантации в бестимусных мышей отбирали и осаждали центрифугированием при 450×g в течение 5-10 минут. Осадки клеток один раз промывали и ресуспендировали в стерильной бессыворочной среде. Опухолевые клетки дополняли 50% Matrigel (BD Biosciences) для облегчения сбора опухолей и роста отобранных опухолевых клеток в виде ксенотрансплантатов. Клетки (2-3×106 в 100 мкл) подкожно имплантировали в заднюю боковую область мыши и давали им расти до намеченного размера до введения соединения для каждого эксперимента.
Для исследований противоопухолевой эффективности животных, имеющих опухоли размером 150-300 мм3, случайным образом, делили на группы, которые получали либо контрольное антитело (26H6), либо гуманизированное 438 VH1.1/VL1.8, которые еженедельно дозировали п.к. (подкожная) инъекцией. Еженедельно дозировали доцетаксел посредством в.б. инъекции. Измерения опухолей получали каждые 2-3 суток. Объем опухоли (мм3), показанный в Таблицах 32 и 33, измеряли штангенциркулем и рассчитывали с использованием формулы: длина (мм) × ширина (мм) × ширина (мм) × 0,52.
|
|
Значения процента (%) ингибирования измеряли на последние сутки исследования для мышей, обработанных лекарственным средством, по сравнению с обработанными носителем и рассчитывали как 100-{1-[(ОбработанныеКонечные сутки - ОбработанныеСутки 1)/(контрольныеКонечные сутки - контрольныеСутки 1)]}. Для всех экспериментов по ингибированию роста опухоли использовали от 8 до 10 мышей на группу дозировки. Для определения значения P использовали t-критерий Стьюдента. В Таблице 34 показана эффективность гуманизированного 438 VH1.1/VL1.8 в моделях ксенотрансплантатов стройным негативным раком молочной железы.
|
Пример 10
Действие ингибирующих антител против Notch1 на дифференцировку и пролиферацию клеток кишечника
Фармакологическое и генетическое ингибирование Notch сигнализации превращает пролиферирующие клетки-предшественники в кишечных криптах в секреторные бокаловидные клетки (van Es et al., Nature 435:959-963, 2005). Эффекты ингибирующих, антител против Notch1 на пролиферацию и дифференцировку клеток в мышином кишечнике исследовали на тканях, отобранных из исследований по эффективности на Calu-6 и 87393A1 NSCLC PDX Примера 9. На образцах, кишок проводили иммуногистохимию с использованием красителя альцианового синего на муцины (т.е. секреторные бокаловидные клетки) и антитела против Ki67 на пролиферацию.
Мышиный тонкий кишечник отбирали из исследований по эффективности на Calu-6 и 87393А1 NSCLC PDX, разрезали продольно, фиксировали в формалине и выдерживали в 70%-ном EtOH (этанол). Данную ткань затем заливали в парафин. Окрашивание альциановым синим проводили на мукосоединения согласно инструкциям производителя. Иммуногистохимию с использованием антитела против Ki67 (SP6, Abcam, Cambridge, MA) для демонстрации пролиферации клеток проводили на Dako Auto Stainer (Dako, Carpinteria, CA) согласно инструкциям изготовителя.
1. Получение изображений
Окрашенные срезы тканей сканировали на сканере для предметных стекол Nanozoomer (Hamamatsu, Bridgewater, NJ) с использованием установок 20х объектива. Изображения сканировали и сохраняли в файлах формата ndp. Цифровые изображения открывали в программе Aperio Image Scope (Aperio Technologies, Vista, CA). Два изображения с противоположных сторон полости кишки получали с 10X цифровым увеличением и сохраняли в виде tiff изображений.
На Фиг.27 показана гистохимическая идентификация секреторных бокаловидных клеток с использованием красителя альциановый синий на срезе подвздошной кишки мышиного кишечника из исслеования по эффективности на Calu-6 при обрабоке 10 мг/кг одного из антител: крысиного 438-mIgG1, A2 или контрольного против E.tenella. Показаны репрезентативные изображения кишечных ворсинок и крипт. Бокаловидные клетки отмечены стрелками и, для простоты, в качестве примера на каждом изображении отмечена только 1 клетка. Несмотря на то, что антитела против Notch1 не вызывали потери массы на протяжении исследования, обработка либо крысиным 438-mIgG1, либо A индуцировала дифференцировку секреторных бокаловидных клеток, что доказывается усиленным окрашиванием альциановым синим в ворсинках, а также в криптах. Таким образом, одно ингибирование, Notch1 сигнализации усиливало дифференцировку бокаловидных клеток, однако, не до уровня, который оказывал значимое влияние на массу тела.
2. Анализ изображений
Цифровые изображения открывали в программе Image Pro-Plus (Media: Cybernetics, Bethesda, MD). Вручную создавали очерченную интересующую область (AOI), которая включала кишечную ткань (крипту и ворсинки), но исключала гладкие мышцы, артефакты, складки и обломки. Для идентификации площади окрашивания альциановым синим и площади ткани задавали пороговое значение. Пороговые значения применяли к AOI, и ранговую статистику экспортировали в таблицу Excel. В Excel для каждого животного рассчитывали среднее отношение окрашивания альциановым синим из двух отобранных отношений окрашивания с получением одного рассчитанного отношения окрашивания альциановым синим на животное. Для каждой группы получали среднее значение отношения окрашивания альциановым синим и стандартное отклонение. Статистику анализировали с использованием статистической программы JMP (JMP, Cary, NC).
В Таблице 35 показан количественный анализ изображений на основе отношения окрашивания альциановым синим мышиного кишечника при обработке антителами: крысиным 438-mIgG1, A2 и контрольным против E.tenella в исследовании эффективности на Calu-6. По сравнению с контрольным антителом против E.tenella в дозировке 10 мг/кг, имелось значимое увеличение отношения окрашивания альциановым синим при обработке крысиным 438-mIgG1 в дозировке 10 мг/кг и 30 мг/кг. Количественный анализ изображения при окрашивании альциановым синим подтверждает повышенную дифференцировку бокаловидных клеток в большей области подвздошной кишки по сравнению с областью, показанной на Фиг.27.
В Таблице 35 показан количественный анализ изображений на основе отношения окрашивания альциановым синим мышиного кишечника при обработке антителами: крысиным 438-mIgG1, A2 и контрольным против E.tenella в исследовании эффективности на Calu-6.
|
|
Статистический анализ попарных сравнений между средним арифметическим или средними отношениями окрашивания альциановым синим из каждой группы обработки показан в Таблице 36. Отношения для каждой пары определяли с использованием t-критерия Стьюдента. Положительные значения показывают пары средних, которые являются значимо отличными. В отличие от A2, крысиное 438-mIgG1, дозированное в 3 мг/кг, не индуцировало значимого увеличения в отношении окрашивания альциановым синим по сравнению с контрольным антителом против E.tenella. Кроме того, A2, дозированное в 10 мг/кг, индуцировало значимое увеличения в отношении окрашивания альциановым синим по сравнению с крысиным 438-mIgG1, дозированным в 10 мг/кг, свидетельствуя о том, что крысиное 438-mIgG1 вызывало более слабую дифференцировку кишечных клеток, чем A2.
|
|
На Фиг.28 показана иммуногистохимия антителом против Ki67 на мышиных кишечных криптах из исследования эффективности на Calu-6 при обработке 10 мг/кг одного из антител: крысиного 438-mIgG1, А2 или контрольного против E.tenella. Показаны репрезентативные изображения кишечных крипт, окрашенных Ki67. Окрашивание Ki67 в основании крипт уменьшалось у животных, обработанных крысиным 438-mIgG1, но не у животных, обработанных контрольным антителом против E.tenella. Потеря окрашенных Ki67 пролиферирующих клеток крипт согласовалась с превращением в постмитотические бокаловидные клетки, которое наблюдалось посредством окрашивания альциановым синим.
В Таблице 37 показан количественный анализ изображений на основе отношения окрашивания альциановым синим мышиного кишечника при обработке антителами: крысиным 351-mIgG1 и контрольным против E.tenella в исследовании эффективности на 87393А1 NSCLC PDX. По сравнению с контрольным антителом: против E.tenella, не было значимого отличия в отношении окрашивания альциановым синим у мышей, обработанных крысиным 351-mIgG1 (p=0,22). Количественный анализ изображений на основе окрашивания альциановым синим показал, что крысиное 351-mIgG1 не индуцировало гиперплазию бокаловидных клеток, подобно другим ингибиторам пути Notch. Таким образом, ингибирование Notch1 сигнализации крысиным 351-mIgG1 не увеличивало дифференцировку бокаловидных клеток.
|
На Фиг.29 и в Таблице 38 показана иммуногистохимия антителом против Ki67 и количественный анализ отношения окрашивания Ki67 на кишечных криптах мыши из исследования эффективности на 87393А1 NSCLC PDX при обработке одним из антител: крысиным 351-mIgG1 или контрольным против Е.tenella. На Фиг.29 показаны репрезентативные изображения крипт кишечника, окрашенных Ki67, показывающие, что окрашивание Ki67 уменьшалось в основании крипт у животных, обработанных крысиным 351-mIgG1, но не у животных, обработанных контрольным антителом против E.tenella.
В соответствии с данным наблюдением, в Таблице 38 показан количественный анализ изображения отношений окрашивания Ki67 мышиного кишечника при обработке крысиным 351-mIgG1 и контрольным антителом против E.tenella. Данные показали, что имеется небольшое, но статистически значимое (р равно 0,023) уменьшение отношений окрашивания Ki67 при обработках крысиным 351-mIgG1 по сравнению с контрольным антителом против E.tenella. Количественный анализ отношений окрашивания Ki67 показал уменьшение пролиферации клеток в основании крипт, что демонстрируется снижением относительных уровней окрашивания Ki67 в большей области подвздошной кишки по сравнению с областью, показанной на верхних панелях Фиг.29. Таким образом, ингибирование Notch1 сигнализации крысиным 351-mIgG1 уменьшало пролиферацию.
|
Фармакокинетика и фармакодинамика ингибирующего антитела против Notch1
1. Методика йодирования
Йодирование проводили с использованием способа IODO-BEADS согласно инструкциям изготовителя (Pierce, Rockford, IL). Вкратце, использовали ~200 мкг тестируемого вещества на 2 мКи 125-йода (Perkin-Elmer) и инкубировали в течение 15-25 минут при температуре окружающей среды с 2 IODO-BEADS и ~200 мкл PBS. Реакционную смесь отделяли от IODO-BEADS посредством фильтрования (Centricon-10 от Millipore, Billerica, MA).
2. Получение и характеристики раствора для дозирования
Для крысиного 438-mIgG1 раствор для дозирования получали смешиванием немеченого тестируемого вещества - крысиного 438-mIgG1, следового количества тестируемого вещества, меченного 125I, и буфера для приготовления препарата (PBS) для получения конечных концентраций белка 2 мг/мл для обеспечения объема дозировки у мышей 10 мл/кг. Для крысиного 351-mIgG1 получали три раствора для дозирования посредством смешивания немеченого тестируемого вещества - крысиного 351-mIgG1, следового количества тестируемого вещества, меченного 125I, и буфера для приготовления препарата (PBS) для получения конечных концентраций белка 2, 0,5 и 2,4 мг/мл для обеспечения объема дозировки 2,5, 10 и 12,5 мл/кг у мышей для группы I (5 мг/кг в.в. (внутривенно)), II (5 мг/кг в.б.) и III (30 мг/кг в.б.) соответственно.
Долю радиоактивности в растворе для дозирования, объясняемую свободным йодом («% свободного йода») определяли с использованием осаждения трихлоруксусной кислотой (TCA). Аликвоты раствора для дозирования (5 мкл) смешивали с мышиной сывороткой (45 мкл) и осуществляли их счет (в тройной повторности) на общую радиоактивность (модель 1480 WIZARD™, Wallac Inc., Gaithersburg, MD или модель 2470 Perkin Elmer, Waltham MA). Добавляли в образцы TCA (50 мкл 20%-ного маточного раствора). Образцы центрифугировали при приблизительно 3000 g в течение 10 минут. На 50 мкл аликвоте образующегося супернатанта осуществляли счет в отношении импульсов в растворе в минуту (имп./мин). Долю свободного йода в растворе для дозирования рассчитывали с использованием формулы: [2 * среднее значение имп./мин растворимого элюата/среднее значение имп./мин общего элюата * 100%]. Удельную активность раствора для дозирования (мкКи/мг) рассчитывали по формуле: [среднее значение общих имп./мин-2 * среднее значение имп./мин в растворе]/[концентрацию раствора для дозирования (мг/мл) * объем раствора для дозирования (мл) * 2200000 имп./мин/мкКи]. Чистоту раствора для дозирования также количественно анализировали с исползованием SDS-PAGE и подтверждали в виде преимущественно одной полосы при невосстанавливающих условиях и в виде двойных полос при восстанавливающих условиях.
3. Определение радиоактивных эквивалентных концентраций в сыворотке и в тканях
Общую радиоактивность в образцах сыворотки (50 мкл, в двойной повторности) определяли посредством счета гамма излучения. В каждую аликвоту сыворотки добавляли эквивалентный объем 20%-ной TCA, и образцы центрифугировали при ~12000 об./мин в течение 10 минут. TCA-растворимую радиоактивность в 50 мкл аликвотах супернатанта определяли счетом гамма излучения. Осаждаемую TCA радиоактивность (имп./мин) в данном образце (имп./мин общей - 2 * имп./мин TCA-растворимой), удельную активность раствора для дозирования (имп./мин осаждаемой TCA на мг белка), а также данные измерений образца (tS) и раствора для дозирования (tD) использовали для расчета концентрации тестируемого соединения в данном образце, используя формулу: [среднее значение имп./мин осаждаемой TCA/EXP(-0,693/60,2*(tS-td))]/[удельная активность (в имп./мин/мг) * объем образца (в мл)].
Количественное измерение эквивалентной радиоактивной концентрации в ткани (мкг экв./г) тестируемого соединения, меченного 125I, было основано на общей радиоактивности в тканях и удельной активности раствора для дозирования после поправки на период полувыведения 125I с использованием, формулы: [имп./мин образца/EXP(-0,693/60,2×(tS-td))]/[удельная активность (в имп./мин/мг) × масса образца (в мг)]. Осаждение в TCA для образцов ткани не проводили. Отношения концентраций в ткани к концентрациям в сыворотке (T/S) для образца ткани в данный момент времени рассчитывали с использованием отношения концентрации радиоактивных эквивалентов в ткани (мкг экв./г) к концентрации радиоактивных эквивалентов в сыворотке (мкг экв./мл).
4. Фармакокинетические расчеты
Фармакокинетические расчеты были основаны на средних концентрациях в сыворотке или в ткани у мышей. Использовали модуль некомпартментного анализа (модель 201 и 200 для анализа сывороточных данных после в.в. и в.б. введения соответственно) фармакокинетического программного пакета WinNonlin, версия 5.1 (Pharsight). Площадь под кривой концентрации в сыворотке относительно времени (AUC) рассчитывали с использованием линейного трапезоидного способа. Наклон кажущейся конечной фазы оценивали посредством логлинейной регрессии с использованием по меньшей мере 3 точек данных, и константу конечной скорости (λ) получали из наклона. AUC0-∞ оценивали как сумму AUC0-t (где t представляет собой время последней измеримой концентрации) и Ct/λ. Кажущийся конечный период полувыведения (t½) рассчитывали как 0,693/λ.
В Таблице 39 показаны экспозиции крысиных антител 438-mIgG1 в сыворотке и ткани голых мышей, не имеющих опухоль, которые измеряли в указанные моменты времени после однократной в.б. инъекции 5 мг/кг крысиного антитела 438-mIgG1, меченного 125йодом. Наивысшие концентрации радиоактивных эквивалентов (RE) и экспозиции (AUC0-беск.) были обнаружены в сыворотке во все исследованные моменты времени, после которой следуют печень, кожа, почка, толстая кишка, тонкая кишка, легкие и глаза. Радиоактивность в тканях снижалась со временем, как показано в Таблице 39. Несмотря на известную экспрессию и важную роль Notch1 сигнализации в желудочно-кишечном тракте мышей, крысиное 438-mIgG1 предпочтительно не накапливалось в толстой или тонкой кишке по сравнению с другими протестированными тканями.
|
Были рассчитаны отношения тканевых к сывороточным концентрациям, и средние отношения тканевая/сывороточная концентрация после однократной 5 мг/кг в.б. дозы крысиного 438-mIgG1 голым мышам, которые показаны в Таблице 40. Отношения тканевых к сывороточным концентрациям оставались относительно постоянными на протяжении исследованных моментов времени, указывая на равновесие между сывороткой и тканями. Сывороточные концентрации крысиного 438-mIgG1 были выше, чем тканевые концентрации, так что отношения T/S были низкими (в общем меньше 1) и находились в пределах типичного интервала, наблюдаемого для mIgG1.
|
|
После введения крысиного 438-mIgG1, меченного 125I, рассчитали, что Cmax составляет 16,4 мкг экв./мл с Tmax, достигающимся в 3 ч. t1/2 выведения составлял 58 ч, и экспозиция (AUC0-∞) составляла 788 мкг экв.*ч/мл, как показано в Таблице 41. Период полувыведения крысиного 438-mIgG1 после однократной 5 мг/кг в.б. дозы является относительно коротким (~2,4 сут.).
|
Экспозиции в сыворотке крысиного 351-mIgG1 измеряли у голых мышей, не имещих опухоли, после одной 5 мг/кг в.в, 5 мг/кг в.б. или 30 мг/кг в.б. инъекции крысиного антитела 351-mIgG1, меченного 125I. Наблюдаемые значения сывороточной концентрации использовали для расчета многочисленных фармакокинетических параметров, как показано в Таблице 42 и в Таблице 43.
В Таблице 42 показаны фармакокинетические параметры после в.в. введения самкам голых мышей 5 мг/кг крысиного 351-mIgG1, меченного 125I. t1/2 выведения и системный клиренс крысиного 351-mIgG1 составляли ~3 суток (70,2 ч) и 1,74 мл/ч/кг соответственно. Объем распределения в стационарном состоянии (Vdss) составлял 177 мл/кг. Экспозиция (AUC0-беск.) составляла 2871 мкг экв. ч/мл.
|
В Таблице 43 показаны фармакокинетические параметры после в.б. введения самкам голых мышей 5 и 30 мг/кг крысиного 351-mIgG1, меченного 125I. Cmax составляла 30 и 151 мкг экв./мл соответственно, и Tmax достигалось в 6 часов для групп с обеими дозировками. t1/2 выведения составлял 93 и 163 часа (~4-7 суток), и экспозиция (AUC0-беск.) составляла 2754 и 24080 мкг экв.*ч/мл после 5 и 30 мг/кг соответственно. Нормированное по дозе отношение AUC (F) между в.б. и в.в. введением составляло ~1,4, свидетельствуя о том, что поглощение у мышей после в.б. введения 30 мг/кг было полным.
|
Сывороточные и тканевые экспозиции крысиного 351-mIgG1 у голых мышей, не имеющих опухоли, измеряли после одной в.б. инъекции 5 и 30 мг/кг крысиного 351-mIgG1, меченного 125I. Для в.б. дозы 5 мг/кг наивысшие концентрации радиоактивных эквивалентов (RE) и экспозиция (AUC0-беск.) были обнаружены в сыворотке во все исследованные моменты времени, после которой следовали печень, селезенка, кожа, почки, тонкая кишка, толстая кишка, легкое и глаза, как показано в Таблице 44. Для в.б. дозы 30 мг/кг наивысшие концентрации радиоактивных эквивалентов (RE) и, экспозиция, (AUC0-беск.) были обнаружены в сыворотке во все исследованные моменты времени, после которой следовали печень, кожа, селезенка, тонкая кишка, легкое, почки, глаза и толстая кишка, как показано в Таблице 45. Данные показывают, что крысиное 351-mIgG1 предпочтительно не накапливалось в толстой или тонкой кишке по сравнению с другими протестированными тканями как для 5 мг/кг, так и для 30 мг/кг в.б. доз.
|
|