Результат интеллектуальной деятельности: Средство для использования в фотон-захватной терапии злокачественных солидных новообразований
Вид РИД
Изобретение
Изобретение относится к медицине, а точнее к средствам для бинарной лучевой терапии злокачественных опухолей (фотон-захватная терапия) (ФЗТ). Изобретение может быть использовано как в экспериментальных, так и в клинических исследованиях.
В фотон-захватной лучевой терапии лекарственные средства, содержащие висмут, применяются для формирования дополнительной энергии в облучаемой мишени, которая образуется в результате ядерно-физических взаимодействий висмута с фотонами;
n+157Gd→158Gd→фотоны (7,88 мэВ) + электроны конверсии (45-66 кэВ) + электроны Оже и Кестер-Кронига (5-9 кэВ);
Y(~60 кэВ) + Gd, Bi ~ рентгеновское излучение (-30 кэВ) + электроны (~30 кэВ)
В настоящее время известен ряд коммерческих магнитно-резонансных контрастных средств, нашедших применение в клинической практике в качестве диагностических препаратов. Все они представляют собой водные растворы комплексных соединений гадолиния с органическими лигандами. Это препараты Магневист и Гадовист германской фирмы Bayer AG, Омнискан американской фирмы GE Healthcare, Дотарем французской фирмы Laboratore Gubert. ПроХанс и МультиХанс итальянской фирмы Вгассо.
Наиболее широко используются препараты на основе диэтилентриаминопентауксусной кислоты и, в частности, препарат Магневист (DE 3129906, А61, опубл. 1981).
Препарат Магневист представляет собой 0,5 М водный раствор димеглюминовой соли гадопентетата с рН~7, вязкостью 4,9 cP при 20°С и плотностью не более 1,2 г/см3 при 20°С.
Применение Магневиста и других магнитно-резонансных контрастных средств для формирования дополнительного энерговыделения в бинарных лучевых технологиях ограничено высокой скоростью элиминации из места их внутритканевого введения. Системные пути введения этих препаратов не эффективны для этой цели, поскольку все они являются внеклеточными веществами и не способны накапливаться внутри нормальных и опухолевых клеток. Кроме того, препарат Магневист не безопасен для медицинского применения, так как сложен для контроля его качества.
Известна лекарственная форма гадопентетата, представляющая собой 0,5 М раствор динатриевой соли комплекса гадолиния с диэтилентриаминопентауксусной кислотой с рН 5,0-8,5, содержащий до 5% поливинилпирролидона с молекулярной массой 12000±1500 дальтон (RU 2150961, A61K 49/00, опубл. 20.06.2000).
Наличие в лекарственной форме поливинилпирролидона с молекулярной массой 12000±1500 дальтон обеспечивает замедленную элиминацию основной субстанции гадопентетата при интратуморальном пути его введения. Недостатком лекарственной формы - наличие в них поливинилпирролидона с молекулярной массой 12000±1500 дальтон, запрещенного для использования в медицинских целях (Циркуляр Федеральной службы по надзору в сфере здравоохранения и социального развития (№1100-Пр/05 от 24.05.2005). Скорость элиминации гадопентетата при интратуморальном введении лекарственной формы в технологиях нейтрон-захватной и фотон-захватной лучевой терапии характеризуется периодом полуэлиминации, Т1/2Э, равным 50±5 мин, что не является оптимальной величиной для реализации бинарных лучевых технологий.
Известна контрастная композиция для магнитно-резонансной томографии и рентгеновских исследований на основе комплекса гадолиния, согласно изобретению, содержащая от 0,1 до 1,5 моль/л комплекса гадолиния (Gd3+) с динатриевой солью диэтилентриаминопентауксусной кислоты (ДТПА) или диметиламиддиэтилентриаминопентауксусной кислоты (ДМАДТПА) с рН 6-8 и дополнительно содержащая от 0,0001 до 0,5% металлохромного индикатора от массы гадолиния. В качестве металлохромного индикатора используют хромазурол S или хромоксан чисто-голубой БЛД, растворы которых устойчивы в течение длительного времени. Хромазурол S и хромоксан чисто-голубой БЛД имеют контрастный переход (желтый - фиолетовый) в рабочем диапазоне рН от 6 до 8 единиц. Константа комплексообразования этих индикаторов составляет 12 до 16 единиц. Изменение цвета раствора композиции обусловлено образованием комплекса гадолиний-индикатор при распаде комплекса гадолиний-ДТПА или гадолиний-ДМАДТПА (RU 2308290, A61K 49/06, A61K 49/04, опубл. 20.10.2007). Этот источник принят в качестве прототипа.
Положительный результат, получаемый при реализации предложенной композиции, заключается в высокой безопасности препарата в качестве магнитно-резонансной и рентгеновской контрастной композиции. Но при наличии таких положительных качеств данное контрастное средство имеет недостаток, заключающийся в недостаточной визуализации специфической ферментативной активности и активации факторов транскрипции в живых системах.
Настоящее изобретение направлено на достижение технического результата, заключающегося в повышении эффективности применения в фотон-захватной терапии за счет формирования дополнительной энергии в облучаемой мишени, которая образуется в результате ядерно-физических взаимодействий висмута с фотонами.
Указанный технический результат достигается тем, что в качестве фармацевтической субстанции используют комплекс висмута с диэтилентриаминопентауксусной кислотой (H5dtpa) в виде его динатриевой соли BiNa2dtpa с общей формулой и в следующем весовом соотношении:
|
Кроме того, фармацевтическая субстанция выполнена в виде раствора для вводимых интратуморальным путем в эффективном количестве инъекций, содержащего в качестве активного вещества комплекс висмута с диэтилентриаминопентауксусной кислотой от 305,0 до 330,0 мг.
Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Комплекс висмута с ДТПА получают в две стадии. В основе технологии получения препарата лежит реакция взаимодействия лиганда - ДТПА с катионом висмута - Bi3+. Комплекс висмута с ДТПА отличается высокой стабильностью в водной среде - logK более 32, что исключает проявление токсических свойств катиона висмута. Реакция образования комплекса протекает в водной среде. Т.к. соли висмута легко подвергаются гидролизу, в качестве источника катиона висмута они малопригодны. Так при гидролизе хлорида висмута образуется хлорид висмутила - BiOCl, где BiO+ выполняет роль одновалентного металла. Подобная картина имеет место и в случае нитрата висмута. В водной среде пятиводный кристаллогидрат нитрата висмута образует основные соли, химический состав которых определяется условиями протекания гидролиза. Наряду с основными нитратами висмута в этом случае образуется также нитрат висмутила:

Кроме того, при использовании нитрата висмута необходимо осуществить очистку раствора субстанции от нитратов ионов, а также разработать методику определения нитратов в растворе субстанции и лекарственной формы, что усложняет и удорожает технологию получения целевого продукта.
По указанным причинам в качестве источника катиона висмута был выбран оксид висмута - Bi2O3. Реакция приготовления субстанции - комплекса висмута с ДТПА в этом случае выглядит следующим образом:

Реакция оксида с ДТПА, являющейся достаточно сильной кислотой, протекает в водной среде. Оксид висмута добавляют в концентрированный водный раствор ДТПА при повышенной температуре (около 80-90°С). Процесс продолжают при перемешивании до полного растворения оксида висмута. Динатриевую соль комплекса висмута, являющуюся субстанцией препарата, получают подщелачиванием образовавшегося раствора концентрированным водным раствором натрия гидроксида. Процесс получения динатриевой соли висмутового комплекса с H2dtpa представлен следующими уравнениями:

Описанный процесс лежит в основе технологии получения субстанции препарата - динатриевой соли комплекса висмута с диэтилентриаминпентауксусной кислотой.
Метод получения основной субстанции препарата (IV) основан на взаимодействии диэтилентриаминопентауксусной кислоты (I, DTPA) с висмута оксидом (II) в водной среде с последующей нейтрализацией полученной кислой висмутовой соли диэтилентриаминопентауксусной кислоты (III) концентрированным водным раствором натрия гидроксида. Процесс получения висмутдинатриевой соли диэтилентриаминопентауксусной кислоты (IV) представлен следующими уравнениями:


Полученный раствор висмутдинатриевой соли диэтилентриаминопентауксусной кислоты (IV, BiNa2dtpa) стерилизуют, используя метод ультрафильтрования, и фасуют в стерильные флаконы в нужных объемах.
На первой стадии к 59,0 г (150 мМоль) диэтилентриаминопентауксусной кислоты добавляют 250 мл воды и 37,8 г (0,0726 мМоль) висмута оксида. Реакцию проводят в колбе с обратным холодильником, охлаждаемым водой, при постоянном перемешивании и температуре, близкой к температуре кипения растворителя, до полного растворения реагентов (8-10 час).
На второй стадии рН реакционной среды доводят водный раствор натрия гидроксида (50,0 г натрия гидроксида в 350 мл воды) до 6,0-8,0 при интенсивном перемешивании. Раствор охлаждают до комнатной температуры, доводя общий объем до 300 мл, перемешивают и фильтруют через стеклянный фильтр (ПОР 10). Полученный раствор фасуют в стерильных условиях во флаконы для лекарственных средств, используя мембранные ультрафильтры с диаметром пор 0,22 мкм.
Характеристика полученного препарата представлена в Таблице 1.


Пример 1
Суспензию клеток мышиной меланомы B6F10 (Банк опухолевых штаммов ФГБУ РОНЦ им. Н.Н. Блохина РАМН) второго пассажа трансплантируют под кожу и внутрь мышцы правого заднего бедра мышам самцам лини C57B 1/6 с массой тела 20-22 грамма (2-3-го месяцев жизни) в 0,2 мл полного раствора Хенкса. При инъекции животным вводят 2×106 опухолевых клеток. Развитие опухоли контролируется путем измерения размеров опухоли. Животные отбираются к дальнейшим исследованиям по достижении объемов опухоли 200-300 мм3.
Облучение животных опытных и контрольных групп рентгеновским излучением проводили с помощью рентгеновского аппарата УФИ-01, изготовленного ООО «Диагностика-М» по заказу ЗАО ГК «Эпидбиомед». Облучения проводились при анодном напряжении 110 кВ и токе трубки 700 мкА. Кожно-фокусное расстояние составляло 7 см. Диаметр поля рентгеновского излучения составлял 2 см, т.е. в поле облучения с указанным диаметром гарантированно вписывалась трансплантированная опухоль животного. Мощность дозы в позиции расположения центра облучаемой опухоли составляла 0,8 Гр/мин. Контроль поля излучения аппарата осуществлялся при помощи дозиметра ДКС-АТ 5350/1 с ионизационной камерой PTW ТМ 30013.
Дозиметрическое сопровождение в технологии ФЗТ не отличалось от дозиметрического сопровождения, принятого в дистанционной лучевой терапии, и заключалось в определении дозы от внешнего источника рентгеновского излучения на поверхности мишени - центра опухоли животного, которому была трансплантирована опухоль. Дозиметрическое сопровождение облучения животных в технологии ФЗТ осуществляли с использованием дозиметрических пленок Gafchromic.
Оценка противоопухолевого эффекта производилась по изменению объема опухолей в опытных и контрольных группах. Измерение размеров опухолей производилось при помощи штангенциркуля в трех взаимно перпендикулярных плоскостях. По полученным данным рассчитывался объем опухоли по формуле объема эллипсоида:

где а, b, с геометрические размеры опухоли в трех взаимно перпендикулярных направлениях.
Измерение объемов опухолей производилось каждые два дня с момента проведения терапии и до окончания исследования.
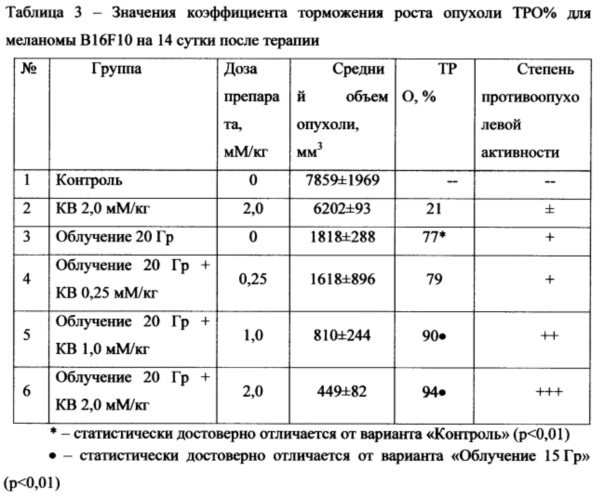
В качестве количественных параметров оценки противоопухолевой терапии были использованы: коэффициент торможения роста опухоли (ТРО%), время задержки роста опухоли (Т-С) и логарифм количества погибших клеток (LGn). Торможение роста опухоли в % на 7 и 14 сутки после терапии (ТРО%), вычисляли по формуле

где Vt и Vc - средние объемы опухоли в опытных и контрольной группах на 7 и 14 сутки соответственно.
Время задержки роста опухоли Т-С вычисляли как разницу во времени в достижении среднего объема опухоли (1000 мм3) в опытной и контрольной группах.
Логарифм количества убитых опухолевых клеток LGn, вычисляемого по формуле

где Т-С - время задержки роста опухоли, Td - время удвоения объема опухоли в контроле в экспоненциальной фазе роста. Степень противоопухолевой активности определяли в соответствии с действующими российскими и международными методическими рекомендациями.
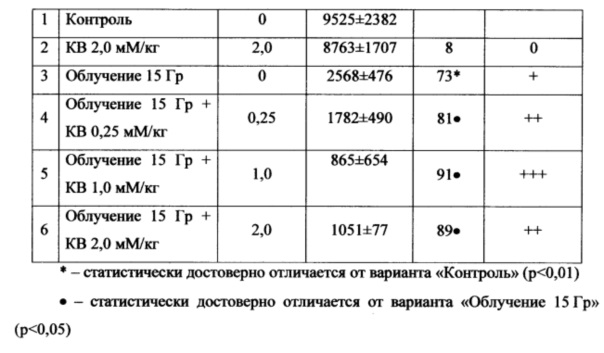
Животные были распределены в 6 групп: контрольная группа, группа только с введением исследуемого препарата (КВ - комплекс висмута) в дозе 2,0 мМ/кг, группа только облученная рентгеновским излучением, группа с введением КВ в дозе 0,25 мМ/кг и рентгеновским облучением, группа с введением КВ в дозе 1,0 мМ/кг и рентгеновским облучением, группа с введением КВ в дозе 2,0 мМ/кг и рентгеновским облучением.
ФЗТ животных опытных групп проводилась сразу после интратуморального введения препарата. Доза рентгеновского облучения составляла 20 Гр. Отсутствие адресной доставки КВ и результаты изучения его острой и субхронической активности определили путь введения препарата - интратуморальный. Доза вводимого КВ рассчитывалась индивидуально на каждое животное. Животным основных опытных групп препарат вводился в опухоль однократной инъекцией в дозах 2 мМ/кг, 1 мМ/кг и 0,25 мМ/кг, непосредственно перед рентгеновским облучением.
Результаты обрабатывались общепринятыми методами вариационной статистики (с учетом критериев Стьюдента) и выражались в виде среднеарифметического значения (М) и его стандартной ошибки (m). Статистические различия определялись по t-тесту Стьюдента и U-критерию Манна-Уитни. Обработка полученных данных производилась с использованием пакета Statistica 6.
Полученные результаты приведены в Таблицах 2-4. Результаты показывают, что введение исследуемого препарата перед рентгеновским облучением трансплантированной опухоли меланомы B16F10 существенно увеличивает противоопухолевый эффект для двух из исследованных доз (1 мМ/кг и 2 мМ/кг). Противоопухолевый эффект проявлялся как на ранней стадии (7 сутки после терапии), так и на более позднем сроке наблюдения (14 сутки). Статистически значимого эффекта от введения КВ в дозе 0,25 мМ/кг в ФЗТ трансплантированной меланомы B16F10 не обнаружено.



Пример 2
Суспензию клеток аденокарциномы молочной железы человека Са755 (Банк опухолевых штаммов ФГБУ РОНЦ им. Н.Н. Блохина РАМН) второго пассажа трансплантируют под кожу и внутрь мышцы правого заднего бедра мышам-самцам линии С57В 1/6 с массой тела 20-22 грамма (2-3-го месяцев жизни) в 0,2 мл полного раствора Хенкса. При инъекции животным вводят 2×106 опухолевых клеток. Развитие опухоли контролируется путем измерения размеров опухоли. Животные отбираются к дальнейшим исследованиям по достижении объемов опухоли 200-300 мм3.
Облучение животных опытных и контрольных групп рентгеновским излучением проводили с помощью рентгеновского аппарата УФИ-01, изготовленного ООО «Диагностика-М» по заказу ЗАО ГК «Эпидбиомед». Облучения проводились при анодном напряжении 110 кВ и токе трубки 700 мкА. Кожно-фокусное расстояние составляло 7 см. Диаметр поля рентгеновского излучения составлял 2 см, т.е. в поле облучения с указанным диаметром гарантированно вписывалась трансплантированная опухоль животного. Мощность дозы в позиции расположения центра облучаемой опухоли составляла 0,8 Гр/мин. Контроль поля излучения аппарата осуществлялся при помощи дозиметра ДКС-АТ5350/1 с ионизационной камерой PTW ТМ 30013.
Дозиметрическое сопровождение в технологии ФЗТ не отличалось от дозиметрического сопровождения, принятого в дистанционной лучевой терапии, и заключалось в определении дозы от внешнего источника рентгеновского излучения на поверхности мишени - центра опухоли животного, которому была трансплантирована опухоль. Дозиметрическое сопровождение облучения животных в технологии ФЗТ осуществляли с использованием дозиметрических пленок Gafchromic.
Оценка противоопухолевого эффекта производилась по изменению объема опухолей в опытных и контрольных группах. Измерение размеров опухолей производилось при помощи штангенциркуля в трех взаимно перпендикулярных плоскостях. По полученным данным рассчитывался объем опухоли по формуле объема эллипсоида:
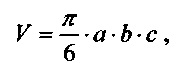
где а, b, с геометрические размеры опухоли в трех взаимно перпендикулярных направлениях.
Измерение объемов опухолей производилось каждые два дня с момента проведения терапии и до окончания исследования.
В качестве количественных параметров оценки противоопухолевой терапии были использованы: коэффициент торможения роста опухоли (ТРО%), время задержки роста опухоли (Т-С) и логарифм количества погибших клеток (LGn). Торможение роста опухоли в % на 7 и 14 сутки после терапии (ТРО%) вычисляли по формуле

где Vt и Vc - средние объемы опухоли в опытных и контрольной группах на 7 и 14 сутки, соответственно.
Время задержки роста опухоли Т-С вычисляли как разницу во времени в достижении среднего объема опухоли (1000 мм3) в опытной и контрольной группах.
Логарифм количества убитых опухолевых клеток LGn, вычисляемого по формуле

где Т-С - время задержки роста опухоли, Td - время удвоения объема опухоли в контроле в экспоненциальной фазе роста. Степень противоопухолевой активности определяли в соответствии с действующими российскими и международными методическими рекомендациями.
Животные были распределены в 6 групп: контрольная группа, группа только с введением исследуемого препарата (КВ - комплекс висмута) в дозе 2,0 мМ/кг, группа только облученная рентгеновским излучением, группа с введением КВ в дозе 0,25 мМ/кг и рентгеновским облучением, группа с введением КВ в дозе 1,0 мМ/кг и рентгеновским облучением, группа с введением КВ в дозе 2,0 мМ/кг и рентгеновским облучением.
ФЗТ животных опытных групп проводилась сразу после интратуморального введения препарата. Доза рентгеновского облучения составляла 20 Гр. Отсутствие адресной доставки КВ и результаты изучения его острой и субхронической активности определили путь введения препарата - интратуморальный. Доза вводимого КВ рассчитывалась индивидуально на каждое животное. Животным основных опытных групп препарат вводился в опухоль однократной инъекцией в дозах 2 мМ/кг, 1 мМ/кг и 0,25 мМ/кг, непосредственно перед рентгеновским облучением.
Результаты обрабатывались общепринятыми методами вариационной статистики (с учетом критериев Стьюдента) и выражались в виде среднеарифметического значения (М) и его стандартной ошибки (m). Статистические различия определялись по t-тесту Стьюдента и U-критерию Манна-Уитни. Обработка полученных данных производилась с использованием пакета Statistica 6.
Полученные результаты приведены в Таблицах 5-7. Результаты показывают, что введение исследуемого препарата перед рентгеновским облучением трансплантированной опухоли аденокарциномы Са755 существенно увеличивает противоопухолевый эффекта для для всех трех исследованных доз препарата. Противоопухолевый эффект отчетливо проявлялся на более позднем сроке наблюдения (14 сутки).