Результат интеллектуальной деятельности: Биотрансформация фенилметилового сульфида в (R)-сульфоксид с помощью иммобилизованных клеток Gordonia terrae ИЭГМ 136
Вид РИД
Изобретение
Изобретение относится к биотехнологии и может быть использовано для получения (R)-фенилметилсульфоксида с использованием в качестве биокатализатора клеток актинобактерий Gordonia terrae ИЭГМ 136, иммобилизованных в гелевый носитель.
Оптически активные сульфоксиды различной структуры используются в асимметрическом синтезе в качестве стереонаправляющих групп и строительных блоков в синтезе биологически активных соединений. Высокая значимость сульфоксидов с
(R)-конфигурацией асимметрического центра демонстрируется рядом примеров. Так,
(R)-фенилметилсульфоксид является интермедиатом в синтезе препарата тетрагидролипстатина (син. Орлистат, Ксеникал) для лечения ожирения [Raghavan S. and Rathore К. Asymmetric synthesis of (-)-tetrahydrolipstatin. Tetrahedron, 2009, v. 65, p. 10083-10092]. (R)-n-Толилметилсульфоксид используют в синтезе лигандов глюкокортикостероидных рецепторов [Han Z., Song J.J. et al. Development of a Preparative-Scale Asymmetric Synthesis of (R)-p-Tolyl Methyl Sulfoxide for Use in a One-Pot Synthesis of a Drug Intermediate Containing a Trifluoromethyl-Substituted Alcohol Functionality. Org. Process Res. Dev., 2007, v. 11, p. 605-608; 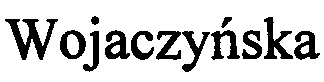 E. and
E. and  J. Enantioselective Synthesis of Sulfoxides: 2000-2009. Chem. Rev., 2010, v. 110, p. 4303-4356.], а также гипохолестеринемических и противоопухолевых препаратов [Ludwig G.,
J. Enantioselective Synthesis of Sulfoxides: 2000-2009. Chem. Rev., 2010, v. 110, p. 4303-4356.], а также гипохолестеринемических и противоопухолевых препаратов [Ludwig G.,  G.N. et al. Cationic arene ruthenium(II) complexes with chelating P-functionalized alkyl phenyl sulfide and sulfoxide ligands as potent anticancer agents. Dalton Trans., 2013, v. 42, p. 3771-3774]. (R)-n-Метоксифенилметилсульфоксид - интермедиат в синтезе антигипертензивных агентов [Davis R., Kern J.R., Kurz L.J., Pfister J.R. Enantioselective Synthesis of Dihydropyridine Sulfones. J. Am. Chem. Soc, 1988, v. 110, р. 7873-7874]. Продукты, образующиеся в процессе реакций сульфоксидирования, могут быть использованы в качестве инсектицидов [Fieseler С, Walek W. et al. Synergistic fungicides against Phytophthora infestans - contg. halo-substd. 1,2,4-thiadiazole sulphoxide and tri:phenyl-tin acetate or 2,4-di:chloro-6-chloro:anilino-1,3,5-triazine. German Patent DE 4032414, 1990], фунгицидов [Graf H., Rentzea C. et al. Pyridazinon-Derivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Fungizide. German Patent DE 3328770, 1983], гербицидов [Casida J.E., Gray R.A., Tilles H. Thiocarbamate sulfoxides; potent, selective and biodegradable herbicides. Science, 1974, p.573-574] и лекарственных препаратов для лечения аллергии [Reinholz Е., Friebe W.-G. et al. Thioethers, process for their preparation and medicaments containing them. Eur. Patent EP 232 820, 1987], лучевого дерматита [Bryce G., Shapiro S. Tetrahydronaphthalene and indane compounds useful for reversing the photodamage in sun-exposed skin. US Patent 5061 733, 1990], алкогольной интоксикации [Plapp B.V., Chadha V.K. Inhibition of alcohol metabolism by tetramethylene sulfoxides. US Patent 4 482 568, 1984]. (R)-фенилэтилсульфоксид используется для получения люминесцентных материалов (Li J.-R., Bu Х.-Н. et al. Lanthanide perchlorate complexes with 1,4-bis(phenylsulfinyl)butane: structures and luminescent properties. New. J. Chem., 2004, v. 28, p. 261-265). Наиболее экономным и перспективным способом получения оптически чистых сульфоксидов является окисление соответствующих прохиральных сульфидов. Известно, что различные диалкилсульфиды, арилалкилсульфиды, диарилсульфиды присутствуют в нефти [Waldo G.S., Carison R.M.K. et al. Sulfur speciation in heavy petroleums: Information from X-ray absorption near-edge structure. Geochim. Cosmochim. Acta, 1991, v.55, p.801-814; Hopkins R.L., Kendall R.F., Thompson C.J., Coleman HJ. Identificationof Alkyl Aryl Sulfides in Wasson, Texas, Crude Oil. Anal. Chem., 1969, v. 41 (2), p. 362-365] и могут выступать в качестве исходного материала для получения оптически чистых сульфоксидов.
G.N. et al. Cationic arene ruthenium(II) complexes with chelating P-functionalized alkyl phenyl sulfide and sulfoxide ligands as potent anticancer agents. Dalton Trans., 2013, v. 42, p. 3771-3774]. (R)-n-Метоксифенилметилсульфоксид - интермедиат в синтезе антигипертензивных агентов [Davis R., Kern J.R., Kurz L.J., Pfister J.R. Enantioselective Synthesis of Dihydropyridine Sulfones. J. Am. Chem. Soc, 1988, v. 110, р. 7873-7874]. Продукты, образующиеся в процессе реакций сульфоксидирования, могут быть использованы в качестве инсектицидов [Fieseler С, Walek W. et al. Synergistic fungicides against Phytophthora infestans - contg. halo-substd. 1,2,4-thiadiazole sulphoxide and tri:phenyl-tin acetate or 2,4-di:chloro-6-chloro:anilino-1,3,5-triazine. German Patent DE 4032414, 1990], фунгицидов [Graf H., Rentzea C. et al. Pyridazinon-Derivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Fungizide. German Patent DE 3328770, 1983], гербицидов [Casida J.E., Gray R.A., Tilles H. Thiocarbamate sulfoxides; potent, selective and biodegradable herbicides. Science, 1974, p.573-574] и лекарственных препаратов для лечения аллергии [Reinholz Е., Friebe W.-G. et al. Thioethers, process for their preparation and medicaments containing them. Eur. Patent EP 232 820, 1987], лучевого дерматита [Bryce G., Shapiro S. Tetrahydronaphthalene and indane compounds useful for reversing the photodamage in sun-exposed skin. US Patent 5061 733, 1990], алкогольной интоксикации [Plapp B.V., Chadha V.K. Inhibition of alcohol metabolism by tetramethylene sulfoxides. US Patent 4 482 568, 1984]. (R)-фенилэтилсульфоксид используется для получения люминесцентных материалов (Li J.-R., Bu Х.-Н. et al. Lanthanide perchlorate complexes with 1,4-bis(phenylsulfinyl)butane: structures and luminescent properties. New. J. Chem., 2004, v. 28, p. 261-265). Наиболее экономным и перспективным способом получения оптически чистых сульфоксидов является окисление соответствующих прохиральных сульфидов. Известно, что различные диалкилсульфиды, арилалкилсульфиды, диарилсульфиды присутствуют в нефти [Waldo G.S., Carison R.M.K. et al. Sulfur speciation in heavy petroleums: Information from X-ray absorption near-edge structure. Geochim. Cosmochim. Acta, 1991, v.55, p.801-814; Hopkins R.L., Kendall R.F., Thompson C.J., Coleman HJ. Identificationof Alkyl Aryl Sulfides in Wasson, Texas, Crude Oil. Anal. Chem., 1969, v. 41 (2), p. 362-365] и могут выступать в качестве исходного материала для получения оптически чистых сульфоксидов.
Химический синтез оптически чистых сульфоксидов, как правило, осуществляется с применением дорогостоящих катализаторов и требует защиты других реакционно-активных функциональных групп. При этом не всегда достигается высокая энантиоселективность реакций.
Перспективным способом прямого получения энантиомерно-однородных сульфоксидов представляется использование специфических ферментных систем в качестве биокатализаторов, что позволяет получать целевые продукты с высокой степенью регио- и стереоселективности в одну технологическую стадию при обычных температурах и давлении, в неагрессивной реакции среды [Matsui Т., Dekishima Y., Ueda М. Biotechnological production of chiral organic sulfoxides: current state and perspectives. Appl. Microbiol. Biotechnol., 2014, v. 98, p. 7699-7706; Grishko V.V., Ivshina LB., Tolstikov A.G. Bioconversion of thioanisole by actinobacteria Rhodococcus sensu stricto. Biotechnol. Russia, 2004, v. 5, р. 69-77]. Первые работы по биотрансформации прохиральных органических сульфидов проведены с использованием целых клеток актинобактерий Corynebacterium equi IFO 3730 (Rhodococcus hoagii) [Ohta H., Okamoto Y., Tsuchihashi G. Asymmetric synthesis of chiral sulfoxides via microbial oxidation of sulfides. Chem. Lett., 1984, v. 13. (2), p.205-208], а также мицелиальных грибов Aspergillus [Mascotti M.L., Orden A.A. et al. Aspergillus genus as a source of new catalysts for sulfide oxidation. J. Mol. Catal. B: Enzym., 2012, v. 82, p. 32-36.], Helminthosporium sp., Mortierella isabellina [Holland H.L. Biotransformation of organic sulfides. Nat. Prod. Rep., 2001, v. 18, p. 171-181; Holland H.L., Ihasz N., Lounsbery B.J. Formation of single diastereomers of β-hydroxy sulfoxides by biotransformation of P-ketosulfides using Helminthosporium species NRRL 4671. Can. J. Chem., 2002, v. 80 (6), р. 640-642]. Описанные процессы окислительной биотрансформации сульфидов с использованием грибов имеют значительные недостатки, поскольку они осуществляются в условиях сложных питательных сред, характеризуются низким уровнем биоконверсии субстрата при внесении низких концентраций исходного соединения. Использование грибов в качестве биокатализаторов потенциально опасно вследствие характера их посевного материала (споры) и способности к синтезу микотоксинов с мутагенным и канцерогенным действием. В связи с этим в последние годы для направленного получения оптически активных сульфоксидов используются непатогенные бактерии [Mascotti M.L., Palazzolo М.А. et al. Expanding the toolbox for enantioselective sulfide oxidations: Streptomyces strains as biocatalysts. Biocatal. Agr. Biotechnol., 2013 v. 2, p. 399-402; Chen Y., Zhuo J. et al. Stereoselective oxidation of sulfides to optically active sulfoxides with resting cells of Pseudomonas monteilii ССТСС M2013683. J. Mol. Catal. B: Enzym., 2014, v. 106, p. 100-104; Елькин A.A., Гришко B.B., Ившина И.Б. Окислительная биотрансформация тиоанизола клетками Rhodococcus rhodochrous ИЭГМ 66. Прикл. биохим. микробиол., 2010, т. 46 (6), с. 637-643; Elkin А.А., Kylosova T.I., Grishko V.V., Ivshina I.B. Enantioselective oxidation of sulfides to sulfoxides by Gordonia terrae IEGM 136 and Rhodococcus rhodochrous IEGM 66. J. Mol. Catal. B: Enzym., 2013, v. 89, p. 82-85; He Y.-C, Ma C.-L. et al. Highly enantioselective oxidation of phenyl methyl sulfide and its derivatives into optically pure (*S)-sulfoxides with Rhodococcus sp.CCZU10-1 in an n-octane-water biphasic system. Appl. Microbiol. Biotechnol., 2013, v. 97, p. 10329-10337].
В частности, биоконверсия тиоанизола (1,0 г/л), осуществленная в течение 72 часов с использованием штамма R. equi IFO 3730, привела к образованию (R)-фенилметилсульфоксида с энантиомерным избытком (ее) 75% [Ohta Н., Okamoto Y., Tsuchihashi G. Asymmetric synthesis of chiral sulfoxides via microbial oxidation of sulfides. Chem. Lett., 1984, v. 13. (2), p. 205-208].
Успешная биоконверсия ряда арилалкилсульфидов в (S)-сульфоксиды с высоким энантиомерным избытком (>99% ее) продемонстрирована китайскими учеными в условиях использования двухфазной системы октан-вода и высокой (80 г кл/л) концентрации бактериальной биомассы Rhodococcus sp. CCZU10 [Не Y.-C, Ma C.-L. et al. Highly enantioselective oxidation of phenyl methyl sulfide and its derivatives into optically pure (S)-sulfoxides with Rhodococcus sp. CCZU10-1 in an n-octane-water biphasic system. Appl. Microbiol. Biotechnol., 2013, v. 97, p. 10329-10337]. При этом нагрузка сульфидов составляла 100 ммоль, а химические выходы образующихся через 24 часа фенилметилсульфоксида и n-толилметилсульфоксида - 55,3 и 78,7% соответственно.
Chen с соавт. [Chen Y., Zhuo J. et al. Stereoselective oxidation of sulfides to optically active sulfoxides withresting cells of Pseudomonas monteilii CCTCC M2013683. J. Mol. Catal. B: Enzym., 2014, v. 106, p. 100-104] провели окисление арилалкилсульфидов (30 ммоль) в соответствующие (R)-сульфоксиды в течение 24 часов с использованием нерастующих клеток Pseudomonas monteilii CCTCC М2013683. При этом выход сульфоксидов составил 54-99%, а энантиомерный избыток - 63-99%.
Авторами настоящего изобретения ранее была показана возможность получения как (R)-фенилметилсульфоксида, так и (S)-фенилметилсульфоксида из прохирального фенилметилсульфида с применением актинобактерий [Елькин А.А., Гришко В.В., Ившина И.Б. Окислительная биотрансформация тиоанизола клетками Rhodococcus rhodochrous ИЭГМ 66. Прикл. биохим. микробиол., 2010, т. 46 (6), с. 637-643; Elkin А.А., Kylosova T.I., Grishko V.V., Ivshina LB. Enantioselective oxidation of sulfides to sulfoxides by Gordonia terrae IEGM 136 and Rhodococcus rhodochrous IEGM 66. J. Mol. Catal. B: Enzym., 2013, v. 89, р. 82-85]. Однако ввиду высокой практической ценности получаемого соединения актуальной задачей является оптимизация процесса биосинтеза (R)-фенилметилсульфоксида. Решение этой задачи предполагало принципиальную возможность получения сульфоксидов в условиях обеспечения приемлемых стандартов энантиоселективного окисления прохиральных сульфидных субстратов.
Наиболее близким к заявленному способу является способ получения (R)-фенилметилсульфоксида путем окислительной биотрансформации соответствующего сульфида с использованием свободных клеток Gordonia terrae ИЭГМ 136 в н-гексадекансодержащей среде или с использованием иммобилизованных клеток G. terrae ИЭГМ 136 в глицеринсодержащей среде. Продолжительность процесса биотрансформации составляла 3 сут [Elkin А.А., Kylosova T.I., Grishko V.V., Ivshina LB. Enantioselective oxidation of sulfides to sulfoxides by Gordonia terrae IEGM 136 and Rhodococcus rhodochrous IEGM 66. J. Mol. Catal. B: Enzym., 2013, v. 89, р. 82-85]. Целевой (R)-фенилметилсульфоксид получали с достаточно высокими показателями выхода и энантиомерной однородности. Однако в приведенном примере максимальная нагрузка сульфидного субстрата в условиях использования одной порции биокатализатора не превышала 1,5 г/л, при этом процесс протекал в глицеринсодержащей среде.
Таким образом, недостатком описанного ранее способа являются низкий уровень трансформируемого сульфидного субстрата и невозможность достижения высоких качественных показателей процесса в условиях глицеринсодержащей среды.
Цель настоящего изобретения - оптимизация процесса биотрансформации прохиральных сульфидов с образованием (R)-сульфоксидов на примере окисления модельного фенилметилсульфида с использованием клеток G. terrae ИЭГМ 136, иммобилизованных в криогель на основе поливинилового спирта (ПВС).
Техническим результатом описываемого способа является увеличение концентрации трансформируемого сульфида за счет многократного использования иммобилизованных клеток или дробного внесения сульфидного субстрата в условиях соокисления с
н-гексадеканом.
Описываемый способ получения (R)-сульфоксида предусматривает взаимодействие прохирального сульфида с биокатализатором - клетками штамма G. terrae ИЭГМ 136 в минеральной среде К с добавлением 0,1 об. % н-гексадекана в качестве источника углерода и энергии, причем в качестве биокатализатора используют указанные бактериальные клетки, иммобилизованные в матрицу криогеля на основе поливинилового спирта.
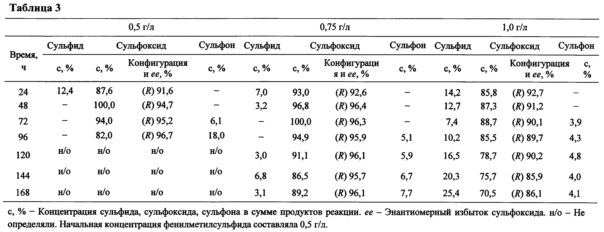
В заявляемом способе в качестве сульфидного субстрата используют фенилметилсульфид. Описываемый способ обладает рядом существенных преимуществ. Процесс протекает в минеральной среде, содержащей не более 0,1 об. % н-гексадекана. Обеспечивается возможность оптимизации процесса биотрансформации фенилметилсульфида в оптически чистый (R)-сульфоксид с использованием приема дробного внесения сульфидного субстрата. Экспериментально обоснована возможность многократного использования иммобилизованных клеток для биотрансформации прохиральных сульфидов. При этом на начальных этапах биосинтеза (R)-фенилметилсульфоксида клетками гордоний используется остаточный н-гексадекан, который содержится в гранулах биокатализатора.
Используемый в способе штамм G. terrae ИЭГМ 136, выделенный из загрязненной нефтепродуктами почвы, хранится в Региональной специализированной коллекции алканотрофных микроорганизмов (акроним коллекции ИЭГМ, www.iegm.ru/iegmcol, Институт экологии и генетики микроорганизмов УрО РАН, г. Пермь, Россия). Штамм депонирован в Всероссийской коллекции промышленных микроорганизмов под номером ВКПМАС-1897.
В биотехнологии для иммобилизации применяются ферментные системы или индивидуальные ферменты, фрагменты или вся метаболическая система микробной клетки. Применение целых клеток предпочтительнее, поскольку оно позволяет избежать стадии выделения и очистки ферментных препаратов, применения дорогостоящих кофакторов. В живой клетке наряду с образованием целевого продукта реализуются сложноорганизованные процессы (регенерация кофакторов, в частности), способствующие поддержанию ее каталитической активности на высоком уровне. Иммобилизованные на различных носителях микроорганизмы по сравнению с незакрепленными клетками в течение длительного времени сохраняют функциональную активность, более устойчивы к воздействию ксенобиотиков и неблагоприятным факторам среды [van Loosdrecht М.С.М., Lyklema J., Norde W., Zehnder AJ.B. Influence of interfaces on microbial activity. Microbiol. Rev., 1990, v. 54, p. 75-87; Cassidy M.B., Lee H., Trevors J.T. Environmental applications of immobilized microbial cells: a review. J. Ind. Microbiol. Biotechnol., 1996, v. 6, р. 79-101]. Использование в качестве биокатализатора процесса сульфоксидирования бактериальных клеток, иммобилизованных в гелевый носитель, обеспечивает ряд преимуществ технического характера. Криогели на основе поливинилового спирта (ПВС) представляют собой макропористые вязкоупругие полимерные гелевые материалы, получаемые в результате криогенной обработки (замораживание - выдерживание в замороженном состоянии - оттаивание) растворов ПВС [Lozinsky V.I., Galaev I.Yu. et al. Polymeric cryogels as promising materials of biotechnological interest. Trends Biotechnol., 2003, v. 21, p. 445-451.]. По сравнению с другими гелевыми носителями, ПВС-криогели биологически совместимы и нетоксичны для клеток, они механически и химически стабильны, а их макропористая структура обеспечивает свободный массоперенос субстратов и метаболитов.
Клеточные суспензии G. terrae ИЭГМ 136, используемые для иммобилизации, получали культивированием гордоний в среде, содержащей 3,0 об. % н-гексадекана. Остаточное содержание н-гексадекана в биокатализаторе (из расчета 60 гранул/30 мл среды) составляло 0,1 об. %. Экспериментально установлено, что при данной концентрации н-гексадекана стереоселективное окисление фенилметилсульфида иммобилизованными клетками G. terrae ИЭГМ 136 протекает наиболее эффективно.
Способ осуществляется следующим образом.
Культивирование иммобилизованных клеток G. terrae ИЭГМ 136 проводят в инкубационной минеральной среде объемом 30 мл, содержащей фенилметилсульфид, при постоянном перемешивании (160 об/мин) и 28°C. В среду культивирования добавляют 60 гранул иммобилизованного биокатализатора (5,0±0,6×106 кл/мл, 8,0±0,5 г/л сырой биомассы), предварительно регидратированных в 0,5%-ном растворе NaCl в течение 24 ч. Продолжительность процесса биотрансформации составляет от 24 до 72 ч. В качестве контроля используют стерильный раствор фенилметилсульфида в минеральной среде, а также носитель в 30 мл среды, содержащей фенилметилсульфид.
Долговременная каталитическая стабильность иммобилизованных клеток в процессе биотрансформации сульфида установлена при изучении многократных периодических биотрансформаций сульфида. После каждого цикла инкубации (24 ч/цикл) использованную среду декантируют, иммобилизованные в ПВС клетки трижды промывают стерильным 0,5% раствором NaCl и переносят в свежеприготовленную минеральную среду, содержащую 0,5 г/л фенилметилсульфида и 0,1 об. % н-гексадекана. Осуществляют процесс биотрансформации, проводят анализ остаточного сульфида и продуктов его биоконверсии в постферментационной среде.
Кроме того, применяли дробное внесение фенилметилсульфида в среду ферментации. Начальная концентрация фенилметилсульфида составляла 0,5 г/л. Добавление новой порции (0,5-1,0 г/л) сульфида осуществляли каждые 24 ч в течение 144 ч. Через 96 ч культивирования в среду дополнительно вносили н-гексадекан 0,1 об. %. Образование сульфоксида контролировали путем периодического отбора образцов культуральной жидкости (0,5 мл) в стерильных условиях с интервалом 24 ч (перед внесением новой порции сульфидного субстрата) в течение 168 ч.
Продукты биотрансформации фенилметилсульфида экстрагировали с помощью этилацетата. Объединенные этилацетатные вытяжки обезвоживали над Na2SO4. Растворитель удаляли с помощью роторного испарителя (Heidolph). Образование продуктов биотрансформации контролировали методом тонкослойной хроматографии на пластинах с флуоресцентной добавкой (Sigma-Aldrich), фиксируя наличие продуктов окисления в УФ (254 нм) при сравнении с эталонными образцами. В качестве эталонных образцов использовали сульфоксид и сульфон, синтезированные из фенилметилсульфида с помощью метода химического окисления [Grishko V.V., Ivshina LB., Tolstikov A.G. Bioconversion of thioanisole by actinobacteria Rhodococcus sensu stricto. Biotechnol. Russia, 2004, v. 5, p. 69-77].
Качественный и количественный анализ продуктов биотрансформации осуществляли методом хромато-масс-спектрометрии (ХМС) с помощью газового хроматографа 6890N Agilent с кварцевой колонкой HP-5MS SN US 15189741-1 и квадрупольным масс-спектрометром MSD 5973N в качестве детектора. Фенилметилсульфоксид выделяли с использованием колоночной хроматографии на силикагеле (Merck) при соотношении вещества и сорбента ≈1:12. В качестве элюента использовали смесь гексана с градиентом 5-40% этилацетата. Величину удельного оптического вращения фенилметилсульфоксида в хлороформе измеряли на поляриметре модели 341 (Perkin-Elmer) при длине волны 589 нм. Конфигурацию асимметрического центра фенилметилсульфоксида подтверждали путем сравнения экспериментального значения [αD] с литературными данными [Holland H.L., Popperl Н. et al. The oxidation of organic sulphides by Mortierella isabellina. 2. Effects of substituents on the stereochemistry of sulphoxide formation. Can. J. Chem., 1985, v. 63, p. 1118-1120; Boyd D.R., Sharma N.D. Dioxygenase-catalysed oxidation of alkylaryl sulfides: sulfoxidation versus cis-dihydrodiol formation. Org. Biomol. Chem., 2004, v. 2, p. 2530-2537; Boyd D.R., Sharma N.D. Toluene and naphthalene dioxygenase-catalyzed sulfoxidation of alkyl aryl sulfides. J. Chem. Soc. Perkin Trans., 1998, v. 1 (12), р. 1929-1933]. Полученный (R)-фенилметилсульфоксид использовали в качестве стандарта для определения времени удержания (R)- и (S)-изомеров методом хиральной ВЭЖХ с помощью хроматографа LC Prominence (Shimadzu), оборудованного хиральной колонкой Knauer® и диодноматричным детектором. В таблице 1 представлены условия для детекции (R)- и (S)-фенилметилсульфоксидов. Энантиомерный избыток (R)-фенилметилсульфоксида определяли по формуле:
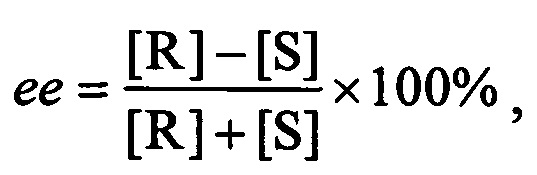
где [R] и [S] - концентрации (R)- и (S)-сульфоксидов соответственно.
В качестве носителя использовали гетерофазный макропористый криогель на основе поливинилового спирта производства ПО Азот (Невинномысск, Россия). Бактериальную суспензию (ОП600 1.6) вносили в раствор ПВС в соотношении 1:2 об/об. Полученную смесь раскапывали в полистироловые круглодонные планшеты стандартной конфигурации 8×12 (96) лунок. Поэтапное замораживание и оттаивание гранул осуществляли согласно методике [Kuyukina M.S., Ivshina LB. et al. Immobilization of hydrocarbonoxidizing bacteria in poly(vinyl alchohol) cryogels hydrophobized using a biosurfactant. J. Microbiol. Methods, 2006, v. 65, p. 596-603.]. Остаточное содержание н-гексадекана в гранулах определяли весовым методом. Хранение полученных иммобилизованных клеток осуществляли при +5°C.
Пример 1
Биотрансформацию фенилметилсульфида иммобилизованными клетками G. terrae ИЭГМ 136 проводят в инкубационной минеральной среде, содержащей (г/л): KNO3 - 1,0; K2HPO4 - 1,0; KH2PO4 - 1,0; NaCl - 1,0; MgSO4⋅7H2O - 0,2; CaCl2⋅2H2O - 0,02; FeCl3 - 0,001. В качестве источника углерода служит остаточный в гранулах биокатализатора н-гексадекан, концентрация которого составляет 0,1 об. %. В среду добавляют дрожжевой экстракт 0,1% (Микроген, Россия), раствор микроэлементов 0,1% (1,5 г/л FeCl3×7H2O, 0,1 г/л H3BO3, 0,01 г/л ZnSO4×7H2O, 0,05 г/л Co(NO3)2×6H2O, 0,005 г/л CuSO4×5H2O, и 0,005 г/л MnCl2×4H2O). Культивирование иммобилизованных гордоний проводят в колбах Эрленмейера вместимостью 100 мл с объемом инкубационной минеральной среды 30 мл при постоянном перемешивании (160 об/мин) и 28°C. В среду культивирования добавляют 60 гранул иммобилизованного биокатализатора (5,0±0,6×106 кл/мл, 8,0±0,5 г/л сырой биомассы), предварительно регидратированных в 0,5%-ном растворе NaCl в течение 24 ч. Фенилметилсульфид (0,5 г/л) в среду культивирования добавляют в виде раствора в изопропаноле (1:10 v/v). Продолжительность процесса биотрансформации составляет 72 ч.
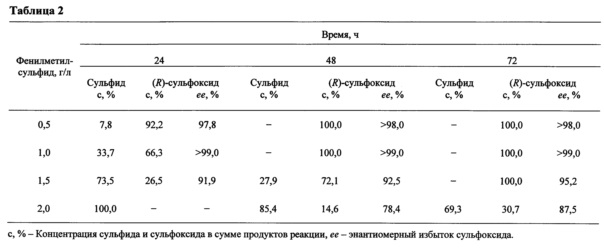
Степень конверсии фенилметилсульфида через 24 часа составляет >92%, энантиомерный избыток (R)-фенилметилового сульфоксида ≥98%. При последующем увеличении продолжительности (до 72 ч) эксперимента изменения показателя энантиомерного избытка (R)-фенилметилового сульфоксида не наблюдается (Таблица 2). Выход (R)-фенилметилового сульфоксида составляет 85-90%.
Пример 2
Способ осуществляется по Примеру 1, но в среду культивирования добавляют 1,0 г/л фенилметилсульфида. Полная конверсии фенилметилсульфида регистрируется через 48 ч, энантиомерный избыток (R)-фенилметилового сульфоксида составляет ≥99%. При последующем увеличении продолжительности (до 72 ч) эксперимента изменения ее (R)-фенилметилового сульфоксида не наблюдается (Таблица 2). Выход (R)-фенилметилового сульфоксида составляет 85-90%.
Пример 3
Способ осуществляется по Примеру 1, но в среду культивирования добавляют 1,5 г/л фенилметилсульфида. Полная конверсии фенилметилсульфида регистрируется через 72 ч, энантиомерный избыток (R)-фенилметилового сульфоксида составляет ≥95% (Таблица 2). Выход (R)-фенилметилового сульфоксида составляет 85-90%.
Пример 4
Способ осуществляется по Примеру 1, но в среду культивирования добавляют 2,0 г/л фенилметилсульфида. Конверсия фенилметилсульфида через 72 ч составляет не более 31%, энантиомерный избыток (R)-фенилметилового сульфоксида составляет 87-88% (Таблица 2). Выход (R)-фенилметилового сульфоксида составляет не более 25%.
Пример 5
Способ осуществляется по Примеру 1, после 24 ч процесса биотрансформации фенилметилсульфида использованную среду декантируют, иммобилизованные клетки трижды промывают стерильным 0,5% раствором NaCl и переносят в свежеприготовленную минеральную среду, содержащую 0,5 г/л сульфида и 0,1 об. % н-гексадекана. Перенос биокатализатора осуществляют семь раз.
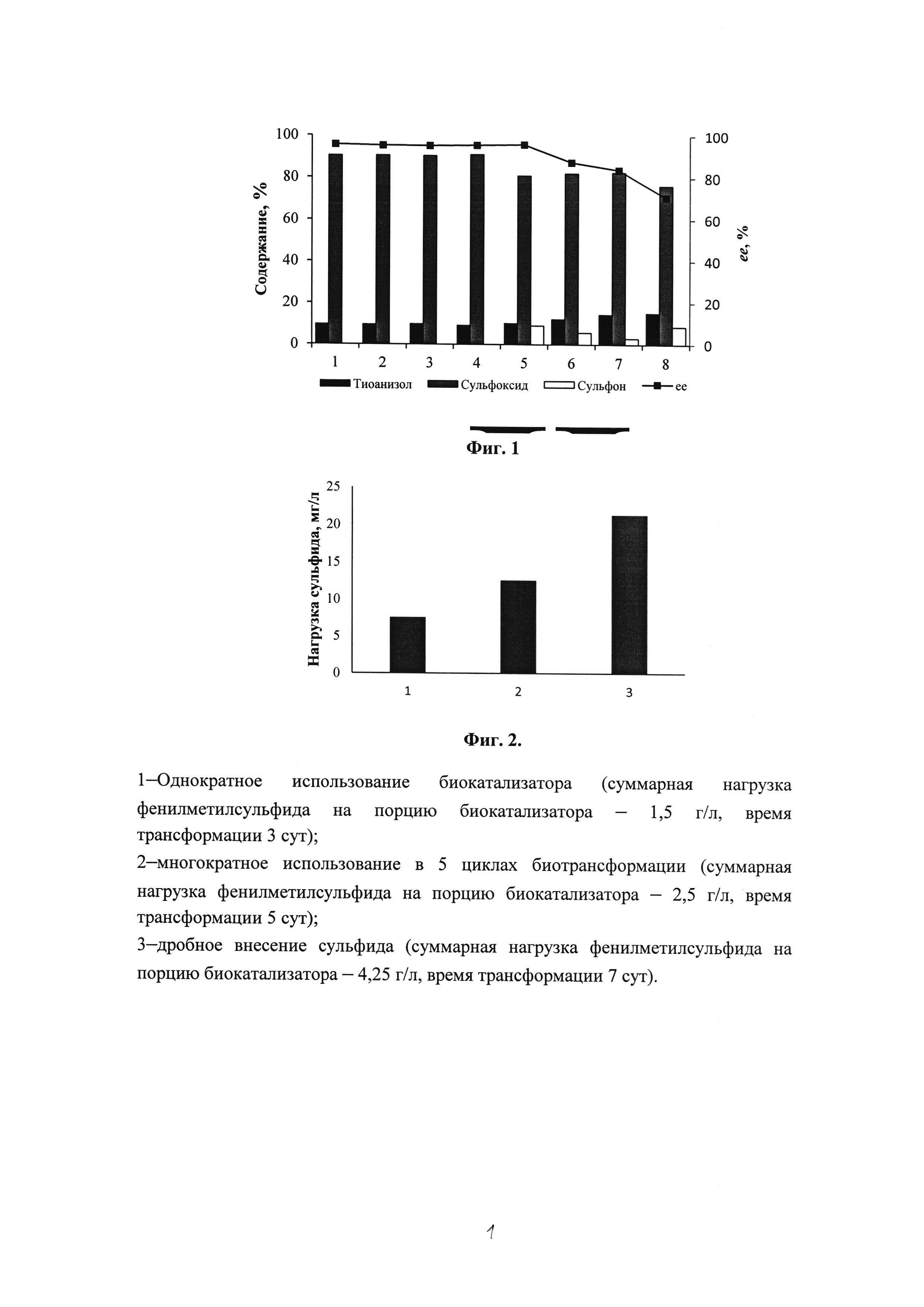
Биоконверсия (84,9-90,5%) фенилметилсульфида в концентрации 0,5 г/л стабильно регистрируется на протяжении восьми циклов использования одной порции иммобилизованных клеток G. terrae ИЭГМ 136, что позволяет осуществить в течение 192 ч окисление 4,0 г/л фенилметилсульфида в целевой (R)-сульфоксид (Фиг.1). Выход (R)-фенилметилового сульфоксида составляет 85-90%. Энантиомерный избыток (R)-сульфоксида на протяжении первых пяти циклов составляет ≥95%. Однако эксплуатация закрепленных в матрице ПВС-криогеля гордоний в последующих циклах биотрансформации фенилметилсульфида приводит к постепенному снижению энантиомерного избытка образующегося (R)-сульфоксида, уровень которого после восьмого цикла составляет 70%. Таким образом, снижение энантиоселективности процесса в ходе многократного применения биокатализатора при использовании сульфида в малых (0,5 г/л) концентрациях целесообразно на протяжении 5 циклов с суммарной нагрузкой фенилметилсульфида 2,5 г/л (Фиг. 2).
Пример 6
Способ осуществляется по Примеру 1, но через каждые 24 ч инкубации биокатализатора в среду культивирования добавляют по 0,5 г/л сульфида. Трансформация фенилметилсульфида осуществляется на протяжении 96 ч (4 цикла). Суммарная нагрузка фенилметилсульфида составляет 2,0 г/л.
Дробное добавление сульфида в дозах по 0,5 г/л приводит к накоплению в продуктах реакции 18% нежелательного сульфона уже через 96 ч, показатель ее целевого (R)-сульфоксида составляет >94%. Выход (R)-фенилметилового сульфоксида через 96 ч конверсии составляет 70-75%.
Пример 7
Способ осуществляется по Примеру 1, но через каждые 24 ч инкубации клеток в среду культивирования добавляют по 0,75 г/л фенилметилсульфида. Через 96 ч инкубации в среду культивирования добавляют 0,1 об. % н-гексадекана. Трансформация фенилметилсульфида осуществляется на протяжении 168 ч (7 циклов). Суммарная нагрузка фенилметилсульфида составляет 4,25 г/л.
Увеличение концентрации дополнительно вносимого сульфида до 0,75 г/л обеспечивает полную биоконверсию 2,0 г/л фенилметилсульфида в (R)-сульфоксид (ее≥97%) в течение 72 ч. При этом в продуктах реакции сульфон не обнаруживается. Дальнейшее добавление фенилметилсульфида в дозах по 0,75 г/л приводит к постепенному накоплению сульфона, содержание которого через 168 ч биотрансформации сульфида не превышает 8,0%. В постферментационной жидкости присутствует также непрореагировавший (до 3,1%) фенилметилсульфид. Суммарная нагрузка сульфида через 168 ч достигает 4,25 г/л, а содержание целевого (R)-фенилметилсульфоксида (ее≥96%) составляет более 89%. Выход (R)-фенилметилового сульфоксида составляет 80-85%. Из расчета суммарной нагрузки сульфида на одну гранулу биокатализатора данный способ получения (R)-фенилметилсульфоксида наиболее оптимален (Фиг. 2).
Пример 8
Способ осуществляется по Примеру 1, но через каждые 24 ч инкубации клеток в среду культивирования добавляют по 1,0 г/л фенилметилсульфида. Через 96 ч инкубации в среду культивирования добавляют 0,1 об. % н-гексадекана. Трансформация фенилметилсульфида осуществляется на протяжении 168 ч (7 циклов). Суммарная нагрузка фенилметилсульфида составляет 5,5 г/л.
При внесении фенилметилсульфида в дозах по 1,0 г/л его суммарная нагрузка в среде культивирования по окончании эксперимента достигает 5,5 г/л. Через 168 ч содержание (R)-сульфоксида составляет 70,5%, при этом в продуктах биотрансформации регистрируется остаточный фенилметилсульфид 25,4% и продукт более глубокого окисления фенилметилсульфида - сульфон до 4,1%. Выход (R)-фенилметилового сульфоксида составляет 60-65%. Дальнейшее продолжение процесса биотрансформации сульфида нецелесообразно ввиду происходящего разрушения гранул ПВС, что приводит к выходу (утечке) бактериальных клеток в среду культивирования.
Фиг. 1. Многократное использование биокатализатора в процессе биотрансформации фенилметилсульфида (0,5 г/л).
Фиг. 2. Нагрузка фенилметилсульфида на одну гранулу биокатализатора при однократном использовании биокатализатора, многократном использовании биокатализатора и дробном внесении фенилметилсульфида.
Табл. 1. Экспериментально подобранные условия хиральной ВЭЖХ для детекции (R)- и (S)-фенилметилсульфоксидов.
Табл. 2. Биотрансформация фенилметилсульфида иммобилизованными клетками G. terrae ИЭГМ 136.
Табл. 3. Динамика биотрансформации фенилметилсульфида иммобилизованными клетками G. terrae ИЭГМ 136 при дробном внесении сульфида в среду культивирования.