Результат интеллектуальной деятельности: Способ анализа соматических мутаций в химерном гене BCR/ABL с использованием ОТ-ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом)
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области генетики, молекулярной биологии и медицины и касается способа определения устойчивости к терапии иматинибом при хроническом миелолейкозе посредством анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL с использованием обратной транскрипции - полимеразной цепной реакции (ОТ-ПЦР) и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом).
Уровень техники
Известен ряд способов определения соматических мутаций, в которых используются различные инструменты для анализа уникальной нуклеотидной последовательности ДНК человека. Условно среди них можно выделить шесть групп:
1) Ферментативные методы:
полиморфизм длин рестрикционных фрагментов (RFLP);
ПЦР, обогащенная мутантной последовательностью;
LNA-блокирующая ПЦР в реальном времени (LNA-clamp PCR);
PNA-блокирующая ПЦР в реальном времени (PNA-clamp PCR);
аллель-специфическая ПЦР (AS-PCR, PCR-SSP);
секвенирование по Сенгеру;
высокопроизводительное секвенирование (NGS).
2) Химические методы:
химическое расщепление гетеродуплексов;
химическое лигирование.
3) Методы, основанные на различной электрофоретической подвижности полиморфных участков ДНК:
гетеродуплексный анализ (НА);
разделение продуктов амплификации посредством капиллярного электрофореза.
4) Детекция на твердой фазе:
гибридизация на олигонуклеотидных матрицах;
оптико-волоконный ДНК-гибридизационный анализ;
элонгация иммобилизованных праймеров (минисеквенирование);
пиросеквенирование.
5) Хроматографические методы:
Денатурирующая высокоэффективная жидкостная хроматография (ВЭЖХ).
Наиболее распространенными из представленных методов являются:
1. Секвенирование амплифицированных фрагментов ДНК по Сенгеру.
High-sensitivity detection of BCR-ABL kinase domain mutations in imatinib-naive patients: correlation with clonal cytogenetic evolution but not response to therapy. Willis SG1, Lange T, Demehri S, Otto S, Crossman L, Niederwieser D, Stoffregen EP, McWeeney S, Kovacs I, Park B, Druker BJ, Deininger MW. Blood. 2005 Sep 15; 106(6): 2128-37. Epub 2005 May 24.
Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommenddations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood. 2006; 108(1): 28-37
2. Денатурирующая высокоэффективная жидкостная хроматография (Д-ВЭЖХ).
Detection of ABL kinase domain mutations with denaturing high-performance liquid chromatography / Deininger MW, McGreevey L, Willis S, Bainbridge TM, Druker BJ, Heinrich MC // Leukemia. - 2004. - Vol. 18. - P. 864-871.
Denaturing-HPLC-based assay for detection of ABL mutations in chronic myeloid leukemia patients resistant to Imatinib / Soverini S, Martinelli G, Amabile M, et al. // Clin Chem. - 2004. - Vol. 50. - P. 1205-1213.
Use of denaturing HPLC for detection of mutations in the BCR-ABL kinase domain in patients resistant to Imatinib / Irving JA, O'Brien S, Lennard AL, Minto L, Lin F, Hall AG. // Clin Chem. - 2004. - Vol. 50. - P. 1233-1237.
3. Аллель-специфичная ПЦР (AS-PCR).
High-sensitivity detection of BCR-ABL kinase domain mutations in imatinib-naive patients: correlation with clonal cytogenetic evolution but not response to therapy / Willis SG, Lange T, Demehri S, Otto S, Crossman L, Niederwieser D, Stoffregen EP, McWeeney S, Kovacs I, Park B, Druker BJ, Deininger MW // Blood. - 2005. - Vol. 106. - P. 2128-37.
Establishment of real-time fluorescent quantitative polymerase chain reaction for rapid detection of M244V mutation in kinase domain of BCR-ABL fusion gene / Huang Q, DU X, Zhang QX, Zhuo JC // Zhongguo Shi Yan Xue Ye Xue Za Zhi. - 2014. - Vol. 22. - P. 1728-34.
Sensitive detection of pre-existing BCR-ABL kinase domain mutations in CD34+ cells of newly diagnosed chronic-phase chronic myeloid leukemia patients is associated with imatinib resistance: implications in the post-imatinib era / Iqbal Z, Aleem A, Iqbal M, Naqvi MI, Gill A, Taj AS, Qayyum A, ur-Rehman N, Khalid AM, Shah IH, Khalid M, Haq R, Khan M, Baig SM, Jamil A, Abbas MN, Absar M, Mahmood A, Rasool M, Akhtar T // PLoS One. - 2013. - Vol. 8.
Метод 1 является наиболее широко распространенным методом выявления мутаций у резистентных пациентов, он позволяет детектировать любую мутацию в исследуемом участке. Основными недостатками этого подхода является довольно низкая чувствительность (наличие более 20% опухолевых клеток в образце), при которой мутантный клон не всегда может быть выявлен, и сложность интерпретации полученных результатов в условиях клинико-лабораторной диагностики.
Метод 2 дает возможность узнать, есть ли мутация в исследуемом образце, но не позволяет идентифицировать, какая именно. Подходит для прескрининга, в случае положительного ответа образец подвергается секвенированию для определения мутации. Метод обладает чувствительностью 2-5% опухолевых клеток в образце. Однако он требует дорогостоящего оборудования, также для подтверждения результата анализа необходимо последующее ДНК-секвенирование с целью идентификации обнаруженных мутантных аллелей.
Метод 3 обладает очень высокой чувствительностью и способен выявлять 1 мутантную клетку среди 1000 клеток с последовательностью дикого типа. Клиническое значение выявления такого слабо представленного клона до лечения не всегда очевидно, к тому же для исследования мутационного спектра требуется постановка множества индивидуальных реакций.
Новые технологии выявления мутаций с высокой чувствительностью, такие как масс-спектрометрия, секвенирование нового поколения (next generation sequencing, NGS), цифровая ПЦР, пока остаются экспериментальными дорогостоящими подходами и не используются в повседневной клинической практике.
Таким образом, существует острая потребность в разработке способа выявления основных клинически значимых мутаций в химерном гене BCR/ABL, влияющих на чувствительность опухоли к терапии иматинибом при ХМЛ.
В настоящее время существуют методы анализа мутаций в тирозин-киназном домене гена BCR/ABL, ассоциированных с чувствительностью опухоли к терапии иматинибом. Спектр анализируемых мутаций существенно варьируется.
В некоторых патентах описаны способы определения только 1 мутации. Например, в заявке на патент WO 2011 KR 08056 20111027 (опубл. 18.05.2012) описан способ детекции мутации T315I с использованием ПЦР в реальном времени и подавлением амплификации «дикого типа» с помощью PNA (peptide nucleic acid). Метод, описанный в патенте JP 2006325446 (опубл. 18.05.2012), позволяет детектировать мутации в локусе Е255.
С другой стороны, некоторые методы позволяют выявлять любые возможные мутации в киназном домене гена BCR-ABL. Это достигается за счет того, что изобретения представляют собой наборы прамеров для амплификации изучаемого участка, а также праймера, с которого осуществляется секвенирование. В качестве матрицы может быть использована РНК (патент CN 103045590, опубл. 17.04.2013) или геномная ДНК (патент CN 102676638, опубл. 19.09.2012). Однако диагностическая важность подтверждена лишь для части мутаций, а трудности подготовки и интерпретации результатов являются существенным недостатком данных методик для применения в клинической практике.
Более востребованными являются методы определения наиболее клинически значимых и часто встречающихся мутаций в тирозин-киназном домене гена BCR-ABL.
Метод, описанный в патенте CN 104372095 (опубл. 25.02.2015), позволяет производить одновременный анализ 7 точечных мутаций в киназном домене гена BCR/ABL с помощью ПЦР в реальном времени с использованием специфических праймеров и зондов. Выполнение анализа производится в 7 пробирках на один анализируемый образец, что является трудоемким для клинической диагностики, а также требует дорогостоящего оборудования.
Жидкий чип, описанный в патенте CN 101984071 (опубл. 09.03.2011), позволяет детектировать 16 мутаций в 13 кодонах. В основе метода лежит ПЦР на микросферах с использованием аллель-специфичных праймеров. Метод обладает высокой чувствительностью, но для проведения анализа и интерпретации результатов требуется дорогостоящее оборудование.
В патенте CN 103667269 (опубл. 26.03.2014) описан метод, который применяется для обогащения последовательностями химерного гена BCR-ABL с последующим проведением высокопроизводительного секвенирования нового поколения. Метод является трудоемким и дорогостоящим и не может быть использован в рутинной клинической практике.
Поскольку все имеющиеся в настоящее время методы определения соматических мутаций в киназном домене гена BCR-ABL обладают теми или иными недостатками, существует реальная потребность в создании простого, недорогого и специфичного метода для выявления соматических мутаций, ассоциированных с устойчивостью к терапии иматинибом, с целью дальнейшего внедрения в любую стандартную клиническую лабораторию.
Раскрытие изобретения
Сущность изобретения заключается в обеспечении способа определения соматических мутаций в тирозон-киназном домене гена BCR/ABL, которые влияют на чувствительность опухоли к терапии иматинибом. Данный способ позволяет выявлять точечные соматические мутации M244V, G250E, Y253H, Y253F, E255K, E255V, T315I, М351Т, F359C, F359I, F359V. Данные мутации определяют до 85% случаев устойчивости к терапии иматинибом [Contribution of ABL kinase domain mutations to imatinib resistance in different subsets of Philadelphia-positive patients: by the GIMEMA Working Party on Chronic Myeloid Leukemia / Soverini S, Colorossi S, Gnani A, Rosti G, Castagnetti F, Poerio A, Iacobucci I, Amabile M, Abruzzese E, Orlandi E, Radaelli F, Ciccone F, Tiribelli M, di Lorenzo R, Caracciolo C, Izzo B, Pane F, Saglio G, Baccarani M, Martinelli G; GIMEMA Working Party on Chronic Myeloid Leukemia // Clin. Cancer Res. - 2006. - Vol. 12. - P. 7374-7379].
Основными аспектами данного изобретения являются ОТ-ПЦР с последующей «гнездовой» ПЦР и гибридизацией на биочипе, содержащем набор иммобилизованных дифференцирующих олигонуклеотидных зондов.
Первый важный аспект изобретения - специфический праймер для обратной транскрипции, который используется для получения кДНК на матрице мРНК химерного гена BCR/ABL. Последовательность праймера для обратной транскрипции приведена в табл. 1 и Перечне последовательностей (SEQ ID NO: 1).
Второй важный аспект изобретения - праймеры для амплификации участка киназного домена гена BCR/ABL, набор которых используется для получения флуоресцентно меченных продуктов в необходимом для гибридизации на биочипе количестве. Последовательности праймеров для проведения ПЦР приведены в табл. 1 и Перечне последовательностей (SEQ ID NO: 2-7).
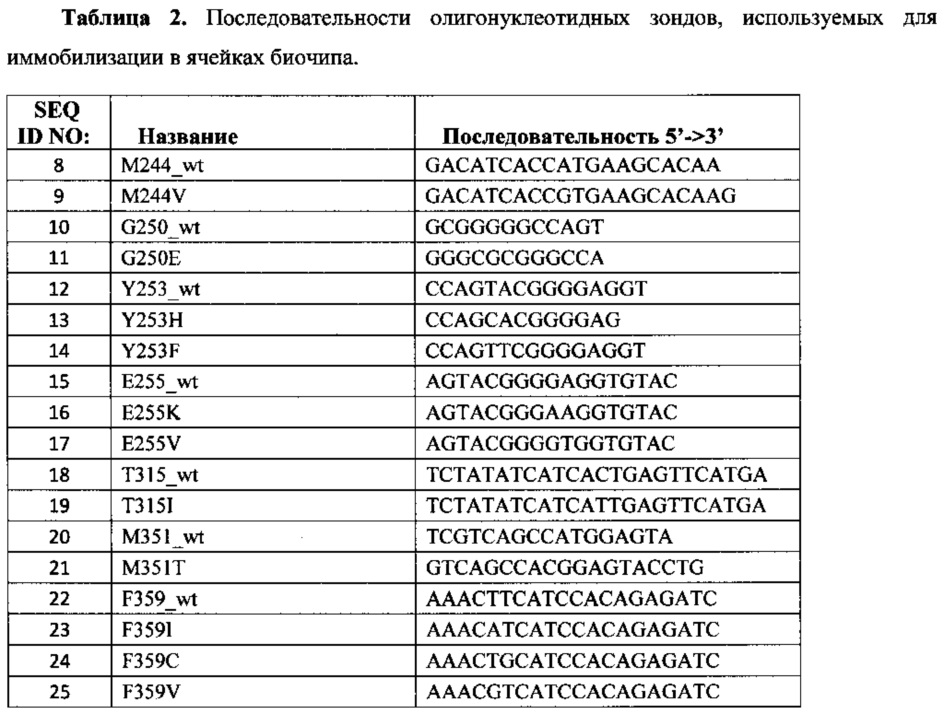
Третий важный аспект изобретения - биочип, содержащий набор иммобилизованных дифференцирующих олигонуклеотидных зондов, последовательности которых приведены в табл. 2 и Перечне последовательностей (SEQ ID NO: 8-25). Дифференцирующие олигонуклеотидные зонды иммобилизуются в ячейках гидрогелевого микрочипа, как описано в патенте RU 2206575 (опубл. 20.06.2003), в концентрации 2000 мкМ. Схема расположения зондов в ячейках биочипа для анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL приведена на Фиг. 1.
Специфический праймер для обратной транскрипции, комплементарный участку гена ABL, используется для получения кДНК на матрице мРНК химерного гена BCR/ABL. Набор праймеров для ПЦР используется для проведения «гнездовой» ПЦР для получения флюоресцентно меченного продукта для гибридизации на биочипе. На первом этапе использовались праймеры, комплементарные участкам генов ABL и BCR, за счет чего нарабатывался только продукт, соответствующий химерному гену. На втором этапе используются праймеры для наработки участков тирозин-киназного домен гена BCR/ABL, в которых расположены анализируемые кодоны, с помощью них на матрице продукта первого раунда нарабатывается одноцепочечная ДНК с одновременным введением флуоресцентной метки. Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидными зондами, расположенными на пластиковой подложке. После проведения гибридизации и отмывки биочипа проводится анализ полученной флуоресцентной картины, на основании которого делается вывод о наличии мутаций в исследуемом образце. Пример картины гибридизации приведен на Фиг. 2.
Краткое описание чертежей
Фигура 1. Схема расположения зондов в ячейках биочипа для анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL. (а) локализация ячеек на биочипе; (б) расшифровка условных обозначений. В нижних угловых позициях нанесены ячейки (М), содержащие флуоресцентный краситель Cy5, светящийся перманентно, для ориентировки и контроля интенсивности свечения.
Фигура 2. Гибридизационная картина, полученная с помощью биочипа для анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL у испытуемого №ХХХ. Распределение флюоресцентных сигналов ячеек свидетельствует о том, что образец содержит мутацию T315I.
Осуществление изобретения
Задача настоящего изобретения состоит в создании способа экспресс-диагностики соматических мутаций в тирозон-киназном домене гена BCR/ABL.
Для обеспечения оптимальных условий обратной транскрипции и ПЦР необходимо использовать специфические праймеры, отжиг которых на мишени происходит при одинаковой температуре (для одного этапа), и они не образуют при этой температуре вторичных структур. Для оптимальной наработки необходимого для гибридизации на биочипе количества флюоресцентно меченного ПЦР-продукта должны быть подобраны такие параметры, как концентрации реагентов и температурный режим реакций. В результате проведенной работы подобраны праймеры ОТ, 1 и 2 этапа ПЦР, которые позволяют осуществлять эффективную наработку фрагмента, соответствующего тирозон-киназному домену гена BCR/ABL.
Олигонуклеотиды для иммобилизации на биочипе подбираются таким образом, чтобы идентифицировать все выбранные для анализа соматические мутации в тирозон-киназном домене гена BCR/ABL.
Олигонуклеотидные зонды должны быть подобраны в соответствии со следующими критериями:
1) Олигонуклеотидный зонд должен обладать высокой специфичностью к анализируемуму локусу.
2) Предпочтительно расположение вариабельного нуклеотида в серединной области зонда, так как такая конструкция зонда позволяет добиться лучшей дискриминации между совершенными и несовершенными дуплексами.
3) Олигонуклеотидный зонд не должен образовывать стабильных вторичных структур в условиях, при которых проводится гибридизация, наличие которых может приводить к снижению эффективности гибридизации.
На биочипе для определения соматических мутаций в тирозон-киназном домене гена BCR/ABL иммобилизовано 18 высокоспецифичных дифференцирующих олигонуклеотидных зондов (табл. 2 и Перечень последовательностей (SEQ ID NO: 8-25)), структура которых обеспечивает специфичное связывание с полностью комплементарными ДНК-мишенями. Зонды подобраны таким образом, что яркий флюоресцентный сигнал наблюдается только в ячейках, с которых образовался совершенный дуплекс между олигонуклеотидным зондом и флюоресцентно меченным ПЦР-продуктом.
Приведем последовательность анализа с использованием данного метода. Обратная транскрипция на матрице РНК для получения кДНК проводится со специфическим праймером с использованием обратной транскриптазы MMLV. Амплификация ПЦР-продуктов для последующей гибридизации на биочипе проводится посредством «гнездовой» ПЦР в два этапа, при этом в качестве матрицы для проведения реакции используют образец кДНК.
ПЦР может быть проведена с использованием любого вида термостабильной полимеразы (Taq-полимераза, Tth-полимераза, Tfl-полимераза, Pfu-полимераза, Vent-полимераза, DeepVent-полимераза и другие коммерчески доступные ферменты, выделенные из термофилов), работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ), при этом вместо дТТФ может быть использован дУТФ. Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы (например, фирмы Qiagen), содержащие все необходимые компоненты за исключением праймеров.
На первом этапе проходит амплификация ДНК-локусов, соответствующих только химерной кДНК, с использованием праймеров, комплементарных участкам генов ABL и BCR. Продукт первого этапа ПЦР используют в качестве матрицы на втором этапе, который проводят в реакционной смеси того же состава, но используют праймеры д для наработки участков тирозин-киназного домен гена BCR/ABL, в которых расположены анализируемые кодоны (праймеры SEQ ID NO: 4-5 служит для наработки продукта, содержащего локусы, M244V, G250E, Y253H, Y253F, E255K, E255V; праймеры SEQ ID NO: 6-7 - T315I, М351Т, F359C, F359I, F359V) и добавляют избыток обратных праймеров для получения избытка флуоресцентно меченных одноцепочечных ПЦР-продуктов, способных к гибридизации с аллель-специфичными ДНК-зондами на биочипе. В качестве флуоресцентной метки используется Cy5-дУТФ, встраивающийся de novo в синтезируемую ДНК-цепь. В качестве флуоресцентной метки также может быть использован любой флуорохром без ограничения (например, FITC, Texas red, Cy-3 и т.д.), а также биотин.
Для синтеза праймеров и олигонуклеотидных зондов используют такие химические подходы, как фосфодиэфирный метод, гидрофосфорильный метод и т.д., при этом наиболее распространенным в настоящее время является фосфоамидитный синтез. Синтез праймеров осуществляется на автоматических ДНК/РНК синтезаторах, например, производства фирмы «Applied Biosystems» (США). Олигонуклеотидные зонды модифицируются путем добавления к 5'- или 3'-концу активной группы, обеспечивающей иммобилизацию, в автоматическом или постсинтетически в ручном режиме. Например, при синтезе олигонуклеотидных зондов с помощью 3'-Amino-Modifier С7 CPG 500 («Glen Research)), США) на 3'-конец олигонуклеотидов вводится спейсер со свободной аминогруппой, используемый для последующей иммобилизации олигонуклеотида на биочипе.
Для проведения обратной транскрипции используют праймер SEQ ID NO: 1, приведенный в Перечне последовательностей в табл. 1.
Для проведения «гнездовой» ПЦР используют праймеры SEQ ID NO: 2-7 и приведенные в Перечне последовательностей в табл. 1.
В ПЦР I этапа используют праймеры: SEQ ID NO: 2,3.
В ПЦР II этапа используют праймеры: SEQ ID NO: 4-7.
Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами, которые представляют собой участки целевых последовательностей тирозин-киназного домена гена BCR/ABL и являются комплементарными последовательностям «дикого типа» или последовательностям, содержащим мутации.
Гибридизация ПЦР-продукта с олигонуклеотидными зондами на биочипе может быть проведена в любом гибридизационном буфере, например в гуанидиновом или SSPE-буфере. Перед постановкой гибридизации ПЦР-продукт прогревают при 95°С в течение 5 мин, затем охлаждают на льду в течение 2 минут, после чего наносят гибридизационную смесь на биочип. Гибридизация проводится 12-14 ч при 37°С. Отмывка биочипа после проведения гибридизации может быть проведена в любом известном в данной области техники буфере с добавлением соли (SSC, SSPE и т.п.) или более короткое время в дистиллированной воде [Molecular cloning: a laboratory manual I J.F. Sambrook, D.W. Russell // Cold Spring Harbor Laboratory Press. - 2001].
Анализируемый фрагмент ДНК в условиях (состав реакции и температура), при которых осуществляется гибридизация, образует совершенные дуплексы только с полностью комплементарными ему олигонуклеотидными зондами. Сигнал флюоресценции детектируется только в ячейках, в которых образовался совершенный дуплекс. В случае если дуплекс несовершенный (присутствует хотя бы 1 неспаренное основание), то сигнал флюоресценции отсутствует.
После проведения гибридизации и отмывки биочипа проводится визуализация результатов гибридизации с помощью любой детектирующей системы, возбуждающей флюоресценцию и распознающей флуоресцентный сигнал (флуоресцентный микроскоп с ПЗС-камерой, лазерный сканер, портативный анализатор биочипов и т.п. коммерчески доступные флуоресцентные анализаторы, например портативный анализатор биочипов, снабженный ПЗС-камерой и специальным программным обеспечением, производства ООО «БИОЧИП-ИМБ» (Москва, Россия).
Изготовление биочипов может осуществляться посредством последовательного нанесения на поверхность подложки из стекла ячеек акриламидного геля, активации ячеек и иммобилизации в ячейках модифицированных олигонуклеотидов [Analvsis of SNPs and other genomic variations using gel-based chips / A. Kolchinsky, A. Mirzabekov // Hum Mutat. - 2002. - Vol. 19. - P. 343-360. Review]. В качестве подложки кроме стекла может быть использован другой материал, в том числе металл, гибкие мембраны и пластик (патент RU 2309959, опубликован 2007.11.10) Биочипы также могут быть изготовлены любыми другими известными специалисту в данной области способами [Arrays of immobilized oligonucleotides--contributions to nucleic acids technology / H. Seliger, M. Hinz, E. Happ // Curr Pharm Biotechnol. -2003. - Vol. 4. - P. 379-395].
Для изготовления биочипа в настоящем изобретении используется набор олигонуклеотидов SEQ ID NO: 8-25, приведенных в Перечне последовательностей, а также в табл. 2. Расположение конкретных олигонуклеотидных зондов на биочипе может варьироваться в зависимости от удобства интерпретации результатов.
Далее приводятся примеры, которые показывают применение способа анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL, ассоциированных с чувствительностью к терапии иматинибом. Следует понимать, что приводимые примеры служат исключительно для иллюстрации и не предназначены для ограничения объема притязаний, выраженных в формуле изобретения. На основании настоящего описания специалист в данной области сможет легко предложить свои варианты и модификации осуществления изобретения не отходя от общей концепции настоящего изобретения и без привлечения собственной изобретательской деятельности, так что должно быть понятно, что такие варианты и модификации также будут входить в объем притязаний настоящего изобретения.
Пример 1. Амплификация участка тирозон-киназного домена гена BCR/ABL методом ОТ-ПЦР с целью получения флуоресцентно меченного ПЦР-продукта в необходимом количестве.
Из костного мозга пациента, больного хроническим миелолейкозом, у которого была выявлена транслокация t(9;22), выделяли общую РНК с помощью набора RNeasy MiniKit (Qiagen, США).
Проводили обратную транскрипцию в объеме 25 мкл. РНК (5 мкг) инкубировали при 70°С в течение 5 мин со специфичным праймером (15 моль), затем проводили реакцию с обратной транскриптазой M-MLV («Силекс», Россия) 25 ед. на 25 мкл реакционной смеси, содержащей 25 ед. ингибитора РНКазы («Promega», США), по 1 мМ каждого dNTP («Силекс», Россия), 10 мМ дитиотрейтол, 50 мМТ рис-HCl, рН 8.3, 75 мМ KCl и 3 мМ MgCl2 при 42°С в течение 90 мин с последующей инактивацией при 70°С в течение 10 мин.
Наработку участка, соответствующего тирозон-киназному домену гена BCR/ABL, проводили методом двухраундовой «гнездовой» ПЦР. Смесь первого этапа содержала следующие праймеры - SEQ ID NO: 2, 3. ПЦР проводили на приборе Dyad («Bio-Rad», США). ПЦР-смесь первого этапа общим объемом 25 мкл включала в себя: 1× ПЦР-буфер (67 мМ Трис-HCl, рН 8.6, 166 мМ (NH4)2SO4, 0,01% Тритон Х-100), 1.5 мМ MgCl2, 0.2 мМ каждого из дНТФ («Силекс», Россия), 1.5 ед. акт. HotTaq-полимеразы («Силекс», Россия), по 10 пмоль каждого праймера, 2 мкл кДНК. Амплификацию проводили по следующей схеме: денатурация при 95°С (10 мин); далее 45 циклов: 95°С (15 с), 60°С (20 с), 72°С (120 с); затем элонгация при 72°С в течение 3 мин. Смесь второго этапа ПЦР (25 мкл) отличалась составом и концентрацией праймеров. Она содержала по 5 пмоль прямых праймеров (SEQ ID NO: 4,6) и по 50 пмоль обратных праймеров (SEQ ID NO: 5, 7), 0.2 нМ флуоресцентно меченного дУТФ-Cy5 для флуоресцентного мечения ПЦР-продукта. В качестве матрицы в смесь добавляли 1 мкл продукта I этапа ПЦР и проводили амплификацию по следующей схеме: денатурация при 95°С (10 мин); далее 45 циклов: 95°С (15 с), 60°С (20 с), 72°С (120 с); затем элонгация при 72°С в течение 3 мин.
Пример 2. Олигонуклеотидный биочип для анализа соматических мутаций в тирозон-киназном домене гена BCR/ABL.
Олигонуклеотиды для иммобилизации на микрочипе синтезируют на автоматическом синтезаторе 394 DNA/RNA Synthesizer («Applied Biosystems», США) с использованием стандартной фосфоамидитной процедуры. 3'-конец олигонуклеотидов содержит спейсер со свободной аминогруппой, который вводят в состав олигонуклеотида при синтезе путем использования 3'-Amino-Modifier С7 CPG 500 («Glen Research)), США). Присоединение флуоресцентной метки к олигонуклеотидам по свободной аминогруппе осуществляют в соответствии с рекомендациями производителя.
Биочип изготовляют методом сополимеризации олигонуклеотида в акриламидном геле, как описано ранее [Применение немодифицированных полимерных материалов для изготовления подложки биочипов, биочип на их основе и способ его изготовления, способ иммобилизации гидрогелей на немодифицированных полимерных материалах / СВ. Паньков, Э.Я. Крейндлин, ОТ. Сомова, и др. // Патент RU 2309959. - 2007], [Способ иммобилизации олигонуклеотидов, содержащих непредельные группы, в полимерных гидрогелях при формировании микрочипа /А.Д. Мирзабеков, А.Ю. Рубина, С.В. Паньков, и др. //патент RU 2175972. - 2001.]. Биочип содержит 18 иммобилизованных олигонуклеотидных зондов (SEQ ID NO: 8-25), список которых представлен также в табл. 2. Ячейки наносят согласно схеме на Фиг. 1.
Пример 3. Гибридизация меченого продукта на биочипе
Реакционную смесь, полученную после проведения II этапа ПЦР, описанного в Примере 1, используют для гибридизации на биочипе. Гибридизационная смесь общим объемом 45 мкл состояла из 6х SSPE («Promega», США), 2М раствора гуанидин-изотиоцианата и амплификата. Гибридизационную смесь денатурировали при 95°С 5 минут, охлаждали во льду 2 минуты, наносили на биочип и оставляли на 12 часов при 37°С. После проведения гибридизации биочип отмывали в 1× SSPE в течение 10 мин при комнатной температуре.
Пример 4. Регистрация и интерпретация результатов гибридизации
Регистрацию гибридизационной картины производят с помощью портативного анализатора биочипов, снабженного ПЗС-камерой, производимого ООО «Биочип-ИМБ». Описание алгоритма автоматического анализа изображения с помощью программы Image Ware™ выходит за рамки настоящего изобретения.
Определим генотип по гибридизационной картине, представленной на Фиг. 2.
В образце наблюдаются сигналы в ячейках, соответствующих последовательности «дикого типа» по локусам М244, G250, Y253, Е255, М351, F359, а также сигналы в ячейках, соответствующих мутации T315I. Соответственно, можно сделать вывод, что в образце содержится мутация Т3151.