Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ИНГИБИРОВАНИЯ ФЕРМЕНТА ТИРОЗИЛ-ДНК-ФОСФОДИЭСТЕРАЗЫ 1 ЧЕЛОВЕКА
Вид РИД
Изобретение
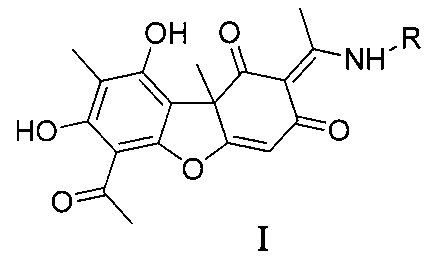
Изобретение относится к молекулярной биологии, биохимии и биотехнологии, конкретно к соединениям, представляющим собой енаминовые производные усниновой кислоты, общей формулы I:
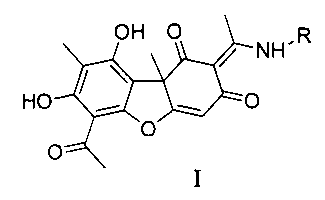
где R - ароматический заместитель, присоединенный к атому азота непосредственно или через этильный или пропильный линкер, содержащий галогеновые или гидрокси- и трет-бутильные заместители, у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
В последние годы ведутся активные поиски ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 (Tdp1), который рассматривается как перспективная фермент-мишень для создания лекарственных препаратов для лечения онкологических и нейродегенеративных заболеваний [1].
Tdp1 относится к классу фосфодиэстераз - ферментов, расщепляющих фосфодиэфирные связи [2]. Природный мутант этого фермента SCAN1 вызывает тяжелое нейродегенеративное заболевание - синдром спиноцеребеллярной атаксии и нейропатии [3].
Tdp1 играет важную роль в удалении повреждений ДНК, создаваемых топоизомеразой 1 (Top1), ее ингибитором камптотецином и антираковыми препаратами. Нормальный ферментативный цикл топоизомеразы 1 включает обратимую реакцию трансэтерификации. Остаток тирозина-723 активного центра фермента образует переходный ковалентный комплекс с 3′-фосфатом основания ДНК. При этом образуется одноцепочечный разрыв, который позволяет «разрезанной» цепи вращаться вокруг интактной, снимая локальное напряжение в спирали. Затем целостность ДНК восстанавливается за счет обратной реакции [4]. В нормальных условиях скорость реакции лигирования значительно выше, чем скорость расщепления, но в ряде случаев переходные комплексы оказываются стабильными. В частности, ингибиторы Top1, такие как камптотецин и его производные, применяющиеся в клинике, существенно замедляют скорость обратной реакции [4]. Невозможность восстановить структуру ДНК приводит к образованию одноцепочечных разрывов, которые могут превратиться в более токсичные двухцепочечные. Помимо ингибиторов, ряд повреждений ДНК вблизи от места присоединения Top1 также могут блокировать реакцию лигирования.
Tdp1 расщепляет 3′-диэфирную связь между остатком тирозина и 3′-концом ДНК, а также удаляет другие повреждения с 3′-конца ДНК [5, 6]. При этом на 3′-конце ДНК остается фосфат, на 5′-конце - гидроксильный остаток. Такая структура является субстратом для фермента полинуклеотидкиназа-3′-фосфатаза (PNKP), которая восстанавливает традиционную для эксцизионной репарации (ЭРО) конфигурацию 3′-ОН, 5′-фосфат [7]. В результате, Tdp1 противостоит ингибиторам Top1, которые являются достаточно эффективными антираковыми препаратами (см. обзоры [8, 9]). Предполагается, что именно Tdp1 ответственна за лекарственную устойчивость некоторых видов рака [4, 10]. Эта гипотеза подтверждается рядом исследований: мыши, нокаутные по Tdp1, и человеческие клеточные линии, имеющие мутацию SCAN1, гиперчувствительны к камптотецину [11-14]. И, наоборот, в клетках с повышенным уровнем экспрессии Tdp1 камптотецин и этопозид вызывают меньше повреждений ДНК [15, 16]. Таким образом, сочетание препаратов, воздействующих на Top1 и Tdp1, может существенно повысить эффективность химиотерапии.
В литературе описано немного ингибиторов Tdp1, и они обладают мягким ингибирующим действием (в диапазоне 100-10 мкМ) [4, 17, 18].
Известно также, что подавление активности Tdp1 делает опухолевые клетки гиперчувствтительными к противораковому препарату темозоломиду (метилирование пуринов) [19], метилметансульфонату (образование апуриновых/апиримидиновых сайтов), блеомицину (одноцепочечные/двухцепочечные разрывы с 3′-фосфогликолятами), перекиси водорода и ионизирующему излучению (разрывы и др. виды повреждений) [20]. Это предполагает участие Tdp1 в различных путях репарации ДНК.
Таким образом, ингибиторы Tdp1 могут увеличить цитотоксичность камптотецинов. Терапевтическим эффектом таких веществ может быть селективное увеличение активности ингибиторов Top1 в опухолях с нарушениями в процессах репарации ДНК и контроля клеточного цикла.
Наиболее ближайшим к заявляемому средству - прототипом, является фурамидин, представляющий собой гетероциклический диамидин [17] общей формулы II:
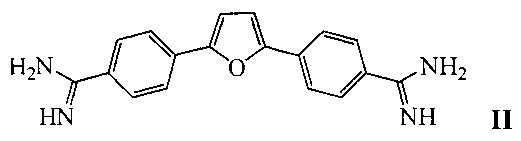
Недостатком известного средства являются низкие ингибиторные характеристики (IC50 для одноцепочечной ДНК составляет порядка 100 мкМ).
Задачей изобретения является создание более эффективного и специфичного ингибитора Tdp1 на основе природных полифенольных соединений.
Поставленная задача решается предлагаемым средством, представляющим собой одно из енаминовых производных усниновой кислоты, общей формулы (I) с повышенными ингибирующими характеристиками в отношении Tdp1 (IC50 для одноцепочечной ДНК 0.16÷1.9 мкМ).
Технический результат: повышение ингибирующего действия на фермент Tdp1 и расширение арсенала ингибиторов данного фермента.
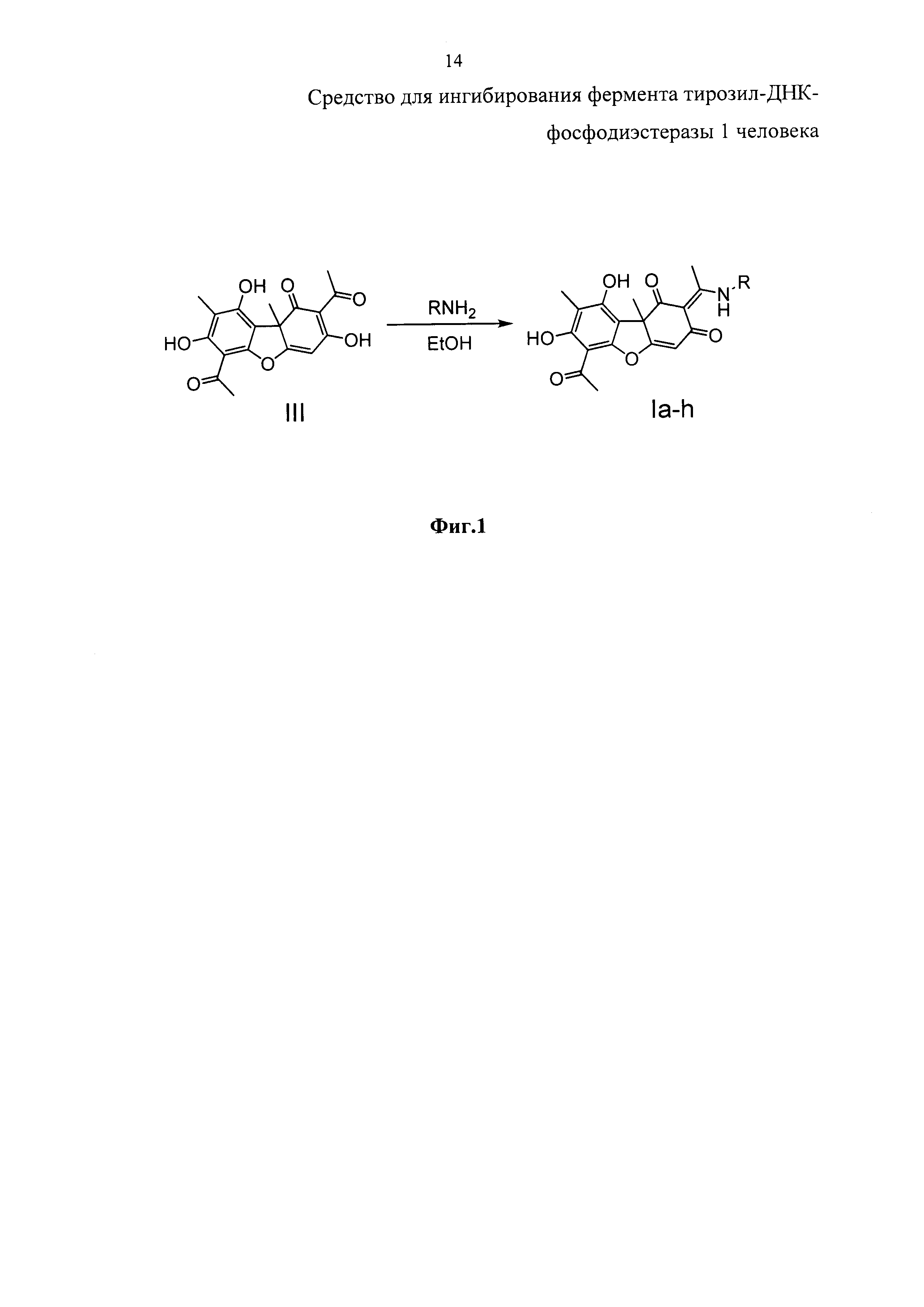
Предлагаемые соединения могут быть синтезированы в соответствии со схемой, приведенной на фиг. 1.
Енаминовые производные усниновой кислоты (таблица, соединения Ia-Ih) получают путем взаимодействия (+)- или (-)-усниновых кислот с соответствующими анилинами или аминами по методике [21]. Структура и чистота полученных соединений подтверждена данными ЯМР-спектроскопии, масс-спектрометрии и ВЭЖХ.
В качестве исходных веществ для синтеза были взяты (+)- и (-)-усниновые кислоты III (2,6-диацетил-3,7,9-тригидрокси-8,9b-диметил-9bH-дибензофуран-1-она), выделенные по методике [22]. (+)-Усниновую кислоту (+)-III {[α]20 D +478 (с 0.1; CHCl3)} выделяли из смеси лишайников рода Usnea, (-)-усниновую кислоту (-)-III {[α]20 D -458 (с 0.1; CHCl3)} выделяли из лишайника Cladonia Stellaris.
Усниновая кислота (III) является уникальным и доступным отечественным растительным метаболитом.
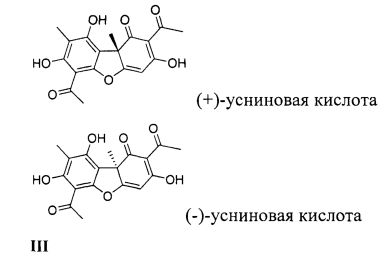
Из лишайников различных видов в достаточных количествах выделяют оптически активную усниновую кислоту с противоположными по знаку углами вращения и высокой оптической чистотой. Оба энантиомера обладают целым спектром биоактивных свойств. Наиболее широко изучены антибактериальные, инсектицидные и фунгицидные свойства усниновой кислоты, но известны также данные об активности усниновых кислот и их производных в отношении репарационного фермента ПАРП1 [23]. Соединения (+)-Ia, (+)-Id, (+)-Ie, (+)-Ig и (+)-1h были описаны в этой работе, они обладают ингибирующей активностью по отношению к ПАРП1 в миллимолярных концентрациях. Соединения (+)-Ib, (+)-Ic, (+)-Id, (+)-Ie, (+)-If были описаны в работе [24], они обладают незначительной противовирусной активностью в отношении вируса гриппа A(H1N1)2009.
Соединения общей формулы I, после проведения углубленных фармакологических исследований, могут использоваться для дальнейшей разработки новых низкотоксичных высокоэффективных противораковых средств.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Синтез (2S,4Е)-10-ацетил-4-[1-(фениламино)этилиден]-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((-)-Ia)
К 1 ммоль (-)-усниновой кислоты (III) добавляют 1.1 ммоль анилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%. В результате получают соединение (-)-Ia с выходом 92%. Все физико-химические характеристики совпадают с литературными [23].
Пример 2. Синтез (2R,4Е)-10-ацетил-4-[1-(фениламино)этилиден]-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион (соединение (+)-Ia)
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль анилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%. В результате получают соединение (+)-Ia с выходом 92%. Все физико-химические характеристики совпадают с литературными [23].
Пример 3. Синтез (2S,4Е)-10-ацетил-4-{1-[(4-фторфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((-)-Ib)
К 1 ммоль (-)-усниновой кислоты (III) добавляют 1.1 ммоль пара-фторанилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (-)-Ib с выходом 70%. Все физико-химические характеристики совпадают с литературными [24].
Пример 4. Синтез (2R,4Е)-10-ацетил-4-{1-[(4-фторфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((+)-Ib).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль пара-фторанилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-Ib с выходом 70%. Все физико-химические характеристики совпадают с литературными [24].
Пример 5. Синтез (2S,4Е)-10-ацетил-4-{1-[(3-фторфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((-)-Ic).
К 1 ммоль (-)-усниновой кислоты (III) добавляют 1.1 ммоль мета-фторанилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (-)-Ic с выходом 75%. Все физико-химические характеристики совпадают с литературными [24].
Пример 6. Синтез (2S,4Е)-10-ацетил-4-{1-[(4-хлорфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((-)-Id).
К 1 ммоль (-)-усниновой кислоты (III) добавляют 1.1 ммоль пара-хлоранилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (-)-Id с выходом 87%. Все физико-химические характеристики совпадают с литературными [21].
Пример 7. Синтез (2R,4Е)-10-ацетил-4-{1-[(4-хлорфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((+)-Id).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль пара-хлоранилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-Id с выходом 87%. Все физико-химические характеристики совпадают с литературными [21].
Пример 8. Синтез (2S,4Е)-10-ацетил-4-{1-[(4-бромфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((-)-Ie).
К 1 ммоль (-)-усниновой кислоты (III) добавляют 1.1 ммоль пара-броманилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (-)-Ie с выходом 87%. Все физико-химические характеристики совпадают с литературными [21].
Пример 9. Синтез (2R,4Е)-10-ацетил-4-{1-[(4-бромфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((+)-Ie).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль пара-броманилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-Ie с выходом 87%. Все физико-химические характеристики совпадают с литературными [21].
Пример 10. Синтез (2R,4Е)-10-ацетил-4-{1-[(3-бромфенил)амино]этилиден}-11,13-дигидрокси-2,12-диметил-8-оксатрицикло[7.4.0.02,7]тридека-1(9),6,10,12-тетраен-3,5-дион ((+)-If).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль мета-броманилина и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-If с выходом 87%. Все физико-химические характеристики совпадают с литературными [24].
Пример 11. Синтез (E)-6-ацетил-2-(1-(3,5-ди-трет-бутил-4-гидроксифенилэтиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дион (соединение (+)-Ig).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 ммоль 4-(3-аминоэтил)-2,6-ди-трет-бутилфенола и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-Ig с выходом 93%. Все физико-химические характеристики совпадают с литературными [21].
Пример 12. Синтез (E)-6-ацетил-2-(1-(3,5-ди-трет-бутил-4-гидроксифенил-пропиламино)этилиден)-7,9-дигидрокси-8,9b-диметилдибензо[b,d]фуран-1,3(2Н,9bH)-дион (соединение (+)-Ih).
К 1 ммоль (+)-усниновой кислоты (III) добавляют 1.1 4-(3-аминопропил)-2,6-ди-трет-бутилфенола и растворяют смесь в 12 мл этилового спирта. Смесь кипятят на водяной бане 3 часа, охлаждают, добавляют 10 мл дистиллированной воды. Выпавший осадок хроматографируют на колонке с силикагелем (фракции 60-200 мкм фирмы Merck). Элюент хлороформ с градиентом метанола от 0 до 5%.
В результате получают соединение (+)-Ih с выходом 91%. Все физико-химические характеристики совпадают с литературными [21].
Пример 13. Исследование влияния предлагаемых соединений на активность Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.) была экспрессирована в системе Escherichia coli (плазмида рЕТ 16B-Tdp1 предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена, как описано [2, 25].
В качестве тест-системы для определения ингибирующих свойств исследуемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3′-конца олигонуклеотида, катализируемая Tdp1. На 5′-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-HCl, рН 8,0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением Tdp1 до конечной концентрации 1,3 нМ. Измерения проводились в линейном диапазоне зависимости от скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводили с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
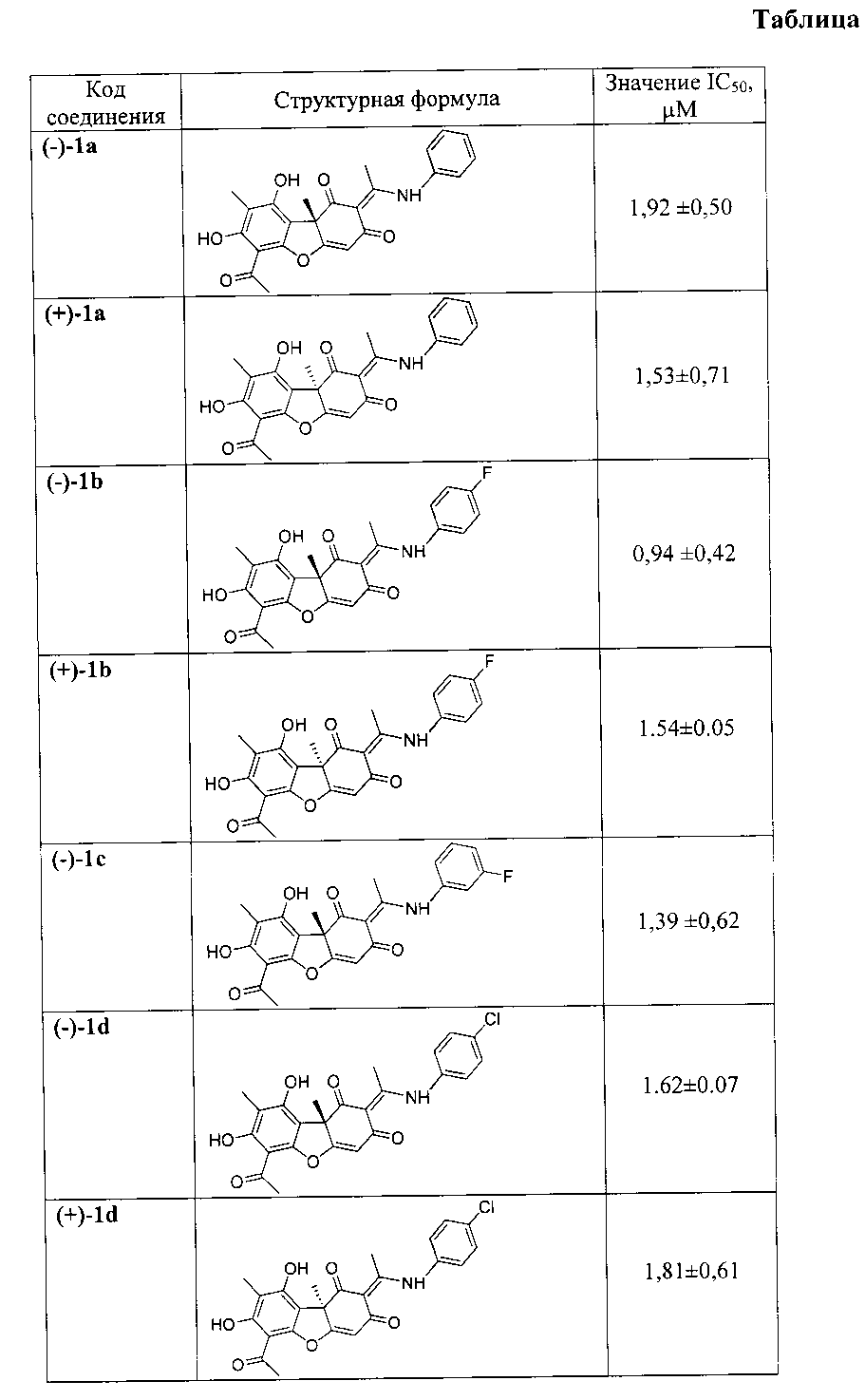
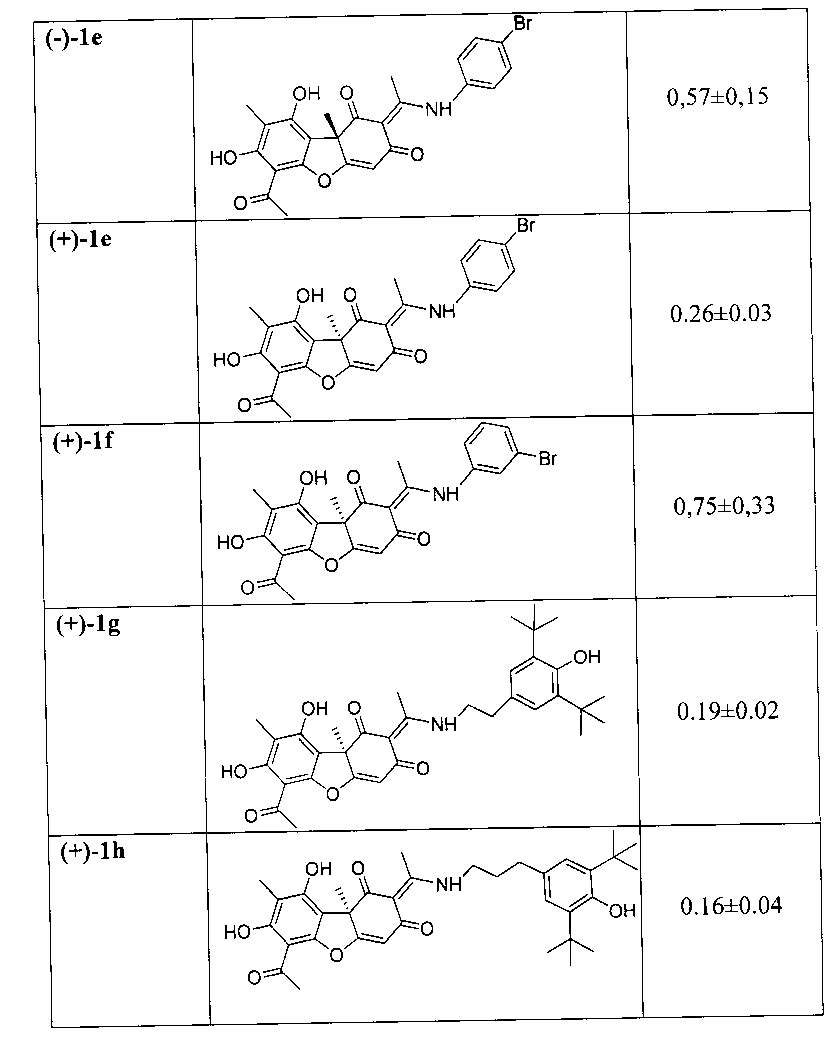
Влияние исследуемых соединений на активность Tdp1 представлено в таблице. Из таблицы видно, что величины IC50 для предлагаемых соединений составляют 0,16 - 1,9, что в 600-50 раз ниже, чем у соединения-прототипа.
Таким образом, предложено средство, представляющее собой одно из известных енаминовых производных усниновой кислоты общей формулы (I), где R - ароматический заместитель, присоединенный к атому азота непосредственно (соединения 1a - 1f) или через этильный (1g) или пропильный (1h) линкер, содержащий галогеновые (соединения 1b - 1f) или гидрокси- и трет-бутильные заместители (соединения 1g и 1h), у которых выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1).
Предлагаемые соединения оказывают специфическое ингибирующее действие на фермент тирозил-ДНК-фосфодиэстераза 1 человека (Tdp1) и, являясь эффективными соединениями, расширяют арсенал ингибиторов данного фермента и могут быть использованы для разработки лекарственных препаратов, применимых в клинической медицине.
Источники информации
1. Cortes Ledesma F, et al., Nature, 2009, 461, 674-678.
2. Interthal H, et al., Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014.
3. Rass U, et al., Cell., 2007, 130, 991-1004.
4. Dexheimer TS, et al., Anticancer Agents Med Chem. 2008, 8, 381-389.
5. Ben Hassine S, et al., The EMBO Journal, 2009, 28, 632-640.
6. Povirk LF. ISRN Mol. Biol., 2012, 1-16.
7. Vance JR, Wilson TE. J. Biol. Chem., 2001, 276, 15073-15081.
8. Pommier Y. Nat. Rev. Cancer, 2006, 6, 789-802.
9. Pommier Y, et al. Chem Biol., 2010, 17, 421-433.
10. Beretta GL, et al., Curr. Med. Chem. 2010, 17, 1500-1508.
11. El-Khamisy SF, et al., DNA Repair (Amst)., 2009, 8 760-766.
12. Das BB, et al., The EMBO Journal., 2009, 28, 3667-3680.
13. Katyal S, et al., EMBO J., 2007, 26, 4720-4731.
14. Hirano R, et al., EMBO J., 2007, 26, 4732-4743.
15. Barthelmes HU, et al., J Biol Chem. 2004, 279, 55618-25565.
16. Nivens MC, et al., Cancer Chemother Pharmacol., 2004, 53, 107-115.
17. Antony, S et al., Nucleic Acids Res. 2007, 35, 4474-4484.
18. Nguyen TX, et al., J. Med. Chem., 2012, 55, 4457-4478.
19. Alagoz M, et al., Nucleic Acids Res., 2013, [Epub ahead of print].
20. Murai J, et al, J Biol Chem. 2012, 287, 12848-12857.
21. А.А. Тазетдинова и др. Химия природных соединений, №.6, с. 672, 2009
22. Патент RU 2317076 С1, оп. 20.02.2008,. Бюл. №5
23. Zakharenko A, et al., Med. Chem. 2012, 8, 883-893.
24. Sokolov DN, et al., Bioorg. Med. Chem. Lett. 2012, 22, 7060.
25. Lebedeva NA, et al., FEBS Lett., 2011, 585, 683-686.