Результат интеллектуальной деятельности: СОБЫТИЕ 416 AAD-12, РОДСТВЕННЫЕ ЛИНИИ ТРАНСГЕННОЙ СОИ И ИХ СОБЫТИЕСПЕЦИФИЧНАЯ ИДЕНТИФИКАЦИЯ
Вид РИД
Изобретение
Уровень техники
Ген aad-12 (первоначально выделенный из Delftia acidovorans) кодирует белок арилоксиалканоатдиоксигеназы (AAD-12). Этот признак сообщает устойчивость к 2,4-дихлорфеноксиуксусной кислоте, например, к гербицидам на основе пиридилоксиацетата. Ген aad-12 в качестве гена, сообщающего растениям устойчивость к гербицидам, был впервые описан в публикации заявки WO 2007/053482.
Экспрессия гетерологичных или чужеродных генов в растениях зависит от места введения чужеродного гена в хромосому. Это может быть связано, например, со структурой хроматина (например, гетерохроматина) или с близостью расположения элементов, регулирующих транскрипцию (например, энхансеров), от сайта интеграции (Weising et al., Ann. Rev. Genet. 22:421-477, 1988). Один и тот же ген в трансгенном растении (или другом организме) одинакового типа может характеризоваться большой изменчивостью уровня экспрессии по сравнению с другими генами. Кроме того, могут иметь место различия в пространственных или временных паттернах экспрессии. Например, различия в относительной экспрессии трансгена в разных тканях растения могут не соответствовать паттернам, ожидаемым от регулирующих транскрипцию элементов в конструкции введенного гена.
Таким образом, часто приходится создавать и исследовать большое число событий, чтобы идентифицировать событие, экспрессирующее введенный для определенной цели ген на удовлетворительном уровне. Для достижения коммерческих целей обычно продуцируют сотни и тысячи разных событий, чтобы обнаружить единственное событие, характеризующееся требуемыми уровнями и паттернами экспрессии трансгена. Событие, характеризующееся требуемыми уровнями и/или паттернами экспрессии трансгена, имеет важное значение для интрогрессии трансгена в другие генетические среды путем полового ауткроссинга стандартными методами селекции. Потомство таких гибридов сохраняет характеристики экспрессии трансгена первичного трансформанта. Такой метод используют для достижения надежной экспрессии гена в ряде сортов, хорошо адаптированных к местным условиям выращивания.
Заявка на патент США 20090130071 относится к событию сои MON87701 и способам детекции. Заявки на патент США 20090036308 и 20080051288 относятся к событию сои 3560.4.3.5 и способам детекции. Заявка на патент США 20080312082 относится к событию сои DP-305423-1 и способам детекции. Заявка на патент США 20060282915 относится к событию сои MON89788 и способам детекции.
Соя AAD-12, обладающая специфическим событием по настоящему изобретению, ранее не была описана в научной литературе.
Сущность изобретения
Настоящее изобретение относится к сое AAD-12 (Glycine max) с событием, определяемым как DAS-68416-4, семена которой депонированы в Американскую коллекцию типовых культур (АТСС) под номером доступа РТА-10442, и к потомству указанной сои. Другими объектами настоящего изобретения являются растения-потомки, соя, семена и/или регенерируемые части растений, семян и потомков сои с событием DAS-68416-4, а также к пищевым или кормовым продуктам, полученным из указанной сои. Настоящее изобретение также относится к частям растений сои с событием DAS-68416-4, которые включают, не ограничиваясь ими, пыльцу, семяпочку, цветки, побеги, корни и листья, а также ядра вегетативных клеток, клетки пыльцы и яйцеклетки. Настоящее изобретение далее относится к растениям сои, обладающим устойчивостью к феноксиауксиновым и/или арилоксиалканоатным гербицидам (при нанесении указанных гербицидов поверх растений сои, в близлежащую почву или на произрастающие рядом сорняки), к новым генетическим композициям сои с событием DAS-68416-4 и аспектам агрономической продуктивности растений сои, содержащих событие DAS-68416-4.
Настоящее изобретение частично относится к селекции растений и к растениям, устойчивым к гербицидам. Настоящее изобретение относится к новому событию трансформации aad-12 в растениях сои, включающих полинуклеотидную последовательность по настоящему изобретению, введенную в определенный сайт генома клетки сои.
В некоторых вариантах осуществления изобретения указанное событие/полинуклеотидная последовательность могут быть объединены с другими признаками, включающими, например, другие гены устойчивости к гербицидам и/или инсектицидные белки. Однако настоящее изобретение относится к растениям, содержащим одно событие, рассмотренное в настоящем описании изобретения. В конкретном варианте осуществления изобретения один или несколько признаков устойчивости к гербицидам объединены с событием сои DAS-68416-4 с целью борьбы с разными сорняками, устойчивыми к гербицидам (например, с сорняками, устойчивыми к глифосату).
Кроме того, настоящее изобретение относится к тестам, предназначенным для детекции в образце (например, сои) события по настоящему изобретению. Указанные тесты могут быть выполнены на основе последовательности ДНК рекомбинантной конструкции, введенной в геном сои, и на основе геномных последовательностей, фланкирующих инсерционный сайт. В объем настоящего изобретения также входят наборы и условия для выполнения указанных тестов.
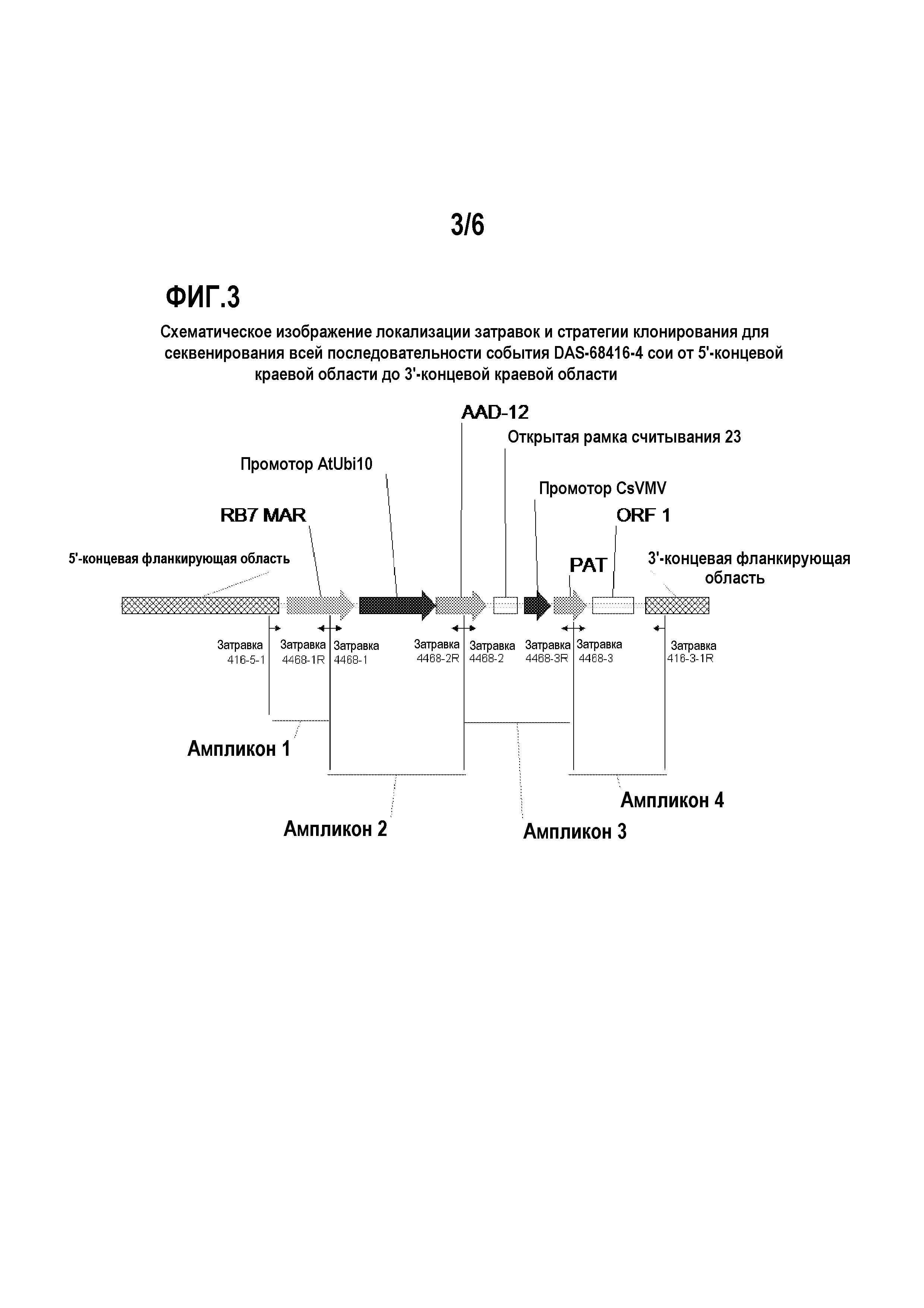
Таким образом, настоящее изобретение частично относится к клонированию и анализу последовательностей ДНК всей вставки AAD-12 и ее краевых областей (в линиях трансгенной сои). Указанные последовательности являются уникальными. На основании указанной вставки и краевых последовательностей были созданы событиеспецифичные затравки. Анализ методом ПЦР показал, что указанные события могут быть идентифицированы в результате анализа ампликонов ПЦР, созданных с использованием наборов событиеспецифичных затравок. Таким образом, указанные и другие методы могут быть использованы для идентификации линий сои, включающих событие по настоящему изобретению.
Краткое описание чертежей
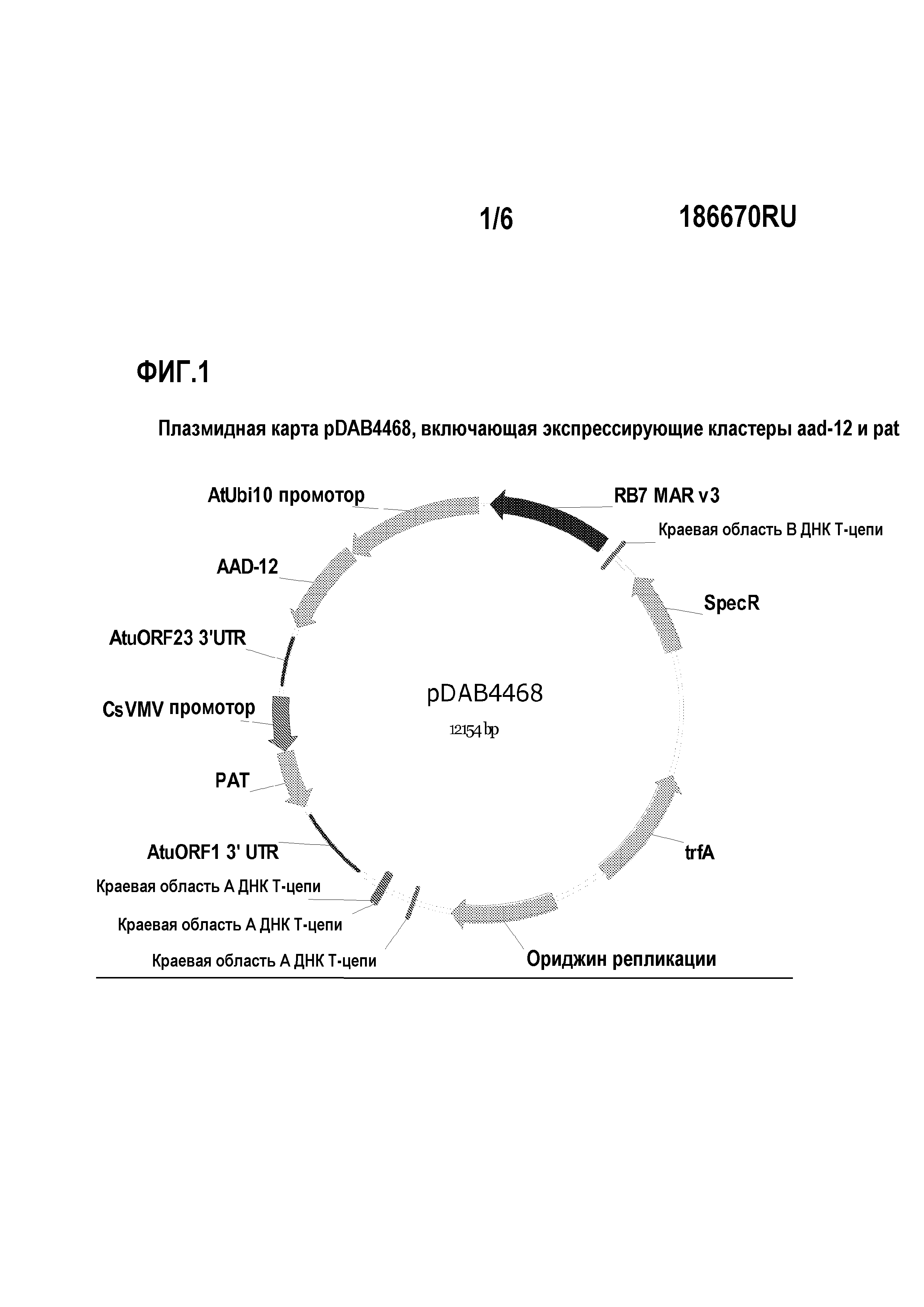
На фиг.1 показана плазмидная карта pDAB4468.
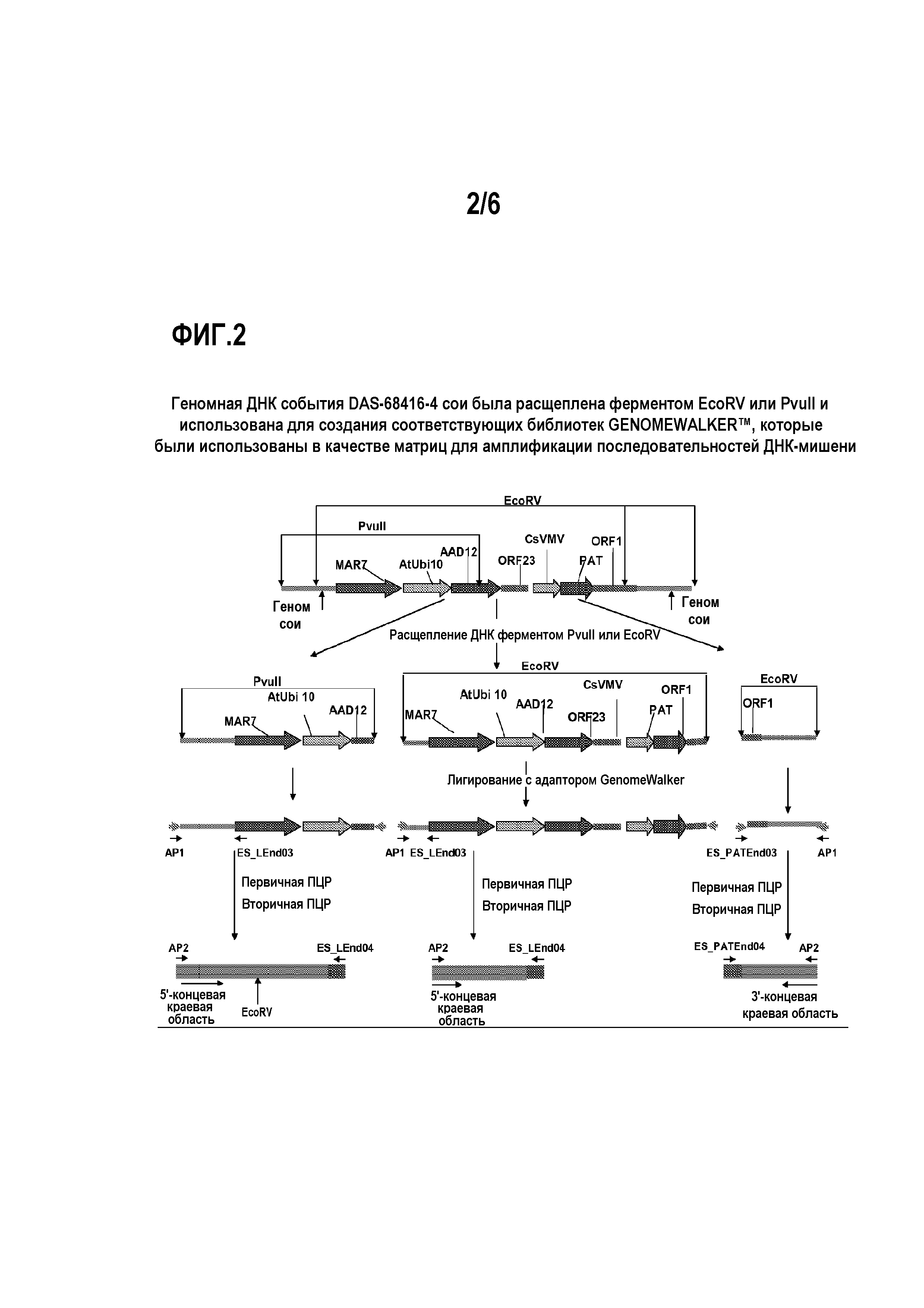
На фиг.2 показана схема геномной ДНК события сои, в которой DAS-68416-4 расщеплен ферментами EcoRV или PvuII и использован для создания соответствующих библиотек GENOMEWALKER™, которые были использованы в качестве матриц для амплификации последовательностей ДНК-мишени.
На фиг.3 показаны положения затравок для подтверждения всей последовательности события DAS-68416-4 сои от 5'- до 3'-концевых краевых областей.
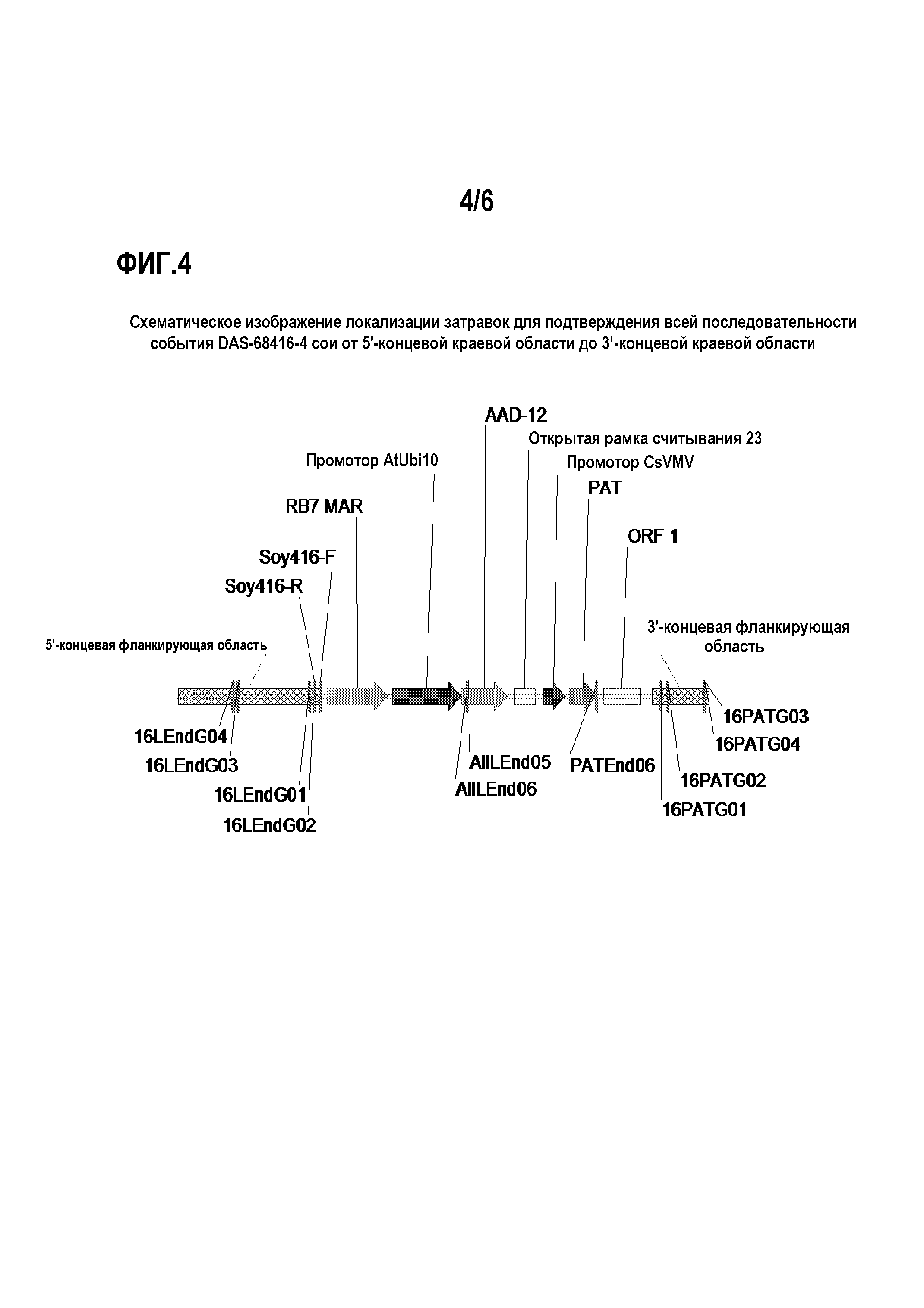
На фиг.4 показаны положения затравок для подтверждения всей последовательности события DAS-68416-4 сои от 5'- до 3'-концевых краевых областей.
На фиг.5 показаны положения затравок для подтверждения последовательности инсерционного сайта события DAS-68416-4 сои AAD-12.
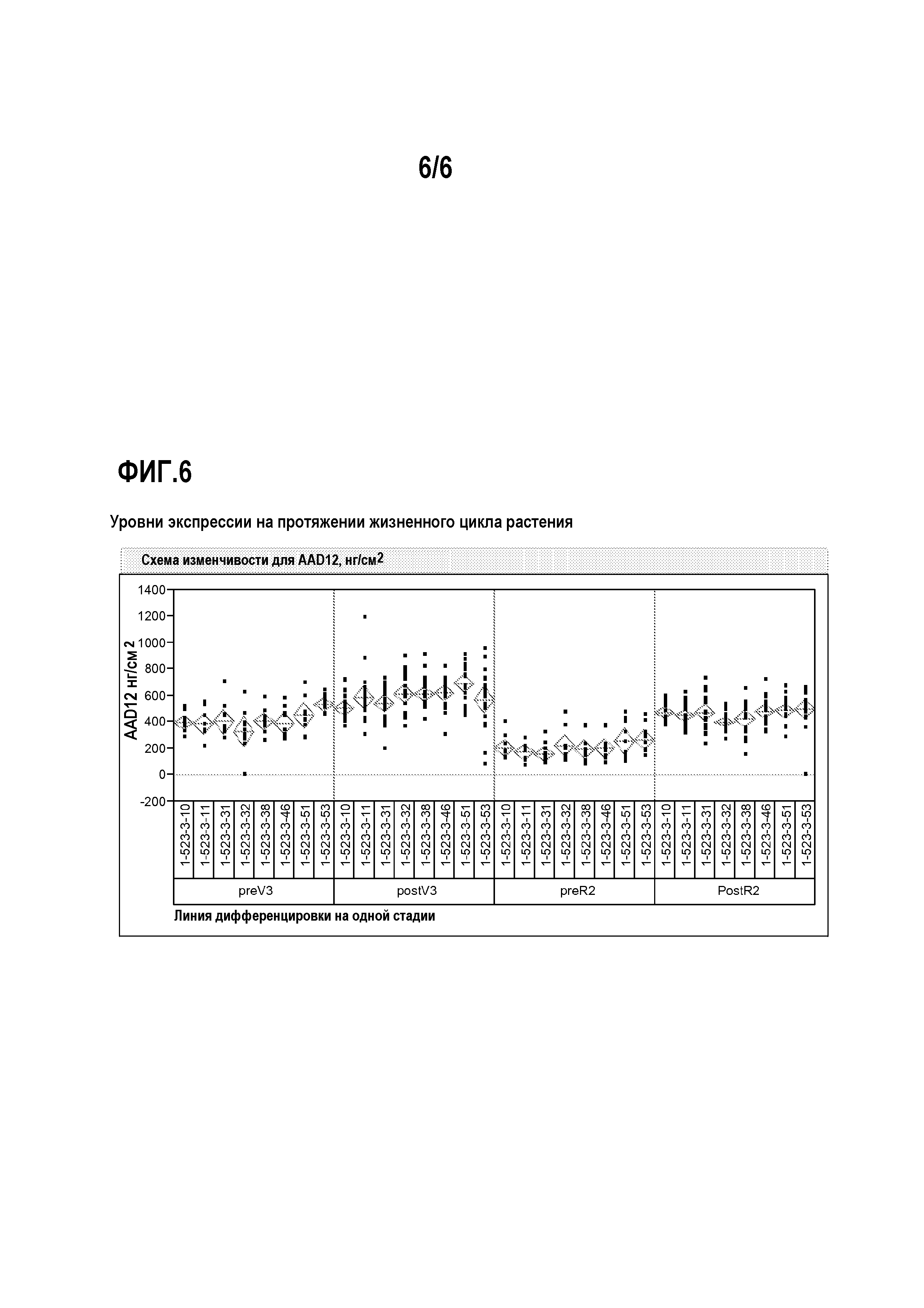
На фиг.6 показаны уровни экспрессии на протяжении жизненного цикла растения.
Краткое описание таблиц
В таблице 1 представлена нумерация остатков в SEQ ID NO:1 вставки и фланкирующих последовательностей для события DAS-68416-4.
В таблице 2 показаны положение и длина зондов, использованных при выполнении анализа методом саузерн-блоттинга.
В таблице 3 представлены прогнозированные и полученные гидбридизирующие фрагменты при выполнении анализа методом саузерн-блоттинга.
В таблице 4 показаны условия скрининга в геноме события DAS-68416-4 сои для амплификации фланкирующих краевых областей.
В таблице 5 показаны условия амплификации стандартным методом ПЦР краевых областей и событиеспецифичных последовательностей в событии DAS-68416-4 сои.
В таблице 6 приведено описание затравок для ампликонов 1-4 вставки Т-цепи.
В таблице 7 показана смесь ПЦР для амплификации стандартным методом ПЦР краевых областей и событиеспецифичных последовательностей в событии DAS-68416-4 сои.
В таблице 8 представлен краткий обзор уровней белка AAD-12 в тканях, полученных из сои с событием DAS-68416-4, выращенной в США и Канаде в 2008 г.
В таблице 9 показаны положение и длина зондов, использованных при выполнении анализа методом саузерн-блоттинга.
В таблице 10 показаны прогнозированные и полученные гибридизирующие фрагменты при выполнении анализа методом саузерн-блоттинга.
В таблице 11 показаны агрономические параметры, оценка которых была произведена в эксперименте 1.
В таблице 12 показаны результаты анализа агрономических характеристик, выполненного в эксперименте 1.
В таблице 13 представлены данные, собранные в результате исследований агрономических признаков и урожайности, выполненных в 2009 г.
В таблице 14 представлен краткий обзор результатов исследования агрономических характеристик на разных участках, выполненного в 2009 г.
В таблице 15 показан анализ заболеваемости и повреждения насекомыми в эксперименте 1.
В таблице 16 представлены стрессоры, вызывающие заболевания и повреждения насекомыми, которые имели место в испытаниях сои с событием DAS-68416-4 и стандартной сои.
В таблице 17 показано прорастание семян сои с событием DAS-68416-4 в теплых и холодных условиях.
В таблице 18 представлен краткий обзор анализа общих показателей, клетчатки и минералов в стеблях сои.
В таблице 19 представлен краткий обзор анализа общих показателей и клетчатки в зерне сои.
В таблице 20 представлен краткий обзор анализа минералов в зерне сои.
В таблице 21 представлен краткий обзор анализа аминокислот в зерне сои.
В таблице 22 представлен краткий обзор анализа жирных кислот в зерне сои.
В таблице 23 представлен краткий обзор анализа витаминов в зерне сои.
В таблице 24 представлен краткий обзор анализа изофлавонов в зерне сои.
В таблице 25 представлен краткий обзор анализа вредных веществ в зерне сои.
В таблице 26 приведена информация об участке и обработке при выполнении довсходовых испытаний устойчивости к гербициду 2,4-D.
В таблице 27 показана устойчивость сои DAS-68416-4 к довсходовому внесению гербицида 2,4-D.
Краткое описание последовательностей
SEQ ID NO:1 представляет собой вставку и фланкирующие последовательности для сои с событием DAS-68416-4 по настоящему изобретению.
SEQ ID NO:2-28 представляют собой затравки, рассмотренные в настоящем описании изобретения.
SEQ ID NO:29 и 30 представляют собой маркеры SNP BARC-019093-03299 и BARC-044607-08736 фланкирующих последовательностей, рассмотренные в настоящем описании изобретения.
Подробное описание изобретения
Настоящее изобретение частично относится к селекции растений и к растениям, устойчивым к гербицидам. Это изобретение относится к новым событиям трансформации растений сои (сои), которые включают полинуклеотидные последовательности aad-12 по настоящему изобретению, введенные в определенный сайт генома клетки сои. В некоторых вариантах осуществления изобретения указанная полинуклеотидная последовательность может быть объединена с другими признаками (такими как, другие гены устойчивости к гербицидам и/или гены, кодирующие инсектицидные белки. Однако настоящее изобретение относится к растениям, включающим одно событие, рассмотренное в настоящем описании.
Кроме того, настоящее изобретение относится к тестам, предназначенным для детекции в образце события по настоящему изобретению. Объектами настоящего изобретения являются способы создания и/или продуцирования любых молекул диагностических нуклеиновых кислот, рассмотренных или предложенных в настоящем описании, в частности, молекул нуклеиновых кислот, полностью или частично созданных на основе фланкирующих последовательностей по настоящему изобретению.
В частности, настоящее изобретение частично относится к трансгенной сое, содержащей событие DAS-68416-4, линиям растений, включающим указанные события, клонированию и анализу последовательностей ДНК указанной вставки и/или ее краевых областей. Линии растений по настоящему изобретению могут быть обнаружены с помощью последовательностей, рассмотренных и предложенных в настоящем описании изобретения.
Некоторые варианты осуществления изобретения относятся к линиям сои, устойчивой к гербицидам, и их идентификации. Настоящее изобретение частично относится к детекции события по настоящему изобретению с целью определения наличия представляющего интерес события в потомстве, полученном в результате скрещивания. Кроме того, в объем настоящего изобретения входит способ детекции события, соответствующий правилам, требующим предпродажной сертификации и маркировки продуктов, полученных из рекомбинантных сельскохозяйственных культур. Событие по настоящему изобретению можно детектировать любым хорошо известным методом детекции нуклеиновой кислоты, таким как полимеразная цепная реакция (ПЦР) или гибридизация ДНК с использованием зондов нуклеиновой кислоты. Событиеспецифичный анализ методом ПЦР описан, например, в публикации Windels et al., Med. Fac. Landbouww, Univ. Gent 64/5b:459462 (1999). Указанный метод включает идентификацию события 40-3-2 сои, устойчивой к глифосату, с использованием набора затравок, заполняющих место соединения между вставкой и фланкирующей ДНК. В частности, одна затравка включала последовательность из вставки, и вторая затравка включала последовательность из фланкирующей ДНК.
Соя была модифицирована путем введения гена aad-12, выделенного из Delftia acifovorans, который кодирует белок арилоксиалканоатдиоксигеназы (AAD-12). Указанный признак сообщает устойчивость к гербицидам на основе 2,4-дихлорфеноксиуксусной кислоты и пиридилоксиацетата и может быть использован в качестве селектируемого маркера в процессе трансформации и селекции растений.
В частности, в настоящем изобретении описано событие pDAB4468-0416 сои AAD-12, его отбор и исследование в отношении устойчивости и экспрессии во всем растении и на молекулярных уровнях в разных поколениях.
Синтетический ген (aad-12) по настоящему изобретению, выделенный из Delftia acidovorans, кодирует фермент, способный деактивировать несколько гербицидов, содержащих арилоксиалканоатную часть, включая феноксиауксин (например, 2,4-D, МСРА), а также пиридилоксиауксины (например, флуроксипир, триклопир). Ген aad-12 был введен при помощи промоторов atUbi10 в линию сои Maverick при помощи методов с использованием Agrobacterium tumefaciens. Трансгенные растения Т0 самоопылялись на протяжении 4-6 поколений. Ген aad-12 был параллельно введен в элитные сорта сои. Все трансгенные события исследовали на протяжении 4-5 поколений в полевом питомнике с контролируемыми условиями выращивания и в лаборатории.
Оба конца вставки события pDAB4468-0416 секвенировали и исследовали. Были разработаны событиеспецифичные анализы. Было произведено картирование данного события в геноме сои (хромосома 4 сои); маркеры SNP фланкирующих последовательностей представлены в настоящем описании изобретения как SEQ ID NO:29 и 30. Это событие было введено в другие элитные сорта. Указанное событие сообщает устойчивость к 2,4-D и глюфозинату.
При помощи промотора atUbi10 методами на основе Agtobacterium tumefaciens было создано более 100 событий сои AAD-12 Т1 Maverick. Событие pDAB4468-0416 было отобрано в результате селекции одной линии дифференцировки на протяжении пяти самоопылявшихся поколений и нескольких обратно скрещивающихся поколений. Это событие было морфологически нормальным, и выдерживало воздействие гербицида 2,4-D, используемого в количестве до 2240 г эквивалента кислоты/га для опрыскивания сои на стадии V3 в каждом самоопылявшемся поколении. Указанное событие было наследовано в виде одного доминантного гена, и характеризовалось нормальным менделеевским расщеплением в самоопылявшихся поколениях, а также в поколениях с обратным скрещиванием.
Было установлено, что событие pDAB4468-0416 характеризуется наличием одной вставки в полную транскрипционную единицу растения (PTU). В остове вектора не была обнаружена последовательность гена устойчивости к антибиотикам, и на протяжении нескольких поколений в гомозиготном и гемизиготном состоянии гена aad-12 не было обнаружено сайленсинга гена. Ген aad-12 был экспрессирован на ожидаемых уровнях, соответствующих уровням устойчивости к 2,4-D. Указанное событие устойчиво экспрессировало ген aad-12 на протяжении нескольких поколений и в линиях сиблингов в данном поколении.
Как указано в приведенном выше разделе ”Уровень техники”, введение и интеграция трансгена в геном растения предполагает некоторые случайные события (отсюда название “событие” для данной экспрессируемой инсерции). То есть, в результате применения многих методов трансформации, таких как трансформация, с помощью бактерий Agrobacterium, ”генное ружье” и точечная трансформация, невозможно предсказать, в какое положение в геноме будет введен трансген. Таким образом, идентификация фланкирующей геномной ДНК растения с обеих сторон вставки может иметь важное значение для идентификации растения, имеющего данное инсерционное событие. Например, можно создать затравки для ПЦР, образующие ампликон ПЦР в области соединения вставки с геномом хозяина. Указанный ампликон ПЦР может быть использован для идентификации уникального или отличающегося типа инсерционного события.
Так как ”события” первоначально являются случайными событиями, то в качестве части настоящего изобретения по меньшей мере 2500 семян линии сои, включающей событие, были депонированы, став достоянием общественности без каких-либо ограничений (за исключением патентных прав), в Американскую коллекцию типовых культур (АТСС), 10802 University Boulevard, Manassas, VA, 20110. Указанный депозит был зарегистрирован в качестве депозита АТСС № РТА-10442. 25 флаконов с семенами Glycine max (событие pDAB4468-0416 сои AAD-12) были депонированы от имени компании Dow AgroScience LLC 22 октября 2009 г. Депозит был проверен 2 ноября 2009 г, и на указанную дату семена были жизнеспособными. Этот депозит был сделан, и будет храниться в соответствии с условиями Будапештского договора о международном признании депонирования семян для целей патентной процедуры. Этот депозит будет храниться без каких-либо ограничений в депозитарии АТСС, который является общедоступным депозитарием, в течение 30 лет или в течение пяти лет после самого последнего запроса или в течение эффективного времени действия патента в зависимости от того, какой из указанных периодов времени является наиболее продолжительным, и будет заменен, если станет нежизнеспособным в течение указанного срока.
Депонированные семена являются частью настоящего изобретения. Из указанных семян могут быть выращены растения сои, и такие растения также являются частью настоящего изобретения. Настоящее изобретение также относится к последовательностям ДНК, содержащимся в указанных растениях сои, которые пригодны для детекции указанных растений и их потомства. Методы детекции и наборы по настоящему изобретению могут быть использованы для идентификации любого одного, двух или даже всех трех указанных событий в зависимости от конечной цели исследования.
Определения терминов и примеры, приведенные в настоящем описании, помогут описать, и осуществить настоящее изобретение специалистами в данной области. За исключением особо оговоренных случаев термины имеют общепринятые значения, известные специалистам в соответствующей области. Использована номенклатура оснований ДНК, приведенная в 37 статье Свода федеральных правил, §1.822.
В использованном здесь значении термин ”потомство” означает потомство любого поколения родительского растения, содержащего событие DAS-68416-4 сои AAD-12.
Трансгенное ”событие” получают путем трансформации растительных клеток гетерологичной ДНК, то есть конструкцией нуклеиновой кислоты, включающей представляющий интерес трансген, регенерации популяции растений, полученной в результате инсерции указанного трансгена в геном растения, и отбора конкретного растения, характеризующегося наличием инсерции в определенном положении в геноме. Термин ”событие” относится к первичному трансформанту и потомству указанного трансформанта, включающему гетерологичную ДНК. Термин ”событие” также относится к потомству, полученному в результате ауткроссинга трансформанта с другим сортом, включающим геномную/трансгенную ДНК. Даже после повторного обратного скрещивания с родительской формой, с которой гибрид скрещивается вновь, введенная трансгенная ДНК и фланкирующая геномная ДНК (геномная/трансгенная ДНК) из трансформированной родительской формы присутствует в потомстве гибрида в том же положении в хромосоме. Термин ”событие” также относится к ДНК первичного трансформанта и его потомства, включающего введенную ДНК и фланкирующую геномную последовательность рядом с введенной ДНК, которые должны быть переданы потомству, включая представляющий интерес трансген, в результате скрещивания одной родительской формы, включающей введенную ДНК (например, первичный трансформант и потомство, полученное в результате самоопыления), с родительской формой, не содержащей введенную ДНК.
“Соединительная последовательность” заполняет участок, на котором ДНК, введенная в геном, связывается с ДНК нативного генома сои, фланкирующей участок инсерции, при этом для диагностики события достаточно идентифицировать или детектировать одну или несколько соединительных последовательностей в генетическом материале растения. К таким последовательностям относятся последовательности ДНК, заполняющие места вставки событий сои по настоящему изобретению, и фланкирующие ДНК одинаковой длины. В настоящем описании приведены конкретные примеры таких диагностических последовательностей; однако, другие последовательности, которые перекрывают места соединения инсерций или места соединения инсерций и геномной последовательности, также являются диагностическими, и могут быть использованы в соответствии с настоящим изобретением.
Настоящее изобретение относится к идентификации таких фланкирующих, соединительных и вставочных последовательностей. В объем настоящего изобретения входят соответствующие затравки и ампликоны ПЦР. В соответствии с настоящим изобретением для детекции или идентификации промышленных сортов трансгенной сои или линий, выделенных из линий трансгенной сои, являющихся частной собственностью, могут быть использованы методы ПЦР с применением ампликонов, расположенных рядом с введенной ДНК и ее краевыми последовательностями.
В процессе введения вставки в геном растительных клеток могут произойти некоторые делеции или другие изменения вставки и/или геномных фланкирующих последовательностей. Таким образом, соответствующий сегмент последовательности плазмиды может включать некоторые незначительные изменения. То же самое верно для фланкирующих последовательностей по настоящему изобретению. Так, в объем настоящего изобретения входит растение, включающее полинуклеотид, характеризующийся некоторой степенью идентичности с фланкирующими и/или вставочными последовательностями. Последовательность по настоящему изобретению может быть полинуклеотидной последовательностью, которая по меньшей мере на 65%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, более предпочтительно по меньшей мере на 80% и более предпочтительно по меньшей мере на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентична последовательности, приведенной или рассмотренной в настоящем описании. Гибридизация и условия гибридизации по настоящему изобретению также могут быть использованы для определения таких растений и полинуклеотидных последовательностей по настоящему изобретению. Фланкирующие последовательности и вставочная последовательность могут быть подтверждены со ссылкой на депонированные семена.
Полные последовательности всех указанных вставок наряду с частями соответствующих фланкирующих последовательностей представлены в настоящем описании изобретения в виде SEQ ID NO:1. Координаты вставочной и фланкирующих последовательностей данного события, относящегося к SEQ ID NO:1 (всего 10212 пар оснований), приведены ниже в таблице 1. Этот вопрос более подробно рассмотрен в примере 3.
|
Указанные последовательности (в частности, фланкирующие последовательности) являются уникальными. На основании указанной вставочной и краевых последовательностей были созданы событиеспецифичные затравки. Анализ методом ПЦР показал, что указанные линии сои могут быть идентифицированы в разных генотипах сои путем анализа ампликонов ПЦР, созданных при помощи наборов событиеспецифичных затравок. Таким образом, для идентификации указанных линий сои могут быть использованы вышеуказанные и другие родственные методы. Последовательности, идентифицированные указанными методами, являются уникальными.
Методы детекции по настоящему изобретению особенно полезны в сочетании с селекцией растений для определения потомства растений, включающего это событие, которое было получено после скрещивания родительского растения, включающего представляющее интерес событие, с другой линией растений с целью сообщения указанному потомству одного или нескольких дополнительных признаков. Указанные методы ПЦР позволяют эффективно разрабатывать программы селекции сои и контролировать качество, в частности, промышленных семян трансгенной сои. В настоящее время также могут быть созданы, и использованы наборы для детекции методом ПЦР указанных линий трансгенной сои. Указанные методы также позволяют регистрировать, и хранить продукты.
Кроме того, фланкирующие/геномные последовательности сои могут быть использованы для специфической идентификации положения каждой вставки в геноме. Такая информация может быть использована для создания систем молекулярных маркеров, специфичных к каждому событию. Указанные последовательности могут быть использованы для ускоренной селекции и получения данных о сцеплении генов.
Информация о фланкирующих последовательностях может быть далее использована для изучения и исследования процессов интеграции трансгенов, определения сайтов для интеграции трансгенов в геноме, сортировки событий, определения устойчивости трансгенов и их фланкирующих последовательностей и экспрессии генов (особенно в отношении сайленсинга генов, паттернов метилирования трансгенов, влияния положения и возможных элементов, определяющих экспрессию, таких как MAR [области присоединения матрицы] и тому подобных).
В свете настоящего описания должно быть ясно, что в объем настоящего изобретения входят семена, депонированные в АТСС под номером РТА-10442. Настоящее изобретение также относится к растению сои, устойчивому к гербицидам, выращенному из семени, депонированного в АТСС под номером доступа РТА-10442. Настоящее изобретение далее относится к частям указанного растения, таким как листья, образцы тканей, семена, произведенные указанным растением, пыльца и тому подобные.
Настоящее изобретение далее относится к потомству растений, выращенных из депонированных семян, предпочтительно к растению сои, устойчивому к гербицидам, геном которого включает обнаруживаемую последовательность, соединяющую геномную ДНК дикого типа и вставочную ДНК по настоящему изобретению. В использованном здесь значении термин ”соя” означает Glycine max, и в определение данного термина входят все сорта, которые могут быть получены в результате селекции растения сои.
Настоящее изобретение далее относится к способам получения гибридов при использовании растения по настоящему изобретению в качестве по меньшей мере одной родительской формы. Например, настоящее изобретение относится к гибридному растению F1, имеющему в качестве одной или обеих родительских форм любые растения по настоящему изобретению. Кроме того, в объем настоящего изобретения входит семя, произведенное такими гибридами F1 по настоящему изобретению. Настоящее изобретение относится к способу получения семени гибрида F1 путем скрещивания указанного растения с другим (например, инбредной родительской линией) растением и получения гибридного семени. Настоящее изобретение относится к указанному растению, которое является материнской или отцовской родительской формой. Характеристики полученных растений могут быть улучшены в результате тщательного отбора родительских растений.
Растение сои, устойчивой к гербицидам, может быть получено в результате первоначального скрещивания первого родительского растения сои, выращенного из семени любой линии по настоящему изобретению, и второго родительского растения сои, что позволяет получить множество растений первого потомства; отбора растения первого потомства, устойчивого к гербицидам (или содержащего по меньшей мере одно из событий по настоящему изобретению); самоопыления растения первого потомства, что позволяет получить множество растений второго потомства; и отбора из растений второго потомства одного растения, устойчивого к гербициду (или содержащего по меньшей мере одно из событий по настоящему изобретению). Указанные стадии могут далее включать обратное скрещивание растения первого потомства или растения второго потомства со вторым родительским растением сои или третьим родительским растением сои. Затем могут быть посеяны семена сои по настоящему изобретению или их потомство.
Следует также отметить, что могут быть скрещены два разных трансгенных растения с целью получения потомства, содержащего два независимо добавленных экзогенных гена. В результате самоопыления соответствующего потомства могут быть получены растения, которые являются гомозиготными для обоих добавленных экзогенных генов. В объем настоящего изобретения также входит обратное скрещивание родительского растения и ауткроссинг с нетрансгенным растением в качестве вегетативного размножения. В данной области известны другие методы селекции, обычно используемые для сообщения растениям разных признаков и получения сельскохозяйственных культур. Селекцию методом обратного скрещивания используют для переноса генов с целью создания наследственного и хорошо наследуемого признака в требуемом гомозиготном культиваре или инбредной линии, являющейся родительской формой, с которой гибрид скрещивается вновь. Источник передаваемого признака именуется родителем-донором. Предполагается, что полученное растение должно иметь признаки родительской формы, с которой гибрид скрещивается вновь (то есть культивара) и требуемый признак, перенесенный от родителя-донора. После первичного скрещивания отбирают растения, обладающие фенотипом родителя-донора, и повторно скрещивают (обратное скрещивание) с родительской формой, с которой гибрид скрещивается вновь. Предполагается, что полученная родительская форма должна иметь признаки родительской формы, с которой гибрид скрещивается вновь (например, культивара) и требуемый признак, перенесенный от родителя-донора.
Молекулы ДНК по настоящему изобретению могут быть использованы в качестве молекулярных маркеров при осуществлении метода селекции с использованием маркеров (МАВ). Молекулы ДНК по настоящему изобретению (такие как маркеры AFLP, маркеры RFLP, маркеры RAPD, SNP и SSR) могут быть использованы в методах, позволяющих идентифицировать генетически связанные агрономически полезные признаки, известные в данной области. Признак устойчивости к гербицидам может быть прослежен в потомстве гибрида растения сои по настоящему изобретению (или в его потомстве и в любом другом культиваре или сорте сои) с помощью методов МАВ. Молекулы ДНК являются маркерами данного признака, и методы МАВ, хорошо известные в данной области, могут быть использованы для отслеживания признака устойчивости к гербицидам в растениях сои, если по меньшей мере одна линия сои по настоящему изобретению или ее потомство было родителем или предком. Способы по настоящему изобретению могут быть использованы для идентификации любого сорта сои, имеющего событие по настоящему изобретению.
Способы по настоящему изобретению включают получение растения сои, устойчивого к гербицидам, путем селекции растения по настоящему изобретению. В частности, указанные способы могут включать скрещивание двух растений по настоящему изобретению или одного растения по настоящему изобретению и любого другого растения. Предпочтительные способы далее включают отбор потомства указанного гибрида путем исследования потомства в отношении наличия события, обнаруживаемого методами по настоящему изобретению. Например, настоящее изобретение может быть использовано для отслеживания события по настоящему изобретению на протяжении нескольких циклов селекции растений, включающих другие требуемые признаки, в частности, агрономические признаки, анализируемые в разных примерах, приведенных в настоящем описании изобретения. Растения, включающие событие по настоящему изобретению и требуемый признак, например, могут быть обнаружены, идентифицированы, отобраны, и быстро использованы в последующих циклах селекции. Событие по настоящему изобретению/признак могут быть также объединены в процессе селекции, и отслежены в соответствии с настоящим изобретением наряду с признаком устойчивости к воздействию насекомых и/или другими признаками устойчивости к гербицидам. Один предпочтительный вариант осуществления изобретения относится к растению, включающему событие по настоящему изобретению, объединенное с геном, кодирующим устойчивость к гербициду дикамба.
Таким образом, настоящее изобретение может быть, например, объединено с признаками, кодирующими устойчивость к глифосату (например, устойчивые растительные и бактериальные гены EPSPS, GOX, GAT), устойчивость к глюфозинату (например, Pat, bar), устойчивость к гербициду, ингибирующему ацетолактат-синтазу (ALS) (например, имидазолиноны [такие как имазетапир], сульфонилмочевины, триазолопиримидинсульфонанилид, пиримидинилтиобензоат и другие химические вещества [Csrl, SurA и т.д.]), устойчивость к бромоксинилу (например, Bxn), устойчивость к ингибиторам фермента HPPD (4-гидроксифенилпируват-диоксигеназа), устойчивость к ингибиторам фитоендезатуразы (PDS), устойчивость к гербицидам, ингибирующим фотосистему II (например, psbA), устойчивость к гербицидам, ингибирующим фотосистему I, устойчивость к гербицидам, ингибирующим протопорфириногеноксидазу IX (РРО) (например, РРО-1), устойчивость к гербицидам на основе фенилмочевины (например, CYP76B1), ферменты, расщепляющие гербицид дикамба (см., например, заявку на патент США 20030135879), и другими, которые могут быть использованы отдельно или в разных комбинациях, обеспечивая эффективное уничтожение или предотвращение распространения сорняков и/или устойчивость к любому гербициду вышеуказанных классов.
Что касается дополнительных гербицидов, то в качестве некоторых дополнительных предпочтительных ингибиторов ALS (известных также как AHAS) можно указать триазолопиримидинсульфонанилиды (такие как клоранзулам-метил, диклозулам, флоразулам, флуметзулам, метозулам и пеноксзулам), пиримидинилтиобензоаты (такие как биспирибак и пиритиобак) и флукарбазон. Некоторые предпочтительные ингибиторы HPPD включают мезотрион, изоксафлутол и сулкотрион. Некоторые предпочтительные ингибиторы РРО включают флумиклорак, флумиоксазин, флуфенпир, пирафлуфен, флутиацет, бутафенацил, карфентразон, сулфентразон и простые дифениловые эфиры (такие как ацифлуорфен, фомесафен, лактофен и окстифлуорфен).
Кроме того, AAD-12 отдельно или в сочетании с одним или несколькими дополнительными признаками НТС может быть объединен с одним или несколькими дополнительными первичными признаками (такими как, например, устойчивость к воздействию насекомых, устойчивость к грибам, устойчивость к стрессу и т.д.) или вторичными признаками (такими как, например, более высокая урожайность, лучший профиль выхода масла, лучшее качество клетчатки и т.д.). Таким образом, настоящее изобретение может быть использовано для создания полного агрономического набора улучшенных качеств культуры с возможностью гибкой и экономически эффективной борьбы с целым рядом сельскохозяйственных вредителей.
Фермент AAD-12 по настоящему изобретению делает возможной экспрессию трансгена, определяющую устойчивость к комбинациям гербицидов, которые уничтожают почти все широколистные и травянистые сорняки. AAD-12 может быть великолепным признаком устойчивости культуры к гербициду (HTC), объединяемым с другими признаками HTC (такими как, например, устойчивость к глифосату, устойчивость к глюфозинату, устойчивость к имидазолинону, устойчивость к бромоксинилу и т.д.) и признаками устойчивости к воздействию насекомых (Cry1F, Cry1Ab, Cry34/45 и т.д.). Кроме того, AAD-12 может быть селектируемым маркером, помогающим отобрать первичные трансформанты растений, генетически созданные с использованием второго гена или группы генов.
Ген AAD-12 по настоящему изобретению также сообщает устойчивость к соединениям, превращаемым в гербициды на основе феноксиацетатауксина (например, 2,4-DB, MCPB и т.д.). Группа масляной кислоты, присутствующая в гербициде 2,4-DB, превращается в результате β-окисления в фитотоксичную 2,4-дихлорфеноксиуксусную кислоту. Аналогичным образом МСРВ превращается в результате β-окисления в фитотоксичный гербицид МСРА. Гербициды на основе бутановой кислоты сами по себе не являются гербицидами. Они превращаются в соответствующую кислоту в результате β-окисления в восприимчивых растениях, и именно уксусная кислота образует фитотоксичный гербицид. Гербициды на основе бутановой кислоты не причиняют вреда растениям, не обладающим способностью быстрого β-окисления. Однако растения, вызывающие быстрое β-окисление и способные превращать гербицид на основе бутановой кислоты в форму уксусной кислоты, защищаются геном AAD-12.
В данной области известны методы внесения гербицидов. Такие методы могут включать смешивание в баке нескольких гербицидов. Некоторые предпочтительные гербициды, пригодные для использования в настоящем изобретении, включают гербицид на основе феноксиауксина, такой как 2,4-D, 2,4-DB, MCPA, MCPB. Указанные гербициды могут быть объединены с одним или несколькими дополнительными генами устойчивости к гербицидам и соответствующим гербицидом (таким как, например, глифосат и/или глюфозинат). В полезных комбинациях, которые, как должно быть очевидно специалисту в данной области, обладают благоприятными свойствами по настоящему изобретению, может быть использован один, два, три или большее число гербицидов. Один или несколько гербицидов могут быть внесены в поле/участок до посева семян по настоящему изобретению. Такие гербициды могут быть внесены, например, в течение 14 дней до посева семян. Один или несколько гербицидов могут быть также внесены во время посева и/или после посева семян, но до появления всходов. Один или несколько гербицидов могут быть внесены в почву (для уничтожения сорняков) или нанесены на сорняки и/или трансгенные растения по настоящему изобретению. Гербициды можно чередовать или использовать в комбинации для уничтожения или предотвращения появления сорняков, которые могут быть устойчивыми к одному из гербицидов. Гербициды трех типов могут быть внесены в разное время разными способами, известными в данной области. Настоящее изобретение также относится к способам уничтожения растений-самосевов, содержащих ген AAD-12. См. одновременно поданную заявку РСТ, озаглавленную ”Уничтожение двудольных растений-самосевов с геном AAD в однодольных сельскохозяйственных культурах”.
Признаки НТС по настоящему изобретению могут быть использованы в новых комбинациях с другими признаками НТС (которые включают, не ограничиваясь ими, устойчивость к глифосату). Указанные комбинации признаков позволяют создать новые методы уничтожения сорняков (и подобных видов), благодаря вновь приобретенной или наследственной устойчивости к гербицидам (например, к глифосату). Таким образом, в объем настоящего изобретения входят, помимо признаков НТС, новые способы уничтожения сорняков при помощи гербицидов, в которых устойчивость к гербицидам была достигнута в результате введения указанного фермента в трансгенные культуры.
Кроме того, во всем мире преимущественно выращивают сельскохозяйственные культуры, устойчивые к глифосату. При многократном чередовании с другими сельскохозяйственными культурами, устойчивыми к глифосату, могут возникнуть трудности с уничтожением растений-самосевов, устойчивых к глифосату, в севооборотных культурах. Таким образом, использование трансгенных признаков по настоящему изобретению, совместно или отдельно введенных в сельскохозяйственные культуры, делает возможным уничтожение других растений-самосевов с признаками НТС.
Предпочтительное растение или семя по настоящему изобретению содержит в своем геноме вставочные последовательности по настоящему изобретению наряду с 20-500 или большим числом смежных фланкирующих нуклеотидов с обеих сторон вставки. За исключением особо оговоренных случаев фланкирующие последовательности являются последовательностями, идентифицированными в SEQ ID NO:1 (см. приведенную выше таблицу 1). SEQ ID NO:1 включает гетерогенную ДНК, введенную в первичный трансформант и иллюстративные фланкирующие геномные последовательности, расположенные рядом с введенной ДНК. Можно ожидать, что все или часть указанных фланкирующих последовательностей будет передана потомству, которое получит вставленную ДНК в результате скрещивания родительной линии, включающей это событие.
Настоящее изобретение относится к культурам тканей регенерируемых клеток растения по настоящему изобретению. В объем настоящего изобретения также входит растение, регенерированное из такой культуры ткани, особенно, если указанное растение может экспрессировать все морфологические и физиологические свойства иллюстративного сорта. Предпочтительные растения по настоящему изобретению обладают всеми физиологическими и морфологическими свойствами растения, выращенного из депонированного семени. Настоящее изобретение далее относится к потомству такого семени и семени, обладающему представляющими интерес качественными признаками.
Манипуляции (такие как мутация, последующая трансфекция и селекция) с растениями, семенами или их частями могут привести к созданию так называемых ”по существу производных” сортов. Международный союз по защите новых сортов растений (UPOV) выработал следующее руководство для определения сорта, который является по существу производным защищенного сорта:
[A] сорт следует считать по существу производным другого сорта (“первоначального сорта”), если
(i) он в основном выведен из первоначального сорта или из сорта, который сам был выведен из первоначального сорта, при сохранении экспрессии основных характеристик, присущих генотипу или комбинации генотипов первоначального сорта;
(ii) он имеет явные отличия от первоначального сорта; и
(iii) за исключением отличий, возникших в результате деривации, он соответствует первоначальному сорту в отношении экспрессии основных характеристик, присущих генотипу или комбинации генотипов первоначального сорта.
UPOV, шестой съезд Международных организаций, Женева, 30 октября 1992 г.; документ подготовлен президиумом Союза.
В использованном здесь значении термин ”линия” означает группу растений, характеризующихся незначительной или отсутствием наследственной изменчивости среди особей в отношении по меньшей мере одного признака. Такие линии могут быть созданы несколькими поколениями самоопыления и селекции или вегетативного размножения из одной родительной формы при помощи методов с использованием культур тканей или клеток.
В использованном здесь значении термины ”культивар” и “сорт” являются синонимами, и означают линию, используемую для промышленного производства.
Термин ”устойчивость” или “устойчивый” применительно к определенному компоненту означает сохранение данного компонента из поколения в поколение, предпочтительно на протяжении по меньшей мере трех поколений по существу на одном и том же уровне, например, предпочтительно ±15%, более предпочтительно ±10%, наиболее предпочтительно ±5%. На устойчивость может влиять температура, местоположение, стресс и время посева. При сравнении последующих поколений в полевых условиях указанный компонент должен быть выявлен аналогичным образом.
Термин ”коммерческая полезность” означает хорошую мощность растения и высокую фертильность, благодаря которым фермеры могут выращивать данную сельскохозяйственную культуру с использованием обычных сельскохозяйственных машин и могут экстрагировать из семени масло с описанными компонентами при помощи обычного измельчающего и экстрагирующего оборудования. Урожайность коммерчески полезной культуры, измеренная с учетом массы семени, содержания масла и общего количества масла, полученного на акр площади, должна составлять 15% от средней урожайности другого сравниваемого коммерческого сорта, не обладающего первосортными признаками, который был выращен в том же регионе.
Термин ”агрономически элитная” означает линию, которая обладает требуемыми агрономическими характеристиками, такими как урожайность, созревание, устойчивость к болезням и тому подобные, помимо устойчивости к воздействию насекомых, благодаря наличию одного или нескольких событий по настоящему изобретению. В объем настоящего изобретения входят агрономические признаки, рассматриваемые отдельно или в любой комбинации в приведенных ниже примерах, которыми обладает растение, включающее событие по настоящему изобретению. Любые и все указанные агрономические характеристики, и данные могут быть использованы для идентификации таких растений на основании одного признака, части диапазона или всего диапазона характеристик, используемых для определения таких растений.
Как должно быть понятно специалисту в данной области в свете настоящего описания изобретения, предпочтительные варианты наборов для детекции признаков по настоящему изобретению могут включать, например, зонды и/или затравки, предназначенные для создания и/или включающие ”соединительные последовательности” или “переходные последовательности” (где геномная фланкирующая последовательность сои стыкуется с вставочной последовательностью). Например, данный набор включает полинуклеотидные зонды, затравки и/или ампликоны, созданные для идентификации одной или обеих соединительных последовательностей (где вставка стыкуется с фланкирующей последовательностью), представленные в таблице 1. Одной общей особенностью такого набора является наличие одной затравки, гибридизирующей в фланкирующей области, и одной затравки, гибридизирующей в вставке. Такие затравки часто имеют длину, равную по меньшей мере примерно ~15 остаткам. Указанные затравки могут быть использованы для создания/амплификации обнаруживаемого ампликона, указывающего на наличие события по настоящему изобретению. Затравки могут быть использованы для создания ампликона, заполняющего (и включающего) вышеуказанную соединительную последовательность.
Затравка, ”обеспечивающая соединение” во фланкирующей последовательности, обычно не гибридизирует на расстоянии более примерно 200 оснований или за пределами соединения. Таким образом, типичные фланкирующие затравки включают по меньшей мере 15 остатков цепи в пределах 200 оснований фланкирующих последовательностей от начала вставки. То есть, в объем настоящего изобретения входят затравки, включающие последовательность соответствующей длины, состоящую из остатков (или гибридизирующую с остатками) ~2530-2730 и/или ~9122-9322 SEQ ID NO:1. Затравки для вставки могут быть созданы аналогичным образом в любом месте вставки, но для создания таких затравок могут быть также использованы остатки ~2731-2931 и ~8921-9121.
Специалисту в данной области должно быть также известно, что затравки и зонды могут быть созданы с возможностью гибридизации в стандартных условиях гибридизации и/или ПЦР с сегментом SEQ ID NO:29 (или комплементом) и ее комплементами, когда затравка или зонд не являются полностью комплементарными приведенной последовательности. То есть допустима некоторая степень ошибочного спаривания. Например, в затравке, состоящей примерно из 20 нуклеотидов, обычно один, два или около того нуклеотидов могут не связываться с противоположной цепью, если ошибочно спаренное основание находится внутри или у конца затравки, противоположной ампликону. Ниже приведены разные приемлемые условия гибридизации. В зондах также могут быть использованы синтетические аналоги нуклеотидов, такие как инозин. Также могут быть использованы пептидные зонды нуклеиновой кислоты (PNA), а также ДНК- и РНК-зонды. Важно, чтобы такие зонды и затравки позволяли диагностировать (однозначно идентифицировать, и выявлять) наличие события по настоящему изобретению.
Следует отметить, что при амплификации методом ПЦР могут возникать ошибки, вызывающие, например, незначительные ошибки секвенирования. То есть, за исключением особо оговоренных случаев, последовательности, приведенные в настоящем описании изобретения, были определены в результате создания длинных ампликонов из геномных ДНК сои, после чего ампликоны клонировали и секвенировали. В последовательностях, созданных и определенных таким образом, вполне вероятно, могут быть обнаружены небольшие отличия и незначительные расхождения, связанные с многочисленными циклами амплификации, необходимыми для создания ампликона достаточной длины для секвенирования из геномных ДНК. Специалисту в данной области должно быть понятно, что в объем настоящего изобретения входят любые корректировки, необходимые в связи с возникновением обычных ошибок секвенирования или расхождений указанных типов.
Следует также отметить, что возможно удаление некоторой геномной последовательности, например, при введении последовательности в процессе создания события. Таким образом, фланкирующие последовательности по настоящему изобретению могут несколько отличаться от геномных последовательностей, представленных, например, в базе данных GENBANK.
Компоненты “вставки” показаны на фигурах, и более подробно рассмотрены ниже в разделе ”Примеры”. Полинуклеотидные последовательности ДНК указанных компонентов или их фрагменты могут быть использованы в качестве ДНК-затравок или зондов при осуществлении способов по настоящему изобретению.
Некоторые варианты осуществления изобретения относятся к способам детекции трансгена/инсерционной области генома в растениях, семенах и подобных частях растения сои, и композициям для осуществления указанных способов. Созданы последовательности ДНК, включающие соединительную последовательность трансгена/инсерционной области генома по настоящему изобретению (между остатками 2730-2731 и 9121-9122 SEQ ID NO:1), их сегменты, комплементы приведенных последовательностей и любые их сегменты. Соединительная последовательность инсерционной области заполняет место соединения между гетерологичной ДНК, введенной в геном, и ДНК из клетки сои, фланкирующей инсерционный сайт. Такие последовательности позволяют диагностировать данное событие.
На основании указанной вставки и краевых последовательностей могут быть созданы событиеспецифичные затравки. Анализ методом ПЦР показал, что линии сои по настоящему изобретению могут быть идентифицированы в разных генотипах сои путем анализа ампликонов ПЦР, созданных с помощью наборов событиеспецифичных затравок. Для идентификации линий сои по настоящему изобретению могут быть использованы вышеуказанные и другие родственные методы. Таким образом, ампликоны ПЦР, полученные из таких пар затравок, являются уникальными, и могут быть использованы для идентификации указанных линий сои.
Некоторые варианты осуществления изобретения относятся к последовательностям ДНК, включающим смежный фрагмент нового трансгена/инсерционной области генома. В объем настоящего изобретения входят последовательности ДНК, включающие полинуклеотиды вставочной последовательности трансгена достаточной длины и полинуклеотиды геномной последовательности сои достаточной длины, из одного или более чем из трех вышеуказанных растений сои, и/или последовательности, пригодные для использования в качестве последовательностей затравок с целью получения ампликона, позволяющего диагностировать одно или несколько указанных растений сои.
Родственные варианты осуществления изобретения относятся к последовательностям ДНК, включающим по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более смежных нуклеотидов части трансгена последовательности ДНК, идентифицированной в настоящем описании изобретения (такой как SEQ ID NO:1 и ее сегменты), или ее комплементов, и фланкирующей последовательности ДНК сои аналогичной длины из указанных последовательностей или их комплементов. Такие последовательности могут быть использованы в качестве ДНК-затравок при осуществлении методов амплификации ДНК. Ампликоны, полученные с помощью указанных затравок, позволяют диагностировать любые события сои по настоящему изобретению. Поэтому настоящее изобретение также относится к ампликонам, полученным с помощью таких ДНК-затравок и гомологичных затравок.
Настоящее изобретение также относится к способам детекции в образце ДНК, соответствующей событию сои по настоящему изобретению. Такие способы могут включать: (а) контактирование образца, включающего ДНК, с набором затравок, которые при использовании в реакции амплификации нуклеиновой кислоты с ДНК по меньшей мере одного из указанных событий сои, образуют ампликон, позволяющий диагностировать указанное событие; (b) выполнение реакции амплификации нуклеиновой кислоты с образованием ампликона; и (с) детекция полученного ампликона.
Другие способы детекции по настоящему изобретению включают способ детекции в образце ДНК, соответствующей по меньшей мере одному из указанных событий, который включает: (а) контактирование образца, включающего ДНК, с зондом, который гибридизирует в строгих условиях гибридизации с ДНК по меньшей мере одного из указанных событий сои и не гибридизирует в строгих условиях гибридизации с ДНК контрольного растения сои (ДНК не представляющего интереса события); (b) гибридизацию образца и зонда в строгих условиях гибридизации; и (с) детекцию гибридизации зонда с указанной ДНК.
Другие варианты осуществления изобретения относятся к способам создания растения сои, включающего событие aad-12 по настоящему изобретению, которые включают стадии: (а) полового скрещивания первой родительской линии сои (включающей экспрессирующие кластеры по настоящему изобретению, сообщающие растениям указанной линии признак устойчивости к гербицидам) и второй родительской линии сои (в которой отсутствует указанный признак устойчивости к гербицидам) с образованием многочисленного потомства растений; и (b) отбор растения-потомка при помощи молекулярных маркеров. Такие способы могут необязательно включать стадию обратного скрещивания растения-потомка со второй родительской линией сои с целью получения растения сои с разведением гомозигот, включающего указанный признак устойчивости к воздействию насекомых.
Другим объектом настоящего изобретения являются способы определения зиготности потомства гибрида, включающего любой один (или несколько) из трех указанных событий. Указанные способы могут включать контактирование образца, содержащего ДНК сои, с набором затравок по настоящему изобретению. Указанные затравки, используемые при осуществлении реакции амплификации нуклеиновой кислоты с геномной ДНК по меньшей мере одного из указанных событий сои, образуют первый ампликон, позволяющий диагностировать по меньшей мере одно из указанных событий сои. Такие способы далее включают выполнение реакции амплификации нуклеиновой кислоты с образованием первого ампликона; детекцию первого ампликона и контактирование образца, содержащего ДНК сои, с указанным набором затравок (указанный набор затравок, используемый при осуществлении реакции амплификации нуклеиновой кислоты с геномной ДНК из растений сои, продуцирует второй ампликон, включающий нативную геномную ДНК сои, гомологичную геномной области сои; и выполнение реакции амплификации нуклеиновой кислоты с образованием второго ампликона. Указанные способы далее включают детекцию второго ампликона и сравнение первого и второго ампликонов в образце, при этом присутствие обоих ампликонов свидетельствует о том, что образец является гетерозиготным для инсерции трансгена.
Наборы для детекции ДНК могут быть созданы с использованием композиций по настоящему изобретению и методов, хорошо известных в области детекции ДНК. Указанные наборы могут быть использованы для идентификации ДНК события сои по настоящему изобретению в образце в процессе селекции растений сои, содержащих указанную ДНК. Наборы включают последовательности ДНК, гомологичные или комплементарные ампликонам, рассмотренным в настоящем описании изобретения, или последовательности ДНК, гомологичные или комплементарные ДНК, содержащейся в генетических элементах трансгена событий по настоящему изобретению. Указанные последовательности ДНК могут быть использованы при осуществлении реакций амплификации ДНК или в качестве зондов в способе гибридизации ДНК. Наборы могут также содержать реагенты и вещества, необходимые для выполнения способа детекции.
Термин ”зонд” означает выделенную молекулу нуклеиновой кислоты, к которой присоединена стандартная детектируемая метка или репортерная молекула (такая как радиоактивный изотоп, лиганд, хемилюминесцентное вещество или фермент). Такой зонд является комплементарным цепи нуклеиновой кислоты-мишени в случае настоящего изобретения, цепи геномной ДНК одного из указанных событий сои, растения сои или образца, включающего ДНК этого события. Зонды по настоящему изобретению включают не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но также полиамиды и другие вещества зонда, которые специфически связываются с последовательностью ДНК-мишени, и могут быть использованы для детекции указанной последовательности ДНК-мишени.
Термин ”затравки” означает выделенные/синтезированные нуклеиновые кислоты, которые гибридизированы с цепью комплементарной ДНК-мишени методом гибридизации нуклеиновых кислот с образованием гибрида между затравкой и цепью ДНК-мишени и затем удлинены по цепи ДНК-мишени полимеразой, например, ДНК-полимеразой. Пары затравок по настоящему изобретению используют для амплификации последовательности нуклеиновой кислоты-мишени, например, при помощи полимеразной цепной реакции (ПЦР) или других стандартных методов амплификации нуклеиновых кислот.
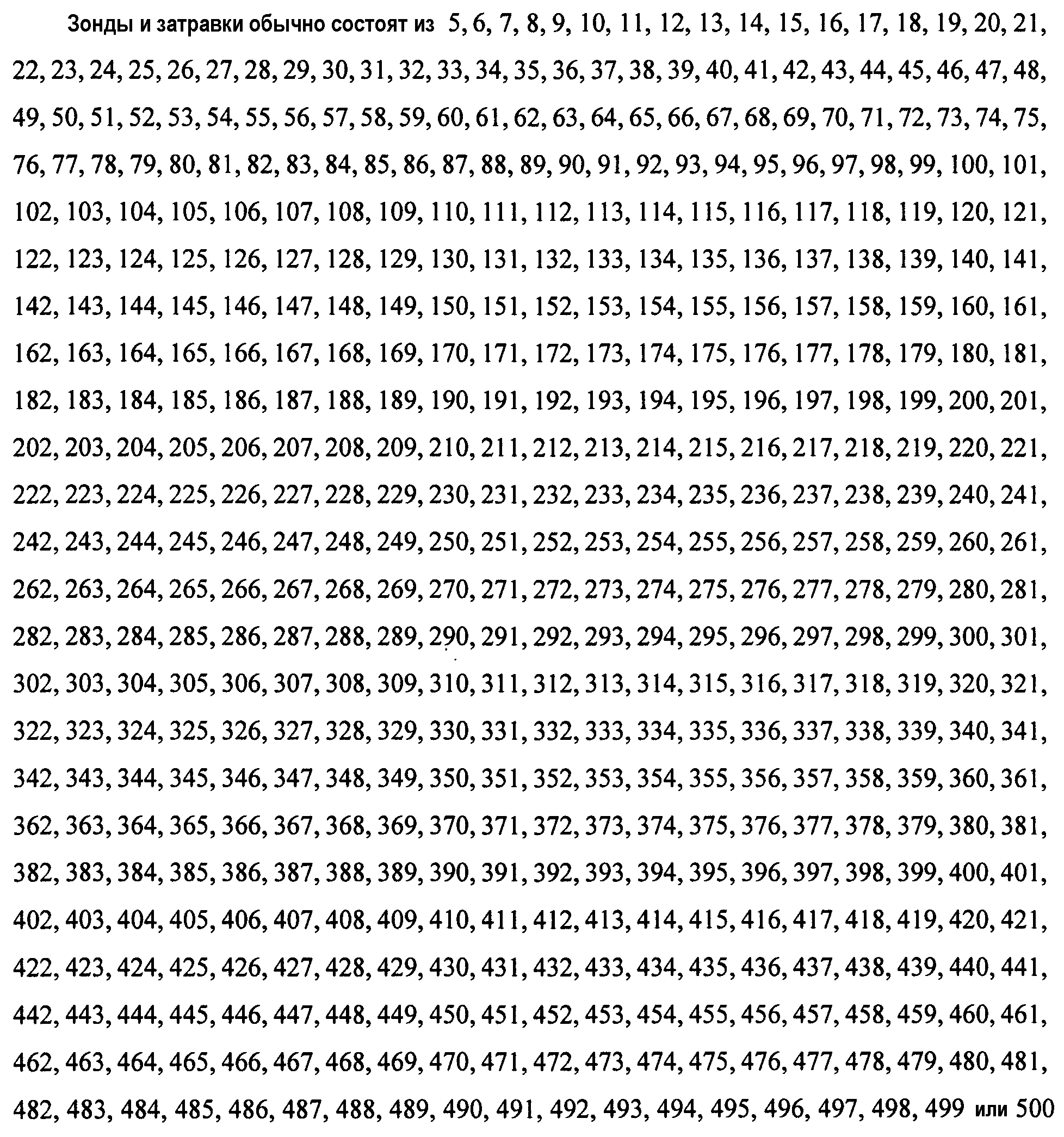
или большего числа полинуклеотидов. Такие зонды и затравки специфически гибридизируют с последовательностью-мишенью в строгих условиях гибридизации. Зонды и затравки по настоящему изобретению предпочтительно обладают полным сходством последовательности с последовательностью-мишенью, хотя стандартными методами могут быть созданы зонды, отличающиеся от последовательности-мишени, но сохраняющие способность гибридизировать с последовательностями-мишенями.
Методы получения и использования зондов и затравок описаны, например, в публикации Molecular Cloning: A Laboratory Manual, 2nd ed., vol.1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989. Пары затравок для ПЦР могут быть выделены из известной последовательности, например, при помощи компьютерных программ, предназначенных для указанной цели.
Затравки и зонды на основе фланкирующих последовательностей ДНК и вставочных последовательностей по настоящему изобретению могут быть использованы для подтверждения (и при необходимости для коррекции) рассмотренных последовательностей стандартными методами, например, методами повторного клонирования и секвенирования таких последовательностей.
Зонды и затравки нуклеиновых кислот по настоящему изобретению гибридизируют в строгих условиях с последовательностью ДНК-мишени. Для идентификации ДНК из трансгенного события в образце могут быть использованы любые стандартные методы гибридизации или амплификации нуклеиновых кислот. Молекулы нуклеиновых кислот или их фрагменты могут специфически гибридизировать с другими молекулами нуклеиновых кислот в определенных условиях. Как указано в настоящем описании, две молекулы нуклеиновых кислот могут специфически гибридизировать друг с другом, если такие молекулы способны образовывать непараллельную двухцепочечную структуру нуклеиновой кислоты. Считается, что молекула нуклеиновой кислоты является ”комплементом” другой молекулы нуклеиновой кислоты, если указанные молекулы являются полностью комплементарными. Как указано в настоящем описании, молекулы являются ”полностью комплементарными”, если каждый нуклеотид одной молекулы комплементарен нуклеотиду другой молекулы. Две молекулы считаются ”минимально комплементарными”, если указанные молекулы способны гибридизировать друг с другом с достаточной степенью устойчивости для сохранения гибрида по меньшей мере в условиях пониженной строгости. Аналогичным образом молекулы считаются ”комплементарными”, если указанные молекулы способны гибридизировать друг с другом с достаточной степенью устойчивости для сохранения гибрида в стандартных строгих условиях. Стандартные строгие условия гибридизации описаны в публикации Sambrook et al., 1989. Отклонения от полной комплементарности допустимы, если такие отклонения полностью не аннулируют способность молекул образовывать двухцепочечную структуру. Молекула нуклеиновой кислоты, которая может быть использована в качестве затравки или зонда, должна иметь достаточно комплементарную последовательность, способную образовывать устойчивую двухцепочечную структуру при определенных концентрациях растворителя и соли.
В использованном здесь значении по существу гомологичная последовательность является последовательностью нуклеиновой кислоты, которая специфически гибридизирует с комплементом последовательности нуклеиновой кислоты, сравниваемой в строгих условиях гибридизации. Термин ”строгие условия” применительно к гибридизации зонда нуклеиновой кислоты с нуклеиновой кислотой-мишенью (то есть, с конкретной, представляющей интерес последовательностью нуклеиновой кислоты) методом специфической гибридизации описан в публикации Sambrook et al., 1989, стр.9.52-9.55. См. также публикацию Sambrook et al., 1989, стр.9.47-9.52 и 9.56-9.58. Таким образом, нуклеотидные последовательности по настоящему изобретению могут быть использованы, благодаря их способности избирательно образовывать дуплексные молекулы с комплементарными участками фрагментов ДНК.
В зависимости от предполагаемого применения можно использовать разные условия гибридизации для достижения разных степеней избирательности зонда в отношении последовательности-мишени. Для применений, требующих высокой избирательности, обычно используют относительно строгие условия образования гибридов, например, могут быть выбраны условия, характеризующиеся низкой концентрацией соли и/или высокой температурой, например, достигаемые при использовании от около 0,02 М до около 0,15 М NaCl при температуре от около 50°С до около 70°С. Строгие условия, например, могут включать по меньшей мере двукратную промывку фильтра для гибридизации строгим промывающим буфером (0,2-кратный объем SSC, 0,1% SDS, 65°С). Специалистам в данной области известны соответствующие строгие условия, стимулирующие гибридизацию ДНК, например, 6,0-кратный объем хлорида натрия/цитрата натрия (SSC) при температуре около 45°С с последующей промывкой 2,0-кратным объемом SSC при 50°С. Например, концентрация соли на стадии промывки может быть выбрана в диапазоне от условий пониженной строгости, включающих использование примерно 2,0-кратного объема SSC при 50°С, до строгих условий, включающих использование примерно 0,2-кратного объема SSC при 50°С. Кроме того, температура на стадии промывки может быть повышена от комнатной температуры, примерно 22°С, создаваемой в условиях пониженной строгости, до температуры около 65°С, применяемой в строгих условиях. Могут быть изменены как температура, так и концентрация соли, либо один из параметров, температура или концентрация соли, может оставаться постоянным при изменении другого параметра. Такие избирательные условия допускают незначительные, если вообще допускают, ошибочные спаривания между зондом и матрицей или цепью-мишенью. Специалистам в данной области хорошо известны методы детекции последовательностей ДНК путем гибридизации, и в качестве примера таких анализов методом гибридизации можно привести патенты США №№ 4965188 и 5176995.
В особенно предпочтительном варианте осуществления изобретения нуклеиновая кислота по настоящему изобретению специфически гибридизирует в строгих условиях с одной или несколькими затравками (ампликонами или другими последовательностями), приведенными или предложенными в настоящем описании, включая их комплементы и фрагменты. В одном объекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению включает последовательность нуклеиновой кислоты, представленную в одной из приведенных последовательностей, ее комплементы и/или фрагменты.
В другом объекте настоящего изобретения, маркерная молекула нуклеиновой кислоты по настоящему изобретению включает последовательность, которая идентична таким последовательностям нуклеиновых кислот на 80%-100% или 90%-100%. В еще одном объекте настоящего изобретения маркерная молекула нуклеиновой кислоты по настоящему изобретению идентична такой последовательности на 95%-100%. Такие последовательности могут быть использованы в качестве маркеров в процессе селекции растений для идентификации потомства генетических гибридов. Гибридизацию зонда с молекулой ДНК-мишени можно детектировать разными методами, известными специалистам в данной области, которые включают, не ограничиваясь ими, флуоресцентные метки, радиоактивные метки, метки на основе антител и хемилюминесцентные метки.
В случае амплификации последовательности-мишени нуклеиновой кислоты (например, методом ПЦР) с использованием конкретной пары затравок для амплификации, ”строгие условия” представляют собой условия, в которых указанная пара затравок гибридизирует только с последовательностью-мишенью нуклеиновой кислоты, с которой затравка, имеющая соответствующую последовательность дикого типа (или ее комплемент), должна связываться и предпочтительно продуцировать уникальный продукт амплификации, ампликон.
Термин ”специфичный к (последовательности-мишени)” означает, что зонд или затравка гибридизирует в строгих условиях гибридизации только с последовательностью-мишенью в образце, включающем такую последовательность-мишень.
В использованном здесь значении термин ”амплифицированная ДНК” или “ампликон” означает продукт амплификации нуклеиновой кислоты последовательности-мишени нуклеиновой кислоты, являющейся частью матрицы нуклеиновой кислоты. Например, для определения наличия в растении сои, полученном в результате полового скрещивания, геномной ДНК трансгенного события из растения сои по настоящему изобретению, ДНК, экстрагированная из образца ткани растения сои, может быть подвергнута амплификации нуклеиновой кислоты с использованием пары затравок, из которых одна затравка выделена из фланкирующей последовательности, локализованной в геноме растения рядом с инсерционным сайтом вставленной гетерологичной ДНК, и вторая затравка выделена из вставленной гетерологичной ДНК, для продуцирования ампликона, позволяющего диагностировать наличие ДНК события. Событие также можно диагностировать на основании длины и последовательности ампликона. Длина ампликона может быть равна общей длине пар затравок и одной пары нуклеотидных оснований и/или общей длине 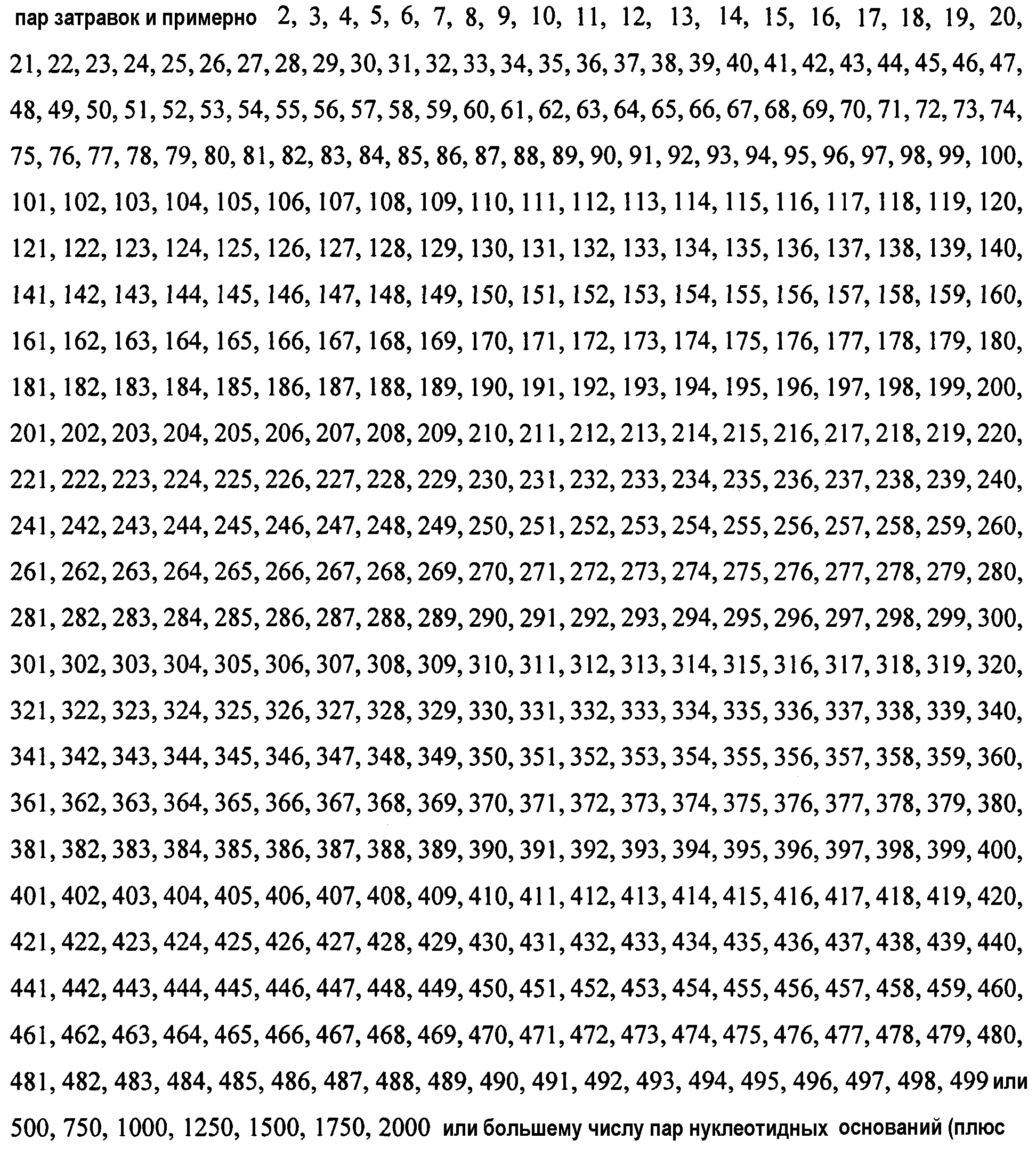
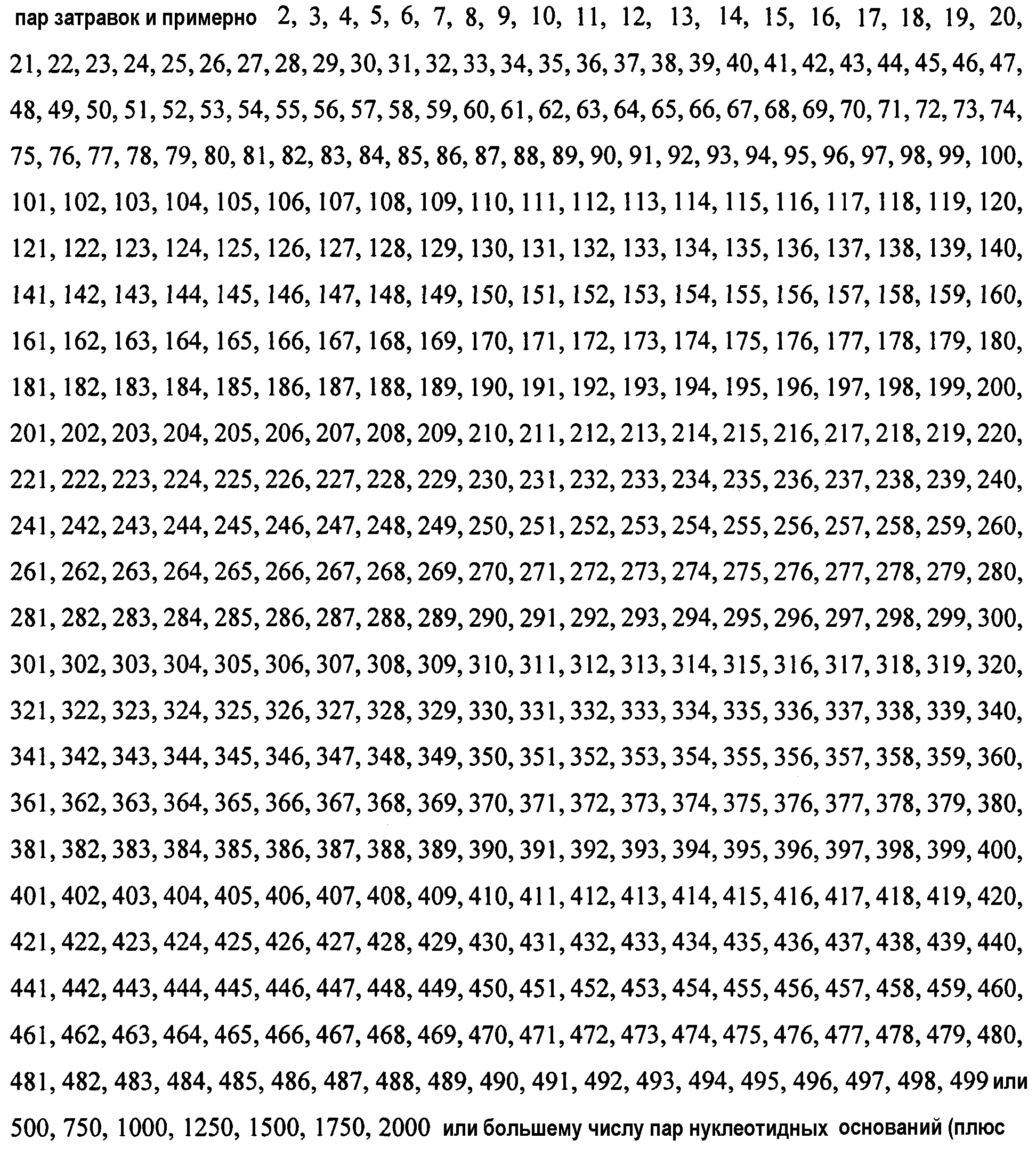
или минус любое число вышеуказанных приращений). Альтернативно, пара затравок может быть выделена из фланкирующей последовательности с обеих сторон вставленной ДНК с образованием ампликона, включающего всю нуклеотидную последовательность вставки. Один член пары затравок, выделенной из геномной последовательности растения, может быть расположен на расстоянии от вставленной последовательности ДНК. Указанное расстояние может составлять от одной пары нуклеотидных оснований примерно до двадцати тысяч пар нуклеотидных оснований. В определение термина ”ампликон” входят димеры затравок, которые могут быть образованы при выполнении термической реакции амплификации ДНК.
Нуклеиновая кислота может быть амплифицирована разными методами амплификации нуклеиновых кислот, известными в данной области, включая полимеразную цепную реакцию (ПЦР). В данной области известны разные методы амплификации, которые описаны, наряду с прочими публикациями, в патенте США № 4683195 и патенте США № 4683202. Методом ПЦР можно амплифицировать до 22 т.п.о. геномной ДНК. При осуществлении настоящего изобретения могут быть использованы указанные методы, а также другие методы амплификации ДНК, известные в данной области. Последовательность ДНК-вставки или фланкирующей геномной последовательности гетерологичного трансгена из события сои по настоящему изобретению может быть проверена (и при необходимости скорректирована) путем амплификации таких последовательностей события с помощью затравок, выделенных из последовательностей по настоящему изобретению, стандартными методами секвенирования ДНК ампликона ПЦР или клонированной ДНК.
Ампликон, полученный указанными методами, может быть обнаружен разными методами. Электрофорез в агарозном геле и окрашивание бромидом этидия является общепринятым, хорошо известным методом детекции ампликонов ДНК. Другим таким методом является генетический двоичный анализ с использованием олигонуклеотида ДНК, перекрывающего смежную фланкирующую геномную последовательность ДНК и вставленную последовательность ДНК. Указанный олигонуклеотид иммобилизуют в лунках микропланшета. После ПЦР представляющей интерес области (с использованием одной затравки в вставленной последовательности и одной затравки в смежной фланкирующей геномной последовательности) одноцепочечный продукт ПЦР может быть гибридизирован с иммобилизованным олигонуклеотидом и использован в качестве матрицы для выполнения реакции удлинения на одно основание с использованием ДНК-полимеразы и меченых ddNTP, специфичных к предполагаемому следующему основанию. Считывание может быть произведено при помощи флуоресцентного анализа или ELISA. Сигнал указывает на наличие вставки/фланкирующей последовательности, вследствие успешной амплификации, гибридизации и удлинения на одно основание.
Другим методом является метод пиросеквенирования, описанный в публикации Winge, Innov. Pharma. Tech. 00:18-24, 2000. При выполнении указанного метода создают олигонуклеотид, который перекрывает место соединения смежной геномной ДНК и вставленной ДНК. Олигонуклеотид гибридизируют с одноцепочечным продуктом ПЦР из представляющей интерес области (одна затравка во вставленной последовательности и одна затравка во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК-полимеразы, АТР, сульфурилазы, люциферазы, апиразы, аденозин-5'-фосфосульфата и люциферина. Отдельно добавляют DNTP, в результате чего возникает световой сигнал, который измеряют. Световой сигнал свидетельствует о наличии вставки/фланкирующей последовательности трансгена вследствие успешной амплификации, гибридизации и удлинения на одно или несколько оснований.
Поляризация флуоресценции является еще одним методом, который может быть использован для детекции ампликона по настоящему изобретению. В соответствии с данным методом создают олигонуклеотид, который перекрывает место соединения геномной фланкирующей последовательности и вставленной ДНК. Олигонуклеотид гибридизируют с одноцепочечным продуктом ПЦР из представляющей интерес области (одна затравка во вставленной ДНК и одна затравка во фланкирующей геномной последовательности ДНК) и инкубируют в присутствии ДНК-полимеразы и меченного флуоресцентным красителем ddNTP. Удлинение на одно основание вызывает включение ddNTP. Такое включение можно измерить в виде изменения поляризации при помощи флуорометра. Изменение поляризации свидетельствует о наличии вставки/фланкирующей последовательности трансгена вследствие успешной амплификации, гибридизации и удлинения на одно основание.
TAQMAN (PE Applied Biosystems, Foster City, Calif.) является методом детекции, и количественного определения наличия последовательности ДНК. В кратком изложении данный метод включает создание олигонуклеотидного зонда FRET, который перекрывает место соединения геномной фланкирующей и вставочной ДНК. Зонд FRET и затравки для ПЦР (одна затравка в последовательности вставочной ДНК и одна затравка во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостойкой полимеразы и dNTP. В процессе специфической амплификации taq полимераза ДНК отщепляется, и высвобождает флуоресцентную часть из гасящей части зонда FRET. Флуоресцентный сигнал свидетельствует о наличии фланкирующей/вставочной последовательности трансгена вследствие успешной амплификации и гибридизации.
Для детекции последовательности был предложен метод молекулярных маяков. В кратком изложении данный метод включает создание олигонуклеотидного зонда FRET, который перекрывает место соединения фланкирующей геномной и вставочной ДНК. Уникальная структура зонда FRET позволяет получить вторичную структуру, содержащую флуоресцентную и гасящую части в непосредственной близости друг от друга. Зонд FRET и затравки для ПЦР (одна затравка в последовательности вставочной ДНК и одна затравка во фланкирующей геномной последовательности) подвергают циклической обработке в присутствии термостойкой полимеразы и dNTP. После успешной амплификации методом ПЦР гибридизация зонда FRET с последовательностью-мишенью вызывает удаление вторичной структуры зонда и пространственное отделение флуоресцентной и гасящей частей. Возникает флуоресцентный сигнал. Флуоресцентный сигнал свидетельствует о наличии фланкирующей геномной/вставочной последовательности трансгена вследствие успешной амплификации и гибридизации.
Помимо рассмотренного положения в геноме сои, которое является наиболее подходящим для инсерции, настоящее изобретение также относится к семени сои и/или растению сои, включающему по меньшей мере одну вставку, отличную от гена aad-12, в непосредственной близости от данного положения в геноме. Один вариант осуществления изобретения относится к замене вставки aad-12, рассмотренной в настоящем описании, другой вставкой. Для указанной цели может быть использована, например, направленная гомологичная рекомбинация. Данный метод описан, например, в WO 03/080809 A2 и соответствующей опубликованной заявке на патент США (US 2003/0232410). Таким образом, настоящее изобретение относится к растениям и растительным клеткам, включающим гетерологичную вставку (вместо гена aad-12 или с несколькими копиями гена aad-12), фланкированную полными фланкирующими последовательностями или узнаваемыми частями фланкирующих последовательностей по настоящему изобретению (например, остатками 1-2730 и 9122-10212 SEQ ID NO:1). Подобным образом может быть использована для вставки дополнительная копия (или дополнительные копии) гена aad-12.
В данной области описаны методы введения полинуклеотидной последовательности в конкретный участок хромосомы растительной клетки путем гомологичной рекомбинации. Например, метод сайт-специфической интеграции, описанный в публикации заявки на патент США № 2009/0111188 А1, предполагает использование рекомбиназ или интеграз, опосредующих введение полинуклеотидной последовательности донора в хромосому-мишень. Кроме того, в международной заявке на патент № WO 2008/021207 описан метод гомологичной рекомбинации, опосредуемой цинкосодержащей пальцеобразной областью, для введения одной или нескольких полинуклеотидных последовательностей донора в определенные положения генома. Для введения полинуклеотидной последовательности в определенный участок хромосомы могут быть использованы рекомбиназы, такие как FLP/FRT, описанные в патенте США № 6720475, или CRE/LOX, описанные в патенте США № 5658772. И, наконец, мегануклеазы, используемые для направленного введения донорских полинуклеотидов в определенный участок хромосомы, были описаны в публикации Puchta et al., PNAS USA 93 (1996) pp.5055-5060.
Хорошо известны и широко применяются разные другие методы сайт-специфической интеграции в растительные клетки (Kumor et al., Trands in Plant Sci. 6(4) (2001) pp.155-159). Кроме того, для модификации растений могут быть использованы системы сайт-специфической рекомбинации, идентифицированные в нескольких прокариотических и низших эукариотических организмах. Примеры таких систем включают, не ограничиваясь ими, систему рекомбиназ R/RS из плазмиды pSR1 дрожжей Zygosaccharomyces rouxii (Araki et al. (1985) J. Mol. Biol. 182:191-203) и систему Gin/gix фага Mu (Maeser and Kahlmann (1991) Mol. Gen. Genet. 230:170-176).
В некоторых вариантах осуществления настоящего изобретения может быть желательно, интегрировать или присоединить новый трансген рядом с существующим трансгенным событием. Трансгенным событием может быть предпочтительный геномный локус, выбранный на основании уникальных характеристик, таких как единственный инсерционный сайт, нормальное менделеевское расщепление, устойчивая экспрессия и лучшая комбинация эффективности, включающая устойчивость к гербицидам и агрономическую продуктивность в разных окружениях. Вновь интегрированные трансгены должны сохранять характеристики экспрессии трансгенов существующих трансформантов. Кроме того, разработаны анализы, предназначенные для детекции и подтверждения наличия вновь интегрированного события, которые позволяют идентифицировать геномные фланкирующие последовательности и положение в хромосоме вновь интегрированного события. И, наконец, введение нового трансгена в определенный участок хромосомы, связанный с существующим трансгеном, позволит ускорить интрогрессию трансгенов в другие генетические среды в результате ауткроссинга при помощи стандартных методов селекции.
В некоторых вариантах осуществления настоящего изобретения может быть желательно, удалить полинуклеотидные последовательности из трансгенного события. Например, эксзиция трансгена, описанная в предварительной заявке на патент США № 61/297628, предполагает использование нуклеаз цинкосодержащей пальцеобразной области для удаления полинуклеотидной последовательности, состоящей из полигенного экспрессирующего кластера, из введенного в хромосому трансгенного события. Удаляемая полинуклеотидная последовательность может быть селектируемым маркером. После эксцизии и удаления полинуклеотидной последовательности модифицированное трансгенное событие может быть перенацелено путем инсерции полинуклеотидной последовательности. Эксцизия полинуклеотидной последовательности и последующее перенацеливание модифицированного трансгенного события создают такие преимущества как возможность повторного использования селектируемого маркера или устранения случайных изменений транскриптомы растения, возникающих в результате экспрессии специфических генов.
Настоящее изобретение относится к определенному сайту в хромосоме 4 генома сои, который великолепно подходит для инсерции гетерологичных нуклеиновых кислот. Кроме того, в объем настоящего изобретения входят 5'-концевой молекулярный маркер, 3'-концевой молекулярный маркер, 5'-концевая фланкирующая последовательность и 3'-концевая фланкирующая последовательность, используемые для идентификации положения сайта-мишени в хромосоме 4. Таким образом, настоящее изобретение относится к способам введения представляющих интерес гетерологичных нуклеиновых кислот в заранее определенный сайт-мишень или рядом с указанным сайтом-мишенью. Настоящее изобретение также относится к семени и/или растению сои, включающим любую гетерологичную нуклеотидную последовательность, введенную в указанный сайт-мишень или в непосредственной близости от такого сайта. Одним способом осуществления такой целенаправленной интеграции является эксцизия и/или замена экспрессирующего кластера гена pat другой вставкой по настоящему изобретению. Таким образом, целенаправленная гомологичная рекомбинация может быть использована в соответствии с настоящим изобретением без каких-либо ограничений.
В использованном здесь значении термин ”стекинг” генов, событий или признаков означает объединение желаемых признаков в одной трансгенной линии. Селекционеры растений объединяют трансгенные признаки путем скрещивания родительских форм, каждая из которых обладает требуемым признаком, и последующей идентификации потомства, имеющего оба требуемых признака. Другим способом стекинга генов является одновременный перенос двух или более генов в ядро клетки растения в процессе трансформации. Другим способом стекинга генов является повторная трансформация трансгенного растения другим, представляющим интерес геном. Например, стекинг генов может быть использован для объединения двух или более разных признаков, включающих, например, два или более разных признаков устойчивости к воздействию насекомых и признаков устойчивости к болезням, два или более признаков устойчивости к гербицидам и/или признаков устойчивости к воздействию насекомых и признаков устойчивости к гербицидам. Использование селектируемого маркера помимо представляющего интерес гена также может считаться стекингом генов.
Термин ”гомологичная рекомбинация” означает взаимодействие любой пары нуклеотидных последовательностей, имеющих соответствующие сайты, содержащие подобную нуклеотидную последовательность, с помощью которой две указанные нуклеотидные последовательности могут взаимодействовать (рекомбинировать) с образованием новой последовательности рекомбинантной ДНК. Сайты подобной нуклеотидной последовательности определяются в настоящем описании как ”гомологичная последовательность”. Частота гомологичной рекомбинации обычно возрастает с увеличением длины гомологичной последовательности. Таким образом, хотя гомологичная рекомбинация может происходить между двумя нуклеотидными последовательностями, которые являются недостаточно идентичными, частота (или эффективность) рекомбинации уменьшается при увеличении расхождения между двумя последовательностями. Рекомбинация может быть осуществлена при использовании одной гомологичной последовательности в донорской молекуле и молекуле-мишени, в результате чего образуется продукт рекомбинации ”одного кроссинговера”. Альтернативно в нуклеотидную последовательность-мишень и донорскую нуклеотидную последовательность могут быть введены две гомологичные последовательности. В результате рекомбинации двух гомологичных последовательностей донорской молекулы с двумя гомологичными последовательностями мишени образуется продукт рекомбинации ”двух кроссинговеров”. Если гомологичные последовательности в донорской молекуле фланкируют последовательность, предназначенную для манипуляции (например, представляющую интерес последовательность), рекомбинация молекулы-мишени двумя кроссинговерами позволяет получить продукт рекомбинации, в котором представляющая интерес последовательность заменяет последовательность ДНК, которая первоначально находилась между гомологичными последовательностями в молекуле-мишени. Обмен последовательностями ДНК между мишенью и донором в результате рекомбинации ”двумя кроссинговерами” именуется “заменой последовательности”.
Все патенты, заявки на патент, предварительные заявки и публикации, приведенные в настоящем описании, полностью включены в настоящее описание в качестве ссылки в той мере, в какой они соответствуют положениям настоящего изобретения.
Приведенные ниже примеры иллюстрируют способы осуществления изобретения, и демонстрируют определенные предпочтительные варианты осуществления изобретения. Указанные примеры не ограничивают объем изобретения. Специалистам в данной области должно быть понятно, что методы, описанные в нижеследующих примерах, представляют определенные подходы, используемые для иллюстрации предпочтительных вариантов осуществления изобретения. Однако специалистам в данной области должно быть понятно в свете настоящего описания изобретения, что в конкретные варианты осуществления изобретения могут быть внесены многие изменения, позволяющие получить аналогичные или подобные результаты, не выходя за пределы существа и объема изобретения. За исключением особо оговоренных случаев все проценты являются массовыми процентами, и соотношения смесей растворителей являются объемными соотношениями.
За исключением особо оговоренных случаев в настоящем описании использованы следующие аббревиатуры.
|
|
Примеры
Пример 1. Трансформация и отбор события DAS-68416-4 сои AAD-12
Событие DAS-68416-4 трансгенной сои (Glycine max) было получено в результате опосредованной Agrobacterium трансформации эксплантатов семядольного узла сои. Для инициации трансформации был использован штамм Agrobacterium EHA101 без плеча хромосомы (Hood et al., 2006), содержащий двойной вектор pDAB4468 (фиг.1) с селектируемым маркером (pat) и представляющим интерес геном (aad-12) в области Т-цепи ДНК.
Опосредованную Agrobacterium трансформацию выполняли при помощи модифицированного метода, описанного в публикации Zeng et al. (Zeng et al., 2004). Семена сои (сорта Maverick) проращивали на базальной среде, семядольные узлы удаляли, и инфицировали Agrobacterium. В среду для образования ростков, удлинения ростков и укоренения добавляли цефотаксим, тиментин и ванкомицин для удаления Agrobacterium. Для ингибирования роста нетрансформированных ростков использовали глюфозинат. Отобранные ростки переносили в среду для укоренения, обеспечивающую развитие корневой системы, и затем переносили в почвенную смесь для акклиматизации ростков.
Верхушечные листья отобранных ростков окрашивали глюфозинатом для скрининга предполагаемых трансформантов. Исследованные ростки переносили в теплицу, оставляли для акклиматизации и окрашивали листья глюфозинатом для подтверждения устойчивости и выявления предполагаемых трансформантов. Брали образцы исследованных растений, и выполняли молекулярные анализы для подтверждения наличия гена селектируемого маркера и/или представляющего интерес гена. Растения Т0 оставляли в теплице для самоопыления, в результате чего было получено семя Т1.
Растения Т1 подвергали обратному скрещиванию и использовали для интрогрессии в элитную зародышевую плазму (Maverick). Событие DAS-68416-4 сои было получено из независимого трансформированного изолята. Это событие было отобрано на основании уникальных характеристик, таких как один инсерционный сайт, нормальное менделеевское расщепление, устойчивая экспрессия и великолепная комбинация эффективности, включающая устойчивость к гербицидам и агрономическую продуктивность в широких генотипических средах и различных окружающих условиях. В нижеследующих примерах представлены данные, которые были использованы для исследования события DAS-68416-4 сои.
Пример 2. Исследование события DAS-68416-4 сои методом саузерн-блоттинга
Анализ методом саузерн-блоттинга был выполнен для определения паттерна интеграции события DAS-68418-4 сои. В результате выполненных экспериментов были получены данные, свидетельствующие об интеграции и целостности трансгена aad-12 в геноме сои. Событие DAS-68418-4 сои представляло собой полное, простое интеграционное событие, содержащее одну копию PTU aad-12 из плазмиды pDAB4468.
Данные, полученные в результате выполнения сайзерн-блоттинга, показали, что в геном события DAS-68418-4 сои был введен фрагмент Т-цепи pDAB4468. Детальный анализ методом саузерн-блоттинга был выполнен с использованием зонда, специфичного к гену aad-12, находившегося в области интеграции pDAB4468 Т-цепи, и дескриптивных рестрикционных ферментов, имеющих сайты расщепления в плазмиде и продуцирующих гибридизирующие фрагменты внутри плазмиды или фрагменты, заполняющие место соединения плазмиды с геномной ДНК сои (краевые фрагменты). Молекулярные массы, установленные в результате гибридизации методом саузерн-блоттинга для комбинации рестрикционного фермента и зонда, были характерны для этого события, и определяли его идентифицирующие паттерны. Указанные анализы также показали, что фрагмент плазмиды был введен в геномную ДНК сои без реаранжировки PTU aad-12.
Пример 2.1. Получения образца листьев сои и выделение геномной ДНК (гДНК)
Геномную ДНК экстрагировали из ткани листьев отдельных растений сои, содержащих событие DAS-68416-4. Кроме того, гДНК была выделена из стандартного растения сои сорта Maverick, генетический фон которого типичен для данной линии с отсутствием гена aad-12.
Геномную ДНК экстрагировали из лиофилизованной ткани листьев стандартным методом СТАВ. Экстрагированную ДНК подвергали количественному спектрофлуорометрическому анализу, используя реагент Pico Green (Invitrogen, Carlsbad, CA). Затем ДНК визуализировали на агарозном геле для подтверждения результатов анализа с использованием реагента Pico Green и определения качества ДНК.
Пример 2.2 Расщепление и выделение ДНК
Для молекулярного исследования события DAS-68416-4 сои методом сайзерн-блоттинга расщепляли десять микрограммов (10 мкг) геномной ДНК. Геномную ДНК из события DAS-68416-4 сои и линии нетрансгенной сои Mavrick расщепляли, добавляя к каждому образцу ДНК, примерно пять единиц выбранного рестрикционного фермена на один мкг ДНК и соответствующий реакционный буфер. Каждый образец инкубировали в течение ночи, примерно при 37°С. Для расщепления использовали рестрикционные ферменты SpeI, KpnI и PacI (New England Biolabs, Ipswich, MA). Кроме того, был получен положительный контрольный гибридизированный образец путем объединения плазмидной ДНК, pDAB4468, с геномной ДНК нетрансгенной сои сорта Maverick. Смесь плазмидной ДНК/геномной ДНК расщепляли такими же методами с использованием такого же рестрикционного фермента, что и экспериментальные образцы. Расщепленную ДНК инкубировали в течение ночи, добавляли NaCl до конечной концентрации 0,1 М, после чего образцы расщепленной дНК осаждали изопропанолом. Осажденную ДНК ресуспендировали в 20 мкл 1-кратного наполняющего буфера (0,1% бромфенолового синего, 100 мМ EDTA, 50% глицерина, 10 мМ трис-буфера, рН 7,5). Образцы ДНК и маркеры молекулярной массы подвергали электрофорезу в 0,85% агарозном геле, используя 0,4-кратный буфер ТАЕ (Fisher Scientific, Pittsburg, PA), под напряжением 35 вольт в течение примерно 18-22 часов для отделения фрагмента. Гели окрашивали бромидом этидия (Invitrogen, Carlsbad, CA) и ДНК визуализировали в ультрафиолетовом (УФ) свете.
Пример 2.3. Перенос методом саузерн-блоттинга и обработка мембраны
Анализ методом саузерн-блоттинга выполняли в соответствии с описанием, приведенным в публикации Severson et al. (1997). После отделения методом электрофореза и визуализации фрагментов ДНК в УФ-свете гели погружали в денатурирующий раствор (150 мМ NaOH, 3 мМ EDTA) примерно на 20 минут и затем переносили в нейтрализующий раствор (150 мМ NaPO4, рН 7,8) по меньшей мере на 20 минут. Перенос методом сайзерн-блоттинга на нейлоновые мембраны (Roche Diagnostics, Indianapolis, IN) выполняли в течение ночи, используя систему тампонов с буфером для переноса (25 мМ пирофосфата натрия, рН 10). Перенесенную ДНК связывали с мембраной путем нагревания мембраны при 65°С в течение примерно 2 часов. Таким образом, методом саузерн-блоттинга были получены мембраны, готовые для гибридизации.
Пример 2.4. Мечение ДНК-зонда и гибридизация
Фрагменты ДНК, связанные с нейлоновой мембраной, обнаруживали при помощи меченого зонда. Зонд, использованный в данном эксперименте, был получен в результате амплификации методом ПЦР с использованием затравок для конкретной нуклеотидной области плазмиды pDAB4468. Фрагмент, амплифицированный методом ПЦР, выделяли, очищали от агарозного геля и использовали в качестве матрицы для гибридизирующего зонда. Гибридизирующий зонд, созданный методом саузерн-блоттинга, метили α32Р-специфическим нуклеотидом путем произвольного примирования с использованием гранул для мечения ДНК READY-TO-GO™ GE Healthcare (GE Healthcare, Piscataway, NJ) в соответствии с инструкциями производителя и очищали на микроколонках PROBEQUATN™ G-50 (Amersham/Pharmacia, Piscataway, New Jersey, USA). Зонд, использованный в данном эксперименте, представлен в таблице 2. Предварительную гибридизацию выполняли при 65°С в течение 4 часов с использованием буфера для гибридизации (Sigma-Aldrich, St. Louis, MO). Раствор для предварительной гибридизации декантировали, и заменяли раствором для гибридизации, содержащим требуемое количество специфического зонда, предварительно денатурированного путем кипячения в воде в течение 5 минут. Смесь раствора для гибридизации и зонда инкубировали с нейлоновой мембраной в течение ночи при 65°С.
После гибридизации мембрану трижды промывали при 65°С в течение 20 минут в промывочном буфере (10 мМ фосфата натрия, 2,5 мМ пирофосфата натрия, 0,5 мМ EDTA, 0,1% SDS, который доводили до рН 7,8, добавляя фосфорную кислоту). Промытые фильтры экспонировали на экране устройства Phosphorimager для выполнения авторадиографии, и сканировали изображения. Для данного зонда были зарегистрированы число и размеры обнаруженных полос. Кроме того, был использован маркер молекулярной массы для определения размера гибридизирующего фрагмента на саузерн-блотах.
|
Пример 2.5. Результаты анализа методом саузерн-блоттинга
В таблице 3 приведены размеры предполагаемых фрагментов и фрагментов, полученных для определенного гидролизата и зонда на основании известных сайтов рестрикционных ферментов PTU aad-12. Размеры предполагаемых фрагментов определены на основании плазмидной карты pDAB4468 (фиг.1), размеры полученных фрагментов определены по результатам указанных анализов и на основании установленных размеров фрагментов маркера молекулярной массы II α32Р-меченой ДНК.
В результате указанных расщеплений и гибридизаций были идентифицированы фрагменты двух типов: внутренние фрагменты, где известные сайты ферментов фланкируют область зонда, и полностью находятся в инсерционной области PTU aad-12, и краевые фрагменты, где известный сайт фермента локализован у одного конца области зонда и второй сайт находится в геноме сои. Размеры краевых фрагментов изменяются в зависимости от события, так как в большинстве случаев сайты интеграции фрагментов ДНК являются уникальными для каждого события. Краевые фрагменты представляют собой средство локализации сайта рестрикционного фермента по отношению к интегрированной ДНК и определения числа инсерций ДНК. Анализы методов саузерн-блоттинга, выполненные в трех поколениях сои, содержащей событие DAS-68416-4, позволили получить данные, из которых следует, что в геном события DAS-68416-4 сои была введена интактная PTU aad-12 из плазмиды pDAB4468.
|
Рестрикционные ферменты SpeI и KpnI содержат уникальные сайты рестрикции в плазмиде pDAB4468. Поэтому указанные ферменты были выбраны для исследования вставки гена aad-12 в событии DAS-68416-4 сои. Было предположено, что краевые фрагменты >5436 п.о. или >5383 п.о. должны гибридизировать с зондом к гену aad-12 соответственно после расщепления ферментами SpeI и KpnI (таблица 3). Отдельные полосы гибридизации aad-12 ~12000 п.о. и ~16000 п.о. были обнаружены при использовании соответственно SpeI и KpnI. Гибридизация зонда с полосами указанного размера позволяет предположить наличие одного сайта инсерции для гена aad-12 в геноме события DAS-68416-4 сои. Рестрикционный фермент PacI был выбран для высвобождения фрагмента длиной 2904 п.о., содержащего транскрипционную единицу растения aad-12 (PTU, промотор/ген/терминатор) (таблица 3). Прогнозированный фрагмент длиной 2904 п.о. был обнаружен при помощи зонда к гену aad-12 после расщепления ферментом PacI. Результаты, полученные при расщеплении образца DAS-68416-4 всеми тремя ферментами с последующей гибридизацией с зондом к гену aad-12, показали, что в геном события DAS-68416-4 сои была введена одна копия интактной PTU aad-12 из плазмиды pDAB4468.
Пример 2.6. Отсутствие остовных последовательностей
Для проверки наличия или отсутствия гена устойчивости к спектиномицину в событии DAS-68416-4 сои, выполняли мультиплексный анализ методом ПЦР. Целью данного эксперимента была детекция пяти разных областей кодирующей последовательности гена устойчивости к спектиномицину и области длиной 407 п.о. в последовательности эндогенного гена сои, лектине (идентифицирующий номер GenBank: К00821 М30884) в качестве внутреннего контрольного образца. Кроме того, были использованы следующие контрольные образцы: (i) положительный контрольный образец с плазмидной ДНК, содержащей ген устойчивости к спектиномицину, введенный в геномную ДНК нетрансформированной сои; (ii) отрицательный контрольный образец, полученный при использовании геномной ДНК из нетрансформированной сои Maverick; и (iii) контрольный образец без геномной ДНК.
Геномную ДНК выделяли из сои методом СТАВ, и производили количественное определение с использованием реагента Pico Green. Концентрацию ДНК в каждом образце нормализовали до 100 нг/мкл. ПЦР выполняли, используя последовательности затравок, специфичные к кодирующей последовательности гена устойчивости к спектиномицину, и последовательности гена лектина. Продукты реакции анализировали, помещая 20 мкл продукта ПЦР каждого образца на 2% Е-гель.
Наличие множества ампликонов (полосы, соответствующие 100 п.о., 150 п.о. и 407 п.о.) на Е-геле показывает, что событие DAS-68416-4 сои содержит кодирующую последовательность гена устойчивости к спектиномицину (к кодирующим последовательностям гена устойчивости к спектиномицину предположительно относятся амплифицированные полосы, соответствующие 100 п.о. и 150 п.о.). Наличие только одного ампликона длиной 407 п.о., соответствующего внутренней регуляторной последовательности гена лектина, указывает на то, что событие DAS-68416-4 сои не содержит кодирующую последовательность гена устойчивости к спектиномицину.
Образцы ДНК из события DAS-68416-4 сои не амплифицировали фрагменты длиной 100 п.о. или 150 п.о. Был амплифицирован только фрагмент длиной 407 п.о. Однако амплифицированные фрагменты длиной 100 п.о., 150 п.о. и 407 п.о. присутствовали в положительном контрольном образце, в котором плазмидную ДНК, содержащую ген устойчивости к спектиномицину, вводили в геномную ДНК сои. Отрицательный контрольный образец, содержащий ДНК из нетрансформированной сои, амплифицировал один фрагмент длиной 407 п.о. И, наконец, продукты реакции, не содержавшие геномную ДНК, не продуцировали никаких амплифицированных фрагментов. Поэтому кодирующая последовательность гена устойчивости к спектиномицину не была обнаружена в событии DAS-68416-4 сои.
Пример 3. Клонирование и исследование последовательности ДНК в вставке и фланкирующих краевых областях события DAS-68416-4 сои
Для исследования и описания инсерционного сайта геномной ДНК была определена ДНК-вставка Т-цепи и фланкирующие краевые области геномной ДНК события DAS-68416-4. Было подтверждено в общей сложности 10212 п.о. геномной последовательности события DAS-68416-4 сои, из которых 2730 п.о. принадлежали 5'-концевой фланкирующей краевой последовательности, 1091 п.о. принадлежали 3'-концевой фланкирующей краевой последовательности и 6391 п.о. принадлежали вставке Т-цепи (SEQ ID NO:1). Анализ последовательности показал, что событие DAS-68416-4 сои содержит единственную копию интактного трансгена, включающую элемент MAR, экспрессирующий кластер aad-12 и экспрессирующий кластер pat, без изменения последовательности предполагаемой вставки Т-цепи.
Амплификация методом ПЦР на основе вставки и краевых последовательностей события DAS-68416-4 сои показала, что краевые области принадлежат сое, и соединительные области могут быть использованы для событиеспецифичной идентификации события DAS-68416-4 сои. Анализ последовательности, заполняющей соединительные области, включая фланкирующие краевые последовательности, не позволил выявить новые открытые рамки считывания (ORF>=150 кодонов), образовавшиеся в результате инсерции в Т-цепь. Кроме того, был исследован инсерционный сайт Т-цепи путем клонирования геномного фрагмента, соответствующего области идентифицированных фланкирующих краевых последовательностей из генома нетрансгенной сои. В результате сравнения события DAS-68416-4 сои с геномной последовательностью дикого типа была обнаружена делеция длиной 55 п.о. в исходном локусе и инсерция длиной 9 п.о. в положении 3'-концевого интеграционного соединения этого события. Исследование вставки и краевой последовательности события DAS-68416-4 сои указало на наличие в геноме сои одной интактной копии Т-цепи.
Пример 3.1. Экстракция и количественный анализ геномной ДНК
Геномную ДНК экстрагировали из лиофилизованных или только что измельченных тканей листьев при помощи модифицированного метода СТАВ. После экстракции геномной ДНК образцы ДНК растворяли в 1-кратном буфере ТЕ (10 мМ трис-буфера, рН 8,0, 1 мМ EDTA) (Fluka, Sigma, St. Louis, MO), и выполняли количественный анализ с использованием реагента Pico Green в соответствии с инструкциями производителя (Molecular Probes, Eugene, OR). Для выполнения анализа методом ПЦР образцы ДНК разводили водой со степенью чистоты для молекулярной биологии (5 PRIME, Gaithersburg, MD) до концентрации 10-100 нг/мкл.
Пример 3.2 Затравки для ПЦР
В таблице 4 представлены последовательности затравок, которые были использованы для клонирования и подтверждения ДНК-вставки и фланкирующих краевых областей события DAS-68416-4 сои, с указанием положений и описаниями, приведенными на фиг.2. Все затравки были синтезированы в компании Integrated DNA Technologies, Inc. (Coralville, IA). Затравки растворяли в воде (5 PRIME, Gaithersburg, MD) до концентрации 100 мкМ для получения исходного раствора и разбавляли водой до концентрации 10 мкМ для получения рабочего раствора.
|
|
|
|
|
Пример 3.3. Скрининг генома
Для клонирования 5'- и 3'-концевых фланкирующих краевых областей вставки pDAB4468 Т-цепи для события DAS-68416-4 был использован универсальный набор GENOMEWALKER™ (Clontech Laboratories, Inc., Mountain View, CA) в соответствии с инструкциями производителя. Примерно 2 мкг геномной ДНК из события DAS-68416-4 сои расщепляли в течение ночи ферментами EcoRV и PvuII (фиг.2). Гидролизаты ДНК очищали, используя набор DNA CLEAN & CONCENTRATOR™-25 (ZYMO Research, Orange, CA) и лигировали с адапторами GENOMEWALKER™ с созданием библиотек GENOMEWALKER™. Каждую библиотеку GENOMEWALKER™ использовали в качестве матричной ДНК для амплификации при помощи первичной ПЦР с использованием адапторной затравки АР1 (входит в набор) и специфичной для конструкции затравки ES_LEnd03 или ES_PATEnd03 (таблица 4). Один микролитр (1 мкл) реакционной смеси для первичной ПЦР, разведенной в отношении 1:25, использовали в качестве матрицы для амплификации при помощи вторичной ПЦР с использованием вложенной адапторной затравки АР2, предусмотренной в наборе, и вложенной специфичной для конструкции затравки ES_LEnd04 или ES_PATEnd04 (таблицы 4, 7 и фиг.2).
Пример 3.4. Стандартная ПЦР
Стандартную ПЦР использовали для клонирования и подтверждения наличия вставки и краевой последовательности события DAS-68416-4 сои. Для амплификации при помощи стандартной ПЦР использовали набор TaKaRa LA TAQ™ (Takara Bio Inc., Shiga, Japan), ДНК-полимеразу HOTSTARTAQ™ (Qiagen, Valencia, CA), набор для ПЦР HIGH FIDELITY™ (Roche Diagnostics, Inc.) или набор высокоточных полимераз EASY-A™ (Stratagene, LaJolla, CA) в соответствии с рекомендациями производителя. Специфические условия выполнения ПЦР и описания ампликонов приведены в таблицах 5, 6 и 7.
Пример 3.5. Детекция, очистка, субклонирование и секвенирование продуктов ПЦР
Продукты ПЦР исследовали при помощи электрофореза, используя 1,2% или 2% Е-гель® (Invitrogen, Carlsbad, CA) в соответствии с инструкциями производителя. Размер фрагмента определяли путем сравнения с маркерами ДНК. При необходимости фрагменты, полученные при помощи ПЦР, очищали, для чего указанные фрагменты переносили из 1% агарозного геля в 1-кратный буфер ТВЕ (89 мМ трис-буфера с боратом, 2 мМ EDTA, рН 8,3) и окрашивали бромидом этидия, используя набор для экстракции геля QIAquick (Qiagen, Valencia, CA).
Фрагменты, полученные при помощи ПЦР, субклонировали в вектор PCR®4-TOPO®, используя набор для секвенирования TOPO TA CLONING® (Invitrogen, Carlsbad, CA) в соответствии с инструкциями производителя. В частности, два-пять микролитров клонируемого продукта реакции ТОРО® переносили в химически компетентные клетки ТОР10 One Shot в соответствии с инструкциями производителя. Клонированные фрагменты, правильность которых проверяли с помощью минипрепарата плазмидной ДНК (набор QIAprep Spin Miniprep, Qiagen, CA), расщепляли рестрикционным ферментом EcoRI или при помощи колониеспецифической ПЦР с использованием затравок Т3 и Т7. Плазмидную ДНК или исходные растворы отобранных колоний в глицерине отправляли для секвенирования.
После субклонирования предполагаемые продукты направленной ПЦР сначала секвенировали для подтверждения клонирования ожидаемых фрагментов ДНК. Колонии, содержащие предполагаемые последовательности ДНК, отбирали для секвенирования полных двухцепочечных последовательностей путем скрининга с помощью затравок. Секвенирование было выполнено в компании Cogenics (Houston, TX).
Конечную сборку вставки и краевых последовательностей выполняли при помощи программного обеспечения SEQUENCHER (Gene Codes Corporation, Ann Arbor, MI). Описание вставки и фланкирующих краевых последовательностей события DAS-68416-4 сои было произведено при помощи программы Vector NTI (версия 10 и 11, Invitrogen, Carlsbad, CA).
Поиск гомологии был выполнен при помощи программы BLAST на основании неизбыточной базы данных нуклеотидов GenBank. Открытую рамку считывания (ORF) анализировали при помощи программы Vector NTI (версия 11, Invitrogen) для идентификации ORF (>=150 кодонов) в полной вставке и фланкирующих краевых последовательностях события DAS-68416-4 сои и исходного локуса линии сои Maverick дикого типа.
Пример 3.6. 5'-Концевая краевая последовательность
Фрагмент ДНК амплифицировали из каждой библиотеки GENOMEWALKER™ события DAS-68416-4 сои, используя набор специфических вложенных затравок для 5'-конца трансгена. Был обнаружен фрагмент длиной ~1,8 т.п.о. из библиотеки EcoRV GENOMEWALKER™ и фрагмент длиной ~3 т.п.о. из библиотеки PvuII GENOMEWALKER™. Указанные фрагменты клонировали в вектор PCR®4-TOPO®. Для секвенирования конца были произвольно выбраны пять колоний в каждой библиотеке с целью получения данных для нуклеотидных последовательностей. Колонии, содержащие последовательности обеих затравок для ПЦР, были отобраны для получения полных последовательностей путем скрининга с помощью затравок. Анализ последовательностей показал, что клон, амплифицированный из библиотеки EcoRV GENOMEWALKER™ события DAS-68416-4 сои, содержал фрагмент ДНК длиной 1744 п.о. и клон, амплифицированный из библиотеки PvuII GENOMEWALKER™ события DAS-68416-4 сои, содержал фрагмент ДНК длиной 3047 п.о. Анализ последовательностей показал, что фрагмент ДНК, полученный из библиотеки EcoRV GENOMEWALKER™, был перекрыт фрагментом ДНК, полученным из библиотеки PvuII GENOMEWALKER™, в областях между затравкой ES_LEnd04 и сайтом EcoRV. Все фрагменты ДНК содержали 5'-концевое соединение краевой последовательности В Т-цепи в трансгене, из чего следует, что указанные фрагменты были амплифицированы из одной и той же области 5'-концевой вставки трансгена и фланкирующей краевой последовательности в событии DAS-68416-4 сои. Было установлено, что полученная геномная последовательность длиной 2730 п.о. не обладает значительной гомологией с последовательностями в GenBank.
Пример 3.7. 3'-Концевая краевая последовательность
Фрагмент ДНК длиной около 1,3 т.п.о. был амплифицирован из библиотеки EcoRV GENOMEWALKER™ события DAS-68416-4 сои с использованием набора специфических вложенных затравок для 3'-конца трансгена. Полученный фрагмент ДНК затем клонировали в вектор PCR®4-ТОРО®. Для секвенирования конца были произвольно отобраны пять колоний. Все пять колоний содержали последовательности затравки АР2 и затравки ES_PATEnd04. В результате полного секвенирования указанных клонов был обнаружен фрагмент консенсусной ДНК длиной 1359 п.о. Анализ последовательностей показал, что фрагмент длиной 1359 п.о. включал фрагмент длиной 268 п.о. из 3'-концевой области краевой последовательности А Т-цепи и фрагмент длиной 1091 п.о. из геномной ДНК сои. Поиск с помощью программы BLAST не выявил значительной гомологии между последовательностью ДНК сои длиной 1091 п.о. и последовательностями в GenBank.
Пример 3.8. ДНК-вставка и соединительная последовательность
ДНК-вставку и фланкирующие краевые области клонировали из события DAS-68416-4 сои ранее описанными методами на основе ПЦР. 5'- и 3'-концевые фланкирующие краевые последовательности и прогнозируемую последовательность трансгена использовали для создания затравок для ПЦР, приведенных в таблице 6. Были клонированы и секвенированы в общей сложности четыре перекрывающихся фрагмента ДНК (ампликон 1 длиной 978 п.о., ампликон 2 длиной 2414 п.о., ампликон 3 длиной 1834 п.о. и ампликон 4 длиной 1705 п.о.) (фиг.3). Полную вставку и фланкирующие краевые последовательности собирали на основании последовательности, перекрывающей четыре фрагмента. Анализ собранной последовательности подтвердил наличие фрагмента длиной 6391 п.о. из трансгена pDAB4468 и отсутствие изменений оснований во вставленной последовательности ДНК при сравнении с прогнозируемыми последовательностями из плазмиды pDAB4468.
Пример 3.9. Подтверждение геномных последовательностей сои
Для подтверждения наличия инсерционного сайта трансгена события DAS-68416-4 сои в геноме сои выполняли ПЦР с использованием разных пар затравок (фиг.4 и фиг.5). Геномную ДНК из события DAS-68416-4 сои и других линий трансгенной или нетрансгенной сои использовали в качестве матрицы. Таким образом, для подтверждения правильности полученных 5'-концевых краевых последовательностей две затравки, специфичные к aad-12, например, AIILEnd05 и AIILEnd06, и две затравки, созданные в соответствии с 5'-концевой краевой последовательностью и получившие название 16LEndG01 и 16LEndG02, были использованы для амплификации сегмента ДНК, заполняющего участок от гена aad-12 до 5'-концевой краевой последовательности. Аналогичным образом для подтверждения клонированной 3'-концевой краевой последовательности pat-специфичная затравка, например, PATEnd06, и две затравки, созданные в соответствии с 3'-концевой краевой последовательностью и получившие название 16PATG01 и 16PATG02, были использованы для амплификации сегментов ДНК, заполняющих участок от гена pat до 3'-концевой краевой последовательности. Фрагменты ДНК прогнозируемого размера были амплифицированы только из геномной ДНК события DAS-68416-4 сои с использованием каждой пары затравок, из которых одна затравка находилась во фланкирующей краевой последовательности события DAS-68416-4 сои и другая затравка была специфичной к трансгену, но не была амплифицирована из образцов ДНК других линий трансгенной сои или нетрансгенной контрольной сои. Полученные результаты показывают, что клонированные 5'- и 3'-концевые краевые последовательности являются фланкирующими краевыми последовательностями вставки Т-цепи в событии DAS-68416-4 сои.
Для дальнейшего подтверждения инсерции ДНК в геном сои методом ПЦР амплифицировали две последовательности сои. Две затравки, созданные в соответствии с 5'-концевой краевой последовательностью, 16LEndG03 и 16LEndG04, и две затравки для 3'-концевой краевой последовательности, 16PATG03 и 16PATG04, были использованы для амплификации сегментов ДНК, содержащих весь трансген, 5'-концевую краевую последовательность и 3'-концевую краевую последовательность. Как и предполагалось, в результате амплификации методом ПЦР с использованием пары затравок 16LEndG03 и 16PATG03 был амплифицирован фрагмент ДНК длиной 9 т.п.о. из геномной ДНК события DAS-68416-4 сои и фрагмент ДНК длиной 2,7 т.п.о. из нетрансгенной контрольной сои и других линий трансгенной сои. Аналогичным образом при выполнении ПЦР с использованием пары затравок 16LEndG04 и 16PATG04 был получен фрагмент ДНК длиной примерно 9 т.п.о. из образца события DAS-68416-4 и фрагмент ДНК длиной 2,8 т.п.о. из всех других линий контрольной сои. Была обнаружена слабая полоса размером около 6 т.п.о. во всех образцах сои за исключением события DAS-68416-4 сои при использовании обеих пар затравок для ПЦР, из чего следует, что указанная слабая полоса появилась в результате неспецифической ампликации в геноме сои с помощью данной пары затравок.
Пример 3.10. Подтверждение геномных последовательностей сои
Фрагменты ДНК длиной 2,7 т.п.о. и 2,8 т.п.о., амплифицированные с использованием пары затравок 16LEndG03 и 16PATG03 или пары затравок 16LEndG04 и 16PATG04 из линии нетрансгенной сои Maverick, клонировали и секвенировали. Последовательности указанных фрагментов совмещали друг с другом, и сравнивали с клонированными 5'- и 3'-концевыми краевыми последовательностями из события DAS-68416-4 сои. Было установлено, что клонированная последовательность ДНК включала локус, в котором Т-цепь pDAB4468 была интегрирована в событие DAS-68416-4 сои. В результате выполнения сравнительного анализа была обнаружена делеция 55 п.о. из исходного локуса и инсерция 9 п.о. в положении 3'-концевого интеграционного соединения (фиг.5). В клонированной геномной области исходного локуса сои не были обнаружены открытые рамки считывания (>/=450 п.о., 150 аминокислот).
Пример 4. Исследование генома при помощи маркеров SNP фланкирующих последовательностей события DAS-68416-4 сои
Для исследования и описания инсерционного сайта генома были определены маркерные последовательности, расположенные в непосредственной близости от вставки. Для идентификации и картирования положения трансгена была использована панель полиморфных маркеров полиморфизма отдельных нуклеотидов (SNP). Событие DAS-68416-4 сои локализовано на расстоянии 119,6 сМ в хромосоме 4. Указанное положение находится между двумя маркерами SNP BARC-044607-08736 и BARC-019093-03299 фланкирующих последовательностей. В частности, данное положение трансгена было картировано на расстоянии 1,3 сМ (480 т.п.о.) от маркера SNP BARC-019093-03299.
Пример 4.1. Программа BLAST с использованием последовательностей фланкирующих краевых областей
Последовательности фланкирующих краевых областей события DAS-68416-4 сои (SEQ ID NO:1) использовали для исследования с помощью программы BLAST всей геномной последовательности сои. Результаты исследования с помощью программы BLAST показали, что обе краевые последовательности события DAS-68416-4 сои были локализованы в хромосоме 4 (Gm04), которая является связывающей группой С1.
Пример 4.2. Картирование SNP и результаты исследования с помощью программы BLAST
На основании результатов исследования с помощью программы BLAST с использованием краевых последовательностей и картирования было установлено нахождение указанного события в хромосоме 4. Маркеры SNP были отобраны на основании карт сцепления генов сои. Последовательности SNP были выбраны из маркеров SNP, созданных д-ром Креганом, Beltsville Agricultural Research Center, и Министерством сельского хозяйства США. Указанные маркеры SNP ассоциированы со связывающей группой С1, соответствующей хромосоме 4. Последовательности SNP были использованы для исследования с помощью программы BLAST всей геномной последовательности сои с целью определения физических положений вставки Т-цепи для события DAS-68416-4 сои.
Пример 4.3. Результаты исследования с помощью маркеров SNP
Событие DAS-68416-4 сои картировано на расстоянии 119.6 сМ в хромосоме 4. Двумя фланкирующими маркерами SNP являются BARC-044607-08736 и BARC-019093-03299. Трансген расположен на расстоянии 1,3 сМ (480 т.п.о.) от маркера SNP BARC-019093-03299, при расстоянии примерно 119,6 сМ между маркерами SNP BARC-044607-08736 и BARC-019093-03299.
Пример 5. Исследование белка AAD-12 в событии DAS-68416-4 сои
Были исследованы биохимические свойства рекомбинантного белка AAD-12, выделенного из события DAS-68416-4 трансгенной сои. Биохимические свойства указанного белка исследовали при помощи количественного твердофазного иммуноферментного анализа (ELISA), электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE, окрашенном кумассии голубым и с помощью методов детекции гликопротеина) и вестерн-блоттинга и подтверждали экспрессию белка AAD-12.
Пример 5.1. Экспрессия белка AAD-12 в тканях растения
В событии DAS-68416-4 сои определяли уровни белка AAD-12. Растворимый, экстрагируемый белок AAD-12 измеряли при помощи количественного твердофазного иммуноферментного анализа (ELISA) в листьях сои.
Образцы тканей сои, выделенные из подопытных растений, готовили к выполнению анализа экспрессии. Белок AAD-12 экстрагировали из тканей растений сои при помощи солевого раствора с фосфатным буфером, содержащего детергент твин-20 (PBST), включающий 0,5% бычьего сывороточного альбумина (BSA). Ткань растения центрифугировали, водный супернатант собирали, при необходимости разбавляли соответствующим буфером и анализировали в виде сэндвича при помощи набора для ELISA AAD-12. Указанный набор использовали в соответствии с рекомендациями производителя.
Выполняли анализ для исследования устойчивости экспрессии и наследуемости как по вертикали (между поколениями), так и по горизонтали (между линиями) в событии DAS-68416-4 сои. Экспрессия события DAS-68416-4 сои в поколении Т5 была устойчивой (без расщепления) и сопоставимой во всей линиях (фиг.6).
Уровни экспрессии события DAS-68416-4 сои в полевых условиях исследовали на разных стадиях роста растений, включающих стадии до V3, после V3, до R2 и после R2. Значения экспрессии были аналогичны для всех условий опрыскивания растений, а также для делянок, опрысканных и не опрысканных гербицидом 2,4-D. Была внесена 2-кратная норма гербицида (2240 г эквивалента кислоты/га 2,4-D) и при этом не было обнаружено повреждения растений на всех этапах исследования. Средняя экспрессия во всех линиях на стадии роста растений до V3 была равна 300 мкг/см2. После опрыскивания 2,4-D экспрессия оставалась устойчивой и составляла в среднем 400 мкг/см2 во всех линиях. Ко времени достижения соей стадии роста, предшествующей R2, средняя экспрессия несколько снизилась и составляла в среднем 200 мкг/см2. После опрыскивания 2,4-D экспрессия на стадии после R2 вернулась к предыдущему среднему значению, равному 400 мкг/см2. См. фиг.6.
Пример 5.2. Экспрессия белка AAD-12 в тканях растения
В 2008 г. было выполнено дополнительное исследование экспрессии в полевых условиях на шести участках в США и Канаде. Исследовали сою с событием DAS-68416-4, которая была подвергнута четырем обработкам (отсутствие опрыскивания, опрыскивание 2,4-D, опрыскивание глюфозинатом или опрыскивание 2,4-D и глюфозинатом). Образцы тканей растения включали листья, зерна, корни и стебли. Ткани листьев были получены на стадии V5 и V10, корни и стебли были получены на стадии развития R3. Зерно было получено на стадии развития R8 (Gaska, 2006). Растворимый, экстрагируемый белок AAD-12 измеряли при помощи достоверного твердофазного иммуноферментного анализа (ELISA), описанного в примере 5.1. Уровни белка AAD-12 для всех типов тканей вычисляли в виде нг/мг сухой массы.
Краткий обзор концентраций белка AAD-12 (в среднем на участках) в разных матрицах сои представлен в таблице 8. Средние значения экспрессии составляли от 15,5 нг/мг сухой массы в корнях на стадии R3 до 66,1 нг/мг в ткани листьев на стадии V5. Значения экспрессии были аналогичны для всех опрыскиваний, а также для растений, опрысканных и не опрысканных гербицидами 2,4-D и глюфозинатом. Белок AAD-12 не был обнаружен в тканях контрольных растений на всех шести участках.
|
|
Пример 5.3. Анализ белка AAD-12 методами SDS PAGE и вестерн-блоттинга
Белок AAD-12 экстрагировали из лиофилизованной ткани листьев сои с событием DAS-68416-4 в буфер PBST (солевой раствор с фосфатным буфером, содержащий 0,05% твина-20, рН 7,4) с добавленными стабилизаторами и растворимые белки собирали центрифугированием. Супернатант фильтровали, и растворимые белки оставляли связываться с гранулами фенилсефарозы (PS) (GE Healthcare, Piscataway, NJ). После инкубации в течение одного часа гранулы PS промывали PBST и связанные белки элюировали водой Milli-Q. Для увеличения проводимости добавляли хлорид натрия и белки, очищенные от PS, вводили в колонку для иммуноаффинной хроматографии, которая была конъюгирована с поликлональным антителом, специфичным к AAD-12. Несвязанные белки удаляли из колонки и колонку в течение длительного времени промывали предварительно охлажденным PBS (солевой раствор с фосфатным буфером, рН 7,4). Связанные белки элюировали из колонки 3,5 М раствором NaSCN, 50 мМ трис-буфера, рН 8,0, и исследовали методами SDS-PAGE и вестерн-блоттинга. Таким же образом выделяли белок из ткани листьев контрольной линии сои Maverick. Линия сои Maverick не содержит ген aad-12, но характеризуется генетическим фоном, типичным для растений сои с событием DAS-68416-4.
Лиофилизованную ткань листьев сои с событием DAS-68416-4 и сои Maverick смешивали с буфером PBST, содержащим ~2,0% смеси ингибиторов протеазы (Sigma, St. Louis, MO), и экстрагировали белок, измельчая в шаровой мельнице Geno-Grinder. Образцы центрифугировали, супернатанты смешивали с буфером для образца Laemmli, нагревали, и центрифугировали в течение короткого времени. Образцы помещали на гель для SDS-PAGE компании Bio-Rad Criterion. Положительный эталон, белок AAD-12, выделенный из микроорганизмов, также смешивали с буфером для образца и помещали на гель. Электрофорез выполняли с использованием трис-буфера/глицина/буфера для SDS (Bio-Rad, Hercules, CA). После выполнения электрофореза гель разрезали пополам, одну половину окрашивали синим красителем для белка GelCode компании Pierce и другую половину геля подвергали электроблоттингу на нитроцеллюлозной мембране. Затем нитроцеллюлозную мембрану зондировали поликлональным антителом кролика, специфичным к AAD-12. Хемилюминесцентный субстрат использовали для визуализации иммунореактивных полос.
В AAD-12, выделенном из микроорганизмов, основная полоса белка, визуализированная на геле для SDS-PAGE, окрашенном кумассии, соответствовала примерно 32 кДа. Как и предполагалось, размер соответствующего белка AAD-12, выделенного из растения, был идентичен размеру белка, выделенного из микроорганизмов. Очищенные фракции растения содержали незначительное количество неиммунореактивных примесей помимо белка AAD-12. Совместно очищенные белки, по-видимому, остались в колонке в результате слабого взаимодействия с матрицей колонки (Williams, et al., 2006, Kennedy and Barnes, 1983 and Holroyde et al., 1976).
AAD-12, выделенный из микроорганизмов, и экстракт тканей растения DAS-68416-4 демонстрировали положительный сигнал предполагаемого размера при выполнении вестерн-блоттинга с использованием поликлонального антитела против AAD-12. При выполнении анализа AAD-12 методом вестерн-блоттинга не были обнаружены иммунореактивные белки в экстракте контрольной сои Maverick, и не были обнаружены белки альтернативного размера (агрегаты или продукты разрушения) в образцах, полученных из трансгенного растения. С помощью моноклонального антитела в белке, выделенном из микроорганизмов, было обнаружено небольшое количество димера AAD-12. Полученные результаты указывают на экспрессию белка AAD-12 в сое.
Пример 6. Анализ метилирования события DAS-68416-4 сои методом саузерн-блоттинга
Введенные трансгены могут подвергаться сайленсингу после интеграции в геном растения. Экспрессия трансгена может быть ингибирована на транскрипционном уровне и/или посттранскрипционном уровне. В научной литературе отмечено, что сайленсинг транскрипционного гена обусловлен метилированием трансгена, его промотора и других родственных последовательностей (Stem et al., 1997). Для детекции метилирования в специфических последовательностях в качестве одного метода используют чувствительные к метилированию рестрикционные ферменты для расщепления ДНК с последующим выполнением анализа продуктов ДНК методом саузерн-блоттинга. В случае метилирования специфических сайтов рестрикционных ферментов указанные ферменты не расщепляют ДНК. Метилирование сайтов рестрикции вызывает образование фрагментов ДНК с большей молекулярной массой, которые могут быть обнаружены при помощи саузерн-блоттинга. Анализ метилирования на основе саузерн-блоттинга выполняли для определения состояния метилирования вставки Т-цепи для события DAS-68416-4 сои. Данный анализ выполняли, используя зонды, специфичные к гену aad-12, его промотору и двум рестрикционным ферментам, чувствительным к метилированию. Не было обнаружено метилирования экспрессирующего кластера aad-12.
6.1. Получение образца листьев сои и выделение геномной ДНК (гДНК)
Геномная ДНК была получена из листьев отдельных растений сои с событием DAS-68416-4 и линии нетрансгенной сои Maverick. Геномную ДНК выделяли из лиофилизованных образцов листьев традиционным методом СТАВ. Производили количественное определение экстрагированной ДНК с использованием реагента Pico Green (Invitrogen, Carlsbad, CA).
6.2. Расщепление и выделение ДНК
Для молекулярного исследования ДНК десять микрограммов (10 мкг) геномной ДНК из сои с событием DAS-68416-4 и линии нетрансгенной сои Maverick расщепляли, добавляя к каждому образцу ДНК, примерно пять единиц выбранного рестрикционного фермента на 1 мкг ДНК и соответствующий реакционный буфер. Каждый образец инкубировали в течение ночи примерно при 37°С. Для расщепления использовали рестрикционные ферменты AciI и Hyp188III (New England Biolabs, Ipswich, MA). ДНК из нетрансгенной сои Maverick расщепляли такими же методами и рестрикционными ферментами, что и экспериментальные образцы, и использовали в качестве отрицательных контрольных образцов. Образцы расщепленной ДНК осаждали изопропанолом после добавления NaCl до конечной концентрации 0,1 М и ресуспендировали в 20 мкл 1-кратного наполняющего буфера (0,1% бромфенола синего, 100 мМ EDTA, 50% глицерина, 10 мМ трис-буфера, рН 7,5). Затем образцы ДНК и маркеры молекулярной массы подвергали электрофорезу в 0,85% агарозных гелях с 0,4-кратным буфером ТАЕ (Fisher Scientific, Pittsburgh, PA) под напряжением 35 вольт в течение примерно 18-22 часов до отделения фрагмента. Гели окрашивали бромидом этидия (Invitrogen, Carlsbad, CA) и визуализировали ДНК в ультрафиолетовом (УФ) свете.
6.3. Перенос методом саузерн-блоттинга и обработка мембраны
Анализ методом саузерн-блоттинга выполняли в соответствии с описанием, приведенным в публикации Severson et al., (1997). После отделения при помощи электрофореза и визуализации фрагментов ДНК в УФ-свете гели обрабатывали денатурирующим раствором (150 мМ NaOH, 3 мМ EDTA) в течение примерно 20 минут и затем нейтрализующим раствором (150 мМ NaPO4, рН 7,8) в течение по меньшей мере 20 минут. Перенос методом саузерн-блоттинга на нейлоновые мембраны выполняли в течение ночи (Roche Diagnostics, Indianapolis, IN), используя систему тампонов с буфером для переноса (25 мМ пирофосфата натрия, рН 10). После переноса мембраны нагревали при 65°С в течение примерно 2 часов. Таким образом, методом саузерн-блоттинга были получены мембраны, готовые для гибридизации.
6.4. Мечение ДНК-зонда и гибридизация
Фрагменты ДНК, связанные с нейлоновой мембраной, обнаруживали при помощи меченого зонда. Зонды были созданы методом ПЦР в виде фрагментов, амплифицированных специфическими затравками из плазмиды pDAB4468. Фрагменты, амплифицированные ПЦР, вырезали, и очищали от агарозного геля. Очищенные фрагменты ДНК использовали в качестве матриц для создания гибридизирующих зондов. Гибридизирующие зонды метили α32Р-специфическим нуклеотидом путем произвольного примирования с использованием гранул для мечения ДНК READY-TO-GO™ GE Healthcare (GE Healthcare, Piscataway, NJ) в соответствии с инструкциями производителя и очищали на микроколонках PROBEQUANT™ G-50 (Amersham/Pharmacia, Piscataway, New Jersey, USA). Список зондов, использованных для данного исследования, приведен в таблице 9.
Предварительную гибридизацию и гибридизацию выполняли при 65°С соответственно в течение 4 часов и в течение ночи, используя буфер для гибридизации (Sigma, St. Louis, MO). После гибридизации мембрану трижды промывали при 65°С в промывочном буфере (10 мМ фосфата натрия, 2,5 мМ пирофосфата натрия, 0,5 мМ EDTA, 0,1% SDS, который доводили до рН 7,8, добавляя фосфорную кислоту) в течение 20 минут. Промытые фильтры экспонировали на экране устройства Phosphorimager для выполнения авторадиографии, и сканировали изображения.
|
6.5. Отделение зонда
ДНК-зонды отделяли от мембранных блотов после получения данных гибридизации методом саузерн-блоттинга, после чего мембранные блоты могут быть повторно использованы для гибридизации с другим ДНК-зондом. После экспонирования мембранные блоты промывали регенерирующим раствором 1 (30 мМ NaOH, 1 мМ Na2EDTA) при комнатной температуре в течение 10 минут и регенерирующим раствором 2 (5 мМ NaPO4, 1 мМ Na2EDTA, 0,1% SDS) при 65°С в течение 30 минут. Мембранные блоты в течение короткого времени промывали 2-кратным объемом SSC, после чего они были готовы для гибридизации с другим ДНК-зондом. Мембранные блоты экспонировали на экране устройства Phosphorimager для выполнения авторадиографии для гарантии того, что все ДНК-зонды были удалены до выполнения следующей гибридизации.
6.6. Результаты исследования методом саузерн-блоттинга
В данном исследовании для определения состояния метилирования гена aad-12 и его промотора AtUbi10 были использованы чувствительные к метилированию рестрикционные ферменты AciI и Hyp188III. Предполагаемые размеры фрагментов при использовании конкретного гидролизата и зонда на основании известных сайтов рестрикционных ферментов ДНК Т-цепи pDAB4468 приведены в таблице 10. Детекция фрагментов с более высокой молекулярной массой методом саузерн-блоттинга указывает на метилирование цитозина в последовательности узнавания сайтов рестрикционных ферментов AciI и Hyp188III. Таким образом, в результате метилирования рестрикционные ферменты утрачивают способность расщеплять геномную ДНК.
Рестрикционные ферменты AciI и Hyp188III были использованы для исследования состояния метилирования гена aad-12. Полосы гибридизации предполагаемого размера были обнаружены с помощью зонда aad-12. Полученные данные свидетельствуют об отсутствии метилирования на сайте узнавания ферментов AciI и Hyp188III в событии DAS-68416-4 сои. Аналогичным образом полосы, соответствующие прогнозированной молекулярной массе, были обнаружены в образцах ДНК события DAS-68416-4 сои, расщепленных ферментом Hyp188III с использованием зонда AtUbi10. Полученные данные показывают, что указанный сайт узнавания не был метилирован в последовательности промотора aad-12.
|
Пример 7. Агрономические данные
Агрономические испытания были выполнены в отношении сои с событием DAS-68416-4 в качестве части исследования композиций, проведенного в 2008 г. на 6 участках в США и Канаде, а также в виде отдельного исследования, проведенного в 2009 г. на 8 участках в США и Канаде. При выполнении указанных исследований было произведено сравнение сои, включающей событие DAS-68416-4, (с внесением и без внесения гербицидов 2,4-D и/или глюфозината) с близкой изолинией нетрансгенной контрольной сои (Maverick). Результаты обоих исследований показали, что агрономические параметры находились в пределах, установленных для стандартных линий сои.
Пример 7.1. Получение агрономических данных исследования, выполненного в 2008 г.
Агрономическое исследование сои с событием DAS-68416-4 и нетрансгенной контрольной сои (сорт Maverick) было выполнено в 2008 г. на шести участках, расположенных в штатах Айова, Иллинойс, Индиана, Небраска и в провинции Онтарио, Канада (2 участка). Была произведена оценка таких агрономических показателей, как плотность/число растений, мощность проростков/растений, высота растений, полегание, заболеваемость, повреждение насекомыми и число дней до цветения, для исследования соответствия сои, включающей событие DAS-68416-4, (с обработкой и без обработки гербицидами) контрольной линии сои сорта Maverick. Данное исследование представлено как эксперимент 1.
Семена экспериментальной и контрольной сои сеяли при норме посева, равной примерно 112 семенам в ряду длиной 7,6 м (25 футов), с расстоянием между семенами около 75 см (30 дюймов). На каждом участке были созданы три одинаковые делянки для каждой обработки, которые состояли из рядов длиной от 71 см до 7,6 м (2-25 футов). Делянки были расположены по принципу рандомизированного полного повторения (RCB) с уникальной рандомизацией на каждом участке. Каждая делянка сои была огорожена двумя рядами нетрансгенной сои аналогичной спелости. Весь опытный участок был окружен как минимум 3,5 м (10 футов) нетрансгенной сои аналогичной относительной спелости.
Обработку гербицидами производили путем опрыскивания в объеме, равном примерно 187 л/га (20 галлонов/акр). Внесение гербицидов в таких количествах соответствует максимальной норме, применяемой в агрономической практике. Гербицид 2,4-D вносили вразброс поверх растений три раза за сезон в общем количестве, равном 3 фунтам эквивалента кислоты/акр. Отдельные внесения гербицидов в количестве 1120 г/га (1,0 фунт эквивалента кислоты/акр) производили до появления всходов и примерно на стадиях роста V4 и R2. Глюфозинат вносили вразброс поверх растений два раза за сезон в общем количестве, равном 828 г активного ингредиента/га (0,74 фунта активного ингредиента/акр). Отдельные внесения гербицидов в количестве 374 и 454 г активного ингредиента/га (0,33 фунта активного ингредиента/акр и 0,41 фунта активного ингредиента/акр) производили примерно на стадиях роста V6 и R1.
Дисперсионный анализ агрономических данных выполняли на полевых участках с использованием смешанной модели (версия 8 SAS; SAS Institute 1999). Исследуемые сорта сои считались постоянными величинами, а местоположение участка, расположение блока на участке, местоположение сортов сои на участке и сои в блоке считались произвольными величинами. Значимость общего эффекта обработки оценивали при помощи F-критерия. Парные отличия между контрольной соей и трансгенной соей, такой как неопрысканная соя с событием DAS-68416-4 (неопрысканная соя), соя с событием DAS-68416-4, опрысканная глюфозинатом (соя с событием DAS-68416-4 + глюфозинат), соя с событием DAS-68416-4, опрысканная 2,4-D (соя с событием DAS-68416-4+2,4-D), и соя с событием DAS-68416-4, опрысканная глюфозинатом и 2,4-D (соя с событием DAS-68416-4 + глюфозинат + 2,4-D), были установлены при помощи t-критериев. Скорректированные значения Р были также вычислены с помощью коэффициента ложной детекции (FDR) для контроля множественности (Benjamini and Hochberg, 1995).
|
|
Был произведен анализ агрономических данных, полученных для контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + 2,4-D, сои с событием DAS-68416-4 + глюфозинат и сои с событием DAS-68416-4 + оба гербицида. Не было обнаружено статистически значимых отличий для таких показателей как подсчет растений, начальная плотность растений, мощность проростков, повреждение после внесения гербицидов, полегание, конечная плотность растений или число дней до цветения (таблица 12). В отношении показателя высоты был обнаружен значимый парный t-критерий для контрольной сои и сои с событием DAS-68416-4 + 2,4-D. Однако не был обнаружен значимый показатель общего эффекта обработки, отличия были весьма незначительными между обработанной соей с событием DAS-68416-4 и контрольной соей, при этом отсутствовали различия между растениями сои с событием DAS-68416-4, подвергнутыми разным обработкам. На основании полученных результатов можно сделать вывод о том, что соя с событием DAS-68416-4 была агрономически эквивалентна близкой изолинии нетрансгенной контрольной сои.
|
|
Пример 7.2. Получение агрономических данных исследования, выполненного в 2009 г.
Агрономическое исследование сои с событием DAS-68416-4 и нетрансгенной контрольной сои (сорт Maverick) было выполнено в 2009 г. на восьми участках, расположенных в штатах Арканзас, Айова, Иллинойс, Индиана, Миссури и Небраска. Была произведена оценка таких агрономических показателей, как плотность/число растений, мощность проростков/растений, высота растений, заболеваемость, повреждение насекомыми и число дней до цветения, для исследования соответствия сои, включающей событие DAS-68416-4, (с обработкой и без обработки гербицидами) контрольной сое (таблица 13).
|
|
В испытаниях был использован принцип рандомизированного полного повторения. При выполнении испытаний исследовали сою с событием DAS-68416-4, контрольную сою сорта Maverick и коммерчески доступные линии нетрансгенной сои. Экспериментальную, контрольную и эталонную сою сеяли при норме посева, равной примерно 112 семенам в ряду с расстоянием между семенами около 75 см (30 дюймов). На каждом участке были созданы 4 одинаковые делянки для каждой обработки, которые состояли из рядов длиной от 71 см до 7,6 м (2-25 футов). Каждая делянка сои была огорожена 2 рядами нетрансгенной сои (Maverick). Весь опытный участок был огорожен как минимум 4 рядами (или 10 футами) нетрансгенной сои (Maverick). Были использованы соответствующие методы борьбы с насекомыми, сорняками и болезнями для получения агрономически приемлемой культуры.
Обработку гербицидами производили на максимальном уровне, принятом в сельскохозяйственной практике. В испытаниях была использована контрольная соя, не опрыскиваемая гербицидами, и в качестве гербицидов вносили 2,4-D, глюфозинат, 2,4-D/глюфозинат на определенных стадиях роста. Гербицид 2,4-D вносили в количестве 1120 г эквивалента кислоты/га (1,0 фунт эквивалента кислоты/акр) на стадиях роста V4 и R2. Глюфозинатом обрабатывали растения на стадиях роста V4 и V6-R2. В обоих случаях глюфозинат вносили в количестве 374 г активного ингредиента/га (0,33 фунта активного ингредиента/акр) и 454 г активного ингредиента/га (0,41 фунта активного ингредиента/акр) соответственно на стадиях роста V4 и V6-R2. В испытаниях по внесению гербицидов были использованы соя с событием DAS-68416-4 и контрольные сорта сои, включающие нетрансгенную сою сорта Maverick. Предполагалось, что посеянная на делянках соя сорта Maverick погибнет после внесения гербицидов.
Дисперсионный анализ агрономических данных выполняли на полевых участках с использованием смешанной модели (версия 8 SAS; SAS Institute 1999). Исследуемые сорта сои считались постоянными величинами, а местоположение участка, расположение блока на участке, местоположение участков сои и сои в блоке считались произвольными величинами. Анализ на отдельных участках производили аналогичным образом, считая сорта сои постоянными величинами и расположение блока и сои в блоке произвольными величинами. При выполнении статистического анализа данные не округлялись. Значимые отличия определяли на 95% доверительном уровне, и значимость общего эффекта обработки оценивали при помощи F-критерия. Парные отличия между неопрысканной соей AAD-12 (неопрысканная), соей AAD-12, опрысканной глюфозинатом (соя AAD-12 + глюфозинат), соей AAD-12, опрысканной 2,4-D (соя AAD-12 + 2,4-D) и соей AAD-12, опрысканной глюфозинатом и 2,4-D (соя AAD-12 + 2,4-D + глюфозинат) и контрольной соей были установлены при помощи t-критериев.
Из-за большого числа сравнений, сделанных в данном исследовании, главным вопросом была множественность исследования. Вопрос множественности исследования возникает при необходимости выполнения большого числа сравнений в одном исследовании для поиска неожиданных эффектов. В указанных условиях вероятность ложных отличий, выявленных на основании значений Р сравнения, является очень высокой (1-0,95число сравнений). В данном исследовании было произведено четыре сравнения каждого анализируемого показателя (16 типов анализированных агрономических показателей), в результате чего было выполнено 64 сравнения агрономических показателей. Поэтому вероятность получения одного или нескольких ложных отличий на основании нескорректированных значений Р была равна 99% для агрономических показателей (1-0,9564).
Был произведен анализ агрономических данных, полученных для контрольной сои, неопрысканной сои AAD-12, сои AAD-12 + глюфозинат, сои AAD-12 + 2,4-D и сои AAD-12 + 2,4-D + глюфозинат. При выполнении анализа на разных участках (таблица 14) не было обнаружено статистически значимых отличий для таких показателей как мощность проростков, конечная плотность растений, мощность/повреждение растений (V4, R1), полегание, заболеваемость, повреждение насекомыми, число дней до цветения, число дней до созревания, число стручков, число семян, урожайность и высота растений. В отношении числа растений и начальной плотности был обнаружен значимый парный t-критерий для контрольной сои и сои AAD-12 + глюфозинат, который не сопровождался значимым показателем общего эффекта обработки или значением Р, скорректированным с помощью FDR. В отношении мощности/повреждения растений (R2) были обнаружены значимые парные t-критерии и значимый показатель общего эффекта обработки между контрольной соей, соей AAD-12 + глюфозинат и соей AAD-12 + 2,4-D + глюфозинат, которые не сопровождались значимым значением Р, скорректированным с помощью FDR. Средние значения для всех указанных переменных также находились в пределах, обнаруженных для эталонных линий, испытанных в данном исследовании.
|
|
|
|
Пример 7.3. Экологические оценки
Полевые испытания сои с событием DAS-68416-4 контролировали сотрудники, знакомые с практикой выращивания сои (селекционеры, сотрудники полевых станций, агрономы, техники). Сотрудники, проводившие полевые испытания, визуально контролировали появление заболеваний у растений и вредителей на сое с событием DAS-68416-4 по сравнению со стандартными сортами сои, используемыми в тех же испытаниях. В качестве составной части эксперимента 1, описанного в примере 7,1, повреждение болезнями и насекомыми оценивали по шкале 0-100%, в соответствии с которой 0% означает отсутствие повреждений, вследствие болезней или устойчивость к воздействию насекомых. В таблице 15 приведены результаты для 6 участков, представленных в эксперименте 1.
|
В отношении заболеваемости не были обнаружены статистически значимые отличия. В отношении повреждения насекомыми был отмечен значимый парный t-критерий между контрольной соей и соей с событием DAS-68416-4 + оба гербицида. Однако отсутствовал значимый показатель общего эффекта обработки, различие между соей с событием DAS-68416-4, обработанной гербицидом, и контрольной соей было незначительным, при этом отсутствовали различия между соей с событием DAS-68416-4, подвергнутой разным видам обработки.
При выполнении полевых испытаний, проведенных USDA APHIS в 2006-2008 гг., были также произведены экологические наблюдения. Случаи заболевания растений и присутствия насекомых в испытаниях сои с событием DAS-68416-4 были зарегистрированы, и исследованы в отношении различий между соей с событием DAS-68416-4 и стандартной контрольной соей. Во всех случаях не было обнаружено различий между соей с событием DAS-68416-4 и стандартными контрольными сортами сои. Показатели заболеваемости и повреждения насекомыми, имевшие место в испытаниях сои с событием DAS-68416-4 и стандартной сои, приведены в таблице 16. Указанные наблюдения подтверждают вывод о том, что реакция сои с событием DAS-68416-4 на экологические стрессоры не отличается от реакции стандартной сои.
|
Пример 7.4. Оценки всхожести и покоя семян
Изменения характеристик покоя семян оценивали, исследуя всхожесть семян сои с событием DAS-68416-4 по сравнению с близкой изолинией компаратора в теплых и холодных условиях.
Для исследования всхожести семян в теплых условиях семена сои с событием DAS-68416-4 и контрольной сои помещали в количестве 25 семян на чашку Петри, содержащие насыщенные водой подушки для прорастания, и удаляли избыток воды. Пластинки выдерживали при 25°С в течение 5 дней. Было приготовлено шестнадцать пластинок (400 семян) для каждой линии. Через пять дней регистрировали число невзошедших семян.
Для исследования всхожести семян в холодных условиях 100 семян высевали в широкую неглубокую корзину, заполненную почвой для горшечных растений. Корзины, почву в которых немного смачивали, выдерживали при 10°С в течение 7 дней и затем при 25°С в течение 5 дней, после чего регистрировали число невзошедших семян.
Данные, полученные в результате каждого испытания, анализировали при помощи дисперсионного анализа (ANOVA) в соответствии с полностью рандомизированной схемой, используя четыре репликата по 100 семян в каждом репликате. Данные преобразовывали, используя для статистического анализа арксинус квадратного корня из числа проросших семян, деленный на 100. Процентное значение всхожести семян суммировано в таблице 17.
|
Всхожесть семян сои с событием DAS-68416-4 не отличалась в значительной степени от всхожести семян контрольной сои при выполнении испытаний на всхожесть в теплых или холодных условиях (Pr>F=1,0 и 0,13, соответственно). Полученные результаты показывают, что характеристики покоя семян не изменились в сое с событием DAS-68416-4.
Пример 7.5. Краткий обзор агрономических показателей, заболеваемости, повреждения вредителями и всхожести
Агрономические данные, позволяющие оценить характеристики роста растений в течение вегетационного периода, свидетельствуют о соответствии сои с событием DAS-68416-4 стандартной нетрансгенной сои. Характеристики роста растений и фенотипические признаки, реакция на экологические стрессоры, выраженная в восприимчивости к болезням и воздействию насекомых, характеристики всхожести и покоя семян были одинаковы для сои с событием DAS-68416-4 и стандартной сои в разных условиях. Поэтому полученные данные подтверждают вывод о том, что агрономические показатели, характеристики заболеваемости и повреждения вредителями сои с событием DAS-68416-4 существенно не отличаются от аналогичных показателей стандартной сои, при этом отсутствуют свидетельства того, что соя с событием DAS-68416-4 в большей степени подвержена риску повреждения вредителями. Benjamini, Y., Hochberg, Y. (1995) Controlling the false discovery rate: A practical and powerful approach to multiple testing, J. Royal Statistical Soc. B, 57:289-300.
Пример 8. Состав зерна и стеблей
Анализировали состав стеблей и зерна сои с целью исследования эквивалентности сои с событием DAS-68416-4 (опрысканной 2,4-D, глюфозинатом, 2,4-D + глюфозинатом или не опрысканной 2,4-D или глюфозинатом) и стандартной сои. Испытания проводили на шести опытных участках, расположенных в основных регионах возделывания сои в США и Канаде, с использованием семян, включающих и не включающих событие DAS-68416-4. Опытные участки находились в регионах с разной агрономической практикой возделывания сои и окружающими условиями, и представляли собой те же участки, которые были использованы при выполнении анализа экспрессии белка и в агрономическом эксперименте 1, описанном в примере 7.1. Указанные участки были расположены в штатах Айова, Иллинойс, Индиана, Небраска и в провинции Онтарио, Канада (2 участка).
Образцы стеблей и зерен сои анализировали в отношении содержания питательных веществ, при выполнении разных испытаний. Анализы стеблей включали определение белка, жира, золы, влажности, углеводов, клетчатки с кислым детергентом (ADF), клетчатки с нейтральным детергентом (TDF), кальция и фосфора. Анализы зерна включали определение общих показателей (золы, общего жира, влажности, белка, холестерина, углеводов), клетчатки, минералов, аминокислот, жирных кислот, витаминов и вредных веществ.
Результаты анализа питательных веществ в стебле и зерне сои сравнивали со значениями, приведенными в научной литературе. Также был выполнен дисперсионный анализ на разных полевых участках с использованием смешанной модели. Исследуемые сорта сои считались постоянными величинами, а местоположение участка, расположение блока на участке, местоположение сортов сои на участке считались произвольными величинами. Значимость общего эффекта обработки оценивали при помощи F-критерия. Парные отличия между соей с событием DAS-68416-4 (неопрысканная соя AAD-12; не опрысканная 2,4-D или глюфозинатом), соей с событием DAS-68416-4, опрысканной глюфозинатом (соя с событием DAS-68416-4 + глюфозинат), соей с событием DAS-68416-4, опрысканной 2,4-D (соя с событием DAS-68416-4 + 2,4-D) и соей с событием DAS-68416-4, опрысканной глюфозинатом и 2,4-D (соя с событием DAS-68416-4 + оба гербицида) и контрольной соей были установлены при помощи t-критериев.
Из-за большого числа сравнений, сделанных в данном исследовании, главным вопросом была множественность исследования. Вопрос множественности исследования возникает при необходимости выполнения большого числа сравнений в одном исследовании для поиска неожиданных эффектов. В указанных условиях вероятность ложных отличий, выявленных на основании значений Р сравнения, является очень высокой (1-0,95число сравнений). В данном исследовании было произведено четыре сравнения каждого анализируемого показателя (75 анализируемых показателей, подвергнутых количественному определению), в результате чего было выполнено 300 сравнений при выполнении анализа состава на разных участках. Поэтому вероятность получения одного или нескольких ложных отличий на основании нескорректированных значений Р была >99,99%.
Одним методом учета множественности является корректировка значений Р, необходимая для регулирования нормы ошибок в эксперименте (вероятности того, что все указанные отличия являются значимыми), но при выполнении множества сравнений в исследовании вероятность детекции истинных эффектов может значительно снизиться. Альтернативой, имеющей гораздо большее значение, является корректировка значений Р для контролирования вероятности того, что каждое указанное отличие является значимым. Такого результата можно достичь с помощью коэффициента ложной детекции (FDR) (Benjamini and Hochberg, 1995). Поэтому значения Р корректировали с помощью FDR для лучшего отделения действительных отличий от случайных эффектов (ложные положительные эффекты).
Пример 8.1. Анализ состава стеблей сои
Был выполнен анализ белка, жира, золы, влажности, углеводов, клетчатки с кислым детергентом (ADF), клетчатки с нейтральным детергентом (NDF), кальция и фосфора в образцах стеблей сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов, полученных на всех участках, представлен в таблице 18.
При выполнении анализа на разных участках не было обнаружено статистически значимых отличий между контрольной и трансгенной соей в отношении белка, жира, золы, влажности, углеводов, ADF, NDF, кальция или фосфора. Средние значения золы на разных участках для сои с событием DAS-68416-4 + глюфозинат и сои с событием DAS-68416-4 + оба гербицида находились за пределами диапазона, указанного в научной литературе, аналогично значению NDF для сои с событием DAS-68416-4 + глюфозинат и сои с событием DAS-68416-4 + 2,4-D. Значения ADF для всех обработок, включая нетрансгенную контрольную сою, также находились за пределами значений, указанных в научной литературе. Средние значения существенно не отличались для нетрансгенной контрольной сои и любой трансгенной сои в отношении любых общих показателей, типа клетчатки или содержания минералов в стеблях. С учетом указанных компонентов состава стебли сои с событием DAS-68416-4 были по существу эквивалентны стеблям близкой изолинии нетрансгенной контрольной сои.
|
|
Пример 8.2. Анализ состава зерна сои
Пример 8.2.1. Общие показатели и клетчатка
Был выполнен анализ белка, жира, золы, влажности, холестерина, углеводов, ADF, NDF и общего содержания пищевой клетчатки в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов, полученных на всех участках, представлен в таблице 19.
При выполнении анализа на разных участках не было обнаружено статистически значимых отличий в отношении жира, ADF или общей пищевой клетчатки между контрольной и трансгенной соей. Однако значение ADF было несколько выше, чем в диапазоне, приведенном в научной литературе для сои с событием DAS-68416-4 + 2,4-D.
Уровни белка, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для неопрысканной сои, сои с событием DAS-68416-4 + 2,4-D, сои с событием DAS-68416-4 + оба гербицида и контрольной сои. Однако после корректировки при помощи FDR только значение Р для сои с событием DAS-68416-4 + 2,4-D было значимым, и общие средние значения белка для всех обработок находились в пределах значений, указанных в научной литературе, из чего следует, что указанные отличия не были биологически значимыми.
При выполнении анализа золы на разных участках было обнаружено значимое нескорректированное значение Р для контрольной сои и сои с событием DAS-68416-4, опрысканной 2,4-D, но при этом не был отмечен общий эффект обработки или скорректированное значение Р. Значения золы также находились в пределах значений, указанных в научной литературе, из чего следует, что указанные отличия не были биологически значимыми.
Уровни влажности, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для неопрысканной сои, сои с событием DAS-68416-4 + 2,4-D, сои с событием DAS-68416-4 + оба гербицида и контрольной сои. Однако значение общего эффекта обработки не было значимым для влажности, только соя с событием DAS-68416-4 + 2,4-D имела значимое FDR-скорректированное значение Р, и средние уровни влажности для всех обработок находились в пределах диапазонов, указанных в научной литературе. Полученные результаты показывают, что указанные отличия не были биологически значимыми.
Все значения холестерина были ниже предела количественного определения (<LOQ), при этом в научной литературе значения холестерина указаны не были.
Уровни углеводов, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для неопрысканной сои, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и контрольной сои. Однако только соя с событием DAS-68416-4 + 2,4-D существенно отличалась от контрольной сои с учетом FDR-скорректированного значения Р, и все средние значения обработки находились в пределах значений, указанных в научной литературе, из чего следует, что данная соя эквивалентна нетрансгенной сое.
Уровни NDF, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для сои с событием DAS-68416-4 + глюфозинат и контрольной сои, но данное отличие не сопровождалось значимым скорректированным значением Р или общим эффектом обработки. Значения NDF на всех участках были несколько выше значений, указанных в научной литературе, для сои с событием DAS-68416-4 + глюфозинат и сои с событием DAS-68416-4 + 2,4-D, но указанные отличия составляли <9% по сравнению с близкой изолинией нетрансгенной контрольной сои.
На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
|
Пример 8.2.2 Минералы
Был выполнен анализ кальция, хрома, меди, иода, железа, магния, марганца, молибдена, фосфора, калия, селена, натрия и цинка в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов, полученных на всех участках, приведен в таблице 20.
При выполнении анализа на разных участках не было обнаружено статистически значимых отличий между контрольной и трансгенной соей с учетом нескорректированного значения Р для хрома, меди, иода, железа, марганца, молибдена, фосфора, селена и натрия (не обнаружен).
Уровни кальция, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для сои с событием DAS-68416-4 + 2,4-D, но данный результат не был ассоциирован со значимым FDR-скорректированным значением Р или общим эффектом обработки, и все средние значения обработки находились в пределах диапазона, указанного в научной литературе, из чего следует, что указанное отличие не было биологически значимым.
Уровни магния, установленные при выполнении анализа на разных участках, существенно отличались для сои с событием DAS-68416-4 + оба гербицида, сои с событием DAS-68416-4 + глюфозинат и контрольной сои с учетом соответственно нескорректированных и скорректированных значений Р, но общий эффект обработки не был значимым. Средние значения магния на разных участках были несколько ниже значений, указанных в научной литературе, но указанные отличия были незначительными (<3%) по сравнению с контрольной соей, и все значения сои с событием DAS-68416-4 были ближе к значениям, указанным в научной литературе, по сравнению с контрольной соей.
Все сои с событием DAS-68416-4 характеризовались значительно более высокими значениями калия по сравнению с контрольной соей при выполнении анализа на разных участках. Однако отличия были незначительными (<5%) по сравнению с контрольной соей, и все значения сои с событием DAS-68416-4 были ближе к диапазону, указанному в научной литературе, по сравнению с контрольной соей.
Уровни цинка, установленные при выполнении анализа на разных участках, существенно отличались с учетом нескорректированного значения Р для сои с событием DAS-68416-4 + оба гербицида, однако данный результат не сопровождался значимым FDR-скорректированным значением Р или общим эффектом обработки, и такое отличие было незначительным (<4%).
На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
|
Пример 8.2.3. Аминокислоты
Был выполнен анализ следующих асминокислот: аланина, аргинина, аспарагиновой кислоты, цистина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов для всех участков приведен в таблице 21.
Не было обнаружено статистически значимых отличий между контрольной и трансгенной соей для цистеина, метионина, пролина, тирозина или триптофана. Уровень изолейцина для сои с событием DAS-68416-4 + 2,4-D существенно отличался от контрольной сои с учетом нескорректированного значения Р, но данный результат не сопровождался значимым FDR-скорректированным значением Р или значимым значением общего эффекта обработки. Уровни остальных 12 аминокислот были несколько ниже (<7%) для двух или более типов сои с событием DAS-68416-4 по сравнению с контрольной соей, но все значения находились в пределах, указанных в научной литературе для нетрансгенной сои. Все аминокислоты для всех типов сои находились в пределах диапазонов, указанных в научной литературе, из чего следует, что отличия не были биологически значимыми. На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
|
Пример 8.2.4. Жирные кислоты
Был выполнен анализ 22 жирных кислот в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов для всех участков приведен в таблице 22.
Результаты анализа, полученные для каприновой кислоты (10:0), пентадекановой кислоты (15:0), пентадеценовой кислоты (15:1), эйкозатриеновой кислоты (20:3), арахидоновой кислоты (20:4), каприловой кислоты (8:0), лауриловой кислоты (12:0), миристиновой кислоты (14:0), миристолеиновой кислоты (14:1), гептадеценовой кислоты (17:1), гамма-линоленовой кислоты (18:3), эйкозадиеновой кислоты (20:2), были ниже предела количественного определения (<LOQ). Уровни пальмитиновой кислоты (16:0), гептадекановой кислоты (17:0) и эйкозеновой кислоты (20:1) существенно не отличались от аналогичных показателей контрольной сои и сои AAD-12, хотя значения эйкозеновой кислоты (20:1) были ниже значений, указанных в научной литературе для AAD-12 + глюфозинат и AAD-12 + оба гербицида. Однако отличия были незначительными (<5%) по сравнению с контрольной соей.
Уровень пальмитолеиновой кислоты (16:1) существенно отличался между контрольной соей и неопрысканной соей с событием DAS-68416-4, соей с событием DAS-68416-4 + глюфозинат, соей с событием DAS-68416-4 + 2,4-D и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных значений Р. Однако только неопрысканная соя с событием DAS-68416-4 имела FDR-скорректированное значение Р, которое было значимым для пальмитолеиновой кислоты (16:1). Значение пальмитолеиновой кислоты (16:1) на разных участках было ниже для данной обработки по сравнению со значениями, приведенными в научной литературе, но отличие было незначительным (<13%) по сравнению с близкой изолинией контрольной сои.
Уровень стеариновой кислоты (18:0) существенно отличался между контрольной соей, неопрысканной соей и соей с событием DAS-68416-4 + глюфозинат с учетом нескорректированных значений Р. Однако не было обнаружено значимых отличий с учетом скорректированных значений Р или общего эффекта обработки, и все значения находились в пределах значений, приведенных в научной литературе, что свидетельствует о соответствии нетрансгенной сое.
Уровень олеиновой кислоты (18:1) существенно отличался между контрольной соей и неопрысканной соей с событием DAS-68416-4, соей с событием DAS-68416-4 + глюфозинат, соей с событием DAS-68416-4 + 2,4-D и соей с событием DAS-68416-4 + оба гербицида. Однако уровни олеиновой кислоты (18:1) находились в пределах значений, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Уровень линолевой кислоты (18:2) существенно отличался между контрольной соей, неопрысканной соей и соей с событием DAS-68416-4 с учетом нескорректированных значений Р. Однако не было обнаружено значимых отличий скорректированных значений Р или общего эффекта обработки, и уровни линолевой кислоты (18:2) находились в пределах значений, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Уровни линоленовой кислоты (18:3) существенно отличались между соей с событием DAS-684165-4 и контрольной соей с учетом нескорректированных значений Р, и скорректированные значения Р также были значимыми для неопрысканной сои с событием DAS-68416-4 и сои с событием DAS-68416-4 + оба гербицида, по сравнению с контрольной соей. В научной литературе отсутствуют значения для линоленовой кислоты (18:3), однако, отличия сои с событием DAS-68416-4 от контрольной сои были незначительными (<6%).
Уровень арахидоновой кислоты (20:0) существенно отличался между контрольной соей, неопрысканной соей с событием DAS-68416-4, соей с событием DAS-68416-4 + глюфозинат, соей с событием DAS-68416-4 + 2,4-D и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных значений Р, при этом арахидоновая кислота (20:0) также характеризовалась существенными отличиями скорректированного значения Р для неопрысканной сои и сои с событием DAS-68416-4 + глюфозинат при выполнении анализа на разных участках. Однако уровни арахидоновой кислоты (20:0) находились в пределах значений, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Уровень бегеновой кислоты (22:0) существенно отличался между контрольной соей, неопрысканной соей с событием DAS-68416-4, соей с событием DAS-68416-4 + глюфозинат, соей с событием DAS-68416-4 + 2,4-D и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных значений Р, при этом уровень бегеновой кислоты (22:0) также характеризовался существенным отличием скорректированного значения Р для сои с событием DAS-68416-4 + глюфозинат. Однако не было обнаружено значимое значение общего эффекта обработки, и уровни бегеновой кислоты (22:0) находились в пределах значений, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Значения 22 исследованных жирных кислот во всех четырех вариантах сои с событием DAS-68416-4, подвергнутых разной обработке, не отличались на статистически значимом уровне от контрольной сои или находились в пределах значений, указанных в литературе для 21 жирной кислоты. В одном случае (неопрысканная соя с событием DAS-68416-4; пальмитолеиновая кислота (16:1)) значение было немного ниже значений, указанных в научной литературе, и отличалось на статистически значимом уровне от контрольной сои (на <13% ниже), однако, значения для всех трех опрыскиваний находились в пределах диапазона, указанного в научной литературе. На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
|
Пример 8.2.5. Витамины
Был выполнен анализ витаминов в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов для всех участков приведен в таблице 23.
В научной литературе отсутствовали значения для бета-токоферола, дельта-токоферола, гамма-токоферола, витамина А, витамина В5, витамина В6, витамина В12, витамина С, витамина D и ниацина в зерне сои. Уровни бета-токоферола, витамина А, витамина В12 и витамина D были ниже предела количественного определения (<LOQ). Не было обнаружено отличий между контрольной соей, неопрысканной соей AAD-12 и обработанной соей AAD-12 в отношении витамина В1, витамина В2, витамина В6, витамина С, витамина Е и ниацина. Витамины, для которых были указаны диапазоны значений в научной литературе, находились в пределах указанных диапазонов за исключением витамина В2, значения которого превышали указанные значения для всех обработок, включая близкую изолинию контрольной сои.
Уровни дельта-токоферона существенно отличались между контрольной соей, соей с событием DAS-68416-4 + глюфозинат и соей с событием DAS-68416-4 + 2,4-D c учетом нескорректированных значений Р. Однако данный результат не сопровождался значимым скорректированным значением Р или общим эффектом обработки. Значение гамма-токоферола существенно отличалось между контрольной соей, неопрысканной соей с событием DAS-68416-4 и соей с событием DAS-68416-4 + 2,4-D с учетом нескорректированных и скорректированных значений Р. Однако уровень гамма-токоферола был <11% выше для сои с событием DAS-68416-4 по сравнению с близкой изолинией контрольной сои.
Уровни витамина В5 существенно отличались между контрольной соей и соей с событием DAS-68416-4 + глюфозинат с учетом скорректированного значения Р. Однако данный результат не сопровождался значимым значением общего эффекта обработки.
Уровень фолиевой кислоты существенно отличался между контрольной соей, неопрысканной соей с событием DAS-68416-4, соей с событием DAS-68416-4 + 2,4-D и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных значений Р. Значение фолиевой кислоты также характеризовалось существенным отличием скорректированных значений Р для сои с событием DAS-68416-4 от контрольной сои. Однако уровни фолиевой кислоты находились в пределах значений, указанных в научной литературе для всех обработок, и соя с событием DAS-68416-4 отличалась от близкой изолинии контрольной сои на <9%, что свидетельствует о соответствии нетрансгенной сое.
На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
|
Пример 8.2.5. Изофлавоны
Был выполнен анализ изофлавонов в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов для всех участков приведен в таблице 24.
Результаты, полученные для генистеина и глицитеина, были ниже предела количественного определения (LOQ) для обработанных образцов. Уровни диадзина существенно отличались между контрольной соей и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных и скорректированных значений Р. Однако значение общего эффекта обработки не было значимым. Несмотря на то, что в научной литературе отсутствуют данные для диадзина, значение, полученное для сои с событием DAS-68416-4 + оба гербицида, отличалось <9% от близкой изолинии контрольной сои. Уровни генистина существенно отличались между контрольной соей и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных и скорректированных значений Р. Однако значение общего эффекта обработки не было значимым. Значения генистина для всех обработок были выше значений, указанных в научной литературе, но значения, полученные для обработок сои с событием DAS-68416-4, отличались <9% от близкой изолинии контрольной сои. Значения глицитина существенно отличались между контрольной соей и соей с событием DAS-68416-4 + оба гербицида с учетом нескорректированных и скорректированных значений Р. Несмотря на то, что в научной литературе отсутствуют данные для глицитина, значения, полученные для всех типов сои с событием DAS-68416-4 отличались <13% от близкой изолинии сои.
На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
Пример 8.2.6. Вредные вещества
Был выполнен анализ вредных веществ в образцах зерна сои, полученных из контрольной сои, неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида. Краткий обзор результатов для всех участков приведен в таблице 25.
Не было обнаружено статистически значимых отличий между контрольной соей и трансгенной соей в отношении лектина, фитиновой кислоты или ингибитора трипсина. Значения трех указанных вредных веществ также находились в пределах диапазона, приведенного в научной литературе, что свидетельствует о соответствии нетрансгенной сое.
Значение рафинозы было существенно ниже (<10%) для сои с событием DAS-68416-4 + глюфозинат по сравнению с контрольной соей с учетом нескорректированных значений Р. Значение рафинозы существенно не отличалось с учетом скорректированного значения Р или общего эффекта обработки при выполнении анализа на разных участках. Уровни рафинозы находились в пределах, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Уровень стахиозы существенно отличался между контрольной соей и соей с событием DAS-68416-4 + глюфозинат с учетом нескорректированного значения Р. Уровни стахиозы существенно не отличались с учетом скорректированного значения Р или общего эффекта обработки при выполнении анализа на разных участках. Уровни стахиозы также находились в пределах значений, указанных в научной литературе для всех обработок, что свидетельствует о соответствии нетрансгенной сое.
Анализ вредных веществ на содержание лектина, фитиновой кислоты, рафинозы, стахиозы и ингибитора трипсина показал, что все значения находятся в пределах диапазонов значений, указанных в научной литературе, при наличии двух существенных отличий с учетом нескорректированных значений Р, представляющих собой более низкие уровни вредных веществ для сои с событием DAS-68416-4 по сравнению с контрольной соей.
На основании указанных компонентов состава зерно сои с событием DAS-68416-4 было по существу эквивалентно зерну нетрансгенной сои.
|
Пример 8.3. Краткий обзор состава зерна и стеблей
Состав сои с событием DAS-68416-4 или не отличался на статистическом уровне от близкой изолинии, отличие <13% от близкой изолинии, или находился в пределах значений, указанных в научной литературе для нетрансгенной сои. Таким образом, было установлено, что соя с событием DAS-68416-4 по существу эквивалентна нетрансгенной сое. На графиках состава отсутствуют какие-либо биологически значимые, связанные с обработкой отличия в составе неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида и линии контрольной сои. В заключение следует отметить, что результаты исследования состава неопрысканной сои с событием DAS-68416-4, сои с событием DAS-68416-4 + глюфозинат, сои с событием DAS-68416-4 + 2,4-D и сои с событием DAS-68416-4 + оба гербицида подтверждают эквивалентность сои с событием DAS-68416-4 и стандартной сои.
Пример 9. Предпосевное внесение гербицидов и довсходовые испытания
В данном примере описаны новые способы возделывания сельскохозяйственной сои и использования гербицидов по настоящему изобретению.
Целью предпосевного внесения гербицидов является уничтожение сорняков, успешно перезимовавших или появившихся ранней весной до посева данной сельскохозяйственной культуры. Такое внесение гербицидов обычно производят в системах землепользования при отсутствии или недостаточной предпосевной обработки почвы, в результате чего сорняки не были физически уничтожены до посева сельскохозяйственной культуры. Поэтому программа внесения гербицидов, используемая в случае отсутствия или недостаточной предпосевной обработки почвы, должна быть направлена на уничтожение самого широкого спектра широколистных и травянистых сорняков, имевшихся до посева.
Глифосат, грамоксон и глюфозинат являются примерами неизбирательно действующих гербицидов, широко применяемых для предпосевной обработки. Однако некоторые сорняки плохо поддаются уничтожению такими гербицидами, благодаря одному или нескольким следующим факторам: присущая такому виду или биотипу сорняков невосприимчивость к данному гербициду, относительно большое количество перезимовавших сорняков и холодные погодные условия, ограничивающие поглощение и активность гербицида. Существует несколько вариантов гербицидов, используемых в виде смеси с указанными гербицидами для увеличения спектра действия и активности в отношении сорняков, для уничтожения которых неизбирательно действующие гербициды оказываются недостаточными. Одним примером является использование смеси гербицидов 2,4-D + глифосат для уничтожения Conyza canadensis (мелколепестник канадский). Глифосат может быть использован в количестве 420-1680 г эквивалента кислоты/га, в частности, 560-840 г эквивалента кислоты/га, для предпосевного уничтожения большинства имеющихся сорняков; однако можно также внести 280-1120 г эквивалента кислоты/га 2,4-D для уничтожения многих широколистных сорняков (например, мелколепестника канадского).
2,4-D является предпосевным гербицидом избирательного действия, так как данный гербицид эффективно воздействует на большое число широколистных сорняков (даже при относительно низких температурах) и является очень дешевым. Однако, если сельскохозяйственная культура, посеянная после внесения гербицида, чувствительна к 2,4-D (например, большинство двудольных растений), остатки 2,4-D в почве (хотя и сохраняющиеся в течение короткого периода времени) могут повредить данной сельскохозяйственной культуре. Многие инструкции, прилагаемые к гербициду 2,4-D, используемому для обработки сои, предостерегают от посева новых сельскохозяйственных культур ранее, чем через по меньшей мере 15 дней после внесения данного гербицида в количестве 1 фунта активного ингредиента/акр. В случае применения малолетучих эфирных препаратов 2,4-D при нормах внесения до 0,5 фунта активного ингредиента/акр посев сельскохозяйственных культур обычно производят через 7 дней после внесения гербицида, а при нормах внесения 1,0 фунт активного ингредиента/акр посев сельскохозяйственных культур производят через 30 дней после внесения гербицида. Дополнительной проблемой в случае применения продуктов на основе амина 2,4-D, являющихся водорастворимыми, является то, что данный гербицид может выщелачиваться в зоне заделки семян. Однако, сельскохозяйственные культуры, содержащие ген aad-12, устойчивы к воздействию 2,4-D и не подвергаются отрицательному воздействию остатков 2,4-D в почве. Благодаря такой устойчивости растения, содержащие ген aad-12, можно высевать раньше после уничтожения сорняков без какого-либо вреда для указанных растений по сравнению с растениями, не содержащими ген aad-12. Кроме того, повышенная гибкость и более низкая стоимость гербицида 2,4-D в смесях с другими гербицидами (или коммерческих премиксах) позволяет лучше уничтожать сорняки и повысить надежность внесения гербицидов в случаях отсутствия или недостаточной обработки почвы до посева сельскохозяйственной культуры.
Довсходовое внесение амина 2,4-D производят в норме 1120, 2240, 4480 г эквивалента кислоты/га за 7 дней, 15 дней или 30 дней до посева сои, содержащей ген aad-12 (событие DAS-68416-4), и контрольной сои. Довсходовое внесение гербицидов на полевые участки, расположенные в разных географических зонах, производят методами, хорошо известными в данной области. Участки, обработанные гербицидами, сравнивают с необработанными участками для получения точной оценки всхожести и роста на ранней стадии вегетации. После посева сельскохозяйственной культуры и внесения гербицида 2,4-D за 7, 15 или 30 дней до посева измеряют повреждение сои, содержащей ген aad-12 (событие DAS-68416-4), и контрольной сои. Результаты полевых испытаний показывают, что соя, содержащая ген aad-12 (событие DAS-68416-4), характеризуется устойчивостью к довсходовой обработке гербицидом 2,4-D, производимой за 7, 15 или 30 дней до посева.
Приведенные примеры являются лишь несколькими из многих возможных вариантов. Специалисты в области уничтожения сорняков, могут привести в качестве примеров целый ряд других применений, которые включают, не ограничиваясь ими, грамоксон + 2,4-D или глюфозинат + 2,4-D с использованием продуктов, описанных в федеральных инструкциях по применению гербицидов (CRP, 2003), и в руководстве по защите сельскохозяйственных культур компании Agrilliance (2003). Специалистам в данной области также должно быть известно, что приведенный выше пример применим к любой чувствительной к гербициду 2,4-D (или другому гербициду на основе феноксиауксина) сельскохозяйственной культуре, защищенной геном AAD-12 в случае устойчивой трансформации.
Соя DAS-68416-4 устойчива к гербициду 2,4-D. Данный пример представлен на основании исследования устойчивости сои DAS-68416-4 к гербицидам в полевых условиях. Устойчивость сои DAS-68416-4 к гербициду 2,4-D оценивали при проведении полевых испытаний в США. Для сои DAS-68416-4 максимальная норма внесения гербицида 2,4-D равна 1120 г эквивалента кислоты/га. Приведенные ниже данные показывают, что соя DAS-68416-4 обладает приемлемой устойчивостью при нормах внесения, которые по меньшей мере в четыре раза выше предложенных максимальных норм внесения.
Эффективность детоксикации сои DAS-68416-4 от 2,4-D и последующая защита от повреждения, вызванного указанным соединением, были исследованы в полевых испытаниях. Целью полевых испытаний была оценка устойчивости сои к довсходовой обработке гербицидом 2,4-D. Довсходовые испытания проводили по принципу рандомизированного полного повторения. Экспериментальные участки состояли из двухрядных делянок длиной примерно 3 м, и все испытания выполняли в виде трех повторов. Все гербициды вносили при помощи пневматического распыляющего оборудования для небольших участков, обеспечивающего подачу гербицида в объеме, равном примерно 140-190 л/га. Препарат 2,4-D представлял собой соль диметиламмония в количестве 456 г эквивалента кислоты/литр. Визуальную оценку повреждения производили примерно через 7 дней после появления всходов сельскохозяйственной культуры. Оценку производили по шкале от 0 до 100, отражавшей визуальное восприятие всех симптомов повреждения, имевшихся у всех растений на делянке, при этом 0 = отсутствие повреждений по сравнению с необработанными делянками и 100 = гибель всех растений.
При выполнении довсходовых испытаний вносили 1120, 2240 и 4480 г эквивалента кислоты/га после посева сельскохозяйственной культуры, но до появления всходов. Информация, относящаяся к довсходовым испытаниям, приведена в таблице 26.
|
Были произведены полевые оценки устойчивости к 2,4-D. Исследования реакции сои DAS-68416-4 и нетрансформированной сои сорта Maverick на довсходовое внесение амина 2,4-D проводили в штатах Миссисипи, Индиана и Миннесота. Средняя оценка повреждения сои DAS-68416-4 при довсходовом внесении амина 2,4-D для трех участков была равна ≤2% независимо от нормы внесения (таблица 27). Такая же обработка вызвала повреждение 34-60% нетрансформированной сои Maverick. Повреждение сои в результате довсходового внесения 2,4-D состояло в сокращении числа растений и замедлении роста.
|
Пример 10. Методы уничтожения сорняков, устойчивых к глифосату, при помощи комбинации гена устойчивости к глифосату и сои с событием DAS-68416-4
Глифосат находит широкое применение, благодаря уничтожению целого ряда широколистных и травянистых сорняков. Однако повторное использование глифосата в ГМК и применениях, не связанных с сельскохозяйственными культурами, вызывает, и будет продолжать вызывать появление сорняков, устойчивых к воздействию данного гербицида, или биотипов, устойчивых к глифосату. В качестве метода, препятствующего появлению устойчивых сорняков, для уничтожения большинства устойчивых сорняков предлагается использовать смеси гербицидов в эффективных дозах, которые уничтожают одинаковые виды сорняков, но оказывают разное воздействие. Объединение события 416 AAD-12 c признаком устойчивости к глифосату (и/или с другими признаками устойчивости к гербицидам) создает механизм, позволяющий уничтожать устойчивые к глифосату двудольные сорняки в ГМК при помощи глифосата, феноксиауксина (например, 2,4-D) и пиридилоксиацетатауксина (например, триклопира), избирательно действующих в одной сельскохозяйственной культуре. Указанные гербициды можно вносить одновременно в виде смеси, включающей два или более гербицидов с разным механизмом действия; последовательно в виде отдельных гербицидов для предпосевной, довсходовой или послевсходовой обработки и обработки в разное время с интервалом от около 2 часов до около 3 месяцев; или альтернативно в виде любой комбинации любого числа гербицидов, представляющих разные химические классы, которые вносят в любое время в течение примерно 7 месяцев вегетации растений до сбора урожая (или в период времени до сбора урожая, соответствующий внесению конкретного гербицида, в зависимости от того, какой период времени является наиболее коротким).
Важное значение имеет гибкость уничтожения широкого спектра травянистых и широколистных сорняков в отношении времени внесения, нормы внесения отдельных гербицидов и способности уничтожать плохоуничтожаемые или устойчивые сорняки. Сельскохозяйственную культуру, содержащую ген устойчивости к глифосату/событие 416 AAD12, обрабатывают глифосатом при норме внесения около 250-2500 г эквивалента кислоты/га; гербициды на основе феноксиауксина (один или несколько) можно вносить в количестве примерно 25-4000 г эквивалента кислоты/га; и гербициды на основе пиридилоксиацетатауксина (один или несколько) можно вносить в количестве 25-2000 г эквивалента кислоты/га. Оптимальные комбинации и время внесения указанных гербицидов зависят от конкретной ситуации, видов и окружающих условий и могут быть определены специалистом в области уничтожения сорняков с учетом настоящего описания изобретения.
Большинство сортов хлопчатника, рапса, кукурузы и сои, выращиваемых в Северной Америке, имеют признак устойчивости к глифосату (GT), и в настоящее время ведутся работы по внедрению кукурузы, устойчивой к глифосату. Создаются дополнительные сельскохозяйственные культуры, устойчивые к глифосату (например, пшеница, рис, сахарная свекла и травяной покров), которые на данный момент еще не получили коммерческого применения. Многие другие виды, устойчивые к глифосату, находятся на экспериментальной стадии разработки (например, люцерна, сахарный тростник, подсолнечник, свекла, фасоль, морковь, огурцы, латук, лук, земляника, томаты и табак; лесные виды, такие как тополь и амбровое дерево; и садовые виды, такие как бархатцы, петунья и бегония; сайт isb.vt.edu/cfdocs/fieldtests1.cfm, 2005 в Интернете). ГТС являются ценным инструментом уничтожения сорняков, благодаря удобству и эффективности данной системы. Однако применение глифосата в качестве стандартной обработки неприемлемо для уничтожения сорняков, устойчивых к глифосату. Кроме того, сорняки, которые менее эффективно поддаются обработке глифосатом, являются наиболее распространенными видами на полях, где в настоящее время применяются только химические программы обработки глифосатом. В результате объединения события 416 AAD-12 с признаком устойчивости к глифосату путем обычной селекции или в виде нового трансформационного события, повышается эффективность уничтожения сорняков, гибкость и способность управлять изменением свойств сорняков и устойчивость к гербицидам. Благодаря трансформации сельскохозяйственных культур событием 416 AAD-12, однодольные сельскохозяйственные культуры приобретают большую степень защиты от фенокси- или пиридилоксиауксина, и феноксиауксины могут избирательно применяться для обработки двудольных сельскохозяйственных культур. Можно предположить несколько сценариев более эффективной борьбы с сорняками в результате объединения события 416 AAD-12 и признака устойчивости к глифосату в любых однодольных или двудольных сельскохозяйственных культурах:
а) Глифосат можно применять в стандартной норме для послевсходового внесения (420-2160 г эквивалента кислоты/га, предпочтительно 560-840 г эквивалента кислоты/га) с целью уничтожения большинства травянистых и широколистных видов сорняков. Для уничтожения устойчивых к глифосату широколистных сорняков, таких как Conyza canadensis, или сорняков, плохо уничтожаемых глифосатом (например, Commelina spp, Ipomoea spp и т.д.) можно вносить 2,4-D последовательно, в виде смеси или премикса с глифосатом в норме 280-2240 г эквивалента кислоты/га (предпочтительно 560-1120 г эквивалента кислоты/га). Для триклопира нормы внесения обычно составляют 70-1120 г эквивалента кислоты/га, обычно 140-420 г эквивалента кислоты/га. Для флуроксипира нормы внесения обычно составляют 35-560 г эквивалента кислоты/га, обычно 70-280 г эквивалента кислоты/га.
b) В настоящее время нормы внесения глифосата для обработки ГМК обычно составляют 560-2240 г эквивалента кислоты/га в один период времени. Глифосат гораздо более эффективно воздействует на травянистые виды, чем на широколистные виды. Объединение события 416 AAD-12 с признаком устойчивости к глифосату позволит вносить глифосат в норме, необходимой для уничтожения травянистых сорняков (105-840 г эквивалента кислоты/га, более предпочтительно 210-420 г эквивалента кислоты/га). Гербицид 2,4-D (в норме 280-2240 г эквивалента кислоты/га, более предпочтительно 560-1120 г эквивалента кислоты/га) можно будет вносить последовательно, в виде смеси или премикса с глифосатом, используемых в эффективной для уничтожения травянистых сорняков норме, для уничтожения широколистных сорняков. Триклопир и флуроксипир в вышеуказанных нормах внесения станут приемлемыми компонентами в данном режиме обработки. Глифосат в низкой норме также будет способствовать некоторому уничтожению широколистных сорняков; однако основное уничтожение сорняков будут обеспечивать 2,4-D, триклопир или флуроксипир.
Специалисту в области уничтожения сорняков должно быть понятно, что применение одного или нескольких коммерческих гербицидов на основе арилоксиауксина отдельно или в комбинации (последовательно или независимо) возможно, благодаря введению события 416 AAD-12 в сельскохозяйственные культуры. Конкретные нормы внесения других гербицидов, применяемых в данной области, можно определить по описаниям гербицидов в справочнике по защите сельскохозяйственных культур или аналогичных изданиях, описаниям в Интернете (например, на сайте cdms.net/manuf/manuf.asp) или в любых коммерческих или академических руководствах по защите сельскохозяйственных культур, таких как Crop Protection Guide компании Agriliance (2005). В объем настоящего изобретения входят все альтернативные гербициды, которые могут быть использованы для обработки ГМК с событием 416 AAD-12 отдельно, в виде смеси или последовательно.
Ссылки
Severson, David W (Genomic Mapping Techniques, chapter 26th, RFLP analysis of insect genomes).
Stam M., Mol. J.N.M. and Kooter J.M., (1997) The Silence of Genes in Transgenic Plants Annals of Botany 79: 3±12, 1997.
Hood, E.E.; Helmer, G.L.; Fraley, R.T.; Chilton, M.-D. The Hypervirulence of Agrobacterium tumefaciens A281 Is Encoded in a Region of pTiBo542 Outside of T-DNA, Journal of Bacteriology, 1986, 168(3):1291-1301.
Zeng, P.; Vadnais, D.A.; Zhang, Z.; Polacco, J.C. Refined glufosinate selection in Agrobacterium-mediated transformation of soybean [Glycine max (L.) Merrill] Plant Cell Reports 2004 22:478-482.