Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА
Вид РИД
Изобретение
Изобретение относится к области органической химии - синтезу производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана, представляющих интерес для синтеза веществ фармацевтического назначения.
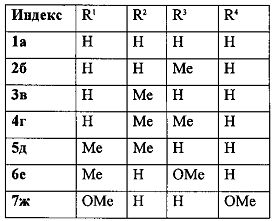
Изобретение относится к разработке способа получения производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана 1а-к, которые могут найти применение в качестве ингибиторов рецепторов интерлейкина-8 и протеинкиназы С - потенциальных противовоспалительных и противоопухолевых агентов [A.D. Patil, A.J. Freyer, L. Killmer, P. Offen, В. Carte, A.J. Jurewicz, R.K. Johnson, Tetrahedron, 1997, 53, 5047-5060].
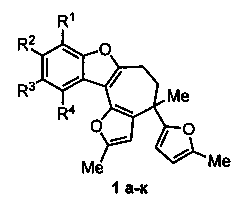
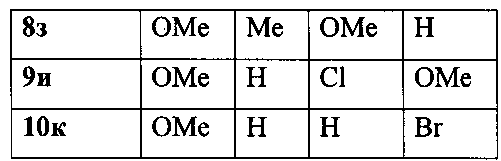
На настоящий момент большинство методов построения 7,8,9,10-тетрагидро-6H-циклогепта[b]бензофуранового каркаса разработано для осуществления полного синтеза фрондозина В - природного соединения, выделенного из морской губки Dysidea frondosa [A.D. Patil, A.J. Freyer, L. Killmer, P. Offen, B. Carte, A.J. Jurewicz, R.K. Johnson, Tetrahedron, 1997, 53, 5047-5060], которое обладает ингибирующей активностью по отношению к рецепторам интерлейкина-8 и протеинкиназы С, что делает его перспективным потенциальным противовоспалительным и противоопухолевым средством. Известные методы построения данного каркаса включают многостадийные синтезы (до 15 стадий), и характеризуются низким общим выходом, большими временными затратами и использованием дорогостоящих реагентов [М. Inoue, A.J. Frontier, S.J. Danishefsky, Angew. Chem. Int. Ed., 2000, 39, 761-764; M. Inoue, M.W. Carson, A.J. Frontier, S.J. Danishefsky, J. Am. Chem. Soc. 2001, 123, 1878-1889; X. Li, Т.V. Ovaska, Org. Lett., 2007, 9, 3837-3840; Т.V. Ovaska, J.A. Sullivan, S.I. Ovaska, J.B. Winegrad, J.D. Fair, Org. Lett., 2009, 11, 2715-2718; J. Zhang, L. Li, Y. Wang, W. Wang, J. Xue, Y. Li, Org. Lett., 2012, 14, 4528-4530; D.R. Laplace, B. Verbraeken, K.V. Hecke, J.M. Winne; Chem. Eur. J. 2014, 20, 253-262; E.Z. Oblak, M.D. VanHeyst, J. Li, A.J. Wiemer, D.L. Wright; J. Am. Chem. Soc. 2014, 136, 4309-4315].
Описанные методы не позволяют вводить требуемый набор заместителей в 7,8,9,10-тетрагидро-6H-циклогепта[b]бензофурановое ядро, что делает разработку простых и эффективных методов синтеза соединений данного класса актуальной задачей.
Задача изобретения - поиск простого и эффективного каталитического метода синтеза широкого ряда производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана с использованием коммерчески доступных фурановых соединений.
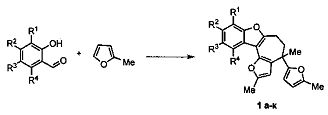
Техническим результатом является разработка нового каталитического метода получения производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана взаимодействием 2-метилфурана с замещенными салициловыми альдегидами.
В основе заявляемого метода лежит описанный ранее метод синтеза нитропроизводного 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана в результате взаимодействия 5-нитросалицилового альдегида с 2-метилфураном в присутствии каталитических количеств хлорной кислоты [А.В. Бутин, В.Е. Заводник, В.Г. Кульневич, ХГС, 1992, 997-998]. К недостаткам данного метода следует отнести низкую селективность реакции - выход целевого продукта составляет всего 4%. Одновременно с этим недостатком является необходимость в использовании весьма токсичной и взрывоопасной хлорной кислоты.
Технический результат достигается при использовании в качестве катализатора бромида меди(II) в реакции коммерчески доступных салициловых альдегидов и 2-метилфурана в 1,2-дихлорэтане.
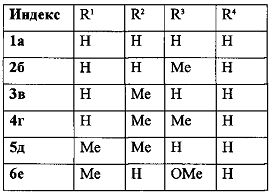
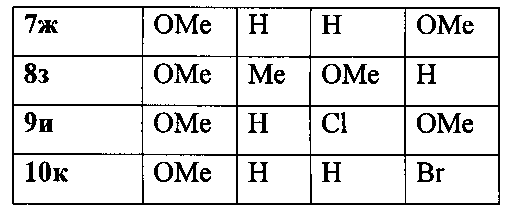
Спектральные характеристики 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана 1б-к приведены в таблице 1.
Полученный технический результат открывает путь к широкому ряду производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана 1 и позволяет вводить в ароматическое ядро разнообразные заместители.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Спектральные характеристики 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана 1б-к приведены в таблице 1.
Полученный технический результат открывает путь к широкому ряду производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана 1 и позволяет вводить в ароматическое ядро разнообразные заместители.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.


Примеры осуществления заявляемого способа получения 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фурана 1а.
Пример 1.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 34 мг CuBr2 (0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 37% (184 мг).
Спектр 1Н ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 1.67 (с, 3Н, Me), 2.18 (ддд, J=13.5 Гц, J=11.0 Гц, J=2.4 Гц, 1Н, СН2), 2.28 (с, 3Н, Me), 2.41 (с, 3Н, Me), 2.47 (ддд, J=13.5 Гц, J=7.4 Гц, J=2.4 Гц, 1Н, СН2), 2.84 (ддд, J=18.0 Гц, J=11.0 Гц, J=2.4 Гц, 1Н, СН2), 3.07 (ддд, J=18.0 Гц, J=7.4 Гц, J=2.4 Гц, 1Н, СН2), 5.71 (д, J=2.8 Гц, 1Н, HFur), 5.80 (д, J=2.8 Гц, 1Н, HFur), 5.99 (с, 1Н, HFur), 7.25-7.73 (м, 2Н, НAr), 7.39-7.41 (м, 1Н, НAr), 8.16-8.18 (м, 1Н, НAr).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 13.7, 13.8, 25.5, 27.4, 34.6, 38.9, 105.8, 107.1, 108.0 109.2, 110.7, 121.6, 122.8, 123.7, 125.7, 126.6, 142.6, 149.7, 151.0, 153.5, 154.1, 158.4.
Пример 2.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 51 мг CuBr2 (0,225 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 37% (184 мг).
Пример 3.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 170 мг CuBr2 (0,75 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 12% (60 мг).
Пример 4.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 34 мг CuBr2 (0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 48 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 36% (180 мг).
Пример 5.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 28,5 мкл HBr (43% w/w, 0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 0%.
Пример 6.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 0%.
Пример 7.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 34 мг CuBr2 (0,15 ммоль) и 4 мл 1,4-диоксана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 8% (40 мг).
Пример 8.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 34 мг CuBr2 (0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 60°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 25% (125 мг).
Пример 9.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 20 мг CuCl2 (0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 30% (150 мг).
Пример 10.
Смесь 160 мкл салицилового альдегида (1,5 моль), 675 мкл 2-метилфурана (7,5 ммоль), 37 мг CuSO4·5H2O (0,15 ммоль) и 4 мл 1,2-дихлорэтана нагревают при 85°С в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают до комнатной температуры, удаляют растворитель при пониженном давлении. Продукт реакции - 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фуран выделяют методом колоночной хроматографии на силикагеле производства фирмы Macherey-Nagel, фракция 40-63 мкм, элюент - петролейный эфир. Выход 0%.
В таблице 2 приведены данные о влиянии условий проведения реакции на выход 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фурана 1а (примеры 1-10).
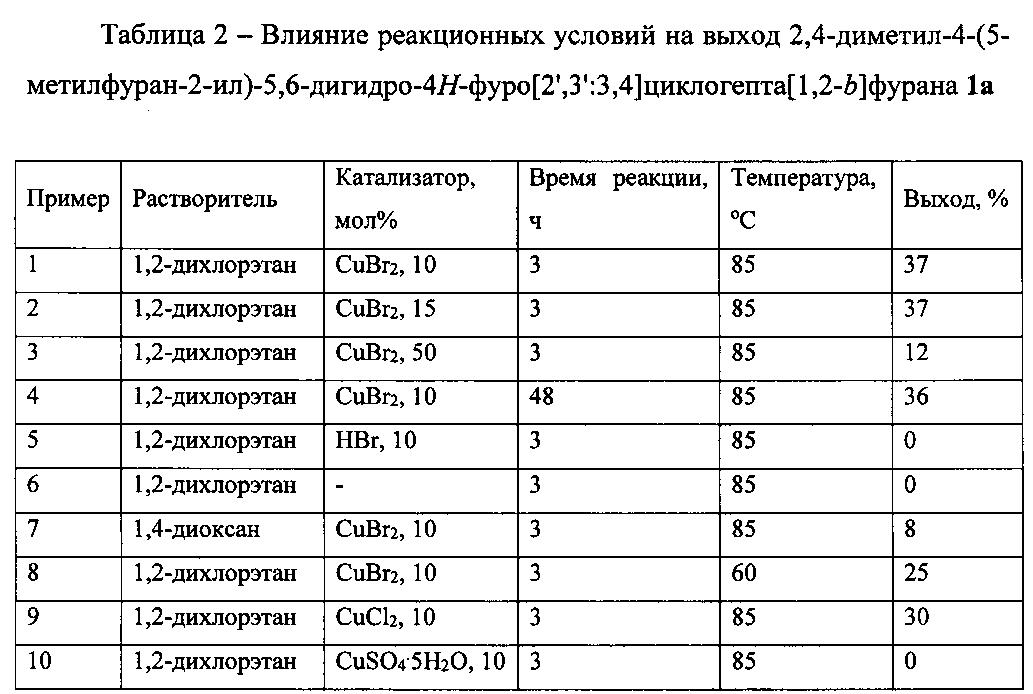
Как видно из таблицы 2, результат, а именно получение 2,4-диметил-4-(5-метилфуран-2-ил)-5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]фурана 1а, с максимально возможным выходом может быть достигнут при нагревании смеси исходных соединений в 1,2-дихлорэтане при температуре 85°С в присутствии 10 мол.% бромида меди(II). Увеличение загрузки катализатора, более длительное нагревание, снижение температуры реакции, а также замена растворителя приводит к снижению выхода продукта. Использование таких катализаторов, как HBr, CuSO4·5H2O, CuCl2, а также проведение реакции без катализатора не позволяет выделить целевой продукт с более высоким выходом.
Методом 1 получен ряд производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-b]бензофурана Ia-к с выходами 23-52%.
Способ получения производных 5,6-дигидро-4H-фуро[2′,3′:3,4]циклогепта[1,2-6]бензофурана общей формулы 1, характеризующийся тем, что смесь доступных замещенных салициловых альдегидов и 2-метилфурана нагревают при 85°С в 1,2-дихлорэтане в присутствии бромида меди (II) в течение 3 часов.![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА](https://fips.edrid.ru/images/rid/29/ad/10/1ad151979e25eaaa15d110b76813b908.png)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА](https://fips.edrid.ru/images/rid/29/ad/10/29af2d006e30932633377425d6929c94.png)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА](https://fips.edrid.ru/images/rid/29/ad/10/65ed78f68cc53cd7c87cb4ce56c99573.png)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА](https://fips.edrid.ru/images/rid/29/ad/10/d46632054335ee661a3e59520b6c0ba2.png)

