Результат интеллектуальной деятельности: БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ХРЯЩЕВОЙ ТКАНИ СУСТАВОВ
Вид РИД
Изобретение
Изобретение относится к медицине и биотехнологии, а именно к технологии регенеративной медицины и трансплантологии, и направлено на усовершенствование материалов, предназначенных для восстановления дефектов хрящевой ткани суставов.
Восстановление дефектов хрящевой ткани суставных поверхностей (суставов) является серьезной проблемой современной медицины. В силу гистологического строения хрящевая ткань практически не регенерирует, а в процессе регенерации часто образуется фиброзная ткань, которая не выполняет функций нормального гиалинового хряща, что приводит к усугублению патологического процесса в суставе.
Однако все известные на сегодняшний день биотрансплантаты зачастую приводят к формированию фиброзно-хрящевой ткани, либо используемые материалы не обладают требуемыми физическими свойствами или стимулируют иммунный ответ, а способы их использования для восстановления дефектов хрящевой ткани суставов отличаются трудоемкостью, требуют больших затрат времени и средств.
Известен комбинированный трансплантат для восполнения дефектов хрящевой ткани суставов, представляющий собой аллогенный деминерализованный пористый костный материал (брефоостеоматрикс или спонгиоза), заселенный аутологичными хондробластами и фибробластоподобными клетками, получаемыми из стромы суставного или реберного гиалинового хряща, или аллогенными хондробластами и фибробластоподобными клетками, получаемыми из стромы суставного или реберного гиалинового хряща органных доноров после установления смерти мозга. Первый трансплантат покрывают вторым трансплантатом, представляющим собой консервированную аллогенную донорскую твердую мозговую оболочку с прикрепленными к ней аллогенными хондробластами и фибробластоподобными клетками. Полученный комбинированный трансплантат помещают в предварительно сформированную костно-хрящевую полость (Патент RU 2383310 C1, оп. 10.03.2010).
Известен биотрансплантат для лечения травматических и дегенеративных заболеваний хрящевой ткани суставов, представляющий собой многокомпонентную, объемную, трехмерную структуру, содержащую матрицу-носитель и малодифференцированные клетки человека. В качестве матрицы-носителя используют хитозан, и/или альгинат, и/или коллаген и композиционные добавки - гиалуроновую кислоту, хондроитин сульфат при соотношении базового вещества и композиционной добавки 90-99%:1-10%. По завершении процесса изготовления носителя в него вносят суспензию клеточной культуры хондробластов, фибробластов, мезенхимальных стволовых клеток (МСК) костного мозга, жировой ткани или иного происхождения, как аутологичные так и аллогенные (патент RU 2301677 С1, оп. 27.06.2007).
Основным недостатком известных биотрансплантатов является сложная и дорогостоящая, многостадийная процедура их получения. Недостатком указанных материалов является то, что они содержат быстро разрушающиеся биополимеры - водорастворимый коллаген и полиэтиленгликоль, в результате чего входящие в состав этих композиций неколлагеновые белки, также быстро выходят в ткань и подвергаются деструкции, не оказывая предполагаемого индуцирующего эффекта.
Известен биотрансплантат для восстановления деффектов хрящевой ткани суставов, включающий матрицу-носитель для роста клеток, изготовленный из ходроитин сульфата, модифицированного метакрилатными и альдегидными группами, и фотополимеризуемый гидрогель для его применения (Wang D.A., et al., Nature Materials., 2007, V. 6, P. 385-392). Фотополимеризуемый гидрогель содержит полиэтиленгликоль диметакрилат и фотоинициатор Igracure 2959 в фосфатном буфере (рН 7.4) при соотношении компонентов 15:0.05 (в масс. %).
Для восстановления дефекта суставного хряща удаляют поврежденный участок гиалинового хряща с образованием углубления, затем осуществляют микрофракционирование и обработку углубления 25% раствором хондроитин сульфата с последующим введением гидрогеля и его фотополимеризацией в области удаленного участка поврежденного хряща (Sharma В., et al., Sci. Transl. Med., 2013, V. 5, 167ra6).
Недостатками известного биотрансплантата являются:
- недостаточные функциональные возможности биотрансплантата, поскольку он пригоден для восстановления дефектов хрящевой ткани суставов размером не более 2-4 см, вследствие того что использование данного комбинированного трансплантата не позволяет воспроизводить требуемую форму и прочно фиксировать большие объемы геля;
- в такую матрицу-носитель из субхондральной кости могут прорастать сосуды, что приводит к оссификации хрящевой ткани;
- использование такого биотрансплантата требует продолжительной терапии и ограничения физических нагрузок у пациента.
Наиболее ближайшим к заявляемому изобретению - прототипом, является биотрансплантат для замещения дефектов хрящевой ткани, включающий двухслойную матрицу-носитель из свиного коллагена I и III типа (Chondro-Gide®), предварительно заселенный хондробластами (Gooding C.R., Bartlett W., Bentley G., Skinner J.A., Carrington R., Flanagan A., Knee, 2006, V. 13, P. 203-210).
Двухслойная матрица-носитель выполнена в виде пластины с плотной и пористой сторонами. Плотный слой представляет собой гладкую поверхность, не проницаемую для клеток, препятствует проникновению клеток в полость сустава и защищает их от механической нагрузки. Другой слой матрицы-носителя состоит из коллагеновых волокон, который способствует проникновению клеток и их адсорбции.
Для фиксации биотрансплантата используют фибриновый гель, 1 мл которого содержит коагулирующие белки 75-115 мг (в т.ч. фибриноген 70-110 мг и фибронектин плазмы 2-9 мг), фактор XIII 10-50 ЕД и плазминоген 40-120 мкг.
Биотрансплантат получают следующим образом. На первой стадии в результате операционного вмешательства забирают донорские клетки, затем их наращивают в течение нескольких недель (не менее 3-х) в культуральном пластике, затем заселяют матрицу-носитель, что дополнительно занимает около 5-7 дней, и только после этого биотрансплантат используют в качестве материала для заместительной терапии хрящевой ткани.
Основными недостатками известного биотрансплантата являются низкие механические характеристики, возможность формирования фиброзной ткани, недостаточная прочность его установки в поврежденный участок хрящевой ткани, а также сложная и дорогостоящая, многостадийная процедура его получения. Кроме этого, матрица-носитель не выравнивается по высоте с поверхностью хряща. Повторное оперативное вмешательство в суставной хрящ усугубляет патологический процесс из-за повреждения синовиальной оболочки, рубцевания/воспаления, приводящего к нарушению питания хряща. Кроме того, культивирование клеток in vitro, и их повторное введение представляет определенные сложности в плане возможной контаминации клеток не идентифицированными инфекционными агентами и применение такой технологии законодательно ограничено.
Задачей изобретения является улучшение механических характеристик биотрансплантата, улучшение прочности его фиксации в поврежденный участок хрящевой ткани, предотвращение формирования фиброзной ткани.
Техническим результатом изобретения является улучшение механических характеристик биотрансплантата, улучшение прочности его фиксации в поврежденный участок хрящевой ткани, предотвращение формирования фиброзной ткани.
Поставленная задача достигается предлагаемым биотрансплантатом для восстановления дефектов хрящевой ткани суставов, представляющим собой матрицу-носитель, выполненную из волокнистого биосовместимого материала в виде пластины с толщиной 50-500 мкм, полученную методом электроспиннинга из раствора синтетического полимера или его смеси с природным полимером, формирующими в ней поры с диаметром 5-40 мкм.
Биотрансплантат может иметь прямоугольную, трапециевидную или овальную форму в зависимости от конкретной клинической ситуации.
В качестве синтетического полимера может быть использован полимер, выбранный из группы: поликапролактон (ПКЛ), полибутилентерефталат (ПБТФ), полилактид-ко-гликолид (ПЛГА), нейлон.
В качестве природного полимера может быть использован желатин, аггрекан или коллаген 2 типа, при этом конечная концентрация природного полимера в смеси с синтетическим полимером составляет 0,05-10% от массы синтетического полимера.
В качестве добавок к синтетическим полимерам и их смесям с природными полимерами при изготовлении биотрасплантата могут быть введены ростовые факторы, например костный морфогенный белок 2 (ВМР-2), инсулиноподобный фактор роста (ИФР) до конечной концентрации 1-20 нг/мл, а также лекарственные препараты, выбранные из группы антибиотиков, обезболивающих (анальгетиков) или нестероидных противовоспалительных средств, например диклофенак, теноксикам, кеторолак, что способствует созданию благоприятных условий для роста и пролиферации хондрабластов/хондроцитов.
Изготовление пластин биотрансплантата осуществляют методом электроспиннинга со следующими параметрами: напряжение - 10÷30 кВ, скорость подачи раствора полимеров - 1÷5 мл/ч, расстояние между иглой и коллектором - 10÷30 см, скорость вращения коллектора - 100÷300 об/мин.
Раствор синтетического полимера для получения пластин биотрансплантата путем электроспиннинга готовят в гексафторизопропаноле (ГФИП) до конечной концентрации полимера 5-10%.
Раствор природного полимера для получения пластин биотрансплантата путем электроспиннинга готовят в гексафторизопропаноле (ГФИП) до конечной концентрации полимера 0,5-10%.
Существенными отличительными признаками биотрансплантата, по сравнению с прототипом, являются:
1. Биотрансплантат выполнен из волокнистого биосовместимого материала в виде пластины с толщиной 50-500 мкм, полученной методом электроспиннинга из раствора синтетического полимера или его смеси с природным полимером, формирующими в ней поры с диаметром 5-40 мкм, что позволяет создавать биотрансплантат необходимой формы с улучшенными механическими характеристиками и обеспечить эффективную пролиферацию хондрабластов/хондроцитов на поверхности пластин.
2. Синтетический полимер для формирования волокон биотрансплантата выбирают из группы: поликапролактон, полибутилентерефталат, полилактид-ко-гликолид, нейлон, а природный полимер выбирают из группы: коллаген, желатин, аггрекан, что позволяет повысить прочность фиксирования биотрансплантата в области дефекта хрящевой ткани суставов и обеспечить формирование нормальной хрящевой ткани без фиброзных включений.
Заявляемый биотрансплантат имеет следующие механические характеристики: прочность на разрыв в поперечном направлении для биотрансплантата из ПКЛ 3270±983 кПа, прочность на разрыв в направлении укладки волокон для биотрансплантата из ПКЛ 4990±220 кПа, прочность на сдвиг композиции из биотрансплантата (ПКЛ) с фотополимеризуемым гелем 2330±184 кПа, прочность на сжатие композиции из биотрансплантата (ПКЛ) с гелем 13167±1157 кПа. Для сравнения, прочность на сжатие геля составляет в среднем 124±30 кПа.
Биотрансплантат используют следующим образом.
При помощи специальной фрезы удаляют поврежденный участок гиалинового хряща и формируют углубление диаметром 2-3 мм, при этом стараются не повредить субхондральную кость. В полученном отверстии послойно формируют конструкцию, состоящую из матрицы-носителя в виде пластин, пропитанных раствором фотополимеризуемого геля, которые послойно фиксируют в месте повреждения облучением светом с длиной волны 365 нм, с мощностью светового пучка 100 мВт/см2 в течение 1-2 мин.
Предлагаемый биотрансплантат обладает более высокими механическими свойствами, например прочность на сжатие как минимум в 10÷100 раз больше, чем прочность на сжатие фотополимеризуемого геля.
Использование заявляемого биотрансплантата позволит немедленно нагружать суставные поверхности, что способствует пролиферации хондроцитов и восстановлению нормального гиалинового хряща в месте имплантации.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
Изготовление пластины биотрансплантата из синтетических и природных полимеров осуществляли следующим способом. 150 мг полилактид-ко-гликолида (ПЛГА) растворили в 2,7 мл гексафтоизопропанола (ГФИП) при перемешивании и комнатной температуре и получили 7% раствор ПЛГА. Затем к 2,7 мл приготовленного 7% раствора ПЛГА добавили 300 мкл 5% раствора желатина в гексафтоизопропаноле (массовое соотношение ПЛГА: желатин равно 9:1, концентрация ПЛГА в пересчете на сухой вес составила 5%) и тщательно перемешали полученный раствор. Стерильный шприц заполнили 2,5 мл готовой смесью, состоящей из ПЛГА и желатина в ГФИП, и запустили процесс электроспиннинга при следующем режиме: напряжение - 23 кВ, скорость подачи полимерной композиции - 1,25 мл/ч, скорость вращения электрода-коллектора - 300 об/мин, диаметр барабана коллектора -1,5 см, длина 5 см.
По завершении электроспиннинга разрезали материал в направлении вдоль оси барабана и сняли полученный лист, из которого получали пластины необходимой формы для изготовления биотрансплантата.
На фиг. 1 представлена фотография волокнистого биотрансплантата, полученная методом сканирующей электронной микроскопии, из которой видно, что материал состоит из волокон полимера, толщина которых составляет от 0,5-1,5 микрон, размер пор составляет 5÷40 мкм.
Пример 2.
300 мг полилактид-ко-гликолида (ПЛГА) растворили в 2,7 мл гексафтоизопропанола (ГФИП) при перемешивании и комнатной температуре и получили 14% раствор. Затем к 2,7 мл приготовленного 14% раствора ПЛГА добавили 300 мкл 10% раствора желатина в гексафтоизопропаноле (массовое соотношение ПЛГА : желатин равно 9:1, концентрация ПЛГА в пересчете на сухой вес составила 10%) и тщательно перемешали полученный раствор. Стерильный шприц заполнили 2,5 мл готовой смесью, состоящей из ПЛГА и желатина в ГФИП, и запустили процесс изготовления листа волокнистого материала при следующем режиме: напряжение - 23 кВ, скорость подачи полимерной композиции - 1,5 мл/ч, скорость вращения электрода-коллектора - 300 об/мин, диаметр барабана коллектора - 1,5 см, длина 4 см.
По завершении электроспиннинга разрезали материал в направлении вдоль оси барабана и сняли полученный лист, из которого получали пластины необходимой формы для изготовления биотрансплантата.
Пример 3.
Процедуру изготовления пластины биотрансплантата из смеси синтетических и природных полимеров осуществляли аналогично примеру 1, за исключением того, что в качестве синтетического полимера использовали 10% раствор поликапролактона (ПКЛ), а в качестве белка -5% раствора аггрекана в гексафтоизопропаноле. Для электроспиннинга приготавливали композицию, содержащую смесь ПКЛ и аггрекана, взятых в массовом соотношении, равном 8,5:1,5 (концентрация ПКЛ в растворе в пересчете на сухой вес составила 6%). В результате получили лист волокнистого материала размером 5×3,5 см2, из которого изготавливали необходимой формы биотрансплантата.
Пример 4.
Процедуру изготовления пластины биотрансплантата из синтетических полимеров без добавок осуществляли следующим способом. Для приготовления 7% раствора нейлона в гексафторизопропаноле навеску 0,21 мг нейлона растворяли в 3 мл гексафторизопропанола при тщательном перемешивании. Стерильный шприц заполнили 2,3 мл готового раствора нейлона и запустили процесс электроспиннинга при следующем режиме: напряжение - 21 кВ, скорость подачи полимерной композиции - 1,6 мл/ч, скорость вращения электрода-коллектора - 300 об/мин, диаметр барабана коллектора - 1,5 см, длина 5 см.
По завершении электроспиннинга получили лист волокнистого материала размером 5×3,5 см2, из которого изготавливали необходимой формы биотрансплантат.
Было показано, что биотрансплантат из данного полимера недеградуемый и предотвращает проникновение клеток в полость сустава.
Пример 5.
Процедуру изготовления пластины биотрансплантата из синтетических и природных полимеров осуществляли аналогично примеру 1, за исключением того, что в качестве полимера использовали 15% раствор полибутилентерефталата (ПБТФ), а в качестве белка использовали 5% раствор водорастворимого коллагена. Для электроспиннинга приготавливали композицию, содержащую смесь ПБТФ и коллагена, взятых в массовом соотношении, равном 8:2 (концентрация ПБТФ в растворе в пересчете на сухой вес составила 6%). В результате получили лист волокнистого материала размером 5×<3,5 см2, из которого изготавливали необходимой формы биотрансплантат.
Пример 6.
Процедуру изготовления пластины биотрансплантата из смеси синтетических и природных полимеров осуществляли аналогично примеру 1, за исключением того, что в качестве добавки в смесь полимеров для электроспиннинга добавляли 0,5% водный раствор фактора роста ВМР-2 (костный морфогенный белок 2) до конечной концентрации 10 нг/мл в готовой композиции. Из полученной композиции изготавливали биотрансплантат электроспиннингом, как описано в примере 1.
Пример 7.
Процедуру изготовления пластины биотрансплантата из смеси синтетических и природных полимеров осуществляли аналогично примеру 1, за исключением того, что в качестве добавки в смесь полимеров для электроспиннинга добавляли 1% раствор диклофенака до конечной концентрации 1 мкг/мл в готовой композиции. Из полученной композиции изготавливали биотрансплантат электроспиннингом, как описано в примере 1.
Пример 8.
Для проверки эффективности предлагаемого биотрансплантата его имплантировали в поврежденный участок коленного сустава кролика.
Кроликов оперировали под общим наркозом. Сустав вскрывали спереди послойно С-образным доступом (разрез до 3 см, надколенник вывихнут внутрь). На наружной поверхности сустава в мыщелке бедренной кости фрезеровали отверстие диаметром 3 мм конической фрезой с плоской нижней поверхностью до субхондральной кости (не затрагивая губчатую кость), глубиной приблизительно 1 мм. Отверстие обрабатывали раствором фотополимеризуемого геля, приготовленного из желатина и хондроитин-4-сульфата по известной методике (Li Q., Williams C.G., Sun D.D., et al., J. Biomed. Mater. Res. A., 2004, V. 68, P. 28-33), освещали светом светодиодного фонаря MTE U 301 с конденсором с длиной волны 365 нм в течение 40 с, вкладывали в отверстие вырезанный высечкой биотрансплантат в виде круглой пластины, изготовленный по примерам 1-5 и пропитанный раствором геля, добавляли 15 мкл раствора геля и полимеризовали под действием светового потока фонаря МТЕ U 301 в течение 2-5 мин. Затем укладывали в отверстие дополнительные слои (1-3 в зависимости от глубины повреждения) биотрансплантата и добавляли 15 мкл геля и повторно полимеризовали светом фонаря МТЕ U 301 с длиной волны 365 нм в течение 2-5 мин. По окончании протезирования плотно послойно ушивали капсулу сустава, восстанавливая его поддерживающую функцию. Шов обрабатывали раствором йода.
На фиг. 2 представлены основные этапы операции, где: 1-2 - формирование отверстия в гиалиновом хряще коленного сустава кролика; 3 - внешний вид биотрансплантата сразу после установки.
В качестве контроля в месте повреждения использовали биотрансплантат Chondro-Gide® (Geistlich Pharma AG, Германия, прототип) или аналог острой травмы - незаполненное отверстие (контроль без вмешательства).
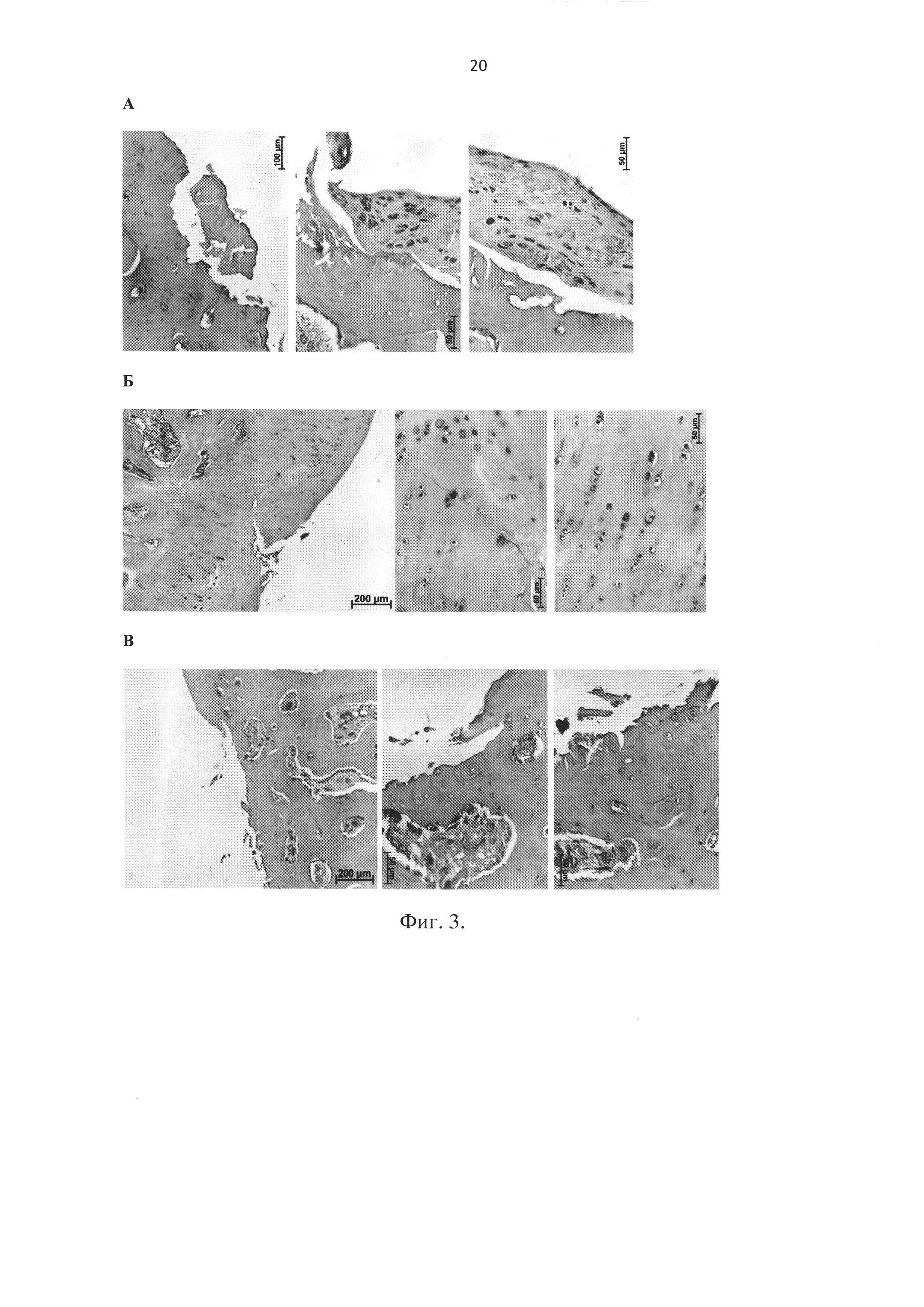
Спустя 1-3 месяца после операции кроликов забивали, забирали костный материал с областью повреждения и проводили его гистологическое исследование. Результаты гистологии приведены на фиг. 3, где: А - препарат костной ткани, где аналог острой травмы - незаполненное отверстие (контроль без вмешательства), Б - препарат костной ткани, где в месте повреждения использовали биотрансплантат Chondro-Gide® (прототип), В - препарат костной ткани, где искусственно созданное повреждение заполнено разработанным биотрансплантатом и зафиксировано фотополимеризуемым гелем.
На фиг. 3 А видно, что в области искусственно созданного повреждения наблюдается образование частично плотной соединительной ткани с большим числом макрофагов и частично присутствием хрящевой ткани. Консолидация новообразованных структур с окружающим хрящом и костной тканью непрочная, при процедурах de novo образованные структуры легко отслаиваются от подлежащих тканей по краю дефекта.
На фиг. 3 Б видно, что в области искусственно созданного повреждения, заполненного биотрансплантатом Chondro-Gide® (прототип), наблюдается образование хрящевой ткани с участками фиброзных включений. Образованные структуры неплотно контактируют с окружающим хрящом и костной тканью, что приводит к их частичному отслаиванию.
На фиг. 3 В видно, что в области искусственно созданного повреждения, заполненного предлагаемым биотрансплантатом в виде пластины из нейлона (пример 4) и 2-х пластин из ПЛГА (примеры 1-2, 6-7), наблюдается отсутствие воспалительных процессов, образование гомологичной хрящевой ткани и плотный контакт новообразованных структур с окружающими тканями.
Использование биотрансплантата позволит надежно зафиксировать последний в области повреждения, исключит прорастание сосудов из субхондральной кости в хрящевую ткань за счет использования в прилегающем к кости слое матрицы-носителя из недеградируемого полимера, обеспечит формирование нормальной хрящевой ткани без фиброзных включений.