Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ ПСОРИАЗА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ IL-17
Вид РИД
Изобретение
Данное описание заявляет приоритет по предварительной патентной заявке США № 61/391388, поданной 8 октября 2010 г., содержание которой полностью включено в настоящий документ путем ссылки.
Область техники
Изобретение относится к новым схемам лечения псориаза, в которых используется терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17, например, антитела к IL-17, такого как антитело AIN457 (которое также известно как «Секукинумаб»).
Предпосылки изобретения
Псориаз является хроническим рецидивирующим заболеванием кожи, характеризующимся различными клиническими признаками. Простой псориаз (также называемый бляшковидным или хроническим бляшковидным), который представлен красными чешуйчатыми бляшками, является наиболее часто встречающейся клинической формой, и поэтому также называется обыкновенным псориазом (psoriasis vulgaris). Накапливающиеся данные свидетельствуют о том, что псориаз является многофакторным заболеванием, вызванным согласованным действием многочисленных генов, связанных с этим заболеванием, у одного индивидуума, запускаемым факторами окружающей среды. Предполагают, что это может являться следствием эффектов хронического воспаления. Вне зависимости от первопричины, после появления псориаза в локализованной форме, он остается пожизненно, проявляясь часто через непредсказуемые интервалы.
Традиционные подходы к лечению псориаза с течением от умеренного до тяжелого включают местную терапию, фототерапию (UVB, PUVA) и системную терапию низкомолекулярными соединениями, а именно, метотрексатом и циклоспорином. Безопасность, преимущественно связанная с кумулятивной почечной и печеночной токсичностью, является основной проблемой в ходе продолжительного лечения псориаза с использованием циклоспорина и метотрексата и требует постоянного наблюдения. McClure et al. (2001) Drug Safety 25:913-27. Чтобы уменьшить проблемы, связанные с безопасностью, терапевтами были разработаны стратегии лечения, такие как комбинированные, ротационные, последовательные или интермиттирующие терапевтические подходы с целью исключения кумулятивной органной токсичности (или, в случае фототерапии, возможного возникновения злокачественных новообразований). Van de Kerkhoff et al. (2001) Clin. Exp. Dermatol 26:356-61. В общем, при переходе на новую терапию, первый препарат постепенно отменяют при введении следующего препарата (или следующей терапии). В некоторых случаях после постепенной отмены первого препарата пациент может не получать лечения до появления слабых симптомов, для лечения которых используют фототерапию или местную терапию до тех пор, пока симптомы не станут невыносимыми, после чего вводят второй препарат. С использованием этого способа повторное лечение первым препаратом может быть максимально отложено (например, на годы). Однако в ходе циклической терапии может возникнуть усиление симптомов, например, в ответ на циклоспорин. Более того, даже в течение «отдыха» от первого препарата, пациент, как правило, получает лечение от псориаза с использованием фототерапии или местной терапии.
Биопрепараты, по-видимому, представляют собой решение проблемы с громоздкими, опасными и неудобными традиционными схемами системного лечения псориаза. Учитывая то, что биопрепараты не должны иметь органной токсичности, ожидается, что их продолжительное использование будет безопасным, обеспечивая возможность осуществления длительного лечения. К сожалению, в течение хронического биологического лечения псориаза возникают побочные эффекты различной тяжести, главным образом, реактивация латентных туберкулезных инфекций и индукция (или обострение) демиелинизирующих патологических состояний вследствие антагонизма TNF-альфа. Ferrandiz et al. (2010) Clinics in Dermatology 28:81-87. Другие побочные эффекты включают тромбоцитопению, связанные с псориазом побочные эффекты (например, папулезную сыпь и обострения воспаления), печеночную токсичность, лимфопению и сердечно-сосудистые осложнения, включая застойную сердечную недостаточность или ее усугубление). Ferrandiz et al; Sullivan and Preda (2009) Aust. Prescr. 32:14-18; Korkina et al. (2010) Drugs of Today 46:119-36. В результате, некоторые клиницисты в своей практике используют модифицированные схемы лечения биопрепаратами, а именно отменяя и возобновляя терапию. Однако проблемы, связанные с интермиттирующей терапией биопрепаратами, которые включают усиление симптомов, иммуногенность при повторном лечении и снижение ответа по сравнению с достигнутым при первичном лечении (возникающее при повтором лечении инфликсимабом, адалимумабом и этанерцептом), предполагают, что лечение некоторыми биопрепаратами лучше всего применять в непрерывном режиме, а не по мере необходимости. Ferrandiz et al.; Sullivan and Preda; Menter et al. (2008) J. Am. Acad. Dermatol 58:826-850; Gelfand et al. (2008) Value in Health 11:400-407; Menter et al. (2007) Am Acad Dermatol. 56(1):31.
Финансовые расходы на длительное непрерывное лечение биопрепаратами являются огромными. Также существует беспокойство, что длительное использование биопрепаратов, особенно постоянное применение антагонистов TNF-альфа, может привести к злокачественным перерождениям и другим серьезным нарушениям. Соответственно, необходимы новые схемы лечения псориаза, которые исключают опасности традиционной непрерывной системной терапии (а именно, неудобную циклическую терапию, побочные эффекты, органную токсичность) и непрерывной терапии биопрепаратами (а именно, инфекции, потенциальную злокачественность, финансовую нагрузку, неизвестные побочные эффекты в результате длительного применения), а также недостатки интермиттирующей терапии (а именно, усиление симптомов, снижение ответа на повторное лечение). В настоящем документе раскрыты новые схемы лечения псориаза, которые устраняют препятствия, встречающиеся при непрерывной системной терапии (как низкомолекулярными соединениями, так и биопрепаратами) и интермиттирующей терапии биопрепаратами.
Краткое изложение сущности изобретения
IL-17A является центральным лимфокином ряда воспалительных Т-клеток, Th17, которые в некоторых животных моделях являются ключевыми в некоторых аутоиммунных и воспалительных процессах. IL-17A продуцируется, главным образом, эффекторными клетками памяти, CD4+ и CD8+ T-лимфоцитами. IL-17А считается одним из основных провоспалительных цитокинов в опосредованных иммунной системой воспалительных заболеваниях. Нейтрализацию IL-17A можно использовать для лечения патофизиологии, лежащей в основе опосредованного иммунной системой заболевания, и как следствие, для ослабления его симптомов.
В схемах лечения псориаза по изобретению используется терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17, например, антитела к IL-17, такого как антитело AIN457 (Секукинумаб). Секукинумаб, раскрытый в WO 2006/013107 (также опубликованной как US20090280131, которая таким образом полностью включена путем ссылки в настоящее описание), представляет собой рекомбинантное высокоаффинное полностью человеческое моноклональное антитело к интерлейкину 17А человека класса IgG1/κ. Секукинумаб связывает IL-17A человека и нейтрализует биологическую активность этого цитокина. Секукинумаб обладает очень высокой аффинностью к IL-17, а именно, KD примерно 100-200 пМ и IC50 примерно 0,4 нМ для in vitro нейтрализации биологической активности 0,67 нМ IL-17A человека. Таким образом, секукинумаб нейтрализует антиген в молярном соотношении примерно 1:1. Благодаря этой высокой аффинности связывания секукинумаб особенно подходит для применения в терапии. Кроме того, секукинумаб имеет очень большое время полужизни, а именно, около 4 недель (то есть примерно 30 дней), обеспечивающее длительные интервалы между введениями, что является исключительным свойством при лечении хронических пожизненных заболеваний, таких как псориаз. Вследствие большого времени полужизни, высокой аффинности и быстрого начала действия секукинумаба, псориаз можно лечить, используя относительно низкие дозы секукинумаба, вводимые через большие интервалы.
Целью изобретения являются новые схемы лечения псориаза, в которых используют индукционные и/или поддерживающие схемы с использованием терапевтически эффективных количеств антагониста IL-17, например молекулы, связывающей IL-17, например, антитела к IL-17, такого как секукинумаб. Другой целью изобретения являются новые способы лечения псориаза у пациентов в начале рецидива (SoR), в которых используют терапевтически эффективные количества антагониста IL-17, например молекулы, связывающей IL-17, например, антитела к IL-17, такого как секукинумаб. Лечение в начале рецидива позволяет индивидуальный подход в терапии псориаза и обеспечивает эффективное ослабление симптомов при применении минимальной возможной дозировки лекарственного соединения.
Соответственно, в настоящем документе раскрыты способы лечения псориаза, включающие: а) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы лечения; и b) впоследствии введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в ходе поддерживающей схемы лечения. В поддерживающей схеме лечения может использоваться непрерывное (например, ежемесячное) или интермиттирующее введение (например, лечение в начале рецидива).
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, причем нагрузочная схема включает введение пациенту пяти доз по примерно 75 мг - 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; и b) впоследствии введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в ходе поддерживающей схемы лечения.
В настоящем документе раскрыты антагонисты IL-17, например, молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что по меньшей мере одну дозу антагониста IL-17, например, молекулы, связывающей IL-17, вводят пациенту в начале рецидива после предшествующего лечения антагонистом IL-17, например, молекулой, связывающей IL-17. Также раскрыты способы лечения псориаза, включающие: а) идентификацию пациента на момент начала рецидива после предшествующего лечения псориаза антагонистом IL-17, например, молекулой, связывающей IL-17; и b) введение пациенту по меньшей мере одной дозы антагониста IL-17, например, молекулы, связывающей IL-17.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение пациенту, нуждающемуся в этом, пяти доз по примерно 75 мг - 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; b) введение пациенту примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17 в течение восьмой недели; с) введение пациенту по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, в момент начала рецидива; и d) повтор стадии (c) при каждом повторном начале рецидива.
В настоящем документе раскрыты терапевтические схемы лечения псориаза, включающие: а) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, включающей: (i) введение пациенту примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту еженедельно в течение пяти недель, причем первую дозу антагониста IL-17, например, молекулы, связывающей IL-17, вводят в нулевую неделю; и (ii) впоследствии введение примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в течение восьмой недели; и b) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, включающей: (i) введение примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту каждый месяц, каждые два месяца или каждые три месяца; или (ii) введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в момент начала рецидива.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить: а) в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, причем нагрузочная схема включает введение пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; и b) впоследствии в течение поддерживающей схемы.
В настоящем документе раскрыты антагонисты IL-17, например, молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует: а) вводить пациенту, нуждающемуся в этом, в виде пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг), причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; b) впоследствии вводить пациенту в течение восьмой недели в количестве примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг); с) впоследствии вводить пациенту в виде по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) в начале рецидива; и d) впоследствии вводить пациенту в начале каждого повторного рецидива по меньшей мере одну дозу примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг).
В настоящем документе раскрыты антагонисты IL-17, например, молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует: а) вводить пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает: (i) антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) еженедельно в течение пяти недель, причем первую дозу антагониста IL-17, например, молекулы, связывающей IL-17, следует вводить в течение нулевой недели; и (ii) впоследствии антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) в течение восьмой недели; и b) вводить пациенту в течение поддерживающей схемы, включающей: (i) антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) каждый месяц, каждые два месяца или каждые три месяца; или (ii) антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в виде по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, в начале рецидива.
В настоящем документе раскрыты варианты применения антагонистов IL-17, например, молекул, связывающих IL-17, для получения лекарственного средства для лечения псориаза, отличающегося тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в начале рецидива после предшествующего лечения антагонистом IL-17, например, молекулой, связывающей IL-17.
В настоящем документе раскрыты антагонисты IL-17, например, молекулы, связывающие IL-17, для применения в лечении псориаза у пациента, причем указанный пациент должен быть идентифицирован в начале рецидива после предшествующего лечения антагонистом IL-17, например, молекулой, связывающей IL-17, и указанному пациенту следует вводить по меньшей мере одну дозу антагониста IL-17, например, молекулы, связывающей IL-17.
В настоящем документе раскрыты фармацевтические композиции для лечения псориаза, включающие действующий ингредиент антагонист IL-17, например, молекулу, связывающую IL-17, причем антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в начале рецидива после предшествующего лечения антагонистом IL-17, например, молекулой, связывающей IL-17.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение пациенту, нуждающемуся в этом, пяти еженедельных доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17; и b) впоследствии введение: (i) примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту ежемесячно, или (ii) одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту примерно через один месяц после стадии (а), и впоследствии введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в начале рецидива.
В настоящем документе раскрыты терапевтические схемы лечения псориаза, включающего: а) введение пациенту, нуждающемуся в этом, пяти еженедельных доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17; и b) впоследствии введение: (i) примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту ежемесячно, или (ii) одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту примерно через один месяц после стадии (а), и впоследствии введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в начале рецидива.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает среднюю максимальную концентрацию в плазме (Cmax) антагониста IL-17, например, молекулы, связывающей IL-17, примерно 52 мкг/мл - примерно 104 мкг/мл; и b) впоследствии введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень антагониста IL-17, например, молекулы, связывающей IL-17, примерно 5 мкг/мл - примерно 70 мкг/мл.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, примерно 52-104 мкг/мл; и b) впоследствии следует вводить пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 5-70 мкг/мл.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает средний минимальный уровень через один месяц после четвертой дозы примерно 29,2 мкг/мл; и b) впоследствии введение антагониста IL-17, например, молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень антагониста IL-17, например, молекулы, связывающей IL-17, примерно 15 мкг/мл.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает средний минимальный уровень через один месяц после четвертой дозы примерно 29,2 мкг/мл; и b) впоследствии следует вводить пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 15 мкг/мл.
В некоторых из вышеуказанных способов, терапевтических схем, наборов, вариантов применения и фармацевтических композиций предшествующее лечение антагонистом IL-17, например, молекулой, связывающей IL-17, включает индукционную схему. В дополнительных вариантах осуществления изобретения индукционная схема включает нагрузочную схему. В некоторых вариантах осуществления изобретения нагрузочная схема включает введение пациенту пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели. В некоторых вариантах осуществления изобретения для пяти доз каждая составляет примерно 75 мг, примерно 150 мг или примерно 300 мг. В некоторых вариантах осуществления изобретения пять доз по примерно 150 мг вводят пациенту, если пациент весит меньше 90 кг, и пять доз по примерно 300 мг вводят пациенту, если пациент весит 90 кг или больше. В некоторых вариантах осуществления изобретения индукционная схема дополнительно включает введение пациенту примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) антагониста IL-17, например, молекулы, связывающей IL-17, в течение восьмой недели. В некоторых вариантах осуществления изобретения предшествующее лечение антагонистом IL-17, например, молекулой, связывающей IL-17, включает введение пациенту по меньшей мере одной дозы антагониста IL-17, например, молекулы, связывающей IL-17, в начале рецидива. В некоторых из вышеуказанных способов, терапевтических схем, наборов, вариантов применения и фармацевтических композиций начало рецидива определяют как потерю 20% от максимального PASI-ответа (индекса распространенности и тяжести псориаза), достигнутого в любое время до визита к лечащему врачу, на котором устанавливают начало рецидива, и потерю PASI 75. В некоторых из вышеуказанных способов, терапевтических схем, наборов, вариантов применения и фармацевтических композиций псориазом является хронический бляшковидный псориаз.
В некоторых из вышеуказанных способов, терапевтических схем, комбинаций, комбинированных методов лечения, наборов, вариантов применения и фармацевтических композиций, антагонист IL-17, например, молекула, связывающая IL-17, выбрана из группы, состоящей из:
a) секукинумаба;
b) антитела к IL-17, которое связывает эпитоп IL-17, содержащий Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129;
c) антитела к IL-17, которое связывает эпитоп IL-17, содержащий Tyr43, Tyr44, Arg46, Ala79, Asp80;
d) антитела к IL-17, которое связывает эпитоп гомодимера IL-17, имеющего две цепи зрелого белка IL-17, причем указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи;
e) антитела к IL-17, которое связывает эпитоп гомодимера IL-17, имеющего две цепи зрелого белка IL-17, причем указанный эпитоп включает Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи, причем молекула, связывающая IL-17, имеет KD примерно 100-200 пМ, и молекула, связывающая IL-17, имеет время полужизни in vivo примерно 4 недели; и
f) антитела к IL-17, которое включает антитело, выбранное из группы, состоящей из:
(i) вариабельного домена тяжелой цепи (VH) иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:8;
ii) вариабельного домена легкой цепи (VL) иммуноглобулина содержащего аминокислотную последовательность, указанную в SEQ ID NO:10;
iii) VH-домена иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:8, и VL-домена иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:10;
iv) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3;
v) VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6;
vi) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13;
vii) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, и VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; и
viii) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13, и VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
В некоторых из вышеуказанных способов, терапевтических схем, наборов, вариантов применения и фармацевтических композиций в предпочтительном варианте осуществления изобретения используют антитело человека к IL-17, например, наиболее предпочтительно - секукинумаб.
Краткое описание чертежей
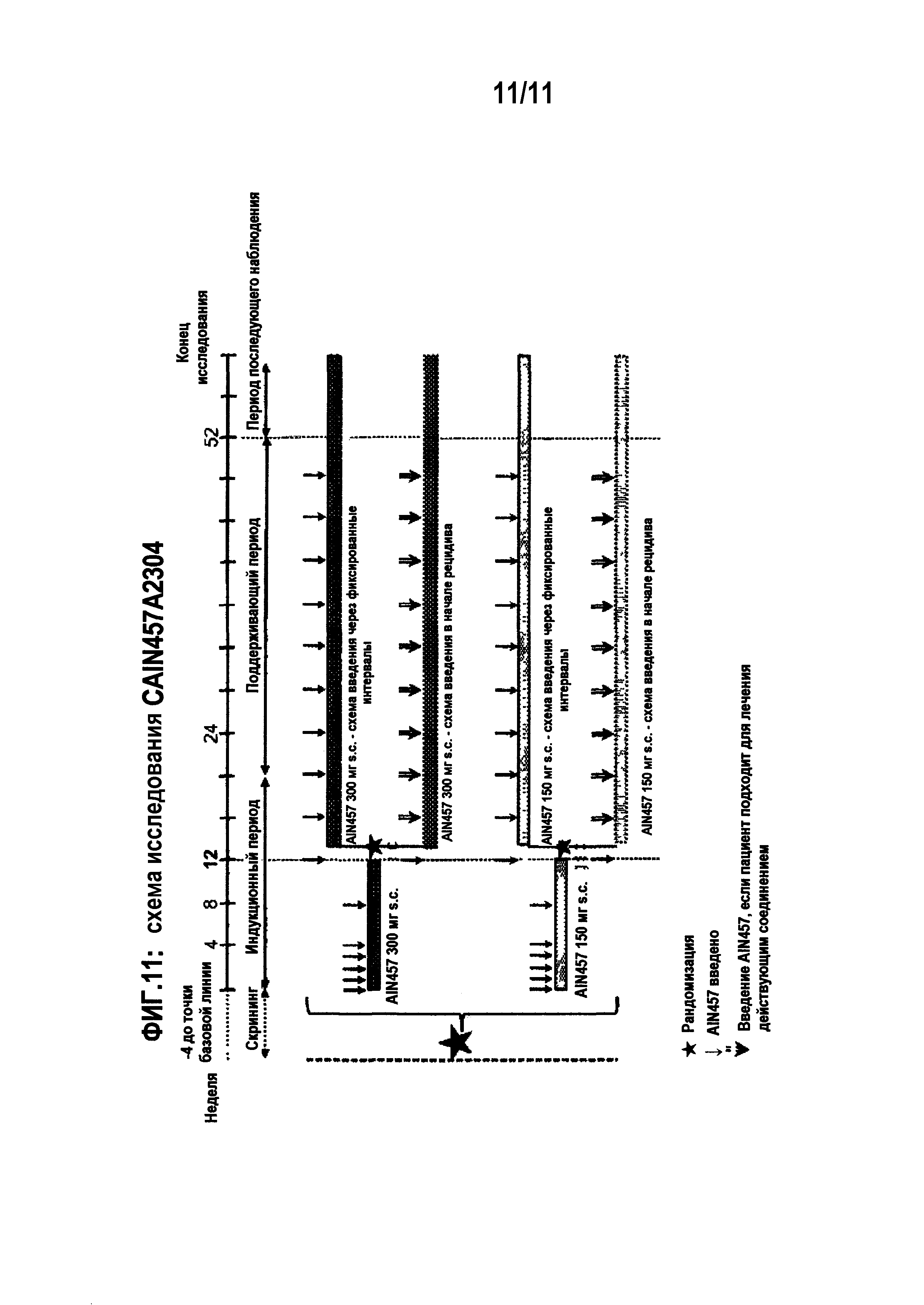
На фигуре 1 показано, что у пациентов, получавших секукинумаб, усиления симптомов не наблюдалось в течение 8 недель после введения. На этой фигуре показаны профили отдельных пациентов из исследования CAIN457A2212. Показаны все пациенты в каждой группе. Базовая линия PASI показана как 100% для всех пациентов. Ответ PASI 75 достигается, если кривая доходит до 25% на оси Y. Усиление симптомов наблюдалось бы, если бы было достигнуто значение 25% на оси Y (отмечено горизонтальной серой линией) в течение 8 недель после последнего введения исследуемого лекарственного соединения. Следует отметить, что временная точка восемь недель после последнего введения исследуемого лекарственного соединения (отмечена на фигуре вертикальной серой линией) соответствует 8-й неделе для групп «1×3 мг/кг» и «1×10 мг/кг», но 12-й неделе для группы «3×10 мг/кг»; группа «плацебо» не получала никакого активного лечения.
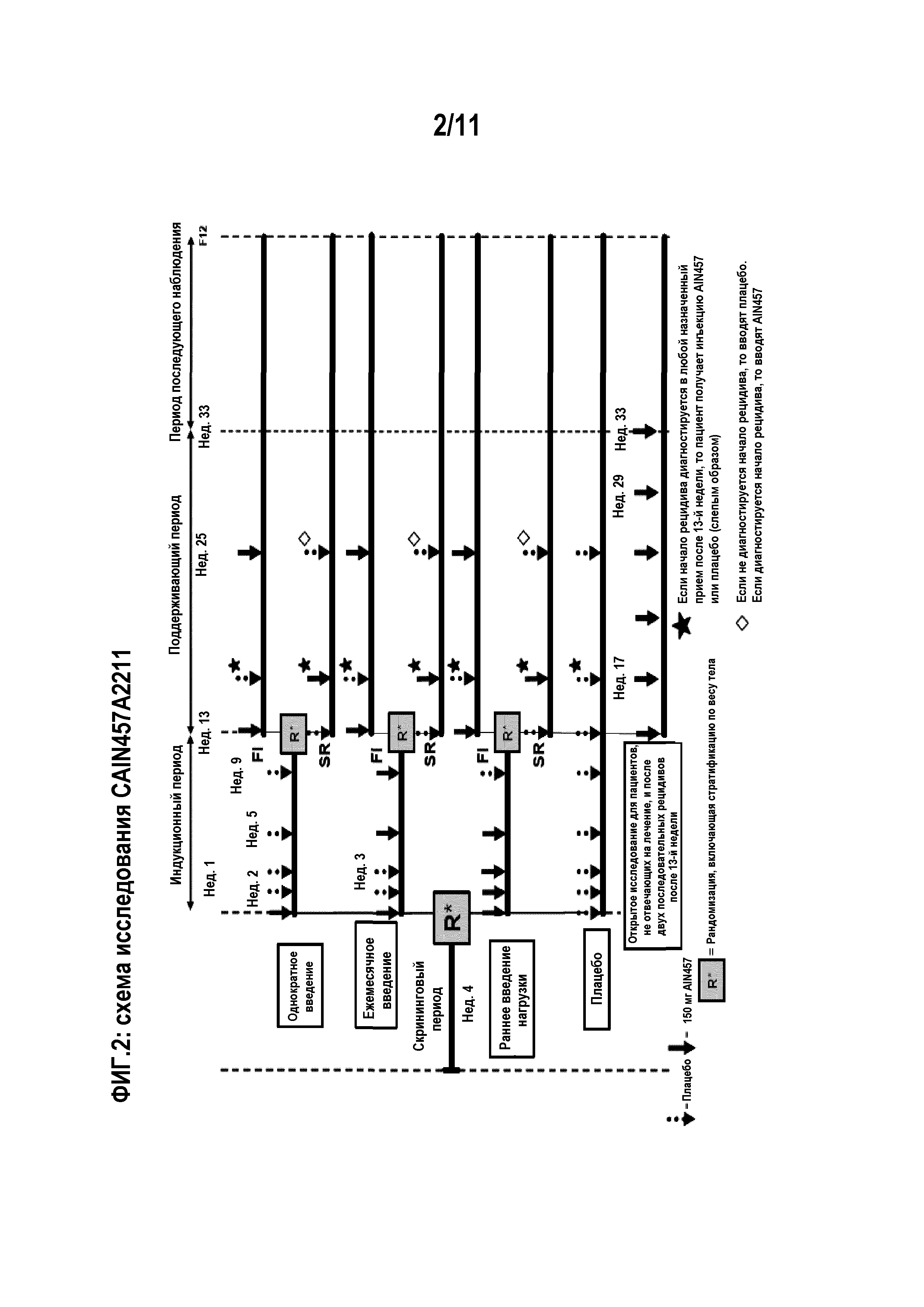
На фигуре 2 показана схема лечения для клинического испытания CAIN457A2211.
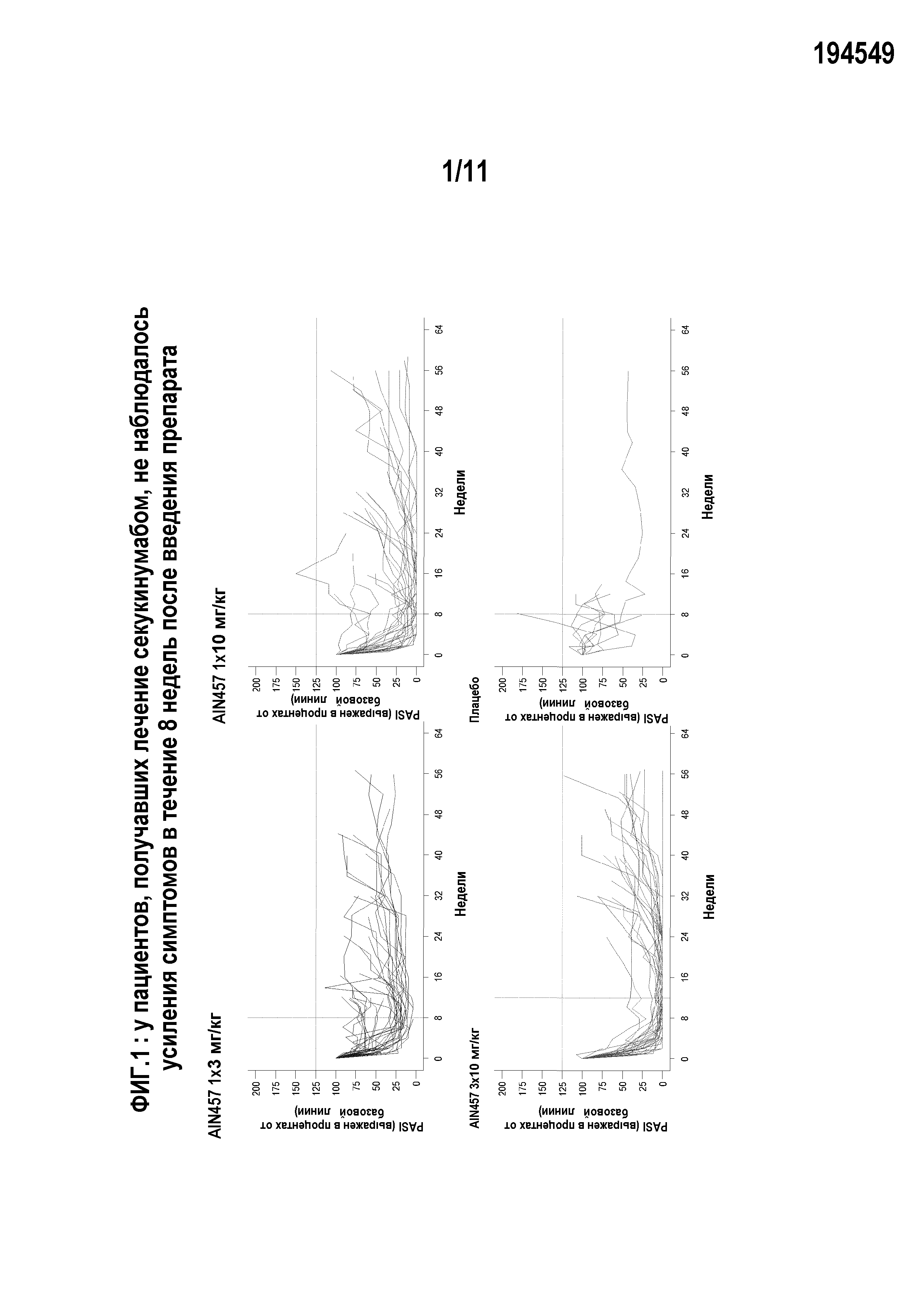
На фигуре 3 показана степень ответа PASI75 в исследовании CAIN457A2211 в течение 12-недельной индукционной фазы при различных схемах лечения 150 мг секукинумаба подкожно. Стрелки указывают на временные точки введения секукинумаба. Пациентам в группе «плацебо» не вводили секукинумаба.
Фигура 4. Исследование CAIN457A2211: уровень достижения ответа PASI 75 к моменту визита к лечащему врачу (подгруппы субъектов, рандомизированных для поддерживающего периода). По определению, степень ответа PASI 75 на 13-й неделе составляла 100%, так как только пациентов, достигших PASI 75, повторно рандомизировали для периода исследовании двойного слепого поддерживающего лечения. Пациенты в группе «фиксированного интервала» получали по 150 мг секукинумаба на 13-й и 25-й неделе. Пациенты в группе «лечение в начале рецидива» не получали секукинумаб на 13-й неделе; они получали 150 мг секукинумаба на 17-й, 21-й, 25-й и 29-й неделе, ТОЛЬКО если они страдали от начала рецидива в соответствующей временной точке. На фигуре 4А показаны результаты как для группы «фиксированного интервала», так и для группы «начало рецидива». Разница в степени ответа по сравнению с 13-й неделей (100% по определению) приведена для 17-й, 21-й и 25-й недель. Указаны временные точки введения секукинумаба (AIN457).
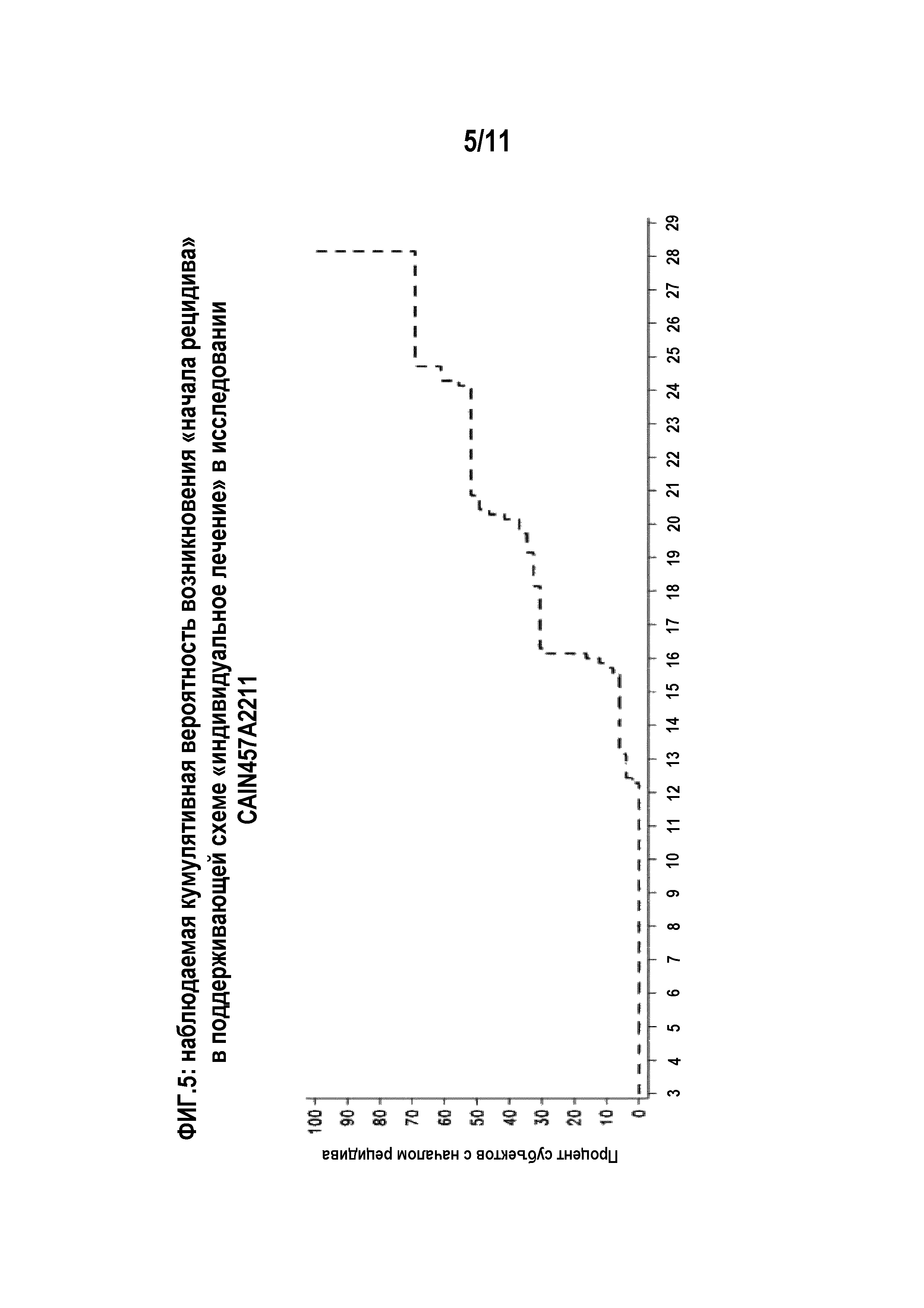
На фигуре 5 показана наблюдаемая кумулятивная вероятность «начала рецидива» при поддерживающей схеме «индивидуальное лечение» в исследовании CAIN457A2211. На фигуре процент субъектов с началом рецидива (ось Y) указан относительно времени (в неделях) после последней инъекции секукинумаба в индукционном периоде. Пациенты находились на одной из трех индукционных схем секукинумаба («однократная», «ежемесячная» и «ранняя») в течение первых двенадцати недель. В результате время с момента последнего введения секукинумаба отличается в пределах этой группы.
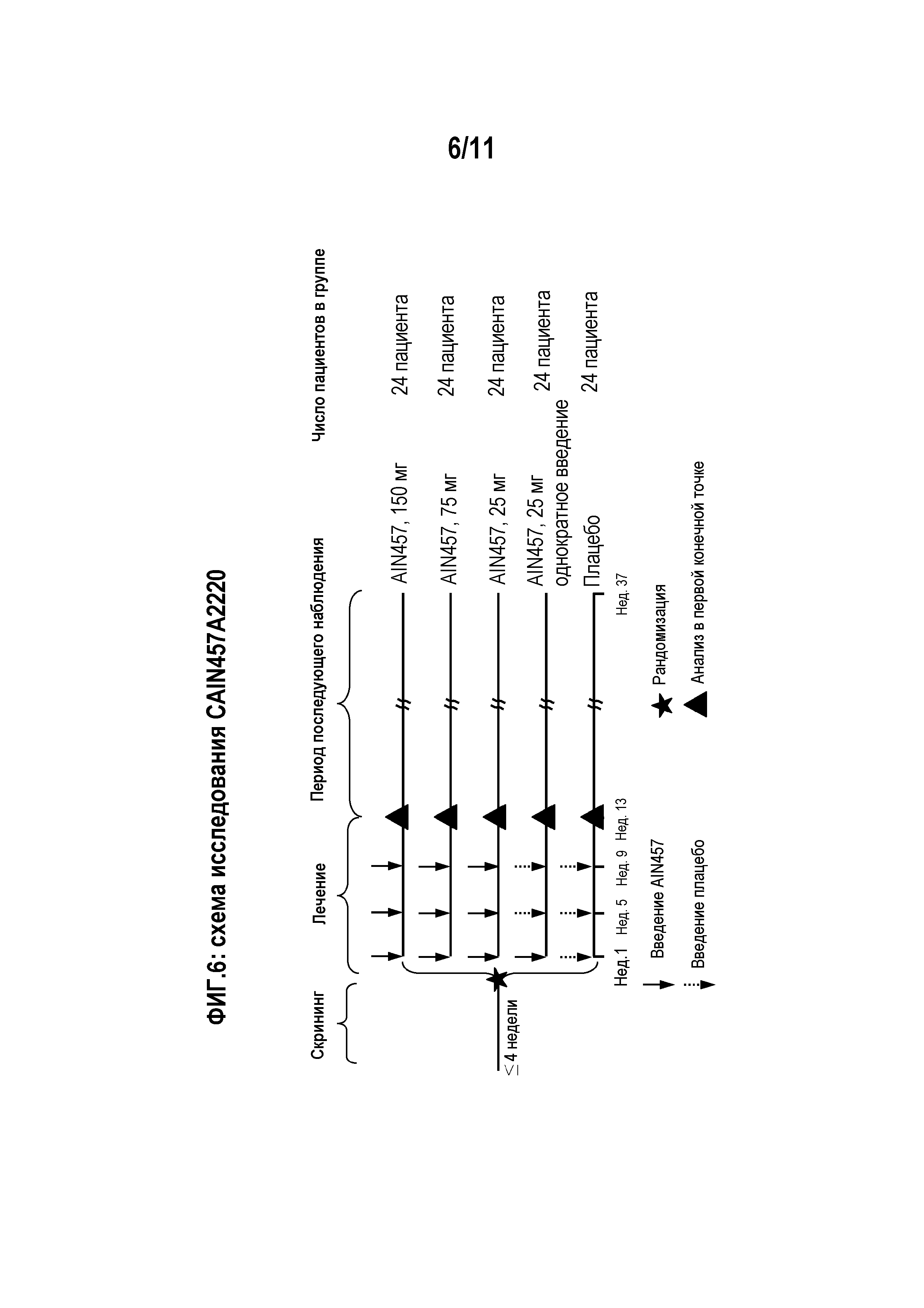
На фигуре 6 показана схема исследования для клинического испытания CAIN457A2220.
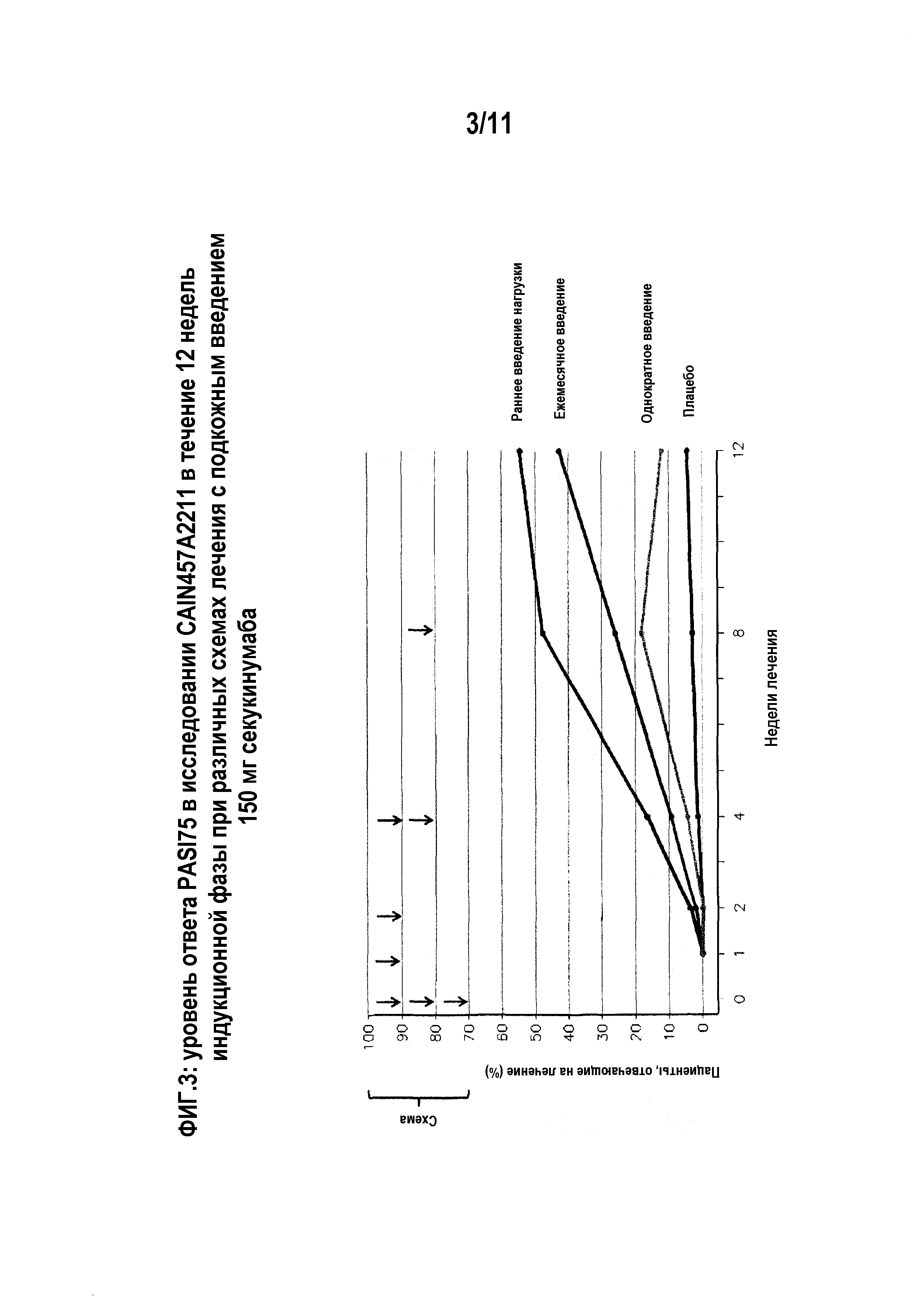
На фигуре 7 показана степень ответа PASI 75 в исследовании CAIN457A2220 (12 недель). Субъекты на «ежемесячной» схеме воздействия получали инъекции секукинумаба в 0-ю, 4-ю и 8-ю неделю. Субъекты из группы «однократное введение 25 мг» получали секукинумаб только в 0-ю неделю. Пациенты из группы «плацебо» не получали инъекций секукинумаба.
На фигуре 8 показаны моделированные фармакокинетические профили концентрации секукинумаба в плазме для схем, задействованных в фазе III (подкожное введение), а также для схем в исследованиях CATN457A2212 (внутривенное введение) и CAIN457A2211 (подкожное введение). Все моделированные профили были созданы для типичных пациентов с предположительным весом тела 90,9 кг (исходя из типичного веса тела, наблюдаемого в исследованиях действия секукинумаба на псориаз).
На фигуре 9 показаны моделированные уровни ответа PASI 75 во время индукционного и поддерживающего лечения для дозировок 75 мг, 150 мг и 300 мг на протяжении 200-дневного интервала. После индукционного лечения (0-я, 1-я, 2-я, 3-я, 4-я и 8-я недели) дозировки вводили на 12-й неделе и после этого каждую четвертую неделю.
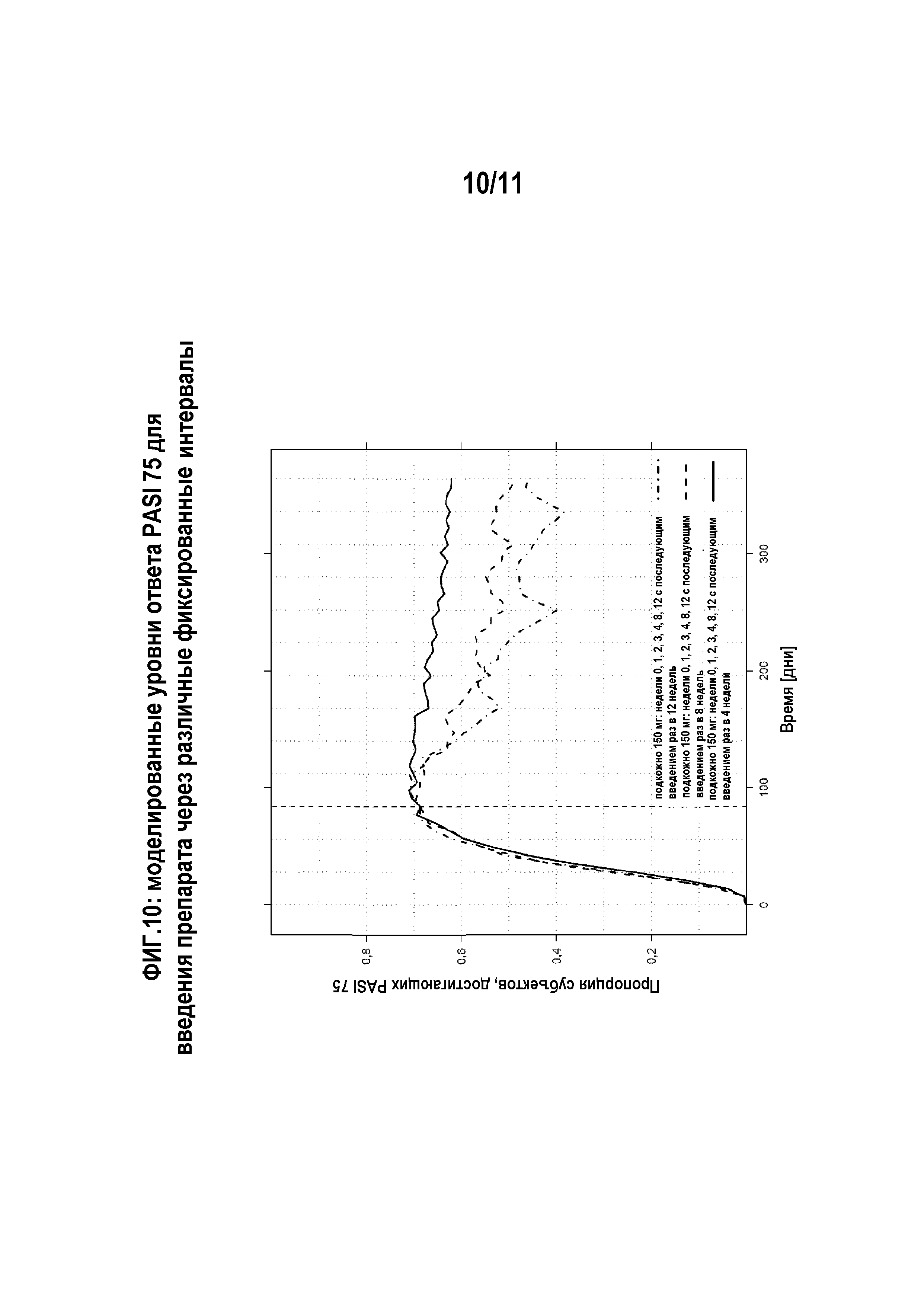
На фигуре 10 показаны моделированные уровни ответа PASI 75 для различных фиксированных интервалов воздействия. На основе одной из доз для фазы III (150 мг) моделировали влияние различных фиксированных интервалов воздействия (4, 8 и 12 недель) для продолжительности лечения 365 дней. Индукционное лечение было одинаковым для всех трех групп, и первую дозу в поддерживающей схем давали на 84-й день (= 12-я неделя) во всех группах.
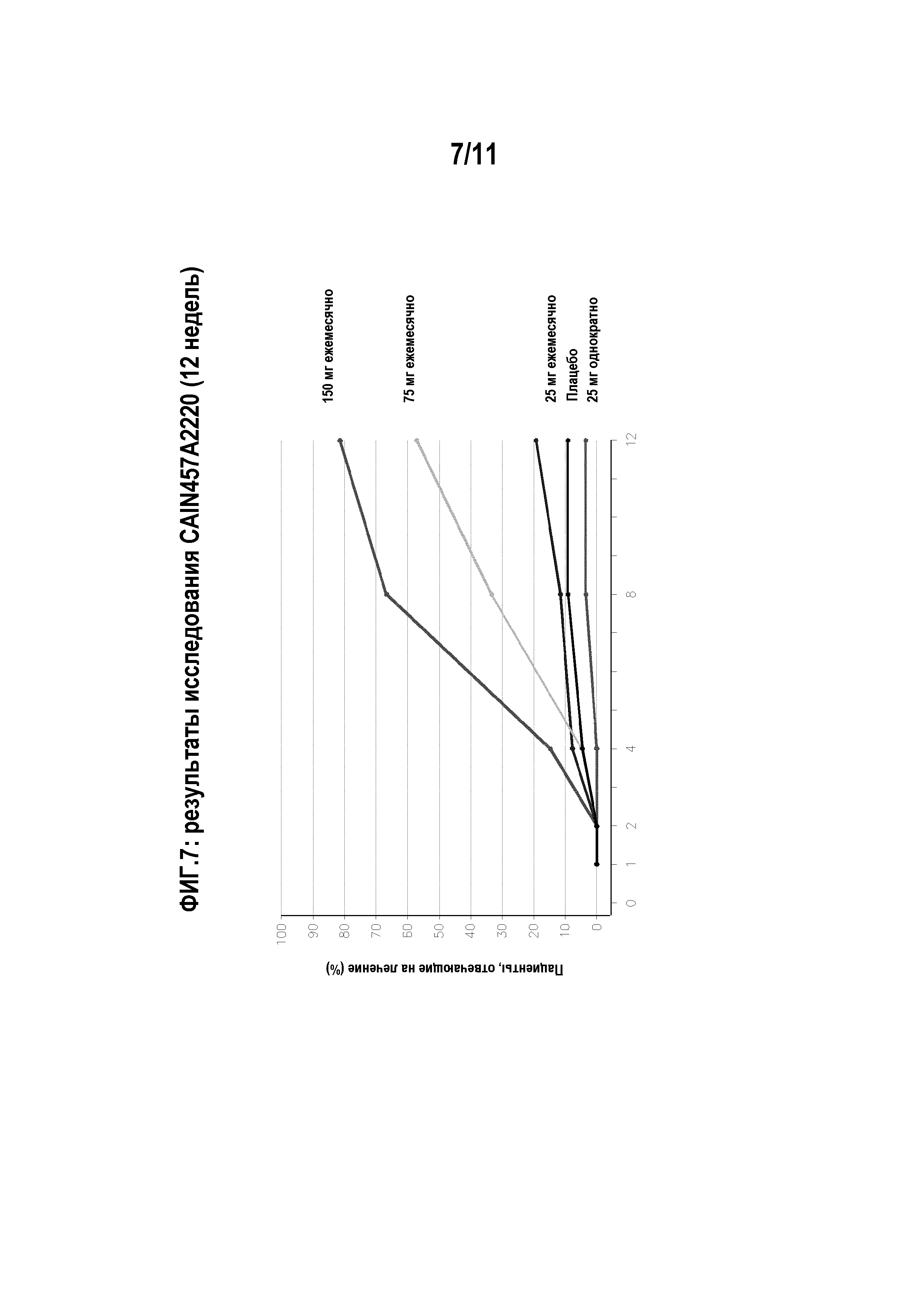
На фигуре 11 показана схема исследования для клинического испытания CAIN457A2304.
Подробное описание изобретения
Различные аспекте изобретения более подробно описаны с нижеследующих подразделах. Все патенты, опубликованные патентные заявки, публикации, ссылки и другие материалы, упомянутые в настоящем документе, полностью включены в него путем ссылки.
Термин «содержащий» охватывает «включающий», а также «состоящий из», например, композиция «содержащая» Х может состоять исключительно из Х или может включать что-то дополнительное, например Х+Y.
Термин «примерно» в отношении числового значения Х означает ±10%, если контекст не указывает иное.
Выражение «по существу» не исключает «полностью», например, композиция, которая «по существу свободна» от Y, может быть полностью свободна от Y. При необходимости, выражение «по существу» может быть пропущено в описании изобретения.
В контексте настоящего изобретения «антагонист IL-17» относится к молекуле, способной противодействовать (например, снижать, ингибировать, уменьшать, задерживать) функции, экспрессии и/или передаче сигнала от IL-17 (например, путем блокирования связывания IL-17 с рецептором IL-17). Неограничивающие примеры антагонистов IL-17 включают молекулы, связывающие IL-17, и молекулы, связывающие рецептор IL-17. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используется антагонист IL-17.
Под «молекулой, связывающей IL-17» понимают любую молекулу, способную связывать антиген IL-17 человека либо отдельно, либо в ассоциации с другими молекулами. Реакцию связывания можно показать стандартными способами (качественными методами анализа), включающими, например, анализ связывания, конкурентный метод анализа или биологический метод анализа для определения ингибирования связывания IL-17 с его рецептором, или любой тип методов анализа связывания, относительно отрицательного контроля, в котором используют антитело другой специфичности, но такого же изотипа, например, анти-CD25 антитело. Неограничивающие примеры молекул, связывающих IL-17, включают низкомолекулярные соединения, рецепторы-ловушки IL-17 и антитела, продуцируемые В-клетками или гибридомами, а также химерные, CDR-пересаженные антитела или антитела человека, или любой их фрагмент, например, F(ab')2- и Fab-фрагменты, а также одноцепочечные или однодоменные антитела. Предпочтительно, чтобы молекула, связывающая IL-17, противодействовала (например, снижала, ингибировала, уменьшала, задерживала) функции, экспрессии и/или передаче сигнала от IL-17. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используется молекула, связывающая IL-17.
Под «молекулой, связывающей рецептор IL-17» понимают любую молекулу, способную связывать рецептор IL-17 человека либо отдельно, либо в ассоциации с другими молекулами. Реакцию связывания можно показать стандартными способами (качественными методами анализа), включающими, например, анализ связывания, конкурентный метод анализа или биологический метод анализа для определения ингибирования связывания рецептора IL-17 с IL-17, или любой тип методов анализа связывания, относительно отрицательного контроля, в котором используют антитело другой специфичности, но такого же изотипа, например, анти-CD25 антитело. Неограничивающие примеры молекул, связывающих рецептор IL-17, включают низкомолекулярные соединения, ловушки IL-17 и антитела к рецептору IL-17, продуцируемые В-клетками или гибридомами, а также химерные, CDR-пересаженные антитела или антитела человека, или любой их фрагмент, например, F(ab')2- и Fab-фрагменты, а также одноцепочечные или однодоменные антитела. Предпочтительно, чтобы молекула, связывающая рецептор IL-17, противодействовала (например, снижала, ингибировала, уменьшала, задерживала) функции, экспрессии и/или передаче сигнала от IL-17. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используется молекула, связывающая рецептор IL-17.
Термин «антитело» в контексте настоящего описания включает полноразмерные антитела и их любые антиген-связывающие участки или цепи. Природным «антителом» является гликопротеин, содержащий по меньшей мере две тяжелых (H) цепи и две легких (L) цепи, соединенные друг с другом дисульфидными мостиками. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в настоящем документе VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена - СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в настоящем документе VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен CL. VL- и VH-области могут быть дополнительно разделены на участки гипервариабельности, называемыми участками, определяющими комплементарность (CDR), между которыми находятся более консервативные участки, называемыми каркасными участками (FR). Каждая VL и VH состоит из трех CDR и четырех FR, расположенных от аминоконца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами организма, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используется антитело к IL-17 или к рецептору IL-17.
Термин «антиген-связывающий участок» антитела, используемый в настоящем описании, относится к фрагментам антитела, которые сохраняют способность связывать антиген (например, IL-17). Было показано, что антиген-связывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охваченные термином «антиген-связывающий участок» антитела включают Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1-доменов; F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирном участке; Fd-фрагмент, состоящий из VH и CH1-доменов; Fv-фрагмент, состоящий из VL и VH-доменов одного плеча антитела; dAb-фрагмент (Ward et al., 1989, Nature 341:544-546), который состоит из VH-домена; и выделенный участок, определяющий комплементарность (CDR). Примеры антиген-связывающих сайтов включают CDR секукинумаба, указанные в SEQ ID NO:1-6 и 11-13 (таблица 5), предпочтительно, CDR3 тяжелой цепи. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются разными генами, их можно соединить с помощью рекомбинантных методик через синтетический линкер, который позволяет получать их в виде одной белковой цепи, в которой VL и VH-области образуют пару с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например, Bird et al., 1988, Science 242:423-426 и Huston et al., 1988 Proc. Natl. Acad. Sci. USA 85:5879-5883). Подразумевается, что такие одноцепочечные антитела также охвачены термином «антитело». Одноцепочечные антитела и антиген-связывающие участки получают с использованием общепринятых методик, известных специалистам в данной области. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используется одноцепочечное антитело или антиген-связывающий участок антитела к IL-17 или рецептору IL-17.
Термин «фармацевтически приемлемый» означает нетоксичный материал, который не нарушает эффективность биологической активности действующего(-их) ингредиента(-ов).
«Выделенное антитело» в контексте настоящего изобретения относится к антителу, которое по существу свободно от других антител, имеющих другую антигенную специфичность (например, выделенное антитело, которое специфично связывает IL-17, по существу свободно от антител, которые специфично связывают антигены, отличающиеся от IL-17). Выделенное антитело может быть по существу свободно от другого клеточного материала и/или химических соединений. Выделенное антитело, которое «специфично связывает» IL-17, может перекрестно реагировать с другими антигенами, такими как молекулы IL-17 из других биологических видов. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, молекулой, связывающей IL-17, является выделенное антитело.
Термины «моноклональное антитело» или «композиция моноклонального антитела» в контексте настоящего изобретения относятся к препарату молекул антитела одной молекулярной композиции. Композиция моноклонального антитела проявляет одну специфичность связывания и аффинность в отношении конкретного эпитопа. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, молекулой, связывающей IL-17, является моноклональное антитело.
Подразумевается, что термин «антитело человека» в контексте настоящего описания включает антитела, имеющие вариабельные области, в которых как каркасные, так и CDR-участки получены из последовательностей человека. Кроме того, если антитело содержит константную область, то константная область также получена из таких последовательностей человека, например, последовательностей зародышевой линии человека или мутированных версий последовательностей зародышевой линии человека, или антитела, содержащего консенсусные каркасные последовательности, полученные в результате анализа каркасных последовательностей человека, описанного в Knappik, et al. (2000. J Mol. Biol. 296, 57-86). «Антитело человека» необязательно должно продуцироваться человеком, тканью человека или клеткой человека. Антитела человека по настоящему изобретению могут включать аминокислотные остатки, не кодируемые последовательностями человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro, или соматическим мутагенезом in vivo). Однако подразумевается, что термин «антитело человека» в контексте настоящего описания не включает антитела, в которых в каркасные последовательности человека встроены CDR-последовательности, полученные из зародышевой линии другого вида млекопитающего, такого как мышь. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, молекулой, связывающей IL-17, является антитело человека.
Термин «IL-17» относится к IL-17A, ранее известному как CTLA8, и включает IL-17A дикого типа из различных видов (например, человека, мыши и обезьяны), полиморфные варианты IL-17A и функциональные эквиваленты IL-17A. Функциональные эквиваленты IL-17A по настоящему изобретению предпочтительно имеют по меньшей мере примерно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% общей идентичности по последовательности с IL-17A дикого типа (например, IL-17A человека) и по существу сохраняют способность индуцировать продукцию IL-6 фибробластами кожи человека.
Подразумевается, что термин «Kdis» или «KD» в контексте настоящего описания относится к скорости диссоциации конкретного взаимодействия антиген-антитела, которую получают из отношения Kd к Ka (а именно, Kd/Ka) и выражают как молярную концентрацию (М). Значения KD для антител можно определить с использованием способов, известных в данной области. Способом определения KD антитела является использование поверхностного плазмонного резонанса или использование биосенсорной системы, такой как система Biacore®.
В контексте настоящего описания понятие «аффинность» относится к силе взаимодействия между антителом и антигеном в отдельных антигенных сайтах. В каждом антигенном сайте вариабельная область «плеча» антитела взаимодействует через слабые нековалентные силы с антигеном в многочисленных местах; чем больше взаимодействий, тем сильнее аффинность. В данной области известны стандартные методы анализа для оценки аффинности связывания антител с IL-17 различных биологических видов, включая, например, методы ELISA, Вестерн-блоттинг и методы RIA. Кинетику связывания (например, аффинность связывания антител) также можно оценить стандартными методами анализа, известными в данной области, таким как Biacore-анализ. Методы анализа для оценки эффектов антител на функциональные свойства IL-17 (например, связывание рецептора, предупреждение или ослабление остеолиза) более подробно описаны в разделе «Примеры».
В контексте настоящего документа термин «субъект» или «пациент» включает любого человека или животное. Термин «животное» включает всех позвоночных, например, млекопитающих и немлекопитающих животных, таких как приматы, овцы, собаки, кошки, лошади, коровы, куры, земноводные, рептилии и т.п.
Антитело, которое «ингибирует» одно или несколько функциональных свойств IL-17 (например, биохимическую, иммунохимическую, клеточную, физиологическую или другую биологическую активность, или аналогичные свойства), определенных в соответствии с методиками, известными в данной области и описанными в настоящем документе, будет восприниматься как связанное со статистически значительным снижением конкретной активности относительно наблюдаемой в отсутствие антитела (или в присутствии контрольного неспецифичного антитела). Антитело, которое ингибирует активность IL-17, вызывает статистически значимое снижение, например, по меньшей мере на 10%, измеряемого параметра, по меньшей мере на 50%, 80% или 90%, и в некоторых вариантах осуществления изобретения антитело по изобретению может ингибировать функциональную активность IL-17 более чем на 95%, 98% или 99%.
Термин «производное», если не указано иное, используют для определения вариантов аминокислотных последовательностей и ковалентных модификаций молекул, связывающих IL-17, и молекул, связывающих рецептор IL-17, по настоящему изобретению, например, конкретной последовательности.
«Функциональное производное» включает молекулу, имеющую качественную биологическую активность, общую с раскрытыми молекулами, связывающими IL-17, и молекулами, связывающими рецептор IL-17. Функциональное производное включает фрагменты и пептидные аналоги молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17, по настоящему изобретению. Фрагменты содержат области в последовательности полипептида по настоящему изобретению, например, конкретной последовательности. Функциональные производные молекул, связывающих IL-17, или молекул, связывающих рецептор IL-17, раскрытых в настоящем документе, предпочтительно содержат VH и/или VL-домены, которые имеют по меньшей мере примерно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% общей идентичности по последовательности с последовательностями VH и/или VL молекул, связывающих IL-17, или молекул, связывающих рецептор IL-17, раскрытых в настоящем документе (например, последовательностями VH и/или VL из таблицы 5), или содержат CDR, которые имеют по меньшей мере примерно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% общей идентичности по последовательности с CDR молекул, связывающих IL-17 (например, секукинумабом), или молекул, связывающих рецептор IL-17, раскрытых в настоящем документе (например, имеют 1, 2 или 3 аминокислотных отличия от CDR, указанных в таблице 5), и по существу сохраняют способность связывать IL-17 человека или, например, ингибировать продукцию IL-6 фибробластами кожи человека, индуцированными IL-17. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций, используют функциональные производные молекул, связывающих IL-17, или молекул, связывающих рецептор IL-17, раскрытых в настоящем документе.
«Ингибировать IL-6» в контексте настоящего изобретения относится к способности молекулы, связывающей IL-17, снижать продукцию IL-6 первичными фибробластами кожи человека. Продукция IL-6 в первичных фибробластах кожи человека зависит от IL-17 (Hwang S.Y. et al., (2004) Arthritis Res Ther; 6:R120-128). Кратко, фибробласты кожи человека стимулируют рекомбинантным IL-17 в присутствии различных концентраций молекулы, связывающей IL-17, или содержащего Fc-фрагмент рецептора IL-17 человека. В качестве отрицательного контроля обычно можно использовать химерное антитело к CD25 Симулект (басиликсимаб). После стимуляции в течение 16 ч отбирают супернатант и анализируют на IL-6 с помощью ELISA. Молекула, связывающая IL-17, как правило, имеет IC50 ингибирования продукции IL-6 (в присутствии 1 нМ IL-17 человека), составляющую примерно 50 нМ или меньше (например, от примерно 0,01 до примерно 50 нМ), при тестировании как указано выше, т.е. указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций молекулы, связывающие IL-17, и их функциональные производные имеют IC50 ингибирования продукции IL-6, определенную выше, примерно 20 нМ или меньше, более предпочтительно, примерно 10 нМ или меньше, более предпочтительно, примерно 5 нМ или меньше, более предпочтительно, примерно 2 нМ или меньше, более предпочтительно, примерно 1 нМ или меньше.
Термин «ковалентная модификация» включает модификации полипептида по настоящему изобретению например, конкретной последовательности или ее фрагмента с использованием органического белкового или небелкового дериватизирующего агента; слияние с гетерологичными полипептидными последовательностями и посттрансляционные модификации. Ковалентно модифицированные полипептиды, например, конкретной последовательности, все еще сохраняют способность связываться с IL-17 человека или, например, нейтрализовать индуцируемую IL-17 продукцию IL-6 в фибробластах кожи человека в результате перекрестного связывания. Как правило, ковалентные модификации вводят путем реакции аминокислотных остатков-мишеней с органическим дериватизирующим агентом, который обладает способностью вступать в реакцию с отдельными боковыми или концевыми остатками, или путем использования механизмов посттрансляционных модификаций, которые функционируют в выбранных рекомбинантных клетках-хозяевах. Некоторые пост-трансляционные модификации являются результатом воздействия рекомбинантных клеток-хозяев на экспрессируемый полипептид. Глутаминильные и аспарагинильные остатки часто деамидируют после трансляции с получением соответствующих глутамильных и аспартильных остатков. В альтернативном варианте эти остатки деаминируют в мягких кислотных условиях. Другие пост-трансляционные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серила, тирозина или треонила, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина, см., например, T. E. Creighton, Proteins: Structure and Molecular Properties, W. H. Freeman & Co., San Francisco, pp.79-86 (1983). Ковалентные модификации включают, например, слитые белки, содержащие полипептид по настоящему изобретению, например, конкретной последовательности, и варианты его аминокислотной последовательности, такие как иммуноадгезины, и белки, слитые на N-конце с гетерологичными сигнальными последовательностями. Типичным примером неприродной ковалентной модификации является пегилирование. В некоторых вариантах осуществления раскрытых способов, схем, наборов, процессов, вариантов применения и композиций молекулы, связывающие IL-17, или молекулы, связывающие рецептор IL-17, раскрытые в настоящем документе, ковалентно модифицированы.
Фраза «по существу идентична» означает, что данная аминокислотная или нуклеотидная последовательность (например, CDR, VH- или VL-домена) будет идентична или будет иметь незначительные отличия (например, консервативные аминокислотные замены) по сравнению с конкретной референсной последовательностью. Незначительные отличия включают минорные аминокислотные замены, такие как 1 или 2 замены в 5-аминокислотной последовательности конкретной области. В случае антител, второе антитело имеет такую же специфичность и имеет по меньшей мере, 50% аффинности к той же мишени. Последовательности, по существу идентичные (например, имеющие по меньшей мере примерно 85% идентичности по последовательности) с последовательностями, раскрытыми в настоящем документе, также являются частью этой заявки. В некоторых вариантах осуществления изобретения идентичность по последовательности может составлять 90% или выше, например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше.
«Идентичность» в отношении нативного полипептида и его функционального производного в контексте настоящего изобретения определена как процент аминокислотных остатков в исследуемой последовательности, которые идентичны остаткам соответствующего нативного полипептида, после выравнивания последовательностей и введения разрывов, при необходимости, для достижения максимального процента гомологии и без учета каких-либо консервативных замещений в качестве части идентичности последовательностей. Ни N- или С-концевые удлинения, ни вставки не могут быть истолковываться, как снижающие идентичность. Способы и компьютерные программы для выравнивания последовательностей хорошо известны. Процент идентичности можно определить с помощью стандартных алгоритмов выравнивания, например, метода поиска на основе базового локального выравнивания (BLAST, Basic Local Alignment Search Tool), описанным Altshul и др. ((1990) J. Mol. Biol., 215: 403-410); алгоритма Needleman и др. ((1970) J. Mol. Biol., 48:444-453); или алгоритма Meyers и др. ((1988) Comput. Appl. Biosci., 4:11-17). Набором параметров может служить матрица стоимости аминокислотных замен Blosum 62 со штрафом за разрыв, равным 12, штрафом за продолжение разрыва, равным 4, и штрафом за внесение разрыва со сдвигом рамки считывания, равным 5. Процент идентичности между двумя аминокислотными или нуклеотидными последовательностями можно также определить, применяя алгоритм Е.Meyers и W.Miller ((1989) CABIOS, 4: 11-17), который был встроен в программу ALIGN (версия 2.0), применяя таблицу весов остатков РАМ120, штраф за длину разрыва, равный 12, и штраф за разрыв, равный 4.
«Аминокислота(-ы)» относится ко всем природным L-α-аминокислотам, например, и включает D-аминокислоты. Аминокислоты обозначают с помощью широко известных однобуквенных или трехбуквенных обозначений.
Термин «вариант аминокислотной последовательности» относится к молекулам с некоторыми отличиями в их аминокислотных последовательностях по сравнению с последовательностями по настоящему изобретению. Варианты аминокислотной последовательности полипептида по настоящему изобретению, например, конкретной последовательности, все еще сохраняют способность связывать IL-17 человека или, например, ингибировать индуцированную IL-17 продукцию IL-6 в фибробластах кожи человека. Замещающими вариантами являются те, которые имеют по меньшей мере один удаленный остаток аминокислоты и другую аминокислоту, вставленную на его место в ту же позицию в полипептиде по настоящему изобретению, например, конкретной последовательности. Такие замещения могут быть одиночными, если была замещена только одна аминокислота в молекуле, или они могут быть множественными, если в одной молекуле были замещены две или несколько аминокислот. Инсерционными являются те варианты, которые содержат одну или несколько аминокислот, вставленных непосредственно к аминокислоте в определенной позиции в полипептиде по настоящему изобретению, например, конкретной последовательности. Непосредственно к аминокислоте означает присоединение либо к α-карбокси-, либо α-аминофункциональной группе аминокислоты. Делеционными являются те варианты, у которых удалены одна или несколько аминокислот в полипептиде по настоящему изобретению, например конкретной последовательности. Обычно делеционные варианты могут иметь одну или две аминокислоты, удаленные в конкретной области молекулы.
В контексте настоящего документа «терапевтически эффективное количество» относится к количеству антагониста IL-17 (например, молекулы, связывающей IL-17 (например, антитела к IL-17, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17)), которое является эффективным при введении одной или нескольких доз субъекту (такому как пациент) для лечения, предупреждения, излечения, замедления, снижения тяжести или уменьшения выраженности по меньшей мере одного симптома расстройства или рецидивирующего расстройства, или увеличения продолжительности жизни субъекта по сравнению с тем, что ожидалось в отсутствие такого лечения. При применении в отношении индивидуального действующего ингредиента (например, молекулы, связывающей IL-17), вводимого отдельно, термин относится только к этому ингредиенту. При применении к комбинации термин относится к объединенным количествам действующих ингредиентов, которые дают терапевтический эффект, при введении в комбинации, либо последовательно, либо одновременно.
В контексте настоящего изобретения термин «псориаз» включает бляшковидный, каплевидный, инверсный, пустулярный и эритродермальный псориаз. Предпочтительным типом псориаза для лечения с использованием способов, схем, комбинаций, наборов и композиций, раскрытых в настоящем документе, является бляшковидный псориаз.
Термины «лечение» или «лечить» относятся как к профилактическому или превентивному лечению, так и к исцеляющему или изменяющему течение заболевания лечению, включая лечение пациента, который имеет риск заражения заболеванием или который возможно получил заболевание, а также пациентов, которые уже больны или у которых диагностировано наличие болезни или болезненного состояния, и включают подавление клинического рецидива. Лечение может получать субъект, имеющий расстройство, или который в итоге может получить расстройство с целью предупреждения, излечения, замедления, снижения тяжести или уменьшения выраженности по меньшей мере одного симптома расстройства или рецидивирующего расстройства, или с целью увеличения продолжительности жизни субъекта по сравнению с тем, что ожидалось в отсутствие такого лечения.
Следующие определения используют согласно Руководству по клиническому исследованию лекарственных средств, показанных для лечения псориаза Комитета по лекарственным препаратам для применения у человека (CHMP), Европейского агентства по лекарственным средствам для оценки лекарственных средств для применения у человека (2004), CHMP/EWP/2454/02 corr document. London, UK:
Ответ на лечение (пациент, отвечающий на лечение): пациенты, достигающие ≥75% улучшения (снижения) индекса Площади и тяжести псориаза (PASI) по сравнению с базовой линией (также именуемого PASI 75), считаются пациентами, отвечающими на лечение.
Частичный ответ на лечение (пациент, частично отвечающий на лечение): пациенты, достигающие ≥50% улучшения от базовой линии PASI (также именуемого PASI 50), но меньшей 75% улучшения (также именуемого PASI 75), считаются пациентами, частично отвечающими на лечение.
Нет ответа (пациент, не отвечающий на лечение): пациенты, достигающие <50% улучшения от базовой линии индекса PASI, считаются пациентами, не отвечающими на лечение.
Рецидив (пациент с рецидивом заболевания): если пациенты теряют ≥50% улучшения индекса PASI, достигнутого в течение предшествующего периода исследования, то эти пациенты будут считаться, как имеющие «рецидив».
Усиление симптомов (пациент, с усилением симптомов): ухудшение значений до базовой линии PASI (или возникновение нового пустулярного, эритродермального или более воспалительного псориаза в течение 8 недель после отмены терапии), например, PASI>125% значения базовой линии PASI.
В системе определения индекса PASI голову, туловище, верхние конечности и нижние конечности оценивают отдельно по эритеме, утолщению (поднятию, уплотнению бляшек) и шелушению (слущиванию), указанным в таблице 1. Среднюю степень тяжести каждого симптома в каждой из четырех областей тела оценивают по шкале от 0 до 4. Площадь, покрытую язвами в каждой области тела, указывают как процент от общей площади этой конкретной области тела. Поскольку голова и шея, верхние конечности, туловище и нижние конечности соответствуют приблизительно 10%, 20%, 30% и 40% площади поверхности тела, соответственно, то индекс PASI вычисляют, используя формулу:
PASI=0,1(EH+IH+DH)AH + 0,2(EU+IU+DU)AU + 0,3(ET+IT+DT)AT + 0,4(EL+IL+DL)AL
Индекс PASI может варьировать от минимального значения 0, соответствующего отсутствию симптомов псориаза, до теоретического максимума 72,0. Индекс PASI определяют с точностью до десятой доли, например, 9,0, 10,1, 14,2, 17,3, и т.д. Дополнительная информация по определению индекса PASI доступна в Henseler T, Schmitt-Rau K (2008) Int. J. Dermatol.; 47:1019-1023.
|
В контексте настоящего документа фраза «начало рецидива» (SoR) относится к потере 15%-25% от максимального ответа на лекарственное средство (по сравнению с базовой линией), достигнутого в любой момент до визита к лечащему врачу, на котором устанавливают начало рецидива, и потерю PASI 75. В некоторых вариантах осуществления раскрытых способов, вариантов применения и терапевтических схем у пациента с псориазом детектируют SoR. В некоторых вариантах осуществления изобретения SoR относится к потере 20% максимального ответа на лекарственное средство (по сравнению с базовой линией), достигнутого в любой момент до визита к лечащему врачу, на котором устанавливают начало рецидива, и потерю PASI 75.
В таблице 2 приведены несколько неограничивающих примеров вычислений, определяющих наличие у пациента «начала рецидива» SoR) с использованием системы определения индекса PASI. Определением SoR, используемым в таблице 2, является потеря 20% улучшения PASI и потерю ответа PASI75. Это определение позволяет пациентам с сильным ответом (либо первичным ответом, либо ответом, следующим за лечением SoR) продолжать лечение без дополнительного введения препаратов, даже несмотря на то, что они потеряли 20% от когда-либо достигнутого максимального улучшения (см. пациента 5 в таблице 2). В случае пациента, отвечающего на лечение, такого как пациент 5, лечение SoR не будет начато до потери PASI75 (величина F для пациента 5), и не будет продолжено до следующей потери PASI75 (величина K для пациента 5).
|
Таблица 2 иллюстрирует, помимо прочего, что пациенты не будут подходить для лечения SoR до тех пор, пока не будет достигнуто PASI75 (сравнить значение B со значением C для пациента 1). В таблице также проиллюстрировано, что некоторые пациенты, которые первоначально получали лечение SoR, не подойдут снова для продолжения лечения SoR, поскольку они не достигают по меньшей мере PASI75 (сравнить значение B со значением G2 для пациента 2).
В таблице 2 также проиллюстрировано, что пациент, после диагностирования у него SoR, будет получать лечение молекулой, связывающей IL-17, например, секукинумабом, каждые 4 недели до прохождения PASI75 (значения B). В некоторых случаях, например, в случае пациентов 4 и 5, для повторного достижения PASI75 требуется только однократная доза молекулы, связывающей IL-17, например, секукинумаба (величина G1 для пациентов 4 и 5). В других случаях, например, в случае пациента 3, для повторного достижения PASI75 необходимо более одной дозы (величина G2 для пациента 3).
Как показано в таблице 2, после достижения PASI75 в течение лечения SoR, проводят новые вычисления, для того чтобы определить индекс PASI для следующего SoR (величина K). В случае пациентов 3 и 4, поскольку новое улучшение (величина Н) после лечения SoR является максимальным когда-либо достигнутым улучшением (сравнить H с D для каждого пациента), это новое улучшение (величина Н) будет использовано для определения нового индекса PASI для SoR (величина K). Однако в некоторых ситуациях, например, в случае пациента 6, новое улучшение (величина Н) после лечения SoR не является когда-либо достигнутым лучшим улучшением (сравнить H с D для пациента 6), и поэтому максимальное когда-либо достигнутое улучшение (величина D) останется эталоном при определении индекса PASI для следующего SoR (величина K).
Очевидно, что максимальный ответ, улучшение, достигнутое улучшение, потерянное улучшение, SoR и т.д., можно измерить с помощью любой доступной системы оценки, например, проводимого врачом измерения эффективности, такого как PASI, визуальная оценка индекса поражений, измерение поверхности тела (BSA), индекс клинических симптомов: индекс Общей тяжести симптомов (TSS), Общая врачебная оценка улучшения (PGA) или другая общая оценка (например, исследовательская общая оценка (IGA)); или проводимого пациентом измерения эффективности, такого как улучшение симптомов (зуда, болезненности), Оценка пациентом общего улучшения, оценка пациентом PASI (самодиагностика PASI - SAPASI) или шкала HRQL для дерматологии (общие шкалы, такие как DLQI, DQOLS и шкалы для псориаза, такие как PDI, PLSI)). В предпочтительном примере SoR оценивают, используя систему оценки индекса PASI (проводимую врачом или пациентом, предпочтительно, врачом).
Если у пациента уже наблюдалось SoR, и наблюдается еще одно SoR, то этот последующий рецидив именуют «повторным началом рецидива» или «повторным SoR». В некоторых вариантах осуществления изобретения у пациента повторно начинается рецидив.
В контексте настоящего документа фразы «ранее получал лечение системным агентом против псориаза» и «предшествующее лечение псориаза» используются для обозначения пациента, который ранее подвергался лечению от псориаза с использованием системного агента, например, пациента, не отвечающего на лечение, пациента, отвечающего на лечение, пациента с рецидивом, пациента с усилением симптомов или пациента, частично отвечающего на лечение. Такие пациенты включают пациентов, ранее получавших лечение биопрепаратами, такими как эфализумаб, и пациентов, которые получали лечение другими препаратам, такими как циклоспорин. В контексте настоящего документа пациент, ранее получавший лечение от псориаза с использованием секукинумаба, именуется как прошедший «предшествующее лечение секукинумабом».
В контексте настоящего документа фразу «ранее не получал лечение системным агентом против псориаза» используют для обозначения пациента, который ранее не подвергался системному лечению от псориаза. В некоторых вариантах осуществления изобретения пациент ранее не получал лечение системным агентом против псориаза.
В контексте настоящего изобретения термин «интактный» относится к пациенту, которые ранее не получал системного лечения от псориаза. В некоторых вариантах осуществления изобретения пациент является интактным.
Под «терапевтической схемой» понимается план лечения заболевания, например, схема дозирования, используемая в течение лечения псориаза. Терапевтическая схема может включать индукционную схему и поддерживающую схему. В некоторых вариантах осуществления изобретения пациент получает антагонист IL-17 (например, молекулу, связывающую IL-17, например, антитело к IL-17, например, секукинумаб, или молекулу, связывающую рецептор IL-17, например, антитело к рецептору IL-17) по индукционной схеме и поддерживающей схеме. В таблице 3 приведены примеры одобренных терапевтических схем лечения псориаза. Следует отметить, что ни одна из этих схем не обеспечивает лечение в начале рецидива.
|
Фраза «индукционная схема» относится к схеме лечения (или участку схемы лечения), которую используют для первоначального лечения заболевания. В ходе лечения псориаза первые 12 недель обычно называют «индукционным периодом», и в течение этого времени используют индукционную схему. Общая цель индукционной схемы состоит в том, чтобы обеспечить высокий уровень лекарственного средства в системном кровотоке пациента в течение индукционного периода. В индукционной схеме может использоваться (частично или вся) «нагрузочная схема», которая может включать введение более высокой дозы лекарственного соединения, чем лечащий врач использовал бы в течение поддерживающей схемы, более частое введение лекарственного соединения, чем лечащий врач вводил бы в течение поддерживающей схемы, или и то и другое. Доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17) в течение индукционной схемы можно осуществить подкожно, например, в дозировках, составляющих примерно 75 мг - примерно 300 мг; внутривенно, например, в дозировках, составляющих примерно 1 мг/кг - примерно 50 мг/кг (например, примерно 1 мг/кг, примерно 3 мг/кг, примерно 10 мг/кг, примерно 30 мг/кг, примерно 40 мг/кг, примерно 50 мг/кг и т.д.); или любым другим путем (например, внутримышечно). В некоторых вариантах осуществления изобретения дозировка молекулы, связывающей IL-17 (например, секукинумаба), используемая в течение индукционной схемы, составляет примерно 150 мг или примерно 300 мг, которые вводят подкожно.
Индукционную схему для доставки антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), также можно разработать с использованием фармакокинетической информации (см. таблицу 10), а не конкретных дозировок. Для раскрытых схем и способов, специалист в данной области может осуществить доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), в течение индукционной схемы, чтобы обеспечить средний минимальный уровень примерно 29,2 мкг/мл (с 30-40% вариабельностью между пациентами). В альтернативном варианте специалист в данной области может осуществить доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17) в течение индукционной схемы, чтобы обеспечить Cmax для типичного пациента весом 90 кг от примерно 52 мкг/мл - примерно 104 мкг/мл. В некоторых вариантах осуществления изобретения молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), имеет Tmax примерно 7-8 дней и период полувыведения, составляющий примерно 30 дней.
Фраза «поддерживающая схема» относится к схеме лечения (или части схемы лечения), которую используют для поддержания пациента в ходе лечения заболевания, например, для поддержания пациента в ремиссии на протяжении более продолжительных периодов времени (месяцев или лет). Эти временные рамки называются «поддерживающим периодом». В поддерживающей схеме может использоваться непрерывная терапия (например, введение лекарственного соединения через регулярные интервалы времени, например, еженедельно, ежемесячно, ежегодно и т.д.) или интермиттирующая терапия (например, прерывистое лечение, интермиттирующее лечение, лечение при рецидиве или лечение при достижении конкретных заданных критериев (например, боли, появлении симптомов, индекса PASI и т.д.). Доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), в течение поддерживающей схемы можно осуществить подкожно, например, в дозировках, составляющих примерно 75 мг - примерно 300 мг; внутривенно, например, в дозировках, составляющих примерно 1 мг/кг - примерно 50 мг/кг (например, примерно 1 мг/кг, примерно 3 мг/кг, примерно 10 мг/кг, примерно 30 мг/кг, примерно 40 мг/кг, примерно 50 мг/кг и т.д.), или любым другим путем (например, внутримышечно). В некоторых вариантах раскрытой цели изобретения дозировка молекулы, связывающей IL-17 (например, секукинумаба), используемая в течение поддерживающей схемы составляет примерно 150 мг или примерно 300 мг (например, вводимые подкожно). Дозу можно вводить одной или несколькими инъекциями, например, дозу 150 мг можно ввести двумя инъекциями по 75 мг, а дозу 300 мг можно ввести двумя инъекциями по 150 мг.
Поддерживающую схему для доставки антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), также можно разработать с использованием фармакокинетической информации (см. таблицу 10), а не конкретных дозировок. Для раскрытых схем и способов, специалист в данной области может осуществить доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), в течение поддерживающей схемы, чтобы обеспечить средний устойчивый минимальный уровень примерно 15 мкг/мл (с 30-40% вариабельностью между пациентами). В альтернативном варианте, специалист в данной области может осуществить доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), в течение поддерживающей схемы, чтобы обеспечить средний устойчивый минимальный уровень для типичного пациента весом 90 кг примерно 5 мкг/мл - примерно 70 мкг/мл, например, примерно 5 мкг/мл - примерно 33 мкг/мл или примерно 11 мкг/мл - примерно 70 мкг/мл, предпочтительно, примерно 16 мкг/мл или примерно 33 мкг/мл. В некоторых вариантах осуществления изобретения молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), имеет Tmax примерно 7-8 дней. В некоторых вариантах осуществления изобретения молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), имеет период полувыведения, составляющий примерно 30 дней.
В одном варианте осуществления изобретения в поддерживающей схеме используют введение по меньшей мере одной (например, одной или двух доз) лекарственного средства, например, однократной дозы секукинумаба, при появлении заданных критериев ответа (например, индекса PASI или клинических симптомов, указывающих на SoR). Такая терапия известна как интермиттирующая (прерывистая) терапия (например, по сравнению с непрерывной терапией); формой интермиттирующей терапии является лечение в SoR. После введения секукинумаба в момент SoR пациента можно наблюдать (или пациент может осуществлять самонаблюдение) на предмет достижения заданных критериев ответа (например, PASI75). Если пациент не достигает заданных критериев ответа при лечении в SoR, то пациента можно продолжить лечить антагонистом IL-17, например, молекулой, связывающей IL-17 (например, антителом к IL-17, таким как секукинумаб), или молекулой, связывающей рецептор IL-17 (например, антителом к рецептору IL-17), до достижения заданных критериев ответа. Если пациент достигает заданных критериев ответа после лечения в SoR, то лечение будет прекращено до следующего SoR. Если пациент будет иметь индекс, указывающий на следующее SoR, то пациенту можно ввести (или пациент может ввести сам) по меньшей мере одну (например, одну или две) дозы секукинумаба, например, другую однократную дозу секукинумаба. Этот процесс повторяется в течение терапии в SoR. Очевидно, что лечение в SoR обеспечивает уникальный подход в лечении псориаза, поскольку оно поддерживает наиболее минимальный уровень воздействия препарата, возможный для достижения клинически значимого ответа, одновременно позволяя пациенту находиться полностью на индивидуальной терапии.
Соответственно, в некоторых вариантах осуществления изобретения в поддерживающей схеме можно использовать введение антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), до достижения конечной точки, например, достижения PASI75. В дополнительных вариантах осуществления изобретения поддерживающая схема включает лечение пациента с использованием дозировки, составляющей примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале рецидива и после этого лечение пациента ежемесячно с использованием дозировки, составляющей примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, до достижения PASI75.
В некоторых вариантах осуществления изобретения после наступления у пациента SoR (например, потери 20% от максимального ответа, достигнутого в любое время до визита к лечащему врачу, на котором устанавливают начало рецидива, и потери PASI 75) пациенту будут вводить по меньшей мере одну дозу (например, одну, две, три, четыре или большее количество) молекулы, связывающей IL-17 (например, секукинумаба), например, ежемесячно (каждые 4 недели), причем лечение будет продолжаться до достижения заданных критериев ответа (например, PASI75). В другом варианте осуществления изобретения после наступления у пациента SoR (например, потери 20% от максимального ответа, достигнутого в любое время до визита к лечащему врачу, на котором устанавливают начало рецидива, и потери PASI 75) пациенту вводят по меньшей мере одну дозу (например, одну, две, три, четыре или большее количество), составляющую примерно 75 мг - примерно 300 мг (например, примерно 75 мг, примерно 150 мг, примерно 300 мг, предпочтительно, примерно 150 мг или примерно 300 мг) молекулы, связывающей IL-17 (например, антитела к IL-17, например, секукинумаба), ежемесячно до достижения PASI75. В некоторых вариантах осуществления изобретения молекулу, связывающую IL-17, вводят пациенту сразу после диагностирования SoR (например, через 1, 2, 3, 4, 5, 6, 7, 10, 14, 21 день), и после этого вводят ежемесячно до достижения PASI75. В других вариантах осуществления изобретения пациенту, у которого диагностируют симптомы SoR, будут вводить молекулу, связывающую IL-17, во время следующего назначенного визита к лечащему врачу, и после этого пациенту будут вводить молекулу, связывающую IL-17, ежемесячно до достижения PASI75.
В контексте настоящего описания «идентификация у пациента начала рецидива», «идентифицировать у пациента начало рецидива» и т.п. означает, что лечащий врач определяет у пациента SoR, вследствие проявления заданного параметра, например, заданного индекса PASI. В некоторых вариантах осуществления изобретения, раскрытые способы, схемы и варианты применения обеспечивают идентификацию SoR у пациента.
Время введения обычно отсчитывают от дня введения первой дозы секукинумаба (который также известен как «базовая линия»). Однако разные медицинские организации часто используют разные способы наименования для обозначения схем введения, показанные в таблице 4.

Следует отметить, что нулевая неделя может называться первой неделей некоторыми медицинскими организациями, а также нулевой день может называться первым днем некоторыми медицинскими организациями. Поэтому возможно, что различные терапевты будут указывать, например, дозу, введенную в течение 3-й недели на 21-й день, в течение 3-й недели на 22-й день, в течение 4 недели на 21 день, в течение 4 недели на 22-й день, описывая одну и ту же схему введения. Для однообразия, первую неделю введения будут называть в настоящем документе 0-й неделей, в то время как первый день введения дозы будут называть днем 1 (1-м днем). Однако специалисту в данной области будет понятно, что данный способ наименования используют просто для единообразия, и его не следует истолковывать, как ограничивающий, а именно, еженедельное введение представляет собой еженедельную дозу молекулы, связывающей IL-17, вне зависимости от того, указывает ли терапевт конкретную неделю как «1-ю неделю» или «2-ю неделю». В качестве примера наименования с использованием способа, указанного в настоящем документе, пять нагрузочных доз секукинумаба, вводимых еженедельно в течение индукционной схем, можно вводить в течение 0-й недели (например, примерно в 1-й день), в течение 1-й недели (например, примерно на 8-й день), в течение 2-й недели (например, примерно на 15-й день), в течение 3-й недели (например, примерно на 22-й день) и в течение 4-й недели (например, примерно на 29-й день). Эту часть индукционной схемы также называют «еженедельно в течение пяти недель». Нагрузочные дозы можно вводить каждые две недели (то есть через неделю), например, в течение 0-й недели, в течение 2-й недели, в течение 4-й недели и т.д. Нагрузочные дозы можно вводить каждую третью неделю, например, в течение 0-й недели, в течение 3-й недели, в течение 6-й недели и т.д. Нагрузочные дозы можно вводить ежедневно в течение одной недели, например в 1-7-й день.
В течение индукционной схемы можно ввести дополнительную дозу секукинумаба примерно на 57-й день (в течение 8-й недели). Эту часть индукционной схемы называют «ежемесячной», и эту временную точку называют «в течение 8-й недели». Нагрузочные дозы также можно вводить каждую неделю (например, в течение 0-й, 1-й, 2-й, 3-й, 4-й и т.д. недели) или через неделю (например, в течение 0-й, 2-й, 4-й, 6-й, 8-й, 10-й и т.д. недели). В альтернативном варианте нагрузочную дозу можно вводить однократной инфузией высокой дозы (например, примерно 10 мг/кг, примерно 30 мг/кг) в течение первого месяца, и затем можно вводить соединение с помощью подкожных инъекций (например, в течение 4-й недели и в течение 8-й недели и т.д.). В альтернативном варианте нагрузочную дозу можно вводить больше чем одной инфузией высокой дозы (например, 3 дозы по примерно 10 мг/кг) в течение первого месяца, и затем ежемесячно вводить соединение с помощью подкожных инъекций. Понятно, что дозу не обязательно вводить, точно соблюдая время, например, дозу для 57-го дня можно ввести, например, с 52-го по 62-день (±5 дней). В предпочтительных вариантах осуществления изобретения в индукционной схеме используют введение соединения еженедельно в течение пяти недель (0-я, 1-я, 2-я, 3-я и 4-я недели) с последующим ежемесячным введением в течение 8-й недели.
В поддерживающей схеме дозу можно вводить каждый месяц (также называется «ежемесячное» введение) (т.е. каждые 4 недели, т.е. примерно каждые 28 дней), каждые два месяца (т.е. каждые 8 недель, т.е. примерно каждые 56 дней) или каждые три месяца (т.е. каждые 12 недель, т.е. примерно каждые 84 дня). В контексте настоящего изобретения первую дозу поддерживающей схемы, в которой используют непрерывную терапию, будут вводить в день, отсчитываемый от дня введения последней дозы в индукционной схеме. Поэтому, в качестве примера, если последнюю дозу индукционной схемы вводят в течение 8-й недели, то первую дозу ежемесячной поддерживающей схемы будут вводить в течение 12-й недели, первую дозу поддерживающей схемы с введением каждые два месяца будут вводить в течение 16-й недели, первую дозу поддерживающей схемы с введением каждые три месяца будут вводить в течение 20-й недели и т.д. В предпочтительных вариантах осуществления изобретения в поддерживающей схеме используют ежемесячное введение, начиная с 12-й недели.
В контексте настоящего документа фразу «средство введения» используют для указания любого доступного устройства для системного введения биопрепарата, включая, без ограничения, заполненный в заводских условиях шприц, ампулу и шприц, шприц-ручку, устройство для автоматического введения с помощью инъекций, капельницу и мешок, пластырь, гель, нанос для введения и т.д. Используя такие устройства пациент может сам вводить себе лекарственный препарат (т.е. вводить препарат самостоятельно), или терапевт можно вводить лекарственное средство.
В некоторых вариантах осуществления изобретения антагонист IL-17, например, молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17), можно вводить в дозировке примерно 150 мг в 0-й, 1-й, 2-й, 3-й, 4-й и 8-й неделе, с последующим введением по примерно 150 мг каждый месяц (т.е. каждые 4 недели), соответственно, в качестве непрерывной поддерживающей терапии. В некоторых вариантах осуществления изобретения антагонист IL-17, например, молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17), можно вводить в дозировке примерно 300 мг в 0-й, 1-й, 2-й, 3-й, 4-й и 8-й неделе, с последующим введением примерно 300 мг каждый месяц (т.е. каждые 4 недели), соответственно, в качестве непрерывной поддерживающей терапии. В дополнительных вариантах осуществления после достижения удовлетворительного ответа антагонист IL-17, например, молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17), можно отменить, и последующий рецидив купировать повторным курсом антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), в ранее эффективной дозировке, при обнаружении SoR или другого типа потери ответа.
В некоторых вариантах осуществления изобретения в течение терапии антагонистом IL-17, например, молекулой, связывающей IL-17 (например, антителом к IL-17, таким как секукинумаб), или молекулой, связывающей рецептор IL-17 (например, антителом к рецептору IL-17), может использоваться ударная доза. «Ударная доза» в контексте настоящего изобретения относится к дозировке (или нескольким дозировкам) антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), которая превышает стандартные дозы, вводимые в течение лечения псориаза молекулами, связывающими IL-17. Например, доза антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), может быть повышена для пациентов, которые не отвечают на лечение или которые частично отвечают на лечение в течение индукционного периода. Поэтому пациент, которого лечили 150 мг молекулы, связывающей IL-17, в течение 0-й, 1-й, 2-й, 3-й и 8-й недели, может получить примерно 300 мг молекулы, связывающей IL-17, в течение 12-й недели, и если затем пациент станет отвечать на лечение, то после этого пациент будет получать лечение дозами по 150 мг. В альтернативном варианте лечащий врач может ввести ударную дозу в течение 16-й недели (а не в течение 12-й недели). В некоторых вариантах осуществления изобретения лечащий врач может использовать одну или несколько ударных доз (например, однократную ударную дозу на 12-й неделе, и затем стандартные дозы, ударную дозу на 12-й и 16-й неделе, и затем стандартные дозы, и т.д.). В некоторых вариантах осуществления изобретения, если исходная доза составляла 150 мг, то ударная доза будет составлять, например, примерно 300 мг или по меньшей мере примерно 10 мг/кг (например, примерно 10 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 15 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 20 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 30 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.] и т.д.). В некоторых вариантах осуществления изобретения, если исходная доза составляла 300 мг, то ударная доза будет составлять, например, по меньшей мере примерно 10 мг/кг (например, примерно 10 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 15 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 20 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.]; примерно 30 мг/кг, вводимые 1, 2, 3, 4 или 5 раз [например, дважды в неделю, каждую неделю, каждые две недели, каждые три недели и т.д.] и т.д.). В некоторых вариантах осуществления изобретения пациенту с частичным ответом или не отвечающему на лечение вводят ударные дозы в течение 4-8 недель после индукционного периода.
В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента ударной дозой молекулы, связывающей IL-17, которая превышает дозу молекулы, связывающей IL-17, используемую в течение индукционной схемы, если пациент отвечает частично или не отвечает на индукционную схему.
В предпочтительном варианте осуществления изобретения способы и варианты применения молекулы, связывающей IL-17, обеспечивают лечение среднетяжелого хронического бляшковидного псориаза у взрослых пациентов, которые являются кандидатами для системной терапии (или фототерапии). Также ожидается, что способы и варианты применения по настоящему изобретению будут обеспечивать снижение (т.е. уменьшение) различных признаков и симптомов псориаза, включая, связанный с псориазом зуд, шелушение, отслаивание, трещины, боль, образование корки и покраснение.
Молекулы, связывающие IL-17
В различных раскрытых фармацевтических композициях, схемах, вариантах применения, способах и наборах используется антагонист IL-17, например, молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), или молекула, связывающая рецептор IL-17 (например, антитело к рецептору IL-17), такая как секукинумаб.
В одном варианте осуществления изобретения молекула, связывающая IL-17, содержит по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), включающий последовательно гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1 (N-Y-W-M-N), причем указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2 (A-I-N-Q-D-G-S-E-K-Y-Y-V-G-S-V-K-G), и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3 (D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L).
В одном варианте осуществления изобретения молекула, связывающая IL-17, содержит по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), который последовательно включает гипервариабельные участки CDR1-x, CDR2-x и CDR3-x, причем указанный CDR1-x имеет аминокислотную последовательность SEQ ID NO:11 (G-F-T-F-S-N-Y-W-M-N), указанный CDR2-x имеет аминокислотную последовательность SEQ ID NO:12 (A-I-N-Q-D-G-S-E-K-Y-Y), и указанный CDR3-x имеет аминокислотную последовательность SEQ ID NO:13 (C-V-R-D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L-W-G).
В одном варианте осуществления настоящего изобретения молекула, связывающая IL-17, содержит по меньшей мере один вариабельный домен легкой цепи иммуноглобулина (VL), который последовательно включает гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:4 (R-A-S-Q-S-V-S-S-S-Y-L-A), указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:5 (G-A-S-S-R-A-T), и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:6 (Q-Q-Y-G-S-S-P-C-T).
В одном варианте осуществления изобретения молекула, связывающая IL-17, содержит по меньшей мере один VH-домен иммуноглобулина и по меньшей мере один VL-домен иммуноглобулина, причем: (а) VH-домен иммуноглобулина содержит: i) гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2, и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3; или ii) гипервариабельные участки CDR1-x, CDR2-x и CDR3-x, причем CDR1-x имеет аминокислотную последовательность SEQ ID NO:11, CDR2-x имеет аминокислотную последовательность SEQ ID NO:12 и CDR3-x имеет аминокислотную последовательность SEQ ID NO:13; и (b) VL-домен иммуноглобулина содержит гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанный CDR2' имеет аминокислотную последовательность SEQ ID NO:5, и указанный CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления изобретения молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), содержит по меньшей мере один VH-домен иммуноглобулина и по меньшей мере один VL-домен иммуноглобулина, причем: (а) по меньшей мере один VH-домен иммуноглобулина содержит последовательно гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2, и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и (b) VL-домен иммуноглобулина содержит последовательно гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанный CDR2' имеет аминокислотную последовательность SEQ ID NO:5, и указанный CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления изобретения молекула, связывающая IL-17 (например, антитело к IL-17, например, секукинумаб), содержит по меньшей мере один VH-домен иммуноглобулина и по меньшей мере один VL-домен иммуноглобулина, причем: (а) по меньшей мере один VH-домен иммуноглобулина содержит последовательно гипервариабельные участки CDR1-х, CDR2-х и CDR3-х, причем указанный CDR1-х имеет аминокислотную последовательность SEQ ID NO:11, указанный CDR2-х имеет аминокислотную последовательность SEQ ID NO:12, и указанный CDR3-х имеет аминокислотную последовательность SEQ ID NO:13; и (b) VL-домен иммуноглобулина содержит последовательно гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанный CDR2' имеет аминокислотную последовательность SEQ ID NO:5, и указанный CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления изобретения молекула, связывающая IL-17, содержит:
a) вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий аминокислотную последовательность, указанную в SEQ ID NO:8;
b) вариабельный домен легкой цепи (VL) иммуноглобулина содержащий аминокислотную последовательность, указанную в SEQ ID NO:10;
c) VH-домен иммуноглобулина, содержащий аминокислотную последовательность, указанную в SEQ ID NO:8, и VL-домен иммуноглобулина, содержащий аминокислотную последовательность, указанную в SEQ ID NO:10;
d) VH-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3;
e) VL-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6;
f) VH-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13;
g) VH-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, и VL-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; или
h) VH-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13, и VL-домен иммуноглобулина, содержащий гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
Аминокислотные последовательности гипервариабельных областей секукинумаба на основе классификации по Kabat, и определенные рентгеноструктурным анализом и с использованием подхода по Chothia и др., приведены в таблице 5.
|
В предпочтительных вариантах осуществления изобретения вариабельные домены и тяжелой, и легкой цепей получены из антител человека, например из антитела секукинумаб, которое показано в SEQ ID NO:10 (=вариабельному домену легкой цепи, т.е. аминокислотам 1-109 последовательности SEQ ID NO:10) и SEQ ID NO:8 (=вариабельному домену тяжелой цепи, т.е. аминокислотам 1-127 последовательности SEQ ID NO:8). Домены константной области также предпочтительно содержат соответствующие домены константных областей антител человека, например, описанных в "Sequences of Proteins of Immunological Interest", Kabat E.A. et al., Министерство здравоохранения и социальных служб США, Служба здравоохранения, Национальный институт здоровья.
В некоторых вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит вариабельный домен легкой цепи SEQ ID NO:10. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит вариабельный домен тяжелой цепи SEQ ID NO:8. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит вариабельный домен легкой цепи SEQ ID NO:10 и вариабельный домен тяжелой цепи SEQ ID NO:8. В некоторых вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:10. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:8. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:10 и три CDR из SEQ ID NO:8. CDR из SEQ ID NO:8 и SEQ ID NO:10 согласно классификации как по Chothia, так и по Kabat, можно найти в таблице 5.
В некоторых вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит домен легкой цепи SEQ ID NO:15. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит домен тяжелой цепи SEQ ID NO:17. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит домен легкой цепи SEQ ID NO:15 и домен тяжелой цепи SEQ ID NO:17. В некоторых вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:15. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:17. В других вариантах осуществления изобретения молекула, связывающая IL-17, по изобретению содержит три CDR из SEQ ID NO:15 и три CDR из SEQ ID NO:17. CDR из SEQ ID NO:15 и SEQ ID NO:17 согласно классификации как по Chothia, так и по Kabat, можно найти в таблице 5.
Гипервариабельные участки могут быть связаны с каркасными участками любого типа, хотя предпочтительно, чтобы они принадлежали человеку. Подходящие каркасные участки описаны в Kabat E.A. et al, ibid. Предпочтительным каркасным участком тяжелой цепи является каркасный участок тяжелой цепи иммуноглобулина человека, например антитела секукинумаба. Он состоит из последовательно расположенных участков FR1 (аминокислоты 1-30 в SEQ ID NO:8), FR2 (аминокислоты 36-49 в SEQ ID NO:8), FR3 (аминокислоты 67-98 в SEQ ID NO:8) и FR4 (аминокислоты 117-127 SEQ ID NO:8). С учетом определенных с помощью рентгеноструктурного анализа гипервариабельных участков секукинумаба, другой предпочтительный каркасный участок состоит из последовательно расположенных участков FR1-x (аминокислоты 1-25 в SEQ ID NO:8), FR2-x (аминокислоты 36-49 в SEQ ID NO:8), FR3-x (аминокислоты 61-95 в SEQ ID NO:8) и FR4-x (аминокислоты 119-127 в SEQ ID NO:8). Аналогичным образом каркасный участок легкой цепи состоит из последовательно расположенных участков FR1' (аминокислоты 1-23 в SEQ ID NO:10), FR2' (аминокислоты 36-50 в SEQ ID NO:10), FR3' (аминокислоты 58-89 в SEQ ID NO:10) и FR4' (аминокислоты 99-109 в SEQ ID NO:10).
В одном варианте осуществления изобретения молекула, связывающая IL-17, выбрана из анти-IL-17 антитела человека, которое содержит по меньшей мере: (а) тяжелую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, и константную часть или ее фрагмент тяжелой цепи иммуноглобулина человека; причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2, и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и (b) легкую цепь иммуноглобулина или ее фрагмент, которые содержат вариабельный домен, содержащий последовательно расположенные гипервариабельные участки и необязательно также гипервариабельные участки CDR1', CDR2' и CDR3', и константную часть или ее фрагмент легкой цепи иммуноглобулина человека, причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанный CDR2' имеет аминокислотную последовательность SEQ ID NO:5, и указанный CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления изобретения молекула, связывающая IL-17, выбрана из одноцепочечной связывающей молекулы, которая содержит антиген-связывающий участок, содержащий: (а) первый домен, содержащий последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2, и указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и (b) второй домен, содержащий последовательно расположенные гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанный CDR2' имеет аминокислотную последовательность SEQ ID NO:5, и указанный CDR3' имеет аминокислотную последовательность SEQ ID NO:6; и (с) пептидный линкер, связанный либо с N-концом первого домена и с С-концом второго домена, либо с С-концом первого домена и с N-концом второго домена.
В альтернативном варианте молекула, связывающая IL-17, может содержать по меньшей мере один антиген-связывающий участок, содержащий по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные: a) гипервариабельные участки CDR1 (SEQ ID NO:1), CDR2 (SEQ ID NO:2) и CDR3 (SEQ ID NO:3); или b) гипервариабельные участки CDR1i, CDR2i, CDR3i, причем указанный гипервариабельный участок CDR1i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR1, приведенного в SEQ ID NO:1; указанный гипервариабельный участок CDR2i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR2, приведенного в SEQ ID NO:2; и указанный гипервариабельный участок CDR3i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR3, приведенного в SEQ ID NO:3; и указанная молекула, связывающая IL-17, способна ингибировать активность примерно 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50%, причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека.
Аналогичным образом, молекула, связывающая IL-17, может содержать по меньшей мере один антиген-связывающий участок, содержащий по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные: a) гипервариабельные участки CDR1-х (SEQ ID NO:11), CDR2-х (SEQ ID NO:12) и CDR3-х (SEQ ID NO:13); или b) гипервариабельные участки CDR1i-х, CDR2i-х, CDR3i-х, причем указанный гипервариабельный участок CDR1i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR1-х, приведенного в SEQ ID NO:11; указанный гипервариабельный участок CDR2i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR2-х, приведенного в SEQ ID NO:12; и указанный гипервариабельный участок CDR3i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR3-х, приведенного в SEQ ID NO:13; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50%, причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека.
Аналогичным образом, молекула, связывающая IL-17, может содержать по меньшей мере один антиген-связывающий участок, содержащий по меньшей мере один вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные: a) гипервариабельные участки CDR'1 (SEQ ID NO:4), CDR'2 (SEQ ID NO:5) и CDR'3 (SEQ ID NO:6); или b) гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, причем указанный гипервариабельный участок CDR'1i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'1, приведенного в SEQ ID NO:4; указанный гипервариабельный участок CDR'2i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'2, приведенного в SEQ ID NO:5; и указанный гипервариабельный участок CDR'3i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'3, приведенного в SEQ ID NO:6; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50%, причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека.
В альтернативном варианте молекула, связывающая IL-17, может содержать вариабельные домены как тяжелой (VH), так и легкой (VL) цепей, и указанная молекула, связывающая IL-17, имеет по меньшей мере один антиген-связывающий участок, содержащий: (а) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные участки CDR1 (SEQ ID NO:1), CDR2 (SEQ ID NO:2) и CDR3 (SEQ ID NO:3); и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные участки CDR1' (SEQ ID NO:4), CDR2' (SEQ ID NO:5) и CDR3' (SEQ ID NO:6); или b) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные участки CDR1i, CDR2i и CDR3i, причем указанный гипервариабельный участок CDR1i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR1, приведенного в SEQ ID NO:1; указанный гипервариабельный участок CDR2i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR2, приведенного в SEQ ID NO:2; и указанный гипервариабельный участок CDR3i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR3, приведенного в SEQ ID NO:3; и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, причем указанный гипервариабельный участок CDR'1i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'1, приведенного в SEQ ID NO:4; указанный гипервариабельный участок CDR'2i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'2, приведенного в SEQ ID NO:5; и указанный гипервариабельный участок CDR'3i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'3, приведенного в SEQ ID NO:6; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50%, причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека.
В альтернативном варианте молекула, связывающая IL-17, может содержать вариабельные домены как тяжелой (VH), так и легкой (VL) цепей, и указанная молекула, связывающая IL-17, имеет по меньшей мере один антиген-связывающий участок, содержащий: (а) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные участки CDR1-х (SEQ ID NO:11), CDR2-х (SEQ ID NO:12) и CDR3-х (SEQ ID NO:13); и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные участки CDR1' (SEQ ID NO:4), CDR2' (SEQ ID NO:5) и CDR3' (SEQ ID NO:6); или b) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные участки CDR1i-х, CDR2i-х и CDR3i-х, причем указанный гипервариабельный участок CDR1i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR1-х, приведенного в SEQ ID NO:11; указанный гипервариабельный участок CDR2i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR2-х, приведенного в SEQ ID NO:12; и указанный гипервариабельный участок CDR3i-х отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR3-х, приведенного в SEQ ID NO:13; и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные участки CDR1'i, CDR2'i, CDR3'i, причем указанный гипервариабельный участок CDR'1i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'1, приведенного в SEQ ID NO:4; указанный гипервариабельный участок CDR'2i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'2, приведенного в SEQ ID NO:5; и указанный гипервариабельный участок CDR'3i отличается 3, предпочтительно 2 аминокислотами, более предпочтительно 1 аминокислотой, от гипервариабельного участка CDR'3, приведенного в SEQ ID NO:6; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50%, причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека.
Человеческое антитело к IL-17, раскрытое в настоящем документе, может содержать тяжелую цепь, которая по существу идентична приведенной в SEQ ID NO:17, и легкую цепь, которая по существу идентична приведенной в SEQ ID NO:15. Человеческое антитело к IL-17, раскрытое в настоящем документе, может содержать тяжелую цепь, которая содержит SEQ ID NO:17, и легкую цепь, которая содержит SEQ ID NO:15.
Человеческое антитело к IL-17, раскрытое в настоящем документе, может содержать: (а) одну тяжелую цепь, которая содержит вариабельный домен, имеющий аминокислотную последовательность, по существу идентичную приведенной в SEQ ID NO:8, и константную часть тяжелой цепи иммуноглобулина человека; и b) одну легкую цепь, которая содержит вариабельный домен, имеющий аминокислотную последовательность, по существу идентичную приведенной в SEQ ID NO:10, и константную часть легкой цепи иммуноглобулина человека.
Ингибирование связывания IL-17 с его рецептором можно без труда протестировать различными методами, включая методы анализа, описанные в WO 2006/013107. Под термином «в такой же степени» понимается то, что референсная и эквивалентные молекулы проявляют (статистически) по существу идентичную IL-17-ингибирующую активность в одном из методов анализа, указанных в настоящем документе (см. пример 1 в WO 2006/013107). Например, молекулы, связывающие IL-17, по изобретению, как правило, имеют IC50 для ингибирования IL-17 человека в отношении индуцируемой IL-17 человека продукции IL-6 в фибробластах кожи человека, которая не превышает примерно 10 нМ, более предпочтительно, примерно 9, 8, 7, 6, 5, 4, 3, 2 или примерно 1 нМ, предпочтительно, по существу такая же как IC50 соответствующей референсной молекулы, при анализе, описанном в примере 1 из WO 2006/013107. В альтернативном варианте, используемым методом может является анализ конкурентного связывания IL-17 растворимыми рецепторами IL-17 (например, конструкцией IL-17 R/Fc человека в примере 1 из WO 2006/013107) и молекулами, связывающими IL-17, по изобретению.
Изобретение также включает молекулы, связывающие IL-17, в которых изменены один или несколько из аминокислотных остатков из CDR1, CDR2, CDR3, CDR1-x, CDR2-х, CDR3-х, CDR1', CDR2' или CDR3' или каркасных участков, как правило, несколько (например, 1-4); например, в результате мутации, например, сайт-направленного мутагенеза соответствующих последовательностей ДНК. Изобретение включает последовательности ДНК, кодирующие такие измененные молекулы, связывающие IL-17. Более конкретно, изобретение включает молекулы, связывающие IL-17, в которых один или несколько остатков в CDR1' или CDR2' изменены относительно остатков, приведенных в SEQ ID NO:4 (для CDR1') и SEQ ID NO:5 (для CDR2').
Изобретение также включает молекулы, связывающие IL-17, которые имеют специфичность связывания в отношении IL-17 человека, в частности, антитела к IL-17, способные ингибировать связывание IL-17 с его рецептором, и антитела к IL-17, способные ингибировать 1 нмоль (=30 нг/мл) IL-17 человека в концентрации примерно 50 нМ или меньше, примерно 20 нМ или меньше, примерно 10 нМ или меньше, примерно 5 нМ или меньше, примерно 2 нМ или меньше, или более предпочтительно примерно 1 нМ или меньше указанной молекулы, на 50% (причем указанную ингибирующую активность измеряют по продукции IL-6, индуцируемой hu-IL-17 в фибробластах кожи человека).
В некоторых вариантах осуществления изобретения молекулы, связывающие IL-17, например антитело к IL-17, например, секукинумаб, связывает эпитоп зрелого IL-17 человека, содержащий Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129. В некоторых вариантах осуществления изобретения антитело к IL-17, например, секукинумаб, связывает эпитоп зрелого IL-17 человека, содержащий Tyr43, Tyr44, Arg46, Ala79, Asp80. В некоторых вариантах осуществления изобретения антитело к IL-17, например, секукинумаб, связывает эпитоп гомодимера IL-17, имеющего две цепи зрелого IL-17 человека, причем указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи. Схема нумерации остатков, используемая для указания этих эпитопов, основана на остатке 1, который представляет собой первую аминокислоту зрелого белка (т.е. IL-17A, у которого отсутствует 23-аминокислотный N-концевой сигнальный пептид и который начинается с глицина). Последовательность незрелого IL-17A приведена под номером Q16552 в базе данных Swiss-Prot. В некоторых вариантах осуществления изобретения антитело к IL-17 имеет KD примерно 100-200 пМ. В некоторых вариантах осуществления изобретения антитело к IL-17 имеет IC50 примерно 0,4 нМ для in vitro нейтрализации биологической активности примерно 0,67 М IL-17A человека. В некоторых вариантах осуществления изобретения антитело к IL-17 имеет время полужизни in vivo примерно 4 недели (например, от примерно 23 до примерно 30 дней). В некоторых вариантах осуществления изобретения абсолютная биодоступность подкожно введенного антитела IL-17 имеет диапазон примерно 60-80%, например, примерно 76%.
Особенно предпочтительными молекулами, связывающими IL-17, по изобретению являются антитела человека, в частности, секукинумаб, описанный в примерах 1 и 2 в WO 2006/013107. Секукинумаб (AIN457) является рекомбинантным высокоаффинным полностью человеческим моноклональным антителом к интерлейкину 17А человека (IL-17A, IL-17), имеющим IgG1/каппа-изотип, которое в настоящее время проходит клинические испытания в области лечения иммуно-опосредованных воспалительных состояний.
Схемы лечения, методы лечения, фармацевтические композиции и варианты применения
Раскрытые антагонисты IL-17, например, молекулы, связывающие IL-17, например, антитело к IL-17, такое как секукинумаб, пригодны для лечения, предупреждения или ослабления протекания псориаза.
Антагонисты IL-17, например, молекулы, связывающие IL-17, например, антитело к IL-17, такое как секукинумаб, можно использовать in vitro, ex vivo или включенным в фармацевтические композиции и вводимым индивидуумам (например, людям) in vivo для лечения, ослабления или предупреждения псориаза. Фармацевтическую композицию будут составлять так, чтобы она была совместима с предполагаемым путем введения (например, пероральные композиции обычно включают инертный разбавитель или съедобный носитель). Другие неограничивающие пути введения включают парентеральное (например, внутривенное), интрадермальное, подкожное, пероральное (например, ингаляционное), трансдермальное (местное), трансмукозальное и ректальное введение. Фармацевтические композиции, совместимые с каждым предполагаемым путем, хорошо известны в данной области.
Антагонисты IL-17, например, молекулы, связывающие IL-17, например, антитело к IL-17, такое как секукинумаб, можно использовать в качестве фармацевтической композиции, будучи объединенными с фармацевтически приемлемым носителем. В дополнение к молекуле, связывающей IL-17, такая композиция может содержать носители, различные разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие вещества, хорошо известные в данной области. Характеристики носителя будут зависеть от пути введения.
Фармацевтические композиций для применения в раскрытых способах могут также содержать дополнительные терапевтические агенты для лечения конкретного целевого расстройства. Например, фармацевтическая композиция может также включать противовоспалительные агенты. Такие дополнительные факторы и/или агенты могут быть включены в фармацевтическую композицию для получения синергетического эффекта с молекулами, связывающими IL-17, или для минимизации побочных эффектов, вызываемых молекулами, связывающими IL-17.
Фармацевтические композиции по изобретению могут также находиться в форме липосом, в которых молекула, связывающая IL-17, в дополнение к другим фармацевтически приемлемым носителям, объединена с амфипатическими агентами, такими как липиды, которые существуют в агрегированной форме в виде мицелл, нерастворимых монослоев, жидких кристаллов или ламеллярных слоев в водном растворе. Подходящие липиды для образования липосом включают, без ограничения, моноглицериды, диглицериды, сульфатиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и т.д.
В применении на практике способа лечения или применения по настоящему изобретению терапевтически эффективное количество молекулы, связывающей IL-17, вводят субъекту, например, млекопитающему (например, человеку). Молекулу, связывающую IL-17, можно вводить согласно способу по изобретению либо отдельно, либо в комбинации с другими терапевтическими препаратами, например, в комбинации с дополнительными противовоспалительными средствами. При совместном введении с одним или несколькими агентами, молекулу, связывающую IL-17, можно вводить либо одновременно с другим агентом, либо последовательно. При последовательном введении лечащий терапевт будет определять соответствующую последовательность введения молекулы, связывающей IL-17, в комбинации с другими агентами.
При пероральном введении терапевтически эффективного количества молекулы, связывающей IL-17, связующий агент будет представлять собой таблетку, капсулу, порошок, раствор или эликсир. При введении в форме таблетки, фармацевтическая композиция по изобретению может дополнительно содержать твердый носитель, такой как желатин или адъювант. При введении в жидкой форме может быть добавлен жидкий носитель, такой как вода, вазелин, масло животного или растительного происхождения, такое как арахисовое масло (следует соблюдать осторожность при аллергии на арахис), минеральное масло, соевое масло или кунжутное масло, или синтетические масла. Жидкая форма фармацевтической композиции может дополнительно содержать физиологический солевой раствор, раствор декстрозы или другого сахара, или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль.
При введении терапевтически эффективного количества молекулы, связывающей IL-17, с помощью внутривенной, внутрикожной или подкожной инъекции, молекула, связывающая IL-17, будет находиться в апирогенном растворе, пригодном для парентерального введения. Фармацевтическая композиция для внутривенной, внутрикожной или подкожной инъекции может содержать дополнительно к молекуле, связывающей IL-17, изотонический носитель, такой как раствор натрия хлорида для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор натрия хлорида и декстрозы для инъекций, Рингер-лактат раствор для инъекций или другой носитель, известный в данной области.
Фармацевтические композиции для применения в раскрытых способах можно получать обычным образом. В одном варианте осуществления изобретения фармацевтическая композиция предпочтительно представлена в лиофилизированной форме. Непосредственно перед введением ее растворяют в подходящем водном носителе, например, в стерильной воде для инъекций или в стерильном забуференном физиологическом растворе. Если требуется больший объем раствора для введения путем инфузии, а не болюсной инъекцией, целесообразно в физиологический раствор во время приготовления состава включить человеческий сывороточный альбумин или гепаринизированную собственную кровь пациента. В альтернативном варианте композицию вводят подкожно. Присутствие избытка такого физиологически инертного белка предупреждает потерю антитела в результате адсорбции на стенках контейнера и шлангов, используемых для инфузионного раствора. При использовании альбумина, подходящая концентрация составляет от 0,5 до 4,5% по весу солевого раствора. Другие составы содержат жидкий или лиофилизированный состав.
Подходящая дозировка будет конечно варьировать в зависимости, например, от конкретной молекулы, связывающей IL-17, которую будут использовать, организма-хозяина, пути введения и природы и тяжести состояния, в отношении которого проводится лечение, и типа предшествующего лечения, которое проходил пациент. В итоге, лечащий врач будет определять количество молекулы, связывающей IL-17, которое следует использовать для лечения каждого отдельного субъекта. В некоторых вариантах осуществления изобретения лечащий врач может вводить низкие дозы молекулы, связывающей IL-17, и наблюдать ответ субъекта. В других вариантах осуществления изобретения первичная доза (первичные дозы) молекулы, связывающей IL-17, вводимые субъекту, являются высокими, и затем снижаются до появления симптомов рецидива. Более высокие дозы молекулы, связывающей IL-17, можно вводить до получения у субъекта оптимального терапевтического эффекта, и после этого дозировку, в общем, не повышают дополнительно.
Молекулу, связывающую IL-17, обычно вводят парентерально, внутривенно, например, в локтевую или другую периферическую вену, внутримышечно или подкожно. Длительность внутривенной (i.v.) терапии с использованием фармацевтической композиции по настоящему изобретению будет варьировать в зависимости от тяжести заболевания, против которого проводится лечение, и состояния и ответа каждого отдельного пациента. Также предусмотрено подкожное введение (s.c.) с использованием терапевтической композиции по настоящему изобретению. Лечащий врач будет определять длительность сроков проведения терапии, осуществляемой внутривенным или подкожным введением, с использованием фармацевтической композиции по настоящему изобретению.
В общем, удовлетворительные результаты (лечения, профилактики, задержки появления симптомов) получают при дозировках от примерно 0,05 до примерно 20 мг на кг веса тела, более типично, при дозировках от примерно 0,1 мг до примерно 20 мг на кг веса тела. Частота введения может варьировать в диапазоне примерно от одного раза в неделю, до примерно одного раза в три месяца, например, в диапазоне от примерно одного раза в 2 недели до примерно одного раза в 12 недель, например, один раз в 4-8 недель. Частота дозирования будет зависеть inter alia от фазы схемы лечения.
В некоторых вариантах осуществления изобретения молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), вводят в течение индукционной схемы и/или поддерживающей схемы. В некоторых вариантах осуществления изобретения индукционная схема включает нагрузочную схему. В дополнительных вариантах осуществления изобретения нагрузочная схема включает введение 1, 2, 3, 4, 5, 6 или большего количества еженедельных доз секукинумаба, предпочтительно, пяти еженедельных доз секукинумаба (например, вводимых, в течение 0-й, 1-й, 2-й, 3-й, 4-й недель). В некоторых вариантах осуществления изобретения нагрузочная схема включает введение ежедневных доз секукинумаба, например, ежедневных доз секукинумаба, вводимых в течение одной недели. В некоторых вариантах осуществления изобретения нагрузочная дозировка, которую можно вводить в указанных еженедельных или ежедневных количествах, может составлять от примерно 25 мг до примерно 300 мг при подкожном введении, например, от примерно 150 мг до примерно 300 мг при подкожном введении, например, примерно 150 мг или примерно 300 мг при подкожном введении. В других вариантах осуществления изобретения индукционная схема в дополнение к нагрузочной схеме, дополнительно включает ежемесячное введение секукинумаба, например, 1, 2, 3, 4, 5 или большее количество ежемесячно вводимых доз секукинумаба, предпочтительно, одну ежемесячную дозу секукинумаба, вводимую на 8-й неделе.
В некоторых вариантах осуществления изобретения поддерживающая схема включает непрерывное введение молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб) (например, примерно 75 мг - примерно 300 мг при подкожном введении, например, примерно 150 мг - примерно 300 мг при подкожном введении, например, примерно 150 мг или примерно 300 мг), дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца. В предпочтительном варианте осуществления изобретения поддерживающую дозу вводят ежемесячно. В некоторых вариантах осуществления изобретения, если дозировку в течение поддерживающей схемы вводят ежемесячно, то первую ежемесячную дозу вводят на 12-й неделе, и после этого дозу вводят ежемесячно (например, примерно каждые 4 недели или примерно каждые 28 дней). В некоторых вариантах осуществления изобретения, если дозировку в течение поддерживающей схемы вводят каждые два месяца, то первую дозу вводят на 16-й неделе, и после этого дозу вводят каждые два месяца (например, примерно каждые 8 недель или примерно каждые 56 дней). В некоторых вариантах осуществления изобретения, если дозировку в течение поддерживающей схемы вводят каждые три месяца, то первую дозу вводят на 20-й неделе, и после этого дозу вводят каждые три месяца (например, примерно каждые 12 недель или примерно каждые 84 дня).
В некоторых вариантах осуществления изобретения поддерживающая схема включает интермиттирующее введение молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб) (например, примерно 75 мг - примерно 300 мг при подкожном введении, например, примерно 150 мг - примерно 300 мг при подкожном введении, например, примерно 150 мг или примерно 300 мг), в одной или двух дозах (например, однократной дозы) после SoR. После введения этих одной или двух доз за пациентом наблюдают, чтобы определить повторное SoR, определенное в настоящем документе. При обнаружении повторного SoR (которое можно определить с использованием любой приемлемой дерматологической оценочной системы, предпочтительно системы оценки индекса PASI) пациенту можно ввести дополнительные одну или две дозы (например, однократную дозу) секукинумаба. Это лечение в SoR можно продолжать пожизненно, при условии, что симптомы псориаза у пациента эффективно излечиваются с помощью интермиттирующей терапии, применяемой в SoR (например, индекс PASI при рецидиве может улучшаться до приемлемого значения). В некоторых вариантах осуществления изобретения SoR определяют как потерю 20% от максимального ответа по PASI, достигнутого в любое время до визита к лечащему врачу, на котором устанавливают начало рецидива, и потерю PASI 75.
В некоторых вариантах осуществления изобретения поддерживающая схема, следующая за SoR, включает введение по меньшей мере одной дозы (например, одной, двух, трех, четырех или больше) секукинумаба (например, примерно 75 мг - примерно 300 мг, при подкожном введении, например, примерно 150 мг - примерно 300 мг при подкожном введении, например, примерно 150 мг или примерно 300 мг), до достижения конечной точки, например, достижения PASI75. В предпочтительном варианте осуществления изобретения после начала рецидива у пациента ему вводят по меньшей мере одну дозу (например, одну, две, три, четыре или больше) примерно 75 мг - примерно 300 мг (например, примерно 75 мг, примерно 150 мг, примерно 300 мг, предпочтительно, примерно 150 мг или примерно 300 мг) молекулы, связывающей IL-17 (например, секукинумаба) ежемесячно до достижения PASI75.
Если интермиттирующая терапия, например, лечение в SoR, больше не ослабляет симптомы псориаза у пациента (например, индекс PASI при рецидиве больше не улучшается до приемлемого индекса PASI, например PASI75), тогда пациент может перейти на непрерывную терапию. В поддерживающей схеме, в которой используется непрерывная терапия, пациенту можно вводить секукинумаб (например, примерно 150 мг - примерно 300 мг подкожно, например, примерно 150 мг или примерно 300 мг подкожно) еженедельно, два раза в месяц, ежемесячно, каждые два месяца или каждые три месяца. В альтернативном варианте поддерживающая схема может начинаться как интермиттирующая терапия (например, лечение в SoR), но ее можно переключить на непрерывную терапию. Например, если у пациента наблюдаются равные интервалы между SoR, то терапевт может принять решение о смене терапии пациента на непрерывную, но используя конкретный интервал, определенный для этого конкретного пациента (а не заранее заданный интервал). Такой подход в результате является «полуиндивидуальным», а не полностью индивидуальным, при котором каждую дозу вводят при SoR. Например, если у пациента постоянно наблюдаются показатели SoR каждые 5-6 недель, то терапевт может перевести пациента с интермиттирующей терапии (лечение в SoR) на непрерывное введение секукинумаба каждые пять или шесть недель.
В некоторых вариантах осуществления изобретения дозировка секукинумаба, используемая в раскрытых индукционной и/или поддерживающей схемах, основана на весе пациента. В одном варианте осуществления изобретения пациенту вводят примерно 150 мг подкожно, если вес пациента меньше или равен примерно 90 кг. В одном варианте осуществления изобретения пациенту вводят примерно 150 мг подкожно, если вес пациента меньше или равен примерно 100 кг. В другом варианте осуществления изобретения пациенту вводят примерно 300 мг подкожно, если вес пациента превышает примерно 90 кг. В другом варианте осуществления изобретения пациенту вводят примерно 300 мг подкожно, если вес пациента превышает примерно 100 кг. Другие типы дозирования на основе веса пациента для применения в раскрытых способах включают, например, 75 мг для веса меньше 70 кг, 150 мг для веса меньше 90 кг, 300 мг для веса равного или выше 90 кг. Кроме того, специалист в данной области мог бы также вводить молекулу, связывающую IL-17, исходя из комбинации дозирования на основе веса тела и дозирования на основе ответа на лечение, например, пациентам, не отвечающим на лечение 150 мг, вес которых, например, меньше 70 мг, увеличивают дозировку до 300 мг.
Будет понятно, что для некоторых пациентов может потребоваться увеличение дозы (например, в течение индукционной и/или поддерживающей фазы), например, для пациентов, проявляющих частичный ответ, не отвечающих на лечение с использованием молекул, связывающих IL-17 (например, секукинумаба). Поэтому, дозировка секукинумаба при подкожном введении может быть выше примерно 75 мг до примерно 300 мг, например, может составлять примерно 80 мг, примерно 100 мг, примерно 125 мг, примерно 175 мг, примерно 200 мг, примерно 250 мг, примерно 350 мг, примерно 400 мг и т.д. Также будет понятно, что для некоторых пациентов также может потребоваться снижение дозы (например, в течение индукционной и/или поддерживающей фазы), например, для пациентов, у которых наблюдаются побочные эффекты или неблагоприятная ответная реакция на лечение молекулами, связывающими IL-17 (например, секукинумабом). Поэтому, дозировки секукинумаба могут составлять меньше примерно 75 до примерно 300 мг при подкожном введении, например, примерно 25 мг, примерно 50 мг, примерно 80 мг, примерно 100 мг, примерно 125 мг, примерно 175 мг, примерно 200 мг, 250 мг и т.д.
В настоящем документе раскрыты способы лечения псориаза, включающие: (а) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, причем нагрузочная схема включает введение пациенту пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; и b) впоследствии введение молекулы, связывающей IL-17, пациенту в ходе поддерживающей схемы лечения.
В некоторых вариантах осуществления изобретения пять доз молекулы, связывающей IL-17, составляют примерно 75 мг - примерно 300 мг каждая. В некоторых вариантах осуществления изобретения из пяти доз каждая составляет примерно 150 мг или примерно 300 мг. В некоторых вариантах осуществления изобретения пять доз по примерно 150 мг вводят пациенту, если его вес меньше 90 кг, и пять доз по примерно 300 мг вводят пациенту, если его вес больше или равен 90 кг. В некоторых вариантах осуществления изобретения индукционная схема дополнительно включает введение пациенту примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в течение восьмой недели.
В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента по меньшей мере одной дозой примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале рецидива. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента по меньшей мере одной дозой примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале каждого повторного рецидива. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента по меньшей мере одной дозой примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале рецидива, и после этого лечение пациента ежемесячно с использованием дозировки примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, до достижения PASI75. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента ударной дозой молекулы, связывающей IL-17, которая выше дозы молекулы, связывающей IL-17, используемой в течение индукционной схемы, если пациент частично отвечает или не отвечает на лечение молекулой, связывающей IL-17, в течение индукционной схемы.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что по меньшей мере одну дозу молекулы, связывающей IL-17, вводят пациенту в начале рецидива после предшествующего лечения молекулой, связывающей IL-17. Также раскрыты способы лечения псориаза, включающие: а) идентификацию пациента на момент начала рецидива после предшествующего лечения псориаза с использованием молекулы, связывающей IL-17; и b) введение пациенту по меньшей мере одной дозы молекулы, связывающей IL-17.
В некоторых вариантах осуществления изобретения по меньшей мере одна доза молекулы, связывающей IL-17, составляет примерно 75 мг - примерно 300 мг каждая. В некоторых вариантах осуществления изобретения по меньшей мере одна доза молекулы, связывающей IL-17, составляет примерно 150 или примерно 300 мг каждая. В некоторых вариантах осуществления изобретения повторяют стадии (a) и (b).
В некоторых вариантах осуществления изобретения предшествующее лечение молекулой, связывающей IL-17, включает индукционную схему лечения. В некоторых вариантах осуществления изобретения индукционная схема включает нагрузочную схему. В некоторых вариантах осуществления изобретения нагрузочная схема включает введение пациенту пяти доз по примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели. В некоторых вариантах осуществления изобретения каждая из пяти доз составляет примерно 150 мг или примерно 300 мг. В некоторых вариантах осуществления изобретения пять доз по примерно 150 мг вводят пациенту, если его вес меньше 90 кг, и пять доз по примерно 300 мг вводят пациенту, если его вес превышает или равен 90 кг. В некоторых вариантах осуществления изобретения индукционная схема дополнительно включает введение пациенту примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в течение восьмой недели.
В некоторых вариантах осуществления изобретения предшествующее лечение молекулой, связывающей IL-17, включает введение пациенту по меньшей мере одной дозы молекулы, связывающей IL-17, в начале рецидива.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение пациенту, нуждающемуся в этом, пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; b) введение пациенту примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17 в течение восьмой недели; с) введение пациенту по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, в начале рецидива; и d) повтор стадии (c) при каждом последующем начале рецидива.
В настоящем документе раскрыты терапевтические схемы лечения псориаза, включающие:
а) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, включающей: (i) введение пациенту примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту еженедельно в течение пяти недель, причем первую дозу молекулы, связывающей IL-17, вводят в нулевую неделю; и (ii) впоследствии введение примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту в течение восьмой недели; и
b) введение молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, включающей: (i) введение примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту каждый месяц, каждые два месяца или каждые три месяца; или (ii) введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту в момент начала рецидива.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: (а) следует вводить в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, причем нагрузочная схема включает введение пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; и b) впоследствии следует вводить в течение поддерживающей схемы.
В некоторых вариантах осуществления изобретения нагрузочная схема включает введение пяти доз от примерно 150 мг до примерно 300 мг молекулы, связывающей IL-17. В некоторых вариантах осуществления изобретения пять доз по примерно 150 мг вводят пациенту, если его вес меньше 90 кг, и причем пять доз по примерно 300 мг вводят пациенту, если его вес превышает или равен 90 кг. В некоторых вариантах осуществления изобретения индукционная схема дополнительно включает введение пациенту примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в течение восьмой недели.
В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента по меньшей мере одной дозой примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале рецидива. В некоторых вариантах осуществления изобретения поддерживающая схема включает лечение пациента по меньшей мере одной дозой примерно 75 мг - примерно 300 мг молекулы, связывающей IL-17, в начале каждого повторного рецидива.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17, следует: а) вводить пациенту, нуждающемуся в этом, в виде пяти доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг), причем каждую из пяти доз вводят еженедельно, начиная с нулевой недели; b) впоследствии вводить пациенту в течение восьмой недели в количестве примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг); с) впоследствии вводить пациенту в виде по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) в начале рецидива; и d) впоследствии вводить пациенту в начале каждого повторного рецидива по меньшей мере одну дозу примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг).
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует:
а) вводить пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает: (i) молекулу, связывающую IL-17, которую следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) еженедельно в течение пяти недель, причем первую дозу молекулы, связывающей IL-17, следует вводить в течение нулевой недели; и (ii) впоследствии молекулу, связывающую IL-17, следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) в течение восьмой недели; и
b) вводить пациенту в течение поддерживающей схемы, включающей: (i) молекулу, связывающую IL-17, следует вводить пациенту в дозировке по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) каждый месяц, каждые два месяца или каждые три месяца; или (ii) молекулу, связывающую IL-17, следует вводить пациенту в виде по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, в начале рецидива.
В настоящем документе раскрыты варианты применения молекул, связывающих IL-17, для получения лекарственного средства для лечения псориаза, отличающегося тем, что антагонист IL-17, например, молекулу, связывающую IL-17, следует вводить пациенту в начале рецидива после предшествующего лечения молекулой, связывающей IL-17.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза у пациента, причем указанный пациент должен быть идентифицирован в начале рецидива после предшествующего лечения молекулой, связывающей IL-17, и указанному пациенту необходимо вводить по меньшей мере одну дозу молекулы, связывающей IL-17.
В настоящем документе раскрыты фармацевтические композиции для лечения псориаза, включающие в качестве действующего ингредиента молекулу, связывающую IL-17, причем молекулу, связывающую IL-17, следует вводить пациенту в начале рецидива после предшествующего лечения антагонистом IL-17, например, молекулой, связывающей IL-17.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение пациенту, нуждающемуся в этом, пяти еженедельных доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17; и b) впоследствии введение: (i) примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту ежемесячно, или (ii) одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту примерно через один месяц после стадии (а), и впоследствии введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту в начале рецидива.
В настоящем документе раскрыты терапевтические схемы лечения псориаза, включающего: а) введение пациенту, нуждающемуся в этом, пяти еженедельных доз по примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17; и b) впоследствии введение: (i) примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту ежемесячно, или (ii) одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту примерно через один месяц после стадии (а), и впоследствии введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг (например, примерно 150 мг - примерно 300 мг) молекулы, связывающей IL-17, пациенту в начале рецидива.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, примерно 52 мкг/мл - примерно 104 мкг/мл; и b) впоследствии введение молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 5 мкг/мл - примерно 70 мкг/мл.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, примерно 52 мкг/мл - примерно 104 мкг/мл; и b) впоследствии следует вводить пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 5 мкг/мл - примерно 70 мкг/мл.
В некоторых вариантах осуществления изобретения нагрузочная схема обеспечивает Cmax молекулы, связывающей IL-17, примерно 52 мкг/мл примерно на 32-й день. В некоторых вариантах осуществления изобретения поддерживающая схема обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 5 мкг/мл - примерно 33 мкг/мл. В некоторых вариантах осуществления изобретения поддерживающая схема обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 16 мкг/мл. В некоторых вариантах осуществления изобретения нагрузочная схема обеспечивает Cmax молекулы, связывающей IL-17, примерно 104 мкг/мл примерно на 32-й день. В некоторых вариантах осуществления изобретения поддерживающая схема обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 11 мкг/мл - примерно 70 мкг/мл. В некоторых вариантах осуществления изобретения поддерживающая схема обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 33 мкг/мл. В некоторых вариантах осуществления изобретения индукционная схема составляет двенадцать недель. В некоторых вариантах осуществления изобретения в поддерживающей схеме используется ежемесячное введение молекулы, связывающей IL-17.
В настоящем документе раскрыты способы лечения псориаза, включающие: а) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в этом, в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает средний минимальный уровень через один месяц после четвертой дозы примерно 29,2 мкг/мл; и b) впоследствии введение молекулы, связывающей IL-17, пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 15 мкг/мл.
В настоящем документе раскрыты молекулы, связывающие IL-17, для применения в лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: a) необходимо вводить пациенту в течение индукционной схемы, причем индукционная схема включает нагрузочную схему, которая обеспечивает средний минимальный уровень через один месяц после четвертой дозы примерно 29,2 мкг/мл; и b) впоследствии необходимо вводить пациенту в течение поддерживающей схемы, которая обеспечивает средний устойчивый минимальный уровень молекулы, связывающей IL-17, примерно 15 мкг/мл.
Варианты комбинированной терапии для лечения псориаза
В применении на практике способов лечения, схем или вариантов применения по настоящему изобретению, терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17, вводят субъекту, например, млекопитающему (например, человеку). Антагонист IL-17, например, молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), или молекулу, связывающую рецептор IL-17, можно вводить согласно способу по изобретению либо отдельно, либо в комбинации с другими вариантами терапии, например, в комбинации с дополнительными агентами или вариантами терапии псориаза. При совместном введении с одним или несколькими дополнительными агентами антагонист IL-17, например, молекулу, связывающую IL-17 (например, антитело к IL-17, такое как секукинумаб), или молекулу, связывающую рецептор IL-17, можно вводить либо одновременно с другим агентом, либо последовательно. При последовательном введении лечащий терапевт будет определять соответствующую последовательность введения антагониста IL-17, например, молекулы, связывающей IL-17 (например, антитела к IL-17, такого как секукинумаб), или молекулы, связывающей рецептор IL-17, в комбинации с другими агентами.
В ходе лечения псориаза различные варианты терапии целесообразно объединить с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17. Такие варианты терапии включают местные средства (отпускаемые без рецепта, нестероидные соединения и стероидные соединения), фототерапию и системное лечение (например, биопрепаратами и химическими соединениями). Неограничивающие примеры местных агентов для применения с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17, включают салициловую кислоту, каменноугольную смолу, Dovonex® (кальципотриен), Taclonex® (кальципотриен и бетаметазона дипропионат), Tazorec® (тазаротен), пимекролимус, такролимус, Vectical® (кальцитриол), Zithranol-RR® (антралин) и стероиды для местного применения (например, кортикостероиды). Примеры фототерапии для применения с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17, включают воздействие псоралена и UVA или воздействие UVB (с дегтем или без него). Примеры агентов, используемых в системном лечении, для применения с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17, включают ретиноиды, такие как Ацитретин (Soriatane®), циклоспорин, метотрексат, Hydrea® (гидроксимочевину), изотретиноин, микофенолята мофетил, микофеноловую кислоту, сульфасалазин, 6-тиогуанин, фумараты (например, диметилфумарат и сложные эфиры фумаровой кислоты), азатиоприн, кортикостероиды, лефлуномид, такролимус, блокаторы Т-клеток (такие как Amevive® (алефацепт) и Raptiva® (эфализумаб), блокаторы фактора некроза опухолей альфа (TNF-альфа) (такие как Enbrel® (этанерцепт), Humira® (адалимумаб), Remicade® (инфликсимаб) и Simponi® (голимумаб)) и блокаторы интерлейкина 12/23 (такие как Stelara® (устекинумаб), тазоцитиниб, Эфализумаб и бриакинумаб.
Дополнительные агенты для применения в комбинации с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17, в течение лечения псориаза включают апремиласт, мометазом, воклоспорин, кетоконазол, Neuroskin Forte, рекомбинантный интерлейкин-10 человека, воклоспорин, VX-765, MED-I545, флуфеназина деканоат, ацетаминофен, бимозиамозный крем, доксициклин, ванкомицин, AbGn168, витамин D3, RO5310074, флударабин Кальципотриол и гидрокортизон (LEO 80190), LE80185 (суспензию для местного лечения кожи головы Taclonex®/гель Xamiol®), Фоцетрию (моновалентную MF59-адъювантную вакцину, вектор для генной терапии - tgAAC94, Апремиласт, Капсаицин, Псирелакс, ABT-874 (анти-IL-12), IDEC-114, MEDI-522, INCB018424 фосфата крем, LE29102, BMS 587101, CD 2027, CRx-191, 8-метоксипсорален или 5-метоксипсорален, Бициллин L-A, LY2525623, INCB018424, LY2439821, CEP-701, CC-10004, цертолизумаб (CZP), GW786034 (пазопаниб), доксициклин, С3-комплекс куркуминоидов, NYC 0462, RG3421, hOKT3гамма1(Ala-Ala), BT061, теплизумаб, хондроитина сульфат, CNTO 1275, моноклональное антитело к субъединицам IL-12p40 и IL-23p40, BMS-582949, MK0873, MEDI-507, M518101, ABT-874, Amg 827, AN2728, AMG 714, AMG 139, PTH (1-34), пена U0267, CNTO 1275, QRX-101, CNTO 1959, LEO 22811, Имиквимод, CTLA4Ig, водоросли Dunaliella Bardawil, крем AS 101, пиоглитазон, пимекролимус, ранибизумаб, зидовудин, CDP870 (Цертолизумаб пегол), Онерцепт (r-hTBP-1), ACT-128800, 4,4-диметил-бензизо-2Н-селеназин, CRx-191, CRx-197, доксеркальциферол, крем LEO 19123 (кальципотнол плюс LEO 80122), LAS 41004, WBI-1001, такролимус, RAD001, рапамицин, розиглитазон, пиоглитазон, ABT-874, Аминоптерин, AN2728, CD2027, ACT-128800, мометазона фуроат, CT 327, клобетазол + LCD, BTT1023, E6201, витамин B12 для местного применения, крем INCB018424 фосфат, гель Ксамиол, IP10.C8, BFH772, LEO 22811, Флуфеназин, MM-093, Клобекс, SCH 527123, CF101, SRT2104, BIRT2584, CC10004, Тетратиомолибдат, CP-690,550, U0267, ASP015K, VB-201, Ацитретин (также называемый U0279), RWJ-445380, Псоралайт, Клобетазола пропионат, ботулиновый токсин тип А, алефацепт, эрлотиниб, BCT194, мазь Ультрават, Рофлумиласт, CNTO 1275, галобетазол, крем CTA018, ILV-094, COL-121, MEDI-507, AEB071. Дополнительные агенты для применения в комбинации с секукинумабом при лечении псориаза включают антагонисты IL-6, антагонисты CD20, антагонисты CTLA4, антагонисты IL-17, антагонисты IL-8, антагонисты IL-21, антагониста IL-22, антагонисты VGEF, антагонисты CXCL, антагонисты MMP, антагонисты дефензина, антагонисты IL-1бета и антагонисты IL-23 (например, рецепторы-ловушки, антагонистические антитела и т.д.). Специалист в данной области сможет подобрать подходящие дозировки вышеуказанных агентов для совместного введения с раскрытыми антагонистами IL-17, например, молекулами, связывающими IL-17 (например, антителом к IL-17, таким как секукинумаб), и молекулами, связывающими рецептор IL-17.
Наборы для лечения псориаза
Настоящее изобретение относится к наборам, обеспечивающим антагонисты IL-17, например, молекулы, связывающие IL-17 (например, антитело к IL-17, такое как секукинумаб), и молекулы, связывающие рецептор IL-17, для лечения псориаза. Такие наборы могут содержать антагонист IL-17 (например, в жидкой или лиофилизированной форме) или фармацевтическую композицию, содержащую антагонист IL-17. Дополнительно такие наборы могут включать средство введения молекулы, связывающей IL-17 (например, шприц или шприц-ручку) и инструкции по применению. Эти наборы могут содержать дополнительные терапевтические агенты (описаны выше) для лечения псориаза, например, для введения в комбинации с вложенными антагонистами IL-17, например, секукинумабом.
Соответственно, настоящее изобретение относится к наборам, включающим: (а) фармацевтическую композицию, содержащую терапевтически эффективное количество молекулы, связывающей IL-17; b) средство введения антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту, имеющему псориаз; и с) инструкции, обеспечивающие: (i) введение антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту в течение индукционной схемы, включающей: а. введение примерно 75 мг - примерно 300 мг антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту еженедельно в течение пяти недель, причем первую дозу молекулы, связывающей IL-17, вводят в нулевую неделю; и b. впоследствии введение примерно 75 мг - примерно 300 мг антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту в течение восьмой недели; и (ii) введение антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту в течение поддерживающей схемы, включающей: а. введение примерно 75 мг - примерно 300 мг антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту каждый месяц, каждые два месяца или каждые три месяца; или b. введение по меньшей мере одной дозы примерно 75 мг - примерно 300 мг антагониста IL-17 (например, молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17) пациенту в начале рецидива.
Общее
В некоторых вариантах раскрытых способов, терапевтических схем, наборов, вариантов применения или фармацевтических композиций, антагонист IL-17 (например, молекула, связывающая IL-17, или молекула, связывающая рецептор IL-17) выбран из группы, состоящей из:
a) секукинумаба;
b) антитела к IL-17, которое связывает эпитоп IL-17, содержащий Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129;
c) антитела к IL-17, которое связывает эпитоп IL-17, содержащий Tyr43, Tyr44, Arg46, Ala79, Asp80;
d) антитела к IL-17, которое связывает эпитоп гомодимера IL-17, имеющего две цепи зрелого белка IL-17, причем указанный эпитоп включает Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи;
e) антитела к IL-17, которое связывает эпитоп гомодимера IL-17, имеющего две цепи зрелого белка IL-17, причем указанный эпитоп включает Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи, причем молекула, связывающая IL-17, имеет KD примерно 100-200 пМ, и молекула, связывающая IL-17, имеет время полужизни in vivo примерно 4 недели; и
f) антитела к IL-17, которое включает антитело, выбранное из группы, состоящей из:
(i) вариабельного домена тяжелой цепи (VH) иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:8;
ii) вариабельного домена легкой цепи (VL) иммуноглобулина содержащего аминокислотную последовательность, указанную в SEQ ID NO:10;
iii) VH-домена иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:8, и VL-домена иммуноглобулина, содержащего аминокислотную последовательность, указанную в SEQ ID NO:10;
iv) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3;
v) VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6;
vi) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13;
vii) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, и VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; и
viii) VH-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13, и VL-домена иммуноглобулина, содержащего гипервариабельные участки, указанные в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
В вышеуказанных способах, терапевтических схемах, вариантах применения, фармацевтических композициях, комбинациях, вариантах комбинированной терапии и наборах, в предпочтительном варианте осуществления используется человеческое антитело к IL-17, например, человеческое антитело к IL-17 (например, человеческое моноклональное антитело), наиболее предпочтительно, секукинумаб.
В некоторых вариантах осуществления изобретения раскрытых способов, терапевтических схем, наборов, молекул, связывающих IL-17, вариантов применения и фармацевтических композиций антагонист IL-17 (например, молекулу, связывающую IL-17, или молекулу, связывающую рецептор IL-17) пациент вводит себе самостоятельно.
В некоторых вариантах вышеуказанных способов, терапевтических схем, вариантов применения, фармацевтических композиций, комбинаций, вариантов комбинированной терапии и наборов пациент, которого предполагается лечить секукинумабом, является интактным (т.е. он ранее не получал лечение от псориаза). В других вариантах осуществления изобретения пациента, которого предполагается лечить секукинумабом, ранее лечили системным агентом против псориаза, например, агентом, выбранным из группы, состоящей из метотрексата, циклоспорина, сложных эфиров фумаровой кислоты, ацитретина, алефацепта, адалимумаба, эфализумаба, этанерцепта, инфликсимаба, голимумаба или устекинумаба. В предпочтительных вариантах осуществления изобретения системным агентом является метотрексат.
В некоторых вариантах осуществления изобретения раскрытые схемы лечения используют у пациентов, имеющих среднетяжелый хронический бляшковидный псориаз, которые являются кандидатами для системной терапии или фототерапии. В некоторых вариантах осуществления изобретения используют у пациентов, имеющих среднетяжелый хронический бляшковидный псориаз, которые являются кандидатами для системной терапии или фототерапии, и для которых другие системные методы лечения менее приемлемы по медицинским показаниям. В некоторых вариантах осуществления изобретения раскрытые схемы лечения используют у пациентов, имеющих среднетяжелый хронический бляшковидный псориаз, которые являются кандидатами для системной терапии или фототерапии, и для которых другие системные методы лечения менее приемлемы по медицинским показаниям. В некоторых вариантах осуществления изобретения пациент может не отвечать, частично отвечать (например, недостаточно отвечать) на лечение псориаза анти-TNF-альфа агентами, иметь рецидив или ухудшение симптомов после них.
В некоторых из вышеуказанных способов, терапевтических схем, вариантов применения, фармацевтических композиций, комбинаций, вариантов комбинированной терапии и наборов начало рецидива определяют как: (а) потерю по меньшей мере 20% (1/5) от максимального ответа PASI, достигнутого в любое время до визита к лечащему врачу, на котором устанавливают начало рецидива; и (b) и потерю PASI 75.
В некоторых из вышеуказанных способов, терапевтических схем, вариантов применения, фармацевтических композиций, комбинаций, вариантов комбинированной терапии и наборов пациент страдает от псориаза ладоней и/или стоп, псориаза лица, псориаза головы, генитального псориаза, инверсного псориаза или псориаза ногтей. В дополнительных вариантах осуществления изобретения псориаз представляет собой хронический бляшковидный псориаз.
ПРИМЕРЫ
Пример 1
Доказательство обоснованности применения секукинумаба для лечения псориаза
В завершенном исследовании обоснованности (CAIN457A2102) эффекты секукинумаба, вводимого в количестве 3 мг/кг в виде одной внутривенной инфузии, сравнивали с эффектами плацебо у тридцати шести пациентов, имеющих активный хронический бляшковидный псориаз. В исследовании была продемонстрирована эффективность в 4-недельной конечной точке и непрерывная эффективность в течение 12 недель, исходя из конечных показателей Индекса площади и тяжести псориаза (PASI) и Исследовательской общей оценки (IGA).
В следующем исследовании (CAIN457A2212) были протестировали три схемы внутривенного (i.v.) введения секукинумаба у пациентов с активным хроническим бляшковидным псориазом: 1× по 3 мг/кг (вводится в день 1), 1× по 10 мг/кг (вводится в день 1) и 3× по 10 мг/кг (вводится в дни 1, 15 и 29). В группе 3 мг/кг i.v. была подтверждена эффективность, наблюдаемая в проведенном исследовании обоснованности (40% пациентов достигали PASI75 через 12 недель). В группах 10 мг/кг i.v. наблюдалась значительно лучшая эффективность по сравнению с группой 3 мг/кг i.v. с 73% (группа 10 мг/кг) и 87% (группа 3×10 мг/кг) пациентов, достигающих PASI75 на 12-й неделе. Более того, начало действия секукинумаба было очень быстрым (примерно 2 недели). Следует отметить (показано на фигуре 1), что у пациентов, получавших секукинумаб, не наблюдалось никакого усиления симптомов в течение 8 недель после введения препарата. Это отличается от различных других методов лечения псориаза, которые, как было показано, вызывают усиление симптомов у пациентов, например, в случае использования антагонистов TNF-альфа и циклоспорина. Это отсутствие усиления симптомов позволяет предположить возможность осуществления интермиттирующего лечения псориаза, например, лечения в начале рецидива (SoR), с использованием секукинумаба.
Пример 2 - Исследование CAIN457A2211
Пример 2.1 - Протокол исследования
Основные задачи
Задачей исследования являлась оценка эффективности трех индукционных схем подкожного (s.c.) введения секукинумаба у пациентов со среднетяжелым хроническим бляшковидным псориазом в отношении достижения PASI75 через 12 недель лечения в сравнении с плацебо.
Схема исследования
В этом многоцентровом исследовании используют рандомизированную двойную слепую схему с параллельными группами. Графическое представление исследования показано на фигуре 2. Исследование состоит из 4 периодов: периода скрининга, индукционного периода, поддерживающего периода и периода последующего наблюдения. Скрининговый период длительностью в 4 недели будет использоваться для оценки пригодности пациентов для исследования и для отмены у пациентов неподходящих лекарственных средств. Во время визита (базовая линия) пациенты, подходящие для исследования, будут случайным образом распределены (рандомизированы) по группам индукционного лечения. Рандомизацию стратифицируют по весу тела (≥90 кг или <90 кг). Пациенты будут рандомизированы следующим образом:
Индукционный период
Пациентов относят к одной из следующих четырех групп индукционного лечения в соотношении 1:2:2:1, соответственно:
- Индукция однократной инъекцией - «Группа однократного введения»: секукинумаб (150 мг s.c.) вводили в 1-ю неделю;
- Индукция ежемесячными инъекциями - «Группа ежемесячного введения»: секукинумаб (150 мг s.c.) вводили в 1-ю, 5-ю, 9-ю недели;
- Индукция ранней нагрузкой - «Группа ранней нагрузки»: секукинумаб (150 мг s.c.) вводили в 1-ю, 2-ю, 3-ю, 5-ю недели;
- Плацебо - «Группа плацебо»: плацебо вводили в 1-ю, 2-ю, 3-ю, 5-ю, 9-ю недели.
В каждой из групп действующего лечения вводились инъекции плацебо для сохранения «слепого» метода исследования.
Поддерживающий период
На 13-й неделе пациентов разделяли, как отвечающих на лечение (достигающих по меньшей мере PASI75), частично отвечающих на лечение (достигающих PASI50, но не достигающих PASI75) или не отвечающих на лечение (не достигающих PASI 50). Группу пациентов, отвечающих на лечение, дополнительно разделяли случайным образом по следующих группам поддерживающего лечения в соотношении 1:1:
- Схема фиксированного интервала - «Группа FI»: секукинумаб (150 мг s.c.) вводили на 13-й и 25-й неделе, и плацебо вводили в очередной назначенный визит, на котором наблюдается начало рецидива;
- Схема лечения в начале рецидива - «Группа SR»: Плацебо вводили на 13-й неделе и возможно на 25-й неделе, если не наблюдалось начала рецидива, и секукинумаб (150 мг s.c.) вводили в очередной назначенный визит, на котором диагностировали начало рецидива.
Отвечающие на схему плацебо будут оставаться в группе плацебо и будут получать плацебо на 13-й и 25-й недели, и плацебо в очередной назначенный визит, на котором наблюдается начало рецидива.
Фаза открытого исследования
Пациенты, не отвечающие и частично отвечающие на лечение на 13-й неделе, и пациенты, у которых наблюдались два последовательных рецидива в назначенные визиты, начиная с 13-й недели, будут подходить для фазы открытого исследования - «Группа OL»: секукинумаб (150 мг s.c) вводят каждые 4 недели. Последнее введение исследуемого соединения для всех пациентов, остающихся в исследовании, может быть на 33-й неделе. Для мониторинга безопасности после последнего введения исследуемого соединения будет проводиться наблюдение за всеми рандомизированными пациентами в течение 4-недельного периода последующего наблюдения, свободного от воздействия, и наблюдение за ними будет продолжаться в течение 12 недель (визиты 13, 14 и 15). Оценка достижения основной задачи будет проведена в конце индукционного периода (13-я неделя).
Индекс площади и тяжести псориаза: PASI
Индекс PASI будут определять в назначенные визиты. В системе определения индекса PASI голову, туловище, верхние конечности и нижние конечности оценивают отдельно по эритеме, утолщению (поднятию, уплотнению бляшек) и шелушению (слущиванию) (см. таблицу 1).
Пример 2.2 - Результаты CAIN457A2211
Результаты промежуточного анализа (12 недель):
PASI-ответ
Данные, доступные из промежуточного анализа, проведенного на 12-й неделе, показывают наличие PASI75 у 12% в «Группе однократного введения», 43% в «Группе ежемесячного введения» и 55% в «Группе ранней нагрузки» по сравнению с 5% в «Группе плацебо» (таблица 5 и фигура 3). Для обеих групп, «ежемесячного введения» и «ранней нагрузки», была показана статистическая достоверность по сравнению с плацебо (p<0,001). В «группе ранней нагрузки» (4×150 мг секукинумаба s.c. в течение первых пяти недель) была показана максимальная эффективность, которая превышала эффективность введения 3 мг/кг i.v. (исследование обоснованности), но ниже эффекта введения 10 мг/кг i.v. (CAIN457A2212).
|
В исследовании CAIN457A2211 степень ответа значительно не улучшалась после 8-й недели в «группе ранней нагрузки» (которая не включала введение исследуемого соединения на 8-й неделе), в то время как степень ответа явно улучшалась после 8-й недели в «группе ежемесячного введения» (которая включала введение исследуемого препарата на 8-й неделе) (фигура 3). Более того, 8 пациентов в группе «ранней нагрузки», которые уже достигли ответа PASI75 к 8-й неделе, потеряли PASI75 к 12-й неделе. Эти данные поддерживают схему ежемесячного дозирования после еженедельной нагрузки.
В исследовании CAIN457A2211 также была показана взаимосвязь между весом тела и ответом на лечение; 60,9% пациентов с весом тела <90 кг показывали ответ PASI75 через двенадцать недель лечения, в то время как только 47,6% достигали этого ответа в группе пациентов, весящих ≥90 кг (таблица 6). Степень достижения индекса Исследовательской общей оценки (IGA) 0 или 1 также была статистически значительно лучше для групп «ежемесячного введения» (22,6%) и «ранней нагрузки» (37,9%) по сравнению с плацебо (3,0%; p<0,001). Краткосрочный профиль безопасности секукинумаба в этом исследовании был сравним с плацебо без наблюдаемого дозозависимого эффекта и аналогичным процентом (~60-70%) побочных эффектов для всех дозировок в группах действующих соединений и плацебо. Это включало инфекции, которые составляли 21%, 39%, 33% в когортах «однократного введения», «ежемесячного введения» и «ранней нагрузки», соответственно, по сравнению с 37% в когорте плацебо. Процент серьезных побочных эффектов (SAE) составлял 5%, 2%, 5% в когортах «однократного введения», «ежемесячного введения» и «ранней нагрузки», соответственно, по сравнению с 3% в когорте плацебо.
|
IGA-ответ
В дополнение к PASI-ответу первичный анализ в конечной точке проводили по достижению Исследовательской общей оценки (IGA). Использовали шкалу от 0 (чистая кожа) до 5 (очень тяжелые симптомы). Согласно IGA пациент считался отвечающим на лечение, если достигалась IGA, составляющая 0 (чистая кожа) или 1 (практически чистая кожа); критерием включения была базовая IGA ≥3. После двенадцати недель лечения IGA-ответа достигали 4,5% пациентов в группе «однократного введения», 22,6% пациентов из группы «ежемесячного введения» и 37,9% пациентов из группы «ранней нагрузки»; только 3,0% пациентов в группе плацебо достигали IGA-ответа 0/1.
Так же как и для PASI-ответа, на протяжении длительного времени было показано, что число пациентов, отвечающих по IGA, увеличивалось после введения секукинумаба через восемь недель в группе «ежемесячного введения», но только немного в группе «ранней нагрузки», в которой пациенты не получали секукинумаба после восьми недель. Кроме того, взаимосвязь между весом тела и IGA-ответом также была показана для схем «однократного» и «ежемесячного введения», но не для схемы «ранней нагрузки». В группе «однократного введения», процент IGA-ответа через двенадцать недель лечения составлял 8,8% в весовой группе <90 кг, но 0,0% в весовой группе ≥90 кг. Аналогичным образом, в группе «ежемесячного введения» процент ответа составлял 35,3% и 10,1%. В группе «ранней нагрузки» проценты ответа были очень похожими между весовыми группами, составляя 39,1% (<90 кг) и 36,5% (≥90 кг).
Результаты промежуточного анализа (28 недель):
Промежуточный анализ проводили через 16 недель после того, как 103 пациента достигли ответа PASI75 после двенадцати недель лечения. В этом промежуточном анализе ключевую вторую задачу сравнения двух поддерживающих схем («фиксированных интервалов» и «лечения в начале рецидива») оценивали с помощью служебного Комитета по мониторингу данных (DMC).
Демографические данные пациентов на момент базовой линии
По сравнению с демографическими данными популяции на момент рандомизации популяция в этом промежуточном анализе состояла из пациентов с меньшим средним весом тела (85,1 кг по сравнению с 93,1 кг на момент рандомизации). По всем иным параметрам демографические данные были сравнимыми. Разница в среднем весе тела была ожидаемой, поскольку в двойную слепую поддерживающую схему входили только пациенты, отвечающие на лечение, а более низкий вес тела связан с более высокой вероятностью ответа после лечения секукинумабом.
PASI-ответ
В группе «фиксированного интервала» (51 пациент, поддерживающая схема, включающая введение 150 мг секукинумаба s.c. через двенадцать и двадцать четыре недели после рандомизации) 94,1% пациентов показывали ответ PASI 75 (потеря 5,9% ответа) через четыре недели на поддерживающей схеме, 80,4% - через восемь недель (потеря 19,6%), и 66,7% через двенадцать недель в поддерживающем периоде (потеря 33,3%) (фигура 4А и 4В). Во время визита к лечащему врачу на 25-й неделе пациенты повторно получали лечение секукинумабом и через четыре недели процент пациентов с ответом PASI75 немного увеличился до 68,6%.
В дополнение схему «фиксированных интервалов» по четыре недели испытывали в открытой части исследования CAIN457A2211. По определению, пациенты, которые участвовали в этой части исследования, не имели ответа PASI 75 на 12-й неделе. При введении секукинумаба (150 мг) открытым образом каждые четыре недели значительная часть пациентов стала отвечать на лечение в течение 8-12 недель (таблица 7). Для обоснования четырехнедельного интервала в поддерживающей схеме следует отметить, что после достижения некоторого уровня ответа PASI75 («однократное введение» и «ежемесячное введение»: 20 неделя; «ранняя нагрузка» и плацебо: 24-я неделя) этот процент поддерживался на одном уровне или немного улучшался после этой схемы. Анализ безопасности пациентов в открытой группе исследования CAIN457A2211, в течение которого пациентов лечили 150 мг секукинумаба каждые четыре недели, не выявляет клинически значимой разницы между группой открытого исследования и другими схемами лечения (т.е. Фиксированный интервал = лечение каждые 12 недель, и повторное лечение в начале рецидива). Это подтверждает предположение, что лечение секукинумабом в поддерживающей схеме каждые четыре недели обещает показать приемлемый профиль безопасности.
|
Дополнительно определяли время «начала рецидива» у пациентов (в исследовании CAIN457A2211: это время определяли, как потерю по меньшей мере 33% от улучшения PASI, достигнутого ранее, причем улучшением PASI являлся индекс PASI при рандомизации минус наименьший индекс PASI, когда-либо достигнутый в течение исследования). В группе «лечения в начале рецидива» (в которой пациенты получали повторное лечение, только если они страдали от «начала рецидива») первое «начало рецидива» наблюдалось через тринадцать недель после последнего введения исследуемого препарата (у 6,0% пациентов). Через шестнадцать недель после последнего введения исследуемого препарата только у 28,5% пациентов наблюдалось «начало рецидива», у 41,4% на 20-й неделе и у 55,6% на 24 неделе (фигура 4A, пунктирная линия).
IGA-ответ
В начале поддерживающего периода (т.е. через двенадцать недель после начала введения исследуемого препарата) у 64,7% пациентов в группе «фиксированного интервала» наблюдался IGA-ответ 0 («чистая кожа») или 1 («практически чистая кожа»). Через четыре недели на поддерживающей схеме этот ответ наблюдался у 70,6% пациентов, а через восемь недель - у 60,8% пациентов. Через двенадцать недель в поддерживающем периоде до первого повторного введения препарата в поддерживающей схеме, 52,9% пациентов имели IGA-ответ 0/1, и этот уровень сохранялся четыре недели спустя (51,0%).
Обсуждение и анализ
Внутренний анализ в первой конечной точке (РЕА) проводили после того, как все пациенты достигли двенадцати недель лечения. Результаты подтвердили, что секукинумаб эффективен для исследуемых показаний, так как в первой конечной точке был показан эффект секукинумаба в отношении достижения PASI75 через двенадцать недель лечения по сравнению с плацебо в группах «ежемесячного введения» и «ранней нагрузки».
Промежуточный анализ проводили на 103 пациентах, которые отвечали на лечение после двенадцати недель. Оценку в ключевой второй конечной точке сравнения двух поддерживающих схем («фиксированных интервалов» и «лечения в начале рецидива») проводил внутренний Комитет мониторинга данных (DMC). Принимая во внимание то, что целью лечения в течение поддерживающего периода в схеме с «фиксированными интервалами введения» являлось сохранение у пациентов статуса ответа PASI75, промежуточный анализ показал, что уточненный фиксированный интервал введения должен составлять четыре недели. Эту схему используют во всех исследованиях III фазы, в которых анализируют фиксированное введение препарата.
Интерпретация информации, полученной в поддерживающий период исследования CAIN457A2211, показала, что для того чтобы сохранить у большинства пациентов ответ PASI75, требуется 4-недельный фиксированный интервал введения (фигура 4). Однако у 66,7% пациентов сохранялся их ответ PASI75 до 12 недель после последнего введения секукинумаба, и поэтому им может не потребоваться повторное введение препарата ранее этой временной точки (фигура 4А и В). Анализ подхода повторного лечения в начале рецидива показывает, что некоторым пациентам можно успешно повторно вводить препарат через более продолжительные интервалы. На фигуре 5 представлено время начала рецидива для ряда субъектов, и показано, что даже через 6 месяцев после последнего введения секукинумаба значительный процент пациентов сохраняет выраженный клинический ответ. Эти данные предполагают, что подход индивидуального поддерживающего лечения мог бы быть полезным при лечении псориаза секукинумабом. Несмотря на то, что не все пациенты подходят для такого подхода (т.е. вследствие их индивидуального ответа/появления рецидивов, вследствие необходимости тщательного контроля симптомов или вследствие необходимости срочного контакта с терапевтом), и могут поэтому предпочитать схему лечения с фиксированными интервалами, ожидается, что для некоторых пациентов будет целесообразна индивидуальная терапия. Пациенты, которым нужны инъекции реже, чем раз в четыре недели, будут получать меньшее количество препарата по сравнению со схемой с фиксированными интервалами, что считается более безопасным.
Анализ поддерживающего периода исследования CAIN457A2211 параллельно с возможностью и потенциальной целесообразностью индивидуального подхода в лечении также показал, что для того чтобы достигнуть лучшего контроля заболевания, можно изменить инструкции для схемы «повторное введение препарата в начале рецидива». Поэтому для схемы повторного введения препарата в начале рецидива обе инструкции по началу, а также по остановке лечения, были модифицированы для III фазы с целью максимального повышения и сохранения идеального контроля заболевания: начало рецидива в III фазе определяли как потерю 20% предшествующего улучшения PASI (в отличие от 33% в фазе II) и потерю ответа PASI 75. В дополнение, после начала повторного лечения в начале рецидива его продолжают с одним введением секукинумаба каждые четыре недели до повторного достижения ответа PASI75.
Пример 3 - Исследование A2220
Пример 3.1 - Протокол
Основная задача
Для оценки эффективности трех различных дозировок секукинумаба, вводимого подкожно ежемесячно (по 25 мг, 75 мг и 150 мг) или однократным введением (25 мг), у пациентов со среднетяжелым хроническим бляшковидным псориазом в отношении достижения PASI 75 через 12 недель после лечения по сравнению с плацебо.
Схема исследования
Данное исследование является многоцентровым, рандомизированным, двойным слепым, плацебо-контролируемым исследованием с параллельными группами на 120 пациентах со среднетяжелым хроническим бляшковидным псориазом. Ожидается, что пациентов будут отбирать примерно в 25 участках исследования, тогда как на участке должны отобрать для исследования не менее 5 пациентов.
Исследование состоит из 3 периодов: скрининга, лечения и периода последующего наблюдения. Графическое представление исследования показано на фигуре 6.
Скрининговый период продолжительностью до 4 недель будет использоваться для оценки пригодности пациентов для исследования и для отмены у пациентов неподходящих лекарственных средств. Пациенты, подходящие для исследования, будут случайным образом распределены по одной из пяти групп воздействия и будут получать исследуемый препарат ежемесячно три раза (недели 1, 5 и 9). В каждой группе пациентам будут вводить либо плацебо, либо одну из трех различных дозировок с использованием двух различных схем введения секукинумаба с соотношением рандомизации, составляющим 1:1:1:1:1. Рандомизацию стратифицируют по весу тела (<90 кг или ≥90 кг). В течение лечения, пациенты будут посещать врача на 2-й, 3-й, 5-й и 9-й неделе. В 5-ю и 9-ю неделю пациенты получать исследуемый препарат. Во время всех визитов будет проведена оценка безопасности, эффективности и фармакокинетики. За 12-недельным периодом лечения будет следовать период последующего наблюдения максимальной длительности 24 недели. Если пациент нуждается в другом системном лечении псориаза или фототерапии до окончания периода наблюдения, то следует провести визит «окончания исследования».
Анализ в первой конечной точке (т.е. достижение PASI 75 через 12 недель после начала лечения) будет проведен после завершения всеми пациентами фазы лечения.
Доказательство обоснованности схемы исследования
В этом исследовании будет получена информация по определению оптимальной дозы для 12-недельного периода лечения (с последним введением исследуемого препарата на 9-й неделе). Целью настоящего исследования является определение дозы (доз) секукинумаба, которые снижают тяжесть симптомов псориаза (по сравнению с плацебо).
Исследование было разработано для изучения того, наблюдается ли уменьшение тяжести симптомов псориаза, измеренных исходя из Индекса площади и тяжести псориаза (PASI) и Исследовательской общей оценки (IGA) у пациентов со среднетяжелым бляшковидным псориазом через 12 недель после начала лечения секукинумабом. Индекс PASI, оценка тяжести симптомов псориаза и степень, до которой поверхность тела человека поражена заболеванием, считается приемлемым органами здравоохранения для оценки эффективности препарата вместе с Исследовательской общей оценкой (IGA).
Исследуемые группы
Пациенты были распределены по следующим 5 исследуемым группам в соотношении 1:1:1:1:1, с 24 пациентами на группу.
- Группа «3×150 мг»: секукинумаб 150 мг s.c., вводимый в 1-ю, 5-ю и 9-ю недели;
- Группа «3×75 мг»: секукинумаб 75 мг s.c., вводимый в 1-ю, 5-ю и 9-ю недели;
- Группа «3×25 мг»: секукинумаб 25 мг s.c., вводимый в 1-ю, 5-ю и 9-ю недели;
- Группа «1×25 мг»: секукинумаб 25 мг s.c., вводимый в 1-ю неделю и плацебо, вводимое в 5-ю и 9-ю недели;
- Группа «Плацебо»: плацебо s.c., вводимое в 1-ю, 5-ю и 9-ю недели.
Индекс площади и тяжести псориаза: PASI
Индекс PASI будут определять в назначенные визиты. В системе определения индекса PASI голову, туловище, верхние конечности и нижние конечности оценивают отдельно по эритеме, утолщению (поднятию, уплотнению бляшек) и шелушению (слущиванию) (см. таблицу 1).
Пример 3.2
Результаты исследования CAIN457A2220 (12-я неделя)
PASI-ответ
Результаты ответов PASI 75 (основная переменная), PASI 50 и PASI 90 показаны на фигуре 7 и обобщены в таблице 8. Наиболее высокие ответы наблюдались в когорте 3×150 мг с PASI75 у 81,5% (p<0,001 относительно плацебо) и PASI90 у 51,9% (p<0,001 относительно плацебо) пациентов. В когорте 3×75 мг ответ PASI 75 наблюдался у 57,1% пациентов (p=0,002 относительно плацебо) через 12 недель лечения. Таким образом, наблюдается явная дозозависимость между когортами для всех когорт за исключением группы 1×25 мг, которая статистически не отличалась от плацебо (а именно, когорты 1×25 мг с 3,4% (p=0,308) и 3×25 мг с 19,2% (p=0,362) ответа PASI не показывали статистически значимой разницы при сравнении с плацебо (таблица 9)). Следует отметить, что PASI90 достигался только у 19% пациентов в когорте 3×75 мг и у 7,7% пациентов в когорте 3×25 мг. Уровень ответа был очень низким в когорте 1×25 мг, в которой ни один из пациентов не достиг PASI90. Уровень ответов в группе плацебо составлял 9,1% (2 из 22 пациентов) для PASI75 и 4,5% (1 из 22 пациентов) для PASI 90. В анализах подгрупп (таблица 9) наивысший ответ PASI 75 (93,8%) наблюдался у пациентов, получавших лечение 3×150 мг и весящих меньше 90 кг, в то время как только 63,6% пациентов, весящих больше 90 кг, достигали PASI 75 в этой когорте после 12 недель лечения.
|
|
Обсуждение и анализ
Результаты этого 12-недельного исследования по определению оптимальной дозы подтверждают эффективность секукинумаба при хроническом бляшковидном псориазе. Подкожное введение 3 доз по 150 мг секукинумаба ежемесячно давало уровень ответов PASI 75 и PASI 90, составляющий 81,5% и 51,9%, соответственно (таблица 8). Этот уровень ответа был выше наблюдаемого в когорте с максимальным ответом в исследовании A2211, группа «ранней нагрузки», в которой пациенты получали 4 раза подкожно по 150 мг секукинумаба (в точке базовой линии, в 1-ю, 2-ю и 4-ю недели).
Данные анализа в первой конечной точке этого исследования явно подразумевают, что клинический эффект однократной инъекции секукинумаба 25 мг s.c. аналогичен плацебо. Хотя ответы в когорте 3×25 мг по численным значениям немного выше, чем в группе плацебо, они не показывают никакой статистически достоверной разницы с плацебо. Обе когорты 3×75 мг и 3×150 мг показывают хорошие ответы PASI 75. Однако только в когорте 3×150 мг достигаются ответы PASI 90 более чем у 50% пациентов через 12 недель.
В некоторых из схем дозирования в исследовании CAIN457A2211 наблюдается эффект веса тела на ответ на лечение, причем субъекты, весящие меньше 90 кг, имеют заметно более высокий уровень ответов PASI 75 (таблица 9). Хотя этот эффект наблюдается для большинства когорт по дозам, разница в ответе между пациентами <90 кг относительно пациентов ≥90 кг в когортах 1×25 мг и 3×25 мг не сильно отличается от плацебо. Это является дополнительным подтверждением того, что эти низкие дозы не дают клинически значимого эффекта.
В общем, в CAIN457A2220 была выполнена задача по определению неэффективных схем дозирования секукинумаба (1×25 мг и 3×25 мг) при псориазе, и продемонстрировано, что для того чтобы получить хороший ответ PASI 75 на 12-й неделе, требуется по меньшей мере 3×150 мг. Так же как и другие испытания секукинумаба в лечении псориаза, это исследование подтвердило существование эффекта влияния веса тела на степень клинического эффекта при использовании исследуемых схем дозирования.
Пример 4
Создание модели и моделирование - улучшенные индукционные и поддерживающие схемы
Пример 4.3
Создание модели и моделирование
Взаимосвязь между дозой/схемой введения секукинумаба, его концентрацией в плазме и PASI-ответом была смоделирована с использованием популяционного анализа фармакокинетики/фармакодинамики. Модель строили постепенно и обновляли на основе данных из исследований CAIN457A2102, CAIN457A2103, CAIN457A2211, CAIN457A2212 и CAIN457A2220.
Исследования CAIN457A2102 и CAIN457A2212 описаны в примере 1; исследование CAIN457A2211 описано в примере 2. Исследование CAIN457A2220 описано в примере 3. В исследовании CAIN457A2103 оценивали абсолютную биодоступность секукинумаба после подкожного введения. Четырнадцать пациентов со среднетяжелым хроническим бляшковидным псориазом распределяли случайным образом, чтобы им вводили секукинумаб либо подкожно (150 мг, n=7), либо внутривенно (1 мг/кг, n=7) в 1-й день. Второе введение исследуемого препарата на 29-й день проводили через другой путь введения. За пациентами наблюдали до 12 недель после последней дозы. Местная переносимость секукинумаба, введенного под кожу, была превосходной без данных о сообщениях пациентов о болевой реакции или сообщении терапевта о реакциях в месте инъекции. Биодоступность секукинумаба, введенного подкожно, приблизительно составляла 60% по сравнению с внутривенным введением. Результаты поддерживали целесообразность подкожного введения секукинумаба.
Концентрационные профили секукинумаба описаны с помощью двухкамерной модели, с объединенной адсорбцией первого порядка для отражения подкожного введения и адсорбцией нулевого порядка для отражения внутривенного введения. Профили PASI описываются моделью обновления (непрямого ответа). Эффект лекарственного соединения влияет на модель обновления через Emax-функцию, зависящую от концентрации секукинумаба в центральной камере. Вариабельность между субъектами оценивали как случайный эффект на фармакокинетические параметры (клиренс, объем распределения, межкамерный клиренс, объем распределения в периферической камере, биодоступность и скорость всасывания), и на фармакодинамические параметры (kout скорости элиминации, стабильный уровень PASI и EC50).
На основе этой модели и ожидаемых конечных параметров было проведено моделирование для предсказания ожидаемого результата для предлагаемой схемы дозирования. Учитывали неопределенность фиксированных эффектов, а также параметры переменной случайных эффектов, путем отбора новых наборов параметров на повторное моделирование. Валидацию модели проводили с использованием стандартных способов оценки (анализа степени согласия, прогностических проверок и внешней валидации исходя из предполагаемых прогнозов).
Пример 4.3
Результаты моделирования
Тогда как 300 мг секукинумаба s.c. не тестировали во II фазе исследований на псориазе (хотя эту дозировку тестировали на ревматоидном артрите), пациенты получали более высокие дозы (до 3×10 мг/кг i.v.) в исследованиях на псориазе CAIN457A2212. Как продемонстрировано на фигуре 8, предполагаемая схема нагрузки с использованием 150 мг и 300 мг s.c. будет приводить к воздействию меньшего количества введенного препарата по сравнению с исследованием CAIN457A2212. Более конкретно, предполагаемая схема введения по 300 мг s.c. обеспечивает профиль воздействия, аналогичный введению 10 мг/кг i.v., одновременно позволяя избежать пиковых количеств препарата, и предполагается, что она будет давать уровень ответов PASI 75, аналогичный наблюдаемому при введении 10 мг/кг i.v. Поэтому, CAIN457A2304 продолжается со схемами нагрузки при подкожном введении с использованием дозировок 150 мг и 300 мг.
Предлагаемая схема индукции подтверждается дополнительными анализами на основе модели с использованием данных из четырех исследований псориаза (CAIN457A2102, CAIN457A2211, CAIN457A2212 и CAIN457A2220). Как видно из фигуры 9, прогнозируется, что предлагаемая схема индукции (еженедельно в течение пяти недель в течение недель 1, 2, 3, 4 и 5 с последующей дополнительной индукционной дозой в 9-ю неделю) обеспечивает заметно лучший уровень ответа PASI 75 через двенадцать недель лечения при сравнении с уровнями ответа, наблюдаемыми в исследовании CAIN457A2211. Прогнозируемая эффективность схемы дозирования по 75 мг, изображенная на фигуре 9, не является идеальной.
Предлагаемая поддерживающая схема также поддерживается анализами на основе модели. Для дозы 150 мг было смоделировано введение с фиксированными интервалами в четыре, восемь и двенадцать недель с результатами, показанными на фигуре 10. Можно увидеть, что только четырехнедельный интервал эффективно сохраняет ответ PASI 75 у большинства пациентов.
Пример 5
Исследование CAIN457A2304
Исследование CATN457A2304 спланировано как рандомизированое, двойное слепое, многоцентровое исследование подкожного введения секукинумаба либо через фиксированные интервалы, либо по поддерживающей схеме «лечение в начале рецидива» с целью демонстрации эффективности на Индекс площади и тяжести псориаза (PASI) и на показатель Исследовательской общей оценки (IGA), а также с целью оценки эффективности и переносимости препарата в течение срока до одного года, у пациентов со среднетяжелым хроническим бляшковидным псориазом.
После четырехнедельного скринингового периода, примерно 918 пациентов распределяли случайным образом в группы, получавшие секукинумаб в одной из двух доз (150 мг или 300 мг). В течение индукционной фазы секукинумаб будут вводить в 0-й, 1-й, 2-й, 3-й, 4-й и 8-й неделе. В конце индукционной фазы пациенты, которые демонстрировали ответ PASI 75 через двенадцать недель лечения, будут распределены случайным образом, чтобы получать секукинумаб каждые четыре недели (две различные дозировки, а именно - 150 мг или 300 мг), начиная с 12-й недели и до 48-й недели (с общей продолжительностью лечения, составляющей 52 недели), или чтобы получать секукинумаб по индивидуальной схеме лечения. В индивидуальной схеме лечения пациенты будут получать секукинумаб только в начале рецидива (определенного как потеря по меньшей мере 20% от максимального улучшения PASI, достигаемого ранее, и потеря ответа PASI 75); они затем будут продолжать получать секукинумаб каждые четыре недели до достижения ответа PASI 75, после чего у них повторно отменят лечение. Индивидуальные дозы будут равны дозам, которые пациенты получали и на которые отвечали в течение индукционного периода (т.е. 150 мг или 300 мг). Графическая иллюстрация исследования показана на фигуре 11.
Поскольку основной задачей этого исследования, CAIN457A2304, является сравнение двух различных поддерживающих схем, и поскольку ожидается, что только очень небольшое число получающих плацебо пациентов вошли бы в поддерживающую часть исследования (т.е. после первых двенадцати недель лечения), исследование не содержит группы плацебо. После окончания периода поддерживающего лечения пациенты будут удовлетворять критериям для вхождения в добавочное исследование CAIN457A2304E1 или для вхождения в двенадцатинедельный период последующего наблюдения после последнего введения исследуемого препарата.
Дополнительное исследование к исследованию CAIN457A2304 (CAIN457A2304E1) спланировано как рандомизированное, двойное слепое, многоцентровое исследование подкожного введения секукинумаба либо через фиксированные интервалы, либо по поддерживающей схеме «лечение в начале рецидива» с целью демонстрации эффективности на Индекс площади и тяжести псориаза (PASI) и на показатель Исследовательской общей оценки (IGA), а также с целью оценки эффективности и переносимости препарата в течение дополнительного года, у пациентов со среднетяжелым хроническим бляшковидным псориазом.
Пациенты, которые участвовали в исследовании CAIN457A2304 и завершили поддерживающий период лечения соответствующего исследования, будут удовлетворять критериям вхождения в это дополнительное исследование. Пациенты будут оставаться на дозировке (т.е. либо на 150 мг, либо 300 мг секукинумаба) и схеме (т.е. либо «введение через фиксированные интервалы», либо «введение в начале рецидива»), которые они получали в течение основного исследования. В настоящий момент планируется, что продолжительность лечения в дополнительном исследовании будет составлять по меньшей мере 52 недели.
Пример 6
Фармакокинетическая (ФК) информация по секукинумабу
На основе данных, полученных из различных исследований, включая описанные в вышеприведенных примерах, для секукинумаба приведена следующая ФК-информация (таблица 10).
|
В дополнение было определено, что секукинумаб имеет Tmax примерно 7-8 дней и период полувыведения примерно 30 дней. Фармакокинетическую информацию, приведенную в этом примере, можно использовать для подбора различных схем дозирования для лечения псориаза в начале рецидива, например, введения дозировки молекулы, связывающей IL-17 (например, антитела к IL-17, например, секукинумаба), отличающейся от дозировки, используемой в примерах, или введения дозировки, такой же как используемая в примерах, но которую вводят во временной точке, отличающейся от временных точек, используемых в примерах. Ожидается, что при сохранении такого же ФК-профиля, даже посредством изменения схемы дозирования, специалист в данной области будет способен использовать молекулу, связывающую L-17 (например, антитело к IL-17, например, секукинумаб), для лечения псориаза, включая лечение псориаза в начале рецидива.