Результат интеллектуальной деятельности: КОМБИНАЦИЯ, ВКЛЮЧАЮЩАЯ ИНГИБИТОР ЦИКЛИНЗАВИСИМОЙ КИНАЗЫ 4 ИЛИ ЦИКЛИНЗАВИСИМОЙ КИНАЗЫ 6 (CDK4/6) И ИНГИБИТОР mTOR, ДЛЯ ЛЕЧЕНИЯ РАКА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Комбинация ингибитора мишени рапамицина в клетках млекопитающих (mTOR) и ингибитора циклинзависимой киназы 4/6 (CDK4/6) для лечения солидных опухолей и гематологических злокачественных опухолей. Настоящее изобретение также относится к использованию их комбинации для лечения гиперпролиферативных заболеваний, таких как рак.
УРОВЕНЬ ТЕХНИКИ, ОТНОСЯЩИЙСЯ К ИЗОБРЕТЕНИЮ
Развитие опухоли тесно связано с генетическим изменением и нарушением регуляции CDK и их регуляторов, что наводит на мысль, что ингибиторы CDK могут быть применимы в качестве противораковых терапевтических средств. Действительно, предварительные результаты показывают, что трансформированные и нормальные клетки различаются по своей потребности, например, в комплексе циклин D/CDK4/6, и что возможна разработка новых противоопухолевых средств, лишенных системной токсичности, наблюдаемой у обычных цитотоксических и цитостатических лекарств.
Функция CDK состоит в фосфорилировании, а потому в активации или дезактивации некоторых белков, включая, например, белки ретинобластомы, ламины, гистон H1 и компоненты митотического веретена. Каталитическая стадия, опосредуемая CDK, включает реакцию переноса фосфата от АТФ к макромолекулярному субстрату фермента. Было обнаружено, что несколько групп соединений (рассмотренные, например, в Fischer, P.M. Curr. Opin. Drug Discovery Dev. 2001, 4, 623-634), обладают антипролиферативными свойствами в силу CDK-специфического антагонизма АТФ.
На молекулярном уровне опосредование активности комплекса CDK/циклин требует серии событий, стимулирующих и ингибирующих фосфорилирование или дефосфорилирование. Фосфорилирование CDK осуществляется группой CDK-активирующих киназ (CAK) и/или киназами, такими как wee1, Myt1 и Mik1. Дефосфорилирование осуществляется фосфатазами, такими как cdc25 (a и c), pp2a или KAP.
Активность комплекса CDK/циклин может дополнительно регулироваться двумя семействами эндогенных клеточных белковоподобных ингибиторов: семейством Kip/Cip или семейством INK. Белки INK специфически связывают CDK4 и CDK6. p16ink4 (также известный как MTS1) представляет собой потенциальный ген-супрессор опухолевого роста, который мутирован или делетирован у большого числа первичных злокачественных опухолей. Семейство Kip/Cip включает белки, такие как p21cip1,Waf1, p27Kip1 и p57kip2, где p21 индуцируется p53 и способен инактивировать комплекс CDK2/циклин(E/A). Нетипично низкие уровни экспрессии p27 наблюдаются при раке молочной железы, толстой кишки и предстательной железы. И наоборот, было показано, что повышенная экспрессия циклина E в солидных опухолях коррелирует с неблагоприятным для пациента прогнозом. Повышенная экспрессия циклина D1 была ассоциирована с карциномами пищевода, молочной железы, плоскоклеточной карциномой и немелкоклеточной карциномой легкого.
Основные роли CDK и ассоциированных с ними белков в координировании и управлении клеточным циклом в пролиферирующих клетках были кратко изложены выше. Также были описаны некоторые биохимические каскады реакций, в которых CDK играют основную роль. Поэтому потенциально весьма желательно развитие монотерапий для лечения пролиферативных нарушений, таких как рак, с использованием терапевтических средств, генетически нацеленных на CDK или на конкретную CDK. Таким образом, существует постоянная потребность в обнаружении новых терапевтических средств для лечения болезней человека.
mTOR представляет собой протеинкиназу, преимущественно обнаруживаемую в цитоплазме клетки. Она действует как центральный регулятор многих биологических процессов, связанных с пролиферацией клетки, ангиогенезом и клеточным метаболизмом. mTOR оказывает свое действие, главным образом, путем включения и выключения трансляционного аппарата клетки, который включает рибосомы и отвечает за синтез белка. mTOR представляет собой важную внутриклеточную точку конвергенции для целого ряда клеточных сигнальных путей. mTOR выполняет свою регуляторную функцию в ответ на активирующие или ингибирующие сигналы, переданные по указанным путям, которые расположены в клетке выше mTOR. Указанные разнообразные сигнальные пути активируются целым рядом факторов роста (включая факторы роста эндотелия сосудов (VEGF), тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста 1 (IGF-1)), гормонами (эстроген, прогестерон) и наличием или отсутствием питательных веществ (глюкоза, аминокислоты) или кислорода. Один или несколько из указанных сигнальных путей могут быть аномально активированы у пациентов со многими различными типами рака, что приводит к нарушению регуляции пролиферации клеток, ангиогенезу опухоли и аномальному клеточному метаболизму.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к комбинации, включающей первое средство, которое ингибирует каскад реакций с участием CDK4/6, и второе средство, которое ингибирует mTOR, т.е. киназную активность mTOR и ее нижележащих эффекторов. Согласно другому аспекту, настоящее изобретение относится к комбинациям, включающим фармацевтические композиции, содержащие терапевтически эффективное количество первого средства, которое ингибирует CDK4/6, второго средства, которое ингибирует киназную активность mTOR и нижележащих эффекторов, и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к использованию терапевтически эффективного количества комбинации, содержащей первое средство, которое ингибирует каскад реакций CDK4/6, и второе средство, которое ингибирует киназную активность mTOR и нижележащих эффекторов, или их фармацевтически приемлемой соли или фармацевтической композиции, в производстве лекарства для лечения рака.
Настоящее изобретение обладает терапевтическим применением при лечении рака, в частности, рака, позитивного по белку ретинобластомы (белок-супрессор роста ретинобластомы или pRb). Типы такого рака включают лимфому из клеток мантийной зоны, рак поджелудочной железы, рак молочной железы, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода и липосаркому.
Описанные выше комбинации и композиции могут вводиться в систему, состоящую из клеток или тканей, а также пациенту-человеку или животному.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
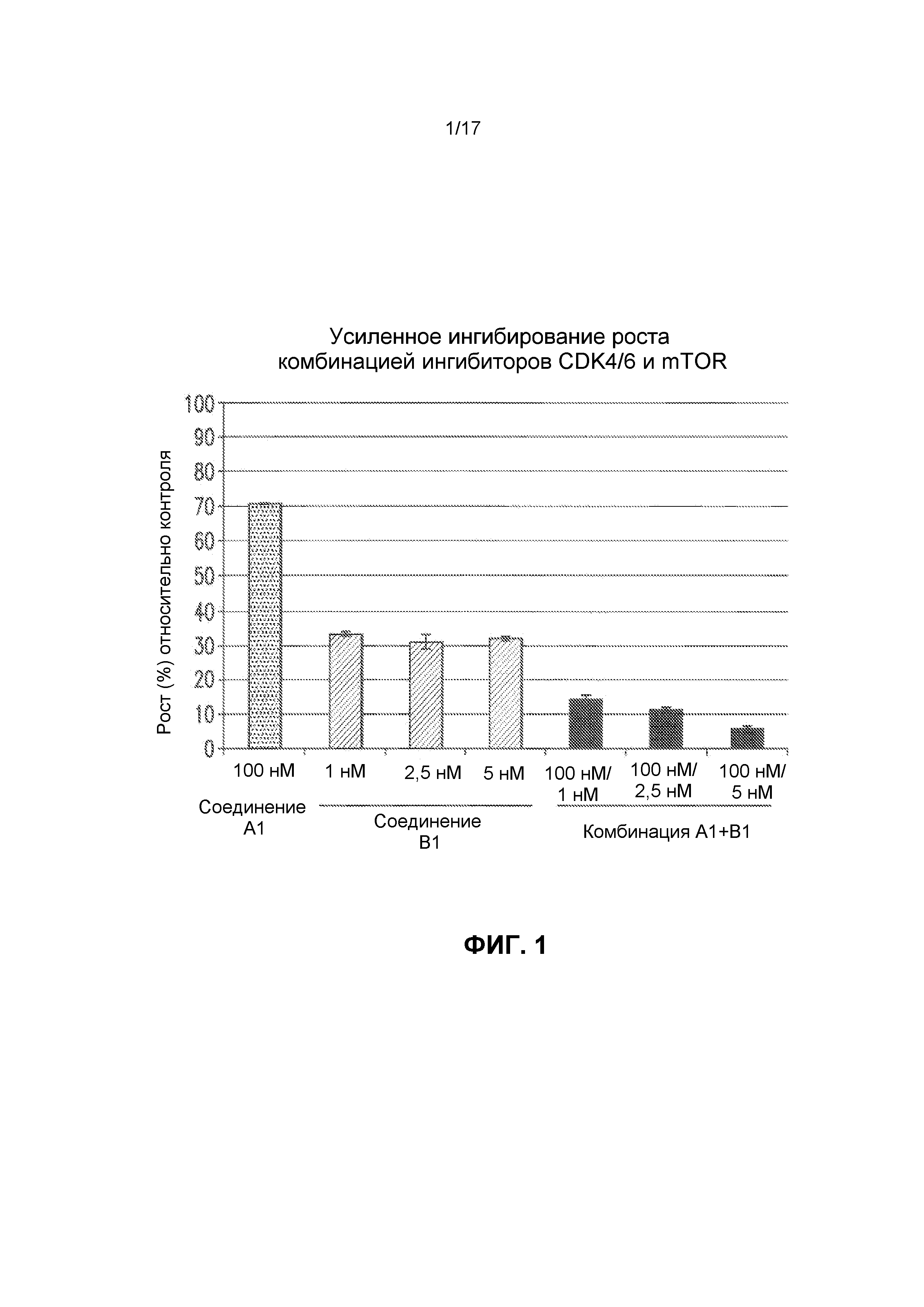
На фиг.1 представлено усиление ингибирования роста комбинациями ингибиторов CDK4/6 и mTOR. Для оценки эффектов на рост клеток использовали линию лимфомных клеток из мантийной зоны Jeko-1. Представлен % роста по сравнению с контролем (100%). Соединение A1 представляет собой ингибитор CDK4/6, а соединение B1 представляет собой ингибитор mTOR. Комбинации A1+B1 ингибируют рост, что наблюдается при одновременной обработке клеток линии Jeko-1 соединениями A1 и B1. Фактические использованные концентрации представлены на чертежах.
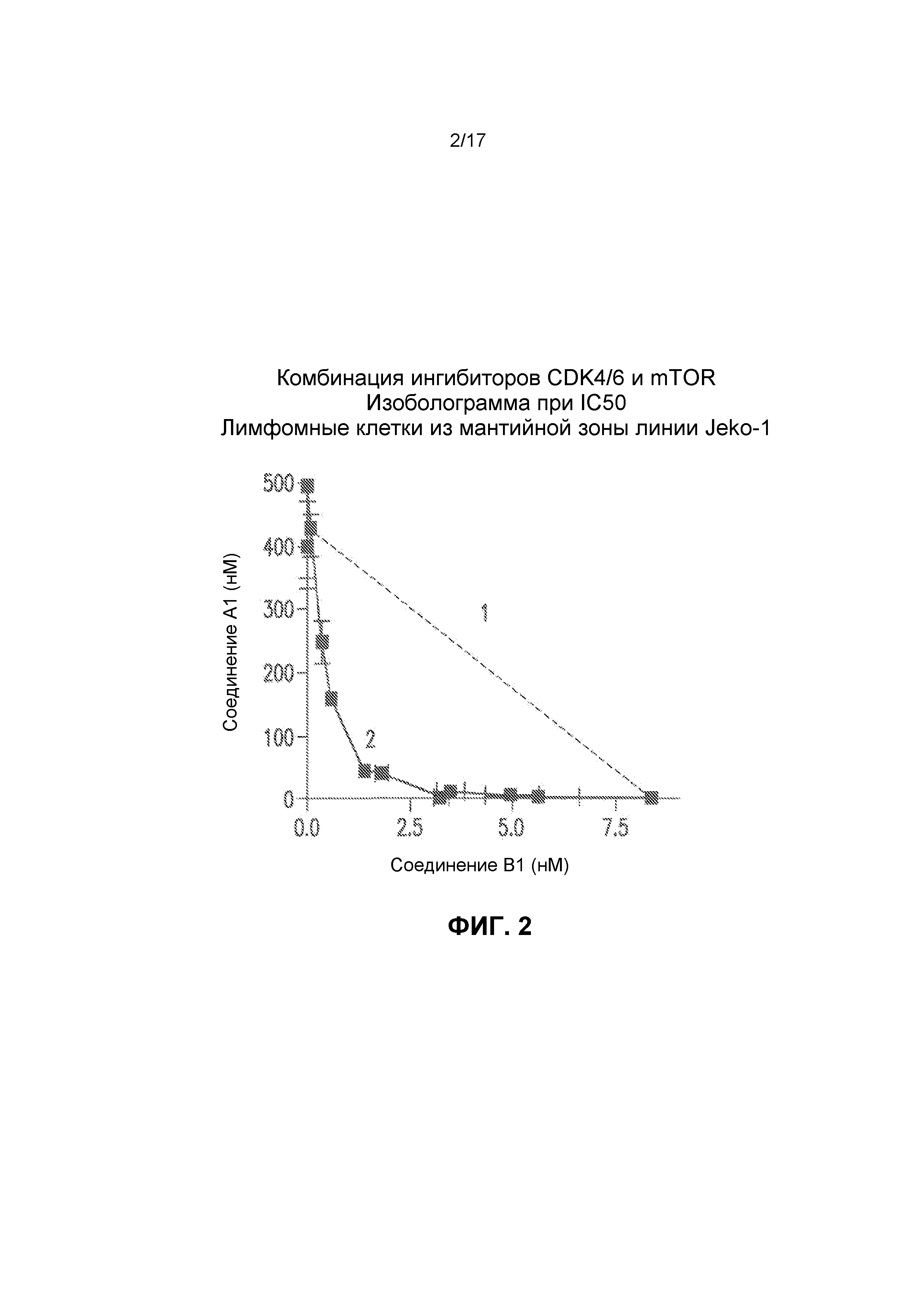
Фиг.2 представляет собой изоболограмму анализа комбинации ингибиторов CDK4/6 и mTOR в линии лимфомных клеток из мантийной зоны Jeko-1. Соединения A1 и B1 представляют собой ингибиторы CDK4/6 и mTOR, соответственно. Представленный чертеж строили с использованием концентраций, которые обеспечивали 50% ингибирование роста. Пунктирная линия 1 представляет собой значения ингибирования роста, спрогнозированные для простой аддитивности, когда эффекты A1 и B1 объединены. Линия 2 представляет собой наблюдаемые значения ингибирования роста, показывающие, что комбинация A1+B1 приводит к сильному синергическому ингибированию роста.
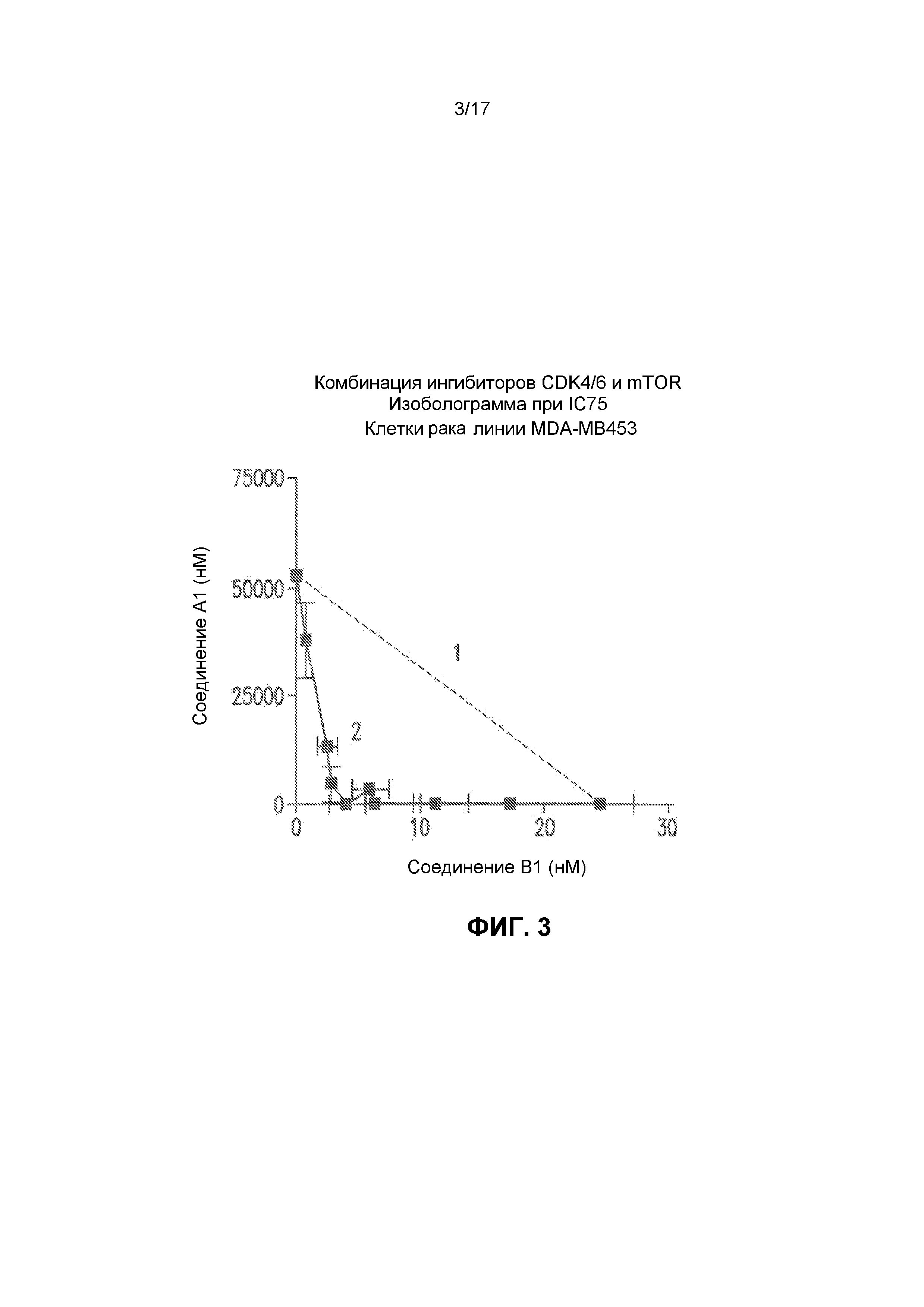
Фиг.3 представляет собой изоболограмму анализа комбинации ингибиторов CDK4/6 и mTOR в клеточной линии рака молочной железы MDA-MB453. Соединения A1 и B1 представляют собой ингибиторы CDK4/6 и mTOR, соответственно. По аналогии с представленной выше фиг.2, представленный чертеж строили с использованием концентраций, которые обеспечивали 50% ингибирование роста, причем пунктирная линия 1 представляет собой значения ингибирования роста, спрогнозированные для простой аддитивности. Линия 2 представляет собой наблюдаемые ингибирования роста, показывающие, что комбинация A1+B1 приводит к сильному синергическому ингибированию роста.
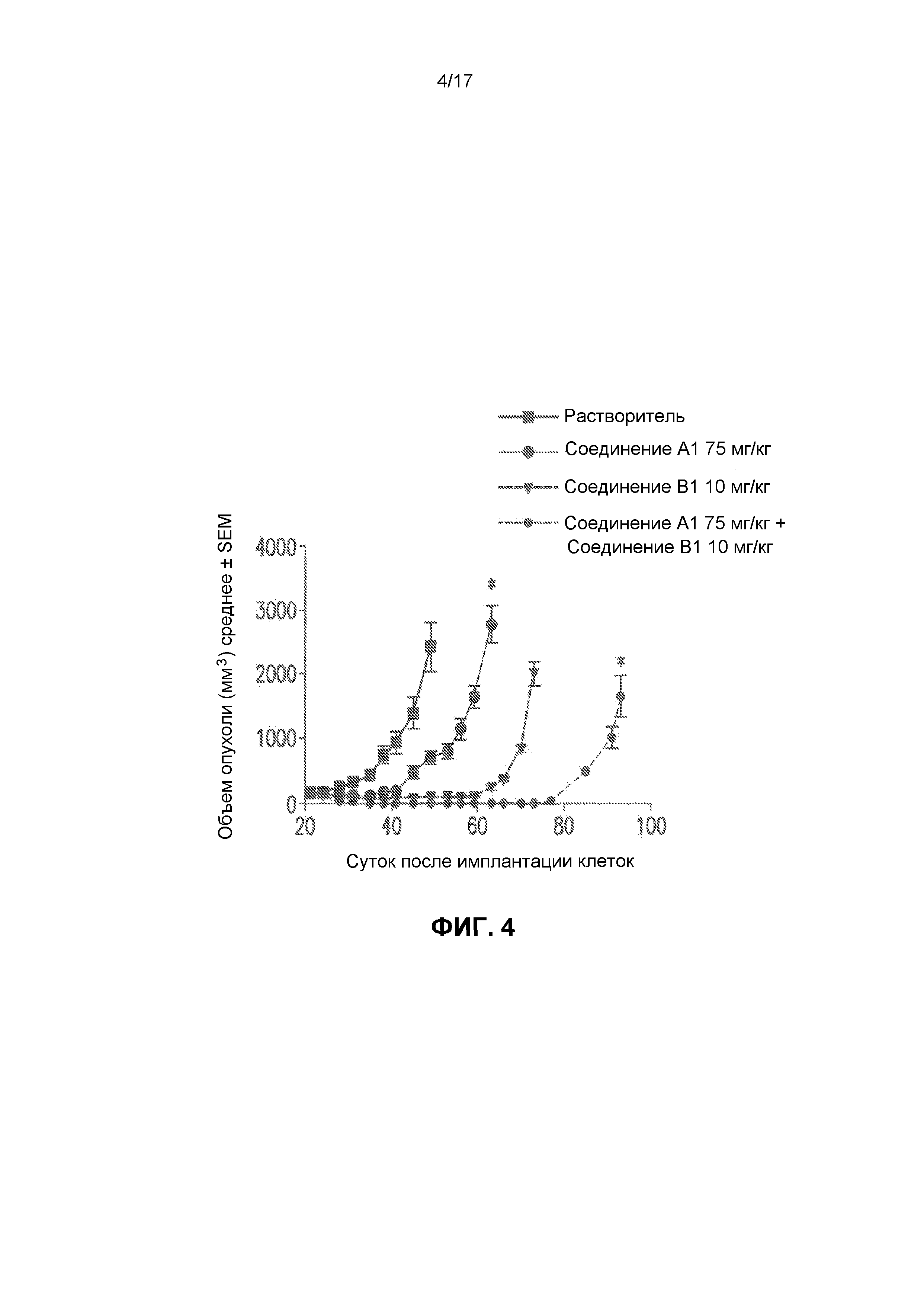
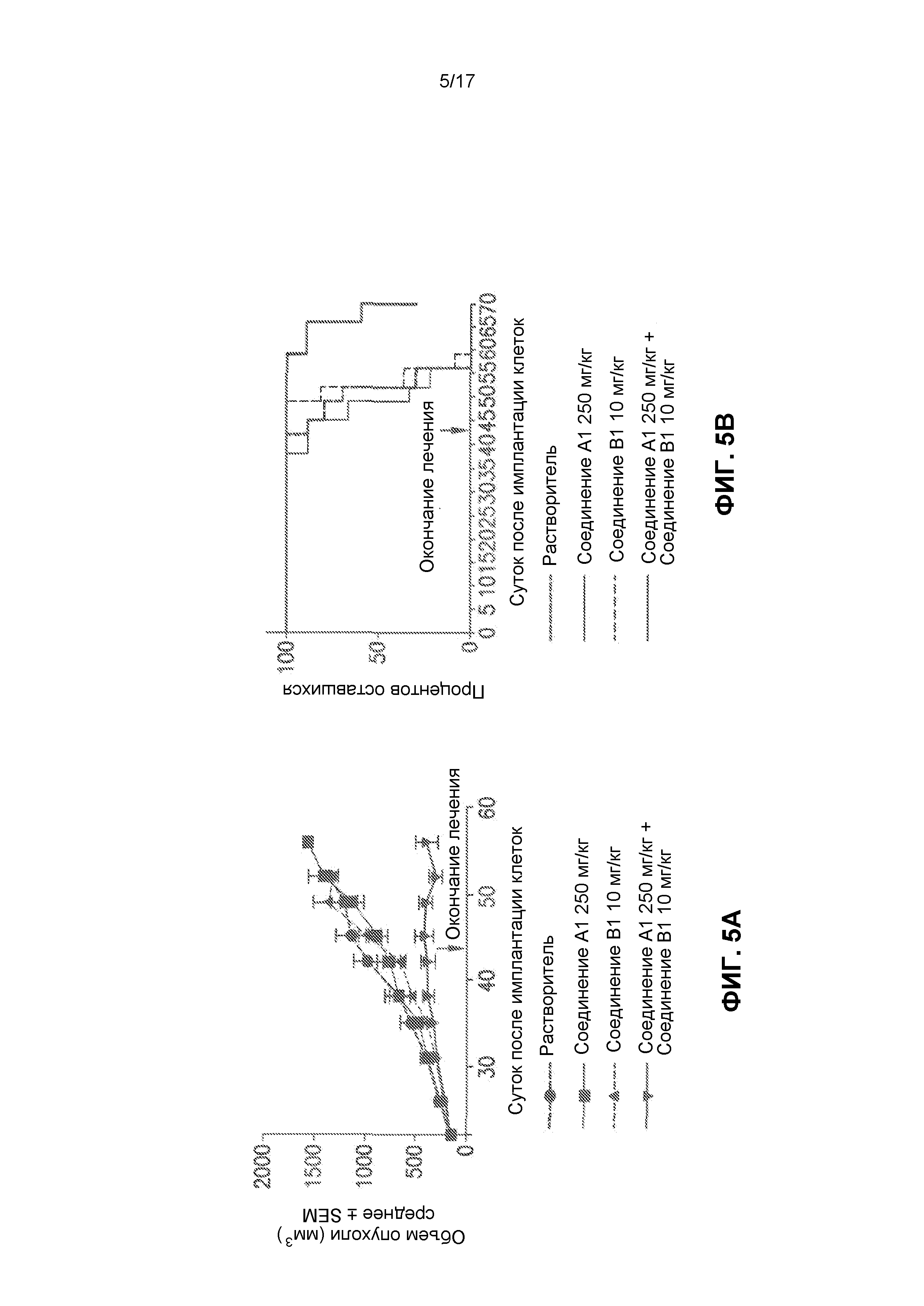
На фиг.4 представлено, что комбинация соединения A1 с соединением B1 усиливает задержку роста опухоли в ксенотрансплантационной модели с линией лимфомных клеток из мантийной зоны Jeko-1. Введение лекарственных средств прекращали спустя 35 суток после начала терапии (56 суток после имплантации), и позволяли опухолям повторно расти. Группа с введением комбинации обладала значительно усиленной задержкой роста опухоли (20 суток).
Фиг.5 представляет собой эффект комбинации соединения A1 с соединением B1, которая усиливает задержку и ингибирование роста опухоли в ксенотрансплантационной модели с клеточной линией карциномы поджелудочной железы PANC-1, применительно к объему опухоли (фиг. 5А) и проценту выживаемости (фиг. 5B). Введение лекарственных средств прекращали спустя 22 суток после начала лечения, и позволяли опухолям повторно расти. Группа с введением комбинации обладала значительно усиленной задержкой роста опухоли (18 суток).
Фиг.6 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A1 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
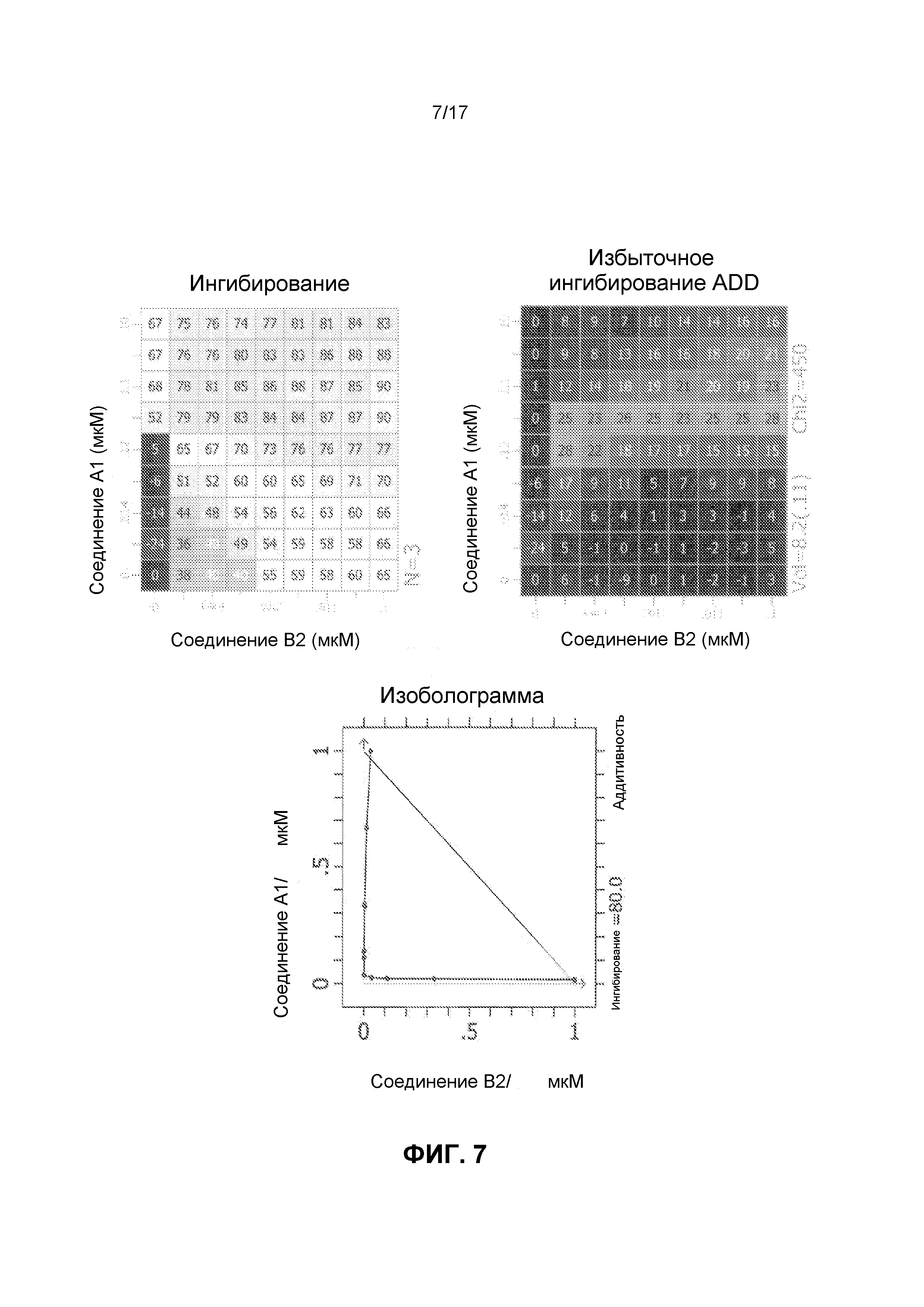
Фиг.7 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A1 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
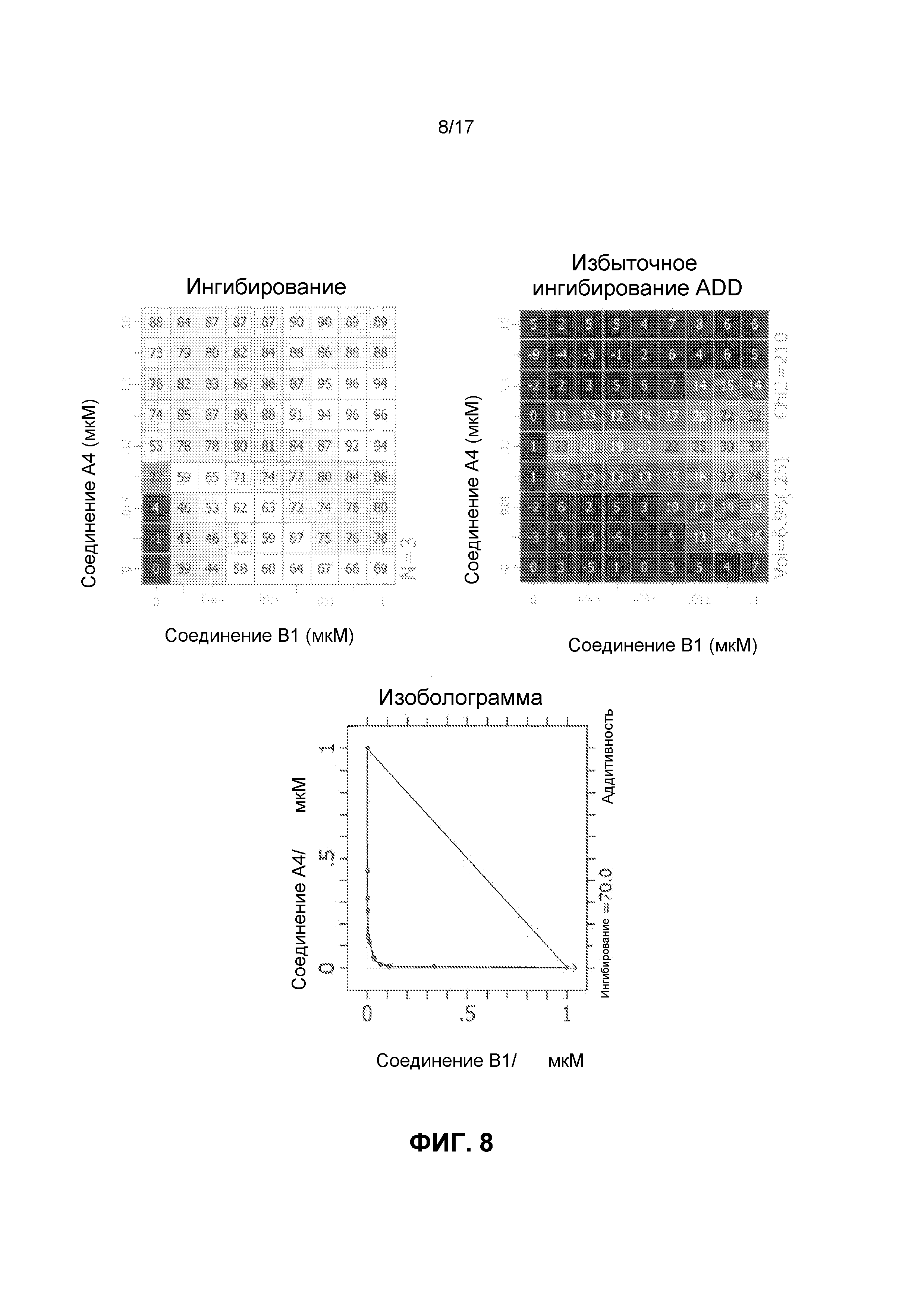
Фиг.8 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A4 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
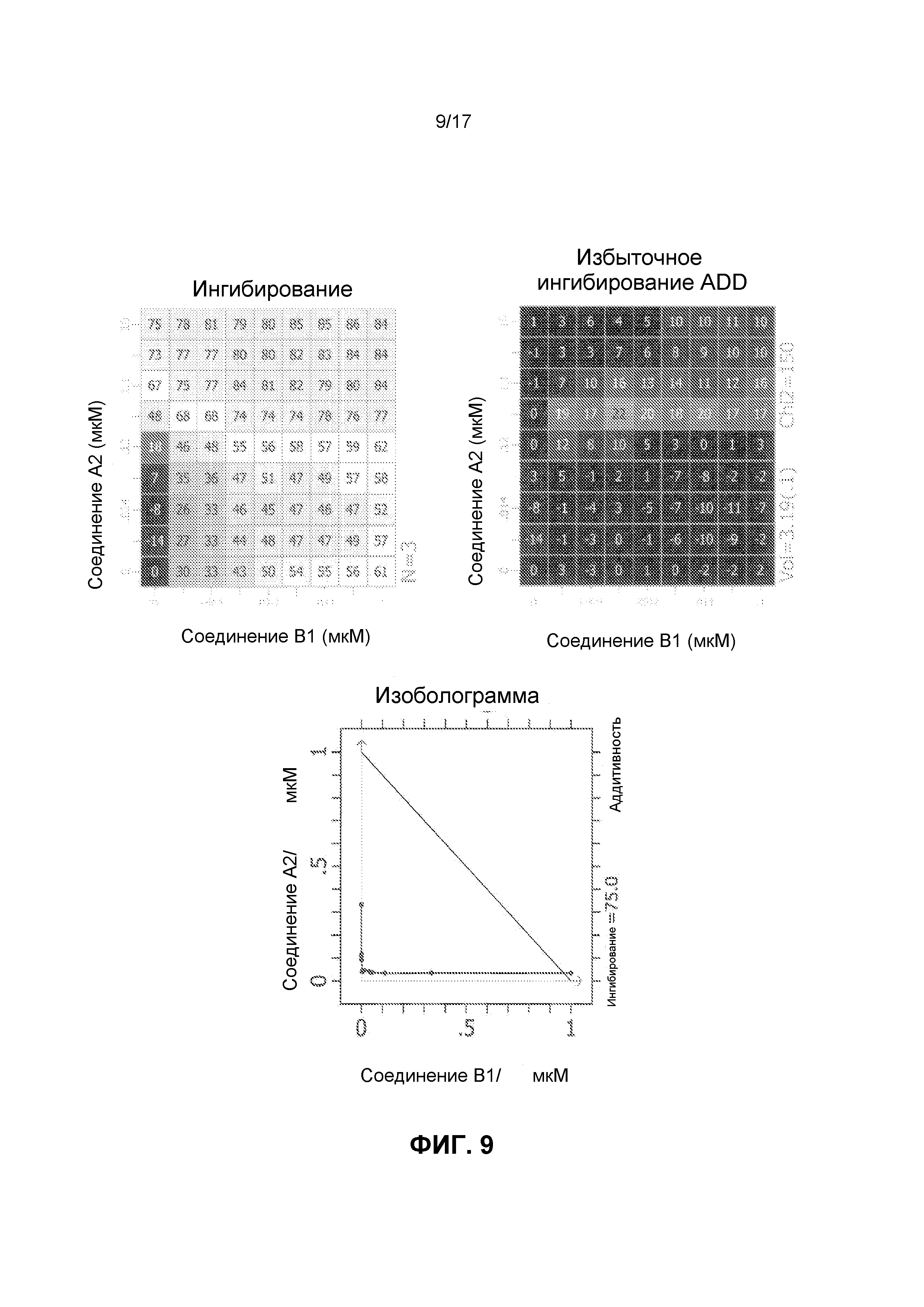
Фиг.9 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A2 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.10 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A3 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
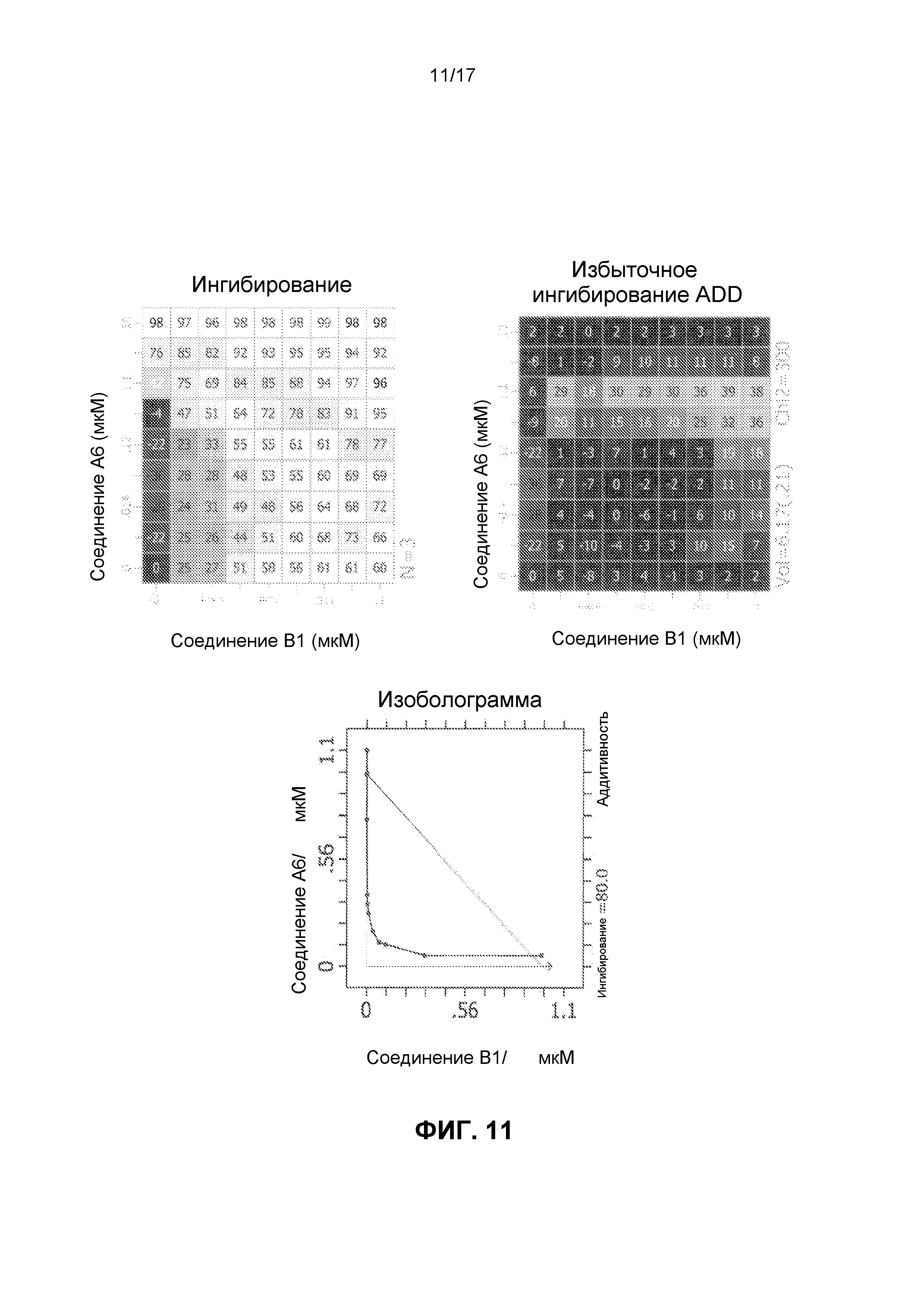
Фиг.11 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A6 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
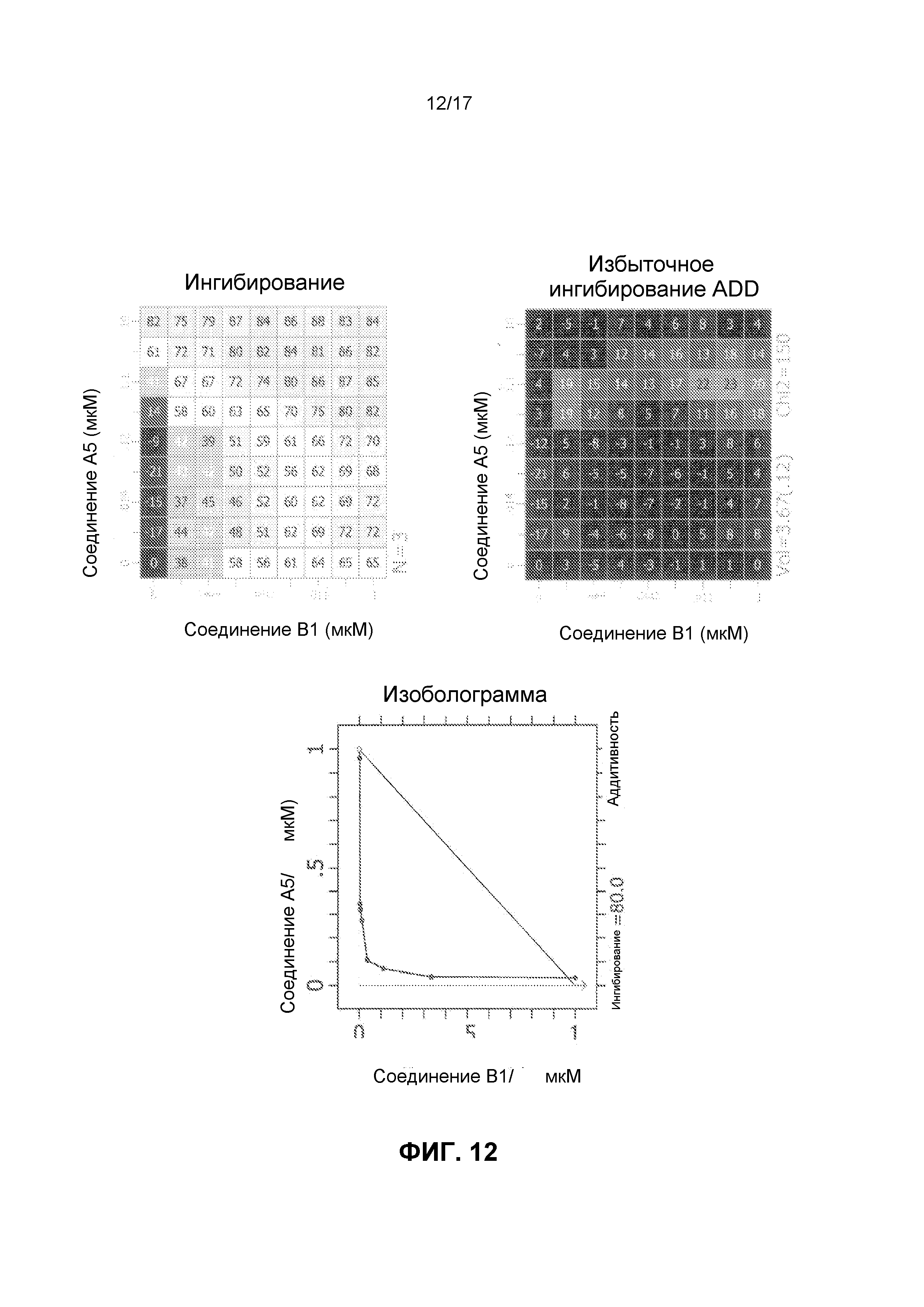
Фиг.12 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A5 и ингибирующего mTOR соединения B1 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.13 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A4 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
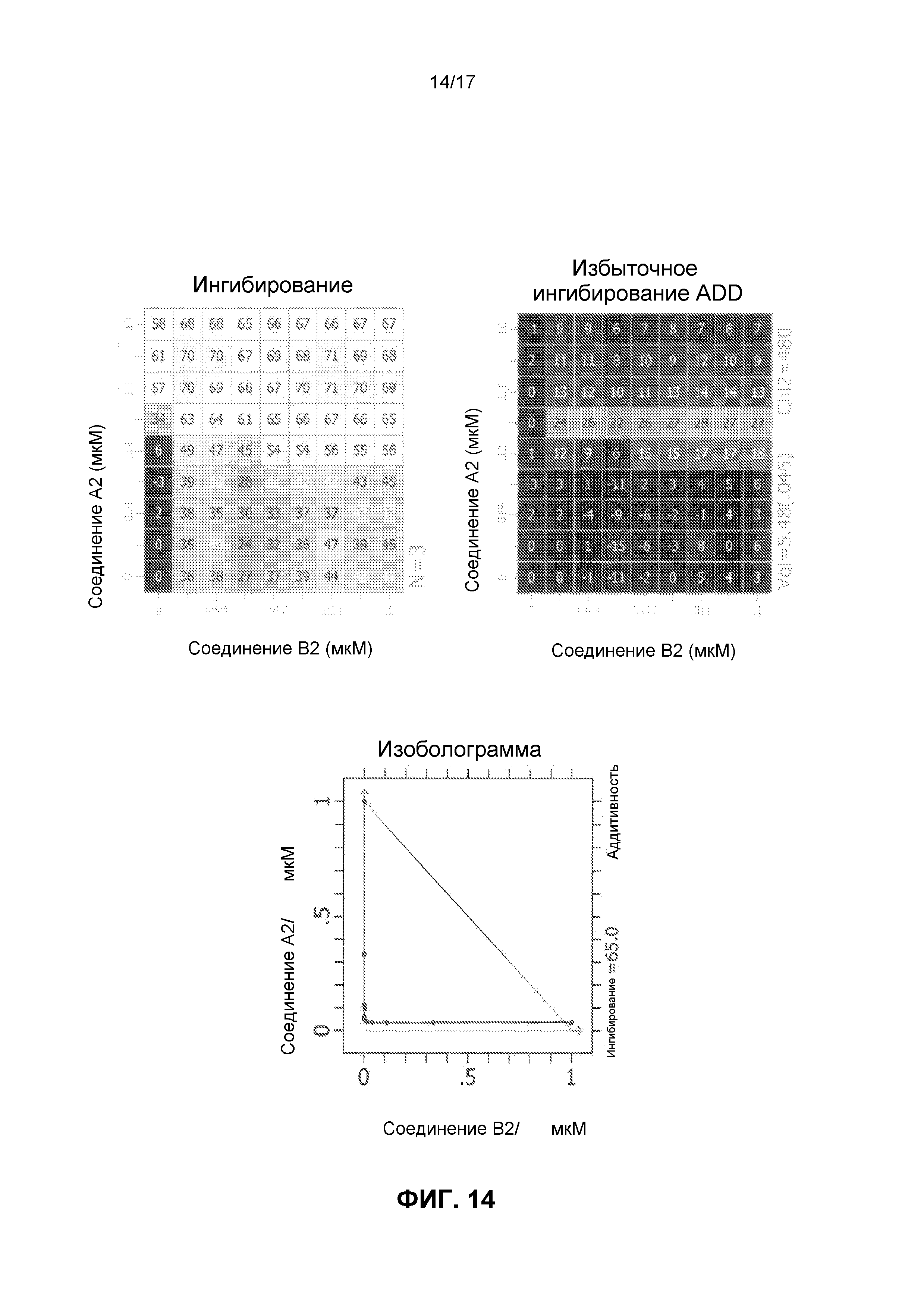
Фиг.14 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A2 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
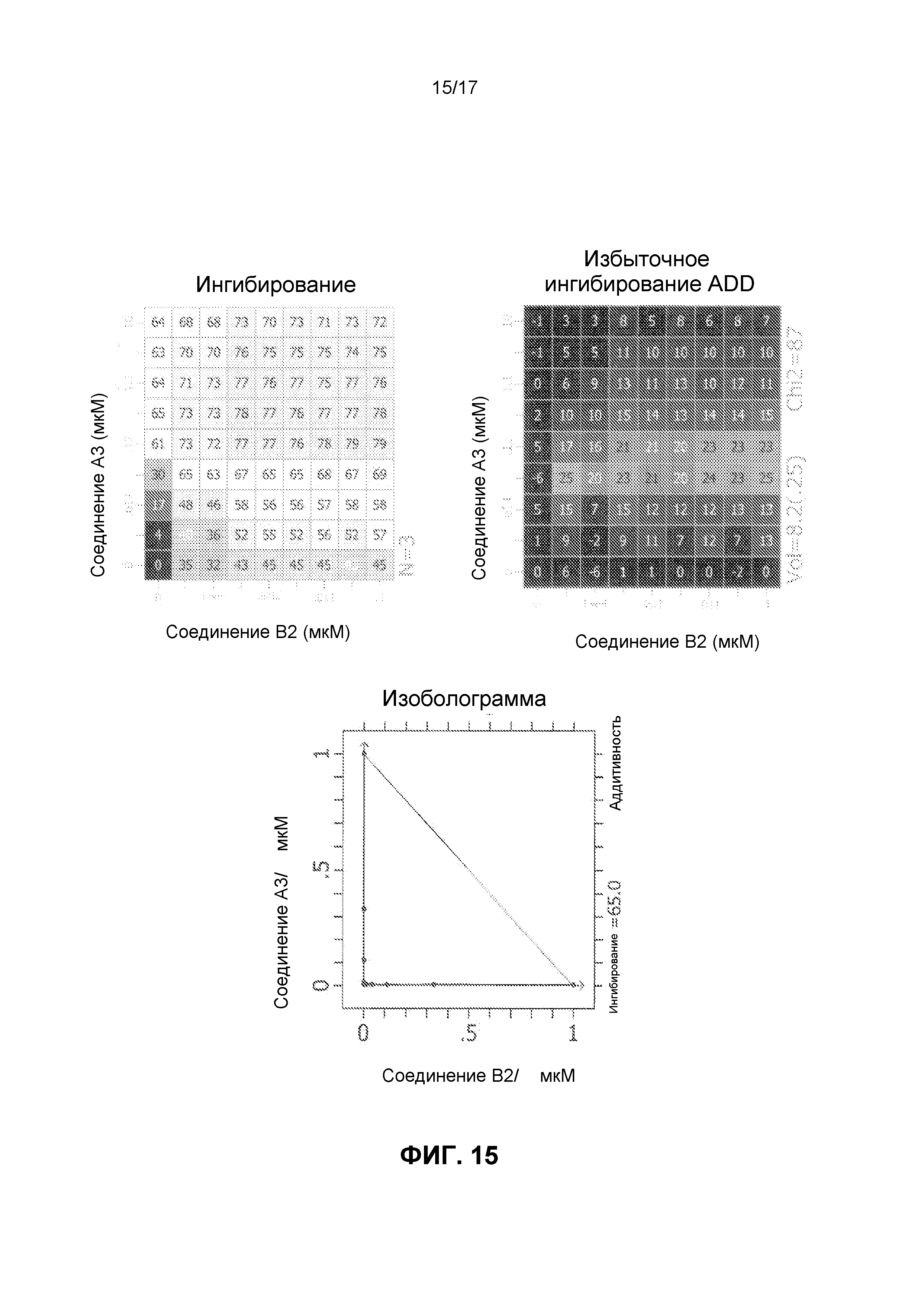
Фиг.15 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A3 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
Фиг.16 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A6 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
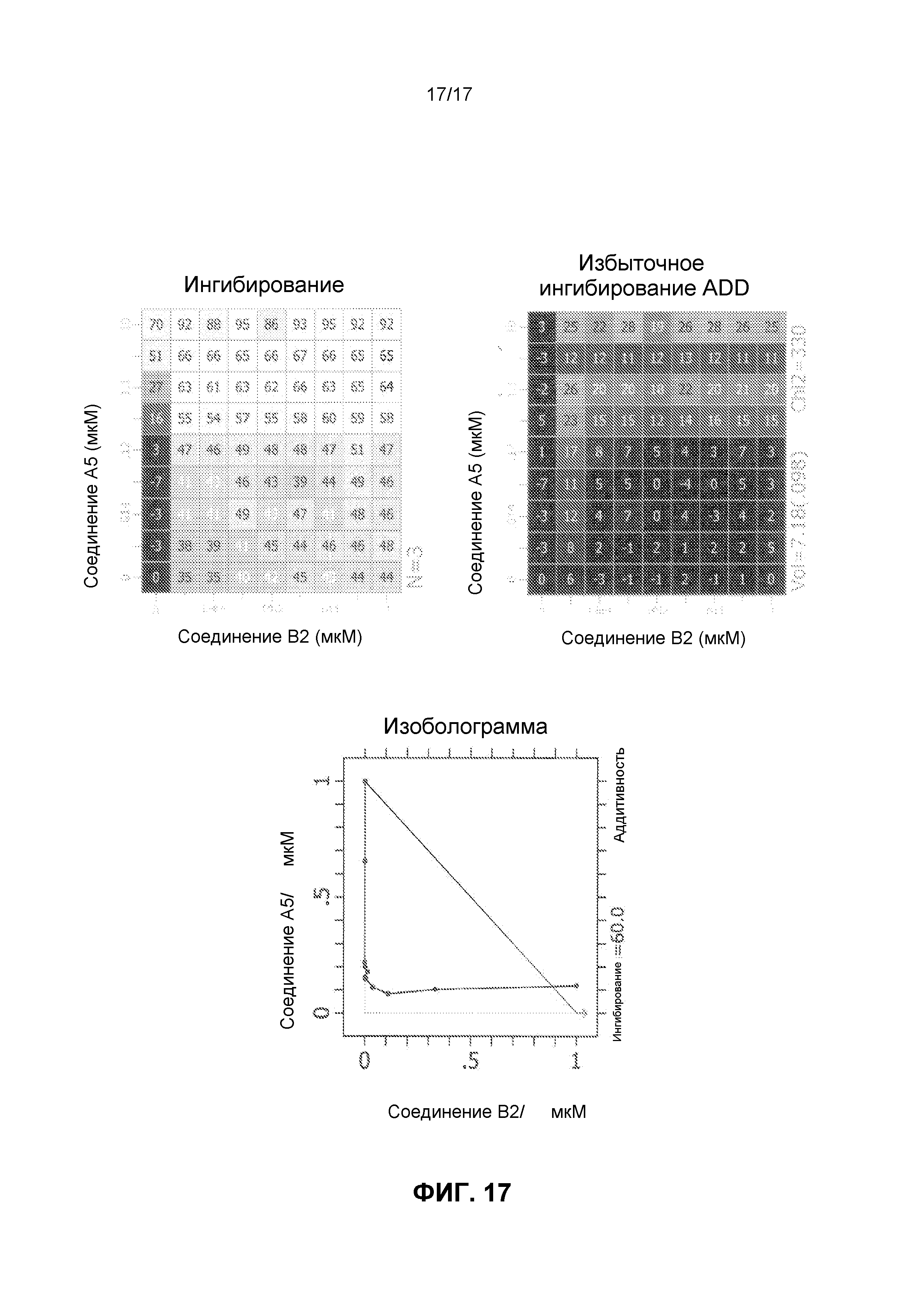
Фиг.17 иллюстрирует матрицы ингибирования и избыточного ингибирования ADD, созданные программным обеспечением CHALICE из полученных значений ингибирования, при использовании комбинации ингибирующего CDK4/6 соединения A5 и ингибирующего mTOR соединения B2 для обработки клеток линии Jeko-1, а также изоболограммы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Последовательность клеточного цикла у млекопитающих представляет собой жестко контролируемый процесс, при котором переходы между различными фазами происходят высокоупорядоченным образом и контролируются в многочисленных контрольных точках. Белок ретинобластомы (pRb) представляет собой белок контрольной точки при переходе от фазы G1 к фазе S, который ассоциирован с семейством факторов транскрипции E2F для предотвращения их активности в отсутствие соответствующих стимулов роста. При стимуляции митогеном покоящиеся клетки начинают вхождение в фазу S с помощью только что синтезированных D-циклинов, которые являются активаторами циклинзависимых киназ 4 и 6 (CDK4/6). После связывания с циклинами CDK4/6 деактивируют белок pRb посредством фосфорилирования, и это высвобождает E2F для прямой транскрипции генов, необходимых для фазы S. Полная дезактивация pRb требует фосфорилирования как комплекса циклин D/CDK4/6, так и комплекса циклин E/CDK2, где фосфорилирование CDK4/6 в конкретных сайтах pRb (Ser780, Ser795), как было показано, является необходимым условием для фосфорилирования комплекса циклин E/CDK2. Помимо D-циклинов, активность CDK4/6 регулируется p16, кодируемым геном INK4a, который ингибирует киназную активность. Белки CIP/KIP, которые являются ингибиторами комплекса циклин E/CDK2, также связываются с комплексом циклин D/CDK4/6, и это приводит к дальнейшей активации CDK2 путем изолирования CIP/KIP от их мишени. Поэтому комплекс циклин D/CDK4/6 представляет собой ключевой ферментный комплекс, который регулирует переход от фазы G1 к фазе S.
Путь D-циклин-CDK4/6-INK4a-pRb повсеместно нарушается для благоприятствования пролиферации клеток при злокачественных опухолях. В большинстве случаев (~80%), злокачественные опухоли поддерживают функциональность pRb и используют различные механизмы для увеличения активности киназы CDK4/6. Одним из наиболее распространенных процессов является инактивация p16 посредством мутаций, делеций и эпигенетического сайленсинга. Действительно, функциональное отсутствие p16 часто наблюдается в значительной доле случаев немелкоклеточного рака легкого, меланомы, рака поджелудочной железы и мезотелиомы. В совокупности с наблюдением, что специфическая мутация гена CDK4 (CDKR24C), который придает резистентность связыванию с p16, как было обнаружено, играет причинную роль в наследственной меланоме, преимущество в росте, обеспечиваемое бесконтрольной активностью CDK4/6, по-видимому, является одним из ключевых элементов, ассоциированных с развитием опухоли.
Другим механизмом усиления киназной активности является увеличение относительного содержания D-циклинов, и это достигается путем транслокации, амплификации и повышенной экспрессии гена. При большинстве лимфом из клеток мантийной зоны ген циклина D1 транслоцирован на тяжелую цепь иммуноглобулина, и это аберрация приводит к конститутивной экспрессии гена, приводящей к неконтролируемой пролиферации клеток. Транслокацию также наблюдают при многих случаях множественной миеломы. Пример амплификации гена наблюдается при плоскоклеточном раке пищевода, где о наличии амплификаций циклина D1 сообщалось приблизительно для 50% случаев. Это наводит на мысль, что большая доля случаев рака пищевода может быть высоко зависимой от активированных на рост киназ. Амплификация циклина D1 также часто обнаруживается при раке молочной железы. В дополнение к генетическим дефектам, напрямую связанным с геном циклина D1, его транскрипция также может быть чрезвычайно повышена при помощи активированных онкогенов, которые являются расположенными выше него регуляторами генов. Было показано, что активированные онкогены Ras или Neu способствуют раку молочной железы у мышей путем преимущественного повышения экспрессии циклина D1. Супрессия содержания циклина D1 или ингибирование киназной активности были способны предотвратить рост опухоли, как в фазе инициации, так и в фазе стабилизации, демонстрируя, что неконтролируемая CDK4/6 является ключевым элементом в развитии рака. Другие активирующие аберрации митогенных каскадов реакций, такие как V600E B-Raf в MAPK и делеции PTEN в PI3K, также увеличивают содержание D-циклинов с ускорением пролиферации, что наводит на мысль, что CDK4/6 также может иметь ключевое значение для злокачественных опухолей, характеризующихся… Наконец, кодирующие CDK4 и 6 гены также амплифицированы в подгруппе бластом человека. Ген CDK4 амплифицирован в 100% случаев липосарком наряду с геном MDM2, тогда как ген CDK6 часто амплифицирован при T-LBL/ALL. В совокупности, CDK4/6, по-видимому, является ключевым белком, необходимым для пролиферации множества видов рака у человека с функциональным pRb, включая лимфому из клеток мантийной зоны, рак поджелудочной железы, рак молочной железы, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода и липосаркому.
Первый общий вариант осуществления настоящего изобретения
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы I:
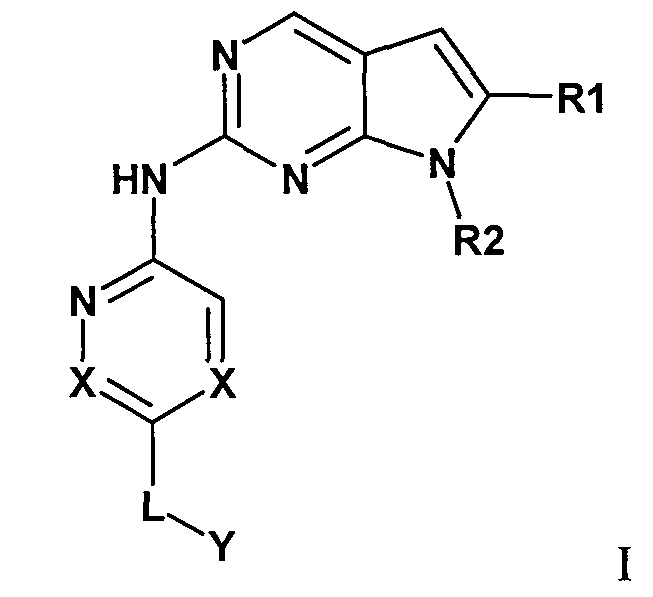
или его фармацевтически приемлемую соль, где:
X представляет собой CR9 или N;
R1 представляет собой C1-8алкил, CN, C(О)OR4 или CONR5R6, 5-14-членную гетероарильную группу или 3-14-членную циклогетероалкильную группу;
R2 представляет собой C1-8алкил, C3-14циклоалкил или 5-14-членную гетероарильную группу, и где R2 может быть замещен одним или несколькими C1-8алкилами или OH;
L представляет собой связь, C1-8алкилен, C(O) или C(О)NR10, и где L может быть замещенным или незамещенным;
Y представляет собой H, R11, NR12R13, OH, или Y представляет собой часть следующей группы
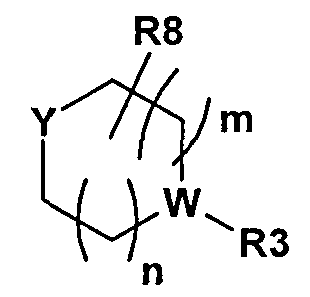 ,
,
в которой Y представляет собой CR9 или N;
в которой может содержаться 0-3 R8, и R8 представляет собой C1-8алкил, оксо, галоген, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу;
W представляет собой CR9 или N;
R3 представляет собой H, C1-8алкил, C1-8алкилR14, C3-14циклоалкил, C(О)C1-8алкил, C1-8галогеналкил, C1-8алкилОН, C(О)NR14R15, C1-8цианоалкил, C(О)R14, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(О)OR14, NR14R15, SO2C1-8алкил, C1-8алкилС3-14циклоалкил, C(О)C1-8алкилС3-14циклоалкил, C1-8алкокси или OH, который может быть замещенным или незамещенным, если R3 не представляет собой H;
R9 представляет собой H или галоген;
каждый R4, R5, R6, R7, R10, R11, R12, R13, R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, 3-14-членной циклогетероалкильной группы, C6-14арильной группы, 5-14-членной гетероарильной группы, алкокси, C(О)H, C(N)OH, C(N)OCH3, C(О)C1-3алкила, C1-8алкилNH2, C1-6алкилОН, и если R4, R5, R6, R7, R10, R11, R12 и R13, R14 и R15 не представляют собой H, то могут быть замещенными или незамещенными;
m и n независимо равны 0-2; и
где L, R3, R4, R5, R6, R7, R10, R11, R12 и R13, R14 и R15 могут быть замещены одним или несколькими из C1-8алкила, C2-8алкенила, C2-8алкинила, C3-14циклоалкила, 5-14-членной гетероарильной группы, C6-14арильной группы, 3-14-членной циклогетероалкильной группы, OH, (O), CN, алкокси, галогена или NH2.
Согласно одному варианту осуществления первого общего варианта осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R3 представляет собой H, C1-8алкил, C3-14циклоалкил, C(О)C1-8алкил, C1-8алкилОН, C1-8цианоалкил, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(O)OR14, NR14R15, C1-8алкилС3-14циклоалкил, C(О)C1-8алкилС3-14циклоалкил, C0-8алкокси, C1-8алкилR14, C1-8галогеналкил или C(О)R14, который может быть замещен одним или несколькими из OH, CN, F или NH2, и где каждый R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, алкокси, C(О)C1-3алкила, C1-8алкилNH2 или C1-6алкилОН.
Согласно другому варианту осуществления первого общего варианта осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R3 представляет собой H, C1-8алкил или C1-8алкилОН. Согласно другому варианту осуществления, комбинация согласно настоящему изобретению включает ингибитор CDK4/6 или соединение формулы I, где Y представляет собой H, OH, или Y представляет собой часть следующей группы
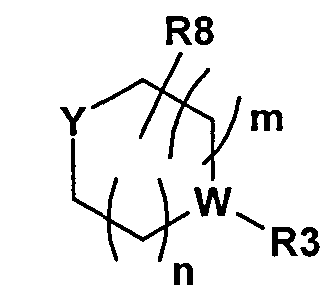 ,
,
в которой Y представляет собой N, и W представляет собой CR9 или N; и в которой может содержаться 0-2 R8, и R8 представляет собой C1-8алкил, оксо, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где L представляет собой связь, C1-8алкилен, или C(О)NH или C(O). Согласно другому предпочтительному варианту осуществления, комбинация включает ингибитор CDK4/6 формулы I, где R2 представляет собой C3-14циклоалкил. Согласно другому варианту осуществления, R2 представляет собой циклопентан.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где R1 представляет собой CN, C(О)OR4, CONR5R6 или 5-14-членную гетероарильную группу. Согласно другому варианту осуществления, R1 представляет собой CONR5R6, и R5 и R6 представляют собой C1-8алкил.
Согласно другому варианту осуществления, настоящее изобретение включает ингибитор CDK4/6 формулы I, где X представляет собой CR9. Согласно другому варианту осуществления, один X представляет собой N, а другой X представляет собой CR9. Согласно другому варианту осуществления, комбинация включает ингибитор CDK4/6 формулы I, где X представляет собой CR9, и Y представляет собой
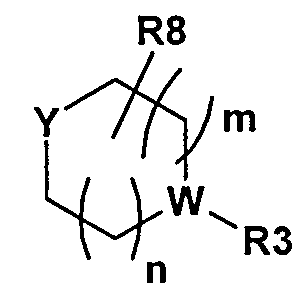 ,
,
где m и n равны 1, и Y и W представляют собой N.
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает ингибиторы CDK4/6 формулы I, где один X представляет собой N, а другой X представляет собой CR9. Согласно одному варианту осуществления, настоящее изобретение включает соединения формулы (I), такие как:
Согласно другому варианту осуществления первого общего варианта осуществления, настоящее изобретение включает соединения формулы I, где X представляет собой CR9, и Y представляет собой
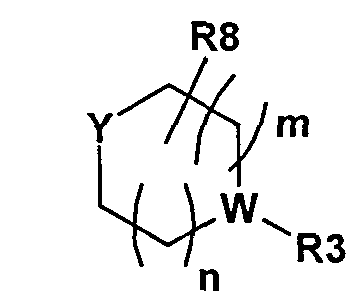 ,
,
где m и n равны 1, и Y и W представляют собой N.
Согласно другому варианту осуществления формулы I, R3 представляет собой H, C1-8алкил, C3-14циклоалкил, C(О)C1-8алкил, C1-8алкилОН, C1-8цианоалкил, C0-8алкилС(O)C0-8алкилNR14R15, C0-8алкилС(O)OR14, NR14R15, C1-8алкилС3-14циклоалкил, C(О)C]-8алкилС3-14циклоалкил, C0-8алкокси, C1-8алкилR14, C1-8галогеналкил или C(О)R14, который может быть замещен одним или несколькими из OH, CN, F или NH2, и где каждый из R14 и R15 независимо выбирают из H, C1-8алкила, C3-14циклоалкила, алкокси, C(О)С1-3алкила, C1-8алкилNH2 или C1-6алкилОН.
Согласно другому варианту осуществления формулы I, Y представляет собой H, OH, или Y представляет собой часть следующей группы
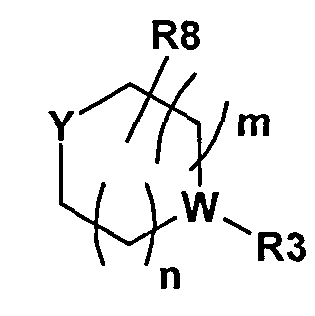 ,
,
в которой Y представляет собой N, и W представляет собой CR9 или N;
в которой может содержаться 0-2 R8, и R8 представляет собой C1-8алкил, оксо, или два или несколько R8 могут образовывать соединенную мостиковой связью алкильную группу.
Согласно другому варианту осуществления формулы I,
L представляет собой связь, С1-8алкилен или C(О)NH или C(O);
R2 представляет собой любой из C3-7циклоалкила;
R1 представляет собой CN, C(О)OR4, CONR5R6 или 5-14-членную гетероарильную группу.
Согласно другому варианту осуществления формулы I, X представляет собой CR9, или X представляет собой N, а другой X представляет собой CR9, или X представляет собой CR9, и Y представляет собой
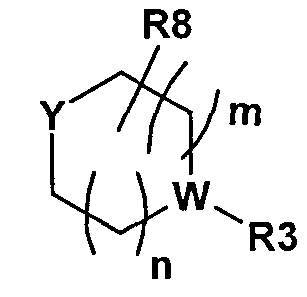 ,
,
где m и n равны 1, и Y и W представляют собой N.
Предпочтительные соединения формулы I включают:
7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбонитрил;
диметиламид 7-циклопентил-2-{5-[4-(2-фторэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(4-диметиламино-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-6'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-[5-(4-карбамоилметилпиперазин-1-ил)пиридин-2-иламино]-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-{5-[4-(2-аминоацетил)пиперазин-1-ил]пиридин-2-иламино}-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-[5-(3-аминопирролидин-1-ил)пиридин-2-иламино]-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-метоксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[4-(2-гидроксиэтил)-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((R)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(3-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(пирролидин-1-карбонил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((S)-2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(5-{4-[2-(2-гидроксиэтокси)этил]пиперазин-1-ил}пиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-1-метилэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридазин-3-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((R)-2,3-дигидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
7-циклопентил-2-(4-диметиламино-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-6'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбонитрил;
диметиламид 7-циклопентил-2-(3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(пиперазин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-диметиламинопиперидин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-илметил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((S)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((R)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
метиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(4-метилпентил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[6-(4-изопропилпиперазин-1-ил)пиридазин-3-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-2-метилпропил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,3-диметилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,8-диазабицикло[3.2.1]окт-3-илметил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-этилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-циклопентилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1'-изопропил-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(R)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(S)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-илметил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-диметиламиноацетил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-этилбутил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 2-{5-[4-(2-циклогексилацетил)пиперазин-1-ил]пиридин-2-иламино}-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(3-циклопентилпропионил)пиперазин-1-ил]пиридин-2-иламино}7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изобутилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
сложный метиловый эфир {4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусной кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-изопропоксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
сложный этиловый эфир {4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусной кислоты;
сложный трет-бутиловый эфир 4-(6-{7-циклопентил-6-[(2-гидроксиэтил)метилкарбамоил]-7H-пирроло[2,3-d]пиримидин-2-иламино}пиридин-3-ил)пиперазин-1-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-метилбутил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[1'-(2-гидроксиэтил)-1',2',3',4',5',6'-гексагидро-[3,4']бипиридинил-6-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
{4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}уксусную кислоту и
2-{4-[6-(7-циклопентил-6-диметилкарбамоил-7H-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-ил}пропионовую кислоту;
или их фармацевтически приемлемую соль.
Соединения формулы (I) описаны, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2010/020675, которая включена в настоящий документ посредством ссылки.
Второй общий вариант осуществления настоящего изобретения
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы II:
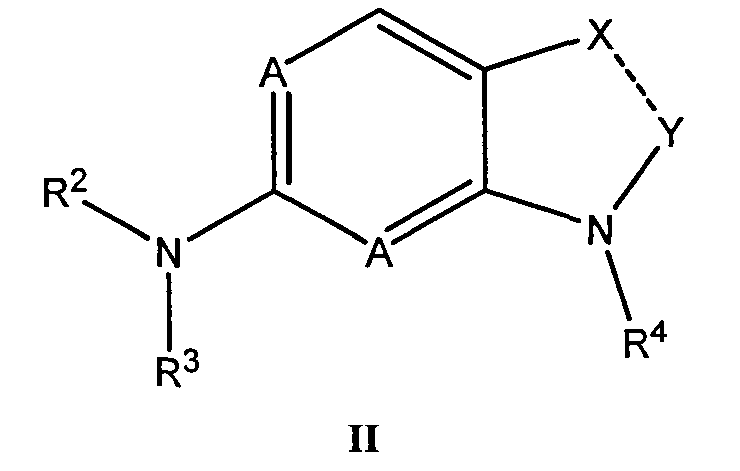
или его фармацевтически приемлемую соль или сольват, где:
пунктирная линия обозначает простую или двойную связь;
A представляет собой N или CR5, где R5 представляет собой водород или C1-C3алкил;
каждый из R2 и R3 независимо выбирают из группы, состоящей из водорода, гидроксила, C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного C1-C3алкила, замещенного C3-C8циклоалкила, замещенного гетероциклила, замещенного арила и замещенного гетероарила;
R4 выбирают из группы, состоящей из водорода, C1-C8алкила, замещенного C1-C8алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероарила и замещенного гетероарила;
если связь между X и Y представляет собой простую связь, то X представляет собой CR6R7, NR8 или C=О, и Y представляет собой CR9R10 или C=О;
если связь между X и Y представляет собой двойную связь, то X представляет собой N или CR11, и Y представляет собой CR12;
где каждый из R6 и R7 независимо выбирают из группы, состоящей из арила, замещенного арила, гетероарила, замещенного гетероарила, водорода, C1-C3алкила, C3-C8циклоалкила, гетероциклила, замещенного алкила, замещенного циклоалкила и замещенного гетероциклила;
R8 представляет собой водород, C1-C3алкил и C3-C8циклоалкил;
каждый из R9 и R10 независимо представляет собой водород, C1-C3алкил или C3-C8циклоалкил;
каждый из R11 и R12 независимо выбирают из группы, состоящей из галогена, водорода, C1-C3алкила, C1-C3алкокси, CN, C=NOH, C=NOCH3, C(О)H, C(О)C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного C1-C3алкила, замещенного C3-C8циклоалкила, замещенного гетероциклила, замещенного арила, замещенного гетероарила, -BNR13R14, -BOR13, -BC(О)R13, -BC(О)OR13, -BC(О)NR13R14; где B представляет собой связь, C1-C3алкил или разветвленный C1-C3алкил; где каждый из R13 и R14 независимо выбирают из группы, состоящей из водорода, C1-C3алкила, C3-C8циклоалкила, гетероциклила, арила, гетероарила, замещенного алкила, замещенного циклоалкила, замещенного гетероциклила, замещенного арила и замещенного гетероарила.
Согласно одному варианту осуществления второго общего варианта осуществления, соединение формулы II выбирают из группы, состоящей из:
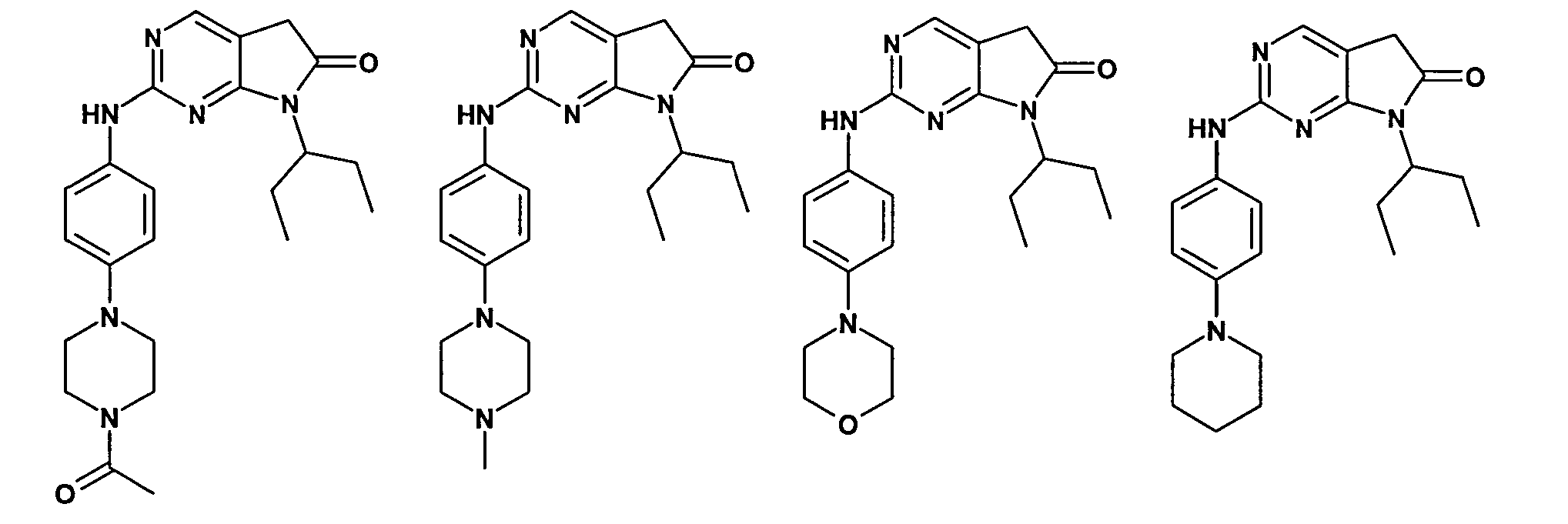
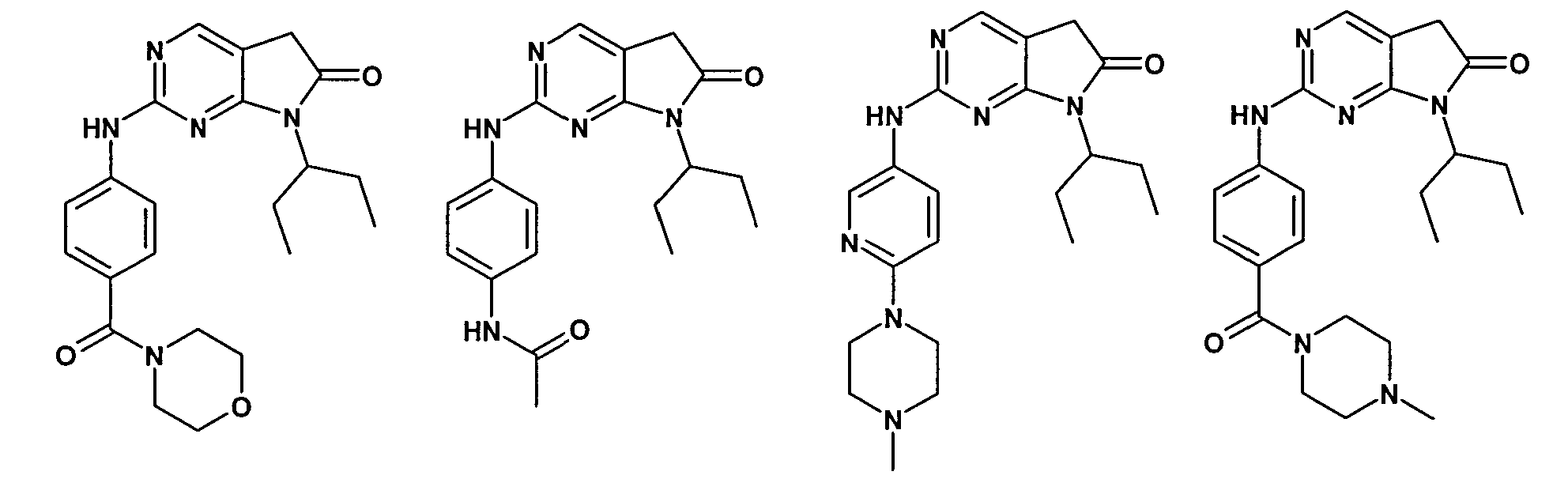
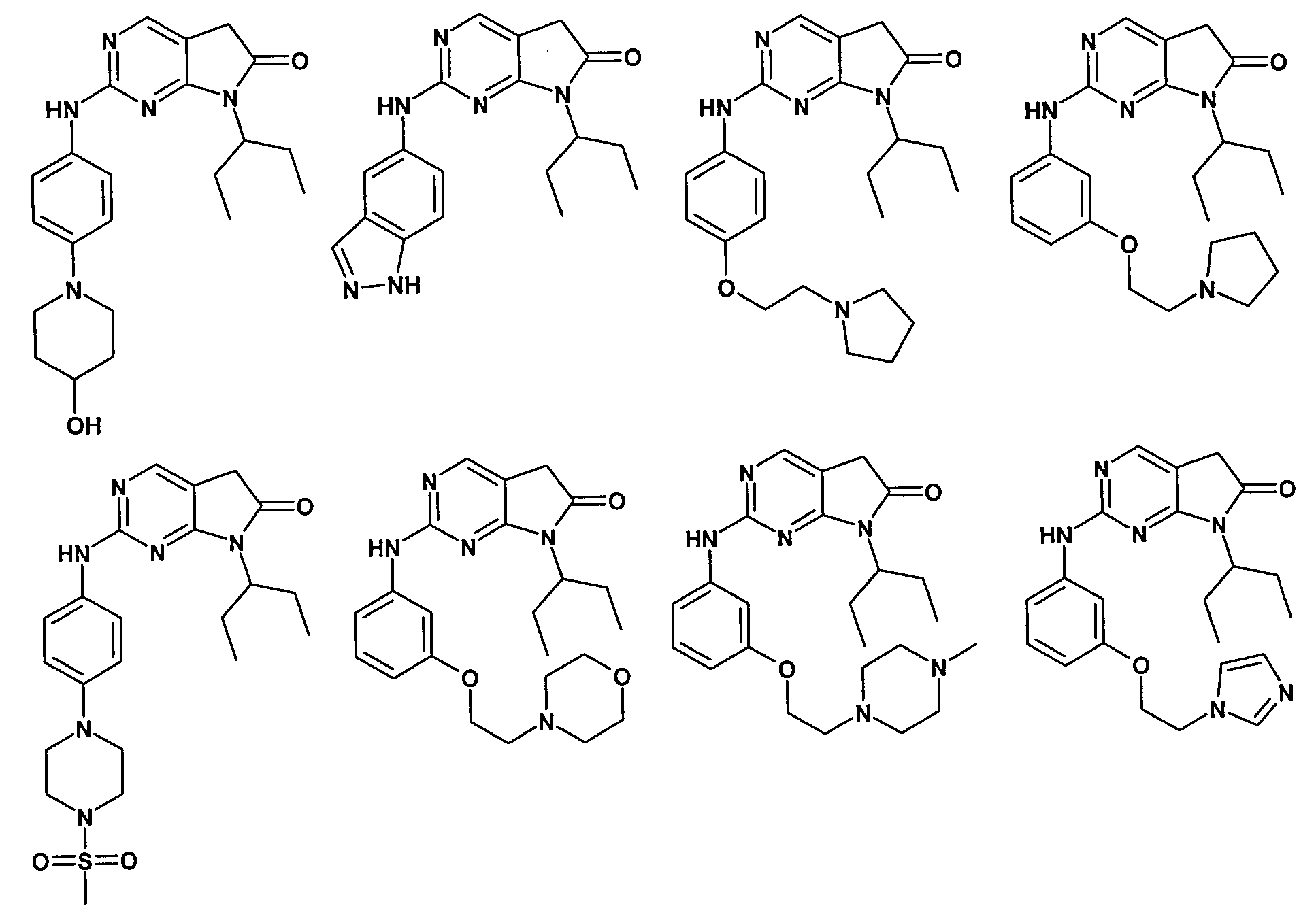
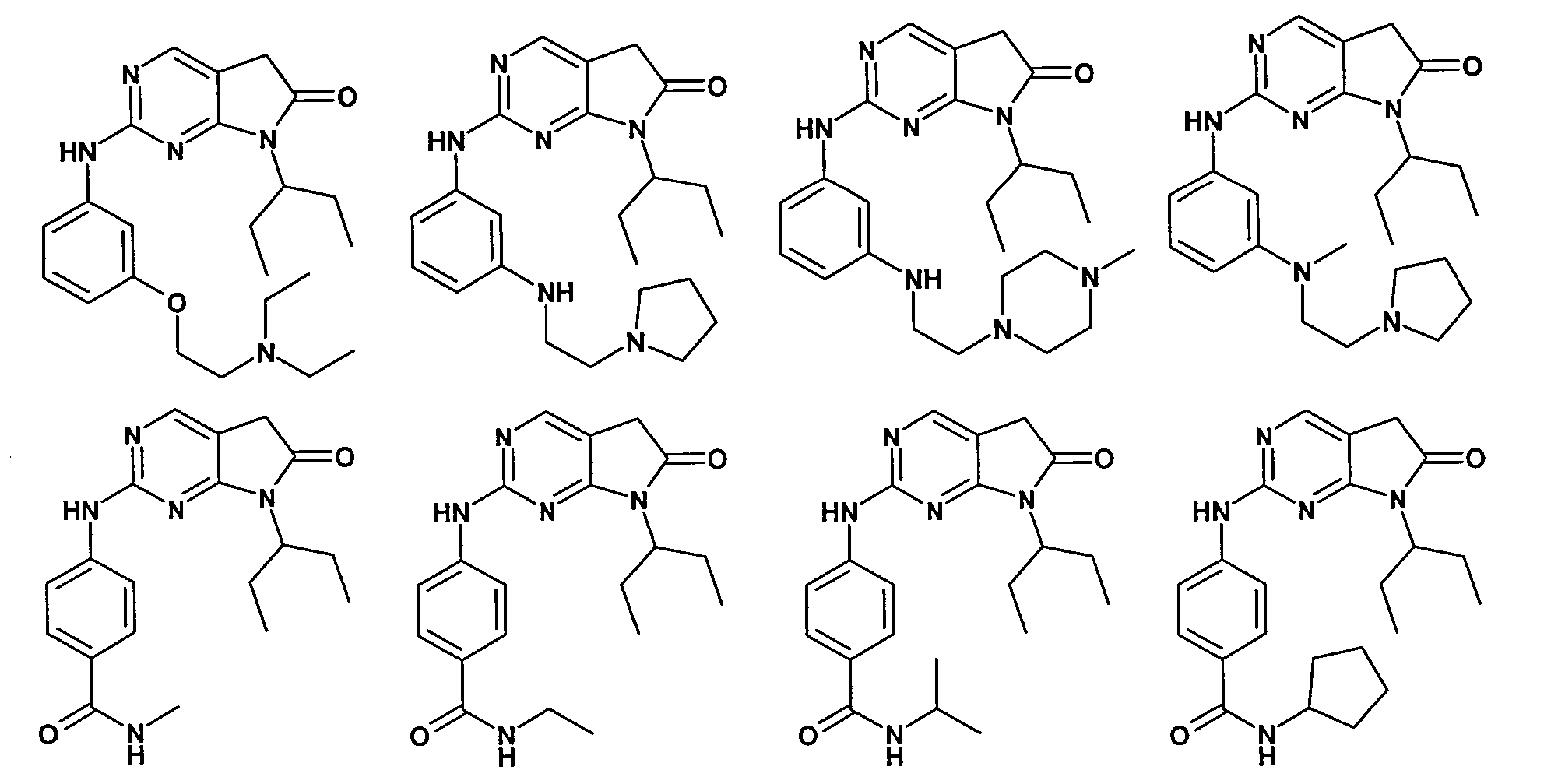
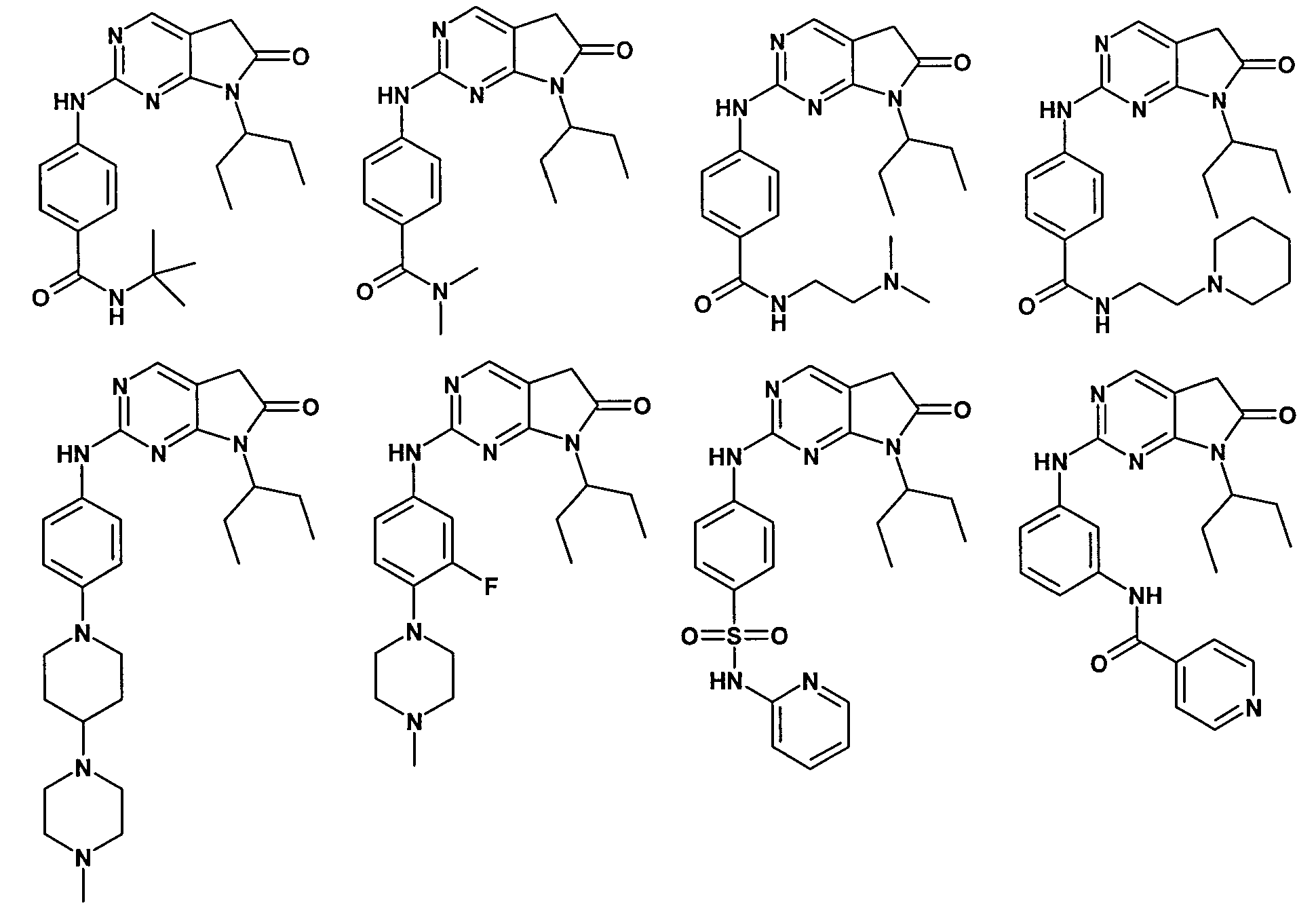
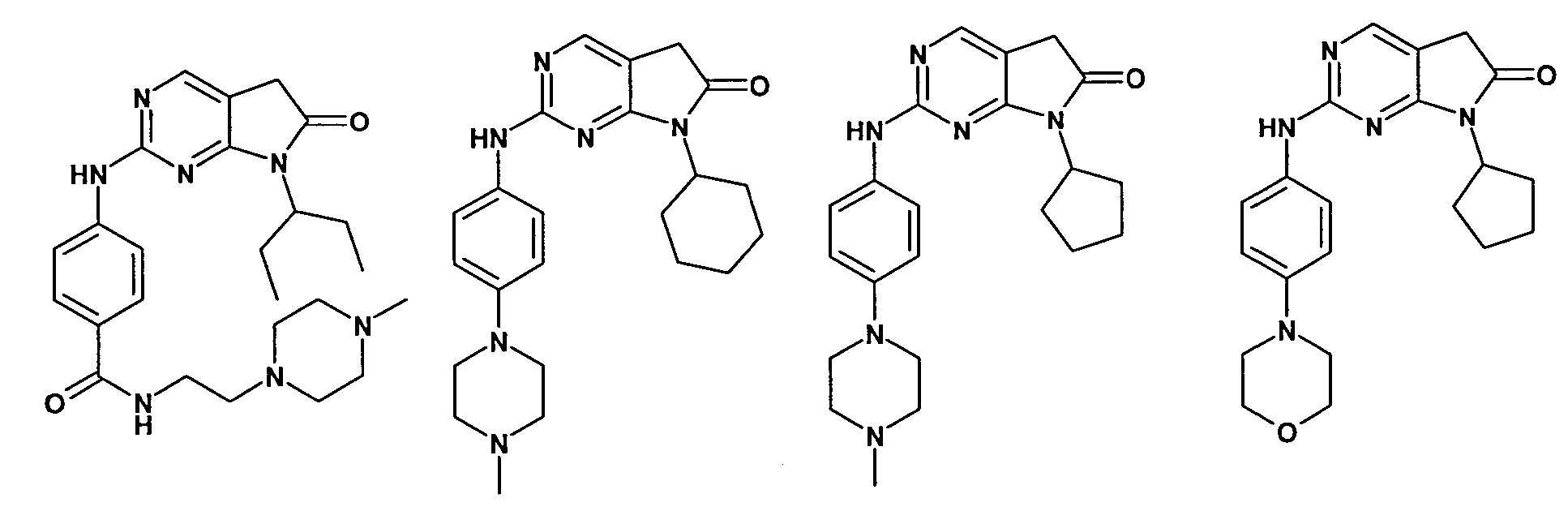
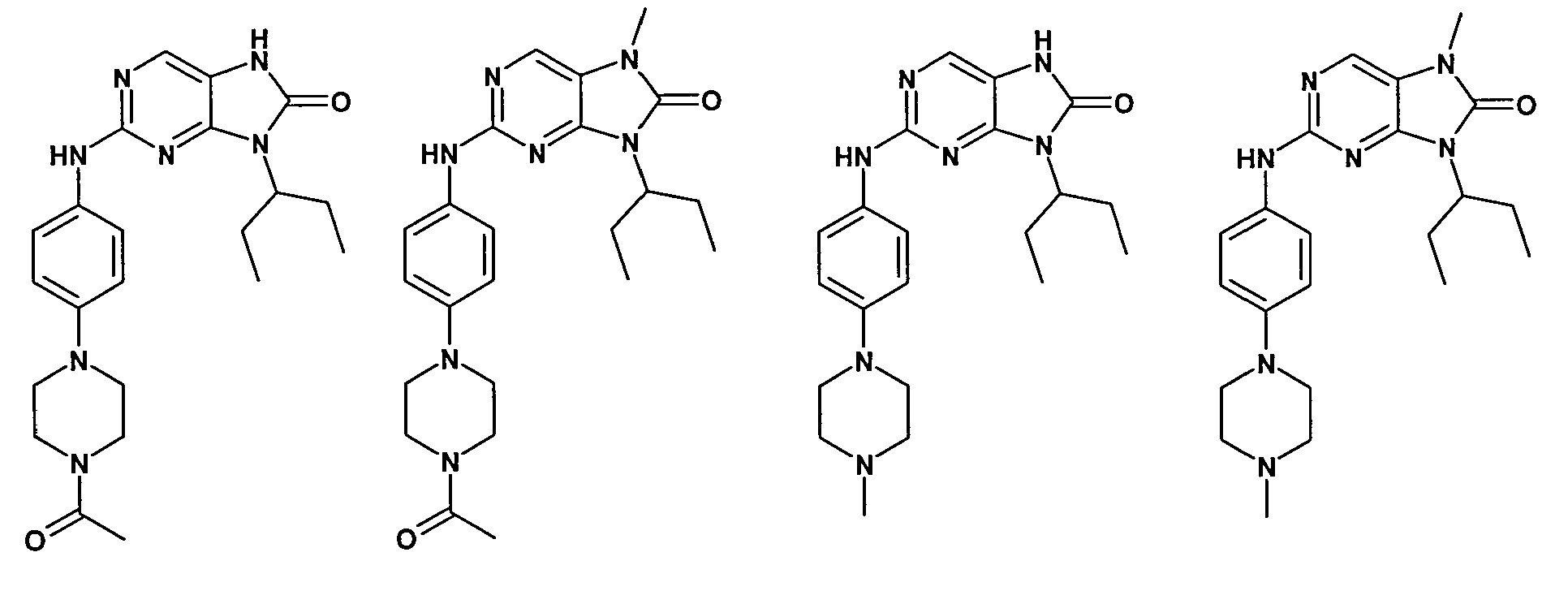
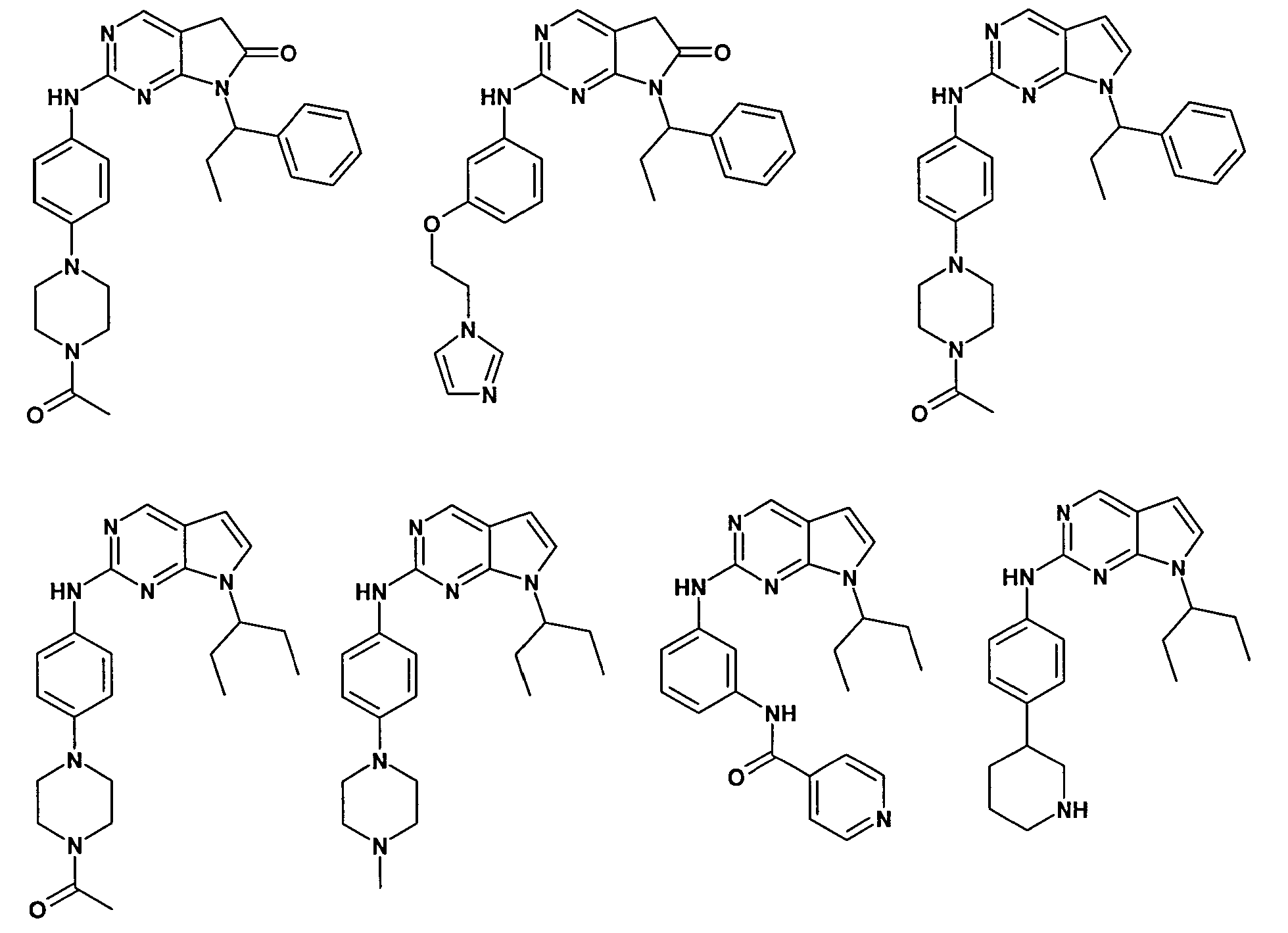
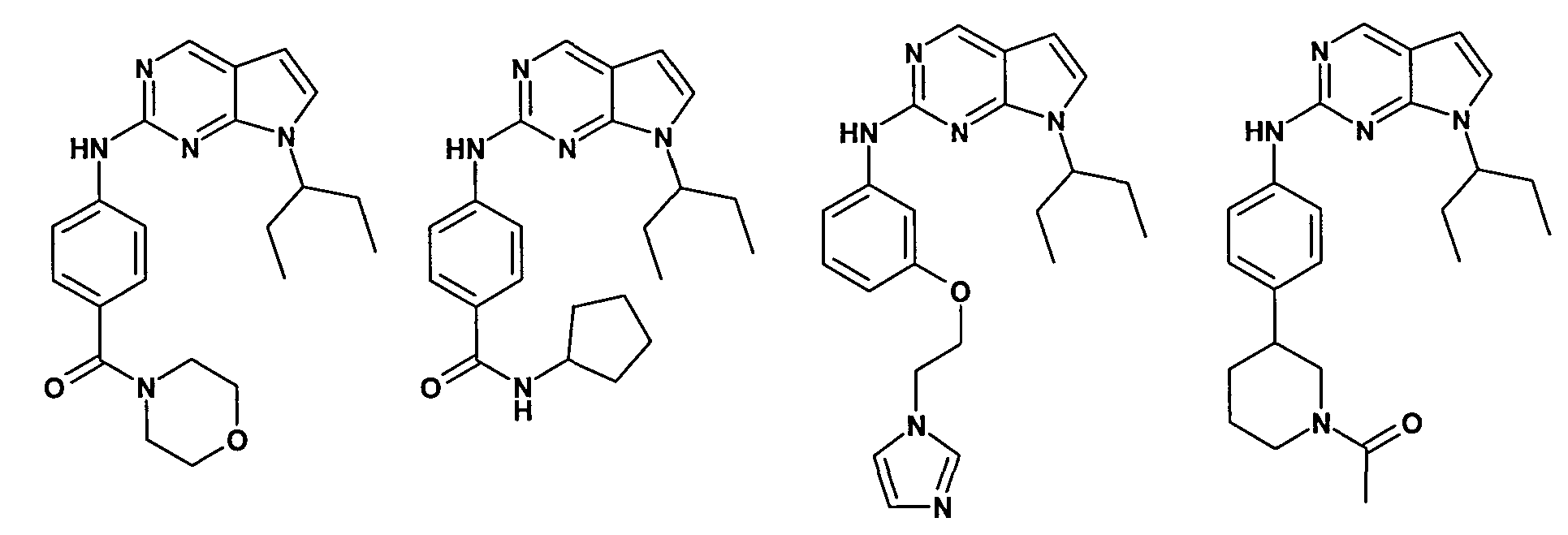
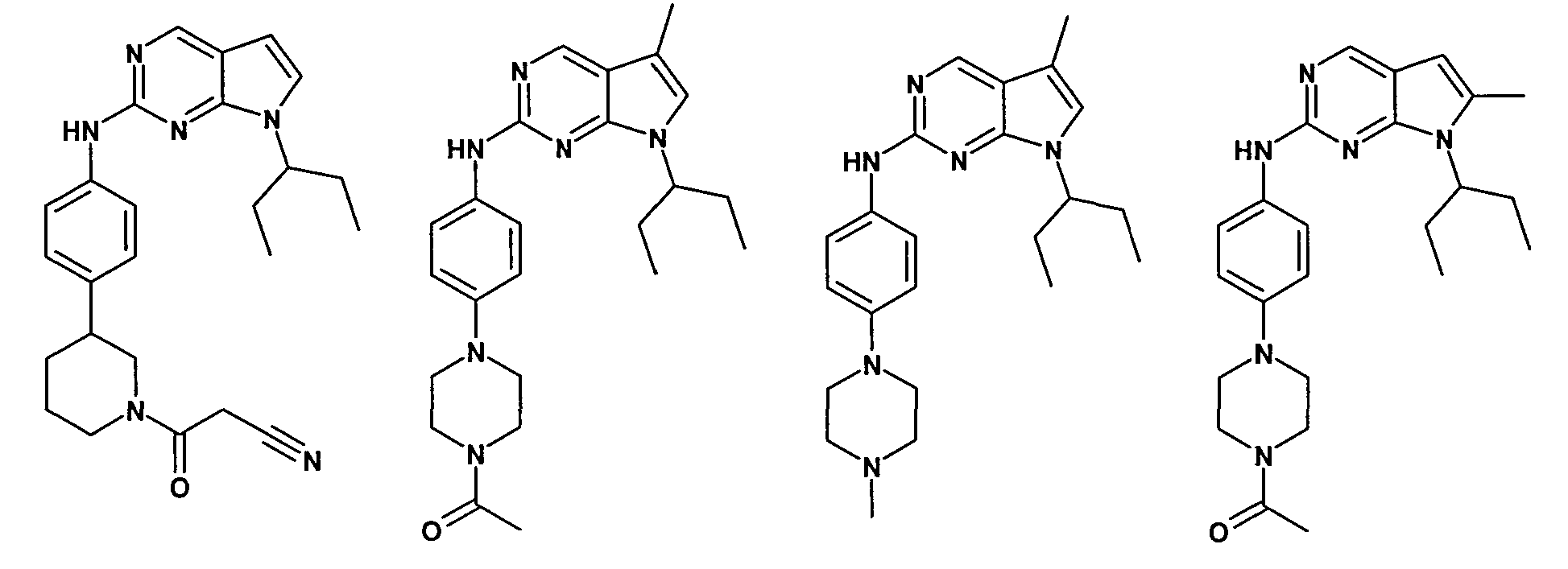
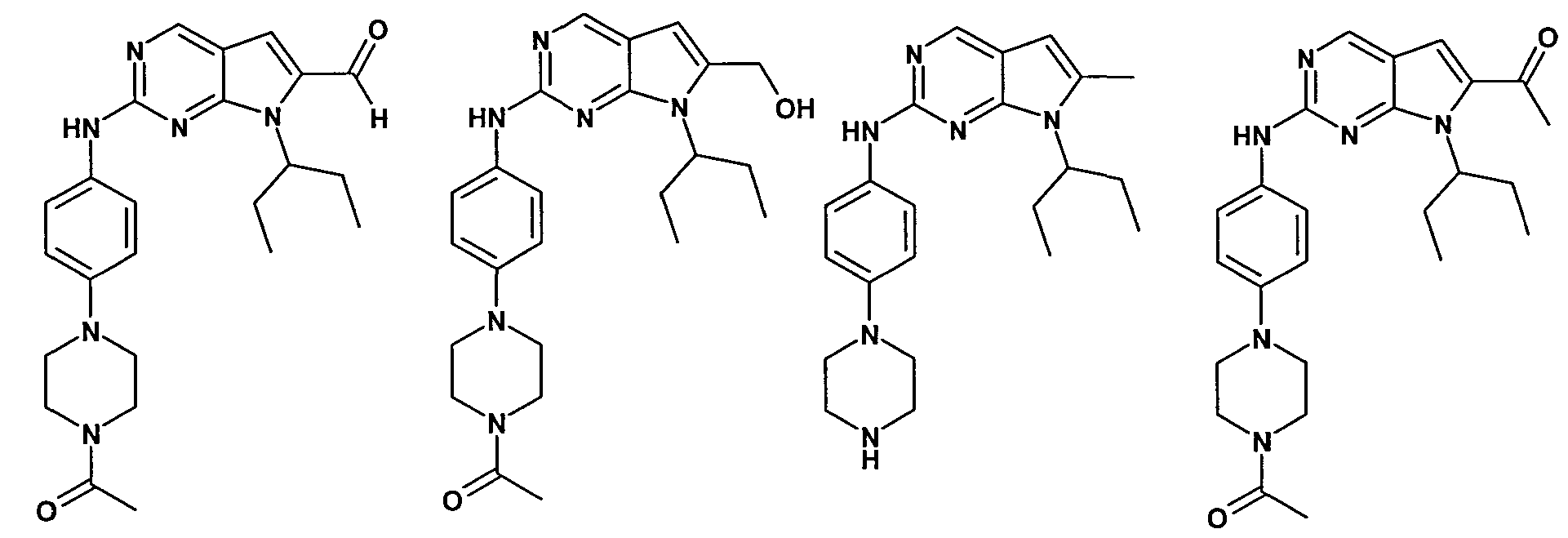

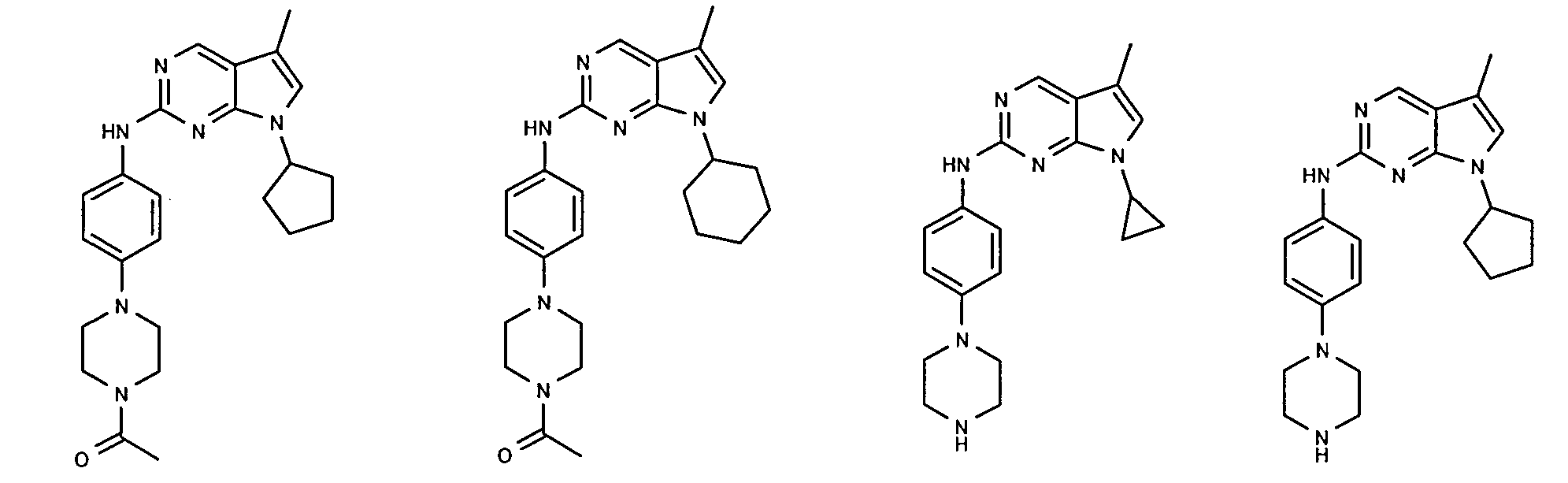
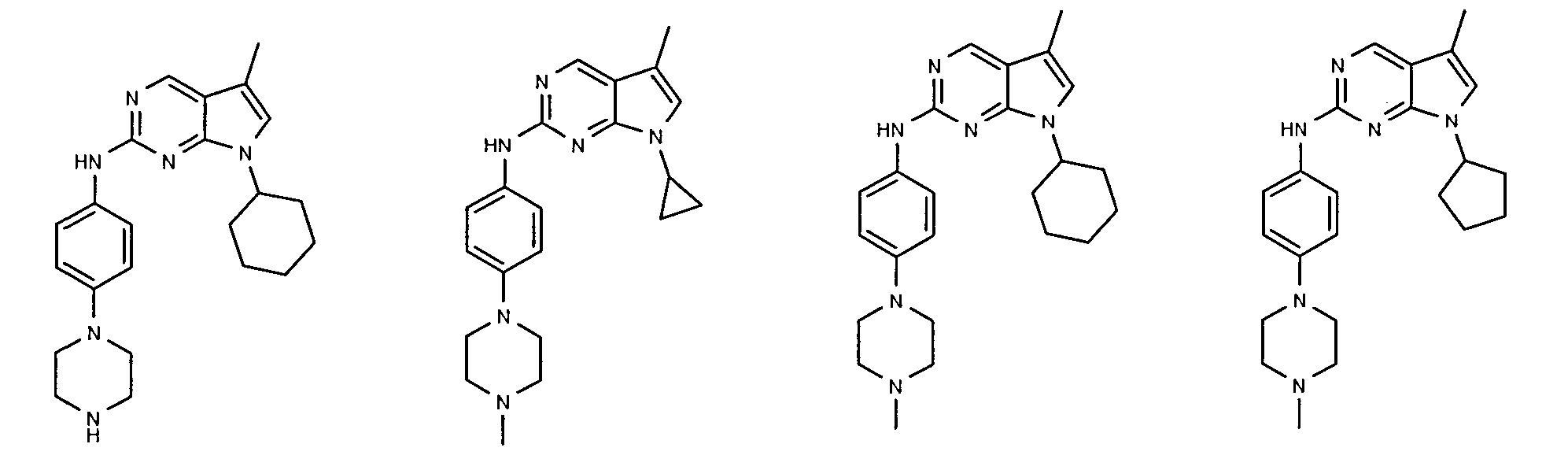
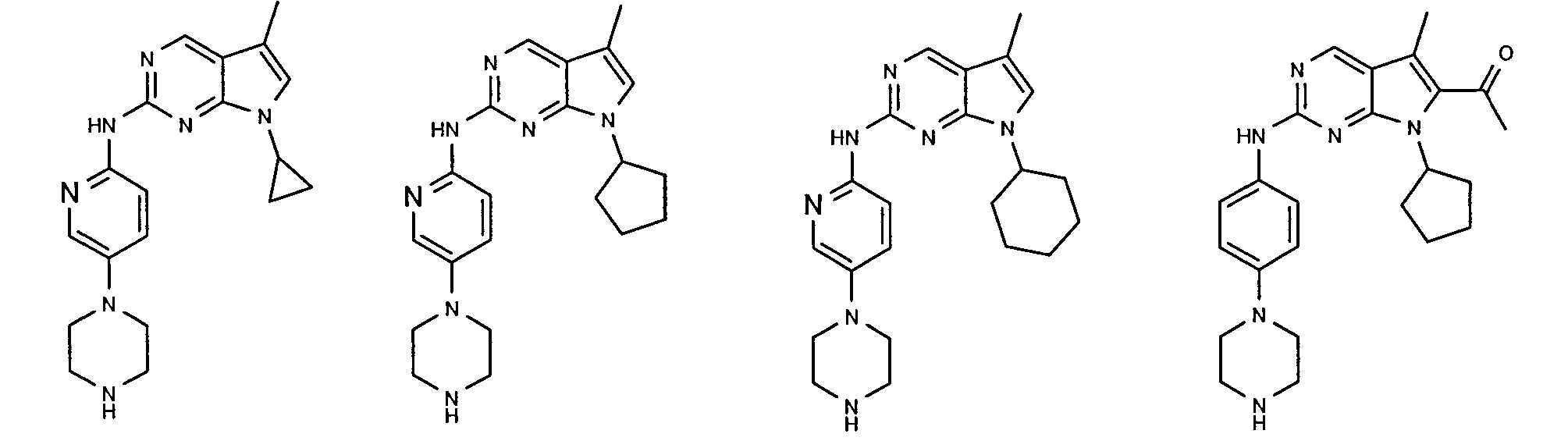
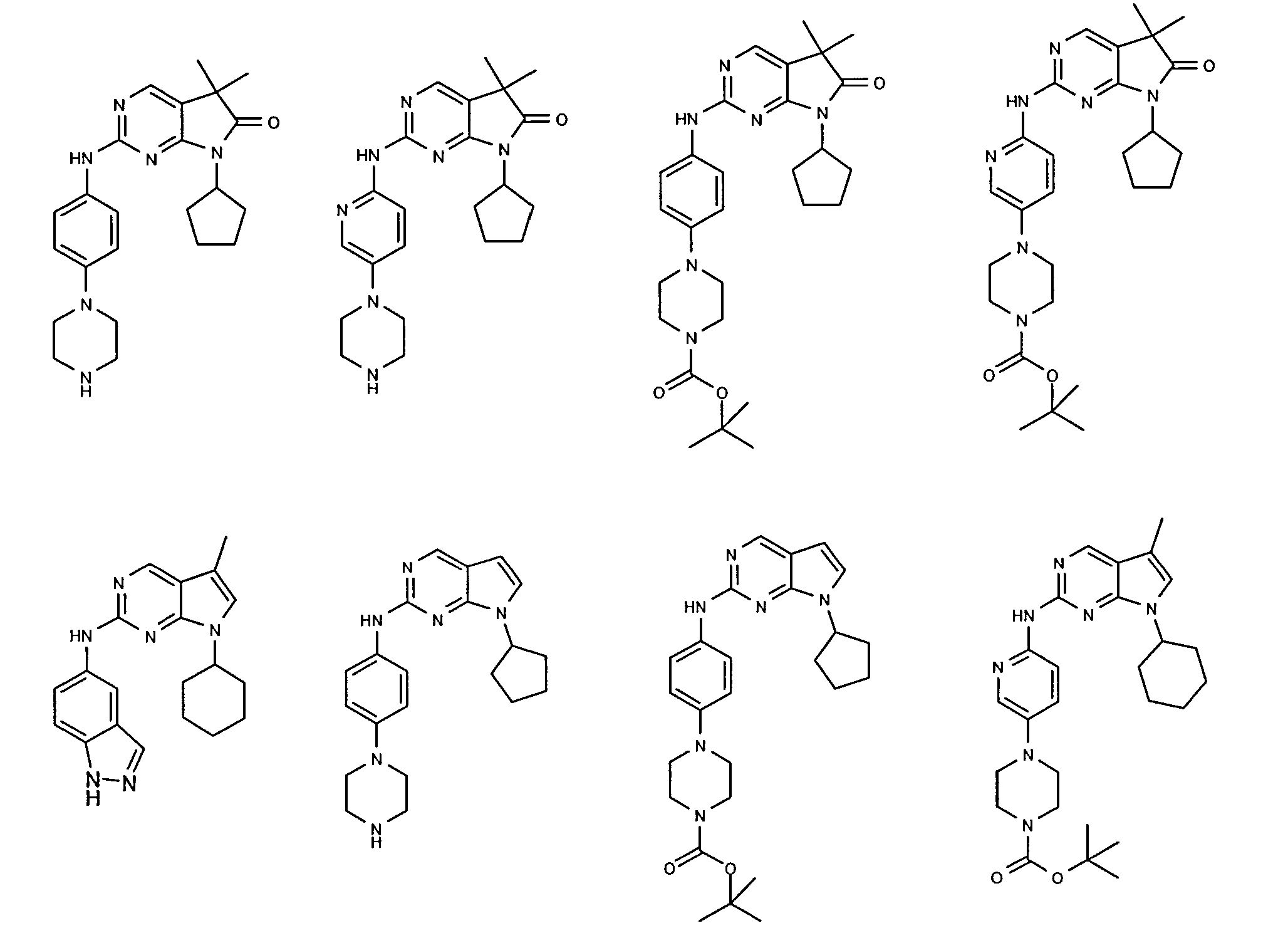
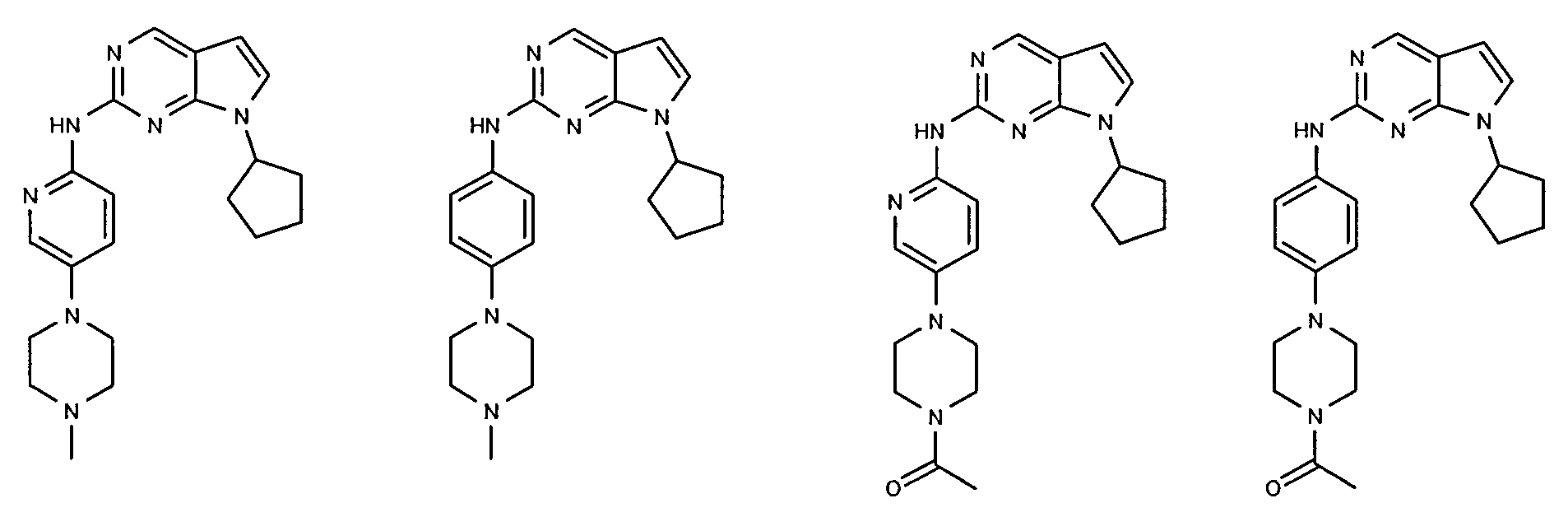
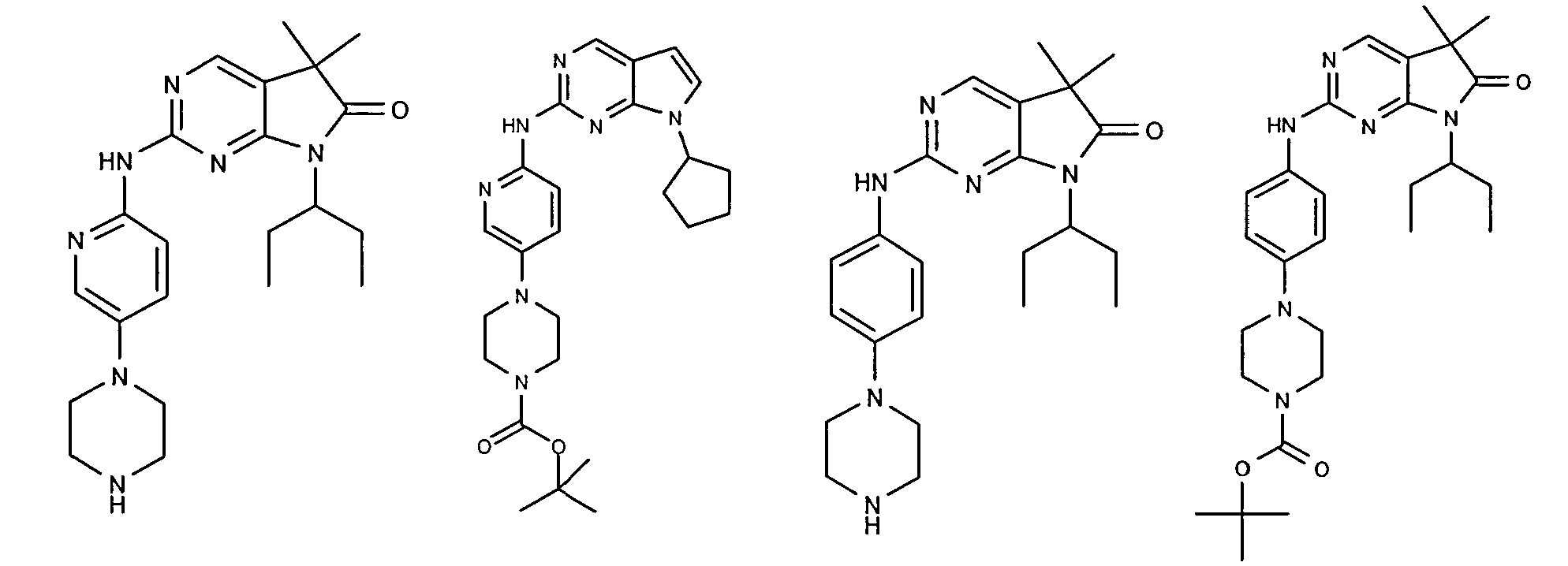
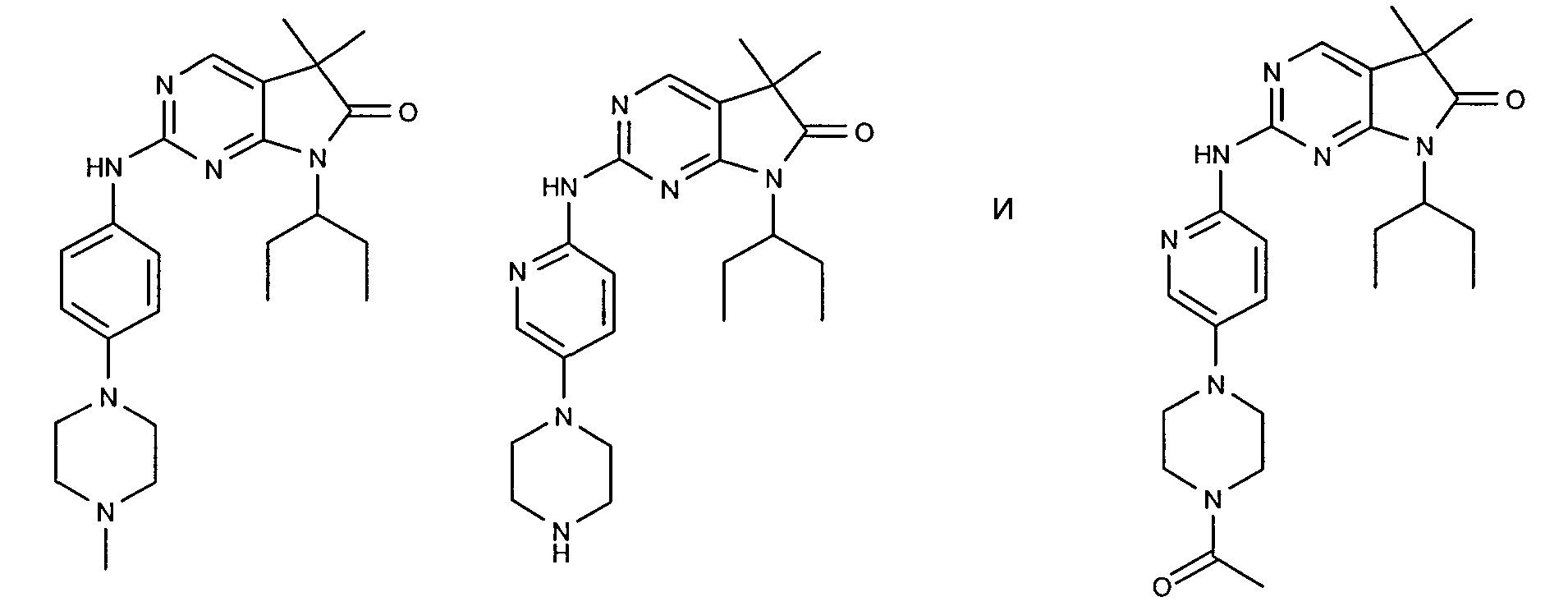
Соединения формулы II описаны, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2007/140222, которая включена в настоящий документ посредством ссылки.
Третий общий вариант осуществления настоящего изобретения
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы III:
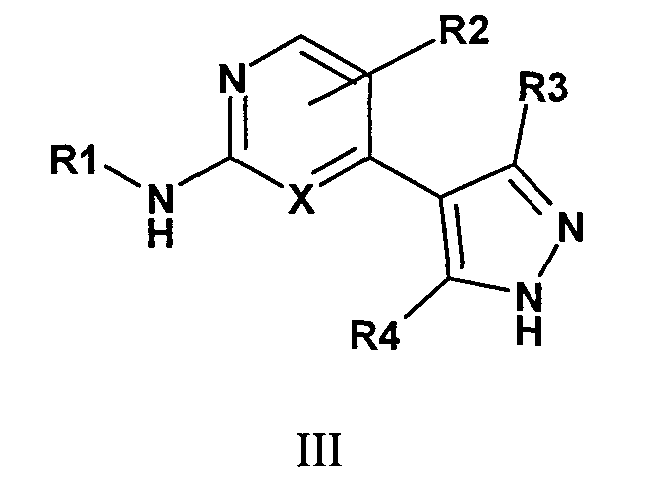
или фармацевтически приемлемую соль, где
R1 представляет собой C1-6алкил, C3-14циклоалкил, 3-14-членную циклогетероалкильную группу, C6-14арил, C1-6алкокси, C1-6алкилС6-14арил, C1-6алкилС3-14циклоалкил, C1-6алкил-3-14-членную циклогетероалкильную группу, C1-6алкил-5-14-членную гетероарильную группу, C1-6алкилOR7, C1-6алкилNR5R6, C1-6алкоксиС6-14арил, C1-6алкилCN или C1-6алкилС(О)OR7, который может быть незамещенным или замещенным одним или несколькими C1-6алкилами, C6-14арилами, гидроксилами, C1-6алкилгалогенами, C1-6алкоксигалогенами, галогенами, C1-6алкокси, C1-6алкилС6-14арилами, С(О)OR8, CN, оксо или NR9R10;
R2 представляет собой Н, C1-6алкил, C2-6алкенил, C2-6алкинил, гидроксил или галоген;
R3 и R4 независимо представляют собой Н, C1-6алкил, C3-14циклоалкил или галоген, которые могут быть незамещенными или замещенными;
R5, R6, R7, R8, R9 и R10 независимо представляют собой водород, C1-6алкил, C2-6алкенил, C2-6алкинил, C3-14циклоалкил, 5-14-членную гетероарильную группу, C6-14арил, C(О)OR11 или C(О)R11, который может быть незамещенным или замещенным;
X представляет собой N или CR12, где R11 и R12 независимо представляют собой H, галоген или C1-6алкил.
Согласно одному варианту осуществления третьего общего варианта осуществления, соединение формулы III, где R1 представляет собой C1-6алкил, C3-14циклоалкил, C6-14арил, 3-14-членную циклогетероалкильную группу, C1-6алкилС6-14арил, C1-6алкилС3-14циклоалкил, C1-6алкил-3-14-членную циклогетероалкильную группу или C1-6алкил-5-14-членную гетероарильную группу, которая может быть незамещенной или замещенной одним или несколькими C1-6алкилами, C6-14арилами, гидроксилами, C1-6алкилгалогенами, галогенами, C1-6алкокси, C1-6алкилС6-14арилами.
Примеры соединений формулы III включают
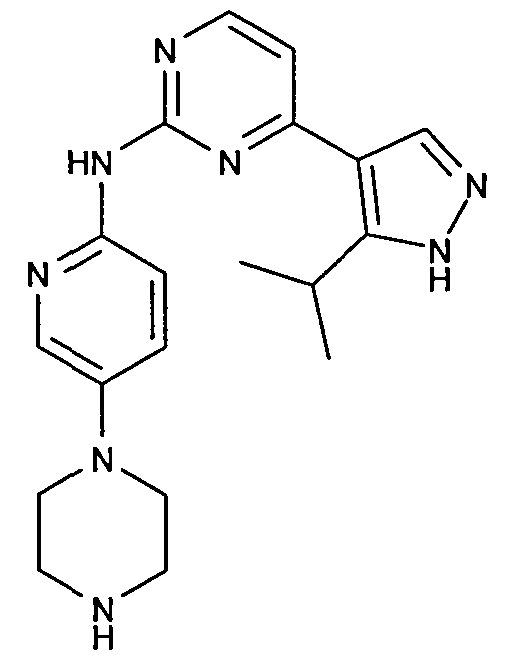
([4-(5-изопропил-1H-пиразол-4-ил)пиримидин-2-ил]-(5-пиперазин-1-илпиридин-2-ил)амин)
и
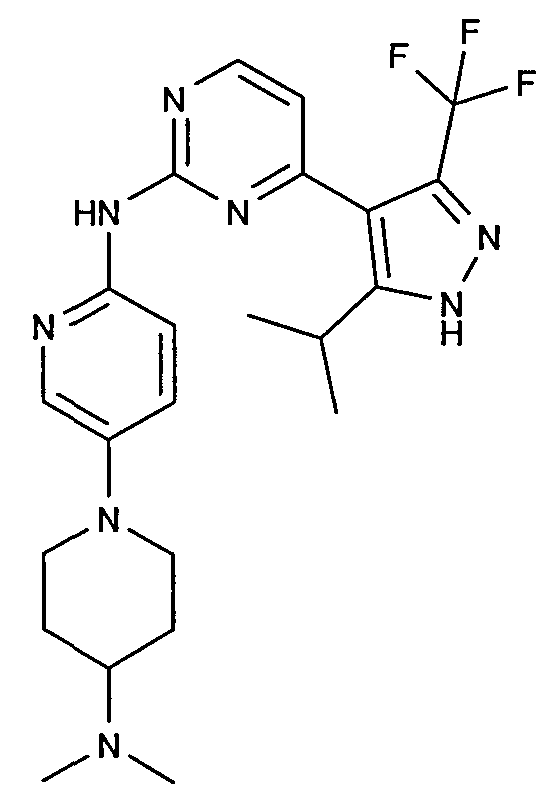
(N*6'*-[4-(5-изопропил-3-трифторметил-1H-пиразол-4-ил)пиримидин-2-ил]-N*4*,N*4*-диметил-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-4,6'-диамин).
Соединения формулы III описаны, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2009/071701, которая включена в настоящий документ посредством ссылки.
Четвертый общий вариант осуществления настоящего изобретения
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы IV:
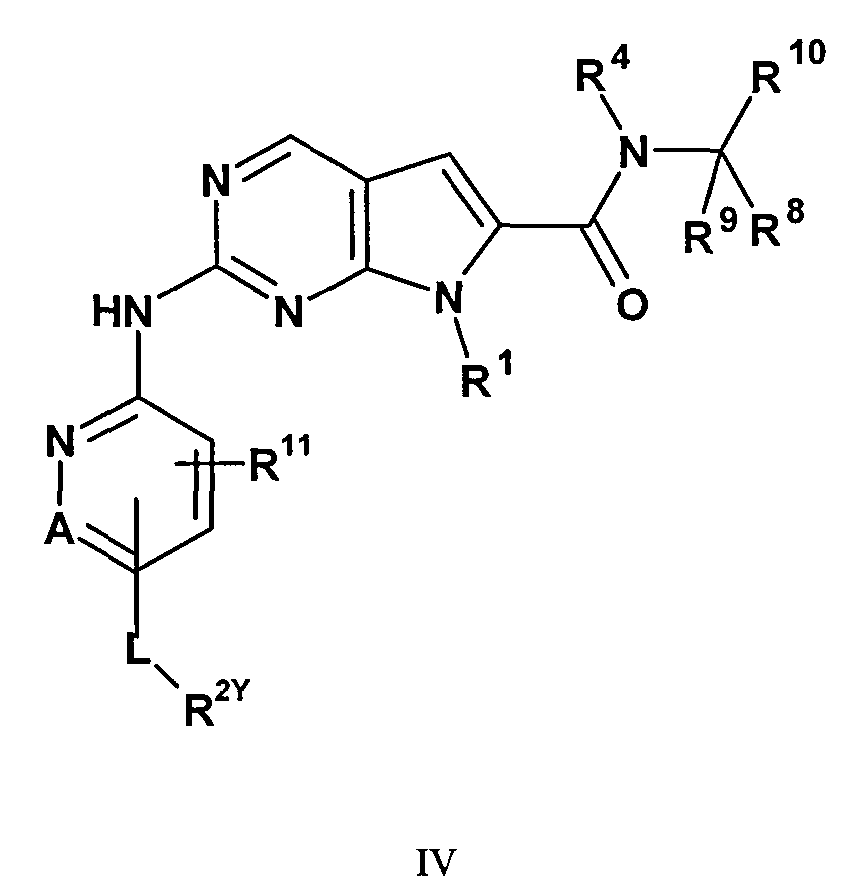
в которой:
R1 представляет собой C3-7алкил, C4-7циклоалкил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из C1-6алкила и OH; фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из C1-6алкила, C(CH3)2CN и OH; пиперидинил, необязательно замещенный одним циклопропилом или C1-6алкилом; тетрагидропиранил, необязательно замещенный одним циклопропилом или C1-6алкилом; или бицикло[2.2.1]гептанил;
A представляет собой CH или N;
R11 представляет собой водород или C1-4алкил;
L представляет собой связь, C(O) или S(О)2;
R2Y представляет собой
V представляет собой NH или CH2;
X представляет собой O или CН2;
W представляет собой O или NH;
каждый m и n независимо равен 1, 2 или 3, при условии, что оба m и n не равны 3;
каждый R2Y необязательно замещен одним-четырьмя заместителями, каждый из которых независимо выбирают из группы, состоящей из: C1-3алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из гидрокси, NH2 и -S-C1-3алкила; CD3; галогена; оксо; C1-3галогеналкила; гидрокси; NH2; диметиламино; бензила; -C(О)-C1-3алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из NH2, -SCH3 и NHC(О)CH3-, -S(О)2-C1-4алкила; пирролидинил-C(O)- и -C(О)2-C1-3алкила;
R4 представляет собой водород, дейтерий или C(R5)(R6)(R7); и
каждый из R5, R6, R7, R8, R9 и R10 независимо представляет собой H или дейтерий; или его фармацевтически приемлемую соль.
Согласно одному варианту осуществления четвертого общего варианта осуществления, ингибитор циклинзависимой киназы 4/6 (CDK4/6) представляет собой соединение, представленное формулой IV-B:
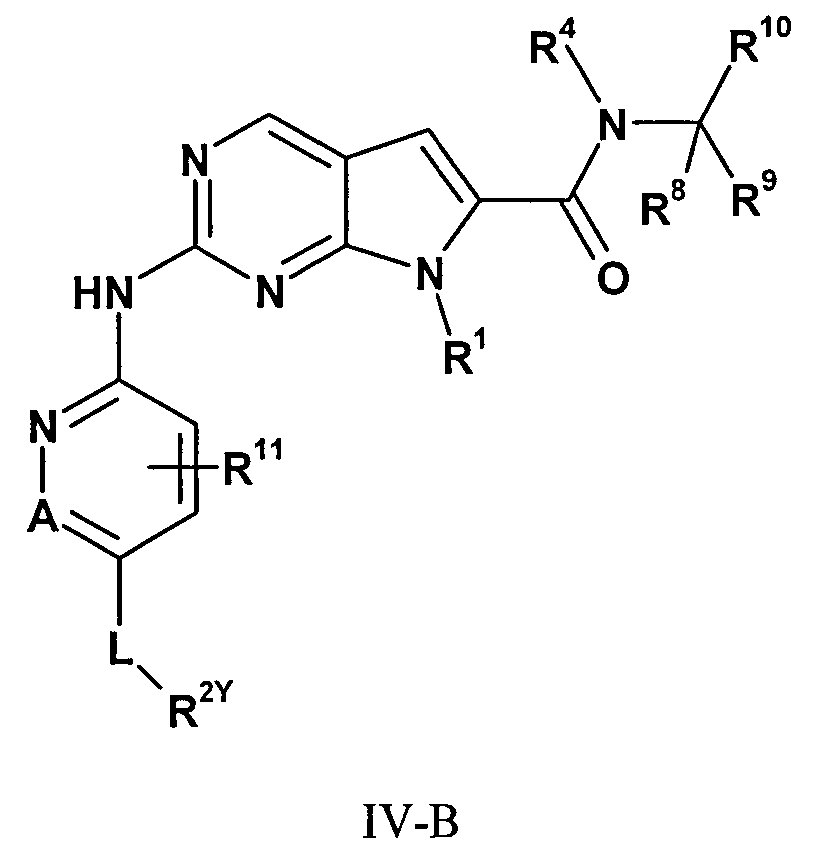
в которой
L представляет собой связь или C(O);
R2Y представляет собой
V представляет собой H или CH2;
X представляет собой O или CH2;
W представляет собой O или NH;
каждый m и n независимо равен 1, 2 или 3, при условии, что m и n оба не равны 3; и
каждый R5 необязательно замещен одним-четырьмя заместителями, каждый из которых независимо выбирают из группы, состоящей из: C1-3алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из гидрокси, NH2 и -S-C1-3алкила; CD3; C1-3галогеналкила; гидрокси; NH2; диметиламино; бензила; -C(O)-C1-3алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из NH2, -SCH3 и NHC(О)CH3; -S(О)2-C1-4алкила; пирролидинил-C(O)-; и -C(О)2-C1-3алкила; или его фармацевтически приемлемую соль.
Соединения формулы IV описаны, в целом и конкретно, в находящейся на стадии рассмотрении заявке согласно PCT PCT/EP2011/052353, которая включена в настоящий документ посредством ссылки.
Пятый общий вариант осуществления настоящего изобретения
Комбинация, включающая первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение формулы V:
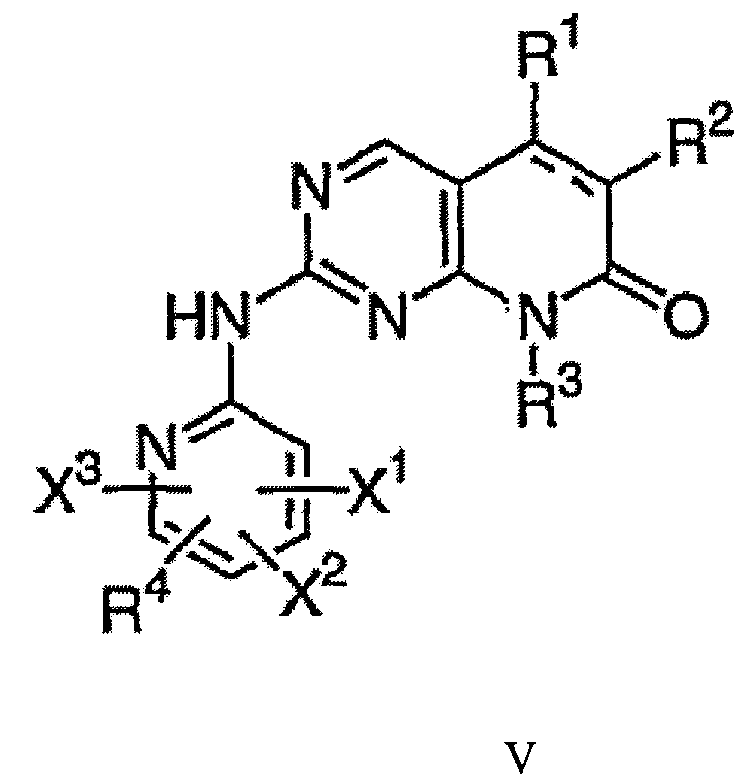
в которой:
пунктирная линия представляет собой необязательную связь,
X1, X2 и X3 в каждом случае независимо выбирают из водорода, галогена, C1-C6алкила, C1-C6галогеналкила, C1-C8алкокси, C1-C8алкоксиалкила, CN, NO2, OR5, NR5R6, CО2R5, COR5, S(О)NR5, CONR5R6, NR5COR6, NR5SO2R6, SO2NR5R6 и P(О)(OR5)(OR6); при условии, что по меньшей мере один из X1, X2 и X3 должен представлять собой водород;
n = 0-2;
R1 в каждом случае независимо представляет собой водород, галоген, C1-C6алкил, C1-C6галогеналкил, C1-C6гидроксиалкил или C3-C7циклоалкил;
R2 и R4 независимо выбирают из водорода, галогена, C1-C8алкила, C3-C7циклоалкила, C1-C8алкокси, C1-C8алкоксиалкила, C1-C8галогеналкила, C1-C8гидроксиалкила, C2-C8алкенила, C2-C8алкинила, нитрила, нитро, OR5, SR5, NR5R6, N(О)R5R6, P(О)(OR5)(OR6), (CR5R6)mNR7R8, COR5, (CR4R5)mC(О)R7, CО2R, CONR5R6, C(О)NR5SO2R6, NR5SO2R6, C(О)NR5OR6, S(О)nR5, SO2NR5R6, P(О)(OR5)(OR6), (CR5R6)mP(О)(OR7)(OR8)-, (CR5R6)m-арила, (CR5R6)m-гетероарила, T(CH2)mQR5, -C(О)T(CH2)mQR5, NR5C(О)T(CH2)mQR5 и -CR5=CR6C(О)R7; или
R1 и R2 могут образовывать карбоциклическую группу, содержащую 3-7 кольцевых атомов, предпочтительно, 5-6 кольцевых атомов, до четырех из которых могут быть необязательно замещены гетероатомом, независимо выбранным из кислорода, серы и азота, и где карбоциклическая группа является незамещенной или замещенной одной, двумя или тремя группами, независимо выбранными из галогена, гидрокси, гидроксиалкила, нитрила, низшего C1-C8алкила, низшего C1-C8алкокси, алкоксикарбонила, алкилкарбонила, алкилкарбониламино, аминоалкила, трифторметила, N-гидроксиацетамида, трифторметилалкила, амино и моно- или диалкиламино, (CH2)mC(О)NR5R6 и О(CH2)mC(О)OR5, но при условии, что в карбоциклическом кольце содержится по меньшей мере один атом углерода, и что при наличии двух или более кольцевых атомов кислорода кольцевые атомы кислорода не являются смежными друг с другом;
T представляет собой O, S, NR7, N(О)R7, NR7R8W или CR7R8;
Q представляет собой O, S, NR7, N(О)R7, NR7R8W, CО2, О(CH2)m-гетероарил, О(CH2)mS(О)nR8, (CH2)-гетероарил или карбоциклическую группу, содержащую 3-7 кольцевых атомов, причем до четырех из указанных кольцевых атомов необязательно представляют собой гетероатомы, независимо выбранные из кислорода, серы и азота, но при условии, что в карбоциклическом кольце содержится по меньшей мере один атом углерода, и что при наличии двух или более кольцевых атомов кислорода кольцевые атомы кислорода не являются смежными друг с другом, где карбоциклическая группа является незамещенной или замещенной одной, двумя или тремя группами, независимо выбранными из галогена, гидрокси, гидроксиалкила, низшего алкила, низшего алкокси, алкоксикарбонила, алкилкарбонила, алкилкарбониламино, аминоалкила, трифторметила, N-гидроксиацетамида, трифторметилалкила, амино и моно- или диалкиламино;
W представляет собой анион, выбранный из группы, состоящей из хлорида, бромида, трифторацетата и триэтиламмония;
m = 0-6;
R4 и один из X1, X2 и X3 могут образовывать ароматическое кольцо, содержащее до трех гетероатомов, независимо выбранных из кислорода, серы и азота, и необязательно замещенных до 4 группами, независимо выбранными из галогена, гидрокси, гидроксиалкила, низшего алкила, низшего алкокси, алкоксикарбонила, алкилкарбонила, алкилкарбониламино, аминоалкила, аминоалкилкарбонила, трифторметила, трифторметилалкила, трифторметилалкиламиноалкила, амино, моно- или диалкиламино, N-гидроксиацетамидо, арила, гетероарила, карбоксиалкила, нитрила, NR7SO2R8, C(О)NR7R8, NR7C(О)R8, C(О)nR7, C(О)NR7SO2R8, (CH2)mS(О)-nR7, (CH2)mгетероарила, О(CH2)m-гетероарила, (CH2)mC(О)NR7R8, О(CH2)mC(О)OR7, (CH2)mSO2NR7R8 и C(О)R7;
R3 представляет собой водород, арил, С1-С8алкил, С1-С8алкокси, C3-C7циклоалкил или C3-C7гетероциклил;
R5 и R6 независимо представляют собой водород, С1-С8алкил, C2-C8алкенил, C2-C8алкинил, арилалкил, циклоалкил, гетероциклоалкил, арил, гетероарил или гетероарилалкил; или
R5 и R6, будучи присоединенными к одному и тому же атому азота, образуют вместе с азотом, к которому они присоединены, гетероциклическое кольцо, содержащее 3-8 кольцевых атомов, причем до четырех из указанных атомов могут быть необязательно замещены гетероатомами, независимо выбранными из кислорода, серы, S(O), S(О)2 и азота, но при условии, что в гетероциклическом кольце содержится по меньшей мере один атом углерода, и что при наличии двух или более кольцевых атомов кислорода кольцевые атомы кислорода не являются смежными друг к другу, причем гетероциклическая группы является незамещенной или замещенной одной, двумя или тремя группами, независимо выбранными из галогена, гидрокси, гидроксиалкила, низшего алкила, низшего алкокси, алкоксикарбонила, алкилкарбонила, алкилкарбониламино, аминоалкила, аминоалкилкарбонила, трифторметила, трифторметилалкила, трифторметилалкиламиноалкила, амино, нитрила, моно- или диалкиламино, N-гидроксиацетамидо, арила, гетероарила, карбоксиалкила, NR7SO2R8, C(О)NR7R8, NR7C(О)R8, C(О)OR7, C(О)NR7SO2R8, (CH2)mS(О)nR7, (CH2)m-гетероарила, О(CH2)m-гетероарила, (CH2)mC(О)NR7R8, О(CH2)mC(О)OR7 и (CH2)SO2NR7R8;
R7 и R8 независимо представляют собой водород, C1-C8алкил, C2-C8алкенил, C2-C8алкинил, арилалкил, циклоалкил, гетероциклоалкил, арил, гетероарил или гетероарилалкил; или
R7 и R8, будучи присоединенными к одному и тому же атому азота, могут образовывать вместе с азотом, к которому они присоединены, гетероциклическое кольцо, содержащее 3-8 кольцевых атомов, причем до четырех из указанных атомов представляют собой гетероатомы, независимо выбранные из кислорода, серы, S(O), S(О)2 и азота, но при условии, что в гетероциклическом кольце содержится по меньшей мере один атом углерода, и что при наличии двух или более кольцевых атомов кислорода кольцевые атомы кислорода не являются смежными друг к другу, где гетероциклическая группа является незамещенной или замещенной одной, двумя или тремя группами, независимо выбранными из галогена, гидрокси, гидроксиалкила, низшего алкила, низшего алкокси, алкоксикарбонила, алкилкарбонила, алкилкарбониламино, аминоалкила, аминоалкилкарбонила, трифторметила, трифторметилалкила, трифторметилалкиламиноалкила, амино, нитрила, моно- или диалкиламино, N-гидроксиацетамидо, арила, гетероарила, карбоксиалкила; и его фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства.
Соединения формулы V описаны, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2003/062236, которая включена в настоящий документ посредством ссылки.
В дополнение к общим вариантам осуществления от первого до пятого, настоящее изобретение также относится к комбинации, включающей первое средство, которое представляет собой ингибитор циклинзависимой киназы 4/6 (CDK4/6), и второе средство, которое представляет собой ингибитор mTOR, где первое средство представляет собой соединение, которое описано, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2010/125402, которая включена в настоящий документ посредством ссылки, или соединение, которое описано, в целом и конкретно, в опубликованной заявке согласно PCT на выдачу патента WO 2008/007123, которая включена в настоящий документ посредством ссылки.
Конкретные типичные ингибиторы циклинзависимой киназы 4/6 (CDK4/6) включают без ограничения:
Соединение A1: диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, который характеризуется следующей химической структурой:
Соединение A2: диметиламид 7-циклопентил-2-[5-(3,8-диазабицикло[3.2.1]октан-3-карбонил)пиридин-2-иламино]-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, который характеризуется следующей химической структурой:
Соединение A3: диметиламид 7-циклопентил-2-[5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]нон-3-ил)пиридин-2-иламино]- 7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, который характеризуется следующей химической структурой:
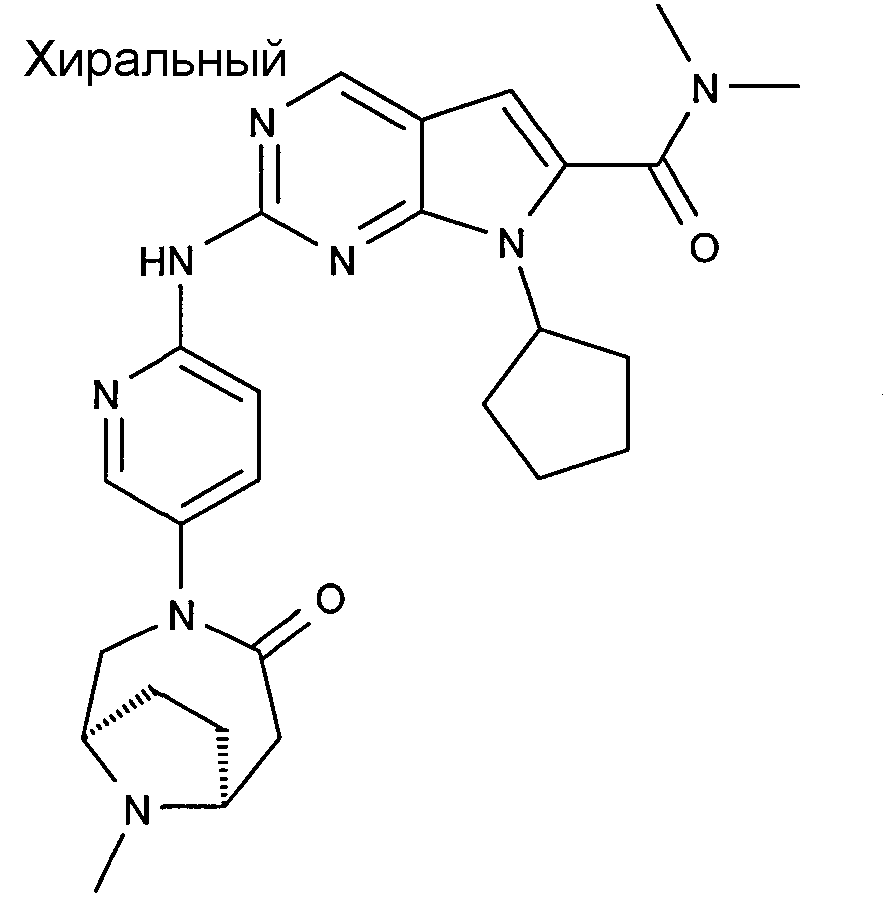
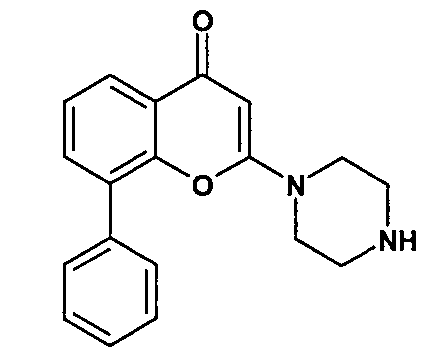
Соединение A4: 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-он, который характеризуется следующей химической структурой:
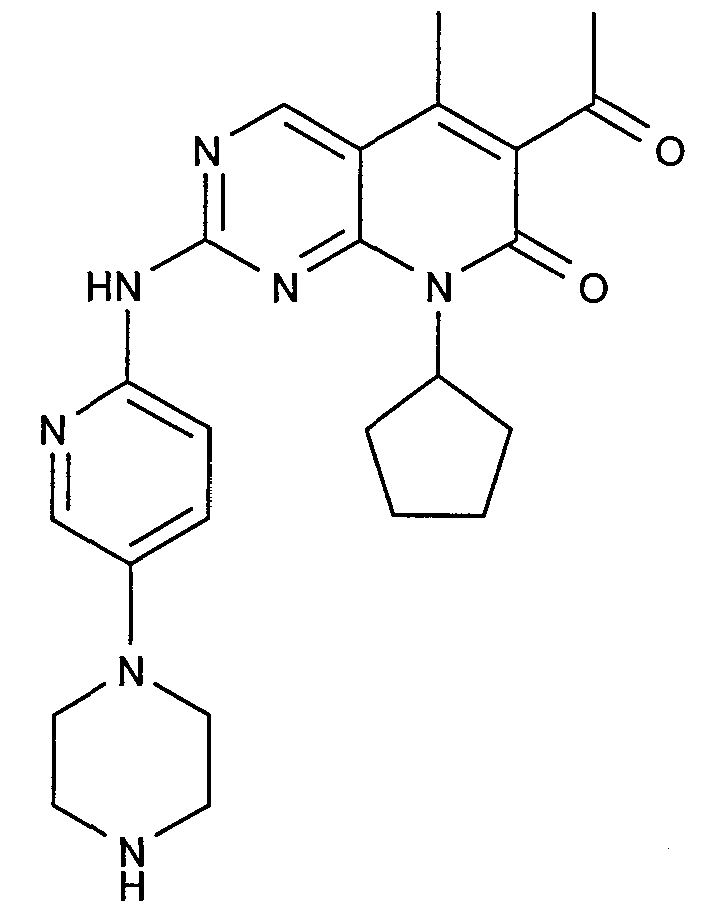
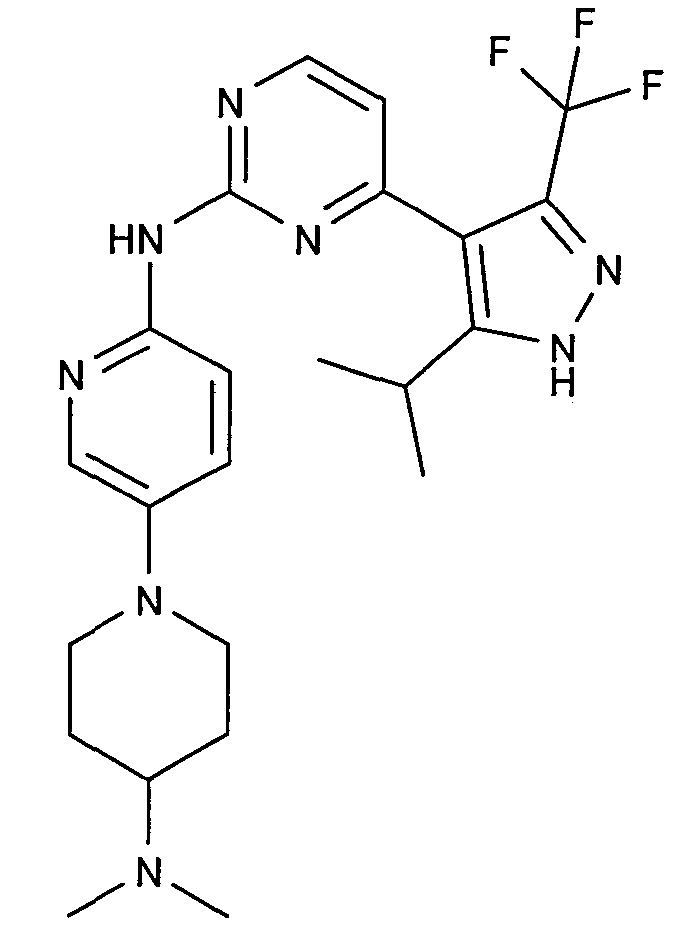
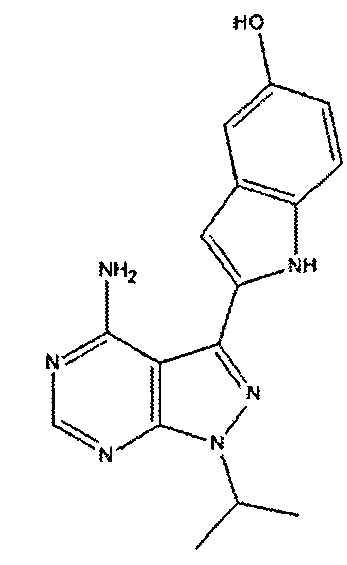
Соединение A5: N*6'*-[4-(5-изопропил-3-трифторметил-1H-пиразол-4-ил)пиримидин-2-ил]-N*4*,N*4*-диметил-3,4,5,6-тетрагидро-2H-[1,3']бипиридинил-4,6'-диамин, который характеризуется следующей химической структурой:
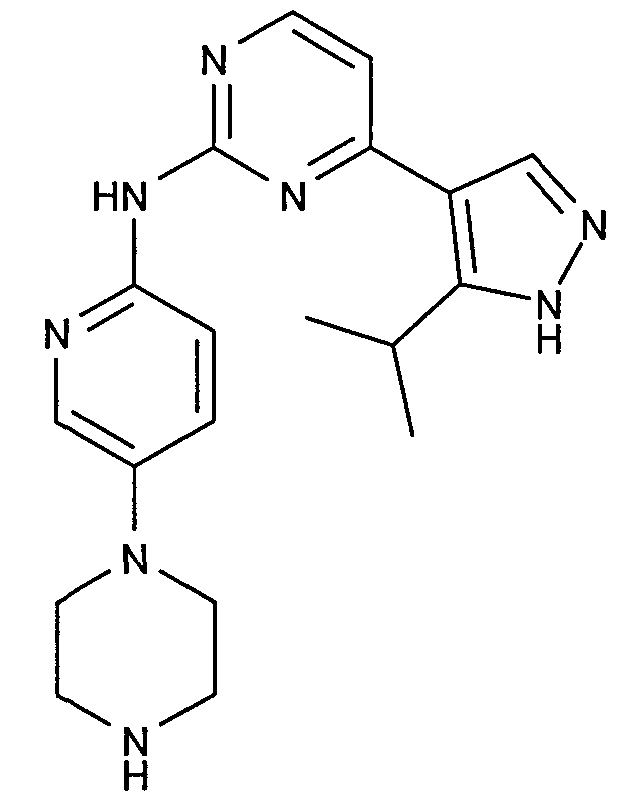
Соединение A6: [4-(5-изопропил-1H-пиразол-4-ил)пиримидин-2-ил]-(5-пиперазин-1-илпиридин-2-ил)амин, который характеризуется следующей химической структурой:
Типичные ингибиторы mTOR, которые могут быть использованы для применения настоящего изобретения на практике, включают сиролимус (рапамицин, AY-22989, Wyeth), эверолимус (RAD001, Novartis), темсиролимус (CCI-779, Wyeth) и деферолимус (AP-23573/MK-8669, Ariad/Merck & Co), AP23841 (Ariad), AZD-8055 (AstraZeneca), Ku-0063794 (AstraZeneca, Kudos), OSI-027 (OSI Pharmaceuticals), WYE-125132 (Wyeth), зотаролимус (ABT-578), SAR543, аскомицин, IΝΚ-128 (Intellikine), XL765 (Exelisis), NV-128 (Novogen), WYE-125132 (Wyeth), EM101/LY303511 (Emiliem), {5-[2,4-бис-((S)-3-метилморфолин-4-ил)пиридо[2,3-d]пиримидин-7-ил]-2-метоксифенил}метанол), соединение OSI-027 (OSI)
HTS-1 (Университет Лестера)
и PP242 (Intellikine)
Каждый из описанных выше ингибиторов mTOR может быть использован в комбинации с любым из общих и/или конкретных вариантов осуществления описанного выше ингибитора циклинзависимой киназы 4/6 (CDK4/6).
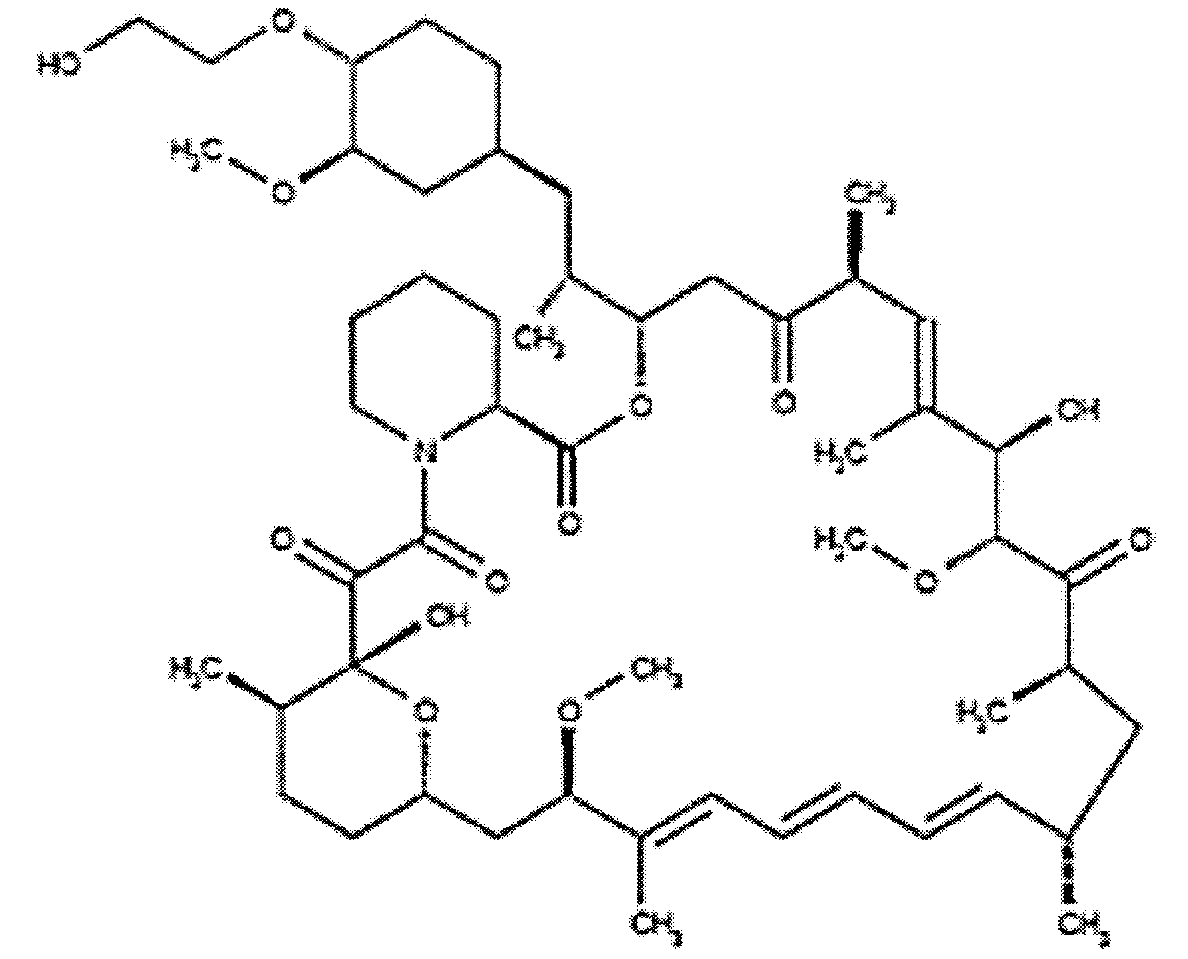
Эверолимус, который представляет собой соединение B1, характеризуется химическим названием ((1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон). Эверолимус и аналоги описаны в патенте США № 5665772 от столбца 1, строка 39 до столбца 3, строка 11. Эверолимус описывается следующей структурой:
Рапамицин, который представляет собой соединение B2, характеризуется химическим названием (3S,6R,7E,9R,10R,12R,14S,15E,17E,19E,21S,23S,26R,27R,34aS)-9,10,12,13,14,21,22,23,24,25,26,27,32,33,34,34a-гексадекагидро-9,27-дигидрокси-3-[(1R)-2-[(1S,3R,4R)-4-гидрокси-3-метоксициклогексил]-1-метилэтил]-10,21-диметокси-6,8,12,14,20,26-гексаметил-23,27-эпокси-3H-пиридо[2,1-c][1,4]-оксаазациклогентриаконтин-1,5,11,28,29(4H,6H,31H)-пентон. Он описывается следующей структурой:
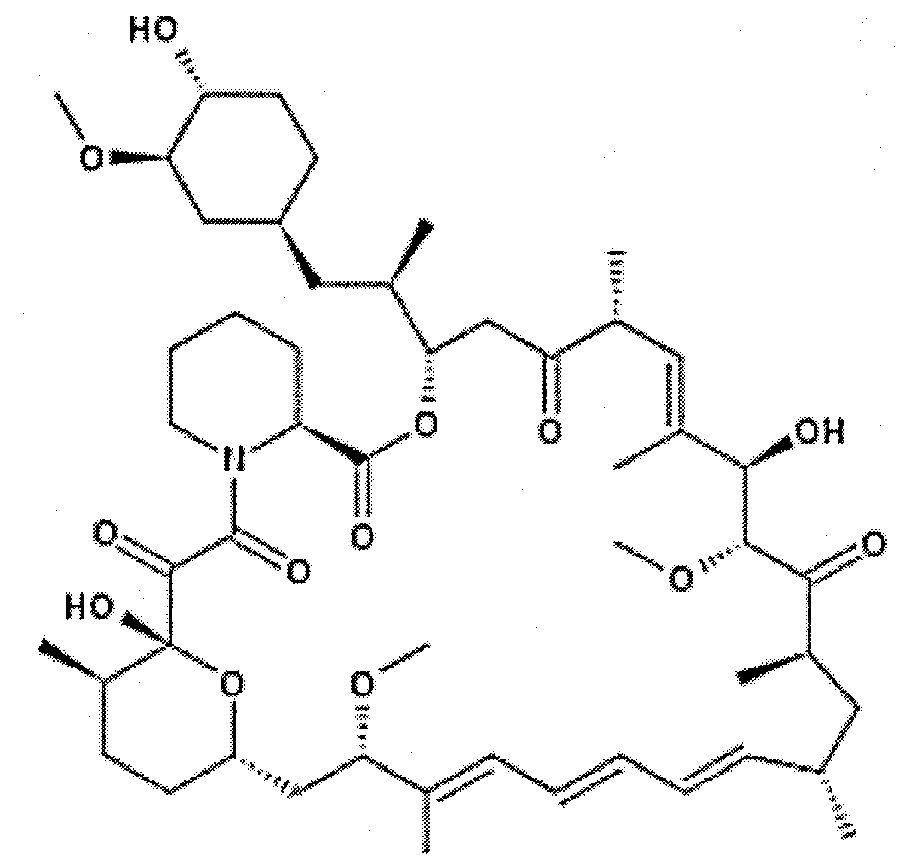
Другие ингибиторы mTOR, применимые согласно настоящему изобретению, включают ингибиторы, раскрытые в публикациях заявок на выдачу патента США №№ 2008/0194546 и 2008/0081809, соединения, описанные в примерах WO 06/090167, WO 06/090169, WO 07/080382, WO 07/060404, WO 07/061737 и WO 07/087395 и WO 08/02316, и соединения, описанные в J. Med. Chem. 2009, 52, 5013-5016.
Согласно другому варианту осуществления, настоящее изобретение включает комбинацию, в которой указанное второе средство выбирают из группы, состоящей из рапамицина (AY-22989), эверолимуса, CCI-779, AP-23573, MK-8669, AZD-8055, Ku-0063794, OSI-027, WYE-125132. Согласно предпочтительному варианту осуществления, второе средство представляет собой эверолимус.
Согласно другому варианту осуществления настоящего изобретения, ингибитор mTOR выбирают из производных рапамицина, таких как:
a. замещенный рапамицин, например, 40-O-замещенный рапамицин, например, соединения, описанные в патенте США № 5258389, WO 94/09010, WO 92/05179, патенте США № 5118677, патенте США № 5118678, патенте США № 5100883, патенте США № 5151413, патенте США № 5120842, WO 93/11130, WO 94/02136, WO 94/02485 и WO 95/14023;
b. 16-O-замещенный рапамицин, например, примеры, раскрытые в WO 94/02136, WO 95/16691 и WO 96/41807;
c. 32-гидрированный рапамицин, например, примеры, раскрытые в WO 96/41807 и патенте США № 5256790;
d. производные, раскрытые в WO 94/09010, WO 95/16691 или WO 96/41807, более подходяще 32-деоксорапамицин, 16-пент-2-инилокси-32-деоксорапамицин, 16-пент-2-инилокси-32(S)-дигидрорапамицин, 16-пент-2-инилокси-32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин, и более предпочтительно 40-O-(2-гидроксиэтил)рапамицин, раскрытый в примере 8 в WO 94/09010, предпочтительно 40-O-(2-гидроксиэтил)рапамицин, 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый CCI-779), 40-эпи-(тетразолил)рапамицин (также называемый ABT578), 32-деоксорапамицин, 16-пент-2-инилокси-32(S)-дигидрорапамицин или TAFA-93; и
e. производные, раскрытые в WO 98/02441 и WO 01/14387, например, AP23573, AP23464 или AP23841.
Согласно другому варианту осуществления, настоящее изобретение включает комбинацию, в которой указанное второе средство выбирают из группы, состоящей из AY-22989, эверолимуса, CCI-779, AP-23573, MK-8669, AZD-8055, Ku-0063794, OSI-027, WYE-125132. Согласно предпочтительному варианту осуществления, второе средство представляет собой эверолимус.
Согласно другому варианту осуществления, настоящее изобретение относится к способу терапии CDK4/6- или mTOR-зависимого гиперпролиферативного заболевания, предпочтительно рака, причем способ включает введение комбинации согласно настоящему изобретению нуждающемуся в этом пациенту. CDK4/6-зависимые злокачественные опухоли, как правило, также характеризуются гиперфосфорилированным Rb-белком (ретинобластомным). Рак является зависимым от каскада реакций, если ингибирование или блокирование такого каскада реакций может замедлить или прервать рост такого рака. Примеры рака, зависимых от каскада реакций с участием CDK4 или CDK6, включают рак молочной железы, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода, липосаркому, лимфому из клеток мантийной зоны, множественную миелому, Т-клеточный лейкоз, почечно-клеточную карциному, рак желудка и рак поджелудочной железы. Примеры типов рака, зависимых от каскада реакций с участием mTOR, включают рак молочной железы, рак поджелудочной железы, почечно-клеточную карциному, лимфому из клеток мантийной зоны, глиобластому, печеночно-клеточную карциному, рак желудка, рак легкого и рак толстой кишки. В данной области техники была установлена взаимосвязь рака с каскадом реакций с участием CDK4/6 или с каскадом реакций с участием mTOR (например, см. Shapiro, Journal of Clinical Oncology, Vol. 24, No. 11 (2006) pp. 1770-1783 или Fasolo, Expert Opin. Investig. Drugs Vol. 17, No. 11 (2008) pp. 1717-1734).
Поэтому, согласно одному варианту осуществления, настоящее изобретение относится к комбинации ингибитора CDK4/6 и ингибитора mTOR для применения при лечении рака, путем производства лекарственного средства, которое может быть продано либо в виде комбинированной, либо в виде раздельной лекарственной формы, или к способу лечения рака путем введения комбинации нуждающемуся в этом пациенту. Раком может являться солидная опухоль или лимфома. Предпочтительные злокачественные опухоли включают рак поджелудочной железы, рак молочной железы, лимфому из клеток мантийной зоны, немелкоклеточный рак легкого, меланому, рак толстой кишки, рак пищевода, липосаркому, множественную миелому, Т-клеточный лейкоз, почечно-клеточную карциному, рак желудка, почечно-клеточную карциному, глиобластому, печеночно-клеточную карциному, рак желудка, рак легкого или рак толстой кишки.
Выражение «фармацевтически приемлемый» относится к молекулярным субстанциям и композициям, которые являются физиологически приемлемыми и при введении человеку, как правило, не вызывают аллергические или аналогичные нежелательные реакции, такие как расстройство желудка, головокружение и т.п. Предпочтительно, используемый в настоящем документе термин «фармацевтически приемлемый» означает одобренный регулирующим агентством федерального правительства или правительства штата, или перечисленные в Фармакопеи США или в другой общепризнанной фармакопее для использования на животных, и, более конкретно, на людях.
Термин «носитель» относится к растворителю, адъюванту, эксципиенту или основе, с которыми вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая петролейного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло, и т.п. Вода или водные растворы, солевые растворы и водные растворы декстрозы и глицерина являются предпочтительно используемыми в качестве носителей, в частности для инъекционных растворов. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences" by E.W. Martin.
Выражение «терапевтически эффективное количество» используется в настоящем документе для обозначения количества, достаточного для снижения по меньшей мере приблизительно на 15 процентов, предпочтительно по меньшей мере на 50 процентов, более предпочтительно по меньшей мере на 90 процентов, и наиболее предпочтительно для предотвращения клинически значимого дефицита активности, функции и реакции организма. В качестве альтернативы, терапевтически эффективное количество является достаточным для того, чтобы вызвать улучшение клинически значимого состояния/симптома в организме.
Термин «средство» относится ко всем веществам, которые могут быть использованы для приготовления фармацевтических и диагностических композиций или которые могут представлять собой соединения, нуклеиновые кислоты, полипептиды, фрагменты, изоформы, варианты или другие вещества, которые могут использоваться независимо для таких целей, которые все находятся в соответствии с настоящим изобретением.
Используемый в настоящем документе термин «аналог» относится к небольшому органическому соединению, нуклеотиду, белку или полипептиду, которые обладают аналогичной или идентичной активностью или функцией (функциями), как и соединение, нуклеотид, белок или полипептид или соединение, обладающие желаемой активностью и терапевтическим эффектом согласно настоящему изобретению (например, ингибирование роста опухоли), но не должны обязательно содержать последовательность или структуру, которая аналогична или идентична последовательности или структуре согласно предпочтительному варианту осуществления.
Термин «производное» относится к соединению, белку или полипептиду, который содержит аминокислотную последовательность исходного белка, или к полипептиду, который был изменен путем введения замен, делеций или добавлений аминокислотных остатков, или к нуклеиновой кислоте или нуклеотиду, которые были модифицированы либо путем введения замен нуклеотидов, либо путем делеций, добавлений или мутаций. Производное нуклеиновой кислоты, нуклеотида, белка или полипептида обладает аналогичной или идентичной функцией, как и исходный полипептид.
Используемый в настоящем документе термин «гало» или «галоген» относится к фтор-, хлор-, бром- и иод-.
Используемый в настоящем документе термин «алкил» относится к неразветвленной или разветвленной насыщенной углеводородной группе. Согласно некоторым вариантам осуществления, алкильная группа может содержать от 1 до 10 атомов углерода (например, от 1 до 8 атомов углерода). Примеры алкильных групп включают метил (Me), этил (Et), пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил, втор-бутил, трет-бутил), пентил группы (например, н-пентил, изопентил, неопентил), гексил (например, н-гексил и их изомеры) и т.п. Низшая алкильная группа обычно содержит до 4 атомов углерода. Примеры низших алкильных групп включают метильную, этильную, пропильную (например, н-пропил и изопропил) и бутильную (например, н-бутил, изобутил, втор-бутил, трет-бутил) группы. Согласно варианту осуществления, алкильная группа, или две или несколько алкильных групп, могут образовывать соединенную мостиковой связью алкильную группу. Это происходит в случае, когда алкильная группа соединена поперек другой группы (особенно, представлено в циклических группах) с образованием кольца, соединенного мостиковой связью при помощи алкильной цепи, например, с образованием соединенного мостиковой связью конденсированного кольца. Без ограничения это показано случаем, когда две или несколько групп R8 для алкильной группы с мостиковыми связями поперек группы кольца Y образуют кольцо, соединенное мостиковой связью при помощи алкильной цепи.
Используемый в настоящем документе термин «алкенил» относится к неразветвленной или разветвленной алкильной группе, содержащей одну или несколько углерод-углеродных двойных связей. Согласно некоторым вариантам осуществления, алкенильная группа может содержать от 2 до 10 атомов углерода (например, от 2 до 8 атомов углерода). Примеры алкенильных групп включают этенильную, пропенильную, бутенильную, пентенильную, гексенильную, бутадиенильную, пентадиенильную, гексадиенильную группы и т.п. Одна или несколько из двойных углерод-углеродных связей может быть внутренней (как например в 2-бутене) или концевой (как например в 1-бутене).
Используемый в настоящем документе термин «алкинил» относится к неразветвленной или разветвленной алкильной группе, содержащей одну или несколько тройных углерод-углеродных связей. Согласно некоторым вариантам осуществления, алкинильная группа может содержать от 2 до 10 атомов углерода (например, от 2 до 8 атомов углерода). Примеры алкинильных групп включают этинил, пропинил, бутинил, пентинил и т.п. Одна или несколько из тройных углерод-углеродных связей может быть внутренней (как например в 2-бутине) или концевой (как например в 1-бутине).
Используемый в настоящем документе термин «алкокси» относится к -O-алкильной группе. Примеры алкоксигрупп включают метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутоксигруппы и т.п.
Используемый в настоящем документе термин «алкилтио» относится к -S-алкильной группе. Примеры алкилтиогрупп включают метилтио, этилтио, пропилтио (например, н-пропилтио и изопропилтио), трет-бутилтиогруппы и т.п.
Термин «карбалкокси» относится к алкоксикарбонильной группе, в которой присоединение к основной цепи проходит по карбонильной группе (C(O)). Примеры включают без ограничения метоксикарбонил, этоксикарбонил и т.п.
Используемый в настоящем документе термин «оксо» относится к кислороду, связанному двойной связью (т.е., =О). Также следует понимать, что обозначение C(O) относится к -C=О группе, будь то кетон, альдегид или кислота или производные кислоты. По аналогии, S(O) относится к -S=О группе.
Используемый в настоящем документе термин «галогеналкил» относится к алкильной группе, содержащей один или несколько галогеновых заместителей. Согласно некоторым вариантам осуществления, галогеналкильная группа может содержать от 1 до 10 атомов углерода (например, от 1 до 8 атомов углерода). Примеры галогеналкильных групп включают CF3, C2F5, CHF2, CH2F, CCl3, CHCl2, CH2Cl, C2Cl5 и т.п. Пергалогеналкильные группы, т.е. алкильные группы, в которых все атомы водорода замещены атомами галогена (например, CF3 и C2F5), включены в определение «галогеналкила». Например, C1-10галогеналкильная группа может характеризоваться формулой -CiH2i+1-jXj, где X представляет собой F, Cl, Br или I, i представляет собой целое число в диапазоне от 1 до 10, и j представляет собой целое число в диапазоне от 0 до 21, при условии, что j меньше чем или равно 2i+1.
Используемый в настоящем документе термин «циклоалкил» относится к неароматической карбоциклической группе, включая циклизированные алкильные, алкенильные и алкинильные группы. Циклоалкильная группа может быть моноциклической (например, циклогексил) или полициклической (например, содержащей конденсированные, соединенные мостиковой связью и/или спирокольцевые системы), где атомы углерода расположены внутри или снаружи кольцевой системы. Циклоалкильная группа может, в целом, содержать от 3 до 14 кольцевых атомов (например, от 3 до 8 атомов углерода для моноциклической циклоалкильной группы и от 7 до 14 атомов углерода для полициклической циклоалкильной группы). Циклоалкильная группа может быть ковалентно связана с определенной химической структурой по любому подходящему положению в кольце. Примеры циклоалкильных групп включают циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную, циклопентенильную, циклогексенильную, циклогексадиенильную, циклогептатриенильную, норборнильную, норпинильную, норкарильную, адамантильную и спиро[4.5]деканильную группы, а также их гомологи, изомеры и т.п.
Используемый в настоящем документе термин «гетероатом» относится к атому любого элемента, отличного от углерода или водорода, и включает, например, азот, кислород, серу, фосфор и селен.
Используемый в настоящем документе термин «циклогетероалкил» относится к неароматической циклоалкильной группе, которая содержит по меньшей мере один (например, один, два, три, четыре или пять) кольцевой гетероатом, выбранный из O, N и S, и необязательно содержит одну или несколько (например, одну, две или три) двойных или тройных связей. Циклогетероалкильная группа может, в целом, содержать от 3 до 14 кольцевых атомов и содержит от 1 до 5 кольцевых гетероатомов (например, 3-6 кольцевых атомов для моноциклической циклогетероалкильной группы и от 7 до 14 кольцевых атомов для полициклической циклогетероалкильной группы). Циклогетероалкильная группа может быть ковалентно присоединена к определенной химической структуре через любой(ые) гетероатом(ы) или атом(ы) углерода, что приводит к образованию стабильной структуры. Один или несколько атомов N или S в циклогетероалкильном кольце могут быть окислены (например, N-оксид морфолина, S-оксид тиоморфолина, S,S-диоксид тиоморфолина). Циклогетероалкильные группы также могут содержать одну или несколько оксогрупп, таких как фталимидил, пиперидонил, оксазолидинонил, 2,4(1H,3H)-диоксопиримидинил, пиридин-2(1H)-онил и т.п. Примеры циклогетероалкильных групп включают, среди прочих, морфолинил, тиоморфолинил, пиранил, имидазолидинил, имидазолинил, оксазолидинил, пиразолидинил, пиразолинил, пирролидинил, пирролинил, тетрагидрофуранил, тетрагидротиенил, пиперидинил, пиперазинил, азетидин и т.п.
Используемый в настоящем документе термин «арил» относится к ароматической моноциклической углеводородной кольцевой системе или полициклической кольцевой системе, в которой по меньшей мере одно из колец в кольцевой системе представляет собой ароматическое углеводородное кольцо, а любые другие ароматические кольца в кольцевой системе включают только углеводороды. Согласно некоторым вариантам осуществления, моноциклические арильные группы могут содержать от 6 до 14 атомов углерода, а полициклические арильные группы могут содержать от 8 до 14 атомов углерода. Арильные группы могут ковалентно присоединяться к определенной химической структуре через любой(ые) атом(ы) углерода, что приводит к образованию стабильной структуры. Согласно некоторым вариантам осуществления, арильные группы могут содержать только ароматические карбоциклические кольца, например, фенил, 1-нафтил, 2-нафтил, антраценил, фенантренильные группы и т.п. Согласно другим вариантам осуществления, арильные группы могут представлять собой полициклическую кольцевую систему, в которой по меньшей мере одно ароматическое карбоциклическое кольцо конденсировано (т.е. содержит общую связь) с одним или несколькими циклоалкильными или циклогетероалкильными кольцами.
Примеры таких арильных групп включают, среди прочих, бензопроизводные циклопентана (т.е. инданильную группу, которая представляет собой 5,6-бициклическую циклоалкильную/ароматическую кольцевую систему), циклогексана (т.е. тетрагидронафтильную группу, которая представляет собой 6,6-бициклическую циклоалкильную/ароматическую кольцевую систему), имидазолина (т.е. бензимидазолинильную группу, которая представляет собой 5,6-бициклическую циклогетероалкильную/ароматическую кольцевую систему) и пирана (т.е. хроменильную группу, которая представляет собой 6,6-бициклическую циклогетероалкильную/ароматическую кольцевую систему). Другие примеры арильных групп включают бензодиоксанил, бензодиоксолил, хроманил, индолинильные группы и т.п.
Используемый в настоящем документе термин «гетероарил» относится к ароматической моноциклической кольцевой системе, содержащей по меньшей мере один кольцевой гетероатом, выбранный из O, N и S, или полициклической кольцевой системе, в которой по меньшей мере одно из колец в кольцевой системе является ароматическим и содержит по меньшей мере один кольцевой гетероатом. Гетероарильные группы могут, в целом, содержать от 5 до 14 кольцевых атомов и содержат 1-5 кольцевых гетероатомов. Согласно некоторым вариантам осуществления, гетероарильные группы могут включать моноциклические гетероарильные кольца, конденсированные с одним или несколькими ароматическими карбоциклическими кольцами, неароматическими карбоциклическими кольцами или неароматическими циклогетероалкильными кольцами. Гетероарильные группы могут ковалентно присоединяться к определенной химической структуре через любой гетероатом или атом углерода, что приводит к образованию стабильной структуры. В общем, гетероарильные кольца не содержат O-O, S-S или S-О связи. Тем не менее, один или несколько атомов N или S в гетероарильной группе могут быть окислены (например, N-оксид пиридина, S-оксид тиофена, S,S-диоксид тиофена). Примеры таких гетероарильных колец включают пирролильную, фурильную, тиенильную, пиридильную, пиримидильную, пиридазинильную, пиразинильную, триазолильную, тетразолильную, пиразолильную, имидазолильную, изотиазолильную, тиазолильную, тиадиазолильную, изоксазолильную, оксазолильную, оксадиазолильную, индолильную, изоиндолильную, бензофурильную, бензотиенильную, хинолильную, 2-метилхинолильную, изохинолильную, хиноксалильную, хиназолильную, бензотриазолильную, бензимидазолильную, бензотиазолильную, бензизотиазолильную, бензизоксазолильную, бензоксадиазолильную, бензоксазолильную, циннолинильную, 1H-индазолильную, 2H-индазолильную, индолизинильную, изобензофурильную, нафтиридинильную, фталазинильную, птеридинильную, пуринильную, оксазолопиридинильную, тиазолопиридинильную, имидазопиридинильную, фуропиридинильную, тиенопиридинильную, пиридопиримидинильную, пиридопиразинильную, пиридопиридазинильную, тиенотиазолильную, тиеноксазолильную, тиеноимидазолильную группы и т.п. Дополнительные примеры гетероарильных групп включают 4,5,6,7-тетрагидроиндолильную, тетрагидрохинолинильную, бензотиенопиридинильную, бензофуропиридинильную группы и т.п.
Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения согласно настоящему изобретению, т.е. соединения формулы (I), где один или несколько атомов заменены атомами, имеющими то же атомное число, но атомная масса или массовое число отличаются от атомной массы или массового числа обычно встречаемого в природе.
Примеры изотопов, подходящих для включения в соединения согласно настоящему изобретению, включают такие изотопы водорода, как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, иода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S.
Некоторые меченные изотопами соединения формулы (I), например, соединения, которые содержат радиоактивный изотоп, применимы при изучениях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3H, и углерода-14, т.е. 14C, особенно применимы для этих целей в связи с легкостью их введения и легкодоступных способов определения.
Замена более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может обеспечить определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенным периодом полураспада in vivo или сниженными требованиями к дозировке, а потому могут быть предпочтительными в некоторых обстоятельствах.
Замена такими позитронно-активными изотопами, как 11C, 18F, 15O и 13N, может быть полезной при исследованиях методом позитронно-эмиссионной томографии (PET) для изучения степени занятости рецептора субстратом.
Меченные изотопами соединения формулы (I), как правило, могут быть получены традиционными методиками, известными специалистам настоящей области, или способами, аналогичными описанным в последующих примерах и способах получениях с использованием подходящих меченных изотопами реагентов вместо ранее используемого немеченого реагента.
ПРИМЕРЫ
В примерах 1-3 представлена общая методика, которая может быть использована для получения диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (соединение A1). Дополнительные способы получения описанных в настоящем документе ингибиторов CDK4/6 могут быть найдены в заявке № PCT/EP09/060793, опубликованной как WO 2010/020675.
Пример 1
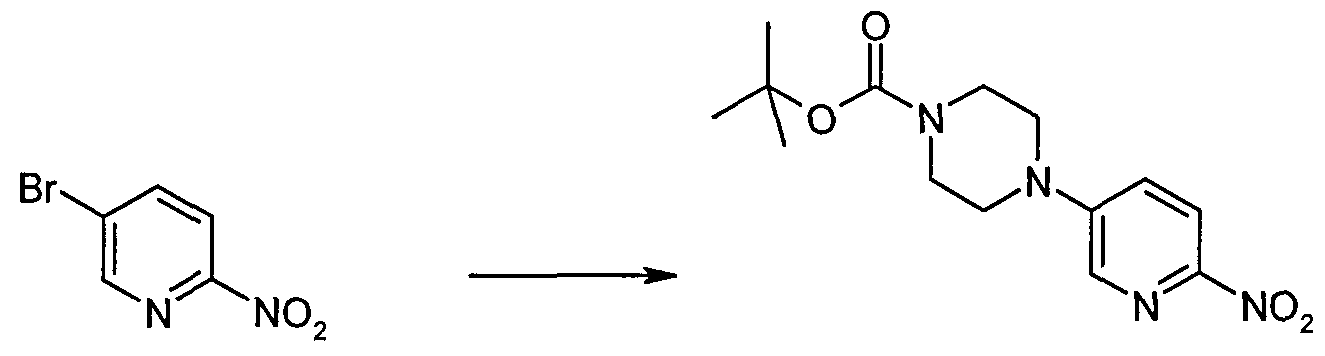
Аналоги нитрила могут быть получены следующим образом. В перемешанный раствор 5-бром-2-нитропиридина (4,93 г, 24,3 ммоль) и сложного трет-бутилового эфира пиперазин-1-карбоновой кислоты (4,97 г, 26,7 ммоль) в CH3CN (60 мл) добавляли DIPEA (4,65 мл, 26,7 ммоль). Смесь нагревали с обратным холодильником в течение 72 часов, затем охлаждали до комнатной температуры, и собирали выпавший в осадок продукт путем фильтрования. Фильтрат концентрировали и очищали методом колоночной флэш-хроматографии, элюируя 30% EtOAc/петролейным эфиром. Объединенные продукты перекристаллизовывали из EtOAc/петролейного эфира с получением сложного трет-бутилового эфира 4-(6-нитропиридин-3-ил)пиперазин-1-карбоновой кислоты (4,50 г, выход 80%). MS(ESI) m/z 308 (M+H)+.
Пример 2
Смесь 5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]пиридин-2-иламина (158 мг, 0,607 ммоль), диметиламида 2-хлор-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (118 мг, 0,405 ммоль), Pd2(dba)3 (18,5 мг, 0,020 ммоль), BINAP (25 мг, 0,040 ммоль) и трет-бутоксида натрия (70 мг, 0,728 ммоль) в диоксане (3,5 мл) дегазировали и нагревали до 100ºC в течение 1 ч в микроволновой печи CEM Discover. Реакционную смесь распределяли между дихлометаном и насыщенным раствором NaHCO3. Органической слой отделяли, и экстрагировали водный слой дополнительным количеством дихлорметана. Объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Неочищенный продукт очищали методом хроматографии на силикагеле (0-10% метанол/дихлорметан) с получением диметиламида 7-циклопентил-2-{5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]пиридин-2-иламино}-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, который дополнительно очищали растиранием с ацетонитрилом (115 мг, 55%). MS(ESI) m/z 517,2 (M+H)+ (способ A).
1H-ЯМР (400 МГц, Me-d3-OD): 8,72 (1H, с), 8,24 (1H, д), 7,98 (1H, д), 7,50 (1H, дд), 6,62 (1H, с), 4,81-4,72 (1H, м), 3,27-3,09 (12H, м), 2,89 (4H, т), 2,61-2,49 (2H, м), 2,16-2,01 (4H, м), 1,81-1,69 (2H, м).
Пример 3
Диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты
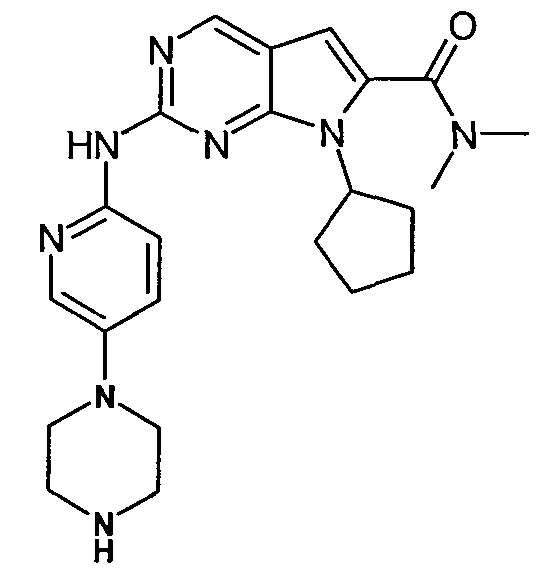
Следуя способу Бухвальда согласно примеру 2, а затем общей методике согласно примеру 1, из диметиламида 2-хлор-7-циклопентил-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (300 мг, 1,02 ммоль) и 5-пиперазин-1-илпиридин-2-иламина (314 мг, 1,13 ммоль) получали диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7H-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (142 мг, 36%). MS(ESI) m/z 435,3 (M+H)+
Пример 4
В люминесцентном методе анализа жизнеспособности клеток с реагентом Cell Titer-Glo (Promega# G7572) генерируется люминесцентный сигнал, пропорциональный числу участвующих в реакции метаболически активных клеток и основанный на количественном определении АТФ. Реагент Cell Titer-Glo приготавливали отогреванием флакона с буфером Cell Titer-Glo при 37ºC в водяной бане. Все содержимое флакона с буфером затем добавляли в бутылку с лиофилизированным субстратом Cell Titer-Glo, входящим в набор. Лиофилизированный субстрат оставляли растворяться; затем раствор перемешивали путем переворачивания, и раствор был готов к использованию. Клетки линии Jeko-1 разбавляли до плотности 200000 клеток/мл и выращивали в колбе T250. Перед обработкой (момент времени 0) 3 аликвоты по 100 мкл отбирали и помещали в черный 96-луночный микропланшет с прозрачным дном (Costar #3904). В каждую лунку добавляли 50 мкл реагента CTG. Микропланшет помещали на защищенный от света орбитальный шейкер и инкубировали с использованием режима 4 в течение 30 минут при комнатной температуре. Затем считывали показания микропланшента с помощью люминометра Envision, и экспортировали результаты. Оставшиеся в колбах T250 клетки либо оставляли необработанными, либо обрабатывали средствами по отдельности или их комбинациями. Использованная концентрация ингибитора CDK4/6 составляла 100 нМ, а использованные концентрации ингибитора mTOR составляли 1, 2,5 и 5 нМ. Микропланшеты оставляли инкубироваться в течение 72 часов при 37ºC и 5% CO2. Спустя 72 часа отбирали 3 аликвоты по 100 мкл и подвергали обработке CTG, как описано выше. Результаты экспортировали и анализировали с использованием Microsoft Excel. Процент жизнеспособных клеток по сравнению с ростом в контроле рассчитывали с использованием следующего уравнения:
Если A>B, то 100×((A-B)/(C-B)), а если нет, то 100×(A-B/B)
где:
A представляет собой показание CTG, снятое в условиях обработки
B представляет собой показание CTG, снятое у клеток в момент времени 0
C представляет собой показание CTG, снятое у необработанных клеток в момент времени 72 часа
Пример 5
Для оценки того, приводит ли комбинация ингибиторов CDK4/6 и mTOR к более выраженному ингибированию роста по сравнению с ингибированием роста, наблюдаемым при использовании средств по отдельности, лимфомные клетки мантийной зоны линии Jeko-1 обрабатывали 100 нМ ингибитора CDK4/6, 1, 2,5 и 5 нМ ингибитора mTOR и комбинацией двух ингибиторов, как представлено на фиг.1. Ингибирование роста измеряют с использованием набора CellTiter-Glo согласно примеру 4. Получали % роста обработанных клеток по сравнению с контролем с растворителем. Как представлено на фиг.1, обработка 100 нМ ингибитора CDK4/6 приводила к 70% росту клеток по сравнению с контролем с растворителем, тогда как обработка лишь ингибитором mTOR приводила приблизительно к 30% росту во всех трех протестированных концентрациях. Примечательно, что комбинации ингибиторов CDK4/6 и mTOR приводили к значительно более выраженному ингибированию роста во всех протестированных комбинациях. Например, в комбинации ингибиторов CDK4/6 и mTOR (100 нМ/5 нМ) наблюдалось менее 10% роста клеток. Это показывает, что комбинация ингибиторов CDK4/6 и mTOR вызывает большее ингибирование роста клеток по сравнению с индивидуальной активностью отдельного соединения.
Пример 6
Для определения того, приводит ли комбинация ингибиторов CDK4/6 и mTOR к синергическому ингибированию роста, заявители строили изоболограммы, где сравнивали фактические значения ингибирования роста в комбинациях с спрогнозированным для аддитивности ингибированием роста на 25, 50 и 75% (Tallarida RJ (2006) An overview of drug combination analysis with isobolograms, Journal of Pharmacology and Experimental Therapeutics; 319 (1): 1-7). Вкратце, для ингибиторов CDK4/6 и mTOR определяли 9 титруемых значений концентраций, включая 0 нМ, которые приводили к ингибированию роста в диапазоне значений от 0 до 100% при использовании их в виде отдельных средств. Оба средства в 9 концентрациях смешивали в матричной формате в 96-луночном микропланшете с получением 81 комбинации. Этот микропланшет использовали для обработки клеток линии Jeko-1, и использовали полученные значения ингибирования роста для получения значений IC50 для отдельных средств и комбинаций. Строили график с концентрациями ингибитора CDK4/6, отложенными по оси y, и концентрациями ингибитора mTOR, отложенными по оси х. Прямая, соединяющая значения IC50 для ингибитора CDK4/6 и ингибитора mTOR, представляла собой значения ингибирования роста, которые были определенно аддитивными для комбинаций. Участки графика, расположенные ниже линии аддитивности (больше ингибирования роста) представляли собой значения синергического ингибирования роста, тогда как участки графика выше линии аддитивности (меньше ингибирования роста) представляли собой значения антагонистического ингибирования роста.
Пример 7
Для оценки того, является ли ингибирование клеточного роста комбинацией ингибиторов CDK4/6 и mTOR синергическим, заявители измерили активность отдельных средств и комбинаций в клетках линии Jeko-1 и проанализировали их с помощью анализа изоболограмм, полученных в соответствии с примером 6. Вкратце, измеряли активность ингибиторов CDK4/6 и mTOR по отдельности для определения 9 титруемых значений концентраций, которые приводили бы к ингибированию роста от 0 до 100% для каждого средства. Все возможные комбинации 9 значений концентраций для каждого ингибитора добавляли совместно в матричном формате к клеткам линии Jeko-1, и регистрировали наблюдаемые значения ингибирования роста. Затем для каждого соединения и комбинации рассчитывали концентрации, которые приводили к 50% ингибированию роста, и использовали их для создания чертежа, представленного на фиг.2. Оси X и Y представляют собой концентрации ингибиторов mTOR и CDK4/6, соответственно. Линия 1 представляет собой значения ингибирования роста, прогнозируемые для аддитивности, при рассмотрении 50% ингибирования роста. Линия 2 представляет собой график, полученный для наблюдаемых комбинаций концентраций, которые приводили к 50% ингибированию роста, и она расположена значительно ниже линии аддитивности, что свидетельствует о сильном синергизме ингибирования роста. Таким образом, комбинация ингибиторов CDK4/6 и mTOR синергично ингибирует рост лимфомных клеток мантийной зоны линии Jeko-1.
Пример 8
Синергический эффект комбинации ингибиторов CDK4/6 и mTOR на клетки рака молочной железы линии MDA-MB453 также анализировали с помощью анализа изоболограмм, как описано выше в примере 7. В соответствии с примером 7, комбинация ингибиторов CDK4/6 и mTOR также синергично ингибирует рост клеток рака молочной железы линии MDA-MB453.
Пример 9
Для оценки противоопухолевой активности в ходе 35-суточного периода терапии соединением A1, соединением B1 и комбинацией соединений A1 и B1 использовали ксенотрансплантационную модель с клетками линии Jeko-1. Наблюдали значительную противоопухолевую активность. Когда введение лекарств останавливали и позволяли опухолям повторно вырасти, комбинация соединений A1 и B1 значительно задерживала рост опухоли на 20 суток. В этой модели, и соединение A1, и соединение B1, обладали противоопухолевой активностью. Тем не менее, комбинация соединений A1 и B1 значительно увеличивала задержку роста опухоли после остановки лечения (см. фиг.4).
Пример 10
Используемые для имплантации клетки рака поджелудочной железы линии PANC-1 поддерживали путем последовательного приживления бестимусным мышам. Для инициации роста опухоли в правый бок каждого подопытного животного подкожно имплантировали фрагмент объемом 1 мм3. Опухоли контролировали два раза в неделю, а затем ежесуточно, когда их средний объем достигал 100-150 мм3. Спустя 22 суток после имплантации опухолевых клеток (сутки 1 исследования), животных делили на четыре группы по десять мышей, с индивидуальными размерами опухоли 108-221 мм3 и средним по группе размером опухоли 150-153 мм3. Размер опухоли в мм3 рассчитывали по формуле:
Объем опухоли = (W2 × L)/2
где W = ширина и L = длина опухоли в мм; вес опухоли может быть оценен при допущении, что 1 мг эквивалентен 1 мм3 объему опухоли.
Мыши 1 группы получали растворители соединения A1 и соединения B1, и служили в качестве контроля во всех анализах. Мыши 2 и 3 групп получали пероральную монотерапию соединением A1 по 250 мг/кг один раз в сутки в течение 21 суток, или пероральную монотерапию соединением B1 по 10 мг/кг один раз в сутки в течение 21 суток. Мыши 4 группы получали комбинированную терапию соединением A1 и соединением B1.
Каждое животное усыпляли, когда объем опухоли достигал 1200 мм3, или в последний день исследования (сутки 55). Для каждого животного, у которого опухоль достигла конечного объема, время до конечной точки (TTE) рассчитывали по следующей формуле:
TTE = (log10(конечный объем) - b)/m
где TTE выражается в сутках, конечный объем выражается в мм3, b представляет собой отсекаемый отрезок, а m - наклон линии, полученной методом линейной регрессии логарифма значений из массива данных по росту опухоли. Массив данных содержит первое наблюдение, которое превысило конечный объем в исследовании, и трех наблюдений подряд, которые непосредственно предшествуют достижению конечного объема. Рассчитанное значение TTE, как правило, меньше, чем сутки, на которые животное усыпляют из-за размера опухоли. Животному с опухолью, которая не достигла конечного объема, присваивают значение TTE, равное значению в последние сутки исследования. Животному, классифицированному как умершему по связанным с лечением (TR) причинам или от не связанных с лечением метастазов (NTRm), присваивают значение TTE, равное значению на сутки смерти. Животное, классифицированное как умершее по несвязанным с лечением (NTR) причинам, исключают из расчетов TTE.
Эффективность лечения определяли по задержке роста опухоли (TGD), которую определяли как увеличение медианного значения TTE в терапевтической группе по сравнению с контрольной группой: TGD = T - C, выраженная в сутках, либо в процентах от медианного значения TTE в контрольной группе: %TGD = [(T - C)/C]×100, где: T = медианное значение TTE для терапевтической группы, C = медианное значение TTE для указанной контрольной группы.
Указанные исследования показывают, что ни соединение A1, ни соединение B1 не обладали значительной противоопухолевой активностью в ксенотрансплантационной модели с клеточной линией PANC-1. Тем не менее, комбинация соединений A1 и B1 приводила к остановке роста опухоли (фиг.5А) и значительной задержке повторного роста опухоли на 18 сутки (фиг.5В).
Пример 11
Потенциальные синергические взаимодействия между комбинациями ингибиторов CDK4/6 и mTOR оценивали в сравнении с моделью аддитивности по Loewe с использованием программного обеспечения CHALICE посредством балла синергии, рассчитанного из разницы между наблюдаемыми значениями и значениями в модели Loewe по всей матрице ответов. Вкратце, использовали 9 титруемых значений концентраций, начиная с 10 мкМ, последовательно разбавляемых в 3 раза, для ингибиторов CDK4/6, и начиная с 0,1 мкМ, последовательно разбавляемых в 3 раза, для ингибиторов mTOR, включая 0 мкM. Оба средства в 9 концентрациях смешивали в матричной формате в 96-луночном микропланшете с получением 81 комбинации. Этот микропланшет использовали для обработки клеток линии Jeko-1, и полученные значения ингибирования были использованы программным обеспечением CHALICE для создания матриц ингибирования и избыточного ингибирования ADD, а также изоболограмм. Более подробное описание методики и расчета может быть найдено в Lehar et al. "Synergistic drug combinations improve therapeutic selectivity", Nat. Biotechnol. 2009, July; 27(7), 659-666, которая включена в настоящий документ посредством ссылки.
Матрица ингибирования демонстрирует фактическое ингибирование, наблюдаемое в методе анализа с CTG при соответствующих концентрациях соединений. Избыточное ингибирование ADD демонстрирует избыточное ингибирование, наблюдаемое в сравнении с ингибированием, прогнозируемым в соответствии с моделью аддитивности по Loewe. В дополнение к матрицам, для наблюдения синергии можно использовать изоболограммы. Уровень ингибирования для каждой изоболограммы выбирали вручную так, чтобы наблюдать наилучшие синергические эффекты. Изоболограмму получали с концентрациями ингибитора CDK4/6, представленными на оси y, и концентрациями ингибитора mTOR, представленными на оси х. Прямая линия, соединяющая концентрации ингибитора CDK4/6 и ингибитора mTOR, которые обеспечивают выбранный уровень ингибирования, представляла собой значения ингибирования роста, которые были определенно аддитивными для комбинаций. Участки графика, расположенные ниже линии аддитивности (больше ингибирования роста) представляли собой значения синергического ингибирования роста, тогда как участки графика выше линии аддитивности (меньше ингибирования роста) представляли собой значения антагонистического ингибирования роста.
Было изучено синергическое взаимодействие между следующими парными комбинациями ингибитора CDK4/6 и ингибитора mTOR, а баллы синергии и соответствующие фигуры перечислены ниже:
|
|