Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, к применению таких композиций в медицине и к способу получения таких композиций. Кроме того, изобретение относится к специфической форме [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты и к получению и применению такой формы.
Предпосылки создания изобретения
В заявках WO 2007/131201 и WO 2008/154259 описаны соединения, обладающие активностью модуляторов сигнального пути Хеджхок, включающие [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты. Местные фармацевтические композиции подробно описаны. Каждая из публикаций включена в настоящее описание в качестве ссылки.
Краткое описание сущности настоящего изобретения
Существует необходимость в разработке фармацевтической композиции для местного введения, включающей [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]-амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, которая обладает преимуществами, такими как оптимальная проницаемость активного соединения в кожу, ограниченное системное воздействие, достаточно высокая стабильность и/или переносимость пациентом. Следовательно, в основном объекте настоящего изобретения предлагаются композиции, которые обладают требуемыми свойствами и указанная цель достигается при получении описанных в данном контексте композиций.
В широком объеме изобретения предлагается местная фармацевтическая композиция, включающая [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты:
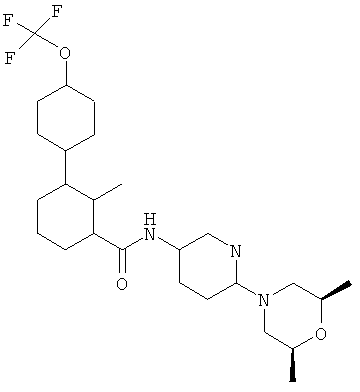
или его сольват ("агент по изобретению") и один или более эксципиентов. Другие названия агента по изобретению: рел-N-[6-[(2R,6S)-2,6-диметил-4-морфолинил]-3-пиридинил]-2-метил-4'-(трифторметокси)[1,1'-бифенил]-3-карбоксамид или N-(6-((2S,6R)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид. Чтобы исключить любую неопределенность, следует отметить, что все вышеприведенные химические названия соответствуют одному и тому же химическому соединению, обозначенному выше химической структурой и их можно использовать взаимозаменяемо.
Такие композиции предпочтительно являются полутвердыми. Неожиданно было установлено, что такие комбинации эффективно доставляют агент по изобретению в кожу, они ограничивают системное воздействие, поддерживают проницаемость через кожу на приемлемых уровнях, являются благоприятными с точки зрения переносимости пациентом и/или стабильными.
Другие объекты изобретения описаны в данном контексте и включают твердую форму [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, способы получения и применения этих композиций. Описанные композиции можно использовать для лечения заболеваний кожи, как определено ниже.
Краткое описание фигур
На фиг.1 представлены концентрации в коже человека (проницаемость) [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, после введения композиций по настоящему изобретению.
На фиг.2 представлены уровни [6-(цис-2,6-диметилморфолин-4-ил)-пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты в коже свиней с удаленным эпидермисом через 24 ч после местного введения композиций по настоящему изобретению.
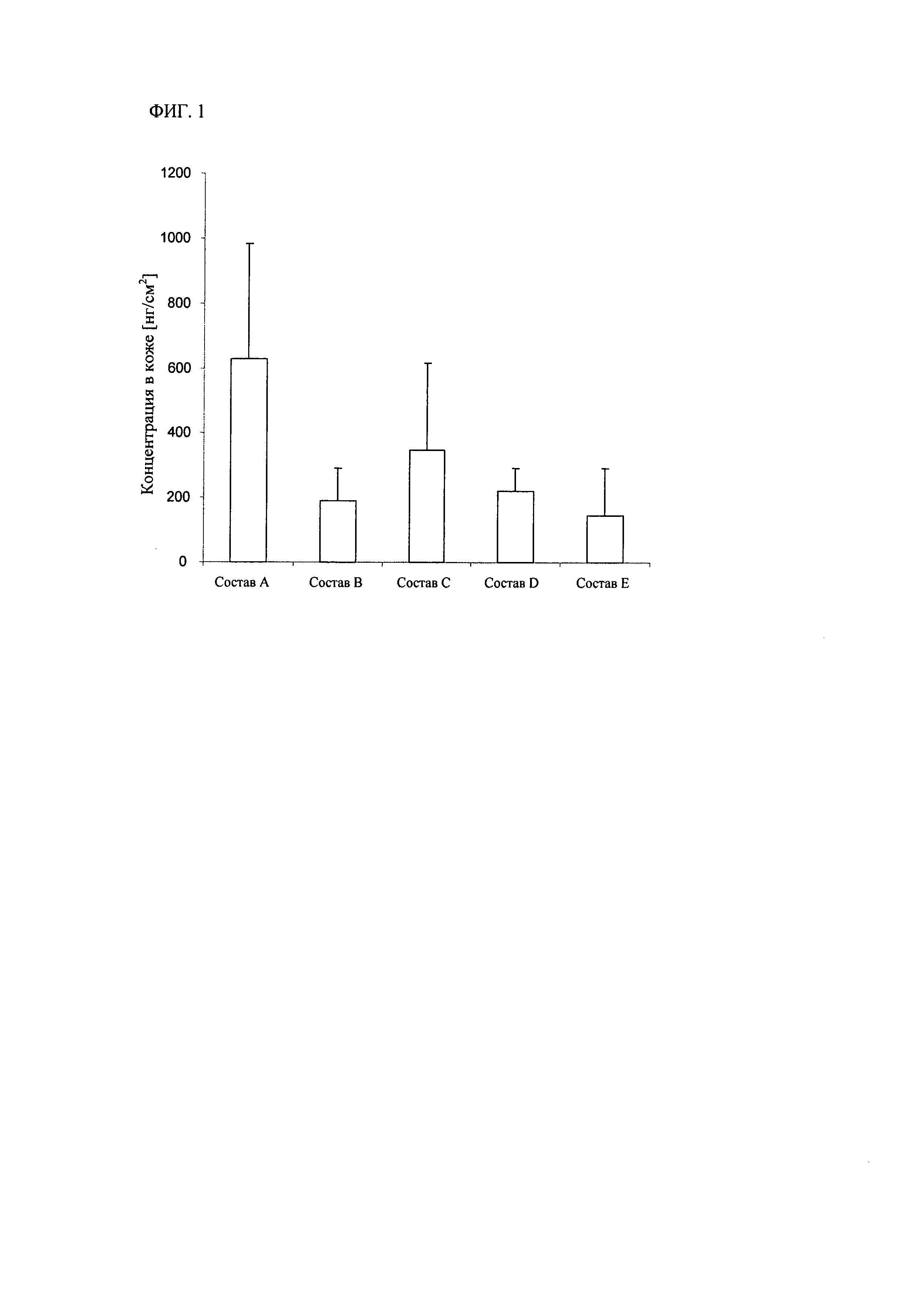
На фиг.3 представлена порошковая рентгеновская дифрактограмма [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, форма А.
Подробное описание предпочтительных вариантов осуществления настоящего изобретения
Для более полного понимания сущности и объектов изобретения, кроме указанных выше, представлено следующее описание, включающее словарь терминов и заключительные примеры.
Термин "агент по изобретению", использованный в данном описании, означает [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты в виде аморфной и кристаллической форм. "Агент по изобретению" представлен также в виде его сольвата или его пролекарства, его фармацевтически приемлемой соли и их смесей. Предпочтительно агент по изобретению, [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, присутствует в свободной форме, то есть не в форме соли.
Термины "включающий", "содержащий" и "состоящий из", использованные в данном описании, представлены в их широком, неограниченном объеме. Если используется множественное число (например, соединения, эксципиенты), то в описание включены объекты в единственном числе (например, одно соединение, один эксципиент). Термин "соединение" не исключает, что (например, в фармацевтической композиции) присутствует более одного соединения (или его солей).
Следует также понимать, что различные варианты осуществления изобретения, предпочтения и диапазоны настоящего изобретения, как представлено/указано в описании изобретения и формуле изобретения, можно при необходимости комбинировать. Кроме того, в зависимости от конкретного варианта осуществления изобретения, выбранные определения, варианты или диапазоны, можно не применять. В настоящем описании использованы следующие общие определения изобретения, если не указано иное.
Термин "сольват", использованный в данном контексте, обозначает молекулярный комплекс, включающий соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" обозначает, что упомянутым растворителем является вода.
Термин "агент по изобретению", использованный в данном контексте, также включает совместные кристаллы [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, которые образуются в присутствии пригодных совместных кристаллообразователей. Такие совместные кристаллы можно получать по известным методикам формирования совместных кристаллов. Такие методики включают измельчение, нагревание, совместную сублимацию, совместное плавление или контактирование в растворе [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты с совместными кристаллообразователями в условиях кристаллизации и выделение сформированных таким образом совместных кристаллов. Пригодные совместные кристаллообразователи описаны в заявке WO 2004/078163.
Термин "пролекарство", использованный в данном контексте, обозначает соединение, которое в физиологических условиях или в ходе сольволиза превращается в биологически активное соединение по изобретению. Таким образом, этот термин обозначает фармацевтически приемлемый метаболический предшественник агента по изобретению. Пролекарство является не активным при его введении пациенту, нуждающемуся в лечении, но in vivo превращается в активное соединение по изобретению. Пролекарства, как правило, быстро превращаются in vivo в исходное соединение по изобретению, например, в ходе гидролиза в крови.
Соединение в виде пролекарств в большинстве случаев обладают преимуществом в отношении растворимости, тканевой совместимости или замедленного высвобождения в организме млекопитающих. Пролекарства агента по изобретению можно получить за счет модификации функциональных групп, присутствующих в агенте по изобретению, таким образом, что модифицированные группы расщепляются в стандартных условиях или in vivo, при этом образуется исходное соединение по изобретению. Пролекарство включает соединения по изобретению, в которых гидроксильная группа присоединена к любой группе и при введении Пролекарства агента по изобретению в организм млекопитающего происходит расщепление указанной группы и образование свободной гидроксильной группы.
Примеры пролекарств включают, но не ограничиваясь только ими, ацетатные, формиатные и бензоатные производные спиртовых групп в агенте по изобретению. Пригодные Пролекарства включают фармацевтически приемлемые сложные эфиры агента по изобретению. Термин "фармацевтически приемлемый сложный эфир", использующийся в данном контексте, относится к эфирам, которые гидролизируются in vivo и включают сложные эфиры, которые быстро разрушаются в организме человека, высвобождая исходное соединение или его соль. Пригодные сложноэфирные группы включают, например, сложноэфирные группы фармацевтически приемлемых алифатических карбоновых кислот, прежде всего алкановых, алкеновых, циклоалкановых и алкандиовых кислот, где каждый алкильный или алкенильный фрагмент предпочтительно содержит не более 6 атомов углерода, прежде всего формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Термин "фармацевтически приемлемые соли", использованный в данном контексте, относится к солям нетоксичных кислот и соединений по изобретению. Эти соли можно получить in situ на конечной стадии выделения и очистки соединений или отдельно при взаимодействии основных функциональных групп с пригодной органической или неорганической кислотой. Типичные соли включают, но не ограничиваясь только ими, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, полусульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, паратолуолсульфонат и ундеканоат.
Кроме того, азотсодержащие основные группы могут образовывать группы четвертичного азота с такими агентами, как алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлорид, бромиды и йодиды, диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды, и другие.
Термин "местная фармацевтическая композиция", использованный в данном контексте, известен в данной области техники (см., например, Европейская фармакопея, 6.3, 01/2009, 0132). Такие композиции содержат (то есть содержат, включают или состоят из) 1) агент по изобретению и 2) матрицу. Матрица (так называемая "основа") содержит фармацевтически приемлемые эксципиенты и предназначена для местного введения. Кроме того, композиции по изобретению представлены в виде геля, пены, настойки, губной помады или спрея. Следовательно, вязкость композиций по изобретению может изменяться в широком диапазоне, как правило, они являются полутвердыми или жидкими, предпочтительно полутвердыми. Композиции по изобретению в виде раствора включают агент по изобретению, растворенный в матрице. В предпочтительном объекте настоящего изобретения композиции представляют собой кремы, обладающие более высокой переносимостью для пациентов.
В одном варианте осуществления изобретения предлагается местная фармацевтическая композиция, включающая [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты и один или более фармацевтически приемлемых эксципиентов.
В другом варианте предлагается местная фармацевтическая композиция, включающая:
а) агент по изобретению,
б) один или более растворителей,
в) необязательно масляную фазу,
г) необязательно один или более антиоксидантов,
д) необязательно один или более улучшителей консистенции,
е) необязательно один или более ПАВ,
ж) необязательно один или более консервантов и
з) необязательно один или более гелеобразующих агентов.
В еще одном варианте предлагается местная фармацевтическая композиция, включающая:
а) агент по изобретению,
б) один или более растворителей,
в) масляную фазу,
г) необязательно один или более антиоксидантов,
д) необязательно один или более улучшителей консистенции,
е) необязательно один или более ПАВ,
ж) необязательно один или более консервантов и
з) необязательно один или более гелеобразующих агентов.
В другом варианте предлагается местная фармацевтическая композиция, включающая:
а) агент по изобретению,
б) диметилизосорбид (ДМИ), пропиленгликоль и необязательно один или более дополнительных растворителей,
в) необязательно масляную фазу,
г) необязательно один или более антиоксидантов,
д) необязательно один или более улучшителей консистенции,
е) необязательно один или более ПАВ,
ж) необязательно один или более консервантов и
з) необязательно один или более гелеобразующих агентов.
В еще одном варианте предлагается композиция по изобретению, содержащая один или более дополнительных эксципиентов. Пригодные эксципиенты выбирают из группы, включающей антиоксиданты, гелеобразующие агенты, регуляторы рН/буферные вещества, агенты для модификации консистенции, консерванты, сорастворители, наполнители, связующие агенты, дезинтегрирующие агенты, модификаторы текучести, смазывающие вещества, ароматизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, растворители и соли для регулировки осмотического давления. Такие эксципиенты известны в данной области техники, выпускаются в виде коммерческих продуктов и приводятся в стандартных справочниках, таких как R.C.Rowe и др., «Handbook of Pharmaceutical Excipients». Такие композиции предпочтительны для переработки или введения пациентам, и, таким образом, указанные композиции улучшают свойства продукта (такие как срок хранения или согласие пациента с курсом лечения). Пригодные эксципиенты описаны ниже.
Растворителем является эксципиент, в котором растворяется агент по изобретению. Следует понимать, что можно использовать один или более растворителей.
Предпочтительным растворителем в композициях по изобретению является диметилизосорбид (ДМИ). В одном варианте содержание ДМИ в композиции находится в диапазоне от 5,0 до 15,0 мас.%, предпочтительно от 7,0 до 13,0 мас.%. В конкретном варианте содержание ДМИ составляет 10,0 мас.%.
В другом варианте композиция дополнительно содержит в качестве растворителя бензиловый спирт. Содержание бензилового спирта предпочтительно составляет до 10 мас.%, более предпочтительно до 5 мас.%. В предпочтительном варианте содержание бензилового спирта находится в диапазоне от 0,5 до 5 мас.%, например, приблизительно 3 мас.%.
В еще одном варианте композиция также содержит в качестве растворителя диизопропиладипат (ДИПА). В одном варианте содержание ДИПА в композиции находится в диапазоне от 10,0 до 20,0 мас.%. Предпочтительно общее количество ДМИ и ДИПА составляет до 30,0 мас.%, включительно. Более предпочтительно содержание ДИПА составляет от 12,0 до 18,0 мас.% и наиболее предпочтительно содержание ДИПА составляет 15,0 мас.%.
В другом варианте осуществления настоящего изобретения композиция включает в качестве растворителя пропиленгликоль. В одном варианте содержание пропиленгликоля в композиции находится в диапазоне от 0,5 до 20 мас.% и прежде всего в диапазоне от 1,0 до 3,0 мас.%, более предпочтительно 2,0 мас.%. В другом варианте содержание пропиленгликоля находится в диапазоне от 7,0 до 13,0 мас.%, прежде всего 10,0 мас.%.
В другом варианте композиция включает по крайней мере один растворитель, выбранный из пропиленгликоля и ДИПА.
В еще одном варианте композиция включает пропиленгликоль, ДИПА или смесь пропиленгликоля и ДИПА в диапазоне 10-35 мас.%, предпочтительно 15-30 мас.%, более предпочтительно 17-25 мас.% в расчете на общую массу композиции.
Предпочтительно композиция по изобретению включает в качестве растворителя ДМИ и дополнительный растворитель, выбранный из пропиленгликоля и ДИПА. Предпочтительные композиции содержат смесь ДМИ и пропиленгликоля, смесь ДМИ и ДИПА или смесь ДМИ, пропиленгликоля и ДИПА, в каждом случае необязательно в смеси с дополнительным растворителем или растворителями.
В другом варианте присутствует масляная фаза, предпочтительно содержащая среднецепочечный триглицерид (СТГ). Масляная фаза включает любую фазу, которая не растворима в воде и может содержать эксципиенты, такие как среднецепочечные триглицериды, парафин, вазелин, полиалкилсилоксан, изопропилмиристат, изопропилпальмиат, изоадипат и растительные масла, то есть касторовое масло, оливковое масло. В одном варианте содержание масляной фазы, такой как СТГ, находится в диапазоне от 2,0 мас.% до 20 мас.%. В другом варианте содержание масляной фазы составляет от 3,0 мас.% до 18 мас.%. В предпочтительном варианте содержание масляной фазы составляет 5,0 мас.%, и в другом варианте 15,0 мас.%.
Следует понимать, что можно использовать один или более антиоксидантов. В одном варианте антиоксидант присутствует в композиции и выбран из группы, включающей производные фенола (например, бутилированный гидрокситолуол (БГТ), бутилированный гидроксианизол (БГА)), производные аскорбиновой кислоты (например, аскорбиновая кислота, аскорбилпальмитат), производные токоферола (например, витамин Е, витамин Е TPGS), производные бисульфита (бисульфит натрия, метабисульфит натрия) и тиомочевину. В предпочтительном варианте композиция включает как БТГ, так и БГА. Пригодная комбинация содержит до 2 мас.% антиоксиданта, предпочтительно 0,05-0,5 мас.%. В еще одном варианте композиция содержит от 0,05 до 0,15 мас.% БГТ и от 0,05 до 0,15 мас.% БГА. Предпочтительно композиция содержит 0,10 мас.% БГТ и 0,10 мас.% БГА.
Агенты для модификации консистенции, так называемые улучшители консистенции, известны в данной области техники, и в другом варианте композиция включает такие агенты. Следует понимать, что можно использовать один или более таких агентов, например цетиловый спирт, стеариловый спирт и их смеси. Пригодная комбинация содержит до 15 мас.%, например всего от 5,0 до 10,0 мас.% улучшителей или модификаторов консистенции. В одном варианте композиция содержит в качестве улучшителей консистенции стеариловый спирт и цетиловый спирт.В другом варианте стеариловый спирт и цетиловый спирт присутствуют в качестве улучшителей консистенции в равных количествах. В предпочтительном варианте содержание стеарилового спирта в композиции находится в диапазоне от 2,0 до 6,0 мас.%, а содержание цетилового спирта находится в диапазоне от 2,0 до 6,0 мас.%. В еще одном варианте содержание стеарилового спирта составляет 4 мас.% и цетилового спирта 4 мас.%.
Следует понимать, что можно использовать одно или более поверхностно-активных веществ (ПАВ). В одном варианте в композиции присутствует по крайней мере одно ПАВ. В еще одном варианте содержание ПАВ или нескольких ПАВ находится в диапазоне от 0,5 до 6,0 мас.%. В предпочтительном варианте в композиции присутствуют в качестве ПАВ глицерилмоностеарат и цетилстеарилсульфат натрия (Lanette Е®). В одном варианте содержание глицерилмоностеарата составляет от 1,0 мас.% до 3,0 мас,%, а содержание цетилстеарилсульфата натрия (Lanette Е®) составляет от 0,1 до 2,0 мас.%. В предпочтительном варианте содержание глицерилмоностеарата составляет 2,0 мас.%, а цетилстеарилсульфата натрия (Lanette Е®) составляет 1,0 мас.%.
Следует понимать, что можно использовать один или более консервантов. Консерванты включают в фармацевтические композиции по настоящему изобретению для увеличения срока хранения. В одном варианте в композиции присутствует по крайней мере один консервант, который выбирают из группы кислот (например, сорбиновая кислота, бензойная кислота), спиртов (например, бензиловый спирт), четвертичных аминов, фенолов и парагидроксибензоатов. В предпочтительном варианте консервантом является бензиловый спирт. Бензиловый спирт также действует в качестве сорастворителя в композициях по изобретению. В одном варианте содержание консерванта находится в диапазоне от 0,5 до 5,0 мас.%. Предпочтительно содержание бензилового спирта составляет 3,0 мас.%.
Гелеобразующие агенты по выбору включают в композиции по настоящему изобретению для модификации вязкости. Следует понимать, что можно использовать один или более гелеобразующих агентов. Например, гелеобразующие агенты включают карбомеры, производные акриловой кислоты или производные целлюлозы, такие как гидроксипропилцеллюлоза. Пригодная композиция содержит до 5 мас.% гелеобразующего агента. В одном варианте композиция содержит от 0,02 до 2,0 мас.% гелеобразующего агента. В предпочтительном варианте композиция содержит 0,5 мас.% или 0,2 мас.% гелеобразующего агента. Предпочтительно гелеобразующим агентом является карбомер 974Р.
Агенты для регуляции рН или буферные вещества известны в данной области техники. Следует понимать, что можно использовать один или более таких агентов, например гидроксид натрия. Пригодная композиция содержит такие кислоты/основания для регуляции рН композиции по изобретению в диапазоне 4-8, предпочтительно 5-7, например 6,5.
Количество агента по изобретению в композиции по изобретению можно изменять в широком диапазоне, как правило, для обеспечения эффективного количества. Термин "эффективное количество" обозначает количество агента по изобретению, которое обеспечивает после его введения млекопитающему, прежде всего человеку, эффективное лечение, как описано ниже. Пригодное количество агента по изобретению определяет специалист в данной области медицины после стандартных экспериментов, и, как правило, пригодное содержание агента по изобретению находится в диапазоне от 0,2 до 5 мас.%, предпочтительно от 0,5 до 2,0 мас.%, например, 0,25, 0,5, 0,75 или 1,0 мас.% в расчете на общую массу композиции.
В другом объекте изобретения предлагается способ получения описанных в данном контексте композиций, который включает следующие стадии:
1. Смешивание описанных в данном контексте липофильных эксципиентов для получения липофильной фазы, смешивание указанной фазы с агентом по изобретению и расплавление смеси.
2. Смешивание гидрофильных эксципиентов и нагревание.
3. Смешивание гидрофильных и липофильных фаз, затем доведение рН. Композицию по настоящему изобретению получают по известным способам, но которые еще не применяли для получения композиций по настоящему изобретению, таким образом, такие способы являются новыми способами. В основном получение фармацевтической композиции включает стадию смешивания агента по изобретению с матрицей, например, при перемешивании, растворении и/или лиофилизации. Такие стадии также могут включать нагревание или охлаждение используемых материалов. Агент по изобретению получают известными способами или описанными в данном контексте способами, а отдельные компоненты матрицы либо являются коммерческими продуктами, либо их получают по известным методикам.
В одном варианте осуществления настоящего изобретения предлагается способ получения композиции описанным в данном контексте способом, включающим следующие стадии:
- смешивание всех жидких неводных эксципиентов и агента по изобретению и при необходимости нагревание смеси при 30-95°С, при этом получают раствор,
- расплавление твердых эксципиентов при температуре от 30 до 95°С, при этом получают расплав,
- смешивание раствора и расплава, предпочтительно при температуре от 30 до 95°С,
- необязательно добавление воды или водной фазы к полученной смеси,
- необязательно охлаждение полученной композиции.
В другом объекте изобретения предлагается применение таких композиций в качестве лекарственных препаратов, прежде всего в качестве лекарственных препаратов для лечения заболеваний кожи.
Композиции, включающие [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]-амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, можно использовать для лечения, включая профилактику и замедление прогрессирования заболеваний, связанных с модуляцией активности сигнального пути Хеджхок. Прежде всего эти композиции можно использовать для лечения заболеваний кожи. Термин "заболевания кожи", использованный в настоящем описании, включает все типы заболеваний, нарушений или состояний кожи у млекопитающих (прежде всего человека). В конкретном варианте композиции, описанные в данном контексте, можно использовать для лечения заболеваний или состояний, включая гиперпролиферативные заболевания кожи, такие как синдром базально-клеточного невуса (так называемый синдром Горлина и/или базально-клеточная карцинома), редкий аутосомно-доминантный генетический синдром, приводящий к раковым образованиям, таким как раковые образования кожи, базально-клеточная карцинома (БКК), прежде всего поверхностная базально-клеточная карцинома (пБКК) и узелковая базально-клеточная карцинома, гиперплазия сальных желез и псориаз.
Таким образом, в одном варианте предлагается композиция, описанная в данном контексте, для применения в медицине. В другом варианте предлагается композиция для применения при лечении заболевания, нарушения или состояния кожи, связанного с сигнальным путем Хеджхок. В еще одном варианте предлагается композиция для применения при лечении гиперпролиферативного заболевания кожи, или заболевания, нарушения или состояния кожи, выбранных из синдрома Горлина, базально-клеточной карциномы, сальной гиперплазии и псориаза.
В другом варианте предлагается применение описанной в данном контексте композиции для получения лекарственного средства, предназначенного для лечения заболевания, нарушения или состояния кожи, опосредованного сигнальным путем Хеджхок. В еще одном варианте предлагается применение описанной в данном контексте композиции для получения лекарственного средства, предназначенного для лечения гиперпролиферативного заболевания кожи или заболевания, нарушения или состояния кожи, выбранных из синдрома Горлина, базально-клеточной карциномы, сальной гиперплазии и псориаза.
В другом варианте предлагается способ лечения заболевания, нарушения или состояния кожи, обусловленного сигнальным путем Хеджхок (прежде всего, выбранных из группы, включающей гиперпролиферативное состояние или синдром Горлина, базально-клеточную карциному, сальную гиперплазию и псориаз), причем лечение заключается во введении субъекту, прежде всего человеку, нуждающемуся в таком лечении, эффективного количества описанной в данном контексте композиции.
В еще одном варианте предлагается описанный в данном контексте способ, согласно которому описанную в данном контексте композицию вводят в комбинации с другой фармацевтически приемлемой композицией, либо одновременно, либо последовательно.
Соответствующая дозировка композиции по изобретению, используемой для лечения, в значительной степени зависит, например, от типа используемой композиции, индивидуального организма-хозяина, природы и тяжести состояния, подлежащего лечению. Однако, в основном, для достижения удовлетворительных результатов лечения крупных млекопитающих, например человека, указанная суточная доза находится в диапазоне приблизительно от 0,01 г до 1,0 г соединения по настоящему изобретению, которую вводят стандартным способом, например, в разделенных дозах до четырех раз в сутки.
В еще одном объекте изобретения предлагаются специфические формы агента по изобретению.
В одном варианте предлагается [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты в кристаллической форме.
Прежде всего, изобретение включает описанную в данном контексте полиморфную форму А, в основном не содержащую другие полиморфные формы агента по изобретению. В другом варианте предлагается форма А [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амида 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты, характеризующаяся следующими пиками на порошковой рентгеновской дифрактограмме (ПРД): угла 29: 12,9, 16,5, 17,0, 18,6, 19,9, 21,2, 22,4, 24,3, 25,8 и 26,1. Форму А получают описанными в данном контексте методами синтеза.
Изобретение также включает описанную в данном контексте полиморфную форму В, в основном не содержащую другие полиморфные формы агента по изобретению или в смеси с другими полиморфными формами агента по изобретению. Форму В получают описанными в данном контексте методами синтеза.
Изобретение, кроме того, включает описанную в данном контексте аморфную форму агента по изобретению.
На фиг.3 представлена порошковая рентгеновская дифрактограмма полиморфной формы А. Относительная интенсивность пиков зависит от нескольких факторов, включая размер частиц, форму и метод приготовления образца и указанная интенсивность может изменяться. Данные были получены на приборе Scintag INC, источник излучения CuKα (45 кВ, 40 мА), непрерывное сканирование со скоростью сканирования 0,5°/мин (значение угла 2θ), диапазон сканирования 1,5-40° (2θ).
Еще один вариант осуществления изобретения включает агент по изобретению, полученный описанным в данном контексте способом.
Способы осуществления настоящего изобретения
Следующие примеры представлены для иллюстрации изобретения и не ограничивают его объем, причем все такие варианты включены в объем изобретения, как определено в формуле изобретения.
А. Синтез N-(6-((2S,6R)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамида
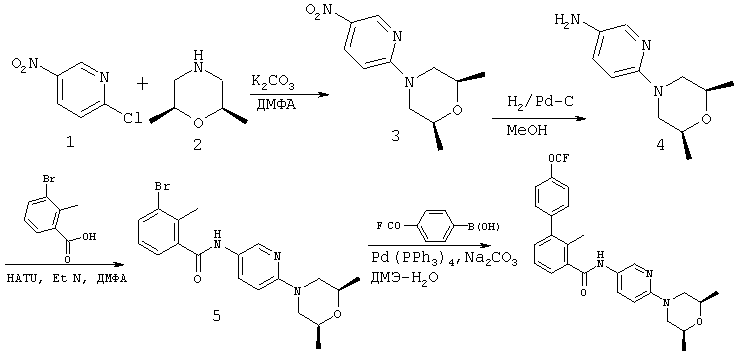
Стадия 1
В раствор 2-хлор-5-нитропиридина 1 (5,58 г, 35,2 ммоль) и цис-2,6-диметилморфолина (4,05 г, 35,2 ммоль) в безводном ДМФА (30 мл) добавляли К2СО3 (9,71 г, 70,4 ммоль). Смесь нагревали в течение ночи при 50°С. После концентрирования остаток распределяли между EtOAc и водой. Слой EtOAc сушили над безводным Na2SO4, концентрировали и получали неочищенный продукт 3 в виде твердого вещества желтого цвета. После очистки методом хроматографии на силикагеле получали очищенный продукт (7,80 г, 93,2%). ЖХ-МС m/z: 238,2 (M+1).
Стадия 2
Полученный материал 3 (7,3 г, 30,8 ммоль) гидрировали в присутствии 10% Pd-C (1,0 г) в МеОН (120 мл) в атмосфере водорода в течение ночи. Суспензию фильтровали через целит и фильтрат концентрировали, а при этом получали неочищенный продукт 4 (5,92 г) в виде масла темно-коричневого цвета, которое использовали на следующей стадии без дополнительной очистки. ЖХ-МС m/z: 208,2 (M+1).
Стадия 3
В раствор 3-бром-2-метилбензойной кислоты (2,71 г, 12,6 ммоль), 6-((2S,6R)-2,6-диметилморфолино)пиридин-3-амина 4 (2,61 г, 12,6 ммоль) и HATU (4,80 г, 12,6 ммоль) в безводном ДМФА (30 мл) по каплям добавляли диизопропилэтиламин (6,58 мл, 37,8 ммоль). Полученную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (50 мл) и затем экстрагировали EtOAc (3×120 мл). Органический слой сушили и концентрировали, при этом получали неочищенный продукт. Этот неочищенный продукт затем очищали методом колоночной экспресс-хроматографии с использованием 30% EtOAc в гексане в качестве элюента, при этом получали соединение 5 в виде твердого вещества белого цвета (4,23 г, 83,0%). ЖХ-МС т/г: 404,1 (М+1).
Стадия 4
Смесь 4-(трифторметокси)фенилбороновой кислоты (254 мг, 1,24 ммоль), 3-бром-М-[6-(2,6-диметилморфолин-4-ил)пиридин-3-ил]-4-метилбензамида 5 (250 мг, 0,62 ммоль), Pd(PPh3)4 (36 мг, 0,03 ммоль), Na2CO3 (2,0 М водный раствор, 1,23 мл, 2,4 ммоль) и ДМЭ (4,5 мл) в закрытой пробирке нагревали в течение ночи при 130°С. Реакционную смесь разбавляли EtOAc и водой. Водный слой экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором и концентрировали, при этом получали неочищенный продукт, который затем очищали с помощью МС-ЖХВР (колонка C18, элюент смесь СН3СМ-Н2О, содержащая 0,05% трифторуксусной кислоты), при этом получали N-(6-((2S,6R)-2,6-диметилморфолино)пиридин-3-ил)-2-метил-4'-(трифторметокси)бифенил-3-карбоксамид (183,5 мг, выход 61,1%). ЖХ-МС m/z: 486,2 (М+1).
Полученный кристаллический продукт (форма А) превращали в аморфную форму при растворении в 3 мас.% водном этаноле и полученный раствор высушивали в сушилке с распылением при 150°С.
Форму В получали при нагревании аморфной формы в сушильном шкафу при 110°С в течение 2 ч.
В еще одном варианте предлагается постадийный способ получения или промежуточный продукт, как описано в данном контексте.
|
|
"Активное соединение" обозначает [6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]амид 2-метил-4'-трифторметоксибифенил-3-карбоновой кислоты.
Оценка проникновения/проницаемости in vitro через кожу человека Приблизительно 300 мг или 300 мкл состава наносили на каждый образец кожи (размороженные срезы брюшной кожи трупа толщиной 500 мкм). Целостность кожи определяли при оценке проницаемости меченой тритием воды. Составы испытывали на образцах кожи с аналогичной проницаемостью для 3Н2О. Приемную камеру заполняли смесью фосфатно-солевого буферного раствора и эмбриональной телячьей сыворотки (2+1, об., рН 7,4) в качестве приемного раствора (Gibco BRL, СН) для имитации физиологических условий в организме человека и системного удаления лекарственного средства с кожи.
Приемный раствор содержал 100 Ед/мл 1% смеси пенициллина и стрептомицина для предотвращения микробиологического заражения. Температура клеток поддерживалась на уровне 34±1°С.
200 мкл приемного раствора отбирали, заменяли тем же объемом исходного раствора для поддержания постоянного объема буферного раствора в течение периода испытаний. Пробы отбирали через 4, 7, 20, 24, 28, 32, 44 и 48 ч после нанесения состава.
После завершения эксперимента остатки состава удаляли с поверхности каждого образа кожи. Роговой слой отделяли от эпидермиса/дермы (путем 20 отслаиваний), и получали образцы обработанных участков отслоенной кожи методом биопсии. Содержание лекарственного средства в приемных жидкостях и отслоенной коже определяли методом ЖХ/МС/МС.
Проницаемость рассчитывали методом линейного регрессионного анализа в линейном участке зависимости концентрации от времени. Кроме того, определяли общее количество прошедшего через кожу лекарственного средства.
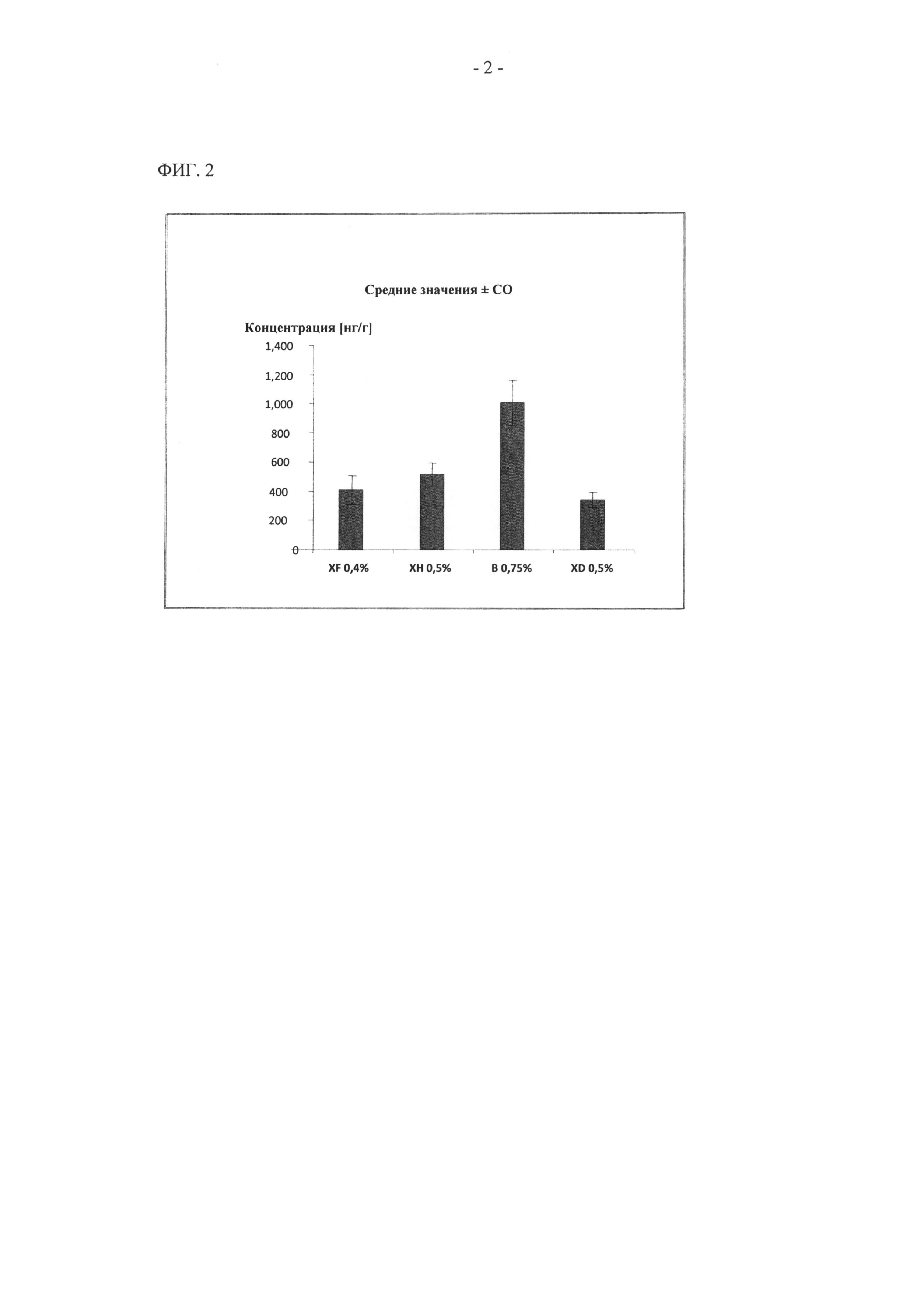
На фиг.1 показана концентрация в коже (проницаемость), где состав А является стандартным составом, содержащим 1% активного соединения в смеси этанол/ПЭГ (полиэтиленгликоль) 30:70. Составы В, D и Е характеризуются аналогичной достаточно высокой проницаемостью через кожу. Неожиданно было установлено, что после нанесения состава С наблюдаются даже более высокие уровни проницаемости через кожу.
Проницаемость через кожу человека составов XD, XF и ХН также оценивали in vitro по сравнению с составом В. Результаты свидетельствуют о том, что все исследованные составы характеризуются приемлемым уровнем проницаемости через кожу, однако состав В характеризуется неожиданно высоким уровнем проницаемости через кожу.
|
Испытания in vivo
1. Оценка проницаемости через кожу домашних свиней ("участки площадью 4 см2")
Для оценки зависимости от времени проницаемости соединения, нанесенного на кожу молодых домашних свиней, животных (массой 12-18 кг) помещали в фиксирующую упряжку. Фармацевтические композиции в виде раствора, полученные, как описано выше, наносили однократно на различные небольшие участки (4 см2) дорсолатеральной части спины свиней за 8, 6, 4, 2, 1 и 0,5 ч до умерщвления животных и иссечения обработанных образцов кожи. Затем нагретые металлические блоки помещали на обработанные лоскуты кожи на 1 мин и отделенный эпидермис отслаивали с помощью щипцов. Из лоскутов кожи с удаленным эпидермисом готовили пластинки кожи толщиной 1 мм с использованием дерматома, из которых получали образцы (6 мм) методом пункционной биопсии и проводили анализ зависимости концентрации исследованного соединения от времени методом ЖХ/МС. Описанную процедуру проводили, принимая меры предосторожности, чтобы исключить загрязнение образцов кожи исследуемым соединением, оставшимся на поверхности.
Результаты
В следующей таблице приведены значения AUC для агента по настоящему изобретению в дерме свиней после нанесения на кожу в составе указанных композиций.
|
+: Среднее значение (среднее отклонение (СО)) для 8 образцов кожи для каждого состава и каждого периода времени (4 свиньи, 2 образца на каждое животное)
Результаты испытаний образцов кожи площадью 4 см2 подтверждают достаточно высокую проницаемость через кожу агента по настоящему изобретению после нанесения составов В, С и D в условиях in vivo.
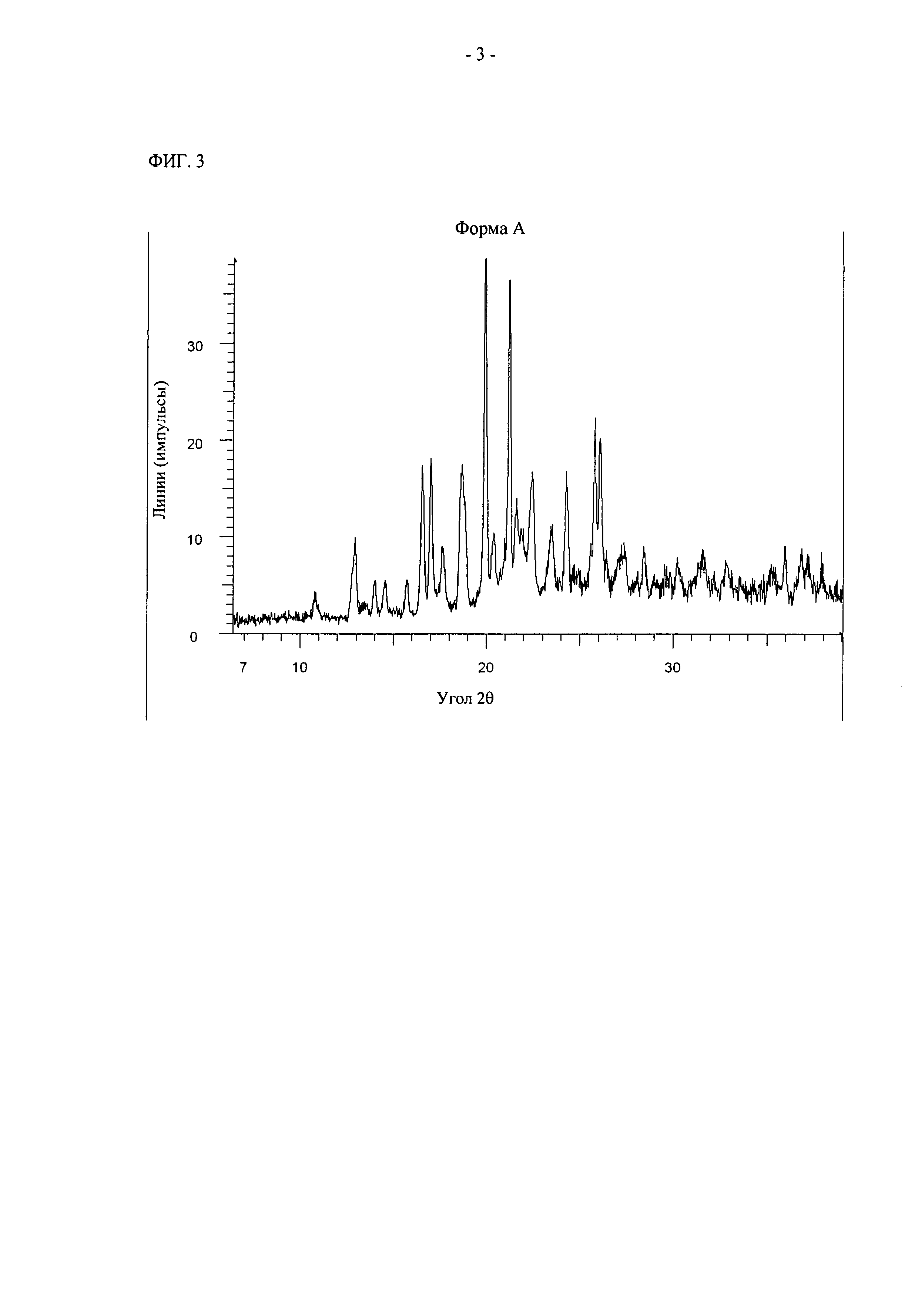
На фиг.2 показаны уровни концентрации активного соединения в коже свиней с удаленным эпидермисом через 24 ч после нанесения на кожу различных составов. После нанесения состава В наблюдалось неожиданное увеличение концентрации активного соединения в коже по сравнению с составами для сравнения. Уровни концентраций увеличиваются пропорционально нанесенному количеству соединения.
|
+Среднее значение (СО) для 6 образцов для каждого состава (3 животных, 2 образца кожи на каждое животное)
2. Оценка проницаемости через кожу домашних свиней (нанесение на 10% поверхности тела)
Способ
Первичным параметром испытаний при нанесении на 10% поверхности тела является подкожная адсорбция (проницаемость через кожу) соединения в виде состава после нанесения на 10% поверхности тела молодых свиней массой 12-18 кг. Кроме того, определяли концентрацию соединения в дерме обработанной кожи после завершения испытаний (через 24 ч после нанесения). Состав наносили в количестве 5 мл на 400 см2 спинной части (соответствует 10% поверхности тела животного массой 10 кг). Образцы крови отбирали из яремной вены через 0,5, 1, 2, 4, 8 и 24 ч после нанесения состава. Образцы дермы из обработанной кожи получали, как описано выше.
Результаты
После нанесения составов XF (0,45%), ХН (0,5%), XD (0,5%) и В (0,75%) концентрации активного соединения в большинстве образцов плазмы составляли величину ниже нижнего предела количественного определения (0,1 нг/мл). Наименьшее число положительных образцов с наименьшими уровнями концентрации было обнаружено у животных, обработанных составами ХН и В. Наибольший уровень и наиболее часто наблюдающиеся уровни концентрации были обнаружены для животных, обработанных составом XD. Эти уровни составили 0,29 (СО 0,11) и 0,08 (СО 0,04) нг/мл через 0,5 и 1 ч после нанесения соответственно. В более поздние периоды времени уровни концентрации составляли величину ниже нижнего предела количественного определения.
3.Оценка эффективности при лечении базально-клеточной карциномы (БКК)
Способы
8 пациентов с диагнозом синдрома Горлина (27 БКК) лечили два раза в сутки составом В или носителем в течение 4 недель. Носителем является состав, аналогичный составу В, но в котором активное соединение заменено эквивалентным количеством воды.
Результаты
Состав В характеризуется удовлетворительной переносимостью и не оказывает раздражающего действия на кожу. Концентрация активного соединения в плазме через 4 недели лечения составляла величину ниже предела обнаружения (0,05 нг/мл) у 4 из 8 пациентов (максимальная обнаруженная концентрация в плазме составляла 0,11 нг/мл). Средняя концентрация активного соединения в коже составляла 737 нг/г (БКК) и 605 нг/г (здоровая кожа). При лечении БКК составом В (n=13) наблюдалась полная клиническая ответная реакция в 3 случаях, частичная ответная реакция в 9 случаях и отсутствие реакции в 1 случае БКК. За исключением одной частичной ответной реакции при нанесении носителя ответная клиническая реакция не наблюдалась ни в одном из 14 случаев БКК.
Среднее уменьшение объема составляло 49,8% при лечении БКК составом В по сравнению с 9,1% при лечении носителем, а среднее уменьшение площади поверхности составляло 40,8% и 10,5% соответственно (трехмерная цифровая фотография). По данным гистологического анализа после лечения составом В очагов БКК наблюдалось среднее уменьшение числа пролиферативных клеток Ki-67 на уровне 60% по сравнению с лечением носителем. Анализ с использованием биомаркеров свидетельствовал о том, что, за исключением одного пациента, уровень уменьшения мРНК Gli 1, Gli 2, Ptch 1 и Ptch 2 коррелирует с клиническим исходом заболевания.
Заключение
Эти результаты свидетельствуют о том, что составы по изобретению проявляют эффективность при лечении БКК пациентов с диагнозом синдрома Горлина. Поскольку использование других современных местных лекарственных средств для лечения БКК ограничено вследствие их раздражающего действия на кожу, лечение пациентов с диагнозом синдрома базально-клеточного невуса составами по настоящему изобретению может представлять существенное и неожиданное преимущество.