Результат интеллектуальной деятельности: СЛОИСТОЕ УСТРОЙСТВО ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Вид РИД
Изобретение
Предпосылки создания изобретения
Настоящее изобретение относится к слоистому устройству для доставки лекарственных средств в форме тонких листов для пероральной/трансбуккальной, трансмукозальной доставки активного лекарственного средства человеку или животному.
Введение лекарственных веществ в кровоток является сложной задачей в фармацевтике. Пероральное введение фармацевтических композиций характеризуется недостатками, включающими сложность удерживания активного агента в необходимом участке для абсорбции, потери лекарственного средства вследствие его разложения в кислотной среде желудка и снижение биодоступности вследствие метаболизма активного агента в печени, низкой растворимости и/или выведения активного агента.
Большой интерес представляет доставка лекарственного средства через слизистую оболочку полости рта. Щечная, десневая (например, десны, небо (например, твердое небо)) и сублингвальная (например, подъязычная) мембраны характеризуются рядом преимуществ для доставки активного компонента, по сравнению со стандартным пероральным введением активного компонента. Например, активные агенты, введенные через слизистую оболочку полости рта, быстро начинают действовать, достигают высокой концентрации в крови за короткий период времени, позволяют исключить пресистемный печеночный метаболизм и воздействие жидкостей желудочно-кишечного тракта.
В патентах US 4517173, 4572832, 4713243, 4900554 и 5137729 и опубликованных патентных заявках US 2001/0051186 и 2004/0006111, которые включены в настоящее описание в качестве ссылок, описана доставка активных веществ через мембрану слизистой оболочки с помощью тонких пленочных композиций. Однако все еще существует необходимость в устройстве для доставки лекарственных средств, которое обеспечивает доставку неустойчивых и/или труднорастворимых активных ингредиентов через мембрану слизистой оболочки.
Краткое описание сущности настоящего изобретения
В настоящем изобретении предлагается слоистое устройство для доставки лекарственного средства, которое представляет собой форму тонких листов и включает внутреннюю и внешнюю стороны. Устройство включает (в порядке их расположения от внешней стороны к внутренней стороне) первый слой, причем первый слой является водонерастворимым, водонабухающим и водопроницаемым по крайней мере в набухшем состоянии, и второй слой, включающий терапевтическое количество водорастворимого лекарственного средства и водорастворимую мукоадгезивную пленку. Второй слой расположен таким образом, что вода, проникающая через указанный первый слой, солюбилизирует лекарственное средство, причем солюбилизированное лекарственное средство проникает через мембрану слизистой оболочки, когда внутренняя сторона контактирует с мембраной слизистой оболочки.
Краткое описание фигур
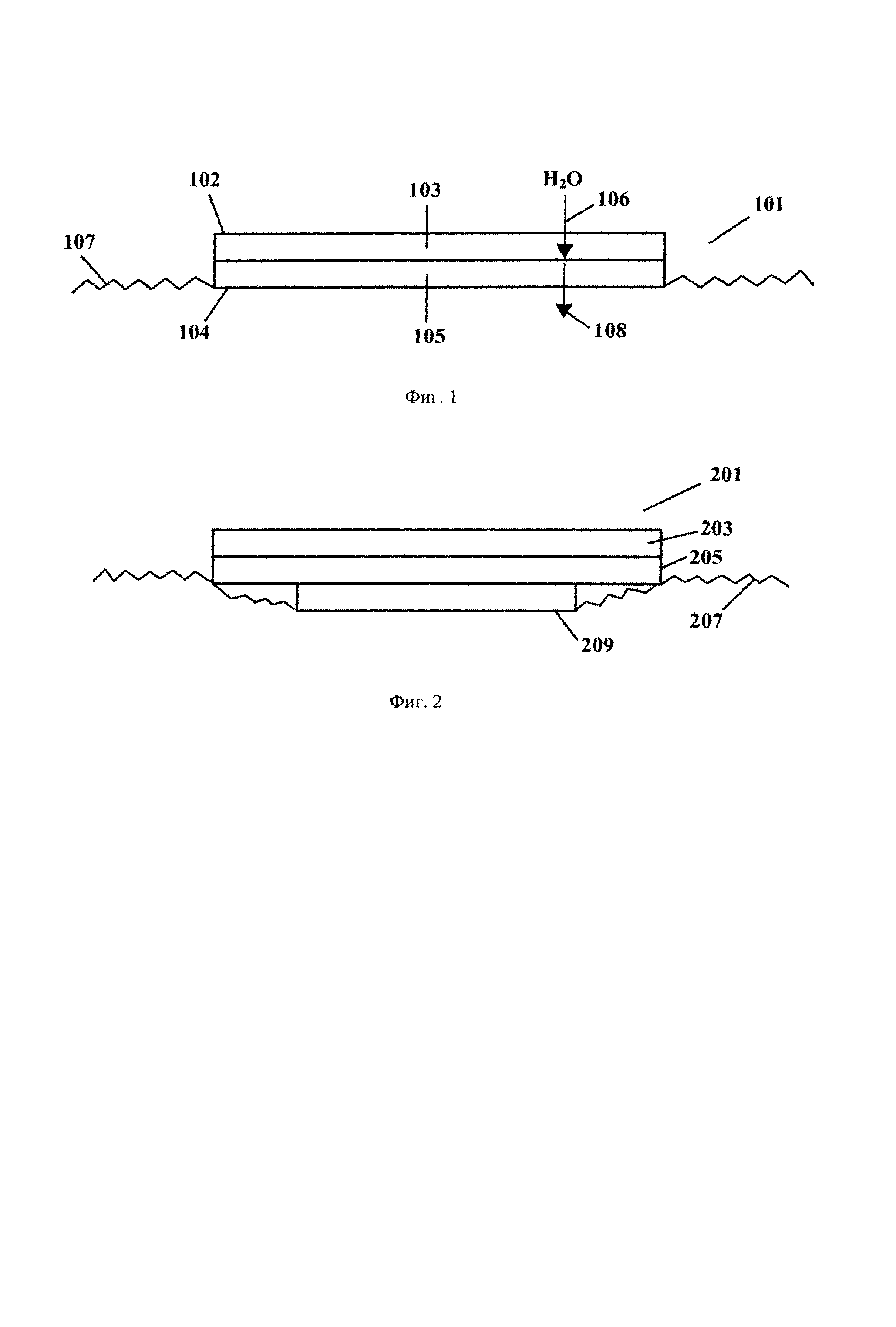
На фиг.1 представлен вид сбоку слоистого устройства для доставки лекарственного средства.
На фиг.2 представлен вид сбоку слоистого устройства для доставки лекарственного средства.
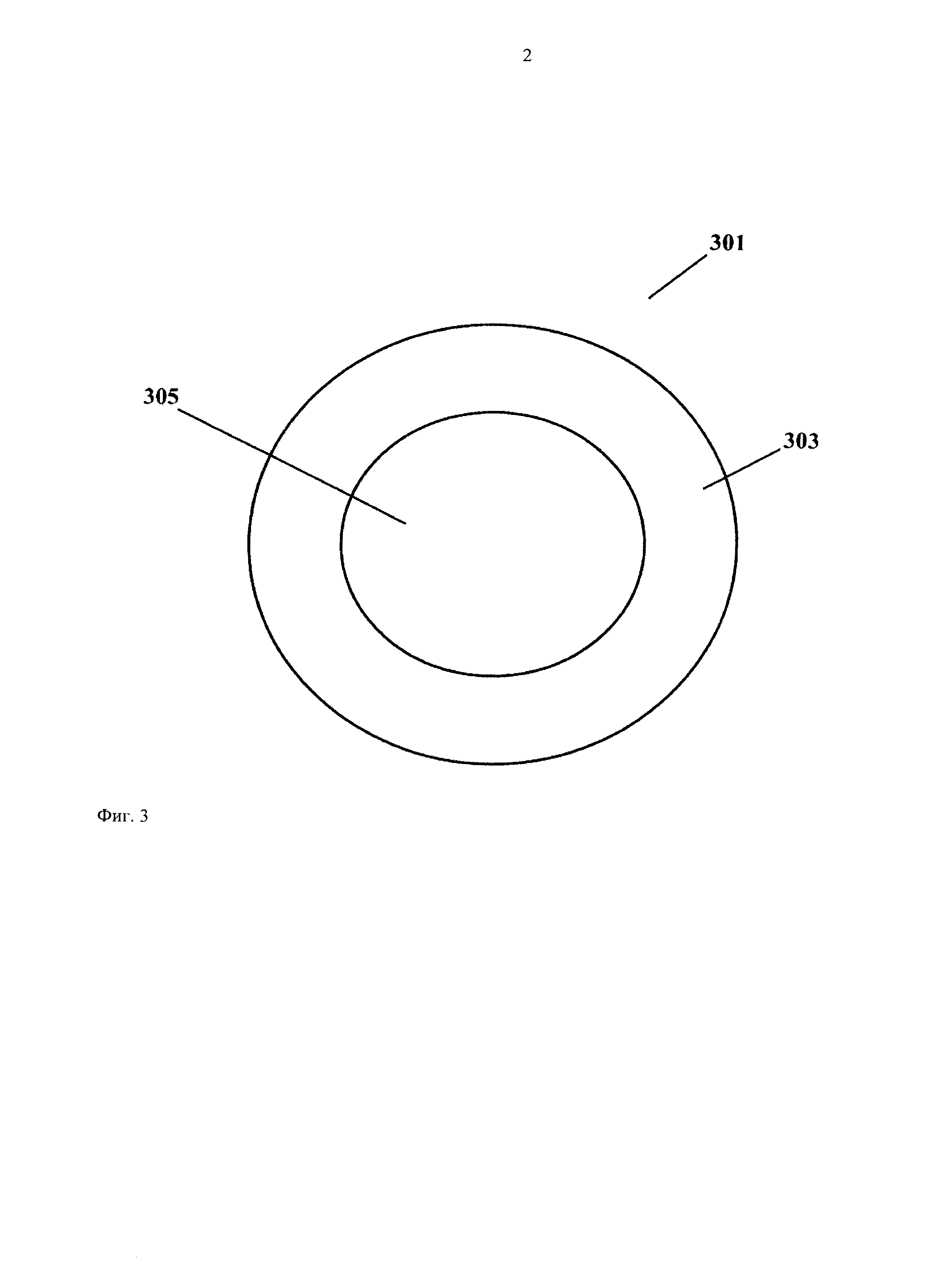
На фиг.3 представлен вид снизу слоистого устройства для доставки лекарственного средства.
На фиг.4-8 представлены графические результаты из раздела Примеры.
Подробное описание настоящего изобретения
Численные значения, приведенные в описании и формуле изобретения, прежде всего в отношении полимерных материалов, отражают средние значения для композиции, которая может содержать отдельные молекулы полимера с различными характеристиками. Кроме того, следует понимать, что численные значения включают численные значения, которые являются одинаковыми, если они приведены к одинаковому количеству значащих цифр, и численные значения, которые отличаются от указанного значения на величину, меньше экспериментальной ошибки метода, используемого для определения значения.
Термин "один вариант осуществления изобретения", "другой вариант осуществления изобретения", "вариант осуществления изобретения", "некоторые варианты осуществления изобретения", использованный в данном контексте, обозначает, что конкретный элемент (например, признак, структура, свойство и/или характеристика), описанный в связи с вариантом осуществления изобретения, включен по крайней мере в один вариант осуществления изобретения, описанный в данном контексте, и может присутствовать или отсутствовать в других вариантах осуществления изобретения. Кроме того, следует понимать, что описанный элемент (элементы) можно комбинировать любым пригодным способом в различных вариантах осуществления изобретения.
В предпочтительном устройстве для доставки лекарственного средства в форме тонких листов, тонкий лист должен обладать рядом важных свойств, а именно:
(1) способность содержать достаточное количество лекарственного средства для обеспечения терапевтической дозы в полоске, размер которой является пригодным для пользователя;
(2) обеспечение пригодного времени трансбуккального проникновения в ротовой полости для доставки активного агента через слизистую оболочку полости рта. Слишком продолжительные времена проникновения приводят к недостаточным уровням в крови, чтобы снизить или контролировать симптомы;
(3) способность перерабатывать слой в тонкую полоску без существенной деградации и/или потери активного агента в исходном составе;
(4) способность предотвращать деградацию или потерю активного агента в течение времени. Тонкая полоска должна характеризоваться пригодным сроком хранения, чтобы в процессе переработки, транспортировки и реализации потребителю сохранялись требуемые свойства, описанные в данном контексте;
(5) способность поддерживать активный ингредиент в форме раствора, для проникновения активного агента через поверхность слизистой оболочки и в кровоток;
(6) способность обеспечивать растворение лекарственного средства в слюне. Для растворения многих лекарственных средств необходим специфический диапазон pH, поэтому pH среды в абсорбционном участке и в слое активного агента необходимо поддерживать в требуемом диапазоне;
(7) способность поддерживать лекарственное средство в предпочтительной форме для повышения проницаемости. Незаряженные формы лекарственных средств, как правило, обладают большей проницаемостью, по сравнению с заряженными и солевыми формами. Часто проницаемость зависит от pH среды и природы лекарственного средства;
(8) способность поддерживать высокую концентрацию растворенного лекарственного средства в непосредственной близости со слизистой оболочкой полости рта и предотвращать вымывание и проглатывание лекарственного средства.
Устройство для доставки лекарственного средства
Устройство для доставки лекарственного средства по настоящему изобретению обладает указанными и многими другими преимуществами. Как представлено на фиг.1, слоистое устройство для доставки лекарственного средства 101 по настоящему изобретению включает внешнюю сторону 102 и внутреннюю сторону 104. В одном варианте осуществления изобретения, представленном на фиг.1, устройство 101 включает, в порядке их расположения от внешней стороны 102 к внутренней стороне 104, первый слой 103 и второй слой 105. Первый слой 103 является водонерастворимым, набухаемым в воде и водопроницаемым по крайней мере в набухшем состоянии. Второй слой 105 включает терапевтическое количество водорастворимого лекарственного средства и водорастворимую мукоадгезивную пленку. Второй слой 105 расположен таким образом, что вода, проникающая 106 через указанный первый слой, солюбилизирует лекарственное средство. Указанное солюбилизированное лекарственное средство затем может проникать 108 через мембрану слизистой оболочки 107, когда внутренняя часть 104 контактирует с мембраной слизистой оболочки 107.
Первый слой 103
Первый слой 103 устройства для доставки лекарственного средства является водонерастворимым, набухаемым в воде и водопроницаемым, по крайней мере в набухшем состоянии. Вода/слюна могут проникать через первый слой и гидратировать второй слой. Даже если первый слой 103 нерастворим в воде, это не означает, что первый слой не распадается в течение времени. В предпочтительном варианте осуществления изобретения первый слой распадается после того, как по крайней мере 50 мас.%, более предпочтительно по крайней мере 75 мас.%, наиболее предпочтительно по крайней мере 90 мас.% (например, более 95 мас.%) первоначально содержащегося во втором слое лекарственного средства проникает через мембрану слизистой оболочки.
Компоненты первого слоя 103 особо не ограничены. В одном варианте осуществления изобретения, описанном ниже, первый слой, удовлетворяющий указанным выше требованиям, представляет собой тонкую пленку, включающую водонерастворимую, набухающую в воде и водопроницаемую пленкообразующую полимерную композицию, водорастворимый пленкообразующий агент, порообразующий агент и низкомолекулярный пластификатор. В широком смысле в настоящем варианте осуществления изобретения первый слой в форме тонкой пленки включает от 25 до 85 мас.% водонерастворимой, набухающей в воде и водопроницаемой пленкообразующей полимерной композиции, от 1 до 75 мас.% водорастворимого пленкообразующего агента, от 5 до 50 мас.% порообразующего агента и от 1 до 20 мас.% низкомолекулярного пластификатора. В более предпочтительном варианте осуществления изобретения первый слой в форме тонкой пленки включает от 35 до 75 мас.% водонерастворимой, набухающей в воде и водопроницаемой пленкообразующей полимерной композиции, от 2 до 65 мас.% водорастворимого пленкообразующего агента, от 5 до 20 мас.% порообразующего агента и от 5 до 15 мас.% низкомолекулярного пластификатора. В некоторых случаях в еще более предпочтительном варианте осуществления изобретения первый слой в форме тонкой пленки включает от 54 до 63 мас.% водонерастворимой, набухающей в воде и водопроницаемой пленкообразующей полимерной композиции, от 6 до 19 мас.% водорастворимого пленкообразующего агента, от 10 до 15 мас.% порообразующего агента и от 8 до 12 мас.% низкомолекулярного пластификатора.
Водонерастворимая, набухающая в воде и водопроницаемая пленкообразующая полимерная композиция особо не ограничена и может включать любой пленкообразующий полимер (полимеры)/полимерную композицию, которые проявляют указанные свойства. Например, можно использовать нейтральный сополимер на основе этилакрилата или метилметакрилата, выпускаемый с торговым названием EUDRAGIT® (NE 30D, L100, S100 или т.п.), или полимер поливинилацетата, стабилизированный повидоном и лаурилсульфатом натрия, выпускаемый с торговым названием Kollicoat® SR30D. Kollicoat® SR30D является водной дисперсией, состоящей из 27% поливинилацетата, стабилизированного 2,7% повидона и 0,3% лаурилсульфата натрия. Он представляет собой дисперсию с низкой вязкостью, молочного или желтоватого цвета со слабым характерным запахом. Такую дисперсию в прошлом использовали для получения покрытий с контролируемым высвобождением для таблеток. Авторами настоящего изобретения неожиданно было установлено, что эта особая композиция является предпочтительной для применения при формировании тонколистового устройства для доставки лекарственного средства по настоящему изобретению.
Водорастворимый пленкообразующий агент особо не ограничен и может состоять из любого растворимого в воде пленкообразующего агента. В предпочтительном варианте осуществления изобретения этот компонент первого слоя также обладает мукоадгезивными свойствами. В некоторых вариантах осуществления изобретения водорастворимый пленкообразующий агент является гидрофильным полимерным материалом или смесью полимеров, которые способны прилипать к влажным поверхностям слизистой оболочки. Примеры пригодных полимеров включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу (например, гипромеллозу или ГПМЦ), гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, декстран, гуаровую камедь, поливинилпирролидон, пектины, крахмалы, желатин, сополимеры акриловой кислоты, виниловые полимеры, виниловые сополимеры, виниловые спирты, алкоксиполимеры, полимеры полиэтиленоксида, полиэфиры и т.п. Среди представленных примеров наиболее предпочтительными водорастворимыми пленкообразующими агентами являются полимеры на основе гипромеллозы и полиэтиленоксида, в отдельности или в комбинации.
Гипромеллоза (ГПМЦ) выпускается фирмой Dow Chemical Company с торговым названием METHOCEL™. Эти продукты являются водорастворимыми эфирами целлюлозы. В таблице фирмы Dow Chemical представлены некоторые характеристики этих полимеров.
|
Было установлено, что в первом слое требуемые свойства обеспечивает комбинация полимеров с низкой/средней вязкостью (например, Methocel E50) и высокой вязкостью (MethocelK4M). При использовании в комбинации массовые соотношения комбинации могут изменяться от 20:1 до 1:20, более предпочтительно от 10:1 до 1:10 (например, от 5:1 до 1:5).
Полиэтиленоксид (ПЭО), пригодный для применения в первом слое в настоящем варианте осуществления изобретения, характеризуется молекулярной массой от 70000 до 300000 Да, например от 100000 до 200000 Да (например, предпочтительно, приблизительно 100000 Да). ПЭО с указанными характеристиками является коммерческим продуктом POLYOX™ WSR N-10 (MM приблизительно 100000 Да) и POLYOX™ WSR N-80 (MM приблизительно 200000 Да) фирмы Dow Chemical. Среди них POLYOX™ WSR N-80 часто является более предпочтительным. ПЭО с значительно большей молекулярной массой (например, до 7000000 Да или более) или композиции, которые включают коагулянты, увеличивающие молекулярную массу полиэтиленоксида, также можно использовать в других вариантах осуществления изобретения. Например, в случае, если требуется пролонгированное высвобождение лекарственного средства, можно использовать высокомолекулярный ПЭО, чтобы продлить сохранность целостности слоя.
При использовании комбинации гипромеллозы и полиэтиленоксида в качестве водорастворимого пленкообразующего агента, массовое соотношение гипромеллозы и пропиленоксида особо не ограничено и предпочтительно находится в диапазоне от 1:20 до 20:1, более предпочтительно в диапазоне от 1:10 до 10:1 (например, в диапазоне от 1:5 до 5:1). В одном варианте осуществления изобретения массовое соотношение находится в диапазоне от 1:2 до 2:1 (например, 1:1). Следует понимать, что в данной области техники ПЭО также упоминается как полиэтиленгликоль (ПЭГ). Однако, так как в композиции также используется низкомолекулярный пластификатор, которым может являться ПЭГ, этот компонент упоминается как ПЭО с целью отличить оба агента друг от друга.
Так как в первом слое также присутствует порообразующий агент, в первом слое образуется пористая матрица, что позволяет воде (например, слюне) проникать через первый слой и гидратировать второй слой. Взаимодействие между вязким и гидратированным вторым слоем и первым слоем сводит к минимуму возможность вымывания солюбилизированного активного фармацевтического ингредиента (АФИ) из второго слоя через первый слой. Такое взаимодействие имеет важное значение для предотвращения вымывания лекарственного средства из мембраны и его проглатывания вместо абсорбции. Кроме того, указанное взаимодействие имеет важное значение в некоторых случаях для предотвращения вымывания в ротовую полость из мембраны слизистой лекарственных средств с неприятным вкусом.
Порообразующий агент в первом слое особо не ограничен. Предпочтительно, он должен эффективно и быстро растворяться или распадаться в воде с образованием пористой матрицы, которая обеспечивает быстрое проникновение слюны через первый слой и солюбилизацию лекарственного средства во втором слое. В одном варианте осуществления изобретения порообразующим агентом является низкомолекулярный и водорастворимый углевод или водорастворимый гидрированный углевод, такой как мальтодекстрин и т.п. В еще одном варианте осуществления изобретения порообразующий агент включает быстрорастворимый полимер, такой как полимер винилпирролидона (например, ПВП или повидон). В других вариантах осуществления изобретения используют комбинацию порообразующих агентов (например, мальтодекстрина и ПВП или повидона).
В других вариантах осуществления изобретения порообразующим агентом является водорастворимый полиол (например, альдит). Примеры альдитов, пригодных для этой цели, включают, но не ограничиваясь только ими, сорбит, ксилит, маннит, лактит и мальтит. В других вариантах осуществления изобретения в качестве альдита или в комбинации с другими альдитами необязательно используют эритрит. Из них прежде всего предпочтительными являются сорбит (температура плавления 95°C) и маннит (температура плавления 167°C), причем маннит является наиболее предпочтительным.
Не основываясь ни на каком механизме действия, следует понимать, что контроль типа и количества порообразующего агента и агента, образующего водорастворимую пленку, позволяет также контролировать скорость распадаемости тонких полосок. Следовательно, предпочтительно выбирать тип и количество этих компонентов таким образом, чтобы значительная часть (например, 80 мас.% или более или 90 мас.% или более) АФИ проникала через мембрану слизистой оболочки до момента полного распадения полоски.
Первый слой по настоящему варианту осуществления изобретения также включает низкомолекулярный пластификатор. Такие пластификаторы включают глицерин, пропиленгликоль, триэтилцитрат и низкомолекулярный (например, менее 4000 Да) полиэтиленгликоль (ПЭГ). В предпочтительном варианте осуществления изобретения низкомолекулярным пластификатором является пропиленгликоль.
Первый слой 103 может включать множество дополнительных эксципиентов или добавок, таких как красители, стабилизаторы и ароматизаторы. Добавление этих эксципиентов или добавок известно в данной области техники и не выходит за пределы объема настоящего изобретения.
Второй слой 105
Второй слой 105 включает терапевтическое количество водорастворимого лекарственного средства и водорастворимую мукоадгезивную пленку, содержащую водорастворимый пленкообразующий агент. Второй слой 105 расположен таким образом, что вода, проходящая через 106 упомянутый первый слой 103, гидратирует второй слой и солюбилизирует лекарственное средство. Солюбилизированное лекарственное средство затем проникает 108 через мембрану слизистой оболочки 107, когда внутренняя сторона 104 контактирует с мембраной слизистой оболочки 107.
Второй слой предпочтительно присутствует в виде твердого раствора. Вода, проходящая через первый слой, и в основном меньшее количество воды с поверхности слизистой оболочки полости рта гидратируют второй слой и предпочтительно превращаются в вязкую жидкость или гель. Твердым раствором является раствор в твердом состоянии (или молекулярная дисперсия) одного или более растворенных веществ в растворителе (например, ацетоне и/или воде). Такая смесь рассматривается скорее как раствор, а не соединение, когда кристаллическая структура растворителя не изменяется при добавлении растворенного вещества и когда смесь находится в одной гомогенной фазе.
Водорастворимым лекарственным средством является водорастворимый активный фармацевтический ингредиент (АФИ), пригодный для трансмукозальной абсорбции в кровоток и особо не ограничен. Термин "водорастворимый", применяемый для описания лекарственного средства, обозначает, что по крайней мере часть лекарственного средства растворяется в воде. Растворимость активного ингредиента может зависеть от pH воды. Например, как объясняется ниже, вода может содержать модификатор pH и/или агент, повышающий растворимость, для доведения pH или увеличения растворимости лекарственного средства, чтобы часть лекарственного средства могла раствориться в воде. Лекарственное средство можно выбрать из любой группы, причем желательно, чтобы продолжительность трансмукозального введения лекарственного средства составляла диапазон, например, от минуты до нескольких часов. Лекарственное средство можно выбрать из следующих лекарственных средств: болеутоляющие, анорексические, противоподагрические, антибактериальные, антибиотические, противосудорожные, антидепрессантные, противодиабетические, притивогрибковые, антигистаминные, противогипертонические, противовоспалительные, противоопухолевые, против болезни Паркинсона, жаропонижающие, антихолинергические, анестезирующие, противомикробные, противовирусные, противоязвенные, бронхорасширяющие, сердечнососудистые, контрацептивные, влияющие на центральную нервную систему, ионотропные, сосудорасширяющие, сосудосуживающие, противоотечные, мочегонные, против эректильной дисфункции, гипогликемические, гормональные, снотворные, повышающие количество гемоглобина в крови, пищевые добавки для поддержания электролитного баланса, бактерицидные, миорелаксантные, парасимпатетолитические, парасимпатетомиметики, ингибиторы протонового насоса, транквилизаторы, офтальмологические, психостимуляторы, витамины и т.п. В предпочтительном варианте осуществления изобретения лекарственным средством является водорастворимый ингибитор протонового насоса, выбранный из группы, включающей лансопразол, омепразол, эзомепразол, рабепразол, пантопразол, парипразол, тентапразол и леминопразол. Среди них наиболее предпочтительным является коммерческий продукт Prevacid.
Водорастворимый пленкообразующий агент во втором слое 105 особо не ограничен и может включать любой пленкообразующий агент, который растворим в воде. В предпочтительных вариантах осуществления настоящего изобретения водорастворимый пленкообразующий агент сам по себе обладает мукоадгезивными свойствами. В этом случае дополнительные мукоадгезивные агенты не требуются, но предпочтительно их добавлять для увеличения мукоадгезивных свойств слоя. В некоторых вариантах осуществления изобретения водорастворимым пленкообразующим агентом является гидрофильный полимерный материал или смесь полимеров, которые могут прилипать к влажным поверхностям слизистой оболочки. Примеры пригодных водорастворимых пленкообразующих полимеров включают, но не ограничиваясь только ими, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу (например, гипромеллозу или ГПМЦ), гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, декстран, гуаровую камедь, поливинилпирролидон, пектины, крахмалы, желатин, сополимеры акриловой кислоты, виниловые полимеры, виниловые сополимеры, виниловые спирты, алкоксиполимеры, полимеры полиэтиленоксида, полиэфиры и т.п.
Среди указанных типичных водорастворимых пленкообразующих агентов наиболее предпочтительными является полимеры на основе гипромеллозы и полиэтиленоксида в отдельности или в комбинации. Для использования во втором слое пригоден тот же тип полимеров на основе полиэтиленоксида, которые описаны выше в отношении первого слоя. Аналогичным образом предпочтительным полиэтиленоксидом является продукт POLYOX™ WSR N-80 (MM приблизительно 200000 Да). Значительно более высокомолекулярные ПЭО (например, до 7000000 Да или более), или композиции, которые включают коагулянты, увеличивающие молекулярную массу полиэтиленоксида, также можно использовать в других вариантах осуществления изобретения. Например, если требуется пролонгированное высвобождение лекарственного средства, использование высокомолекулярного ПЭО позволяет продлить сохранность целостности слоя.
Как описано выше, гипромеллоза (ГПМЦ), пригодная для использования в настоящем изобретении, является коммерческим продуктом METHOCEL фирмы Dow Chemical. Было установлено, что низковязкие продукты или комбинация низковязких продуктов гипромеллозы (например, Methocel E3 и/или Е5) обеспечивают требуемые свойства второго слоя слоистого устройства. В некоторых вариантах осуществления изобретения при использовании в комбинации массовое соотношение гипромеллозы может составлять от 20:1 до 1:20, более предпочтительно от 10:1 до 1:10 (например, от 5:1 до 1:5), например приблизительно 1:1.
При использовании гипромеллозы и полиэтиленоксида в комбинации в качестве водорастворимого пленкообразующего агента, массовое соотношение гипромеллозы и полиэтиленоксида не ограничено и может находиться в диапазоне от 1:20 до 20:1 или от 1:10 до 10:1, более предпочтительно в диапазоне от 1:5 до 5:1. В одном варианте осуществления изобретения массовое соотношение находится в диапазоне от 1:2 до 2:1 (например, 1:1). Следует понимать, что ПЭО также упоминается в данной области техники как полиэтиленгликоль (ПЭГ). Однако, так как в композиции также используется низкомолекулярный пластификатор, которым может являться ПЭГ, этот компонент упоминается как ПЭО с целью отличить оба агента друг от друга.
В одном варианте осуществления изобретения второй слой 105 включает другие ингредиенты и представляет собой тонкую пленку, включающую от 1 до 50 мас.% водорастворимого лекарственного средства (например, АФИ), от 1 до 75 мас.% водорастворимого пленкообразующего агента, от 0,1 до 50 мас.% водорастворимого мукоадгезивного агента, от 1 до 50 мас.% агента для увеличения проницаемости, от 0,1 до 10 мас.% модификатора pH и от 1 до 20 мас.% низкомолекулярного пластификатора. В более предпочтительном варианте осуществления изобретения второй слой представляет собой тонкую пленку, включающую от 10 до 25 мас.% водорастворимого лекарственного средства (например, АФИ), от 25 до 60 мас.% водорастворимого пленкообразующего агента, от 0,3 до 25 мас.% водорастворимого мукоадгезивного агента, от 5 до 40 мас.% агента для увеличения проницаемости, от 1 до 7,5 мас.% модификатора pH и от 2,5 до 10 мас.% низкомолекулярного пластификатора. В другом иногда более предпочтительном варианте осуществления изобретения второй слой представляет собой тонкую пленку, включающую от 14 до 20 мас.% водорастворимого лекарственного средства (например, АФИ), от 35 до 50 мас.% водорастворимого пленкообразующего агента, от 1 до 5 мас.% водорастворимого мукоадгезивного агента, от 15 до 30 мас.% агента для увеличения проницаемости, от 2,5 до 5 мас.% модификатора pH и от 5 до 7 мас.% низкомолекулярного пластификатора.
Как обсуждалось выше, водорастворимый пленкообразующий агент необязательно, но предпочтительно сам по себе обладает мукоадгезивными свойствами. В любом случае водорастворимый мукоадгезивный агент предпочтительно добавлять во второй слой или использовать в виде отдельного слоя, расположенного на внутренней стороне устройства. Водорастворимым мукоадгезивным агентом является соединение, которое прилипает к мембране слизистой оболочки. В предпочтительном варианте осуществления изобретения мукоадгезивным агентом является гидрофильный полимер, природный или синтетический, который прилипает к поверхностям слизистой оболочки. В другом варианте осуществления изобретения мукоадгезивным агентом является гидрогель, природный или синтетический, который прилипает к поверхностям слизистой оболочки. Мукоадгезивные гидрофильные полимерные пленки известны в данной области техники и некоторые из них можно предпочтительно использовать в качестве "водорастворимого пленкообразующего агента" в первом и втором слоях настоящего устройства для доставки. Однако, чтобы отличить термины "водорастворимый мукоадгезивный агент", описанный в данном контексте, и "водорастворимый пленкообразующий агент", описанный выше, следует отметить, что несмотря на наличие или отсутствие у водорастворимого пленкообразующего агента мукоадгезивных свойств, второй слой (или третий слой, расположенный на внутренней стороне второго слоя) предпочтительно включает дополнительный, отдельный или отличающийся "водорастворимый мукоадгезивный агент". Примеры пригодных водорастворимых мукоадгезивных агентов включают, но не ограничиваясь только ими, поливинилпирролидон (ПВП), метилцеллюлозу (МЦ), натриевую соль карбоксиметилцеллюлозы (КМЦН), гидроксипропилцеллюлозу (ГПЦ), другие производные целлюлозы, карбоксивиниловые полимеры (также известные как "полимеры акриловой кислоты"), которые сшиты сшивателем на основе дивинилгликоля (например, поликарбофилы) или аллиловым эфиром пентаэритрита (например, "карбомер", такой как карбомер 940, карбомер 947Р, карбомер 974Р, карбомер 971P, карбомер 71G), полиакрилаты и их сшитые и/или сополимеризованные модификации (например, водорастворимые композиции PROLOC™), хитозан и его производные, эудрагит их комбинации и т.п. Другие примеры пригодных мукоадгезивных агентов включают, но не ограничиваясь только ими, декстран, гуаровую камедь, крахмалы, желатин, казеин, акриловую кислоту, эфиры акриловой кислоты, сополимеры акриловой кислоты, виниловые полимеры, виниловые сополимеры, виниловые спирты, алкоксиполимеры, полимеры полиэтиленоксида, полиэфиры, тиополимеры, их комбинации и т.п.
Среди этих типичных мукоадгезивных соединений обычно предпочтительными являются карбоксивиниловые полимеры, сшитые аллиловым эфиром пентаэритрита (например, карбомер 974Р с вязкостью от 29400 до 39400 сП, измеренной при 25°C) или дивинилгликолем (например, поликарбофил АА-1 USP с вязкостью от 4000 до 11000 сП, измеренной при 25°C).
Информация фирмы-производителя о свойствах коммерческого продукта Carbopol 974P представлена в следующей таблице.
|
Информация фирмы-производителя о свойствах коммерческого продукта Noveon® Polycarbophil AA-1 USP представлена в следующей таблице.
|
Термин "усилитель проницаемости" или аналогичные термины обозначают материал, который ускоряет проникновение водорастворимого лекарственного средства через мембрану слизистой оболочки, и "эффективное количество" усилителя проницаемости обозначает количество, эффективное для ускорения проникновения лекарственного средства через мембрану слизистой оболочки до выбранной степени. Усилители проницаемости известны в данной области техники и их использование в настоящем изобретении особо не ограничено. Известно, что некоторые усилители проницаемости также являются солюбилизирующими агентами, т.е. увеличивают растворимость активных агентов в воде. В предпочтительном варианте выбирают один из этих указанных солюбилизирующих агентов/усилителей проницаемости. Например, некоторые пригодные усилители проницаемости описаны в статье Nicollazo и др. Permeation Enhancers - How Do They Work, Journal of Controlled Release 105, на стр.1-15 (2005). Список пригодных усилителей проницаемости включает, но не ограничиваясь только ими, ферменты, такие как папаин, бромелаин, терпены, такие как ментол, камфора и тимол, Azone (1-додецилазациклогептан-2-он), жирные кислоты, их соли и сложные эфиры, лецитин, моноглицериды, триглицериды, хитозан и метилированный хитозан, соли желчных кислот, такие как гликохолат натрия, циклодекстрины, неионные ПАВ, ионные ПАВ, такие как лаурилсульфат натрия, карбамеры, масла, такие как кремофор RH40, ПЭГ-40 и гидрированное касторовое масло, солюбилизатор для гидрофобных фармацевтических средств, такой как жирорастворимые агенты, эфирные масла, неионный солюбилизатор и эмульгирующий агент, лутрол F68 (полоксамер 188), 2,3-лауриловый эфир, фосфатидилхолин, апротинин, полиоксиэтилен, Azone, полисорбат 80, хлорид бензалкония, полиоксиэтилен, хлорид цетилпиридиния, фосфатидилхолин, бромид цетилтриметиламмония, натриевая соль ЭДТУ, циклодекстрин, гликохолат натрия, сульфат декстрана, гликодеоксихолат натрия, гликоль, лаурилсульфат натрия, диметилсульфоксид, лауриновая кислота, салицилат натрия, лауриновая кислота/пропилен, таурохолат натрия, лизофосфатидилхолин, тауродеоксихолат натрия, ментол и сульфоксиды. В предпочтительном варианте осуществления изобретения усилитель проницаемости выбирают из группы, включающей ментол, диметилсульфоксид (ДМСО), гликохолат натрия, моноглицериды, Azone и циклодекстрины.
Второй слой также предпочтительно включает модификатор pH. Модификатор pH предпочтительно добавляют для контроля pH мембраны слизистой оболочки в диапазоне, в котором водорастворимое лекарственное средство является стабильным, в наибольшей степени растворенным, поддерживается в состоянии раствора и/или в котором ускоряется проникновение через мембрану слизистой оболочки. Если, например, водорастворимым лекарственным средством является ингибитор протонного насоса (например, лансопразол), то требуется поддерживать pH абсорбционной поверхности на уровне более 8. Было установлено, что лекарственное средство является стабильным и поддерживается в состоянии раствора при высоком/щелочном значении pH от 8 до 11 (например, более предпочтительно от 8,5 до 10,5). Для поддержания pH мембраны слизистой оболочки/щечной мембраны в этом диапазоне pH добавляют щелочной модификатор. Процесс модификации pH и связанные с ним теоретические основы известны специалистам в данной области техники, и настоящее изобретение не ограничивается конкретным модификатором или способом модификации. Если в настоящем изобретении используют основный модификатор, как правило, предпочтительным является NaOH в связи с его эффективностью в качестве модификатора pH и его стоимостью. При использовании кислотного модификатора, его предпочтительно выбирают из группы, включающей лимонную кислоту, соляную кислоту, аспарагиновую кислоту и глутаминовую кислоту. Выбор модификатора pH и его количества имеет важное значение для обеспечения предпочтительного профиля растворения и абсорбции и при этом сводится к минимуму отрицательный эффект высокого или низкого pH среды в слизистой оболочке полости рта.
Второй слой также предпочтительно включает низкомолекулярный пластификатор. Такие пластификаторы включают глицерин, пропиленгликоль, триэтилцитрат и полиэтиленгликоль (ПЭГ). В предпочтительном варианте осуществления изобретения низкомолекулярным пластификатором является ПЭГ, который смешивают с ПЭО и который характеризуется ММ от 100 до 4000 Да, более предпочтительно от 300 до 600 Да (например, 400 Да или ПЭГ 400 в жидкой форме). ПЭГ присутствует в количестве от 5 до 30 мас.% в расчете на общую массу состава, более предпочтительно от 7 до 15 мас.% (например, 10 мас.%) в расчете на общую массу состава.
В другом варианте осуществления изобретения и как показано на фиг.2, слоистое устройство для доставки лекарственного средства 201 содержит первый 203 и второй 205 слои. Первый слой 203, как описано выше, является водонерастворимым, набухающим в воде и водопроницаемым. Второй слой 205 включает водорастворимое лекарственное средство и мукоадгезивное пленкообразующее соединение. Слоистое устройство для доставки лекарственного средства также включает необязательный дополнительный слой (слои) 209 (например, как показано на фиг.2, расположенный на внутренней поверхности устройства). В предпочтительном варианте осуществления настоящего изобретения дополнительный слой 209 (слои) включает модификатор pH и/или усилитель проницаемости и/или дополнительный водорастворимый мукоадгезивный агент. Если присутствует более одного дополнительного слоя 209 (например, не показано), каждый дополнительный слой 209 может содержать другой компонент (компоненты). В другом варианте осуществления изобретения дополнительный слой расположен между первым и вторым слоями. Этот последний вариант осуществления изобретения может свидетельствовать о применимости градиента концентрации, который направляет компонент (например, лекарственное средство, усилитель проницаемости или стабилизатор pH) в направлении или к мембране слизистой оболочки или от нее.
Второй слой 105, 205 может включать множество дополнительных эксципиентов или добавок, таких как красители, стабилизаторы или ароматизаторы. Добавление указанных эксципиентов или добавок не выходит за пределы объема настоящего изобретения.
Формирование слоистого устройства для доставки лекарственного средства
Слоистое устройство для доставки лекарственного средства включает по крайней мере два слоя или тонких листа (например, по крайней мере первый и второй тонкие листы), и может включать большее число слоев/листов, контактирующих в одной плоскости. Слоистое устройство для доставки лекарственного средства можно сформировать и разрезать, как описано ниже, до размера, который является пригодным для пользователя, из исходного листа устройства для доставки лекарственного средства. Исходный лист устройства для доставки лекарственного средства состоит по крайней мере из двух тонких исходных листов (например, первого исходного листа и второго исходного листа).
Способ формирования тонких листов особо не ограничен, и их можно формировать, например, формованием с погружением в раствор, экструзией из расплава или комбинацией способов (например, первый лист получают формованием с погружением в раствор, а второй лист получают экструзией). В случае экструзии из расплава предпочтительно, чтобы пленкообразующие композиции обладали большой молекулярной массой, что позволяет осуществлять экструзию и каландрование тонкого листа из композиции.
В предпочтительном варианте осуществления изобретения первый исходный и второй исходный листы получают формованием с погружением в раствор, при этом компоненты листа, описанные выше, растворяют или суспендируют в растворе-носителе. Затем взвесь или раствор выливают в поддон или другую форму с большой площадью поверхности, где растворитель удаляют из раствора и/или лист охлаждают, при этом требуемые компоненты остаются в составе тонкой пленки. В описанном выше предпочтительном варианте осуществления изобретения, в котором второй лист представляет собой форму твердого раствора, компоненты второго листа растворяют в соответствующем растворителе (например, ацетоне и/или воде), и затем раствор переносят/наносят на поддон или другую форму с большой площадью поверхности. Во время удаления растворителя "высушиваемой фазы" необходимо соблюдать осторожность и поддерживать компоненты в растворе, которые обеспечивают образование пленки в виде твердого раствора. При удалении растворителя увеличивается вязкость и процентное содержание твердой фазы. Более высокая вязкость позволяет исключить самоассоциацию или рекристаллизацию лекарственного средства и других эксципиентов.
После формирования обеспечивают контактирование первого и второго исходных тонких листов, необязательно при нагревании и/или под давлением (например, ламинируют), и получают исходный лист устройства для доставки лекарственного средства. Исходный лист устройства для доставки лекарственного средства затем можно разрезать и получать отдельные слоистые устройства для доставки лекарственного средства по настоящему изобретению. Количество водорастворимого лекарственного средства/АФИ в устройстве для доставки зависит от размера слоя устройства (длина × ширина × толщина), на который нанесен АФИ, и от концентрации лекарственного средства в слое. В предпочтительном варианте осуществления изобретения отдельное устройство для доставки лекарственного средства (например, отдельная тонкая полоска) содержит рекомендованную дозу АФИ. В предпочтительных вариантах осуществления изобретения размер устройства для доставки лекарственного средства составляет от 0,5 до 4 см в ширину и от 0,5 до 6 см в длину. В других вариантах осуществления изобретения размер устройства для доставки лекарственного средства составляет от 1,5 до 3 см в ширину (например, приблизительно 2 см в ширину) и от 1,5 до 5 см в длину (например, приблизительно 3,5 см в длину). В одном варианте осуществления изобретения размеры устройства для доставки лекарственного средства предпочтительно составляют от 22 мм × 11 мм до 22 мм × 37 мм. В другом варианте осуществления изобретения устройство для введения лекарственного средства формируют таким образом, чтобы общая площадь полоски составляла от 1 см2 до 20 см2 (например, от 1 см2 до 10 см2). После формирования отдельных устройств для доставки лекарственного средства в виде полосок их можно упаковывать отдельно или по несколько штук в контейнер для многократного введения (например, в контейнер для ленточных лекарственных форм или контейнер для стопочных лекарственных форм).
Толщина слоистого устройства для доставки лекарственного средства составляет предпочтительно от 0,01 мм до 3,00 мм, например от 0,1 мм до 2,00 мм (например, от 0,1 мм до 1,00 мм). Предпочтительно соотношение ширины первого слоя и ширины второго слоя находится в диапазоне от 1:10 до 10:1, более предпочтительно в диапазоне от 1:5 до 5:1 и наиболее предпочтительно от 1:3 до 3:1 (например, приблизительно 1:1, приблизительно 1:2 или приблизительно 2:1). В другом варианте осуществления изобретения содержание первого слоя составляет от 10 мас.% до 90 мас.% (например, от 10 мас.% до 50 мас.%) в расчете на общую массу слоистого устройства для доставки лекарственного средства, а содержание второго слоя составляет от 90 мас.% до 10 мас.% (например, от 50 мас.% до 90 мас.%) в расчете на общую массу слоистого устройства для доставки лекарственного средства.
В описанных в данном контексте вариантах осуществления настоящего изобретения упоминаются, по крайней мере, два различных тонких листовых слоя в устройстве для доставки лекарственного средства. Авторы заявки отмечают, что возможно наличие более двух различных тонких листовых слоев. Например, некоторые ингредиенты первого или второго слоя могут содержаться в отдельном листе, который затем ламинируют с другими листами и получают комбинированное устройство для доставки.
Геометрическая форма отдельного слоистого устройства для доставки лекарственного средства особо не ограничена, но за исключением того, что геометрическая форма должна представлять собой форму листа и с площадью поверхности любых размеров. Предпочтительно размер плоской поверхности устройства выбирают таким образом, чтобы устройство удобно располагалось во рту пациента и предпочтительно не содержало неровных или угловых граней. В наиболее предпочтительно варианте осуществления изобретения устройство характеризуется круглой, овальной или яйцеобразной поверхностью/формой. В другом предпочтительном варианте осуществления изобретения, представленном на фиг.3, поверхности первого 303 и второго 305 слоев выбирают таким образом, чтобы вся поверхность второго слоя 305 располагалась на поверхности первого слоя 303 слоистого устройства 301. Было установлено, что в этом предпочтительном варианте можно исключить вымывание активного агента из комбинированного устройства 301. Предпочтительно также, чтобы первый слой 303 содержал водорастворимый пленкообразующий агент, который также обладает мукоадгезивными свойствами, причем при нанесении на мембрану слизистой оболочки второй слой полностью изолирован от остальной части ротовой полости. Количество воды, проходящей через первый слой, предпочтительно составляет более 75%, еще более 90%, наиболее 95% (например, 99%) количества воды, необходимого для солюбилизации/смачивания второго слоя, а остальное количество воды необязательно поступает с поверхности, непосредственно контактирующей со слизистой оболочкой полости рта.
Примеры
После подробного описания настоящего изобретения приводятся следующие примеры. В следующих примерах описаны пригодные и предпочтительные способы формирования исследуемых полосок, которые являются пригодными для применения в промышленности. Примеры приведены для иллюстрации настоящего изобретения и не ограничивают его объем.
Иллюстрация 1. Испытания in vivo
Следующие два двухслойных устройства для доставки лекарственного средства (вариант 1 и вариант 2) были получены стандартным способом формования с погружением в раствор для получения каждого слоя тонкой пленки. Для получения двух пленочных слоев с водорастворимым активным лекарственным средством и одного водопроницаемого первого слоя в качестве растворителя использовали смесь воды и ацетона. Компоненты растворяли в растворителе вода/ацетон и затем вводили их в систему формования с погружением в раствор, где растворитель удаляли и получали тонкие слои.
|
|
|
Заявители получали первый и второй слои, содержащие водорастворимое лекарственное средство в виде твердых растворов. Первое устройство для доставки лекарственного средства (вариант 1) формировали для дальнейших испытаний при ламинировании пленки первого слоя, содержащего водорастворимое лекарственное средство, с водопроницаемым первым слоем, с последующим разрезанием на кусочки размером 22×22 мм и массой 150 мг. В первом устройстве для доставки лекарственного средства слой, содержащий водорастворимый активный компонент, составляет приблизительно 73 мас.% в расчете на общую массу устройства, тогда как водопроницаемый первый слой составляет приблизительно 27 мас.% в расчете на общую массу устройства.
Второе устройство для доставки (вариант 2) формировали для дальнейших испытаний при ламинировании пленки второго слоя, содержащего водорастворимое лекарственное средство, с водопроницаемым первым слоем с последующим разрезанием на кусочки размером 22×22 мм и массой 120 мг. Во втором устройстве для доставки лекарственного средства слой, содержащий водорастворимый активный компонент, составляет приблизительно 67 мас.% в расчете на общую массу устройства, тогда как водопроницаемый первый слой составляет приблизительно 33 мас.% в расчете на общую массу устройства.
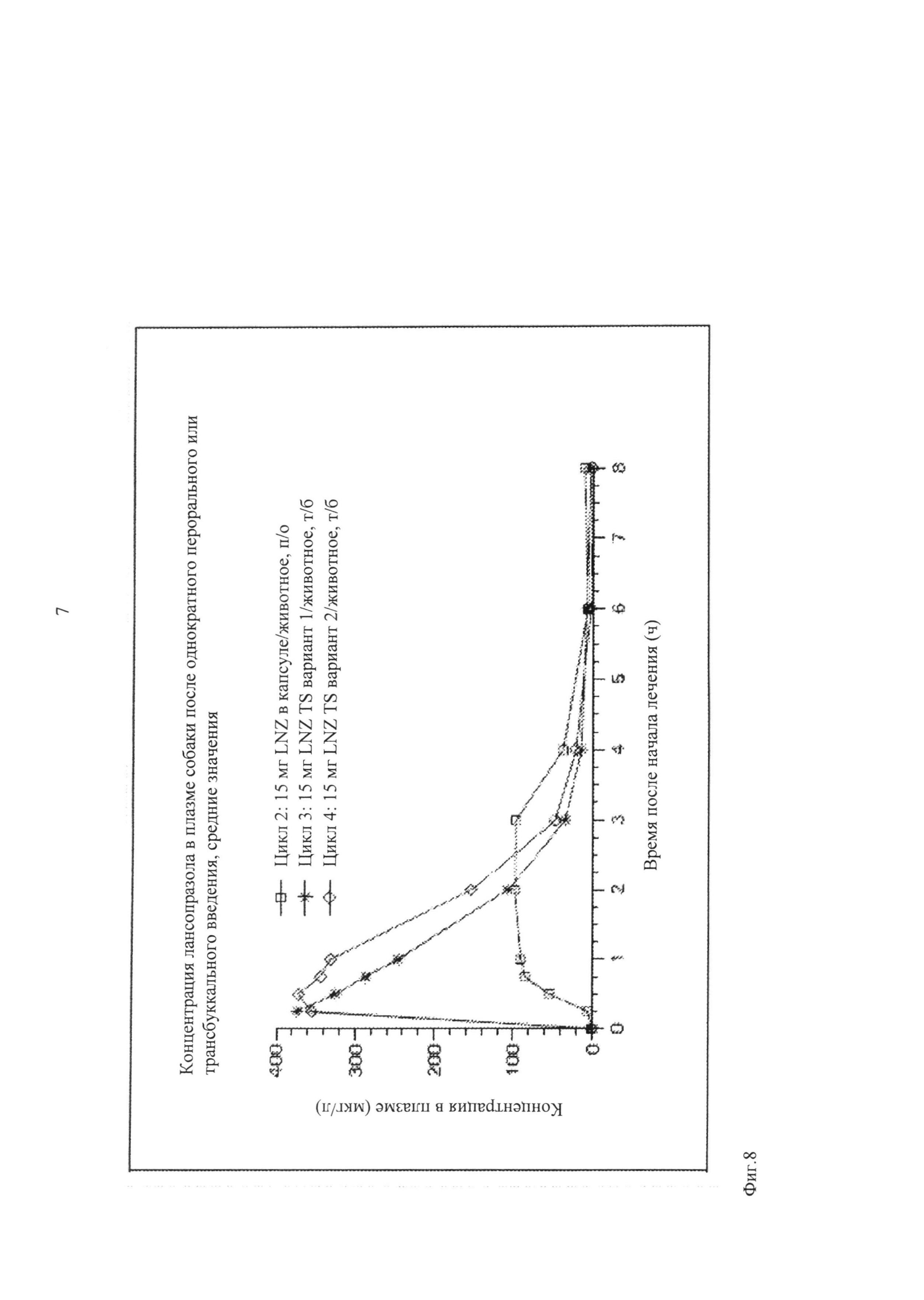
Как показано на фиг.8, в ходе испытаний на собаках как первого, так и второго щечного устройства для доставки лекарственного средства (вариант 1 и 2), было установлено что при щечном введении с использованием обоих устройств наблюдается значительно более быстрое увеличение уровня лекарственного средства в кровотоке (например, в плазме) по сравнению с пероральным введением собакам капсул (капсулы LNZ), содержащих такое же количество лекарственного средства с энтеросолюбильным покрытием. Кроме того, первичные испытания свидетельствовали о том, что терапевтические уровни лекарственного средства в крови сохраняются в течение нескольких часов. Полученные результаты являются специфическими по крайней мере по двум причинам. Во-первых, время достижения максимальной концентрации лекарственного средства в плазме крови составляет 30 мин или менее (например, 15 мин или менее). Во-вторых, концентрация лекарственного средства в плазме крови достигает значительно более высоких уровней по сравнению с ожидаемым. Таким образом, в одном варианте осуществления изобретения активный слой предпочтительно включает лансопразол и основный стабилизатор.
Иллюстрация 2. Испытания in vitro
2.1 Краткое описание
Оба слоя двухслойной щечной пленки получали способом формования с погружением в раствор. Составы первоначально получали в виде гомогенной жидкой смеси, используя воду и ацетон в качестве растворителей. Жидкие смеси наносили на рулонную подложку в виде влажного слоя с равномерной толщиной и затем сушили до требуемого содержания влаги. Защитный слой и слой, содержащий лекарственное средство, получали в виде отдельных пленок, которые затем ламинировали друг с другом. Для нанесения смеси и сушки всех пленок на силиконизированные бумажные подложки 120# (Wausau GR 421200) использовали установку для нанесения покрытий Mathis labcoater LTE-S.
Для ламинирования защитного слоя и слоя, содержащего лекарственное средство, использовали ручной утюг, установленный на низкую мощность нагревания. В этом способе защитный слой помещали на слой, содержащий лекарственное средство, на подложке с еще неприлипающим покрытием. Другую подложку с неприлипающим покрытием помещали на защитный слой и оба слоя ламинировали утюгом с умеренным давлением и с непрерывным движением до образования ламината обоих слоев (~2-4 мин). Существует современное оборудование для ламинирования, которое позволяет осуществлять этот процесс быстрее и более равномерно. Для более четкого отличия защитного слоя от слоя, содержащего лекарственное средство, и улучшения вкусовых свойств в защитный слой можно добавлять красители, пигменты и ароматизаторы.
Защитный/водопроницаемый слой включает:
(а) Kollicoat SR, добавляемый в виде 30%-ной дисперсии в воде (30D)-(90% поливинилацетат, 9% поливидон и 1% лаурилсульфат), образует водонерастворимую, но разбухающую в воде пленку, через которую может диффундировать вода из слюны и гидратировать слой, содержащий лекарственное средство. Согласно настоящему изобретению авторами изобретения было установлено, что Kollicoat SR гидратируется и набухает, в то время как растворимые эксципиенты растворяются, образуя поры, через которые слой, содержащий лекарственное средство, может гидратироваться слюной.
(б) ГПМЦ (гипромеллозу) - Methocel E50 и Methocel K4M в качестве укрепляющего пленку агента и порообразователя.
(в) Мальтодекстрин в качестве дезинтигрирующего агента/порообразователя.
(г) Полиэтиленоксид в качестве пластификатора.
(д) Пропиленгликоль в качестве пластификатора.
Защитный слой обеспечивает близкое контактирование слоя, содержащего лекарственное средство, с тканями слизистой оболочки, поддерживает высокие концентрации лекарственного средства и замедляет распадение слоя, содержащего лекарственное средство.
Слой, содержащий водорастворимое лекарственное средство, включает:
(а) Лансопразол в дозе 15 мг в виде твердого раствора, гомогенно распределенного в пленке.
(б) ГПМЦ (гипромеллоза)- Methocel E3, Е5 и Е50 в качестве водорастворимого полимера/пленкообразователя.
(в) Пластификаторы/увлажняющие агенты: полиэтиленоксид и ПЭГ 400 для обеспечения гибкости пленки.
(г) Модификатор pH: гидроксид натрия, для поддержания щелочного значения pH.
(д) Мукоадгезивные агенты: Proloc 25, Carbopol 974P и т.п. для поддержания близкого контактирования лекарственного средства со слизистой оболочкой полости рта.
(е) Усилители проницаемости: ментол, ДМСО, гликохолат натрия, моноглицериды, усилитель Azone и/или циклодекстрины.
Авторами настоящего изобретения было неожиданно установлено, что вследствие высокой вязкости гидратированного геля при распадении пленки лансопразол (LNZ) находится в слое, содержащем лекарственное средства, в локализованном виде. При этом в ходе трансбуккальной доставки лекарственного средства также поддерживается высокое значение pH и лекарственное средство остается в растворенном состоянии. Мукоадгезивные агенты и усилители проницаемости ускоряют контактирование лекарственного средства и абсорбцию по чресклеточному пути (через клеточную мембрану) или параклеточному (через межклеточные пространства) пути.
2.2 Испытания in vitro
Испытания проницаемости через щечную слизистую оболочку в условиях in vitro осуществляли при 35°C в стеклянных статических диффузионных ячейках, используя щечную слизистую оболочку, иссеченную из щеки свиней, которая не подвергалась температурной обработке после вскрытия. Образцы хранили в замороженном состоянии при -80°С.
Непосредственно перед использованием из размороженных образцов слизистой оболочки готовили образцы толщиной 8 мм с использованием дерматома и помещали их горизонтально в ячейки Франца слоем дермы вниз. Рецепторную фазу ФСБ pH 9,0 (фосфатно-солевой буферный раствор, 7,58 г/л Na2HPO4, 1,62 г/л NaH2PO4 и 4,4 г/л NaCl), содержащуюся в каждой диффузионной ячейке (приблизительно 4 мл), содержащей 20% метанол, перемешивали на магнитной мешалке. Сначала оценивали проникновение тритиевой воды, чтобы определить целостность образцов кожи. Краткое описание методики испытаний: после установления равновесного состояния 50 мкл (2,7 мкКи/мл) тритиевой воды наносили на поверхность. Через 30 мин радиоактивно меченую воду удаляли со слизистой оболочки ватными тампонами. Затем для определения количества тритиевой воды (%), прошедшей через кожу, отбирали 2 мл рецепторной фазы. Составы испытывали на образцах кожи с аналогичной проницаемостью для тритиевой воды. Состав объемом 15 мл в неокклюзионных условиях наносили на слизистую оболочку. Образцы рецепторной фазы отбирали через различные периоды времени: 0, 1, 3, 6 и 24 ч. После каждого отбора пробы отобранный объем рецепторной фазы (1 мл) восполняли свежим рецепторным раствором. Количество лансопразола, прошедшего через кожу, определяли методом сверхэффективной ЖХВР, отобранные фракции подвергали ультрацентрифугированию при 13000 об/мин в течение 10 мин, затем наносили на колонку СЭЖХВР. Для каждой пробы проводили по крайней мере 3 параллельных анализа.
2.3 Условия хроматографического анализа
Для хроматографического анализа использовали колонку для СЭЖХВР Acquity UPLCO ВЕН С 18 1,7:мкл, 2,1×50 мм. В качестве подвижной фазы использовали смесь 5:3:2 (об./об./об.) 0,05 М дигидрофосфата калия, метанола и ацетонитрила, отфильтрованную через мембранный нейлоновый фильтр 0,20 мкм. Скорость потока составляла 0,25 мл/мин, наносимый объем 10 мл, температура колонки 35°C. Разделение регистрировали при длине волны 280 нм. Количество и достоверность анализа определяли по свежеполученным калибровочным кривым. Стандартные образцы получали в ФСБ, pH 7,4/метанол в соотношении 80:20 и по крайней мере 90% лекарственного средства сохранялось в образце через 24 ч при 35°C. Концентрации лекарственного средства в образцах определяли в пределах линейного участка на калибровочных кривых.
2.4 Изделия для испытаний
Композиции щечных пленок, содержащие лансопразол, получали и исследовали описанными выше способами. Целевая доза составляла 15 мг LNZ для каждой пленки размером 22 мм × 22 мм (484 мм2). Основное внимание уделяли сравнению различных усилителей проницаемости, а также солюбилизирующих и мукоадгезивных агентов.
2.5 Защитный слой
Для испытаний in vitro с использованием защитного слоя последний получали при смешивании компонентов в соотношениях, представленных в следующей таблице.
|
Жидкую смесь для получения защитного слоя наносили в виде влажного слоя толщиной 0,3 мм и сушили при температуре от 35 до 50°C в течение 6,5-13 мин в приборе Mathis labcoater LTE-S.
2.6 Слой, содержащий лекарственное средство
Для испытаний in vitro получали слои, содержащие лекарственное средство, и усилители проницаемости, как представлено в следующей таблице. Для специальной оценки эффективности различных усилителей проницаемости, солюбилизирующих и мукоадгезивных агентов поддерживали постоянное содержание в пленке LNZ, ГПМЦ, PolyOx N80 и ПЭГ 400. Отклонения от целевых концентраций связаны с ручным способом нанесения покрытия на листы.
|
Исследовали влияние более высоких и низких концентраций Azone.
2.7 Результаты испытаний на проницаемость in vitro
2.7.1 Влияние защитного слоя
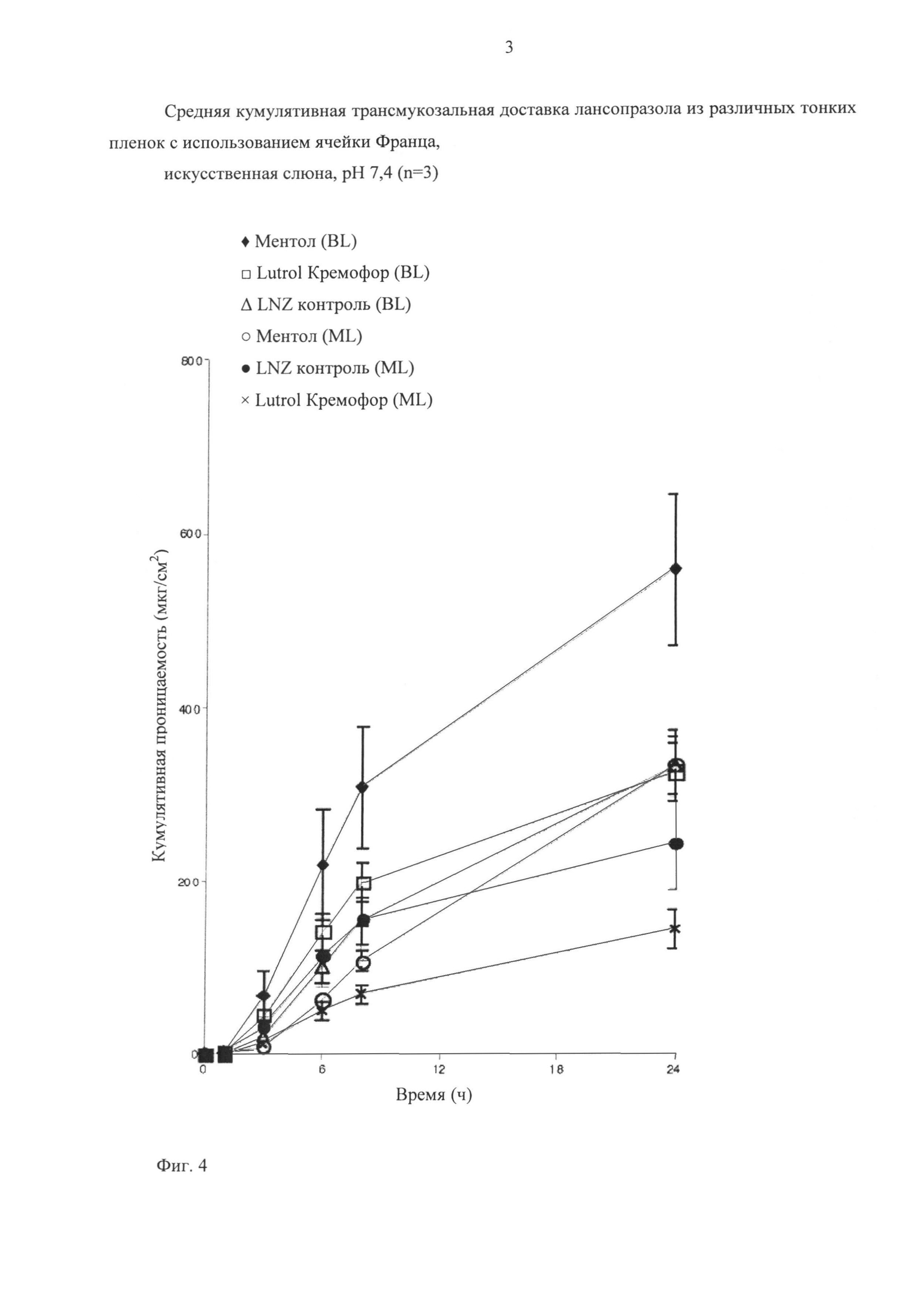
При испытаниях на проницаемость in vitro сначала сравнивали три состава слоя, содержащего лекарственное средство, указанные выше в таблице в виде однослойной и двухслойной пленок. Сравнивали контрольный состав (образец 1, без усилителей проницаемости), состав с ментолом (образец 2) и состав, содержащий Lutrol F-68, Cremophor (образец 3), результаты представлены на фиг.4.
На фигуре 4 показано сравнение проницаемости в условиях in vitro составов, содержащих и не содержащих защитный слой. Для каждого состава слоя, содержащего лекарственное средство, двухслойная пленка обладает большей проницаемостью по сравнению с однослойной пленкой. Эти свойства свидетельствуют о том, что водопроницаемый защитный слой значительно улучшает трансбуккальную проницаемость по сравнению с простой перорально распадающейся пленкой. Такие свойства также подтверждают теорию, что защитный слой действительно поддерживает слой, содержащий лекарственное средство, в микросреде, которая оказывает благоприятное действие на растворимость и проницаемость LNZ.
Защитный слой, использованный в настоящих испытаниях, представлен в качестве примера его функциональности. Для достижения подобного или большего эффекта можно использовать другие варианты и компоненты защитного слоя. Наилучшей проницаемостью в настоящем испытании характеризуются пленки с ментолом. Неожиданно было установлено, что однослойные пленки, содержащие Lutrol F-68 и Cremophor, оказывают ингибирующее действие по сравнению с контрольной однослойной пленкой, а двухслойная пленка характеризуется эквивалентными свойствами по сравнению с контрольной двухслойной пленкой. Состав с ментолом обладал наилучшими свойствами по сравнению с остальными составами и впоследствии его использовали в качестве контрольного для испытаний на проницаемость in vitro. Этот состав позволил нормализовать данные и сравнивать составы, исследованные в различные дни с использованием различных образцов ткани.
2.7.2 Эффективность усилителя проницаемости в двухслойных пленках
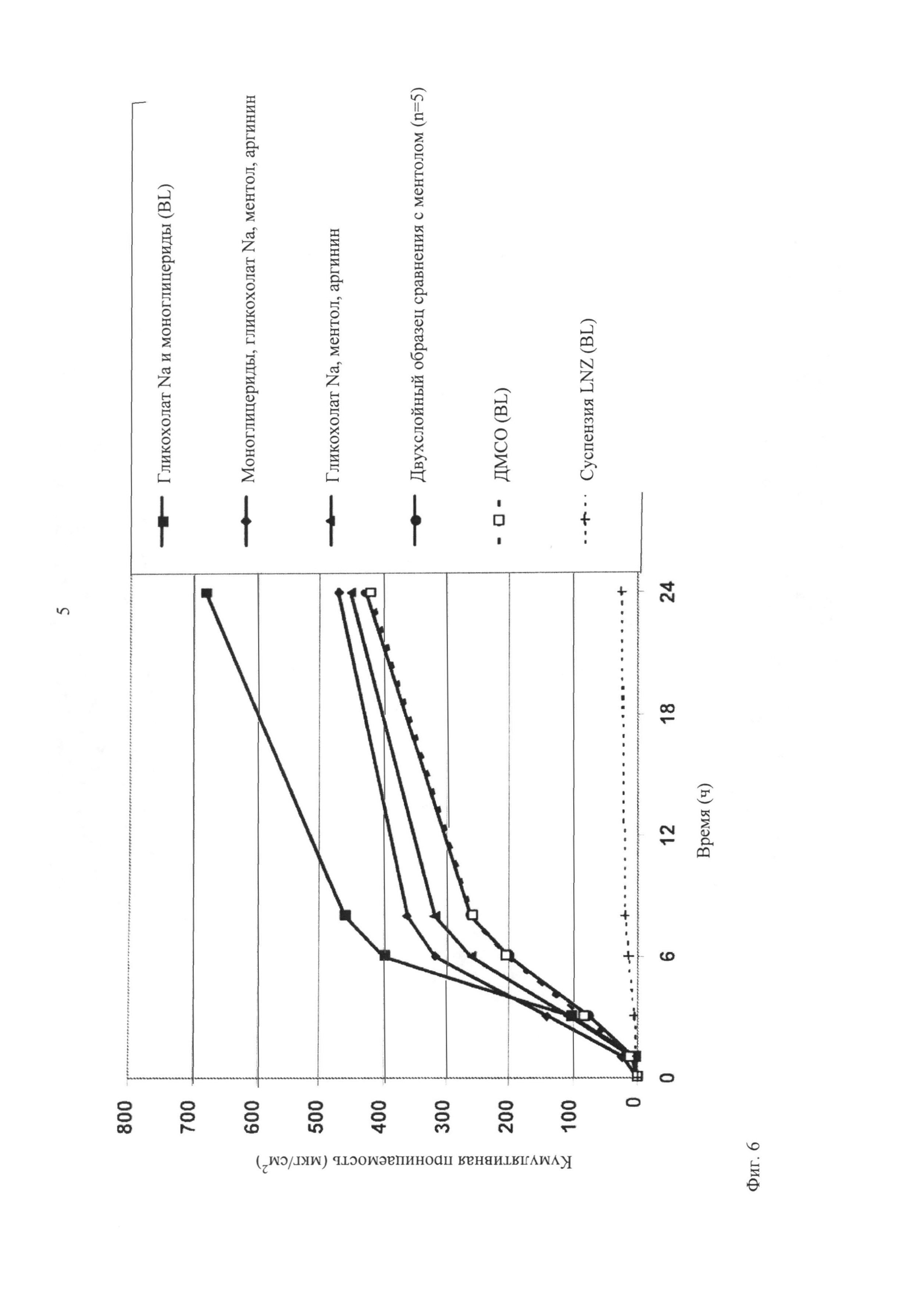
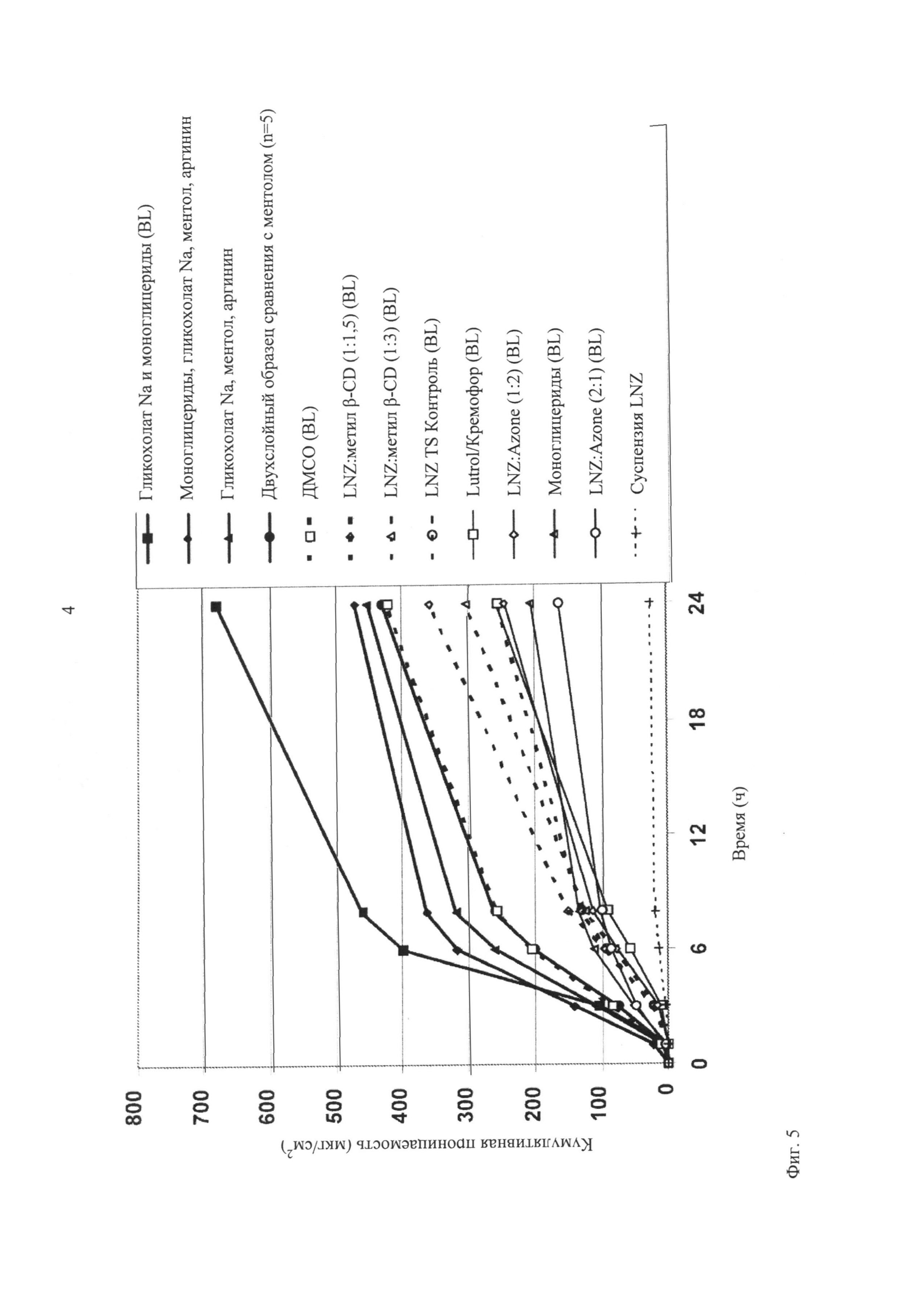
Список усилителей проницаемости не ограничен агентами, использованными в настоящем изобретении. Другие усилители могут проявлять равную или большую трансбуккальную проницаемость. Двухслойную пленку с ментолом использовали в качестве контрольного образца для нормализации данных анализа, полученных в различные дни с использованием различных образцов слизистой оболочки.
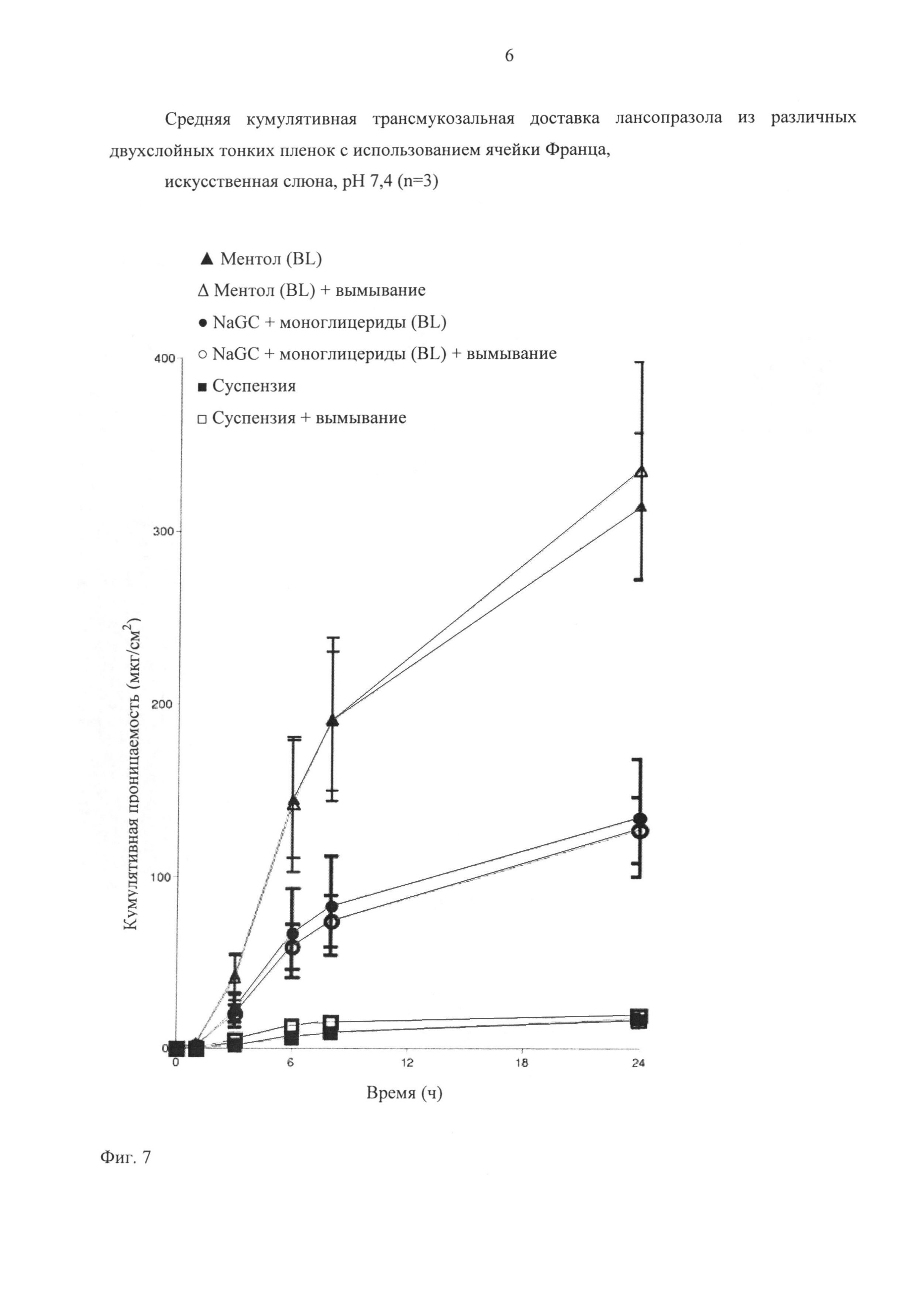
На фигуре 5 представлены результаты испытаний на проницаемость in vitro двухслойных щечных пленок с LNZ по сравнению с контрольной суспензией LNZ. Кроме того, исследовали суспензию LNZ с концентрацией 4 мг/мл в искусственной слюне, pH 7,4. Суспензию получали при растворении LNZ в метаноле и разбавлении в искусственной слюне до концентрации 4 мг/мл. Концентрация 4 мг/мл соответствует дозе 15 мг, распределенной в приблизительно 15 мл слюны. Эту суспензию использовали в качестве отрицательного контроля, который не обладал трансбуккальными свойствами пленок, такими как pH, эффекты усилителей проницаемости, защитного слоя и т.п., и который обладал по своей природе слабыми трансбуккальными свойствами в отношении лекарственного средства в нормальных физиологических условиях. Согласно представленным выше результатам проницаемость LNZ из двухслойных щечных пленок увеличивается вплоть до 29 раз по сравнению с суспензией лекарственного средства. На фиг.6 показаны усилители проницаемости, которые проявляют самую высокую проницаемость.
2.7.3 Эффекты вымывания (имитация вымывания слюной/проглатывания)
В этом эксперименте двухслойную пленку с ментолом, двухслойную пленку с NaGC и моноглицеридом и суспензию LNZ испытывали в ячейке Франца. Через 3 мин выдерживания в условиях проницаемости донорную фазу в половине ячеек Франца, содержащей каждый исследуемый образец, отбирали и камеру промывали. Отобранный объем восполняли свежей порцией искусственной слюны и продолжали испытания на проницаемость. Эти испытания имитируют процесс проглатывания, который, как ожидается, будет происходить в условиях in vivo во рту человека.
На фиг.7 представлены результаты испытаний на проницаемость образцов in vitro с вымыванием и без него. Существенной разницы между пленками с вымыванием и без вымывания не наблюдалось, что дополнительно подтверждает протективную природу защитного слоя и однонаправленный поток воды через защитный слой в слой, содержащий лекарственное средство. Если бы LNZ в значительной степени диффундировал через защитный слой в донорную камеру, вымывание уменьшало бы степень проницаемости лекарственного средства. Такой же эффект можно было бы ожидать во рту, в условиях когда слюна проглатывается, а свежая слюна высвобождается для увлажнения ротовой полости.
2.7.4 Предполагаемое значение pH распавшихся пленок в слюне
В этом эксперименте 3 однослойных пленочных образца (1,6 см2) различных составов подвергали распадению, каждый в 2 мл: вода, искусственная слюна, pH 7,4, или 50 мМ NaOH (контроль). Распавшиеся смеси выдерживали в течение вплоть до 4 ч для осаждения любых пересыщенных растворов. Каждый образец затем центрифугировали при 20000 об/мин для удаления осажденного или нерастворенного LNZ. Каждый образец супернатанта разбавляли в 10 раз (100 мл образец +900 мл) 50 мМ раствором NaOH. Разбавленные образцы анализировали на спектрофотометре, УФ-видимая область при 292 нм в кювете с толщиной оптического пути 1 мм. Коэффициент экстинкции, использованный для расчета концентрации в каждом образце, составлял 46,5. Измеряли pH распавшихся образцов. Результаты обобщены в таблице ниже.
Растворимость лансопразола и pH раствора из однослойных пленок, распавшихся в различных растворителях.
|
Из представленных результатов следует, что в случае полного распадения пленки в слюне значение pH во рту составляет приблизительно 8. При использовании защитного слоя гидратированный гель из пленки удерживается в гораздо меньшем объеме. Следует ожидать, что сразу после нанесения пленки локализованное значение pH составит приблизительно 10, и pH медленно снижается до физиологического диапазона в процессе распадения и диспергирования пленки. Следовательно, более высокая концентрация лекарственного средства наблюдается до диспергирования пленки.