Результат интеллектуальной деятельности: СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ГЛИОМ ГОЛОВНОГО МОЗГА ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к области молекулярной биологии, нейрохирургии и медицины, в частности к онкологии, и предназначено для быстрого определения типа глиальных опухолей головного мозга человека.
В нейроонкологической практике наиболее часто встречаются внутримозговые нейроэпителиальные опухоли головного мозга (глиомы), растущие из клеток нейроглии. Глиальные клетки окружают все нервные волокна нервной системы. Астроциты являются одними из типов глиальных клеток звездчатой формы, соответственно, происходящие из них астроцитарные опухоли являются разновидностью глиальных опухолей и первым подтипом нейроэпителиальных опухолей головного мозга. По степени злокачественности глиомы астроцитарного подтипа делятся на 4 группы (grade, грейды по классификации ВОЗ 2007 года):
I степень злокачественности, грейд 1, пилоцитарная астроцитома - доброкачественная опухоль с четкими границами, растет медленно. В основном локализируется в мозжечке, стволе мозга и зрительных нервах. Признаки злокачественности отсутствуют.
II степень злокачественности, грейд 2, диффузная астроцитома - опухоль без четких границ, растет медленно. Встречается у больных 20-30 лет. Имеет, как правило, один признак злокачественности - клеточную атипию.
III степень злокачественности, грейд 3, анапластическая астроцитома - злокачественная опухоль без четких границ, растет быстро, прорастает в мозговую ткань. Возраст у больных 30-50 лет, чаще болеют мужчины. Имеет два признака злокачественности из трех, исключая некрозы.
IV степень злокачественности, грейд 4, мультиформная глиобластома (далее глиобластома) - наиболее злокачественная опухоль без четких границ, растет очень быстро, прорастает в мозговую ткань. Возраст у больных 40-70 лет, чаще болеют мужчины. На клеточном уровне имеет отличительные особенности злокачественности: гетерогенность состава, быструю пролиферацию, ангиогенез, экстенсивную инвазию, гипоксию и некроз.
Диагностика опухолей головного мозга основывается на методах КТ (компьютерная томография) и МРТ (магнитная резонансная томография), которые позволяют в большинстве случаев различить внутри- и внемозговые опухоли, определить локализацию и размер патологического процесса, однако далеко не всегда способны достоверно определить гистопринадлежность опухоли [1].
В настоящее время основным методом диагностики является цитологическое и гистологическое исследование биоптата опухоли, забранного в момент прямого оперативного вмешательства, направленного на ее удаление.
Известен стандартный способ дифференциальной диагностики глиом, включающий гистологическое исследование, на основании которого чаще всего ставится окончательный диагноз [2]. Образец опухоли, забранный в момент ее удаления, переносят на предметное стекло, вторым предметным стеклом смещают на расстояние 1-1.5 см, после чего помещают в фиксатор (формалин). Полученный мазок-отпечаток подсушивают на воздухе (10-15 мин), фиксируют в этаноле 96%, окрашивают гематоксилин-эозином, помещают в бальзам под покровное стекло, а через 24 часа готовят гистологический препарат. В общей сложности на диагностику уходит 4-5 суток. Если позволяет количество материала биопсии, то применяют также цитологические методы исследования, которые, в свою очередь, могут быть использованы для дополнительных методов исследования: иммуноцитохимических, флюоресцентных, электронно-микроскопических.
Для уточнения гистопатологического строения опухолей глубинной, труднодоступной локализации в функционально важных зонах головного мозга применяют стереотаксическую биопсию [3]. Проведение данной операции в силу разнородности структуры глиомы в 10-15% не позволяет точно установить степень ее злокачественности.
В целом любой способ получения материала опухоли головного мозга является инвазивным, а результат гистопатологического анализа клеточной структуры опухоли не всегда необходимо точный, не количественный, достаточно субъективный, требующий большого практического опыта врача-нейрохирурга и врача-патогистолога при визуальной оценке клеточных структур опухоли на препаратах.
Известен способ дифференциальной диагностики глиом, включающий взятие образца опухолевой ткани головного мозга, выделение микроРНК из образца, измерение уровня экспрессии диагностических микроРНК с помощью микрочипа, с последующим сравнительным анализом изменения уровня экспрессии диагностических микроРНК и составлением заключения о наличии и типе глиальной опухоли, при этом измеряют уровень экспрессии 7 групп микроРНК, выбранных из общего количества проанализированных 756 микроРНК [4].
Для того, чтобы отличить норму от астроцитомы, были выбраны 53 микроРНК с повышенной экспрессией (группа 1) и 24 - с пониженной экспрессией (группа 2); для того чтобы отличить астроцитому и глиобластому, выбраны 56 микроРНК с повышенной экспрессией (группа 3) и 11 микроРНК с пониженной экспрессией (группа 4); для того чтобы отличить первичную и вторичную астроцитомы выбраны 2 микроРНК с повышенной экспрессией (группа 5) и 5 микроРНК с пониженной экспрессией (группа 6). Для анализа степени прогрессии опухоли (вторичная или первичная глиобластома) были выбраны 21 микроРНК (группа 7). Выбор диагностических микроРНК для каждого типа опухолей, вошедших в состав 7 групп, осуществляли специальным статистическим методом SAM (Significance Analysis Microarrays).
Недостатками известного способа являются сложность, громоздкость, многоэтапность определения и анализа, ограниченные функциональные возможности, поскольку способ служит для распознавания только двух типов глиом из грейдов 3 и 4 - анапластической астроцитомы и глиобластомы, соответственно. Кроме того, диапазон количественных измерений при использовании микрочипов значительно уже, этот метод дает практически на порядок менее точные результаты, чем метод ПНР в реальном времени.
Наиболее ближайшим к заявляемому способу - прототипом является способ дифференциальной диагностики глиальных опухолей головного мозга, включающий взятие образца опухолевой ткани головного мозга, выделение микроРНК из образца, измерение уровня экспрессии микроРНК на основе микрочипа (технология microarray) и составление заключения о наличии и типе опухоли [5]. Способ заключается в измерении экспрессии 2-х групп микроРНК: первая состоит из 5 микроРНК (hsa-miR-155, hsa-miR-210, hsa-miR-10a, hsa-miR-409, hsa-miR-134), а вторая - из 14 микроРНК (hsa-miR-126, hsa-miR-15b, hsa-miR-16, hsa-miR-17, hsa-miR-20a, hsa-let-7a, hsa-let-7e, hsa-let-7d, hsa-miR-374, hsa-miR-339, hsa-miR-127, hsa-miR-151, hsa-miR-26b, hsa-miR-34b*). Способ заключается в проведении сравнения экспрессии выбранных микроРНК в исследуемом образце с экспрессией этих же микроРНК в нормальном эталонном образце, в эталонных образцах глиобластомы и олигодендроглиомы. При этом рассматривают все вероятные сочетания микроРНК из разных групп, т.е. каждую микроРНК из 1-й группы сравнивают с каждой микроРНК из 2-й группы. Группа из 5 микроРНК отличается тем, что эти микроРНК имеют значительно более высокую экспрессию в глиобластоме (грейд 4) по сравнению с олигодендроглиомой (грейд 2). За эталонный образец принимают опухоль или здоровую ткань других пациентов с диагнозом, подтвержденным иными методами (гистология, экспрессия онкогенов).
Вывод о наличии в исследуемом образце глиобластомы делают, когда:
(I) уровень экспрессии микроРНК из 1-й группы, по крайней мере, в 3 раза больше или меньше, чем уровень экспрессии этих же микроРНК в здоровом эталонном образце;
(II) уровень экспрессии микроРНК из 1-й группы в указанном образце, по крайней мере, в 3 раза больше, чем уровень экспрессии этих же микроРНК, измеренных в эталонном образце олигодендроглиомы;
(III) уровень экспрессии микроРНК из 2-й группы, измеренных в исследуемом образце, по крайней мере, в 3 раза больше или меньше, чем уровень экспрессии этих же микроРНК, измеренных в здоровом эталонном образце;
(IV) уровень экспрессии микроРНК из 2-й группы, измеренных в исследуемом образце, не более чем на 20%, в ту или другую сторону, отличается от уровня экспрессии этих же микроРНК в эталонном образце глиобластомы.
Вывод о наличии в исследуемом образце олигодендроглиомы делают, когда:
(I) уровень экспрессии микроРНК из 1-й группы, по крайней мере, в 3 раза больше или меньше, чем уровень экспрессии этих же микроРНК в здоровом эталонном образце,
(II) уровень экспрессии микроРНК из 1-й группы, измеренных в исследуемом образце, по крайней мере, в 3 раза меньше, чем уровень экспрессии этих же микроРНК, измеренных в эталонном образце глиобластомы,
(III) уровень экспрессии микроРНК из 2-й группы, измеренных в исследуемом образце, по крайней мере, в 3 раза больше или меньше, чем уровень экспрессии этих же микроРНК, измеренных в здоровом эталонном образце,
(IV) уровень экспрессии микроРНК из 2-й группы, измеренных в исследуемом образце, не более чем на 20%, в ту или другую сторону, отличается от уровня экспрессии этих же микроРНК в эталонном образце олигодендроглиомы.
Дальнейшее исследование заключается в сравнении уровней экспрессии пары микроРНК из 1-й группы с любой парой микроРНК из 2-й группы. Алгоритм сравнения аналогичный. Рассматривают все возможные сочетания пар из 1-й и 2-й групп. По результатам из коэффициентов соотношений строят 2- и 3-мерные диаграммы и проводят сравнение данных от исследуемых образцов опухоли с данными, полученными как для нормальной ткани, так и для глиобластомы и олигодендроглиомы.
Недостатками известного способа являются длительность, трудоемкость, сложность анализа и ограниченные функциональные возможности, поскольку способ обеспечивает распознавание только двух типов глиом: олигодендроглиомы и глиобластомы (грейды 2 и 4) и не обеспечивает типирование других опухолевых патологий головного мозга.
Кроме этого, поскольку прототип основан на использовании микрочипов (технология microarray), то диапазон количественных измерений дает практически на порядок менее точные результаты, чем метод ПЦР в реальном времени. Поэтому технология microarray неприемлема для быстрого анализа материала в клинической практической онкологии. Более того, в силу вариабельности индивидуальной экспрессии использование чужеродной нормальной ткани головного мозга в качестве эталонного контрольного образца для сравнения некорректно.
Задачей, на решение которой направлено настоящее изобретение, является упрощение способа, сокращение его длительности, повышение точности анализа, расширение функциональных возможностей способа за счет обеспечения возможности диагностики глиом различной степени злокачественности (диффузной астроцитомы, анапластической астроцитомы и глиобластомы, грейды 2-3-4).
Технический результат: упрощение способа, повышение его точности и расширение функциональных возможностей.
Поставленная задача достигается предлагаемым способом, заключающимся в следующем.
Забор образца опухолевой ткани головного мозга человека осуществляют при операции или с помощью биопсии. Из полученных образцов выделяют суммарный пул РНК (в том числе содержащий и микроРНК) любым пригодным методом выделения нуклеиновых кислот [6].
Далее проводят измерение уровней экспрессии 10 микроРНК, а именно микроРНК-21, -221, -31, -124, -125b, -16, -451, -191, -181b, -223 (диагностируемые микроРНК) в опухолевых образцах методом ОТ-ПЦР в реальном времени (qRT-PCR платформа) [7], позволяющим селективно выявлять зрелые микроРНК с высокой чувствительностью и специфичностью. Метод ОТ-ПЦР включает в себя обратную транскрипцию зрелой микроРНК с помощью длинного праймера со шпилькой с последующей детекцией полученной кДНК с помощью ПЦР в реальном времени. В качестве внутреннего контроля используют малую РНК U58A, которая характеризуется стабильной экспрессией. Сочетание времени и температуры на каждом этапе протокола реакции подбирают специально для эффективной реакции с используемыми олигонуклеотидами (праймерами).
Заключение о наличии и типе глиальной опухоли головного мозга составляют на основании значений комплексного критерия (К), рассчитанного на основе значений уровней экспрессии микроРНК в разных типах глиальных опухолей, характеризующихся специфическим профилем экспрессии, представленного в классификаторе (таблица 1). Значение критерия, по которому определяют злокачественность образца, получают путем суммирования всех слагаемых, каждое из которых соответствует значению уровня экспрессии конкретной диагностической микроРНК.
В соответствии с таблицей 1, если в образце опухолевой ткани головного мозга, из специфического профиля экспрессии 10-ти микроРНК, получено значение К, равное или больше 1, то делают заключение о наличии глиобластомы, если значение К лежит в интервале от 0 до -3, то делают заключение о наличии диффузной астроцитомы, а если значение К меньше либо равно -4, то делают заключение о наличии анапластической астроцитомы.
Определяющими отличиями заявляемого способа, по сравнению с прототипом, являются:
1) В образцах опухолевой ткани головного мозга измеряют уровни экспрессии экспериментально подобранных 10-ти микроРНК (микроРНК-21, -221, -31, -124, -125b, -16, -451, -191, -181b, -223), что позволяет упростить способ в сравнении с прототипом, вследствие подбора минимально значимого количества диагностируемых микроРНК, ускорить проведение диагностики (5-6 часов или один рабочий день, вместо как минимум трех рабочих дней по прототипу);
2) Заключение о наличии и типе глиальной опухоли головного мозга составляют на основании комплексного критерия, рассчитанного по значениям уровней экспрессии микроРНК в разных типах глиальных опухолей, характеризующихся специфическим профилем экспрессии, представленного в классификаторе (таблица 1), что позволяет расширить функциональные возможности способа за счет обеспечения возможности диагностики глиом разной степени злокачественных (грейдов 2, 3 и 4, т.е. диффузной астроцитомы, анапластической астроцитомы и глиобластомы).
Преимущественно, измерение уровня экспрессии 10 микроРНК в образцах тканей головного мозга проводят методом ОТ-ПЦР в реальном времени (qRT-PCR платформа), что позволяет расширить диапазон количественной характеристики экспрессии, по сравнению с методом microarray (прототип). Кроме этого, метод microarray имеет более низкую специфичность, чем qRT-PCR, что соответственно снижает точность анализа.
Выбранные для анализа микроРНК являются онкогенными (микроРНК-21, микроРНК-221, микроРНК-223) или онкосупрессорными (микроРНК-451) или имеющими непосредственное отношение к процессу метастазирования, например микроРНК-31 (по эпителиально-мезенхимной трансформации, способности стимулировать или подавлять образование метастазов), или отличающимися по степени участия в процессах апоптоза, ангиогенеза и инвазивности. Данные 10 микроРНК являются оптимальными и достаточными для определения типов глиом 2, 3 и 4 грейдов.
Предварительно, для определения и обоснования диагностических значений микроРНК был проведен сравнительный анализ уровней экспрессии 10 человеческих микроРНК: микроРНК-21, микроРНК-221, микроРНК-31, микроРНК-124, микроРНК-125b, микроРНК-16, микроРНК-451, микроРНК-191, микроРНК-181b и микроРНК-223 в 62 образцах операционного материала и биоптатов различных гистопатологических типов глиом головного мозга, различающихся по степени злокачественности (грейды 2, 3 и 4). Согласно данным гистологического заключения образцы распределились следующим образом: 45 случаев - глиобластома, 12 случаев - анапластическая астроцитома, 5 - диффузная астроцитома.
Уровень экспрессии каждой микроРНК в образце (fold change) по отношению к нормализатору U58A (во сколько раз) вычисляли по формуле [8]:
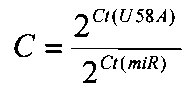
где Ct - пороговый цикл реакции микроРНК или малой РНК U58A (нормализатора).
При проведении сравнительного анализа уровней экспрессии 10 онкогенных и онкосупрессорных микроРНК в разных типах глиом человека, различающихся степенью злокачественности, были определены характерные для каждого вида новообразования специфические изменения экспрессии микроРНК. По изменению уровней экспрессии для каждой микроРНК были подсчитаны слагаемые (таблица 2), суммирование которых позволило определить значение комплексного критерия (К), что отражено в классификаторе (таблица 1). Комплексный критерий заключается в том, что для каждого типа глиальных опухолей по 10 диагностируемым микроРНК экспериментально установлено специфическое изменение экспрессии этих микроРНК, которое характеризует именно конкретный тип глиальной опухоли головного мозга. При этом каждый тип глиальной опухоли характеризуется специфическим профилем из 10 микроРНК, что соответствует определенному значению критерия К.
Предлагаемый способ позволяет просто, быстро и точно идентифицировать и различать типы глиом головного мозга человека: глиобластому, анапластическую астроцитому и диффузную астроцитому.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1.
Пациент №210 (мужчина, 52 года) на фоне полного здоровья заболел 2 февраля 2014 года, когда появился первый приступ с потерей сознания и судорожным синдромом. МРТ головного мозга с контрастным усилением выявила картину кистозно-солидного образования правой лобной доли. Проведена костно-пластическая трепанация черепа в правой лобно-теменной области, микрохирургическое удаление внутримозговой кистозно-солидной опухоли под нейронавигационным контролем. Гистологическое заключение: диффузная астроцитома, грейд 2.
Во время операции были взяты образцы ткани опухоли и исследованы заявляемым способом.
Выделение РНК. Выделение суммарного пула РНК, содержащего также и микроРНК, из образцов ткани проводили с помощью набора «РеалБест экстракция 100» (ЗАО «Вектор-Бест», Новосибирск) в соответствии с инструкцией производителя. К 50 мг ткани добавляли 500 мкл лизирующего гуанидинового буфера, содержащего 4 М гуанидин изотиоцианат, 25 мМ цитрат натрия, 0,3% саркозил, 3% дитиотреитол. Ткань в растворе интенсивно перемешивали и оставляли в термошейкере при 65°C на 10 мин. Раствор центрифугировали 2 мин на 10000 об/мин, переносили супернатант в новые пробирки и добавляли к нему равный объем изопропанола, перемешивали и оставляли при комнатной температуре на 5 мин. Центрифугировали 10 мин при 13000 об/мин, супернатант сливали, а осадок промывали с помощью 500 мкл 70% этанола, затем 300 мкл ацетона. РНК растворяли в 200 мкл деионизованной воды.
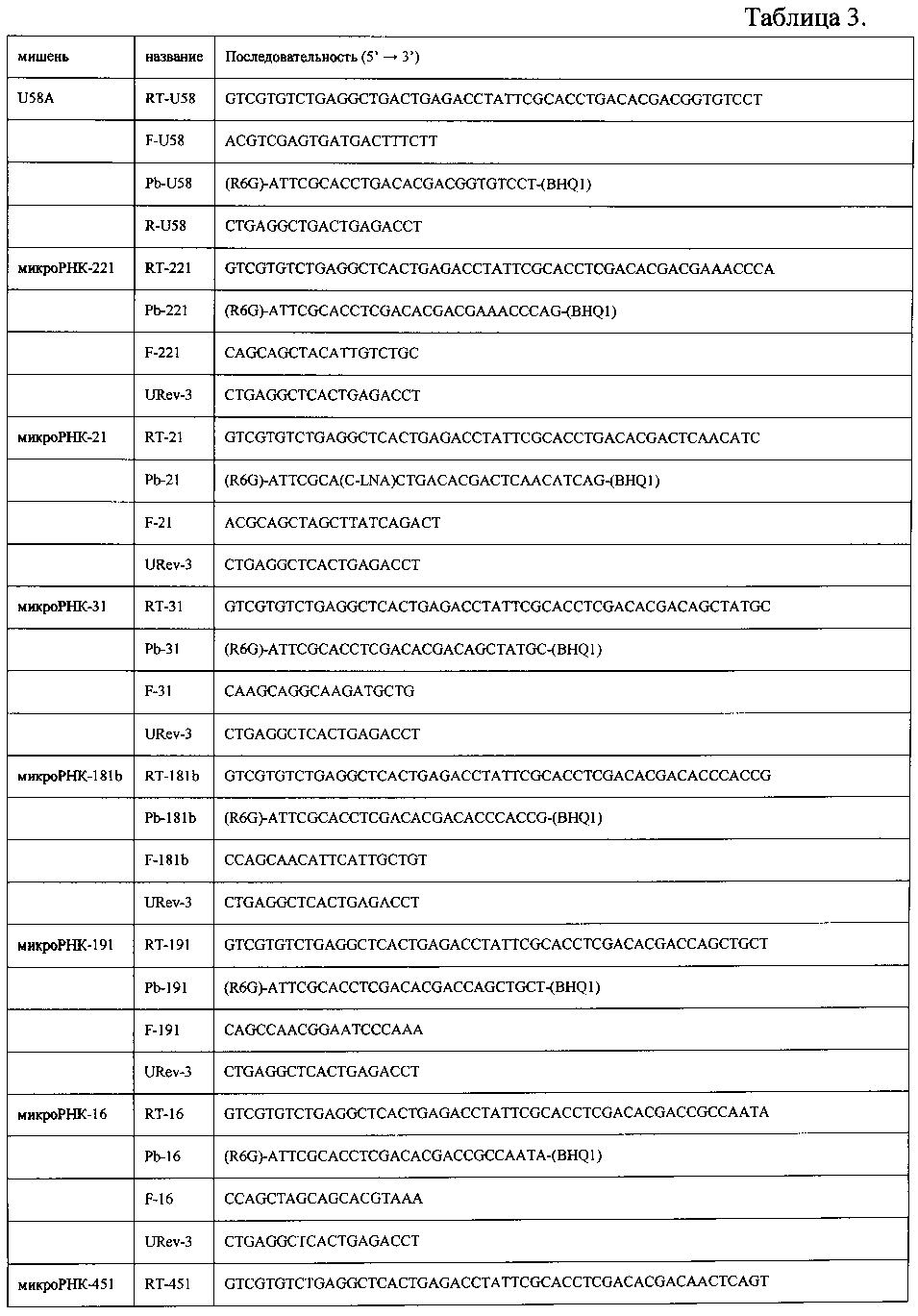
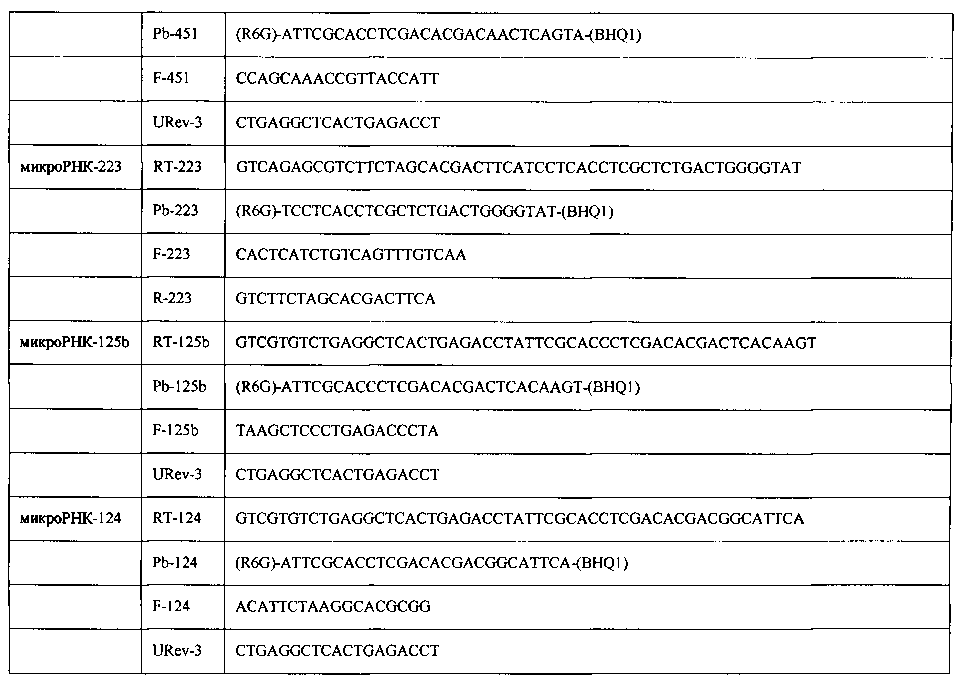
Реакция обратной транскрипции. Реакцию обратной транскрипции для получения кДНК проводили в объеме 50 мкл. Использовали готовые реакционные смеси «РеалБест Мастер микс ОТ» (ЗАО «Вектор-Бест», Новосибирск). Реакция обратной транскрипции содержала: 3 мкл выделенной РНК, 16.2 мкл 40% раствора трегалозы, 3 мкл 10х буфера для обратной транскрипции, 3 мкл 4 мМ раствора дезоксинуклеозидтрифосфатов, 3 мкл 10% раствора бычьего сывороточного альбумина (BSA), 100 e.a.M-MLV обратной транскриптазы, 1.5 мкл 10 мкМ раствора соответствующего праймера для обратной транскрипции. Использованные праймеры приведены в таблице 3.
Реакцию проводили в течение 30 мин при 42°C, после чего реакционную смесь инкубировали 2 мин при 95°C для инактивации обратной транскриптазы. Полученную реакционную смесь, содержащую кДНК, в объеме 3 мкл сразу использовали в качестве матрицы для проведения ПЦР.
ПЦР в реальном времени. Измерение уровней экспрессии 10-ти микроРНК-124, -125b, -16, -181b, -191, -21, -221, -223, -31, -451 проводили методом ПЦР в реальном времени на амплификаторе CFX96 (Bio-Rad Laboratories, США). В качестве нормализатора использовали малую РНК U58A. Использовали праймеры и зонды, приведенные в таблице 3. Реакцию проводили в объеме 30 мкл: 3 мкл полученной кДНК, 14 мкл H2O, 3 мкл 10х буфера для ПЦР (ЗАО «Вектор-Бест»), 3 мкл 4 мМ раствора дезоксинуклеозидтрифосфатов, 3 мкл 10% раствора BSA, 1 е.a. Taq-полимеразы (ЗАО «Вектор-Бест») в комплексе с моноклональными антителами к ее активному центру (Clontech, США), 3 мкл раствора прямого и обратного праймеров (5 мкМ) и зонда (2.5 мкМ).
Протокол реакции ПЦР: предварительный прогрев при 94°C - 2 мин, 50 основных циклов: денатурация при 94°C - 10 сек, отжиг и элонгация: 60°C - 20 сек.
Уровень экспрессии каждой из 10 микроРНК в образце опухоли по отношению к нормализатору U58A (во сколько раз) вычисляли по формуле [8]:
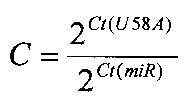
где Ct - пороговый цикл реакции микроРНК (miR) или малой РНК U58A (нормализатор).
После определения значений уровней экспрессии 10 диагностических микроРНК, для каждой из них были подсчитаны слагаемые по описанному выше алгоритму, суммирование которых позволило определить значение критерия К, а также степень злокачественности новообразования по классификатору.
Результаты, полученные при измерении уровней экспрессии микроРНК пациента №210, представленные в таблице 4, показали, что значение К равно 12 (сумма слагаемых), поэтому в соответствии с классификатором (таблица 1) можно сделать заключение о наличии у пациента глиобластомы.
После уточнения диагноза заявляемым способом, а именно выявления более злокачественной опухоли - глиобластомы, для пациента проведена индивидуальная дополнительная коррекция дальнейшего лечения.
Пример 2.
Пациент №93 (мужчина, 55 лет), в 2011 году поставлен диагноз: внутримозговое объемное образование лобных долей головного мозга с распространением на валик мозолистого тела и передние рога боковых желудочков. В 2012 году для определения типа опухоли проведена пункционная стереотаксическая биопсия внутримозгового образования под навигационным контролем.
Гистологическое заключение: диффузная астроцитома (грейд 2), нельзя исключить анапластическую астроцитому (грейд 3). Взятые во время биопсии образцы ткани опухоли исследованы заявляемым способом аналогично примеру 1.
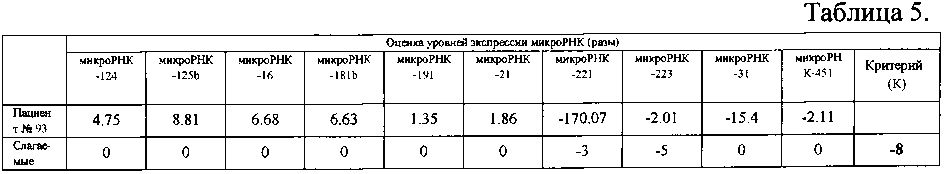
Результаты, полученные при измерении уровней экспрессии микроРНК образца пациента №93, представлены в таблице 5. Из таблицы 5 видно, что изменение уровней экспрессии микроРНК пациента №93 соответствует значению К, равному 8 (сумма слагаемых), поэтому в соответствии с классификатором (таблица 1) можно сделать заключение о наличии у пациента анапластической астроцитомы (грейд 3).
Пример 3.
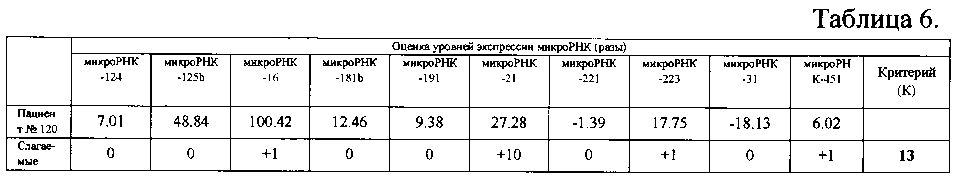
Пациент №120 (мужчина, 52 года), в 2012 году поставлен диагноз: анапластическая астроцитома головного мозга (грейд 3) левой лобно-височной локализации с элементами моторной афазии, правосторонний гемипарез. В 2012 году проведена пункционная стереотаксическая биопсия объемного образования головного мозга лобно-височной локализации с применением нейронавигации. Гистологическое заключение: анапластическая астроцитома (грейд 3). Взятые во время биопсии образцы ткани опухоли были исследованы заявляемым способом аналогично примеру 1. Представленные в таблице 6 результаты, полученные при измерении уровней экспрессии микроРНК у пациента №120, показали, что значение К равно 13 (сумма слагаемых), поэтому в соответствии с классификатором (таблица 1) можно сделать заключение о наличии у пациента глиобластомы (грейд 4).
Пример 4.
Пациент №135 (женщина, 64 года), в 2012 году выявлено объемное кистозно-солидное образование в левой теменной области, сенсорно-моторная афазия. В 2013 году проведена костно-пластическая трепанация черепа в левой теменной области, удалена внутримозговая опухоль с использованием микрохирургической техники под нейронавигационным контролем. Гистологическое заключение: глиобластома (грейд 4).
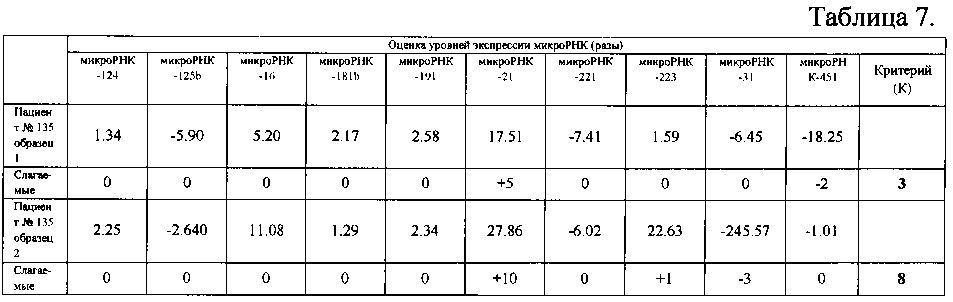
Взятые во время операции 2 образца ткани из разных отделов опухоли были исследованы заявляемым способом, аналогично примеру 1. Результаты, полученные при измерении уровней экспрессии микроРНК пациента №135, представленные в таблице 7, показали, что в первом образце значение К равно 3, что согласно классификатору (таблица 1) соответствует глиобластоме. Во втором образце значение К равно 8, что также соответствует глиобластоме.
Таким образом, заявляемый способ диагностики глиальных опухолей головного мозга человека является более точным и надежным, чем гистологический и цитологический, что позволяет избежать ошибок в диагностике опухолевых патологий головного мозга.
Заявляемый способ позволит просто, быстро и точно диагностировать тип глиомы до или после операции, чтобы подтвердить или скорректировать результаты, полученные при гистологическом исследовании, своевременно выбрать правильную тактику последующего лечения пациента.



ИСТОЧНИКИ ИНФОРМАЦИИ
1. Hashemi R.Н., Bradley W.G., Lisanti C.J. MRI: the basics. Lippincott Williams & Wilkins, 2004. C. 353.
2. Батороев Ю.К. Цитологическая диагностика опухолей центральной нервной системы, возможности и особенности: возможности и границы применения. Сибирский медицинский журнал. - 2009. - №2. - с. 5-9.
3. Elder J.В., Amar А.P., Apuzzo L.J. Stereotactic and Image-Guided Biopsy / Lozano A.M., Gildenberg Ph.L., Tasker R.R. // Textbook of Stereotactic and Functional Neurosurgery. Second Edition. 2009. P. 679-698.
4. Somasundaram K., Mahabala RAO S.A., Santosh V. MicroRNAa (miRNA) as biomarkers for diagnosing different grades of gliomas and pathways of glioma progression. - Patent WO 2011121610 A1, Pub. 25.10.2011.
5. Berger F., Issartel J-P., Atifi-Borel M.E., Lages E., Guttin A. Use of mirnas as biomarkers in glioma diagnosis. - Patent WO 2011070297 A3, Pub. 20.12.2012.
6. Tan S.C., Yiap B.C. DNA, RNA, and protein extraction: the past and the present. J Biomed Biotechnol. - V. 2009 (2009). - Article ID 574398, 10 pages. - doi: 10.1155/2009/574398.
7. Chen C., Ridzon D.A., Broomer A.J., Zhou Z., Lee D.H., Nguyen J.T., Barbisin M., Xu N.L., Mahuvakar V.R., Andersen M.R., Lao K.Q., Livak K.J., Guegler K.J. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Research. - 2005. - V. 33. - №20. - e179, doi:10.1093/nar/gni178.
8. Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR //Nucleic Acids Res. - 2001. - V. 29. - №9. - e45.

