Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ СНИЖЕНИЯ АЛКОГОЛЬНОЙ МОТИВАЦИИ ПРИ АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к фармакологии и касается нового применения известного вещества гидрохлорида N-2-адамантил-гексаметиленимина (гимантана) в качестве средства для снижения алкогольной мотивации при алкогольной зависимости.
В настоящее время стратегии поиска, разработки и создания новых оригинальных лекарственных препаратов для профилактики и лечения алкогольной зависимости продолжают оставаться актуальными для современной психофармакологии и наркологии, учитывая широкую распространенность и высокую социально-экономическую значимость данного заболевания (Медицинские, социальные и экономические последствия наркомании и алкоголизма / Е.А. Кошкина и соавт. - М.: Пер СЭ, 2008. - 288 с.). Данные по алкоголизму, опубликованные в отчете НИИ Росстата по итогам 2011 года, свидетельствуют, что фактически в стране насчитывается 12 миллионов злоупотребляющих алкоголем, при этом арсенал фармакологических средств для подавления алкогольной мотивации и влечения ограничен и отличается низкой эффективностью.
Чрезмерное потребление алкоголя в течение длительного времени может приводить к психологическим и психическим нарушениям, в результате сложного динамического процесса, в который вовлечены многочисленные адаптивные изменения, затрагивающие нейробиологические системы «награды» и реакции на стресс (Vengeliene V. et al., Br. J. Pharmacol. 2008; 154(2):299-315). В числе биологических и средовых влияний, формирующих алкогольную мотивацию, стресс рассматривается как один из важнейших факторов, определяющих потребление алкоголя. Многократное повторение циклов «интоксикация-абстиненция» существенным образом изменяет характер стрессового ответа, включая нарушение регуляции гипоталамо-гипофизарно-надпочечниковой системы (Heilig M, Koob GF. Trends Neurosci. 2007;30(8):399-406). В последние годы большое внимание уделяется роли патологической зависимости с точки зрения формирования устойчивой мотивации и возврата к потреблению алкоголя при срыве ремиссии. Это связано с тем, что аффективные (психологические) компоненты острого синдрома отмены и затянувшейся абстиненции влияют, по-видимому, на влечение к алкоголю в большей степени, чем физиологические симптомы алкогольной депривации (Heilig M. et al., Addict Biol. 2010;15(2):169-84).
Нарушение регуляторных функций глутаматергической системы сегодня рассматривается как ключевой патофизиологический фактор в формировании алкоголизма, а также как механизм, который может быть мишенью для фармакотерапии данного заболевания (De Witte P. et al. Neuroscience and Biobehav. Rev. 2003; 27:189-197; Spanagel R, Kiefer F. Trends in Pharmacol. Sci.. 2008; 29:109-115). С помощью метода микродиализа показано увеличение внеклеточного содержания глутамата при моделировании синдрома отмены этанола у крыс (Dahchour A, et al. Psychiatry Research. 1998; 82:107-114), и это увеличение пропорционально увеличивалось с последующими циклами «интоксикации-отмены» (Dahchour A, De Witte P. Alcohol Clin Exp Res. 2003;27:465-470). При введении ингибитора обратного захвата глутамата ТВОА наблюдается увеличение потребления этанола (Kapasova Z, Szumlinski K.K. Alcoholism: Clinical and Experimental Research. 2008;32:617-631), и наоборот, акампросат, функциональный антагонист глутаматных NMDA-рецепторов, является в настоящее время одобренным средством для лечения алкоголизма в США и в ряде стран Европы (Spanagel R, Kiefer F. Trends in Pharmacol. Sci. 2008; 29:109-115).
Снижение нейрональной активности, так же как и нарушение функциональной связи между вентральным стриатумом и префронтальной корой, ассоциируется с неудержимым влечением к алкоголю у больных алкоголизмом в состоянии абстиненции. У этанол-предпочитающих крыс на фоне алкогольной депривации отмечается повышение глутаматергической передачи в области дорсомедиального стриатума (DMS). Кроме того, экспозиция с этанолом и его отмена в опытах ex vivo и in vivo вызывают продолжительную активацию в DMS глутаматных NMDA-рецепторов, содержащих NR2B-субъединицы, способствуя увеличению потребления раствора этанола (Chen G. et al., Alcohol.Clin.Exp.Res. 2011; 35(10):1739-1748).
В таблице 1 представлены экспериментальные данные о действии двух психотропных препаратов из группы производных адамантана, механизм действия которых связан с неконкурентной блокадой NMDA-рецепторов, на экспериментальных моделях алкоголизма. Несмотря на определенные положительные результаты, достигнутые при использовании мемантина в опытах на животных, в пилотных двойных слепых клинических испытаниях эффективность мемантина у больных с алкогольной зависимостью доказана не была (Evans S.M. et al.. Alcohol Clin Exp Res. 2007;31(5):775-82). В дальнейшем при помощи метода ядерного магнитного резонанса было показано, что по сравнению с пациентами, неотягощенными семейной историей алкоголизма, лица с наследственной формой алкоголизма менее чувствительны к действию мемантина, по-видимому, за счет изначально повышенной функциональной активности NMDA-рецепторов (Jamadar S. et al. Psychopharmacology (Beri). 2012 Jul; 222(1):129-40).
С помощью методов нейровизуализации выявлены нейроанатомические и нейрохимические субстраты аддиктивного поведения. Так, в мозге больного, злоупотребляющего алкоголем, выделяют зону миндалины, включая прилежащее ядро, орбито-фронтальную кору и дорсальный стриатум, то есть области, ответственные за подкрепляющие эффекты, принятие решения и контроль импульсивного поведения. Показано, что снижение функционирования дофаминергической системы коррелируют с патологическим влечением к алкоголю и срывом ремиссии (Heinz A. et al., Am. J. Psychiatry. 2005; 162: 1515-15120).
Согласно исследованиям, выполненным на животных, при продолжительном потреблении растворов этанола наблюдается снижение синтеза дофамина и его высвобождения в стриатуме на фоне алкогольной абстиненции, что в целом свидетельствует о снижении функциональной активности центральных дофаминергических нейронов (Kaliszuk S. et al., Ann Univ Mariae Curie Sklodowska Med. 1990; 45:163-7). Учитывая тот факт, что в опытах in vivo предпочтение к этанолу и его чрезмерное потребление сопровождаются дисфункцией дофаминергической и серотонинергической систем, в настоящее время получены доказательства эффективности одновременного применения агонистов дофаминергических и серотонинергических рецепторов, в частности амфетамина и фенфлурамина для снижения потребления этанола и предотвращения возникновения индуцированных отменой этанола судорог у лабораторных животных (Mirovsky Y. et al.. Alcohol Clin Exp Res. 1995; 19(1):160-3; Yu Y.L. et al., Alcohol. 1997; 14(1):45-8).
В работе Cohen С.et al. (1999) необратимые ингибиторы МАО-В паргилин и депренил ослабляют подкрепляющие свойства этанола и снижают добровольное потребление 10%-го раствора этанола у крыс, что также подтверждает вовлеченность дофамина и серотонина в контроль алкогольного поведения и позволяет предположить использование ингибиторов МАО, увеличивающих содержание указанных медиаторов за счет блокады их метаболизма, при фармакотерапии алкогольной зависимости (Cohen С.et al., Pharmacol Biochem Behav. 1999; 64(3):535-9).
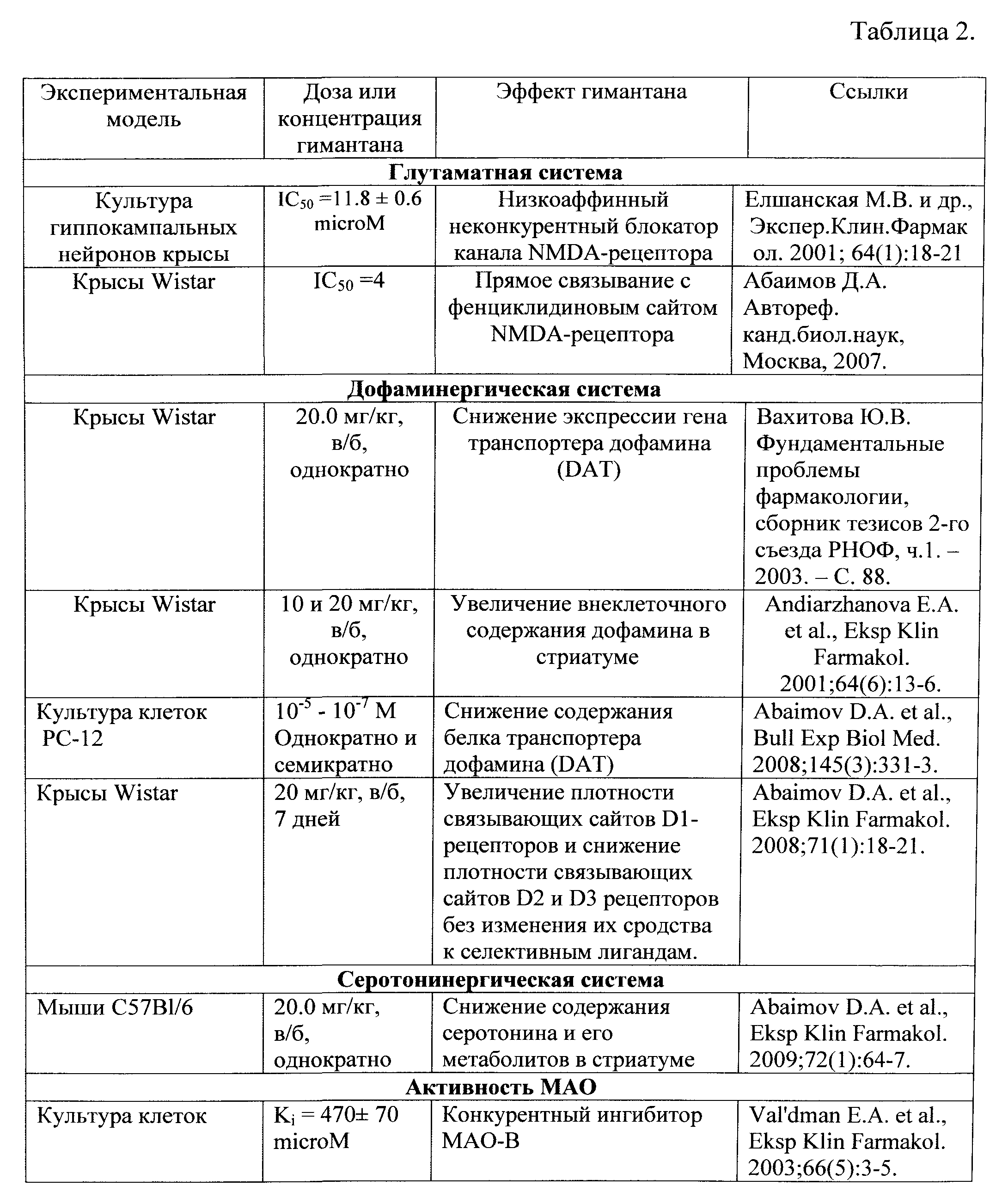
Гимантан (гидрохлорид N-2-адамантил-гексаметиленимина) - новый оригинальный препарат, созданный в ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН на основе структуры адамантана, обладает выраженной противопаркинсонической активностью, доказанной на экспериментальных моделях (Вальдман Е.А. и др. Экспер. и Клин. Фармакол. 1999;4:3-6; Капица и др. Психофармакол. и биол. наркология. 2005; 1:822-827; Капица И.Г. и др. Эксперим. и Клин. Фармакол. 2011; 7:9-12), и подтвержденной в клинике у больных с начальными стадиями болезни Паркинсона (Катунина Е.В. и др. Жур. неврологии и психиатрии им. С.С. Корсакова. 2008; 108(6):24-27). Кроме того, на модели ранней («домоторной») стадии болезни Паркинсона, гимантан, подобно амантадину, препятствует развитию когнитивных нарушений и депрессивно-подобного поведения у крыс (Непоклонов А.В. и др., Экспер. и Клин. Фармакол. 2012; 11:3-6). В таблице 2 представлены экспериментальные данные о комплексном механизме действия гимантана на ряд нейротрансмиттерных систем.
Таким образом, наличие в спектре фармакологической активности гимантана антидепрессивного и противотревожного действий, комплексный механизм действия, включающий дофаминергический компонент, блокаду ионных каналов глутаматных рецепторов NMDA подтипа и ингибирование МАО-В, а также отсутствие негативных побочных эффектов, таких как развитие лекарственной зависимости и потенцирование наркотического эффекта этанола, позволяют его использовать в качестве средства для снижения алкогольной мотивации при алкогольной зависимости. В доступных литературных источниках до настоящего времени отсутствуют указания на применение гимантана по предлагаемому назначению.
Настоящее исследование выполнено на мышах-самцах линии CD-1 с массой тела 20-22 г. (питомник РАМН «Столбовая», n=109), инбредных мышах-самцах линии DBA/2 с массой тела 20-22 г. (питомник РАМН «Столбовая», n=41), аутбредных крысах-самцах (питомник РАМН «Столбовая», n=55) в возрасте 8-ми месяцев со средней массой 470-490 г. в активной фазе эксперимента.
Гимантан (гидрохлорид N-2-адамантил-гексаметиленимина, субстанция, синтезированная в ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМН) в эффективных дозах 5.0, 10.0 и 20.0 мг/кг растворяли в воде для инъекций и вводили внутрибрюшинно (в/б) из расчета 0.1 мл/10 г (мыши) или 0.1 мл/100 г (крысы) массы животного.
Методика формирования алкогольной зависимости у аутбредных крыс.
За исключением нескольких селективных инбредных линий грызуны имеют врожденное отвращение к вкусу алкоголя и обычно избегают его потреблять. Однако крысы и мыши могут быть «обучены» выпивать относительно большие объемы алкоголя, используя раствор этанола с добавлением сахарозы, что соответствует типичному паттерну алкогольного поведения человека, когда привыкание к алкоголю начинается с потребления сладких алкогольсодержащих коктейлей с постепенным переходом к несладким напиткам. Другим способом форсированной алкоголизации животных является предоставление раствора этанола в качестве единственного источника жидкости с последующей оценкой уровня алкогольной мотивации в условиях свободного выбора между этанолом и водой (Анохина И.П. и Колик Л.Г. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.: Гриф и К, 2012. - С. 310-333).
Для моделирования патологического влечения к этанолу мы использовали методику принудительной алкоголизации (1-й этап) животных с предоставлением 10%-го раствора этанола в качестве единственного источника жидкости в течение 20-ти недель. Животных содержали в индивидуальных клетках в стандартных условиях вивария ФГБУ «НИИ фармакологии имени В.В. Закусова» РАМЫ с предоставлением брикетированного корма ad libitum при регулируемом 12/12 (свет/темнота) световом режиме. Раз в неделю регистрировали изменение массы тела животных и количество потребляемого этанола (в г/кг). В процессе принудительной алкоголизации крысы потребляли физиологически значимые количества алкоголя (4.93±0.09 г/кг в пересчете на этанол). Далее, с целью моделирования циклов «интоксикация - абстиненция», наблюдаемых в клинической практике, была использована методика добровольной алкоголизации (2-й этап) с предоставлением животным выбора между сосудом с 10%-ным этанолом и сосудом с водой в течение 24-х часов в сутки с повторяющимися периодами 48-ми часовой алкогольной депривации (21-я, 23-я и 25-я недели от момента первого контакта с этанолом). В результате многократных «синдромов отмены» алкогольное поведение животных, до этого рассматриваемое как «контролируемое», постепенно трансформируется в «неконтролируемое», что позволяет транслировать полученные данные на человеческую популяцию, в которой отличительной особенностью алкоголизма является компульсивность, то есть сильное пристрастие и почти болезненное влечение к алкоголю (Spanagel R. Physiol. Rev. 2009; 89:649-705).
Животные были разделены на опытные и контрольные группы с учетом массы тела, количества потребляемого алкоголя, степени выраженности синдрома отмены этанола и содержались в стандартных условиях вивария в индивидуальных клетках до начала эксперимента.
Оценка среднесуточного потребления раствора этанола.
Наиболее распространенной методикой для изучения подкрепляющих свойств этанола у лабораторных животных при моделировании алкогольной зависимости считается измерение количества потребляемых жидкостей при предоставлении неограниченного доступа к сосуду с раствором этанола выбранной концентрации и сосуду с водой в течение 24-х часов в сутки.
Оценка уровня алкогольной мотивации проводится по показателю среднесуточного потребления этанола (из расчета на 1 кг веса животных в сутки). Поскольку усилия, необходимые для получения этанола, минимальны, данная методика позволяет оценить лишь мотивационный компонент алкогольного поведения (Tabakoff B. and Hoffman P.L. Alcohol Res Health. 2000; 24(2):77-84).
Опыты выполнены на крысах, потребляющих относительно большие количества 10%-го этанола (4.00±0.29 г/кг в сутки). Оценивали влияние гимантана в эффективной дозе 20.0 мг/кг/сутки на добровольное потребление алкоголя животными с устойчивой алкогольной мотивацией, сформированной в течение 20-ти недель принудительной алкоголизации. Измеряли суточное потребление алкоголя отдельными животными, далее, вычисляли среднесуточное потребление алкоголя (в г/кг) в соответствующей группе животных и сопоставляли данные о фоновом потреблении (до инъекций) с данными по потреблению раствора этанола животными на фоне применения изучаемого препарата.
Оценка потребления алкоголя в условиях АДЭ.
Алкоголь-депривационный эффект (АДЭ) - реакция животных на повторное предоставление свободного доступа к алкоголю в период абстиненции в виде временного увеличения его потребления по сравнению с предшествующим алкогольной депривации периодом.
Модель позволяет количественно оценить уровень добровольного потребления алкоголя после разных сроков лишения животных доступа к этанолу: на этапе формирования алкогольной мотивации или на этапе развития физической зависимости от этанола в условиях свободного выбора между этанолом и водой.
В период депривации животных, находящихся в индивидуальных клетках, снабженных поилками с раствором этанола и водой, лишали доступа к раствору этанола. Через 48 часов после отмены этанола животным вновь предоставляли раствор этанола, после чего оценку индивидуального потребления жидкостей осуществляют в тех же условиях, что и оценку добровольного потребления алкоголя в условиях свободного выбора между раствором этанола и водой. Количество жидкостей в поилках после предоставления этанола измеряют: через 90 мин после начала индивидуального теста; через 24 часа после начала индивидуального теста; при тесте продолжительностью более суток - каждые последующие 24 часа. Оценивали амплитуду АДЭ в виде разницы между темпом потребления алкоголя в первые 90 мин после депривации и таковыми до депривации, а также скорость восстановления потребления алкоголя до уровня, имевшегося перед лишением алкоголя. Определяли потребление спирта и выражали в г/кг.
Оценка влияния изучаемого вещества на этанол-индуцированную гиперлокомоторную реакцию (тест «этанол-индуцированная стимуляция двигательной активности»).
Данный тест используются для выявления патофизиологических механизмов, лежащих в основе формирования аддиктивного состояния. У мышей этанол в низких и умеренных дозах вызывает стимуляцию двигательной активности, что, по мнению ряда авторов, имитирует алкоголь-индуцированную эйфорию у людей (Wise R.A. and Bozarth M.A. Psychol. Rev. 1987; 94:469-492; Koob G.F. TIPS, 1992; 13:177-184).
Регистрацию двигательной активности проводили в актометре ОРТО-VARIMEX 4 (Columbus Instruments, USA), оснащенном 8-ю парами ИК-датчиков на высоте 1.27 см от пола, расположенных по периметру 40×40 см экспериментальной установки, при естественном освещении в течение 10 минут. Сразу после введения этанола (20%-ный раствор в дозе 2.0 г/кг, объем 20 мл/кг веса тела, в/б) мышей помещали в OPTO-VARIMEX 4 и автоматически фиксировали общее расстояние (в см), пройденное животными. При оценке влияния гимантана в дозе 20.0 мг/кг на острое стимулирующее действие этанола препарат вводили за 30 мин до инъекции этанола.
Оценка влияния изучаемого вещества на миорелаксацию, индуцированную этанолом (тест «вращающийся стержень»).
Опыты выполнены на аутбредных мышах-самцах. Установка представляет собой приподнятый на высоту 60 см стержень диаметром 6 см с фиксированной скоростью вращения (6,5 об/мин). При оценке влияния фармакологических веществ на вызываемую этанолом атаксию мышей предварительно тестировали не менее трех раз (время каждой экспозиции - 3 минуты) для достижения стабильных показателей. Этанол вводили (20%-ный раствор в дозе 2.0 г/кг, объем 20 мл/кг веса тела, в/б) за 45 мин до тестирования. Основной регистрируемый показатель - время удержания на стержне (Rustay N.R. et al. Proc Nati Acad Sci USA. 2003; 100(5):2917-22.4). Способность животных сохранять равновесие и увеличивать время нахождения на вращающемся стержне под действием изучаемого вещества, вводимого на фоне этанола, расценивается как способность уменьшать токсическое действие этанола и оказывать вытрезвляющий эффект. И наоборот, сокращение времени удержания на вращающемся стержне под действием изучаемых веществ свидетельствует об усилении миорелаксации, индуцированной этанолом. Гимантан в диапазоне эффективных доз 5.0, 10.0 и 20.0 мг/кг вводили за 30 мин до тестирования (на фоне действия тест-дозы этанола).
Оценка влияния изучаемого вещества на продолжительность сна, вызываемого этанолом (тест «этаноловый наркоз»)
Опыты выполнены на аутбредных мышах-самцах. Животным вводили 25%-ный раствор этанола в тест-дозе (5.5 г/кг, в/б), вызывающей развитие алкогольного наркоза, который сохраняется в течение 1-2 часов, что позволяет выявить как ослабление, так и усиление действия этанола. Животных размещали на ровной горизонтальной поверхности и регистрировали время наступления и окончания алкогольного наркоза по принятию «бокового положения» и, соответственно, самостоятельному устойчивому выходу из него. Изучаемое вещество вводили на фоне этанолового наркоза. Контрольной группе животных вводили раствор этанола в тест-дозе в/б и изомерное количество растворителя, используемого для изучаемого вещества (воду для инъекций). Объем вводимого 25%-го раствора этанола (V) в соответствии с его необходимой дозой (D) с учетом массы животного (М) рассчитывали по формуле:
V(мл)=(D(г/кг)×М(г))/250.
Тест «этаноловый наркоз» применяется для суммарной оценки активности этанол-метаболизирующих систем и чувствительности ЦНС к этанолу.
Статистическая обработка результатов производилась с использованием однофакторного дисперсионного анализа ANOVA с последующим применением теста Дункана и при помощи t-критерия Стьюдента. Данные графиков представлены в виде средних значений и стандартной ошибки средних значений mean ±SEM.
Изобретение иллюстрируется следующими примерами
Пример 1. Влияние гимантана на алкоголь-депривационный эффект (АДЭ) у крыс с устойчивой алкогольной мотивацией.
Опыты выполнены на аутбредных крысах-самцах (n=37) со сформированной в течение 6-ти месяцев алкогольной зависимостью. При моделировании состояния острой алкогольной абстиненции установлено, что гимантан в диапазоне доз от 5.0 до 20.0 мг/кг при однократном системном введении снижает выраженность алкоголь-депривационного эффекта в дозо-зависимой манере. Максимальная активность препарата по сравнению с контрольной группой (р<0.001) проявляется в дозе 20.0 мг/кг (фиг. 1). Ранее подобное действие было описано для таких неконкурентных антагонистов NMDA-рецепторов как акампросат, мемантин и neramexane (Spanagel R., Physiol. Rev. 2009; 89:649-705).
При последующей оценке действия гимантана на восстановление потребления этанола в первые 24 часа после алкоголь-депривационного эффекта у крыс с устойчивой алкогольной мотивацией была выявлена тенденция к уменьшению потребления этанола особенно в дозах 10.0 и 20.0 мг/кг (фиг. 2), что позволило использовать препарат в дальнейших исследованиях при хроническом способе введения именно в максимальной дозе 20.0 мг/кг.
Пример 2. Влияние гимантана на среднесуточное потребление этанола.
Опыты выполнены на аутбредных крысах-самцах (n=18) со сформированной в течение 6-ти месяцев алкогольной зависимостью (потребление 4.00±0.29 г/кг/сутки в пересчете на чистый этанол). Изучено влияние гимантана в наиболее эффективной дозе 20.0 мг/кг при хроническом системном введении на среднесуточное потребление 10%-ого раствора этанола в условиях свободного выбора между этанолом и водой в течение 24 ч в сутки. Показано, что гимантан снижает количество этанола, выпиваемое животными, по сравнению с контрольной группой в течение всего периода введения препарата. Статистически значимый эффект развивается с 3-го дня эксперимента (фиг. 3).
Пример 3. Влияние гимантана на стимуляцию двигательной активности, вызываемую этанолом.
Опыты выполнены на интактных инбредных мышах-самцах линии DBA/2 (n=41), отличающихся повышенной чувствительность к стимулирующему действию этанола. При предварительном тестировании мышей в актометре показано, что базовый уровень двигательной активности животных из контрольной и опытных групп не отличается. При остром введении этанол в дозе 2.0 г/кг, в/б, вызывал значительное увеличение двигательной активности у животных из контрольной группы по сравнению с фоновым значением (р<0.001). Гимантан в дозе 20.0 мг/кг, не влияя на уровень двигательной активности per se, статистически значимо (р<0.01) препятствовали формированию индуцированной этанолом гиперлокомоторной реакции (фиг. 4).
Полученные результаты согласуются с данными о способности антагонистов NMDA-рецепторов МК-801 и ifenprodil блокировать стимулирующее действие этанола у мышей DBA/2J (Broadbent J. et al., Psychopharmacology (Berl). 2003; 167(3):225-34).
Пример 4. Влияние гимантана на атаксию, вызываемую этанолом.
Опыты выполнены на аутбредных мышах-самцах (n=68). В отличие от диазепама, транквилизатора, традиционно применяющегося для коррекции нарушений, связанных с алкогольной зависимостью, и вызывающего усиление миорелаксации, индуцированной этанолом в тесте «вращающийся стержень», гимантан в дозах 10.0 и 20.0 мг/кг в дозо-зависимой манере восстанавливал нарушенную координацию движения и увеличивал время удержания на «вращающемся стержне» на фоне действия этанола по сравнению с контрольной группой (р<0.05, р<001), что свидетельствует об эффективности гимантана в условиях легкой алкогольной интоксикации (фиг. 5).
Пример 5. Оценка влияния гимантана на длительность этанолового наркоза.
Опыты выполнены на аутбредных мышах-самцах (n=41). При инъекции наркотической дозы этанола 5.5 г/кг наблюдается гипноседативное действие этанола, проявляющееся в увеличении времени пребывания в боковом положении по сравнению с фоновыми значениями (р<0.05). Гимантан ни в одной из изученных доз 10.0 и 20.0 мг/кг не оказывал статистически значимого эффекта на длительность этанолового наркоза, что позволяет сделать вывод об отсутствии влияния гимантана на систему этанол-метаболизирующих ферментов (фиг. 6), что выгодно отличает препарат от другого неконкурентного антагониста NMDA-рецепторов мемантина, который, как и бензодиазепиновые транквилизаторы, потенцирует продолжительность алкогольного сна (Beleslin D.B. et al.. Alcohol. 1997 Mar-Apr; 14(2):167-73).
На основании полученных данных, можно сделать вывод, что гимантан представляет собой эффективное средство для снижения влечения к алкоголю, поскольку препарат: 1) при однократном введении ослабляет влечение к алкоголю по показателю алкоголь-депривационного эффекта; 2) при хроническом введении в течение 2-х недель уменьшает алкогольную мотивацию, снижая среднесуточное потребление этанола у животных со сформированной зависимостью от алкоголя. Кроме того, гимантан препятствует реализации острых эффектов этанола, блокируя стимуляцию двигательной активности и восстанавливая нарушенную координацию движений при легкой алкогольной интоксикации.
Описание чертежей.
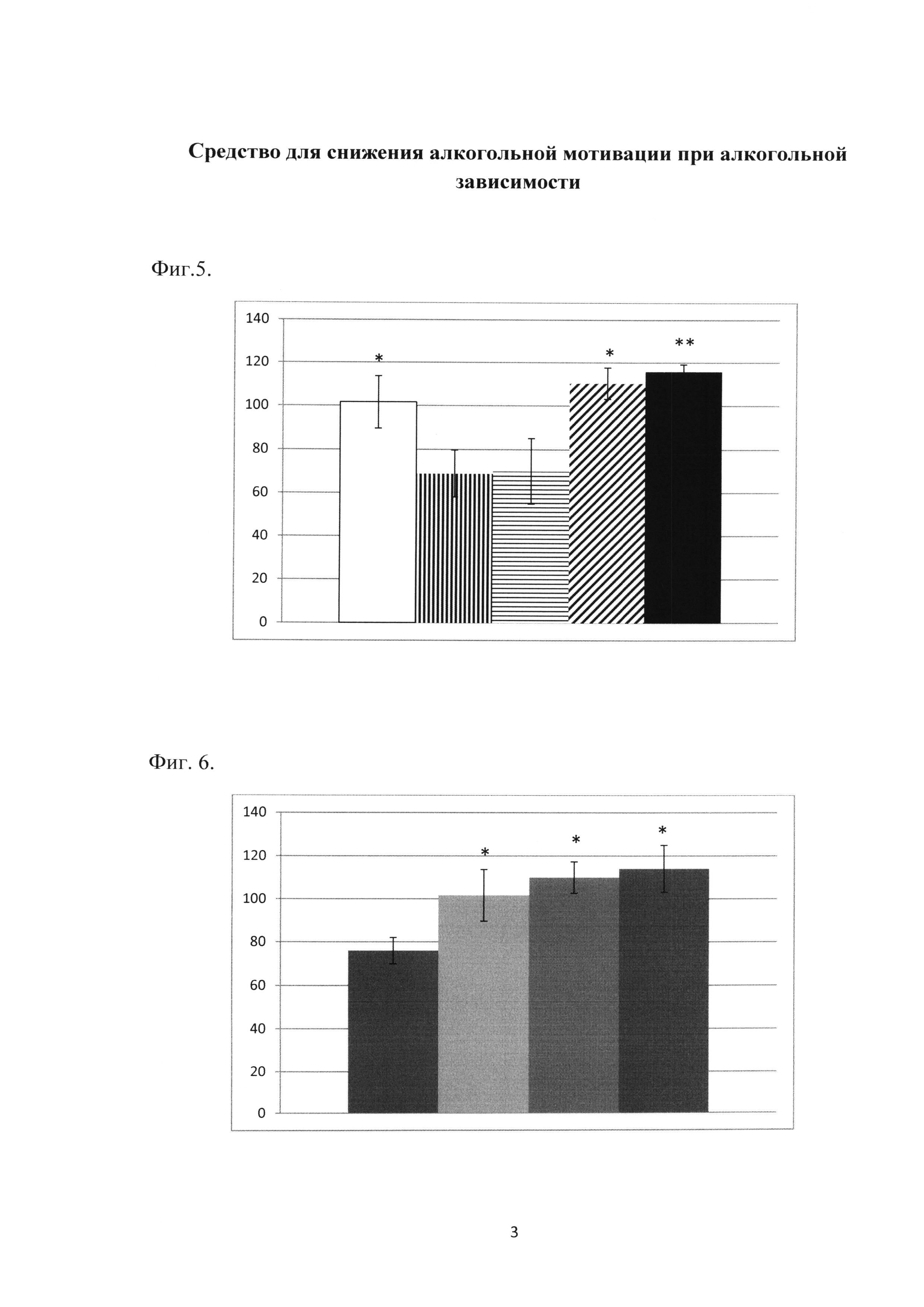
Фиг. 1. Влияние гимантана на алкоголь-депривационный (АДЭ) эффект у крыс с устойчивой алкогольной мотивацией.
По оси абсцисс представлены фоновые значения АДЭ до введения гимантана (1) и опытные (2) данные, по оси ординат - количество выпитого этанола (в г/кг) за 90 мин после 48-часовой алкогольной депривации. Экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - гимантан в дозе 5.0 мг/кг, 3-й столбец - гимантан в дозе 10.0 мг/кг, 4-й столбец - гимантан в дозе 20.0 мг/кг.
По оси ординат указано количество выпитого алкоголя за 90 мин (в г/кг). ** - р<0.01, ** - р<0.001 статистически значимые отличия по сравнению с контрольной группой, ANOVA, тест Дункана; число животных в группе - 9-10; mean ±SEM.
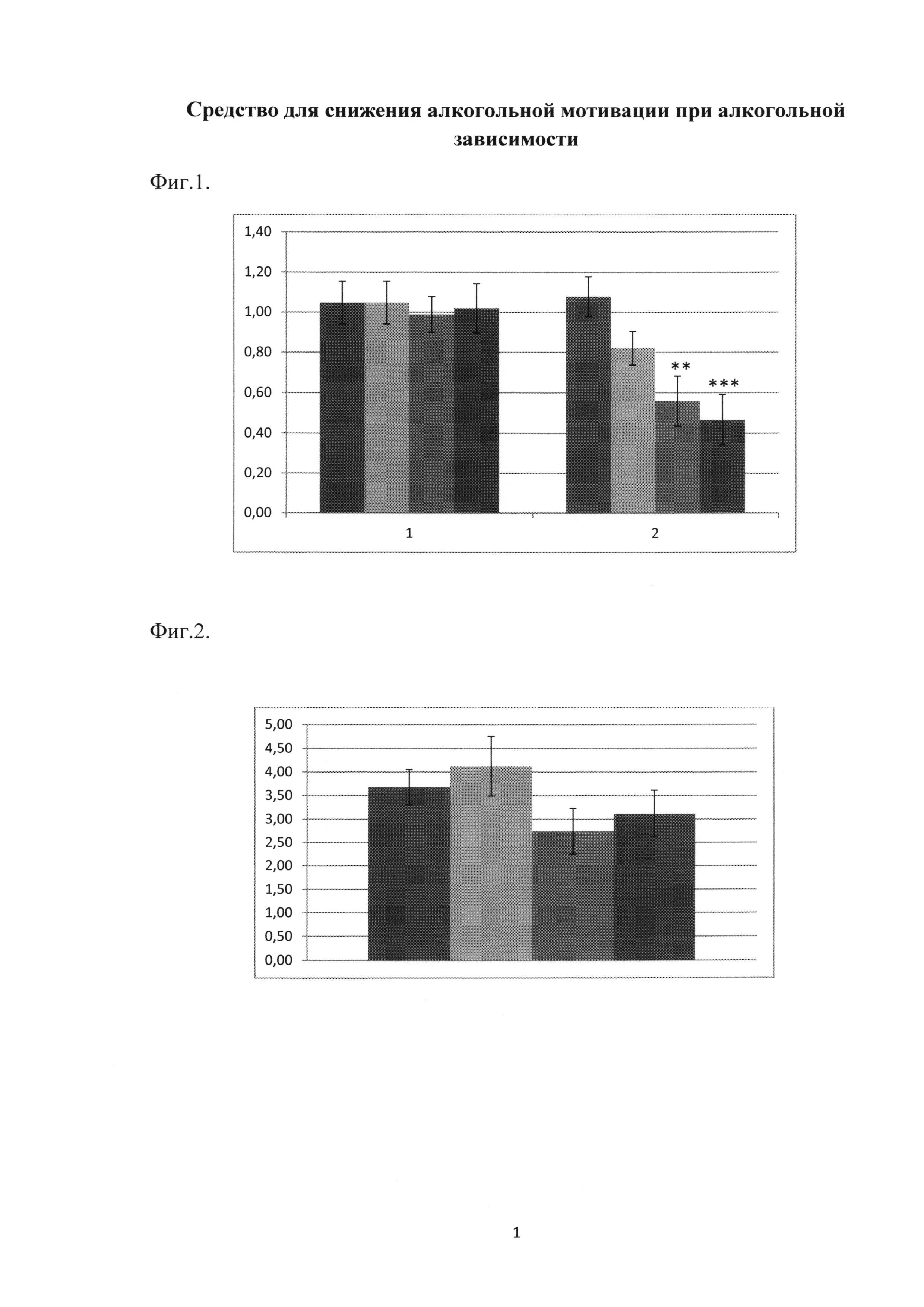
Фиг. 2. Действие гимантана при однократном введении на восстановление потребления этанола в первые 24 часа после алкоголь-депривационного эффекта у крыс с устойчивой алкогольной мотивацией.
По оси абсцисс - экспериментальные группы: 1-й столбец - контрольная группа (вода для инъекций), 2-й столбец - гимантан в дозе 5.0 мг/кг, 3-й столбец - гимантан в дозе 10.0 мг/кг, 4-й столбец - гимантан в дозе 20.0 мг/кг.
По оси ординат указано количество выпитого алкоголя за 24 часа после 48-часовой алкогольной депривации (в г/кг).
Статистически значимые отличия по сравнению с контрольной группой отсутствуют; ANOVA; число животных в группе - 9-10; mean ±SEM.
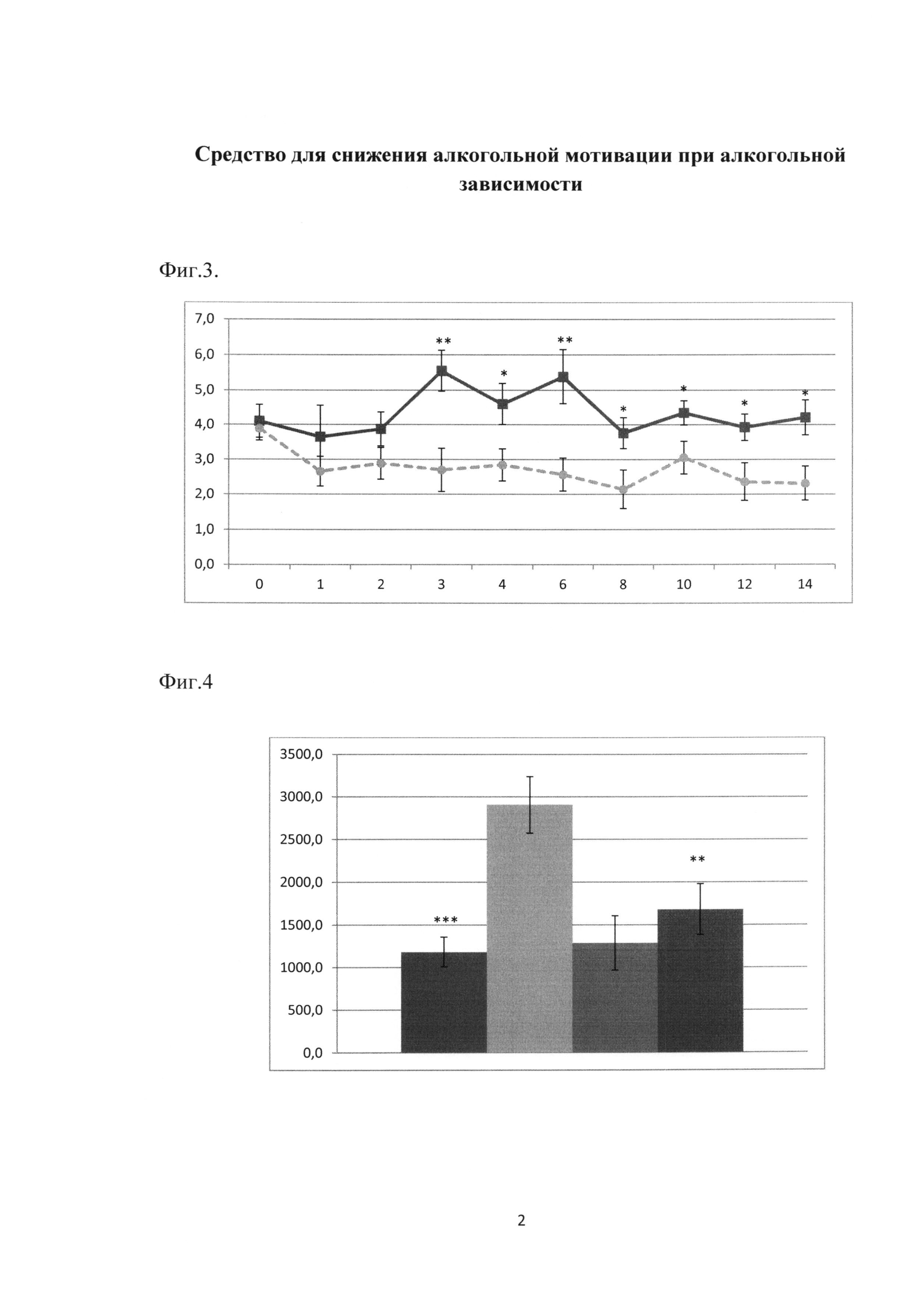
Фиг. 3. Влияние гимантана в дозе 20.0 мг/кг при хроническом системном введении на среднесуточное потребление этанола.
По оси абсцисс представлены дни эксперимента с 0 (фоновые значения до начала инъекций) по 14, когда проводили измерение количества потребляемых жидкостей. Экспериментальные группы животных: сплошная линия с квадратным маркером - вода для инъекций (контроль); пунктирная линия с круглым маркером - гимантан в дозе 20.0 мг/кг (опыт).
По оси ординат указано количество выпиваемого этанола в сутки (в г/кг).
*** -р<0.001, ** -р<0.01 статистически значимые отличия по сравнению с контрольной группой согласно t-критерию Стьюдента, число животных в каждой группе по 9, mean±SEM.
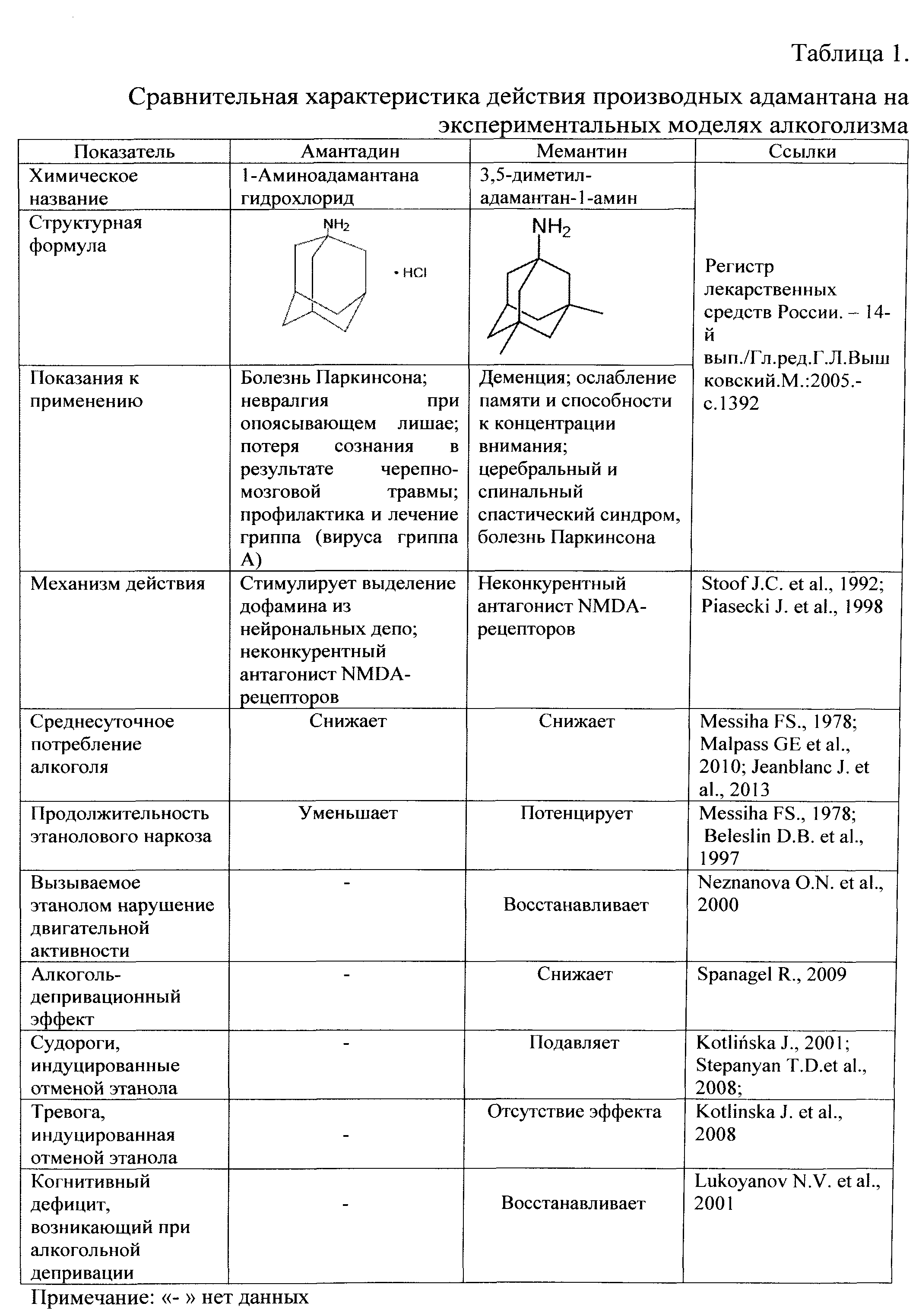
Фиг.4. Влияние гимантана на индуцированную этанолом гиперлокомоторную реакцию у мышей линии DBA/2.
По оси абсцисс представлены следующие группы животных: 1-й столбец -вода для инъекций (фон); 2-й столбец - этанол в дозе 2.0 г/кг (контроль); 3-й столбец - гимантан в дозе 20.0 мг/кг; 4-й столбец - этанол в дозе 2.0 г/кг + гимантан в дозе 20.0 мг/кг.
По оси ординат - пройденное расстояние в см.
*** - р<0.001, ** - р<0.01 статистически значимые отличия по сравнению с контрольной группой согласно однофакторному дисперсионному анализу ANOVA, тест Дункана, число животных в каждой группе - 9-12, mean ±SEM.
Фиг.5. Влияние гимантана на миорелаксацию, индуцированную этанолом в тесте «вращающийся стержень» у мышей линии CD-1.
По оси абсцисс групп животных, получавших: белый столбец - вода для инъекций (фон); столбец с вертикальной штриховкой - этанол в дозе 2.0 г/кг (контроль); столбец с горизонтальной штриховкой - этанол + гимантан в дозе 5.0 мг/кг; столбец с диагональной штриховкой - этанол + гимантан в дозе 10.0 мг/кг; черный столбец - этанол + гимантан в дозе 20.0 мг/кг.
По оси ординат - время удержания равновесия на вращающемся стержне в секундах (сек).
*-р<0.05, **-р<0.01 статистически значимые отличия по сравнению с контрольной группой согласно однофакторному дисперсионному анализу ANOVA, тест Дункана; число животных в каждой группе - 12-18; mean ±SEM.
Фиг.6. Оценка влияния гимантана на продолжительность этанолового наркоза у мышей линии CD-1.
По оси абсцисс представлены группы животных, получавших: 1-й столбец - воду для инъекций (фон); 2-й столбец - этанол в дозе 5.5 г/кг (контроль); 3-й столбец - этанол в дозе 5.5 г/кг + гимантан в дозе 10.0 мг/кг; 4-й столбец - этанол в дозе 5.5 г/кг + гимантан в дозе 20.0 мг/кг.
По оси ординат - время пребывания в боковом положении в минутах (мин).
*-р<0.05 статистически значимые отличия по сравнению с фоновыми значениями, согласно ANOVA, тест Дункана; число животных в каждой группе - 10-11; mean ± SEM.
Применение гидрохлорида N-2-адамантил-гексаметиленимина (гимантана) в качестве средства для снижения алкогольной мотивации при алкогольной зависимости.