Результат интеллектуальной деятельности: ПРОЛЕКАРСТВО ТРИАЗОЛОНОВОГО СОЕДИНЕНИЯ
Вид РИД
Изобретение
Область изобретения
[0001] Настоящее изобретение относится к пролекарству триазолонового соединения или к его фармацевтически приемлемой соли, которые применимы в качестве фармацевтического и терапевтического или профилактического средства, содержащего их в качестве эффективного ингредиента, для заболевания, вызванного образованием тромба.
Предшествующий уровень техники изобретения
[0002] При разрушении кровеносного сосуда в организме сразу же продуцируется тромбин, чтобы избежать смерти от кровотечения. С другой стороны, избыточное количество тромбина, продуцированного по причине воспалительной реакции или подобного в поврежденном сосуде, вызывает тромбоз, что приводит к ухудшению важных функций органа. Следовательно, для лечения или профилактики тромбоза применялся ингибитор тромбина, такой как гепарин или варфарин, который ингибирует продуцирование тромбина или непосредственно ингибирует активность тромбина, в качестве антикоагулянта в течение длительного времени. Однако степень медицинской удовлетворительности этих лекарственных средств не достаточно высока, и в настоящее время в глобальном масштабе осуществляется исследование и разработка новых антикоагулянтов, обладающих исключительными отношениями дозы и ответа, низким риском кровоизлияния, и которые могут быть введены перорально.
[0003] Механизмы коагуляции крови делятся на “внутренний путь коагуляции”, который инициируется активацией фактора XII (FXII), благодаря контакту с отрицательно заряженным веществом, и “внешний путь коагуляции”, который активируется тканевым фактором (TF) и фактором VII (FVII). В случае развития тромбоза важен внешний путь коагуляции, как предполагали, поскольку TF особенно экспрессируется при патологическом состоянии. Следовательно, полагали, что соединения, которые ингибируют фактор коагуляции крови VIIa, который позиционируется выше точки приложения воздействия во внешнем пути коагуляции, являются применимыми в качестве терапевтических и/или профилактических средств от заболеваний, вызванных образованием тромба, таких как тромбоз, при котором включается внешний путь коагуляции.
Известные примеры таких соединений, которые ингибируют фактор коагуляции крови VIIa, включают амидинонафтоловые производные (см. непатентный документ 1), амидиновые производные (см. патентный документ 1), N-сульфонилдипептидные производные (см. патентный документ 2), 6-[[(аллил)окси]метил]нафтален-2-карбоксиимидамидные производные (см. патентный документ 3) и фенилглициновые производные (см. патентные документы 4 и 5). Кроме того, известны триазолоновые производные (см. патентный документ 6), которые являются активными компонентами пролекарств настоящего изобретения.
[0004] Однако, известные соединения являются неудовлетворительными по их ингибиторной активности по отношению к фактору коагуляции крови VIIa, антикоагулянтному действию, терапевтическому действию по отношению к тромбозу и т.п. Для триазолоновых производных, кроме того, считается, что необходимо улучшение абсорбционной способности при пероральном введении.
Перечень цитированных ссылок
Непатентная литература
[0005] Непатентный документ 1: Tetrahedron, vol. 55, p. 6219, 1999.
Патентная литература
[0006] Патентный документ 1: публикация заявки на европейский патент № 1078917.
Патентный документ 2: WO 00/58346.
Патентный документ 3: WO 00/66545.
Патентный документ 4: WO 00/35858.
Патентный документ 5: WO 00/41531.
Патентный документ 6: WO 07/111212.
Краткое описание изобретения
Техническая проблема
[0007] Целью настоящего изобретения является обеспечение производного пролекарства триазолонового соединения, которое обладает высокой селективной ингибиторной активностью по отношению к фактору коагуляции крови VIIa, и его фармацевтически приемлемой соли с высокой пероральной абсорбционной способностью, и терапевтического и/или профилактического средства с его использованием от заболевания, вызванного образованием тромба.
Решение проблемы
[0008] Авторы настоящего изобретения тщательно обдумывали решения вышеописанных проблем, и им удалось синтезировать новые производные пролекарства триазолоновых соединений, обладающих конкретной химической структурой, и они обнаружили, что эти соединения показывают улучшенную абсорбционную способность при пероральном введении, то есть улучшенную биодоступность активного компонента, осуществив, таким образом, настоящее изобретение.
[0009] А именно, настоящее изобретение относится
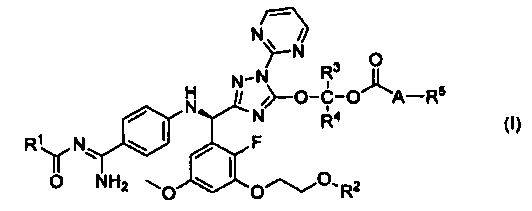
<1> к соединению, представленному следующей формулой (I), или его фармацевтически приемлемой соли:
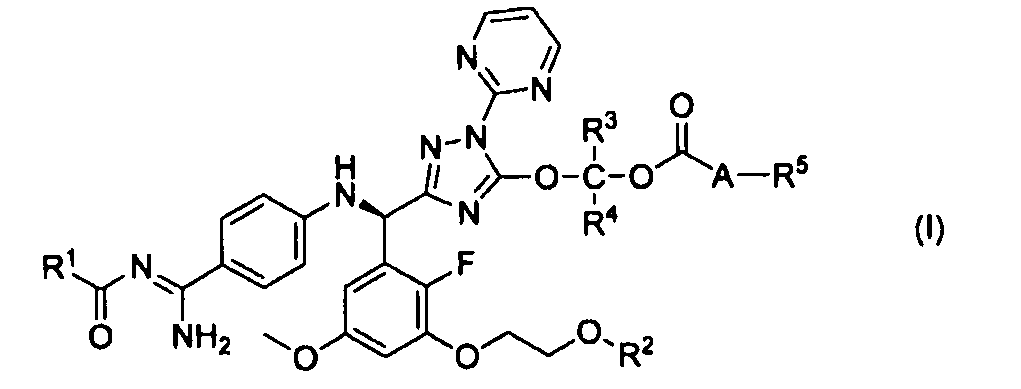 ,
,
где R1 представляет фенил, необязательно замещенный одной-тремя C1-C6алкильными группами, C1-C6алкокси или C2-C6алкенилокси;
R2 представляет атом водорода, C1-C6алкилкарбонил или пиридилкарбонил;
каждый R3 и R4 независимо представляет атом водорода или C1-C6алкил;
A представляет одинарную связь, атом кислорода, группу, представленную формулой (II):
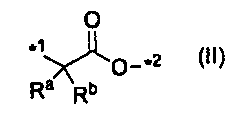
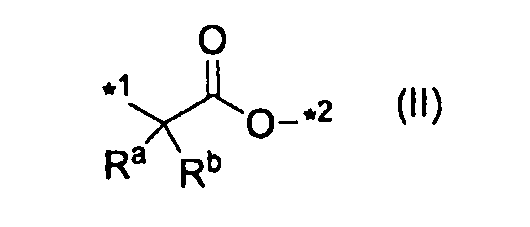 ,
,
где каждый Ra и Rb независимо представляет атом водорода или C1-C6алкил, а *1 и *2 означают связывание с карбонилом и с R5, соответственно, в формуле (I),
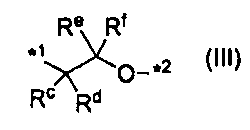
или группу, представленную формулой (III):
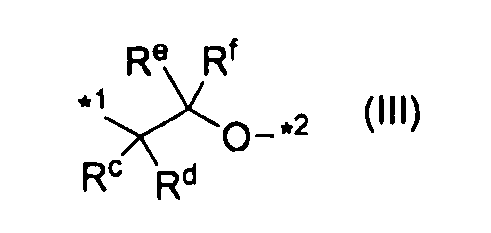 ,
,
где каждый Rc, Rd, Re и Rf независимо представляет атом водорода или C1-C6алкил, а *1 и *2 характеризуются теми же значениями, как описано выше; и
R5 представляет C1-C6алкил или C3-C8циклоалкил, а C1-C6алкил или C3-C8циклоалкил в R5 необязательно замещен одним-тремя идентичными или различными заместителями, выбранными из группы заместителей, состоящей из атома галогена, C1-C6алкила и C1-C6алкокси;
<2> к соединению или его фармацевтически приемлемой соли согласно <1>, где R1 представляет собой фенил, 4-толил, 2,2-диметил-1-пропилокси, 2,2-диметил-1-бутилокси или 2-метил-2-пропенилокси;
<3> к соединению или его фармацевтически приемлемой соли согласно <1>, где R2 представляет собой атом водорода, ацетил или 4-пиридилкарбонил;
<4> к соединению или его фармацевтически приемлемой соли согласно <1>, где каждый R3 и R4 независимо представляет собой атом водорода, метил или этил;
<5> к соединению или его фармацевтически приемлемой соли согласно <1>, где R5 представляет собой C1-C6алкил, необязательно замещенный метокси, или циклогексил, необязательно замещенный атомом галогена или метилом;
<6> к соединению или его фармацевтически приемлемой соли согласно <1>, где каждый Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой атом водорода или метил;
<7> к соединению или его фармацевтически приемлемой соли согласно <1>, где
R1 представляет собой 4-толил, фенил, 2,2-диметил-1-пропилокси, 2,2-диметил-1-бутилокси или 2-метил-2-пропенилокси;
R2 представляет собой атом водорода, ацетил или 4-пиридилкарбонил;
каждый R3 и R4 независимо представляет собой атом водорода, метил или этил;
R5 представляет собой C1-C6алкил, необязательно замещенный метокси, или циклогексил, необязательно замещенный атомом галогена или метилом;
A представляет собой одинарную связь, атом кислорода, группу, представленную формулой (II), или группу, представленную формулой (III); и
каждый Ra, Rb, Rc, Rd, Re и Rf независимо представляет собой атом водорода или метил;
<8> к соединению или его фармацевтически приемлемой соли согласно <1>, где соединение представляет собой (1) 3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (2) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира трет-бутиловый сложный эфир, (3) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир, (4) 4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (5) 2-этилбутановой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (6) 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (7) циклогексанкарбоновой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (8) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира циклогексиловый сложный эфир, (9) угольной кислоты 1-(5-{(R)-(4-{амино[4-метилбензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир, (10) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир, (11) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир, (12) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1S,2S)-2-фторциклогексиловый сложный эфир, (13) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира циклогексиловый сложный эфир, (14) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира транс-2-фтор-циклогексиловый сложный эфир, (15) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира этиловый сложный эфир, (16) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира изопропиловый сложный эфир, (17) изоникотиновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир или (18) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир;
<9> к соединению или его фармацевтически приемлемой соли согласно <1>, где соединение представляет собой (1) 3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (4) 4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (5) 2-этилбутановой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (6) 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир, (13) угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира циклогексиловый сложный эфир или (18) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир;
<10> к (1) 3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловому сложному эфиру или его фармацевтически приемлемой соли;
<11> к (6) 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловому сложному эфиру или его фармацевтически приемлемой соли;
<12> к соединению или его фармацевтически приемлемой соли согласно <1>, где соединение представляет собой (51) уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (52) уксусной кислоты 2-{3-[(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир, (53) уксусной кислоты 2-{3-[(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир, (54) уксусной кислоты 2-(3-{(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (55) уксусной кислоты 2-(3-{(R)-(4-{амино[изобутоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (56) угольной кислоты 5-{(R)-(4-{амино-[2-метилаллилоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир, (57) уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (58) угольной кислоты 5-{(R)-(4-{амино-[2-этоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир, (59) угольной кислоты 5-{(R)-(4-{амино-[2-пропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир, (60) угольной кислоты 5-{(R)-(4-{амино-[2-бутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир, (61) уксусной кислоты 2-(3-{(R)-(4-{амино[этоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (62) уксусной кислоты 2-(3-{(R)-(4-{амино[пропоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (63) уксусной кислоты 2-(3-{(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир, (67) уксусной кислоты 2-{3-[(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир или (68) уксусной кислоты 2-{3-[(R)-(4-{амино[изобутоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир;
<13> к фармацевтической композиции, содержащей соединение или его фармацевтически приемлемую соль согласно любому из <1> - <12>;
<14> к терапевтическому и/или профилактическому средству от заболевания, вызванного образованием тромба, к терапевтическому и/или профилактическому средству, содержащему соединение или его фармацевтически приемлемую соль согласно любому из <1> - <12>;
<15> к терапевтическому и/или профилактическому средству согласно <14>, где заболеванием, вызванным образованием тромба, является тромбоз, тромбоз глубокой вены, легочная эмболия, церебральный инфаркт, инфаркт миокарда, острый коронарный синдром, сосудистый рестеноз, синдром диссеминированной внутрисосудистой коагуляции или злокачественная опухоль; и
<16> к терапевтическому и/или профилактическому средству согласно <14>, где заболеванием, вызванным образованием тромба, является тромбоз, тромбоз глубокой вены, легочная эмболия, церебральный инфаркт, инфаркт миокарда, острый коронарный синдром, сосудистый рестеноз или синдром диссеминированной внутрисосудистой коагуляции.
[0010] При пероральном введении соединения настоящего изобретения уровень следующего соединения (IV) в крови, которое обладает высоким ингибиторным действием по отношению к фактору коагуляции крови VIIa и антикоагулянтным действием, достигает уровня, достаточного для экспрессии его фармакологический действий.
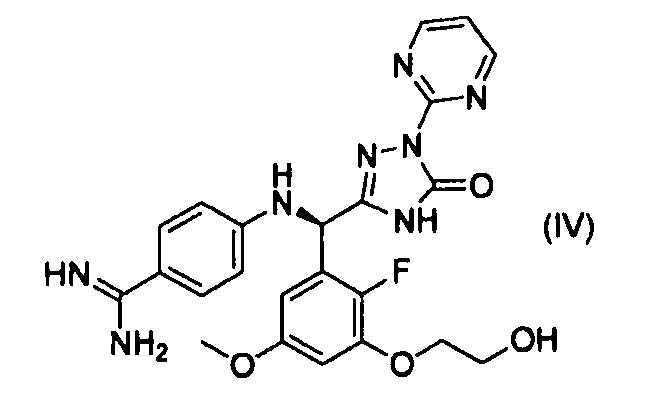
Следовательно, соединение настоящего изобретения применимо в качестве терапевтического и/или профилактического средства от заболеваний, вызванных образованием тромба (таких как тромбоз, тромбоз глубокой вены, легочная эмболия, церебральный инфаркт, инфаркт миокарда, острый коронарный синдром, сосудистый рестеноз и синдром диссеминированной внутрисосудистой коагуляции) (Johannes Ruef & Hugo A Katus, New antithrombotic drugs on the horizon, Expert Opin. Investig. Drugs (2003) 12(5): 781-797).
[0011] Кроме того, сообщалось, что вещества с ингибиторным действием по отношению к фактору коагуляции крови VIIa, являются эффективными для подавления метастазирования и для регрессии злокачественных опухолей. Следовательно, соединение настоящего изобретения с высоким ингибиторным действием по отношению к фактору коагуляции крови VIIa применимо также в качестве терапевтического и/или профилактического средства для злокачественных опухолей и т.п. (Mattias Belting et al., Regulation of angiogenesis by tissue factor cytoplasmic domain signaling, Nature Medicine (2004) 10(5):502-509; X Jiang et al., Formation of tissue factor-factor VIIa-factor Xa complex promotes cellular signaling and migration of human breast cancer cells, J Thromb Haemost, (2004) 2: 93-101; Hembrough TA. Swartz GM. Papathanasiu A. Vlasuk GP. Roote WE. Green SJ. Priblud a VS., Tissue factor/factor VIIa inhibitors block angiogenesis and tumor growth through a nonhemostatic mechanism. Cancer Research. (2003) 63(11):2997-3000).
Эффекты изобретения
[0012] Соединение настоящего изобретения показывает высокую биодоступность при его пероральном введении и обладает высоким действием по подавлению коагуляции крови. Кроме того, оно безопасно и характеризуется приемлемой физико-химической стабильностью, так что соединение настоящего изобретения применимо в качестве фармацевтического, особенно в качестве терапевтического и/или профилактического средства от заболеваний, вызванных образованием тромба.
Краткое описание графических материалов
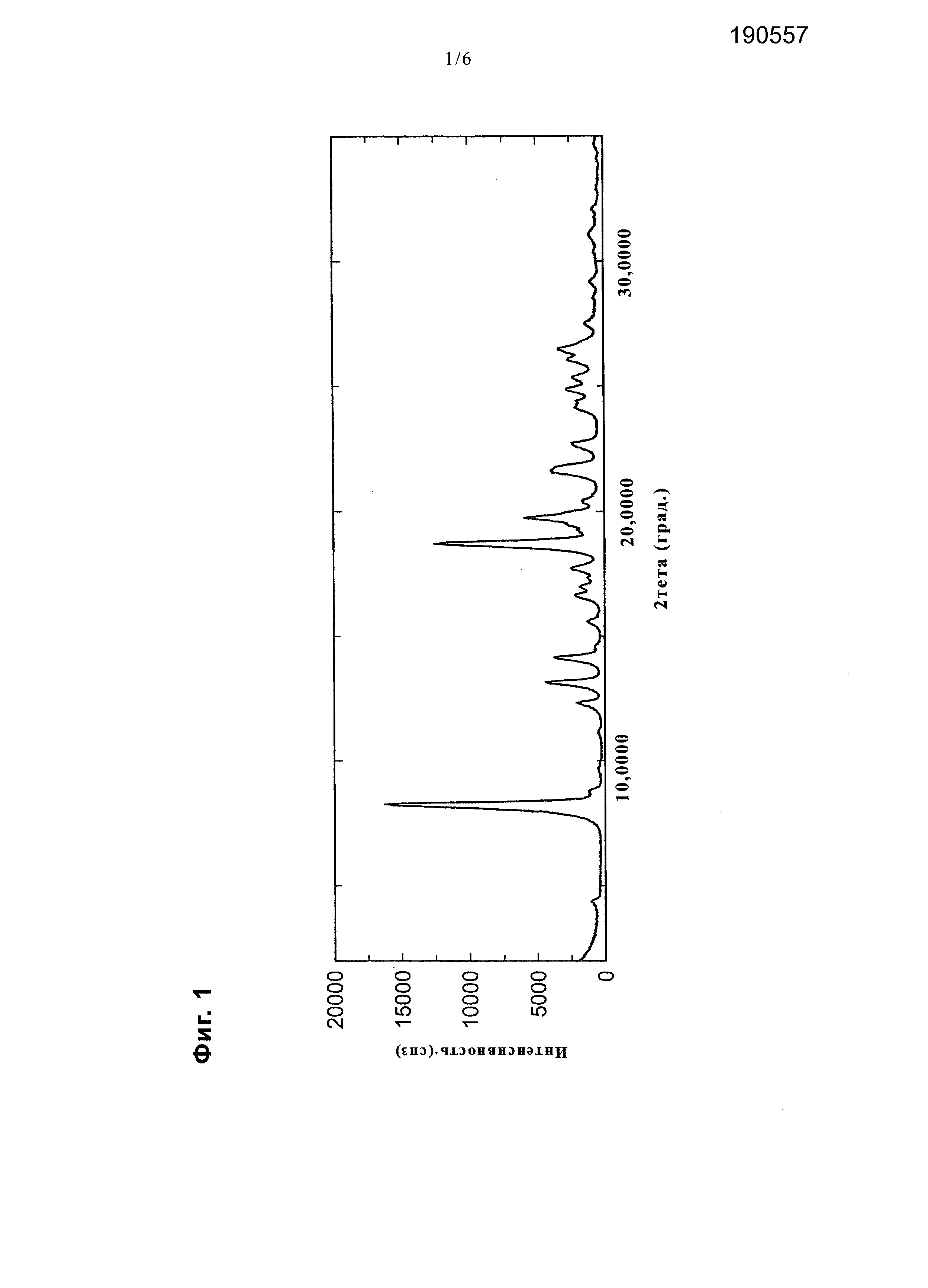
[0013] На фиг. 1 представлена диаграмма, показывающая порошковую дифракционную рентгенограмму соединения примера 20.
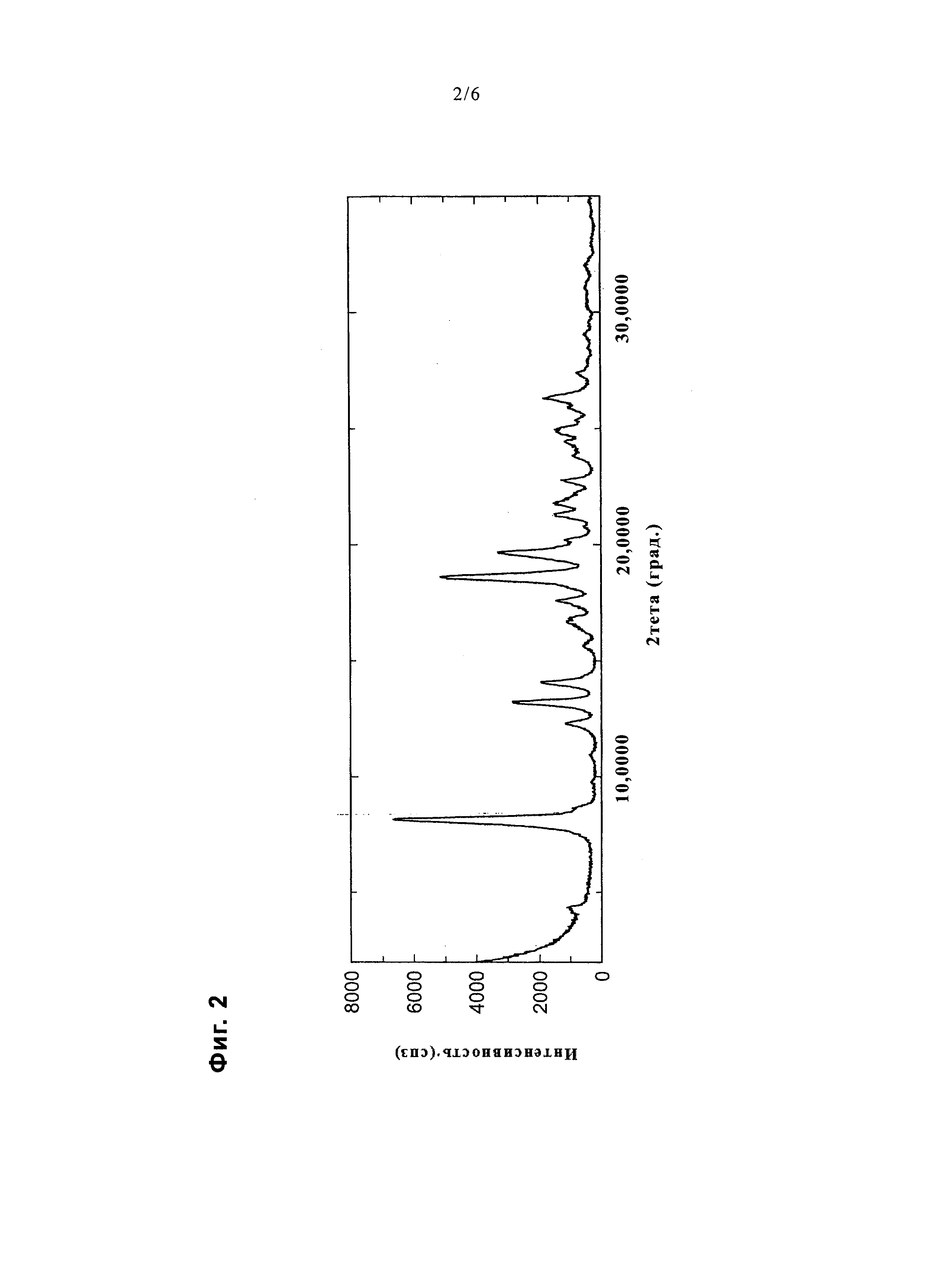
На фиг. 2 представлена диаграмма, показывающая порошковую дифракционную рентгенограмму соединения примера 24.
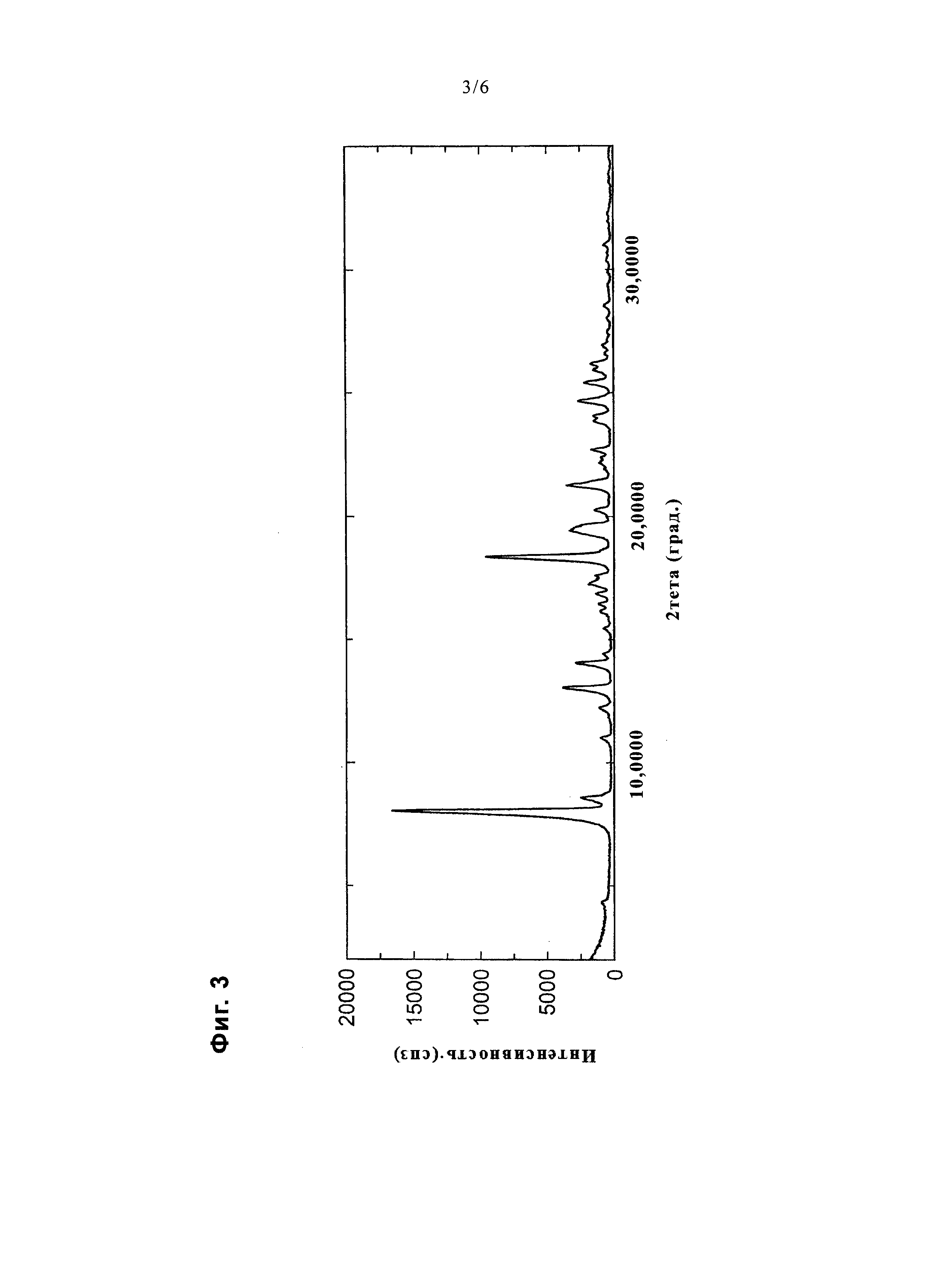
На фиг. 3 представлена диаграмма, показывающая порошковую дифракционную рентгенограмму соединения примера 25.
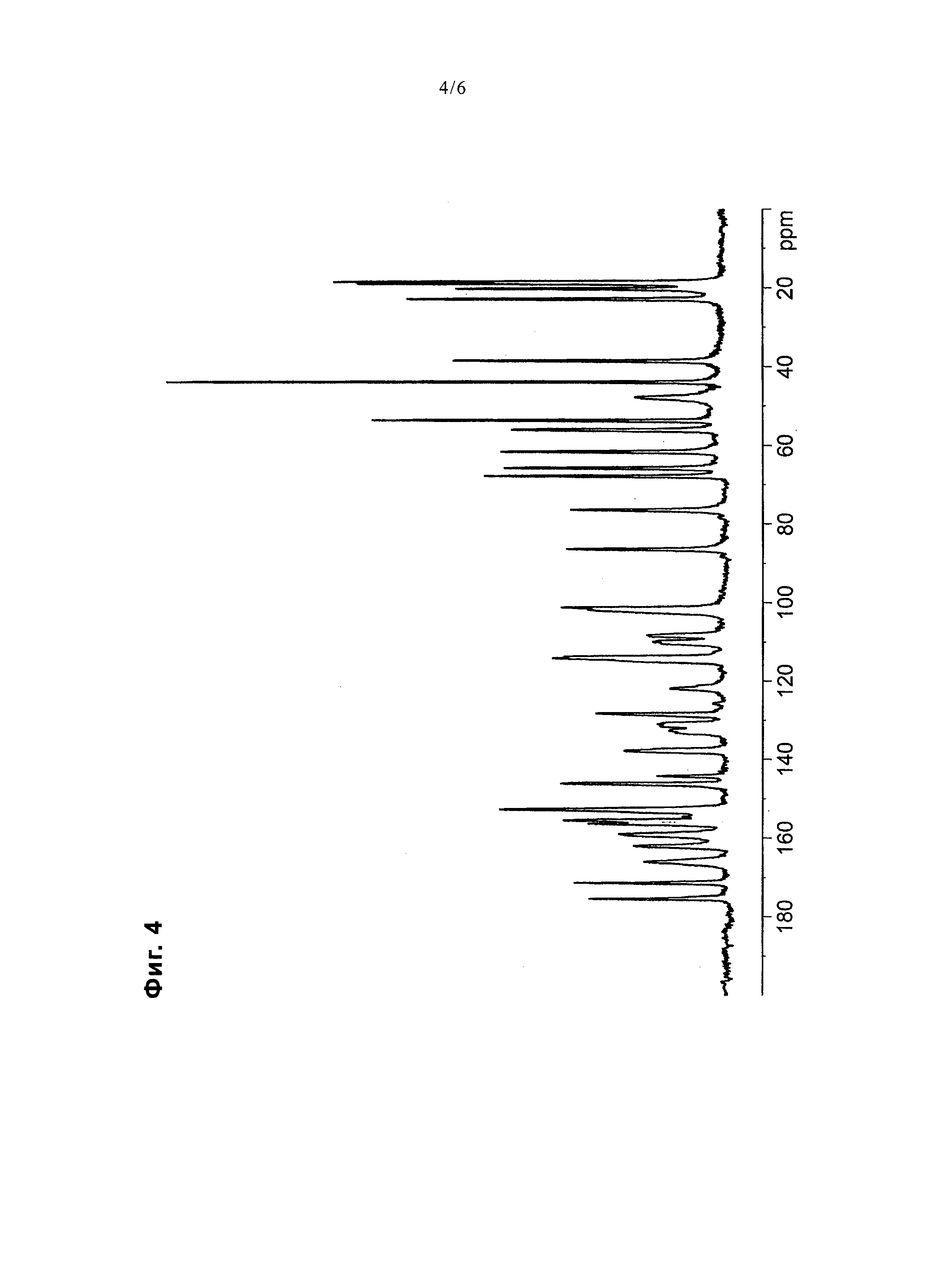
На фиг. 4 представлена диаграмма, показывающая ЯМР спектр 13C в твердом состоянии соединения примера 20.
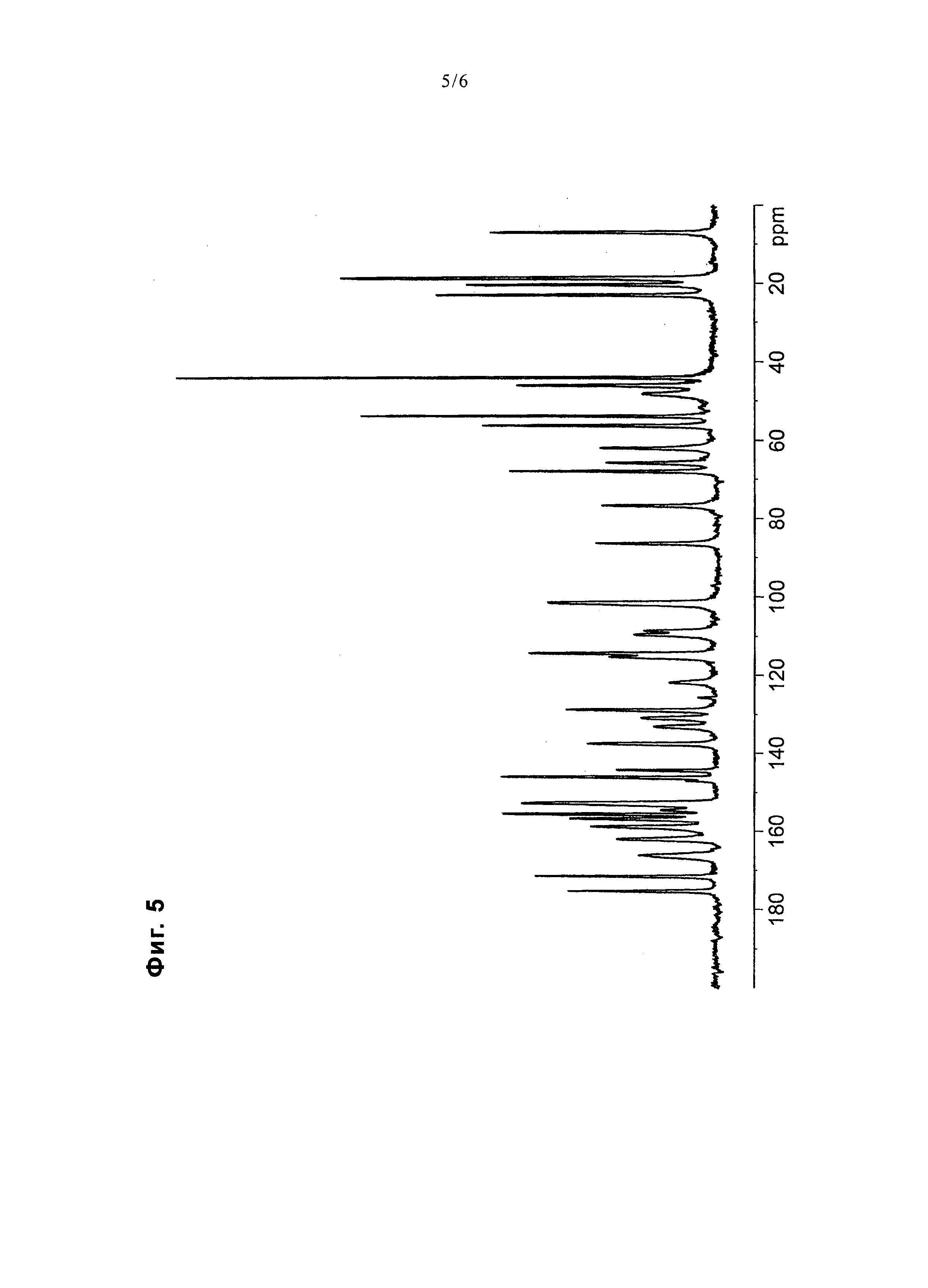
На фиг. 5 представлена диаграмма, показывающая ЯМР спектр 13C в твердом состоянии соединения примера 24.
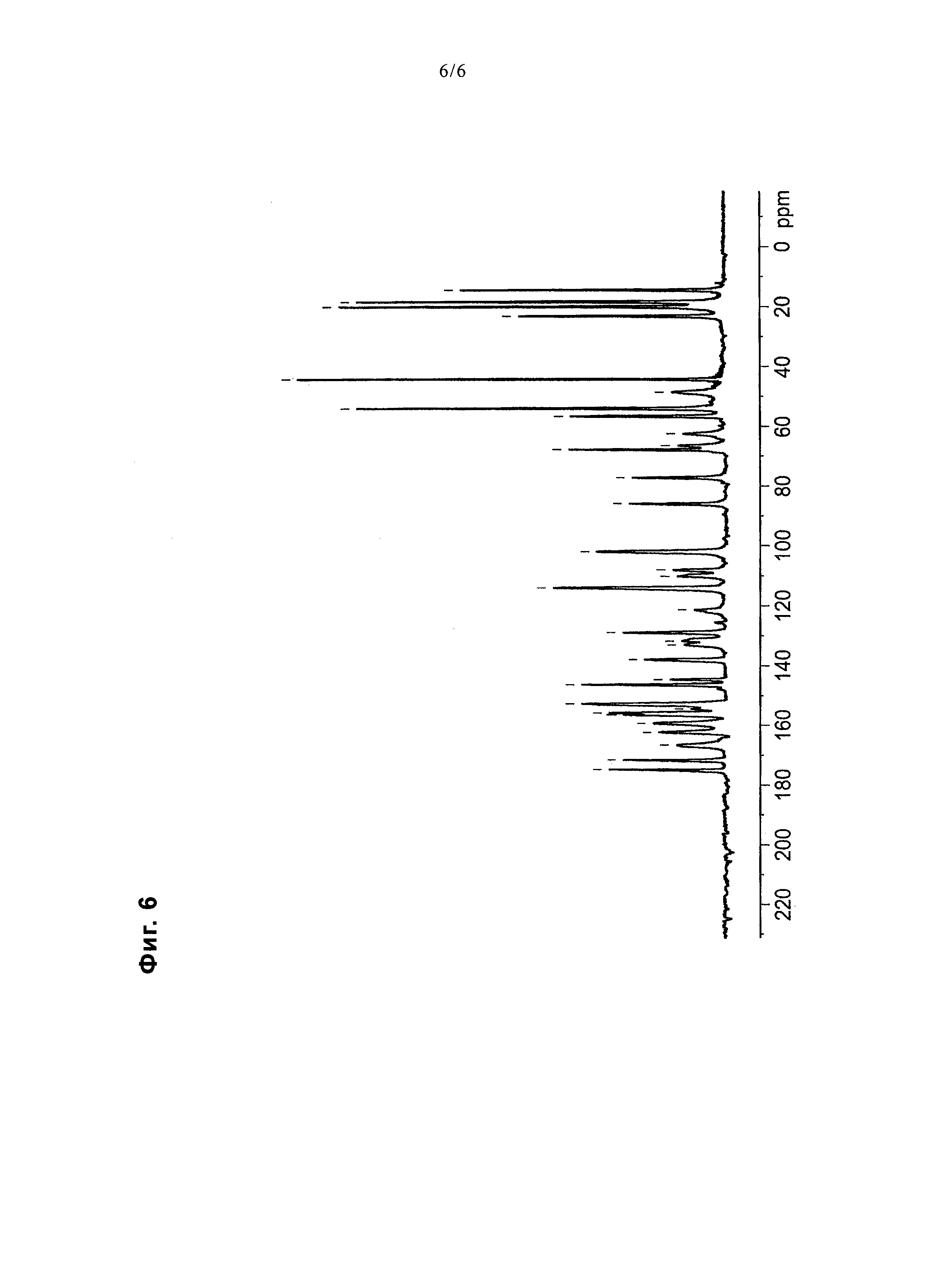
На фиг. 6 представлена диаграмма, показывающая ЯМР спектр 13C в твердом состоянии соединения примера 25.
Описание вариантов осуществления
[0014] Ниже настоящее изобретение описывается подробно.
[0015] В настоящем описании для удобства структурная формула соединения может представлять конкретный изомер. Однако, все изомеры, такие как геометрические изомеры, оптические изомеры, стереоизомеры и таутомеры, которые могут быть получены, исходя из структуры соединения, и смеси изомеров включены в настоящее изобретение. Соединение не ограничивается формулой, описанной для удобства, и может быть либо одним из изомеров, либо смесью изомеров. Следовательно, соединение настоящего изобретения может существовать как смесь оптически активных соединений, рацематов или диастереомеров, но любые из них включены в настоящее изобретение без ограничения. Кроме того, могут существовать кристаллические полиморфы, но, подобным образом, соединение не ограничивается и может проявлять либо одинарную кристаллическую форму, либо смесь различных кристаллических форм. Кроме того, соединение настоящего изобретения включает и ангидрид, и гидрат.
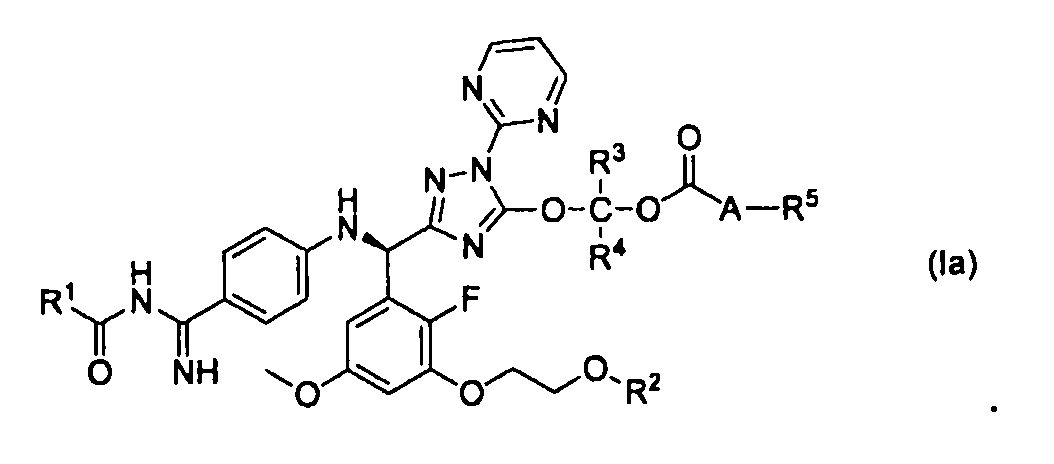
Примеры таутомеров соединения, представленного формулой (I), включают соединение, представленное следующей формулой (Ia):
[0016]
[0017] Ниже приведены значения выражений, символов и т.п., применяемых в настоящем описании, и настоящее изобретение будет описано подробно.
[0018] “Заболевание, вызванное образованием тромба”, не является ограниченным понятием, при условии, что заболевание возникает прямо или косвенно из-за образования тромба, и конкретные примеры заболевания включают тромбоз, тромбоз глубокой вены, легочную эмболию, церебральный инфаркт, инфаркт миокарда, острый коронарный синдром, сосудистый рестеноз, синдром диссеминированной внутрисосудистой коагуляции и злокачественные опухоли. Предпочтительные примеры заболевания включают тромбоз, тромбоз глубокой вены, легочную эмболию, церебральный инфаркт, инфаркт миокарда, острый коронарный синдром, сосудистый рестеноз и синдром диссеминированной внутрисосудистой коагуляции.
[0019] “Атом галогена” означает атом фтора, атом хлора, атом брома или атом йода. Предпочтительные примеры атома галогена включают атом фтора и атом хлора.
[0020] “C1-C6алкил” означает линейную или разветвленную алкильную группу с 1-6 атомами углерода. Их конкретные примеры включают метил, этил, 1-пропил (н-пропил), 2-пропил (изопропил), 2-метил-1-пропил (изобутил), 2-метил-2-пропил (трет-бутил), 1-бутил (н-бутил), 2-бутил (втор-бутил), 1-пентил, 2-пентил, 3-пентил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-2-бутил, 3-метил-2-бутил, 2,2-диметил-1-пропил, 1-гексил, 2-гексил, 3-гексил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2-метил-3-пентил, 3-метил-3-пентил, 2,3-диметил-1-бутил, 3,3-диметил-1-бутил, 2,2-диметил-1-бутил, 2-этил-1-бутил, 3,3-диметил-2-бутил и 2,3-диметил-2-бутил.
[0021] “C2-C6алкенил” означает линейную или разветвленную алкенильную группу с двойной связью, имеющую 2-6 атомов углерода. Их конкретные примеры включают винил (этенил), аллил (2-пропенил), 1-пропенил, изопропенил (1-метилвинил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, пентенил и гексенил.
[0022] “C3-C8циклоалкил” означает моноциклическую насыщенную алифатическую углеводородную группу, имеющую 3-8 атомов углерода. Их конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
[0023] “C1-C6алкокси” означает оксигруппу (атом кислорода), к которой присоединен “C1-C6алкил”, определенный выше, и их конкретные примеры включают метокси, этокси, 1-пропилокси, 2-пропилокси, 2-метил-1-пропилокси, 2-метил-2-пропилокси, 1-бутилокси, 2-бутилокси, 1-пентилокси, 2-пентилокси, 3-пентилокси, 2-метил-1-бутилокси, 3-метил-1-бутилокси, 2-метил-2-бутилокси, 3-метил-2-бутилокси, 2,2-диметил-1-пропилокси, 1-гексилокси, 2-гексилокси, 3-гексилокси, 2-метил-1-пентилокси, 3-метил-1-пентилокси, 4-метил-1-пентилокси, 2-метил-2-пентилокси, 3-метил-2-пентилокси, 4-метил-2-пентилокси, 2-метил-3-пентилокси, 3-метил-3-пентилокси, 2,3-диметил-1-бутилокси, 3,3-диметил-1-бутилокси, 2,2-диметил-1-бутилокси, 2-этил-1-бутилокси, 3,3-диметил-2-бутилокси и 2,3-диметил-2-бутилокси.
[0024] “C2-C6алкенилокси” означает оксигруппу (атом кислорода), к которой присоединен “C2-C6алкенил”, определенный выше, и их конкретные примеры включают винилокси (этенилокси), аллилокси (2-пропенилокси), 1-пропенилокси, изопропенилокси (1-метилвинилокси), 1-бутенилокси, 2-бутенилокси, 3-бутенилокси, 2-метил-2-пропенилокси, пентенилокси и гексенилокси.
[0025] “C1-C6алкилкарбонил” означает карбонильную группу, к которой присоединен “C1-C6алкил”, определенный выше, и их конкретные примеры включают ацетил, пропионил, изопропионил, бутирил, изобутирил, валерил, изовалерил и пивалоил.
[0026] Соль в настоящем описании не является ограниченным понятием, при условии, что она представляет собой соль соединения настоящего изобретения и является фармацевтически приемлемой, и ее примеры включают соли неорганических кислот, соли органических кислот и соли кислых аминокислот.
[0027] Предпочтительные примеры солей неорганических кислот включают соль хлористоводородной кислоты, соль бромистоводородной кислоты, соль серной кислоты, соль азотной кислоты и соль фосфорной кислоты, а предпочтительные примеры солей органических кислот включают соль уксусной кислоты, соль янтарной кислоты, соль фумаровой кислоты, соль малеиновой кислоты, соль винной кислоты, соль лимонной кислоты, соль молочной кислоты, соль стеариновой кислоты, соль бензойной кислоты, соль метансульфоновой кислоты, соль этансульфоновой кислоты, соль пропансульфоновой кислоты, соль циклопропансульфоновой кислоты, соль гидроксиэтансульфоновой кислоты, соль п-толуолсульфоновой кислоты и соль бензолсульфоновой кислоты.
[0028] Предпочтительные примеры солей кислых аминокислот включают соль аспарагиновой кислоты и соль глутаминовой кислоты.
[0029] Ниже описан каждый заместитель в соединениях настоящего изобретения, представленных вышеупомянутыми общими формулами (I), (II) и (III).
[0030] R1 означает фенил, который может быть замещен одной-тремя C1-C6алкильными группами, C1-C6алкокси или C2-C6алкенилокси. Предпочтительные примеры R1 включают фенил, который может быть замещен одной метильной группой или этильной группой, C4-C6алкокси и C4-C6алкенилокси. Предпочтительные примеры R1 включают 4-толил, фенил, 2,2-диметил-1-пропилокси, 2,2-диметил-1-бутилокси и 2-метил-2-пропенилокси.
[0031] R2 означает атом водорода, C1-C6алкилкарбонил или пиридилкарбонил. Предпочтительные примеры R2 включают атом водорода, ацетил и 4-пиридилкарбонил.
[0032] Каждый R3 и R4 независимо означает атом водорода или C1-C6алкил. Предпочтительные примеры каждого из R3 и R4 включают атом водорода, метил и этил, которые выбираются независимо. Наиболее предпочтительные примеры комбинации R3 и R4 включают случай, когда и R3, и R4 представляют атомы водорода, и случаи, когда один из R3 и R4 представляет метил или этил, тогда как другой представляет атом водорода.
[0033] A означает одинарную связь, атом кислорода, группу, представленную формулой (II):
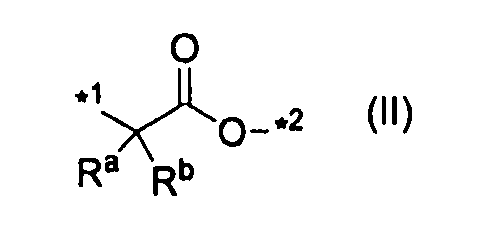 ,
,
где каждый Ra и Rb независимо представляет атом водорода или C1-C6алкил, а *1 и *2 означают связывание с карбонилом и с R5, соответственно, в формуле (I),
или группу, представленную формулой (III):
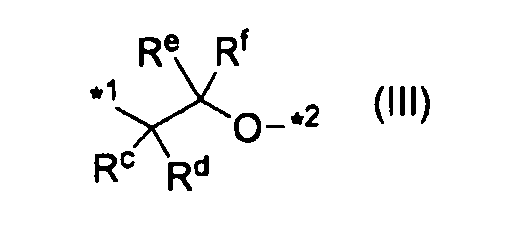 ,
,
где каждый Rc, Rd, Re и Rf независимо представляет атом водорода или C1-C6алкил, а *1 и *2 характеризуются теми же значениями, как описано выше.
[0034] Предпочтительные примеры каждого из Ra и Rb включают атом водорода и метил, которые выбираются независимо. Наиболее предпочтительные примеры комбинации Ra и Rb включают случай, когда оба представляют метил.
[0035] Предпочтительные примеры каждого из Rc, Rd, Re и Rf включают атом водорода и метил, которые выбираются независимо. Наиболее предпочтительные примеры комбинации Rc, Rd, Re и Rf включают случай, когда оба Rc и Rd представляют собой метил, и оба Re и Rf представляют собой атомы водорода.
[0036] R5 означает C1-C6алкил или C3-C8циклоалкил, и C1-C6алкил или C3-C8циклоалкил в R5 могут быть замещены одним-тремя идентичными или различными заместителями, выбранными из группы заместителей, состоящей из атома галогена, C1-C6алкила и C1-C6алкокси. Предпочтительные примеры R5 включают C1-C6алкил, который может быть замещен метокси, и циклогексил, который может быть замещен атомом галогена или метилом.
[0037] Конкретные примеры соединения общей формулы (I) включают соединения, описанные в примерах 1-18 и 51-68, но настоящее изобретение не ограничивается этими соединениями.
[0038] [Общий способ получения соединения настоящего изобретения]
Соединения настоящего изобретения могут быть получены способами, описанными ниже. Однако способ получения настоящего изобретения не ограничивается этим.
Каждый способ описан ниже.
[0039] [Способ получения A]
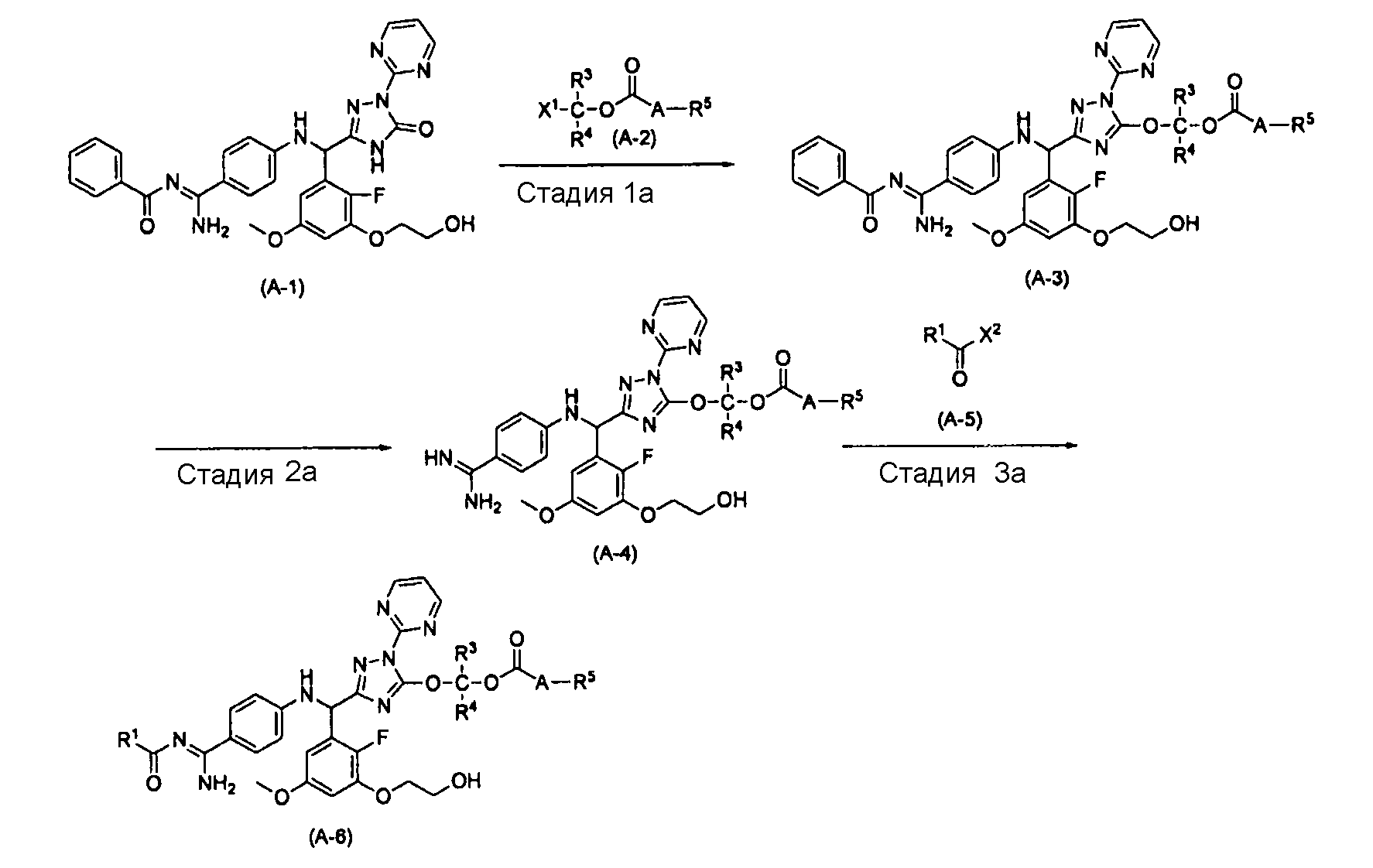
где R1, R3, R4, R5 и A характеризуются теми же значениями, как определено выше. X1 означает уходящую группу, такую как атом хлора, атом брома, атом йода, метансульфонилокси или п-толуолсульфонилокси, а X2 означает уходящую группу, такую как атом хлора, 4-нитрофенокси, 4-бромфенокси или 4-хлорфенокси.
[0040] Стадия 1a
На этой стадии обеспечивается реакция соединения (A-1) с соединением (A-2) в растворителе с получением соединения (A-3). На этой реакционной стадии реакция выполняется в присутствии основания.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0041] В качестве соединения (A-1) могут быть использованы нижеупомянутые соединения (пример 1a, 12b).
[0042] В качестве соединения (A-2) могут быть использованы коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, соединения (G-1, H-3), которые могут быть получены нижеупомянутыми способами получения (способы получения G и H), и т.п. Конкретные примеры соединения (A-2), которое может использоваться, включают триметилуксусной кислоты хлорметиловый сложный эфир [CAS № 18997-19-8], 3-метокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир, 2,2-диметилмалоновой кислоты хлорметилового сложного эфира этиловый сложный эфир, 3-метоксиметокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир, 1-хлорэтилизопропил-карбонат [CAS № 98298-66-9] и 1-хлорэтилциклогексил-карбонат [CAS № 99464-83-2].
[0043] Растворитель, применяемый в этой реакции, не является ограниченным понятием при условии, что исходный материал может быть растворен в нем до определенной степени, и реакция им не ингибируется, и примеры растворителя включают амидные растворители, такие как N,N-диметилформамид и N,N-диметилацетамид; эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, диэтиловый эфир, диизопропиловый эфир и 1,4-диоксан; и смешанные растворители из них. Растворителем предпочтительно является N,N-диметилформамид или N,N-диметилацетамид.
[0044] Вышеописанное основание означает карбонат калия, гидрокарбонат калия, карбонат натрия, гидрокарбонат натрия, карбонат цезия, гидрокарбонат цезия, карбонат рубидия или подобное. Основанием предпочтительно является карбонат калия, гидрокарбонат калия или карбонат рубидия.
[0045] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 20°C до 120°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно от приблизительно 40°C до 90°C (с точки зрения внутренней температуры в реакционном сосуде).
[0046] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя, других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-72 часов, более предпочтительно перемешивается в течение 12-36 часов при вышеописанной температуре реакции.
[0047] Соединение (A-2) может использоваться в 1-5-кратном молярном количестве, предпочтительно 1,05-3-кратном молярном количестве по отношению к соединению (A-1).
[0048] Вышеописанное основание может использоваться в 0,5-10-кратном молярном количестве, предпочтительно 0,5-3-кратном молярном количестве, более предпочтительно 0,6-2-кратном молярном количестве по отношению к соединению (A-1).
[0049] Стадия 2a
На этой стадии соединение (A-4) получается из соединения (A-3) в растворителе. На этой реакционной стадии реакция выполняется в спиртовом растворителе в присутствии кислоты.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0050] Растворитель, который будет применяться в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, а примеры растворителя включают спиртовые растворители, такие как метанол, этанол и 2-пропанол, среди которых предпочтительным является метанол.
[0051] Вышеописанная кислота означает муравьиную кислоту, уксусную кислоту, хлористоводородную кислоту или подобное, и предпочтительной является уксусная кислота.
[0052] Температура реакции, как правило, варьирует в зависимости от исходного материал, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 20°C до 60°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно от приблизительно 30°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде).
[0053] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя, других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 8-24 часов, более предпочтительно перемешивается в течение приблизительно 12 часов при вышеописанной температуре реакции.
[0054] Вышеописанная кислота может использоваться в количестве 1-100 об.%, предпочтительно в количестве 10-50 об.% по отношению к растворителю (метанолу).
[0055] Стадия 3a
На этой стадии обеспечивается реакция соединения (A-4) с соединением (A-5) в растворителе с образованием соединения (A-6). На этой стадии реакция выполняется в присутствии основания.
Эта реакция может быть выполнена обычно применяемым способом, таким как описанный в TETRAHEDRON LETTERS, 1999, 40, 4847.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0056] В качестве соединения (A-5) могут использоваться известные соединения, коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, как правило, выполняемыми специалистами данной области, соединения (I-3, J-3), которые могут быть получены нижеупомянутыми способами получения (способы получения I и J), и т.п. Конкретные примеры соединения (A-5), которое может использоваться, включают бензойной кислоты 4-нитрофениловый сложный эфир [CAS № 959-22-8], 4-метилбензойной кислоты 4-нитрофениловый сложный эфир [CAS № 15023-67-3], угольной кислоты 2-метил-2-пропенилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 218598-29-9], угольной кислоты 2-метил-2-пропенилового сложного эфира фениловый сложный эфир [CAS № 138621-73-5], угольной кислоты 2,2-диметилпропилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 158810-98-1], угольной кислоты 2,2-диметилбутилового сложного эфира 4-нитрофениловый сложный эфир и бензоилхлорид.
[0057] Растворитель, который будут применять в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают амидные растворители, такие как N,N-диметилформамид и N,N-диметилацетамид; эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, диэтиловый эфир, диизопропиловый эфир и 1,4-диоксан; диметилсульфоксид; и смешанные растворители из них. Растворителем предпочтительно является N,N-диметилформамид или диметилсульфоксид.
[0058] Вышеописанное основание означает триэтиламин, диизопропилэтиламин, пиридин, карбонат калия, гидрокарбонат калия, гидрокарбонат натрия или подобное. Основанием предпочтительно является триэтиламин или карбонат калия.
[0059] Температура реакции, как правило, варьирует в зависимости от исходного материал, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 0°C до 70°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно от 20°C до 60°C (с точки зрения внутренней температуры в реакционном сосуде).
[0060] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя, других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 0,5-24 часов, более предпочтительно перемешивается в течение приблизительно 4-14 часов при вышеописанной температуре реакции.
[0061] Соединение (A-5) может использоваться в 1-3-кратном молярном количестве, предпочтительно в 1-1,5-кратном молярном количестве, более предпочтительно в 1-1,2-кратном молярном количестве по отношению к соединению (A-4).
[0062] Вышеописанное основание может использоваться в 1-10-кратном молярном количестве, предпочтительно в 1-3-кратном молярном количестве, более предпочтительно в 2-кратном молярном количестве по отношению к соединению (A-4).
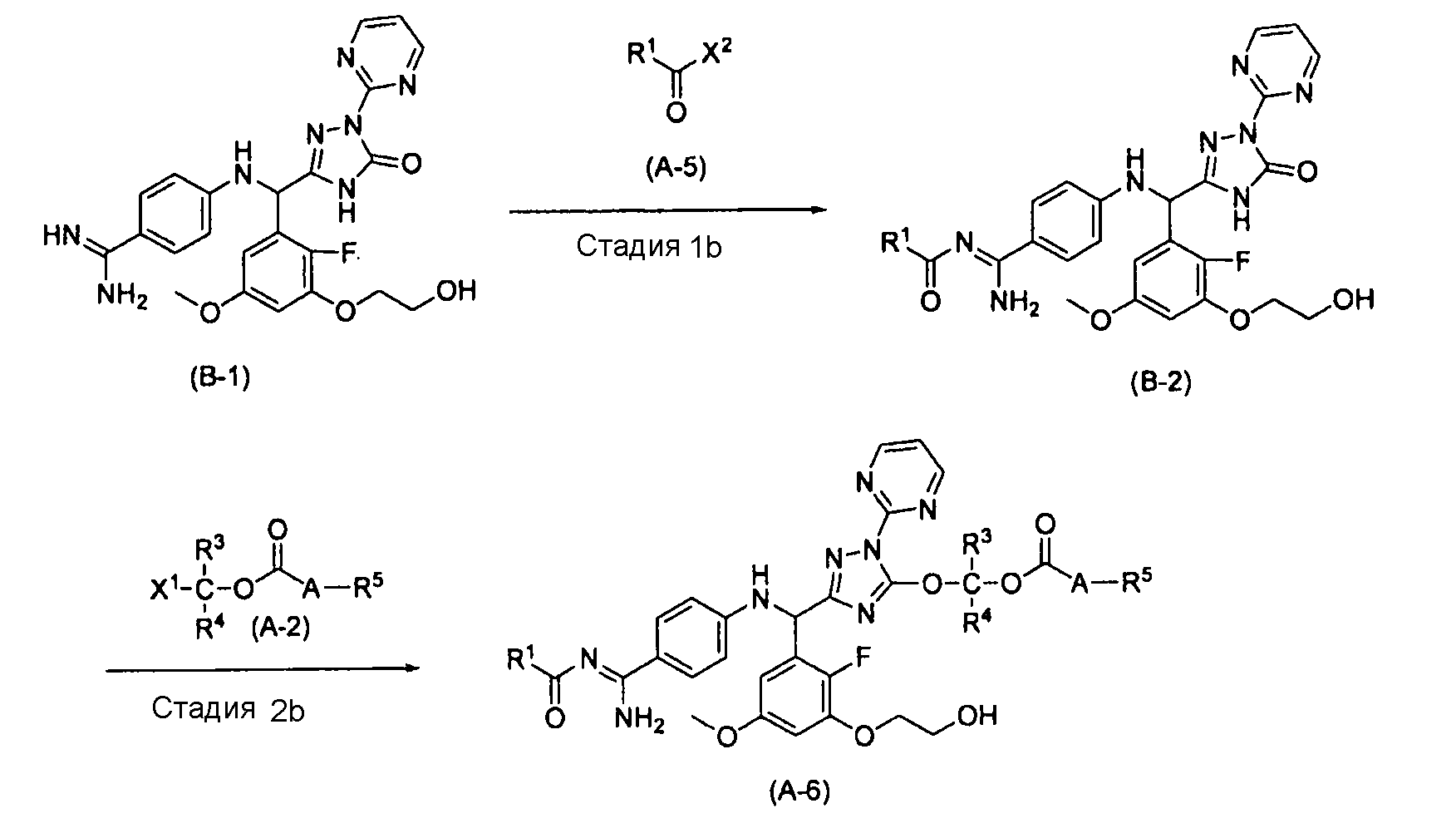
[0063] Способ получения B
 ,
,
где R1, R3, R4, R5, A, X1 и X2 характеризуются теми же значениями, как определено выше.
[0064] Стадия 1b
На этой стадии обеспечивается реакция соединения (B-1) с соединением (A-5) в растворителе для получения соединения (B-2). На этой стадии реакция выполняется в присутствии основания.
[0065] Примеры соединения (B-1), которое может быть использовано, включают 4-({[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил}амино)бензамидина ацетат [CAS № 951803-95-5] и 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}бензамидина ацетат [CAS № 951803-91-1].
В качестве реакционных условий для этой стадии могут быть применены условия и способы обработки, которые являются такими же, как и для стадии 3a в вышеупомянутом способе получения A.
[0066] Стадия 2b
На этой стадии обеспечивается реакция соединения (B-2) с соединением (A-2) в растворителе для получения соединения (A-6). На этой стадии реакция выполняется в присутствии основания.
В качестве реакционных условий для этой стадии могут быть применены условия и способы обработки, которые являются такими же, как и для стадии 1a в вышеупомянутом способе получения A.
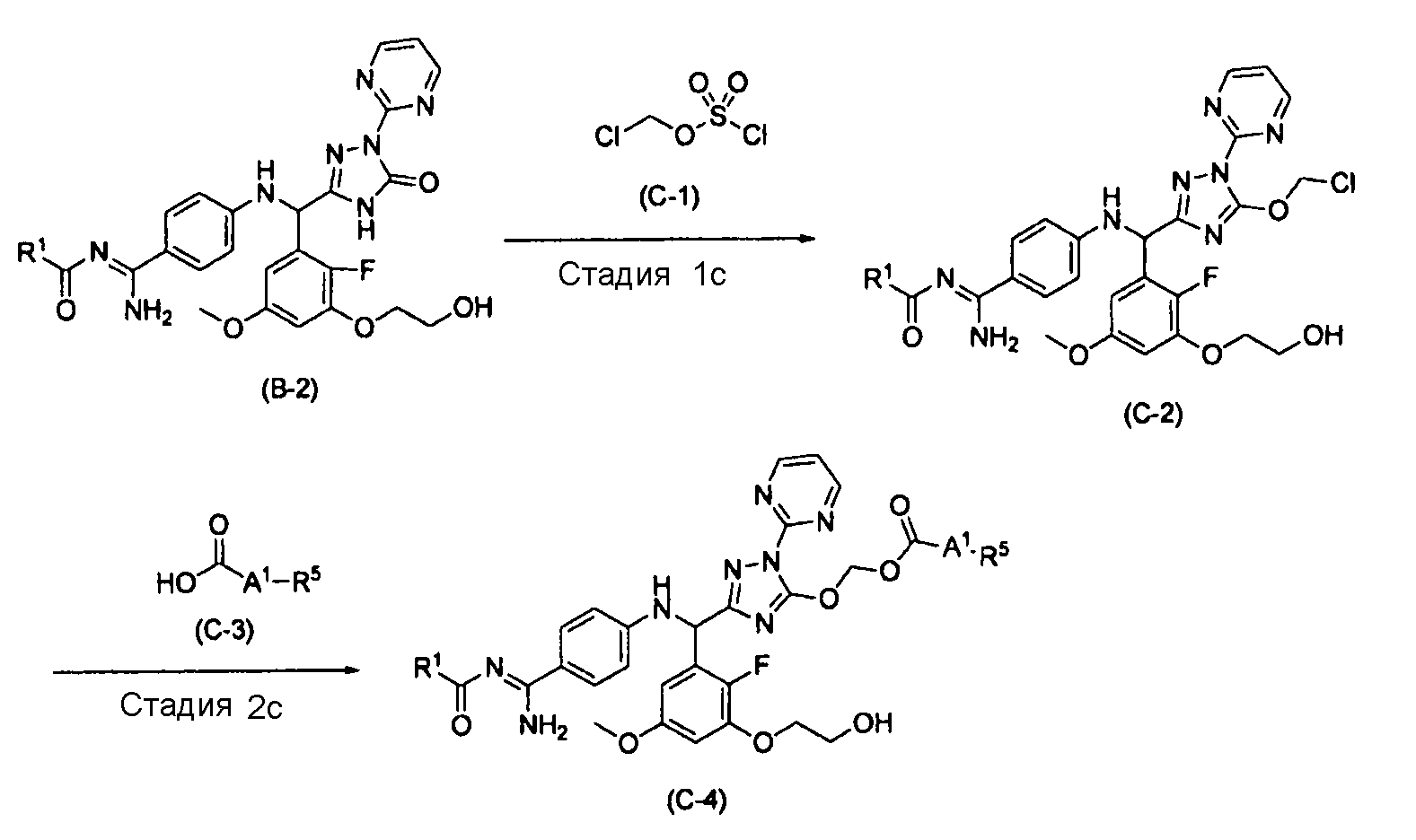
[0067] Способ получения C
 ,
,
где R1 и R5 характеризуются теми же значениями, как определено выше; и
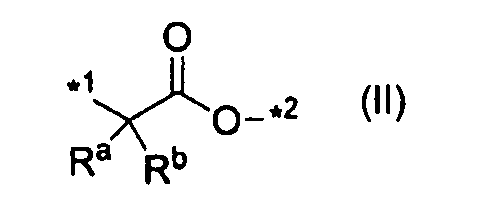
A1 означает одинарную связь, группу, представленную формулой (II):
 ,
,
где каждый Ra и Rb независимо представляет атом водорода или C1-C6алкил, а *1 и *2 означают связывание с карбонилом и с R5, соответственно,
или группу, представленную формулой (III):
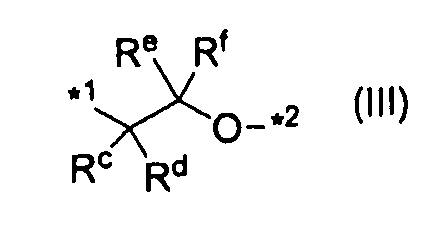 ,
,
где каждый Rc, Rd, Re и Rf независимо представляет атом водорода или C1-C6алкил, а *1 и *2 характеризуются теми же значениями, как описано выше.
[0068] Стадия 1c
На этой стадии обеспечивается реакция соединения (B-2) с соединением (C-1) в растворителе для получения соединения (C-2). На этой стадии реакция выполняется в присутствии основания, в присутствии или отсутствии катализатора фазового переноса.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0069] В качестве соединения (C-1) может быть применен хлорметилхлорсульфат [CAS № 49715-04-0].
[0070] Растворитель, который будет применяться в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; галогенированные углеводородные растворители, такие как дихлорметан и хлороформ; и смешанные растворители таких; а также воду. Растворителем предпочтительно является бислойная система растворителя из смешанных дихлорметана и тетрагидрофурана и воды, или бислойная система трет-бутилметилового эфира и воды.
[0071] Вышеописанное основание означает карбонат калия, гидрокарбонат калия, карбонат натрия, гидрокарбонат натрия, карбонат цезия, фосфат дикалия или подобное. Основанием предпочтительно является гидрокарбонат натрия или дикалия фосфат.
[0072] Вышеописанный катализатор фазового переноса означает гидросульфат тетрабутиламмония, галогенированный тетрабутиламмоний или подобное. Катализатором фазового переноса предпочтительно является гидросульфат тетрабутиламмония.
[0073] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 0°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от 10°C до 30°C (с точки зрения внутренней температуры в реакционном сосуде).
[0074] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя, других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-50 часов, более предпочтительно перемешивается в течение приблизительно 20 часов при вышеописанной температуре реакции.
[0075] Соединение (C-1) может использоваться в 1-5-кратном молярном количестве, предпочтительно в 2-4-кратном молярном количестве, более предпочтительно в 3-кратном молярном количестве по отношению к соединению (B-2).
[0076] Вышеописанное основание может использоваться в 1-50-кратном молярном количестве, предпочтительно в 5-20-кратном молярном количестве, более предпочтительно в 5-15-кратном молярном количестве по отношению к соединению (B-2).
[0077] Вышеописанный катализатор фазового переноса может использоваться в 0,01-1-кратном молярном количестве, предпочтительно в 0,05-0,5-кратном молярном количестве, более предпочтительно в 0,1-0,3-кратном молярном количестве по отношению к соединению (B-2).
[0078] Стадия 2c
На этой стадии обеспечивается реакция соединения (C-2) с карбоновой кислотой (C-3) в растворителе с получением соединения (C-4). На этой стадии реакция выполняется в присутствии основания, в присутствии или в отсутствие йодида.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0079] В качестве карбоновой кислоты (C-3) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры карбоновой кислоты (C-3), которая может использоваться, включают 2,2-диметилпропионовую кислоту, 3-метокси-2,2-диметилпропионовую кислоту [CAS № 64241-78-7], 3-метоксиметокси-2,2-диметилпропионовую кислоту, 2-этилбутановую кислоту [CAS № 118315-05-2], циклогексанкарбоновую кислоту, 2,2-диметилмалоновой кислоты моно-трет-бутиловый сложный эфир [CAS № 143688-40-8], 2,2-диметилмалоновой кислоты моноэтиловый сложный эфир [CAS № 5471-77-2], 2,2-диметилмалоновой кислоты моноизопропиловый сложный эфир [CAS № 7695-26-3] и 2,2-диметилмалоновой кислоты моноциклогексиловый сложный эфир.
[0080] Растворитель, который будет применяться в этой реакции, не является ограниченным при условии, что соединение (C-2) и карбоновая кислота (C-3) могут быть растворены в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают амидные растворители, такие как N,N-диметилформамид и N,N-диметилацетамид; эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; и смешанные растворители из них. Растворителем предпочтительно является N,N-диметилформамид.
[0081] Вышеописанное основание означает карбонат калия, гидрокарбонат калия, карбонат натрия, гидрокарбонат натрия, карбонат цезия или подобное. Основанием предпочтительно является гидрокарбонат калия.
[0082] Вышеописанный йодид означает йодид натрия, йодид калия, йодид тетрабутиламмония или подобное. Йодидом предпочтительно является йодид натрия.
[0083] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 0°C до 80°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от 20°C до 60°C (с точки зрения внутренней температуры в реакционном сосуде).
[0084] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-100 часов, более предпочтительно перемешивается в течение приблизительно 3-64 часов при вышеописанной температуре реакции.
[0085] Карбоновая кислота (C-3) может использоваться в 1-5-кратном молярном количестве, предпочтительно в 2-4-кратном молярном количестве, более предпочтительно в 3-кратном молярном количестве по отношению к соединению (C-2).
[0086] Вышеописанное описание может использоваться в 1-50-кратном молярном количестве, предпочтительно в 5-20-кратном молярном количестве по отношению к соединению (C-2).
[0087] Вышеописанный йодид может использоваться в 0,1-20-кратном молярном количестве, предпочтительно в 2-10-кратном молярном количестве по отношению к соединению (C-2).
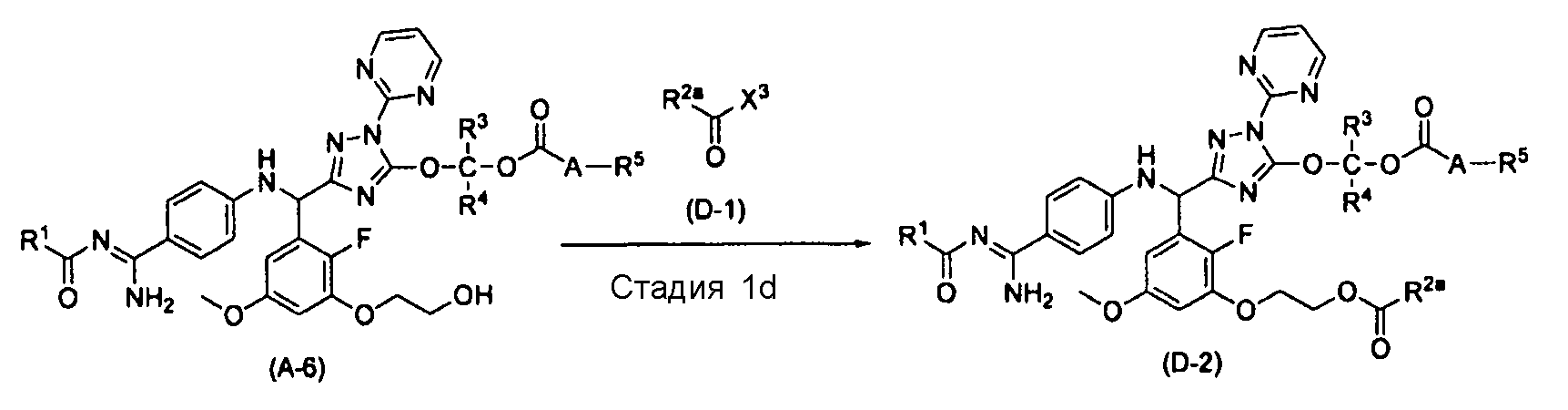
[0088] Способ получения D
 ,
,
где R1, R3, R4, R5 и A характеризуются теми же значениями, как определено выше. R2a означает C1-C6алкил или пиридил. X3 означает уходящую группу, такую как атом хлора, атом фтора, или группу, представленную формулой:
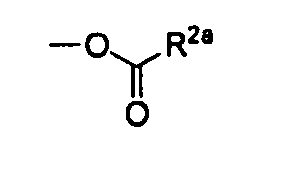 ,
,
где R2a имеет то же значение, как определено выше.
[0089] Стадия 1d
На этой стадии обеспечивается реакция соединения (A-6) с соединением (D-1) в растворителе с получением соединения (D-2). На этой стадии реакция выполняется в присутствии основания, в присутствии или в отсутствие катализатора этерификации.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0090] В качестве соединения (D-1) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (D-1), которое может использоваться, включают ацетилфторид, который может быть получен добавлением триэтиламина в смесь уксусной кислоты, TFFH (фтор-N,N,N',N'-тетраметилформамидиния гексафторфосфата) и дихлорметана; изоникотинилфторид, который может быть получен добавлением триэтиламина в смесь изоникотиновой кислоты, TFFH и дихлорметана; ацетилхлорид; изоникотинилхлорид и уксусный ангидрид.
[0091] Растворитель, который будут применять в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя, который может использоваться, включают эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; галогенированные углеводородные растворители, такие как дихлорметан и хлороформ; амидные растворители, такие как N,N-диметилформамид и N,N-диметилацетамид; сульфоксидные растворители, такие как диметилсульфоксид; и смешанные растворители из них. Растворителем предпочтительно является смешанный растворитель дихлорметан-N,N-диметилформамида.
[0092] Вышеописанное основание означает триэтиламин, N,N-диизопропилэтиламин или подобное. Основанием предпочтительно является триэтиламин.
[0093] Вышеописанный катализатор этерификации означает 4-диметиламинопиридин или подобное.
[0094] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от 0°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от 10°C до 30°C (с точки зрения внутренней температуры в реакционном сосуде).
[0095] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-12 часов, более предпочтительно перемешивается в течение приблизительно 2-4 часов при вышеописанной температуре реакции.
[0096] Соединение (D-1) может использоваться в 1,0-5-кратном молярном количестве, предпочтительно в 1,5-3-кратном молярном количестве, более предпочтительно в 2-кратном молярном количестве по отношению к соединению (A-6).
[0097] Вышеописанное основание может использоваться в 1-10-кратном молярном количестве, предпочтительно в 3-8-кратном молярном количестве по отношению к соединению (A-6).
[0098] Вышеописанный катализатор этерификации может использоваться в 0,01-1-кратном молярном количестве, предпочтительно в 0,05-0,2-кратном молярном количестве по отношению к соединению (A-6).
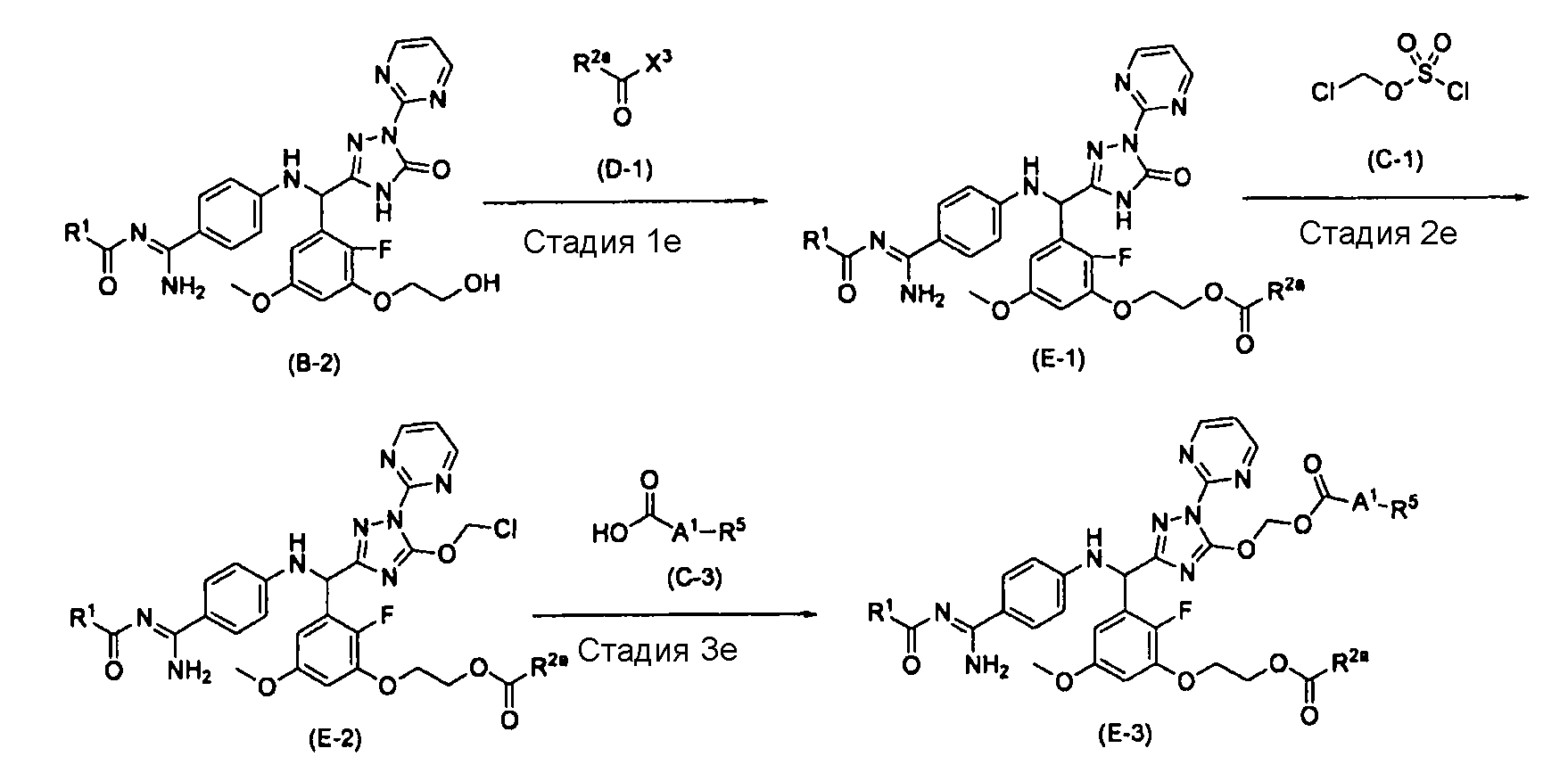
[0099] Способ получения E
 ,
,
где R1, R2a, R5, A1 и X3 характеризуются теми же значениями, как определено выше.
[0100] Стадия 1e
На этой стадии обеспечивается реакция соединения (B-2) с соединением (D-1) в растворителе с получением соединения (E-1). В качестве реакционных условий для этой стадии могут применяться условия и способы обработки, которые являются такими же, как на стадии 1d вышеупомянутого способа получения D.
[0101] Стадия 2e
На этой стадии обеспечивается реакция соединения (E-1) с соединением (C-1) в растворителе с получением соединения (E-2). В качестве реакционных условий для этой стадии могут применяться условия и способы обработки, которые являются такими же, как на стадии 1c вышеупомянутого способа получения C.
[0102] Стадия 3e
На этой стадии обеспечивается реакция соединения (E-2) с карбоновой кислотой (C-3) в растворителе с получением соединения (E-3). В качестве реакционных условий для этой стадии могут применяться условия и способы обработки, которые являются такими же, как на стадии 2c вышеупомянутого способа получения C.
[0103] Способ получения F
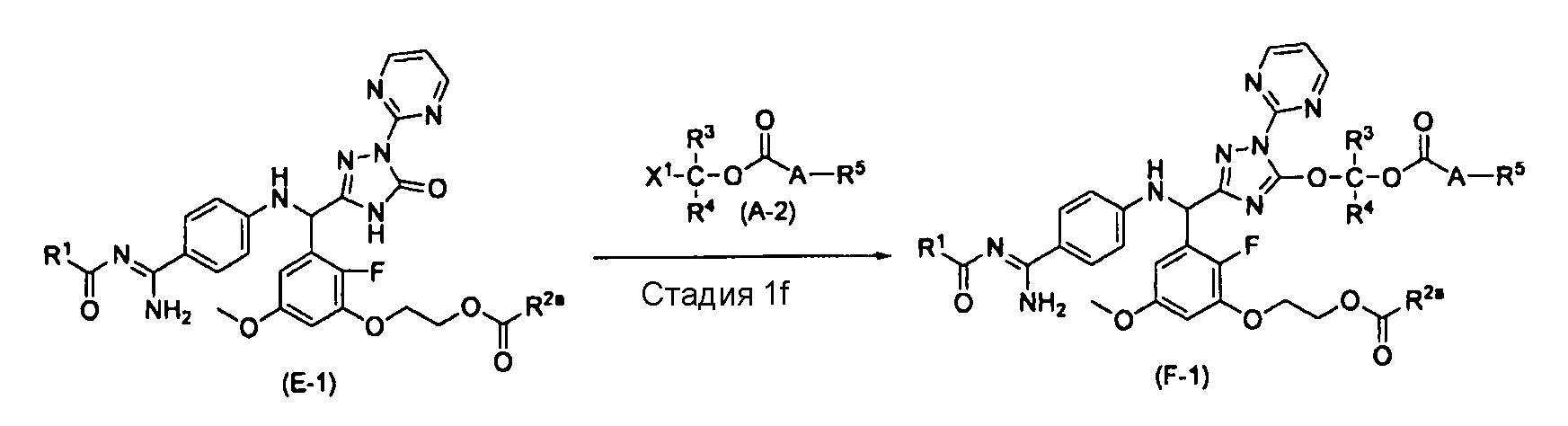 ,
,
где R1, R2a, R3, R4, R5, A и X1 характеризуются теми же значениями, как определено выше.
[0104] Стадия 1f
На этой стадии обеспечивается реакция соединения (E-1) с соединением (A-2) в растворителе с получением соединения (F-1). Этот реакционный стадия выполняется в присутствии основания.
В качестве реакционных условий для этой стадии могут применяться условия и способы обработки, которые являются такими же, как на стадии 1a вышеупомянутого способа получения A.
[0105] Способ получения G
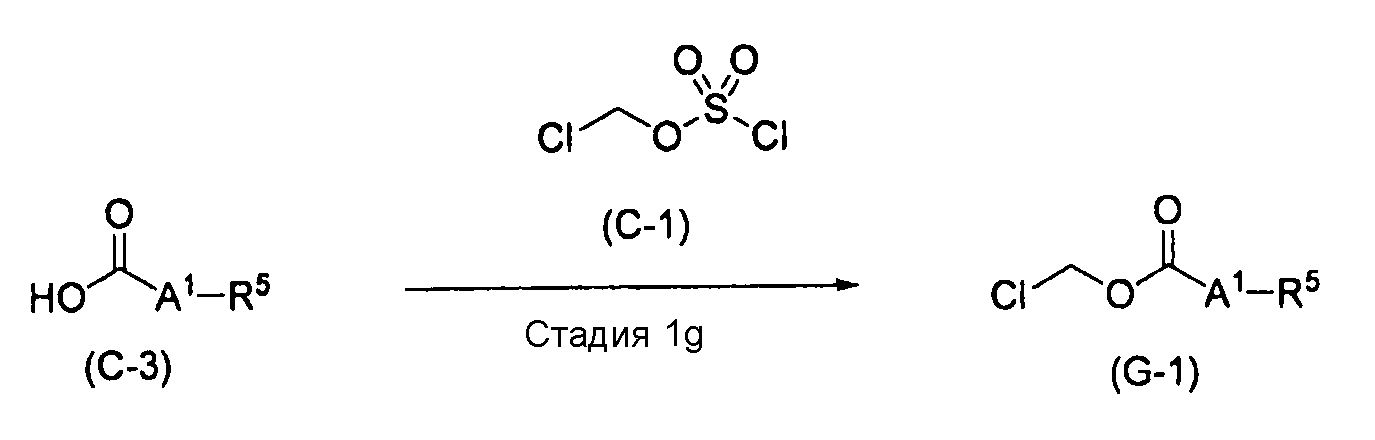 ,
,
где A1 и R5 характеризуются теми же значениями, как определено выше.
[0106] Стадия 1g
На этой стадии обеспечивается реакция карбоновой кислоты (C-3) с соединением (C-1) в растворителе с получением соединения (G-1). На этой стадии реакция выполняется в присутствии основания.
[0107] В качестве реакционных условий для этой стадии могут применяться условия и способы обработки, которые являются такими же, как на стадии 1c вышеупомянутого способа получения C.
[0108] Способ получения H
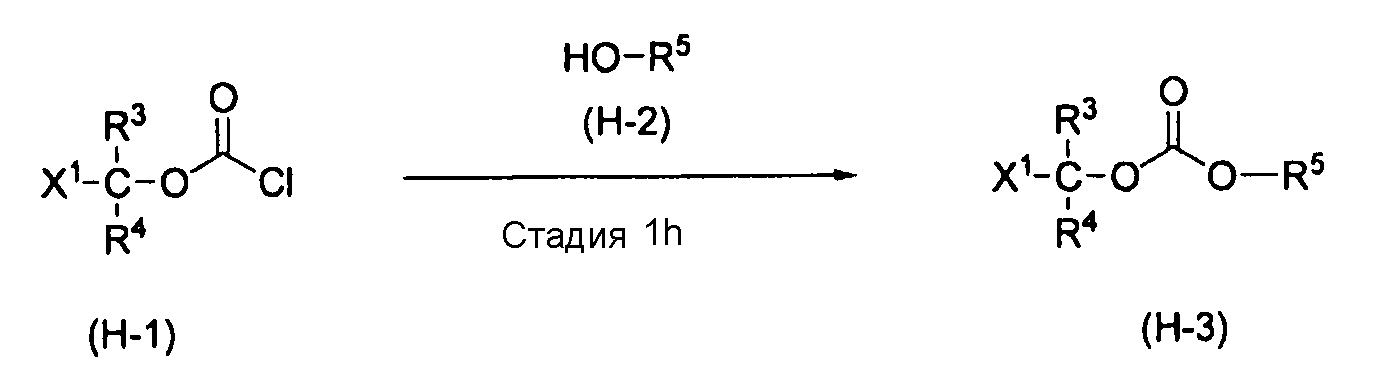 ,
,
где R3, R4, R5 и X1 характеризуются теми же значениями, как определено выше.
[0109] Стадия 1h
На этой стадии обеспечивается реакция соединения (H-1) с соединением (H-2) в растворителе с получением соединения (H-3). Эта реакционная стадия выполняется в присутствии основания.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0110] В качестве соединения (H-1) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (H-1), которое может использоваться, включают хлорметилхлорформиат [CAS № 22128-62-7], 1-хлорэтилхлорформиат [CAS № 50893-53-3] и 1-хлорпропилхлорформиат [CAS № 92600-20-9].
[0111] В качестве соединения (H-2) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (H-2), которое может использоваться, включают этанол, 2-пропанол, трет-бутанол, циклогексанол, 2-пентанол, транс-2-фторциклогексанол [CAS № 14365-32-3], (1S,2S)-2-фторциклогексанол [CAS № 292150-03-9] и (1R,2R)-2-метилциклогексанол [CAS № 19043-03-9].
[0112] Растворитель, который будут применять в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; галогенированные углеводородные растворители, такие как дихлорметан и хлороформ; сложноэфирные растворители, такие как этилацетат и изопропилацетат; и смешанные растворители из них. Растворителем предпочтительно является тетрагидрофуран, этилацетат или дихлорметан.
[0113] Вышеописанное основание означает пиридин, коллидин, триэтиламин или подобное. Основанием предпочтительно является пиридин.
[0114] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от -78°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от -78°C до 30°C (с точки зрения внутренней температуры в реакционном сосуде).
[0115] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-24 часов, более предпочтительно перемешивается в течение приблизительно 2-12 часов при вышеописанной температуре реакции.
[0116] Соединение (H-2) может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1,1-2-кратном молярном количестве по отношению к соединению (H-1).
Вышеописанное основание может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1-3-кратном молярном количестве, более предпочтительно в 2-кратном молярном количестве по отношению к соединению (H-1).
[0117] Способ получения I
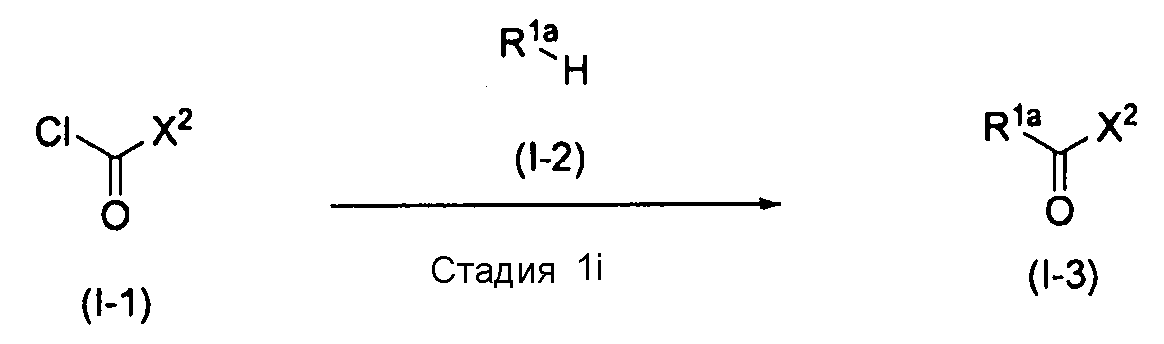 ,
,
где X2 имеет то же значение, как определено выше. R1a означает C1-C6алкокси или C2-C6алкенилокси.
[0118] Стадия 1i
На этой стадии обеспечивается реакция соединения (I-1) с соединением (I-2) в растворителе с получением соединения (I-3). На этой стадии реакция выполняется в присутствии основания.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0119] В качестве соединения (I-1) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (I-1), которое может использоваться, включают 4-нитрофенилхлорформиат.
[0120] В качестве соединения (I-2) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (I-2), которые могут использоваться, включают этанол, пропанол, 2,2-диметил-1-пропанол, 2,2-диметил-1-бутанол и β-металлиловый спирт.
[0121] Растворитель, который будут применять в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; галогенированные углеводородные растворители, такие как дихлорметан и хлороформ; сложноэфирные растворители, такие как этилацетат и изопропилацетат; и смешанные растворители из них. Растворителем предпочтительно является тетрагидрофуран, этилацетат или дихлорметан.
[0122] Вышеописанное основание означает пиридин, коллидин, триэтиламин или подобное. Основанием предпочтительно является пиридин.
[0123] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от -20°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от 0°C до 20°C (с точки зрения внутренней температуры в реакционном сосуде).
[0124] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-24 часов, более предпочтительно перемешивается в течение приблизительно 2-12 часов при вышеописанной температуре реакции.
[0125] Соединение (I-2) может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1-2-кратном молярном количестве по отношению к соединению (I-1).
[0126] Вышеописанное основание может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1-3-кратном молярном количестве, более предпочтительно в 2-кратном молярном количестве по отношению к соединению (I-1).
[0127] Способ получения J
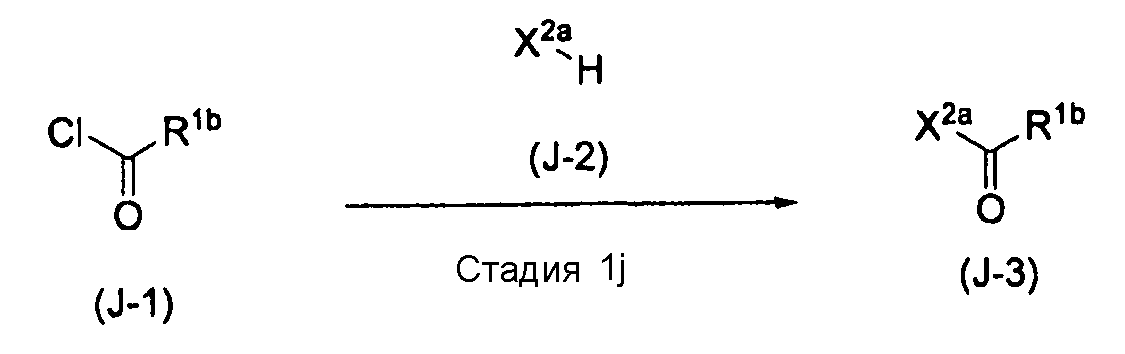 ,
,
где X2a означает уходящую группу, такую как 4-нитрофенокси. R1b означает фенил, который может быть замещен одним-тремя C1-C6алкилами.
[0128] Стадия 1j
На этой стадии обеспечивается реакция соединения (J-1) с соединением (J-2) в растворителе с получением соединения (J-3). На этой стадии реакция выполняется в присутствии основания.
Эта реакция также может быть выполнена в потоке или в атмосфере инертного газа, такого как азот или аргон.
[0129] В качестве соединения (J-1) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (J-1), которые могут использоваться, включают бензоилхлорид и п-толуоилхлорид.
[0130] В качестве соединения (J-2) могут использоваться коммерчески доступные соединения, соединения, которые могут быть легко получены из коммерчески доступных соединений способами, обычно выполняемыми специалистами данной области, и т.п. Конкретные примеры соединения (I-2), которые могут использоваться, включают 4-нитрофенол.
[0131] Растворитель, который будут применять в этой реакции, не является ограниченным при условии, что исходный материал может быть растворен в нем до определенной степени, и он не ингибирует реакцию, и примеры растворителя включают эфирные растворители, такие как тетрагидрофуран, 1,2-диметоксиэтан, трет-бутилметиловый эфир, циклопентилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, дициклопентиловый эфир и 1,4-диоксан; галогенированные углеводородные растворители, такие как дихлорметан и хлороформ; сложноэфирные растворители, такие как этилацетат и изопропилацетат; и смешанные растворители из них. Растворителем предпочтительно является тетрагидрофуран, этилацетат или дихлорметан.
[0132] Вышеописанное основание означает пиридин, коллидин, триэтиламин или подобное. Основанием предпочтительно является пиридин.
[0133] Температура реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и предпочтительно составляет от -20°C до 50°C (с точки зрения внутренней температуры в реакционном сосуде), более предпочтительно приблизительно от 0°C до 20°C (с точки зрения внутренней температуры в реакционном сосуде).
[0134] Время реакции, как правило, варьирует в зависимости от исходного материала, растворителя и других реагентов, применяемых в реакции, и температуры реакции, и после добавления реагентов реакционная смесь предпочтительно перемешивается в течение 1-24 часов, более предпочтительно перемешивается в течение приблизительно 2-12 часов при вышеописанной температуре реакции.
[0135] Соединение (J-2) может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1-1,5-кратном молярном количестве по отношению к соединению (J-1).
[0136] Вышеописанное основание может использоваться в 1-5-кратном молярном количестве, предпочтительно в 1-3-кратном молярном количестве, более предпочтительно в 1-2-кратном молярном количестве по отношению к количеству соединения (J-1).
[0137] В каждом из вышеописанных способов после реакции на каждой стадии представляющее интерес соединение этой стадии может быть извлечено согласно общепринятому способу из реакционной смеси.
[0138] Например, в случаях, когда целая реакционная смесь является жидкой, реакционная смесь нагревается/охлаждается до комнатной температуры или охлаждается на льду при необходимости, и кислота, щелочь, окисляющее средство или восстанавливающее средство нейтрализуется по необходимости с последующим добавлением воды и органического растворителя, такого как этилацетат, который не смешивается с водой и не реагирует с представляющим интерес соединением, и отделяется слой, содержащий представляющее интерес соединение. Затем растворитель, не смешивающийся с полученным слоем и не реагирующий с представляющим интерес соединением, добавляется для промывания слоя, содержащего представляющее интерес соединение, а затем слои отделяются. Кроме того, в случаях, когда слой, содержащий представляющее интерес соединение, является органическим слоем, он может быть высушен с использованием высушивающего средства, такого как безводный магния сульфат или безводный натрия сульфат, а затем растворитель удаляется выпариванием, таким образом, извлекается представляющее интерес соединение. Кроме того, в случаях, когда слой, содержащий представляющее интерес соединение, является водным слоем, представляющее интерес соединение может быть извлечено электрическим обессоливанием с последующей сушкой замораживанием слоя.
[0139] Кроме того, в случаях, когда цельная реакционная смесь является жидкой, а это возможно, представляющее интерес соединение может быть извлечено только испарением веществ, отличных от представляющего интерес соединения (например, растворителя и реагентов) при нормальном давлении или пониженном давлении.
[0140] Кроме того, в случаях, когда только реагент или катализатор присутствует в виде твердого вещества, или в случаях, когда цельная реакционная смесь является жидкой, и только реагент или катализатор осаждается во время процесса извлечения, тогда как представляющее интерес соединение растворено в растворе, реагент или катализатор сначала извлекается фильтрацией, а извлеченный реагент или катализатор промывается приемлемым органическим или неорганическим растворителем, с последующим объединением полученной промывной жидкости с маточной жидкостью. Представляющее интерес соединение может быть извлечено путем обработки полученной в результате смеси тем же способом, как в случаях, когда цельная реакционная смесь является жидкой.
[0141] В частности, в случаях, когда вещества, отличные от представляющего интерес соединения, которые содержатся в реакционной смеси, не ингибируют следующую стадию реакции, реакционная смесь также может применяться, как она есть, без выделения представляющего интерес соединения.
[0142] Для повышения чистоты представляющего интерес соединения, извлеченного вышеупомянутым способом, по необходимости могут быть выполнены перекристаллизация, различные хроматографические способы и дистилляция.
[0143] В случаях, когда извлеченное представляющее интерес соединение является твердым веществом, чистота представляющего интерес соединения может быть, как правило, повышена перекристаллизацией. При перекристаллизации могут использоваться отдельный растворитель или смесь растворителей, которые не реагируют с представляющим интерес соединением. Более конкретно, представляющее интерес соединение сначала растворяется при комнатной температуре или при нагревании в отдельном растворителе или в смеси растворителей, которые не реагируют с представляющим интерес соединением. Полученная смесь охлаждается в ледяной воде или подобном или оставляется стоять при комнатной температуре для обеспечения кристаллизации представляющего интерес соединения из смеси.
[0144] Извлеченное представляющее интерес соединение может быть подвергнуто различным хроматографическим способам, таким как хроматография на колонке с прямой фазой или хроматография на колонке с обращенной фазой, для повышения чистоты представляющего интерес соединения. В основном, могут быть применены слабокислотные силикагели, такие как силикагель 60 (70-230 меш или 340-400 меш), изготовленный Merck, или BW-300 (300 меш), изготовленный Fuji Silysia Chemical Ltd. В случаях, когда, например, представляющее интерес соединение является основным и показывает слишком сильную адсорбцию вышеупомянутыми силикагелями, также может применяться покрытый пропиламином силикагель (200-350 меш), изготовленный Fuji Silysia Chemical Ltd., или подобное. В случаях, когда, например, представляющее интерес соединение является биполярным, или необходимо элюирование с высоко полярным растворителем, таким как метанол, также может применяться NAM-200H или NAM-300H, изготовленный Nagara Science Co., Ltd. Для очистки с помощью хроматографии также могут применяться хроматография на колонке с силикагелем с прямой фазой, такой как FLASH+Cartridge (KP-SIL, 60 Å, 32-63 мкм), изготовленной Biotage, или колонке Hi-FlashTM (40 мкм, 60 Å), изготовленной Yamazen Corporation.; или хроматография на колонке с силикагелем с обращенной фазой, такой как YMC*GEL ODS-A, изготовленной YMC Co., Ltd.
С использованием одного из этих силикагелей и элюирования представляющего интерес соединения одним или несколькими растворителями, которые не реагируют с ним, а затем с удалением растворителя(ей) путем выпаривания, может быть получено представляющее интерес соединение с повышенной чистотой.
[0145] В случаях, когда представляющее интерес соединение, которое извлечено, является жидким, можно повысить чистоту представляющего интерес соединения с помощью дистилляции. При дистилляции представляющее интерес соединение может быть дистиллировано помещением при пониженном давлении при комнатной температуре или при нагревании.
[0146] Типичные примеры способов получения соединений настоящего изобретения описаны выше, но соединения сырьевого материала и реагенты, подлежащие применению для получения соединений настоящего изобретения, могут иметь форму соли, сольвата или гидрата и могут варьировать в зависимости от исходного материала, растворителя, подлежащего применению, и т.п., и не являются ограниченными при условии, что они не ингибируют реакцию. Разумеется, что растворитель, подлежащий применению, также варьирует в зависимости от исходного материала, реагентов, подлежащих применению, и т.п., и не является ограниченным при условии, что он не ингибирует реакцию, и исходный материал может быть растворен в нем до некоторой степени. В случаях, когда соединение настоящего изобретения получено в свободной форме, оно может быть превращено в состояние получаемой соли соединения или его гидрата согласно общепринятому способу.
[0147] В случаях, когда соединение настоящего изобретения получается в виде соли или гидрата, оно может быть превращено в свободную форму соединения согласно общепринятому способу.
[0148] Различные изомеры (например, геометрические изомеры, оптические изомеры, ротационные изомеры, стереоизомеры и таутомеры), полученные для соединения настоящего изобретения, могут быть очищены и выделены с использованием способа нормального разделения, включая перекристаллизацию, способ диастереомерной соли, способ ферментативного разделения и различные хроматографические способы (например, тонкослойная хроматография, колоночная хроматография и газовая хроматография).
[0149] В случаях, когда соединение настоящего изобретения применяется в качестве фармацевтического средства, фармацевтическое средство, как правило, составляется путем смешивания соединения настоящего изобретения с приемлемой добавкой. Однако это не отрицает использование в качестве фармацевтического средства соединения настоящего изобретения как такового.
[0150] Примеры добавки включают эксципиенты, связующие, смазочные средства, дезинтеграторы, красящие вещества, корригирующие средства, эмульгаторы, поверхностно-активные вещества, солюбилизаторы, суспендирующие средства, изотонические средства, буферы, антисептики, антиоксиданты, стабилизаторы и усилители абсорбции, которые при необходимости могут быть применены в качестве приемлемой комбинации.
Примеры эксципиентов включают лактозу, сахарозу, глюкозу, кукурузный крахмал, маннит, сорбит, крахмал, прежелатинизированный крахмал, декстрин, кристаллическую целлюлозу, легкую безводную кремниевую кислоту, силикат алюминия, силикат кальция, алюмометасиликат магния и гидрофосфат кальция.
Примеры связующих включают поливиниловый спирт, метилцеллюлозу, этилцеллюлозу, гуммиарабик, трагакант, желатин, шеллак, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натрия карбоксиметилцеллюлозу, поливинилпирролидон и макрогол.
Примеры смазочных средств включают стеарат магния, стеарат кальция, стеарилфумарат натрия, тальк, полиэтиленгликоль и коллоидный кремнезем.
Примеры дезинтеграторов включают кристаллическую целлюлозу, агар, желатин, карбонат кальция, гидрокарбонат натрия, цитрат кальция, декстрин, пектин, низкозамещенную гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу кальция, кроскармеллозу натрия, карбоксиметиловый крахмал и натрия карбоксиметиловый крахмал.
Примеры красящих веществ включают те, которые разрешено добавлять в фармацевтические продукты, такие как полуторная окись железа, желтая полуторная окись железа, кармин, карамель, β-каротин, оксид титана, тальк, рибофлавин натрия фосфат и желтый алюминиевый лак.
Примеры корригирующих средств включают порошок какао, ментол, ароматический порошок, масло мяты перечной, борнеол и коричный порошок.
Примеры эмульгаторов и поверхностно-активных веществ включают стеарилтриэтаноламин, натрия лаурилсульфат, лауриламинопропионат, лецитин, глицирин моностеарат, сложный эфир жирной кислоты и сахарозы и сложный эфир жирной кислоты и глицерина.
Примеры солюбилизаторов включают полиэтиленгликоль, пропиленгликоль, бензилбензоат, этанол, холестерин, триэтаноламин, натрия карбонат, натрия цитрат, полисорбат 80 и никотинамид.
Примеры суспендирующих средств включают, вдобавок к вышеупомянутым поверхностно-активным веществам, гидрофильные макромолекулы, такие как поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилцеллюлозу.
Примеры изотонических средств включают глюкозу, хлорид натрия, маннит и сорбит.
Примеры буферов включают буферные растворы, содержащие соль фосфорной кислоты, соль уксусной кислоты, соль угольной кислоты или соль лимонной кислоты.
Примеры антисептиков включают метилпарабен, пропилпарабен, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту и сорбиновую кислоту.
Примеры антиоксидантов включают соли серной кислоты, аскорбиновую кислоту и α-токоферол.
Примеры стабилизаторов включают обычно применяемые для фармацевтических продуктов.
Примеры усилителей абсорбции включают обычно применяемые для фармацевтических продуктов.
[0151] Кроме того, примеры вышеупомянутых составов включают пероральные препараты, такие как таблетки, порошки, гранулы, капсулы, сиропы, пастилки и ингаляции; и препараты наружного применения, такие как суппозитории, мази, офтальмологические мази, ленты, глазные капли, назальные капли, ушные капли, горячие компрессы, лосьоны, и инъекционные растворы.
Вышеупомянутые пероральные препараты составляются путем комбинирования вышеупомянутых добавок по необходимости. В случае необходимости поверхности пероральных препаратов могут быть покрытыми.
Вышеупомянутые препараты наружного применения составляются, в частности, путем комбинирования, по необходимости, эксципиентов, связующих, корригирующих средств, эмульгаторов, поверхностно-активных веществ, солюбилизаторов, суспендирующих средств, изотонических средств, антисептиков, антиоксидантов, стабилизаторов или усилителей абсорбции среди вышеупомянутых добавок.
Вышеупомянутые инъекционные растворы составляются, в частности, путем комбинирования, по необходимости, эмульгаторов, поверхностно-активных веществ, солюбилизаторов, суспендирующих средств, изотонических средств, буферов, антисептиков, антиоксидантов, стабилизаторов или усилителей абсорбции среди вышеупомянутых добавок.
[0152] Хотя доза фармацевтического продукта настоящего изобретения варьирует в зависимости от симптомов, возраста, пола, веса тела, способа введения, типа соли, чувствительности к лекарственному препарату, конкретного типа заболевания и т.п., суточная доза для взрослого, как правило, составляет от приблизительно 1 мг до приблизительно 1000 мг (предпочтительно от приблизительно 10 мг до приблизительно 500 мг) в случае перорального введения или от приблизительно 1 мг до приблизительно 1000 мг (предпочтительно от приблизительно 10 до приблизительно 500 мг) в случае препарата для наружного применения или от приблизительно 1 мкг до приблизительно 3000 мкг (предпочтительно от приблизительно 3 мкг до приблизительно 3000 мкг) на кг веса тела в случае инъекционного раствора, который вводится один раз или поделен на 2-6 раз в сутки.
В случаях перорального препарата и инъекционного раствора значения указывают на их количества, подлежащие фактически введению, а в случае препарата для наружного применения значения указывают на их количество, фактически абсорбируемое в живой организм.
Примеры
[0153] Соединение настоящего изобретения может быть получено, например, процессами, описанными в следующих примерах, и эффект соединения может быть подтвержден процессом, описанным в следующих тестовых примерах. Однако следует понимать, что они являются исключительно иллюстративными, и что настоящее изобретение в любом случае не ограничивается следующими конкретными примерами, и различные варианты могут быть выполнены без отступления от объема настоящего изобретения.
[0154] Соединения, упомянутые со ссылкой на опубликованные документы, получены согласно этим документам.
[0155] "Силикагелем" в "хроматографии на колонке с силикагелем", описанной в примерах, если не указано иное, является силикагель 60 (70-230 меш или 230-400 меш) от Merck, FLASH+Cartridge (KP-SIL, 60 Å, 32-63 мкм) от Biotage или колонка Hi-FlashTM (40 мкм, 60 Å) от Yamazen Corporation.
[0156] "Силикагелем обращенной фазы" в "хроматографии на колонке с силикагелем с обращенной фазой", описанной в примерах, если не указано иное, является YMC*GEL ODS-A (12 нм, S-50 мкм) от YMC Co., Ltd.
[0157] "NAM силикагелем" в "хроматографии на колонке с NAM силикагелем", описанной в примерах, является NAM-200H или NAM-300H от Nagara Science Co., Ltd.
[0158] "SUMICHIRAL OA-2500" или "SUMICHIRAL OA-2500S", описанной в примерах, является ВЭЖХ колонка от Sumika Chemical Analysis Service, Ltd.
[0159] "Очистку высокоэффективной жидкостной хроматографией с обращенными фазами", описанной в примерах, выполняли при следующих условиях, если не указано иное.
[0160] Колонка
Применяемой колонкой была следующая:
Компания: SHISEIDO
Название: CAPCELL PAK C18
Размер: 50 мм × 20 мм внутренний диаметр
Тип: ACR 5 мкм
[0161] Подвижная фаза
Применяли комбинацию (1) и (2) ниже с градиентом при диапазоне соотношения 100:0-0:100 в качестве подвижного слоя для жидкостной хроматографии.
(1) 99,9% воды (0,1% уксусной кислоты)
(2) 99,9% ацетонитрила (0,1% уксусной кислоты)
[0162] "Комнатная температура" в следующих примерах, как правило, относится к температурам от приблизительно 10°C до 35°C. "%", если не указано иное, представляет собой весовые процентные соотношения. Другие символы, применяемые в настоящем документе, являются следующими:
1H-ЯМР: протонный ядерный магнитный резонанс
δ: химический сдвиг
s: синглет
d: дуплет
t: триплет
q: квартет
quint: квинтет
sext: секстет
m: мультиплет
br: широкий
sept: септет
J: константа взаимодействия
Hz: Герц
M: моль/л
н-: нормальный
втор-: вторичный
т-: третичный
н: нормальность
CDCl3: дейтерохлороформ
d6-DMSO: дейтеродиметилсульфоксид
CD3OD: дейтерометанол
CD3CN: дейтероацетонитрил
DMF: N,N-диметилформамид
DMA: N,N-диметилацетамид
DMAP: 4-(диметиламино)пиридин
TBME: трет-бутилметиловый эфир
THF: тетрагидрофуран
TFA: трифторуксусная кислота
DMSO: диметилсульфоксид
WSC: хлористоводородной кислоты 1-этил-3-(3-диметиламинопропил)карбодиимид
TFFH: фтор-N,N,N',N'-тетраметилформамидиния гексафторфосфат
[0163] Пример 1
3-Метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
(1a) N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамид
К смеси 4-({[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил}амино)бензамидиновой соли уксусной кислоты [CAS № 951803-95-5] (613 мг) и DMF (5 мл) добавляли бензойной кислоты 4-нитрофениловый сложный эфир [CAS № 959-22-8] (280 мг) и триэтиламин (0,2 мл) и полученную в результате смесь перемешивали при 50°C в течение ночи. Уксусную кислоту добавляли в реакционный раствор, а растворитель выпаривали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (492 мг).
1H-ЯМР (CD3OD) δ = 3,72 (s, 3H), 3,88 (t, J=4,8 Hz, 2H), 4,10 (t, J=4,8 Hz, 2H), 6,00 (s, 1H), 6,65 (d, J=5,2 Hz, 2H), 6,83 (d, J=8,4 Hz, 2H), 7,35 (t, J=4,8 Hz, 1H), 7,43 (t, J=7,2 Hz, 2H), 7,50 (t, J=7,2 Hz, 1H), 7,98 (d, J=8,4 Hz, 2H), 8,23 (d, J=7,2 Hz, 2H), 8,77 (d, J=4,8 Hz, 2H).
[0164] (1b) 3-Метоксиметокси-2,2-диметилпропионовой кислоты метоксиметиловый сложный эфир
К смеси 3-гидрокси-2,2-диметилпропионовой кислоты [CAS № 4835-90-9] (10 г) и дихлорметана (350 мл) при 0°C последовательно добавляли хлорметилметиловый эфир (16,1 мл), растворенный в дихлорметане (30 мл), и N,N-диизопропилэтиламин (44,2 мл). После перемешивания смеси в течение ночи при комнатной температуре в нее добавляли водный аммиак (50 мл). К смеси добавляли 2н хлористоводородную кислоту (500 мл) и диэтиловый эфир (800 мл) и полученную в результате смесь встряхивали с последующим сбором органического слоя. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия (300 мл) и насыщенным водным раствором хлорида натрия (300 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении с получением названного соединения (16,5 г).
1H-ЯМР (CDCl3) δ = 1,25 (s, 6H), 3,35 (s, 3H), 3,46 (s, 3H), 3,56 (s, 2H), 4,61 (s, 2H), 5,26 (s, 2H).
[0165] (1c) 3-Метоксиметокси-2,2-диметилпропионовая кислота
К смеси 3-метоксиметокси-2,2-диметилпропионовой кислоты метоксиметилового сложного эфира (16,5 г) и метанола (30 мл) добавляли 5н водный раствор гидроксида натрия (30 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 4 дней. К смеси добавляли лед и при 0°C в нее добавляли 5н хлористоводородную кислоту (35 мл) и диэтиловый эфир (300 мл). Смесь встряхивали и собирали органический слой. Органический слой промывали насыщенным водным раствором хлорида натрия (100 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении с получением названного соединения (14,5 г).
1H-ЯМР (CDCl3) δ = 1,25 (s, 6H), 3,36 (s, 3H), 3,55 (s, 2H), 4,64 (s, 2H).
[0166] (1d) 3-Метоксиметокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир
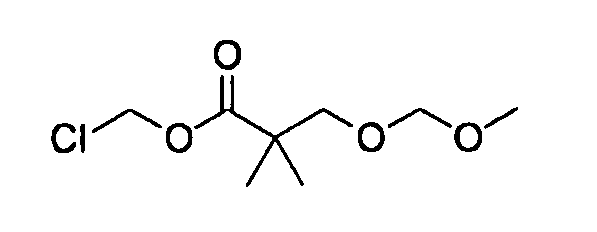
К смеси воды (240 мл) и TBME (360 мл) последовательно добавляли дикалия гидрофосфат (246 г), тетрабутиламмония гидросульфат (9,65 г) и 3-метоксиметокси-2,2-диметилпропионовую кислоту (45,8 г). Смесь охлаждали до 0°C и каплями добавляли в нее хлорметилхлорсульфат [CAS № 49715-04-0] (42,1 мл) при перемешивании с последующим перемешиванием полученной в результате смеси в течение ночи при комнатной температуре. К смеси добавляли воду (1,3 л) и TBME (800 мл). После встряхивания смеси собирали органический слой и дважды промывали насыщенным водным раствором хлорида натрия (300 мл) с последующей сушкой над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (41,7 г).
1H-ЯМР (CDCl3) δ = 1,25 (s, 6H), 3,35 (s, 3H), 3,55 (s, 2H), 4,61 (s, 2H), 5,73 (s, 2H).
[0167] (1e) 3-Метоксиметокси-2,2-диметилпропионовой кислоты 5-{[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
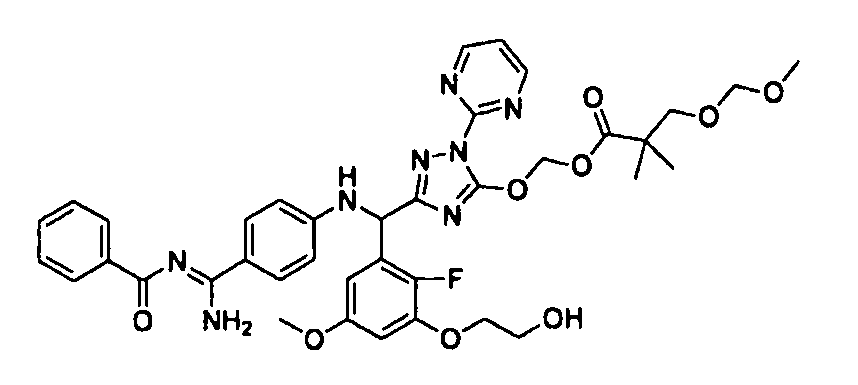
К смеси N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (120 мг) и DMF (3 мл) последовательно добавляли гидрокарбонат калия (30 мг) и 3-метоксиметокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир (54,8 мг), и полученную в результате смесь перемешивали при 60°C в течение 14 часов. К смеси добавляли этилацетат (100 мл). Полученную в результате смесь последовательно трижды промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с NAM силикагелем (смешанный растворитель из гептан-этилацетата и метанол-этилацетата) с получением названного соединения (40 мг).
1H-ЯМР (CD3CN) δ = 1,23 (s, 6H), 3,10 (t, J=5,6 Hz, 1H), 3,17 (s, 3H), 3,43 (s, 2H), 3,73 (s, 3H), 3,85 (q, J=5,6 Hz, 2H), 4,11 (t, J=5,6 Hz, 2H), 4,36 (d, J=7,4 Hz, 1H), 4,38 (d, J=7,4 Hz, 1H), 6,02 (d, J=8,4 Hz, 1H), 6,09 (s, 2H), 6,10 (d, J=8,4 Hz, 1H), 6,62 (dd, J=2,4, 7,4 Hz, 1H), 6,67 (dd, J=2,4, 5,3 Hz, 1H), 6,85 (d, J=8,9 Hz, 2H), 7,44 (t, J=4,3 Hz, 1H), 7,46 (t, J=7,4 Hz, 2H), 7,54 (t, J=7,4 Hz, 1H), 8,00 (d, J=8,9 Hz, 2H), 8,33 (d, J=7,4 Hz, 2H), 8,84 (d, J=4,3 Hz, 2H).
[0168] (1f) 3-Метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
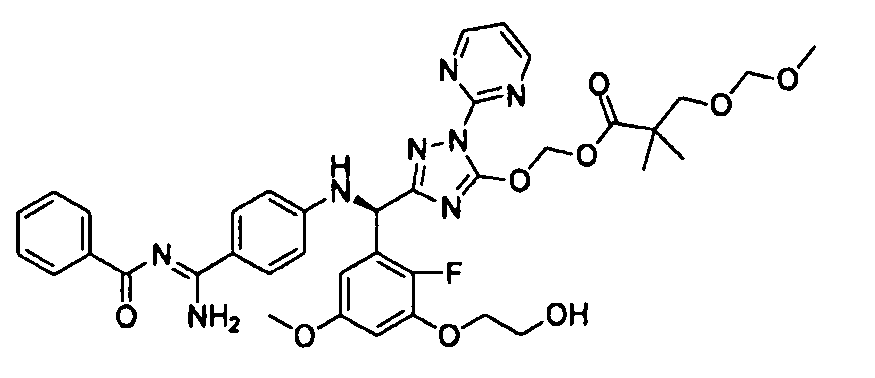
С использованием колонки SUMICHIRAL OA-2500 3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (568 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (247,6 мг) в последней фракции.
Время удерживания ВЭЖХ: 15 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин).
1H-ЯМР (CD3OD) δ = 1,10 (s, 6H), 3,14 (s, 3H), 3,37 (d, J=9,2 Hz, 1H), 3,40 (d, J=9,2 Hz, 1H), 3,73 (s, 3H), 3,89 (t, J=4,8 Hz, 2H), 4,10 (t, J=4,8 Hz, 2H), 4,30 (d, J=6,6 Hz, 1H), 4,33 (d, J=6,6 Hz, 1H), 6,11 (s, 1H), 6,12 (d, J=5,6 Hz, 1H), 6,15 (d, J=5,6 Hz, 1H), 6,62 (dd, J=2,8, 6,8 Hz, 1H), 6,76 (dd, J=2,8, 4,8 Hz, 1H), 6,85 (d, J=9,2 Hz, 2H), 7,41-7,52 (m, 4H), 7,98 (d, J=8,8 Hz, 2H), 8,24 (d, J=8,8 Hz, 2H), 8,87 (d, J=4,8 Hz, 2H).
[0169] Пример 22,2-Диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира трет-бутиловый сложный эфир
[0170] (2a) [1-Амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]карбаминовой кислоты 2,2-диметилпропиловый сложный эфир
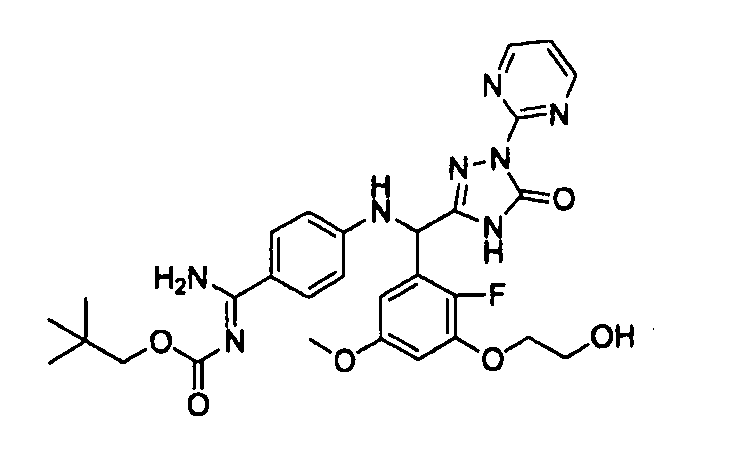
К смеси 4-({[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил}амино)бензамидиновой соли уксусной кислоты (6 г) и DMF (500 мл) добавляли угольной кислоты 2,2-диметилпропилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 158810-98-1] (3,06 г) и триэтиламин (4,64 мл), а полученную в результате смесь перемешивали в течение ночи при комнатной температуре. В реакционный раствор добавляли уксусную кислоту (5 мл), а растворитель выпаривали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (6,5 г).
1H-ЯМР (CD3OD) δ = 0,98 (s, 9H), 3,34 (s, 2H), 3,83 (s, 3H), 3,88 (t, J=4,8 Hz, 2H), 4,10 (t, J=4,8 Hz, 2H), 5,96 (s, 1H), 6,63-6,66 (m, 2H), 6,79 (d, J=8,8 Hz, 2H), 7,33 (t, J=5,0 Hz, 1H), 7,71 (d, J=8,8 Hz, 2H), 7,97 (s, 1H), 8,77 (d, J=4,8 Hz, 2H)
[0171] (2b)
[1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропиловый сложный эфир
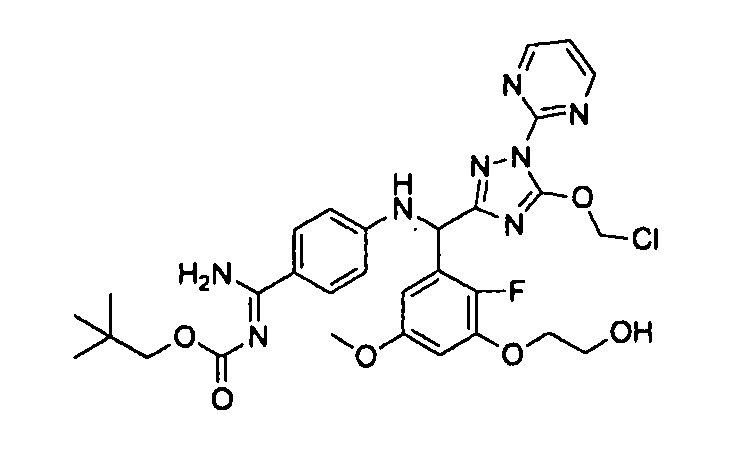
К смеси [1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (4 г) и дихлорметана (80 мл) добавляли гидрокарбонат натрия (6,63 г) и тетрабутиламмония гидросульфат (447 мг) при низкой температуре (-10°C~5°C). К полученной в результате смеси добавляли THF (80 мл) и воду (80 мл). К полученной в результате смеси каплями добавляли хлорметилхлорсульфат (3,26 г) в смеси дихлорметан/THF (1:1) (10 мл) при -5°C, и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Под ледяным охлаждением к смеси добавляли смесь THF/этилацетат (1:4) (500 мл), а полученную в результате смесь фильтровали. К полученному фильтрату добавляли воду (300 мл), а полученную в результате смесь встряхивали, после чего собирали органический слой. Органический слой промывали насыщенным водным раствором хлорида натрия (150 мл). Водный слой экстрагировали смесью THF/этилацетат (1:4) (250 мл, дважды). Органические слои объединяли и промывали насыщенным водным раствором хлорида натрия (150 мл). Все органические слои объединяли и сушили над безводным сульфатом натрия и безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (1,56 г).
1H-ЯМР (CDCl3) δ = 0,98 (s, 9H), 3,49 (s, 2H), 3,70 (s, 3H), 3,85 (s, 2H), 3,97 (t, J=5,2 Hz, 2H), 4,10 (t, J=5,2 Hz, 2H), 5,38 (d, J=7,4 Hz, 1H), 6,15 (d, J=6,0 Hz, 1H), 6,17 (d, J=7,4 Hz, 1H), 6,45 (dd, J=3,2, 7,4 Hz, 1H), 6,68 (dd, J=3,2, 4,8 Hz, 1H), 6,73 (d, J=8,8 Hz, 2H), 7,32 (t, J=4,4 Hz, 1H), 7,71 (d, J=8,8 Hz, 2H), 8,85 (d, J=3,6 Hz, 2H)
[0172] (2c)
Трет-бутиловый сложный эфир 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилмалоновой кислоты
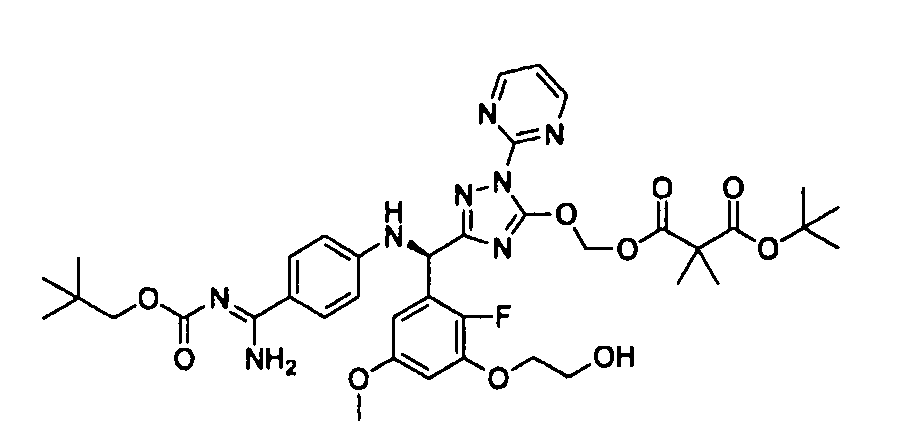
Смесь [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (170 мг), 2,2-диметилмалоновой кислоты моно-трет-бутилового сложного эфира [CAS № 143688-40-8] (490 мг), йодида натрия (390 мг), гидрокарбоната калия (182 мг) и DMA (25 мл) перемешивали при 50°C в течение ночи. После охлаждения смеси до комнатной температуры к ней добавляли 1:1 смесь воды и насыщенного водного хлорида натрия и этилацетата, а полученную в результате смесь экстрагировали. Водный слой дважды реэкстрагировали этилацетатом. Все органические слои объединяли, промывали водой и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали и полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением рацемата названного соединения.
Рацемат оптически отделяли с использованием колонки SUMICHIRAL OA-2500S при нижеупомянутых условиях с получением грубо очищенного продукта названного соединения в предыдущей фракции.
Время удерживания ВЭЖХ; 11 минут (название колонки: SUMICHIRAL OA-2500S, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин)
Полученный грубо очищенный продукт снова очищали с использованием колонки SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин) с получением названного соединения (57,21 мг).
1H-ЯМР (CD3OD) δ = 1,00 (s, 9H), 1,21 (s, 9H), 1,31 (s, 3H), 1,32 (s, 3H), 3,73 (s, 3H), 3,82 (s, 2H), 3,89-3,91 (m, 2H), 4,09-4,11 (m, 2H), 6,07 (s, 1H), 6,16-6,20 (m, 2H), 6,61 (dd, J=3,2, 6,8 Hz, 1H), 6,75 (dd, J=3,2, 4,8 Hz, 1H), 6,79-6,81 (m, 2H), 7,50 (t, J=5,2 Hz, 1H), 7,71-7,73 (m, 2H), 8,89 (d, J=5,2 Hz, 2H)
[0173] Пример 3-1
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир (диастереомер 1)
Пример 3-2
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир (диастереомер 2)
(3a) Угольной кислоты 1-(5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир
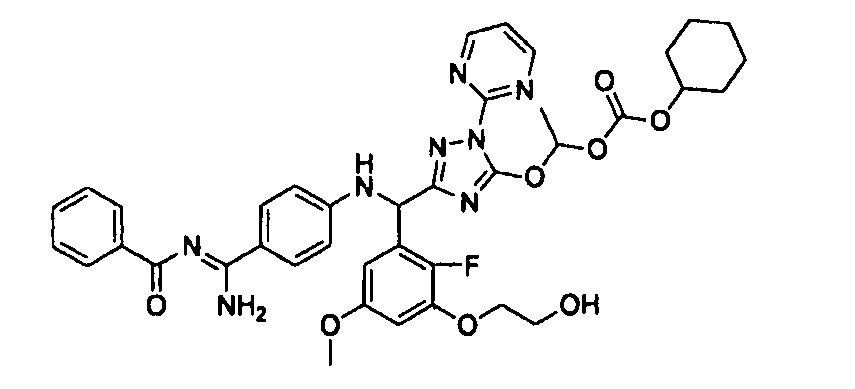
К смеси N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 1a, 1,0 г) и DMF (20 мл) добавляли гидрокарбонат калия (1,67 г) и 1-хлорэтилциклогексил-карбонат (2,76 г) и полученную в результате смесь перемешивали при 55°C в течение 26 часов. Реакционный раствор фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (680 мг).
Массовый спектр (ESI) m/z: 769 (M+H)+
[0174] (3b) Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир
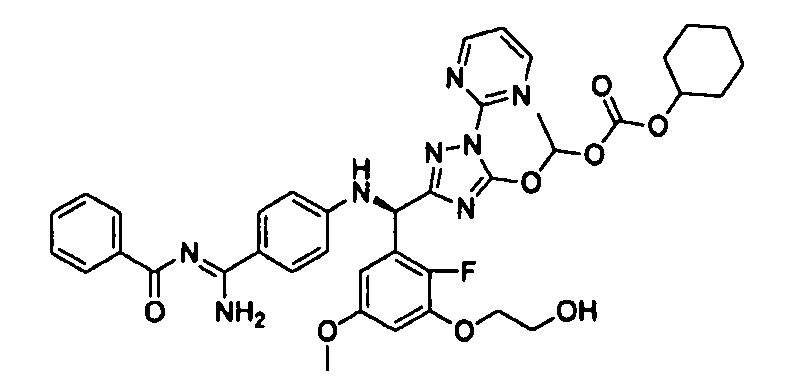
С использованием колонки SUMICHIRAL OA-2500 угольной кислоты 1-(5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира циклогексиловый сложный эфир (680 мг) оптически отделяли при нижеупомянутых условиях с получением названных соединений во второй фракции и третьей фракции в качестве грубо очищенного продукта.
Время удерживания ВЭЖХ; (вторая фракция) 14 минут, (третья фракция) 17 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
Полученный грубо очищенный продукт (вторая фракция) очищали с использованием колонки SUMICHIRAL OA-2500S (20 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением диастереомера 1 (48,22 мг).
Вторая фракция (диастереомер 1)
1H-ЯМР (CD3OD) δ = 1,15-1,90 (m, 13H), 3,71 (s, 3H), 3,84-3,94 (m, 2H), 4,02-4,13 (m, 2H), 4,45-4,57 (m, 1H), 6,08 (s, 1H), 6,59 (dd, J=2,8, 7,2 Hz, 1H), 6,73 (dd, J=2,8, 4,8 Hz, 1H), 6,82 (d, J=8,8 Hz, 2H), 6,91 (q, J=5,6 Hz, 1H), 7,36-7,54 (m, 4H), 7,96 (d, J=8,8 Hz, 2H), 8,16-8,30 (m, 2H), 8,84 (d, J=4,4 Hz, 2H)
Массовый спектр(ESI) m/z: 769 (M+H)+
Полученный грубо очищенный продукт (третья фракция) очищали с использованием колонки SUMICHIRAL OA-2500S (20 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением диастереомера 2 (46,07 мг).
Третья фракция (диастереомер 2)
1H-ЯМР (CD3OD) δ = 1,10-1,90 (m, 13H), 3,71 (s, 3H), 3,82-3,93 (m, 2H), 4,03-4,14 (m, 2H), 4,42-4,55 (m, 1H), 6,08 (s, 1H), 6,60 (dd, J=2,8, 7,2 Hz, 1H), 6,71 (dd, J=2,8, 4,8 Hz, 1H), 6,82 (d, J=8,8 Hz, 2H), 6,86 (q, J=5,2 Hz, 1H), 7,36-7,53 (m, 4H), 7,97 (d, J=8,8 Hz, 2H), 8,24 (dd, J=1,6, 8,0 Hz, 2H), 8,85 (d, J=4,4 Hz, 2H)
[0175] Пример 4
4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
(4a) 3-метокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир
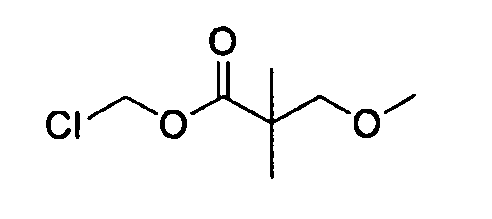
К смеси воды (25 мл) и TBME (40 мл) последовательно добавляли дикалия гидрофосфат (45,2 г), тетрабутиламмония гидросульфат (1,76 г) и 3-метокси-2,2-диметилпропионовую кислоту [CAS № 64241-78-7] (6,86 г). После охлаждения полученной в результате смеси до -5°C к ней каплями добавляли смесь хлорметилхлорсульфата (12,8 г) и TBME (10 мл), и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К полученной в результате смеси добавляли воду (50 мл) и TBME (30 мл). После встряхивания полученной в результате смеси собирали органический слой, а к оставшемуся водному слою добавляли TBME (50 мл). Полученную в результате смесь снова встряхивали и собирали органический слой. Объединенные органические слои дважды промывали водой (30 мл) и насыщенным водным раствором хлорида натрия (30 мл), и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток дистиллировали (точка кипения: 85-86°C/20 мм.рт.ст) при пониженном давлении с получением названного соединения (5,68 г).
1H-ЯМР (CDCl3) δ = 1,23 (s, 6H), 3,34 (s, 3H), 3,41 (s, 2H), 5,75 (s, 2H)
[0176] (4b) 3-метокси-2,2-диметилпропионовой кислоты 5-({4-[амино(бензоилимино)метил]фениламино}-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил)-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
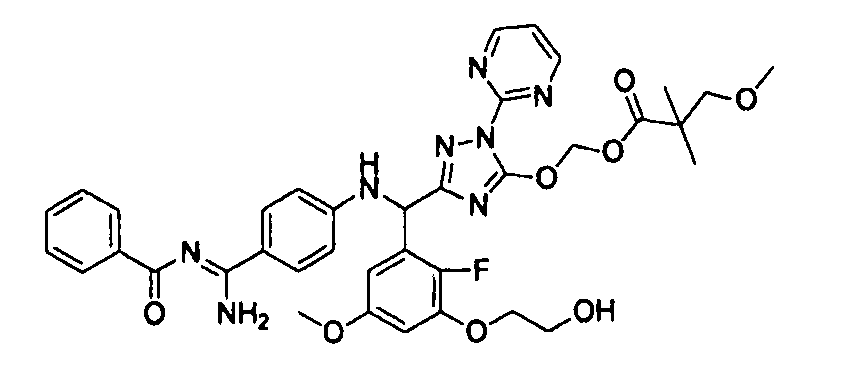
К смеси N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 1a, 45 мг) и DMF (2 мл) последовательно добавляли карбонат цезия (29 мг) и 3-метокси-2,2-диметилпропионовой кислоты хлорметиловый сложный эфир (20 мг), и полученную в результате смесь перемешивали при 60°C в течение 4 часов. Полученную в результате смесь вливали в этилацетат (30 мл) и воду (20 мл). После встряхивания смеси собирали органический слой. Органический слой дважды последовательно промывали водой (30 мл) и насыщенным водным раствором хлорида натрия (20 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (20 мг).
1H-ЯМР (CD3CN) δ = 1,10 (s, 6H), 3,05 (s, 3H), 3,09 (br.s, 1H), 3,26 (s, 2H), 3,74 (s, 3H), 3,85 (br.s, 2H), 4,09 (br.s, 2H), 6,03 (d, J=7,6 Hz, 1H), 6,08 (s, 1H), 6,10 (d, J=7,6 Hz, 1H), 6,61 (dd, J=2,4, 7,3 Hz, 1H), 6,67 (dd, J=2,4, 5,0 Hz, 1H), 6,85 (d, J=8,9 Hz, 2H), 7,44 (t, J=4,4 Hz, 1H), 7,46 (t, J=7,8 Hz, 2H), 7,54 (t, J=7,8 Hz, 1H), 8,00 (d, J=8,9 Hz, 2H), 8,33 (d, J=7,8 Hz, 2H), 8,84 (d, J=4,4 Hz, 2H)
[0177] (4c) 4-пиридинкарбоновой кислоты 2-(3-{(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
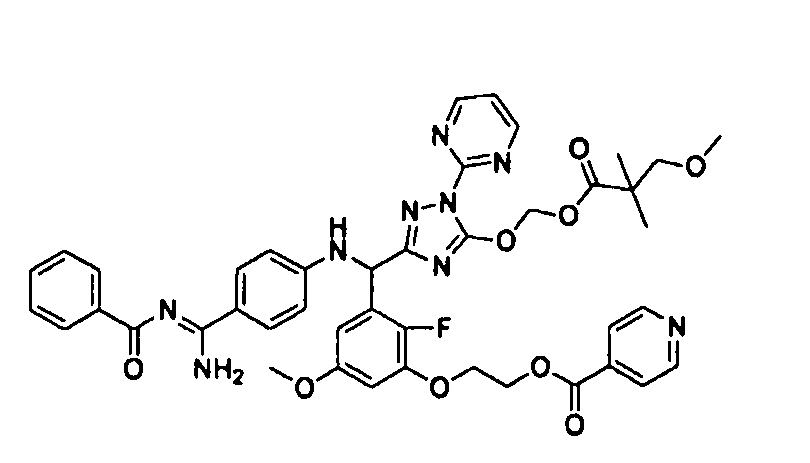
В атмосфере азота добавляли триэтиламин (0,112 мл) под ледяным охлаждением к смеси 4-пиридинкарбоновой кислоты [CAS № 55-22-1] (19,6 мг), TFFH (42,4 мг) и дихлорметана (6 мл), а полученную в результате смесь перемешивали в течение 1 часа. К полученной в результате смеси добавляли 3-метокси-2,2-диметилпропионовой кислоты 5-({4-[амино(бензоилимино)метил]фениламино}-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил)-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (14,9 мг) и DMAP (0,27 мг), а полученную в результате смесь перемешивали в течение ночи при комнатной температуре. При пониженном давлении растворитель отгоняли из смеси. Полученный остаток очищали с помощью высоэффективной жидкостной хроматографии с обращенной фазой (смешанный растворитель из ацетонитрила и воды, содержащий 0,1% уксусной кислоты) с получением названного соединения (10,4 мг).
1H-ЯМР (CD3OD) δ = 1,04 (s, 3H), 1,05 (s, 3H), 3,00 (s, 3H), 3,17 (d, J=9,6 Hz, 1H), 3,20 (d, J=9,6 Hz, 1H), 3,71 (s, 3H), 4,44 (t, J=4,6 Hz, 2H), 4,72 (t, J=4,6 Hz, 2H), 6,08-6,13 (m, 3H), 6,67 (dd, J=2,8, 6,4 Hz, 1H), 6,78 (dd, J=2,8, 4,6 Hz, 1H), 6,86 (d, J=8,8 Hz, 2H), 7,47-7,52 (m, 4H), 7,87 (d, J=5,4 Hz, 2H), 7,95 (d, J=8,8 Hz, 2H), 8,23 (d, J=6,8 Hz, 2H), 8,67 (d, J=5,4 Hz, 2H), 8,86 (d, J=4,4 Hz, 2H)
[0178] (4d) 4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
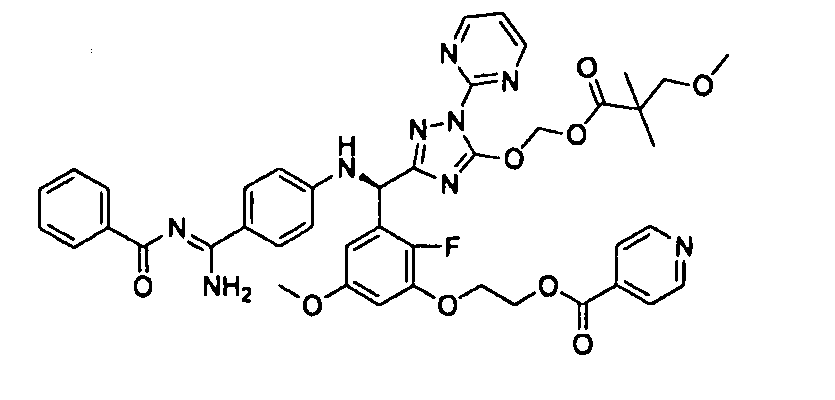
С использованием колонки SUMICHIRAL OA-2500S 4-пиридинкарбоновой кислоты 2-(3-{(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир (10,4 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (3,3 мг) в вышеупомянутой фракции.
Время удерживания ВЭЖХ; 14 минут (название колонки: SUMICHIRAL OA-2500S, 30 мм φ × 25 см, подвижная фаза: ацетонитрил, скорость элюирования: 50 мл/мин)
1H-ЯМР (CDCl3) δ = 1,14 (s, 3H), 1,15 (s, 3H), 3,16 (s, 3H), 3,31 (d, J=9,6 Hz, 1H), 3,33 (d, J=9,6 Hz, 1H), 3,70 (s, 3H), 4,36 (t, J=4,6 Hz, 2H), 4,70 (t, J=4,6 Hz, 2H), 5,69 (br,s, 1H), 6,09 (br,s, 1H), 6,12 (d, J=5,3 Hz, 1H), 6,22 (d, J=5,3 Hz, 1H), 6,48 (dd, J=2,8, 6,4 Hz, 1H), 6,71 (dd, J=2,8, 4,6 Hz, 1H), 6,76 (d, J=8,8 Hz, 2H), 7,31 (t, J=4,9 Hz, 1H), 7,43 (tt, J=1,6, 6,8 Hz, 2H), 7,50 (tt, J=1,6, 6,8 Hz, 1H), 7,84 (d, J=5,6 Hz, 2H), 7,88 (d, J=8,8 Hz, 2H), 8,30 (dd, J=1,6, 6,8 Hz, 2H), 8,74 (d, J=5,6 Hz, 2H), 8,83 (d, J=4,9 Hz, 2H)
[0179] Пример 5
2-этилбутановой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
(5a) 2-этилбутановой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
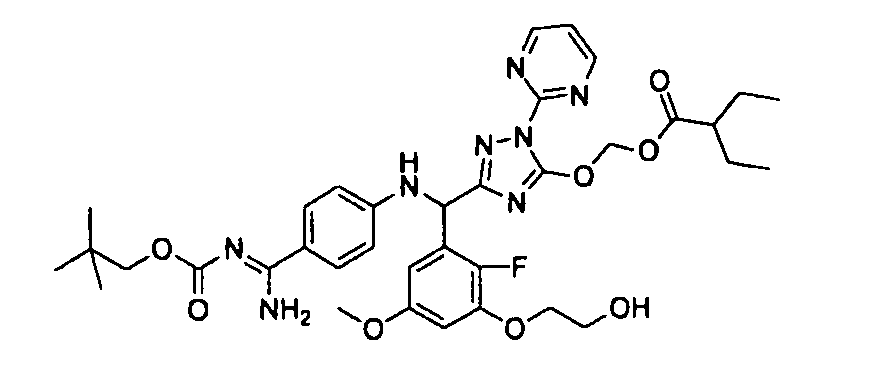
К смеси [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (пример 2b, 100 мг), гидрокарбоната калия (109 мг) и DMF (13,3 мл) добавляли 2-этилбутановую кислоту (88,3 мг) и йодид натрия (117 мг), а полученную в результате смесь перемешивали при 45°C в течение ночи и затем охлаждали до комнатной температуры. К реакционной смеси добавляли лед и насыщенный водный раствор хлорида аммония, а полученную в результате смесь экстрагировали смесью THF и этилацетата. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом магния.
Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (90 мг).
1H-ЯМР (CD3OD) δ = 0,78 (t, J=7,6 Hz, 6H), 0,98 (s, 9H), 1,42-1,58 (m, 4H), 2,20-2,27 (m, 1H), 3,71 (s, 3H), 3,81 (s, 2H), 3,87 (t, J=6,4 Hz, 2H), 4,08 (t, J=6,4 Hz, 2H), 6,06 (s, 1H), 6,10 (d, J=5,6 Hz, 1H), 6,14 (d, J=5,6 Hz, 1H), 6,60 (dd, J=3,2, 6,4 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,79 (d, J=7,2 Hz, 2H), 7,47 (t, J=4,8 Hz, 1H), 7,71 (d, J=7,2 Hz, 2H), 8,85 (d, J=4,8 Hz, 2H)
[0180] (5b) 2-этилбутановой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
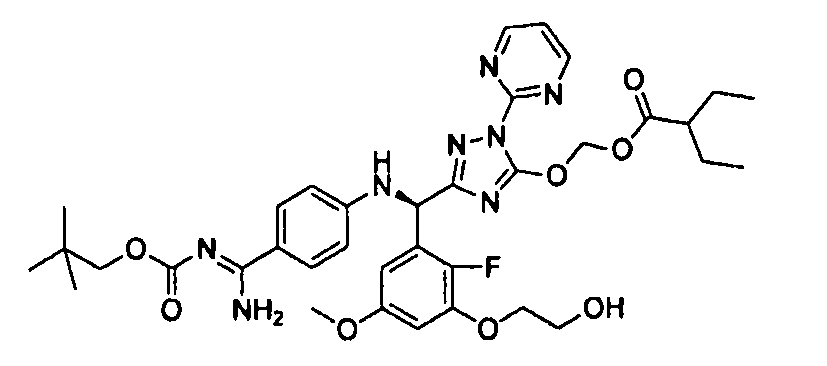
С использованием колонки SUMICHIRAL OA-2500 2-этилбутановой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (90 мг) оптически отделяли при нижеупомянутых условиях с получением грубо очищенного продукта названного соединения в последней фракции.
Время удерживания ВЭЖХ; 10 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
Полученный грубо очищенный продукт очищали снова с использованием колонки SUMICHIRAL OA-2500S (20 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (37 мг).
[0181] (5c) 2-этилбутановой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
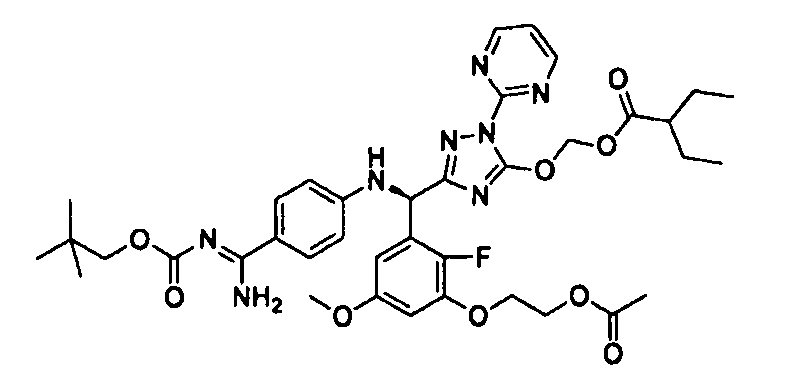
2-этилбутановой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (37 мг), DMAP (0,6 мг) и триэтиламин (0,056 мл) растворяли в DMF (2,5 мл) и дихлорметане (2,5 мл). К раствору медленно добавляли смесь TFFH (26,5 мг), уксусной кислоты (0,00576 мл) и дихлорметана (3 мл), а полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов. После концентрирования реакционной смеси при пониженном давлении к полученному остатку добавляли лед, THF, насыщенный водный раствор гидрокарбоната натрия и насыщенный водный раствор хлорида аммония, а полученную в результате смесь экстрагировали смесью THF и этилацетата. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток грубо очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением грубо очищенного продукта названного соединения.
Полученный грубо очищенный продукт очищали с использованием колонки SUMICHIRAL OA-2500 (20 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (23,9 мг).
1H-ЯМР (CD3OD) δ = 0,78 (t, J=7,6 Hz, 6H), 0,98 (s, 9H), 1,43-1,58 (m, 4H), 2,05 (s, 3H), 2,20-2,27 (m, 1H), 3,71 (s, 3H), 3,81 (s, 2H), 4,23 (dd, J=1,6, 6,4 Hz, 2H), 4,40 (dd, J=1,6, 6,4 Hz, 2H), 6,06 (s, 1H), 6,11 (d, J=5,6 Hz, 1H), 6,15 (d, J=5,6 Hz, 1H), 6,60 (dd, J=3,2, 6,4 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,79 (d, J=7,2 Hz, 2H), 7,47 (t, J=4,8 Hz, 1H), 7,71 (d, J=7,2 Hz, 2H), 8,85 (d, J=4,8 Hz, 2H)
[0182] Пример 6
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
[0183](6a) Угольной кислоты 2-метилаллилового сложного эфира 4-нитрофениловый сложный эфир
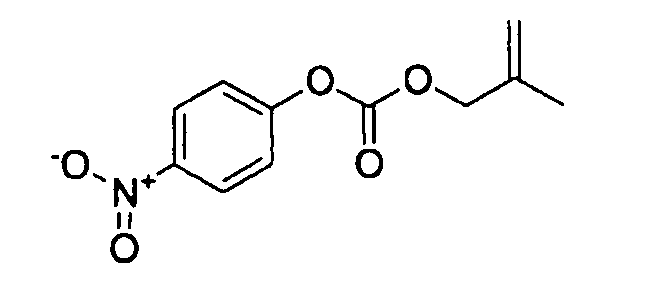
Металлиловый спирт [CAS № 513-42-8] (5 г) и 4-нитрофенилхлорформиат [CAS № 7693-46-1] (12,6 г) растворяли в THF (70 мл) и к полученной в результате смеси при ледяном охлаждении добавляли пиридин (6,69 мл), после чего полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли лед и насыщенный водный раствор хлорида аммония, а полученную в результате смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (10,5 г).
1H-ЯМР (CDCl3) δ = 1,85 (s, 3H), 4,72 (s, 2H), 5,06 (s, 1H), 5,13 (s, 1H), 7,43 (d, J=8,0 Hz, 2H), 8,32 (d, J=8,0 Hz, 2H)
[0184] (6b) Уксусной кислоты 2-{3-[(4-{амино[бензоилимино]метил}фениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир
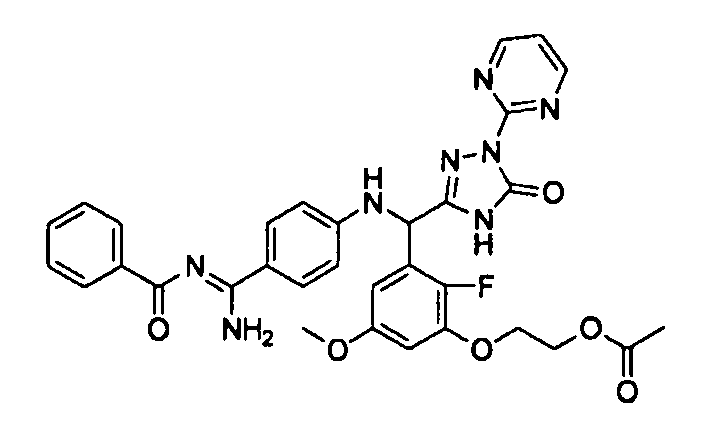
В атмосфере азота при ледяном охлаждении добавляли триэтиламин (6,97 мл) к смеси уксусной кислоты (601 мг), TFFH (2,64 г) и дихлорметана (50 мл), а полученную в результате смесь перемешивали в течение 1 часа. К полученной в результате смеси каплями добавляли смесь N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 1a, 3 г), DMAP (5 мг) и DMF (50 мл). После перемешивания полученной в результате смеси в течение ночи при комнатной температуре растворитель из смеси отгоняли при пониженном давлении. Полученный остаток растворяли в малом количестве THF и к полученной в результате смеси добавляли этилацетат (300 мл) и воду (100 мл). После того как буфер (полученный добавлением 37 мл 0,1 M лимонной кислоты к 63 мл 0,2 M дигидрофосфата натрия) добавляли к полученной в результате смеси, чтобы довести pH до 6, смесь встряхивали и собирали органический слой. Органический слой дважды последовательно промывали водой (100 мл) и насыщенным водным раствором хлорида натрия (100 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (2,16 г).
1H-ЯМР (d6-DMSO) δ = 2,04 (s, 3H), 3,72 (s, 3H), 4,26-4,29 (m, 2H), 4,34-4,37 (m, 2H), 5,93 (d, J=7,2 Hz, 1H), 6,70 (dd, J=3,1, 4,1 Hz, 1H), 6,76 (dd, J=3,1, 6,2 Hz, 1H), 6,79 (d, J=9,1 Hz, 2H), 7,40-7,55 (m, 4H), 8,05 (d, J=9,1 Hz, 2H), 8,14 (d, J=7,8 Hz, 2H), 8,82 (d, J=5,3 Hz, 2H), 8,99 (br,s, 1H), 10,44 (s, 1H), 12,28 (s, 1H)
[0185] (6c) 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[бензоилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
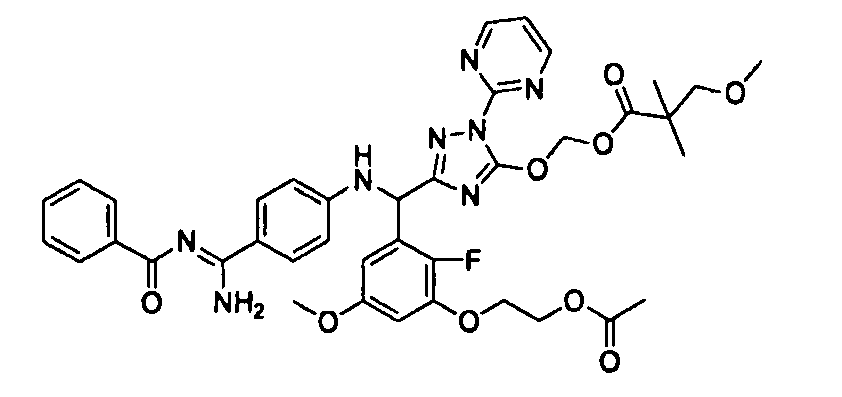
В атмосфере азота смесь уксусной кислоты 2-{3-[(4-{амино[бензоилимино]метил}фениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этилового сложного эфира (441 мг), 3-метокси-2,2-диметилпропионовой кислоты хлорметилового сложного эфира (пример 4a, 373 мг), гидрокарбоната калия (241 мг) и DMF (20 мл) перемешивали при 55°C в течение 15 часов. Полученную в результате смесь вливали в этилацетат (200 мл) и воду (50 мл). После встряхивания полученной в результате смеси собирали органический слой, дважды последовательно промывали водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (184 мг).
1H-ЯМР (CD3OD) δ = 1,06 (s, 3H), 1,07 (s, 3H), 2,02 (s, 3H), 3,00 (s, 3H), 3,19 (d, J=9,0 Hz, 1H), 3,21 (d, J=9,0 Hz, 1H), 3,71 (s, 3H) 4,23-4,26 (m, 2H), 4,39-4,44 (m, 2H), 6,09-6,13 (m, 3H), 6,60 (dd, J=3,0, 7,2 Hz, 1H), 6,78 (dd, J=3,0, 4,5 Hz, 1H), 6,85 (d, J=8,5 Hz, 2H), 7,41-7,51 (m, 4H), 7,98 (d, J=8,5 Hz, 2H), 8,24 (d, J=7,1 Hz, 2H), 8,86 (d, J=4,8 Hz, 2H)
[0186] (6d) 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-карбамимидоилфениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира ацетат
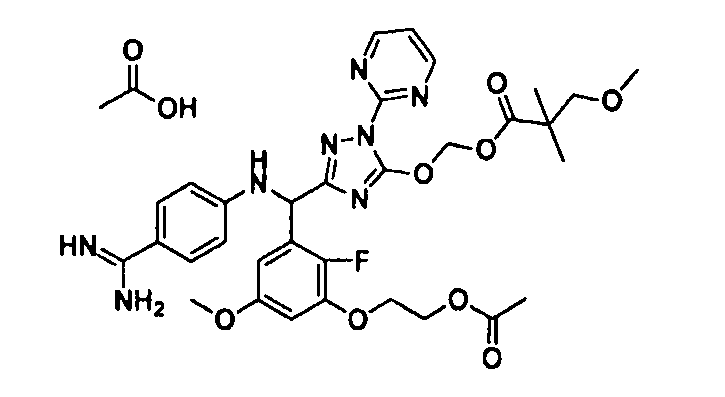
В атмосфере азота смесь 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[бензоилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира (184 мг), метанола (10 мл) и уксусной кислоты (1 мл) перемешивали при 40°C в течение 15 часов. При пониженном давлении отгоняли растворитель из смеси. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды, содержащий 0,1% уксусной кислоты) с получением названного соединения (146 мг).
1H-ЯМР (CD3OD) δ = 1,06 (s, 3H), 1,07 (s, 3H), 1,91 (s, 3H), 2,04 (s, 3H), 3,02 (s, 3H), 3,20 (s, 2H), 3,72 (s, 3H), 4,23-4,27 (m, 2H), 4,39-4,43 (m, 2H), 6,09-6,13 (m, 3H), 6,62 (dd, J=2,8, 6,8 Hz, 1H), 6,75 (dd, J=2,8, 4,8 Hz, 1H), 6,87 (dd, J=1,6, 7,6 Hz, 2H), 7,49 (t, J=4,7 Hz, 1H), 7,62 (dd, J=1,6, 7,6 Hz, 2H), 8,87 (d, J=4,7 Hz, 2H)
[0187] (6e) 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
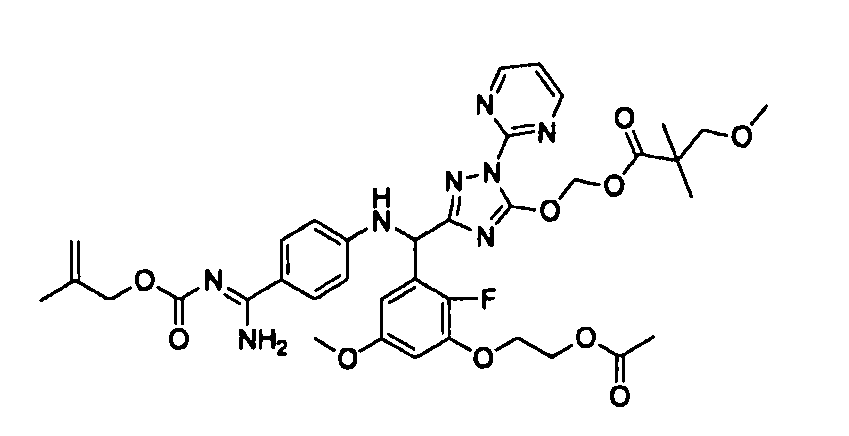
Смесь 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-карбамимидоилфениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира ацетата (13 мг), триэтиламина (0,0074 мл), угольной кислоты 2-метилаллилового сложного эфира 4-нитрофенилового сложного эфира (5,6 мг) и DMF (2 мл) перемешивали в течение 3 дней при комнатной температуре. Полученную в результате смесь вливали в этилацетат (100 мл) и воду (30 мл). После встряхивания смеси собирали органический слой, дважды последовательно промывали водой (30 мл) и насыщенным водным раствором хлорида натрия (30 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (13 мг).
1H-ЯМР (CD3CN): δ = 1,09 (s, 3H), 1,10 (s, 3H), 1,78 (s, 3H), 2,05 (s, 3H), 3,05 (s, 3H), 3,26 (s, 2H), 3,74 (s, 3H), 4,24-4,27 (m, 2H), 4,37-4,42 (m, 2H), 4,54 (s, 2H), 4,93 (br,s, 1H), 4,98 (br,s, 1H), 5,96 (d, J=7,2 Hz, 1H), 6,06 (d, J=7,2 Hz, 1H), 6,08 (s, 1H), 6,62 (dd, J=3,1, 7,2 Hz, 1H), 6,69 (dd, J=3,1, 5,1 Hz, 1H), 6,78 (d, J=8,8 Hz, 2H), 7,44 (t, J=5,0 Hz, 1H), 7,57 (d, J=8,8 Hz, 2H), 8,84 (d, J=5,0 Hz, 2H)
[0188] (6f) 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
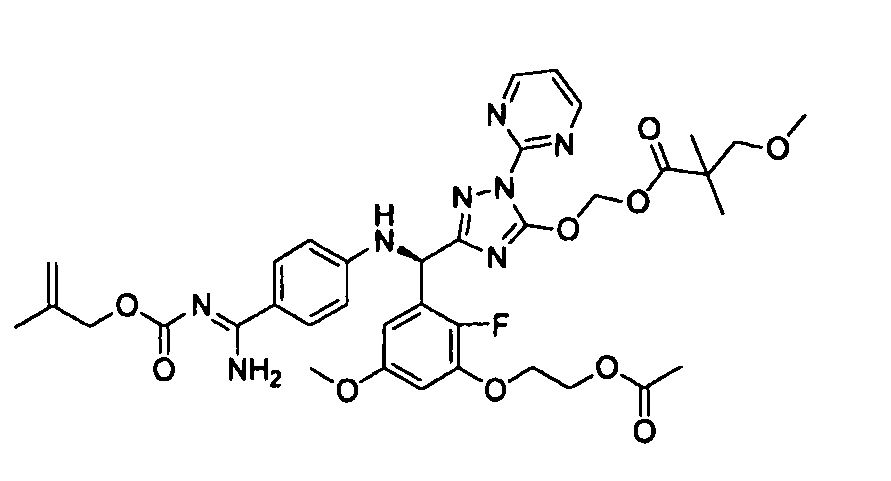
С использованием колонки SUMICHIRAL OA-2500S 3-метокси-2,2-диметилпропионовой кислоты 5-[[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (13,3 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (4,8 мг) в вышеупомянутой фракции.
Время удерживания ВЭЖХ; 8 минут (название колонки: SUMICHIRAL OA-2500S, 20 мм φ × 25 см, подвижная фаза: ацетонитрил, скорость элюирования: 15 мл/мин)
1H-ЯМР (CDCl3): δ = 1,14 (s, 3H), 1,15 (s, 3H), 1,80 (s, 3H), 2,09 (s, 3H), 3,16 (s, 3H), 3,31 (s, 2H), 3,70 (s, 3H), 4,19-4,21 (m, 2H), 4,41-4,44 (m, 2H), 4,57 (s, 2H), 4,91 (s, 1H), 5,03 (s, 1H), 5,51 (d, J=7,1 Hz, 1H), 6,11 (d, J=6,4 Hz, 1H), 6,12 (d, J=7,1 Hz, 1H), 6,21 (d, J=6,4 Hz, 1H), 6,44 (dd, J=2,9, 6,6 Hz, 1H), 6,68 (dd, J=2,9, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=5,0 Hz, 1H), 7,73 (d, J=8,8 Hz, 2H), 8,82 (d, J=5,0 Hz, 2H)
[0189] Пример 7
Циклогексанкарбоновой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
(7a) Циклогексанкарбоновой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
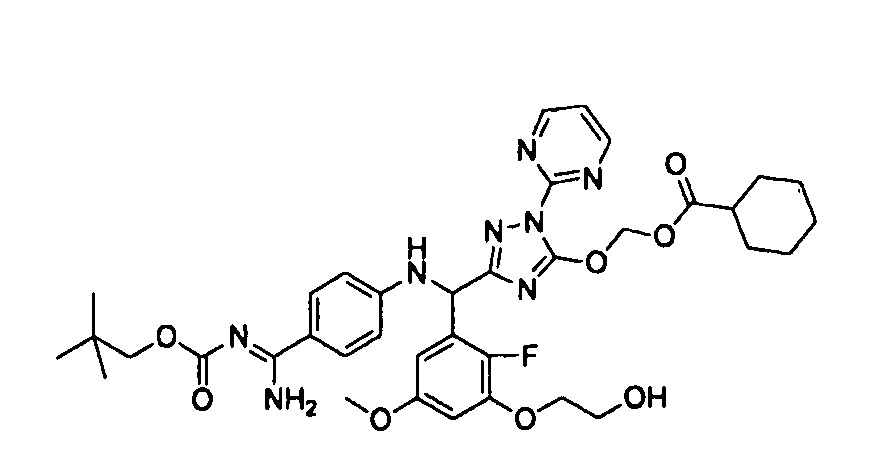
К смеси [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (пример 2b, 120 мг), гидрокарбоната калия (131 мг) и DMF (16 мл) добавляли йодид натрия (140 мг) и циклогексанкарбоновую кислоту (163 мг) и полученную в результате смесь перемешивали при 45°C в течение ночи. После охлаждения реакционной смеси до комнатной температуры к ней добавляли лед и насыщенный водный раствор хлорида аммония, а полученную в результате смесь экстрагировали трижды смесью THF и этилацетата. Собирали органический слой, промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (123 мг).
1H-ЯМР (CD3OD): δ = 0,93 (s, 9H), 1,16-1,40 (m, 6H), 1,55-1,65 (m, 2H), 1,70-1,82 (m, 2H), 2,27-2,40 (m, 1H), 3,73 (s, 3H), 3,80 (s, 2H), 3,86 (t, J=6,0 Hz, 2H), 4,08 (t, J=6,0 Hz, 2H), 6,03 (s, 1H), 6,10 (d, J=5,6 Hz, 1H), 6,14 (d, J=5,6 Hz, 1H), 6,60 (dd, J=2,8, 6,8 Hz, 1H), 6,73 (dd, J=2,8, 4,8 Hz, 1H), 6,79 (d, J=7,2 Hz, 2H), 7,47 (t, J=4,8 Hz, 1H), 7,71 (d, J=7,2 Hz, 2H), 8,86 (d, J=4,8 Hz, 2H)
[0190] (7b) Циклогексанкарбоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
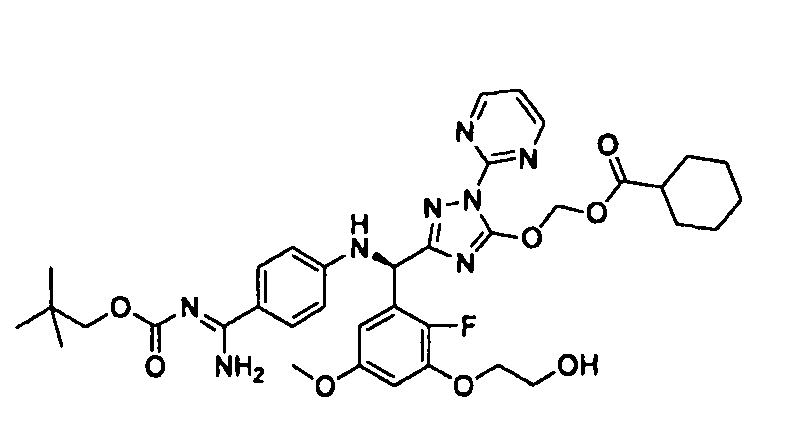
С использованием колонки SUMICHIRAL OA-2500 циклогексанкарбоновой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (123 мг) оптически отделяли при нижеупомянутых условиях с получением грубо очищенного продукта названного соединения в последней фракции.
Время удерживания ВЭЖХ; 11 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
Полученный грубо очищенный продукт очищали снова с использованием колонки SUMICHIRAL OA-2500S (20 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (42 мг).
[0191] (7c) Циклогексанкарбоновой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
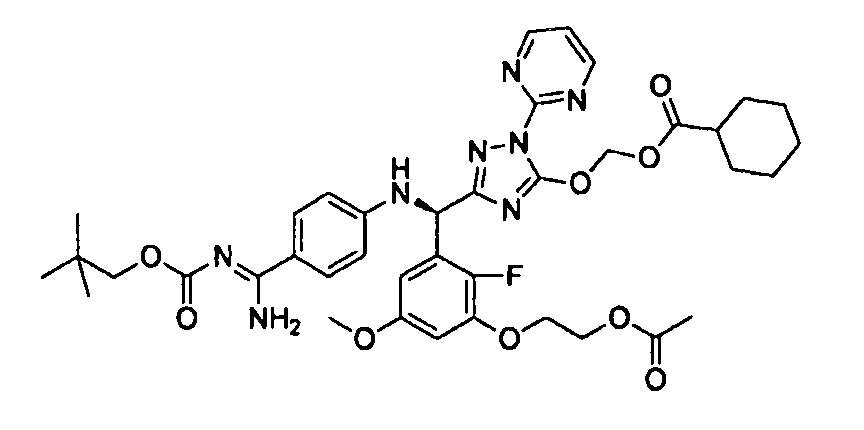
Циклогексанкарбоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (42 мг), DMAP (1 мг) и триэтиламин (0,0648 мл) растворяли в DMF (3 мл) и дихлорметане (3 мл). К раствору медленно добавляли смесь TFFH (30,7 мг), уксусной кислоты (0,00665 мл) и дихлорметана (3 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов. После концентрирования реакционной смеси при пониженном давлении к полученному остатку добавляли лед, THF, насыщенный водный раствор гидрокарбоната натрия и насыщенный водный раствор хлорида аммония, а полученную в результате смесь экстрагировали смесью THF и этилацетата. Органический слой промывали насыщенным водным раствором хлорида аммония и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток грубо очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением грубо очищенного продукта названного соединения.
Полученный грубо очищенный продукт очищали с использованием колонки SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: раствор метанола, скорость элюирования: 30 мл/мин) с получением названного соединения (34,62 мг).
1H-ЯМР (CD3OD): δ = 0,98 (s, 9H), 1,14-1,38 (m, 6H), 1,55-1,70 (m, 2H), 1,74-1,82 (m, 2H), 2,05 (s, 3H), 2,28-2,37 (m, 1H), 3,72 (s, 3H), 3,82 (s, 2H), 4,23 (t, J=4,4 Hz, 2H), 4,40 (t, J=4,4 Hz, 2H), 6,06 (s, 1H), 6,10 (d, J=5,6 Hz, 1H), 6,12 (d, J=5,6 Hz, 1H), 6,60 (dd, J=2,8, 6,8 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,79 (d, J=8,0 Hz, 2H), 7,48 (t, J=4,8 Hz, 1H), 7,71 (d, J=8,0 Hz, 2H), 8,86 (d, J=4,8 Hz, 2H)
[0192] Пример 8
2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира циклогексиловый сложный эфир
(8a) 2,2-диметилмалоновой кислоты трет-бутилового сложного эфира циклогексиловый сложный эфир
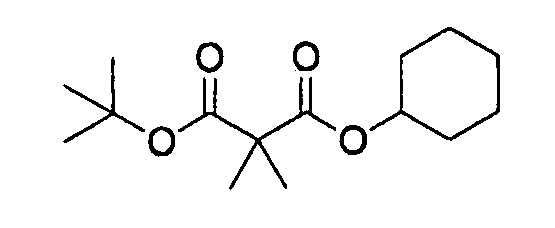
К смеси 2,2-диметилмалоновой кислоты моно-трет-бутилового сложного эфира [CAS № 143688-40-8] (800 мг), DMAP (104 мг) и дихлорметана (8 мл) последовательно добавляли циклогексанол (0,494 мл) и WSC (976 мг) при 0°C. Полученную в результате смесь перемешивали в течение ночи при комнатной температуре и добавляли в нее TBME (50 мл). Полученную в результате смесь последовательно промывали водой (30 мл) и насыщенным водным раствором хлорида натрия (30 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (817 мг).
1H-ЯМР (CDCl3): δ = 1,24-1,56 (m, 6H), 1,37 (s, 6H), 1,44 (s, 9H), 1,69-1,74 (m, 2H), 1,79-1,85 (m, 2H), 4,77-4,83 (m, 1H)
[0193] (8b) 2,2-диметилмалоновой кислоты моноциклогексиловый сложный эфир
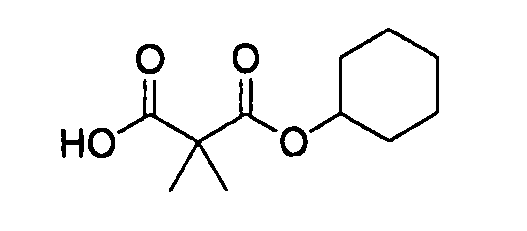
К смеси 2,2-диметилмалоновой кислоты трет-бутилового сложного эфира циклогексилового сложного эфира (817 мг) и дихлорметана (7,5 мл) добавляли TFA (1,5 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 2,5 часов. К полученной в результате смеси добавляли этилацетат (100 мл). Полученную в результате смесь последовательно промывали водой (30 мл) и насыщенным водным раствором хлорида натрия (30 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали и к полученному фильтрату добавляли толуол (10 мл), после чего фильтрат концентрировали при пониженном давлении с получением названного соединения (571 мг).
1H-ЯМР (CDCl3): δ = 1,28-1,54 (m, 6H), 1,47 (s, 6H), 1,66-1,73 (m, 2H), 1,78-1,83 (m, 2H), 4,81-4,87 (m, 1H)
[0194] (8c) 2,2-диметилмалоновой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира циклогексиловый сложный эфир
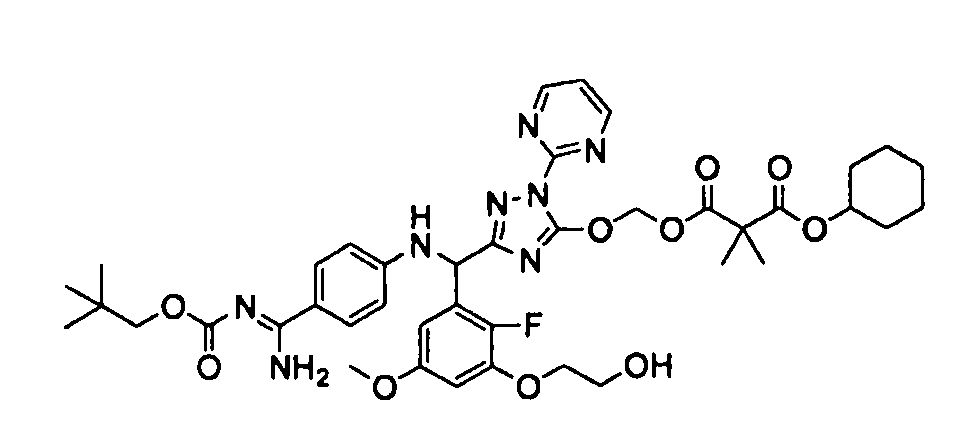
К смеси [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (пример 2b, 80 мг) и DMF (5 мл) добавляли йодид натрия (183 мг), гидрокарбонат калия (85,5 мг) и 2,2-диметилмалоновой кислоты моноциклогексиловый сложный эфир (261 мг) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 дней. К смеси добавляли этилацетат (30 мл) и воду (10 мл) и полученную в результате смесь встряхивали, после чего собирали органический слой. К водному слою добавляли этилацетат (20 мл) и полученную в результате смесь встряхивали, после чего собирали органический слой. Все органические слои объединяли, промывали насыщенным водным раствором хлорида натрия (10 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (97,9 мг).
1H-ЯМР (CDCl3): δ = 0,99 (s, 9H), 1,10-1,27 (m, 5H), 1,39 (s, 6H), 1,41-1,44 (m, 1H), 1,51-1,61 (m, 4H), 3,68 (s, 3H), 3,85 (s, 2H), 3,96 (t, J=4,4 Hz, 2H), 4,09 (t, J=4,4 Hz, 2H), 4,64-4,67 (m, 1H), 5,56 (d, J=7,2 Hz, 1H), 6,08 (d, J=7,2 Hz, 1H), 6,16 (d, J=5,6 Hz, 1H), 6,18 (d, J=5,6 Hz, 1H), 6,44 (dd, J=3,0, 6,6 Hz, 1H), 6,63 (dd, J=3,0, 4,6 Hz, 1H), 6,70 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,70 (d, J=8,8 Hz, 2H), 8,82 (d, J=4,8 Hz, 2H)
[0195] (8d) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира циклогексиловый сложный эфир
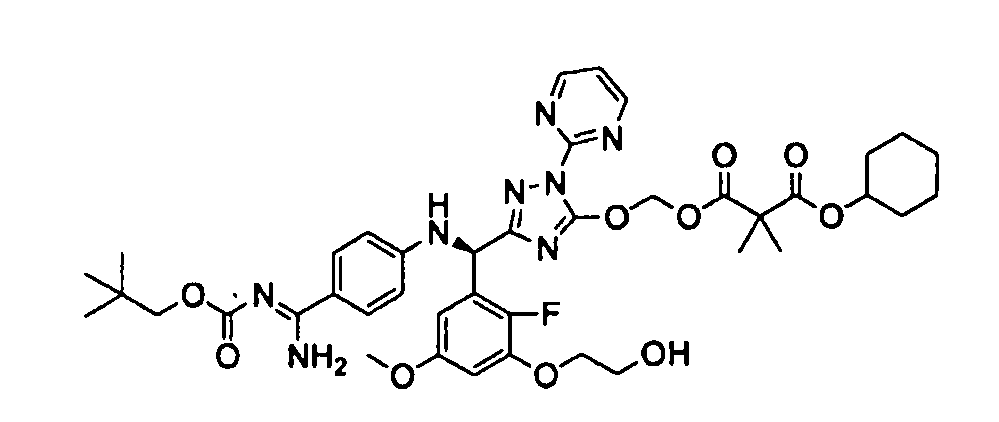
С использованием колонки SUMICHIRAL OA-2500S 2,2-диметилмалоновой кислоты 5-{(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира циклогексиловый сложный эфир (97,8 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (34,8 мг) в вышеупомянутой фракции.
Время удерживания ВЭЖХ; 12 минут (название колонки: SUMICHIRAL OA-2500S, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин)
1H-ЯМР (CDCl3): δ = 0,99 (s, 9H), 1,10-1,27 (m, 5H), 1,39 (s, 6H), 1,41-1,44 (m, 1H), 1,51-1,61 (m, 4H), 3,68 (s, 3H), 3,85 (s, 2H), 3,96 (t, J=4,4 Hz, 2H), 4,09 (t, J=4,4 Hz, 2H), 4,64-4,67 (m, 1H), 5,56 (d, J=7,2 Hz, 1H), 6,08 (d, J=7,2 Hz, 1H), 6,16 (d, J=5,6 Hz, 1H), 6,18 (d, J=5,6 Hz, 1H), 6,44 (dd, J=3,0, 6,6 Hz, 1H), 6,63 (dd, J=3,0, 4,6 Hz, 1H), 6,70 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,70 (d, J=8,8 Hz, 2H), 8,82 (d, J=4,8 Hz, 2H)
[0196] Пример 9
Угольной кислоты 1-(5-{(R)-(4-{амино[4-метилбензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир
(9a) N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]-4-метилбензамид
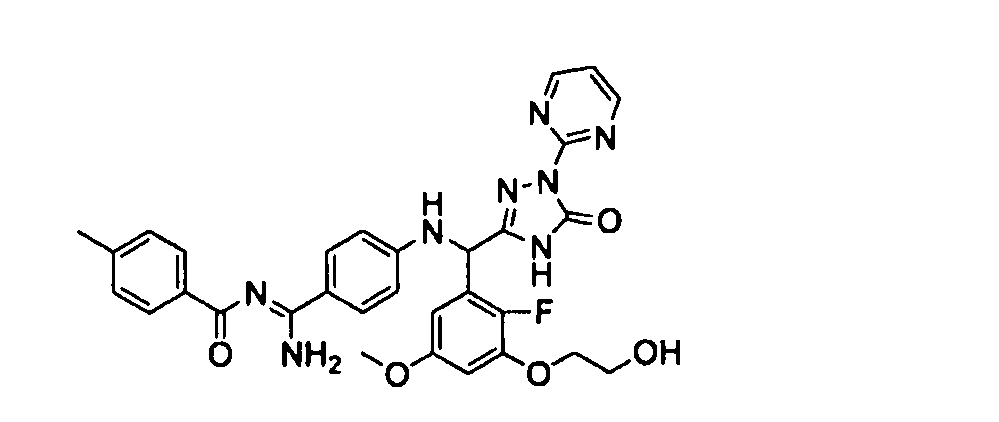
К смеси 4-({[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил}амино)бензамидиновой соли уксусной кислоты (1,6 г) и DMF (120 мл) добавляли 4-метилбензойной кислоты 4-нитрофениловый сложный эфир [CAS № 15023-67-3] (815 мг) и триэтиламин (1,21 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Растворитель из реакционного раствора отгоняли при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (1,01 г).
1H-ЯМР (CD3OD): δ = 2,39 (s, 3H), 3,73 (s, 3H), 3,89 (t, J=4,8 Hz, 2H), 4,11 (t, J=4,8 Hz, 2H), 6,00 (s, 1H), 6,65-6,67 (m, 2H), 6,83 (d, J=8,8 Hz, 2H), 7,25 (d, J=8,2 Hz, 2H), 7,35 (t, J=5,2 Hz, 1H), 7,96 (d, J=8,8 Hz, 2H), 8,12 (d, J=8,2 Hz, 2H), 8,78 (d, J=5,2 Hz, 2H)
[0197] (9b) Угольной кислоты 1-хлорэтилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир
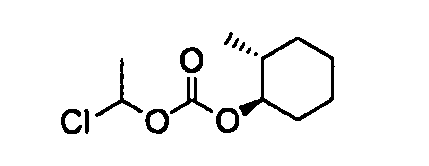
К смеси 1-хлорэтилхлорформиата [CSA № 50893-53-3] (0,416 мл), пиридина (0,624 мл) и THF (25 мл) добавляли (1R,2R)-2-метилциклогексанол [CSA № 19043-03-9] (441 мг), растворенный в THF (5 мл), при -78°C. После перемешивания в течение ночи при комнатной температуре к смеси добавляли этилацетат (100 мл) и гептан (100 мл). Полученную в результате смесь последовательно промывали 0,5н хлористоводородной кислотой (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл), водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении с получением названного соединения (482 мг).
1H-ЯМР (CDCl3): δ = 0,95 (d, J=6,0 Hz, 1,5H), 0,97 (d, J=6,4 Hz, 1,5H), 1,03-1,13 (m, 1H), 1,18-1,28 (m, 1H), 1,31-1,40 (m, 2H), 1,56-1,66 (m, 2H), 1,68-1,82 (m, 2H), 1,84 (d, J=10,0 Hz, 1,5H), 1,86 (d, J=9,6 Hz, 1,5H), 2,03-2,11 (m, 1H), 4,32 (q, J=9,6 Hz, 0,5H), 4,33 (q, J=10,0 Hz, 0,5H), 6,42-6,48 (m, 1H)
[0198] (9c) Угольной кислоты 1-(5-{(4-{амино[4-метилбензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир
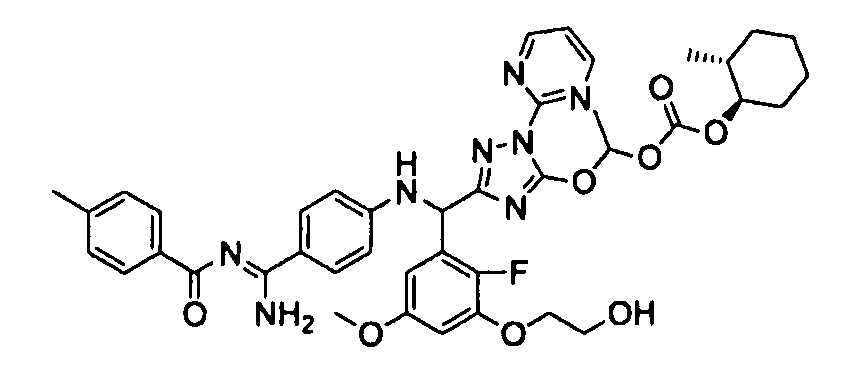
К смеси N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]-4-метилбензамида (230 мг) и DMF (3 мл) последовательно добавляли гидрокарбонат калия (113 мг) и угольной кислоты 1-хлорэтилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир (250 мг) и полученную в результате смесь перемешивали при 55°C в течение 24 часов и при комнатной температуре в течение следующих 2 дней. Реакционный раствор очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды) с получением названного соединения (129,2 мг).
[0199] (9d) Угольной кислоты 1-(5-{(R)-(4-{амино[4-метилбензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир
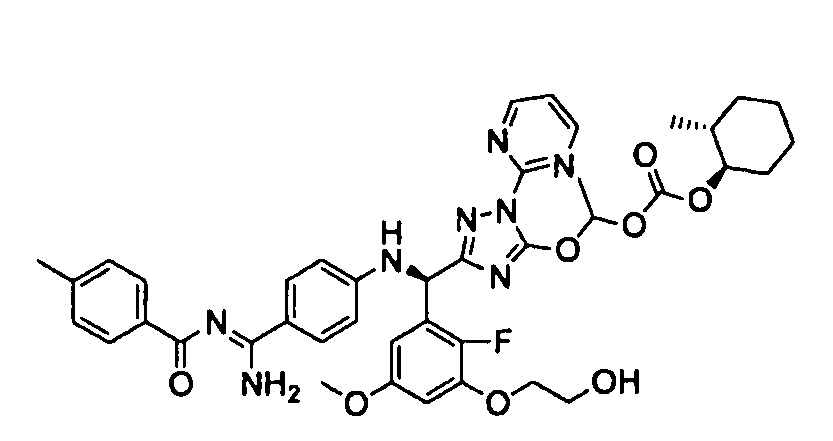
С использованием колонки SUMICHIRAL OA-2500 угольной кислоты 1-(5-{(4-{амино[4-метилбензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1R,2R)-2-метилциклогексиловый сложный эфир (129 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением грубо очищенного продукта названного соединения, диастереомерной смеси, в третьей фракции.
Время удерживания ВЭЖХ; 15 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
Полученный грубо очищенный продукт очищали снова с использованием колонки SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (15,6 мг) в качестве диастереомерной смеси.
1H-ЯМР (CDCl3): δ = 0,91 (d, J=6,4 Hz, 3H), 0,98-1,08 (m, 1H), 1,11-1,27 (m, 3H), 1,48-1,55 (m, 1H), 1,56-1,61 (m, 1H), 1,68-1,76 (m, 2H), 1,78 (d, J=5,2 Hz, 3H), 1,91-1,95 (m, 1H), 2,40 (s, 3H), 3,70 (s, 3H), 3,97 (t, J=4,4 Hz, 2H), 4,10 (t, J=4,4 Hz, 2H), 4,23 (dt, J=4,4, 10,0 Hz, 1H), 5,54 (d, J=6,8 Hz, 1H), 6,13 (d, J=6,8 Hz, 1H), 6,44 (dd, J=2,8, 6,8 Hz, 1H), 6,64 (dd, J=2,8, 4,8 Hz, 1H), 6,74 (d, J=8,8 Hz, 2H), 6,97 (q, J=5,2 Hz, 1H), 7,23 (d, J=8,4 Hz, 2H), 7,28 (t, J=5,2 Hz, 1H), 7,88 (d, J=8,8 Hz, 2H), 8,24 (d, J=8,4 Hz, 2H), 8,81 (d, J=5,2 Hz, 2H)
[0200] Пример 10
2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир
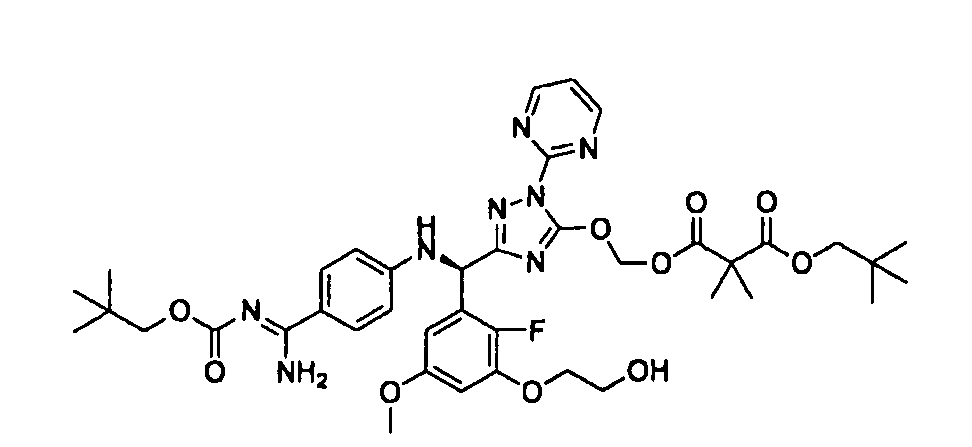
К смеси 2,2-диметилмалоновой кислоты 5-{(4-карбамимидоилфениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропилового сложного эфира ацетата (пример 18e, 70 мг) и DMA (2 мл) добавляли угольной кислоты 2,2-диметилпропилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 158810-98-1] (70 мг) и триэтиламин (0,07 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением рацемата названного соединения.
Рацемат оптически отделяли при нижеупомянутых условиях с использованием колонки SUMICHIRAL OA-2500 с получением грубо очищенного продукта названного соединения в последней фракции.
Время удерживания ВЭЖХ; 14 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин)
Полученный грубо очищенный продукт очищали снова с использованием колонки SUMICHIRAL OA-2500S (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 15 мл/мин) с получением названного соединения (15,77 мг).
1H-ЯМР (CD3OD): δ = 0,71 (s, 9H), 0,98 (s, 9H), 1,35 (s, 3H), 1,37 (s, 3H), 3,55 (d, J=10,4 Hz, 1H), 3,59 (d, J=10,4 Hz, 1H), 3,72 (s, 3H), 3,81 (s, 2H), 3,88 (t, J=4,8 Hz, 2H), 4,08 (t, J=4,8 Hz, 2H), 6,06 (s, 1H), 6,13-6,17 (m, 2H), 6,60 (dd, J=2,8, 6,8 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,78-6,80 (m, 2H), 7,48 (t, J=4,8 Hz, 1H), 7,70-7,72 (m, 2H), 8,87 (d, J=4,8 Hz, 2H)
[0201] Пример 11-1
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир (диастереомер 1)
Пример 11-2
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир (диастереомер 2)
[0202] (11a) Угольной кислоты 1-хлорэтилового сложного эфира (R)-1-метилбутиловый сложный эфир
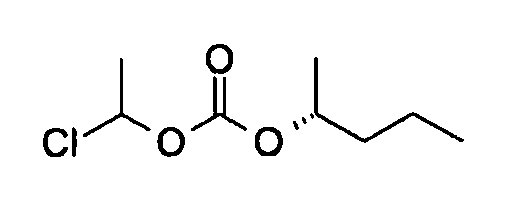
К смеси 1-хлорэтилхлорформиата (1,19 мл), пиридина (1,49 мл) и THF (100 мл) добавляли (R)-(-)-2-пентанол [CSA № 31087-44-2] (1 мл), растворенный в THF (3 мл), при -78°C. После перемешивания смеси в течение ночи при комнатной температуре к реакционной смеси добавляли этилацетат и гептан. Полученную в результате смесь последовательно промывали 0,5н хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении с получением названного соединения (1,8 г) в качестве неочищенного продукта.
1H-ЯМР (CDCl3): δ = 0,93 (td, J=7,2, 2,4 Hz, 3H), 1,31 (dd, J=7,2, 6,4 Hz, 3H), 1,36-1,44 (m, 2H), 1,47-1,57 (m, 1H), 1,62-1,73 (m, 1H), 1,83 (d, J=5,6 Hz, 3H), 4,80-4,87 (m, 1H), 6,43 (q, J=5,6 Hz, 1H)
[0203] (11b) Угольной кислоты 1-(5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир
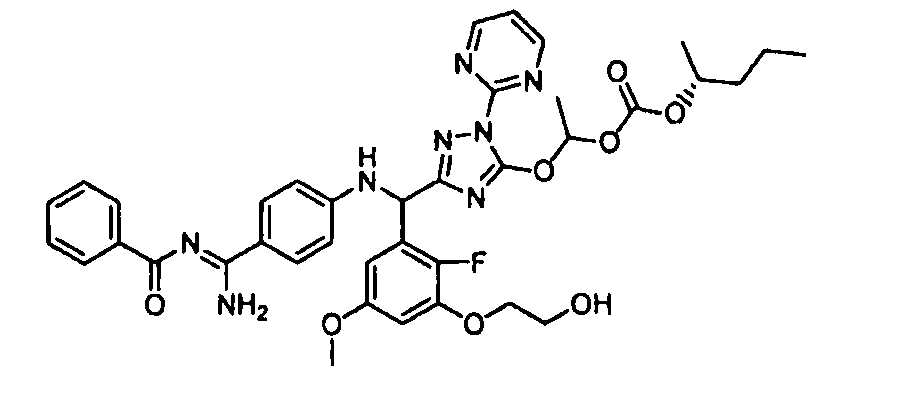
К смеси N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 1a, 150 мг) и DMF (3 мл) последовательно добавляли гидрокарбонат калия (150 мг) и угольной кислоты 1-хлорэтилового сложного эфира (R)-1-метилбутиловый сложный эфир (150 мг) и полученную в результате смесь перемешивали при 55°C в течение 18 часов. Реакционную смесь очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды) с получением названного соединения (130 мг).
[0204] (11c) Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир
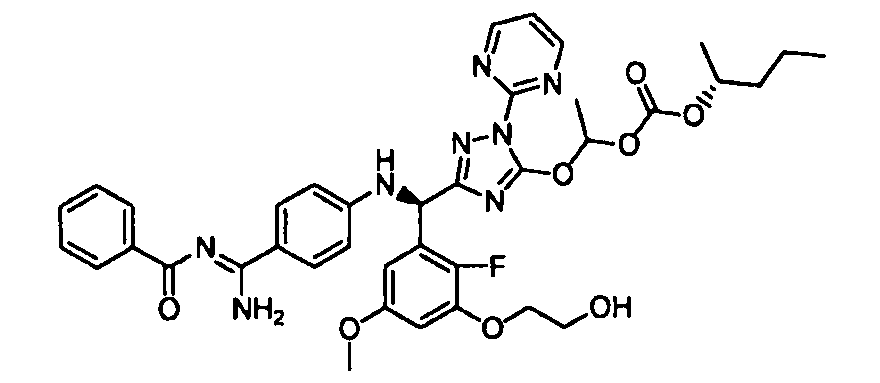
С использованием колонки SUMICHIRAL OA-2500 угольной кислоты 1-(5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (R)-1-метилбутиловый сложный эфир (130 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения в третьей фракции (23,7 мг) и четвертой фракции (26,8 мг).
Время удерживания ВЭЖХ; (третья фракция) 12 минут, (четвертая фракция) 14 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
Третья фракция (диастереомер 1)
1H-ЯМР (CDCl3): δ = 0,86 (t, J=7,2 Hz, 3H), 1,26 (d, J=6,4 Hz, 3H), 1,26-1,40 (m, 2H), 1,42-1,52 (m, 1H), 1,58-1,68 (m, 1H), 1,74 (d, J=5,6 Hz, 3H), 3,70 (s, 3H), 3,98 (t, J=4,8 Hz, 2H), 4,12 (t, J=4,8 Hz, 2H), 4,76-4,79 (m, 1H), 5,61 (d, J=6,8 Hz, 1H), 6,12 (d, J=6,8 Hz, 1H), 6,45 (dd, J=6,8, 2,8 Hz, 1H), 6,62 (dd, J=4,8, 2,8 Hz, 1H), 6,77 (d, J=8,8 Hz, 2H), 6,95 (q, J=5,6 Hz, 1H), 7,28 (t, J=5,2 Hz, 1H), 7,40-7,49 (m, 3H), 7,90 (d, J=8,8 Hz, 2H), 8,34-8,37 (m, 2H), 8,82 (d, J=5,2 Hz, 2H)
Четвертая фракция (диастереомер 2)
1H-ЯМР (CDCl3): δ = 0,89 (t, J=7,6 Hz, 3H), 1,19 (d, J=6,4 Hz, 3H), 1,26-1,40 (m, 2H), 1,42-1,52 (m, 1H), 1,56-1,68 (m, 1H), 1,77 (d, J=5,6 Hz, 3H), 3,69 (s, 3H), 3,69-3,98 (m, 2H), 4,08-4,12 (m, 2H), 4,72-4,77 (m, 1H), 5,58 (d, J=6,8 Hz, 1H), 6,13 (d, J=6,8 Hz, 1H), 6,44 (dd, J=6,8, 2,8 Hz, 1H), 6,64 (dd, J=4,8, 2,8 Hz, 1H), 6,75 (d, J=8,8 Hz, 2H), 6,96 (q, J=5,6 Hz, 1H), 7,28 (t, J=5,2 Hz, 1H), 7,40-7,49 (m, 3H), 7,90 (d, J=8,8 Hz, 2H), 8,34-8,37 (m, 2H), 8,81 (d, J=5,2 Hz, 2H)
[0205] Пример 12
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1S,2S)-2-фторциклогексиловый сложный эфир
[0206] (12a) Угольной кислоты 1-хлорэтилового сложного эфира (1S,2S)-2-фторциклогексиловый сложный эфир
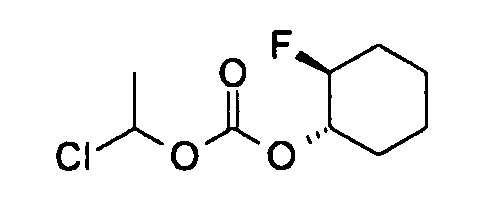
К смеси 1-хлорэтилхлорформиата (1,0 мл), пиридина (1,0 мл) и дихлорметана (30 мл) добавляли (1S,2S)-2-фторциклогексанол [CSA № 292150-03-9] (900 мг), растворенный в дихлорметане (10 мл), при -78°C. После перемешивания полученной в результате смеси в течение ночи при комнатной температуре добавляли дихлорметан (30 мл). Полученную в результате смесь последовательно промывали 0,5н хлористоводородной кислотой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (480 мг).
1H-ЯМР (CDCl3): δ = 1,24-1,64 (m, 4H), 1,70-1,81 (m, 2H), 1,84 (d, J=5,6 Hz, 3H), 2,08-2,22 (m, 2H), 4,36-4,57 (m, 1H), 4,72-4,82 (m, 1H), 6,27 (q, J=5,6 Hz, 1H)
[0207] (12b) N-[1-амино-1-(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамид
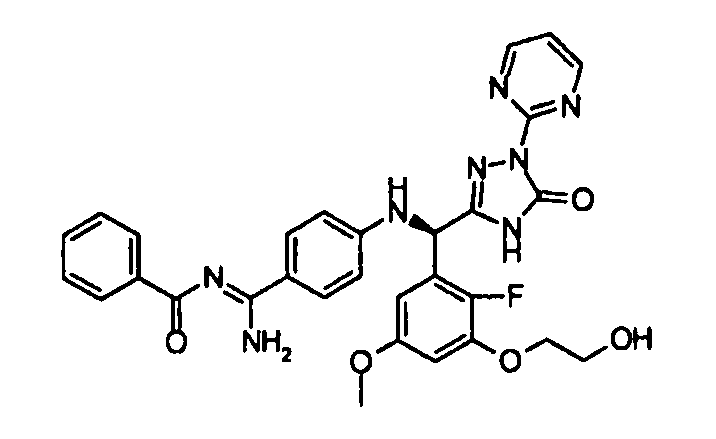
К смеси 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}бензамидиновой соли уксусной кислоты [CAS № 951803-91-1] (5,6 г) и DMF (200 мл) добавляли бензойной кислоты 4-нитрофениловый сложный эфир (2,89 г) и триэтиламин (4,7 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. В реакционный раствор добавляли уксусную кислоту (6,5 мл) и затем растворитель выпаривали при пониженном давлении. Полученный остаток грубо очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды, содержащий 0,1% уксусной кислоты) и полученный грубо очищенный продукт очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (4,48 г).
1H-ЯМР (CD3OD): δ = 3,73 (s, 3H), 3,35-3,43 (m, 2H), 4,08-4,15 (m, 2H), 6,00 (s, 1H), 6,61-6,71 (m, 2H), 6,85 (d, J=8,8 Hz, 2H), 7,37 (t, J=4,8 Hz, 1H), 7,42-7,56 (m, 3H), 7,98 (d, J=8,8 Hz, 2H), 8,22 (dd, J=1,2, 7,2 Hz, 2H), 8,79 (d, J=4,8 Hz, 2H)
[0208] (12c) Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)этилового сложного эфира (1S,2S)-2-фторциклогексиловый сложный эфир
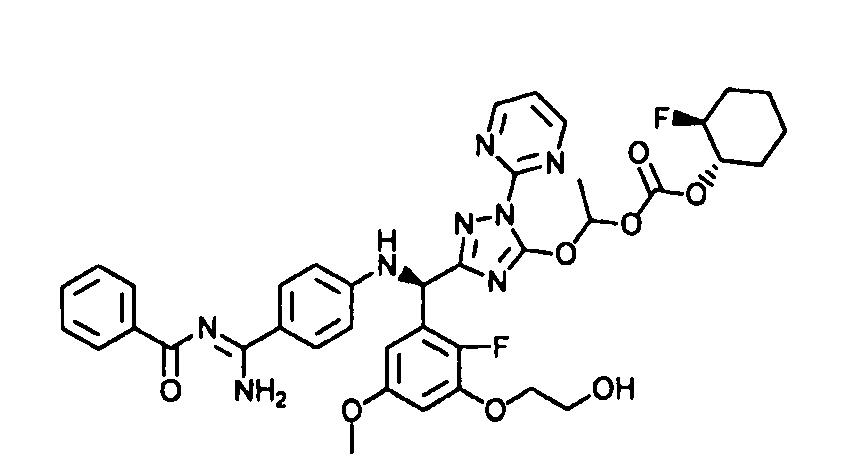
К смеси N-[1-амино-1-(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (200 мг) и DMF (3 мл) последовательно добавляли гидрокарбонат калия (200 мг), угольной кислоты 1-хлорэтилового сложного эфира (1S,2S)-2-фторциклогексиловый сложный эфир (200 мг) и йодид натрия (100 мг) и полученную в результате смесь перемешивали при 55°C в течение 24 часов. Реакционную смесь грубо очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из этилацетата и метанола) с получением названного соединения (110 мг) в качестве грубо очищенного продукта.
Полученный грубо очищенный продукт очищали с использованием SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (60,5 мг) в качестве диастереомерной смеси.
1H-ЯМР (CD3OD): δ = 1,24-1,64 (m, 4H), 1,70-1,81 (m, 2H), 1,75, 1,78 (каждое d, J=5,6 Hz, J=5,2 Hz, общее 3H), 2,05-2,22 (m, 2H), 3,69, 3,73 (каждое s, общее 3H), 3,98 (br.s, 2H), 4,09-4,13 (m, 2H), 4,32-4,55 (m, 1H), 4,68-4,80 (m, 1H), 5,54-5,57 (m, 1H), 6,12, 6,17 (каждое d, J=7,2 Hz, J=7,6 Hz, общее 1H), 6,43-6,47 (m, 1H), 6,30, 6,72 (каждое dd, J=4,8, 3,2 Hz, J=4,4, 2,8 Hz, общее 1H), 6,77 (d, J=8,8 Hz, 2H), 6,92, 6,98 (каждое q, J=4,4 Hz, общее 1H), 7,26-7,30 (m, 1H), 7,41-7,49 (m, 3H), 7,88-7,91 (m, 2H), 8,36 (d, J=7,2 Hz, 2H), 8,81-8,83 (m, 2H)
[0209] Пример 13
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира циклогексиловый сложный эфир
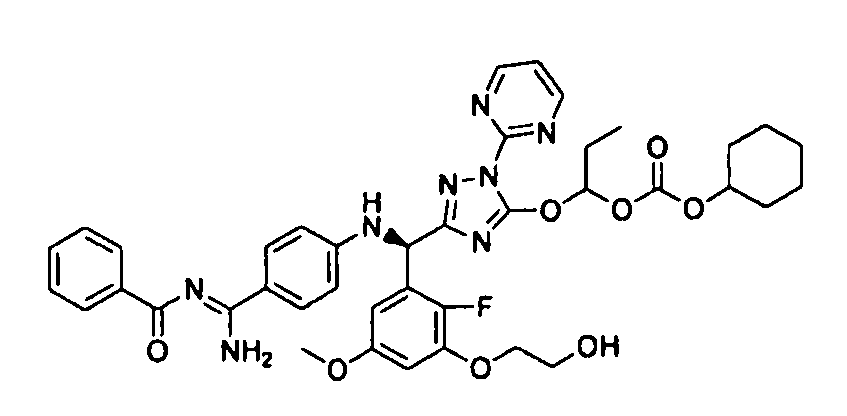
К смеси N-[1-амино-1-(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 12b, 200 мг) и DMA (2 мл) добавляли угольной кислоты 1-хлорпропилового сложного эфира циклогексиловый сложный эфир [CAS № 108098-53-9] (300 мг) и гидрокарбонат калия (100 мг) и полученную в результате смесь перемешивали при 55°C в течение 36 часов. Полученную в результате смесь вливали в этилацетат и воду. После встряхивания смеси собирали органический слой, дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток грубо очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением грубо очищенного продукта (120 мг).
Полученный грубо очищенный продукт очищали с использованием SUMICHIRAL OA-2500S (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (101 мг) в качестве диастереомерной смеси.
1H-ЯМР (CD3OD): δ = 1,06, 1,08 (каждое t, J=7,2 Hz, 3H), 1,22-1,39 (m, 5H), 1,47-1,52 (m, 1H), 1,59-1,87 (m, 4H), 1,98-2,06 (m, 2H), 3,72, 3,73 (каждое s, 3H), 3,89 (t, J=4,4 Hz, 2H), 4,10 (t, J=4,4 Hz, 2H), 4,47-4,54 (m, 1H), 6,08 (s, 1H), 6,61 (dd, J=2,4, 6,4 Hz, 1H), 6,71-6,84 (m, 4H), 7,41-7,52 (m, 4H), 7,97 (d, J=8,4 Hz, 2H), 8,24 (d, J=8,4 Hz, 2H), 8,87 (d, J=4,8 Hz, 2H)
[0210] Пример 14
Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира транс-2-фтор-циклогексиловый сложный эфир
(14a) Угольной кислоты 1-хлорпропилового сложного эфира транс-2-фторциклогексиловый сложный эфир
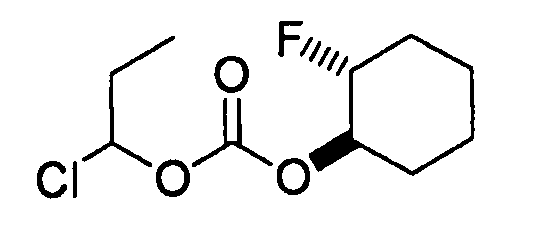
1-Хлорпропилхлорформиат [CAS № 92600-20-9] (2,99 г) и пиридин (1,62 мл) растворяли в дихлорметане (30 мл) и раствор транс-2-фторциклогексанола [CAS № 14365-32-3] (2,36 г) в дихлорметане каплями добавляли туда при ледяном охлаждении. После перемешивания полученной в результате смеси в течение ночи при комнатной температуре реакционную смесь разбавляли этилацетатом и последовательно промывали 1н хлористоводородной кислотой, водой и насыщенным водным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (2,731 г).
1H-ЯМР (CDCl3): δ = 1,08 (t, J=7,2 Hz, 3H), 1,22-1,52 (m, 3H), 1,52-1,62 (m, 1H), 1,70-1,81 (m, 2H), 2,03-2,21 (m, 4H), 4,37-4,57 (m, 1H), 4,73-4,81 (m, 1H), 6,27 (q, J=7,2 Hz, 1H)
[0211] (14b) Угольной кислоты 1-(5-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илокси)пропилового сложного эфира транс-2-фтор-циклогексиловый сложный эфир
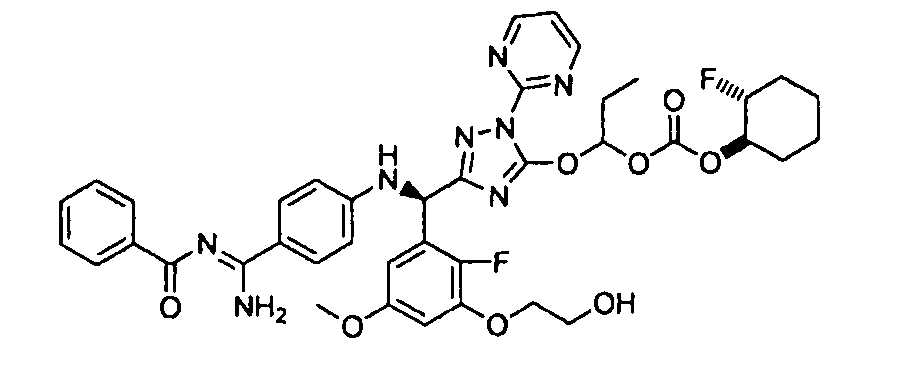
К смеси N-[1-амино-1-(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 12b, 500 мг) и DMF (5 мл) добавляли угольной кислоты 1-хлорпропилового сложного эфира транс-2-фторциклогексиловый сложный эфир (998 мг), йодид натрия (625 мг) и гидрокарбонат калия (100 мг) и полученную в результате смесь перемешивали при 40°C в течение 76 часов. К смеси добавляли воду и полученную в результате смесь экстрагировали этилацетатом. Органический слой дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток грубо очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из метанола и этилацетата) с получением грубо очищенного продукта.
Полученный грубо очищенный продукт очищали с использованием SUMICHIRAL OA-2500S при нижеупомянутых условиях с получением названного соединения (114 мг) в качестве диастереомерной смеси.
Время удерживания ВЭЖХ; 11 минут (название колонки: SUMICHIRAL OA-2500S, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
1H-ЯМР (CD3OD): δ = 1,07, 1,09 (каждое t, J=7,2 Hz, 3H), 1,18-1,36 (m, 3H), 1,40-1,54 (m, 1H), 1,58-1,64 (m, 2H), 1,94-2,10 (m, 4H), 3,73 (s, 3H), 3,89 (t, J=4,4 Hz, 2H), 4,10 (t, J=4,4 Hz, 2H), 4,23-4,44 (m, 1H), 4,52-4,64 (m, 1H), 6,07-6,11 (m, 1H), 6,59-6,63 (m, 1H), 6,72-6,84 (m, 4H), 7,41-7,52 (m, 4H), 7,97 (d, J=8,8 Hz, 2H), 8,24 (d, J=8,4 Hz, 2H), 8,86, 8,87 (каждое d, J=4,4 Hz, 2H)
[0212] Пример 15
2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилпропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира этиловый сложный эфир
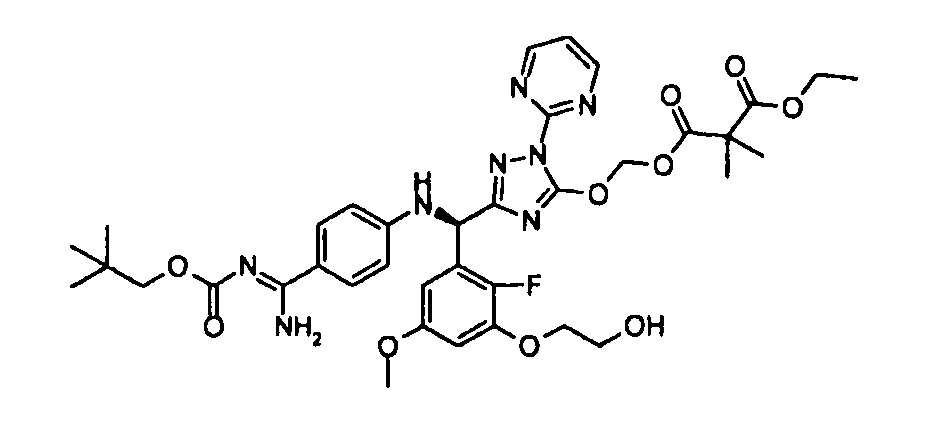
К смеси [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (пример 2b, 100 мг), гидрокарбоната калия (107 мг) и DMF (8 мл) добавляли йодид натрия (113 мг) и 2,2-диметилмалоновой кислоты моноэтиловый сложный эфир [CAS № 5471-77-2] (121 мг) и полученную в результате смесь перемешивали при 45°C в течение ночи. Реакционную смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением рацемата названного соединения.
С использованием колонки SUMICHIRAL OA-2500 рацемат названного соединения отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (36 мг) в последней фракции.
Время удерживания ВЭЖХ; 11 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
1H-ЯМР (CDCl3): δ = 0,96 (s, 9H), 1,05 (t, J=6,8 Hz, 3H), 1,37 (s, 6H), 3,66 (s, 3H), 3,83 (s, 2H), 3,94-4,02 (m, 4H), 4,08 (t, J=5,2 Hz, 2H), 5,59 (d, J=7,2 Hz, 1H), 6,06 (d, J=6,8 Hz, 1H), 6,14 (d, J=6,4 Hz, 1H), 6,16 (J=6,4 Hz, 1H), 6,42 (dd, J=2,8, 6,8 Hz, 1H), 6,59 (dd, J=3,2, 4,6 Hz, 1H), 6,67 (d, J=8,8 Hz, 2H), 7,29 (t, J=4,8 Hz, 1H), 7,65 (d, J=8,8 Hz, 2H), 8,80 (d, J=5,2 Hz, 2H)
[0213] Пример 16
2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино(2,2-диметилпропоксикарбонилимино)метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира изопропиловый сложный эфир
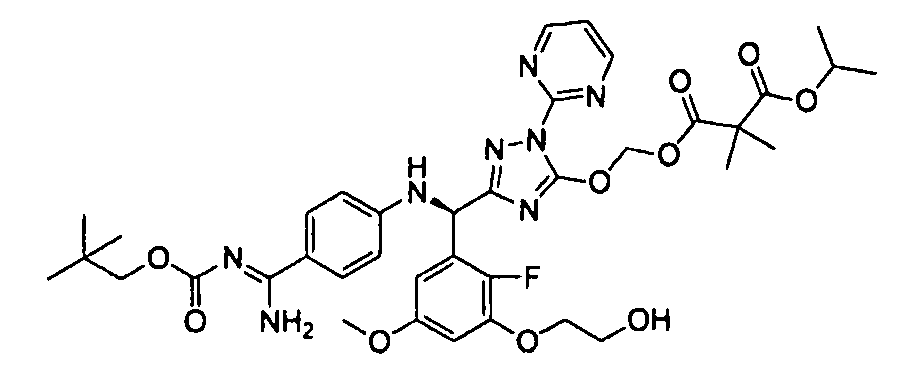
К смеси [1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]карбаминовой кислоты 2,2-диметилпропилового сложного эфира (пример 2b, 70 мг), гидрокарбоната калия (74 мг) и DMF (5 мл) добавляли йодид натрия (79 мг) и 2,2-диметилмалоновой кислоты моноизопропиловый сложный эфир [CAS № 7695-26-3] (92 мг) и полученную в результате смесь перемешивали при 45°C в течение ночи. Реакционную смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением рацемата названного соединения.
С использованием колонки SUMICHIRAL OA-2500 полученный рацемат отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (28 мг) в последней фракции.
Время удерживания ВЭЖХ; 11 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин)
1H-ЯМР (CDCl3): δ = 0,99 (s, 9H), 1,06 (d, 6,4 Hz, 3H), 1,07 (d, 6,4 Hz, 3H), 1,38 (s, 6H), 3,70 (s, 3H), 3,86 (s, 2H), 3,96 (t, J=3,6 Hz, 2H), 4,11 (t, J=4,4 Hz, 2H), 4,90 (sept, J=6,0 Hz, 1H), 5,51 (d, J=7,2 Hz, 1H), 6,10 (d, J=7,2 Hz, 1H), 6,16 (d, J=5,6 Hz, 1H), 6,19 (d, J=5,6 Hz, 1H), 6,45 (dd, J=2,8, 6,6 Hz, 1H), 6,63 (dd, J=2,8, 4,6 Hz, 1H), 6,71 (d, J=8,4 Hz, 2H), 7,31 (t, J=4,8 Hz, 1H), 7,71 (d, J=8,4 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H)
[0214] Пример 17
Изоникотиновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
(17a) Изоникотиновой кислоты 2-{3-[(4-{амино[бензоилимино]метил}фениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир
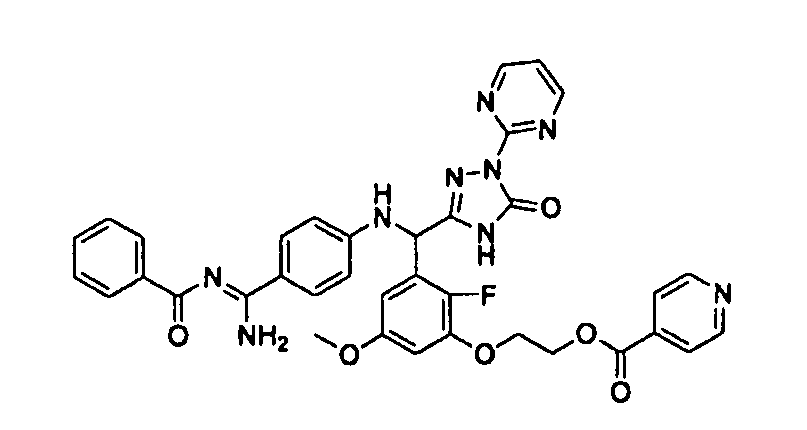
В атмосфере азота триэтиламин (0,348 мл) добавляли при ледяном охлаждении к смеси 4-пиридинкарбоновой кислоты [CAS № 55-22-1] (61,6 мг), TFFH (132 мг) и дихлорметана (5 мл) и полученную в результате смесь перемешивали в течение 1 часа. К смеси каплями добавляли смесь N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамида (пример 1a, 150 мг), DMAP (5 мг) и DMF (2,5 мл). После перемешивания полученной в результате смеси при комнатной температуре в течение 3 дней растворитель в смеси концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды, содержащий 0,1% уксусной кислоты) с получением названного соединения (188 мг).
1H-ЯМР (CD3OD): δ = 3,71 (s, 3H), 4,43 (t, J=4,4 Hz, 2H), 4,71 (t, J=4,4 Hz, 2H), 6,02 (s, 1H), 6,64-6,67 (m, 1H), 6,75-6,78 (m, 1H), 6,86 (d, J=8,8 Hz, 2H), 7,35 (t, J=4,8 Hz, 1H), 7,48 (t, J=6,8 Hz, 2H), 7,57 (t, J=6,8 Hz, 1H), 7,87 (d, J=6,0 Hz, 2H), 7,90 (d, J=8,8 Hz, 2H), 8,16 (d, J=6,8 Hz, 2H), 8,66 (d, J=6,0 Hz, 2H), 8,76 (d, J=4,8 Hz, 2H)
[0215] (17b) Изоникотиновой кислоты 2-(3-{(4-{амино[бензоилимино]метил}фениламино)-[5-(2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
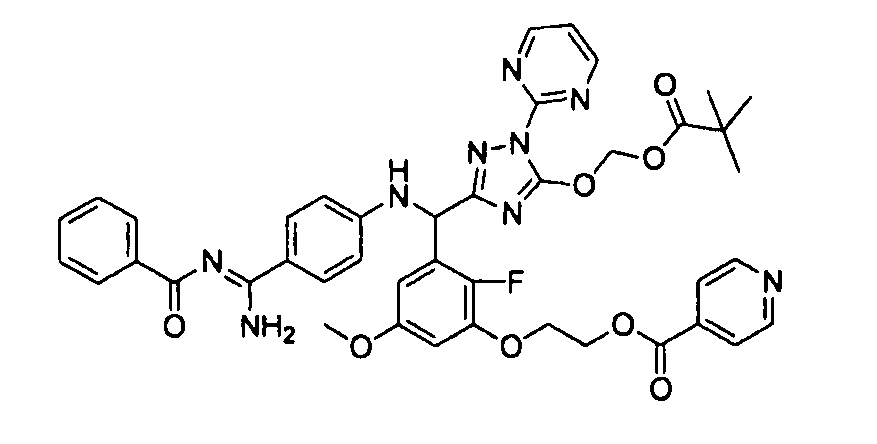
В атмосфере азота смесь изоникотиновой кислоты 2-{3-[(4-{амино[бензоилимино]метил}фениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (31,3 мг), 2,2-диметилпропионовой кислоты хлорметилового сложного эфира (9,1 мг), гидрокарбоната калия (6,7 мг) и DMF (2 мл) перемешивали при 45°C в течение 20 часов. Смесь вливали в этилацетат (100 мл) и воду (20 мл). После встряхивания смеси собирали органический слой, последовательно промывали трижды водой (20 мл) и насыщенным водным раствором хлорида натрия (20 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (12,2 мг).
1H-ЯМР (CDCl3): δ = 1,15 (s, 9H), 3,70 (s, 3H), 4,37 (t, J=5,0 Hz, 2H), 4,72 (t, J=5,0 Hz, 2H), 5,52 (d, J=7,0 Hz, 1H), 6,14 (d, J=6,3 Hz, 1H), 6,15 (d, J=6,3 Hz, 1H), 6,16 (d, J=7,0 Hz, 1H), 6,49 (dd, J=2,9, 6,6 Hz, 1H), 6,69 (dd, J=2,9, 5,3 Hz, 1H), 6,77 (d, J=9,0 Hz, 2H), 7,31 (t, J=4,9 Hz, 1H), 7,43 (tt, J=1,3, 7,5 Hz, 2H), 7,49 (tt, J=1,3, 7,5 Hz, 1H), 7,85 (dd, J=1,1, 6,6 Hz, 2H), 7,89 (d, J=9,0 Hz, 2H), 8,36 (dd, J=1,3, 7,5 Hz, 2H), 8,77 (dd, J=1,1, 6,6 Hz, 2H), 8,84 (d, J=4,9 Hz, 2H)
[0216] (17c) Изоникотиновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
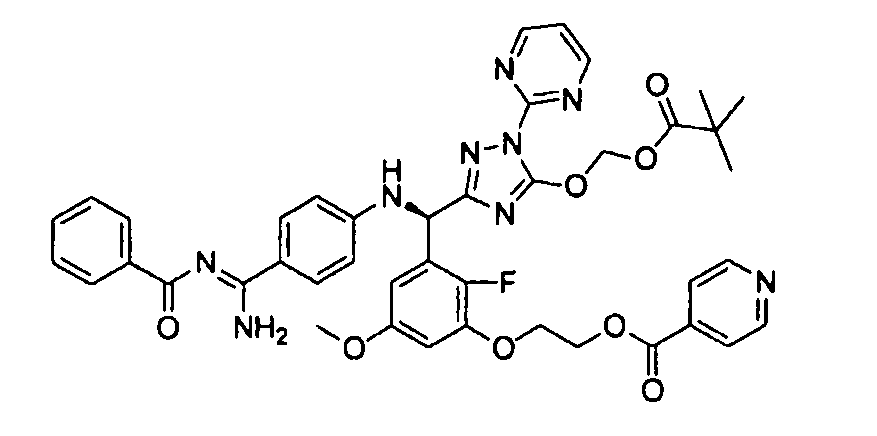
С использованием колонки SUMICHIRAL OA-2500S изоникотиновой кислоты 2-(3-{(4-{амино[бензоилимино]метил}фениламино)-[5-(2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир (12,2 мг) отделяли (оптическое разделение) при нижеупомянутых условиях с получением названного соединения (3,8 мг) в вышеупомянутой фракции.
Время удерживания ВЭЖХ; 10 минут (название колонки: SUMICHIRAL OA-2500S, 20 мм φ × 25 см, подвижная фаза: ацетонитрил, скорость элюирования: 20 мл/мин)
[0217] Пример 18
2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир
(18a) Угольной кислоты 2,2-диметилбутилового сложного эфира 4-нитрофениловый сложный эфир
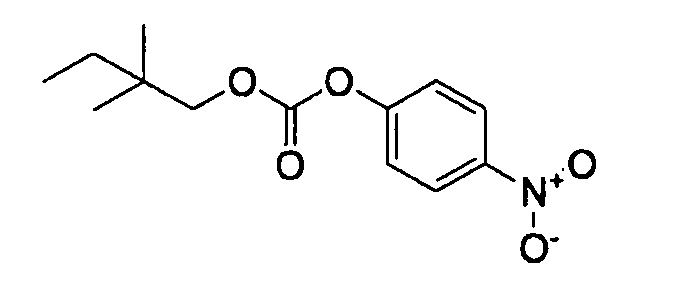
К смеси 4-нитрофенилхлорформиата (1,97 г), 2,2-диметилбутан-1-ола [CAS № 1185-33-7] (1 г) и дихлорметана (30 мл) добавляли пиридин (1,58 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 дней. К смеси добавляли этилацетат и 1н хлористоводородную кислоту. После встряхивания полученной в результате смеси собирали органический слой, дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (2,23 г).
1H-ЯМР (CDCl3): δ = 0,89 (t, J=7,6 Hz, 3H), 0,97 (s, 6H), 1,38 (q, J=7,6 Hz, 2H), 4,02 (s, 2H), 7,38 (d, J=8,8 Hz, 2H), 8,29 (d, J=8,8 Hz, 2H)
[0218] (18b) 2,2-диметилмалоновой кислоты моно-(2,2-диметилпропил)сложный эфир
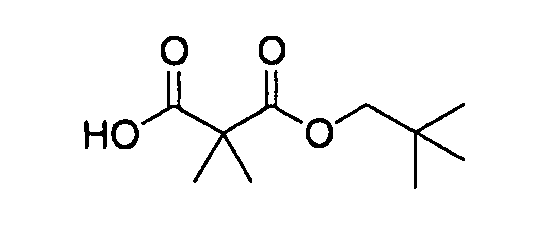
К смеси 2,2-диметилмалоновой кислоты моно-трет-бутилового сложного эфира (10 г), 2,2-диметил-1-пропанола [CAS № 75-84-3] (5,15 г), DMAP (1,3 г) и дихлорметана (100 мл) добавляли WSC (12,2 г) при перемешивании при ледяном охлаждении и полученную в результате смесь перемешивали при комнатной температуре в течение 2 дней. TBME и воду добавляли к смеси и полученную в результате смесь экстрагировали. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением 2,2-диметилмалоновой кислоты трет-бутилового сложного эфира(2,2-диметилпропил)сложного эфира (12 г).
К раствору полученного 2,2-диметилмалоновой кислоты трет-бутилового сложного эфира (2,2-диметилпропил)сложного эфира (12 г) в дихлорметане (100 мл) добавляли TFA (20 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов. К смеси добавляли этилацетат и воду. После встряхивания полученной в результате смеси собирали органический слой, последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали и к полученному фильтрату добавляли толуол, после чего полученную в результате смесь концентрировали при пониженном давлении с получением названного соединения (8,7 г).
1H-ЯМР (CD3OD): δ = 0,94 (s, 9H), 1,41 (s, 6H), 3,81 (s, 2H)
[0219] (18c) N-[1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]бензамид
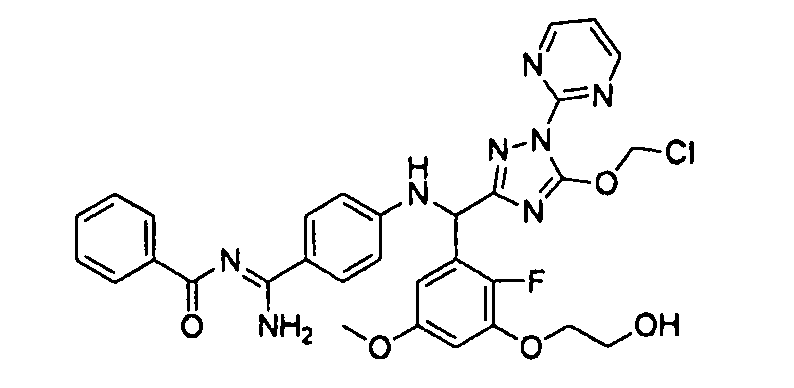
К смеси дихлорметана (20 мл), THF (20 мл) и воды (20 мл) последовательно добавляли N-[1-амино-1-(4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]триазол-3-ил)метил]амино}фенил)метилиден]бензамид (пример 1a, 901 мг), гидрокарбонат натрия (632 мг) и тетрабутиламмония гидросульфат (102 мг). После охлаждения полученной в результате смеси до -10°C в нее каплями добавляли при перемешивании смесь хлорметилхлорсульфата (373 мг) и дихлорметана (5 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Дихлорметан (10 мл), THF (10 мл) и воду (10 мл) добавляли к смеси и полученную в результате смесь охлаждали снова до -10°C, после чего каплями добавляли в нее смесь хлорметилхлорсульфата (373 мг) и дихлорметана (5 мл) при перемешивании и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (300 мл) и воду (100 мл) и полученную в результате смесь встряхивали, после чего собирали органический слой. К водному слою добавляли этилацетат (80 мл) и THF (20 мл) и полученную в результате смесь встряхивали снова, после чего собирали органический слой. Объединенные органические слои сушили над безводным сульфатом магния. Смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (340 мг).
1H-ЯМР (CD3OD): δ = 3,73 (s, 3H), 3,88 (t, J=5,0 Hz, 2H), 4,09 (t, J=5,0 Hz, 2H), 6,14 (s, 1H), 6,23 (d, J=6,8 Hz, 1H), 6,29 (d, J=6,8 Hz, 1H), 6,62 (dd, J=3,6, 8,3 Hz, 1H), 6,78 (dd, J=3,6, 5,1 Hz, 1H), 6,85 (d, J=8,7 Hz, 2H), 7,44 (t, J=7,6 Hz, 2H), 7,50 (t, J=4,7 Hz, 1H), 7,51 (t, J=7,6 Hz, 1H), 7,97 (d, J=8,7 Hz, 2H), 8,25 (d, J=7,6 Hz, 2H), 8,88 (d, J=4,7 Hz, 2H)
[0220] (18d) 2,2-диметилмалоновой кислоты 5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир
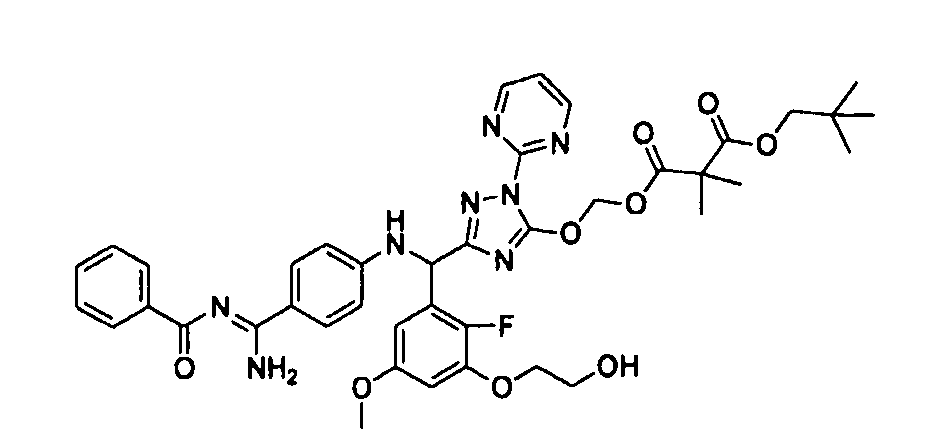
Смесь N-[1-амино-1-[4-({(5-хлорметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)фенил]метилиден]бензамида (500 мг), 2,2-диметилмалоновой кислоты моно-(2,2-диметилпропил)сложного эфира (1,56 г), йодида натрия (1,16 г), гидрокарбоната калия (543 мг) и DMA (50 мл) перемешивали при 50°C в течение 7 часов. После охлаждения смеси до комнатной температуры в нее добавляли этилацетат и полученную в результате смесь дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения (500 мг).
1H-ЯМР (CD3OD): δ = 0,70 (s, 9H), 1,36 (s, 3H), 1,37 (s, 3H), 3,55 (d, J=10,4 Hz, 1H), 3,59 (d, J=10,4 Hz, 1H), 3,73 (s, 3H), 3,85-3,93 (m, 2H), 4,05-4,12 (m, 2H), 6,10 (s, 1H), 6,15 (d, J=6,0 Hz, 1H), 6,16 (d, J=6,0 Hz, 1H), 6,61 (dd, J=2,8, 6,8 Hz, 1H), 6,76 (dd, J=2,8, 4,4 Hz, 1H), 6,84 (d, J=8,8 Hz, 2H), 7,40-7,53 (m, 4H), 7,98 (d, J=8,8 Hz, 2H), 8,22-8,28 (m, 2H), 8,87 (d, J=4,8 Hz, 2H)
[0221] (18e) 2,2-диметилмалоновой кислоты 5-{(4-карбамимидоилфениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропилового сложного эфира ацетат
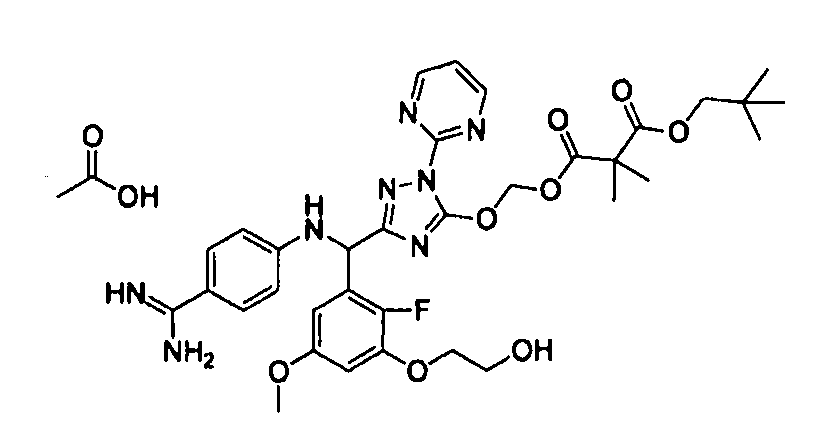
К смеси 2,2-диметилмалоновой кислоты 5-{(4-{амино[бензоилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропилового сложного эфира (500 мг) и метанола (4 мл) добавляли уксусную кислоту (1 мл) и полученную в результате смесь перемешивали при 40°C в течение 4 часов. Смесь концентрировали при пониженном давлении и полученный остаток очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из ацетонитрила и воды, содержащий 0,1% уксусной кислоты) с получением названного соединения (430 мг).
[0222] (18f) 2,2-диметилмалоновой кислоты 5-{(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир
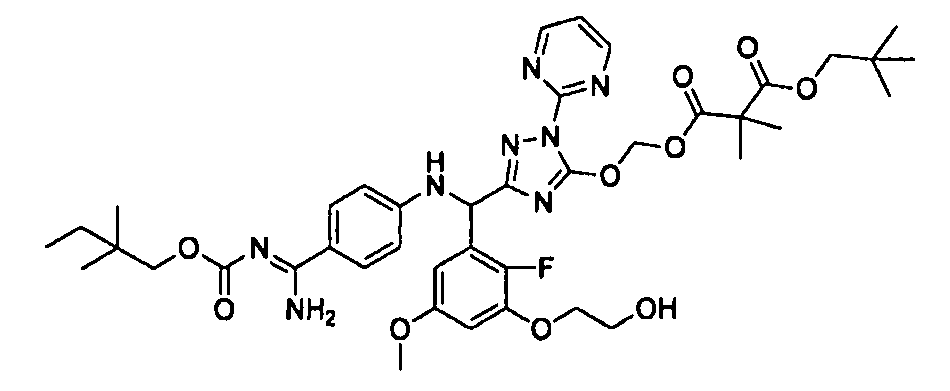
К смеси 2,2-диметилмалоновой кислоты 5-{(4-карбамимидоилфениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропилового сложного эфира ацетата (270 мг), угольной кислоты 2,2-диметилбутилового сложного эфира 4-нитрофенилового сложного эфира (141 мг) и THF (10 мл) добавляли триэтиламин (0,17 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 26 часов. В реакционный раствор добавляли уксусную кислоту (0,3 мл) и полученную в результате смесь концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из метанола и этилацетата) с получением названного соединения.
[0223] (18g) 2,2-диметилмалоновой кислоты 5-{(R)-(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир
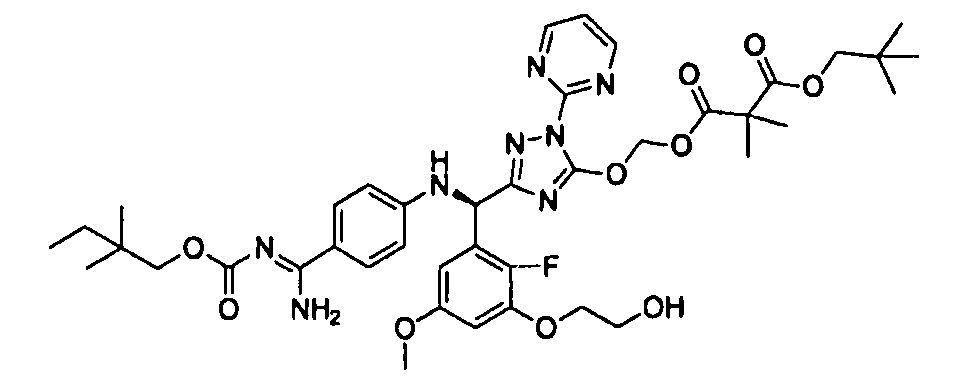
С использованием колонки SUMICHIRAL OA-2500 2,2-диметилмалоновой кислоты 5-{(4-{амино[2,2-диметилбутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2,2-диметилпропиловый сложный эфир отделяли (оптическое разделение) при нижеупомянутых условиях с получением грубо очищенного продукта названного соединения в последней фракции.
Время удерживания ВЭЖХ; 13 минут (название колонки: SUMICHIRAL OA-2500, 30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин)
Полученный грубо очищенный продукт очищали снова с использованием колонки SUMICHIRAL OA-2500S (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 20 мл/мин) с получением названного соединения (88,80 мг).
1H-ЯМР (CD3OD): δ = 0,74 (s, 9H), 0,87 (t, J=7,6 Hz, 3H), 0,93 (s, 6H), 1,32-1,43 (m, 8H), 3,55 (d, J=10,4 Hz, 1H), 3,59 (d, J=10,4 Hz, 1H), 3,71 (s, 3H), 3,83 (s, 2H), 3,85-3,91 (m, 2H), 4,05-4,11 (m, 2H), 6,06 (s, 1H), 6,14 (d, J=6,0 Hz, 1H), 6,15 (d, J=6,0 Hz, 1H), 6,59 (dd, J=2,8, 6,8 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,79 (d, J=8,8 Hz, 2H), 7,48 (t, J=4,8 Hz, 1H), 7,70 (d, J=8,8 Hz, 2H), 8,86 (d, J=4,8 Hz, 2H)
[0224] Пример 19
3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира гидрохлорид
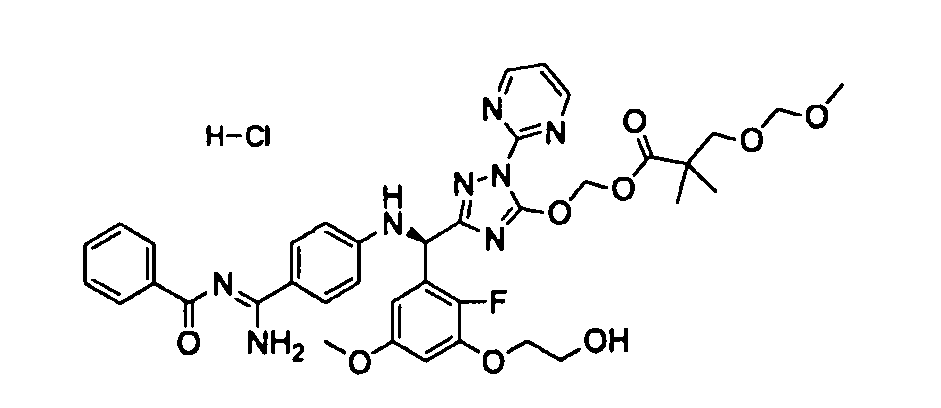
К смеси 3-метоксиметокси-2,2-диметилпропионовой кислоты 5-{(R)-[4-(амино[бензоилимино]метил)фениламино]-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира (пример 1f, 300 мг), TBME (4 мл), толуола (4 мл) и изопропилового спирта (2 мл) медленно добавляли 4н раствор хлороводород-этилацетат (0,098 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 5 минут. Растворитель из реакционного раствора отгоняли при пониженном давлении с получением названного соединения (333 мг).
1H-ЯМР (CD3OD): δ = 1,10 (s, 6H), 3,15 (s, 3H), 3,40 (s, 2H), 3,72 (s, 3H), 3,89 (t, J=4,8 Hz, 2H), 4,09 (t, J=4,8 Hz, 2H), 4,32 (d, J=6,6 Hz, 1H), 4,34 (d, J=6,6 Hz, 1H), 6,11 (d, J=5,6 Hz, 1H), 6,14 (s, 1H), 6,15 (d, J=5,6 Hz, 1H), 6,63 (dd, J=2,8, 7,0 Hz, 1H), 6,73 (dd, J=2,8, 4,4 Hz, 1H), 6,94 (d, J=9,0 Hz, 2H), 7,49 (t, J=4,8 Hz, 1H), 7,55 (t, J=7,6 Hz, 2H), 7,67 (t, J=7,6 Hz, 1H), 7,83 (d, J=9,0 Hz, 2H), 8,09 (d, J=7,6 Hz, 2H), 8,87 (d, J=4,8 Hz, 2H)
[0225] Пример 20
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира метансульфонат
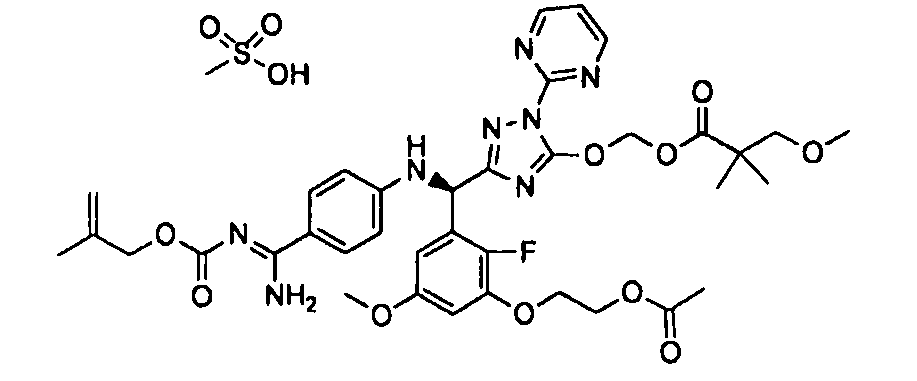
При комнатной температуре 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (пример 6f, 50 мг) растворяли в этилацетате (5 мл) и каплями добавляли туда раствор метансульфоновой кислоты (0,0041 мл) в этилацетате (0,5 мл). Полученную в результате смесь перемешивали в течение ночи при комнатной температуре и осажденное твердое вещество фильтровали. Полученный фильтрат промывали этилацетатом и TBME и сушили. Получали названное соединение (48 мг).
1H-ЯМР (d6-DMSO): δ = 0,988 (s, 3H), 0,994 (s, 3H), 1,75 (s, 3H), 2,02 (s, 3H), 2,27 (s, 3H), 2,97 (s, 3H), 3,18 (s, 2H), 3,69 (s, 3H), 4,21-4,27 (m, 2H), 4,29-4,34 (m, 2H), 4,68 (s, 2H), 4,98 (s, 1H), 5,07 (s, 1H), 6,04 (s, 2H), 6,06 (d, J=3,2 Hz, 1H), 6,68 (dd, J=2,4, 4,4 Hz, 1H), 6,72 (dd, J=2,4, 6,4 Hz, 1H), 6,87 (d, J=9,2 Hz, 2H), 7,59 (t, J=4,4 Hz, 1H), 7,65 (d, J=9,2 Hz, 2H), 7,82 (d, J=7,6 Hz, 1H), 8,92 (d, J=5,2 Hz, 2H), 10,06 (br.s, 1H), 10,70 (br.s, 1H), 11,97 (br.s, 1H)
[0226] Пример 21
4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира гидрохлорид
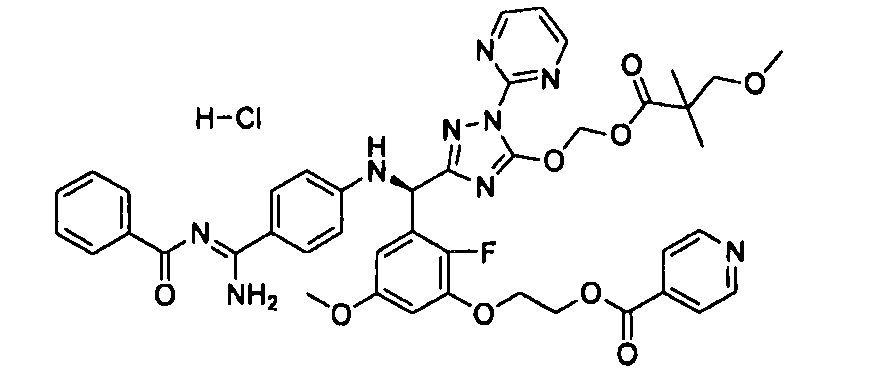
К смеси 4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира (пример 4d, 208 мг), дихлорметана (3 мл) и TBME (6 мл) каплями добавляли 0,4 M раствор хлороводород-этилацетат (0,62 мл) при комнатной температуре. К полученной в результате смеси добавляли TBME (6 мл) и после перемешивания полученной в результате смеси в течение 10 минут смесь диспергировали с помощью ультразвука в течение 2 минут. Осадок извлекали фильтрацией, дважды промывали TBME (5 мл) и сушили при пониженном давлении. Получали названное соединение (192 мг).
1H-ЯМР (CDCl3): δ = 1,13 (s, 3H), 1,14 (s, 3H), 3,16 (s, 3H), 3,33 (d, J=9,4 Hz, 1H), 3,34 (d, J=9,4 Hz, 1H), 3,70 (s, 3H), 4,36 (t, J=5,0 Hz, 2H), 4,71 (t, J=5,0 Hz, 2H), 6,09 (s, 1H), 6,10 (d, J=5,3 Hz, 1H), 6,23 (d, J=5,3 Hz, 1H), 6,48 (dd, J=2,8, 6,4 Hz, 1H), 6,67 (dd, J=2,8, 4,4 Hz, 1H), 6,75 (d, J=8,9 Hz, 2H), 7,28 (m, 1H), 7,50 (t, J=7,5 Hz, 2H), 7,61 (t, J=7,5 Hz, 1H), 7,83 (d, J=5,3 Hz, 2H), 7,94 (d, J=8,9 Hz, 2H), 8,19 (d, J=7,5 Hz, 2H), 8,69 (d, J=5,3 Hz, 2H), 8,78 (d, J=4,9 Hz, 2H)
[0227] Пример 22
4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира метансульфонат
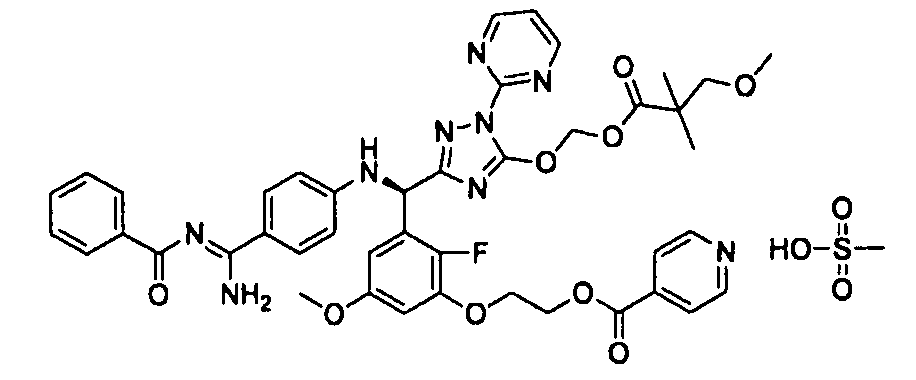
К смеси 4-пиридинкарбоновой кислоты 2-(3-{(R)-(4-{амино[бензоилимино]метил}фениламино)-[5-(3-метокси-2,2-диметилпропионилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира (219 мг), дихлорметана (3 мл) и TBME (6 мл) каплями добавляли смесь метансульфоновой кислоты (0,0171 мл) и дихлорметана (1 мл) при комнатной температуре. К полученной в результате смеси добавляли TBME (6 мл) и после перемешивания полученной в результате смеси в течение 10 минут смесь диспергировали с помощью ультразвука в течение 2 минут. Осадок извлекали фильтрацией, дважды промывали TBME (5 мл) и сушили при пониженном давлении. Получали названное соединение (206 мг).
1H-ЯМР (CDCl3): δ = 1,13 (s, 3H), 1,14 (s, 3H), 2,31 (s, 3H), 3,18 (s, 3H), 3,33 (d, J=9,4 Hz, 1H), 3,34 (d, J=9,4 Hz, 1H), 3,59 (s, 3H), 4,31 (t, J=5,1 Hz, 2H), 4,70 (t, J=5,1 Hz, 2H), 6,07 (d, J=5,5 Hz, 1H), 6,08 (s, 1H), 6,17 (d, J=5,5 Hz, 1H), 6,35 (dd, J=2,8, 6,4 Hz, 1H), 6,54 (dd, J=2,8, 4,4 Hz, 1H), 6,73 (d, J=8,8 Hz, 2H), 7,05 (br.s, 1H), 7,16 (t, J=4,8 Hz, 1H), 7,48 (t, J=7,3 Hz, 2H), 7,60 (t, J=7,3 Hz, 1H), 7,85 (d, J=8,8 Hz, 2H), 7,87 (d, J=5,2 Hz, 2H), 8,04 (d, J=7,3 Hz, 2H), 8,61 (d, J=5,2 Hz, 2H), 8,74 (d, J=4,8 Hz, 2H)
[0228] Пример 23
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира гидрохлорид
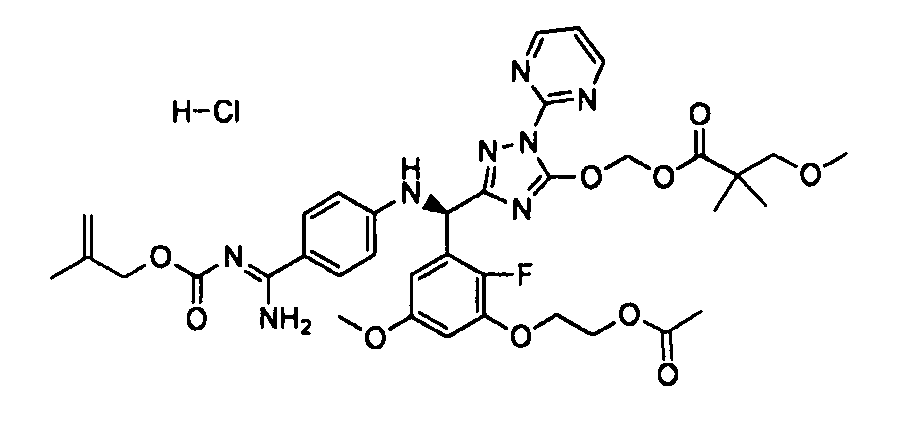
К смеси 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира (пример 6f, 20 мг) и толуола (4 мл) при перемешивании при комнатной температуре каплями добавляли разбавленный раствор (0,2 мл), полученный добавлением 4 M раствора хлороводород-этилацетат (0,32 мл) к этилацетату (10 мл). Растворитель из смеси отгоняли при пониженном давлении с получением названного соединения (20 мг).
1H-ЯМР (d6-DMSO): δ = 1,007 (s, 3H), 1,010 (s, 3H), 1,76 (s, 3H), 2,04 (s, 3H), 2,99 (s, 3H), 3,19 (s, 2H), 3,71 (s, 3H), 4,21-4,29 (m, 2H), 4,31-4,38 (m, 2H), 4,65 (br.s, 2H), 4,98 (s, 1H), 5,06 (s, 1H), 6,05 (s, 3H), 6,68-6,78 (m, 2H), 6,86 (d, J=8,0 Hz, 2H), 7,60 (t, J=4,8 Hz, 1H), 7,68 (d, J=8,0 Hz, 2H), 8,94 (d, J=4,8 Hz, 2H)
Массовый спектр(ESI) m/z: 779 (M+H)+
[0229] Пример 24
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира этансульфонат
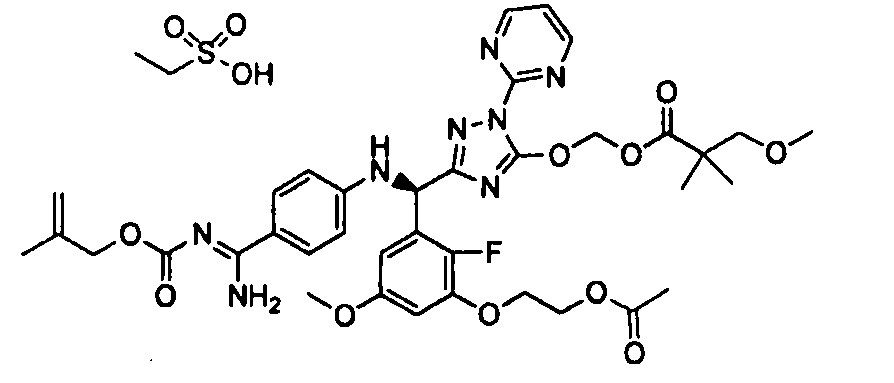
При комнатной температуре 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (пример 6f, 100 мг) растворяли в этилацетате (10 мл) и каплями добавляли туда раствор этансульфоновой кислоты (14,2 мг) в этилацетате (1 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа и осажденное твердое вещество фильтровали. Полученный фильтрат промывали TBME и сушили. Получали названное соединение (103 мг).
1H-ЯМР (CD3OD): δ = 1,068 (s, 3H), 1,073 (s, 3H), 1,29 (t, J=7,2 Hz, 3H), 1,82 (s, 3H), 2,06 (s, 3H), 2,79 (q, J=7,2 Hz, 2H), 3,03 (s, 3H), 3,22 (s, 2H), 3,73 (s, 3H), 4,23-4,25 (m, 2H), 4,39-4,42 (m, 2H), 4,75 (s, 2H), 5,02 (s, 1H), 5,10 (s, 1H), 6,11-6,13 (m, 3H), 6,63 (dd, J=3,2, 6,4 Hz, 1H), 6,74 (dd, J=3,2, 4,8 Hz, 1H), 6,91 (d, J=9,2 Hz, 2H), 7,50 (t, J=4,8 Hz, 1H), 7,66 (d, J=9,2 Hz, 2H), 8,88 (d, J=4,8 Hz, 2H)
[0230] Пример 25
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира пропансульфонат
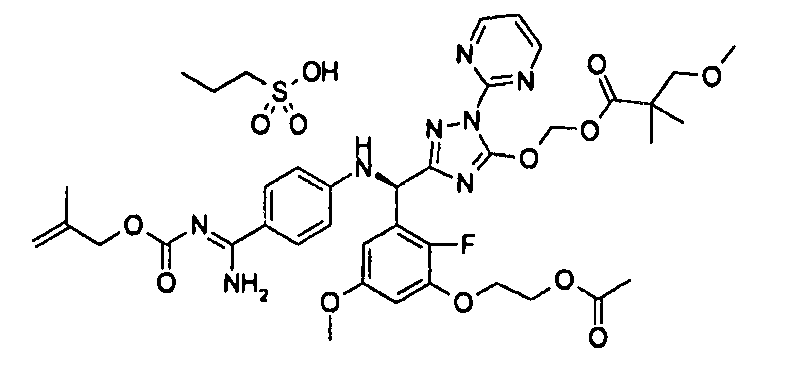
При комнатной температуре 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (пример 6f, 100 мг) растворяли в этилацетате (10 мл), каплями добавляли туда раствор 1-пропансульфоновой кислоты [CAS № 5284-66-2] (13,5 мг) в этилацетате (1 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 22 часов и осажденное твердое вещество фильтровали. Твердые вещества, извлеченные фильтрацией, промывали этилацетатом и TBME и сушили. Получали названное соединение (90 мг).
1H-ЯМР (CD3OD): δ = 1,02 (t, J=7,2 Hz, 3H), 1,068 (s, 3H), 1,073 (s, 3H), 1,76-1,86 (m, 2H), 1,82 (s, 3H), 2,05 (s, 3H), 2,73-2,78 (m, 2H), 3,03 (s, 3H), 3,22 (d, J=0,8 Hz, 2H), 3,73 (s, 3H), 4,23-4,25 (m, 2H), 4,39-4,42 (m, 2H), 4,75 (s, 2H), 5,02 (s, 1H), 5,10 (s, 1H), 6,11-6,13 (m, 3H), 6,63 (dd, J=3,2, 7,2 Hz, 1H), 6,74 (dd, J=3,2, 4,8 Hz, 1H), 6,91 (d, J=9,2 Hz, 2H), 7,50 (t, J=4,8 Hz, 1H), 7,66 (d, J=9,2 Hz, 2H), 8,88 (d, J=4,8 Hz, 2H)
[0231] Пример 26
2-фтор-5-метоксифенол
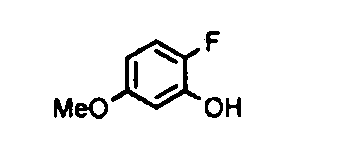
В колбу добавляли 4-фторанизол (20,00 г, 159 ммоль), N,N,N',N'',N''-пентаметилдиэтилентриамин (27,75 г, 160 ммоль) и тетрагидрофуран (100 мл) и полученную в результате смесь охлаждали до -70°C в атмосфере азота. К раствору каплями добавляли н-бутиллитий (59,2 мл, 163 ммоль, 2,76 M, в гексане) и три часа спустя добавляли триметилборат (39,8 мл, 357 ммоль). Спустя один час реакционную смесь нагревали до -10°С и добавляли в нее уксусную кислоту (28,0 мл). Температуру реакции затем изменяли до 5°C и к реакционной смеси каплями добавляли 30% водный раствор перекиси водорода (30 мл), после чего полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли 10% водный раствор сульфита натрия и полученную в результате смесь экстрагировали трет-бутилметиловым эфиром. К органическому слою добавляли 2н водный раствор гидроксида натрия и полученную в результате смесь экстрагировали. После добавления 5н хлористоводородной кислоты к водному слою, чтобы довести pH до 6, полученную в результате смесь экстрагировали трет-бутилметиловым эфиром. Органический слой последовательно промывали водой и 5% солевым раствором, сушили над безводным сульфатом магния и затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении с получением названного соединения (21,7 г) в качестве бесцветного масла.
1H-ЯМР (400 MHz, CDCl3): δ = 3,76 (s, 3H), 5,43 (bs, 1H), 6,34-6,40 (m, 1H), 6,57 (dd, J=3,1, 7,3 Hz, 1H), 6,97 (dd, J=9,0, 10,3 Hz, 1H).
[0232] Пример 27
Трет-бутил(2-фтор-5-метоксифенокси)диметилсилан
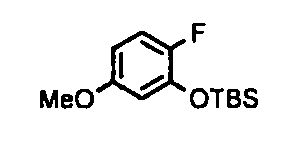
В колбу добавляли 2-фтор-5-метоксифенол (6,00 г, 42 ммоль), триэтиламин (5,77 г, 57 ммоль) и тетрагидрофуран (36,0 мл) и полученную в результате смесь охлаждали в водяной ванне со льдом в атмосфере азота. К раствору каплями добавляли раствор трет-бутилдиметилсилилхлорида (6,89 г, 44 ммоль) в тетрагидрофуране (30,0 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли гептан и 2н водный раствор гидроксида натрия и полученную в результате смесь экстрагировали. Органический слой промывали водой и концентрировали при пониженном давлении с получением названного соединения (10,2 г) в качестве светлого коричневато-красного масла.
1H-ЯМР (400 MHz, CDCl3): δ = 0,19 (s, 6H), 1,00 (s, 9H), 3,74 (s, 3H), 6,38-6,44 (m, 1H), 6,47 (dd, J=3,0, 7,1 Hz, 1H), 6,94 (dd, J=8,9, 10,4 Hz, 1H).
[0233] Пример 28
2-фтор-3-гидрокси-5-метоксибензальдегид
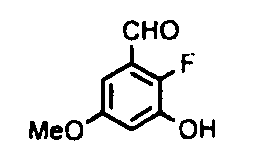
В колбу добавляли трет-бутил(2-фтор-5-метоксифенокси)диметилсилан (6,00 г, 23 ммоль), N,N,N',N'',N''-пентаметилдиэтилентриамин (4,87 г, 28 ммоль) и тетрагидрофуран (48,0 мл) и полученную в результате смесь охлаждали до -72°C в атмосфере азота. К раствору каплями добавляли н-бутиллитий (10,2 мл, 28 ммоль, 2,76 M, в гексане) и полученную в результате смесь перемешивали при -56°C в течение 3 часов. К раствору добавляли раствор N,N-диметилформамида (3,42 г, 47 ммоль) в тетрагидрофуране (6,0 мл) и полученную в результате смесь нагревали до 10°C, после чего туда добавляли воду и двухслойный реакционный раствор перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли гептан и собирали водный слой. К водному слою добавляли толуол. К полученной в результате смеси добавляли 5н хлористоводородную кислоту, чтобы довести pH до 2, и полученную в результате смесь экстрагировали. Органический слой промывали водой и концентрировали при пониженном давлении, после чего смесь толуола и этилацетата добавляли к полученному в результате концентрированному остатку и полученную в результате смесь очищали суспензией. Полученный очищенный продукт фильтровали и сушили с получением названного соединения (3,16 г) в качестве светло-коричневого твердого вещества.
1H-ЯМР (400 MHz, CDCl3): δ = 3,81 (s, 3H), 6,80-6,90 (m, 2H), 10,30 (s, 1H).
[0234] Пример 29
4-{[циано(2-фтор-3-гидрокси-5-метоксифенил)метил]амино}бензонитрил
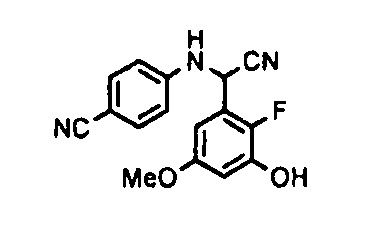
В атмосфере азота раствор 2-фтор-3-гидрокси-5-метоксибензальдегида (17,01 г, 100 ммоль), 4-аминобензонитрила (11,81 г, 100 ммоль) и гуанидина гидрохлорида (287 мг, 3 ммоль) в метаноле (85 мл) перемешивали при 40°C в течение 1,5 часов. Затем каплями добавляли туда триметилсилилцианид (18,1 мл, 130 ммоль) и полученную в результате смесь перемешивали при 40°C в течение 22 часов. После охлаждения смеси, при охлаждении при 15°C, каплями добавляли в нее 3% водный раствор гидрокарбоната натрия (87,65 г) и полученную в результате смесь перемешивали в течение 1 часа при охлаждении при 10°C. Осажденное твердое вещество фильтровали и сушили с получением названного соединения (27,91 г) в качестве белого твердого вещества.
1H-ЯМР (400 MHz, CDCl3): δ = 3,76 (s, 3H), 5,61 (d, J=6,0 Hz, 1H), 6,27 (d, J=5,2 Hz, 1H), 6,59-6,63 (m, 2H), 6,80 (d, J=6,8 Hz, 2H), 7,49 (d, J=6,8 Hz, 2H), 9,44 (brs, 1H).
[0235] Пример 30
4-({циано[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)бензонитрил
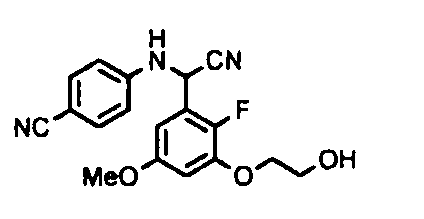
В атмосфере азота смесь 4-{[циано(2-фтор-3-гидрокси-5-метоксифенил)метил]амино}бензонитрила (1,49 г, 5 ммоль), 2-хлорэтанола (1,61 г, 20 ммоль), йодида натрия (3,00 г, 20 ммоль), карбоната калия (967 мг, 7 ммоль) и N,N-диметилформамида (7,43 мл) перемешивали при 70°C в течение 13,5 часов. После охлаждения к реакционной смеси добавляли этилацетат и воду и полученную в результате смесь экстрагировали. Органический слой промывали 10% солевым раствором, а затем концентрировали при пониженном давлении с получением неочищенного продукта названного соединения (2,77 г) в качестве желто-коричневого масла.
1H-ЯМР (400 MHz, CDCl3): δ = 3,82 (s, 3H), 3,98-4,02 (m, 2H), 4,08-4,17 (m, 3H), 4,55 (d, J=7,2 Hz, 1H), 5,62 (d, J=7,2 Hz, 1H), 6,62-6,69 (m, 2H), 6,78 (d, J=8,4 Hz, 2H), 7,56 (d, J=8,4 Hz, 2H).
[0236] Пример 31
2-(4-цианофениламино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетамид
Полученный в примере 30 неочищенный продукт 4-({циано[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}амино)бензонитрила (2,77 г) растворяли в тетрагидрофуране (4,26 мл) и метаноле (4,26 мл) и каплями добавляли туда 20% водный раствор сульфида аммония (8,54 мл, 25 ммоль) при комнатной температуре, и полученную в результате смесь перемешивали при той же температуре. По завершении реакции к реакционной смеси каплями добавляли воду (4,26 мл) и полученную в результате смесь перемешивали при той же температуре в течение 0,5 часов. Осажденное твердое вещество фильтровали. Полученный фильтрат последовательно промывали водой и трет-бутилметиловым эфиром и сушили с получением названного соединения (1,87 г) в качестве бледно-желтого твердого вещества.
1H-ЯМР (400 MHz, DMSO-d6): δ = 3,68-3,73 (m, 5H), 4,02-4,07 (m, 2H), 4,90 (t, J=5,6 Hz, 1H), 5,44 (d, J=5,6 Hz, 1H), 6,60-6,64 (m, 1H), 6,68-6,73 (m, 3H), 7,15 (d, J=6,0 Hz, 1H), 7,52 (d, J=9,2 Hz, 2H), 9,53 (brs, 1H), 9,94 (brs, 1H).
[0237] Пример 32
2-фтор-3-(2-гидроксиэтокси)-5-метоксибензальдегид
В атмосфере азота смесь 2-фтор-3-гидрокси-5-метоксибензальдегида (17,01 г, 100 ммоль), 2-хлорэтанола (8,72 мл, 130 ммоль), йодида натрия (19,49 г, 130 ммоль), карбоната калия (17,97 г, 130 ммоль) и N,N-диметилформамида (85 мл) перемешивали при 100°C в течение 4,25 часа, после чего туда добавляли 2-хлорэтанол (4,70 мл, 70 ммоль), йодид натрия (10,49 г, 70 ммоль), калия карбонат (9,68 г, 70 ммоль) и N,N-диметилформамид (17 мл) и полученную в результате смесь перемешивали при той же температуре в течение 4,25 часа. К смеси добавляли 2-хлорэтанол (2,01 мл, 30 ммоль), йодид натрия (4,50 г, 30 ммоль) и калия карбонат (4,15 г, 30 ммоль) и полученную в результате смесь перемешивали при 100°C в течение 7 часов, после чего добавляли в нее 2-хлорэтанол (2,01 мл, 30 ммоль) и полученную в результате смесь перемешивали при той же температуре в течение 2,5 часов. После охлаждения смеси к реакционной смеси добавляли этилацетат и воду и полученную в результате смесь экстрагировали. Органический слой промывали водой и концентрировали при пониженном давлении с получением неочищенного продукта, содержащего названное соединение (17,70 г) в качестве красно-коричневого твердого вещества.
1H-ЯМР (400 MHz, CDCl3): δ = 2,17 (t, J=6,4 Hz, 1H), 3,82 (s, 3H), 3,98-4,04 (m, 2H), 4,14-4,17 (m, 2H), 6,78-6,82 (m, 1H), 6,85-6,89 (m, 1H), 10,36 (s, 1H).
[0238] Пример 33
2-(4-цианофениламино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетамид
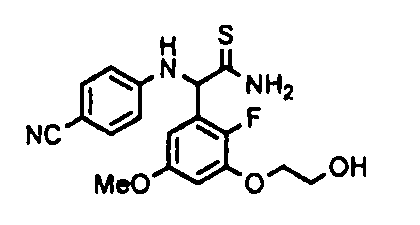
В атмосфере азота к раствору неочищенного продукта, содержащего 2-фтор-3-(2-гидроксиэтокси)-5-метоксибензальдегид (16,68 г, 77,9 ммоль), 4-аминобензонитрил (9,20 г, 77,9 ммоль) и гуанидина гидрохлорид (372 мг, 3,9 ммоль) в метаноле (132 мл), добавляли триметилсилилцианид (12,09 г, 116,9 ммоль) при комнатной температуре и полученную в результате смесь перемешивали при 40°C в течение 19 часов. После охлаждения смеси добавляли в нее тетрагидрофуран (132 мл) при охлаждении водой и к полученной в результате смеси каплями добавляли 20% водный раствор сульфида аммония (133 мл), после чего полученную в результате смесь перемешивали при комнатной температуре. По завершении реакции к реакционной смеси добавляли этилацетат и 5% солевой раствор и полученную в результате смесь экстрагировали. Органический слой промывали 5% солевым раствором и затем концентрировали при пониженном давлении. К полученному остатку добавляли метанол (100 мл) и полученную в результате смесь концентрировали при пониженном давлении. Кроме того, к полученному остатку добавляли метанол (100 мл) и полученную в результате смесь концентрировали при пониженном давлении. К полученному остатку добавляли метанол (120 мл) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Осажденное твердое вещество фильтровали и сушили с получением названного соединения (20,46 г) в качестве бледно-пурпурного твердого вещества.
1H-ЯМР (400 MHz, DMSO-d6): δ = 3,68-3,73 (m, 5H), 4,02-4,07 (m, 2H), 4,90 (t, J=5,6 Hz, 1H), 5,44 (d, J=5,6 Hz, 1H), 6,60-6,64 (m, 1H), 6,68-6,73 (m, 3H), 7,15 (d, J=6,0 Hz, 1H), 7,52 (d, J=9,2 Hz, 2H), 9,53 (brs, 1H), 9,94 (brs, 1H).
[0239] Пример 34
2-(4-цианофенилимино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетимидата метиловый сложный эфир
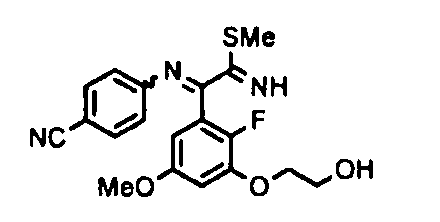
К суспензии 2-(4-цианофениламино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетамида (100 г, 267 ммоль) в ацетонитриле (600 мл) при охлаждении водой добавляли триметилоксония тетрафторборат (39,5 г, 267 ммоль) на протяжении больше 20 минут и полученную в результате смесь перемешивали при комнатной температуре в течение 0,5 часа. К раствору при охлаждении водой добавляли диоксид марганца (139 г, 1,602 ммоль) на протяжении больше 10 минут и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли толуол (500 мл) и полученную в результате смесь фильтровали, после чего полученный в результате фильтровальный осадок промывали этилацетатом. Полученный фильтрат и промывной раствор объединяли и полученную в результате смесь последовательно промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, а затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении с получением неочищенного продукта названного соединения в качестве маслянистого продукта.
1H-ЯМР (400 MHz, CDCl3): δ = 2,35 и 2,40 (s, 3H), 3,64 (s, 3H), 3,91-3,98 (m, 2H), 4,05 (t, J=5,2 Hz, 2H), 6,01-6,06 (m, 1H), 6,48-6,55 (m, 1H), 6,84 (d, J=8,4 Hz, 2H), 7,15-7,20 (m, 1H), 7,50 (d, J=8,4 Hz, 2H).
[0240] Пример 35
Угольной кислоты {3-[1-(4-цианофенилимино)-2-метоксикарбонилимино-2-метилсульфанилэтил]-2-фтор-5-метоксифенокси}этилового сложного эфира метиловый сложный эфир
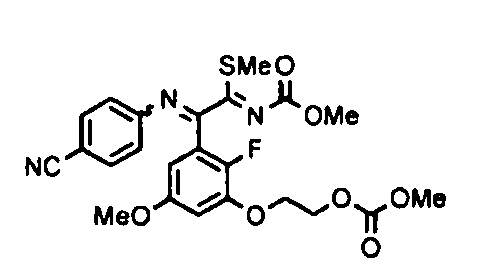
К раствору неочищенного продукта 2-(4-цианофенилимино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетимидата метилового сложного эфира, полученного в примере 34, в этилацетате (100 мл) добавляли толуол (700 мл) с последующим добавлением метилхлорформиата (61,9 мл, 801 ммоль) и 2,4,6-коллидина (123 мл, 935 ммоль) и полученную в результате смесь перемешивали при 85°C в течение ночи. После охлаждения к реакционной смеси добавляли этилацетат и 1н хлористоводородную кислоту и полученную в результате смесь экстрагировали. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния, а затем фильтровали. Полученный фильтрат пропускали через силикагелевую подушку, а затем концентрировали при пониженном давлении с получением неочищенного продукта названного соединения (119,4 г) в качестве маслянистого продукта.
1H-ЯМР (400 MHz, CDCl3): δ = 2,34 и 2,48 (s, 3H), 3,59-3,84 (m, 9H), 4,15 и 4,25 (d, J=4,8 Hz, 2H), 4,44 и 4,51 (d, J=4,8 Hz, 2H), 6,18 и 6,98 (dd, J=3,2, 4,4 Hz, 1H), 6,52 и 6,71 (dd, J=3,2, 6,8 Hz, 1H), 6,82 и 7,08 (d, J=8,8 Hz, 2H), 7,50 и 7,61 (d, J=8,8 Hz, 2H).
[0241] Пример 36
Угольной кислоты 2-{3-[(4-цианофенилимино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира метиловый сложный эфир
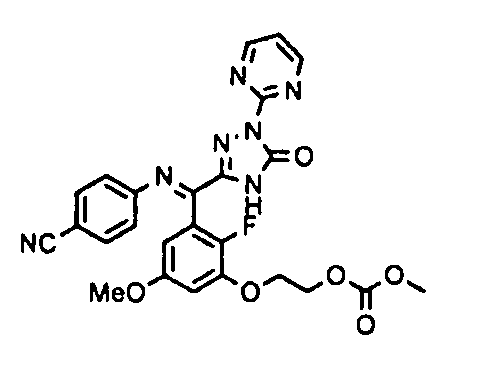
Смесь неочищенного продукта, что включает угольной кислоты {3-[1-(4-цианофенилимино)-2-метоксикарбонилимино-2-метилсульфанилэтил]-2-фтор-5-метоксифенокси}этилового сложного эфира метиловый сложный эфир (37 г, 73,4 ммоль), толуол (740 мл), пиримидин-2-ил-гидразин (8,08 г, 73,4 ммоль) и триэтиламин (12,3 мл, 88,2 ммоль), нагревали при 50°C в течение 10 минут при перемешивании, постепенно нагревали до 110°C, и прогревали при 110°C в течение 4 часов при перемешивании. Смесь постепенно охлаждали до комнатной температуры, а затем осадок фильтровали и сушили с получением названного соединения (23,89 г) в качестве бледно-желтого порошка.
1H-ЯМР (400 MHz, CDCl3): δ = 3,68 (s, 3H), 3,80 (s, 3H), 4,15 (t, J=4,4 Hz, 2H), 4,43 (t, J=4,4 Hz, 2H), 6,29 (t, J=3,2 Hz, 1H), 6,54 (dd, J=3,2, 6,4 Hz, 1H), 6,86 (d, J=8,4 Hz, 2H), 7,26 (t, J=4,8 Hz, 1H), 7,53 (d, J=8,4 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H), 9,43 (brs, 1H).
[0242] Пример 37
Угольной кислоты 2-{3-[(4-цианофениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира метиловый сложный эфир
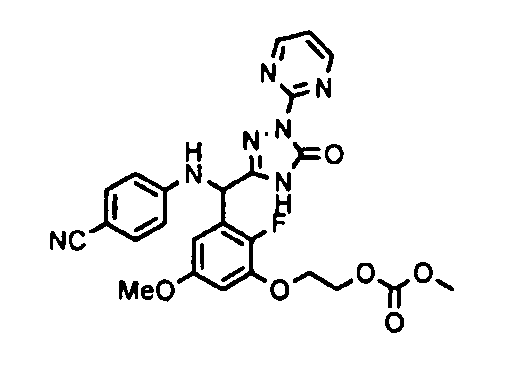
К смеси угольной кислоты 2-{3-[(4-цианофенилимино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира метилового сложного эфира (2,0 г, 3,75 ммоль), 2-метилпиридинборана [CAS № 3999-38-0] (0,802 мг, 7,5 ммоль), метанола (6 мл) и воды (6 мл) каплями добавляли уксусную кислоту (6 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор фильтровали и промывали тетрагидрофураном (6 мл). Полученное твердое вещество сушили в потоке воздуха с получением неочищенного продукта названного соединения (2,02 г) в качестве белого твердого вещества.
1H-ЯМР (400 MHz, DMSO-d6): δ = 3,71 (s, 6H), 4,25-4,35 (m, 2H), 4,40-4,50 (m, 2H), 5,89 (d, J=7,6 Hz, 1H), 6,60-6,68 (m, 1H), 6,72-6,85 (m, 3H), 7,41 (t, J=5,6 Hz, 1H), 7,52 (d, J=8,4 Hz, 2H), 7,64 (d, J=7,2 Hz, 1H), 8,81 (d, J=5,6 Hz, 2H), 12,26 (brs, 1H)
[0243] Пример 38
4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензонитрил
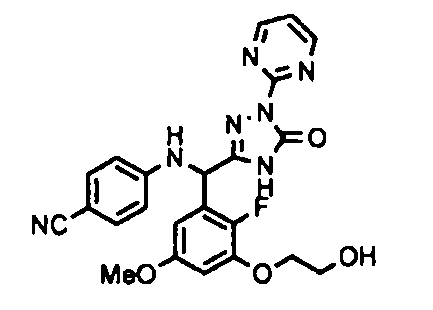
К смеси неочищенного продукта угольной кислоты 2-{3-[(4-цианофениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира метилового сложного эфира (2,02 г), метанола (6 мл), тетрагидрофурана (6 мл) и воды (2,3 мл) добавляли 5н водный раствор гидроксида натрия (3,71 мл, 18,6 ммоль). В реакционный раствор добавляли метанол (2 мл), тетрагидрофуран (2 мл) и воду (2 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 23 часов и 30 минут. В реакционный раствор добавляли уксусную кислоту (4,25 мл) и полученную в результате смесь перемешивали в течение 20 минут, после чего в нее каплями добавляли воду (20 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 дня. Осажденное твердое вещество фильтровали и промывали водой (6 мл) и трет-бутилметиловым эфиром (6 мл). Полученное твердое вещество сушили в потоке воздуха с получением названного соединения (1,576 г) в качестве белого твердого вещества.
1H-ЯМР (DMSO-d6): δ = 3,66-3,78 (m, 5H), 4,07 (d, J=5,2 Hz, 2H), 4,92 (t, J=5,2 Hz, 1H), 5,88 (d, J=7,6 Hz, 1H), 6,55-6,65 (m, 1H), 6,70-6,82 (m, 3H), 7,41 (t, J=4,8 Hz, 1H), 7,52 (d, J=8,8 Hz, 2H), 7,63 (d, J=7,6 Hz, 1H), 8,81 (d, J=4,8 Hz, 2H), 12,26 (brs, 1H).
[0244] Пример 39
4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензонитрил
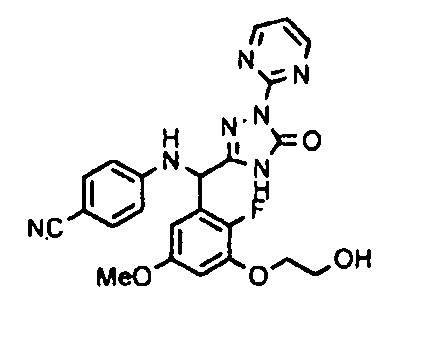
Суспензию угольной кислоты 2-{3-[(4-цианофенилимино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира метилового сложного эфира (25,0 г, 47,1 ммоль) и метанола (90 мл) охлаждали до 15°C. В нее добавляли натрия цианоборогидрид (5,45 г, 87 ммоль) и прополаскивали метанолом (10 мл). Каплями добавляли в нее уксусную кислоту (21,5 мл, 375 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 28 часов. Смесь охлаждали в водяной ванне со льдом и добавляли в нее тетрагидрофуран (100 мл) и 5н водный раствор гидроксида натрия (113 мл, 565 ммоль). После перемешивания полученной в результате смеси в течение 18 часов смесь охлаждали до 15°C или ниже и добавляли в нее уксусную кислоту (81 мл, 1,410 моль). К полученному раствору добавляли затравку (5,0 мг) названного соединения при комнатной температуре и к полученной в результате смеси каплями добавляли воду (250 мл), после чего полученную в результате смесь перемешивали при 4°C в течение 21,5 часа. Полученную суспензию фильтровали и промывали 25% водным метанолом (100 мл) и сушили при 40°C при пониженном давлении с получением названного соединения (21,1 г) в качестве белого твердого вещества.
1H-ЯМР (400 MHz, DMSO-d6): δ = 3,70 (s, 3H), 3,73 (dt, J=5,2, 5,2 Hz, 2H), 4,07 (t, J=4,8 Hz, 2H), 4,92 (t, J=4,8 Hz, 1H), 5,88 (d, J=7,2 Hz, 1H), 6,53-6,63 (m, 1H), 6,70-6,84 (m, 3H), 7,41 (dt, J=1,2, 4,8 Hz, 1H), 7,53 (d, J=8,0 Hz, 2H), 7,63 (d, J=7,6 Hz, 1H), 8,81 (dd, J=1,2, 4,8 Hz, 2H), 12,26 (brs, 1H).
[0245] Пример 40
4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензамидина гидрохлорид
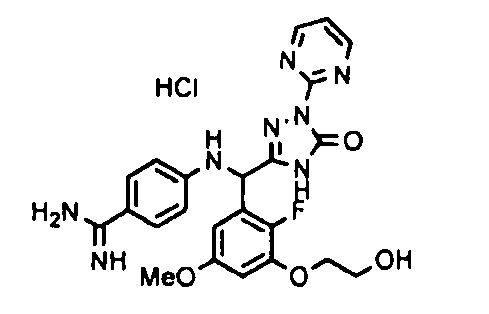
Суспензию 4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензонитрила (5,12 г, 97,6% чистота, 10,5 ммоль) и метанола (15 мл) охлаждали до 5°C или ниже. В нее медленно добавляли ацетилхлорид (15 мл, 211 ммоль) и полученную в результате смесь перемешивали при 10°C или ниже в течение 18,5 часов. К полученной смеси добавляли метанол (25 мл) и полученную в результате смесь перемешивали в течение 1 часа или больше. Смесь концентрировали при 10°C или ниже при пониженном давлении и дополнительно дважды подвергали азеотропной дистилляции с метанолом (20 мл). К остатку для его растворения добавляли метанол (15 мл) и полученную в результате смесь охлаждали до 10°C или ниже. Туда добавляли хлорид аммония (5,05 г, 94,5 ммоль) с последующим раствором триэтиламина (14,6 мл, 105 ммоль) в метаноле (15 мл) при 20°C или ниже. Полученную в результате смесь перемешивали при комнатной температуре в течение 18 часов и добавляли в нее 2н хлористоводородную кислоту (50 мл) при 20°C или ниже, и полученную в результате смесь перемешивали при комнатной температуре в течение 18 часов или больше. После охлаждения до 10°C или ниже полученную суспензию фильтровали и последовательно промывали водой (10 мл) и трет-бутилметиловым эфиром (10 мл). Полученное твердое вещество сушили при 40°C при пониженном давлении с получением названного соединения (4,7 г) в качестве белого твердого вещества.
1H-ЯМР (CD3OD): δ = 3,73 (s, 3H), 3,89 (t, J=4,8 Hz, 2H), 4,11 (t, J=4,8 Hz, 2H), 6,01 (s, 1H), 6,60-6,64 (m, 1H), 6,66-6,72 (m, 1H), 6,87 (d, J=8,8 Hz, 2H), 7,37 (t, J=5,2 Hz, 1H), 7,63 (d, J=8,8 Hz, 2H), 8,79 (d, J=5,2 Hz, 2H).
[0246] Пример 41
4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]амино}бензамидин (R)-метоксифенилацетат
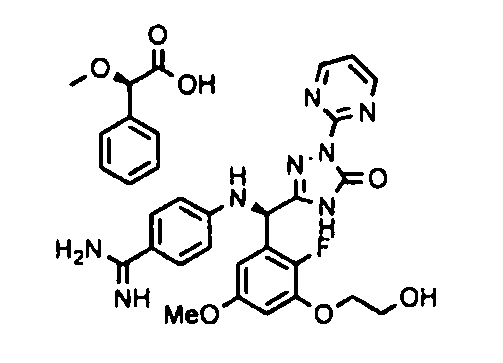
Суспензию 4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензамидина гидрохлорида (4,73 г, чистота 92%, 8,2 ммоль) и метанола (131 мл) нагревали до 60°C, чтоб перевести в раствор. Добавляли туда триэтиламин (1,71 мл, 12,3 ммоль) при 60°C и полученную в результате смесь перемешивали в течение 15 минут или больше. К полученной суспензии добавляли (R)-(-)-α-метоксифенилуксусную кислоту (2,73 г, 16,4 ммоль) и уксусную кислоту (4,35 мл), чтоб перевести ее в раствор. Полученный раствор охлаждали до 35°C и добавляли в него затравку названного соединения, и полученную в результате смесь перемешивали при комнатной температуре в течение 20 часов и при 0°C в течение 3 часов. Полученное в результате твердое вещество фильтровали, последовательно промывали этанолом (13 мл) и трет-бутилметиловым эфиром (13 мл), а затем сушили при комнатной температуре при пониженном давлении с получением названного соединения (2,1 г) в качестве белого твердого вещества.
1H-ЯМР (CD3OD): δ = 3,35 (s, 3H), 3,73 (s, 3H), 3,89 (t, J=4,4 Hz, 2H), 4,11 (t, J=4,4 Hz, 2H), 4,56 (s, 1H), 6,00 (s, 1H), 6,60-6,64 (m, 1H), 6,65-6,71 (m, 1H), 6,87 (d, J=8,8 Hz, 2H), 7,22-7,32 (m, 3H), 7,35 (t, J=4,8 Hz, 1H), 7,47 (dd, J=1,6, 7,6 Hz, 2H), 7,63 (dd, J=2,0, 7,2 Hz, 2H), 8,78 (d, J=4,8 Hz, 2H).
[0247] Пример 42
4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензамидина гидрохлорид
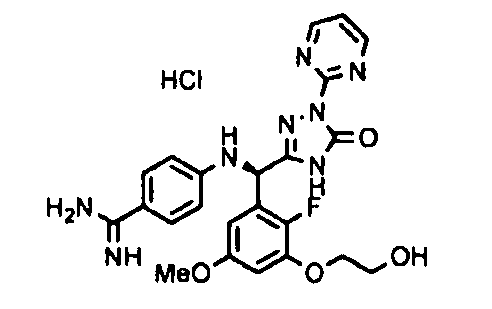
К смеси 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]амино}бензамидина (R)-метоксифенилацетата (20 г, 30,2 ммоль), метанола (200 мл) и этанола (400 мл) для ее растворения добавляли 5н хлористоводородную кислоту (20 мл, 100 ммоль). В реакционный раствор добавляли затравку названного соединения и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Осажденное твердое вещество фильтровали и последовательно промывали смешанным растворителем из этанола и метанола (этанол:метанол=2:1, 50 мл) и трет-бутилметиловым эфиром (50 мл). Полученное твердое вещество сушили в потоке воздуха с получением названного соединения (14,52 г) в качестве белого твердого вещества.
1H-ЯМР (CD3OD): δ = 3,73 (s, 3H), 3,89 (t, J=4,8 Hz, 2H), 4,11 (t, J=4,8 Hz, 2H), 6,01 (s, 1H), 6,60-6,64 (m, 1H), 6,66-6,72 (m, 1H), 6,87 (d, J=8,8 Hz, 2H), 7,37 (t, J=5,2 Hz, 1H), 7,63 (d, J=8,8 Hz, 2H), 8,79 (d, J=5,2 Hz, 2H).
Массовый спектр (ESI): m/z 495 (M+H)+
[0248] Пример 43
[1-амино(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}фенил)метилен]карбаминовой кислоты 2-метилаллиловый сложный эфир
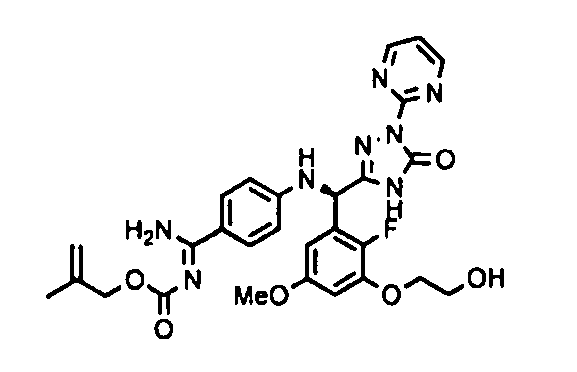
К смеси 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]амино}бензамидина (R)-метоксифенилацетата (0,5 г, 0,755 ммоль), карбоната калия (104 мг, 0,755 ммоль) и диметилсульфоксида (1,5 мл) добавляли угольной кислоты 2-метилаллилового сложного эфира фениловый сложный эфир [CAS № 138621-73-5] (145 мг, 0,755 ммоль) и полученную в результате смесь перемешивали при 60°C в течение 2 часов и 30 минут. После охлаждения смеси реакционный раствор добавляли к смеси этилацетата (5 мл) и воды (15 мл) и водный раствор уксусной кислоты (полученный из уксусной кислоты (0,1 мл) и воды (5 мл)) каплями добавляли к полученной в результате смеси при перемешивании. Осажденное твердое вещество фильтровали и последовательно промывали этилацетатом (10 мл) и водой (10 мл). Полученное твердое вещество сушили в потоке воздуха с получением названного соединения (361 мг) в качестве желтого твердого вещества.
1H-ЯМР (CD3OD): δ = 1,79 (s, 3H), 3,71 (s, 3H), 3,87 (t, J=4,8 Hz, 2H), 4,09 (t, J=4,8 Hz, 2H), 4,55 (s, 2H), 4,91 (s, 1H), 5,02 (s, 1H), 5,96 (s, 1H), 6,60-6,67 (m, 2H), 6,78 (d, J=8,8 Hz, 2H), 7,34 (t, J=4,8 Hz, 1H), 7,71 (d, J=8,8 Hz, 2H), 8,77 (d, J=4,8 Hz, 2H)
Массовый спектр (ESI): m/z 593 (M+H)+
[0249] Пример 44
[1-амино(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}фенил)метилен]карбаминовой кислоты 2-метилаллиловый сложный эфир
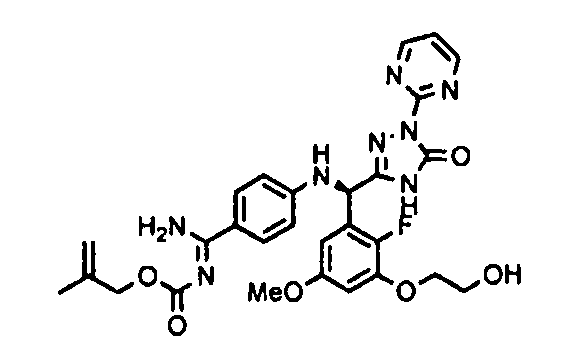
К смеси 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензамидина гидрохлорида (5,0 г, 9,41 ммоль), карбоната калия (2,6 г, 18,8 ммоль) и диметилсульфоксида (15 мл) добавляли угольной кислоты 2-метилаллилового сложного эфира фениловый сложный эфир [CAS № 138621-73-5] (1,57 г, 8,19 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 4 дней. В реакционный раствор добавляли этилацетат (100 мл) и воду (200 мл) и собирали водный слой. К водному слою каплями добавляли уксусную кислоту (1,62 мл, 28,2 ммоль) при перемешивании и осажденное твердое вещество фильтровали и последовательно промывали водой (20 мл) и диэтиловым эфиром (20 мл). Полученное твердое вещество суспендировали в этилацетате, фильтровали, а затем сушили в потоке воздуха. Высушенное твердое вещество суспендировали в этилацетате (50 мл) и суспензию перемешивали в течение 1 дня. Суспензию фильтровали и полученное твердое вещество промывали этилацетатом, и сушили в потоке воздуха с получением названного соединения (4,87 г) в качестве желтого твердого вещества.
1H-ЯМР (CD3OD): δ = 1,79 (s, 3H), 3,71 (s, 3H), 3,87 (t, J=4,8 Hz, 2H), 4,09 (t, J=4,8 Hz, 2H), 4,55 (s, 2H), 4,91 (s, 1H), 5,02 (s, 1H), 5,96 (s, 1H), 6,60-6,67 (m, 2H), 6,78 (d, J=8,8 Hz, 2H), 7,34 (t, J=4,8 Hz, 1H), 7,71 (d, J=8,8 Hz, 2H), 8,77 (d, J=4,8 Hz, 2H)
Массовый спектр (ESI): m/z 593 (M+H)+
[0250] Пример 45
Уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир
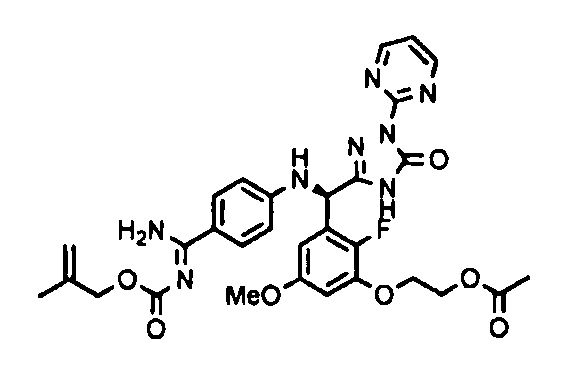
К смеси 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-1,2,4-триазол-3-ил)метил]амино}бензамидина (R)-метоксифенилацетата (0,5 г, 0,755 ммоль), угольной кислоты 2-метилаллилового сложного эфира 4-нитрофенилового сложного эфира [CAS № 218598-29-9] (179 мг, 0,755 ммоль) и N,N-диметилформамида (1,5 мл) добавляли триэтиламин (0,532 мл, 3,78 ммоль) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. В реакционный раствор добавляли 4-диметиламинопиридин (2,78 мг, 0,0228 ммоль) и уксусный ангидрид (0,157 мл, 1,66 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа и 20 минут. В реакционный раствор добавляли буфер с pH 6 и полученную в результате смесь четырежды экстрагировали смесью этилацетата и тетрагидрофурана (этилацетат:тетрагидрофуран=1:1). Все органические слои объединяли, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, а затем фильтровали. Полученный фильтрат концентрировали при пониженном давлении, после чего к полученному остатку добавляли ацетон (3 мл), и полученную в результате смесь перемешивали при комнатной температуре в течение 3 дней. Осажденное твердое вещество фильтровали и промывали ацетоном (1,5 мл). Полученное твердое вещество сушили в потоке воздуха с получением названного соединения (246 мг).
1H-ЯМР (CD3OD): δ = 1,79 (s, 3H), 2,05 (s, 3H), 3,72 (s, 3H), 4,22-4,27 (m, 2H), 4,37-4,44 (m, 2H), 4,55 (s, 2H), 4,90 (s, 1H), 5,02 (s, 1H), 5,96 (s, 1H), 6,62-6,69 (m, 2H), 6,78 (d, J=9,2 Hz, 2H), 7,35 (t, J=4,8 Hz, 1H), 7,72 (d, J=9,2 Hz, 2H), 8,77 (d, J=4,8 Hz, 2H)
Массовый спектр (ESI): m/z 635 (M+H)+
[0251] Пример 46
Уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир
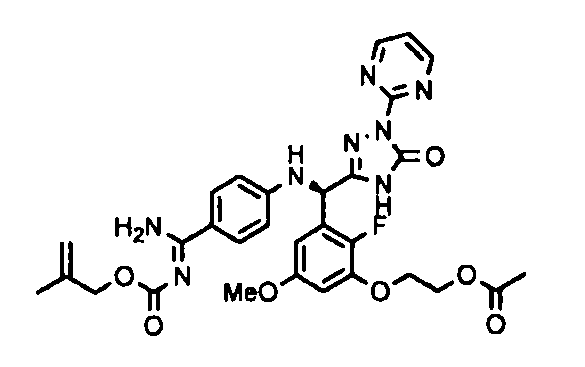
При комнатной температуре 4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензамидина гидрохлорид (5,058 г, 9,42 ммоль) растворяли в диметилсульфоксиде (15 мл) и добавляли туда калия карбонат (3,91 г, 28,3 ммоль). К полученной в результате смеси добавляли 2-метил-аллил фенил карбонат (1,81 г, 9,42 ммоль) при перемешивании при комнатной температуре и полученную в результате смесь перемешивали в течение 18 часов. После этого в реакционный раствор добавляли 4-диметиламинопиридин (57,5 мг, 0,471 ммоль) и уксусный ангидрид (2,23 мл, 23,6 ммоль) и полученную в результате смесь перемешивали в течение 1,5 часов. Кроме того, к смеси добавляли уксусный ангидрид (0,223 мл, 2,36 ммоль) и полученную в результате смесь перемешивали в течение 2 часов. В реакционный раствор добавляли тетрагидрофуран (20 мл) и этилацетат (40 мл), и чтобы погасить реакцию добавляли 5% водный раствор гидрокарбоната натрия (50 г), после чего слои отделяли при 50°C. Кроме того, водный слой дважды экстрагировали смесью тетрагидрофурана (20 мл) и этилацетата (40 мл). Органический слой объединяли, дважды промывали 5% водным раствором гидрокарбоната натрия (25 г) и один раз 5% солевым раствором, а затем концентрировали при пониженном давлении. К полученному остатку добавляли ацетон (30 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов, после чего к смеси добавляли трет-бутилметиловый эфир (25 мл) и полученную в результате смесь перемешивали при 4°C в течение 16 часов. Осадок фильтровали и сушили с получением названного соединения (3,74 г) в качестве бледно-желтого твердого вещества.
1H-ЯМР (400 MHz, DMSO-d6): δ = 1,72 (s, 3H), 2,04 (s, 3H), 3,71 (s, 3H), 4,27 (m, 2H), 4,34 (m, 2H), 4,44 (s, 2H), 4,87 (s, 1H), 4,94 (s, 1H), 5,90 (d, J=7,6 Hz, 1H), 6,67 (m, 1H), 6,73 (d, J=8,8 Hz, 2H), 6,76 (m, 1H), 7,34 (d, J=7,6 Hz, 1H), 7,41 (t, J=4,8 Hz, 1H), 7,82 (d, J=8,8 Hz, 2H), 8,81 (d, J=4,8 Hz, 1H), 12,27 (brs, 1H).
Массовый спектр (ESI): m/z 635 (M+H)+
[0252] Пример 47
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
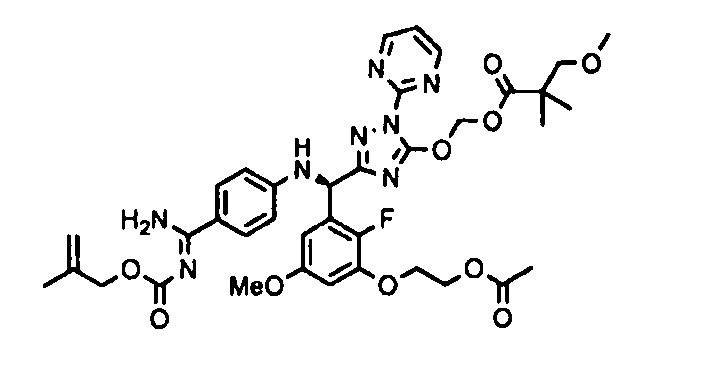
В атмосфере азота смесь уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (1,0 г, 1,57 ммоль), 3-метокси-2,2-диметилпропионовой кислоты хлорметилового сложного эфира (598 мг, 3,31 ммоль), карбоната рубидия (255 мг, 1,10 ммоль) и N,N-диметилацетамида (20 мл) перемешивали при 85°C в течение 75 минут. После охлаждения до комнатной температуры к реакционной смеси добавляли этилацетат (100 мл) и воду (100 мл). Собирали органический слой, последовательно промывали водой (100 мл) и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (560 мг) в качестве твердого вещества.
1H-ЯМР (CDCl3): δ = 1,14 (s, 3H), 1,15 (s, 3H), 1,80 (s, 3H), 2,09 (s, 3H), 3,16 (s, 3H), 3,31 (s, 2H), 3,70 (s, 3H), 4,19-4,21 (m, 2H), 4,41-4,44 (m, 2H), 4,57 (s, 2H), 4,91 (s, 1H), 5,03 (s, 1H), 5,51 (d, J=7,1 Hz, 1H), 6,11 (d, J=6,4 Hz, 1H), 6,12 (d, J=7,1 Hz, 1H), 6,21 (d, J=6,4 Hz, 1H), 6,44 (dd, J=2,9, 6,6 Hz, 1H), 6,68 (dd, J=2,9, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=5,0 Hz, 1H), 7,73 (d, J=8,8 Hz, 2H), 8,82 (d, J=5,0 Hz, 2H).
[0253] Пример 48
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир
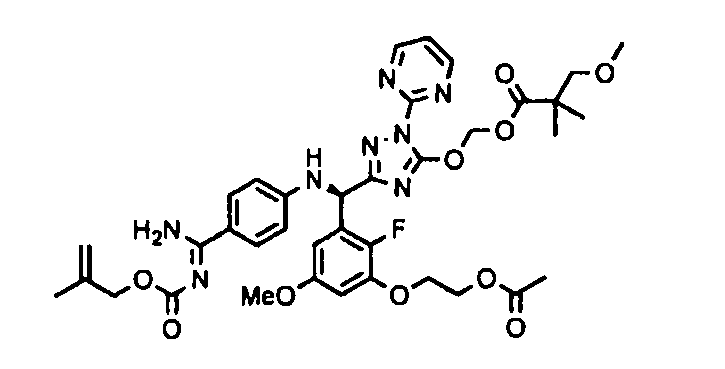
В атмосфере азота смесь [1-амино(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}фенил)метилен]карбаминовой кислоты 2-метилаллилового сложного эфира (1,0 г, 1,69 ммоль), 3-метокси-2,2-диметилпропионовой кислоты хлорметилового сложного эфира (641 мг, 3,55 ммоль), карбоната рубидия (312 мг, 1,35 ммоль) и N,N-диметилацетамида (30 мл) перемешивали при 85°C в течение 115 минут. После охлаждения до комнатной температуры в реакционный раствор добавляли пиридин (0,69 мл, 8,45 ммоль), 4-диметиламинопиридин (20,7 мг, 0,169 ммоль) и уксусный ангидрид (0,32 мл, 3,39 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат (150 мл) и воду (150 мл) и полученную в результате смесь экстрагировали. Собирали органический слой, последовательно промывали водой (100 мл) и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из этилацетата и метанола) с получением названного соединения (610 мг) в качестве твердого вещества.
1H-ЯМР (CDCl3): δ = 1,14 (s, 3H), 1,15 (s, 3H), 1,80 (s, 3H), 2,09 (s, 3H), 3,16 (s, 3H), 3,31 (s, 2H), 3,70 (s, 3H), 4,19-4,21 (m, 2H), 4,41-4,44 (m, 2H), 4,57 (s, 2H), 4,91 (s, 1H), 5,03 (s, 1H), 5,51 (d, J=7,1 Hz, 1H), 6,11 (d, J=6,4 Hz, 1H), 6,12 (d, J=7,1 Hz, 1H), 6,21 (d, J=6,4 Hz, 1H), 6,44 (dd, J=2,9, 6,6 Hz, 1H), 6,68 (dd, J=2,9, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=5,0 Hz, 1H), 7,73 (d, J=8,8 Hz, 2H), 8,82 (d, J=5,0 Hz, 2H).
[0254] Пример 49
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира этансульфонат
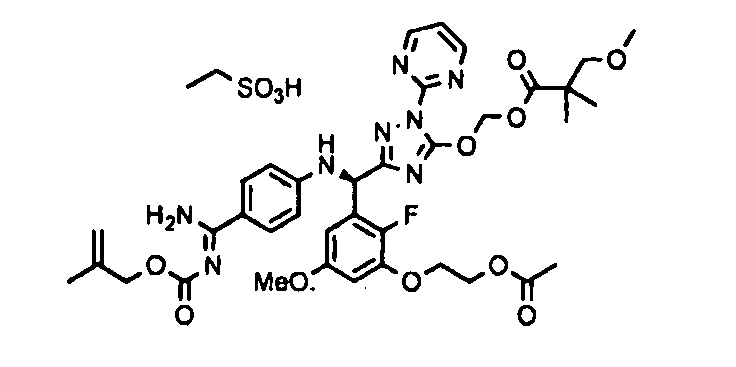
При комнатной температуре 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (1,0 г, 1,28 ммоль) растворяли в ацетоне (80 мл) и каплями добавляли туда раствор этансульфоновой кислоты (127 мг, 1,15 ммоль) в ацетоне (20 мл). К полученной в результате смеси добавляли затравку названного соединения и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Осажденное твердое вещество фильтровали, промывали ацетоном, а затем сушили с получением названного соединения (889 мг) в качестве белого порошка.
1H-ЯМР (CD3OD): δ = 1,068 (s, 3H), 1,073 (s, 3H), 1,29 (t, J=7,2 Hz, 3H), 1,82 (s, 3H), 2,06 (s, 3H), 2,79 (q, J=7,2 Hz, 2H), 3,03 (s, 3H), 3,22 (s, 2H), 3,73 (s, 3H), 4,23-4,25 (m, 2H), 4,39-4,42 (m, 2H), 4,75 (s, 2H), 5,02 (s, 1H), 5,10 (s, 1H), 6,11-6,13 (m, 3H), 6,63 (dd, J=3,2, 6,4 Hz, 1H), 6,74 (dd, J=3,2, 4,8 Hz, 1H), 6,91 (d, J=9,2 Hz, 2H), 7,50 (t, J=4,8 Hz, 1H), 7,66 (d, J=9,2 Hz, 2H), 8,88 (d, J=4,8 Hz, 2H).
[0255] Пример 50
3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира пропансульфонат
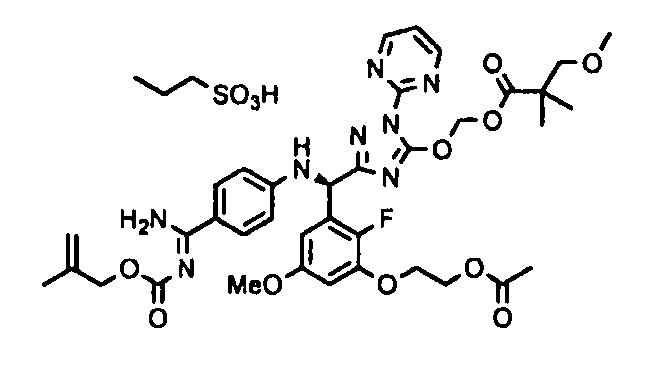
При комнатной температуре 3-метокси-2,2-диметилпропионовой кислоты 5-[(R)-[3-(2-ацетоксиэтокси)-2-фтор-5-метоксифенил]-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)метил]-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметиловый сложный эфир (1,0 г, 1,28 ммоль) растворяли в этилацетате (100 мл), каплями добавляли туда раствор 1-пропансульфоновой кислоты [CAS № 5284-66-2] (151 мг, 1,22 ммоль) в этилацетате (5 мл). К полученной в результате смеси добавляли затравку названного соединения и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Осажденное твердое вещество фильтровали, последовательно промывали этилацетатом и трет-бутилметиловым эфиром, а затем сушили с получением названного соединения (950 мг) в качестве белого порошка.
1H-ЯМР (CD3OD): δ = 1,02 (t, J=7,2 Hz, 3H), 1,068 (s, 3H), 1,073 (s, 3H), 1,76-1,86 (m, 2H), 1,82 (s, 3H), 2,05 (s, 3H), 2,73-2,78 (m, 2H), 3,03 (s, 3H), 3,22 (d, J=0,8 Hz, 2H), 3,73 (s, 3H), 4,23-4,25 (m, 2H), 4,39-4,42 (m, 2H), 4,75 (s, 2H), 5,02 (s, 1H), 5,10 (s, 1H), 6,11-6,13 (m, 3H), 6,63 (dd, J=3,2, 7,2 Hz, 1H), 6,74 (dd, J=3,2, 4,8 Hz, 1H), 6,91 (d, J=9,2 Hz, 2H), 7,50 (t, J=4,8 Hz, 1H), 7,66 (d, J=9,2 Hz, 2H), 8,88 (d, J=4,8 Hz, 2H).
[0256] Пример 51
Уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
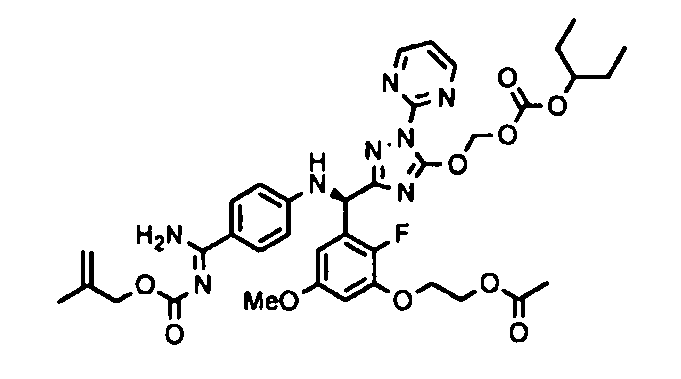
В атмосфере азота смесь уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (пример 45, 300 мг), угольной кислоты хлорметилового сложного эфира 1-этилпропилового сложного эфира [CAS № 176310-42-2] (177 мг), карбоната калия (80 мг) и N,N-диметилформамида (5 мл) перемешивали при 85°C в течение 60 минут. После охлаждения смеси до комнатной температуры добавляли в нее этилацетат и воду. Собирали органический слой, водный слой реэкстрагировали этилацетатом и все органические слои объединяли. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (130 мг) в качестве твердого вещества.
1H-ЯМР (CD3OD): δ = 0,84 (dt, J=1,6, 7,6 Hz, 6H), 1,56 (m, 4H), 1,78 (s, 3H), 2,04 (s, 3H), 3,69 (s, 3H), 4,20-4,23 (m, 2H), 4,37-4,40 (m, 2H), 4,53 (s, 2H), 4,58 (m, 1H), 4,89 (br.s, 1H), 5,01 (br.s, 1H), 6,06 (s, 1H), 6,10 (d, J=6,0 Hz, 1H), 6,13 (d, J=6,0 Hz, 1H), 6,57 (dd, J=2,8, 6,8 Hz, 1H), 6,74 (dd, J=2,8, 4,4 Hz, 1H), 6,77 (d, J=9,2 Hz, 2H), 7,46 (t, J=5,2 Hz, 1H), 7,71 (d, J=8,8 Hz, 2H), 8,84 (d, J=5,2 Hz, 2H).
[0257] Пример 52
Уксусной кислоты 2-{3-[(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этиловый сложный эфир

В атмосфере азота смесь уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (пример 45, 75 мг), угольной кислоты хлорметилового сложного эфира изопропилового сложного эфира [CAS № 35180-01-9] (44,3 мг), карбоната калия (33,3 мг) и N,N-диметилформамида (3 мл) перемешивали при 85°C в течение 60 минут. После охлаждения реакционной смеси до комнатной температуры добавляли в нее этилацетат и воду. Собирали органический слой, водный слой реэкстрагировали этилацетатом и все органические слои объединяли. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (28,9 мг) в качестве твердого вещества.
1H-ЯМР (CD3CN): δ = 1,26 (d, J=6,4 Hz, 6H), 1,78 (s, 3H), 2,04 (s, 3H), 3,72 (s, 3H), 4,23-4,26 (m, 2H), 4,38-4,40 (m, 2H), 4,52 (s, 2H), 4,87 (quint, J=6,0 Hz, 1H), 4,92 (br.s, 1H), 4,98 (br.s, 1H), 6,00 (d, J=7,6 Hz, 1H), 6,05 (d, J=7,6 Hz, 1H), 6,07 (s, 2H), 6,60 (dd, J=2,8, 6,8 Hz, 1H), 6,67 (dd, J=2,8, 4,8 Hz, 1H), 6,77 (d, J=8,8 Hz, 2H), 7,42 (t, J=4,8 Hz, 1H), 7,77 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H).
[0258] Пример 53
Уксусной кислоты 2-(3-{(R)-(4-{амино[пропоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
(53a) Уксуснокислая соль 2-(3-{(R)-(4-карбамимидоилфениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира уксусной кислоты
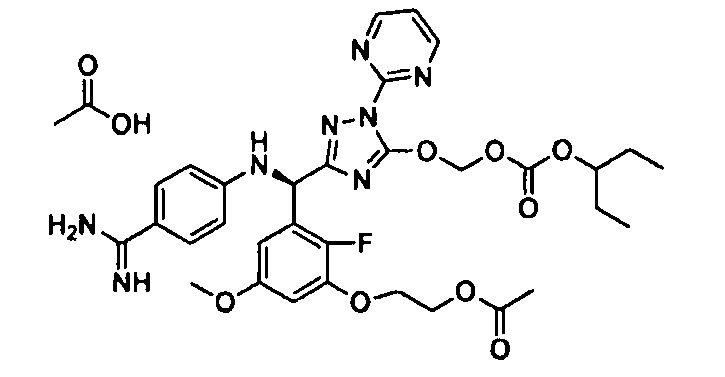
К смеси уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира (пример 51, 266 мг), DMF (2 мл) и уксусной кислоты (0,196 мл) добавляли тетракис(трифенилфосфин)палладий (0) (20 мг) и полученную в результате смесь перемешивали в течение ночи при внешней температуре 45°C. После охлаждения смеси до комнатной температуры реакционный раствор, содержащий названное соединение, разделяли на 4 равные порции и применяли для следующих реакций.
[0259] (53b) Уксусной кислоты 2-(3-{(R)-(4-{амино[пропоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
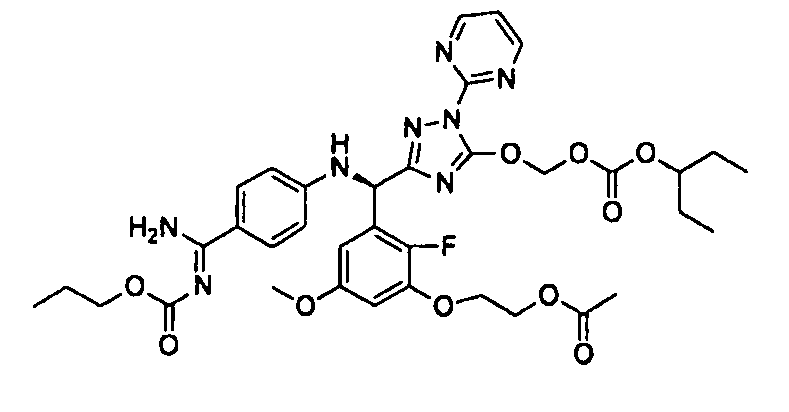
К смеси одной порции, содержащей уксуснокислую соль 2-(3-{(R)-(4-карбамимидоилфениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира уксусной кислоты (соответствует 63,2 мг), полученную в примере 53a, и DMF (3 мл), добавляли угольной кислоты 4-нитрофенилового сложного эфира пропиловый сложный эфир [CAS № 67036-12-8] (38,4 мг) и пиридин (55,2 мкл) и полученную в результате смесь перемешивали при комнатной температуре в течение 2 дней. К смеси добавляли этилацетат и воду и собирали органический слой. Органический слой дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из гексана и этилацетата) с получением названного соединения (23,21 мг).
1H-ЯМР (CDCl3): δ = 0,86-0,91 (m, 6H), 0,98 (t, J=7,2 Hz, 3H), 1,58-1,66 (m, 4H), 1,70-1,78 (m, 2H), 2,1 (s, 3H), 3,70 (s, 3H), 4,08 (t, J=6,8 Hz), 4,20 (t, J=4,4 Hz, 2H), 4,43 (t, J=4,4 Hz, 2H), 4,61-4,67 (m, 1H), 5,44 (d, J=7,2 Hz, 1H), 6,13 (d, J=7,2 Hz, 1H), 6,16-6,19 (m, 2H), 6,43-6,45 (m, 1H), 6,66-6,68 (m, 1H), 6,71 (d, J=8,4 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,82 (d, J=4,8 Hz, 2H).
[0260] Пример 54
Уксусной кислоты 2-(3-{(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
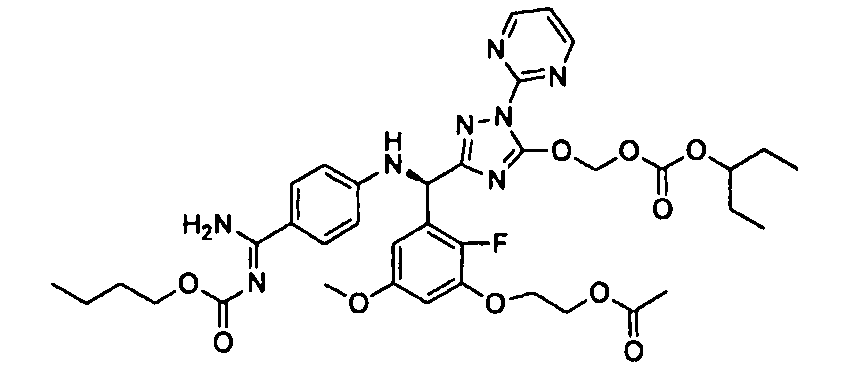
К смеси одной порции, содержащей уксуснокислую соль 2-(3-{(R)-(4-карбамимидоилфениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира уксусной кислоты (соответствует 63,2 мг), полученную в примере 53a, и DMF (3 мл), добавляли угольной кислоты бутилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 67036-13-9] (40,8 мг) и пиридин (55,2 мкл) и полученную в результате смесь перемешивали при комнатной температуре в течение 2 дней. К смеси добавляли этилацетат и воду и собирали органический слой. Органический слой дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из гексана и этилацетата) с получением названного соединения. Это соединение растворяли в метаноле и очищали снова с использованием колонки SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (18,85 мг).
1H-ЯМР (CDCl3): δ = 0,86-0,91 (m, 6H), 0,94 (t, J=7,2 Hz, 3H), 1,39-1,48 (m, 2H), 1,58-1,73 (m, 6H), 2,1 (s, 3H), 3,70 (s, 3H), 4,13 (t, J=6,8 Hz, 2H), 4,20 (t, J=4,4 Hz, 2H), 4,43 (t, J=4,4 Hz, 2H), 4,61-4,67 (m, 1H), 5,43 (d, J=7,6 Hz, 1H), 6,13 (d, J=7,2 Hz, 1H), 6,16-6,19 (m, 2H), 6,43-6,45 (m, 1H), 6,66-6,68 (m, 1H), 6,72 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,82 (d, J=4,8 Hz, 2H).
[0261] Пример 55
Уксусной кислоты 2-(3-{(R)-(4-{амино[изобутоксикарбонилимино]метил}фениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
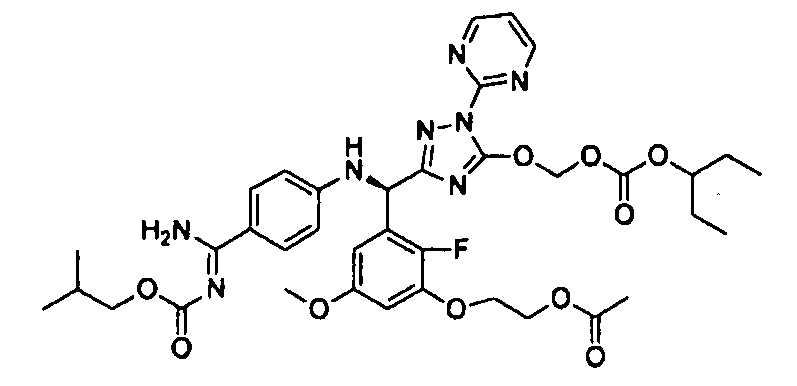
К смеси одной порции, содержащей уксуснокислую соль 2-(3-{(R)-(4-карбамимидоилфениламино)-[5-(1-этилпропоксикарбонилоксиметокси)-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира уксусной кислоты (соответствует 63,2 мг), полученную в примере (53a), и DMF (3 мл), добавляли угольной кислоты изобутилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 112240-73-0] (40,8 мг) и пиридин (55,2 мкл) и полученную в результате смесь перемешивали при комнатной температуре в течение 2 дней. К смеси добавляли этилацетат и воду и собирали органический слой. Органический слой дважды последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с NAM силикагелем (смешанный растворитель из гексана и этилацетата) с получением названного соединения. Это соединение растворяли в метаноле и очищали снова с использованием колонки SUMICHIRAL OA-2500 (30 мм φ × 25 см, подвижная фаза: метанол, скорость элюирования: 30 мл/мин) с получением названного соединения (26,74 мг).
1H-ЯМР (CDCl3): δ = 0,86-0,91 (m, 6H), 0,97 (d, J=6,8 Hz, 6H), 1,58-1,66 (m, 4H), 1,99-2,07 (m, 1H), 2,1 (s, 3H), 3,69 (s, 3H), 3,91 (d, J=6,8 Hz, 2H), 4,20 (t, J=4,0 Hz, 2H), 4,43 (t, J=4,0 Hz, 2H), 4,61-4,67 (m, 1H), 5,44 (d, J=7,2 Hz, 1H), 6,13 (d, J=7,2 Hz, 1H), 6,16-6,19 (m, 2H), 6,43-6,45 (m, 1H), 6,66-6,67 (m, 1H), 6,72 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,82 (d, J=4,8 Hz, 2H).
[0262] Пример 56
Угольной кислоты 5-{(R)-(4-{амино-[2-метилаллилоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
(56a) Угольной кислоты хлорметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
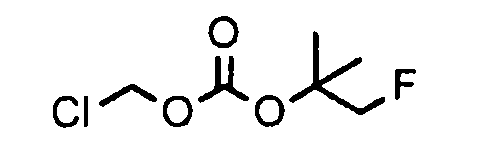
В атмосфере азота к смеси 1-фтор-2-метилпропан-2-ола (THF раствор, 5,25 г) [CAS № 353-80-0] (Biorg. Med. Chem., volume 19, page 1580, 2011), THF (95 мл) и хлорметилхлорформиата (7 мл) каплями добавляли пиридин (6,4 мл) при -78°C. Полученную в результате смесь перемешивали в течение ночи при комнатной температуре, а затем к смеси добавляли этилацетат (200 мл) и гептан (200 мл). Полученную в результате смесь последовательно промывали 0,5н хлористоводородной кислотой (300 мл), насыщенным водным раствором гидрокарбоната натрия (200 мл), водой (200 мл) и насыщенным водным раствором хлорида натрия (200 мл) и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток дистиллировали при пониженном давлении с получением названного соединения (5,25 г).
1H-ЯМР (CDCl3): δ = 1,55 (d, J=1,6 Hz, 6H), 4,46 (d, J=47,2 Hz, 2H), 5,69 (s, 2H).
[0263] (56b) Угольной кислоты 5-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
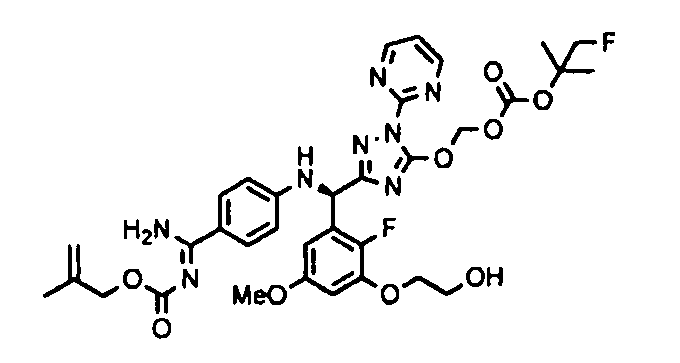
В атмосфере азота смесь [1-амино(4-{[(R)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}фенил)метилен]карбаминовой кислоты 2-метилаллилового сложного эфира (пример 44, 474 мг), угольной кислоты хлорметилового сложного эфира 2-фтор-1,1,диметилэтилового сложного эфира (295 мг), карбоната рубидия (166 мг) и N,N-диметилацетамида (15 мл) перемешивали при 85°C в течение 60 минут. После охлаждения смеси до комнатной температуры реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из метанола и воды, содержащий 0,1% уксусной кислоты), а затем полученное соединение дополнительно очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (98 мг).
1H-ЯМР (CDCl3): δ = 1,50 (d, J=1,6 Hz, 6H), 1,80 (s, 3H), 2,35 (br.s, 1H), 3,69 (s, 3H), 3,97 (t, J=4,2 Hz, 2H), 4,10 (t, J=4,2 Hz, 2H), 4,44 (d, J=47,2 Hz, 2H), 4,57 (s, 2H), 4,90 (s, 1H), 5,04 (s, 1H), 5,46 (d, J=7,2 Hz, 1H), 6,13 (m, 3H), 6,44 (dd, J=2,8, 6,4 Hz, 1H), 6,65 (dd, J=2,8, 5,0 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H).
[0264] Пример 57
Уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
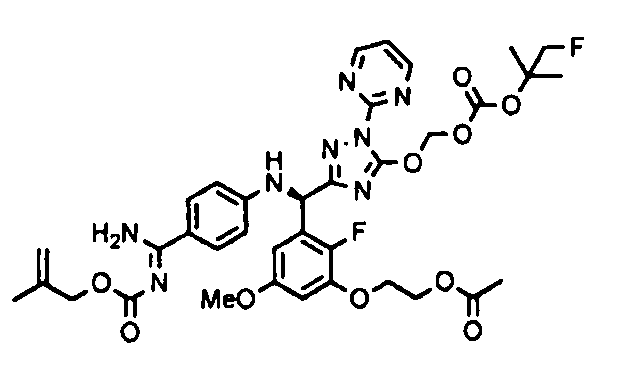
В атмосфере азота смесь уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (пример 45, 508 мг), угольной кислоты хлорметилового сложного эфира 2-фтор-1,1,диметилэтилового сложного эфира (пример 56a, 295 мг), карбоната рубидия (166 мг) и N,N-диметилацетамида (15 мл) перемешивали при 85°C в течение 60 минут. После охлаждения смеси до комнатной температуры реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из метанола и воды, содержащий 0,1% уксусной кислоты), а затем полученное соединение дополнительно очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (104 мг).
1H-ЯМР (CDCl3): δ = 1,50 (d, J=1,6 Hz, 6H), 1,80 (s, 3H), 2,10 (s, 3H), 3,69 (s, 3H), 4,20 (t, J=4,8 Hz, 2H), 4,41 (t, J=4,8 Hz, 2H), 4,45 (d, J=47,2 Hz, 2H), 4,57 (s, 2H), 4,91 (s, 1H), 5,04 (s, 1H), 5,46 (d, J=7,6 Hz, 1H), 6,14 (m, 3H), 6,44 (dd, J=3,1, 6,5 Hz, 1H), 6,65 (dd, J=3,1, 4,9 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,4 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,4 Hz, 2H).
[0265] Пример 58
Угольной кислоты 5-{(R)-(4-{амино-[2-этоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
(58a) Уксуснокислая соль угольной кислоты 5-{(R)-(4-карбамимидоилфениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтилового сложного эфира
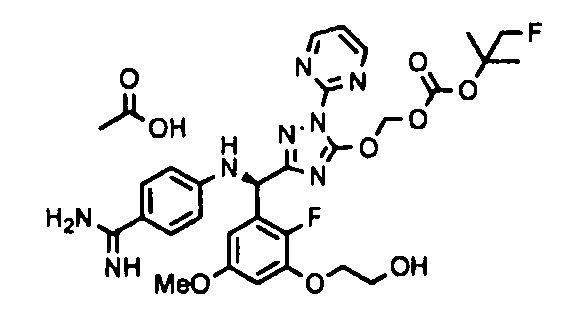
В атмосфере азота к смеси угольной кислоты 5-{(R)-(4-{амино-[2-метилаллилоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтилового сложного эфира (пример 56b, 63,5 мг), уксусной кислоты (49 мкл) и N,N-диметилформамида (0,70 мл) добавляли тетракис(трифенилфосфин)палладий (0) (4,9 мг) и полученную в результате смесь перемешивали при 45°C в течение 15 часов. После охлаждения смеси до комнатной температуры реакционный раствор, содержащий названное соединение, разделяли на 3 равные порции и применяли для следующих реакций.
[0266] (58b) Угольной кислоты 5-{(R)-(4-{амино-[2-этоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
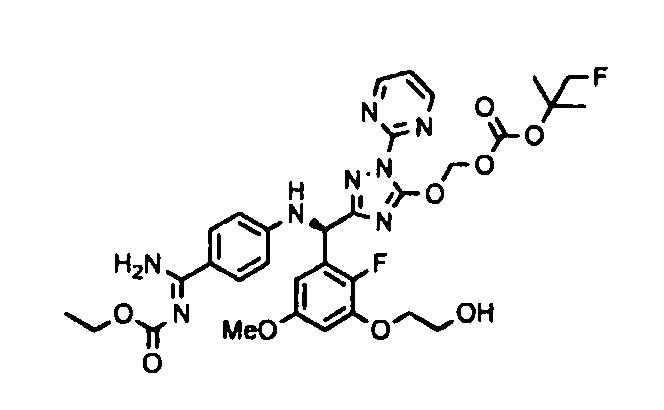
К одной порции, полученной в примере (58a), добавляли пиридин (18 мкл) и угольной кислоты этилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 6132-45-2] (12 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (4,9 мг).
1H-ЯМР (CDCl3): δ = 1,37 (t, J=6,9 Hz, 3H), 1,50 (d, J=1,6 Hz, 6H), 3,70 (s, 3H), 3,97 (t, J=4,2 Hz, 2H), 4,10 (t, J=4,2 Hz, 2H), 4,19 (q, J=6,9 Hz, 2H), 4,44 (d, J=47,2 Hz, 2H), 5,47 (d, J=7,5 Hz, 1H), 6,12 (m, 3H), 6,45 (dd, J=2,8, 6,4 Hz, 1H), 6,65 (dd, J=2,8, 4,7 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=5,2 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=5,2 Hz, 2H).
[0267] Пример 59
Угольной кислоты 5-{(R)-(4-{амино-[2-пропоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
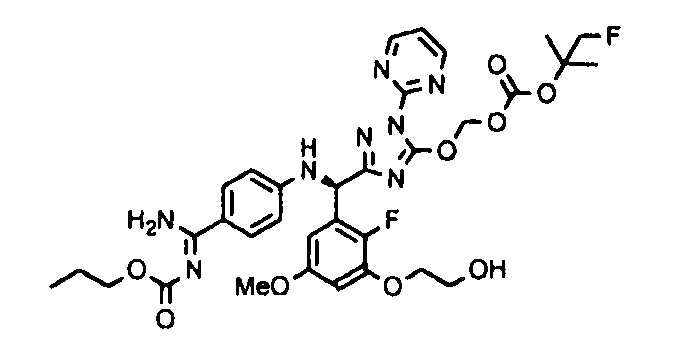
К одной порции, полученной в примере (58a), добавляли пиридин (18 мкл) и угольной кислоты 4-нитрофенилового сложного эфира пропиловый сложный эфир (13 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (7,0 мг).
1H-ЯМР (CDCl3): δ = 0,98 (t, J=7,4 Hz, 3H), 1,50 (d, J=1,6 Hz, 6H), 1,74 (sext, J=7,4 Hz, 2H), 3,70 (s, 3H), 3,97 (t, J=4,2 Hz, 2H), 4,09 (m, 4H), 4,44 (d, J=47,2 Hz, 2H), 5,44 (d, J=7,5 Hz, 1H), 6,13 (m, 3H), 6,45 (dd, J=3,0, 6,5 Hz, 1H), 6,65 (dd, J=3,0, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,4 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,4 Hz, 2H).
[0268] Пример 60
Угольной кислоты 5-{(R)-(4-{амино-[2-бутоксикарбонилимино]метил}фениламино)-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]метил}-2-пиримидин-2-ил-2H-[1,2,4]триазол-3-илоксиметилового сложного эфира 2-фтор-1,1-диметилэтиловый сложный эфир
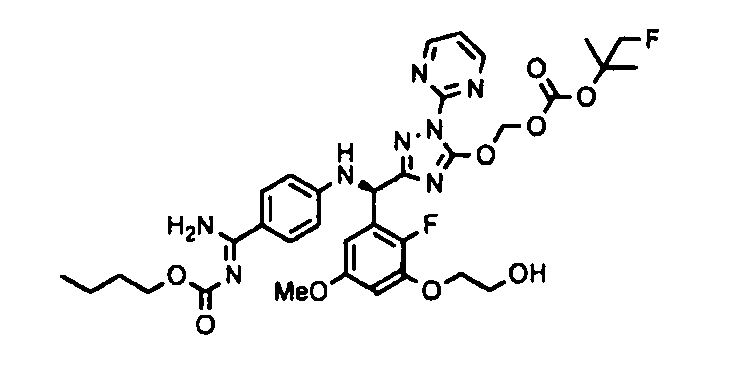
К одной порции, полученной в примере (58a), добавляли пиридин (18 мкл) и угольной кислоты бутокси сложный эфир 4-нитрофенилового сложного эфира (14 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (8,9 мг).
1H-ЯМР (CDCl3): δ = 0,94 (t, J=7,2 Hz, 3H), 1,41 (sext, J=7,2 Hz, 2H), 1,50 (d, J=1,7 Hz, 6H), 1,71 (quint, J=7,2 Hz, 2H), 3,70 (s, 3H), 3,97 (dd, J=4,0, 4,8 Hz, 2H), 4,11 (m, 4H), 4,44 (d, J=47,2 Hz, 2H), 4,97 (d, J=7,3 Hz, 1H), 6,12 (m, 3H), 6,45 (dd, J=2,8, 6,3 Hz, 1H), 6,64 (dd, J=2,8, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H).
[0269] Пример 61
Уксусной кислоты 2-(3-{(R)-(4-{амино[этоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
(61a) Уксуснокислая соль 2-(3-{(R)-(карбамимидоилфениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира уксусной кислоты
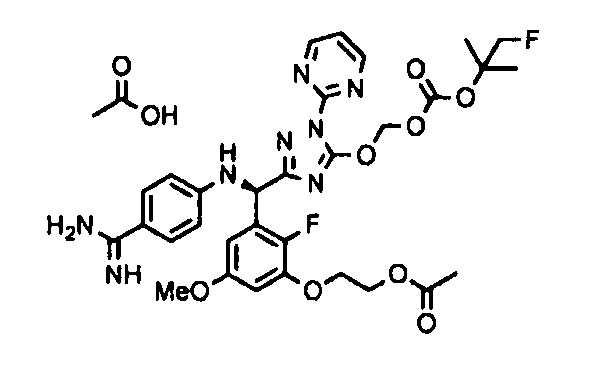
В атмосфере азота к смеси уксусной кислоты 2-(3-{(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этилового сложного эфира (пример 57, 72,4 мг), уксусной кислоты (53 мкл) и N,N-диметилформамида (0,80 мл) добавляли тетракис(трифенилфосфин)палладий (0) (5,4 мг) и полученную в результате смесь перемешивали при 45°C в течение 15 часов. После охлаждения смеси до комнатной температуры реакционный раствор, содержащий названное соединение, разделяли на 3 равные порции и применяли для следующих реакций.
[0270] (61b) Уксусной кислоты 2-(3-{(R)-(4-{амино[этоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
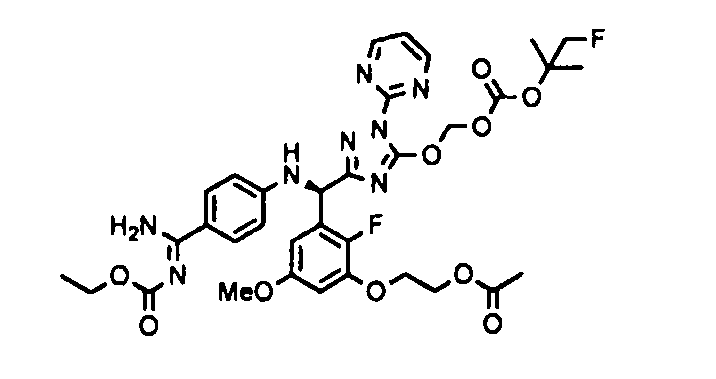
К одной порции, полученной в примере (61a), добавляли пиридин (18 мкл) и угольной кислоты этилового сложного эфира 4-нитрофениловый сложный эфир (12 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (8,4 мг).
1H-ЯМР (CDCl3): δ = 1,33 (t, J=7,0 Hz, 3H), 1,50 (d, J=1,6 Hz, 6H), 2,10 (s, 3H), 3,70 (s, 3H), 4,16 (m, 4H), 4,43 (t, J=4,8 Hz, 2H), 4,44 (d, J=47,2 Hz, 2H), 5,43 (d, J=7,2 Hz, 1H), 6,12 (m, 3H), 6,45 (dd, J=2,8, 6,5 Hz, 1H), 6,65 (dd, J=2,8, 4,7 Hz, 1H), 6,72 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,73 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H).
[0271] Пример 62
Уксусной кислоты 2-(3-{(R)-(4-{амино[пропоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
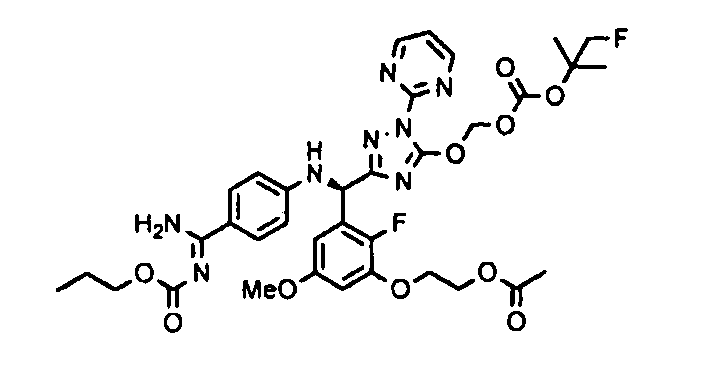
К одной порции, полученной в примере (61a), добавляли пиридин (18 мкл) и угольной кислоты 4-нитрофенилового сложного эфира пропиловый сложный эфир (13 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (9,2 мг).
1H-ЯМР (CDCl3): δ = 0,98 (t, J=7,6 Hz, 3H), 1,50 (d, J=1,6 Hz, 6H), 1,74 (sext, J=7,6 Hz, 2H), 2,10 (s, 3H), 3,70 (s, 3H), 4,09 (t, J=7,6 Hz, 2H), 4,20 (t, J=4,8 Hz), 4,43 (t, J=4,8 Hz, 2H), 4,44 (d, J=47,2 Hz, 2H), 5,43 (d, J=7,9 Hz, 1H), 6,13 (m, 3H), 6,44 (dd, J=3,1, 6,3 Hz, 1H), 6,67 (dd, J=3,1, 4,7 Hz, 1H), 6,72 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,9 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,9 Hz, 2H).
[0272] Пример 63
Уксусной кислоты 2-(3-{(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-[5-(2-фтор-1,1-диметилэтоксикарбонилоксиметокси)-1-пиримидин-2-ил-2H-[1,2,4]триазол-3-ил]метил}-2-фтор-5-метоксифенокси)этиловый сложный эфир
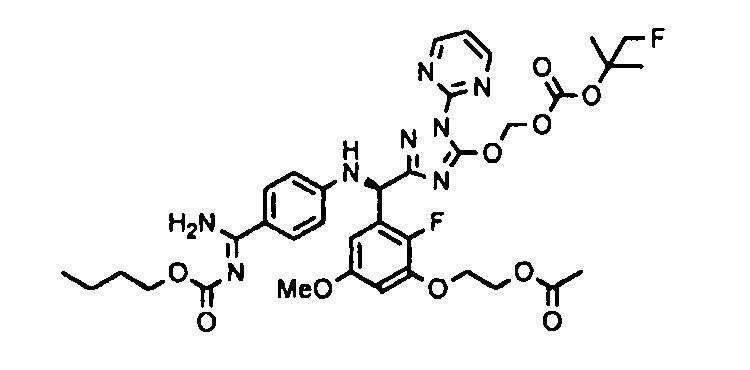
К одной порции, полученной в примере (61a), добавляли пиридин (18 мкл) и угольной кислоты бутокси сложного эфира 4-нитрофениловый сложный эфир (14 мг) и полученную в результате смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли этилацетат (5 мл) и воду (4 мл) и собирали органический слой. Водный слой экстрагировали этилацетатом (5 мл), все органические слои объединяли и сушили над безводным сульфатом магния. Полученную в результате смесь фильтровали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением названного соединения (9,4 мг).
1H-ЯМР (CDCl3): δ = 0,94 (t, J=7,2 Hz, 3H), 1,41 (sext, J=7,2 Hz, 2H), 1,51 (d, J=1,7 Hz, 6H), 1,70 (quint, J=7,2 Hz, 2H) 2,10 (s, 3H), 3,70 (s, 3H), 4,14 (t, J=7,4 Hz, 2H), 4,20 (t, J=5,0 Hz, 2H), 4,43 (t, J=5,0 Hz, 2H), 4,44 (d, J=47,2 Hz, 2H), 5,42 (d, J=7,1 Hz, 1H), 6,12 (m, 3H), 6,45 (dd, J=2,8, 6,4 Hz, 1H), 6,64 (dd, J=2,8, 4,8 Hz, 1H), 6,71 (d, J=8,8 Hz, 2H), 7,30 (t, J=4,8 Hz, 1H), 7,72 (d, J=8,8 Hz, 2H), 8,83 (d, J=4,8 Hz, 2H).
[0273] Пример 64
Угольной кислоты 2-(3-{1-(4-цианофениламино)-2-[этоксикарбонилимино]-2-метилсульфанилэтил]-2-фтор-5-метоксифенокси)этилового сложного эфира этиловый сложный эфир
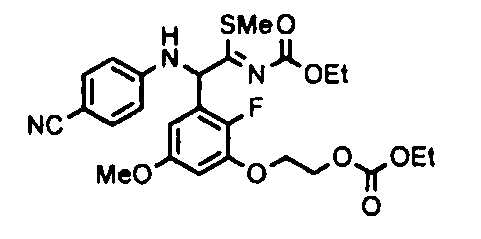
После того как воздух в реакционном сосуде был вытеснен азотом, добавляли толуол (1126 мл) и ацетонитрил (1126 мл). При перемешивании полученной в результате смеси при комнатной температуре порциями добавляли 2-(4-цианофениламино)-2-[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил]тиоацетамид (837,5 г, чистый вес 750,4 г, 1,999 моль). После прополаскивания смешанным растворителем толуол:ацетонитрил=1:1 (750 мл) температуру ванны устанавливали на 18°C. К этой смеси порциями добавляли триметилоксония тетрафторборат (311 г, 1,999 моль) на протяжении приблизительно 2 часов, прополаскивая ацетонитрилом (750 мл), и смесь перемешивали 3 часа при температуре ванны 22°C. Кроме того, дополнительно добавляли триметилоксония тетрафторборат (15,6 г, 0,100 моль), смесь дополнительно перемешивали в течение приблизительно 2 часов, а затем температуру ванны устанавливали на 0°C и смесь перемешивали в течение 12 часов. При температуре ванны 0°C в полученный реакционный раствор каплями добавляли этилхлороформиат (911 г, 8,395 моль) с последующим добавлением каплями пиридина (889 г, 11,233 моль) при внутренней температуре 16°C или меньше. После этого полученную в результате смесь перемешивали при температуре ванны 22°C в течение 2 часов, добавляли к смеси этилацетат (7504 мл) и воду (7504 мл) и собирали органический слой. Органический слой последовательно промывали водой (7504 мл) и 5% водным бикарбонатом натрия, затем 10% водным раствором хлорида натрия (7504 г) дважды и концентрировали при пониженном давлении до приблизительно 2300 мл. К полученному остатку добавляли тетрагидрофуран и смесь дополнительно трижды подвергали азеотропной дистилляции (применяли 2500 мл, 2500 мл, затем 2250 мл тетрагидрофурана) с получением тетрагидрофуранового раствора названного соединения.
[0274] Пример 65
Угольной кислоты 2-{3-[(4-цианофениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира этиловый сложный эфир
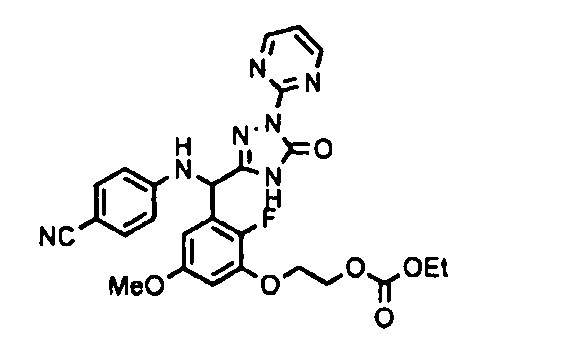
После того как воздух в реакционном сосуде был вытеснен азотом, добавляли тетрагидрофурановый раствор, содержащий угольной кислоты 2-(3-{1-(4-цианофениламино)-2-[этоксикарбонилимино]-2-метилсульфанилэтил]-2-фтор-5-метоксифенокси)этилового сложного эфира этиловый сложный эфир, полученный в примере 64, прополаскивая тетрагидрофураном (1250 мл), и перемешивали. После этого добавляли порциями пиримидин-2-ил-гидразин (275 г, 2,497 моль) при температуре ванны 15°C, прополаскивая тетрагидрофураном (1000 мл), и смесь перемешивали при температуре ванны 22°C в течение 14 часов. Дополнительно добавляли пиримидин-2-ил-гидразин (8,2 г, 0,074 моль), прополаскивая тетрагидрофураном (30 мл), и продолжали перемешивание в течение одного часа. После этого температуру ванны устанавливали на 15°C, каплями добавляли к смеси 1,8-диазабицикло[5.4.0]ундец-7-ен (304 г, 1,999 моль), прополаскивая тетрагидрофураном (50 мл), а затем температуру ванны устанавливали на 22°C и смесь перемешивали в течение 2,5 часов. После этого температуру ванны устанавливали на 15°C и добавляли в реакционный раствор этилацетат (7504 мл) и 1н хлористоводородную кислоту (7504 мл). Затем температуру ванны устанавливали на 22°C, собирали органический слой, и водный слой дополнительно экстрагировали этилацетатом (3752 мл). Все органические слои объединяли, органический слой дважды промывали 10% водным раствором хлорида натрия (7504 г) и концентрировали при пониженном давлении. Полученный остаток трижды подвергали азеотропной дистилляция c метанолом (применяли 1250 мл метанола, каждый раз). К полученному остатку добавляли тетрагидрофуран (375 мл) и метанол (475 мл) с получением суспензии названного соединения.
1H-ЯМР (400MHz, DMSO-d6): δ = 1,20 (t, J=7,2, 3H), 3,71 (s, 3H), 4,13 (q, J=7,2, 2H), 4,26-4,32 (m, 2H), 4,38―4,43 (m, 2H), 5,89 (d, J=7,2 Hz, 1H), 6,60-6,66 (m, 1H), 6,72-6,82 (m, 3H), 7,41 (dt, J=4,8, 0,4 Hz, 1H), 7,52 (d, J=8,8 Hz, 2H), 7,64 (d, J=7,2 Hz, 1H), 8,81 (dd, J=4,8, 0,4 Hz, 2H), 12,26 (brs, 1H).
[0275] Пример 66
4-{[[2-фтор-3-(2-гидроксиэтокси)-5-метоксифенил](5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]амино}бензонитрил
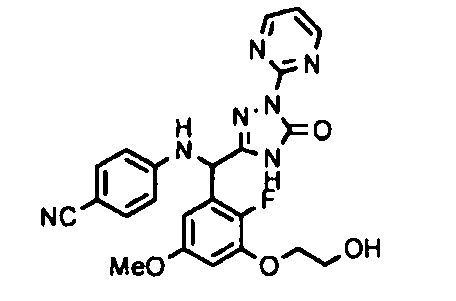
После того как воздух в реакционном сосуде был вытеснен азотом, добавляли суспензию, содержащую угольной кислоты 2-{3-[(4-цианофениламино)-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира этиловый сложный эфир, полученный в примере 65, при температуре ванны 15°C, и прополаскивая метанолом (2407 мл) и тетрагидрофураном (826 мл). 5н водный раствор гидроксида натрия (1599 мл, 7,995 моль) каплями добавляли к смеси при температуре ванны 15°C, затем температуру ванны устанавливали на 20°C и реакционную суспензию перемешивали в течение 16 часов. После этого температуру ванны устанавливали на 15°C и к полученному раствору каплями добавляли уксусную кислоту (2288 мл). Затем температуру ванны устанавливали на 22°C и каплями добавляли воду (3750 мл). Добавляли затравку названного соединения (374 мг, 0,836 ммоль) к смеси, которую затем перемешивали в течение 20 минут. Затем каплями добавляли воду (3754 мл) и температуру ванны охлаждали до 0°C на протяжении приблизительно 2 часов. Перемешивание продолжали в течение 16 часов при температуре ванны 0°C. Осадок фильтровали, промывали водой (2250 мл) и сушили при пониженном давлении при 40-50°C с получением названного соединения (660 г, чистый вес 631,6 г) в качестве бледно-желто-белого порошка.
1H-ЯМР (400 MHz, DMSO-d6): δ = 3,70 (s, 3H), 3,73 (dt, J=5,2, 5,2 Hz, 2H), 4,07 (t, J=4,8 Hz, 2H), 4,92 (t, J=4,8 Hz, 1H), 5,88 (d, J=7,2 Hz, 1H), 6,53-6,63 (m, 1H), 6,70-6,84 (m, 3H), 7,41 (dt, J=1,2, 4,8 Hz, 1H), 7,53 (d, J=8,0 Hz, 2H), 7,63 (d, J=7,6 Hz, 1H), 8,81 (dd, J=1,2, 4,8 Hz, 2H), 12,26 (brs, 1H).
[0276] Пример 67
Уксусной кислоты 2-{3-[(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир
(67a) Уксуснокислая соль 2-{3-[(R)-(4-карбамимидоилфениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира уксусной кислоты
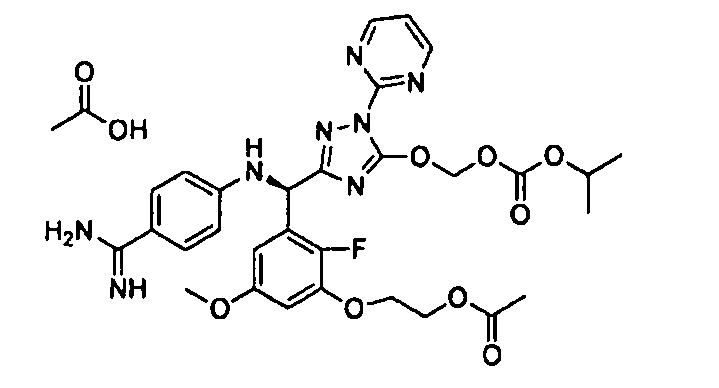
В атмосфере азота смесь уксусной кислоты 2-{3-[(R)-{4-[амино(2-метилаллилоксикарбонилимино)метил]фениламино}-(5-оксо-1-пиримидин-2-ил-4,5-дигидро-1H-[1,2,4]-триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира (пример 45, 250 мг), угольной кислоты хлорметилового сложного эфира изопропилового сложного эфира [CAS № 35180-01-9] (121 мг), карбоната рубидия (73,2 мг) и DMA (10 мл) перемешивали при 85°C в течение 90 минут. После охлаждения смеси до комнатной температуры добавляли в нее этилацетат и воду. Собирали органический слой, водный слой реэкстрагировали этилацетатом и все органические слои объединяли. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана, этилацетата и метанола) с получением уксусной кислоты 2-{3-[(R)-(4-{амино[2-метилаллилоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира в качестве твердого вещества.
К смеси полученного твердого вещества, DMF (3 мл) и уксусной кислоты (0,3 мл) добавляли тетракис(трифенилфосфин)палладий (22,9 мг) и полученную в результате смесь перемешивали в течение 24 часов при 45°C. После охлаждения смеси до комнатной температуры реакционную смесь очищали с помощью хроматографии на колонке с силикагелем с обращенной фазой (смешанный растворитель из метанола и воды, содержащий 0,1% уксусной кислоты) с получением названного соединения (95 мг).
[0277] (67b) Уксусной кислоты 2-{3-[(R)-(4-{амино[бутоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир
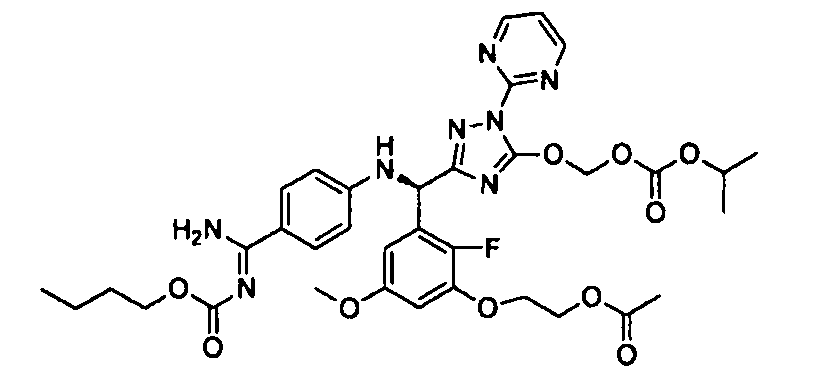
К смеси уксуснокислой соли 2-{3-[(R)-(4-карбамимидоилфениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира уксусной кислоты (23 мг), полученной в примере 67a, и DMF (1 мл) добавляли угольной кислоты бутилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 67036-13-9] (10 мг) и триэтиламин (50 мкл) и полученную в результате смесь перемешивали при комнатной температуре в течение 63 часов. К смеси добавляли этилацетат и воду и собирали органический слой. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (16,80 мг).
1H-ЯМР (CD3OD) δ 0,95 (t, J=7,2 Hz, 3H), 1,24 (d, J=6,0 Hz, 6H), 1,44 (m, 2H), 1,65 (m, 2H), 2,04 (s, 3H), 3,70 (s, 3H), 4,09 (t, J=6,4 Hz, 2H), 4,20-4,24 (m, 2H), 4,37-4,39 (m, 2H), 4,85 (квинт, J=6,0 Hz, 1H), 6,05 (s, 1H), 6,08 (d, J=5,6 Hz, 1H), 6,11 (d, J=5,6 Hz, 1H), 6,57 (dd, J=2,8, 6,8 Hz, 1H), 6,74 (dd, J=2,8, 4,8 Hz, 1H), 6,77 (d, J=8,8 Hz, 2H), 7,46 (t, J=4,8 Hz, 1H), 7,69 (d, J=8,8 Hz, 2H), 8,85 (d, J=4,8 Hz, 2H)
[0278] Пример 68
Уксусной кислоты 2-{3-[(R)-(4-{амино[изобутоксикарбонилимино]метил}фениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси)этиловый сложный эфир
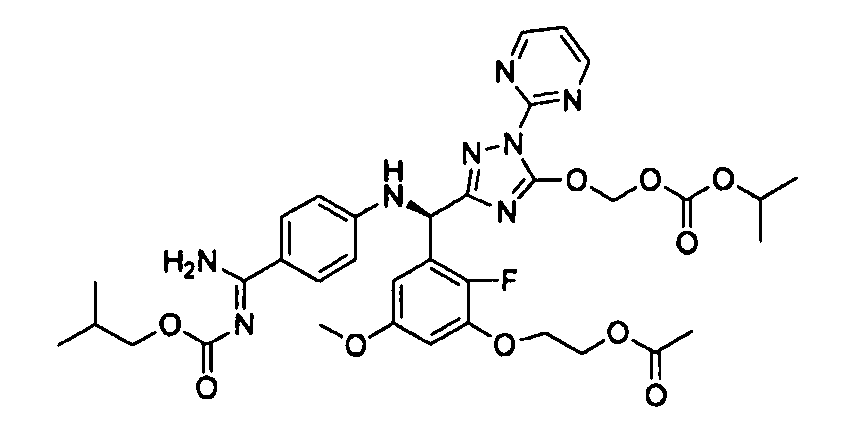
К смеси уксуснокислой соли 2-{3-[(R)-(4-карбамимидоилфениламино)-(5-изопропоксикарбонилоксиметокси-1-пиримидин-2-ил-1H-[1,2,4]триазол-3-ил)метил]-2-фтор-5-метоксифенокси}этилового сложного эфира уксусной кислоты (23 мг), полученной в примере 67a, и DMF (1 мл) добавляли угольной кислоты изобутилового сложного эфира 4-нитрофениловый сложный эфир [CAS № 112240-73-0] (10 мг) и триэтиламин (50 мкл) и полученную в результате смесь перемешивали при комнатной температуре в течение 64 часов. К смеси добавляли этилацетат и воду и собирали органический слой. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Высушивающее средство отфильтровывали, а полученный фильтрат концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии на колонке с силикагелем (смешанный растворитель из гептана и этилацетата) с получением названного соединения (14,99 мг).
1H-ЯМР (CD3OD) δ 0,97 (d, J=6,8 Hz, 6H), 1,24 (d, J=6,4 Hz, 6H), 1,95 (m, 1H), 2,05 (s, 3H), 3,70 (s, 3H), 3,87 (d, J=6,8 Hz, 2H), 4,20-4,24 (m, 2H), 4,37-4,40 (m, 2H), 4,85 (quint, J=6,4 Hz, 1H), 6,06 (s, 1H), 6,08 (d, J=5,6 Hz, 1H), 6,12 (d, J=5,6 Hz, 1H), 6,57 (dd, J=2,8, 6,8 Hz, 1H), 6,75 (dd, J=2,8, 4,8 Hz, 1H), 6,77 (d, J=9,2 Hz, 2H), 7,46 (t, J=4,8 Hz, 1H), 7,69 (d, J=9,2 Hz, 2H), 8,85 (d, J=4,8 Hz, 2H)
[0279] [Измерение порошковых дифракционных рентгенограмм]
Для кристаллов соединений, полученных в примерах 20, 24 и 25, порошковые дифракционные рентгенограммы измеряли при нижеприведенных условиях.
[Условия измерений]
Применяемое рентгеновское излучение: CuKα излучение
Напряжение: 50 кВ
Сила тока: 300 мА
Щель расходимости: 0,50 мм
Щель рассеивания: открыта
Приемная щель: открыта
Скорость сканирования: 2°/мин
[0280] На фиг. 1 показаны порошковые дифракционные рентгенограммы соединения примера 20, а в таблице 1 показаны пики угла дифракции [2θ] и интенсивность пиков.
|
[0281] На фиг. 2 показаны порошковые дифракционные рентгенограммы соединения примера 24, а в таблице 2 показаны пики угла дифракции [2θ] и интенсивность пиков.
|
[0282] На фиг. 3 показаны порошковые дифракционные рентгенограммы соединения примера 25, а в таблице 3 показаны пики угла дифракции [2θ] и интенсивность пиков.
|
[0283] [Измерение ЯМР спектра 13C в твердом состоянии]
ЯМР спектра 13C в твердом состоянии соединений, полученных в примерах 20, 24 и 25, измеряли при нижеупомянутых условиях.
[Условия измерений]
Температура измерения: комнатная температура (~23°C)
Эталонный материал: глицин (внешний эталон: карбонильный углерод, 176,03 ppm)
Измеряемое ядро: 13C (100,625 МГц)
Вид импульсов: CP/TOSS измерение
Накопление: 4096
Частота повторения импульсов: 3 секунды
[0284] На фиг. 4 показан ЯМР спектр 13C в твердом состоянии соединения примера 20, а химический сдвиг сигнала показан ниже.
δ (ppm) 175,6, 171,5, 166,1, 162,1, 159,1, 156,5, 155,7, 154,6, 153,0, 146,4, 144,3, 138,0, 132,8, 131,1, 128,4, 122,0, 114,4, 110,0, 108,4, 101,4, 86,6, 76,6, 67,9, 65,9, 61,7, 56,1, 53,8, 48,0, 44,1, 38,7, 23,0, 20,4, 19,1, 18,6
[0285] На фиг. 5 показан ЯМР спектр 13C в твердом состоянии соединения примера 24, а химический сдвиг сигнала показан ниже.
δ (ppm) 175,5, 171,7, 166,3, 162,1, 158,9, 156,9, 155,7, 154,6, 153,0, 147,0, 146,3, 144,4, 137,7, 133,2, 131,0, 128,9, 121,9, 115,4, 114,5, 109,7, 108,7, 101,6, 86,4, 76,8, 68,0, 65,8, 62,1, 56,3, 53,9, 48,3, 46,2, 44,2, 23,2, 20,5, 18,8, 7,1
[0286] На фиг. 6 показан ЯМР спектр 13C в твердом состоянии соединения примера 25, а химический сдвиг сигнала показан ниже.
δ (ppm) 175,0, 171,7, 166,7, 162,4, 159,4, 156,6, 156,0, 154,5, 152,9, 146,5, 144,7, 138,0, 133,0, 131,8, 129,0, 121,3, 114,1, 110,2, 108,1, 102,0, 86,0, 77,2, 67,9, 66,5, 62,5, 56,8, 54,2, 48,7, 44,3, 23,2, 20,1, 18,5, 14,5
[0287] [Тестовый пример 1 Измерение уровня крови у макаки-резус посредством перорального введения]
(1) Животное:
Применяли выводок самцов макак-резус в возрасте 4 лет или старше.
(2) Оценка образца:
DMSO (Wako Pure Chemical Industries, Ltd.) добавляли к соединению настоящего изобретения для приготовления раствора (A) с концентрацией 10 мг/мл. Раствор (A) хранили при -20°C до применения в анализе.
(3) Способ приготовления раствора для введения:
К 1,2 мл вышеупомянутого раствора (A) добавляли 3 мл полиоксиэтиленсорбитанмонолаурата (20) (Wako Pure Chemical Industries, Ltd.) и 25,8 мл воды сверхвысокой чистоты (вода, полученная путем очистки водопроводной воды MQ Gradient-A10 (прибор) и Elix-UV5 (фильтр) (MILLIPORE)) и полученную в результате смесь смешивали для приготовления раствора для введения (B) (конечная концентрация раствора для введения (B): 0,4 мг/мл).
(4) Введение, взятие крови и взятие плазмы:
Применяя одноразовый стеклянный шприц емкостью 10 или 20 мл, макакам-резус вводили раствор (B) 2,5 мл на 1 кг живого веса (доза: 1 мг/кг). Приблизительно 0,5 мл крови каждого отбирали из вены через 0,25, 0,5, 1, 2, 4, 6 и 8 часов после введения. В 1,5 мл полипропиленовую пробирку (Eppendorf), в которую добавляли (п-амидинофенил)метансульфонила фторида гидрохлорид (Wako Pure Chemical Industries, Ltd.) для конечной концентрации 2-5 ммоль, добавляли ранее взятую кровь и полученную в результате смесь хранили при ледяном охлаждении. Этот раствор центрифугировали при 10000 об/мин в течение 5 минут при 4°C и аккуратно собирали 50 мкл плазмы, и хранили до анализа при -20°C.
(5) Способ измерения концентрации соединения в плазме:
Концентрацию соединения в плазме определяли с помощью использования жидкостного хроматомасс-спектрометра (LC-MS/MS). К гидрохлориду имипрамина (SIGMA) добавляли смешанный растворитель из ацетонитрила и метанола (1:1) для концентрации 100 нг/мл, чтобы приготовить внутренний стандарт раствора вещества (IS раствор) для измерения концентрации. После оттаивания плазмы в нее добавляли ацетонитрил (5 мкл) с последующим добавлением 0,3 мл IS раствора и полученную в результате смесь смешивали и центрифугировали (освобождали от белков) при 2700 об/мин в течение 10 минут при 4°C. Полученную надосадочную жидкость фильтровали с помощью миллипорового фильтра (MILLIPORE) с получением фильтрата (C).
Фильтрат (C) (3-5 мкл) анализировали с помощью LC-MS/MS. Для получения хроматограмм площади пиков измеряемых соединений и площади пиков, соответствующих веществу внутреннего стандарта, анализировали с использованием MassLynx (MicroMass) для вычисления концентрации соединения, содержащегося в плазме, с помощью способа внутреннего стандарта.
(6) Результаты
С помощью перорального введения соединения настоящего изобретения макакам-резус подтверждали наличие соединения (IV) в венозной крови. Вышеупомянутый тест выполняли дважды для каждого соединения, чтобы определить, с помощью моментального анализа, максимальную концентрацию в плазме (Смакс) соединения (IV) и площадь под кривой концентрации в плазме (AUC) экстраполировали до бесконечного времени. Смакс и AUC (среднее значение двух тестов) каждого соединения показаны в таблице 4 ниже.
[0288]
|
[0289] [Тестовый пример 2 Измерение уровня в крови у макак-резус с помощью перорального введения]
(1) Животное:
Применяли выводок самцов макак-резус в возрасте 4 лет или старше.
(2) Оценка образца:
DMSO (Wako Pure Chemical Industries, Ltd.) добавляли к соединению настоящего изобретения для приготовления раствора (A) с концентрацией 10 мг/мл. Раствор (A) хранили при -20°C до применения в анализе.
(3) Способ приготовления раствора для введения:
К 1,1 мл вышеупомянутого раствора (A) добавляли 2,2 мл полиоксиэтиленсорбитанмонолаурата (80) (Tokyo Chemical Industry Co., Ltd.) и 18,7 мл дистиллированной воды для инъекции (Otsuka Pharmaceutical Co., Ltd.) и полученную в результате смесь смешивали для приготовления раствора для введения (B) (конечная концентрация раствора для введения (B): 0,5 мг/мл).
(4) Введение, взятие крови и взятие плазмы:
Применяя одноразовый стеклянный шприц емкостью 10 или 20 мл, макакам-резус вводили раствор (B) 2,0 мл на 1 кг живого веса (доза: 1 мг/кг). Приблизительно 0,5 мл крови каждого отбирали из вены через 0,5, 1, 2, 4, 6 и 8 часов после введения и хранили при ледяном охлаждении. Этот раствор центрифугировали при 10000 об/мин в течение 5 минут при 4°C и аккуратно собирали 50 мкл плазмы и хранили до анализа при -20°C.
(5) Способ измерения концентрации соединения в плазме:
Концентрацию соединения в плазме определяли с помощью использования жидкостного хроматомасс-спектрометра (LC-MS/MS). К гидрохлориду имипрамина (SIGMA) добавляли смешанный растворитель из ацетонитрила и метанола (1:1) для концентрации 100 нг/мл, чтобы приготовить внутренний стандарт раствора вещества (IS раствор) для измерения концентрации. После оттаивания плазмы в нее добавляли ацетонитрил (5 мкл) с последующим добавлением 0,3 мл IS раствора и полученную в результате смесь смешивали и центрифугировали (освобождали от белков) при 2700 об/мин в течение 10 минут при 4°C. Полученную надосадочную жидкость фильтровали с помощью миллипорового фильтра (MILLIPORE) с получением фильтрата (C).
Фильтрат (C) (3-5 мкл) анализировали с помощью LC-MS/MS. Для полученных хроматограмм площади пиков измеряемых соединений и площади пиков, соответствующих веществу внутреннего стандарта, анализировали с использованием MassLynx (MicroMass) для вычисления концентрации соединения, содержащегося в плазме, с помощью способа внутреннего стандарта.
(6) Результаты
С помощью перорального введения соединения настоящего изобретения макакам-резус подтверждали наличие соединения (IV) в венозной крови. Вышеупомянутый тест выполняли дважды для каждого соединения, чтобы определить, с помощью моментального анализа, максимальную концентрацию в плазме (Смакс) соединения (IV) и площадь под кривой концентрации в плазме (AUC) экстраполировали до бесконечного времени. Смакс и AUC (среднее значение двух тестов) каждого соединения показаны в таблице 5 ниже.
|
Промышленная применимость
[0290] Благодаря пероральному введению соединения настоящего изобретения высокое ингибирующее действие на фактор коагуляции крови VIIa и концентрация в крови соединения (IV), характеризующегося эффектом антикоагуляции крови, достигают уровня, достаточного для проявления фармакологического действия. Следовательно, соединение настоящего изобретения является применимым в качестве терапевтического и/или профилактического средства для заболеваний, вызванных образованием тромба.