Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЦИСТЕИНА ИЛИ ЕГО ПРОИЗВОДНОГО С ИСПОЛЬЗОВАНИЕМ НОВОЙ О-ФОСФОСЕРИНСУЛЬФГИДРИЛАЗЫ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к способу получения цистеина или его производного с использованием новой О-фосфосерин-сульфгидрилазы.
Предшествующий уровень техники
Цистеин является важной аминокислотой в метаболизме серы у всех живых организмов. Он используется в биосинтезе белков, таких как кератин волос, глутатион, биотин, метионин и других серосодержащих метаболитов, или используется в качестве соединения-предшественника кофермента А. Кроме того, известно, что биосинтез цистеина тесно связан с биосинтезом других аминокислот, таких как серин, глицин и метионин. В промышленности цистеин и его производные используют в различных областях, включая фармацевтическую промышленность (для лечения бронхиальных заболеваний), косметическую промышленность (в шампунях для волос, композициях для химических завивок) и пищевую промышленность (антиоксиданты, усилители вкуса, размягчители теста).
До настоящего времени цистеин получали химически посредством кислотного гидролиза исходных материалов, таких как человеческие волосы или перья животных. Однако не только выход при получении цистеина из волос составляет всего лишь 7-8%, но также использование соляной кислоты или серной кислоты приводит к большому количеству отходов, результатом чего является загрязнение окружающей среды. Также, использование волос в качестве исходного материала может вызывать у пользователя сильное отвращение. Эти проблемы дали толчок к разработке экологически безопасных способов получения цистеина. Таким образом, был разработан способ получения цистеина с использованием микроорганизмов.
Типичным микробиологическим получением цистеина является: 1) биологическое превращение D, L-ATC (D, L2-амино-2-тиазолин-4-карбоновая кислота) с использованием микроорганизма. Однако этот процесс превращения сложно применить в промышленности вследствие низкой растворимости соединения-предшественника D, L-ATC. 2) Другим способом получения цистеина является прямая ферментация с использованием Е. coli. В этом способе избыточное накопление цистеина в микроорганизмах может привести к внутриклеточной токсичности, и существует ограничение в получении цистеина в высоких концентрациях с использованием микроорганизма.
В одном из путей биосинтеза цистеина в микроорганизмах и растениях О-ацетилсерин (OAS) действует в качестве промежуточного соединения-предшественника, обеспечивая углеродный скелет цистеина. О-ацетилсеринсульфгидрилаза (OASS), используя сульфид водорода в качестве донора серы, катализирует превращение OAS в цистеин. Следовательно, цистеин может быть получен из микроорганизмов, накапливающих OAS, и различных доноров серы с использованием OASS (патент США 6579705).
Авторы настоящего изобретения исследовали новый способ получения цистеина, непохожий на традиционный способ, и они обнаружили существование О-фосфосерин-сульфгидрилазы (OPSS), катализирующей синтез цистеина из О-фосфосерина (OPS) в конкретном микроорганизме. OPS представляет собой промежуточное соединение-предшественник L-серина и имеет более короткий метаболический путь, чем OAS. Таким образом, использование OPS может быть более выгодным по сравнению с OAS. В частности, было обнаружено, что OPSS, полученная из Trichomonas vaginalis, не требует коферментов переноса серы, таких как mec+ и cys0, в отличие от OPSS, полученной из Mycobacterium tuberculosis, а также демонстрирует оптимальную активность при 37°C, в отличие от OPSS, полученной из Aeropyrum pernix.
Описание изобретения
Техническая задача
Авторы настоящего изобретения приложили большие усилия для разработки способа получения цистеина с высоким выходом и в результате идентифицировали новую OPSS, обладающую активностью синтезировать цистеин, используя OPS в качестве субстрата, из различных микроорганизмов, и обнаружили, что эта новая OPSS обладает более высокой цистеин-синтезирующей активностью, чем известная OPSS из Trichomonas vaginalis, что таким образом завершает настоящее изобретение.
Техническое решение
Целью настоящего изобретения является предложение способа получения цистеина или его производных, включающего стадию взаимодействия О-фосфосерина (OPS) с сульфидом в присутствии новой О-фосфосерин-сульфгидрилазы (OPSS) или микроорганизма, экспрессирующего ее, тем самым получая цистеин или его производные.
Полезные эффекты
В настоящем изобретении предложен способ получения цистеина при помощи новой О-фосфосерин-сульфгидрилазы (OPSS) с использованием О-фосфосерина в качестве субстрата, и преимуществом этого способа является то, что цистеин может быть экологически безопасно получен с высоким выходом простым способом.
Описание графических материалов
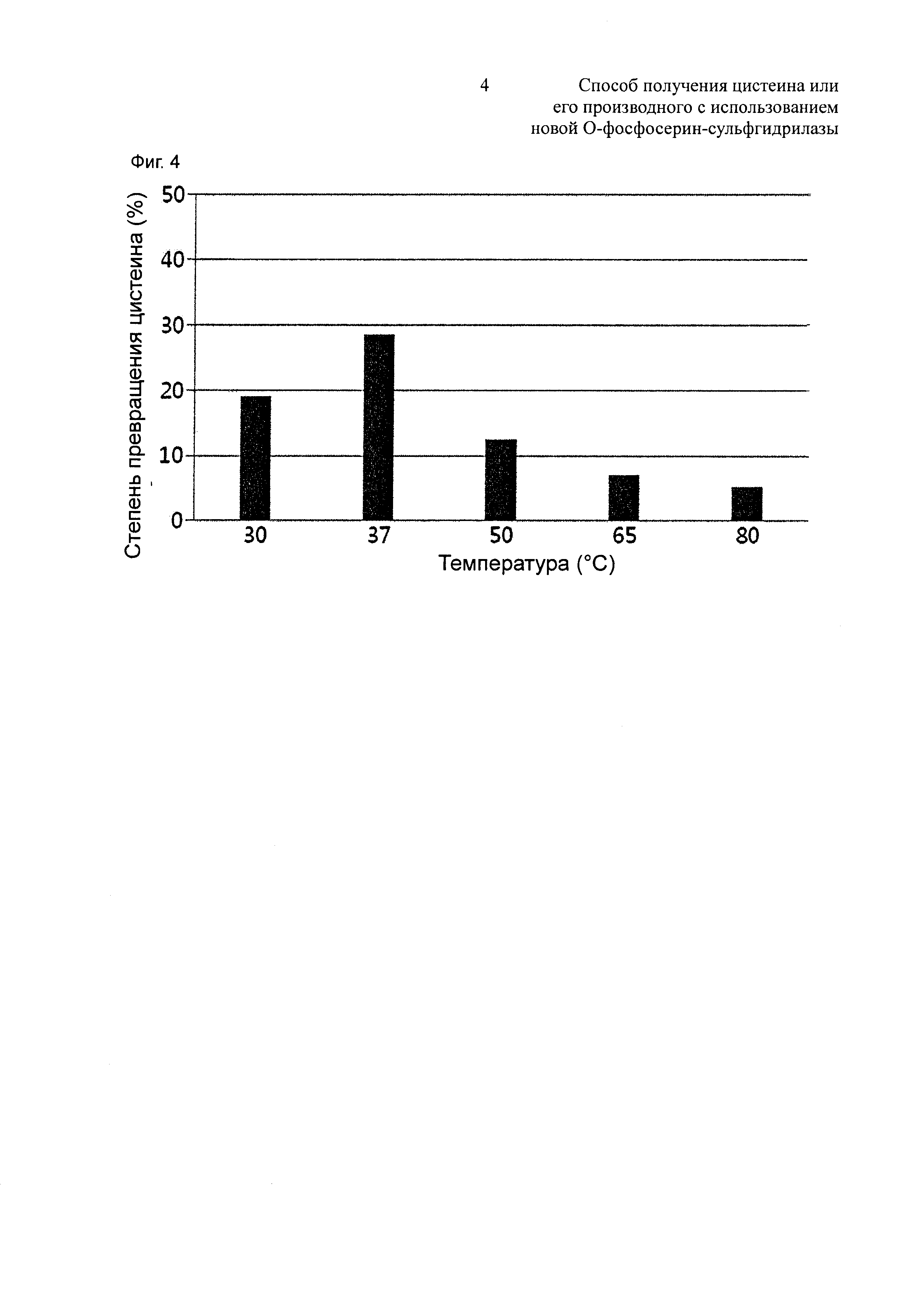
На Фиг. 1 показан результат измерения степеней превращения цистеина для трех типов OPSS за 10 минут, 30 минут и 60 минут;
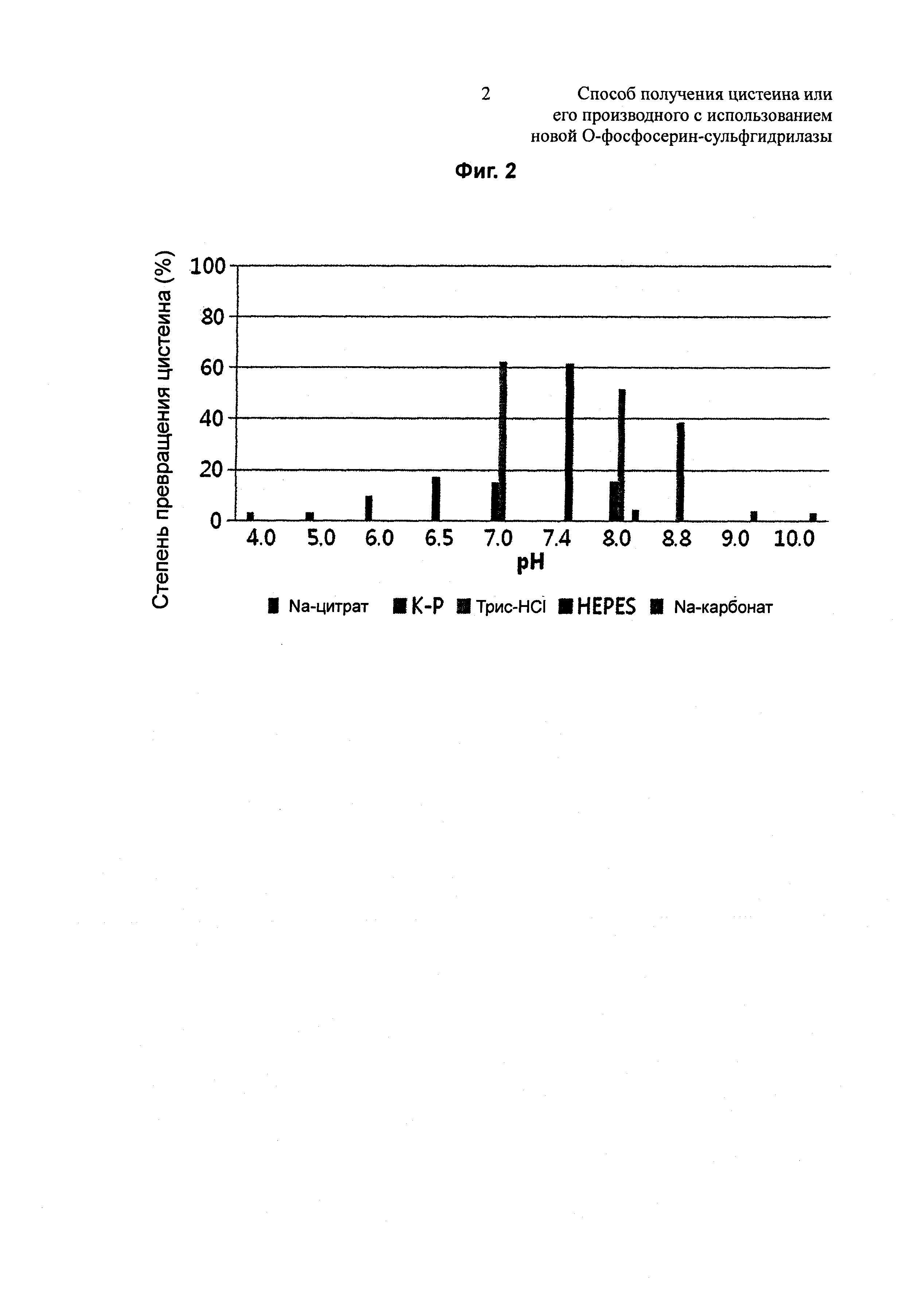
На Фиг. 2 показан результат измерения степеней превращения цистеина в зависимости от pH для изучения pH-чувствительности Dal-OPSS;
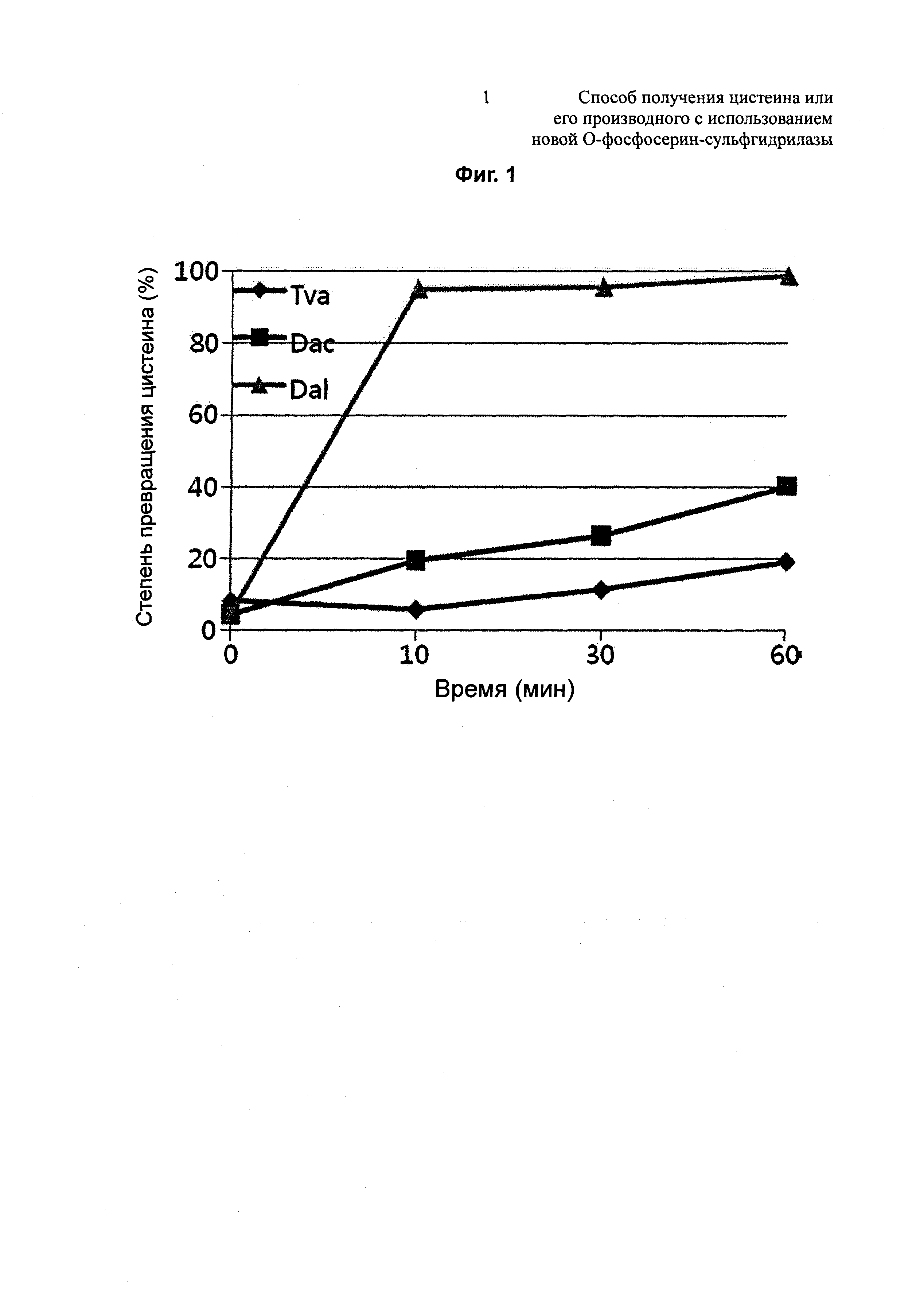
На Фиг. 3 показан результат измерения степеней превращения цистеина для трех типов OPSS за 10 минут, 30 минут и 60 минут с использованием ферментативного бульона, содержащего OPS, и сульфида в качестве субстратов; и
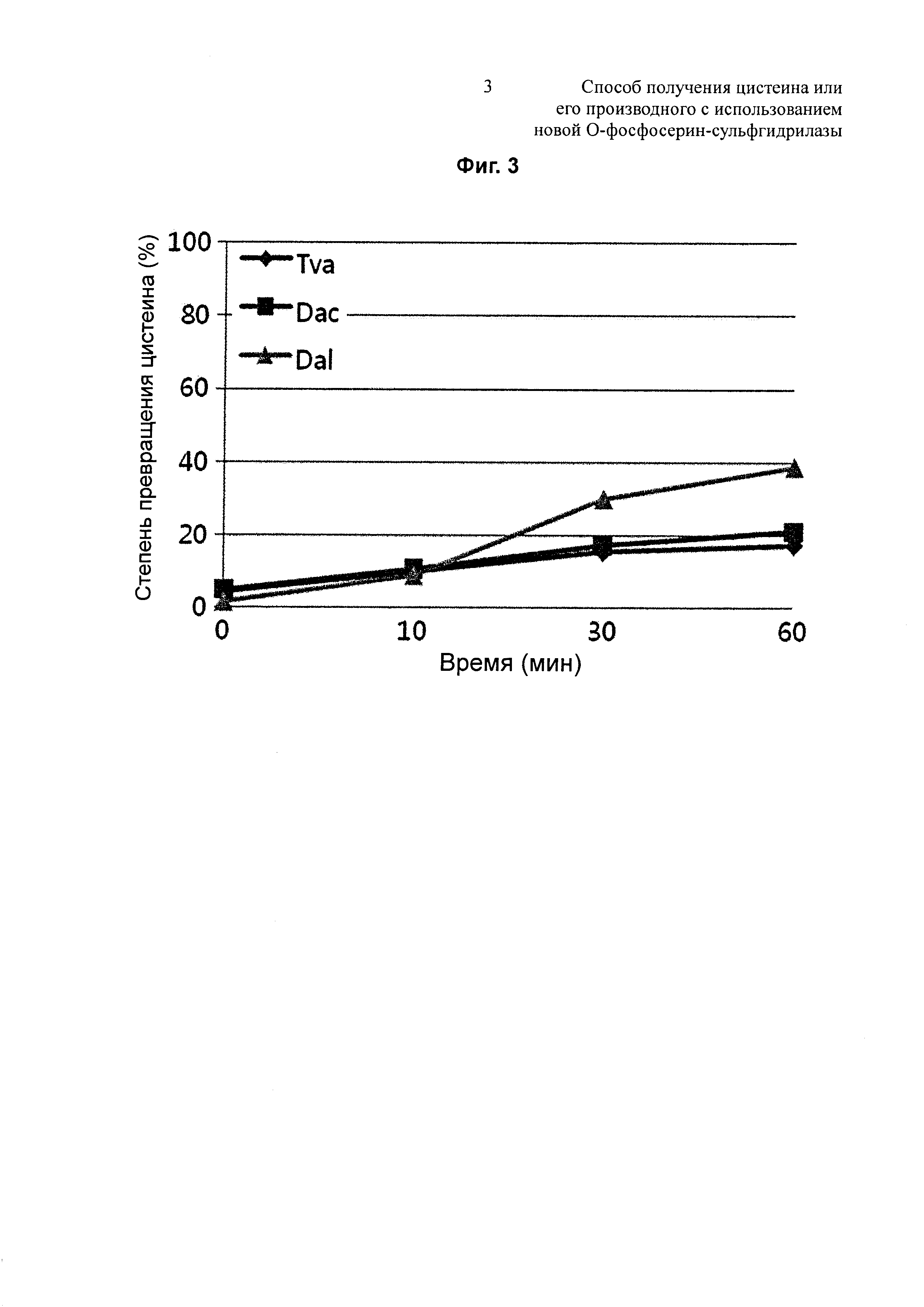
На Фиг. 4 показан результат измерения степеней превращения Dal-OPSS в зависимости от температуры.
Лучший способ осуществления изобретения
В одном аспекте настоящего изобретения предложен способ получения цистеина или его производных, включающий стадию взаимодействия О-фосфосерина (OPS) с сульфидом в присутствии О-фосфосерин-сульфгидрилазы (OPSS), имеющей аминокислотную последовательность, представленную в SEQ ID NO:1 или 2, или микроорганизма, экспрессирующего ее, с получением посредством этого цистеина или его производных.
При использовании в данном описании изобретения термин "О-фосфосерин-сульфгидрилаза" (ниже упоминаемый как OPSS) относится к ферменту, который переносит тиольную группу (группа SH) на О-фосфосерин (ниже упоминаемый как OPS), превращая OPS в цистеин.
В настоящем изобретении OPSS может быть представлена аминокислотной последовательностью SEQ ID NO:1 или 2 и представляет собой новую OPSS, идентифицированную авторами настоящего изобретения. Возможны некоторые модификации аминокислотной последовательности, представленной SEQ ID NO:1 или 2 до тех пор, пока она обладает OPSS-активностью и сохраняет эту активность. Специалистам в данной области очевидно, что аминокислотная последовательность, имеющая 70%-ную или более, конкретно 80%-ную или более, более конкретно 90%-ную или более, и наиболее конкретно 95%-ную или более гомологию с аминокислотной последовательностью из-за искусственной модификации, эквивалентна аминокислотной последовательности по настоящему изобретению до тех пор, пока она обладает нужной активностью.
В одном конкретном воплощении настоящего изобретения использовали Dac-OPSS, имеющую аминокислотную последовательность SEQ ID NO:1, и Dal-OPSS, имеющую аминокислотную последовательность SEQ ID NO:2, использовали для оценки их активностей в отношении синтеза цистеина путем использования очищенного ферментативного бульона, содержащего OPS, или OPS в качестве субстрата. В результате, они демонстрировали более высокие степени превращения цистеина, чем контрольная группа, Tva-OPSS, так что предполагалось, что OPSS, имеющая аминокислотную последовательность SEQ ID NO:1 или 2, способна производить цистеин с высоким выходом (Фиг. 1 и 3, и Таблицы 3 и 4).
При использовании в данном описании изобретения термин "гомология" относится к проценту сходства последовательностей двух полипептидных группировок. Соответствие между последовательностями одной и другой группировки может быть определено при помощи методик, известных в данной области. Например, гомология может быть определена путем прямого сравнения данных о последовательности двух полипептидных молекул при выравнивании данных о последовательности и использования легкодоступных компьютерных программ. Кроме того, гомология может быть определена путем гибридизации полинуклеотидов в условиях, в которых образуются стабильные дуплексы между гомологичными областями, с последующим разрушением посредством одноцепочечно-специфичных(ой) нуклеаз(ы) и определением размера разрушенных фрагментов.
При использовании в данном описании изобретения термин "подобие последовательностей" относится к степени котождества или соответствия между нуклеиновокислотными или аминокислотными последовательностями белков, которые могут иметь или могут не иметь общее эволюционное происхождение. В одном конкретном воплощении две аминокислотные последовательности являются "по существу гомологичными" или "по существу подобными", когда по меньшей мере примерно 21% (конкретно, по меньшей мере примерно 50%, и наиболее конкретно, по меньшей мере примерно 75%, 90%, 95%, 96%, 97% или 99%) полипептидов совпадают на протяжении определенной длины аминокислотных последовательностей. Последовательности, которые являются по существу гомологичными, можно идентифицирвать путем сравнения последовательностей с использованием стандартного программного обеспечения, доступного в базах данных последовательностей, или в эксперименте гибридизации, например в жестких условиях, определенных для данной конкретной системы. Определение подходящих условий гибридизации находится в рамках специальных знаний в данной области (см. напр., Sambrook et al., 1989, ниже).
При использовании в данном описании изобретения термин "превращение цистеина", как предполагается, относится к каталитической реакции OPSS, результатом которой является превращение субстрата OPS в продукт цистеин, то есть он относится к каталитической реакции превращения OPS в цистеин. Также, при использовании в данном описании изобретения термин "степень превращения цистеина" относится к проценту OPS, превращенному в цистеин. В оптимальных условиях реакции 1 моль OPS превращается в 1 моль цистеина. Например, если 100 молей OPS превращаются в 100 молей цистеина, степень превращения цистеина составляет 100%. OPSS по настоящему изобретению катализирует превращение OPS в цистеин, что демонстрирует более короткий метаболический путь, чем метаболический путь с использованием OAS, и таким образом является предпочтительным в получении соединений-предшественников. Также преимуществом является то, что OPSS по настоящему изобретению способна производить цистеин сама по себе, без коферментов переноса серы (mec+ и cys0 из М. tuberculosis), в отличие от традиционной OPSS.
OPSS по настоящему изобретению может кодироваться полинуклеотидом, имеющим нуклеотидную последовательность SEQ ID NO:9-12. OPSS, имеющая аминокислотную последовательность SEQ ID NO:1 или 2 по настоящему изобретению, может кодироваться полинуклеотидом, имеющим нуклеотидную последовательность SEQ ID NO:9 или 10, соответственно. Более конкретно, для увеличения экспрессии гетерогенного белка в Е. coli, она может кодироваться полинуклеотидом, имеющим нуклеотидную последовательность SEQ ID NO:11 или 12, которая оптимизирована для Е. coli путем оптимизации частоты использования кодонов.
Микроорганизм, экспрессирующий OPSS по настоящему изобретению, может представлять собой микроорганизм, который эндогенно экспрессирует OPSS по настоящему изобретению, или микроорганизм, в который нуклеотидная последовательность, кодирующая OPSS по настоящему изобретению, введена в форме вектора или интегрирована в хромосому. OPSS-активность микроорганизма, экспрессирующего OPSS, может быть дополнительно повышена. Способ повышения активности OPSS включает способ увеличения числа копий путем введения вектора, включающего полинуклеотид, обладающий нуклеотидной последовательностью, кодирующей OPSS, в микроорганизм, способ оптимизации частоты использования кодонов нуклеотидной последовательности в соответствии с использованием кодонов, предпочтительным для данного микроорганизма, способ замещения промотора гена, кодирующего OPSS, сильным промотором в микроорганизме, экспрессирующем OPSS, способ введения мутации в промотор, способ введения мутации в ген, кодирующий новую выделенную OPSS, для повышения OPSS-активности или тому подобное.
При использовании в данном описании изобретения термин "вектор" относится к любому носителю для клонирования и/или переноса нуклеиновой кислоты в клетку-хозяина. Вектор может представлять собой репликон, который может быть присоединен к другому сегменту ДНК, так чтобы индуцировать репликацию присоединенного сегмента. "Репликон" относится к любому генетическому элементу (например, плазмиде, фагу, космиде, хромосоме, вирусу), который функционирует как автономная единица репликации ДНК in vivo, другими словами, способен реплицироваться под своим собственным контролем.
В настоящем изобретении микроорганизм, экспрессирующий OPSS, может представлять собой микроорганизм, который получен путем трансформации вектора, включающего OPSS. Способ трансформации может включать любой способ введения нуклеиновой кислоты в клетки, и может быть осуществлен путем выбора подходящей стандартной методики, известной в данной области. Например, он может включать электропорацию, соосаждение с фосфатом кальция, ретровирусное инфицирование, микроинъекцию, DEAE-декстран, катионную липосому или подобное, но не ограничен ими.
Микроорганизм, экспрессирующий OPSS, может быть прокариотическим или эукариотическим, конкретно энтеробактериями или дифтериеподобными бактериями, более конкретно микроорганизмом, принадлежащим к Escherichia sp., Serratia sp. или тому подобному, и наиболее конкретно Е. coli.
OPSS может быть выделена из культурального бульона, который получают путем культивирования микроорганизма, экспрессирующего новую выделенную OPSS, в настоящем изобретении. Можно использовать любой способ, обычно известный в области техники, и в конкретном воплощении настоящего изобретения для культивирования микроорганизма использовали руководство по системе экспрессии рЕТ (Novagen Inc.) с последующим выделением с использованием колонок Ni-NTA.
В настоящем изобретении OPS, используемый в качестве субстрата для новой OPSS, может представлять собой OPS-ферментативный бульон, полученный посредством ферментации, а также имеющийся в продаже чистый OPS. Пример чистого OPS может включать продукт Р0878 от Sigma-Aldrich или продукт CAS407-41-0 от Wako. Кроме того, ферментативный бульон OPS может быть получен путем культивирования микроорганизма, вырабатывающего OPS, например микроорганизма, депонированного под номером КССМ 111ОЗР (СА07-0022/pCL-prmf-serA*(G336V)-serC; см. корейскую патентную публикацию 10-2012-0041115).
При использовании в данном описании изобретения термин "сульфид" относится к соединению серы и более электроположительного элемента, чем сера, и в связи с объектом настоящего изобретения сульфид используется в получении цистеина или его производных. Сульфид может быть представлен в твердой форме, обычно используемой в данной области, а также в жидкой форме или в газообразной форме, благодаря различию в pH, давления или растворимости. Так как он может быть превращен в тиольную группу (группу SH), такую как сульфид (S2-), тиосульфат (S2O3 2-) и т.д., можно использовать любое серосодержащее соединение. Конкретно, можно использовать Na2S, H2S, NaSH, (NH4)2S и S2O3. В одном конкретном воплощении настоящего изобретения в качестве источника серы использовали Na2S. Реакция по настоящему изобретению представляет собой реакцию предоставления одной тиольной группы одной реакционноспособной группе OPS с целью получения одного цистеина или одного производного цистеина. В этой реакции сульфид может быть конкретно добавлен в молярной концентрации, которая от 0,1 до 3 раз, и более конкретно от 1 до 2 раз выше, чем концентрации добавленного OPS, но не ограничивается этим.
Оптимизация ферментативного превращения OPSS по настоящему изобретению может быть достигнута с использованием различных способов, известных в области техники. Например, оптимизация может быть основана, без ограничения ими, на полном понимании характеристик фермента OPSS, конкретно оптимальной температуры и pH, ингибирования в зависимости от субстратов, концентрации субстрата, температурной стабильности самого фермента OPSS и т.д. Кроме того, оптимизация может определяться оптимальными условиями ферментативного превращения, в частности оптимальной концентрацией OPSS, оптимальными балансами концентраций используемых субстратов, предпочтением сульфида, используемого в ферментативном превращении кроме субстрата OPS, предпочтением буферов, используемых в реакции превращения, влиянием генерируемых ионов и присутствием кофакторов и их оптимальными концентрациями, или т.д.
В одном конкретном воплощении настоящего изобретения изучали степень превращения цистеина в зависимости от pH и температуры с использованием Dal-OPSS. В результате оптимальная активность наблюдалась при pH от 7,0 до 7,4 (Фиг. 2) и при температуре 37°C (Фиг. 4).
В настоящем изобретении могут быть добавлены дополнительные кофакторы для реакции превращения цистеина, например PLP (пиридоксаль-5-фосфат), DTT (дитиотреитол) или PLP и DTT. Эти кофакторы способны улучшать эффективность реакции превращения цистеина. В конкретном воплощении настоящего изобретения было подтверждено, что добавление 0,2 мМ PLP, 25 мМ DTT или обоих из этих двух кофакторов увеличивало степень превращения цистеина (Таблица 5). PLP может быть конкретно добавлен в количестве от 0,001 до 2 мМ, и более конкретно, от 0,01 до 1 мМ, без ограничения этим. Также, DTT может быть конкретно добавлен в количестве от 0,001 до 100 мМ, и более конкретно от 0,01 до 50 мМ, без ограничения этим.
Способ по настоящему изобретению может также включать стадию выделения и очистки цистеина или его производных, полученных на стадии реакции. На этой стадии целевой цистеин может быть собран путем выделения и очистки цистеина из реакционной смеси с использованием подходящего способа, известного в данной области.
Специалисты в данной области могут легко синтезировать производные цистеина, используя известный химический способ синтеза из цистеина, полученного способом по настоящему изобретению. Цистеин может легко взаимодействовать с ацетилирующим агентом с получением NAC (N-ацетилцистеина) и с галогеноуксусной кислотой в щелочных условиях с получением SCMC (S-карбоксиметилцистеина). Эти производные цистеина используют в качестве фармацевтических веществ, которые лечат кашель, бронхит, бронхиальную астму, боль в горле или т.д.
Осуществление изобретения
Ниже настоящее изобретение будет описано более подробно со ссылкой на Примеры. Однако данные Примеры предназначены только для иллюстративных целей, и не предполагается ограничивать изобретение данными Примерами.
Пример 1: Идентификация Фермента О-ФосФосерин-сульФгидрилазы (OPSS)
Сообщалось, что полученная из Trichomonas vaginalis OPSS обладает активностью без кофакторов, в отличие от OPSS, полученной из Mycobacterium tuberculosis, для которой требуется два типа кофакторов в дополнение к OPSS, и обладает оптической активностью при 37°С, в отличие от OPSS, полученной из Aeropyrum pernix, которая показывает оптическую активность при 60°C. На основании этого авторы настоящего изобретения выделили новые OPSS, полученные из микроорганизмов, которые демонстрируют высокую гомологию аминокислотной последовательности OPSS, полученной из Т. vaginalis. Новые OPSS имеют аминокислотную последовательность SEQ ID NO:1 или 2, и обозначены как Dac-OPSS или Dal-OPSS, соответственно. Также, новая OPSS, имеющая аминокислотную последовательность SEQ ID NO:1 или 2, кодируется полинуклеотидом, имеющим нуклеотидную последовательность SEQ ID NO:9 или 10, соответственно.
Так как эти две OPSS получены не из E. coli, их экспрессия в E. coli может быть затруднительной. Для облегчения их экспрессии в E. coli осуществляли оптимизацию кодонов новых выделенных OPSS, используя Jcat, который представляет собой инструмент оптимизации использования кодона (http://www.icat.de). Посредством этой процедуры осуществляли оптимизацию использования кодонов полинуклеотидов SEQ ID NO:9 и 10 с получением SEQ ID NO:11 и 12. Полинуклеотиды, имеющие нуклеотидные последовательности SEQ ID NO:11 и 12, были предоставлены и синтезированы Genotech Corp., и их получали в форме векторов посредством клонирования Topo ТА. Для получения фермента OPSS из каждого штамма конструировали рЕТ28а (novagen) векторную систему, обычно используемую для экспрессии фермента.
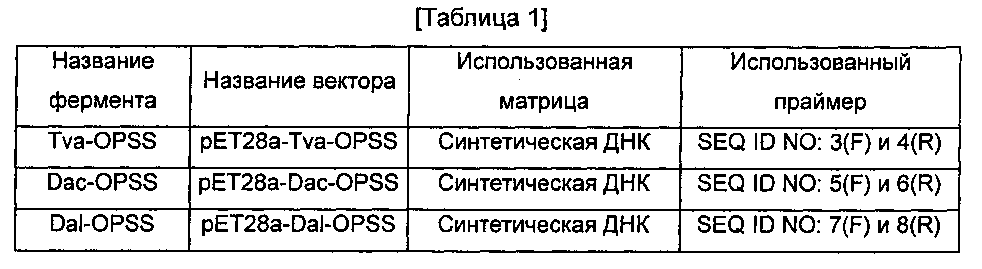
3 типа векторов, экспрессирующих OPSS ферменты, и матрицы, и праймеры, используемые для построения этих векторов, являются такими же, как показано в следующей ниже Таблице 1. PCR (полимеразную цепную реакцию) осуществляли, используя комбинации матриц и праймеров для амплификации каждого из генов OPSS. Полученные фрагменты генов и вектор рЕТ28а обрабатывали ферментами рестрикции, NdeI и HindIII (при 37°C в течение 3 часов). После этого каждый фрагмент гена вставляли в вектор рЕТ28а при помощи обычного способа лигирования. Фермент-экспрессирующие векторы и их генные последовательности изучали посредством секвенирования. Полученные фермент-экспрессирующие векторы вводили в E. coli, имеющую генотип DE3, для того, чтобы получить три типа штаммов, экспрессирующих фермент OPSS.
Экспрессию ферментов осуществляли на основании руководства для системы pET (novagen). Единичные колонии каждого штамма выбирали из LB-планшета и инокулировали в 5 мл жидкой LB-среды, после чего культивировали при 37°C и 200 об./мин в течение 16 часов. Штаммы повторно инокулировали в 25 мл свежей LB-среды (колбы объемом 250 мл) и культивировали до тех пор, пока OD600 не достигал 0,5~0,6 (2~3 часа) в тех же условиях культивирования. Затем к среде добавляли 1 мМ IPTG (изопропил-β-D-1-тиогалактопиранозид), после чего культивировали при 18°C и 120 об./мин в течение 18 часов, чтобы индуцировать экспрессию фермента. Очистку ферментов осуществляли с использованием колонок his-tag и Ni-NTA. Очистку осуществляли с использованием His spintrap (GE healthcare).
Пример 2: Анализ фермента OPSS в отношении активности синтеза цистеина
Активности превращения цистеина для полученных выше 3 типов ферментов OPSS измеряли, чтобы исследовать, можно ли синтезировать цистеин, используя OPS в качестве субстрата. Условия и методы анализа активности превращения цистеина (анализ фермента cysM) соответствовали предыдущим сообщениям (Mino K and Ishikawa K, FEBS letters, 551: 133-138, 2003; Burns KE, Baumgart S, Dorrestein PC, Zhai H, McLafferty FW and Begley TP, J. Am. Chem. Soc, 127: 11602-11603, 2005; Westrop GD, Goodall G, Mottram JC and Coombs GH, J. Biol. Chem., 281: 25062-25075, 2006). Условия анализа ферментативной активности являются такими, как показано в Таблице 2 ниже.

Реакционные растворы, за исключением ферментов, инкубировали при 37°C в течение 5 мин. Затем к реакционному раствору добавляли 50 мкг очищенного OPSS, культивируемого при 37°C. 100 мл ферментативно-реакционных растворов отбирали через 10 мин, 30 мин, 60 мин, и смешивали со 100 мл 33,2% ТСА (трихлоруксусная кислота) для остановки ферментативной реакции. Концентрации цистеина в ферментативно-реакционном растворе количественно определяли путем измерения поглощения при OD560 согласно методу Gaitonde. Активности синтеза цистеина для трех разных OPSS показаны на Фиг. 1 и следующей ниже Таблице 3. Титры синтеза цистеина для OPSS анализировали путем сравнения степеней превращения цистеина за время реакции.

Вышеприведенные результаты показывают, что Tva-OPSS обладает активностью синтеза цистеина с использованием OPS в качестве субстрата, и активности синтеза цистеина новых OPSS, Dac-OPSS и Dal-OPSS, были обнаружены впервые. Было обнаружено, что, по сравнению с Tva-OPSS, Dac-OPSS и Dal-OPSS увеличивают степени превращения цистеина, и в частности, было обнаружено, что Dal-OPSS обладает необыкновенно высокой активностью.
Пример 3: pH-Чувствительность фермента OPSS
Для изучения влияния pH на синтез цистеина измеряли степени превращения цистеина Dal-OPSS в зависимости от pH. В 100 мМ буфера, 50 мкг/мл Dal-OPSS подвергали взаимодействию при 37°С в течение 30 минут .Для этого использовали K-фосфатный буфер с pH 6,4/7,0 /7,4/8,0, трис-HCl буфер с pH 7,0/7,4/8,0/8,5/8,8, Na-карбонатный буфер с pH 8,0/8,5/9,0/10,0, HEPES-буфер с pH 7,4 и Na-цитратный буфер с pH 4,0/5,0/6,0. Количественный анализ полученного цистеина осуществляли, используя метод Gaitonde. Как показано на Фиг. 2, наибольшая активность наблюдалась при pH 7,0~7,4, и наибольшая активность наблюдалась в трис-HCl (pH 7,0), а небольшая активность наблюдалась в Na-цитратном и Na-карбонатном буфере. Кроме того, оптимальное значение pH варьировалось от одного буфера к другому.
Пример 4: Реакция превращения цистеина с помощью OPSS Фермента с использованием Ферментативного бульона OPS в качестве субстрата
КССМ 11103Р (CA07-0022/pCL-prmf-serA*(G336V)-serC; корейская патентная публикация 10-2012-0041115), способный продуцировать OPS, который был получен путем введения serB и мутированного serA* в штамм E. coli W3110, высевали на твердую среду MMYE и культивировали при 30°С в течение ночи. Платиновую петлю штамма, культивируемого на твердой среде MMYE в течение ночи, инокулировали в 25 мл среды для титрования и затем культивировали в инкубаторе на 30°С при 200 об./мин в течение 48 часов. Степени превращения цистеина Tva-OPSS, Dac-OPSS и Dal-OPSS изучали, используя ферментативный бульон OPS, приготовленный в качестве субстрата. Реакцию превращения цистеина осуществляли в присутствии 5,4 мМ ферментативного бульона OPS, 10 мМ Na2S и 0,2 мМ PLP при концентрации каждой OPSS 50 мкг/мл при 37°С. Количества полученного цистеина измеряли, используя метод Gaitonde. На Фиг. 3 и в Таблице 4 показаны степени превращения цистеина для трех типов OPSS при 37°С с течением времени. Было обнаружено, что среди этих трех типов OPSS, Dal-OPSS демонстрирует наиболее высокую степень превращения в вышеуказанных условиях реакции превращения.

Между тем, для того чтобы изучить влияние температуры на синтез цистеина, измеряли степени превращения цистеина Dal-OPSS в зависимости от температуры. Степени превращения цистеина измеряли в тех же условиях, что описаны выше, за исключением того, что температура варьировалась 30°С, 37°С, 50°С, 65°С и 80°С. В результате, как показано на Фиг. 4, когда Dal-OPSS взаимодействовал при каждой температуре в течение 30 минут, он демонстрировал наибольшую активность при 37°С.
Пример 5: Необходимость кофактора для OPSS
Для изучения необходимости кофактора в реакции превращения цистеина, степень превращения цистеина Dal-OPSS измеряли в отсутствии или в присутствии PLP (пиридоксаль-5′-фосфат) и DTT (дититреитол). Для этого 5,4 мМ ферментативного бульона OPS и 10 мМ Na2S в качестве субстратов взаимодействовали при 37°С в течение 30 минут в присутствии 25 мМ DTT и/или 0,2 мМ PLP. Полученный цистеин количественно определяли, используя метод Gaitonde. Результаты показаны в Таблице 5 ниже.

Как показано в Таблице 5, степень превращения цистеина в экспериментальной группе, где были добавлены PLP и DTT, была примерно в 2,4 раза больше, чем степень превращения в контрольной группе, где не был добавлен ни PLP, ни DTT. Кроме того, степень превращения цистеина также увеличивалась в экспериментальной группе, где были добавлены PLP или DTT, соответственно. Таким образом, обнаружено, что и PLP, и DTT оказывают положительное влияние на превращение цистеина.