Результат интеллектуальной деятельности: ОЧИСТКА КАПСУЛЬНЫХ САХАРИДОВ STAPHYLOCOCCUS AUREUS ТИПА 5 И ТИПА 8
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/256905, поданной 30 октября 2009 года, полностью включенной в настоящий документ в виде ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области очистки бактериальных капсульных полисахаридов, в частности капсульных полисахаридов Staphylococcus aureus типа 5 и типа 8, и в частности для применения в получении вакцин.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Капсульные сахариды бактерий в течение многих лет используют в вакцинах против капсулированных бактерий. Хотя сахариды являются T-зависимыми антигенами, однако они являются слабо иммуногенными. Конъюгация с носителем может конвертировать T-независимые антигены в T-зависимые антигены, таким образом, усиливая вторичный иммунный ответ и обеспечивая развитие защитного иммунитета. Таким образом, наиболее эффективные сахаридные вакцины основаны на гликоконъюгатах, а прототипическую вакцину с конъюгатами получили против Haemophilus influenzae типа b ("Hib") [например, см. главу 14 ссылки 96].
Другая бактерия, для которой описаны вакцины с конъюгатами, представляет собой Staphylococcus aureus (S.aureus). Для применения в гликоконъюгатах из S.aureus выделены различные полисахариды. Двумя полисахаридами, представляющими особый интерес, являются капсульные полисахариды типа 5 и типа 8. Приблизительно 60% штаммов S.aureus человека являются типом 8, а приблизительно 30% являются типом 5. Множество исследований конъюгатов типа 5 и типа 8 проводили и описывали в документах, таких как ссылки 1-9, Fattom et al.
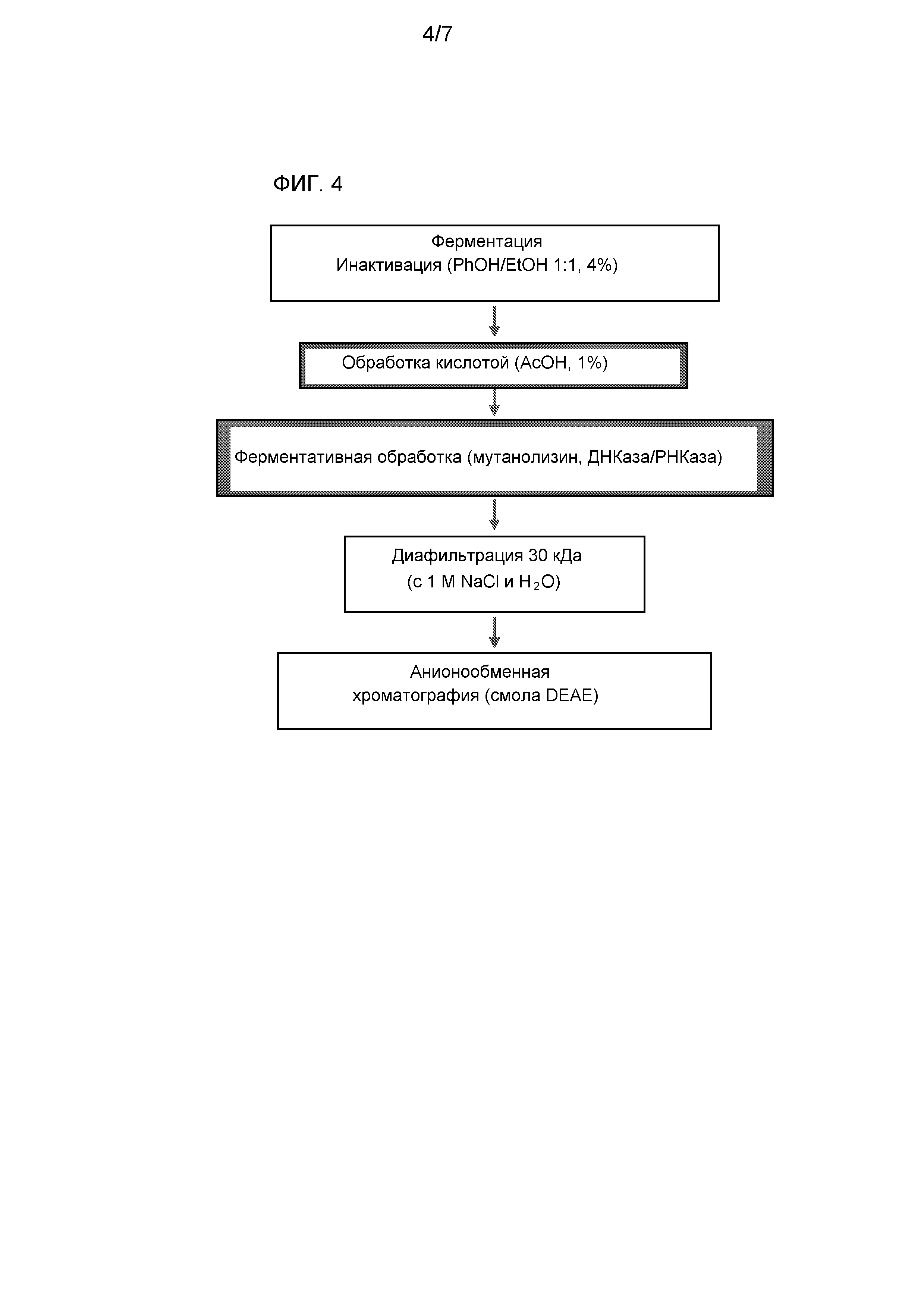
Отправной точкой для вакцины на основе полисахаридов является сам полисахарид, и, как правило, его очищают из заданных бактерий. Fattom et al. разработали сложный способ очистки капсульных полисахаридов типа 5 и типа 8, который подробно описан в ссылке 1, и включает следующие ключевые этапы после культивирования бактерий: суспендирование бактериальных клеток в буфере, обработку лизостафином, обработку ДНКазой и РНКазой, центрифугирование, диализ против буфера, обработку протеазой, дополнительный диализ, фильтрация, добавление этанола до 25% с хлоридом кальция для осаждения примесей; дополнительное добавление этанола до 75% для осаждения полисахаридов; сбор и сушку осадка; анионообменную хроматографию; диализ; лиофилизацию; эксклюзионную хроматографию; диализ и конечную лиофилизацию.
Способ Fattom для лизиса стенок бактериальных клеток и, таким образом, высвобождения капсульных полисахаридов включает использование лизостафина. Однако этот этап занимает много времени и делает способ сложным для масштабирования до промышленных условий. Он также увеличивает общую стоимость и сложность способа. Другие исследователи пытались пропустить этот этап и разработать более простой, более эффективный способ очистки полисахаридов. Например, в ссылке [10] описан альтернативный способ, включающий автоклавирование клеток S. aureus, ультрафильтрацию содержащего полисахариды супернатанта, концентрацию, лиофилизацию, обработку метаперйодатом натрия, дополнительную ультрафильтрацию, диафильтрацию, высокоэффективную жидкостную эксклюзионную хроматографию, диализ и лиофилизацию. Авторы предполагают, что этот способ обеспечивает хороший выход и подходит для производства полисахарида в крупном масштабе. В этом способе для высвобождения капсульных полисахаридов обработку лизостафином заменяют автоклавированием. Способ дополнительно развивали в ссылке [11]. Важным этапом в этих альтернативных способах является обработка метаперйодатом натрия. Этот этап проводят для удаления примесей тейхоевой кислотой в капсульных полисахаридах. Однако этот этап снова увеличивает длительность, сложность и общую стоимость способа. В ссылке [12] описан сходный способ, в котором включены автоклавирование для высвобождения капсульного полисахарида и обработка метаперйодатом натрия для удаления тейхоевой кислоты. В отличие от этого большинство других групп используют способы с сохранением обработки лизостафином (см., например, ссылки 13, 14, 15, 16, 17 и 18), иногда включая обработку метаперйодатом натрия (например, в ссылках 13 и 14).
Указанные выше способы являются сложными и могут оставлять примеси в получаемом полисахариде. Таким образом, сохраняется необходимость в дополнительных и улучшенных способах очистки капсульных полисахаридов S.aureus типа 5 и типа 8, и, в особенности, в менее сложных способах, приводящих к меньшему количеству примесей.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение основано на способе очистки, в котором полисахариды сначала выделяют из бактериальных клеток посредством обработки кислотой. Этот этап устраняет необходимость обработки лизостафином и его можно использовать в качестве альтернативы автоклавированию, как в указанных выше способах. Авторы изобретения выявили, что способ приводит к очищенным полисахаридам, с малым количеством примесей тейхоевой кислоты. Это означает отсутствие необходимости обработки полисахарида метаперйодатом натрия. В очищенных полисахаридах также мало примесей пептидогликанов, делая их особенно подходящими для медицинского применения. Способ авторов изобретения может являться быстрым и простым вследствие отсутствия необходимости в трудоемких этапов из ранее указанных способов.
Изобретение относится к способу выделения капсульных полисахаридов из клеток S. aureus типа 5 или типа 8, включающему этап обработки клеток кислотой. Изобретение дополнительно относится к способу очистки капсульных полисахаридов из клеток S. aureus типа 5 или типа 8, включающему этот способ. В способ можно включать другие этапы обработки, такие как, например, ферментативная обработка для удаления примесей нуклеиновых кислот, белков и/или пептидогликанов; диафильтрацию, например, для удаления высокомолекулярных примесей; анионообменную хроматографию, например, для удаления остаточного белка; и концентрирование.
Таким образом, изобретение относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, включающему этап выделения полисахаридов из клеток S.aureus типа 5 или типа 8 посредством обработки клеток кислотой. Подобным образом, изобретение относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где улучшение заключается в использовании обработки клеток S.aureus типа 5 или типа 8 кислотой с выделением полисахаридов из клеток. Выделение при обработки кислотой устраняет необходимость в обработке лизостафином или автоклавировании для выделения полисахаридов.
Изобретение также относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где способ не включает этапа обработки лизостафином. Подобным образом, изобретение относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где способ не включает этапа обработки метаперйодатом натрия. Как правило, способ не включает один или оба из этих этапов.
Изобретение также относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где способ позволяет получать композицию, содержащую полисахариды и уровень примесей пептидогликанов, меньший 5% (например, ≤4%, ≤3%, ≤2%, ≤1% и т.д.) пептидогликана по массе относительно общей массы полисахаридов. Как правило, композиция содержит менее 4%, в частности - менее 3% пептидогликана по массе. Авторы изобретения выявили, что способами по изобретению можно получать уровни приблизительно 2% или даже приблизительно 1%. Авторы изобретения выявили, что композиции с этими уровнями пептидогликанов пригодны для производства вакцин. В отличие от этого, в ссылке 17 указано, что для этой цели следует использовать уровни выше 5%. Уровень примесей пептидогликанов можно измерять способами, описываемыми в настоящем документе.
Подобным образом, изобретение относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где способ позволяет получать композицию, содержащую полисахариды и уровень примесей белков, меньший 5% (например, ≤4%, ≤3%, ≤2%, ≤1%, ≤0,5% и т.д.) белков по массе относительно общей массы полисахаридов. Как правило, композиция содержит менее 3%, в частности - приблизительно 2,4% белков по массе. Уровень примесей белков можно измерять с использованием анализа MicroBCA (Pierce).
Изобретение также относится к способу очистки капсульных полисахаридов S.aureus типа 5 или типа 8, где способ позволяет получать композицию, содержащую полисахарид и уровень примесей нуклеиновых кислот, меньший 1% (например, ≤0,75%, ≤0,50%, ≤0,25%, ≤0,10%, ≤0,01% и т.д.) нуклеиновой кислоты по массе относительно общей массы полисахарида. Как правило, композиция содержит менее 0,25%, в частности - приблизительно 0,09% нуклеиновой кислоты по массе. Уровень примесей нуклеиновых кислот можно измерять по поглощению при 260 нм в спектрофотометре.
Изобретение также относится к способу очистки капсульных полисахаридов S. aureus типа 5 или типа 8, где (a) уровень примесей кислых пептидогликанов составляет менее 5% (как описано выше); (b) уровень примесей белков составляет менее 5% (как описано выше); (c) уровень примесей нуклеиновых кислот составляет менее 1% (как описано выше).
Изобретение также относится к композиции, содержащей капсульные полисахариды S. aureus типа 5 или типа 8, получаемые любым из способов по изобретению.
В частности, изобретение относится к композиции, содержащей капсульные полисахариды S. aureus типа 5 или типа 8, где композиция содержит уровень примесей пептидогликанов, меньший 5% (например, ≤4%, ≤3%, ≤2%, ≤1% и т.д.) пептидогликана по массе относительно общей массы полисахарида. Как правило, композиция содержит менее 3%, в частности - менее 2% пептидогликана по массе. По изобретению конкретно предоставлены композиции с уровнями приблизительно 2% или даже приблизительно 1%.
Подобным образом, изобретение относится к композиции, содержащей капсульные полисахариды S.aureus типа 5 или типа 8, где композиция содержит уровень примесей белков, меньший 5% (например, ≤4%, ≤3%, ≤2%, ≤1%, ≤0,5% и т.д.) белка по массе относительно общей массы полисахарида. Как правило, композиция содержит менее 3%, в частности - приблизительно 2,4% белка по массе.
Изобретение также относится к композиции, содержащей капсульные полисахариды S. aureus типа 5 или типа 8, где композиция содержит уровень примесей нуклеиновых кислот, меньший 1% (например, ≤0,75%, ≤0,50%, ≤0,25%, ≤0,10%, ≤0,01% и т.д.) нуклеиновой кислоты по массе относительно общей массы полисахарида. Как правило, композиция содержит менее 0,25%, в частности - приблизительно 0,09% нуклеиновой кислоты по массе.
Изобретение также относится к композиции, содержащей капсульные полисахариды S. aureus типа 5 или типа 8, где a), где уровень примесей кислых пептидогликанов составляет менее 5% (как описано выше); (b) уровень примесей белков составляет менее 5% (как описано выше); (c) уровень примесей нуклеиновых кислот составляет менее 1% (как описано выше).
Капсульные полисахариды
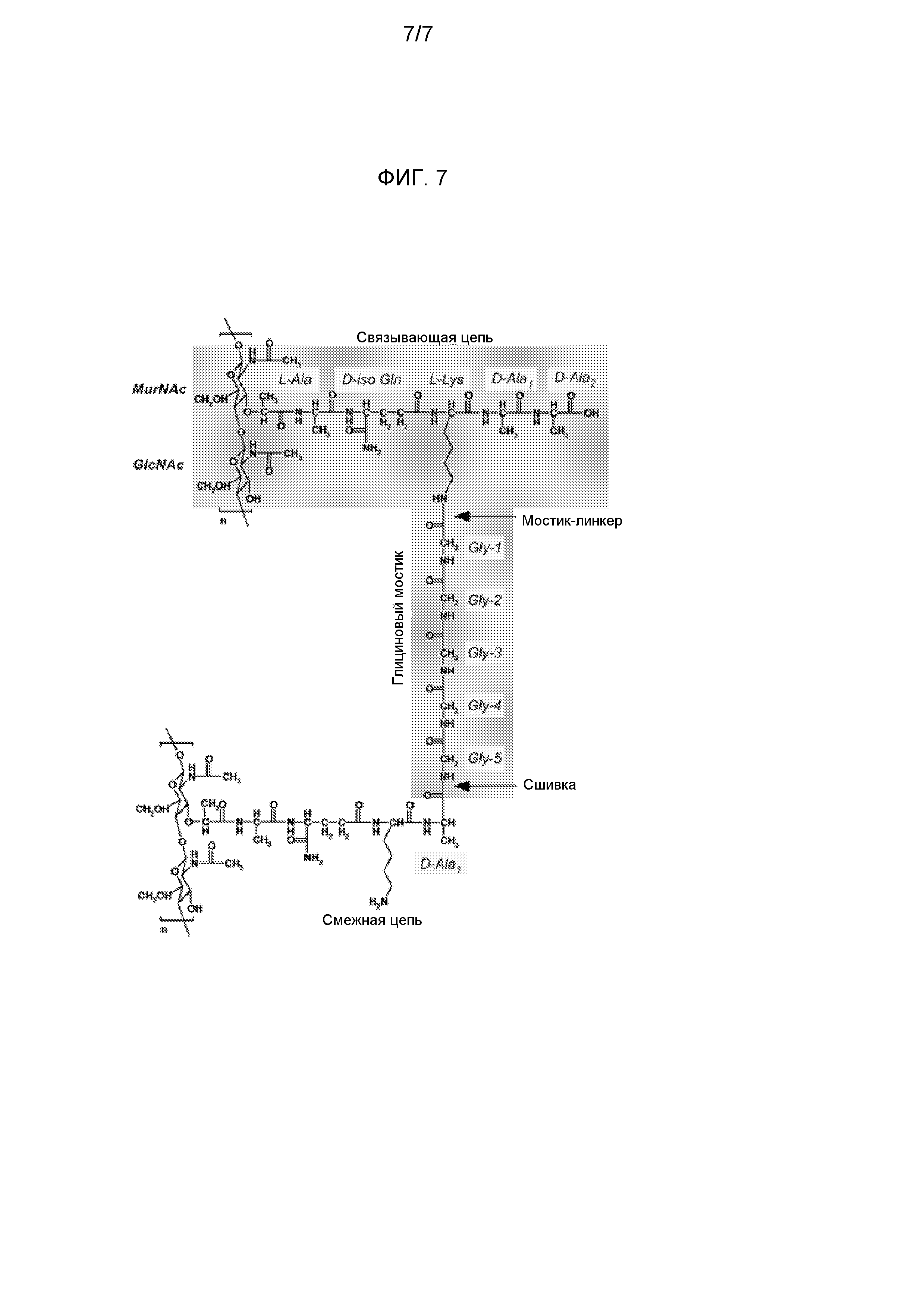
Изобретение основано на капсульных полисахаридах S. aureus типа 5 и типа 8. Структуры капсульных полисахаридов типа 5 и типа 8 описаны в ссылках 19 и 20 как:
Тип 5
→4)-β-D-ManNAcA(3OAc)-(1→4)-α-L-FucNAc(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FueNAc(1→3)-β-D-FueNAc-(1→.
Недавние данных ЯМР-спектроскопии [21] привели к пересмотру этих структур на:
Тип 5
→4)-β-D-ManNAcA-(1→4)-α-L-FucNAc(3OAc)-(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FucNAc(1→3)-α-D-FucNAc(1→.
После выделения из клеток полисахариды S.aureus типа 5 или типа 8 можно химически модифицировать относительно капсульных полисахаридов, находящихся в природе. Например, полисахарид может являться де-O-ацетилированным (частично или полностью), де-N-ацетилированным (частично или полностью), N-пропионированным (частично или полностью) и т.д. Деацетилирование можно проводить до, в течение или после других этапов обработки, но, как правило, его проводят перед любым этапом конъюгации. В зависимости от конкретного полисахарида, деацетилирование может влиять на иммуногенность или нет, например, в вакцине NeisVac-C™ используют де-O-ацетилированный полисахарид, тогда как Menjugate™ является ацетилированной, но обе вакцины являются эффективными. Эффект деацетилирования и т.д. можно оценивать посредством общепринятых анализов. Например, значимость O-ацетилирования для капсульных полисахаридов S.aureus типа 5 или типа 8 обсуждается в ссылке 6. Указано, что природные полисахариды в настоящем документе обладают 75% O-ацетилированием. Эти полисахариды индуцируют антитела к полисахаридному каркасу и к O-ацетильным группам. Полисахариды с 0% O-ацетилированием все еще индуцируют антитела к полисахаридному каркасу. Оба типа антител являются опсонизирующими против штаммов S.aureus различающихся по их содержанию O-ацетила. Таким образом, O-ацетилирование капсульных полисахаридов типа 5 или типа 8, используемых по настоящему изобретению, может составлять от 0 до 100%. Например, степень O-ацетилирования капсульного полисахарида типа 5 может составлять 10-100%, 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50- 90%, 60-90%, 70-90% или 80-90%. Альтернативно можно использовать капсульный полисахарид типа 5 O-ацетилированный на 0%. Подобным образом, степень O-ацетилирования капсульного полисахарида типа 8 может составлять 10-100%, 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50- 90%, 60-90%, 70-90% или 80-90%. Альтернативно можно использовать капсульный полисахарид типа 8 O-ацетилированный на 0%. В одном из вариантов осуществления степень O-ацетилирования капсульных полисахаридов типа 5 и типа 8 может составлять 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В других вариантах осуществления используют капсульные полисахариды типа 5 и типа 8 O-ацетилированные на 0%. степень N-ацетилирования капсульного полисахарида типа 5, используемого по изобретению, может составлять 0-100%, 50-100%, 75-100%, 80-100%, 90-100% или 95-100%. Как правило, степень N-ацетилирования капсульного полисахарида типа 5 составляет 100%. Подобным образом, степень N-ацетилирования капсульного полисахарида типа 8, используемого по изобретению, может составлять 0-100%, 50-100%, 75-100%, 80-100%, 90-100%, или 95-100%. Как правило, степень N-ацетилирования капсульного полисахарида типа 8 составляет 100%. В одном из вариантов осуществления степень N-ацетилирования капсульных полисахаридов типа 5 и типа 8 может составлять 0-100%, 50-100%, 75-100%, 80-100%, 90-100% или 95-100%. Как правило, степень N-ацетилирования капсульных полисахаридов типа 5 и типа 8 составляет 100%.
Степень O-ацетилирования полисахарида можно определять любым известным в данной области способом, например, посредством протонного ЯМР (например, как описано в ссылках 22, 23, 24 или 25). Дополнительный способ описан в ссылке 26. Подобные способы можно использовать для определения степени N-ацетилирования полисахарида. O-ацетильные группы можно удалять гидролизом, например, посредством обработки основанием, таким как безводный гидразин [27] или NaOH [6], Подобные способы можно использовать для удаления N-ацетильных групп. Для поддержания высоких уровней O-ацетилирования в капсульных полисахаридах типа 5 и/или 8, обработку, приводящую к гидролизу O-ацетильных групп, минимизируют, например, обработку при крайних значениях pH.
Исходное вещество
Способ по изобретению начинается с клеток S.aureus типа 5 или типа 8. Как правило, клетки перед выделением капсульного полисахарида выращивают посредством ферментации. Подходящие способы культивирования клеток S.aureus типа 5 или типа 8 хорошо известны специалистам и описаны, например, в ссылках 1-21 и в цитируемых в них ссылках. После выращивания клеток, клетки, как правило, дезактивируют. Подходящим способом дезактивации является обработка фенолом:этанолом, например, как описано в ссылке 1.
Клетки перед выделением капсульного полисахарида можно центрифугировать. Таким образом, способ начинается с клеток в форме сырой клеточной массы. Однако, как правило, клетки ресуспендируют в водной среде, подходящей для следующего этапа в способе, например, в буфере или в дистиллированной воде. Клетки перед ресуспендированием можно промывать этой средой. В другом варианте осуществления клетки можно обрабатывать в суспензии в их исходной среде для культивирования. Альтернативно клетки обрабатывают в сухой форме.
Обработка кислотой
В способе по изобретению клетки S.aureus типа 5 или типа 8 обрабатывают кислотой. Этот этап приводит к высвобождению капсульного полисахарида из клеток. В отличие от этого в предыдущих способах для выделения полисахаридов использовали обработку лизостафином или автоклавирование. Обработку кислотой по изобретению предпочтительно проводят с использованием умеренной кислоты, например, уксусной кислоты, для минимизации повреждения полисахаридов. Специалист может определить подходящие кислоты и условия (например, концентрацию, температуру и/или время) для выделения полисахаридов. Например, авторы изобретения выявили, что подходящей является обработка клеток, суспендированных приблизительно при 0,5 мг/мл в дистиллированной воде, 1% уксусной кислотой (об./об.) при 100°C в течение 2 часов. Также подходящей может являться обработка другими кислотами, например, трифторуксусной или другими органическими кислотами.
Эффективность обработки различными кислотами можно тестировать и использованием общепринятых способов. Например, после обработки кислотой клетки можно выделять и обрабатывать с применением известных способов выделения капсульных полисахаридов S.aureus типа 5 или типа 8 (например, способ на основе лизостафина по ссылке 1) с выявлением возможности выделения дополнительных капсульных полисахаридов. Если выделяют дополнительные капсульные полисахариды, тогда условия обработки кислотой можно изменять так, чтобы при обработке кислотой выделять большую долю капсульных сахаридов. Таким образом, можно оптимизировать условия обработки кислотой так, чтобы выделять оптимальное количество капсульных сахаридов. Например, авторы изобретения выявили, что после обработки клеток, суспендированных приблизительно при 0,5 мг/мл в дистиллированной воде, 1% уксусной кислотой (об./об.) при 100°C в течение 2 часов, из клеток при последующей обработке лизостафином можно выделить очень мало дополнительных капсульных сахаридов.
Авторы изобретения выявили, что после обработки кислотой, степень O-ацетилирования капсульного полисахарида типа 5 может составлять 60-100%. В частности, степень O-ацетилирования может составлять 65-95%, в частности - 70-90%. Как правило, степень O-ацетилирования составляет 75-85%, например, приблизительно 80%. Подобные значения можно получать для капсульного сахарида типа 8. При желании, затем степень O-ацетилирования капсульного сахарида можно изменять на дополнительных этапах обработки, как указано выше.
После обработки кислотой реакционную смесь, как правило, нейтрализуют. Этого можно достигать добавлением основания, например, NaOH. Клетки можно центрифугировать и содержащий полисахариды супернатант собирать для хранения и/или дополнительной обработки.
Ферментативная обработка
Полисахарид, получаемый после обработки кислотой, может быть загрязнен и смешан с бактериальными нуклеиновыми кислотами и белками. Эти примеси можно удалять ферментативной обработкой. Например, РНК можно удалять обработкой РНКазой, ДНК - ДНКазой, а белок - протеазой (например, проназой). Специалист может определить подходящие ферменты и условия для удаления примесей. Например, авторы изобретения выявили, что подходящей является обработка содержащего полисахариды супернатанта 50 мкг/мл каждой из ДНКазы и РНКазы при 37°C в течение 6-8 часов. Другие подходящие условия описаны в литературе, например, в ссылке 1.
Полисахарид, получаемый после обработки кислотой, может быть также или альтернативно смешан с пептидогликанами. Эту примесь также можно удалять ферментативной обработкой. Авторы изобретения выявили, что для удаления примеси пептидогликанов эффективной является обработка мутанолизином. Специалист может определить подходящие условия для удаления пептидогликанов мутанолизином. Например, авторы изобретения выявили, что подходящей является обработка содержащего полисахариды супернатанта 180 Ед/мл каждого из мутанолизинов при 37°C в течение 16 часов. После обработки суспензию можно очищать посредством центрифугирования, и содержащий полисахариды супернатант собирать для хранения и/или дополнительной обработки.
Диафильтрация
Способ по изобретению может включать этап диафильтрации. Как правило, этот этап проводят после обработки кислотой и/или ферментативной обработки, описанных выше. Авторы изобретения выявили, что этап диафильтрации, в частности посредством фильтрации тангенциальным потоком, является особенно эффективным для удаления загрязнений из полисахаридов. Как правило, загрязнения представляют собой низкомолекулярные примеси, подобные фрагментам тейхоевых кислот и/или пептидогликанов. Фильтрация тангенциальным потоком подходящим образом проводят против 1 М NaCl (например, приблизительно против 10 объемов), а затем 10 мМ pH 7,2 буфера NaPi (например, против дополнительных 10 объемов). Таким образом, фильтровальная мембрана должна представлять собой фильтровальную мембрану, обеспечивающую прохождение низкомолекулярных примесей при удерживании капсульных полисахаридов. Типичным является граница пропускания в диапазоне 10 кДа-30 кДа. Авторы изобретения выявили, что фильтрация тангенциальным потоком с использованием мембраны с границей пропускания 30 кДа является особенно подходящим для способов в крупном масштабе.
Как правило, проводят по меньшей мере 5 циклов диафильтрации тангенциальным потоком, например, 6, 7, 8, 9, 10, 11 или более.
Содержащий полисахариды концентрат после диафильтрации собирают для хранения и/или дополнительной обработки.
Анионообменная хроматография
Полисахариды можно дополнительно очищать на этапе анионообменной хроматографии. Авторы изобретения выявили, что анионообменная хроматография является особенно эффективным для удаления остаточных примесей белков и нуклеиновых кислот при сохранении хорошего выхода полисахаридов.
Этап анионообменной хроматографии можно проводить после этапов обработки кислотой, ферментативной обработки и/или диафильтрации, описанных выше.
Анионообменную хроматография можно проводить с использованием любого подходящего анионообменного матрикса. Широко используемыми анионообменными матриксами являются смолы, такие как Q-смолы (на основе четвертичных аминов) и DEAE смолы (на основе диэтиламиноэтана). Авторы изобретения выявили, что особенно подходящими являются DEAE смолы (например, смола DEAE-Sepharose™ Fast Flow (GE Healthcare)), хотя можно использовать другие смолы.
Подходящие стартовые буферы и буферы подвижных фаз для анионообменной хроматографии также можно определять посредством общепринятых экспериментов без чрезмерного труда. Типичные буферы для применения в анионообменной хроматографии включают буферы с N-метилпиперазином, пиперазином, L-гистидином, бис-Tris, бис-Tris-пропаном, триэтаноламином, Tris, N-метилдиэтаноламином, диэтаноламином, 1,3-диаминопропаном, этаноламином, пиперидином, хлоридом натрия и фосфатные буферы. Авторы изобретения выявили, что в качестве стартового буфера для анионообменной хроматографии подходящими являются фосфатные буферы, например, натрийфосфатный буфер. Буфер может иметь любую подходящую концентрацию. Например, выявлено, что подходящим является 10 мМ фосфат натрия. Вещество, связываемое с анионообменной смолой можно элюировать подходящим буфером. Авторы изобретения выявили, что подходящим является градиент 1M NaCl.
Фракции элюата, содержащие полисахарид, можно определять, изменяя поглощение УФ при 215 нм. Фракции, содержащие полисахарид, как правило, комбинированные вместе, собирают для хранения и/или дополнительной обработки.
Этап анионообменной хроматографии можно повторять, например, 1, 2, 3, 4 или 5 раз. Как правило, этап анионообменной хроматографии проводят однократно.
Гель-фильтрация
Способ по изобретению может включать один или несколько этапов гель-фильтрации. Эту гель-фильтрацию применяют для отбора молекулы полисахаридов конкретной длины и для дополнительного снижения примесей, особенно белков. Однако авторы изобретения выявили, что в отличие от предыдущих способов, подобных способам, описанным в ссылках 1-9, этап гель-фильтрации для получения полисахаридов высокой чистоты не требуется. Таким образом, этот этап в способах по изобретению можно пропустить. Пропуск этого этапа является выгодным, так как это упрощает способ и снижает общую стоимость.
Когда он присутствует этап(ы) гель-фильтрации можно проводить после этапов обработки кислотой, ферментативной обработки, диафильтрации и/или анионообменной хроматографии, описанных выше. Как правило, любой этап(ы) гель-фильтрации проводят после этапа анионообменной хроматографии, описанного выше.
Этап(ы) гель-фильтрация можно проводить с использованием любого подходящего гель-фильтрационного матрикса. Широко используемые гель-фильтрационные матриксы основаны на декстрановых гелях, агарозных гелях, полиакриламидных гелях, полиакрилоилморфолиновых гелях и полистироловых гелях и т.д. Также можно использовать гели из сшитого декстрана и смешанные полиакриламидные/агарозные гели. Авторы изобретения выявили, что особенно подходящими являются декстрановые гели (например, гель сефакрил (Sephacryl™) S300 (GE Healthcare)), хотя можно использовать другие гели.
Подходящие буферы для подвижных фаз для гель-фильтрации можно определять посредством общепринятых экспериментов без чрезмерного труда. Типичные буферы для применения в гель-фильтрации включают буферы с N-метилпиперазином, пиперазином, L-гистидином, бис-Tris, бис-Tris-пропаном, триэтаноламином, Tris, N-метилдиэтаноламином, диэтаноламином, 1,3-диаминопропаном, этаноламином, пиперидином, хлоридом натрия и фосфатные буферы. Например, подходящими могут являться буферы с хлоридом натрия. Буфер может иметь любую подходящую концентрацию. Например, для подвижной фазы можно использовать 50 мМ хлорид натрия.
Фракции элюата, содержащие полисахарид, можно определять, изменяя поглощение УФ при 215 нм. Фракции, содержащие полисахарид, как правило, комбинированные вместе, собирают для хранения и/или дополнительной обработки.
Концентрирование
В дополнение к одному или нескольким этапам гель-фильтрации или вместо них способ по изобретению может включать один или несколько этапов концентрирования полисахаридов. Это концентрирование пригодно для получения образца с концентрацией, подходящей для любой последующей конъюгации полисахарида с молекулой-носителем, как описано ниже. Однако авторы изобретения выявили, что этот этап концентрирования для получения полисахарида высокой чистоты не требуется. Таким образом, этот этап в способах по изобретению можно пропустить.
Когда он присутствует, этап(ы) концентрирования можно проводить после этапов обработки кислотой, ферментативной обработки, диафильтрации, анионообменной хроматографии и/или гель-фильтрации, описанных выше. Как правило, любой этап(ы) концентрирования проводят после этапа анионообменной хроматографии, описанного выше. Если его используют в дополнение к этапу(ам) гель-фильтрация, описанному выше, этап(ы) концентрирования можно проводить до или после этапа(ов) гель-фильтрация, описанного выше. Однако как правило, этап(ы) концентрирования применяют вместо этапа(ов) гель-фильтрации.
Этап(ы) концентрирования можно проводить любым подходящим способом. Например, авторы изобретения выявили, что этапом(ы) концентрирования может являться этап(ы) диафильтрации, как описано выше, например, фильтрация тангенциальным потоком с использованием отделяющей 30 кДа мембраны. Например, можно использовать отделяющую 30 кДа мембрану Hydrosart™ (Sartorius) (с площадью мембраны 200 см2).
Концентрированный образец полисахарида собирают для хранения и/или дополнительной обработки.
Дополнительная обработка капсульного полисахарида
После очистки полисахарид можно дополнительно обрабатывать для удаления примесей. Это особенно важно в ситуациях, когда неприемлемы даже малейшие примеси (например, для получения вакцины для человека).
Молекулярную массу очищенных капсульных полисахаридов S.aureus типа 5 или типа 8 можно измерять посредством гель-фильтрации относительно пуллулановых стандартов, таких как пуллулановые стандарты доступные в Polymer Standard Service [28]. Как правило, очищенные полисахариды представляют собой смесь полисахаридов с массами в диапазоне значений. Для капсульного полисахарида типа 5, молекулярная масса очищенного полисахарида, как правило, составляет 2-3500 кДа, например, 10-2000 кДа, в частности - 20-1000 кДа, а более конкретно - 100-600 кДа. Подобным образом, для капсульного полисахарида типа 8 молекулярная масса очищенного полисахарида может составлять 2-3500 кДа, например, 10-2000 кДа, в частности - 20-1000 кДа, а более конкретно - 100-600 кДа.
Очищенный полисахарид можно деполимеризовывать с получением олигосахарида. Олигосахариды могут являться предпочтительными для применения в вакцинах. Деполимеризацию до олигосахарида можно проводить до или после любого из указанных выше этапов. Как правило, деполимеризацию проводят после анионообменной хроматографии, описанной выше. Если полисахарид после этой хроматографии концентрируют, тогда деполимеризацию, как правило, проводят после этого концентрирования. Когда композиция по изобретению содержит деполимеризованный полисахарид, предпочтительно, чтобы деполимеризация предшествовала любой конъюгации.
Полноразмерные полисахариды можно деполимеризовывать с получением более коротких фрагментов для применения по изобретению различными способами. Предпочтительно, используют способ, описанный в ссылке 29. Альтернативно можно использовать другие способы деполимеризации полисахаридов. Например, полисахариды можно нагревать или подвергать микрофлюидизации [30] или облучению ультразвуком [3]. Альтернативно можно использовать деполимеризацию посредством окисления-восстановления [31] или озонолиза [32].
Олигосахариды можно идентифицировать посредством хроматографии, например, эксклюзионной хроматографии. Продукты можно разделять по размерам для удаления коротких олигосахаридов. Этого можно достигать различными способами, например, гель-фильтрацией. Конкретные молекулярные массы можно измерять посредством гель-фильтрации относительно пуллулановых стандартов, таких как пуллулановые стандарты, доступные в Polymer Standard Service [33].
Если N-ацетильные группы в природных капсульных полисахаридах были де-N-ацетилированы, тогда способ по изобретению может включать этап ре-N-ацетилирования. Контролируемое ре-N-ацетилирование можно проводить подходящим способом с использованием, например, такого реагента как уксусный ангидрид (CH3CO)2O в 5% бикарбонате аммония [34].
Также можно проводить дополнительные этапы фильтрации, например, стерильной фильтрации.
Как правило, эти дополнительные этапы можно проводить при комнатной температуре.
Хранение
Препараты капсульных полисахаридов S.aureus типа 5 или типа 8 можно лиофилизировать, например, посредством лиофилизации в вакууме или замораживания в растворе (например, в виде элюата после конечного этапа концентрирования, если он включен), для хранения на любом этапе способа очистки. Таким образом, необходимости немедленного перенесения препарата из одного этапа способа в другой нет. Например, если препарат полисахарида необходимо очищать посредством диафильтрации, его до этой очистки можно лиофилизировать или замораживать в растворе. Подобным образом, полисахарид можно лиофилизировать или замораживать в растворе до этапа анионообменной хроматографии. Если препарат полисахарида необходимо очищать посредством гель-фильтрации, тогда его до этого этапа можно лиофилизировать или замораживать в растворе. Подобным образом, если препарат полисахарида необходимо концентрировать, тогда его до этого этапа можно лиофилизировать или замораживать в растворе. Лиофилизированный препарат перед дальнейшей обработкой восстанавливают в подходящем растворе. Подобным образом, замороженный раствор перед дальнейшей обработкой размораживают.
Очищенный полисахарид, получаемый способом по изобретению можно перерабатывать для хранения любым подходящим способом. Например, полисахарид можно лиофилизировать, как описано выше. Альтернативно, полисахарид можно хранить в водном растворе, как правило, при низкой температуре, например, при -20°C. Подходящим способом, полисахарид можно хранить в виде элюата после этапов анионообменной хроматографии, гель-фильтрации или концентрирования.
Конъюгация
Конечные очищенные капсульные полисахариды по изобретению можно использовать в качестве антигена без дополнительной модификации, например, для применения в диагностических анализах in vitro, для применения в иммунизации и т.д.
Однако с целью иммунизации предпочтительно конъюгировать полисахариды с молекулой-носителем, такой как белок. В основном, ковалентная конъюгация полисахаридов с носителями увеличивает иммуногенность полисахаридов, так как это преобразует их из T-независимых антигенов в T-зависимые антигены, таким образом, обеспечивая примирование для иммунологической памяти. Конъюгация особенно пригодна для педиатрических вакцин [например, ссылка 35] и представляет собой хорошо известный способ [например, рассмотренный в ссылках 36-44]. Таким образом, способы по изобретению могут включать дополнительный этап конъюгации очищенного полисахарида с молекулой-носителем.
О конъюгации капсульных полисахаридов S.aureus типа 5 и типа 8 существует множество публикаций, например, см. ссылки 1-9. Типичный способ, используемый для конъюгации в литературе, включает тиолирование очищенного полисахарида с использованием цистамина. Реакция основана на наличии в капсульных полисахаридах карбоксилатных групп. Эти группы реагируют с цистамином в присутствии карбодиимида, например, EDAC. Затем дериватизированный полисахарид конъюгируют с белком-носителем, таким как эндотоксин A Pseudomononas aeruginosa (ETA), как правило, посредством линкера [2]. Показано, что полученные, таким образом, вакцины с конъюгатами являются безопасными и иммуногенными у людей [5]. Другие исследователи проводили конъюгацию очищенных капсульных полисахаридов типа 5 и типа 8 посредством восстановительного аминирования [45 и 12]; связывания глутаральдегидом [45] или реакции гидроксильных групп полисахаридов с цианилирующими средствами, такими как CDAP [46] или циануровый трихлорид [11]. Предпочтительно используют способ, описанный в ссылке 29.
Предпочтительными белками-носителями являются бактериальные токсины, такие как дифтерийный или столбнячный токсины, или анатоксины или их мутанты. Авторы изобретения выявили, что подходящим является мутант дифтерийного токсина CRM 197 [47]. Для капсульных полисахаридов S.aureus типа 5 или типа 8 в качестве белков-носителей использовали экзотоксин A Pseudomonas aeruginosa (ETA) и его нетоксический мутантный рекомбинантный экзопротеин A (rEPA) ([1] и [2]). Также использовали α-гемолизин S.aureus (α-токсин) ([45] и [48]), овальбумин [11] и сывороточный альбумин человека [12]. Эти носители можно использовать по настоящему изобретению.
Другие подходящие белки-носители включают белковый комплекс наружной мембраны N.meningitidis [49], синтетические пептиды [50,51], белки теплового шока [52,53], белки коклюша [54,55], цитокины [56], лимфокины [56], гормоны [56], факторы роста [56], сывороточный альбумин человека (как правило, рекомбинантый), искусственные белки, содержащие несколько CD4+ T-клеточных эпитопов человека из различных происходящих из патогенов антигенов [57], таких как N19 [58], белок D H.influenzae [59-61], белок PspA поверхности пневмококков [62], пневмолизин [63] или его нетоксические производные [64], захватывающие железо белки [65], токсин A или B C.difficile [66], белок GBS [67], белок GAS [68] и т.д.
Другие подходящие белки-носители включают белковые антигены S.aureus, например, белковые антигены S.aureus, указанные ниже.
Присоединение к носителю предпочтительно проводят посредством группы -NH2, например, в боковой цепи остатка лизина в белке-носителе или остатка аргинина. Также присоединение можно проводить посредством группы -SH, например, в боковой цепи остатка цистеина.
Если можно используют более одного белка-носителя, например, для снижения риска супрессии носителя. Таким образом, для капсульных полисахаридов типа 5 и типа 8 можно использовать различные белки-носители, например, полисахарид типа 5 можно конъюгировать с CRM197, тогда как полисахарид типа 8 можно конъюгировать с rEPA. Также для конкретного полисахаридного антигена можно использовать более одного белка-носителя, например, полисахарид типа 5 может содержаться в двух группах, где одна группа конъюгирована с CRM197, а другая конъюгирована с rEPA. Однако, как правило, для всех полисахаридов используют один и тот же белок-носитель.
Один белок-носитель может нести более одного полисахаридного антигена [69,70]. Например, один белок-носитель можно конъюгировать с капсульными полисахаридами типа 5 и типа 8. Для достижения этой цели, до процесса конъюгации можно смешивать различные полисахариды. Однако, как правило, для каждого полисахарида существуют отдельные конъюгаты, где различные полисахариды смешивают после конъюгации. Отдельные конъюгаты могут основываться на одном и том же носителе.
Как правило, используют конъюгаты с соотношением полисахарид:белок (масс./масс.) от 1:20 (т.е. избыток белка) до 20:1 (т.е. избыток полисахарида). Предпочтительными являются соотношения от 1:10 до 1:1, особенно соотношения от 1:5 до 1:2, а наиболее предпочтительно - приблизительно 1:3. В отличие от этого, у конъюгатов капсульных полисахаридов типа 5 и типа 8, используемых в литературе, существует тенденция более высоких соотношений, например, от 0,73 до 1,08 в ссылках 1, 2 и 3. В конкретных вариантах осуществления изобретения соотношение полисахарид:белок (масс./масс.) для конъюгата капсульного полисахарида типа 5 составляет от 1:10 до 1:2; и/или отношение полисахарид:белок (масс./масс.) для конъюгата капсульного полисахарида типа 8 составляет от 1:5 до 7:10.
Конъюгаты можно использовать в сочетании со свободным носителем [71]. Когда данный белок-носитель в композиции по изобретению присутствует в свободной и конъюгированной форме, неконъюгированная форма предпочтительно составляет не более 5% от общего количества белка-носителя в композиции в целом, а более предпочтительно она присутствует в количестве менее 2% по массе.
После конъюгации, свободные и конъюгированные полисахариды можно разделять. Существует множество подходящих способов, включая гидрофобную хроматографию, ультрафильтрацию тангенциальным потоком, диафильтрацию и т.д. [также см. ссылки 72 и 73 и т.д.].
Комбинации конъюгатов и других антигенов
Полисахариды, получаемые способами по изобретению (в частности после конъюгации, как описано выше), можно смешивать, например, с любым другим и/или с другим антигенами. Таким образом, способы по изобретению могут включать дополнительный этап смешивания полисахарида с одним или несколькими дополнительными антигенами. Таким образом, изобретение относится к композиции, содержащей полисахарид, получаемый способом по изобретению и один или несколько дополнительных антигенов. Как правило, композиция представляют собой иммуногенную композицию.
Дополнительный антиген(ы) может содержать дополнительные полисахариды, получаемые способом по изобретению, и, таким образом, изобретение относится к композиции, содержащей более одного полисахарида по изобретению. В частности, настоящее изобретение относится к композиции, содержащей капсульный полисахарид типа 5 по изобретению и капсульный полисахарид типа 8 по изобретению. Альтернативно, дополнительный антиген(ы) может являться капсульными полисахаридами типа 5 или типа 8, получаемыми способами, отличными от способов по изобретению, например, способами по ссылкам 1-18, выше. Таким образом, изобретение относится к композиции, содержащей капсульный полисахарид типа 5 и капсульный полисахарид типа 8, где один из полисахаридов (полисахарид типа 5 или полисахарид типа 8) представляет собой полисахарид по изобретению, а другой полисахарид не является полисахаридом по изобретению.
Когда смешивают несколько различных конъюгатов из S.aureus, тогда они могут включать различные типы конъюгатов из того же серотипа S.aureus и/или конъюгаты из различных серотипов S.aureus. Например, конъюгаты могут происходить из S.aureus типа 5 и типа 8. Композицию получают, получая отдельные конъюгаты (например, отличный конъюгат для каждого серотипа), а затем комбинируя конъюгаты.
Дополнительный антиген(ы) может содержать другие антигены S.aureus, включая сахаридные и белковые антигены, указанные ниже.
Дополнительный антиген(ы) может содержать антигены не из патогенных микроорганизмов S.aureus. Таким образом, композиции по изобретению могут дополнительно содержать один или несколько не принадлежащих S.aureus антигенов, включая дополнительные бактериальные, вирусные или паразитарные антигены. Их можно выбирать из следующего:
- белковый антиген серогруппы B N. meningitidis, такой как белковые антигены в ссылках 74-80, где особенно предпочтительными являются белок "287" (см. ниже) и его производные (например, "ΔG287").
- везикула внешней мембраны (OMV), полученная из серогруппы B N.meningitidis, такая как везикулы, описанные в ссылках 81, 82, 83, 84 и т.д.
- сахаридный антиген серогрупп A, C, W135 и/или Y N.meningitidis, такой как олигосахарид, описанный в ссылке 85 для серогруппы C, или олигосахариды из ссылки 86.
- сахаридный антиген Streptococcus pneumoniae [например, ссылки 87-89; главы 22 и 23 ссылки 96].
- антиген вируса гепатита A, такой как инактивированный вирус [например, 90, 91; глава 15 ссылки 96].
- антиген вируса гепатита B, такой как поверхностные и/или коровые антигены [например, 91,92; глава 16 ссылки 96].
- антиген вируса гепатита C [например, 93].
- антиген Bordetella pertussis, такой как голотоксин коклюша (PT) и нитчатый гемагглютинин (FHA) из B.pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 94 и 95; глава 21 ссылки 96].
- дифтерийный антиген, такой как дифтерийный анатоксин [например, глава 13 ссылки 96].
- столбнячный антиген, такой как столбнячный токсин [например, глава 27 ссылки 96].
- сахаридный антиген Haemophilus influenzae B [например, глава 14 ссылки 96]
- антиген N.gonorrhoeae [например, 74, 75, 76].
- антиген Chlamydia pneumoniae [например, 97, 98, 99, 100, 101, 102, 103].
- антиген Chlamydia trachomatis [например, 104].
- антиген Porphyromonas gingivalis [например, 105].
- антиген(ы) полиомиелита [например, 106, 107; глава 24 ссылки 96], такой как IPV.
- антиген(ы) бешенства [например, 108], такой как лиофилизированный инактивированный вирус [например, 109, RabAvert™].
- антигены кори, эпидемического паротита и/или краснухи [например, главы 19,20 и 26 ссылки 96].
- антиген(ы) гриппа [например, главы 17 & 18 ссылки 96], такой как поверхностные белки гемагглютинин и/или нейраминидаза.
- антиген Moraxella catarrhalis [например, 110].
- антиген Streptococcus pyogenes (стрептококк группы A) [например, 111,112, 113].
- антиген Streptococcus agalactiae (стрептококк группы B) [например, 68, 114-116].
- антиген S.epidermidis [например, капсульный полисахарид типа I, II и/или III, получаемый из штаммов ATCC-31432, SE-360 и SE-10, как описано в ссылках 117, 118 и 119.
Когда используют сахаридный или углеводный антиген, он предпочтительно конъюгирован с носителем для увеличения иммуногенности. Конъюгация сахаридных антигенов H.influenzae B, менингококков и пневмококков хорошо известна.
Когда необходимо токсические белковый антигены можно детоксицировать (например, детоксикация токсина коклюш химическими и/или генетическими способами [95]).
Когда в композицию включен дифтерийный антиген, предпочтительно, чтобы она также включала столбнячный антиген и антигены коклюша. Подобным образом, когда включен столбнячный антиген, предпочтительно, чтобы также был включен дифтерийный антиген и антиген коклюша. Подобным образом, когда включен антиген коклюша, предпочтительно, чтобы также был включен дифтерийный и столбнячный антигены.
Антигены можно адсорбировать на соль алюминия.
Один из типов предпочтительных композиций содержит дополнительные антигены, которые воздействуют на ослабленный иммунитет, и, таким образом, полисахариды S.aureus по изобретению можно комбинировать с одним или несколькими антигенами следующих не принадлежащих S.aureus патогенных микроорганизмов: Steptococcus agalactiae, Staphylococcus epidermis, вирус гриппа, Enterococcus faecalis, Pseudomonas aeruginosa, Legionella pneumophila, Listeria monocytogenes, Neisseria meningitidis и вирус парагриппа.
Другой тип предпочтительных композиций включает дополнительные антигены бактерий, ассоциированных с нозокомиальными инфекциями, и, таким образом, полисахариды S.aureus по изобретению можно комбинировать с одним или несколькими антигенами следующих не принадлежащих S.aureus патогенных микроорганизмов: Clostridium difficile, Pseudomonas aeruginosa, Candida albicans и внекишечные патогенные Escherichia coli.
Антигены в композиции, как правило, находятся в концентрации по меньшей мере 1 мкг/мл каждый. В основном, концентрация конкретного антигена достаточна для вызова иммунного ответа на этот антиген.
В качестве альтернативы использованию в композиции по изобретению белковых антигенов, можно использовать нуклеиновую кислоту, кодирующую антиген [например, ссылки 120 до 128]. Таким образом, белковые компоненты композиций по изобретению можно заменять нуклеиновой кислотой (предпочтительно ДНК например, в форме плазмиды), кодирующей белок.
Практически может существовать верхний предел количества антигенов, включаемых в композиции по изобретению. Количество антигенов в композиции по изобретению (включая антигены S. aureus) может составлять менее 20, менее 19, менее 18, менее 17, менее 16, менее 15, менее 14, менее 13, менее 12, менее 11, менее 10, менее 9, менее 8, менее 7, менее 6, менее 5, менее 4 или менее 3. Количество антигенов S.aureus в композиции по изобретению может составлять менее 6, менее 5 или менее 4.
Фармацевтические композиции и способы
Изобретение относится к способам получения фармацевтических композиций, включающим этапы смешивания (a) полисахарида по изобретению (необязательно в форме конъюгата) с (b) фармацевтически приемлемым носителем. Типичные "фармацевтически приемлемые носители" включают любой носитель, который самостоятельно не индуцирует продукцию антител, вредных для индивидуума, получающего композицию. Подходящие носители, как правило, представляют собой большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, лактозу и липидные агрегаты (такие как масляные капли или липосомы). Такие носители хорошо известны специалистам в данной области. Вакцины также могут содержать разбавители, такие как вода, физиологический раствор, глицерин и т.д. Кроме того, могут присутствовать вспомогательные вещества, такие как средства для смачивания или эмульгаторы, буферизирующие pH вещества и т.п. Типичным носителем является стерильный не содержащий пирогенов, буферный фосфатно-солевой физиологический раствор. Подробное описание фармацевтически приемлемых эксципиентов доступно в ссылке 129.
Композиции по изобретению могут находиться в водной форме (т.е. растворы или суспензии) или в сухой форме (например, в лиофилизированном виде). Если используют высушенную вакцину, тогда ее перед инъекцией восстанавливают в жидкую среду. Лиофилизация вакцин с конъюгатами известна в данной области, например, продукт Menjugate™ предоставляют в лиофилизированной форме, тогда как NeisVac-C™ и Meningitec™ предоставляют в водной форме. Для стабилизации конъюгаты при лиофилизации, типичным может являться добавление в композицию, например, сахарного спирта (например, маннита) или дисахарида (например, сахарозы или трегалозы) при концентрациях от 1 мг/мл до 30 мг/мл (например, приблизительно 25 мг/мл).
Фармацевтические композиции можно упаковывать во флаконы или в шприцы. Шприцы можно поставлять с иглами или без. Шприц включает однократную дозу композиции, тогда как флакон может содержать однократную дозу или несколько доз.
Водные композиции полисахаридов по изобретению подходят для восстановления других вакцин из лиофилизированной формы. Когда композицию по изобретению необходимо использовать для такого непредусмотренного восстановления, изобретение относится к способу восстановления такой лиофилизированной вакцины, включающему этап смешивания лиофилизированного материала с водной композицией по изобретению. Восстановленный материал можно использовать для инъекции.
Антигены S.aureus
Как указано выше, в композиции по изобретению можно включать один или несколько дополнительных антигенов S.aureus. Антигены могут представлять собой белковые или сахаридные антигены. Белковые антигены S.aureus можно использовать в качестве белков-носителей для конъюгатов по изобретению, белков-носителей для других конъюгатов или в качестве неконъюгированных белковых антигенов. Сахаридные антигены S.aureus можно использовать в качестве сахаридов для других конъюгатов или в качестве неконъюгированных сахаридных антигенов.
Подходящие сахаридные антигены S.aureus включают экзополисахарид S.aureus, который представляет собой поли-N-ацетилглюкозамин (PNAG). Этот полисахарид присутствует у S.aureus и S.epidermidis, и его можно выделять из любого из этих источников [130, 131], Например, PNAG можно выделять из штамма S.aureus MN8m [132]. Сахаридный антиген может представлять собой полисахарид с размером, образующимся при очистке экзополисахарида из бактерий, или он может представлять собой полисахарид получаемый посредством фрагментации такого полисахарида, например, размер может варьировать от более 400 кДа до размера от 75 до 400 кДа или от 10 до 75 кДа, или до 30 повторяющихся единиц. Сахаридный антиген может иметь различные степени N-ацетилирования и, как описано в ссылке 133, PNAG может быть N-ацетилированным менее чем на 40% (например, N-ацетилированным менее чем на 35, 30, 20, 15, 10 или 5%; деацетилированный PNAG также известен как dPNAG). Деацетилированные эпитопы PNAG могут индуцировать антитела, способные к опосредованию опсонизирующего киллинга. Получение dPNAG описано в ссылке 134. PNAG может являться O-сукцинилированным или нет, например, он может являться O-сукцинилированным менее чем по 25, 20, 15, 10, 5, 2, 1 или 0,1% остатков. PNAG можно конъюгировать с молекулой-носителем, как описано выше, или, альтернативно, он может оставаться неконъюгированным.
Другим подходящим сахаридным антигеном S.aureus является антиген типа 336, который представляет собой β-сцепленный гексозамин с отсутствием O-ацетилирования [135,136]. Антиген типа 336 пререкрестно реагирует с антителами к штамму 336 (ATCC 55804). Антиген типа 336 можно конъюгировать с молекулой-носителем, как описано выше, или, альтернативно, он может оставаться неконъюгированным.
Подходящие белковые антигены S.aureus включают следующие антигены (или антигены S.aureus содержат их иммуногенный фрагмент(ы)) [например, см. ссылки 137-144]: AhpC, AhpF, амидазу аутолизина, глюкозаминидазу аутолизина, связывающий белок коллагена CAN, EbhB, липазу GehD, гепарин-связывающий белок HBP (17 кДа), рецептор ламинина, MAP, MntC (также известный как SitC), MRPII, Npase, ORFO594, ORFO657n, ORFO826, PBP4, RAP (активирующий РНК III белок), Sai-1, SasK, SBI, SdrG, SdrH, SSP-1, SSP-2 и витронектин-связывающий белок.
Дополнительные подходящие белковые антигены S.aureus включают антиген clfA; антиген clfB; антиген sdrE2; антиген sdrC; антиген sasF, антиген emp; антиген sdrD; антиген spa; антиген esaC; антиген esxA; антиген esxB; антиген sta006; антиген isdC; антиген Hla; антиген sta011; антиген isdA; антиген isdB и антиген sta073, как описано ниже. В композиции по изобретению могут присутствовать один или несколько (т.е. 1, 2, 3, 4, 5, 6 или более) из этих антигенов. Из этих антигенов особенно предпочтительно использование одного или нескольких (т.е. 1, 2, 3, 4, 5, 6 или более) из антигена esxA; антигена esxB; антигена sta006; антигена Hla; антигена sta011 и/или антигена sta073.
Например, композиция по изобретению может содержать одну из следующих комбинаций белковых антигенов S.aureus:
(1) Антиген esxA, антиген esxB, антиген sta006 и антиген Hla. Антигены esxA и esxB можно эффективно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB с антигеном esxB ниже антигена esxA. Антиген Hla может представлять собой детоксифицированный мутант, например, содержащий мутацию H35L.
(2) Антиген esxA, антиген esxB, антиген sta006 и антиген sta011. Антигены esxA и esxB можно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB.
(3) Антиген esxA, антиген esxB и антиген sta011. Антигены esxA и esxB можно эффективно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB.
(4) Антиген esxA, антиген esxB, антиген Hla, антиген sta006 и антиген sta011. Антигены esxA и esxB можно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB. Антиген Hla может представлять собой детоксифицированный мутант, например, содержащий мутацию H35L.
(5) Антиген esxA, антиген esxB и антиген Hla. Антигены esxA и esxB можно эффективно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB. Антиген Hla может представлять собой детоксифицированный мутант, например, содержащий мутацию H35L.
(6) Антиген Hla, антиген sta006 и антиген sta011. Антиген Hla может представлять собой детоксифицированный мутант, например, содержащий мутацию H35L.
(7) Антиген esxA и антиген esxB. Антигены esxA и esxB можно эффективно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB.
(8) Антиген esxA, антиген esxB и антиген sta006. Антигены esxA и esxB можно эффективно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB.
(9) Антиген esxA, антиген esxB, антиген sta011 и антиген sta073. Антигены esxA и esxB можно комбинировать в качестве гибридного полипептида, как описано ниже, например, в качестве гибрида EsxAB.
(10) Антиген sta006 и антиген sta011.
Дополнительные антигены Staphylococcus aureus описаны в ссылке 145.
clfA
"Антиген clfA" аннотирован как "фактор агглютинации A". В NCTC 8325 штамм clfA представляет собой SAOUHSC_00812 и обладает последовательностью аминокислот SEQ ID NO: 1 (GI:88194572). В штаммах Newman он представляет собой nwmn_0756 (GI: 151220968).
Пригодные антигены clfA могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 1 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 1; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 1, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки clfA включают варианты SEQ ID NO: 1. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 1. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 1 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 1. Конечные 368 C-концевых аминокислот SEQ ID NO: 1 можно успешно не включать. Первые 39 N-концевых аминокислот SEQ ID NO: 1 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка.
Пригодным фрагментом SEQ ID NO: 1 является SEQ ID NO: 2 ("ClfA40-559"). В этих фрагментах не включена протяженная повторяющаяся область по направлению к C-концу SEQ ID NO: 1.
clfB
"Антиген clfB" аннотирован как "фактор агглютинации B". В NCTC 8325 штамм clfB представляет собой SAOUHSC_02963 и обладает последовательностью аминокислот SEQ ID NO: 3 (GI:88196585). В штаммах Newman он представляет собой nwmn_2529 (GI:151222741).
Пригодные антигены clfB могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 3 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 3; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 3, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки clfB включают варианты SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 3. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 3 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 3. Конечные 40 C-концевых аминокислот SEQ ID NO: 3 можно успешно не включать. Первые 44 N-концевых аминокислот SEQ ID NO: 3 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. ClfB в природе представляет собой длинный белок и, таким образом, использование фрагментов полезно, например, для очистки, обработки, слияния, экспрессии и т.д.
Пригодным фрагментом SEQ ID NO: 3 является SEQ ID NO: 4 ("ClfB45-552"). Этот фрагмент содержит наиболее поверхностный домен ClfB и его проще использовать в промышленном масштабе. Он также снижает сходство антигена с белками человека. Другие пригодные фрагменты, на основе 3-доменой модели ClfB, включают: ClfB45-360 (также известный как CLfB-N12; SEQ ID NO: 5); ClfB212-542 (также известный как CLfB-N23; SEQ ID NO: 6) и ClfB360-542 (также известный как CLfB-N3; SEQ ID NO: 7).
sdrE2
"Антиген sdrE2" аннотирован как "богатый Ser-Asp связывающий фибриноген/костный сиалопротеин белок SdrE". В штаммах Newman sdrE2 представляет собой NWMN_0525 и обладает последовательностью аминокислот SEQ ID NO: 8 (GI: 151220737).
Пригодные антигены sdrE2 могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 8 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 8; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 8, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sdrE2 включают варианты SEQ ID NO: 8. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 8. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 8 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 8. Конечные 38 C-концевых аминокислот SEQ ID NO: 8 можно успешно не включать. Первые 52 N-концевых аминокислот SEQ ID NO: 8 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. SdrE2 в природе представляет собой длинный белок и, таким образом, использование фрагментов очень полезно например, для очистки, обработки, слияния, экспрессии и т.д.
Пригодным фрагментом SEQ ID NO: 8 является SEQ ID NO: 9 ("SdrE53-632"). Этот фрагмент содержит наиболее поверхностный домен SdrE2 и его проще использовать в промышленном масштабе. Он также снижает сходство антигена с белками человека.
sdrC
"Антиген sdrC" аннотирован как "белок sdrC". В NCTC 8325 штамм sdrC представляет собой SAOUHSC_00544 и обладает последовательностью аминокислот SEQ ID NO: 10 (GI:88194324).
Пригодные антигены sdrC могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 10 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 10; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 10, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sdrC включают варианты SEQ ID NO: 10. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 10. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 10 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 10. Конечные 38 C-концевых аминокислот SEQ ID NO: 10 можно успешно не включать. Первые 50 N-концевых аминокислот SEQ ID NO: 10 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. SdrC в природе представляет собой длинный белок и, таким образом, использование фрагментов полезно например, для очистки, обработки, слияния, экспрессии и т.д.
Пригодным фрагментом SEQ ID NO: 10 является SEQ ID NO: 11 ("SdrC51-518"). Этот фрагмент содержит наиболее поверхностный домен SdrC и его проще использовать в промышленном масштабе. Он также снижает сходство антигена с белками человека.
sasF
"Антиген sasF" аннотирован как "белок sasF". В NCTC 8325 штамм sasF представляет собой SAOUHSC_02982 и обладает последовательностью аминокислот SEQ ID NO: 12 (GI:88196601).
Пригодные антигены sasF могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 12 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 12; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 12, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sasF включают варианты SEQ ID NO: 12. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 12. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 12 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 12. Конечные 39 C-концевых аминокислот SEQ ID NO: 12 можно успешно не включать. Первые 37 N-концевых аминокислот SEQ ID NO: 12 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка.
emp
"Антиген emp" аннотирован как "связывающий внеклеточный матрикс и плазму белок". В NCTC 8325 штамм emp представляет собой SAOUHSC_00816 и обладает последовательностью аминокислот SEQ ID NO: 13 (GI:88194575). В штаммах Newman он представляет собой nwmn_0758 (GI: 151220970).
Пригодные антигены emp могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 13 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 13; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 13, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки emp включают варианты SEQ ID NO: 13. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 13. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 13 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 13. Первые 26 N-концевых аминокислот SEQ ID NO: 13 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка.
Пригодными фрагментами SEQ ID NO: 13 являются SEQ ID NO: 14, 15, 16 и 17 ("Emp35-340", "Emp27-334", "Emp35-334" и "Emp27-147", соответственно).
sdrD
"Антиген sdrD" аннотирован как "белок sdrD". В NCTC 8325 штамм sdrD представляет собой SAOUHSC_00545 и обладает последовательностью аминокислот SEQ ID NO: 18 (GI:88194325).
Пригодные антигены sdrD могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 18 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 18; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 18, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sdrD включают варианты SEQ ID NO: 18. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 18. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 18 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 18. Конечные 38 C-концевых аминокислот SEQ ID NO: 18 можно успешно не включать. Первые 52 N-концевых аминокислот SEQ ID NO: 18 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. SdrD в природе представляет собой длинный белок и, таким образом, использование фрагментов очень полезно например, для очистки, обработки, слияния, экспрессии и т.д.
Пригодным фрагментом SEQ ID NO: 18 является SEQ ID NO: 19 ("SdrD53-592"). Этот фрагмент содержит наиболее поверхностный домен SdrD и его проще использовать в промышленном масштабе. Он также снижает сходство антигена с белками человека. Другим пригодным фрагментом с тем же C-концевым остатком является SdrD394-592 (также известный как SdrD-N3; SEQ ID NO: 20).
spa
Антиген "spa" аннотирован как "белок A" или "SpA". В NCTC 8325 штамм spa представляет собой SAOUHSC_00069 и обладает последовательностью аминокислот SEQ ID NO: 21 (GI:88193885). В штаммах Newman он представляет собой nwmn_0055 (GI: 151220267). Все штаммы S.aureus strains экспрессируют структурный ген spa, хорошо охарактеризованный фактор вирулентности, заякоренный на поверхности клеточной стенки продукт которого содержит пять высокогомологичных иммуноглобулин-связывающих доменов, обозначенных E, D, A, B, и C [146]. Эти домены демонстрируют ≈80% идентичность на уровне аминокислот, составляют от 56 до 61 остатков в длину и организованы в виде тандемных повторов [147]. SpA синтезируются в виде белка-предшественника с N-концевым сигнальным пептидом и C-концевым сигналом сортировки [148,149]. Заякоренный на клеточной стенке spa в большом избытке экспонирован на поверхности стафилококков [150, 151]. Каждый из его иммуноглобулин-связывающих доменов состоит из антипараллельных α-спиралей, составленных в трехспиральный тяж и может связывать Fc-домен иммуноглобулина G (IgG) [152,153], VH3 тяжелой цепи (Fab) IgM (т.е. B-клеточного рецептора) [154], фактор фон Виллебранда по его домену A1 [155] и/или рецептор I TNF-α (TNFRI) [156], который экспонирован на поверхностях эпителия дыхательных путей.
Пригодные антигены spa могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 21 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 21; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 21, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки spa включают варианты SEQ ID NO: 21. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 21. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 21 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 21. Конечные 35 C-концевых аминокислот SEQ ID NO: 21 можно успешно не включать. Первые 36 N-концевых аминокислот SEQ ID NO: 21 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. Ссылка 157 позволяет предположить, что отдельные IgG-связывающие домены могут представлять собой пригодные иммуногены, отдельно или в комбинации.
Пригодным фрагментом SEQ ID NO: 21 является SEQ ID NO: 22 ("Spa37-325"). Этот фрагмент содержит все пять Ig-связывающих доменов SpA и содержит наиболее поверхностный домен SpA. Он также снижает сходство антигена с белками человека. В других пригодных фрагментах могут быть пропущены 1, 2, 3 или 4 из природных доменов A, B, C, D и/или E. Как указано в ссылке 157, другие пригодные фрагменты могут содержать только 1, 2, 3 или 4 из природных доменов A, B, C, D и/или E, например, содержать только домен SpA(A), но не B-E, или содержать только домен SpA(D) но не A, B, C или E и т.д. Таким образом, антиген spa, пригодный по изобретению, может содержать 1, 2, 3, 4 или 5 IgG-связывающих доменов, но в идеале содержит 4 или менее. Если антиген содержит только домен spa одного типа (например, только домен Spa(A) или SpA(D)), он может содержать более одной копии этого домена, например, несколько доменов SpA(D) в одной полипептидной цепи. Отдельный домен в антигене может быть мутантным по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислотам относительно SEQ ID NO: 21 (например, см. ссылку 157, где описаны мутации по остаткам 3 и/или 24 домена D, по остатку 46 и/или 53 домена A и т.д.). Такие мутанты не должны устранять способность антигена индуцировать антитела, распознающие SEQ ID NO: 21, но могут устранять связывание антигена с IgG. В определенных аспектах антиген spa содержит замену с (a) одной или нескольким заменами аминокислот в связывающем Fc IgG поддомене домена A, B, C, D и/или E SpA, которые нарушают или снижают связывание с Fc IgG, и (b) одной или нескольким заменами аминокислот в связывающем VH3 поддомене домена A, B, C, D и/или E SpA,, которые нарушают или снижают связывание с VH3. В определенных вариантах осуществления вариант SpA содержит по меньшей мере или самое большое 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более пептидов вариантных доменов D SpA.
esaC
"Антиген esaC" аннотирован как "esaC". В NCTC 8325 штамм esaC представляет собой SAOUHSC_00264 и обладает последовательностью аминокислот SEQ ID NO: 23 (GI:88194069).
Пригодные антигены esaC могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 23 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 23; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 23, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100 или более). Эти белки esaC включают варианты SEQ ID NO: 23. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 23. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 23 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 23. В других фрагментах отсутствуют один или несколько доменов белка.
esxA
"Антиген esxA" аннотирован как "белок". В NCTC 8325 штамм esxA представляет собой SAOUHSC_00257 и обладает последовательностью аминокислот SEQ ID NO: 24 (GI:88194063).
Пригодные антигены esxA могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 24 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 24; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 24, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90 или более). Эти белки esxA включают варианты SEQ ID NO: 24. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 24. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 24 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 24. В других фрагментах отсутствуют один или несколько доменов белка.
esxB
"Антиген esxB" аннотирован как "esxB". В NCTC 8325 штамм esxB представляет собой SAOUHSC_00265 и обладает последовательностью аминокислот SEQ ID NO: 25 (GI:88194070).
Пригодные антигены esxB могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 25 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 25; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 25, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100 или более). Эти белки esxB включают варианты SEQ ID NO: 25. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 25. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 25 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 25. В других фрагментах отсутствуют один или несколько доменов белка.
sta006
Антиген "sta006" антиген аннотирован как "феррихром-связывающий белок", и он также обозначен в литературе как "FhuD2" [158]. В NCTC 8325 штамм sta006 представляет собой SAOUHSC_02554 и обладает последовательностью аминокислот SEQ ID NO: 26 (GI:88196199). В штаммах Newman он представляет собой nwmn_2185 (GI: 151222397).
Пригодные антигены sta006 могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 26 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 26; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 26, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sta006 включают варианты SEQ ID NO: 26. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 26. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 26 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 26. Первые 17 N-концевых аминокислот SEQ ID NO: 26 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. В ссылке 159 приведены мутантные формы sta006. Антиген sta006 можно липидировать, например, с использованием ацилированного N-концевого цистеина.
isdC
"Антиген isdC" аннотирован как "белок". В NCTC 8325 штамм isdC представляет собой SAOUHSC_01082 и обладает последовательностью аминокислот SEQ ID NO: 27 (GI:88194830).
Пригодные антигены isdC могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 27 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 10%, 15%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 27; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 27, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200 или более). Эти белки isdC включают варианты SEQ ID NO: 27. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 27. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 27 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 27. Конечные 39 C-концевых аминокислот SEQ ID NO: 27 можно успешно не включать. Первые 28 N-концевых аминокислот SEQ ID NO: 27 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. Пригодные фрагменты IsdB описаны в ссылке 165.
В ссылке 160 описаны антигены, которые эффективно включат эпитопы и из IsdB, и из IsdH.
Hla
Антиген "Hla" представляет собой "предшественник альфа-гемолизина" также известный как "альфа-токсин" или просто "гемолизин". В NCTC 8325 штамм Hla представляет собой SAOUHSC_01121 и обладает последовательностью аминокислот SEQ ID NO: 28 (GI:88194865). В штаммах Newman он представляет собой nwmn_1073 (GI:151221285). Hla представляет собой важную детерминанту вирулентности, продуцируемую большинством штаммов S.aureus с активностью формирования пор и гемолитической активностью. Антитела к Hla могут нейтрализовать вредоносное действие токсина в моделях на животных, и Hla особенно пригоден для защиты от пневмонии.
Пригодные антигены Hla могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 28 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 28; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 28, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки Hla включают варианты SEQ ID NO: 28. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 28. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 28 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 28. Первые 26 N-концевых аминокислот SEQ ID NO: 28 можно успешно не включать. Также можно использовать укорочение на C-конце, например, оставляя только 50 аминокислот (остатки 27-76 SEQ ID NO: 28) [161]. В других фрагментах отсутствуют один или несколько доменов белка.
Токсичность Hla в композиции по изобретению можно устранить посредством химической инактивации (например, с использованием формальдегида, глутаральдегида или других сшивающих реагентов). Однако вместо этого предпочтительно использовать мутантные формы Hla, устраняющие токсическую активность при сохранении его иммуногенности. Такие детоксифицированные мутанты уже известны в данной области. Один из пригодных антигенов Hla содержит мутацию по остатку 61 SEQ ID NO: 28, который представляет собой остаток 35 зрелого антигена (т.е. после невключения первых 26 N-концевых аминокислот). Таким образом, остаток 61 не может быть гистидином и, вместо этого, может представлять собой, например, Ile, Val или предпочтительно Leu. Также можно использовать мутацию His-Arg в этом положении. Например, SEQ ID NO: 29 представляет собой последовательность зрелого мутанта Hla-H35L, а пригодный антиген Hla содержит SEQ ID NO: 29. В другой пригодной мутации происходит замена длинной петли короткой последовательностью, например, с заменой 39-мера по остаткам 136-174 SEQ ID NO: 28 на такой тетрамер, как PSGS (SEQ ID NO: 30), как в SEQ ID NO: 31 (которая также содержит мутацию H35L) и SEQ ID NO: 32 (которая не содержит мутацию H35L).
Дополнительные пригодные антигены Hla описаны в ссылках 162 и 163.
Тремя пригодными фрагментами SEQ ID NO: 28 являются SEQ ID NO: 33, 34 и 35 ("Hla27-76", "Hla27-89" и "Hla27-79", соответственно). Соответствующими фрагментами из SEQ ID NO: 29 являются SEQ ID NO: 36, 37 и 38.
sta011
Антиген "sta011" аннотирован как "липопротеин". В NCTC 8325 штамм sta011 представляет собой SAOUHSC_00052 и обладает последовательностью аминокислот SEQ ID NO: 39 (GI:88193872).
Пригодные антигены sta011 могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 39 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 39; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 39, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sta011 включают варианты SEQ ID NO: 39. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 39. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 39 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 39. Первые 23 N-концевых аминокислот SEQ ID NO: 39 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. Антиген sta006 можно липидировать, например, с использованием ацилированного N-конца цистеина.
Вариантные формы SEQ ID NO: 39, которые можно использовать для получения антигенов sta011, в качестве неограничивающих примеров включают SEQ ID NO: 40, 41 и 42 с различными заменами Ile/Val/Leu.
isdA
"Антиген isdA" аннотирован как "белок IsdA". В NCTC 8325 штамм isdA представляет собой SAOUHSC_01081 и обладает последовательностью аминокислот SEQ ID NO: 43 (GI:88194829). В штаммах Newman он представляет собой nwmn_1041 (GI:151221253).
Пригодные антигены isdA могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 43 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 43; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 43, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки isdA включают варианты SEQ ID NO: 43. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 43. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 43 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 43. Конечные 38 C-концевых аминокислот SEQ ID NO: 43 можно успешно не включать. Первые 46 N-концевых аминокислот SEQ ID NO: 43 можно успешно не включать. также пригодны укорочения с исключением C-концевого 38-мера SEQ ID NO: 43 (начиная с мотива LPKTG). В других фрагментах отсутствуют один или несколько доменов белка. Пригодным фрагментом SEQ ID NO: 43 является SEQ ID NO: 44 (аминокислоты 40-184 SEQ ID NO: 43; "IsdA40-184") которая содержит гем-связывающий участок природного белка и содержит наиболее поверхностный домен антигена. Он также снижает сходство антигена с белками человека. Другие пригодные фрагменты описаны в ссылках 164 и 165.
IsdA не адсорбируется на адъювантах с гидроксидом алюминия должным образом так, что IsdA, присутствующий в композиции, может являться неадсорбированным или может быть адсорбирован на альтернативном адъюванте, например, на фосфате алюминия.
isdB
"Антиген isdB" аннотирован как "белок нейрофиламентов isdB". В NCTC 8325 штамм isdB представляет собой SAOUHSC_01079 и обладает последовательностью аминокислот SEQ ID NO: 45 (GI:88194828). IsdB предлагали для применения в качестве антигена вакцины отдельно [166], но он не может предотвратить пневмонию.
Пригодные антигены isdB могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 45 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 45; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 45, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки isdB включают варианты SEQ ID NO: 45. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 45. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 45 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 45. Конечные 36 C-концевых аминокислот SEQ ID NO: 45 можно успешно не включать. Первые 40 N-концевых аминокислот SEQ ID NO: 45 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка. Пригодные фрагменты IsdB, например, с отсутствием 37 внутренних аминокислот SEQ ID NO: 45, описаны в ссылках 165 и 167.
В некоторых вариантах осуществления композиции по изобретению не содержит антиген isdB.
sta073
Антиген "sta073" аннотирован как "бифункциональный предшественник аутолизина". В NCTC 8325 штамм sta073 представляет собой SAOUHSC_00994 и обладает последовательностью аминокислот SEQ ID NO: 46 (GI:88194750). В штаммах Newman он представляет собой nwmn_0922 (GI:151221134). Протеомный анализ выявил, что этот белок секретируется или экспонирован на поверхности.
Пригодные антигены sta073 могут индуцировать антитела (например, при введении человеку), распознающие SEQ ID NO: 46 и/или могут содержать последовательность аминокислот: (a) с 50% или более идентичностью (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 46; и/или (b) содержащую фрагмент по меньшей мере из "n" последовательных аминокислот из SEQ ID NO: 46, где "n" представляет собой 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти белки sta073 включают варианты SEQ ID NO: 46. Предпочтительные фрагменты (b) содержат эпитоп из SEQ ID NO: 46. В других предпочтительных фрагментах отсутствует одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с C-конца и/или одна или несколько аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) с N-конца SEQ ID NO: 46 при сохранении по меньшей мере одного эпитопа SEQ ID NO: 46. Первые 24 N-концевых аминокислот SEQ ID NO: 46 можно успешно не включать. В других фрагментах отсутствуют один или несколько доменов белка.
Sta073 не адсорбируется на адъювантах с гидроксидом алюминия должным образом так, что Sta073, присутствующий в композиции, может являться неадсорбированным или может быть адсорбирован на альтернативном адъюванте, например, на фосфате алюминия.
Гибридные полипептиды
Белковые антигены S.aureus, используемые по изобретению, могут присутствовать в композиции в виде индивидуальных отдельных полипептидов. Однако когда используют более одного антигена, они не должны присутствовать в виде отдельных полипептидов. Наоборот, по меньшей мере два (например, 2, 3, 4, 5, или более) антигена можно экспрессировать в виде единой полипептидной цепи ("гибридного" полипептида). Гибридные полипептиды обладают двумя основными преимуществами: во-первых, полипептиду, который может являться нестабильным или плохо экспрессируемым сам по себе, можно содействовать посредством добавления подходящего партнера по гибриду, который преодолевает эту проблему; во-вторых, упрощается коммерческое производство, так как для получения двух полипептидов, которые оба являются антигенно пригодными, необходимо проводить только одну экспрессию и очистку.
Гибридный полипептид может содержать две или более полипептидных последовательности из каждого из перечисленных выше антигенов или два или более варианта одного и того же антигена в случаях, когда последовательность обладает частичной вариативностью между штаммами.
Пригодны гибриды, состоящие из аминокислотных последовательностей из двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти антигены. В частности, предпочтительны гибриды, состоящие из аминокислотных последовательностей из двух, трех, четырех или пяти антигенов, например, из двух или трех антигенов.
Различные гибридные полипептиды можно смешивать вместе в один состав. Гибриды можно комбинировать с негибридными антигенами, выбранными из первой, второй или третьей антигенных групп. В таких комбинациях антиген может присутствовать более чем на одном гибридном полипептиде и/или в виде негибридного полипептида. Однако предпочтительно, чтобы антиген присутствовал или в качестве гибрида или не в качестве гибрида, но не в обоих качествах.
Гибридные полипептиды можно представить формулой NH2-A-{-X-L-}n-B-COOH, где: X представляет собой аминокислотную последовательность антигена S.aureus, как описано выше; L представляет собой необязательную линкерную аминокислотную последовательность; A представляет собой необязательную N-концевую аминокислотную последовательность; B представляет собой необязательную C-концевую аминокислотную последовательность; n представляет собой целое число, равное 2 или более (например, 2, 3, 4, 5, 6 и т.д.). Как правило, n представляет собой 2 или 3.
Если группа -X- в ее форме дикого типа содержит последовательность лидерного пептида, ее можно включить или не включать в гибридный белок. В некоторых вариантах осуществления лидерные пептиды удаляют за исключением лидерного пептида группы -X-, расположенной на N-конце гибридного белка т.е. лидерный пептид X1 будет оставлен, но лидерные пептиды X2.. Xn не будут включены. Это эквивалентно удалению всех лидерных пептидов и использования лидерного пептида X1 в качестве группы -A-.
Для каждой из n случаев {-X-L-}, линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2 гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность(и) -L-, как правило, являются короткими (например, 20 или менее аминокислот, т.е. 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают короткие пептидные последовательности, облегчающие клонирование, полиглициновые линкеры (т.е. содержащие Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Специалистам в данной области очевидны другие подходящие линкерные аминокислотные последовательности. Пригодным линкером является GSGGGG (SEQ ID NO: 47) или GSGSGGGG (SEQ ID NO: 48), где дипептид Gly-Ser формирует участок рестрикции BamHI, таким образом, способствуя клонированию и манипуляциям, а тетрапептид (Gly)4 является типичным полиглициновым линкером. Другие подходящие линкеры, особенно для применения в качестве конечного Ln представляют собой ASGGGS (например, SEQ ID NO: 49, кодируемый SEQ ID NO: 50) или дипептид Leu-Glu.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Как правило, она является короткой (например, 40 или менее аминокислот, т.е. 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают лидерные последовательности для направления транспорта белка или короткие пептидные последовательности, способствующие клонированию или очистке (например, гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Специалистам в данной области очевидны другие подходящие N-концевые аминокислотные последовательности. Если X1 не содержит своего собственного N-концевого метионина, -A- предпочтительно представляет собой олигопептид (например, с 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотами), предоставляющий N-концевой метионин, например, Met-Ala-Ser или один остаток Met.
-B- представляет собой необязательную C-концевую аминокислотную последовательность. Как правило, она является короткой (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают последовательности для направления транспорта белка, короткие пептидные последовательности, способствующие клонированию или очистке (например, содержащие гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более, такие как SEQ ID NO: 51) или последовательности, увеличивающие стабильность белка. Специалистам в данной области очевидны другие подходящие C-концевые аминокислотные последовательности.
Один гибридный полипептид по изобретению может содержать оба антигена esxA и esxB. Они могут присутствовать в любом порядке от N- до C-концов. Примерами таких гибридов являются SEQ ID NO: 52 ("EsxAB"; кодируемая SEQ ID NO: 53) и 54 ("EsxBA"), где оба содержат гексапептидные линкеры ASGGGS (SEQ ID NO: 49).
Общая часть
Если не указано иначе, в практическом осуществлении настоящего изобретения используют общепринятые способы химии, биохимии, молекулярной биологии, иммунологии и фармакологии, в пределах знаний в данных областях. Такие способы полностью описаны в литературе. См., например, ссылки 168-175 и т.д.
Выше используют нумерацию "GI". Номер GI или "идентификатор GenInfo" представляет собой ряд цифр, последовательно присваиваемый каждой записи последовательности, обрабатываемой NCBI, когда последовательности добавляют в его базу данных. Номер GI не имеет никакой аналогии с номером доступа записи последовательности. Когда последовательность обновляют (например, для коррекции или добавления дополнительной аннотации или информации), тогда она получает новый номер GI. Таким образом, последовательность, ассоциированная с данным номером GI, никогда не изменяется.
Указание на процент идентичности последовательностей между двух аминокислотных последовательностей означает, что при выравнивании, этот процент аминокислот при сравнении двух последовательностей является одинаковым. Это выравнивание и процент гомологии или идентичности последовательностей можно определять с использованием программного обеспечения известного в данной области, например, программного обеспечения, описанного в разделе 7.7.18 ссылки 176. Предпочтительное выравнивание определяют по алгоритму поиска гомологии Смита-Уотермана с использованием поиска однородного пропуска со штрафом за создание пропуска 12 и штрафом за продление пропуска 2, матрицы BLOSUM 62. Алгоритм поиска гомологии Смита-Уотермана описан в ссылке 177.
Когда изобретение относится к "эпитопу", этот эпитоп может являться B-клеточным эпитопом и/или T-клеточным эпитопом. Такие эпитопы можно идентифицировать экспериментально (например, с использованием PEPSCAN [178,179] или подобных способов) или их можно предсказывать (например, с использованием индекса антигенности Джеймсона-Вольфа [180], подходов на основе матриц [181], MAPITOPE [182], TEPITOPE [183,184], нейронных сетей [185], OptiMer и EpiMer [186, 187], ADEPT [188], Tsites [189], гидрофильности [190], индекса антигенности [191] или способов, описанных в ссылках 192-196 и т.д.). Эпитопы являются частями антигена, которые распознают и связывают антигенсвязывающие участки антител или T-клеточных рецепторов, и их также можно обозначать как "антигенные детерминанты".
Когда не включают "домен" антигена, это может включать невключение сигнального пептида, цитоплазматического домена, трансмембранного домена, внеклеточного домена и т.д.
Термин "содержащий" включает "включающий", а также "состоящий" например, композиция "содержащая" X может состоять исключительно из X или может включать что-либо дополнительное, например, X+Y.
Термин "приблизительно" в отношении числовых значений x означает, например, x±10%.
Выражение "по существу" не исключает "полностью", например, композиция которая "по существу не содержит" Y может совсем не содержать Y. Если необходимо, выражение "по существу" в определении по изобретению может быть пропущено.
Когда изобретение относится к способы, включающему несколько последовательных этапов, изобретение также может относиться к способу, включающему меньшее общего количество этапов. Различные этапы можно проводить в очень разные моменты времени, их могут проводить разные люди в различных местах (например, в разных странах).
Следует понимать, что циклы сахаров могут существовать в открытой и закрытой формах и что, хотя в структурных формулах в настоящем документе приведены закрытые формы, открытые формы также включены в изобретение. Подобным образом, следует понимать что сахара могут существовать в пиранозной и фуранозной формах и что, хотя в структурных формулах в настоящем документе приведены пиранозные формы, фуранозные формы также включены. Также включены различные аномерные формы сахаров.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 проиллюстрирован способ очистки капсульных полисахаридов S.aureus типа 5 и типа 8 на основе способа по ссылке 13.
На фигуре 2 представлена хроматограмма капсульного полисахарида на DEAE сефарозе и спектр 1H ЯМР содержащих капсульные полисахариды фракций (фракции 68-80), получаемых способом по фигуре 1.
На фигуре 3 представлена хроматограмма капсульного полисахарида на сефакриле S300 и спектр 1H ЯМР содержащих капсульные полисахариды фракций (фракции 22-44), получаемых способом по фигуре 1.
На фигуре 4 проиллюстрирован иллюстративный способ очистки капсульных полисахаридов S.aureus типа 5 и типа 8 по изобретению.
На фигуре 5 представлена хроматограмма капсульного полисахарида на DEAE сефарозе, получаемая способом по изобретению.
На фигуре 6 представлен спектр 1H ЯМР очищенного капсульного полисахарида S.aureus типа 5.
На фигуре 7 представлена химическая структура пептидогликана S.aureus на основе ссылок 197, 198, 199 и 200. Повторяющиеся единицы выделены.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
A. Очистка капсульного полисахарида S.aureus типа 5 (сравнительный пример)
Капсульный полисахарид S.aureus типа 5 очищали в соответствии со схемой, проиллюстрированной на фигуре 1, на основе способа по ссылке 13. Условия и содержания различных этапов этого способа описаны в таблице 1:
|
Центрифугирование бактериального осадка и ферментативные реакции (с лизостафином и РНКазой/ДНКазой)
S.aureus выращивали в твердой среде для получения 600-800 мл бактериальной суспензии. Масса влажного клеточного осадка, собранного посредством центрифугирования при 8000 об./мин., составляла приблизительно 30-50 г. Собранный осадок три раза промывали 50 мМ Tris-2 мМ MgSO4, pH 7,5, а затем суспендировали при 0,25-0,5 г на мл в 50 мМ Tris-2 мМ MgSO4, pH 7,5 и обрабатывали 0,1-0,13 мг/мл лизостафина (Sigma-Aldrich). Реакционную смесь инкубировали при 37°C в течение 16 часов (ON) с умеренным перемешиванием. К суспензии добавляли 0,05 мг/мл ДНКазы/РНКазы (Sigma-Aldrich) и инкубировали в течение 5-7 часов при 37°C. Затем суспензию очищали посредством центрифугирования.
Реакция с NaIO 4
Вещество инкубировали с 50 мМ NaIO4 (Sigma-Aldrich) в темноте в течение 5-7 часов. Затем NaIO4 удаляли, добавляя избыток глицерина в течение 30 минут с перемешиванием на свету.
Фильтрация 30 кДа тангенциальным потоком
|
Фильтрацию тангенциальным потоком проводили в держателе Sartorius™ для кассет 0,1 м2 с использованием перистальтического насоса WatsonMarlon™. Затем мембрану отмывали 1M NaOH и хранили в NaOH 0,1M при +2-8°C.
Хроматография на DEAE Sepharose Fast Flow
Остаточные белки, нуклеиновую кислоту и другие загрязнения удаляли посредством анионообменной хроматографии, проводимой в соответствии с таблицей 3:
|
Хроматографию проводили с использованием системы Akta™ (G&E Healthcare), а капсульный полисахарид детектировали, измеряя поглощение в УФ при 215 нм. Сначала раствор капсульного полисахарида добавляли к 100 мМ буферу NaPi pH 7,2 с получением конечной концентрации буфера 10 мМ NaPi pH 7,2. Смолу DEAE предварительно уравновешивали 100 мМ буфером NaPi pH 7,2 до pH 7,2, а затем уравновешивали 10 мМ буфером NaPi pH 7,2 с достижением указанной проводимости (проводимости 10 мМ буфера NaPi pH 7,2). Полученные фракции анализировали посредством ЯМР, и фракции, содержащие капсульный полисахарид, объединяли вместе (фигура 2).
Хроматография на сефакриле S300
Полисахарид дополнительно очищали посредством гель-фильтрационной хроматографии, проводимой в соответствии с таблицей 4:
|
Хроматографию проводили на системе Akta™ (G&E Healthcare), а капсульный полисахарид детектировали, измеряя поглощение в УФ при 215 нм. Полученные фракции анализировали посредством ЯМР, и фракции, содержащие капсульный полисахарид, объединяли вместе (фигура 3).
B. Очистка капсульных полисахаридов S.aureus типа 5 и типа 8 (пример)
Капсульные полисахариды S.aureus типа 5 и типа 8 очищали в соответствии со схемой, проиллюстрированной на фигуре 4. Условия и смысл различных этапов этого способа описаны в таблице 5:
|
Центрифугирование бактериального осадка и реакции с кислотой и ферментами (уксусной кислотой, РНКазой/ДНКазой и мутанолизином)
S.aureus выращивали в твердой среде с получением бактериальной суспензии 600-800 мл. Масса влажного клеточного осадка, собранного посредством центрифугирования при 8000 об./мин., составляла приблизительно 30-50 г. Собранный осадок три раза промывали 50 мМ Tris-2 мМ MgSO4, pH 7,5, а затем суспендировали при 0,5-0,6 г на мл в дистиллированной воде и энергично перемешивали, поднимая температуру до 100°C. Реакционную смесь инкубировали при 37°C в течение 16 часов (ON) с умеренным перемешиванием. К суспензии добавляли 0,05 мг/мл ДНКазы/РНКазы (Sigma-Aldrich) и инкубировали в течение 5-7 часов при 37°C. Затем суспензию очищали посредством центрифугирования. Затем добавляли уксусную кислоту до конечной концентрации 1% и смесь оставляли при 100°C в течение 2 часов. Смесь нейтрализовали 1M NaOH и центрифугировали при 8000 об./мин.
Супернатант переливали от осадка и комбинировали с 0,05 мг/мл ДНКазы/РНКазы (Sigma-Aldrich). Затем смесь инкубировали в течение 5-7 часов при 37°C, а затем очищали посредством центрифугирования. Затем к суспензии добавляли 180 Ед/мл мутанолизина (Sigma-Aldrich) и смесь инкубировали в течение ночи (в течение 16 часов) при 37°C с умеренным перемешиванием. Затем суспензию снова очищали посредством центрифугирования.
Фильтрация 30 кДа тангенциальным потоком
Фильтрацию тангенциальным потоком проводили, как указано в таблице 6:
|
Фильтрацию тангенциальным потоком проводили в держателе Sartorius™ для кассет 0,2 м2 с использованием перистальтического насоса WatsonMarlon™. Затем мембрану отмывали 1M NaOH и хранили в NaOH 0,1M при +2-8°C.
Хроматография на DEAE Sepharose Fast Flow
Остаточные белки, нуклеиновую кислоту и другие загрязнения удаляли посредством анионообменной хроматографии, проводимой в соответствии с таблицей 7:
|
Хроматографию проводили с использованием системы Akta™ (G&E Healthcare), а капсульный полисахарид детектировали, измеряя поглощение в УФ при 215 нм. Сначала раствор капсульного полисахарида добавляли к 100 мМ буферу NaPi pH 7,2 с получением конечной концентрации буфера 10 мМ NaPi pH 7,2. Смолу DEAE предварительно уравновешивали 100 мМ буфером NaPi pH 7,2 до pH 7,2, а затем уравновешивали 10 мМ буфером NaPi pH 7,2 с достижением указанной проводимости (проводимости 10 мМ буфера NaPi pH 7,2). Полученные фракции анализировали посредством ЯМР, и фракции, содержащие капсульный полисахарид, объединяли вместе (фигура 2).
Фильтрация 30 кДа тангенциальным потоком
Фильтрацию тангенциальным потоком проводили для удаления NaCl, оставшегося после анионообменной хроматографии и для концентрирования очищенных полисахаридов. Фильтрацию проводили, как указано в таблице 8:
|
Фильтрацию тангенциальным потоком проводили в держателе Sartorius™ для кассет 0,2 м2 с использованием перистальтического насоса WatsonMarlon™. Затем мембрану отмывали 1M NaOH и хранили в NaOH 0,1M при +2-8°C. Очищенный полисахарид анализировали посредством ЯМР (например, фигура 6 для капсульного полисахарида типа 5).
C. Определение примесей пептидогликанов в очищенном полисахариде
Содержание пептидогликанов (фигура 7) в очищенном полисахариде типа 5, получаемом способами из разделов A и B выше, определяли посредством анализа аминокислот с использованием HPAEC-PAD в соответствии с системой Dionex AAA-Direct™ (AminoPac™ PA 10 AAA-Direct™, Dionex) по инструкциям производителя. В кратком изложении, к 200 мкл полисахарида при 250 мкг/мл в воде добавляли 20 мкл 100 мкМ норлейцина в обработанную 400°C стеклянную пробирку и сушили с использованием системы Speedvac. Норлейцин служил в качестве внутреннего стандарта. Образцы гидролизовали in vacuo с использованием паров кипящей соляной кислоты/фенола с получением свободных аминокислот из остаточных белков и примесей пептидогликанов. Разделение свободных аминокислот проводили на колонке AminoPac™ PA 10 (2×250 мм), оборудованной предохранительной колонкой AminoPac™ PA10 (2×50 мм) с использованием состояния градиента для аминокислот и углеводов по рекомендациям производителя. Эти условия градиента обобщены в таблице 9:
|
Детекцию проводили с использованием волнообразного потенциала AAA-Direct (таблица 10).
|
Количественное определение проводили с использованием негидролизованного стандартного раствора 17 аминокислот (Fluka P/N 09428) в диапазоне 2,5-50 мкМ. Стандартные образцы анализировали с норлейцином и без при той же концентрации образца. Для учета возможной потери аминокислот на этапе гидролиза в качестве поправочного коэффициента использовали отношение площади пика норлейцина в образце, деленной на среднюю площадь пика норлейцина в стандартах. В качестве контрольного образца использовали образец BSA.
Расчет содержания пептидогликанов
Содержание пептидогликанов определяли с использованием двух различных способов. Первый способ (способ 1) основан на способе, используемом в ссылке 17, который включает суммирование содержания лизина, аланина, глицина и глутамината. Во втором способе (способ 2), для каждой кислоты рассчитывали коэффициент пропорциональности по следующей формуле:
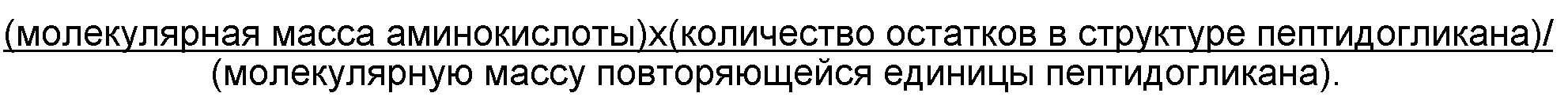
Молекулярная масса повторяющейся единицы пептидогликана составляет 1233,27 Да (фигура 7). Затем рассчитывали содержание пептидогликанов в виде средней концентрации пептидогликанов, получаемой посредством расчета отношения концентрации аминокислот и коэффициента пропорциональности.
Содержание пептидогликанов в очищенном капсульном полисахариде типа 5 после анионообменной хроматографии приведено в таблице 11:
|
Способ по изобретению относится к очень низкому содержанию пептидогликанов в очищенных полисахаридах.
D. Конъюгация и иммуногенность очищенных полисахаридов
Очищенные полисахариды типа 5, получаемые способами из разделов A и B выше, конъюгировали с CRM197 способом по ссылке 29. Общий сахарид в конъюгате определяли посредством анализа HPAEC-PAD, а содержание белка - анализом MicroBCA (таблица 12).
|
Конъюгаты, получаемые с использованием полисахаридов, очищаемых способом по изобретению (партии 4 и 5), обладали более высокими соотношениями полисахарид:белок.
Иммуногенность партии 5 тестировали в модели гибели мышей от инфекции S.aureus. В кратком изложении, мышей CD1 иммунизировали посредством интраперитонеальной инъекции дозы 2 мкг антигена с объемом инъекции 200 мкл. Иммунизацию перед заражением посредством интраперитонеальной инъекции бактериальной суспензии 5×108 КОЕ S.aureus типа 5 проводили в группах из двенадцати мышей по приведенной ниже схеме. Перед заражением культуры S.aureus центрифугировали, дважды промывали и разводили в PBS. Дополнительные разведения необходимы для желаемого инокулята, который экспериментально проверяли посредством посева на агаре и формирования колоний. Животных наблюдали в течение 14 суток и регистрировали летальное заболевание.
Группа 1 - PBS и квасцы
Группа 2 - Конъюгат капсульного полисахарида типа с 5-CRM (партия 5) и квасцы
Группа 4 - Конъюгат капсульного полисахарида типа с 5-CRM (партия 5) и белки EsxAB, Sta006 и Sta011 и квасцы
Группа 5 - Конъюгат капсульного полисахарида типа с 5-CRM (партия 5) и белки HlaH35L, Sta006 и Sta011 и квасцы
Данные о выживаемости представлены в таблице 13:
|
Конъюгаты, получаемые с использованием полисахаридов, очищаемых способом по изобретению, приводили к высокому уровню выживаемости. При добавлении белковых антигенов S.aureus выживаемость увеличивалась.
Следует понимать, что изобретение описано исключительно в качестве примера и можно проводить модификации при сохранении объема и сущности изобретения.
ССЫЛКИ