Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПАЦИЕНТ (ДОНОР)-СПЕЦИФИЧЕСКИХ ФИБРОБЛАСТОПОДОБНЫХ КЛЕТОК ИЗ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к биотехнологии и трансплантологии (клеточной терапии). Изобретение позволяет получать донор- и пациент-специфические фибробластоподобные клетки для использования их в трансплантологии и в качестве аутологичного фидерного (питающего) слоя для культивирования индуцированных плюрипотентных стволовых клеток человека и поддержания их в недифференцированном состоянии.
В 2006 г. японским исследователям Такахаши и Яманака [1] удалось осуществить репрограммирование взрослых и эмбриональных фибробластов мыши в плюрипотентные стволовые клетки путем введения в эти клетки с помощью ретровирусных векторов, четырех транскрипционных факторов Oct3/4, Sox2, c-Myc и Klf4. Авторы назвали эти клетки индуцированными плюрипотентными стволовыми (ИПС) клетками. Полученные в результате такой обработки ИПС клетки своей морфологией, ростовыми свойствами и экспрессией специфических маркеров были аналогичны эмбриональным стволовым (ЭС) клеткам. Уже через год Такахаши [2] и Накагава [3] из той же лаборатории Киотского университета сообщили об успешной дедифференцировке фибробластов взрослого человека и получении ИПС клеток с помощью тех же факторов (Oct4, Sox2, c-Myc и Klf4). Недифференцированное состояние ИПС клеток характеризуется различными признаками и поддерживается, в частности, культивированием на слое питающих клеток. Эти клетки ингибируют и предотвращают дифференцировку ИПС клеток, обеспечивая их всеми необходимыми факторами (Lif, FGF, TGFβ, Activin, Wnt и др.) для поддержания роста и самообновления. Слой питающих клеток, называемых фидерными клетками, обычно представляет собой слой эмбриональных мышиных фибробластов или фибробластов человека, полученных из крайней плоти, инактивированных митомицином С или гамма-облучением. Недифференцированные ЭС и ИПС клетки характеризуются высокой активностью щелочной фосфатазы [2], экспрессией протеогликанов TRA-1-60 и TRA-1-81, гликолипида SSEA-4 и в меньшей степени гликолипида SSEA-3 [4]. SSEA-4 и SSEA-3 характерны только для ЭС и ИПС клеток человека и приматов, ЭС клетки мыши несут на своей поверхности только гликопротеин SSEA-1 [1]. Внутриклеточными маркерами недифференцированного состояния являются транскрипционные факторы (ТФ), необходимые для поддержания плюрипотентности ИПС и ЭС клеток, такие как Oct4, Nanog и Sox2 [1-3]. Недифференцированные ЭС и ИПС клетки растут плотными чаще всего круглыми колониями. Размер клеток составляет около 20 микрон, наблюдается высокое соотношение ядро-цитоплазма, хорошо видны ядрышки, характерно перинуклеарное расположение митохондрий, низкое содержание АТФ, высокий уровень потребления кислорода и низкий уровень содержания митохондриальной ДНК [5-8].
ИПС клетки, находясь в недифференцированном состоянии, являются неисчерпаемым источником для получения любых дифференцированных клеток организма и поэтому представляются весьма перспективными для индивидуализированной клеточной терапии различных патологий человека. ИПС и ЭС клетки способны неограниченно пролиферировать in vitro, не теряя своих плюрипотентных свойств. В этих клетках работают каскады сигнальных путей, которые блокируют дифференцировку и способствуют поддержанию и активации ТФ плюрипотентности. В конце 20 века определили три главных ТФ, необходимых для поддержания плюрипотентности: Oct3/4 (POU5F1), Sox2 и Nanog. [9-11]. Они тесно взаимодействуют как между собой, так и с множеством активных и, что не менее важно, не активных генов. Часть генов ответственны за поддержание плюрипотентности ЭС и ИПС клеток, а часть за дифференцировку в экто-, энто- и мезодермальном направлении, а также в экстраэмбриональные ткани.
Дифференцировка ИПС и ЭС клеток в определенные типы клеток происходит вследствие восстановления маркеров метилирования, которые, в свою очередь, позволяют регулировать экспрессию тканеспецифичных генов.
Недавно были описаны способы получения фибробластоподобных клеток из ЭС клеток человека [12, 13]. Клетки имели схожий с фибробластами фенотип, и было показано, что фибробластоподобные клетки экспрессируют паттерн генов, характерных для первичных фибробластов (коллагены I, III, IV и V типов, фибронектин). При этом уровень экспрессии был в несколько раз выше, чем у первичных фибробластов. Для получения фибробластоподобных клеток использовали фактор роста фибробластов и проводили неоднократные пассирования, чтобы добиться моногенной культуры.
Однако работ по получению фибробластов из ИПС клеток к настоящему времени не известно.
Фибробласты являются важной составляющей частью технологии культивирования как ЭС, так и ИПС клеток человека в недифференцированном состоянии, выступая для них в качестве фидерного слоя.
Техническим результатом, достигаемым при реализации настоящего изобретения, является получение пациент-специфических или индивидуализированных фибробластов из ИПС клеток в больших количествах, что открывает широкие перспективы для их использования не только в качестве фидерного слоя, но и в качестве материала для аутологичной трансплантации человеку при различных травмах или заболеваниях. Указанный технический результат достигается за счет подобранных условий диссоциации ИПС клеток до моноклеточной суспензии и дальнейшего культивирования в специальных ростовых средах.
Под индуцированными плюрипотентными стволовыми клетками человека понимаются клетки, полученные из дифференцированных соматических клеток человека путем репрограммирования.
Под фидерным слоем понимается слой фибробластов, на котором проходит культивирование ЭС и ИПС клеток человека.
Примеры
Авторы настоящего изобретения установили, что ИПС клетки человека способны дифференцироваться в производные трех зародышевых листков: эктодерму, мезодерму и энтодерму и что ИПС клетки человека способны дифференцироваться в фибробласты (фибробластоподобные клетки).
Было установлено, что фибробласты, полученные из ИПС клеток человека, могут служить эффективным фидерным слоем для культивирования аутологичных ИПС клеток и ИПС клеток от других доноров и поддержания их в недифференцированном состоянии.
Пример 1.
Проводили исследование возможности дифференцировки ИПС клеток человека в фибробласты и способности полученных фибробластов служить эффективным фидерным слоем для культивирования ИПС клеток и поддержания их в недифференцированном состоянии.
Эксперименты были проведены на линиях ИПС клеток человека. Для получения фибробластов были использованы 2 линии клеток от здорового донора.
ИПС клетки линия ПО2, 56 пассаж,
ИПС клетки линия ПО6, 32 пассаж.
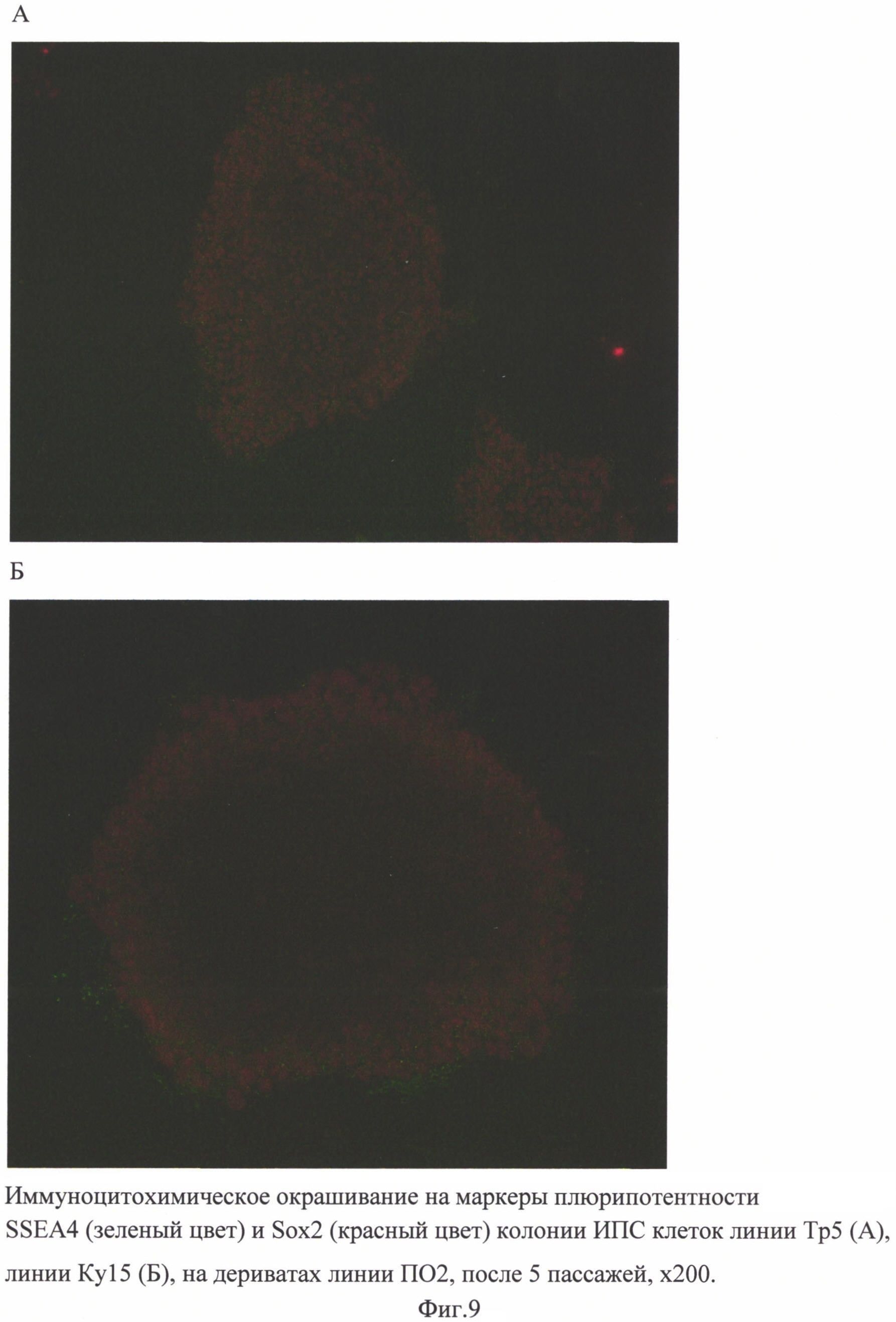
Способность сохранять плюрипотентность ИПС клеток на полученных фибробластах проверяли на линиях здорового донора (ПО2 и ПО6 - аутологичные клетки), а также на линиях от трех пациентов с болезнью Паркинсона: Тр5, Ку15 и Бл6.
Способность сохранять плюрипотентность на полученных фибробластах также проверяли на линии ЭС клеток человека huES09 (клетки любезно предоставлены М.А. Лагарьковой, Институт Общей генетики им. Н.И. Вавилова, РАН).
Недифференцированные ИПС клетки снимали стандартным способом с применением диспазы, далее клетки аккуратно ресуспендировали до моноклеточной суспензии и помещали в среду, состоящую из среды для культивирования недифференцированных ЭС клеток (mTeSr)+среда для культивирования эмбриоидных тел (ЭТ среда) в соотношении 1:1.
Среда для эмбриоидных тел:
DMEM/F12, 20% фетальной сыворотки коровы, 2 мМ L-глутамин, 1% заменимых аминокислот, 0,1 мМ бета-меркаптоэтанол, пенициллин/стрептомицин (50 ед.мл / 50 мкг мл).
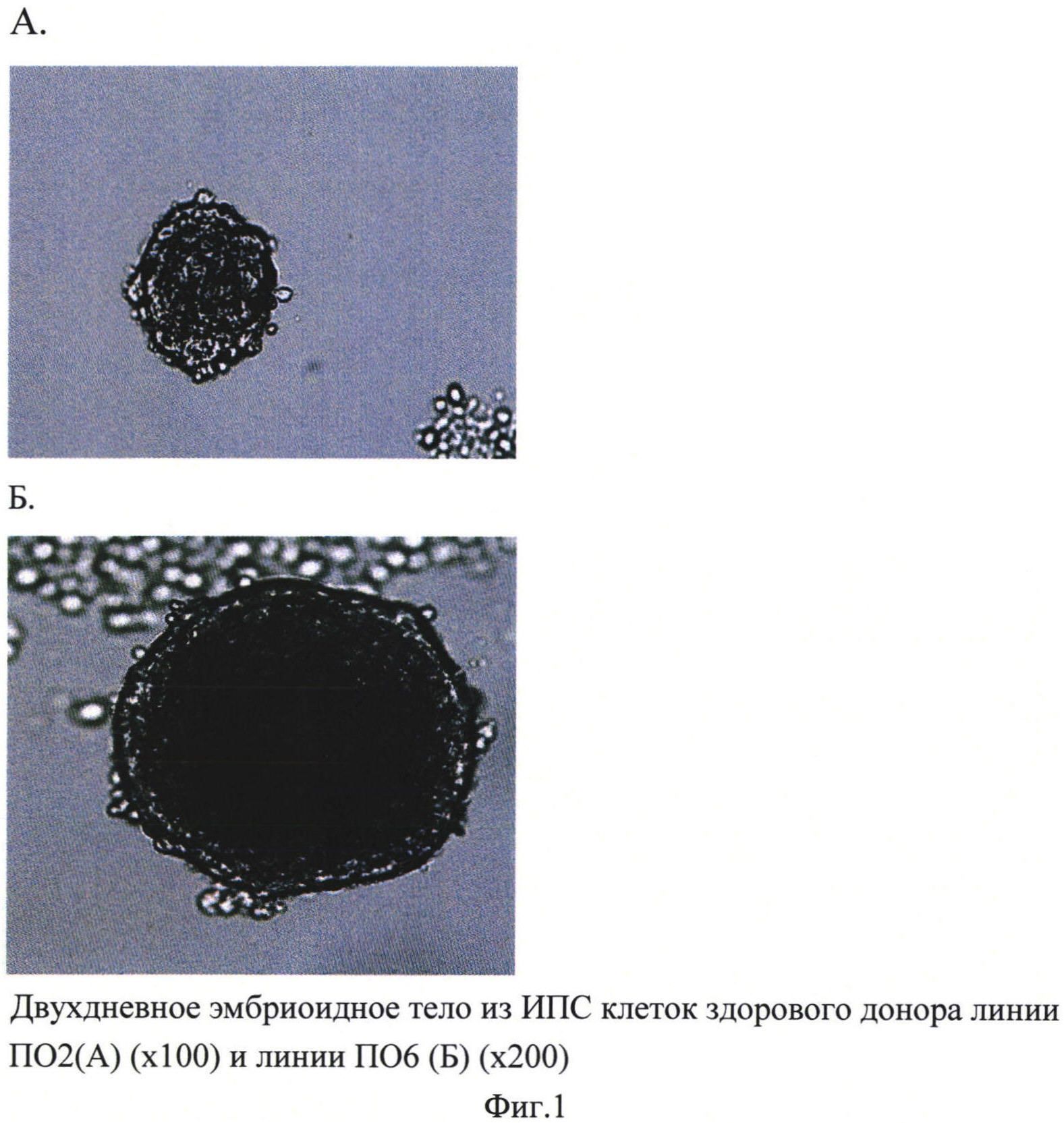
Для получения эмбриоидных тел ИПС клетки культивировали в СО-2-инкубаторе при 37°С и 5% СО2 методом «висячей капли» или помещали в 96-луночный круглодонный планшет из расчета 3000-6000 клеток на лунку в 100 мкл среды. Суть метода «висячей капли» заключалась в следующем: на внутреннюю поверхность крышки чашки Петри по каплям наносили суспензию клеток, в 20 мкл которой содержалось 2000 клеток. Капли наносили на таком расстоянии друг от друга, чтобы они не слились, когда крышку переворачивают и возвращают на чашку. В саму чашку наливали 4 мл среды DMEM, содержащей пенициллин/стрептомицин (50 ед. в мл / 50 мкг в мл), аккуратно переворачивали крышку с капельками суспензии и закрывали ею чашку. Через сутки наблюдали появление ЭТ в каплях. В случае посева клеток в 96-луночный круглодонный планшет также через сутки наблюдали образование ЭТ (фиг. 1).
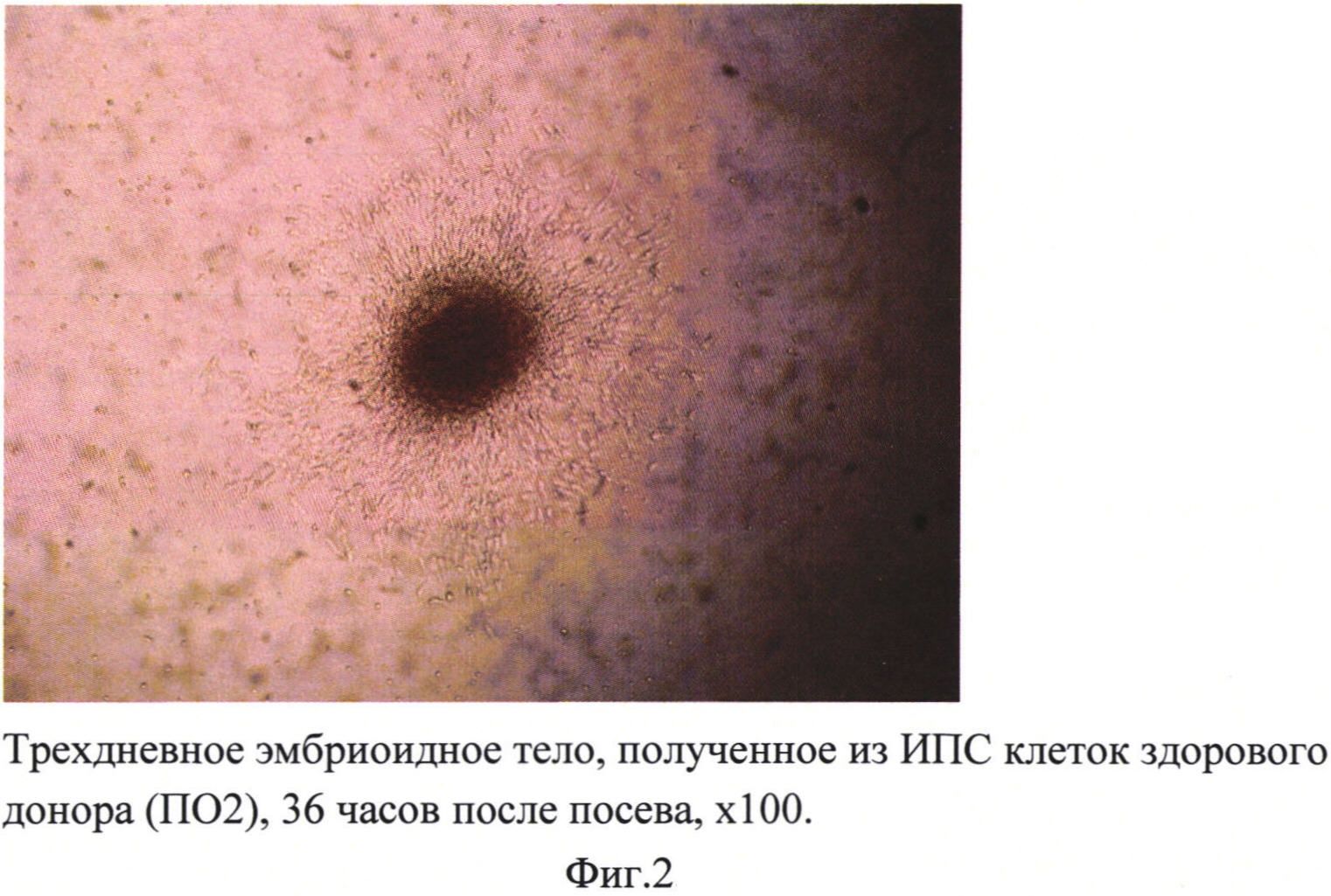
Далее трехдневные ЭТ переносили на 24-луночный планшет, покрытый 0,1% желатином или матригелем из расчета по 1 ЭТ на лунку в 1 мл среды для ЭТ. Прикрепление происходило одинаково хорошо как на желатиновую подложку, так и на подложку из матригеля. Через сутки по периметру ЭТ начинали появляться фибробластоподобные клетки (фиг. 2). Смену ростовой среды осуществляли каждые 2-3 дня. Культивирование проводили в СО-2-инкубаторе при 37°С и 5% СО2 в течение 8-10 суток, за это время клетки достигали 50-60% монослоя.
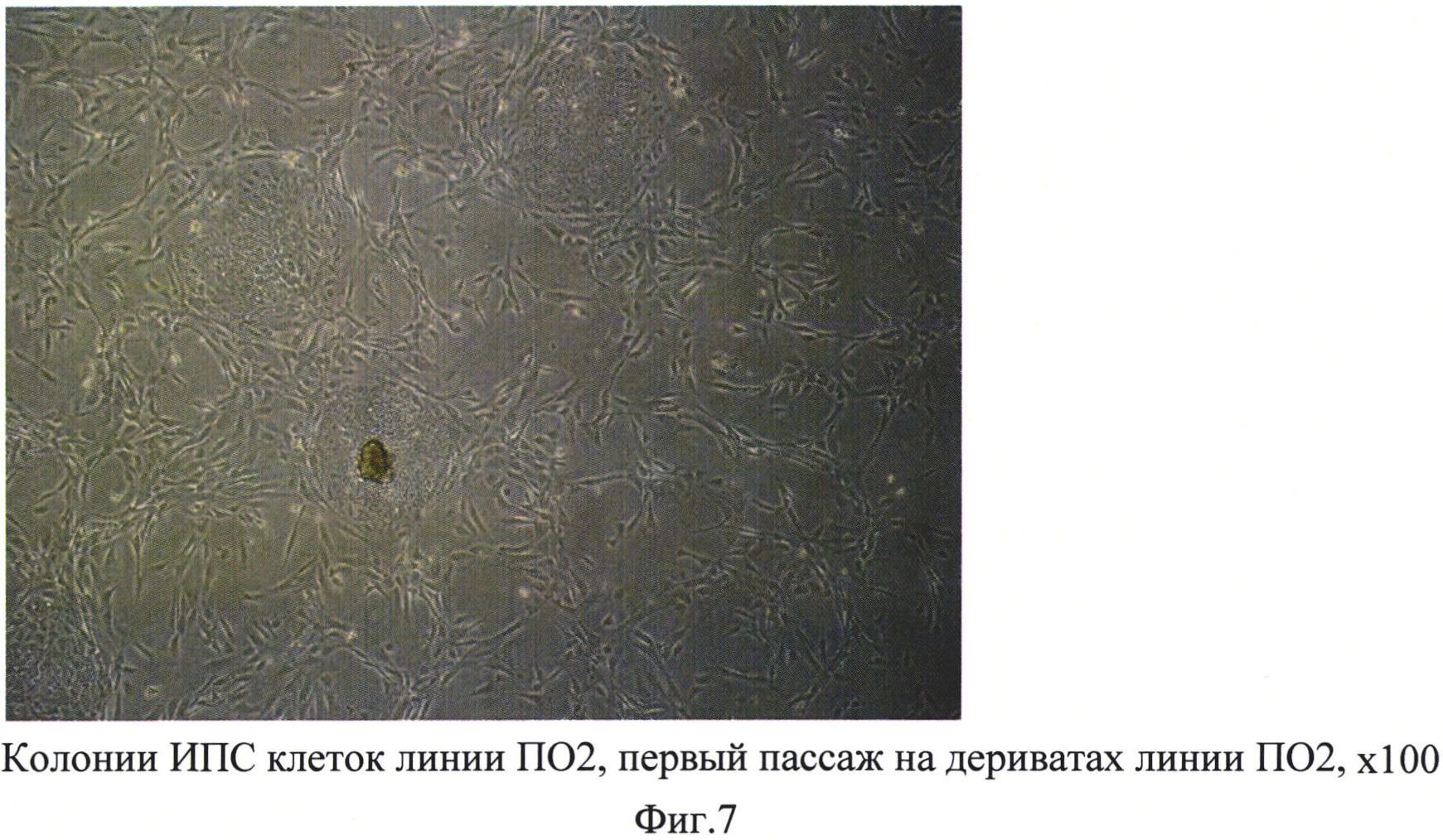
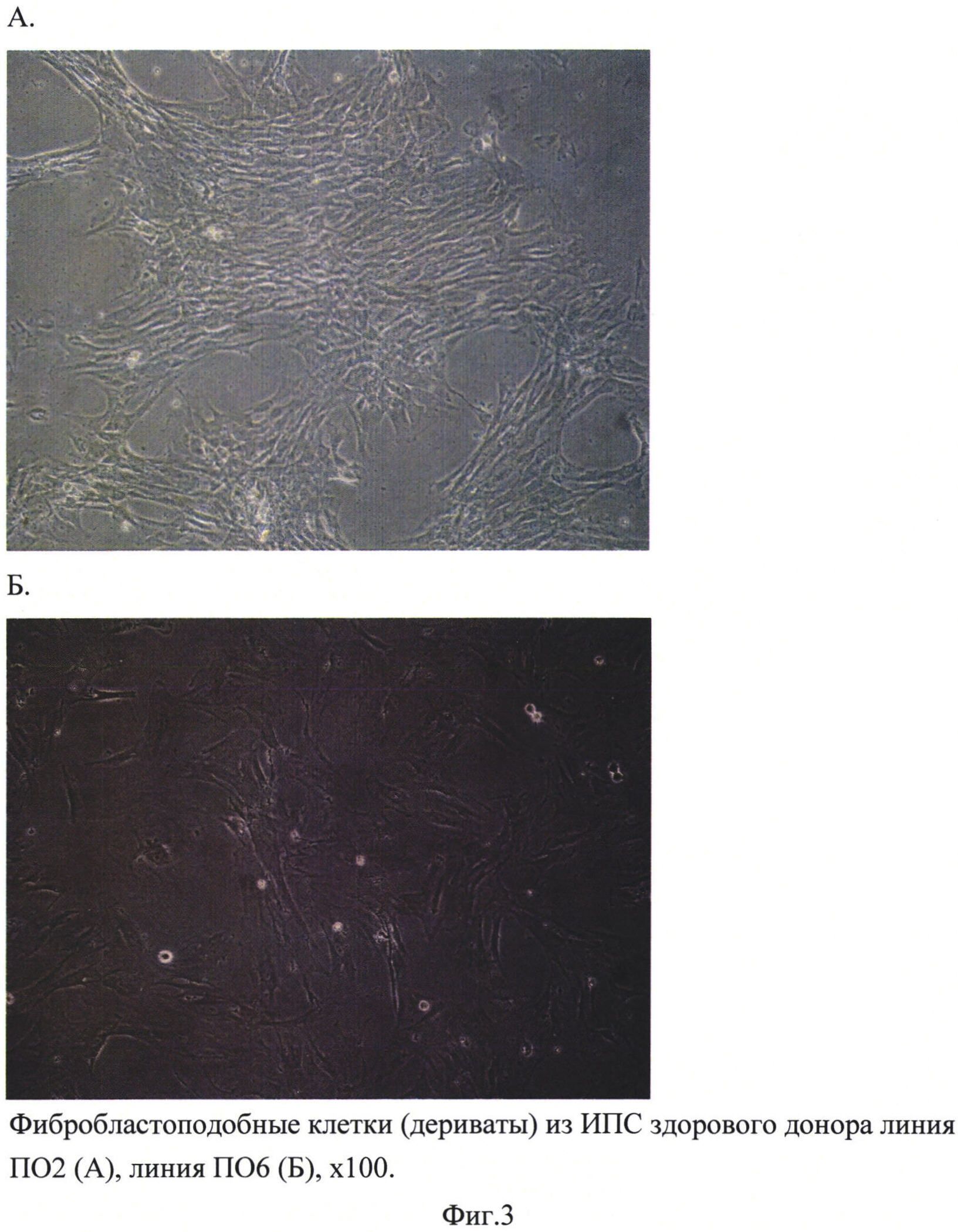
Для того чтобы при первом пересеве получить моногенную культуру из фибробластоподобных клеток, было необходимо механически отделить остатки эмбриоидного тела (на фиг. 2 выглядит как темное пятно в центре) от слоя фибробластоподобных клеток. Под микроскопом, при увеличении ×50, стерильным наконечником для автоматического дозатора на 200 мкл аккуратно отделяли остатки ЭТ и удаляли его из лунки. Клетки промывали средой DMEM пенициллин/стрептомицин (50ед.мл / 50 мкг мл) и в лунки вносили теплый (37°С) 0,05% раствор трипсина. Планшеты инкубировали 3-5 мин в СО-2-инкубаторе и пипетировали клетки в ЭТ среде до моноклеточной суспензии. Затем клетки переносили на чашку Петри (диаметр 35 мм) в 2 мл среды для ЭТ. Использовали как необработанные чашки Петри, так и покрытые матригелем и 0,1% желатином. Фибробластоподобные клетки одинаково хорошо росли на всех чашках. Через сутки делали смену среды с заменой ее на среду для роста фибробластов (среда DMEM, содержащая 10% фетальной сыворотки, 1% заменимых аминокислот, 2 мМ L-глутамин, пеницилин/стрептомицин (50ед.мл / 50 мкг мл) (фиг. 3). Все последующие смены среды и пересевы осуществляли на этой же среде для фибробластов. Через 3-4 дня по достижении монослоя клеток осуществляли пересев в соотношении 1:2 на новые чашки Петри диаметром 35 мм (фиг. 4). Как видно из фотографии, представленной на фиг. 4, полученные клетки морфологически схожи с фибробластами кожи человека. Имунноцитохимическое окрашивание антителами к AFP-alfa («abcam», ab28244) показал наличие специфического для фибробластов антигена в 100% клетках (фиг. 5).
Полученные фибробласты (фибробластоподобные клетки) были способны проходить до 20 пассажей, при этом до 10-го пассажа они сохраняли активный пролиферативный потенциал. Далее он несколько снижался, что характерно и для первичных фибробластов кожи человека.
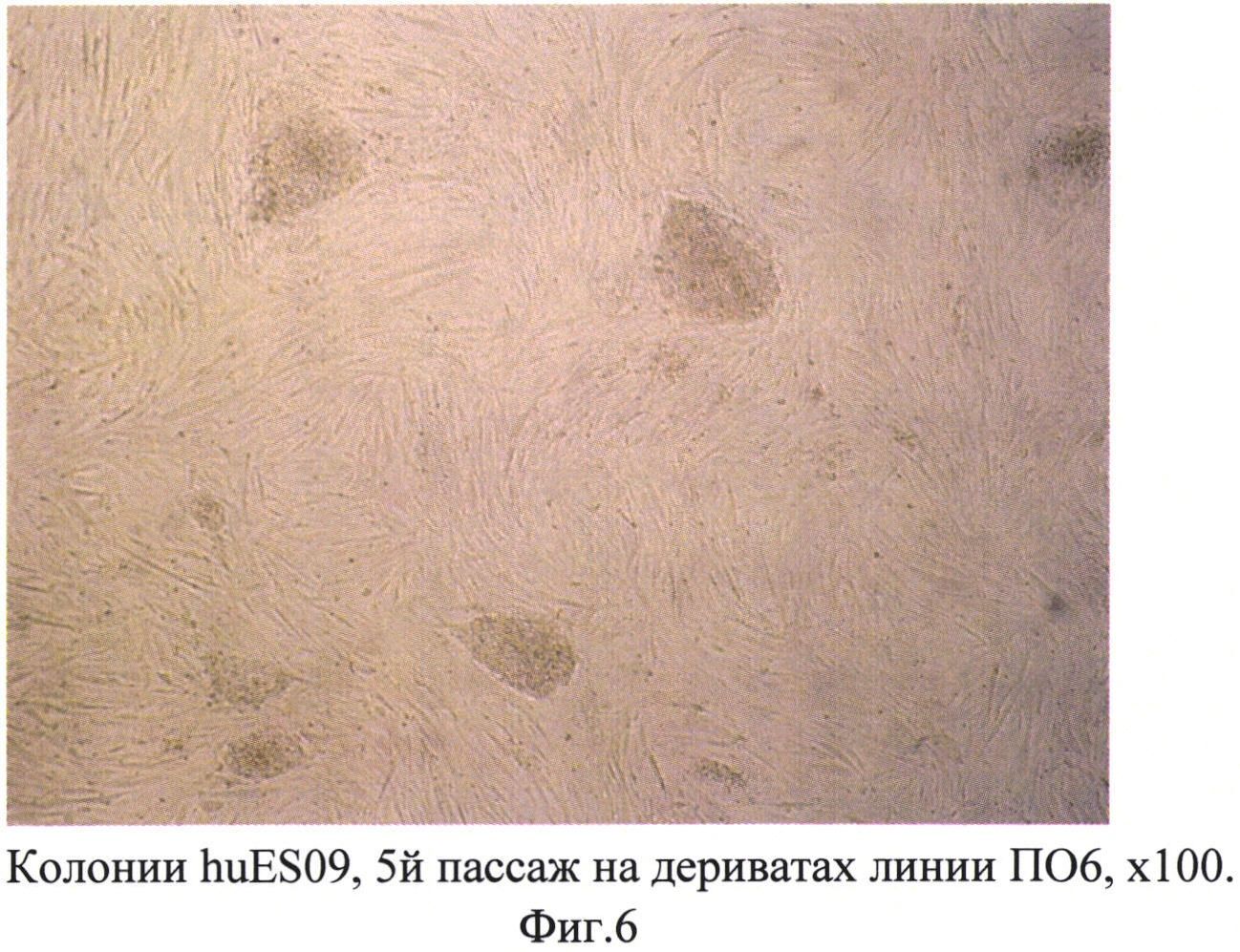
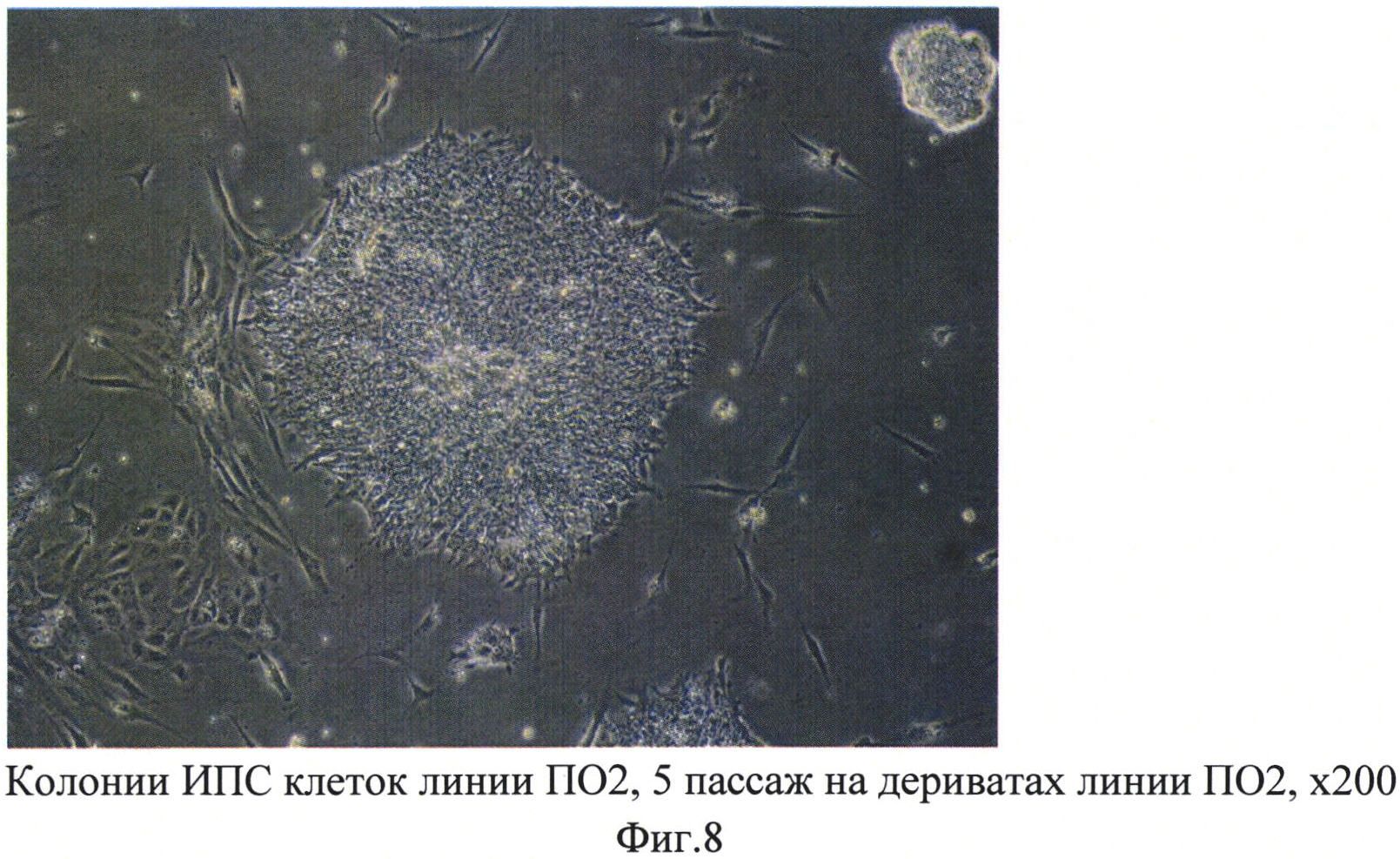
На полученных фибробластоподобных клетках (дериватах) в разных экспериментах культивировали ИПС клетки линий ПО2, Бл6, Ку15, Тр5, ПО6, а также ЭС клетки линии huES09. Для культивирования использовали среду DMEM/F12, содержащую 20% заменителя сыворотки, 2 мМ глутамин, 0,1 мМ бета-меркаптоэтанол, 1% заменимых аминокислот, пенициллин/стрептомицин (50 ед. мл / 50 мкг мл). Все 6 линий клеток успешно культивировались на фидерном слое из полученных дериватов, при этом они сохраняли морфологию недифференцированных плюрипотентных клеток даже после 3-5 пассажей (фиг. 6-8). Не было отмечено фенотипических и морфологических отличий при культивировании на дериватах, полученных из линий ПО2 и ПО6 между аутологичными ИПС клетками (дериваты из линии ПО2 - ИПС клетки линии ПО2, дериваты из линии ПО6 - ИПС клетки линии ПО6) и ИПС клетками от других доноров (дериваты из линии ПО2 - ИПС клетки линий Тр5, Бл6, Ку15; дериваты ПО6 - ИПС клетки Тр5, Бл6, Ку15). Схожий фенотип сохраняли также ЭС клетки huES09 как на дериватах ПО2, так и на ПО6.
ИПС клетки линий Тр5 и Ку15 были впоследствии перенесены на подложку из матригеля в ростовую среду mTeSr и прошли еще несколько пассажей, после чего были окрашены на меркеры плюрипотентности SSEA4 и Sox2 (фиг. 9). На линии ЭС huES09 методом ОТ-ПЦР была показана экспрессия генов Nanog, Oct4, Klf4, FoxD3, Hesx1, DPPA4, Sox. Экспрессия в ЭС клетках прошедших 5 пассажей на линии фибробластоподобных клеток, затем 4 пассажа на подложке из матригеля в среде mTeSr была сравнима с экспрессией в клетках, культивирующихся в стандартных условиях только на подложке из матригеля в среде mTeSr. (фиг. 10).
Надо отметить, что ИПС и ЭС клетки после переноса их на дериваты значительно улучшают свою морфологию, практически все колонии имеют правильную округлую форму, количество дифференцированных клеток, которые неизбежно появляются в процессе культивирования на матригеле, практически сводится к нулю.
При стандартных условиях культивирования ИПС и ЭС клеток человека с использованием подложки из матригеля и специально созданной среды mTeSr необходима ежедневная смена среды. Было показано, что при культивировании ЭС и ИПС клеток человека на полученных нами фибробластоподобных клетках смену среды можно проводить через 2-3 суток без потери этими клетками свойств плюрипотентности.
Полученные фибробластоподобные клетки можно подвергать криозамораживанию в фетальной сыворотке с 10% ДМСО, 1 час при -20°С, с последующим переносом в кельвинатор на -70°С. Для длительного хранения клетки переносятся в жидкий азот (-196°С).
Разморозка полученных дериватов.
Разморозку можно проводить двумя способами.
1. Ампулы с клетками помещаются в водяную баню на 37°С, после полной разморозки суспензия клеток переносится на чашку Петри (диаметр 35 мм) в 2 мл среды для культивирования фибробластов, через 3-4 часа после прикрепления клеток делается полная замена среды на свежую.
2. Ампулы с клетками помещаются в водяную баню на 37°С, после полной разморозки суспензия клеток переносится в 15 мл пробирку с 10 мл теплой среды DMEM, центрифугируется 5 мин, 2 тыс. об. мин. Надосадочная жидкость удаляется, клетки аккуратно ресуспендируются в ростовой среде для фибробластов и переносятся на чашку Петри (диаметр 35 мм) в 2 мл среды для культивирования фибробластов. Фибробластоподобные клетки можно размораживать как на чашки, обработанные желатином, так и на необработанные чашки Петри.
Литература
1. Takahashi К., Yamanaka S. (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, Cell, 126: 663-676.
2. Takahashi K., Tanabe K., et al. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors, Cell, 131: 861-872.
3. Nakagawa M., Koyanagi M., Tanabe K., et al. (2008) Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts, Nature Biotechnology, 26(1): 101-106.
4. Park I. - H., Arora N., Huo H., et al. (2008) Disease-specific induced pluripotent stem (iPS) cells, Cell. 134(5): 877-886.
5. Parker, G.C., Acsadi, G., Brenner, C.A. (2009) Mitochondria: determinants of stem cell fate? Stem Cells and Development, 18, 803-806.
6. Facucho-Oliveira, J.M., St John, J.C. (2009) The relationship between pluripotency and mitochondrial DNA proliferation during early embryo development and embryonic stem cell differentiation, Stem Cell Reviews and Reports, 5, 140-158.
7. Mattout, Α., Meshorer, E. (2010) Chromatin plasticity and genome organization in pluripotent embryonic stem cells, Current Opinion in Cell Biology, 22, 334-341.
8. Park, S.H., Kook, M.C, Kim, E.Y., Park, S., Lim, J. (2004) Ultra structure of human embryonic stem cells and spontaneous and retinoic acid-induced differentiating cells, Ultra structural Pathology, 28, 229-238.
9. Chambers, I., Colby, D., Robertson, M, Nichols, J., Lee, S., Tweedie, S., Smith, A. (2003) Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells, Cell, 113, 643-655.
10. Schöler, H.R., Hatzopoulos, A.K., Balling, R., Suzuki, N., Gruss, P. (1989) A family of octamer-specific proteins present during mouse embryogenesis: evidence for germlinespecific expression of an Oct factor, The EMBO Journal, 8, 2543-2550.
11. Yuan, H., Corbi, N., Basilico, C, Dailey, L. (1995) Developmental-specific activity of the FGF-4 enhancer requires the synergistic action of Sox2 and Oct-3, Genes & Development, 9, 2635-2645.
12. Hsin-Fu Chen, Ching-Yu Chuang, Yu-Kai Shieh, Hao-Wei Chang, Hong-Nerng Ho, and Hung-Chih Kuo. (2009) Novel autogenic feeders derived from human embryonic stem cells (hESCs) support an undifferentiated status of hESCs in xeno-free culture conditions, Human Reproduction, Vol. 24, No.5 pp. 1114-1125.
13. Chunhui Xu, Jianjie Jiang, Virginie Sottile, Jim McWhir, Jane Lebkowski, Melissa K. Carpentera. (2004) Immortalized Fibroblast-Like Cells Derived from Human Embryonic Stem Cells Support Undifferentiated Cell Growth, STEM CELLS, 22, 972-980.
Способ получения пациент (донор)-специфических фибробластоподобных клеток из индуцированных плюрипотентных стволовых клеток человека, включающий механическую диссоциацию кластеров ИПС клеток до моноклеточной культуры в присутствии диспазы, помещение клеточной суспензии в среду, состоящую из среды для культивирования недифференцированных ЭС клеток (mTeSr) + среды для культивирования эмбриоидных тел (ЭТ) (ЭТ среда) в соотношении 1:1, последующее получение эмбриоидных тел методом висячей капли или помещением клеток в 96-луночный круглодонный планшет, перенос трехдневных ЭТ на 24-луночную плашку, покрытую 0.1% желатином, по 1 телу на лунку в 1 мл среды для ЭТ, последующее культивирование до появления монослоя фибробластоподобных клеток через 8-10 суток с предварительным удалением остатков эмбриоидного тела.