Результат интеллектуальной деятельности: Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления
Вид РИД
Изобретение
Изобретение относится к фармакологии. Изобретение позволяет проводить оценку наличия нейропротекторных свойств у соединений, представляющих фармакологический интерес.
Одной из актуальных проблем современной фармакологии и медицины является создание эффективных и безопасных лекарственных препаратов, направленных на лечение тех или иных заболеваний. Для их создания необходимы адекватные, высокопроизводительные и воспроизводимые, а главное относительно дешевые технологии скрининга потенциальных лекарственных соединений. Разработка технологии репрограммирования соматических клеток и получения индуцированных плюрипотентных стволовых (ИПС) клеток млекопитающих, включая человека, открыла новые перспективы в трансплантологии и изучении молекулярных и клеточных основ тяжелых болезней человека in vitro [1, 2]. Не случайно, что именно за эти работы («за открытие возможности репрограммирования дифференцированных клеток в плюрипотентные») японскому ученому Синья Яманака была присуждена Нобелевская премия по физиологии и медицине за 2012 г. Развитие технологии репрограммирования соматических клеток человека в ИПС клетки открывает новые возможности для создания моделей ряда тяжелых патологий человека, в том числе нейродегенеративных, а также тест-систем, позволяющих проводить масштабный скрининг и выяснять свойства лекарственных средств, направленных на лечение конкретных заболеваний in vitro, учитывая при этом индивидуальные особенности пациента [3, 4]. Тот факт, что технология репрограммирования позволяет получать ИПС клетки из индивидуальных дифференцированных соматических клеток больных и здоровых пациентов, дает ей существенные преимущества перед технологией эмбриональных стволовых клеток, что, в свою очередь, открывает большие перспективы в развитии персонализированной медицины [5, 6]. Развитие такой технологии позволит существенным образом сократить эксперименты по тестированию перспективных для фармакологии соединений на клетках животных, проводя их сразу на клетках человека. Возможность дифференцировки ИПС клеток в кардиомиоциты, гепатоциты, фибробласты и нейроны позволит проводить прицельный доклинический скрининг соединений на кардиопротекторную, гепатопротекторную и нейропротекторную активность in vitro [7, 8].
Известны первичные культуры нервных и глиальных клеток, полученных из мозга крысы, которые используются для скрининга соединений на наличие нейропротекторной активности [9]. При этом результаты, полученные на животных моделях, не всегда воспроизводятся на человеке. С другой стороны, невозможно получать нервные клетки из мозга взрослого человека в достаточных количествах для проведения скрининга фармакологических соединений. И, к тому же, нейроны из мозга взрослого человека не способны к росту в культуре in vitro.
Известны индуцированные плюрипотентные стволовые клетки, полученные из фибробластов кожи человека, которые используются для оценки цито- и эмбриотоксических свойств фармакологических соединений [10]. В данной заявке идет речь о недифференцированных ИПС клетках и их производных в виде эмбриоидных тел и производных трех зародышевых листков.
Таким образом, создание адекватной модели для изучения нейродегенеративных заболеваний у человека и оценка нейропротекторных свойств различных соединений с целью создания на их основе эффективных лекарственных средств для лечения этих заболеваний, является в настоящее время чрезвычайно актуальной.
С целью устранения указанных выше недостатков предлагается:
1. Способ оценки нейропротекторных свойств веществ in vitro, с использованием тест-системы, содержащей дифференцированные в нейрональном направлении индуцированные плюрипотентные стволовые клетки (ИПС) человека, включающий этап репрограммирования фибробластов кожи человека в ИПС клеток, после чего ИПС клетки неоднократно помещают в культуральную среду, обеспечивающую их дифференцировку в нейрональном направлении и формирование на них дофаминергических нейронов, полученную тест-систему подвергают повреждающему воздействию в присутствии исследуемых веществ и по результатам выживаемости клеток оценивают их протекторное действие.
2. Способ по п. 1, отличающийся тем, что ИПС клетки помещают в среду DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% N2 («Life Technologies», США), 10 мкМ SB431542 («Stemgent», США), 80 нг Noggin («Peprotech», США).
3. Способ по п. 2, отличающийся тем, что смену среды осуществляют ежедневно в течение 7-10 дней, сформированные нейрональные розетки и гребни механически отделяют и переносят в 24-луночный плашет с предельно низкой адгезией («Costar», США), где впоследствии формировались нейросферы, которые еще 5-7 дней культивируют в планшете, нейросферы собирают в центрифужные пробирки, диссоциируют до моноклеточной суспензии с помощью трипсина (0.25%) и высевают на чашки Петри, покрытые матригелем, и получают культуру нейрональных предшественников.
4. Способ по п. 3, отличающийся тем, что далее полученную культуру нейрональных предшественников культивируют до плотного монослоя и рассевают 1:4 или 1:5 на новые чашки Петри 35 мм, покрытые матригелем.
5. Способ по п. 4, отличающийся тем, что полученные нейрональные предшественники культивируют 10 дней в среде для нейрональных предшественников: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 100 нг/мл Shh (PeproTech), 20 нг/мл FGF8 (PeproTech) и 2 мкМ пуроморфамин (Stemgent), далее еще 14 дней в среде для созревания: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 20 нг/мл BDNF (PeproTech), 20 нг/мл GDNF (PeproTech), 200 мкМ аскорбиновая кислота, 5 мкМ форсколин (Stemgent).
6. Способ по п. 5, отличающийся тем, что смену среды осуществляют каждые 48 часов впервые дни культивирования и далее каждые 24 часа, дифференцировку проводят в течение 24-32 дней.
7. Способ по п. 1, отличающийся тем, что тестируемое соединение добавляют однократно в объеме 100 мкл за сутки до повреждающего воздействия в виде окислительного стресса.
8. Способ по п. 1, отличающийся тем, что тестируемое соединение добавляют однократно в объеме 100 мкл за 40 мин до повреждающего воздействия в виде добавления перекиси водорода.
9. Способ по п. 1, отличающийся тем, что оценку выживаемости нейронов проводят через 24 часа после повреждающего воздействия в виде добавления перекиси водорода.
10. Способ по пп. 1-9, отличающийся тем, что культивирование всех используемых в работе клеток проводят в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% СО2 и 95% воздуха.
11. Способ по пп. 1-10, отличающийся тем, что для оценки нейропротекторных свойств веществ in vitro индуцированные плюрипотентные стволовые клетки неоднократно помещают в культуральную среду, обеспечивающую их дифференцировку в нейрональном направлении и формирование дофаминергических нейронов.
12. Способ по п. 11, отличающийся тем, что индуцированные плюрипотентные стволовые клетки помещают в среду DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement N2 («Life Technologies», США), 10 мкМ SB431542 («Stemgent», США), 80 нг Noggin («Peprotech», США).
13. Способ по п. 12, отличающийся тем, что смену среды осуществляют ежедневно в течение 7-10 дней, сформированные нейрональные розетки и гребни механически отделяют и переносят в 24-луночный плашет с предельно низкой адгезией («Costar», США), где впоследствии формировались нейросферы, которые еще 5-7 дней культивируют в планшете, нейросферы собирают в центрифужные пробирки, диссоциируют до моноклеточной суспензии с помощью трипсина (0.25%) и высевают на чашки Петри, покрытые матригелем.
14. Способ по п. 13, отличающийся тем, что далее полученную культуру нейрональных предшественников культивируют до плотного монослоя и рассевают 1:4 или 1:5 на новые чашки Петри 35 мм, покрытые матригелем.
15. Способ по п. 14, отличающийся тем, что полученные нейрональные предшественники культивируют 10 дней в среде для нейрональных предшественников: DMEM/F12, 2% заменитель сыворотки («Gibco)), США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 100 нг/мл Shh (PeproTech), 20 нг/мл FGF8 (PeproTech) и 2 мкМ пуроморфамин (Stemgent), далее еще 14 дней в среде для созревания: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 20 нг/мл BDNF (PeproTech), 20 нг/мл GDNF, до полной зрелости полученных нейронов.
16. Способ по п. 15, отличающийся тем, что смену среды осуществляют каждые 48 часов в первые дни культивирования и далее каждые 24 часа, дифференцировку проводят в течение 24-32 дней.
17. Способ по пп. 11-16, отличающийся тем, что культивирование всех используемых в работе клеток проводят в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% CO2 и 95% воздуха.
Техническим результатом, достигаемым при реализации настоящего изобретения, является поиск и ускорение тестирования соединений, представляющих фармакологический интерес, на наличие нейропротекторной активности или соответственно нейротоксической активности, а также получение более точной информации относительно степени активности тестируемых соединений. Указанный технический результат достигается за счет использования дифференцированных в нейрональном направлении ИПС клеток, полученных репрограммированием фибробластов кожи человека в ИПС клетки, после чего ИПС клетки помещают в культуральную среду, обеспечивающую дифференцировку ИПС клеток в нейрональном направлении с формированием нейронов определенной ергичности, в частности дофаминергических нейронов, что особенно важно в случае болезни Паркинсона, для которой доказана избирательная гибель именно нейронов этого типа в определенных отделах мозга.
Определение терминов
Под культурой ИПС клеток понимается клеточная культура, полученная репрограммированием фибробластов кожи взрослого человека по описанной ранее методике [1, 2, 11].
Под культурой дифференцированных в нейрональном направлении ИПС клеток понимается клеточная культура, содержащая до 90% нейронов, которые детектируются иммуноцитохимически.
Под нейропротекцией понимается способность тестируемого соединения замедлять или предотвращать гибель нервных клеток по сравнению с контролем (без добавления тестируемого соединения).
Под нейротоксичностью понимается способность тестируемого соединения вызывать или ускорять гибель нервных клеток по сравнению с контролем (без добавления тестируемого соединения)
Примеры собственных экспериментов
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1. Получение репрограммированных клеток, а именно ИПС клеток из фибробластов кожи взрослого донора.
Фибробласты кожи взрослого донора были разморожены и в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% CO2 и 95% воздуха, посеяны на лунки 12-луночного планшета с плотностью 30% монослоя в среде: DMEM («ПанЭко», РФ), пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 2 мМ L-глутамин, 10% эмбриональная телячья сыворотка («HyClone», США), 2 нг/мкл bFGF («Peprotech», США). Через 2 дня после рассева клетки достигли плотности 60% монослоя и в этот момент они были инфицированы четырьмя вирусами в следующем количестве LeGO-hOct4 - MOI 5, LeGO-hSox2 - MOI 5, LeGO-hc-Myc - MOI 2.5, LeGO-hKlf4-MOI 5. Через 4 дня клетки были пересеяны на новые чашки Петри 1:22,5 в среде DMEM («ПанЭко», РФ), пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 2 мМ L-глутамин, 10% эмбриональная телячья сыворотка («HyClone», США). На следующий день среда была заменена на среду mTeSR1. Затем клетки культивировали в этой среде в течение 8-10 дней, среду меняли раз в 2 дня. К этому моменту на чашках образовалось множество клонов с различной морфологией. Эти клоны были механически пересеяны 1:1 на матригель в среде mTeSR1 («STEM CELL Technologies», США). Через несколько дней некоторые из колоний стали расти и морфологически становиться более похожими на эмбриональные стволовые клетки, другие же дифференцировались и перестали расти.
Через неделю был произведен отбор клонов на 24-луночный планшет, покрытый матригелем («BD Biosciences», США), в среде mTeSR1 было посеяно 15 различных клонов, после чего их культивировали раздельно. В итоге 6 клонов показали способность к стабильному росту на подложке матригель в среде mTeSR1. Два клона были использованы для дальнейшей работы, оставшиеся заморожены в жидком азоте. Все полученные клоны ИПС клеток методом иммуноцитохимического анализа были исследованы на маркеры плюрипотентности, на способность формировать эмбриоидные тела и давать начало трем зародышевым листкам (эктодерме, мезодерме, энтодерме).
Пример 2. Получение нейрональных предшественников из ИПС клеток.
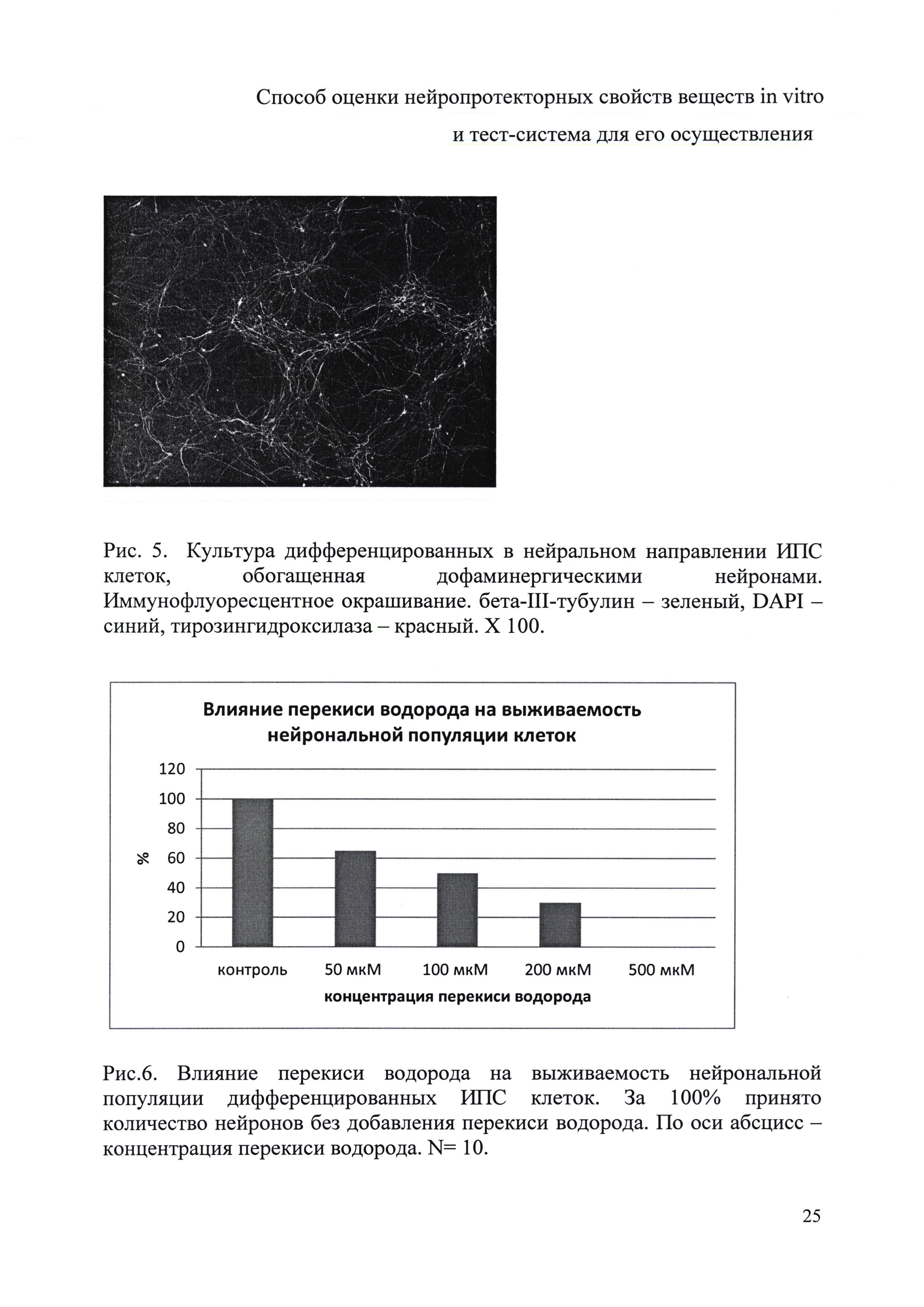
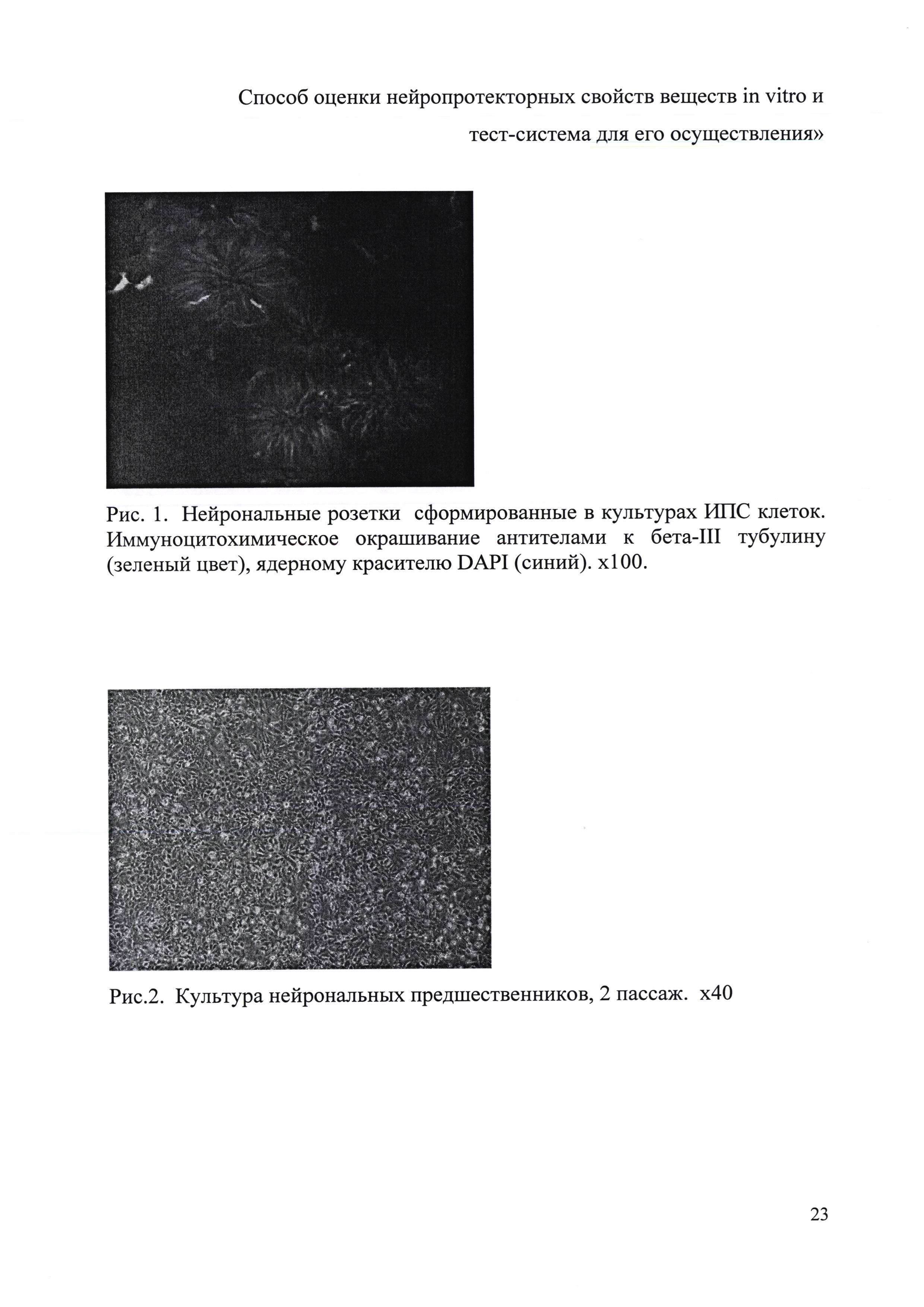
После достижения ИПС клетками 50-60% монослоя делали смену среды на нейрональную DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement N2 («Life Technologies», США), 10 мкМ SB431542 («Stemgent», США), 80 нг Noggin («Peprotech», США). Инкубацию проводили в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% СО2 и 95% воздуха. Смена среды осуществлялась ежедневно в течение 7-10 дней. За это время происходило образование нейрональных розеток и гребней (рис. 1).
Сформированные нейрональные розетки и гребни механически отделяли и переносили в 24-луночный плашет с предельно низкой адгезией («Costar», США), где впоследствии формировались нейросферы, которые еще 5-7 дней культивировали в планшете.
Нейросферы собирали в центрифужные пробирки, диссоциировали до моноклеточной суспензии с помощью трипсина (0.25%) и высевали на чашки Петри, покрытые матригелем, в нейрональную среду DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement N2 («Life Technologies)), США), 10 мкМ SB431542(«Stemgent», США), 80 нг Noggin («Peprotech», США). Далее полученную культуру нейрональных предшественников культивировали до плотного монослоя (рис. 2) и рассевали 1:4 или 1:5 на новые чашки Петри 35 мм, покрытые матригелем. Пассирование нейрональных предшественников осуществляли каждые 3-5 дней, в зависимости от плотности посева. Нейрональные предшественники имеют высокую пролиферативную активность, за 2-3 пассирования наращивается большое количество клеток, которые успешно подвергаются криоконсервации и хранению в жидком азоте, с высоким процентом (от 50 до 70%) выхода живых клеток из заморозки. При дальнейшей направленной дифференцировке нейрональных предшественников после 8 пассажа пролиферативная активность клеток существенно снижалась и начиналось формирование сети нейритов (рис. 3).
Пример 3. Дифференцировка нейрональных предшественников в культуры зрелых нейронов, обогащенных дофаминергическими нейронами.
Полученные нейрональные предшественники культивировали в CO2-инкубаторе при 37°С в атмосфере, содержащей 5% CO2 и 95% воздуха в среде DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США). Для получения терминально дифференцированных дофаминергических нейронов клетки рассевали в количестве 200 тыс./см2 на чашки Петри, покрытые матригелем. На следующий день делали смену среды на среду для нейрональных предшественников: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 100 нг/мл Shh («PeproTech», США), 20 нг/мл FGF8 («PeproTech», США) и 2 мкМ пуроморфамин («Stemgent», США). Клетки культивировали в течение 10 дней, смену среды осуществляли каждые 48 часов. На 11 сутки культивирования нейрональную среду заменяли на среду для созревания: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 20 нг/мл BDNF («PeproTech», США), 20 нг/мл GDNF («PeproTech», США), 200 мкМ аскорбиновой кислоты, 5 мкМ форсколина («Stemgent», США). Клетки культивировали еще 14 дней до полной зрелости нейронов. Смену среды осуществляли каждые 48 часов в первые дни культивирования и далее каждые 24 часа.
В результате разработанной методики была получена морфологически гомогенная популяция нейрональных клеток, в которой не менее 90% клеток окрашивались антителами к нейрон-специфическому белку бета-III-тубулину (рис. 4). Более того, согласно разработанной модели были получены нейрональные культуры, обогащенные дофаминергическими нейронами (рис. 5), что особенно важно в случае болезни Паркинсона, для которой доказана избирательная гибель именно нейронов этого типа в определенных отделах мозга. В качестве маркера дофаминергических нейронов использовались антитела к ферменту синтеза катехоламинов-тирозингидроксилазе.
Пример 4. Оценка нейропротекторных эффектов исследуемых соединений в культурах дифференцированных в нейрональном направлении ИПС клеток.
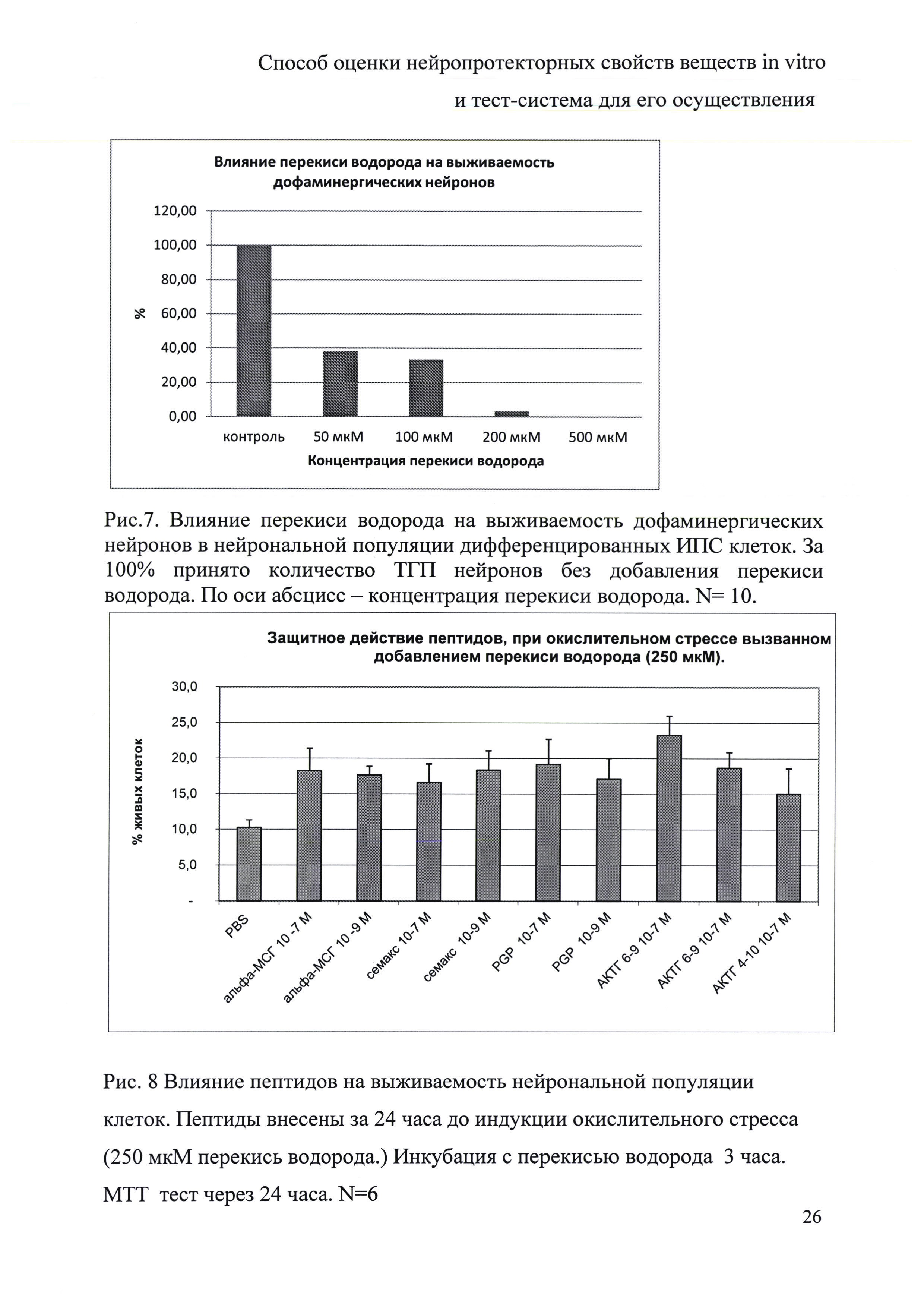
Модель цитотоксического повреждения нейронов с применением перекиси водорода. Для создания модели цитотоксического повреждения нейронов, полученных при дифференцировке ИПС клеток, был использован подход с применением перекиси водорода. Подбор концентраций перекиси водорода, оказывающих токсическое действие на клетки, проводили на нейронах, полученных от здорового донора. В этом случае нейрональные предшественники культивировали в присутствии соответствующих факторов дифференцировки в течение 24 суток. Перекись водорода в широком диапазоне концентраций (50-500 мкМ) вносили одновременно со сменой среды и клетки инкубировали 24 ч. Затем клетки фиксировали 4% параформальдегидом и окрашивали специфическими антителами против бета-III-тубулина. Было показано, что перекись водорода в концентрации 50 мкм существенно снижает количество тубулин положительных клеток, в концентрации 200 мкм гибель клеток составила более 50%, при 500 мкм все клетки погибали (рис. 6).
В аналогичных экспериментах исследование гибели дофаминергических нейронов (ТГП нейроны) в дифференцированных культурах ИПС клеток выявило более существенную чувствительность этих клеток к действию перекиси. Так, было показано, что перекись водорода в концентрации 50 мкМ убивает около 60% клеток, а при 200 мкМ живыми оставались менее 5% клеток (рис. 7).
Таким образом, установлен важный факт разной чувствительности дифференцированных в нейральном направлении ИПС клеток к такому цитотоксическому соединению, как перекись водорода. В дальнейшем, разработанная модель позволяет проводить скрининг соединений на наличие нейропротекторной активности как для общей нейрональной популяции, так и для нейронов определенной ергичности.
Оценка нейропротекторных эффектов исследуемых соединений на модели цитотоксического повреждения нейронов с применением перекиси водорода. Добавление тестируемых соединений в объеме 100 мкл за 24 ч до внесения перекиси водорода.
Для этого нейрональные предшественники, прошедшие 1 этап дифференцировки (культивирование в течение 10 дней, в присутствии 100 нг/мл Shh, 20 нг/мл FGF8 и 2 мкМ пуроморфамин) высевали по 20 тыс. клеток в 100 мкл нейрональной среды (DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 100 нг/мл Shh (PeproTech), 20 нг/мл FGF8 («PeproTech», США) и 2 мкМ пуроморфамин («Stemgent», США) на лунку 96-луночной плашки, покрытой матригелем. Через 24 часа среду заменяли на среду для созревания: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 20 нг/мл BDNF («PeproTech», США), 20 нг/мл GDNF («PeproTech», США), 200 мкМ аскорбиновая кислота, 5 мкМ форсколина («Stemgent», США). Клетки культивировали еще 7-14 дней. За 24 ч до внесения перекиси водорода делали смену среды в объеме 100 мкл с соответствующими пептидами (тестируемыми соединениями) до конечных концентраций 10-7 М и 10-9 М. Через 24 часа делали смену среды с добавлением перекиси водорода до конечной концентрации 250 мкМ. Клетки инкубировали 3 часа, после чего делали полную смену среды на ростовую (DMEM/F12, 2% заменитель сыворотки, 1 мМ заменимые аминокислоты, 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27, 20 нг/мл BDNF, 20 нг/мл GDNF, 200 мкМ аскорбиновой кислоты, 5 мкМ форсколина). Через 24 часа определяли количество жизнеспособных клеток. Оптическую плотность измеряли на приборе Metertech ∑960. Полученные результаты представлены на рис. 8.
АКТГ (6-9), Семакс и альфа-МСГ увеличивали число выживших клеток при воздействии перекиси водорода, то есть обладали нейропротекторным эффектом.
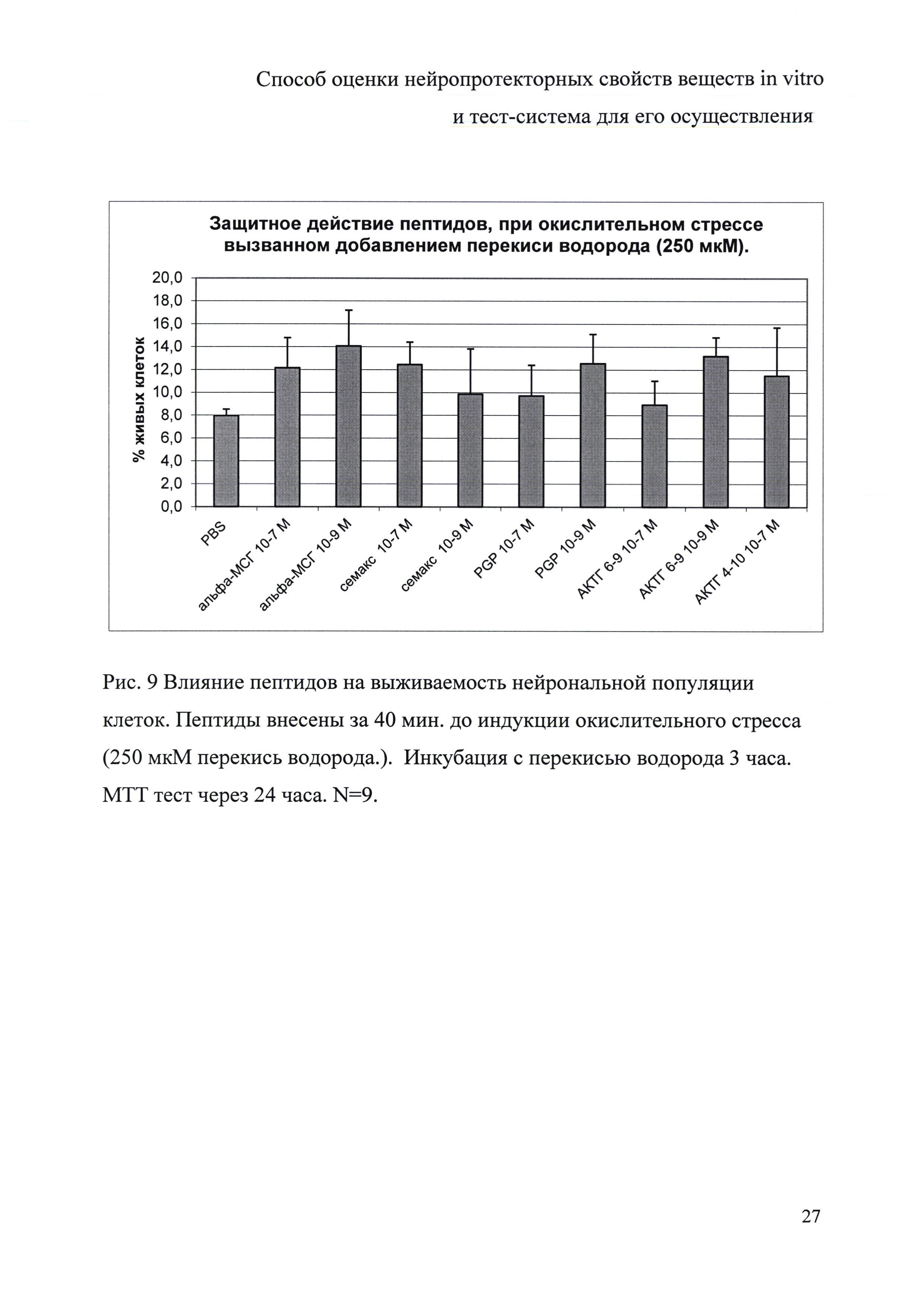
Оценка нейропротекторных эффектов исследуемых соединений на модели цитотоксического повреждения нейронов с применением перекиси водорода. Добавление тестируемых соединений в объеме 100 мкл за 40 мин до внесения перекиси водорода.
Для этого нейрональные предшественники, прошедшие 1 этап дифференцировки (культивирование в течение 10 дней, в присутствии 100 нг/мл Shh, 20 нг/мл FGF8 и 2 мкМ пуроморфамин) высевали по 20 тыс. клеток в 100 мкл нейрональной среды (DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 100 нг/мл Shh («PeproTech», США), 20 нг/мл FGF8 («PeproTech»», США) и 2 мкМ пуроморфамин («Stemgent», США) на лунку 96-луночной плашки, покрытой матригелем. Через 24 часа среду заменяли на среду для созревания: DMEM/F12, 2% заменитель сыворотки («Gibco», США), 1 мМ заменимые аминокислоты («ПанЭко», РФ), 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27 («Life Technologies», США), 20 нг/мл BDNF («PeproTech», США), 20 нг/мл GDNF («PeproTech», США), 200 мкМ аскорбиновой кислоты, 5 мкМ форсколина («Stemgent», США). Клетки культивировали еще 7-14 дней. За 40 минут до внесения перекиси водорода делали смену среды (100 мкл) с соответствующими пептидами до конечных концентраций 10-7 М и 10-9 М. Через 40 мин вносили еще 100 мкл среды с перекисью водорода до конечной ее концентрации 250 мкМ. Клетки инкубировали 3 часа, после чего делали полную смену среды на ростовую (DMEM/F12, 2% заменитель сыворотки, 1 мМ заменимые аминокислоты, 2 мМ L-глутамин, пенициллин-стрептомицин (50 ЕД/мл; 50 мкг/мл), 1% supplement В27, 20 нг/мл BDNF, 20 нг/мл GDNF, 200 мкМ аскорбиновой кислоты, 5 мкМ форсколина). Через 24 часа определяли количество жизнеспособных клеток. Оптическую плотность измеряли на приборе Metertech ∑960.
Полученные результаты представлены на рис. 9. Было показано, что АКТГ (6-9), Семакс и альфа-МСГ увеличивали число выживших клеток при воздействии перекиси водорода, то есть обладали нейропротекторным эффектом.
Оценка нейропротекторных эффектов исследуемых соединений на модели цитотоксического повреждения нейронов при кратковременном действии (30 мин) перекиси водорода. Добавление тестируемых соединений в объеме 100 мкл в течение 7 дней до внесения перекиси водорода.
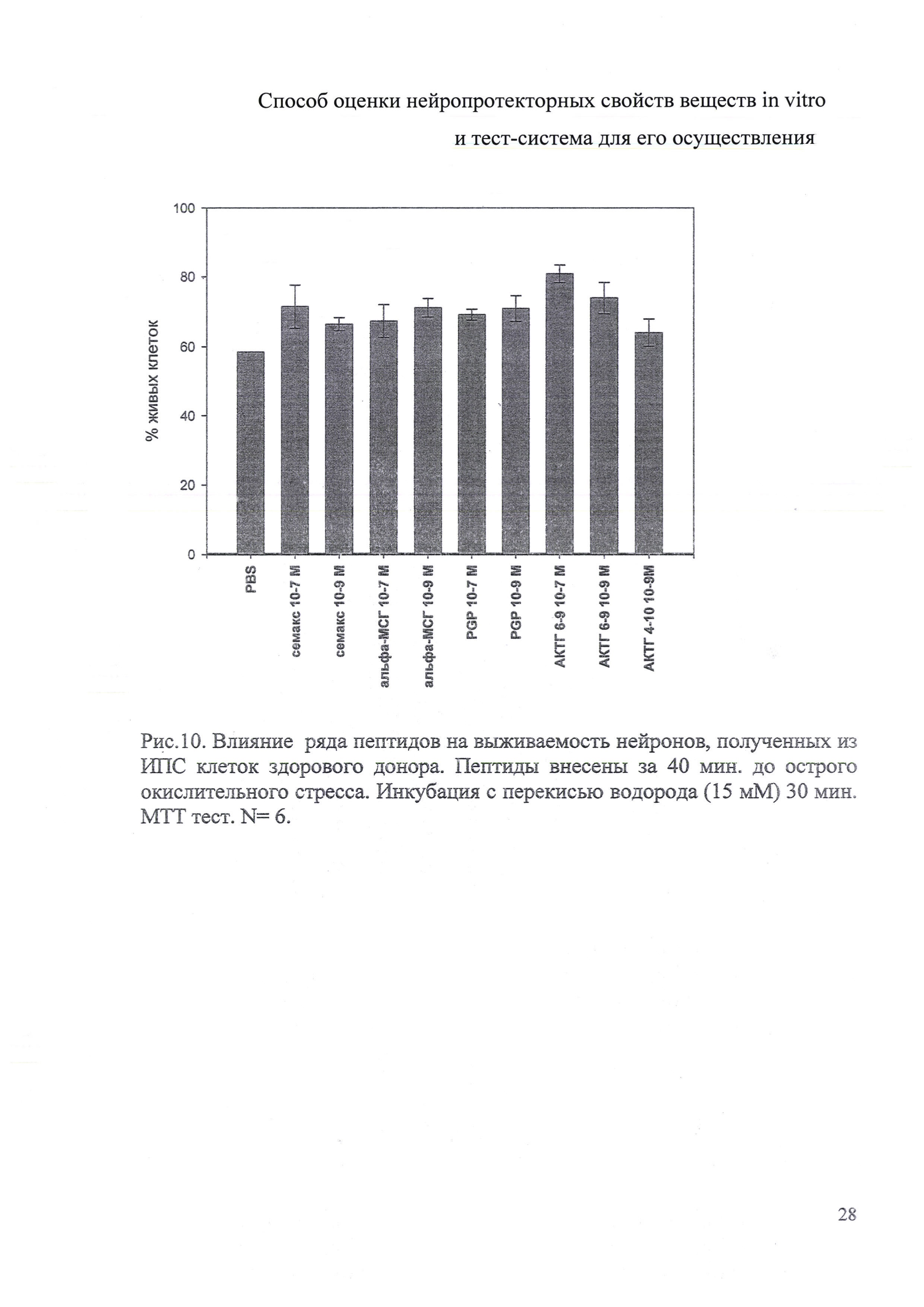
На данном этапе работы исследовали действие ряда пептидных соединений на жизнеспособность нейронов при кратковременном воздействии перекиси водорода. Для этого нейрональные предшественники, прошедшие 1-й этап дифференцировки в течение 10 дней в присутствии таких факторов, как FGF8, Shh, Puromorfamin, были рассеяны на 96-луночный планшеты по 40 тыс./лунку в 100 мкл среды. Клетки культивировали еще 7 дней с пептидами и факторами второго этапа дифференцировки - BDNF, GDNF, аскорбиновая кислота, форсколин. На 8 сутки культивирования осуществляли полную смену среды, добавляли перекись водорода (15 мМ), инкубировали 30 минут, затем опять полностью заменяли среду и проводили МТТ тест для определения количества живых клеток. Данные этих экспериментов представлены на рис. 10. АКТГ 6-9, Семакс увеличивали число выживших клеток при кратковременном действии высоких концентраций перекиси водорода на 15-30%, то есть обладали нейропротекторным эффектом.
Литература
1. Takahashi, K., Yamanaka, S. (2006) Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors, Cell, 126, 663-676.
2. Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, Т., Tomoda, K., Yamanaka, S. (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors, Cell, 131, 861-872.
3. Лебедева O.C., Лагарькова M.A., Гривенников И.А. Индуцированные плюрипотентные стволовые клетки: получение и перспективы применения. В Сборнике «Стволовые клетки и регенеративная медицина» 2011, 304-318. МАКС Пресс, ISBN 978-5-317-03583-9.
4. Е.В. Новосадова, И.А. Гривенников. Индуцированные плюрипотентные стволовые клетки: от получения до применения в биохимических и биомедицинских исследованиях. Успехи биологической химии. (2014), 54, 3-38.
5. Grskovic, М., Javaherian, A., Strulovici, В., Daley, G.Q. (2011) Induced pluripotent stem cells-opportunities for disease modeling and drug discovery, Nature Reviews Drug Discovery, 10, 915-929.
6. Mackay-Sim, A. (2013) Patient-derived stem cells: pathways to drug discovery for brain diseases, Frontiers in Cellular Neuroscience, 7, Article 29, 1-10.
7. Maury, Y., Gauthier, M., Peschanski, M., Martinat, C. (2012) Human pluripotent stem cells for disease modelling and drug screening, Bioessays, 34, 61-71.
8. Гривенников И.А. (2008) Эмбриональные стволовые клетки и проблема направленной дифференцировки, Успехи биологической химии, 48, 181-220.
9. Гривенников И.А., О.В. Долотов, Н.Ф. Мясоедов. «Способ скрининга фармакологических соединений на нейропротекторную активность». Патент РФ №2383615. Зарегистрирован в Государственном реестре изобретений РФ 10.03.2010 г. Приоритет от 12 марта 2009 г.
10. Е.В. Новосадова, Л.А. Андреева, Е.Л. Арсеньева, И.А. Гривенников, С.Н. Иллариошкин, О.С. Лебедева, И.В. Макарова, Е.С. Мануйлова, Н.Ф. Мясоедов, В.З. Тарантул. «Применение индуцированных плюрипотентных стволовых клеток человека для оценки цито- и эмбриотоксических свойств фармакологических соединений». Заявка на патент от 10.09.2015 г. рег. №2015138572.
11. Гривенников И.А., О.С. Лебедева, Е.В. Новосадова, С.Л. Киселев, М.А. Лагарькова, С.Н. Иллариошкин, С.А. Клюшников. «Способ получения индуцированных плюрипотентных стволовых клеток из фибробластов пациентов с болезнью Гентингтона». Патент №2458983. Зарегистрирован в Государственном реестре изобретений РФ 20 августа 2012 г. Приоритет от 18 июля 2011 г.