Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ КОЛИЧЕСТВА И РАЗМЕРОВ ГРУППОВЫХ ЛИМФОИДНЫХ ФОЛЛИКУЛОВ ТОНКОГО КИШЕЧНИКА У МЫШЕЙ
Вид РИД
Изобретение
Изобретение относится к области ветеринарии и медицины, в частности к морфологии и иммунологии, и может быть использовано для оценки функционального состояния групповых лимфоидных фолликулов тонкого кишечника у лабораторных мышей.
Одними из самых распространенных экспериментальных животных являются лабораторные мыши. Их используют в микробиологии, генетике, общей физиологии, иммунологии, эндокринологии и фармакологии (Лопухин Ю.М. Экспериментальная хирургия / Ю.М. Лопухин. - М.: Медицина, 1971. - 360 с., Шуркалин Б.К. Руководство по экспериментальной хирургии / Б.К. Шуркалин, В.А. Горский, А.П. Фаллер. - М.: Медицина, 2010. - 174 с.).
В связи с широким использованием мышей в экспериментальных исследованиях существует потребность в детальном изучении иммунной системы этих животных. В частности, особый интерес представляет лимфоидная ткань, ассоциированная со слизистыми оболочками (mucosa-associated lymphoid tissue - MALT), в которой особенно велика антигенная нагрузка. Групповым лимфоидным фолликулам (пейеровым бляшкам), входящим в состав MALT, отводится важнейшая функция, которая заключается в транспорте антигенов из просвета кишечника посредством уникальных морфологических структур - М-клеточных карманов. Оценка количества и размеров этих образований позволяет изучать состояние лимфатического аппарата кишечника как в норме, так и при патологических состояниях, а также позволяет понять функциональную значимость морфологических изменений в этих структурах.
Однако в силу миниатюрных размеров мышей выявление групповых лимфоидных фолликулов тонкого кишечника затруднено. При определенных условиях, например при гиперемии кишечника, наличии химуса определенного цвета, желчи или пузырьков газа в кишечнике, сложно определить границы пейеровых бляшек. Можно ошибочно принять изменения цвета участка кишки за лимфоидные образования либо не заметить некоторые из них вовсе. Количество ошибок также увеличивается при плохом зрении исследователя и при его утомлении во время обработки больших объемов материала, поскольку работа с миниатюрными плохо различимыми объектами требует значительного зрительного напряжения. Добиться улучшения визуализации пейеровых бляшек и снижения числа ошибок при их подсчете и измерении можно при помощи окрашивания.
Известен способ выявления морфологических особенностей лимфоидных образований тонкой кишки при окраске нативного препарата (Кащенко С.А. Выявление морфологических особенностей лимфоидных образований тонкой кишки при окраске нативного препарата / С.А. Кащенко, Е.Н. Морозова// Мир медицины и биологии, 2011 - Т. VII - №1 - С. 27-29), при котором на слизистую оболочку тонкой кишки наносят натуральные соки вишни и черной смородины. Затем промывают поверхность слизистой оболочки и погружают кишку в дистиллированную воду. Учет пейеровых бляшек проводят в погруженном в воду органе.
К недостаткам данного способа можно отнести сложности его применения у мышей. Прежде всего это обусловлено миниатюрными размерами органов этих животных. Вскрытие, расправление, промывание, погружение в воду кишки мыши неизбежно приведет к повреждению и изменению структуры органа, сделает его непригодным для гистологических исследований.
Наиболее близким решением, принятым за прототип, является известный способ исследования прямой кишки, включающий использование в качестве контрастного вещества туши (патент РФ №2004195, кл. А61В 17/00, А61В 6/00, от 14.02.1987).
Недостатком данного способа является отсутствие сведений о возможности контрастирования тушью групповых лимфоидных фолликулов тонкого кишечника у мелких лабораторных животных.
Задачей является создание способа, позволяющего с высокой точностью выявлять групповые лимфоидные фолликулы у таких миниатюрных объектов исследования как мыши, при этом не изменяя грубо структуру органа и обеспечивая его пригодность для дальнейшего гистологического исследования.
Сущность изобретения заключается в том, что в способе оценки количества и размеров групповых лимфоидных фолликулов тонкого кишечника у мышей, включающем контрастирование тонкого кишечника, использование в качестве контрастного вещества туши, согласно изобретению, лабораторным мышам внутрижелудочно вводят контрастное вещество в количестве 0,04-0,06 мл на 1 г массы тела животного с М-холиноблокатором атропина сульфатом в количестве 0,005-0,01 мг, оценку количества и размеров пейеровых бляшек проводят через 65-75 минут в ходе вскрытия.
Изобретение поясняется чертежами. На всех фигурах расстояние между линиями квадратных ячеек фона соответствует 1 см.
На фиг. 1 изображены желудок и кишечник. Тонкий отдел кишечника и желудок заполнены черной тушью.
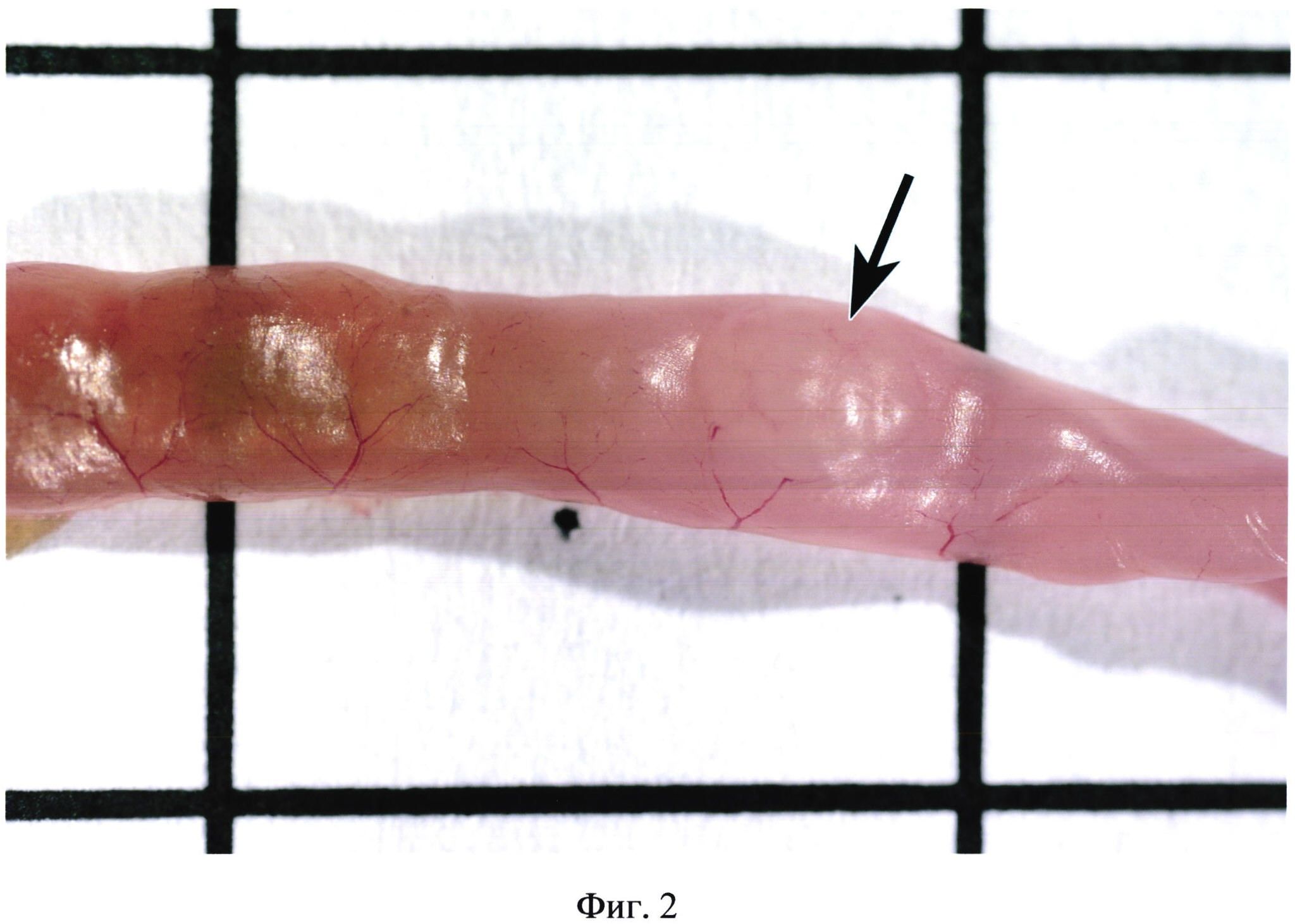
На фиг. 2 изображена пейерова бляшка (указана стрелкой) без контрастирования (интактное животное).
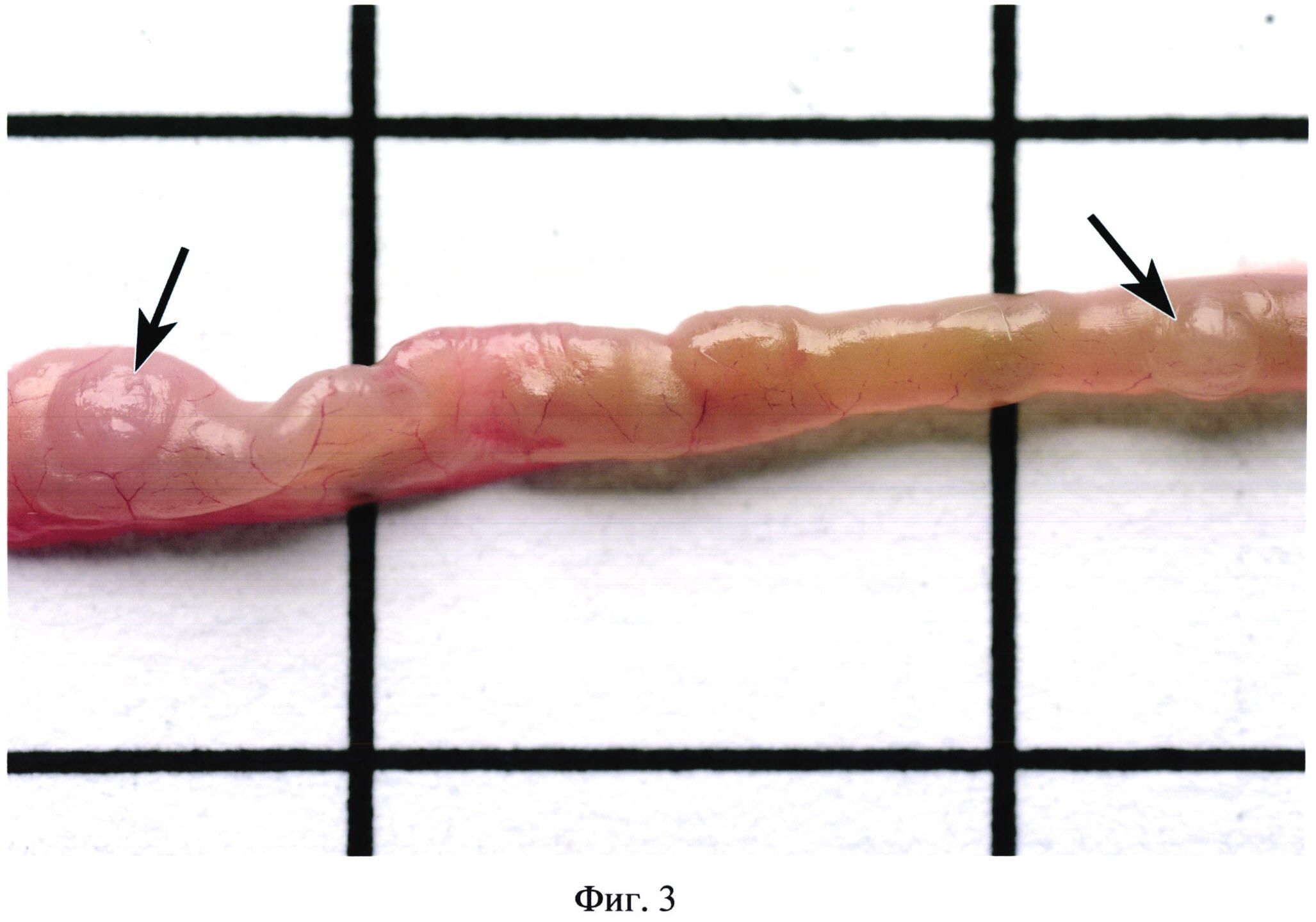
На фиг. 3 изображены групповые лимфоидные фолликулы (указаны стрелками) без контрастирования при перитоните.
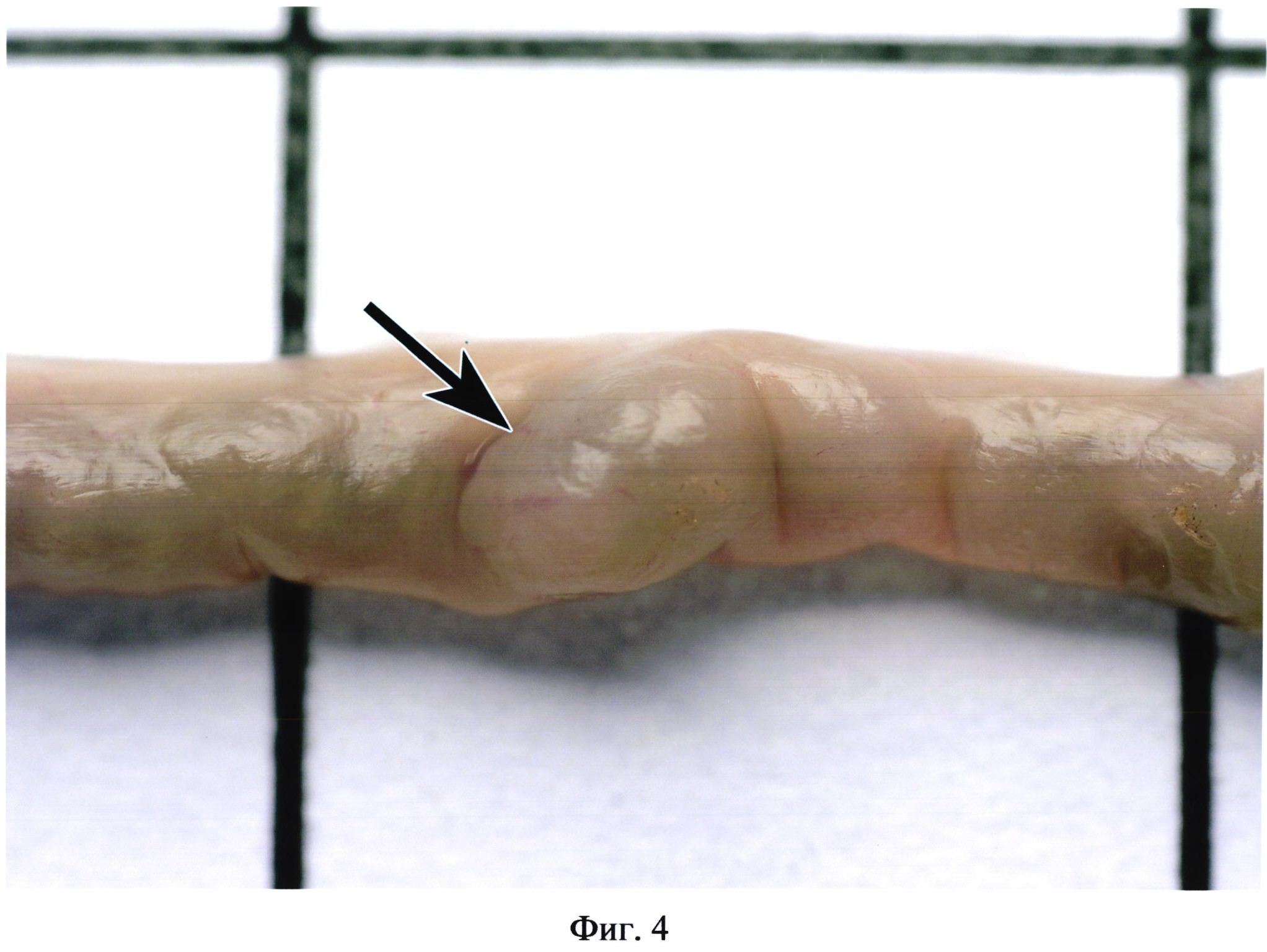
На фиг. 4 изображена пейерова бляшка (указана стрелкой) без контрастирования при эрозивно-язвенном поражении кишечника.
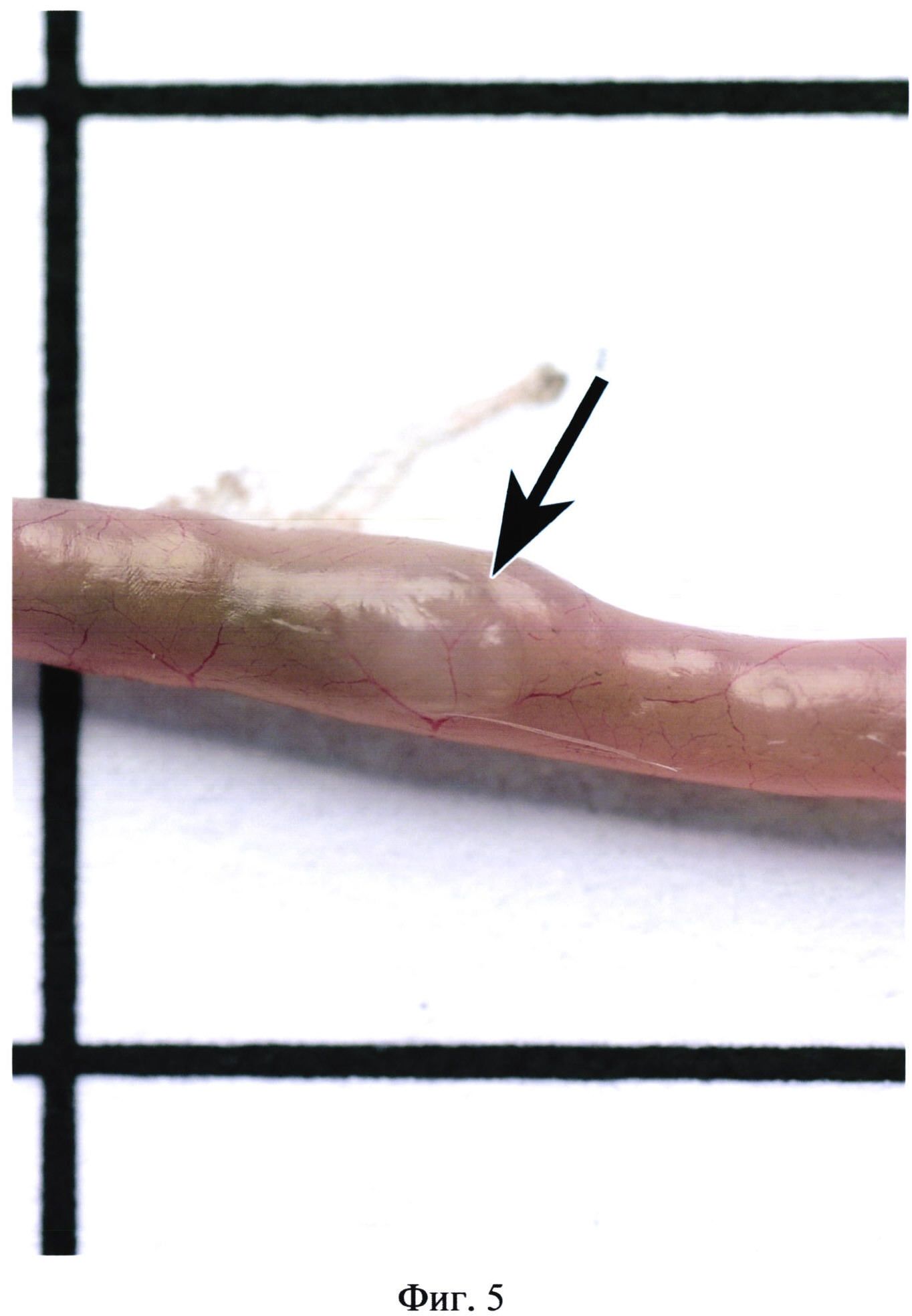
На фиг. 5 изображена пейерова бляшка (указана стрелкой), не выступающая над поверхностью серозной оболочки кишечника (без контрастирования).
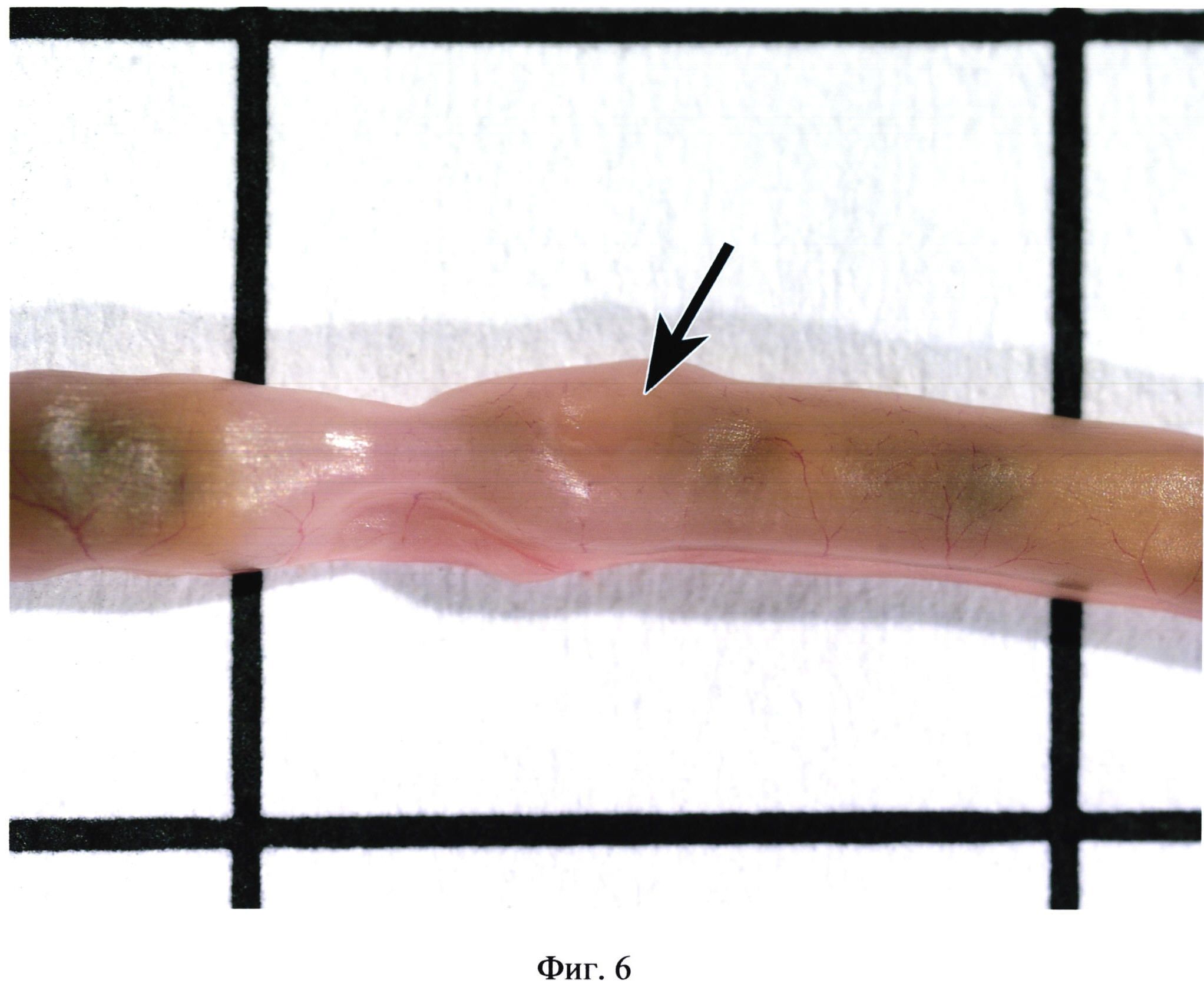
На фиг. 6 изображена пейерова бляшка (указана стрелкой), в месте расположения которой образовалось углубление в кишечной стенке (без контрастирования).
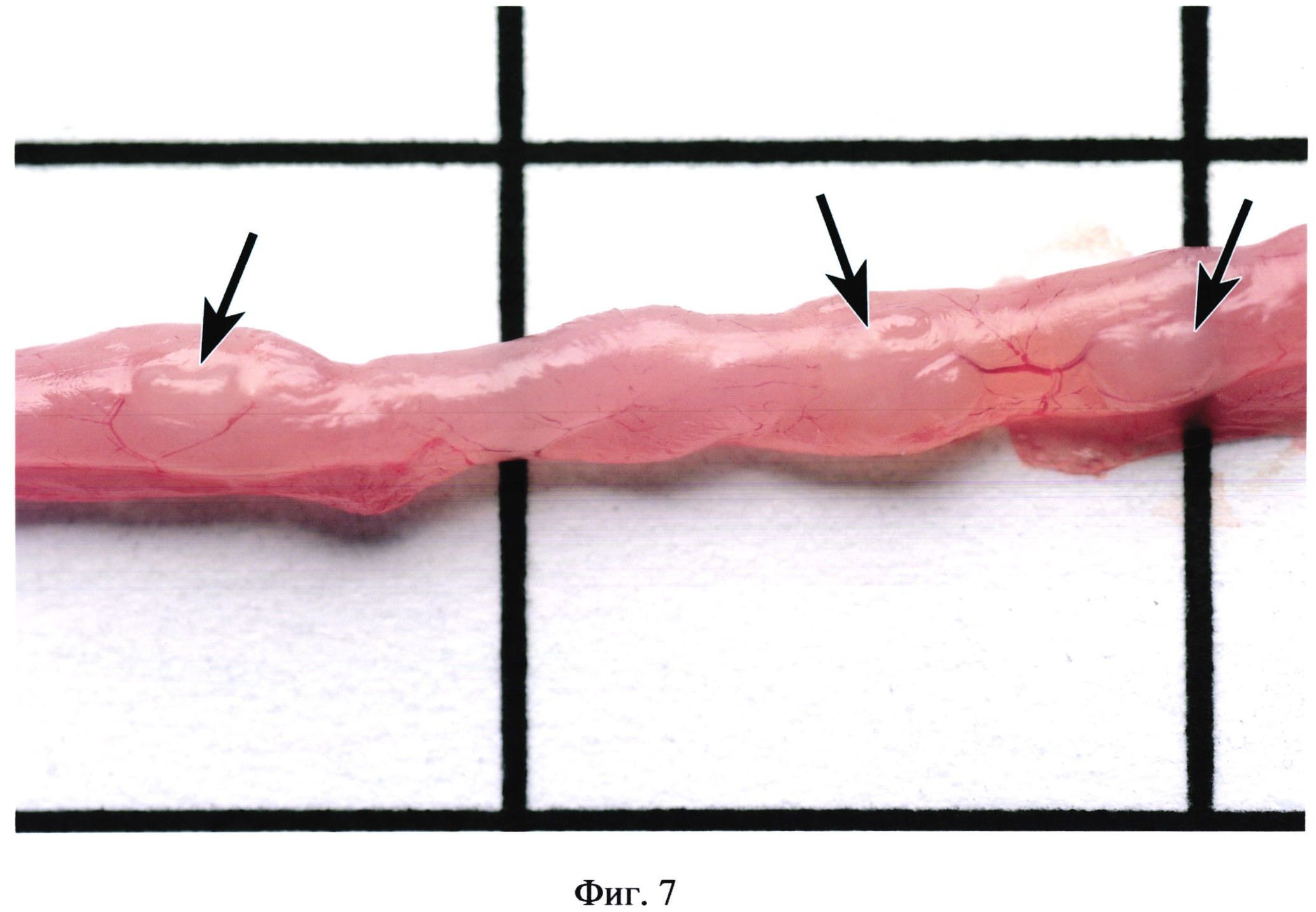
На фиг. 7 изображены групповые лимфоидные фолликулы (указаны стрелкой) без контрастирования при гиперемии кишечника.
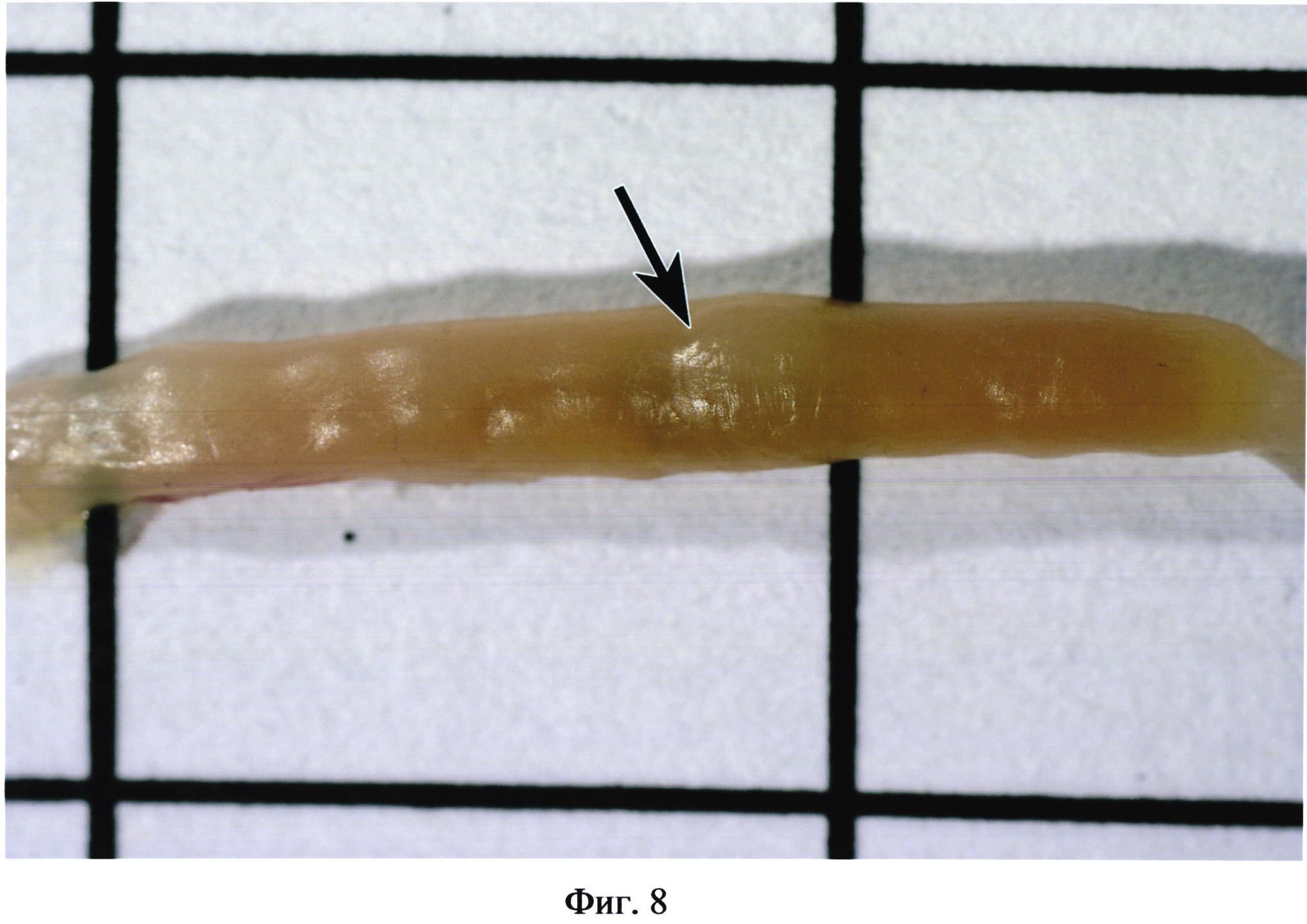
На фиг. 8 изображена пейерова бляшка (указана стрелкой) на фоне желчи, заполняющей просвет кишечника, при эрозивно-язвенном поражении кишечника.
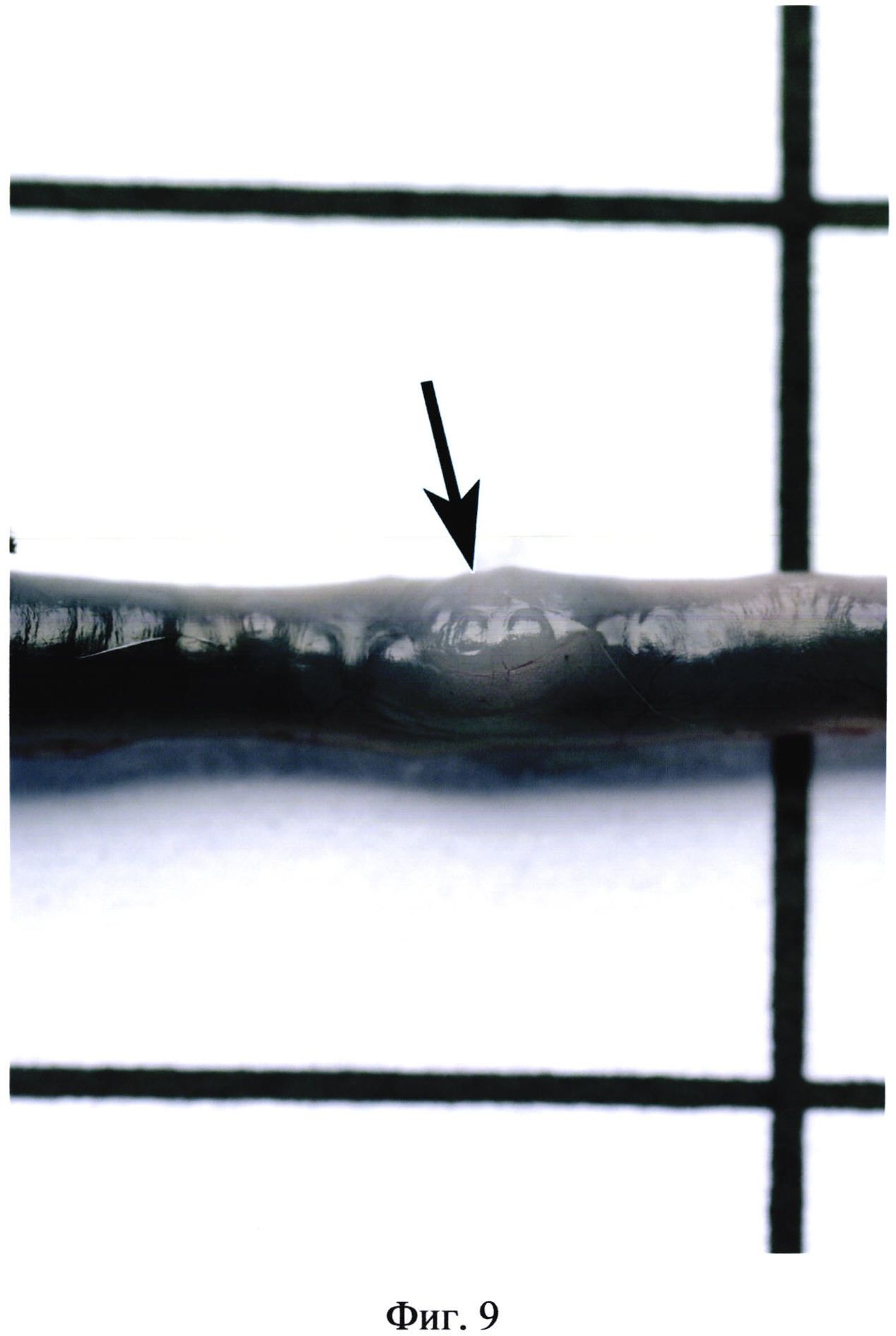
На фиг. 9 изображен групповой лимфоидный фолликул (указан стрелкой) на фоне черной туши, заполняющей просвет тонкого кишечника, интактной мыши.
На фиг. 10 изображены групповые лимфоидные фолликулы (указаны стрелками) на фоне черной туши, заполняющей просвет кишечника, при перитоните.
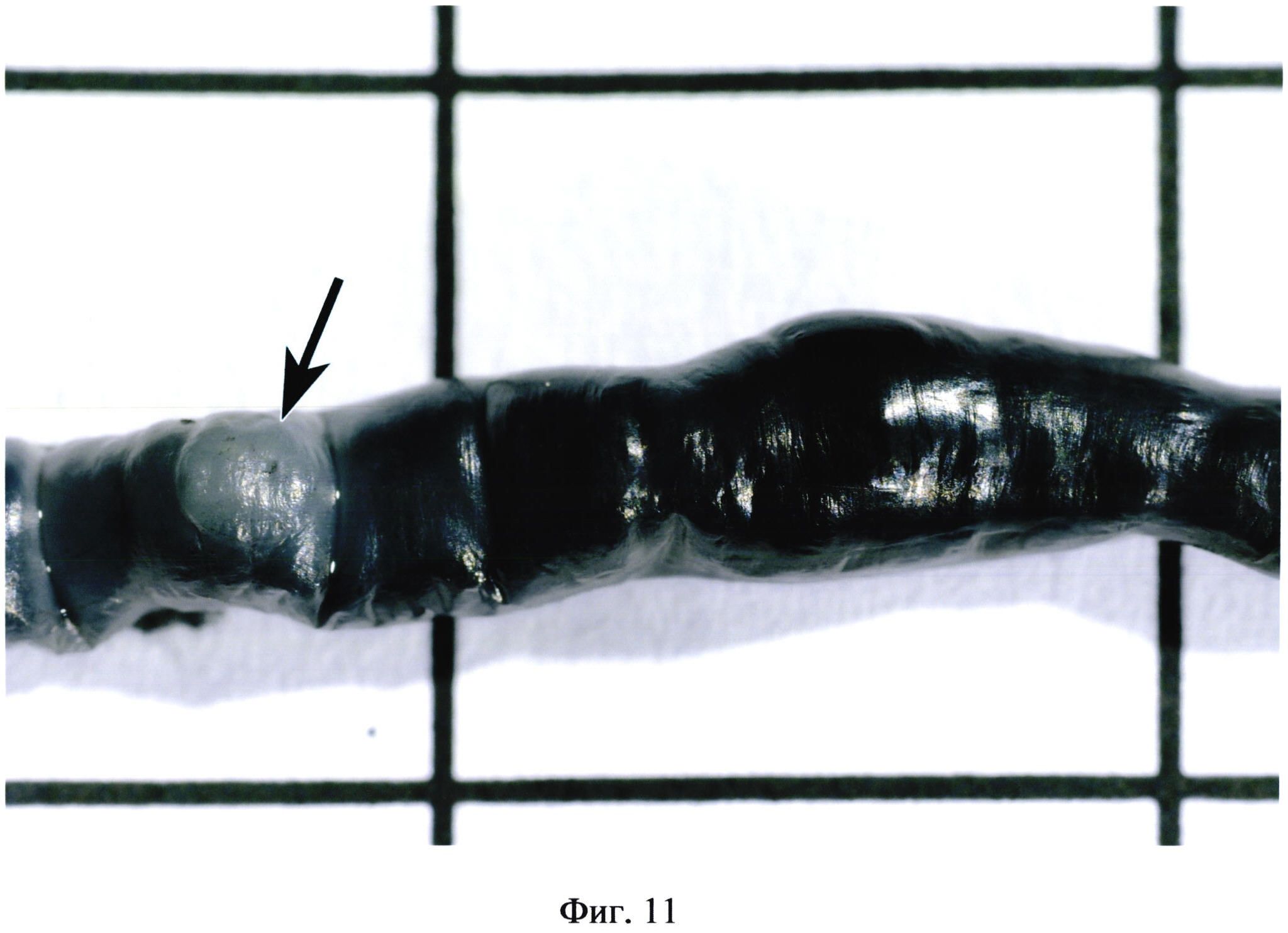
На фиг. 11 изображена пейерова бляшка (указана стрелкой) на фоне черной туши, заполняющей просвет кишечника, при эрозивно-язвенном поражении кишечника.
Способ осуществляют следующим образом.
Подбирают лабораторных мышей массой 18-24 г. Животных выдерживают на голодной диете в течение суток со свободным доступом к воде на решетчатом полу (с целью уменьшения копрофагии). После этого внутрижелудочно вводят контрастное вещество (черную тушь на водной основе) в количестве 0,04-0,06 мл на 1 г массы тела животного с М-холиноблокатором атропина сульфатом (0,1% раствором) в количестве 0,005-0,01 мг. Затем через 65-75 минут в ходе вскрытия проводят оценку количества и размеров пейеровых бляшек на фоне контраста, заполняющего просвет кишечника.
При определении параметров способа использовали самцов лабораторных нелинейных мышей. В эксперименты включали только молодых животных, масса которых составляла 18-24 г согласно рекомендациям Н.Н. Каркищенко и С.В. Грачевой (Каркищенко Н.Н. Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях / Н.Н. Каркищенко, С.В. Грачева. - М.: Профиль, 2010. - 358 с.).
В качестве контрастного вещества выбрали черную тушь на водной основе производства ОАО "ГАММА", г. Москва. Преимуществами ее применения являются низкая стоимость и доступность.
Мышей выдерживали на голодной диете в течение суток со свободным доступом к воде на решетчатом полу (с целью уменьшения копрофагии). После этого внутрижелудочно вводили контраст.
Определение переносимости черной туши провели на группе клинически здоровых мышей. Через гибкий желудочный зонд животным вводили от 0,1 до 1,4 мл туши. В течение трех дней путем осмотра изучали общее состояние животных. Результаты представлены в таблице 1.
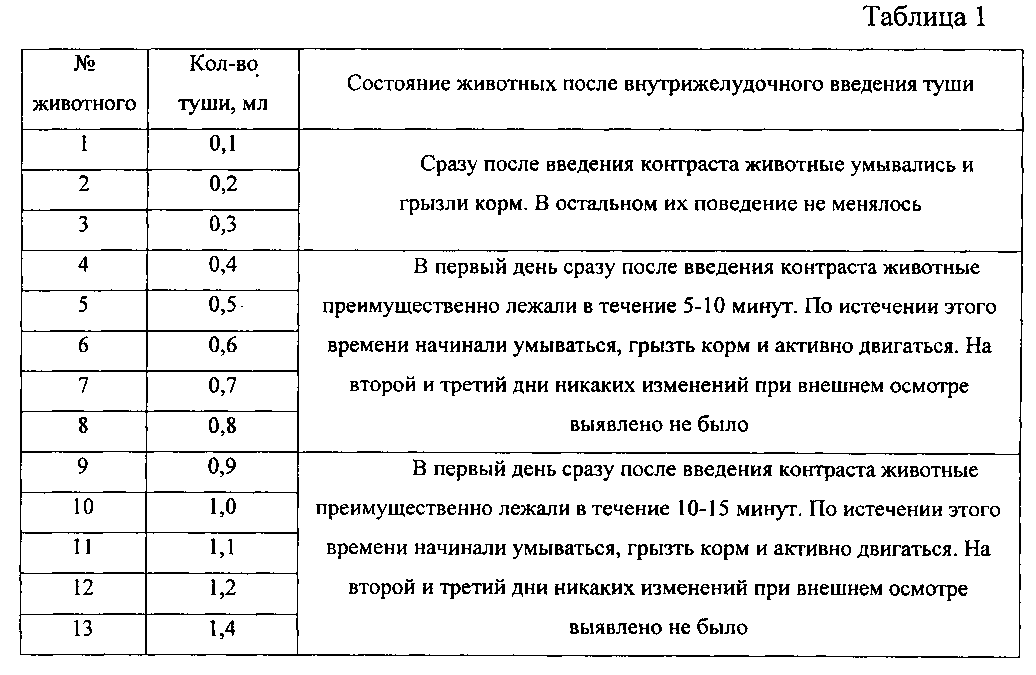
Из данных, приведенных в таблице 1, видно, что введение мышам туши в количестве 0,1-0,3 мл не влияет на их состояние. Количество туши 0,4-1,4 мл вызывает снижение активности мышей в течение 5-15 минут сразу после введения, что, видимо, связанно с кратковременным растяжением стенок желудка контрастным веществом.
При введении животным более 1 мл туши разрыва стенок желудка не происходит. Это экспериментально подтвердили путем вскрытия нескольких животных сразу после введения контраста. При этом установлено, что тушь после заполнения желудка сразу начинает поступать в двенадцатиперстную кишку. В результате этого давление жидкости на стенки желудка снижается. Данный эксперимент был проделан при возникновении необходимости вводить мышам более 1 мл туши с целью выяснить, можно ли это делать без вреда для животных, поскольку в руководствах по работе с лабораторными животными превышать данный объем не рекомендуют (Каркищенко Н.Н. Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях/ Н.Н. Каркищенко, С.В. Грачева. - М.: Профиль, 2010. - 358 с.).
Определение дозы фармакологического препарата для снижения тонуса гладкой мускулатуры желудочно-кишечного тракта у мышей.
В нормальных условиях тонус гладкой мускулатуры желудочно-кишечного тракта препятствует равномерному распределению контрастного вещества в кишечнике. При этом в органе остаются не заполненные тушью промежутки длиной более 1 см, в которых затруднено выявление пейеровых бляшек. Применение препарата, снижающего тонус гладкой мускулатуры желудочно-кишечного тракта, позволяет устранить данную проблему.
В качестве спазмолитика выбран М-холиноблокатор атропина сульфат 0,1% раствор. Известно, что атропин широко применяют для снижения тонуса гладких мышц внутренних органов и уменьшения моторики желудочно-кишечного тракта. Преимуществами применения данного препарата являются низкая стоимость и выраженное расслабляющее действие на гладкую мускулатуру кишечника. Помимо этого, атропин в форме раствора гораздо проще дозировать, чем таблетированные формы.
Выбор дозы атропина проводили на 7 группах животных (в каждой по 3 мыши). Были опробованы следующие дозы атропина: 0,0005, 0,001, 0,0025, 0,005, 0,01, 0,02, 0,05 мг. Дозирование препарата осуществляли с помощью инсулинового шприца методом последовательных разведений в физиологическом растворе. Перед внутрижелудочным введением к каждой дозе атропина добавляли тушь до объема 1 мл.
Предварительно в серии опытов определили, что через 40 мин после введения контрастного вещества степень заполнения тонкого кишечника составляет около 70%. Такого заполнения достаточно для подбора дозы атропина.
Через 40 мин после введения туши животных вскрывали, выделяли тонкий кишечник и расправляли его на ровной поверхности, рассекая брыжейку. Затем отмечали характер распределения туши в кишечнике: неравномерное (с чередованием заполненных и не заполненных участков, длина которых обычно составляла от 0,5 до 5 см) или равномерное (без такого чередования).
В ходе изучения влияния различных доз атропина на характер распределения туши в кишечнике было установлено, что при дозах 0,0005-0,0025 мг тушь распределяется не равномерно (таблица 2).

Равномерное распределение туши происходило при введении атропина в дозах 0,005-0,05 мг. При этом побочных эффектов атропина не наблюдалось. Дозы атропина 0,005-0,01 мг оказывали достаточное действие при минимальном риске побочных эффектов и экономном расходовании препарата.
Определение количества контрастного вещества.
Количество туши подбирали таким образом, чтобы оно было минимальным (для улучшения переносимости процедуры), но в то же время обеспечивало полное заполнение тонкого кишечника без не заполненных промежутков.
В эксперимент включили 5 групп мышей (в каждой по 5 животных). В группах №1, 2, 3, 4 и 5 внутрижелудочно вводили тушь с атропином (0,01 мг) в объеме 0,3, 0,6, 0,8, 1,0 и 1,2 мл соответственно.
Предварительно установили, что через 70 мин после введения 1 мл контрастного вещества степень заполнения тонкого кишечника составляет 100% (т.е. за это время тушь заполняет весь тонкий кишечник). Поэтому именно через данный интервал времени решили подбирать оптимальное количество туши.
Через 70 мин после введения контраста проводили вскрытие животных. Выделяли из брюшной полости желудок и тонкий кишечник. Измеряли длину кишечника. Для этого расправляли его, рассекая брыжейку, и, не вытягивая, раскладывали на ровной поверхности. Определяли степень заполнения кишечника (%). Для этого дополнительно измеряли длину участков, заполненных тушью.
О возможности дальнейшего пассажа контраста в тонком кишечнике судили по наличию остаточных количеств туши в желудке. Для этого рассекали по большой кривизне желудок и определяли наличие или отсутствие туши.
Результаты определения количества контрастного вещества, необходимого для заполнения тонкого кишечника по всей длине, отображены в таблице 3. Количественные признаки представлены в виде М±m, где Μ - среднее, a m - стандартная ошибка среднего.

Из данных, приведенных в таблице 3, видно, что в группах №1, 2 и 3 контрастного вещества в количестве 0,3, 0,6 и 0,8 мл не достаточно для заполнения тонкого кишечника по всей длине, о чем свидетельствует и отсутствие туши в желудках у 100% животных. Степень заполнения контрастным веществом кишечника в группах №1, 2 и 3 составляет 45,0±1,6, 70,4±4,2 и 85,1±2,4% соответственно.
Через 70 мин после введения туши в количестве 1,0-1,2 мл (группы №4 и 5) степень заполнения кишечника составляет 100%. При этом в желудках 80% животных имеется контраст. Следовательно, туши в количестве 1,0-1,2 мл достаточно для заполнения тонкого кишечника по всей его длине.
В группах №4 и 5 в ходе вскрытия у мелких животных (массой менее 21 г) отмечали более тугое наполнение желудка тушью по сравнению с более крупными мышами. В группе №4 у двух животных массой 22,7 и 24,0 г в желудке не оказалось остаточных количеств туши. Это свидетельствует о том, что при введении контрастного вещества необходимо учитывать массу тела мышей. Для удобства работы с животными разной массы было вычислено необходимое количество контраста на 1 г массы тела. За основу взяли количество туши 1,0-1,2 г и массу животных 4-й и 5-й групп, в которых удалось получить наилучшее контрастирование. Результаты представлены в таблице 4.
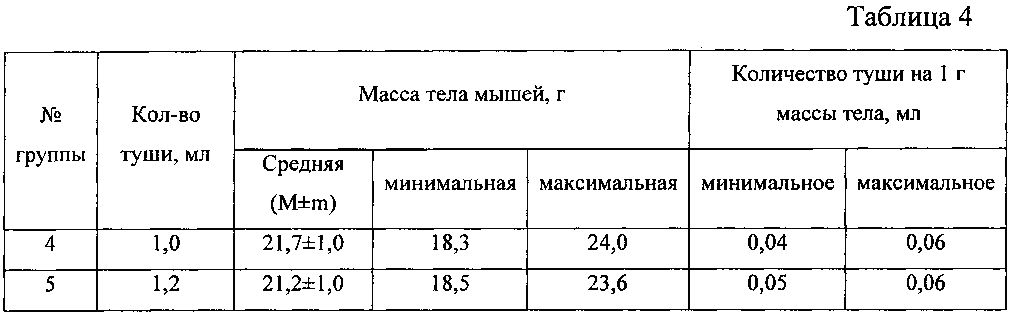
Из данных, приведенных в таблице 4, видно, что для заполнения тонкого кишечника по всей его длине контрастным веществом необходимо 0,04-0,06 мл туши на 1 г массы тела.
Определение оптимального интервала времени между введением контрастного вещества и временем измерения групповых лимфоидных фолликулов тонкого кишечника.
Определение оптимального времени, необходимого для равномерного заполнения тонкого кишечника по всей его длине контрастом, осуществлялось на группе из 11 лабораторных мышей. Животным внутрижелудочно вводили по 0,05 мл туши на 1 г массы тела с атропином в количестве 0,01 мг. Степень заполнения тонкого кишечника оценивали через 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 и 120 минут после введения контраста.
В ходе вскрытия выделяли из брюшной полости тонкий кишечник и измеряли его длину. Для этого расправляли кишечник, рассекая брыжейку, и, не вытягивая, раскладывали на ровной поверхности. Определяли степень заполнения кишечника (%). Для этого дополнительно измеряли длину участков, заполненных тушью. Результаты представлены в таблице 5.

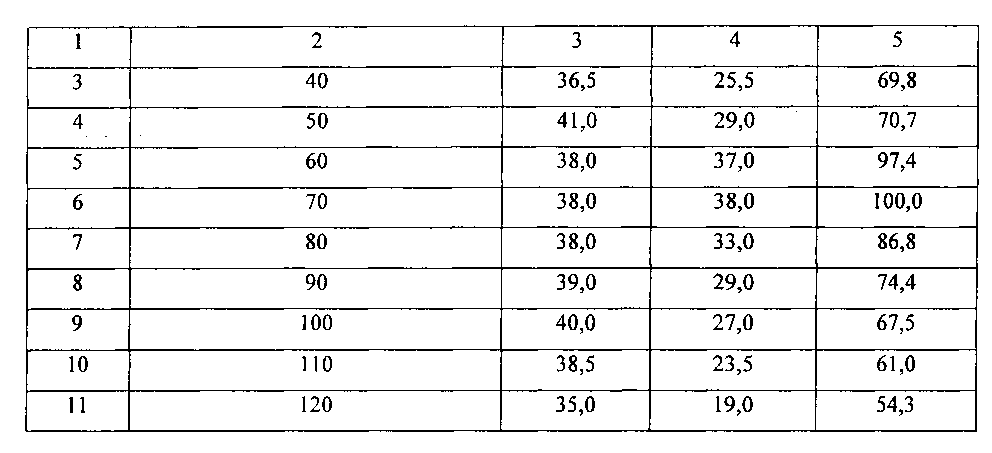
Из данных таблицы видно, что 60 минут не достаточно для заполнения тонкого кишечника тушью по всей длине. При этом степень заполнения составляет не более 97,4%.
Через 70 минут после введения контрастного вещества степень заполнения тонкого кишечника составляет 100%, а через 80 минут начинает снижаться и составляет 86,8%.
Следовательно, оптимальный интервал времени между введением контрастного вещества и измерением пейеровых бляшек у мышей массой 18-24 г находится в промежутке между 65 и 75 минутами.
Апробацию способа провели с целью выявить его преимущества по сравнению с подсчетом пейеровых бляшек без контрастирования. При этом обращали внимание на скорость, легкость, точность измерений и выявляемость пейеровых бляшек. Подсчет проводил человек с нормальным зрением без использования увеличительной техники в условиях хорошего освещения.
Использовали лабораторных нелинейных мышей массой 20-22 г. Все животные были разбиты на 6 групп по 10 животных (таблица 6).


В группы №1 и 2 входили здоровые животные. В группах №3 и 4 на мышах воспроизводили перитонит путем однократного внутрибрюшинного введения 0,3 мл 10%-ной каловой взвеси из свежих крысиных фекалий (заявка на патент №2014135314 от 28.08.2014). Оценку количества и размеров групповых лимфоидных фолликулов проводили на 3 день после инфицирования животных.
В группах №5 и 6 воспроизводили эрозивно-язвенное поражение кишечника путем внутримышечного введения препарата "Диклофенак" (раствор для внутримышечных инъекций, в 1 мл содержится 25 мг действующего вещества натрия диклофенака). Известно, что нестероидные противовоспалительные препараты обладают выраженным побочным действием, заключающимся в изъязвлении слизистой оболочки кишечника. "Диклофенак" является одним из самых распространенных и доступных препаратов из этой фармакологической группы.
Животным групп №5 и 6 ежедневно выполняли внутримышечные инъекции препарата "Диклофенак" в дозе 0,5 мг в течение 12 дней. Образование язв и эрозий на слизистой оболочке кишечника подтверждалось патоморфологическим исследованием. Оценку количества и размеров групповых лимфоидных фолликулов проводили на следующий день после последней внутримышечной инъекции.
Перед измерением пейеровых бляшек в течение суток животных всех групп выдерживали на голодной диете со свободным доступом к воде на решетчатом полу. После этого мышам групп №2, 4 и 6 внутрижелудочно с помощью гибкого зонда вводили тушь в количестве 0,05 мл на 1 г массы тела с 0,01 мг атропина сульфата. Через 70 минут в ходе вскрытия проводили оценку количества и размеров групповых лимфоидных фолликулов на фоне контрастного вещества, заполняющего просвет тонкого кишечника (фиг. 1).
У мышей всех групп измеряли длину и ширину пейеровых бляшек со стороны серозной оболочки тонкого кишечника с помощью миллиметровой линейки. Исходя из этих величин, определяли площадь поверхности пейеровых бляшек по формуле площади эллипса (S=π×a×b, где S - площадь эллипса, а - длина большой полуоси, b - длина малой полуоси). Нормальность распределения количественных признаков проверяли путем построения гистограмм. Достоверность различий определяли по t-критерию Стьюдента с поправкой Бонферрони для множественных сравнений (Медик В.А. Статистика в медицине и биологии. Т. 1 Теоретическая статистика/ В.А. Медик, М.С. Токмачев, Б.Б. Фишман - М.: Медицина, 2000 - 412 с.). Различия считали достоверными при p<0,05.
Количество выявленных групповых лимфоидных фолликулов тонкого кишечника при контрастировании и без контрастирования представлено в таблице 7.

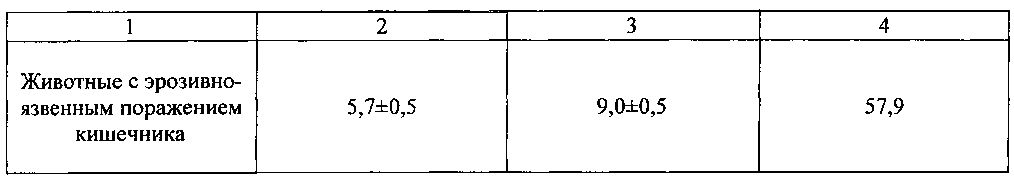
Из данных таблицы следует, что контрастирование позволяет выявлять больше пейеровых бляшек (на 44,6, 35,8 и 57,9%) при разных состояниях. Во всех трех сравнениях различия значимы для p<0,05.
Площадь пейеровых бляшек, выявленных при контрастировании и без контрастирования, представлена в таблице 8.
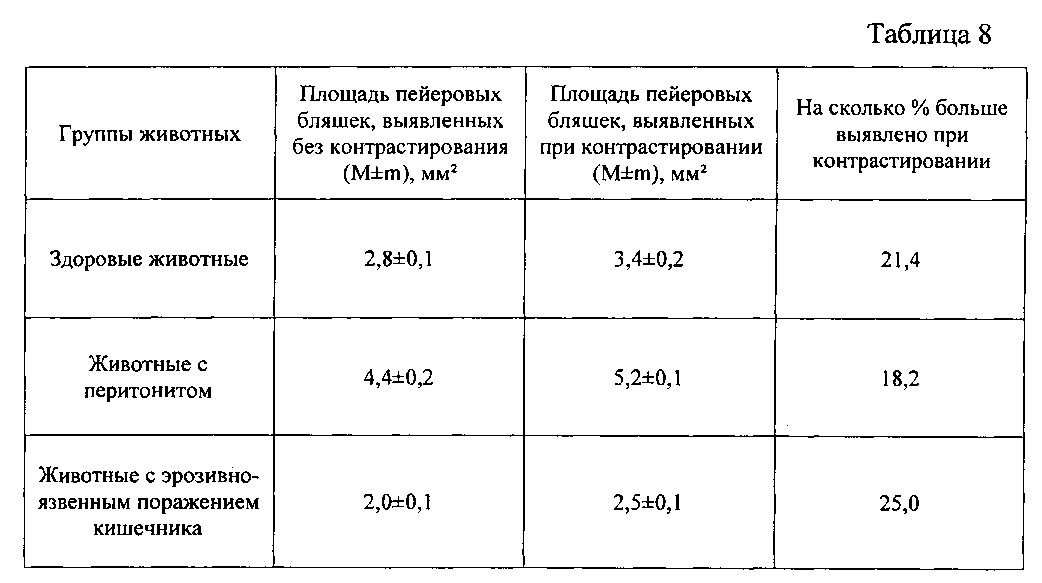
Из данных таблицы видно, что контрастирование позволило выявить большую площадь пейеровых бляшек (на 21,4, 18,2 и 25,0%) при разных состояниях. Все различия значимы для p<0,05.
Меньшая выявляемость пейеровых бляшек в проведенном эксперименте при подсчете без контрастирования обусловлена сложностью их выявления. Однако вероятна и обратная ситуация. На грани возможностей зрения исследователя простые очаговые изменения цвета и рельефа кишки могут быть приняты за пейеровы бляшки. В этом случае результаты подсчета будут завышенными. Некоторые из сложностей выявления бляшек и преимущества метода контрастирования проиллюстрированы ниже.
Фигуры 2, 3, 4 иллюстрируют сходство окраски некоторых бляшек с окружающими участками кишки. Встречаются бляшки, совершенно не выступающие над поверхностью кишки (фиг. 5). В некоторых случаях в местах расположения групповых лимфоидных фолликулов могут образовываться даже углубления в стенке органа (фиг. 6). Выявить пейеровы бляшки и определить их линейные размеры очень сложно при гиперемии кишечника (фиг. 7), наличии в просвете кишечника желчи (фиг. 8), пузырьков газа, химуса.
Значительно легче изучать групповые лимфоидные фолликулы на фоне контраста, заполняющего просвет кишечника. При этом пейеровы бляшки хорошо видны на фоне туши. Они имеют четкие контуры, в них хорошо просматриваются фолликулы (фиг. 9, 10, 11). Очевидно, что при менее благоприятных условиях подсчета (плохое освещение, утомление зрения, нарушения зрения) различия между сравниваемыми группами были бы более существенными.
Таким образом, можно назвать следующие преимущества предложенного способа количественной оценки пейеровых бляшек у мышей (по сравнению с подсчетом без контрастирования): большая точность и скорость измерений, меньшее утомление зрения. При этом метод введения контраста относительно не сложный и в ходе исследования не происходит грубого нарушения структуры органа.
Способ оценки количества и размеров групповых лимфоидных фолликулов тонкого кишечника у мышей, включающий контрастирование тонкого кишечника, использование в качестве контрастного вещества туши, отличающийся тем, что лабораторным мышам внутрижелудочно вводят контрастное вещество в количестве 0,04-0,06 мл на 1 г массы тела с M-холиноблокатором атропина сульфатом в количестве 0,005-0,01 мг, оценку количества и размеров пейеровых бляшек проводят через 65-75 мин в ходе вскрытия.