Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ, НА ОСНОВЕ НАНОЧАСТИЦ
Вид РИД
Изобретение
Изобретение относится к области фармакологии и медицины, в том числе ветеринарной медицины, и может быть использовано как эффективное средство внутриклеточной доставки низкомолекулярных лекарственных веществ и биологически активных молекул при лечении болезней различного генеза.
Внутриклеточная доставка лекарственных веществ и биологически активных молекул является актуальной проблемой в биологии, медицине и ветеринарии. Прямая поставка лекарств и биомолекул к органам-мишеням, малоэффективна, что связано с ферментной деградацией активных веществ, их нейтрализацией печенью и выведением из организма почками. Поэтому поиск эффективных и безопасных переносчиков к генам, клеткам и органам-мишеням является важной областью исследования.
В качестве корпускулярных носителей для биологически активных веществ используются такие структуры, как фуллерены, дендримеры, липосомы, полиакрилатные частицы, мицеллы, коллоидное золото и другие.
Наиболее перспективными разработками в данной области являются липидсодержащие (липосомальные) наносистемы, полимерные наночастицы, коллоидные частицы, а также наноносители из пористого кремния.
Данные транспортные наносистемы несовершенны и имеют ряд недостатков (в частности, недостаточная стабильность и высокая сложность технологии производства и, соответственно, чрезвычайно высокая стоимость), чем и объясняется отсутствие «адресных» лекарств в практической медицине.
В частности, липосомальные наносистемы в большинстве случаев предлагаются в виде растворов, содержащих частицы, составляющие более 100 нм. Липосомы используются в качестве «контейнера» для доставки лекарственных средств к органам мишеням.
Частицы такого размера, как правило, нестабильны и, соответственно, не представляется возможным контролировать размер частиц при формировании системы. Кроме того, при введении в организм липосомы быстро выводятся из кровотока ретикуло-эндотелиальной системой, что приводит к снижению эффективности препаратов.
Подобные недостатки присущи следующей разработке - «Иммунолипосомальная наносистема адресной доставки к коннексин-43 положительным опухолевым клеткам» (патент РФ 2422154 по кл. МПК А61К 39/00, опуб. 27.02.2011). Система включает биотинилированные моноклональные антитела к экстраклеточному фрагменту коннексина-43 (первый компонент) и ПЭГилированные липосомальные контейнеры диаметром 70-100 нм, ковалентно связанные со стрептавидином (второй компонент). Последовательное введение в живую систему первого и второго компонентов бинарной системы приводит к селективной доставке липосом к Сх-43-положительным клеткам путем специфического связывания биотинилированных антител с экстраклеточным фрагментом Сх-43 на цитолемме глиомных клеток и последующим образованием стрептавидин-биотинового комплекса.
Однако данная наносистема имеет узконаправленное действие - предназначена только для адресной доставки липосом к опухолевым клеткам. Кроме того, существенным недостатком данной системы является низкая стабильность липосом при хранении.
Известна также лекарственная форма доставки водонерастворимых и плохорастворимых лекарственных средств в виде наночастиц и способ получения системы доставки лекарственной формы (см. заявку №2006123043 по кл. МПК А61К 31/00, опуб. 20.01.2008). Способ предусматривает лиофилизацию водонерастворимых и плохорастворимых биологически активных веществ с образованием в результате этого частиц в виде сферических наноразмерных структур. Лиофилизацию осуществляют липосомами, состоящими из липидов, которые образуют при ассоциации векторное окружение вокруг ядра - липосомальную мембрану. Наночастицы имеют размеры от 5 до 1500 нм. В качестве плохорастворимых и водонерастворимых биологически активных веществ система содержит снотворные, успокаивающие, противосудорожные средства, транквилизаторы, анальгезирующие, противовоспалительные, сердечнососудистые, гормональные препараты, витамины, ферментные и стимулирующие метаболические процессы средства, противогрибковые, противоопухолевые, биологически активные пептиды и белки. Однако существенным недостатком данной системы является низкая стабильность при хранении и невозможность контролировать размер частиц при формировании системы.
Наиболее стабильной является высокодисперсная наносистема, предложенная в 2011 г. НИИ биомедицинской химии имени В.Н. Ореховича (ИБМХ РАМН). Данная система получена на основе соевого фосфолипида и представляет собой систему для транспорта как жирорастворимых (гидрофобных), так и водорастворимых (гидрофильных) биологически активных соединений. Авторами разработки на основании скрининга лекарственных субстанций разного спектра действия была проанализирована их способность встраивания в фосфолипидную транспортную наносистему, а также проведены предварительные испытания in vitro и in vivo. По результатам указанных тестов в качестве наиболее перспективных для промышленного выпуска были выбраны препараты, содержащие низкокомолекулярные соединения лекарственных веществ доксорубицин (препарат «Доксолип») и индометацин (препарат «Индолип»), снабженные фосфолипидной транспортной наносистемой. Проведены доклинические исследования этих нанолекарств, разработан полный комплект нормативно-технической документации, необходимой для их выпуска, подготовлены документы для подачи в Министерство Здравоохранения РФ для получения разрешения на проведение клинических испытаний.
Предложенная технология позволяет получать нанолекарства в виде лиофилизированного порошка, что увеличивает их срок хранения до 5 лет, предохраняет фосфолипиды от агрегации. Однако технологический процесс, требующий наличие уникального оборудования, весьма сложный и трудоемкий. Он включает в себя получение стабильной наноэмульсии фосфолипидных частиц со включенной лекарственной субстанцией (гомогенизация высокого давления) и последующее лиофильное высушивание получаемых эмульсий. Данный фактор негативно сказывается на себестоимости готовой продукции.
Наноносители из пористого кремния представлены следующими разработками:
- «Способ получения наноразмерной системы доставки лекарственных средств на основе диоксида кремния» (патент РФ №2372890 по кл. МПК А61J 3/00, А61К 47/04, А61К 38/33, опуб. 20.11.2009),
- «Фармпрепараты с наноносителями. Производство фармпрепаратов с наноносителями из пористого кремния» (разработчики - Nanolek Holding Limited (Кипр) и ООО «Нанолек» Россия).
Наиболее близким из них к заявляемому способу является способ получения наноразмерной системы доставки лекарственных средств на основе диоксида кремния (см. патент РФ №2372890 по кл. МПК A61J 3/00, А61К 47/04, А61К 38/33, опуб. 20.11.2009), а именно - мет-энкефалина на гидрозоле наночастиц SiO2. Способ включает смешивание дистиллированной воды, соляной кислоты и тетраэтоксисилана, добавление приготовленного раствора в NaOH, упаривание и фильтрацию с получением гидрозоля SiO2, ультразвуковую обработку полученного гидрозоля SiO2, добавление мет-энкефалина и раствора ПАВ в количестве 0,5-2% от общего объема полученной системы. Система доставки мет-энкефалина способна преодолеть гематоэнцефалический барьер и доставлять лекарственное средство к клеткам головного мозга. Способ позволяет создать наночастицы с диаметром 6-10 нм. Данный препарат и система его доставки имеют узконаправленное действие - предназначено только для преодоления гематоэнцефалического барьера.
Как следует из описания проекта «Фармпрепараты с наноносителями. Производство фармпрепаратов с наноносителями из пористого кремния» (разработчики - Nanolek Holding Limited (Кипр) и ООО «Нанолек» Россия) - технология адресной доставки наноносителей из пористого кремния предполагает обеспечение пролонгации биологически активного вещества за счет сорбирования его на наночастицах пористого кремния, которые выполняют транспорт активного вещества, обеспечивая постепенное выделение из пор размером около 10 нм. На данном принципе планируется разработка группы твердых лекарственных форм, включающих препараты для лечения сердечнососудистых заболеваний, противораковые и противовирусные препараты. Действие уже известных активных веществ в этих препаратах продлевается за счет их сорбирования на наночастицах пористого кремния.
Как следует из описания, данная наносистема не подразумевает адресную доставку, а только пролонгацию действия активных веществ. Неясным остается вопрос о скорости высвобождения данных веществ из пор наночастиц. Также сомнительна вероятность дальнейшей утилизации (биодеградации) достаточно крупной кремниевой частицы (более 150 нм), находящейся в кровеносном русле. Не исключается, что данные наночастицы могут оказывать раздражающее действие на иммунную систему, что может привести впоследствии к аллергическим и аутоиммунным заболеваниям.
Следует отметить, что основным недостатком применяемых в настоящее время наночастиц является их высокая токсичность по сравнению с макрочастицами. Они способны проникать в неизмененном виде через клеточные барьеры, через гематоэнцефалический барьер в центральную нервную систему, циркулировать и накапливаться в органах и тканях, вызывая более выраженные патоморфологические поражения внутренних органов (например, образование гранулем в легких, цирроз печени, гломерулонефроз), а также обладая длительным периодом полувыведения.
Токсичность наночастиц определяется их формой и размерами, при этом мельчайшие наночастицы веретенообразной формы вызывают более разрушительные эффекты в организме, нежели подобные им частицы сферической формы. При воздействии наночастиц на организм отчетливо прослеживается зависимость «доза-эффект». Клинические проявления определяются содержанием того или иного химического элемента в составе каждой конкретной наночастицы, однако при этом наблюдается значительное усиление токсического эффекта.
Кроме этого наночастицы могут оказывать раздражающее действие на иммунную систему. Поскольку выведение наночастиц из организма происходит длительное время, то постоянная миграция наноструктур по организму в малых количествах может привести к дестабилизации иммунной системы и в дальнейшем к аллергическим и аутоиммунным заболеваниям.
Изобретение направлено на решение задачи создания нетоксичного и эффективного средства внутриклеточной доставки биологически активных низкомолекулярных соединений на основе наночастиц селена, а именно на разработку способа его получения.
Для решения поставленной задачи способ осуществляется следующим образом
Сначала готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе, в полученный раствор вносится низкомолекулярное соединение, выбранное из группы гентамицин, гексаметилентетрамин, метионин, цефалексин, индол-3-карбинол. Доводят pH до 7,2-7,4.
В результате заявленного способа получают средство следующего состава, в масс. %:
|
В качестве низкомолекулярного биологически активного вещества соединение может содержать гентамицин, гексаметилентетрамин, метионин, цефалексин, индол-3-карбинол.
В качестве селенсодержащего вещества используют селенистую кислоту.
В известных авторам источниках патентной и научно-технической информации не описано нетоксичного и эффективного средства внутриклеточной доставки низкомолекулярных биологически активных веществ и способов его получения, в котором в качестве носителя (наноплатформы) используют коллоидный селен, на который выполнено конъюгирование ряда биологически активных молекул.
Известно использование селена в качестве терапевтического средства, т.е. препарата, способного участвовать в окислительно-восстановительных процессах клеток организма (см., например, патенты РФ №2394583, №2426444, сайты http://fitoapteka.com/read/ru: http://www.naturoprof.ru, http://bezvreda.com/selen-v-pitanii/). Селен нормализует обмен протеинов и нуклеиновых кислот; регулирует специфический и неспецифический иммунитет за счет активизации функции нейтрофилов, пролифирации Т-, В-лимфоцитов, генерирование продукции антител, лимфокинов; улучшает адаптацию организма; уменьшает токсичное влияние веществ, солей тяжелых металлов, лекарств, других различных антибиотиков; предотвращает развитие окислительного процесса, свободнорадикальных болезней, в том числе атеросклероза и его осложнений, некрозов печени, панкреатитов, рассеянного склероза, паркинсонизма, других заболеваний.
Общепризнано, что микроэлемент селен (Se) - необходимый нутриент для нормального функционирования организма человека и животных, так как он входит в состав большинства гормонов и ферментов, активно участвуя в обмене веществ. Он выполняет в организме каталитическую, структурную и регуляторную функции; взаимодействует с витаминами, ферментами и биологическими мембранами; участвует в окислительно-восстановительных процессах, клеточном дыхании, обмене жиров, белков и углеводов. Роль селена в организме во многом определяется его включением в состав одного из важнейших ферментов - глутатионпероксидазы, защищающей клетки от продуктов перекисного окисления. Таким образом, селен и его соединения проявляют значительную антиоксидантную активность. Данный элемент входит в состав и других ферментов, участвует в детоксикации ксенобиотиков, регулирует функции щитовидной и поджелудочной желез, проявляет гепатозащитный эффект, стимулирует антитоксическую защиту организма, положительно влияет на систему репродукции, обладает радиопротекторным действием.
Применение коллоидного селена в качестве наноносителя для доставки низкомолекулярных биологически активных веществ до настоящего времени неизвестно.
Преимуществом заявляемого способа доставки низкомолекулярных биологически активных веществ с помощью наночастиц на основе коллоидного селена является возможность внутриклеточного проникновения наночастицы коллоидного селена с конъюгированными на нем лекарственными веществами - низкомолекулярными соединениями. При этом биодинамика лекарственных веществ и биологически активных молекул, соединенных с коллоидным селеном, происходит лимфогенным путем и в меньшей степени подвергается ферментной деградации и нейтрализации печенью.
Также определенным преимуществом служит то, что сам коллоидный селен является частью метаболической цепочки организма и способен усваиваться во внутриклеточном пространстве. Тем самым устраняются нежелательные последствия, связанные с «утилизацией» организмом самого носителя.
Сказанное позволяет сделать вывод о наличии в заявляемом изобретении критерия «изобретательский уровень».
Средство, полученное предложенным способом, представляет собой коллоидный раствор наночастиц селена с адсорбированными на его поверхности частицами низкомолекулярных соединений. Оно представляет собой прозрачный раствор, цвет которого варьируется от кирпично-красного до оранжевого. Средство хранят при температуре от +2 до +20°C в темном месте. Срок хранения - 1 год.
Для получения средства внутриклеточной доставки биологически активного низкомолекулярного соединения готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды, удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе при 60 об/мин и 70°C, в полученный раствор вносится низкомолекулярное соединение, выбранное из группы гентамицин, гексаметилентетрамин, метионин, цефалексин, индол-3-карбинол, в концентрации 0,001-5,0% по массе, доводят pH до 7,2-7,4.
Доведение pH до 7,2-7,4 обусловлено необходимостью создания стабильной системы, поскольку значения кислотности выше или ниже указанных пределов приведет к разрушению коллоидного раствора.
Выбор количественного содержания селена в средстве 0,0001-1,0% масс., а также биологически активного низкомолекулярного соединения 0,001-5% масс., обусловлен необходимостью соответствия решаемой задачи. Значения концентраций компонентов обеспечивает однородность и стабильность полученного средства.
Предпочтительный путь введения средства для внутриклеточной доставки - парентеральный. Доза рассчитывается в зависимости от биологически активного вещества, используемого в системе, из расчета 0,1-7 мг на килограмм массы тела биологического организма.
Пример 1
Готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды, удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе при 60 об/мин при 70°, в полученный раствор вносится метионин до конечной концентрации 1,7 масс. %, доводят pH до 7,2-7,4.
Итого получаем:
|
В процентном соотношении от общего объема состав средства будет следующим, в масс. %:
|
Пример 2
Готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды, удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе при 60 об/мин при 70°, в полученный раствор вносится гентамицин или цефалексин до конечной концентрации 1 масс. %, доводят pH до 7,2-7,4.
Итого получаем:
|
В процентном соотношении от общего объема состав средства будет следующим, в масс. %:
|
Пример 3
Готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды, удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе при 60 об/мин при 70°, в полученный раствор вносится гексаметилентетрамин до конечной концентрации 5 масс. %, доводят pH до 7,2-7,4.
Итого получаем:
|
В процентном соотношении от общего объема состав средства будет следующим, в масс. %:
|
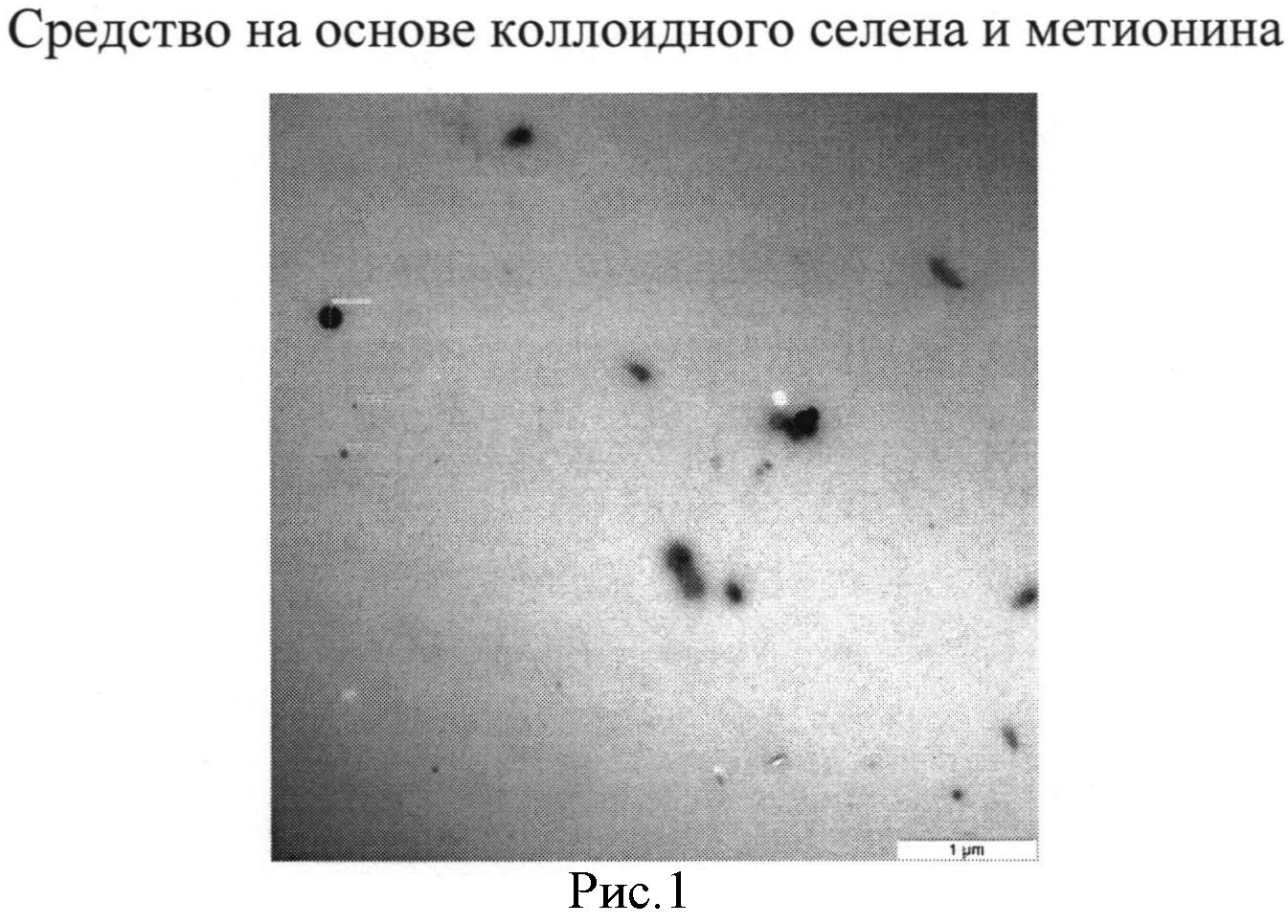
Размер частиц полученного средства изучали с использованием электронной микроскопии, результаты которой показали, что средство, полученное предложенным способом, содержит частицы селена от 40 до 100 нм (см. рис. 1). На рисунке видны наночастицы с размером от 40 до 100 нм.
Влияние коллоидного селена на внутриклеточное проникновение метионина определяли по его накоплению во внутриклеточном пространстве. Измерение метионина определяли хроматографически по следующей методике:
Определение концентрации метионина осуществляли методом высокоэффективной жидкостной хроматографии. Измерение концентрации метионина в клетках определяли на жидкостном хроматографе типа «Стайер», анализ проводили при длине волны - 288 нм, скорости потока - 0,9 см3/мин, объем вносимой пробы - 20 мкл, температура проведения анализа -30-35°C, элюэнт - ацетонитрил «для жидкостной хроматографии» - 1% раствор уксусной кислоты в соотношении 2:3 по объему. В указанных условиях хроматографируют стандартные растворы по два раза каждый. Измеряют площадь пика при времени удерживания 3,9-4,3 мин (зависит от эффективности колонки). По средним параллельных измерений, расхождение между которыми не должно превышать 5% (отн.), строят калибровочный график в координатах: площадь пика - концентрация мг/мл. Хроматографию анализируемых образцов проводят аналогично. По полученному среднему значению двух параллельных измерений (относительное стандартное отклонение которых не должно превышать 5%) из калибровочного графика находят концентрацию метионина в анализируемом растворе.
Накопление метионина наблюдали в перитонеальных клетках крыс и лимфоцитах.
Получение перитонеальных макрофагов
Перитонеальные макрофаги получали из брюшной полости крыс. Усыпленным хлороформом крысам внутрибрюшинно вводили 10 мл среды для выделения клеток из брюшной полости (среда 199+2% лошадиной сыворотки + 100 ед. гепарина + 100 ед. пенициллина) и выдерживали 1 мин, массируя брюшко. Затем крысу вскрывали и собирали введенную среду со смытыми макрофагами. После клетки осаждали при 2500 об/мин в течение 30 мин и отмывали 3 раза средой для отмывания клеток (среда 199+2% лошадиной сыворотки + 100 ед. пенициллина). Далее клетки ресуспендировали в среде для культивирования (среда 199+10% лошадиной сыворотки + 100 ед., пенициллина). Содержание и лейкограмму выделенных клеток определяли на геманализаторе «Arkus» (Австрия).
Получение лимфоцитов
Лимфоидные клетки получали из периферической крови телят. Периферическую кровь центрифугировали при 1500 об/мин в течение 30 мин, после чего отбирали плазму. Полученную плазму разводили раствором Хенкса 3:1. Разбавленную плазму наслаивали на фикол-верографин, не нарушая границу раздела плазма/фикол и центрифугировали при 1500 об/мин в течение 30 мин.
После центрифугирования собирали образовавшееся кольцо мононуклеарных клеток в отдельную пробирку, разбавляли раствором Хенкса 1:1 и осаждали клеточную фракцию при 3000 об/мин в течение 10 мин. Осадок отмывали раствором Хенкса 1:7 от фикол-верографина, осаждая клеточную фракцию так же. Осадок с остатком супернатанта в суммарном объеме 1 мл разводили средой для получения лимфоцитов (среда 199+5% лошадиной сыворотки + 0,1% желатина) 1:1, осаждали при 2000 об/мин в течение 10 мин и полученный осадок ресуспендировали в той же среде. Содержание и лейкограмму выделенных клеток определяли на геманализаторе «Arkus» (Австрия).
Инкубация частиц коллоидного селена конъюгированного с метионином с перитонеальными макрофагами и лимфоцитами
Исследуемый коллоидные частицы инкубировали с перитонеальными макрофагами и лимфоцитами в течение 3 часов в термостате при 37°C.
После окончания инкубации клетки трижды отмывали холодным физиологическим раствором для удаления непоглощенных частиц. После отмывки клетки суспендировали в 200 мкл физиологического раствора. В полученной клеточной суспензии замеряли количество накопившегося в клетках метионина методом ВЭЖХ, а также готовили мазки.
В результате проведенных экспериментов были получены следующие данные. При культивировании метионина, конъюгированного с коллоидным селеном как носителем, наибольшая концентрация препарата определялась при использовании в качестве объекта исследования перитонеальных макрофагов крыс. При использовании лимфоцитов цельной крови телят в качестве объекта проникновения нами наблюдалось снижение количества метионина в 2 раза в клеточной популяции (табл. 1). Полученные данные указывают на способность коллоидного селена переносить метионин во внутриклеточное пространство.
|
Аналогичные результаты получены и при использовании других низкомолекулярных веществ - гентамицина, гексаметилентетрамина, цефалексина, индол-3 карбинола.
Изучали биодинамику средства внутриклеточной доставки биологически активных веществ путем оценки проникающей способности коллоидных частиц селена внутрь клетки.
В качестве средства внутриклеточной доставки использовали средство, полученное в соответствии с примером 1 или 2.
Осуществляли маркирование препарата флуоресцентным красителем (ФИТЦ) по методике, описанной, например, в книге: Иммунологическаие методы / Под редакцией Г. Фримель, Перевод с немецкого А.П. Тарасова. - М.: Медицина, 1987, с. 130.
Объектом исследований служили белые мыши массой 20 грамм.
Все животные были разбиты на группы: первой группе мышей (n=3) препарат, меченый ФИТЦ, вводили внутримышечно в дозе 0,1 мл; второй - внутрибрюшинно в дозе 0,2 мл, третьей - орально в дозе 0,2 мл. Одна мышь была контрольной.
Через 2, 6 и 24 часа постмортально были получены отпечатки печени, почек, селезенки, костного мозга и мазок цельной крови.
Результаты исследований представлены в таблице 2.
|
Как видно из таблицы 2, комплекс на основе коллоидного селена с метионином или гентамицином в организме животных находится внутри структурных элементов, имеющих оболочку, т.е. внутри иммунокомпетентных клеток. При этом средство чаще всего проникает в клетки селезенки. Препарат достаточно быстро всасывается в желудочно-кишечном тракте.
Однако при оральном введении препарата в клеточные элементы крови он попадает значительно позднее, чем при парентеральном введении. Вместе с этим при парентеральном введении препарат достигает печени и селезенки позднее чем, при оральном.
Представленные данные свидетельствуют о проникновении препарата в клеточные элементы иммунокомпетентных органов, где и происходит его метаболизация. Отсутствие препарата в межклеточном пространстве указывает на его полную биодеградацию клеточными элементами.
Таким образом, средство не подвергается ферментной деградации и нейтрализации печенью, т.е. оно полностью проникает во внутриклеточное пространство.
Сам коллоидный селен, являясь частью метаболической цепочки организма, усваивается во внутриклеточном пространстве, т.е. в данном изобретении решена задача «утилизации» в организме самого носителя.
Определяли острую токсичность препарата методом Кербера.
Для этого использовали белых беспородных мышей в количестве 10 голов живой массой 20-25 г.
Средство на основе метионина или гентамицина вводили мышам внутрибрюшинно в максимально возможной дозе - 0,5 мл. Средство вводили в течение суток через каждые 3-4 часа.
В течение первых суток за мышами вели тщательное наблюдение, отмечая поведение, потребление пищи, воды, а также общее состояние.
Всего наблюдения вели в течение 2-х недель, гибели мышей не наблюдали. Таким образом, можно констатировать, что препарат относится к группе нетоксичных соединений.
Аналогичные результаты получены и при использовании других низкомолекулярных веществ - гексаметилентетрамина, цефалексина, индол-3-карбинола.
Вышеизложенные эксперименты доказывают, что средство, полученное разработанным способом обладает низкой токсичностью и высокой биодоступностью.
Кроме того, биодинамика биологически активных низкомолекулярных соединений, конъюгированных с коллоидным селеном, происходит лимфогенным путем и в меньшей степени подвергается ферментной деградации и нейтрализации печенью, при этом биологически активные низкомолекулярные вещества проявляют свое действие непосредственно в патологическом очаге.
Способ получения средства внутриклеточной доставки биологически активного низкомолекулярного соединения, заключающийся в том, что готовят смесь 1 путем внесения 250 мкл 0,5М водного раствора селенистой кислоты в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 7,55, далее готовят смесь 2 путем внесения 250 мкл 0,5М водного раствора солянокислого гидразина в 8 мл ПЭГ 400, интенсивного перемешивания на магнитной мешалке при не менее 750 об/мин, pH данной смеси - 0,68, при интенсивном перемешивании вносится в смесь 1 смесь 2 по каплям, полученный раствор ставят на диализ против дистиллированной воды, удаляя ПЭГ 400 и солянокислый гидразин, избыток воды отгоняют на роторном испарителе при 60 об/мин и 70°C, в полученный раствор вносится низкомолекулярное соединение, выбранное из группы гентамицин, гексаметилентетрамин, метионин, цефалексин, индол-3-карбинол, доводят pH до 7,2-7,4, при этом компоненты смешивают в количестве, обеспечивающем содержание их в средстве, в масс. %: