Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ БИОАКТИВНОСТИ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и молекулярной биологии, может быть использовано в фармацевтической промышленности и касается способов оценки биоактивности химических соединений путем определения функциональной активности транскрипционных факторов в эукариотической клетке.
Уровень техники
Клеточные культуры с каждым годом находят все большее применение в самых разнообразных областях биологии, медицины и сельского хозяйства. Одной из важнейших областей применения культур клеток, безусловно, является их использование в качестве тест-объектов при фармакологическом скрининге. Технология высокопроизводительного скрининга или, другими словами, определения биоактивности различных химических соединений рассматривается в качестве ключевой на ранних этапах поиска и разработки лекарственных средств.
Современные системы фармскрининга способны проанализировать более 100 тыс. индивидуальных образцов в день на индивидуальной биомишени, что обычно позволяет выявить не более нескольких активных соединений, так называемых «хитов». Информация, полученная в процессе определения биоактивности, используется на последующих стадиях оптимизации хитов. Обнаруженные при этом соединения-лидеры затем подвергаются всесторонним испытаниям специализированными научно-исследовательскими и клиническими организациями. Результатом является идентификация соединений, которые после прохождения клинических испытаний могут стать лекарствами.
В настоящее время накоплен значительный экспериментальный материал по изучению биоактивности веществ различного происхождения на культуре клеток [1].
Однако процедура биотестирования, в том числе и лекарственных препаратов, достаточно сложна, дорога и требует значительного времени [2].
В связи с этим, одной из актуальных проблем при оценке биоактивности различных веществ является разработка и валидация адекватных тест-систем, сопоставимых по основным характеристикам с млекопитающими, для последующего использования таких тест-моделей вместо высших животных. Для успешной разработки и адекватного применения таких модельных систем необходимо детально представлять общие механизмы реализации биоактивности на клеточном уровне.
Механизмы клеточного ответа изучают с использованием современных технологий - транскриптомики и протеомики [3,4]. Однако, несмотря на высокий технический уровень, эти технологии имеют свои недостатки. Так, для высокочувствительной транскриптомики характерны нерешенные технические проблемы: высокий уровень неспецифической гибридизации, который ведет к уменьшению соотношения сигнал/шум и трудность в интерпретации полученных данных. С другой стороны, протеом человека гораздо более сложен по сравнению с транскриптомом и современная протеомная методология, несмотря на высокую специфичность, не способна инвентаризировать все белки клетки.
Таким образом, разработка новых способов оценки биоактивности различных химических веществ и биологических факторов, сочетающих в себе чувствительность транскриптомики и специфичность протеомики, является актуальной задачей.
Областями применения способов оценки биоактивности, безусловно, являются фармакология и токсикология. Первым этапом валидации кандидатных фармакологических субстанций является их тестирование на предмет токсичности и биологического действия на культуре клеток и на лабораторных животных.
Таким способом оценки биоактивности химических соединений может стать измерение активности транскрипционных факторов (ТФ) под действием тестируемого химического вещества. Транскрипционная активность ТФ (т.е. способность инициировать транскрипцию) регулируется различными сигнальными каскадами [5]. В ядре клетки ТФ связываются со специфическими последовательностями в регуляторных элементах генов-мишеней и активируют, либо ингибируют транскрипцию. Таким образом, анализируя активность единичного ТФ, возможно оценить активность всего соответствующего сигнального каскада. Измерение профиля активности всех ТФ является инструментом для анализа функционального состояния глобальной регуляторной сети клетки. Функциональная активность многих ТФ хорошо охарактеризована, то есть, следя за изменением активности определенных ТФ, можно получать полную информацию о механизме действия различных химических веществ и биологических факторов.
«Золотым» стандартом оценки функциональной активности ТФ является так называемый репортерный анализ, в котором репортерный ген находится под контролем ТФ-зависимого промотора. Измеряя изменение концентрации репортерного белка, можно судить об активности соответствующего ТФ. Однако, ограниченное число репортерных белков не позволяет производить мультиплексный анализ ТФ. Эта проблема может быть решена путем использования различных нуклеотидных последовательностей в качестве репортерных генов. Однако и этот методический подход имеет существенные ограничения, связанные с различной эффективностью транскрипции гетерогенных нуклеотидных последовательностей, их различной вторичной структурой и стабильностью в клетке. В конечном счете, все это влияет на чувствительность, специфичность и воспроизводимость технологий.
Поскольку существующие сегодня методические подходы не позволяют производить множественную оценку активности ТФ, в данном изобретении предлагается новая технология оценки биоактивности химических соединений на основе анализа активности ТФ в эукариотической клетке с использованием флуоресцентного и хромато-масс-спектрометрического анализа.
В работе Romanov S. et al. [6] (ближайший аналог) был предложен метод определения активности различных ТФ эукариот. Принцип этого метода заключается в следующем. Культура клеток гепатоцитов HepG2 трансфицируется плазмидными конструкциями, в которых регуляторным элементом является ТФ-зависимый промотор, под контролем которого находится ген щелочной фосфатазы. В данной системе детектируется не конечный продукт - щелочная фосфатаза, а транскрипт кодирующего ее гена. Гетерогенность транскриптов реализуется путем введения в последовательность репортерного гена сайта для расщепления эндонуклеазой рестрикции на различном расстоянии от старта транскрипции. После действия индуктора происходит тотальное выделение РНК, построение комплементарной ДНК, введение метки в кДНК, гидролиз кДНК эндонуклеазой рестрикции и анализ продуктов расщепления с использованием капиллярного электрофореза. Многочисленность, сложность и трудоемкость стадий анализа делает эту систему ограниченной для применения. Кроме того, нестабильность транскриптов в клетке может приводить к искажению конечного результата.
Задачей настоящего изобретения является разработка быстрого, высокочувствительного, воспроизводимого метода определения активности ТФ эукариот по детекции конечного продукта - протеотипического пептида с использованием хромато-масс-спектрометрического анализа.
Поставленная задача решается путем транзиентной трансфекции клеток линии эукариот путем введения в клетку плазмидного вектора, содержащего регуляторные элементы для ТФ и последовательность нуклеотидов, кодирующих протеотипический пептид (ПП). Протеотипическими считаются протеолитические пептиды, соответствующие белковому продукту одного гена и не встречающиеся в продуктах других генов в составе генома, а также способные ионизироваться и детектироваться при масс-спектрометрическом анализе.
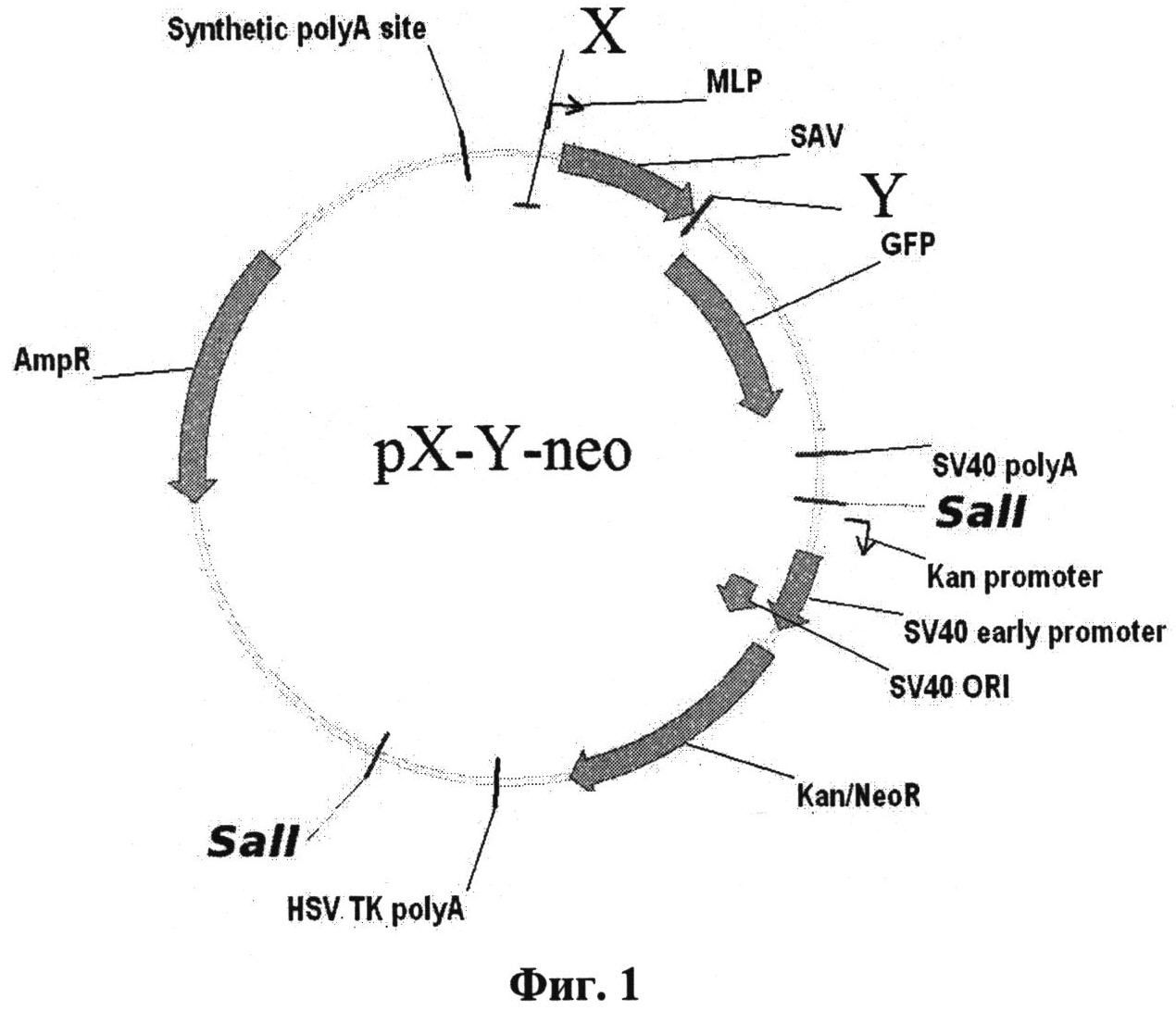
Плазмидный вектор содержит необходимые регуляторные элементы для определения активности ТФ и последовательность нуклеотидов, кодирующих ПП, причем для каждого ТФ используется индивидуальный ПП. Плазмидный вектор, имеющий название pX-Y-neo (X - любой транскрипционный фактор эукариот, Y - протеотипический пептид, соответствующий данному транскрипционному фактору), получают на основе плазмиды pSEAP2-Basic (Clontech, США) путем клонирования последовательностей, кодирующих сайт связывания транскрипционного фактора по сайтам рестрикции Nhel - BglII и последовательности нуклеотидов, кодирующей протеотипический пептид по сайтам рестрикции EcoRI - BamHI и минимальный промотор аденовируса человека по сайтам BglII - HindIII. Таким образом, плазмидный вектор pX-Y-neo содержит минимальный промотор аденовируса человека типа 5; ген зеленого флуоресцирующего белка; последовательность нуклеотидов, кодирующих сайт связывания транскрипционного фактора; последовательность нуклеотидов, кодирующих протеотипический пептид; ген устойчивости к неомицину. Схема плазмидного вектора pX-Y-neo приведена на фиг.1. Благодаря наличию гена устойчивости к неомицину возможно получение стабильно трансфицированных линий на основе этого вектора.
Транзиентную трансфекцию плазмидным вектором pX-Y-neo клеток млекопитающих осуществляют путем липофекции. После добавления к этим клеткам химического вещества или биологического фактора, изменяющего (активирующего или ингибирующего) активность ТФ, происходит активация или ингибирование образования комплекса тестируемого ТФ с сайтом его связывания, что приводит к повышению или снижению уровня транскрипции гена, кодирующего протеотипический пептид, и гена зеленого флуоресцентного белка, приводящее, в свою очередь, к повышению или снижению концентрации протеотипического пептида в клетке, которое детектируется хромато-масс-спектрометрическим анализом и изменению концентрации зеленого флуоресцирующего белка, которое детектируется флуоресцентным анализом с использованием планшетного флуориметра или флуоресцентного микроскопа.
Таким образом, данный способ оценки биоактивности химических соединений сочетает в себе простоту исполнения (отсутствие стадии обратной транскрипции и мечения), чувствительность (детекция не транскриптов гена, а конечного продукта - пептида), специфичность (точный масс-спектрометрический анализ), воспроизводимость (возможность стандартизации протокола на каждом этапе), мультиплексность (одновременная оценка активности 50 ТФ), масштабность (анализ в планшетном формате), а также возможность нормализации данных по флуоресценции репортерного гена.
Раскрытие изобретения
Для оценки биоактивности химических соединений был разработан протокол, состоящий из двух последовательных стадий: (1) транзиентной трансфекции линии клеток эукариот плазмидным вектором, содержащим регуляторные элементы для определенного транскрипционного фактора, последовательность, кодирующую протеотипический пептид и ген, кодирующий зеленый флуоресцентный белок и (2) непосредственно определения биоактивности тестируемого химического соединения по изменению активности ТФ.
На первой стадии проводят:
1) трансфекцию культуры клеток НЕК. 293 (АТСС CRL-1573) рекомбинантным плазмидным вектором pX-Y-neo с использованием липофектамина 2000 (Invitrogen, США).
На второй стадии проводят:
1) добавление к стабильно трансфицированным клеткам вещества, изменяющего активность транскрипционного фактора;
2) измерение концентрации протеотипического пептида с использованием хромато-масс-спектрометра и флуоресценции зеленого флуоресцирующего белка GFP с использованием флуоресцентного микроскопа или планшетного спектрофлуориметра.
Пример реализации изобретения
Определение изменения активности транскрипционного фактора CREB в транзиентно трансфицированной линии клеток НЕК 293 после добавления индуктора транскрипционного фактора CREB - адреналина.
1.1. Клетки линии НЕК 293 выращивают в среде DMEM (Invitrogen, США), содержащей 10% эмбриональной бычьей сыворотки (ЭБС), 4.5 мг/мл глюкозы в 24 луночном планшете (Nunc, США) при температуре 37°С при 5% CO2.
1.2. Трансфекцию проводят с использованием липофектамина 2000 (Invitrogen, США) и плазмидного вектора pCREB-glix-neo. В одной пробирке к 1 мкг рекомбинантного плазмидного вектора добавляют 15 мкл среды MEM без ЭБС. В другой пробирке к 15 мкл среды MEM без ЭБС добавляют 5 мкл липофектамина. Перемешивают осторожным пилотированием, после чего содержимое пробирок объединяют и инкубируют при комнатной температуре 15 мин. Далее полученную смесь ДНК/липофектамин добавляют к клеткам.
2.1. Для тестирования определения изменения активности транскрипционного фактора CREB в транзиентно трансфицированной плазмидным вектором pCREB-glix-neo линии клеток НЕК 293, клетки выращивают и трансфицируют как описано в п.1.1-1.2.
2.2. К клеткам добавляют адреналин (Sigma, США) до конечной концентрации 10 мкМ и 100 мкМ и инкубируют в течении 24 часов.
2.3. Регистрацию флуоресценции производят на эпифлуоресцентном микроскопе ECLIPSE E800 с конфокальным модулем Nicon ECLIPSE Cl (Nicon, Япония) с аргоновым лазером. Конфокальные изображения получают с использованием 40Х 1,25 NA объектива, с разрешением 512×512 пикселей и обрабатывают с помощью программного обеспечения к микроскопу EZ-C1 2.00.
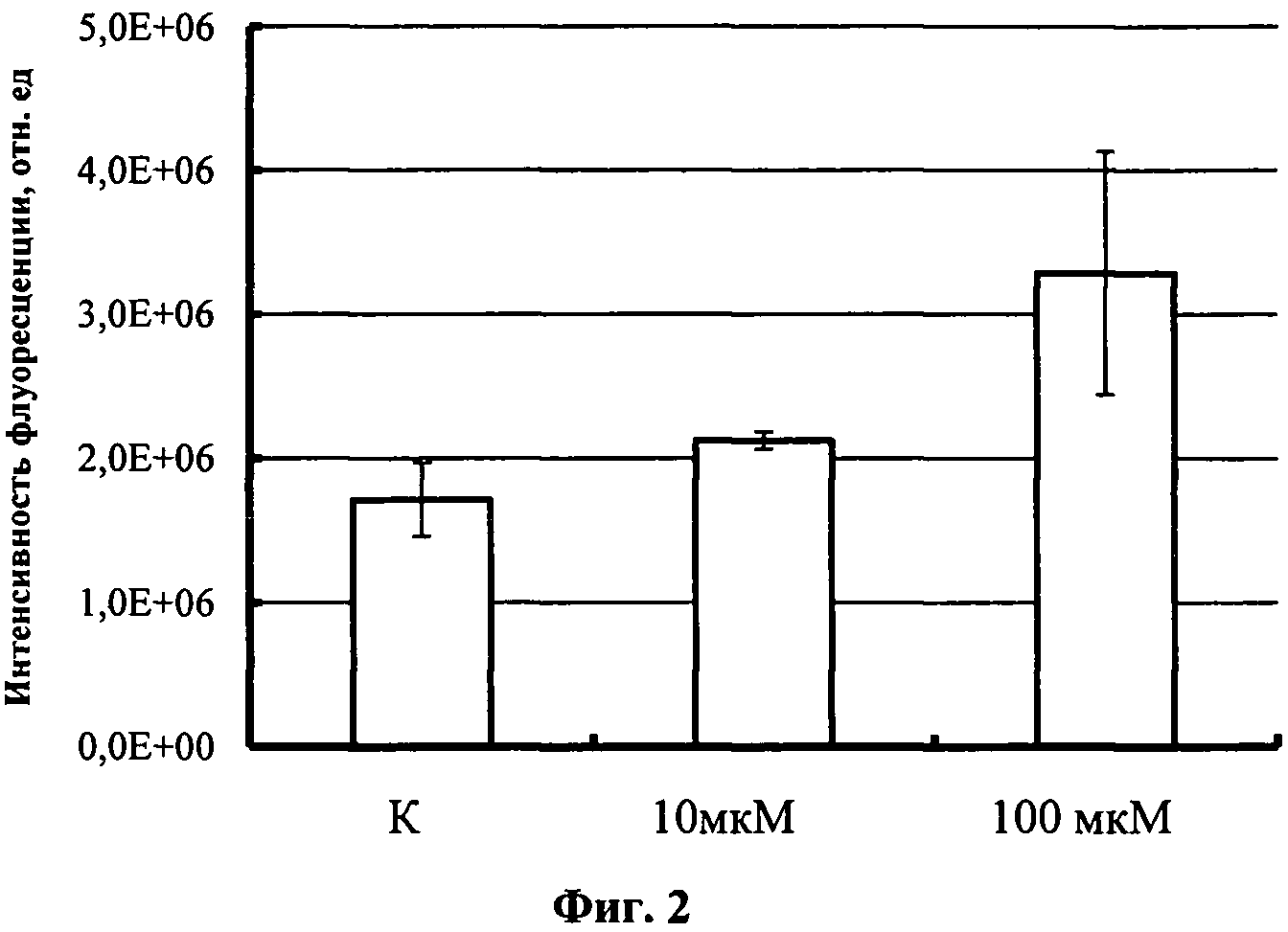
2.4. О увеличении активности транскрипционного фактора судят по увеличению интенсивности витальной GFP-флуоресценции образца монослойной культуры клеток в присутствии адреналина в сравнении с интактным образцом. Результаты приведены на фиг.2.
2.5. Хромато-масс-спектрометрический анализ проводят на масс-спектрометре TripleTOF 5600+, оснащенном источником ионов NanoSpray III (ABSciex, Canada) и совмещенном с нано-поточной хроматографической системой NanoLC Ultra 2D+(Eksigent). ВЭЖХ система используется в конфигурации предколонка - разделяющая колонка. Для хроматографического разделения используются следующие буферные растворы: буфер для загрузки образца на предколонку и буфер А - 98.9% H2O, 1% МеОН, 0.1% FA (v/v); буфер В - 99.9% CH2CN, 0.1% FA (v/v). Образцы суммарного клеточного лизата обессоливают через обращенно-фазовые картриджи SPE С 18 HLB Oasis (Waters), наносят на предколонку Chrom ХР С18 3 µm 120 Å 350 µm*0.5 mm (Eksigent, Dublin, CA) при скорости потока 3 мкл/мин в течение 10 мин. Разделение осуществляют на колонке 3C18-CL-120 (3 µm 120 Å) 75 µm*150 mm (Eksigent, Dublin, CA) при скорости потока 300 нл/мин в линейном повышающемся градиенте буфера В от 5 до 40% за 120 мин.
2.6. Для идентификации пептидов используют данные - зависимый режим работы масс-спектрометра. Каждый цикл включает 1 обзорный MS1 спектр с последующими 50 зависимыми MS2 спектрами. Для MS1 анализа используются следующие параметры работы прибора: диапазон масс для анализа и последующего отбора ионов для фрагментационного анализа 300-1250 m/z, время накопления сигнала 250 мс. Ионы для MS2 анализа выбираются на основании интенсивности ионного тока с пороговым значением 250 cps и зарядом от +2 до +5. Для MS2 анализа используют следующие параметры: разрешение квадруполя UNIT (0.7 Da), диапазон масс 200-1800 m/z, оптимизация фокусировки ионного пучка - для получения максимальной чувствительности (разрешение ~20000), время накопления сигнала 50 мс для каждого иона. Для столкновительной диссоциации используют азот. Энергия столкновений должна быть одинаковой для всех ионов и линейно изменяться от 25 до 55 В в течение 50 мс времени накопления сигнала. Ионы, для которых получают MS2 спектр, вносят в динамический лист исключения на 15 сек с целью повышения вероятности получения MS2 спектра в высшей точке хроматографического пика пептида (средняя ширина пика для компонентов составляла 30 сек).
2.6. Для анализа результатов хромато-масс-спектрометрии используют алгоритм Paragon (программа ProteinPilot, версия 4.5.0.0., ABSciex). Поиск осуществляют по базе данных SwissProt, таксой HomoSapiens. Проверку статистической достоверности идентификаций осуществляют на основании поиска по реверсированной базе данных белковых последовательностей.
Краткое описание чертежей
Фиг.1
Х - последовательности нуклеотидов, кодирующих сайты связывания соответствующих транскрипционных факторов
MLP - главный поздний промотор аденовируса человека типа 5
SAV - ген стрептавидина
Y - последовательность нуклеотидов, кодирующая протеотипический пептид
GFP - ген зеленого флуоресцирующего белка
SV40poly A - файт полиаденилирования из вируса SV40
Kan promoter - промотор гена устойчивости к неомицину/канамицину
SV40 early promoter и SV40 ORI - промотор и точка начала репликации из вируса SV40
Kan/NeoR - ген устойчивости к неомицину/канамицину
HSV TK polyA - сигнал полиаденилирования из гена тимидинкиназы вируса простого герпеса
AmpR - ген устойчивости к ампициллину
Synthetic polyA site - синтетический сигнал полиаденилирования
Фиг.2
Изменение активности транскрипционного фактора CREB (рассчитана по флуоресценции зеленого флуоресцирующего белка) в транзиентно трансфицированной плазмидным вектором pCREB-glix-neo линии клеток НЕК 293 после добавления адреналина в концентрации 10 мкМ и 100 мкМ.
Литература
[1] Astashkina A, Mann B, Grainger DW. A critical evaluation of in vitro cell culture models for high-throughput drug screening and toxicity. Pharmacol Ther. 2012. V.134. P.82-106.
[2] Azad MA, Wright GD. Determining the mode of action ofbioactive compounds. Bioorg Med Chem. 2012. V.20. P.1929-1939.
[3] Mendrick DL. Transcriptional profiling to identify biomarkers of disease and drug response. Pharmacogenomics. 2011. V.12. P.235-249.
[4] Govorun VM, Archakov AI. Proteomic technologies in modem biomedical science. Biochemistry (Mosc). 2002. V.67. P.I 109-1123.
[5] Spitz F, Furlong ЕЕ. Transcription factors: from enhancer binding to developmental control. Nat Rev Genet. 2012. V13. P.613-626.
[6] Romanov S, Medvedev A, Gambarian M, Poltoratskaya N, Moeser M, Medvedeva L, Gambarian M, Diatchenko L, Makarov S. Homogeneous reporter system enables quantitative functional assessment of multiple transcription factors. Nat Methods. 2008 V.5. P.253-260.
Способ оценки биоактивности химических соединений, отличающийся тем, что на первой стадии проводят транзиентную трансфекцию клеток линии HEK 293 плазмидным вектором pX-Y-neo (X - любой транскрипционный фактор эукариот, Y - протеотипический пептид, соответствующий данному транскрипционному фактору), содержащим минимальный промотор аденовируса человека типа 5; ген зеленого флуоресцирующего белка; последовательность нуклеотидов, кодирующих сайт связывания транскрипционного фактора; последовательность нуклеотидов, кодирующих протеотипический пептид; ген устойчивости к неомицину, затем на второй стадии определяют активность транскрипционного фактора путем флуоресцентного анализа и хромато-масс-спектрометрического измерения содержания протеотипического пептида в трансфицированной культуре клеток в присутствии тестируемого вещества в сравнении с трансфицированной интактной культурой клеток.