Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ТРАНСКРИПЦИОННЫХ ФАКТОРОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и молекулярной биологии, может быть использовано в фармацевтической промышленности и касается способов определения функциональной активности транскрипционных факторов в эукариотической клетке.
Уровень техники
В настоящее время накоплен значительный экспериментальный материал по изучению биоактивности веществ различного происхождения [1]. Однако, большинство исследований по изучению биологических эффектов этих веществ выполнено с помощью разнообразных, недостаточно стандартизированных методик и тест-систем, полученные при этом результаты часто не сопоставимы.
С практической точки зрения одной из актуальных проблем при оценке биоактивности различных веществ является разработка и валидация адекватных тест-систем, сопоставимых по основным характеристикам с млекопитающими, для последующего использования таких тест-моделей вместо высших животных. Для успешной разработки и адекватного применения таких модельных систем необходимо детально представлять общие механизмы реализации биоактивности на клеточном уровне. В настоящее время эта задача решается с использованием протеомики и транскриптомики [2].
В общем смысле, биоактивность различных химических соединений определяется при контакте их с клеткой-мишенью посредством анализа клеточных ответов. На молекулярном уровне, этот контакт активирует каскады реакций, которые передают в ядро клетки специфические сигналы для изменения экспрессии генов-мишеней и, соответственно, изменения концентрации белков, кодируемых этими генами. Считается, что наиболее исчерпывающий ответ можно получить путем транскрипционного профилирования клеточного ответа (измерением количества транскриптов). Данная методология и техника сегодня доступны в виде гибридизационных микрочипов [3]. Однако, для транскриптомики характерны нерешенные технические проблемы: например, высокий уровень неспецифической гибридизации ведет к уменьшению соотношения сигнал/шум. Другой проблемой является трудность в интерпретации транскриптомных данных.
Клеточный ответ также можно охарактеризовать путем анализа изменения паттернов белковых молекул - протеомики. Однако, протеом человека гораздо более сложен по сравнению с транскриптомом и современная протеомная методология еще далека от главной задачи протеомики - мониторинга всех белков клетки [4].
Таким образом, создание новых способов для изучения биоактивности различных химических веществ и биологических факторов, сочетающих в себе чувствительность транскриптомики и специфичность протеомики, является актуальной задачей.
Областью применения может стать молекулярная и экспериментальная онкология, где эти методы будут использоваться для валидации новых противоопухолевых препаратов и оценки их влияния не только на опухолевые клетки, но и на организм в целом.
Широкое поле для применения новых способов оценки биоактивности открывается и в фармакологии. Первым этапом валидации кандидатных фармакологических субстанций является их тестирование на культуре клеток и на лабораторных животных. Трудность интерпретации транскриптома человека накладывает серьезные ограничения применения существующих методов в этой области.
Как известно, адаптивная регуляция экспрессии генов происходит, главным образом, на уровне транскрипции и контролируется транскрипционными факторами (ТФ). В ядре ТФ связываются со специфическими последовательностями в регуляторных элементах генов-мишеней и активируют, либо ингибируют транскрипцию. Транскрипционная активность ТФ (т.е. способность инициировать транскрипцию) регулируется различными сигнальными каскадами [5]. Таким образом, анализируя активность единичного ТФ, возможно оценить активность всего соответствующего сигнального каскада. Измерение профиля активности всех ТФ является инструментом для анализа функционального состояния глобальной регуляторной сети клетки.
Для эукариотической клетки характерно наличие от 100 до 300 различных семейств ТФ, однако лишь небольшая их часть является индуцибельными ТФ, откликающимися на токсические компоненты и стресс. Следовательно, интерпретация клеточных ответов на уровне ТФ намного легче по сравнению с интерпретацией профилей экспрессии генов. Функциональная активность многих ТФ хорошо охарактеризована, то есть, следя за изменением активности определенных ТФ, можно получать полную информацию о механизме действия различных химических веществ и биологических факторов [6].
В разработке Romanov S. et al. [7] (ближайший аналог) был предложен метод определения активности различных ТФ эукариот. Принцип этого метода заключается в следующем. Культура клеток гепатоцитов HepG2 трансфицируется плазмидными конструкциями, в которых регуляторным элементом является ТФ-зависимый промотор, под контролем которого находится ген щелочной фосфатазы. В данной системе детектируется не конечный продукт - щелочная фосфатаза, а транскрипт кодирующего ее гена. Гетерогенность транскриптов реализуется путем введения в последовательность репортерного гена сайта для расщепления эндонуклеазой рестрикции на различном расстоянии от старта транскрипции. После действия индуктора происходит тотальное выделение РНК, построение комплементарной ДНК, введение метки в кДНК, гидролиз кДНК эндонуклеазой рестрикции и анализ продуктов расщепления с использованием капиллярного электрофореза. Многочисленность, сложность и трудоемкость стадий анализа делает эту систему ограниченной для применения. Кроме того, нестабильность транскриптов в клетке может приводить к искажению конечного результата.
Задачей настоящего изобретения является разработка быстрого, высокочувствительного, воспроизводимого метода определения активности ТФ эукариот по детекции конечного продукта репортерного гена с использованием флуоресцентного анализа.
Поставленная задача решается путем получения стабильно трансфицированных клеток линии эукариот путем введения плазмидного вектора, содержащего регуляторные элементы для ТФ и ген, кодирующий репортерный белок в хромосому этих клеток.
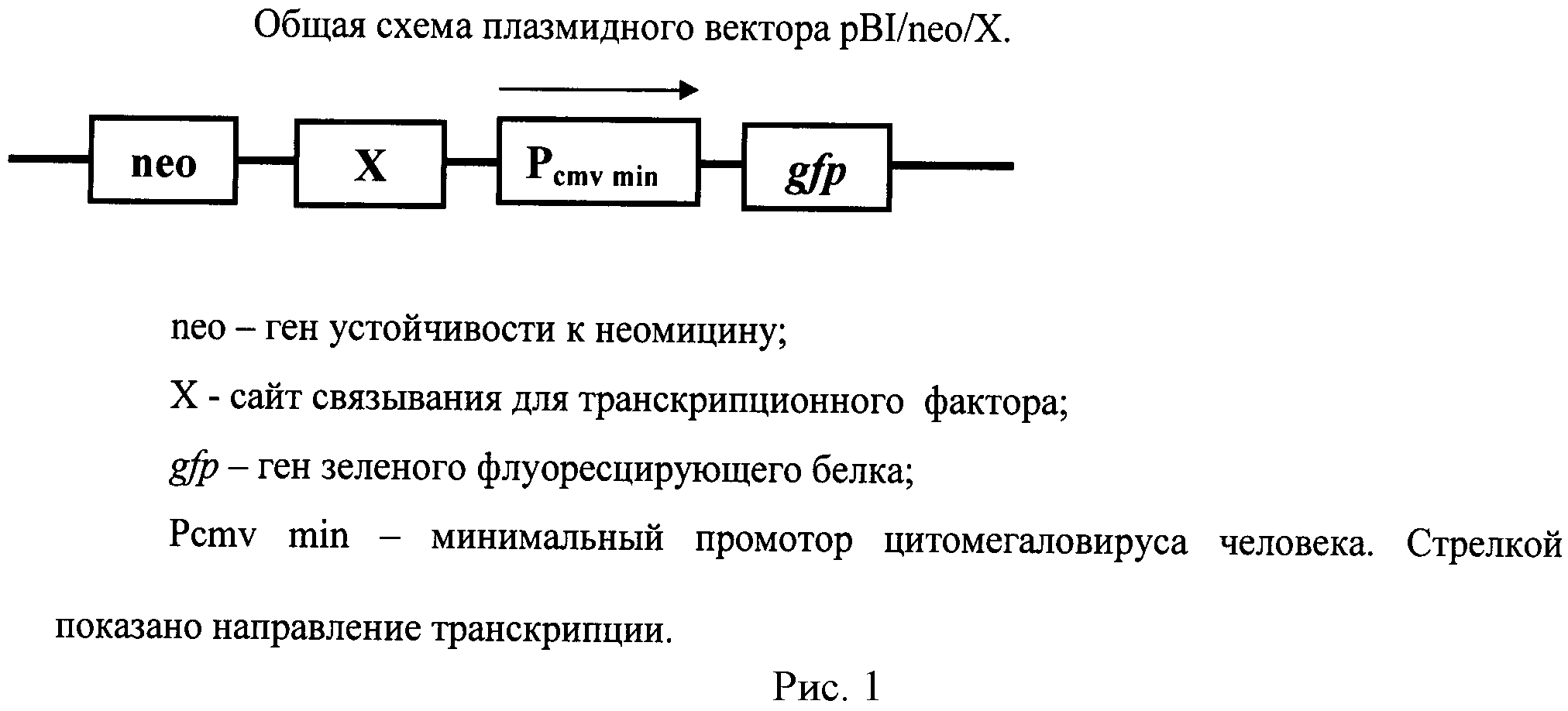
Плазмидный вектор содержит необходимые регуляторные элементы для определения активности ТФ и ген, кодирующий зеленый флуоресцирующий белок GFP. Плазмидный вектор, имеющий название pBI/neo/X, где X - любой ТФ, получают на основе плазмиды pBI-EGFP (Clontech, США) путем клонирования гена устойчивости к неомицину по сайту рестрикции PvuII и последовательности нуклеотидов, кодирующей сайт связывания определенного транскрипционного фактора по сайту рестрикции SacI. Таким образом, плазмидный вектор pBI/neo/X содержит ген устойчивости к неомицину, ген зеленого флуоресцирующего белка, последовательность нуклеотидов, кодирующую сайт связывания определенного транскрипционного фактора и минимальный промотор цитомегаловируса человека. Схема плазмидного вектора pBI/neo/Х приведена на рисунке 1.
Стабильно трансфицированные клетки линий эукариот получают путем введения ДНК плазмидного вектора pBI/neo/X в хромосому. После добавления к этим клеткам химического вещества или биологического фактора, изменяющего (активирующего или ингибирующего) активность ТФ, происходит активация или ингибирование образования комплекса тестируемого ТФ с сайтом его связывания, что приводит к повышению или снижению уровня транскрипции гена зеленого флуоресцентного белка, приводящее, в свою очередь, к повышению или снижению концентрации зеленого флуоресцирующего белка в клетке, которое детектируется флуоресцентными методами анализа (спекторофлуориметрией или флуоресцентной микроскопией).
Раскрытие изобретения
Для определения активности транскрипционных факторов был разработан протокол, состоящий из двух последовательных стадий: (1) получения стабильно трансфицированных клеток линии эукариот путем введения плазмидного вектора, содержащего регуляторные элементы для определенного транскрипционного фактора и ген, кодирующий зеленый флуоресцентный белок в хромосому и (2) непосредственно определения активности транскрипционного фактора.
На первой стадии проводят:
1. трансфекцию культуры клеток HeLa (АТСС CCL-2) рекомбинантным плазмидным вектором pBI/neo/Х с использованием липофектамина 2000 (Invitrogen, США);
2. получение клонов стабильно трансфицированных клеток HeLa путем добавления антибиотика G-418 (Invitrogen, США);
На второй стадии проводят:
1. добавление к стабильно трансфицированным клеткам вещества, изменяющего активность транскрипционного фактора;
2. измерение флуоресценции зеленого флуоресцирующего белка GFP с использованием флуоресцентного микроскопа или планшетного спектрофлуориметра.
Пример реализации изобретения
Определение изменения активности транскрипционного фактора NF-kB в стабильно трансфицированной линии клеток HeLa после добавления ингибитора транскрипционного фактора NF-kB - целастрола.
1.1. Клетки линии HeLa выращивают в среде DMEM (Invitrogen, США), содержащей 10% эмбриональной бычьей сыворотки (ЭБС), 2 мг/мл глюкозы в 24 луночном планшете (Nunc, США) при температуре 37°C при 5% CO2.
1.2. Трансфекцию проводят с использованием липофектамина 2000 (Invitrogen, США) и плазмидного вектора pBI/neo/ NF-kB. В одной пробирке к 1 мкг рекомбинантного плазмидного вектора добавляют 15 мкл среды MEM без ЭБС. В другой пробирке к 15 мкл среды MEM без ЭБС добавляют 5 мкл липофектамина. Перемешивают осторожным пипетированием, после чего содержимое пробирок объединяют и инкубируют при комнатной температуре 15 мин. Далее полученную смесь ДНК/липофектамин добавляют к клеткам.
1.3. Через 48 часов клетки пересевают в 6ти луночный планшет (Nunc, США) с использованием ростовой среды, описанной в п.1.1 с добавлением антибиотика G418 (Invitrogen, США) в концентрации 500 мкг/мл для селекции стабильно трансфицированных клонов. Ростовую среду с антибиотиком заменяют на новую каждые 48 часов.
1.4. Через 7-10 дней отдельные колонии клеток пересевают в культуральные флаконы (Nunc, США) и размножают.
2.1. Для тестирования определения изменения активности транскрипционного фактора NF-kB в стабильно трансфицированной плазмидным вектором pBI/neo/NF-kB линии клеток HeLa, полученной в пп.1.1-1.4, клетки выращивают в как описано в п.1.1.
2.2. К клеткам добавляют целастрол (Invivogen, США) до конечной концентрации 10 мкМ и инкубируют в течении 6 часов.
2.3. Регистрацию флуоресценции производят на эпифлуоресцентном микроскопе ECLIPSE Е800 с конфокальным модулем Nicon ECLIPSE C1 (Nicon, Япония) с аргоновым лазером. Конфокальные изображения получают с использованием 40Х 1,25 NA объектива, с разрешением 512×512 пикселей и обрабатывают с помощью программного обеспечения к микроскопу EZ-C1 2.00.
2.4. О подавлении активности транскрипционного фактора судят по снижению интенсивности витальной GFP-флуоресценции образца монослойной культуры клеток в присутствии целастрола в сравнении с интактным образцом. Результаты приведены на рисунке 2.
Литература
[1] Azad MA, Wright GD. Determining the mode of action of bioactive compounds. Bioorg Med Chem. 2012. V.20. P.1929-1939.
[2] Dunn DA, Apanovitch D, Follettie M, He T, Ryan T. Taking a systems approach to the identification of novel therapeutic targets and biomarkers. Curr Pharm Biotechnol. 2010. V.11. P.721-734.
[3] Mendrick DL. Transcriptional profiling to identify biomarkers of disease and drug response. Pharmacogenomics. 2011. V.12. P.235-249.
[4] Govorun VM, Archakov AI. Proteomic technologies in modern biomedical science. Biochemistry (Mosc). 2002. V.67. P.1109-1123.
[5] Spitz F, Furlong EE. Transcription factors: from enhancer binding to developmental control. Nat Rev Genet. 2012. V13. P.613-626.
[6] Lackner DH, Bähler J. Translational control of gene expression from transcripts to transcriptomes. Int Rev Cell Mol Biol. 2008. V.271. P.199-251.
[7] Romanov S, Medvedev A, Gambarian M, Poltoratskaya N, Moeser M, Medvedeva L, Gambarian M, Diatchenko L, Makarov S. Homogeneous reporter system enables quantitative functional assessment of multiple transcription factors. Nat Methods. 2008 V.5. P.253-260.
Способ определения активности транскрипционных факторов, отличающийся тем, что на первой стадии получают стабильно трансфицированные клетки линии HeLa путем введения в их хромосому плазмидного вектора pBI/neo/X (X - любой транскрипционный фактор эукариот), содержащего минимальный промотор цитомегаловируса человека, ген зеленого флуоресцирующего белка, последовательность нуклеотидов, кодирующих сайт связывания транскрипционного фактора, ген устойчивости к неомицину, затем на второй стадии определяют активность транскрипционного фактора путем измерения интенсивности витальной флуоресценции полученной культуры клеток в присутствии тестируемого вещества в сравнении с интактной культурой клеток.