Результат интеллектуальной деятельности: ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка претендует на приоритет предварительной заявки на патент США № 61/167389, поданной 7 апреля 2009 года.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Уникальные свойства наночастиц могут быть использованы для доставки ДНК в клетки. Среди исследованных наночастиц (например, вольфрама, алюминия, никеля и т.д.), наночастицы золота (НЧЗ), по-видимому, являются наилучшими кандидатами для доставки ДНК. Низкая цитотоксичность и легкость функционализации различными биологически важными лигандами делает наночастицы золота средством первого выбора при трансформации. Размеры наночастиц золота могут варьировать от 1,2 нм до 600 нм. В результате обычно используемого синтеза НЧЗ образуются частицы размером от 20 до 400 нм с отрицательно заряженной (например, покрытой цитратом) поверхностью, в то время как более мелкие НЧЗ размером от 1 до 10 нм заряжены положительно. Плазмидная ДНК, которая является достаточно гибкой, чтобы частично раскручивать свои основания, может быть подвергнута действию наночастиц золота. В случае функционализированных цитратом НЧЗ плазмидная ДНК может частично раскручиваться. Отрицательные заряды на остове ДНК достаточно удалены друг от друга, для того чтобы вызвать притяжение между основаниями за счет сил Ван дер Ваальса, и поэтому в присутствии наночастицы золота плазмидная ДНК прикрепляется к ней и покрывает ее поверхность. Между тем, в случае положительно заряженных НЧЗ электростатические и Ван дер Ваальсовы силы могут вносить свой вклад в покрытие или прикрепление ДНК.
Кроме наночастиц металлов наночастицы полупроводников (например, квантовые точки («КТ»)) с размерами 3-5 нм также могут быть использованы в качестве носителей для доставки молекул в клетки. ДНК и белки могут покрывать или быть присоединенными к поверхности КТ, то есть мультифункционализировать ее лигандом (см., например, Patolsky, F., et al., J. Am. Chem. Soc. 125, 13918 (2003)). Мультифункционализированные карбоновой кислотой или амином КТ могут быть связаны поперечной связью с молекулами, содержащими тиоловую группу (см., например, Dubertret, B. et al., Science 298, 1759 (2002); Akerman, M. E., W. C. W. Chan, P. Laakkonen, S. N. Bhatia, E. Ruoslahti, Proc. Natl. Acad. Sci. U.S.A. 99, 12617 (2002); Mitchell, G. P., C. A. Mirkin, R. L. Letsinger, J. Am. Chem. Soc. 121, 8122 (1999)) или N-гидроксисукцинимидную (NHS) сложноэфирную группу с использованием стандартных протоколов биоконъюгации (см., например, Pinaud, F., D. King, H.-P. Moore, S. Weiss, J. Am. Chem. Soc. 126, 6115 (2004); Bruchez, M., M. Moronne, P. Gin, S. Weiss, A. P. Alivisatos, Science 281, 2013 (1998)). Альтернативным способом мультифункционализации КТ является конъюгация со стрептавидином. Стрептавидин конъюгирует с биотинилированными белками, олигонуклеотидами или антителами (см., например, Dahan M. et al., Science 302, 442 (2003); Pinaud, F., D. King, H.-P. Moore, S. Weiss, J. Am. Chem. Soc. 126, 6115 (2004); Dahan M. et al., Science 302, 442 (2003); Wu. X. Y., et al., Nature Biotechnol. 21, 41 (2003); Jaiswal, J. K., H. Mattoussi, J. M. Mauro, S. M. Simon, Nature Biotechnol. 21, 47 (2003); и Mansson, A., et al., Biochem. Biophys. Res. Commun. 314, 529 (2004)).
Наночастицы были использованы для доставки плазмидной ДНК в различные животные клетки. Было обнаружено, что когда покрытые ДНК наночастицы инкубируют с клетками, не имеющими клеточной стенки, эти клетки поглощают наночастицы и начинают экспрессировать любые гены, кодируемые этой ДНК. В тех случаях, когда желательна доставка наночастиц в клетки, обычно имеющие клеточную стенку, эту клеточную стенку удаляют перед добавлением частиц к протопластам (см. Torney, F. et al., Nature Nanotechnol. 2, (2007)). В растительных клетках клеточная стенка действует как барьер для доставки экзогенно применяемых молекул. Множество инвазивных методов, таких как генная пушка (баллистическая трансфекция), микроинъекция, электропорация и трансфекция с помощью Agrobacterium, применялись для обеспечения доставки генов и малых молекул в растительные клетки, имеющие клеточную стенку. Доставка малых молекул и белков через клеточную стенку в растительную клетку была бы перспективна для развития передовых технологий in vitro и in vivo манипуляции клетками, тканями и органами интактных растений.
Хотя для бактерий, дрожжей, животных клеток и мхов добавление гена - введение чужеродной ДНК в заранее определенный участок генома - хорошо отработано, в случае высших растений это остается серьезной проблемой. Сайт-специфичное встраивание трансгена в растительные клетки происходит с очень низкой частотой по сравнению со случайным встраиванием даже тогда, когда вводимая ДНК содержит большие участки последовательности, гомологичные ДНК хозяина (Halfter et al. 1992; Lee et al. 1990; Mia and Lam (1995)). Например, высокоэффективная система агробактериальной трансфекции и гербицидная селекция у риса приводили к направленному встраиванию гена с частотой 5×10-4. Попытки повысить эффективность направленного встраивания гена у растений включали в себя использование маркеров для отрицательной селекции и использование генно-инженерных растений, обнаруживших более высокую частоту направленного встраивания. Несмотря на эти усилия случайное встраивание ДНК в результате негомологичных процессов продолжает оставаться главным препятствием для направленного встраивания генов у растений. Принимая во внимание общую пользу, ожидаемую от направленного встраивания генов при модификации сельскохозяйственных культур для сельского хозяйства и промышленной биотехнологии, решение этой проблемы является крайне необходимым.
В этом отношении существенное увеличение частоты направленного встраивания генов наблюдали у широкого круга растительных и животных модельных систем после индукции двухцепочечного разрыва ДНК (ДЦР) в конкретном участке генома клетки-хозяина, которая стимулирует естественный клеточный процесс гомологично направленной репарации ДЦР. Существующие в природе сайт-специфичные эндонуклеазы, сайты узнавания которых редко встречаются в растительном геноме, были использованы для этой цели, чтобы таким образом управлять встраиванием трансгена в последовательность-мишень, предварительно перенесенную в геном растения путем случайного встраивания. Эти исследования показывают перспективность использования направленной индукции ДЦР для повышения эффективности направленного встраивания генов в растительные клетки, хотя внесение ДЦР в нативный локус остается проблематичным.
Решение проблемы направленного изменения генома или манипуляции с ним в животных клетках было достигнуто за счет использования различных белков, специфично связывающихся с нуклеотидной последовательностью, таких как лейциновые застежки-молнии, белки с цинковыми пальцами и т.д. Эти белки участвуют в регуляции генов в качестве факторов транскрипции и/или могут быть использованы для индуцирования ДЦР в участках нативного генома. ДЦР может быть внесен несколькими различными классами сиквес-специфичных нуклеаз, такими как мегануклеазы, лейциновые застежки-молнии, белки с цинковыми пальцами и т.д., и в последнее время создаются новые гибридные варианты этих белков. Одними из наиболее описанных белков, специфично связывающихся с нуклеотидной последовательностью, являются белки с цинковыми пальцами (ZFP). Цинковый палец C2H2 был впервые обнаружен в факторе транскрипции амфибии TFIIIA, и с тех пор было установлено, что он является наиболее распространенным мотивом распознавания ДНК у всех видов многоклеточных. Рентгеноструктурный анализ C2H2 ZFP Zif268 выявил удивительный силлабический тип распознавания белок-ДНК, при котором каждый цинковый палец специфичен в отношении конкретного субсайта из 3 или 4 п.н. в случае их последовательного расположения, и было сделано предположение о возможности использования этого пептидного мотива в качестве каркаса для ДНК-связывающих доменов с новой специфичностью. С тех пор большое количество ZFP, сконструированных для того, чтобы связываться с новыми последовательностями, было с успехом использовано во множестве различных лабораторий в области искусственных факторов транскрипции и других функциональных гибридных белков. Домен C2H2 белка с цинковым пальцем был использован в качестве каркаса для сиквенс-специфичного связывания ДНК (Pavelitch and Pabo 1991), и нуклеазы с доменом цинкового пальца (ZFN) были получены путем слияния доменов белков с цинковыми пальцами с неспецифичным в отношении последовательности доменом нуклеазы, полученным из эндонуклеазы рестрикции FokI типа IIS (Kim et al. 1996). Рекомбинантные ZFN были использованы для обеспечения высокоэффективного нацеливания на эндогенный геномный локус в трансформированных (Moehle et al. 2007) и исходных клетках человека (Lombardo et al. 2007).
Первые попытки использования ZFN в растениях оказались многообещающими (Lloyd et al. 2005; Wright et al. 2005; Maeder et al. 2008). Конструкция, несущая ген ZFN под контролем индуцибельного промотора вместе с соответствующей распознаваемой ею последовательностью, была стабильно встроена в Arabidopsis, и было показано введение целевых мутаций в результате негомологичного соединения концов в сайте узнавания со средней частотой 7,9% среди индуцированных проростков потомства (Lloyd et al. 2005). Аналогично, из 66 растений табака, регенерированных из протопластов, трансформированных ZFN, предназначенной для расщепления локуса SuRA, у трех были обнаружены делеции одной пары оснований в сайте-мишени, появившиеся в результате негомологичного соединения концов при репарации (Maeder et al. 2008). Клетки табака, содержащие предварительно встроенный нефункциональный репортерный ген, у которого отсутствовал участок из 600 п.н., непосредственно фланкирующий последовательность распознавания цинкового пальца, при котрансформации их конструкциями, содержащими соответствующий ген ZFN и донорную ДНК, гомологичную предварительно встроенной последовательности, у которой отсутствовал участок из 600 п.н., обнаружили признаки гомологичной репарации репортерного гена (Wright et al. 2005). Совсем недавно основанный на дрожжевой системе тест был использован для выявления ZFN, способных расщеплять ген эндохитиназы растений (Cai et al., 2009). Агробактериальная доставка Ti плазмиды, несущей как ZFN, так и донорную ДНК конструкцию, содержащую кассету гена устойчивости к гербицидам pat, фланкированную короткими участками гомологии с локусом эндохитаназы, обеспечила до 10% направленного гомологичного встраивания трансгена точно в сайт расщепления ZFN. Важно отметить, что другие конструкции цинковых пальцев на основе домена C3H1 были использованы в растениях (Shukla et al., 2009, Cai et al. 2009).
Настоящее изобретение относится к способам использования наночастиц для неинвазивной доставки сиквенс-специфичных нуклеаз в растительные клетки, имеющие клеточную стенку.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следующие варианты осуществления изобретения описывают системы, средства и способы, которые предназначены быть примером и иллюстрацией данного изобретения и не ограничивают его объем.
В соответствии с настоящим изобретением предложены способы введения сиквенс-специфичной нуклеазы в растительную клетку, этот способ включает в себя: обеспечение наличия растительной клетки, имеющей клеточную стенку; покрытие наночастицы, по меньшей мере, сиквенс-специфичной нуклеазой; приведение растительной клетки, имеющей клеточную стенку, и наночастицы, покрытой сиквенс-специфичной нуклеазой, в контакт друг с другом; и обеспечение поглощения покрытой сиквенс-специфичной нуклеазой наночастицы растительной клеткой, имеющей клеточную стенку.
Кроме приведенных в качестве примера аспектов и вышеописанных вариантов осуществления изобретения дополнительные аспекты и варианты осуществления изобретения станут очевидны из следующего описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
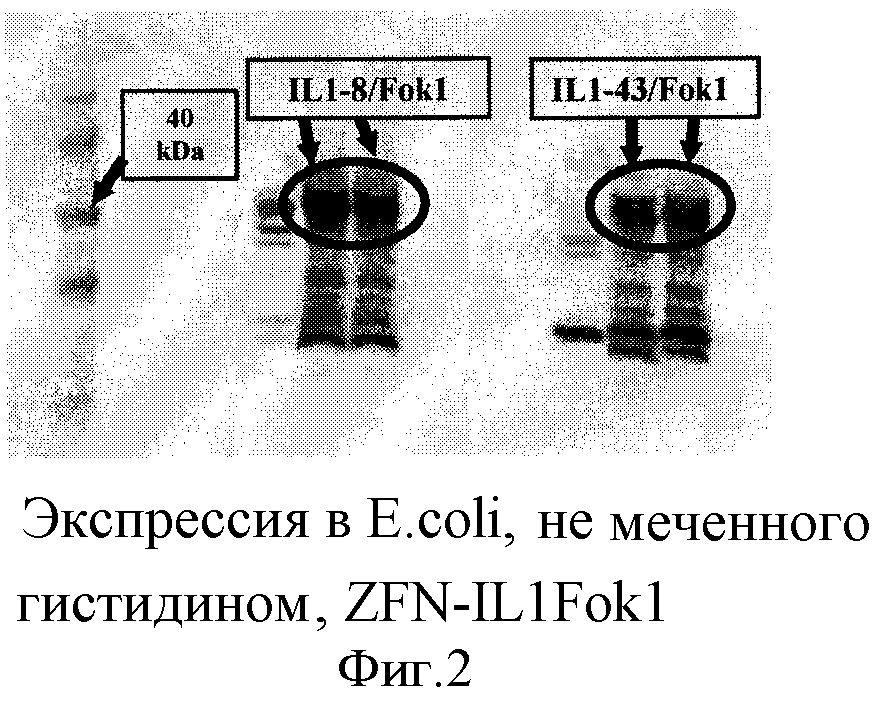
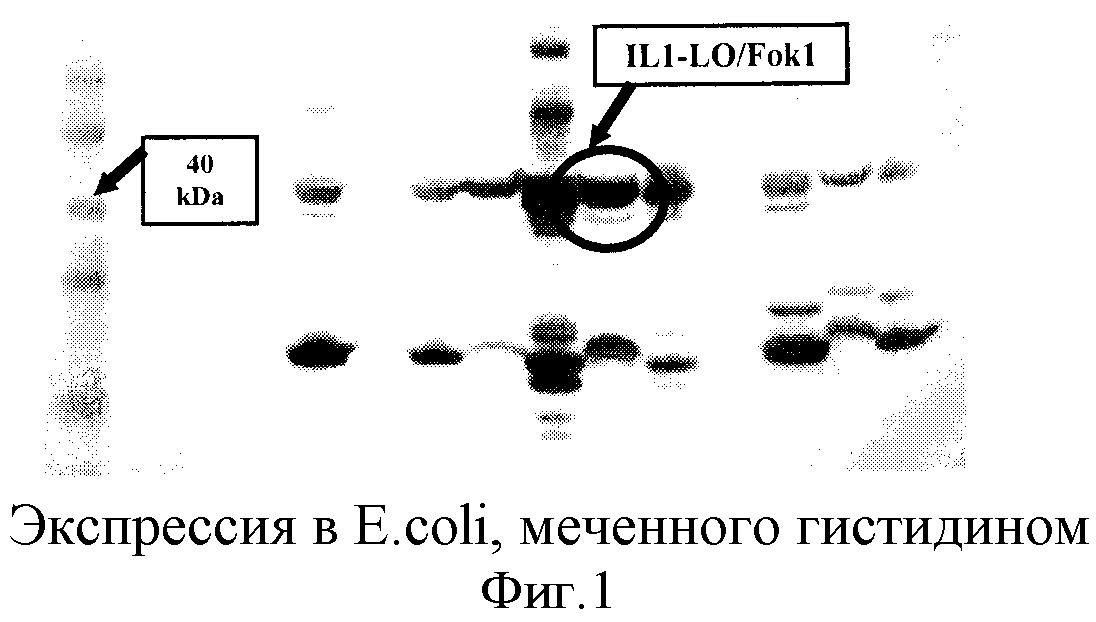
На фиг.1 и 2 показана экспрессия в E.coli, меченного гистидином (1) и не меченного гистидином (2), ZFN-IL1 FokI, соответственно.
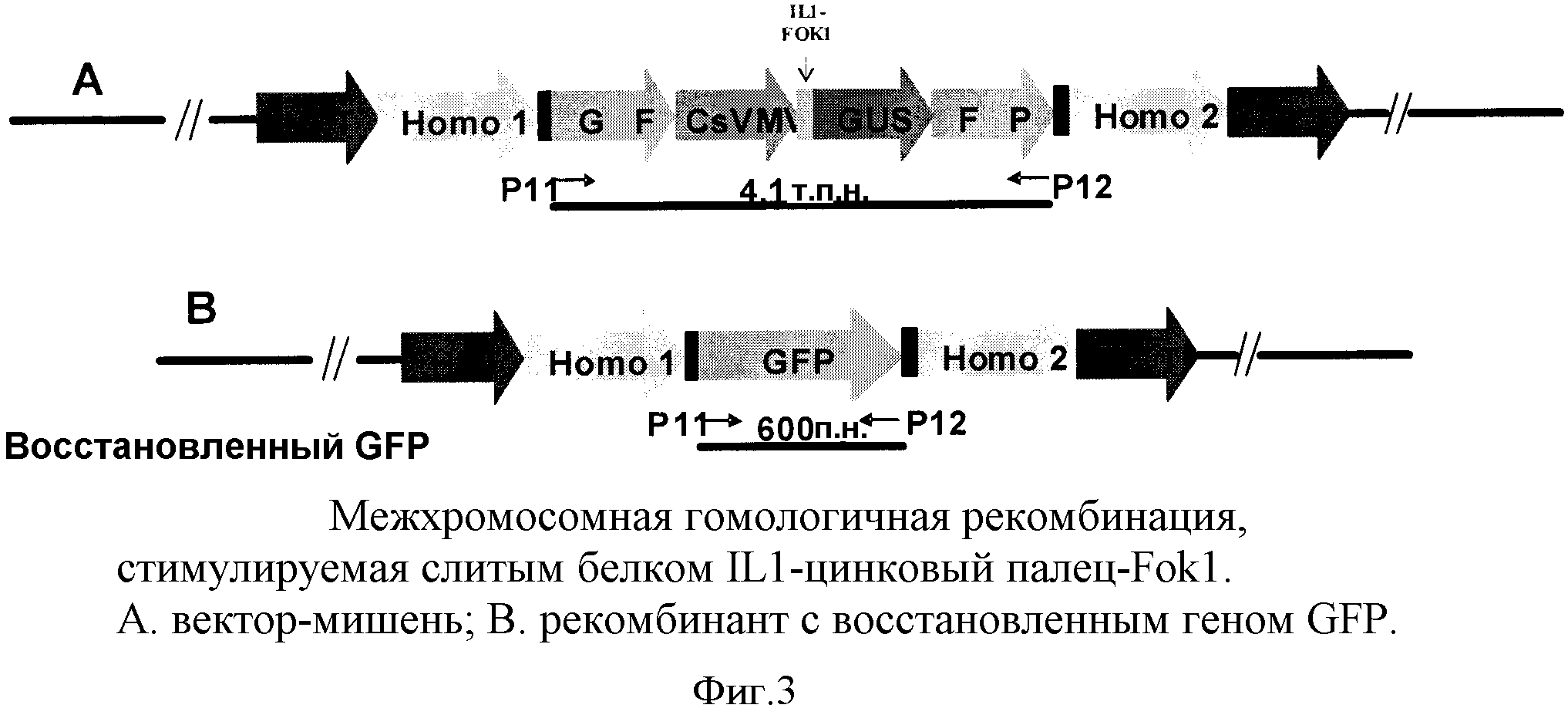
На фиг.3 показана межхромосомная гомологичная рекомбинация, стимулируемая слитым белком IL1-цинковый палец-FokI, где A представляет вектор-мишень и B представляет рекомбинант с восстановленным геном GFP.
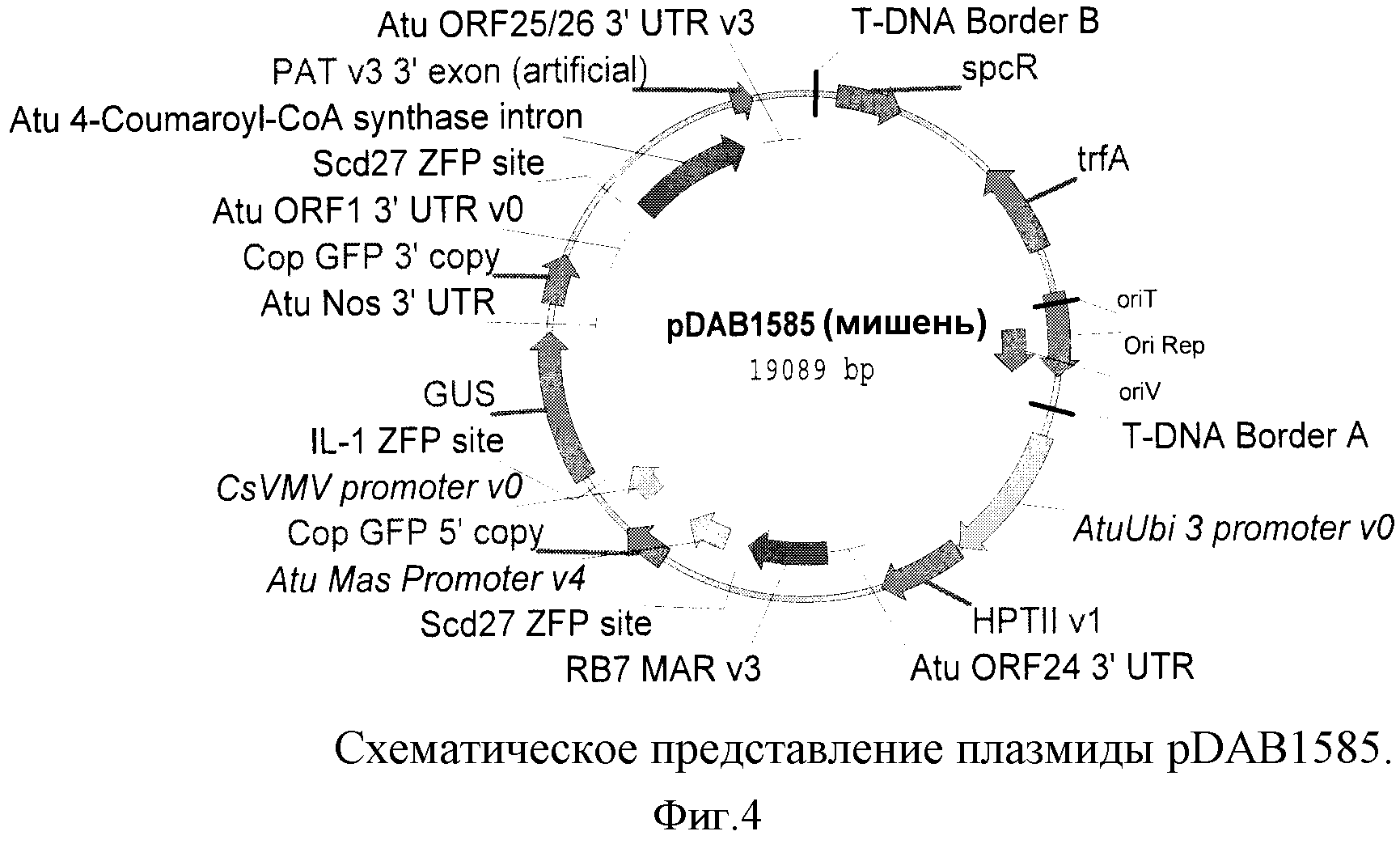
На фиг.4 показано схематическое изображение плазмиды pDAB1585.
На фиг.5 показаны клональные клеточные линии BY2-E, обнаружившие опосредованную НЧЗ интернализацию YFP после двух часов инкубации клеток; фотография A (флуоресцеин изотиоцианат (ФИТЦ)), B (родамин), C (дифференциальное интерференционное контрастирование), D (A+B), E (A+B+C), F (отраженное инвертированное изображение): интернализация YFP, наблюдаемая с помощью флуоресцентной микроскопии.
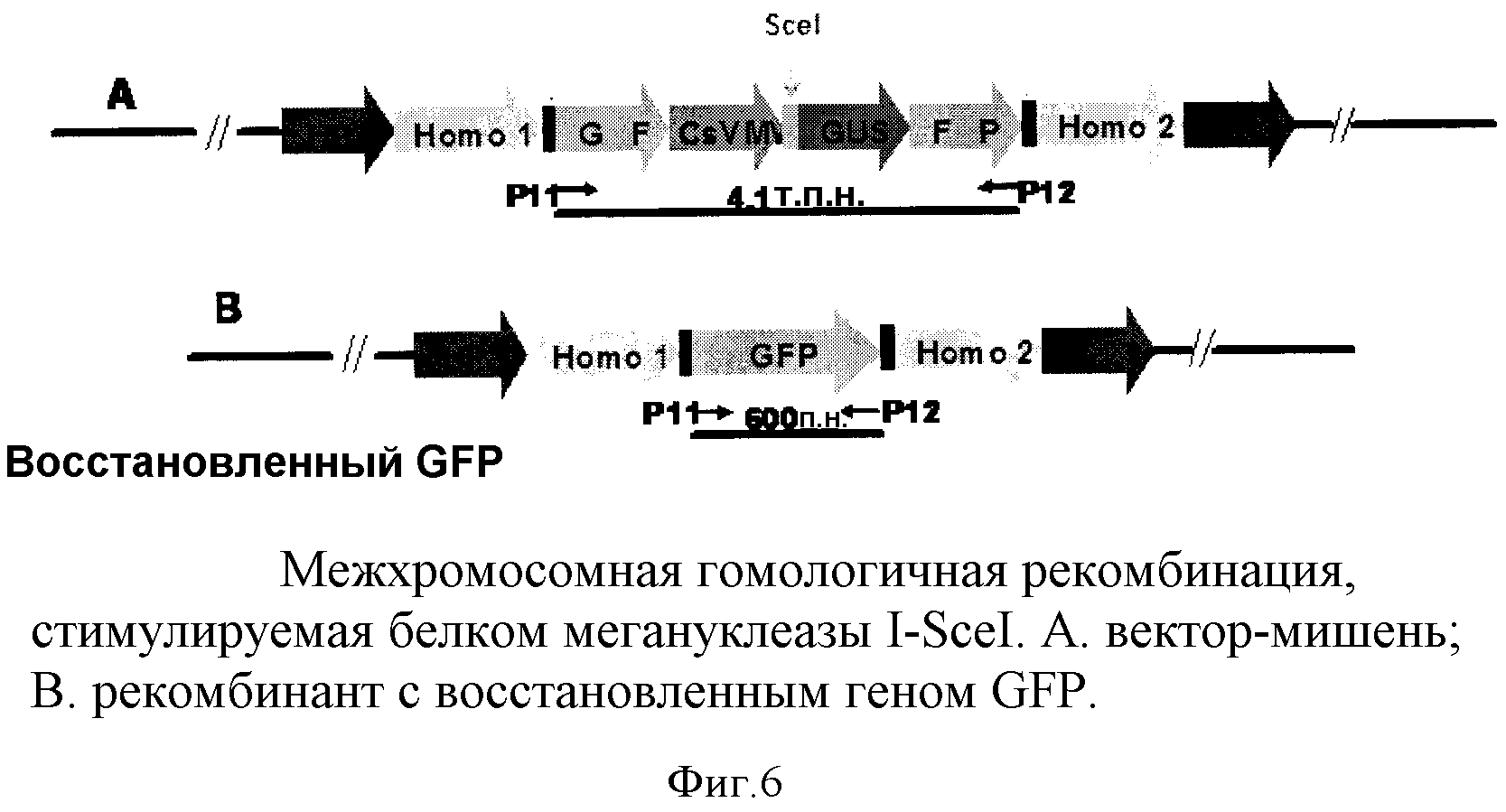
На фиг.6 показана межхромосомная гомологичная рекомбинация, стимулируемая белком мегануклеазы I-SceI, где A представляет вектор-мишень и B представляет рекомбинант с восстановленным геном GFP.
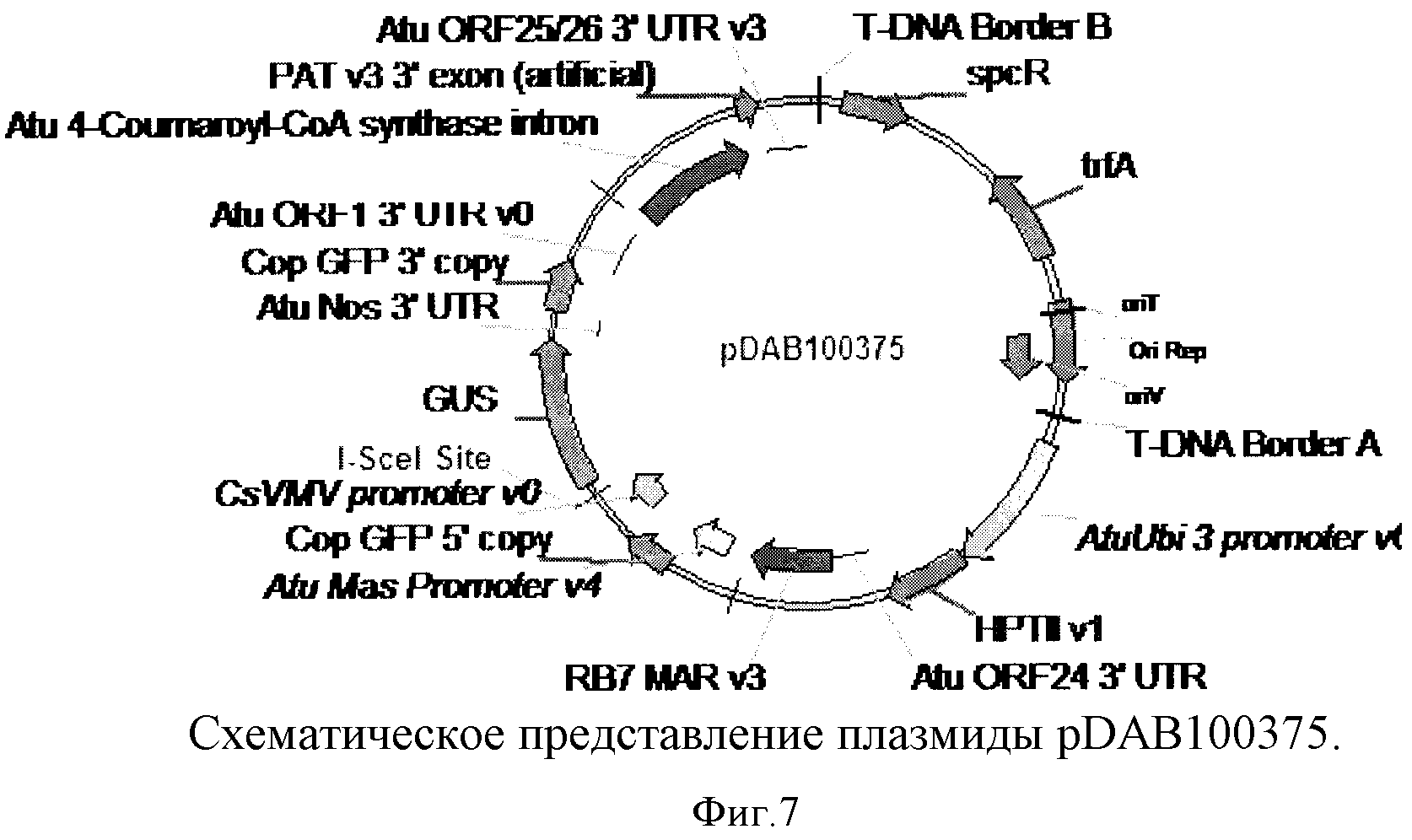
На фиг.7 показано схематическое изображение плазмиды pDAB100375.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В последующем описании употребляется много терминов. Для обеспечения ясного и единообразного понимания описания и формулы изобретения, включая объем этих терминов, приводятся следующие определения:
Возвратное скрещивание. Возвратным скрещиванием может быть процесс, при котором селекционер повторно скрещивает гибридное потомство с одним из родителей, например гибрид первого поколения F1 с одним из родительских генотипов гибрида F1.
Зародыш. Зародышем может быть маленькое растение, содержащееся в зрелом семени.
Наночастица. Микроскопическая частица, имеющая, по меньшей мере, одно наноразмерное измерение, обычно менее 100 нм. Наночастицы, пригодные для использования в настоящем изобретении, могут иметь размер от 1 нм до 0,4 мкм. Квантовая точка может иметь срединный диаметр от 1 нм до 10 нм, предпочтительно 2-4 нм. Наночастицы, используемые в настоящей заявке, включают в себя без ограничений наночастицы золота, наночастицы вольфрама, покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, наночастицы диоксида кремния, наночастицы полимера, наночастицы желатина, нанооболочки, наноядра, наносферы, наностержни, магнитные наночастицы, наночастицы полупроводников, квантовые точки, наноматрицы, дендримерные наноматрицы и их комбинации.
Квантовая точка. Квантовая точка является полупроводниковой наночастицей, которая ограничивает перемещение электронов зоны проводимости, дырок валентной зоны или экситонов (связанных пар электронов зоны проводимости и дырок валентной зоны) во всех трех пространственных направлениях. Ограничение может быть обусловлено электростатическими потенциалами (создаваемыми внешними электродами, легированием, механическим напряжением, примесями), наличием зоны соприкосновения между различными полупроводниковыми материалами (например, в нанокристаллических системах ядро-оболочка), наличием полупроводниковой поверхности (например, в полупроводниковом нанокристалле) или их комбинацией. Квантовая точка может иметь дискретный квантованный энергетический спектр. Соответствующие волновые функции пространственно локализованы внутри квантовой точки, но распространяются на многие периоды кристаллической решетки. Квантовая точка содержит небольшое определенное число (порядка 1-100) электронов зоны проводимости, дырок валентной зоны или экситонов (т.е. определенное число элементарных электрических зарядов).
Наноматрицы включают в себя без ограничений дендримеры. Дендримеры представляют собой сфероидальные или шарообразные наночастицы, созданные для того, чтобы переносить молекулы, инкапсулированные в их внутренние пустоты или прикрепленные к поверхности. Эти молекулы являются многократно разветвленными молекулами; ветвление позволяет возникать поливалентным взаимодействиям между поверхностью и внутренним веществом. Примером дендримера являются каскадные полимеры сферического катионного полиамидоамина (ПАМАМ). Эти полимеры состоят из первичных аминов на поверхности и третичных аминов внутри. Этот тип дендримера частично разлагается при термической обработке в присутствии растворителей, что приводит к меньшей жесткости пространственной структуры и большей гибкости. Большой положительный заряд дендримеров способствует возникновению электростатических взаимодействий с ДНК, а гибкая структура позволяет дендримеру сжиматься, когда он связан с ДНК, и расправляться при освобождении от ДНК. Эффективность трансфекции или трансформации повышается в результате положительного заряда и гибких структурных свойств дендримера. Дендримеры можно получить от компании Qiagen (Qiagen, Germantown, MD), дендримеры для потребителей поставляются на рынок под названием SuperfectTM Transfection Reagent (Cat # 301305).
Мультифункционализированные. Если не указано иное, то термин «мультифункционализированные» используется для описания или моно- или мультифункционализированных наночастиц. Термин «монофункционализированные частицы» относится к функционализированным наночастицам или агломератам наночастиц, с которыми химически связаны функциональные группы одного типа. Термин «мультифункционализированные частицы» относится к наночастицам или агломератам наночастиц, с которыми химически связаны функциональные группы, по меньшей мере, двух, а возможно трех и более различных типов.
Устойчивость к гербициду. Устойчивость к дозе гербицида относится к способности растения выживать (т.е. растение может не погибнуть) при такой дозе действующего вещества, которая подавляла бы рост и/или приводила бы неустойчивое растение к гибели. В некоторых случаях устойчивые растения могут временно пожелтеть или иначе проявить некоторые вызванные гербицидом повреждения, но потом восстанавливаются.
Стабилизированный. Термин «стабилизированный» относится к признакам растения, которые воспроизводимо передаются от одного поколения к следующему поколению инбредных растений того же сорта.
Поглощение. Термин «поглощение» относится к перемещению частиц или матриц, таких как наночастицы, например, золота, дендримеры или квантовые точки, через клеточную стенку или клеточную мембрану, где это перемещение не происходит только за счет импульса, сообщаемого частице чем-либо иным, кроме клетки, которой эта частица поглощается. Неограничивающими примерами устройств или способов, которые вызывают перемещение частицы через клеточную стенку или клеточную мембрану только за счет сообщаемого частице импульса, являются биолистика, генная пушка, микроинъекция и/или импалефекция.
Нуклеиновая кислота. Термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» являются взаимозаменяемыми и относятся к дезоксирибонуклеотидному, рибонуклеотидному полимеру или иному нуклеотидному или нуклеозидному полимеру в линейной или кольцевой конформации, находящемуся или в одно-, или в двухцепочечной форме. Применительно к настоящему раскрытию эти термины не следует рассматривать как ограничивающие по отношению к длине полимера. Эти термины могут охватывать известные аналоги естественных нуклеотидов, а также нуклеотиды с модифицированным основанием, сахаром и/или фосфатными группами (например, фосфотиоатные остовы). Обычно аналог конкретного нуклеотида имеет такую же специфичность спаривания оснований; т.е. аналог A будет спариваться с T.
Хромосома. Хромосома представляет собой хроматиновый комплекс, включающий в себя весь или часть генома клетки. Геном клетки часто характеризуется ее кариотипом, который является совокупностью всех хромосом, составляющих геном клетки. Геном клетки может включать в себя одну или несколько хромосом. «Эписома» является реплицирующейся нуклеиновой кислотой, нуклеопротеиновым комплексом или другой структурой, содержащей нуклеиновую кислоту, которая не является частью хромосомного кариотипа клетки. Примеры эписом включают в себя плазмиды и некоторые вирусные геномы. «Доступный участок» представляет собой участок клеточного хроматина, в котором сайт-мишень, присутствующий в нуклеиновой кислоте, может быть связан экзогенной молекулой, которая распознает этот сайт-мишень. Не желая быть связанными какой-либо конкретной теорией, считается, что доступный участок - это участок, который не упакован в нуклеосомную структуру. Точную структуру доступного участка часто можно определить по его чувствительности к химическим или ферментным зондам, например нуклеазам. «Сайт-мишень» или «последовательность-мишень» представляет собой нуклеотидную последовательность, которая образует часть нуклеиновой кислоты, с которой связывается связывающая молекула при наличии достаточных для связывания условий. Например, последовательность 5'-GAATTC-3' является сайтом-мишенью для эндонуклеазы рестрикции EcoRI.
Ген. Применительно к настоящему раскрытию термин «ген» включает в себя участок ДНК, кодирующий продукт гена, а также все участки ДНК, которые регулируют синтез продукта гена независимо от того, соседствуют ли такие регуляторные последовательности с кодирующими и/или транскрибируемыми последовательностями или нет. Исходя из этого ген включает в себя, но не обязательно ограничивается этим, промоторные последовательности, терминаторы, последовательности, регулирующие трансляцию, такие как сайты связывания рибосом и сайты внутренней посадки рибосом, энхансеры, сайленсеры, инсуляторы, пограничные элементы, точки начала репликации, сайты присоединения к матриксу и участки контроля локусов.
Экспрессия. Термины «экспрессия» или «генная экспрессия» являются взаимозаменяемыми и относятся к преобразованию информации, содержащейся в гене, в продукт гена. Продуктом гена может быть непосредственный транскрипционный продукт гена (например, мРНК, тРНК, рРНК, антисмысловая РНК, рибозим, структурная РНК или любой другой тип РНК) или белок, получаемый в результате трансляции мРНК. Продукт гена также включает в себя РНК, которые были модифицированы в результате таких процессов как кэппирование, полиаденилирование, метилирование и редактирование, и белки, модифицированные, например, метилированием, ацетилированием, фосфорилированием, убиквитинированием, АДФ-рибозилированием, миристилированием и гликозилированием. Термин «модуляция» генной экспрессии относится к изменению активности гена. Модуляция экспрессии может включать в себя без ограничений активацию гена или репрессию гена.
Белок. Термины «полипептид», «пептид» и «белок» являются взаимозаменяемыми и относятся к полимеру аминокислотных остатков. Эти термины также применяются к аминокислотным полимерам, у которых одна или несколько аминокислот являются химическими аналогами или модифицированными производными соответствующих аминокислот, встречающихся в природе.
Последовательность. Термин «последовательность» относится к нуклеотидной последовательности любой длины, которая может быть ДНК или РНК, может быть линейной, кольцевой или разветвленной и может быть или одноцепочечной, или двухцепочечной. Термин «донорная последовательность» относится к нуклеотидной последовательности, которая встраивается в геном. Донорная последовательность может быть любой длины, например от 2 до 25000 нуклеотидов в длину (или любое целое число между ними или больше их), предпочтительно от примерно 100 до 5000 нуклеотидов в длину (или любое целое число между ними), более предпочтительно от примерно 200 до 2500 нуклеотидов в длину.
Гомологичная последовательность. Термин «гомологичная последовательность» относится к первой последовательности, которая обладает определенной степенью идентичности по последовательности со второй последовательностью и чья последовательность может быть идентичной последовательности второй последовательности. Термин «гомологичная неидентичная последовательность» относится к первой последовательности, которая обладает определенной степенью идентичности по последовательности со второй последовательностью, но чья последовательность не является идентичной последовательности второй последовательности. Например, полинуклеотид, включающий в себя последовательность дикого типа мутантного гена, является гомологичным и неидентичным последовательности мутантного гена. В некоторых вариантах осуществления изобретения степень гомологии между двумя последовательностями является достаточной для осуществления гомологичной рекомбинации между ними с использованием нормальных клеточных механизмов. Две гомологичных неидентичных последовательности могут быть любой длины, и степень их негомологичности может составлять один нуклеотид (например, для исправления геномной точечной мутации при помощи направленной гомологичной рекомбинации) или достигать 10 или более тысяч пар нуклеотидов (например, при встраивании гена в заранее определенный сайт на хромосоме). Два полинуклеотида, включающих в себя гомологичные неидентичные последовательности, не обязательно должны быть одинаковой длины. Например, экзогенный полинуклеотид (т.е. донорный полинуклеотид) длиной от 20 до 10000 нуклеотидов или нуклеотидных пар может быть использован.
Рекомбинация. Термин «рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами. Применительно к настоящему раскрытию термин «гомологичная рекомбинация (ГР)» относится к специализированной форме такого обмена, который имеет место, например репарации двухцепочечных разрывов в клетке. Этот процесс требует гомологии нуклеотидных последовательностей, использует «донорную» молекулу для матричной репарации молекулы-«мишени» (т.е. молекулы, которая имеет двухцепочечный разрыв) и известен под разными наименованиями, таким как «некроссинговерная конверсия генов» или «конверсия коротких участков гена», потому что он приводит к передаче генетической информации от донора к мишени. Не желая быть связанными какой-либо конкретной теорией, такая передача может включать в себя исправление ошибочно спаренных оснований гетеродуплексной ДНК, которая образуется между разорванной мишенью и донором, и/или «синтез-зависимое спаривание цепей», при котором донор используется для ресинтеза генетической информации, которая станет частью мишени, и/или связанные с этим процессы. Такая специализированная ГР часто приводит к изменению последовательности молекулы-мишени таким образом, что часть или вся последовательность донорного полинуклеотида встраивается в полинуклеотид-мишень.
Расщепление. Термины «расщепление», «индуцирование двухцепочечного разрыва» и «разрыв» являются взаимозаменяемыми и относятся к разрыву ковалентного остова молекулы ДНК. Расщепление может быть инициировано различными способами, включая без ограничений ферментативный или химический гидролиз фосфодиэфирной связи. Возможно как одноцепочечное расщепление, так и двухцепочечное расщепление, и двухцепочечное расщепление может происходить в результате двух отдельных событий одноцепочечного расщепления. Расщепление ДНК может приводить к образованию или тупых концов или липких концов. В некоторых вариантах осуществления изобретения слитые полипептиды используются для направленного двухцепочечного расщепления ДНК. «Домен расщепления» включает в себя одну или несколько полипептидных последовательностей, обладающих каталитической активностью для расщепления ДНК. Домен расщепления может содержаться в одной полипептидной цепи, или расщепляющая активность может возникать в результате объединения двух (или более) полипептидов. «Неполный домен расщепления» представляет собой полипептидную последовательность, которая в сочетании со вторым полипептидом (или таким же, или другим) образует комплекс, обладающий расщепляющей активностью (как правило, двухцепочечной расщепляющей активностью). Термины «двухцепочечный разрыв» и «двухцепочечное расщепление» используются как синонимы.
Хроматин. Хроматин представляет собой нуклеопротеиновую структуру, вмещающую в себя геном клетки. Клеточный хроматин включает в себя нуклеиновую кислоту, преимущественно ДНК, и белок, включая гистоны и негистоновые хромосомные белки. Основная часть эукариотического клеточного хроматина существует в форме нуклеосом, где нуклеосомное ядро включает в себя приблизительно 150 пар оснований ДНК, связанных с октамером, включающим в себя по два каждого гистона H2A, H2B, H3 и H4; и ДНК-линкер (переменной длины в зависимости от организма) находится между нуклеосомными ядрами. Молекула гистона HZ обычно связана с ДНК-линкером. Применительно к настоящему раскрытию предполагается, что термин «хроматин» охватывает все типы клеточных нуклеопротеинов, как прокариотических, так и эукариотических. Клеточный хроматин включает в себя как хроматин хромосом, так и хроматин эписом.
Связывание. Термин «связывание» относится к сиквенс-специфичному, нековалентному взаимодействию между макромолекулами (например, между белком и нуклеиновой кислотой). При взаимодействии во время связывания не все компоненты обязательно являются сиквенс-специфичными (например, контакты в фосфатных остатках в остове ДНК) при условии, что взаимодействие в целом является сиквенс-специфичным. Такие взаимодействия, как правило, характеризуются константой диссоциации (Kd) 10-6 M-1 или ниже. Термин «сродство» относится к силе связывание: увеличенное сродство при связывании коррелирует с более низкой Kd.
Оперативная связь. Термины «оперативная связь» и «оперативно связанный» (или «операбельно связанный») являются взаимозаменяемыми и относятся к расположению в непосредственной близости двух или более компонентов (таких как элементы последовательности), при котором компоненты расположены так, что оба компонента функционируют нормально, и допускается возможность того, что, по меньшей мере, один из компонентов может обладать функцией, на которую оказывает действие, по меньшей мере, один из других компонентов. В качестве иллюстрации, регулирующая транскрипцию последовательность, такая как промотор, является оперативно связанной с кодирующей последовательностью, если эта регулирующая транскрипцию последовательность регулирует уровень транскрипции кодирующей последовательности в ответ на наличие или отсутствие одного или нескольких факторов регуляции транскрипции. Регулирующая транскрипцию последовательность, как правило, оперативно связана с кодирующей последовательностью, но не обязательно непосредственно примыкает к ней. Например, энхансер является последовательностью, регулирующей транскрипцию, которая оперативно связана с кодирующей последовательностью, даже если они не являются смежными. В случае слитых полипептидов термин «оперативно связанный» может относиться к тому факту, что каждый из компонентов, будучи связанным с другим компонентом, выполняет ту же функцию, какую он выполнял бы, если бы не был связан. Например, в случае слитого полипептида, в котором ДНК связывающий домен ZFP слит с доменом расщепления, ДНК связывающий домен ZFP и домен расщепления находятся в оперативной связи, если в этом слитом полипептиде область ДНК связывающего домена ZFP способна связываться с его сайтом-мишенью и/или его сайтом связывания, в то время как домен расщепления способен расщеплять ДНК вблизи от сайта-мишени.
Термин «сиквенс-специфичная нуклеаза (ССН)» относится к нескольким классам бифункциональных белков, способных распознавать специфичные и уникальные нуклеотидные последовательности (нативные или искусственно созданные сайты узнавания), таким как, без ограничений, мегануклеазы, лейциновые застежки-молнии и белки с цинковыми пальцами. Мегануклеазы представляют собой семейство ферментов, которые способны с высокой специфичностью расщеплять двухцепочечную ДНК в присутствии ионов двухвалентных металлов (Ca, Mn, Mg). Однако они отличаются от эндонуклеаз рестрикции по своим распознавательным свойствам и структуре (Belfort, M. Roberts RJ. Homing endonucleases: keeping the house in order; Nucleic Acid Research 1997, 25: 3379-3388). В частности, если эндонуклеазы рестрикции распознают короткие последовательности нуклеиновых кислот (3-8 п.н.), то мегануклеазы распознают более длинные последовательности (12-40 п.н.), что обеспечивает улучшенную специфичность при внесении ДЦР (Mueller, JE, Bryk, M. Loizos, N. Belfort M. Homing endonucleases. In Nucleases 2nd Edition. Linn, SM, Lloyd, RS, Roberts, RJ (Eds) Cold Spring Harbor Laboratory Press: 1993 111-143). Лейциновые застежки-молнии представляют собой класс белков, которые вовлечены в белок-белковые взаимодействия многих эукариотических регуляторных белков, являющихся важными факторами транскрипции, связанными с генной экспрессией. Термин «лейциновая застежка-молния» относится к структурному мотиву, общему для этих факторов транскрипции у представителей нескольких царств, включая животных, растения, дрожжи и т.д. Лейциновая застежка-молния образована двумя полипептидами (гомодимер или гетеродимер), которые связываются со специфичной последовательностью ДНК таким образом, что лейциновые остатки равномерно распределены по α-спирали, так что лейциновые остатки двух полипептидов оказываются на одной стороне спирали.
Связывающие ДНК белки с цинковыми пальцами. Связывающий ДНК белок с цинковым пальцем ZFP (или связывающий домен) представляет собой белок или домен большего белка, который связывает ДНК сиквенс-специфичным образом при помощи одного или нескольких цинковых пальцев, которые представляют собой участки аминокислотной последовательности связывающего домена, чья структура стабилизирована за счет координационных связей с ионом цинка. Термин «связывающий ДНК белок с цинковым пальцем» часто сокращают как белок с цинковым пальцем или ZFP. Связывающие домены цинкового пальца могут быть «сконструированы» так, чтобы связываться с заранее определенной нуклеотидной последовательностью. Неограничивающими примерами способов конструирования белков с цинковыми пальцами являются синтез и отбор. Синтезированным белком с цинковым пальцем является белок, не встречающийся в природе, чье строение/состав определены, в основном, исходя из рациональных критериев. Рациональные критерии для конструирования включают в себя применение правил замещения и компьютеризированных алгоритмов обработки информации в базе данных, хранящей информацию о существующих ZFP-конструкциях и данные о связывании. См., например, патенты США №№ 6140081; 6453242; 6534261 и 6785613; см., также международные заявки WO 98153058; WO 98153059; WO 98153060; WO 021016536 и WO 031016496; и патенты США №№ 6746838; 6866997 и 7030215.
Геномная последовательность. Геномные последовательности включают в себя последовательности, присутствующие в хромосомах, эписомах, геномах органелл (например, митохондрий, хлоропластов), искусственных хромосомах и в любом другом типе нуклеиновой кислоты, присутствующем в клетке, таком как, например, амплифицированные последовательности двойных микрохромосом и геномы эндогенных или инфицирующих бактерий и вирусов. Геномные последовательности могут быть нормальными (т.е. дикого типа) или мутантными; мутантные последовательности могут включать в себя, например, инсерции, делеции, транслокации, 25 перестройки и/или точечные мутации. Геномная последовательность может также включать в себя один из целого ряда различных аллелей.
Растительные клетки. Растительные клетки включают в себя без ограничений клетки односемянодольных (однодольных) или двусемянодольных (двудольных) растений, или водорослей, или мхов. Неограничивающие примеры однодольных включают в себя злаковые растения, такие как кукуруза, рис, ячмень, овес, пшеница, сорго, рожь, сахарный тростник, ананас, лук, банан и кокосовый орех. Неограничивающие примеры двудольных включают в себя табак, томат, подсолнечник, хлопчатник, сахарную свеклу, картофель, латук, дыню, сою, майолу (рапс) и люцерну. Растительные клетки могут быть получены из любой части растения и/или на любой стадии развития растения.
Целевая область. Целевая область представляет собой любой участок полимера нуклеиновой кислоты, такой как, например, ген или некодирующая последовательность внутри или рядом с геном, в котором желательно связывание экзогенной молекулы. Связывание может осуществляться с целью направленного расщепления ДНК и/или направленной рекомбинации. Целевая область может находиться, например, в хромосоме, эписоме, геноме органеллы (например, митохондриальном, хлоропластном), плазмиде, геноме инфицирующего вируса или в любой другой нуклеотидной последовательности. Целевая область может находиться в кодирующей области гена, в транскрибируемых не кодирующих областях, таких как, например, лидерные последовательности, концевые последовательности или интроны, или в нетранскрибируемых областях, находящихся перед или после кодирующей области. Длина целевой области может быть от одной пары нуклеотидов до 25000 пар нуклеотидов, или любое целое число пар нуклеотидов.
В некоторых вариантах осуществления настоящее изобретение может относиться к способу введения сиквенс-специфичной нуклеазы в растительную клетку, имеющую клеточную стенку, этот способ включает в себя приведение покрытой сиквенс-специфичной нуклеазой наночастицы в контакт с растительной клеткой и обеспечение прохождения этой наночастицы через растительную клеточную стенку. В частных аспектах изобретения наночастица может быть любой наночастицей и может обратимо или необратимо содержать, быть покрытой или быть иначе связанной и/или нести нуклеазу с доменом цинкового пальца и/или мегануклеазу. В некоторых вариантах осуществления изобретения нуклеаза с доменом цинкового пальца может быть введена в наночастицу до контакта с растительной клеткой, имеющей клеточную стенку, или одновременно с введением наночастицы в растительную клетку, имеющую клеточную стенку. Примеры наночастиц, которые могут быть использованы в вариантах осуществления настоящего изобретения, включают в себя без ограничений золото, квантовые точки, покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, наночастицы диоксида кремния, наночастицы полимера, наночастицы вольфрама, наночастицы желатина, нанооболочки, наноядра, наносферы, наностержни, магнитные наночастицы, наночастицы полупроводников, квантовые точки, наноматрицы и/или их комбинации.
Согласно вариантам осуществления настоящего изобретения растительная клетка, имеющая клеточную стенку, может быть любой растительной клеткой, содержащей интактную и целую клеточную стенку. Варианты осуществления настоящего изобретения могут включать в себя клетки, содержащие клеточную стенку, из любых тканей или любого места, где бы они не находились, включая без ограничений зародыши, меристематические клетки, каллусы, пыльцу, листья, пыльники, корни, корневые кончики, цветки, семена, стручки, стебли, суспензионные культуры и культуру тканей.
В конкретных вариантах осуществления изобретения ССН может быть любой ZFN, которая может быть доставлена в растительную клетку в соответствии с настоящим изобретением. Например, ZFN могут включать в себя слитые белки, содержащие домен расщепления (или неполный домен расщепления) и связывающий домен цинкового пальца, полинуклеотиды, кодирующие эти белки, и комбинации полипептидов и кодирующих полипептиды полинуклеотидов. Связывающий домен цинкового пальца может содержать один или несколько цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или больше цинковых пальцев) и может быть сконструирован таким образом, чтобы связываться с любой целевой областью. Таким образом, определив целевую область-мишень, в которой желательно осуществить расщепление или рекомбинацию, можно в соответствии с раскрытыми здесь способами сконструировать один или несколько слитых белков, содержащих домен расщепления (или неполный домен расщепления) и домен цинкового пальца, сконструированный таким образом, чтобы распознавать последовательность-мишень в указанной целевой области. Наличие такого слитого белка (или белков) в клетке будет приводить к связыванию этого слитого белка(ов) с его (их) сайтом(ами) связывания и расщеплению в указанной целевой области или рядом с ней. Кроме того, если в такой клетке также присутствует экзогенный полинуклеотид, гомологичный целевой области, то между нуклеотидной последовательностью двухцепочечного разрыва и экзогенным полинуклеотидом с высокой эффективностью происходит гомологичная рекомбинация.
В конкретных вариантах осуществления изобретения доставка, по меньшей мере, одной ССН в клетку может включать в себя непосредственную доставку одной или нескольких копий белка ССН в клетку при помощи наночастицы. В других вариантах осуществления изобретения доставка, по меньшей мере, одной ССН в клетку может включать в себя получение клетки с наночастицей, включающей в себя нуклеиновую кислоту, кодирующую ССН, и предоставление этой клетке возможности продуцировать ССН при помощи кодирующей ее нуклеиновой кислоты.
В других вариантах осуществления изобретения одна или несколько ССН, доставленных в клетку, способны производить расщепление по отдельности или совместно с другими ССН в одной или нескольких целевых областях или рядом с ними. В конкретных вариантах осуществления изобретения одна или несколько целевых областей могут находиться внутри кодирующей последовательности сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В некоторых вариантах осуществления изобретения одна или несколько целевых областей могут находиться внутри и/или рядом с локусом, включающим в себя нуклеотидную последовательность, кодирующую сильно, более сильно, очень сильно или наиболее сильно экспрессирующийся белок. В других вариантах осуществления изобретения нуклеотидная последовательность может быть двухцепочечным разрывом в одной целевой области. В дополнительных вариантах осуществления изобретения нуклеотидная последовательность может быть двухцепочечным разрывом в двух или нескольких целевых областях. В конкретных вариантах осуществления изобретения один или несколько двухцепочечных разрывов могут находиться в кодирующей последовательности сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В других вариантах осуществления изобретения один или несколько двухцепочечных разрывов могут находиться внутри и/или рядом с локусом, включающим в себя нуклеотидную последовательность, кодирующую сильно, более сильно, очень сильно или наиболее сильно экспрессирующийся белок.
В конкретном варианте осуществления изобретения, в котором сделаны, по меньшей мере, два двухцепочечных разрыва, репарация двухцепочечных разрывов может включать в себя удаление материала между двухцепочечными разрывами и повторное соединение концов нуклеотидных последовательностей таким образом, чтобы вырезать последовательности между двухцепочечными разрывами. В вариантах осуществления изобретения вырезаемые последовательности могут включать в себя, помимо прочего, последовательности, кодирующие всю или часть нуклеотидной последовательности, кодирующей сильно, более сильно, очень сильно или наиболее сильно экспрессирующийся белок. В дополнительных вариантах осуществления изобретения вырезаемые последовательности могут включать в себя, помимо прочего, регуляторные последовательности, оказывающие влияние на экспрессию сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В таких вариантах осуществления изобретения экспрессия сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка снижена по сравнению с уровнем экспрессии до расщепления.
В альтернативных вариантах осуществления изобретения, в которых сделаны, по меньшей мере, два двухцепочечных разрыва, репарация двухцепочечных разрывов может включать в себя удаление материала между двухцепочечными разрывами, замещение его донорной последовательностью таким образом, чтобы заменять донорной последовательностью последовательности между двухцепочечными разрывами. В других вариантах осуществления изобретения удаляемые последовательности могут включать в себя, помимо прочего, последовательности, кодирующие всю или часть нуклеотидной последовательности, кодирующей сильно, более сильно, очень сильно или наиболее сильно экспрессирующийся белок. В дополнительных вариантах осуществления изобретения удаляемые последовательности могут включать в себя, помимо прочего, регуляторные последовательности, оказывающие влияние на экспрессию сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В таких вариантах осуществления изобретения экспрессия сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка снижена по сравнению с уровнем экспрессии до расщепления.
В вариантах осуществления изобретения, в которых сделан один двухцепочечный разрыв, репарация этого двухцепочечного разрыва может включать в себя инсерцию донорной последовательности в или через двухцепочечный разрыв. В некоторых вариантах осуществления изобретения донорная последовательность может быть вставлена в кодирующую последовательность сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В вариантах осуществления изобретения инсерция такой последовательности может нарушать транскрипцию кодирующей последовательности сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка путем, в качестве неограничивающего примера, присутствия в рамке считывания стоп кодона. В дополнительных вариантах осуществления изобретения донор может, помимо прочего, нарушать функцию регуляторных последовательностей, оказывающих влияние на экспрессию сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка. В вариантах осуществления изобретения экспрессия сильно, более сильно, очень сильно или наиболее сильно экспрессирующегося белка снижена по сравнению с уровнем экспрессии до расщепления.
В еще других вариантах осуществления изобретения донорная последовательность может кодировать представляющий интерес белок. В дополнительных вариантах осуществления изобретения экспрессия представляющего интерес белка в донорной последовательности может контролироваться, регулироваться или быть оперативно связанной с регуляторными последовательностями, присутствующими в донорной последовательности, и/или регуляторными последовательностями, присутствующими в последовательности, в которую эта донорная последовательность была вставлена. В дополнительных вариантах осуществления изобретения последовательность нуклеиновых кислот, кодирующая представляющий интерес белок, может быть доставлена в клетку отдельно от или в сочетании с донорной последовательностью. В некоторых вариантах осуществления донорная последовательность может содержаться в той же молекуле нуклеиновой кислоты, что и последовательность, кодирующая представляющий интерес белок.
В других вариантах осуществления изобретения нуклеотидная последовательность, кодирующая сильно, более сильно, очень сильно или наиболее сильно экспрессирующийся белок, может находиться, например, без ограничений, в геноме, плазмиде, космиде, искусственной хромосоме, эписоме или в другой нуклеотидной структуре клетки.
При осуществлении способов, а также приготовлении и использовании композиций, раскрытых в настоящем изобретении, если не указано иное, применяются обычные технологии молекулярной биологии, биохимии, анализа структуры хроматина, вычислительной химии, культуры клеток, рекомбинантных ДНК и смежных областей, которые известны из уровня техники. Эти технологии подробно описаны в литературе. См., например, Sambrook et al. MOLECULAR CLONING: A LABORATORY MANUAL, Second edition, Cold Spring Harbor Laboratory Press, 1989 и Third edition, 2001; Ausubel et al, CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические обновления; серия METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, CHROMATIN STRUCTURE AND FUNCTION, Third edition, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, "Chromatin" (P.M. Wassarman and A.P. Wolffe, eds.), Academic Press, San Diego, 1999; and METHODS IN MOLECULAR BIOLOGY, Vol. 119, "Chromatin Protocols" (P.B. Becker, ed.) Humana Press, Totowa, 1999.
Доставка нуклеиновых кислот в растительные клетки
Как было отмечено выше, ДНК конструкции могут быть введены в желаемое растение-хозяин (например, в его геном) при помощи различных традиционных методов. Для знакомства с такими методами см., например, Weissbach & Weissbach Methods for Plant Molecular Biology (1988, Academic Press, N.Y.) Section VIII, pp. 421-463; и Grierson & Corey, Plant Molecular Biology (1988, 2d Ed.), Blackie, London, Ch. 7-9.
Например, ДНК конструкция может быть введена непосредственно в геномную ДНК растительной клетки при помощи таких методов, как электропорация и микроинъекция протопластов растительных клеток, или ДНК конструкция может быть введена непосредственно в растительную ткань при помощи биолистических способов, таких как бомбардировка частицами, несущими ДНК (см., например, Klein et al (1987) Nature 327:70-73). Как вариант, ДНК конструкции могут быть объединены с подходящими T-ДНК фланкирующими областями и введены в обычный хозяйский вектор Agrobacterium tumefaciens. Методы опосредованной Agrobacterium tumefaciens трансфекции, включая разоруженную трансфекцию и использование бинарных векторов, хорошо описаны в научной литературе. См., например, Horsch et al (1984) Science 233:496-498, и Fraley et al (1983) Proc. Nat. Acad. Sci. USA 80:4803.
Кроме того, перенос генов может осуществляться с использованием отличных от Agrobacterium бактерий и вирусов, таких как Rhizobium штамм NGR234, Sinorhizoboium meliloti, Mesorhizobium loti, X вирус картофеля, вирус мозаики цветной капусты и вирус мозаики прожилок листьев маниоки и/или вирус табачной мозаики, см., например, Chung et al. (2006) Trends Plant Sci. 11(1): 1-4.
Кроме того, проникающие в клетку пептиды, слитые с наночастицей или сиквенс-специфичной нуклеазой, могут быть использованы для доставки нуклеотидных или белковых последовательностей в растительную клетку. Проникающий в клетку пептид может быть экспрессирован, выделен и функционализирован наночастицей, нуклеотидной последовательностью или белком для доставки в растительные клетки. Проникающие в клетку пептиды, способные функционально доставлять молекулы в растительные клетки, известны из уровня техники и могут включать в себя без ограничений TAT (Chugh et al, (2008) FEBS 275: 2403-2414); R9 (Chang et al (2005) Plant Cell Physiol 46(3): 482-488 и Chen et al (2007) FEBS Lett 581(9): 1891-1897); MPG (Ziegler et al (2008) Adv Drug Deliver Rev 6: 580-597 и Morris et al (1997) Nucleic Acids Res. 25: 2730-2736); PEP1 (Henriques et al (2005) Biochemistry-US 44(3): 10189-10198); и проникающие в клетку пептиды растительного происхождения.
Вирулентные функции бактерии-хозяина Agrobacterium tumefaciens будут направлять инсерцию конструкции и фланкирующих ее маркеров в ДНК растительной клетки при инфицировании клетки бактериями с использованием бинарного T-ДНК вектора (Bevan (1984) Nuc. Acid Res. 12: 8711-8721) или процедуре совместного культивирования (Horsch et al (1985) Science 227: 1229-1231). Как правило, система агробактериальной трансфекции используется для трансформации двудольных растений (Bevan et al (1982) Ann. Rev. Genet 16: 357-384; Rogers et al (1986) Methods Enzymol. 118: 627-641). Система агробактериальной трансфекции также может использоваться для тансформации, а также переноса ДНК в однодольные растения и их клетки. См. Патент США № 5591616; Hemalsteen et al (1984) EMBO J 3: 3039-3041; Hooykass-Van Slogteren et al (1984) Nature 311: 763-764; Grimsley et al (1987) Nature 325: 1677-179; Boulton et al (1989) Plant Mol. Biol. 12:3 1-40; и Gould et al (1991) Plant Physiol. 95: 426-434.
Альтернативные способы переноса генов и трансфекции включают в себя без ограничений трансфекцию протопластов через поглощение депротеинизированной ДНК, опосредованное кальцием, полиэтиленгликолем (ПЭГ) или электропорацией (см. Paszkowski et al. (1984) EMBO J 3: 2717-2722, Potrykus et al. (1985) Molec. Gen. Genet. 199: 169-177; From et al. (1985) Proc. Nat. Acad. Sci USA 82: 5824-5828; и Shimamoto (1989) Nature 338: 274-276), и электропорацию растительных тканей (D'Halluin et al. (1992) Plant Cell 4: 1495-1505). Дополнительные способы трансфекции растительной клетки включают в себя микроинъекцию, опосредованное карбидом кремния поглощение ДНК (Kaeppler et al. (1990) Plant Cell Reporter 9: 415-418) и бомбардировку микрочастицами (см. Klein et al. (1988) Proc. Nat. Acad. Sci. USA 85: 4305-4309; и Gordon-Kim et al. (1990) Plant Cell 2: 603-618).
Раскрытые способы и композиции могут быть использованы для вставки экзогенных последовательностей в заранее определенные участки в геноме растительной клетки. Это является целесообразным, поскольку экспрессия введенного трансгена в растительном геноме критически зависит от места его интеграции. Таким образом, гены, кодирующие, например, питательные вещества, антибиотики или терапевтические молекулы, с помощью направленной рекомбинации могут быть вставлены в области растительного генома, благоприятные для их экспрессии.
Трансфицированные растительные клетки, полученные с помощью любого из вышеперечисленных методов трансфекции, могут быть культивированы для регенерации целого растения, обладающего трансфицированным генотипом и, таким образом, желаемым фенотипом. Такие методы регенерации основаны на манипуляции с определенными фитогормонами в питательной среде для культуры тканей, обычно полагаясь на биоцидные и/или гербицидные маркеры, которые были введены вместе с желаемыми нуклеотидными последовательностями. Регенерация растений из культивируемых протопластов описана в Evans, et al., «Protoplasts Isolation and Culture» in Handbook of Plant Cell Culture, pp. 124-176, Macmillian Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, pp. 21-73, CRC Press, Boca Raton, 1985. Регенерация также может быть осуществлена из растительных каллусов, эксплантов, органов, пыльцы, зародышей или их частей. Такие методы регенерации описаны в общих чертах в Klee et al (1987) Ann. Rev. of Plant Phys. 38: 467-486.
Вводимые в растительную клетку нуклеиновые кислоты могут быть использованы для придания желаемых признаков фактически любому растению. Широкий спектр растений и растительных клеточных систем может быть создан для желаемых физиологических и агрономических характеристик, описанных здесь, с использованием конструкций нуклеиновых кислот настоящего раскрытия и различных способов трансфекции, упомянутых выше. В предпочтительных вариантах осуществления изобретения растения и растительные клетки для целей генетической инженерии включают в себя без ограничений односемядольные и двусемядольные растения, такие как культурные растения, включая зерновые культуры (например, пшеница, кукуруза, рис, просо, ячмень), плодовые культуры (например, томат, яблоня, груша, земляника, апельсин), кормовые культуры (например, люцерна), корнеплоды (например, морковь, картофель, сахарная свекла, батат), листовые овощные культуры (например, латук, шпинат, капуста); цветочные растения (например, петуния, роза, хризантема), хвойные деревья и сосны (например, сосна, пихта, ель); растения, используемые в фиторемедиации (например, растения, накапливающие тяжелые металлы); масличные культуры (например, подсолнечник, рапс, соя, пальма) и растения, используемые для экспериментальных целей (например, Arabidopsis). Таким образом, раскрытые способы и композиции применяются к широкому кругу растений, включая без ограничений виды из родов Asparagus, Avena, Brassica, Citrus, Citrullus, Capsicum, Cucurbita, Daucus, Glycine, Gossypium, Hordeum, Lactuca, Lycopersicon, Malus, Manihot, Nicotiana, Oryza, Persea, Pisum, Pyrus, Prunus, Raphanus, Secale, Solanurn, Sorghum, Triticum, Vitis, Vigna и Zea.
Специалисту в данной области техники будет понятно, что после того как экспрессионная кассета была стабильно встроена в трансгенные растения и была подтверждена операбельность этого встраивания, она может быть введена в другие растения путем полового скрещивания. Любой из ряда стандартных селекционных методов может быть использован в зависимости от скрещиваемого вида.
Трансфицированные растительная клетка, каллус, ткань или растение могут быть выявлены и выделены путем отбора или скрининга модифицированного растительного материала по наличию признаков, кодируемых маркерными генами, присутствующими в трансфицирующей ДНК. Например, отбор может осуществляться путем выращивания модифицированного растительного материала на средах, содержащих ингибирующее количество антибиотика или гербицида, которому трансфицирующая генетическая конструкция придает устойчивость. Кроме того, трансфицированные растения и растительные клетки могут также быть выявлены при помощи скрининга по активности любого видимого маркерного гена (например, гены β-глюкуронидазы, люциферазы, B или C1 гены), которые могут присутствовать в рекомбинантной конструкции нуклеиновых кислот. Такие методики отбора и скрининга хорошо известны специалистам в данной области техники.
Физические и биохимические методы также могут быть использованы для выявления растений или растительных клеток трансфектантов, содержащих встроенные генные конструкции. Эти методы включают в себя без ограничений 1) Саузерн анализ или ПЦР амплификацию для детекции и определения структуры вставки рекомбинантной ДНК; 2) Нозерн блоттинг, ПЦР амплификация методом удлинения праймера или методом обратной транскрипции для детекции и изучения РНК транскриптов генных конструкций; 3) ферментный анализ для детекции ферментной или рибозимной активности, когда такие продукты генов кодируются генной конструкцией; 4) гель-электрофорез белков, метод Вестерн блоттинга, иммунопреципитация или иммуноферментный анализ, когда продуктами генных конструкций являются белки; 5) методы детекции однонуклеотидного полиморфизма, метод инвазивных зондов, пиросеквенирование, секвенирование методом солекса. Дополнительные методы, такие как гибридизация, ферментное окрашивание и иммуноокрашивание, также могут быть использованы для детекции наличия или экспрессии рекомбинантной конструкции в конкретных органах и тканях растения. Способы выполнения всех этих анализов хорошо известны специалистам в данной области техники.
Результаты генных манипуляций с использованием раскрытых здесь способов можно определить, например, путем Нозерн блоттинга РНК (например, мРНК), выделенной из представляющих интерес тканей. Как правило, если количество мРНК увеличилось, можно предположить, что соответствующий эндогенный ген экспрессируется с большей интенсивностью, чем до этого. Другие способы измерения генной активности могут быть использованы. Различные типы ферментного анализа могут быть использованы в зависимости от используемого субстрата и способа детекции увеличения или уменьшения количества продукта реакции или побочного продукта. Кроме того, уровень экспрессированного белка может быть измерен иммунохимически, т.е. при помощи твердофазного иммуноферментного анализа (ELISA), радиоиммуноанализа (RIA), иммуноферментного анализа (ИФА) и других основанных на антителах типов анализа, хорошо известных специалистам в данной области техники, таких как анализ с электрофоретической детекцией (или с окрашиванием, или с Вестерн блоттингом). Трансген может быть избирательно экспрессирован в определенных тканях растения или на определенной стадии развития, или трансген может быть экспрессирован практически во всех тканях растения в течение практически всего его жизненного цикла. Однако любые комбинации типов экспрессии также применимы.
Настоящее раскрытие также относится к семенам вышеописанных трансгенных растений, когда эти семена содержат трансген или генную конструкцию. Настоящее раскрытие также относится к потомству, клонам, клеточным линиям или клеткам вышеописанных трансгенных растений, когда эти потомство, клоны, клеточные линии или клетки содержат трансген или генную конструкцию.
Практическое применение
Раскрытые способы и композиции для направленного расщепления могут быть использованы для индуцирования мутаций в геномной последовательности. Направленное расщепление также может быть использовано для достижения нокаута гена или нокдауна гена (например, для функциональной геномики или целевой валидации) и для облегчения направленной вставки последовательности в геном (т.е. нокина последовательности). Инсерция может быть осуществлена путем замены хромосомных последовательностей с помощью, в качестве неограничивающего примера, гомологичной рекомбинации или направленной интеграции, при которой новая последовательность (т.е. последовательность, не находящаяся в целевой области) вставляется в заранее определенный сайт-мишень. В некоторых примерах такие новые последовательности могут быть фланкированы последовательностями, гомологичными целевой области в хромосоме. Те же способы также могут быть использованы для замены последовательности дикого типа мутантной последовательностью или для преобразования одного аллеля в другой аллель.
Направленное расщепление инфицирующих или интегрируемых в растение патогенов может быть использовано для лечения патогенных инфекций у растения-хозяина, например, путем расщепления генома патогена так, чтобы его патогенность ослаблялась или устранялась. Кроме того, направленное расщепление генов, кодирующих рецепторы для растительных вирусов, может быть использовано для того, чтобы блокировать экспрессию таких рецепторов, предотвращая тем самым вирусную инфекцию и/или распространение вируса в растении.
Примеры растительных патогенов включают в себя без ограничений вирусы растений, такие как Alfarnoviruses, Alphacryptoviruses, Badnaviruses, Betaciyptoviruses, Bigeminiviruses, Bromoviruses, Bymoviruses, Capilloviruses, Carlaviruses, Carrnoviruses, Caulimoviruses, Closteroviruses, Comoviruses, Cucurnoviruses, Cytorhabdoviruses, Dianthoviruses, Enamoviruses, Fabaviruses, Fijiviruses, Furoviruses, Hordeiviruses, Hybrigeminiviruses, Idaeoviruses, Ilawiruses, Ipomoviruses, Luteoviruses, Machlomoviruses, Macluraviruses, Marafiviruses, Monogeminiviruses, Nanaviruses, Necroviruses, Nepoviruses, Nucleorhabdoviruses, Oryzaviruses, Ourmiaviruses, Phytoreoviruses, Potexviruses, Potyviruses, Rymoviruses, сопутствующий WAS, satelliviruses, Sequiviruses, Sobemoviruses, Tenuiviruses, Tobamoviruses, Tobraviruses, Tornbusviruses, Tospoviruses, Trichoviruses, Tymoviruses, Umbraviruses, Varicosaviruses и Waikaviruses; патогенные грибы, такие как головня (например, Ustilaginales), ржавчина (Uredinales), спорынья (Clavicepts pupurea) и ложная мучнистая роса; плесени (Oomycetes), такие как Phytophthora infestam (фитофтороз картофеля); патогенные бактерии, такие как Erwinia (например, E. herbicola), Pseudomonas (например, P. aeruginosa, P. syringae, P. fluorescens и P. putida), Ralstonia (например, R. solanacearum), Agrobacterium и Xanthomonas; круглые черви (Nematoda); и Phytomyxea (Polymyxa и Plasmodiophora).
Раскрытые способы получения целевых белков при помощи направленной рекомбинации могут быть использованы для замены любой геномной последовательности с неидентичной последовательностью. Например, мутантная геномная последовательность может быть заменена своей копией дикого типа, что обеспечивает способы лечения заболеваний растений; придает устойчивость к растительным патогенам; повышает урожайность и т.д. Подобным образом один аллель гена может быть заменен другим аллелем при помощи способов направленной рекомбинации, раскрытых в настоящей заявке.
Во многих из этих случаев целевая область содержит мутацию, а донорный полинуклеотид содержит соответствующую последовательность дикого типа. Аналогично, геномная последовательность дикого типа может быть заменена мутантной последовательностью, если это необходимо. Например, сверхэкспрессия онкогена может быть подавлена или при помощи мутации этого гена или путем замены его регуляторных последовательностей последовательностями, которые поддерживают более низкий, непатологический, уровень экспрессии. В действительности, любая патология, зависящая от конкретной геномной последовательности, каким-либо образом может быть исправлена или ослаблена с помощью способов и композиций, раскрытых в настоящей заявке.
Направленное расщепление, инсерция, удаление и/или рекомбинация могут также быть использованы для изменения некодирующих последовательностей (например, регуляторных последовательностей, таких как промоторы, энхансеры, инициаторы, терминаторы, сайты сплайсинга) для того, чтобы изменять уровень экспрессии продукта гена. Такие способы могут быть использованы, например, для терапевтических целей, исследований в области функциональной геномики и/или целевой валидации.
Направленная модификация структуры хроматина может быть использована для облегчения связывания слитых белков с клеточным хроматином. В дополнительных вариантах осуществления изобретения одно или несколько слияний между связывающим доменом цинкового пальца и рекомбиназой (или ее функциональным фрагментом) может быть использовано в дополнение или вместо слияний цинкового пальца с доменом расщепления, раскрытых в настоящей заявке, с целью облегчения направленной рекомбинации. См., например, совместный Патент США № 6534261 и Akopian et al. (2003) Proc. Natl. Acad. Sci USA 100: 8688-8691. В дополнительных вариантах осуществления изобретения раскрытые способы и композиции используются для обеспечения слияния связывающих доменов ZFP с доменами активации или репрессии транскрипции, которые для своей активности требуют димеризации (или гомодимеризации, или гетеродимеризации). В этих случаях слитый полипептид включает в себя связывающий домен цинкового пальца и мономер функционального домена (например, мономер из димерного домена активации или репрессии транскрипции). Связывание двух таких слитых полипептидов с правильно расположенными сайтами-мишенями обеспечивает димеризацию с образованием домена активации или репрессии транскрипции.
Кроме того, как указано выше, способы и композиции, описанные в настоящей заявке, могут быть использованы для направленной интеграции экзогенных последовательностей в целевую область генома клетки, например в ту, в которой расщепление стимулирует инсерцию при помощи зависящих от гомологии механизмов (например, инсерция донорной последовательности, содержащей экзогенную последовательность вместе с одной или несколькими последовательностями, которые являются или идентичными или гомологичными, но неидентичными заранее определенной геномной последовательности (т.е. сайту-мишени)).
Донорная последовательность может обладать значительной гомологией в участках, фланкирующих экзогенную последовательность, для поддержки гомологично-направленной репарации двухцепочечного разрыва в геномной последовательности, обеспечивая тем самым инсерцию экзогенной последовательности в геномный сайт-мишень. Таким образом, донорная нуклеиновая кислота может быть любого размера, достаточного для поддержки интеграции экзогенной последовательности при помощи зависящих от гомологии механизмов (например, гомологичной рекомбинации). Не желая быть связанными какой-либо конкретной теорией, считается, что участки гомологии, фланкирующие экзогенную последовательность, обеспечивают получение разорванных концов хромосомы с матрицей для резинтеза генетической информации на участке двухцепочечного разрыва. В некоторых вариантах осуществления изобретения присутствуют две идентичных последовательности или две гомологичных, но неидентичных последовательности (или по одной из каждой), которые фланкируют экзогенную последовательность. Экзогенной последовательностью (или экзогенной нуклеиновой кислотой или экзогенным полинуклеотидом) является последовательность, содержащая нуклеотидную последовательность, которая обычно не присутствует в целевой области.
Примеры экзогенных последовательностей включают в себя без ограничений, кДНК, промоторные последовательности, энхансерные последовательности, эпитопные метки, маркерные гены, сайты узнавания ферментов расщепления и различные типы экспрессионных конструкций. См., например, Патент США № 6833252. Дополнительные примеры сайт-специфичных эндонуклеаз включают в себя I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, ICreI, I-TevI, I-TevII и I-TaiIII. Их сайты узнавания являются известными. См. также Патент США № 5420032; Belfort et al. (1997) Nucleic Acids Res. 25: 3379-3388; Dujon et al. (1989) Gene 82: 115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12: 224-228; Gimble et al. (1996) J. Mol. Biol. 263: 163-180; Argast et al. (1998) J. Mol. Biol. 280: 345-353 и the New England Biolabs catalogue.
Маркерные гены включают в себя без ограничений последовательности, кодирующие белки, которые обуславливают устойчивость к антибиотикам (например, устойчивость к ампициллину, устойчивость к неомицину, устойчивость к G418, устойчивость к пуромицину), последовательности, кодирующие окрашенные или флуоресцентные или люминесцентные белки (например, зеленый флуоресцентный белок, усиленный зеленый флуоресцентный белок, красный флуоресцентный белок, люциферазу) и белки, способствующие усиленному росту клеток и/или генной амплификации (например, дигидрофолатредуктаза). Так, примеры маркерных генов включают в себя без ограничений β-глюкуронидазу (GUS), фосфинотрицин-N-ацетилтрансферазу (PAT, BAR), неомицин фосфотрансферазу, p-лактамазу, катехолдиоксигеназу, α-амилазу, тирозиназу, P-галактозидазу, люциферазу, экворин, 5-енолпирувилшикимат-3-фосфатсинтазу (EPSP), нитрилазу, ацетолактатсинтазу (ALS), дигидрофолатредуктазу (DHFR), далапондегалогеназу и антранилатсинтазу. В некоторых вариантах осуществления изобретения направленная интеграция используется для инсерции РНК экспрессирующей конструкции, например, последовательностей, отвечающих за регулируемую экспрессию микроРНК или миРНК. Промоторы, энхансеры и дополнительные регулирующие транскрипцию последовательности, как описано выше, также могут быть включены в РНК экспрессирующую конструкцию.
Обычная трансформация использует случайную интеграцию чужеродной ДНК для получения модифицированных трансгенных культурных растений, обладающих желаемым признаком, которые подвергаются жестким ограничениям на некоторых зарубежных рынках. Кроме того, нежелательные последствия также возникают из-за способа введения ДНК или из-за случайной инсерции трансгена в чувствительные области генома, часто много раз на геном. В частности, последствия неточной вставки могут не проявлять себя в ранних поколениях, так как различные механизмы исправления ошибок в ДНК активируются в течение роста, размножения, эмбриогенеза и развития. Эти последствия влияют на время и стоимость любой программы по трансгенозу в сельскохозяйственной биотехнологии. Однако в недавнем изобретении компании Dow AgroSciences (WO/2008/021207) описан способ точной инсерции трансгенов при помощи гомологичной рекомбинации, опосредованной нуклеазами с доменом цинкового пальца (ZFN). С другой стороны, когда белок ZFN может быть экспрессирован и очищен вне целевого организма и затем доставлен в растительную клетку-мишень, оперативная специфическая мутация/нокаут гена могут быть индуцированы при помощи негомологичного соединения концов (НГСК). Таким образом, с помощью настоящего изобретения можно получать нетрансгенные генетически модифицированные растения, которые могли бы обходить ограничения на трансгенные сельскохозяйственные культуры, и процесс направленного изменения генов возможно будет осуществлять, не используя трансгенный подход.
Способы гетерологичной экспрессии белков сиквенс-специфичных нуклеаз, таких как белки ZFN, известны из уровня техники. Применимые экспрессионные системы включают в себя без ограничений: использование системы in vitro, такой как бесклеточная система зародышей пшеницы (см. Патент США № 7235382, включенный в настоящую заявку путем ссылки); экспрессионную систему Pseudomonas fluorescens (Madduri et al (2007) Protein Expres Purif, 55(2): 352-360); и белковую экспрессионную систему Pichia (см. Патенты США №№ 4683293; 4808537; 4812405; 4818700; 4837148; 4855231; 4857467; 4879231; 4882279; 4885242; 4895800; 4929555; 5002876; 5004688; 5032516; 5122465; 5135868; 5166329, включенные в настоящую заявку путем ссылки).
Конкретные варианты осуществления изобретения включают в себя экзогенно экспрессированную функциональную ZFN, конъюгированную с наночастицами (НЧ) и доставленную при помощи НЧ опосредованного эффективного и аккуратного способа доставки в интактные растительные клетки для индуцирования двухцепочечного разрыва и восстановления функциональности нарушенного гена при помощи НГСК. В других вариантах осуществления изобретения функциональная ZFN, конъюгированная с НЧ, доставляется с донорным фрагментом ДНК при помощи НЧ опосредованного эффективного и аккуратного способа доставки. При этом ZFN расщепляет специфичную последовательность в геноме, и донорная ДНК интегрируется в этот локус при помощи гомологичной рекомбинации. Стратегии присоединения белка к НЧ используют четыре основных подхода: (1) электростатическая адсорбция, (2) конъюгация с лигандом на поверхности НЧ, (3) конъюгация с малой кофакторной молекулой, которую белок может распознать и связаться, и (4) непосредственная конъюгация с поверхностью НЧ (Aubin-Tam and Hamad-Schifferli, 2008). Другие стратегии описаны в обзоре Medintz et al. Проблемы, связанные с этими стратегиями мечения, включают в себя стерические проблемы, другими словами, может ли белок «пройти мимо» лиганда к поверхности НЧ или соответствующей связывающей группе. Выбору химических реактивов, которые обеспечат специфичное связывание (т.е. не вызовут образование большого количества перекрестных связей) и будут стабильными для желаемых целей, также необходимо уделить внимание. Пептид ZFN необходимо функционализировать при высокой концентрации ДДТ и в присутствии ионов цинка. Для того чтобы сохранить стабильность конъюгатов, функционализация будет выполнена в соответствии с процедурой конъюгации, описанной в Oh et. al., 2010.
Настоящее изобретение далее описывается при помощи следующих иллюстративных примеров.
ПРИМЕРЫ
Пример 1: Получение сиквенс-специфичных нуклеаз (ССН) с помощью трансляции in vitro или бактериальной экспрессии
ССН (IL1-LO/Fok1, IL1-43/Fok1, IL1-8/Fok1 и I-SceI) конструировали и ПЦР амплифицировали из плазмид, содержащих ССН, сайты присоединения эндонуклеаз рестрикции и 6х гистидиновые метки. ПЦР продукт встраивали в TOPO вектор pCR2.1 для клонирования и секвенирования. Генные фрагменты, содержащие кодирующую последовательность ССН, удаляли из плазмиды при помощи ферментной рестрикции и лигировали в экспрессионный вектор pET15b по совместимым сайтам рестрикции. Этими образцами трансформировали компетентные клетки E.coli штамма BL21 вместе с pDAB4883. Для эффективной экспрессии повреждение ДНК BL21 E.coli белком ССН уменьшали путем трансформации BL21 плазмидой pDAB4883, состоящей из экспрессионной плазмиды pCOT4, содержащей ген лигазы после промотора, который также индуцируется ИПТГ (изопропил-бета-D-тиогалактопиранозид). Это помогает репарации любых повреждений, причиняемых ССН геному клеток BL21 во время сверхэкспрессии.
Одни и те же экспрессионные клетки BL21 котрансформировали конструкцией ген лигазы-pCOT4 и конструкциями ССН-pET15b. Культуры трансгенных BL21 выращивали в 50 мл среды LB с хлорамфениколом, карбенициллином и ZnCl2 и инкубировали при температуре 37°С до достижения оптической плотности OD600nm 0,5. Экспрессию индуцировали различными концентрациями ИПТГ (0,1-0,7 мМ), инкубацию осуществляли при различных температурах (16-28°С) и проводили анализ на наличие белка ССН при помощи метода электрофореза в полиакриламидном геле с додецилсульфатом натрия и Вестерн блоттинга. Таким образом, IL1-LO/Fok1, IL1-43/Fok1, IL1-8/Fok1 и I-SceI экспрессировали в клетках E.coli и очищали при помощи нитрилацетата никеля (Ni-NTA). После очистки функцию ССН определяли на основе ее способности высвобождать специфичный фрагмент из экспрессионной плазмиды.
Кроме того, сиквенс-специфичные нуклеазы экспрессировали при помощи трансляции in vitro. Коммерческий набор TNT® компании Promega обеспечивает эффективный и удобный процесс для экспрессии белков. Кольцевые плазмиды, содержащие гены сиквенс-специфичных нуклеаз, клонированные или после промотора T7 или после промотора SP6 РНК полимеразы, экспрессировали in vitro с помощью ферментов белковой экспрессии, поставляемых с набором. Синтез белков осуществляется в реакционной смеси объемом 50 мкл в течение 60-90 минут в соответствии с протоколом производителя. Дополнительные коммерческие наборы доступны для трансляции белков in vitro, в число дополнительных наборов, которые могут быть использованы, входят: ActiveProTM компании Ambion, PROTEINscriptTM II компании Ambion, PURExpressTM компании New England Biolabs в дополнение к другим коммерчески доступным наборам.
На фиг.1 и 2 показана экспрессия в E.coli, меченной гистидином (1) и не меченной гистидином (2), ССН ZFN-IL1FokI. Экспрессированный in vitro ZFN-IL1FokI высвобождает из плазмиды четко определенный фрагмент, фланкированный сайтами связывания ZFN. Таким образом, ССН, экспрессированные как в E.coli, так и in vitro, пригодны для эффективного и специфичного расщепления ДНК молекулы-мишени, и они могут быть использованы поочередно на протяжении всего этого исследования.
Было показано, что белки, экспрессируемые клонированными генами ССН, являются функциональными (т.е. расщепляют донорную ДНК). Например, плазмиду pDAB1585 (показана на фиг.4) обрабатывали ZFN-IL1FokI. Обработанная плазмидная ДНК становилась линеаризованной. Линеаризованный фрагмент из обработанной ZFN-IL1FokI плазмиды был затем выделен из геля и самолигирован с использованием процедуры лигирования in vitro в течение ночи. Продукт лигирования переносили в химически компетентные клетки E.coli DH5α. Несколько рекомбинантных колоний пересевали и анализировали при помощи анализа характера рестрикции и секвенирования ДНК, которые показали, что pDAB1585 расщеплялась так, как ожидалось.
Пример 2: Получение целевых культур клеток с сайтами связывания ССН, фланкированными фрагментами репортерного гена GFP
Последовательности-мишени состоят из двух фрагментов гена зеленого флуоресцентного белка (gfp) (ЗАО Евроген, Москва, Россия), фланкирующих экспрессионную кассету β-глюкуронидазы (uidA). В одной целевой конструкции сайт связывания ZFN с распознаваемой последовательностью, состоящий из инвертированных повторов, с которыми слитые белки цинковый палец-FokI могут связываться как гомодимеры (фиг.3), интегрированы в эту целевую конструкцию. Сайт связывания содержит четыре тандемных повтора распознаваемой последовательности слитого белка IL1-FokI, так что каждый сайт связывания имеет размер примерно 200 п.н., чтобы гарантировать доступность распознаваемой последовательности для слитого белка цинковый палец-FokI в сложном хроматиновом окружении. Во второй конструкции сайт связывания I-SceI интегрирован в целевую конструкцию (фиг.6). В каждой целевой конструкции сайты связывания слиты с кодирующей последовательностью uidA на N-конце. 5' и 3' концы фрагментов гена gfp перекрываются на 540 п.н. Эти перекрывающиеся последовательности обеспечивают гомологию в пределах последовательностей-мишеней, и стоп-кодон встроен на 3' конце 5' фрагмента gfp, чтобы гарантировать отсутствие функциональной транскрипции gfp с последовательности-мишени.
Последовательности-мишени стабильно интегрировали в суспензионные культуры клеток табака BY2 с использованием агробактериальной трансформации. Культуры BY2 (полученные из Jun Ueki of Japan Tobacco, Iwata, Shizuoka, Japan) поддерживали в среде Линсмайера-Скуга (LS), содержащей основные соли, (PhytoTechnology Labs, Shawnee Mission, KS, #L689), 170 мг/л KH2PO4, 30 г/л сахарозы, 0,2 мг/л 2,4-D и 0,6 мг/л тиамин-HCl при значении pH 6,0. Клетки BY2 пересевали каждые 7 дней путем добавления 0,25 мл объема осажденных клеток в 50 мл среды, основанной на среде LS, поддерживали в 250-мл колбах на ротационном шейкере при температуре 25°С и 125 об/мин. Для получения трансгенных культур клеток BY2 с интегрированными последовательностями-мишенями колбу с четырехдневной суспензией после пересева разделяли на четыре аликвоты по 10-12 мл, которые культивировали на чашках Петри размером 100×25 мм совместно со штаммом Agrobacterium LBA4404, несущим или pZFN-МИШЕНЬ (фиг.4) pDAB1585 или pI-SceI-МИШЕНЬ pDAB100375 (фиг.7), оставляли расти в течение ночи до достижения оптической плотности OD600nm примерно 1,5. Чашки заворачивали в Nescofilm® (Azwell Inc., Osaka, Japan) и инкубировали при температуре 25°С без встряхивания в течение 3 дней, после чего лишнюю жидкость удаляли и заменяли 11 мл среды LS, содержащей 500 мг/л карбенициллина. После ресуспендирования клеток табака 1 мл суспензии наносили на чашки размером 100×25 мм со средой LS, содержащей 500 мг/л карбенициллина и 200 мг/л гигромицина и отвержденной 8 г/л TC агара (PhytoTechnology, Shawnee Mission, KS). Чашки инкубировали незавернутыми при температуре 28°С в темноте. Это приводит к получению 120-144 селекционных чашек для одной обработки. Отдельные гигромицин-устойчивые изоляты появлялись на 10-14 день после высева на чашки, и их переносили в индивидуальные чашки размером 60×20 мм (один изолят на чашку), где они поддерживались в селективных условиях в виде каллусов с пересевом через каждые 14 дней до тех пор, пока их не использовали для анализа и последующих экспериментов по повторной трансформации.
Гигромицин-устойчивые трансгенные культуры клеток, содержащие одну полноразмерную интегрированную копию последовательности-мишени, отбирали и использовали для повторного перевода в суспензионные культуры путем помещения примерно 250-500 мг каллусной ткани в 40-50 мл основной среды LS, содержащей 100 мл/л гигромицина, и пересева каждые 7 дней, как описано выше.
Как кластеры клеток, так и отдельные клетки (получаемые как отдельные клетки DAS, описанные в патентной заявке WO/2008/083233) использовались для экспериментов. За три-четыре дня до эксперимента однонедельную суспензионную культуру пересевали на свежую среду путем переноса 2 мл суспензионных агрегатов BY2 в 40 мл среды LSBY2, содержащей исходную концентрацию (4-хлоро-1,5-дифенил-1H-пиразол-3-илокси)-сложного этилового эфира уксусной кислоты (как описано в заявке WO/2008/083233), 1-3% глицерина и 0,05-0,1% (об./об.) ДМСО в 250 мл колбе. Отдельные клетки собирали или через 3,5 дня или через 7 дней после обработки, вызывающей образование отдельных клеток. Отдельные клетки BY2 пропускали через проточный цитометр для того, чтобы определить жизнеспособность клеток, а также оценить при помощи конфокальной микроскопии стабильность клеток. Стабильность определяли путем наблюдения за уровнем фоновой флуоресценции, если таковой имелся. Небольшой процент клеток обладает фоновой флуоресценцией, которая соответствует мертвым клеткам, указывая на то, что фоновая флуоресценция исходит от клеток, которые подверглись некрозу. Как отдельные клетки, так и обычные суспензионные агрегаты использовались в экспериментах после проверки на фоновую флуоресценцию.
Пример 3: Покрытие наночастиц (НЧ) ССН для доставки в растительные клетки
Коллоидное золото с размером частиц 150 нм в диаметре (BBI International, GC150), 5-((2-(и-3)-S(ацетилмеркапто)сукциноил)амино) флуоресцеин (SAMSA флуоресцеин: Invitrogen, A-685), наночастицы коллоидного золота размером 80 и 90 нм, мультифункционализированные карбоновой кислотой (TedPella, 32019), сульфо-NHS (N-гидроксисукцинимид), EDC (1-этил-3-[3-диметиламинопропил]карбодиимид гидрохлорид) (Pierce Bitoechnology, 24510, 22980), MES (2-[N-морфолино]этансульфоновая кислота) (Fisher Scientific, AC32776-1000), пакеты фосфатно-солевого буфера (Sigma, P5368-10PAK), меченный гистидином GFP (Evrogen, возбуждение макс. - 482 нм, испускание макс. - 502 нм, FP611), турбо YFP (Evrogen, возбуждение макс. - 525 нм, испускание макс. - 538 нм, FP611), пропидиум иодид (Sigma P4864), диацетат флуоресцеина (Sigma, F7378) являются типами мультифункционализированных НЧ, которые покрыты ССН и используются для доставки в целевые культуры клеток.
(i) Приготовление конъюгатов наночастиц
(a) Синтез конъюгатов наночастиц золота с флуоресцеином без ССН для контрольной обработки: конъюгаты наночастиц золота с флуоресцеином готовили способом, описанным ранее (Cannone et. al. 2006), для доставки и отслеживания частиц в кластерах клеток BY2 или отдельных клетках без ССН. Один (1) мг SAMSA флуоресцеина растворяли в 100 мкл 0,1 M NaOH и перемешивали на вортексе в течение 15 минут для удаления ацетильной группы, защищающей тиол. Затем активированный SAMSA смешивали со 100 мкл коллоидного золота с размером частиц 150 нм (примерно 109 частиц на мл). Этот раствор затем инкубировали в течение 1 часа, чтобы гарантировать завершение реакции. Затем добавляли 50 мкл 1 M HCl для нейтрализации раствора. Раствор центрифугировали при 3000 об/мин в течение 30 минут и супернатант удаляли. Полученный желтый осадок ресуспендировали в 200 мкл 0,1 M ФСБ, в результате чего получали раствор оранжевого цвета. Этот этап очистки повторяли два раза, чтобы гарантировать удаление свободного SAMSA флуоресцеина. Присоединение SAMSA к золоту происходит в основном за счет тиоловых связей. Из-за значительного электростатического отталкивания (SAMSA является дианионом при pH>7) считается, что SAMSA располагается перпендикулярно к поверхности частицы коллоидного золота (Cannone et. al. 2006). Такие НЧ используются для отслеживания проникновения нескольких таких флуоресцирующих частиц в клетки как меры восприимчивости клетки при данных условиях.
(b) Синтез наночастицы золота (НЧЗ), покрытой ССН: конъюгаты НЧЗ-ССН синтезировали с использованием незначительно измененного протокола, описанного у Grabarek and Gergely, 1990. 0,25 мл раствора коллоидного золота с размером частиц 20-150 нм (примерно 109 частиц на мл), мультифункционализированных карбоновой кислотой, центрифугировали при 3000 об/мин в течение 10 минут. После удаления супернатанта красный осадок ресуспендировали в 1 мл активирующего буфера (0,1 M MES, 0,5 M NaCl, pH 6,0). Затем в этот раствор добавляли 0,4 мг EDC и 1,1 мг сульфо-NHS и перемешивали на вортексе в течение 15 минут при комнатной температуре. Затем к полученному раствору добавляли 9 мкл ZFN-IL1Fok1 и инкубировали в течение 2 часов в темноте при комнатной температуре для того, чтобы белок и золото прореагировали полностью. Соотношение между используемыми в этой реакции коллоидным золотом и белком определяли путем нахождения количества карбоновых кислот, присутствующих на частицах коллоидного золота. Сначала число карбоксильных групп, присутствующих на одной частице коллоидного золота, вычисляли путем деления площади поверхности одной частицы золота (предполагая, что она имеет сферическую форму) на площадь поверхности, занимаемую одной карбоксильной группой (0,20 нм2 (Kimura, et. al. 2002)). Затем полученный результат умножали на общее число присутствующих частиц коллоидного золота для того, чтобы получить общее число карбоксильных групп, присутствующих во всем растворе коллоидного золота. Это число приравнивается к числу аминогрупп, присутствующих в данном количестве белка. Частицы коллоидного золота присоединяются к белку через образование амидной связи между карбоновой кислотой, присутствующей на частице коллоидного золота, и аминогруппой белка (Grabarek and Gergely, 1990). С одной наночастицей золота связывается примерно 127285 молекул белка.
(ii) Обработка клеток
(a) Динамика поглощения наночастиц золота и жизнеспособность клеток: следующие образцы были приготовлены в 24-луночных стерильных планшетах: (i) 500 мкл целевой суспензии кластеров или отдельных клеток (контроль); (ii) 500 мкл суспензии кластеров BY2 или отдельных клеток BY2 + 20 мкл НЧЗ + 25 мкл диацетата флуоресцеина (FDA) + 25 мкл пропидиум иодида; и (iii) другие образцы, которые включали в себя 40, 60, 80 мкл НЧЗ, отдельно или в комбинации с ZFN-IL1Fok1, с клетками и красителями для определения жизнеспособности клеток. Обработанные образцы исследовали под флуоресцентным микроскопом через 5, 20, 120 минут и окончательно через 24-48 часов для того, чтобы подтвердить жизнеспособность клеток.
(b) Обработка наночастицами золота и SAMSA флуоресцеином: следующие образцы были приготовлены в 24-луночных стерильных планшетах перед экспериментами: (i) 500 мкл целевой суспензии кластеров или отдельных клеток (контроль); (ii) 500 мкл целевой суспензии кластеров или отдельных клеток + 20 мкл SAMSA флуоресцеина (контроль); и (iii) целевые суспензии кластеров или отдельных клеток обрабатывали 20 мкл НЧЗ-SAMSA-флуоресцеин и суспензии инкубировали в течение 20 минут в темноте при комнатной температуре для того, чтобы подтвердить проникновение частиц.
c) Получение НЧЗ, покрытых (например, меченных) ZFN-IL1Fok1: следующие образцы были приготовлены в 24-луночных стерильных планшетах до обработки клеток или суспензии кластеров: (i) 500 мкл целевой суспензии кластеров или отдельных клеток (контроль); (ii) 500 мкл целевой суспензии кластеров или отдельных клеток + 9-20 мкл ZFN (контроль); и (iii) 500 мкл отдельных клеток + 10-40 мкл НЧЗ, покрытых (например, связанных с) ZFN-IL1Fok1. Обработанные клетки и кластеры перед экспериментами инкубировали в течение 2 часов в темноте при комнатной температуре.
Контрольные варианты с использованием НЧЗ, связанных с GFP/YFP, были включены во все эксперименты для того, чтобы гарантировать неинвазивность проникновения и определить время для оптимального проникновения, которое использовалось в качестве методической основы экспериментов (см. фиг.5). Кроме того, слитые пептиды, проникающие в клетку, (ППК) были слиты (например, мультифункционализированы) с НЧ для того, чтобы отследить реальное время проникновения частиц в целевую суспензию кластеров или отдельных клеток.
Пример 4: Синтез конъюгатов квантовых точек (КТ), связанных с ССН
Люминесцентные полупроводниковые нанокристаллические КТ являются хорошим прототипным примером многих продемонстрированных биологических применений (Thermes V, et al. 2002; Windbichler et.al, 2007; Fajardo-Sanchez et. al, 2008; Arnould S, et al., 2006). Их применимость является результатом сочетания уникальных фотофизических свойств и размеров, сопоставимых с размерами крупного белка. Гидродинамический радиус гидрофильных CdSe-ZnS КТ колеблется от примерно 5 нм (для нанокристаллов с кэпами, замененными молекулярными лигандами) до примерно 20 нм (для нанокристаллов, инкапсулированных внутри блок-сополимеров) (Smith J, et al., 2006). Одну КТ конъюгировали с несколькими биомолекулами (такими как антитела, пептиды, ДНК) для того, чтобы получить покрытые биоконъюгаты КТ с повышенной авидностью.
В этом примере описывается использование ZFN-IL1Fok1, конъюгированных (например, покрытых) с гидрофильными КТ, как альтернативной стратегии облегчения их внутриклеточного поглощения и доставки к соответствующим сайтам-мишеням в ДНК.
(i) Синтез КТ: CdSe-ZnS КТ типа ядро-оболочка с максимумом испускания в центре диапазона от 510 до 540 нм синтезировали с помощью многостадийной реакции металлорганических предшественников в горячих смесях с координирующим растворителем в соответствии с процедурами, описанными в Lu et. al., 2007; Doyon et. al. 2006; Collins et. al., 2003; Lanio et. al, 2000. Нанокристаллы мультифункционализировали и делали гидрофильными путем замены нативной кэппирующей оболочки, состоящей в основном из триоктилфосфина и триоктилфосфин оксида (TOP/TOPO), бифункциональными лигандами, как описано ранее (Lie et al., 2002; Mani et. al., 2005; Desjarlais and Berg, 1993). Два типа гидрофильных КТ было использовано: (1) нанокристаллы, кэппированные только дигидролипоевой кислотой; и (2) нанокристаллы, кэппированные смесью полиэтиленгликоля с присоединенной к нему дигидролипоевой кислотой (ПЭГ М.в. ~600, ДГЛК-ПЭГ) и заканчивающегося биотином ДГЛК-полиэтиленгликоля (ПЭГ М.в. ~400, ДГЛК-ПЭГ-биотин) с молярным соотношением лигандов 9:1. Эти типы обозначаются как ДГЛК-КТ и ДГЛК-ПЭГ-биотин-КТ, соответственно.
(ii) Самосборка биоконъюгатов квантовых точек: для самосборки КТ-ZFN-IL1Fok1 конъюгатов с желаемой валентностью His-ZFN в соответствующих молярных соотношениях добавляли к 0,3 мкМ испускающих при 510 нм ДГЛК-кэппированных КТ в 10 мМ Tris-Cl буфере pH 8 и инкубировали при комнатной температуре в течение 30 минут. Аналогично, b-ПЭ-стрептавидин добавляли к 0,3 мкМ испускающих при 540 нм КТ (кэппированных ДГЛК-ПЭГ:ДГЛК-ПЭГ-биотин в соотношении 9:1) в фосфатно-солевом буфере (137 мМ NaCl, 10 мМ фосфата, 2,7 мМ KCl pH 7,4, ФСБ) и инкубировали при температуре 4°С в течение ночи; образование конъюгатов в этом случае осуществлялось за счет взаимодействий стрептавидин-биотин. Конъюгаты определяли с использованием гель-электрофореза, при помощи которого отслеживали изменения в электрофоретической подвижности КТ, собранных или с His-соединенной ZFN, или со связанным со стрептавидином b-ПЭ. Образцы разводили в 1×TBE буфере (0,09 M Трис, 0,002 M Na2-ЭДТА, 0,09 M борная кислота, pH 8,3) и разделяли в 1% или 2% агарозном геле для КТ-b-ПЭ и YFP конъюгатов соответственно. В частности, результаты изменения числа молекул ZFN-IL1Fok1 на КТ биоконьюгата определяли, если они соединялись с флуоресцентными белками для отслеживания. Изображения гелей получали путем возбуждения КТ и/или белка и улавливания флуоресцентных изображений от разделенных полос на геле. Образование конъюгатов подтверждали отслеживанием изменений в переносе энергии между КТ и флуоресцентными белками в результате самосборки. Флуоресцентные спектры получали на многофункциональном ридере титрационных микропланшетов с двойным монохроматором Safire фирмы Tecan (Tecan, Research Triangle Park, NC), используя для возбуждения свет с длиной волны 325 нм. Для экспериментов по внутриклеточной доставке и получению изображений КТ самособирались со смесью ZFN-IL1Fok1 при незначительном молярном соотношении ZFN:КТ.
(iii) Внутриклеточное поглощение конъюгатов квантовых точек с флуоресцентными белками: эксперименты по клеточной интернализации проводили в стерильных условиях, как описано выше. Биоконъюгаты КТ разводили в полной культуральной среде, добавляли к культуре клеток и инкубировали при 37°С в течение 1 часа при концентрации 40-150 мкг/мл. Смешанные конъюгаты КТ с покрытой поверхностью, состоящие из КТ/ZFN в соотношении или 1:5 или 1:10, и КТ/b-ПЭ со сборной валентностью от 1:1 до 1:2,5, вместе с ППК в количестве 50 ППК на КТ, инкубировали в культурах клеток при различных концентрациях конъюгатов КТ. Излишние несвязанные конъюгаты КТ удаляли путем промывки культуры ФСБ или культуральной средой, по меньшей мере, три раза. Затем клетки фиксировали в 3,7% параформальдегиде в течение 10 минут при комнатной температуре, дважды промывали ФСБ и помещали в заливочную среду ProLong Antifade, содержащую краситель DAPI (Invitrogen), для окраски ядер. Получение эпифлуоресцентных изображений выполняли с использованием микроскопа фирмы Leica. Прилежащие друг к другу фрагменты флуоресцентных изображений получали и проводили их количественный анализ с использованием системы DualView, оснащенной 565 нм дихроичным фильтром. Для получения клеточных изображений с 510 нм КТ-YFP/ZFN образцы возбуждали длиной волны 488 нм и испускание получали/разделяли с применением 565 нм дихроичного фильтра и деконволюировали. Флуоресценцию КТ получали при λ<565 нм, а флуоресценцию YFP получали при λ>565 нм. Утечку флуоресценции YFP в диапазон флуоресценции КТ вычитали как часть деконволюции. 540 нм КТ и b-ПЭ возбуждали длиной волны 488 нм и соответствующие им испускания разделяли с использованием 565 нм дихроичного фильтра и деконволюировали. Флуоресценцию DAPI возбуждали с использованием ксеноновой лампы и испускание получали с использованием фильтрового куба DAPI (D350/50x для возбуждения, 400DCLP дихроичный, D460/50 м для детекции). Флуоресценцию AF647-TF возбуждали с использованием ксеноновой лампы и флуоресценцию детектировали с использованием фильтрового куба Cy5 (HQ620/60x для возбуждения, Q660LP дихроичный, HQ700/75 м для испускания). Оба фильтровых куба возбуждения/детекции были предоставлены компанией Chroma Technology. Дифференциальные интерференционные контрастные изображения получали с помощью источника яркого света.
(iv) Подтверждение КТ, покрытых ZFN-IL1Fok1: His взаимодействует непосредственно с богатой Zn неорганической поверхностью нанокристалла. Конструирование ZFN-IL1Fok1 с N-концом, несущим две последовательности из 6 гистидинов (His), разделенные небольшим спейсером, и ППК, имеющего на N-конце последовательность из 8 His, позволяет формироваться прочным комплексам КТ-белок/пептитд. Связывание биотина с авидином является широко распространенной стратегией биоконъюгации, известной из уровня техники, благодаря их сильному взаимодействию (Kd ~10-15 M). Использование КТ с поверхностью, кэппировнной смесью заканчивающегося гидроксилом и биотином ПЭГ (ДГЛК-ПЭГ-биотин-КТ), обеспечивает легкую конъюгацию с коммерчески доступным b-ПЭ-стрептавидином.
(v) Внутриклеточная доставка конъюгатов КТ-ZFN-IL1Fok1: чтобы убедиться в том, что поглощение мультифункционализированных (например, с мультифункционализированной поверхностью) КТ, нагруженных YFP/ZFN-IL1Fok1, обусловлено присутствием ППК на поверхности нанокристалла, целевые клеточные линии BY2 раздельно инкубировали с тремя типами конъюгатов: КТ-ППК конъюгаты (10-100 ППК на КТ), КТ-ZFN-IL1Fok1/ППК и КТ, собранные со смесью ZFN-IL1Fok1 и ППК (КТ-ZFN-IL1Fok1-ППК с примерно 10 ZFN-IL1Fok1 и примерно 50 ППК на КТ). Клетки инкубировали в растворах 510 нм испускающих конъюгатов КТ (при концентрации примерно 75 нМ), промывали, чтобы удалить несвязанные материалы, и затем получали изображение с использованием флуоресцентной микроскопии. Клетки также докрашивали DAPI, чтобы обеспечить визуализацию ядер и эндосом, соответственно. Когда дополнительный ППК присутствует на поверхности КТ (смешанный вариант с КТ-ZFN-IL1Fok1-ППК на поверхности), имеет место значительное внутриклеточное поглощение конъюгатов, на что указывает выраженная интенсивность флуоресценции, измеренной для обеих групп клеток. Кроме того, изображения, полученные для обеих культур, показали, что существует почти полное перекрывание между картинами распределения флуоресценции КТ и ZFN-IL1Fok1/YFP. Оценка характера окрашивания и типа солокализации указывает на перинуклеарное распределение, которое в основном сосредоточено в эндосомальных компартментах. Эффективная интернализация конъюгатов КТ клеточными линиями в присутствии ППК показывает, что ППК способствует внутриклеточному поглощению мультифункционализированных (например, с мультифункционализированной поверхностью) КТ, нагруженных ZFN-IL1Fok1-флуоресцентный слитый белок.
Отдельные клетки и агрегированные кластеры обрабатывали аналогично обработке НЧ, описанной в разделе, относящемся к наночастицам, высевали без отбора и проверяли колонии на предмет экспрессии GFP в течение 2-4 недель после экспериментов.
Пример 5: Гомологично-направленная репарация после доставки ССН в клетки табака с помощью НЧЗ и КТ
Целевые клеточные линии с интегрированными сайтами связывания ZFN или I-SceI обрабатывали связанными с частицами ZFN-IL1Fok1 или I-SceI, как описано выше, и высевали в среду на чашки Петри. Клетки высевали на неселективную среду после обработки. Очаги зеленой флуоресценции становились видны через 7 дней. Чтобы подтвердить, что наблюдаемая флуоресценция является результатом восстановления функционального гена gfp, пул флуоресцирующих сегментов ткани выделяли и вручную обогащали путем нескольких пересевов отобранных субкультур. Из этих флуоресцирующих тканей выделяли геномную ДНК и анализировали ее с помощью ПЦР с зондами, связывающимися с каждым из фрагментов гена gfp. Образцы из обогащенных флуоресцирующих тканей, обработанных ССН, при амплификации давали ожидаемый ПЦР продукт размером 0,6 т.п.н., указывающий на то, что предполагаемая рекомбинация восстановила функциональный ген gfp в этих тканях. Кроме того, в обогащенных образцах также наблюдался ПЦР продукт размером 4,1 т.п.н., указывающий на присутствие нерекомбинантной репортерной последовательности в этой популяции клеток. Это не является неожиданным, так как для достижения обогащения gfp-положительными клетками использовался способ визуального отбора.
Хотя ряд приведенных в качестве примеров аспектов и вариантов осуществления настоящего изобретения обсуждался выше, специалистам в данной области техники будут понятны их некоторые модификации, преобразования, дополнения и субкомбинации. В связи с этим предполагается, что следующая прилагаемая формула изобретения и последующие формулы изобретения рассматриваются как включающие в себя все модификации, преобразования, дополнения и субкомбинации, которые находятся в рамках их подлинных сущности и объема.