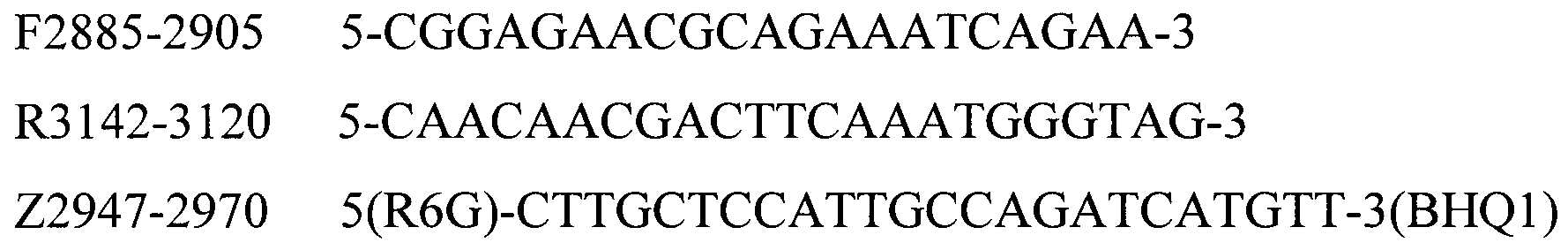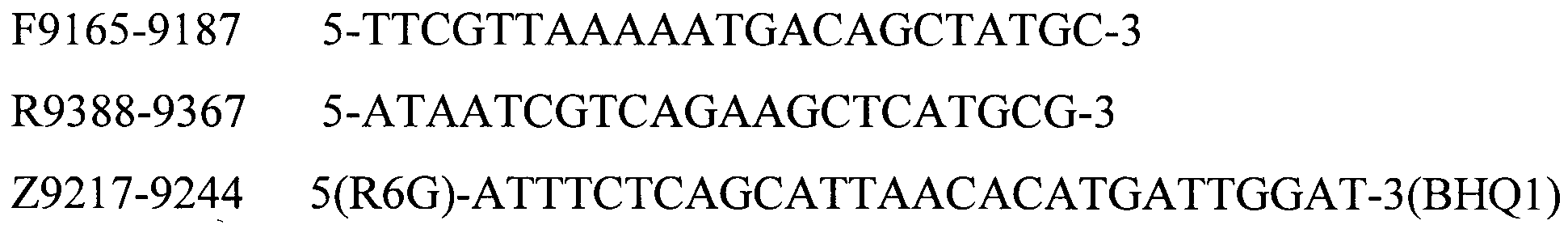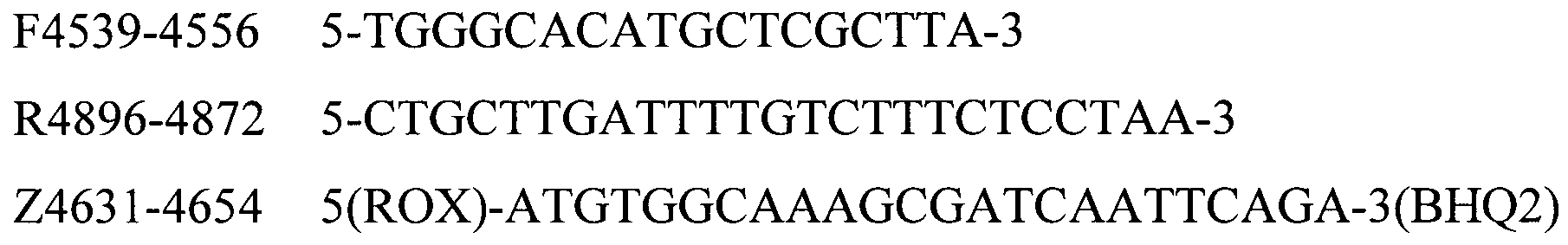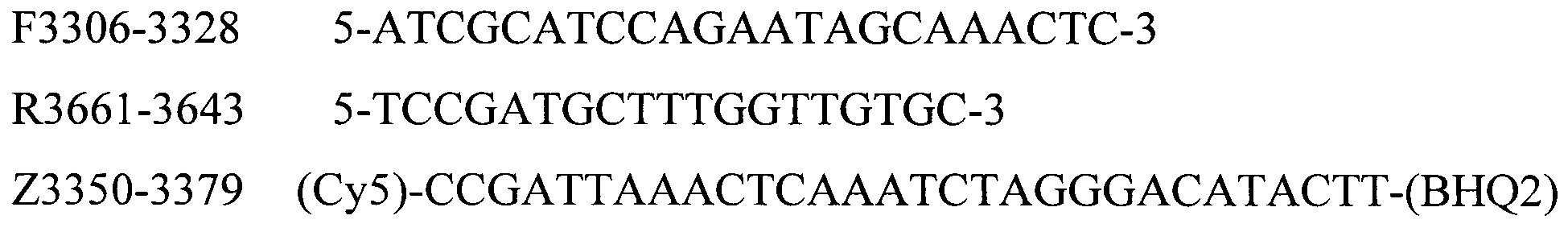Результат интеллектуальной деятельности: НАБОР ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫХ ЗОНДОВ ДЛЯ ИДЕНТИФИКАЦИИ И СУБТИПИРОВАНИЯ ДНК БАКТЕРИИ Pasteurella multocida СЕРОТИПОВ A, B, D, E, F МЕТОДОМ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ
Вид РИД
Изобретение
Изобретение относится к наборам олигонуклеотидных праймеров и зондов и может быть использовано в биотехнологии, в частности в генетической инженерии, и ветеринарной практике для выявления генетического материала (ДНК) бактерии Pasteurella multocida серотипов A, B, D, E, F в клинических или секционных образцах для уточнения диагноза, а также для решения научно-исследовательских задач по изучению свойств бактерии P.multocida, по оценке эффективности диагностических, профилактических или лечебных препаратов против пастереллеза крупного рогатого скота. Использование специфичных праймеров и зондов позволяет выявлять генетический материал бактерии P. multocida в исследуемых образцах и проводить типирование бактерии P. multocida методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени.
Пастереллез крупного рогатого скота (лат., англ. - Pasteurellosis; легочной пастереллез, геморрагическая септицемия, транспортная лихорадка, энзоотическая бронхопневмония крупного рогатого скота) - контагиозная инфекционная болезнь, характеризующаяся при остром течении септическими явлениями, крупозным воспалением легких, плевритом, отеками в различных областях тела, а при подостром и хроническом течениях гнойно-некротизирующей пневмонией. Возбудитель пастереллеза - Pasteurella multocida - представляет собой полиморфные, чаще короткие грамотрицательные, неподвижные эллипсовидные палочки, располагающиеся изолированно, парами или реже цепочками, спор не образуют; аэробы и факультативные анаэробы. Pasteurella multocida - бактерия, которая вызывает инфекционные болезни у многих видов млекопитающих и птиц (Arumugam et al. 2011, Sharma et al. 2010; Shayegh et al. 2009; Varshney et al. 2009; Wilkie I.W. et al., 2012).
Выраженности клинических проявлений и патологоанатомических изменений при пастереллезе неодинаковы и зависят от многих факторов (кормовой или транспортный стресс, бактериальные или вирусные инфекции, колебания температуры окружающей среды), а также от сероварианта штамма, вызвавшего заболевание. В настоящее время все штаммы Р.multocida, циркулирующие в природе, подразделяют на пять капсульных серогрупп, охарактеризованных на основании антигенных характеристик капсульных полисахаридов, обозначаемых латинскими буквами А, В, D, Е и F и 16, соматических серотипов, отличающихся по липополисахаридным антигенам (от 1 до 16) (Carter G.R., 1961; Rimler R.B., Rhoades K.R., 1987).
Наибольший ущерб эти возбудители причиняют в мясном и молочном скотоводстве, являясь важными этиологическими агентами массовых респираторных болезней молодняка. P. multocida вызывает вспышки респираторных болезней, характеризующихся как острым проявлением и тяжелым течением, так и имеющих тенденцию к подострому и хроническому течению.
Диагностика пастереллеза основана на комплексе эпизоотологических, клинических, патологических и лабораторных исследований. В качестве основных лабораторных методов первичной идентификации возбудителя применяются морфологические (микроскопию мазков из крови и мазков-отпечатков из пораженных органов) и фенотипические (выделение чистой культуры на питательных средах с идентификацией по биохимическим свойствам) методы диагностики, а также определение серовариантов P. multocida. Для видовой идентификации, определения серотипов и серогрупп P. multocida проводится серологическое типирование со специфическими кроличьими антисыворотками. Однако в нашей стране серологическое типирование не разработано.
Как альтернатива серологическому типированию, в последнее десятилетие для диагностики и типирования P.multocida, применяется метод, основанный на полимеразной цепной реакции (ПЦР). Этот метод обладает рядом преимуществ, так как повышает точность видовой идентификации бактерий, сокращает сроки их выявления, дает возможность обнаруживать и типировать возбудителя в исследуемом материале без выделения чистой культуры. Кроме того, разные модификации ПЦР дают возможность проводить анализ в мультиплексном формате.
Аналогом является ПЦР-тест-системы для выявления Pasteurella multocida (LSI VetMAX™ Pasteurella multocida - toxinogenic strains - Real-Time PCR Kit пр-во LSI, Франция; Pasteurella Multocida Real time PCR Kit, пр-ва Bio SB performs R&D и др), а также лабораторные варианты ПЦР-тест-систем для выявления бактерии Pasteurella multocida [Rocke T.E., ., ., Shadduck D.J. 2002. A serotype-specific polymerase chain reaction for identification of Pasteurella multocida serotype 1 // http://www.ncbi.nlm.nih.gov/pubmed/12061646" \o "Avian diseases., 46, 370-377.]. Однако коммерческие варианты ПЦР-тест-систем не определяют серотип бактерии, а лабораторный вариант ПЦР-тест-систем для выявления бактерии Pasteurella multocida, предложенный Rocke T.E. и соавторами в 2002 г, определяет только 1-й серотип бактерии.
Известными аналогами являются ПЦР-тест-системы для определения серогрупп A, B, D, E и F бактерии Pasteurella multocida [Arumugam, N.D., Ajam, N., Blackall, P.J., Asiah, N.M., Ramlan, M., Maria, J., Yuslan, S. and Thong, K.L. 2011. Capsular serotyping of Pasteurella multocida from various animal hosts - a comparison of phenotypic and genotypic methods // Trop. Biomed., 28, 55-63.
Ferreira T.S.P., Felizardo M.R., de Gobbi D.D.S., Gomes C.R., Filsner P.H.L.N., Moreno M., Paix˜ao R., Pereira J., Moreno A.M. 2012. Virulence Genes and Antimicrobial Resistance Profiles of Pasteurella multocida Strains Isolated from Rabbits in Brazil // Sci. World J., Vol. 2012, Article ID 685028, 6 pages].
Наиболее близким аналогом (прототипом) является ПЦР-тест-система для определения серогрупп A, B, D, E и F бактерии Pasteurella multocida [Swaraj Rajkhowa, Ingudam Shakuntala, Seema Rani Pegu, Rajib Kumar Das, Anubrata Das. 2012. Detection of Pasteurella multocida isolates from local pigs of India by polymerase chain reaction and their antibiogram // Trop. Anim. Health Prod., 44, 1497-1503].
Однако вышеприведенные тест-системы (аналоги и прототип) имеют электрофоретический режим регистрации результата, что значительно увеличивает время проведения анализа, т.к. требуются дополнительные манипуляции, связанные с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов. Стадия электрофореза ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации.
Техническим результатом заявляемого изобретения является разработка более чувствительного набора специфичных олигонуклеотидных праймеров и зондов для идентификации генетического материала P. multocida с возможностью определения серотипа в биологических жидкостях, образцах внешней среды и других пробах методом ПЦР с использованием гибридизационно-флуоресцентной детекции в режиме реального времени.
Указанный технический результат достигается набором олигонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации и субтипирования ДНК бактерии Pasteurella multocida серотипов A, B, D, E, F методом ПЦР в режиме реального времени, охарактеризованном в приложении.
ПЦР в реальном времени не требует дополнительных манипуляций, связанных с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов. Подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации, а также позволяет снизить требования, предъявляемые к ПЦР лаборатории.
Технический результат получен путем конструирования диагностических праймеров и флуоресцентно-меченых зондов на консервативном участке (cap locus) генома бактерии и оптимизации концентраций компонентов реакционной смеси и условий проведения ПЦР. Были рассчитаны пара праймеров и зонды для выявления генетического материала бактерии P. multocida. Для контроля амплификации были получены рекомбинантные плазмиды, несущие специфические для каждого из серотипов участки ДНК-матрицы.
На начальном этапе был проведен анализ нуклеотидных последовательностей геномов серотипов A, B, D, E, F бактерии P. multocida из базы данных NCBI (http://www.ncbi.nlm.nih.gov/) и определены наиболее консервативные участки.
Анализ свойств олигонуклеотидных праймеров и зондов проводился с использованием программы Vector NTI 9.0.0 (InforMax).
Для идентификации генетического материала бактерии P. multocida (Kmt1 ген) методом ПЦР в реальном времени были подобраны общие праймеры и зонд, представленные в таблице 1.
Таблица 1. Структура праймеров и зонда для детекцции генетического материала бактерии P. multocida по участку Kmt1 гена
|
Для определения серотипов A, B, D, E, F бактерии P. multocida методом мультиплексной ПЦР в реальном времени были подобраны праймеры и зонды, структура приведена в таблице 2.
Таблица 2. Структура праймеров и зондов для детекции серотипов A, B, D, E, F бактерии P. multocida
|
Пример 1. Проверка аналитической чувствительности набора праймеров и зондов.
Методом молекулярной трансформации компетентных бактериальных клеток Escherichia coli плазмидами pCR 2.1, содержащими специфические ДНК вставки бактерии P. multocida, для контроля амплификации были получены положительные контрольные образцы (ПКО).
Для проведения ПЦР в режиме реального времени в качестве анализируемых образцов использовали рекомбинантную плазмидную ДНК, включающую вставку ДНК, соответствующую детектируемым участкам геномов каждого серотипа бактерии P. multocida.
Для подтверждения специфичности полученных фрагментов ДНК определяли их нуклеотидную последовательность, для чего использовали набор реагентов BigDye® Terminator v3.1 Cycle Sequencing Kits (Applied Biosystems, США). Продукты секвенирующей реакции анализировали методом капиллярного электрофореза в автоматическом секвенаторе ABI PRISM® 3130xl (Applied Biosystems/Hitachi, Япония). Полученные нуклеотидные последовательности сравнивали с последовательностями базы данных NCBI BLAST (http://www.ncbi.nlm.nih.gov/). Все фрагменты ДНК, необходимые для получения ПКО, являлись целевыми и соответствовали участкам генома бактерий P. multocida.
Условия проведения амплификации оптимизировались по следующим параметрам: концентрация ионов магния в реакционной смеси; концентрация праймеров и зондов в реакционной смеси; температура отжига праймеров.
Оптимизированный состав реакционной смеси включал следующие компоненты: 10×Taq буфер без Mg2+ (ООО «Лаборатория Медиген», Россия) - конечная концентрация 1×; 100 mM раствор MgCl2 - конечная концентрация 3,3 mM; 5 mM раствор dNTP - конечная концентрация каждого 0,2 mM; смесь праймеров - конечная концентрация каждого 0,15 µM; смесь зондов - конечная концентрация каждого 0,2 µM; SmartTaq ДНК-полимераза - конечная концентрация 1,5 е.а./мкл; вода для ПЦР. Общий объем реакционной смеси составлял 30 мкл.
Аналитическую чувствительность метода для каждого аналита определяли постановкой ПЦР «в реальном времени», где в качестве исследуемых образцов использовались 10-кратные разведения положительных контрольных образцов (ПКО/P.m.-Kmt1; ПКО/M.h.; ПКО/P.m.-A, ПКО/P.m.-D, ПКО/P.m.-B, ПКО/P.m.-E и ПКО/P.m.-F), характеристики которых приведены в таблице 3.
Таблица 3. Характеристика положительных контрольных образцов, использовавшихся для определения аналитической чувствительности
|
Концентрацию плазмидной ДНК определяли с использованием набора реагентов Quant-iT dsDNA, HS (Invitrogen, США) и флуориметра QUBIT (Invitrogen, США).
Пересчет концентрации ДНК в количество копий произведен в программе-конвертере http://molbiol.ru/scripts/01_07.html по формулам:
m[g] = Q[mol] x Mwолиг[kDa] x 103
m[g] = Q[mol] x <Mw>[Da] x L[kb] x 103
N[штук] = Q[mol] x NA
c[M] x V[L] = Q[mol],
где: m [g] - вес нуклеиновой кислоты;
Mwолиг [kDa] - молекулярный вес олигонуклеотида.
<Mw> [Da] - средний молекулярный вес одного/пары оснований;
base= 324.5 Da
base pair = 649 Da
ribo base = 340.5 Da
Q [mol] - количество нуклеиновой кислоты;
N [копий] - количество молекул нуклеиновой кислоты;
c [M] - молярная концентрация нуклеиновой кислоты;
V [L] - объем, в котором растворена нуклеиновая кислота;
L [kb] - длина нуклеиновой кислоты;
NA - Число Авогадро = 6.022045x1023[1/моль].
Для мультиплексного ПЦР-анализа предложен следующий
формат постановки реакции с использованием 2-реакционных смесей, для детекции следующих аналитов:
Смесь №1:
P.m.-Kmt1 - Pasteurella multocida (Kmt1 gene);
P.m.-A - Pasteurella multocida serogroup A;
P.m.-D - Pasteurella multocida serogroup D.
Смесь №2:
P.m.-B - Pasteurella multocida serogroup B;
P.m.-E - Pasteurella multocida serogroup E;
P.m.-F - Pasteurella multocida serogroup F.
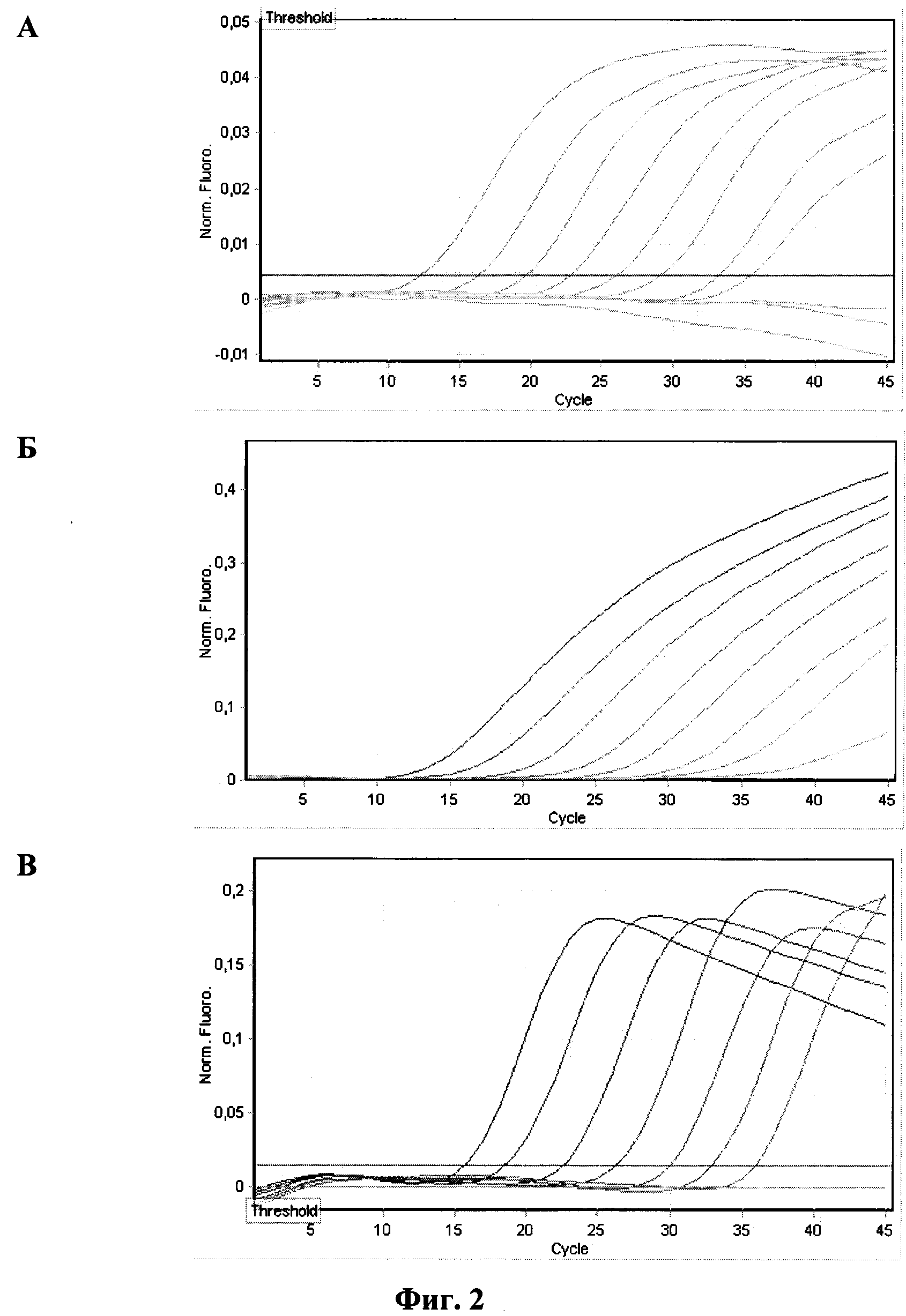
Результаты определения аналитической чувствительности приведены на
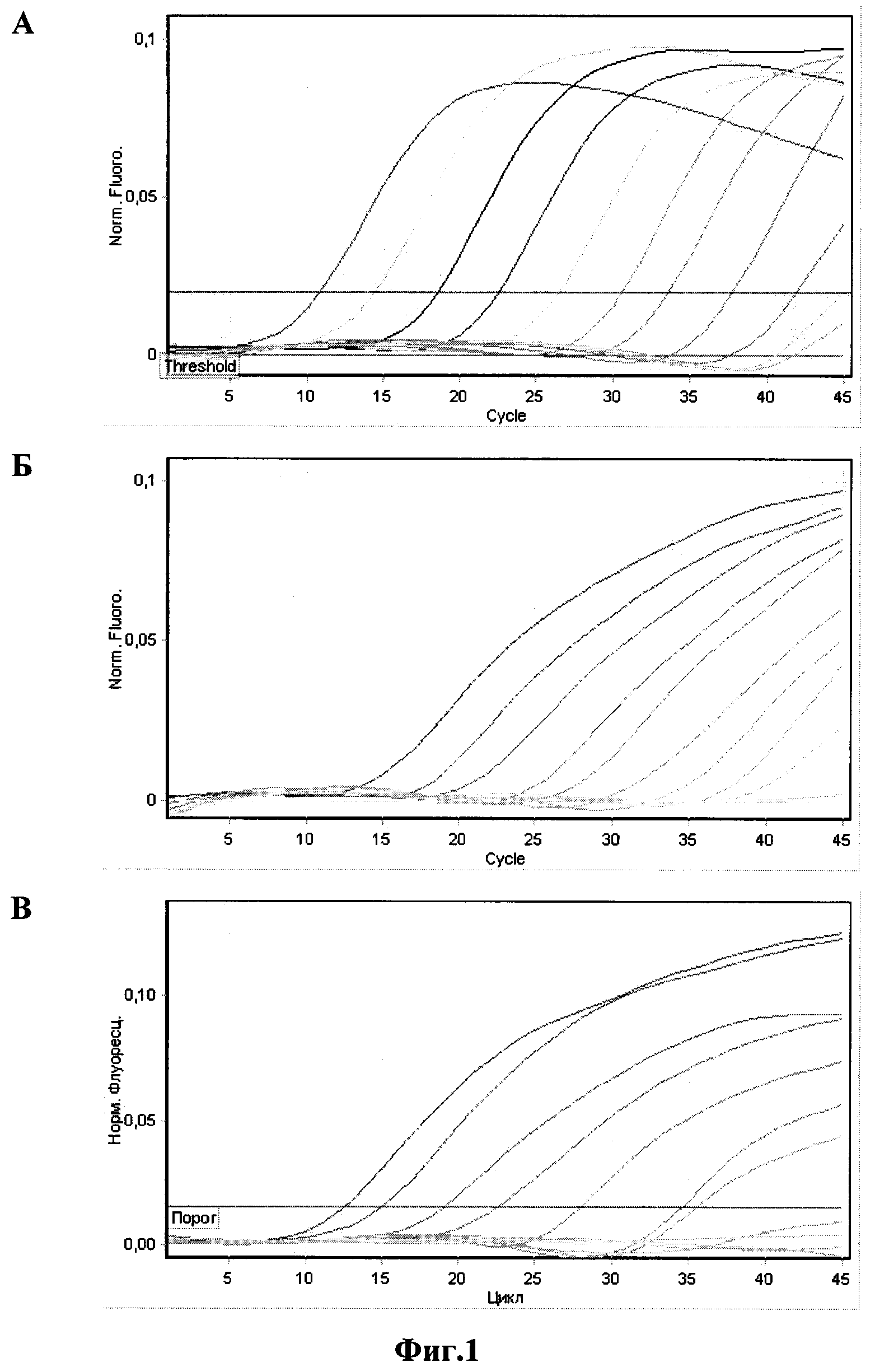
фиг. 1 и 2.
Фиг. 1 - оценка аналитической чувствительности набора праймеров и зондов
для смеси №1. Амплификацию и учет результатов проводили в приборе
Rotor Gene 6000 (Corbett Research, Австралия):
A - кривые флуоресценции на канале FAM/Green образцов ПКО/P.m.-Kmt1;
Б - кривые флуоресценции на канале R6G/Yellow образцов ПКО/P.m.-A;
В - кривые флуоресценции на канале Cy5/Red образцов ПКО/P.m.-D.
Фиг. 2 - оценка аналитической чувствительности набора праймеров и зондов
для смеси №2. Амплификацию и учет результатов проводили в приборе
Rotor Gene 6000 (Corbett Research, Австралия):
A - кривые флуоресценции на канале FAM/Green образцов ПКО/P.m.-B;
Б - кривые флуоресценции на канале ROX/Orange образцов ПКО/P.m.-E;
В - кривые флуоресценции на канале R6G/Yellow образцов ПКО/P.m.-F.
За аналитическую чувствительность принимали последнее разведение ПКО, с которым результат ПЦР-анализа интерпретировался как положительный. Положительными считались образцы со значением Ct не превышающим 40. Результаты проведенных экспериментов по оценке аналитической чувствительности метода приведены в таблице 4.
Таблица 4. Результаты определения аналитической чувствительности набора праймеров и зондов для детекции бактерии P. multocida и ее серотипов
|
Минимальное количество ДНК-матриц, детектируемое с применением наших праймеров и зондов после оптимизации условий проведения реакции, выраженное в ГЭ (геномных эквивалентах) в 30 мкл реакционной смеси, составило от 72 до 1500 ГЭ на реакцию для разных серотипов бактерии P. multocida и 160 ГЭ на реакцию для бактерии P. multocida (ген Kmt1).
Пример 2. Определение и субтипирование P. multocida в образцах.
Процедуру выделения ДНК из исследуемого материала проводили с использованием набора реагентов «Комплект для выделения ДНК/РНК из сыворотки или плазмы крови» (ООО «НПФ Литех», Россия) в соответствии с инструкцией по применению.
ПЦР в режиме реального времени как для определения ДНК P. multocida, так и для определения субтипа бактерии проводили в реакционной смеси следующего состава (на 1 исследование):
|
ПЦР в режиме реального времени, как для определения генетического материала P. multocida, так и для определения ее субтипа, и регистрацию результатов проводили в приборе Rotor Gene 6000 (Corbett Research, Австралия) по следующей программе:
|
Измерение флуоресценции осуществляли при температуре 54 С.
Для проведения исследования использовали смывы бактерии P. multocida с питательной среды (агар Хоттингера с сывороткой лошади) и высушенные культуры субтипов бактерий P. multocida, разведенные в физиологическом растворе до концентрации 1000 микробных клеток/реакцию. В качестве отрицательных контролей были использованы высушенные культуры бактерий Mannheimia haemolytica тип A1 (штамм 16, коллекция микроорганизмов Института экспериментальной ветеринарии Сибири и Дальнего Востока РАСХН) и Escherichia coli (штамм F-50, ATCC 25922, коллекция микроорганизмов ГНЦ ВБ «Вектор»), разведенные в физиологическом растворе до концентрации 100000 микробных клеток/реакцию. Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считали положительным в случае, если кривая накопления флуоресценции для соответствующего образца имела характерную «сигмовидную» форму и пересекала пороговую линию. При этом значение Ct для данного образца было не больше 40. Результаты эксперимента приведены в таблице 5.
Таблица 5. Определение и субтипирование P. multocida в образцах культур микроорганизмов методом ПЦР «в режиме реального времени» с использованием в качестве образцов панели штаммов бактерий рода P. multocida (субтипов A, B, D)
|
Проведенные исследования (табл. 4) показали, что рассчитанные и синтезированные праймеры и зонды по сравнению с прототипом более специфично выявляли бактерию P. Multocida и серотип F в 10 раз, а серотипы A, B и E в 100 раз. Использование отрицательных контролей (штамм 16 M. haemolytica тип A1 и штамм F-50 E. coli), разведенных в физиологическом растворе до концентрации 100 000 микробных клеток/реакцию, не вызывало появления флуоресцентного сигнала, что говорит о специфичности использованных праймеров и зондов.
Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации и субтипирования ДНК бактерии Pasteurella multocida серотипов A, B, D, E, F методом ПЦР в режиме реального времени, характеризующийся тем, что он содержит:- универсальные прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации бактерии P. multocida: - специфические прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации серотипа А бактерии P. multocida: - специфические прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации серотипа В бактерии P. multocida: - специфические прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации серотипа D бактерии P. multocida: - специфические прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации серотипа E бактерии P. multocida: - специфические прямой (F) и обратный (R) праймеры и флуоресцентно-меченый ДНК-зонд (Z) для идентификации серотипа F бактерии P. multocida: