Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ПИРИДОКСИНА С АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к области фармацевтики, а именно к синтетическим биологически активным веществам гетероциклического ряда, обладающим антихолинэстеразной активностью, и представляет собой продукты модификации ацеталей пиридоксина.
Антихолинэстеразные средства являются едва ли не самой обширной группой среди биологически активных веществ. На основе ингибиторов холинэстераз создано большое количество лекарственных препаратов для лечения различных заболеваний нервной системы, включая болезнь Альцгеймера [Braida, D. Eptastigmine: Ten Years of Pharmacology, Toxicology, Pharmacokinetic, and Clinical Studies [Текст] / D. Braida, M. Sala // CNS Drug Rev. - 2001. - V.7, N.4. - P.369-386; Millard, С.В. Anticholinesterases: Medical Applications of Neurochemical Principles [Текст] / C.B. Millard, C.A. Broomfield // J. Neurochem. - 1995. - V.64, N.5. - P.1909-1918]. Изучение различных классов соединений на протяжении длительного времени привело к созданию эффективных препаратов антихолинэстеразного действия, в частности широко известных и хорошо себя зарекомендовавших производных 3-гидроксипиридина - структурных аналогов объекта настоящего изобретения.
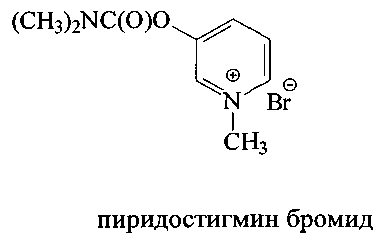
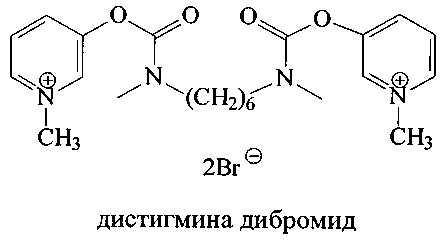
Пиридостигмин [Pat. CH 246834. Verfahren zur Darstellung des N,N-Dimethyl-carbaminsaureesters des 3-Оху-1-methyl-pyridiniumbromids [Текст] / Aktiengesellschaft F Hoffmann; Hoffmann La Roche. - Опубл. - 31.01.1947.] и дистигмин [Pat. US 2789981, IPC C07C 271/06. Bis-carbamic acid ester compounds, and a process of making same [Текст] / Otto Schmid; Chemie Linz AG. - Опубл. - 23.04.1957] обладают высокой антихолинэстеразной активностью, и находят широкое применение в практике, в частности пиридостигмин применяется при миастении, двигательных нарушениях после травм, параличей, в восстановительном периоде после перенесенного полиомиелита, энцефалита и т.п.
Важно отметить, что данные вещества обладают значительными недостатками: высокая токсичность, наличие серьезных побочных эффектов. Так, применение пиридостигмина оказывает разрушительное действие на ЦНС и приводит к беспокойству, снижению внимания, ухудшению памяти [Abdullah, L. Proteomic CNS Profile of Delayed Cognitive Impairment in Mice Exposed to Gulf War Agents [Текст] / G. Crynen, J. Reed, A. Bishop, J. Phillips, S. Ferguson, B. Mouzon, M. Mullan, V. Mathura, M. Mullan, G. Ait-Ghezala, F. Crawford // Neuromol Med. - 2011. - V.13, N.4. - P.275-288; Lamproglou, I. Repeated stress in combination with pyridostigmine Part I: Long-term behavioural consequences [Текст] / I. Lamproglou, L. Barbier, M. Diserbo, F. Fauvelle, W. Fauquette, С Amourette, // Behavioural Brain Research. - 2009. - V.197, N.2. - P.301-310].
Задача заявленного технического решения состоит в создании биологически активного вещества с высокой антихолинэстеразной активностью и относительно низкой токсичностью.
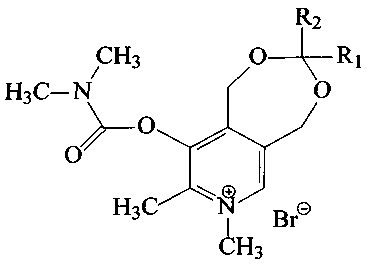
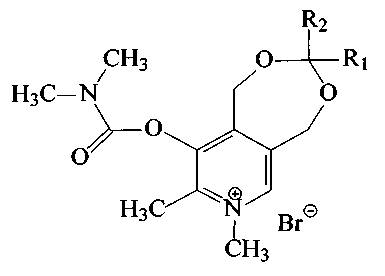
Поставленная задача решается путем синтеза 1,5-дигидро-3-R1-3-R2-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромидов общей формулы (I):
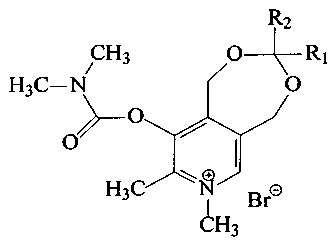
где R1 - атом водорода или метил,
R2 выбраны из группы: атом водорода, метил, этил, пропил, изо-пропил, трет-бутил, гептил, октил или (1-метилдецил).
Создание ингибитора холинэстеразы на основе природного соединения (витамин В6) позволяет значительно снизить токсичность.
Заявляемые вещества общей формулы (I) могут применяться в виде солей с анионами брома, хлора, йода или другими фармакологически приемлемыми анионами.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Заявляемые вещества проявили высокую антихолинэстеразную активность и могут найти применение в медицине.
Заявителем не выявлены источники, в которых содержались бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. Указанное новое свойство объекта обусловливает, по мнению заявителя, соответствие изобретения критерию «изобретательский уровень».
Предлагаемые в данном изобретении соединения формулы (I) получали согласно нижеприведенной схеме:
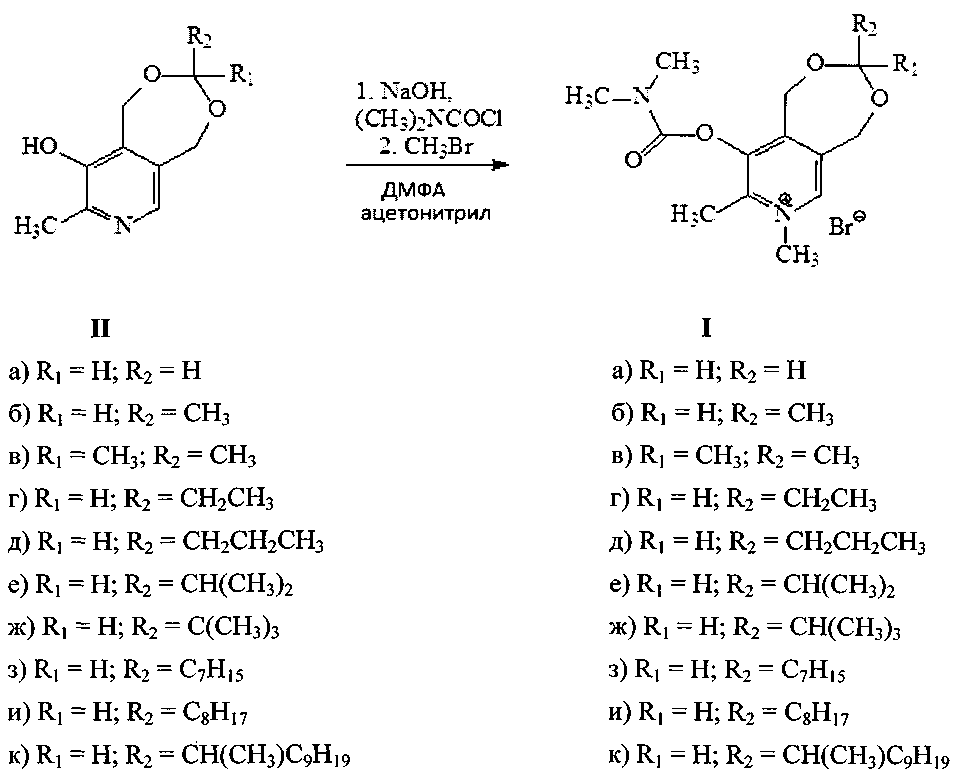
Ацетали пиридоксина были получены по описанным в литературе методикам [Пат. РФ 2480471, МПК A61K 31/4375. Антибактериальные соединения на основе сульфаниловой кислоты и пиридоксина [Текст] / Штырлин Ю.Г., Петухов А.С., Стрельник А.Д., Никитина Е.В., Гарипов М.Р.; ВГАОУ ВПО К(П)ФУ. - Опубл. - 27.04.2013].
Реакция карбамоилирования по ароматическому атому кислорода проводилась нагреванием натриевой соли ацеталя пиридоксина и карбамоилхлорида в ДМФА. Алкилирование выделенных из реакционной смеси без дополнительной очистки продуктов проводили бромистым метилом в ацетонитриле или бензоле при 60°C Характеристики новых соединений приведены в примерах конкретного выполнения.
Примеры конкретного выполнения заявленного технического решения
Пример 1. Синтез 1,5-дигидро-7,8-диметил-9-диметилкарбамоилокси -[1,3]диоксепино-[5,6-с]-пиридиний бромида (Ia).
К 0,005 молям ацеталя пиридоксина добавили раствор 0,005 молей гидроксида натрия в этаноле и выпарили досуха. Сухой остаток растворили в 15 мл диметилформамида и при перемешивании добавили 0,005 молей диметилкарбамоила хлористого. Реакционную массу нагревали на водяной бане два с половиной часа, затем растворитель отогнали в вакууме и обработали 0,015 моль метила бромистого в 50 мл ацетонитрила при нагревании до 60°C в течение 6 часов. Продукт высадили из реакционной массы эфиром и после фильтрования перекристаллизовали из этилового спирта. Выход реакции 80%.
Т.пл. с разл. 193-195°C, ЯМР 1H (200 МГц, ДМСО-d6): δ 2.60 (с, СН3, 3Н); 2.97 (с, СН3, 3Н); 3.16 (с, СН3, 3Н); 4.26 (с, СН3, 3Н); 4.98 (с, СН2, 2Н); 5.01 (с, 2СН2, 4Н); 9.03 (с, СН, 1Н). Найдено, %: С 44.86; Н 5.63; N 8.86; Br 23.01. C13H19N2O4Br. Вычислено, %: С 44.97; Н 5.52; N 8.07; Br 24.78.
Пример 2. Синтез 1,5-дигидро-3,7,8-триметил-9-диметилкарбамоил-окси-[1,3] диоксепино-[5,6-с]-пиридиний бромида (Iб).
Синтезируют и разрабатывают аналогично соединению (Ia), используя ацеталь (IIб) вместо ацеталя (IIа). Выход реакции 80%. Т.пл. с разл. 194°C, ЯМР 1H (200 МГц, ДМСО-d6): δ 1.32 (д, 3JHH=5.2 Гц, СН3, 3Н); 2.58 (с, СН3, 3Н); 2.96 (с, СН3, 3Н); 3.15 (с, СН3, 3H); 4.25 (с, CH3, 3H); 4.91,5.04 (АВ, 2JHH=-16.5 Гц, СН2); 4.93, 5.05 (АВ, 2JHH=-14.9 Гц, СН2); 5.27 (к, 3JHH=5.2 Гц, 1H); 8.97 (с, СН, 1H). Найдено, %: С 46.89; Н 6.05; N 7.90; Br 24.12. C14H21N2O4Br. Вычислено, %: С 46.55; Н 5.86; N 7.75; Br 22.12.
Пример 3. Синтез 1,5-дигидро-3,3,7,8-тетраметил-9-диметилкарбамоилокси-[1,3]диоксепино-[5,6-с]-пиридиний бромида (Iв).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIв) вместо ацеталя (IIа). Выход реакции 75%. Т.пл. с разл. 220-224°C, ЯМР 1Н (200 МГц, ДМСО-d6): δ 1.45 (с, 2СН3, 6H); 2.57 (с, CH3, 3H); 2.96 (c, CH3, 3H); 3.14 (c, CH3, 3H); 4.25 (с, CH2, 2H); 4.94 (с, 2CH2, 4H); 8.95 (с, CH, 1H). Найдено, %: C 47.60; Н 6.75; N 7.30; Br 24.00. C15H23N2O4Br. Вычислено, %: C 48.01; H 6.17; N 7.46; Br 21.29.
Пример 4. Синтез 1,5-дигидро-3-этил-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромида (Iг).
Синтезируют и разрабатывают аналогично соединению (Ia), используя ацеталь (IIг) вместо ацеталя (IIa). Выход реакции 60%. Т.пл. с разл. 173-175°C, ЯМР 1Н (300 МГц, ДМСО-d6): δ 0.89 (m, 3JHH=7.2 Гц, СН3, 3 Н); 1.65 (м, СН2, 2H); 2.59(с, СН3, 3H); 2.96 (с, СН3, 3H); 3.14 (с, СН3, 3H); 4.26 (с, СН3, 3H); 4.91, 5.03 (АВ, 2JHH=-16.8 Гц, СН2); 4.94, 5.05 (АВ, 2JHH=-15.3 Гц, СН2); 5.00 (т, 3JHH=5.8 Гц, СН, 1 Н); 9.04 (с, СН, 1H). Найдено, %: С 48.32; H 5.99; N 7.78. C15H23N2O4Br. Вычислено, %: С 48.01; Н 6.18; N 7.47.
Пример 5. Синтез 1,5-дигидро-3-пропил-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-c] пиридиний бромида (Iд).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIд) вместо ацеталя (IIa). Выход реакции 65%. Т.пл. с разл. 190-195°C, ЯМР 1Н. (300 МГц, ДМСО-d6): δ 0.91 (m, 3JHH=7.4 Гц, СН3., 3H); 1.36 (м, СН2., 2 Н); 1.62 (м, СН2., 2H); 2.58 (с, СН3., 3Н); 2.96 (с, СН3., 3Н); 3.15 (с, СН3., 3Н); 4.25 (с, СН3., 3Н); 4.92 5.04 (АВ, 2J=16.8 Гц, СН2., 2Н); 4.94 5.05 (АВ, 2J=15, СН2., 2Н); 5.08 (т 3J=5.7 Гц, СН., 1H) 8.99 (с, СН., 1H) δ 8,94 (с, ОН., 1H). Найдено, %: С 49.11; Н 6.13; N 7.58. C16H25N2O4Br. Вычислено, %: С 49.37; Н 6.47; N 7.20.
Пример 6. Синтез 1,5-дигидро-3-изопропил-9-диметилкарбамоилокси-[1,3]диоксепино-[5,6-с]-пиридиний бромида (Iе).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIе) вместо ацеталя (IIа). Выход реакции 55%. Т.пл. с разл. 200-205°C, ЯМР 1Н (300 МГц, ДМСО-d6): δ 0.93 (д, 3JHH=7,7 Гц, 2СН3, 6H); 1.36 (м, Н, 1H); 2.58 (с, СН3, 3H); 2.96 (с, СН3, 3H); 3.15 (с, СН3, 3H); 4.25 (с, СН3, 3H); 4.90 (д, 3JHH=7,7 Гц, С-Н, 1Н); 4.92-5.13 (АВ, уш., 2СН2, 4Н); 8.97 (с, СН, 1Н). Найдено, %: С 49.82; Н 6.37; N 7.12; Br 23.61. C16H25N2O4Br. Вычислено, %: С 49.36; Н 6.47; N 7.19; Br 20.52.
Пример 7. Синтез 1,5-дигидро-3-трет-бутил-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино-[5,6-с]-пиридиний бромида (Iж).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIж) вместо ацеталя (IIa). Выход реакции 45%. Т.пл. с разл. 200°C, ЯМР 1H (200 МГц, ДМСО-d6): δ 0.89 (с, 3СН3, 9H); 2.60 (с, СН3, 3H); 2.96 (с, СН3, 3H); 3.16 (с, СН3, 3H); 4.25 (с, СН3, 3Н); 4.73(с, Н, 1Н); 5.08(с, 2СН2, 4Н); 9.07 (с, СН, 1Н). Найдено, %: С 49.73; Н 6.75; N 6.48. C17H27N2O4Br. Вычислено, %: С 50.63; Н 6.75; N 6.95.
Пример 8. Синтез 1,5-дигидро-3-гептил-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромида (Iз).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIз) вместо ацеталя (IIа). Выход реакции 50%. Т.пл. с разл. 226°C, ЯМР 1H (300 МГц, ДМСО-d6): δ 0.86 (уш.с, СН3, 3Н); 1.27 (уш.с, 5СН2, 10Н); 1.63 (м, СН2, 2Н); 2.57 (с, СН3, 3Н); 2.96 (с, СН3, 3Н); 3.15 (с, СН3, 3Н); 4.80 5.25 (уш.м, СН, 2 СН2, 5Н); 8.94 (с, СН, 1Н). Найдено, %: С 53.54; Н 7.24; N 6.56. C20H33N2O4Br. Вычислено, %: С 53.93; Н 7.47; N 6.29.
Пример 9. Синтез 1,5-дигидро-3-октил-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромида (Iи).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIи) вместо ацеталя (IIа). Выход реакции 50%. ЯМР 1Н (300 МГц, ДМСО-d6): δ 0.86 (т, 3JHH=6,7 Гц, СН3, 3Н); 1.26 (уш.с, 6СН2, 12Н); 1.63 (м, СН2, 2Н); 2.58 (с, СН3, 3H); 2.96 (с, СН3, 3H); 3.15 (с, СН3, 3H); 4.25 (с, СН3, 3H); 4.90 5.03 (АВ, 2J=-16.2 Гц., СН2, 2H); 4.92 5.04 (АВ, 2J=-16.5 Гц., СН2, 2H); 5.07 (т, 3JHH=5.6 Гц, СН, 1Н); 8.97 (с, СН, 1H). Найдено, %: C 54.20; H 7.79; N 5.19. C21H35N2O4Br. Вычислено, %: C 54.9; H 7.68; N 6.10.
Пример 10. Синтез 1,5-дигидро-3-(1 метилдецил)-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромида (Iк).
Синтезируют и разрабатывают аналогично соединению (Iа), используя ацеталь (IIк) вместо ацеталя (IIа). Выход реакции 50%. ЯМР 1Н (300 МГц, ДМСО-d6): δ 0.86 (м, 2 СН3, 6Н); 1.25 (уш.с, 8СН2, 15H); 1.47 (м, СН2, 1Н); 1.77 (м, СН2, 2Н); 2.58 (с, СН3, 3Н); 2.96 (с, СН3, 3Н); 3.15 (с, СН3, 3Н); 4.24 (с, СН3, 3Н); 4.77 (д, 3JHH=6.6 Гц, СН, 1H); 4.93 5.05 (АВ, 2J=-16.5 Гц., СН2, 2H); 4.96 5.03 (АВ, 2J=-14.7 Гц., СН2, 2H); 8.94 (с, СН, 1H).
Пример 11. Исследование антихолинэстеразной активности заявленных соединений.
Регистрацию ферментативной реакции осуществляли согласно методу Элмана [Ellman G.L., Courtney K.D., Andres V. Jr., Feather-Stone R.M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 1961, №7, C.88-95]. Анализ зависимости активности холинэстеразы от концентрации ингибитора проводили уравнением Хилла (Hill) с вычислением среднеэффективной концентрации - IC50. Ацетилхолинэстераза и бутирилхолинэстераза человека были куплены в Sigma-Aldrich. Результаты ингибиторной активности заявляемых соединений приведены в таблице 1, которые свидетельствуют о том, что все соединения проявляли антихолинэстеразную активность, сопоставимую с активностью пиридостигмина.

Пример 12. Исследование антихолинэстеразной активности заявленных соединений in vivo.
Первичную токсикологическую оценку соединений (в рамках поточного скрининга) при внутрибрюшинном способе (в/б) введения в виде водных растворов проводили в острых опытах на мышах обоего пола массой 19,0±2,0 г. Затем в течение последующих 72 часов проводилось наблюдение за состоянием мышей, регистрировались симптомы интоксикации. Критерием токсичности служил расчетный показатель ЛД50 - доза, при которой у 50% животных наблюдались смертельные исходы (таблица 2). Для установления ЛД50 каждое соединение вводили 4 группам мышей (по 6 особей на каждую дозу; n=24) [Методика определения ЛД50 - Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Изд. 2-е переработанное и дополненное. - М.: ЗАО ИИА Ремедиум, 2005. - 829 с.].
В качестве показателей целевой эффективности (ЭД50) соединений в отношении функций мионеврального аппарата (миорелаксантная активность) соединений были избраны среднеэффективные дозы (ЭД50) в тесте «бег на третбане» (третбан Nihon Kohden sts-7500a/cc-730da, Япония) при скоростях протяжки ленты 1 км/ч для мышей (угол наклона 0°). Исследуемые соединения и вещества сравнения в виде водных растворов вводили внутрибрюшинно (мыши) за 5 мин до начала выполнения физической нагрузки. Контрольным мышам вводился физиологический раствор. Критерием эффективности соединений была неспособность 50% животных выполнять физическую нагрузку на третбане в течение 30 мин. Для установления ЭД50 (таблица 2) каждое соединение вводили 4 группам предварительно тренированных животных (по 8 особей на каждую дозу; n=32). [Методика определения ЭД50 - Бобков Ю.Г., Виноградов В.М., Катков В.Ф., Лосев С.С., Смирнов А.В. Фармакологическая коррекция утомления. - М.: Медицина, 1984. - 208 с.].
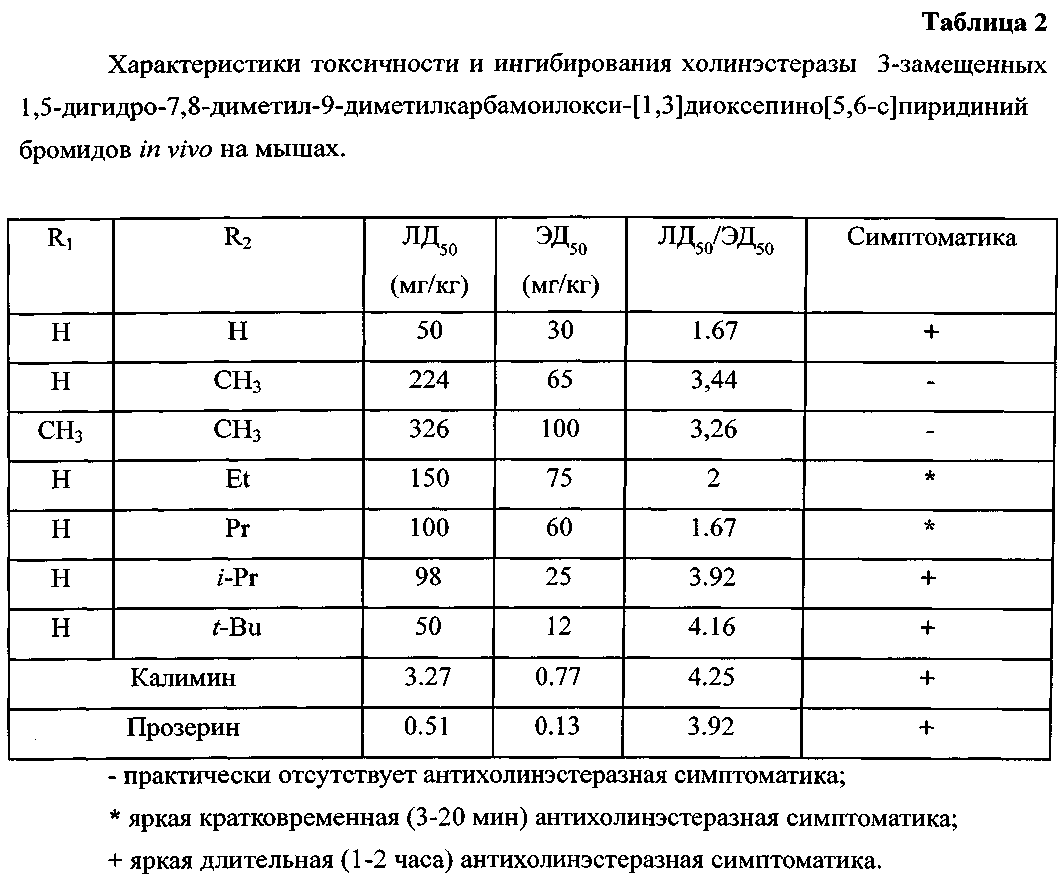
К очевидному достоинству полученных соединений следует отнести значительно меньшую их острую токсичность по сравнению с калимином и прозерином.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Производные ацеталей пиридоксина, а именно 1,5-дигидро-3-R-3-R-7,8-диметил-9-диметилкарбамоилокси-[1,3]диоксепино[5,6-с]пиридиний бромиды общей формулы I, обладающие антихолинэстеразной активностью: I, где R - атом водорода или метил,R выбраны из группы: метил, этил, пропил, изо-пропил, трет-бутил, гептил, октил или (1-метилдецил).