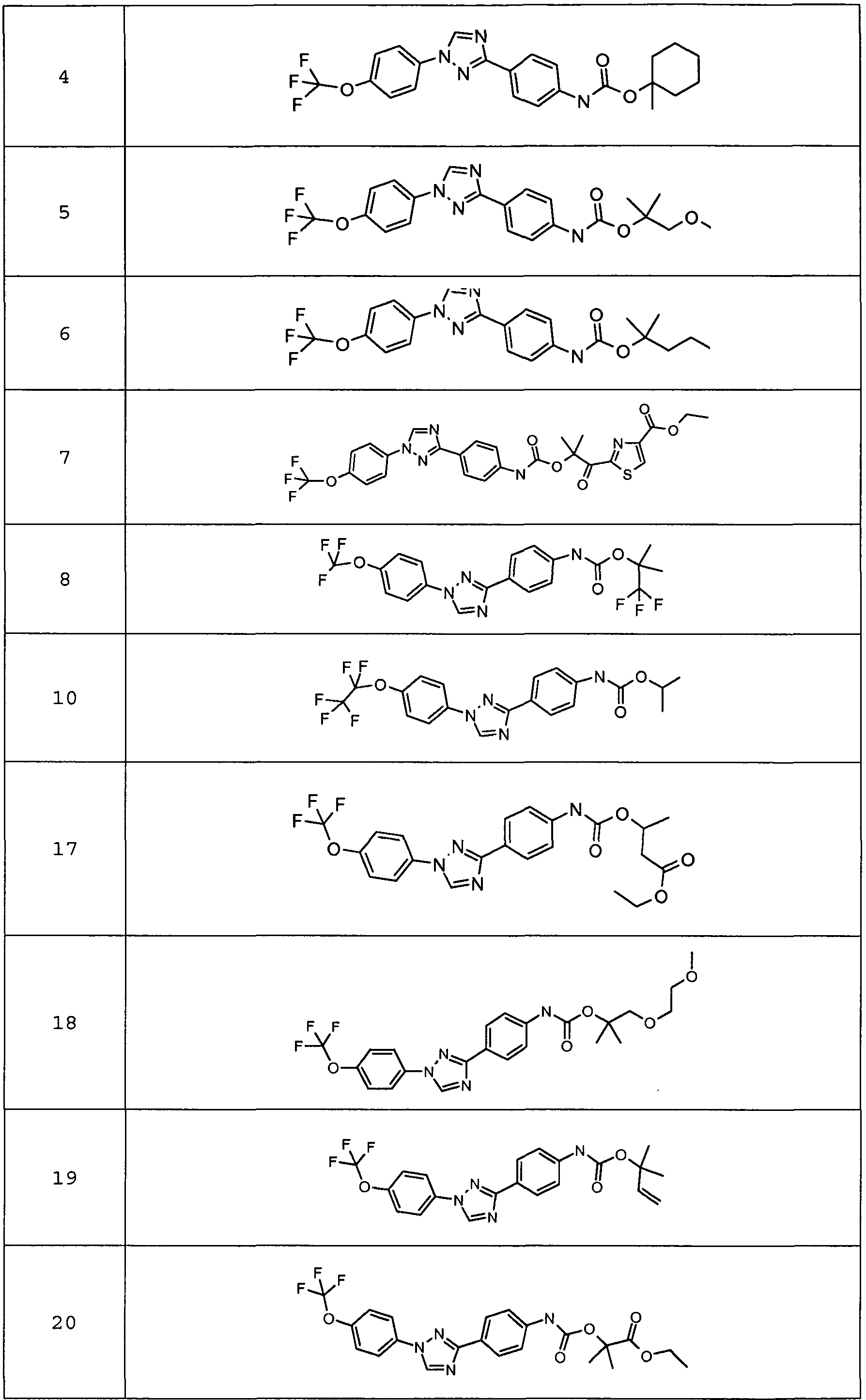
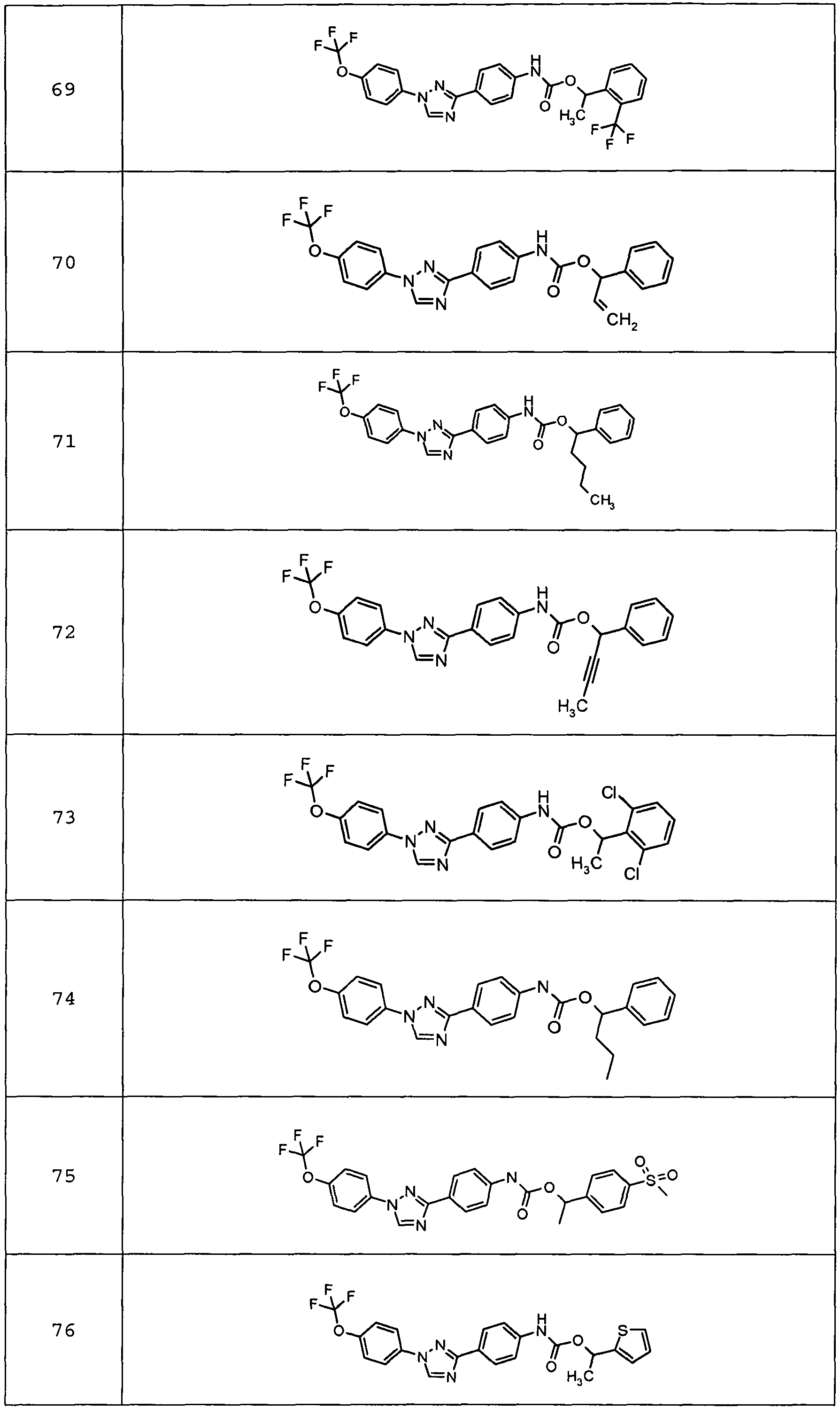
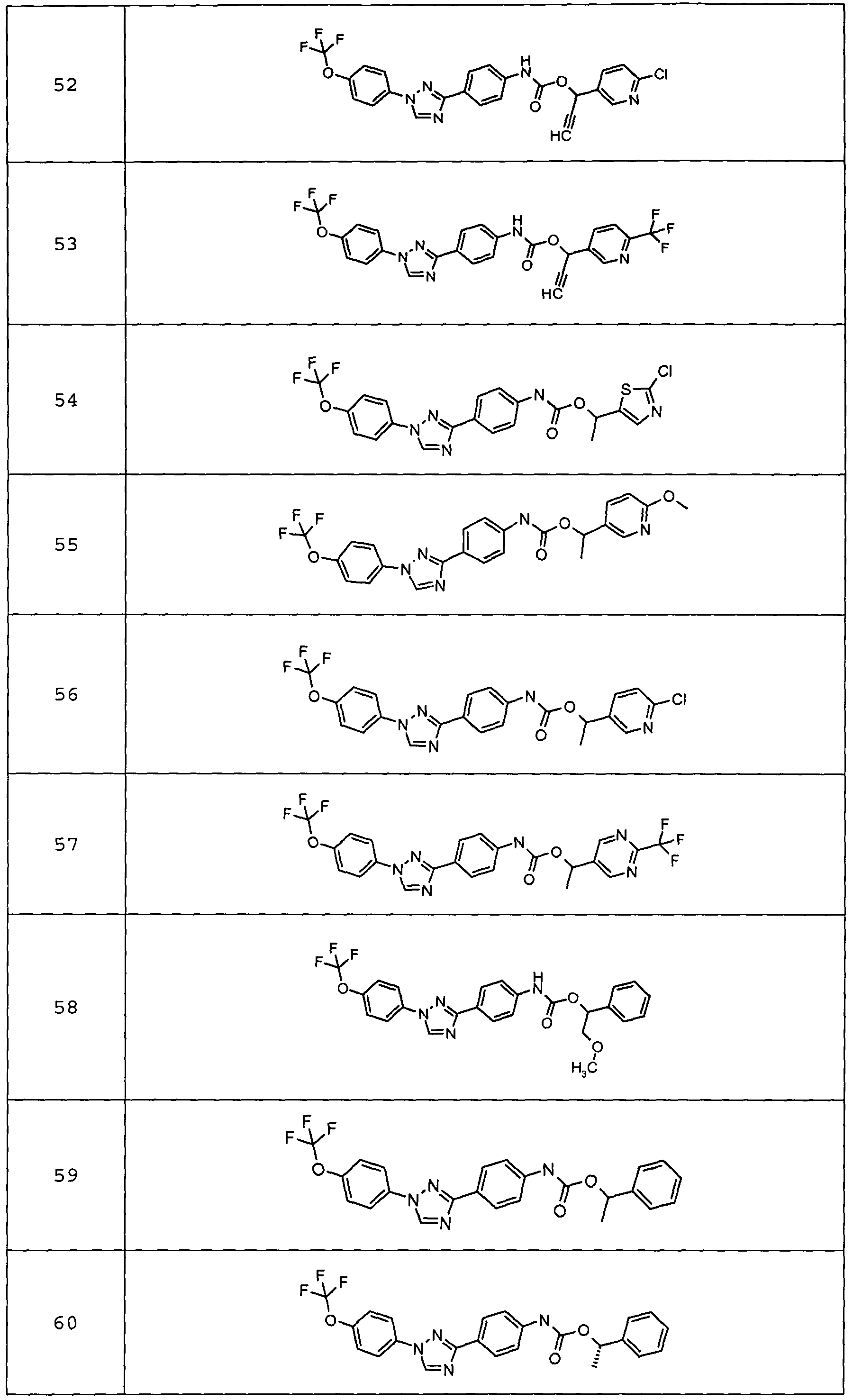
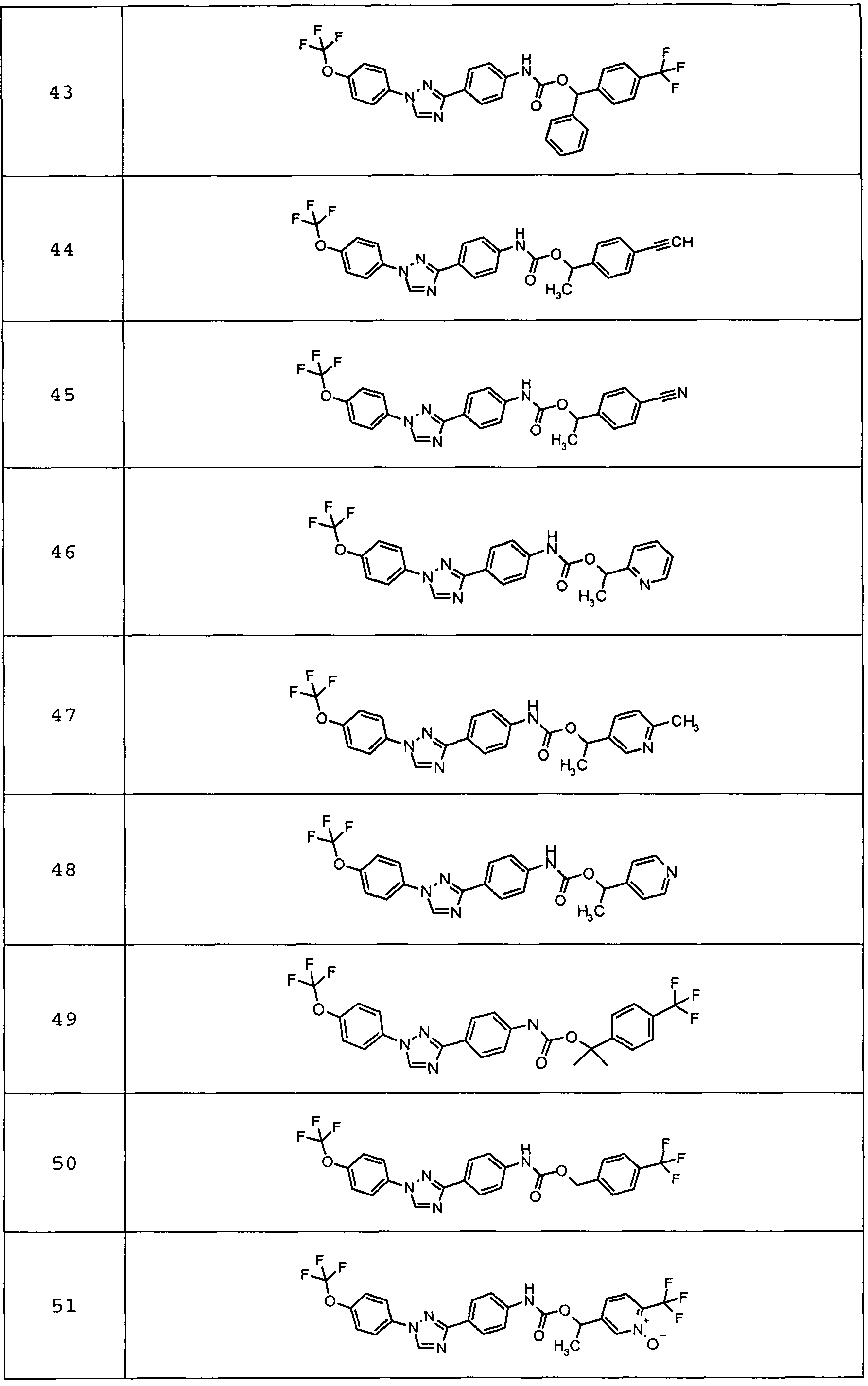
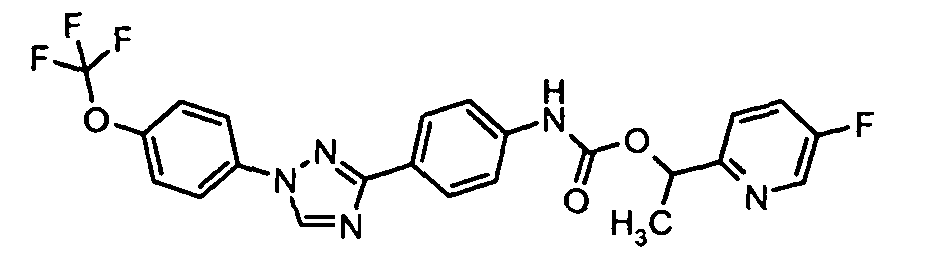
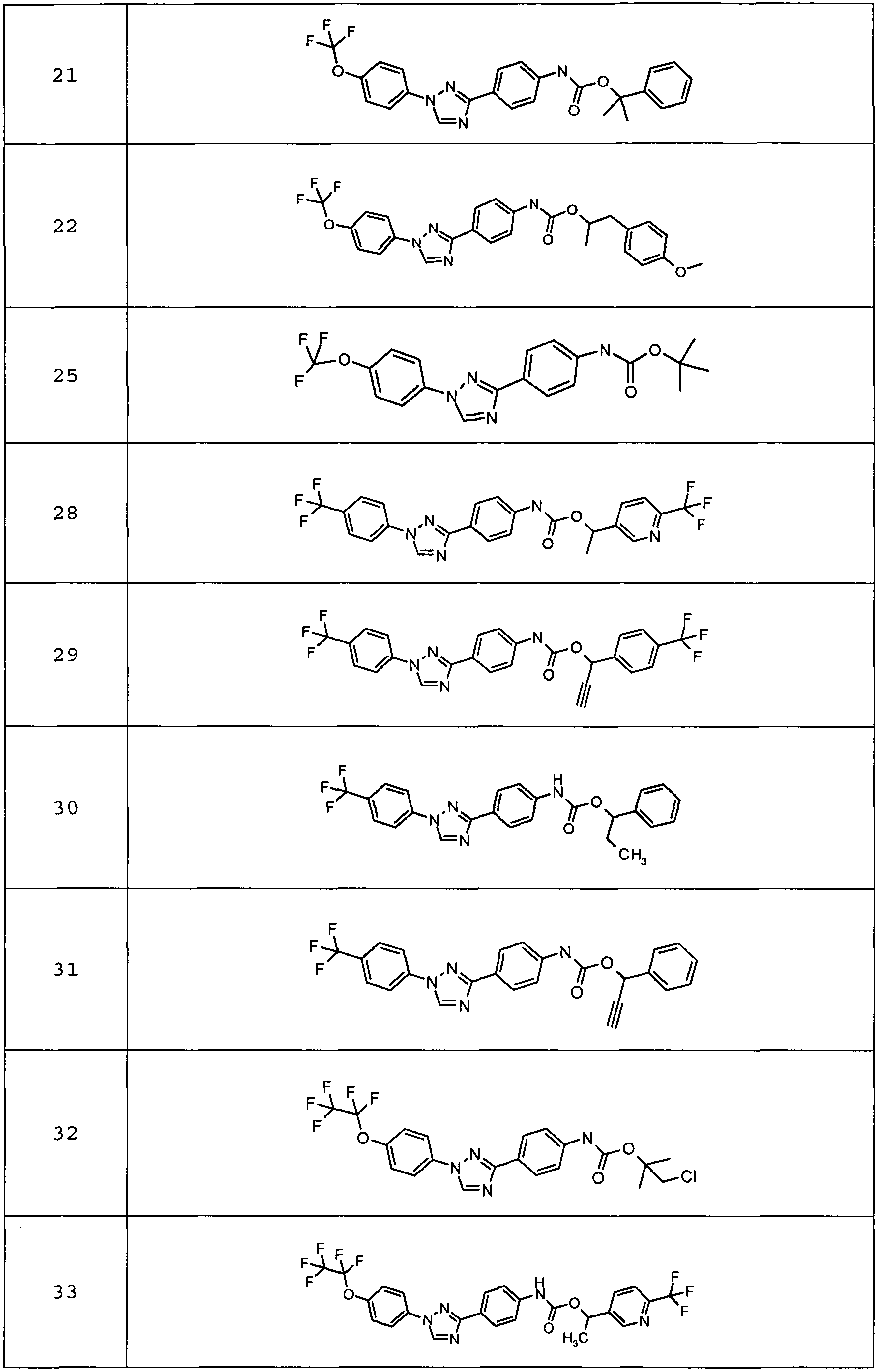
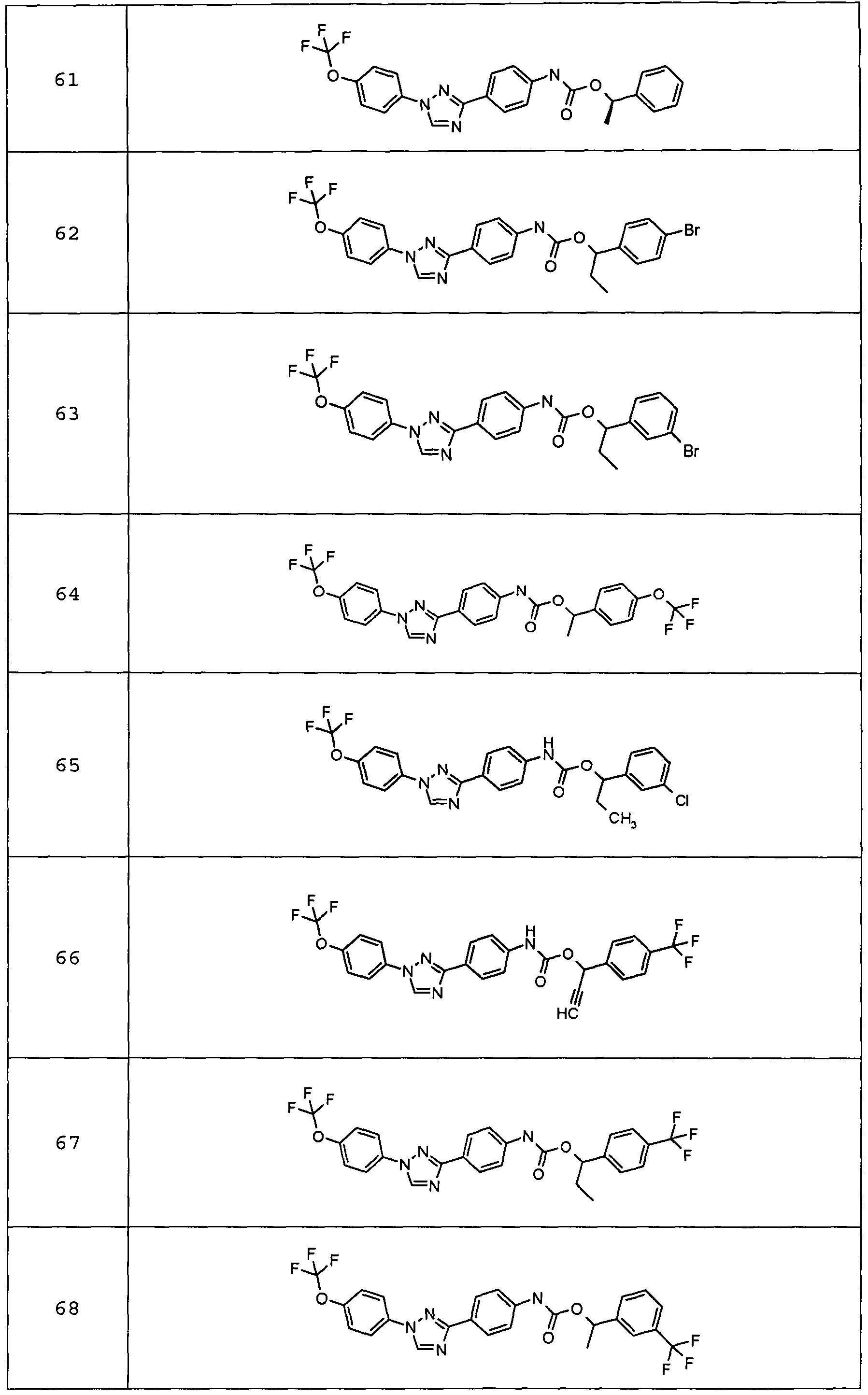
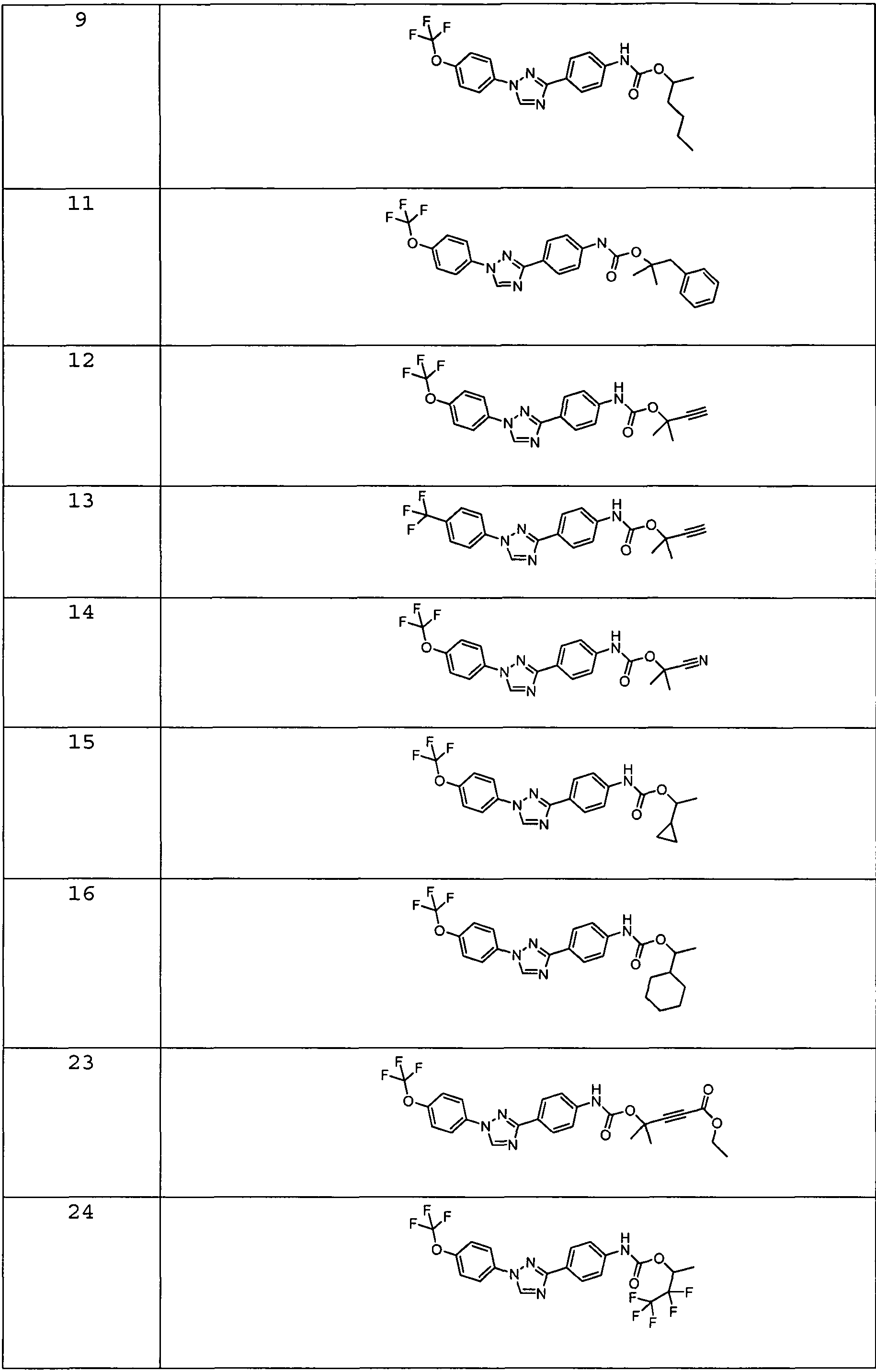
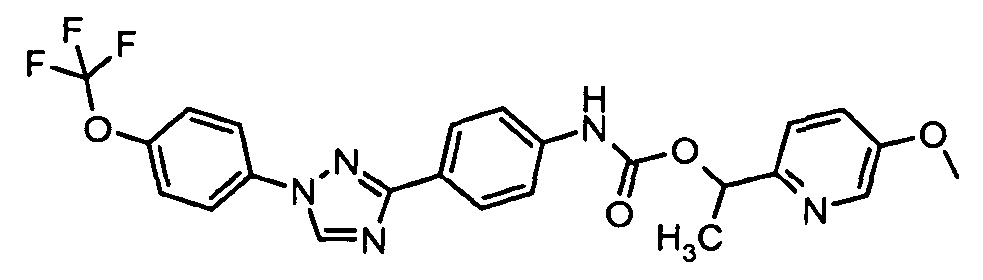
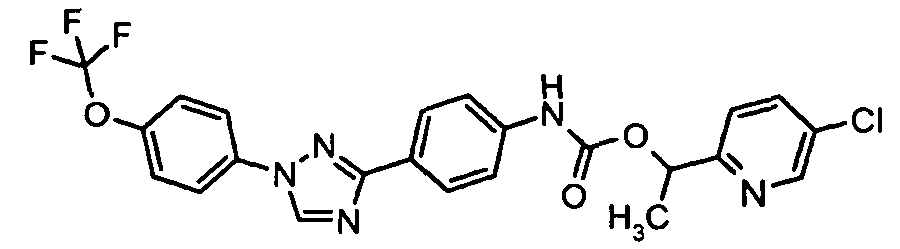
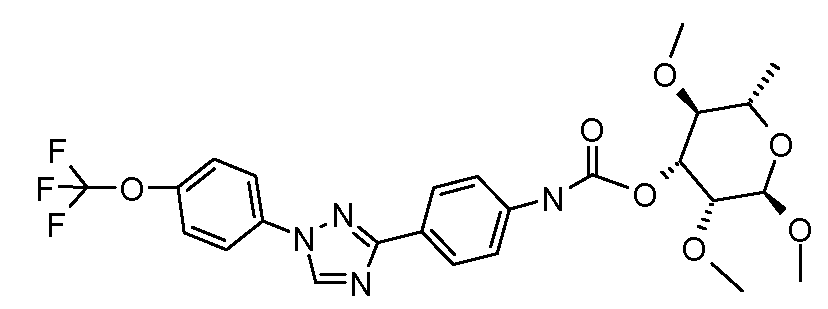
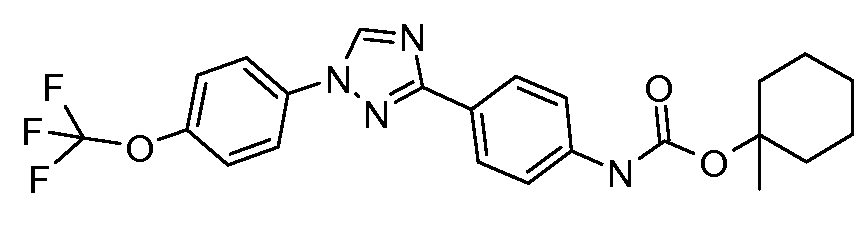
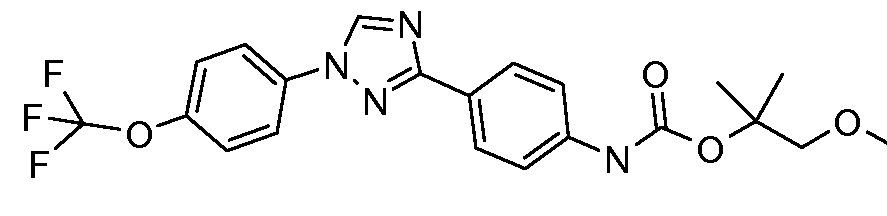
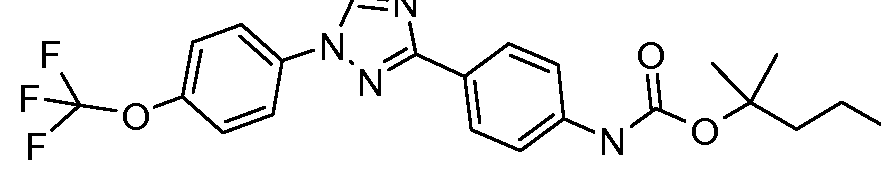
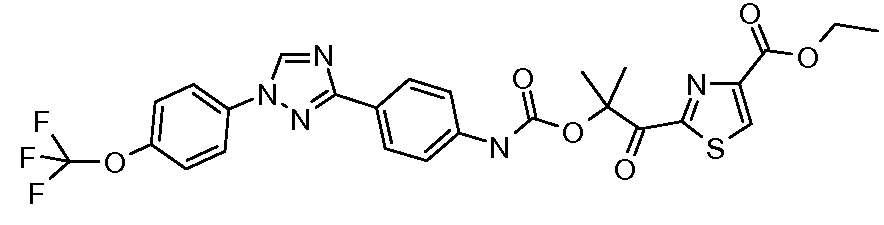
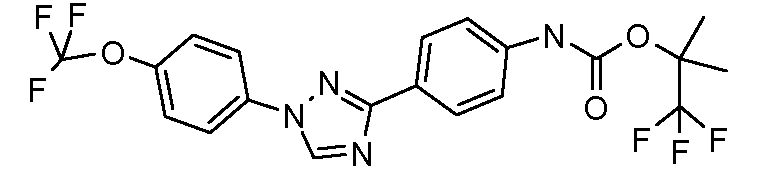
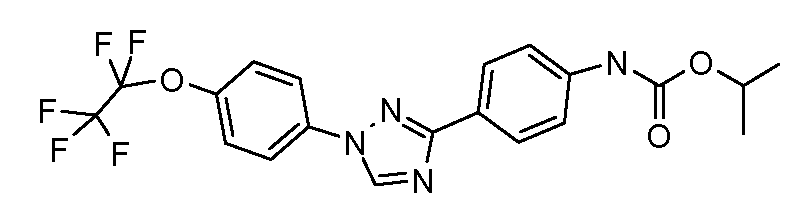
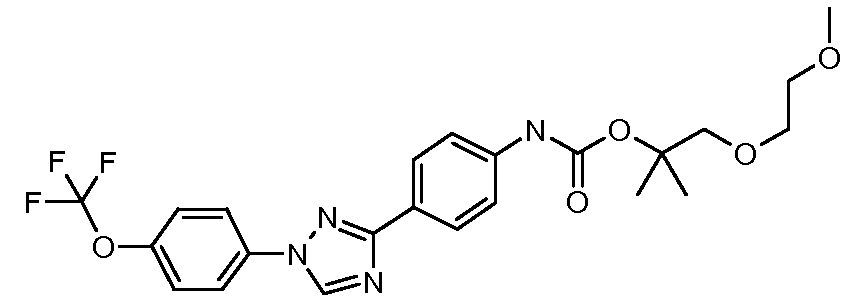
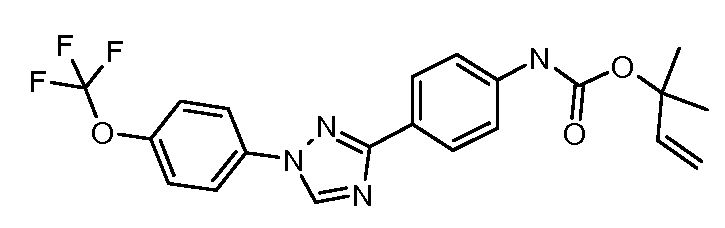
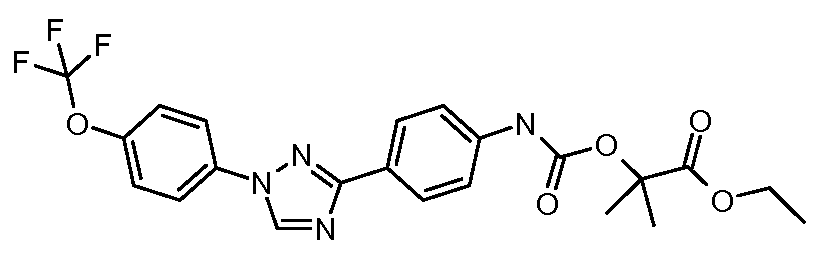
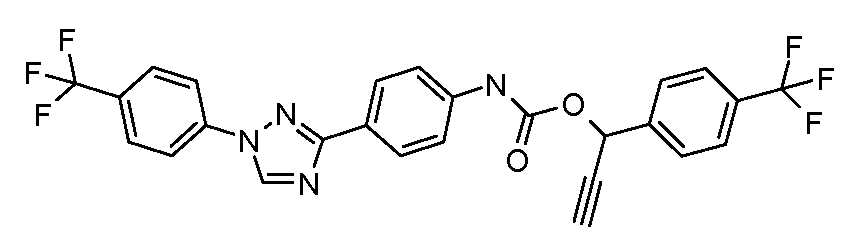
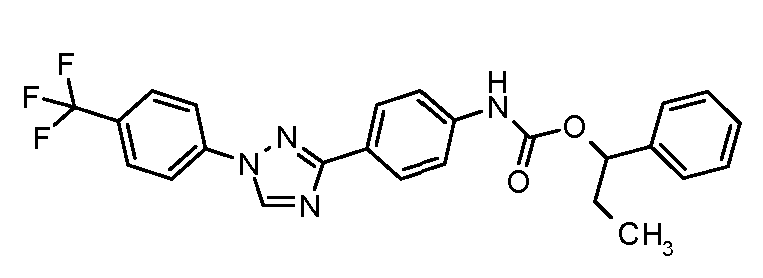
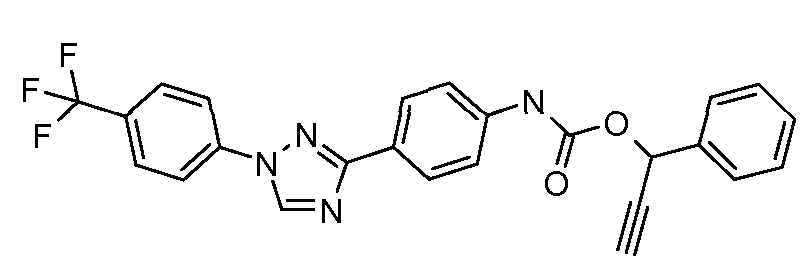
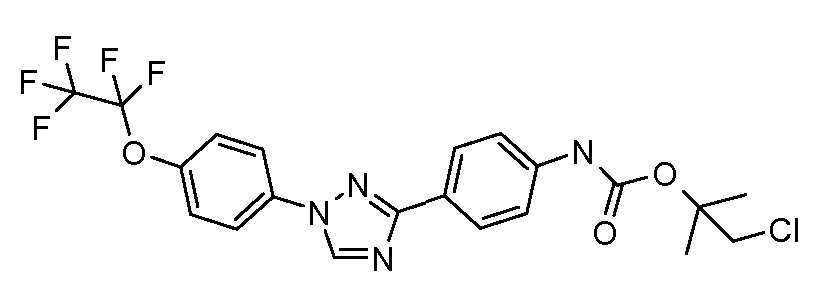
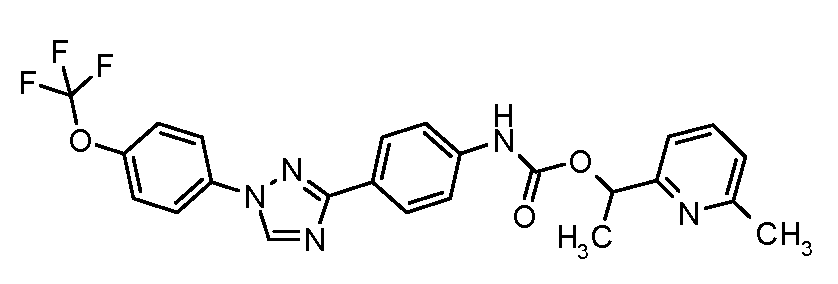
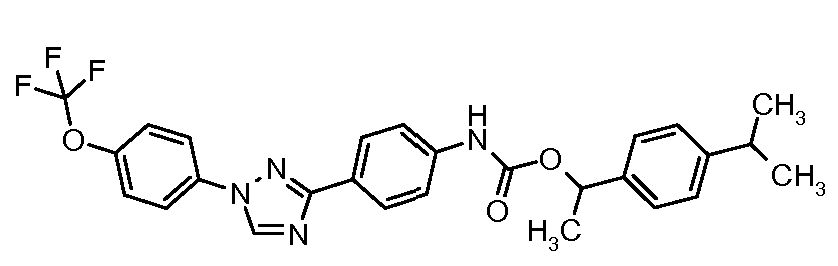
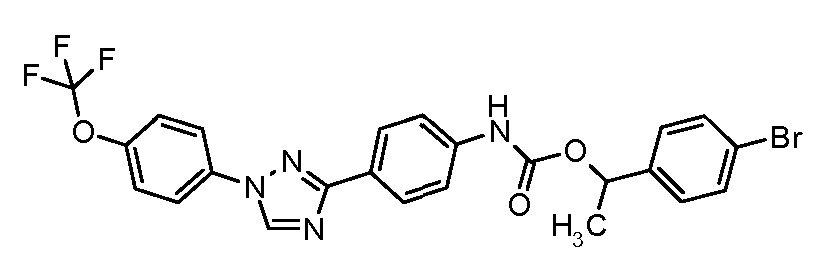
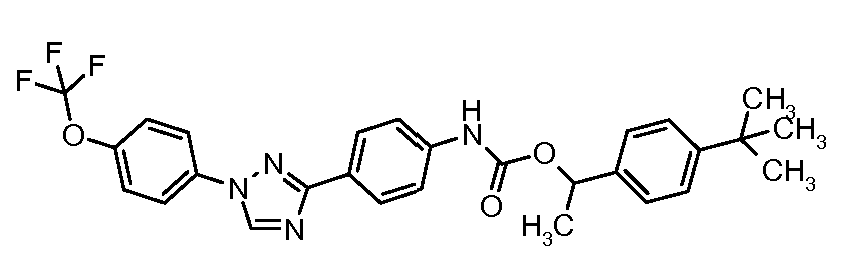
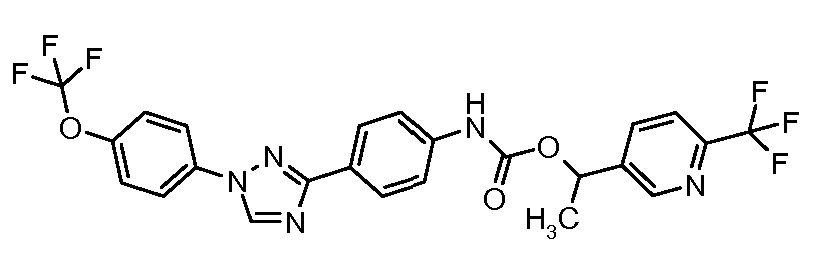
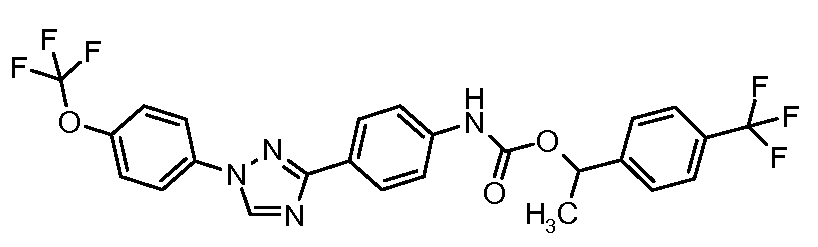
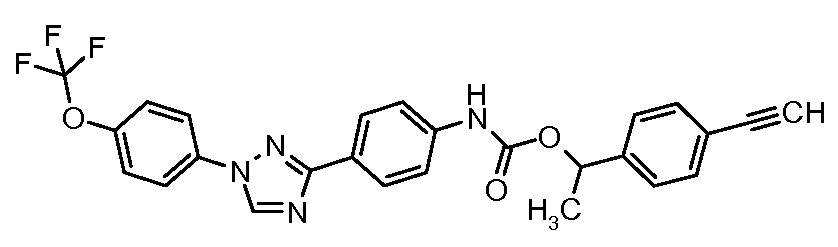
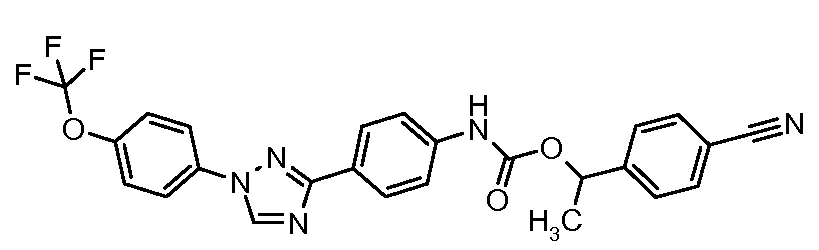
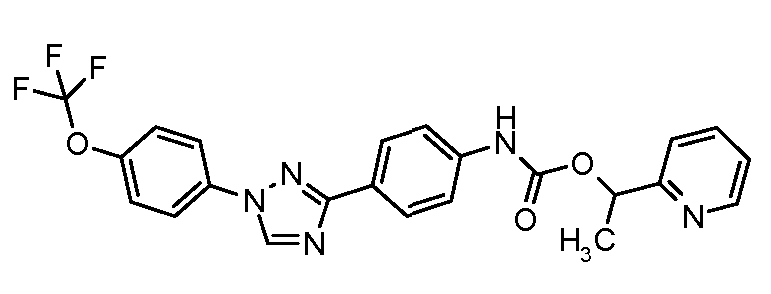
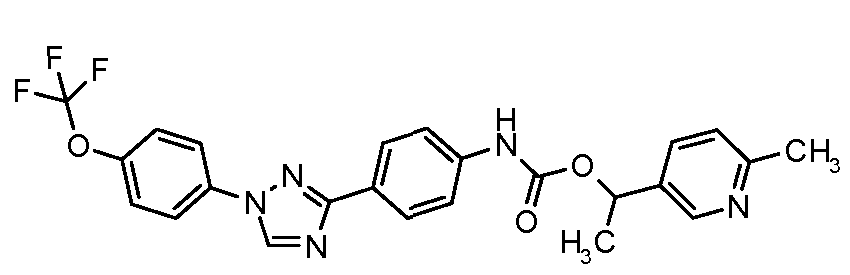
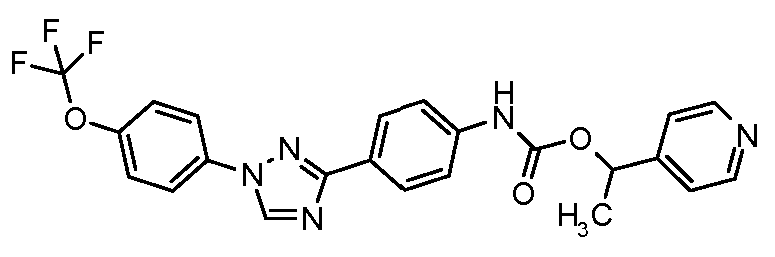
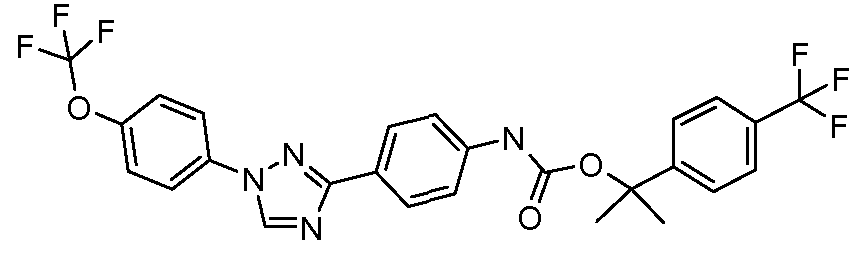
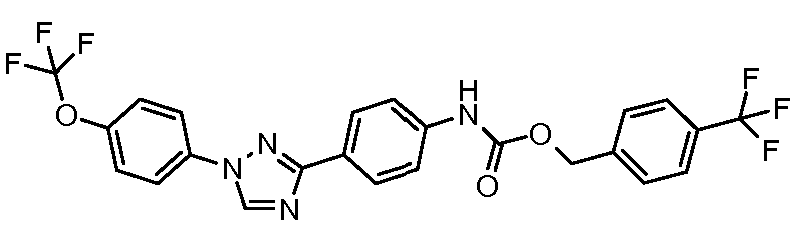
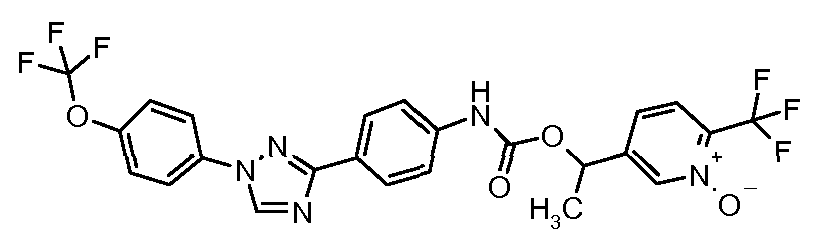
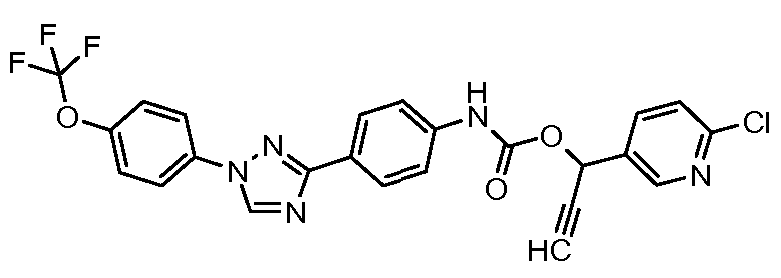
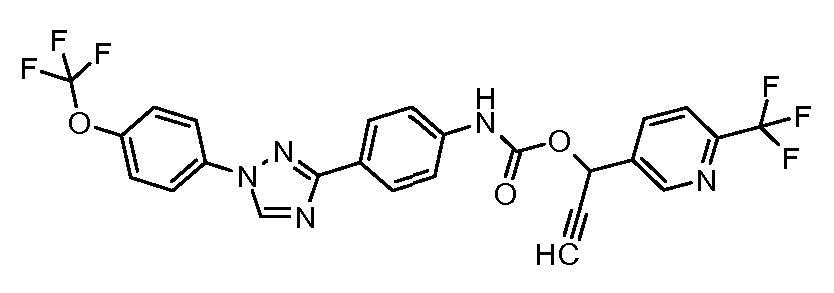
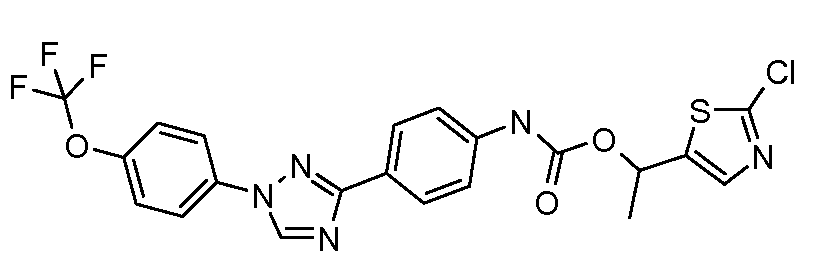
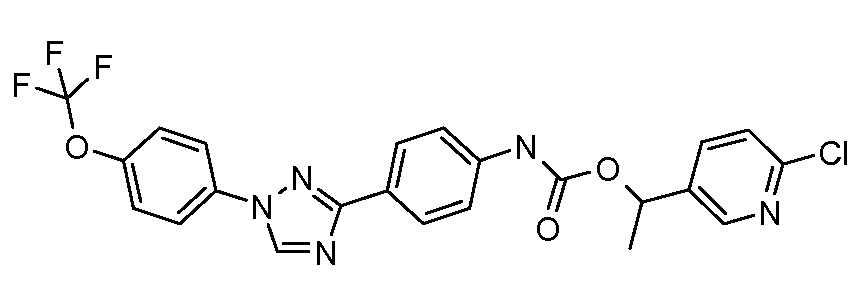
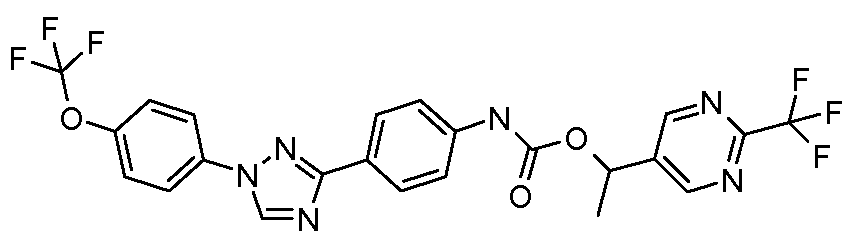
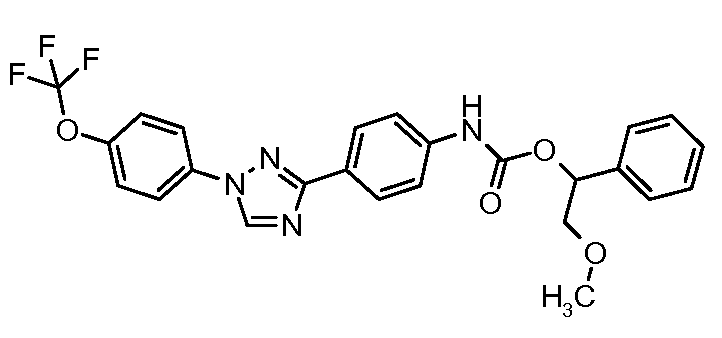
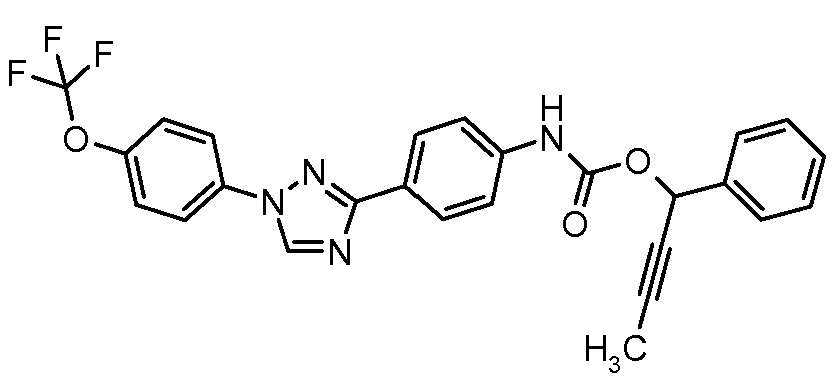
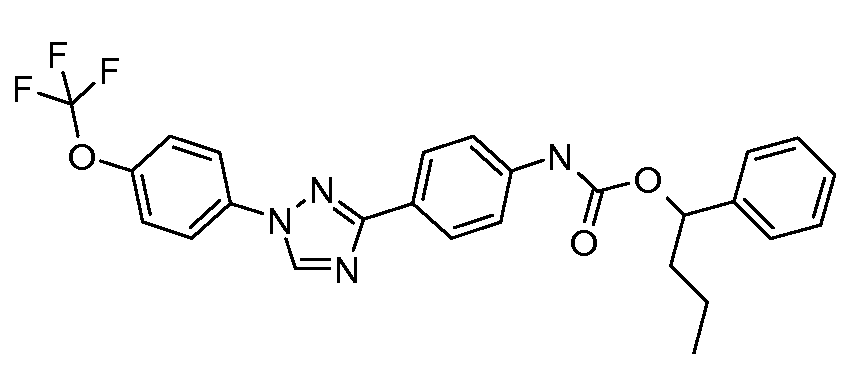
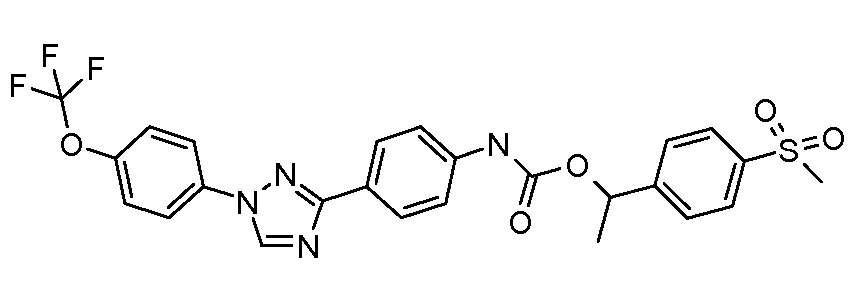
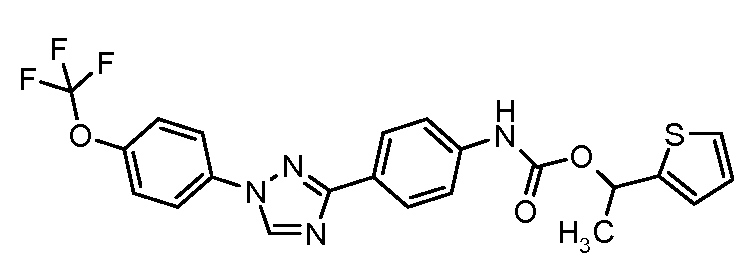
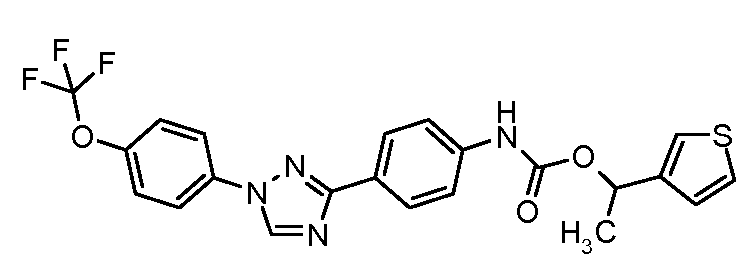
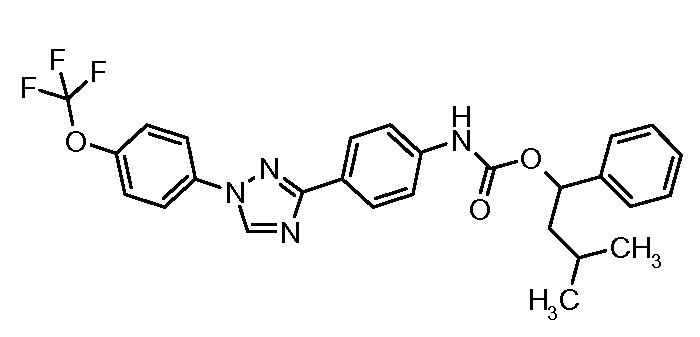
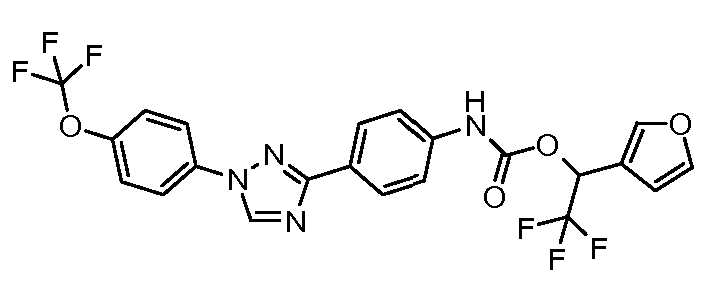
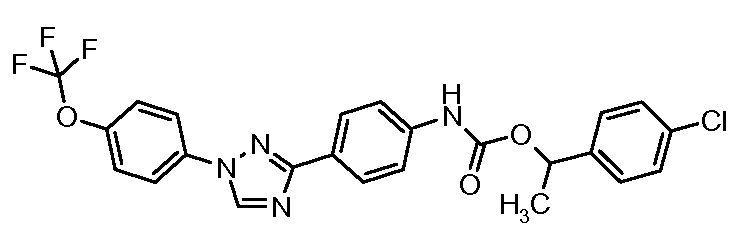
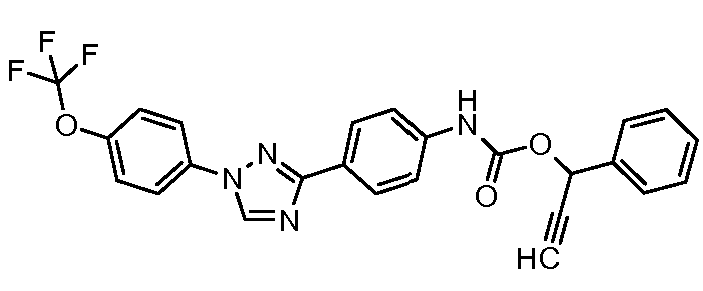
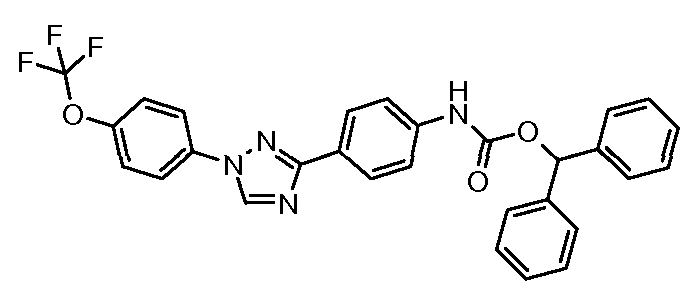
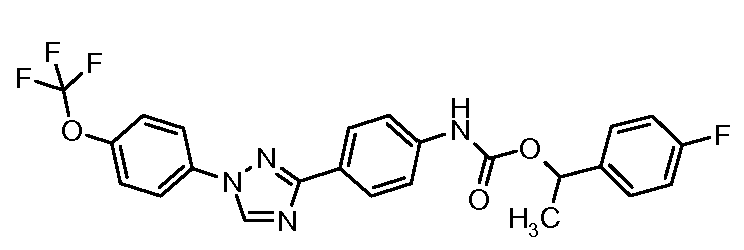
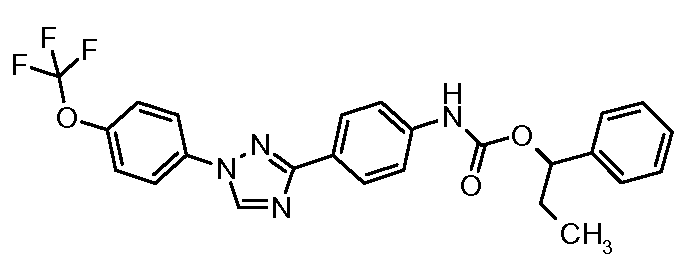
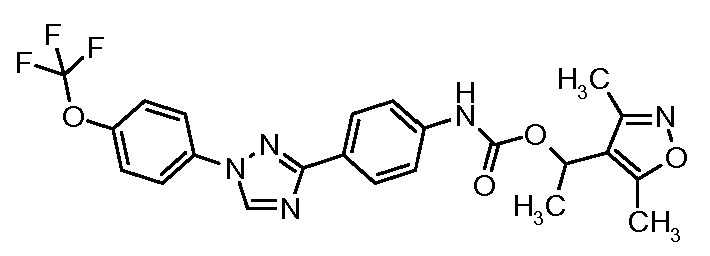
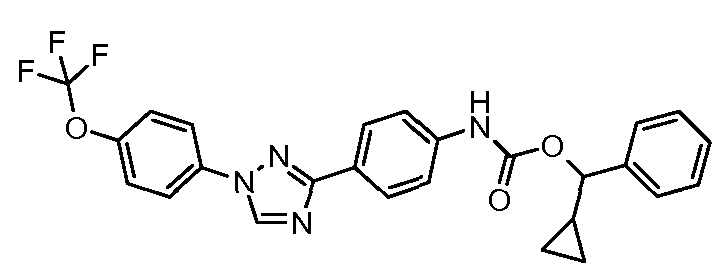
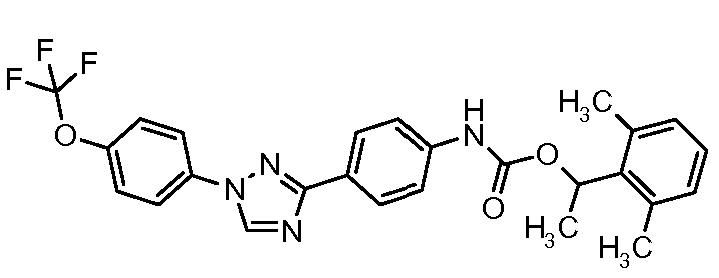
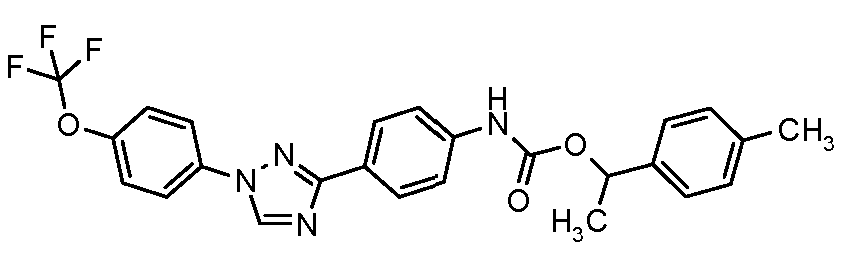
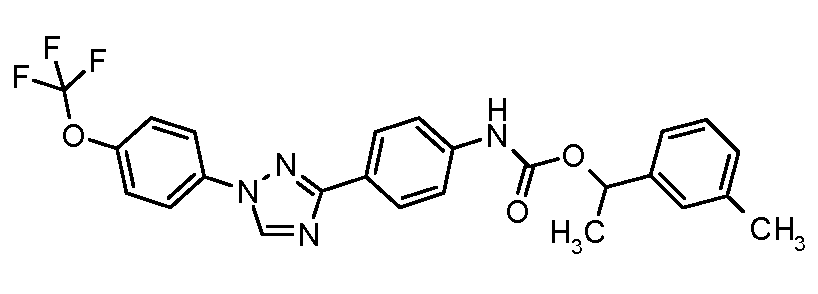
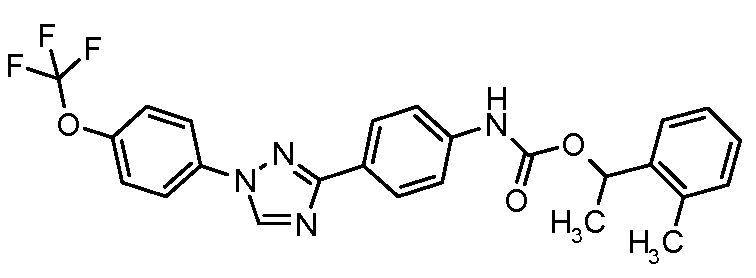
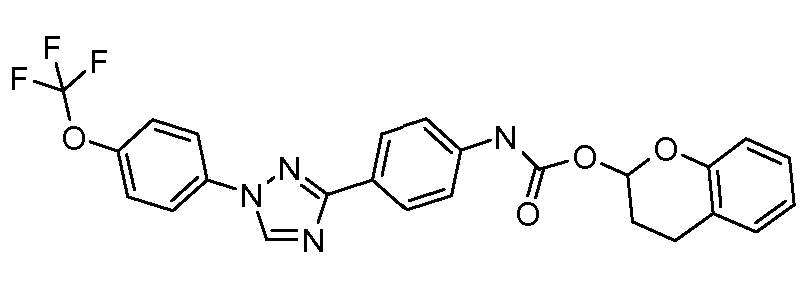
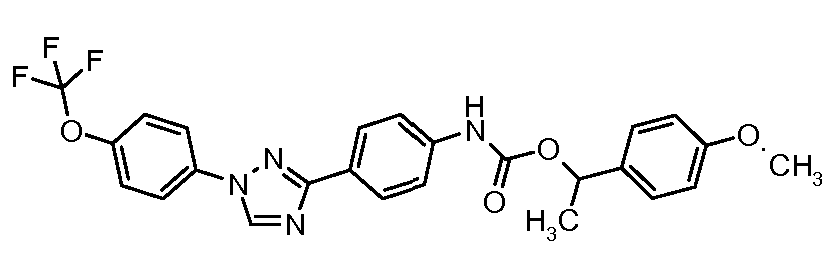
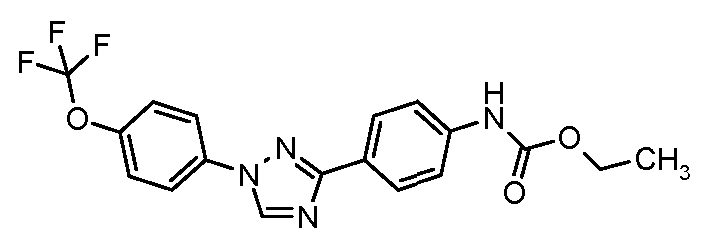
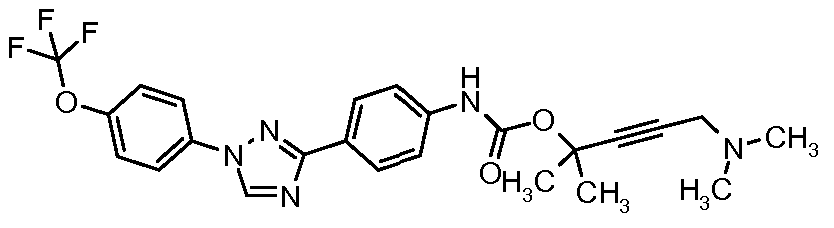
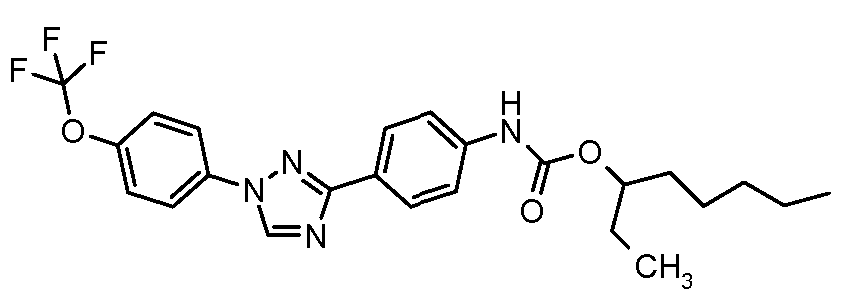
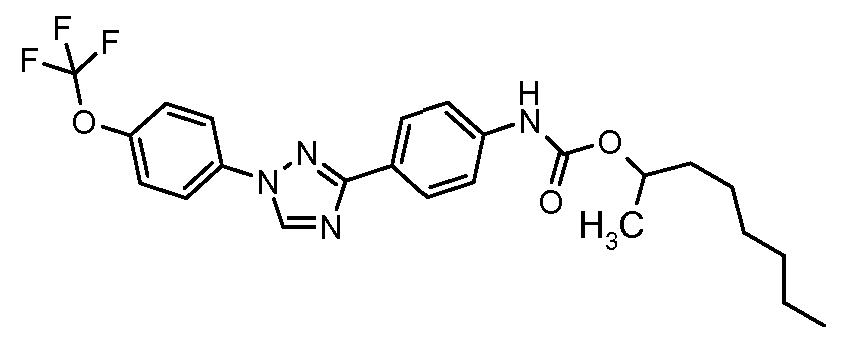
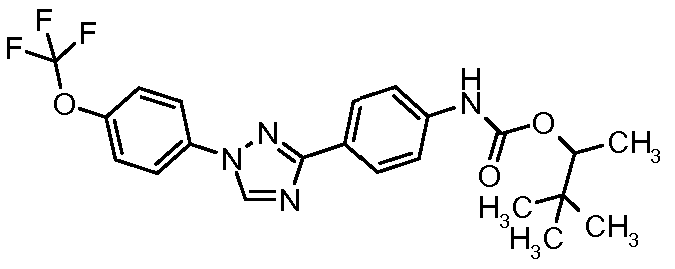
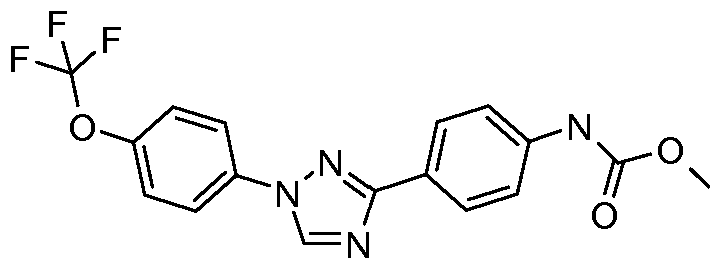
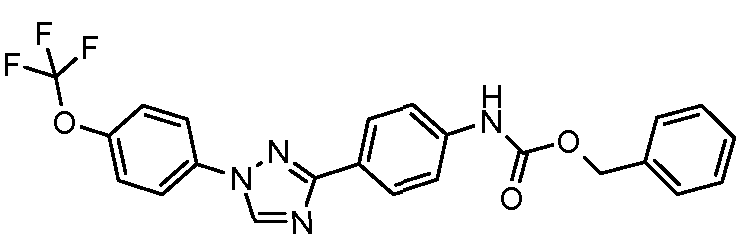
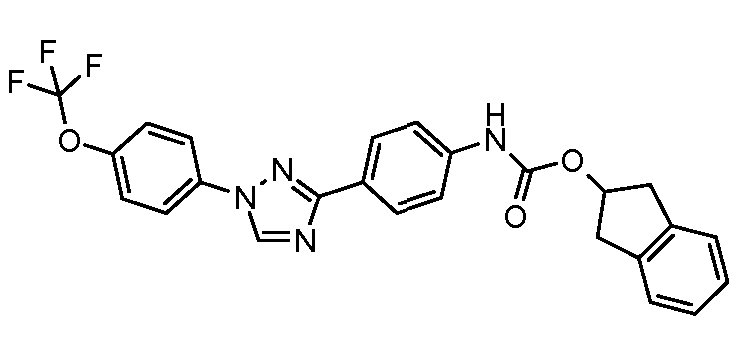
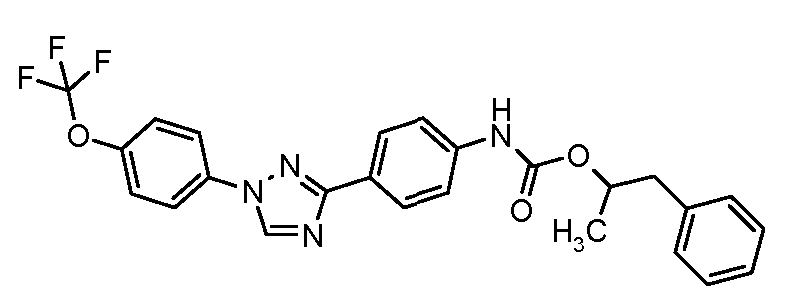
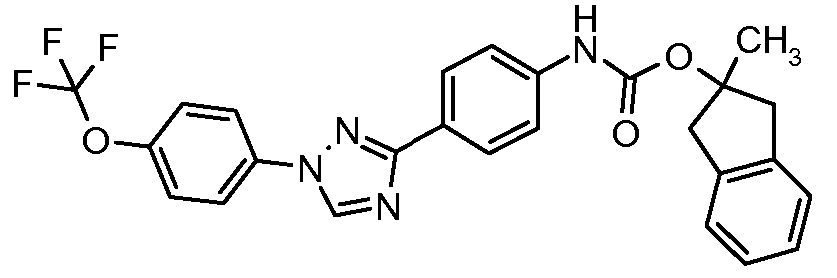
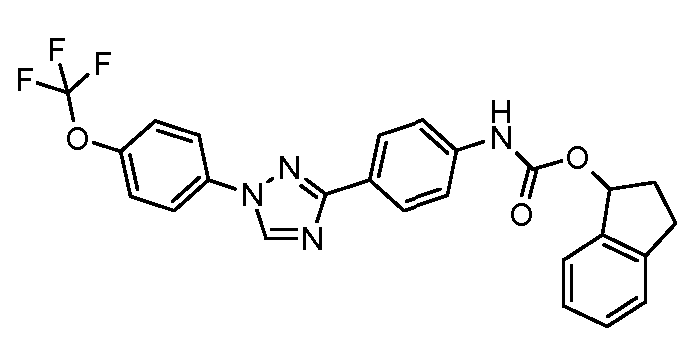
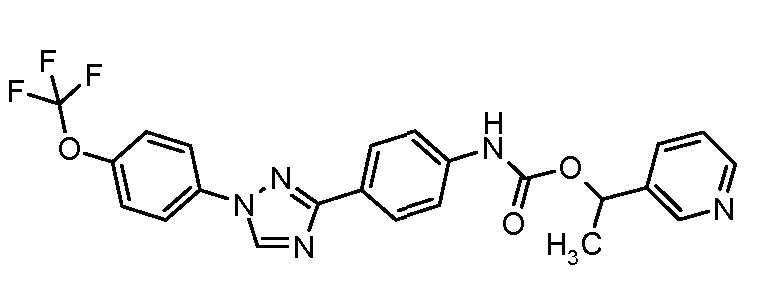
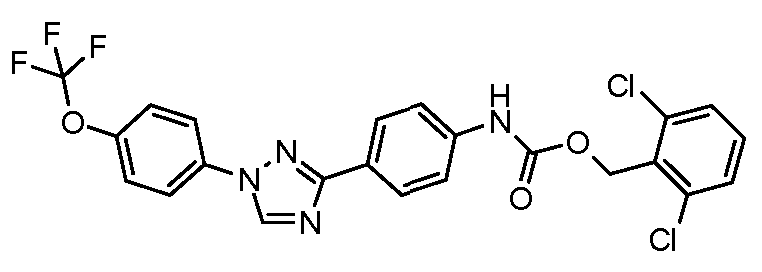
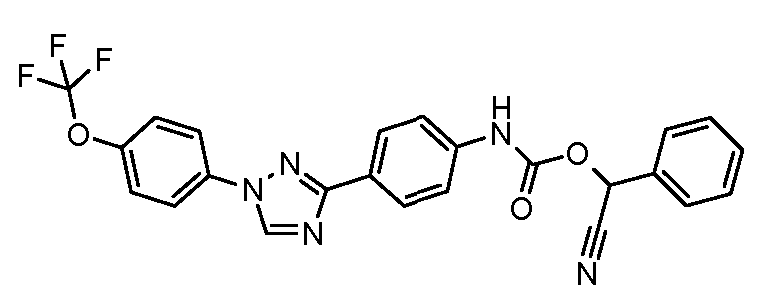
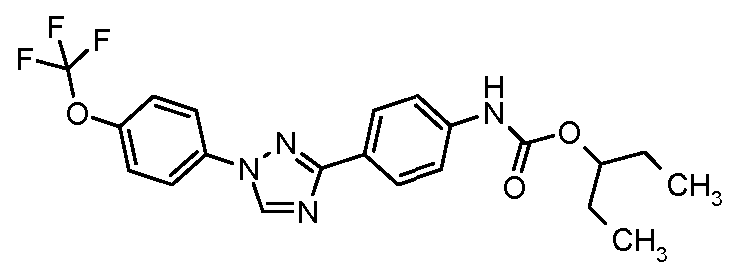
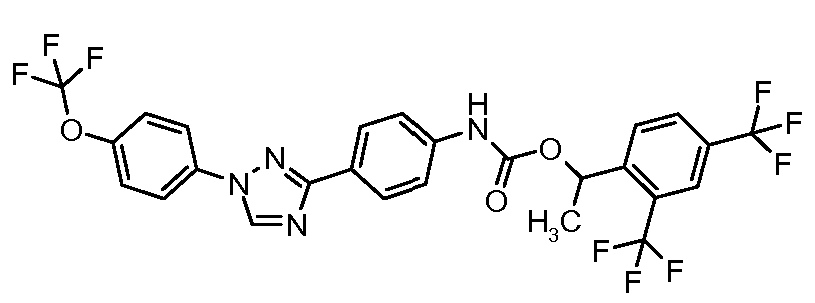
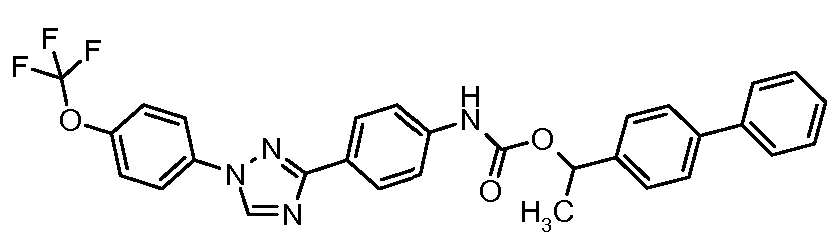
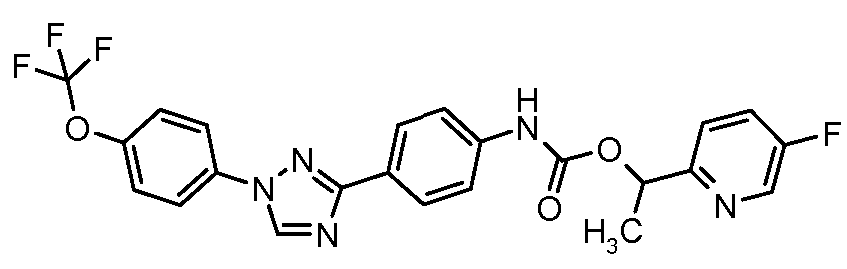
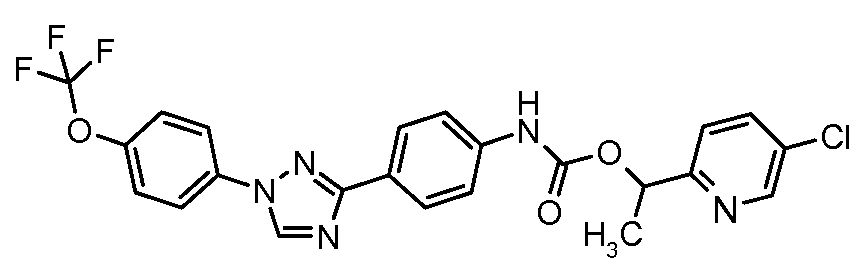
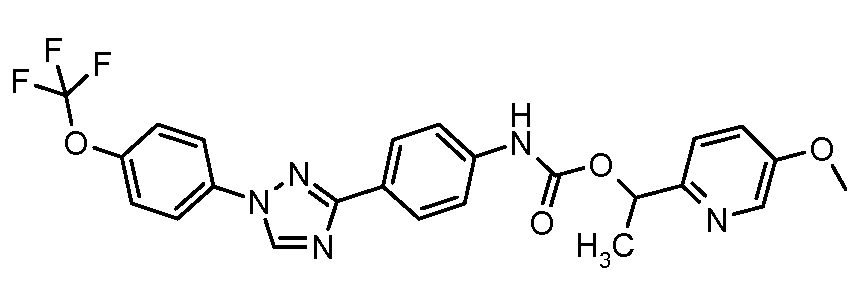
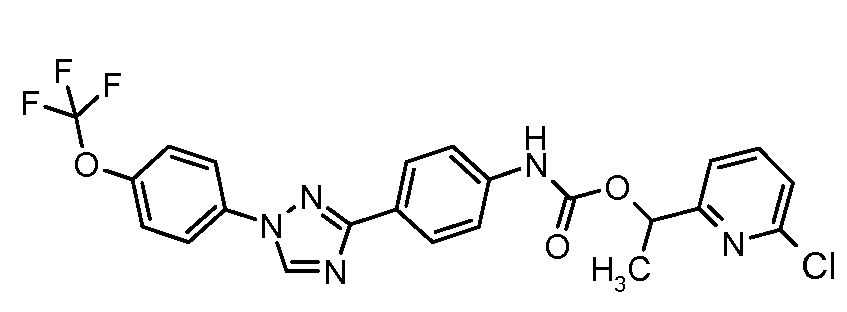
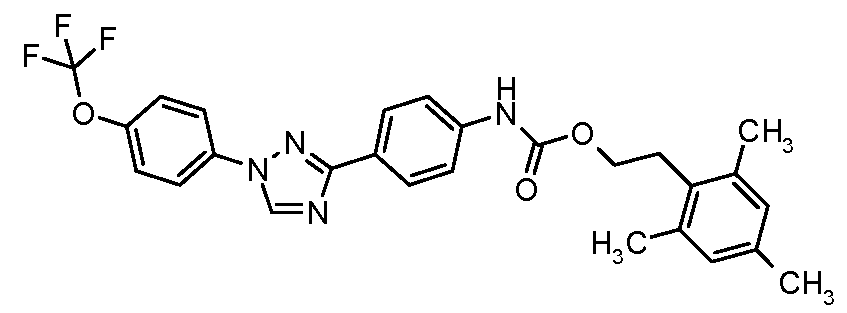
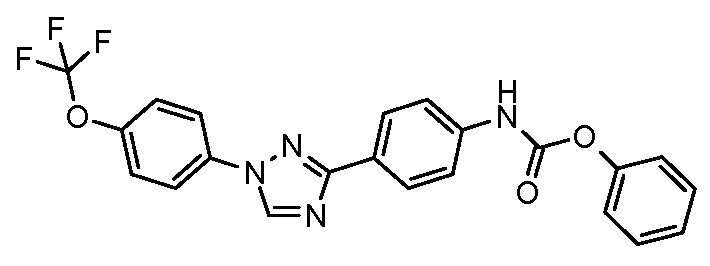
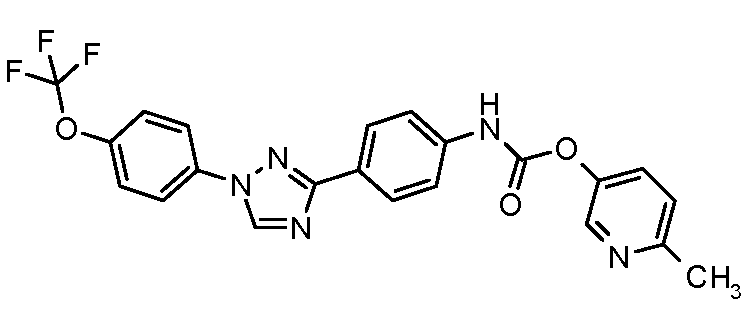
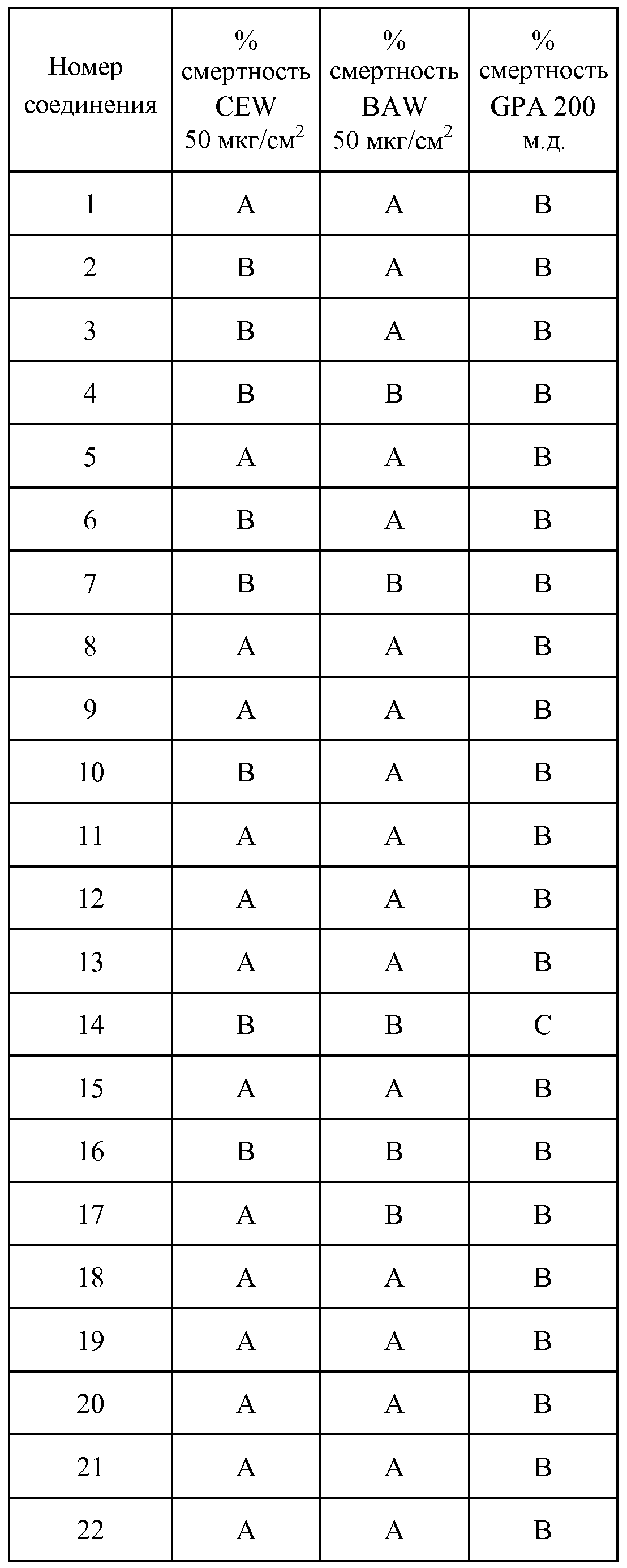
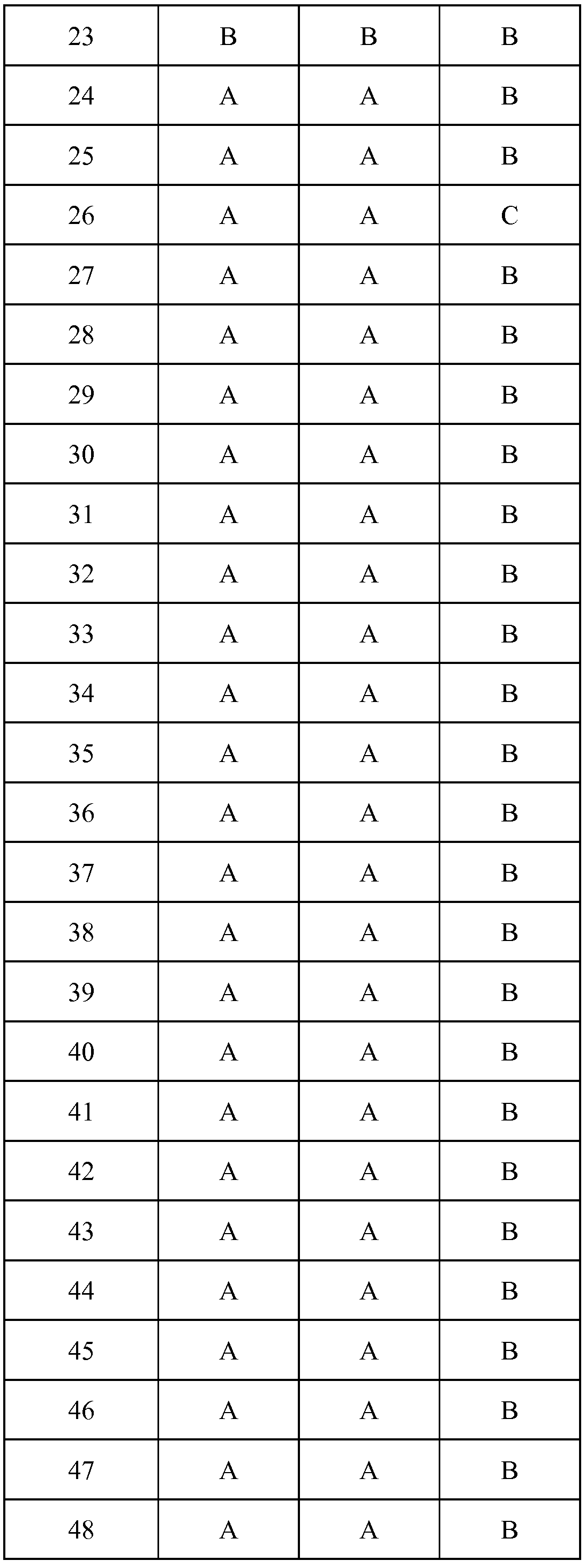
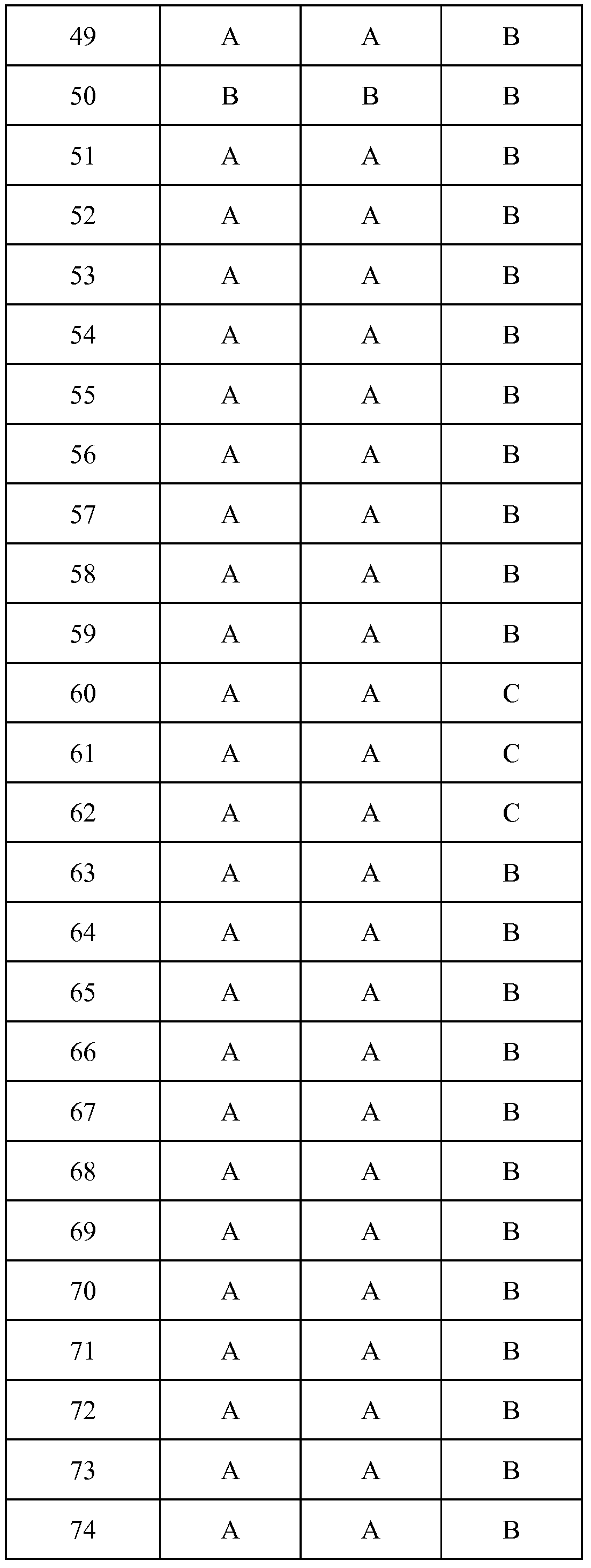
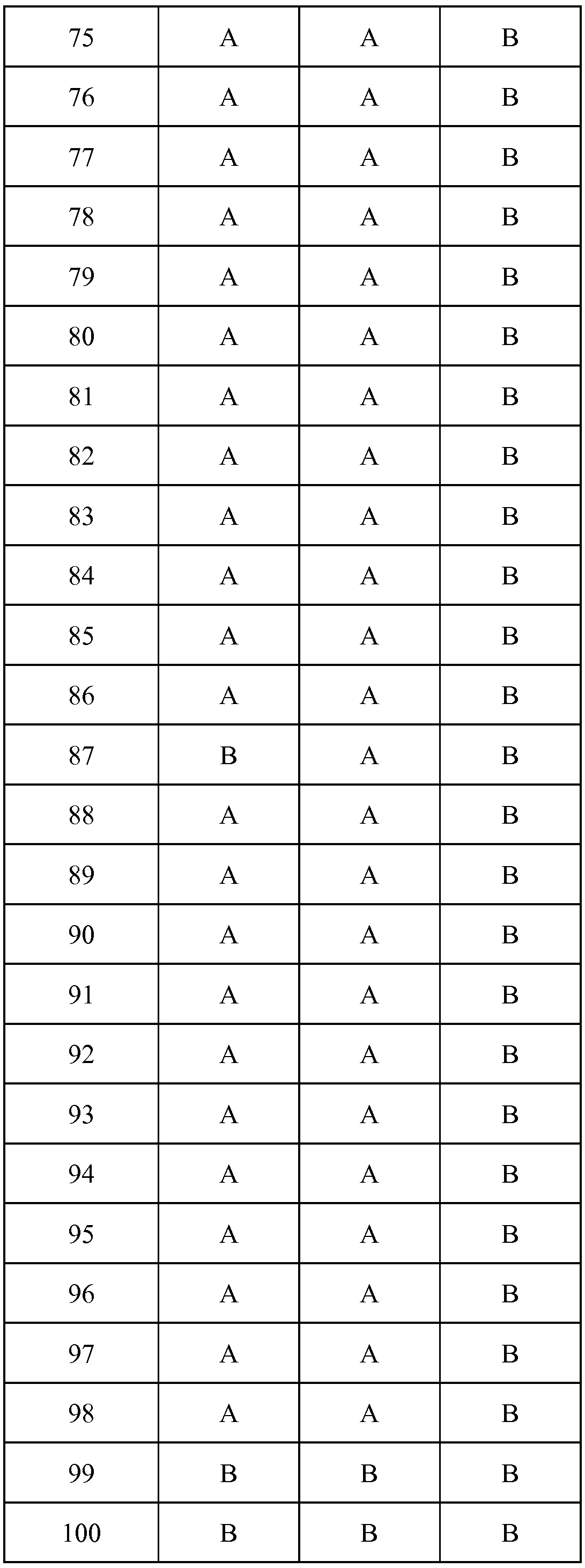
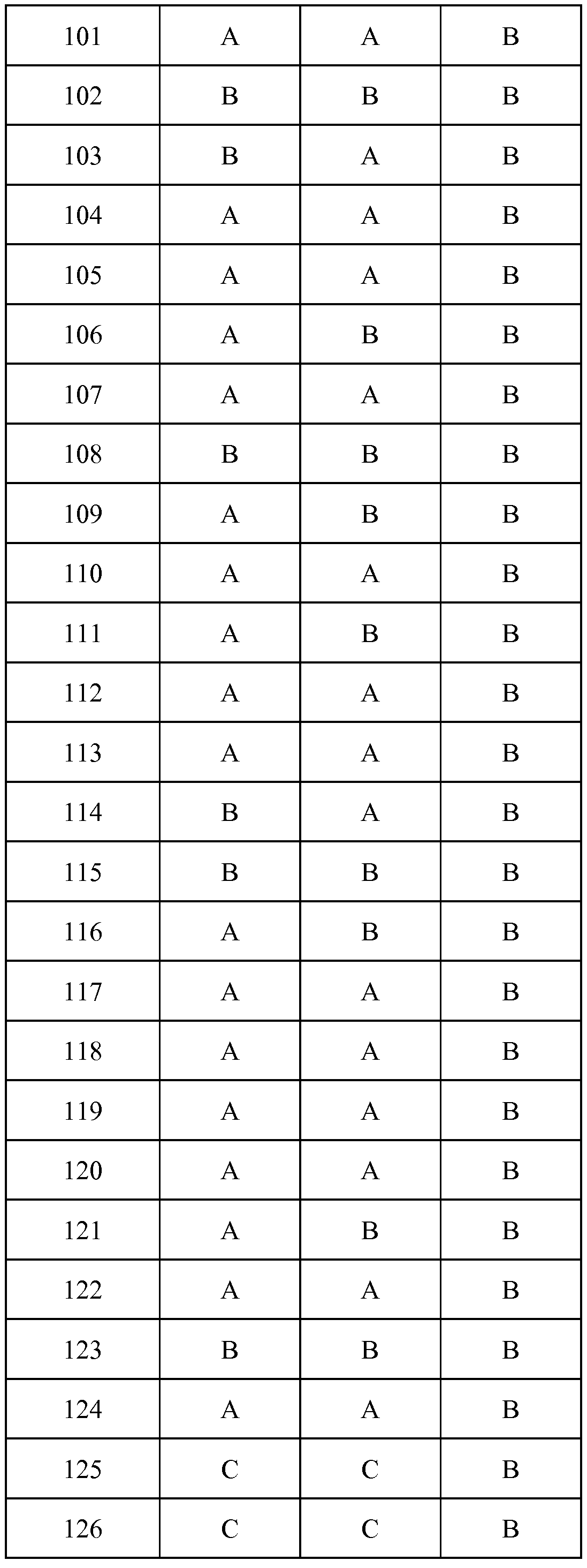
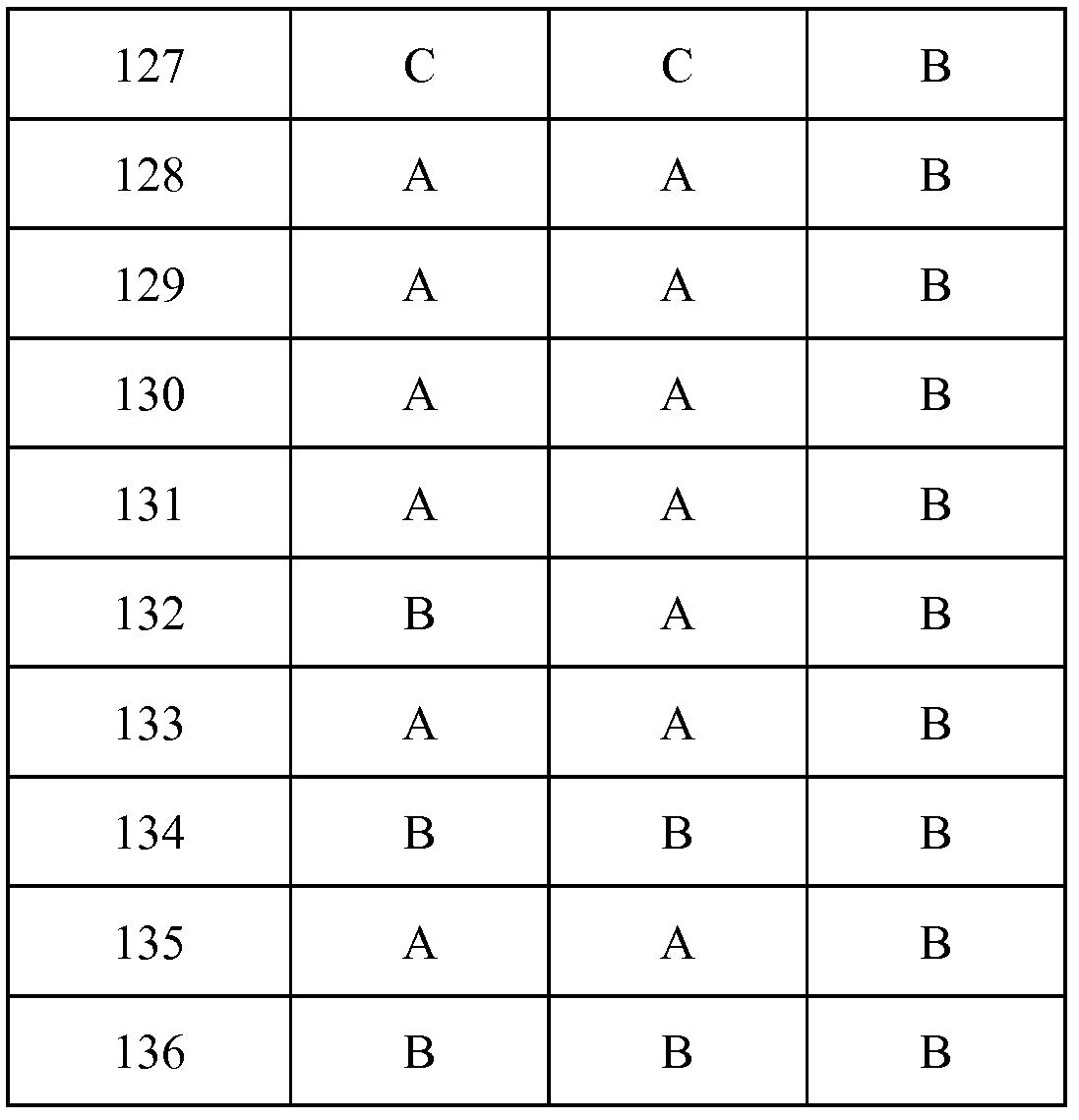
Результат интеллектуальной деятельности: ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данная заявка заявляет преимущество предварительной заявки Соединенных Штатов с порядковым номером 61/232142, поданной 7 августа 2009. Изобретение, раскрытое в этом документе, относится к области пестицидов и к их применению в осуществлении борьбы с насекомыми-вредителями.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Насекомые-вредители вызывают ежегодно миллионы человеческих смертей по всему миру. Кроме того, существует более десяти тысяч видов насекомых-вредителей, которые вызывают потери сельскохозяйственной продукции. Эти потери сельскохозяйственной продукции составляют каждый год миллиарды долларов США. Термиты нарушают целостность (наносят ущерб) различных конструкций, таких как дома. Потери от этих вызванных термитами потерь составляют каждый год миллиарды долларов США. В качестве решающего примечания, многие насекомые-вредители, обитающие в хранимых пищевых продуктах, едят и ухудшают хранимые пищевые продукты. Такие потери, связанные с потерями хранимых пищевых продуктов, составляют миллиарды долларов США ежегодно, но что более важно, лишают людей необходимых пищевых продуктов.
Существует острая потребность в новых пестицидах. Насекомые развивают устойчивость к пестицидам, применяемым в настоящее время. Сотни видов насекомых являются устойчивыми к одному или ко многим пестицидам. Развитие устойчивости к некоторым из более старых пестицидов, таким как ДДТ, карбаматы, и фосфорорганические соединения, общеизвестно. Но устойчивость развилась даже к некоторым из более новых пестицидов. Таким образом, существует потребность в новых пестицидах и, в особенности, в пестицидах, которые имеют новые механизмы действия.
ЗАМЕСТИТЕЛИ (НЕПОЛНЫЙ ПЕРЕЧЕНЬ)
Примеры, приведенные для заместителей (за исключением галогеновых заместителей), являются неполными и не должны быть истолкованы как ограничивающие изобретение, раскрываемое в этом документе.
«Алкенил» означает ациклический, ненасыщенный (имеется, по меньшей мере, одна углерод-углеродная двойная связь), разветвленный или неразветвленный, заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
«Алкенилоксигруппа» представляет собой алкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, аллилоксигруппу, бутенилоксигруппу, пентенилоксигруппу, гексенилоксигруппу, гептенилоксигруппу, октенилоксигруппу, ноненилоксигруппу и деценилоксигруппу.
«Алкоксигруппа» означает алкил, дополнительно содержащий углерод-кислородную одинарную связь, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, 1-бутоксигруппу, 2-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу, 2-метилбутоксигруппу, 1,1-диметилпропоксигруппу, гексоксигруппу, гептоксигруппу, октоксигруппу, ноноксигруппу и декоксигруппу.
«Алкил» представляет собой ациклический, насыщенный, разветвленный или неразветвленный, заместитель, содержащий углерод и водород, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
«Алкинил» означает ациклический, ненасыщенный (имеются, по меньшей мере, одна углерод-углеродная тройная связь, и любое количество двойных связей), разветвленный или неразветвленный, заместитель, содержащий углерод и водород, например, этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
«Алкинилоксигруппа» представляет собой алкинил, дополнительно содержащий углерод-кислородную одинарную связь, например, пентинилоксигруппу, гексинилоксигруппу, гептинилоксигруппу, октинилоксигруппу, нонинилоксигруппу и децинилоксигруппу.
«Арил» означает циклический, ароматический заместитель, содержащий водород и углерод, например, фенил, нафтил и бифенил.
«Циклоалкенил» представляет собой моноциклический или полициклический, ненасыщенный (имеется, по меньшей мере, одна углерод-углеродная двойная связь) заместитель, содержащий углерод и водород, например, циклобутенил, циклопентенил. Циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
«Циклоалкенилоксигруппа» означает циклоалкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклобутенилоксигруппу, циклопентенилоксигруппу, циклогексенилоксигруппу, циклогептенилоксигруппу, циклооктенилоксигруппу, циклодеценилоксигруппу, норборненилоксигруппу, и бицикло[2.2.2]октенилоксигруппу.
«Циклоалкил» представляет собой моноциклический или полициклический, насыщенный заместитель, содержащий углерод и водород, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
«Циклоалкоксигруппа» означает циклоалкил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, циклогептилоксигруппу, циклооктилоксигруппу, циклодецилоксигруппу, норборнилоксигруппу и бицикло[2.2.2]октилоксигруппу.
«Галоген» представляет собой фтор, хлор, бром, и йод.
«Галогеналкил» означает алкил, дополнительно содержащий, от одного до максимально возможного количества, идентичных или различных, галогенов, например, фторметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил, и 1,1,2,2-тетрафторэтил.
«Гетероциклил» представляет собой циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным, или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один углерод и, по меньшей мере, один гетероатом, где упомянутый гетероатом представляет собой азот, серу, или кислород, например, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
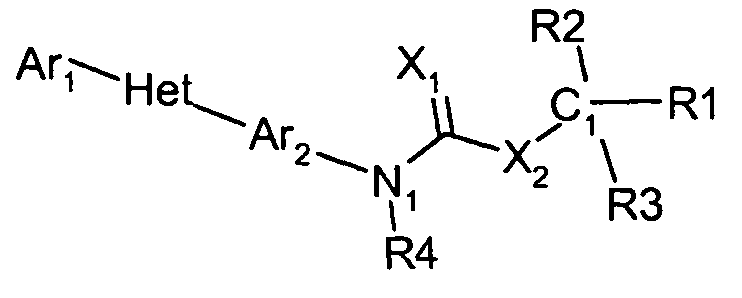
Соединения этого изобретения имеют следующую формулу:
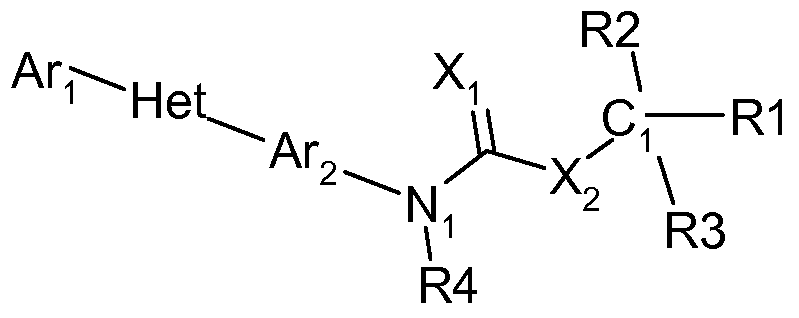
где:
(а) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, и замещенный тиенил, имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы,
где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы;
(b) Het представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или более гетероатомов, независимо выбранных из азота, серы, или кислорода, и, где Ar1 и Ar2 не находятся в орто-положении по отношению друг к другу (но могут находиться в мета- или в пара-положении, например, в случае 5-членного кольца они находятся в 1,3-положении, и в случае 6-членного кольца они находятся либо в 1,3-положении, либо в 1,4-положении), и, где упомянутое гетероциклическое кольцо может также быть замещено одним или более заместителями, независимо выбранными из H, F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы,
где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы;
(с) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, и замещенный тиенил, имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы (где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила и феноксигруппы;
(d) Х1 представляет собой О или S;
(е) Х2 представляет собой О или S;
(f) R4 представляет собой Н, С1-С6 алкил, С1-С6 галогеналкил, С3-С6 циклоалкил, С3-С6 галогенциклоалкил, C3-C6 циклоалкоксигруппу, C3-C6 галогенциклоалкоксигруппу, C1-C6 алкоксигруппу, C1-C6 галогеналкоксигруппу, C2-C6 алкенил, C2-C6 алкинил, S(=O)n(C1-C6 алкил), S(=O)n(C1-C6 галогеналкил), OSO2(C1-C6 алкил), OSO2(C1-C6 галогеналкил), С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил), C(=O)O(C1-C6 алкил), C(=O)(C1-C6 галогеналкил), C(=O)О(C1-C6 галогеналкил), C(=O)(C3-C6 циклоалкил), C(=O)О(C3-C6 циклоалкил), C(=O)(C2-C6 алкенил), C(=O)О(C2-C6 алкенил), (С1-С6 алкил)O(C1-C6 алкил), (С1-С6 алкил)S(C1-C6 алкил), С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил), фенил, феноксигруппу,
где каждый(ая) алкил, галогеналкил, циклоалкил, галогенциклоалкил, циклоалкоксигруппа, галогенциклоалкоксигруппа, алкоксигруппа, галогеналкоксигруппа, алкенил, алкинил, фенил, и феноксигруппа необязательно замещены одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, и феноксигруппы;
(g) n=0, 1 или 2;
(h) Rx и Ry независимо выбирают из Н, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, и феноксигруппы; и
(i) R1, R2 и R3 независимо выбирают из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C2-C6 алкенила, C2-C6 алкинила, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, (С1-С6 алкил)O(C1-C6 алкил)О(С1-С6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, С(=О)фенила, фенила, С1-С6 алкилфенила, С(=О)феноксигруппы, феноксигруппы, С1-С6 алкилфеноксигруппы, С(=О)Het-1, Het-1, или C1-C6 алкилHet-1,
где Het-1 представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или более гетероатомов, независимо выбранных из азота, серы или кислорода, и
где каждый(ая) алкил, галогеналкил, циклоалкил, галогенциклоалкил, циклоалкоксигруппа, галогенциклоалкоксигруппа, алкоксигруппа, галогеналкоксигруппа, алкенил, алкинил, фенил, феноксигруппа, и Het-1, необязательно замещены одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, (C1-C6 алкенил)NRxRy, (C1-C6 алкинил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, и Het-1,
где R1 и R2 вместе необязательно могут образовывать 3-12-членную насыщенную или ненасыщенную циклическую группу, которая может содержать один или более гетероатомов, выбранных из азота, серы, и кислорода (при условии, что в такой циклической группе имеется предпочтительно не С1-О-связь), где упомянутая циклическая группа может иметь один или более заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы и Het-1.
В другом варианте осуществления Ar1 представляет собой замещенный фенил, где упомянутый замещенный фенил, имеет один или более заместителей, независимо выбранных из С1-С6 галогеналкила и С1-С6 галогеналкоксигруппы.
В еще одном варианте осуществления Het означает триазолил.
В другом варианте осуществления Ar2 представляет собой фенил.
В еще одном варианте осуществления R4 означает Н или С1-С6 алкил.
В другом варианте осуществления R1, R2 и R3 независимо выбирают из Н, CN, С1-С6 алкила, С1-С6 галогеналкила, С3-С6 циклоалкила, С2-С6 алкенила, С2-С6 алкинила, C(=O)O(C1-C6 алкил)а, фенила и Het-1.
В еще одном варианте осуществления R1, R2 и R3 независимо выбирают из С1-С6 алкила, С1-С6 галогеналкила, С3-С6 циклоалкила, С2-С6 алкенила, С2-С6 алкинила, C(=O)O(C1-C6 алкил)а, фенила, и Het-1, каждый из которых замещен одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкоксигруппы, S(=O)n(C1-C6 алкил)а, (C1-C6 алкил)NRxRy, (C1-C6 алкенил)NRxRy, (C1-C6 алкинил)NRxRy, С(=О)О(C1-C6 алкил)а и фенила.
В другом варианте осуществления, в том случае, когда R1, R2, и R3 представляют собой Het-1, их независимо выбирают из пиримидинила, пиридила, хинолинила, тиазолила, тиенила, фуранила, изоксазолила, каждый из которых может быть необязательно замещен.
В другом варианте осуществления Het и Het-1 в том случае, когда они имеют азот кольца, включают группу (N+-O-).
Хотя и были представлены эти варианты осуществления, другие варианты осуществления и комбинации этих представленных вариантов осуществления и других вариантов осуществления являются возможными.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ТРИАРИЛЬНЫХ СОЕДИНЕНИЙ
Соединения этого изобретения получают присоединением Х2(С1)R1R2R3 к промежуточному триарильному соединению, Ar1-Het-Ar2, посредством карбаматной или тиокарбаматной связи N1(C=X1) (определено выше). Широкий спектр триарильных предшественников может быть использован для получения соединений этого изобретения, при условии, что они содержат подходящую функциональную группу на Ar2. Подходящие функциональные группы включают аминогруппу, или группу карбоновой кислоты. Эти промежуточные триарил-соединения могут быть получены способами, ранее описанными в химической литературе. Несколько из этих способов описаны ниже.
Промежуточные соединения, где 'Het' представляет собой дизамещенный пиридин, пиримидин, пиразин или пиридазин, могут быть сделаны с использованием реакции сочетания галоген- или алкилтио-замещенного пиридина, пиримидина или пиразина с арилбороновой кислотой или боратным сложным эфиром, в условиях арилирования по Сузуки. Смотри, например, следующее.
В случае пиридинов: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 и Puglisi et al. Eur. J. Org. Chem. 2003, 1552.
В случае пиразинов: Schultheiss and Bosch Heterocycles 2003, 60, 1891.
В случае пиримидинов: Qing et al. J. Fluorine Chem. 2003, 120, 21 и Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415.
Для 2,4-диарил-пиримидинов: Schomaker and Delia J. Org. Chem. 2001, 66, 7125.
Таким образом, последовательные катализированные палладием реакции арилирования, с использованием 4-формилфенил-бороновой кислоты и 4-трифторметоксифенил-бороновой кислоты, могут давать по существу любую схему замещения, что показано на схеме ниже:
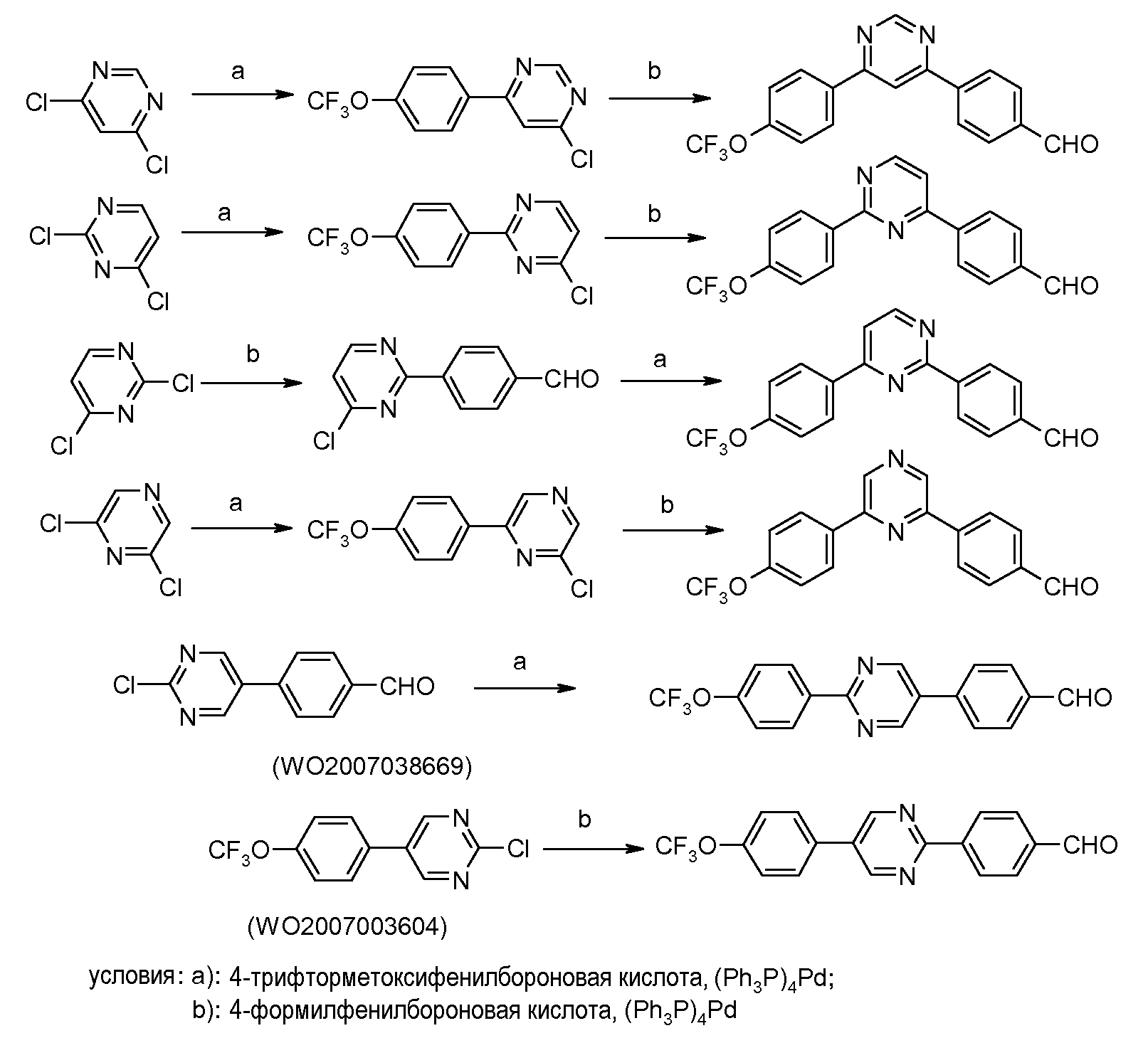
Подобно тому, диарил- пиридины и пиразины и другие дигалогенированные гетероциклические ароматические соединения могут быть получены из дигалогенированных пиридинов и пиразинов и других дигалогенированных гетероциклических ароматических соединений с использованием аналогичного протокола:
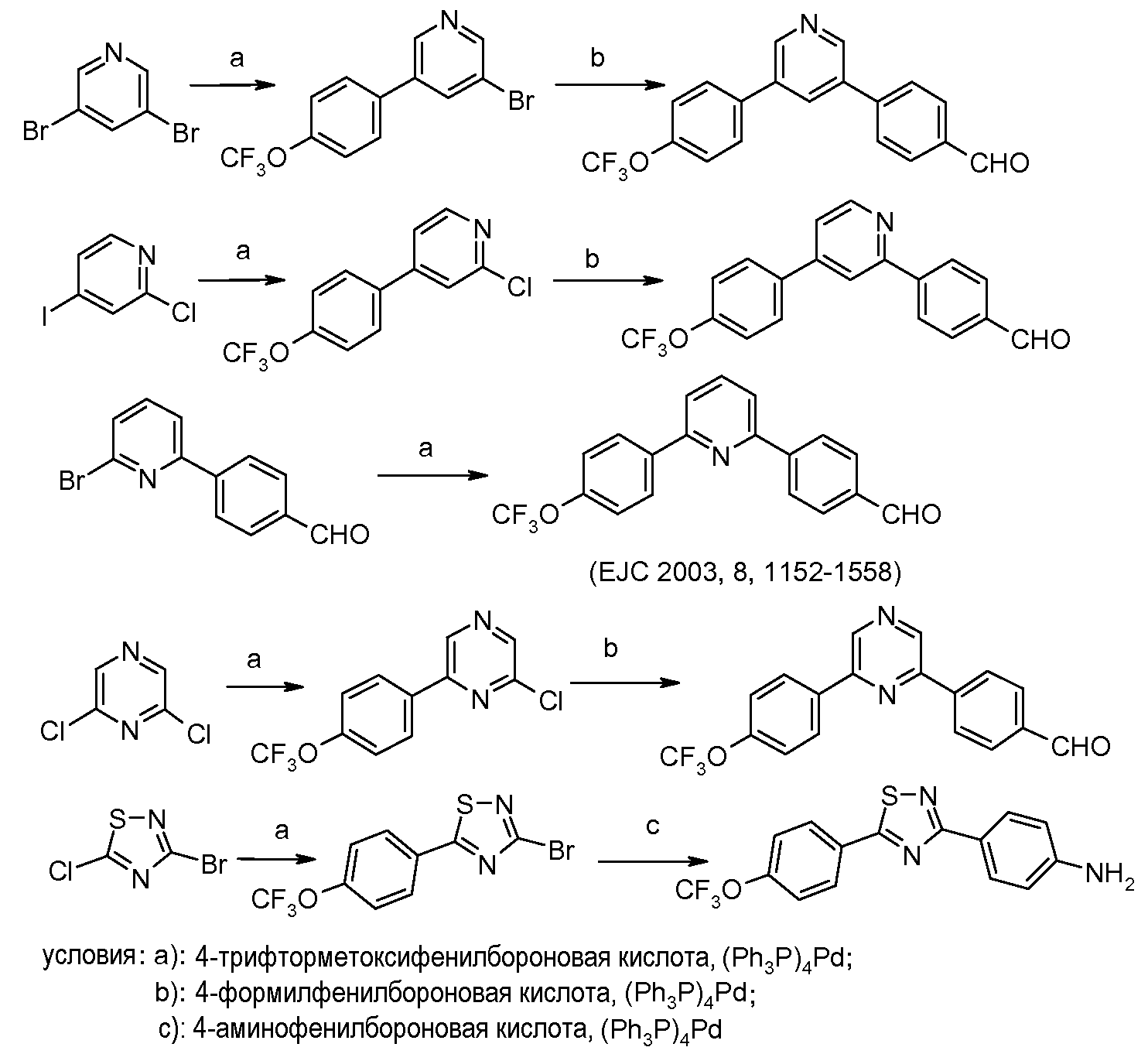
Галоген- или алкилтио-пиримидиновые и пиридиновые предшественники являются либо коммерчески доступными, либо могут быть синтезированы с использованием путей, описанных в литературе (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235).
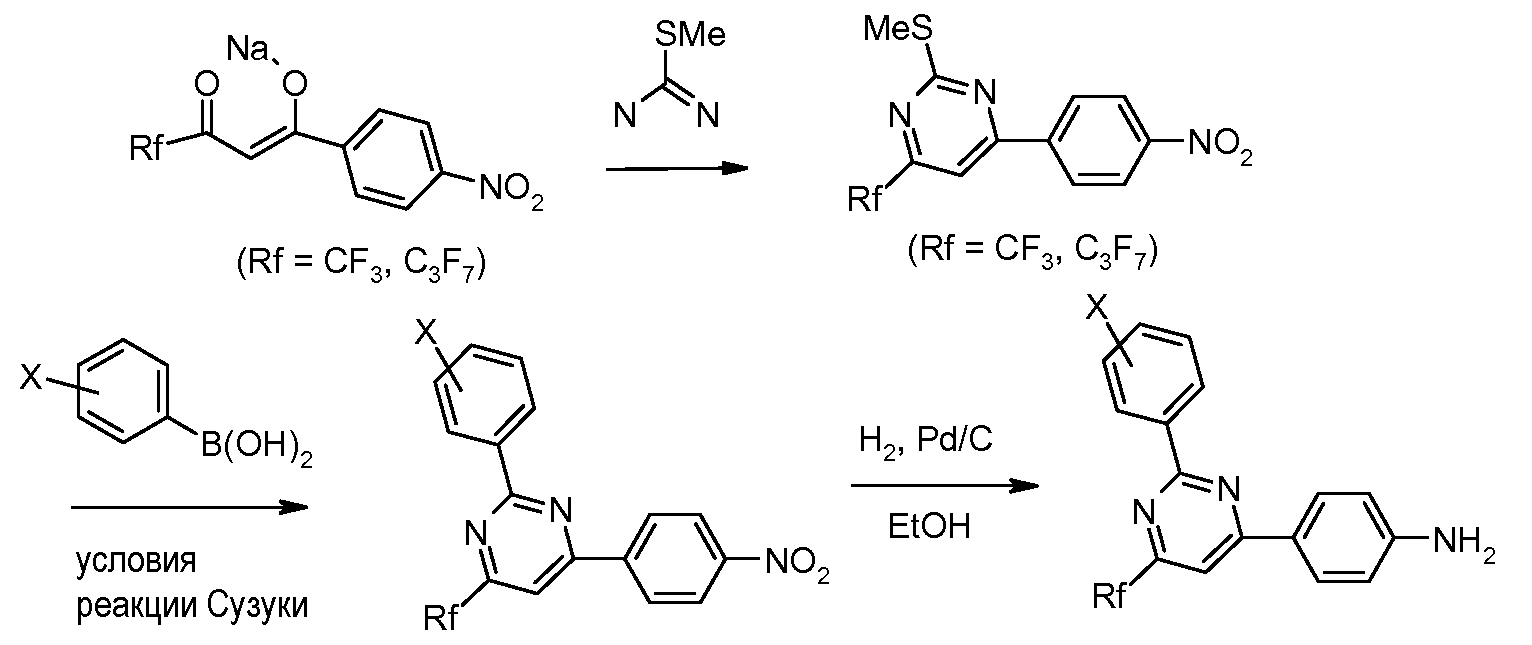
Соединения, где 'Het' представляет собой 1,3-диарил-6-перфторалкил-пиримидин, могут быть получены в соответствии со следующей схемой. 2-Метилтио-замещенный пиримидин был арилирован в модифицированных условиях реакции Сузуки (Liebeskind and Srogl Org. Lett. 2002, 4, 979), что дает 2-фенил-пиримидины, которые затем были восстановлены до соответствующих анилинов с использованием, например, палладиевого катализатора на углеродном носителе (Pd/C) в EtOH в атмосфере водорода.
Промежуточные соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазол, могут быть получены в соответствии с одной из следующих схем.
Путь А: 1,3-Диарил 1,2,4-триазолы были получены из соответствующих -NH 3-арил-1,2,4-триазолов, следуя опубликованному пути для N-арилирования имидазолов (Lin et al. J. Org. Chem. 1979, 44, 4160). Реакция сочетания 1,2,4-триазолов с арилгалогенидами была проведена в термических или, предпочтительно, микроволновых условиях (Antilla et al. J. Org. Chem. 2004, 69, 5578).
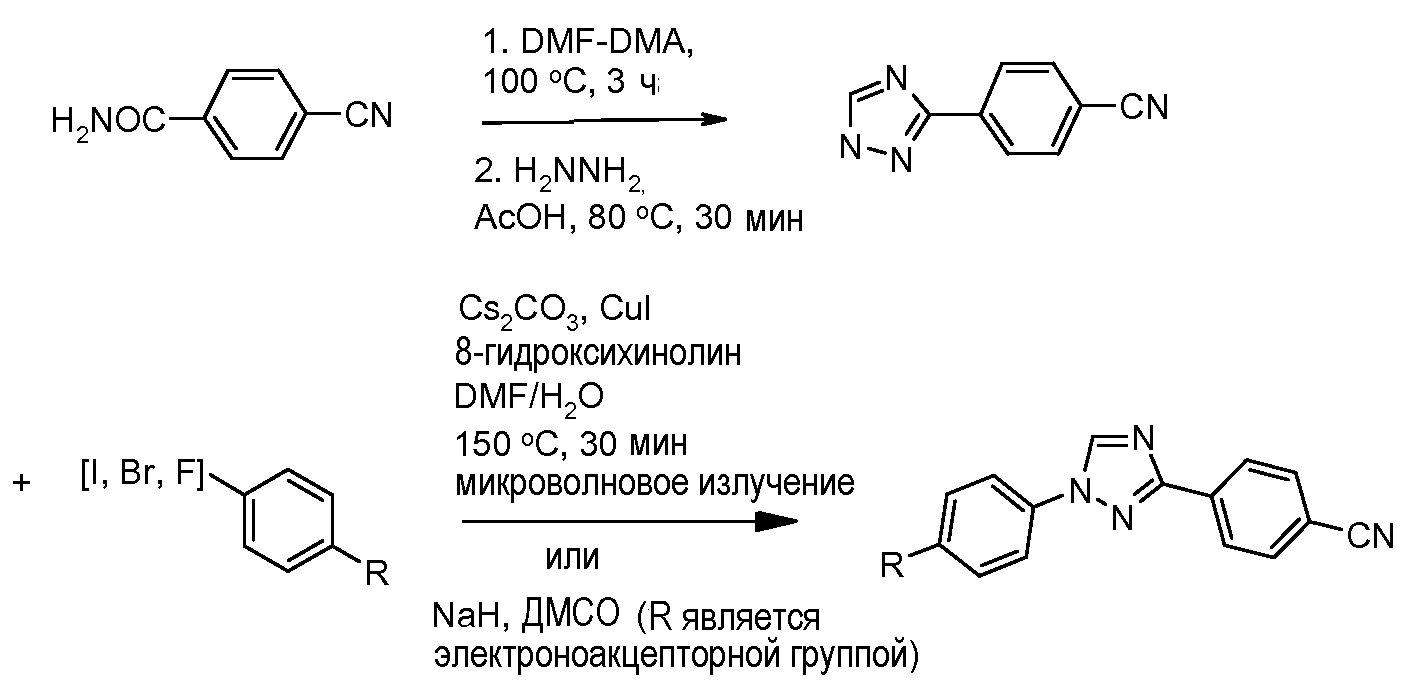
Путь В: Бромирование гидразонов с последующей обработкой бромгидразона тетразолом приводит к образованию 1,3-диарил 1,2,4-триазола (Butler and Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587).
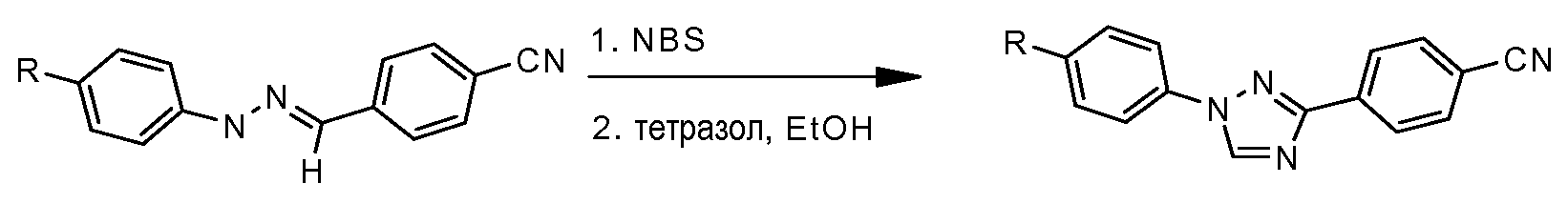
Путь С: Соединения 1,2,4-триазола, в которых 5-положение дополнительно замещено алкильной или замещенной алкильной группой, могут быть получены в соответствии со следующей схемой (Paulvannan and Hale Tetrahedron 2000, 56, 8071):
Соединения, где 'Het' представляет собой имидазол, могут быть получены в соответствии с одной из следующих схем:
Путь А: (Стадия 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадия 2: Liu et al. J. Org. Chem. 2005, 70, 10135):
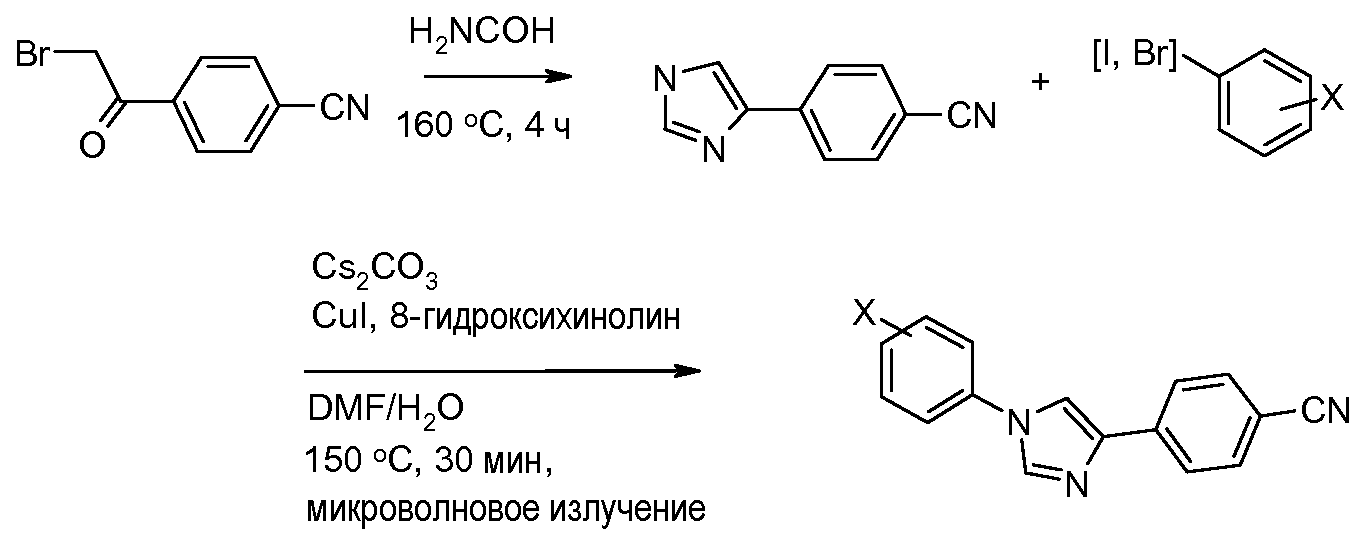
Путь В: В случае галоген-арильных групп, которые также содержат активирующую группу, такую как нитро-группа или циано-группа, замена арил-галогенида имидазолом, с использованием основания, такого как карбонат калия в полярном апротонном растворителе, таком как N,N-диметилформамид (DMF) или диметилсульфоксид (DMSO), может быть выполнена следующим образом (Bouchet et al. Tetrahedron 1979, 35, 1331):
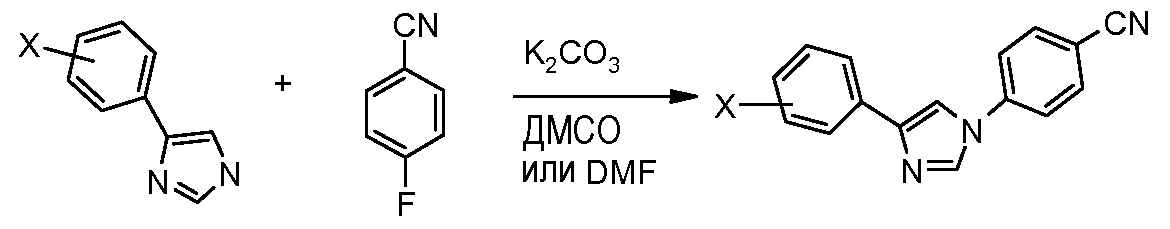
Путь С: Следуя методике, впервые описанной Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенацил-анилин обрабатывают тиоцианатом калия в кислой среде (HCl), и получающийся в результате 2-меркапто-имидазол затем превращают в десульфурированный диарил-имидазол посредством обработки азотной кислотой в уксусной кислоте.
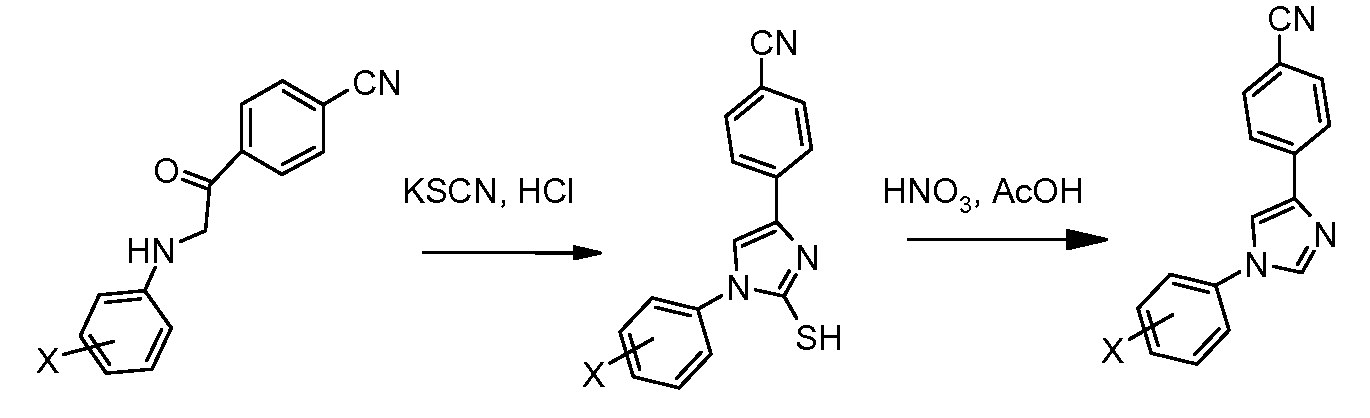
Путь D: N-Арилирование 4-бромимидазола в условиях микроволнового излучения (Путь А, Стадия 2) предоставило промежуточный 1-арил-4-бромимидазол, который был превращен в промежуточные триарил-соединения посредством обработки арил-бороновыми кислотами в катализируемых палладием условиях.
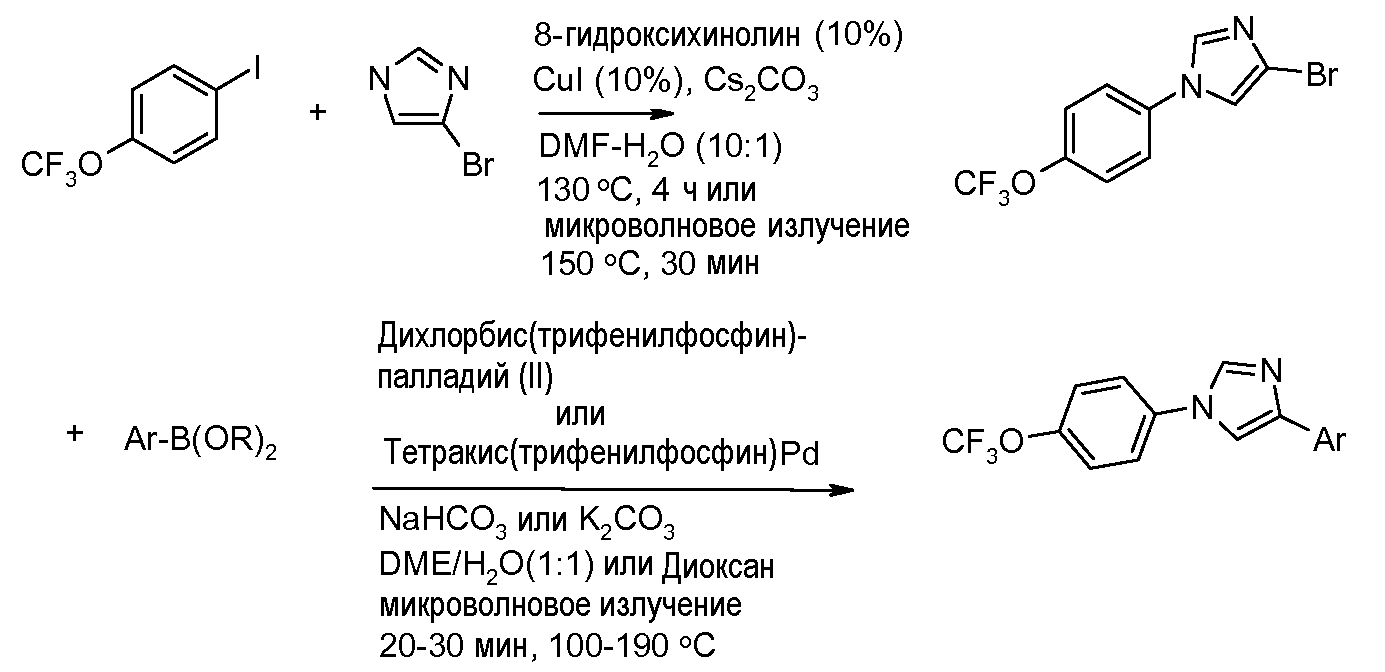
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,3-триазол, могут быть получены в соответствии со следующей схемой (Feldman et al. Org Lett. 2004, 6, 3897):

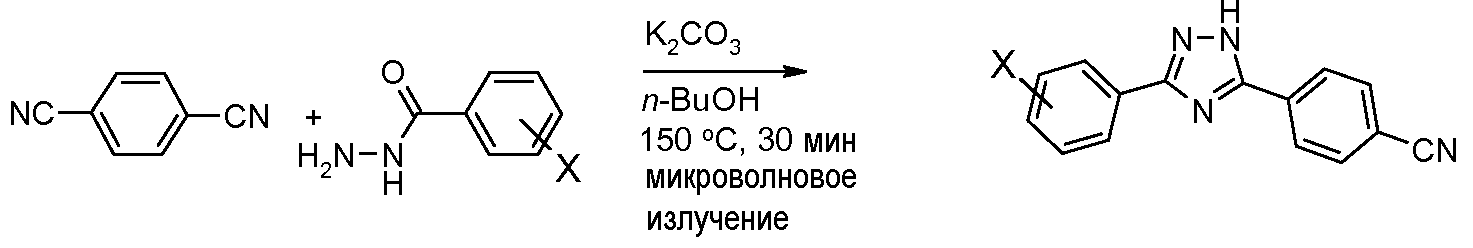
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазол, могут быть получены в соответствии со следующей схемой (Yeung et al. Tetrahedron Lett. 2005, 46, 3429):
Соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазолин-5-он, могут быть получены в соответствии со следующей схемой (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 и Lyga Synth. Commun. 1986, 16, 163). (DPPA означает дифенил-фосфорилазид):
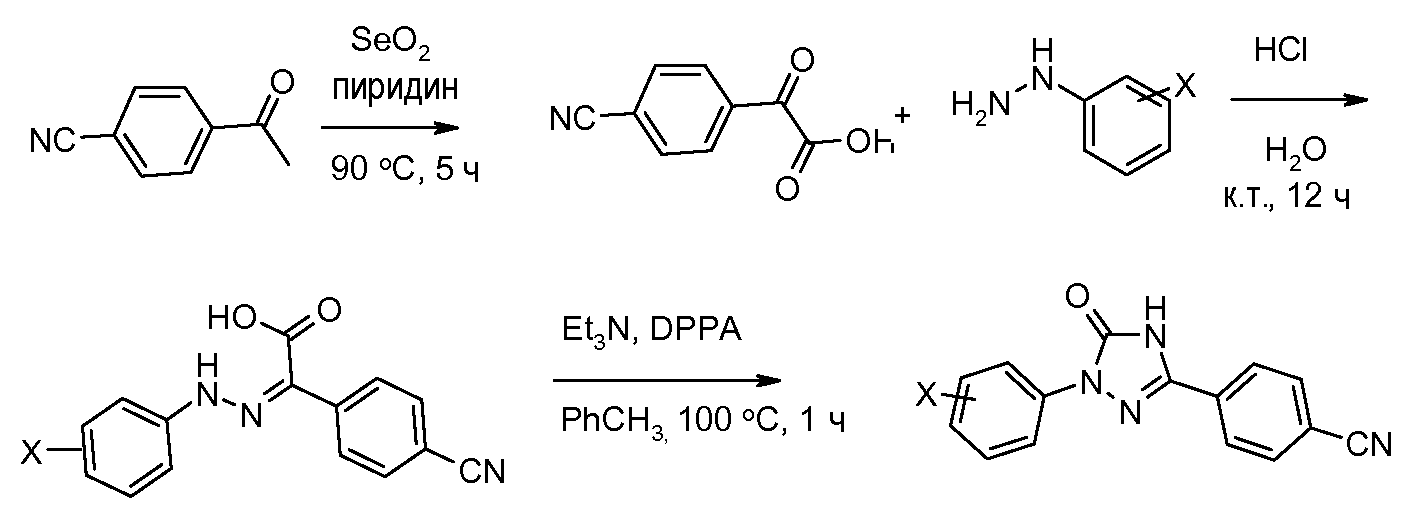
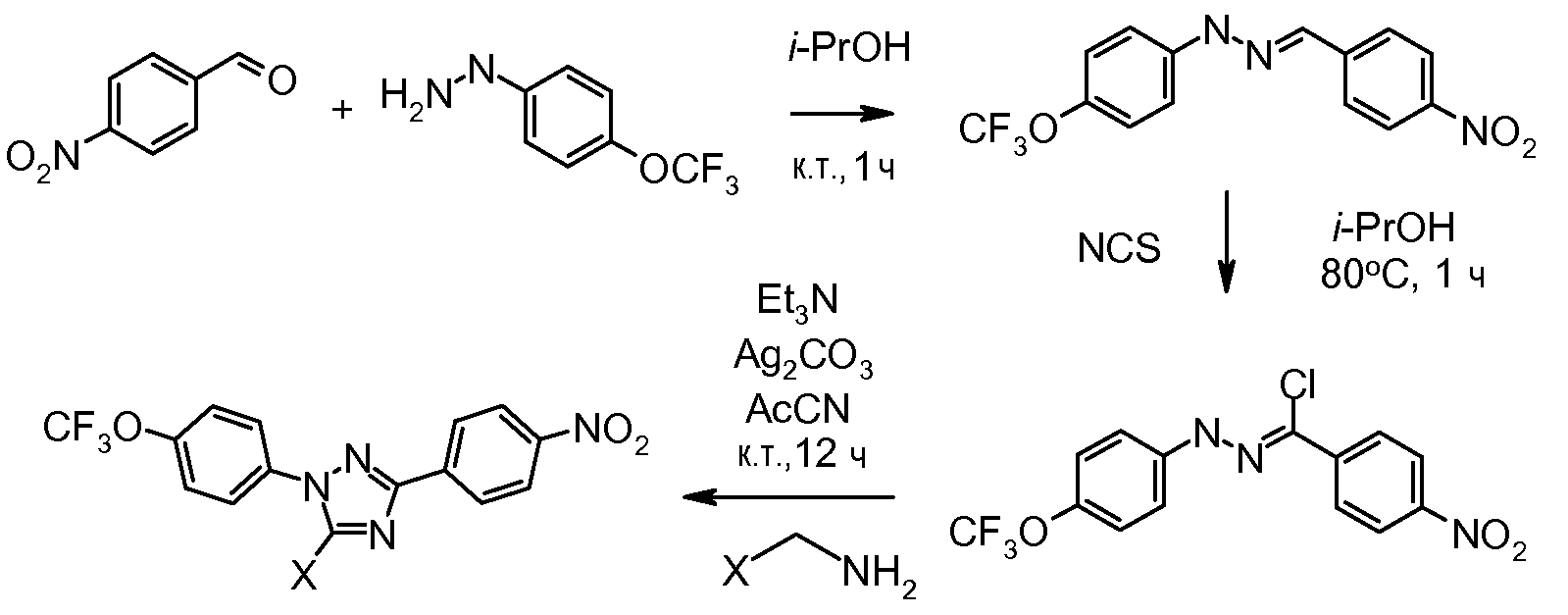
Соединения, где 'Het' представляет собой 1,3-диарил-пиразолин, могут быть получены в соответствии со следующей схемой. Моногидразон терефталальдегида обрабатывают N-хлорсукцинимидом (NCS) в изопропиловом спирте (i-PrOH), и получающееся в результате хлоргидразоновое промежуточное соединение обрабатывают непосредственно основанием и замещенным олефином с получением пиразолина:
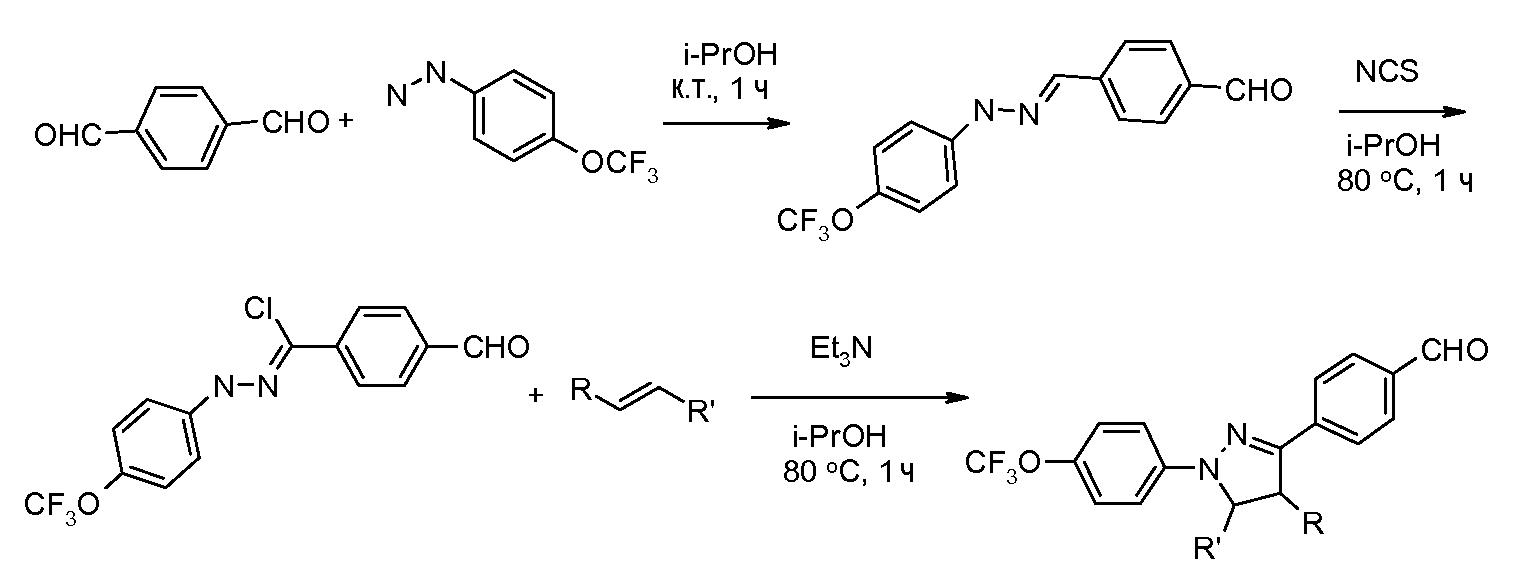
Соединения, где 'Het' представляет собой 3,5-дизамещенный изоксазол, могут быть получены в соответствии со следующей схемой:
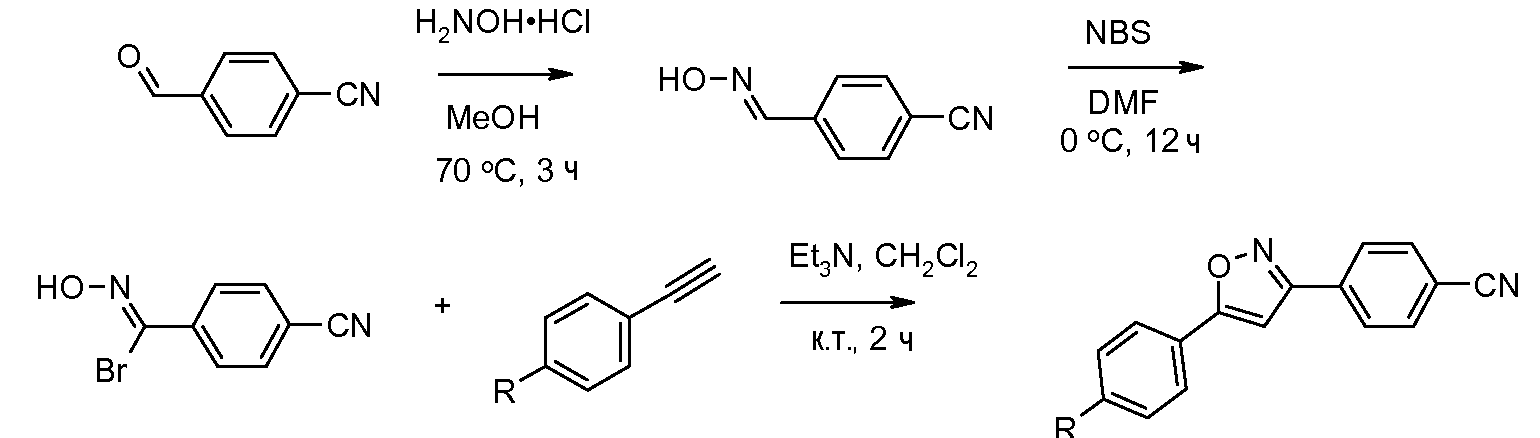
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразол, могут быть получены в соответствии со следующей схемой. Реакция сочетания пиразола с галогенированными ароматическими соединениями была выполнена с использованием условий микроволнового излучения, описанных Liu et al., Путь А, Стадия 2, приведенная выше. (DMA представляет собой диметилацеталь.)
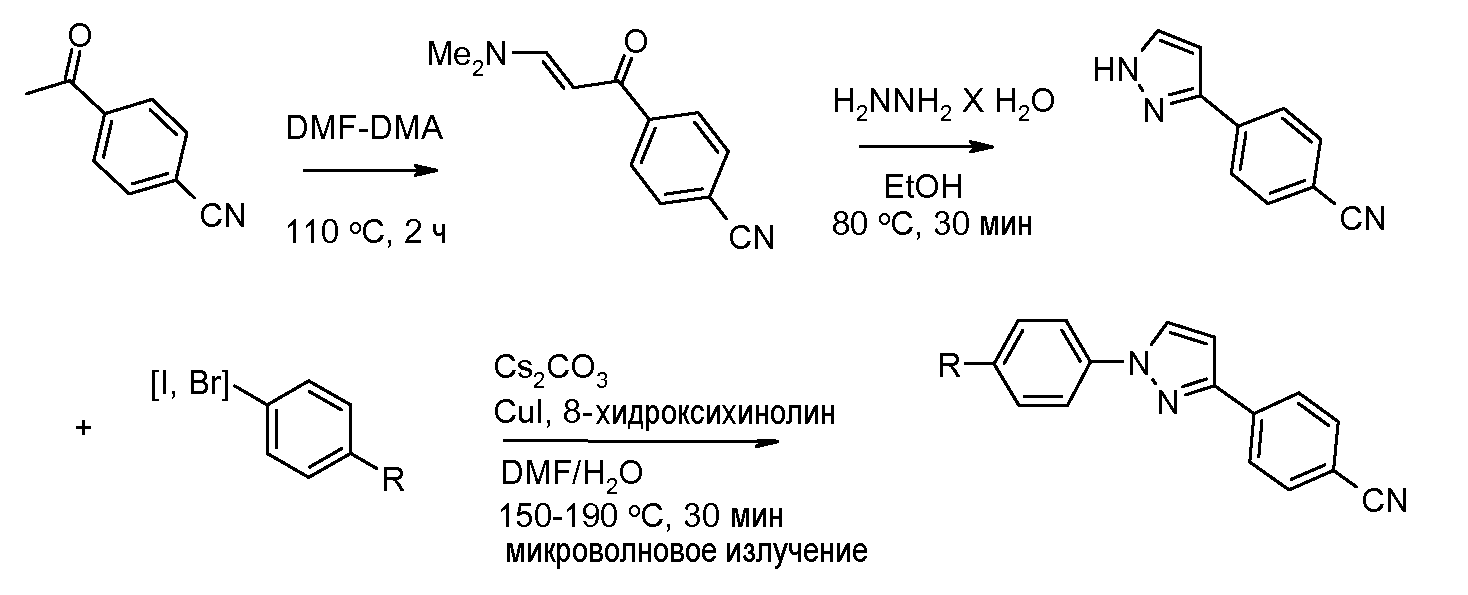
Соединения, где 'Het' представляет собой 2,4-дизамещенный тиазол, получают реакцией конденсации тиоамида с α-галоген-ацетофеноном в протонном растворителе, таком как этанол (например, Potts and Marshall J. Org. Chem. 1976, 41, 129).
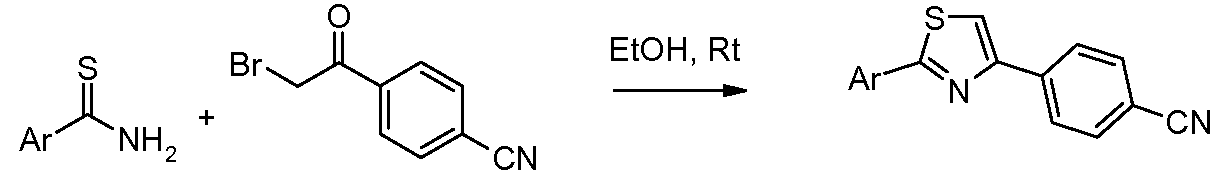
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,4-триазолин-5-он, получают в соответствии со следующей схемой (Henbach DE 2724819 A1, 1978 с небольшим изменением в двух стадиях):
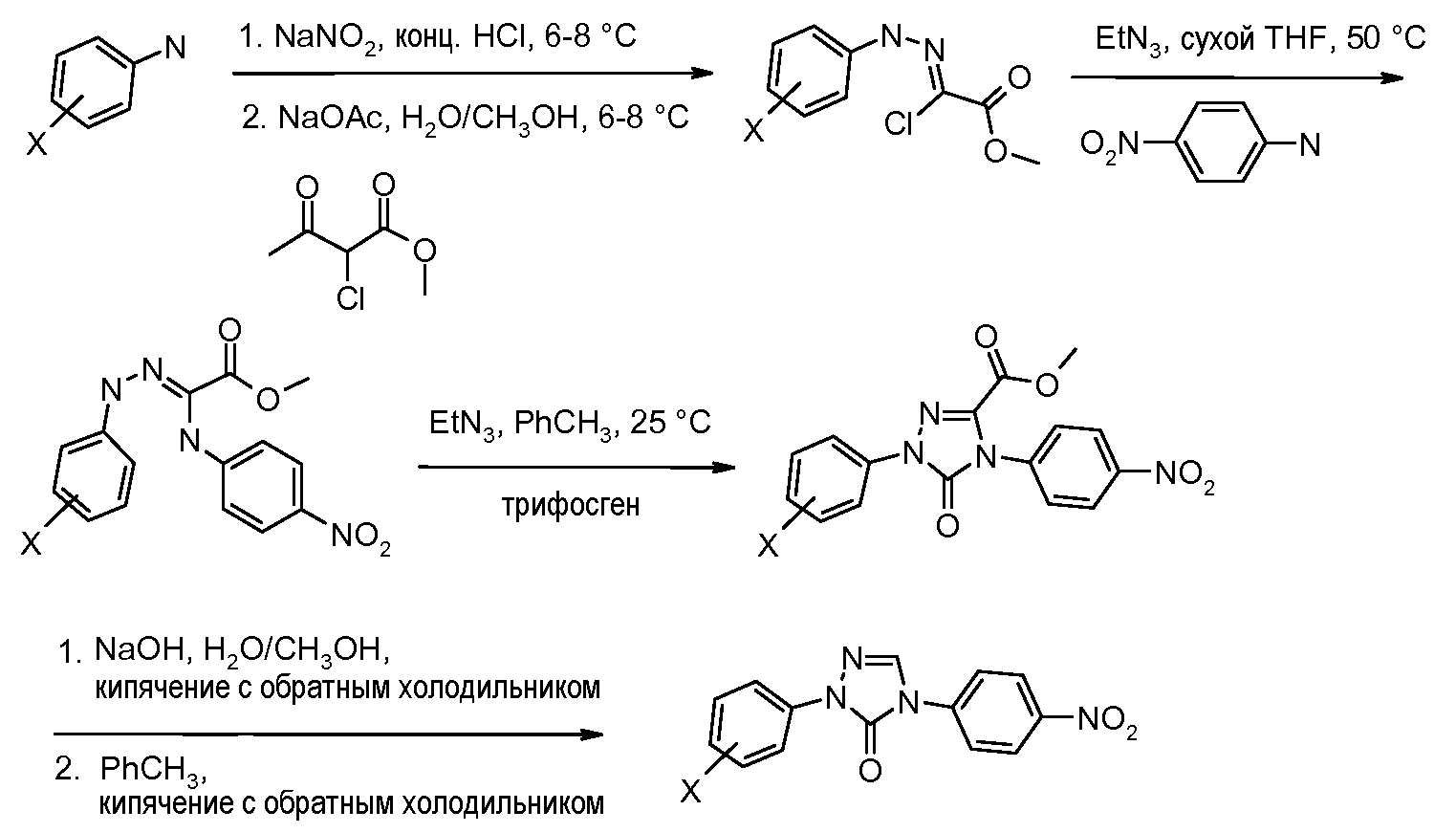
Соединения, где 'Het' представляет собой 2,4-дизамещенный оксазолин, получают, начиная с α-бромацетофенона, в соответствии со следующей схемой (Periasamy et al. Synthesis 2003, 1965 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
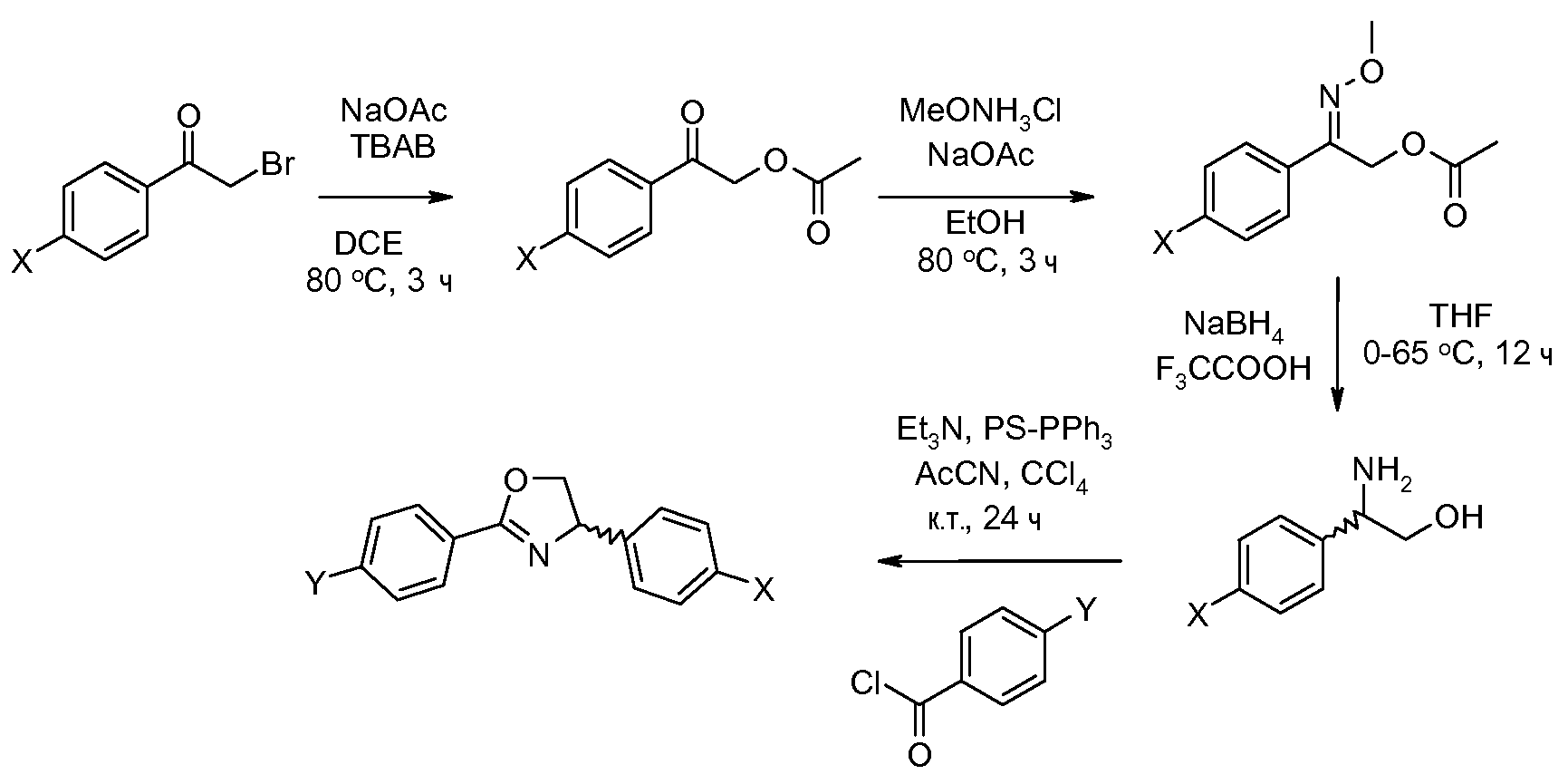
Соединения, где 'Het' представляет собой 2,5-дизамещенный оксазолин, получают в соответствии со следующей схемой (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
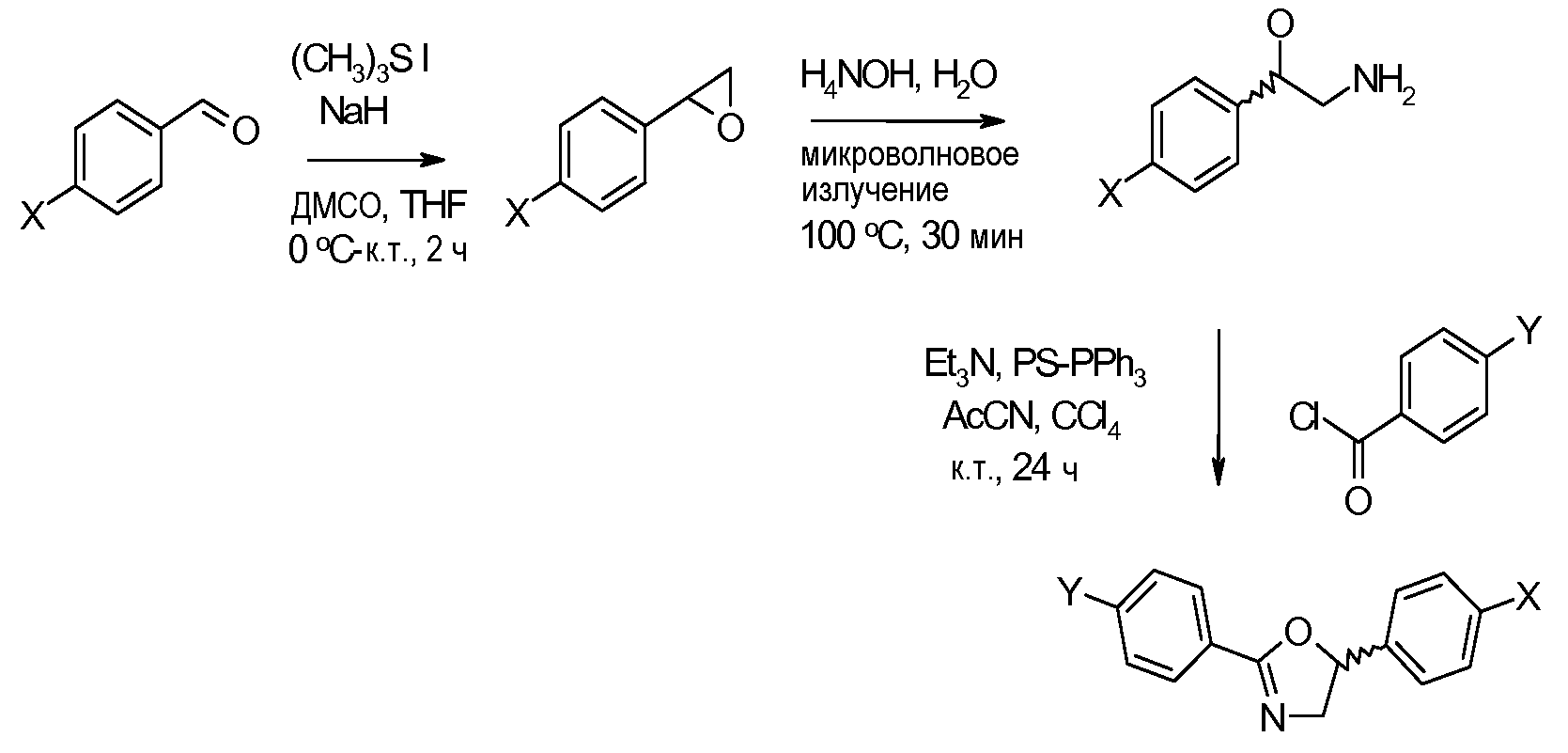
Соединения, где 'Het' представляет собой 1,4-дизамещенный пиперазин, получают в соответствии со следующей схемой (Evans et al. Tetrahedron Lett. 1998, 39, 2937):
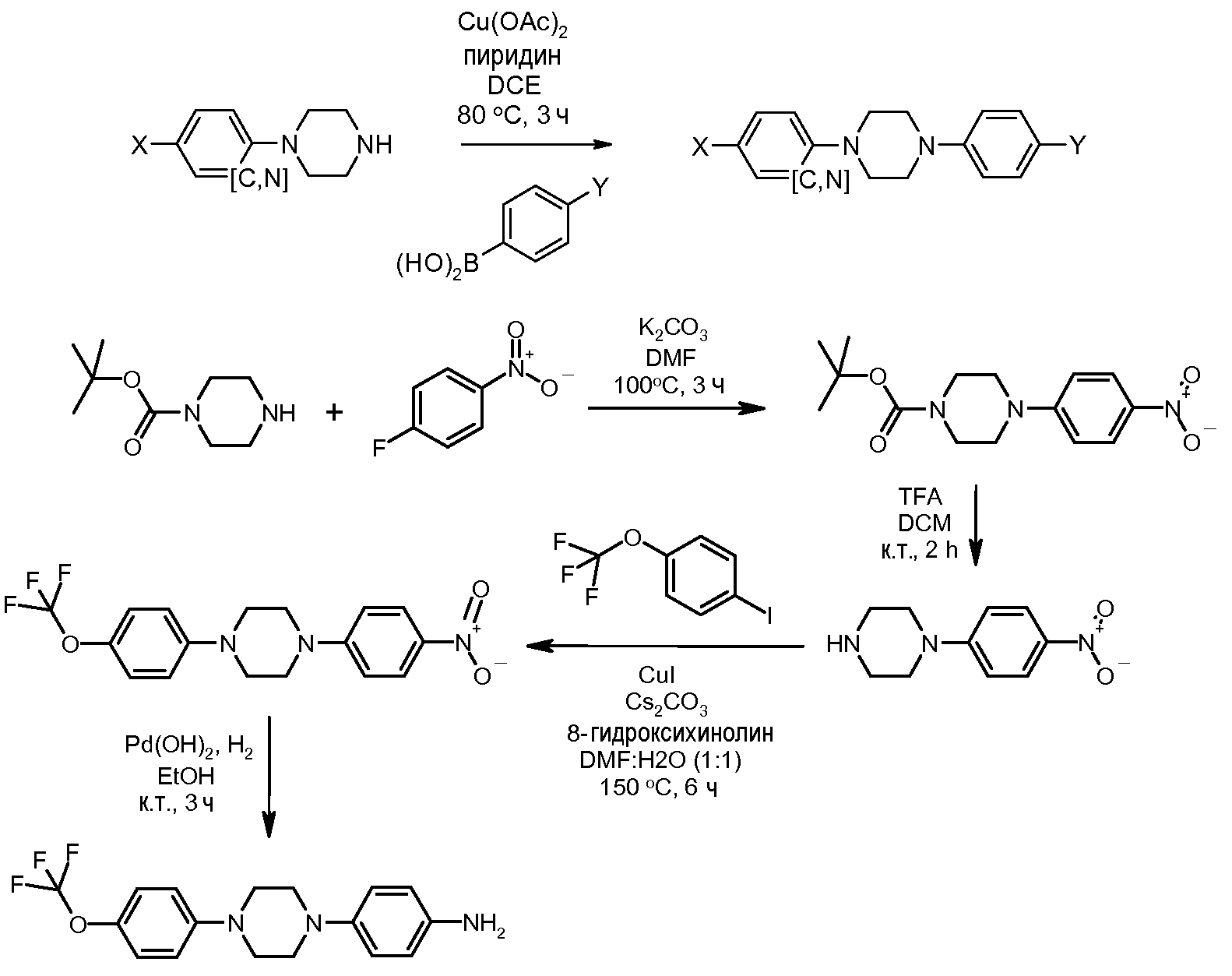
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразолин, получают добавлением арил-гидразина к β-диметиламино-пропиофенону так, как показано в следующей схеме, которая описана в публикации Linton et al. Tetrahedron Lett. 2007, 48, 1993, и в публикации Wheatley et al. J. Am. Chem. Soc. 1954, 76, 4490. В дополнение к пиразолину, небольшая доля бис-присоединения дает в результате соответствующий диметиламинометил-пиразолин. Эти вещества могут быть разделены хроматографическими методами.
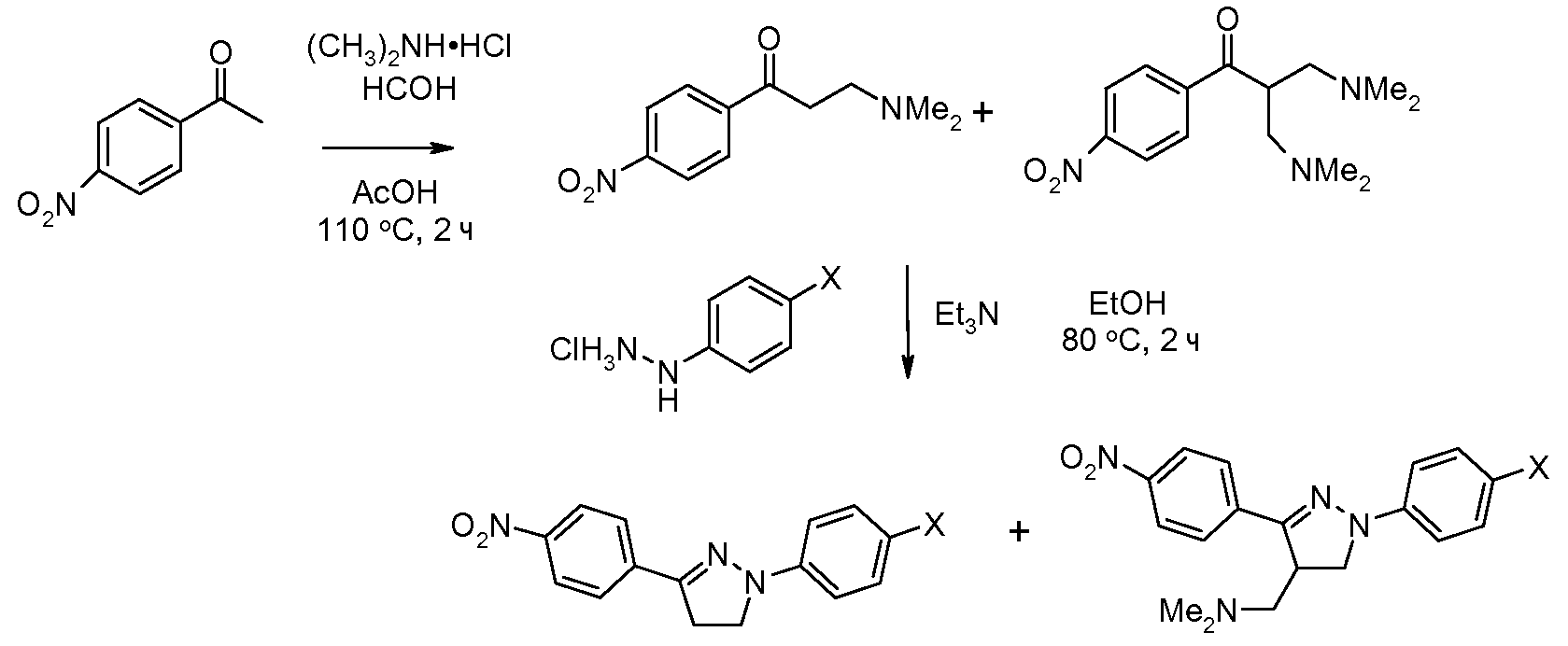
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазин, получают в соответствии со следующей схемой (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 и Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315):
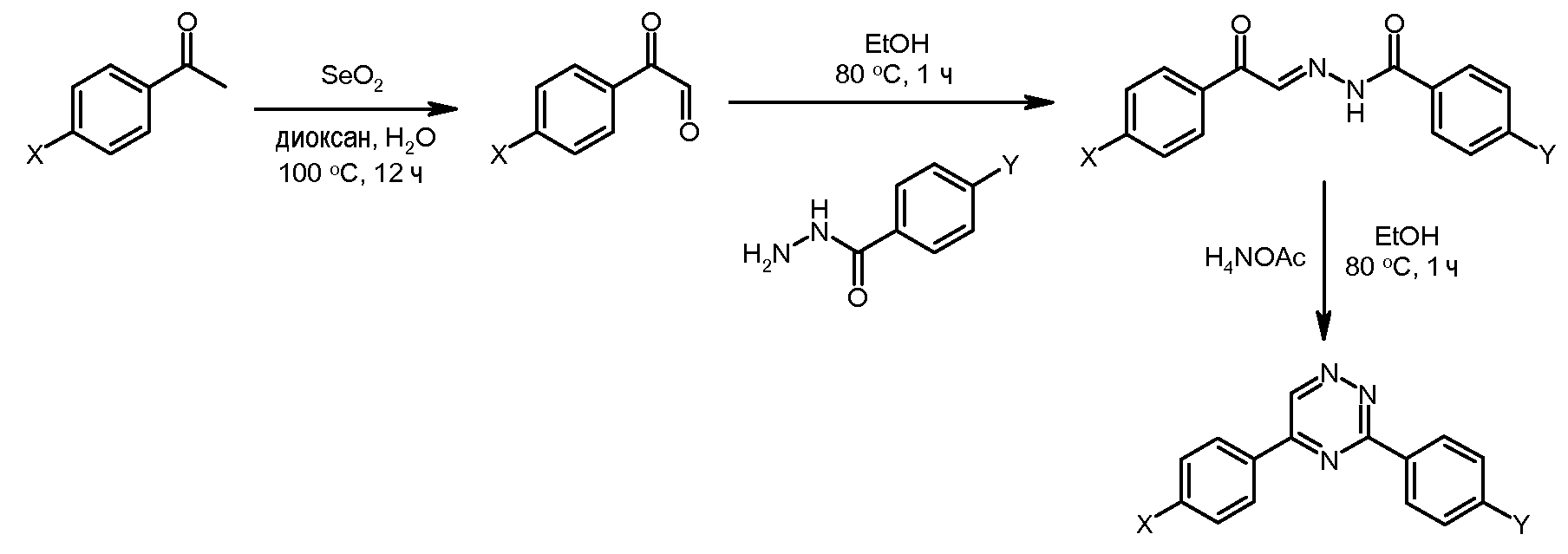
Соединения, где 'Het' представляет собой 2-кетопиперазин или 2,5-дикетопиперазин, получают так, как в следующей схеме. Сложный эфир нитрофенил-глицина может быть подвергнут ацилированию с использованием хлорацетил-хлорида, и промежуточный N-хлорацетилированный сложный эфир глицина, при обработке анилином, подвергается замещению и циклизации при температуре от 120 до 180°С с образованием дикетопиперазина. Альтернативно, насыщенные или ненасыщенные монокето-пиперазины могут быть образованы из промежуточного ацеталь-соединения, показанного ниже, посредством гидролиза и циклизации.
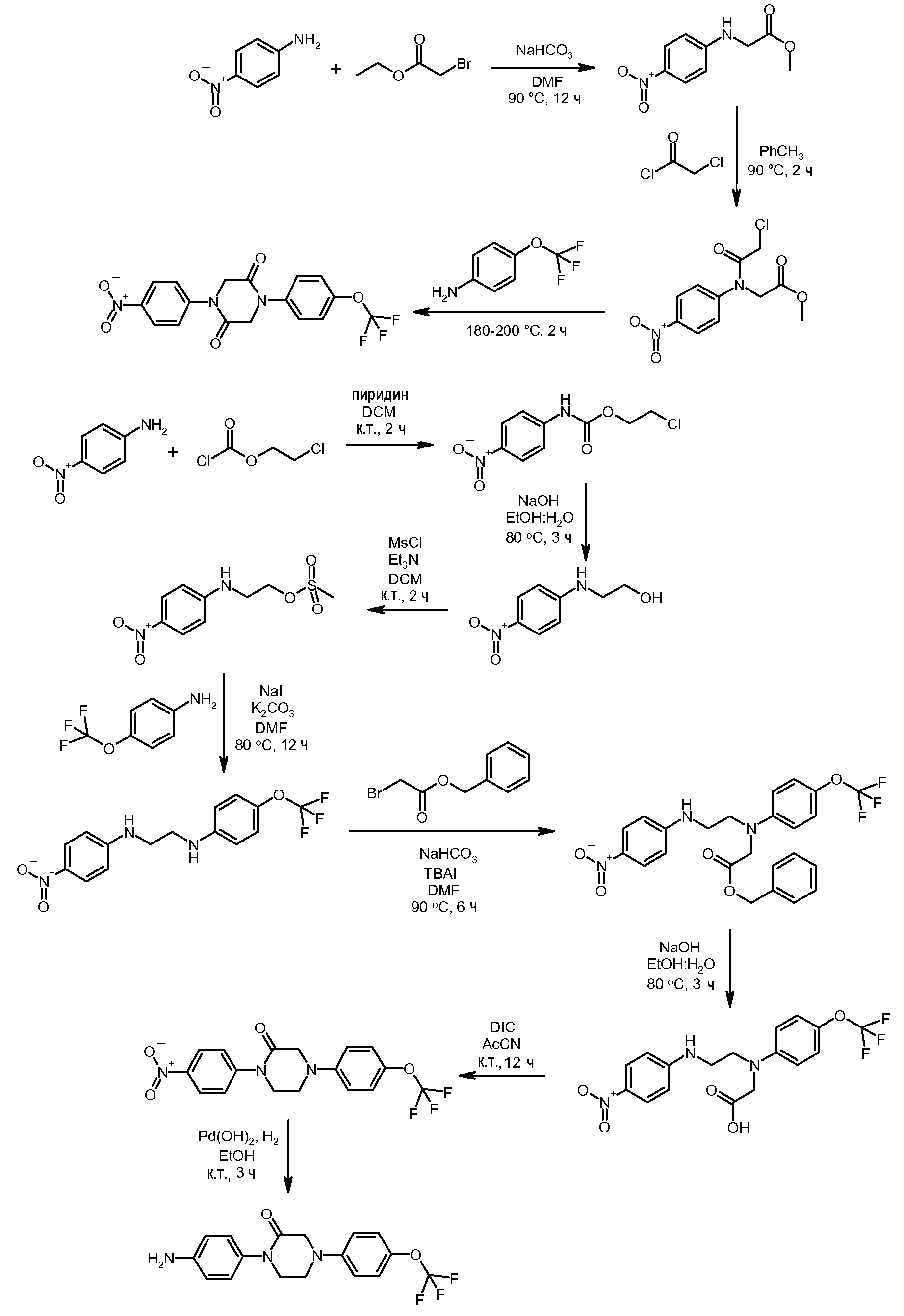
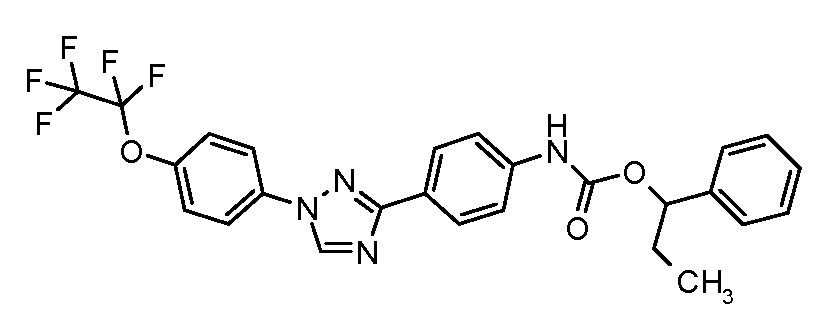
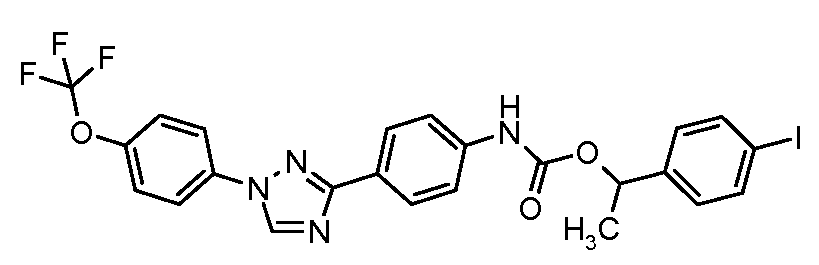
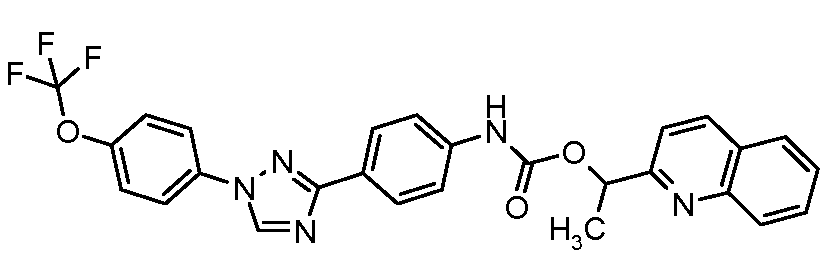
ПОЛУЧЕНИЕ СОЕДИНЕНИЙ С (ТИО)КАРБАМАТНОЙ СВЯЗЬЮ
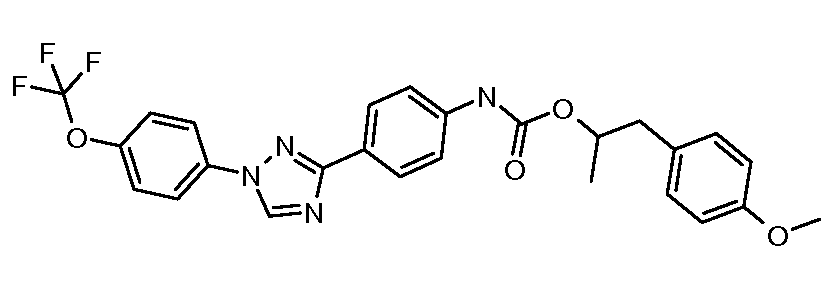
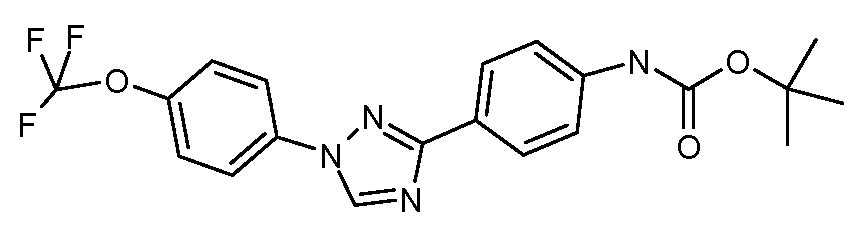
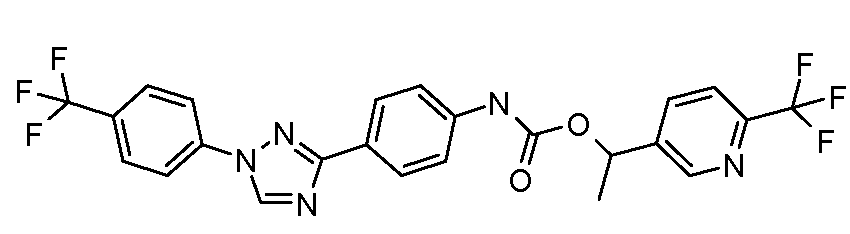
Соединения с карбаматной или тио-карбаматной связью могут быть получены из соответствующих арил-аминов путем превращения либо в изоцианат, либо в изотиоцианат, либо в пара-нитрофенил-карбамат, с последующей обработкой соответственным спиртом (ROH) и органическим или неорганическим основанием в подходящем растворителе, таком как тетрагидрофуран (THF), при температурах от 0 до 100°С. Альтернативно, карбамат может быть получен из хлорформиата, образованного из спирта (ROH) посредством обработки трифосгеном в присутствии основания, такого как пиридин, с последующей реакцией с соответствующим амином.
Промежуточное изоцианатное соединение может быть получено из карбоновой кислоты путем обработки с использованием источника азида, такого как дифенилфосфорил-азид (DPPA). Затем может быть получен ацилазид с тем, чтобы подвергнуть его перегруппировке Курциуса посредством нагревания до 110°С в толуоле, и получающийся в результате изоцианат может быть обработан соответствующими спиртом и основанием, что описано выше, с тем, чтобы получить карбамат. Карбоновые кислоты-предшественники могут быть получены посредством окисления альдегида, с использованием условий, описанных в Примере 18, посредством основного гидролиза нитрила (например, гидролиза 4-(1-(4-трифторметоксифенил)-1,2,4-триазол-3-ил)-бензонитрила, который описан в Примере 10), или посредством кислотного гидролиза нитрила с использованием любого из множества условий, описанных в литературе.
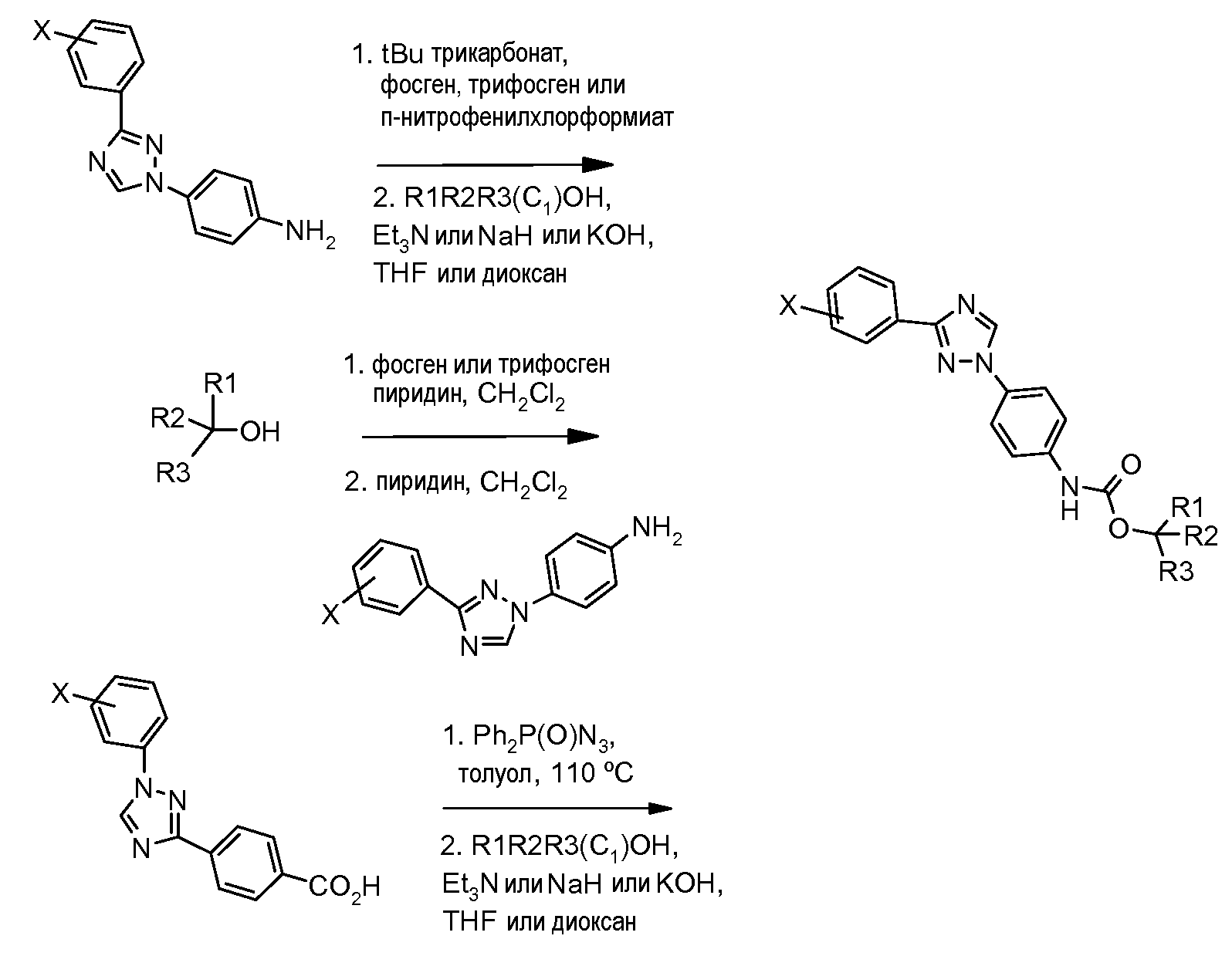
Карбаматы также могут быть получены с использованием нитрофенил-карбонатов так, как показано ниже и продемонстрировано в публикации McClure and Sieber Heteroat. Chem. 2000, 11, 192. Реакция третичного карбинола с металлическим калием, с последующим добавлением пара-нитрофенил-хлорформиата, обеспечивает желаемый пара-нитрофенилкарбонат. Последующая реакция карбоната с амином в присутствии карбоната натрия в диметилформамиде предоставляет карбамат.
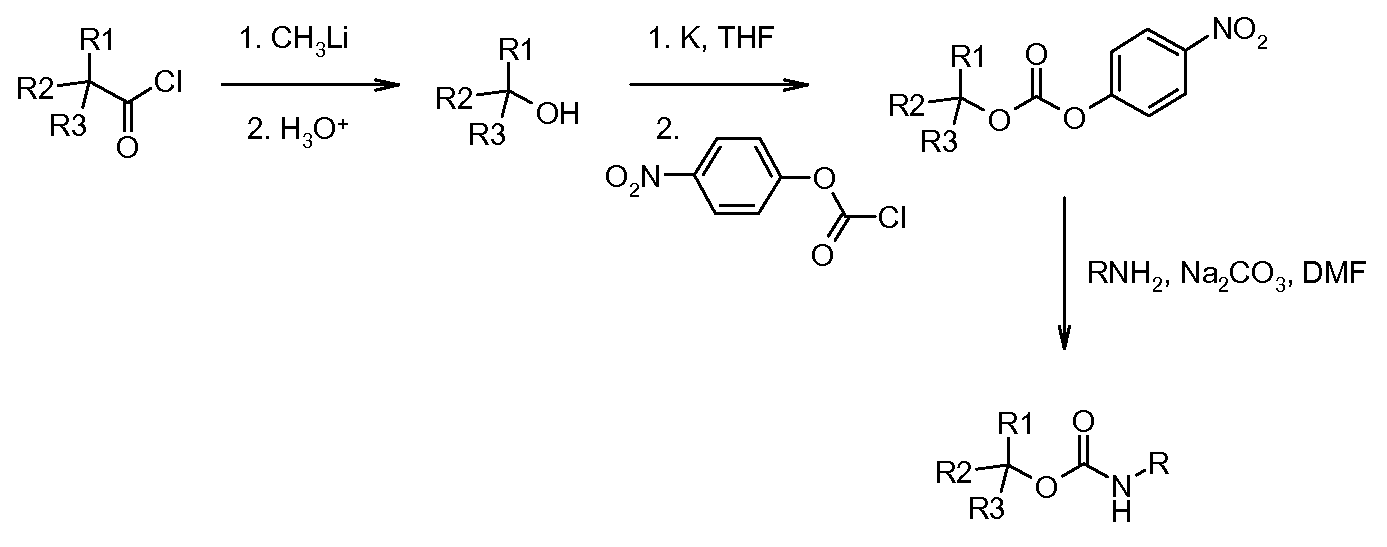
Алкинилкарбаматы могут быть дополнительно функционализированы путем депротонирования посредством основания, такого как н-бутил-литий, в полярном апротонном растворителе, таком как тетрагидрофуран (THF), с последующим проведением реакции с этилхлорформиатом с обеспечением замещенного алкина.
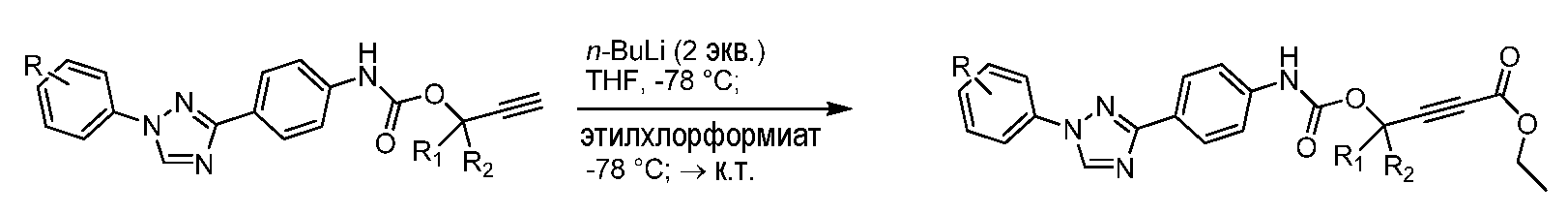
Алкен-содержащие карбаматы могут быть дополнительно функционализированы посредством гидроборирования-окисления с использованием комплекса боран-диметилсульфид, с последующей обработкой тетрагидратом пербората натрия.
ПРИМЕРЫ
Примеры приведены с целью иллюстрации, и их не следует истолковывать как ограничивающие раскрытое в этом документе изобретение только вариантами осуществления, раскрытыми в этих примерах.
Исходные вещества, реагенты и растворители, которые были получены из коммерческих источников, были использованы без дополнительной очистки. Безводные растворители были закуплены как растворители Sure/Seal™ от компании Aldrich и были использованы не подвергнутыми после получения какой-либо обработке. Температуры плавления были получены на капиллярном приборе для измерения температуры плавления Thomas Hoover Unimelt или посредством автоматизированной системы измерения температуры плавления OptiMelt от компании Sanford Research Systems и являются неисправленными.
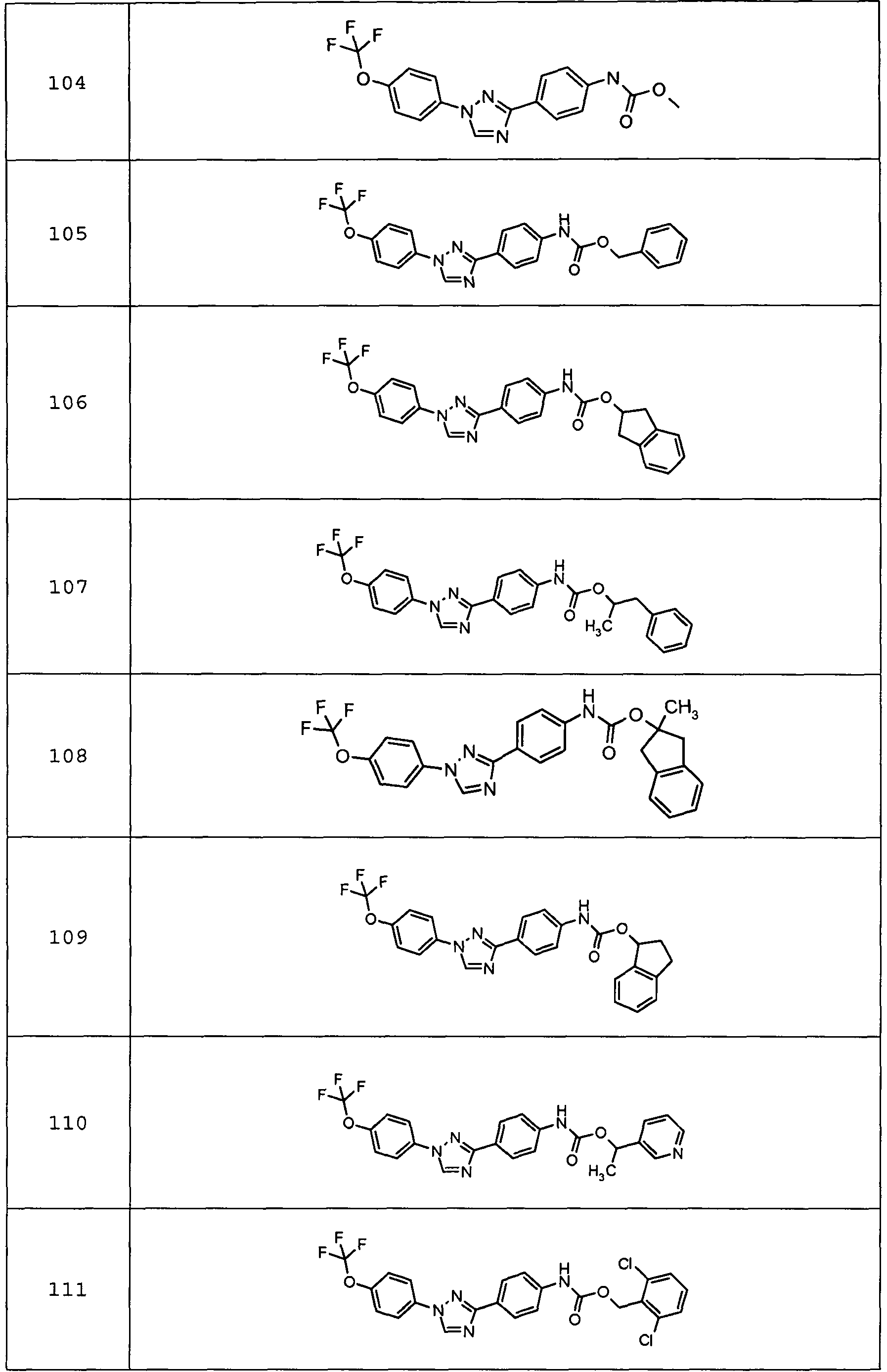
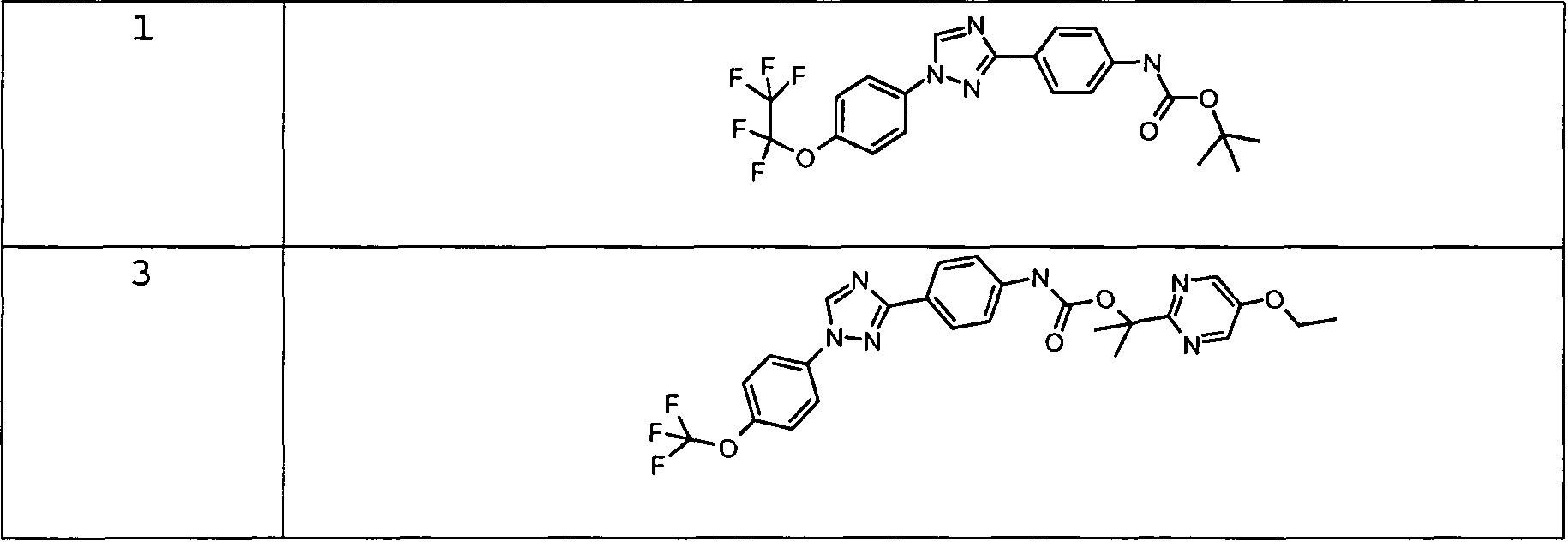
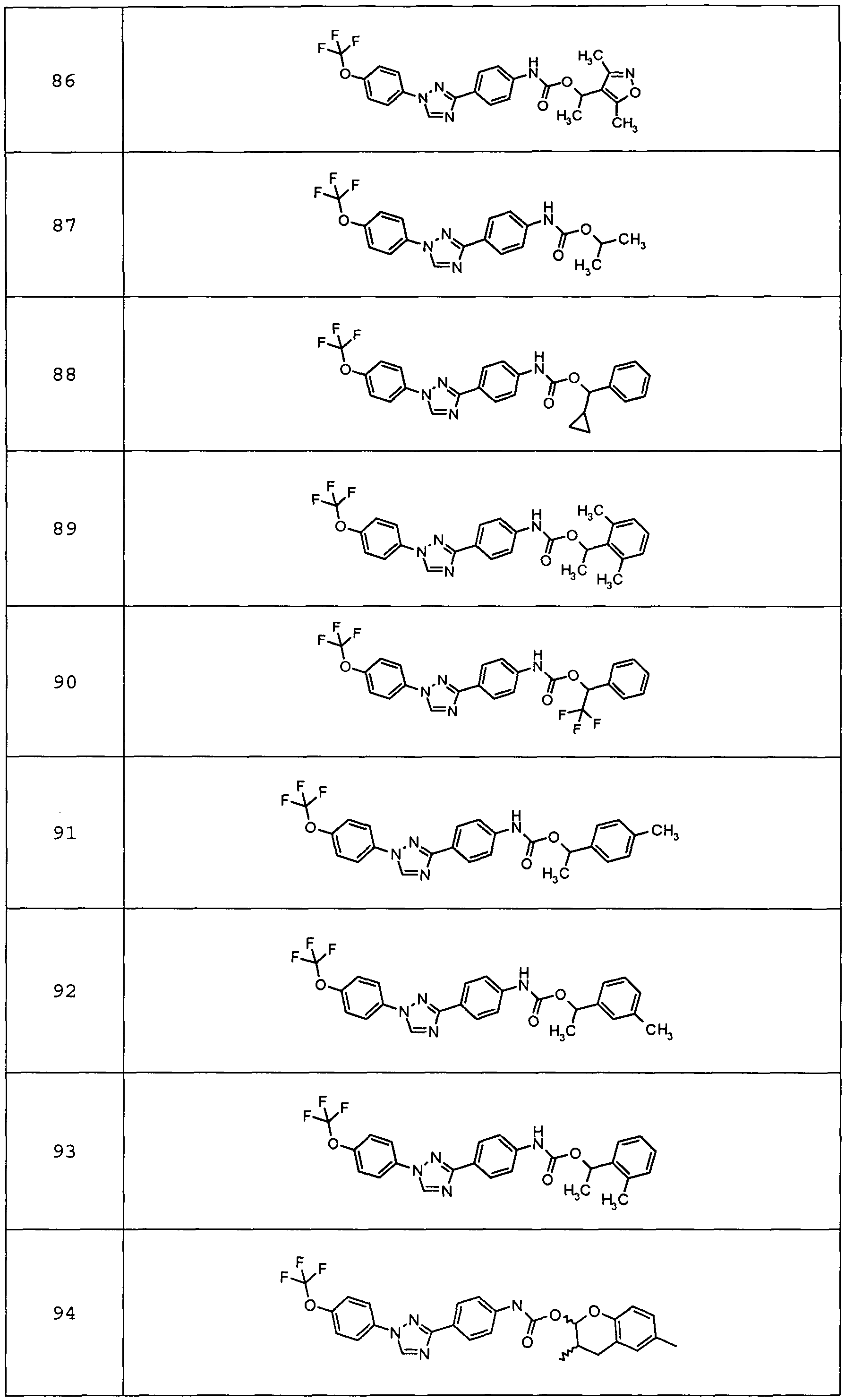
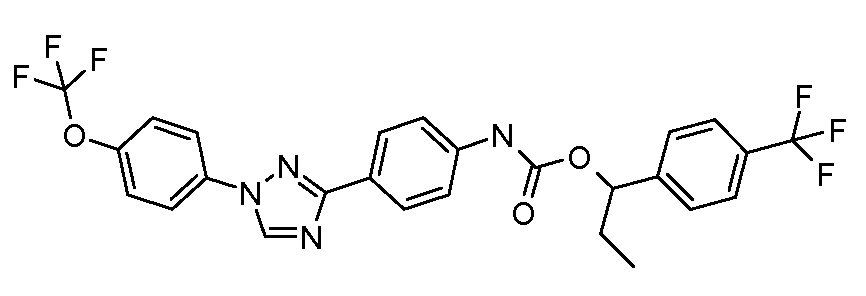
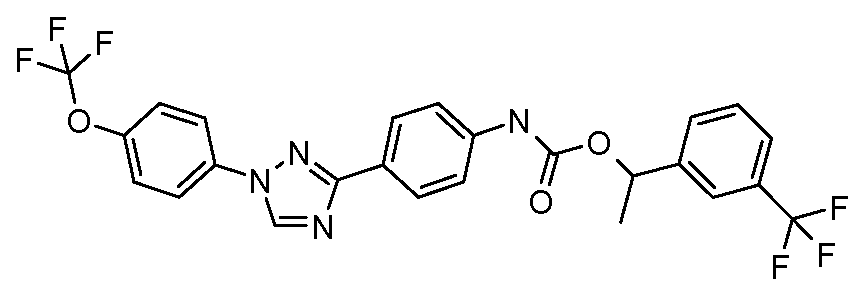
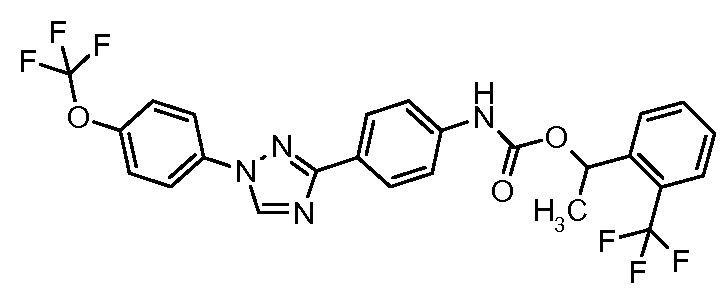
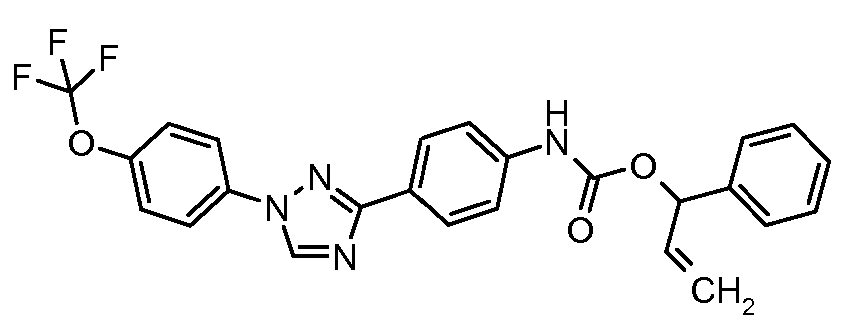
Примеры 1-55 иллюстрируют получение дополнительных молекул, полезных в изготовлении различных вариантов осуществления этого изобретения.
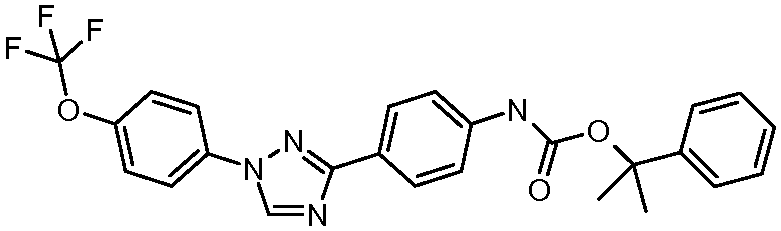
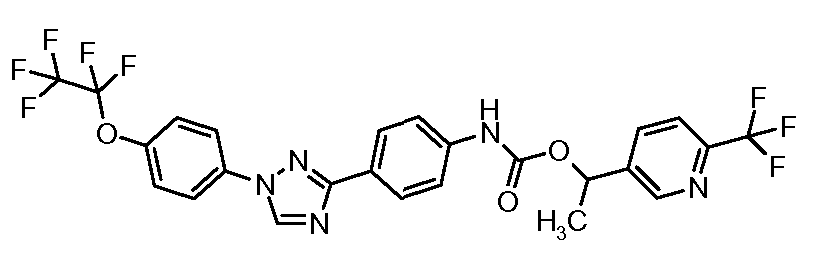
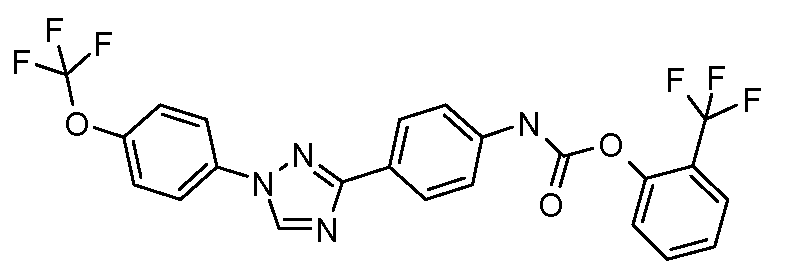
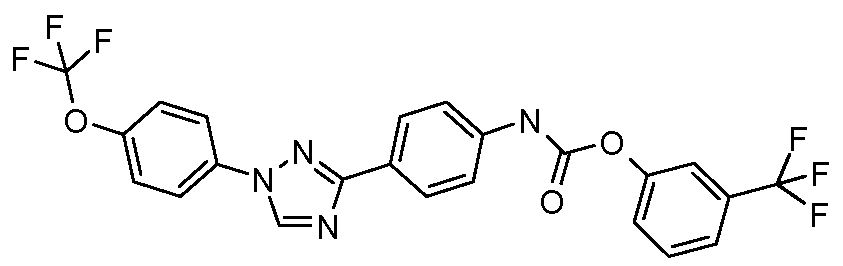
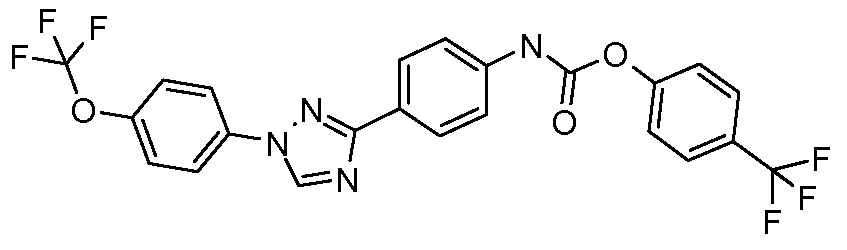
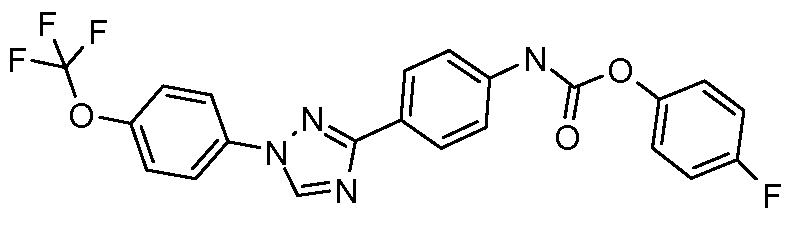
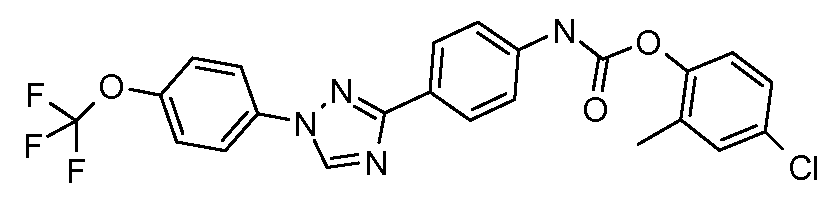
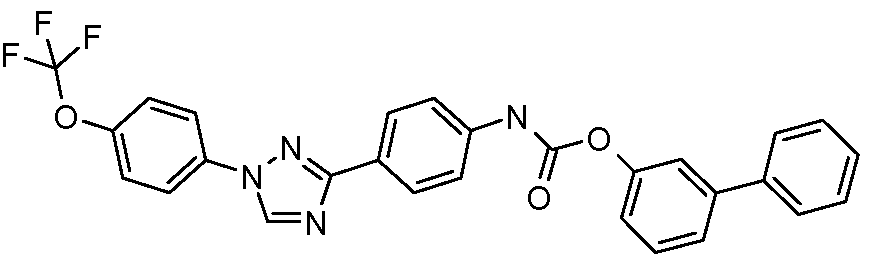
Пример 1: Получение 4-[1-(4-трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегида
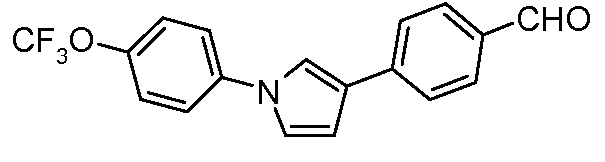
Стадия 1. 1-(4-Трифторметоксифенил)-1Н-пиррол. Соединение получают в соответствии с публикацией Colotta et al. J. Med. Chem. 2006, 49, 6015. Раствор 4-трифторметоксифенил-амина (500 миллиграмм (мг), 2,82 миллимоль (ммоль), 1,00 эквивалент (экв.)) и 2,5-диэтокси-тетрагидрофурана (452 мг, 2,82 ммоль, 1,00 экв) в ледяной уксусной кислоте (20 миллилитров (мл)) нагревают при 90°С в течение 1 часа (час) перед его высушиванием на силикагеле. Затем остаток переводят в суспензию в гексане, который кипятят с обратным холодильником, фильтруют в горячем состоянии, и концентрируют досуха с предоставлением желаемого промежуточного соединения (519 мг, 81%).
Стадия 2. 3-Бром-1-(4-трифторметоксифенил)-1Н-пиррол. Соединение получают в соответствии с публикацией Bray et al. J. Org. Chem. 1990, 55, 6317. К раствору 1-(4-трифторметоксифенил)-1Н-пиррола (519 мг, 2,29 ммоль, 1,00 экв.) в тетрагидрофуране (250 мл) при -78°С добавляют 0,05 М-ный раствор N-бромсукцинимида (NBS; 408 мг, 2,29 ммоль, 1,00 экв.) в тетрагидрофуране в течение 45 минут (мин.). Сосуд медленно нагревают до комнатной температуры с тем, чтобы получить сырой бромпиррол, с концентрацией, которая, как показано методом GC-MS (Газовая хроматография-Масс-спектрометрия), составляет 55% желаемого промежуточного соединения. Вещество используют в последующей реакции без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1Н-пиррол-3-ил]-бензальдегид. Суспензию сырого 3-бром-1-(4-трифторметоксифенил)-1Н-пиррола (356 мг, 1,26 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (283 мг, 1,89 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (27 мг, 0,04 ммоль, 0,03 экв.), 2 М водного раствора Na2CO3 (1,26 мл, 2,52 ммоль, 2,0 экв.), и 1,4-диоксана (5 мл) греют при 150°С в реакционном сосуде, который используется в микроволновой печи, в течение 45 минут. Охлажденный раствор затем разбавляют этилацетатом (EtOAc) (20 мл), фильтруют через целит Celite®, концентрируют досуха, и очищают посредством хроматографии (2:2:1, гексан:EtOAc:ацетон) с предоставлением желаемого промежуточного соединения (79 мг, 21%).
Пример 2: Получение 4-[1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегида
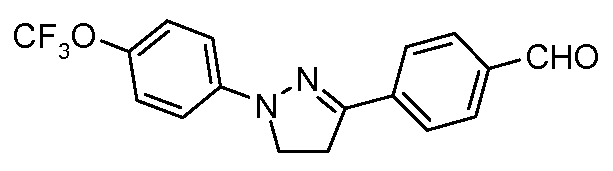
Стадия 1. 1-(4-Трифторметоксифенил)-пиразолидин-3-он. Соединение получают в соответствии с публикацией Rees and Tsoi Chem. Commun. 2000, 415. Суспензию (4-трифторметоксифенил)-гидразин-гидрохлорида (300 мг, 1,32 ммоль, 1,00 экв.), 3-хлорпропионилхлорида (167 мг, 1,32 ммоль, 1,00 экв.), и диизопропилэтиламина на полимерной подложке (PS-DIEA) (1,30 грамм (г), 5,28 ммоль, 4,00 экв) в THF (20 мл) перемешивают при температуре окружающей среды в течение 12 часов. Затем раствор фильтруют, концентрируют досуха, и очищают с помощью хроматографии (гексан:EtOAc:ацетон, 2:2:1) с предоставлением желаемого промежуточного соединения (120 мг, 37%).
Стадия 2. 3-Хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразол: Общую методику берут из публикации Wang et al. Tetrahedron Lett. 2005, 46, 2631. К раствору 1-(4-трифторметоксифенил)-пиразолидин-3-она (120 мг, 0,49 ммоль, 1,00 экв.) в толуоле (20 мл) медленно добавляют фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 экв.). Затем смесь греют при 80°С в течение 1 часа прежде, чем охлаждать до комнатной температуры и разлагать водой (10 мл). Реакционную смесь в сосуде перемешивают в атмосфере азота (N2) в течение 8 часов прежде, чем экстрагировать продукт посредством EtOAc (200 мл), сушить (MgSO4), и концентрировать при пониженном давлении. Метод газовой хроматографии-Масс-спектрометрии (GC-MS) подтверждает 88%-ное образование желаемого промежуточного соединения, который используют в последующих реакциях без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-4,5-дигидро-1Н-пиразол-3-ил]-бензальдегид: Суспензию 3-хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1Н-пиразола (114 мг, 0,43 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (97 мг, 0,65 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (10 мг, 0,01 ммоль, 0,03 экв.), 2 М водного раствора Na2CO3 (0,43 мл, 0,86 ммоль, 2,0 экв.), и 1,4-диоксана (5 мл) греют при 150°С в реакционном сосуде, который используется в микроволновой печи, в течение 45 минут. Охлажденный раствор затем разбавляют этилацетатом (20 мл), фильтруют через целит Celite®, концентрируют досуха, и очищают хроматографией (гексан: EtOAc:ацетон, 2:2:1) с предоставлением желаемого промежуточного соединения (50 мг, 0,15 ммоль, 31%).
Пример 3: Получение 4-[1-(5-бром-2-хлорфенил)-1Н-имидазол-4-ил]-бензонитрила
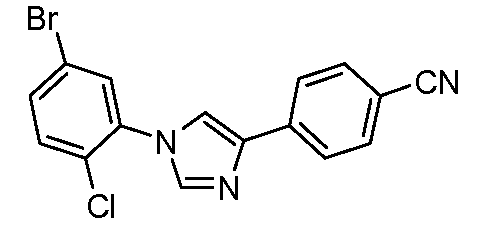
Соединение получают в соответствии с публикацией Liu et al. J. Org. Chem. 2005, 70, 10135. 4-(1H-Имидазол-4-ил)-бензонитрил (75 мг, 0,44 ммоль; полученный из 4-(2-бром-ацетил)-бензонитрила с использованием способа Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030), 4-бром-1-хлор-2-йодбензол (169 мг, 0,532 ммоль), CsCO3 (577 мг, 1,77 ммоль), CuI (3 мг, 0,013 ммоль), 8-гидроксихинолин (2 мг, 0,013 ммоль), и диметилформамид/вода (2 мл; раствор 10:1) соединяют в 10-миллилитровом используемом в микроволновой печи реакционном сосуде от компании CEM, оснащенном магнитной мешалкой и подвергают воздействию микроволнового излучения при 150°С в течение 30 минут. Затем содержимое фильтруют и концентрируют досуха с предоставлением промежуточного соединения: 5-бром-2-хлорфенил-1Н-имидазол-4-ил]-бензонитрила (68 мг, 43%).
Пример 4: Получение 4-[5-(4-пропилофенил)-изоксазол-3-ил]-бензонитрила
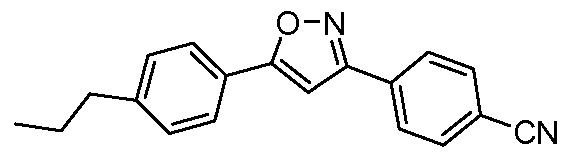
Стадия 1. 4-(Гидроксииминометил)-бензонитрил. Соединение получают в соответствии с публикацией Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензию 4-формилбензонитрила (500 мг, 3,81 ммоль, 1,00 экв.), гидроксиламин-гидрохлорида (290 мг, 4,19 ммоль, 1,10 экв.), и ацетата натрия (1,56 г, 19,05 ммоль, 5,00 экв.) в метиловом спирте (50 мл) греют при 70°С в течение 4 часов прежде, чем концентрировать досуха. Остаток затем переводят в суспензию в диэтиловом эфире (Et2O), фильтруют, и концентрируют с предоставлением желаемого промежуточного соединения (496 мг, 3,39 ммоль, 89%).
Стадия 2. 4-(Гидроксиимино-бромметил)-бензонитрил. Соединение получают в соответствии с публикацией Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05 М Раствор NBS (724 мг, 4,07 ммоль, 1,20 экв.) в дихлорметане добавляют по каплям при 0°С к раствору 4-(гидроксииминометил)-бензонитрила (496 мг, 3,39 ммоль, 1,00 экв.) в дихлорметане (50 мл). Раствор нагревают до комнатной температуры до волюмометрического распределения по двум различным реакционным ампулам. Содержимое каждой ампулы затем концентрируют, и сырые остатки используют без дополнительной очистки.
Стадия 3. 4-[5-(4-Пропилфенил)-изоксазол-3-ил]-бензонитрил. Раствор 4-(гидроксиимино-бромметил)-бензонитрила (381 мг, 1,70 ммоль), триэтиламина (0,71 мл, 5,10 ммоль, 3,0 экв.), и 1-этинил-4-пропилбензола (1,23 г, 8,50 ммоль, 5,0 экв.) в толуоле (20 мл) греют при 100°С в течение 1 часа до проведения концентрирования досуха. Очистка с помощью нормальной фазовой хроматографии предоставляет желаемое промежуточное соединение (108 мг, 22%).
Пример 5: Получение 4-{1-[4-(1-гидроксипропил)фенил]-1Н-пиразол-3-ил}-бензонитрила
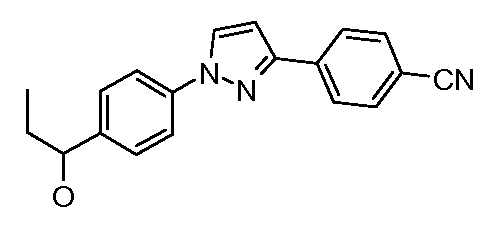
Стадия 1. 3-(4-Цианофенил)пиразол. В круглодонную колбу, оснащенную мешалкой и обратным холодильником, добавляют пара-цианоацетофенон (5 г, 34,44 ммоль) и диметилформамид-диметилацеталь (DMF-DMA; 40 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 5 часов до проведения концентрирования при пониженном давлении с предоставлением сырого диметиламино-акрилоилбензонитрильного промежуточного соединения. Затем остаток суспендируют в минимальном объеме этилового спирта (~20 мл), загружают к нему гидразин-моногидрат (1,67 мл, 34,4 ммоль), и греют при 80°С в течение 30 минут перед проведением концентрирования. Сырое 3-(4-цианофенил)пиразольное вещество (5,59 г, 33 ммоль, 96%), которое выделяют, имеет чистоту, достаточную для использования в последующей реакции.
Стадия 2. 4-[1-(4-Пропионил-фенил)-1Н-пиразол-3-ил]-бензонитрил. 4-(1Н-Пиразол-3-ил)-бензонитрил (100 мг, 0,591 ммоль), 1-(4-бромфенил)-пропан-1-он (126 мг, 0,591 ммоль), Cs2CO3 (770 мг, 2,364 ммоль), CuI (4 мг, 0,018 ммоль), 8-гидроксихинолин (3 мг, 0,018 ммоль), и раствор диметилформамид/вода (2 мл; раствор 10:1) соединяют в 10-миллиметровом используемом в микроволновой печи реакционном сосуде от компании CEM, оснащенном магнитной мешалкой, и подвергают воздействию микроволнового излучения при 150°С в течение 30 минут. Затем содержимое фильтруют и концентрируют досуха с предоставлением нитрила (158 мг, 0,508 ммоль, 86%).
Пример 6: Получение сложного диэтилового эфира 5-(4-формилфенил)-2-(4-трифторметоксифенил)-3,4-дигидро-2Н-пиразол-3,4-дикарбоновой кислоты
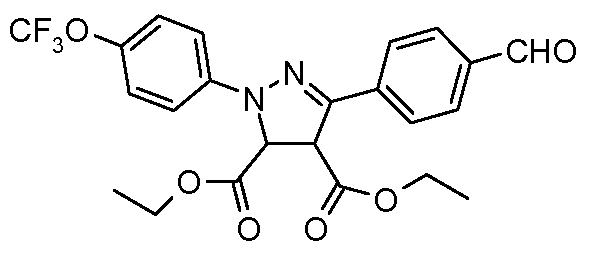
Стадия 1. Получение 4-[(4-трифторметоксифенил)-гидразонометил]-бензальдегида. Соединение получают в соответствии с публикацией Paulvannan et al. Tetrahedron. 2000, 56, 8071. К перемешиваемому раствору бензол-1,4-дикарбальдегида (1,50 г, 11,2 ммоль, 1,00 экв.) в изопропиловом спирте (250 мл) добавляют 4-трифторметокси)фенилгидразин-гидрохлорид (2,55 г, 11,2 ммоль, 1,00 экв.) порциями в течение 5 минут. Раствор перемешивают при температуре окружающей среды в течение 1 часа перед тем, как проводить концентрирование досуха и очистку с использованием хроматографии (гексан: EtOAc:ацетон, 2:2:1), что дает промежуточное соединение (2,48 г, 72%).
Стадия 2. Синтез хлоргидразона. Промежуточное соединение получают в соответствии с публикацией Lokanatha Rai and Hassner Synth. Commun. 1989, 19, 2799. Раствор 4-[(4-трифторметоксифенил)-гидразонометил]-бензальдегида (2,48 г, 8,05 ммоль, 1,00 экв.) и N-хлорсукцинимида (1,61 г, 12,08 ммоль, 1,5 экв.) в изопропиловом спирте (100 мл) греют при 80°С в течение 1 часа. Затем раствор охлаждают и волюмометрически распределяют поровну между шестью различными реакционными сосудами по 1,34 ммоль промежуточного соединения в каждый сосуд.
Стадия 3. Синтез пиразолина. Соединения получают в соответствии с публикацией Paulvannan et al. Tetrahedron 2000, 56, 8071. В каждый реакционный сосуд добавляют триэтиламин (0,56 мл, 4,02 ммоль, 3,00 экв.) и соответственные акрилаты (6,70 ммоль, 5,00 экв.). Затем реакционные смеси греют при 70°С в течение 90 минут прежде, чем проводить концентрирование досуха и очистку с использованием хроматографии (гексан:этилацетат:ацетон, 2:2:1).
Пример 7: Получение 4-{1-[4-(2,2,2-трифторэтокси)-фенил]-1Н-имидазол-4-ил}-бензонитрила
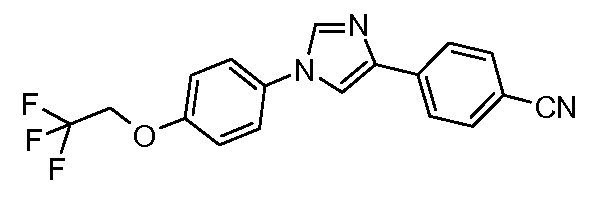
4-(2-Бромацетил)-бензонитрил (58 мг, 0,21 ммоль) и 4-(2,2,2-трифторэтокси)-фениламин (50 мг, 0,21 ммоль) объединяют в 100-миллилитровой колбе Эрленмейера, оснащенной магнитной мешалкой. Содержимое растворяют в этиловом спирте (1 мл) и перемешивают при температуре окружающей среды в течение 2 часов. Затем сырое промежуточное соединение переносят в 100-миллилитровую круглодонную колбу, содержащую KSCN (21 мг, 0,21 ммоль) и конц. HCl (18 мкл, 0,21 ммоль). Сосуд греют при 80°С в течение 1 часа прежде, чем вылить его содержимое в 5 мл раствора H2O/NH4OH (1:1). Раствору дают отстояться в течение 24 часов, и затем твердое вещество отфильтровывают и промывают простым эфиром с предоставлением промежуточного имидазолтиола (32 мг, 0,086 ммоль, 33%). Водный раствор HNO3 (1,35 мл, 0,387 ммоль) и KNO3 (1 мг, 0,003 ммоль) затем добавляют по каплям в течение 10 минут к суспензии имидазолэтиола в уксусной кислоте (2 мл). После перемешивания в течение 2 часов при температуре окружающей среды раствор выливают в дробленый лед и нейтрализуют (рН=7) 0,1 N-ным раствором гидроксида натрия (NaOH, водный). Нитрил выделяют вакуумной фильтрацией и сушат в 45°С-ной вакуумной печи в течение 12 часов (23 мг, 78%), температура плавления 179°С.
Пример 8: Получение 4-[1-(4-пропилфенил)-1Н-имидазол-4-ил]-бензонитрила
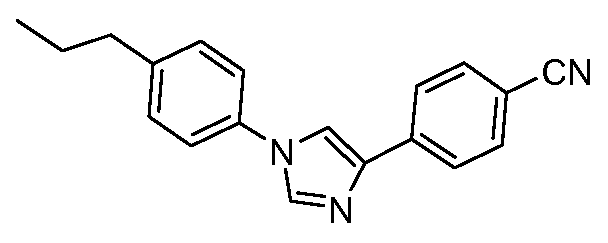
4-Пропиланилин (2,70 г, 20 ммоль) добавляют по каплям в раствор 4-цианофенацил-бромида (2,20 г, 10 ммоль) в диметилформамиде (5 мл). Этот раствор затем добавляют в горячий (180°С) формамид (20 мл) в течение 5 минут, и объединенный раствор оставляют перемешиваться при 180°С в течение 2 часов. Охлажденный раствор затем выливают в лед (100 мл), и экстрагируют простым эфиром (2×75 мл). После проведения сушки и концентрирования, получающееся в результате темное масло очищают хроматографией (гексаны:этилацетат:дихлорметан, 3:1:2). Первый продукт (510 мг) идентифицируют как 4-(5-пропил-1Н-индол-3-ил)-бензонитрил, температура плавления 140°С. Вторую фракцию (275 мг) идентифицируют как желаемый имидазол: температура плавления 133°C;
1H ЯМР (400 МГц, CDCl3) δ 7,95 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,70 (д, J=6 Гц, 2H), 7,68 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Hz, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H);
ESIMS m/z 288,1 (M+H); ESIMS (Масс-спектрометрия с ионизацией методом электрораспыления) m/z 288,1 (M+H).
Пример 9: Получение 4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]-бензонитрила
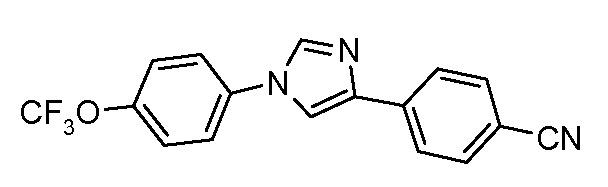
4-Трифторметоксианилин (2,20 г, 12,4 ммоль) добавляют по каплям к раствору 4-цианофенацил-бромида (1,50 г, 6,7 ммоль) в диметилформамиде (5 мл). Этот раствор затем добавляют к горячему (180°С) формамиду (20 мл) в течение 5 минут, и объединенный раствор оставляют перемешиваться при 180°С в течение 2 часов. Охлажденный раствор затем выливают на лед (100 мл), и экстрагируют простым эфиром (2×75 мл). После высушивания и концентрирования, получающееся в результате полутвердое вещество перекристаллизовывают из MeOH/H2O. Вторая перекристаллизация из MeOH/H2O удаляет следовые количества форманилидной примеси и предоставляет чистый продукт (200 мг): температура плавления 155°С. Анализ: Вычислено для C17H10F3N3O: C, 62,01; H, 3,06; N, 12,76. Найдено: С, 61,53; Н, 3,13; N, 12,55.
Пример 10: Получение 4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]-бензойной кислоты
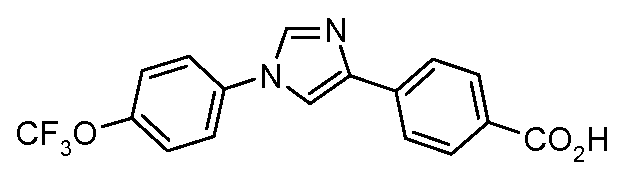
Раствор нитрила (1,1 г, 3,3 ммоль) в этиловом спирте (5 мл) и в воде (2 мл) обрабатывают гидроксидом натрия (1 г, 20 ммоль), и раствор греют с кипячением с обратным холодильником в течение 6 часов. Затем его охлаждают и подкисляют 1N-ным раствором HCl, и получающееся в результате белое твердое вещество фильтруют и сушат на воздухе, что дает кислоту (1,1 г) в виде светлого серого твердого вещества: температура плавления 230°С;
1H ЯМР (400 МГц, CDCl3) δ 11,4 (с, 1H), 7,90 (д, J=6,4 Гц, 2H), 7,89 (с, 1H), 7,80 (д, J=8,6 Гц, 2H), 7,63 (д, J=1,3 Гц, 1H), 7,49 (д, J=9,3 Гц, 2H), 7,38 (д, J=8,9 Гц, 2H).
Пример 11: Получение 4-[4-(4-трифторметилфенил)-1Н-имидазол-1-ил]-бензонитрила
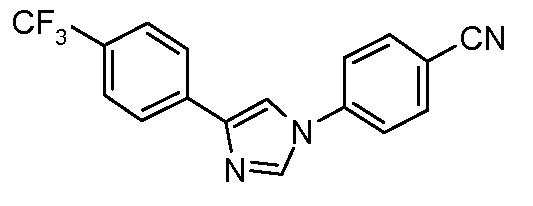
4-Трифторметилфенил-имидазол (4,0 г, 19 ммоль), 4-фторбензонитрил (1,2 г, 8,5 ммоль) и карбонат калия (1,5 г, 10,9 ммоль) соединяют в диметилсульфоксиде (15 мл) и греют при 100°С в течение 6 часов. Охлажденный раствор затем выливают в воду (100 мл), и получающееся в результате твердое вещество фильтруют и сушат на воздухе, что дает имидазол-нитрил (4,65 г) в виде белого твердого вещества: температура плавления 252°С;
1Н ЯМР (300 МГц, CDCl3) δ 8,05 с, 1H), 7,95 (д, J=8 Гц, 2H), 7,85 (д, 2 H), 7,72 (с, 1H), 7,72 (д, J=8 Гц, 2 H), 7,62 (д, J=8 Гц, 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 314,1 (М+Н). Анализ: Вычислено для C16H10F3N3O2: C, 65,18; H, 3,22; N, 13,41. Найдено: С, 64,49; Н, 3,23; N, 13,08.
Пример 12: Получение 4-бром-1-(4-трифторметоксифенил)-1Н-имидазола
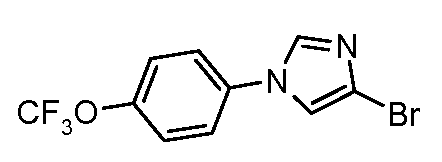
В круглодонную колбу загружают 4-бромимидазол (1,15 г, 7,81 ммоль), CuI (0,07 г, 0,36 ммоль), 8-гидроксихинолин (0,05 г, 0,36 ммоль), карбонат цезия (3,39 г, 10,4 ммоль) и 4-трифторметоксийодбензол (1,50 г, 5,21 ммоль). Смесь (10:1) диметилформамида (15 мл) и воды (1,5 мл) добавляют к реакционной смеси, и раствор нагревают до 130°С в течение 4 часов. Реакционную смесь затем разбавляют этилацетатом и промывают последовательно водой, хлоридом аммония (насыщенный раствор), водой и бикарбонатом натрия. Органические соединения сушат над MgSO4, фильтруют и очищают на колонке с обращенной фазой, что дает имидазол (820 мг) в виде белого твердого вещества: температура плавления 139-141°С; ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 308,0 (М+Н).
Пример 13: Получение 4-метокси-2-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]-бензальдегида
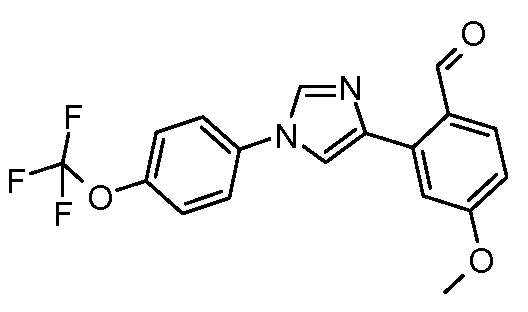
4-Бром-1-(4-трифторметоксифенил)-1Н-имидазол (100 мг, 0,326 ммоль), 2-формил-5-метоксифенилбороновую кислоту (73 мг, 0,41 ммоль), дихлорид бис(трифенилфосфин)палладия (2 мг, 0,003 ммоль), бикарбонат натрия (49 мг, 0,59 ммоль) и раствор DME/H2O, 1:1 (8:8 мл) объединяют и добавляют в сосуд, который используется в микроволновой печи. Реакционную смесь греют в микроволновой печи при перемешивании при 100°С в течение 12 минут. Для достижения 100°С в микроволновой печи требуется 5 минут, затем микроволновую печь поддерживают при 100°С в течение 12 минут, и затем охлаждают. Анализ методом тонкослойной хроматографии (TLC) (этилацетат:циклогексан, 1:1) показывает присутствие исходных веществ, в связи с чем образец нагревают до 100°С в течение дополнительных 8 минут. При охлаждении образуется осадок; его отфильтровывают и промывают водой, что дает серое твердое вещество (86 мг): ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 363,0 (М+Н).
Следующее промежуточное вещество также получают с использованием этой методики:
Пример 14: Получение 2-фтор-4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]-бензальдегида
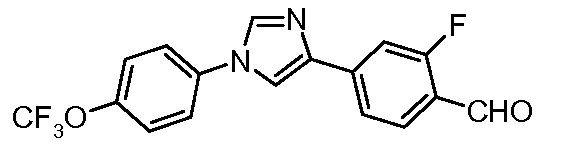
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 351,0 (М+Н).
Пример 15: Получение 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрила
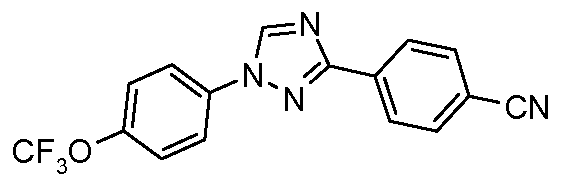
Стадия 1. 4-(1Н-[1,2,4]Триазол-3-ил)-бензонитрил. Используется общая методика, изложенная автором публикации: Lin et al. J. Org. Chem. 1979, 44, 4163, для получения 3-(4-нитрофенил)-1Н-[1,2,4]триазола. 4-Цианобензамид (21,63 г, 0,148 моль) растворяют в смеси DMF-DMA (100 мл) и перемешивают при кипячении с обратным холодильником в атмосфере азота в течение 8 часов. Смесь концентрируют досуха и суспендируют в уксусной кислоте (AcOH, 50 мл). Затем в сосуд загружают гидразин-моногидрат (7,18 мл, 0,148 ммоль) и перемешивают при кипячении с обратным холодильником в течение 1 часа перед концентрированием. Получают желаемый 4-(1Н-[1,2,4]триазол-3-ил)-бензонитрил с чистотой 98% путем растирания в порошок с диэтиловым эфиром с последующей фильтрацией (12,17 г, 0,072 моль, 48%).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрил. Триазол (70 мг, 0,41 ммоль), 1-йод-4-трифторметоксибензол (142 мг, 0,493 ммоль), CsCO3 (535 мг, 1,644 ммоль), CuI (3 мг, 0,012 ммоль), 8-гидроксихинолин (2 мг, 0,012 ммоль), и раствор DMF/H2O (2 мл, раствор 10:1) объединяют в 10-миллилитровом используемом в микроволновой печи реакционном сосуде от компании CEM, оснащенном магнитной мешалкой, и подвергают воздействию микроволнового излучения при 150°С в течение 30 минут. Затем содержимое фильтруют и концентрирут досуха с предоставлением промежуточного 1,3-дифенил-триазольного соединения (18 мг, 13%).
Пример 16: Получение 4-[1-(4-пентафторэтилсульфонилфенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрила

Стадия 1. 1-Бром-4-пентафторэтилсульфонилбензол. Соединение, указанное в заглавии, получают с использованием условий перфторалкилирования, первоначально описанных в публикации: Popov et al. J. Fluorine Chem. 1982, 21, 365. В раствор 4-бромбензолтиола (500 мг, 2,64 ммоль, 1,00 экв.) и хлорида триэтилбензиламмония (60 мг, 0,26 ммоль, 0,10 экв.) в 10 мл водного раствора смеси Et2O/NaOH 1:1 (25%-ный водный раствор) при 0°С барботируют газ, 1,1,1,2,2-пентафтор-2-йодэтан, в течение 30 минут (>5 экв.). На протяжении этого периода времени УФ-лампа является направленной на реакционный сосуд, при этом температура поддерживается на уровне ниже 10°С путем использования с перерывами ледяной бани. Содержимое затем нагревают до комнатной температуры, экстрагируют диэтиловым эфиром (300 мл), сушат (MgSO4), и концентрируют при пониженном давлении. Часть этого сырого материала используют в последующих реакциях без дополнительной очистки (остаток 200 мг: продукт 120 мг, 0,39 ммоль, 1,2 экв.).
Стадия 2. 4-[1-(4-Пентафторэтилсульфонилфенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрил. Реакция сочетания с 4-(1Н)-[1,2,4]триазол-3-ил)-бензонитрилом, которая описана выше, дает 4-[1-(4-пентафторэтилсульфонилфенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрил (70 мг, 46%).
Пример 17: Получение 4-[1-(4-пентафторэтилокси-фенил)-1Н-[1,2,4]триазол-3-ил]-бензальдегида
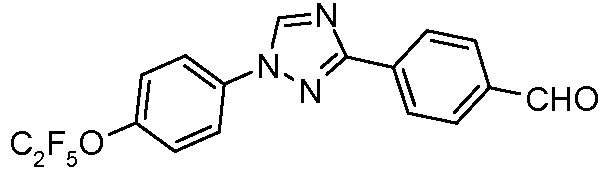
Стадия 1. Раствор 3-пара-толил-1Н-[1,2,4]триазола (4,85 г, 30,5 ммоль), 4-бромфенил-пентафторэтилового эфира (10,0 г, 34,4 ммоль), Cs2CO3 (25 г, 77 ммоль), CuI (1,25 г, 6,5 ммоль) и 8-гидроксихинолина (0,35 г, 2,4 ммоль) в смеси DMF/H2O, 9:1 (50 мл) энергично перемешивают и нагревают до 130°С (внутренняя температура) в течение 20 часов. Затем раствор охлаждают, выливают в воду, и подкисляют 2N-ным раствором HCl до рН 2. Затем добавляют эфир (250 мл), и раствор встряхивают и фильтруют перед тем, как разделять слои. Органический слой сушат и концентрируют, и получающееся камедеобразное твердое вещество греют со смесью гексанов (100 мл). Слой с горячим гексаном отделяют декантированием от нерастворимого остатка, получающийся в результате раствор охлаждают до 0°С, а осажденное твердое вещество отфильтровывают и сушат на воздухе с предоставлением 1-(4-пентафторэтилокси-фенил)-3-пара-толил-1Н-[1,2,4]триазола (7,0 г, 61%, исходя из исходного триазола) в виде твердого вещества грязно-белого цвета: температура плавления 130-132°С; ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 370,8 (М+Н).
Стадия 2. Продукт Стадии 1 (7,0 г, 18,7 ммоль) растворяют в ацетонитриле (200 мл) и перемешивают при температуре окружающей среды, в то время как нитрат церия аммония (32 г, 58 ммоль) в воде (60 мл) добавляют порциями в течение 10 минут. Затем раствор нагревают до температуры кипения, которое осуществляют с обратным холодильником в течение 4 часов, охлаждают, и разбавляют водой (200 мл). Раствор экстрагируют простым эфиром (2×200 мл), и объединенный органический слой сушат и концентрируют, что дает масло оранжевого цвета. Это вещество растворяют в диоксане (40 мл) и обрабатывают раствором КОН (5 г, 90 ммоль) в воде (20 мл). Раствор нагревают до температуры кипения, которое осуществляют с обратным холодильником в течение 2 часов, затем охлаждают и разбавляют водой (100 мл). Альдегид выпадает в осадок, и его собирают фильтрацией. Перекристаллизация из смеси MeOH/H2O дает чистый альдегид в виде твердого вещества белого цвета (2,2 г, 30%): температура плавления 137-144°C.
1Н ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 384,2 (М+Н).
Пример 18: Получение 4-[1-(4-пентафторэтилокси-фенил)-1Н-[1,2,4]триазол-3-ил]-бензойной кислоты
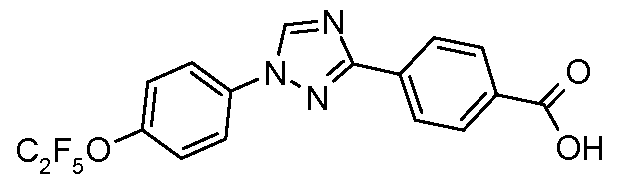
Раствор 4-[1-(4-пентафторэтилокси-фенил)-1Н-[1,2,4]триазол-3-ил]бензальдегида (1,7 г, 4,4 ммоль), бромата натрия (2,1 г, 13,9 ммоль) и бисульфата натрия (0,53 г, 4,5 ммоль) в ацетонитриле (50 мл) нагревают до температуры кипения, которое осуществляют с обратным холодильником в течение 5 часов, на протяжении которых образуется объемный осадок. Затем раствор охлаждают и выливают в воду (100 мл), фильтруют, и сушат с предоставлением кислоты (1,67 г) в виде белого твердого вещества: температура плавления 225°С;
1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,63 (с, 1H), 8,35 (д, J=8,4 Гц, 2H), 8,5 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,43 (д, J=9 Гц, 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 399,2 (M+H).
Пример 19: Получение 4-[1-(4-пентафторэтилокси-фенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азида
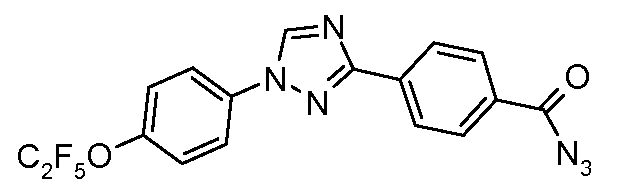
Раствор 4-[1-(4-пентафторэтилокси-фенил)-1Н-[1,2,4]триазол-3-ил]бензойной кислоты (1,67 г, 4,2 ммоль), дифенилфосфорилазида (1,26 г, 4,58 ммоль) и триэтиламина (0,5 г, 5 ммоль) в обезвоженном трет-бутиловом спирте (10 мл) нагревают до 75°С в течение 90 минут, что приводит к растворению исходной кислоты и к последующему осаждению азида. Охлажденный раствор затем выливают на лед (10 г), и получающуюся в результате смесь фильтруют и сушат с предоставлением азида (0,80 г) в виде белого твердого вещества: температура плавления 112-115°С с разложением;
1Н ЯМР (300 МГц, CDCl3) δ 8,62 (с, 1H), 8,33 (д, J=8,4 Гц, 2H), 8,16 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,42 (д, J=9 Гц, 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 425 (M+H).
Пример 20: Получение 4-[1-(4-бутилфенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрила

Раствор 4-н-бутил-фенилгидразина (1,0 г, 5 ммоль) и 4-цианобензальдегида (0,8 г, 6,0 ммоль) в изо-пропиловом спирте (15 мл) нагревают на паровой бане в течение 2 часов и затем охлаждают и разбавляют водой (5 мл). Получающееся в результате твердое вещество оранжевого цвета отфильтровывают и сушат на воздухе, что дает гидразон (1,30 г) в виде твердого вещества желтого цвета, с температурой плавления 107°С. Раствор этого гидразона (1,1 г, 4,0 ммоль) и NCS (0,67 г, 5 ммоль) в изо-пропиловом спирте (20 мл) перемешивают в атмосфере азота при температуре окружающей среды в течение 2 часов, на протяжении которых исходное твердое вещество растворяется, а новое твердое вещество образуется. Получающийся в результате раствор оранжевого цвета затем обрабатывают тетразолом (0,45 г, 6,4 ммоль) и триэтиламином (960 мкл, 7,0 ммоль). Раствор оранжево-коричневого цвета греют при кипячении с обратным холодильником в течение 2 часов. Затем раствор охлаждают, разбавляют водой (25 мл), экстрагируют этилацетатом, сушат, концентрируют, и подвергают очистке хроматографией (Biotage, гексан:этилацетат 4:1), что дает триазол (0,42 г, 35%) в виде твердого вещества грязно-белого цвета: температура плавления 124°С;
1Н ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,33 (д, J=8 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 303,1 (M+H).
Пример 21: Получение 4-[1-(4-пентафторэтил-фенил)-1Н-[1,2,4]триазол-3-ил]-бензальдегида
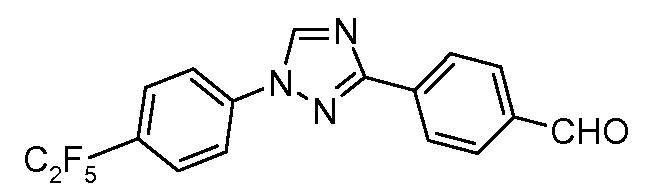
Стадия 1. 1-(4-Пентафторэтил-фенил)-3-пара-толил-1Н-[1,2,4]триазол. Пентафторэтил-йодид (521 мг, 2,12 ммоль) конденсируют в ампулу, содержащую 1-бром-4-йодбензол (300 мг, 1,06 ммоль), порошок меди(0) (135 мг, 2,12 ммоль), и диметилсульфоксид (5 мл). Затем ампулу герметизируют (запаивают) и подвергают воздействию микроволнового излучения при 150°С в течение 60 минут. Анализ методом газовой хроматографии-масс-спектрометрии показал расходование исходного вещества, что дает как 1-бром-4-пентафторэтилбензольное, так и 1-йод-4-пентафторэтилбензольное промежуточные соединения. Смесь (1,06 ммоль) переносят в 250-миллилитровую круглодонную колбу и добавляют 3-пара-толил-1Н-[1,2,4]триазол (169 мг, 1,06 ммоль), Cs2CO3 (1,38 г, 4,24 ммоль), CuI (202 мг, 1,06 ммоль), 8-гидроксихинолин (2 мг, 0,011 ммоль), и раствор DMF/H2O (12 мл; раствор 10:1). Раствор перемешивают при кипячении с обратным холодильником при 160°С в течение 6 часов. По завершении, охлажденное содержимое выливают в воду и дают осесть в течение 1 часа. Осадок собирают вакуумной фильтрацией и сушат в течение ночи в вакуумной печи при 45°С. Сырое промежуточное 1-(4-пентафторэтилфенил)-3-пара-толил-1Н-[1,2,4]триазольное соединение используют на стадии 2 без дополнительной очистки.
Стадия 2. Окисление до альдегида. Нитрат аммония-церия(IV) (3,32 г, 4,24 ммоль) и промежуточное соединение со Стадии 1 объединяют в круглодонной колбе с ацетонитрилом и водой (20 мл; 1:1). Раствор перемешивают при кипячении с обратным холодильником при 110°С в течение 4 часов, что предоставляет смесь 3-(4-нитрооксиметил-фенил)-1-(4-пентафторэтил-фенил)-1Н-[1,2,4]триазольного и 4-[1-(4-пентафторэтил-фенил)-1Н-[1,2,4]триазол-3-ил]-бензальдегидного промежуточных соединений. Ацетонитрил удаляют в вакууме, и осадки сырых промежуточных соединений собирают фильтрацией. Вещество затем соединяют с порошком КОН (178 мг, 3,18 ммоль) в диоксане и воде (10 мл; 1:1) и перемешивают при кипячении с обратным холодильником при 105°С в течение 90 минут прежде, чем удаляют диоксан в вакууме, что дает осаждение промежуточного соединения из воды. 4-[1-(4-Пентафторэтил-фенил)-1Н-[1,2,4]триазол-3-ил]-бензальдегидное промежуточное соединение собирают фильтрацией (35 мг, 0,095 ммоль, 9% всего из 4-толил-триазола).
Пример 22: Получение 4-[3-(4-формил-фенил)-[1,2,4]триазол-1-ил]-фенилового сложного эфира трифторметансульфокислоты.
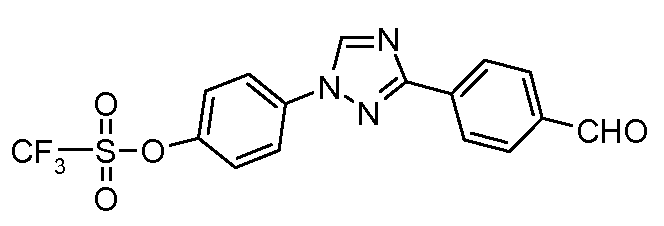
Стадия 1. 1-(4-Метоксифенил)-3-пара-толил-1Н-[1,2,4]триазол получают реакцией сочетания 3-пара-толил-1Н-[1,2,4]-триазола с 4-йоданизолом в условиях, описанных для Стадии 1 предыдущего примера. Это вещество затем деметилируют с использованием условий, описанных в публикации: Hitchcock et al. Synlett 2006, 2625. К раствору 1-(4-метоксифенил)-3-пара-толил-1Н-[1,2,4]триазола (300 мг, 1,28 ммоль) в дихлорметане (10 мл) при 0°С в атмосфере азота добавляют по каплям трибромид бора (1 М-ный раствор в гексане; 1,67 мл, 1,67 ммоль). По завершении добавления, сосуд нагревают до температуры окружающей среды, после чего кипятят с обратным холодильником при 40°С в течение 6 часов. Охлажденное содержимое затем разлагают водой перед удалением дихлорметана и распределением между этилацетатом и водой. Органический слой собирают, промывают рассолом, сушат (MgSO4), концентрируют, и очищают хроматографией (гексаны:этилацетат:ацетон 3:1:1) с предоставлением промежуточного 4-(3-пара-толил-[1,2,4]триазол-1-ил)-фенольного соединения (219 мг, 0,872 ммоль, 68%). Ангидрид трифторметансульфокислоты (0,16 мл, 0,96 ммоль) добавляют по каплям к раствору фенола и 4-трет-бутил-2,6-диметилпиридина (142 мг, 0,872 ммоль) в дихлорметане (10 мл) при 0°С в атмосфере азота. Сосуд нагревают до температуры окружающей среды перед удалением растворителя при пониженном давлении и очищением остатка хроматографией (гексаны:этилацетат:ацетон, 2:2:1) с предоставлением промежуточного соединения, 4-(3-пара-толил-[1,2,4]триазол-1-ил]-фенилового сложного эфира трифторметансульфокислоты (304 мг, 0,794 ммоль, 91%).
Стадия 2. Окисление вышеупомянутого промежуточного 4-метильного соединения до соответствующего альдегида выполняют с использованием нитрата аммония церия(IV) в условиях, описанных для Стадии 2 в предыдущем примере.
Пример 23: Получение 4-[5-(4-трифторметилфенил)-1Н-[1,2,4]триазол-3-ил]-бензонитрила
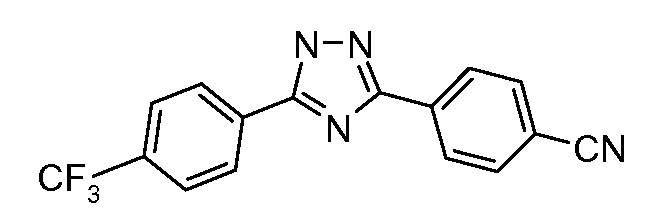
Терефталонитрил (115 мг, 0,90 ммоль), гидразид 4-трифторметилбензойной кислоты (92 мг, 0,450 ммоль), К2СО3 (31 мг, 0,225 ммоль), и н-бутиловый спирт (~2 мл) соединяют в 10-миллилитровой используемой в микроволновой печи реакционной ампуле от компании CEM, оснащенной магнитной мешалкой, и подвергают воздействию микроволнового излучения при 150°С в течение 30 минут. Затем содержимое фильтруют и концентрируют досуха. Хроматография (гексаны:этилацетат, 3:1) предоставляет 1,2,4-триазол-нитрил (72 мг, 0,230 ммоль, 51%).
Пример 24: Получение 4-[1-(3,4-дихлорфенил)-5-оксо-4,5-дигидро-1Н-[1,2,4]триазол-3-ил]-бензонитрила
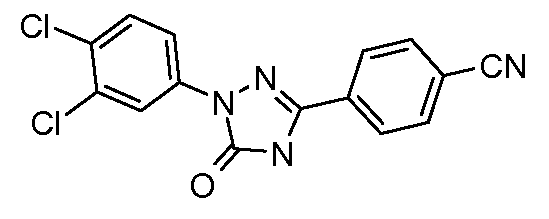
Стадия 1. 4-Цианофенил-оксо-уксусная кислота. В круглодонную колбу, оснащенную механической мешалкой и обратным холодильником загружают пара-цианоацетофенон (5 г, 34,44 моль), SeO2 (9,55 г,86,1 ммоль), и пиридин (~100 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 6 часов, после чего удаляют осадки фильтрацией и загружают в фильтрат 10%-ный водный раствор HCl (20 мл). Фильтрат экстрагируют в этилацетат (3×50 мл), и объединенные органические слои дополнительно экстрагируют в почти насыщенный раствор NaHCO3. Водный слой затем осторожно подкисляют (рН=1) концентрированной соляной кислотой, что дает небольшое количество желаемого продукта. Оставшуюся оксо-уксусную кислоту извлекают экстрагированием в этилацетат, сушкой (MgSO4), и концентрированием (1,69 г, 28%).
Стадия 2. 4-[1-(3,4-Дихлорфенил)-5-оксо-4,5-дигидро-1Н-[1,2,4]-триазол-3-ил]-бензонитрил. Суспензию 4-цианофенил-оксо-уксусной кислоты (100 мг, 0,571 ммоль), гидрохлорида (3,4-дихлорфенил)гидразина (122 мг, 0,571 ммоль), 12,1 N-ого раствора HCl (5 мкл, 0,057 ммоль), и воды (~10 мл) в 25-миллилитровой реакционной пробирке энергично перемешивают при температуре окружающей среды в течение 24 часов. Получают гидразон вакуумной фильтрацией и помещают в 100-миллилитровую круглодонную колбу с магнитной мешалкой. Затем в колбу добавляют триэтиламин (0,08 мл, 0,571 ммоль), дифенилфосфорилазид (157 мг, 0,571 ммоль), и толуол (20 мл), после чего нагревают при 110°С в течение 1 часа. После охлаждения содержимое разлагают 10%-ным водным раствором NaOH и подкисляют (рН 1) концентрированной соляной кислотой. Осадку дают осесть в течение 15 минут перед тем, как получать промежуточное соединение вакуумной фильтрацией и сушить в течение ночи в вакуумной печи при 45°С (16 мг, 8%).
Пример 25: Получение 4-[1-(4-Хлорфенил)-1Н-[1,2,3]триазол-4-ил]-бензонитрила
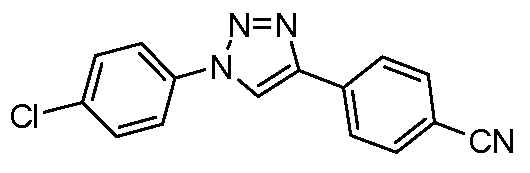
Следуя методике, опубликованной Feldman et al. (Org Lett. 2004, 6, 3897), суспензию 4-этинилбензонитрила (50 мг, 0,393 ммоль), 1-хлор-4-йодбензола (94 мг, 0.393 ммоль), L-пролина (9 мг, 0,079 ммоль), аскорбиновой кислоты (7 мг, 0,039 ммоль), NaN3 (31 мг, 0,472 ммоль), CuSO4 (3 мг, 0,020 ммоль), и Na2SO4 (11 мг, 0,079 ммоль) в диметилсульфоксиде (1,5 мл) греют при 65°С в течение 24 часов. После охлаждения смесь разбавляют водой и перемешивают в течение 30 минут при температуре окружающей среды. Затем промежуточный 4-[1-(4-хлорфенил)-1Н-[1,2,3]-триазол-4-ил]-бензонитрил (54 мг, 48%) получают вакуумной фильтрацией после промывания избыточными объемами воды и 20%-ого раствора NH4OH (~20 мл).
Пример 26: Получение 4-[5-(4-трифторметилфенил)-тетразол-2-ил]-бензальдегида
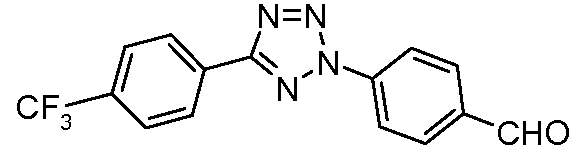
Этот альдегид получают из 4-трифторметилбензальдегида, следуя пути, описанному в публикации: Roppe et al. J. Med. Chem. 2004, 47, 4645.
Пример 27: Получение 4-[5-(4-трифторметоксифенил)-пиридин-3-ил]-бензальдегида
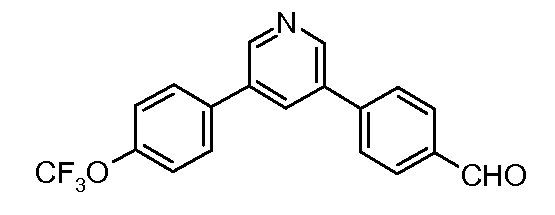
Стадия 1. 3,5-Дибромпиридин (4,4 ммоль), 4-трифторметоксифенил-бороновую кислоту (5,1 ммоль), тетракис(трифенилфосфин)палладий(0) (0,04 ммоль), 2 М-ный раствор карбоната калия (8,44 ммоль) и диоксан (21 мл) соединяют в пробирке и греют посредством микроволнового излучения в течение 10 минут при 150°С. Реакционную смесь смывают простым эфиром и промывают рассолом. Слой с простым эфиром сушат над сульфатом магния, фильтруют, и удаляют растворитель в вакууме. Сырую смесь подвергают очистке хроматографией на силикагеле, что дает 3-бром-5-(4-трифторметоксифенил)-пиридин (130 мг) в виде желтого твердого вещества:
1Н ЯМР (400 МГц, CDCl3) δ 8,71 (м, 2H), 8,00 (т, J=2,1 Гц, 1H), 7,58 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 317 (M+).
Стадия 2. Соединение получают путем катализируемого палладием арилирования продукта стадии 1 посредством 4-формилфенил-бороновой кислоты.
Пример 28: Получение 4-[4-(4-трифторметоксифенил)-пиридин-2-ил]-бензальдегида
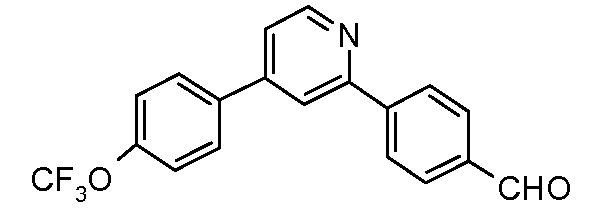
Стадия 1. Соединение получают путем катализируемого палладием арилирования 2-хлор-4-йодпиридина посредством 4-трифторметоксифенил-бороновой кислоты.
Стадия 2. 2-Хлор-4-(4-трифторметоксифенил)-пиридин (0,55 ммоль), полученный из 2-хлор-4-йодпиридина, 4-формилфенил-бороновую кислоту (0,82 ммоль), тетракис(трифенилфосфин)палладий(0) (0,005 ммоль), 2 М-ный раствор карбоната калия (0,55 мл) и диоксан (3 мл) соединяют в пробирке и облучают микроволнами в течение 15 минут при 150°С. Реакционную смесь смывают этилацетатом и промывают рассолом. Органический слой сушат над сульфатом магния, фильтруют, и удаляют растворитель в вакууме. Очистка хроматографией на силикагеле (этилацетат/гексаны) дает продукт (120 мг) в виде твердого вещества грязно-белого цвета:
1Н ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,81 (д, J=4,8 Гц, 1H), 8,24 (д, J=8,7 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,96 (м, 1H), 7,73 (д, J=9,0 Гц, 2H), 7,49 (дд, J=5,3, 1,8 Гц, 1H), 7,37 (д, J=8,1 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 343 (M+).
Пример 29: Получение 4-[6-(4-трифторметоксифенил)-пиридин-2-ил]-бензальдегида
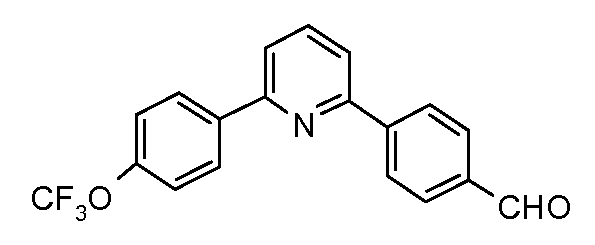
Стадия 1. 4-(6-Бромпиридин-2-ил)-бензальдегид (0,31 ммоль) получают так, как показано в публикации: Puglisi et al. Eur. J. Org. Chem. 2003, 8, 1552 - 1558.
Стадия 2. 4-[6-(4-Трифторметоксифенил)-пиридин-2-ил]-бензальдегид. 4-(6-Бром-пиридин-2-ил)-бензальдегид (0,31 ммоль), 4-трифторметоксифенил-бороновую кислоту (0,46 ммоль), тетракис(трифенилфосфин)палладий(0) (0,003 ммоль), 2М раствор карбоната калия (0,31 мл) и диоксан (2 мл) соединяют в пробирке и облучают микроволнами в течение 10 минут при 150°С. Реакционную смесь смывают простым эфиром и промывают рассолом. Органический слой сушат над сульфатом магния, фильтруют, и удаляют растворитель в вакууме. Очистка хроматографией на силикагеле (этилацетат/гексаны) дает продукт (80 мг) в виде твердого вещества грязно-белого цвета: температура плавления 109-112°С;
1Н ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,32 (д, J=8,5 Гц, 2H), 8,19 (д, J=8,1 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,89 (т, J=7,9 Гц, 1H), 7,79 (д, J=7,7 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,35 (д, J=8,3 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 343 (M+).
Пример 30: Получение 4-[6-(4-трифторметоксифенил)-пиримидин-4-ил]-бензальдегида
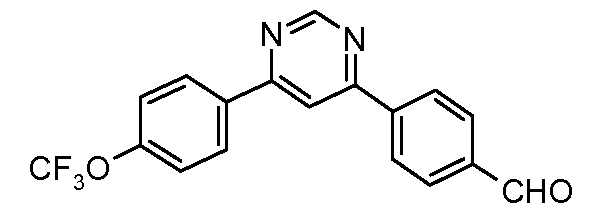
Стадия 1. 4-Хлор-6-(4-трифторметоксифенил)-пиримидин получают путем катализируемого палладием арилирования 4,6-дихлорпиримидина посредством 4-трифторметоксифенил-бороновой кислоты:
1Н ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,14 (д, J=9,8 Гц, 2H), 7,74 (м, 1H), 7,36 (д, J=8,4 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 274 (M+).
Стадия 2. Соединение получают путем катализируемого палладием арилирования продукта стадии 1 посредством 4-формилфенил-бороновой кислоты:
1Н ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1H), 9,38 (д, J=0,9 Гц, 1H), 8,33 (д, J=8,4 Гц, 2H), 8,23 (д, J=8,5 Гц, 2H), 8,16 (д, J=0,8 Гц, 1H), 8,08 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,1 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 31: Получение 4-[2-(4-трифторметоксифенил)-пиримидин-4-ил]-бензальдегида
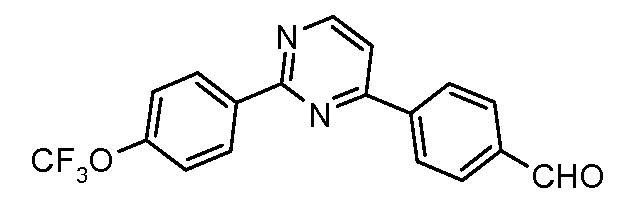
Стадия 1. 4-Хлор-2-(4-трифторметоксифенил)-пиримидин. Указанное в заглавии соединение получают путем катализируемого палладием арилирования 2,4-дихлорпиримидина посредством 4-трифторметоксифенил-бороновой кислоты: температура плавления 70-73°С;
1Н ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=5,6 Гц, 1H), 8,16 (д, J=9,1 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,36 (дд, J=9,2, 0,9 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 274 (M+).
Стадия 2. Соединение получают путем катализируемого палладием арилирования продукта стадии 1 посредством 4-формилфенил-бороновой кислоты:
1Н ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,91 (д, J=4,8 Гц, 1H), 8,74 (д, J=8,5 Гц, 2H), 8,28 (д, J=8,4 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,39 (д, J=8,6 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 32: Получение 4-[4-(4-трифторметоксифенил)-пиримидин-2-ил]-бензальдегида
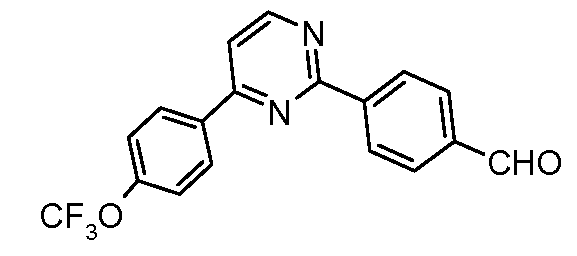
Стадия 1. 4-(4-Хлорпиримидин-2-ил)-бензальдегид. Соединение получают путем катализируемого палладием арилирования 2,4-дихлорпиримидина посредством 4-формилфенил-бороновой кислоты:
1H ЯМР ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,74 (д, J=5,0 Гц, 1H), 8,27 (д, J=7,8 Гц, 2H), 8,04 (д, J=7,9 Гц, 2H), 7,74 (м, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 218 (M+).
Стадия 2. Соединение получают путем катализируемого палладием арилирования продукта Стадии 1 посредством 4-трифторметоксифенил-бороновой кислоты:
1H ЯМР (400 МГц, CDCl3) δ 10,14 (с, 1H), 8,91 (д, J=4,2 Гц, 1H), 8,63 (д, J=8,5 Гц, 2H), 8,37 (д, J=8,4 Гц, 2H), 8,06 (д, J=8,8 Гц, 2H), 7,67 (д, J=5,4 Гц, 1H), 7,35 (д, J=8,7 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 33: Получение 4-[6-(4-трифторметоксифенил)-пиразин-2-ил]-бензальдегида
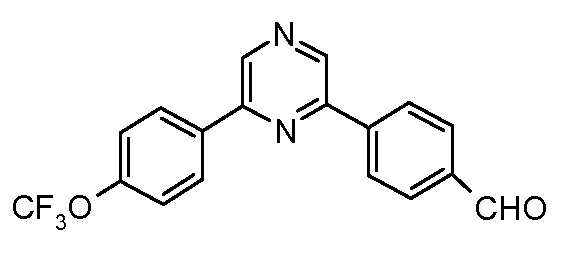
Стадия 1. 2-Хлор-6-(4-трифторметоксифенил)-пиразин. Соединение получают путем катализируемого палладием арилирования 2,6-дихлорпиразина посредством 4-трифторметоксифенил-бороновой кислоты: температура плавления 58-60°С;
1Н ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (с, 1H), 8,10 (д, J=9,0 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 274 (M+).
Стадия 2. Соединение получают путем катализируемого палладием арилирования продукта Стадии 1 посредством 4-формилфенил-бороновой кислоты:
1Н ЯМР (400 МГц, CDCl3) δ 10,13 с, 1H), 9,07 (с, 1H), 9,03 (с, 1H), 8,33 (д, J=8,1 Гц, 2H), 8,21 (д, J=8,7 Гц, 2H), 8,07 (д, J=7,6 Гц, 2H), 7,40 (д, J=8,3 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 34: Получение 4-[2-(4-трифторметоксифенил)-пиримидин-5-ил]-бензальдегида
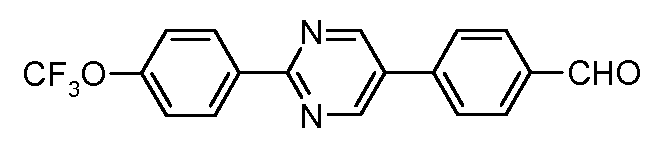
Стадия 1. 4-(2-Хлорпиримидин-5-ил)-бензальдегид. Соединение получают путем катализируемого палладием арилирования 2,5-дихлорпиримидина посредством 4-формилфенил-бороновой кислоты.
Стадия 2. 4-(2-Хлорпиримидин-5-ил)-бензальдегид (0,92 ммоль), 4-трифторметоксифенил-бороновую кислоту (1,10 ммоль), дихлорбис(трифенилфосфин)палладий(II) (0,01 ммоль), 2М раствор карбоната калия (0,92 мл) и диоксан (5 мл) соединяют в пробирке и облучают микроволнами в течение 10 минут при 150°С. Органический слой из реакционной смеси вводят непосредственно на диоксид кремния и сушат в вакууме. Очистка хроматографией на силикагеле (этилацетат/гексаны) дает продукт (140 мг) в виде твердого вещества белого цвета:
1Н ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 9,07 (с, 2H), 8,57 (д, J=9,0 Гц, 2H), 8,07 (д, J=8,5 Гц, 2H), 7,82 (д, J=8,3 Гц, 2H), 7,35 (д, J=8,3 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 35: Получение 4-[5-(4-трифторметоксифенил)-пиримидин-2-ил]-бензальдегида

Стадия 1. 2-Хлор-5-(4-трифторметоксифенил)-пиримидин. Соединение получают путем катализируемого палладием арилирования 2,5-дихлорпиримидина посредством 4-трифторметоксифенил-бороновой кислоты.
Стадия 2. 2-Хлор-5-(4-трифторметоксифенил)-пиримидин (4,22 ммоль), 4-формилфенил-бороновую кислоту (5,1 ммоль), дихлорбис(трифенилфосфин)палладий(II) (0,05 ммоль), 2М раствор карбоната калия (4,2 мл) и диоксан (21 мл) соединяют в пробирке и облучают микроволнами в течение 20 минут при 150°С. Органический слой из реакционной смеси вводят непосредственно в диоксид кремния и сушат в вакууме. Очистка хроматографией на силикагеле (этилацетат/гексаны) дает продукт (75 мг) в виде твердого вещества белого цвета:
1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,06 (с, 2H), 8,68 (д, J=8,8 Гц, 2H), 8,03 (д, J=8,3 Гц, 2H), 7,68 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,7 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 344 (M+).
Пример 36: Получение 4-гептафторпропил-6-(4-нитрофенил)-2-(4-трифторметилфенил)-пиримидина
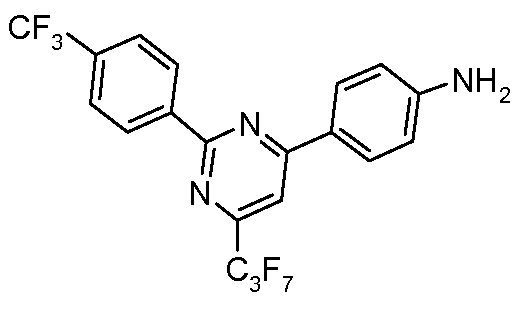
Стадия 1. 4-Гептафторпропил-6-(4-нитрофенил)-2-(4-трифторметилфенил)-пиримидин. Раствор 4-гептафторпропил-2-метилсульфанил-6-(4-нитрофенил)-пиримидина (1,20 г, 2,90 ммоль; полученного из 1-(4-нитрофенил)-4,4,5,5,6,6,6-гептафторгексан-1,3-диона в соответствии с публикацией Green et al. WO 200138311 A2), 4-трифторметилфенил-бороновую кислоту (0,608 г, 3,2 ммоль), трифурилфосфин (114 мг, 0,49 ммоль), и 2-тиофенкарбоксилат меди (II) (750 мг, 3,9 ммоль) соединяют в обезвоженном THF (15 мл) и нагревают до 50°С. Затем в течение 3 часов добавляют тремя порциями аддукт катализатора, трис(дибензилиденацетон)дипалладия(0), и хлороформа (60 мг, кат.), и затем раствор оставляют перемешиваться при 50°С в течение ночи. Концентрирование и хроматография (Biotage, гексан/дихлорметан, 5:1) предоставляют указанное в заглавии соединение (0,60 г, 40%) в виде твердого вещества светло-желтого цвета: температура плавления 191°C; EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 514 (M+H).
Стадия 2. 4-Гептафторпропил-6-(4-аминофенил)-2-(4-трифторметилфенил)-пиримидин. Раствор 4-гептафторпропил-2-(4-трифторметилфенил)-6-(4-нитрофенил)-пиримидина (0,18 г, 0,35 ммоль), порошка железа (0,20 г, 3,5 ммоль), сульфата аммония-железа(II) (0,15 г, 0,3 ммоль) в смеси этилового спирта/воды (3:1) греют на паровой бане в течение 3 часов. Затем его охлаждают, разбавляют диэтиловым эфиром (50 мл), фильтруют через целит Celite®, и концентрируют, что дает анилин в виде твердого вещества желтого цвета:
1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,18 (д, J=8 Гц, 2H), 7,90 (с, 1H), 7,80 (д, J=8 Гц, 2H), 6,82 (д, J=8 Гц, 2 H), 4,20 (с, 2H).
Пример 37: Получение 4-трифторметил-6-(4-аминофенил)-2-(4-трифторметилфенил)-пиримидина
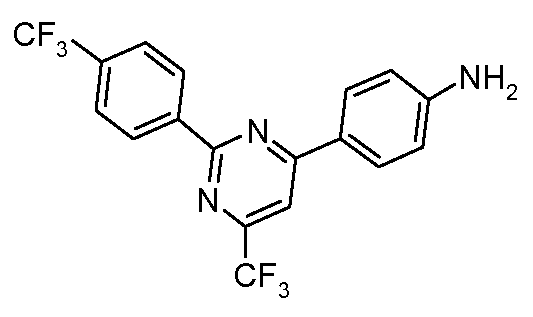
Стадия 1. 4-Трифторметил-6-(4-нитрофенил)-2-(4-трифторметилфенил)-пиримидин. Раствор 4-трифторметил-2-метилсульфонил-6-(4-нитрофенил)-пиримидина (1,25 г, 4,0 ммоль; полученного из 1-(4-нитрофенил)-4,4,4-трифторбутан-1,3-диона в соответствии с публикацией Green et al. WO 200138311 A2), 4-трифторметилфенил-бороновую кислоту (0,95 г, 5,0 ммоль), трифурилфосфин (140 мг, 0,60 ммоль), и 2-тиофенкарбоксилат меди (II) (1,05 г, 5,0 ммоль) соединяют в обезвоженном THF (25 мл) и нагревают до 52°С. Затем в течение 3 часов добавляют тремя порциями аддукт катализатора, трис(дибензилиденацетон)дипалладия(0), и хлороформа (100 мг), и затем раствор оставляют перемешиваться при 50°С в течение 12 часов. Концентрирование и хроматография (Biotage, гексан/дихлорметан, 4:1) предоставляют указанное в заглавии соединение (0,67 г, 41%) в виде твердого вещества светло-желтого цвета: температура плавления 162°C;
1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,41 (с, 4H), 8,03 (с, 1H), 7,80 (д, J=8 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 414 (M+H).
Стадия 2. 4-Трифторметил-6-(4-аминофенил)-2-(4-трифторметилфенил)-пиримидин. Раствор 4-трифторметил-2-(4-трифторметилфенил)-6-(4-нитрофенил)-пиримидина (0,50 г, 1,2 ммоль), порошка железа (0,50 г, 9 ммоль), сульфата аммония-железа(II) (0,5 г, 1,0 ммоль) в смеси(3:1) этилового спирта/воды (30 мл) греют на паровой бане в течение 3 часов. Затем его охлаждают, разбавляют диэтиловым эфиром (50 мл), фильтруют через целит Celite®, и концентрируют. Сырой амин очищают на колонке Biotage (гексаны/этилацетат/дихлорметан, 4:1:1), что дает чистый анилин (0,22 г). Это вещество используют непосредственно в образовании соответствующего карбамата:
1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,16 (д, J=8 Гц, 2H), 7,81 (с, 1H), 7,77 (д, J=8 Гц, 2H), 6,82 (д, J=8 Гц, 2H), 4,15 (с, 2H).
Пример 38: Получение 4-[2-(4-трифторметилфенил)-пиримидин-4-ил]-фениламина
Стадия 1. 4-(4-Нитрофенил)-2-(4-трифторметилфенил)-пиримидин. К металлическому натрию (82,7 мг, 3,60 ммоль), растворенному в абсолютном этиловом спирте (3 мл) добавляют дигидрат 4-трифторметилбензамидин-гидрохлорида (938 мг, 3,60 ммоль), после этого добавляют этиловый спирт (4 мл). По истечении 30 минут, добавляют 3-диметиламино-1-(4-нитрофенил)-пропенон (498 мг, 2,26 ммоль), и смесь нагревают при кипячении с обратным холодильником приблизительно 66 часов, и затем оставляют охлаждаться. Смесь концентрируют до получения твердого вещества рыжевато-коричневого цвета, которое растирают в порошок с насыщенным раствором бикарбоната натрия. Твердое вещество собирают и сушат на воздухе, что дает 937 мг. Затем его растворяют в смеси хлороформа/этилацетата и пропускают через силикагель с элюированием смесью хлороформ/этилацетат, что дает указанное в заглавии соединение (710 мг, 91%): температура плавления 175-176,5°С;
1Н ЯМР δ 9,01 (д, J=5,3 Гц, 1H), 8,73 (д, J=8,2 Гц, 2H), 8,43 (с, 4H), 7,82 (д, J=8,1 Гц, 2H), 7,76 (д, J=5,2 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 345 (M+, 100), 299 (57). Анализ: Вычислено для C17H10F3N3O2: C, 59,13; H, 2,92; N, 12,17. Найдено: С, 58,82; Н, 2,63; N, 11,98.
Стадия 2. 4-[2-(4-Трифторметилфенил)-пиримидин-4-ил]-фениламин. Смесь 4-(4-нитрофенил)-2-(4-трифторметил-фенил)-пиримидина (670 мг, 1,94 ммоль) и 10% палладиевого катализатора на углеродном носителе (Pd/C) (75 мг) в этиловом спирте (30 мл) помещают на встряхиватель Parr при давлении водорода 40 фунт/кв.дюйм при комнатной температуре. По истечении 7 часов смесь фильтруют через целит Celite®, и удаляют этиловый спирт в вакууме. Осадок распределяется между этилацетатом и насыщенным раствором NaHCO3, и органическая фаза подвергается сушке (MgSO4). Концентрирование дает твердое вещество, которое растворяют в этилацетате и фильтруют через пробку из силикагеля. Концентрирование дает указанное в заглавии соединение (500 мг, 82%): температура плавления 166-167°С;
1H ЯМР δ 8,75 (д, J=5,30 Гц, 1H), 8,67 (д, J=8,3 Гц, 2H), 8,10 (д, J=8,9 Гц, 2H), 7,75 (д, J=7,9 Гц, 2H), 7,54 (д, J=5,3 Гц, 1H), 6,80 (д, J=8,6 Гц, 2H), 4,03 (шир.с, 2H);
MS (API-ES+) (Масс-спектрометрия с химической ионизацией при атмосферном давлении и ионизацией электрораспылением) 316 (M+H)+, 100). Анализ: Вычислено для C17H12F3N3: C, 64,76; H, 3,84; N, 13,33. Найдено: С, 64,37; Н, 3,71; N, 13,08.
Пример 39: Получение 2-хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]-фениламина
Стадия 1. 1-(3-Хлор-4-нитрофенил)-3-(4-трифторметил-фенил)-1Н-[1,2,4]триазол. Раствор NBS (180 мг, 1 ммоль) в дихлорметане (4 мл) перемешивают в атмосфере азота при 0°С, и в то же время шприцом добавляют диметилсульфид (110 мг, 1,8 ммоль). Раствор, который принимает вид твердого вещества белого цвета, затем охлаждают до -20°С, и добавляют (N-(3-хлор-4-нитрофенил)-N'-(4-трифторметил-бензилиден)-гидразин (200 мг, 0,58 ммоль) в дихлорметане (4 мл). Раствор оставляют нагреться до температуры окружающей среды и перемешивают в течение дополнительных 2 часов. Затем получающийся в результате раствор оранжевого цвета разбавляют дихлорметаном (25 мл) и промывают водой и рассолом перед тем, как сушить и концентрировать. Получающийся в результате оранжевый твердый гидразонил-бромид (150 мг) затем обрабатывают непосредственно тетразолом (25 мг, 0,35 ммоль) и триэтиламином (50 мкл, 0,35 ммоль) в абсолютном этиловом спирте (5 мл). Получающийся в результате раствор оранжево-коричневого цвета греют при кипячении с обратным холодильником в течение 2 часов. Анализ методом тонкослойной хроматографии (TLC) показывает, что первоначальный бромид сначала превращается в два промежуточных соединения желтого цвета, которые затем исчезают и заменяются одним, бесцветным пятном. Раствор оранжевого цвета затем разбавляют водой (10 мл), с получением твердого вещества рыжевато-коричнево-желтого цвета, которое фильтруют, сушат на воздухе, и перекристаллизовывают из толуола, что дает твердое вещество желто-рыжевато-коричневого цвета (60 мг): температура плавления 185°С;
1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,41 (д, J=8,7 Гц, 1H), 8,33 (д, J=7,5 Гц, 2H), 7,90 (д, J=2 Гц, 1H), 7,70 (д, J=7,5 Гц, 2H), 7,65 (дд, J=8,7, 2 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 368,9. Анализ: Вычислено для C15H8ClF3N4O2: C, 48,86; H, 2,19; N, 15,20. Найдено: С, 48,39; Н, 2,61; N, 14,91.
Стадия 2. 2-Хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]-фениламин. Раствор нитрофенильного производного (0,75 г, 2,0 ммоль) в метиловом спирте (7 мл) и воде (3 мл) обрабатывают порошком железа (0,7 г, 12,5 ммоль) и сульфатом аммония-железа(III) (гексагидрат; 0,7 г, 1,8 ммоль). Раствор нагревают на паровой бане в течение 3 часов, после чего анализ методом тонкослойной хроматографии показывает полное превращение в более полярный, флуоресцентный продукт. Раствор охлаждают и фильтруют, и фильтрат концентрируют в вакууме. Очистка хроматографией с использованием короткой пробки из силикагеля (гексан/этилацетат/дихлорметан, 7:2:1) дает амин (0,55 г) в виде твердого вещества светло-рыжевато-коричневого цвета: температура плавления 148°С;
1H ЯМР (300 МГц, CDCl3) δ 8,40 (с, 1H), 8,31 (д, J=8,4 Гц, 1H), 7,72 (д, J=8,4 Гц, 2H), 7,69 (д, J=2 Гц, 1H), 7,42 (дд, J=8,5, 2 Гц, 1H), 6,9 (д, J=8,4 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 340,4, 342,3 (М+Н). Анализ: Вычислено для C15H10ClF3N4: C, 53,19; H, 2,98; N, 16,83. Найдено: С, 52,90; Н, 3,10; N, 16,83.
Пример 40: Получение 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина
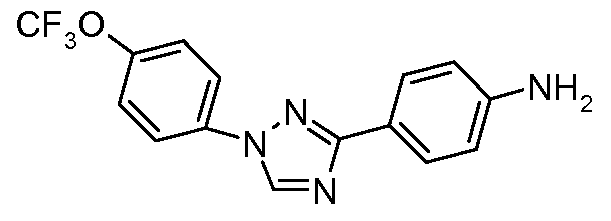
Стадия 1. 1-(4-Трифторметоксифенил)-3-(4-нитрофенил)-1Н-[1,2,4]триазол. Раствор NBS (0,70 г, 3,9 ммоль) в дихлорметане (25 мл) перемешивают в атмосфере азота при 0°С, и в то же время шприцом добавляют диметилсульфид (0,40 г, 6,5 ммоль). Раствор, который принимает вид твердого вещества белого цвета, затем охлаждают до -20°С, и добавляют N-(4-нитробензилиден)-N'-(4-трифторметоксифенил)-гидразин (0,70 г, 2,15 ммоль) в дихлорметане (10 мл). Раствор оставляют нагреться до температуры окружающей среды и перемешивают в течение дополнительных 2 часов. Затем получающийся в результате раствор оранжевого цвета разбавляют дихлорметаном (25 мл) и промывают водой и рассолом перед тем, как сушить и концентрировать. Получающийся в результате оранжевый твердый гидразонил-бромид (0,9 г) затем обрабатывают непосредственно тетразолом (154 мг, 2,2 ммоль) и триэтиламином (280 мкл, 0,23 ммоль) в абсолютном этиловом спирте (5 мл). Получающийся в результате раствор оранжево-коричневого цвета греют при кипячении с обратным холодильником в течение 2 часов. Анализ методом тонкослойной хроматографии (TLC) показывает то, что исходный бромид сначала превращается в два промежуточных соединения желтого цвета, которые заменяются одним, бесцветным пятном. Раствор оранжевого цвета затем концентрируют и очищают хроматографией (гексаны/этилацетат/дихлорметан, 2:1:2), с получением указанного в заглавии соединения (0,30 г) в виде твердого вещества светло-желтого цвета: температура плавления 147°С;
1H ЯМР (300 МГц, CDCl3) δ 8,68 (с, 1H), 8,40 (д, J=5 Гц, 2H), 8,35 (д, J=5 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=8 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 350 (M+, 100), 299 (57).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламин. Каталитическое восстановление с использованием палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте в атмосфере водорода дает соответствующий анилин в виде твердого вещества светло-серого цвета: температура плавления 160°C;
1H ЯМР (300 МГц, CDCl3) δ 8,50 (с, 1H), 8,00 (д, J=8,4 Гц, 2H), 7,78 (д, J=8,7 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 6,76 (д, J=8,7 Гц, 2H), 3,9 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 321.
Пример 41: Получение 4-[1-(4-пентафторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина
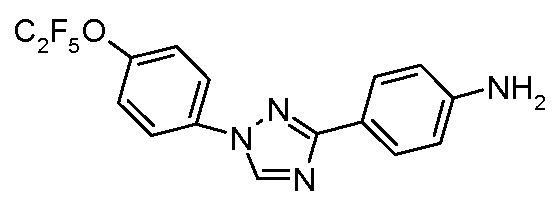
Стадия 1. 1-(4-Пентафторэтилоксифенил)-3-(4-нитрофенил)-1Н-[1,2,4]триазол. Суспензию 3-(4-нитрофенил)триазола (11,4 г, 60 ммоль), 1-йод-4-пентафторэтоксибензола (20 г, 60 ммоль), карбоната цезия (39,0 г, 120 ммоль), CuI (3,5 г, 18 ммоль), 8-гидроксихинолина (2,0 г, 13,8 ммоль) и смеси DMF-H2O (9:1, 155 мл) греют при 150°С в течение 5 часов и затем охлаждают. Содержимое круглодонной колбы выливают в воду (150 мл) и экстрагируют диэтиловым эфиром (2×100 мл). Органический слой сушат и концентрируют, и твердый остаток перекристаллизовывают из метилового спирта и воды, что дает нитротриазол (11,8 г, 49%) в виде твердого вещества рыжевато-коричневого цвета: температура плавления 170-175°C;
1H ЯМР (300 МГц, CDCl3) δ 8,68 (с, 1H), 8,40 (д, J=5 Гц, 2H), 8,35 (д, J=5 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=5,2 Гц, 8 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 400 (М+).
Стадия 2. 4-[1-(4-Пентафторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламин. Каталитическое восстановление с использованием палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте в атмосфере водорода дает соответствующий анилин в виде твердого вещества светло-рыжевато-коричневого цвета: температура плавления 160°C;
1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,00 (д, J=1 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 6,78 (д, J=8 Гц, 2H), 3,9 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 371.
Пример 42: Получение 4-[1-(4-гептафторпропилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина
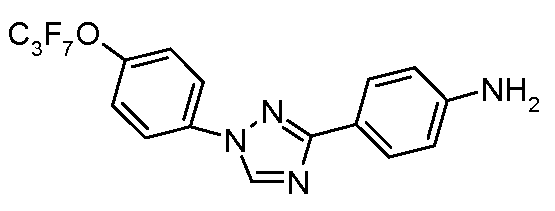
Стадия 1. 1-(4-Гептафторпропилоксифенил)-3-(4-нитрофенил)-1Н-[1,2,4]триазол. Суспензию 3-(4-нитрофенил)триазола (1,0 г, 5,2 ммоль), 1-йод-4-гептафторпропилоксибензола (6,1 г, 15,8 ммоль), карбоната цезия (10,0 г, 30,7 ммоль), CuI (900 мг, 4,7 ммоль), и 8-гидроксихинолина (500 мг, 3,4 ммоль) в смеси DMF-H2O (9:1, 40 мл) греют при 150°С в течение 12 часов, затем охлаждают, и содержимое круглодонной колбы выливают в воду (50 мл) и в концентрированный раствор NH4OH (50 мл). Раствор голубого цвета экстрагируют диэтиловым эфиром (100 мл), и органический слой отделяют и фильтруют с удалением некоторой части нерастворимого вещества, затем сушат и концентрируют досуха. Твердый остаток перекристаллизовывают из смеси метилового спирта/воды, с предоставлением нитрофенил-триазола (4,69 г) в виде твердого вещества светло-рыжевато-коричневого цвета: температура плавления 114-116°C;
1H ЯМР (300 МГц, CDCl3) δ 8,66 (с, 1H), 8,40 (м, 4H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=8 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 450,1 (М+).
Стадия 2. 4-[1-(4-Гептафторпропилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламин. Каталитическое восстановление в условиях, описанных выше, дает соответствующий анилин в виде твердого вещества светло-рыжевато-коричневого цвета: температура плавления 181-183°C;
1H ЯМР (300 МГц, CDCl3) δ 8,54 (с, 1H), 8,00 (д, J=8 Гц, 2H), 7,80 (д, J=8 Гц, 2H), 7,40 (д, J=8 Гц, 2H), 6,78 (д, J=8 Гц, 2H), 3,9 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 421,3 (М+1).
Пример 43: Получение 4-[4-(4-трифторметилфенил)-имидазол-1-ил]-фениламина
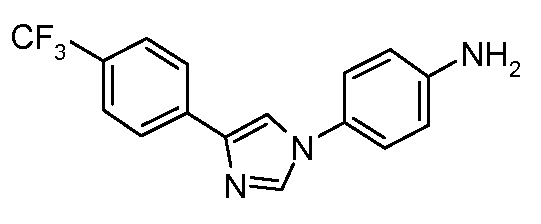
Стадия 1. 4-[4-(4-Трифторметилфенил)-1Н-имидазол-1-ил]-нитробензол. 4-Трифторметилфенил-имидазол (1,43 г, 6,7 ммоль), 4-фтор-нитробензол (1,2 г, 8,5 ммоль) и карбонат калия (1,5 г, 10,9 ммоль) соединяют в диметилфорамиде (15 мл) и греют при 100°С в течение 6 часов. Охлажденный раствор затем выливают на воду (100 мл), и получающееся в результате твердое вещество отфильтровывают и сушат на воздухе, что дает указанный в заглавии имидазол (1,0 г) в виде твердого вещества светло-желтого цвета: температура плавления 197°С. Анализ: Вычислено для C16H10F3N3O2: C, 57,66; H, 3,02; N, 12,61. Найдено: С, 57,69; Н, 3,01; N, 12,48.
Стадия 2. 4-[4-(4-Трифторметилфенил)-имидазол-1-ил]-фениламин. Каталитическое восстановление с использованием палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте в атмосфере водорода дает соответствующий анилин в виде твердого вещества светло-серого цвета: температура плавления 142-143°С;
1H ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=1 Гц, 2H), 7,75 (с, 1H), 7,65 (д, J=1 Гц, 2H), 7,52 (с, 1H), 7,19 (д, J=8 Гц, 2H), 6,75 (д, 8 Гц, 2H), 3,8 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 302,0.
Пример 44: Получение 4-[1-(4-трифторметилфенил)-1Н-имидазол-4-ил]-фениламина
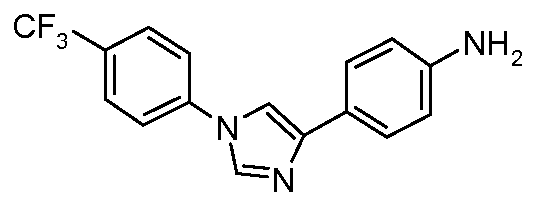
Стадия 1. 4-[4-(4-Трифторметилфенил)-1Н-имидазол-1-ил]-нитробензол. Получают так же, как на стадии 1 предыдущего примера.
Стадия 2. 4-[1-(4-Трифторметилфенил)-1Н-имидазол-4-ил]-фениламин. Каталитическое восстановление с использованием палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте в атмосфере водорода дает соответствующий анилин в виде твердого вещества светло-серого цвета: температура плавления 191°C;
1H ЯМР (400 МГц, CDCl3) δ 7,92 (с, 1H), 7,76 (д, J=8 Гц, 2H), 7,66 (д, J=4,5 Гц, 2H), 7,55 (с, 1H), 6,75 (д, J=4,5 Гц, 2H), 3,8 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 304,0. Анализ: Вычислено для C16H12F3N3: C, 63,36; H, 3,99; N, 13,85. Найдено: С, 63,14; Н, 4,07; N, 13,52.
Пример 45. Получение 4-[1-(4-трифторметоксифенил)-1Н-имидазол-4-ил]-фениламина
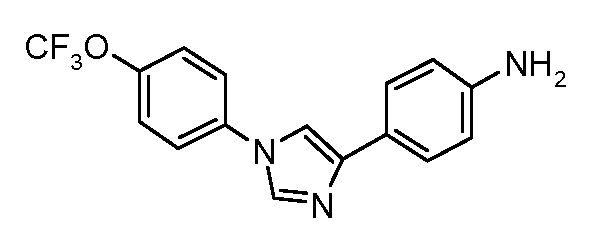
Стадия 1. 4-(4-Нитрофенил)-1-[4-трифторметоксифенил)-1Н-имидазол. Условия, описанные в публикации: Porretta et al. Farmaco, Edizione Scientifica 1985, 40, 404, используют для превращения 4-трифторметоксианилина (5,3 г, 30 ммоль) и α-бром-4-нитроацетофенона (3,7 г, 15 ммоль) в имидазол (2,1 г, 41%).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1Н-имидазол-4-ил]-фениламин. Каталитическое восстановление с использованием палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте в атмосфере водорода дает соответствующий анилин в виде твердого вещества светло-серого цвета: температура плавления 167°C;
1H ЯМР (300 МГц, CDCl3) δ 7,83 (с, 1H), 7,64 (д, J=4,8 Гц, 2H), 7,47 (д, J=4,4 Гц, 2H), 7,40 (с, 1H), 7,36 (д, J=4,8 Гц, 2H), 6,75 (д, J=4,4 Гц, 2H), 3,5 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 320. Анализ: Вычислено для C16H12F3N3O: C, 60,19; H, 3,79; N, 13,16. Найдено: С, 59,91; Н, 3,67; N, 13,03.
Пример 46. Получение 4-(4-аминофенил)-2-[4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-она
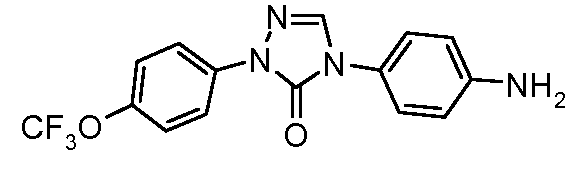
Стадия 1. 4-(4-Нитрофенил)-2-(4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-он. Указанное в заглавии соединение получают в соответствии с методикой публикации: Henbach, DE 2724891 A1, 1978, с модификациями, касающимися проведения в три стадии: В дополнение к анилину, 4-нитроанилин используют вместо 3,5-дихлоранилина, и обезвоженный THF используют в качестве растворителя вместо толуола. В образовании триазолинонового кольца, используют трифосген (0,65 экв.) вместо фосгена: температура плавления 136-140°С;
1H ЯМР (300 МГц, CDCl3) δ 8,40 (д, J=8,8 Гц, 2H), 8,05 (д, J=8,8 Гц, 2H), 7,99 (с, 1H), 7,89 (д, J=9,3 Гц, 2H), 7,32 (д, J=9,3 Гц, 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 367 (M+H).
Стадия 2. 4-(4-Аминофенил)-2-(4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-он. Нитрофенил-триазолинон (0,037 г, 0,10 ммоль) растворяют в абсолютном этиловом спирте (1 мл) в атмосфере азота. К этому добавляют дигидрат хлорида олова(II) (0,114 г, 0,51 ммоль), и смесь перемешивают при кипячении с обратным холодильником в течение 2 часов. Смесь охлаждают до 25°С, выливают на смесь лед-H2O (25 мл), и водную смесь доводят до рН 9-10 посредством 1N раствора NaOH. Смесь экстрагируют диэтиловым эфиром (3×25 мл), и объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют досуха, что дает твердое вещество темно-коричневого цвета (0,0297 г, 87%), которое используют без дополнительной очистки: температура плавления 115-120°С;
1H ЯМР (300 МГц, CDCl3) δ 8,07 (д, J=9,7 Гц, 2H), 7,73 (с, 1H), 7,32-7,23 (м, 4H), 6,77 (д, J=8,5 Гц, 2H), 3,85 (шир., 2H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 336 (M+).
Пример 47: Получение 4-[5-(4-трифторметилфенил)-4,5-дигидро-изоксазол-3-ил]-фениламина
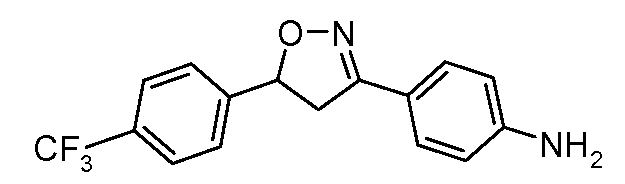
Стадия 1. Трет-бутиловый сложный эфир {4-[5-(4-трифторметилфенил)-4,5-дигидро-изоксазол-3-ил]-фенил}-карбаминовой кислоты. К перемешанному раствору NCS (57 мг, 0,424 ммоль) и пиридина (3 мкл) в хлороформе (1,7 мл) добавляют оксим 4-N-трет-бутоксикарбонил-аминобензальдегида (100 мг, 0,424 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Затем добавляют 4-трифторметилстирол (78 мкл, 0,53 ммоль), и температуру повышают до 45°С. К этому раствору добавляют по каплям триэтиламин (62 мкл, 0,445 ммоль), растворенный в хлороформе (0,5 мл). Реакционную смесь перемешивают при 45°С в течение 5 часов. Охлажденный раствор разбавляют хлороформом (10 мл) и промывают водой (2×5 мл). Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют, что дает изоксазолин (100 мг, 58%):
1H ЯМР (400 МГц, CDCl3) δ 7,40-7,83 (м, 8H), 6,60 (шир.с, 1H), 5,76 (дд, J=11,0, 7,7 Гц, 1H), 3,81 (дд, J=16,5, 11,0 Гц, 1H), 3,29 (дд, J=16,5, 7,7 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 406 (М+).
Стадия 2. 4-[5-(4-Трифторметилфенил)-4,5-дигидро-изоксазол-3-ил]-фениламин. К перемешанному раствору N-бутоксикарбонил-изоксазолина (полученного на стадии 1) в дихлорметане (2,5 мл) добавляют трифторуксусную кислоту (6,16 мл), и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Раствор концентрируют, и остаток смывают насыщенным раствором KHCO3 (5 мл) и перемешивают в течение 30 минут. Затем смесь экстрагируют дихлорметаном (3×10 мл). Органическую фазу сушат над MgSO4, фильтруют и концентрируют с предоставлением предполагаемого анилина (68 мг, 90%):
1H ЯМР (400 МГц, CDCl3) δ 7,45-7,63 (м, 6H), 6,67 (д, J=8,6 Гц, 2H), 5,72 (дд, J=10,9, 7,6 Гц, 1H), 3,92 (шир.с, 2H), 3,78 (дд, J=16,7, 10,9 Гц, 1H), 3,25 (дд, J=16,7, 7,6 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 306 (М+).
Пример 48: Получение 4-[3-(4-трифторметоксифенил)-4,5-дигидро-изоксазол-5-ил]-фениламина
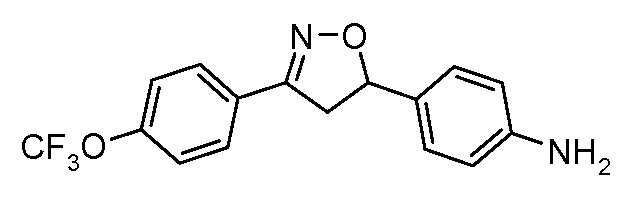
К перемешанному раствору NCS (85 мкл, 0,634 ммоль) и пиридина (4 мкл) в хлороформе (2,5 мл) добавляют оксим пара-трифторметоксибензальдегида (130 мг, 0,634 ммоль). Реакционную смесь греют при 50°С в течение 3 часов. Затем добавляют 4-аминостирол (93 мкл, 0,793 ммоль), после этого добавляют по каплям раствор триэтиламина (93 мкл, 0,666 ммоль), растворенный в хлороформе (0,5 мл). Реакционную смесь перемешивают при 50°С в течение 3 часов. Охлажденный раствор разбавляют хлороформом (15 мл) и промывают водой (2×10 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток очищают радиальной хроматографией с использованием раствора гексан/этилацетат (2:1) в качестве элюента (Rf=0,18) с предоставлением 4-[3-(4-трифторметоксифенил)-4,5-дигидро-изоксазол-5-ил]-фениламина (125 мг; 61%):
1H ЯМР (400 МГц, CDCl3) δ 7,73 (д, J=8,2 Гц, 2H), 7,25 (д, J=8,2 Гц, 2H), 7,17 (д, J=8,2 Гц, 2H), 6,68 (д, J=8,2 Гц, 2H), 5,65 (дд, J=10,9, 8,9 Гц, 1H), 3,55-3,75 (шир.с, 2H), 3,67 (дд, J=16,8, 10,9 Гц, 1H), 3,30 (дд, J=16,8, 8,9 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 322 (М+).
Пример 49: Получение 1-(4-аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она
Эти соединения получают в соответствии с методикой, описанной в публикации: Bromidge et al. WO 2003057220 A1, с незначительными модификациями.
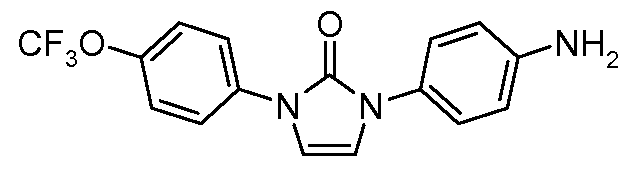
Стадия 1. (2,2-Диметоксиэтил)-(4-трифторметоксифенил)амин. К перемешанному раствору 4-трифторметоксианилина (1 мл, 7,46 ммоль) и диметилацеталя глиоксальдегида (60% (объем/объем) в воде; 8,95 ммоль, 1,6 мл) в этиловом спирте (37 мл) добавляют 10% палладиевый катализатор на углеродном носителе (Pd/С, 300 мг). Смесь вакуумируют и продувают азотом три раза. Затем в устройство в виде баллона вводят водород, и смесь перемешивают под давлением водорода в 1 атмосферу в течение 31 часа. Смесь фильтруют через слой целита Celite®, и слой промывают этиловым спиртом (25 мл). Этанол удаляют при пониженном давлении, и остаток разбавляют дихлорметаном (30 мл). Слои разделяют, и органическую фазу сушат над MgSO4, фильтруют и концентрируют, что дает (2,2-диметоксиэтил)-(4-трифторметоксифенил)амин (1,7 г, 86%):
1H ЯМР (400 МГц, CDCl3) δ 7,04 (д, J=8,9 Гц, 2H), 6,59 (д, J=8,9 Гц, 2H), 4,56 (т, J=5,4 Гц, 1H), 3,92 (шир.с, 1H), 3,51 (д, J=5,4 Гц, 2H), 3,42 (с, 6H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 265 (М+).
Стадия 2. 1-(2,2-Диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)-мочевина. К перемешанному раствору (2,2-диметоксиэтил)-(4-трифторметоксифенил)амина (0,85 г, 3,2 ммоль), растворенного в дихлорметане (32 мл), добавляют пара-нитрофенил-изоцианат (0,58 г, 3,53 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют дихлорметаном (50 мл) и промывают последовательно раствором NaHCO3 (30 мл) и рассолом (30 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора гексан/этилацетат (2:1) в качестве элюента (Rf=0,32) с предоставлением 1-(2,2-диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)-мочевины (0,87 г, 63%):
1H ЯМР (400 МГц, CDCl3) δ 8,15 (д, J=9,2 Гц, 2H), 7,50-7,30 (м, 6H), 7,02 (шир.с, 1H), 4,65 (т, J=5,4 Гц, 1H), 3,82 (д, J=5,4 Гц, 2H), 3,41 (с, 6H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 429 (М+).
Стадия 3. 1-(4-Нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-он. К перемешанному раствору 1-(2,2-диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)-мочевины (0,23 г, 0,53 ммоль), растворенной в толуоле (28 мл), добавляют концентрированную соляную кислоту (2 капли). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 3 часов. Охлажденный раствор разбавляют этилацетатом (75 мл) и промывают насыщенным раствором NaHCO3 (25 мл) и рассолом (25 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора гексан/этилацетат (2:1) в качестве элюента (Rf=0,28) с предоставлением 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (134 мг, 71%):
1H ЯМР (400 МГц, CDCl3) δ 8,35 (д, J=9,2 Гц, 2H), 7,93 (д, J=9,2 Гц, 2H), 7,67 (д, J=9,2 Гц, 2H), 7,34 (д, J=9,2 Гц, 2H), 6,87 (д, J=3,3 Гц, 1H), 6,81 (д, J=3,3 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 365 (М+).
Стадия 4. 1-(4-Аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидро-имидазол-2-он. К перемешанному раствору 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (120 мг, 0,33 ммоль) в этилацетате (3,5 мл) добавляют дихлорид олова (371 мг, 1,64 ммоль), и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 3 часов. Охлажденный раствор выливают на лед (15 мл), и рН корректируют с доведением до значения рН 7-8 путем добавления 10%-ого раствора NaHCO3. Смесь экстрагируют этилацетатом (3×10 мл) и промывают рассолом (10 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют с получением 1-(4-аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (102 мг, 92%):
1H ЯМР(400 МГц, CDCl3) δ 7,72 (д, J=8,8 Гц, 2H), 7,37 (д, J=8,8 Гц, 2H), 7,32 (д, J=8,8 Гц, 2H), 6,76 (д, J=8,8 Гц, 2H), 6,69 (д, J=3,3 Гц, 1H), 6,65 (д, J=3,3 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 335 (М+).
Пример 50: Получение 1-(4-аминофенил)-3-(4-трифторметоксифенил)-имидазолидин-2-она
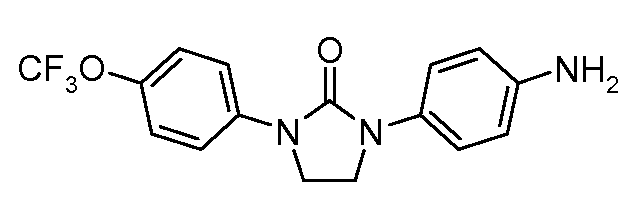
К раствору 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (144 мг, 0,395 ммоль) в этиловом спирте (40 мл) добавляют 10%-ный палладиевый катализатор на углеродном носителе (Pd/C, 100 мг). Смесь вакуумируют и продувают азотом три раза. В сосуде Парра создают давление водорода 45 фунт/кв.дюйм и встряхивают в течение 5 часов. После снижения давления в сосуде раствор фильтруют через слой целита Celite®, и слой промывают этиловым спиртом (25 мл). Этанол удаляют при пониженном давлении с предоставлением указанного в заглавии продукта (114 мг, 95%):
1H ЯМР (400 МГц, CDCl3) δ 7,61 (д, J=9,2 Гц, 2H), 7,33 (д, J=9,2 Гц, 2H), 7,21 (д, J=8,6 Гц, 2H), 6,71 (д, J=9,2 Гц, 2H), 3,92 (с, 4H), 3,61 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 307 (М+).
Пример 51: Получение 4-[6-(4-трифторметоксифенил)-пиридазин-3-ил]-фениламина
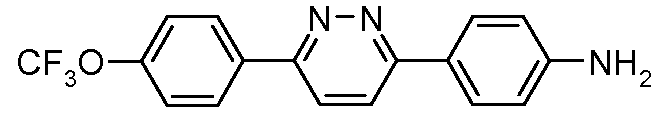
Стадия 1. 3-Хлор-6-(4-трифторметоксифенил)-пиридазин. К раствору, содержащему 3,6-дихлорпиридазин (0,3 г, 2,01 ммоль), 4-трифторметоксифенил-бороновую кислоту (0,50 г, 2,42 ммоль) и 2 М K2CO3 (2 мл, 4,03 ммоль), растворенные в обезвоженном 1,4-диоксане (11 мл), добавляют дихлорбис(трифенилфосфин)палладий(II) (14 мг, 0,02 ммоль). Смесь подвергают облучению микроволнами с использованием системы Discover фирмы CEM при 190°С в течение 30 минут. Смесь разбавляют диэтиловым эфиром (100 мл) и промывают рассолом (30 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора гексан/этилацетат (3:1) в качестве элюента. Выделяют две фракции. Первая фракция (Rf=0,63), как было показано, является продуктом двойной реакции Сузуки (95 мг, 12%). Выделенную вторую фракцию (Rf=0,34) идентифицируют как 3-хлор-6-(4-трифторметоксифенил)-пиридазин (174 мг, 32%):
1H ЯМР (400 МГц, CDCl3) δ 8,10 (д, J=9,2 Гц, 2H), 7,83 (д, J=8,9 Гц, 2H), 7,60 (д, J=8,9 Гц, 2H), 7,37 (д, J=9,2 Гц, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 274 (М+).
Стадия 2. 4-[6-(4-Трифторметоксифенил)-пиридазин-3-ил]-фениламин. К раствору, содержащему 3-хлор-6-(4-трифторметоксифенил)-пиридазин (157 мг, 0,57 ммоль), 4-аминофенилбороновую кислоту (118 мг, 0,86 ммоль) и 2 М К2СО3 (0,57 мл, 1,14 ммоль), растворенные в обезвоженном 1,4-диоксане (3,5 мл), добавляют дихлорбис(трифенилфосфин)палладий(II) (4 мг, 0,006 ммоль). Смесь подвергают облучению микроволнами с использованием системы Discover фирмы CEM при 190°С в течение 30 минут. Смесь разбавляют диэтиловым эфиром (100 мл) и промывают рассолом (30 мл). Затем органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора трихлорметан/метиловый спирт (97:3) в качестве элюента (Rf = 0,26) с предоставлением указанного в заглавии соединения (105 мг, 56%):
1H ЯМР (400 МГц, CDCl3) δ 8,18 (д, J=8,6 Гц, 2H), 8,01 (д, J=8,6 Гц, 2H), 7,30-7,45 (м, 4H), 6,82 (д, J=8,6 Гц, 2H), 3,96 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 331 (М+).
Пример 52: Получение 4-[3-(4-трифторметоксифенил)-4,5-дигидро-[1,2,4]оксадиазол-5-ил]-бензальдегида
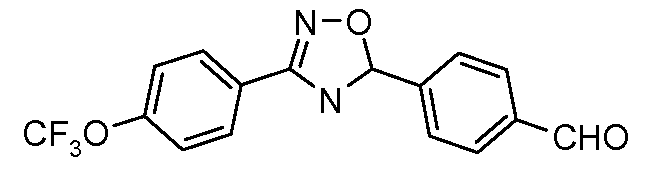
Соединение получают в соответствии с общей методикой публикации: Srivastava et al. J. Heterocycl. Chem. 1987, 24, 101, с незначительными модификациями. К перемешанному раствору 4-(трифторметокси)бензамидоксима (Acros) (300 мг, 1,36 ммоль), растворенного в уксусной кислоте (1,4 мл), добавляют 1,4-терефтальдегид (1,1 г, 8,18 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение 4 дней. Затем смесь растворяют в трихлорметане (20 мл) с последующим добавлением гептана (10 мл). Этот раствор концентрируют при пониженном давлении. Эту методику выполняют повторно, дважды. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора трихлорметан/метиловый спирт (99:1) в качестве элюента. Выделяют две фракции. Первая выделенная фракция (Rf=0,30), как было показано, является исходным веществом (20 мг). Вторая выделенная фракция (Rf=0,17), как было показано, является указанным в заглавии соединением (23 мг, 5%):
1H ЯМР (400 МГц, CDCl3) δ 10,02 (с, 1H), 7,91 (д, J=8,2 Гц, 2H), 7,77 (д, J=9,2 Гц, 2H), 7,70 (д, J=8,2 Гц, 2H), 7,27 (д, J=8,2 Гц, 2H), 6,64 (д, J=4,3 Гц, 1H), 5,18 (д, J=4,3 Гц, 1H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 336 (М+).
Пример 53: Получение 4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]-фениламина
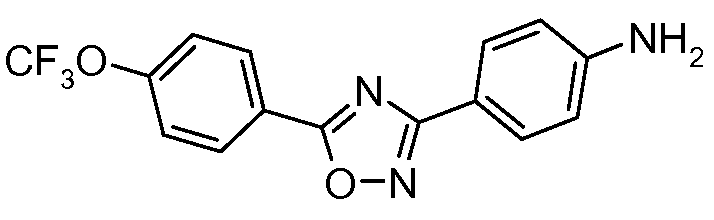
Стадия 1. Трет-бутиловый сложный эфир {4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]-фенил}-карбаминовой кислоты. К перемешанному раствору трет-бутил-4-(N-гидроксикарбамимидоил)-фенилкарбамата (Ace Synthesis) (500 мг, 1,99 ммоль), растворенного в уксусной кислоте (2,5 мл), добавляют 4-трифторметоксибензальдегид (1,7 мл, 11,94 ммоль), и реакционную смесь перемешивают при комнатной температуре в течение 4 дней. Смесь разбавляют трихлорметаном (20 мл) и фильтруют через слой целита Celite®. Этот слой промывают трихлорметаном (20 мл). Затем к раствору добавляют гептан (20 мл), и раствор концентрируют при пониженном давлении. Эту методику повторяют дважды. Остаток подвергают очистке с помощью радиальной хроматографии с использованием раствора гексан/этилацетат спирт (3:1) в качестве элюента. Выделяют две фракции. Первая выделенная фракция (Rf=0,42), как было показано, является указанным в заглавии соединением (127 мг, 15%):
1H ЯМР (300 МГц, CDCl3) δ 8,26 (д, J=8,9 Гц, 2H), 8,09 (д, J=8,9 Гц, 2H), 7,52 (д, J=8,6 Гц, 2H), 7,39 (д, J=8,3 Гц, 2H), 6,70 (с, 1H), 1,54 (с, 9H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 421 (М+).
Вторая выделенная фракция (Rf=0,11), как было показано, включает в себя 4,5-дигидро-1,2,4-оксадиазол (96 мг, 11%):
1H ЯМР (300 МГц, CDCl3) δ 8,40 (д, J=8,9 Гц, 2H), 8,00 (д, J=8,9 Гц, 2H), 7,51 (д, J=8,9 Гц, 2H), 7,22-7,31 (м, 3H), 6,87 (с, 1H), 1,54 (с, 9H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 423 (М+).
Стадия 2. 4-[5-(4-Трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]-фениламин. К перемешанному раствору трет-бутилового сложного эфира {4-[5-(4-Трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]-фенил}-карбаминовой кислоты (198 мг, 0,47 ммоль) в дихлорметане (4,7 мл) добавляют трифторуксусную кислоту (11,76 ммоль, 0,87 мл), и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Раствор концентрируют, и остаток смывают насыщенным раствором KHCO3 (10 мл) и перемешивают в течение 30 минут. Затем смесь экстрагируют дихлорметаном (3×10 мл). Органическую фазу сушат над MgSO4, фильтруют и концентрируют с предоставлением 4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]-фениламина (127 мг; 84%):
1H ЯМР (300 МГц, CDCl3) δ 8,26 (д, J=8,9 Гц, 2H), 7,97 (д, J=8,9 Гц, 2H), 7,39 (д, J=8,6 Гц, 2H), 6,77 (д, J=8,6 Гц, 2H), 3,40-3,80 (шир.с, 2H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 321 (М+).
Пример 54: Получение 1-(4-аминофенил)-4-(4-трифторметоксифенил)-пиперазин-2,5-диона
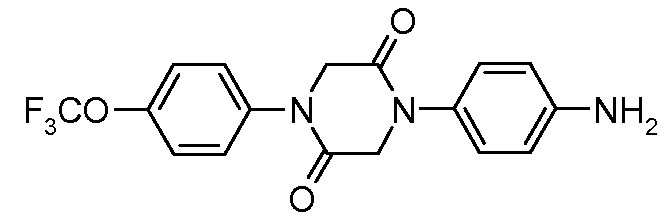
Стадия 1. Метиловый сложный эфир 4-нитрофениламино-уксусной кислоты. К раствору этил-бромацетата (60 г, 0,36 моль) и 4-нитроанилина (5 г, 0,036 моль) в диметилформамиде (100 мл) добавляют NaHCO3 (60 г, 0,71 моль) и йодид тетра-н-бутиламмония (500 мг, кат.). Раствор нагревают до 90°С в течение 16 часов, и затем его охлаждают и выливают в воду (300 мл). Получающееся в результате твердое вещество желтого цвета отфильтровывают и сушат на воздухе. Перекристаллизация из метилового спирта предоставляет метиловый сложный эфир (5 г) в виде твердого вещества светло-желтого цвета: температура плавления 179-182°С;
1H ЯМР (400 МГц, CDCl3) δ 8,13 (д, J=8,4 Гц, 2H), 6,57 (д, J=8,4 Гц, 2H), 5,10 (с, 1H), 4,02 (с, 2H), 3,85 (с, 3H).
Стадия 2. Метиловый сложный эфир [(2-хлорацетил)-(4-трифторметоксифенил)-амино]-уксусной кислоты. К суспензии метилового сложного эфира 4-нитрофениламино-уксусной кислоты (3,0 г, 14,2 ммоль) в толуоле (30 мл) добавляют хлорацетилхлорид (3 мл, избыток). Раствор нагревают до 80°С в течение 1 часа, вследствие чего твердое вещество растворяется. Затем раствор охлаждают и концентрируют, и затем остаточное твердое вещество перекристаллизовывают из метилового спирта, что дает сложный эфир (3,5 г) в виде твердого вещества светло-желтого цвета: температура плавления 106-109°С;
1H ЯМР (400 МГц, CDCl3) δ 8,36 (д, J=8,4 Гц, 2H), 7,65 (д, J=8,4 Гц, 2H), 4,42 (с, 2H), 3,93 (с, 2H), 3,79 (с, 3H);
MS (Масс-спектрометрия) m/z 286 (M+).
Стадия 3. 1-(4-Аминофенил)-4-(4-трифторметоксифенил)-пиперазин-2,5-дион. Продукт стадии 2 (0,6 г, 2,3 ммоль) соединяют с 4-трифторметоксианилином (0,81 г, 4,6 ммоль), и вещества нагревают до 140°С в течение 90 минут. Остаточное твердое вещество перемешивают с дихлорметаном (50 мл) и фильтруют с удалением гидрохлоридной соли анилина, и затем остаток концентрируют и очищают. Хроматография (элюирование смесью этилацетата-гексанов) предоставляет нитрофенил-пиперазиндион (0,44 г) в виде твердого вещества белого цвета, температура плавления 223-224°С. Восстановление нитрогруппы с использованием палладиевого катализатора на углеродном носителе (Pd/C) в условиях, описанных выше, дает указанный в заглавии амин в виде твердого вещества белого цвета: температура плавления 250°C c разложением;
1H ЯМР (400 МГц, CDCl3) δ 7,4 (д, J=8,5 Гц, 2H), 7,33 (д, J=8,6 Гц, 2H), 7,12 (д, J=8,7 Гц, 2H), 6,75 (д, J=8,7 Гц, 2H), 4,5 (с, 2H), 4,45 (с, 2H);
MS (Масс-спектрометрия) m/z 366,2 (M+Н+).
Пример 55: Получение 5-(4-аминофенил)-3-(4-трифторметилфенил)-3Н-[1,3,4]оксадиазол-2-она
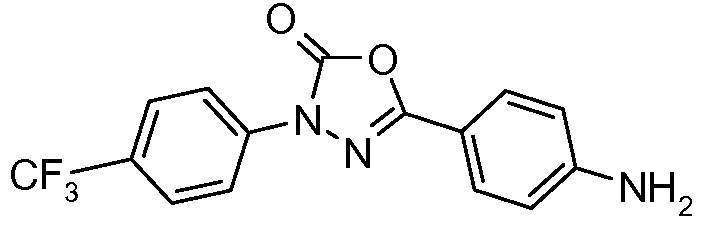
5-(4-Нитрофенил)-3-(4-трифторметилфенил)-3Н-[1,3,4]оксадиазол-2-он получают путем обработки соответствующего N'-(4-трифторметилфенил)-гидразида 4-нитробензойной кислоты фосгеном, с использованием условий, описанных в публикации: Reimlinger et al. Chem. Ber. 1970, 103, 1934. Нитрогруппу затем восстанавливают до амина обработкой водородом в присутствии палладиевого катализатора на углеродном носителе (Pd/C) в этиловом спирте: температура плавления 160-163°С;
1H ЯМР (400 МГц, CDCl3) δ 8,1 (д, J=8,4 Гц, 2H), 7,75 (м, 4H), 6,75 (д, J=8,4 Гц, 2H), 4,1 (шир.с, 2H);
MS (Масс-спектрометрия) m/z 322,6 (M+Н+).
Пример 56: Получение трет-бутилового сложного эфира {4-[1-(4-пентафторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 1)
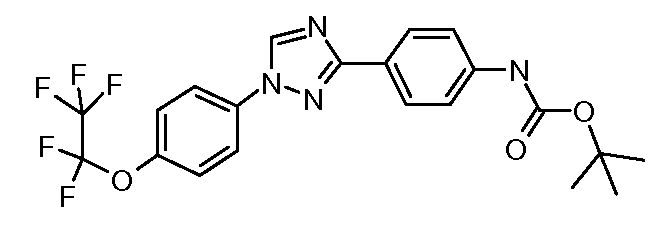
Раствор 4-[1-(4-пентафторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина (1,0 г, 2,7 ммоль) в обезвоженном тетрагидрофуране (8 мл) перемешивают, и в то же время одной порцией добавляют пара-нитрофенил-хлорформиат (0,60 г, 3 ммоль), и раствор оставляют перемешиваться в течение 3 часов. Получающееся в результате твердое вещество отфильтровывают и сушат на воздухе. Меньшую часть пара-нитрофенилкарбамата (152 мг, 0,28 ммоль) суспендируют в обезвоженном тетрагидрофуране (3 мл). К этому добавляют 2-метил-2-пропанол (41 мг, 0,32 ммоль) в обезвоженном тетрагидрофуране (1 мл), после этого добавляют одной порцией NaH (60%-ная дисперсия в минеральном масле; 26 мг, 0,67 ммоль). Дополнительный обезвоженный тетрагидрофуран (1 мл) используют для протирания шлифов, и так далее. Раствор нагревают до 60°С (наружная) в течение 1,5 часов, и в этой точке анализ методом тонкослойной хроматографии (TLC) (этилацетат/гексаны/дихлорметан/ацетон, 3:3:3:1) не показывает исходное вещество. Смесь охлаждают и оставляют перемешиваться при 25°С в течение 20 часов. Смесь охлаждают, выливают в смесь лед-вода (50 мл), и экстрагируют этилацетатом (3×50 мл). Объединенные экстракты промывают насыщенным водным раствором NaCl (75 мл), сушат (Na2SO4), фильтруют и концентрируют. Обращеннофазовая - Высокоэффективная жидкостная хроматография (RP-HPLC) (градиентное элюирование смесью вода-ацетонитрил в среде свободной кислоты) обеспечивает указанное в заглавии соединение (31 мг, 23%) в виде твердого вещества грязно-белого цвета: температура плавления 205-209°C;
1H ЯМР (400 МГц, CDCl3) δ 8,55 (с, 1H), 8,12 (д, J=9,0 Гц, 2H), 7,80 (д, J=9,3 Гц, 2H), 7,48 (д, J=8,8 Гц, 2H), 7,38 (д, J=9,0 Гц, 2H), 6,58 (с, 1H), 1,54 (с, 9H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 471 (M+Н), 469 (М-Н).
Соединение 2 в Таблице 1 синтезируют так же, как в Примере 56.
Пример 57: Получение 1-(5-этокси-пиримидин-2-ил)-1-метил-этилового сложного эфира {4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 3)
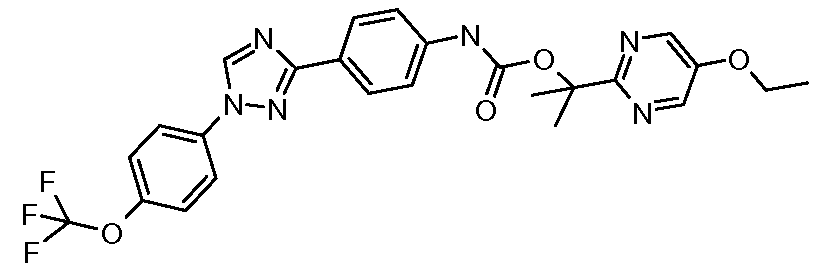
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]бензоил-азид (204 мг, 0,55 ммоль) смывают обезвоженным толуолом (2 мл), и смесь нагревают до 110°С и перемешивают при той температуре в течение 1,5 часов. В ходе нагревания наблюдается выделение газа. Смесь охлаждают, и затем добавляют спирт (106 мг, 0,59 ммоль) и NaH (60% дисперсия в минеральном масле; 76 мг, 1,9 ммоль). Смесь перемешивают при 25°С в течение 18 часов. Смесь выливают в Н2О (50 мл) и экстрагируют этилацетатом (3×50 мл). Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют, что дает остаток светло-рыжевато-коричневого цвета. Колоночная хроматография на силикагеле (циклогексан:этилацетат:дихлорметан:ацетон, 3:3:3:1) дает указанное в заглавии соединение (97 мг, 34%) в виде твердого вещества светло-рыжевато-коричневого цвета: температура плавления 168-171°С;
1H ЯМР (400 МГц, CDCl3) δ 8,52 (с, 1H), 8,37 (с, 2H), 8,08 (д, J=9,0 Гц, 2H), 7,77 (д, J=8,9 Гц, 2H), 7,42 (д, J=8,7 Гц, 2H), 7,36 (д, J=9,0 Гц, 2H), 6,91 (с, 1H), 4,12 (кв, J=7,0 Гц, 2H), 1,87 (с, 6H), 1,44 (т, J=6,9 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 529 (M+Н), 527 (М-Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C25H23F3N6O4, 528,1727; найдено, 528,1730.
Соединения 4-8 в Таблице 1 синтезируют так же, как в Примере 57.
Пример 58: Получение 1-метил-пентилового сложного эфира {4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 9)
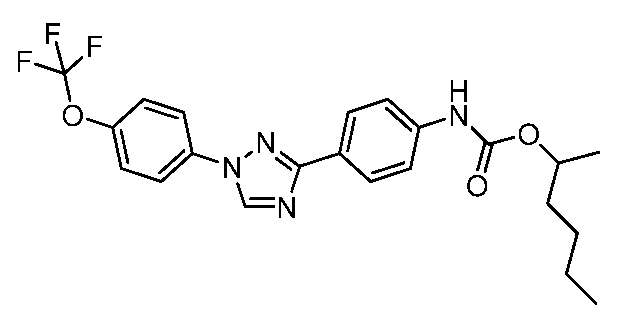
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (131 мг, 0,350 ммоль) суспендируют в безводном толуоле (1,0 мл). К получающейся в результате суспензии добавляют 2-гексанол (221 мкл, 1,75 ммоль) одной порцией. Суспензию грязно-белого цвета затем нагревают до 100°С (наружная). После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, раствор светло-желтого цвета охлаждают до 23°С и концентрируют. Хроматография на силикагеле (Колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 20%-40%-75%) обеспечивает указанное в заглавии соединение (134 мг, 85%) в виде твердого вещества белого цвета: температура плавления 111-113°С;
1H ЯМР (300 МГц, CDCl3) δ 8,54 (с, 1H), 8,13 (д, J=8,8 Гц, 2H), 7,78 (д, J=9,0 Гц, 2H), 7,51 (д, J=8,7 Гц, 2H), 7,37 (дд, J=9,0, 0,8 Гц, 2H), 6,76 (с, 1H), 5,00-4,83 (м, 1H), 1,76-1,44 (м, 2H), 1,44-1,31 (м, 4H), 1,29 (д, J=6,3 Гц, 3H), 0,91 (т, J=7,0 Гц, 3H); ESIMS m/z 449 (M+H), 447 (M-H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 449 (M+Н), 447 (М-Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C22H23F3N4O3, 448,172; найдено, 448,173.
Соединение 10 в Таблице 1 синтезируют так, как в Примере 58.
Пример 59: Получение 1,1-диметил-2-фенил-этилового сложного эфира {4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 11)
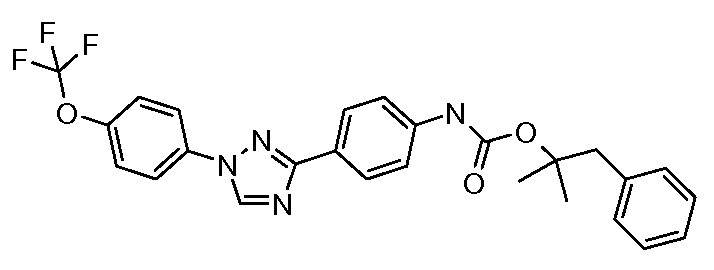
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (93 мг, 0,248 ммоль) суспендируют в безводном толуоле (0,71 мл). К получающейся в результате суспензии добавляют 2-метил-1-фенил-2-пропанол (191 мкл, 1,24 ммоль) одной порцией. Суспензию грязно-белого цвета затем нагревают до 100°С (наружная). После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, суспензию желтого цвета охлаждают до 23°С, фильтруют через фритту средней пористости, и концентрируют. Хроматография на силикагеле (Колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 10%-40%-75%) обеспечивает указанное в заглавии соединение (71 мг, 58%) в виде твердого вещества белого цвета: температура плавления 153-155°С;
1H ЯМР (300 МГц, CDCl3) δ 8,54 (с, 1H), 8,14 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,50 (д, J=8,5 Гц, 2H), 7,38 (д, J=8,6 Гц, 2H), 7,34-7,17 (м, 5H), 6,61 (с, 1H), 3,19 (с, 2H), 1,53 (с, 6H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 497 (M+Н), 495 (М-Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C26H23F3N4O3, 496,172; найдено, 496,172.
Пример 60: Получение 1,1-диметил-проп-2-инилового сложного эфира {4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 12)
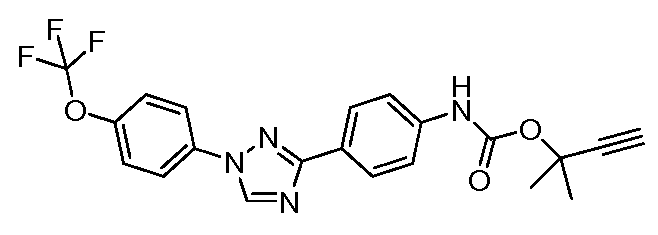
2-Метил-3-бутин-2-ол (48 мкл, 0,44 ммоль) добавляют к раствору трифосгена (42 мг, 0,14 ммоль) и пиридина (38 мкл, 0,47 ммоль) в дихлорметане (1,0 мл) при 23°С. Во время добавления спирта наблюдают выделение газа, и наблюдают образование осадка. Получающуюся в результате суспензию перемешивают при 23°С в течение 1 часа. Перемешивание прекращают, твердому веществу дают осесть на дно колбы, и надосадочную жидкость добавляют посредством канюли к суспензии 4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина (100 мг, 0,312 ммоль) и пиридина (38 мкл, 0,47 ммоль) в дихлорметане (1,0 мл) при 23°С. Наблюдают образование густого осадка. В этот момент времени, анализ методом тонкослойной хроматографии (TLC) показывает наличие некоторого количества оставшегося исходного вещества, поэтому эквивалентное количество трифосгена/пиридина/спирта соединяют так же, как выше, и получающуюся в результате надосадочную жидкость повторно добавляют к анилин-содержащей смеси. После перемешивания в течение дополнительных 3 часов при 23°С, реакционную смесь разбавляют посредством 30% этилацетата в гексане (10 мл), и мелкодисперсный осадок белого цвета отфильтровывают на крупнозернистой фритте. Фильтрат светло-желтого цвета концентрируют, и получающееся в результате масло желтого цвета подвергают очистке хроматографией на силикагеле (колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 10%-25%-50%) с обеспечением указанного в заглавии соединения (55 мг, 41%) в виде твердого вещества белого цвета: температура плавления 164-165°С;
1H ЯМР (400 МГц, CDCl3) δ 8,54 (с, 1H), 8,13 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,53 (д, J=8,5 Гц, 2H), 7,38 (д, J=8,8 Гц, 2H), 6,73 (с, 1H), 2,61 (с, 1H), 1,77 (с, 6H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 431 (M+Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C21H17F3N4O3, 430,125; найдено, 430,126.
Пример 61: Получение 1,1-диметил-проп-2-инилового сложного эфира {4-[1-(4-трифторметилфенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 13)

4-[1-(4-Трифторметилфенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (137 мг, 0,383 ммоль) суспендируют в безводном толуоле (1,5 мл). К получающейся в результате суспензии добавляют 2-метил-3-бутин-2-ол (187 мкл, 1,91 ммоль), после этого триэтиламин (264 мкл, 1,91 ммоль). Суспензию грязно-белого цвета затем нагревают до 100°С (наружная). После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, суспензию желтого цвета охлаждают до 23°С и выливают в 50%-ный этилацетат в гексанах. Суспензию грязно-белого цвета затем фильтруют через фритту средней пористости, и концентрируют. Хроматография на силикагеле (Колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 10%-40%-75%) обеспечивает указанное в заглавии соединение (20 мг, 13%) в виде твердого вещества белого цвета: температура плавления 187-189°С;
1H ЯМР (400 МГц, CDCl3) δ 8,64 (с, 1H), 8,14 (д, J=8,7 Гц, 2H), 7,90 (д, J=8,4 Гц, 2H), 7,79 (д, J=8,6 Гц, 2H), 7,53 (д, J=8,6 Гц, 2H), 6,76 (с, 1H), 2,61 (с, 1H), 1,77 (с, 6H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 415 (M+Н), 413 (М-Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C21H17F3N4O2, 414,130; найдено, 414,131.
Пример 62: Получение циано-диметил-метилового сложного эфира {4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 14)
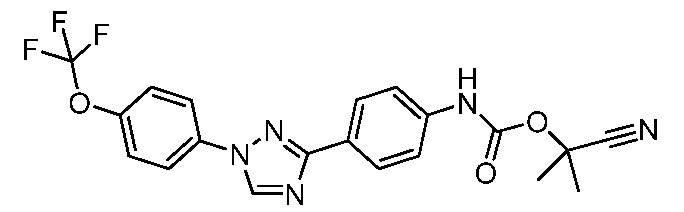
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (107 мг, 0,286 ммоль) суспендируют в безводном толуоле (1,0 мл). К получающейся в результате суспензии добавляют 2-циано-2-пропанол (78 мкл, 0,858 ммоль). Суспензию грязно-белого цвета затем нагревают до 90°С (наружная). В течение 10 секунд при этой температуре, суспензия становится однородной, и наблюдается энергичное выделение газа. По истечении дополнительных 10 минут при этой температуре наблюдают образование осадка. После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, суспензию желтого цвета охлаждают до 23°С и выливают в гексаны. Суспензию грязно-белого цвета затем фильтруют через фритту средней пористости, и концентрируют. Хроматография на силикагеле (Колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 20%-40%-75%) обеспечивает указанное в заглавии соединение (7 мг, 6%) в виде твердого вещества светло-желтого цвета: температура плавления 172-175°С;
1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,16 (д, J=8,6 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,52 (д, J=8,4 Гц, 2H), 7,38 (д, J=8,7 Гц, 2H), 6,79 (с, 1H), 1,84 (с, 6H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 432 (M+Н), 430 (М-Н).
Пример 63: Получение 1-циклопропил-этилового сложного эфира 4-{4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]-триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 15)
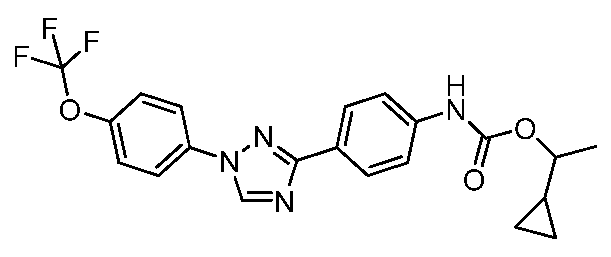
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (84 мг, 0,225 ммоль) суспендируют в безводном толуоле (0,65 мл). К получающейся в результате суспензии добавляют 1-циклопропилэтиловый спирт (109 мкл, 1,12 ммоль). Суспензию грязно-белого цвета затем нагревают до 90°С (наружная). В течение 10 секунд при этой температуре, суспензия становится однородной, и наблюдается энергичное выделение газа. По истечении 1 часа, слегка мутный раствор желтого цвета охлаждают до 23°С и концентрируют. Хроматография на силикагеле (колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 10%-25%-50%) обеспечивает извлеченное исходное вещество (20 мг, 24%) в виде твердого вещества белого цвета наряду с указанным в заглавии соединением (67 мг, 69%) в виде твердого вещества белого цвета: температура плавления 123-124°С;
1H ЯМР (400 МГц, CDCl3) δ 8,54 (с, 1H), 8,13 (д, J=8,7 Гц, 2H), 7,78 (д, J=9,0 Гц, 2H), 7,51 (д, J=8,6 Гц, 2H), 7,37 (д, J=8,6 Гц, 2H), 6,85 (с, 1H), 4,34 (д.кв, J=12,7, 6,3 Гц, 1H), 1,38 (д, J=6,3 Гц, 3H), 1,14-0,95 (м, 1H), 0,67-0,42 (м, 3H), 0,29 (ддд, J=7,6, 6,5, 3,8 Гц, 1H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 433 (M+Н), 431 (М-Н).
Пример 64: Получение 1-циклогексил-этилового сложного эфира 4-{4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]-триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 16)
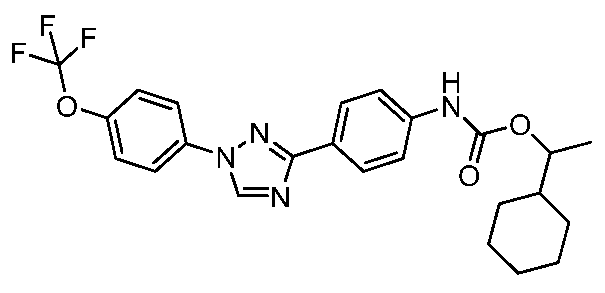
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (90 мг, 0,241 ммоль) суспендируют в безводном толуоле (0,70 мл). К получающейся в результате суспензии добавляют (1-циклогексил)этиловый спирт (166 мкл, 1,20 ммоль). Суспензию грязно-белого цвета затем нагревают до 90°С (наружная). В течение 10 секунд при этой температуре, суспензия становится однородной, и наблюдается энергичное выделение газа. По истечении дополнительных 10 минут при этой температуре наблюдают образование некоторого количества осадка. После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, суспензию желтого цвета охлаждают до 23°С и выливают в смесь, представляющую собой 25% этилацетата в гексане. Суспензию грязно-белого цвета затем фильтруют через фритту средней пористости, и концентрируют. Хроматография на силикагеле (Колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 15%-30%-50%) обеспечивает указанное в заглавии соединение (98 мг, 86%) в виде твердого вещества белого цвета: температура плавления 146-148°С;
1H ЯМР (400 МГц, CDCl3) δ 8,54 (с, 1H), 8,13 (д, J=8,7 Гц, 2H), 7,78 (д, J=9,0 Гц, 2H), 7,52 (д, J=8,5 Гц, 2H), 7,36 (д, J=8,4 Гц, 2H), 6,89 (с, 1H), 4,76 (п, J=6,3Гц, 1H), 2,13-1,61 (м, 4H), 1,49 (тдд, J=11,8, 6,1, 3,1 Гц, 1H), 1,24 (д, J=6,4 Гц, 3H), 1,22-0,96 (м, 6H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 475 (M+Н), 473 (М-Н).
Соединения 17-22 в Таблице 1 синтезируют так же, как в Примере 64.
Пример 65: Получение этилового сложного эфира 4-метил-4-{4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]-триазол-3-ил]-фенилкарбамоилокси}-пент-2-иновой кислоты (Соединение 23)
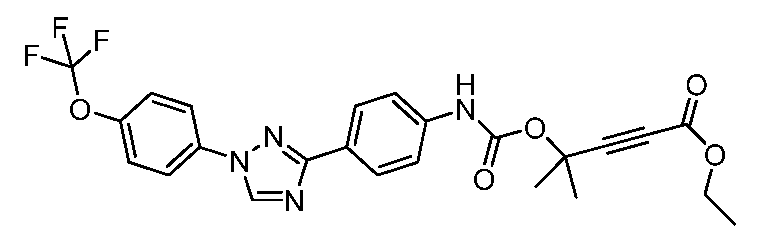
1,1-Диметил-проп-2-иниловый сложный эфир 4-[1-(4-трифторметилфенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 13; 11981077; 88 мг, 0,20 ммоль) растворяют в безводном тетрагидрофуране (2,0 мл) и охлаждают до -78°С. Затем добавляют по каплям н-бутиллитий (164 мкл 2,5М раствора в гексане, 0,410 ммоль). Смесь перемешивают в течение дополнительных 20 минут при -78°С, и затем добавляют одной порцией этилхлорформиат (24 мкл, 0,25 ммоль). Смесь перемешивают в течение еще 30 минут при -78°С и затем нагревают до 23°С. Смесь разлагают полунасыщенным водным раствором NH4Cl и экстрагируют смесью, представляющую собой 50% этилацетата в гексане. Объединенные органические слои затем промывают рассолом, сушат над Na2SO4 и концентрируют. Хроматография на силикагеле (колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 15%-30%-50%-75%) с последующей перекристаллизацией из смеси диэтиловый эфир/гексаны обеспечивают указанное в заглавии соединение (10 мг, 10%) в виде твердого вещества желтого цвета: температура плавления 183-188°С;
1H ЯМР (300 МГц, CDCl3) δ 8,57 (с, 1H), 8,27 (д, J=8,7 Гц, 2H), 7,80 (д, J=9,1 Гц, 2H), 7,40 (псевдо д, J=8,7 Гц, 4H), 4,99 (с, 1H), 3,66 (кв, J=7,1 Гц, 2H), 1,70 (с, 6H), 0,98 (т, J=7,1 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 503 (M+Н).
Пример 66: Получение 2,2,3,3,3-пентафтор-1-метил-пропилового сложного эфира {4-[1-(трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 24)
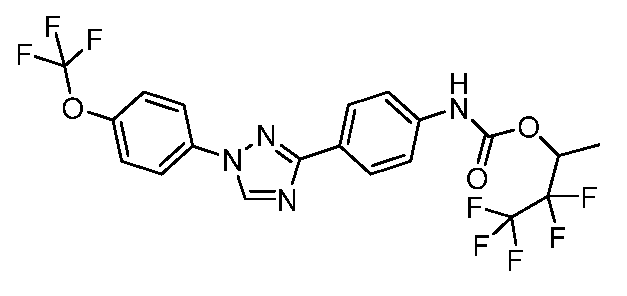
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (77 мг, 0,206 ммоль) суспендируют в безводном толуоле (0,60 мл). К получающейся в результате суспензии добавляют 3,3,4,4,4-пентафтор-2-бутанол (120 мкл, 1,03 ммоль). Суспензию грязно-белого цвета затем нагревают до 90°С (наружная). В течение 10 секунд при этой температуре, суспензия становится однородной, и наблюдается энергичное выделение газа. По истечении дополнительных 10 минут при этой температуре наблюдается образование небольшого количества осадка. После того, как анализ методом UPLC (Сверхэффективная жидкостная хроматография) показывает полное израсходование исходного вещества, суспензию желтого цвета охлаждают до 23°С и выливают в смесь, представляющую собой 25% этилацетата в гексане. Суспензию грязно-белого цвета фильтруют через фритту средней пористости, и концентрируют с обеспечением указанного в заглавии соединения (80 мг, 76%) в виде твердого вещества грязно-белого цвета: температура плавления 171-173°С;
1H ЯМР (400 МГц, ДМСО-d6) δ 10,33 (с, 1H), 9,38 (с, 1H), 8,10-7,99 (м, 4H), 7,67-7,58 (м, 4H), 5,81-5,23 (м, 1H), 1,47 (д, J=6,3 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 511 (M+Н), 509 (М-Н); HRMS-ESI (Масс-спектрометрия высокого разрешения с ионизацией электрораспылением) (m/z): [M]+ вычислено для C20H14F8N4O3, 510,0933; найдено, 510,0998.
Соединение 25 в Таблице 1 синтезируют так же, как в Примере 66.
Пример 67: Получение этилового сложного эфира 2-{4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]-триазол-3-ил]-фенилкарбамоилокси}-гексановой кислоты (Соединение 26)
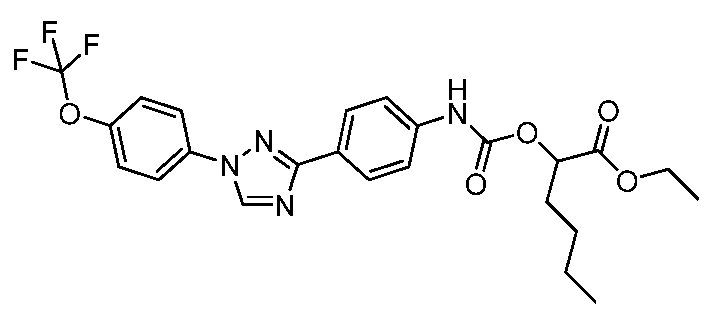
4-[1-(4-Трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-бензоил-азид (90 мг, 0,241 ммоль) суспендируют в безводном толуоле (0,70 мл). Суспензию грязно-белого цвета затем нагревают до 90°С (наружная) и перемешивают в течение 30 минут. В течение 10 секунд при этой температуре, суспензия становится однородной, и наблюдается энергичное выделение газа. Слегка мутный раствор желтого цвета охлаждают до 23°С, и добавляют этил-2-гидроксикапроат (52 мкл, 1,20 ммоль). Смесь перемешивают при 23°С в течение еще 15 часов, и затем выливают в смесь, представляющую собой 25% этилацетата в гексане. Суспензию грязно-белого цвета фильтруют через фритту средней пористости, и концентрируют. Хроматография на силикагеле (колонка SNAP 10 г Biotage, градиентное элюирование смесью этилацетат/гексаны, 15%-30%-50%-75%) обеспечивает указанное в заглавии соединение (10 мг, 8%) в виде твердого вещества белого цвета: температура плавления 135-139°С;
1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,14 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,51 (д, J=8,8 Гц, 2H), 7,38 (дд, J=9,0, 0,8 Гц, 2H), 6,97 (с, 1H), 5,08 (дд, J=7,2, 5,4 Гц, 1H), 4,25 (кв, J=7,1 Гц, 2H), 1,95-1,80 (м, 2H), 1,52-1,34 (м, 4H), 1,30 (т, J=7,1 Гц, 3H), 0,93 (т, J=7,2 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 507 (M+Н), 505 (М-Н).
Пример 68: Получение 1-(4-(трифторметил)фенил)этил 4-(1-(4-(трифторметил)фенил)-1Н-1,2,4-триазол-3-ил)-фенилкарбамата (Соединение 27)
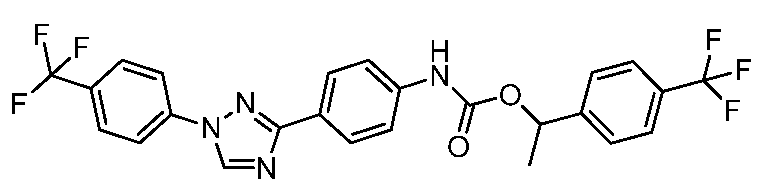
4-[1-(4-Трифторметил)фенил)-1Н-1,2,4-триазол-3-ил)-бензоил-азид (62,5 мг, 0,174 ммоль) суспендируют в безводном толуоле (0,498 мл). К получающейся в результате суспензии добавляют 1-(4-(трифторметил)фенил)этиловый спирт (36,5 мг, 0,192 ммоль). Суспензию грязно-белого цвета затем нагревают до 100°С (наружная) в течение 18 часов и затем охлаждают до температуры окружающей среды. Реакционную смесь наносят непосредственно на колонку с силикагелем, и градиентное элюирование смесью этилацетат/гексаны (10%-50%-100%) обеспечивает указанное в заглавии соединение (57,6 мг, 63%) в виде твердого вещества белого цвета: температура плавления 155,5-158,5°С;
1H ЯМР (400 МГц, CDCl3) δ 8,62 (с, 1H), 8,15 (д, J=8,8 Гц, 2H), 7,90 (д, J=8,5 Гц, 2H), 7,79 (д, J=8,5 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,51 (псевдо т, J=8,4 Гц, 4H), 6,79 (с, 1H), 5,95 (кв, J=6,6 Гц, 1H), 1,63 (д, J=6,7 Гц, 3H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 521 (M+Н), 519 (М-Н).
Пример 69: Получение карбаматов - Общий Способ А
Ацилазид суспендируют в безводном толуоле (0,35 М). К получающейся в результате суспензии добавляют соответственный спирт (1,20 экв.). Суспензию нагревают до 100°С (наружная) в течение 4-24 часов и затем охлаждают до температуры окружающей среды. Продукт выделяют вакуумной фильтрацией или очищают колоночной хроматографией на силикагеле (после нанесения вещества непосредственно на колонку) с использованием градиентного элюирования смесью этилацетат/гексаны. В некоторых случаях, необходима дополнительная очистка перекристаллизацией. Обычно используемые растворители включают: хлороформ-d, смеси диэтиловый эфир/гексаны, и диэтиловый эфир/дихлорметан/гексаны.
Соединения 28-121 в Таблице 1 синтезируют так же, как в Примере 69.
Пример 70: Получение карбаматов - Общий Способ В
Ацилазид суспендируют в безводном толуоле (0,35 М). К получающейся в результате суспензии добавляют соответственный спирт (1,20 экв.). Суспензию нагревают до 100°С (наружная) в течение 4-24 часов и затем охлаждают до температуры окружающей среды. Добавляют триэтиламин (1,50 экв.), и реакционную смесь перемешивают при температуре окружающей среды в течение дополнительного 1 часа. Продукт выделяют вакуумной фильтрацией или очищают колоночной хроматографией на силикагеле (после нанесения вещества непосредственно на колонку) с использованием градиентного элюирования смесью этилацетат/гексаны.
Соединения 122-129 синтезируют так же, как в Примере 70.
Пример 71: Получение 1-(6-(трифторметил)пиридин-3-ил)этил этил(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенил)карбамата (Соединение 130)
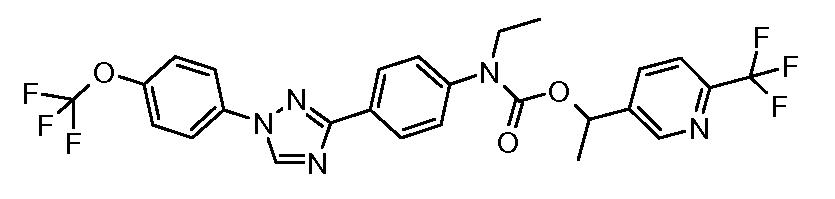
1-(6-(Трифторметил)пиридин-3-ил)этил 4-(1-(4-трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамат (54 мг. 0,10 ммоль) растворяют в безводном диметилформамиде (0,5 мл) в атмосфере азота и охлаждают до 0°С. Добавляют NaH (60%-ная суспензия в минеральном масле; 4,4 мг, 0,11 ммоль), и смесь перемешивают в течение 10 минут при 0°С. Добавляют йодэтан (9 мкл, 0,11 ммоль), и смесь нагревают до температуры окружающей среды и перемешивают в течение 1 часа. При температуре окружающей среды добавляют дополнительные NaH (4 мг) и йодэтан (5 мкл) для содействия полному расходованию исходного вещества. Смесь разлагают водным раствором NH4Cl и экстрагируют смесью, составляющей 80% этилацетата в гексане (×3). Объединенные органические слои промывают рассолом, сушат над Na2SO4, и концентрируют. Сырой продукт наносят на колонку с силикагелем, и градиентное элюирование смесью 80% этилацетата в гексане (15%-40%-80%) обеспечивает указанное в заглавии соединение (52,1 мг, 91%) в виде масла светло-желтого цвета:
ИК-спектроскопия 3111, 2983, 2936, 1707, 1519, 1340, 1268, 1155 см-1;
1H ЯМР (300 МГц, CDCl3) δ 8,62 (с, J=10,6 Гц, 1H), 8,58 (с, 1H), 8,21 (д, J=8,5 Гц, 2H), 7,81 (д, J=9,0 Гц, 2H), 7,73-7,58 (м, 2H), 7,40 (д, J=8,5 Гц, 2H), 7,30 (д, J=8,5 Гц, 2H), 5,95 (кв, J=6,6 Гц, 1H), 3,84-3,70 (м, 2H), 1,53 (д, J=6,2 Гц, 3H), 1,19 (т, J=7,1 Гц, 3H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C26H21F6N5O3, 565,1549; найдено, 565,1568.
Пример 72: Получение трет-бутил метил(4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенил)карбамата (Соединение 131)
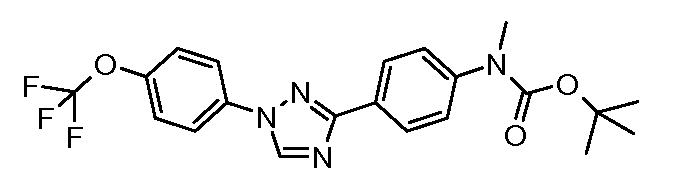
трет-Бутил (4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенил)карбамат (120 мг, 0,286 ммоль) растворяют в безводном диметилформамиде (2,0 мл) в атмосфере азота и охлаждают до 0°С. Добавляют NaH (60%-ная суспензия в минеральном масле; 15 мг, 0,372 ммоль), и смесь перемешивают в течение 10 минут при 0°С. Добавляют йодметан (23 мкл, 0,372 ммоль), и смесь нагревают до температуры окружающей среды и перемешивают в течение 1 часа. Смесь разлагают водным раствором NH4Cl и экстрагируют смесью, составляющей 80% этилацетата в гексане (×3). Объединенные органические слои промывают рассолом, сушат над Na2SO4, и концентрируют. Сырой продукт наносят на колонку с силикагелем, и градиентное элюирование смесью этилацетата в гексане (15%-40%-80%) обеспечивает указанное в заглавии соединение (108,0 мг, 87%) в виде твердого вещества белого цвета: температура плавления 125-128°С;
1H ЯМР (400 МГц, CDCl3) δ 8,55 (с, 1H), 8,14 (д, J=8,6 Гц, 2H), 7,79 (д, J=8,9 Гц, 2H), 7,38 (д, J=9,8 Гц, 2H), 7,35 (д, J=8,8 Гц, 2H), 3,31 (с, 3H), 1,47 (с, 9H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C21H21F3N4O3, 434,156; найдено, 434,157.
Пример 73: Получение О-метил 4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамотиоата (Соединение 132)
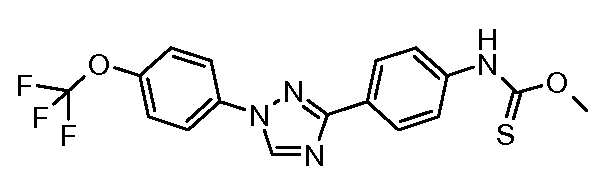
Стадия 1. 4-(1-(4-(Трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)анилин растворяют в тетрагидрофуране (2,5 мл) с получением раствора рыжевато-коричневого цвета. Затем добавляют фенил-хлортионформиат (0,205 мг, 1,19 ммоль). Мгновенно выпадает в осадок твердое вещество, и перемешивание становится затруднительным. Для облегчения перемешивания добавляют дополнительный тетрагидрофуран (2,5 мл). Добавляют дополнительную порцию фенил-хлортионформиата (0,205 мг, 1,19 ммоль), после этого триэтиламин (0,38 мл, 2,80 ммоль). Реакционную смесь разлагают насыщенным водным раствором NaHCO3 и экстрагируют смесью 50% этилацетата в гексане. Органический слой промывают водным раствором NaHCO3 и рассолом, сушат над Na2SO4, и концентрируют. Очистка посредством хроматографии на силикагеле (градиентное элюирование смесью этилацетата в гексане, 15%-30%-50%-80%) предоставляет N,N-бис(тионфенокси)-4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)анилин (0,472 г, 80%) в виде твердого вещества желтого цвета: температура плавления 142-144°С;
1H ЯМР (400 МГц, CDCl3) δ 8,58 (с, 1H), 8,34 (д, J=8,6 Гц, 2H), 7,80 (д, J=9,0 Гц, 2H), 7,66 (д, J=8,6 Гц, 2H), 7,49-7,34 (м, 6H), 7,34-7,28 (м, 2H), 7,26-7,13 (м, 4H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C29H19F3N4O3S2, 592,085; найдено, 592,0861.
Стадия 2. К раствору продукта стадии 1 в метиловом спирте (2,5 мл) и тетрагидрофуране (2,5 мл) добавляют NaOH (2,5 мл 1М водного раствора). Мгновенно образуется густой осадок желтого цвета. Добавляют дополнительные тетрагидрофуран, метиловый спирт, и 1М раствор NaOH (по 2,5 мл каждого), и получают прозрачный раствор желтого цвета. Затем смесь выливают в водный раствор NaHCO3 и экстрагируют смесью 50% этилацетата в гексане (×3). Объединенные органические слои промывают рассолом, сушат над Na2SO4, и концентрируют с получением твердого вещества желтого цвета. Твердое вещество растирают в порошок со смесью 20% этилацетата в гексане, что дает указанное в заглавии соединение (137 мг, 51%) в виде твердого вещества белого цвета. Фильтрат концентрируют и очищают хроматографией на силикагеле (градиентное элюирование смесью этилацетат/гексан, 15%-40%-80%) с предоставлением дополнительного продукта (57,6 мг, 0,126 ммоль, 22%): температура плавления 192-194°С;
1H ЯМР (300 МГц, ДМСО-d6) δ 11,32 (с, 1H), 9,39 (с, 1H), 8,14-7,95 (м, 4H), 7,90-7,65 (шир., 1H), 7,62 (псевдо дд, J=9,0, 0,7 Гц, 2H), 7,60-7,40 (шир., 1H), 4,01 (шир.с, 3H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C17H13F3N4O2S, 394,071; найдено, 394,0712.
Пример 74: Получение О-1-(6-(трифторметил)пиридин-3-ил)этил 4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамотиоата (Соединение 133)
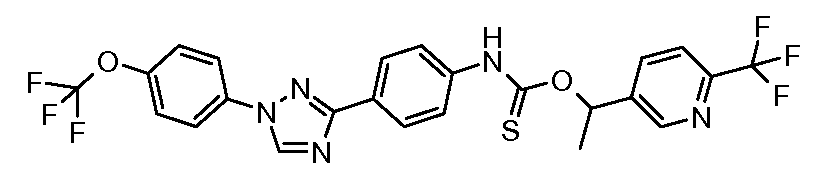
В атмосфере азота, к холодному дихлорметану, охлажденному на ледяной бане, добавляют по каплям тиофосген (0,56 ммоль). К этому раствору добавляют холодный 0,2 мМ раствор K2CO3 (0,13 ммоль). Реакционную смесь перемешивают в течение 10 минут. 4-(1-(4-(Трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)анилин (0,56 ммоль) растворяют в дихлорметане и добавляют по каплям к вышеупомянутой смеси. Реакционную смесь оставляют перемешиваться в течение дополнительных 10 минут. Затем добавляют холодный 0,6 мМ раствор КОН (0,92 ммоль). По истечении 30 минут, реакционную смесь разбавляют дихлорметаном и промывают водой и рассолом. Органический слой сушат над MgSO4 и концентрируют. Сырой изотиоцианат используют без дополнительной очистки на следующей стадии.
К суспензии NaH (9,2 мг 60%-ной суспензии в минеральном масле, 0,229 ммоль) в тетрагидрофуране (1 мл) при 0°С добавляют 1-(6-(трифторметил)пиридин-3-ил)этанол (43,7 мг, 0,229 ммоль) в фенилметане (0,4 мл). Смесь нагревают до температуры окружающей среды и перемешивают в течение 15 минут, и затем добавляют с помощью канюли упоминаемый выше изотиоцианат (75,6 мг, 0,209 ммоль) в тетрагидрофуране (1 мл). После перемешивания в течение 20 минут, смесь разлагают путем добавления водного раствора NH4Cl и экстрагируют этилацетатом (×3). Объединенные органические экстракты промывают рассолом, сушат над Na2SO4, и концентрируют. Сырой продукт наносят на колонку с силикагелем, и градиентное элюирование смесью этилацетат/гексан (15%-40%-65%) обеспечивает указанное в заглавии соединение (88,2 мг, 77%) в виде твердого вещества грязно-белого цвета: температура плавления 186,5-188°С;
1H ЯМР (300 МГц, CDCl3) δ 8,76 (с, 1H), 8,58 (с, 1H), 8,50 (с, 1H), 8,19 (д, J=8,7 Гц, 2H), 7,91-7,83 (м, 1H), 7,80 (д, J=9,1 Гц, 2H), 7,69 (д, J=8,1 Гц, 1H), 7,49-7,29 (м, 4H), 6,68 (кв, J=6,7 Гц, 1H), 1,76 (д, J=6,6 Гц, 3H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C24H17F6N5O2S, 553,101; найдено, 553,1006.
Пример 75: Получение О-4-фторфенил 4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамотиоата (Соединение 134)
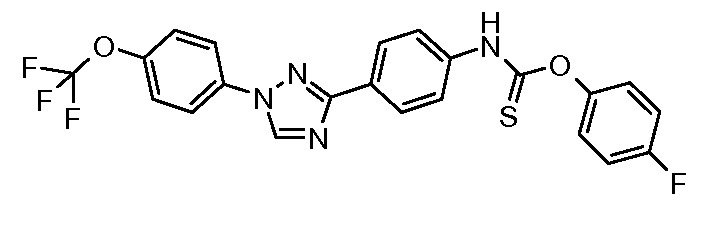
В 25-миллилитровую круглодонную колбу добавляют 4-(1-(4-(трифторметокси)фенил)-1Н-1,2,4-триазол-3-ил)анилин (200 мг, 0,624 ммоль), О-4-фторфенил хлорангидрид-тиоугольной кислоты (238 мг, 1,249 ммоль), и триэтиламин (0,348 мл, 2,498 ммоль) в тетрагидрофуране (5 мл). Раствор перемешивают в условиях окружающей среды в течение 2 часов прежде, чем удалять растворитель при пониженном давлении. Сырой продукт вводят в колонку с силикагелем и проводят градиентное элюирование смесью этилацетат/гексан с предоставлением указанного в заглавии соединения (50 мг, 0,105 ммоль, 17%) в виде твердого вещества желтого цвета: температура плавления 164-169°С;
1H ЯМР (400 МГц, ДМСО-d6) δ 9,42 (с, 1H), 8,19-8,04 (м, 6H), 7,97 (шир.с, 1H), 7,66-7,57 (д, J=8,24 Гц, 2H), 7,33-7,19 (м, 4H);
ESIMS (Масс-спектрометрия с ионизацией электрораспылением) m/z 475 (M+1).
Пример 76: Получение метил 4-(1-(4-(перфторэтокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамата (Соединение 135)
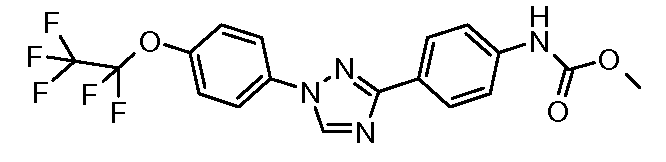
4-Нитрофенил 4-(1-(4-(перфторэтокси)фенил)-1Н-1,2,4-триазол-3-ил)фенилкарбамат (1,90 г, 3,55 ммоль) суспендируют в метиловом спирте (15 мл) и охлаждают на бане с сухим льдом в ацетоне при -10°С. В течение 10 минут добавляют по каплям метоксид натрия (1,33 мл 30% мас. раствора в метиловом спирте, 7,10 ммоль). Получающуюся в результате суспензию ярко-желтого цвета нагревают до температуры окружающей среды и выливают в ледяную воду (150 мл). После энергичного перемешивания в течение 10 минут, смесь фильтруют на воронке Бюхнера. Твердое вещество рыжевато-коричневого цвета ополаскивают водой и сушат на воздухе. Перекристаллизация из смеси метиловый спирт/вода обеспечивает указанное в заглавии соединение (0,989 г, 65%) в виде твердого вещества рыжевато-коричневого цвета: температура плавления 183-184,5°С;
1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,14 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,0 Гц, 2H), 7,50 (д, J=8,6 Гц, 2H), 7,38 (д, J=8,9 Гц, 2H), 6,79 (с, 1H), 3,80 (с, 3H);
HRMS-FAB (Масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами) m/z [M+Н]+, вычислено для C18H13F5N4O3, 428,0908; найдено, 428,0903.
Пример 77: Получение 4-нитрофенилового сложного эфира метил-{4-(1-(4-(трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-карбаминовой кислоты (Соединение 136)
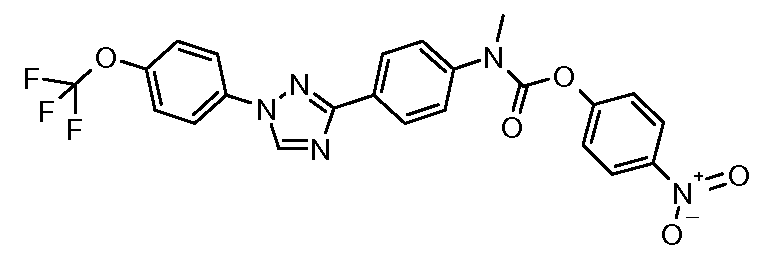
Суспензию 4-[1-(4-трифторэтилоксифенил)-1Н-[1,2,4]триазол-3-ил]-фениламина (1,2 г, 3,7 ммоль) в этиловом спирте (4 мл) обрабатывают 1Н-бензотриазолом (0,48 г, 4,0 ммоль) и формальдегидом (0,5 мл 37%-ого водного раствора, 6 ммоль), и раствор нагревают до 40°С в течение 10 минут. После охлаждения, образуется твердое вещество, которое собирают фильтрацией. Получают 1,33 г триазольного аддукта в виде твердого вещества светло-желтого цвета, температура плавления 185-187°С. Это вещество (1,2 г, 2,66 ммоль) растворяют в тетрагидрофуране (20 мл) и обрабатывают посредством NaBH4 (0,11 г, 2,9 ммоль). Раствор перемешивают при температуре окружающей среды в течение 30 минут, затем нагревают до температуры кипения, которое осуществляют с обратным холодильником в течение 1 часа. После охлаждения, раствор выливают в воду (30 мл) и экстрагируют диэтиловым эфиром. Сушка и концентрирование, с последующей хроматографией на силикагеле (смесь гексан:этилацетат, 75:25) предоставляют метил-{4-[1-(4-трифторметоксифенил)-1Н-[1,2,4]триазол-3-ил]-фенил}-амин (0,76 г, 86%) в виде твердого вещества белого цвета, температура плавления 121-123°C;
1H ЯМР (300 МГц, CDCl3) δ 8,51 (с, 1H), 8,02 (д, J=8,8 Гц, 2H), 7,78 (д, J=9,1 Гц, 2H), 7,37 (д, J=8,3 Гц, 2H), 6,68 (д, J=8,8 Гц, 2H), 3,96 (с, 1H), 2,91 (с, 3H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 499 (M+).
Часть этого амина (0,11 г, 0,33 ммоль) растворяют в безводном тетрагидрофуране (2 мл) и обрабатывают 4-нитрофенил-хлорформиатом (0,069 г, 0,34 ммоль). Твердое вещество, которое образуется в течение 10 минут, собирают фильтрацией и сушат на воздухе, что дает твердое вещество грязно-белого цвета (0,10 г): температура плавления 145-147°С;
1H ЯМР (300 МГц, CDCl3) δ 8,59 (с, 1H), 8,28 (д, J=8 Гц, 4H), 7,8 (д, J=8 Гц, 2H), 7,50-7,3 (м, 6 H) 3,55 (с, 3H);
EIMS (Масс-спектрометрия с ионизацией электронным ударом) m/z 499 (M+).
Соединения испытывают в борьбе против совки малой и совки хлопковой с использованием методик, описанных в следующих примерах и отраженных в Таблице 2.
В каждом случае, представленном в Таблице 2, шкала оценки является следующей:
|
Пример 78: Инсектицидное испытание в отношении совки малой (Spodoptera exigua)
Биоанализы на совке малой (BAW; Spodoptera exigua: Lepidoptera) проводят с использованием испытания посредством 128-луночного планшета с питательной средой. Три-пять личинок BAW второго возраста помещают в каждую лунку (3 мл) планшета с питательной средой, который был заранее заполнен искусственной питательной средой (по 1 мл на лунку), в которую были нанесены (в каждую из восьми лунок) 50 мкг/см2 испытуемого соединения (растворенного в 50 мкл смеси ацетон-вода, 90:10), и затем оставляют высыхать. Планшеты покрывают прозрачным самоприклеивающимся слоем, и выдерживают при 25°С, в течение шести дней в режиме свет-темнота 14:10. Процент гибели регистрируют для личинок в каждой лунке; интенсивность действия в восьми лунках затем усредняют. Результаты для обоих биоанализов показаны в Таблице 2.
Пример 79: Инсектицидное испытание в отношении совки хлопковой (Helicoverpa zea)
Биоанализы на совке хлопковой (CEW; Helicoverpa zea: Lepidoptera) проводят с использованием испытания посредством 128-луночного планшета с питательной средой. Три-пять личинок CEW второго возраста помещают в каждую лунку (3 мл) планшета с питательной средой, который был заранее заполнен искусственной питательной средой (по 1 мл на лунку), в которую были нанесены (в каждую из восьми лунок) 50 мкг/см2 испытуемого соединения (растворенного в 50 мкл смеси ацетон-вода, 90:10), и затем оставляют высыхать. Планшеты покрывают прозрачным самоприклеивающимся слоем, и выдерживают при 25°С, в течение шести дней в режиме свет-темнота 14:10. Процент гибели регистрируют для личинок в каждой лунке; интенсивность действия в восьми лунках затем усредняют. Результаты для обоих биоанализов показаны в Таблице 2.
Соединения также испытывают в отношении тли персиковой зеленой с использованием методики, описанной в следующем примере и отраженной в Таблице 2.
В каждом случае, представленном в Таблице 2, шкала оценки является следующей:
|
Пример 80: Инсектицидное испытание в отношении тли персиковой зеленой (Myzus persicae) в анализе спрея для лиственной системы растений
В качестве испытуемого субстрата используют капустную рассаду, выращенную в 3-дюймовых горшочках, с 2-3 небольшими (3-5 см) настоящими листьями. Рассаду заражают 20-50 особями тли персиковой зеленой (бескрылое взрослое насекомое и личинка вида с неполным превращением) за один день до нанесения химических средств. Четыре горшочка с отдельно взятой рассадой используют для каждой обработки. Соединения (2 мг) растворяют в 2 мл растворителя ацетон/метанол (1:1), с получением базовых растворов, содержащих 1000 м.д.. Базовые растворы разбавляют в 5 раз 0,025%-ным раствором Tween 20 в воде с получением раствора, содержащего 200 м.д.. Переносной распылитель Devilbiss используют для распыления раствора с обеих сторон листьев капусты до стекания. Контрольные растения (проверка обработкой растворителем) опрыскивают только разбавителем. Прежде, чем производить отбор, обработанные растения выдерживают в помещении для хранения в течение трех дней при приблизительно 25°С и при относительной влажности (RH) 40%. Оценку проводят путем подсчета количества живых особей тли на одно растение под микроскопом. Инсектицидная активность, вычисленная с использованием поправочной формулы Эбботта, представлена в Таблице 2:
Скорректир. %, Борьба с насекомыми-вредителями = 100*(X-Y)/X
где Х = количество живых особей тли на растениях, обработанных для проверки растворителем,
Y = количество живых особей тли на обработанных соединениями растениях
ПРОИЗВОДНЫЕ НА ОСНОВЕ КИСЛОТ И СОЛЕЙ И СОЛЬВАТЫ
Соединения, раскрытые в этом изобретении, могут находиться в форме пестицидно приемлемых солей присоединения кислоты.
В качестве неограничивающего примера, функциональная аминогруппа может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой, и гидроксиэтансульфоновой кислотами.
Кроме того, в качестве неограничивающего примера, функциональная группа кислоты может образовывать соли, включающие соли, полученные из щелочных или щелочноземельных металлов, и соли, полученные из аммиака и аминов. Примеры предпочтительных катионов включают натриевые, калиевые, магниевые, и аминиевые катионы.
Соли приготавливают путем проведения контактирования “свободно” основной формы с достаточным количеством желательной кислоты, что дает соль. “Свободно” основные формы могут быть регенерированы обработкой соли подходящим разбавленным водным раствором основания, таким как разбавленный водный раствор NaOH, разбавленный водный раствор карбоната калия, разбавленный водный раствор аммиака, и разбавленный водный раствор бикарбоната натрия. В качестве примера, во многих случаях, пестицид модифицируют с превращением в более водорастворимую форму, например, соль диметиламина и 2,4-дихлорфенокси-уксусной кислоты является более водорастворимой формой 2,4-дихлорфенокси-уксусной кислоты, общеизвестного гербицида.
Соединения, раскрытые в этом изобретении также могут образовывать стабильные комплексы с молекулами растворителя, которые остаются в неизменном виде после удаления из соединений не связанных в комплекс молекул растворителя. Эти комплексы часто называют как «сольваты».
СТЕРЕОИЗОМЕРЫ
Некоторые соединения, раскрытые в этом документе, могут существовать в форме одного или более стереоизомеров. Различные стереоизомеры включают геометрические изомеры, диастереомеры, и энантиомеры. Таким образом, соединения, раскрытые в этом изобретении, включают рацемические смеси, индивидуальные стереоизомеры, и оптически активные смеси. Специалистам в данной области будет ясно, что один стереоизомер может быть более активным, чем другие. Индивидуальные стереоизомеры и оптически активные смеси могут быть получены по методикам селективного синтеза, по методикам обычно применяемого синтеза с использованием выделенных/разделенных исходных веществ, или по обычно применяемым методикам разделения.
НАСЕКОМЫЕ-ВРЕДИТЕЛИ
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Phylum Nematoda (тип Nematoda).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Phylum Arthropoda (тип членистоногие).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Subphylum Chelicerata (подтип Chelicerata).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Class Arachnida (класс паукообразные).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Subphylum Myriapoda (подтип многоножки).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Class Symphyla (Класс Симфилы).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Subphylum Hexapoda (подтип шестиножки).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Class Insecta (Класс Насекомых).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Coloptera (отряд жуки). Неисчерпывающий перечень этих вредителей включает Acanthoscelides spp. (долгоносики), Acanthoscelides obtectus (зерновка фасолевая), Agrilus planipennis (жук-точильщик или жук-короед, губительный для ясеня), Agriotes spp. (проволочники), Anoplophora glabripennis (азиатский усач), Anthonomus spp. (долгоносики-цветоеды), Anthonomus grandis (долгоносик хлопковый), Aphidius spp., Apion spp. (клеверные долгоносики-семяеды и клеверные стеблееды), Apogonia spp. (червовидная личинка), Ataenius spretulus (черные навозники), Atomaria linearis (крошка свекловичная), Aulacophore spp., Bothynoderes punctiventris (долгоносик свекловичный), Bruchus spp. (зерновки-брухусы), Brucchus pisorum (зерновка гороховая), Cacoesia spp., Callosobruchus maculatus (зерновка четырехпятнистая), Carpophilus hemipteras (блестянка полужесткокрылая), Cassida vittata, Cerosterna spp., Cerotoma spp. (листоеды), Cerotoma trifurcate (жук-листоед), Ceutorhynchus spp. (скрытнохоботники семенные), Ceutorhynchus assimilis (рапсовый семенной скрытнохоботник), Ceutorhynchus napi (скрытнохоботник репный), Chaetocnema spp. (листоеды), Colaspis spp. (почвенные жуки), Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar (плодовый долгоносик), Cotinus nitidis (хрущ блестящий зеленый), Crioceris asparagi (трещалка спаржевая), Cryptolestes ferrugineus (мукоед рыжий), Cryptolestes pusillus (мукоед крошечный), Cryptolestes turcicus (мукоед турецкий), Ctenicera spp. (проволочники), Curculio spp. (долгоносики/слоники), Cyclocephala spp. (червовидные личинки жука), Cylindrocpturus adspersus (скрытнохоботник стеблевой на подсолнечнике), Deporaus marginatus (манговые долгоносики-листорезы), Dermestes lardarius (кожеед ветчинный), Dermestes maculates (кожеед пятнистый), Diabrotica spp. (chrysolemids), Epilachna varivestis (Мексиканская зерновка бобовая), Faustinus cubae, Hylobius pales (жук-долгоносик), Hypera spp. (долгоносики/слоники), Hypera postica (жук-долгоносик), Heperdoes spp. (долгоносик-Hyperodes), Hypothenemus hampei (жук кофейный), Ips spp. (короед), Lasioderma serricorne (жук табачный), Leptinotarsa decemlineata (колорадский картофельный жук), Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus (долгоносик рисовый водяной), Lyctus spp. (древоточцы/жуки-древогрызы), Maecolaspis joliveti, Megascelis spp., Melanotus communis, Meligethes spp., Meligethes aeneus (цветоед рапсовый), Melolontha melolontha (хрущ майский западный), Oberea brevis, Oberea linearis, Oryctes rhinoceros (жук финиковой пальмы), Oryzaephilus mercator (плоскотелка арахисовая), Oryzaephilus surinamensis (мукоед суринамский), Otiorhynchus spp. (долгоносики), Oulema melanopus (пьявица красногрудая), Oulema oryzae, Pantomorus spp. (долгоносики), Phyllophaga spp. (майский жук), Phyllophaga cuyabana, Phyllotreta spp. (листоеды), Phynchites spp., Popillia japonica (хрущик японский), Prostephanus truncates (капюшонник), Rhizopertha dominica (точильщик зерновой), Rhizotrogus spp. (корнегрызы - Amphimallon majalis), Rhynchophorus spp. (пальмовые долгоносики), Scolytus spp. (короеды), Shenophorus spp. (долгоносик), Sitona lineatus (слоник гороховый полосатый), Sitophilus spp. (долгоносик амбарный зерновой), Sitophilus granaries (амбарный долгоносик обыкновенный), Sitophilus oryzae (долгоносик рисовый), Stegobium paniceum (точильщик хлебный), Tribolium spp. (хрущак большой мучной), Tribolium castaneum (хрущак каштановый), Tribolium confusum (хрущак малый мучной), Trogoderma variabile (трогодерма изменчивая) и Zabrus tenebioides, но не ограничивается этим.
В другом варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с сельскохозяйственными вредителями Dermaptera (уховертки (кожистокрылые)).
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомым-вредителем Dictyoptera (тараканы). Неисчерпывающий перечень этих насекомых-вредителей включает Blattella germanica (прусак (таракан рыжий)), Blatta orientalis (таракан черный), Parcoblatta pennylvanica (таракан древесин Пенсильвании), Periplaneta americana (таракан американский), Periplaneta australoasiae (таракан австралийский), Periplaneta brunnea (коричневый таракан), Periplaneta fuliginosa (таракан Smokybrown), Pyncoselus suninamensis (таракан Суринама) и Supella longipalpa (таракан с коричневыми полосами), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Diptera (истинные мухи). Неисчерпывающий перечень этих насекомых-вредителей включает Aedes spp. (кусаки), Agromyza frontella (моль-пестрянка люценовая), Agromyza spp. (минирующие мушки), Anastrepha spp. (плодовые мушки), Anastrepha suspensa (Карибская фруктовая мошка), Anopheles spp. (комары), Batrocera spp. (плодовые мушки), Bactrocera cucurbitae (дынная муха), Bactrocera dorsalis (восточная плодовая мушка), Ceratitis spp. (плодовые мушки), Ceratitis capitata (средиземноморская плодовая муха), Chrysops spp. (оленьи слепни), Cochliomyia spp. (личинки мясной мухи), Contarinia spp. (галлицы), Culex spp. (комары-кулексы), Dasineura spp. (галлицы), Dasineura brassicae (галлицы капустные), Delia spp., Delia platura (личинка мухи ростковой), Drosophila spp. (дрозофилы), Fannia spp. (милихииды (комнатные мухи)), Fannia canicularis (муха комнатная малая), Fannia scalaris (муха лестничная), Gasterophilus intestinalis (желудочный овод), Gracillia perseae, Haematobia irritans (жигалка коровья малая), Hylemyia spp. (капустные мухи), Hypoderma lineatum (личинка бычьего полосатого овода), Liriomyza spp. (листовые минирующие мушки), Liriomyza brassica (минер крестоцветный), Melophagus ovinus (рунец овечий), Musca spp. (настоящие мухи), Musca autumnalis (муха обыкновенная полевая), Musca domestica (муха комнатная), Oestrus ovis (овод овечий полостной), Oscinella frit (мушка шведская), Pegomyia betae (муха свекловичная), Phorbia spp., Psila rosae (муха морковная), Rhagoletis cerasi (муха вишневая), Rhagoletis pomonella (личинка пестрокрылки яблонной), Sitodiplosis mosellana (галлица злаковая оранжевая), Stomoxys calcitrans (жигалка осенняя (обыкновенная)), Tabanus spp. (слепни) и Tipula spp. (долгоножки), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Hemiptera (клопы настоящие полужесткокрылые). Неисчерпывающий перечень этих насекомых-вредителей включает Acrosternum hilare (щитники), Blissus leucopterus (клоп-черепашка пшеничный североамериканский), Calocoris norvegicus (клопик картофельный), Cimex hemipterus (тропический постельный клоп), Cimex lectularius (постельный клоп), Dagbertus fasciatus, Dichelops furcatus, Dysdercus suturellus (красноклоп хлопковый), Edessa meditabunda, Eurygaster maura (черепашка таврская), Euschistus heros, Euschistus servus (растительноядный клоп), Helopeltis antonii, Helopeltis theivora (слепняк чайный индийский), Lagynotomus spp. (stink bugs), Leptocorisa oratorius, Leptocorisa varicornis, Lygus spp. (травяные клопы), Lygus hesperus (западный клоп травяной), Maconellicoccus hirsutus, Neurocolpus longirostris, Nezara viridula (личинки хлопково-огородного клопа (зеленый овощной клоп)), Phytocoris spp. (слепняки), Phytocoris californicus, Phytocoris relativus, Piezodorus guildingi, Poecilocapsus lineatus (клоп четырехполосный травяной), Psallus vaccinicola, Pseudacysta perseae, Scaptocoris castanea и Triatoma spp. (триатомовые клопы: кровососущие конусоносные клопы/поцелуйные клопы), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Homoptera (тли, кокциды, белокрылки, кобылочки). Неисчерпывающий перечень этих насекомых-вредителей включает Acrythosiphon pisum (тля гороховая), Adelges spp. (хермесы), Aleurodes proletella (белокрылка капустная), Aleurodicus disperses, Aleurothrixus floccosus (шерстистая белокрылка), Aluacaspis spp., Amrasca bigutella bigutella, Aphrophora spp. (кобылочки, цикадки), Aonidiella aurantii (щитовка красная померанцевая), Aphis spp. (афиды, тли), Aphis gossypii (тля бахчевая или хлопковая), Aphis pomi (тля яблонная), Aulacorthum solani (тля картофельная обыкновенная), Bemisia spp. (белокрылки), Bemisia argentifolii, Bemisia tabaci (табачная или хлопковая белокрылка), Brachycolus noxius (русская пшеничная тля), Brachycorynella asparagi (тля спаржевая), Brevennia rehi, Brevicoryne brassicae (тля капустная), Ceroplastes spp. (щитовки), Ceroplastes rubens (ложнощитовка рубиновая), Chionaspis spp. (щитовки), Chrysomphalus spp. (щитовки), Coccus spp. (щитовки), Dysaphis plantaginea (тля яблоневая розовая), Empoasca spp. (цикада зеленая), Eriosoma lanigerum (тля яблонная кровяная), Icerya purchasi (червец австралийский желобчатый), Idioscopus nitidulus (манговая цикадка), Laodelphax striatellus (цикада темная), Lepidosaphes spp., Macrosiphum spp., Macrosiphum euphorbiae (тля картофельная большая), Macrosiphum granarium (тля злаковая), Macrosiphum rosae (тля резанная большая), Macrosteles quadrilineatus (цикадка), Mahanarva frimbiolata, Metopolophium dirhodum (тля розанно-злаковая), Mictis longicornis, Myzus persicae (тля персиковая зеленая), Nephotettix spp. (блохи листьев риса), Nephotettix cinctipes (цикадка зеленая), Nilaparvata lugens (дельфацид коричневый рисовый), Parlatoria pergandii (щитовка цитрусовая фиолетовая), Parlatoria ziziphi (щитовка черная), Peregrinus maidis (цикада кукурузная), Philaenus spp. (пенницы слюнявые), Phylloxera vitifoliae (филлоксера виноградная листовая), Physokermes piceae (ложнощитовка еловая малая), Planococcus spp. (мучнистые червецы), Pseudococcus spp. (войлочники или ложноподушечницы), Pseudococcus brevipes (мучнистый червец ананасовый), Quadraspidiotus perniciosus (щитовка калифорнийская), Rhapalosiphum spp. (тли), Rhapalosiphum maida (тля кукурузная), Rhapalosiphum padi (тля черемуховая обыкновенная), Saissetia spp. (щитовки, червецы), Saissetia oleae (ложнощитовка маслинная или червец оливковый), Schizaphis graminum (тля злаковая обыкновенная), Sitobion avenae (большая злаковая тля), Sogatella furcifera (цикадка белоспинная), Therioaphis spp. (бородавчатая тля), Toumeyella spp. (червецы), Toxoptera spp. (тли), Trialeurodes spp. (белокрылки), Trialeurodes vaporariorum (тепличная белокрылка), Trialeurodes abutiloneus (белокрылка с полосатыми крыльями), Unaspis spp. (щитовки), Unaspis yanonensis (щитовка цитрусовая восточная) и Zulia entreriana, но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Hymenoptera (муравьи, осы, и пчелы). Неисчерпывающий перечень этих насекомых-вредителей включает Acromyrrmex spp., Athalia rosae, Atta spp. (муравей зонтичный или муравей-листорез), Camponotus spp. (муравей-древоточец), Diprion spp. (пилильщики), Formica spp. (муравьи), Iridomyrmex humilis (муравей аргентинский), Monomorium ssp., Monomorium minumum (муравей малый), Monomorium pharaonis (муравей фараонов), Neodiprion spp. (пилильщики), Pogonomyrmex spp. (муравей-жнец), Polistes spp. (бумажная оса), Solenopsis spp. (муравей огненный), Tapoinoma sessile (пахучий домашний муравей), Tetranomorium spp. (муравей дерновый), Vespula spp. (оса обыкновенная) и Xylocopa spp. (пчела-плотник), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Isoptcra (термиты). Неисчерпывающий перечень этих насекомых-вредителей включает Coptotermes spp., Coptotermes curvignathus, Coptotermes frenchii, Coptotermes formosanus (тайваньский желтоногий термит), Cornitermes spp. (термит-солдат с рострумом), Cryptotermes spp. (древоядные термиты), Heterotertnes spp. (термиты пустынные), Heterotermes aureus, Kalotermes spp. (древоядные термиты), Incistitermes spp. (древоядные термиты), Macrotermes spp. (термит-грибовод), Marginitermes spp. (древоядные термиты), Microcerotermes spp. (термиты-жнецы), Microtermes obesi, Procornitermes spp., Reticulitermes spp. (подземные термиты), Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes (восточный подземный термит), Reticulitermes hageni, Reticulitermes hesperus (западный подземный термит), Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis, Reticulitermes virginicus, Schedorhinotermes spp. и Zootermopsis spp. (древесные термиты), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Lepidoptera - чешуекрылые (мотылки и бабочки). Неисчерпывающий перечень этих насекомых-вредителей включает Achoea janata, Adoxophyes spp., Adoxophyes orana, Agrotis spp. (совки), Agrotis ipsilon (совка-ипсилон), Alabama argillacea (совка хлопковая американская), Amorbia cuneana, Amyelosis transitella (navel orangeworm), Anacamptodes defectaria, Anarsia lineatella (моль фруктовая полосатая), Anomis sabulifera (джутовая пяденица - jute looper), Anticarsia gemmatalis (совка (velvetbean caterpillar)), Archips argyrospila (листовертка плодовых деревьев), Archips rosana (листовертка резанная золотистая), Argyrotaenia spp. (листовертки), Argyrotaenia citrana (листовертка цитрусовая), Autographa gamma, Bonagota cranaodes, Borbo cinnara (огневка рисовая), Bucculatrix thurberiella (мотылек семейства Bucculatricidae - cotton leaf perforator), Caloptilia spp. (листовые минеры), Capua reticulana, Carposina niponensis (персиковая плодожорка), Chilo spp., Chlumetia transversa (побеговая моль - mango shoot borer), Choristoneura rosaceana (листовертка - oblique banded leaf roller), Chrysodeixis spp., Cnaphalocerus medinalis (листовертка - grass leafroller), Colias spp., Conpomorpha cramerella, Cossus cossus (бабочка-древоточец), Crambus spp. (шашени -Sod webworms), Cydia funebrana (сливовая плодожорка), Cydia molesta (восточная плодожорка), Cydia nignicana (гороховая плодожорка), Cydia pomonella (яблонная плодожорка), Darna diducta, Diaphania spp. (стеблевые точильщики), Diatraea spp. (виды огневок), Diatraea saccharalis (тростниковая огневка), Diatraea graniosella (огневка кукурузная юго-западная), Earias spp. (виды хлопковых совок), Earias insulata (шиповатый червь совки), Earias vitella (коробочный червь), Ecdytopopha aurantianum, Elasmopalpus lignosellus (огневка - lesser cornstalk borer), Epiphysias postruttana (моль яблоневая светло-коричневая), Ephestia spp. (виды огневок - flour moths), Ephestia cautella (огневка сухофруктовая), Ephestia elutella (огневка табачная), Ephestia kuehniella (огневка мельничная), Epimeces spp., Epinotia aporema, Erionota thrax (банановая толстоголовка), Eupoecilia ambiguella (вертунья виноградная), Euxoa auxiliaris (гусеница бабочки-совки эуксоа), Feltia spp. (гусеница бабочки-совки Feltia), Gortyna spp. (виды стеблевых точильщиков), Grapholita molesta (плодожорка восточная персиковая), Hedylepta indicata (bean leaf webber), Helicoverpa spp. (совки), Helicoverpa armigera (хлопковая совка), Helicoverpa zea (коробочный червь/совка хлопковая), Heliothis spp. (совки), Heliothis virescens (совка табачная), Hellula undalis (гусеница огневки капустной), Indarbela spp. (корнееды), Keiferia lycopersicella (томатная листовая минирующая моль), Leucinodes orbonalis (пилильщик баклажанный), Leucoptera malifoliella, Lithocollectis spp., Lobesia botrana (листовертка гроздевая), Loxagrotis spp. (совки рода Loxagrotis), Loxagrotis albicosta (совки рода loxagrotis), Lymantria dispar (шелкопряд непарный), Lyonetia clerkella (моль яблонная минирующая), Mahasena corbetti (мешочница рода Mahasena), Malacosoma spp. (коконопряд кольчатый), Mamestra brassicae (капустная совка), Maruca testulalis (огневка рода Maruca), Metisa plana (мешочница рода Metisa), Mythimna unipuncta (гусеница совки рода Mythimna), Neoleucinodes elegantalis (огневка), Nymphula depunctalis (куколка или кокон в свернутом листе риса), Operophthera brumata (зимняя пяденица), Ostrinia nubilalis (огневка кукурузная), Oxydia vesulia, Pandemis cerasana (листовертка обычная смородинная), Pandemis heparana (ивовая кривоусая листовертка), Papilio demodocus, Pectinophora gossypiella (розовый коробочный червь хлопчатника), Peridroma spp. (совки), Peridroma saucia (совка маргаритковая), Perileucoptera coffeella (минирующая моль), Phthorimaea operculella (моль картофельная клубневая), Phyllocnisitis citrella, Phyllonorycter spp. (минирующие моли), Pieris rapae (гусеница репницы), Plathypena scabra, Plodia interpunctella (южная амбарная огневка), Plutella xylostella (капустная моль), Polychrosis viteana (листовертка виноградная), Prays endocarpa, Prays oleae (маслинная моль), Pseudaletia spp. (совки), Pseudaletia unipunctata (совка луговая), Pseudoplusia includens (пяденица), Rachiplusia nu, Scirpophaga incertulas, Sesamia spp. (стеблевые точильщики), Sesamia inferens (розовый стеблевой точильщик), Sesamia nonagrioides, Setora nitens, Sitotroga cerealella (моль ячменная или зерновая), Sparganothis pilleriana, Spodoptera spp. (совки), Spodoptera exigua (свекловичная совка), Spodoptera frugiperda (совка травяная), Spodoptera oridania (южная совка), Synanthedon spp. (корнееды, стеклянницы), Thecla basilides, Thermisia gemmatalis, Tineola bisselliella (моль комнатная, мебельная), Trichoplusia ni (совка ни), Tuta absoluta, Yponomeuta spp., Zeuzera coffeae (древесница мино-муси) и Zeuzera pyrina (древесница въедливая), но не ограничивается этим.
В одном варианте осуществления, изобретение, раскрытое в этом документе, может быть использовано для борьбы с насекомыми-вредителями Mallophaga (власоеды, пухоеды, пероеды). Неисчерпывающий перечень этих насекомых-вредителей включает Bovicola ovis (власоед овечий), Menacanthus stramineus (пухоед двухщетинковый куриный) и Menopon gallinea (пухоед бледный куриный), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Orthoptera - ортоптероидные, прыгающие прямокрылые (кузнечики, саранча, прыгунчики, кобылки, и сверчки). Неисчерпывающий перечень этих насекомых-вредителей включает Anabrus simplex (большой темный бескрылый зеленый кузнечик), Gryllotalpidae (медведки), Locusta migratoria, Melanoplus spp. (кобылки), Microcentrum retinerve (кузнечик углокрылый), Pterophylla spp. (кузнечики), chistocerca gregaria, Scudderia furcata (кузнечик вилохвостый) и Valanga nigricorni, но не ограничивается этим.
В другом варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Phthiraptera (вши). Неисчерпывающий перечень этих насекомых-вредителей включает Haematopinus spp. (вши рода кровососущих крупного и мелкого рогатого скота и свиней), Linognathus ovillus (вошь овечья), Pediculus humanus capitis (вошь головная), Pediculus humanus humanus (вши платяные) и Pthirus pubis (вошь лобковая), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Siphonaptera (блохи). Неисчерпывающий перечень этих насекомых-вредителей включает Ctenocephalides canis (блоха собачья), Ctenocephalides felis (кошачья блоха) и Pulex irritans (блоха человеческая), но не ограничивается этим.
В другом варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Thysanoptera (бахромчатокрылые, пузыреногие, трипсы). Неисчерпывающий перечень этих насекомых-вредителей включает Frankliniella fusca (табачный трипс), Frankliniella occidentalis (западный цветочный трипс), Frankliniella shultzei Frankliniella williamsi (кукурузный трипс), Heliothrips haemorrhaidalis (трипс тепличный), Riphiphorothrips cruentatus, Scirtothrips spp., Scirtothrips citri (трипс цитрусовый), Scirtothrips dorsalis (трипс желтый чайный), Taeniothrips rhopalantennalis и Thrips spp., но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Thysanura (щетинохвостки). Неисчерпывающий перечень этих насекомых-вредителей включает Lepisma spp. (чешуйница) и Thermobia spp. (термобия), но не ограничивается этим.
В другом варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Acarina (клещи и зудни). Неисчерпывающий перечень этих насекомых-вредителей включает Acarapsis woodi (трахеальный клещ медоносных пчел), Acarus spp. (тироглифоидные (амбарные, хлебные) клещи), Acarus siro (зерновой клещ), Aceria mangiferae (манговый клещик), Aculops spp., Aculops lycopersici (ржавый томатный клещ), Aculops pelekasi, Aculus pelekassi, Aculus schlechtendali (яблоневый бурый клещ), Amblyomma americanum (клещ-тик Lone Star), Boophilus spp. (клещи), Brevipalpus obovatus (красный оранжерейный клещ), Brevipalpus phoenicis (клещ-плоскотелка), Demodex spp. (чесоточные клещи рода Демодекс), Dermacentor spp. (клещи с твердым покровом рода Дермацентор), Dermacentor variabilis (иксодовый клещ собачий изменчивый), Dermatophagoides pteronyssinus (клещ домашней пыли), Eotetranycus spp., Eotetranychus carpini (желтый грабовый паутинный клещ), Epitimerus spp., Eriophyes spp., Ixodes spp. (клещи рода Иксодес), Metatetranycus spp., Notoedres cati, Oligonychus spp., Oligonychus coffee, Oligonychus ilicus (клещик паутинный южный), Panonychus spp., Panonychus citri (красный цитрусовый клещ), Panonychus ulmi (клещ красный плодовый), Phyllocoptruta oleivora (цитрусовый ржавчинный клещ), Polyphagotarsonemun latus (оранжерейный прозрачный клещ), Rhipicephalus sanguineus (коричневый собачий клещ), Rhizoglyphus spp. (клещи корневые), Sarcoptes scabiei (клещ чесоточный, зудень чесоточный), Tegolophus perseaflorae, Tetranychus spp., Tetranychus urticae (обыкновенный паутинный клещ) и Varroa destructor (паразитический варриатозный клещ медоносных пчел рода Варроа), но не ограничивается этим.
В еще одном варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями Nematoda (нематоды - тип первичнополостных червей). Неисчерпывающий перечень этих насекомых-вредителей включает Aphelenchoides spp. (паразитические листовые и почковые нематоды хвойных пород), Belonolaimus spp. (жалящие нематоды), Criconemella spp. (кольчатые нематоды), Dirofilaria immitis (сердечный червь у собак), Ditylenchus spp. (стеблевая и луковичная нематоды), Heterodera spp. (цистообразующие нематоды), Heterodera zeae (кукурузная цистообразующая нематода), Hirschmanniella spp. (корневые нематоды), Hoplolaimus spp. (нематоды-ланцетники), Meloidogyne spp. (клубеньковые нематоды), Meloidogyne incognita (клубеньковая нематода incognita), Onchocerca volvulus (паразитический червь с круто изогнутым хвостом, вызывающий онхоцеркоз), Pratylenchus spp. (корневые нематоды рода Pratylenchus), Radopholus spp. (земляные нематоды) и Rotylenchus reniformis (почковидная нематода), но не ограничивается этим.
В другом варианте осуществления, изобретение, раскрытое в этом документе, может быть применено для борьбы с насекомыми-вредителями класса Симфила (symphylans). Неисчерпывающий перечень этих насекомых-вредителей включает многоножки Scutigerella immaculate, но не ограничивается этим.
Более подробную информацию можно получить в справочнике: Arnold Mallis "Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests", 9-ое издание, издательское право GIE Media Inc. (2004).
СМЕСИ
Изобретение, раскрытое в этом документе, также может быть применено совместно с различными инсектицидами, как с целью экономии, так и с целью получения эффекта синергии. Такие инсектициды включают антибиотические инссектициды, инсектициды на основе макроциклического лактона (например, авермектиновые инсектициды, милбемициновые инсектициды, и спинозиновые инсектициды), содержащие мышьяк инсектициды, инсектициды растительного происхождения, карбаматные инсектициды (например, бензофуранил-метилкарбаматные инсектициды, диметил-карбаматные инсектициды, оксим-карбаматные инсектициды, и фенил-метил-карбаматные инсектициды), диамидные инсектициды, десиккантные инсектициды, динитро-фенольные инсектициды, фторсодержащие инсектициды, формамидиновые инсектициды, фумигантные инсектициды, неорганические инсектициды, регуляторы развития насекомых (например, ингибиторы синтеза хитина, аналоги ювенильных гормонов, ювенильные гормоны, агонисты гормона линьки, гормоны линьки, ингибиторы линьки, прекоцены, и другие неклассифицированные регуляторы развития насекомых), инсектициды на основе аналогов нереистоксина, аналогичные инсектициды, никотиноидные инсектициды (например, нитрогуанидиновые инсектициды, нитрометиленовые инсектициды, и пиридилметиламинсодержащие инсектициды), хлорорганические инсектициды, фосфорорганические инсектициды, оксадиазиновые инсектициды, оксадиазолон-содержащие инсектициды, фталимидные инсектициды, пиразольные инсектициды, пиретроидные инсектициды, аминопиримидиновые инсектициды, пиррол-содержащие инсектициды, инсектициды на основе тетрамовой кислоты, инсектициды на основе тетроновых кислот, тиазоловые инсектициды, тиазолидиновые инсектициды, тиомочевиновые инсектициды, мочевиновые инсектициды, а также другие неклассифицированные инсектициды, но не граничиваются этим.
Некоторые из конкретных инсектицидов, которые могут быть благотворно (с пользой) применены в комбинации с изобретением, раскрытым в этом документе, включают следующее: 1,2-дихлорпропан, 1,3-дихлорпропен, абамектин, ацефат, ацетамиприд, ацетион, ацетопрол, акринатрин, акрилонитрил, аланикарб, алдикарб, алдоксикарб, алдрин, аллетрин, аллозамидин, алликсикарб, альфа-циперметрин, альфа-эндосульфан, амидитион, аминокарб, амитон, амитраз, анабазин, атидатион, азадирахтин, азаметифос, азинфос-этил, азинфос-метил, азотоат, гексафторсиликат бария, бартрин, бендиокарб, бенфуракарб, бенсултап, бета-цифлутрин, бета-циперметрин, бифентрин, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бистрифлурон, боракс, борная кислота, ортоборная кислота, бромфенвинфос, бромоциклен, бром-ДДТ, бромофос, бромофос-этил, буфенкарб, бупрофезин, бутакарб, бутатиофос, бутокарбоксим, бутонат, бутоксикарбоксим, кадусафос, арсенат кальция, полисульфид кальция, камфехлор, карбанолат, карбарил, карбофуран, карбондисульфид, карбонтетрахлорид, карбофенотион, карбосульфан, картап, хлорантранилипрол, хлорбициклен, хлордан, хлордекон, хлордимеформ, хлортоксифос, хлорфенапир, хлорфенвинфос, хлорфлуазурон, хлормефос, хлороформ, хлорпикрин, хлорфоксим, хлорпразофос, хлорпирифос, хлорпирифос-метил, хлортиофос, хромафенозид, цинерин I, цинерин II, цисметрин, клоэтокарб, клозантел, клотианидин, ацетоарсенит меди, арсенат меди, нафтенат меди, олеат меди, кумафос, кумитоат, кротамитон, кротоксифос, круфомат, криолит, цианофенфос, цианофос, циантоат, циантранилипрол, циклетрин, циклопротрин, цифлутрин, цигалотрин, циперметрин, цифенотрин, циромазин, цитиоат, ДДТ, декарбофуран, делтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, диафентиурон, диалифос, диатомовую землю, диазинон, дикаптон, дихлофентион, дихлорвос, дикрезил, дикротофос, дицикланил, диелдрин, дифлубензурон, дилор, димефлутрин, димефокс, диметан, диметоат, диметрин, диметилвинфос, диметилан, динекс, динопроп, диносам, динотефуран, диофенолан, диоксабензофос, диоксакарб, диоксатион, дисульфотон, дитикрофос, d-лимонен, динитро-о-крезол, дорамектин, экдистерон, эмамектин, EMPC, эмпентрин, эндосульфан, эндотион, эндрин, энтомопатогенную нематоду (EPN), эпофенонан, эприномектин, эсфенвалерат, этафос, этиофенкарб, этион, этипрол, этоат-метил, этопрофос, этилформиат, этил-ДДД, этилен-дибромид, этилен-дихлорид, этиленоксид, этофенпрокс, этримфос, этилксантоген-дисульфид (EXD), фамфур, фенамифос, феназафлор, фенхлорфос, фенетакарб, фенфлутрин, фенитротион, фенобукарб, феноксакрим, феноксикарб, фенпиритрин, фенпропатрин, фенсульфотион, фентион, фентион-этил, фенвалерат, фипронил, флоникамид, флубендиамид, флукофурон, флуциклоксурон, флуцитринат, флуфенерим, флуфеноксурон, флуфенпрокс, флувалинат, фонофос, форметанат, формотион, формпаранат, фосметилан, фоспират, фостиэтан, фуратиокарб, фуретрин, гамма-цигалотрин, гамма-HCH, галфенпрокс, галофенозид, гексахлорциклогексан (HCH), HEOD, гептахлор, гептенофос, гетерофос, гексафлумурон, алдрин (HHDN), гидраметилнон, цианид водорода (синильная кислота), гидропрен, хиквинкарб, имидаклоприд, имипротрин, индоксакарб, йодметан, IPSP, исазофос, изобензан, изокарбофос, изодрин, изофенфос, изопрокарб, изопротиолан, изотиоат, изоксатион, ивермектин, жасмолин I, жасмолин II, йодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, келеван, кинопрен, лямбда-цигалотрин, арсенат свинца, лепимектин, лептофос, линдан, лиримфос, луфенурон, литидатион, малатион, малонобен, мазидокс, мекарбам, мекарфон, меназон, мефосфолан, хлорид ртути, месулфенфос, метафлумезон, метакрифос, метамидофос, метидатион, метиокарб, метокротофос, метомил, метопрен, метоксихлор, метоксифенозид, метилбромид, метилхлороформ, метиленхлорид, метофлутрин, метолкарб, метоксадиазон, мевинфос, мексакарбат, милбемектин, милбемицин-оксим, мипафокс, мирекс, монокротофос, морфотион, моксидектин, нафталофос, налед, нафталин, никотин, нифлуридид, нитенпирам, нитиазин, нитрилакарб, новалурон, новифлумурон, ометоат, оксамил, оксидеметон-метил, оксидепрофос, оксидисульфотон, пара-дихлорбензол, паратион, паратион-метил, пенфлурон, пентахлорфенол, перметрин, фенкаптон, фенотрин, фентоат, форат, фозалон, фосфолан, фосмет, фоснихлор, фосфамидон, фосфин, фоксим, фоксим-метил, пириметафос, пиримикарб, пиримифос-этил, пиримифос-метил, арсенит калия, тиоцианат калия, дихлордифенилтрихлорметилметан (pp'-DDT), праллетрин, прекоцен I, прекоцен II, прекоцен III, примидофос, профенофос, профлутрин, промацил, промекарб, пропафос, пропетамфос, пропоксур, протидатион, протиофос, протоат, протрифенбут, пираклофос, пирафлупрол, пиразофос, пиресметрин, пиретрин I, пиретрин II, пиридабен, пиридалил, пиридафентион, пирифлухиназон, пиримидифен, пиримитат, пирипрол, пирипроксифен, квассию, хиналфос, хиналфос-метил, хинотион, рафоксанид, ресметрин, ротенон, рианию, сабадиллу, скрадан, селамектин, силафлуофен, силикагель, арсенит натрия, фторид натрия, гексафторсиликат натрия, тиоцианат натрия, софамид, спинеторам, спиносад, спиромесифен, спиротетрамат, сулкофурон, сульфоксафлор, сулфлурамид, сульфотеп, сульфурил-фторид, сулпрофос, тау-флувалинат, тазимкарб, тетрахлордифенилэтан (TDE), тебуфенозид, тебуфенпирад, тебупиримфос, тефлубензурон, тефлутрин, темефос, тетраэтилпирофосфат (TEPP), тераллетрин, тербуфос, тетрахлорэтан, тетрахлорвинфос, тетраметрин, тета-циперметрин, тиаклоприд, тиаметоксам, тикрофос, тиокарбоксим, тиоциклам, тиодикарб, тиофанокс, тиометон, тиосултап, турингиенсин, толфенпирад, тралометрин, трансфлутрин, трансперметрин, триаратен, триазамат, триазофос, трихлорфон, трихлорметафос-3, трихлоронат, трифенофос, трифлумурон, триметакарб, трипрен, вамидотион, ванилипрол, XMC, ксилилкарб, зета-циперметрин, золапрофос, и альфа-экдисон, но не ограничиваются этим.
Кроме того, может быть применена любая комбинация вышеупомянутых инсектицидов.
Изобретение, раскрытое в этом документе, также может быть применено, с целью достижения экономии и эффекта синергии, совместно с акарицидами, альгицидами, антифидантами, авицидами, бактерицидами, средствами для отпугивания птиц, хемостерилянтами, фунгицидами, антидотами для гербицидов, гербицидами, приманками для насекомых, средствами для отпугивания насекомых (репеллентами), средствами для отпугивания млекопитающих, средствами нарушения функции спаривания, моллюскоцидами, активаторами защитных реакций растений, регуляторами развития растений, родентицидами, синергистами, дефолиантами, высушивающими средствами (дессикантами), дезинфицирующими средствами, химическими сигнальными веществами, и вирусоцидами (эти категории не обязательно являются взаимоисключающими).
За дополнительной информацией можно обратиться к руководству "Compendium of Pesticide Common Names", размещенному на сайте: http://www.alanwood.net/pesticides/index.html. Также можно обратиться к справочнику: "The Pesticide Manual" 14th Edition, под редакцией C D S Tomlin, издательское право 2006 - British Crop Production Council.
СИНЕРГЕТИЧЕСКИЕ СМЕСИ
Изобретение, раскрытое в этом документе, может быть применено совместно с другими соединениями, такими как соединения, упомянутые в разделе "Смеси", с получением синергетических смесей, где механизм (способ) действия соединений в смесях является аналогичным, подобным, или различным.
Примеры механизма действия включают: ингибитор ацетилхолинэстеразы; модулятор натриевых каналов; ингибитор биосинтеза хитина; антагонист ГАМК-зависимых хлоридных каналов; антагонист ГАМК- и глутамат-зависимых хлоридных каналов; агонист ацетилхолинового рецептора; ингибитор MET I; ингибитор Mg-стимулированной ATФазы (аденозинтрифосфатазы); никотиновый ацетилхолиновый рецептор; дизраптер мембран средней кишки насекомого; прерыватель окислительного фосфорилирования, и рецептор рианодина (RyRs), но не ограничиваются этим.
Кроме того, следующие соединения: пиперонил-бутоксид, пипротал, пропилизом, сезамекс, сезамолин и сульфоксид, известны как синергисты и могут быть использованы совместно с соединением изобретения, раскрытым в этом документе.
СОСТАВЫ
Пестицид редко подходит для применения в его чистой форме. Обычно его необходимо добавлять к другим веществам таким образом, чтобы пестицид мог быть использован в требуемой концентрации и в приемлемой форме, позволяющей легко наносить, манипулировать им, транспортировать, хранить пестицид и получить максимальную активность пестицида. Так, пестициды составляют в смеси с получением, например, приманок, концентрированных эмульсий, пылевидных препаратов, эмульгируемых концентратов, фумигантов, гелей, гранул, микроинкапсулированных препаратов, препаратов для протравливания семян, суспензионных концентратов, суспоэмульсий, таблеток, водорастворимых жидкостей, диспергируемых в воде гранул или сыпучих препаратов, смачиваемых порошков, и ультрамалообъемных растворов.
Для дополнительной информации по типам составов обращайтесь к каталогу «Catalogue of Pesticide Formulation Types and International Coding System» Техническая монография No.2, 5-ое издание, CropLife International (2002).
Пестициды применяют наиболее часто в виде водных суспензий или эмульсий, приготовленных из концентрированных составов таких пестицидов. Такие водорастворимые, суспендируемые в воде, или эмульгируемые составы, представляют собой либо твердые вещества, обычно называемые как смачиваемые порошки, или диспергируемые в воде гранулы, или жидкости, обычно известные как эмульгируемые концентраты, или водные суспензии. Смачиваемые порошки, которые могут быть спрессованы с получением диспергируемых в воде гранул, включают однородную смесь пестицида, носителя, и поверхностно-активных веществ. Концентрация пестицида обычно составляет от приблизительно 10% до приблизительно 90% мас.. Носитель обычно выбирают из числа аттапульгитовых глин, монтмориллонитовых глин, диатомовых земель, или очищенные силикаты. Эффективные поверхностно-активные вещества, содержащиеся в количестве от приблизительно 0,5% до приблизительно 10% относительно смачиваемого порошка, находят из числа сульфонированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов, и неионогенных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгируемые концентраты пестицидов имеют подходящую концентрацию пестицида, такую как от приблизительно 50 до приблизительно 500 грамм на литр жидкости, который растворен в носителе, представляющем собой либо смешивающийся с водой растворитель либо смесь несмешивающегося с водой органического растворителя и эмульгаторов. Полезные органические растворители включают ароматические вещества, в особенности ксилолы и фракции нефти, особенно высококипящие нафталиновые и олефиновые порции нефти, такие как тяжелый лигроин, обогащенный ароматическими соединениями. Также могут быть использованы другие органические растворители, такие как терпеновые растворители, включающие дериваты канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгируемых концентратов выбирают из подходящих анионных и неионогенных поверхностно-активных веществ.
Водные суспензии включают суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе в концентрации в диапазоне от приблизительно 5% до приблизительно 50% мас. Суспензии приготавливают путем тонкого измельчения пестицида и энергичного вмешивания его в носитель, состоящий из воды и поверхностно-активных веществ. Ингредиенты, такие как неорганические соли и синтетические или природные камеди, также могут быть добавлены, для повышения плотности и вязкости водного носителя. Часто наиболее эффективным является одновременное измельчение и смешение пестицида путем приготовления водной смеси и гомогенизирования ее в таком устройстве, как песочная мельница, шаровая мельница, или гомогенизатор поршевого типа.
Пестициды также могут быть применены в виде гранулированных композиций, которые являются особенно полезными для нанесения на почву. Гранулированные композиции обычно содержат от приблизительно 0,5% до приблизительно 10% мас. пестицида, диспергированного в носителе, который включает глину или подобное вещество. Такие композиции обычно приготавливают путем растворения пестицида в подходящем растворителе и путем нанесения его на гранулированный носитель, который был заранее сформован с соответствующим размером частиц, в диапазоне от приблизительно 0,5 до приблизительно 3 мм. Такие композиции также могут быть составлены путем изготовления густой массы или пасты из носителя и соединения и путем грубого измельчения и высушивания с получением желаемого размера гранулированных частиц.
Пылевидные препараты, содержащие пестицид, приготавливают путем тщательного смешения пестицида в порошкообразной форме с подходящим пылеобразным сельскохозяйственным носителем, таким как каолиновая глина, измельченная вулканическая порода, и тому подобное. Пылевидные препараты подходящим образом могут содержать от приблизительно 1% до приблизительно 10% пестицида. Они могут быть применены в виде препарата для обеззараживания семян или в виде препарата для внекорневой подкормки с помощью машины-опыливателя.
Столь же практичным является нанесение пестицида в форме раствора в соответственном органическом растворителе, обычно в минеральном масле, таком как инсектицидные (аэрозольные) масла, которые широко используются в агрохимии.
Пестициды также могут быть нанесены в форме аэрозольной композиции. В таких композициях пестицид растворяют или диспергируют в носителе, который представляет собой создающую давление смесь пропеллентов. Аэрозольную композицию упаковывают в контейнер-баллончик, из которого смесь распределяют посредством дозатора-распылителя.
Пестицидные приманки получают в том случае, когда пестицид смешивают с пищевым продуктом или с аттрактантом, или и с тем и с другим. В том случае, когда насекомые-вредители едят приманку, они также потребляют и пестицид. Приманки могут иметь форму гранул, гелей, сыпучих порошков, жидкостей, или твердых веществ. Их применяют в очагах скопления насекомых вредителей.
Фумиганты представляют собой пестициды, которые имеют относительно высокое давление паров и, следовательно, могут пребывать в виде газа в концентрациях, достаточных для того, чтобы убить насекомых-вредителей в почве или в замкнутых/закрытых пространствах. Токсичность фумиганта пропорциональна его концентрации и времени воздействия. Они характеризуются хорошей способностью к диффузии и действуют путем проникновения в дыхательную систему насекомых-вредителей или путем поглощения через кутикулу насекомых-вредителей. Фумиганты применяют для борьбы с насекомыми-вредителями, образуемыми в продуктах, сохраняемых в газонепроницаемых полотнах, в герметичных комнатах или в помещениях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования частиц или капель пестицида в пласт-полимерах различных типов. Путем изменения химии полимера или путем изменения факторов в технологии переработки, могут быть сформованы микрокапсулы с различными размерами, растворимостью, толщинами стенок, и степенями проницаемости. Эти факторы определяют скорость, с которой высвобождается активный ингредиент, находящийся внутри, которая, в свою очередь, оказывает влияние на последующее остаточное действие, скорость действия, и на запах продукта.
Концентраты масляных растворов делают путем растворения пестицида в растворителе, который будет держать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрый нокдаун-эффект и гибель насекомых-вредителей, чем другие составы благодаря растворителям, которые сами по себе обладают пестицидным действием, и вследсвие растворения восковой оболочки наружного покрова, что повышает скорость захвата пестицида. Другие преимущества масляных растворов включают лучшую стабильность хранения, лучшее проникновение в зазоры/прожилки, и лучшую адгезию к жирным поверхностям.
Другим вариантом осуществления является эмульсия масло-в-воде, где эмульсия содержит масляные глобулы, каждая из которых обеспечена оболочкой на основе ламеллярного жидкого кристалла и диспергирована в водной фазе, где каждая масляная глобула содержит, по меньшей мере, одно соединение, которое является активным с точки зрения сельского хозяйства, и является по отдельности покрытой моноламеллярным или олиголамеллярным слоем, включающем в себя: (1) по меньшей мере, одно неионогенное липофильное поверхностно-активное вещество, (2) по меньшей мере, одно неионогенное гидрофильное поверхностно-активное вещество и (3) по меньшей мере, одно ионное поверхностно-активное вещество, где глобулы имеют средний диаметр частиц, равный менее, чем 800 нанометрам. Дополнительная информация по варианту осуществления раскрыта в патентной публикации: U.S. patent publication 20070027034, опубликованной 1 февраля 2007 г., имеющей порядковый номер заявки на патент 11/495228. Для простоты использования этот вариант осуществления будет называться как «OIWE = эмульсия масло-в-воде».
Для получения дополнительной информации обращайтесь к руководству «Insect Pest Management» 2-ое издание, D. Dent, издательское право CAB International (2000). Кроме того, для получения более подробной информации обращайтесь к справочнику Arnold Mallis «Handbook of Pest Control - The Behavior, Life History, and Control of Household Pest» 9-ое издание, издательское право GIE Media Inc. (2004).
ДРУГИЕ КОМПОНЕНТЫ СОСТАВОВ
Как правило, в том случае, когда изобретение, раскрытое в этом документе, применяют в составе, такой состав также может содержать другие компоненты. Эти компоненты включают (это представляет собой неисчерпывающий перечень взаимонеисключающих (взаимодополняющих или совместимых) компонентов) смачивающие вещества, заполнители, клейкие заполнители, пенетранты, буферные вещества, комплексообразующие/связывающие вещества, реагенты, снижающие смещение, вещества, способствующие повышению совместимости компонентов, противовспенивающие реагенты, осветляющие/моющие вещества, и эмульгаторы, но не ограничиваются этим. Несколько компонентов описано непосредственно далее.
Смачивающее вещество представляет собой вещество, которое при добавлении к жидкости повышает распределение или способность проникновения жидкости посредством снижения натяжения на межфазной границе между жидкостью и поверхностью, на которой она распределяется. Смачивающие вещества применяют в используемых в сельском хозяйстве составах для достижения двух основных функций: во время переработки и изготовления для повышения скорости смачивания порошков в воде с тем, чтобы изготовить концентраты для растворимых жидкостей или концентраты суспензий; и во время смешения продукта с водой в резервуаре-распылителе для снижения времени смачивания смачиваемых порошков и для улучшения проникновения воды в диспергируемые в воде гранулы. Примерами смачивающих веществ, используемых в составах на основе смачиваемых порошков, концентратов суспензий, и диспергируемых в воде гранул, являются: лаурилсульфат натрия; диоктил-сульфосукцинат натрия; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующий реагент представляет собой вещество, которое адсорбируется на поверхности частиц и способствует сохранению состояния дисперсии частиц и предотвращает их реагрегирование. Диспергирующие реагенты добавляют в используемые в сельском хозяйстве составы для облегчения образования дисперсии и суспензии во время изготовления, и для гарантированного обеспечения повторного образования дисперсии в воде в резервуаре-распылителе. Они широко используются в смачиваемых порошках, в концентратах суспензий и в диспергируемых в воде гранулах. Поверхностно-активные вещества, которые используются в качестве диспергирующих реагентов, имеют способность сильно адсорбироваться на поверхности частиц и обеспечивать барьер заряда или пространственный барьер к реагрегации частиц. Чаще всего используемые поверхностно-активные вещества представляют собой анионные, неионогенные вещества, или смеси двух типов поверхностно-активных веществ. Для составов на основе смачиваемых порошков, чаще всего используемые диспергирующие реагенты представляют собой лигносульфонаты натрия. Что касается концентратов суспензий, очень хорошую адсорбцию и стабилизацию получают с использованием полиэлектролитов, таких как конденсаты формальдегида и нафталинсульфоната натрия. Также используют тристирилфенол-этоксилатные сложные эфиры фосфорной кислоты. Неионогенные соединения, такие как алкиларилэтиленоксидные конденсаты и блоксополимеры этиленоксида-пропиленоксида, иногда соединяют с анионными соединениями в качестве диспергирующих реагентов для концентратов суспензий. В последние годы, в качестве диспергирующих реагентов были разработаны новые типы полимерных поверхностно-активных веществ с очень высокой молекулярной массой. Они имеют очень длинные гидрофобные 'основные цепи' и большое количество этиленоксидных цепей, образующих 'зубья' 'гребнеобразного' поверхностно-активного вещества. Эти полимеры с высокой молекулярной массой могут давать очень хорошую длительную стабильность концентратам суспензий, поскольку гидрофобные основные цепи имеют много узловых точек механической фиксации на поверхностях частиц. Примерами диспергирующих реагентов, используемых в составах для сельского хозяйства, являются: лигносульфонаты натрия; конденсаты формальдегида и нафталинсульфоната натрия; тристирилфенол-этоксилатные сложные эфиры фосфорной кислоты; этоксилаты алифатических спиртов; алкил-этоксилаты; блок-сополимеры этиленоксида-пропиленоксида; и привитые сополимеры.
Эмульгирующий реагент представляет собой вещество, которое стабилизирует суспензию капельной жидкой фазы в другой жидкой фазе. Без эмульгирующего реагента две жидкости могли бы разделиться на две несмешивающиеся жидкие фазы. Чаще всего используемые смеси эмульгаторов содержат алкилфенол или алифатический спирт с двенадцатью или более этиленоксидными звеньями и маслорастворимую кальциевую соль додецилбензолсульфокислоту. Диапазон значений гидрофильно-липофильного баланса («HBL») от 8 до 18 будут обычно обеспечивать хорошие стабильные эмульсии. Стабильность эмульсии иногда может быть улучшена посредством добавления небольшого количества поверхностно-активного вещества на основе блоксополимера этиленоксида-пропиленоксида (EO-PO).
Солюбилизирующее вещество представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрациях, превышающих критическую концентрацию мицелл. Тогда мицеллы могут растворять или солюбилизировать нерастворимые в воде вещества внутри гидрофобной части мицеллы. Тип поверхностно-активных веществ, обычно используемых для солюбилизации, составляют неионогенные вещества: сорбитан-моноолеаты; этоксилаты сорбитан-моноолеата; и метилолеатные сложные эфиры.
Поверхностно-активные вещества иногда используют, либо как таковые, либо совместно с другими добавками, такими как минеральные или растительные масла в качестве адъювантов, которые вводят в находящиеся в резервуаре-распылителе смеси для усиления биологического воздействия пестицида на мишень. Типы поверхностно-активных веществ, используемых для эффекта биологического усиления, как правило, зависят от природы и механизма действия пестицида. Однако, часто они представляют собой неионогенные вещества, такие как: алкилэтоксилаты; этоксилаты линейных алифатических спиртов; этоксилаты алифатических аминов.
Носитель или разбавитель в составе, применяемом в сельском хозяйстве, представляет собой вещество, добавляемое к пестициду для получения продукта с требуемой прочностью. Обычно носители представляют собой вещества с высокой абсорбирующей способностью, тогда как разбавители обычно представляют собой вещества с низкой абсорбирующей способностью. Носители и разбавители используют в составе пылевидных препаратов, смачиваемых порошков, гранул и диспергируемых в воде гранул.
Органические растворители в основном используют в составе эмульгируемых концентратов, препаратов ULV (ультрамалый объем), и в меньшей степени в составе гранулированных препаратов. Иногда используют смеси растворителей. Первую основную группу растворителей составляют алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая основная и чаще всего используемая группа охватывает ароматические растворители, такие как ксилол и фракции с большей молекулярной массой, включающие С9 и С10 ароматические растворители. Хлорированные углеводороды являются полезными в качестве сорастворителей для предотвращения кристаллизации пестицидов при эмульгировании состава в воду. Спирты иногда используют в качестве сорастворителей для повышения растворяющей способности.
Загустители или гелеобразующие реагенты в основном используют в составе концентратов суспензий, эмульсий и суспоэмульсий для модифицирования реологических свойств или текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель. Загущающие, гелеобразующие, и противоосаждающие реагенты, как правило, попадают в две категории, а именно, нерастворимые в воде твердые частицы и водорастворимые полимеры. Можно получить составы на основе концентратов суспензий с использованием глин и кремнеземов. Примеры этих типов материалов включают монтмориллонит, например, бентонит; алюмосиликат магния; и аттапульгит, но не ограничиваются этим. В течение многих лет в качестве загущающих-гелеобразующих реагентов использовались водорастворимые полисахариды. Наиболее часто используемые типы полисахаридов представляют собой экстракты семян и морских водорослей или являются синтетическими производными целлюлозы. Примеры этих типов веществ включают гуаровую камедь; камедь бобов рожкового дерева; каррагинан; альгинаты; метилцеллюлозу; карбоксиметилцеллюлозу натрия (SCMC); гидроксиэтилцеллюлозу (HEC), но не ограничиваются этим. Другие типы противоосаждающих реагентов основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Еще одним хорошим противоосаждающим реагентом является ксантановая камедь.
Микроорганизмы вызывают порчу составленных продуктов. Поэтому для исключения или снижения их воздействия используют консервирующие реагенты. Примеры таких реагентов включают пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую или калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль пара-гидрокибензойной кислоты; метил пара-гидроксибензоат; и 1,2-бензизотиазолин-3-он (BIT), но не ограничиваются этим.
Присутствие поверхностно-активных веществ, которые снижают межфазное натяжение, часто вызывает вспенивание составов на основе воды во время операций смешения при получении и при нанесении посредством резервуара-распылителя. Для того, чтобы снизить тенденцию к вспениванию, либо во время стадии приготовления, либо перед наливанием в бутылки часто добавляют противовспенивающие реагенты. Как правило, существует два типа противовспенивающих реагентов, а именно, силиконовые соединения и несиликоновые соединения. Силиконовые соединения обычно представляют собой водные эмульсии диметилполисилоксана, тогда как несиликоновые противовспенивающие реагенты представляют собой нерастворимые в воде масла, такие как октанол и нонанол, или диоксид кремния. В обоих случаях, функция противовспенивающего реагента заключается в вытеснении поверхностно-активного вещества с межфазной границы воздух-вода.
Дополнительную информацию можно получить в сборнике «Chemistry and Technology of Agrochemical Formulations» под редакцией D.A. Knowles, издательское право Kluwer Academic Publishers (1998). Также можно обратиться к обзору A.S. Perry, I. Yamamoto, I. Ishaaya, and R. Perry «Insecticides in Agriculture and Environment - Retrospects and Prospects» издательское право Springer-Verlag (1998).
ПРИМЕНЕНИЯ
Действительное количество пестицида, которое должно быть нанесено на локус (местоположение) насекомых-вредителей, как правило, не является критичной и может быть легко определено специалистами в данной области. В общем и целом, полагают, что концентрации от приблизительно 0,01 грамма пестицида на гектар до приблизительно 5000 грамм пестицида на гектар обеспечивают хорошую борьбу с вредными насекомыми.
Локус, в который наносят пестицид, может представлять собой любой локус обитания насекомого-вредителя, например, овощные культуры, фруктовые и орехоплодные деревья, виноградные лозы, декоративные растения, домашние животные, внутренние или наружные поверхности зданий, и почва вокруг зданий. Осуществление борьбы с насекомыми-вредителями, как правило, означает то, что в локусе снижают популяции насекомых-вредителей, их активность, или и то и другое. Это может происходить в том случае, когда: популяции насекомых вредителей выдворяют из локуса; когда насекомых-вредителей 'выводят из строя' внутри локуса или вокруг него; или когда насекомых-вредителей уничтожают, в целом или частично, внутри или вокруг локуса. Разумеется, может иметь место комбинация этих результатов. Как правило, популяции насекомых-вредителей, их активность, или и то и другое, желательно снижаются более чем, на пятьдесят процентов, предпочтительно более, чем на 90 процентов.
Как правило, при использовании приманок, приманки помещают на поверхность земли в том месте, где, например, термиты могут вступить в контакт с приманкой. Приманки также могут быть нанесены на поверхность помещения, (горизонтальную, вертикальную, или наклонную, поверхность) там, где, например, муравьи, термиты, тараканы, и мухи, могут вступать в контакт с приманкой.
Вследствие уникальной способности яиц некоторых насекомых-вредителей быть устойчивыми к пестицидам, для борьбы с недавно появившимися личинками могут быть желательны повторные нанесения пестицидов.
Системное передвижение пестицидов в растениях может быть использовано для борьбы с насекомыми-вредителями на одной части растения путем нанесения пестицидов на другую часть растения. Например, борьба с питающимися листвой насекомыми может контролироваться путем капельного орошения или нанесения пестицидов на дно бороздки, или путем обработки семян перед посевом. Обработка семян может быть применена ко всем типам семян, включая семена, из которых будут прорастать растения, генетически модифицированные с получением экспрессирования характерных признаков приспособления к определенным условиям. Репрезентативные примеры включают семена, экспрессирующие белки, токсичные для беспозвоночных насекомых-вредителей, такие как Bacillus thuringiensis или другие инсектицидные токсины, семена, экспрессирующие гербицидную устойчивость, такие как семена «Roundup Ready» (сорт семян, допускающий распыление гербицида Roundup в течение вегетационного периода), или семена с «пакетированными» чужеродными генами, экспрессирующие инсектицидные токсины, гербицидную устойчивость, увеличение питательной ценности или любые другие благотворные признаки. Кроме того, такие обработки семян соединением (составом) изобретения, раскрытым в этом документе, могут дополнительно усилить способность растения лучше выдерживать тяжелые/стрессовые условия произрастания. Это приводит к более здоровому, более сильному растению, которое может в результате дать более высокие показатели урожайности в срок уборки урожая.
Со всей очевидностью ясно, что изобретение может быть применено на растениях, генетически модифицированных с получением экспрессирования характерных признаков приспособления к определенным условиям, таких как Bacillus thuringiensis или другие инсектицидные токсины, или на растениях, экспрессирующих гербицидную устойчивость, или на растениях с «пакетированными» чужеродными генами, экспрессирующих инсектицидные токсины, гербицидную устойчивость, увеличение питательной ценности или любые другие благотворные признаки.
Изобретение, раскрытое в этом документе, подходит для борьбы с эндопаразитами и эктопаразитами в секторе ветеринарной лечебной помощи или в области содержания животных. Соединения применяют известным способом, например, путем перорального введения в форме, например, таблеток, капсул, напитков, гранул, путем накожного нанесения в форме, например, окунания, распыления, поливания, точечного/местного нанесения, или напыления/опудривания, и путем парентерального введения в форме, например, инъекции.
Изобретение, раскрытое в этом документе, также может быть применено преимущественно в содержании домашнего скота, например, в содержании крупного и мелкого рогатого скота, овец, свиней, кур, и гусей. Подходящие составы вводят перорально животным с питьевой водой или с пищей. Дозировки и составы, которые являются подходящими, зависят от вида животного.
Прежде, чем пестицид может быть применен или продан в больших количествах, такой пестицид подвергается длительным процессам оценивания различными государственными органами власти (местные, региональные, государственные, национальные, международные). Многочисленные требования к данным точно определены регламентирующими органами власти и должны быть рассмотрены при получении данных и при подаче документов регистрантом продукта или любым другим представителем от имени регистранта продукта. Эти правительственные органы власти затем рассматривают такие данные и, если приходят к заключению об определении безопасности, то дают потенциальному потребителю или продавцу разрешение на регистрацию продукта. После этого, в том населенном пункте, где предоставлена и поддержана регистрация продукта, такой потребитель или продавец может применять или продавать такой пестицид.
Рубрики и заголовки в этом документе даны лишь для удобства и не должны быть использованы для интерпретирования его любой части.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|