Результат интеллектуальной деятельности: ИММУНОГЛОБУЛИНЫ С УМЕНЬШЕННОЙ АГРЕГАЦИЕЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее раскрытие относится к улучшенным иммуноглобулинам, которые обладают уменьшенной агрегацией.
Уровень техники
Область понимания и контроля стабильности белков была желанным устремлением биологов, химиков и инженеров. Первая связь между аминокислотной заменой и заболеванием (Ingram. Nature. 1957, 180(4581): 326-8) открыла новые и имеющие принципиальное значение горизонты в области исследований стабильности белков в норме и патологии. Серьезное увеличение количества препаратов на основе белков в последнее время, особенно препаратов на основе иммуноглобулинов, привело к появлению новой проблемы. Терапевтические белки хранятся в жидкости в течение нескольких месяцев при очень высоких концентрациях. С течением времени увеличивается процент немономерных видов. Образование агрегатов не только уменьшает эффективность продукта, но также может привести к появлению побочных эффектов, таких как иммунный ответ на введение. Гарантия стабильности белкового фармацевтического препарата в течение срока годности продукта является первоочередным требованием.
По причине высокого потенциала антител при лечении различных заболеваний, в настоящее время они являются наиболее быстро растущим классом терапевтических препаратов для человека (Carter. Nature Reviews Immunology. 2006, 6(5), 343). С 2001 года, рынок таких препаратов растет в среднем ежегодно со скоростью 35%, с наибольшей скоростью среди всех категорий биотехнологических лекарственных средств (S.Aggarwal. Nature. BioTech. 2007, 25 (10) 1097).
Терапевтические иммуноглобулины получают и хранят в водных растворах в высоких концентрациях, т.к. это требуется для лечения заболеваний. Однако в таких условиях эти иммуноглобулины являются термодинамически нестабильными и деградируют в результате агрегации. Агрегация, в свою очередь, приводит к уменьшению активности антител, делая лекарственное средство неэффективным, и даже может вызвать иммунный ответ. Таким образом, существует неотложная потребность в получении терапевтических иммуноглобулинов менее склонных к агрегации.
Во множестве существующих подходов для предотвращения агрегации иммуноглобулинов прибегают к применению добавок составах на основе белков. Такой подход отличается от описанного в данном документе прямого подхода, в котором иммуноглобулин сам по себе модифицируют в предрасполагающих к агрегации областях, предсказанных с помощью молекулярного моделирования. Добавки, обычно используемые для стабилизации антител, являются солями азотсодержащих оснований, таких как аргинин, гуанидин или имидазол (ЕР 0025275). Другими подходящими добавками для стабилизации являются полиэфиры (ЕРА 0018609), глицерин, альбумин и декстран сульфат (патент США №. 4808705), детергенты и ПАВ, такие как ПАВ на основе полисорбата (публикация DE 2652636, и публикация GB 2175906 (заявка на патент Великобритании № GB 8514349)), шапероны, такие как GroEL (Mendoza. Biotechnol. Tech. 1991, (10) 535-540), нитратный буфер (WO 9322335) или хелатирующие агенты (WO 9115509). Хотя эти добавки позволяют в некоторой степени стабилизировать белки в растворе, они страдают от определенных недостатков, таких как необходимость дополнительных стадий обработки для удаления добавок.
Для улучшения других характеристик, таких как связывание с Fc-рецептором, были получены оптимизированные варианты иммуноглобулинов. Например, получили набор двухсот шестнадцати вариантов антитела (включая мутантные виды L234 и L235) и протестировали их на эффект связывания с FcγRIIIa и FcγRIIb, как раскрыто в публикации США 2004/0132101 (Lazar et al.). Однако Lazar et al. не тестировали какой-либо из вариантов антитела на предмет их склонности к агрегации.
Таким образом, существует потребность в улучшенных иммуноглобулиновых композициях, таких как терапевтические препараты с антителами, напрямую стабилизированные без применения добавок.
Раскрытие изобретения
Описанное в данном документе является удовлетворяющими эту потребность в улучшенных иммуноглобулинах, которые демонстрируют уменьшенную агрегацию и/или улучшенную стабильность.
Таким образом, один аспект включает модифицированные и/или изолированные иммуноглобулины, обладающие уменьшенной склонностью к агрегации и содержащие, по меньшей мере, одну уменьшающую агрегацию мутацию в остатке из консервативного домена иммуноглобулина, который (i) имеет значение пространственной склонности к агрегации (ПСА) (радиус сферы 5 Å) равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА больше чем 0,0 и находится в пределах 5 Å от остатка имеющего значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, где, по меньшей мере, одна уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å) остатка по сравнению с немутированным иммуноглобулином, а агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация не является остатком, соответствующим по Кабату остатку 234 (шарнир) или 235 (шарнир) в IgG1 на основании выравнивания с последовательностью IgG1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет вторую мутацию, уменьшающую агрегацию, в остатке, который (1) имеет значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА (радиус сферы 5 Å) больше чем 0,0 и находится в пределах 5 Å относительно остатка, имеющего значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, где вторая уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å) остатка по сравнению с немутированным иммуноглобулином. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, где уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5 Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в разных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в модифицированном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина и аспарагина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина и гистидина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на остаток лизина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин является IgG1, IgG2, IgG3, или IgG4. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин является IgG1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН3. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин обладает сродством связывания с целевым антигеном и сродство связывания с целевым антигеном составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов от сродства связывания с целевым антигеном немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
Другой аспект включает измененный или выделенный иммуноглобулин, обладающий уменьшенной склонностью к агрегации, который содержит, по меньшей мере, одну уменьшающую агрегацию мутацию в остатке, выбранном из группы, состоящей из остатков мотива агрегации 1: 174 (СН1), 175 (СН1), и 181 (СН1), мотива агрегации 2:226 (шарнир), 227 (шарнир), 228 (шарнир), 229 (шарнир), 230 (шарнир), 231 (шарнир) и 232 (шарнир); мотива агрегации 3:234 (шарнир) и 235(шарнир); мотива агрегации 4:252 (СН2) и 253 (CH2); мотива агрегации 5:282 (СН1); мотива агрегации 6:291 (СН2); мотива агрегации 7: 296 (СН2); мотива агрегации 8:308 (СН2) и 309 (СН2); мотива агрегации 9: 328 (СН2), 329 (СН2), 330 (СН2) и 331 (СН2); мотива агрегации 10:395 (СН3), 396 (СН3), 397 (СН3), 398 (СН3) и 404 (СН3); мотива агрегации 11:443 (СН3); мотива агрегации 12:110 (CL) и 111 (CL); мотива агрегации 13:153 (CL) и 154 (CL) и мотива агрегации 14: 201 (CL), и в котором, по меньшей мере, одна уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в немодифицированном иммуноглобулине и агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе; и в котором номера остатков соответствуют номерам остатков по Кабату в IgG1 на основе выравнивания с последовательностью IgG1. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация выбирается из группы, состоящей из остатков мотива агрегации 1: 175 (СН1); мотива агрегации 2: 227 (шарнир), 228 (шарнир), и 230 (шарнир); мотива агрегации 3: 234 (шарнир) и 235 (шарнир); мотива агрегации 4: 253 (СН2); мотива агрегации 5: 282 (СН2); мотива агрегации 6: 291 (СН2); мотива агрегации 7: 296 (СН3); мотива агрегации 8: 309 (СН2); мотива агрегации 9: 329 (СН1) и 330 (СН2); мотива агрегации 10: 395 (СН3) и 398 (СН3); мотива агрегации 11: 443 (СН3); мотива агрегации 12: 110 (CL); мотива агрегации 13: 154 (CL); и мотива агрегации 14: 201 (CL). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающей агрегацию мутацией не являются остатки 234 (шарнир) или 235 (шарнир). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, остатком уменьшающей агрегацию мутации являются 234 (шарнир), 235 (шарнир), 253 (СН1) или 309 (СН1). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, остатком уменьшающей агрегацию мутации являются 253 (СН2) или 309 (СН2). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин обладает второй уменьшающей агрегацию мутацией в гидрофобном остатке, который (i) имеет значение ПСА равное, по меньшей мере, 0,15, или который (ii) находится в пределах 5 Å от остатка имеющего значение ПСА равное, по меньшей мере, 0,15, где третья уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в немодифицированном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, где уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5 Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, имеющих вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в отдельных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет, по меньшей мере, пятнадцать уменьшающих агрегацию мутаций, где каждая уменьшающая агрегацию мутация выбирается из отдельного вызывающего агрегацию мотива. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина и аспарагина. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина и гистидина. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на остаток лизина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин является IgG1, IgG2, IgG3, или IgG4. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин содержит IgG1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН3. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин обладает сродством связывания с целевым антигеном и сродство связывания с целевым антигеном составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов от сродства связывания с целевым антигеном немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
Другой аспект включает составы с измененным иммуноглобулином, которые могут быть сделаны из иммуноглобулина любого из предыдущих аспектов и с любой и со всеми комбинациями предыдущих воплощений в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл или, по меньшей мере, 150 мг/мл. В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов измененного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав включает фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Еще один аспект включает изолированные или рекомбинантные полинуклеотиды, которые кодируют иммуноглобулин по любому из предыдущих аспектов, касающихся модифицированного иммуноглобулина, и по любой или всем комбинациям предыдущих воплощений. В некоторых воплощениях, полинуклеотид находится в векторе. В некоторых воплощениях, вектор является экспрессирующим вектором. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, с полинуклеотидом функционально связан индуцируемый промотор. Другой аспект включает клетки-хозяина с вектором любого из предыдущих воплощений. В некоторых воплощениях, клетки-хозяина способны экспрессировать иммуноглобулин, кодируемый полинуклеотидом.
Еще один аспект включает способы получения иммуноглобулина с уменьшенной склонностью к агрегации, включающие обеспечение культуральной среды, содержащей клетки-хозяина предыдущего аспекта, и помещение культуральной среды в условия, в которых экспрессируется иммуноглобулин. В некоторых воплощениях, способы включают дополнительную стадию изолирования экспрессируемого иммуноглобулина.
Другой аспект включает способы уменьшения склонности к агрегации иммуноглобулина в сильноконцентрированном фармацевтическом составе, которые включают: обеспечение иммуноглобулина, склонного к агрегации; замену остатка в консервативном домене иммуноглобулина, который (1) имеет значение ПСА равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА (радиус сферы 5 Å) больше чем 0,0 и находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15, на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å); и образование высококонцентрированного жидкого состава с модифицированным иммуноглобулином, в котором концентрация измененного иммуноглобулина составляет, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл, и в котором агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе.
Другой аспект включает применения измененного иммуноглобулина по любому из предыдущих аспектов и по любой и всем комбинациям предыдущих воплощений для изготовления лекарственного средства, содержащего высококонцентрированный жидкий состав, в котором концентрация модифицированного иммуноглобулина составляет, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл. В некоторых воплощениях применения лекарственное средство предназначается для лечения аутоиммунных заболеваний, иммунологических заболеваний, инфекционных заболеваний, воспалительных заболеваний, неврологических заболеваний и онкологических и неопластических заболеваний, включая злокачественное новообразование. В некоторых воплощениях применения лекарственное средство предназначается для лечения застойной сердечной недостаточности, васкулита, розацеа, акне, экземы, миокардита и других состояний миокарда, системной красной волчанки, диабета, спондилопатий, синовиальных фибробластов и стромы костного мозга; потери костной массы; болезни Педжета, остеокластомы, рака молочной железы; остеопении при бездействии; нарушения питания, пародонтоза, болезни Гоше, гистиоцитоза клеток Лангерганса, травмы спинного мозга, острого септического артрита, остеомаляции, синдрома Кушинга, монооссальной формы фиброзной дисплазии, полиоссальной формы фиброзной дисплазии, периодонтальной реконструкции и переломов костей; саркоидоза; остолитических злокачественных опухолей костей, рака молочной железы, рака легких, рака почек и рака прямой кишки; костных метастазов, купировании болевого синдрома в костях и гуморальной злокачественной гиперкальциемии, анкилозирующего спондилита, и других спонгилоартропатий; отторжения при трансплантации, вирусных инфекций, гематологических неоплазий и похожих на неоплазии состояний, например, ходжкинской лимфомы; неходжкинской лимфомы (лимфомы Беркитта, мелкоклеточной лимфоцитарной лимфомы/хронического лимфолейкоза, грибовидного лейкоза, лимфомы из клеток мантии, фолликулярной лимфомы, диффузной В-крупноклеточной лимфомы, лимфомы маргинальной зоны, волосатоклеточного лейкоза и лимфоплазматической лейкемии), опухоли клеток-предшественников лейкоцитов, включая В-клеточный острый лимфобластный лейкоз/лимфому, тимому, опухоли зрелых Т-клеток и натуральных киллеров, включая лейкемии периферических Т-клеток, зрелой Т-клеточной лейкемии/Т-клеточной лимфомы, лейкемии больших гранулярных лимфоцитов, гистиоцитоза из клеток Лангерганса, миелоидных неоплазий, таких как острые миелобластные лейкозы, включая ОМЛ без созревания, ОМЛ без дифференцировки, острую промиелоцитарную лейкемию, острую миеломоноцитарную лейкемию, и острые моноцитарные лейкемии, миелодиспластические синдромы и хронические миелопролиферативные расстройства, в том числе хронические миелоидные лейкемии, новообразований центральной нервной системы, например новообразований мозга (глиомы, нейробластомы, астроцитомы, медуллобластомы, эпендимомы и ретинобластомы), солидных опухолей (рака носоглотки, базальноклеточного рака, рака поджелудочной железы, рака желчного протока, саркомы Калоши, рака яичек, рака матки, влагалища и шейки матки, рака яичников, первичного рака печени или рака эндометрия, и новообразований сосудистой системы (ангиосаркомы и гемангиоперицитомы), остеопороза, гепатита, ВИЧ, СПИД, спондилоартрита, ревматоидного артрита, воспалительных заболеваний кишечника, сепсиса и септического шока, болезни Крона, псориаза, склеродермы, реакции «трансплантат против хозяина», отторжения аллогенного островкового трансплантата, гематологических злокачественных новообразований, таких как множественная миелома, миелодиспластический синдром и острый миелобластный лейкоз, воспалений, ассоциированных с опухолями, травм периферических нервов или демиелинизирующих заболеваний. В некоторых воплощениях применения лекарственное средство предназначается для лечения пятнистого псориаза, язвенного колита, неходжкинской лимфомы, рака молочной железы, колоректального рака, ювенильного идиопатического артрита, дегенерации желтого пятна, респираторно-синцитиального вируса, болезни Крона, ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, остеопороза, потери костной массы, вызванной лечением, костных метастазов, множественной миеломы, болезни Альцгеймера, глаукомы и рассеянного склероза. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, применение лекарственного средства дополнительно содержит фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин в лекарственном средстве демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, лекарственное средство практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Другой аспект включает применения измененного иммуноглобулина по любому из предыдущих аспектов и по любому и всем комбинациям предыдущих воплощений, в качестве неагрегирующего фармацевтически активного ингредиента.
Другой аспект включает фармацевтические композиции, которые содержат иммуноглобулин по любому из предыдущих аспектов и любой и всех комбинаций предыдущих воплощений и фармацевтически приемлемый наполнитель. В некоторых воплощениях иммуноглобулин находится в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл. В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов измененного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Другой аспект включает модифицированный или изолированный иммуноглобулин, который обладает уменьшенной склонностью к агрегации, имеющий, по меньшей мере, одну уменьшающую агрегацию мутацию в остатке, выбранном из группы, состоящей из 235 (шарнир), 241 (СН1), 243 (СН2), 282 (СН2) и 309 (СН2), где если выбирается остаток 235, то его мутируют в глутамин или серин, если выбирается остаток 282, то его мутируют в лизин, а если выбирается остаток 309, то его мутируют в лизин, и где, по меньшей мере, одна уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине, а агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе; и где нумерация остатков соответствует нумерации остатков по Кабату в IgG1 на основе выравнивания с последовательностью IgG1. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 241 в серин, а модифицированный и изолированный иммуноглобулин дополнительно содержит вторую уменьшающую агрегацию мутацию остатка 243 в серин. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 241 в тирозин, и модифицированный и изолированный иммуноглобулин дополнительно содержит вторую уменьшающую агрегацию мутацию остатка 243 в тирозин. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 282 в лизин, и модифицированный или изолированный иммуноглобулин дополнительно содержит вторую и третью уменьшающие агрегацию мутации, где вторая уменьшающая агрегацию мутация является мутацией остатка 235 в лизин, а третья уменьшающая агрегацию мутация является мутацией остатка 309 в лизин. В некоторых воплощения, иммуноглобулин имеет вторую уменьшающую агрегацию мутацию в гидрофобном остатке, где вторая уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, вторая уменьшающая агрегацию мутация (1) имеет значение ПСА равное, по меньшей мере, 0,15, или (ii) находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, иммуноглобулин обладает третьей уменьшающей агрегацию мутацией, которая (i) имеет значение ПСА равное, по меньшей мере, 0,15, или которая (ii) находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15, где третья уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, где уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5 Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, имеющих вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в отдельных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет, по меньшей мере, пятнадцать уменьшающих агрегацию мутаций, где каждая уменьшающая агрегацию мутация выбирается из отдельного вызывающего агрегацию мотива. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина, аспарагина, тирозина и серина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, серина, глутамата и тирозина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин является IgG1, IgG2, IgG3 или IgG4. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин содержит IgG1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН3. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин обладает сродством связывания к целевому антигену и сродство связывания к целевому антигену составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов относительно сродства связывания с целевым антигеном немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
Другой аспект включает составы с модифицированным иммуноглобулином, который может быть сделан из иммуноглобулина любого из предыдущих аспектов и любой из всех комбинаций предыдущих воплощений в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл или, по меньшей мере, 150 мг/мл. В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов модифицированного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав включает фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Еще один аспект включает изолированные или рекомбинантные полинуклеотиды, которые кодируют иммуноглобулин по любому из предыдущих аспектов, касающихся измененного иммуноглобулина и любой или всем комбинациям предыдущих воплощений. В некоторых воплощениях, полинуклеотид находится в векторе. В некоторых воплощениях, вектор является экспрессирующим вектором. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, индуцируемый промотор функционально связан с полинуклеотидом. Другой аспект включает клетки-хозяина с вектором любого из предыдущих воплощений. В некоторых воплощениях, клетки-хозяина способны экспрессировать иммуноглобулин, кодируемый полинуклеотидом.
Другой аспект включает способы получения иммуноглобулина с уменьшенной склонностью к агрегации, включающие предоставление культуральной среды, содержащей клетку-хозяина предыдущего аспекта и размещение культуральной среды в условиях, в которых экспрессируется иммуноглобулин. В некоторых воплощениях, способы включают дополнительную стадию выделения экспрессируемого иммуноглобулина.
Другой аспект включает применение измененного иммуноглобулина по любому из предыдущих аспектов и по любой или всем комбинациям предыдущих воплощений для приготовления лекарственного средства, содержащего высококонцентрированный жидкий состав, в котором концентрация модифицированного иммуноглобулина составляет, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл. В некоторых воплощениях применения лекарственное средство предназначается для лечения аутоиммунных заболеваний, иммунологических заболеваний, инфекционных заболеваний, воспалительных заболеваний, неврологических заболеваний и онкологических и неопластических заболеваний, включая злокачественное новообразование. В некоторых воплощениях применения лекарственное средство предназначается для лечения застойной сердечной недостаточности, васкулита, розацеа, акне, экземы, миокардита и других состояний миокарда, системной красной волчанки, диабета, спондилопатий, синовиальных фибробластов и стромы костного мозга; потери костной массы; болезни Педжета, остеокластомы, рака молочной железы; остеопении при бездействии; нарушения питания, пародонтоза, болезни Гоше, гистиоцитоза клеток Лангерганса, травмы спинного мозга, острого септического артрита, остеомаляции, синдрома Кушинга, монооссальной формы фиброзной дисплазии, полиоссальной формы фиброзной дисплазии, периодонтальной реконструкции и переломов костей; саркоидоза; остолитических злокачественных опухолей костей, рака молочной железы, рака легких, рака почек и рака прямой кишки; костных метастазов, купировании болевого синдрома в костях и гуморальной злокачественной гиперкальциемии, анкилозирующего спондилита, и других спонгилоартропатий; отторжения при трансплантации, вирусных инфекций, гематологических неоплазий и похожих на неоплазии состояний, например ходжкинской лимфомы; неходжкинской лимфомы (лимфомы Беркитта, мелкоклеточной лимфоцитарной лимфомы/хронического лимфолейкоза, грибовидного лейкоза, лимфомы из клеток мантии, фолликулярной лимфомы, диффузной В-крупноклеточной лимфомы, лимфомы маргинальной зоны, волосатоклеточного лейкоза и лимфоплазматической лейкемии), опухоли клеток предшественников лейкоцитов, включая В-клеточный острый лимфобластный лейкоз/лимфому, тимому, опухоли зрелых Т-клеток и натуральных киллеров, включая лейкемии периферических Т-клеток, зрелой Т-клеточной лейкемии/Т-клеточной лимфомы, лейкемии больших гранулярных лимфоцитов, гистиоцитоза из клеток Лангерганса, миелоидных неоплазий, таких как острые миелобластные лейкозы, включая ОМЛ без созревания, ОМЛ без дифференцировки, острую промиелоцитарную лейкемию, острую миеломоноцитарную лейкемию, и острые моноцитарные лейкемии, миелодиспластические синдромы и хронические миелопролиферативные расстройства, в том числе хронические миелоидные лейкемии, новообразований центральной нервной системы, например новообразований мозга (глиомы, нейробластомы, астроцитомы, медуллобластомы, эпендимомы и ретинобластомы), солидных опухолей (рака носоглотки, базальноклеточного рака, рака поджелудочной железы, рака желчного протока, саркомы Капоши, рака яичек, рака матки, влагалища и шейки матки, рака яичников, первичного рака печени или рака эндометрия и новообразований сосудистой системы (ангиосаркомы и гемангиоперицитомы), остеопороза, гепатита, ВИЧ, СПИД, спондилоартрита, ревматоидного артрита, воспалительных заболеваний кишечника, сепсиса и септического шока, болезни Крона, псориаза, склеродермы, реакции «трансплантат против хозяина», отторжения аллогенного островкового трансплантата, гематологических злокачественных новообразований, таких как множественная миелома, миелодиспластический синдром и острый миелобластный лейкоз, воспалений ассоциированных с опухолями, травм периферических нервов или демиелинизирующих заболеваний. В некоторых воплощениях применения лекарственное средство предназначается для лечения пятнистого псориаза, язвенного колита, неходжкинской лимфомы, рака молочной железы, колоректального рака, ювенильного идиопатического артрита, дегенерации желтого пятна, респираторно-синцитиального вируса, болезни Крона, ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, остеопороза, потери костной массы, вызванной лечением, костных метастазов, множественной миеломы, болезни Альцгеймера, глаукомы и рассеянного склероза. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, применение лекарственного средства дополнительно содержит фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин в лекарственном средстве демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, лекарственное средство практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Другой аспект включает применение измененного иммуноглобулина по любому из предыдущих аспектов и по любой или по всем комбинациям предыдущих воплощений в качестве неагрегирующего фармацевтически активного ингредиента.
Другой аспект включает фармацевтические композиции, которые включают иммуноглобулин по любому из предыдущих аспектов и по любой или по всем комбинациям предыдущих воплощений и фармацевтически приемлемый наполнитель. В некоторых воплощениях иммуноглобулин находится в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл.
В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов измененного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Дополнительные аспекты и воплощения изобретения могут быть обнаружены по всему описанию изобретения.
Осуществление предпочтительных воплощений
Настоящее раскрытие относится к улучшенным иммуноглобулинам, особенно к человеческим антителам, обладающим уменьшенной агрегацией. В некоторых воплощениях иммуноглобулины раскрытия модифицируются в специфических гидрофобных остатках, в пределах константных областей тяжелой и легкой цепей иммуноглобулина. Раскрытие обеспечивает измененные иммуноглобулины, способ изготовления таких иммуноглобулинов, иммуноконъюгаты и мультивалентные или мультиспецифичные молекулы, содержащие такие иммуноглобулины, и фармацевтические композиции, содержащие иммуноглобулины, иммуноконъюгаты или биспецифические молекулы раскрытия.
Определения
Термин «антитело», упоминаемый в данном документе, включает целые антитела и любой антигенсвязывающий фрагмент (т.е., «антигенсвязывающую часть») или их одиночные цепи. Естественное «антитело» является гликопротеином, содержащим, по меньшей мере, две тяжелые цепи (Н) и две легкие цепи (L), взаимосвязанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначенную здесь как VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначенную здесь как VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен, CL. Области VH и VL далее могут быть разделены на области гипервариабельности, называемыми областями, отвечающими за комплементарность связывания (CDR-complementarity-determining region), которые перемежаются более консервативными областями, называемыми каркасными областями (FR-framework region), каждая VH и VL состоит из трех CDR и четырех FR размещенных от N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (CIq) классической системы комплемента.
Используемый здесь термин «антигенсвязывающая часть» антитела (или просто «антигенная часть») относится к полноразмерному антителу или одному или нескольким его фрагментам, которые сохраняют способность специфически связываться с антигеном и, по меньшей мере, часть константной области тяжелой или легкой цепи. Было показано, что антигенсвязывающая функция антитела может быть осуществлена с помощью фрагментов полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела включают Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; F(ab)2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных посредством дисульфидного мостика в шарнирной области; Fd-фрагмент, состоящий из доменов VH и СН1; и Fv-фрагмент, состоящий из доменов VL и VH одиночного плеча антитела.
Более того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть объединены, с помощью рекомбинантных способов, посредством синтетического линкера, который позволяет им создать отдельную белковую цепь, в которой области VL и VH сливаются для образования моновалентных молекул (известных как одноцепочечный вариабельный фрагмент (scFv); см. Bird et al., 1988 Science 242: 423-426; и Huston et al., 1988 Proc. Natl. Acad. Sci. 85: 5879-5883). Такие одноцепочечные антитела также охватываются термином «антигенсвязывающая область» антитела. Эти фрагменты антител получают с помощью традиционных методов, известных специалистам в данной области, и на пригодность такие фрагменты проверяются также как и интактные антитела.
Используемый здесь термин «изолированное» антитело или иммуноглобулин, относится к антителу или иммуноглобулину, которое практически не содержит другие компоненты, в которых такие антитела или иммуноглобулины обнаруживаются в естественных условиях. Более того, изолированное антитело или иммуноглобулин практически не содержат другой клеточный материал и/или химические вещества.
Используемые здесь термины «моноклональное антитело» или «композиция с моноклональным антителом» относятся к препарату молекул антитела одиночной молекулярной композиции. Композиция моноклонального антитела, как правило, демонстрирует одиночную специфичность связывания и сродство к определенному эпитопу.
Используемый здесь термин «человеческое антитело» предназначен для включения антител, обладающих вариабельными областями, в которых как каркас, так и области CDR происходят из последовательностей человеческого происхождения. Более того, если антитело содержит константную область, константная область также происходит из таких человеческих последовательностей, например человеческих зародышевых последовательностей, или мутированных версий человеческих зародышевых последовательностей или из антитела, содержащего консенсусные каркасные последовательности, которые получены после анализа человеческих зародышевых последовательностей, как описано Knappik, et al. (2000. J Mol. Biol 296, 57-86).
Человеческие антитела заявки могут также включать аминокислотные остатки, не кодируемые человеческими последовательностями (например, мутации, введенные неспецифическим или сайтспецифическим мутагенезом in vitro или соматическими мутациями in vivo). Однако используемый здесь термин «человеческое антитело» не предназначен для включения антител, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мыши, были пересажены в человеческие каркасные последовательности.
Используемый здесь термин «человеческий домен» предназначен для включения доменов константных областей иммуноглобулина, полученных из последовательностей человеческого происхождения, например человеческих зародышевых последовательностей, или мутированных версий человеческих зародышевых последовательностей или из антитела, содержащего консенсусные каркасные последовательности, полученные анализом человеческих зародышевых последовательностей как описано Knappik, et al. (2000. J Mol Biol 296, 57-86).
Используемый здесь термин «рекомбинантное человеческое антитело» включает все человеческие антитела, которые приготовляются, экспрессируются, образуются или выделяются рекомбинантными средствами, такие как антитела, выделенные из животных (например, мышей), которые являются трансгенными или трансхромосомными по человеческим иммуноглобулиновым генам, или выделенные из полученных из них гибридом, включая антитела, выделенные из клетки-хозяина, трансформированной для экспрессии человеческого антитела, например, из трансфектомы, включая антитела, выделенные из рекомбинантной, комбинаторной библиотеки человеческих антител, и включая антитела, приготовленные, экспрессированные, образованные и выделенные с помощью любого средства, которое включает сплайсинг всей или части последовательности человеческого гена иммуноглобулина с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела обладают вариабельными областями, в которых области каркаса и CDR происходят из человеческих зародышевых иммуноглобулиновых последовательностей. Однако, в некоторых воплощениях, такие рекомбинантные человеческие антитела могут быть подвергнуты in vitro мутагенезу (или, если используется трансгенное по человеческой последовательности иммуноглобулина животное, соматический мутагенез in vivo) и таким образом аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, хотя и происходят из и относятся к человеческим зародышевым последовательностям VH и VL, не могут существовать в естественных условиях в зародышевом репертуаре человеческих антител in vivo.
«Химерное антитело» является молекулой антитела, в которой (а) константная область, или ее часть, изменяется, заменяется или обменивается так, что антигенсвязывающий сайт (вариабельная область) связывается с константной областью отличного или измененного класса, эффекторной функции и/или вида, или с полностью отличной молекулой, которая придает новые свойства химерному антителу, например, ферменту, токсину, гормону, фактору роста, лекарственному средству и т.д., или в которой (b) вариабельная область или ее часть изменяется, заменяется или обменивается с вариабельной областью обладающей отличной или измененной антигенной специфичностью. Например, мышиное антитело может быть модифицировано заменой константной области на константную область из человеческого иммуноглобулина, содержащего модификацию, описанную здесь. Из-за замены человеческой константной областью, химерное антитело может сохранять свою специфичность, в то же время обладая уменьшенной антигенностью в человеке и уменьшенной общей агрегацией по сравнению с оригинальным мышиным антителом или химерным антителом без описанной здесь модификации.
«Гуманизированное» антитело является антителом, которое сохраняет реактивность нечеловеческого антитела, в то же время являясь менее иммунногенным в человеке. Подобное может быть получено, например, сохранением нечеловеческих областей CDR и заменой оставшихся частей антитела их аналогами из человека (т.е. константной области, а также каркасной части вариабельной области). См., например, Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855, 1984; Morrison and Oi, Adv. ImmunoL, 44: 65-92, 1988; Verhoeyen et al., Science, 239:1534-1536, 1988; Padlan, Molec. Immun., 28: 489-498, 1991; и Padlan, Molec. Immun., 31: 169-217, 1994. Другие примеры инженерной технологии очеловечивания включают, в частности, технологию «Хота», раскрытую в US 5,766,886.
Термин «гуманирование», используемый в данной заявке, относится к способу превращения нечеловеческих антител в сконструированные человеческие антитела (см., например, технологию «KaloBios' Humaneering™ technology»).
Используемый здесь термин «изотип» относится к любому классу антител (например, IgM, IgE, IgG, такие как IgG1 или IgG2), которые обеспечиваются генами константных областей тяжелых цепей, которые имеют склонные к агрегации мотивы, которые описаны в данном документе (и, следовательно, поддаются описанным здесь изменениям, которые уменьшают агрегацию).
Используемый здесь термин «сродство» относится к силе взаимодействия между антителом и антигеном в одиночных антигенных сайтах. В пределах каждого антигенного сайта, вариабельная область «плеча» антитела взаимодействует посредством слабых нековалентных сил, с антигеном во множестве сайтов; чем больше взаимодействий, тем сильнее сродство. Описанные здесь модификации предпочтительно не уменьшают сродство иммуноглобулина или антител, описанных в данной заявке, или сродство уменьшается менее чем на тридцать процентов, менее чем на двадцать процентов, менее чем на десять процентов, или менее чем на пять процентов. При использовании здесь, при определении являются ли модификации, раскрытые в данном документе, снижающими сродство, сравнение производится между иммуноглобулином или антителом с изменением и таким же иммуноглобулином без изменения, но с какими-либо несвязанными мутациями. Например, гуманизированное антитело с мутацией L234K, раскрытое в данной заявке, могло бы сравниваться с гуманизированным антителом с точно такой же последовательностью за исключением остатка дикого типа L234.
Используемый здесь термин «объект» включает любое животное человеческого или нечеловеческого вида.
Термин «животное нечеловеческого вида» включает всех позвоночных, например млекопитающих и немлекопитающих, таких как нечеловекообразные обезьяны, овцы, собаки, кошки, лошади, коровы, цыплята, амфибии, рептилии и т.п.
Используемый здесь термина «оптимизированная» означает, что нуклеотидная последовательность изменяется таким образом, чтобы кодировать аминокислотную последовательность с помощью кодонов, которые являются предпочтительными в продуцирующей клетке или организме, главным образом в эукариотической клетке, например в клетке Pichia, в клетке яичников китайского хомяка (СНО) или в человеческой клетке. Оптимизированная нуклеотидная последовательность конструируется для полного или максимально возможного сохранения аминокислотной последовательности, изначально кодируемой исходной нуклеотидной последовательностью, которая также известна как «родительская» последовательность. Оптимизированная экспрессия этих последовательностей в других эукариотических клетках также предусмотрена в данном документе. Аминокислотные последовательности, кодируемые оптимизированными нуклеотидными последовательностями, также называются оптимизированными.
Термин «эпитоп» означает белковую детерминанту, способную специфически связываться с антителом. Эпитопы, как правило, содержат химически активные поверхностные группировки молекул, таких как аминокислоты или сахарные боковые цепи, и, как правило, имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первым, но не последним, нарушается в присутствии денатурирующих растворителей.
Термин «консервативно измененный вариант» относится как к аминокислотным, так и к нуклеотидным последовательностям. Что касается определенных нуклеотидных последовательностей, то консервативно измененные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или практически идентичные аминокислотные последовательности, или где в случае, когда нуклеиновые последовательности не кодируют аминокислотные последовательности, к практически идентичным последовательностям. Из-за вырожденности генетического кода, большое число функционально идентичных нуклеиновых кислот кодируют тот или иной белок. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждой позиции, в которой кодон определяет аланин, кодон может быть изменен на любой из соответствующих описанных кодонов, без изменения кодируемого полипептида. Такие варианты нуклеиновых кислот, или «молчащие варианты», являются одним из видов консервативно измененных вариантов. Каждая последовательность нуклеиновой кислоты в данном документе, которая кодирует полипептид, также описывает каждый возможный молчащий вариант нуклеиновой кислоты. Специалист знает, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана) может быть изменен для получения функционально идентичной молекулы. Соответственно, каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид, подразумевается в каждой описанной последовательности.
Для полипептидных последовательностей, «консервативно измененные варианты» включают индивидуальные замены, делеции или добавки (вставки) к полипептидной последовательности, которые приводят к замене аминокислоты на химически подобную аминокислоту. Таблицы консервативных замен, предоставляющие подобные аминокислоты, хорошо известны в данной области. Такие консервативно измененные варианты являются дополнением и не исключают полиморфных вариантов, межвидовых гомологов и аллелей раскрытия. Следующие восемь групп содержат аминокислоты, которые являются консервативными заменами друг друга; 1) Аланин (А), Глицин (G), 2) Аспарагиновая кислота (D), Глутаминовая кислота (Е); 3) Аспарагин (N), Глутамин (Q), 4) Аргинин (R), Лизин (К); 5) Изолейцин (I), Лейцин (L), Метионин (М), Валин (V); 6) Фенилаланин (F), Тирозин (Y), Триптофан (W); 7) Серин (S), Треонин (Т) и 8) Цистеин (С), Метионин (М) (см., например, Creighton, Proteins (1984)).
Термины «идентичный» или процент «идентичности», в контексте двух или более нуклеиновых кислот или полипептидных последовательностей, относятся к двум или нескольких последовательностям или подпоследовательностям, которые являются одинаковыми. Две последовательности являются «практически идентичными» если две последовательности имеют определенный процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.е. имеют 60% идентичности, необязательно 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% идентичности в определенной области, или, если, не определено, во всех последовательности), если сравниваются и выравниваются для максимального соответствия в окне сравнения, или в обозначенной области, как измерено с помощью указанных ниже алгоритмов сравнения последовательностей или с помощью ручного выравнивания и визуальной проверки. При необходимости, идентичность имеет место в области, длина которой составляет около 50 нуклеотидов (или 10 аминокислот), или более предпочтительно, длина которой составляет от 100 до 500 или 1000 или больше нуклеотидов (или 20, 50, 200 или больше аминокислот).
При сравнении последовательностей, как правило, одна последовательность выполняет роль эталонной последовательности, с которой сравниваются тестируемые последовательности. При применении алгоритма сравнения последовательностей, тестовые и эталонные последовательности вводятся в компьютер, если необходимо, обозначаются координаты подпоследовательностей, и устанавливаются программные параметры алгоритма сравнения последовательностей. Могут быть использованы программные параметры по умолчанию, или могут быть установлены альтернативные параметры. Алгоритм сравнения последовательностей затем рассчитывает процент совпадений последовательности для тестовых последовательностей относительно эталонной последовательности, на основе программных параметров. Если сравнивается идентичность последовательностей то в этом случае нет необходимости, чтобы последовательности были непрерывными, но каждый разрыв должен привносить штраф, который будет уменьшать общий процент идентичности. Для «blastn» параметрами по умолчанию являются: штраф за открытие делеции =5, штраф за продолжение делеции =2. Для «blastp» параметрами по умолчанию являются: штраф за открытие делеции =11, штраф за продолжение делеции =1.
Используемый здесь термин «окно сравнения» включает ссылки на сегмент любого из множества непрерывных позиций, включая, в частности, сегменты размером от 20 до 600, как правило, от около 50 до около 200, более предпочтительно, от около 100 до около 150, в которых последовательности могут быть сравнены с эталонной последовательностью с таким же количеством непрерывных позиций после оптимального выравнивания двух последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, с помощью алгоритма локальной гомологии Смита и Ватермана (1970) Adv. Appl. Math. 2: 482 c., с помощью алгоритма гомологичного выравнивания Нидлмана и Вунша, J. Mol. Biol. 48: 443, 1970, с помощью способа поиска сходства Пеарсона и Липмана, Proc. Natl. Acad. Sci. USA 85: 2444, 1988, с помощью компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в программном пакете «Wisconsin Genetics Software Package» от «Genetics Computer Group», 575 Сайенс Др., Мэдисон, Висконсин) или с помощью ручного выравнивания и визуальной оценки (см., например, Brent et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (ringbou ed., 2003)).
Двумя примерами алгоритма, которые подходят для определения процента идентичности последовательности и схожести последовательностей, являются алгоритмы «BLAST» и «BLAST 2.0» которые описаны в работах Altschul et al., Nuc. Acids Res. 25: 3389-3402, 1977; и Altschul et al., J. Mol. Biol. 215: 403-410, 1990, соответственно. Публичный доступ к программному обеспечению для осуществления анализов «BLAST» предоставляет Национальный Центр Биотехнологической Информации (http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает, во-первых, идентификацию пар последовательностей с наибольшей балльной оценкой (HSPs - high scoring sequence pairs) путем определения коротких слов длиной W в последовательности запроса, которые либо совпадают, либо удовлетворяют некоторому пороговому баллу Т с положительной оценкой, либо соответствуют слову такой же длины в последовательности базы данных. Т называют пороговым баллом соседних слов (Altschul et al., выше). Эти изначальные совпадения соседних слов выполняют роль затравки для начальных поисков для того, чтобы найти более длинные содержащие их HSP. Совпадения слов распространяются в обоих направлениях вдоль каждой последовательности по мере увеличения кумулятивной балльной оценки выравнивания. Кумулятивные балльные оценки рассчитываются с помощью нуклеотидных последовательностей, параметр М (наградная балльная оценка для пар совпадающих остатков, всегда>0) и N (штрафная балльная оценка для несовпадающих остатков, всегда<0). Для аминокислотных последовательностей, матрица баллов используется для расчета кумулятивной балльной оценки. Распространение совпадений слов в каждом направлении останавливается когда: кумулятивный балл выравнивания падает ниже величины Х от его полученного максимального значения; кумулятивный балл достигает ноля или ниже, из-за накопления в выравнивании одного или нескольких остатков с отрицательным баллом; либо же достигается конец последовательности. Параметры алгоритма «BLAST» W, Т и Х определяют чувствительность и скорость выравнивания. В программе «BLASTN» (для нуклеотидных последовательностей) по умолчанию применяются длина «слова» (W) 11, ожидание (Е) 10, М=5, N=-4 и сравнение обоих цепей. Для аминокислотных последовательностей по умолчанию используется программа «BLASTP» с длиной «слова» 3, и ожиданием (Е) 10, и матрицей расчета баллов «BLOSUM62» (см. Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89:10915, 1989) выравнивания (В) 50, ожидание (Е) 10, М=5, N=-4, и сравнение обоих цепей.
Алгоритм «BLAST» также осуществляет статистический анализ схожести двух последовательностей (см., например, Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90: 5873-5787, 1993). Одно измерение схожести, обеспеченное алгоритмом «BLAST» заключается в определении наименьшей суммарной вероятности P(N)), которая обеспечивает представление о вероятности, посредством которой совпадение между двумя нуклеотидными или аминокислотными последовательностями будет происходить случайно. Например, нуклеотидная последовательность считается похожей на эталонную последовательность, если наименьшая суммарная вероятность в сравнении тестируемой последовательности с эталонной последовательностью меньше чем около 0,2, более предпочтительно меньше чем около 0,01 и наиболее предпочтительно меньше чем около 0,001.
Другое отличное от указанного выше процента идентичности последовательности, указание того, что две нуклеотидные последовательности или полипептида являются практически идентичными, заключается в том, что полипептид, кодируемый первой нуклеиновой кислотой, является кросс-реактивным с антителом, созданным полипептидом, кодируемым второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид, как правило, является практически идентичным второму полипептиду, например, когда два полипептида отличаются только консервативными заменами. Другое указание того, что две нуклеотидные последовательности являются практически идентичными, заключается в том, что две молекулы или комплементарные им последовательности гибридизуются друг с другом в жестких условиях, как описано ниже. Еще одно указание того, что две нуклеотидные последовательности являются практически идентичными, заключается в том, что для амплификации последовательности могут быть использованы похожие праймеры.
Термин «функционально связанный» относится к функциональному взаимодействию между двумя или большим количеством полинуклеотидных (например, ДНК) сегментов. Как правило, он относится к функциональному взаимодействию транскрипционной регуляторной последовательности с транскрибируемой последовательностью. Например, промоторная или энхансерная последовательность функционально связана с кодирующей последовательностью, если она стимулирует или модулирует транскрипцию кодирующей последовательности в подходящей клетке-хозяине или другой экспрессирующей системе. Как правило, промоторные транскрипционные регуляторные последовательности, которые функционально связаны с транскрибируемой последовательностью, физически примыкают к транскрибируемой последовательности, т.е. они являются els-действующими. Однако для некоторых транскрипционных регуляторных последовательностей, таких как энхансеры, нет необходимости физически примыкать или находится в непосредственной близости от кодирующих последовательностей, чью транскрипцию они усиливают.
Термин «вектор» предназначен для обозначения полинуклеотидной молекулы, способной переносить другой полинуклеотид, с которым они связаны. Один тип вектора является «плазмидой», которая представляет собой кольцевой, замкнутый фрагмент двухцепочечной ДНК, с которым могут быть лигированы дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Некоторые вектора проявляют способность к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные вектора, имеющие бактериальную точку начала репликации и эписомальные вектора млекопитающих). Другие вектора (например, неэписомальные вектора млекопитающих) интегрируются в геном клетки-хозяина при введении в клетку-хозяина, и таким образом, реплицируются вместе с хозяйским геномом. Более того, некоторые вектора способны управлять экспрессией генов, с которыми они функционально связаны. В данном документе такие вектора называются «рекомбинантными экспрессирующими векторами» (или просто «экспрессирующими векторами»). В общем, экспрессирующие вектора, используемые в методах рекомбинантных ДНК, часто представлены в виде плазмид. В настоящем описании изобретения, термины «плазмида» и «вектор» могут быть использованы взаимозаменяемо, поскольку плазмида является наиболее часто используемой формой вектора. Однако описание имеет целью включить другие формы экспрессирующих векторов, таких как вирусные вектора (например, репликативно-дефектные ретровирусы, аденовирусы и аденоассоциированные вирусы), которые выполняют аналогичные функции.
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») относится к клетке, в которую вводится рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины предназначены для обозначения не только определенного объекта, но также объекты из потомства такой клетки. Так как некоторые изменения могут происходить в последующих поколениях либо из-за мутации, либо из-за влияния окружающей среды, то потомство может быть фактически не идентичным родительской клетке, но все еще включаться в объем используемого в данном документе термина «клетка-хозяин».
Термин «целевой антиген» относится к антигену, против которого получают родительский иммуноглобулин или в ином случае создают (например, фаговым дисплеем).
Термин «немутированный иммуноглобулин» относится к иммуноглобулинам, которые не содержат, по меньшей мере, одной уменьшающей агрегацию мутации. Используемый в данном документе, немутированный иммуноглобулин может быть гипотетической конструкцией для целей сравнения склонности к агрегации или сродства связывания с иммуноглобулином с или без мутаций, уменьшающих агрегацию. Например, мышиное антитело, которое включает гуманизированные мутации, а также мутации, уменьшающие агрегацию, не является немутированным иммуноглобулином. Немутированный иммуноглобулин может быть антителом с гуманизированными мутациями, но без мутаций уменьшающих агрегацию. Если мутация предназначена для более чем одной цели, включая снижение агрегации, немутированный иммуноглобулин не включает такую мутацию.
Термин «мотив агрегации» относится к набору остатков сгруппированных вместе на основании следующего процесса. Во-первых, идентифицируются остатки, обладающие значением ПСА (радиус 5 Å) больше чем 0,15. Затем идентифицируются все остатки в пределах 5 Å от каждого остатка, обладающего значением ПСА (радиус 5 Å) больше чем 0,15. После этого мотивом является остаток со значением ПСА (радиус 5 Å) больше чем 0,15, и все остатки со значением ПСА (радиус 5 Å) больше чем 0,0 в пределах 5 Å от остатка со значением ПСА (радиус 5 Å) больше чем 0,15. Любые такие мотивы, обладающие, по меньшей мере, одним остатком, в совокупности повторно объединяются в более больший мотив, пока не останется мотивов, которые обладают общим остатком. Эти оставшиеся мотивы или наборы остатков составляют мотивы агрегации. В таблице 2 ниже представлены мотивы агрегации для константных доменов IgG.
Соответственно, задача настоящего изобретения заключается в обеспечении модифицированного или изолированного иммуноглобулина, имеющего уменьшенную склонность к агрегации, который содержит, по меньшей мере, одну уменьшающую агрегацию мутацию в остатке, выбранном из группы, состоящей из остатков мотива агрегации 1: 174 (СН1), 175 (СН1) и 181 (СН1); и мотива агрегации 2: 226 (шарнир), 227 (шарнир), 228 (шарнир), 229 (шарнир), 230 (шарнир), 231 (шарнир) и 232 (шарнир); мотива агрегации 3: 234 (шарнир) и 235 (шарнир); мотива агрегации 4: 252 (СН3) и 253 (СН2); мотива агрегации 5: 282 (СН1); мотива агрегации 6: 291 (СН2); мотива агрегации 7: 296 (СН1); мотива агрегации 8: 308 (СН2) и 309 (СН2); мотива агрегации 9: 328 (СН2), 329 (СН2), 330 (СН2) и 331 (СН2); мотива агрегации 10: 395 (СН3), 396 (СН3), 397 (СН3), 398 (СН3) и 404 (СН3); мотива агрегации 11: 443 (СН3); мотива агрегации 12: 110 (CL) и 111 (CL); мотива агрегации 13: 153 (CL) и 154 (CL); и мотива агрегации 14: 201 (CL), в котором, по меньшей мере, одна уменьшающая агрегацию мутация является заменой аминокислотного остатка, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине, а агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе; и в котором нумерация остатков соответствует нумерации остатков по Кабату в IgG1 на основе выравнивания с последовательностью IgG1. В некоторых воплощениях, по меньшей мере, один остаток, уменьшающий агрегацию, выбирается из группы, состоящей из остатков из мотива агрегации 1: 175 (СН1); мотива агрегации 2: 227 (шарнир), 228 (шарнир) и 230 (шарнир); мотива агрегации 3: 234 (шарнир) и 235 (шарнир); мотива агрегации 4: 253 (СН2); мотива агрегации 5: 282 (СН2); мотива агрегации 6: 291 (СН1); мотива агрегации 7: 296 (СН2); мотива агрегации 8: 309 (СН1); мотива агрегации 9: 329 (СН1), 330 (СН2); мотива агрегации 10: 395 (СН3) и 398 (СН3); мотива агрегации 11: 443 (СН3); мотива агрегации 12: 110 (CL); мотива агрегации 13: 154 (CL); и мотива агрегации 14: 201 (CL). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающей агрегацию мутацией, не являются остатки 234 (шарнир) или 235 (шарнир). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, остатком уменьшающей агрегацию мутации являются 234 (шарнир), 235 (шарнир), 253 (CH2) или 309 (СН2). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, остатком уменьшающей агрегацию мутации являются 253 (СН2) или 309 (СН2). В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин обладает второй уменьшающей агрегацию мутацией в гидрофобном остатке, который (i) имеет значение ПСА равное, по меньшей мере, 0,15, или который (ii) находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15, где, по меньшей мере, одна мутация, уменьшающая агрегацию, является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, имеющих вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в отдельных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет, по меньшей мере, пятнадцать уменьшающих агрегацию мутаций, где каждая уменьшающая агрегацию мутация выбирается из отдельного вызывающего агрегацию мотива. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина и аспарагина. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина и гистидина. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на остаток лизина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин является IgG1, IgG2, IgG3, или IgG4. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин содержит IgG1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин обладает сродством связывания к целевому антигену и сродство связывания к целевому антигену составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов относительно сродства связывания с целевым антигеном немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
В соответствии с дополнительной задачей изобретения обеспечивается модифицированный или изолированный иммуноглобулин, обладающий уменьшенной склонностью к агрегации, который содержит, по меньшей мере, одну уменьшающую агрегацию мутацию в остатке, выбранном из группы, состоящей из 235 (шарнир), 241 (СН2), 243 (СН2), 282 (СН2) и 309 (СН2), где если выбирается остаток 235, то его мутируют в глутамин или серин, если выбирается остаток 282, то его мутируют в лизин, и если выбирается остаток 309, то его мутируют в лизин, и где, по меньшей мере, одна уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине и агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе; и где нумерация остатков соответствует нумерации остатков по Кабату в IgG1 на основе выравнивания с последовательностью IgG1. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 241 в серин, и модифицированный и изолированный иммуноглобулин дополнительно содержит вторую уменьшающую агрегацию мутацию остатка 243 в серин. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 241 в тирозин, и измененный и выделенный иммуноглобулин дополнительно содержит вторую уменьшающую агрегацию мутацию остатка 243 в тирозин. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация является мутацией остатка 282 в лизин, и модифицированный или изолированный иммуноглобулин дополнительно содержит вторую и третью уменьшающие агрегацию мутации, где вторая уменьшающая агрегацию мутация является мутацией остатка 235 в лизин, а третья уменьшающая агрегацию мутация является мутацией остатка 309 в лизин. В некоторых воплощениях, иммуноглобулин имеет вторую уменьшающую агрегацию мутацию в гидрофобном остатке, где вторая уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями имеющими вторую уменьшающую агрегацию мутацию, вторая уменьшающая агрегацию мутация (1) имеет значение ПСА равное, по меньшей мере, 0,15, или (ii) находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, иммуноглобулин обладает третьей уменьшающей агрегацию мутацией, которая (i) имеет значение ПСА равное, по меньшей мере, 0,15, или которая (ii) находится в пределах 5 Å от остатка имеющего значение ПСА равное, по меньшей мере, 0,15, где третья уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5 Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, имеющих вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в отдельных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет, по меньшей мере, пятнадцать уменьшающих агрегацию мутаций, где каждая уменьшающая агрегацию мутация выбирается из отдельного вызывающего агрегацию мотива. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина, аспарагина, тирозина и серина. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, серина, глутамата и гистидина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулином является IgG1, IgG2, IgG3, или IgG4. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин содержит IgG1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен СН3. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин обладает сродством связывания к целевому антигену и сродство связывания к целевому антигену составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов относительно сродства связывания с целевым антигеном немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
Если остатки иммуноглобулинов называются согласно нумерации данного документа, то нумерация остатков соответствует нумерации по Кабату соответствующего остатка в молекуле IgG, при выравнивании последовательности иммуноглобулина интереса с человеческим иммуноглобулином IgG1. Для справки, выравниваются константные домены человеческих IgG1, IgG2, IgG3 и IgG4.
Пространственная склонность к агрегации (ПСА)
В данной заявке изобретение относится к способам для определения предрасполагающих к агрегации областей на поверхности белка и для предотвращения или уменьшения агрегации белка. Изобретение может быть применено для получения иммуноглобулина с уменьшенной склонностью к агрегации, т.е. иммуноглобулин в концентрированном растворе остается, главным образом, в мономерной форме, а не в виде агрегированных мультимеров высшего порядка. Способы данного документа представляют собой улучшение способности вычислительных методов определять белковые области, которые могут быть изменены для уменьшения склонности белка к агрегации. В частности, способы основываются, по меньшей мере, частично, на расчете ПДР (площади поверхности, доступной растворителю), которая известна в данной области для описания характеристик поверхности белка. ПДР дает площадь поверхности каждой аминокислоты в структуре белка, которая находится в контакте с растворителем. ПДР может быть, как правило, рассчитана путем вычисления локуса центра сферы зонда, который катится по поверхности белка, т.е. по поверхности структурной модели белка. Сфера зонда имеет тот же радиус что и молекула воды, R=1,4 Å. Альтернативные способы расчета ПДР, описанные ниже, известные в данной области, сравнимы со способами, описанными в данном документе. Хотя ПДР весьма полезна для описания характеристик поверхности белка, было обнаружено, что ПДР не адекватно характеризует предрасполагающие к агрегации гидрофобные участки на поверхности белка из-за следующих недостатков:
1. ПДР не делает различий между гидрофобными и гидрофильными областями;
2. Значение ПДР не является прямо пропорциональным гидрофобности остатка (например, MET имеет большую площадь поверхности, чем LEU но является менее гидрофобным);
3. Значение ПДР не указывает, находятся ли несколько гидрофобных остатков рядом и, таким образом, не усиливают ли они гидрофобность определенной области. Эти остатки могут быть поблизости либо в первичной последовательности, либо в третичной структуре, даже если они находятся далеко в первичной последовательности. В любом случае, они могут усиливать гидрофобность определенного участка поверхности антитела.
Одна система измерений, которая описана в данном документе, Эффективная-ПДР, получается расчетом гидрофобности фракции экспонированной аминокислоты в соответствии с формулой ниже

Дополнительное воплощение эффективной-ПДР дополнительно содержит суммирование значений эффективных-ПДР, по меньшей мере, двух, по меньшей мере, трех, по меньшей мере, четырех, по меньшей мере, пяти или, по меньшей мере, шести (например, двух, трех, четырех, пяти, шести и т.д.) аминокислотных остатков, которые прилегают друг к другу в первичной белковой последовательности. Хотя эффективная-ПДР представляет собой улучшение по сравнению с обычной ПДР, ей тем не менее не хватает способности в полной мере учесть структуру свернутого белка, и того факта, что аминокислоты, которые не являются прилегающими в белкой последовательности, могут находиться в непосредственной близости друг от друга в свернутой вторичной, третичной или четвертичной структуре белка. Такие складки белка могут образовывать области, предрасполагающие к агрегации, которые отсутствуют отдельно в первичной структуре, или которые могут быть определены только более сложным анализом свернутой белковой структуры.
Настоящее изобретение обеспечивает новый, более совершенный критерий, названный ПСА, который рассчитывается для определенных областей в пространстве вокруг или около атомов в структурной модели белка.
В этом контексте, «определенная область пространства» является трехмерным пространством или объемом, выбранным для захвата локальной физической структуры и/или химической окружающей среды на или около белковой структуры. В особенно предпочтительном воплощении ПСА рассчитывают для сферических областей с радиусом R отцентрованных на атомах в белке (например, на атомах в структурной модели белка). ПСА может быть также рассчитана для сферических участков с радиусом R с центром на химических связях, или точках, расположенных в пространстве около структурной модели. Соответственно, в другом воплощении, ПСА может быть рассчитана для определенной области пространства с центром около атома, например с центром в точке пространства, которая находится на расстоянии в диапазоне 1-10 Å, 1-5 Å или 1-2 Å, от центра конкретного атома или химической связи.
В некоторых воплощениях, выбранный радиус R находится в интервале между 1 Å и 50 Å. В конкретных воплощениях, выбранный радиус составляет, по меньшей мере, 1 Å, по меньшей мере, 3 Å, по меньшей мере, 4 Å, по меньшей мере, 5 Å, по меньшей мере, 6 Å, по меньшей мере, 7 Å, по меньшей мере, 8 Å, по меньшей мере, 9 Å, по меньшей мере, 10 Å, по меньшей мере, 11 Å, по меньшей мере, 12 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å, по меньшей мере, 25 Å, или, по меньшей мере, 30 Å. В некоторых воплощениях, выбранный радиус находится в интервале между 5 Å и 15 Å, между 5 Å и 12 Å, между 5 Å и 10 Å. В определенных воплощениях, выбранный радиус составляет 5 Å или 10 Å.
В других воплощениях, область, для которой рассчитывается значение ПСА не является сферической. Возможная форма области может дополнительно содержать куб, цилиндр, конус, эллиптический сфероид, пирамиду, полусферу или любую другую форму, которая может использоваться для ограничения пространства. В таких воплощениях, размер области может выбираться с использованием величин, отличных от радиуса, например с использованием расстояния от центра формы до стороны или вершины.
В определенном воплощении, ПСА может использоваться для выбора остатков в белке, которые могут быть заменены, для увеличения, таким образом, стабильности белка. В предыдущих исследованиях были разработаны два основных подхода стабилизации белка in vitro для (1) создания самой последовательности белка и (2) для включения добавок в жидкий состав. Оба подхода были изучены и были получены значимые результаты. Первый подход базировался на скрининге обширных библиотек случайных вариантов in silico или экспериментально. Во втором подходе проводился высокопроизводительный скрининг стабилизирующих добавок, а также рациональный дизайн добавок позволяют идентифицировать оптимальные составы для терапевтического белка.
Настоящее изобретение, как ожидается, упростит процесс повышения стабильности посредством обнаружения существующих горячих точек агрегации путем вычисления, и посредством экспериментального анализа вариантов с заменами в данных сайтах.
Таким образом, вообще говоря, метод расчета ПСА для конкретного атома в белке содержит (а) идентификацию одного или более атомов в структурной модели, представляющей белок, где один или более атомов находятся внутри определенной области пространства с центром в конкретном атоме или около него; (b) расчет для каждого одного или нескольких атомов в определенной области пространства отношения площади поверхности атомов доступной растворителю (ПДР) к ПДР атомов в идентичном, полностью экспонированном остатке; (с) умножение каждого отношения на гидрофобность одного или нескольких атомов; и (d) суммирование продуктов стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома.
В смежном воплощении, ПСА может рассчитываться согласно другому способу, содержащему (а) идентификацию одного или более аминокислотных остатков в структурной модели, представляющей белок, где один или несколько аминокислотных остатков содержат, по меньшей мере, один атом внутри определенного участка пространства с центром в конкретном атоме или около него; (b) расчет для каждого идентифицированного одного или нескольких аминокислотных остатков отношения площади поверхности атомов в аминокислоте, доступной растворителю (ПДР), к ПДР атомов в идентичном, полностью экспонированном остатке; (с) умножение каждого отношения на гидрофобность одного или нескольких аминокислотных остатков, определенную по шкале гидрофобности аминокислот; и (d) суммирование продуктов стадии (с); в результате чего сумма представляет собой ПСА для конкретного атома. В предпочтительных воплощениях, структурная модель обрабатывается перед стадией (а) путем разрешения структурной модели взаимодействовать с растворителем при моделировании молекулярной динамики. Когда идентифицируют аминокислотный остаток, содержащий, по меньшей мере, один атом внутри определенной области пространства, то может потребоваться, чтобы этот, по меньшей мере, один атом представлял собой исключительно атом в боковой цепи аминокислоты. В ином случае, он может представлять собой атом, который, по требованию, является атомом основной цепи.
В других воплощениях, этот способ может дополнительно необязательно содержать проведение моделирования молекулярной динамики перед стадией (а) и повторение стадий (a)-(d), каждый раз проводя следующее моделирование молекулярной динамики во множестве временных интервалов, получая, таким образом, множество сумм, как в стадии (d), и расчет среднего значения сумм; в результате чего рассчитанное среднее значение представляет собой ПСА для конкретного атома.
Специалисту в данной области понятно, что воплощение настоящего изобретения, в котором используется усреднение величин, рассчитанных во время моделирования молекулярной динамики, будет более интенсивным в вычислительном отношении. Также в некоторых случаях такое воплощение будет обеспечивать более точную или с более высоким разрешением карту ПСА. Однако эксперименты, обсуждаемые в настоящем документе, продемонстрировали, что даже если не применяется усреднение молекулярной динамики, способ все равно остается высокоточным. В одном предпочтительном воплощении, значения ПСА могут быть рассчитаны для всех белковых структур в базе данных, например в Белковой базе данных (PDB), в результате чего будут быстро идентифицироваться гидрофобные остатки и участки на всех известных белковых структурах. Этот способ дает возможность быстрого скрининга больших наборов белков для обнаружения потенциальных участков, предрасполагающих к агрегации и/или сайтов взаимодействия белков.
В предпочтительном применении, ПСА описывается с помощью следующей формулы:
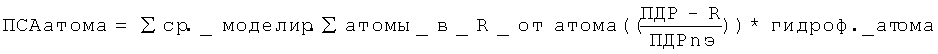
где
1) ПДР-R является ПДР атомов боковой цепи в пределах радиуса R, которая рассчитывается для каждого «кадра» при моделировании. ПДР предпочтительно рассчитывают в модели имитационного моделирования путем расчета локуса центра зондовой сферы, которая как бы катится по поверхности белка. Зондовая сфера имеет такой же радиус, что и радиус молекулы воды, R=1,4 Å. Специалисту в данной области понятно, что другие способы вычисления ПДР будут совместимы с описанными в настоящем документе способами для расчета ПСА. Например, ПДР может быть рассчитана только для атомов боковой цепи аминокислоты. ПДР также может быть рассчитана только для атомов основной цепи аминокислоты (т.е., для атомов пептидного каркаса и ассоциированных атомов водорода). В ином случае, ПДР может быть рассчитана только для атомов основной цепи аминокислоты с исключением ассоциированных атомов водорода;
2) ПДР-nэ является ПДР боковой цепи полностью экспонированного остатка (скажем, для аминокислоты 'X'), которую получают в предпочтительном воплощении путем расчета ПДР боковых цепей среднего остатка в полностью раскрытой конформации трипептида 'Ala-X-Ala'; и
3) «гидроф._атома» является значением гидрофобности атома, которое получают, как описано выше, с помощью шкалы гидрофобности Блэка и Моулд (Black and Mould, Anal. Biochem. 1991, 193, 72-82). Шкала нормализуется таким образом, чтобы глицин имел гидрофобность равную нулю. Следовательно, аминокислоты, которые являются более гидрофобными по сравнению с глицином, являются положительными, а менее гидрофобные по сравнению с глицином являются отрицательными по шкале гидрофобности.
Остаток, который «полностью экспонирован», представляет собой остаток Х в полностью раскрытой конформации трипептида Ala-X-Ala. Специалисту в данной области понятно, что это расположение создается таким образом, чтобы расчет ПДР на таком остатке Х приводил к получению максимальной поверхности, доступной растворителю. Соответственно, предполагается, что другие остатки кроме аланина могут использоваться в расчете без полного нарушения или изменения результатов.
Как описано выше, способы по настоящему изобретению могут применяться в любой структурной модели белка, включая рентгеновскую структуру, с помощью той же формулы, что и представленная выше.
Аналогично, если рентгеновская структура не доступна, то такой же параметр ПСА может применяться к структуре, полученной посредством гомологического моделирования, а величина ПСА может быть рассчитана с помощью той же формулы, что и представленная выше.
В некоторых воплощениях, ПСА рассчитывают для всех атомов в структурной модели белка. В некоторых воплощениях, значения атомистической ПСА могут быть усреднены для каждого индивидуального остатка в белке или для небольших групп остатков.
Применение методологии ПСА
В одном аспекте, настоящее изобретение может применяться, как описано выше, для определения гидрофобных аминокислотных остатков, областей или участков в белке. Не желая придерживаться конкретных пороговых значений, полагаем, что атомы или аминокислотные остатки, обладающие значением ПСА>0, рассматриваются как гидрофобные или как принадлежащие областям, предрасполагающим к агрегации. В зависимости от типа белка, его конкретной структуры и растворителя, в котором он находится, может потребоваться определить атомы или остатки с помощью порога, который находится немного ниже нуля, например, отбором атомов или остатков, которые имеют значение ПСА больше чем -0,1, -0,15, -0,2 и т.д. В ином случае, может потребоваться использовать более жесткий предел, например 0, 0,05, 0,1, 0,15, 0,2 и т.д., для того чтобы выбрать наиболее сильные гидрофобные атомы, остатки или участки. Кроме того, поскольку алгоритм дает более высокие значения остаткам, расположенным в центре участка, остатки в пределах 3 Å, 4 Å, 5 Å, 7.5 Å или 10 Å от остатка, преодолевающие предел, также могут быть отобраны для мутации на менее гидрофобные остатки для уменьшения агрегации. В другом воплощении, выгодным может быть простой отбор атомов или остатков, имеющих значение ПСА, которое больше чем у атомов или остатков, которые находятся в непосредственной близости, либо по последовательности (т.е. вдоль белковой последовательности), либо, в предпочтительном воплощении, находятся в непосредственной близости в пространстве (т.е. в трехмерной структуре). Один предпочтительный способ отбора атомов или остатков в гидрофобном участке заключается в картировании рассчитанных значений ПСА, например, с помощью цветового кодирования или числового кодирования, на структурной модели белка, из которого они были получены, что таким образом приводит к визуализации различий в ПСА параллельно поверхности белка, что, следовательно, обеспечивает легкий отбор гидрофобных участков или остатков. В особенно предпочтительном воплощении, расчеты для ПСА проводятся отдельно с помощью двух значений, выбранных для радиуса, одного для высокого разрешения, например 5 Å, и другого для низкого разрешения, например, 10 Å. В таком воплощении более большие или более широкие гидрофобные участки можно увидеть на поверхности белка с картой низкого разрешения. Поскольку гидрофобные участки интереса выбираются на карте низкого разрешения, эти участки можно рассмотреть более детально на карте высокого разрешения, которая может, в некоторых воплощениях, позволить специалисту в данной области более легко и более точно выбрать остатки для мутации или модификации. Например, при просмотре гидрофобного участка на карте более высокого разрешения, может потребоваться выбрать для мутации остаток, который имеет наибольшую балльную оценку ПСА или который является наиболее гидрофобным (например, наиболее гидрофобный остаток на участке в соответствии со шкалой Блэка и Моулд (Black and Mould), Anal. Biochem. 1991, 193, 72-82).
В конкретном воплощении, способ обнаружения на белке области, предрасполагающей к агрегации, содержит (а) картирование ПСА на структурной модели белка, рассчитанной согласно любому способу, описанному в настоящем документе, для атомов в белке; и (b) обнаружение внутри белка области, содержащей множество атомов, имеющих ПСА>0; где область, предрасполагающая к агрегации, содержит аминокислоты, содержащие указанное множество атомов. В таком воплощении ПСА может быть рассчитана для всех атомов в белке или для части атомов. Предполагается, что специалист может рассчитать значение ПСА только для определенных, представляющих интерес, остатков или групп остатков.
В аналогичном воплощении, информативным может быть нанесение балльной оценки ПСА атомов на график (или балльной оценки ПСА как усредненной относительно аминокислотных остатков). Такой график, демонстрирующий балльную оценку ПСА по всем атомам или остаткам белка, позволяет легко обнаруживать пики, которые могут указывать на кандидатов для замены. В особенно предпочтительном воплощении на график наносятся баллы ПСА по всем атомам или остаткам белка и рассчитывается площадь под кривой (Area Under the Curve (AUC)) для пиков на графике. В таком воплощении, пики с наибольшими значениями AUC представляют более большие или более гидрофобные области, предрасполагающие к агрегации. В определенных воплощениях, для замены будет необходимо выбрать один или несколько остатков, которые определяются как присутствующие в пике, или более предпочтительно в пике с большим значением AUC.
В определенных воплощениях настоящее изобретение может применяться для изготовления варианта иммуноглобулина, который демонстрирует уменьшенную склонность к агрегации, путем замены, по меньшей мере, одного аминокислотного остатка в пределах предрасполагающей к агрегации области в иммуноглобулине, определенной любым способом, описанным в данном документе, на естественный аминокислотный остаток, измененный аминокислотный остаток, особенный аминокислотный остаток, искусственный аминокислотный остаток, аналог аминокислотного остатка или производное, которое является более гидрофильным, чем остаток, который заменяется, так чтобы склонность варианта к агрегации уменьшилась. При использовании в настоящем документе, если аминокислотные остатки обозначаются как «более» или «менее» гидрофильные или гидрофобные, то специалисту в данной области понятно, что это обозначает более или менее гидрофобный по сравнению с другой аминокислотой согласно величине гидрофобности (гидрофильности), известной из уровня техники, например, по шкале гидрофобности Блэка и Моулд.
В аналогичном воплощении настоящее изобретение может быть применено для изготовления варианта иммуноглобулина, который демонстрирует уменьшенную склонность к агрегации путем генерации множества вариантов иммуноглобулина посредством замены в каждом варианте, по меньшей мере, одного остатка в иммуноглобулине в пределах области, предрасполагающей к агрегации, где область, предрасполагающая к агрегации, определяется с помощью балльных оценок ПСА, рассчитанных в соответствии с описанным в данном документе способом, где один или различные остатки или различные комбинации остатков заменяются в каждом варианте, и где, по меньшей мере, один остаток заменяется на остаток, который является более гидрофильным; и (b) отбором приготовленных в (а) вариантов иммуноглобулина, которые демонстрируют уменьшенную склонность к агрегации.
Кроме того, аминокислотный остаток в области, предрасполагающей к агрегации, может быть удален или заменен. В некоторых иммуноглобулинах, в которых для замены отбирается множество аминокислотных остатков, некоторые остатки могут быть замены на другие или удалены.
В других воплощениях, множество предрасполагающих к агрегации областей или остатков могут быть обнаружены в исходном иммуноглобулине с помощью способов, описанных выше (например, с помощью предела значений ПСА, выше которого отбираются остатки). Впоследствии множество вариантов иммуноглобулинов может быть образовано путем замены в указанном исходном иммуноглобулине одного или нескольких отобранных аминокислотных остатков (или одного или нескольких остатков, расположенных в выбранном участке) на аминокислотные остатки, которые являются более гидрофильными, и таким образом создается множество вариантов иммуноглобулина, которое представляет собой множество различных аминокислотных замен. Эта популяция затем может быть отскринирована для выбора одного или нескольких вариантов иммуноглобулина, обладающих уменьшенной склонностью к агрегации. Специалисту в данной области будет понятно, что может быть обнаружено множество областей, предрасполагающих к агрегации, и что одна или несколько замен и/или делеций могут быть сделаны в одной или нескольких предрасполагающих к агрегации областях. Относительная гидрофобность аминокислот может быть определена по шкале гидрофобности Блэка и Моулд, как описано выше. В конкретных воплощениях, аминокислота, выбранная для замены, выбирается из группы, содержащей или состоящей из Phe, Leu, He, Туг, Тгр, Val, Met, Pro, Cys, Ala или Gly. В аналогичных воплощениях, более гидрофильная аминокислота, на которую заменяют аминокислоту в иммуноглобулине, может быть выбрана из группы, состоящей из Thr, Ser, Lys, Gin, Asn, His, Glu, Asp и Arg.
Соответственно задача настоящего изобретения заключается в обеспечении измененного и/или выделенного иммуноглобулина, обладающего сниженной склонностью к агрегации и содержащего, по меньшей мере, одну снижающую агрегацию мутацию в остатке в консервативном домене иммуноглобулина, который (i) имеет значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА больше чем 0,0 и находится в пределах 5 Å от остатка, имеющего значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, где, по меньшей мере, одна уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å) остатка по сравнению с немутированным иммуноглобулином, а агрегация, склонность к которой уменьшается, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе. В некоторых воплощениях, по меньшей мере, одна уменьшающая агрегацию мутация не является остатком, соответствующим по Кабату остатку 234 (шарнир) или 235 (шарнир) в IgG1 на основании выравнивания с последовательностью IgG1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет вторую мутацию, уменьшающую агрегацию в остатке, который (i) имеет значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА (радиус сферы 5 Å) больше чем 0,0 и находится в пределах 5 Å относительно остатка, имеющего значение ПСА (радиус сферы 5 Å) равное, по меньшей мере, 0,15, где вторая уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å) остатка по сравнению с немутированным иммуноглобулином. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся на расстоянии, по меньшей мере, 5 Å, по меньшей мере, 10 Å, по меньшей мере, 15 Å, по меньшей мере, 20 Å друг от друга. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, имеющими вторую уменьшающую агрегацию мутацию, уменьшающая агрегацию мутация и вторая уменьшающая агрегацию мутация находятся в разных вызывающих агрегацию мотивах. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, который является менее гидрофобным, чем остаток в неизмененном иммуноглобулине. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина, гистидина, глутамата, аспартата, глутамина и аспарагина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на аминокислотный остаток, выбранный из группы, состоящей из лизина, аргинина и гистидина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, уменьшающая агрегацию мутация является заменой на остаток лизина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, значение ПСА (радиус сферы 5 Å) рассчитывается с помощью шкалы гидрофобности Блэка-Моулд, нормализованной так, чтобы глицин был равен 0. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин является IgG1, IgG2, IgG3, или IgG4. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин является IgG1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН1. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН2. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен СН3. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин имеет человеческий домен CL. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, иммуноглобулин обладает сродством связывания к целевому антигену и сродство связывания к целевому антигену составляет, по меньшей мере, семьдесят процентов, по меньшей мере, восемьдесят процентов, по меньшей мере, девяносто процентов, по меньшей мере, сто процентов, или, по меньшей мере, сто пять процентов относительно сродства связывания к целевому антигену немутированного иммуноглобулина. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, концентрированный жидкий раствор имеет концентрацию, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, по меньшей мере, 150 мг/мл.
Варианты иммуноглобулина могут быть сделаны любым способом, известным в данной области, включая сайт-направленный мутагенез и другие технологии рекомбинантных ДНК, например, см. патенты США №5284760; 5556747; 5789166; 6878531, 5932419 и 6391548.
В определенных воплощениях настоящее изобретение может применяться для изготовления варианта иммуноглобулина, демонстрирующего уменьшенную склонность к агрегации, путем замены в иммуноглобулине, по меньшей мере, одного аминокислотного остатка в пределах области, предрасполагающей к агрегации, определенной любым способом, описанным в данном документе, на естественный аминокислотный остаток, измененный аминокислотный остаток, особенный аминокислотный остаток, искусственный аминокислотный остаток, аналог аминокислотного остатка или производное, которое является более гидрофильным, чем остаток, который заменяется, так что склонность варианта к агрегации уменьшается.
Синтез искусственных аминокислот известен специалистам в данной области и дополнительно описан, например, в публикации патента США №2003-0082575. В общем, любой способ, известный в данной области для синтеза или включения искусственных, измененных или особенных аминокислот в белки, может быть использован, включая, но не ограничиваясь, способами, описанными или процитированными в публикациях Liao J. Biotechnol Prog. 2007 Jan-Feb; 23(1): 28-31; Rajesh,and Iqbal. Curr Pharm Biotechnol. 2006 Aug; 7(4): 247-59; Cardillo et al. Mini Rev Med Chem. 2006 Mar; 6(3): 293-304; Wang et al. Annu Rev Biophys Biomol Struct. 2006; 35: 225-49; Chakraborty et al, Glycoconj J. 2005 Mar; 22(3): 83-93. В качестве еще одного примера, технология «Ambrx ReCODE™» может быть использована для разработки и включения искусственных аминокислот, или особенных аминокислот в белки, как указано в способах, описанных в данном документе.
Варианты иммуноглобулина по изобретению могут демонстрировать усиленную или улучшенную стабильность, определенную, например, ускоренными исследованиями стабильности. Примерные ускоренные исследования стабильности включают, в частности, исследования, характерной чертой которых является повышенная температура хранения.
Уменьшение образования агрегатов, наблюдаемое для варианта иммуноглобулина по сравнению с диким типом или изначальным белком, указывает на увеличение стабильности. Стабильность вариантов иммуноглобулина также может тестироваться путем измерения изменения при переходе температуры плавления варианта по сравнению с диким типом или исходным иммуноглобулином. В таком воплощении, при увеличении стабильности очевидным будет увеличение перехода температуры плавления в варианте. Дополнительные способы для измерения агрегации белка описаны в заявке на патент США №10/176,809.
Соответственно, задача настоящего изобретения заключается в обеспечении выделенных или рекомбинантных полинуклеотидов, которые кодируют измененные иммуноглобулины, в соответствии с обсуждением в абзацах выше и в соответствии с любой и всеми комбинациями их воплощений. В некоторых воплощениях, полинуклеотид находится в векторе. В некоторых воплощениях, вектор является экспрессирующим вектором. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, индуцируемый промотор функционально связан с полинуклеотидом. Другой аспект включает клетки-хозяина с вектором любого из предыдущих воплощений. В некоторых воплощениях, клетки-хозяина способны экспрессировать иммуноглобулин, кодируемый полинуклеотидом.
Соответственно, задача настоящего изобретения заключается в обеспечении способов получения иммуноглобулинов с уменьшенной склонностью к агрегации, содержащих обеспечение культуральной среды, содержащей клетки-хозяина предыдущего абзаца и размещение культуральной среды в условиях, в которых экспрессируется иммуноглобулин. В некоторых воплощениях, способы включают дополнительную стадию выделения экспрессируемого иммуноглобулина.
В другом аспекте изобретения рассчитанное значение ПСА может быть использовано для определения участков белок-белковых взаимодействий на поверхности белковой структуры. В данной области известно, что участки взаимодействий белков часто содержат гидрофобные остатки или гидрофобные участки. Ожидается, что способы, описанные в данном документе, будут полезны при определении местоположения сайтов связывания путем определения гидрофобных участков. Такие гидрофобные участки будут кандидатами для белок-белковых или белок-лигандных сайтов узнавания.
В некоторых воплощениях, к изобретению дополнительно относится компьютерный код для определения ПСА в соответствии со способами изобретения. В других воплощениях, изобретение относится к компьютеру, суперкомпьютеру или кластеру компьютеров, предназначенных для исполнения способов изобретения. В еще одном аспекте, изобретение обеспечивает вэб-, серверный или интернет-сервис для определения областей, предрасполагающих к агрегации в белках, где сервис одержит прием данных о белке (например, структурную модель белка) от пользователя (например, через Интернет) или извлечение таких данных из базы данных, так чтобы поставщик услуг мог генерировать, извлечь или получить доступ к статической структуре белка, необязательно включая моделирование молекулярной динамики белка для обеспечения динамической структуры белка, определения ПСА для атомов или остатков белка на основе статической или динамической структуры, сгенерированной таким образом, и возвращение пользователю данных о ПСА, например, в виде структурной модели с картированными на ней поставщиком услуг указанными данными о ПСА. В некоторых воплощениях, пользователь является человеком. В других воплощениях пользователь является компьютерной системой или автоматическим компьютерным алгоритмом.
В некоторых воплощениях настоящее изобретение утверждает систему расчета ПСА, содержащую: вэб-сервер для обеспечения вэб-сервиса для расчета ПСА для пользовательского терминала через Интернет; базу данных для хранения общей информации о способе расчета, аминокислотной гидрофобности и т.п., и сервер расчета для осуществления расчета ПСА на основе информации в базе данных и информации, предоставленной или переданной через Интернет пользователем.
В некоторых воплощениях, вэб-сервер и сервер расчетов являются одной и той же компьютерной системой. В некоторых воплощениях, компьютерная система является суперкомпьютером, кластерным компьютером или одиночной рабочей станцией или сервером. В связанном воплощении вэб-сервер системы расчета ПСА дополнительно содержит котроллер для контроля всей операции, устройство для подключения к сети для соединения с Интернетом, и блок вэб-сервиса для обеспечения вэб-сервиса для расчета ПСА для пользовательского терминала, соединенного посредством Интернета.
Кроме того, к воплощениям настоящего изобретения дополнительно относятся продукты компьютерных запоминающих устройств с машиночитаемой средой, которые содержат программный код для осуществления различных исполняемых компьютером операций, например, расчет ПСА для структурной модели, расчета ПДР, расчета эффективного-ПДР, манипулирования структурными моделями, осуществления молекулярно-динамического моделирования, организации и хранения соответствующих данных или осуществления других операций, описанных в данном документе. Машиночитаемая среда является любым устройством хранения данных, которое может хранить данные, которые затем могут быть прочитаны компьютерной системой. Примеры машиночитаемых сред включают, в частности, жесткие диски, флоппи-диски, флэш-диски, оптические диски (например, CD, DVD, HD-DVD, диски Blu-Ray и т.п.) и специально сконфигурированные аппаратные устройства, такие как специализированные микросхемы или программируемые логические устройства. Машиночитаемая среда может также распространяться как сигнал данных, воплощенный в волне несущей частоты по сети спаренных компьютерных систем, так чтобы код машиночитаемой среды хранился и выполнялся в распределенном режиме. Специалистом будет учтено, что вышеописанные аппаратные и программные элементы имеют стандартный дизайн и конструкцию. Описанные выше воплощения, связанные с компьютером, Интернетом, сервером и сервисом могут дополнительно применяться для ПДР и эффективной-ПДР а также ПСА.
Фармацевтические композиции, содержащие иммуноглобулины, и варианты иммуноглобулинов
В другом аспекте, настоящее изобретение обеспечивает композицию, например фармацевтическую композицию, содержащую один или несколько вариантов иммуноглобулина, полученного способами по изобретению, рецептура которой составлена вместе с фармацевтически приемлемым носителем. Фармацевтические композиции изобретения также могут быть введены при комбинированном лечении, т.е. объединены с другими средствами. Например, комбинированное лечение может включать иммуноглобулин настоящего изобретения, объединенный, по меньшей мере, с одним средством лечения злокачественных новообразований.
Используемый здесь термин «фармацевтически приемлемый носитель» включает любой или все растворители, дисперсные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие абсорбцию средства и т.п., которые являются физиологически совместимыми. Предпочтительно, носитель является подходящим для внутривенного, внутримышечного, подкожного, парентерального спинального или эпидермального введения (например, инъекцией или инфузией). В зависимости от пути введения, активное соединение, т.е. иммуноглобулин или его вариант по изобретению, может быть покрыто материалом для защиты соединения от действия кислот или других естественных условий, которые могут инактивировать соединение.
Фармацевтические композиции изобретения могут включать одни или несколько фармацевтически приемлемых солей. Термин «фармацевтически приемлемая соль» относится к соли, которая сохраняет требуемую биологическую активность родительского соединения и не привносит каких-либо нежелательных токсикологических эффектов (см., например, Berge, S.M., et al. (1977) J. Pharm. Sci. 66: 1-19). Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включает те из них, которые получаются из нетоксичных неорганических кислот, таких как соляная, азотная, фосфорная, серная, бромоводородная, йодистоводородная, ортофософористая и т.п., а также из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.п. Соли замещения оснований включают те из них, которые происходят из щелочноземельных металлов, таких как натрий, калий, магний, кальций и т.п., а также из нетоксичных органических аминов, таких как N5N'-дибензилэтилендиамин, N-метилглюкамин, хлоропрокаин, холин, диэтаноламин, этилендиамин, прокаин и т.п.
Фармацевтическая композиция по изобретению также может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) маслорастворимые антиоксиданты, такие как аскорбил пальмитат, бутилоксианизол, бутилокситолуол, лецитин, пропил галлат, альфа-токоферол и т.п.; и (3) хелатирующие металлы агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТА), сорбит, винная кислота, фосфорная кислота и т.п.
Примеры подходящих водных и неводных носителей, которые могут быть использованы в фармацевтических композициях изобретения, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), и их подходящие смеси, растительные масла, такие как оливковое масло, и инъекционные органические эфиры, такие как этилолеат. Правильная текучесть может поддерживаться, например, с помощью применения покрывающих материалов, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий, и с помощью ПАВ.
Эти композиции также могут содержать адъюванты, такие как консерванты, увлажняющие средства, эмульгаторы и диспергирующие агенты. Предотвращение присутствия микроорганизмов может быть обеспечено процедурами стерилизации, и путем включения различных антибактериальных и противогрибковых агентов, например парабена, хлоробутанола, фенолсорбиновой кислоты и т.п. Также может потребоваться включение в композиции изотонических агентов, таких как сахара, хлорид натрия и т.п. Кроме того, пролонгированная абсорбция инъецируемой фармацевтической формы может быть достигнута путем включения агентов, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий для немедленного приема. Применение таких сред и агентов для фармацевтически активных веществ известно в данной области. За исключением несовместимых с активным соединением, предусматривается применение в фармацевтических композициях любых традиционных сред или агентов. Дополнительные активные соединения также могут быть включены в композиции.
Примерные составы содержат, по меньшей мере, один вариант иммуноглобулина изобретения и могут содержать более низкие концентрации стабилизирующих (или дезагрегирующих) средств, которые могут, в дополнение к способам, раскрытым в данном документе, использоваться для предотвращения или уменьшения агрегации иммуноглобулина. Соответственно, традиционные способы, используемые для предотвращения агрегации, могут использоваться при разработке фармацевтических композиций, содержащих варианты иммуноглобулинов, полученных способами настоящего изобретения. Например, множество стабилизирующих и дезагрегирующих соединений могут быть включены в фармацевтические композиции изобретения в зависимости от их целевого использования и их биологической токсичности. Такие стабилизирующие соединения могут включать, например, циклодекстрин и его производные (патент США №5730969), алкилгликозидные композиции (заявка на патент США №11/474,049), применение молекул шаперонов(например, LEA (Goyal et al, Biochem J. 2005, 388(Pt 1): 151-7; способы патента США №5688651), соединения бетаина (Xiao, Bum, Tolbert, Bioconjug Chem. 2008 May 23), поверхностно-активные вещества (например, «Pluronic F127», «Pluronic F68», «Tween 20» (Wei et al. International Journal of Pharmaceutics. 2007, 338 (1-2): 125-132)), и способы, описанные в патентах США №5696090, 5688651 и 6420122.
Кроме того, белки и, в частности, антитела, стабилизируются в составах при применении комбинаций различных классов вспомогательных веществ, например (1) дисахаридов (например, сахарозы, трегалозы) или полиолов (например, сорбита и маннита), действующих в качестве стабилизаторов посредством предпочтительного исключения, а также способных действовать в качестве криопротекторов во время лиофилизации, (2) ПАВ (например, полисорбата 80, полисорбата 20), действующих путем минимизации взаимодействий белков на границе раздела типа жидкость/лед, жидкость/поверхность материала и/или жидкость/воздух, и (3) буферов (например, фосфатного, цитратного, гистидинового), помогающих контролировать и поддерживать рН состава. Соответственно, такие дисахариды полиолы, ПАВ и буферы могут применяться в дополнение к способам настоящего изобретения для дополнительной стабилизации иммуноглобулинов и предотвращения их деградации.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Рецептура композиции может быть составлена в виде раствора, микроэмульсии, липосомы или других упорядоченных структур, подходящих для высоких концентраций лекарственных веществ. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Правильная текучесть может поддерживаться, например, с помощью применения покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии, и с помощью использования ПАВ. Во многих случаях, предпочтительным будет включение в композицию изотонических агентов, например, Сахаров, полиспиртов, таких как маннит, сорбит, или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть вызвана, в том числе, включением в композицию средства для замедления абсорбции, например, солей моностеарата и желатина.
Стерильные инъецируемые растворы могут быть приготовлены путем включения активного соединения в необходимом количестве в соответствующий растворитель с одним или с комбинацией ингредиентов, перечисленных выше, по мере необходимости, с последующей стерилизацией микрофильтрацией. Как правило, дисперсии приготовляются путем введения активного соединения в стерильный носитель, который содержит основную дисперсную среду и другие требуемые ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов, предпочтительными способами приготовления являются вакуумная сушка и сублимационная сушка (лиофилизация), которые дают порошок активного ингредиента плюс любой дополнительный требуемый ингредиент из его предварительно стерильно отфильтрованного раствора.
Количество активного ингредиента, которое может быть объединено с материалом носителя для получения одиночной лекарственной формы, будет варьировать в зависимости от объекта, подвергаемого лечению и от конкретного пути введения. Количество активного ингредиента, которое может быть объединено с материалом носителя для получения одиночной лекарственной формы будет, в общем, тем количеством композиции, которое производит терапевтический эффект. В общем, из ста процентов, это количество будет находиться в диапазоне от около 0,01 процента до около девяноста девяти процентов активного ингредиента, предпочтительно от около 0,1 процента до около 70 процентов, наиболее предпочтительно от около 1 процента до около 30 процентов активного ингредиента в комбинации с фармацевтически приемлемым носителем.
Соответственно, задача настоящего изобретения заключается в обеспечении составов с измененным иммуноглобулином, которые могут быть сделаны из измененных иммуноглобулинов, в соответствии с обсуждением в абзацах выше и в соответствии с любой и всеми комбинациями их воплощений в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл или, по меньшей мере, 150 мг/мл. В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов измененного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав включает фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, которые уменьшают агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Соответственно, задача настоящего изобретения заключается в обеспечении применения измененных иммуноглобулинов, в соответствии с обсуждением в абзацах выше и в соответствии с любой или всеми комбинациями их воплощений в качестве неагрегирующего фармацевтически активного ингредиента.
Соответственно, задача настоящего изобретения заключается в обеспечении фармацевтических композиций, которые включают измененный иммуноглобулин, в соответствии с обсуждением в абзацах выше и в соответствии с любой и всеми комбинациями их воплощений и фармацевтически приемлемый наполнитель. В некоторых воплощениях иммуноглобулин находится в концентрации, по меньшей мере, 10 мг/мл, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл. В некоторых воплощениях, иммуноглобулин находится в концентрации большей, чем концентрация, при которой немутированный иммуноглобулин агрегирует сам с собой в концентрированном жидком растворе в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, по меньшей мере, восемьдесят процентов, по меньшей мере, восемьдесят пять процентов, по меньшей мере, девяносто процентов, по меньшей мере, девяносто пять процентов, по меньшей мере, девяносто шесть процентов, по меньшей мере, девяносто семь процентов, по меньшей мере, девяносто восемь процентов или, по меньшей мере, девяносто девять процентов измененного иммуноглобулина является неагрегированным мономером. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, которые могут быть объединены с предыдущими воплощениями, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Режимы дозировки корректируются для обеспечения оптимального требуемого ответа (например, терапевтического ответа). Например, может быть введен одиночный болюс, могут быть введены несколько доз в течение периода времени или дозы могут быть пропорционально уменьшены или увеличены в зависимости от потребностей терапевтической ситуации. Особенно выгодно составлять рецептуру для парентеральных композиций в виде стандартной лекарственной формы для легкого введения и единообразия доз.
Стандартная лекарственная форма, используемая в данном документе, относится к физически дискретным единицам, пригодным в качестве унитарных доз для объекта, подвергаемого лечению; каждая единица содержит заданное количество активного соединения, которое рассчитано для привнесения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Описание для стандартных лекарственных форм по изобретению продиктованы и напрямую зависят от (а) уникальных характеристик активного соединения и определенного терапевтического эффекта, который должен быть достигнут, и (b) от ограничений, присущих области приготовления такого активного соединения при лечении восприимчивости у индивидуумов.
Для введения иммуноглобулина диапазон доз составляет от около 0,0001 до 100 мг/кг, и больше, обычно от 0,01 до 5 мг/кг массы тела хозяина. Например, дозировки могут быть 0,3 мг/кг массы тела, 1 мг/кг массы тела, 3 мг/кг массы тела, 5 мг/кг массы тела или 10 мг/кг массы тела в пределах диапазона 1-10 мг/кг. Примерный режим лечения включает введение раз в неделю, раз каждые две недели, раз каждые три недели, раз каждые четыре недели, раз в месяц, раз каждые три месяца или раз каждые три-шесть месяцев. Предпочтительные схемы дозировки для иммуноглобулина по изобретению включают 1 мг/кг массы тела или 3 мг/кг массы тела посредством внутривенного введения, с антителом дается в одном из следующих режимов дозирования: (i) каждые четыре недели для шести доз, затем каждые три месяца; (ii) каждые три недели; (ill) 3 мг/кг массы тела однократно с последующим 1 мг/кг массы тела каждые три недели.
В ином случае иммуноглобулин изобретения может быть введен в качестве состава с замедленным высвобождением, в случае которого требуется менее частое введение. Дозировка и частота могут варьировать в зависимости от периода полужизни введенной субстанции в пациенте. В общем, человеческие антитела демонстрируют наиболее долгий период полужизни, за ними следуют гуманизированные антитела, химерные антитела и нечеловеческие антитела. Дозировка и частота введения может варьировать в зависимости от того является ли лечение профилактическим или терапевтическим. В профилактических приложениях, относительно низкая дозировка вводится с относительно нечастыми интервалами в течение длительного периода времени. Некоторые пациенты продолжают получать лечение до конца своей жизни. В терапевтических приложениях, иногда требуется относительно высокая дозировка при относительно коротких интервалах до уменьшения или прекращения прогрессии заболевания, и предпочтительно до того, как пациент продемонстрирует частичное или полное улучшение симптомов заболевания. После этого введение пациенту может осуществляться в профилактическом режиме.
Фактические уровни доз активных ингредиентов в фармацевтических композициях настоящего изобретения могут варьировать для того, чтобы количество активного ингредиента являлось эффективным для достижения требуемого терапевтического ответа для конкретных пациента, композиции и режима введения, без оказания токсичного воздействия на пациента. Выбранный уровень дозировки будет зависеть от целого ряда фармакокинетических факторов, включая активность определенных композиций, используемых настоящим изобретением, или их эфира, соли или амида, путь введения, время введения, скорость выведения определенного используемого соединения, длительность лечения, другие лекарственные средства, соединения и/или материалы, используемые в комбинации с конкретными используемыми композициями, возраст, пол, массу, состояние, общий уровень здоровья и предыдущую история болезни подвергаемого лечению пациента и т.п. факторы, хорошо известные в медицине.
«Терапевтически эффективная дозировка» иммуноглобулина по изобретению предпочтительно приводит к уменьшению тяжести симптомов заболевания, и увеличению частоты и длительности периодов без симптомов заболевания, или к профилактике нарушений или недееспособности, вызванных недугом. Например, при лечении злокачественных новообразований, «терапевтически эффективная дозировка» предпочтительно ингибирует рост клеток или опухоли, по меньшей мере, на около 20%, более предпочтительно, по меньшей мере, на около 40%, еще более предпочтительно, по меньшей мере, на около 60%, еще более предпочтительно, по меньшей мере, на около 80% относительно не подвергнутых лечению объектов. Способность соединения ингибировать рост злокачественного новообразования может быть оценена в системе модели на животных, являющейся эффективно предсказательной для человеческих злокачественных опухолей. В ином случае, это свойство композиции может быть оценено проверкой способности соединения ингибировать; анализы такого ингибирования in vitro известны квалифицированному врачу. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли, или, с другой стороны, улучшить симптомы пациента. Любой специалист в данной области будет способен определить такие количества, основываясь на таких факторах, как размер пациента, тяжесть симптомов у пациента, и основываясь на конкретной композиции или на выбранном пути введения.
Композиция настоящего изобретения может быть введена посредством одного или нескольких путей введения с помощью одного или нескольких из множества способов, известных в данной области. Специалистом будет учтено, что способ и/или режим введения будет варьировать в зависимости от требуемых результатов. Предпочтительные пути введения для связывающих компонентов по изобретению включают внутривенное, внутримышечное, внутрикожное, внутрибрюшинное, подкожное спинальное или другие парентеральные пути введения, например, инъекцией или инфузией. Словосочетание «парентеральное введение», используемое в данном документе, означает режимы введения, отличные от энтерального или местного введения, обычно инъекцией, и включает, без ограничений, внутривенную, внутримышечную, внутриартериальную, внутритрахеальную, внутрикапсулярную, внутриорбитальную, внутрикардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную, эпидуральную и надчревную инъекцию или инфузию.
В ином случае, иммуноглобулин по изобретению может быть введен непарентеральным путем, таким как местный, эпидермальный или путь введения через слизистую, например, интраназально, перорально, вагинально, ректально, сублингвально или местно.
Активные соединения могут быть приготовлены с носителями, которые будут предохранять соединение от быстрого высвобождения, такие как состав с контролируемым высвобождением, включая импланты, трансдермальные пластыри и микрокапсулированные системы доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Множество способов приготовления таких составов запатентовано или хорошо известно специалистам в данной области. См., например. Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
Терапевтические композиции могут быть введены с помощью медицинских устройств, известных в данной области. Например, в предпочтительном воплощении, терапевтическая композиция изобретения может быть введена с помощью безиголочного устройства для подкожных инъекций, такого как устройства, раскрытые в патентах США №5,399,163; 5,383,851; 5,312,335; 5,064,413; 4,941.880; 4,790,824; или 4,596,556. Примеры хорошо известных имплантов и модулей, полезных в настоящем изобретении, включают: патент США №4,487,603, в котором раскрывается имплантируемый насос для микроинфузий для дозирования медикамента контролируемым путем; патент США №4,486,194, в котором раскрывается терапевтическое устройство для введения медикаментов через кожу; патент США №4,447,233, в котором раскрывается насос для инфузии медикамента для доставки медикамента с точной скоростью инфузии; патент США №4,447,224, в котором раскрывается имплантируемое устройство для инфузии с изменяемым потоком для непрерывной доставки лекарственного препарата; патент США №4,439,196, в котором раскрывается осмотическая система доставки лекарственных препаратов, обладающая многокамерными отсеками; и патент США №4,475,196, в котором раскрывается осмотическая система доставки лекарственных препаратов.
Соответственно, задача настоящего изобретения заключается в обеспечении способов уменьшения склонности к агрегации иммуноглобулина в сильноконцентрированном фармацевтическом составе, которые содержат обеспечение иммуноглобулином, склонным к агрегации; замену остатка в консервативном домене иммуноглобулина, который (1) имеет значение ПСА равное, по меньшей мере, 0,15, или (ii) имеет значение ПСА (радиус сферы 5 Å) больше, чем 0,0 и находится в пределах 5 Å от остатка, имеющего значение ПСА равное, по меньшей мере, 0,15, на аминокислотный остаток, который снижает значение ПСА (радиус сферы 5 Å); и которые содержат образование высококонцентрированного жидкого состава с измененным иммуноглобулином, в котором концентрация измененного иммуноглобулина составляет, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл, и где агрегация, склонность к которой уменьшают, является агрегацией между молекулами иммуноглобулина в концентрированном жидком растворе.
Соответственно, задача настоящего изобретения заключается в обеспечении применений модифицированных иммуноглобулинов, в соответствии с обсуждением в абзацах выше и в соответствии с любой или всеми комбинациями их воплощений при приготовлении лекарственного средства, содержащего сильноконцентрированный жидкий состав, в котором концентрация измененного иммуноглобулина составляет, по меньшей мере, 20 мг/мл, по меньшей мере, 30 мг/мл, по меньшей мере, 40 мг/мл, по меньшей мере, 50 мг/мл, по меньшей мере, 75 мг/мл, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл, или, по меньшей мере, 150 мг/мл. В некоторых воплощениях применение лекарственного средства предназначается для лечения аутоиммунных заболеваний, иммунологических заболеваний, инфекционных заболеваний, воспалительных заболеваний, неврологических заболеваний и онкологических и неопластических заболеваний, включая злокачественное новообразование. В некоторых воплощениях применения лекарственное средство предназначается для лечения застойной сердечной недостаточности, васкулита, розацеа, акне, экземы, миокардита и других состояний миокарда, системной красной волчанки, диабета, спондилопатий, синовиальных фибробластов и стромы костного мозга; потери костной массы; болезни Педжета, остеокластомы, рака молочной железы; остеопении при бездействии; нарушения питания, пародонтоза, болезни Гоше, гистиоцитоза клеток Лангерганса, травмы спинного мозга, острого септического артрита, остеомаляции, синдрома Кушинга, монооссальной формы фиброзной дисплазии, полиоссальной формы фиброзной дисплазии, периодонтальной реконструкции и переломов костей; саркоидоза; остолитических злокачественных опухолей костей, рака молочной железы, рака легких, рака почек и рака прямой кишки; костных метастазов, купировании болевого синдрома в костях и гуморальной злокачественной гиперкальциемии, анкилозирующего спондилита, и других спонгилоартропатий; отторжения при трансплантации, вирусных инфекций, гематологических неоплазий и похожих на неоплазии состояний, например, ходжкинской лимфомы; неходжкинской лимфомы (лимфомы Беркитта, мелкоклеточной лимфоцитарной лимфомы/хронического лимфолейкоза, грибовидного лейкоза, лимфомы из клеток мантии, фолликулярной лимфомы, диффузной В-крупноклеточной лимфомы, лимфомы маргинальной зоны, волосатоклеточного лейкоза и лимфоплазматической лейкемии), опухоли клеток предшественников лейкоцитов, включая В-клеточный острый лимфобластный лейкоз/лимфому, тимому, опухоли зрелых Т-клеток и натуральных киллеров, включая лейкемии периферических Т-клеток, зрелой Т-клеточной лейкемии/Т-клеточной лимфомы, лейкемии больших гранулярных лимфоцитов, гистиоцитоза из клеток Лангерганса, миелоидных неоплазий, таких как острые миелобластные лейкозы, включая ОМЛ без созревания, ОМЛ без дифференцировки, острую промиелоцитарную лейкемию, острую миеломоноцитарную лейкемию, и острые моноцитарные лейкемии, миелодиспластические синдромы и хронические миелопролиферативные расстройства, в том числе хронические миелоидные лейкемии, новообразований центральной нервной системы, например, новообразований мозга (глиомы, нейробластомы, астроцитомы, медуллобластомы, эпендимомы и ретинобластомы), солидных опухолей (рака носоглотки, базальноклеточного рака, рака поджелудочной железы, рака желчного протока, саркомы Капоши, рака яичек, рака матки, влагалища и шейки матки, рака яичников, первичного рака печени или рака эндометрия и новообразований сосудистой системы (ангиосаркомы и гемангиоперицитомы), остеопороза, гепатита, ВИЧ, СПИД, спондилоартрита, ревматоидного артрита, воспалительных заболеваний кишечника, сепсиса и септического шока, болезни Крона, псориаза, склеродермы, реакции «трансплантат против хозяина», отторжения аллогенного островкового трансплантата, гематологических злокачественных новообразований, таких как множественная миелома миелодиспластический синдром и острый миелобластный лейкоз, воспалений ассоциированных с опухолями, травм периферических нервов или демиелинизирующих заболеваний. В некоторых воплощениях применения лекарственное средство предназначается для лечения пятнистого псориаза, язвенного колита, неходжкинской лимфомы, рака молочной железы, колоректального рака, ювенильного идиопатического артрита, дегенерации желтого пятна, респираторно-синцитиального вируса, болезни Крона, ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, остеопороза, потери костной массы, вызванной лечением, костных метастазов, множественной миеломы, болезни Альцгеймера, глаукомы и рассеянного склероза. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, применение лекарственного средства дополнительно содержит фармацевтически приемлемый наполнитель. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, иммуноглобулин в лекарственном средстве демонстрирует, по меньшей мере, на пять процентов, по меньшей мере, на десять процентов, по меньшей мере, на пятнадцать процентов, по меньшей мере, на двадцать процентов, по меньшей мере, на двадцать пять процентов, по меньшей мере, на тридцать процентов, по меньшей мере, на тридцать пять процентов, по меньшей мере, на сорок процентов или, по меньшей мере, на пятьдесят процентов меньше агрегации после двадцати четырех часовой ускоренной агрегации по сравнению с немутированным иммуноглобулином в тех же условиях. В некоторых воплощениях, агрегация измеряется с помощью гель-фильтрации с ВЭЖХ. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, лекарственное средство практически не содержит каких-либо добавок, уменьшающих агрегацию иммуноглобулинов. В некоторых воплощениях, которые могут быть объединены с любым из предыдущих воплощений, состав с иммуноглобулином практически не содержит свободного гистидина, сахаридов и полиолов.
Примеры
Методы молекулярного моделирования для предсказания областей, предрасполагающих к агрегации, и для изучения механизма агрегации в основном используют сравнительно простые симуляционные модели (Ма and Nussinov. Curr. Opin. Chem. Biol. 2006, 10, 445-452; Cellmer, et al, TRENDS in Biotechnology 2007, 25(6), 254), в отличие от подробных атомистических моделей, которые могут быть использованы в настоящем изобретении. Наименее подробная из применяемых моделей имитационного моделирования представляет собой решеточную модель, которую использовали во множестве исследований агрегации белков (Harrison et al. J. Mol Biol. 1999, 286, 593-606; Dima and Thirumalai. Protein Sci. 2002, 11, 1036-1049; Leonhard et al. Protein Sci. 2004, 13, 358-369; Patro and Przybycien. Biophys. J. 1994, 66, 1274-1289; Patro and Przybycien. Biophys. J. 1996, 70, 2888-2902; Broglia et al. Proc. Natl. Acad. Sci. U.S.A. 1998, 95, 12930-12933; Istrail et al. Comput. Biol. 1999, 6, 143-162; Giugliarelli et al. Chem. Phys. 2000, 113, 5072-5077; Bratko et al. J. Chem. Phys. 2001, 114, 561-569; Bratko and Blanch /. Chem. Phys. 2003, 118, 5185-5194; Combe and Frenkel Chem. Phys. 2003, 118, 9015- 9022; Toma and Toma. Biomacromolecules 2000, 1, 232-238; Gupta et al. Protein Sci. 1998, 7, 2642-2652; и Nguyen and Hall Biotechnol. Bioeng. 2002, 80, 823-834). В ней каждый остаток представлен в виде шара, который занимает одиночный участок в трехмерной решетке. Из-за своей простоты, решетчатая модель является менее вычислительно сложной и используется для моделирования больших систем в больших временных масштабах. Хотя эти решетчатые модели обеспечивают понимание физических основ, лежащих в основе агрегации белков, они не всегда точно представляют вторичную и третичную структуру и не могут адекватно учесть различные взаимодействия на атомистическом уровне, такие как водородные связи.
Более подробной моделью, по сравнению с решетчатой, является модель с промежуточным разрешением, в которой несколько атомов обычно объединяются в одиночный шар, а псевдосвязи иногда вводятся для сохранения углов связи в каркасе и состояний изомеризации (Smith and Hall, Mol. Biol. 2001, 312, 187-202; Smith and Hall. Proteins: Struct, Fund., Genet. 2001, 44, 344-360; Smith and Hall. Proteins: Struct., Fund, Genet. 2001, 44, 376-391; Nguyen, et al., Protein Sci. 2004, 13, 2909-2924; Nguyen and Hall, Proc.Natl. Acad. Sci. U.S.A., 2004, 101(46), 16180-16185; Nguyen and Hall. /. Am. Chem. Soc, 2006, 128, 1890-1901; Jang, et al., Biophys. J. 2004, 86, 31-49; Jang, et al., Protein Sci. 2004, 13, 40-53). Данная модель была успешно применена для моделирования образования фибрилл в системе, содержащей от 12 до 96 полиаланиновых пептидов (длиной 16 остатков каждый), начиная со случайного состояния (Nguyen and Hall, Proc. Natl. Acad. Sci. U.S.A., 2004, 101(46), 16180 -16185; Nguyen and Hall, /. Am. Chem. Soc, 2006, 128, 1890- 1901). Dokholyan и соавторы применили такую модель для изучения образования фибриллярных β-листовых структур восемью модельными белками домена SH3 Src (Ding, et al., Mol. Biol. 2002, 324, 851-857) или 28 модельными А β (1-40) пептидами (Peng, et al., Phys. Rev. E: Stat. Ph. mterdiscip. Top. 2004, 69, 41908-41914.).
В отличие от более простых моделей, атомистические модели включают все атомистические подробности, такие как образование водородной связи и, таким образом, являются более точными, чем решетчатая модель или модель с промежуточным разрешением. Такие атомистические модели использовались или с явно заданным или с неявно заданным растворителем, где растворитель рассматривается как сплошная среда. Явная модель является более точной, чем не явная, но также требует больше компьютерных вычислений. Такая атомистическая модель с неявным растворителем была применена для исследования ранних стадий агрегации гептапептида GNNQQNY (SEQ ID NO: 17), который является частью дрожжевого белка Sup35 (Gsponer, et al, Proc. Natl. Acad. Sci U.S.A. 2003, 100, 5154-5159.). Похожая модель применялась для агрегации амилоидного пептида Abl6-22 (KLVFFAE (SEQ ID NO: 18)) в антипараллельных β-листах (Klimov and Thirumalai, Structure 2003, 11, 295-307). Dokholyan и соавторы (Khare, et al., Proteins. 2005, 61, 617-632.) применяли явную атомистическую модель для исследования упорядоченной склонности к агрегации по всей последовательности фермента Cu, Zn-супероксиддисмутазы (SOD1). Они разложили последовательность SOD1 на перекрывающиеся гептапептиды и осуществили большое число молекулярно-динамических моделирований с явной водой (по 0,5 не каждое) мономерных, димерных и тетрамерных сегментов. При этом они обнаружили местонахождение амилоидогенных областей в последовательности SOD1: два конца, β-цепи 4 и 7, и две пересекающиеся петли.
Позднее был разработан протокол моделирования молекулярной динамики для получения структурной информации об упорядоченной β-агрегации амилоидогенных полипептидов (Cecchini et al., J Mol Biol. 2006, 357, 1306-1321.). Процедура основана на разложении полипептидной цепи на перекрывающиеся сегменты и на равновесных молекулярно-динамических моделированиях малого числа копий каждого сегмента. Склонность к β-агрегации по всей длине последовательности пептида болезни Альцгеймера Аβ (1-42) была найдена крайне гетерогенной с максимумом в сегменте V12HHQKLVFFAE22 (SEQ ID NO: 19) и минимумами в четырех петлеподобных дипептидах. С помощью этого метода прогнозируемое изменение склонности к агрегации двойных мутантов в двух сайтах в N-концевом домене дрожжевого приона Ure2p было проверено in vitro с помощью анализа связывания с тиофлавином Т. Такая процедура разложения полипептидной цепи на перекрывающиеся сегменты будет крайне сложной для систем, подобных антителам, из-за их огромного размера. Даже атомистическое моделирование одиночного полноразмерного антитела в явном растворителе очень требовательно в вычислительном плане, из-за огромного размера антитела. Поэтому в литературе отсутствуют атомистические модели полноразмерного антитела.
Однако существуют атомистические модели небольших частей антитела, по большей части Fab-фрагмента (Noon, et al., PNAS. 2002, 99, 6466; Sinha and Smith-Gill, Cell Biochemistry and Biophysics. 2005, 43, 253). В работе, раскрытой в данном документе, были исполнены атомистические модели молекулы полноразмерного антитела с явным растворителем. Основываясь на этих моделях, с помощью параметра 'ПСА', описанного в данной работе, на антителе были обнаружены области, предрасполагающие к агрегации. Эти предрасполагающие к агрегации области были мутированы для создания антител с улучшенной стабильностью. Описанные в данном документе примеры, относятся к определенным, не ограничивающим, воплощениям изобретения.
Пример 1. Методология моделирования молекулярной динамики
Моделирования молекулярной динамики осуществляли для полноразмерного антитела с помощью полной атомной модели. Исходная структура для моделирования полноразмерного антитела была получена из рентгеновских структур индивидуальных фрагментов Fab и Fc. Рентгеновская структура пробной версии (proof-of-concept (РОС)) Fab фрагмента была отобрана для моделирования на рентгеновской структуре Fc, полученной из IgG1 антитела 1HZH (Saphire et al., Science. 2001, 293, 1155). 1HZH было выбрано, поскольку рентгеновская структура известна для полноразмерного антитела и поскольку структура Fc является одной и той же для всех антител класса IgG1. Затем с помощью использованной в качестве модельного шаблона структуры 1HZH путем выравнивания фрагментов Fab и Fc была получена структура полноразмерного «РОС» антитела. В целях выравнивания фрагментов с правильными расстояниями и ориентацией, было сведено к минимуму СКО (среднеквадратичное отклонение) между общими остатками CYS фрагментов и полноразмерной матрицы (1HZH). Остатки CYS были выбраны, потому что каждый поддомен антитела (chi, СН2 и т.п.) содержит дисульфидную связь, и таким образом остатки CYS широко распространены вдоль всей структуры антитела. Полученная в результате структура полноразмерного антитела затем применялась для осуществления моделирования с явно заданными атомами с 30 не интервалами. Для моделирования применяли паттерн G0-гликозилирования, поскольку он является наиболее распространенным паттерном, наблюдаемым в антителах.
Пакет для моделирования CHARMM (Brooks et al. J. Comput. Chem., 1983, 4, 187) применяли для настройки и анализа, а пакет NAMD (Phillips et al. Journal of Computational Chemistry. 2005, 26, 1781) - для проведения моделирования. Полностью атомистическое силовое поле CHARMM (MacKerell et al. J. Phys Chem. B. 1998, 102, 3586) было применено для белка и TIP3P (Jorgensen et al. J. Chem. Phys., 1983, 79, 926) модели растворителя для воды. Моделирования проводили при 298 К и 1 атм в системе нормальных давления и температуры. Параметры для сахарных групп, участвующих в гликозилировании Fc-фрагмента, были получены таким образом, чтобы они были совместимыми с силовым полем CHARMM, следующим из силового поля CSFF (Kuttel et al. J. Comput. Chem., 2002, 23, 1236). Протонированные состояния остатков гистидина при рН 7,0 были выбраны на основании пространственной близости электроотрицательных групп. Полноразмерное антитело было сольватировано в орторомбической камере, поскольку она минимизирует количество необходимых молекул воды и таким образом минимизирует вычислительное время. Периодические граничные условия были применены во всех 3 направлениях. Водная сольватная оболочка в 8 Å была применена в каждом направлении орторомбической камеры. Конечный общий размер системы составил 202130 атомов. Для нейтрализации общего заряда системы добавляли достаточное количество ионов. Нейтральность зарядов измеряли согласно методу суммирования Эвалда, применяемому для расчета вклада электростатических взаимодействий в системе.
После сольватации антитела, энергию минимизировали с помощью SD (кратчайший спуск) путем фиксирования белка, чтобы дать возможность воде свободно расположиться вокруг белка. Затем ограничения удаляли и структуру дополнительно минимизировали с помощью SD и ABNR (Adopted Basis Newton-Raphson). Систему затем медленно нагревали до комнатной температуры с шагом 5°С каждые 0,5 пс с использованием временных интервалов в 1 фс. Систему затем уравновешивали в течение 1 нс перед вычислением представляющих интерес свойств модели. Во время моделирования для дополнительного статистического анализа сохраняли конфигурации каждые 0,1 пс.
Пример 2. Расчет Пространственной Склонности к Агрегации (ПСА)
Для преодоления недостатков ПДР, был определен описанный выше новый параметр, названный 'Пространственная склонность к агрегации'.
В этом примере 'ПСА' вычисляли для сферических областей с радиусом R, центрированных на каждом атоме в антителе, которое описано в примере 1. Значение ПСА, таким образом, оценивали с 30 нс модельным усреднением, для Fc-фрагмента антитела для двух различных радиусов участков (R=5 Å, 10 Å). В обоих случаях было замечено, что большинство значений были отрицательными, что свидетельствует о том, что наиболее экспонированные области являются гидрофильными. Такой результат ожидался, поскольку наиболее экспонированная поверхность белка, как правило, является гидрофильной. Также было отмечено, что существует несколько областей с положительными пиками ПСА, указывающими на экспонированную гидрофобность. Переход с малых радиусов участков (5 Å) на большие радиусы (10 Å) устраняет некоторые пики, тогда как некоторые другие пики увеличиваются. Некоторые пики уменьшаются из-за того что в этих областях малый гидрофобный участок (с радиусом меньше чем 5 Å) окружен гидрофильными участками; таким образом, усреднение по 10 Å приводит к эффективному уменьшению гидрофобности области. В то же время в некоторых других областях ПСА при R=10 Å усиливается из-за гидрофобных участков, окружающих аналогичный гидрофобный участок.
Выше, ПСА вычисляли как среднее в ходе 30 нс цикла моделирования. Результаты, вычисленные с помощью моделирования, затем сравнивали со значениями ПСА только рентгеновской структуры, без молекулярного моделирования. ПСА (для рентгеновской структуры) таким образом, рассчитывали для радиусов R=5 Å и R=10 Å. ПСА (для рентгеновской структуры) была аналогична значениям усредненного моделирования, и имела пики в тех же местах, но с отличиями по размеру пиков. Отличия были тем больше, чем больше был радиус участка, R=10 Å. Это происходит из-за того, что отличия являются кумулятивными при рассмотрении на большем размере участка. Эти отличия возникают вследствие изменения экспонирования поверхности остатков в цикле динамического моделирования. Тем не менее, это сравнение говорит о том, что хорошую начальную оценку ПСА, особенно для малых радиусов участка R, можно получить получена из самой рентгеновской структуры.
Значения ПСА для моделей с R=5 Å и 10 Å были картированы на структуре антитела. В обоих случаях поверхность антитела была окрашена в соответствии со значениями ПСА. При обоих радиусах, используемых для вычисления ПСА (5 Å и 10 Å) было отмечено, что поверхность является преимущественно гидрофильной. Такой результат ожидался, поскольку наиболее экспонированная поверхность белка, как правило, является гидрофильной. Однако было замечено несколько гидрофобных областей. Контраст между гидрофобными и гидрофильными областями был более заметен при больших радиусах участка, используемого для расчета ПСА, R=10 Å. Некоторые из обнаруженных гидрофобных областей имели превосходную корреляцию с областями антитела, известных в связи с взаимодействиями с белками. Один участок вокруг остатков 234 и 235 в шарнирной области находится там, где происходит взаимодействие с Fc-рецептором. Второй участок вокруг остатка 253 соответствует области в Fc-фрагменте, в которой происходит взаимодействие с протеином А и протеином G. В конце Fab-фрагмента наблюдали значительный гидрофобный участок, соответствующий области, в которой антитело связывается с антигеном. В графиках для ПСА при R=5 Å и 10 Å, соответственно, может наблюдаться одинаковая корреляция пиков и взаимодействующих областей. Сайты белковых взаимодействий были получены из рентгеновской структуры белковых комплексов, записей в PDB 1T89, 1FC2, и IFCC (Radaev, J. Biol. Chem. 2001, 276(19) 16469; Deisenhofer et al. Hoppe-Seyler's Z Physiol Chem. 1978. 359, 975-985; Deisenhofer, J. Biochemistry. 1981, 20, 2361-2370; Sauer-Eriksson et al. Structure. 1995, 3, 265). Гидрофобные взаимодействия очень хорошо коррелируют с положительными пиками ПСА, а гидрофильные взаимодействия очень хорошо коррелируют с отрицательными пиками ПСА. Следовательно, параметр ПСА помимо прочего может применяться для предсказания участков связывания белков. В малочисленных исключениях, в которых остатки с низким значением ПСА (т.е. с близким нулю значением, либо положительным, либо отрицательным) также вступали во взаимодействия, было отмечено, что взаимодействия на самом деле происходили с атомами основной каркасной цепи, а не с атомами боковых цепей.
Кроме гидрофобных участков, которые, как уже продемонстрировано, взаимодействуют с другими белками, на поверхности антитела идентифицировали дополнительные гидрофобные участки (области 4-6). Область-5 на нижней части Fc является в значительной степени гидрофобной, но она отчасти скрыта внутри с гидрофильной областью по ее границам. Аналогичным образом области 4 и 6 являются гидрофобными и экспонированными растворителю, но они обращены в сторону внутренней части антитела. Области 4 и 6 все равно могут быть потенциально вовлечены во взаимодействия с другими белками, если они будут экспонированы благодаря значительным конформационным изменениям или при разворачивании антитела. Все гидрофобные участки также можно наблюдать при меньшем радиусе для участков (R=5 Å), хотя и с меньшим контрастом по сравнению с радиусом для больших участков (R=10 Å).
Значения ПСА для рентгеновской структуры, основанные только на рентгеновской структуре, также картировали на поверхности антитела для сравнения с усредненными величинами, полученными при моделировании. Сравнение ПСА, вычисленной либо посредством моделирования, либо посредством только рентгеновской структуры, говорит о том, что обнаруженные гидрофобные области были вполне похожими. Конечно, есть некоторые отличия, такие как интенсивность участков взаимодействия с протеином А. Тем не менее, это сравнение демонстрирует, что ПСА (для рентгеновской структуры) только на основе рентгеновской структуры может использоваться для получения удовлетворительного описания гидрофобных участков на поверхности. Это важно, поскольку атомистическое моделирование полноразмерного антитела требует серьезных вычислений. Для белков без модели рентгеновской структуры, может применяться параметр ПСА такой же, как для структуры, полученной посредством гомологического моделирования или путем ab-initio прогноза структуры. Наблюдаемая гомологичная структура была очень похожа на рентгеновскую структуру, а значения ПСА для нее также похожи на значения для рентгеновской структуры.
Таким образом, ПСА идентифицирует гидрофобные участки на поверхности антитела. Эти участки могут быть естественно экспонированными или экспонированными из-за динамических флуктуаций или из-за частичного разворачивания антитела. Некоторые из этих гидрофобных участков также хорошо коррелируют с участками, взаимодействующими с другими белками. С целью проверки вовлечения гидрофобных участков, спрогнозированных с помощью ПСА, в агрегацию, в определенных участках были осуществлены мутации для замены гидрофобных остатков на гидрофильные. Полученные в результате антитела продемонстрировали менее склонное к агрегации поведение и повышенную стабильность. Кроме идентификации остатков, предрасполагающих к агрегации, также наблюдали, что способ ПСА корректно идентифицирует участки антитела, предрасполагающие к связыванию с другими белками. Таким образом, способ мог бы широко применяться ко всем белкам для идентификации областей, предрасполагающих к агрегации, или участков связывания с другими белками.
Пример 3. Отбор участков антитела для обеспечения стабильности
Остатки, идентифицированные как обладающие высокими значениями ПСА (и, следовательно, находящиеся в центре склонных к агрегации мотивов, обнаруженных авторами), представлены в таблице 1. В связи с тем, что они находятся в центре мотивов, эти остатки, а также остатки в пределах 5 Å (или 10 Å, если для расчета применяется окно 10 Å) могут быть изменены на менее гидрофобные остатки для уменьшения агрегации и/или повышения стабильности. Остатки были идентифицированы для человеческого антитела IgG1 (с легкой цепью каппа) и соответствующие остатки в различных классах IgG представлены в таблице 1.
|
В таблице 1 представлены мотивы, которые являются наиболее консервативными среди различных IgG с некоторыми отличиями. Однако в большинстве отличий одна гидрофобная аминокислота заменялась другой гидрофобной аминокислотой. Следовательно, гидрофобность мотива остается интактной даже с этими отличиями, и, следовательно, другие классы с гидрофобными остатками в той же позиции также являются мотивами, предрасполагающими к агрегации. Существует несколько исключений из этого (A330S, V110K и делеция L201), которые не принадлежат мотивам, предрасполагающим к агрегации. Помимо этих исключений идентифицированные здесь мотивы, имеют схожую экспонированную гидрофобность и более высокие значения ПСА для всех классов IgG антител.
В таблице 2 представлены гидрофобные остатки, организованные в мотивы, предрасполагающие к агрегации.
|
Пример 4. Отбор участков антитела для проектирования стабильности
Для демонстрации того, что предрасполагающие к агрегации мотивы, обнаруженные по их значениям ПСА, вовлечены в агрегацию и/или нестабильность, были получены мутации в обнаруженных областях с заменой гидрофобных остатков на гидрофильные остатки. В данном случае все выбранные остатки были заменены на лизин. В общем, аминокислоты, которые образуют общие мотивы, могут быть заменены на аминокислоты, которые являются более гидрофильными по шкале Блэка и Моулд, в частности на Thr, Ser, Lys, Gin, Asn, His, Glu, Asp и Arg. Были отобраны следующие области: Al (L235K), А2 (I253K), A3 (L309K), А4 (L309K, L235K), и А5 (L234K, L235K). Полученные в результате мутантные антитела в своем поведении демонстрировали меньшую агрегацию и улучшенную стабильность, как описано в примере 6.
Пример 5. Экспрессия и очистка вариантов антител
Получали мутации выбранных остатков, обсуждаемых в примере 4 выше, и экспрессировали и очищали образованные при этом варианты антител. Векторы, несущие гены легкой и тяжелой цепей человеческого антитела IgG1, получали субклонированием генов из проприетарных векторов (Novartis) в вектор gWIZ (Genlantis), оптимизировали для повышенной экспрессии при временной трансфекции. Варианты антител получали, следуя протоколу «Stratagene» для сайт-направленного мутагенеза. Все конструкты были подтверждены секвенированием ДНК. Плазмидную ДНК в миллиграммовом масштабе очищали из бактериальных культур с помощью колонок «DNA Maxi Prep» (Invitrogen). Для выращивания и временной трансфекции клеток «FreeStyle HEK 293» (Invitrogen) следовали протоколам производителя. Вкратце, для трансфекции 1 л культуры, 1 мг общей ДНК (по 0,5 мг векторов с тяжелой и легкой цепями) инкубировали с 20 мл раствора «OptiPro» в течение 15 минут; в то же время 2 мг реактива для трансфекции, полиэтиленимина (ПЭИ (Polysciences) в концентрации 1 мг/мл), инкубировали с 20 мл раствора «OptiPro» в течение 15 минут. Раствор ПЭИ затем добавляли в раствор ДНК, смешивали встряхиванием и инкубировали в течение других 15 минут. Аликвоты по 20 мл смеси ПЭИ/ДНК добавляли к 500 мл клеточных культур с концентрацией 1,0×106 клеток/мл. Трансфецированные клетки инкубировали в СО2-инкубаторе при 37°С в течение 7-9 дней.
Антитело дикого типа и варианты очищали из супернатанта тканевой культуры на колонке с протеином A (GE Healthcare) с помощью системы очистки «FPLC АКТА Purifier system» (GE Healthcare). Антитела элюировали из колонки с помощью 50 мМ цитратного буфера с рН 3,5, и уравновешивали до рН 6,6-7,0 с помощью IM Tris-HCl pH 9,0. Этот элюат пропускали через колонку с «Q Sepharose» (GE Healthcare) для удаления отрицательно заряженных примесей. При рН 7,0 и ниже, антитела положительно заряжены и остаются в элюате, в то время как отрицательно заряженные примеси связываются с положительно заряженной матрицей колонки с «Q Sepharose». Раствор очищенного антитела концентрировали с помощью фильтров «30К MWCO» (Millipore, VWR), а буфер заменяли на 20 мМ His буфер с рН 6,5 до конечной концентрации 150 мг/мл.
Для контроля качества, аликвоты очищенных и концентрированных образцов анализировали с помощью SDS-PAGE в невосстанавливающих и восстанавливающих условиях. Аликвоты белка по 4 мкг на образец инкубировали в денатурирующем буфере без или с ДТТ и разделяли на 10% полиакриламидном геле (Pierce). Вариант А1 сравнивали с диким типом также с помощью кругового дихроизма, при котором спектры практически совпадали, демонстрируя факт того, чтоб два белка имеют практически один и тот же уровень вторичной структуры.
Пример 6. Биофизическое описание характеристик вариантов антител
Стабильность вариантов антител анализировали с помощью трех различных аналитических подходов.
Анализ мутности
Анализ мутности проводили при 65°С в течение периода времени вплоть до 4 часов. Антитело А и варианты были в концентрации 150 мг/мл в 20 мМ His, рН 6,5, и их разводили в 15 раз в 15 мМ калий-фосфатном буфере, рН 6,5 до 10 мг/мл для оценки мутности. В дополнение к качественным наблюдениям, мутность количественно оценивали после дополнительного разведения образцов до концентрации 1 мг/мл и записи значений поглощения при 320 нм как показано в таблице 3.
|
|
Гель-фильтрация с высокоэффективной жидкостной хроматографией (гелъ-филътрация с ВЭЖХ)
В качестве второго и предпочтительного анализа использовали гель-фильтрацию с ВЭЖХ для определения потери мономеров с течением времени в экспериментах по ускоренной агрегации. Антитело А дикого типа и варианты инкубировали в термоциклере (BioRad) в концентрации 150 мг/мл при 58°С в течение периода времени вплоть до 24 часов. Для каждой временной точки, аликвоты образца по 2 мкл разводили в 15 раз в калий-фосфатном буфере, рН 6,5 до конечной концентрации 10 мг/мл. Мономеры отделяли от немономерных видов с помощью гель-фильтрации с ВЭЖХ на колонке «TSKgel Super SW3000» (TOSOH Bioscience), поддерживаемой при 22°С, с мобильной фазой из 150 мМ фосфата калия, рН 6.5, при скорости потока 0,2 мл/мин. Процент мономеров рассчитывали как площадь мономерного пика разделенную на общую площадь всех пиков, детектируемых при длине волны 280 нм.
Дифференциальная сканирующая микрокалориметрия
В третьих, термодинамическую стабильность антитела А дикого типа и вариантов сравнили с помощью дифференциальной сканирующей микрокалориметрии (DSC, Microcal). MAb обладают характерными ДСК-термограммами с тремя переходами плавления, если не пересекаются: Fab, СН2 и СН3 (lonescu et al., J Pharm Sci, v. 97, 1414, 2008; Mimura et al., J Biol Chem, v.276, 45539, 2001). В использованных здесь экспериментальных условиях. Fab антитела А имеет температуру перехода плавления 77°С. Переходы плавления CH2 и СН3 проходят при температурах 73°С и 83°С, соответственно. Таким образом, в антителе А, СН2 является доменом антитела с наименьшей температурой плавления.
Антитело А дикого типа и варианты А1-А5 анализировали в концентрации 2 мг/мл в 20 мМ His буфере, рН 6,5, при скорости нагревания 1 градус в минуту. Данные образцов анализировали с помощью вычитания эталонных данных, нормализации по отношению к концентрации белка и объема кюветы ДСК и интерполяции кубической базовой линии. Пики подвергли деконволюции с помощью «non-two-state» переходов программы «MicroCal Origin 5.0». Сравнение термограмм показало увеличение перехода плавления СН2 в вариантах по сравнению диким типом на 1-3 градуса, с наиболее выраженным отличием для двойных вариантов А4 и А5 (таблица 4 ниже).
|
Пример 7. Резюме
Результаты экспериментов на определение мутности, гель-фильтрации с ВЭЖХ и ДСК антитела А дикого типа и вариантов суммированы в таблице 5.
|
Каждый из трех одиночных мутантов А1, А2 и A3 продемонстрировал улучшенную стабильность в каждом из трех аналитических способов. При анализе мутности, стрессовое воздействие при 65°С в течение 2 часов на разведение образца с антителом А дикого типа, привело к помутнению раствора, в то время как растворы всех вариантов остались прозрачными. Результаты гель-фильтрации с ВЭЖХ образцов, подвергнутых стрессовому воздействию при 58°С в течение 24 часов, продемонстрировали увеличение количества мономеров с 91% для дикого типа до 93-95% для вариантов. Поскольку изначальная популяция мономеров составляла 99%, то количество немономерных видов в вариантах уменьшилось вплоть до половины по сравнению с диким типом. Анализ ДСК продемонстрировал увеличение температуры перехода плавления для СН2 (домена с наименьшей температурой фазового перехода плавления в антителе А) с 73°С для дикого типа до 75-76°С для вариантов.
Замена дополнительных остатков с высоким значением ПСА в варианте А1 дополнительно улучшила стабильность, что подтверждается результатами определения мутности и ДСК-термограммами вариантов А4 и А5. Результаты гель-фильтрации с ВЭЖХ по сравнению с вариантом А1 продемонстрировали улучшение только для варианта А4 (96% мономеров после 24-часового стресса), но не для варианта А5 (93% мономеров после 24-часового стресса, такое же значение, что и у варианта А1).
Для подтверждения, похожие мутации были внесены во второе антитело с добавлением мутаций в остатки в CDR-областях антитела. Все тестируемые мутации, кроме одной, улучшали стабильность и/или уменьшали агрегацию. Мутации в одном остатке в CDR-области не функционировали, как предсказано, однако данный эффект может являться результатом того, что данный вариант не выражен в достаточной степени, что может быть результатом дефекта сворачивания, и, следовательно, данный вариант обладает большей степенью агрегации по сравнению с диким типом, даже до анализа ускоренной агрегации. Таким образом, все протестированные в каркасе и в консервативных областях мутации, продемонстрировали предсказанный результат, доказав тем самым, что алгоритм ПСА является надежным, с единственным возможным исключением, заключающемся в мутациях, при которых невозможно правильное сворачивание. Однако, учитывая, что все мутации являются остатками экспонированными на поверхности и включают замену на более гидрофильные остатки, такие проблемы сворачивания, как ожидается, будут возникать редко.
Пример 8. Анализ стабильности дополнительных вариантов антитела
Дополнительные варианты были сконструированы и проанализированы для улучшения стабильности в первом и втором антителе. Выбор участков для мутаций был основан на прогнозе ПСА. Мутации в каждом варианте представлены в таблице 6.
|
Для определения потери мономеров с течением времени в экспериментах по ускоренной агрегации использовали гель-фильтрацию с ВЭЖХ. Первое антитело, антитела дикого типа и вариантов инкубировали в термоциклере (BioRad) в концентрации 150 мг/мл при 58°С в течение периода времени вплоть до 24 часов. Второе антитело, антитела дикого типа и вариантов инкубировали в термоциклере (BioRad) в концентрации 60 мг/мл при 52°С в течение периода времени вплоть до 36 часов. Для каждой временной точки, аликвоты образца по 2 мкл разводили в 15 раз в калий-фосфатном буфере, рН 6,5 до конечной концентрации 10 мг/мл. Мономеры отделяли от немономерных видов с помощью гель-фильтрации с ВЭЖХ на колонке «TSKgel Super SW3000» (TOSOH Bioscience), поддерживаемой при 22°С, с мобильной фазой из 150 мМ фосфата калия, рН 6.5, при скорости потока 0,2 мл/мин. Процент мономеров рассчитывали как площадь мономерного пика разделенную на общую площадь всех пиков, детектируемых при длине волны 280 нм.
Для варианта А6 было показано увеличение содержания мономеров с 95,5% для дикого типа до 96% через 12 часов и увеличение с 91% для дикого типа до 92% через 24 часа. Для варианта А7 было показано увеличение содержания мономеров с 96,5% для дикого типа до 97,5% через 12 часов и увеличение с 91% для дикого типа до 94% через 24 часа. Для варианта А8 было показано увеличение содержания мономеров с 96,5% для дикого типа до 98,5% через 12 часов и увеличение с 91% для дикого типа до 97% через 24 часа. Для варианта В6 не было продемонстрировано значительных отличий в проценте содержания мономеров через 12 часов, но был показано увеличение содержания мономеров с 97,5% для дикого типа до 98% через 24 часа и увеличение содержания мономеров с 96% для дикого типа до 97% через 36 часов.
Пример 9. Влияние белок-углеводных взаимодействий на ПСА и стабильность
В этом примере мы определяли влияние гликозилирования антитела на значения ПСА. ПСА определяли при R=5 Å для полноразмерного антитела как с, так и без гликозилирования. ПСА для антитела с гликозилированием определяли для 30 нс моделей молекулярной динамики полноразмерного антитела с G0-гликозилированием. Значение ПСА для антитела без гликозилирования определяли в той же модели, из которой мы в ходе анализа ПСА удалили гликозилирование. Области с высоким значением ПСА являются наиболее предрасполагающими к агрегации областями. Было отмечено, что удаление гликозилирования значительно увеличивает ПСА в областях, скрытых гликозилированием, особенно для остатков F241 и F243. Следовательно, удаление или перемещение гликозилирования приводит к значительному увеличению количества областей, склонных к агрегации. Эти области могут либо напрямую вызывать агрегацию, либо понижать свободную энергию барьера для разворачивания, в результате чего негликозилированная форма становится менее стабильной по сравнению с гликозилированной формой.
Для дальнейшего экспериментального изучения роли белок-углеводных взаимодействий, создали два мутантых антитела, F241S F243S (вариант FS) и F241Y F243Y (вариант FY). В Варианте FS остатки фенилаланина, о которых известно, что они взаимодействуют с углеводной составляющей, заменили на полярные сериновые остатки, которые обладают более мелкими и не ароматическими боковыми цепями (Deisenhofer, Biochem, 1981, 20, 2361-70; Krapp et al, J Mol Biol, 2003, 325, 979-89). В варианте FY, те же остатки фенилаланина заменяли на остатки Туг, которые, как предполагается, имеют более сильную склонность к взаимодействию с сахарами (Taroni et al., Protein Eng, 2000, 13, 89-98). В то же время, другие гидрофобные остатки в этой области, например, Val264, оставили немодифицированными. Как дикий тип, так и вариант FY, имели очень небольшой уровень сиалирования их углеводов или не обладали им вообще, в то время как около 50% молекул варианта FS имели, по меньшей мере, один остаток сиаловой кислоты.
Стабильность дикого типа и вариантов FS и FY сравнивали в экспериментах по ускоренной агрегации и с помощью дифференциальной сканирующей микрокалориметрии (ДСК). В образцах с концентрацией 150 мг/мл агрегацию индуцировали при 58°С в течение периода времени вплоть до 36 часов, и уровень мономеров выясняли и количественно оценивали с помощью гель-фильтрации с высокоэффективной жидкостной хроматографией (гель-фильтрация с ВЭЖХ). Уровни мономеров дикого типа постепенно снижались со 100 до 96, 91 и 87% во временных точках 0, 12, 24 и 36 часов. Для сравнения, в варианте FY уровни мономеров снижались в более ранних временных точках, но оставались на уровне 88% через 36 часов, в пределах статистической ошибки дикого типа. Вариант FS был значительно менее стабильным при этой температуре, о чем говорит уменьшение с 99% до 39% за 12 часов, и до 20% за 24 часа. 36-часовые образцы не прогоняли на гель-фильтрации с ВЭЖХ, из-за наличия обильных видимых агрегатов.
Результаты ДСК также отличаются у вариантов и дикого типа. Температура плавления (Tm) домена СН2 уменьшилась с 73°С для дикого типа до 59°С для варианта FS. Незначительные отличия в варианте FS, не больше чем 1°С, также наблюдали для перехода плавления для Fab и СН3. Хотя плечо перехода плавления для CH2 в варианте FY перекрывается с диким типом, программная подгонка указывает на снижение Tm СН3 до 71°С, в то время как другие два значения Tm остаются неизмененными.
Для сравнения варианта FS с диким типом и для лучшего понимания наблюдаемого снижения стабильности был проведен ряд дополнительных экспериментов. Вариант FS сохраняет такую же богатую β-листами структуру, как и дикий тип. Вариант имел отличные от дикого типа паттерны подвижности в восстанавливающем, а также в нативном гель-электрофорезе. Также для сравнения экспонирования поверхности белка в варианте FS и в диком типе проводили эксперименты с обработкой протеазой. Гидролиз антител с помощью Glu-C был более эффективным (с большим количеством мелких фрагментов) для варианта FS, чем для дикого типа; эта эффективность в значительной степени одинакова в вариантах и дегликозилированных аналогах дикого типа, хотя определенные отличия сохраняются. Более того, вариант FS сохраняет полную функцию связывания с FcRn и частичную с FcγRIa, но теряет связывание с рецепторами FcγRII и FcγRIII.



