Результат интеллектуальной деятельности: СТАБИЛИЗАТОР ЛИПОСОМАЛЬНЫХ СУСПЕНЗИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Заявляемая группа изобретений относится к биотехнологии и химико-фармацевтической промышленности и может быть использована для создания систем, в частности, липосомальных композиций, обладающих повышенной стабильностью и предназначенных для осуществления направленной транспортировки физиологически активных веществ с целью повышения терапевтической активности лекарственных препаратов.
Липосомы широко используют в качестве носителей различных лекарственных веществ, включая противовирусные препараты. За прошедшее время были раскрыты как преимущества, так и недостатки липосомальных лекарственных форм. Липосомы способны переносить любые по строению соединения (полярные, неполярные, амфифильные, с большой и малой молекулярной массой). Кроме того, они обладают высокой биосовместимостью и биодеградируемостью.
Помимо этого во многих случаях с помощью липосом можно обеспечить адресную доставку лекарственного вещества за счет пассивного нацеливания или конъюгации липосомы с биомаркерами.
В тоже время недостатками липосом как лекарственной формы являются сложности, связанные не только с их производством, но и возникающие при длительном хранении липосомальных суспензий.
Липосомальные суспензии представляют собой термодинамически нестабильные коллоидные системы, которые достаточно быстро, иногда в течение нескольких часов, расслаиваются с образованием двух фаз. Еще одним недостатком липосомальных композиций является высокая скорость поглощения липосом макрофагами, что не позволяет достичь специфического эффекта липосомальной лекарственной формы.
Обобщая данные по применению липосомальных форм, можно сделать вывод, что многие из этих недостатков носят принципиальный характер и не могут быть устранены без кардинального изменения технологии получения липосом.
Одним из решений, позволяющим устранить некоторые из недостатков липосомальных форм без потери всех имеющихся преимуществ, является получение липосом с композитными оболочками. Примером могут служить липосомы, в мембрану которых внедрен, например, полисахарид, полипептид или поперечно-сшитый синтетический полимер. При этом достигается значительное повышение прочности оболочки липосомы, так как в этом случае полимерное соединение выполняет функцию своеобразного каркаса.
Кроме того, образовавшаяся дополнительная гидрофильная оболочка позволяет уменьшить взаимодействие с белками плазмы крови пациента и, соответственно, повысить их стабильность.
Таким образом, композитные липосомы во многом напоминают микроорганизмы, имеющие клеточную стенку, при этом на дополнительной оболочке можно закреплять биомаркеры и другие функциональные группировки с целью дальнейшей направленной доставки лекарственных веществ к очагу поражения.
Чрезвычайно важной особенностью липосом с композитной оболочкой является их повышенная стабильность, обеспечивающая длительные сроки хранения в обычных условиях, а также возможность реализации в виде различных лекарственных форм, например растворов, пластырей, трансдермальных терапевтических систем или капсул.
Повышенная стабильность композитных липосом позволяет значительно расширить перечень лекарственных веществ, которые можно применять в виде липосомальных форм.
Таким образом, разработка эффективных способов получения стабильных липосомальных композиций является актуальной задачей.
Из уровня техники известен способ получения стабильной стерильной липосомальной композиции для доставки фармацевтического средства, включающий следующие стадии:
а) обеспечение подходящей водной среды;
б) обеспечение подходящего фосфолипида;
в) обеспечение, по меньшей мере, одного фармацевтического средства, способного, по меньшей мере, частично инкапсулироваться в липосомах и выбранного из
i) липофильного амина и фармацевтически приемлемой кислоты, где фармацевтически приемлемая кислота выбрана из органической или неорганической кислоты, и
ii) фармацевтически приемлемой соли органической кислоты липофильного амина, при этом, необязательно, фармацевтически приемлемая кислота включает фармацевтически приемлемую органическую кислоту;
где количество фармацевтически приемлемой кислоты, присутствующей в композиции, является таким, что рН липосомальной композиции является меньшим или примерно равным рКа аминогруппы фармацевтически активного липофильного амина;
d) объединение водной среды, фосфолипида и фармацевтического средства с образованием липосомальной композиции; и
e) автоклавирование указанной композиции (см. патент РФ №2369384 на изобретение «Стабильные липосомальные композиции», дата подачи 22.11.2004 г., опубликовано 10.10.2009 г.).
Липосомальные композиции, полученные в соответствии с известным способом, автоклавируются с целью увеличения срока хранения. Кроме того, стабильные липосомальные суспензии по данному изобретению не оседают, претерпевая фазовые изменения, они устойчивы к окислению и гидролизу.
Известен способ получения оболочек на основе хитозана и солей альгиновой кислоты для микрокапсул, содержащих фосфолипидные мицеллы, характеризующийся последовательной выдержкой ядер микрокапсул в 0,5+1,0% (вес/объем) растворе хитозана средней или низкой вязкости в 1,0%-ной уксусной кислоте, в 2,5-+3,0%-ном растворе хлорида щелочноземельного металла, в 0,5-+1,0% (вес/объем) растворе альгината натрия и, повторно, в 2,5-+3,0%-ном растворе хлорида щелочноземельного металла (см. патент РФ №2411077 на изобретение «Способ получения оболочек на основе хитозана и солей альгиновой кислоты для микрокапсул, содержащих фосфолипидные мицеллы», дата подачи 09.06.2009 г., опубликовано 27.09.2011 г.).
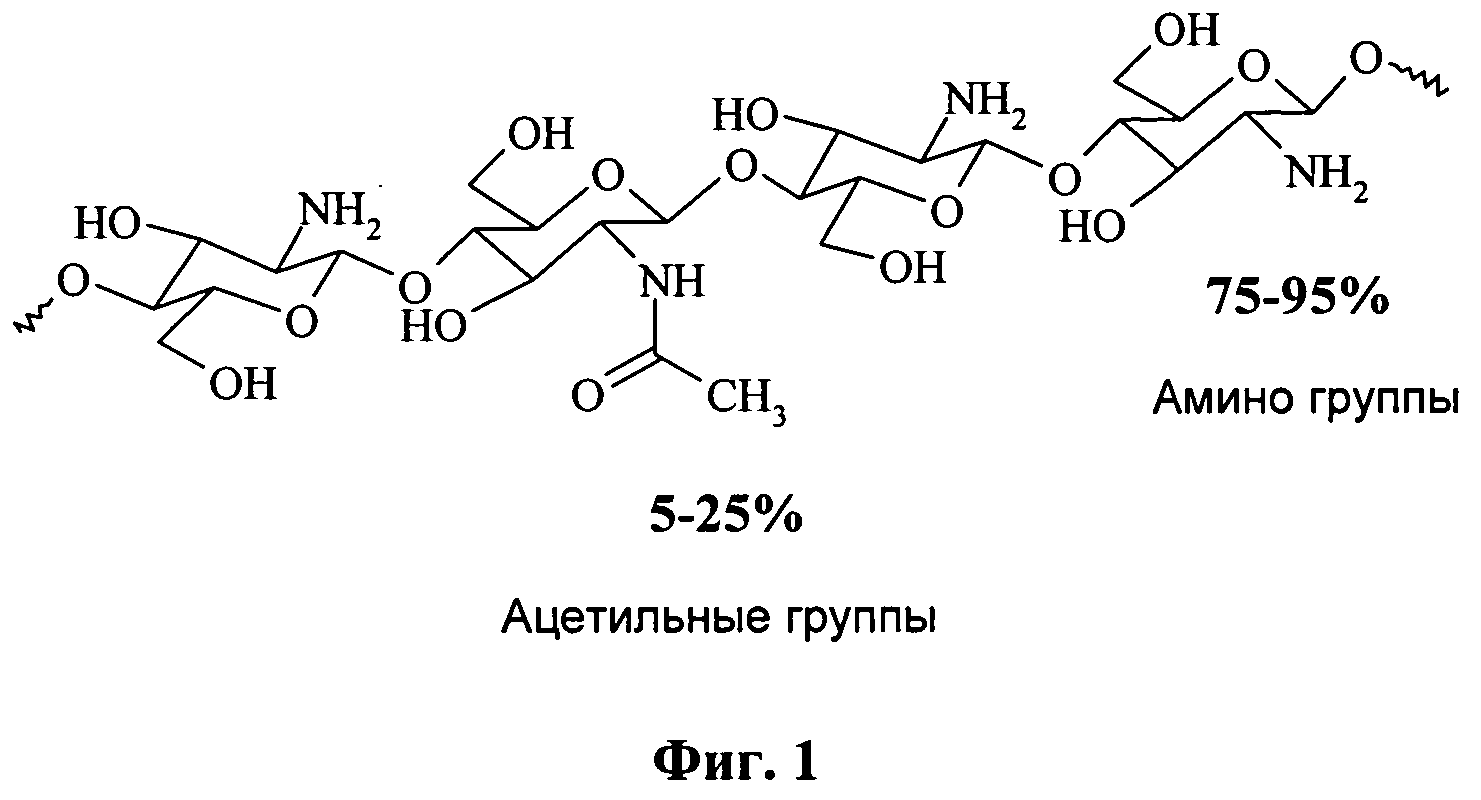
Хитозан представляет собой (1→4)-связанный сополимер глюкозамина и ацетилглюкозамина, получаемый N -дезацетилированием хитина в основной среде (см. фиг.1).
Хитозан вызывает постоянный интерес благодаря своим выдающимся биологическим свойствам таким, как биоразлагаемость, биоактивность и биосовместимость.
Известное изобретение направлено на создание технологического процесса, реализация которого позволяет получить оболочку для микрокапсул на основе альгината кальция или альгината бария и хитозана с различной вязкостью, оказывающей влияние на относительный процент выхода фосфолипидных мицелл из ядра капсул в средах, имитирующих условия желудочно-кишечного тракта человека.
Данное изобретение позволяет создать оболочку для микрокапсул на основе хитозана и солей альгиновой кислоты, через которую фосфолипидные мицеллы проникают с определенной скоростью за счет использования хитозана различной вязкости и разной природы катиона, образующего соль с альгиновой кислотой.
Кроме того, известен способ стабилизации липосомальных композиций за счет присоединения стабилизирующего вещества, которое нековалентно связывается с липидом и присутствует в количестве, достаточном для покрытия липида, но недостаточном для увеличения вязкости композиции, при этом в качестве стабилизирующих веществ используют полимеры, в которых повторяющиеся звенья содержат одну или более гидроксильных групп (полигидроксиполимеры); полимеры, в которых повторяющиеся звенья содержат одну или более аминогрупп (полиамины); полимеры, в которых повторяющиеся звенья содержат одну или более карбоксильных групп (поликарбоксиполимеры); и полимеры, в которых повторяющиеся звенья содержат один или более сахаридных остатков (полисахариды). Молекулярный вес полимеров может варьироваться и обычно составляет от около 50 до около 5000000, предпочтительно от около 100 до около 50000. Более предпочтительны полимеры с молекулярным весом от около 150 до около 10000 и наиболее предпочтительно от около 800 до около 8000. Среди предложенных полимеров представлены природные и модифицированные полисахариды смолы, такие как ксантан, смола из бобов робинии, гуар или карагенан (из красной водоросли Chondrus crispus); метоксилированный пектин; крахмал; агароза; целлюлоза и полусинтетическая целлюлоза, например метилцеллюлоза, гидроксиэтилцеллюлоза, метоксицеллюлоза и гидроксипропилцеллюлоза; агар; хитозан; карбоксиметилцеллюлоза; соли альгиновой кислоты, такие как альгинаты натрия и кальция; соли гликозаминогликанов, включая соли гиалуроновой кислоты; фосфорилированные и сульфированные производные углеводов (см. патент РФ №2181998 на изобретение «Новые композиции липидов и стабилизирующих материалов», дата подачи 27.03.1996 г., опубликовано 10.05.2002 г.).
Подобные композиции обладают повышенной стабильностью. При их применении уменьшается блокирование мелких сосудов.
Наиболее близким техническим решением к заявляемому изобретению является способ стабилизации липосомальной композиции, при котором используют модифицированный биополимер хитозана.
Известная стабильная липосомальная композиция относится к целевым хитозан-производным, содержащим октреотид, а более конкретно N-сукцинил-М-алкилат хитозан производной и к N-алкилат карбоксиметил хитозан. Кроме того, известен способ получения данной композиции (см. патент CN 101396563 «Chitose derivates using octreotide as terget ligand and use thereof in medicalament», дата публикации 01.04.2009 г.).
Недостатки данного изобретения обусловлены использованием сложного многостадийного способа модификации хитозана, а также применением карбоксиметил хитозана, затрудняющего нагрузку липосом анионными лекарственными препаратами.
Техническим результатом, на достижение которого направлено заявляемое изобретение, является упрощение способа получения (синтеза) модифицированного хитозана, а также повышение эффективности стабилизации липосомальных композиций за счет введения стабилизатора на основе модифицированного хитозана.
Указанный технический результат достигается тем, что в стабилизаторе для липосомальных суспензий, включающем модифицированный хитозан, согласно изобретению в качестве модифицированного хитозана используют хитозан, полученный путем модификации частиц хитозана, находящихся в эмульсии органический растворитель - вода с рH 6,0-6,5, путем воздействия сначала смесью, состоящей из карбоновой кислоты в органическом растворителе и конденсирующего агента, а затем органическим основанием, при этом в качестве карбоновых кислот используют или пальмитиновую, или стеариновую, или додекановую кислоту, в качестве конденсирующего агента - смесь из гидроксисукцинимида и алифатического карбодиимида или формальдегида и алифатического изоцианида, а в качестве органического основания - триэтиламин.
В качестве органического растворителя используют или дихлорметан, или хлороформ, или толуол, или бензол.
В заявляемом изобретении используют хитозан с молекулярной массой 20-150 тыс. дальтон и степенью деацетилирования 85-98%.
В качестве жирных кислот используют карбоновые кислоты с длиной цепи C10-C18, предпочтительно стеариновую и пальмитиновую.
Степень замещения остатками жирных кислот составляет 0,5-4,0%.
Оптимальная концентрация стабилизирующего агента составляет 0,5-2,0 г/л.
Указанный технический результат достигается тем, что способ получения стабилизатора для липосомальных суспензий, включающий модификацию хитозана, согласно изобретению модификацию хитозана осуществляют путем подщелачивания раствора гидрохлорида хитозана до образования коллоидного раствора с рН 6,0-6,5, на который воздействуют смесью, состоящей из карбоновой кислоты в органическом растворителе и конденсирующего агента, после чего состав интенсивно перемешивают и выдерживают, а затем вводят в эмульсию органическое основание до достижения рН 8,5, после чего удаляют органический растворитель, при этом в качестве карбоновых кислот используют или пальмитиновую, или стеариновую, или додекановую кислоту, в качестве конденсирующего агента - смесь из гидроксисукцинимида и алифатического карбодиимида или формальдегида и алифатического изоцианида, а в качестве органического основания - триэтиламин.
Органический растворитель удаляют отгонкой или разделением фаз.
Таким образом, сущность заявляемого способа заключается в синтезе гидрофобно-модифицированного хитозана на границе раздела фаз органический растворитель - вода.
Заявляемое изобретение поясняется чертежами, где
Фиг.1 - структура немодифицированного хитозана.
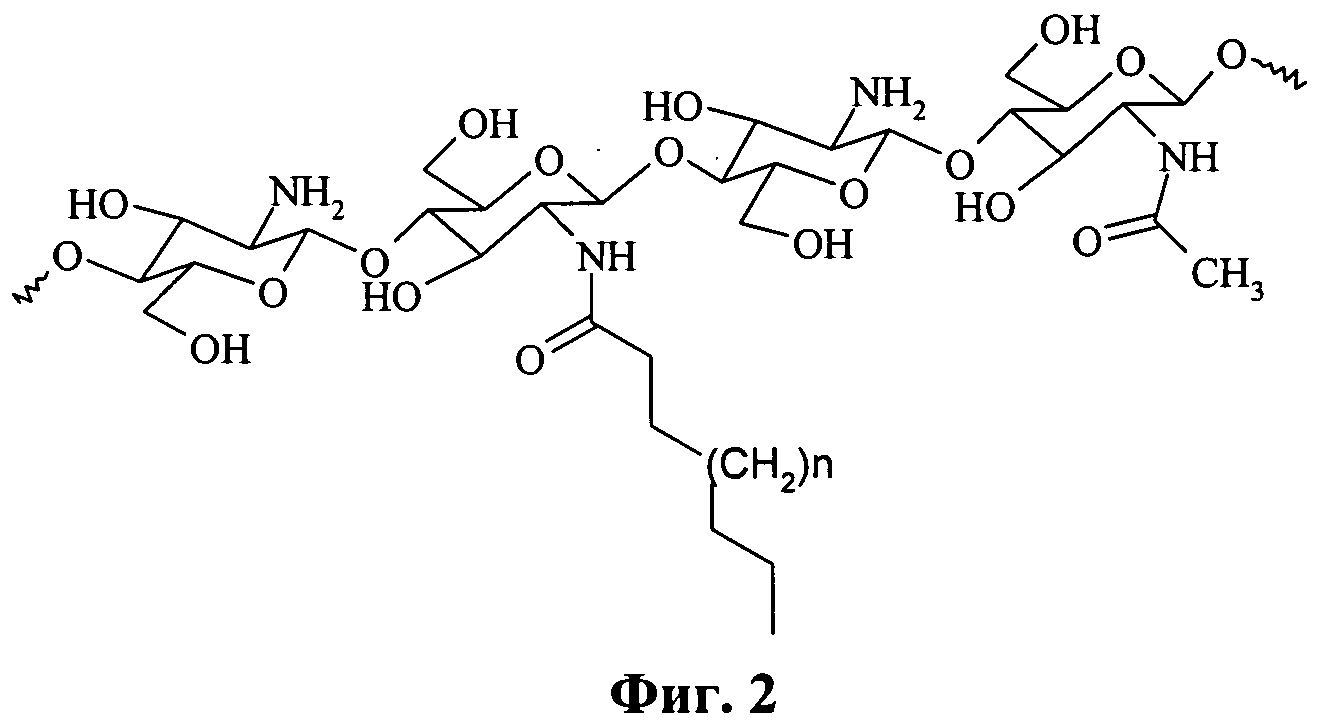
Фиг.2 - структура модифицированного хитозана, полученного посредством реакции ацилирования.
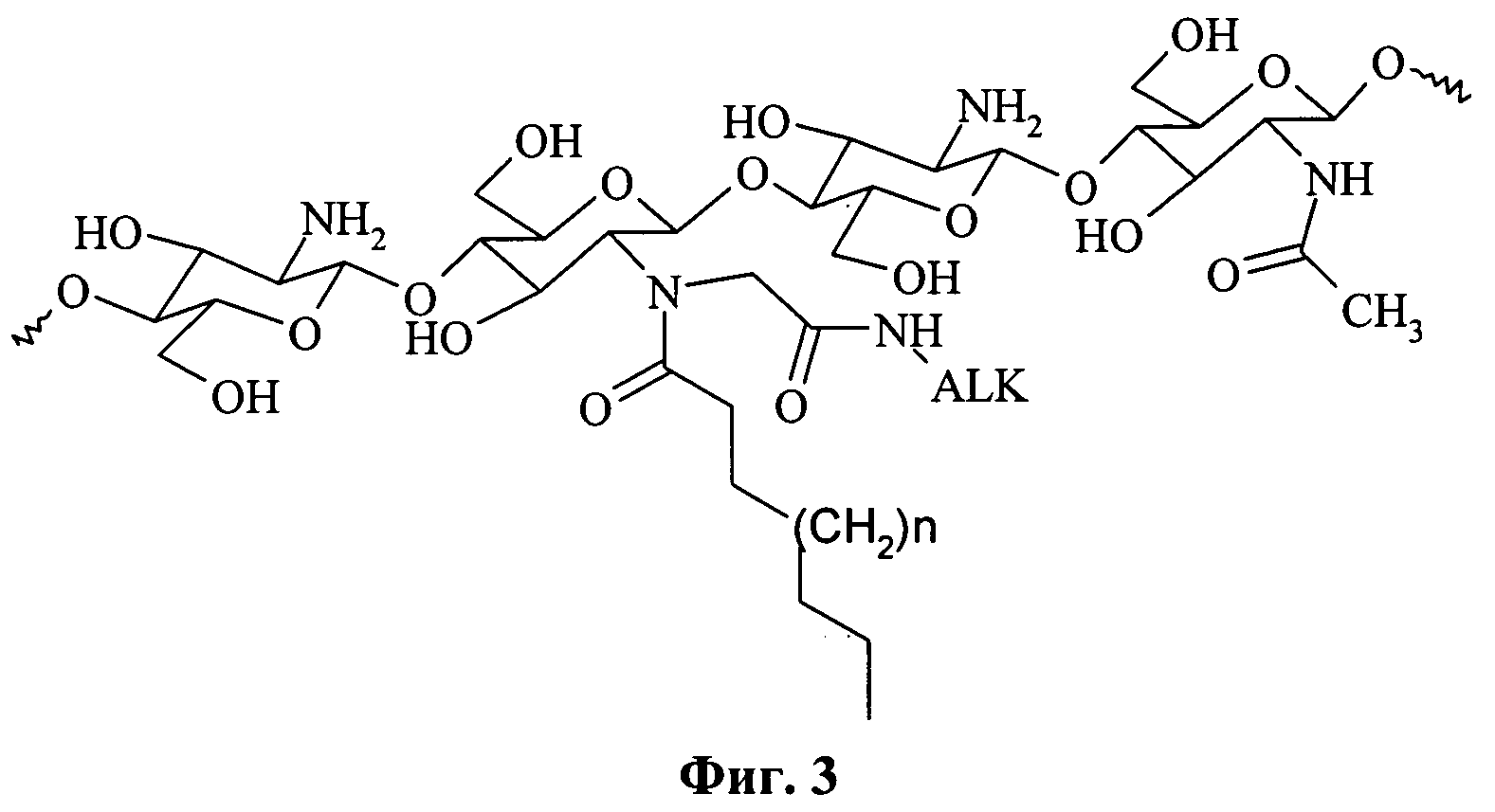
Фиг.3 - структура модифицированного хитозана, полученного посредством реакции Уги.
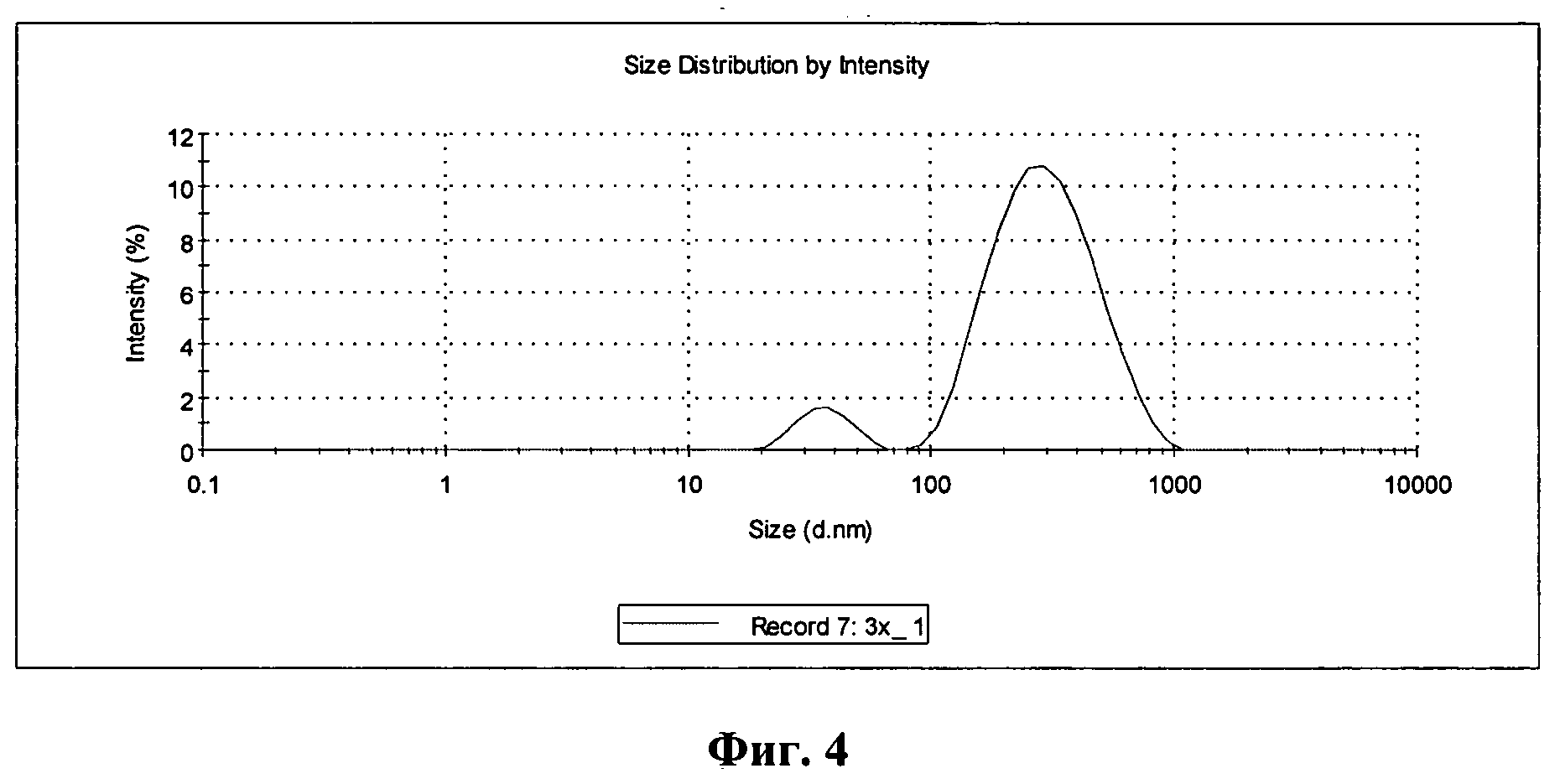
Фиг.4 - график распределения частиц по размеру в образце, обработанном раствором немодифицированного хитозана.
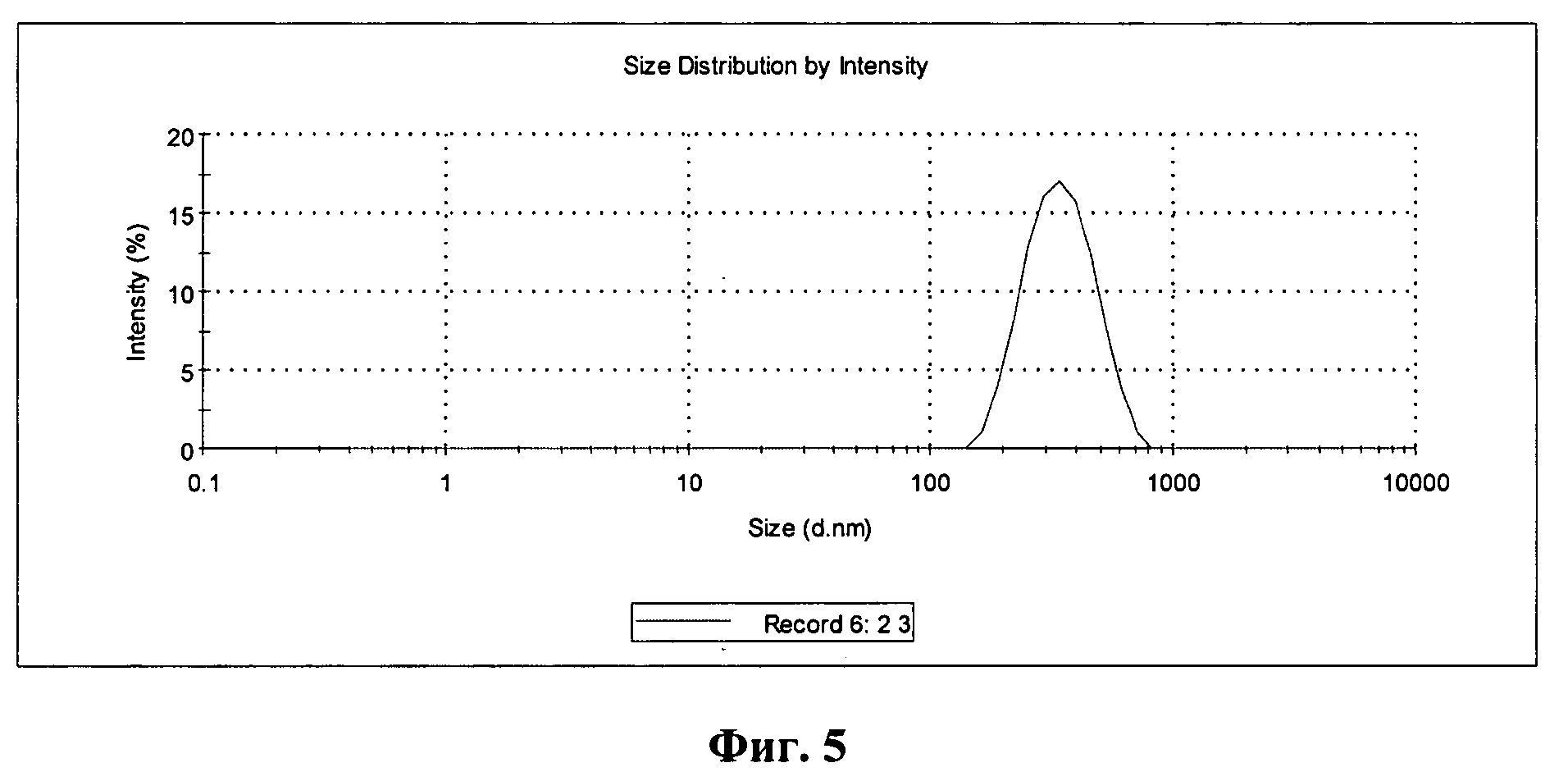
Фиг.5 - график распределения по размеру частиц в образце липосом, выдержанных в растворе модифицированного пальмитиновой кислотой хитозана с вязкостью 45 cps.
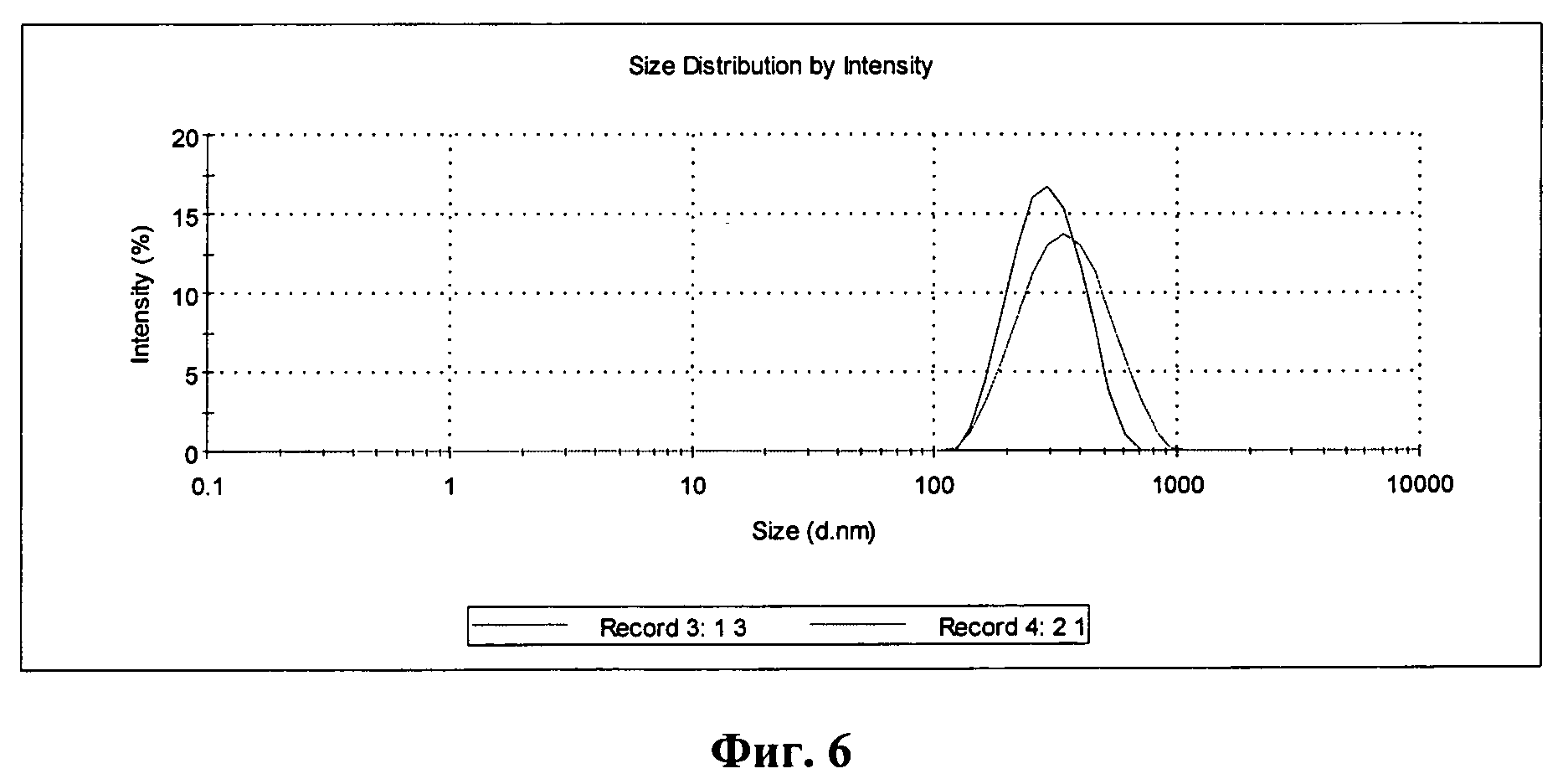
Фиг.6 - график распределения по размеру частиц исходного (Record 3) и покрытого оболочкой (Record 4) образцов.
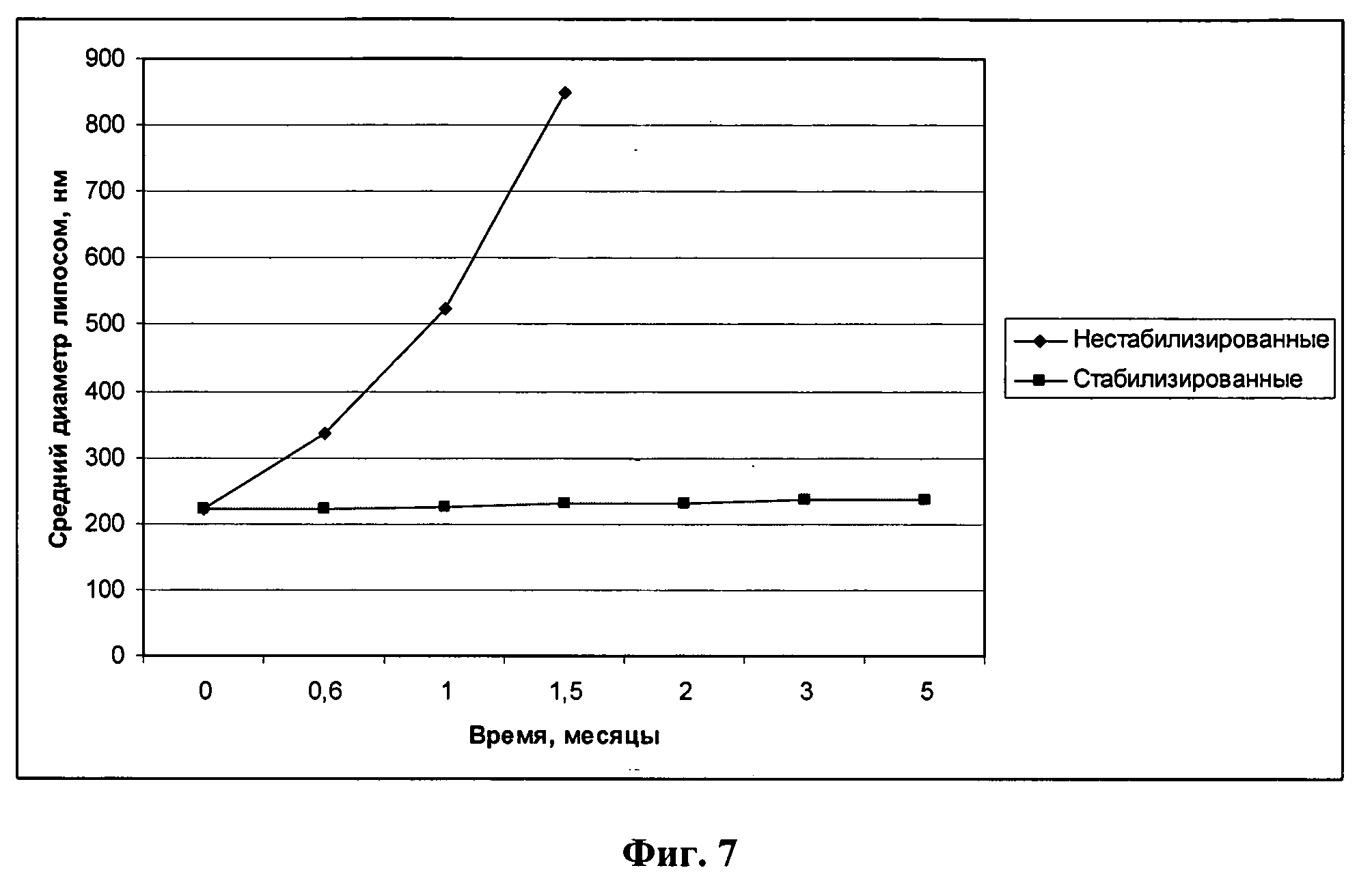
Фиг.7 - график изменения среднего размера и полидисперсности липосом со стабилизатором (1) и без него (2).
В процессе синтеза молекулы хитозана находятся и ориентируются на межфазной границе и поэтому реакция модификации проходит более селективно с получением производных с ярко выраженными поверхностно-активными свойствами. Подобные молекулы активно взаимодействуют с липосомами, обладающими большей удельной поверхностью. Так, гидрофобные фрагменты модифицированного хитозана растворяются в липидном поверхностном слое, в то время как остатки глюкозамина ориентируются в сторону водной фазы. Гидратированные цепи хитозана обеспечивают высокую стерическую стабилизацию липосом.
Кроме того, полимер несет заряд, приводящий к электростатическому отталкиванию между ними. Введение модифицированного хитозана позволяет улучшить механические качества липосомальной оболочки, в том числе повысить упругость и вязкость липидного слоя. В целом все эти эффекты приводят к значительному повышению стабильности липосомальных лекарственных форм. Например, липосомы со стабилизатором в водных растворах не подвержены коакуляции и образованию конгломератов в течение нескольких недель и даже месяцев. Кроме того, снижается скорость поглощения липосом макрофагами, что приводит к более выраженному лекарственному эффекту липосомального препарата. В частности, стабилизированные липосомы способны проходить через слизистую оболочку без разрушения липидного слоя, что открывает большие возможности для практического использования в медицинской практике.
В заявляемом изобретении используют смесь карбоновых кислот в присутствие конденсирующих агентов - фенолов и алифатических карбодиимидов или формальдегида и алифатических изоцианидов. В обоих случаях выход модифицированного продукта достигает 75-80%. Взаимодействие проводится следующим образом. Раствор гидрохлорида хитозана подщелачивают до образования коллоидного раствора, затем к нему добавляют раствор исходных реактивов в органическом растворителе, в качестве которого используют или дихлорметан, или хлороформ, или толуол, или бензол. Обе фазы смешивают до получения устойчивой эмульсии с помощью эффективной мешалки или гомогенизатора. По окончании реакции эмульсия разрушается самопроизвольно, в противном случае расслоение фаз достигается путем добавления разбавленной соляной кислоты или удаления растворителя.
Конечными продуктами во всех случаях являются гидрофобно модифицированные полимеры на основе хитозана (см. фиг.2), строение которых подтверждено спектрами ПМР. Механизм реакции включает образование активированного эфира и последующее нуклеофильное замещение с образованием амидной связи. Полученные таким образом производные проявили ярко выраженную способность к стабилизации эмульсий органических растворителей в воде при низких (меньше 2 г/л) концентрациях. В результате получают биосовместимые и биоразлагаемые стабилизаторы эмульсий, чувствительные к изменению рН и ионной силы растворов, которые применяют для стабилизации липосомальных суспензий и как компоненты липосомальных композиций в пищевой и медицинской промышленности.
При использовании исходных реагентов - пальмитиной кислоты, гидроксисукцинимида и дициклогексилкарбодиимида (<0,5 ммоль/л) был выделен продукт, растворимый в воде и растворах соляной кислоты. В ИК спектре наблюдали интенсивные полосы поглощения в области 1613 и 1550 см-1. В ЯМР 1Н наблюдали пики 1,55 2,76 и 2,85 м.д. Эти пики соответствует сигналам пальмитиновой кислоты, что говорит о прохождении реакции ацилирования.
Аналогичные данные были получены с использованием стеариновой и додекановой кислот. При малой концентрации исходных реагентов в органическом растворителе частицы хитозана легко десорбируются с поверхности раздела фаз и реакция проходит в водной фазе. При высокой концентрации исходных реагентов частицы не могут легко десорбироваться с поверхности, поэтому они накапливаются на ней и реакция происходит на границе водной и органической фазы.
При использовании другой комбинации конденсирующих агентов - формальдегида и алифатических изоцианидов, образуются продукты реакции Уги. Преимущество данного варианта состоит в отсутствии побочных продуктов реакции. В то же время основной продукт реакции - модифицированный хитозан (см. фиг.3) обладает ярко выраженными поверхностно-активными свойствами.
Модификация хитозана алифатическими кислотами позволяет повысить его способность стабилизировать липосомальные суспензии.
Так, например, немодифицированный хитозан (фиг.1) обладает слабой адгезией к липосомальным мембранам (оболочкам) вследствие чего основное содержание полимера находится в растворе и лишь небольшая часть оседает на оболочках.
На Фиг.4 приведен график распределения частиц по размеру в образце, обработанном раствором немодифицированного хитозана.
Образец полидисперсный, при этом индекс полидисперсности в среднем составил 0,46, что значительно выше чем 0,2, который принимается как верхнее значение для монодисперсных образцов. В распределении четко видны два основных пика: один около 320 нм и второй около 37 нм. Пик в области 30-40 нм характерен для образцов исходного полимера, что позволяет сделать вывод о том, что значительная часть хитозана находится в растворе и не принимает участия в образовании оболочки. Кроме того, размер частиц значительно увеличился (с 243 до 320 нм), что свидетельствует об образовании рыхлой оболочки на поверхности липосом.
На фиг.5 представлен график распределения по размеру частиц в образце липосом, выдержанных в растворе модифицированного пальмитиновой кислотой хитозана с вязкостью 45 cps. Образец монодисперсный, при этом индекс полидисперсности в среднем составил 0,17, что незначительно отличается от образца на фиг.4.
В распределении наблюдается один пик при 302 нм, что свидетельствует об увеличении размера липосом за счет формирования оболочки (см. фиг.6). В то же время увеличение объема не так значительно, как в случае немодифицированного хитозана, что подтверждает образование более плотной оболочки.
Определяющее значение для данного способа имеют два фактора: скорость осаждения хитозана на мембране липосомы и стабильность образующихся суспензий. Оба значения можно определить по скорости исчезновения небольших частиц в диапазоне 30-80 нм в спектрах светорассеяния образцов.
Результаты скорости осаждения образцов хитозана, отличающихся по вязкости (10, 20, 45 и 120 cps), приведены в Таблице 1.
|
Как видно из Таблицы 1, с увеличением вязкости скорость осаждения хитозана на поверхности липосом быстро падает. В то же время хитозан с более высокой вязкостью обеспечивает лучшую стабилизацию липосом. Таким образом, заявляемый стабилизатор обеспечивает надежную стабилизацию липосомальной мембраны.
Технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как «новизна».
Заявляемые существенные признаки, предопределяющие получение указанного технического результата, явным образом не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного применения.
Заявляемый стабилизатор для липосомальных суспензий получают и используют следующим образом.
Осуществляют синтез модифицированного хитозана, при котором хитозан в количестве 250 мг растворяют в 100 мл 0,2%-ном растворе соляной кислоты в воде. Полученный раствор титруют 0,2%-ным раствором гидроксида натрия в воде до помутнения раствора (рН 6,0-6,5). К полученному раствору добавляют рассчитанное количество жирной кислоты (или пальмитиновой, или стеариновой, или додекановой) и конденсирующего агента (смеси гидроксисукцинимида и дициклогексилкарбодиимида или алифатического изоцианида и формальдегида) в 20 мл органического растворителя (или дихлорметана, или хлороформа, или бензола, или толуола).
Смесь интенсивно перемешивают до получения однородной эмульсии. Затем рН смеси доводят до 8,5 добавлением триэтиламина и выдерживают эмульсию еще в течение 1 часа. После этого органический растворитель отгоняют при нагревании и интенсивном перемешивании. Водную фазу фильтруют и концентрируют до 10-15 г/л путем упаривания на роторном испарителе. Полученный раствор может непосредственно использоваться для осаждения на поверхности липосом.
Модификация поверхности липосом. К липосомальной суспензии добавляют водный раствор гидрофобно-модифицированного хитозана с концентрацией 10-15 г/л до установления его концентрации в суспензии до 1 г/л. Полученный раствор выдерживают в течение 3 часов при комнатной температуре.
Параметры получаемых липосом со стабилизатором оценивали с помощью спектрофотометра динамического светорассеяния Malvem Zetasizer Nano SL. Для проведения эксперимента липосомальную композицию разбавляли дистиллированной водой до концентрации гидрофобно-модифицированного хитозана 1 г/л и помещали в кювету спектрофотометра. Результаты оценки подтвердили, что заявляемая липосомальная суспензия, в которую введен стабилизатор, получаемая заявляемым способом, обладает необходимыми для медицинского применения характеристиками, в частности, до 95% липосом имели диаметр в диапазоне 150-450 нм.
Основные параметры заявляемой липосомальной композиции приведены в Таблице 2.
|
Кроме того, были проведены сравнительные исследования по изменению среднего размера и полидисперсности липосом, в состав которых был введен заявляемый стабилизатор, и липосом без стабилизатора.
Полученные данные приведены в Таблице 3.
|
Анализ данных, приведенных в Таблице 3, позволяет сделать вывод о том, что изменение размера и полидисперности липосом не превышает 2% в месяц.
Сравнительный анализ изменения параметров образцов липосом со стабилизатором (1) и без него (2) приведен на Фиг.7. Анализ показал, что средний размер липосом без стабилизатора увеличился за 20 суток с 264 до 336 нм, что соответствует скорости старения примерно 35% в месяц. В то же время индекс полидисперсности вырос в полтора раза, что позволяет использовать данные суспензии только в течение 3-4 дней после получения. В то же время параметры липосом со стабилизатором не претерпели существенных изменений во время хранения при комнатной температуре в течение 5 месяцев.
Все вышеперечисленное подтверждает возможность практического использования заявляемого стабилизатора для липосомальных суспензий.
Осуществление заявляемого изобретения подтверждается примерами конкретного выполнения.
Пример №1.
Получение стабилизатора липосомальных суспензий с помощью реакции ацилирования.
Синтез модифицированного хитозана осуществляют следующим образом. Хитозан в количестве 250 мг растворяют в 100 мл 0,2%-ного раствора соляной кислоты в воде. Полученный раствор титруют 0,2%-ным раствором гидроксида натрия в воде до помутнения раствора (рН 6,0-6,5). К полученному раствору добавляют рассчитанное количество смеси из гидроксисукцинимида, дициклогексилкарбодиимида и пальмитиновой кислоты в 20 мл дихлорметана. Смесь интенсивно перемешивают до получения однородной эмульсии. Затем рН смеси путем добавления органического основания - триэтиламина доводят до 8,5 и выдерживают в течение 1 часа. После этого дихлорметан отгоняют при нагревании и интенсивном перемешивании. Отфильтровывают образовавшийся осадок дициклогексилмочевины и водную фазу концентрируют до 10-15 г/л. Полученный раствор может быть использован для осаждения на поверхности липосом.
Пример №2.
Получение стабилизатора липосомальных суспензий с помощью реакции ацилирования.
Синтез модифицированного хитозана осуществляют следующим образом. Хитозан в количестве 250 мг растворяют в 100 мл 0,2%-ного раствора соляной кислоты в воде. Полученный раствор титруют 0,2%-ным раствором гидроксида натрия в воде до помутнения раствора (рН 6,0-6,5). К полученному раствору добавляют рассчитанное количество смеси гидроксисукцинимида, дициклогексилкарбодиимида и додекановой кислоты в 20 мл бензола. Смесь интенсивно перемешивают до получения однородной эмульсии. Затем рН смеси путем добавления триэтиламина доводят до 8,5 и выдерживают в течение 1 часа. После этого бензольный раствор отделяют на делительной воронке. Водную фазу фильтруют от образовавшегося осадка дициклогексилмочевины и концентрируют до 10-15 г/л. Полученный раствор может быть использован для осаждения на поверхности липосом.
Пример №3.
Получение стабилизатора липосомальных суспензий с помощью реакции Уги.
Синтез модифицированного хитозана осуществляют следующим образом. Хитозан в количестве 250 мг растворяют в 100 мл 0,2%-ного раствора соляной кислоты в воде. Полученный раствор титруют 0,2%-ным раствором гидроксида натрия в воде до помутнения раствора (рН 6,0-6,5). К полученному раствору добавляют рассчитанное количество смеси метоксиэтилизоцианида, формальдегида и стеариновой кислоты в 20 мл толуола. Смесь интенсивно перемешивают до получения однородной эмульсии. Затем рН смеси путем добавления триэтиламина доводят до значения 8,5, после чего полученную эмульсию выдерживают в течение 1 часа. В течение этого времени происходит самопроизвольное расслоение эмульсии. После окончания реакции толуол отделяют на делительной воронке, а водную фазу концентрируют до 10-15 г/л. Полученный раствор может быть использован для осаждения на поверхности липосом.
Пример №4.
Получение стабилизатора липосомалъных суспензий с помощью реакции Уги.
Синтез модифицированного хитозана осуществляют следующим образом. Хитозан в количестве 250 мг растворяют в 100 мл 0,2%-ного раствора соляной кислоты в воде. Полученный раствор титруют 0,2%-ным раствором гидроксида натрия в воде до помутнения раствора (рН 6,0-6,5). К полученному раствору добавляют рассчитанное количество смеси циклогексилизоцианида, формальдегида и пальмитиновой кислоты в 20 мл хлороформа. Смесь интенсивно перемешивают до получения однородной эмульсии. Затем рН смеси путем добавления триэтиламина доводят до значения 8,5, после чего полученную эмульсию выдерживают в течение 1 часа. После этого хлороформ отгоняют при нагревании и интенсивном перемешивании. Водную фазу фильтруют и концентрируют до 10-15 г/л. Полученный раствор может быть использован для осаждения на поверхности липосом.
Пример №5.
Применение стабилизатора липосомалъных суспензий.
Проводят модификацию поверхности липосом, для чего к липосомальной суспензии добавляют водный раствор гидрофобно-модифицированного хитозана с концентрацией 10-15 г/л до установления его концентрации в суспензии до 1 г/л. Полученный раствор выдерживают в течение 3 часов при комнатной температуре.
Заявляемая группа изобретений позволяет получить стабилизатор для липосомальных суспензий, обладающих повышенной стабильностью и предназначенных для осуществления направленной транспортировки физиологически активных веществ.