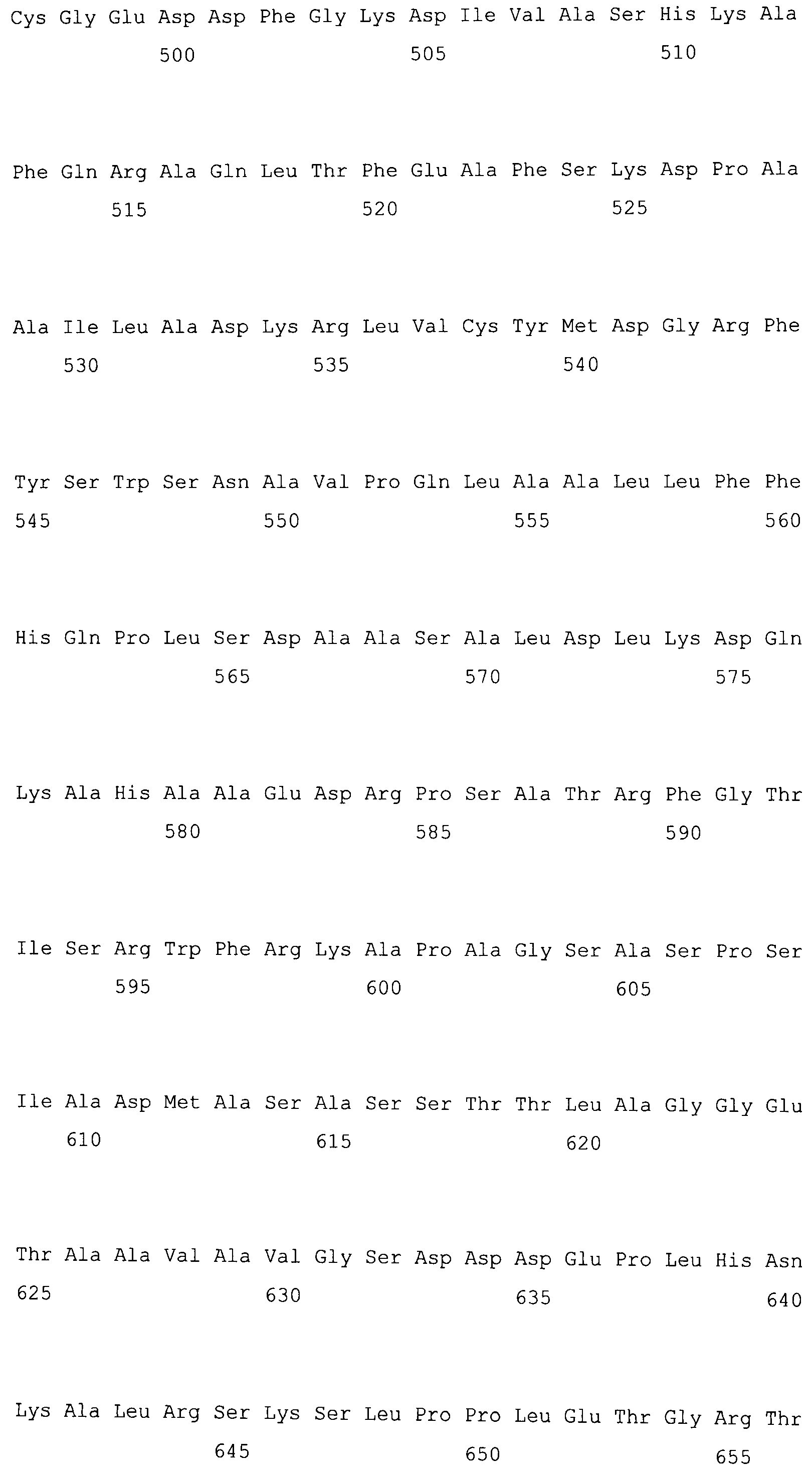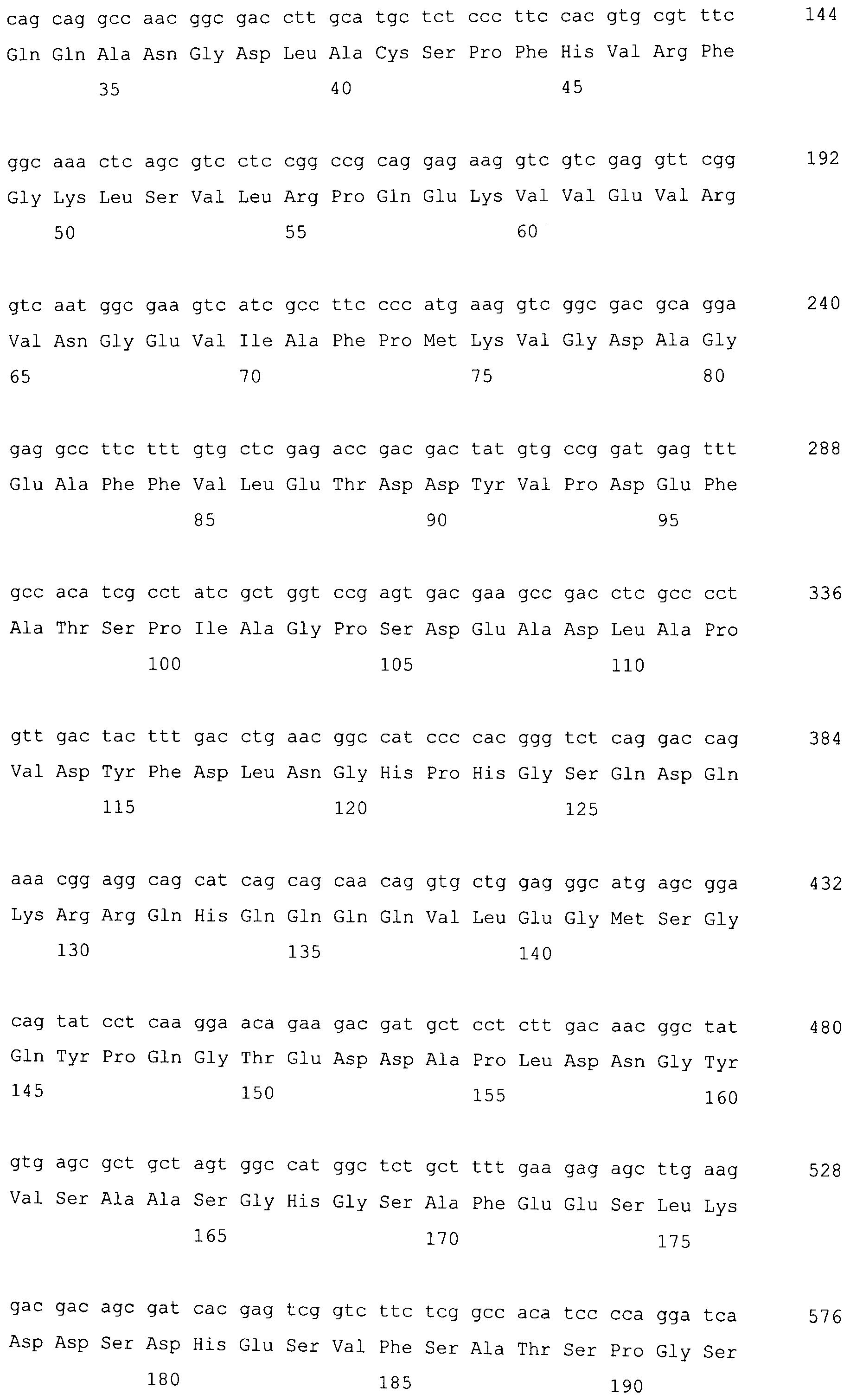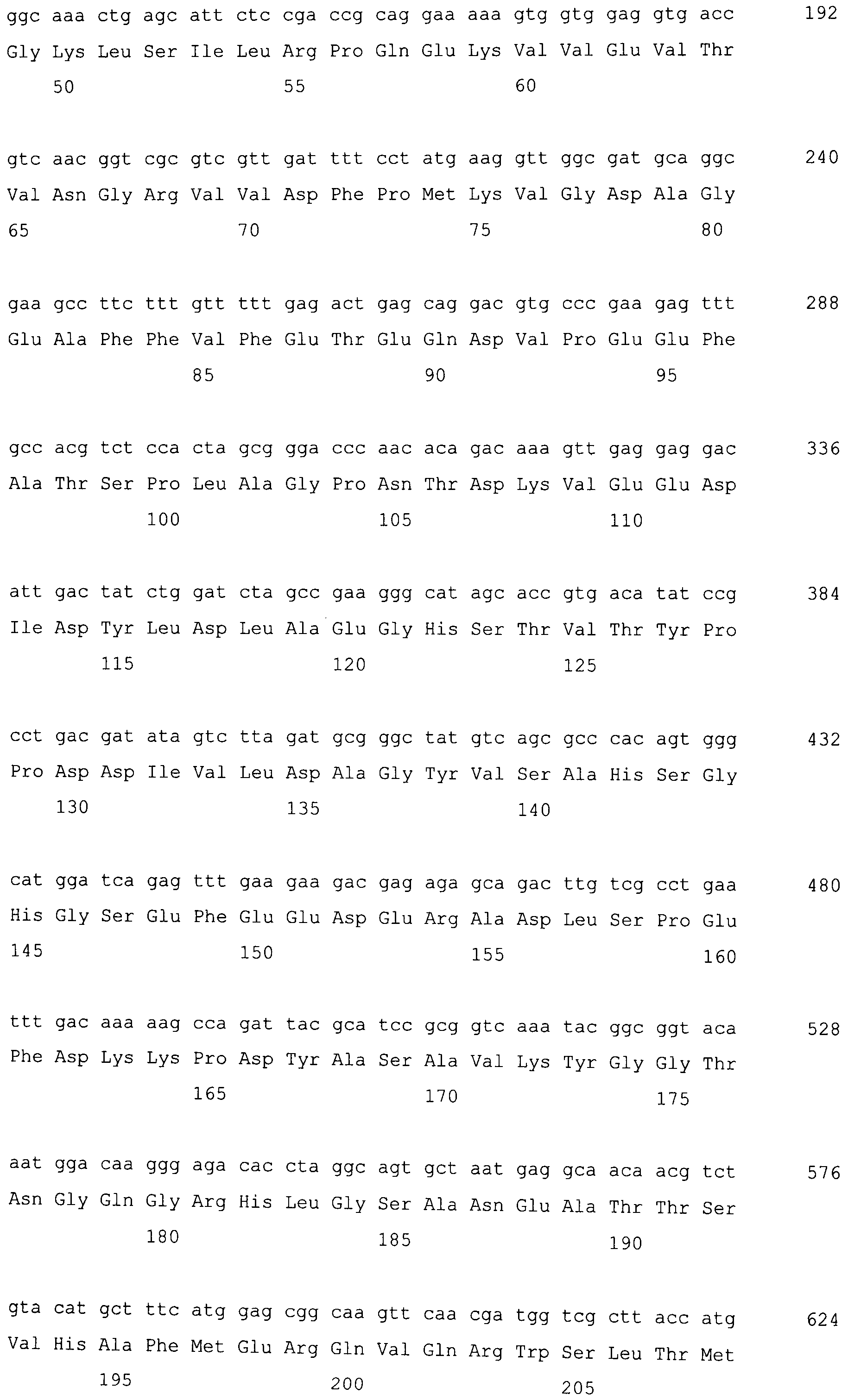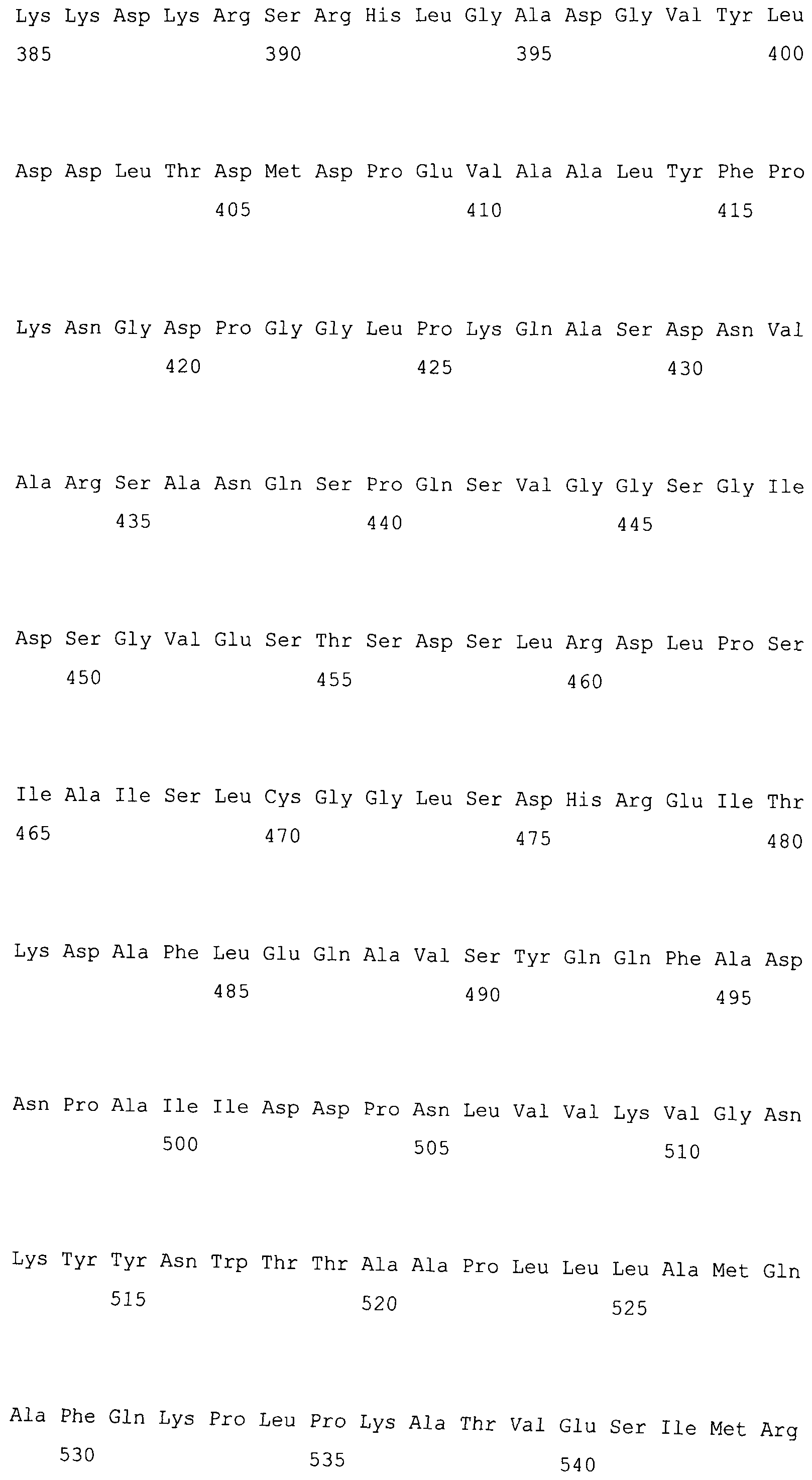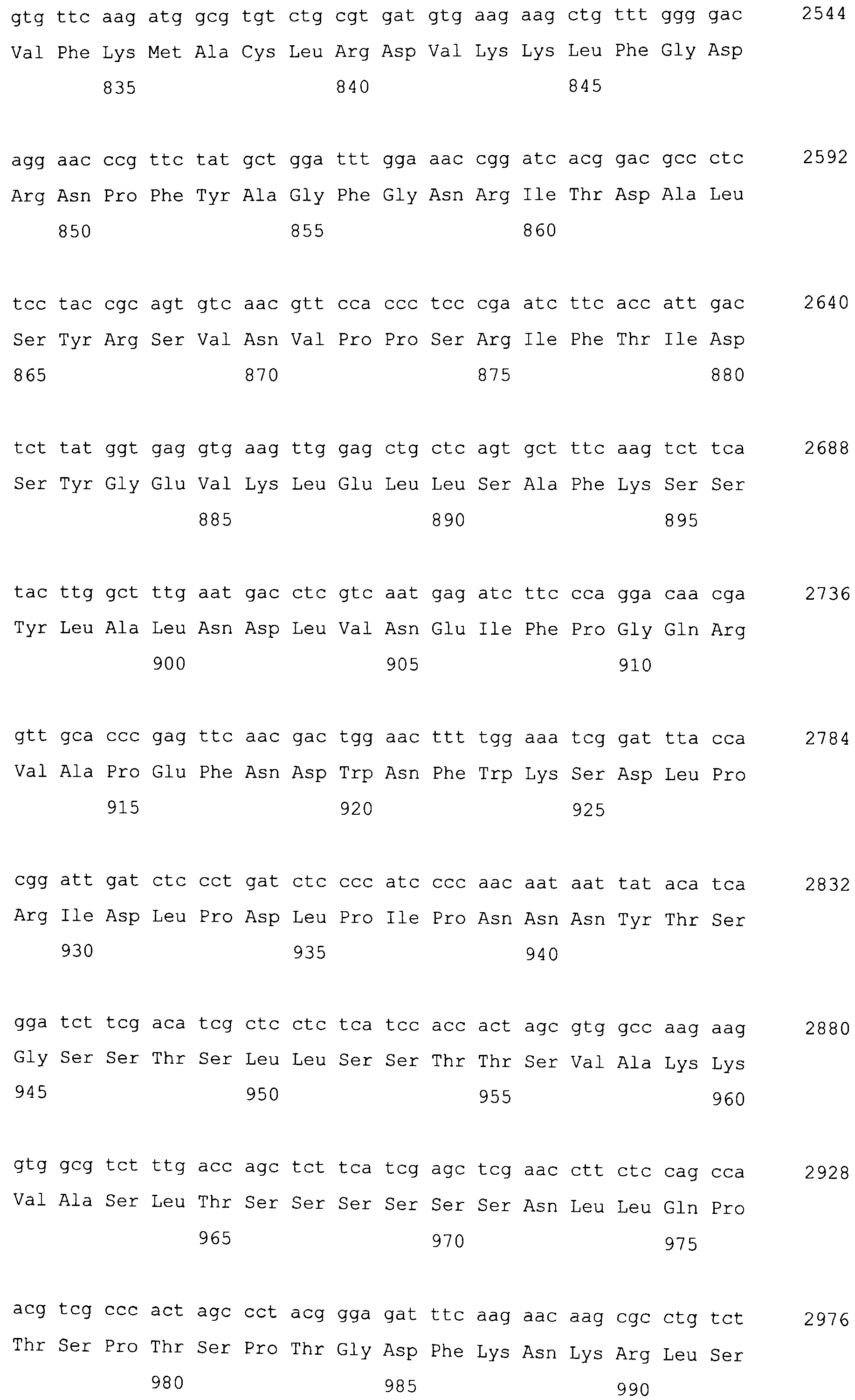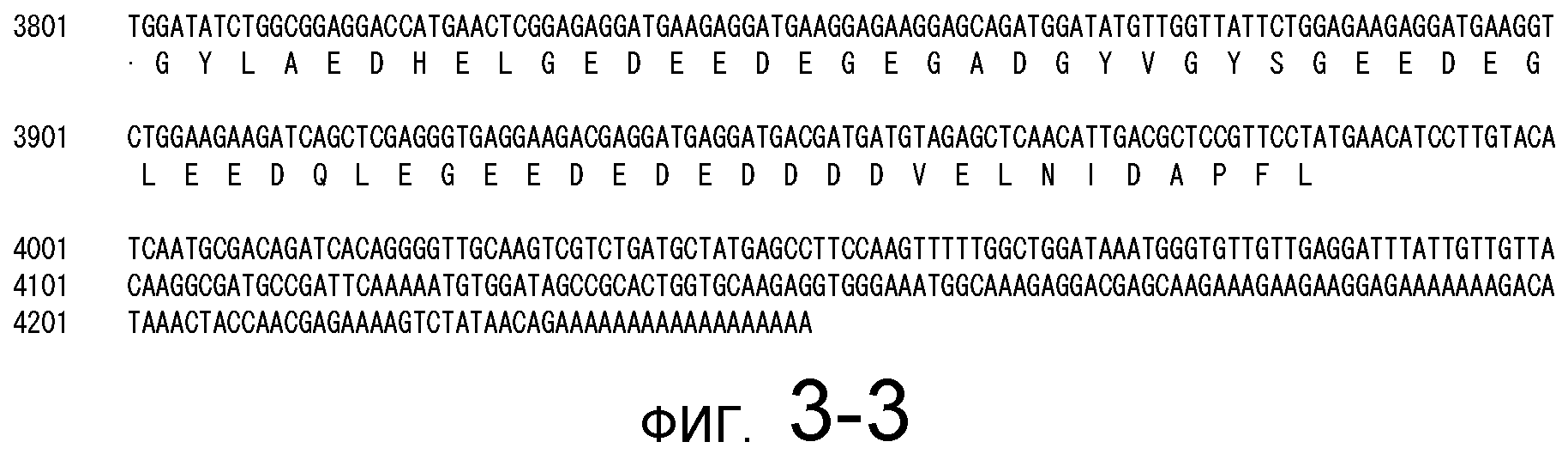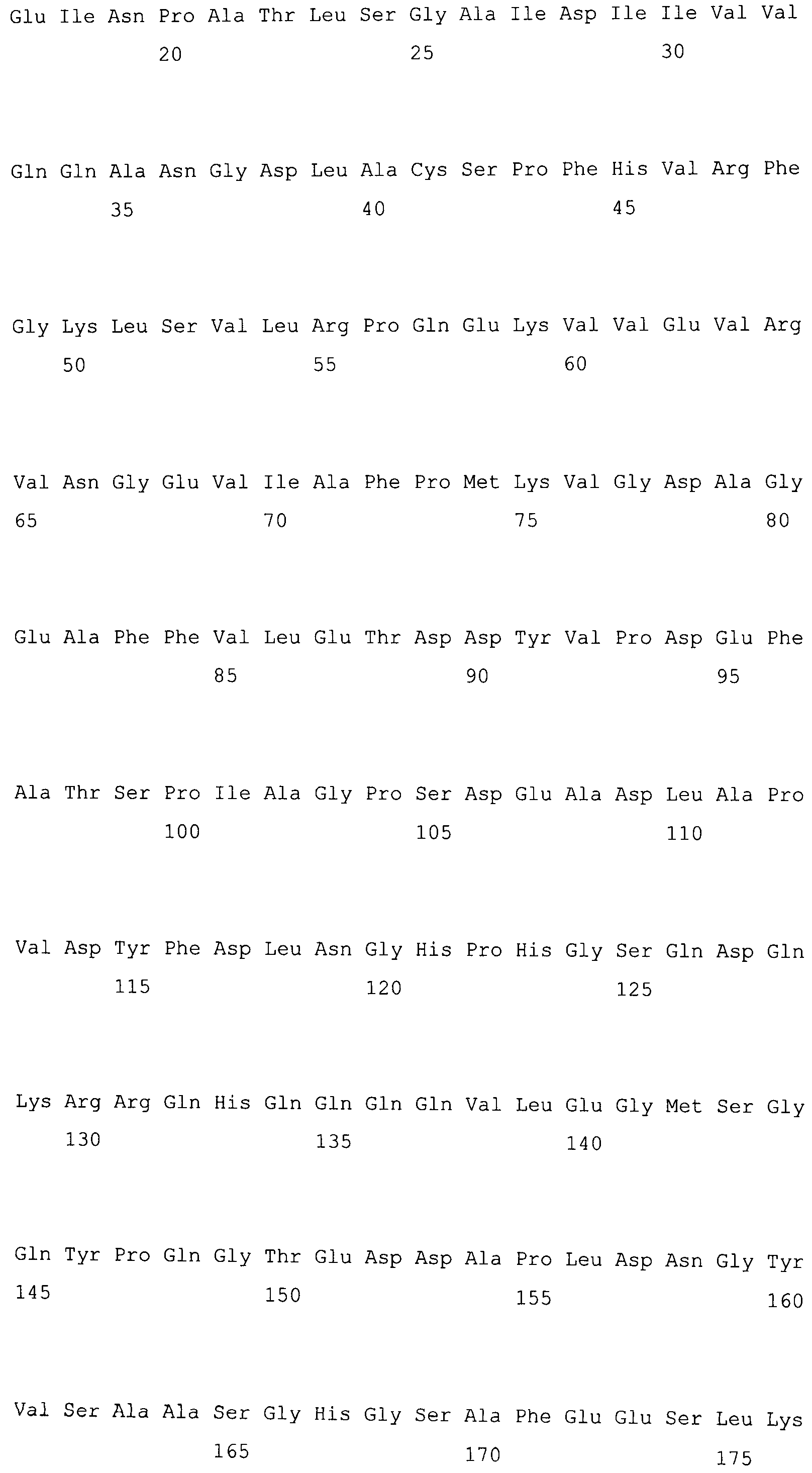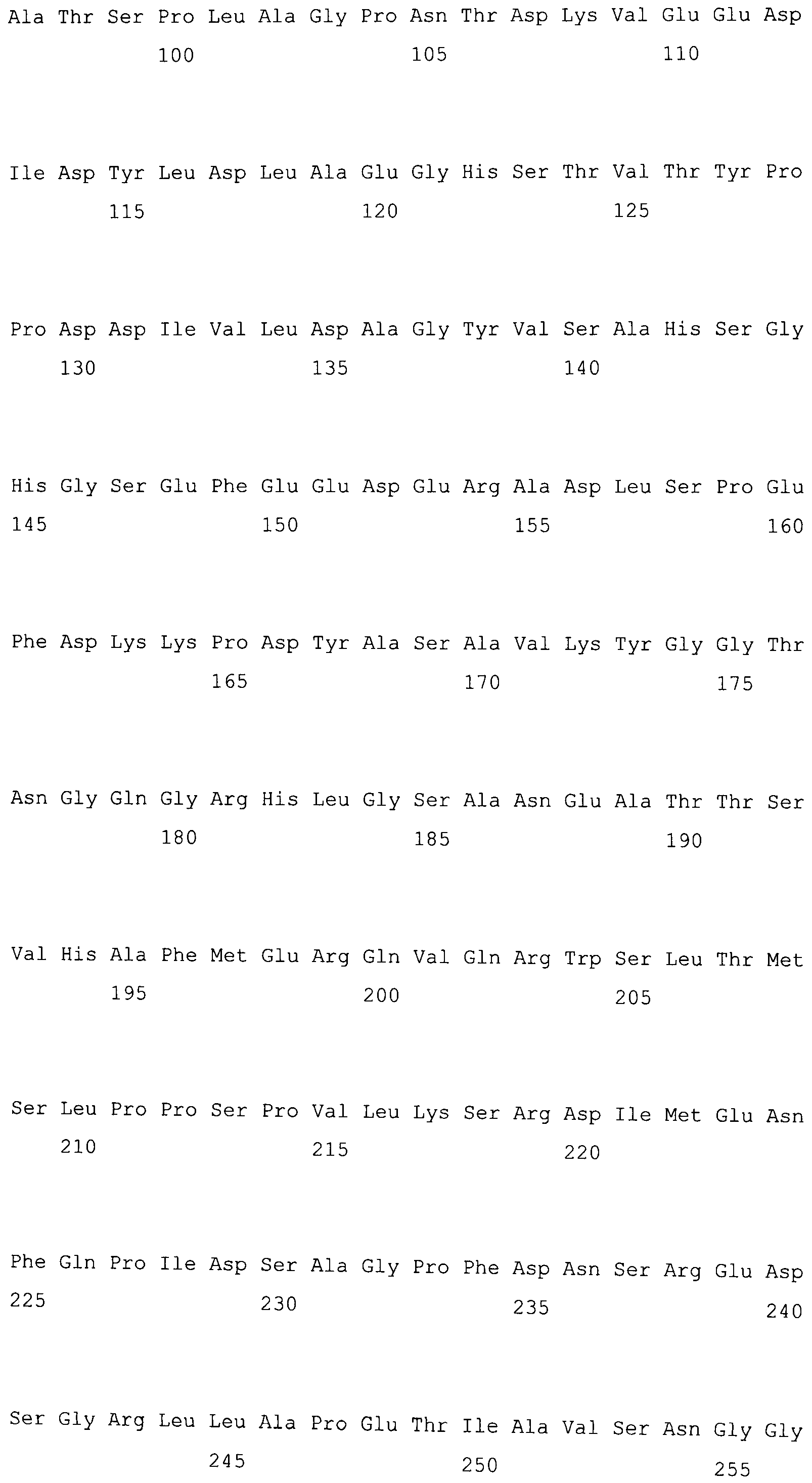Результат интеллектуальной деятельности: НУКЛЕИНОВАЯЯ КИСЛОТА, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ ГЕНА ФОСФАТАЗЫ ФОСФАТИДНОЙ КИСЛОТЫ (ВАРИАНТЫ), БЕЛОК, РЕКОМБИНАНТНЫЙ ВЕКТОР, ТРАНСФОРМАНТ И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ЖИРНОЙ КИСЛОТЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому гену фосфатазы фосфатидной кислоты и его применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Жирные кислоты, содержащие две или более ненасыщенные связи, в совокупности обозначают как полиненасыщенные жирные кислоты (PUFA), которые, как известно, включают арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеновую кислоту, докозагексаеновую кислоту и т.д. Некоторые из данных полиненасыщенных жирных кислот не синтезируются в организме животного, и такие полиненасыщенные жирные кислоты необходимо принимать с пищей в качестве незаменимых жирных кислот. Полиненасыщенные жирные кислоты широко распространены. Например, арахидоновую кислоту выделяют из липидов, выделенных из надпочечников и печени животного. Однако количество данных полиненасыщенных жирных кислот, содержащееся в органах животного, мало, и количество полиненасыщенных жирных кислот, полученных и выделенных в чистом виде только из органов животных, является недостаточным для их обеспечения в большом объеме. Таким образом, с помощью культивирования различных микроорганизмов были разработаны бактериальные методы для получения полиненасыщенных жирных кислот. В частности, известно, что микроорганизмы рода Mortierella продуцируют липиды, содержащие полиненасыщенные жирные кислоты, такие как арахидоновая кислота.
Другие попытки получения полиненасыщенных жирных кислот были предприняты в отношении растений. Известно, что полиненасыщенные жирные кислоты формируют липиды для запасания, такие как триацилглицерины (также обозначаемые как триглицериды, или TG), накапливающиеся внутри клетки микроорганизма или зернах растений.
Триацилглицерин в качестве липида для запасания образуется в организме следующим образом: ацильная группа вводится в глицерин-3-фосфат с помощью глицерин-3-фосфат ацилтрансферазы для получения лизофосфатидиловой кислоты. Ацильная группа вводится в лизофосфатидиловую кислоту с помощью лизофосфат ацилтрансферазы для получения фосфатидной кислоты. Фосфатидную кислоту подвергают дефосфорилированию с помощью фосфатазы фосфатидной кислоты для получения диацилглицерина. Ацильную группу вводят в диацилглицерин с помощью диацилглицерин ацилтрансферазы для получения триацилглицерина.
В данном метаболическом пути фосфатидная кислота (далее в настоящем документе также обозначаемая как «PA» или 1,2-диацил-sn-глицерин-3-фосфат) является предшественником триацилглицерина и также является биосинтетическим предшественником диацил глицерофосфолипида. В клетках дрожжей CDP диацилглицерин (CDP-DG) синтезируется из PA и цитидин 5'-трифосфата (CTP) с помощью фосфатидат цитидилтрансферазы и синтезируется в различные фосфолипиды.
Как описано выше, известно, что реакция биосинтеза диацилглицерина (далее в настоящем документе, также обозначаемого как «DG») катализируется фосфатазой фосфатидной кислоты (E.C. 3.1.3.4, далее в настоящем документе, также обозначаемая как «PAP») через дефосфорилирование PA. Известно, что PAP присутствует во всех организмах от бактерий до позвоночных.
Дрожжи (Saccharomyces cerevisiae), которые представляют собой грибы, обладают двумя типами PAP (непатентная литература 1, 2 и 7). Один из них представляет собой Mg2+-зависимую PAP (PAP1), а другой - представляет собой Mg2+-независимую PAP (PAP2). Известно, что ген PAH1 кодирует PAP1 (непатентная литература 3-5). Вариант pah1Δ также свидетельствует об активности PAP1, что позволяет предположить существование других генов, свидетельствующих об активности PAP1. При наличии варианта pah1Δ, ядерная мембрана и мембрана ER аномально расширены, а экспрессия важных генов для биосинтеза фосфолипидов аномально усилена (непатентная литература 6).
Известно, что гены, кодирующие PAP2, ген DPP1 и ген LPP1 наиболее всего характеризуют виды активности PAP2 у дрожжей. Ферменты, кодируемые этими генами, обладают широкой субстратной специфичностью и также влияют, например, на дефосфорилирование диацилглицерин пирофосфата (DGPP), лизофосфатидной кислоты, фосфатов сфингооснований и изопреноид фосфата.
Известно, что в продуцирующих липиды грибах, Mortierella alpina, содержится ген MaPAP1, являющийся Mg2+-независимым гомологом PAP2 (патентная литература 1).
В данной области известно о существовании гомологов генов, которые, вероятно, кодируют семейство ферментов PAP1 или семейство ферментов PAP2 в других бактериях, но их функции еще не изучены.
Список цитируемых документов
ПАТЕНТНАЯ ЛИТЕРАТУРА
Патентная литература 1: Международная публикация № WO2009/008466
НЕПАТЕНТНАЯ ЛИТЕРАТУРА
Непатентная литература 1: Biochem. Biophys. Acta, 1348, 45-55, 1997
Непатентная литература 2: Trends Biochem. Sci., 31(12), 694-699, 2006
Непатентная литература 3: EMBO J., 24, 1931-1941, 2005
Непатентная литература 4: J. Biol. Chem., 281(14), 9210-9218, 2006
Непатентная литература 5: J. Biol. Chem., 281(45), 34537-34548, 2006
Непатентная литература 6: J. Biol. Chem., 282(51), 37026-37035, 2007
Непатентная литература 7: J. Biol. Chem., 284(5), 2593-2597, 2009
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
В отношении большинства генов PAP, о которых сообщали ранее, однако, не проводили исследований в отношении изменения соотношения жирных кислот в составе композиции с жирными кислотами, продуцируемой клетками-хозяевами, при введении этих генов в клетки-хозяева и экспрессии в них. Существует потребность в выявлении нового гена с помощью введения гена в клетку-хозяина или экспрессирования гена, продуктом которого будет являться жир с заданной композицией жирных кислот или увеличенным содержанием заданных жирных кислот.
Объектом по настоящему изобретению является обеспечение белка или нуклеиновой кислоты, позволяющей клеткам-хозяевам продуцировать жир с заданной композицией жирных кислот или с повышенным содержанием заданных жирных кислот, с помощью экспрессии белка в клетках-хозяевах или введения нуклеиновой кислоты в клетки-хозяева.
РЕШЕНИЕ ПРОБЛЕМЫ
Авторы настоящего изобретения активно искали решение указанных выше проблем. То есть авторы изобретения проанализировали геном продуцирующих липиды грибов Mortierella alpina и выделили из генома последовательности, гомологичные известным генам Mg2+-зависимой фосфатазы фосфатидной кислоты (PAP1). Кроме того, для получения непрерывной открытой рамки считывания (ORF) в гене, кодирующем PAP, осуществляли клонирование полноразмерной кДНК с помощью скрининга библиотеки кДНК или ПЦР ген вводили в клетки-хозяева с высокой пролиферативной активностью, такие как дрожжи. В результате, авторы изобретения обнаружили, что белок, кодируемый клонированной кДНК, обладает активностью фосфатазы фосфатидной кислоты, а введение кДНК в дрожжи увеличивает запасы резервных липидов, триацилглицерина в дрожжах. Таким образом, было успешно достигнуто клонирование гена, относящегося к новой фосфатазе фосфатидной кислоты (PAP), а настоящее изобретение завершено. Таким образом, настоящее изобретение представляет собой как указано ниже.
(1) Нуклеиновая кислота по любому из пунктов от (a) до (g), представленных ниже:
(a) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью фосфатазы фосфатидной кислоты;
(b) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирует белок с активностью фосфатазы фосфатидной кислоты;
(c) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирующую белок с активностью фосфатазы фосфатидной кислоты;
(d) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, на 70% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью фосфатазы фосфатидной кислоты;
(e) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирует белок с активностью фосфатазы фосфатидной кислоты;
(f) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включает экзон, кодирующий белок с активностью фосфатазы фосфатидной кислоты; и
(g) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включающая экзон, кодирующий белок с активностью фосфатазы фосфатидной кислоты.
(2) Нуклеиновая кислота по п.(1), где нуклеиновая кислота представляет собой одну из любых от (a) до (g), представленных ниже:
(a) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью фосфатазы фосфатидной кислоты;
(b) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, в условиях 2×SSC при 50°C, и кодирует белок с активностью фосфатазы фосфатидной кислоты;
(c) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 90% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирующую белок с активностью фосфатазы фосфатидной кислоты;
(d) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью фосфатазы фосфатидной кислоты;
(e) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, в условиях 2×SSC при 50°C, и кодирует белок с активностью фосфатазы фосфатидной кислоты;
(f) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, в условиях 2×SSC при 50°C, и включающей экзон, кодирующий белок с активностью фосфатазы фосфатидной кислоты; и
(g) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 90% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включающую экзон, кодирующий белок с активностью фосфатазы фосфатидной кислоты.
(3) Нуклеиновая кислота по любому из пунктов от (a) до (d), представленных ниже:
(a) нуклеиновая кислота, содержащая нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 6, или ее фрагмент;
(b) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, или ее фрагмент;
(c) нуклеиновая кислота, содержащая нуклеотидную последовательность, представленную в SEQ ID NO: 4 или SEQ ID NO: 9, или ее фрагмент; и
(d) нуклеиновая кислота, содержащая нуклеотидную последовательность, представленную в SEQ ID NO: 5 или SEQ ID NO: 10, или ее фрагмент.
(4) Нуклеиновая кислота по любому из пунктов от (a) до (g), представленных ниже:
(a) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1;
(b) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирует белок, обладающий активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(c) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирующей белок, обладающий активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(d) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, на 70% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(e) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирует белок с активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(f) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая при строгих условиях может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включает экзон, кодирующий белок с активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1; и
(g) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включающей экзон, кодирующий белок с активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1.
(5) Нуклеиновая кислота по пункту (4), где нуклеиновая кислота представляет собой любую от (a) до (g), представленных ниже:
(a) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1;
(b) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, в условиях 2×SSC при 50°C, и кодирует белок с активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(c) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 90% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирующая белок, обладающий активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(d) нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, который состоит из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(e) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, в условиях 2×SSC при 50°C, и кодирует белок, обладающий активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1;
(f) нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, содержащей нуклеотидную последовательность, комплементарную нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, в условиях 2×SSC при 50°C, и включает экзон, кодирующий белок, который обладает активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1; и
(g) нуклеиновая кислота, содержащая нуклеотидную последовательность, состоящую из нуклеотидной последовательности, на 90% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включает экзон, кодирующий белок, который обладает активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1.
(6) Белок по пункту (a) или (b), представленный ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью фосфатазы фосфатидной кислоты; и
(b) белок, который состоит из аминокислотной последовательности, на 70% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью фосфатазы фосфатидной кислоты.
(7) Белок по пункту (a) или (b), представленный ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью фосфатазы фосфатидной кислоты; и
(b) белок, который состоит из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью фосфатазы фосфатидной кислоты.
(8) Белок по пункту (a) или (b), представленный ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1; и
(b) белок, который состоит из аминокислотной последовательности, на 70% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1.
(9) Белок по пункту (a) или (b), представленный ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1; и
(b) белок, который состоит из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1.
(10) Белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7.
(11) Рекомбинантный вектор, содержащий нуклеиновую кислоту по любому из пунктов от (1) до (5).
(12) Трансформант, трансформированный с помощью рекомбинантного вектора по пункту (11).
(13) Композиция жирной кислоты, содержащая жирную кислоту или липид, полученная с помощью культивирования трансформанта по пункту (12).
(14) Способ получения композиции жирной кислоты, характеризующийся получением жирной кислоты или липида из культуры, полученной с помощью культивирования трансформанта по пункту (12).
(15) Пищевой продукт, содержащий композицию жирной кислоты по пункту (13).
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
PAP по настоящему изобретению может усиливать способность продукции жирных кислот и резервных липидов в клетках, в которые вводят PAP, и предпочтительно может усиливать выработку полиненасыщенных жирных кислот в микроорганизмах или растениях.
Предполагают, что PAP по настоящему изобретению способствует продукции жирных кислот в клетке-хозяине, композиции жирных кислот, отличной от композиции жирных кислот, продуцируемой в клетке-хозяине, куда не вводят PAP. Это может обеспечивать липиды с заданными свойствами и эффектами и, таким образом, является полезным для применения при производстве, например, пищевых продуктов, косметики, фармацевтических продуктов и мыла.
КРАТКОЕ ОПИСАНИЕ ФИГУР
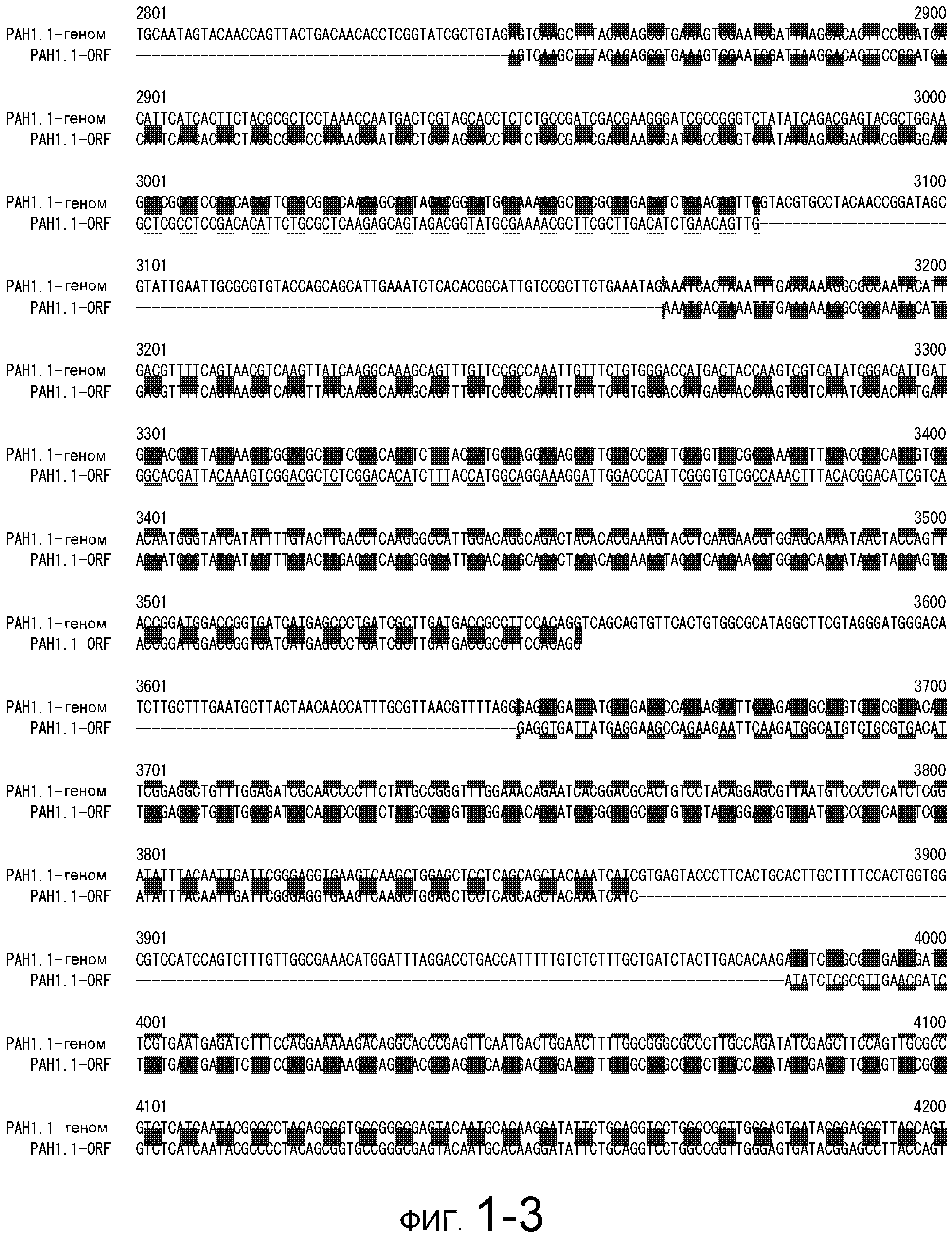
На фигуре 1-1 представлено сравнение между геномной последовательностью (SEQ ID NO: 5) и ORF (SEQ ID NO: 1) MaPAH1.1, полученных из штамма M. alpina 1S-4.
Фигура 1-2 является продолжением фигуры 1-1.
Фигура 1-3 является продолжением фигуры 1-2.
Фигура 1-4 является продолжением фигуры 1-3.
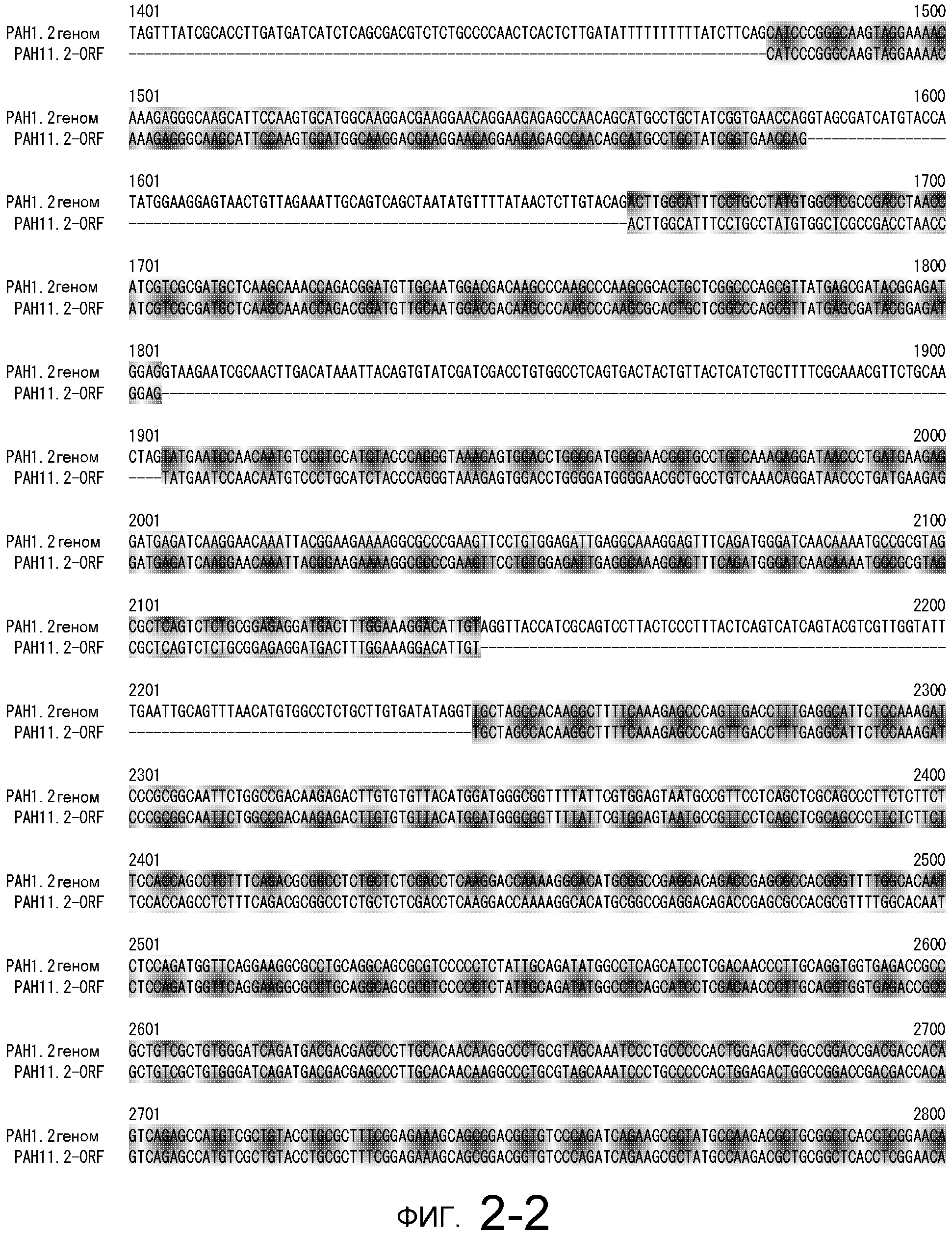
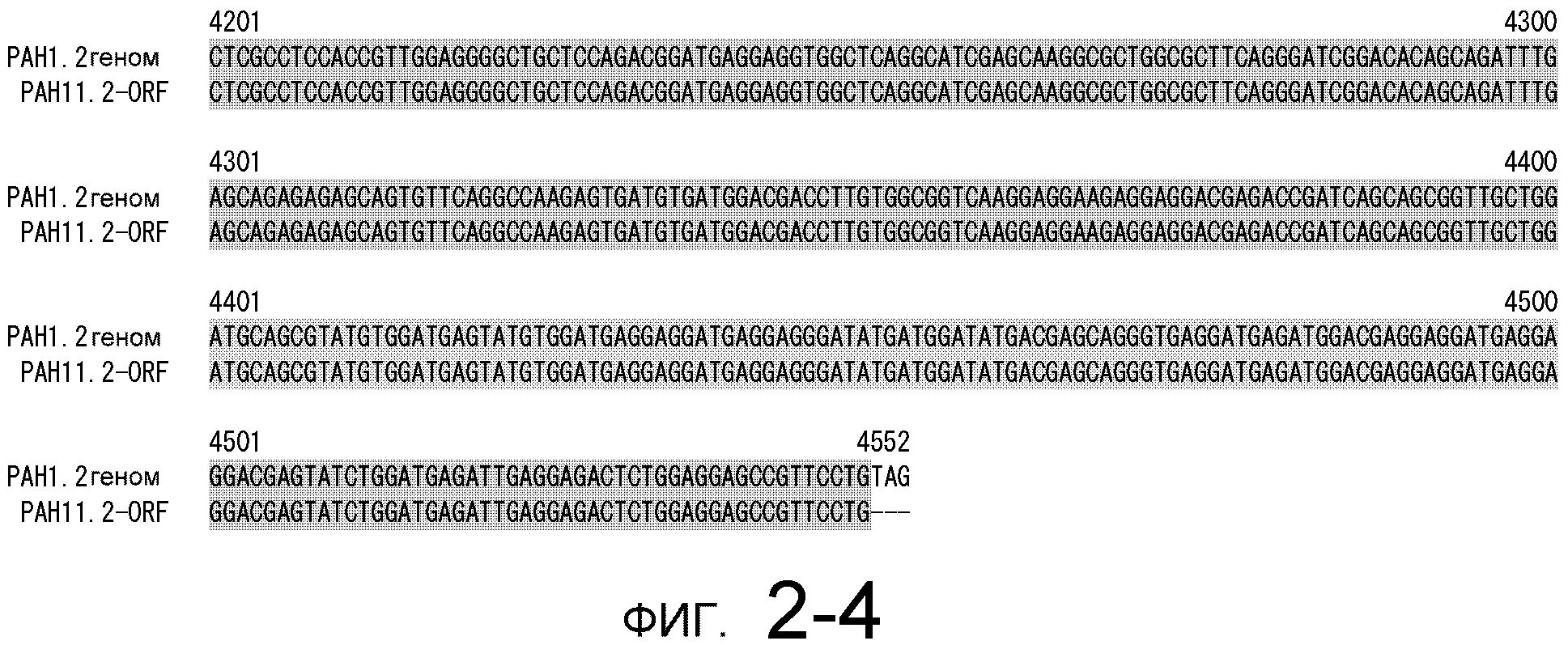
На фигуре 2-1 представлено сравнение между геномной последовательностью (SEQ ID NO: 10) и ORF (SEQ ID NO: 6) MaPAH1.2, полученных из штамма M. alpina 1S-4.
Фигура 2-2 является продолжением фигуры 2-1.
Фигура 2-3 является продолжением фигуры 2-2.
Фигура 2-4 является продолжением фигуры 2-3.
На фигуре 3-1 представлена кДНК (SEQ ID NO: 4) MaPAH1.1, полученная из штамма M. alpina 1S-4 и полученная на основании этого аминокислотная последовательность (SEQ ID NO: 2).
Фигура 3-2 является продолжением фигуры 3-1.
Фигура 3-3 является продолжением фигуры 3-2.
На фигуре 4-1 представлена кДНК (SEQ ID NO: 9) MaPAH1.2, полученная из штамма M. alpina 1S-4 и полученная на основании этого аминокислотная последовательность (SEQ ID NO: 7).
Фигура 4-2 является продолжением фигуры 4-1.
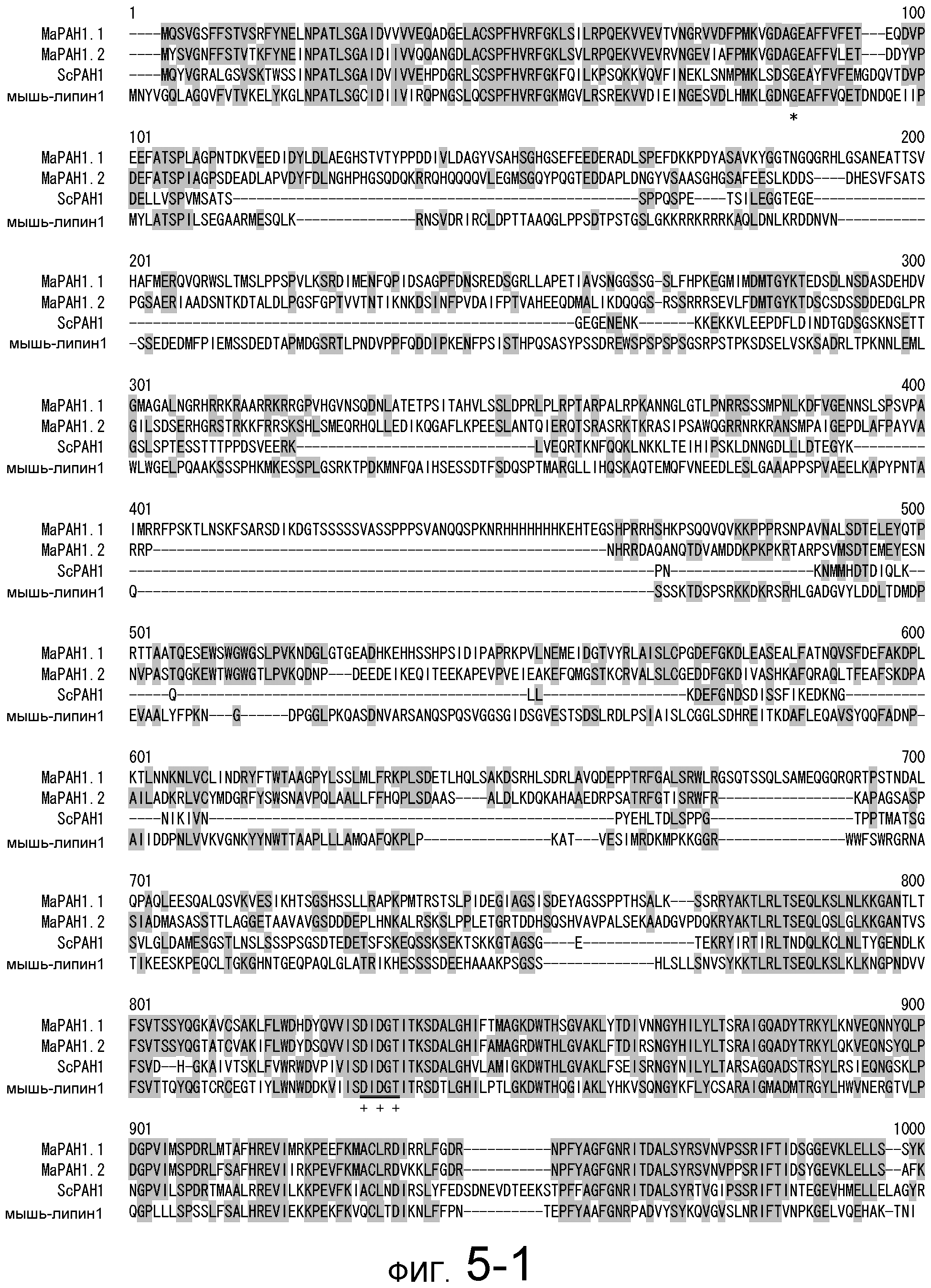
На фигуре 5-1 представлено сравнение полученной аминокислотной последовательности (SEQ ID NO: 2) MaPAH1.1 и полученной аминокислотной последовательности (SEQ ID NO: 7) MaPAH1.2, полученных из штамма M. alpina 1S-4, с фосфатазами фосфатидной кислоты семейства PAP1, белка ScPAH1 (SEQ ID NO: 19), полученного из дрожжей, Saccharomyces cerevisiae, и аминокислотной последовательности липина (SEQ ID NO: 20), полученной из мыши. В фосфатазах фосфатидной кислоты семейства PAP1 N-концевая область является достаточно консервативной и обозначена как липин, консервативная N-концевая область (pfam04571). В MaPAH1.1 и MaPAH1.2 N-концевая область также является достаточно консервативной. В этой последовательности присутствие остатка глицина, отмеченного с помощью ∗ (соответствующий 80-й аминокислоте из SEQ ID NO: 2 и 80-й аминокислоте из SEQ ID NO: 7), является необходимым для активности PAP. Последовательность, отмеченная двойным подчеркиванием (соответствующая от 819-й до 823-й аминокислотам из SEQ ID NO: 2 и от 737-й до 741-й аминокислоте из SEQ ID NO: 7), представляет собой мотив DXDX(T/V), присутствующий в дегалогеназе галогенокислоты (HAD)-подобном домене. Данный мотив также является консервативным в MaPAH1.1 и MaPAH1.2. Последовательности, находящиеся выше и ниже относительно мотива, также являются консервативными.
Фигура 5-2 является продолжением фигуры 5-1.
На фигуре 6-1 представлено сравнение последовательности CDS (SEQ ID NO: 3) MaPAH1.1 и последовательности CDS (SEQ ID NO: 8) MaPAH1.2, полученных из штамма M. alpina 1S-4.
Фигура 6-2 является продолжением фигуры 6-1.
Фигура 6-3 является продолжением фигуры 6-2.
На фигуре 7 представлено сравнение полученной аминокислотной последовательности (SEQ ID NO: 2) MaPAH1.1 с полученной аминокислотной последовательностью (SEQ ID NO: 7) MaPAH1.2, полученных из штамма M. alpina 1S-4.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому гену фосфатазы фосфатидной кислоты, полученному из рода Mortierella, где фосфатазы фосфатидной кислоты дефосфорилирует фосфатидную кислоту с образованием диацилглицерина.
По настоящему изобретению фосфатаза фосфатидной кислоты представляет собой фермент, катализирующий реакцию образования диацилглицерина при дефосфорилировании фосфатидной кислоты. Субстратом PAP по настоящему изобретению, как правило, является фосфатидная кислота, но ею не ограничены.
Нуклеиновая кислота, кодирующая фосфатазу фосфатидной кислоты по настоящему изобретению
Фосфатаза фосфатидной кислоты (PAP) по настоящему изобретению включает MaPAH1.1 и MaPAH1.2. Соответствия между кДНК, CDS и ORF, кодирующих MaPAH1.1 и MaPAH1.2, а также между полученными аминокислотными последовательностями, сведены в таблице 1.
|
Последовательности, относящиеся к MaPAH1.1 по настоящему изобретению, включают SEQ ID NO: 2, которая представляет собой аминокислотную последовательность MaPAH1.1; SEQ ID NO: 1, которая относится к последовательности области ORF MaPAH1.1; SEQ ID NO: 3, которая относится к последовательности области CDS MaPAH1.1; и SEQ ID NO: 4, которая представляет собой нуклеотидную последовательность кДНК для MaPAH1.1. Среди них SEQ ID NO: 3 соответствует нуклеотидам от 1 до 3985 из SEQ ID NO: 4, тогда как SEQ ID NO: 1 соответствует нуклеотидам от 1 до 3982 из SEQ ID NO: 4 и нуклеотидам от 1 до 3982 из SEQ ID NO: 3. SEQ ID NO: 5 представляет собой геномную нуклеотидную последовательность, кодирующую MaPAH1.1 по настоящему изобретению. Геномная последовательность из SEQ ID NO: 5 состоит из одиннадцати экзонов и десяти интронов. В SEQ ID NO: 5 области экзонов соответствуют нуклеотидам от 1 до 182, от 370 до 584, от 690 до 1435, от 1536 до 1856, от 1946 до 2192, от 2292 до 2403, от 2490 до 2763, от 2847 до 3077, от 3166 до 3555, от 3648 до 3862 и от 3981 до 5034.
Последовательности, относящиеся к MaPAH1.2 по настоящему изобретению, включают SEQ ID NO: 7, которая представляет собой аминокислотную последовательность MaPAH1.2; SEQ ID NO: 6, которая представляет собой последовательность области ORF MaPAH1.2; SEQ ID NO: 8, которая представляет собой последовательность области CDS MaPAH1.2, и SEQ ID NO: 9, которая представляет собой нуклеотидную последовательность кДНК MaPAH1.2. Среди них SEQ ID NO: 8 соответствует нуклеотидам 72-3791 SEQ ID NO: 9, тогда как SEQ ID NO: 6 соответствует нуклеотидам от 72 до 3788 SEQ ID NO: 9 и нуклеотидам от 1 до 3717 из SEQ ID NO: 8. SEQ ID NO: 10 представляет собой геномную нуклеотидную последовательность, кодирующую MaPAH1.2 по настоящему изобретению. Геномная последовательность из SEQ ID NO: 10 состоит из восьми экзонов и семи интронов. В SEQ ID NO: 10 область с экзонами соответствует нуклеотидам от 1 до 454, от 674 до 1006, от 1145 до 1390, от 1479 до 1583, от 1662 до 1804, от 1905 до 2143, от 2243 до 3409 и от 3520 до 4552.
Нуклеиновые кислоты по настоящему изобретению включают одноцепочечные и двухцепочечные ДНК, а также комплементарную им РНК, которая может быть либо природной, либо искусственно полученной. Примеры ДНК включают, но не ограничивают, геномные ДНК, кДНК, соответствующие геномным ДНК, химически синтезированные ДНК, амплифицированные с помощью ПЦР ДНК, их сочетания и гибриды ДНК/РНК.
Предпочтительные варианты осуществления для нуклеиновых кислот по настоящему изобретению включают (a) нуклеиновые кислоты, содержащие нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 6, (b) нуклеиновые кислоты, содержащие нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, (c) нуклеиновые кислоты, содержащие нуклеотидную последовательность, представленную в SEQ ID NO: 4 или SEQ ID NO: 9, и (d) нуклеиновые кислоты, содержащие нуклеотидную последовательность, представленную в SEQ ID NO: 5 или SEQ ID NO: 10.
Для получения данных нуклеотидных последовательностей можно использовать данные о нуклеотидной последовательности для EST или геномных ДНК из организмов с активностью PAP для поиска нуклеотидной последовательности, кодирующей белок, очень сходный с известными белками, обладающими активностью PAP. Предпочтительные организмы, обладающие активностью PAP, представляют собой продуцирующие липиды грибы, включая, в качестве неограничивающих примеров, M. alpina.
Для анализа EST сначала получали библиотеку кДНК. Библиотеку кДНК можно получать, руководствуясь «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)). Альтернативно, для получения библиотеки кДНК можно использовать коммерчески доступный набор. Примеры способа получения библиотеки кДНК, подходящей для настоящего изобретения, приведены ниже. То есть, подходящий штамм M. alpina, грибов, продуцирующих липиды, высевают на подходящую среду и предварительно культивируют в течение подходящего периода времени. Условиями культивирования, подходящими для указанного предварительного культивирования, являются, например, композиция среды из 1,8% глюкозы, 1% экстракта дрожжей и pH 6.0, время культивирования составляет от 3 до 4 суток, и температура культивирования 28°C. Продукты предварительного культивирования затем подвергают основному культивированию при подходящих условиях. Композиция среды, подходящей для основного культивирования, включает, например, 1,8% глюкозу, 1% соевый порошок, 0,1% оливковое масло, 0,01% Adekanol, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O и 0,05% MgCl2·6H2O и pH 6,0. Условиями культивирования, подходящими для основного культивирования, являются, например, аэрация и встряхивание культуры при 300 об/мин, 1 vvm и 26°C в течение 8 суток. В течение культивирования можно добавлять подходящее количество глюкозы. После культивирования продукт отбирают в подходящие моменты времени в течение основного культивирования, откуда собирают клетки для получения тотальной РНК. Тотальную РНК можно получать любым известным способом, таким как способ с помощью гуанидин гидрохлорида/CsCl. Из полученной в результате тотальной РНК, поли(A)+ РНК можно выделять с помощью коммерчески доступного набора, и библиотеку кДНК можно получать, используя коммерчески доступный набор. Нуклеотидную последовательность любого клона из полученной библиотеки кДНК определяют с помощью праймеров, сконструированных на основании вектора для определения нуклеотидной последовательности вставки. В результате можно получать EST. Например, при применении набора ZAP-cDNA GigapackIII Gold Cloning Kit (Stratagene Inc.) для получения библиотеки кДНК возможно прямое клонирование.
При анализе геномной ДНК культивируют клетки организма, обладающие активностью PAP, а геномную ДНК получают из клеток. Определяют нуклеотидную последовательность полученной геномной ДНК, и подвергают сборке определяемую нуклеотидную последовательность. В полученной в итоге последовательности суперконтига осуществляют поиск последовательности, кодирующей аминокислотную последовательность, обладающую высокой гомологией с аминокислотной последовательностью известного белка с активностью PAP. Из последовательности суперконтига, находимой в поиске как последовательность, кодирующая такую аминокислотную последовательность, получают праймеры. Проводили ПЦР, используя библиотеку кДНК в качестве матрицы, и полученный фрагмент ДНК вводили в плазмиду для клонирования. Для получения образца проводили ПЦР с использованием клонированной плазмиды в качестве матрицы и указанных выше праймеров. Используя полученные образцы, проводили скрининг библиотеки кДНК.
Поиск гомологии между полученными аминокислотными последовательностями из MaPAH1.1 и MaPAH1.2 по настоящему изобретению осуществляли с помощью программы BLASTp относительно аминокислотных последовательностей, зарегистрированных в GenBank. Данные полученные аминокислотные последовательности из MaPAH1.1 и MaPAH1.2 обладают преимуществом в отношении предполагаемого белка ядерной элонгации и деформации (AAW42851), полученного из Cryptococcus neoformans var. neoformans JEC21, с наивысшими показателями, и идентичность составила 25,9% и 26,6% соответственно. Полученные аминокислотные последовательности MaPAH1.1 и MaPAH1.2 по настоящему изобретению идентичны на 22,7% и 22,5% соответственно с аминокислотной последовательностью белка PAH1, полученного из S. cerevisiae (на всем протяжении описания, также обозначаемого как PAH1 дрожжей, или ScPAH1), который был функционально проанализирован среди гомологов PAP1 грибов.
Настоящее изобретение также включает нуклеиновые кислоты, которые функционально эквивалентны нуклеиновой кислоте, включая нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 6 (далее в настоящем документе также обозначаемую как «нуклеотидная последовательность по настоящему изобретению»), или нуклеотидные последовательности, кодирующие белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7 (далее в настоящем документе также обозначаемой как «аминокислотная последовательность по настоящему изобретению»). Термин «функционально эквивалентный» означает, что белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, и белок, состоящий из аминокислотной последовательности по настоящему изобретению, обладают активностью фосфатазы фосфатидной кислоты (PAP). Кроме того, термин «функционально эквивалентный» подразумевает активность, которая способствует усилению выработки диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1 при экспрессии белка, кодируемого нуклеотидной последовательностью по настоящему изобретению, или белка, состоящего из аминокислотной последовательности по настоящему изобретению. Активность белка по настоящему изобретению в отношении PAP и активность, способствующая усилению выработки DG и/или TG из PA в штамме дрожжей с дефицитом PAH1, может быть Mg2+-зависимой или Mg2+-независимой. Активность белка по настоящему изобретению предпочтительно является Mg2+-зависимой.
Определенные нуклеиновые кислоты, являющиеся функционально эквивалентными в отношении нуклеиновых кислот по настоящему изобретению, включают нуклеиновые кислоты, содержащие нуклеотидные последовательности, представленные ниже в любом из от (a) до (g). Следует отметить, что в описаниях нуклеотидных последовательностей, перечисленных ниже, термин «активность по настоящему изобретению» относится к «активности PAP и/или активности, которая усиливает выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1».
(a) Нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в составе нуклеиновой кислоты по настоящему изобретению, относится к нуклеотидным последовательностям, кодирующим белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладает активностью по настоящему изобретению.
В частности, нуклеотидная последовательность, содержащаяся в составе нуклеиновой кислоты по настоящему изобретению, представляет собой нуклеотидную последовательность, кодирующую белок с описанной выше активностью по настоящему изобретению и состоящую из:
(i) аминокислотной последовательности с делецией одной или более (предпочтительно от одной до нескольких (например, от 1 до 400, от 1 до 200, от 1 до 130, от 1 до 100, от 1 до 75, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(ii) аминокислотной последовательности с заменой одной или более (предпочтительно от одной до нескольких (например, от 1 до 400, от 1 до 200, от 1 до 130, от 1 до 100, от 1 до 75, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(iii) аминокислотной последовательности с добавлением одной или более (предпочтительно от одной до нескольких (например, от 1 до 400, от 1 до 200, от 1 до 130, от 1 до 100, от 1 до 75, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7; или
(iv) аминокислотной последовательности в любой комбинации из от (i) до (iii), описанных выше.
Среди перечисленного выше, замены предпочтительно являются консервативными, что обозначает замену конкретного аминокислотного остатка другим остатком со сходными физическими и химическими свойствами. Это может быть любая замена, которая существенным образом не изменяет структурных свойств оригинальной последовательности. Например, возможна любая замена при условии, что замещаемые аминокислоты не нарушают спиральную структуру оригинальной последовательности или не разрушают любой другой тип вторичной структуры, характеризующей оригинальную последовательность.
Консервативную замену, как правило, вводят посредством синтеза с помощью биологической системы или химического пептидного синтеза, предпочтительно с помощью химического пептидного синтеза. В подобных случаях замещающая группа может включать искусственный аминокислотный остаток, пептидомиметик или обращенную или инвертированную форму, где область без замены в аминокислотной последовательности обращена или инвертирована.
Неограничивающие примеры взаимозаменяемых аминокислотных остатков систематизированы и перечислены ниже:
Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутановая кислота, метионин, O-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин;
Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота;
Группа C: аспарагин и глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминобутановая кислота и 2,3-диаминопропионовая кислота;
Группа E: пролин, 3-гидроксипролин и 4-гидроксипролин;
Группа F: серин, треонин и гомосерин; и
Группа G: фенилаланин и тирозин.
При неконсервативных заменах возможно замещение одного элемента из указанного выше класса элементом из другого класса. В данном случае для поддержания биологической функции белка по настоящему изобретению предпочтительно учитывают индексы гидрофобности аминокислот (индекс гидрофобности аминокислоты) (Kyte, et al., J. Mol. Biol., 157: 105-131 (1982)).
В случае неконсервативной замены, замены аминокислот можно осуществлять на основании гидрофильности.
Необходимо обратить внимание, что как при консервативной замене, так и при неконсервативной замене, аминокислотным остатком, соответствующим 80-й аминокислоте в SEQ ID NO: 2 или SEQ ID NO: 7, предпочтительно является глицин, а областью, соответствующей аминокислотам от 819 до 823 из SEQ ID NO: 2, или аминокислотам от 737 до 741 из SEQ ID NO: 7, предпочтительно является DXDX(T/V) (X является любой аминокислотой).
На всем протяжении описания и фигур нуклеотиды, аминокислоты и их аббревиатуры представлены согласно комиссии по биохимической номенклатуре IUPAC-IUB или любой другой стандартной номенклатуре, используемой в данной области, например, как описано в Immunology--A Synthesis (second edition, edited by E.S. Golub и D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Кроме того, предполагают, что аминокислоты, которые могут иметь оптические изомеры, представлены в виде L-изомеров, если не указано иначе.
Стереоизомеры, такие как D-аминокислоты указанных выше аминокислот, искусственных аминокислот, таких как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нестандартные аминокислоты, также могут быть членами, образующими белки по настоящему изобретению.
Необходимо отметить, что при обозначении белка на всем протяжении описания, левосторонним направлением является аминоконцевое направление, а правосторонним направлением является карбоксиконцевое направление, в соответствии со стандартным применением и условным обозначением в данной области.
Аналогично, в основном, если не указано иначе, левосторонним концом одноцепочечных полинуклеотидных последовательностей является 5'-конец, а левостороннее направление двухцепочечных полинуклеотидных последовательностей обозначают как 5'-направление.
Специалисты в данной области компетентны в области дизайна и получения подходящих мутантных белков, описанных в описании, с помощью применения известных в данной области способов. Например, область в молекуле белка, пригодную для изменения структуры без изменения биологической активности белка по настоящему изобретению, можно идентифицировать с помощью выявления области, которая, по-видимому, является менее важной для осуществления биологической активности белка. Также можно определять остатки или области, являющиеся консервативными между похожими белками. Кроме того, также можно вводить консервативную аминокислотную замену в область, которая, по-видимому, важна для осуществления биологической активности или структуры белка по настоящему изобретению, без изменения биологической активности белка и без неблагоприятного воздействия на полипептидную структуру белка.
В частности, в аминокислотных последовательностях MaPAH1.1 и MaPAH1.2, аминокислотных последовательностях из приблизительно 100 аминокислот в N-концевой области, обозначаемой как липин, N-концевая консервативная область: pfam04571) в отношении семейства ферментов Mg2+-зависимой фосфатазы фосфатидной кислоты (PAP1), является достаточно консервативной. Кроме того, каждая из аминокислотных последовательностей MaPAH1.1 и MaPAH1.2 обладает «мотивом каталитического сайта DXDX(T/V)», который является консервативным мотивом дегалогеназы галогенокислоты (HAD)-подобного белка суперсемейства ферментов. На фигуре 5 данным мотивам соответствуют последовательности DIDGT (соответствующие остаткам от 819 до 823 из SEQ ID NO: 2 и остаткам от 737 до 741 из SEQ ID NO: 7), отмеченные двойным подчеркиванием. В качестве мутантов по настоящему изобретению может быть любой мутант, который сохраняет консервативный мотив и поддерживает описанную выше активность. Сообщали, что изменения в сайте консервативного мотива в PAP1 дрожжей приводят к потере активности PAP (J. Biol. Chem., 282 (51): 37026-37035, (2007)).
Специалисты в данной области могли бы осуществить так называемое структурно-функциональное исследование, которое позволит выявить остатки пептида, являющиеся важными в отношении биологической активности или структуры белка по настоящему изобретению, и остатки пептида, сходные с остатками в белке, позволит осуществить сравнение аминокислотных остатков между двумя данными пептидами, и, таким образом, предсказать, какой остаток в белке, похожем на белок по настоящему изобретению, является аминокислотным остатком, соответствующим важному аминокислотному остатку в отношении биологической активности или структуры. Кроме того, с помощью выбора замещающей аминокислоты, химически схожей с предсказываемым аминокислотным остатком, можно выбрать мутанта, который поддерживает биологическую активность белка по настоящему изобретению. Аналогично, специалисты в данной области также могли бы проанализировать пространственную структуру и аминокислотную последовательность данного мутантного белка. Таким образом, полученные результаты анализа в дальнейшем можно использовать для предсказания выравнивания аминокислотных остатков, включенных в пространственную структуру белка. Поскольку аминокислотные остатки, для которых было предсказано нахождение на поверхности белка, могут быть вовлечены в важные взаимодействия с другими молекулами, специалисты в данной области могли бы получить мутанта, в котором не происходит замены в данных аминокислотных остатках, для которых было предсказано нахождение на поверхности белка, на основании анализа результатов, как указано выше. Кроме того, специалисты в данной области могли бы получить мутанта с заменой единственной аминокислоты на любой из аминокислотных остатков, формирующих белок по настоящему изобретению. Данные мутанты могут быть отобраны с помощью любого из известных анализов для сбора информации об отдельных мутантах, который, в свою очередь, позволяет оценивать практическую ценность отдельных аминокислотных остатков, формирующих белок по настоящему изобретению посредством сравнения случая, где мутант с заменой специфического аминокислотного остатка проявляет более низкую биологическую активность, чем биологическая активность белка по настоящему изобретению, случая, где данный мутант не проявляет биологическую активность или где данный мутант проявляет неприемлемую активность, которая приводит к ингибированию биологической активности белка по настоящему изобретению. Кроме того, на основании полученной информации после отдельных рутинных экспериментов или в сочетании с другими мутациями, специалисты в данной области могут без труда проанализировать замены аминокислот, являющихся нежелательными для мутантов белка по настоящему изобретению.
Как описано выше, белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, можно получать способами, такими как сайт-направленный мутагенез, как описано, например, в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)); «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997); Kunkel, (1985), Proc. Natl. Acad. Sci. USA, 82: 488-92; или Kunkel, (1988), Method Enzymol., 85: 2763-6. Получение мутанта с данной мутацией, включающей делецию, замену или добавление аминокислоты, можно осуществлять, например, с помощью известных способов, таких как способ по Кункелю или способ с внесением разрывов в двойную цепь ДНК, способ с применением набора для внесения мутаций на основе сайт-направленного мутагенеза, такого как набор QuikChangeTM Site-Directed Mutagenesis Kit (производства Stratagene), системы для осуществления сайт-направленного мутагенеза GeneTailorTM (производства Invitrogen) или системы для осуществления сайт-направленного мутагенеза TaKaRa (например, Mutan-K, Mutan-Super Express Km; производства Takara Bio Inc.).
Способы, позволяющие осуществлять делецию, замену или добавление одной или более аминокислот в аминокислотную последовательность белка при поддержании его активности, включают, в дополнение к указанному выше сайт-направленному мутагенезу, способ обработки гена мутагеном и способ селективного расщепления гена и удаления, замещения или добавления выбранного нуклеотида, а затем лигирования гена.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте по настоящему изобретению является предпочтительно нуклеотидной последовательностью, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью PAP.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте по настоящему изобретению, предпочтительно включает нуклеотидные последовательности, которые кодируют белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающий активностью по настоящему изобретению.
Количество сайтов с мутациями, приводящими к замене аминокислот, или модификаций в белке по настоящему изобретению не ограничены при условии поддержания активности PAP или активности, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1.
Активность PAP или активность, усиливающая выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1, можно оценивать с помощью известных способов, например, смотри J. Biol. Chem., 273, 14331-14338 (1998).
Например, «активность PAP» по настоящему изобретению можно измерять как описано ниже: Исходный раствор фермента получают с помощью разрушения трансформированных клеток, экспрессирующих PAP по настоящему изобретению, центрифугирования лизата и сбора супернатанта. Полученный исходный раствор фермента в дальнейшем можно подвергать очистке PAP по настоящему изобретению. Исходный раствор фермента, содержащий PAP по настоящему изобретениюили очищенный PAP по настоящему изобретению, добавляют в раствор для проведения реакции, содержащий 0,5 мМ фосфатидную кислоту, 10 мМ 2-меркаптоэтанол и 50 мМ Tris-HCl (pH 7,5), с последующим проведением реакции при от 25°C до 28°C в течение подходящего времени. Реакцию останавливают с помощью добавления смеси хлороформа и метанола, и выделяют липиды. Полученные липиды фракционируют с помощью тонкослойной хроматографии для измерения количества полученного диацилглицерина.
«Активность, усиливающая выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1» можно измерять, например, как описано ниже: штамм дрожжей с дефицитом PAH1 получают посредством разрушения гена дрожжей (S. cerevisiae) ScPAH1. Штамм дрожжей с дефицитом PAH1 в качестве клетки-хозяина, трансформируют с помощью вектора, содержащего нуклеиновую кислоту, кодирующую PAP по настоящему изобретению, и осуществляют культивирование трансформированного штамма. Раствор культуры центрифугируют для сбора клеток. Клетки промывают водой и лиофилизируют. К высушенным клеткам добавляют хлороформ и метанол и разрушают клетки с помощью стеклянных бусин для выделения липидов. Выделенные липиды фракционируют с помощью тонкослойной хроматографии и измеряют количество выработанного DG и/или TG. Штамм дрожжей с дефицитом PAH1, трансформированный вектором, не содержащим нуклеиновую кислоту, кодирующую PAP по настоящему изобретению, используют в качестве контроля для сравнения. Если количество выработанного DG и/или TG возрастает в штамме дрожжей с дефицитом PAH1, трансформированном вектором, содержащим нуклеиновую кислоту, кодирующую PAP по настоящему изобретению, то PAP определяют как PAP с «активностью, усиливающей выработку DG и/или TG из PA в штамме дрожжей с дефицитом PAH1».
(b) Нуклеиновая кислота, которая содержит нуклеотидную последовательность, способную гибридизоваться с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, при строгих условиях, и кодирует белок, обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте по настоящему изобретению, относится к нуклеотидной последовательности, которая может гибридизоваться с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, при строгих условиях, и кодирует белок, обладающий активностью по настоящему изобретению.
Данную нуклеотидную последовательность можно получать, например, с помощью библиотеки кДНК или геномной библиотеки с помощью известных способов гибридизации, таких как гибридизация колоний, гибридизация бляшек или блоттинг по Саузерну с использованием образцов, полученных из подходящего фрагмента, способом, известным специалистам в данной области.
Подробный способ гибридизации упоминают в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001), в частности, главы 6 и 7), «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997), в частности, главы 6.3 и 6.4), и «DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.» (Oxford University (1995), в частности, глава 2.10 для условий гибридизации).
Строгость условий гибридизации определяют, главным образом, на основании условий гибридизации, более предпочтительно на основании условий гибридизации и условий промывания. Термин «строгие условия», применяемый на всем протяжении описания, предполагает включение умеренно или высоко строгих условий.
В частности, примеры умеренно строгих условий включают условия гибридизации от 1×SSC до 6×SSC при от 42°C до 55°C, более предпочтительно от 1×SSC до 3×SSC при от 45°C до 50°C и наиболее предпочтительно 2×SSC при 50°C. В случае гибридизации с использованием раствора, содержащего, например, приблизительно 50% формамида, применяют температуру гибридизации на от 5°C до 15°C ниже, чем температура, указанная выше. Условия промывания, например, от 0,5×SSC до 6×SSC при от 40°C до 60°C. К раствору для гибридизации и раствору для промывания обычно можно добавлять от 0,05% до 0,2% SDS, предпочтительно приблизительно 0,1% SDS.
Высоко строгие (жесткие условия) включают гибридизацию и/или промывание при высокой температуре и/или более низкой концентрации соли по сравнению с умеренно строгими условиями. Примеры условий гибридизации включают от 0,1×SSC до 2×SSC при от 55°C до 65°C, более предпочтительно от 0,1×SSC до 1×SSC при от 60°C до 65°C и наиболее предпочтительно 0,2×SSC при 63°C. Условия промывания подразумевают, например, от 0,2×SSC до 2×SSC при от 50°C до 68°C и более предпочтительно 0,2×SSC при от 60°C до 65°C.
Примеры условий гибридизации, в частности, применяемые в настоящем изобретении, включают, но не ограничивают, предварительную гибридизацию в 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5) и 50% формамиде, инкубацию при 42°C, инкубацию в течение ночи при 42°C в присутствии зонда для образования гибридов и трехкратное промывание в 0,2×SSC, 0,1% SDS при 65°C в течение 20 минут.
Также возможно применение коммерчески доступного набора для гибридизации, в котором не используют радиоактивное соединение в качестве зонда. В частности, для гибридизации применяют, например, набор DIG nucleic acid detection kit (Roche Diagnostics) или ECL direct labeling & detection system (производство Amersham).
Предпочтительные примеры нуклеотидной последовательности, включенные в настоящее изобретение, включают нуклеотидные последовательности, которые могут быть гибридизованы с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, в условиях 2×SSC при 50°C, и кодируют белок, обладающий активностью PAP.
(c) Нуклеиновая кислота, содержащая нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирующая белок, обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте настоящего изобретения, относится к нуклеотидным последовательностям, которые состоят из нуклеотидной последовательности, по меньшей мере, на 70% идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодируют белок, обладающий активностью по настоящему изобретению.
Предпочтительно, например, что нуклеиновая кислота включает нуклеотидную последовательность, идентичную, по меньшей мере, на 75%, более предпочтительно на 80% или более (например, 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95%, 98% или 99% или более) нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирует белок, обладающий активностью по настоящему изобретению.
Процент сходства между двумя нуклеотидными последовательностями можно определять с помощью визуальной оценки и математического расчета, но предпочтительно определять посредством сравнения информации о последовательностях двух нуклеиновых кислот, используя компьютерную программу. В качестве компьютерных программ для сравнения последовательностей можно использовать, например, программу BLASTN (Altschul et al., (1990), J. Mol. Biol., 215: 403-10) версия 2.2.7, доступная через Национальную Медицинскую Библиотеку, веб-сайт: http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html, или алгоритм WU-BLAST 2.0. Стандартные параметры по умолчанию для WU-BLAST 2.0 описаны на указанном интернет-сайте: http://blast.wustl.edu.
(d) Нуклеиновая кислота, содержащая нуклеотидную последовательность, которая кодирует аминокислотную последовательность, на 70% или более идентичную аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирует белок, обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте настоящего изобретения, относится к нуклеотидным последовательностям, кодирующим аминокислотную последовательность, на 70% или более идентичную аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирует белок, обладающий активностью по настоящему изобретению. В качестве белка, кодируемого нуклеиновой кислотой по настоящему изобретению, может быть белок, обладающий сходством аминокислотной последовательности с аминокислотными последовательностями MaPAH1.1 или MaPAH1.2 при условии, что белок является функционально эквивалентным белку, обладающему активностью по настоящему изобретению.
Конкретные примеры белка включают аминокислотные последовательности, на 75% или более, предпочтительно на 80% или более, более предпочтительно на 85% или более и наиболее предпочтительно на 90% или более (например, на 95% или более, кроме того, на 98% или более) идентичные аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислота по настоящему изобретению, предпочтительно является нуклеотидной последовательностью, кодирующей аминокислотную последовательность, на 90% или более идентичную аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирующей белок, обладающий активностью по настоящему изобретению. Более предпочтительно нуклеотидная последовательность кодирует аминокислотную последовательность, на 95% или более идентичную аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и кодирует белок, обладающий активностью по настоящему изобретению.
Процент сходства между двумя аминокислотными последовательностями можно определять с помощью визуальной оценки и математического расчета или можно определять с использованием компьютерной программы. Примеры такой компьютерной программы включают BLAST, FASTA (Altschul et al., J. Mol. Biol., 215: 403-410, (1990)) и ClustalW. В частности, различные условия (параметры) для поиска сходства с помощью программы BLAST описаны Altschul et al. (Nucl. Acids. Res., 25, pp. 3389-3402, 1997) и являются общедоступными через веб-сайт Национального Центра Биотехнологической Информации (NCBI) США или в базе данных ДНК Японии (DDBJ) (руководство по BLAST, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Также можно применять такие программы, как программное обеспечение GENETYX Ver. 7 (Genetyx Corporation), DINASIS Pro (Hitachisoft) или Vector NTI (Infomax) для обработки генетической информации для определения процента идентичности.
Конкретный алгоритм выравнивания для выравнивания множества аминокислотных последовательностей может также отобразить соответствие последовательностей по специфическим коротким областям и, таким образом, может выявлять область с очень высоким сходством последовательностей в данных коротких областях, даже если между полноразмерными последовательностями нет значимого сходства. Кроме того, алгоритм BLAST может использовать матрицу замен аминокислот BLOSUM62, и можно использовать следующие параметры разделения: (A) включение фильтров для маскировки сегмента анализируемой последовательности, имеющего низкую композиционную сложность (как определено программой SEG от Wootton and Federhen (Computers and Chemistry, 1993); также смотри Wootton and Federhen, 1996, «Analysis of compositionally biased regions in sequence databases», Methods Enzymol., 266: 554-71) или для маскировки сегментов, состоящих из внутренних повторов с низкой повторяемостью (как определено программой XNU от Claverie and States (Computers and Chemistry, 1993), и (B) порог статистической значимости для выявления соответствий относительно последовательностей из базы данных, или ожидаемая вероятность соответствия, найденного только лишь случайным образом, согласно статистической модели E-score (Karlin and Altschul, 1990); если статистическая значимость, приписываемая соответствию, больше, чем заданный порог для E-score, то соответствие не наблюдают.
(e) Нуклеиновая кислота, включающая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, при строгих условиях, и кодирует белок, обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте по настоящему изобретению, относится к нуклеотидным последовательностям, которые могут быть гибридизованы с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, при строгих условиях, и кодируют белок, обладающий активностью по настоящему изобретению.
Белок, состоящий из аминокислотной последовательности, представлен в SEQ ID NO: 2 или SEQ ID NO: 7, а условия гибридизации описаны выше. Примеры нуклеотидной последовательности, содержащейся в нуклеиновой кислоте по настоящему изобретению, включают нуклеотидные последовательности, которые могут быть гибридизованы с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, при строгих условиях, и кодируют белок, обладающий активностью по настоящему изобретению.
(f) Нуклеиновая кислота, содержащая нуклеотидную последовательность, которая может быть гибридизована с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, при строгих условиях, и включает экзон, кодирующий белок, обладающий активностью по настоящему изобретению.
Нуклеотидные последовательности, представленные в SEQ ID NO: 5 и SEQ ID NO: 10, являются последовательностями геномных ДНК, кодирующих MaPAH1.1 и MaPAH1.2 по настоящему изобретению соответственно.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте настоящего изобретения, относится к нуклеотидным последовательностям, которые могут быть гибридизованы с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, при строгих условиях, и включают экзон, кодирующий белок, обладающий активностью по настоящему изобретению.
Данную нуклеотидную последовательность можно получать способами, известными специалистам в данной области, например, из геномной библиотеки с помощью известного способа гибридизации, такого как гибридизация колоний, гибридизация бляшек или блоттинг по Саузерну с использованием зондов, полученных с помощью подходящего фрагмента. Условия гибридизации описаны выше.
(g) Нуклеиновая кислота, содержащая нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, на 70% или более идентичной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и включает экзон, кодирующий белок, обладающий активностью по настоящему изобретению.
Нуклеотидная последовательность, содержащаяся в нуклеиновой кислоте по настоящему изобретению, относится к нуклеотидным последовательностям, которые состоят из нуклеотидной последовательности с идентичностью, по меньшей мере, на 70% с нуклеотидной последовательностью, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и кодирует белок, обладающий активностью по настоящему изобретению. Предпочтительные примеры нуклеотидной последовательности включают последовательности, обладающие сходством, по меньшей мере, на 75%, более предпочтительно на 80% или более (например, на 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95%, на 98% или на 99% или более) с нуклеотидной последовательностью, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и содержащие экзон, кодирующий белок, обладающий активностью по настоящему изобретению. Процент сходства между двумя нуклеотидными последовательностями можно определять как описано выше.
Последовательность геномной ДНК из SEQ ID NO: 5 состоит из одиннадцати экзонов и десяти интронов. В SEQ ID NO: 5 области с экзонами соответствуют нуклеотидам от 1 до 182, от 370 до 584, от 690 до 1435, от 1536 до 1856, от 1946 до 2192, от 2292 до 2403, от 2490 до 2763, от 2847 до 3077, от 3166 до 3555, от 3648 до 3862 и от 3981 до 5034. Последовательность геномной ДНК из SEQ ID NO: 10 состоит из восьми экзонов и семи интронов. В SEQ ID NO: 10 области с экзонами соответствуют нуклеотидам от 1 до 454, от 674 до 1006, от 1145 до 1390, от 1479 до 1583, от 1662 до 1804, от 1905 до 2143, от 2243 до 3409 и от 3520 до 4552.
В другом варианте осуществления примеры нуклеотидной последовательности, содержащейся в нуклеиновой кислоте по настоящему изобретению, включают нуклеотидные последовательности, включающие области с интронами с нуклеотидной последовательностью, на 100% идентичной последовательности геномной ДНК, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, а области с экзонами обладают нуклеотидной последовательностью, идентичной, по меньшей мере, на 70% или более, более предпочтительно на 75% или более и более предпочтительно на 80% или более (например, на 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95%, на 98% или на 99% или более) последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, где экзон кодирует белок, обладающий активностью по настоящему изобретению.
В другом варианте осуществления примеры нуклеотидной последовательности, содержащейся в нуклеиновой кислоте по настоящему изобретению, включают нуклеотидные последовательности, включающие области с экзонами с нуклеотидной последовательностью, на 100% идентичной последовательности геномной ДНК, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и области с интронами с нуклеотидной последовательностью, идентичной, по меньшей мере, на 70% или более, более предпочтительно на 75% или более и более предпочтительно на 80% или более (например, на 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95%, 98% или 99% или более) последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, где области с интронами могут быть вырезаны посредством сплайсинга, и, таким образом, области с экзонами лигируются, кодируя белок, обладающий активностью по настоящему изобретению.
В другом варианте осуществления примеры нуклеотидной последовательности, содержащейся в нуклеиновой кислоте по настоящему изобретению, включают нуклеотидные последовательности, включающие области с интронами с нуклеотидной последовательностью, идентичной, по меньшей мере, на 70% или более, более предпочтительно на 75% или более и более предпочтительно на 80% или более (например, на 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95%, 98% или 99% или более) последовательности геномной ДНК, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, и области с экзонами с нуклеотидной последовательностью, идентичной, по меньшей мере, на 70% или более, более предпочтительно на 75% или более и более предпочтительно на 80% или более (например, на 85% или более, более предпочтительно на 90% или более и наиболее предпочтительно на 95% или более, на 98% или более или на 99% или более) последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, где области с интронами могут быть вырезаны посредством сплайсинга, и, таким образом, области с экзонами лигируются, кодируя белок, обладающий активностью по настоящему изобретению.
Процент сходства между двумя нуклеотидными последовательностями можно определять способом, описанным выше.
Нуклеиновая кислота по настоящему изобретению относится к нуклеиновым кислотам, каждая из которых состоит из нуклеотидной последовательности с делецией, заменой или добавлением одного или более нуклеотидов в нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и кодирует белок, обладающий активностью по настоящему изобретению. Более конкретно, нуклеиновая кислота для применения включает одну любую из следующих нуклеотидных последовательностей:
(i) нуклеотидная последовательность с делецией одного или более (предпочтительно от одного до нескольких (например, от 1 до 1200, от 1 до 1000, от 1 до 750, от 1 до 500, от 1 до 400, от 1 до 300, от 1 до 250, от 1 до 200, от 1 до 150, от 1 до 100, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6;
(ii) нуклеотидная последовательность с заменой одного или более (предпочтительно от одного до нескольких (например, от 1 до 1200, от 1 до 1000, от 1 до 750, от 1 до 500, от 1 до 400, от 1 до 300, от 1 до 250, от 1 до 200, от 1 до 150, от 1 до 100, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6;
(iii) нуклеотидная последовательность с добавлением одного или более (предпочтительно от одного до нескольких (например, от 1 до 1200, от 1 до 1000, от 1 до 750, от 1 до 500, от 1 до 400, от 1 до 300, от 1 до 250, от 1 до 200, от 1 до 150, от 1 до 100, от 1 до 50, от 1 до 30, от 1 до 25, от 1 до 20 или от 1 до 15, более предпочтительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6; или
(iv) нуклеотидная последовательность с любой комбинацией из от (i) до (iii) выше, где нуклеотидная последовательность кодирует белок, обладающий активностью по настоящему изобретению.
Предпочтительный вариант осуществления нуклеиновой кислоты по настоящему изобретению также включает нуклеиновые кислоты, содержащие фрагмент нуклеотидной последовательности, представленной в любом одном из от (a) до (d), представленных ниже:
(a) нуклеотидная последовательность, представленная в SEQ ID NO: 1 или SEQ ID NO: 6;
(b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(c) нуклеотидная последовательность, представленная в SEQ ID NO: 4 или SEQ ID NO: 9; и
(d) нуклеотидная последовательность, представленная в SEQ ID NO: 5 или SEQ ID NO: 10.
(A) Нуклеотидная последовательность, представленная в SEQ ID NO: 1 или SEQ ID NO: 6, (b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и (c) нуклеотидная последовательность, представленная в SEQ ID NO: 4 или SEQ ID NO: 9, представлены как указано в таблице 1. Нуклеотидная последовательность, представленная в SEQ ID NO: 5 или SEQ ID NO: 10, также описана выше. Фрагментами данных последовательностей являются ORF, CDS, биологически активная область, область для применения в качестве праймера, как описано далее, и область, которая может служить в качестве зонда, содержащегося в данных нуклеотидных последовательностях, и могут быть природного происхождения или получены искусственно.
Нуклеиновая кислота по настоящему изобретению относится к перечисленным ниже нуклеиновым кислотам.
(1) Нуклеиновые кислоты, представленные в одном любом из от (a) до (g) ниже:
(a) нуклеиновые кислоты, содержащие нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(b) нуклеиновые кислоты, которые могут быть гибридизованы с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, при строгих условиях;
(c) нуклеиновые кислоты, содержащие нуклеотидную последовательность, на 70% или более идентичную нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6;
(d) нуклеиновые кислоты, содержащие нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, на 70% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(e) нуклеиновые кислоты, подлежащие гибридизации с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, при строгих условиях;
(f) нуклеиновые кислоты, подлежащие гибридизации с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, при строгих условиях; и
(g) нуклеиновые кислоты, содержащие нуклеотидную последовательность, на 70% или более идентичную нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10.
(2) Нуклеиновые кислоты, описанные в (1) выше, представленные в любом от (a) до (g) ниже:
(a) нуклеиновые кислоты, содержащие нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением из от 1 до 130 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(b) нуклеиновые кислоты, подлежащие гибридизации с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, в условиях 2×SSC при 50°C;
(c) нуклеиновые кислоты, содержащие нуклеотидную последовательность, на 90% или более идентичную с нуклеотидной последовательностью, представленной в SEQ ID NO: 1 или SEQ ID NO: 6;
(d) нуклеиновые кислоты, содержащие нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(e) нуклеиновые кислоты, подлежащие гибридизации с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, в условиях 2×SSC при 50°C;
(f) нуклеиновые кислоты, подлежащие гибридизации с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10, в условиях 2×SSC при 50°C; и
(g) нуклеиновые кислоты, содержащие нуклеотидную последовательность, на 90% или более идентичную нуклеотидной последовательности, представленной в SEQ ID NO: 5 или SEQ ID NO: 10.
Фосфатаза фосфатидной кислоты по настоящему изобретению
Белок по настоящему изобретению включает белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и белки, функционально эквивалентные данному белку. Данные белки могут быть природного происхождения или получены искусственным образом. Белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, описан выше. Термин «функционально эквивалентные белки» относится к белкам, обладающим «активностью по настоящему изобретению», описанной выше в «нуклеиновой кислоте, кодирующей фосфатазу фосфатидной кислоты по настоящему изобретению».
В настоящем изобретении, примеры белков, являющихся функционально эквивалентными белку, состоящему из аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, включают белки, представленные ниже в (a) и (b):
(a) белки, состоящие из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающие активностью по настоящему изобретению; и
(b) белки, состоящие из аминокислотной последовательности, на 70% или более идентичные аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, и обладающие активностью по настоящему изобретению.
В указанном выше, аминокислотная последовательность с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7, или аминокислотная последовательность, на 70% или более идентичная аминокислотной последовательности, представленной в SEQ ID NO: 2, описаны выше в «нуклеиновой кислоте, кодирующей фосфатазу фосфатидной кислоты по настоящему изобретению». «Белок, обладающий активностью по настоящему изобретению» включает мутантные белки, кодируемые нуклеиновой кислотой, содержащей нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 6; белки с мутациями, вызванными различными типами модификаций, таких как делеция, замена и добавление одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7; данные модифицированные белки обладают, например, модифицированными боковыми цепями аминокислот; и данные белки, слитые с другими белками, где данные белки обладают активностью PAP и/или активностью, которая усиливает выработку диацилглицерина (DG) и/или триглицерида (TG) из фосфатидной кислоты (PA) в штамме дрожжей с дефицитом PAH1.
Белок по настоящему изобретению можно получать искусственным образом. В данном случае белок можно получать с помощью химического синтеза, такого как способ Fmoc (способ с флуоренилметилоксикарбонилом) или способ tBoc (способ с трет-бутилоксикарбонилом). Кроме того, для химического синтеза можно использовать пептидные синтезаторы, доступные от Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive, Shimadzu Corporation или других производителей.
Белок по настоящему изобретению дополнительно включает следующие белки:
(1) (a) белки, состоящие из аминокислотной последовательности с делецией, заменой или добавлением одной или более аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7;
(b) белки, состоящие из аминокислотной последовательности, на 80% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7; и
(2) белки по любому из пунктов из (a) и (b) ниже:
(a) белки, состоящие из аминокислотной последовательности с делецией, заменой или добавлением от 1 до 200 аминокислот в аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7; и
(b) белки, состоящие из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, представленной в SEQ ID NO: 2 или SEQ ID NO: 7.
Клонирование нуклеиновой кислоты по настоящему изобретению
Нуклеиновую кислоту PAP по настоящему изобретению можно клонировать, например, с помощью скрининга библиотеки кДНК, применяя подходящие зонды. Клонирование можно осуществлять с помощью амплификации с помощью ПЦР, применяя подходящие праймеры с последующим лигированием в подходящий вектор. Клонированную нуклеиновую кислоту можно в дальнейшем субклонировать в другой вектор.
Можно использовать коммерчески доступные плазмидные векторы, такие как pBlue-ScriptTM SK(+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) или pCR2.1-TOPO (Invitrogen). При амплификации с помощью ПЦР, в качестве праймеров могут быть любые участки, например, из нуклеотидной последовательности, представленной в SEQ ID NO: 4. Например, в качестве прямого праймера можно использовать NotI-PAH1-1-F: 5'-GCGGCCGCATGCAGTCCGTGGGAAG-3' (SEQ ID NO: 15), а в качестве обратного праймера можно использовать MaPAH1-1-10R: 5'-TTCTTGAGTAGCTGCTGTTGTTCG-3' (SEQ ID NO: 16). Затем проводят ПЦР, используя кДНК, полученную из клеток M. alpina, с указанными выше праймерами, ДНК полимеразой и любыми другими соединениями. Несмотря на то что специалисты в данной области могут легко осуществлять данный метод согласно, например, «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), условия ПЦР по настоящему изобретению, могут быть, например, как указано ниже.
Температура денатурации: от 90°C до 95°C.
Температура отжига: от 40°C до 60°C.
Температура элонгации: от 60°C до 75°C.
Количество циклов: 10 или более циклов.
Полученные в результате продукты ПЦР можно очищать с помощью известных способов, например, используя набор, такой как набор GENECLEAN (Funakoshi Co., Ltd.), QIAquick PCR purification (QIAGEN) или ExoSAP-IT (GE Healthcare Bio-Sciences)); фильтра из DEAE-целлюлозы или пробирки для диализа. В случае использования агарозного геля продукт после ПЦР подвергают электрофорезу в агарозном геле, а фрагменты нуклеотидной последовательности вырезают из агарозного геля и очищают, например, с помощью набора GENECLEAN (Funakoshi Co., Ltd.), или набора QIAquick Gel extraction (QIAGEN) или с помощью способа замораживания-сдавливания.
Нуклеотидную последовательность клонированной нуклеиновой кислоты можно определять с помощью секвенирования нуклеотидов.
Конструирование вектора для экспрессии PAP и получения трансформантов
Настоящее изобретение также относится к рекомбинантному вектору, содержащему нуклеиновую кислоту, кодирующую PAP по настоящему изобретению. Настоящее изобретение дополнительно относится к трансформанту, трансформированному с помощью данного рекомбинантного вектора.
Рекомбинантный вектор и трансформант можно получать как указано ниже: плазмиду с нуклеиновой кислотой, кодирующей PAP по настоящему изобретению, расщепляют с помощью фермента рестрикции. Примеры ферментов рестрикции включают, но не ограничиваясь, EcoRI, KpnI, BamHI и SalI. Конец можно затуплять с помощью полимеразы T4. Расщепленный фрагмент ДНК выделяют с помощью электрофореза в агарозном геле. Данный фрагмент ДНК известным способом вставляют в экспрессирующий вектор для получения вектора для экспрессии PAP. Данный экспрессирующий вектор вводят в клетку-хозяина для получения трансформанта, обеспечивающего экспрессию желаемого белка.
В данном случае видом экспрессирующего вектора и хозяина может быть любой вид, позволяющий экспрессировать желаемый белок. Примеры хозяина включают грибы, бактерии, растения, животные и их клетки. Примеры грибов включают нитевидные грибы, такие как продуцирующие липиды M. alpina, и штаммы дрожжей, такие как Saccharomyces cerevisiae. Примеры бактерий включают Escherichia coli и Bacillus subtilis. Дополнительные примеры растений включают масличные растения, такие как семена рапса, соевые бобы, хлопчатник, сафлор и лен.
Можно использовать микроорганизмы, продуцирующие липиды, например штаммы, описанные в MYCOTAXON, Vol. XLIV, NO. 2, pp. 257-265 (1992), и их конкретные примеры включают микроорганизмы, принадлежащие роду Mortierella, такие как микроорганизмы, принадлежащие к подроду Mortierella, например Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS 219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70 и CBS754.68; и микроорганизмы, принадлежащие к подроду Micromucor, например Mortierella isabellina CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287 и Mortierella vinacea CBS236.82. В частности, предпочтительным является Mortierella alpina.
При использовании в качестве хозяина грибов, нуклеиновая кислота по настоящему изобретению предпочтительно является автономно реплицируемой в клетке-хозяине или предпочтительно обладает структурой, подходящей для внесения в хромосому грибов. Предпочтительно нуклеиновая кислота также включает промотор и терминатор. При использовании в качестве хозяина M. alpina в качестве экспрессирующего вектора можно использовать, например, pD4, pDuraSC или pDura5. Можно использовать любой промотор, позволяющий осуществлять экспрессию в клетке-хозяине, и его примеры включают промоторы, полученные из M. alpina, такие как промотор гена histonH4,1, промотор гена GAPDH (глицеральдегид-3-фосфат дегидрогеназа) и промотор гена TEF (фактор трансляции и элонгации).
Примеры способа введения рекомбинантного вектора в нитевидные грибы, такие как M. alpina, включают электропорацию, способ со сферопластом, способ доставки частиц и прямая микроинъекция ДНК в ядро. В случае применения ауксотрофного штамма-хозяина трансформированный штамм можно получать посредством отбора штамма, который растет на селективной среде без конкретного питательного вещества(веществ). Альтернативно, при трансформации при использовании маркерного гена, ответственного за устойчивость к лекарственному средству, колонию клеток, устойчивых к лекарственному средству, можно получать с помощью культивирования клеток-хозяев на селективной среде с лекарственным средством.
При использовании дрожжей в качестве хозяина, в качестве экспрессирующего вектора можно использовать, например, pYE22m. Альтернативно, можно использовать коммерчески доступные экспрессирующие векторы дрожжей, такие как pYES (Invitrogen) или pESC (STRATAGENE). Примеры хозяев, подходящих для настоящего изобретения, включают, но не ограничиваясь, штамм Saccharomyces cerevisiae EH13-15 (trp1, MATα). Промотором, который можно использовать, является, например, промотор, полученный из дрожжей, такой как промотор GAPDH, промотор gal1 или промотор gal10.
Примеры способа введения рекомбинантного вектора в дрожжи включает способ с ацетатом лития, электропорацию, способ со сферопластами, опосредованную декстраном трансфекцию, осаждение фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, инкапсулирование полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядро.
При использовании в качестве хозяина бактерий, таких как E. coli, в качестве экспрессирующего вектора можно использовать, например, pGEX или pUC18, доступные от Pharmacia. Промоторы, которые можно использовать, включают промоторы, полученные из, например, E. coli или фага, такие как промотор trp, промотор lac, промотор PL и промотор PR. Примеры способа введения рекомбинантного вектора в бактерии включает электропорацию и способ с хлоридом кальция.
Способ получения композиции жирной кислоты по настоящему изобретению
Настоящее изобретение относится к способу получения композиции жирной кислоты из трансформанта, описанного выше, т.е. к способу получения композиции жирной кислоты из продукта культивирования, полученного с помощью культивирования трансформанта. Композиция жирной кислоты содержит в себе совокупность из одной или более жирных кислот. В качестве жирных кислот могут быть свободные жирные кислоты или они могут быть представлены в виде липидов, содержащих жирные кислоты, таких как триглицерид или фосфолипид. В частности, композицию жирной кислоты по настоящему изобретению можно получать указанным ниже способом. Альтернативно, композицию жирной кислоты также можно получать любым другим известным способом.
В качестве среды для применения при культивировании организма, экспрессирующего PAP, может быть любой культуральный раствор (среда), обладающий подходящим pH и осмотическим давлением, и содержащий биологические вещества, такие как питательные вещества, микроэлементы, сыворотку и антибиотики, необходимые для роста каждого хозяина. Например, в случае экспрессирования PAP трансформированными дрожжами неограничивающие примеры среды включают среду SC-Trp, среду YPD и среду YPD5. Композиция конкретной среды, например, представляет собой среду SC-Trp, как указано ниже: один литр среды включает 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка с аминокислотами (смесь из 1,25 г аденин сульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила).
Можно использовать любые условия культивирования, которые являются подходящими для роста хозяина и подходят для стабильного поддержания получаемого фермента. В частности, конкретные условия включают степень анаэробности условий, время культивирования, температуру, влажность и культивирование в статичных условиях или культивирование с использованием перемешивания, которыми можно варьировать. Культивирование можно осуществлять в тех же условиях (одностадийное культивирование) или с помощью так называемого двустадийного или трехстадийного культивирования с применением двух или более различных условий культивирования. Для массированного культивирования предпочтительным является двух- или более стадийное культивирование вследствие высокой эффективности культивирования.
При двустадийном культивировании с применением дрожжей в качестве хозяина композицию жирной кислоты по настоящему изобретению можно получать как указано ниже: При предварительном культивировании колонию трансформанта переносят, например, в среду SC-Trp и культивируют в условиях встряхивания при 30°C в течение двух суток. Далее 500 мкл раствора после предварительного культивирования в качестве основной культуры добавляют к 10 мл среды YPD5 (2% экстракта дрожжей, 1% полипептона и 5% глюкозы) с последующим культивированием в условиях встряхивания при 30°C в течение двух суток.
Композиция жирной кислоты по настоящему изобретению
Настоящее изобретение также относится к композиции жирной кислоты в качестве совокупности из одной или более жирных кислот в клетках, экспрессирующих PAP по настоящему изобретению, предпочтительно к композиции жирной кислоты, полученной с помощью культивирования трансформанта, экспрессирующего PAP по настоящему изобретению. Жирные кислоты могут быть в виде свободных жирных кислот или могут присутствовать в форме липидов, содержащих жирные кислоты, таких как триглицерид или фосфолипид.
Жирные кислоты, содержащиеся в композиции жирной кислоты по настоящему изобретению, являются линейными или разветвленными монокарбоновыми кислотами углеводов с длинной цепью, и такие примеры включают, но не ограничиваясь, миристиновую кислоту (тетрадекановая кислота) (14:0), миристолеиновую кислоту (тетрадекановая кислота) (14:1), пальмитиновую кислоту (гексадекановая кислота) (16:0), пальмитолеиновую кислоту (9-гексадекановая кислота) (16:1), стеариновую кислоту (октадекановая кислота) (18:0), олеиновую кислоту (цис-9-октадекановая кислота) (18:1(9)), вакценовую кислоту (11-октадекановая кислота) (18:1(11)), линолевую кислоту (цис,цис-9,12 октадекадиеновая кислота) (18:2(9,12)), α-линоленовую кислоту (9,12,15-октадекатриеновая кислота) (18:3(9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеновая кислота) (18:3(6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеновая кислота) (18:4(6,9,12,15)), арахидоновую кислоту (эйкозановая кислота) (20:0), (8,11-эйкозадиеновая кислота) (20:2(8,11)), кислоту Мида (5,8,11-эйкозатриеновая кислота) (20:3(5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-эйкозатриеновая кислота) (20:3(8,11,14)), арахидоновую кислоту (5,8,11,14-эйкозатетраеновая кислота) (20:4(5,8,11,14)), эйкозатетраеновую кислоту (8,11,14,17-эйкозатетраеновая кислота) (20:4(8,11,14,17)), эйкозапентаеновую кислоту (5,8,11,14,17-эйкозапентаеновая кислота) (20:5(5,8,11,14,17)), бегеновую кислоту (докозановая кислота) (22:0), (7,10,13,16-докозатетраеновая кислота) (22:4(7,10,13,16)), (7,10,13,16,19-докозапентаеновая кислота) (22:5(7,10,13,16,19)), (4,7,10,13,16-докозапентаеновая кислота) (22:5(4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеновая кислота) (22:6(4,7,10,13,16,19)), лигноцериновую кислоту (тетракозановая кислота) (24:0), ацетэруковую кислоту (цис-15-тетрадокозановая кислота) (24:1) и церотиновую кислоту (гексакозановая кислота) (26:0). Необходимо отметить, что названия соединений представлены в виде стандартных названий согласно биохимической номенклатуре IUPAC, а их систематические названия вместе с числовыми значениями, отражающими количество молекул углерода и положения двойных связей, представлены в скобках.
Композиция жирной кислоты по настоящему изобретению может состоять из любого количества и типа жирной кислоты, при условии, что она представляет собой комбинацию из одной или более жирных кислот, выбранных из жирных кислот, указанных выше.
Пищевые продукты или другие продукты, содержащие композицию жирной кислоты по настоящему изобретению
Настоящее изобретение также относится к пищевому продукту, содержащему композицию жирной кислоты, описанную выше. Композицию жирной кислоты по настоящему изобретению можно использовать для получения пищевых продуктов, содержащих жиры и масла, и получения промышленных сырьевых материалов (например, сырьевые материалы для косметических средств, фармацевтических средств (например, для наружного применения на коже) и мыл), стандартными способами. Косметические средства (косметические композиции) или фармацевтические средства (фармацевтические композиции) можно составлять в любой лекарственной форме, включая, в качестве неограничивающих примеров, растворы, пасты, гели, твердые вещества и порошки. Примеры форм пищевых продуктов включают фармацевтические составы, такие как капсулы; жидкая пища натурального происхождения, частично-перевариваемая пища и элементарная жидкая пища, где композиция жирной кислоты по настоящему изобретению смешана с белками, сахарами, жирами, микроэлементами, витаминами, эмульгаторами и ароматизаторами; и произведена в виде форм, таких как питьевые препараты и в виде энтерального питательного вещества.
Кроме того, примеры пищевого продукта по настоящему изобретению включают, но не ограничиваясь, питательные добавки, диетические продукты, продукты здорового питания, питание для детей, модифицированное молоко для детей, модифицированное молоко для недоношенных детей и питание для пожилых людей. На всем протяжении описания термин «пищевой продукт» применяют в качестве собирательного термина в отношении съедобных веществ в твердой форме, в форме текучей среды, жидкой форме или их смеси.
Термин «питательные добавки» относится к пищевым продуктам, обогащенным специальными питательными компонентами. Термин «диетические пищевые продукты» относится к пищевым продуктам, являющимся оздоравливающими или полезными для здоровья, и включают питательные добавки, натуральные пищевые продукты и диетические пищевые продукты. Термин «продукты здорового питания» относится к пищевым продуктам для поддержания питательных веществ, поддерживающих функционирование организма, и является синонимом с продуктом для специального применения для здоровья. Термин «пищевые продукты для детей» относится к пищевым продуктам, которые дают детям возрастом приблизительно до 6 лет. Термин «продукты питания для пожилых людей» относится к пищевым продуктам для облегченного переваривания и всасывания по сравнению с необработанными продуктами. Термин «модифицированное молоко для детей» относится к модифицированному молоку, которое дают детям возрастом приблизительно до одного года. Термин «модифицированное молоко для недоношенных детей» относится к модифицированному молоку, которое дают недоношенным детям приблизительно до 6 месяцев после рождения.
Примеры данных пищевых продуктов включают натуральные пищевые продукты (обработанные жирами и маслами), такие как мясо, рыба и орехи; пищевые добавки с добавлением жиров и масел в процессе получения, такие как китайская пища, китайская лапша и супы; пищевые продукты, приготовленные с применением жиров и масел в качестве среды для термической обработки, такие как темпура (жареные во фритюре рыба и овощи), жареные во фритюре пищевые продукты, жареный тофу, жареный китайский рис, пончики и японское жареное печенье из песочного теста (каринто); пищевые продукты на основе жиров и масел или обработанные пищевые продукты с добавлением жиров и масел в процессе приготовления, таких как масло, маргарин, майонез, приправа, шоколад, лапша быстрого приготовления, карамель, печенье, булочки, торты и мороженое; и пищевые продукты, политые или покрытые жирами и маслами при завершении приготовления, такие как рисовые крекеры, твердое печенье и сладкий хлеб из бобов. Однако пищевые продукты по настоящему изобретению не ограничены пищевыми продуктами, содержащими жиры и масла, и другие примеры пищевых продуктов включат сельскохозяйственные пищевые продукты, такие как хлебобулочные изделия, лапша, приготовленный рис, сладости (например, конфеты, жевательная резинка, тянучки, таблетки, японские сладости), тофу и продукты, полученные из них; ферментированные пищевые продукты, такие как очищенное сакэ, лечебная настойка, пряная настойка (мирин), уксус, соевый соус и мисо; пищевые продукты, полученные из сельскохозяйственных животных, такие как йогурт, ветчина, бекон и сосиски; морепродукты, такие как рыбная паста (камабоко), жареная во фритюре рыбная паста (агетен) и рыбный пирог (ханпен); и фруктовые напитки, безалкогольные напитки, напитки для занятий спортом, алкогольные напитки и чай.
Способ анализа и селекции штамма с применением нуклеиновой кислоты, кодирующей PAP, или белка PAP по настоящему изобретению
Настоящее изобретение также относится к способу анализа и селекции продуцирующих липиды грибов с применением нуклеиновой кислоты, кодирующей PAP, или белка PAP по настоящему изобретению. Детали представлены ниже.
(1) Способ анализа
Один из вариантов осуществления настоящего изобретения представляет собой способ анализа продуцирующих липиды грибов, используя нуклеиновую кислоту, кодирующую PAP, или белок PAP по настоящему изобретению. В способе анализа по настоящему изобретению, например, проводят анализ продуцирующего липиды штамма грибов, в качестве экспериментального штамма, в отношении оценки активности по настоящему изобретению, применяя праймеры или зонды, сконструированные на основании нуклеотидной последовательности по настоящему изобретению. Данный анализ можно осуществлять известными способами, например, описанными в международной заявке № WO01/040514 и JP-A-8-205900. Способ анализа кратко описан ниже.
Первым этапом является получение генома исследуемого штамма. Геном можно получать любым известным способом, таким как способ Херефорда или способ с ацетатом калия (смотри, например, Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p. 130 (1990)).
Праймеры или зонды сконструированы на основании нуклеотидной последовательности по настоящему изобретению предпочтительно последовательности, представленной в SEQ ID NO: 1 или SEQ ID NO: 6. В качестве данных праймеров или зондов могут быть любые области нуклеотидной последовательности по настоящему изобретению, и они могут быть сконструированы любым способом. Количество нуклеотидов в полинуклеотиде, используемом в качестве праймера, составляет, как правило, 10 или более предпочтительно от 15 до 25. Количество нуклеотидов, подходящее для фланкирования праймерами, как правило, составляет от 300 до 2000.
Полученные, как указано выше, праймеры или зонды применяют для оценки наличия в геноме анализируемого штамма последовательности, специфичной в отношении нуклеотидной последовательность по настоящему изобретению. Последовательность, являющуюся специфичной в отношении нуклеотидной последовательности по настоящему изобретению, можно выявлять известными способами. Например, полинуклеотид, содержащий часть или целую последовательность, специфичную в отношении нуклеотидной последовательности по настоящему изобретению, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную нуклеотидной последовательности, используют в качестве одного из праймеров, а полинуклеотид, содержащий часть или целую последовательность, расположенную выше или ниже данной последовательности, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную нуклеотидной последовательности, используют в качестве другого праймера, а нуклеиновую кислоту из исследуемого штамма амплифицируют с помощью ПЦР или других способов. В дальнейшем, например, можно определять наличие или отсутствие продукта амплификации и молекулярную массу продукта амплификации.
Условия ПЦР, подходящие для способа по настоящему изобретению, детально не ограничены и, например, могут быть как указано ниже.
Температура денатурации: от 90°C до 95°C.
Температура отжига: от 40°C до 60°C.
Температура элонгации: от 60°C до 75°C.
Количество циклов: от 10 или более циклов.
Полученные в результате продукты реакции можно разделять с помощью электрофореза в агарозном геле или любым другим способом для определения молекулярной массы продукта амплификации. Активность по настоящему изобретению для исследуемого штамма можно прогнозировать или оценивать посредством подтверждения того, что молекулярная масса продукта амплификации достаточна для охвата молекулы нуклеиновой кислоты, соответствующей области, специфичной в отношении нуклеотидной последовательности по настоящему изобретению. Кроме того, активность по настоящему изобретению можно прогнозировать или оценивать с большей точностью, анализируя нуклеотидную последовательность продукта амплификации способом, описанным выше. Способ оценки активности по настоящему изобретению описан выше.
Альтернативно, при анализе по настоящему изобретению активность по настоящему изобретению в отношении исследуемого штамма можно анализировать с помощью культивирования исследуемого штамма и измерения уровня экспрессии PAP, кодируемой нуклеотидной последовательностью по настоящему изобретению, например, последовательностью, представленной в SEQ ID NO: 1 или SEQ ID NO: 6. Уровень экспрессии PAP можно измерять посредством культивирования исследуемого штамма при определенных условиях и определения количества мРНК или белка PAP. Количество мРНК или белка можно определять с помощью известных способов. Например, количество мРНК можно определять с помощью нозерн-гибридизации или количественной ПЦР в реальном времени, а количество белка можно определять с помощью Вестерн-блоттинга (Current Protocols in Molecular Biology, John Wiley & Sons, 1994-2003).
(2) Способ селекции
Другой вариант осуществления настоящего изобретения представляет собой способ селекции продуцирующих липиды грибов с применением нуклеиновой кислоты, кодирующей PAP, или белка PAP по настоящему изобретению. При селекции по настоящему изобретению штамм с желаемой активностью можно отбирать с помощью культивирования исследуемого штамма, измерения уровня экспрессии PAP, кодируемой нуклеотидной последовательностью по настоящему изобретению, например, последовательностью, представленной в SEQ ID NO: 1 или SEQ ID NO: 6, и выбора штамма с желаемым уровнем экспрессии. Альтернативно, желаемый штамм можно выбирать при применении стандартного штамма, культивирования стандартного штамма и исследуемого штамма по-отдельности, измерения уровня экспрессии каждого из штаммов и сравнения уровня экспрессии стандартного штамма с уровнем экспрессии исследуемого штамма. В частности, например, стандартный штамм и исследуемый штамм культивируют при подходящих условиях и измеряют уровень экспрессии каждого штамма. Штамм, проявляющий желаемую активность, можно отбирать посредством выбора исследуемого штамма с большим или меньшим уровнем экспрессии по сравнению со стандартным штаммом. Желаемую активность можно определять, например, при измерении уровня экспрессии PAP и композиции жирных кислот, продуцируемых PAP, как описано выше.
При селекции по настоящему изобретению исследуемый штамм с желаемой активностью можно выбирать посредством культивирования исследуемых штаммов и выбора штамма с высокой или низкой активностью по настоящему изобретению. Желаемую активность можно определять, например, при измерении уровня экспрессии PAP и композиции жирных кислот, продуцируемых PAP, как описано выше.
Примеры исследуемого штамма и стандартного штамма включают, но не ограничены, штаммы, трансформированные с помощью вектора по настоящему изобретению, модифицированные штаммы в отношении супрессии экспрессии нуклеиновой кислоты по настоящему изобретению, штаммы, подвергнутые мутагенезу, и штаммы с естественными мутациями. Активность по настоящему изобретению можно измерять, например, способом, описанным в описании «Нуклеиновая кислота, кодирующая фосфатазу фосфатидной кислоты по настоящему изобретению». Примеры мутационных процессов включают, но не ограничены, физические способы, такие как облучение ультрафиолетовым светом или радиацией; и химические способы воздействия химических веществ, таких как EMS (этилметан сульфонат) или N-метил-N-нитрозогуанидин (смотри, например, Yasuji Oshima ed., Biochemistry Experiments vol. 39, Experimental Protocols for Yeast Molecular Genetics, pp. 67-75, Japan Scientific Societies Press).
Примеры штаммов для применения в качестве стандартного штамма по настоящему изобретению или исследуемого штамма включают, но не ограничены, грибы, продуцирующие липиды, и описанные выше дрожжи. В частности, стандартный штамм и исследуемый штамм могут быть в любом сочетании штаммов, относящихся к различным родам или видам, и одновременно можно анализировать один или более исследуемых штаммов.
Настоящее изобретение в деталях описано далее с помощью приведенных ниже примеров, которые не предназначены для ограничения объема изобретения.
ПРИМЕРЫ
Пример 1: Анализ генома M. alpina
Штамм M. alpina 1S-4 высевали в 100 мл среды GY2:1 (2% глюкоза, 1% экстракт дрожжей, pH 6,0) и культивировали со встряхиванием при 28°C в течение 2 суток. Клетки собирали с помощью фильтрации и получали геномную ДНК с помощью DNeasy (QIAGEN).
Нуклеотидную последовательность геномной ДНК определяли с помощью Roche 454 GS FLX Standard. В этом случае нуклеотидную последовательность из библиотеки фрагментов секвенировали в два захода, а нуклеотидную последовательность из библиотеки «партнеров» (mate pair) секвенировали в три захода. Полученные в результате нуклеотидные последовательности выравнивали для получения 300 суперконтигов.
Пример 2: Синтез кДНК и конструирование библиотеки кДНК
Штамм M. alpina 1S-4 высевали в 100 мл среды (1,8% глюкоза, 1% экстракт дрожжей, pH 6,0) и культивировали со встряхиванием при 28°C в течение 4 суток. Клетки собирали посредством фильтрации и получали полную РНК с помощью способа гуанидин гидрохлорид/CsCl.
Из полной РНК с помощью обратной транскрипции синтезировали кДНК с помощью SuperScript II RT (Invitrogen), применяя случайный гексамер. Кроме того, из полной РНК выделяли поли(A)+ РНК с помощью набора Oligotex-dT30<Super>mRNA Purification Kit (Takara Bio Inc.). Библиотеку кДНК конструировали с помощью набора ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE).
Пример 3: Поиск гомолога PAH1, полученного из S. cerevisiae
Аминокислотная последовательность гена с активностью PAP из Saccharomyces cerevisiae, PAH1 (YMR165C) (также в описании может быть обозначена как ScPAH1), была подвергнута анализу tblastn в сравнении с геномными нуклеотидными последовательностями штамма M. alpina 1S-4. В результате преимуществом обладали суперконтиги, включающие последовательности, представленные в SEQ ID NO: 5 и SEQ ID NO: 10. Ген, относящийся к SEQ ID NO: 5, был назван MaPAH1.1, а ген, относящийся к SEQ ID NO: 10, был назван MaPAH1.2.
Пример 4: Клонирование MaPAH1.1 и MaPAH1.2
(1) Получение зонда
Для клонирования кДНК гена MaPAH1.1 и гена MaPAH1.2 получали нуклеотидные последовательности, представленные в SEQ ID NO: 5 и SEQ ID NO: 10, и подбирали соответствующие праймеры на основании результатов анализа с помощью описанной выше программы BLAST.
MaPAH1-1-3F: 5'-CGCCAATACATTGACGTTTTCAG-3' (SEQ ID NO: 11)
MaPAH1-1-5R: 5'-AGTTCCAGTCATTGAACTCGGGTGC-3' (SEQ ID NO: 12)
MaPAH1-2-3F: 5'-GAGCCCAGTTGACCTTTGAGGCATTC-3' (SEQ ID NO: 13)
MaPAH1-2-5R: 5'-CACTGAGAACGAGACCGTGTTGGCG-3' (SEQ ID NO: 14)
ПЦР проводили с помощью ExTaq (Takara Bio Inc.), используя в качестве матрицы библиотеку кДНК, сконструированную в примере 2, и комбинацию праймера MaPAH1-1-3F и праймера MaPAH1-1-5R или комбинацию праймера MaPAH1-2-3F и прймера MaPAH1-2-5R при 94°C в течение 2 мин, а затем 30 циклов (94°C в течение 30 сек, 55°C в течение 30 сек и 72°C в течение 2 мин). Фрагмент ДНК из приблизительно 0,6 т.п.н., полученный для каждой комбинации, клонировали с помощью набора TOPO-TA cloning Kit (Invitrogen) и определяли нуклеотидную последовательность вставки в полученной плазмиде. Плазмиду, полученную с помощью упомянутой выше комбинации праймеров, с последовательностью, соответствующей нуклеотидам от 2352 до 3010 из SEQ ID NO: 4, определили как pCR-MaPAH1.1-P; а плазмиду, полученную с помощью последней из указанных комбинаций праймеров, с последовательностью, соответствующей нуклеотидам от 1615 до 2201 из SEQ ID NO: 9, определили как pCR-MaPAH1.2-P.
Затем с помощью ПЦР получали образцы, используя данные плазмиды в качестве матриц, и праймеры, описанные выше. В реакции использовали ExTaq (Takara Bio Inc., Japan), кроме того, что вместо прилагаемой смеси dNTP для мечения амплифицируемой ДНК использовали раствор для мечения ПЦР (Roche Diagnostics) с дигоксигенином (DIG) для получения зонда MaPAH1.1 и зонда MaPAH1.2. Затем с помощью данных зондов проводили скрининг библиотеки кДНК.
Условия гибридизации были подобраны как указано ниже.
Буфер: 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамид.
Температура: 42°C (в течение ночи).
Условия промывания: в 0,2××SSC, 0,1% растворе SDS (65°C) в течение 20 мин (трижды).
Для детекции использовали набор DIG nucleic acid detection kit (Roche Diagnostics). Для получения каждой плазмиды ДНК плазмиды вырезали с помощью вырезания in vivo из фаговых клонов, полученных при скрининге. Плазмида с наибольшей длиной вставки среди плазмид, полученных при скрининге с помощью зонда MaPAH1.1, обладала последовательностью начиная с положения 1307-м и далее из последовательности, представленной в SEQ ID NO: 4, и была названа плазмидой pB-MaPAH1.1p. Результаты сравнения аминокислотной последовательности из ScPAH1 показали, что данная плазмида pB-MaPAH1.1p не содержит область, кодирующую N-концевую область PAH1.1. Сравнение геномной последовательности (SEQ ID NO: 5), которая, как предполагали по результатам анализа с помощью BLAST, содержит ген MaPAH1.1, с N-концевой областью аминокислотной последовательности ScPAH1 показало, что ATG в положении от 1 до 3 в последовательности, представленной в SEQ ID NO: 5, является инициирующим кодоном. Каждая рамка плазмиды pB-MaPAH1.1p была транслирована в аминокислотную последовательность. Аминокислотную последовательность сравнивали с аминокислотной последовательностью белка ScPAH1, полученного из S. cerevisiae. В результате было показано, что TGA в положениях от 3985 до 3987 в последовательности, представленной в SEQ ID NO: 4, является стоп-кодоном. Таким образом, для клонирования полноразмерной кДНК, были сконструированы следующие праймеры.
NotI-PAH1-1-F: 5'-GCGGCCGCATGCAGTCCGTGGGAAG-3' (SEQ ID NO: 15)
MaPAH1-1-10R: 5'-TTCTTGAGTAGCTGCTGTTGTTCG-3' (SEQ ID NO: 16)
ПЦР проводили с помощью ExTaq (Takara Bio Inc.), используя указанную выше кДНК в качестве матрицы и комбинацию праймера NotI-PAH1-1-F и праймера MaPAH1-1-10R при 94°C в течение 2 мин, а затем 30 циклов из (94°C в течение 30 сек, 55°C в течение 30 сек и 72°C в течение 2 мин). Полученный в результате фрагмент ДНК из приблизительно 1,5 т.п.н. клонировали с помощью набора TOPO-TA cloning Kit (Invitrogen) и определяли нуклеотидную последовательность вставки. Плазмиду, в которую клонировали фрагмент ДНК, включающий последовательность нуклеотидов от 1 до 1500 из SEQ ID NO: 4, назвали pCR-MaPAH1.1-Np. Затем фрагмент ДНК из приблизительно 1,4 т.п.н., полученный при разрезании плазмиды pCR-MaPAH1.1-Np с помощью ферментов рестрикции NotI и XhoI, фрагмент ДНК из приблизительно 3,7 т.п.н., полученный при разрезании плазмиды pB-MaPAH1.1p с помощью ферментов рестрикции NotI и BamHI, и фрагмент ДНК из приблизительно 2,1 т.п.н., полученный при разрезании плазмиды pB-MaPAH1.1p с помощью ферментов рестрикции XhoI и BamHI, соединяли с помощью лигирования (TOYOBO) для получения кДНК плазмиды pB-MaPAH1.1, которая, как предполагают, содержит полноразмерную кДНК MaPAH1.1. Последовательность кДНК, включающая полноразмерную ORF из MaPAH1.1, указана в SEQ ID NO: 4.
По отдельности, плазмида с наибольшей длиной вставки среди плазмид, полученных при скрининге с помощью зонда MaPAH1.2, обладает нуклеотидной последовательностью, представленной в SEQ ID NO: 9. Результаты сравнения последовательности данной плазмиды с последовательностью ScPAH1, полученной из S. cerevisiae, показали, что кДНК плазмиды включает полноразмерную ORF из MaPAH1.2. Данную плазмиду назвали pB-MaPAH1.2 кДНК.
(2) Анализ последовательности
Последовательность кДНК (SEQ ID NO: 4) из гена MaPAH1.1 включает CDS (SEQ ID NO: 3), состоящую из последовательности нуклеотидов от 1 до 3987 и ORF (SEQ ID NO: 1), включающую последовательность нуклеотидов от 1 до 3984. Установленная аминокислотная последовательность, кодируемая геном MaPAH1.1, представлена в SEQ ID NO: 2. Геномную последовательность гена MaPAH1.1 сравнивали с последовательностью ORF (фигура 1). В результате было показано, что геномная последовательность гена MaPAH1.1 состоит из одиннадцати экзонов и десяти интронов.
Последовательность кДНК (SEQ ID NO: 9) гена MaPAH1.2 включает CDS (SEQ ID NO: 8), состоящую из последовательности нуклеотидов от 72 до 3791, и ORF (SEQ ID NO: 6), состоящую из последовательности нуклеотидов от 72 до 3788. Установленная аминокислотная последовательность, кодирующая ген MaPAH1.2, представлена в SEQ ID NO: 7. Геномную последовательность гена MaPAH1.2 сравнивали с последовательностью ORF (фигура 2). Геномная последовательность гена MaPAH1.2 состоит из восьми экзонов и семи интронов.
Последовательности кДНК MaPAH1.1 и MaPAH1.2 и их установленные аминокислотные последовательности соответственно представлены на фигуре 3 и фигуре 4.
С помощью программы BLASTp проводили поиск гомологии между установленными аминокислотными последовательностями MaPAH1.1 и MaPAH1.2 и аминокислотными последовательностями из GenBank. Обе аминокислотные последовательности достигают гомологии с наибольшими показателями с белком 1 ядерной элонгации и предполагаемым белком деформации (AAW42851), полученными из Cryptococcus neoformans var. neoformans JEC21, но с невысокой идентичностью, т.е. 25,9% и 26,6% соответственно.
Среди гомологов PAP1 грибов аминокислотные последовательности MaPAH1.1 и MaPAH1.2, полученные из M. alpina по настоящему изобретению, идентичны на 22,7% и 22,5% соответственно с аминокислотной последовательностью белка ScPAH1, который подвергали функциональному анализу. Аминокислотные последовательности MaPAH1.1 и MaPAH1.2, полученные из M. alpina в настоящем изобретении, сравнивали с аминокислотными последовательностями известного ScPAH1 и липина, полученного из мыши (фигура 5). В семействе ферментов PAP1, аминокислотная последовательность N-концевой области является высоко консервативной и называется липин, N-концевая консервативная область (pfam04571). Также в MaPAH1.1 и MaPAH1.2, полученных из M. alpina по настоящему изобретению, известный фермент и N-концевая область являются достаточно консервативными. Кроме того, последовательность DIDGT, отмеченная двойным подчеркиванием в фигуре 5, представляет собой белок, подобный суперсемейству ферментов дегалогеназе галогенокислоты (HAD), и соответствует мотиву консервативного каталитического сайта DXDX(T/V).
Последовательности CDS из MaPAH1.1 и MaPAH1.2 сравнивали друг с другом для того, чтобы продемонстрировать идентичность на 54,7% (фигура 6), тогда как идентичность между установленными аминокислотными последовательностями составила 35,6% (фигура 7).
Пример 5: Экспрессия MaPAH1.1 и MaPAH1.2 в дрожжах
Конструирование экспрессионного вектора MaPAH1.1 и MaPAH1.2:
Для экспрессии MaPAH1.1 в дрожжах были сконструированы экспрессионные векторы, как указано ниже.
Экспрессионный вектор дрожжей pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) разрезали с помощью фермента рестрикции EcoRI, а концы затупляли с помощью набора Blunting Kit (TaKaRa Bio Inc.). Полученный фрагмент и линкер pNotI, фосфорилированный (8-мер) (TaKaRa Bio Inc.), соединяли друг с другом с помощью лигирования (TOYOBO) для конструирования вектора pYE22mN. Вектор pYE22mN разрезали с помощью ферментов рестрикции NotI и KpnI, а полученный фрагмент присоединяли к фрагменту ДНК длиной приблизительно 4,2 т.п.н., полученному при разрезании кДНК плазмиды pB-MaPAH1.1 с помощью ферментов рестрикции NotI и KpnI для обеспечения плазмиды pYE-MaPAH1.1. Отдельно, вектор pYE22mN разрезали с помощью ферментов рестрикции NotI и KpnI, а полученный фрагмент присоединяли к фрагменту ДНК длиной приблизительно 3,8 т.п.н., полученному при разрезании кДНК плазмиды pB-MaPAH1.2 с помощью ферментов рестрикции NotI и KpnI для обеспечения плазмиды pYE-MaPAH1.2.
Получение штамма ΔScpah1:URA3 S. cerevisiae
Для клонирования гена ScPAH1, полученного из штамма S288C S. cerevisiae, были получены следующие праймеры:
Праймер KpnI-PAH1-F: 5'-GGTACCATGCAGTACGTAGGCAGAGCTC-3' (SEQ ID NO: 17), и
Праймер XhoI-PAH1-R: 5'-CTCGAGTTAATCTTCGAATTCATCTTCG-3' (SEQ ID NO: 18).
Штамм S288C S. cerevisiae культивировали в жидкой среде YPD (2% экстракта дрожжей, 1% полипептон, 2% глюкоза) при 30°C в течение ночи. ДНК из клеток выделяли с помощью Dr. GenTLE (из дрожжей) (TaKaRa Bio Inc.), а ген ScPAH1 амплифицировали с помощью ПЦР с ExTaq, используя в качестве матрицы полученную ДНК и праймеры KpnI-PAH1-F и XhoI-PAH1-R. Полученный фрагмент ДНК длиной приблизительно 2,5 т.п.н. клонировали, используя набор TOPO TA cloning Kit, а клон с правильной нуклеотидной последовательностью определяли как pCR-ScPAH1. Фрагмент ДНК длиной приблизительно 0,4 т.п.н., полученный при разрезании pCR-ScPAH1 с помощью ферментов рестрикции EcoRI и EcoRV, и фрагмент ДНК длиной приблизительно 2,1 т.п.н., полученный при разрезании pCR-ScPAH1 с помощью ферментов рестрикции EcoRV и XhoI, были лигированы в вектор pBluescriptIISK+, разрезанный с помощью ферментов рестрикции EcoRI и XhoI, для получения плазмиды pBScPAH1. Плазмиду pBScPAH1 разрезали с помощью ферментов рестрикции EcoRV и HincII и лигировали с фрагментом ДНК длиной приблизительно 1,2 т.п.н., полученным при разрезании плазмиды pURA34 (нерассмотренная патентная заявка Японии № 2001-120276) с помощью фермента рестрикции HindIII, а затем затупляли концы. Полученный в результате продукт с геном URA3 в том же направлении, что и ген ScPAH1, определили как плазмиду pBΔpah1:URA3. Далее штамм YPH499 S. cerevisiae (ura3-52 lys2-801amber ade2-101ochre trp1-Δ63 his3-Δ200 leu2-Δ1 a) (STARATAGENE) в качестве хозяина трансформировали с помощью фрагмента ДНК, полученного при разрезании плазмиды pBΔpah1:URA3 с помощью фермента рестрикции EcoRI. Трансформированный штамм отбирали по способности расти на среде с агаром SC-Ura (один литр среды включает 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы, 1,3 г порошка аминокислот (смесь из 1,25 г аденин сульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана) и среду с агаром (2% агар)). Штамм, для которого с помощью ПЦР подтвердили, что конструкция Δpah1:URA3 введена в штамм и что ген ScPAH1 поврежден, определяли как штамм ΔScpah1:URA3.
Получение трансформированного штамма:
Штамм ΔScpah1:URA3 использовали в качестве хозяина и трансформировали плазмидой pYE22m, pYE-MaPAH1.1 или pYE-MaPAH1.2. Трансформированные штаммы отбирали по способности расти на среде с агаром SC-Ura, Trp (один литр среды включает 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы, 1,3 г порошка аминокислот (смесь из 1,25 г аденин сульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина) и среду с агаром (2% агар)). Два произвольных штмамма из соответствующих штаммов, трансформированных каждой из плазмид (контрольные штаммы трансформированы плазмидой pYE22m: C1 и C2, штаммы, трансформированные плазмидой pYE-MaPAH1.1: MaPAH1.1-1 и MaPAH1.1-2, и штаммы, трансформированные плазмидой pYE-MaPAH1.2: MaPAH1.2-1 и MaPAH1.2-2), использовали в последующих экспериментах.
Пример 6: Измерение активности Mg 2+ -зависимой фосфатазы фосфатидной кислоты (активности PAP1)
Каждый трансформированный штамм дрожжей высевали в 100 мл жидкой среды SC-Ura, Trp и культивировали при встряхивании при 30°C в течение суток. Исходный раствор фермента получали из полученного раствора культуры следующим образом. В частности, способ проводили при 4°C или на льду. Клетки собирали из раствора культуры с помощью центрифугирования и промывали водой. Впоследствии, клетки суспендировали в 5 мл буфера А (50 мМ Трис-HCl (pH 7,5), 0,3 М сахарозы, 10 мМ 2-меркаптоэтанола, 0,5 мМ фенилметилсульфонил фторида (PMSF)). Клетки разрушали при обработке с помощью French press (Thermo Fisher Scientific), Mini-Cell, при 16 кПа трижды. Клеточный лизат подвергали центрифугированию при 1500×g в течение 10 минут и супернатант собирали в виде исходного раствора фермента. Концентрацию белка, содержащегося в исходном растворе фермента, измеряли с помощью Protein Assay CBB Solution (5×) (Nacalai Tesque).
Активность PAP1 измеряли с помощью модифицированного способа по Gil-Soo et al. (J. Biol. Chem., 282 (51), 37026-37035, (2007)) как указано ниже. Поскольку S. cerevisiae не может синтезировать линолевую кислоту, в качестве субстрата для PAP использовали 1,2-дилинолеоил-sn-глицеро-3-фосфат (18:2-PA). Использовали пятьсот микролитров реакционного раствора. В качестве композиции реакционного раствора было 100 мкл исходного раствора фермента, 50 мМ Трис-HCl (pH 7,5), 100 мкг/мл 1,2-дилинолеоил-sn-глицеро-3-фосфата, мононатриевая соль (Avanti Polar Lipids, Inc.), 1 мМ MgCl2 и 10 мМ 2-меркаптоэтанола. Реакционный раствор поддерживали при 25°C в течение 30 минут и затем реакцию завершали с помощью добавления хлороформ:метанол (1:2). Липиды экстрагировали с помощью способа Bligh-Dyer. С помощью тонкослойной хроматографии (TLC) липиды фракционировали на планшете с силикагелем 60 (Merck), используя в качестве растворителя для элюирования гексан:диэтиловыйэфир:уксусную кислоту=70:30:1. Липиды визуализировали с помощью распыления раствора примулина (0,015% примулин в водном растворе 80% ацетона), а затем облучали ультрафиолетовым светом. Фракцию диацилглицерина (DG) соскабливали с планшета и жирные кислоты преобразовывали в сложный метиловый эфир с помощью способа с соляной кислотой/метанолом. Далее сложный метиловый эфир жирной кислоты экстрагировали с помощью гексана и гексан отгоняли с последующим анализом с помощью газовой хроматографии.
В таблице 2 указано количество линолевой кислоты, перешедшее во фракцию DG, на количество белка в исходном растворе фермента.
|
Как указано в таблице 2, по сравнению с C1 и C2, трансформированных при помощи pYE22m, активность преобразования 18:2-PA до дилинолеина (18:2-DG) была приблизительно 3-кратной в отношении MaPAH1.1-1 и MaPAH1.1-2, экспрессирующих MaPAH1.1, и приблизительно 1,2-кратной в отношении MaPAH1.2-1 и MaPAH1.2-2, экспрессирующих MaPAH1.2. Это указывает на то, что MaPAH1.1 и MaPAH1.2 обладают активностью PAP.
Зависимость активности PAP от Mg2+ исследовали следующим образом: использовали пятьсот микролитров реакционного раствора. Реакцию и анализ проводили при тех же условиях, указанных выше, за исключением того, что в качестве композиции реакционного раствора было 100 мкл исходного раствора фермента, 50 мМ Трис-HCl (pH 7,5), 100 мкг/мл 1,2-дилинолеоил-sn-глицеро-3-фосфата, мононатриевая соль (Avanti Polar Lipids, Inc.), 2 мМ ЭДТА и 10 мМ 2-меркаптоэтанола. В таблица 3 указаны количества линолевой кислоты, перенесенные во фракцию DG, на количество белка в исходном растворе фермента.
|
Как указано в таблице 3, для каждого штамма активность преобразования 18:2-PA до дилинолеина (18:2-DG) была приблизительно одинаковой.
Это указывает на то, что активность PAP из MaPAH1.1 и MaPAH1.2 зависит от Mg2+ и что MaPAH1.1 и MaPAH1.2 обладают активностью PAP1.
Пример 7: Количество производимого триацилглицерина
Триацилглицерин (на протяжении всего описания называемый триглицеридом, или TG), который является резервным липидом, является липидом, полученным при дальнейшем ацилировании диацилглицерина, который является продуктом белка PAP. Измеряли количества TG, производимого трансформантами дрожжей, в которых высоко эспрессированы MaPAH1.1 или MaPAH1.2.
Клетки трансформантов, хозяйский штамм дрожжей с дефицитом ScPAH1, высевали в 10 мл жидкой среды SC-Ura, Trp и культивировали в статических условиях при 30°C в течение 3 суток. Один миллилитр раствора культуры высевали в 10 мл жидкой среды YPDA (2%м дрожжевой экстракт, 1% полипептон, 2% глюкоза, 0,008% сульфат аденина), с последующим культивированием со встряхиванием при 30°C в течение одних суток (n=3). Клетки собирали с помощью центрифугирования раствора культуры, промывали водой и лиофилизировали. К высушенным клеткам добавляли хлороформ и метанол (2:1). Клетки повторно разрушали с помощью стеклянных шариков и экстрагировали липиды с помощью в общей сложности 8 мл растворителя. Экстрагированные липиды фракционировали с помощью TLC, как указано выше, и соскребали и анализировали фракцию TG. Результаты показаны в таблице 4.
|
Как показано в таблице 4, количество TG было приблизительно 1,5-кратным в штамме, интенсивно экспрессирующем MaPAH1.1, и было приблизительно 1,2-кратным в штамме, интенсивно экспрессирующем MaPAH1.2, по сравнению с таковым в контроле.
Пример 8: Субстратная специфичность MaPAH1.1 и MaPAH1.2
Штамм ΔScpah1:URA3, в качестве хозяина, трансформировали плазмидой pYE22m, pYE-MaPAH1.1 или pYE-MaPAH1.2. Четыре штамма каждого трансформанта использовали в последующих экспериментах. Штаммы, трансформированные плазмидой pYE22m, использовали в качестве контроля.
Каждый трансформант дрожжей высевали в 10 мл жидкой среды SC-Ura, Trp и культивировали в статических условиях при 27,5°C в течение ночи. Каждый из полученных в результате культивирования растворов высевали в 40 мл жидкой среды SC-Ura, Trp в количестве 1/10 в две параллели и культивировали в статических условиях при 27,5°C в течение двух суток. Из полученных растворов культуры получали исходные растворы фермента, как в Примере 6, и измеряли концентрации белков.
Активность PAP1 измеряли как в примере 6 за исключением того, что в качестве субстратов для PAP использовали 1,2-дилинолеоил-sn-глицеро-3-фосфат (18:2-PA) и 1,2-диолеолил-sn-глицеро-3-фосфат (18:1-PA).
В таблице 5 и таблице 6 соответственно указаны количества линолевой кислоты (18:2) и олеиновой кислоты (18:1), перенесенные во фракцию диацилглицерина (DG), на количество белка в исходном растворе фермента.
|
|
При использовании в виде субстрата 18:2-PA, виды активности MaPAH1.1 и MaPAH1.2, полученных из Mortierella, были 1,9-кратными и 1,3-кратными соответственно по сравнению с таковыми в контроле.
При использовании в виде субстрата 18:1-PA, виды активности MaPAH1.1 и MaPAH1.2 были 1,9-кратными и 1,1-кратными соответственно по сравнению с таковыми в контроле. 18:1 - представляет собой жирную кислоту, которую дрожжи продуцируют по природе, и, таким образом, она исходно присутствует в составе DG в исходном растворе фермента. Однако не наблюдали различий в отношении количества 18:1 в составе DG в исходном растворе фермента, в случае если субстрат не добавляли. Соответственно, можно допустить, что отличие активности MaPAH1.1 и MaPAH1.2 от активности в контроле, указанной в таблице 6, основано на эффекте в отношении 18:1-PA, добавленной в качестве субстрата.
При сравнении видов активности того же самого фермента в отношении различных субстратов, MaPAH1.1 увеличивал количество как 18:1, так и 18:2 в 1,9-раз по сравнению с контролем, в то время как MaPAH1.2 увеличивал количество 18:1 в 1,1-раз, а количество 18:2 в 1,3-раз по сравнению с контролем. Это указывает на то, что MaPAH1.1 проявляет одинаковую активность в отношении как 18:1-PA, так и 18:2-PA, но в случае MaPAH1.2 активность в отношении 18:2-PA выше, чем таковая в отношении 18:1-PA.
Данные результаты указывают на то, что MaPAH1.1 и MaPAH1.2 обладают активностью PAP. Кроме того, MaPAH1.2 проявляет более высокою активность в отношении 18:2-PA, чем в отношении 18:1-PA, что указывает на то, что MaPAH1.2 проявляет более высокую активность в отношении фосфатидных кислот, имеющих в составе жирные кислоты с более высокой степенью ненасыщенности
ПРОИЗВОЛЬНЫЙ ТЕКСТ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 11: праймер
SEQ ID NO: 12: праймер
SEQ ID NO: 13: праймер
SEQ ID NO: 14: праймер
SEQ ID NO: 15: праймер
SEQ ID NO: 16: праймер
SEQ ID NO: 17: праймер
SEQ ID NO: 18: праймер.