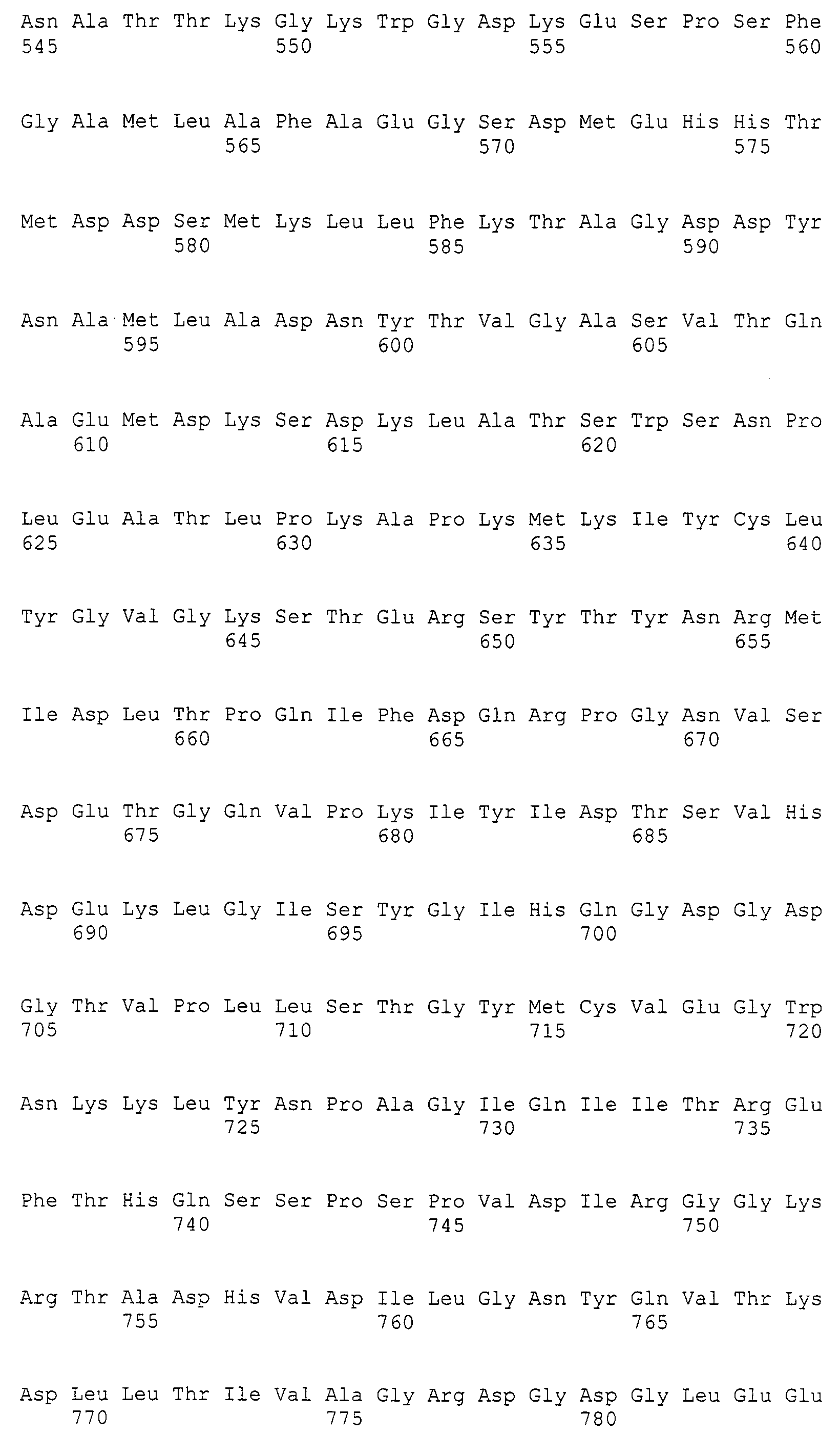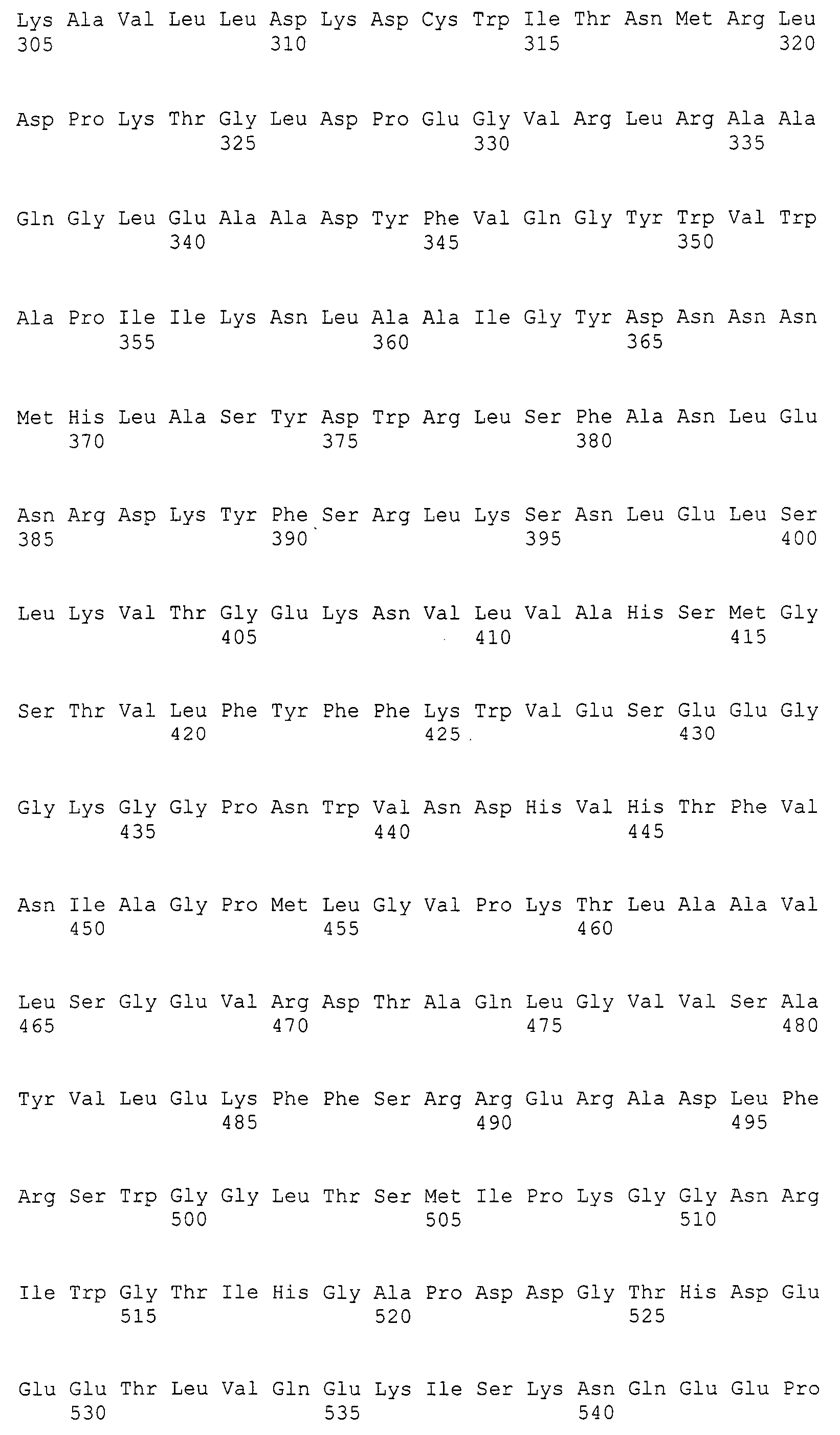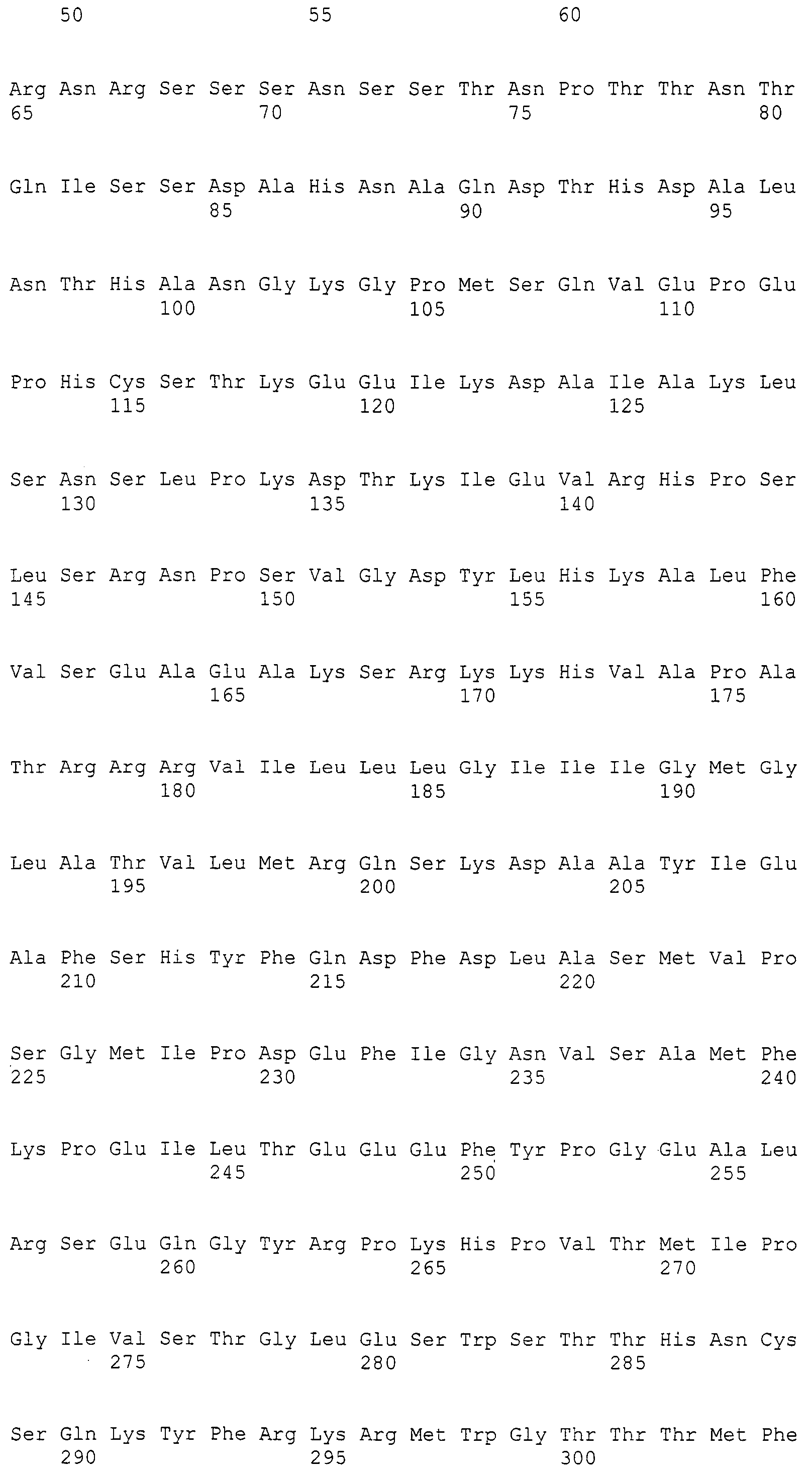Результат интеллектуальной деятельности: ГЕНЫ ДИАЦИЛГЛИЦЕРОЛ-АЦИЛТРАНСФЕРАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к полинуклеотиду, кодирующему новую диацилглицерол-ацилтрансферазу, и способ его использования.
Предпосылки изобретения
Триацилглицеролы, представляющие собой запасные липиды, получаются путем переноса ацильных групп на диацилглицеролы. Ферменты, переносящие ацильную группу на диацилглицерол, называются диацилглицерол-ацилтрансферазами (DGAT). Известна ацил-CoA:диацилглицерол-ацилтрансфераза (EC 2.3.1.20), относящаяся к типу, для которого ацильным донором ацила служит ацил-CoA, и фосфолипид:диацилглицерол-ацилтрансфераза PDAT (EC 2.3.1.158), относящаяся к типу, для которого донором ацила служит фосфолипид.
DGAT, использующие в качестве донора ацила ацил-CoA, разделяются на 2 семейства DGAT1 и DGAT2 на основании разницы в первичной структуре (непатентные документы 1 и 2). Клонированы гены DGAT дрожжей, растений и т.д. (патентный документ 1 и непатентные документы 3 и 4). Известно, что среди этих DGAT, DGAT, полученная из Arabidopsis, использует в качестве доноров ацила различные фосфолипиды, включая фосфатидную кислоту, фосфатидилхолин, фосфатидилэтаноламин и т.п., и может переносить ацильные группы в пределах C10-C22 (непатентный документ 5).
DGAT дрожжей Saccharomyces cerevisiae изучены лучше по сравнению с DGAT грибков. Известны гены дрожжей, кодирующие DGAT, DGA1 (YOR245C), принадлежащую к семейству DGAT2 (непатентный документ 6) и LRO1 (YNR008W), представляющую собой PDAT. Фермент, кодируемый этими двумя генами, обеспечивает большую часть активности DGAT в дрожжах, но даже при одновременной деструкции этих генов некоторая активность DGAT сохраняется. Известно, что в этой оставшейся активности участвует DGAT-активность фермента, кодируемого генами ARE1 и ARE2, которые представляют собой гены ацил-CoA:стерол-ацилтрансферазы (непатентный документ 7).
У Mortierella alpina (M. alpina), представляющей собой грибок, продуцирующий липиды, известны 4 типа DGAT, использующих ацил-CoA в качестве донора ацила, и их гены (два типа генов семейства DGAT1 и два типа генов семейства DGAT2) (патентные документы 2 и 3 и непатентный документ 8).
Однако у M. alpina не было обнаружено гомологов PDAT, использующих фосфолипид в качестве донора ацила. Десатураза жирных кислот Δ5 представляет собой фермент, катализирующий окисление дигомо-γ-линоленовой кислоты (DGLA) до арахидоновой кислоты (ARA). Известно, что, поскольку у M. alpina фермент воздействует главным образом на DGLA, находящуюся в виде ацильных остатков на фосфатидилхолине, арахидоновая кислота образуется в виде ацильных остатков фосфатидилхолина (непатентный документ 9). Таким образом, для образования триацилглицеролов, содержащих арахидоновую кислоту, требуются ферменты, синтезирующие триацилглицеролы, содержащие арахидоновую кислоту, из арахидоновой кислоты, находящейся в виде ацильных остатков фосфолипидов, таких как фосфатидилхолин и т.п.
Патентные документы
Патентный документ 1: нерассмотренная публикация заявки на японский патент № 2002-541783.
Патентный документ 2: патент США № 2006/0094086.
Патентный документ 3: патент США № 2006/0091087.
Непатентные документы
Непатентный документ 1: Proc. Natl. Acad. Sci. USA, 95, 13018-13023, 1998.
Непатентный документ 2: J.B.C., 276 (42) 38862-38869, 2001.
Непатентный документ 3: J.B.C., 275 (21), 15609-15612, 2000.
Непатентный документ 4: Proc. Natl. Acad. Sci. USA, 97(12), 6487-6492.
Непатентный документ 5: Plany Physiology, 135, 1324-1335.
Непатентный документ 6: J. Bacteriol., 184, 519-524, 2002.
Непатентный документ 7: J.B.C., 277 (8), 6478-6482, 2002.
Непатентный документ 8: Collected Abstract of the 2003 Annual Meeting of the Japan Society for Agricultural and Biological Chemistry.
Непатентный документ 9: J.B.C., 278(37), 35115-35126, 2003.
Раскрытие изобретения
В сложившихся обстоятельствах, в области техники существует потребность в новом ферменте, пригодном для продукции триацилглицеролов, содержащих арахидоновую кислоту, в M. alpina.
В результате всесторонних исследований авторам настоящего изобретения удалось клонировать ген, кодирующий гомолог PDAT (MaLRO1) у M. alpina, представляющего собой грибок, продуцирующий липиды. На этом основании выполнено настоящее изобретение. В частности, в настоящем изобретении представлены следующие полинуклеотиды, белки, векторы экспрессии, трансформанты, способ получения композиций липидов или жирных кислот, а также пищевых продуктов с использованием трансформантов, пищевые продукты и т.п., полученные с помощью способа и т.д.
Таким образом, в настоящем изобретении представлено следующее:
[1] Полинуклеотид, согласно любому, выбираемому из группы, состоящей из (а)-(е) ниже:
(а) полинуклеотид, содержащий нуклеотидную последовательность SEQ ID NO:1 или 4;
(b) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO:2;
(с) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, в которой от 1 до 100 аминокислот делетированы, заменены, вставлены и/или добавлены к аминокислотной последовательности SEQ ID NO:2, и обладающий диацилглицерол-ацилтрансферазной активностью;
(d) полинуклеотид, кодирующий белок, чья аминокислотная последовательность гомологична по меньшей мере на 60% аминокислотной последовательности SEQ ID NO:2, и который обладает диацилглицерол-ацилтрансферазной активностью; и
(е) полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1 или 4, и кодирующий белок, обладающий диацилглицерол-ацилтрансферазной активностью.
[2] Полинуклеотид по вышеприведенному п.[1], представляющий собой полипептид, определенный в (g) или (f) ниже:
(f) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, в которой от 1 до 10 аминокислот делетированы, заменены, вставлены и/или добавлены к аминокислотной последовательности SEQ ID NO:2, и обладающий диацилглицерол-ацилтрансферазной активностью; и
(g) полинуклеотид, кодирующий белок, у которого аминокислотная последовательность гомологична по меньшей мере на 75% аминокислотной последовательности SEQ ID NO:2, и который обладает диацилглицерол-ацилтрансферазной активностью.
[3] Полинуклеотид по вышеприведенному п.[1], содержащий нуклеотидную последовательность SEQ ID NO:1 или 4.
[4] Полинуклеотид по вышеприведенному п.[1], кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
[5] Полинуклеотид по любому из вышеприведенных пп.[1]-[4], представляющий собой ДНК.
[6] Белок, кодируемый полинуклеотидом по любому из вышеприведенных пп.[1]-[5].
[7] Вектор, включающий полинуклеотид по любому из вышеприведенных пп.[1]-[5].
[8] Трансформант-не человек, с введенным полинуклеотидом по любому из вышеприведенных пп.[1]-[5].
[9] Трансформант-не человек, с введенным вектором по вышеприведенному п.[7].
[10] Трансформант по вышеприведенным пп.[8] или [9], где трансформант представляет собой грибок, продуцирующий липиды.
[11] Трансформант по вышеприведенному п.[10], где грибок, продуцирующий липиды, представляет собой Mortierella alpina.
[12] Способ получения композиции липидов или жирных кислот, включающей сбор композиции липидов или жирных кислот из культуры трансформанта по любому из вышеприведенных пп.[8]-[11].
[13] Способ по вышеприведенному п.[12], где липид представляет собой триацилглицерол.
[14] Способ по вышеприведенному п.[12], где жирная кислота представляет собой арахидоновую кислоту или дигомо-γ-линоленовую кислоту.
[15] Пищевой продукт, лекарственный препарат, косметический продукт или мыло, включающие композицию липидов или жирных кислот, собранных с помощью способа получения по вышеприведенному п.[12].
Полинуклеотид согласно настоящему изобретению можно использовать для трансформации грибка, продуцирующего липиды (например, M. alpina), дрожжей, растений и т.д. Таким образом, полинуклеотид согласно настоящему изобретению вводят в соответствующую клетку-хозяина для получения трансформанта, экспрессирующего вышеописанный полинуклеотид и, как следствие, эффективно продуцирующего триацилглицеролы, богатые DGLA или ARA. Трансформант (грибок, продуцирующий липиды, дрожжи, растения и т.д.), полученный таким образом, может использоваться для продукции композиций жирных кислот, пищевых продуктов, косметических продуктов, лекарственных препаратов, мыл и т.д.
В частности, для трансформанта согласно настоящему изобретению характерна чрезвычайно высокая эффективность продукции липидов и жирных кислот. Соответственно, настоящее изобретение может эффективно использоваться для производства медикаментов или продуктов здорового питания, требующих большого количества липидов или жирных кислот.
Краткое описание фигур
На фиг.1А представлено выравнивание геномной последовательности и кодирующей последовательности MaLRO1.
На фиг.1В представлено выравнивание геномной последовательности и кодирующей последовательности MaLRO1, продолженное с фиг.1А.
На фиг.2А приведена кодирующая последовательность MaLRO1 и его предполагаемая аминокислотная последовательность.
На фиг.2В приведена кодирующая последовательность MaLRO1 и его предполагаемая аминокислотная последовательность, продолженная с фиг.2А.
На фиг.3 приведено выравнивание аминокислотных последовательностей гомологичных белков PDAT различных грибков. Аминокислотные остатки, помеченные «*», важны для активности PDAT и являются консервативными у разных видов грибков и не только.
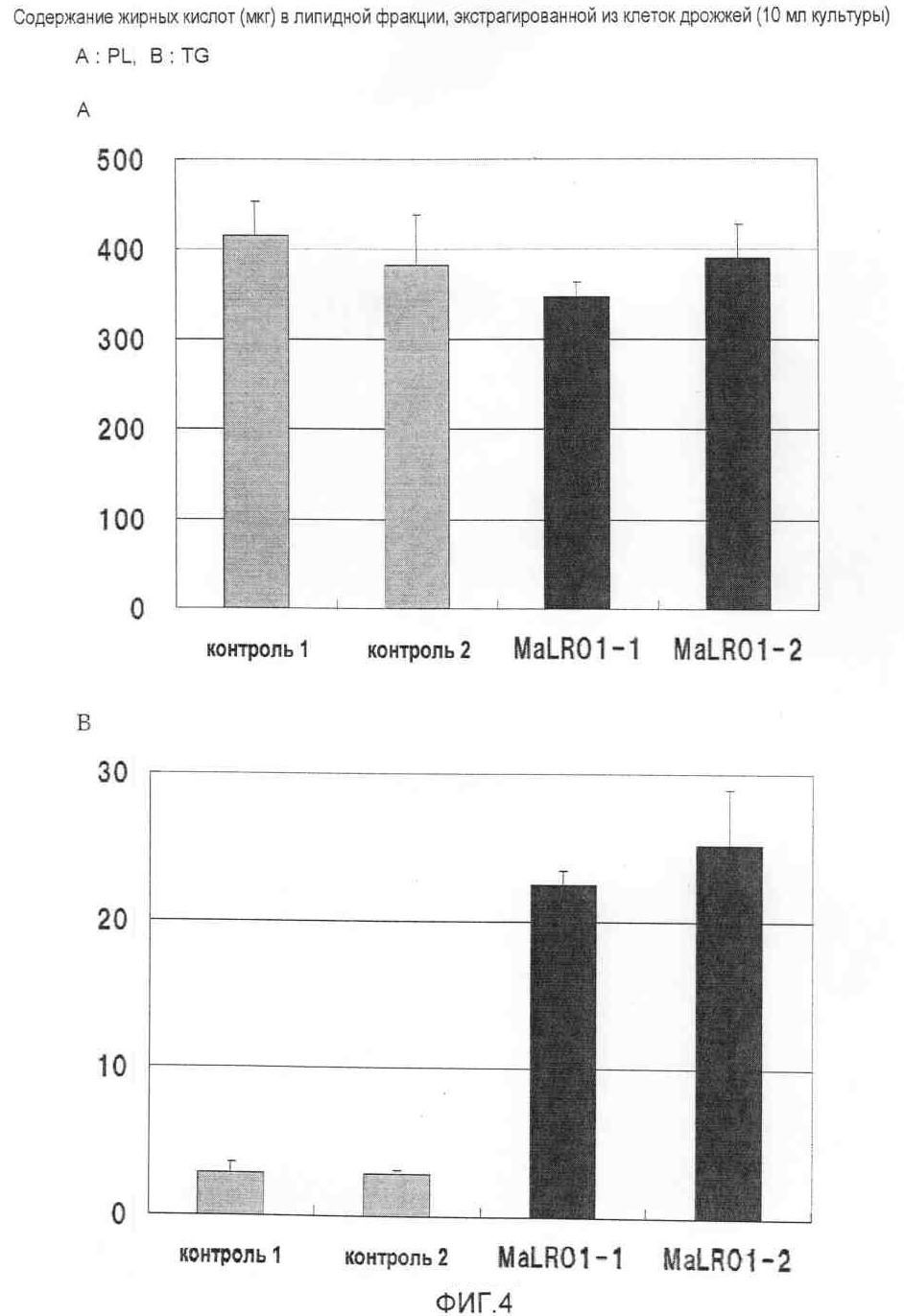
На фиг.4 приведено содержание жирных кислот в липидной фракции, экстрагированной из клеток дрожжей.
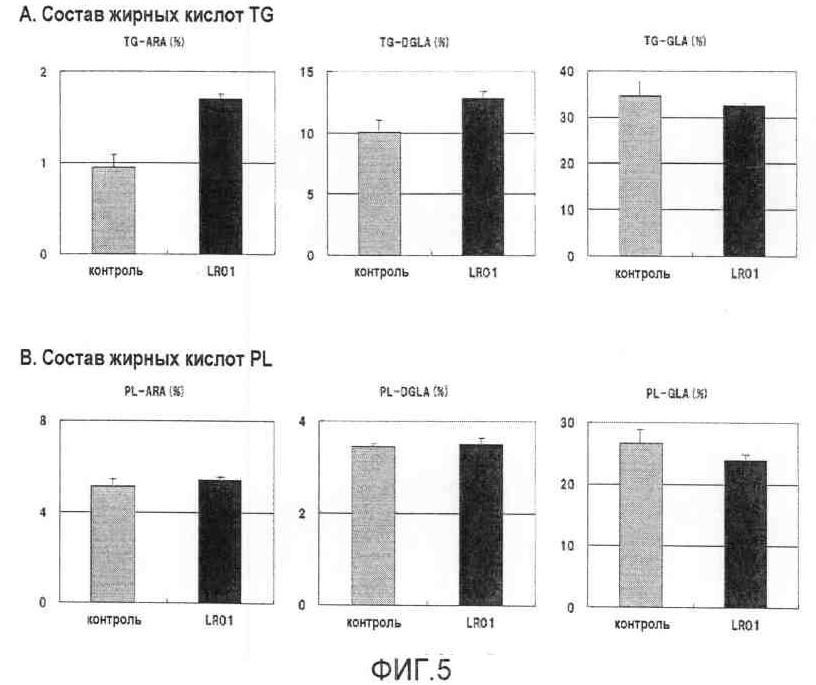
На фиг.5 приведена композиция жирных кислот в липидной фракции, экстрагированной из клеток дрожжей.
Лучший вариант осуществления изобретения
Далее настоящее изобретение описывается детально. Воплощения, приведенные ниже, приведены для описания изобретения с помощью примеров, однако изобретение не ограничено только этими воплощениями. Настоящее изобретение можно осуществлять различными способами без отхода от сущности изобретения.
Все публикации, опубликованные заявки на патенты, патенты и другие патентные документы, процитированные в настоящей заявке, включены в нее полностью путем ссылки. Таким образом, в настоящую заявку включено путем ссылки содержание описания изобретения и чертежей заявки на японский патент (№ 2009-289287), поданной 21 декабря 2009 года, на приоритет которой претендует настоящая заявка.
Авторам настоящего изобретения впервые удалось клонировать ген полноразмерной кДНК гена (MaLRO1) гомологов PDAT, полученных из грибка M. alpina, продуцирующего липиды, что будет более подробно описано ниже в примерах. Авторы настоящего изобретения также определили нуклеотидную последовательность геномной ДНК MaLRO1 M. alpina и его предполагаемую аминокислотную последовательность. Последовательность открытой рамки считывания (ORF MaLRO1), предполагаемая аминокислотная последовательность MaLRO1, кодирующая последовательность MaLRO1, последовательность кДНК MaLRO1 и геномная последовательность MaLRO1 приведены в SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:5 соответственно. Эти полинуклеотиды и ферменты можно получить с помощью способов, описанных в примерах ниже, известных генно-инженерных техник, известных способов синтеза и т.д.
1. Полинуклеотид по изобретению
В настоящем изобретении представлен полинуклеотид, выбираемый из группы, состоящей из (а)-(е) ниже:
(а) полинуклеотид, содержащий нуклеотидную последовательность SEQ ID NO:1 или 4;
(b) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности SEQ ID NO:2;
(с) полинуклеотид, кодирующий белок, состоящий из аминокислотной последовательности, в которой от 1 до 100 аминокислот делетированы, заменены, вставлены и/или добавлены к аминокислотной последовательности SEQ ID NO:2, и обладающий диацилглицерол-ацилтрансферазной активностью;
(d) полинуклеотид, кодирующий белок, у которого аминокислотная последовательность гомологична по меньшей мере на 85% аминокислотной последовательности SEQ ID NO:2, и который обладает диацилглицерол-ацилтрансферазной активностью; и
(е) полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной SEQ ID NO:1 или 4, и кодирующий белок, обладающий диацилглицерол-ацилтрансферазной активностью.
Термин «полинуклеотид», используемый в настоящей заявке, означает ДНК или РНК.
Термин «полинуклеотид, гибридизующийся в жестких условиях», используемый в настоящей заявке, означает полинуклеотид, получаемый способом гибридизации колоний, способом гибридизации бляшек, способом гибридизации по Саузерну и т.п., с использованием в качестве зонда, например, полинуклеотида, состоящего из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1 или 4, или целого или части полинуклеотида, состоящего из нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:2. Использованные способы гибридизации описаны, например, в «Sambook & Russel, Molecular Cloning; A Laboratory Manual», vol.3, Cold Spring Harbor Laboratory press, 2001» и «Ausubel Current Protocols in Molecular Biology, John Wiley & Sons», 1987-1997, и т.п.
Термин «жесткие условия», используемый в настоящей заявке, может означать условия слабой жесткости, условия средней жесткости и условия сильной жесткости. «Условия слабой жесткости» представляют собой, например, 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамида при 32°С. «Условия средней жесткости» представляют собой, например, 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамида при 42°С или 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамида при 42°С. «Условия сильной жесткости» представляют собой, например, 5×SSC, 5× раствор Денхардта, 0,5% SDS, 50% формамида при 50°С или 0,2×SSC, 0,1% SDS при 65°С. Ожидается, что в этих условиях можно эффективно получить ДНК с более высокой гомологией при более высокой температуре, однако на жесткость условий гибридизации влияет множество факторов, включая температуру, концентрацию зонда, длину зонда, ионную силу, время, концентрацию солей и т.д.; специалист в области техники может рассчитать все эти факторы для достижения сходных по жесткости условий.
При использовании для гибридизации коммерческих наборов реактивов, можно использовать, например, систему прямого мечения и детекции Alkphos Direct Labeling and Detection System (GE Healthcare). В этом случае в соответствии с вложенным протоколом, после инкубации с меченым зондом в течение ночи мембрану отмывают первым промывочным буфером с массовой долей SDS 0,1% при 55°С и таким образом детектируют гибридизованную ДНК. Альтернативно, при получении зонда на основе нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1 или 4, или на основе полноразмерной или части нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO:2, гибридизацию можно детектировать с помощью набора реактивов для детекции нуклеиновых кислот DIG Nucleic AcidDetection Kit (Roche Diagnostics), пометив пробу диоксигенином (DIG) и используя коммерческий реактив (например, смесь для мечения PCR Labeling Mix производства Roche Diagnostics) и т.д.
Помимо описанных выше, другие гибридизующиеся полинуклеотиды включают ДНК, идентичную по меньшей мере на 50%, по меньшей мере на 51%, по меньшей мере на 52%, по меньшей мере на 53%, по меньшей мере на 54%, по меньшей мере на 55%, по меньшей мере на 56%, по меньшей мере на 57%, по меньшей мере на 58%, по меньшей мере на 59%, по меньшей мере на 60%, по меньшей мере на 61%, по меньшей мере на 62%, по меньшей мере на 63%, по меньшей мере на 64%, по меньшей мере на 65%, по меньшей мере на 66%, по меньшей мере на 67%, по меньшей мере на 68%, по меньшей мере на 69%, по меньшей мере на 70%, по меньшей мере на 71%, по меньшей мере на 72%, по меньшей мере на 73%, по меньшей мере на 74%, по меньшей мере на 75%, по меньшей мере на 76%, по меньшей мере на 77%, по меньшей мере на 78%, по меньшей мере на 79%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 88%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,1%, по меньшей мере на 99,2%, по меньшей мере на 99,3%, по меньшей мере на 99,4%, по меньшей мере на 99,5%, по меньшей мере на 99,6%, по меньшей мере на 99,7%, по меньшей мере на 99,8%, по меньшей мере на 99,9% или более последовательности ДНК, приведенной в SEQ ID NO:1 или 4, или ДНК, кодирующей аминокислотную последовательность SEQ ID NO:2, рассчитанной с помощью программного обеспечения для поиска гомологии, такого как FASTA и BLAST, с использованием параметров, заданных по умолчанию.
Идентичность аминокислотных последовательностей или нуклеотидных последовательностей можно определить с помощью алгоритма BLAST, разработанного Karlin и Altschul (Proc. Natl. Acad. Sci. USA, 87: 2264-2268, 1990; Proc. Natl. Acad. Sci. USA, 90: 5873, 1993). На основе алгоритма BLAST были разработаны компьютерные программы BLASTN, BLASTX, BLASTP, tBLASTN и tBLASTX (Altschul S.F. et al., J. Mol. Biol. 215: 403, 1990). При секвенировании нуклеотидной последовательности с использованием BLASTN, значения параметров могут составлять, например, score=100 и wordlength=12. При секвенировании аминокислотной последовательности с использованием BLASTP, значения параметров могут составлять, например, score=50 и wordlength=3. При использовании программ BLAST и Gapped BLAST используются значения, принятые по умолчанию для каждой программы.
Вышеописанные полинуклеотиды согласно настоящему изобретению можно получать с помощью известных генно-инженерных техник, известных способов синтеза и т.д.
2. Белок по изобретению
В настоящем изобретении представлен нижеописанный белок.
(i) Белок, кодируемый полинуклеотидом по любому из вышеприведенных (а)-(е).
(ii) Белок, включающий аминокислотную последовательность SEQ ID NO:2.
(iii) Белок, включающий аминокислотную последовательность, в которой одна или более аминокислот делетированы, заменены, вставлены и/или добавлены к SEQ ID NO:2, и обладающий диацилглицерол-ацилтрансферазной активностью.
(iv) Белок с аминокислотной последовательностью, гомологичной по меньшей мере на 60% аминокислотной последовательности SEQ ID NO:2, обладающий диацилглицерол-ацилтрансферазной активностью.
Белки, описанные выше в (iii) или (iv), обычно представляют собой естественные мутанты белка SEQ ID NO:2 и включают белки, получаемые искусственно с помощью сайт-специфического мутагенеза, описанного, например, в «Sambrook & Russell Molecular Cloning: A Laboratory Manual», vol.3, ColdSpring Harbor Laboratory Press, 2001»; «Ausubel Current Protocols in Molecular Biology, John Wiley & Sons, 1987-1997»; Nuc. Acids Res., 10, 6487 (1982); Proc. Natl. Acad. Sci. USA, 79 6409 (1982); Gene, 34, 315 (1985); Nuc. Acids Res., 13, 4431 (1985); Proc. Natl. Acad. Sci. USA, 82, 488 (1985) и т.д.
Термин «белок, содержащий аминокислотную последовательность, в которой одна или более аминокислот делетированы, заменены, вставлены и/или добавлены к аминокислотной последовательности SEQ ID NO:2, и обладающий диацилглицерол-ацилтрансферазной активностью» включает белки, содержащие аминокислотную последовательность, в которой, например, от 1 до 100, от 1 до 90, от 1 до 80, от 1 до 70, от 1 до 60, от 1 до 50, от 1 до 40, от 1 до 39, от 1 до 38, от 1 до 37, от 1 до 36, от 1 до 35, от 1 до 34, от 1 до 33, от 1 до 32, от 1 до 31, от 1 до 30, от 1 до 29, от 1 до 28, от 1 до 27, от 1 до 26, от 1 до 25, от 1 до 24, от 1 до 23, от 1 до 22, от 1 до 21, от 1 до 20, от 1 до 19, от 1 до 18, от 1 до 17, от 1 до 16, от 1 до 15, от 1 до 14, от 1 до 13, от 1 до 12, от 1 до 11, от 1 до 10, от 1 до 9 (от 1 до нескольких), от 1 до 8, от 1 до 7, от 1 до 6, от 1 до 5, от 1 до 4, от 1 до 3, от 1 до 2 или одна аминокислота делетирована, заменена, вставлена и/или добавлена к аминокислотной последовательности SEQ ID NO:2, и обладающие диацилглицерол-ацилтрансферазной активностью. В целом, предпочтительно меньшее число делеций, замен, вставок и/или добавлений.
Такие белки включают белок с аминокислотной последовательностью, гомологичной по меньшей мере на 60%, по меньшей мере на 61%, по меньшей мере на 62%, по меньшей мере на 63%, по меньшей мере на 64%, по меньшей мере на 65%, по меньшей мере на 66%, по меньшей мере на 67%, по меньшей мере на 68%, по меньшей мере на 69%, по меньшей мере на 70%, по меньшей мере на 71%, по меньшей мере на 72%, по меньшей мере на 73%, по меньшей мере на 74%, по меньшей мере на 75%, по меньшей мере на 76%, по меньшей мере на 77%, по меньшей мере на 78%, по меньшей мере на 79%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 88%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,1%, по меньшей мере на 99,2%, по меньшей мере на 99,3%, по меньшей мере на 99,4%, по меньшей мере на 99,5%, по меньшей мере на 99,6%, по меньшей мере на 99,7%, по меньшей мере на 99,8%, по меньшей мере на 99,9% или более аминокислотной последовательности SEQ ID NO:2 и обладающий диацилглицерол-ацилтрансферазной активностью. В целом, предпочтителен белок с более высокой степенью гомологии.
Диацилглицерол-ацилтрансферазную активность можно оценить, например, с помощью способа, описанного в Stahl et al., Plant Physiology 135, 1324-1335 (2004).
Наличие диацилглицерол-ацилтрансферазной активности также можно подтвердить с помощью эксперимента с использованием штаммов дрожжей Δdga1, Δrol1 с пониженной продукцией триацилглицеролов. Если при экспрессии полинуклеотида, кодирующего фермент, в штаммах Δdga1, Δrol1 продукция триацилглициролов повышается, белок или пептид, кодируемый полинуклеотидом, обладает диацилглицерол-ацилтрансферазной активностью. В примерах описано фракционирование липидов на фракцию триацилглицеролов (TG) и фракцию фосфолипидов (PL) и подтверждение повышения уровня продуцируемых триацилглицеролов. Однако изменения уровня продуцируемых фосфолипидов не наблюдалось (фиг.4).
В настоящем изобретении диацилглицерол-ацилтрансферазная активность может представлять собой ацил-CoA:диацилглицерол-ацилтрансферазную активность или фосфолипид:диацилглицерол-ацилтрансферазную активность, предпочтительно, фосфолипид:диацилглицерол-ацилтрансферазную активность.
Делеция, замена, вставка и/или добавление одного или более аминокислотных остатков к аминокислотной последовательности белка согласно изобретению означает, что один или множество аминокислотных остатков делетируют, заменяют, вставляют и/или добавляют в одном или нескольких положениях одной и той же аминокислотной последовательности. Одновременно могут иметь место два или более типа делеций, замен, вставок и добавлений.
Примеры взаимозаменяемых аминокислотных остатков приведены ниже. Аминокислотные остатки одной и той же группы являются взаимозаменяемыми. Группа А: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутановая кислота, метионин, о-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин; группа В: аспартат, глутамат, изоаспартат, изоглутамат, 2-аминоадипиновая кислота и 2-аминосубериновая кислота; группа С: аспарагин и глутамин; группа D: лизин, аргинин, орнитин, 2,4-диаминобутановая кислота и 2,3-аминопропионовая кислота; группа Е: пролин, 3-гидроксипролин и 4-гидроксипролин; группа F: серин, треонин и гомосерин; и группа G: фенилаланин и тирозин.
Белок согласно настоящему изобретению также можно получать способами химического синтеза, такими как способ Fmoc (флуоренилметилоксикарбониловый способ), способ t-Boc (трет-бутилоксикарбониловый способ) и т.д. Кроме того, для химического синтеза могут применяться синтезаторы пептидов производства Advanced Automation Peptide Protein Technologies, Perkin Elmer, Protein Technology Instrument, PerSeptive, Applied Biosystems, SHIMADZU Corp. и т.д.
3. Вектор по изобретению и трансформанты, индуцированные вектором
В другом воплощении в настоящем изобретении также представлен вектор экспрессии, содержащий полинуклеотид по изобретению.
Вектор согласно изобретению конструируют так, чтобы он содержал кассету экспрессии, включающую:
(i) промотор, транскрибируемый в клетке-хозяине;
(ii) любой из полинуклеотидов, описанный в (a)-(g) выше, связанный с промотором; и
(iii) кассету экспрессии, включающую в качестве компонента сигнал, функционирующий в клетке-хозяине как сигнал терминации транскрипции и полиаденилирования молекулы РНК.
Вектор, сконструированный таким образом, вводят в клетку-хозяина. Примеры клеток-хозяев, которые могут использоваться в настоящем изобретении, включают грибки, продуцирующие липиды, дрожжи и т.п.
Грибки, продуцирующие липиды, которые могут использоваться в настоящем изобретении, представляют собой штаммы, описанные, например, в MYCOTAXON, т. XLIV, № 2, стр. 257-265 (1992). Конкретные примеры включают микроорганизмы, принадлежащие к роду Mortierella, включая микроорганизмы, принадлежащие к подроду Mortierella, например Mortierella elongata IFO8570, Mortierella exigua IFO 8571, Mortierella hydrophila IFO5941, Mortierella alpina IFO8568, ATCC 16266, ATCC 32221, ATCC 42430, CBS219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70 и CBS754.68 и т.д., или микроорганизмы, принадлежащие к подроду Micromucor, например, Mortierella isabellina CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308 и IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185 и IFO8287, Mortierella vinacea CBS236.82 и т.д. Из этих грибков предпочтительна Mortierella alpina.
Примерами дрожжей могут служить Saccharomyces cerevisiae NBRC1951, NBRC1952, NBRC1953, NBRC1954 и т.д.
При введении вектора согласно изобретению в дрожжи и оценке диацилглицерол-трансферазной активности белка, кодируемого вектором, отсутствие у дрожжей, используемых в качестве хозяев, генов диацилглицерол-трансферазы (DGA1 и LRO1) дает возможность оценивать только ферментативную активность белка. Соответственно, в воплощении настоящего изобретения у предпочтительных дрожжевых клеток-хозяев отсутствуют гены DGA1 и LRO1.
Эти клетки-хозяева, трансформированные вектором согласно изобретению, продуцируют большее количество липидов, предпочтительно триацилглицеролов (также называемых «триглицериды»), более предпочтительно, триглицеролов, содержащих арахидоновую кислоту или DGLA, и наиболее предпочтительно, триглицеролов, содержащих арахидоновую кислоту, по сравнению с клетками-хозяевами, не трансформированными вектором согласно изобретению.
Векторы для введения в грибки, продуцирующие липиды, включают, но не ограничиваются, например, pDura5 (Appl. Microbiol. Biotechnol., 65, 419-425, (2004)).
Выбор вектора для введения в грибки, продуцирующие липиды, не сильно ограничен, можно использовать любой вектор, способный экспрессировать вставку в клетках дрожжей, включая, например, pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995). Выбор вектора для введения в Mortierella alpina не сильно ограничен, можно использовать любой вектор, способный экспрессировать вставку в клетках Mortierella alpina, включая, например, pDuraMCS для экспрессии в M. alpina.
Промоторы/терминаторы, регулирующие экспрессию в клетках-хозяевах, могут представлять собой произвольную комбинацию, функционирующую в клетках-хозяевах. Например, может использоваться промотор гена гистона H4.1, промотор глицеральдегид-3-фосфатдегидрогеназы и т.д.
В качестве селективного маркера для трансформации могут использовать ауксотрофные маркеры (ura5, niaD), маркеры химической устойчивости (гигромицин, зеоцин), ген устойчивости к генетицину (G418r), ген устойчивости к меди (CUP1) (Marin et al., Proc. Natl. Acad. Sci. USA, 81, 337, 1984), ген устойчивости к церулеину (fas2m, PDR4) (Junji Inokoshi et al., Biochemistry, 64, 660, 1992; и Hussain et al., Gene, 101: 149, 1991 соответственно).
Для трансформации клеток-хозяев могут использоваться известные способы. Например, для трансформации грибков, продуцирующих липиды, можно использовать способ электропорации (Mackenzie D.A. et al., Appl. Environ. Microbiol., 66, 4655-4661, 2000) и способ доставки частиц (способ, описанный в заявке на японский патент № 2005-287403 «Способ выведения грибков, продуцирующих липиды»). Для трансформации дрожжей можно использовать способ электропорации, сферопластный способ (Proc. Natl. Acad. Sci. USA, 75, стр. 1929 (1978)), литий-ацетатный способ (J. Bacteriology, 153, стр. 163 (1983)) и способы, описанные в Proc. Natl. Acad. Sci. USA, 75, стр. 1929 (1978), Methods in yeast genetics, изд. Cold Spring Harbor Laboratory Course Manual (2000) и т.п.
Кроме того, общие техники генетического клонирования описаны по ссылке: Sambrook & Russell, «Molecular Cloning: A Laboratory Manual», т. 3, изд. Cold Spring Harbor Laboratory Press», 2001, «Methods in yeast genetics: A laboratory manual», изд. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.
4. Способ продукции композиции липидов или жирных кислот по изобретению
В другом воплощении в настоящем изобретении далее представлен способ изготовления композиции липидов или жирных кислот, включающей использование вышеописанного трансформанта грибка, продуцирующего липиды, или дрожжей.
Термин «липид», используемый в настоящей заявке, означает простой липид, включая вещество, состоящее из жирной кислоты и спирта, присоединенного с помощью сложноэфирной связи (например, глицерида), или его аналога (например, сложного эфира холестерола) и т.п.; сложный липид, в котором к части простого липида присоединены фосфорная кислота, аминокислота (аминокислоты), или сахарид (сахариды) и т.д.; или производное липида, представляющее собой гидролизат вышеупомянутого липида, нерастворимый в воде.
Термин «масло и жир», используемые в настоящей заявке, означают сложный эфир глицерола и жирной кислоты (глицерид).
Термин «жирная кислота», используемый в настоящей заявке, означает алифатическую монокарбоксикислоту (карбоксикислоту с одной карбоксильной группой и атомами углерода, соединенными в цепочку), в общем случае обозначаемую формулой RCOOH (где R представляет собой алкил). Жирные кислоты включают насыщенные жирные кислоты, не содержащие двойных связей и ненасыщенные кислоты, чья углеводородная цепочка содержит двойную связь (связи).
Композицию липидов или жирных кислот согласно настоящему изобретению можно экстрагировать из клеток, трансформированных согласно настоящему изобретению, следующим образом. Организм-трансформант (например, грибок, продуцирующий липиды, или дрожжи) культивируют и затем обрабатывают стандартным способом, например, с помощью центрифугирования или фильтрации, для получения культивируемых клеток. Клетки тщательно промывают водой и предпочтительно высушивают. Высушивать можно с помощью лиофилизации, высушивания на воздухе и т.д. Высушенные клетки разрушают предпочтительно с помощью дезинтегратора Dynomill или ультрасонификации и далее экстрагируют органическим растворителем предпочтительно в токе азота. Примеры органических растворителей, доступных для использования, включают эфир, гексан, метанол, этанол, хлороформ, дихлорметан, петролейный эфир и т.д. Альтернативно, также хорошие результаты получаются при попеременной экстракции метанолом и петролейным эфиром или экстракцией однофазным растворителем хлорофом-метанол-вода. При дистилляции органического растворителя из экстракта при пониженном давлении получаются липиды, содержащие жирные кислоты. Экстрагированные жирные кислоты можно превратить в метиловые эфиры с помощью соляной кислоты и метанола и т.д.
Кроме того, жирные кислоты можно отделить в виде смеси жирных кислот или смеси сложных эфиров жирных кислот от вышеупомянутых липидов, содержащих жирные кислоты, с помощью стандартных процедур концентрации и сепарации (например, добавления мочевины, сепарации при охлаждении, колоночной хроматографии и т.д.).
Липиды, полученные способом согласно настоящему изобретению, предпочтительно представляют собой триглицеролы, более предпочтительно представляют собой триглицеролы, содержащие арахидоновую или дигомо-γ-линоленовую кислоты, и наиболее предпочтительно представляют собой триацилглицеролы, содержащие арахидоновую кислоту.
Жирные кислоты, полученные способом согласно настоящему изобретению, предпочтительно представляют собой арахидоновую или дигомо-γ-линоленовую кислоты и наиболее предпочтительно представляют собой арахидоновую кислоту. Содержание липидов, полученных способом согласно настоящему изобретению, и состав жирных кислот, содержащихся в липидах, можно подтвердить с помощью способа экстракции липидов или способа сепарации жирных кислот, описанных выше, или их комбинации.
Композиция липидов или жирных кислот, полученных способом продукции согласно настоящему изобретению, может использоваться для продукции, например, продуктов питания, лекарственных препаратов, промышленных материалов (сырья для косметических продуктов, мыла и т.д.), содержащих масла и жиры, и т.п.
Еще в одном воплощении в настоящем изобретении представлен способ получения пищевых продуктов, косметических продуктов, лекарственных препаратов, мыл и т.д. с использованием грибка-трансформанта, продуцирующего липиды, или дрожжей-трансформантов согласно настоящему изобретению. Способ включает стадию образования липидов или жирных кислот с использованием грибка-трансформанта, продуцирующего липиды, или дрожжей-трансформантов согласно настоящему изобретению. Продукты питания, косметические продукты, лекарственные препараты, мыла и т.д., содержащие образованные липид или жирные кислоты, получают стандартными способами. В целом, продукты питания, косметические продукты, лекарственные препараты, мыла и т.д., полученные способом согласно настоящему изобретению, содержат липиды или жирные кислоты, полученные с использованием грибка-трансформанта, продуцирующего липиды, или дрожжей-трансформантов согласно настоящему изобретению. В настоящем изобретении далее представлены продукты питания, косметические продукты, лекарственные препараты, мыла и т.д., полученные с помощью способа.
Форма косметического продукта (композиции) или лекарственного препарата (фармацевтической композиции) согласно настоящему изобретению не ограничена и может представлять собой любую форму, включая вид раствора, пасты, геля, твердого вещества или порошка. Косметическая композиция или фармацевтическая композиция согласно настоящему изобретению может использоваться как косметический продукт или местнодействующее средство для кожи, включая масло, лосьон, крем, эмульсию, гель, шампунь, ополаскиватель для волос, кондиционер для волос, лак, основу под макияж, губную помаду, пудру для лица, маску для лица, мазь, парфюмерный продукт, пудру, одеколон, зубную пасту, мыло, аэрозоль, очищающую пенку и т.д., противовозрастное средство для ухода за кожей, противовоспалительное средство для кожи, средство для ванн, лекарственный тоник, эссенцию красоты, средство для защиты от солнца, или защитное и лечебное средство для проблем с кожей, связанных с травмой, обветриванием или растрескиванием и т.д.
Косметическая композиция согласно настоящему изобретению также может при необходимости включать другие масла и жиры и/или красители, ароматические вещества, консерванты, поверхностно-активные вещества, пигменты, антиоксиданты и т.д. Специалист в области техники может определить необходимую долю этих веществ в составе композиции в зависимости от ее использования (например, массовая доля масел и жиров в композиции может составлять от 1 до 99,99%, предпочтительно от 5 до 99,99% и наиболее предпочтительно от 10 до 99,95%). При необходимости фармацевтическая композиция согласно настоящему изобретению может также включать другие фармацевтически активные компоненты (например, противовоспалительные компоненты) или вспомогательные компоненты (например, смазка или носитель). Примеры других компонентов, обычно используемых в косметических продуктах или препаратах для обработки кожи для наружного применения, включают средство против угревой сыпи, средство для предотвращения перхоти или зуда, антиперспирант и дезодорант, противоожоговое средство, средство против клещей и вшей, средство, размягчающее кератин, средство против ксеродермы, противовирусное средство, средство, повышающее чрезкожную абсорбцию и т.п.
Пищевые продукты согласно настоящему изобретению включают пищевые добавки, здоровое питание, функциональное питание, пищевые продукты для детей младшего возраста, детское питание, модифицированное молоко для младенцев, модифицированное молоко для недоношенных младенцев, питание для пожилых людей и т.д. При использовании в тексте настоящей заявки, питание или пищевые продукты может означать твердые, текучие и жидкие пищевые продукты, а также их смесь, и в совокупности означает продукты, годные для употребления в пищу.
Термин «пищевая добавка» означает пищевые продукты, обогащенные определенными питательными веществами. Термин «здоровое питание» означает оздоравливающие и полезные для здоровья пищевые продукты и охватывает пищевые добавки, натуральные пищевые продукты и диетические пищевые продукты. Термин «функциональное питание» означает пищевой продукт для восполнения питательных веществ, помогающих телу правильно функционировать. Функциональное питание является синонимом питания для специального использования для оздоровления. Термин «питание для детей младшего возраста» означает пищевые продукты, потребляемые детьми в возрасте примерно до 6 лет. Термин «питание для пожилых людей» означает пищевые продукты, обработанные для облегченного переваривания и всасывания по сравнению с необработанными пищевыми продуктами. Термин «модифицированное молоко для питания младенцев» означает, модифицированное молоко, потребляемое детьми примерно до года. Термин «модифицированное молоко для питания недоношенных младенцев» означает модифицированное молоко, потребляемое недоношенными детьми в возрасте примерно до 6 месяцев после рождения.
Эти пищевые продукты включают натуральные продукты (обработанные жирами и маслами), такие как мясо, рыба и орехи; пищевые продукты с жирами и маслами, добавляемыми в процессе готовки, например продукты китайской кухни, китайская лапша, супы и т.д.; продукты питания, приготовленные с использование жиров и масел в качестве среды нагрева, такие как темпура или жаренные во фритюре рыба или овощи, пищевые продукты, жаренные во фритюре, жареный тофу, китайский жареный рис, пончики, японские жареные лепешки или каринто; пищевые продукты на основе жира или масла или полуфабрикаты с жирами и маслами, добавляемыми в процессе обработки, например масло, маргарин, майонез, соус, шоколад, лапша быстрого приготовления, карамель, галеты, печенья, торт, мороженое; и пищевые продукты, сбрызнутые или покрытые жирами и маслами после приготовления, например рисовые крекеры, твердые галеты, хлеб со сладкой бобовой пастой и т.д. Однако пищевые продукты не ограничиваются пищевыми продуктами, содержащими жиры и масла, - другие примеры включают сельскохозяйственные продукты, такие как хлебобулочные изделия, лапшу, вареный рис, конфеты (например, леденцы, жевательная резинка, мармелад, пастилки, японские сладости), тофу и полуфабрикаты на его основе; ферментированные продукты питания, такие как японское рисовое вино или саке, целебный бальзам, сладкое вино для кулинарии (мирин), уксус, соевый соус и паста из мисо или бобов; продукты животноводства, такие как йогурт, ветчина, бекон, сосиски и т.д.; морепродукты, такие как паровые лепешки из рыбного фарша или камабоко; рыбные лепешки, жаренные во фритюре или агетен; лепешки из мяса акулы или ханпен и т.д.; а также фруктовые напитки, прохладительные напитки, спортивные напитки, алкогольные напитки, чай и т.д.
Пищевые продукты согласно настоящему изобретению также могут быть в виде фармацевтических препаратов, таких, как капсулы и т.д. или в виде полуфабрикатов, таких как натуральные жидкие диеты, диеты с заданной формулой и элементные диеты, составленные с жирами и маслами согласно настоящему изобретению вместе с белками, сахарами, микроэлементами, витаминами, эмульгаторами, ароматическими веществами, и т.д., здоровые напитки, парентеральное питание и т.п.
Как описано выше, липиды, в особенности триацилглицеролы, можно эффективно получать путем экспрессии гена диацилглицерол-ацилтрансферазы согласно настоящему изобретению в клетках-хозяевах.
Кроме того, уровень экспрессии гена можно использовать как индикатор для изучения условий культивирования, контроля культивирования и т.д. для эффективной продукции липидов, в особенности триацилглицеролов.
ПРИМЕРЫ
Далее настоящее изобретение описывается более подробно посредством примеров, однако следует понимать, что настоящее изобретение не ограничивается этими примерами.
Анализ генома M. alpina
Штамм 1S-4 M. alpina рассаживали в 100 мл среды GY2:1 (2% глюкозы и 1% дрожжевого экстракта, pH 6,0) и культивировали с перемешиванием при 28°С в течение 2 дней. Клетки грибков собирали с помощью фильтрации и выделяли геномную ДНК с помощью набора реактивов DNeasy (Quiagen).
Нуклеотидную последовательность вышеописанной геномной ДНК расшифровывали с помощью геномного секвенатора Roche 454 Genome Sequencer FLX Standard. Два раза секвенировали библиотеку фрагментов и три раза - библиотеку спаренных оснований. Полученные нуклеотидные последовательности собирали в 300 суперконтигов.
Поиск гомологов LRO1 S. cerevisiae (ScLRO1)
Проводили поиск tblastn в геномной нуклеотидной последовательности штамма 1S-4 M. alpina, используя в качестве запроса предполагаемую аминокислотную последовательность, кодируемую геном PDAT S. cerevisiae (ScLRO1, номер доступа в GenBank Р40345). Было обнаружено совпадение в суперконтиге, содержащем последовательность, приведенную в SEQ ID NO:5. Ген с нуклеотидной последовательностью SEQ ID NO:5 был назван MaLRO1 и его кДНК клонировали следующим образом.
Получение библиотеки кДНК
Штамм 1S-4 M. alpina вносили в 100 мл среды (1,8% глюкозы и 1% дрожжевого экстракта, pH 6,0) и прекультивировали в течение 3 дней при 28°С. В культуральный сосуд объемом 10 л (Able Co., Tokyo) помещали 5 л среды (1,8% глюкозы, 1% соевого порошка, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2×2H2O и 0,05% MgCl2×6H2O, pH 6,0), переносили туда весь прекультивированный продукт и спин-культивировали в аэробных условиях при 300 об/мин, аэрации 1 л/л в мин и 26°С в течение 8 дней. На 1, 2 и 3 дни культивирования добавляли глюкозу в количестве, соответствующем 2%, 2% и 1,5%. Клетки собирали на каждой стадии культивирования на 1, 2, 3, 6 и 8 дни и выделяли тотальную РНК с использованием гуанидингидрохлорида и CsCl. Полиаденилированную РНК отделяли от тотальной РНК с использованием набора реактивов для очистки мРНК Oligotex-dT30<Super> mRNA Purification Kit (Takara Bio). Для каждой стадии получали библиотеку кДНК с использованием набора реактивов для клонирования ZAP-cDNA Gigapack III Cloning Kit (Stratagene).
Клонирование кДНК
Для клонирования кДНК MaLRO1 получали следующие праймеры на основе SEQ ID NO:5.
MaLRO1-1F:5'-CCTGGAATCGTATCAACTGGCCTTG-3' (SEQ ID NO:6)
MaLRO1-3R: 5'-CAGGTCCGCCCGCTCCCGCCTCG-3' (SEQ ID NO:7)
Используя полученную библиотеку кДНК в качестве матрицы, проводили амплификацию PCR с использованием праймеров MaLRO1-1F и MaLRO1-3R, ExTaq (Takara Bio) и циклами, описанными ниже.
[94°С, 2 мин]×1 цикл
[94°С, 1 мин, 55°С, 1 мин, 72°С, 1 мин]×30 циклов
[72°С, 10 мин]×1 цикл
Амплифицированный фрагмент ДНК длиной примерно 0,7 тпн очищали и далее клонировали с использованием набора реагентов для клонирования TOPO-TA-Cloning Kit (Invitrogen Corp).
Нуклеотидную последовательность вставки подтверждали с помощью секвенатора ДНК; плазмиду, несущую нуклеотидную последовательность от 814 до 1485 нуклеотида нуклеотидной последовательности SEQ ID NO:4, назвали pCR-MaLRO1-P. Далее эту плазмиду использовали как матрицу для PCR с праймерами, описанными выше. Для PCR использовали ExTaq (Takara Bio Inc.), но приложенную смесь dNTP заменяли на смесь для мечения PCR (PCR Labeling Kit производства Roche Diagnostics) для получения ДНК, меченной дигоксигенином (DIG) для амплификации.
Вышеописанный зонд использовали для скрининга библиотеки кДНК.
Использовали следующие условия гибридизации:
Буфер: 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамид;
Температура: 42°С (в течение ночи);
Условия отмывки: в растворе 0,2×SSC, 0,1% SDS (65°C) в течение 20 мин, 3 раза.
Детекцию проводили с помощью набора реактивов DIG Nucleic Acid Detection Kit (Roche Diagnostics, Inc.). Из фаговых клонов, полученных в результате скрининга, вырезали плазмиды с помощью эксцизии in vivo для получения соответствующих плазмидных ДНК. Среди плазмид, полученных в результате скрининга, плазмиду с наиболее длинной вставкой назвали pB-MaLRO1-P1.
Сравнивали последовательность вставки и геномную последовательность плазмиды pB-MaLRO1-P1. 5'-конец вставки в плазмиде pB-MaLRO1-P1 обозначен на фиг.1 стрелкой вверх. В геномной последовательности 5'-концевую последовательность, обозначенную стрелкой вверх в геномной последовательности, анализировали от последовательности вставки MaLRO1-P1 по направлению к 5'-концу. Обнаружились два кодона инициации ATG ближе к 3'-концу, чем первый стоп-кодон в рамке считывания, предположительно кодирующей MaLRO1. Далее, получали 5'-праймер MaLRO1-6F, содержащий кодон инициации на 5'-конце, и 3'-праймер MaLRO1-5R.
MaLRO1-5R: 5'-CTCTCCTGGATAGAACTCTTCCTCGG-3' (SEQ ID NO:8)
MaLRO1-6F: 5'-ATGGCTTGGCGAGGGCAACTCAC-3' (SEQ ID NO:9)
Используя в качестве матрицы кДНК, полученную из штамма 1S-4 M. alpina, проводили PCR с использованием праймеров MaLRO1-6F и MaLRO1-5R и ExTaq (Takara Bio). Полученный фрагмент ДНК длиной примерно 0,75 тпн клонировали с использованием набора реактивов для клонирования TOPO-TA Cloning Kit и определяли нуклеотидную последовательность вставки. Вставка содержала нуклеотидную последовательность SEQ ID NO:4 от 1 до 762 нуклеотида, что позволяло предположить, что первый кодон инициации ATG в SEQ ID NO:4 будет транскрибироваться. Полученную таким образом нуклеотидную последовательность лигировали к нуклеотидной последовательности вставки плазмиды pB-MaLRO1-P1 для получения нуклеотидной последовательности SEQ ID NO:4; эту нуклеотидную последовательность считали нуклеотидной последовательностью кДНК MaLRO1.
Анализ сиквенса
Последовательность SEQ ID NO:4 содержала кодирующую последовательность (SEQ ID NO:3) в последовательности нуклеотидов от 1 до 2400 и открытую рамку считывания (SEQ ID NO:1) в последовательности нуклеотидов 1-2397. Аминокислотная последовательность, выведенная из SEQ ID NO:1, приведена в SEQ ID NO:2 на фиг.2. Геномную последовательность (SEQ ID NO:5) MaLRO1 сравнивали с последовательностью кДНК (SEQ ID NO:4) MaLRO1 (фиг.1). Из приведенных результатов видно, что геномная последовательность гена MaLRO1 состоит из 5 интронов и 6 экзонов.
С помощью tblastp был проведен поиск аминокислотной последовательности MaLRO1, приведенной в SEQ ID NO:2, против аминокислотной последовательности, зарегистрированной в GenBank. Оказалось, что аминокислотная последовательность MaLRO1, приведенная в SEQ ID NO:2, обладает определенной степенью гомологии гомологу LRO1, полученному из грибка. Наивысшая степень гомологии (35,7%) была обнаружена с предполагаемым белком (ЕАК81307) с неизвестной функцией базидиомицета Ustilago Maydis. MaLRO1 гомологичен на 31,7% LRO1 (XP_504038) Yarrowia lipolytica и на 28,9% LRO1 S. cerevisiae. Также сравнивали SEQ ID NO:2 и аминокислотные последовательности вышеописанных гомологов LRO1, полученных из грибков (фиг.3). Три аминокислотных остатка, вероятно, составляющие активный центр, оказались консервативными у всех гомологов.
Конструирование вектора экспрессии
Конструировали вектор экспрессии со структурой, подходящей для высокой экспрессии гена LRO1 M. alpina в дрожжах S. cerevisiae.
Вначале получали праймер Bam-MaLRO1-F.
Bam-MaLRO1-F: 5'-GGATCCATGGCTTGGCGAGGGCAACTCAC-3' (SEQ ID NO:10)
Используя в качестве матрицы кДНК, полученную из штамма 1S-4 M. alpina, проводили PCR с праймерами Bam-MaLRO1-F и MaLRO1-5R с использованием KOD-plus (Toyobo). Полученный фрагмент ДНК длиной примерно 0,75 тпн клонировали с использованием набора реактивов Zero Blunt TOPO Cloning Kit (Invitrogen) для подтверждения нуклеотидной последовательности. Последовательность сравнивали с последовательностью кДНК MaLRO1; плазмиду с перекрывающимися участками нуклеотидной последовательности назвали pCR-MaLRO1-5'. Плазмиду pCR-MaLRO1-5' разрезали рестрикционными фрагментами BamHI и PstI. Используя набор реактивов для лигирования Qiock Ligation Kit (New England BioLabs), получившийся фрагмент ДНК длиной примерно 0,35 тпн лигировали к фрагменту ДНК длиной примерно 2,05 тпн, полученному путем разрезания плазмиды pB-MaLRO1-P1 рестрикционными ферментами PstI и XhoI, и фрагменту ДНК длиной примерно 8,3 тпн, полученному путем разрезания дрожжевого вектора экспрессии pYE22m рестрикционными ферментами BamHI и SalI. Полученную плазмиду назвали pYEMaLRO1.
Экспрессия в штаммах Δdga1 и Δlro1 дрожжей S. cerevisiae
(1) Получение штаммов Δdga1 и Δlro1 дрожжей S. cerevisiae
(1-1) Клонирование генов S. cerevisiae DGA1 и LRO1
С целью клонирования полноразмерного гена S. cerevisiae DGA1 (YOR245C, далее обозначаемого как ScDGA1), и гена LRO1 (YNR008W, далее обозначаемого как ScLRO1) получали следующие праймеры.
ScDGA1-F1: 5'-GAATTCATGTCAGGAACATTCAATGATATA-3' (SEQ ID NO:11)
ScDGA1-R1: 5'-GTCGACTTACCCAACTATCTTCAATTCTGC-3' (SEQ ID NO:12)
ScLRO1-F1: 5'-GAATTCATGGGCACACTGTTTCGAAGAAAT-3' (SEQ ID NO:13)
ScLRO1-R1: 5'-GTCGACTTACATTGGGAAGGGCATCTGAGA-3' (SEQ ID NO:14)
Одну платиновую петлю дрожжей S. cerevisiae штамма S288C вносили в 10 мл жидкой среды YPD (Difco) и культивировали с перемешиванием при 30°С в течение дня. Клетки собирали с помощью центрифугирования и экстрагировали ДНК с помощью GenTLE Kun (Takara Bio) для дрожжей.
Используя эту ДНК в качестве матрицы, проводили PCR с использованием полимеразы ExTaq (Takara Bio) и пары праймеров ScDGA1-F1 и ScDGA1-R1 или пары праймеров ScLRO1-F1 и ScLRO1-R1. Фрагмент ДНК длиной примерно 1,3 тпн и фрагмент ДНК длиной примерно 2 тпн, полученные с соответствующими парами, клонировали с использованием набора реактивов для клонирования TA-Cloning Kit (Invitrogen) для подтверждения нуклеотидных последовательностей. Плазмиды с правильными нуклеотидными последовательностями назвали pCR-ScDGA1 и pCR-ScLRO1 соответственно.
(1-2) Конструирование плазмиды pCR-Δdga1:URA3-1
Фрагмент ДНК длиной примерно 4,5 тпн, полученный путем разрезания плазмиды pCR-ScDGA1 рестрикционными ферментами HpaI и AatI, лигировали к фрагменту ДНК длиной примерно 1,2 тпн, полученного путем разрезания плазмиды pURA34 (JPA2001-120276) рестрикционным ферментом HindIII и далее получения ДНК с тупыми концами с помощью набора реактивов DNA Blunting Kit (Takara Bio) с использованием Ligation High (Toyobo). Плазмиду, в которой ген URA3 оказался вставлен в той же ориентации, что и ген ScDGA1, назвали CR-Δdga1:URA3-1.
(1-3) конструирование плазмиды pUC-Δlro1:LEU2-1
Фрагмент ДНК длиной примерно 2 тпн, полученный путем разрезания плазмиды pCR-ScLRO1 рестрикционными ферментами EcoRI и SalI, лигировали к продукту рестрикции pUC18 тем же рестрикционным ферментом с использованием Ligation High (Toyobo) для получения плазмиды pUC-ScLRO1. Плазмиду разрезали рестрикционными ферментами XbaI и ApaI и далее получали ДНК с тупыми концами с помощью набора реактивов DNA Blunting Kit (Takara Bio). Полученный фрагмент ДНК длиной примерно 3,8 тпн лигировали к фрагменту ДНК длиной примерно 2,2 тпн, полученному путем разрезания плазмиды YEp13 (номер доступа в GenBank U03498) рестрикционными ферментами SalI и XhoI и далее получения ДНК с тупыми концами, с помощью Ligation High (Toyobo). Плазмиду, в которой ген URA3 оказался вставлен в той же ориентации, что и ген ScDGA1, назвали pUC-Δlro1:LEU2-1.
(1-4) Получение трансформанта
Используя штамм YPH499 S. cerevisiae (ura3-52 lys2-801amber ade2-101ochre trp1-Δ63 his3-Δ200 leu2-Δ1 a) (Stratagene) в качестве хозяина, получали трансформанты следующим образом. В частности, проводили ко-трансформацию литий-ацетатным способом, с использованием фрагмента ДНК, амплифицированного с помощью PCR с парой праймеров ScDGA1-F1 и Sc-DGA1-R1 и плазмидой pCR-Δdga1:URA3-1 в качестве матрицы, и фрагмента ДНК, амплифицированного PCR с парой праймеров ScLRO1-F1 и ScLRO1-R1 и плазмидой pUC-Δlro1:LEU2-1 в качестве матрицы. Полученных трансформантов скринировали на способность к росту на агаровой среде SC-Leu, Ura (2% агара) (на литр, 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 аминокислот в порошке (смесь 1,25 г аденина сульфата, 0,6 г аргинина, 3 г аспартата, 3 г глутамата, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана). Из числа трансформантов, полученных таким образом, из случайных двух клеток выделяли ДНК с помощью GenTLE Kun (Takara Bio) для дрожжей. Используя эти ДНК в качестве матриц, проводили PCR с использованием следующих пар праймеров (1)-(4).
(1) ScDGA1-F1 и ScDGA1-R1
(2) ScDGA1-F1 и ScDGA1-R2
(3) ScLRO1-F1 и ScLRO1-R1
(4) ScLRO1-F1 и ScLRO1-R2
ScDGA1-R2: 5'-GACCAGTGTCATCAGAGAAATAGG-3' (SEQ ID NO:15)
ScLRO1-R2: 5'-GAGCTGGAACTGCCTTTGGAGC-3' (SEQ ID NO:16)
В результате с парой праймеров (1) амплифицировался фрагмент ДНК длиной примерно 1,8 тпн, а с парой праймеров (3) амплифицировался фрагмент ДНК длиной примерно 3,3 тпн, но ни в одном штамме не амплифицировался фрагмент ДНК с парами праймеров (2) и (4). Результаты подтверждают, что эти штаммы представляли собой штаммы Δdga1, Δlro1. Для получения следующих трансформантов использовался один из этих штаммов, выбранный случайным образом.
(2) Трансфекция дрожжей S. cerevisiae штаммов Δdga1, Δlro1 и анализ
(2-1) Получение трансформантов
Штаммы Δdga1 и Δlro1 трансформировали плазмидами pYE22m и pYE-MaLRO1 соответственно с помощью литий-ацетатного способа. Трансформантов скринировали на способность к росту на агаровой среде SC-Trp, Leu, Ura (2% агара) (на литр, 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы, 1,3 аминокислот в порошке (смесь 1,25 г аденина сульфата, 0,6 г аргинина, 3 г аспартата, 3 г глутамата, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина). Из штаммов, трансфицированных плазмидами, выбирали случайным образом по два штамма для дальнейшего культурального анализа. Штаммы, трансформированные pYE22m, назвали C/ΔDG#1 и 2, а штаммы, трансформированные pYE-MaLRO1, назвали MaLRO1/ΔDG#1 и 2.
(2-2) Культивирование трансформантов
Одну платиновую петлю каждого из трансформантов C/ΔDG#1 и 2 и MaLRO1/ΔDG#1 и 2 вносили в 10 мл жидкой среды SC-Trp, Leu, Ura и культивировали с перемешиванием при 30°С в течение ночи. Полученный культуральный раствор в количестве 1 мл вносили в 10 мл жидкой среды YPDA (1% дрожжевого экстракта, 2% пептона, 2% глюкозы и 0,0075% 1-аденина гемисульфата) и культивировали с перемешиванием при 30°С в течение 24 часов. Клетки собирали с помощью центрифугирования, промывали водой и лиофилизировали. Лиофилизированные клетки разрушали с помощью стеклянных бусин и экстрагировали липиды в 8 мл смеси хлороформ:метанол в соотношении 2:1. Проводили тонкослойную хроматографию (TLC) на пластинке Силикагеля 60 (Merck), используя смесь гексан:диэтиловый эфир:уксусная кислота в соотношениях 70:30:1 в качестве проявляющего растворителя для фракционирования липидов. Липиды детектировали путем распыления водного раствора 0,015% примулина и 80% ацетона (раствора примулина) и облучения ультрафиолетовыми лучами для визуализации липидов. Фракцию триацилглицеролов (TG) и фракцию фосфолипидов (PL) помечали карандашом, соскребали силикагель и помещали в соответствующие пробирки. После преобразования жирных кислот в метиловые сложные эфиры с помощью соляной кислоты и метанола проводили анализ жирных кислот с помощью газовой хроматографии. В частности, жирные кислоты преобразовывали в метиловые эфиры путем добавления 1 мл дихлорметана и 2 мл 10% соляной кислоты-метанола и реакции при 50°С в течение 3 часов. Далее к реакционной смеси добавляли 4 мл гексана и 1 мл воды и энергично перемешивали. Затем смесь центрифугировали и фракционировали верхний слой. Растворитель удаляли с помощью дистилляции с использованием концентратора «speed-vac», а осадок растворяли в ацетонитриле. Далее этот раствор подвергали газовой хроматографии для анализа жирных кислот. В реакции метилирования, описанной выше, добавляли трикозаноевую кислоту в качестве внутреннего контроля для определения количества жирных кислот. Результаты приведены на фиг.4.
В штаммах MaLRO1/ΔDG#1 и 2, экспрессировавших MaLRO1 в качестве гомолога PDAT из M. alpina, уровень TG был повышен примерно в 10 раз по сравнению с контрольными штаммами С/ΔDG#1 и 2, что свидетельствует о том, что MaLRO1 обладает активностью синтеза триглицеридов.
Экспрессия в дрожжах, продуцирующих арахидоновую кислоту
(1) Выведение дрожжей, продуцирующих арахидоновую кислоту
Для выведения штамма дрожжей (S. cerevisiae), продуцирующих арахидоновую кислоту, конструировали следующие плазмиды.
Вначале, используя кДНК, полученную из штамма 1S-4 M. alpina в качестве матрицы, проводили PCR с ExTaq и парами праймеров Δ12-f и Δ12-r, Δ6-f и Δ6-r, GLELO-f и GLELO-r, или Δ5-f и Δ5-r для амплификации гена десатуразы жирных кислот Δ12 (номер доступа в GenBank АВ020033), гена десатуразы жирных кислот Δ6 (номер доступа в GenBank АВ020032), гена элонгазы жирных кислот (номер доступа в GenBank АВ193123) и гена десатуразы жирных кислот Δ5 (номер доступа в GenBank АВ188307) в штамме 1S-4 M. alpina.
Δ12-f: TCTAGAATGGCACCTCCCAACACTATTG (SEQ ID NO:17)
Δ12-r: AAGCTTTTACTTCTTGAAAAAGACCACGTC (SEQ ID NO:18)
Δ6-f: TCTAGAATGGCTGCTGCTCCCAGTGTGAG (SEQ ID NO:19)
Δ6-r: AAGCTTTTACTGTGCCTTGCCCATCTTGG (SEQ ID NO:20)
GLELO-f: TCTAGAATGGAGTCGATTGCGCAATTCC (SEQ ID NO:21)
GLELO-r: GAGCTCTTACTGCAACTTCCTTGCCTTCTC (SEQ ID NO:22)
Δ5-f: TCTAGAATGGGTGCGGACACAGGAAAAACC (SEQ ID NO:23)
Δ5-r: AAGCTTTTACTCTTCCTTGGGACGAAGACC (SEQ ID NO:24)
Эти гены клонировали с использованием набора реактивов для клонирования TOPO-TA-Cloning Kit. Нуклеотидную последовательность клонов подтверждали, и клоны, содержащие нуклеотидные последовательности генов Δ12, Δ6, GLELO и Δ5, называли плазмидами pCR-MAΔ12DS (содержащую нуклеотидную последовательность гена Δ12), pCR-MAΔ6DS (содержащую нуклеотидную последовательность гена Δ6), pCR-MAGLELO (содержащую нуклеотидную последовательность гена GLELO) и pCR-MAΔ5DS (содержащую нуклеотидную последовательность гена Δ5) соответственно.
Также плазмиду pURA34 (JPA2001-120276) разрезали рестрикционным ферментом HindIII. Полученный фрагмент ДНК длиной примерно 1,2 тпн вставляли в сайт HindIII вектора, полученного путем разрезания вектора pUC18 рестрикционными ферментами EcoRI и SphI, далее получения ДНК с тупыми концами и лигирования указанного вектора самого на себя. Клон, в котором сайт EcoRI вектора находился к 5'-концу от URA3, назвали pUC-URA3. Также фрагмент ДНК длиной примерно 2,2 тпн, полученный путем разрезания Yep13 рестрикционными ферментами SalI и XhoI, вставляли в сайт SalI вектора pUC18. Клон, в котором сайт EcoRI вектора находился к 5'-концу от LUE2, назвали pUC-LEU2.
Далее плазмиду pCR-MAΔ12DS разрезали рестрикционным ферментом HindIII, затем получали ДНК с тупыми концами и разрезали рестрикционным ферментом XbaI. Полученный фрагмент ДНК длиной примерно 1,2 тпн лигировали с фрагментом ДНК длиной примерно 6,6 тпн, полученным путем разрезания вектора pESC-URA (Stratagene) рестрикционным ферментом SacI, получения ДНК с тупыми концами и далее разрезания рестрикционным ферментном SpeI, в результате чего получали плазмиду pESC-U-Δ12. Плазмиду pCR-MAΔ6DS разрезали рестрикционным ферментом XbaI, получали ДНК с тупыми концами и далее разрезали рестрикционным ферментом HindIII. Полученный фрагмент ДНК длиной примерно 1,6 тпн лигировали к фрагменту ДНК длиной примерно 8 тпн, полученному при разрезании плазмиды pESC-U-Δ12 рестрикционным ферментом SalI, получения ДНК с тупыми концами и далее разрезания рестрикционным ферментом HindIII, в результате чего получали плазмиду pECS-U-Δ12:Δ6. Эту плазмиду частично разрезали рестрикционным ферментом PvuII. Полученный фрагмент длиной примерно 4,2 тпн вставляли в сайт SmaI pUC-URA3 для получения плазмиды pUC-URA-Δ12:Δ6.
Также плазмиду pCR-MAGLELO разрезали рестрикционными ферментами XbaI и SacI. Полученный фрагмент ДНК длиной примерно 0,95 тпн лигировали к фрагменту ДНК длиной примерно 7,7 тпн, полученному при разрезании вектора pESC-LEU (Stratagene) рестрикционными ферментами XbaI и SacI для получения плазмиды pESC-L-GLELO. Плазмиду pCR-MAΔ5DS разрезали рестрикционным ферментом XbaI, получали ДНК с тупыми концами и далее разрезали рестрикционным ферментом HindIII. Полученный фрагмент ДНК длиной примерно 1,3 тпн лигировали к фрагменту ДНК длиной примерно 8,7 тпн, полученному при разрезании плазмиды pESC-L-GLELO рестрикционным ферментом ApaI, получения ДНК с тупыми концами и далее разрезания рестрикционным ферментом HindIII, для получения плазмиды pESC-L-GLELO:Δ5. Эту плазмиду разрезали рестрикционным ферментом PvuII и полученный фрагмент длиной примерно 3,2 тпн вставляли в сайт SmaI pUC-LEU2 для получения плазмиды pUC-LEU-GLELO:Δ5. Штамм YPH499 Saccharomyces cerevisiae (Stratagene) ко-трансформировали плазмидой pUC-URA-Δ12:Δ6 и плазмидой pUC-LEU-GLELO:Δ5. Трансформантов скринировали на способность к росту на агаровой среде SC-Leu, Ura. Из числа трансформантов, полученных таким образом, один случайный штамм назвали ARA3-1. При культивировании этого штамма в среде с добавлением галактозы, штамм может экспрессировать с промотора GAL1/10 ген десатуразы жирных кислот Δ12, ген десатуразы жирных кислот Δ6, ген GLELO и ген десатуразы жирных кислот Δ5.
(2) Трасформация дрожжей, продуцирующих аразидоновую кислоту и анализ
Штамм ARA3-1 трансформировали плазмидами pYE22m и pYE-MaLRO1. Трансформантов скринировали на способность к росту на агаровой среде SC-Trp, Leu, Ura (2% агара) (на литр, 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 аминокислот в порошке (смесь 1,25 г аденина сульфата, 0,6 г аргинина, 3 г аспартата, 3 г глутамата, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина). Четыре штамма, выбранные случайным образом из соответствующих штаммов, трансфицированных плазмидами, использовали для дальнейшего культивирования.
Эти штаммы культивировали при 30°С в течение дня в 10 мл жидкой среды SC-Trp, Leu, Ura, описанной выше. Далее, по 1 мл культур этих штаммов культивировали при 15°С в течение 6 дней в 10 мл жидкой среды SG-Trp, Leu, Ura (на литр, 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г галактозы и 1,3 аминокислот в порошке (смесь 1,25 г аденина сульфата, 0,6 г аргинина, 3 г аспартата, 3 г глутамата, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина) с добавлением γ-линоленовой кислоты до 50 мкг/мл. Эксперимент повторяли дважды. Клетки собирали, промывали водой и затем лиофилизировали. К лиофилизированным клеткам добавляли 4 мл смеси хлороформ:метанол в соотношении 2:1 и инкубировали при 70°С в течение часа, затем центрифугировали и собирали супернатант. К клеточному осадку добавляли вторые 4 мл смеси хлороформ:метанол в соотношении 2:1. Смесь центрифугировали, супернатант собирали и объединяли с предыдущим супернатантом. Растворитель удаляли с помощью дистилляции с использованием концентратора «speed-vac», осадок растворяли в небольшом количестве хлороформа. Проводили TLC на пластинке Силикагель 60 (Merck), используя смесь гексан:диэтиловый эфир:уксусная кислота в соотношении 70:30:1 в качестве проявляющего растворителя для фракционирования липидов. Липиды детектировали путем распыления раствора примулина и облучения ультрафиолетовыми лучами. Фракции TG и PL соскребали и каждую фракцию переносили в пробирку. После преобразования жирных кислот в метиловые сложные эфиры с помощью соляной кислоты и метанола, с помощью газовой хроматографии анализировали жирные кислоты.
Соотношения полиненасыщенных жирных кислот (polyunsaturated fatty acids, PUFA) во фракции TG и фракции PL приведены на фиг.5. В штамме, экспрессирующем MaLRO1, доля DGLA в TG и арахидоновой кислоты (ARA) была повышена по сравнению с контролем (фиг.5А). Дрожжевые штаммы, используемые в вышеописанном примере, обладали способностью продуцировать арахидоновую кислот из-за вставленных генов десатуразы жирных кислот Δ12, десатуразы жирных кислот Δ6, GLELO и десатуразы жирных кислот Δ5. Система продукции арахидоновой кислоты у этих штаммов сходна с таковой у M. alpina. У M. alpina GLELO продуцирует DGLA из γ-линоленовой кислоты (DGA), связанной с CoA, и DGLA встраивается в липиды. Далее десатураза жирных кислот Δ5 действует на DGLA, находящуюся в основном в виде ацильных остатков фосфатидилхолина, в результате чего получается ARA. Считается, что в штаммах дрожжей, используемых в вышеописанном примере, DGLA будет связана с CoA или присутствовать в других липидах и далее будет присутствовать в виде ацильных остатков фосфатидилхолина, как и у M. alpina. Кроме того, считается, что ARA продуцируется в основном в виде ацильных остатков фосфатидилхолина. Таким образом, считается, что ген MaLRO1 кодирует «диацилглицерол-ацилтрансферазу фосфолипидов», чьими субстратами являются фосфолипиды.
Из данных по содержанию жирных кислот в фосфолипидах было видно, что DGLA и ARA присутствуют в равных соотношениях в контроле и в штамме, экспрессирующем MaLRO1 (фиг.5В).
Исходя из этих результатов, можно предположить, что MaLRO1 высокоспецифична в отношении DGLA и ARA и что использование MaLRO1 позволит эффективно получать TG с повышенным содержанием DGLA и ARA.
Конструирование вектора экспрессии для M. alpina
Для экспрессии в M. alpina использовали вектор pDuraMCS, в котором ген-мишень экспрессируется с промотора гистона.
Для экспрессии гена MaLRO1 в M. alpina вектор конструировали следующим образом. Плазмиду pCR-MaLRO1-5' разрезали рестрикционными ферментами BamHI и PstI. Полученный фрагмент ДНА длиной примерно 0,35 тпн лигировали к фрагменту ДНК длиной примерно 2,05 тпн, полученному путем разрезания плазмиды pB-MaLRO1-P1 рестрикционными ферментами PstI и XhoI, и фрагмента ДНК длиной примерно 8,3 тпн, полученному путем разрезания вектора pDuraMCS для экспресии в M. alpina рестрикционными ферментами BamHI и SalI, с использованием набора реактивов Quick Ligation Kit (New England Biolabs). Полученную плазмиду назвали pDuraMCS-MaLRO1.
Получение трансформантов M. alpina
Используя в качестве хозяина урацил-ауксотрофный штамм Δura-3, полученный из штамма 1S-4 M. alpina и описанный в брошюре международной публикации PCT WO 2005019437, озаглавленной «Способ выведения грибка, продуцирующего липиды», проводили трансформацию этой плазмидой способом доставки частиц. Для скринига трансформантов использовали агаровую среду SC (0,5% дрожжевой азотной основы без аминокислот и сульфата аммония (Difco), 0,17% сульфата аммония, 2% глюкозы, 0,002% аденина, 0,003% тирозина, 0,0001% метионина, 0,0002% аргинина, 0,0002% гистидина, 0,0004% лизина, 0,0004% триптофана, 0,0005% треонина, 0,0006% изолейцина, 0,0006% лейцина, 0,0006% фенилаланина и 2% агара).
Анализ трансформантов M. alpina
13 полученных трансформантов вносили в 10 мл среды GY (2% глюкозы и 1% дрожжевого экстракта) и культивировали при 28°С и 300 об/мин в течение 10 дней. Трансформанта с наивысшей продукцией арахидоновой кислоты, обнаруженного в результате скрининга, назвали LRO1-1.
13 полученных трансформантов по отдельности вносили в 4 мл среды GY и культивировали с перемешиванием при 28°С в течение 2 дней. Клетки собирали с помощью фильтрации и экстрагировали РНК с использованием набора реактивов RNeasy Plant Kit (Quiagen). Для синтеза кДНК использовали систему SuperScript First Strand System for RT-PCR (Invitrogen). Для подтверждения экспрессии гена MaLRO1 с введенного конструкта проводили RT-PCR со следующими парами праймеров:
Праймер PD4P: 5'-CGCATCCCGCAAACACACAC-3' (SEQ ID NO:25)
Праймер MaLRO1-5R: 5'-CTCTCCTGGATAGAACTCTTCCTCGG-3' (SEQ ID NO:8)
Для подтверждения экспрессии гена MaLRO1, включая эндогенный ген MaLRO1 и ген MaLRO1 во введенном конструкте, проводили PCR с использованием праймеров MaLRO1-1F и MaLRO1-3R и пары праймеров MaLRO1-2F и MaLRO1-4R, приведенных ниже. Амплифицированные фрагменты ДНК подтверждали с помощью электрофореза в агарозном геле. После проведения 20 циклов PCR полоса, соответствующая фрагменту ДНК, амплифицированному в штамме LRO1-1, была темнее, чем полоса контрольного штамма. Результаты подтвердили, что уровень экспрессии гена MaLRO1 был повышен в штамме LRO1-1 по сравнению с контрольным штаммом.
MaLRO1-1F: 5'-CCTGGAATCGTATCAACTGGCCTTG-3' (SEQ ID NO:6)
MaLRO1-3R: 5'-CAGGTCCGCCCGCTCCCGCCTCG-3' (SEQ ID NO:7)
MaLRO1-2F: 5'-GGCGGACCCAACTGGGTGAACGAC-3' (SEQ ID NO:26)
MaLRO1-4R: 5'-TCACAAGTCGACCTTGGCAGAGTAC-3' (SEQ ID NO:27)
Трансформант LRO1-1 и контрольный штамм 1S-4 M. alpina вносили (n=3) в 4 мл среды GY и культивировали при перемешивании при 28°С и 125 об/мин. На 9 день культивирования все клетки собирали путем фильтрации и лиофилизировали. После фракционирования части лиофилизированных клеток (примерно 10-20 мг) жирные кислоты в клетках преобразовывали в метиловые сложные эфиры с помощью соляной кислоты и метанола и экстрагировали гексаном. В осадке, полученном после удаления гексана с помощью дистилляции, определяли долю арахидоновой кислоты («ARA (%)» в таблице 1) в общих жирных кислотах в клетках с использованием газовой хроматографии.
|
Как показано в таблице 1, высокий уровень экспрессии гена MaLRO1 в M. alpina приводит к увеличению доли арахидоновой кислоты в общих жирных кислотах.
К части лиофилизированных клеток (примерно 10-20 мг) добавляли примерно 4 мл смеси хлороформ:метанол в соотношении 2:1. Смесь инкубировали при 70°С в течение часа, центрифугировали и отбирали супернатант. К осадку клетов вновь добавляли 4 мл смеси хлороформ:метанол в соотношении 2:1. Смесь центрифугировали, супернатант отбирали и объединяли с предыдущим супернатантом. Растворитель удаляли путем дистилляции с помощью концентратора «speed-vac», а осадок растворяли в небольшом количестве хлороформа. Проводили TLC на пластинке Силикагель 60 (Merck), используя смесь гексан:диэтиловый эфир:уксусная кислота в соотношении 70:30:1 в качестве проявляющего растворителя для фракционирования липидов. Липиды детектировали путем распыления раствора примулина и облучения ультрафиолетовыми лучами. Фракции TG и PL соскребали и каждую фракцию переносили в пробирку. После преобразования жирных кислот в метиловые сложные эфиры с помощью соляной кислоты и метанола, с помощью газовой хроматографии анализировали жирные кислоты.
|
Как показано в таблице 2, высокий уровень экспрессии гена MaLRO1 в M. alpina приводит к увеличению доли арахидоновой кислоты в триглицеридах.
Промышленная применимость
Экспрессия полинуклеотида согласно настоящему изобретению в соответствующих клетках-хозяевах приводит к эффективной продукции триацилглицеролов с высоким содержанием DGLA или ARA. Жирные кислоты, продуцируемые в клетках-хозяевах согласно настоящему изобретению, могут использоваться при производстве пищевых продуктов, косметики, лекарственных препаратов, мыл и т.д.
Список последовательностей
SEQ ID NO:6: синтетическая ДНК
SEQ ID NO:7: синтетическая ДНК
SEQ ID NO:8: синтетическая ДНК
SEQ ID NO:9: синтетическая ДНК
SEQ ID NO:10: синтетическая ДНК
SEQ ID NO:11: синтетическая ДНК
SEQ ID NO:12: синтетическая ДНК
SEQ ID NO:13: синтетическая ДНК
SEQ ID NO:14: синтетическая ДНК
SEQ ID NO:15: синтетическая ДНК
SEQ ID NO:16: синтетическая ДНК
SEQ ID NO:17: синтетическая ДНК
SEQ ID NO:18: синтетическая ДНК
SEQ ID NO:19: синтетическая ДНК
SEQ ID NO:20: синтетическая ДНК
SEQ ID NO:21: синтетическая ДНК
SEQ ID NO:22: синтетическая ДНК
SEQ ID NO:23: синтетическая ДНК
SEQ ID NO:24: синтетическая ДНК
SEQ ID NO:25: синтетическая ДНК
SEQ ID NO:24: синтетическая ДНК
SEQ ID NO:25: синтетическая ДНК