ОРАЛЬНО РАСПАДАЮЩИЕСЯ ТАБЛЕТОЧНЫЕ КОМПОЗИЦИИ ТЕМАЗЕПАМА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет предварительной заявки на патент США №61/015,931, поданной 21 декабря 2007 г., которая включена в данный документ путем ссылки во всей своей полноте для всех целей.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение касается орально распадающихся таблеточных композиций и улучшенных способов получения таких композиций. Композиции данного изобретения включают лекарственное средство, 0,5-3% ODT связывающего полимера, сахарный спирт и/или сахарид, и дезинтегрант.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Дисфагия, или трудность глотания из-за страха удушья, распространена среди всех возрастных групп. Например, она наблюдается у приблизительно 35% общей популяции, а также еще 30-40% пожилых институционализированных пациентов и 18-22% всех лиц в долгосрочной лечебных учреждениях, многие из которых должны регулярно употреблять лекарства для поддержания качества их жизни. Это ведет к плохому соблюдению или даже несоблюдению режима лечения и, таким образом, оказывает отрицательное влияние на эффективность лечения. Традиционные капсульные или таблеточные дозированные формы также неудобны для людей, "живущих на ходу", которые часто не имеют доступа к питьевой воде или жидкостям. Кроме того, некоторые педиатрические, гериатрические и психиатрические пациенты проявляют "щековое" поведение (т.е., держат оральную дозированную форму за щекой), чтобы избежать глотания лекарства. Следовательно, ODT состав был бы желательным для улучшения соблюдения пациентом режима лечения, особенно среди пожилых и институционализированных пациентов, поскольку ODT составы легче глотать и предупреждать держание за щекой.
Однако для того, чтобы быть фармакологически приемлемыми, ODT составы должны быть вкусными, например, обладать приемлемыми органолептическими свойствами, такими как хороший вкус, и привкусом, поскольку ODT таблетки разработаны для распада во рту пациента. Для лучшего вкуса лекарственных средств ODT составу может потребоваться маскирующий вкус полимер для улучшения вкусовых характеристик состава и для обеспечения "сливочного" привкуса. Кроме того, ODT состав также должен быть обеспечен приемлемыми фармакокинетическими характеристиками и биодоступностью для достижения желательного терапевтического эффекта. Эти желательные свойства ODT состава могут быть несовместимыми, т.е. маскирующий вкус может ингибировать или задерживать высвобождение лекарственного средства, тем самым обеспечивая неприемлемые фармакокинетические свойства. Наоборот, компоненты состава, которые обеспечивают быстрое высвобождение, могут давать нежелательные свойства вкуса или вкусовых ощущений во рту. Наконец, любая ODT композиция с подходящими органолептическими и фармакокинетическими свойствами также должна быть произведена с коммерчески применимыми скоростями и выходами.
Следовательно, приемлемый ODT состав должен уравновешивать такие несовместимые характеристики для того, чтобы обеспечить вкусную (например, с замаскированным вкусом), быстро распадающуюся композицию с приемлемыми фармакокинетическими характеристиками.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на орально распадающиеся таблеточные композиции, включающие терапевтически эффективное количество, по меньшей мере, одного лекарственного средства (например, темазепама), 0,5-3% ODT связывающего полимера, сахарный спирт и/или сахарида и дезинтегранта.
В другом варианте осуществления орально распадающиеся таблеточные композиции данного изобретения включают частицы лекарственного средства и быстро диспергирующиеся микрогранулы, где быстро диспергирующиеся микрогранулы включают сахарный спирт и/или сахарид в комбинации с дезинтегрантом, а частицы лекарственного средства включают лекарственное средство и ODT связывающий полимер.
В другом варианте осуществления орально распадающиеся таблеточные композиции данного изобретения включают покрытые лекарственным средством гранулы и быстро диспергирующиеся микрогранулы, где быстро диспергирующиеся микрогранулы включают сахарный спирт и/или сахарид в комбинации с дезинтегрантом, а покрытые лекарственным средством гранулы включают инертные ядра, покрытые, по меньшей мере, одним лекарственным средством и ODT связывающим полимером.
В другом варианте осуществления данное изобретение направлено на способ приготовления орально распадающейся таблеточной композиции, при котором смешивают, по меньшей мере, одно лекарственное средство, 0,5-3% ODT связывающего полимера, сахарный спирт и/или сахарид, и дезинтегрант, и прессуют указанную смесь, посредством этого формируя орально распадающуюся таблетку.
В другом варианте осуществления способ данного изобретения включает гранулирование смеси, включающей, по меньшей мере, одно лекарственное средство и ODT связывающий полимер, посредством этого формирование микрогранул лекарственного средства; гранулирование смеси дезинтегранта, включающей сахарный спирт и/или сахарид в комбинации с дезинтегрантом в присутствии ODT связывающего средства, посредством этого формирование быстро диспергирующихся микрогранул; смешивание микрогранул лекарственного средства и быстро диспергирующихся микрогранул; и прессование смеси микрогранул лекарственного средства, быстро диспергирующихся микрочастиц и факультативно других фармацевтически приемлемых формообразующих средств (например, ароматизатор, подсластитель, вспомогательное средство для прессования и т.д.), посредством этого формирование орально распадающейся таблетки.
В другом варианте осуществления способ данного изобретения включает растворение или суспендирование, по меньшей мере, одного лекарственного средства и наслаивающегося на лекарственное средство связывающего полимера в растворителе; покрытие раствором или суспензией лекарственного средства инертного ядра для формирования гранул с наслоенным лекарственным средством; гранулирование смеси дезинтегранта, включающей сахарный спирт и/или сахарид в комбинации с дезинтегрантом, посредством этого формируя быстро диспергирующиеся микрогранулы, и прессование смеси гранул с наслоенным лекарственным средством, быстро диспергирующихся микрочастиц и факультативно других фармацевтически приемлемых формообразующих средств (например, ароматизатор, подсластитель, вспомогательное средство для прессования и т.д.), посредством этого формируя ODT.
В другом варианте осуществления данное изобретение направлено на способ улучшения придерживания пациентом режима лечения с введением лекарственного средства, такого как темазепам, включающий введение орально распадающейся таблеточной композиции, включающей терапевтически эффективное количество лекарственного средства (например, темазепам), 0,5-3% ODT связывающего полимера, сахарный спирт и/или сахарид, и дезинтегрант, пациенту, нуждающемуся в этом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
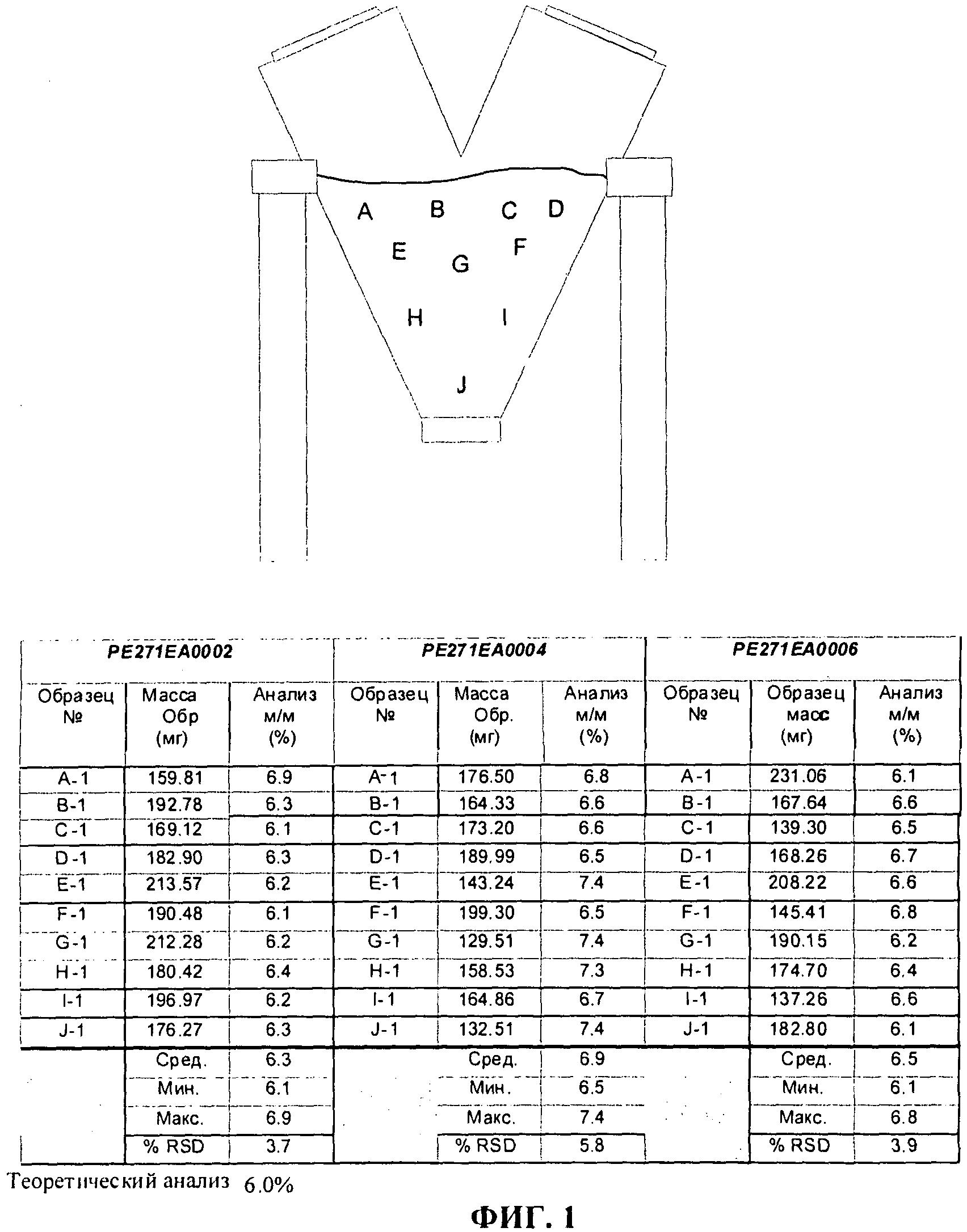
ФИГ.1 показывает места равномерного отбора образцов смесь для 10 ft3 V-смеситель, и соответствующие значения анализа, определенные с применением утвержденной аналитической методике.
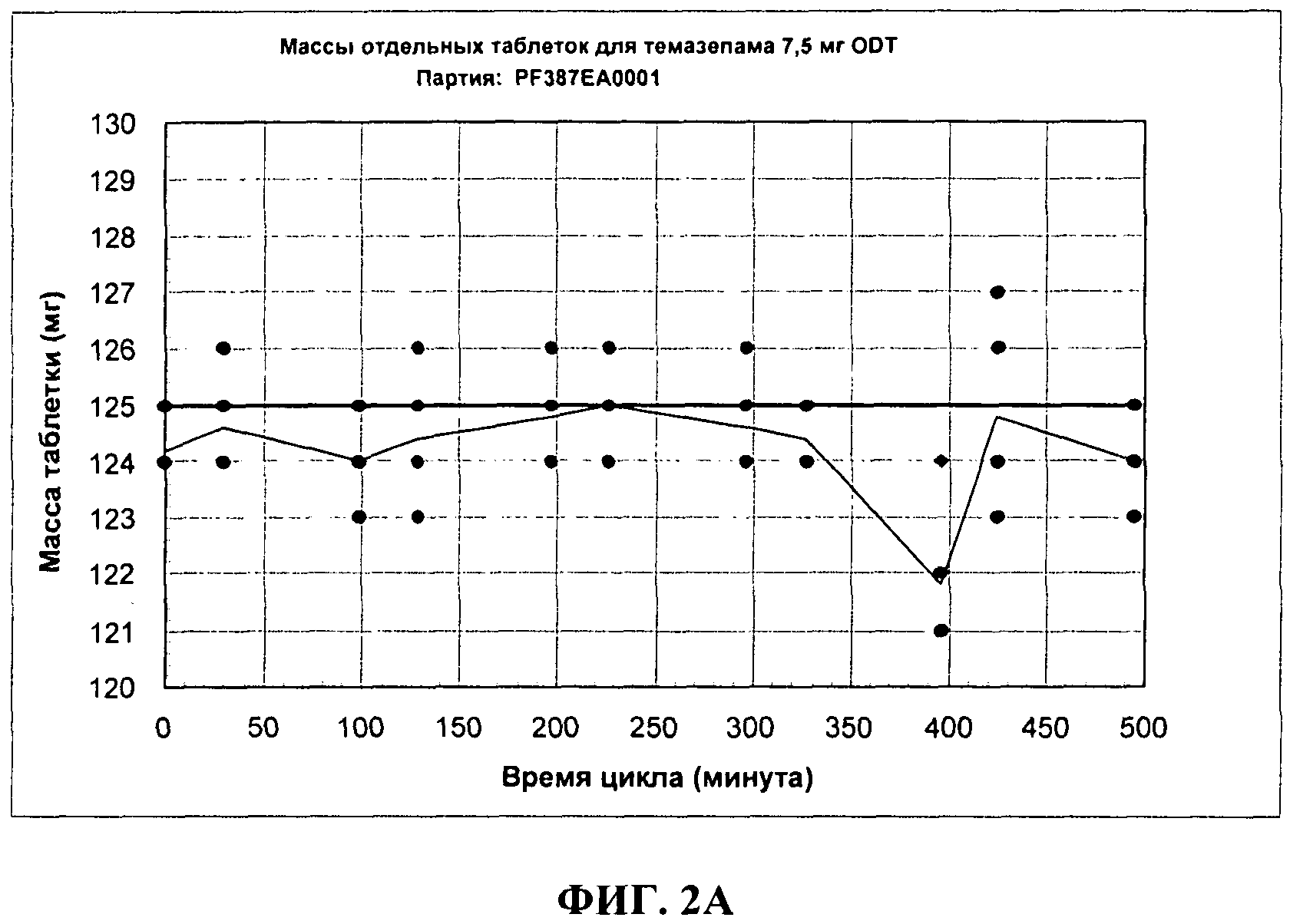
ФИГ.2А показывает изменения массы таблеток для 7,5 мг темазепама ODT дозированных форм Примера 3.
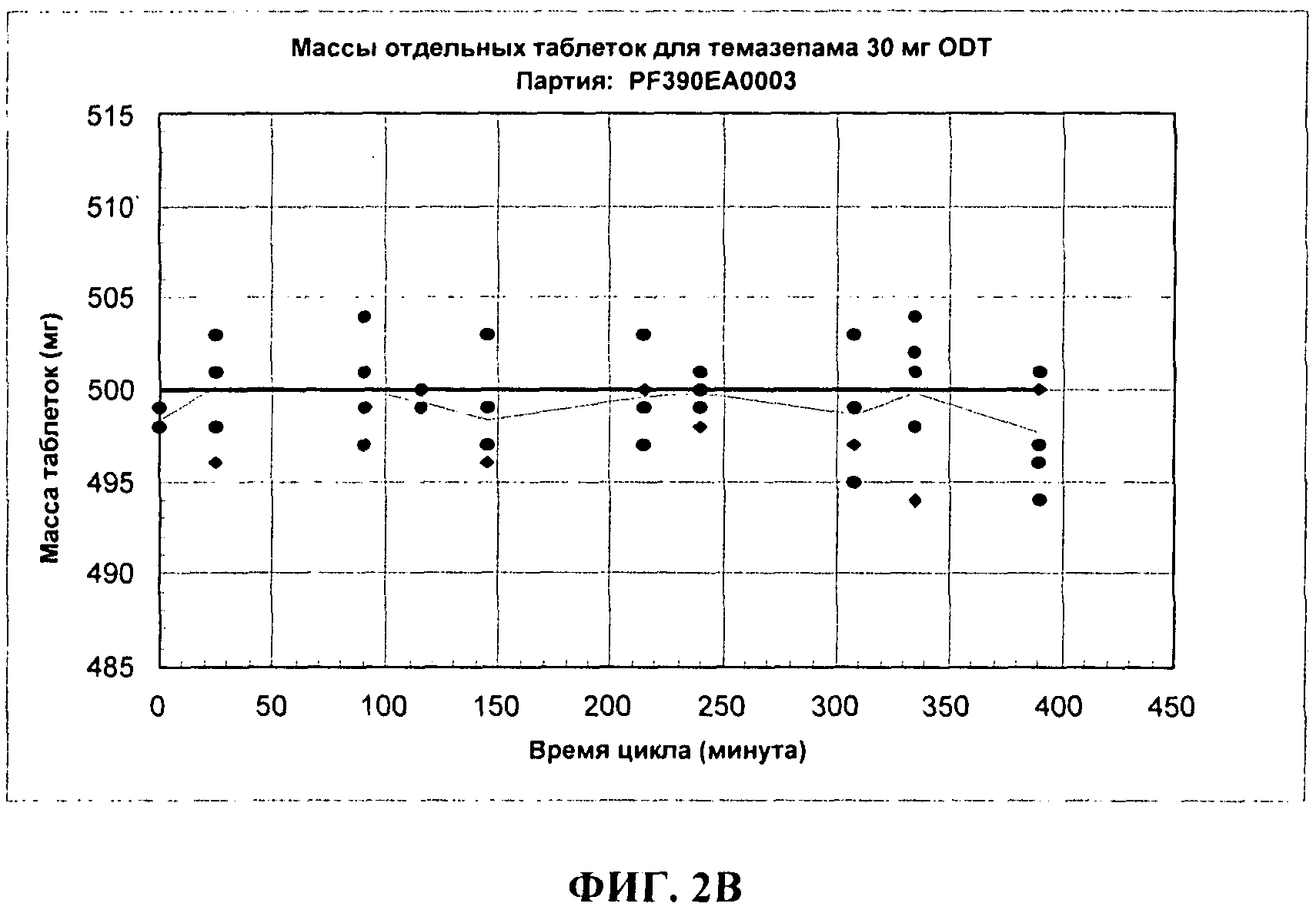
ФИГ.2В показывает изменения массы таблеток для 30 мг темазепама ODT дозированных форм Примера 3.
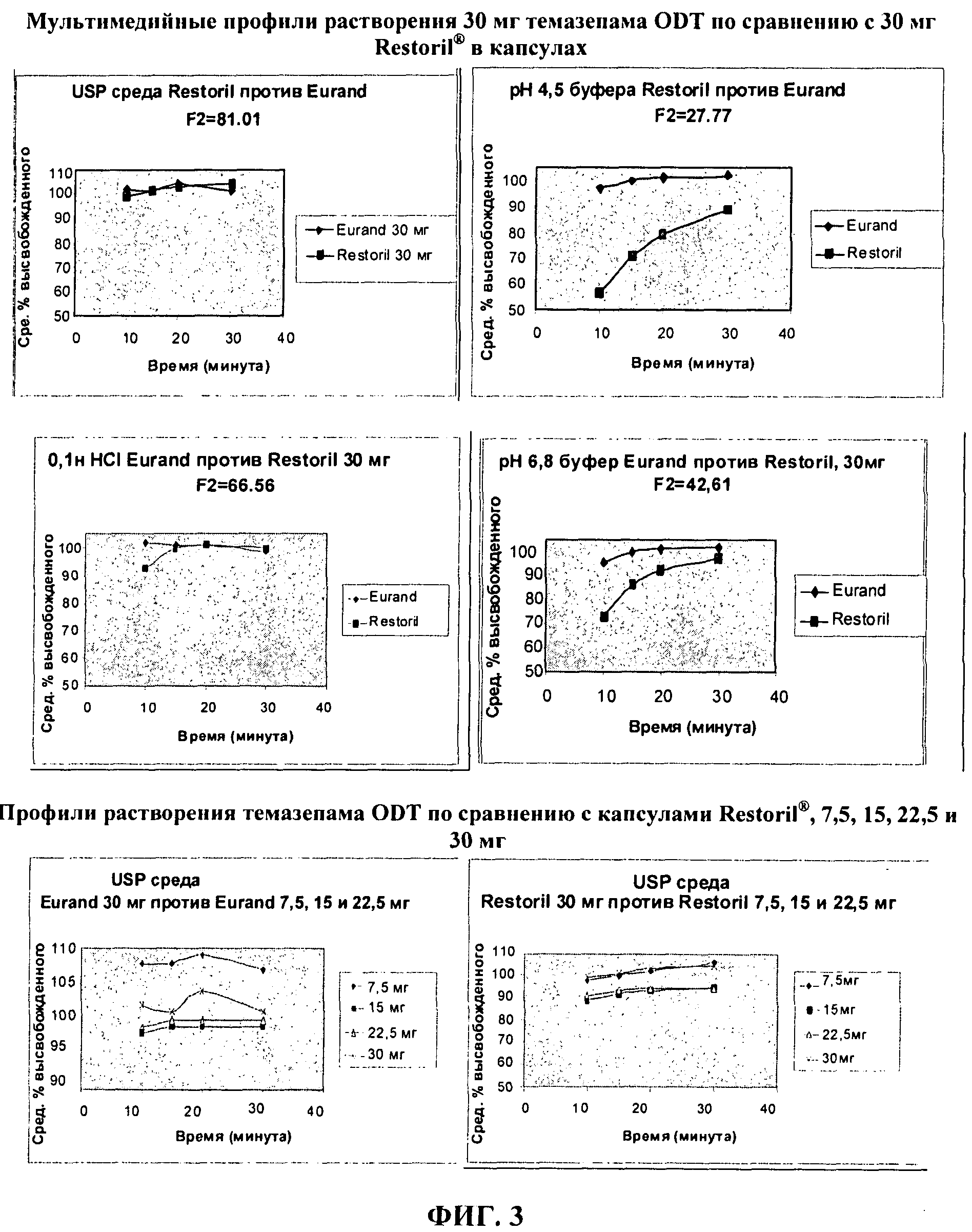
ФИГ.3 показывает мультимедийные профили растворения для 30 мг темазепама ODT дозированных форм по сравнению с 30 мг капсулами Restoril®, официальная среда USP (Фармакопея США), pH 4,5 (вверху); 0,1 н HCl, pH 6,8 (в середине) и 30 мг, 22,5 мг, 15 мг и 7,5 мг дозами ODT или капсулами Restoril® в официальной среде USP (внизу).
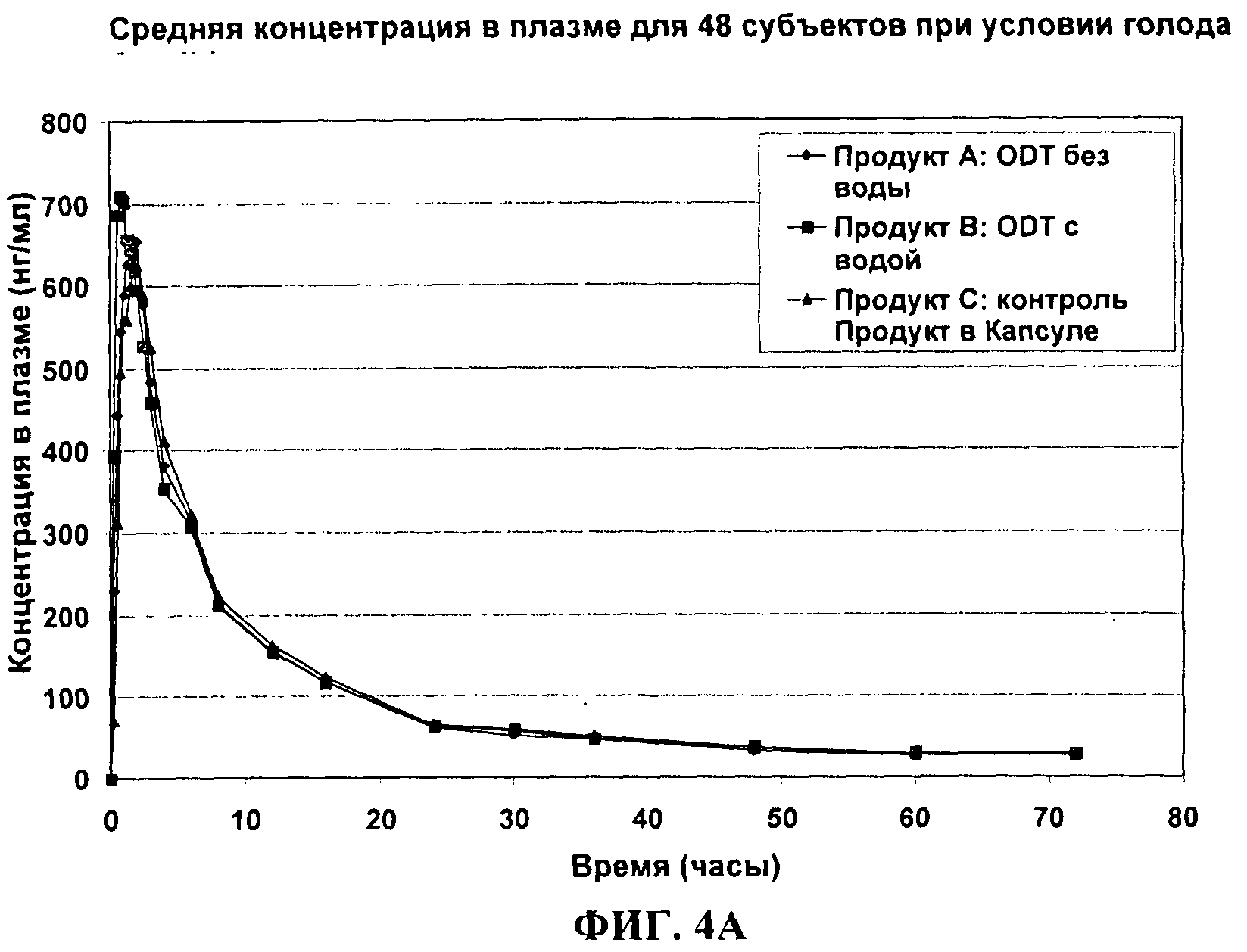
ФИГ.4А сравнивает средние профили концентрации в плазме в зависимости от времени для 30 мг темазепама ODT, дозированного без воды (А) или с водой (В), по сравнению с 30 мг капсулами Restoril® у нормальных людей натощак.
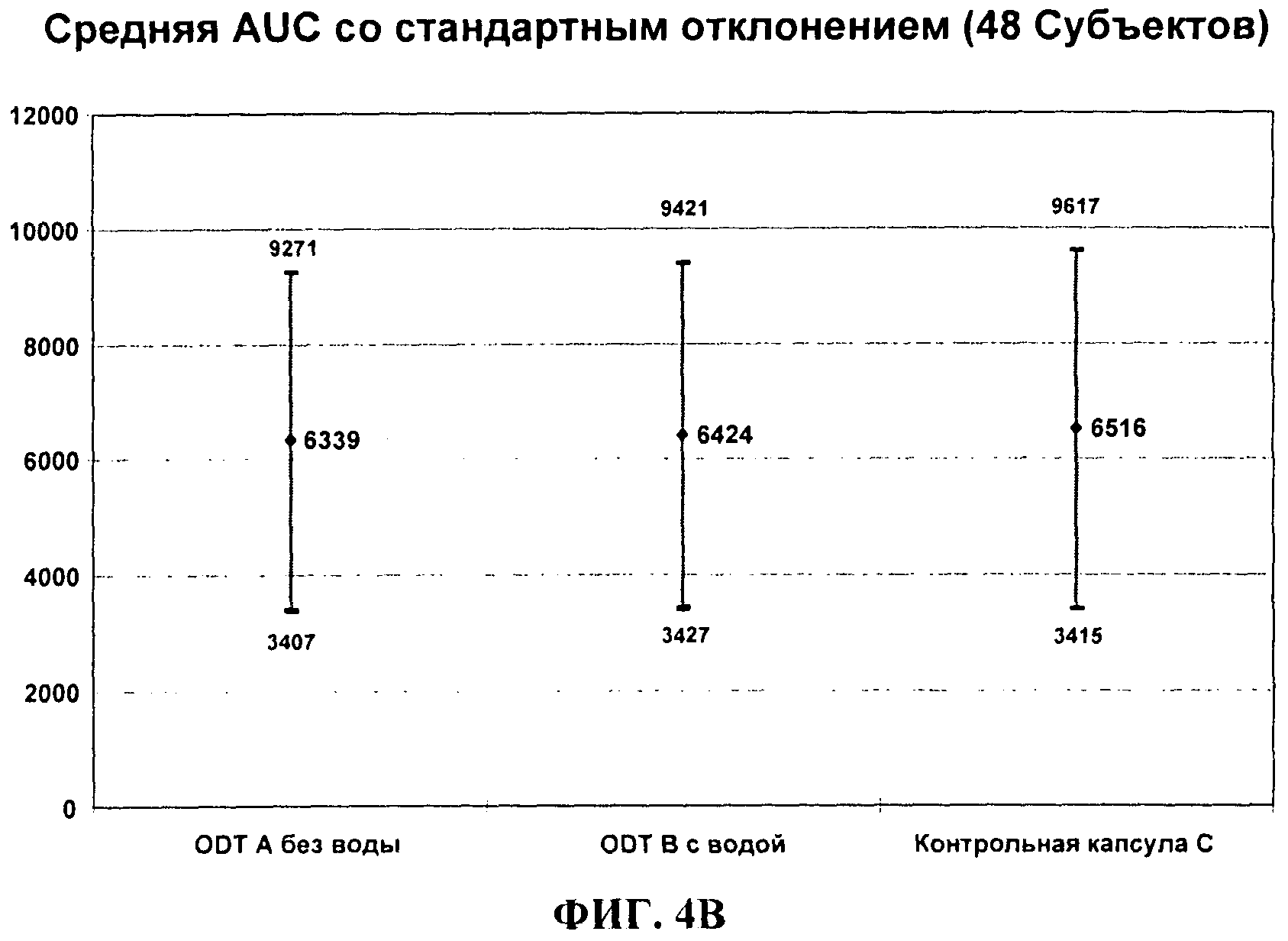
ФИГ.4В сравнивает среднюю AUC (площадь под кривой) (со стандартными отклонениями) для 30 мг темазепама ODT, дозированного без воды (А) или с водой (В) по сравнению с 30 мг капсулами Restoril® у нормальных людей натощак.
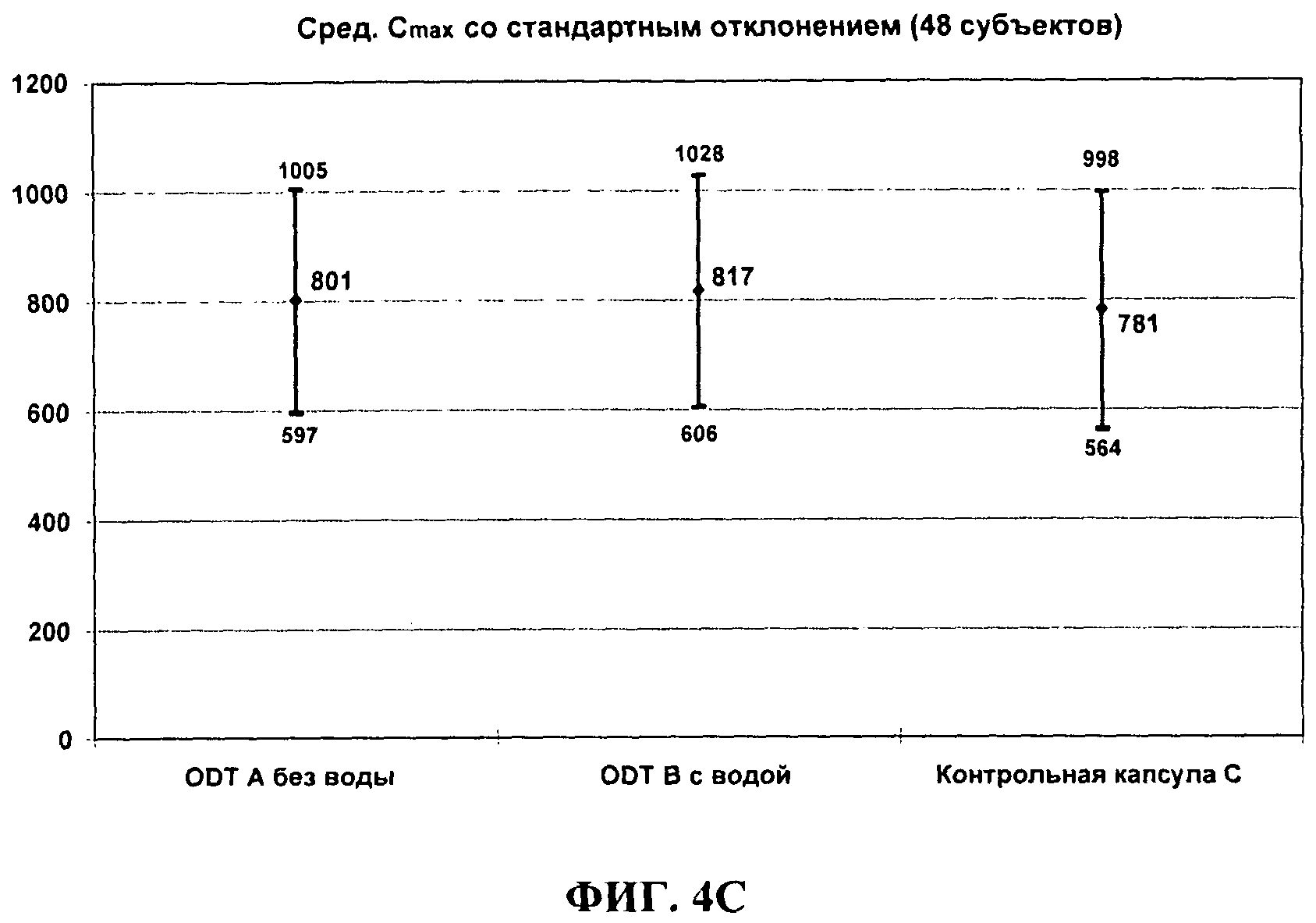
ФИГ.4С сравнивает среднюю Cmax (со стандартными отклонениями) для 30 мг темазепама ODT, дозированного без воды (А) или с водой (В) по сравнению с 30 мг капсулами Restoril® у нормальных людей натощак.
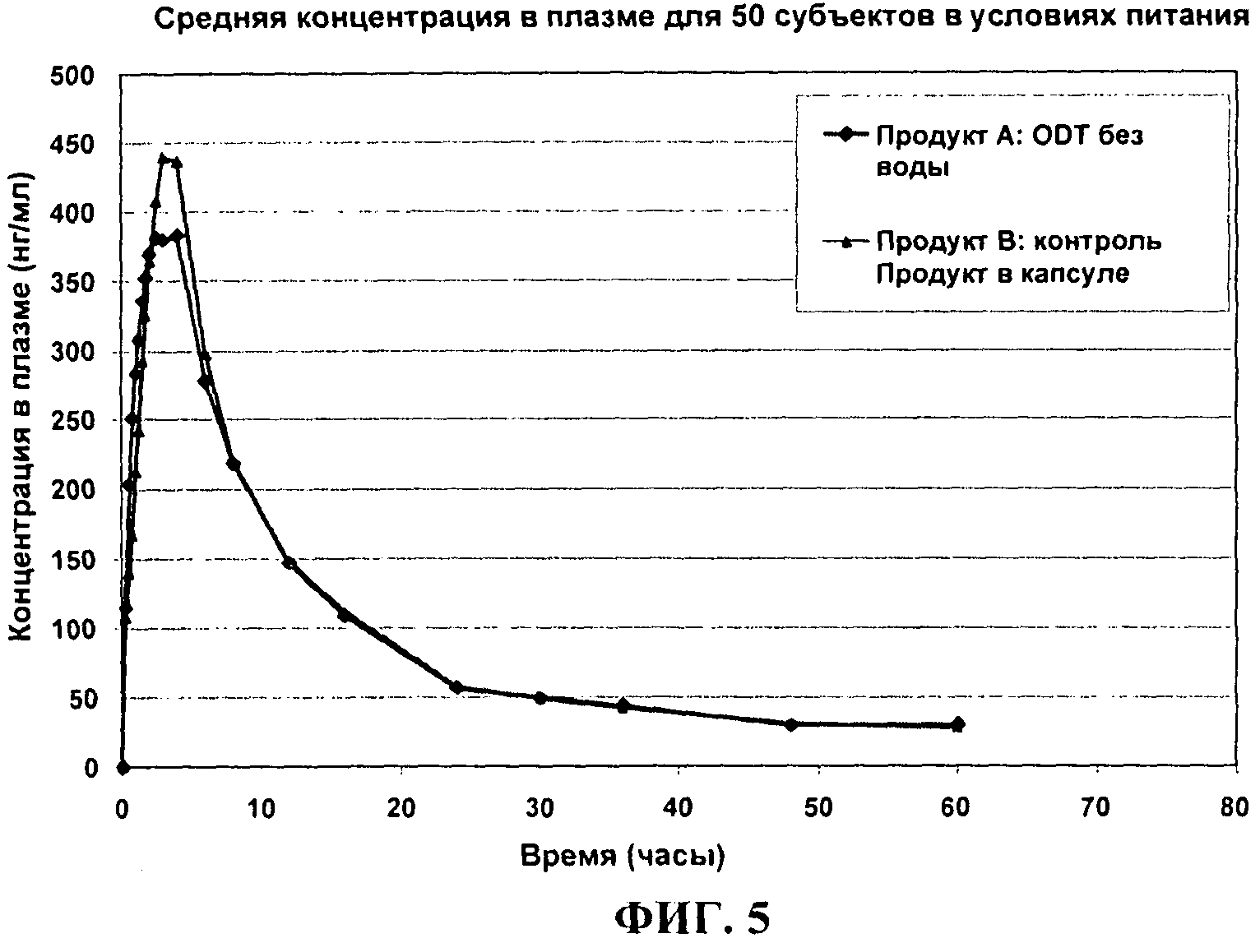
ФИГ.5 сравнивает средние профили концентрации в плазме в зависимости от времени для 30 мг темазепама ODT по сравнению с 30 мг капсулами Restoril® у нормальных людей в условиях питания.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все заявки, патенты и другие документы, цитированные в данном документе, включены путем ссылки во всей своей полноте для всех целей.
Данное изобретение направлено на содержащие лекарственное средство ODT композиции и улучшенные способы приготовления таких композиций, как описано в данном документе. ODT композиции данного изобретения обладают хорошими органолептическими свойствами, но сохраняют свойства высвобождения лекарственного средства, которые биоэквивалентны или выше (т.е. быстрее), чем у традиционных оральных дозированных форм. Кроме того, ODT композиции данного изобретения проявляют достаточную твердость и достаточно низкую рыхлость для возможности упаковки во флаконы из HDPE (полиэтилен высокой плотности), и продавливают через подложенные пленкой или отделяемой бумагой блистерные упаковки с использованием традиционного оборудования для хранения, транспортировки и коммерческого распространения.
Выражения "орально распадающаяся таблетка", "орально диспергируемая таблетка", "быстро растворяющаяся таблетка" или "ODT" относятся к твердой дозированной форме, которая быстро распадается в ротовой полости пациента после введения. Выражение "в основном распадается" означает распад таблетки в значительной степени на составные частицы, которые предварительно были спрессованы в монолитные таблетки.
Выражение "в основном растворяется" означает процент лекарственного средства, высвобожденного или растворенного, т.е., по меньшей мере, приблизительно 50%, по меньшей мере, приблизительно 60%, по меньшей мере, приблизительно 70%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 90% или приблизительно 100% лекарственного средства, растворенного или высвобожденного из ODT композиции.
Выражение "темазепам" включает пролекарства, соли, сольваты, и/или сложные эфиры темазепама (7-хлор-1,3-дигидро-3-гидрокси-1-метил-5-фенил-2H-1,4-бензодиазепин-2-он).
Выражение "единичная доза" относится к фармацевтической композиции, включающей количество лекарственного средства, предназначенное для введения пациенту в отдельной дозе.
Выражение "лекарственное средство", "активный" или "активный фармацевтический ингредиент", как используется в данном документе, включает фармацевтически приемлемое и терапевтически эффективное соединение, подходящее для лечения болезней, симптомов болезней и медицинских состояний, а также фармацевтически приемлемые соли, стереоизомеры и смеси стереоизомеров, сольваты (включая гидраты) и/или их сложные эфиры.
Неограничивающие примеры классов подходящих активных фармацевтических ингредиентов включают, но без ограничения, бензодиазепины, анальгетики, противогипертонические средства, противотревожные средства, средства против свертывания, противосудорожные средства, противодиабетические средства, средства, понижающие уровень глюкозы в крови, противозастойные средства, антигистамины, противовоспалительные средства, противокашлевые средства, противоопухолевые средства, бета-блокаторы, противоревматические средства, противовоспалительные, антипсихотические средства, усилители когнитивных функций, противоатеросклеротические средства, средства против ожирения, средства против импотенции, противоинфекционные средства, противоинфекционные средства, гипнотические средства, средства против паркинсонизма, средства против болезни Альцгеймера, антидепресанты и противовирусные средства, гликоген фосфорилазы ингибиторы, ингибиторы белков-переносчиков эфиров холестерина, стимуляторы ЦНС (центральная нервная система), агонисты допаминовых рецепторов, противорвотные средства, желудочно-кишечные средства, психотерапевтические средства, опиоидные агонисты, опиоидные антагонисты, противоэпилептические лекарственные средства, гистамина Н2 антагонисты, противоастматические средства, релаксанты гладких мышц и релаксанты скелетных мышц. В конкретном варианте осуществления активные фармацевтические ингредиенты, подходящие для применения в ODT композициях данного изобретения, включают лекарственные средства, которые чувствительны к условиям обработки (например, термически чувствительные, имеют низкий взрывной порог, чувствительные к сдвигу или, по-другому, имеют тенденцию разрушаться во время обработки).
Специфические примеры бензодиазепинов включают алпразолам, бромезепам, диазепам, лорезепам, клонезепам, темазепам, оксазепам, флунитразепам, триазолам, хлордиазепоксид, флуразепам, эстазолам, лорметазепам, мидазолам, нитразепам и мексазолам; анальгетики включают ацетаминофен, рофекоксиб, целекоксиб, морфин, кодеин, оксикодон, гидрокодон, диаморфин, петидин, трамадол, бупренорфин; противогипертонические средства включают празозин, нифедипин, лерканидипин, амлодипин безилат, тримазозин и доксазозин; специфические примеры противотревожных средств включают гидроксизин гидрохлорид, лоразепам, буспирон гидрохлорид, пазепам, хлордиазепоксид, мепробамат, оксазепам, трифлуоперазин гидрохлорид, клоразепат дикалия, диазепам; специфические примеры средств против свертывания включают абциксимаб, эптифибатид, тирофибан, ламифнбан, клопидогрель, тиклопидин, дикумарол, гепарин и варфарин; специфические примеры противосудорожных средств включают фенобарбитал, метилфенобарбитал, клобазам, клоназепам, клорезепат, дизепам, мидазолам, лоразепам, фелбамат, карбамезепин, оксакарбезепин, вигабатрин, прогабид, тиагабин, топирамат, габапентин, прегабалин, этотоин, фенитоин, мефенитоин, фосфенитоин, параметадион, триметадион, этадион, бекламид, примидон, бриварацетам, леветирацетам, селетрацетам, этосуксимид, фенсуксимид, месуксимид, ацетазоламид, султиам, метазоламид, зонисамид, ламотригин, фенетурид, фенацимид, валпромид и валноктамид; специфические примеры противодиабетических средств включают репаглинид, натеглинид, метформин, фенформин, росиглитазон, пиоглитазон, троглитазон, миглитол, акарбоз, эксанатид, вилдаглиптин и ситаглиптин; специфические примеры средства, понижающего уровень глюкозы в крови, включают толбутамид, ацетогексамид, толазамид, глибурид, глимепирид, гликлазид, глипизид и хлорпропамид; специфические примеры противозастойных средств включают псевдоэфедрин, фенилэфрин и оксиметазолин; специфические примеры антигистаминов включают мепирамин, антазолин, дифенгидрамин, карбиноксамин, доксиламин, клемастин, дименгидринат, фенирамин, хлорфенирамин, дексхлорфенирамин, бромфенирамин, триполидин, циклизин, хлорциклизин, гидроксизин, меклизин, прометазин, тримепразин, ципрогептадин, азатадин и кетотифен; специфические примеры противокашлевых средств включают декстрометорфан, носкапин, этилморфин и кодеин; специфические примеры противоопухолевых средств включают хлорамбуцил, ломустин, тубулазол и эхиномицин; специфические примеры противовоспалительных средств включают бетаметазон, преднизолон, аспирин, пироксикам, валдекоксиб, карпрофен, целекоксиб, флурбипрофен и (+)-N-{4-[3-(4-фторфенокси)фенокси]-2-циклопентен-1-ил}-N-гидроксимочевину; специфические примеры бета-блокаторов включают тимолол и надолол; специфические примеры противокашлевых средств включают декстрометорфан, носкапин, этилморфин, теобромин и кодеин; специфические примеры противоопухолевых средств включают актиномицин, дактиномицин, доксорубицин, даунорубицин, эпирурубицин, блеомицин, пликамицин и митомицин; специфические примеры бета-блокаторов включают алпренолол, картеолол, левобунолол, мепиндолол, метипранолол, надолол, окспренолол, пенбутолол, пиндолол, пропранолон, соталол, тимолол, ацебутолол, атенолол, бетаксолол, бнсопролол, эсмолол, метопролол, небиволол, карведилол, целипролол, лабеталол и бутаксемин; специфические примеры противоревматических средств включают адалимумаб, азатиоприн, хлороквин, гидроксихлороквин, циклоспорин, D-пеницилламин, этанерцепт, натрия ауротиомалат, ауранофин, инфликсимаб, лефлуномид, метотрексат, миноциклин, сульфасалазин; специфические примеры противовоспалительных средств включают стероидные и нестероидные противовоспалительные лекарственные средства, такие как гидрокортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон, бетаметазон, триамцинолон, беклометазон, альдостерон, ацетаминофен, амиксиприн, бенорилат, дифлунизал, фаисламин, диклофенак, ацеклофенак, ацеметацин, бромфенак, этодолак, индометацин, набуметон, сулиндак, толметин, карпрофен, кеторолак, мефенамовая кислота, фенилбутазон, аза противовоспалительные средства, пропазон, матамизол, оксифенбутазон, сульфинпразон, пироксикам, лорноксикам, мелоксикам, теноксикам, целекоксиб, эторикоксиб, люмирикоксиб, парекоксиб, рофекоксиб, валдекоксиб и нумесулид; специфические примеры антипсихотических средств включают илоперидон, зипразидон, оланзепин, тиотиксен гидрохлорид, флуспирилен, рисперидон и пенлуридол; специфический пример усилителя когнитивных функций включает ампакин; специфические примеры противоатеросклеротических, кардиоваскулярных и/или понижающих холестерин средств включают аторвастатин кальций, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, росувастатин и симвастатин; специфические примеры средств против ожирения включают дексадрин, дексфенфлурамин, фенфлурамин, фентермин, орлистат, акарбоз, и римонабант; специфические примеры средств против импотенции включают силденафил и силденафила цитрат; специфические примеры противоинфекционных средств, таких как противобактериальные, противовирусные, против простейших, противогельминтные и противогрибковые средства включают карбенициллин инданил натрия, бакампициллина гидрохлорид, тролеандомицин, доксицилин гидрат, ампициллин, пенициллин G, азитромицин, окситетрациклин, миноциклин, эритромицин, кларитромицин, спирамицин, ацикловир, нелфинавир, виразол, бензалкония хлорид, хлоргексидин, эконазол, терконазол, флуконазол, вориконазол, гризеофульвин, метронидазол, тиабендазол, оксфендазол, морантел, котримоксазол; специфические примеры гипнотических средств включают альфаксалон и этомидат; специфические примеры средств против паркинсонизма включают леведопа, бромкриптин, прамипексол, ропинирол, перголид и селегилин; аптихолинергические средства, такие как тригексифенидил, бензтропин мезилат, проциклидин, бипериден, андетопропазин; антигистамины, такие как дифенгидрамин и дорфенадрин и амантадин; специфические примеры средств против болезни Альцгеймера включают донепезил ривастигмин, галантамин, такрин; специфические примеры анибиотиков включают миноциклин, рифампин, эритромицин, нафциллин, цефазолин, имипенем, азтреонам, гентамицин, сульфаметоксазол, ванкомицин, ципрофлоксацин, триметоприм, метронидазол, клиндамицин, телкопланин, мупероцин, азитромицин, кларитромицин, офлоксацин, ломефлоксацин, норфлоксацин, налидиксовую кислоту, спарфлоксацин, перфлоксацин, амифлоксацин, эноксацин, флероксацин, тернафлоксацин, тосуфлоксацин, клинафлоксацин, сульбактам, клавулановую кислоту, амфотерицин В, флуконазол, итраконазол, кетоконазол, нистатин; специфические примеры антидепресантов включают изокарбоксазид; фенелзин; транилципромин; специфические примеры противовирусных средств включают азидовудин (AZT), диданозин (дидеоксиинозин, ddI), d4T, залцитабин (дидеоксицитозин, ddC), невирапин, ламивудин (эпивир, 3ТС), саквинавир (Инвираз), ритонавир (Норвир), индинавир (Криксиван), делавирдин (Рескриптор); специфические примеры ингибиторов гликоген фосфорилазы включают [R-(R*S*)]-5-хлор-N-[2-гидрокси-3-{метоксиметиламино}-3-оксо-1-(фенилметил)пропил-1Н-индол-2-карбоксиамид и 5-хлор-1Н-индол-2-карбоновой кислоты[(1S)-бензил-(2R)-гидрокси-3-((3R,4S)-дигидрокси-пирролидин-1-ил-)-3-оксипропил]амид; специфические примеры ингибиторов белков-переносчиков эфиров холестерина включают [2R,4S] 4-[(3,5-бис-трифторметил-бензил)-метоксикарбонил-амино]-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты этиловый сложный эфир, [2R,4S] 4-[ацетил-(3,5-бис-трифторметил-бензил)-амино]-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты изопропиловый сложный эфир, [2R,4S] 4-[(3,5-бис-трифторметил-бензил)-метоксикарбонил-амино]-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты изопропиловый сложный эфир; специфические примеры стимуляторов ЦНС включают кофеин и метилфенидат; специфические примеры агонистов допаминовых рецепторов включают каберголин и прамипексол; специфические примеры противорвотных средств включают доласетрон, гранисетрон, ондасетрон, трописетрон, палоносетрон, домперидон, дроперидол, дименгидринат, гелоперидол, хлорпромазин, прометазин, прохлорперизин, метоклопрамид и ализаприд; специфические примеры желудочно-кишечных средств включают лоперамид и цисаприд; специфические примеры психотерапевтических средств включают хлорпромазин, тиоридазин, прохлорперизин, галоперидол, алпразолам, амитриптилин, бупропион, буспирон, хлордиазепоксид, циатлопрам, клозапин, диазепам, флуоксетин, флуфеназин, флувоксамин, гидроксизин, лорезапам, локсапин, митразепин, молиндон, нефазодон, нортриптилин, оланзепин, пароксетин, фенелзин, кветиапин, рисперидон, сертралин, тиотиксен, транилципромин, тразодон, венлафаксин и зипразидон; специфические примеры опиоидных агонистов включают гидроморфон, фентанил, метадон, морфин, оксикодон и оксиморфон; специфические примеры опиоидных антагонистов включают налтрексон; специфические примеры противоэпилептических лекарственных средств включают натрия валпроат, нитразепам, фенитоин; специфические примеры гистамина H2 антагонистов включают фамотидин, низатидин, циметидин, ранитидин; специфические примеры противоастматических средств включают албутерол, монтелукаст натрия; специфические примеры релаксантов гладких мышц включают никорандил, илоперидон и клоназепам; а специфические примеры релаксантов скелетных мышц включают диазепам, лоразепам, баклофен, каризопродол, хлорзоксазон, циклобензаприн, дантролен, метаксалон, орфенадрин, панкурониум, тизанидин, дицикломин, клонидин и габапентин. Следует понимать, что каждое названное лекарственное средство включает нейтральную форму лекарственного средства, а также фармацевтически приемлемые соли, сольваты, сложные эфиры и их пролекарства.
В одном варианте осуществления композиции данного изобретения представляют собой орально распадающиеся таблеточные (ODT) композиции, включающие терапевтически эффективное количество лекарственного средства (например, темазепама), 0,5-3% ODT связывающего полимера, сахарный спирт и/или сахарид, и дезинтегрант.
В другом варианте осуществления ODT композиции данного изобретения включают терапевтически эффективное количество темазепама (т.е. 7-хлор-1,3-дигидро-3-гидрокси-1-метил-5-фенил-2H-1,4-бензодиазепин-2-он). Терапевтически эффективные количества темазепама в диапазоне от 5 до 50 мг темазепама/единичная доза, например, 5, 7,5, 10, 12.5, 15, 17,5, 20, 22,5, 25, 27,5, 30, 32,5, 35, 37,5, 40, 42,5, 45, 47,5 или 50 мг темазепама/единичная доза. В одном варианте осуществления количество темазепама на единичную дозу составляет 7,5, 15, 22,5 или 30 мг темазепама.
В других вариантах осуществления ODT композиции данного изобретения включают терапевтически эффективное количество, по меньшей мере, одного лекарственного средства. Выражение "терапевтически эффективное количество" относится к количеству лекарственного средства, необходимого для получения одного или более желательных фармакологических эффектов. Терапевтически эффективное количество лекарственного средства традиционно определяется опытами дозирования, и т.д. с помощью способов, хорошо известных в фармацевтической области.
Композиции данного изобретения включают частицы, по меньшей мере, одного лекарственного средства любой подходящей морфологии (например, кристаллической или аморфной), предпочтительными являются морфологии, которые остаются стабильными в условиях обработки и хранения. В одном варианте осуществления лекарственное средство присутствует в кристаллической форме. Кристаллы лекарственного средства могут иметь средний размер частиц, варьирующий от приблизительно 1 мкм до приблизительно 200 мкм, например, приблизительно 1-25 мкм, приблизительно 1-50 мкм, приблизительно 1-100 мкм, приблизительно 1-150 мкм, приблизительно 25-50 мкм, приблизительно 25-150 мкм, приблизительно 50-100 мкм, приблизительно 50-150 мкм, приблизительно 100-150 мкм или приблизительно 100-200 мкм.
ODT связывающие полимеры, подходящие для применения в композициях данного изобретения, включают фармацевтически приемлемые растворимые в воде, растворимые в спирте или растворимые в ацетоне/воде полимеры. Неограничивающий перечень таких полимеров включает, например, поливинилпирролидон (повидон или PVP), крахмалы, такие как кукурузный крахмал, полиэтиленгликоли, полиэтиленоксиды, гидроксипропилметилцеллюлозу (НРМС), метилцеллюлозу, гидроксипропилцеллюлозу (НРС) и т.д., и их смеси. В одном варианте осуществления ODT связывающий полимер представляет собой НРС, например, Klucel® LF или EF. Как описано в данном документе, ODT связывающие полимеры являются фармацевтически приемлемыми растворимыми в воде, растворимыми в спирте или растворимыми в ацетоне/воде полимерами, добавленными для грануляции жидкости во время грануляции содержащих лекарственное средство частицы с другими формообразующими средствами, такими как наполнитель, разбавитель и/или дезинтегрант, посредством чего снижается или устраняется прилипание частиц к сторонам, если во время грануляции используется аппарат для грануляции, снижается или устраняется уровень мелких частиц темазепама, снижается или устраняется образование задиров ODT таблеток во время длительных циклов таблетирования, и улучшается воспроизводимость и выход процесса, без ущерба для фармакокинетических характеристик композиции.
Выбор и количество ODT связывающего полимера, применяемого в композициях данного изобретения, является критическим. В композициях данного изобретения количество ODT связывающего полимера варьирует от 0,5-3% общей массы частицы, содержащей связывающее средство. В одном варианте осуществления количество ODT связывающего полимера менее чем приблизительно 2% по массе относительно общей массы композиции, содержащей связывающее средство. В другом варианте осуществления количество ODT связывающего полимера в композиции, содержащей связывающее средство, составляет приблизительно 0,5-2%, 0,5-1,5%, 0,5-1%, менее чем приблизительно 1%, 1-3%, приблизительно 1-2,5%, приблизительно 1-2% или приблизительно 1,5-2%, включая все значения, диапазоны и поддиапазоны между ними.
Когда общее количество ODT связывающего полимера в композиции, содержащей связывающее средство, составляет ниже 0,5%, становится трудно контролировать однородность (т.е. количество лекарственного средства в единичной дозе) и полный выход продукции орально распадающихся таблеточных композиций, так как ингредиенты орально распадающейся таблеточной композиции прилипают к стенкам производственного оборудования (например, стенкам аппарата с псевдоожиженным слоем для покрытия). Кроме того, когда уровень ODT связывающего полимера в содержащей связывающее средство композиции ниже 0,5%, грануляция приводит к нежелательному бимодальному распределению размеров частиц, и образуются надмерные количества "мелких частиц" (т.е. очень маленьких частиц), что приводит к неуправляемым свойствам текучести и т.д., и "образования задира" или бороздчатости таблеток из-за "мелких частиц" после длинных циклов таблетирования (например, более одного часа). Когда количество ODT связывающего полимера в содержащей связывающее средство композиции превышает 3%, грануляция приводит к более крупным и/или более прочным агломератам, которые неприемлемы для оральных дозированных форм, например, поскольку крупные агломераты дают невкусные "ощущения во рту" в орально распадающихся таблеточных (ODT) составах, и поскольку более крупные агломераты склонны к снижению скорости высвобождения лекарственного средства. Однако, добавление дополнительного этапа измельчения для уменьшения размера частиц таких агломератов и получения коммерчески приемлемых выходов продукции опасно для композиций, которые содержат лекарственные средства, такие как темазепам, который обладает высоким потенциалом взрывания. Композиции по данному изобретению с ODT связывающим полимером в диапазоне 0,5-3% обладают значительно улучшенными свойствами обработки и избегают потребности отбрасывания или измельчения крупных агломератов.
ODT дозированная форма отличается от других оральных дозированных форм (например, традиционных таблеток, капсул и т.д.) тем, что ODT дозированные формы распадаются со значительно более высокой скоростью после введения. ODT композиции данного изобретения содержат фармацевтически приемлемые ингредиенты, которые разбухают, растворяют или иным образом облегчают распад ODT композиции в ротовой полости. Такие ингредиенты могут включать фармацевтические дезинтегранты, наполнители/разбавители, растворимые в воде связывающие средства, плавкие твердые вещества (например, воски), которые могут высвобождать темазепам после попадания в желудок, и т.д.
ODT композиции данного изобретения распадаются по существу полностью за приблизительно 60 секунд или меньше, приблизительно 50 секунд или меньше, приблизительно 40 секунд или меньше, приблизительно 30 секунд или меньше, приблизительно 20 секунд или меньше, или приблизительно 10 секунд или меньше после введения. В одном варианте осуществления ODT композиции данного изобретения высвобождают приблизительно 80% или более лекарственного средства (например, темазепама) за 30 минут или меньше при тестировании на растворение с помощью официальной методики USP (Фармакопея США) (USP аппарат 2; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбция UV (ультрафиолетовый свет) при 310 нм). В другом варианте осуществления ODT композиции данного изобретения высвобождают приблизительно 70% или более лекарственного средства (например, темазепама) за 30 минут или меньше при тестировании на растворение с помощью официальной методики USP (USP аппарат 2; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбция UV при 310 нм).
Вдобавок к лекарственному средству (например, темазепаму) и ODT связывающему полимеру ODT композиции данного изобретения дополнительно включают, по меньшей мере, один дезинтегрант и, по меньшей мере, один сахарный спирт и/или сахарид для облегчения быстрого распада ODT в ротовой полости.
Дезинтегранты, подходящие для применения в орально распадающихся таблеточных композициях данного изобретения, включают любые фармацевтически приемлемые дезинтегранты или "супер-дезинтегранты". Неограничивающий перечень подходящих дезинтегрантов включает кросповидон (поперечно-сшитый PVP (поливинилпирролидон)), натрия крахмалгликолят, поперечно-сшитую натрия карбоксиметилцеллюлозу и низкозамещенную гидроксипропилцеллюлозу.
Сахарные спирты, подходящие для применения в орально распадающихся таблеточных композициях данного изобретения, включают любые фармацевтически приемлемые сахарные спирты. Неограничивающий перечень подходящих сахарных спиртов включает, например, маннит, сорбит, ксилит, мальтит, лактит, эритрит, изомальт, гидрогенизированные гидролизаты крахмал и мальтол.
Сахариды, подходящие для применения в орально распадающихся таблеточных композициях данного изобретения, включают любые фармацевтически приемлемые сахариды. Неограничивающий перечень подходящих сахаридов включает, например, лактозу, сахарозу и мальтозу.
Дезинтегранты и сахарные спирты и/или сахариды могут быть смешаны (например, гранулированы) с лекарственным средством (например, темазепамом) и ODT связывающим полимером, или дезинтегранты и сахарные спирты и/или сахариды могут быть гранулированы вместе для формирования быстро диспергирующихся микрогранул, например, как описано в заявках на патенты США №№10/827,106, 09/147,374, 10/356,641, 10/469,915 и 10/506,349 и европейском патенте ЕР 0914818, каждый из которых включен в данный документ путем ссылки во всей своей полноте для всех целей. В одном варианте осуществления быстро диспергирующиеся микрогранулы включают, по меньшей мере, один дезинтегрант в комбинации, по меньшей мере, с одним сахарным спиртом. В другом варианте осуществления быстро диспергирующиеся микрогранулы включают, по меньшей мере, один дезинтегрант в комбинации, по меньшей мере, с одним сахаридом. В еще одном варианте осуществления быстро диспергирующиеся микрогранулы включают, по меньшей мере, один дезинтегрант в комбинации, по меньшей мере, с одним сахарным спиртом и, по меньшей мере, одним сахаридом. Количество сахарного спирта и/или сахарида в быстро диспергирующихся микрогранулах варьирует от приблизительно 90 до 99% или от приблизительно 95 до 99% общей массы быстро диспергирующихся микрогранул. Альтернативно, количество дезинтегранта в быстро диспергирующихся микрогранулах варьирует от приблизительно 1 до 10% или от приблизительно 1 до 5%.
Средний размер частиц сахарного спирта и/или сахарида, а также быстро диспергирующихся микрогранул, должен быть таким, что при распаде в ротовой полости композиция обеспечивает ощущение гладкости (без привкуса или песчаного или мучнистого вкуса или текстуры). Средний размер частиц сахарного спирта и/или сахарида в быстро диспергирующихся микрогранулах составляет 30 мкм или меньше, например, приблизительно 1-30 мкм, приблизительно 1-25 мкм, приблизительно 1-20 мкм, приблизительно 1-15 мкм, приблизительно 1-10 мкм, приблизительно 1-5 мкм, приблизительно 5-30 мкм, приблизительно 5-25 мкм, приблизительно 5-20 мкм, приблизительно 5-15 мкм, приблизительно 5-10 мкм, приблизительно 10-30 мкм, приблизительно 10-25 мкм, приблизительно 10-20 мкм, приблизительно 10-15 мкм, приблизительно 15-30 мкм, приблизительно 15-25 мкм, или приблизительно 15-20 мкм, приблизительно 20-30 мкм или приблизительно 20-25 мкм, включая все значения, диапазоны и поддиапазоны между ними. В одном варианте осуществления быстро диспергирующиеся микрогранулы имеют средний размер частиц в диапазоне приблизительно 100-400 мкм. В других вариантах осуществления средний размер частиц быстро диспергирующихся микрогранул составляет 300 мкм или меньше. В конкретном варианте осуществления быстро диспергирующиеся микрогранулы включают маннит и/или лактозу и Кросповидон XL-10, где соотношение маннита и/или лактозы к Кросповидону XL-10 в быстро диспергирующихся микрогранулах варьирует от приблизительно 99:1 до приблизительно 90:10. В другом варианте осуществления быстро диспергирующиеся гранулы приготовлены путем влажного гранулирования D-маннита со средним размером частиц приблизительно 15 мкм с Кросповидоном XL-10 при соотношении приблизительно 95/5 в грануляторе с высоким усилием сдвига с использованием очищенной воды в качестве гранулирующей жидкости, и сушки гранул путем распространение гранулированной смеси на лотках в нагретой конвекционной печи, как описано в патентной публикации США №2005/0232988.
В еще одном варианте осуществления данного изобретения ODT композиция дополнительно включает смесь, по меньшей мере, одного дезинтегранта и, по меньшей мере, одного сахарного спирта и/или сахарида, факультативно гранулированную с водным раствором ODT связывающего полимера в диапазоне приблизительно 0,5-3% общей массы композиции, содержащей связывающее средство.
Фармацевтические композиции данного изобретения могут дополнительно включать дополнительные фармацевтически приемлемые ингредиенты или формообразующие средства. Примеры подходящих формообразующих средств для применения в композициях или дозированных формах данного изобретения включают наполнители, разбавители, глиданты, дезинтегранты, связывающие средства, смазочные материалы и т.д. Другие фармацевтически приемлемые формообразующие средства включают подкисляющие средства, подщелачивающие средства, консерванты, антиоксиданты, буферезирующие средства, хелатирующие средства, окрашивающие средства, комплексообразующие средства, эмульгирующие и/или растворяющие средства, ароматизаторы и отдушки, увлажняющие средства, подслащивающие средства, смачивающие средства и т.д.
Примеры подходящих наполнителей, разбавителей и/или связывающих средств включают лактозу (например, высушенную распылением лактозу, α-лактозу, β-лактозу, Tabletose®, различные сорта Pharmatose®, Microtose® или Fast-Floc®), микрокристаллическую целлюлозу (различные сорта Avicel®, Eicema®, Vivacel®, Ming Tai® или Solka-Floc®), гидроксипропилцеллюлозу, L-гидроксипропилцеллюлозу (низко замещенную), гидроксипропилметилцеллюлозу (НРМС) (например, Метоцел Е, F и К, Метолозу SH от Shin-Etsu, Ltd, такую как, например, 4000 cps (санти-Пуассон) сорта Метоцел Е и Метолозы 60 SH, 4000 cps сорта Метоцел F и Метолозы 65 SH, 4000, 15000 и 100000 cps сорта Метоцел К; и 4000, 15000, 39000 и 100000 сорта Метолозы 90 SH), метилцеллюлозные полимеры (такие как, например, Метоцел А, Метоцел А4С, Метоцел А15С, Метоцел А4М), гидроксиэтилцеллюлозу, натрия карбоксиметилцеллюлозу, карбоксиметилгидроксиэтилцеллюлозу и другие производные целлюлозы, сахарозу, агарозу, сорбит, маннит, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (включая картофельный крахмал, маисовый крахмал и рисовый крахмал), кальция фосфат (например, основный кальция фосфат, кальция гидроген фосфат, дикальция фосфат гидрат), кальция сульфат, кальция карбонат, натрия альгинат, коллаген и т.д.
Специфические примеры разбавителей включают, например, кальция карбонат, двухосновный кальция фосфат, трехосновный кальция фосфат, кальция сульфат, микрокристаллическую целлюлозу, порошковую целлюлозу, декстраны, декстрин, декстрозу, фруктозу, каолин, лактозу, маннит, сорбит, крахмал, прежелатинизированный крахмал, сахарозу, сахар и т.д.
Специфические примеры дезинтегрантов включают, например, альгиновую кислоту или альгинаты, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и другие производные целлюлозы, кроскармеллозу натрия, кросповидон, полакриллин калия, натрия крахмалгликолят, крахмал, прежелатинизированный крахмал, карбоксиметил крахмал (например, Primogel® и Explotab®) и т.д. Специфические примеры связывающих средств включают, например, акациевую камедь, альгиновую кислоту, агар, кальция каррагинан, натрия карбоксиметилцеллюлозу, микрокристаллическую целлюлозу, декстрин, этилцеллюлозу, желатин, жидкую глюкозу, гуаровую смолу, гидроксипропилметилцеллюлозу, метилцеллюлозу, пектин, PEG (полиэтиленгликоль), повидон, прежелатинизированный крахмал и т.д.
Специфические примеры глидантов и смазочных материалов включают стеариновую кислоту, магния стеарат, кальция стеарат или другие стеараты металлов, тальк, воски и глицериды, светлое минеральное масло, PEG, глицерил бегенат, коллоидный кремнезем, гидрогенизированные растительные масла, кукурузный крахмал, натрия стеарил фумарат, полиэтиленгликоли, алкил сульфаты, натрия бензоат, ацетат натрия и т.д.
Другие формообразующие средства включают, например, ароматизирующие средства, окрашивающие средства, средства, маскирующий вкус, средства, регулирующие pH, буферизирующие средства, консерванты, стабилизирующие средства, антиоксиданты, смачивающие средства, средства, регулирующие влажность, поверхностно-активные средства, суспендирующие средства, средства, усиливающие абсорбцию, средства для модифицированного высвобождения и т.д.
Неограничивающие примеры ароматизирующих средств включают, например, ароматы вишни, апельсина или другие приемлемые фруктовые ароматы или смеси ароматов вишни, апельсина и других приемлемых фруктовых ароматов, до приблизительно 3% на основе массы таблетки. Кроме того, композиции данного изобретения также могут включать один или более подсластителей, таких как аспартам, сукралоза или другие фармацевтически приемлемые подсластители, или смеси таких подсластителей, до приблизительно 2% по массе на основе массы таблетки. К тому же, композиции данного изобретения могут включать один или более красителей FD&C до 0,5% по массе на основе массы таблетки.
Антиоксиданты включают, например, аскорбиновую кислоту, аскорбил пальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, гипофосфористая кислота, монотиоглицерол, калия метабисульфит, пропилгалат, натрия формальдегид сульфоксилат, натрия метабисульфит, натрия тиосульфат, диоксид серы, токоферол, токоферол ацетат, токоферол гемисукцинат, TPGS (сукцинат d-альфа-токоферилэтиленгликоля 1000) или другие производные токоферола и т.д.
В конкретном варианте осуществления ODT композиции данного изобретения, которые включают быстро диспергирующиеся микрогранулы, могут включать дополнительный дезинтегрант, в добавок к дезинтегранту в быстро диспергирующихся гранулах. Дополнительный дезинтегрант может быть тем же или отличаться от дезинтегранта, используемого в быстро диспергирующихся гранулах. Дополнительный дезинтегрант может присутствовать в ODT композициях данного изобретения до приблизительно 10% на основе общей массы таблетки.
Факультативные фармацевтически приемлемые формообразующие средства могут быть включены в содержащие темазепам частицы, содержащие темазепам микрогранулы, гранулы с наслоенным темазепамом, быстро диспергирующиеся микрогранулы или могут быть добавлены, кроме того, в содержащие темазепам частицы, содержащие темазепам микрогранулы, гранулы с наслоенным темазепамом или быстро диспергирующиеся микрогранулы. В некоторых случаях факультативные фармацевтически приемлемые формообразующие средства могут включать ингредиенты, также присутствующие в содержащих темазепам частицах, содержащих темазепам микрогранулах, гранулах с наслоенным темазепамом или быстро диспергирующихся микрогранулах. Например, содержащие темазепам микрогранулы и быстро диспергирующиеся микрогранулы (которые включают дезинтегрант) могут быть смешаны с дезинтегрантом, который либо такой же, либо отличается от дезинтегранта, присутствующего в быстро диспергирующихся микрогранулах.
В одном варианте осуществления композиции данного изобретения включают в дополнение к лекарственному средству (например, темазепаму) связывающее средство, сахарный спирт и/или сахарид и дезинтегрант, микрокристаллическую целлюлозу (например, Авицел РН101, Авицел РН102, Цеолюс KG-802 или KG-1000, Просолв SMCC 50, SMCC 90 или их смеси).
Количество факультативных фармацевтически приемлемых ингредиентов (например, наполнителей или разбавителей и дезинтегрантов) в содержащих лекарственное средство микрогранулах может варьировать от приблизительно 5% до 80%, включая приблизительно 5%-70%, приблизительно 5%-60%, приблизительно 5%-50%, приблизительно 5%-40%, приблизительно 5%-30%, приблизительно 5%-20%, приблизительно 5%-15%, приблизительно 5%-10%, приблизительно 10%-70%, приблизительно 10%-60%, приблизительно 10%-50%, приблизительно 10%-40%, приблизительно 10%-30%, приблизительно 10%-20%, приблизительно 10%-15%, приблизительно 20%-70%, приблизительно 20%-60%, приблизительно 20%-50%, приблизительно 20%-40%, приблизительно 20%-30%, приблизительно 20%-25%, приблизительно 30%-70%, приблизительно 30%-60%, приблизительно 30%-50%, приблизительно 30%-40%, приблизительно 30%-35%, приблизительно 40%-70%, приблизительно 40%-60%, приблизительно 40%-50%, приблизительно 40%-45%, приблизительно 50%-70%, приблизительно 50%-60%, приблизительно 50%-55%, приблизительно 60%-70% или приблизительно 60%-65%.
Композиции данного изобретения могут включать, по меньшей мере, одно лекарственное средство (например, темазепам), один или более ODT связывающих полимеров, один или более дезинтегрантов и один или более сахарных спиртов; по меньшей мере, одно лекарственное средство (например, темазепам), один или более ODT связывающих полимеров, один или более дезинтегрантов и один или более сахаридов; или, по меньшей мере, одно лекарственное средство (например, темазепам), один или более ODT связывающих полимеров, один или более дезинтегрантов, один или более сахарных спиртов и один или более сахаридов. В одном варианте осуществления композиции данного изобретения включают, по меньшей мере, одно лекарственное средство (например, темазепам), ODT связывающий полимер, дезинтегрант, сахарный спирт. В другом варианте осуществления композиции данного изобретения включают, по меньшей мере, одно лекарственное средство (например, темазепам), гидроксипропилцеллюлозу, кросповидон и маннит.
Например, композиции данного изобретения могут включать смесь частиц лекарственного средства и быстро диспергирующихся микрогранул, спрессованную в форму орально распадающейся таблетки. Частицы лекарственного средства могут быть, например, кристаллами лекарственного средства, микрогранулами лекарственного средства, приготовленными путем (влажного или сухого) гранулирования лекарственного средства в присутствии одного или более ODT связывающих полимеров и факультативно дополнительных фармацевтически приемлемых формообразующих средств. Или частицы лекарственного средства могут быть гранулами с наслоенным лекарственным средством, приготовленными путем растворения или суспендирования лекарственного средства в растворе одного или более наслаивающихся на лекарственное средство связывающих средств, нанесения покрытия из образовавшегося раствора или суспензии на частицы инертного ядра (например, сахарные сферы, такие как Celphere® CP-203 50-100 меш или 150-300 мкм, целлюлозные сферы, сферы диоксида кремния и т.д.) и удаления растворителя.
Подходящие наслаивающиеся на лекарственное средство связывающие средства включают любые ODT связывающие полимеры, раскрытые в данном документе, например, крахмалы, модифицированные целлюлозы (например, гидроксипропилцеллюлоза, карбоксиметилцеллюлоза натрия), альгиновая кислота, поливинилпирролидон (повидон) и их смеси. Количество лекарственного средства в слое лекарственного средства и толщина слоя лекарственного средства могут быть модифицированы для обеспечения терапевтически эффективной дозы лекарственного средства. Содержащий лекарственное средство слой включает от приблизительно 90% до приблизительно 99% лекарственного средства и от приблизительно 10% до приблизительно 1% связывающего средства, и содержащий лекарственное средство слой составляет от приблизительно 10% до приблизительно 30% общей массы гранул с наслоенным лекарственным средством.
Лекарственного средства (например, темазепама) частицы (например, кристаллы, микрогранулы или гранулы с наслоенным лекарственным средством) ODT композиции данного изобретения имеют средний размер частиц 1-400 мкм. Кристаллы лекарственного средства со средним размером частиц в диапазоне приблизительно 1-200 мкм, в некоторых вариантах осуществления приблизительно 50-150 мкм, покрыты маскирующим вкус слоем путем либо покрытия с псевдоожиженным слоем, либо коацервацией, как описано в данном документе. В других вариантах осуществления у кристаллов лекарственного средства со средним размером частиц приблизительно 5-50 мкм замаскирован вкус путем коацервации в растворе, как описано в данном документе.
Как описано в данном документе, частицы лекарственного средства могут содержать дополнительные формообразующие средства. Если частицы лекарственного средства содержат дополнительные формообразующие средства (например, наполнители или разбавители и дезинтегранты), количество таких дополнительных формообразующих средств в частицах лекарственного средства могут варьировать от приблизительно 5% до 80%, включая приблизительно 5%-70%, приблизительно 5%-60%, приблизительно 5%-50%, приблизительно 5%-40%, приблизительно 5%-30%, приблизительно 5%-20%, приблизительно 5%-15%, приблизительно 5%-10%, приблизительно 10%-70%, приблизительно 10%-60%, приблизительно 10%-50%, приблизительно 10%-40%, приблизительно 10%-30%, приблизительно 10%-20%, приблизительно 10%-15%, приблизительно 20%-70%, приблизительно 20%-60%, приблизительно 20%-50%, приблизительно 20%-40%, приблизительно 20%-30%, приблизительно 20%-25%, приблизительно 30%-70%, приблизительно 30%-60%, приблизительно 30%-50%, приблизительно 30%-40%, приблизительно 30%-35%, приблизительно 40%-70%, приблизительно 40%-60%, приблизительно 40%-50%, приблизительно 40%-45%, приблизительно 50%-70%, приблизительно 50%-60%, приблизительно 50%-55%, приблизительно 60%-70% или приблизительно 60%-65%.
В одном варианте осуществления ODT композиции данного изобретения включают частицы лекарственного средства (например, темазепама) в комбинации с ODT связывающим полимером и быстро диспергирующиеся гранулы. Количество быстро диспергирующихся гранул в ODT композициях данного изобретения могут варьировать в зависимости от желательного времени распада, органолептических свойств и желательной дозы лекарственного средства, и могут варьировать от приблизительно 50% до приблизительно 90%, включая приблизительно 50%-80, приблизительно 50%-70, приблизительно 50%-60, приблизительно 60%-80, приблизительно 60%-70 или приблизительно 70%-80%, включая все значения, диапазоны и поддиапазоны между ними.
Более того, ODT композиции данного изобретения должны содержать достаточное количество частиц лекарственного средства для обеспечения терапевтически эффективной дозы лекарственного средства. Количество лекарственного средства в частицах лекарственного средства могут варьировать от приблизительно 5% до приблизительно 50%, включая приблизительно 5-40%, приблизительно 5-30%, приблизительно 5-20%, приблизительно 5-10%, приблизительно 10-40%, приблизительно 10-30%, приблизительно 10-20%, приблизительно 20-40% и приблизительно 20-30%, включая все значения, диапазоны и поддиапазоны между ними.
Композиции данного изобретения могут быть приготовлены путем гранулирования смеси лекарственного средства, одного или более ODT связывающих полимеров и быстро диспергирующихся микрогранул (как описано выше) или путем гранулирования смеси лекарственного средства, одного или более ODT связывающих полимеров, одного или более дезинтегрантов и одного или более сахарных спиртов и/или сахаридов. Затем гранулированные смеси прессуют.
Если композиции данного изобретения включают частицы лекарственного средства (например, микрогранулы темазепама или гранулы с наслоенным темазепамом), частицы лекарственного средства могут быть покрыты маскирующим вкус слоем, таким как описанный в патентных публикациях США №№2006/0105038, 2006/0078614 и 2006/0105039, включенных в данный документ путем ссылки во всей своей полноте для всех целей. Маскирующий вкус слой, если присутствует, включает один или более нерастворимых в воде полимеров. Неограничивающие примеры подходящих нерастворимых в воде полимеров включают, например, этилцеллюлозу (например, ETHOCEL Премиум стандарта от Dow), поливинил ацетат (PVA), целлюлозы ацетат (СА), целлюлозы ацетат бутират (CAB) и метакрилатные сополимеры, доступные под товарным знаком "EUDRAGIT" (такие как Eudragit RL, Eudragit RS, Eudragit NE30D и т.д.). В конкретном варианте осуществления нерастворимый в воде полимер представляет собой этилцеллюлозу, обладающую вязкостью в диапазоне 7-100 cps (измеренную как 5% раствор в 80/20 толуоле/этаноле при 25°С в вискозиметр Ubbelohde).
В других вариантах осуществления маскирующий вкус слой включает смесь одного или более нерастворимых в воде полимеров в комбинации со средством, формирующим поры, которое нерастворимо в воде и слюне, но быстро растворяется в кислотных условиях (например, в желудке). Подходящие средства, формирующие поры, включают, например, растворимые в желудке оксиды, гидроксиды и соли органических и неорганических кислот, а также растворимые в желудке формирующие поры полимеры. Неограничивающий перечень подходящих формирующих поры средств включают кальция карбонат, кальция фосфат, кальция сахарид, кальция сукцинат, кальция тартрат, трехвалентного железа ацетат, трехвалентного железа гидроксид, трехвалентного железа фосфат, магния карбонат, магния цитрат, магния гидроксид, магния фосфат и подобное, полимеры серий EUDRAGJT® Е (например, EUDRAGIT® E100 или EUDRAGIT® EPO) или поли(винилацеталь диэтиламиноацетат), например, АЕА®, доступный от Sankyo Company Limited, Токио (Япония), и их смеси. Соотношение нерастворимого в воде полимера к средству, формирующему поры, типично варьирует от приблизительно 95/5 до приблизительно 50/50, или в некоторых вариантах осуществления от приблизительно 85/15 до 65/35.
Поскольку покрывающие содержащие лекарственное средство частицы (например, кристаллиты темазепама, микрогранулы или гранулы с наслоенным лекарственным средством) с нерастворимым в воде полимером могут снижать скорость высвобождения лекарственного средства, маскирующее вкус покрытие также может включать средство, формирующее поры. Средства, формирующие поры, включают растворимые в желудке средства, формирующие поры, которые нерастворимы в воде и слюне, но быстро растворяются в кислотных условиях, таких как обнаруженные в желудке, и растворимые в воде средства, формирующие поры. Неограничивающие примеры подходящих растворимых в желудке средств, формирующих поры, включают, например, кальция карбонат, магния цитрат и магния гидроксид. Неограничивающие примеры подходящих растворимых в воде средств, формирующих поры включают, например, натрия хлорид, сахарозу и повидон. Соотношение нерастворимого в воде полимера к средству, формирующему поры, в маскирующем вкус слое может варьировать от приблизительно 95/5 до приблизительно 50/50. Маскирующий вкус слой может варьировать от приблизительно 5% до приблизительно 30% общей массы с замаскированным вкусом содержащей темазепам частицы или приблизительно 5%-25%, приблизительно 5%-20%, приблизительно 5%-15%, приблизительно 5%-10%, приблизительно 10%-30%, приблизительно 10%-25%, приблизительно 10%-20%, приблизительно 10%-15%, приблизительно 15%-30%, приблизительно 50%-25%, приблизительно 15%-20%, приблизительно 20%-30%, приблизительно 20%-25% или приблизительно 25%-30% общей массы с замаскированным вкусом содержащей темазепам частицы.
В одном варианте осуществления ODT композиции данного изобретения приготовлены путем (а) формирования частиц лекарственного средства (например, содержащие темазепам гранулы, микроинкапсулированные кристаллы темазепама, гранулы с наслоенным темазепамом и т.д.); (b) смешивания частиц лекарственного средства с дезинтегрантом, сахарным спиртом и/или сахаридом и 0,5-3% ODT связывающего средства (на основе общей массы ODT композиции); и (с) прессования смеси в ODT.
В одном варианте осуществления этап (а) выше, формирование частиц лекарственного средства, представляет собой гранулирование лекарственного средства с другими формообразующими средствами (например, сахарным спиртом, таким как маннит). Этап гранулирования может выполняться во влажных или сухих условиях в зависимости от используемых формообразующих средств на традиционном оборудовании для грануляции, таком как грануляторы с псевдоожиженным слоем, доступные от Glatt and Fluid Air. В специфическом варианте осуществления частицы лекарственного средства готовят путем влажного гранулирования лекарственного средства и маннит. В другом варианте осуществления этап (а) представляет собой микроинкапсулирование кристаллов лекарственного средства путем покрытия с псевдоожиженным слоем или коацервации, например, маскирующей вкус или изолирующей покрывающей композицией. В еще одном варианте осуществления этап (а) представляет собой формирование гранул с наслоенным лекарственным средством путем покрытия инертного ядра, такого как сахарные сферы, раствором или дисперсией лекарственного средства и наслаивающегося на лекарственное средство связывающего средства, такого как PVP.
Дезинтегрант и сахарный спирт и/или сахарид в этапе (b) выше могут быть отдельно добавлены к частицам лекарственного средства (например, темазепама), затем смешаны, или альтернативно могут быть комбинированы для формирования быстро распадающихся гранул, которые затем смешивают с частицами лекарственного средства. В одном варианте осуществления этап (b) представляет собой смешивание частиц лекарственного средства с быстро распадающимися гранулами, приготовленными влажной грануляцией (например, с использованием воды как гранулирующей жидкости) или сухой грануляцией, по меньшей мере, одного дезинтегранта, по меньшей мере, с одним сахарным спиртом и/или сахаридом в грануляторе с псевдоожиженным слоем. В специфическом варианте осуществления быстро распадающиеся гранулы включают кросповидон и маннит. В других вариантах осуществления частицы лекарственного средства (например, темазепама), дезинтегрант и сахарный спирт и/или сахарид гранулируют вместе, факультативно с дополнительными формообразующими средствами, такими как вспомогательные средства для прессования (например, микрокристаллическая целлюлоза), или смазочными материалами (например, магния стеарат). В одном варианте осуществления кристаллический темазепам, сахарный спирт, дезинтегрант и вспомогательное средство для прессования гранулируют с раствором растворимого в воде ODT связывающего средства. В другом конкретном варианте осуществления кристаллический темазепам, маннит, кросповидон и микрокристаллическую целлюлозу гранулируют с водным раствором гидроксипропилцеллюлозы.
Этап прессования (с) выше может быть выполнен с использованием традиционных способов, например, с роторным таблеточным прессом или таблеточным прессом с внешней смазкой.
Альтернативные процессы, которые не включают ODT связывающее средство (во время грануляции лекарственного средства, дезинтегранта, сахарного спирта и/или сахарида и факультативных дополнительных формообразующих средств) не обеспечивают коммерчески приемлемые ODT с приемлемым выходом. Например, в процессе, в котором D-маннит, имеющий средний размер частиц не более чем 35 мкм, кросповидон и темазепам гранулировали с быстро диспергирующимися микрогранулами, включающими маннит и кросповидон и другие формообразующие средства (мятную вкусовую добавку, подсластитель и дополнительный дезинтегрант), значительное прилипание гранулированного материала происходило на сторонах гранулятора с псевдоожиженным слоем, приводя к низкому выходу продукта и бимодальному распределению микрогранул, содержащих значительную фракцию мелких частиц. Проблема прилипания также приводила к образованию продукта ODT с появлением крапчатости (из-за несовместимого распределения ингредиентов в таблетке), уровни несовместимости лекарственного средства (например, темазепама) и образование задиров (бороздок) на таблетках во время прессования, вызванных высоким уровнем мелких частиц.
Неожиданно, добавление ODT связывающего средства в композиции данного изобретения значительно снижает мелкие частицы, отвечающие за наблюдаемое образование задиров, и уменьшает количество прилипания материала к сторонам гранулятора с псевдоожиженным слоем, посредством этого увеличивая выходы продукта и полую композиционную однородность ODT, особенно в длинных циклах производства. Кроме того, выбор и концентрация ODT связывающего средства является критическим во избежание создания более крупных и/или более твердых агломератов, которые будут требовать измельчения для достижения более высокого используемого выхода (увеличенной продуктивности) и для поддержания скоростей растворения в условиях in vitro/in vivo, которые обеспечивают биоэквивалентность для традиционных оральных дозированных форм (например, сравнивая скорости растворения содержащих темазепам ODT композиций данного изобретения со стандартным табличным лекарственным продуктом Restoril®, капсулы с немедленным высвобождением темазепама).
Как описано в данном документе, обнаружено, что незащищенные частицы лекарственного средства, особенно мелкие частицы, отвечали за наблюдаемое образование задиров и бороздчатости ODT таблеток во время длинных циклов таблетирования (типичные для условий коммерческого производства). При использовании небольшого количества ODT связывающего полимера в гранулирующей жидкости неожиданно обнаружено, что количество прилипания материала к сторонам гранулятора с псевдоожиженным слоем было в основном снижено, и образование задиров, наблюдаемых на таблетках во время сжатия также в основном было снижено.
Кроме того, принимая во внимание чувствительность некоторых лекарственных средств к условиям обработки (например, высокий потенциал взрывания темазепама), выбор и концентрация ODT связывающего полимера, как обнаружили, была критической для того, чтобы избежать образования более крупных и/или более твердых агломератов, которые бы требовали измельчения для достижения более высокого используемого выхода, и которые снижали бы биодоступность лекарственного средства (из-за более медленного растворения более крупных агломератов).
Таким образом, в конкретном варианте осуществления ODT композиции данного изобретения приготовлены путем гранулирования композиции, включающей приблизительно 10-15% по массе темазепама, сахарный спирт (например, маннит) и дезинтегрант (например, кросповидон) в присутствии раствора гидрофильного ODT связывающего полимера при относительно низкой концентрации (например, менее чем приблизительно 2% по массе относительно массы ODT), и прессования этой композиции в орально распадающиеся таблетки. Образовавшаяся ODT является достаточно прочной для пакования в блистеры или флаконы для хранения, транспортировки и продажи, обладает хорошими органолептическими свойствами при введении, быстрым in vitro распадом и быстрым растворением/высвобождением лекарственного средства.
В другом варианте осуществления ODT композиции данного изобретения приготовлены путем: (а) приготовления содержащих лекарственное средство микрогранул гранулированием кристаллического лекарственного средства со средним размером частиц приблизительно 1-50 мкм и одного или более разбавителей/наполнителей, таких как лактоза, маннит, микрокристаллическая целлюлоза и их смеси, с полимерным связывающим средством в грануляторе с высоким усилием сдвига или устройстве для нанесения покрытия с псевдоожиженным слоем; (b) гранулирования одного или более сахарных спиртов, сахаридов или их смесей, каждый из которых имеет средний диаметр частиц не более чем приблизительно 30 мкм, с дезинтегрантом, таким как кросповидон, с применением воды или смеси спирта с водой в традиционном грануляторе, и сушки гранулята в оборудовании с псевдоожиженным слоем или в традиционной печи для получения быстро диспергирующихся микрогранул со средним размером частиц не более чем приблизительно 400 мкм; (с) смешивания микрогранул лекарственного средства этапа (а) с одним или более ароматизирующими средствами, подсластителем, микрокристаллической целлюлозой, дополнительным дезинтегрантом и быстро диспергирующимися микрогранулами этапа (b); и (d) прессования смеси этапа (с) в таблетки с применением, например, традиционного роторного таблеточного пресса, оснащенного внешней смазочной системой для предварительного смазывания штампов и пуансонов.
В другом варианте осуществления ODT композиции данного изобретения приготовлены путем: (а) приготовления содержащей лекарственное средство ядерной частицы (например, кристаллиты темазепама, гранулы с наслоенным лекарственным средством или содержащие темазепам микрогранулы) с помощью гранулирования лекарственного средства и одного или более разбавителей/наполнителей, таких как лактоза, маннит, микрокристаллическая целлюлоза и их смеси, с ODT связывающим полимером в грануляторе с высоким усилием сдвига или устройстве для нанесения покрытия с псевдоожиженным слоем, или наслаивания лекарственного средства на инертную частицу (60-100 меш сахарная сфера или целлюлозная сфера, например, Celphere® CP-203) из раствора/суспензии, включающей полимерное связывающее средство и лекарственное средство, в устройстве для нанесения покрытия с псевдоожиженным слоем, и факультативно нанесения изолирующего покрытия (например, Opadry® прозрачный); (b) маскирующих вкус ядерных частиц с помощью микроинкапсулирования, например, коацервацией в растворе или покрытием с псевдоожиженным слоем, с нерастворимым в воде полимером, таким как этилцеллюлоза, или со смесью нерастворимого в воде функционального полимера и растворимого в воде/растворимого в желудке средства, формирующего поры (например, этилцеллюлоза и натрия хлорид или кальция карбонат при соотношении, варьирующем от приблизительно 50/50 до 95/5) для получения приятных на вкус микрочастиц с желаемым распределением размера частиц (например, средний размер частиц не более чем приблизительно 400 мкм или средним размером частиц не более чем приблизительно 300 мкм); (с) гранулирования одного или более сахарных спиртов, сахаридов или их смесей, каждый из которых имеет средний диаметр частиц не более чем приблизительно 30 мкм, с дезинтегрантом, таким как кросповидон, как раскрыто в данном документе; (d) смешивания микрочастиц с замаскированным вкусом этапа (b) с одним или более ароматизирующими средствами, подсластителем, микрокристаллической целлюлозой, дополнительным дезинтегрантом и быстро диспергирующимися микрогранулами этапа (с); и прессования смеси этапа (d) в таблетки с применением, например, традиционного роторного таблеточного пресса, оснащенного внешней смазочной системой для предварительного смазывания штампов и пуансонов.
In Vitro время распада/тестирование растворения:
Время распада измерили с помощью методик теста распада USP <701>. Маскирующее вкус свойство микрочастицы с замаскированным вкусом и орально распадающиеся таблетки можно было оценивать, помещая микрочастицы с замаскированным вкусом или орально распадающиеся таблетки на языке тестируемого субъекта, перемещая микрочастицы с замаскированным вкусом (после распада орально распадающийся таблетки) по ротовой полости субъекта и отмечая воспринимаемый вкус и послевкусие лекарственного средства, если испытывается. Кроме того, свойство быстрого высвобождения в желудке микрочастиц с замаскированным вкусом и орально распадающихся таблеток можно было оценить определением процента высвобождения лекарственного средства при тестировании официальной методикой USP (на аппарате 2 USP; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: UV (ультрафиолетовый свет) абсорбция при 310 нм) (высвобождение не менее чем приблизительно 75% дозы за приблизительно 30 минут считалось приемлемым).
Скорость распада ODT композиций в ротовой полости пациента может составлять порядка приблизительно 60 секунд или меньше, приблизительно 50 секунд или меньше, приблизительно 40 секунд или меньше, приблизительно 30 секунд или меньше, приблизительно 20 секунд или меньше, или приблизительно 10 секунд или меньше.
Альтернативно, скорость распада может быть измерена с использованием различных способов in vitro тестов, например, тест распада USP <701>, тогда ODT тестируют на растворимость с использованием официальной методики Фармакопеи Соединенных Штатов Америки (аппарат 2 USP; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбция UV при 310 нм). Когда используется тест распада USP <701>, скорость распада ODT композиций выше, чем у традиционных не ODT композиций, например, 60 секунд или меньше, 30 секунд или меньше, 20 секунд или меньше, или 10 секунд или меньше. Когда используется официальная методика Фармакопеи Соединенных Штатов Америки, скорость высвобождения лекарственного средства (например, темазепама) является сопоставимой, может быть немного выше или ниже, чем у традиционных не ODT композиций, например, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 100% высвобожденного темазепама за 30 минут.
Как описано выше, поскольку ODT композиции распадаются во рту пациента, ODT композиции должны быть вкусными, то есть, обладать приемлемыми органолептическими свойствами, такими как вкус, послевкусие, "привкус", время in vitro распада (DT), оральное или in vivo DT и равновесие вкусовая добавка-подсластитель (FSB). Свойства вкуса и послевкусия определяют с использованием шкалы горечи от 1 до 10, т.е., 1 (чрезвычайно горький; требующий маскировки вкуса), 5 (приемлемый) и 10 (приятный вкус). Шкала привкуса варьирует от 1 (очень песчаный, неприемлемый), 5 (непесчаный) и 10 (сливочный, гладкий). Шкала FSB (функциональное статическое равновесие) варьирует от 4 (низкое, нуждается в повышении), 7 (оптимальное) и 10 (сверхмеханическое, нуждается в снижении).
ODT композиции данного изобретения обладают свойствами вкуса и послевкусия, по меньшей мере, приблизительно 5, по меньшей мере, приблизительно 6, по меньшей мере, приблизительно 7, по меньшей мере, приблизительно 8, по меньшей мере, приблизительно 9, или приблизительно 10. ODT композиции данного изобретения имеют характеристики привкуса, по меньшей мере, приблизительно 5, по меньшей мере, приблизительно 6, по меньшей мере, приблизительно 7, по меньшей мере, приблизительно 8, по меньшей мере, приблизительно 9 или приблизительно 10. ODT композиции данного изобретения обладают свойствами FSB от приблизительно 5 до приблизительно 9, или от приблизительно 6 до приблизительно 8, или приблизительно 7.
ODT композиции данного изобретения обеспечивают приемлемый маскирующий вкус от времени помещения ODT композиции во рту до глотания. ODT композиции данного изобретения распадаются за приблизительно 60 секунд или меньше при оценивании с использованием теста распада USP <701>, и типично распад при контакте со слюной в преддверии рта происходит за приблизительно 60 секунд, образуя гладкую, легкую для глотания суспензию микрочастиц с замаскированным вкусом с приемлемым послевкусием. Микрочастицы с замаскированным вкусом обеспечивают в основном полное высвобождение дозы темазепама при попадании в желудок (например, не менее чем приблизительно 60%, более конкретно не менее чем 70% общей дозы, высвобожденной за приблизительно 30 минут при тестировании на растворимость с помощью официальной методики растворимости USP (аппарат 2 USP; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбция UV при 310 нм).
Композиции данного изобретения (например, ODT композиции), включающие микрогранулы, содержащие лекарственное средство (например, темазепам), согласно одному варианту высвобождения проявляют следующие свойства:
приемлемые твердость и рыхлость, подходящие для упаковки во флаконы и блистерные упаковки, хранения, транспортировки и коммерческого распределения;
распад при контакте со слюной в ротовой полости за приблизительно 60 секунд с формированием гладкой, легкой для глотания суспензии с приятным вкусом (без песчанистости или послевкусия), что соответствует стандарту не более чем 60 секунд, более конкретно не более чем 30 секунд при тесте распада<USP 701>; и
в основном полное высвобождение темазепама при попадании в желудок, как показано высвобождением не менее чем приблизительно 75% дозы за приблизительно 30 минут в официальной среде растворимости (аппарат 2 USP;
мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбции UV при 310 нм).
В одном варианте осуществления композиции данного изобретения, содержащие терапевтически эффективное количество темазепама, могут вводиться согласно любой подходящей схеме применения, которая можно быть легко определена врачом, и являются подходящими для лечения инсомнии. В одном варианте осуществления данное изобретение касается способа лечения пациента с нарушением сна, включающего орально распадающиеся таблеточные композиции, описанные в данном документе. В другом варианте осуществления данное изобретение касается способа лечения пациента, страдающего дисфагией и нарушением сна, включающего орально распадающиеся таблеточные композиции, описанные в данном документе.
Следующие неограничивающие примеры иллюстрируют ODT композиции данного изобретения и способы приготовления таких композиции.
ПРИМЕРЫ
Пример 1
Пример 1А - Быстро диспергирующиеся микрогранулы
Быстро диспергирующиеся микрогранулы были получены путем смешивания D-маннита со средним размером частиц приблизительно 15 мкм и кросповидона XL-10 при соотношении приблизительно 95/5 в грануляторе с высоким усилием сдвига с использованием очищенной воды в качестве гранулирующей жидкости. Образовавшиеся быстро диспергирующиеся микрогранулы были высушены путем распространения гранулированной смеси на лотках в нагретой конвекционной печи. Средний размер частиц высушенных быстро диспергирующихся микрогранул составлял менее чем приблизительно 400 мкм.
Пример 1В - 30 мг темазепама ODT
Сукралоза, вишневая или мятная вкусовая добавка, кросповидон XL-10 и микрокристаллическая целлюлоза были предварительно смешаны, затем смешаны с кристаллическим темазепамом и прессованы в 30 мг таблетки с использованием таблеточного пресса Hata и 11 мм круглых, стандартных, вогнутых инструментов, вакуумной системы транспортировки, таблеточного пылеуловителя, определителя металлических включений и системы Matsui ExLub. Система ExLub разбрызгивает смазочный материал (например, магния стеарат) с предварительно выбранной скоростью в полостях матрицы и на поверхности пуансона, а затем вакуумом удаляется излишек перед сжатием. Поверхности пуансона и матрицы были внешне смазаны магния стеаратом, поэтому смазочный материал присутствовал только в следовых количествах в таблетках. Установки таблеточного пресса были отрегулированы для обеспечения таблеток с рыхлостью менее чем 1% и твердостью приблизительно 30 Н путем изменения сил сжатия от приблизительно 8 кН до приблизительно 16 кН. Относительные стандартные отклонения (RSD) масс таблеток (целевая масса: 500 мг) были очень низкими, варьирующими от 0,24% до 1,22%. Твердость таблеток варьировала от приблизительно 34 Н до приблизительно 129 Н в зависимости от силы сжатия, а рыхлость варьировала от 0,6% до 1,5% в зависимости от твердости таблеток. Время распада таблеток составляло менее чем 30 секунд, а значения растворимости были все>90% за 30 минут с использованием официальной методики растворимости USP (аппарат 2 USP; мешалки @ 75 оборотов в минуту в 900 мл буфера ацетата натрия (pH 4,0) с 0,05% полисорбата 80; определение: абсорбции UV при 310 нм). Несмотря на жесткий контроль таблеточной массы, анализы темазепама были низкими, и наблюдались высоко изменчивые однородности содержания. Низкие значения анализа темазепама, как представляется, вызваны вакуумной системой транспортировки пресса Hata, которая вакуумом удаляет мелкие частицы лекарственного средства во время прессования. Из-за низкого анализа темазепама и высоко изменчивых значений однородности содержания этот процесс не рассматривали с коммерческой точки зрения.
Пример 2
Пример 2А - Микрогранулы темазепама
Микрогранулы темазепама были получены путем загрузки гранулятора Glatt GPCG 5 с псевдоожиженным слоем темазепамом, маннитом и кросповидоном, и гранулирования смеси с использованием очищенной воды в качестве гранулирующей жидкости (размер партии 6 кг). Партии были получены с приблизительно 6,3% масса/масса, 15,0% масса/масса и 30,0% масса/масса концентрациями лекарственного средства для оценки эффекта повышения концентрации темазепама на качество образовавшихся гранул. Прилипание маннита к сторонам технологической установки с псевдоожиженным слоем наблюдали во время изготовления этих партий, что приводило к бимодальному распределению размеров частиц и значительной фракции мелких частиц, которые в свою очередь вызывали непостоянство свойств текучести.
Пример 2В - Темазепама ODT (7,5, 15, 22,5 и 30 мг дозировки темазепама)
Различные ODT композиции были оценены для определения "надежности" составов (например, эффект количеств наполнителя, дезинтегранта, подсластителя, вкусовой добавки и быстро диспергирующихся микрогранул, условий разбрызгивания смазочного материала и параметры таблетирования, такие как сила сжатия, глубина заполнения, масса таблетки, скорость головки и т.д. на ODT свойства, такие как твердость, рыхлость (цель: <0,6%)). Партии сжатия темазепама были получены путем первого предварительного смешивания сукралозы, вишневой или мятной вкусовой добавки, кросповидона XL-10 и микрокристаллической целлюлозы, затем смешивая эту смесь с быстро диспергирующимися микрогранулами, приготовленными, как описано в Примере 1А, и микрогранулами темазепама, приготовленными, как описано выше в Примере 2А (с содержанием лекарственного средства или приблизительно 6,3%, или приблизительно 30% по массе; смотри Таблицу 1 для более подробного объяснения), для обеспечения композиций темазепама при размере партий 0,5, 2 или 5 кг с теоретическим анализом смеси темазепама 6,0% масса/масса в Таблице 2.
Партия сжатия (1136-JMC-041), приготовленные, как описано выше, была прессована на таблеточном прессе Hata, оснащенном системой внешней смазки ExLub, в 7,5 мг и 30 мг таблетки при скорости головки 15 оборотов в минуту (смотри Таблицу 2 для более подробного объяснения). Темазепама ODT таблетки прочностью 7,5 мг, 15 мг, 22,5 и 30 мг также были прессованы с использованием смеси сжатия (1136-JMC-043), которые были пропорциональны дозе 30 мг ODT таблеток (смотри Таблицу 3 для более подробного объяснения). Не наблюдались проблемы, связанные с текучестью или сжатием во время таких коротких циклов сжатия. Изменение массы таблеток, измеренное в зависимости от относительного стандартного отклонения (RSD), варьировало от 0,21% до 2,35%, и были получены приемлемые значения твердости и рыхлости. Время распада варьировало от низкого в 13 секунд до высокого в 41 секунду. Относительные стандартные отклонения для однородности содержания варьировали от приблизительно 1,5% до 4,5%. Наблюдаемые свойства, по-видимому, показывают, что процессы создания промежуточных, а также окончательных композиции являются достаточно надежными для получения ODT, по меньшей мере, в таком масштабе производства.
Пример 2С - Обработка коммерческого масштаба
Грануляционный состав темазепама, образованный с использованием Glatt gPCG 5, как описано в Примере 2В, был увеличен в масштабе путем приготовления гранул темазепама в грануляторе Fluid Air FA 0300 с псевдоожиженным слоем, оснащенном 32'' верхним контейнером для разбрызгивания продукта (размер партии:
160 кг), размещенным на дне ситом 100 меш (поддержка продукта), тремя соплами с диаметром наконечника сопла 0,085'', двумя крышками насоса/соплами перистальтического насоса, установленными на 6,4 мм, и предназначенным для размера пор 10 мкм фильтровальным мешком. Контейнер для продукта Fluid Air был наполнен 10,1 кг темазепама, 140,0 кг маннита и 8 кг кросповидона. Эти ингредиенты были гранулированы, будучи разбрызганными, с водным раствором сукралозы и FD & С голубого #1 (всего 120 кг: 0,56 кг сукралозы, 0,144 кг FD & С голубого # 1, балансная вода). Были использованы следующие параметры процесса: температура воздуха на впуске: 60-90°С, объем воздуха: 1300 cfm (кубический фут в минуту), скорость разбрызгивания установлена на 25%, температура продукта <50°С. Наблюдалось значительное прилипание мелкого порошка на внутреннюю поверхность технологической установки с псевдоожиженным слоем.
Обработанные на Fluid Air Air микрогранулы темазепама, быстро диспергирующиеся микрогранулы, приготовленные, как описано в Примере 1А, и другие формообразующие средства (сукралоза, вишневая или мятная вкусовая добавка, кросповидон XL-10 и микрокристаллическая целлюлоза) были смешаны в 10 cu-ft V-смесителе (размер партии: 150 кг) и прессованы на таблеточном прессе Hata, оснащенном внешней самазочной системой ExLub. Таблеточный пресс Hata был оснащен 11 мм круглой с плоской поверхностью, инструментом округления края для "товарного вида" с монограммой "R" на одной стороне. Скорость головки была установлена на 25 оборотов в минуту, а скорость разбрызгивания магния стеарата была установлена на приблизительно 1 - 2 вольт (средняя скорость разбрызгивания). Серьезные дефекты (т.е., дефекты, вызванные контаминацией штампа мелкими частицами) почти сразу были отмечены в районе "R". Приблизительно через один час операции также наблюдалось образование задиров по сторонам таблеток. Также наблюдалась некоторая крапчатость во внешнем виде таблеток, что свидетельствует о неравномерном смешивании компонентов смеси. Эти проблемы не наблюдались во время коротких циклов партий экспериментального масштаба.
Для того, чтобы устранить проблемы, идентифицированные во время увеличенного масштаба, были выполнены некоторые модификации условий обработки и ODT состава, включая добавление экстра дезинтегранта, изменяя скорость головки, заменяя конфигурации инструмента, изменяя скорость разбрызгивания внешнего смазочного материала, добавляя внутренний смазочный материал в ODT состав. Тем не менее, ни одно из этих технологических изменений не решило проблем сортировки, образования задиров и крапчатости. Партия плацебо крупного масштаба (т.е., маннит и кросповидон, но без темазепама) также была приготовлена в грануляторе FA 300 с псевдоожиженным слоем и была смешана с оставшимися формообразующими средствами (сукралоза, вишневая или мятная вкусовая добавка, кросповидон XL-10 и микрокристаллическая целлюлоза) и прессована на таблеточном прессе Hata с использованием инструмента округления края для товарного вида, но не наблюдалось образование задиров. Следовательно, образование задиров, наблюдаемое во время сжатия, являлось признаком присутствия непокрытых частиц лекарственного средства, особенно мелких частиц лекарственного средства, образованных во время обработки.
Пример 3
Пример 3А - Гранулы темазепама, содержащие ODT связывающее средство
Серий 6 партий небольшого масштаба (смотри Таблицу 4 для композиций гранул темазепама; размер партии: 6 кг) были гранулированы в грануляторе Glatt 5 с псевдоожиженным слоем в присутствии небольших количеств гидроксипропилцеллюлозы NF с теми же операционными параметрами, используемыми выше в Примере 2.
Пример 3В - Гранулы темазепама увеличенного масштаба
Композиция гранул темазепама показана в Таблице 5, а композиция смеси сжатия показана в Таблице 5.
|
Пример 3С - Микрогранулы темазепама
Маннит 25 (122,4 кг) и Кросповидон XL-10 (8,0 кг) были совместно измельчены индивидуальным пропусканием смеси через мельницу Comil®. Маннит, Кросповидон, а также предварительно подготовленная микрокристаллическая целлюлоза (Avicel РН 101; 8 кг) и кристаллический темазепам (Mallinckrodt, 19,2 кг) были смешаны в течение приблизительно 3-5 минут. Раствор ODT связывающего средства был приготовлен путем медленного добавления гидроксипропилцеллюлозы (Klucel LF, 2,4 кг) к 113 кг очищенной воды USP в контейнере из нержавеющей стали с перемешиванием до растворения. Устройство Fluid Air FA 300 было предварительно нагрето, пока пустое, для снижения количества материала, прилипающего к стенкам устройства. Предварительно смешанная смесь маннита, кросповидона, микрокристаллической целлюлозы и кристаллического темазепама была добавлена в устройство Fluid Air и предварительно нагрета. Водный раствор гидроксипропилцеллюлозы, описанный выше, был разбрызган на смесь и гранулирован. Процесс грануляции был выполнен в 3 контурах с различными расходами воздуха и временем встряхивания фильтровального мешка для минимизации количества мелких частиц в образовавшейся грануляции. После разбрызгивания влажные гранулы сушили для снижения влажности в грануляции до ниже 2,00%. Сухие гранулы были пропущены через сито 20 меш товарного сорта с использованием решета Kason 30'' на картонных барабанах, выстланных двойным внутренним слоем антистатических полиэтиленовых мешков. Гранулы с завышенными размерами не были измельчены, а были отброшены из-за взрывного потенциала темазепама API и гранул. Две дополнительные партии (каждая 160 кг) гранул также были приготовлены, как описано выше. В процессе получили микрогранулы темазепама с очень однородными распределениями размеров частиц и очень высокими выходами, которые варьировали от 96,0% до 98,8%, с количеством материала с завышенными размерами, варьирующим от 0,1% до 0,9%. Значения анализа темазепама варьировали от 11,8% до 12,1%. Эти результаты показывают пониженные уровни прилипания и мелких частиц, и не наблюдалось образование задиров в каких-либо из таблеток, смешанных с микрокристаллической целлюлозой (смотри Таблицу 6 для более подробного объяснения по композиции ODT составов), NF. Все другие таблеточные свойства были подобны тем, что наблюдались ранее (смотри Таблицу 7 для свойств таблетирования для ODT составов (размер партии: 6 кг)). Отдельные значения растворимости за 30 минут для этих таблеток с прочностью 7,5, 15, 22,5 и 30 мг находились в диапазоне 98-101%.
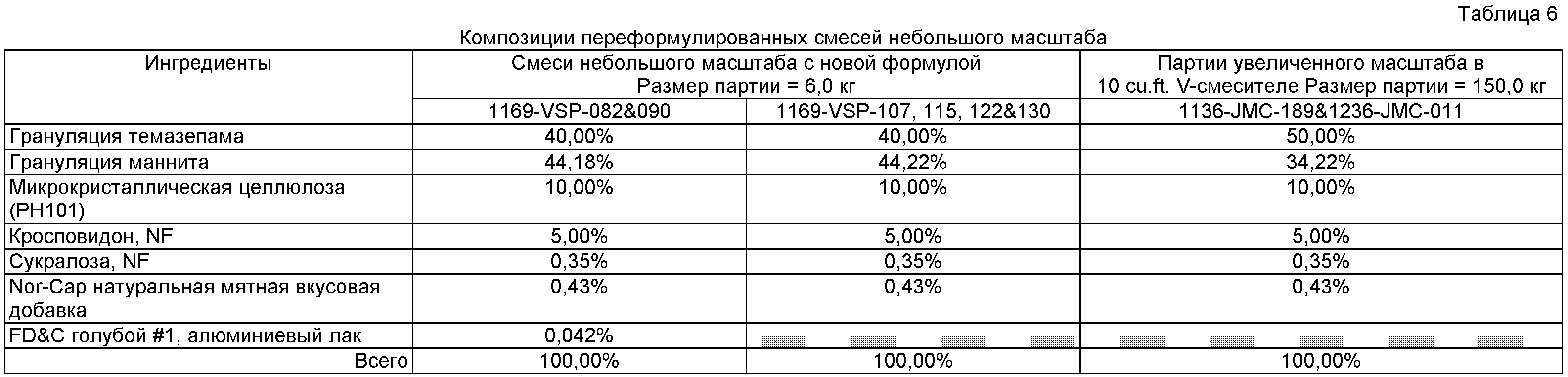

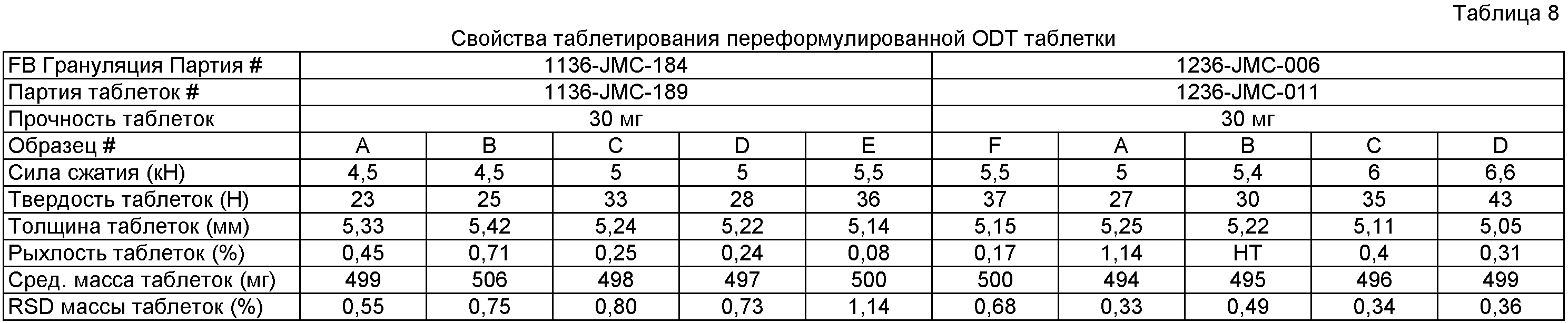
Процесс был увеличен в масштабе с использованием 1,5% гидроксипропилцеллюлозы NF (Klucel LF) во время грануляции для обеспечения гранул темазепама, включающих 12,0 масса/масса% концентрацию темазепама. Были изготовлены две партии (смотри Таблицу 4/5 для композиции грануляции) с использованием гранулятора Fluid Air, следующим образом: Микрогранулы темазепама были смешаны с быстро диспергирующимися микрогранулами и другими формообразующими средствами (сукралоза, вишневая или мятная вкусовая добавка, кросповидон XL-10 и микрокристаллическая целлюлоза), включая микрокристаллическую целлюлозу, для создания окончательных смесей сжатия при активности 6,0% по массе темазепама (смотри Таблицу 5 для композиции ODT смеси). Затем эти смеси были спрессованы в ODT с использованием пресса Plata, оснащенного системой Matsui ExLub (смотри Таблицу 8 для свойств таблетирования). Скорости разбрызгивания внешнего смазочного материала (магния стеарата) варьировали от 1,80 до 3,17 г/минута для определения эффекта скорости разбрызгивания смазочного материала на растворимость таблеток.
Данные растворимости показали, что ни ODT связывающее средство, добавленное во время грануляции темазепама, ни внешнее нанесение смазочного материала не имели какого-либо эффекта на растворимость образовавшихся таблеток (количество растворенного темазепама было более чем 99% для всех составов за 30 минут). Кроме того, во время коротких или длинных циклов сжатия не столкнулись с проблемами, связанными с потоком. Проведенные исследования подтвердили решение технических вопросов, наблюдаемых ранее во время грануляции темазепама (без ODT связывающего полимера) и таблетирования темазепама ODT таблеток, включающих такие гранулы.
Пример 3D - Смесь сжатия темазепама ODT
Сжатия смешивание композиций (Таблица 5), приготовленных, как описано выше, включает два этапа смешивания: 1) предварительное смешивание сукралозы, мятной вкусовой добавки, кросповидона XL-10 и микрокристаллической целлюлозы в 2 cu-ft V-смесителе, и 2) окончательное смешивание предварительно смешанной смеси с быстро диспергирующимися микрогранулами Примера 1А и микрогранул темазепама Примера 3С (Таблица 4) в V-смесителе. На этапе предварительного смешивания микрокристаллическая целлюлоза, кросповидон, Nor-Cap натуральная мятная вкусовая добавка и сукралоза были сначала смешаны в 2 cu-ft V-смесителе, а затем пропущены через мельницу Comil®, чтобы разрушить какие-либо скопления и обеспечить достаточное смешивание сукралозы и мятной вкусовой добавки с другими формообразующими средствами. Мятная вкусовая добавка была пропущена через стандартное ручное сито 40 меш для разрушения каких-либо скоплений перед смешиванием с другими формообразующими средствами. Затем этот смешанный материал был помещен внутрь 10 cu-ft V-смесителя вместе с микрогранулами темазепама, приготовленными, как описано выше (Пример 3С), и быстро диспергирующимися микрогранулами (Пример 1А) и далее смешивали перед разгрузкой на картонных барабанах, выстланных двойным внутренним слоем антистатических мешков. Для проверки гомогенности окончательной смеси было выполнено исследование смешивания единичной дозы на трех из шести партиях смешивания, и были отобраны образцы из 10 различных местоположений для анализа темазепама (смотри Фигуру 1 для местоположений отбора образцов и значений анализа).
Пример 3Е - Сжатие темазепама ODT
Партии смесей сжатия были прессованы на таблеточном прессе Hata, оснащенном системой внешней смазки Exiub. Стартовые операционные параметры даны в Таблице 8, и менялись по необходимости для поддержания таблеточной массы, твердости, толщины и рыхлости в пределах коммерческих допусков. Диапазон масс для таблеток, как правило, поддерживался с ±4% целевой массы таблетки. Была запущена система ExLub, чтобы смазочный материал был разбрызган должным образом, когда таблеточный пресс будет работать. Параметры таблетирования, такие как глубина загрузки (мм), позиция предварительного сжатия (мм или кН) и главная позиция сжатия (мм или кН) были заданы на прессе для того, чтобы получить 7,5 мг таблетки, которые отвечают техническим условиям, показанным в Таблице 9. После успешной установки пресс был запущен в 'автоматическом режиме' до завершения цикла сжатия. Во время цикла таблетки периодически отбирались для гарантии того, что полученные таблетки будут отвечать техническим условиям. Одна партия смеси (размер партии: 140 кг Примера 3D) была прессована в 7,5 мг и 30 мг таблетки, тогда как другая партия смеси была прессована в 15 мг и 30 мг таблетки при скорости головки 15 оборотов в минуту. Каждая партия прогонялась за приблизительно 6-8 часов в зависимости от размера партии. Таблеточная масса, твердость и толщина измеряли на образце пяти таблеток каждые 30 минут. Каждые 60 минут достаточный образец также брали для тестирования рыхлости. Ни один из операционных параметров не требовал регулировок во время какого-либо из циклов для поддержания характеристик таблеток в пределах технических условий, приведенных в Таблице 9, ниже.
|
Фигура 2 показывает изменения массы для 7,5 и 30 мг темазепама ODT, на всем протяжении каждого цикла. Массу таблеток во всех 12 циклах таблетирования (партии) поддерживали очень близко к соответствующим целям. Диапазоны для средней таблеточной массы, толщины, твердости и рыхлости, а также среднее относительное стандартное отклонение (RSD), показаны в Таблице 10. Никаких связанных с текучестью проблем обработки или образования задиров не наблюдали во время этих циклов таблетирования. Кроме того, добавленное связывающее средство не снижает скорости растворимости темазепама (Таблица 10) по сравнению с ODT, приготовленными без ODT связывающего средства (т.е. Примеры 1 и 2).
|
Пример 4
Пример 4А - Протокол исследования
Профили растворения для 7,5, 15, 22,5 или 30 мг темазепама ODT, приготовленных в Примере 3Е, и капсул Restoril представлены в Таблице 11, ниже, а также на Фиг.3
|
Было выполнено два клинических исследования на нормальных субъектах людях при условиях голодания и питания. Первое клиническое исследование было без контроля плацебо, рандомизированным, в трех повторностях, перекрестным исследованием для оценивания биоэквивалентности 30 мг темазепама ODT, взятых с и без воды, по сравнению с 30 мг капсулами темазепама (контрольный продукт лекарственного средства Restoril®) у нормальных людей натощак. Второе клиническое исследование было в двух повторностях, перекрестным исследованием в условиях питания. В обоих исследованиях использовали ODT темазепама (размер партии: 570000 таблеток, анализ: 102,3%; однородность содержания (среднее: 99,7%; CV: (111 1,0%)) и Restoril (серия капсул # 9917J50709 (размер партии: 1,9 миллионов единиц; анализ: 99,2%; CU (среднее: 100,7%; CV: 1,5%)).
В исследовании при голодании 54 здоровых субъектов (47 завершили) получили три отдельных введения лекарственного средства в три определенных периода, одна отдельная 30 мг доза на период. Лекарственное средство было введено через 10 часов голодания во время 0, день 1 исследования. Вводимым лекарственным средством было или: темазепам ODT состав с 240 мл (8 унциями жидкости) водопроводной воды комнатной температуры сразу же после орального распада таблетки, ODT темазепама 46 без воды, или капсула Restoril® с 240 мл (8 унций жидкости) водопроводной воды комнатной температуры. Пища была запрещена в течение еще 4 часов после дозы.
В исследовании при питании 50 здоровых субъектов получили одну 30 мг дозу темазепама ODT, введенную с 240 мл (8 унций жидкости) водопроводной воды комнатной температуры сразу же после орального распада таблетки, или отдельную 30 мг капсулу Restoril® с 240 мл (8 унций жидкости) водопроводной воды комнатной температуры после 10-часового голодания на протяжении ночи, и употребили стандартный завтрак с высоким содержанием жира.
Клиническая безопасность темазепама контролировалась с использованием следующих параметров: нежелательные явления, показатели жизненно важных функций (давление крови в положении сидя, пульс и частота дыхания), проверка состояния здоровья, медицинские осмотры, история болезни, клинические лабораторные показатели (гематология, химия, анализ мочи) и оценки нарушений. В каждом периоде исследования было получено 6 мл образцов крови перед дозированием (за 1 час перед дозированием) и в 0,25, 0,50, 0,75, 1, 1,25, 1,50, 1,75, 2, 2,50, 3, 4, 6, 8, 12, 16, 24, 30, 36, 48, 60 и 72 часа после дозы. Плазма была отделена от всех образцов крови и анализирована на темазепам с использованием утвержденного аналитического способа LC-MS/MS (жидкостная хроматография - масс-спектроскопия/ масс-спектроскопия) (диапазон калибровки: 20-1200 нг/мл). Клиническая безопасность была проконтролирована с помощью нежелательных явлений, показателей жизненно важных функций, проверки состояния здоровья, медицинского осмотра, клинических лабораторных показателей и оценок нарушений. Методика параметрической общей линейной модели (т.е. некомпартментный метод) была использована в анализе вариации фармакокинетических (РК) параметров. Из результатов ANOVA (дисперсионный анализ) на логарифмично превращенных данных 90% доверительных интервалов и внутри-субъектные коэффициенты вариации были вычислены для AUC0-inf(нг*час/мл) и Cmax (нг/мл). Результаты, полученные в исследовании при голодании и питании, представлены в Таблице 12 и 13, соответственно, тогда как профили концентрация в плазме-время, средняя AUC и Cmax и их стандартные отклонения представлены на Фигурах 4 и 5. Кроме того, были получены результаты ANOVA по непревращенным параметрам Tmax (время к максимальному уровню в плазме, часы), t1/2 и kcl. Исходя из этих данных, 30 мг темазепама ODT дозированная форма, вводимая с водой или без воды, как было обнаружено, биоэквивалентна 30 мг капсулам Restoril®, дозированным с водой в состоянии голода или сытости. Обе 30 мг дозированные формы темазепама, как обнаружили, были безопасными и хорошо переносимыми.
|
|
Пример 5
Пример 5А - Микрокапсулы темазепама при 6% покрытии
В 5-галлоновую емкость для коацервации, оснащенный лопастью мешалки 6''+4'' с высоким усилием сдвига с 3-режущими пластинами, загрузили 10 кг циклогексана, а 850 г материала кристаллического темазепама, 150 г этилцеллюлозы (Этоцел стандарт 100 Премиум), 100 г полиэтилена (Epoline С-10) загрузили в емкость. Емкость нагрели до приблизительно 80°С при перемешивании при приблизительно 200 оборотах в минуту для растворения этилцеллюлозы. Затем емкость подвергли контролированному применению для индуцирования разделения фаз. При охлаждении до окружающей температуры микрокапсулы фильтровали, промыли свежим циклогексаном, и фильтрованный материал перенесли в вытяжное устройство, чтобы позволить оставшемуся циклогексану выпариться, посредством этого обеспечивается микроинкапсулированный темазепам с 6 мас.% этилцеллюлозного покрытия.
Пример 5В - Темазепама ODT
Сукралозу (0,35%), вишневую вкусовую добавку (0,50%), микрокристаллическую целлюлозу (Ceolus KG-1000 от Asahi Kasei, Токио, Япония; 5%) и кросповидон (4,15%) предварительно смешали в 0,25 cu-ft V-смесителе и далее смешивали с микрочастицами темазепама с замаскированным вкусом (40%), приготовленными, как описано выше, и быстро диспергирующимися микрогранулами (50%) и прессовали в 7,5, 15, 22,5 и 30 мг темазепама ODT.