Результат интеллектуальной деятельности: СПОСОБ ОБРАБОТКИ УПАКОВКИ С ОДНОКРАТНОЙ ДОЗОЙ ЛЕКАРТВЕННОГО ПРЕПАРАТА
Вид РИД
Изобретение
Ссылка на родственные заявки
Для настоящей заявки испрашивается приоритет по предварительной заявке US 61/000627, поданной 25 октября 2007 г., которая включена в настоящую заявку в полном объеме посредством ссылки.
Область техники
Настоящее изобретение, в частности, относится к обработке (доведению до требуемого состояния) порошковых составов в блистерных упаковках или упаковках других конфигураций, для повышения степени дисперсности порошка. Настоящее изобретение также относится к различным аппаратам для достижения вышеуказанной цели.
Уровень техники
Необходимость эффективного терапевтического лечения пациентов привела к разработке разнообразных способов приема фармацевтических составов пациентами. Один из традиционных способов предполагает пероральное введение фармацевтических составов в форме таблеток, капсул и др. Другой способ, также зарекомендовавший себя в качестве эффективного способа введения лекарственных препаратов, предполагает их введение ингаляцией, при котором пациент вдыхает аэрозольный фармацевтический состав через рот или через нос, для его попадания в дыхательные пути. Согласно одной из техник способа ингаляции фармацевтический состав вводят глубоко в легкие пациента, где указанный состав может абсорбироваться в кровоток. Согласно другой технике фармацевтический состав вводят в конкретную область дыхательных путей для локального лечения этой конкретной области. Существует множество типов устройств для ингаляции, включая устройства, которые переводят фармацевтический состав в виде сухого порошка в аэрозольный состав.
Фармацевтический состав часто имеет такую упаковку, в которой он может быть легко доступен для приема пациентом. Например, доза или часть дозы может располагаться между слоями многослойной упаковки, которую традиционно называют блистером или блистерной упаковкой. В таких упаковках, как правило, нижний слой имеет углубление, в которое помещают лекарственный препарат, а верхний слой герметически наносят на нижний слой способом термосклеивания и(или) прессования слоев, для гарантии нахождения лекарственного препарата внутри указанного углубления. В качестве альтернативного варианта, доза лекарственного препарата может быть заключена в капсулу, предназначенную либо для проглатывания, либо из которой лекарственный препарат может быть переведен в аэрозольный состав. Кроме того, для хранения лекарственных препаратов могут использоваться также и другие упаковочные средства, такие как бутылки, пузырьки и т.д. В публикации международной заявки WO 01/43802 раскрыты системы и способы обращения с упакованными порошковыми лекарственными средствами в момент ингаляции.
Часто эффективное заполнение упаковочных средств лекарственными препаратами связано с определенными трудностями. Например, в процессе заполнения упаковочных средств некоторыми порошковыми препаратами достаточно трудно придать порошку требуемую текучесть и(или) поддерживать текучесть такого порошка постоянной. С другой стороны, иногда порошки могут быть спрессованы в шайбообразные таблетки для их заполнения в штампованные блистерные упаковки. В зависимости от характерных особенностей порошка в насыпном виде, для гарантии требуемого контроля заполняемой массы, специально регулируют степень вакуумирования и амплитуду ультразвукового зонда в расфасовочной машине, формирующей указанные таблетки. Такая таблетка может рассыпаться в порошок во время последующих операций на расфасовочной/упаковочной машине или во время транспортировки. Однако в тех случаях, когда таблетка является относительно "жесткой", она может не полностью диспергироваться с образованием однородного порошка, как это требуется для надлежащего приема пациентом. Механические вибрации, имеющие место во время последующей транспортировки конечного продукта, также могут оказывать влияние на свойства порошка в блистерной упаковке. Такие вибрации могут привести к различию в дозах препарата, предлагаемого пациенту, поскольку результаты выпущенных доз лекарственного препарата на время окончания производственных испытаний могут отличаться от результатов выпущенных доз этого же препарата на момент приема. Следовательно, полезно "обработать" или разбить таблетку порошкового лекарственного препарата после заполнения и герметичного запечатывания блистера для гарантии постоянных характеристик продукта, начиная со времени его производства, до момента его приема. Соответственно имеются в разработке новые механизмы доведения до требуемого состояния упомянутых порошковых препаратов.
Раскрытие изобретения
Настоящее изобретение предлагает способы обработки до требуемого состояния порошковых препаратов (лекарственных средств) после их упаковки для более легкого их извлечения из упаковочных средств. Эти и другие предметы, аспекты, варианты и особенности настоящего изобретения станут еще более очевидными из следующего подробного описания.
Краткое описание чертежей
Далее настоящее изобретение раскрыто в приведенном ниже описании и проиллюстрировано на прилагаемых чертежах, на которых:
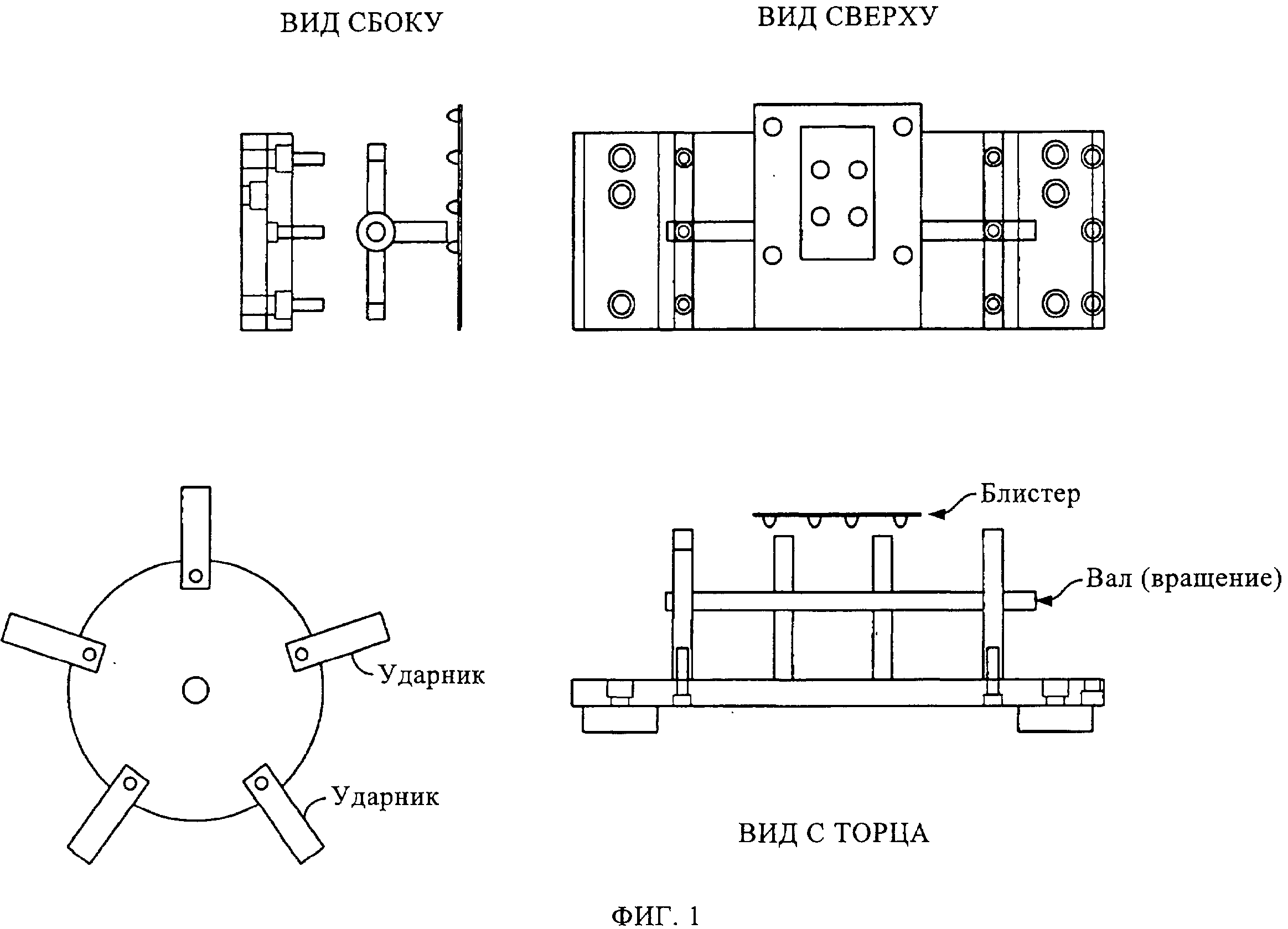
на фиг.1 показан механический встряхиватель;
на фиг.2 показана акустическая система на расфасовочной/упаковочной машине;
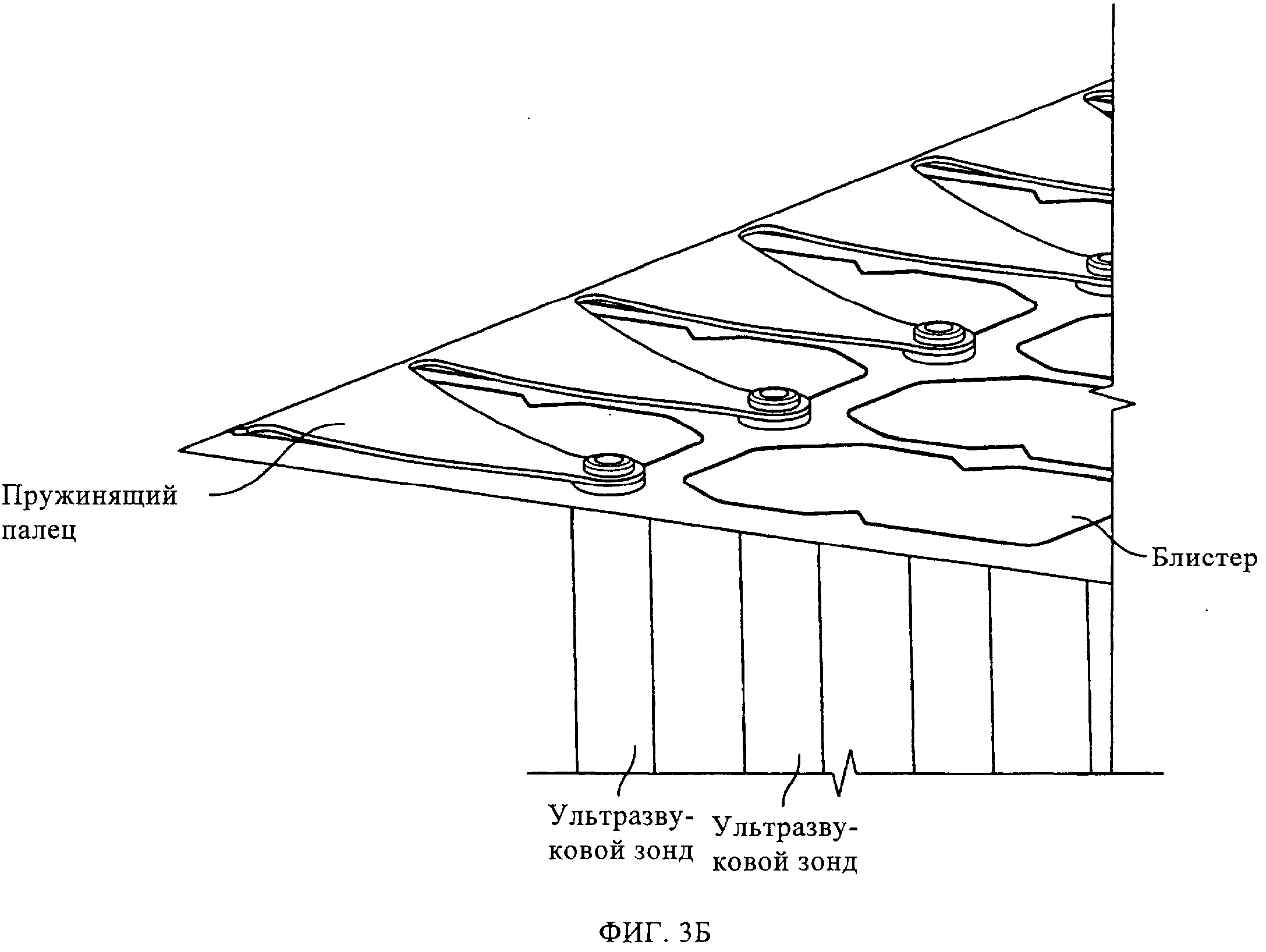
на фиг.3А и 3Б показана обработка блистерных упаковок ультразвуком;
на фиг.4 показана ультразвуковая ванна с блистерными упаковками;
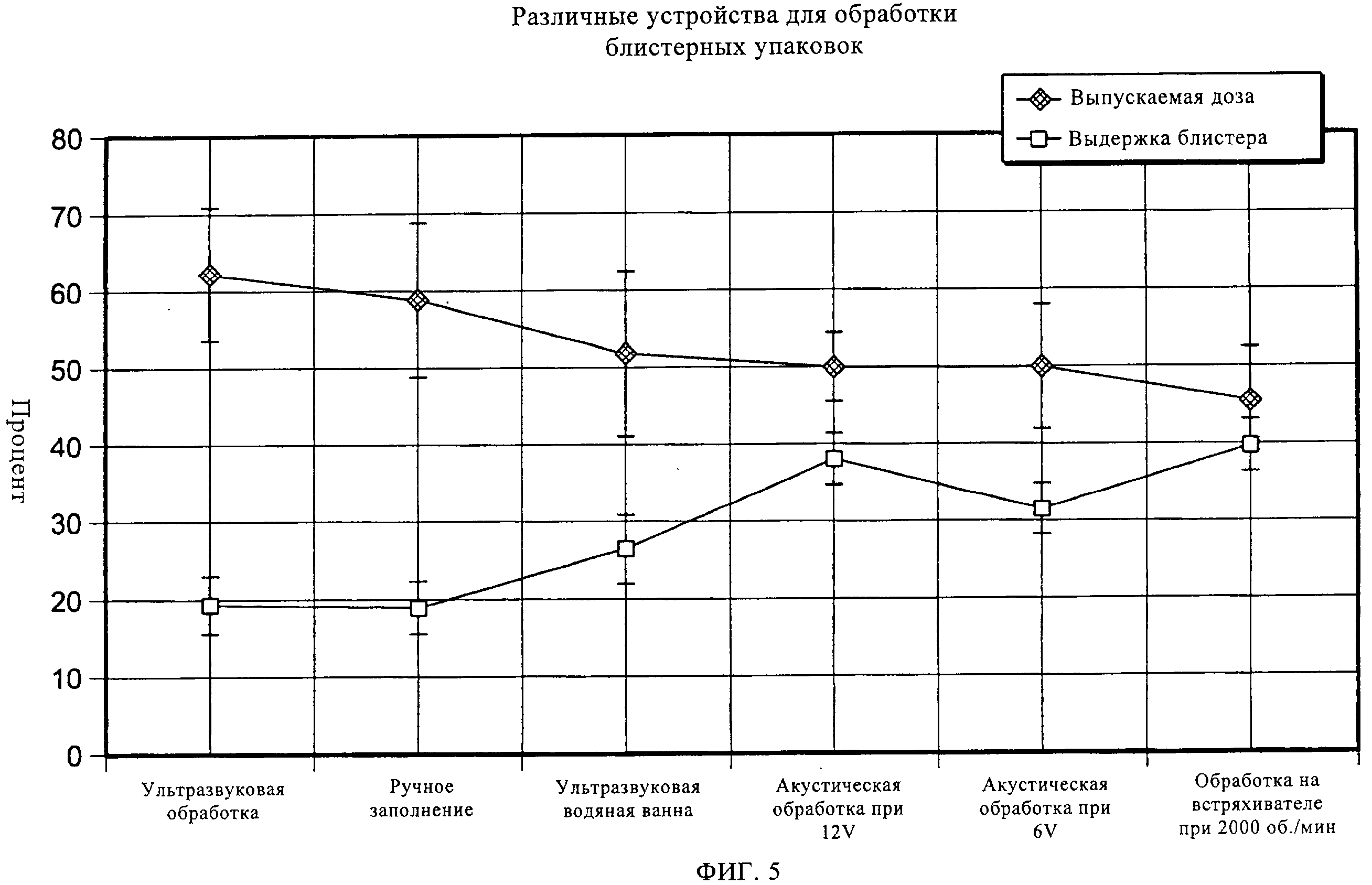
на фиг.5 показано влияние различных способов обработки на подаваемую пациенту дозу и на время выдерживания блистерной упаковки;
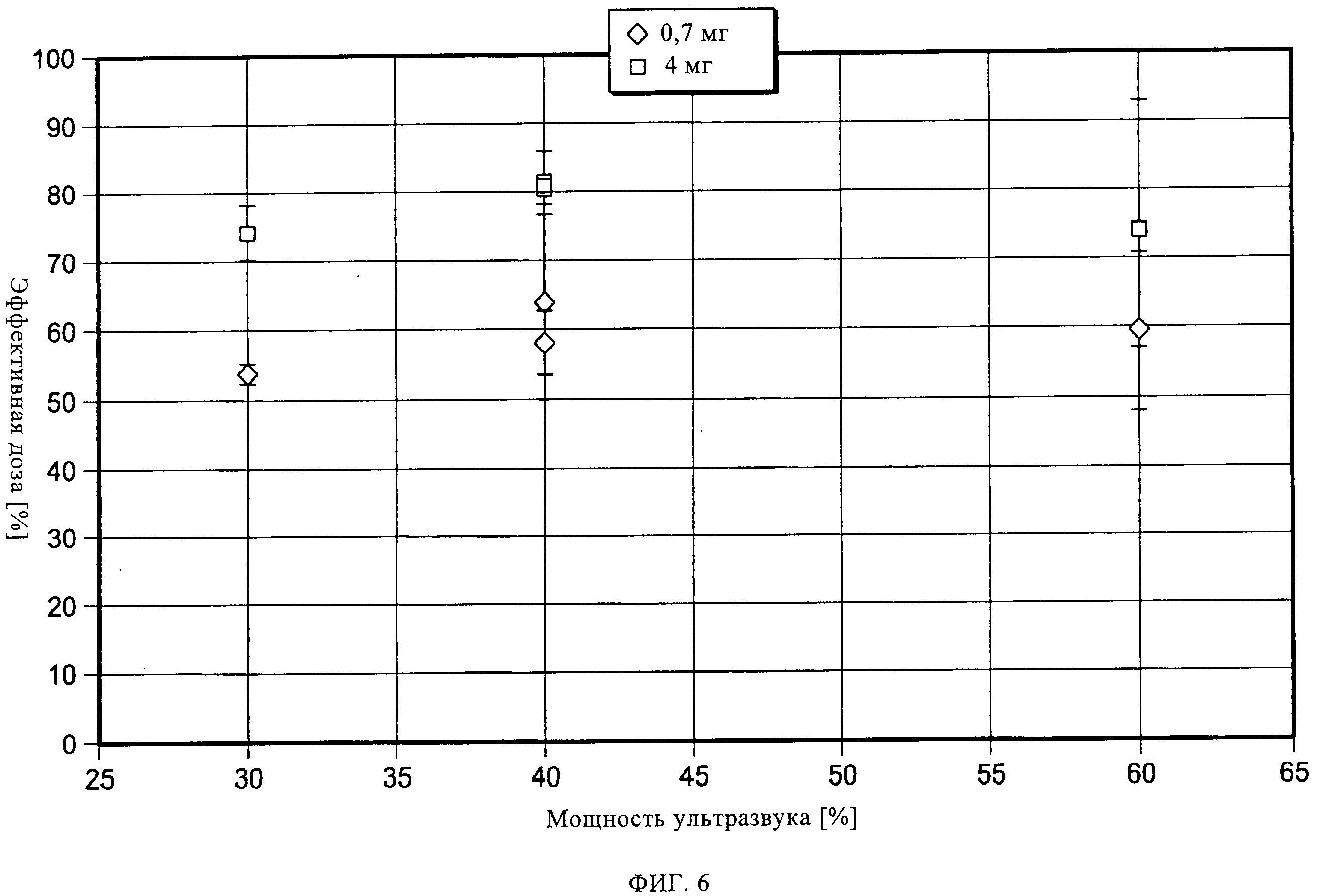
на фиг.6 показано влияние ультразвуковой энергии на процесс обработки;
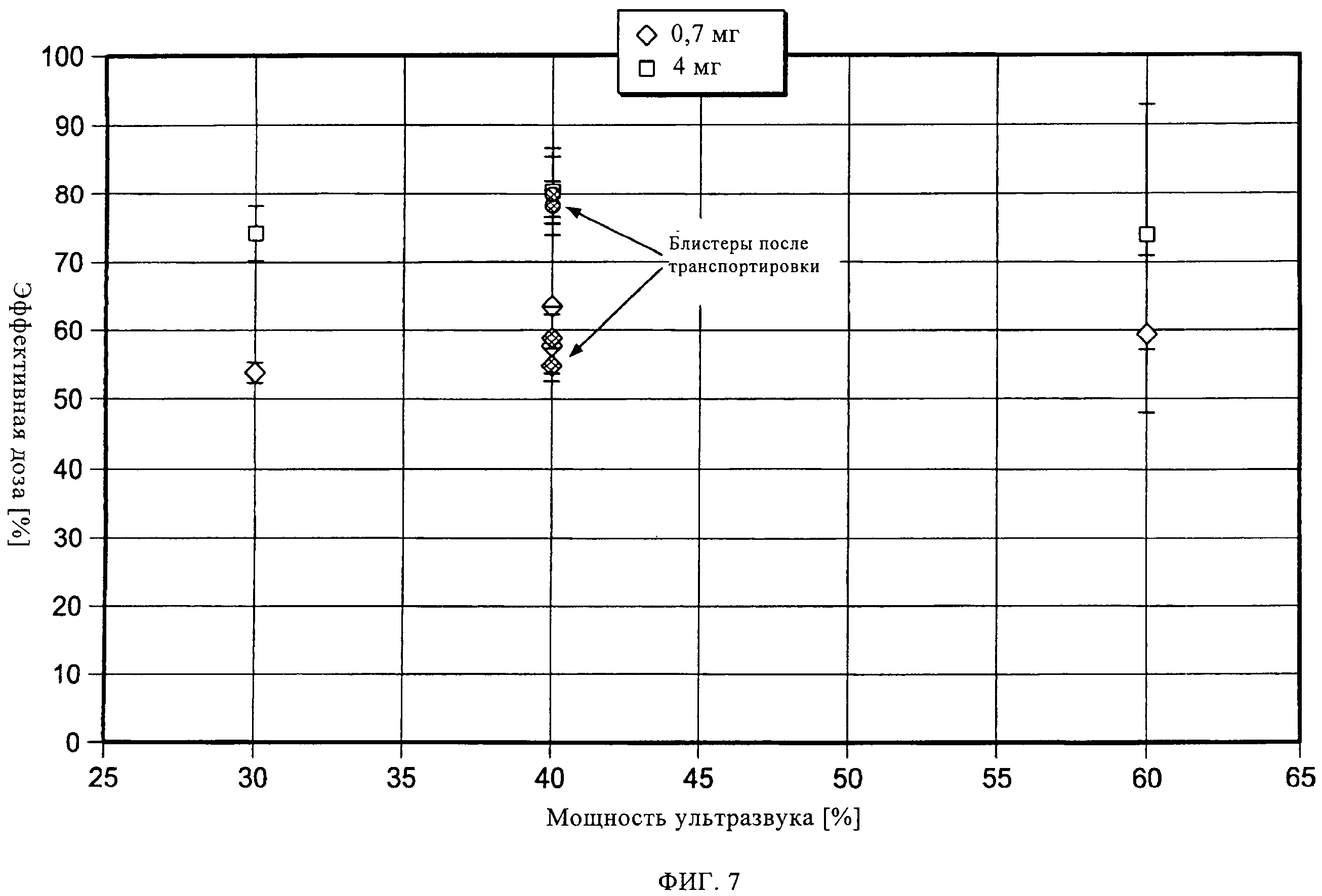
на фиг.7 показано влияние ультразвуковой обработки на примере блистерных упаковок до и после транспортировки при различных уровнях энергии;
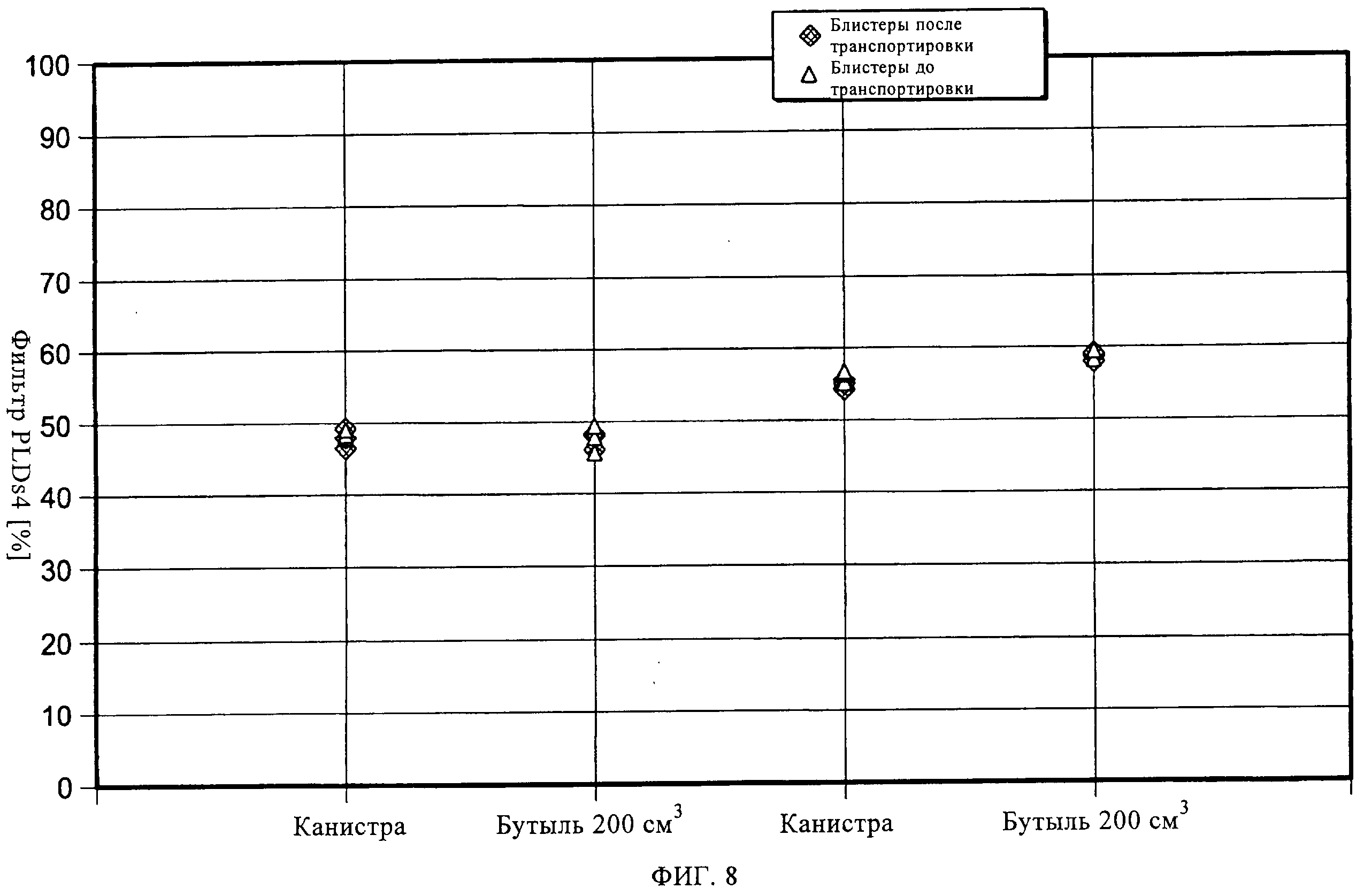
на фиг.8 показано влияние ультразвуковой обработки на примере блистерных упаковок с препаратом в насыпном виде до и после транспортировки.
Осуществление изобретения
Следует отметить, что используемая в данном описании форма единственного числа существительных предполагает также возможность их использования во множественном числе, если только это явно не противоречит контексту.
В описании и формуле настоящего изобретения будет использована следующая терминология, согласно приведенным ниже определениям.
Определения
Если иное не оговорено особо, то термины, используемые в настоящем раскрытии изобретения, имеют ниже данные определения. Если в описании определенно не указано иное, то стандартные термины имеют стандартные, традиционные значения, понятные специалистам в данной области техники.
Термин "обработка (до требуемого состояния)" применяется для описания процессов, используемых для облегчения получения более однородного дисперсного порошкового препарата, который характеризуется меньшей степенью агломерации по сравнению с порошковыми препаратами, не прошедшими такую обработку. Термин "деагломерация" равнозначен по значению и может быть использован попеременно с термином "обработка".
Состав, являющийся "приемлемым для доставки к легким", относится к составам, которые могут быть переведены в аэрозольный состав для их вдыхания человеком так, чтобы часть распыленных частиц достигла легких, например, чтобы позволить им проникнуть в альвеолы и в кровь. Такие составы могут рассматриваться как "вдыхаемые" или "пригодные для ингаляции".
"Аэрозолированный" состав содержит твердые частицы, которые удерживаются во взвешенном состоянии в газообразной среде (в основном, воздушной среде), как правило, в результате активизации (или срабатывания) устройства для ингаляции. Ингалятор пассивного сухого порошка активируется вдохом пациента.
"Сухопорошковый ингалятор" представляет собой устройство, в котором находится емкость (например, блистер) с разовой (однократной) дозой лекарственного препарата в виде порошка. В зависимости от схемы лечения нуждающемуся в лекарственном препарате пациенту может потребоваться более одной разовой дозы препарата. Обычно ингалятор активируется вдохом. Например, в капсуле или блистере проделывают отверстия, и порошок распыляется таким образом, чтобы его можно было вдохнуть, как, например, в ингаляторах марок Spinhaler или Rotahaler. Ингаляторы марки Turbohaler оснащены контейнерами, в которых содержатся отмеренные дозы лекарственного препарата в виде порошка.
Используемый здесь термин "подаваемая доза (ПД)" указывает на подачу сухого порошка из устройства для ингаляции после его активизации или после диспергирования порошка в сухопорошковом устройстве или сосуде. ПД определяют как отношение дозы, подаваемой для приема устройством для ингаляции, к расчетной дозе (т.е. к массе порошка на разовую дозу, находящуюся в соответствующем устройстве для ингаляции до его срабатывания). ПД представляет собой количество препарата, полученное опытным путем, и которое может быть рассчитано при использовании лабораторного сосуда, имитирующего дозированный прием лекарственного препарата пациентом. Для расчета величины ПД, согласно использованию в настоящем изобретении, сухой порошок помещают в испытуемое устройство. Устройство активируют (например, путем загрузки блистера, вращения наконечника устройства и насаживания источника вакуума 30 л/мин на выходное отверстие наконечника) для диспергирования порошка. Полученное в результате аэрозольное облако затем отсасывают из устройства вакуумом (30 л/мин) в течение 2,5 секунд после активизации устройства, где оно осело на тарированном фильтре из стекловолокна (Gelman, диаметр 47 см), присоединенном к наконечнику устройства. Количество порошка, которое достигает фильтра, составляет подаваемую дозу. Например, если рассматривать капсулу с содержанием 5 мг сухого порошка, помещенную в устройство для ингаляции, то если в результате диспергирования порошка его количество на тарированном фильтре составит 4 мг, как описано выше, то ПД для данного сухопорошкового состава составит 80% (=4 мг (подаваемая доза)/5 мг (расчетная доза)).
Состав в виде "сухого порошка" представляет собой порошковый состав с содержанием влаги, как правило, менее чем примерно 20%, или менее чем примерно 10%, или менее чем примерно 5%, или менее чем примерно 3%, или менее чем примерно 1%.
Используемый здесь термин "масс-медианный диаметр (ММД)" относится к средней величине диаметра многочисленных частиц, как правило, в популяции полудисперсных частиц, например, состоящей из множества размеров частиц. Если в контексте явно не указано иное, то значения ММД, как описано здесь, определяют методом лазерной дифракции (Sympatec Helos, Clausthal-Zellerfeld, Германия). Образцы порошка, как правило, помещают непосредственно в воронку питателя устройства Sympatec RODOS для диспергирования сухих порошков. Это можно сделать вручную или за счет механического приведения в действие со стороны вибраторного элемента питателя VIBRI. Образцы порошка диспергируют на первичные частицы за счет нагнетаемого воздуха (давлением от 2 до 3 бар) при максимальном разрежении (вакуум-отсосе) для указанного давления диспергирования. Дисперсные частицы исследуют при помощи лазерного луча 632,8 нм, который пересекает траекторию частиц под правильными углами. Лазерный свет, рассеянный с совокупности частиц, воспроизводится на концентрическую антенную решетку элементов фотоумножителя, на котором используется сборка линз Фурье для обратного рассеяния. Рассеянный свет получают с интервалами 5 мс. Гранулометрический состав частиц рассчитывают методом от обратного, по результатам измерений пространственного распространения/распределения интенсивности рассеянного света, при использовании соответствующего алгоритма.
"Масс-медианный аэродинамический диаметр (ММАД)" представляет собой единицу измерения аэродинамического размера дисперсной частицы. Аэродинамический диаметр используют, чтобы описать аэрозолированный порошок с точки зрения его режима осаждения, и он представляет собой диаметр округлого тела какой-то единицы плотности, имеющего ту же самую скорость осаждения в воздухе, что и частица. Аэродинамический диаметр охватывает форму частицы, ее плотность и естественный размер. Согласно использованию в настоящем изобретении ММАД относится к среднему или медианному гранулометрическому составу частиц аэрозолированного порошка, определенному методом измерения количества аэрозолей в воздухе каскадным импактором, при типовых условиях (температура 20°С; относительная влажность 40%) для испытуемого устройства.
"Фракция тонкодисперсных частиц" - это фракция частиц с аэродинамическим диаметром менее 5 микрон (мкм). Если оговорено особо, то к фракции тонкодисперсных частиц может быть также отнесена фракция частиц с аэродинамическим диаметром менее 3,3 микрон.
"Приемное гнездо" представляет собой контейнер/емкость. Например, таким приемным гнездом может быть гнездо для разовой дозы, или же это может быть контейнер, вмещающий несколько доз. К примерам приемных гнезд для разовых доз могут быть отнесены блистерные порционные упаковки и капсулы. В некоторых примерах осуществления настоящего изобретения такие приемные гнезда могут быть удалены из ингалятора, или же такие приемные гнезда могут быть частью ингалятора. Приемные гнезда, как правило, изготавливают из любого материала, поддающегося разрыву, например контролируемому разрыву, например, из слоистого пластика с защитной пленкой фольги или из других материалов. К примерам таких контейнеров/приемных гнезд можно отнести по меньшей мере капсулы, блистеры, пузырьки, ампулы, или системы контейнер/упаковочный элемент, изготовленные из металла, полимера (например, из пластмассы, эластомеров), стекла, или из подобных материалов.
В одном из примеров осуществления настоящее изобретение включает встряхиватель ленты с лекарственным препаратом в блистерных упаковках или механический ударник, выполненный в виде гибких поворотных механических рук (рычагов), расположенных на чем-то типа округлого вала. Поворотная рука соединена с электродвигателем. Поворотная рука может иметь множество выступов. Рука ударяет по ленте (блистеру, включающему одну или несколько отдельных разовых доз лекарственного препарата в приемных гнездах). Такой удар может приходиться сбоку блистера или с его верха, или с низа, в зависимости от конфигурации руки. Скорость вращения вала или период времени между каждым "продвижением" упаковочной линии определяет степень разрушения таблетированного порошкового препарата. Поворотная рука может вращаться с частотой вращения от примерно 500 оборотов/минуту до примерно 4000 оборотов/минуту. Период времени, в течение которого ленту с препаратом в блистерных упаковках подвергают ударному встряхиванию, определяется балансом между производственной мощностью (временем продвижения упаковочной линии) и эффективностью разбивания таблетки на дисперсный порошок.
Во втором примере осуществления настоящего изобретения, получившим название акустической обработки, ленту с препаратом в блистерных упаковках, состоящую из герметично запечатанных блистеров, подвергают механической вибрации посредством акустической системы до того, как она начнет перемещение и будет выполнена вырубка индивидуальных блистеров на вырубном штампе. Система акустической обработки может располагаться сверху, снизу или сбоку ленты с препаратом в блистерных упаковках. В различных схемах акустической обработки может быть предусмотрено несколько таких систем для оптимизации процесса акустической обработки (например, две акустических системы, обращенные к ленте и расположенные с обеих ее сторон). Вибрацию ленты с препаратом в блистерных упаковках можно регулировать настройкой частоты и амплитуды акустической системы, которая, в свою очередь, регулируется напряжением катушки акустической системы. Период времени, в течение которого ленту с препаратом в блистерных упаковках подвергают акустической вибрации, определяется балансом между производственной мощностью (временем продвижения упаковочной линии) и эффективностью разбивания таблетки на дисперсный порошок.
В третьем примере осуществления настоящего изобретения, получившим название ультразвуковой обработки, ленту с препаратом в блистерных упаковках, состоящую из герметично запечатанных блистеров, подвергают механической вибрации посредством ультразвукового зонда (или ультразвукового звукоулавливателя) до того, как она начнет перемещение и будет выполнена вырубка индивидуальных блистеров на вырубном штампе. Зонд может располагаться снизу, сверху или сбоку такой ленты. Вибрацию ленты с препаратом в блистерных упаковках можно регулировать настройкой амплитуды ультразвукового зонда на заданную частоту. Частота механических вибраций может варьироваться примерно от 5 до примерно 100 кГц, предпочтительно примерно от 10 до примерно 40 кГц. Эффективность разбивания таблеток зависит от взаимодействия зонда и ленты. Амплитуда вибраций может варьироваться примерно от 0,001 до примерно 0,01 дюйма, предпочтительно от 0,0005 до 0,005 дюйма. Ультразвуковой зонд может быть использован в течение различного периода времени. Его можно использовать в течение периода примерно от 0,1 до примерно 3 секунд, предпочтительно, от 0,25 до примерно 2 секунд. Период времени, в течение которого ленту с препаратом в блистерных упаковках подвергают ультразвуковой обработке, определяется балансом между производственной мощностью (временем продвижения упаковочной линии) и эффективностью разбивания таблетки на дисперсный порошок. Гибкость настоящего подхода заключается в том, что зонд может располагаться как снизу, так и сверху и сбоку ленты с препаратом в блистерных упаковках.
Еще в одном примере осуществления настоящего изобретения положение ленты с препаратом в блистерных упаковках или блистеров может определяться при использовании поперечной балки, расположенной по горизонтали в поперечном направлении направлению перемещения ленты и являющейся подвижной в вертикальном направлении; и множества штырьков, структурно оформленных и расположенных на поперечной балке, в то время как поперечная балка имеет рабочее положение, при котором она структурно оформлена и расположена таким образом, что множество штырьков могут соприкасаться по меньшей мере либо с лентой, либо с наконечниками зонда, представляющими собой его рабочий орган, и нерабочее положение, когда она структурно оформлена и расположена таким образом, что множество штырьков могут не соприкасаться с лентой или наконечниками зонда.
Еще в одном примере осуществления настоящего изобретения положение ленты с препаратом в блистерных упаковках или блистеров может определяться при использовании пружинящих пальцев, расположенных на вращающемся валу, который вращается в направлении, поперечном направлению перемещения ленты. Пружинящие пальцы могут далее включать наконечники из пластика или резины для снижения шума и обеспечения плавной работы. Для облегчения работы пружинящие пальцы могут быть присоединены к валу с подшипниками. Ультразвуковая обработка некоторых порошков может привести к переходящему явлению трибозарядки. Для снятия напряжения перед использованием блистеров необходим непродолжительный период их складского хранения.
В четвертом примере осуществления настоящего изобретения, также получившим название ультразвуковой обработки, ленту, состоящую из герметично запечатанных блистеров, подвергают механической вибрации при использовании ультразвуковой ванны, до того как она начнет перемещение и будет выполнена вырубка индивидуальных блистеров на вырубном штампе.
Настоящее изобретение также может включать стадии, касающиеся получения герметично запечатанной упаковки, а именно стадии заполнения полости упаковки по меньшей мере одной однократной дозы лекарственного препарата и герметичного запечатывания указанной заполненной полости, при этом запечатывание может производиться путем нанесения покровного материала на указанную полость. Примером такой упаковки является блистер или блистерная упаковка. В таких упаковках, как правило, нижний слой имеет углубление, в которое помещают лекарственный препарат, а верхний слой герметически наносят на нижний слой способом термосклеивания и(или) прессования слоев, для гарантии нахождения лекарственного препарата внутри указанного углубления. Таким образом, углубление совместно с нанесенным термосклеиванием и/или термопрессованием верхним слоем образуют термоформованную коробочку.
Порошок может изначально храниться в герметично запечатанном приемном гнезде, которое открывается до начала его аэрозолизации, как это описано в патентах US 5785049, US 5415162 и в заявке на патент с регистрационным номером 09/583312. В качестве альтернативного варианта, порошок может содержаться в капсуле, как это описано в патентах US 4955385, US 3991761, US 6230707 и в публикации международной заявки WO 97/27892, при этом капсула открывается до, во время или после установки капсулы в устройство для аэрозолизации. В насыпном виде, в блистерной упаковке, в капсуле или в аналогичном виде, порошок может быть подвергнут аэрозолизации при использовании активного элемента, например сжатого воздуха, как это описано в патентах US 5458135, US 5785049 и US 6257233, или газа-вытеснителя, как описано в заявке US 09/556262, поданной 24 апреля 2000 года, и имеющей название "Способы и аппараты для аэрозолизации", и в публикации международной заявки WO 00/72904. В качестве альтернативного варианта, порошок может быть подвергнут аэрозолизации при вдохе пациента, как это описано, например, в вышеуказанной заявке US 09/583312 и в патенте US 4995385. Все упомянутые выше документы включены в настоящую заявку посредством их приведения в полном объеме в качестве ссылок.
Гнездо может быть вставлено в устройство для аэрозолизации. Оно может иметь приемлемую форму, размер и материал для содержания фармацевтического состава и для поддержания фармацевтического состава в пригодном для приема виде. Например, капсула или блистер могут иметь стенку, которая включает материал, не вступающий в нежелательные реакции с фармацевтическим составом. Кроме того, стенка может включать материал, позволяющий капсуле открыться для аэрозолизации фармацевтического состава. По одному из вариантов стенка включает один или более таких материалов, как желатин, гидроксипропил метилцеллюлоза (ГПМЦ), ГПМЦ, компаундированная с полиэтиленгликолем, гидроксипропилцеллюлоза, агар, алюминиевая фольга и им подобных материалов. По одному из вариантов капсула может быть выполнена в виде микроскопических, примыкающих друг к другу, секций, как это описано, например, в патенте US 4247066, который включен в настоящую заявку в качестве ссылки. Размер капсулы выбирают таким, чтобы она была достаточной для размещения дозы фармацевтического состава. Размеры, как правило, варьируются от размера 5 до размера 000 с наружными диаметрами примерно от 4,91 мм до 9,97 мм; высоты варьируются примерно от 11,10 мм до примерно 26,14 мм, а объемы, соответственно, варьируются примерно от 0,13 мл до примерно 1,37 мл. Промышленное производство приемлемых капсул налажено такими компаниями, как, например, Shionogi Qualicaps Co., Hapa, Япония и Capsugel, Гринвуд, Южная Каролина. После заполнения верхнюю часть можно наложить на нижнюю часть для придания капсуле соответствующей формы и хранить порошок внутри капсулы, как это описано в патентах US 4846876 и US 6357490, а также в заявке WO 00/07572, которые включены в настоящую заявку посредством ссылок. После того, как верхняя часть капсулы установлена на ее нижнюю часть, капсула, по желанию, может быть скреплена ободком.
До начала использования сухие порошки, как правило, хранят в условиях окружающей среды, предпочтительно при температуре 25°С макс. и относительной влажности от 30 до 60%. Более предпочтительная относительная влажность, например, менее 30% может быть достигнута за счет включения влагопоглощающего агента во вторичную упаковку в составе упаковки лекарственной формы.
Устройства
В отношении составов, упомянутых в одном или нескольких примерах осуществления настоящего изобретения, могут быть применены методы и технические средства, известные специалистам в данной области техники.
Например, согласно одному или нескольким примерам осуществления настоящего изобретения, описанные здесь составы могут быть поданы при использовании любого приемлемого сухопорошкового ингалятора (СПИ), например ингалятора, срабатывающего от вдоха пациента, в качестве средства доставки сухопорошкового лекарственного препарата к легким. Предпочтительными сухопорошковыми ингаляторами являются ингаляторы Nektar Therapeutics, как описано в патентах US 5458135; US 5740794 и US 5785049, которые включены в настоящую заявку в качестве ссылки.
При приеме лекарственного препарата с использованием устройства упомянутого выше типа порошок содержится в гнезде, имеющем покрытие с многочисленными точечными отверстиями или другую поверхность, обеспечивающую доступ к препарату, предпочтительно, блистерную упаковку или картридж, в которых в гнезде может содержаться дозированная форма для однократного приема или дозированные формы для многократного приема. Удобные способы заполнения большого количества ячеек (например, упаковок, содержащих лекарственное средство в однократных дозах), отмеренными дозами порошковых лекарственных препаратов, описаны, например в заявке WO 97/41031 (1997), включенной в настоящую заявку посредством ссылки.
Также приемлемыми средствами подачи порошковых препаратов, описанными в настоящей заявке, являются сухопорошковые ингаляторы, например ингаляторы, раскрытые в патентах US 3906950 и US 4013075, включенных в настоящую заявку посредством ссылки, в которых предварительно отмеренная доза сухого порошка, предназначенная для приема пациентом, содержится в жесткой желатиновой капсуле.
Другие устройства для распыления, используемые для ввода сухопорошковых лекарственных препаратов в легкие, раскрыты, например, в публикациях ЕР129985, ЕР472598, ЕР467172 и в патенте US 5522385, включенных в настоящую заявку посредством ссылки. Также приемлемыми средствами для ввода сухопорошковых препаратов по настоящему раскрытию предмета изобретения являются такие устройства для распыления, как Astra-Draco "TURBOHALER". Устройство этого типа подробно описано в патентах US 4668281, US 4667668 и US 4805811, каждый из которых включен в настоящую заявку в качестве ссылки. К другим приемлемым устройствам для распыления относятся сухопорошковые ингаляторы, например ROTAHALER™ (Glaxo), Discus™ (Glaxo), Spiros™ inhaler (Dura Pharmaceuticals) и Spinhaler™ (Fisons). Также в качестве приемлемых можно назвать устройства, в которых имеется поршень, используемый для подачи воздуха либо для захватывания порошкового лекарственного препарата, подъема лекарственного препарата с экрана носителя за счет пропуска воздуха сквозь экран, либо для смешения воздуха с порошковым лекарственным препаратом в смесительной камере с последующим вводом порошка пациенту через горлышко подобного устройства для распыления, как это раскрыто в патенте US 5388572, включенном в настоящую заявку посредством ссылки. Еще одна группа сухопорошковых ингаляторов, которые также могут быть использованы, раскрыта в предварительных заявках US 60/854601 и 69/906977, которые включены в настоящую заявку посредством ссылки, и которые являются собственностью Nektar Therapeutics.
Сухопорошковые препараты могут вводиться при использовании находящихся под давлением устройств для распыления отмеренных доз лекарственного препарата, например ингалятора для распыления отмеренных доз Ventolin™, в котором раствор или суспензия лекарственного препарата содержится в фармацевтически инертной сжатой вытесняющей среде, например хлорофторуглероде или фторуглероде, согласно раскрытию в патентах US 5320094 и US 5672581, оба из которых включены в настоящую заявку посредством ссылки.
Фармацевтический состав/композиция может содержать активно действующий компонент. Активно действующий компонент, описанный в настоящем раскрытии изобретения, представляет собой агент, лекарственное средство, сочетание лекарственных средств, химическое соединение или смесь химических соединений, которые оказывают фармакологическое, обычно благотворное, влияние. Сюда относятся пищевые продукты, пищевые добавки, питательные вещества, лекарственные средства, вакцины, витамины и другие благотворно влияющие вещества. При использовании в настоящем раскрытии изобретения эти термины далее включают любой физиологически или фармакологически активно действующий компонент, обеспечивающий локальное воздействие или общее воздействие на организм пациента. Активно действующий компонент для включения в фармацевтический состав по настоящему изобретению может быть неорганическим или органическим соединением, включая, без ограничений, лекарственные средства, воздействующие на: периферическую нервную систему, адренергические рецепторы, холинергические рецепторы, скелетные мышцы, сердечно-сосудистую систему, гладкие мышцы, систему кровообращения, синоптические локализации, атриовентрикулярные локализации нейроэффектора, эндокринную и гормональную системы, иммунную систему, репродуктивную систему, костную систему, легочный круг кровообращения, системы физиологически активных веществ, пищеварительную и выделительную системы, систему образования гистамина и центральную нервную систему. Приемлемые активно действующие компоненты могут быть выбраны, например, из снотворных средств, успокоительных средств, антидепрессантов, транквилизаторов, лекарственных препаратов, воздействующих на органы дыхания, противосудорожных препаратов, мышечных релаксантов, средств против дрожательного паралича (антагонистов дофаминовых рецепторов), анальгетиков, противовоспалительных средств, успокоительных (анксиолитических) средств, средств, подавляющих аппетит, средств против мигрени, средств для мышечных сокращений, противоинфекционных средств (антибиотиков, антивирусных средств, противогрибковых средств, вакцин), противоартритных препаратов, противомалярийных средств, противорвотных средств, противоэпилептических средств, бронходилататоров, цитокинов, стимуляторов роста, противоопухолевых препаратов, антитромботических препаратов, противогипертонических средств, сердечно-сосудистых средств, антиаритмических препаратов, антиоксидантов, противоастматических средств, гормональных средств, включая противозачаточные средства, симпатомиметических средств, мочегонных средств, липид-регулирующих средств, антиандрогенных веществ, антипаразитарных средств, антикоагулянтов, относящихся к опухолям и противоопухолевых средств, гипогликемических средств, питательных веществ и добавок, добавок, способствующих росту, противоэнтеритных средств, вакцин, антител, диагностических и контрастных веществ. Активно действующий компонент может быть введен ингаляцией, может иметь локальное или общее воздействие на организм пациента.
Активно действующий компонент может относится к одному из нескольких структурных групп, включая по меньшей мере небольшие молекулы, пептиды, полипептиды, протеины, полисахариды, стероиды, способные к физиологическим воздействиям протеины, нуклеотиды, олигонуклеотиды, полинуклиотиды, жиры, электролиты и т.п.
Примеры активно действующих компонентов, приемлемых для использования в настоящем раскрытии изобретения, включают, но не ограничиваются одним или несколькими такими активно действующими компонентами, как кальцитонин, амфоторицин В, эритропоэтин (ЕРО), фактор VIII, фактор IX, цередаза, церезим, циклоспорин, гранулоцитарный колониестимулирующий фактор (GCSF), тромбопоэтин (ТРО), ингибитор альфа-1 протеиназы, элькатонин, гранулоцитарный-моноцитарный колониестимулирующий фактор (GMCSF), гормон роста, гормон роста человека (HGH), гормон, высвобождающий гормон роста (GHRH), гепарин, низкомолекулярный гепарин (LMWH), интерферон-альфа, интерферон-бета, интерферон-гамма, рецептор интерлейкина-1, интерлейкин-2, гибридный белок интерлейкина-2, антагонист рецептора интерлейкина-1, интерлейкин-3, интерлейкин-4, интерлейкин-6, интерлейкин-11, рилизинг-фактор лютеинизирующего гормона (LHRH), инсулин, проинсулин, аналоги инсулина (например моноацильный инсулин, как описано в патенте US 5922675, включенном в настоящую заявку в качестве ссылки в полном объеме), амилин, С-пептид, соматостатин, аналоги соматостатина, включая октреодид, вазопрессин, фолликуло-стимулирующий гормон (FSH), инсулиноподобный фактор роста (IGF), белок, связывающий инсулиноподобный фактор роста (например IGFBP3), инсулинтропин, колониестимулирующий фактор макрофагов (M-CSF), фактор роста нервной ткани (NGF), факторы роста соединительный ткани, фактор роста кератиноцитов (KGF), фактор роста глии (GGF), фактор некроза опухолей (TNF), фактор роста эндотелия сосудов, паратиреоидный гормон (РТН), глюкагоноподобный пептид-тимозин альфа 1, ингибитор IIb/IIIa, альфа-1 антитрипсин, соединения фосфодиэстеразы (PDE), ингибиторы VLA-4, бифосфонаты, антитело респираторно-синцитиального вируса, фактор трансмембранного регулятора муковисцидоза (CFTR), дезоксирибонуклеаза (DNase), бактерицидный белок, увеличивающий проницаемость клеточной мембраны (BPI), антитело цитомегаловируса (anti-CMV), 13-цис ретиноевая кислота, 0-цис ретиноевая кислота, макролиды, например эритромицин, олеандомицин, тролеандомицин, рокситромицин, кларитромицин, даверцин, азитромицин, флуритромицин, диритромицин, джозамицин, спиромицин, мидекамицин, лейкомицин, миокамицин, рокитамицин, андацитромицин, и звинолид А; фторохинолоны, например ципрофлоксацин, офлоксацин, левофлоксацин, тровафлоксацин, алатрофлоксацин, моксифлоксицин, норфлоксацин, эноксацин, грепафлоксацин, гатифлоксацин, ломефлоксацин, спарфлоксацин, темафлоксацин, перфлоксацин, амифлоксацин, флероксацин, тозуфлоксацин, прулифлоксацин, ирлоксацин, пазуфлоксацин, клинафлоксацин и ситафлоксацин; аминогликозины, например гентамицин, нетилмицин, парамецин, тобрамицин, амикацин, канамицин, неомицин и стрептомицин, ванкомицин, тейкопланин, рамполанин, мидепланин, колистин, даптомицин, грамицидин, колистиметат, полимиксины, например полимиксин В, капреомицин, бацитрацин, пенемс; пенициллины, включая пеникллиназ-чувствительные соединения, например пенициллин G, пенициллин V, пеникллиназ-устойчивые соединения, например мецитиллин, оксациллин, клоксациллин, диклоксациллин, флоксациллин, нафциллин; активнодействующие компоненты грамотрицательных микроорганизмов, например ампициллин, амоксициллин и гетациллин, циллин и галампициллин; антипсевдомонадные пенициллины, например карбенициллин, тикарциллин, азлоциллин, мезлоциллин и пиперациллин; цефалоспорины, например цефподоксим, цефпрозил, цефтбутен, цефтизоксим, цефтриаксон, цефалотин, цефапирин, цефалексин, цефрадрин, цефокситин, цефамандол, цефазолин, цефалоридин, цефаклор, цефадроксил, цефалоглицин, цефуроксим, цефоранид, цефотаксим, цефатризин, цефацетрил, цефепим, цефиксим, цетоницид, цефоперазон, цефотетан, цефьетазол, цефтазидим, лоракарбеф и максалактам; монобактамы, например азтреонам; и карбапенемы, например имипенем, меропенем, пентамидин изеционат, альбутерол сульфат, лидокаин, метапротеренол сульфат, беклометазон дипрепионат, триамцинолон ацетонид, будесонид ацетонид, флутиказон, ипратропий бромид, флунизолид, натрий кромолин, эрготамин, тартрат; рилапладиб, дараздфвши, ремоглифлоцин этабонат, отеликсицумаб, карведилол, фондапарнукс, метформин, росиглитазон, фарглитизар, ситамааквин, тафеноквин, белимумаб, пазопаниб, ронакалерет, солабегрон, дутастерид, меполицумаб, офатумумаб, орвепитант, казопитант, фиратеграст, ламотриджин, ропинирол, ибоктадекин, ритуксимаб, тотромбопаг, лапатиниб, элескломол, топотекан, даротропиум, дзафирлукаст, анастрозол, кандесантан цилексетил, бамбутерол, тербуталин, мепивакаин, бикалутамид, прилокаин, розуваститин, пропофол, фулвестрант, изосорбид-5-мононитрат, изосорбид динитрат, пропанолол, гефитиниб, эналаприл, фелодипин, метопролол, омепразол, бупивакаин, примидон, ропивакаин, эзомепразол, атенолол, нифедипин, тамоксифен, формотерол, рамиприл, кветиапин, хлорталидон, ралтитрексед, вилоксацин, лизиноприл, гидрохлоротиацид, гозерелин, золмитриптан, заксаглиптин, дапаглифлоцин, мотавизумаб, ибупрофен, этинилэстрадиол, левоноргестрел, лоратадин, амиодарон, бромфенирамин, декстрометорфан, фенилэфрин, фенилпропаноламин, венлафаксин, этанерцепт, норгестрел, миноциклин, гемтуцумаб озогамицин, опрелвикин, пантопразол, прометацин, медроксипрогестерон, эпинефрин, десвенлафаксин, сиролимус, темсиролимус, этионамид, тигециклин, тазобактам, базедоксифен, приниберел, бифепрунокс, бапинеозумаб, лекозотан, вабиказерин, ротигаптид, стамулумам, метилналтрексон, бозутиниб, альтеплаза, тенектеплаза, мелоксикам, тамсулозин, тиотропий, сальбутамол, фенотерол, невирапин, типранавир, дулоксетин, прамипексол, дипиридамол, напроксен, бевацизумаб, сульфаметоксазол, триметоприм, бензафибрат, ибандронат, мофетила микофенолат, энфувиртид, трастузумаб, саквинавир, гранисетрон, мефлохин, бензеразид леводопы, эпоэтин бета, филграстим, дорназа альфа, изотретиноин, озельтамивир, эрлотиниб, кеторолак, торасемид, валганцикловир, диазепам, третиноин, нелфинавир, капецитабин, орлестат, даклицумаб, тоцилизумаб, окрелицумаб, алеглитазар, пертузумаб, никаравен, омализумаб, ризедронат, фексофенадин, золпидем, доласетрон, лефлуномид, ирбезартан, клиндамицин, флуороурацил, леупролид, расбуриказа, оксалиплатин, гиалуронат, телитромицин, гларгин, эноксапарин, циклопирокс, клопидогрел, рилузол, поли-L-молочная кислота, доцетаксел, альфузозин, глимепирид, хлорохин, мепензолат, кломифен, десмопрессин, меперидин, предникарбат, глибурид, эргосальциферол, метанамин, гидрокортизон, бетаксолол, фуроземид, индапамид, амбенониум, нилутамид, метронидазол, дезипрамин, гидроксихлорохин, рифапентин, милринон, дифлоразон, рифампин, тилудронат, пентазоцин, пентоксифиллин, гиалуроновая кислота, бензалконий, тканевой активатор плазминогена, иммуноглобулин для терапии цитомегаловируса (СМВ), глюкоцереброзидаза, триметрексат, порфимер, стерильная тиотепа, амифостин, доксорубицин, ламивудин (3ТС), даунорубицин, цидофовир, кармустин, митоксантрон, ингибитор протеазы ВИЧ, DA1 агонист дофамина, карбамазепин, серморелин, антагонист пептида GP IIb/IIIa, паливизумаб, талидомид, инфликсимаб, фомивирсен, доксициклин, севеламер, модафинил, антимоцитарный глобулин, иммуноглобулин для серотерапии гепатита В, ампренавир, цитарбин, занамивир, бексаротен, соматропин, зонисамид, вертепорфин, колесевелам, прямой ингибитор тромбина, тромбин, антигемофильный фактор, метилфенидат, трехокись мышьяка, хорионический гонадотропин альфа, гиалуронан, эривир, ретровир, зиаген, бивалирудин, интрон, алемтузумаб, трипторелин, незиритид, остеогенный протеин, тенофовира дизопроксил, бозентан, антагонист рецепторов эндотелина, дексметилфенидад, агонист 5НТ 1B/1D, Y2B8, секретин,трепростинил, оксибат натрия, прастерон, адефовир дипивоксил, митомицин, адалимумаб, алефацепт, агалсидаза бета, ларонидаза, гемифлоксацин, тозитумомаб, йод, нуклеозидный ингибитор обратной транскриптазы, палоносетрон, нитрат галлия, эфализумаб, рисперидон, фосампренавир, абареликс, тадалафил, цетуксимаб, цинакальцет, троспиум, рифаксимин, азацитидин, эмтрицитабин, эрлотиниб, натализумаб, эсзопиклон, полифермин, аптанинб, клофарабин, илопрост, прамлинтид, эксенатид, галаплаза, гидралазин, сорафениб, леналидомид, ранолазин, налтрексон, алглюкозидаза альфа, децитабин, ранибизумаб, эфавиренц, эмтрацитабин, идурсульфаза, оравесент, фентанил, панитумумаб, телбивудин, алискирен, экулизамаб, амбрисентан, армодафинил, ланреотид, сапроптерин, римантидин, и, если приемлемо, аналоги, агонисты, антагонисты, ингибиторы и фармацевтически приемлемые солевые формы вышеуказанных соединений. Что касается пептидов и протеинов, то настоящее изобретение охватывает синтетические, природные, гликозилированные, негликозилированные, пегилированные формы и их биологически активные фрагменты и аналоги.
Активно действующие компоненты, которые могут быть использованы по настоящему изобретению, далее включают кислоты в качестве простых молекул нуклеиновой кислоты, РНК-интереференцию, аптамеры, малые интерферирующие РНК, переносчиков, сопутствующие вирусные частицы, плазмидную дизоксирубонуклеиновую кислоту (ДНК) или плазмидную РНК, или другие типы составляющих нуклеиновой кислоты, приемлемые для трансфекции или трансформации клеток, т.е. приемлемые для генной терапии, включая генную терапию с использованием "антисмысловых последовательностей". Далее, активно действующие компоненты могут включать живые ослабленные или уничтоженные вирусы, пригодные для использования в качестве вакцин, например цитомегаловирус, вирус бешенства, вирус СПИДа, S. вирусной пневмонии, лихорадки денге, вирусы Эпштейна-Барра, лихорадки Западного Нила, гепатита, малярии, туберкулеза, ветряной оспы, гриппа, герпеса, дифтерии, столбняка, коклюша, ацеллюлярного коклюша, папилломы человека, БЦЖ, гемофильной коклюшной палочки человека CY-TT и ACWY-TT. Активно действующие компоненты также могут включать антитела, например моноклональные антитела или фрагменты моноклональных антител, например анти-СО3 mAb, фрагмент дигогсин-связывающего антитела овечьего типа, анти-RSV Ab, анти-TAC mAb или антиагрегантный mAb. К прочим используемым лекарственным средствам можно отнести те, которые перечислены в Настольном Справочнике Врача (Physician's Desk Reference) (самое последние издание).
Как было замечено выше, сухой порошок может включать одно или несколько фармацевтически приемлемых вспомогательных веществ. К примерам таких фармацевтически приемлемых вспомогательных веществ можно отнести по меньшей мере липиды, ионы металлов, поверхностно-активные вещества, аминокислоты, углеводы, буферные растворы, соли, полимеры и т.п., а также сочетания указанных выше вспомогательных веществ.
К примерам липидов можно отнести по меньшей мере фосфолипиды, гликолипиды, ганглиозид GM1, сфингомиелин, фосфатидную кислоту, кардиолипин; липидсодержащие полимерные цепи, например полиэтиленгликоль, хитин, гиалуроновую кислоту или поливинилпирролидон; липидсодержащие сульфированные моно-, ди- и полисахариды; жирные кислоты, например пальмитиновую кислоту, стеариновую кислоту и олеиновую кислоту; холестерин, сложный эфир холестерина и холестерин гемисукцинат.
В одном из примеров осуществления настоящего изобретения, фосфолипид включает насыщенный фосфолипид, например один и более фосфатидилхолин. Примерные длины ациловых цепей составляют 16:0 и 18:0 (т.е. палмитойл и стеаройл). Содержание фосфолипида может быть определено по степени активности активно действующего компонента, по способу приема и по прочим факторам.
Фосфолипиды как из естественных, так и из искусственных источников, могут быть использованы в различных количествах. При присутствии фосфолипидов, их количество, как правило, является достаточным для покрытия активно действующего компонента (компонентов) по меньшей мере одномолекулярным слоем фосфолипида. Как правило, содержание фосфолипида варьируется примерно от 5 мас.% до примерно 99,9 мас.%, например примерно от 20 мас.% до примерно 80 мас.%.
Как правило, смешивающиеся фосфолициды включают те фосфолициды, у которых температура фазового перехода "гель - жидкий кристалл" составляет более 40°С, например более чем примерно 60°С, или более чем примерно 80°С. Включенные в состав фосфолипиды могут быть насыщенными липидами с относительно длинной цепью (например С16-С22). В качестве примеров фосфолипидов, являющихся приемлемыми для включения в стабилизированные препараты, могут быть названы по меньшей мере фосфоглицериды, например дипалмитойлфосфатидилхолин, дистеаройлфосфатидилхолин, диарахидойлфосфатидилхолин, дибехенойлфосфатидилхолин, дифосфатидилглицерины, короткоцепочечные фостатидилхолины, гидрированный фостатидилхолин. Е-100-3 (выпускаемый компанией Lipoid KG, Ludwigshafen, Германия), длинноцепочечные насыщенные фосфатидилэтаноламины, длинноцепочечные насыщенные фостатидилсерины, длинноцепочечные насыщенные фосфатидилглицерины, длинноцепочечные насыщенные фосфатидилинозитолы, фосфатидиловая кислота, фосфатидилинозитол и сфингомиэлин.
К примерам ионов металлов можно отнести по меньшей мере двухвалентные катионы, включая кальций, магний, цинк, железо, и пр. Например, при использовании фосфолипидов, фармацевтический состав может также включать многовалентный катион, как это раскрыто в публикациях WO 01/85136 и WO 01/85137, которые включены в настоящую заявку в полном объеме посредством ссылки. Многовалентный катион может присутствовать в таком количестве, которое является эффективным для повышения температуры плавления (Tm) фосфолипида, так чтобы фармацевтический состав демонстрировал температуру (Tm), которая превышала бы температуру его хранения (Ts), по меньшей мере примерно на 20°С, например по меньшей мере примерно на 40°С. Молярное отношение многовалентного катиона к фосфолипиду может составлять по меньшей мере примерно 0,05:1, например примерно от 0,05:1 до примерно 2,0:1, или примерно от 0,25:1 до примерно 1,0:1. В качестве примера можно привести молярное отношение многовалентного катиона к фосфолипиду, которое составляет примерно 0,50:1. Когда многовалентным катионом является кальций, то он может быть в виде хлорида кальция. Хотя ион металла, например кальция, часто включен в фармацевтический состав вместе с фосфолипидом, в таком ионе нет необходимости.
Как описано выше, сухой порошок может включать одно или несколько поверхностно-активных веществ. Например, одно и более поверхностно-активное вещество может быть в жидкой фазе, и одно и более поверхностно-активное вещество может входить в состав твердых частиц или микрочастиц фармацевтического состава. Под термином "входить в состав" следует понимать, что фармацевтические составы могут включать, адсорбировать, поверхностно-активное вещество, быть покрытыми или образованными поверхностно-активным веществом. К поверхностно-активным веществам относятся по меньшей мере фторированные и нефторированные составы, например насыщенные и ненасыщенные липиды, неионные детергенты, неионные блоксополимеры, ионные поверхностно-активные вещества и их сочетания. Следует обратить особое внимание на то, что, кроме указанных выше поверхностно-активных веществ, приемлемые фторированные поверхностно-активные вещества согласуются с идеями настоящего изобретения и могут быть использованы для приготовления желаемых фармацевтических составов.
К примерам неионных детергентов можно отнести по меньшей мере эфиры сорбита, включая сорбит триолеат (Span™ 85), сорбит полуторный олеат, сорбит моноолеат, сорбит монолаурат, полиоксиэтилен (20) сорбит монолаурат и полиоксиэтилен (20) сорбит моноолеат, олеил полиоксиэтилен (2) эфир, стеарил полиоксиэтилен (2) эфир, лаурил полиоксиэтилен (4) эфир, сложные эфиры глицерина и сахарозы. Прочие приемлемые неионные детергенты могут быть легко идентифицированы при использовании издания McCutcheon "Эмульгаторы и детергенты" (McCutcheon's Emulsifiers and Detergents) (McPublishing Co., Glen Rock, New Jersey), которое включено в настоящую заявку посредством его приведения в полном объеме в качестве ссылки.
К примерам блоксополимеров можно отнести по меньшей мере диблок- и триблоксополимеры полиоксиэтилена и полиоксипропилена, включая полоксамер 188 (Pluronic™ F-68), полоксамер 407 (Pluronic™ F-127) и полоксамер 338.
К примерам ионных поверхностно-активных веществ можно отнести по меньшей мере натрийсульфосукцитат и жирно-кислое мыло.
К примерам аминокислот можно отнести по меньшей мере гидрофобные аминокислоты. Использование аминокислот в качестве фармацевтически приемлемых вспомогательных веществ известно из предшествующего уровня техники и раскрыто в публикациях WO 95/31479, WO 96/32096 и WO 96/32149, которые включены в настоящую заявку посредством ссылки.
К примерам карбогидратов можно отнести по меньшей мере моносахариды, дисахариды и полисахариды. Например, моносахариды, такие как декстроза (обезвоженная и моногидрат), галактоза, маннитол, D-манноза, сорбит, сорбоза и им подобные; дисахариды, такие как лактоза, мальтоза, сахароза, трегалоза и им подобные; трисахариды, такие как раффиноза и ей подобные; и прочие карбогидраты, такие как крахмалы (гидроксиэтил крахмала), циклодекстрины и мальтодекстрины.
К примерам буферных растворов можно отнести по меньшей мере трис-буферы или цитрат.
К примерам кислот можно отнести по меньшей мере карбоновые кислоты.
К примерам солей можно отнести по меньшей мере хлорид натрия, соли карбоновых кислот (например, дигидрат цитрата натрия, аскорбат натрия, глюконат магния, глюконат натрия, трометамин гидрохлорид и т.д.), карбонат аммония, ацетат аммония, хлорид аммония и им подобные.
К примерам органических твердых веществ можно отнести по меньшей мере камфару и ей подобные.
Сухие порошки, согласно одному или нескольким примерам осуществления настоящего изобретения, могут также включать биологически совместимый полимер, например биоразлагаемый полимер, сополимер или смесь или любое другое сочетание вышеупомянутых полимеров. В этом отношении к приемлемым полимерам можно отнести полилактиды, полилактид-гликолиды, циклодекстрины, полиакрилаты, метилцеллюлозу, карбоксиметилцеллюлозу, поливиниловые спирты, полиамиды, поливинилпирролидоны, полисахариды (декстраны, крахмалы, хитин, хитозан, и т.д.), гиалуроновую кислоту, протеины (альбумин, коллаген, желатин и т.д.). Осведомленные в данной области техники оценят то, что за счет выбора приемлемых полимеров может быть повышена эффективность приема лекарственных препаратов и(или) устойчивость дисперсных составов в целях оптимизации воздействия активно действующих компонентов.
Кроме упомянутых выше фармацевтически приемлемых вспомогательных веществ, было бы желательно добавить к сухому порошку еще и другие вспомогательные вещества, способствующие повышению жесткости дисперсных микрочастиц, увеличению выхода продукции, выпускаемой дозы и отложений вещества на каком-либо органе, увеличению срока службы и повышению степени принятия организмом пациента. К таким дополнительным фармацевтически приемлемым вспомогательным веществам можно отнести по меньшей мере красящие добавки, вкусовые добавки, буферные растворы, гигроскопические реагенты, антиоксиданты и химические стабилизаторы. Кроме того, различные фармацевтически приемлемые вспомогательные вещества могут быть использованы для создания структуры и формы дисперсных композиций (например, латексные частицы). В этой связи, было бы полезным, чтобы имелась возможность удаления становящихся все более жесткими компонентов каким-либо способом после производства, например селективной экстракцией растворителем.
Сухой порошок может также включать смеси фармацевтически приемлемых вспомогательных веществ. Например, смеси углеводов и аминокислот также входят в объем настоящего изобретения.
Препарат также может включать противомикробное вещество для предотвращения или защиты от роста микроорганизмов. К неограниченным примерам противомикробных веществ, приемлемых для настоящего предмета изобретения, могут быть отнесены бензалконий хлорид, бензетоний хлорид, бензиловый спирт, цетилпиридиний хлорид, хлоробутанол, фенол, фенилэтиловый спирт, фенилмеркурнитрат, тимерзоль и сочетания вышеуказанных веществ.
В препарате также может присутствовать антиоксидант. Антиоксиданты используют в целях предотвращения окисления, а следовательно, в целях предотвращения ухудшения свойств присоединяемого компонента или других компонентов препарата. К приемлемым антиоксидантам для использования в настоящем раскрытии изобретения можно отнести, например, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, фосфорноватистую кислоту, тиоглицерин, пропилгаллат, натрий бисульфит, натрий формальдегид сульфоксилат, натрий метабисульфит, а также сочетания упомянутых выше антиоксидантов.
В препарате в качестве вспомогательного вещества также может присутствовать поверхностно-активное вещество. К примерам поверхностно-активных веществ могут быть отнесены: полисорбаты, например "Tween 20" и "Tween 80"; поверхностно-активные вещества для буровых растворов на углеводородной основе, инвертных эмульсий и газообразных систем, например F68 и F88 (оба из которых выпускает компания BASF, Mount Olive, New Jersey); эфиры сорбита; липиды, например фосфолипиды, такие как летицин, и другие фосфатидилхолины, фосфатидилэтаноламины (хотя, предпочтительно, не в виде липосом), жирные кислоты и жирные эфиры; стероиды, такие как холестерин; и хелатные добавки, такие как этилендиаминтетрауксусная кислота (EDTA), цинк и прочие аналогичные приемлемые катионы.
В препарате в качестве вспомогательного вещества также могут присутствовать кислоты или основы. К неограниченным примерам кислот, приемлемых для настоящего предмета изобретения, могут быть отнесены кислоты, выбираемые из группы, включающей: соляную кислоту, уксусную кислоту, фосфорную кислоту, лимонную кислоту, яблочную кислоту, молочную кислоту, муравьиную кислоту, трихлороуксусную кислоту, азотную кислоту, хлорную кислоту, фосфорную кислоту, серную кислоту, фумаровую кислоту и сочетания вышеупомянутых кислот. К неограниченным примерам приемлемых основ могут быть отнесены основы, выбираемые из группы, включающей: гидроксид натрия, ацетат натрия, гидроксид аммония, гидроксид калия, ацетат аммония, ацетат калия, фосфат натрия, фосфат калия, цитрат натрия, формиат натрия, сульфат натрия, сульфат калия, фумарат калия, а также сочетания указанных выше основ.
Содержание активно действующего компонента в составе лекарственного препарата может варьироваться в зависимости от ряда факторов, однако когда препарат находится в контейнере с разовыми дозами, наиболее оптимально, чтобы его содержание соответствовало дозе, эффективной с терапевтической точки зрения. Доза, эффективная с терапевтической точки зрения, может быть определена опытным путем, посредством многоразового приема все более увеличивающихся количеств активно действующего компонента, чтобы установить, какое его количество приведет к клинически желаемому результату.
Активно действующий компонент может присутствовать в составе лекарственного препарата в количестве примерно от 1 мас.% до примерно 99 мас.%, предпочтительно, примерно от 5 мас.% до примерно 98 мас.%, более предпочтительно, примерно от 15 мас.% до примерно 95 мас.% активно действующего компонента, при этом наиболее предпочтительно его содержание менее 30 мас.%.
Содержание любого вспомогательного вещества в составе лекарственного препарата может варьироваться в зависимости от активности такого вспомогательного вещества и специфической потребности в нем состава лекарственного препарата. Оптимальное количество каждого индивидуального вспомогательного вещества может быть определено методом стандартных экспериментов, а именно приготовлением составов с различным содержанием конкретного вспомогательного вещества (от низкого до высокого содержания), проверкой устойчивости и других параметров, после чего определением такого содержания, при котором обеспечивается наиболее оптимальное воздействие и отсутствуют какие-либо значительные неблагоприятные эффекты.
Вспомогательное вещество может присутствовать в составе лекарственного препарата в количестве примерно от 1 мас.% до примерно 99 мас.%, предпочтительно, примерно от 5 мас.% до примерно 98 мас.%, более предпочтительно, примерно от 15 мас.% до примерно 95 мас.% вспомогательного вещества, при этом наиболее предпочтительно его содержание менее 30 мас.%.
В одном из примеров осуществления настоящего изобретения, лекарственный препарат может состоять из сухопорошкового фармацевтического состава, включающего примерно от 60 мас.% до примерно 95 мас.% инсулина; и примерно от 5 мас.% до примерно 30 мас.% буферного раствора; при этом, когда указанный выше состав растворяют при концентрации 1 мг/мл в дистиллированной воде для образования раствора, полученный раствор имеет рН≥7,5.
В другом примере осуществления настоящего изобретения, лекарственный препарат может состоять из сухопорошкового фармацевтического состава, включающего примерно от 60 мас.% до примерно мас.95% инсулина; и примерно от 5 мас.% до примерно 30 мас.% буферного раствора; при этом, когда указанный выше состав растворяют в равном количестве воды, полученный раствор имеет рН≥7,5, и этот раствор, при выдерживании в течение 72 часов при температуре 85°С и относительной влажности 50%, демонстрирует меньшую степень разложения, согласно измерениям, выполненным в присутствии продукта разложения - протеина высокой молекулярной массы (HMWP), по сравнению с сухопорошковым инсулинсодержащим составом, состоящим из 60 мас.% рекомбинантного инсулина человека, 27,06 мас.% дегидрированного натрий цитрата, 10,01 мас.% маннитола, 2,60 мас.% глицина и 0,33 мас.% гидроксида натрия, выдержанным при аналогичных условиях.
Еще в одном примере осуществления настоящего изобретения, лекарственный препарат может состоять из сухопорошкового фармацевтического состава, включающего 85-95 мас.%, в пересчете на сухое вещество, инсулина; 5-15 мас.%, в пересчете на сухое вещество, стабилизирующего вспомогательного вещества; 0,001-0,2 мас.%, в пересчете на сухое вещество, спирта, и менее 5 мас.% воды.
Другие патенты и заявки США, относящиеся к порошковым составам, способам их приготовления и способам их использования, например патенты US 6685967, US 5997848, US 5826633, US 6267155, US 6581650, US 6182712, заявки с регистрационными номерами 60/392076, 10/609132, 08/207472, 08/383475, 09/210313, 09/6552910/160229, 10/418966, 11/146950, 60/100437, 10/360603, 60/854601, 60/906677 и международная заявка "Powder Dispersion Apparatus and Methods of Making and Using the Apparatus", поданная 25 октября 2007 года, приписанная Nektar Therapeutics, все включены посредством ссылки в настоящую заявку в полном объеме.
Вышеописанные фармацевтические вспомогательные средства, наряду с другими вспомогательными веществами, описаны в "Remington: The Science & Practice of Pharmacy", 19th ed., Williams & Williams (1995), the "Physician's Desk Reference", 52nd ed.. Medical Economics, Montvale, NJ (1998), and Kibbe, A.H., "Handbook of Pharmaceutical Excipients", 3 ed., American Pharmaceutical Association, Washington, D.C. (2000).
Эксперименты
Следует понимать, что в то время как настоящее изобретение раскрыто на определенных предпочтительных и конкретных примерах его осуществления, вышеприведенное описание, а также последующие примеры служат для иллюстрации и не ограничивают объема настоящего изобретения. Прочие аспекты, преимущества и модификации, входящие в объем настоящего изобретения, будут очевидны специалистам в области техники, к которой относится настоящее изобретение.
Если иное не указано особо, то все химические реагенты, на которые дается ссылка в прилагаемых примерах осуществления настоящего изобретения, доступны для приобретения.
Согласно одному примеру осуществления настоящего изобретения используется механический встряхиватель ленты с препаратом в блистерных упаковках, состоящей из герметично запечатанных блистеров; при этом упомянутую ленту подвергают легким или более сильным ударам, прежде чем лента начнет перемещение и на вырубном штампе будут вырублены индивидуальные блистеры. Сгибающиеся лапы, расположенные на округлом валу, соединенным с электродвигателем, ударяют по ленте с нижней стороны (см. фиг.1). Скорость вращения вала и промежуток времени между каждым "перемещением" ленты с препаратом в блистерных упаковках определяют степень измельчения брикетированного в виде таблеток препарата. Период, в течение которого упомянутую ленту подвергают такому ударному воздействию, определяется балансом между объемом выпуска продукции и эффективностью разбивания таблетированного препарата на диспергируемый порошок.
Согласно второму варианту осуществления настоящего изобретения, получившему название акустической обработки, ленту с препаратом в блистерных упаковках, состоящую из герметично запечатанных блистеров с лекарственным препаратом, подвергают механической вибрации при помощи акустической системы, прежде чем упомянутая лента начнет перемещение и на вырубном штампе будут вырублены индивидуальные блистеры. Акустическая система расположена над лентой (см. фиг.2). Вибрация ленты с препаратом в блистерных упаковках может быть отрегулирована за счет настройки частоты и амплитуды акустической системы, напряжение которой, в свою очередь, держат на контроле. Период, в течение которого ленту упаковку подвергают такой акустической вибрации, определяется балансом между объемом выпуска продукции и эффективностью разбивания таблетированного препарата на диспергируемый порошок.
Согласно третьему варианту осуществления настоящего изобретения, получившему название ультразвуковой обработки, ленту с препаратом в блистерных упаковках, состоящую из герметично запечатанных блистеров с лекарственным препаратом, подвергают механической вибрации при помощи ультразвукового зонда (или ультразвукового датчика), прежде чем упомянутая лента начнет перемещение и на вырубном штампе будут вырублены индивидуальные блистеры. Зонд расположен под лентой (см. фиг.3А). Вибрация ленты с препаратом в блистерных упаковках может быть отрегулирована за счет настройки частоты и амплитуды ультразвукового зонда при фиксированной частоте. Эффективность разбивания таблетированного препарата зависит от взаимосвязи зонда и ленты. Период, в течение которого упомянутую ленту подвергают такой ультразвуковой обработке, определяется балансом между объемом выпуска продукции и эффективностью разбивания таблетированного препарата на диспергируемый порошок. Гибкость данного подхода заключается в том, что такой зонд (датчик) может располагаться как снизу, сверху, так и сбоку ленты с препаратом в блистерных упаковках. На фиг.3Б показан пример осуществления настоящего изобретения с использованием нескольких ультразвуковых датчиков. На фиг.4-8 показаны результаты ультразвуковой обработки выпущенной порции блистеров при различных параметрах. Можно увидеть, что наиболее оптимальная степень обработки была достигнута при амплитуде 40%, однако и другие уставки мощности также являются эффективными. Можно также заметить, что после такой обработки, транспортировка препарата уже не оказывает влияния на выпущенные дозы.
Согласно четвертому варианту осуществления настоящего изобретения, также получившему название ультразвуковой обработки, используют водяную ванну Branson Sonicator, модель 2150. Водяную ванну заполняют водой до определенного уровня. Блистеры с сухопорошковым лекарственным препаратом помещают поверх воды так, чтобы они могли плавать на ее поверхности (см. фиг.4). Ультразвуковую ванну включают и блистеры подвергают ультразвуковой обработке (40 Гц) в течение установленного периода времени (например, от 1 до 5 минут). После ультразвуковой обработки блистеры вытирают насухо и проводят сравнение выпущенной дозы с дозой блистеров, не прошедших упомянутую ультразвуковую обработку. Вибрацию ленты с препаратом в блистерных упаковках определяют по частоте и амплитуде уровня жидкости в ванне. Период, в течение которого ленту подвергают такой ультразвуковой обработке, определяется балансом между объемом выпуска продукции (временем перемещения) и эффективностью разбивания таблетированного препарата на диспергируемый порошок.