Результат интеллектуальной деятельности: 4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ
Вид РИД
Изобретение
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к 4-[2-(2-фторфеноксиметил)фенил]пиперидиновым соединениям, проявляющим активность в качестве ингибиторов обратного захвата серотонина (5-HT) и норэпинефрина (NE). Данное изобретение также относится к фармацевтическим композициям, содержащим такие соединения, способам и промежуточным веществам получения таких соединений и способам применения таких соединений для лечения расстройства, сопровождающегося болью, такого как невропатическая боль, и других заболеваний.
СУЩЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Боль представляет собой неприятные ощущения и эмоциональный опыт, связанные с действительным или возможным повреждением ткани, или отмечается в связи с подобным повреждением (Международная ассоциация по изучению боли (IASP), Терминология боли). Хроническая боль сохраняется после острой боли или после ожидаемого периода времени заживления травмы (Американское общество лечения боли. "Pain Control in the Primary Care Setting." 2006:15). Невропатическая боль представляет собой боль, инициированную или вызванную первичным поражением или дисфункцией нервной системы. Периферическая невропатическая боль возникает в случае, когда поражение или дисфункция оказывает воздействие на периферическую нервную систему, а центральная невропатическая боль - в случае, когда поражение или дисфункция оказывает воздействие на центральную нервную систему (IASP).
В настоящее время для лечения невропатической боли применяют некоторые типы терапевтических агентов, в том числе, например, трициклические антидепрессанты (TCA), ингибиторы обратного захвата серотонина и норэпинефрина (SNRI), лиганды кальциевых каналов (например, габапентин и прегабалин), лидокаин для наружного применения и опиоидные агонисты (например, морфин, оксикодон, метадон, леворфанол и трамадол). Однако невропатическая боль может быть очень трудно излечимой, при этом не более чем у 40-60% пациентов достигается, в лучшем случае, частичное облегчение их боли (Dworkin et al. (2007) Pain 132:237-251). Более того, все терапевтические агенты, применяемые в настоящее время для лечения невропатической боли, имеют различные побочные эффекты (например, тошнота, седативный эффект, головокружение и сонливость), что может ограничивать их эффективность в отношении некоторых пациентов (Dworkin et al. выше).
SNRI, такие как дулоксетин и венлафаксин, часто применяют в терапии первой линии для лечения невропатической боли. Подобные агенты ингибируют как обратный захват серотонина (5-гидрокситриптамин, 5-HT), так и норэпинефрина (NE), связывая переносчики серотонина и норэпинефрина (SERT и NET соответственно). Однако и дулоксетин, и венлафаксин обладают более высоким сродством к SERT по сравнению с NET (Vaishnavi et al. (2004) Biol. Psychiatry 55(3):320-322).
Доклинические исследования показывают, что для максимально эффективного лечения состояний, сопровождающихся невропатической или другой хронической болью, может быть необходимым ингибирование как SERT, так и NET (Jones et al. (2006) Neuropharmacology 51(7-8): 1172-1180; Vickers et al. (2008) Bioorg. Med. Chem. Lett. 18:3230-3235; Fishbain et al. (2000) Pain Med. 1(4):310-316; и Mochizucki (2004) Human Psychopharmacology 19:S15-S19). Однако при клинических исследованиях отмечалось, что ингибированию SERT сопутствует тошнота и другие побочные эффекты (Greist et al. (2004) Clin. Ther. 26(9):1446-1455). Таким образом, ожидается, что терапевтические агенты, имеющие более соразмерное сродство к SERT и NET или немного более высокое сродство к NET, будут особенно подходящими для лечения хронической боли, поскольку они вызывают меньшие побочные эффекты, такие как тошнота.
Таким образом, существует необходимость в новых соединениях, которые будут применяться для лечения хронической боли, такой как невропатическая боль. В частности, существует необходимость в новых соединениях, которые будут применяться для лечения хронической боли и которые вызывают наименьшие побочные эффекты, такие как тошнота. Также существует необходимость в новых соединениях двойного действия, которые ингибируют как SERT, так и NET с высоким сродством (например, pKi≥8,0 или Ki≤10 нМ) и соразмерным эффектом ингибирования (например, с соотношением SERT/NET констант связывания Ki от 0,1 до 100).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает новые соединения, которые, как было обнаружено, обладают ингибирующей активностью обратного захвата серотонина и ингибирующей активностью обратного захвата норэпинефрина. Таким образом, ожидается, что соединения данного изобретения будут подходящими и предпочтительными в качестве терапевтических агентов для таких заболеваний и нарушений, которые можно излечить ингибированием переносчика серотонина и/или норэпинефрина, таких как невропатическая боль.
Один аспект данного изобретения относится к соединению формулы I:
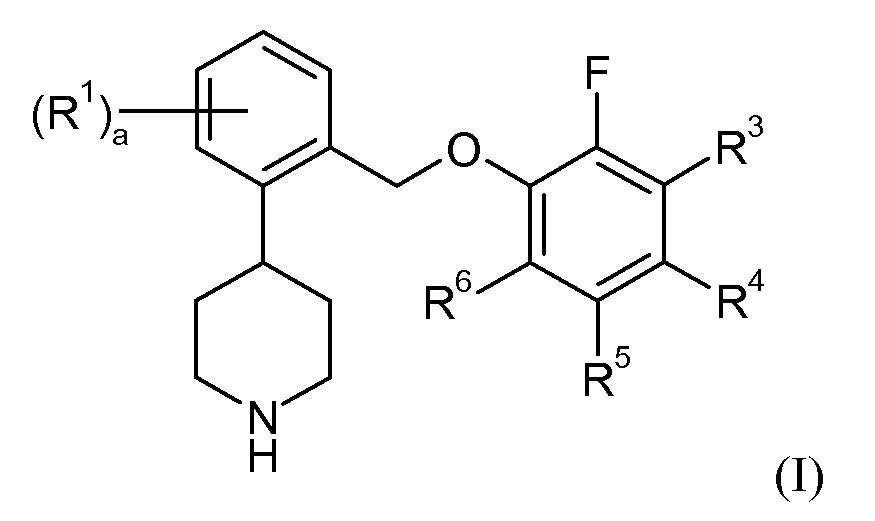
в которой: a представляет собой 0, 1, 2, 3 или 4; каждый R1 независимо представляет собой галоген или трифторметил; R3 представляет собой водород, галоген или -C1-6алкил; R4, R5 и R6 независимо представляют собой водород или галоген; или его фармацевтически приемлемой соли.
Еще один аспект данного изобретения относится к соединению формулы II:
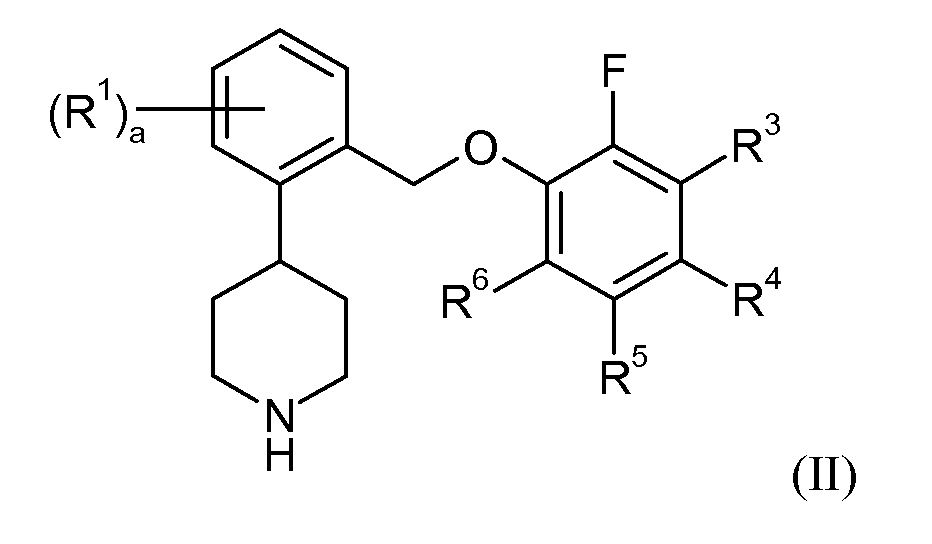
в которой:
(a) R3 и R5 представляют собой водород и:
(i) R4 представляет собой фтор, R6 представляет собой фтор, и a представляет собой 0;
(ii) R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор, 5-трифторметил или 6-фтор;
(iii) R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор, 4,6-дифтор или 5,6-дифтор;
(iv) R4 представляет собой фтор, R6 представляет собой хлор и a представляет собой 0;
(v) R4 представляет собой хлор, R6 представляет собой фтор и a представляет собой 0; или
(vi) R4 представляет собой бром, R6 представляет собой хлор и a представляет собой 0; или
(b) R3 и R4 представляют собой водород, R5 представляет собой фтор, R6 представляет собой хлор и:
(i) a представляет собой 0;
(ii) a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор; или
(iii) a представляет собой 2, и R1 представляет собой 4,6-дифтор; или
(c) R4 и R5 представляют собой водород, R6 представляет собой фтор и;
(i) R3 представляет собой фтор и a представляет собой 0;
(ii) R3 представляет собой фтор, a представляет собой 1, и R1 представляет собой 3-фтор, 5-фтор, 5-трифторметил или 6-фтор;
(iii) R3 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,6-дифтор; или
(iv) R3 представляет собой хлор или метил и a представляет собой 0; или
(d) R3, R4 и R5 представляют собой водород и:
(i) R6 представляет собой H и a представляет собой 0;
(ii) R6 представляет собой H, a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор;
(iii) R6 представляет собой фтор, и a представляет собой 0;
(iv) R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор или 6-фтор;
(v) R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор или 4,6-дифтор;
(vi) R6 представляет собой хлор, и a представляет собой 0;
(vii) R6 представляет собой хлор, a представляет собой 1, и R1 представляет собой 4-фтор, 6-фтор или 5-трифторметил;
(viii) R6 представляет собой хлор, a представляет собой 2, и R1 представляет собой 4,5-дифтор; или
(ix) R6 представляет собой бром, и a представляет собой 0; или его фармацевтически приемлемой соли.
Еще один аспект данного изобретения относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и соединение данного изобретения. Подобные композиции могут необязательно содержать другие активные агенты, такие как агенты против болезни Альцгеймера, противосудорожные средства, антидепрессанты, агенты против болезни Паркинсона, двойные ингибиторы серотонин-норэпинефринового обратного захвата, нестероидные противовоспалительные агенты, ингибиторы обратного захвата норэпинефрина, опиоидные агонисты, опиоидные антагонисты, селективные ингибиторы обратного захвата серотонина, блокаторы натриевых каналов, симпатолитики и их комбинации. Таким образом, в еще одном аспекте данного изобретения фармацевтическая композиция содержит соединение данного изобретения, второй активный агент и фармацевтически приемлемый носитель. Еще один аспект данного изобретения относится к комбинации активных агентов, содержащей соединение данного изобретения и второй активный агент. Соединения данного изобретения могут входить в лекарственную форму совместно с дополнительным агентом(ами) или раздельно. В случае раздельного формулирования с дополнительным агентом(ами) может быть включен фармацевтически приемлемый носитель. Таким образом, еще один аспект данного изобретения относится к комбинации фармацевтических композиций, при этом комбинация включает первую фармацевтическую композицию, содержащую соединение формулы I, или его фармацевтически приемлемую соль, и первый фармацевтически приемлемый носитель; и вторую фармацевтическую композицию, содержащую второй активный агент и второй фармацевтически приемлемый носитель. Данное изобретение также относится к набору, содержащему такие фармацевтические композиции, например, в которых первая и вторая фармацевтические композиции представляют собой отдельные фармацевтические композиции.
Соединения данного изобретения обладают ингибирующей активностью обратного захвата серотонина и ингибирующей активностью обратного захвата норэпинефрина, и, следовательно, ожидается, что они будут применяться в качестве терапевтических агентов для лечения пациентов, страдающих заболеванием или нарушением, которое лечится ингибированием транспортеров серотонина и/или норэпинефрина. Таким образом, один аспект данного изобретения относится к способу лечения нарушения, сопровождающегося болью, такого как невропатическая боль или фибромиалгия; депрессивного расстройства, такого как большая депрессия; аффективного расстройства, такого как тревожное расстройство; синдрома гиперактивности с дефицитом внимания; когнитивного расстройства, такого как деменция; недержания мочи при напряжении; синдрома хронического переутомления; ожирения или вазомоторных симптомов, связанных с менопаузой, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения.
Еще один аспект данного изобретения относится к способу ингибирования обратного захвата серотонина у млекопитающего, включающему введение млекопитающему такого количества соединения данного изобретения, которое ингибирует транспортер серотонина. Еще один аспект данного изобретения относится к способу ингибирования обратного захвата норэпинефрина у млекопитающего, включающему введение млекопитающему такого количества соединения данного изобретения, которое ингибирует транспортер норэпинефрина. И еще один аспект данного изобретения относится к способу ингибирования обратного захвата серотонина и обратного захвата норэпинефрина у млекопитающего, включающему введение млекопитающему такого количества соединения данного изобретения, которое ингибирует транспортер серотонина и транспортер норэпинефрина.
Среди соединений формулы I, соединениями, которые представляют особый интерес, являются соединения, которые имеют константу ингибирования (pKi) для SERT больше или равную около 7,9 и константу ингибирования (pKi) для NET больше или равную около 8,0. В еще одном варианте осуществления представляющие интерес соединения имеют соразмерные активности в отношении SERT и NET, т.е. имеют одинаковые значения pKi и для SERT, и для NET ±0,5. Дополнительными соединениями, которые представляют особый интерес, являются соединения, которые имеют значения pIC50 для ингибирования обратного захвата серотонина больше или равные около 7,0 и значения pIC50 для ингибирования обратного захвата норэпинефрина больше или равные около 7,0.
Поскольку соединения данного изобретения обладают ингибирующей активностью обратного захвата серотонина и ингибирующей активностью обратного захвата норэпинефрина, то подобные соединения также можно применять в качестве инструментов исследования. Таким образом, один аспект данного изобретения относится к способам применения соединений данного изобретения в качестве инструментов исследования, включающим проведение биологического анализа при помощи соединения данного изобретения. Соединения данного изобретения можно также применять для оценки новых химических соединений. Таким образом, еще один аспект данного изобретения относится к способу оценки исследуемого соединения в биологическом анализе, включающему: (a) проведение биологического анализа исследуемого соединения с получением первого результата анализа; (b) проведение биологического анализа соединения данного изобретения с получением второго результата анализа; причем стадия (a) проводится либо до, либо после, либо одновременно со стадией (b); и (c) сравнение первого результата анализа из стадии (a) со вторым результатом анализа из стадии (b).
Типичные биологические анализы включают анализ обратного захвата серотонина и анализ обратного захвата норэпинефрина. Еще один аспект данного изобретения относится к способу изучения биологической системы или образца, содержащим транспортеры серотонина, транспортеры норэпинефрина, или и те, и другие, при этом данный способ включает: (a) контактирование данной биологической системы или образца с соединением данного изобретения; и (b) определение эффектов, оказанных данным соединением на биологическую систему или образец.
Данное изобретение также относится к процессам и промежуточным веществам, применяемым для получения соединений данного изобретения. Таким образом, один аспект данного изобретения относится к способу получения соединения формулы I, при этом данный способ включает снятие защитной группы соединения формулы III:
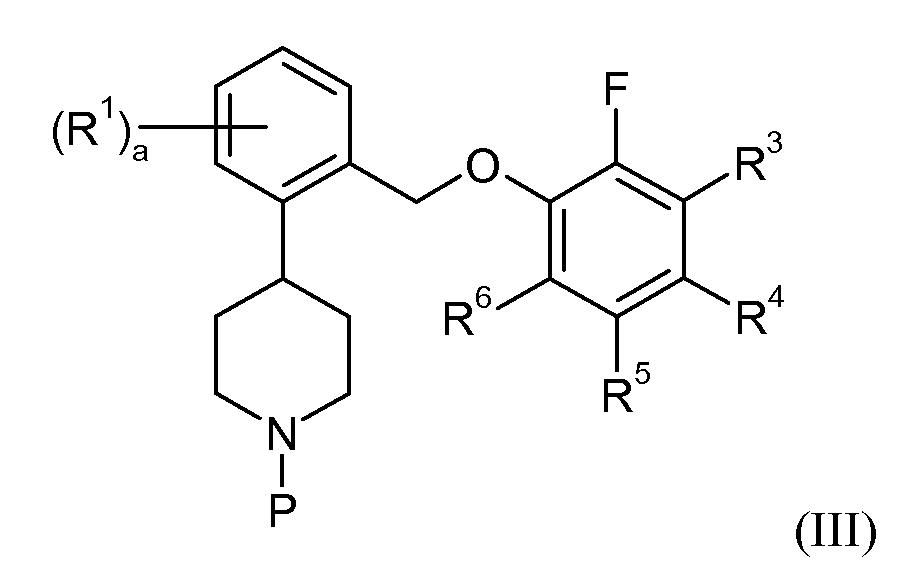
или его соли, в которой P представляет собой защитную аминогруппу, с получением соединения формулы I или II, в которой a, R1 и R3-6 определены для формул I или II соответственно. В других аспектах данное изобретение относится к новым промежуточным соединениям, применяемым в подобных способах.
Еще один аспект данного изобретения относится к применению соединения данного изобретения для производства лекарственных препаратов, особенно для производства лекарственных препаратов, применяемых для лечения болевых нарушений, депрессивных расстройств, аффективных расстройств, синдрома гиперактивности с дефицитом внимания, когнитивных расстройств, недержания мочи при напряжении, для ингибирования обратного захвата серотонина у млекопитающего или для ингибирования обратного захвата норэпинефрина у млекопитающего. Еще один аспект данного изобретения относится к применению соединения данного изобретения в качестве инструментов исследования. Другие аспекты и варианты осуществления данного изобретения раскрыты в контексте данного документа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
При описании соединений, композиций, способов и процессов данного изобретения приведенные ниже понятия имеют приведенные ниже значения, если не оговорено иное. Кроме того, применяемые в контексте данного документа формы единственного числа включают соответствующие формы множественного числа, если в контексте применения не очевидно обратное. Подразумевается, что понятия "содержащий", "включающий" и "имеющий" учитывают и обозначают, что кроме перечисленных элементов могут присутствовать дополнительные элементы. Следует понимать, что все численные значения, выражающие количества ингредиентов, свойства, такие как молекулярный вес, условия реакции и так далее, применяемые в контексте данного документа, сопровождаются во всех примерах понятием "около", если не оговорено иное. Таким образом, численные значения, излагаемые в контексте данного документа, являются приближениями, которые могут варьироваться в зависимости от желаемых свойств, которые стремятся получить при помощи настоящего изобретения. Не пытаясь ограничить применение теории эквивалентов в объеме данной формулы изобретения, каждое численное значение следует интерпретировать, по крайней мере, с учетом имеющихся значащих цифр и с применением общепринятых способов округления.
Понятие "алкил" означает одновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной. Если не оговорено иное, то подобные алкильные группы обычно содержат от 1 до 10 атомов углерода и включают, например, -C1-2алкил, -C1-3алкил, -C1-4алкил, -C1-6алкил и -C1-8алкил. Типичные алкильные группы включают, в качестве примера, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и тому подобное.
В случае, когда для отдельного понятия, применяемого в контексте данного документа, предназначается конкретное число атомов углерода, то данное число атомов углерода показывается перед данным понятием в виде нижнего индекса. Например, понятие "-C1-6алкил" обозначает алкильную группу, содержащую от 1 до 6 атомов углерода, а понятие "-C1-4алкилен" означает алкиленовую группу, содержащую от 1 до 4 атомов углерода, при этом данные атомы углерода находятся в любой приемлемой конфигурации.
Понятие "алкилен" означает двухвалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной. Если не оговорено иное, подобные алкиленовые группы обычно содержат от 0 до 10 атомов углерода и включают, например, -C0-1алкилен, -C0-2алкилен, -C0-3алкилен, -C0-6алкилен, -C1-4алкилен, -C2-4алкилен и -C1-6алкилен. Типичные алкиленовые группы включают, в качестве примера, метилен, этан-1,2-диил ("этилен"), пропан-1,2-диил, пропан-1,3-диил, бутан-1,4-диил, пентан-1,5-диил и тому подобное. Следует понимать, что в случае, когда понятие алкилен включает ноль атомов углерода, как, например, -C0-1алкилен-, -C0-3алкилен- или -C0-6алкилен-, то подразумевается, что подобные понятия включают отсутствие атомов углерода, т.е. алкиленовая группа отсутствует, а присутствует только ковалентная связь, соединяющая группы, разделенные понятием алкилен.
Понятие "алкинил" означает одновалентную ненасыщенную углеводородную группу, которая может быть линейной или разветвленной и которая содержит, по крайней мере, одну, а обычно 1, 2 или 3 углерод-углеродные тройные связи. Если не оговорено иное, подобные алкинильные группы обычно содержат от 2 до 10 атомов углерода и включают, например, -C2-4алкинил, -C2-6алкинил и -C3-10алкинил. Типичные алкинильные группы включают, в качестве примера, этинил, н-пропинил, н-бут-2-инил, н-гекс-3-инил и тому подобное.
Понятие "галоген" означает фтор, хлор, бром и йод.
Подразумевается, что применяемая в контексте данного документа фраза "формулы", "имеющая формулу" или "имеющая структуру", не является ограничивающей и применяется так же, как обычно применяется понятие "включающий".
Понятие "фармацевтически приемлемый" относится к веществу, которое не является биологически или по иным основанием, неприемлемым при применении в данном изобретении. Например, понятие "фармацевтически приемлемый носитель" относится к веществу, которое может быть включено в композицию, и вводится пациенту, не вызывая неприемлемых биологических эффектов или неприемлемого взаимодействия с другими компонентами данной композиции. Подобные фармацевтически приемлемые вещества обычно соответствуют требуемым стандартам токсикологического и производственного испытания и включают вещества, которые определены как подходящие неактивные ингредиенты Управлением по контролю за продуктами питания и лекарственными средствами США.
Понятие "фармацевтически приемлемая соль" обозначает соль, полученную из какого-либо основания или кислоты, которая является приемлемой для введения пациенту, такому как млекопитающее (например, соли, обладающие приемлемой безопасностью для млекопитающих при данном режиме дозировки). Однако следует понимать, что необязательно, чтобы соли, предусматриваемые изобретением, были фармацевтически приемлемыми солями, как, например, соли промежуточного соединения, которые не предназначены для введения пациенту. Фармацевтически приемлемые соли можно получить из фармацевтически приемлемых неорганических или органических оснований и из фармацевтически приемлемых неорганических или органических кислот. Кроме того, когда соединение формулы I содержит и основную функциональную группу, такую как амин, и кислотную функциональную группу, такую как карбоновая кислота, цвиттерионы могут образовываться и включаются в рамки понятия "соль", применяемого в контексте данного документа. Соли, получаемые из фармацевтически приемлемых неорганических оснований, включают соли аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия и цинка, и тому подобное. Соли, получаемые из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, в том числе замещенных аминов, циклических аминов, природных аминов, и тому подобное, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин, и тому подобное. Соли, получаемые из фармацевтически приемлемых неорганических кислот, включают соли борной, угольной, галогеноводородной (бромистоводородной, хлористоводородной, фтористоводородной или йодистоводородной), азотной, фосфорной, сульфаминовой и серной кислот. Соли, получаемые из фармацевтически приемлемых органических кислот, включают соли алифатических гидроксикислот (например, лимонной, глюконовой, гликолевой, молочной, лактобионовой, яблочной и винной кислот), алифатических монокарбоновых кислот (например, уксусной, масляной, муравьиной, пропионовой и трифторуксусной кислот), аминокислот (например, аспарагиновой и глутаминовой кислот), ароматических карбоновых кислот (например, бензойной, п-хлорбензойной, дифенилуксусной, гентизиновой, гиппуровой и трифенилуксусной кислот), ароматических гироксикислот (например, о-гидроксибензойной, п-гидроксибензойной, 1-гидроксинафталин-2-карбоновой и 3-гидроксинафталин-2-карбоновой кислот), аскорбиновой, дикарбоновых кислот (например, фумаровой, малеиновой, щавелевой и янтарной кислот), глюкуроновой, миндальной, муциновой, никотиновой, оротовой, памовой, пантотеновой, сульфоновой кислот (например, бензолсульфоновой, камфорсульфоновой, 1,2-этандисульфоновой, этансульфоновой, изэтионовой, метансульфоновой, нафталинсульфоновой, нафталин-1,5-дисульфоновой, нафталин-2,6-дисульфоновой и п-толуолсульфоновой кислот), ксинафоевой кислоты и тому подобное.
Понятие "сольват" обозначает комплекс или агрегат, образованный одной или более молекулами растворенного вещества, например соединения формулы I или его фармацевтически приемлемой соли, и одной или более молекул растворителя. Подобные сольваты обычно представляют собой кристаллические твердые вещества, имеющие практически постоянное молярное соотношение растворенного вещества и растворителя. Типичные растворители включают, в качестве примера, воду, метанол, этанол, изопропанол, уксусную кислоту и тому подобное. Если растворителем является вода, то образующийся сольват является гидратом.
Понятие "терапевтически эффективное количество" обозначает количество, достаточное для осуществления лечения при введении пациенту, который в этом нуждается, т.е. количество лекарственного средства, необходимое для получения желаемого терапевтического эффекта. Например, терапевтически эффективное количество для лечения невропатической боли представляет собой количество соединения, необходимое, например, для уменьшения, подавления, устранения или предотвращения симптомов невропатической боли или для лечения первопричины невропатической боли. С другой стороны, понятие "эффективное количество" обозначает количество, достаточное для получения желаемого результата, которым необязательно является терапевтический результат. Например, при изучении системы, включающей транспортер норэпинефрина, "эффективным количеством" может быть количество, необходимое для ингибирования обратного захвата норэпинефрина.
Понятие "лечение" или "терапия", применяемые в контексте данного документа, обозначает лечение или терапию заболевания или патологического состояния (такого как невропатическая боль) у пациента, такого как млекопитающее (особенно человек), которая включает одну или более из перечисленных ниже стадий: (a) предотвращение возникновения заболевания или патологического состояния, т.е. профилактическое лечение пациента; (b) улучшение состояния при заболевании или патологическом состоянии, т.е. устранение или инициация ремиссии заболевания или патологического состояния у пациента; (c) подавление заболевания или патологического состояния, т.е. замедление или купирование развития заболевания или патологического состояния у пациента; или (d) облегчение симптомов заболевания или патологического состояния у пациента. Например, понятие "лечение невропатической боли" включало бы предотвращение возникновения невропатической боли, улучшение состояния при невропатической боли, подавление невропатической боли и облегчение симптомов невропатической боли. Подразумевается, что понятие "пациент" включает млекопитающих, таких как люди, которым необходимо лечение или профилактика заболевания, которые в настоящее время проходят терапию с целью профилактики заболевания или лечения специфического заболевания или патологического состояния, а также испытуемые объекты, на которых соединения данного изобретения апробируются или применяются для анализа, например, животная модель.
Подразумевается, что все другие понятия, применяемые в контексте данного документа, имеют общепринятое значение, которое понятно специалистам в данной области техники, к которым они относятся.
В одном аспекте данное изобретение относится к соединениям формулы I:
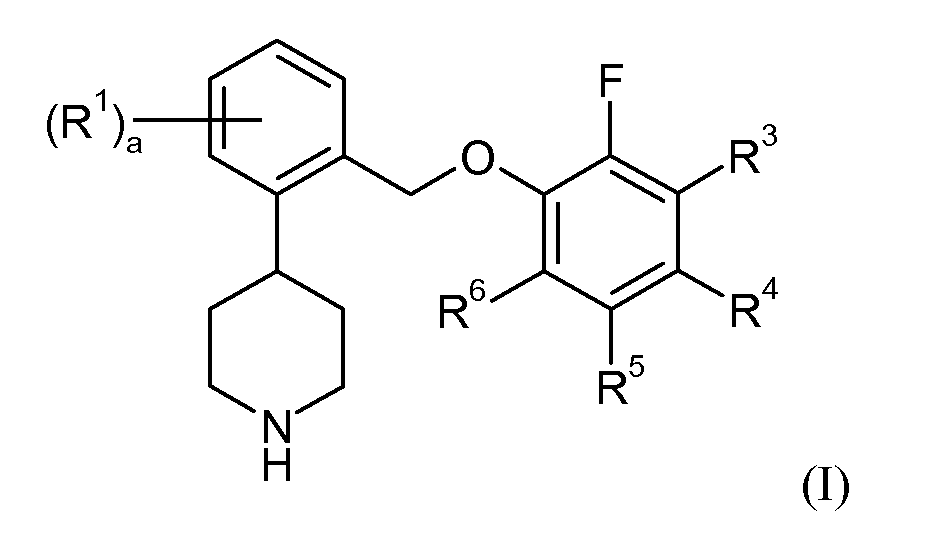
или их фармацевтически приемлемой соли.
Применяемое в контексте данного документа понятие "соединение данного изобретения" или "соединения данного изобретения " включает все соединения, охватываемые формулами I, II и III, как, например, структуры, изображенные на формулах IIa, IIb, IIc и IId, и все другие подструктуры данных формул. Кроме того, если соединение данного изобретения содержит основную или кислотную группу (например, амино или карбоксильную группы), то данное соединение может существовать в виде свободного основания, свободной кислоты, цвиттериона или в различных солевых формах. Все подобные солевые формы включены в рамки объема данного изобретения. Таким образом, специалисты в данной области техники понимают, что ссылка на соединения в контексте данного документа, например ссылка на "соединение данного изобретения" или "соединение формулы I", включает соединение формулы I, а также фармацевтически приемлемые соли данного соединения, если не оговорено иное. Кроме того, сольваты также включены в рамки объема данного изобретения.
Соединения данного изобретения, а также те соединения, которые применяются для их синтеза, могут также включать изотопно меченные соединения, т.е. когда один или более атомов обогащены атомами, имеющими атомную массу, отличную от атомной массы, преимущественно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения данного изобретения, например, включают, но не ограничиваются, 2H, 3H, 13C, 14C, 15N, 18O, 17О, 35S, 36Cl и 18F. Особый интерес представляют соединения формулы I, обогащенные тритием или углеродом-14, которые можно применять, например, в исследованиях распределения в тканях; соединения формулы I, обогащенные дейтерием, особенно в местах, в которых происходят метаболические реакции, например в соединениях, имеющих более высокую метаболическую устойчивость; и соединения формулы I, обогащенные позитронно-активным изотопом, таким как 11C, 18F, 15O и 13N, которые можно применять, например, в исследованиях позитронно-эмиссионной топографии (ПЭТ).
Было обнаружено, что соединения данного изобретения обладают ингибирующей активностью обратного захвата серотонина и ингибирующей активностью обратного захвата норэпинефрина. Среди других свойств ожидается, что подобные соединения будут применяться в качестве терапевтических агентов для лечения хронической боли, такой как невропатическая боль. Комбинируя двойную активность, в одном соединении можно осуществлять двойную терапию, т.е. ингибирующую активность обратного захвата серотонина и ингибирующую активность обратного захвата норэпинефрина при помощи одного активного компонента. Поскольку фармацевтические композиции, содержащие один активный компонент, обычно легче формулировать, чем композиции, содержащие два активных компонента, то подобные однокомпонентные композиции имеют значительное преимущество перед композициями, содержащими два активных компонента.
Многие комбинированные ингибиторы обратного захвата серотонина и норэпинефрина (SNRI) являются более селективными для SERT, чем для NET. Например, милнаципран, дулоксетин и венлафаксин проявляют в 2,5 раза, в 10 раз и в 100 раз большую селективность (измеренную в значениях pKi) для SERT, чем для NET соответственно. Некоторые, однако, менее селективные, такие как бицифадин, который имеет pKi для SERT 7,0, а pKi для NET 6,7. Поскольку может быть желательным избежать селективных соединений, в одном варианте осуществления данного изобретения соединение имеет более соразмерную SERT и NET активность, т.е. имеет одинаковые значения pKi для SERT и NET ± 0,5.
Соединения, описанные в контексте данного изобретения, обычно названы при помощи компонента AutoNom, коммерчески доступного программного обеспечения MDL®ISIS/Draw (Symyx, Santa Clara, California). Обычно соединения данного изобретения названы 4-[2-(2-фторфеноксиметил)фенил]пиперидинами. Частичная нумерация соединений, описанных в контексте данного документа, выглядит следующим образом:
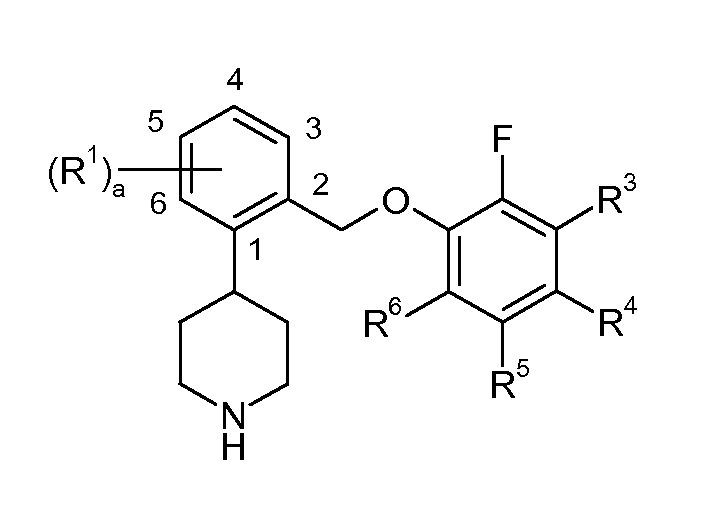
ТИПИЧНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Приведенные ниже заместители и значения предназначены для представления типичных примеров различных аспектов и вариантов осуществления данного изобретение. Данные примерные значения предназначены для дополнительного определения и иллюстрации подобных аспектов и вариантов осуществления и не должны быть истолкованы как исключающие другие варианты осуществления или ограничивающие объем данного изобретения. В связи с этим подразумевается, что утверждение о том, что конкретное значение или заместитель является предпочтительным, ни каким образом не исключает другие значения или заместители из данного изобретения, если специально не оговорено иное.
В одном аспекте данное изобретение относится к соединениям формулы I:
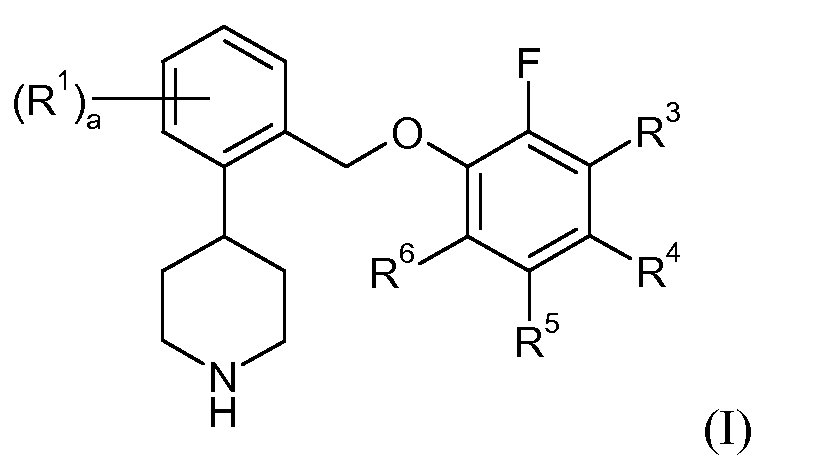
В соединениях формулы I целое число a может представлять собой 0, 1, 2, 3 или 4. Каждый R1 независимо представляет собой галоген или трифторметил. R3 представляет собой водород, галоген или -C1-6алкил. R4, R5 и R6 независимо представляют собой водород или галоген. Типичные галогеновые группы включают фтор, хлор, бром и йод. Типичные -C1-6алкильные группы включают -CH3, -CH2CH3 и -CH(CH3)2. В одном варианте осуществления R3 представляет собой водород, фтор, хлор или метил. В одном варианте осуществления R4 представляют собой водород, фтор, хлор или бром. В одном варианте осуществления R5 представляет собой водород или фтор. В одном варианте осуществления R6 представляет собой водород, фтор, хлор или бром.
В одном варианте осуществления соединений формулы Ia представляет собой 0. Это может быть изображено в виде формулы Ia:
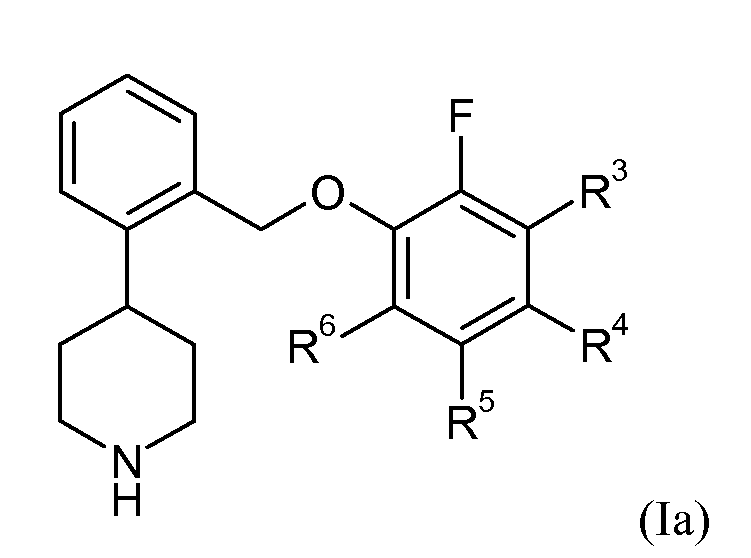
В одном варианте осуществления соединений формулы Ia R3 представляет собой водород, фтор, хлор или метил; R4 представляет собой водород, фтор, хлор или бром; R5 представляет собой водород или фтор; и R6 представляет собой водород, фтор, хлор или бром.
В еще одном варианте осуществления соединений формулы Ia представляет собой 1. Это может быть изображено в виде формулы Ib:
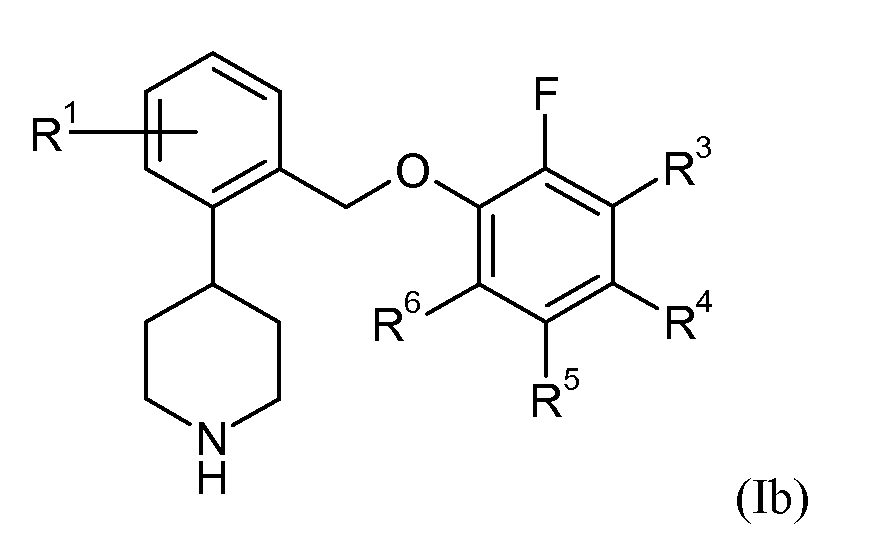
В одном варианте осуществления соединений формулы Ib R1 представляет собой 3-фтор, 4-фтор, 5-фтор, 5-трифторметил или 6-фтор. В еще одном варианте осуществления соединений формулы Ib R3 представляет собой водород или фтор; R4 представляет собой водород или фтор; R5 представляет собой водород или фтор; и R6 представляет собой водород, фтор или хлор.
В еще одном варианте осуществления соединений формулы Ia представляет собой 2. Это может быть изображено в виде формулы Ic:
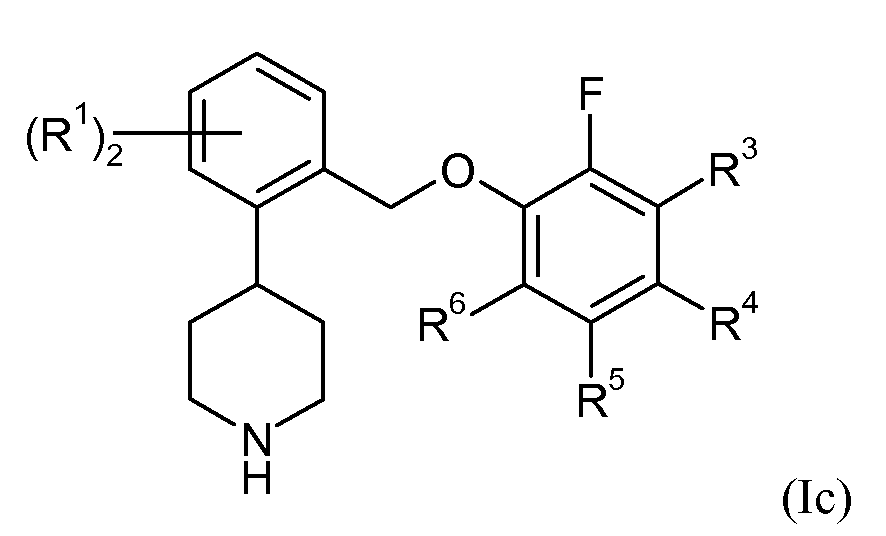
В одном варианте осуществления соединений формулы Ic R1 представляет собой 4,5-дифтор, 4,6-дифтор или 5,6-дифтор. В еще одном варианте осуществления соединений формулы Ic R3 представляет собой водород или фтор; R4 представляет собой водород или фтор; R5 представляет собой водород или фтор; и R6 представляет собой водород, фтор или хлор.
В одном конкретном аспекте данного изобретения соединения формулы I проявляют SERT pKi≥7,9 и NET pKi≥8.
В еще одном аспекте данное изобретение относится к соединениям формулы II:
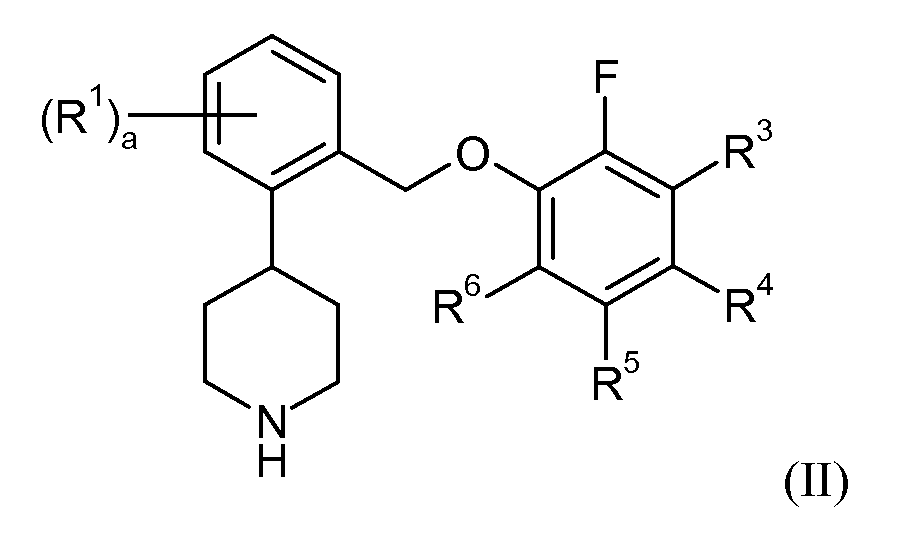
в которой:
(a) R3 и R5 представляют собой водород и:
(i) R4 представляет собой фтор, R6 представляет собой фтор, и a представляет собой 0;
(ii) R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор, 5-трифторметил или 6-фтор;
(iii) R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор, 4,6-дифтор или 5,6-дифтор;
(iv) R4 представляет собой фтор, R6 представляет собой хлор, и a представляет собой 0;
(v) R4 представляет собой хлор, R6 представляет собой фтор, и a представляет собой 0; или
(vi) R4 представляет собой бром, R6 представляет собой хлор, и a представляет собой 0; или
(b) R3 и R4 представляют собой водород, R5 представляет собой фтор, R6 представляет собой хлор, и:
(i) a представляет собой 0;
(ii) a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор; или
(iii) a представляет собой 2, и R1 представляет собой 4,6-дифтор; или
(c) R4 и R5 представляют собой водород, R6 представляет собой фтор и;
(i) R3 представляет собой фтор, и a представляет собой 0;
(ii) R3 представляет собой фтор, a представляет собой 1, и R1 представляет собой 3-фтор, 5-фтор, 5-трифторметил или 6-фтор;
(iii) R3 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,6-дифтор; или
(iv) R3 представляет собой хлор или метил, и a представляет собой 0; или
(d) R3, R4 и R5 представляют собой водород и:
(i) R6 представляет собой H, и a представляет собой 0;
(ii) R6 представляет собой H, a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор;
(iii) R6 представляет собой фтор, и a представляет собой 0;
(iv) R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор или 6-фтор;
(v) R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор или 4,6-дифтор;
(vi) R6 представляет собой хлор, и a представляет собой 0;
(vii) R6 представляет собой хлор, a представляет собой 1, и R1 представляет собой 4-фтор, 6-фтор или 5-трифторметил;
(viii) R6 представляет собой хлор, a представляет собой 2, и R1 представляет собой 4,5-дифтор; или
(ix) R6 представляет собой бром, и a представляет собой 0; или к их фармацевтически приемлемой соли.
В одном варианте осуществления соединений формулы II R3 и R5 представляют собой водород. Это может быть изображено в виде формулы IIa:
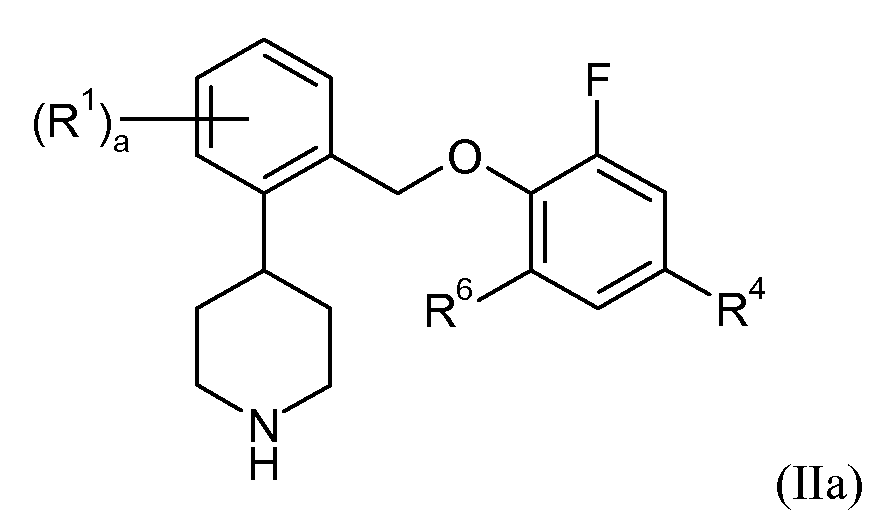
В одном варианте осуществления соединений формулы IIa R4 представляет собой фтор, R6 представляет собой фтор, и a представляет собой 0. В еще одном варианте осуществления R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор, 5-трифторметил или 6-фтор. В еще одном варианте осуществления R4 представляет собой фтор, R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор, 4,6-дифтор или 5,6-дифтор. В одном варианте осуществления R4 представляет собой фтор, R6 представляет собой хлор, и a представляет собой 0. В еще одном варианте осуществления R4 представляет собой хлор, R6 представляет собой фтор, и a представляет собой 0. В еще одном варианте осуществления R4 представляет собой бром, R6 представляет собой хлор, и a представляет собой 0. В еще одном варианте осуществления данные соединения формулы IIa показывают SERT pKi≥7,9 и NET pKi≥8.
В еще одном варианте осуществления соединений формулы II R3 и R4 представляют собой водород, R5 представляет собой фтор, и R6 представляет собой хлор. Это может быть изображено в виде формулы IIb:
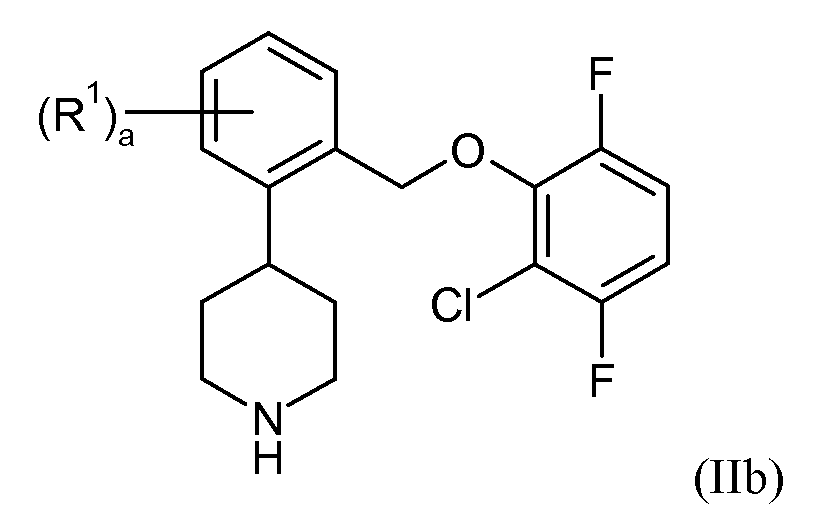
В одном варианте осуществления соединений формулы IIb a представляет собой 0. В еще одном варианте осуществления a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор. В еще одном варианте осуществления a представляет собой 2, и R1 представляет собой 4,6-дифтор. В еще одном варианте осуществления данные соединения формулы IIb показывают SERT pKi≥7,9 и NET pKi≥8.
В еще одном варианте осуществления соединений формулы II R4 и R5 представляют собой водород, и R6 представляет собой фтор. Это может быть изображено в виде формулы IIc:
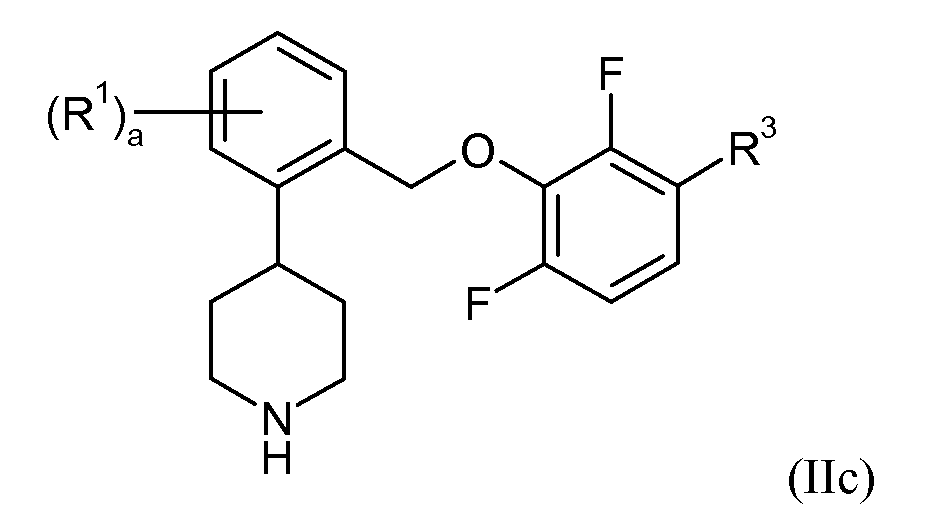
В одном варианте осуществления соединений формулы IIc R3 представляет собой фтор, и a представляет собой 0. В еще одном варианте осуществления R3 представляет собой фтор, a представляет собой 1, и R1 представляет собой 3-фтор, 5-фтор, 5-трифторметил или 6-фтор. В еще одном варианте осуществления R3 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,6-дифтор. В еще одном варианте осуществления R3 представляет собой хлор или метил, и a представляет собой 0. В еще одном варианте осуществления данные соединения формулы IIc показывают SERT pKi≥7,9 и NET pKi≥8.
В еще одном варианте осуществления соединений формулы II R3, R4 и R5 представляют собой водород. Это может быть изображено в виде формулы IId:
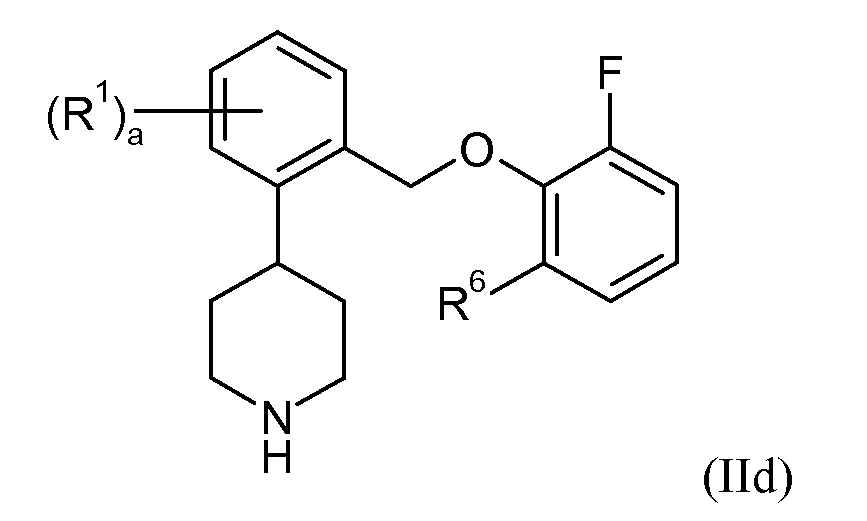
В одном варианте осуществления соединений формулы IId R6 представляет собой H, и a представляет собой 0. В еще одном варианте осуществления R6 представляет собой H, a представляет собой 1, и R1 представляет собой 5-фтор или 6-фтор. В еще одном варианте осуществления R6 представляет собой фтор или хлор, и a представляет собой 0. В еще одном варианте осуществления R6 представляет собой фтор, a представляет собой 1, и R1 представляет собой 4-фтор, 5-фтор или 6-фтор. В еще одном варианте осуществления R6 представляет собой хлор, a представляет собой 1, и R1 представляет собой 4-фтор, 6-фтор или 5-трифторметил. В одном варианте осуществления R6 представляет собой фтор, a представляет собой 2, и R1 представляет собой 4,5-дифтор или 4,6-дифтор. В одном варианте осуществления R6 представляет собой хлор, a представляет собой 2, и R1 представляет собой 4,5-дифтор. В еще одном варианте осуществления, R6 представляет собой бром, и a представляет собой 0. В еще одном варианте осуществления данные соединения формулы IId показывают SERT pKi≥7,9 и NET pKi≥8.
В одном варианте осуществления соединения данного изобретения имеют высокое сродство к NET и имеют относительно соразмерное сродство к SERT по сравнению с NET, и в одном варианте осуществления более высокое сродство к NET по сравнению с SERT. В одном конкретном варианте осуществления соединения данного изобретения показывают SERT pKi≥7,9 и NET pKi≥8. Удивительно, что такая соразмерность SERT и NET активности не обнаруживается в некоторых структурно подобных соединениях. Например, приведенное ниже соединение данного изобретения:
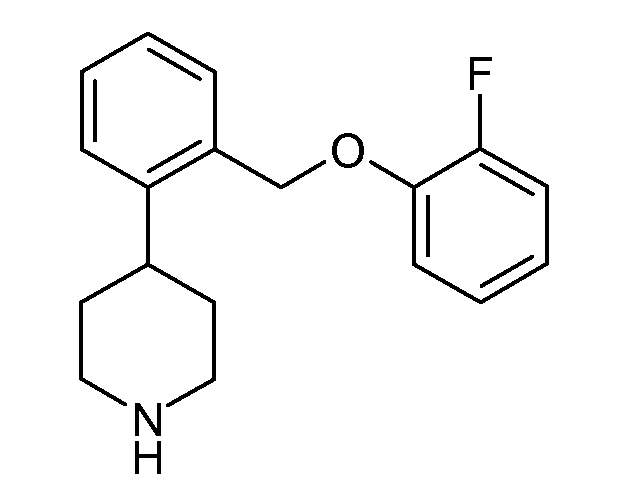
показывает SERT pKi 7,9 и NET pKi 8,3, как определено в анализе 1. По оценкам того же самого анализа приведенные ниже соединения показывают либо слабое связывание с обеими мишенями (незамещенные), либо более сильное связывание с SERT, чем с NET (2-хлор и 2-метил):
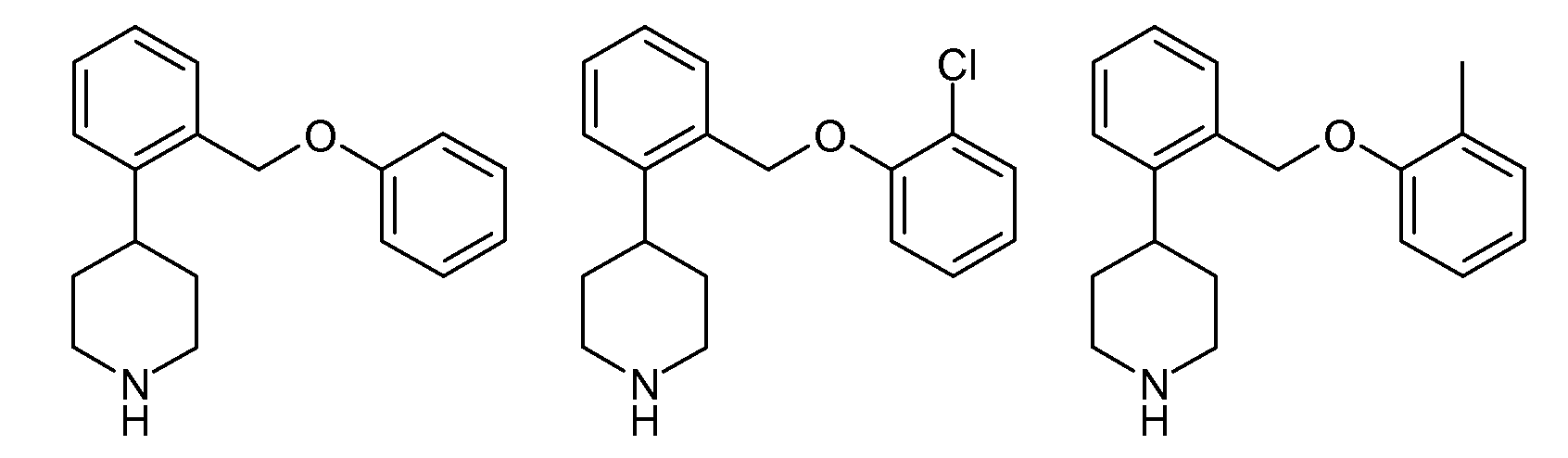
|
ОБЩЕПРИНЯТЫЕ МЕТОДЫ СИНТЕЗА
Соединения данного изобретения можно получить из легко доступных исходных веществ при помощи приведенных ниже обычных способов, методики изложены в данных примерах, или при помощи других способов, реагентов и исходных веществ, которые известны специалистам в данной области техники. Несмотря на то что приведенные ниже методики могут иллюстрировать конкретный вариант осуществления данного изобретения, следует понимать, что аналогично могут быть разработаны и другие варианты осуществления данного изобретения при помощи тех же самых или подобных способов или при помощи других способов, реагентов и исходных веществ, известных специалистам в данной области техники. Следует также понимать, что, несмотря на то, что приведены типичные или предпочтительные условия процесса (т.е. температуры реакции, времена, мольные соотношения реагентов, растворители, давления и т.д.), другие условия процесса также могут применяться, если не оговорено иное. Тогда как оптимальные реакционные условия обычно будут варьироваться в зависимости от различных параметров реакции, таких как конкретные реагенты, растворители и применяемые количества, специалисты в данной области техники легко могут определить подходящие реакционные условия при помощи стандартных процедур оптимизации.
Кроме того, для специалистов в данной области техники будет очевидным, что общепринятые защитные группы могут быть необходимыми или желательными для предохранения определенных функциональных групп от протекания нежелательных реакций. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия и реагенты для защиты и снятия защитной группы подобных функциональных групп хорошо известны на данном уровне техники. При желании могут применяться и другие защитные группы, кроме тех, которые проиллюстрированы в методиках, описанных в контексте данного документа. Например, многочисленные защитные группы и их введение, и удаление описаны в T. W. Greene and G. M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999, и ссылках, приведенных в контексте этого документа.
Конкретнее, в схемах ниже, P представляет собой "аминозащитную группу", понятие, применяемое в контексте данного документа для обозначения защитной группы, подходящей для предотвращения нежелательных реакций при аминогруппе. Типичные аминозащитные группы включают, но не ограничиваются, трет-бутоксикарбонил (Boc), тритил (Tr), бензилоксикарбонил (Cbz), 9-флуоренилметоксикарбонил (Fmoc), формил, бензил и тому подобное. Для удаления защитных групп, если таковые присутствуют, применяются стандартные методики снятия защиты и реагенты, такие как ТФК в ДХМ или HCl в 1,4-диоксане, метаноле или этаноле. Например, Boc-группу можно удалить при помощи кислотного реагента, такого как хлористоводородная кислота, трифторуксусная кислота и тому подобное; тогда как Cbz-группу можно удалить в условиях каталитического гидрирования, таких как H2 (1 атм), 10% Pd/C в спиртовом растворителе. Схемы проиллюстрированы Boc защитной группой.
В приведенных ниже схемах L представляет собой "уходящую группу", понятие, применяемое в контексте данного документа для обозначения функциональной группы или атома, который может быть замещен другой функциональной группой или атомом по реакции замещения, такой как реакция нуклеофильного замещения. В качестве примера, типичные уходящие группы включают хлорную, бромную и йодную группы; группы сульфонового эфира, такие как мезилат, тозилат, брозилат, нозилат, и тому подобное; и ацилоксигруппы, такие как ацетокси, трифторацетокси, и тому подобное.
Подходящие инертные разбавители или растворители для применения в данных схемах включают, в качестве иллюстрации, а не ограничения, тетрагидрофуран (ТГФ), ацетонитрил, N,N-диметилформамид (ДМФ), диметилсульфоксид (ДМСО), толуол, дихлорметан (ДХМ), хлороформ (CHCl3) и тому подобное.
Все реакции обычно проводятся при температуре, лежащей в диапазоне от около -78°C до около 110°C, например при комнатной температуре. Реакции можно контролировать при помощи тонкослойной хроматографии (ТСХ), высокоэффективной жидкостной хроматографии (ВЭЖХ) и/или ЖХМС до завершения. Реакции могут завершаться через минуты, могут занимать часы, обычно от 1-2 часов и вплоть до 48 часов, или дни, например вплоть до 3-4 дней. По завершении реакции полученная реакционная смесь или продукт реакции могут быть дополнительно обработаны, для того чтобы получить желаемый продукт. Например, результирующая смесь или продукт реакции могут быть подвергнуты одной или более из перечисленных ниже процедур: разбавление (например, насыщенным раствором NaHCO3); экстракция (например, этилацетатом, CHCl3, ДХМ, водной HCl); промывка (например, ДХМ, насыщенным водным раствором NaCl или насыщенным водным раствором NaHCO3); сушка (например, над MgSO4 или Na2SO4, или в вакууме); фильтрование; концентрирование (например, в вакууме); перерастворение (например, в растворе уксусная кислота:H2O 1:1); и/или очистка (например, препаративной ВЭЖХ, обращенно-фазовой препаративной ВЭЖХ или кристаллизацией).
В качестве иллюстрации, соединения данного изобретения можно получить по одной или более из приведенных ниже схем, которые подробно описаны в примерах.
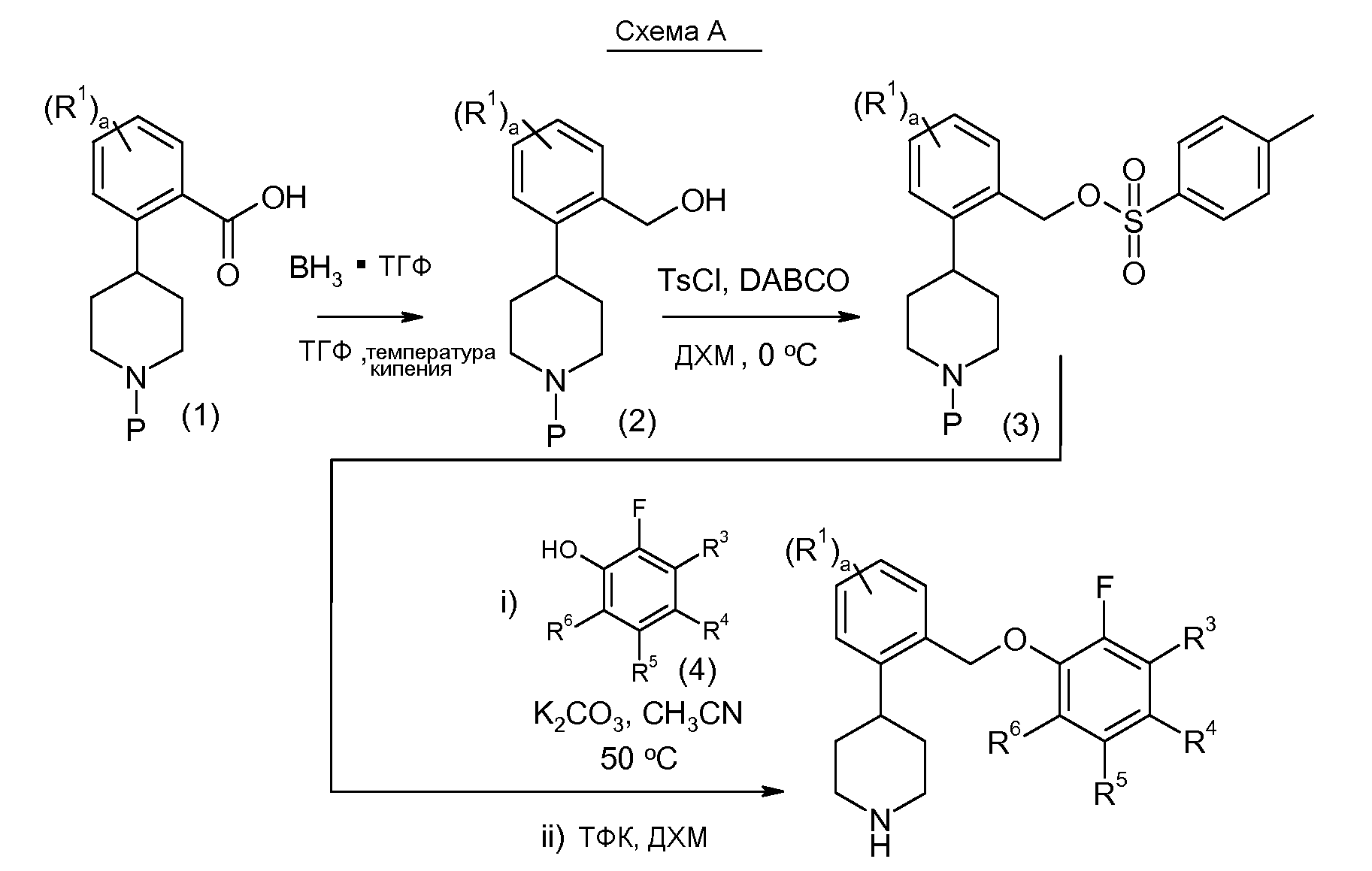
Исходное вещество 1, например трет-бутиловый эфир 4-(2-карбоксифенил)пиперидин-1-карбоновой кислоты (P=Boc), является коммерчески доступным и подвергается восстановлению боргидридом с образованием соединения 2. Подходящие восстановительные реагенты включают комплекс боран-диметилсульфид, 9-борабицикло[3.3.1]нонан, комплекс боран-1,2-бис(трет-бутилтио)этан, комплекс боран-трет-бутиламин, комплекс боран-ди(трет-бутил)фосфин, комплекс боран-тетрагидрофуран и так далее. Следующая стадия заключается в превращении гидроксильной группы соединения 2 в уходящую группу. Например, соединение 2 может подвергаться введению тозила при помощи соответствующего реагента, такого как п-толуолсульфонилхлорид (TsCl), в подходящем основании, таком как триэтилендиамин, с получением тозилатного эфира, соединение 3. См., например, Hartung et al. (1997) Synthesis 12:1433-1438. Иначе, соединение 2 можно объединять с метансульфоновым ангидридом в N,N-диизопропилэтиламине.
2-Фторфенольное соединение 4 взаимодействует с соединением 3 по реакции нуклеофильного замещения. Затем снимается защитная группа с защищенного амина с получением соединения данного изобретения. Соединение 4 либо является коммерчески доступным, либо легко синтезируется по методикам, которые хорошо известны на данном уровне техники.
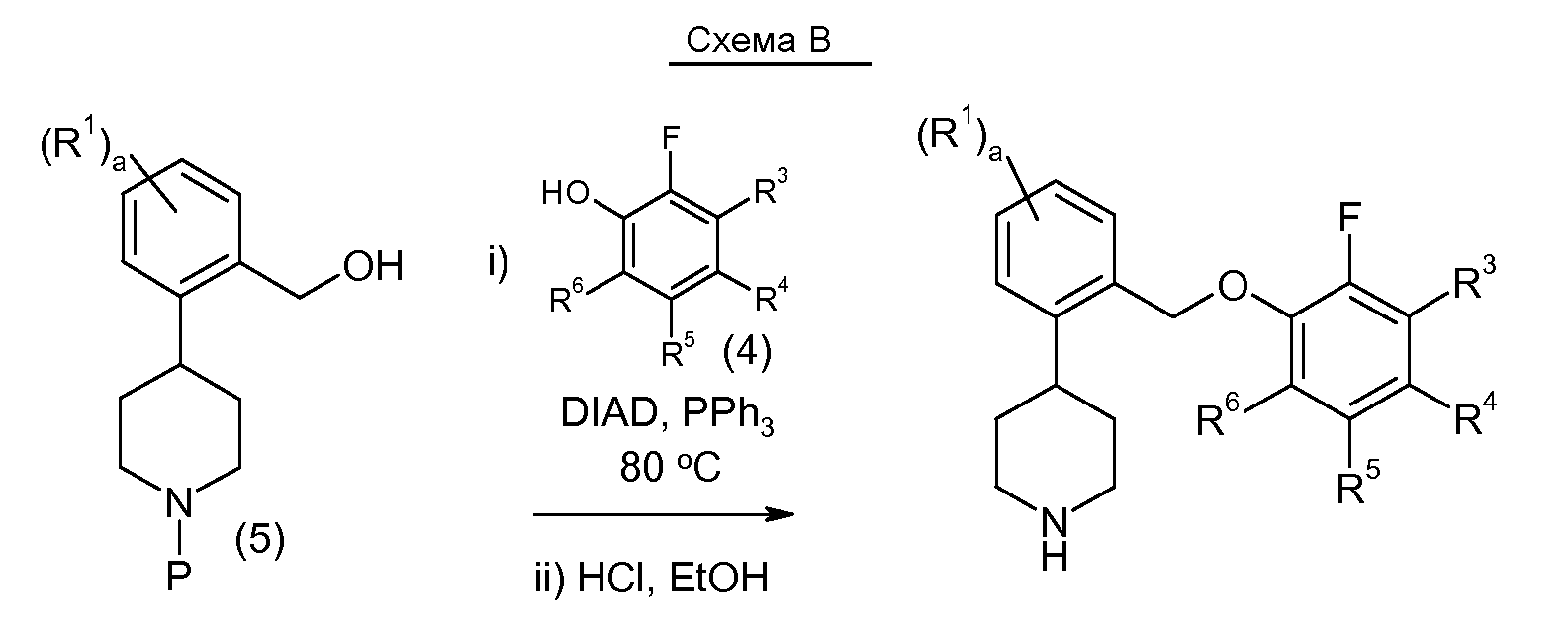
Соединения данного изобретения также можно получить по реакции Мицунобу (Mitsunobu and Yamada (1967) M. Bull Chem. Soc. JPN. 40:2380-2382), после чего следует снятие защитной группы амина. Данную реакцию обычно проводят в стандартных условиях взаимодействия Мицунобу, применяя окислительно-восстановительную систему, содержащую азодикарбоксилат, такой как диэтилазодикарбоксилат (DEAD) или диизопропилазодикарбоксилат (DIAD) и фосфиновый катализатор, такой как трифенилфосфин (PPh3).
Исходное вещество, соединение 5, можно синтезировать следующим образом:
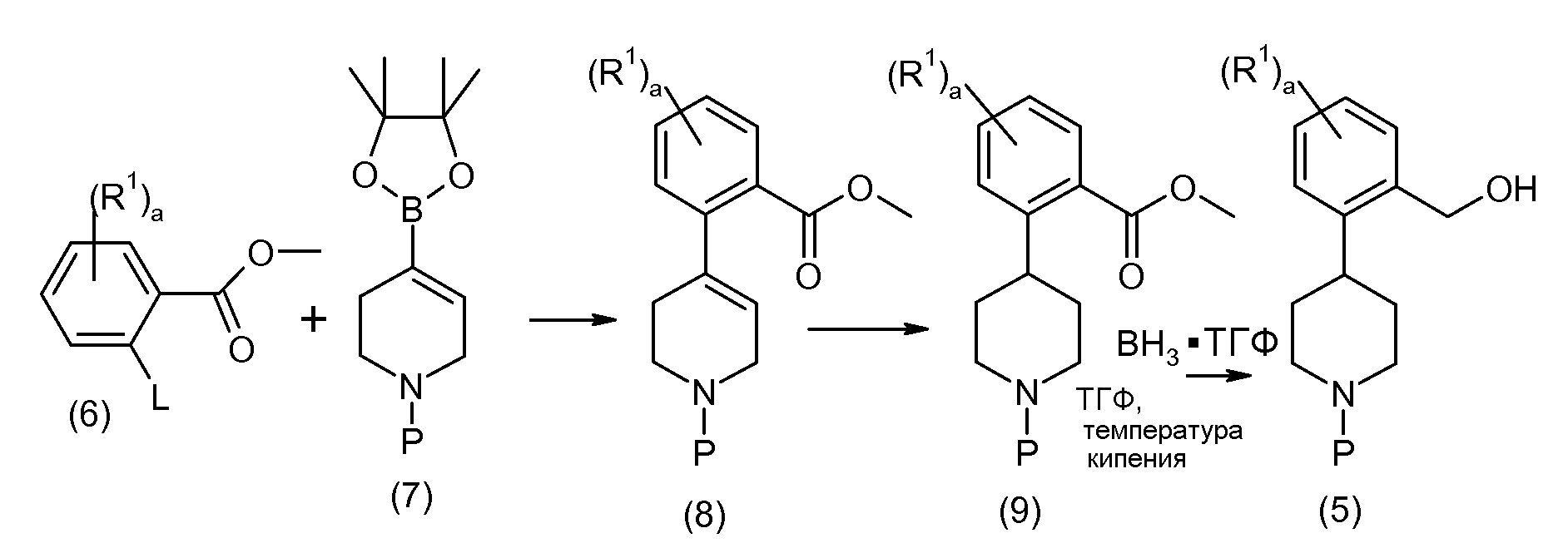
Соединение 6 и соединение 7 подвергаются взаимодействию в условиях реакции перекрестного сочетания Сузуки с образованием соединения 8. Типичные катализаторы включают палладиевые и никелевые катализаторы, такие как бис(трифенилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), бис[1,2-бис(дифенилфосфино)пропан]палладий(0), ацетат палладия(II), [1,1'-бис(дифенилфосфино)ферроцен]дихлорникель(II) и тому подобное. Необязательно в данной реакции применяется основание, такое как карбонат натрия, бикарбонат натрия, фосфат калия, триэтиламин и тому подобное. Соединение 8 гидрируется, обычно с применением катализатора Перлмана (влажный Pd(OH)2/C), с образованием соединения 9, которое затем подвергается восстановлению боргидридом с образованием соединения 5.
Исходные вещества 6 и 7 либо коммерчески доступны, либо легко синтезируются по методикам, которые хорошо известны на данном уровне техники. Предпочтительные уходящие группы (L) включают галогены и трифлат, а примеры соединения 6 включают метил-2-бром-5-фторбензоат. Примеры соединения 7 включают трет-бутиловый эфир 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты.
При желании можно получить фармацевтически приемлемые соли соединений формулы I или II контактированием свободной кислотной или основной формы соединения формулы I или II соответственно с фармацевтически приемлемым основанием или кислотой.
Некоторые из промежуточных соединений, описанных в контексте данного документа, считаются новыми, и, таким образом, подобные соединения обеспечиваются в качестве дополнительных аспектов данного изобретения, в том числе, например, соединения формулы III:
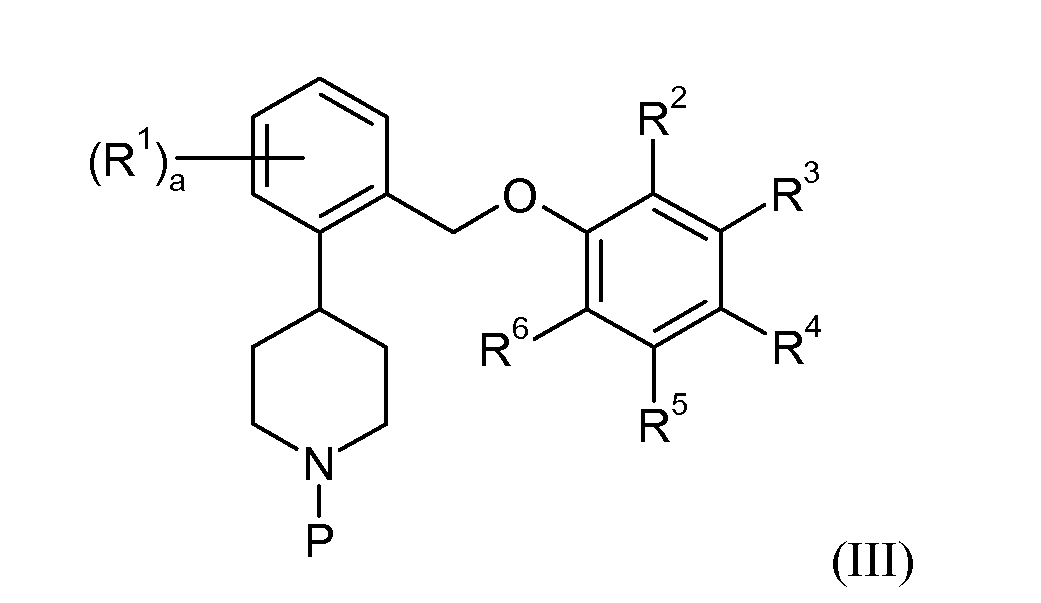
или их соли, при этом P представляет собой аминозащитную группу, в частности трет-бутоксикарбонил (Boc), где a, R1 и R3-6 такие, как определены для формул I или II. В одном варианте осуществления данного изобретения соединения данного изобретения можно получить снятием защитной группы соединений формулы III с получением соединений формулы I или II, или их фармацевтически приемлемой соли.
Дополнительные подробности относительно конкретных условий реакций и других методик получения типичных соединений данного изобретения или их промежуточных веществ описываются в примерах, изложенных ниже.
ПРИМЕНЕНИЕ
Соединения данного изобретения обладают ингибирующей активностью обратного захвата серотонина и норэпинефрина. Таким образом, ожидается, что данные соединения имеют терапевтическое применение в качестве комбинированных ингибиторов обратного захвата серотонина и норэпинефрина (SNRI). В одном варианте осуществления соединения данного изобретения обладают равными или приблизительно равными ингибирующими активностями обратного захвата серотонина и норэпинефрина.
Константа ингибирования (Ki) соединения представляет собой концентрацию конкурирующего лиганда в конкурентном анализе, которая занимала бы 50% транспортеров, если бы не было меченого лиганда. Значения Ki могут быть определены из исследований конкурентного связывания меченого лиганда с применением 3H-низоксетина (для транспортера норэпинефрина, NET) и 3H-циталопрама (для транспортера серотонина, SERT), как описано в анализе 1. Данные значения Ki получают из значений IC50, полученных из анализа связывания при помощи уравнения Ченга-Прусоффа и Kd меченого лиганда (Cheng & Prusoff (1973) Biochem. Pharmacol. 22(23):3099-3108). Функциональные значения IC50 можно определить из анализов функционального ингибирования обратного захвата, описанных в анализе 2. Полученные значения IC50 можно перевести в значения Ki при помощи уравнения Ченга-Прусоффа и Km трансмиттера для транспортера. Следует отметить, однако, что условия анализа обратного захвата, описанные в анализе 2, являются таковыми, что значения IC50 очень близки к значениям Ki, но математический пересчет является необходимым, поскольку концентрация нейротрансмиттера (5-HT или NE), применяемая в данном анализе, значительно ниже его Km для соответствующего транспортера.
Одним показателем сродства соединения к SERT или NET является константа ингибирования (pKi) для связывания с транспортером. Значение pKi представляет собой отрицательный логарифм по основанию 10 величины Ki. Особый интерес представляют соединения данного изобретения, имеющие pKi для SERT больше или равные около 7,5, и в одном конкретном варианте осуществления больше или равные около 7,9. Представляющие особый интерес соединения данного изобретения также включают соединения, имеющие pKi для NET больше или равные около 7,5, и в одном конкретном варианте осуществления больше или равные около 8,0. В еще одном варианте осуществления представляющие интерес соединения имеют pKi для NET, лежащие в диапазоне от 8,0 до 9,0. В еще одном варианте осуществления представляющие интерес соединения имеют pKi для SERT больше или равные около 7,9, а pKi для NET больше или равные около 8,0. В еще одном варианте осуществления представляющие интерес соединения имеют pKi для SERT и для NET больше или равные около 8,0. Данные значения можно определить по методикам, которые хорошо известны на данном уровне техники, а также по результатам анализов, описанных в контексте данного документа.
В одном варианте осуществления соединения данного изобретения показывают NET pKi≥8; соотношение SERT Ki/NET Ki в диапазоне от 0,1 до 100; SERT Ki/NET Ki в диапазоне от 0,3 до 100; SERT Ki/NET Ki в диапазоне от 0,3 до 10; или SERT Ki/NET Ki в диапазоне от 0,1 до 30. В еще одном варианте осуществления соединения данного изобретения показывают NET pKi≥9 и: соотношение SERT Ki/NET Ki в диапазоне от 0,1 до 100; SERT Ki/NET Ki в диапазоне от 0,3 до 100; SERT Ki/NET Ki в диапазоне от 0,3 до 10; или SERT Ki/NET Ki в диапазоне от 0,1 до 30.
Одним показателем ингибирования обратного захвата серотонина и норэпинефрина является значение pIC50. В одном варианте осуществления представляющие интерес соединения имеют значение pIC50 для ингибирования обратного захвата серотонина больше или равное около 7,0 и значение pIC50 для ингибирования обратного захвата норэпинефрина больше или равное около 7,0; и в еще одном варианте осуществления представляющие интерес соединения имеют значение pIC50 для ингибирования обратного захвата серотонина больше или равное около 7,5 и значение pIC50 для ингибирования обратного захвата норэпинефрина больше или равное около 7,5. В одном конкретном варианте осуществления данные соединения имеют значение pIC50 для ингибирования обратного захвата серотонина больше или равное около 8,0 и значение pIC50 для ингибирования обратного захвата норэпинефрина больше или равное около 8,0. В одном конкретном варианте осуществления соединения данного изобретения имеют соразмерные значения pIC50, т.е. имеют одинаковые значения pIC50 и для SERT, и для NET ± 0,6.
В еще одном варианте осуществления соединения данного изобретения являются селективными для ингибирования SERT и NET по сравнению с транспортером допамина (DAT). Например, в данном варианте осуществления соединениями, представляющими особый интерес, являются соединения, которые показывают связывающую способность в отношении SERT и NET, которая, по крайней мере, в 5 раз выше, чем связывающая способность для DAT, или которая, по крайней мере, в 10 раз выше, чем для DAT, или, по крайней мере, в 20 или 30 раз выше, чем для DAT. В еще одном варианте осуществления данные соединения не показывают значительного ингибирования DAT. В еще одном варианте осуществления данные соединения показывают менее чем 50% активность ингибирования DAT, измеренную при концентрации 794 нМ. В применяемых условиях анализа соединение, которое показывает ≤50% ингибирование, должно иметь оценочное значение pKi для DAT ≤6,1.
В еще одном варианте осуществления соединения данного изобретения обладают ингибирующей активностью обратного захвата допамина, так же как и SERT, и NET активностью. Например, в данном варианте осуществления соединениями, представляющими особый интерес, являются соединения, которые показывают pKi для SERT и NET больше или равные около 7,5, а pKi для DAT больше или равные около 7,0.
Следует отметить, что в некоторых случаях соединения данного изобретения могут обладать либо слабой ингибирующей активностью обратного захвата серотонина, либо слабой ингибирующей активностью обратного захвата норэпинефрина. В данных случаях специалисты в данной области техники понимают, что подобные соединения еще имеют применение, прежде всего в качестве NET ингибитора или SERT ингибитора соответственно, или будут иметь применение в качестве инструментов исследования.
Типичные анализы для определения ингибирующей активности обратного захвата серотонина и/или норэпинефрина соединений данного изобретения включают, в качестве иллюстрации, а не ограничения, анализы, которые измеряют SERT и NET связывание, например, как описано в анализе 1. Кроме того, полезно представлять себе уровень связывания и обратного захвата DAT в анализе, таком как описанный в анализе 1. Походящие вторичные анализы включают анализы обратного захвата нейротрансмиттеров для измерения конкурентного ингибирования обратного захвата серотонина и норэпинефрина в клетках, экспрессирующих соответствующий человеческий или крысиный рекомбинантный транспортер (hSERT, hNET или hDAT), описанные в анализе 2, и ex vivo анализы связывания меченого лиганда и обратного захвата нейротрансмиттера, которые применяются для определения in vivo степени заполнения SERT, NET и DAT в ткани, описанные в анализе 3. Другие анализы, которые применяются для оценки фармакологических свойств исследуемых соединений, включают анализы, перечисленные в анализе 4. Типичные in vivo анализы включают формалиновый тест, описанный в анализе 5, который представляет собой надежный прогностический фактор клинической эффективности для лечения невропатической боли, и модель лигатуры спинального нерва, описанную в анализе 6. Вышеупомянутые анализы используются для определения терапевтической применимости, например активности облегчения невропатической боли, соединений данного изобретения. Другие свойства и применения соединений данного изобретения могут быть выявлены при помощи различных in vitro и in vivo анализов, хорошо известных специалистам в данной области техники.
Ожидается, что соединения данного изобретения будут применимы для лечения и/или предотвращения патологических состояний, которые непосредственно связаны с регуляцией функционирования транспортера моноаминов, в частности таких показаний, которые опосредованы или чувствительны к ингибированию обратного захвата серотонина и норэпинефрина. Таким образом, ожидается, что пациентов, страдающих от заболевания или нарушения, которое лечится ингибированием транспортера серотонина и/или норэпинефрина, можно лечить введением терапевтически эффективного количества ингибитора обратного захвата серотонина и норэпинефрина данного изобретения. Подобные патологические состояния включают, в качестве примера, нарушения, сопровождаемые болью, такие как невропатическая боль, фибромиалгия и хроническая боль; депрессивные расстройства, такие как большая депрессия; аффективные расстройства, такие как тревожное расстройство; синдром гиперактивности с дефицитом внимания; когнитивные расстройства, такие как деменция; недержание мочи при напряжении; хроническая боль в спине; и остеоартрит.
Количество активного агента, вводимого в одну дозу, или общее количество, вводимое в день, может быть определено заранее или его можно определить для индивидуального пациента, принимая во внимание многочисленные факторы, в том числе природу и тяжесть состояния пациента, состояние, которое нужно лечить, возраст, вес и общее состояние здоровья пациента, переносимость пациентом активного агента, путь введения, фармакологические аспекты, такие как активность, эффективность, фармакокинетика и токсикологические профили активного агента и любых вторичных агентов, которые вводятся, и тому подобное. Лечение пациента, страдающего от заболевания или патологического состояния (такого как невропатическая боль), можно начинать с заранее определенной дозировки или дозировки, определенной лечащим врачом, и продолжать в течение периода времени, необходимого для предотвращения, улучшения состояния, подавления или облегчения симптомов заболевания или патологического состояния. Пациентов, подвергаемых подобному лечению, обычно контролируют на постоянной основе с целью определения эффективности терапии. Например, при лечении невропатической боли измерение эффективности лечения может включать оценку качества жизни пациента, например улучшений характеристик сна пациента, посещаемости работы, способности к физическим нагрузкам и прохождению лечения на амбулаторном режиме, и т.д. Шкалы боли, относительно некоторой базисной точки, также можно применять для облегчения оценки уровня боли пациента. Индикаторы других заболеваний и состояний, описанные в контексте данного документа, хорошо известны специалистам в данной области техники и легко доступны лечащему врачу. Постоянное наблюдение врача будет обеспечивать то, что оптимальное количество активного агента будет введено в любой момент времени, а также облегчение определения продолжительности лечения. Частным случаем является ситуация, когда вводятся также вторичные агенты, так как их выбор, дозировка и продолжительность приема могут также потребовать регулирования. Таким образом, режим лечения и режим дозирования могут регулироваться в курсе терапии таким образом, чтобы вводить минимальное количество активного агента, которое проявляет желаемую эффективность, и, кроме того, чтобы введение продолжалось настолько долго, насколько это необходимо для успешного лечения заболевания или патологического состояния.
Нарушения, сопровождающиеся болью
Было показано, что SNRI оказывают благоприятный эффект при боли, такой как болезненная диабетическая невропатия (дулоксетин, Goldstein et al. (2005) Pain 116:109-118; венлафаксин, Rowbotham et al. (2004) Pain 110:697-706), фибромиалгия (дулоксетин, Russell et al. (2008) Pain 136(3):432-444; милнаципран, Vitton et al. (2004) Human Psychopharmacology 19:S27-S35), и гемикрания (венлафаксин, Ozyalcin et al. (2005) Headache 45(2):144-152). Таким образом, один вариант осуществления данного изобретения относится к способу лечения нарушения, сопровождающегося болью, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения. Обычно терапевтически эффективным количеством будет такое количество, которое является достаточным для облегчения боли. Типичные нарушения, сопровождающиеся болью, включают, в качестве иллюстрации, острую боль, постоянную боль, хроническую боль, воспалительную боль и невропатическую боль. Более конкретно, нарушения, сопровождающиеся болью, включают боль, связанную с или вызванную артритом; болью в спине, в том числе хронической поясничной болью; раком, в том числе болью, опосредованной опухолью (например, боль в костях, головная боль, лицевая боль или висцеральная боль) и болью, связанной с противораковой терапией (например, болевой синдром после химиотерапии, хронический послеоперационный болевой синдром и болевой синдром после облучения); туннельным синдромом запястья; фибромиалгией; головными болями, в том числе хроническими тензионными головными болями; воспалением, связанным с полимиалгией, ревматоидным артритом и остеоартритом; гемикранией; невропатической болью, в том числе рефлекторной симпатической дистрофией; совокупной болью; послеоперационной болью; болью в плече; таламическим синдромом, в том числе постинсультной болью, и болью, связанной с повреждениями спинного мозга и множественным склерозом; фантомными болями в ампутированных конечностях; болью, связанной с болезнью Паркинсона; и висцеральной болью (например, раздражающий кишечный синдром). Особый интерес представляет лечение невропатической боли, которая включает диабетическую периферическую невропатию (ДПН), невропатию, опосредованную ВИЧ, постгерпетическую невралгию (ПГН) и периферическую невропатия, вызванную химиотерпией. При применении для лечения нарушений, сопровождающихся болью, такой как невропатическая боль, соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе противосудорожными средствами, антидепрессантами, миорелаксантами, НПВС, опиоидными агонистами, опиоидными антагонистами, селективными ингибиторами обратного захвата серотонина, блокаторами натриевых каналов и симпатолитиками. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Депрессивные расстройства
Еще один вариант осуществления данного изобретения относится к способу лечения депрессивного расстройства, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения. Обычно терапевтически эффективным количеством будет такое количество, которое является достаточным для облегчения депрессии и обеспечения ощущения хорошего самочувствия. Типичные депрессивные расстройства включают, в качестве иллюстрации, а не ограничения, депрессию, связанную с болезнью Альцгеймера, биполярным аффективным расстройством, раком, насилием над ребенком, бесплодием, болезнью Паркинсона, постинфарктным синдромом и психозом; дистимию; синдром сварливого или раздражительного старика; индуцированную депрессию; большую депрессию; детскую депрессию; постклимактерическую депрессию; послеродовую депрессию; рецидивирующую депрессию; однократную депрессию и субсиндромальную симптоматическую депрессию. Особый интерес представляет лечение большой депрессии. При применении для лечения депрессивных расстройств соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе антидепрессантами и двойными ингибиторами серотонин-норэпинефринового обратного захвата. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Аффективные расстройства
Еще один вариант осуществления данного изобретения относится к способу лечения аффективных расстройств, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения. Типичные аффективные расстройства включают, в качестве иллюстрации, а не ограничения, тревожные расстройства, такие как общее тревожное расстройство; личностное расстройство избегания; расстройства приема пищи, такие как нервная анорексия, нейрогенная булимия и ожирение; обсессивно-компульсивное расстройство; панический синдром; расстройства личности, такие как личностное расстройство избегания и синдром гиперактивности с дефицитом внимания (ADHD); синдром посттравматического стресса; фобии, такие как агорафобия, а также простые и другие специфические фобии и социофобия; предменструальный синдром; психотические расстройства, такие как шизофрения и мания; сезонное аффективное расстройство; половую дисфункцию, в том числе преждевременную эякуляцию, мужскую импотенцию и женскую половую дисфункцию, такую как нарушение женского полового возбуждения; социальное тревожное расстройство и расстройства, связанные со злоупотреблением психоактивными веществами, в том числе химические зависимости, такие как привыкание к алкоголю, бензодиазепинам, кокаину, героину, никотину и фенобарбиталу, а также синдромы отмены, которые могут вызываться данными зависимостями. При применении для лечения аффективных расстройств соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе антидепрессантами. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Атомоксетин, который является в 10 раз более NET селективным, одобрен для терапии синдрома гиперактивности с дефицитом внимания (ADHD), и клинические исследования показали, что SNRI, венлафаксин, также может оказывать благоприятный эффект при лечении ADHD (Mukaddes et al. (2002) Eur. Neuropsychopharm. 12(Supp 3):421). Таким образом, ожидается, что соединения данного изобретения также будут применяться в способах лечения синдрома гиперактивности с дефицитом внимания введением пациенту терапевтически эффективного количества соединения данного изобретения. При применении для лечения депрессии соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе антидепрессантами. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Когнитивные расстройства
Еще один вариант данного изобретения относится к способу лечения когнитивного расстройства, включающему введение пациенту терапевтически эффективного количество соединения данного изобретения. Типичные когнитивные расстройства включают, в качестве иллюстрации, а не ограничения, деменцию, которая включает дегенеративную деменцию (например, болезнь Альцгеймера, болезнь Крейтцфельда-Якоба, хорея Хантингтона, болезнь Паркинсона, болезнь Пика и сенильная деменция), сосудистую деменцию (например, мультиинфарктная деменция) и деменцию, связанную с поражениями, занимающими интракраниальное пространство, травмой, инфекциями и сопутствующими состояниями (в том числе ВИЧ-инфекция), метаболизмом, токсинами, аноксией и недостатком витаминов; и умеренные когнитивные нарушения, связанные со старением, такие как возрастное нарушение памяти, амнезическое нарушение и возрастное снижение когнитивных способностей. При применении для лечения когнитивных расстройств соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе агентами против болезни Альцгеймера и агентами против болезни Паркинсона. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Другие нарушения
Также было показано, что SNRI являются эффективными при лечении недержания мочи при напряжении (Dmochowski (2003) Journal of Urology 170(4): 1259-1263). Таким образом, еще один вариант осуществления данного изобретения относится к способу лечения недержания мочи при напряжении, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения. При применении для лечения недержания мочи при напряжении соединения данного изобретения можно вводить в комбинации с другими терапевтическими агентами, в том числе противосудорожными средствами. Типичные соединения, попадающие в рамки данных классов, описываются в контексте данного документа.
Дулоксетин, SNRI, подвергается клиническим испытаниям для оценки его эффективности при лечении синдрома хронического переутомления, и недавно было показано, что он является эффективным при лечении фибромиалгии (Russell et al. (2008) Pain 136(3):432-444). Ожидается, что соединения данного изобретения благодаря их способности ингибировать SERT и NET также будут иметь подобное применение, и еще один вариант осуществления данного изобретения относится к способу лечения синдрома хронического переутомления, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения.
Было показано, что сибутрамин, ингибитор обратного захвата норэпинефрина и допамина, можно применять при лечении ожирения (Wirth et al. (2001) JAMA 286(11):1331-1339). Ожидается, что соединения данного изобретения благодаря их способности ингибировать NET также будут иметь подобное применение, и еще один вариант осуществления данного изобретения относится к способу лечения ожирения, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения.
Было показано, что десвенлафаксин, SNRI, облегчает вазомоторные симптомы, связанные с менопаузой (Deecher et al. (2007) Endocrinology 148(3):1376-1383). Ожидается, что соединения данного изобретения благодаря их способности ингибировать SERT и NET также будут иметь подобное применение, и еще один вариант осуществления данного изобретения относится к способу лечения вазомоторных симптомов, связанных с менопаузой, включающему введение пациенту терапевтически эффективного количества соединения данного изобретения.
Инструменты исследования
Поскольку соединения данного изобретения обладают как ингибирующей активностью обратного захвата серотонина, так и ингибирующей активностью обратного захвата норэпинефрина, то подобные соединения можно также применять в качестве инструментов исследования для испытания или изучения биологических систем или образцов, содержащих серотониновые или норэпинефриновые транспортеры. Любая подходящая биологическая система или образец, содержащий серотониновые и/или норэпинефриновые транспортеры, может применяться в подобных исследованиях, которые можно проводить либо in vitro, либо in vivo. Типичные биологические системы или образцы, подходящие для подобных исследований, включают, но не ограничиваются, клетки, клеточные экстракты, плазматические мембраны, образцы ткани, выделенные органы, млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи, люди и так далее), и тому подобное, при этом млекопитающие представляют особый интерес. В одном конкретном варианте осуществления данного изобретения у млекопитающего ингибируется введением ингибирующего обратный захват серотонина количеством соединения данного изобретения. В другом конкретном варианте осуществления, обратный захват норэпинефрина у млекопитающего ингибируется введением ингибирующего обратный захват норэпинефрина количества соединения данного изобретения. Соединения данного изобретения также можно применять в качестве инструментов исследования при проведении биологических анализов с применением подобных соединений.
При применении в качестве инструмента исследования биологическая система или образец, содержащий серотониновый транспортер и/или норэпинефриновый транспортер, обычно контактирует с ингибирующим обратный захват серотонина или ингибирующим обратный захват норэпинефрина количеством соединения данного изобретения. После того как биологическая система или образец подвергается действию данного соединения, эффекты ингибирования обратного захвата серотонина и/или обратного захвата норэпинефрина определяют при помощи общепринятых процедур и оборудования. Действие заключает в себе контактирование клеток или ткани с данным соединением, введение соединения млекопитающему, например и.п. или в.в. способом введения, и так далее. Стадия определения может включать измерение ответа, т.е. количественный анализ, или может включать наблюдение, т.е. качественный анализ. Измерение ответа включает, например, определение эффектов данного соединения на биологическую систему или образец при помощи общепринятых процедур и оборудования, таких как анализы обратного захвата серотонина и норэпинефрина. Результаты анализа можно применять для определения уровня активности, а также количества соединения, необходимого для достижения желаемого результата, т.е. ингибирующего обратный захват серотонина и ингибирующего обратный захват норэпинефрина количества.
Кроме того, соединения данного изобретения можно применять в качестве инструментов исследования для оценки других химических соединений, и, таким образом, можно также применять в скрининговых исследованиях для открытия, например, новых соединений, обладающих как ингибирующей активностью обратного захвата серотонина, так и ингибирующей активностью обратного захвата норэпинефрина. Таким образом, соединения данного изобретения применяются в качестве стандартов в анализе для сравнения результатов, полученных с исследуемым соединением и с соединениями данного изобретения, с целью идентификации данных исследуемых соединений, которые обладают приблизительно равной или превосходящей ингибирующей активностью обратного захвата, если она существует. Например, данные по обратному захвату для исследуемого соединения или группы исследуемых соединений сравниваются с данными по обратному захвату для соединения данного изобретения с целью идентифицировать данные исследуемые соединения, которые обладают желаемыми свойствами, например исследуемые соединения, обладающие ингибирующей активностью обратного захвата приблизительно равной или превосходящей соединение данного изобретения, если она существует. Данный аспект изобретения включает в качестве отдельных вариантов осуществления как получение данных для сравнения (с применением соответствующих анализов), так и анализ данных исследования для идентификации представляющих интерес исследуемых соединений. Таким образом, исследуемое соединение можно оценить в биологическом анализе способом, включающим стадии: (a) проведение биологического анализа исследуемого соединения с получением первого результата анализа; (b) проведение биологического анализа соединения данного изобретения с получением второго результата анализа; причем стадия (a) проводится либо до, либо после, либо одновременно со стадией (b); и (c) сравнение первого результата анализа из стадии (a) со вторым результатом анализа из стадии (b). Типичные биологические анализы включают анализы обратного захвата серотонина и норэпинефрина.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СОСТАВЫ
Соединения данного изобретения обычно вводят пациенту в виде фармацевтической композиции или состава. Подобные фармацевтические композиции можно вводить пациенту любым приемлемым способом введения, в том числе, но не ограничиваясь, пероральным, ректальным, вагинальным, назальным, ингаляционным, местным (в том числе трансдермальным) и парентеральным способами введения. Кроме того, соединения данного изобретения можно вводить, например, перорально, многократным приемом в день (например, дважды, или три раза, или четыре раза в день), в однократный суточный прием, в два приема в день, в однократный недельный прием и так далее. Следует понимать, что любую форму соединения данного изобретения (т.е. свободное основание, фармацевтически приемлемая соль, сольват и т.д.), которая является подходящей для конкретного способа введения, можно применять в фармацевтических композициях, обсуждаемых в контексте данного документа.
Таким образом, в одном варианте осуществления данное изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение данного изобретения. Данные композиции могут содержать другие терапевтические и/или формулирующие агенты, при необходимости. При обсуждении композиции "соединение данного изобретения" может также быть названо в контексте данного документа "активный агент", чтобы отличить его от других компонентов данного состава, таких как носитель. Таким образом, понятно, что понятие "активный агент" включает соединения формулы I, а также фармацевтически приемлемые соли и сольваты данного соединения.
Фармацевтические композиции данного изобретения обычно содержат терапевтически эффективное количество соединения данного изобретения. Специалисты в данной области техники понимают, однако, что фармацевтическая композиция может содержать больше чем терапевтически эффективное количество, т.е. валовые композиции, или меньше чем терапевтически эффективное количество, т.е. отдельные однократные дозы, предназначенные для множественного введения с целью достижения терапевтически эффективного количества. Обычно композиция содержит от около 0,01-95% по массе активного агента, в том числе от около 0,01-30% по массе, также, например, от около 0,01-10% по массе, при этом действительное количество зависит от самого состава, способа введения, частоты дозирования и так далее. В одном варианте осуществления композиция, подходящая для пероральной лекарственной формы, например, может содержать около 5-70% по массе или от около 10-60% по массе активного агента. В одном типичном варианте осуществления фармацевтическая композиция содержит от около 1 до 20 мг активного агента, в том числе от около 1 до 15 мг активного агента и от около 1 до 10 мг активного агента. В еще одном типичном варианте осуществления фармацевтическая композиция содержит от около 5 до 20 мг активного агента, в том числе от около 7,5 до 15 мг активного агента. Например, активный агент может быть сформулирован в 1 мг и 10 мг однократные дозы.
Любой общепринятый носитель или вспомогательное вещество можно применять в фармацевтических композициях данного изобретения. Выбор конкретного носителя или вспомогательного вещества, или комбинаций носителей или вспомогательных веществ, будет зависеть от способа введения, который будет применяться для лечения конкретного пациента, или типа патологического состояния, или стадии заболевания. В этой связи получение подходящей композиции для конкретного способа введения полностью попадает в рамки компетенции специалистов в фармацевтической области техники. Кроме того, носители или вспомогательные вещества, применяемые в подобных композициях, являются коммерчески доступными. В качестве дополнительной иллюстрации, общепринятые методики формулирования описываются в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и H. C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Типичные примеры веществ, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, перечисленные ниже: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные вещества, такие как масло какао и суппозиторные воски; масла, такие как ореховое масло, хлопковое масло, сафлоровое масло, сезамовое масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; сжатые газы-пропелленты, такие как хлорфторуглероды и гидрофторуглероды; и другие нетоксические совместимые вещества, применяемые в фармацевтических композициях.
Фармацевтические композиции обычно получают тщательным и глубоким перемешиванием или измельчением активного агента с фармацевтически приемлемым носителем и одним или более необязательными ингредиентами. Затем данной однородно измельченной смеси можно придать форму или заполнить в таблетки, капсулы пилюли, коробки, картриджи, распылительные флаконы, и тому подобное, при помощи общепринятых процедур и оборудования.
В одном варианте осуществления фармацевтические композиции являются подходящими для перорального введения. Один типичный режим дозирования должен быть пероральной лекарственной формой, вводимой один или два раза в день. Подходящие композиции для перорального введения могут существовать в форме капсул, таблеток, пилюль, пастилок, саше, драже, порошков, гранул; растворов или суспензий в водной или неводной жидкости; жидких эмульсий типа «масло в воде» или «вода в масле»; эликсиров или сиропов; и тому подобное; при этом каждая содержит заранее определенное количество активного агента.
Если композиция предназначена для перорального введения в виде твердой лекарственной формы (т.е. в виде капсул, таблеток, пилюль и тому подобное), то она будет обычно содержать активный агент и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Твердые лекарственные формы могут также содержать наполнители или расширители, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит, и/или кремниевая кислота; связующие вещества, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; смачивающие средства, такие как глицерин; разрыхляющие агенты, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты, и/или карбонат натрия; удерживающие раствор агенты, такие как парафин; ускорители впитывания, такие как соединения четвертичного аммония; смачивающие агенты, такие как цетиловый спирт и/или моностеарат глицерина; абсорбенты, такие как каолиновая и/или бентонитовая глина; лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и/или их смеси; окрашивающие добавки; и буферные вещества.
Регуляторы скорости высвобождения, смачивающие агенты, покровные вещества, подсластители, вкусовые и ароматизирующие добавки, консерванты и антиоксиданты также могут присутствовать в фармацевтических композициях. Типичные покровные вещества для таблеток, капсул, пилюль и тому подобное включают вещества, применяемые для энтеросолюбильного покрытия, такие как фталат ацетата целлюлозы, фталат поливинилацетата, фталат гидроксипропилметилцеллюлозы, сополимеры метакриловой кислоты и эфира метакриловой кислоты, тримеллитат ацетата целлюлозы, карбоксиметилэтилцеллюлоза, сукцинат ацетата гидроксипропилметилцеллюлозы, и тому подобное. Примеры фармацевтически приемлемых антиоксидантов включают водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфат натрия, сульфит натрия, и тому подобное; маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол, и тому подобное; и металл-хелатирующие добавки, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, винная кислота, фосфорная кислота и тому подобное.
Композиции также могут быть сформулированы с целью обеспечения медленного или контролируемого высвобождения активного агента при помощи, например, гидроксипропилметилцеллюлозы в различных пропорциях или других полимерных матриц, липосом и/или микросфер. Кроме того, фармацевтические композиции данного изобретения могут содержать опалесцирующие компоненты и могут быть сформулированы таким образом, что они высвобождают активный агент только, или предпочтительно, в определенной части желудочно-кишечного тракта, необязательно замедленного характера. Примеры заключающих в себе компонентов, которые можно применять, включают полимерные вещества и воски. Активный агент также может быть в микроинкапсулированной форме, при необходимости, с одним или более из описанных выше вспомогательных веществ.
Подходящие жидкие лекарственные формы для перорального введения включают, в качестве иллюстрации, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы обычно содержат активный агент и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и жирнокислотные эфиры сорбитана, и их смеси. Суспензии могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые эфиры, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакантовую камедь, и их смеси.
Фармацевтические композиции данного изобретения, предназначенные для перорального введения, могут быть сформулированы в стандартную лекарственную форму. Понятие "стандартная лекарственная форма" относится к физически дискретной единице, подходящей для дозирования пациента, т.е. каждая единица содержит предварительно определенное количество активного агента, рассчитанное с целью получить желаемый терапевтический эффект либо отдельно, либо в комбинации с одной или более дополнительными единицами. Например, подобные стандартные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и тому подобное.
В еще одном варианте осуществления композиции данного изобретения являются подходящими для ингаляционного введения и обычно существуют в форме аэрозоля или порошка. Подобные композиции обычно вводятся при помощи хорошо известных подающих устройств, таких как небулайзер, ингалятор сухого порошка или дозирующий ингалятор. Небулайзеры производят струю с высокой скоростью вылета, что приводит к тому, что композиция распыляется в виде тумана, который вводится в дыхательные пути пациента. Типичный состав для небулайзера содержит активный агент, растворенный в носителе с образованием раствора, или измельченный и объединенный с носителем с образованием суспензии измельченных частиц пригодного для вдыхания размера. Ингаляторы сухого порошка вводят активный агент в виде порошка в сыпучем состоянии, который диспергируется в струе воздуха пациента в процессе вдыхания. Типичный состав сухого порошка содержит активный агент в сухой смеси со вспомогательным веществом, таким как лактоза, крахмал, маннит, декстроза, полимолочная кислота, полилактид-когликолид, и их комбинации. Дозирующие ингаляторы высвобождают отмеренное количество активного агента при помощи сжатого газа-пропеллента. Типичный состав для дозирующего ингалятора содержит раствор или суспензию активного агента в сжиженном пропелленте, таком как хлорфторуглерод или гидрофторалкан. Необязательные компоненты таких составов включают вспомогательные растворители, такие как этанол или пентан, и поверхностно-активные вещества, такие как сорбитантриолеат, олеиновая кислота, лецитин и глицерин. Подобные композиции обычно получают добавлением охлажденного или сжатого гидрофторалкана в подходящий контейнер, содержащий активный агент, этанол (если есть) и поверхностно-активное вещество (если есть). Для получения суспензии активный агент измельчается и затем объединяется с пропеллентом. В качестве альтернативы, суспензионный состав можно получить распылительной сушкой покрытия из поверхностно-активного вещества на измельченных частицах активного агента. Затем полученный состав заполняют в аэрозольный баллон, который формирует порцию ингалятора.
Соединения данного изобретения можно также вводить парентерально (например, подкожной, внутривенной, внутримышечной или интраперитонеальной инъекцией). Активный агент для подобного введения обеспечивается в виде стерильного раствора, суспензии или эмульсии. Типичные растворители для получения подобных составов включают воду, солевой раствор, низкомолекулярные спирты, такие как пропиленгликоль, полиэтиленгликоль, масла, желатин, эфиры жирных кислот, такие как этилолеат и тому подобное. Обычный парентеральный состав представляет собой стерильный водный раствор, pH 4-7, активного агента. Парентеральные составы могут также содержать один или более солюбилизаторов, стабилизаторов, консервантов, смачивающих веществ, эмульгаторов и диспергирующих агентов. Данные составы могут быть сделаны стерильными применением стерильной среды для инъекций, стерилизующего агента, фильтрованием, облучением или нагреванием.
Соединения данного изобретения можно также вводить трансдермально при помощи известных трансдермальных систем доставки и вспомогательных веществ. Например, соединение можно смешать с интенсификаторами проникновения, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны, и тому подобное, и заключить в пластырь или подобную систему доставки. Дополнительные вспомогательные вещества, в том числе гелеобразующие агенты, эмульгаторы и буферные вещества, можно применять в подобных трансдермальных композициях, при необходимости.
При необходимости, соединения данного изобретения можно вводить в комбинации с одним или более другими терапевтическими агентами. Таким образом, в одном варианте осуществления композиции данного изобретения могут необязательно содержать другие лекарственные средства, которые вводятся совместно с соединением данного изобретения. Например, композиция может дополнительно содержать одно или более лекарственных средств (также называемых "вторичными агентами"), выбранных из группы агентов против болезни Альцгеймера, противосудорожных средств (антиконвульсантов), антидепрессантов, агентов против болезни Паркинсона, двойных ингибиторов серотонин-норэпинефринового обратного захвата (SNRI), нестероидных противовоспалительных средств (НПВС), ингибиторов обратного захвата норэпинефрина, опиоидных агонистов (опиоидных анальгетиков), опиоидных антагонистов, селективных ингибиторов обратного захвата серотонина, блокаторов натриевых каналов, симпатолитиков и их комбинаций. Многочисленные примеры подобных терапевтических агентов хорошо известны в данной области техники, и примеры описываются в контексте данного документа. Комбинированием соединения данного изобретения с вторичным агентом можно осуществлять тройную терапию, т.е. ингибирующую активность обратного захвата серотонина, ингибирующую активность обратного захвата норэпинефрина и активность, связанную с вторичным агентом (например, активность антидепрессанта), при помощи только двух активных компонентов. Так как фармацевтические композиции, содержащие два активных компонента, обычно легче формулировать, чем композиции, содержащие три активных компонента, то подобные двухкомпонентные композиции имеют значительное преимущество перед композициями, содержащими три активных компонента. Таким образом, в еще одном аспекте данного изобретения фармацевтическая композиция содержит соединение данного изобретения, второй активный агент и фармацевтически приемлемый носитель. Третий, четвертый и т.д. активные агенты также могут быть включены в данную композицию. В комбинированной терапии количество соединения данного изобретения, которое вводится, а также количество вторичных агентов может быть меньше, чем количество, обычно вводимое при монотерапии.
Соединение данного изобретения можно либо физически смешать со вторым активным агентом с образованием композиции, содержащей оба агента; либо каждый агент может существовать в отдельных и индивидуальных композициях, которые вводятся пациенту одновременно или последовательно. Например, соединение данного изобретения можно комбинировать со вторым активным агентом при помощи общепринятых процедур и оборудования с образованием комбинации активных агентов, содержащей соединение данного изобретения и второй активный агент. Кроме того, активные агенты можно комбинировать с фармацевтически приемлемым носителем с образованием фармацевтической композиции, содержащей соединение данного изобретения, второй активный агент и фармацевтически приемлемый носитель. В данном варианте осуществления компоненты композиции обычно смешивают или измельчают для получения физической смеси. Затем физическую смесь вводят в терапевтически эффективном количестве любым из способов, описанных в контексте данного документа.
В качестве альтернативы, активные агенты могут оставаться отдельными и индивидуальными до введения пациенту. В данном варианте осуществления агенты физически не смешиваются вместе до введения, вводятся одновременно или в разное время в виде отдельных композиций. Подобные композиции могут быть упакованы отдельно или вместе в наборе. При введении в разное время вторичный агент обычно вводят менее чем через 24 часа после введения соединения данного изобретения, варьируя от одновременного с введением соединения данного изобретения до около 24 часов после введения соединения данного изобретения. То же относится к последовательному введению. Таким образом, соединение данного изобретения можно вводить перорально одновременно или последовательно с другим активным агентом двумя таблетками, одна таблетка для каждого активного агента, при этом последовательное введение может означать немедленное введение после введения соединения данного изобретения или через некоторое заранее определенное время после (например, через один час или через три часа). В качестве альтернативы, комбинацию можно вводить различными способами введения, т.е. одну перорально, а другую ингаляцией.
В одном варианте осуществления набор содержит первую лекарственную форму, содержащую соединение данного изобретения и, по крайней мере, одну дополнительную лекарственную форму, содержащую один или более вторичных агентов, изложенных в контексте данного документа, в количествах, достаточных для осуществления способов данного изобретения. Первая лекарственная форма и вторая (или третья, и т.д.) лекарственная форма вместе включают терапевтически эффективное количество активных агентов для лечения или профилактики заболевания или патологического состояния у пациента.
Вторичные агент(ы), если таковые включены, присутствуют в терапевтически эффективном количестве, т.е. обычно вводятся в количестве, которое производит благоприятный терапевтический эффект при совместном введении с соединением данного изобретения. Вторичный агент может быть в форме фармацевтически приемлемой соли, сольвата, оптически чистого стереоизомера, и так далее. Таким образом, подразумевается, что вторичные агенты, перечисленные ниже, включают все подобные формы и являются коммерчески доступными или их можно получить при помощи общепринятых методик и реагентов.
Типичные агенты против болезни Альцгеймера включают, но не ограничиваются, донепезил, галантамин, мемантин, ривастигмин, селегилин, такрин и их комбинации.
Типичные противосудорожные средства (антиконвульсанты) включают, но не ограничиваются, ацетазоламид, альбутоин, 4-амино-3-гидроксимасляную кислоту, бекламид, карбамазепин, цинромид, клометиазол, клоназепам, диазепам, диметадион, этеробарб, этадион, этосуксимид, этотоин, фелбамат, фосфенитоин, габапентин, лакозамид, ламотриджин, лоразепам, бромид магния, сульфат магния, мефенитоин, мефобарбитал, метсуксимид, мидазолам, нитразепам, оксазепам, окскарбазепин, параметадион, фенацетилмочевину, фенетурид, фенобарбитал, фенсуксимид, фенитоин, бромид калия, прегабалин, примидон, прогабид, бромид натрия, вальпроат натрия, султиам, тиагабин, топирамат, триметадион, вальпроевую кислоту, вальпромид, вигабатрин, зонизамид и их комбинации. В конкретном варианте осуществления антиконвульсант выбирают из карбамазепина, габапентина, прегабалина и их комбинаций.
Типичные антидепрессанты включают, но не ограничиваются, адиназолам, амитриптилин, кломипрамин, дезипрамин, дотиепин (например, дотиепина гидрохлорид), доксепин, имипрамин, лофепрамин, миртазапин, нортриптилин, протриптилин, тримипрамин, венлафаксин, зимелидин и их комбинации.
Типичные агенты против болезни Паркинсона включают, но не ограничиваются, амантадин, апоморфин, бензатропин, бромокриптин, карбидопу, дифенгидрамин, энтакапон, леводопу, перголид, прамипексол, ропинирол, селегилин, толкапон, тригексифенидил и их комбинации.
Типичные двойные ингибиторы серотонин-норэпинефринового обратного захвата (SNRI) включают, но не ограничиваются, бицифадин, десвенлафаксин, дулоксетин, милнаципран, нефазодон, венлафаксин и их комбинации.
Типичный нестероидные противовоспалительные средства (НПВС) включают, но не ограничиваются, ацеметацин, ацетаминофен, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, амиприлозу, амоксиприн, аниролак, апазон, азапропазон, бенорилат, беноксапрофен, безпиперилон, броперамол, буклоксовую кислоту, карпрофен, клиданак, диклофенак, дифлунизал, дифталон, эноликам, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклозовую кислоту, фенопрофен, фентиазак, фепразон, флуфенамовую кислоту, флуфенизал, флупрофен, флурбипрофен, фурофенак, ибуфенак, ибупрофен, индометацин, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лофемизол, лорноксикам, меклофенамат, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, мезаламин, миропрофен, мофебутазон, набуметон, напроксен, нифлумовую кислоту, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, окспинак, оксифенбутазон, фенилбутазон, пироксикам, пирпрофен, пранопрофен, салсалат, судоксикам, сульфасалазин, сулиндак, супрофен, теноксикам, тиопинак, тиапрофеновую кислоту, тиоксапрофен, толфенамовую кислоту, толметин, трифлумидат, зидометацин, зомепирак и их комбинации. В конкретном варианте осуществления НПВС выбирают из этодолака, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, мелоксикама, напроксена, оксапрозина, пироксикама и их комбинаций. В конкретном варианте осуществления НПВС выбирают из ибупрофена, индометацина, набуметона, напроксена (например, напроксена натрия) и их комбинаций.
Типичные миорелаксанты включают, но не ограничиваются, карисопродол, хлорзоксазон, циклобензаприн, дифлунизал, метаксалон, метокарбамол и их комбинации.
Типичные ингибиторы обратного захвата норэпинефрина включают, но не ограничиваются, атомоксетин, бупроприон и бупроприоновый метаболит гидроксибупроприон, мапротилин, ребоксетин (например, (S,S-ребоксетин)), вилоксазин и их комбинации. В конкретном варианте осуществления ингибитор обратного захвата норэпинефрина выбирают из атомоксетина, ребоксетина и их комбинаций.
Типичные опиоидные агонисты (опиоидные аналгетики) и антагонисты включают, но не ограничиваются, бупренорфин, буторфанол, кодеин, дигидрокодеин, фентанил, гидрокодон, гидроморфон, леваллорфан, леворфанол, меперидин, метадон, морфин, налбуфин, налмефен, налорфин, налоксон, налтрексон, налорфин, оксикодон, оксиморфон, пентазоцин, пропоксифен, трамадол и их комбинации. В некоторых вариантах осуществления опиоидный агонист выбирают из кодеина, дигидрокодеина, гидрокодона, гидроморфона, морфина, оксикодона, оксиморфона, трамадола и их комбинаций.
Типичные селективные ингибиторы обратного захвата серотонина (SSRI) включают, но не ограничиваются, циталопрам и циталопрамовый метаболит десметилциталопрам, дапоксетин, эсциталопрам (например, оксалат эсциталопрама), флуоксетин и десметиловый метаболит флуоксетина норфлуоксетин, флувоксамин (например, малеат флувоксамина), пароксетин, сертралин и сертралиновый метаболит деметилсертралин и их комбинации. В некоторых вариантах осуществления SSRI выбирают из циталопрама, пароксетина, сертралина и их комбинаций.
Типичные блокаторы натриевых каналов включают, но не ограничиваются, карбамазепин, фосфенитоин, ламотриджин, лидокаин, мексилетин, окскарбазепин, фенитоин и их комбинации.
Типичные симпатолитики включают, но не ограничиваются, атенолол, клонидин, доксазозин, гуанетидин, гуанфацин, модафинил, фентоламин, празозин, резерпин, толазолин (например, толазолина гидрохлорид), тамсулозин и их комбинации.
Перечисленные ниже составы иллюстрируют типичные фармацевтические композиции настоящего изобретения:
Типичные твердые желатиновые капсулы для перорального введения
Соединение данного изобретения (50 г), распылительно высушенную лактозу (440 г) и стеарат магния (10 г) тщательно измельчают. Затем полученную композицию наполняют в желатиновые капсулы (500 мг композиции на капсулу).
Иначе, соединение данного изобретения (20 мг) тщательно измельчают с крахмалом (89 мг), микрокристаллической целлюлозой (89 мг) и стеаратом магния (2 мг). Затем полученную смесь пропускают через сита с размером отверстий N 45 США и заполняют в твердую желатиновую капсулу (200 мг композиции на капсулу).
Типичный состав желатиновой капсулы для перорального введения
Соединение данного изобретения (100 мг) тщательно измельчают с моноолеатом полиоксиэтиленсорбитана (50 мг) и порошком крахмала (250 мг). Затем полученную смесь заполняют в желатиновую капсулу (400 мг композиции на капсулу).
Иначе, соединение данного изобретения (40 мг) тщательно измельчают с микрокристаллической целлюлозой (Avicel PH 103; 259,2 мг) и стеаратом магния (0,8 мг). Затем полученную смесь заполняют в желатиновую капсулу (размер № 1, белая, непрозрачная) (300 мг композиции на капсулу).
Типичный состав таблеток для перорального введения
Соединение данного изобретения (10 мг), крахмал (45 мг) и микрокристаллическую целлюлозу (35 мг) пропускают через сита с размером отверстий N 20 США и тщательно перемешивают. Полученные таким образом гранулы сушат при 50-60°C и пропускают через сита с размером отверстий N 16 США. Раствор поливинилпирролидона (4 мг в виде 10% раствора в стерильной воде) смешивают с карбоксиметилкрахмалом натрия (4,5 мг), стеаратом магния (0,5 мг) и тальком (1 мг) и затем полученную смесь пропускают через сита с размером отверстий N 16 США. Затем карбоксиметилкрахмал натрия, стеарат магния и тальк добавляют к полученным гранулам. После смешивания полученную смесь прессуют на таблетировочной машине с получением таблетки массой 100 мг.
Иначе, соединение данного изобретения (250 мг) тщательно измельчают с микрокристаллической целлюлозой (400 мг), мореным диоксидом кремния (10 мг) и стеариновой кислотой (5 мг). Затем полученную смесь прессуют с получением таблеток (665 мг композиции на таблетку).
Иначе, соединение данного изобретения (400 мг) тщательно измельчают с кукурузным крахмалом (50 мг), кроскармеллозой натрия (25 мг), лактозой (120 мг) и стеаратом магния (5 мг). Затем полученную смесь прессуют с получением таблетки с насечкой (600 мг композиции на таблетку).
Типичный состав суспензия для перорального введения
Перечисленные ниже ингредиенты смешиваются с образованием суспензии, содержащей 100 мг активного агента на 10 мл суспензии:
|
Типичный инъекционный состав для введения при помощи инъекции
Соединение данного изобретения (0,2 г) перемешивают с буферным раствором 0,4 M ацетата натрия (2,0 мл). pH полученного раствора доводят до pH 4 при помощи 0,5 н. водной хлористоводородной кислоты или 0,5 н. водного гидроксида натрия, при необходимости, а затем добавляют достаточное количество воды для инъекции для получения общего объема 20 мл. Затем полученную смесь фильтруют через стерильный фильтр (0,22 микрона) для получения стерильного раствора, подходящего для введения при помощи инъекции.
Типичные композиции для введения при помощи ингаляции
Соединение данного изобретения (0,2 мг) измельчают и затем смешивают с лактозой (25 мг). Затем полученную смесь заполняют в желатиновый картридж для ингаляций. Содержимое картриджа вводят при помощи ингалятора сухого порошка, например.
Иначе, измельченное соединение данного изобретения (10 г) диспергируют в растворе, полученном растворением лецитина (0,2 г) в деминерализованной воде (200 мл). Полученную суспензию подвергают распылительной сушке, а затем измельчают до получения тонкодисперсной композиции, содержащей частицы со средним диаметром менее около 1,5 мкм. Затем тонкодисперсную композицию заполняют в картриджи дозирующего ингалятора, содержащие сжатый 1,1,1,2-тетрафторэтан в количестве, достаточном для обеспечения от около 10 мкг до около 500 мкг соединения данного изобретения в дозе при введении при помощи ингалятора.
Иначе, соединение данного изобретения (25 мг) растворяют в цитратном буферном (pH 5) изотоническом солевом растворе (125 мл). Полученную смесь перемешивают и обрабатывают ультразвуком до тех пор, пока соединение не растворится. Проверяют pH раствора и доводят, при необходимости, до pH 5 медленным добавлением водного 1 н. гидроксида натрия. Полученный раствор вводят при помощи небулайзера, который обеспечивает от около 10 мкг до около 500 мкг соединения данного изобретения на дозу.
ПРИМЕРЫ
Перечисленные ниже препараты и примеры даны для иллюстрации конкретных вариантов осуществления данного изобретения. Однако подразумевается, что данные конкретные варианты осуществления никаким образом не ограничивают объем данного изобретения, если специально не указано.
Перечисленные ниже аббревиатуры имеют следующие значения, если не указано иное, и любые другие аббревиатуры, которые применяются в контексте данного документа, и не указано, что они имеют стандартное значение:
|
Любые другие аббревиатуры применяются в контексте данного документа, но для которых не указано, что они употребляются в своем стандартном, общепринятом значении. Если не указано иное, то все вещества, такие как реагенты, исходные вещества и растворители, приобретались у коммерческих поставщиков (таких как Sigma-Aldrich, Fluka Riedel-de Haen и тому подобное) и применялись без дополнительной очистки.
Препарат 1
Трет -бутиловый эфир 4-[2-(толуол-4-сульфонилоксиметил)фенил]пиперидин-1-карбоновой кислоты
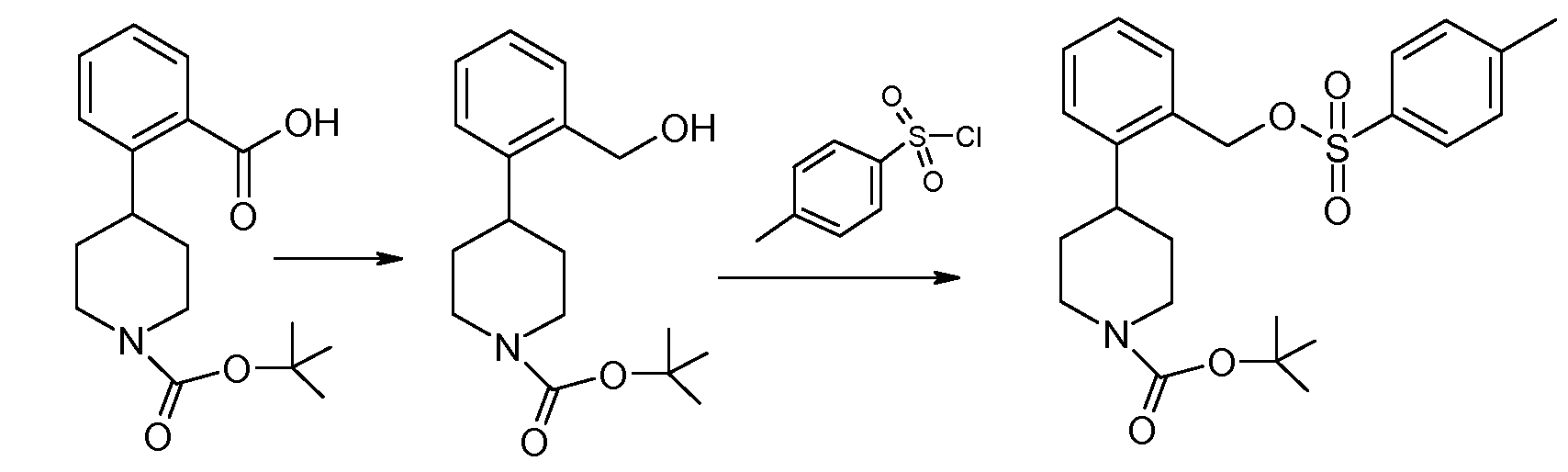
Трет-бутиловый эфир 4-(2-карбоксифенил)пиперидин-1-карбоновой кислоты (5,0 г, 16 ммоль, 1,0 экв.) и ТГФ (130 мл, 1,7 моль) объединяли при комнатной температуре в атмосфере азота. Добавляли по каплям комплекс боран-диметилсульфид (2,9 мл, 33 ммоль, 2,0 экв.) и полученную смесь перемешивали в течение 5 минут, затем нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную смесь охлаждали до комнатной температуры и реакцию гасили добавлением по каплям MeOH (40 мл), затем концентрировали выпариванием на роторном испарителе. Полученное вещество образовывало азеотропную смесь с MeOH (2×40 мл). Затем полученную смесь разбавляли EtOAc (100 мл) и промывали 1M HCl (2×50 мл), затем NaHCO3 (2×50 мл), затем насыщенным водным раствором NaCl (1×50 мл). Органический слой сушили над безводный Na2SO4, фильтровали и концентрировали в вакууме до получения трет-бутилового эфира 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (4,8 г) в виде прозрачного светло-желтого масла, которое затвердевает при стоянии.
1H ЯМР (CDCl3) δ (м.д.) 7,34-7,22 (м, 3H); 7,19 (дт, J=1,6 Гц, 7,2, 1H); 4,73 (c, 2H); 4,32-4,14 (м, 2H); 3,00 (тт, J=4,0 Гц, 12,0, 1H); 2,80 (т, J=11,6 Гц, 2H); 1,78-1,56 (м, 4H); 1,47 (м, 9H).
Трет-бутиловый эфир 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (0,4 г, 1,0 ммоль, 1,0 экв.) и триэтилендиамин (220 мг, 2,0 ммоль, 1,4 экв.) растворяли в ДХМ (11 мл, 170 ммоль). Полученную смесь охлаждали при 0°C в атмосфере азота, добавляли TsCl (290 мг, 1,5 ммоль, 1,1 экв.) и полученную смесь перемешивали при 0°C в течение еще 60 минут. Полученную смесь разбавляли EtOAc (50 мл) и промывали водой (2×25 мл). Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали выпариванием на роторном испарителе до получения соединения, указанного в заголовке (500 мг), которое применяли без дополнительной очистки.
1H ЯМР (CDCl3) δ (м.д.) 7,81 (т, J= 2,0 Гц, 1H); 7,79 (т, J= 2,0 Гц, 1H); 7,37-7,32 (м, 4H); 7,25-7,21 (м, 1H); 7,21-7,13 (м, 1H), 5,12 (c, 2H); 4,34-4,12 (м, 2H); 2,81-2,61 (м, 3H); 2,45 (c, 3H); 1,70-1,52 (м, 4H); 1,48 (c, 9H).
Препарат 2
Трет -бутиловый эфир 4-(2-метансульфонилоксиметилфенил)пиперидин-1-карбоновой кислоты
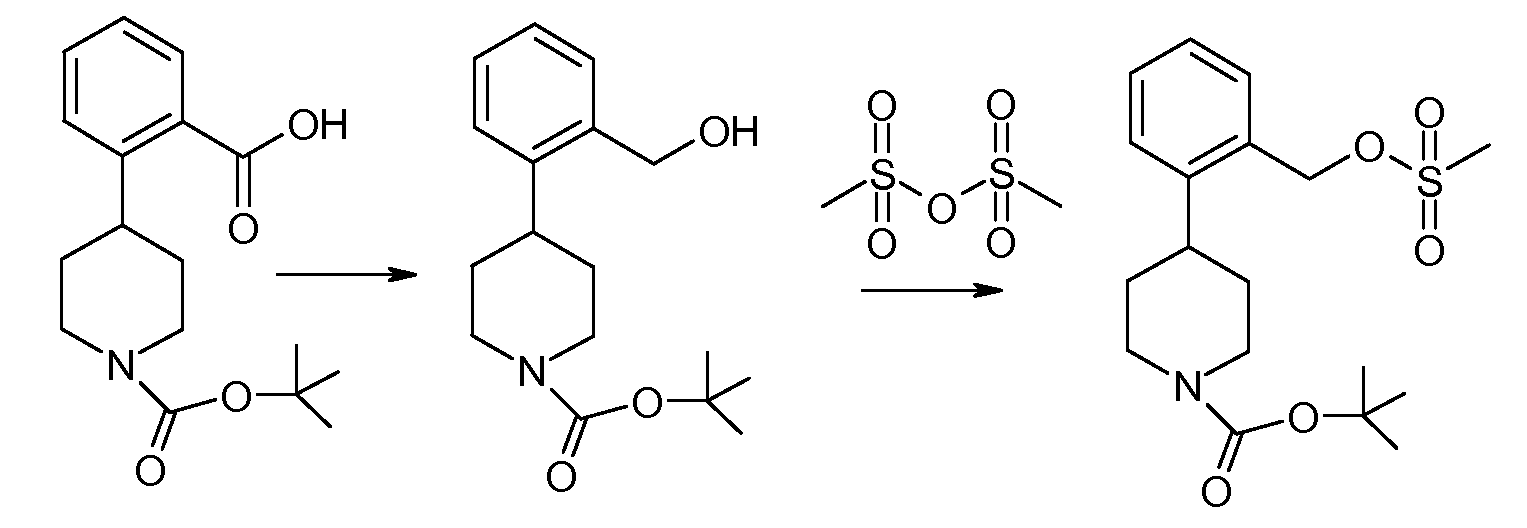
Трет-бутиловый эфир 4-(2-карбоксифенил)пиперидин-1-карбоновой кислоты (5,0 г, 160 ммоль, 1,0 экв.) и ТГФ (100 мл, 1,0 моль) объединяли при комнатной температуре в атмосфере азота. Добавляли по каплям 1,0M комплекс боран-ТГФ в ТГФ (32,7 мл, 32,7 ммоль, 2,0 экв.) в течение 10 минут (5°C экзотермический эффект, выделение газа). Полученную смесь перемешивали при комнатной температуре в течение 5 минут, затем нагревали при 50°C в течение 1 часа. Полученную смесь охлаждали до комнатной температуры и реакцию гасили медленно MeOH (30 мл) (умеренный экзотермический эффект, значительное выделение газа), затем концентрировали выпариванием на роторном испарителе. Полученное вещество образовывало азеотропную смесь с MeOH (2×50 мл). Неочищенный продукт растворяли в EtOAc (100 мл, 1 моль), промывали NaHCO3 (50 мл), затем насыщенным водным NaCl (50 мл). Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме до получения трет-бутилового эфира 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (4,4 г) в виде прозрачного светло-желтого масла, которое затвердевает при стоянии.
Трет-бутиловый эфир 4-(2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (50,0 г, 172 ммоль, 1,0 экв.) растворяли в ДХМ (500 мл, 8000 ммоль). Полученную смесь охлаждали при 0°C в атмосфере азота и добавляли метансульфоновый ангидрид (44,8 г, 257 ммоль, 1,5 экв.) одной порцией. Добавляли по каплям DIPEA (47,8 мл, 274 ммоль, 1,6 экв.) в течение 5 минут и полученную смесь перемешивали при 0°C в течение 90 минут. Добавляли воду (400 мл, 20 моль) и полученную смесь перемешивали в течение 5 минут. Фазы разделяли и органический слой промывали водой (300 мл), сушили над Na2SO4 и удаляли растворитель до получения соединение, указанного в заголовке (70 г), в виде густого масла, которое применяли без дополнительной очистки.
1H ЯМР (400 МГц, ДМСО-d6) δ (м.д.) 7,37-7,43 (м, 3H), 7,31 (д, 1H), 7,22 (м, 2H), 5,38 (c, 2H), 4,28 (м, 2H), 2,92-3,10 (м, 1H), 2,92 (c, 3H), 2,80-2,92 (м, 2H), 1,63-1,81 (м, 4H), 1,51 (c, 9H).
ПРИМЕР 1
4-[2-(2,4,6-Трифторфеноксиметил)фенил]пиперидин
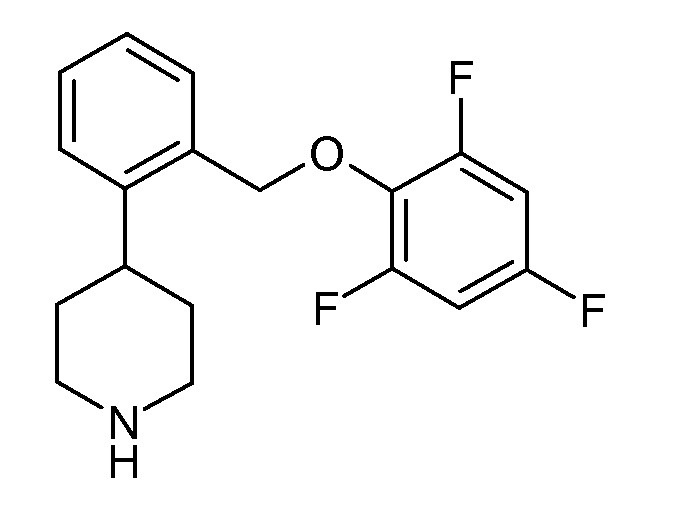
Трет-бутиловый эфир 4-[2-(толуол-4-сульфонилоксиметил)фенил]пиперидин-1-карбоновой кислоты (2,1 г, 4,7 ммоль, 1,0 экв.) растворяли в MeCN (46 мл, 890 ммоль) и добавляли к K2CO3 (1,9 г, 14 ммоль, 3,0 экв.) и 2,4,6-трифторфенолу (1,0 г, 7,0 ммоль, 1,5 экв.). Полученную смесь встряхивали при 50°C в течение ночи, затем охлаждали до комнатной температуры. Супернатант отделяли от K2CO3 и других твердых веществ. ТФК (7 мл, 90 ммоль, 20,0 экв.) добавляли к супернатанту и полученную смесь встряхивали в течение ночи при комнатной температуре. Затем полученный раствор концентрировали до получения неочищенного остатка. Остаток растворяли в 5,0 мл 1:1 AcOH/H2O, затем дополнительно в 2,0 мл AcOH, фильтровали и очищали при помощи препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде соли ТФК (1,3 г, 97,5% чистоты). MS m/z: [M+H]+ рассчитано для C18H18F3NO, 322,13; найдено экспериментально 322,2.
1H ЯМР (CDCl3) δ (м.д.) 9,83 (уш.с, 1H); 9,32 (уш.с, 1H); 7,46-7,39 (м, 2H); 7,32 (д, J= 6,8 Гц, 1H); 7,26-7,21 (м, 1H); 6,76-6,66 (м, 2H); 5,07 (c, 2H); 3,69-3,50 (м, 2H); 3,38 (т, J= 11,6 Гц, 1H); 3,20-3,02 (м, 2H); 2,19 (кв, J= 12,8 Гц, 2H); 2,12-2,01 (м, 2H).
Синтез 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина в виде кристаллической HCl соли
Трет-бутиловый эфир 4-(2-метансульфонилоксиметилфенил)пиперидин-1-карбоновой кислоты (27,0 г, 60,6 ммоль, 1,0 экв.) растворяли в MeCN (540 мл) и добавляли к K2CO3 (25 г, 180 ммоль, 3,0 экв.) и 2,4,6-трифторфенолу (13,5 г, 90,9 ммоль, 1,5 экв.). Полученную смесь интенсивно перемешивали при 50°C в течение 6 часов, убирали нагрев и перемешивали в течение ночи. Полученную смесь охлаждали при комнатной температуре и разбавляли EtOAc (700 мл) и водой (700 мл). Фазы разделяли и органический слой промывали дважды 1,0 M NaOH в воде (2×400 мл) и насыщенным водным раствором NaCl (1×400 мл), затем сушили над Na2SO4 и удаляли растворитель до получения неочищенного трет-бутилового эфира 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты (25,0 г). Полученный неочищенный продукт объединяли с меньшей порцией, в общей сложности 30 г, и очищали хроматографией (0-10% EtOAc в гексане) с получением трет-бутилового эфира 4-[2-(2,4,6-трифторфеноксиметил)фенил] пиперидин-1-карбоновой кислоты (22,0 г).
Полученный трет-бутиловый эфир (22,0 г, 31,3 ммоль, 1,0 экв.) объединяли с 1,25M HCl в EtOH (250 мл, 310 ммоль, 10,0 экв.). Полученную смесь перемешивали при комнатной температуре в течение 8 часов, затем сохраняли при -10°C в течение приблизительно 48 часов. Большую часть растворителя удаляли выпариванием на роторном испарителе. К полученному сгущенному остатку добавляли EtOAc (80 мл), после чего перемешивали при комнатной температуре в течение 2 часов. Первую порцию выделяли фильтрованием, и осадок на фильтре промывали EtOAc (20 мл) и сушили до получения соединения, указанного в заголовке, в виде гидрохлоридной соли (8,5 г, >99% чистота), твердого вещества белого цвета. ВЭЖХ фильтрата показывает ~25% площадь продукта. Из второй порции растворитель удаляли выпариванием на роторном испарителе и полученное твердое вещество (~10 г) суспендировали в EtOAc (40 мл), сначала при комнатной температуре, затем при 60°C, и снова при комнатной температуре с получением указанного в заголовке соединения в виде гидрохлоридной соли (1,7 г, >99% чистота).
Две порции гидрохлоридной соли (18,5 г, 51,7 ммоль) объединяли с EtOAc (75 мл, 770 ммоль). Полученный густой, но свободнотекучий, осадок нагревали при 65°C в течение 30 минут, охлаждали до комнатной температуры и фильтровали. Колбу и осадок на фильтре промывали EtOAc (20 мл) и полученные твердые вещества сушили в глубоком вакууме при комнатной температуре в течение ночи с получением кристаллической гидрохлоридной соли (18,2 г, 99,3% чистота).
Хорошую кристалличность наблюдали при помощи порошковой рентгеновской дифракции. Было обнаружено, что LC-MS (2 мг в 2 мл 1:1 MeCN:1M водной HCl; API 150EX LC/MS System) согласуется со структурой. Было обнаружено, что ЯМР (ДМСО-d6, Varian VnmrJ 400) согласуется со структурой и солевой формой.
Альтернативный синтез 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидина в виде кристаллической HCl соли
Ацетилхлорид (83,5 мл, 1170 ммоль) медленно добавляли к EtOH (140 мл, 2,4 моль). Добавляли трет-бутиловый эфир 4-[2-(2,4,6-трифторфеноксиметил)фенил]пиперидин-1-карбоновой кислоты (55,0 г, 117 ммоль), растворенный в EtOH (100 мл, 2,0 моль), и полученную смесь перемешивали при комнатной температуре в течение 6 часов. Большую часть растворителя удаляли выпариванием на роторном испарителе. К полученному густому остатку добавляли EtOAc (300 мл), после чего следовало частичное удаление растворителя до ~100 мл. Добавляли свежий EtOAc (200 мл) и полученную суспензию перемешивали в течение 1 часа, фильтровали и сушили с получением гидрохлоридной соли (28,0 г, ~99% чистота). Полученный фильтрат концентрировали до густой пасты и добавляли IPAc (100 мл), перемешивали в течение 1 часа, фильтровали и сушили с получением еще 5,0 г гидрохлоридной соли (~99% чистота).
Две порции гидрохлоридной соли (83,0 г, 230 ммоль, ~99% чистота) объединяли с EtOAc (250 мл, 2,6 моль). Полученную суспензию нагревали при 70°C, а затем медленно охлаждали до комнатной температуры, после чего перемешивали в течение ночи. Полученную свободно текучую суспензию фильтровали и осадок на фильтре промывали EtOAc (50 мл), затем сушили в глубоком вакууме в течение приблизительно 48 часов с получением кристаллической гидрохлоридной соли (81,0 г, >99% чистота). Обнаружено, что 1H ЯМР (ДМСО-d6, 400 Гц) согласуется со структурой и солевой формой примера 1.
Кристаллическую гидрохлоридную соль (50,0 г, 1,40 моль, >99% чистота) растворяли в IPA (250 мл, 3,3 моль) и полученную суспензию нагревали до 75°C. Добавляли воду (25 мл, 1,4 моль). Через 5 минут наблюдали полное растворение, и внутренняя температура раствора составляла 65°C. Полученный раствор медленно охлаждали до комнатной температуры и затем перемешивали при комнатной температуре в течение ночи. Полученные твердые вещества фильтровали и сушили на воздухе в течение 2 часов с получением полусухого продукта. Затем данные твердые вещества сушили в глубоком вакууме при комнатной температуре в течение приблизительно 48 часов с получением указанной в заголовке кристаллической гидрохлоридной соли (44,1 г, 99,5% чистота). Полученное вещество показало хорошую кристалличность по результатам порошковой рентгеновской дифракции и дифференциальной сканирующей калориметрии.
Указанную в заголовке кристаллическую гидрохлоридную соль (151,1 г, 99,5% чистота) получают также подобным образом с 175,0 г гидрохлоридной соли и 10 объемами 5% воды в IPA (итого 90 мл воды и 1,8 л IPA).
ПРИМЕР 2
4-[2-(2,6-Дифторфеноксиметил)фенил]пиперидин
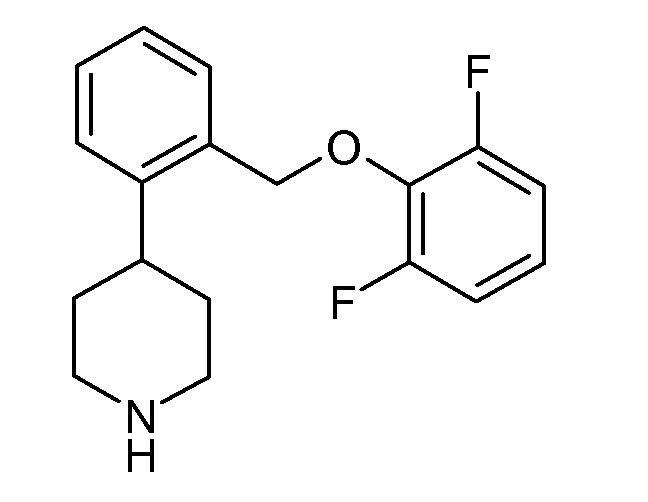
Трет-бутиловый эфир 4-[2-(толуол-4-сульфонилоксиметил)фенил]пиперидин-1-карбоновой кислоты (225 мг, 505 мкмоль, 1,0 экв.) растворяли в MeCN (5,0 мл, 97 ммоль) и добавляли к K2CO3 (210 мг, 1,5 ммоль, 3,0 экв.) и 2,6-дифторфенолу (98 мг, 760 мкмоль, 1,5 экв.). Полученную смесь встряхивали при 50°C в течение ночи, затем охлаждали до комнатной температуры. Супернатант отделяли от K2CO3 и других твердых веществ.
ТФК (800 мкл, 10 ммоль, 20,0 экв.) добавляли к супернатанту и полученную смесь встряхивали в течение ночи при комнатной температуре. Затем полученный раствор концентрировали до получения неочищенного остатка. Данный остаток растворяли в 1,5 мл 1:1 AcOH/H2O, затем дополнительно в 0,3 мл AcOH, фильтровали и очищали препаративной ВЭЖХ с получением указанного в заголовке соединения в виде ТФК соли (115 мг, 95% чистота). MS m/z: [M+H]+ рассчитано для C18H19F2NO, 304,14; найдено экспериментально 304,2.
Приведенные ниже данные ЯМР получены для отдельной порции вещества, которая была получена таким же образом, как описано выше:
1H ЯМР (CDCl3) δ (м.д.) 9,60 (уш.с, 1H); 9,25 (уш.с, 1H); 7,42-7,37 (м, 2H); 7,33 (д, J=7,6 Гц, 1H); 7,26-7,20 (м, 1H); 7,03-6,86 (м, 3H); 5,11 (c, 2H); 3,64-3,50 (м, 2H); 3,38 (т, J=11,0 Гц, 1H); 3,16-3,00 (м, 2H); 2,18 (кв, J=12,4 Гц, 2H); 2,10-2,01 (м, 2H).
ПРИМЕР 3
Следуя методикам, описанным в примерах выше, и заменяя соответствующие исходные вещества и реагенты, также были получены соединения с 3-1 по 3-10, имеющие формулу Ia:
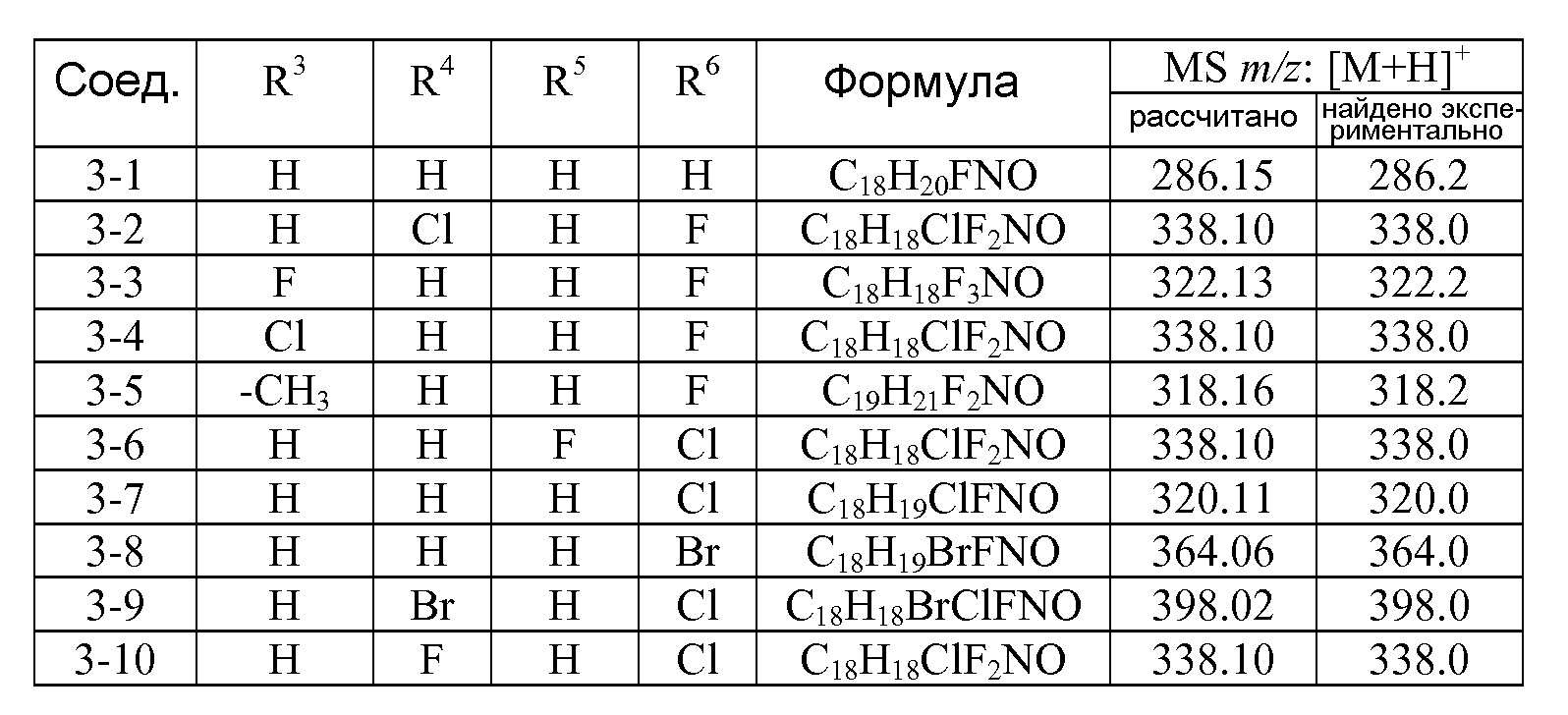
Препарат 3
Трет -бутиловый эфир 4-(4,4,5,5-тетаметил-[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
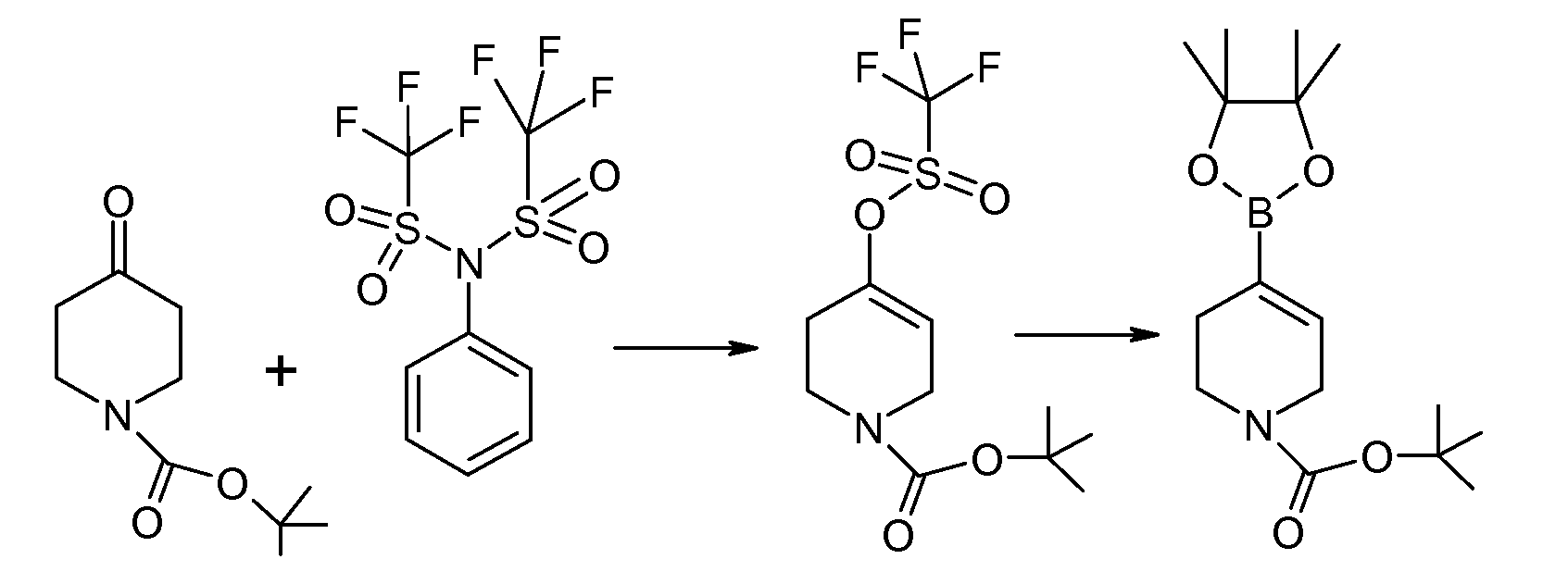
Boc-4-пиперидон (1,99 г, 10 ммоль) растворяли в ТГФ (10 мл, 0,2 моль) и охлаждали при -20°C. Медленно добавляли 1,0 M бис(триметилсилил)амида натрия в ТГФ (11,0 мл, 11 ммоль). Полученную смесь перемешивали при от -30°C до -20°C в течение 30 минут. N-Фенил-бис(трифторметансульфонимид) (3,57 г, 10 ммоль) добавляли в ТГФ (7 мл). Полученную смесь перемешивали при от -20°C до -10°C в течение 60 минут, затем добавляли 1,0 M NaOH в воде (9,4 мл, 9,4 ммоль). Полученной смеси давали нагреться до комнатной температуры. К полученной смеси добавляли EtOAc (60,0 мл) и гептан (30 мл) и перемешивали в течение 5 минут. Слои разделяли и органический слой промывали 1 н. NaOH (5×25 мл), насыщенным водным раствором NaCl (10,0 мл), сушили над Na2SO4, фильтровали и концентрировали до получения трет-бутилового эфира 4-трифторметансульфонилокси-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (3,1 г) в виде желтоватого масла, которое применяют без дополнительной очистки.
1H ЯМР (CDCl3) δ (м.д.) 5,76 (м, 1H); 4,04 (м, 2H); 3,62 (м, 2H); 2,45 (м, 2H); 1,48 (c, 9H).
Трет-бутиловый эфир 4-трифторметансульфонилокси-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (990 мг, 3,0 ммоль) растворяли в 1,4-диоксане (9 мл, 100 ммоль) и добавляли ацетат калия (883,3 мг, 9,0 ммоль), бис(пинаколато)диборан (788 мг, 3,1 ммоль), комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорид-дихлорметан (52 мг, 63 мкмоль) и 1,1'-бис(дифенилфосфино)ферроцен (38 мг, 68 мкмоль). Полученную смесь дегазировали и продували азотом (4×), после чего нагревали при 80°C в течение 17 часов. Полученной смеси давали охладиться до комнатной температуры и фильтровали через Celite®, применяя EtOAc (25 мл) для промывки продукта, получая указанное в заголовке соединение (296 мг) в виде полувоскообразного твердого вещества белого цвета.
Препарат 4
Трет -бутиловый эфир 4-(4-фтор-2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты
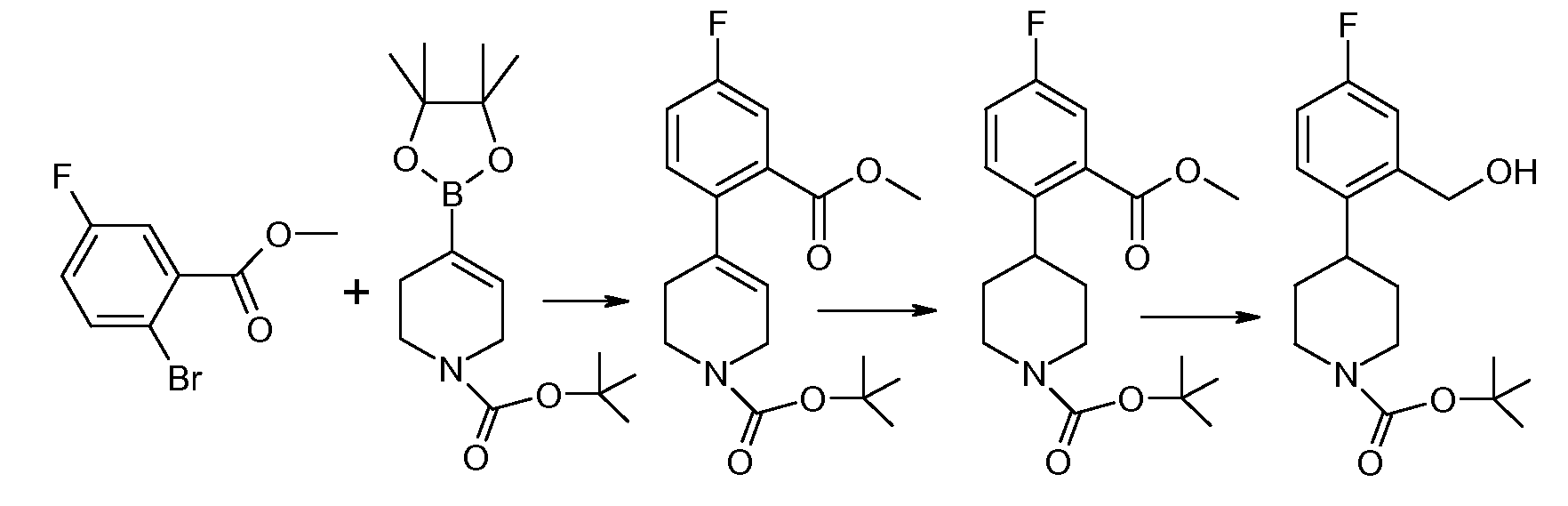
Объединяли метил-2-бром-5-фторбензоат (1,8 г, 7,5 ммоль), трет-бутиловый эфир 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (2,3 г, 7,5 ммоль), ТГФ (69 мл, 850 ммоль) и 2 M карбонат натрия в воде (15,0 мл, 30,0 ммоль), и полученную смесь дегазировали и продували азотом. Добавляли хлорид бис(трифенилфосфин)палладия(II) (158 мг, 225 мкмоль), и полученную смесь снова дегазировали и продували азотом. Смесь нагревали при 80°C в течение 1 часа. Затем смесь охлаждали и разделяли слои, разбавляли EtOAc (50 мл), промывали насыщенным водным раствором NaCl (30 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией (0-50% EtOAc в гексане). Раствор неочищенного вещества и катализатор Перлмана (0,1:0,4, палладий гидроксид:углерод, 1,1 г, 1,5 ммоль) в MeOH (60,8 мл, 150 ммоль) гидрировали при давлении 1 атм. при комнатной температуре в течение ночи. Затем полученную смесь отделяли, продували азотом, фильтровали через Celite® и концентрировали до получения бесцветного масла. Полученное масло растворяли в ТГФ (30 мл, 400 ммоль) и обрабатывали комплексом боран-диметилсульфид (1,3 мл, 15,0 ммоль) при комнатной температуре. Полученную смесь нагревали до температуры кипения в течение 5 часов. После охлаждения до комнатной температуры медленно добавляли MeOH (20 мл) и затем удаляли выпариванием на роторном испарителе. Еще 20 мл MeOH добавляли и удаляли выпариванием на роторном испарителе. Затем полученный остаток растворяли в EtOAc (100 мл) и промывали 1 н. HCl и насыщенного NaHCO3, сушили над Na2SO4, фильтровали и концентрировали. Затем полученное вещество очищали хроматографией на силикагеле (0-50% EtOAc в гексане) с получением указанного в заголовке соединения (924 мг) в виде бесцветного клейкого твердого вещества.
1H ЯМР (CDCl3) δ (м.д.) 7,21 (уш.с, 1H); 7,16 (м, 1H); 6,98 (м, 1H); 4,76 (уш.с, 2H); 4,24 (м, 2H); 2,89 (м, 1H); 2,80 (м, 2H); 1,72 (м, 2H); 1,60 (м, 2H); 1,47 (c, 9H).
ПРИМЕР 4
4-[4-Фтор-2-(2,4,6-трифторфеноксиметил)фенил]пиперидин
DIAD (23,6 мкл, 120 мкмоль) добавляли к раствору PPh3 (28,9 мг, 110 мкмоль) в толуоле (533 мкл, 5 ммоль). Полученную смесь быстро перемешивали и добавляли трет-бутиловый эфир 4-(4-фтор-2-гидроксиметилфенил)пиперидин-1-карбоновой кислоты (30,9 мг, 100 мкмоль). Смесь объединяли с 2,4,6-трифторфенолом (14,8 мг), нагревали при 80°C в течение 4 часов, затем концентрировали. Удаляли защитную группу неочищенного вещества при помощи 1,25 M HCl в EtOH (1 мл) в течение ночи при комнатной температуре. Затем полученное вещество концентрировали и остаток очищали препаративной ВЭЖХ с получением указанного в заголовке соединения в виде ТФК соли (7,8 мг, 100% чистота). MS m/z: [M+H]+ рассчитано для C18H17F4NO, 340,12; найдено экспериментально 340,0.
ПРИМЕР 5
Следуя методикам, описанным в примерах выше, и замещая соответствующие исходные вещества и реагенты, также были получены соединения с 5-1 по 5-17, имеющие формулу Ib:
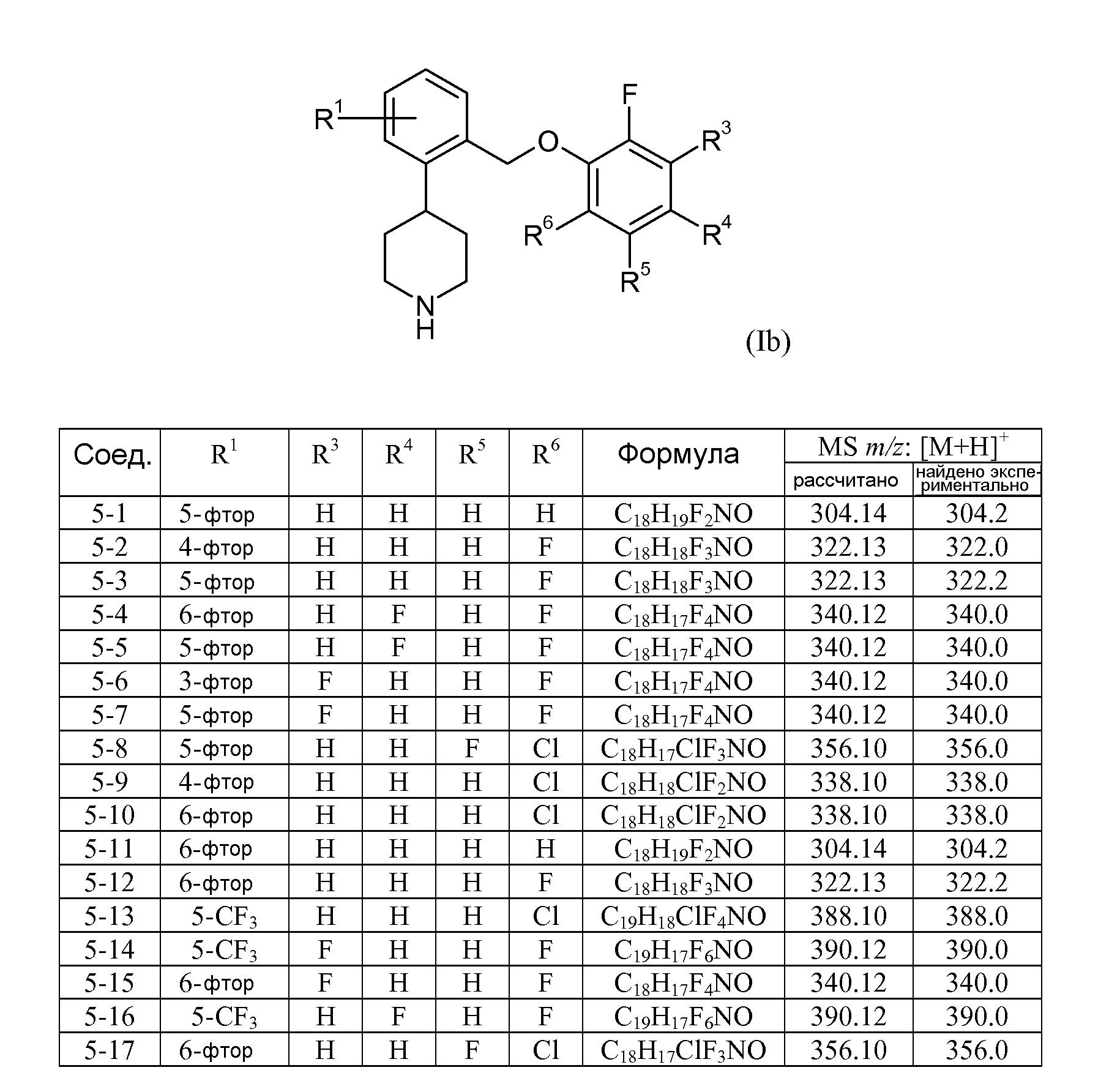
ПРИМЕР 6
Следуя методикам, описанным в примерах выше, и замещая соответствующие исходные вещества и реагенты, также были получены соединения с 6-1 по 6-7, имеющие формулу II-3:
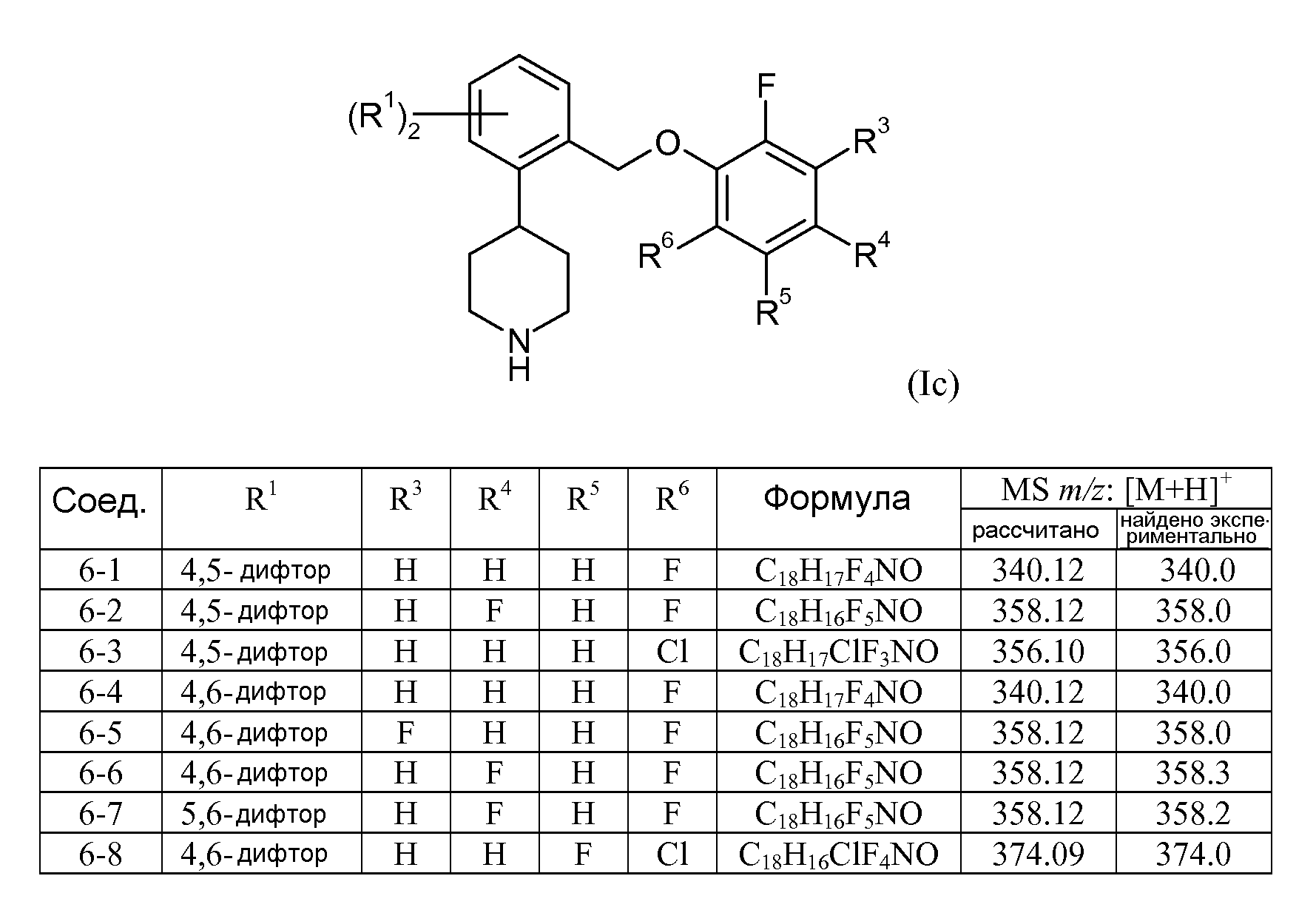
АНАЛИЗ 1
Анализы связывания hSERT, hNET и hDAT
Мембранные анализы связывания меченого лиганда применяли для измерения конкурентного ингибирования связывания меченого лиганда (3H-циталопрам, или 3H-низоксетин, или 3H-WIN35428) с мембранами, полученными из клеток, экспрессирующих соответствующий человеческий рекомбинантный транспортер (hSERT, или hNET, или hDAT), для того чтобы определить значения pKi исследуемых соединений в отношении транспортеров.
Мембранный препарат из клеток, экспрессирующих hSERT, hNET или hDAT
Клеточные линии, полученные из рекомбинантного мезонефроса человека (HEK-293), стабильно трансфицированные hSERT или hNET соответственно, выращивали в среде DMEM, дополненной 10% диализированной ЭБС (для hSERT) или ЭБС (для hNET), 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином и 250 мкг/мл аминогликозидного антибиотика G418, в 5% CO2 влажной камере при 37°C. Когда культуры достигли конфлюэнтности 80%, клетки тщательно промывали ФБР (без Ca2+ и Mg2+) и обрабатывали 5 мМ ЭДТА в ФБР. Клетки формировали в пеллеты центрифугированием, повторно суспендировали в буфере для лизиса (10 мМ Tris-HCl, pH 7,5, содержащий 1 мМ ЭДТА), гомогенизировали, формировали в пеллеты центрифугированием, затем повторно суспендировали в 50 мМ Tris-HCl, pH 7,5 и 10% сахарозе при 4°C. Концентрацию белка мембранной суспензии определяли при помощи набора Bio-Rad Bradford Protein Assay. Мембраны быстро замораживали и хранили при -80°C. Мембраны яичника китайского хомячка, экспрессирующие hDAT (CHO-DAT), приобретали в компании PerkinElmer и хранили при -80°C.
Анализы связывания
Анализы связывания проводили в 96-луночном планшете для анализа в общем объеме буфера для анализа 200 мкл (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4) с 0,5, 1 и 3 мкг мембранного белка, для SERT, NET и DAT соответственно. Для определения значений Kd меченого лиганда для 3H-циталопрама, 3H-низоксетина или 3H-WIN35428 соответственно проводили исследования связывания при насыщении, применяя 12 различных концентраций меченого лиганда, лежащих в диапазоне от 0,005-10 нМ (3H-циталопрам); 0,01-20 нМ (3H-низоксетин) и 0,2-50 нМ (3H-WIN35428). Анализы замещения для определения значений pKi исследуемых соединений проводили с 1,0 нМ 3H-циталопрамом, 1,0 нМ 3H-низоксетином или 3,0 нМ H-WIN35428, при 11 различных концентрациях исследуемого соединения, лежащих в диапазоне от 10 pM до 100 мкM.
Готовили стоковые растворы (10 мМ в ДМСО) исследуемого соединения и делали серийные разбавления буфером для разбавления (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4, 0,1% БСА, 400 мкM аскорбиновая кислота). Неспецифическое связывание меченого лиганда определяли в присутствии 1 мкM дулоксетина, 1 мкM дезипрамина или 10 мкM GBR12909 (каждый в буфере для разбавления) для hSERT, hNET или hDAT анализов соответственно.
После 60-минутной инкубации при 22°C (или в течение периода, достаточного для достижения равновесия) мембраны собирали быстрым фильтрованием через 96-луночный планшет UniFilter GF/B, предварительно обработанный 0,3% полиэтиленимином, и промывали 6 раз 300 мкл буфера для промывки (50 мМ Tris-HCl, 0,9% NaCl, pH 7,5 при 4°C). Планшеты сушили в течение ночи при комнатной температуре, добавляли ~45 мкл МикроScint™-20 (Perkin Elmer) и производили количественный анализ связанного меченого лиганда при помощи жидкостной сцинтилляционной спектроскопии. Кривые конкурентного ингибирования и изотермы насыщения анализировали при помощи пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Значения IC50 получали из концентрационных характеристических кривых при помощи алгоритма Sigmoidal Dose Response (переменный наклон) в Prism GraphPad. Значения Kd и Bmax для меченого лиганда получали из изотерм насыщения при помощи алгоритма Saturation Binding Global Fit в Prism GraphPad. Значения pKi (отрицательный десятичный логарифм Ki) для исследуемых соединений рассчитывали из наиболее точно подобранных значений IC50, а значения Kd меченого лиганда по уравнению Ченга-Прусоффа (Cheng & Prusoff (1973) Biochem. Pharmacol. 22(23):3099-3108): Ki=IC50/(1+[L]/Kd), где [L]=концентрация меченого лиганда.
Все вышеупомянутые соединения исследовались в данном анализе, и было обнаружено, что они показывают SERT pKi≥7,9 и NET pKi≥8,0.
АНАЛИЗ 2
Анализы обратного захвата hSERT, hNET и hDAT нейротрансмиттера
Анализы обратного захвата нейротрансмиттера применяли для измерения конкурентного ингибирования обратного захвата 3H-серотонина (3H-5-HT), 3H-норэпинефрина (3H-NE) и 3H-допамина (3H-DA) в клетках, экспрессирующих соответствующий транспортер (hSERT, hNET или hDAT), для определения значений pIC50 исследуемых соединений в отношении транспортеров.
Анализы захвата 3 H-5-HT, 3 H-NE и 3 H-DA
Клеточные линии, полученные из HEK-293, стабильно трансфицированные hSERT, hNET или hDAT соответственно, выращивали в среде DMEM, дополненной 10% диализированной ЭБС (для hSERT) или ЭБС (для hNET и hDAT), 100 мкг/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином и 250 мкг/мл аминогликозидного антибиотика G418 (для hSERT и hNET) или 800 мкг/мл (для hDAT), в 5% CO2 влажной камере при 37°C. Когда культуры достигли конфлюэнтности 80%, клетки тщательно промывали ФБР (без Ca2+ и Mg2+) и обрабатывали 5 мМ ЭДТА в ФБР. Клетки собирали центрифугированием при 1100 об/мин в течение 5 минут, промывали один раз, повторно суспендируя в ФБР, затем центрифугировали. Супернатант удаляли и клеточную пеллету повторно суспендировали мягкой гомогенизацией в бикарбонатном буфере Кребса-Рингера, содержащем HEPES (10 мМ), CaCl2 (2,2 мМ), аскорбиновую кислоту (200 мкM) и паргилин (200 мкM), pH 7,4 при комнатной температуре. Конечная концентрация клеток в клеточной суспензии составляла 7,5×104 клеток/мл, 1,25×105 клеток/мл и 5,0×104 клеток/мл для SERT, NET и DAT клеточных линий соответственно.
Анализы захвата нейротрансмиттера проводили в 96-луночном планшете для анализа в общем объеме буфера для анализа 400 мкл (бикарбонатный буфер Кребса-Рингера, содержащий HEPES (10 мМ), CaCl2 (2,2 мМ), аскорбиновую кислоту (200 мкM) и паргилин (200 мкM), pH 7,4) с 1,5×104 и 2,5×104 клетками, для SERT и NET соответственно. Конкурентные анализы для определения значений pIC50 исследуемых соединений проводили с 11 различными концентрациями, лежащими в диапазоне от 10 пM до 100 мкM. Готовили стоковые растворы (10 мМ в ДМСО) исследуемого соединения и делали серийные разбавления, применяя 50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4, 0,1% БСА, 400 мкM аскорбиновую кислоту. Исследуемые соединения инкубировали в течение 30 минут при 37°C с соответствующими клетками перед добавлением радиактивно меченного нейротрансмиттера, 3H-5-HT (конечная концентрация 20 нМ), 3H-NE (конечная концентрация 50 нМ) или 3H-DA (конечная концентрация 100 нМ). Неспецифический захват нейротрансмиттера определяли в присутствии 2,5 мкM дулоксетина или 2,5 мкM дезипрамина (каждый в буфере для разбавления) в hSERT, hNET или hDAT анализах соответственно.
После 10-минутной инкубации при 37°C с меченым лигандом клетки собирали быстрым фильтрованием через 96-луночный планшет UniFilter GF/B, предварительно обработанный 1% БСА, и промывали 6 раз 650 мкл буфера для промывки (ледяной ФБР). Планшеты сушили в течение ночи при 37°C, добавляли ~45 мкл МикроScint™-20 (Perkin Elmer) и производили количественный анализ связанного меченого лиганда при помощи жидкостной сцинтилляционной спектроскопии. Кривые конкурентного ингибирования анализировали при помощи пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Значения IC50 получали из концентрационных характеристических кривых при помощи алгоритма Sigmoidal Dose Response (переменный наклон) в Prism GraphPad.
АНАЛИЗ 3
Ex vivo исследования занимаемости транспортера SERT и NET
Ex vivo анализы связывания меченого лиганда и захвата нейротрансмиттера применяли для определения in vivo занимаемости SERT и NET в выбранных участках мозга после in vivo введения (острое или хроническое) исследуемых соединений. После введения исследуемого соединения (внутривенным, интраперитонеальным, пероральным, подкожным или другим способом) в соответствующей дозе (от 0,0001 до 100 мг/кг) крыс (≥n=4 в группе) умерщвляли через определенные моменты времени (от 10 минут до 48 часов) обезглавливанием и иссекали мозг на льду. Соответствующие участки мозга вырезали, замораживали и хранили при -80°C до применения.
Ex vivo анализы связывания SERT и NET меченого лиганда
Для ex vivo анализов связывания меченого лиганда наблюдали исходные скорости ассоциации SERT (3H-циталопрам) и NET (3H-низоксетин) селективных меченых лигандов в неочищенных гомогенатах крысиного мозга, полученных из животных, принимавших среду и исследуемое соединение (см. Hess et al. (2004) J. Pharmacol. Exp. Ther. 310(2):488-497). Неочищенные гомогенаты мозговой ткани готовили гомогенизацией замороженных кусков ткани в 0,15 мл (на мг сырого веса) 50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, pH 7,4 буфера. Анализы ассоциации меченого лиганда проводили в 96-луночном планшете для анализа в общем объеме 200 мкл буфера для анализа (50 мМ Tris-HCl, 120 мМ NaCl, 5 мМ KCl, 0,025% БСА, pH 7,4) с 650 мкг сырого веса ткани (эквивалентно 25 мкг белка). Гомогенаты инкубировали вплоть до 5 минут с 3H-циталопрамом (3 нМ) и 3H-низоксетином (5 нМ) соответственно перед завершением анализа быстрым фильтрованием через 96-луночный планшет UniFilter GF/B, предварительно обработанный 0,3% полиэтиленимином. Затем фильтры промывали 6 раз 300 мкл буфера для промывки (50 мМ Tris-HCl, 0,9% NaCl, pH 7,4 при 4°C). Неспецифическое связывание меченого лиганда определяли в присутствии 1 мкM дулоксетина или 1 мкM деспирамина для 3H-циталопрама или 3H-низоксетина соответственно. Планшеты сушили в течение ночи при комнатной температуре, добавляли ~45 мкл MicroScint™-20 (Perkin Elmer) и производили количественный анализ связанного меченого лиганда при помощи жидкостной сцинтилляционной спектроскопии. Исходные скорости ассоциации 3H-циталопрама и 3H-низоксетина определяли по линейной регрессии при помощи пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA). Определяли среднюю скорость ассоциации меченого лиганда в гомогенатах ткани мозга из животных, принимавших среду. Затем определяли % занимаемости исследуемых соединений при помощи приведенного ниже уравнения:
% занимаемости = 100×(1-(исходная скорость ассоциации для ткани, обработанной исследуемым соединением/средняя скорость ассоциации для ткани, обработанной средой))
Значения ED50 определяли нанесением на график log 10 дозы исследуемого соединения к % занимаемости. Значения ED50 получали из концентрационных характеристических кривых при помощи алгоритма Sigmoidal Dose Response (переменный наклон) в GraphPad Prism.
Ex vivo анализы захвата SERT и NET
Ex vivo анализы захвата нейротрансмиттера, в которых захват 3H-5-HT или 3H-NE в неочищенных гомогенатах крысиного мозга, полученных из животных, принимавших среду и исследуемое соединение, применяли для измерения in vivo занимаемости SERT и NET транспортера (см. Wong et al. (1993) Neuropsychopharmacology 8(1):23-33). Неочищенные гомогенаты мозговой ткани готовили гомогенизацией кусков замороженной ткани в 0,5 мл (на мг сырого веса) 10 мМ HEPES буфера pH 7,4, содержащего 0,32 M сахарозу, 200 мкM аскорбиновую кислоту и 200 мкM паргилин, при 22°C. Анализы захвата нейротрансмиттера проводили в 96-луночном планшете Axygen в общем объеме 350 мкл буфера для анализа (бикарбонатный буфер Кребса-Рингера с 10 мМ HEPES, 2,2 мМ CaCl2, 200 мкM аскорбиновой кислотой и 200 мкM паргилином, pH 7,4) с 50 мкг белка. Гомогенаты инкубировали в течение 5 минут при 37°C с 3H-5-HT (20 нМ) и 3H-NE (50 нМ) соответственно перед завершением анализа быстрым фильтрованием через 96-луночный планшет UniFilter GF/B, предварительно обработанный 1% БСА. Планшеты промывали 6 раз 650 мкл буфера для промывки (ледяной ФБР) и сушили в течение ночи при 37°C перед добавлением ~45 мкл MicroScint™-20 (Perkin Elmer). Количественный анализ связанного меченого лиганда проводили при помощи жидкостной сцинтилляционной спектроскопии. Неспецифический захват нейротрансмиттера определяли в параллельных анализах, в которых гомогенаты ткани инкубировали с 3H-5-HT (20 нМ) или 3H-NE (50 нМ) в течение 5 минут при 4°C.
АНАЛИЗ 4
Другие анализы
Другие анализы, которые применялись для оценки фармакологических свойств исследуемых соединений, включают, но не ограничиваются, кинетические анализы связывания холодного лиганда (Motulsky and Mahan (1984) Molecular Pharmacol. 25(1):1-9) с мембранами, полученными из клеток, экспрессирующих hSERT или hNET; общепринятые анализы связывания меченого лиганда с мембраной с применением радиактивно меченного, например, содержащего тритий, исследуемого соединения; анализы связывания меченого лиганда с применением нативной ткани, например, из мозга грызуна или человека; анализы захвата нейротрансмиттера с применением тромбоцитов человека или грызунов; анализы захвата нейротрансмиттера с применением неочищенных или чистых синаптосомных препаратов из мозга грызунов.
АНАЛИЗ 5
Формалиновый тест
Соединения оцениваются по их способности ингибировать поведенческую реакцию, вызванную 50 мкл инъекцией формалина (5%). Металлическая накладка прикрепляется к левой задней лапке мужских особей крыс Sprague-Dawley (200-250 г), и каждая крыса проводит с такой накладкой около 60 минут в пластиковом цилиндре (диаметр 15 см). Соединения приготавливают в фармацевтически приемлемых средах и вводят систематически (и.п., п.о.) в заранее предусмотренные моменты времени перед формалиновой обработкой. Самопроизвольные ноцицептивные реакции, заключающиеся во вздрагивании инъецированной (обвязанной) задней лапки, постоянно подсчитываются в течение 60 минут при помощи автоматического анализатора ноцицепции (UCSD Anesthesiology Research, San Diego, CA). Антиноцицептивные свойства исследуемых соединений определяются по сравнению с числом вздрагиваний у крыс, принимавших среду и соединение (Yaksh et al., "An automated flinch detecting system for use in the formalin nociceptive bioassay" (2001) J. Appl. Physiol. 90(6):2386-2402).
АНАЛИЗ 6
Модель лигатуры спинального нерва
Соединения оцениваются по их способности противодействовать развитию тактильной аллодинии (повышенной чувствительности к нейтральному механическому раздражителю), вызванной повреждением нерва. Мужских особей крыс Male Sprague-Dawley подготовили хирургически, как описано в Kim and Chung "An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat" (1992) Pain 50(3):355-363. Механическая чувствительность определяется как 50% ответ отдергивания при нейтральных механических стимулах (Chaplan et al., "Quantitative assessment of tactile allodynia in the rat paw" (1994) J. Neurosci. Methods 53(1):55-63) перед и после повреждения нерва. От одной до четырех недель после оперативного вмешательства растворы соединений готовят в фармацевтически приемлемых средах и систематически вводят (и.п., п.о.). Степень механической чувствительности, вызванной повреждением нерва, до и после лечения служит показателем антиноцицептивных свойств соединения.
Тогда как настоящее изобретение было описано со ссылкой на конкретные аспекты или их варианты осуществления, то специалистам в данной области техники следует понимать, что могут быть сделаны различные изменения или могут быть замещены эквиваленты не выходя за рамки истинной сущности и объема данного изобретения. Кроме того, до степени, позволяемой основаниями и правилами заявляемого патента, все публикации, патенты и патентные заявки, приведенные в контексте данного документа, включены полностью в документе путем ссылки до такой же степени, как если бы каждый документ был отдельно включен путем ссылки в контексте данного документа.
![4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ](https://fips.edrid.ru/images/rid/2c/d8/d3/0792e4a67e1f5e340c01d38d21cf310c.png)
![4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ](https://fips.edrid.ru/images/rid/2c/d8/d3/e5cd4d68c86d12d3be7fb631f29ae71c.png)
![4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ](https://fips.edrid.ru/images/rid/2c/d8/d3/d9c9ca033a1823ee02ded22f7696983e.png)
![4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ](https://fips.edrid.ru/images/rid/2c/d8/d3/ce69a66e3086d6cd29c271101f22f730.png)
![4-[2-(2-ФТОРФЕНОКСИМЕТИЛ)ФЕНИЛ]ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ](https://fips.edrid.ru/images/rid/2c/d8/d3/94689ff1609ada077ff470b292727226.png)

