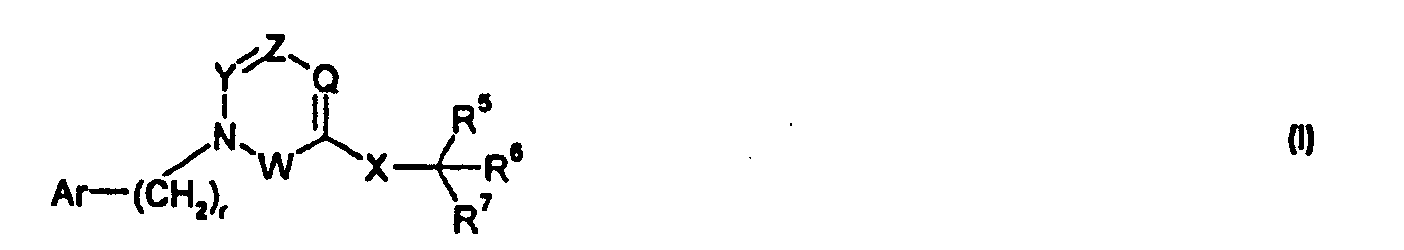Результат интеллектуальной деятельности: АНТИГИПЕРТЕНЗИВНЫЕ СОЕДИНЕНИЯ ДВОЙНОГО ДЕЙСТВИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ
Вид РИД
Изобретение
Изобретение относится к новым соединениям, обладающим активностью антагониста рецептора 1 типа ангиотензина II (AT1) и активностью ингибирования неприлизина. Изобретение относится также к фармацевтическим композициям, содержащим такие соединения, способам и промежуточным соединениям с получением таких соединений и к способам применения таких соединений для лечения заболеваний, таких как гипертензия.
СУЩЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Целью антигипертензивной терапии является снижение кровяного давления и предотвращение связанных с гипертензией осложнений, таких как инфаркт миокарда, инсульт и почечная недостаточность. Надеются, что для пациентов с неосложненной гипертензией (то есть без факторов риска, повреждения органа-мишени, или сердечно-сосудистого заболевания) уменьшение кровяного давления может предотвращать развитие сердечно-сосудистых и почечных сопутствующих заболеваний, состояний, существующих в то же самое время, что и первичное состояние, у того же самого пациента. Для пациентов с существующими факторами риска или сопутствующими заболеваниями мишенью терапии является замедление прогрессирования сопутствующего заболевания и уменьшение смертности.
Терапевты, как правило, назначают лечение лекарственными средствами терапии для пациентов, кровяное давление которых невозможно адекватно контролировать модификациями диеты и/или образа жизни. Общепринятые классы лекарственных средств действуют для стимуляции диуреза, адренергического ингибирования или вазодилатации. Часто назначают сочетание лекарственных средств в зависимости от присутствующих сопутствующих заболеваний.
Существует пять классов лекарственных средств, применяемых для лечения гипертензии: диуретики, включающие тиазид и тиазидоподобные диуретики, такие как гидрохлортиазид, петлевые диуретики, такие как фуросемид, и калийсберегающие диуретики, такие как триамтерен; блокаторы β1-адренергических рецепторов, такие как сукцинат метопролола и карведилол; блокаторы кальциевых каналов, такие как амлодипин; ингибиторы ангиотензинпревращающего фермента (ACE), такие как каптоприл, беназеприл, эналаприл, эналаприлат, лизиноприл, квинаприл и рамиприл; и антагонисты рецепторов AT1, известные так же как блокаторы рецептора 1 типа ангиотензина II (ARB), такие как цилексетил кандесартана, эпросартан, ирбесартан, лозартан, медоксомил олмесартана, телмисартан и валсартан. Вводят также комбинации этих лекарственных средств, например, блокатора кальциевых каналов (амлодипина) и ингибитора ACE (беназеприла), или диуретика (гидрохлортиазида) и ингибитора ACE (эналаприла). Все эти лекарственные средства, при соответствующем использовании, являются эффективными для лечения гипертензии. Тем не менее, как эффективность, так и переносимость, следует далее улучшать в новых лекарственных средствах, нацеленных на гипертензию. Несмотря на доступность многих вариантов лечения, недавно опрос по проверке национального здравоохранения и питания (NHANES) показал, что только приблизительно 50% всех пациентов с гипертензией после лечения достигают адекватного контроля кровяного давления. Более того, плохое соблюдение режима лечения пациентом из-за проблем с переносимостью доступных лекарственных средств дополнительно уменьшает успешность лечения.
Кроме того, каждый из главных классов антигипертензивных средств обладает некоторыми недостатками. Диуретики могут оказывать неблагоприятные эффекты на метаболизм липидов и глюкозы и связаны с другими побочными эффектами, включая ортостатическую гипотензию, гипокалиемию и гиперурикемию. Бета-блокаторы могут вызывать утомляемость, бессонницу и импотенцию; и некоторые бета-блокаторы могут также вызывать сниженный сердечный выброс и брадикардию, что может являться нежелательным в некоторых группах пациентов. Блокаторы кальциевых каналов широко используют, однако, можно оспаривать, насколько эффективно эти лекарственные средства уменьшают смертельные и несмертельные сердечные события по сравнению с другими классами лекарственных средств. Ингибиторы ACE могут вызывать кашель, и более редкие побочные эффекты включают сыпь, ангионевротический отек, гиперкалиемию и функциональную почечную недостаточность. Антагонисты рецепторов AT1 являются такими же эффективными, как ингибиторы ACE, но без высокой распространенности кашля.
Неприлизин (нейтральная эндопептидаза, EC 3.4.24.11) (NEP), представляет собой связанную с мембраной клеток эндотелия Zn2+-металлопептидазу, обнаруженную в многих тканях, включая мозг, почку, легкие, желудочно-кишечный тракт, сердце и периферическую сосудистую систему. NEP отвечает за деградацию и инактивацию ряда вазоактивных пептидов, таких как циркулирующие пептиды брадикинин и ангиотензин, так же как натрийуретические пептиды, последние из которых оказывают несколько эффектов, включая вазодилатацию и диурез. Таким образом, NEP играет важную роль в гомеостазе кровяного давления. Ингибиторы NEP изучали в качестве потенциальных лекарственных средств, и они включают тиорфан, кандоксатрил и кандоксатрилат. Кроме того, сконструированы также соединения, ингибирующие как NEP, так и ACE, и они включают омапатрилат, гемпатрилат и сампатрилат. Рассматриваемый как ингибиторы вазопептидаз, этот класс соединений описан в Robl et al. (1999) Exp. Opin. Ther. Patents 9(12): 1665-1677.
Может существовать возможность увеличивать антигипертензивную эффективность при сочетании антагонизма рецептора AT1 и ингибирования NEP, о чем свидетельствуют комбинации антагониста рецептора AT1/ингибитора NEP, описанные в WO 9213564 Darrow et al. (Schering Corporation); US20030144215 Ksander et al.; Pu et al., реферат, представленный на Канадском сердечно-сосудистом конгрессе (October 2004); и Gardiner et al. (2006) JPET 319:340-348 и WO 2007/045663 (Novartis AG) Glasspool et al.
Недавно в WO 2007/056546 (Novartis AG) Feng et al. описали комплексы антагониста рецептора AT1 и ингибитора NEP, где соединение антагонист рецептора AT1 является нековалентно связанным с соединением ингибитором NEP, или где соединение антагонист связано с соединением ингибитором посредством катиона.
Несмотря на прогресс в данной области, остается необходимость высокоэффективной монотерапии со множеством механизмов действия, приводящих к контролю уровней кровяного давления, который в настоящее время можно достигать только с помощью комбинированной терапии. Таким образом, хотя известны различные антигипертензивные средства и их вводят в различных комбинациях, было бы очень желательным предоставить соединения, обладающие как активностью антагониста рецептора AT1, так и активностью ингибирования NEP в одной и той же молекуле. Ожидают, что соединения, обладающие обоими этими видами активности, могут являться особенно применимыми в качестве лекарственных средств, поскольку они могут проявлять антигипертензивную активность посредством двух независимых механизмов действия, в то же время обладая фармакокинетикой одиночной молекулы.
Кроме того, ожидают также, что такие соединения двойного действия могут иметь применение для лечения множества других заболеваний, которые можно лечить посредством антагонизма рецептора AT1 и/или ингибирования фермента NEP.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, как обнаружено, обладающим активностью антагониста рецептора AT1 и активностью ингибирования фермента неприлизина (NEP). Соответственно, ожидают, что соединения по изобретению могут являться применимыми и преимущественными в качестве лекарственных средств для лечения таких состояний, как гипертензия и сердечная недостаточность.
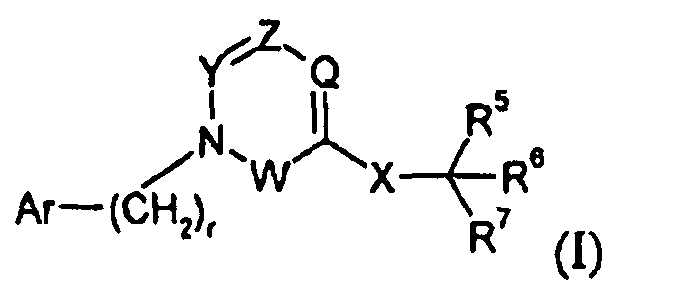
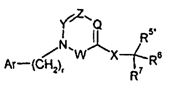
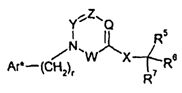
Один аспект изобретения относится к соединению формулы I:
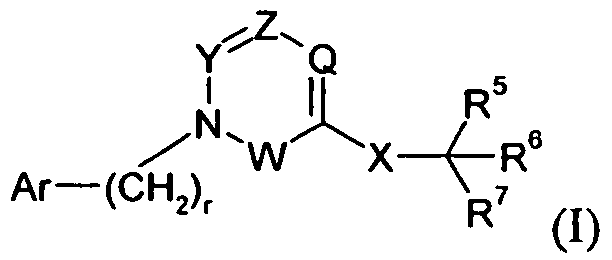
где r представляет собой 0, 1 или 2;
Ar выбран из
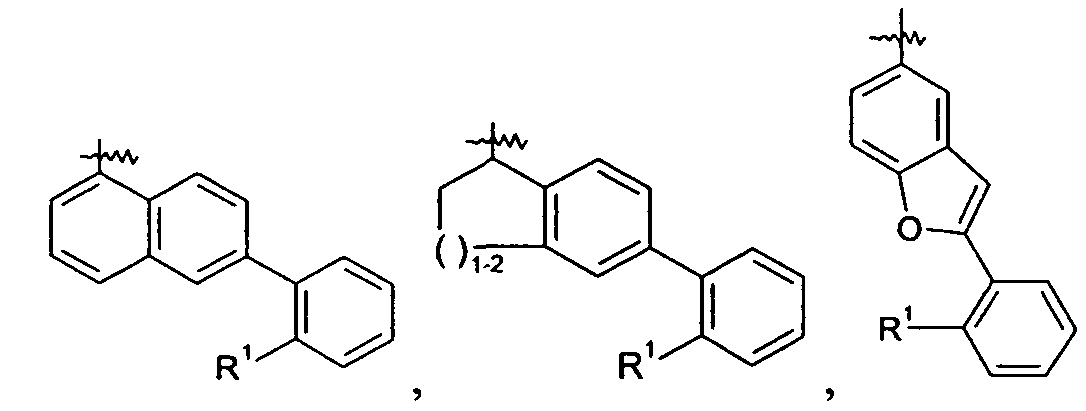 и
и 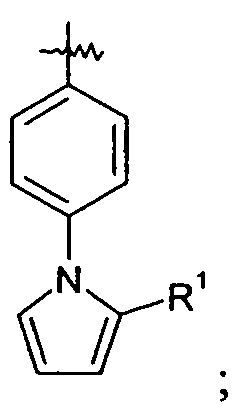
R1 выбран из -COOR1a, -NHSO2R1b, -SO2NHR1d, -SO2OH, -C(O)NH-SO2R1c, -P(O)(OH)2, -CN, -O-CH(R1e)-COOH, тетразол-5-ила,
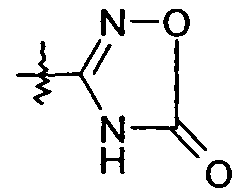 и
и 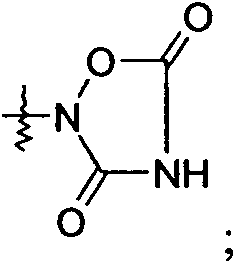
R1a представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa, -C0-6алкиленморфолин,
 или
или 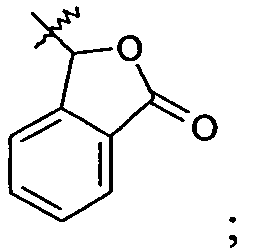
R1aa представляет собой -O-C1-6алкил, -O-C3-7циклоалкил, -NR1abR1ac или -CH(NH2)CH2COOCH3; R1ab и R1ac независимо выбраны из H, -C1-6алкила и бензила, или взяты вместе как -(CH2)3-6-; R1b представляет собой R1c или -NHC(O)R1c; R1c представляет собой -C1-6алкил, -C0-6алкилен-O-R1ca, -C1-5алкилен-NR1cbR1cc, -C0-4алкиленарил или -C0-4алкиленгетероарил; R1ca представляет собой H, -C1-6алкил, или -C1-6алкилен-O-C1-6алкил; R1cb и R1cc независимо выбраны из H и -C1-6алкила, или взяты вместе как -(CH2)2-O-(CH2)2-, или -(CH2)2-N[C(O)CH3]-(CH2)2-; R1d представляет собой H, R1c, -C(O)R1c или -C(O)NHR1c; R1e представляет собой -C1-4алкил или арил;
Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -C(R2)-, и W представляет собой связь; Y представляет собой -N-, Z представляет собой -C(R3)-, Q представляет собой -C(R2)-, и W представляет собой связь; Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -N-, и W представляет собой связь; Y представляет собой -C(R3)-, Z представляет собой -CH-, Q представляет собой -N- и W представляет собой связь; или Y представляет собой -C(R3)-, Z представляет собой -CH-, Q представляет собой -C(R2)- и W представляет собой -C(O)-;
R2 выбран из H, галогена, -NO2, -C1-6алкила, -C2-6алкенила, -C3-6циклоалкила, -CN, -C(O)R2a, -C0-5алкилен-OR2b, -C0-5алкилен-NR2cR2d, -C0-3алкиленарила и -C0-3алкиленгетероарила; где R2a выбран из H, -C1-6алкила, -C3-6циклоалкила, -OR2b и -NR2cR2d; R2b выбран из H, -C1-6алкила, -C3-6циклоалкила и -C0-1алкиленарила; и R2c и R2d независимо выбраны из H, -C1-4алкила, и -C0-1алкиленарила;
R3 выбран из -C1-10алкила, -C2-10алкенила, -C3-10алкинила, -C0-3алкилен-C3-7циклоалкила, -C2-3алкенилен-C3-7циклоалкила, -C2-3алкинилен-C3-7циклоалкила, -C0-5алкилен-NR3a-C0-5алкилен-R3b, -C0-5алкилен-O-C0-5алкилен-R3b, -C0-5алкилен-S-C1-5алкилен-R3b и -C0-3алкиленарила; где R3a выбран из H, -C1-6алкила, -C3-7циклоалкила и -C0-3алкиленарила; и R3b выбран из H, -C1-6алкила, -C3-7циклоалкила, -C2-4алкенила, -C2-4алкинила и арила;
X представляет собой -C1-12алкилен-, где по меньшей мере одна группа -CH2- в алкилене заменена на группу -NR4a-C(O)- или -C(O)-NR4a-, где R4a выбран из H, -OH и -C1-4алкила;
R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f, -C0-2алкилен-CHR5g-COOH, -C0-3алкилен-C(O)NR5h-CHR5i-COOH и -C0-3алкилен-S-SR5j; R5a представляет собой H или -C(O)-R5aa; R5aa представляет собой -C1-6алкил, -C0-6алкилен-C3-7циклоалкил, -C0-6алкиленарил, -C0-6алкиленгетероарил, -C0-6алкиленморфолин, -C0-6алкиленпиперазин-CH3, -CH[N(R5ab)2]-aa, где aa представляет собой боковую цепь аминокислоты, -2-пирролидин, -C0-6алкилен-OR5ab, -O-C0-6алкиленарил, -C1-2алкилен-OC(O)-C1-6алкил, -C1-2алкилен-OC(O)-C0-6алкиленарил или -O-C1-2алкилен-OC(O)O-C1-6алкил; R5ab независимо представляет собой H или -C1-6алкил; R5b представляет собой H, -OH, -OC(O)R5ba, -CH2COOH, -O-бензил, -пиридил или -OC(S)NR5bbR5bc; R5ba представляет собой H, -C1-6алкил, арил, -OCH2-арил, -CH2O-арил или -NR5bbR5bc; R5bb и R5bc независимо выбраны из H и -C1-4алкила; R5c представляет собой H, -C1-6алкил, или -C(O)-R5ca; R5ca представляет собой H, -C1-6алкил, -C3-7циклоалкил, арил или гетероарил; R5d представляет собой H, -C1-4алкил, -C0-3алкиленарил, -NR5daR5db, -CH2SH или -O-C1-6алкил; R5da и R5db независимо выбраны из H и -C1-4алкила; R5e представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(CH3)-O-C(O)R5ea,
 или
или 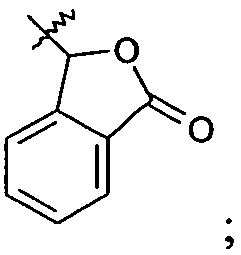
R5ea представляет собой -O-C1-6алкил, -O-C3-7циклоалкил, -NR5ebR5ec или -CH(NH2)CH2COOCH3; R5eb и R5ec независимо выбраны из H, -C1-4алкила и -C1-3алкиленарила или взяты вместе как -(CH2)3-6-; R5f представляет собой H, -C1-4алкил, -C0-3алкиленарил, -C1-3алкилен-NR5faR5fb или -C1-3алкилен(арил)-C0-3алкилен-NR5faR5fb; R5fa и R5fb независимо выбраны из H и -C1-4алкила; R5g представляет собой H, -C1-6алкил, -C1-3алкиленарил или -CH2-O-(CH2)2-O-CH3; R5h представляет собой H или -C1-4алкил; R5i представляет собой H, -C1-4алкил или -C0-3алкиленарил; и R5j представляет собой -C1-6алкил, арил или -CH2CH(NH2)COOH;
R6 выбран из -C1-6алкила, -CH2O(CH2)2-O-CH3, -C1-6алкилен-O-C1-6алкила, -C0-3алкиленарила, -C0-3алкиленгетероарила и -C0-3алкилен-C3-7циклоалкила; и
R7 представляет собой H или взят вместе с R6 с образованием -C3-8циклоалкила;
где каждая группа -CH2- в -(CH2)r-, необязательно, замещена 1 или 2 заместителями, независимо выбранными из -C1-4алкила и фтора; каждое кольцо в Ar и каждый арил и гетероарил в R1-3 и R5-6, необязательно, является замещенным 1-3 заместителями, независимо выбранными из -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила и -N(C1-6алкил)2, где каждый алкил, алкенил и алкинил, необязательно, замещен 1-5 атомами фтора; каждый атом углерода в X, необязательно, замещен одной или несколькими группами R4b, и одна группа -CH2- в X может являться замещенной группой, выбранной из -C4-8циклоалкилена-, -CR4d=CH- и -CH=CR4d-; где R4b выбран из -C0-5алкилен-COOR4c, -C1-6алкила, -C0-1алкилен-CONH2, -C1-2алкилен-OH, -C0-3алкилен-C3-7циклоалкила, 1H-индол-3-ила, бензила и гидроксибензила, где R4c представляет собой H или -C1-4алкил; и R4d выбран из -CH2-тиофена и фенила; каждый алкил и каждый арил в R1-3, R4a-4d и R5-6, необязательно, замещен 1-7 атомами фтора; и его фармацевтически приемлемым солям.
Другой аспект изобретения относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и соединение по изобретению. Такие композиции могут, необязательно, содержать другие лекарственные средства, такие как диуретики, блокаторы β1-адренергических рецепторов, блокаторы кальциевых каналов, ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов AT1, ингибиторы неприлизина, нестероидные противовоспалительные средства, простагландины, антилипидные средства, противодиабетические средства, антитромботические средства, ингибиторы ренина, антагонисты рецепторов эндотелина, ингибиторы эндотелинпревращающего фермента, антагонисты альдостерона, ингибиторы ангиотензинпревращающего фермента/неприлизина, антагонисты рецепторов вазопрессина и их комбинации. Соотвественно, в другом аспекте изобретения фармацевтическая композиция содержит соединение по изобретению, второе лекарственное средство и фармацевтически приемлемый носитель. Другой аспект изобретения относится к комбинации активных средств, содержащих соединение по изобретению и второе лекарственное средство. Соединение по изобретению можно составлять вместе с дополнительным средством(средствами) или отдельно от них. При отдельном составлении фармацевтически приемлемый носитель можно включать с дополнительным средством(средствами). Таким образом, другой аспект изобретения относится к комбинации фармацевтических композиций, где комбинация содержит первую фармацевтическую композицию, содержащую соединение по изобретению и первый фармацевтически приемлемый носитель; и вторую фармацевтическую композицию, содержащую второе лекарственное средство и второй фармацевтически приемлемый носитель. Изобретение также относится к набору, содержащему фармацевтические композиции, например, где первая и вторая фармацевтические композиции представляют собой отдельные фармацевтические композиции.
Соединения по изобретению обладают как активностью антагониста рецептора AT1, так и активностью ингибирования фермента NEP, и таким образом, ожидают, что они могут являться применимыми в качестве лекарственных средств для лечения пациентов, страдающих от заболевания или нарушения, которое лечат посредством антагонизма рецептора AT1 и/или ингибирования фермента NEP. Таким образом, один аспект изобретения относится к способу лечения пациентов, страдающих от заболевания или нарушения, которое лечат посредством антагонизма рецептора AT1 и/или ингибирования фермента NEP, включающему введение пациенту терапевтически эффективного количества соединения по изобретению. Другой аспект изобретения относится к способу лечения гипертензии или сердечной недостаточности, включающему введение пациенту терапевтически эффективного количества соединения по изобретению. Другой аспект изобретения относится к способу антагонизма рецептора AT1 у млекопитающего, включающему введение млекопитающему обеспечивающего антагонизм рецептора AT1 количества соединения по изобретению. Другой аспект изобретения относится к способу ингибирования фермента NEP у млекопитающего, включающему введение млекопитающему обеспечивающего ингибирование фермента NEP количества соединения по изобретению.
Соединения формулы I и их фармацевтически приемлемые соли, представляющие особенный интерес, включают соединения, обладающие константой ингибирования (pKi) для связывания с рецептором AT1, большей или равной приблизительно 5,0; в частности, соединения, обладающие pKi, большей или равной приблизительно 6,0; в одном варианте осуществления соединения, обладающие pKi, большей или равной приблизительно 7,0; более конкретно, соединения, обладающие pKi, большей или равной приблизительно 8,0; и в другом варианте осуществления соединения, обладающие pKi в диапазоне приблизительно 8,0-10,0. Соединения, представляющие особенный интерес, включают также соединения, обладающие ингибирующей концентрацией (pIC50) фермента NEP, большей или равной приблизительно 5,0; в одном варианте осуществления соединения, обладающие pIC50, большей или равной приблизительно 6,0; в частности, соединения, обладающие pIC50, большей или равной приблизительно 7,0; и особенно соединения, обладающие pIC50 в диапазоне приблизительно 7,0-10,0. Соединения, представляющие дополнительный интерес, включают соединения, обладающие pKi для связывания с рецептором AT1, большей или равной приблизительно 7,5, и обладающие pIC50 для фермента NEP, большей или равной приблизительно 7,0.
Поскольку соединения по изобретению обладают активностью антагониста рецептора AT1 и активностью ингибирования NEP, такие соединения являются также применимыми в качестве инструментов исследования. Соответственно, один аспект изобретения относится к способу использования соединения по изобретению в качестве инструмента исследования, где способ включает проведение биологического анализа с использованием соединения по изобретению. Соединения по изобретению можно также использовать для оценки новых химических соединений. Таким образом, другой аспект изобретения относится к способу оценки тестируемого соединения в биологическом анализе, включающему (a) проведение биологического анализа с тестируемым соединением с получением первого результата анализа; (b) проведение биологического анализа с соединением по изобретению с получением второго результата анализа; где стадию (a) проводят до, после или во время стадии (b); и (c) сравнение первого результата анализа со стадии (a) со вторым результатом анализа со стадии (b). Примеры биологических анализов включают анализ связывания рецептора AT1 и анализ ингибирования фермента NEP. Другой аспект изобретения относится к способу исследования биологической системы или образца, содержащего рецептор AT1, фермент NEP, или оба, где способ включает (a) приведение в контакт биологической системы или образца с соединением по изобретению; и (b) определение эффектов, оказываемых соединением на биологическую систему или образец.
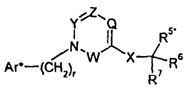
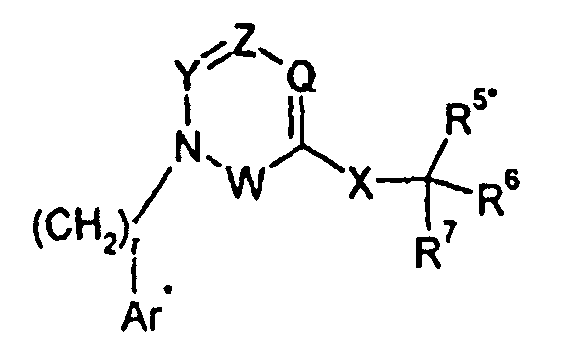
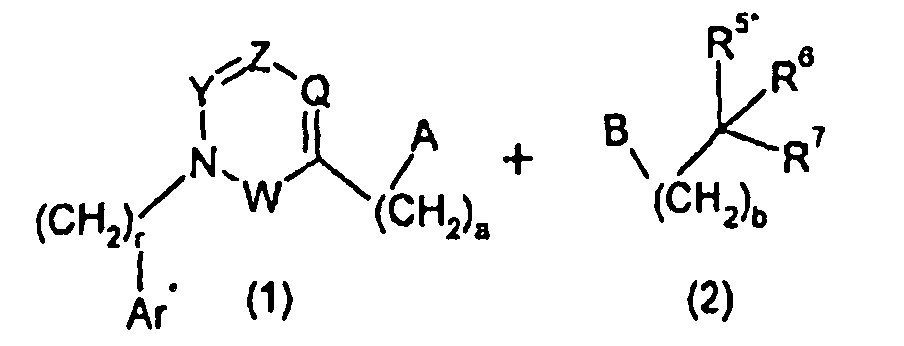
Изобретение относится также к способам и промежуточным соединениям, применимым при получении соединений по изобретению. Соответственно, другой аспект изобретения относится к способу получения соединения по изобретению, включающему взаимодействие соединения формулы 1 с соединением формулы 2:
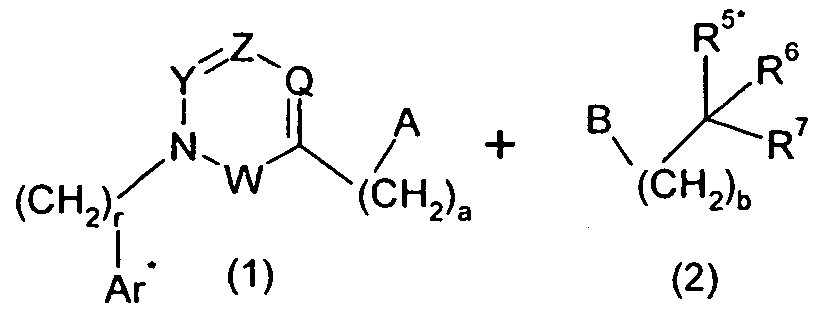
где A представляет собой -NH2 и B представляет собой -COOH или A представляет собой -COOH, и B представляет собой -NH2; сумма a и b лежит в диапазоне от 0 до 11; Ar* представляет собой Ar-R1*, где R1* представляет собой R1 или защищенную форму R1; и R5* представляет собой R5 или защищенную форму R5; атомы углерода в группах -(CH2)a и -(CH2)b могут являться замещенными одной или несколькими группами R4b; и одна группа -CH2- в группе -(CH2)a или -(CH2)b может являться замещенной -C4-8циклоалкиленом-, -CR4d=CH-, или -CH=CR4d-; и необязательно, снятие защиты продукта, когда R1* представляет собой защищенную форму R1 и/или R5* представляет собой защищенную форму R5. Другой аспект изобретения относится к способу получения фармацевтически приемлемой соли соединения формулы I, включающему приведение в контакт соединения формулы I в форме свободной кислоты или основания с фармацевтически приемлемым основанием или кислотой. Другие аспекты изобретения относятся к продуктам, полученным любым из способов, описанных в настоящем описании, так же как к новым промежуточным соединениям, применяемым в таком способе. В одном аспекте изобретения новые промежуточные соединения имеют формулы VIII, IX или X.
Другой аспект изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли для изготовления лекарственного средства, особенно для изготовления лекарственного средства, пригодного для лечения гипертензии или сердечной недостаточности. Другой аспект изобретения относится к применению соединения по изобретению для антагонизма рецептора AT1 или для ингибирования фермента NEP у млекопитающего. Другой аспект изобретения относится к применению соединения по изобретению в качестве инструмента исследования. Другие аспекты и варианты осуществления изобретения описаны в настоящем описании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к соединениям формулы I:
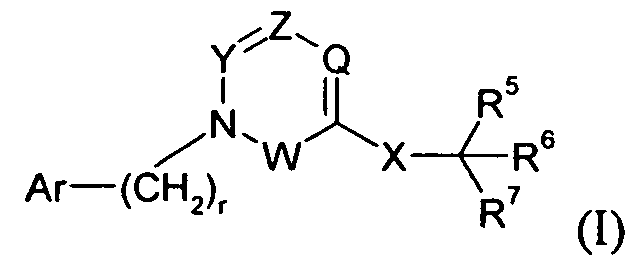
и их фармацевтически приемлемым солям.
Как применяют в настоящем описании, термин «соединение по изобретению» предназначен, чтобы включать соединения формулы I, так же как разновидности, показанные в формулах II-VI. Кроме того, соединения по изобретению могут также содержать основные или кислотные группы (например, амино- или карбоксильные группы), таким образом, такие соединения могут существовать в форме свободного основания, свободной кислоты или в формах различных солей. Все такие формы солей включены в объем изобретения. Более того, сольваты соединений формулы I или их солей включены в объем изобретения. Наконец, соединения по изобретению могут также существовать в форме пролекарств. Соответственно, специалистам в данной области понятно, что ссылка на соединение в настоящем описании, например, ссылка на «соединение по изобретению» включает ссылку на соединение формулы I, так же как на фармацевтически приемлемые соли, сольваты и пролекарства этого соединения, если нет иных указаний. Кроме того, термин «или его фармацевтически приемлемая соль, сольват и/или пролекарство» предназначен, чтобы включать все перестановки солей и сольватов, например, сольват фармацевтически приемлемой соли.
Соединения формулы I могут содержать один или несколько хиральных центров и, таким образом могут существовать в ряде стереоизомерных форм. Когда присутствуют хиральные центры, изобретение относится к рацемическим смесям, чистым стереоизомерам (энантиомерам или диастереомерам), обогащенным стереоизомером смесям, и т.п., если нет иных указаний. Когда химическая структура указана без какой-либо стереохимии, понятно, что все возможные стереоизомеры включены в такую структуру. Таким образом, например, термин «соединение формулы I» предназначен, чтобы включать все возможные стереоизомеры соединения. Подобным образом, когда конкретный стереоизомер показан или назван в настоящем описании, специалист в данной области может понять, что незначительные количества других стереоизомеров могут присутствовать в композициях по изобретению, если нет иных указаний, при условии, что полезность композиции в целом не прекращается посредством присутствия таких других таких изомеров. Отдельные энантиомеры можно получать многими способами, которые хорошо известны в данной области, включая хиральную хроматографию с использованием подходящей для хиральной хроматографии неподвижной фазы или носителя, или посредством химического превращения их в диастереомеры, разделения диастереомеров общепринятыми способами, такими как хроматография или перекристаллизация, затем регенерации исходных энантиомеров. Кроме того, при необходимости, все цис-транс или E/Z изомеры (геометрические изомеры), таутомерные формы и топоизомерные формы соединений по изобретению включены в объем изобретения, если не указано иначе.
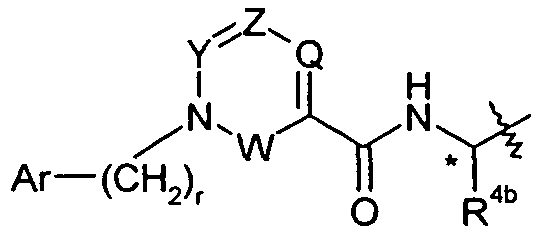
Соединения формулы I могут содержать один или несколько хиральных центров. Один из возможных хиральных центров может присутствовать в части «X» соединения. Например, хиральные центры существуют у атома углерода в алкиленовой группе в X, который замещен на группу R4b, такую как -C1-6алкил, например, -CH3. Этот хиральный центр присутствует у атома углерода, указанного символом * в следующей частичной формуле:
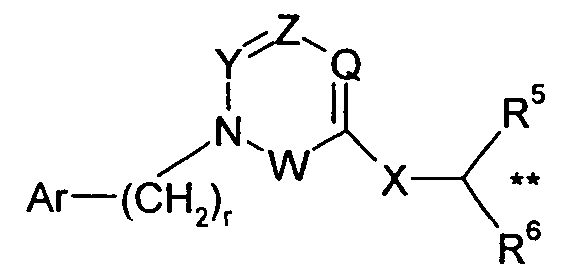
Другой возможный хиральный центр может присутствовать у атома углерода в группе -X-CR5R6R7, когда R6 представляет собой такую группу, как -C1-6алкил, например, -CH2CH(CH3)2, и R7 представляет собой водород. Этот хиральный центр присутствует у атома углерода, указанного символом ** в следующей формуле:
В одном варианте осуществления изобретения атом углерода, обозначенный символом * и/или **, обладает конфигурацией (R). В этом варианте осуществления соединения формулы I обладают конфигурацией (R) по атому углерода, указанному символом * и/или **, или являются обогащенными стереоизомерной формой, обладающей конфигурацией (R) по этому атому (или атомам) углерода. В другом варианте осуществления атом углерода, указанный символом * и/или **, обладает конфигурацией (S). В этом варианте осуществления соединения формулы I обладают конфигурацией (S) по атому углерода, указанному символом * и/или **, или являются обогащенными стереоизомерной формой, обладающей конфигурацией (S) по этому атому углерода. Понятно, что соединение может обладать хиральным центром как на *, так и на ** атомах углерода. В таких случаях могут существовать четыре возможных диастереомера. В некоторых случаях, чтобы оптимизировать терапевтическую активность соединений по изобретению, например, в качестве антигипертензивных средств, может являться желательным, чтобы атом углерода, указанный символом * и/или **, обладал конкретной конфигурацией (R) или (S).
Соединения по изобретению, так же как соединения, используемые при их синтезе, могут также включать меченные изотопами соединения, то есть, где один или несколько атомов обогащены атомами, обладающими атомной массой, отличной от атомной массы, преимущественно обнаруживаемой в природе. Примеры изотопов, которые можно включать в соединения формулы I, включают в качестве неограничивающих примеров, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 35S, 36Cl и 18F.
Обнаружено, что соединения формулы I обладают активностью антагонизма рецептора AT1 и активностью ингибирования фермента NEP. Ожидают, что помимо других свойств, такие соединения могут являться пригодными в качестве лекарственных средств для лечения заболеваний, таких как гипертензия. Объединением двойной активности в одном соединении можно достигать двойной терапии, то есть, активность антагониста рецептора AT1 и активность ингибирования фермента NEP можно получать с использованием одного активного компонента. Поскольку фармацевтические композиции, содержащие один активный компонент, как правило, проще составлять, чем композиции, содержащие два активных компонента, такие однокомпонентные композиции обеспечивают значительное преимущество по сравнению с композициями, содержащими два активных компонента. Кроме того, обнаружено также, что конкретные соединения по изобретению являются избирательными для ингибирования рецептора AT1 по сравнению с рецептором 2 типа ангиотензина II (AT2), и это свойство может обладать терапевтическими преимуществами.
Номенклатура, используемая в настоящем описании для наименования соединений по изобретению, проиллюстрирована в примерах в настоящем описании. Эту номенклатуру получили с использованием коммерчески доступного программного обеспечения AutoNom (MDL, San Leandro, California).
РЕПРЕЗЕНТАТИВНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следующие заместители и значения предназначены для предоставления репрезентативных примеров различных аспектов и вариантов осуществления по изобретению. Эти репрезентативные значения предназначены, чтобы дополнительно определить и проиллюстрировать такие аспекты и варианты осуществления и не предназначены для исключения других вариантов осуществления или для ограничения объема изобретения. В этом отношении утверждение, что конкретное значение или заместитель является предпочтительным, не предназначено, чтобы каким-либо образом исключать другие значения или заместители из изобретения, если не указано конкретно.
Изобретение относится к соединениям формулы I:
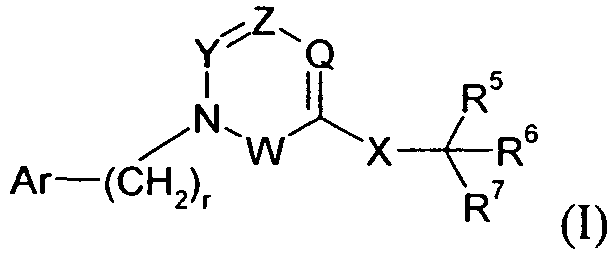
В одном варианте осуществления Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -C(R2)- и W представляет собой связь. Этот вариант осуществления формулы I можно представить формулой II:
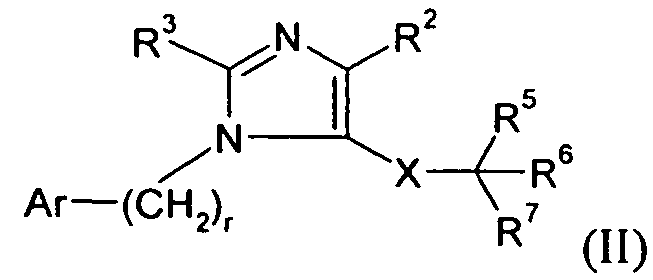
В другом варианте осуществления Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -N- и W представляет собой связь. Этот вариант осуществления формулы I можно представить посредством III:
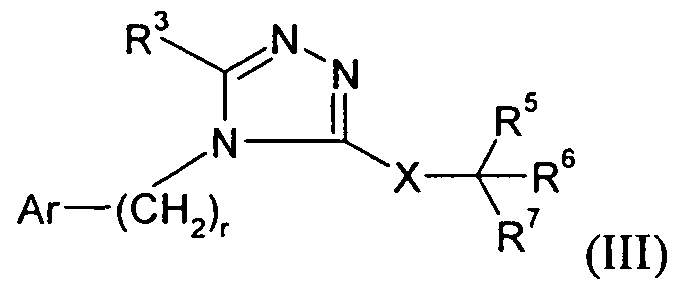
В другом варианте осуществления Y представляет собой -C(R3)-, Z представляет собой -CH-, Q представляет собой -C(R2)- и W представляет собой -C(O)-. Этот вариант осуществления формулы I можно представить посредством IV:
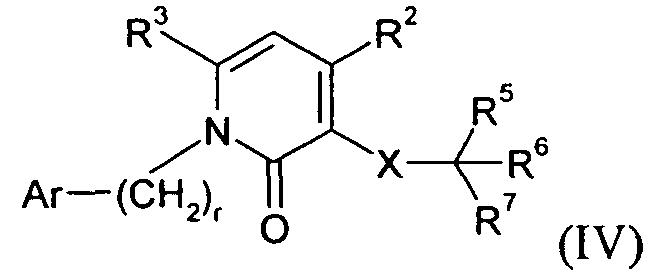
В другом варианте осуществления Y представляет собой -N-, Z представляет собой -C(R3)-, Q представляет собой -C(R2)- и W представляет собой связь. Этот вариант осуществления формулы I можно представить посредством V:
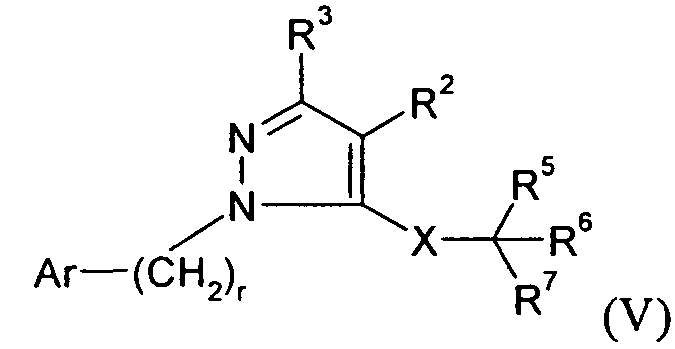
В другом варианте осуществления Y представляет собой -C(R3)-, Z представляет собой -CH-, Q представляет собой -N- и W представляет собой связь. В этом варианте осуществления формулу I можно представить в виде подкласса VI:
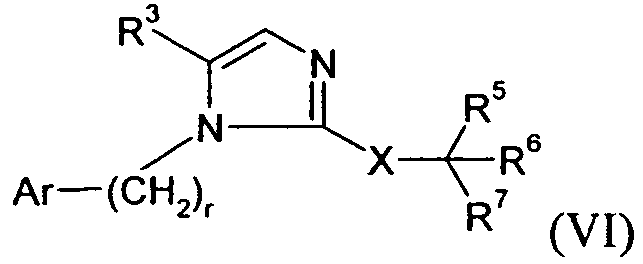
В конкретных вариантах осуществления Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -C(R2)- и W представляет собой связь, или Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -N- и W представляет собой связь.
Значения для r составляют 0, 1 или 2. В одном варианте осуществления r представляет собой 1. Каждая группа -CH2- в -(CH2)r- может являться замещенной 1 или 2 заместителями, независимо выбранными из -C1-4алкила (например, -CH3) и фтора. В одном конкретном варианте осуществления группа -(CH2)r- является незамещенной; в другом варианте осуществления одна или две группы -CH2- в -(CH2)r- являются замещенными -C1-4алкильной группой.
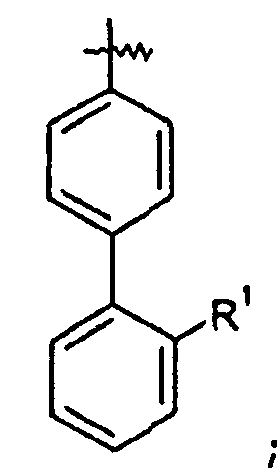
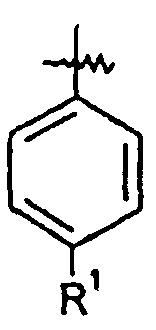
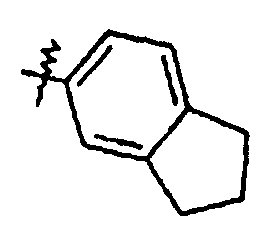
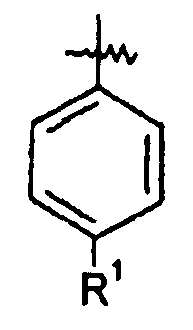
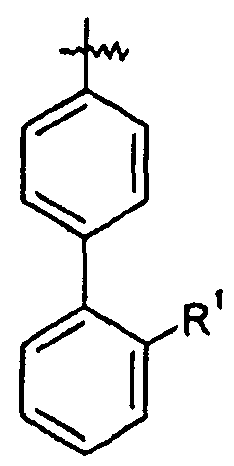
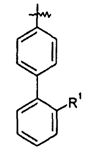
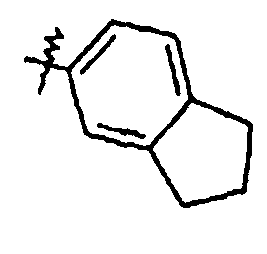
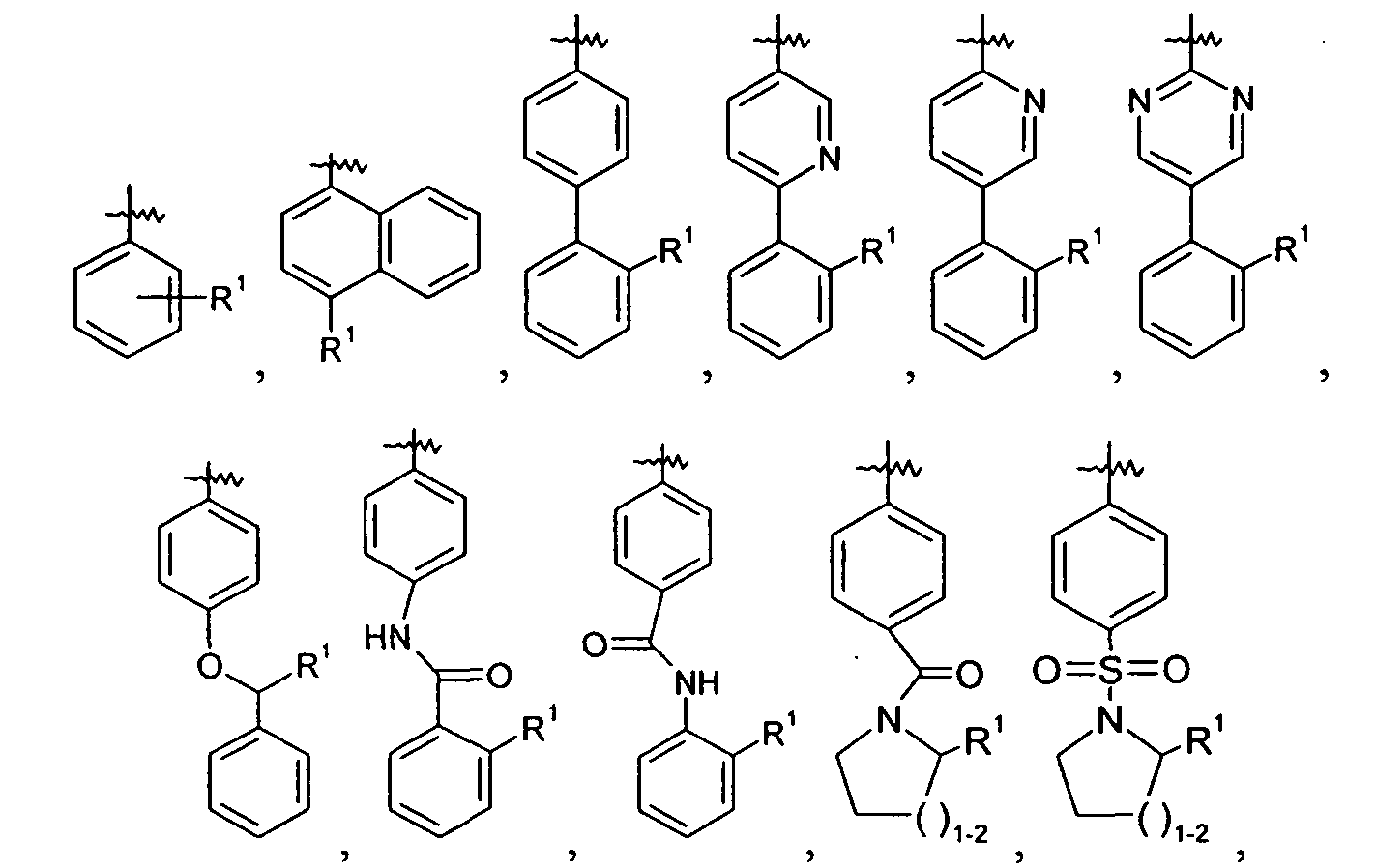
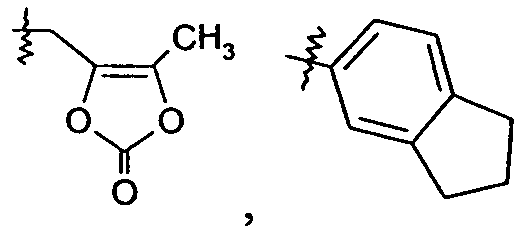
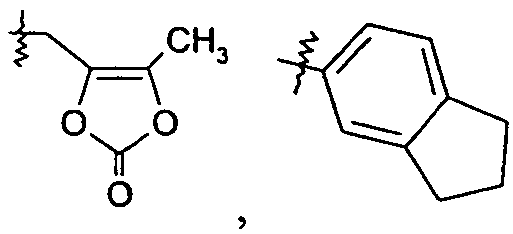
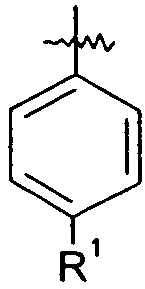
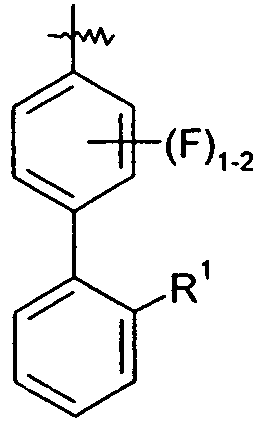
Ar представляет собой арильную группу, выбранную из
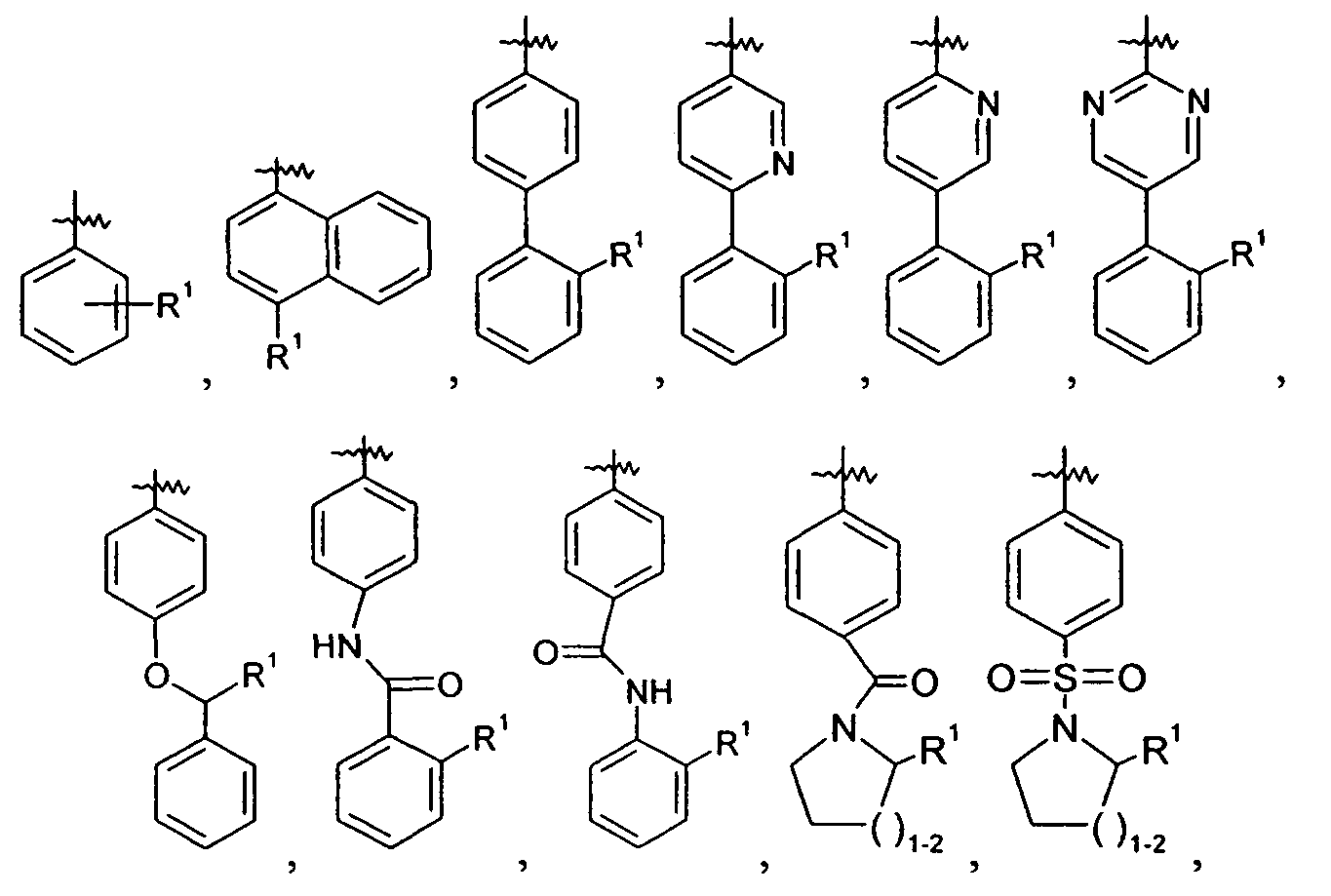
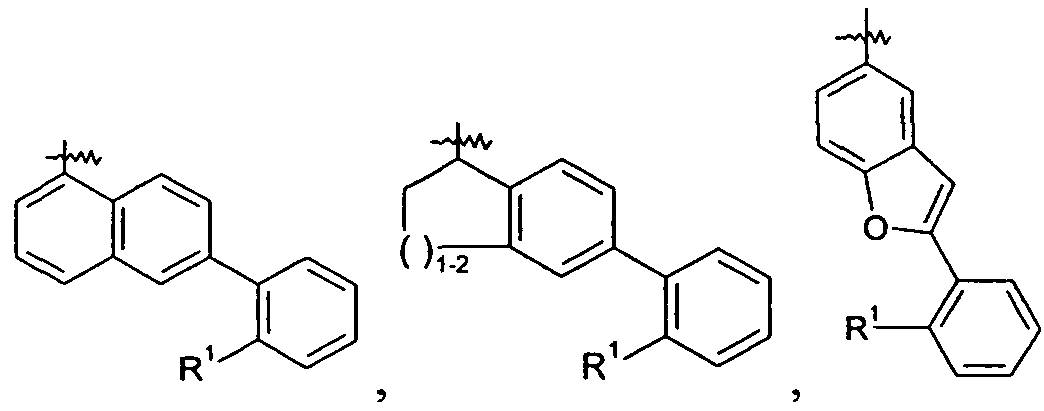 и
и 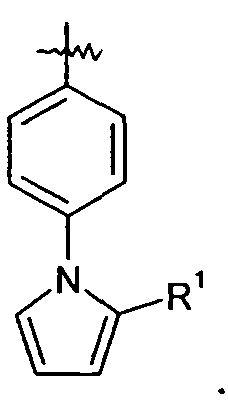
Каждое кольцо в группе Ar может являться замещенным 1-3 заместителями, независимо выбранными из -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила и -N(C1-6алкил)2. Более того, каждая из вышеупомянутых групп алкила, алкенила и алкинила, необязательно, является замещенной 1-5 атомами фтора.
В одном конкретном варианте осуществления каждое кольцо в группе Ar может являться замещенным 1-2 заместителями, независимо выбранными из -OH, -C1-4алкила (например, -CH3), галогена (например, бром, фтор, хлор и дифтор), -O-C1-4алкила (например, -OCH3) и -фенила. Примеры замещенных групп Ar включают:
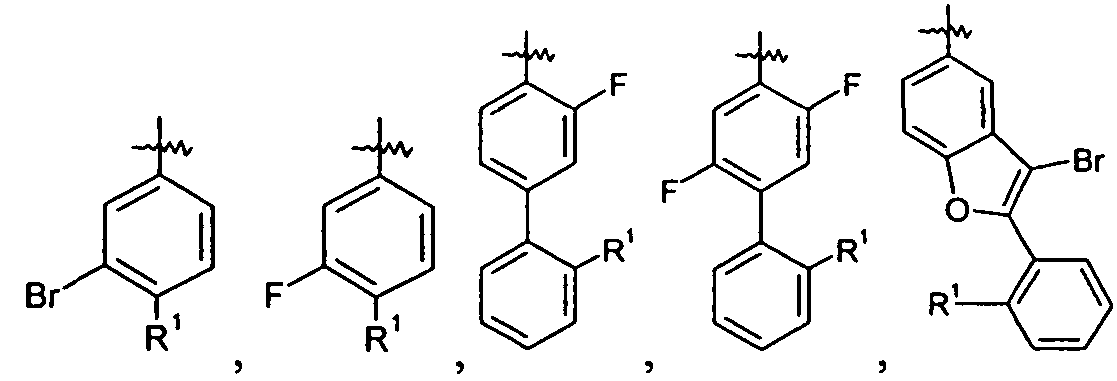 и
и 
Особенный интерес представляют группы, где Ar является замещенным 1 или 2 атомами галогена, в частности, атомами фтора.
Понятно, что:
 представляет собой
представляет собой 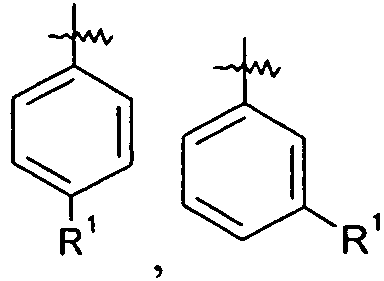 и
и 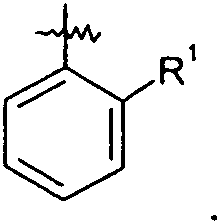
В одном конкретном варианте осуществления Ar выбран из
 и
и 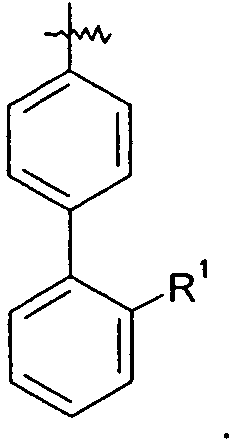
В другом конкретном варианте осуществления Ar представляет собой:
 , в частности,
, в частности, 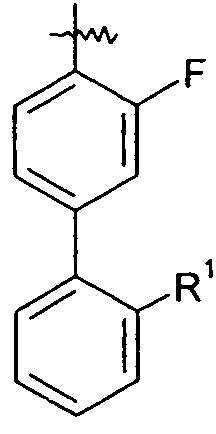 и
и 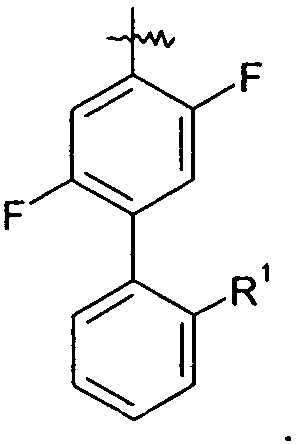
R1 выбран из -COOR1a, -NHSO2R1b, -SO2NHR1d, -SO2OH, -C(O)NH-SO2R1c, -P(O)(OH)2, -CN, -O-CH(R1e)-COOH, тетразол-5-ила,
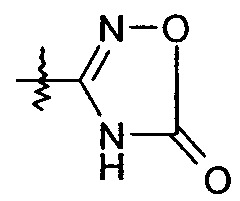 и
и 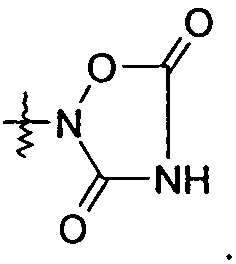
Группа R1a представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa, -C0-6алкиленморфолин,
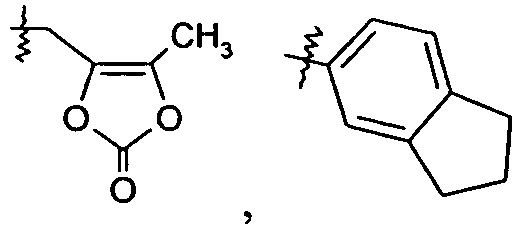 или
или 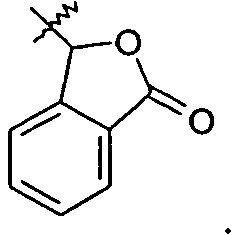
R1aa представляет собой -O-C1-6алкил, -O-C3-7циклоалкил, -NR1abR1ac или -CH(NH2)CH2COOCH3. R1ab и R1ac независимо выбраны из H, -C1-6алкила и бензила или взяты вместе как -(CH2)3-6-.
Группа R1b представляет собой R1c или -NHC(O)R1c. Группа R1c представляет собой -C1-6алкил, -C0-6алкилен-O-R1ca, -C1-5алкилен-NR1cbR1cc или -C0-4алкиленарил. Группа R1ca представляет собой H, -C1-6алкил или -C1-6алкилен-O-C1-6алкил. Группы R1cb и R1cc независимо выбраны из H и -C1-6алкила или взяты вместе как -(CH2)2-O-(CH2)2- или -(CH2)2-N[C(O)CH3]-(CH2)2-. Группа R1d представляет собой H, R1c, -C(O)R1c или -C(O)NHR1c. Группа R1e представляет собой C1-4алкил или арил.
Каждый алкил и каждый арил в R1, необязательно, является замещенным 1-7 атомами фтора. Кроме того, термин «алкил» предназначен, чтобы включать двухвалентные алкиленовые группы, такие как присутствующие, например, в -C1-3алкиленариле и -C1-3алкиленгетероариле. Кроме того, каждая арильная и гетероарильная группа, которая может присутствовать в R1, может являться замещенной 1-3 группами -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила или -N(C1-6алкил)2. Кроме того, каждая из вышеупомянутых групп алкила, алкенила и алкинила может являться замещенной 1-5 атомами фтора. Понятно, что при ссылке на «каждую алкильную», «каждую арильную» и «каждую гетероарильную» группу в R1, термины включают также любую алкильную, арильную и гетероарильную группы, которые могут присутствовать в группах R1a-R1e.
В одном варианте осуществления R1 представляет собой -COOR1a и R1a представляет собой H. В другом варианте осуществления R1 представляет собой -COOR1a и R1a представляет собой -C1-6алкил, примеры которых включают -CH3, -CH2CH3, -(CH2)2CH3, -(CH2)2-CF3, -CH2CH(CH3)2, -CH(CH3)2, -CH(CH3)-CF3, -CH(CH2F)2, -C(CH3)3, -(CH2)3CH3 и -(CH2)2-CF2CF3. Таким образом, примеры R1 включают -C(O)OCH3, -COOCH2CH3 и т.д.
В одном варианте осуществления R1 представляет собой -COOR1a, и R1a представляет собой -C1-3алкиленарильную, например, бензильную, группу, которая может являться замещенной, такую как хлорбензил, фторбензил, дифторбензил, -бензил-CH3, -бензил-CF3, и -бензил-O-CF3. Таким образом, примеры R1 включают -C(O)OCH2-бензил,
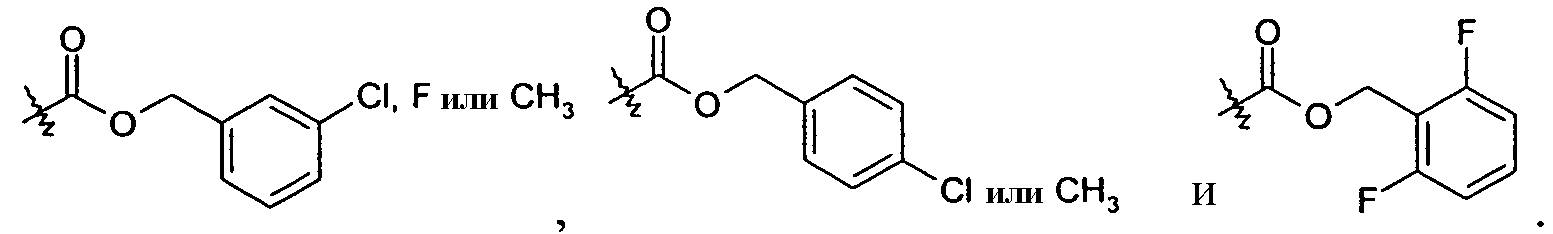
В одном варианте осуществления R1 представляет собой -COOR1a, и R1a представляет собой -C1-3алкиленгетероарил, примеры которых включают -CH2-пиридинил. В одном варианте осуществления R1 представляет собой -COOR1a, и R1a представляет собой -C3-7циклоалкил, примеры которых включают циклопентил.
В другом варианте осуществления R1 представляет собой -COOR1a, и R1a представляет собой -CH(C1-4алкил)OC(O)R1aa, где R1aa представляет собой -O-C1-6алкил, -O-C3-7циклоалкил, -NR1abR1ac или -CH(NH2)CH2COOCH3. R1ab и R1ac независимо выбраны из H, -C1-6алкила и бензила или взяты вместе как -(CH2)3-6-. Примеры -O-C1-6алкильных групп включают -O-CH2CH3 и -O-CH(CH3)2. Примеры -O-C3-7циклоалкильных групп включают -O-циклогексил. Таким образом, примеры R1 включают -C(O)OCH(CH3)OC(O)-O-CH2CH3, -C(O)OCH(CH3)OC(O)-O-CH(CH3)2 и -C(O)OCH(CH3)OC(O)-O-циклогексил.
В одном варианте осуществления R1 представляет собой -COOR1a и R1a представляет собой -C0-6алкиленморфолин, примеры которого включают -(CH2)2-морфолин и -(CH2)3-морфолин. В другом варианте осуществления R1a представляет собой
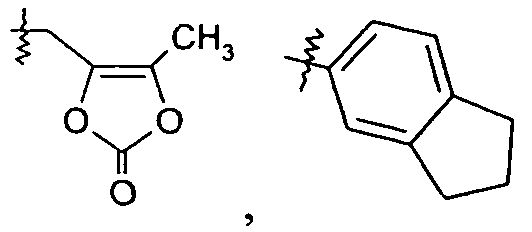 или
или 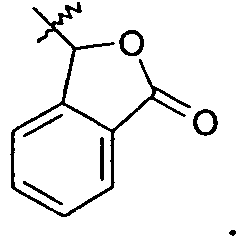
В одном варианте осуществления R1 представляет собой -NHSO2R1b, и R1b представляет собой R1c. Группа R1c представляет собой -C1-6алкил, -C0-6алкилен-O-R1ca, -C1-5алкилен-NR1cbR1cc, -C0-4алкиленарил или -C0-4алкиленгетероарил. Группа R1ca представляет собой H, -C1-6алкил или -C1-6алкилен-O-C1-6алкил. Группы R1cb и R1cc независимо выбраны из H и -C1-6алкила или взяты вместе как -(CH2)2-O-(CH2)2- или -(CH2)2-N[C(O)CH3]-(CH2)2-. В одном варианте осуществления R1c представляет собой -C1-6алкил, так что примеры групп R1 включают -NHSO2-CH3 и фторзамещенную группу, -NHSO2-CF3. В другом варианте осуществления R1c представляет собой -C0-4алкиленарил, так что примеры групп R1 включают -NHSO2-фенил. В другом варианте осуществления R1c представляет собой -C0-4алкиленгетероарил, так что примеры групп R1 включают -NHSO2- 4,5-диметилизоксазол-3-ил.
В другом варианте осуществления R1 представляет собой -NHSO2R1b и R1b представляет собой -NHC(O)R1c, где R1c определен выше. В конкретном варианте осуществления R1 представляет собой -NHSO2R1b, R1b представляет собой -NHC(O)R1c и R1c представляет собой -C1-6алкил или -C0-4алкиленарил.
В одном варианте осуществления R1 представляет собой -SO2NHR1d и R1d представляет собой H. В другом варианте осуществления R1 представляет собой -SO2NHR1d и R1d представляет собой R1c, где R1c определен выше. В конкретном варианте осуществления R1c представляет собой -C1-6алкил или -C0-4алкиленарил. Когда R1c представляет собой -C1-6алкил, примеры групп R1 включают фторзамещенные группы -SO2NH-CF3, -SO2NH-CHF2, -SO2NH-CF2CH2F и -SO2NH-CF2CF2CF3.
В другом варианте осуществления R1 представляет собой -SO2NHR1d и R1d представляет собой -C(O)R1c, где R1c определен выше. В одном представляющем особенный интерес варианте осуществления R1c представляет собой -C1-6алкил или -C0-4алкиленарил. Когда R1c представляет собой -C1-6алкил, примеры групп R1 включают -SO2NHC(O)CH3 и -SO2NHC(O)-(CH2)2CH3. Когда R1c представляет собой -C0-6алкилен-O-R1ca и R1ca представляет собой H, примеры групп R1 включают -SO2NHC(O)CH2OH, -SO2NHC(O)CH(CH3)OH и -SO2NHC(O)C(CH3)2OH. Когда R1c представляет собой -C0-6алкилен-O-R1ca, и R1ca представляет собой -C1-6алкил, примеры групп R1 включают -SO2NHC(O)CH2-O-CH3, -SO2NHC(O)-O-CH3 и -SO2NHC(O)-O-CH2CH3. Когда R1c представляет собой -C0-6алкилен-O-R1ca и R1ca представляет собой -C1-6алкилен-O-C1-6алкил, примеры групп R1 включают -SO2NHC(O)CH2-O-(CH2)2-O-CH3. Когда R1c представляет собой -C1-5алкилен-NR1cbR1cc, примеры групп R1 включают -SO2NHC(O)CH2N(CH3)2, -SO2NHC(O)-CH2-NH2 и -SO2NHC(O)-CH(CH3)-NH2. Другим примером, когда R1c представляет собой -C1-5алкилен-NR1cbR1cc, является тот, где R1cb и R1cc взяты вместе как -(CH2)2-O-(CH2)2- или -(CH2)2-N[C(O)CH3]-(CH2)2-. Такие примеры групп R1 включают
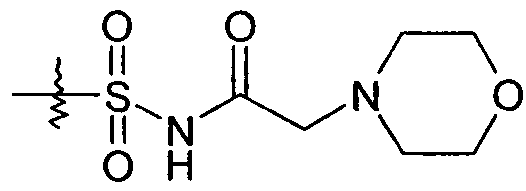 и
и 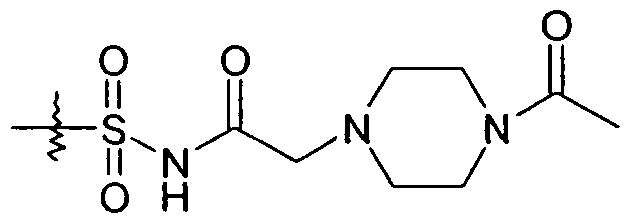
В другом варианте осуществления R1 представляет собой -SO2NHR1d и R1d представляет собой -C(O)NHR1c, где R1c определен выше. В конкретном варианте осуществления R1c представляет собой -C1-6алкил или -C0-4алкиленарил. Когда R1c представляет собой -C1-6алкил, примеры групп R1 включают -SO2NHC(O)NH-CH2CH3 и -SO2NHC(O)NH-(CH2)2CH3. Когда R1c представляет собой -C0-4алкиленарил, примеры групп R1 включают -SO2NHC(O)NH-фенил.
В другом варианте осуществления R1 представляет собой -SO2OH, и в другом варианте осуществления R1 представляет собой -P(O)(OH)2. В другом варианте осуществления R1 представляет собой -CN.
В другом варианте осуществления R1 представляет собой -C(O)NH-SO2R1c, где R1c определен выше. В конкретном варианте осуществления R1c представляет собой -C1-6алкил или -C0-4алкиленарил. Когда R1c представляет собой -C1-6алкил, примеры групп R1 включают -C(O)-NH-SO2-CH3, -C(O)-NH-SO2-CH2CH3 и фторзамещенную группу -C(O)-NH-SO2-CF3.
В другом варианте осуществления R1 представляет собой -O-CH(R1e)-COOH, где R1e представляет собой -C1-4алкил или арил. Примеры таких групп R1 включают -O-CH(CH3)-COOH и -O-CH(фенил)-COOH.
В представляющем особенный интерес варианте осуществления R1 представляет собой тетразол-5-ил. В другом варианте осуществления R1 представляет собой:
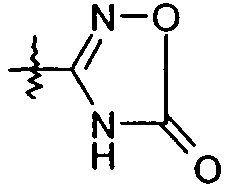 или
или 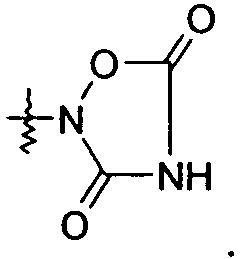
R2 выбран из H, галогена, -NO2, -C1-6алкила, -C2-6алкенила, -C3-6циклоалкила, -CN, -C(O)R2a, -C0-5алкилен-OR2b, -C0-5алкилен-NR2cR2d, -C0-3алкиленарила и -C0-3алкиленгетероарила. В одном конкретном варианте осуществления R2 выбран из H, -C0-5алкилен-OR2b и галогена; и в другом варианте осуществления R2 выбран из H и галогена. В одном варианте осуществления R2 представляет собой галоген, такой как хлор или фтор. В другом варианте осуществления R2 представляет собой -C1-6алкил, такой как -CH3 и -CH2CH3. В другом варианте осуществления R2 представляет собой -C0-3алкиленарил, такой как фенил. В одном варианте осуществления R2 представляет собой -C(O)R2a. Заместитель R2a может представлять собой H, -C1-6алкил, -C3-6циклоалкил, -OR2b или -NR2cR2d. R2b выбран из H, -C1-6алкила, -C3-6циклоалкила и -C0-1алкиленарила. Группы R2c и R2d независимо выбраны из H, -C1-4алкила и -C0-1алкиленарила. В другом конкретном варианте осуществления R2 представляет собой -C0-5алкилен-OR2b, более конкретно, -C0-3алкилен-OR2b. В примерах вариантов осуществления и R2b представляет собой H или -C1-6алкил, например, R2 может представлять собой -CH2OH, -C(CH3)2OH или -OCH3.
Каждый алкил и каждый арил в R2, необязательно, является замещенным 1-7 атомами фтора. Понятно, что при ссылке на «алкил» в R2, термин включает любые алкильные группы, которые могут присутствовать в группах R2a, R2b, R2c и R2d. Кроме того, арил и гетероарил в R2, например, в -C0-3алкиленариле или -C0-3алкиленгетероариле, может являться замещенным 1-3 группами -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила или -N(C1-6алкил)2. Кроме того, каждая из вышеупомянутых групп алкила, алкенила и алкинила может являться замещенной 1-5 атомами фтора. Понятно, что при ссылке на «арил» или «гетероарил» в R2, термин включает любые арильные и гетероарильные группы, которые могут присутствовать в группах R2a, R2b, R2c и R2d.
R3 выбран из -C1-10алкила, -C2-10алкенила, -C3-10алкинила, -C0-3алкилен-C3-7циклоалкила, -C2-3алкенилен-C3-7циклоалкила, -C2-3алкинилен-C3-7циклоалкила, -C0-5алкилен-NR3a-C0-5алкилен-R3b, -C0-5алкилен-O-C0-5алкилен-R3b, -C0-5алкилен-S-C1-5алкилен-R3b и -C0-3алкиленарила. Группа R3a представляет собой H, -C1-6алкил, -C3-7циклоалкил или -C0-3алкиленарил (например, -C0-1алкиленарил, такой как фенил и бензил). Группа R3b представляет собой H, -C1-6алкил, -C3-7циклоалкил, -C2-4алкенил, -C2-4алкинил или арил (такой как фенил).
Кроме того, каждый алкил и каждый арил в R3, необязательно, является замещенным 1-7 атомами фтора, где термин «алкил» предназначен, чтобы включать двухвалентные алкиленовые группы, такие как группы, присутствующие, например, в -C0-3алкилен-C3-7циклоалкиле и -C0-3алкиленариле. Каждый арил в R3, например, в -C0-3алкиленариле или ариле, может являться замещенным 1-3 группами -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила или -N(C1-6алкил)2. Кроме того, каждая из вышеупомянутых алкильных, алкенильных и алкинильных групп может являться замещенной 1-5 атомами фтора. Понятно, что при ссылке на «каждую алкильную» и «каждую арильную» группу в R3, термины также включают любые алкильные и арильные группы, которые могут присутствовать в группах R3a и R3b.
В одном варианте осуществления R3 представляет собой -C1-10алкил, необязательно, замещенный 1-7 атомами фтора, такой как -CF3. В другом варианте осуществления R3 представляет собой -C2-7алкил; и в другом варианте осуществления R3 представляет собой -C2-5алкил, примеры которого включают -CH2CH3, -(CH2)2CH3, и -(CH2)3CH3.
В другом варианте осуществления R3 представляет собой -C2-10алкенил, такой как -CH2CH=CHCH3. В другом варианте осуществления R3 представляет собой -C3-10алкинил, такой как -CH2C≡CCH3.
В другом варианте осуществления R3 представляет собой -C0-3алкилен-C3-7циклоалкил, такой как -циклопропил, -CH2-циклопропил, циклопентил, -CH2-циклопентил, -(CH2)2-циклопентил и -CH2-циклогексил. В конкретном варианте осуществления R3 представляет собой -C0-1алкилен-C3-5циклоалкил. В одном варианте осуществления R3 представляет собой -C2-3алкенилен-C3-7циклоалкил, такой как -CH2CH=CH-циклопентил; и в другом варианте осуществления R3 представляет собой -C2-3алкинилен-C3-7циклоалкил, такой как -CH2C≡C-циклопентил.
В другом варианте осуществления R3 представляет собой -C0-5алкилен-NR3a-C0-5алкилен-R3b. В одном конкретном варианте осуществления R3a представляет собой H и R3b представляет собой -C1-6алкил. Примеры таких групп R3 включают -NHCH2CH3, -NHCH(CH3)2, -NH(CH2)2CH3, -NH(CH2)3CH3, -NHCH(CH3)CH2CH3, -NH(CH2)4CH3 и -NH(CH2)5CH3.
В одном варианте осуществления R3 представляет собой -C0-5алкилен-O-C0-5алкилен-R3b. В одном конкретном варианте осуществления R3b выбран из H, -C1-6алкила и арила. Примеры таких групп R3 включают -OCH3, -OCH2CH3, -OCH(CH3)2, -O(CH2)2CH3, -O(CH2)3CH3, -OCH2CH(CH3)2, -O-фенил и -O-бензил. В другом варианте осуществления R3 представляет собой -C0-5алкилен-O-C0-5алкилен-R3b, где R3b представляет собой -C1-6алкил и в другом варианте осуществления R3 представляет собой -O-C1-5алкил.
В другом варианте осуществления R3 представляет собой -C0-5алкилен-S-C1-5алкилен-R3b и в одном конкретном варианте осуществления R3b представляет собой H, например, когда R3 представляет собой -CH2-S-CH2CH3. В другом варианте осуществления R3 представляет собой -C0-3алкиленарил, такой как фенил, бензил и -(CH2)2-фенил.
В одном конкретном представляющем интерес варианте осуществления R3 представляет собой -C1-10алкил или -C0-5алкилен-O-C0-5алкилен-R3b, где R3b представляет собой H; и в конкретном варианте осуществления, R3 выбран из -C2-5алкила и -C1алкилен-O-C1-5алкилен-H.
X представляет собой -C1-12алкилен-, где по меньшей мере одна группа -CH2- в алкилене заменена на группу -NR4a-C(O)- или -C(O)-NR4a-. Таким образом X может представлять собой -C1алкилен-, -C1алкилен-, -C2алкилен-, -C3алкилен-, -C4алкилен-, -C5алкилен-, -C6алкилен-, -C7алкилен-, -C8алкилен, -C9алкилен-, -C10алкилен-, -C11алкилен- и -C12алкилен-, с замененной по меньшей мере одной группой -CH2-. R4a выбран из H, -OH и -C1-4алкила. В одном варианте осуществления R4a представляет собой H.
Каждый атом углерода в группе -C1-12алкилена- может являться замещенным одной или несколькими группами R4b. R4b выбран из -C0-5алкилен-COOR4c, -C1-6алкила, -C0-1алкилен-CONH2, -C1-2алкилен-OH, -C0-3алкилен-C3-7циклоалкила, 1H-индол-3-ила, бензила и гидроксибензила, где R4c представляет собой H или -C1-4алкил. В одном варианте осуществления атомы углерода в -C1-12алкилен- являются незамещенными группами R4b. В другом варианте осуществления 1 или 2 атом углерода являются замещенными одной или двумя группами R4b. В другом варианте осуществления один атом углерода является замещенным одной группой R4b. В одном конкретном варианте осуществления R4b представляет собой -COOH, бензил или -C1-6алкил, включая группы -C1-3алкила, такие как -CH3 и -CH(CH3)2.
Кроме того, одну группу -CH2- в X можно замещать группой, выбранной из -C4-8циклоалкилен-, -CR4d=CH- и -CH=CR4d-. R4d выбран из -CH2-тиофена и фенила. В одном варианте осуществления ни одна из групп -CH2- не является замещенной таким образом. В другом варианте осуществления одна группа -CH2- является замещенной -C4-8циклоалкилен-, например, циклогексиленом. В другом варианте осуществления одна группа -CH2- является замещенной -CH=CR4d-, где R4d представляет собой -CH2-тиофен, такой как -CH2-тиофен-2-ил.
Каждый алкил и каждый арил в R4a, R4b, R4c и R4d может являться замещенным 1-7 атомами фтора, и термин «алкил» предназначен, чтобы включать двухвалентные алкиленовые группы, например, такие как присутствующие в -C0-5алкилен-COOR4c. Следует отметить, что группа R4b, -C0-3алкилен-C3-7циклоалкил предназначена, чтобы включать C3-7циклоалкил, присоединенный к цепи X -C1-12алкилен- посредством связи, так же как C3-7циклоалкил, непосредственно присоединенный к цепи, как проиллюстрировано ниже:
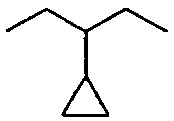 и
и 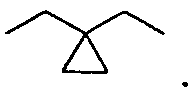
В одном варианте осуществления от одной до четырех групп -CH2- являются замененными. В другом варианте осуществления одна группа -CH2- является замененной, примеры этого включают -C(O)NH- и -CH2-NHC(O)-. В одном варианте осуществления X представляет собой -C2-11алкилен- и 1, 2 или 3 группы -CH2- являются замененными группой -NR4a-C(O)- или -C(O)-NR4a-. В другом варианте осуществления X представляет собой -C2-5алкилен-, где 1 или 2 группы -CH2- являются замененными. Когда более одной группы -CH2- в C1-12алкилене заменено на группу -NR4a-C(O)- или -C(O)-NR4a-, замененные группы могут являться соседними или не соседними. Примеры групп X включают следующие, которые описывают примеры, где одна или несколько групп -CH2- являются замененными группами -NR4a-C(O)- или -C(O)-NR4a-, примеры, где группы -CH2- являются замененными группой, выбранной из -C4-8циклоалкилен-, -CR4d=CH- и -CH=CR4d-, так же как примеры, где атомы углерода в группе -C1-12алкилена- замещены одной или более группами R4b:
C1алкилен с одной группой -CH2-, замененной
-C(O)NH-
-NHC(O)-
C2алкилен с одной группой -CH2-, замененной
-CH2-NHC(O)-
-C(O)NH-CH2-
-CH2-C(O)NH-
-CH[CH(CH3)2]-C(O)NH-
C2алкилен с двумя группами -CH2-, замененными
-C(O)NH-NHC(O)-
-CH=C(-CH2-2-тиофен)-C(O)NH-
C3алкилен с одной группой -CH2-, замененной
-(CH2)2-NHC(O)-
-CH(CH3)-CH2-NHC(O)-
-CH[CH(CH3)2]-CH2-NHC(O)-
-CH(COOH)-CH2-NHC(O)-
-CH2-CH(COOH)-NHC(O)-
C3алкилен с двумя группами -CH2-, замененными
-NHC(O)-CH2-NHC(O)-
C4алкилен с одной группой -CH2-, замененной
-(CH2)3-NHC(O)-
-C(O)NH-CH2-CH(COOH)-CH2-
C4алкилен с двумя группами -CH2-, замененными
-C(O)NH-CH(бензил)-CH2-NHC(O)-
-C(O)NH-CH(бензил)-CH2-C(O)NH-
-CH2-NHC(O)-CH2-NHC(O)-
C4алкилен с тремя группами -CH2-, замененными
-CH2-NHC(O)-циклогексилен-NHC(O)-
-CH2-N(OH)C(O)-циклогексилен-NHC(O)-
C5алкилен с двумя группами -CH2-, замененными
-CH2-NHC(O)-CH2-CH(COOH)-NHC(O)-
-CH2-NHC(O)-(CH2)2-NHC(O)-
-C(O)NH-(CH2)2-C(O)N(OH)-CH2-
-C(O)NH-(CH2)2-CH(COOH)-NHC(O)-
-CH(COOH)-CH2-NHC(O)-CH2-NHC(O)-
-(CH2)2-NHC(O)-циклогексилен-NHC(O)-
C6алкилен с двумя группами -CH2-, замененными
-C(O)NH-(CH2)4-NHC(O)-
-CH2-NHC(O)-(CH2)2-CH(COOH)-NHC(O)-
-C(O)NH-(CH2)3-CH(COOH)-NHC(O)-
C6алкилен с тремя группами -CH2-, замененными
-C(O)NH-(CH2)2-NHC(O)-CH2-NHC(O)-
C6алкилен с четырьмя группами -CH2-, замененными
-C(O)NH-(CH2)2-NHC(O)-циклогексилен-NHC(O)-
C7алкилен с двумя группами -CH2-, замененными
-CH2-NHC(O)-(CH2)4-NHC(O)-
-C(O)NH-(CH2)4-CH(COOH)-NHC(O)-
C7алкилен с тремя группами -CH2-, замененными
-CH[CH(CH3)2]-C(O)NH-(CH2)2-NHC(O)-CH2-NHC(O)-
C7алкилен с четырьмя группами -CH2-, замененными
-CH2-NHC(O)-(CH2)2-NHC(O)-циклогексилен-NHC(O)-
-CH2-C(O)NH-(CH2)2-NHC(O)-циклогексилен-NHC(O)-
C8алкилен с тремя группами -CH2-, замененными
-C(O)NH-(CH2)4-NHC(O)-CH2-NHC(O)-
C8алкилен с четырьмя группами -CH2-, замененными
-C(O)NH-(CH2)4-NHC(O)-циклогексилен-NHC(O)-
C9алкилен с двумя группами -CH2-, замененными
-CH2-NHC(O)-(CH2)6-NHC(O)-
C9алкилен с четырьмя группами -CH2-, замененными
-CH2-NHC(O)-(CH2)4-NHC(O)-циклогексилен-NHC(O)-
C10алкилен с четырьмя группами -CH2-, замененными
-C(O)NH-(CH2)6-NHC(O)-циклогексилен-NHC(O)-
C11алкилен с тремя группами -CH2-, замененными
-CH(CH(CH3)2)-C(O)NH-(CH2)6-NHC(O)-CH2-NHC(O)-
C11алкилен с четырьмя группами -CH2-, замененными
-CH2-NHC(O)-(CH2)6-NHC(O)-циклогексилен-NHC(O)-
В одном конкретном варианте осуществления X представляет собой -C(O)NH- или -CH2-NHC(O)-.
R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f, -C0-2алкилен-CHR5g-COOH, -C0-3алкилен-C(O)NR5h-CHR5i-COOH и -C0-3алкилен-S-SR5j. Каждый алкил и каждый арил в R5, необязательно, замещен 1-7 атомами фтора, где термин «алкил» предназначен, чтобы включать двухвалентные алкиленовые группы, такие как присутствующие, например, в -C0-3алкилен-SR5a и -C0-3алкилен-P(O)OR5eR5f. Каждый арил и гетероарил в R5 может являться замещенным 1-3 группами -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила или -N(C1-6алкил)2. Кроме того, каждая из вышеупомянутых алкильных, алкенильных и алкинильных групп может являться замещенной 1-5 атомами фтора. Понятно, при ссылке на «каждую алкильную», «каждую арильную» и «каждую гетероарильную» группу в R5, термины включают также любую алкильную, арильную и гетероарильную группы, которые могут присутствовать в группах R5a-5j, R5aa, R5ab, R5ba, R5bb, R5bc, R5ca, R5da, R5db, R5ea, R5eb, R5ec, R5fa и R5fb.
В одном варианте осуществления R5 представляет собой -C0-3алкилен-SR5a. R5a представляет собой H или -C(O)-R5aa. Группа R5aa представляет собой -C1-6алкил, -C0-6алкилен-C3-7циклоалкил, -C0-6алкиленарил, -C0-6алкиленгетероарил, -C0-6алкиленморфолин, -C0-6алкиленпиперазин-CH3, -CH[N(R5ab)2]-aa, где aa представляет собой боковую цепь аминокислоты, -2-пирролидин, -C0-6алкилен-OR5ab, -O-C0-6алкиленарил, -C1-2алкилен-OC(O)-C1-6алкил, -C1-2алкилен-OC(O)-C0-6алкиленарил или -O-C1-2алкилен-OC(O)O-C1-6алкил. Группа R5ab представляет собой H или -C1-6алкил. В одном конкретном варианте осуществления R5a представляет собой H, например, R5 может представлять собой -SH или -CH2SH. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C1-6алкил. Примеры групп -C1-6алкила включают -CH3, -CH2CH3, -CH(CH3)2, -C(CH3)3 и -CH2CH(CH3)2. Таким образом, примеры R5 включают -SC(O)CH3, -CH2SC(O)CH3, -CH2SC(O)CH2CH3, -CH2SC(O)CH(CH3)2, и -CH2SC(O)C(CH3)3, и -CH2SC(O)CH2CH(CH3)2. В одном варианте осуществления R5a выбран из H и -C(O)-C1-6алкила.
В одном варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкилен -C3-7циклоалкил. Примеры групп C3-7циклоалкила включают циклопентил и циклогексил. Таким образом, примеры R5 включают -CH2SC(O)-циклопентил, -CH2SC(O)-циклогексил и -CH2SC(O)-CH2-циклопентил. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкиленарил. В одном конкретном варианте осуществления арил, необязательно, является замещенным 1-3 заместителями, такими как -O-C1-6алкил. Примеры арильных групп включают фенил и -фенил-OCH3. Таким образом, примеры R5 включают -CH2SC(O)-фенил и -CH2SC(O)-фенил-OCH3.
В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкиленгетероарил. Примеры гетероарильных групп включают фуранил, тиенил и пиридинил. Таким образом, примеры R5 включают -CH2SC(O)-2-пиридин, -CH2SC(O)-3-пиридин и -CH2SC(O)-4-пиридин. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкиленморфолин:
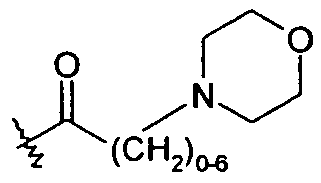 ,
,
более конкретно, -C1-3алкиленморфолин. Таким образом, примеры R5 включают -CH2S-C(O)CH2-морфолин и -CH2S-C(O)(CH2)2-морфолин. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкиленпиперазин-CH3. Таким образом, примеры R5 включают -CH2S-C(O)(CH2)2-пиперазин-CH3. В одном варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -CH[N(R5ab)2]-aa, где aa представляет собой боковую цепь аминокислоты. Например, боковая цепь аминокислоты может представлять собой -CH(CH3)2, боковую цепь валина. Таким образом, одним примером R5 является -CH2S-C(O)CH(NH2)-CH(CH3)2. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -2-пирролидин:
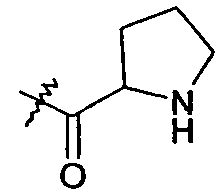 .
.
Таким образом, пример R5 представляет собой -CH2S-C(O)-2-пирролидин.
В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C0-6алкилен-OR5ab. В одном варианте осуществления R5ab представляет собой H, так что R5a представляет собой -C(O)-C0-6алкилен-OH. В другом варианте осуществления R5ab представляет собой -C1-6алкил, так что R5a представляет собой -C(O)-C0-6алкилен-O-C1-6алкил, например, R5 может представлять собой -CH2SC(O)-O-CH2CH3.
В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -O-C0-6алкиленарил. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C1-2алкилен-OC(O)-C1-6алкил и в другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -C1-2алкилен-OC(O)-C0-6алкиленарил. В другом варианте осуществления R5a представляет собой -C(O)-R5aa, где R5aa представляет собой -O-C1-2алкилен-OC(O)O-C1-6алкил, например, R5 может представлять собой -CH2SC(O)OCH(CH3)-OC(O)O-CH(CH3)2.
В одном варианте осуществления R5 представляет собой -C0-3алкилен-C(O)NR5bR5c. Группа R5b представляет собой H, -OH, -OC(O)R5ba, -CH2COOH, -O-бензил, -пиридил, или -OC(S)NR5bbR5bc. R5ba представляет собой H, -C1-6алкил, арил, -OCH2-арил (например, -OCH2-фенил), -CH2O-арил (например, -CH2O-фенил), или -NR5bbR5bc. Группы R5bb и R5bc независимо выбраны из H и -C1-4алкила. В одном варианте осуществления R5b представляет собой -OH или -OC(O)R5ba, где -R5ba представляет собой -C1-6алкил. R5c представляет собой H, -C1-6алкил или -C(O)-R5ca. R5ca представляет собой H, -C1-6алкил, -C3-7циклоалкил, арил или гетероарил. В одном конкретном варианте осуществления R5c представляет собой H. В другом варианте осуществления R5b представляет собой -OH и R5c представляет собой H, например, R5 может представлять собой -C(O)NH(OH) или -CH2C(O)NH(OH). В другом варианте осуществления R5b представляет собой -OC(O)R5ba, где -R5ba представляет собой -C1-6алкил, и R5c представляет собой H, например, R5 может представлять собой -C(O)N[OC(O)CH3]H или -C(O)N[OC(O)C(CH3)3]H. В другом варианте осуществления как R5b, так и R5c представляют собой H, например, R5 может представлять собой -C(O)NH2. В другом варианте осуществления R5b представляет собой -CH2COOH и R5c представляет собой H, например, R5 может представлять собой -C(O)N(CH2COOH)H. В другом варианте осуществления R5b представляет собой -OC(O)R5ba, где -R5ba представляет собой -O-CH2-арил или -CH2-O-арил, например, R5b может представлять собой -OC(O)OCH2-фенил или -OC(O)CH2-O-фенил, и R5c представляет собой H. Таким образом, примеры R5 включают -CH2-C(O)NH[OC(O)OCH2-фенил] и -CH2-C(O)N[OC(O)-CH2O-фенил]H. В другом варианте осуществления R5b представляет собой -OC(S)NR5bbR5bc, где R5bb и R5bc, оба, представляют собой -C1-4алкил, например, R5b может представлять собой -O-C(S)N(CH3)2. В другом варианте осуществления R5b представляет собой -OC(S)NR5bbR5bc, и R5c представляет собой H, например, R5 может представлять собой -CH2-C(O)N[OC(S)N(CH3)2]H.
В одном варианте осуществления R5 представляет собой -C0-3алкилен-NR5b-C(O)R5d. R5d представляет собой H, -C1-4алкил, -C0-3алкиленарил, -NR5daR5db, -CH2SH или -O-C1-6алкил. Группы R5da и R5db независимо выбраны из H и -C1-4алкила. В другом варианте осуществления R5b представляет собой -OH и R5d представляет собой H, например, R5 может представлять собой -CH2-N(OH)C(O)H. В другом варианте осуществления R5b представляет собой -OH и R5d представляет собой -C1-4алкил, например, R5 может представлять собой -CH2-N(OH)C(O)CH3. В другом варианте осуществления R5b представляет собой H и R5d представляет собой -CH2SH, например, R5 может представлять собой -NHC(O)CH2SH или -CH2NHC(O)-CH2SH.
В другом варианте осуществления R5 представляет собой -NH-C0-1алкилен-P(O)(OR5e)2. Группа R5e представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(CH3)-O-C(O)R5ea,
 или
или 
Группа R5ea представляет собой -O-C1-6алкил, -O-C3-7циклоалкил, -NR5ebR5ec или -CH(NH2)CH2COOCH3. R5eb и R5ec независимо выбраны из H, -C1-4алкила и -C1-3алкиленарила (например, бензила). R5eb и R5ec могут также являться взятыми вместе для формирования -(CH2)3-6-. В одном варианте осуществления R5e представляет собой H, например, R5 может представлять собой -NH-CH2-P(O)(OH)2.
В одном варианте осуществления R5 представляет собой -C0-3алкилен-P(O)OR5eR5f. Группа R5f представляет собой H, -C1-4алкил, -C0-3алкиленарил, -C1-3алкилен-NR5faR5fb или -C1-3алкилен(арил)-C0-3алкилен-NR5faR5fb. Группы R5fa и R5fb независимо выбраны из H и -C1-4алкила. В одном варианте осуществления R5e представляет собой H, например, R5 может представлять собой -C0-3алкилен-P(O)(OH)R5f.
В одном варианте осуществления R5 представляет собой -C0-2алкилен-CHR5g-COOH. Группа R5g представляет собой H, -C1-6алкил, -C1-3алкиленарил или -CH2-O-(CH2)2-OCH3. В одном варианте осуществления R5g представляет собой -CH2-O-(CH2)2-OCH3, например, R5 может представлять собой -CH2-C[CH2-O-(CH2)2-OCH3]H-COOH. В другом варианте осуществления R5g представляет собой H, например, R5 может представлять собой -CH2COOH.
В одном варианте осуществления R5 представляет собой -C0-3алкилен-C(O)NR5h-CHR5i-COOH. Группа R5h представляет собой H или -C1-4алкил. Группа R5i представляет собой H, -C1-4алкил или -C0-3алкиленарил. В одном варианте осуществления R5h представляет собой H, и R5i представляет собой -C0-3алкиленарил, и арил, необязательно, является замещенным 1-3 заместителями, такими как -OH, например, R5 может представлять собой -C(O)NH-CH(CH2-фенил-OH)(COOH).
В другом варианте осуществления R5 представляет собой -C0-3алкилен-S-SR5j и R5j выбран из -C1-6алкила, арила и -CH2CH(NH2)COOH. Примеры таких групп R5 включают -C0-3алкилен-S-S-CH3, -C0-3алкилен-S-S-фенил и -C0-3алкилен-S-S-CH2CH(NH2)-COOH.
R6 выбран из -C1-6алкила, -CH2O(CH2)2OCH3, -C1-6алкилен-O-C1-6алкила, -C0-3алкиленарила, -C0-3алкиленгетероарила и -C0-3алкилен-C3-7циклоалкила. В одном конкретном варианте осуществления R6 выбран из -C1-6алкила, -C0-3алкиленарила и -C0-3алкилен-C3-7циклоалкила. Каждый алкил и каждый арил в R6, необязательно, является замещенным 1-7 атомами фтора, где термин «алкил» предназначен, чтобы включать двухвалентные алкиленовые группы, такие как присутствующие, например, в -C1-6алкилен-O-C1-6алкиле и -C0-3алкилен-C3-7циклоалкиле. Кроме того, каждый арил и гетероарил в R6 может являться замещенным 1-3 группами -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O-C1-6алкила, -S-C1-6алкила, -S(O)-C1-6алкила, -S(O)2-C1-4алкила, -фенила, -NO2, -NH2, -NH-C1-6алкила или -N(C1-6алкил)2. Кроме того, каждая из вышеупомянутых алкильных, алкенильных и алкинильных групп может являться замещенной 1-5 атомами фтора.
В одном варианте осуществления R6 представляет собой -C1-6алкил, например, -CH3, -CH2CH3, -CH(CH3)2, -(CH2)2CH3, -(CH2)3CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -CH2C(CH3)3, -(CH2)2CH(CH3)2 или -(CH2)4CH3. Как указано выше, каждый алкил в R6, необязательно, является замещенным 1-7 атомами фтора. Примеры таких фторзамещенных групп R6 включают -(CH2)2CF3 и -(CH2)3CF3.
В другом варианте осуществления R6 представляет собой -CH2O(CH2)2OCH3. В другом варианте осуществления R6 представляет собой -C1-6алкилен-O-C1-6алкил, например, -OCH3 и -CH2OCH3.
В одном варианте осуществления R6 представляет собой -C0-3алкиленарил, например, фенил, бензил, -CH2-бифенил, -(CH2)2-фенил и -CH2-нафталин-1-ил. Арил может являться замещенным 1-3 заместителями. Таким образом, другие примеры R6 включают монозамещенные группы, такие как метилбензил, хлорбензил, фторбензил, фторфенил, бромбензил, йодбензил, -бензил-CF3, 2-трифторметилбензил, -бензил-CN и -бензил-NO2; и двузамещенные группы, такие как дихлорбензил и дифторбензил. Каждый арил может также являться замещенным 1-7 атомами фтора. Таким образом, другие примеры R6 включают пентафторбензил.
В одном варианте осуществления R6 представляет собой -C0-3алкиленгетероарил, например, -CH2-пиридил, -CH2-фуранил, -CH2-тиенил и -CH2-тиофенил. В другом варианте осуществления R6 представляет собой -C0-3алкилен-C3-7циклоалкил, например, -CH2-циклопропил, циклопентил, -CH2-циклопентил, -циклогексил и -CH2-циклогексил.
R7 представляет собой H или является взятым вместе с R6 для формирования -C3-8циклоалкила. В одном варианте осуществления R7 представляет собой H. В другом варианте осуществления R7 является взятым вместе с R6 для формирования -C3-8циклоалкила, например, циклопентила.
В одном конкретном варианте осуществления изобретение относится к активному соединению формулы I, где Ar**-COOH представляет собой Ar-R1, и R5 представляет собой -C0-3алкилен-SH. Одно из соответствующих пролекарств (пролекарство A) может содержать тиоэфирную связь, которую можно расщеплять in vivo с образованием групп -COOH(R1) и -C0-3алкилен-SH (R5). Другое соответствующее пролекарство (пролекарство B, где Z представляет собой -C1-6алкилен, необязательно, замещенный одной или несколькими группами, такими как гидроксил, фенил, карбоксил, и т.д.), содержит как сложноэфирную, так и тиоэфирную группу, которые можно подобным образом расщеплять in vivo, но которые также высвобождают физиологически приемлемую кислоту, такую как α-гидроксикислота (Z представляет собой -CH2-), β-гидроксикислота (Z представляет собой -(CH2)2-), (R)-2-гидроксипропионовая или молочная кислота (Z представляет собой -CH(CH3)-), (R)-гидроксифенилуксусная или миндальная кислота (Z представляет собой -CH(фенил)-), салициловая кислота (Z представляет собой -фенилен-), 2,3-дигидроксиянтарная или виннокаменная кислота (Z представляет собой -CH[CH(OH)(COOH)]-), лимонная кислота (Z представляет собой -C[CH2COOH]2-), гидрокси-бис- и гидрокси-трис-кислоты, и т.д.
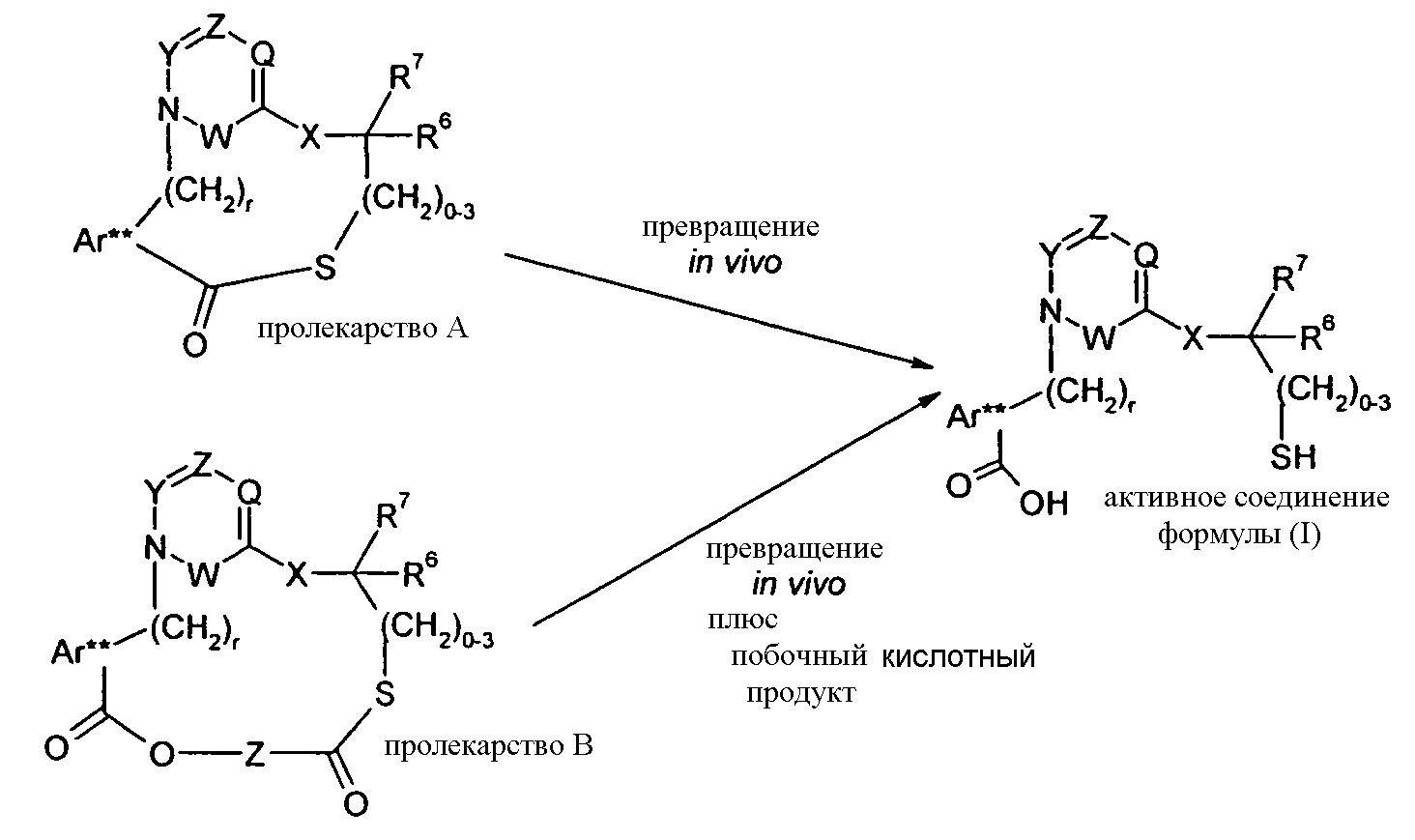
Другое соответствующее пролекарство (пролекарство C) представляет собой димерную форму пролекарства A, таким образом, содержащую две тиоэфирные связи, которые обе можно расщепить in vivo с получением двух активных групп, где каждая содержит группы -COOH (R1) и -C0-3алкилен-SH (R5).
Примеры пролекарства A и C описаны в примере 33.
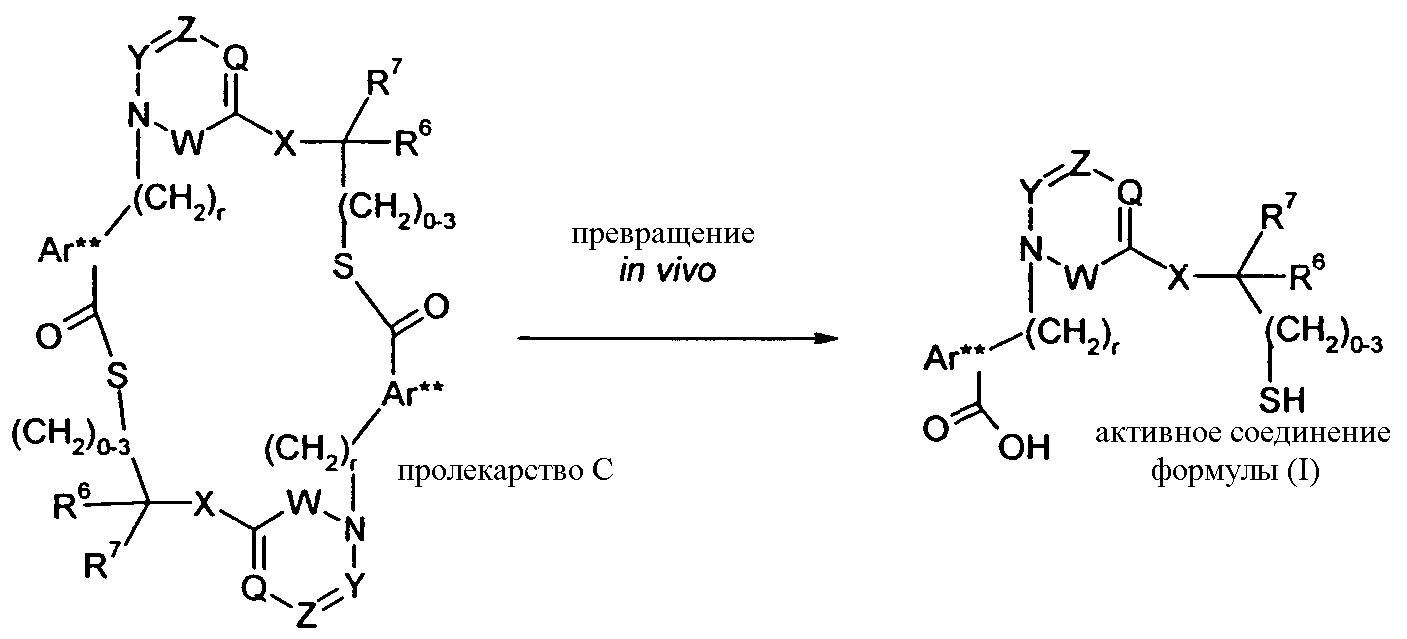
Другой вариант осуществления изобретения относится к активному соединениию формулы I, где R5 представляет собой -C0-3алкилен-SH, и пролекарство (пролекарство D) представляет собой димерную форму соединения:
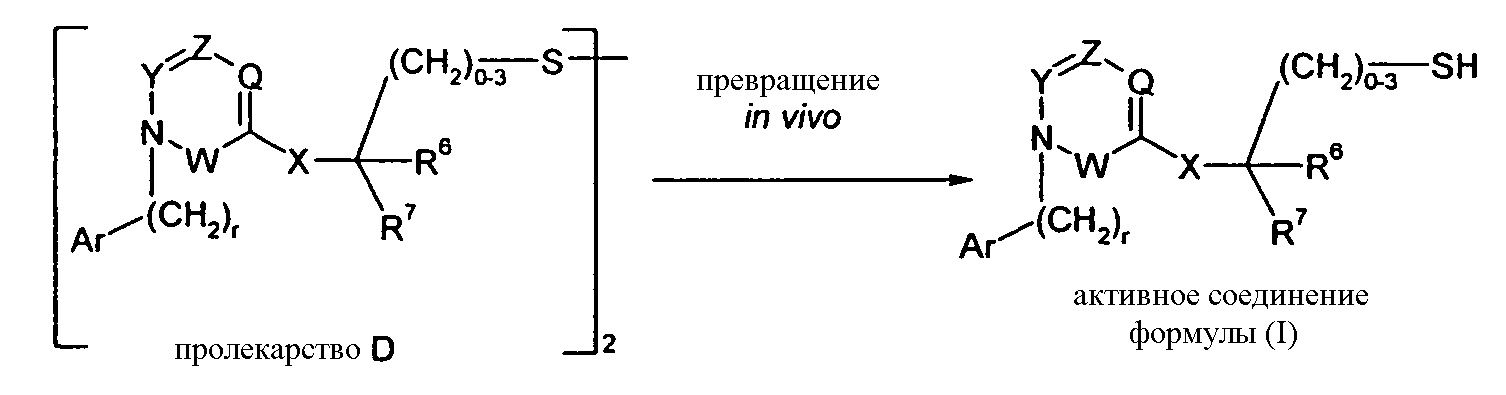
Одним из примеров пролекарства D является димерная форма соединения из примера 19(c). MS m/z рассчитано для C56H66F2N6O8S2, 1053,44; обнаружено 1053,6.
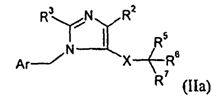
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле IIa:
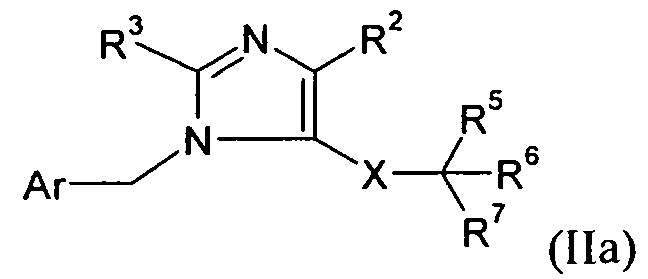
где Ar, R2-3, X, и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли. В одном конкретном варианте осуществления Ar выбран из
 и
и  .
.
R1 выбран из -COOR1a, -NHSO2R1b, -SO2NHR1d, -SO2OH, -O-CH(R1e)-COOH и тетразол-5-ила; где R1a представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa или
R1aa представляет собой -O-C1-6алкил или -O-C3-7циклоалкил; R1b представляет собой R1c; R1c представляет собой -C1-6алкил или -C0-4алкиленарил; R1d представляет собой H, -C(O)R1c или -C(O)NHR1c; R1e представляет собой -C1-4алкил; R2 выбран из H, галогена, -C1-6алкила, -C3-6циклоалкила и -C0-5алкилен-OR2b; где R2b выбран из H и -C1-6алкила; R3 выбран из -C1-10алкила и -C0-5алкилен-O-C0-5алкилен-C1-6алкила; X представляет собой -C1-11алкилен-, где 1-4 группы -CH2- в алкилене являются замененными группой -NR4a-C(O)- или -C(O)-NR4a-, где R4a выбран из H и -OH; R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-2алкилен-CHR5g-COOH и -C0-3алкилен-C(O)NR5h-CHR5i-COOH; R5a представляет собой H или -C(O)-R5aa; R5aa представляет собой -C1-6алкил, -C0-6алкилен-C3-7циклоалкил, -C0-6алкиленарил или -C0-6алкиленморфолин; R5b представляет собой H, -OH, -OC(O)R5ba, -CH2COOH или -OC(S)NR5bbR5bc; R5ba представляет собой -OCH2-арил или -CH2O-арил; R5bb и R5bc независимо представляют собой -C1-4алкил; R5c представляет собой H; R5e представляет собой H; R5g представляет собой -CH2-O-(CH2)2-O-CH3; R5h представляет собой H; и R5i представляет собой -C0-3алкиленарил; R6 выбран из -C1-6алкила, -C0-3алкиленарила, -C0-3алкиленгетероарила и -C0-3алкилен-C3-7циклоалкила; и R7 представляет собой H или является взятым вместе с R6 с образованием -циклопентила. В одном варианте осуществления каждое кольцо в Ar и каждый арил в R1-3 и R5-6, каждый атом углерода в X, и каждый алкил и каждый арил в R1-3, R4a-4d и R5-6 необязательно, являются замещенными, как определено для формулы I. В другом варианте осуществления каждое кольцо в Ar и каждый арил в R1 и R5-6, необязательно, является замещенным 1-2 заместителями, независимо выбранными из -C1-6алкила, -CN, галогена, -O-C1-6алкила и -NO2, где каждый алкил, необязательно, является замещенным 1-5 атомами фтора; каждый атом углерода в X, необязательно, замещен одной группой R4b, и одну группу -CH2- в X можно замещать группой, выбранной из -C4-8циклоалкилен-, -CR4d=CH- и -CH=CR4d-; где R4b представляет собой -C0-5алкилен-COOR4c или бензил; R4c представляет собой H; и R4d представляет собой -CH2-тиофен; и каждый алкил и каждый арил в R1 и R6, необязательно, является замещенным 1-7 атомами фтора. В другом варианте осуществления одно кольцо в Ar является замещенным 1 или 2 атомами фтора.
В одном конкретном варианте осуществления соединений формулы IIa, R1 выбран из -COOH, -CO(O)(C1-6алкил), -NHSO2(C1-6алкил) и -SO2NH[-C(O)(C1-6алкил)]; R2 выбран из H, галогена, -C1-6алкила, -C3-6циклоалкила и -C0-5алкилен-OH; R3 представляет собой -C0-5алкилен-O-C0-5алкилен-C1-6алкил; X представляет собой -C1-11алкилен-, где 1-4 группы -CH2- в алкилене являются замененными -NHC(O)- или -C(O)NH-; R5 представляет собой -C0-3алкилен-SR5a или -C0-3алкилен-C(O)NH(OH); R5a представляет собой H или -C(O)-R5aa; R5aa представляет собой -C1-6алкил, -C0-6алкиленарил или -C0-6алкиленморфолин; R6 выбран из -C1-6алкила, -C0-3алкиленарила и -C0-3алкилен-C3-7циклоалкила; и R7 представляет собой H. В одном варианте осуществления каждое кольцо в Ar и каждый арил в R1 и R6, необязательно, является замещенным 1-2 группами галогена; и каждый алкил и каждый арил в R1 и R6, необязательно, является замещенным 1-7 атомами фтора. В другом варианте осуществления одно кольцо в Ar является замещенным 1 или 2 атомами фтора. В одном конкретном варианте осуществления X представляет собой -C1-5алкилен-, и в другом варианте осуществления X выбран из -C(O)NH- и -CH2-NHC(O)-.
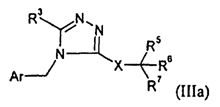
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле IIIa:
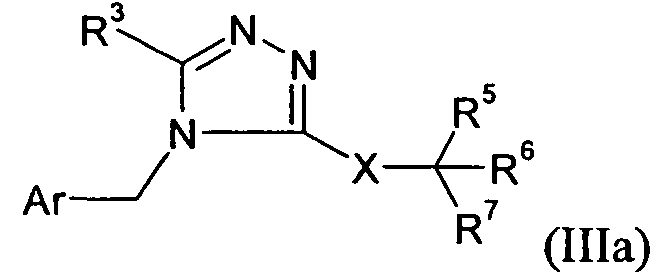
где Ar, R3, X и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли. В одном конкретном варианте осуществления Ar выбран из
 и
и 
R1 представляет собой -COOR1a, где R1a представляет собой H или -C1-6алкил; R3 представляет собой -C1-10алкил; X представляет собой -CH2-NHC(O)-; R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)N(OH)H; R5a представляет собой H или -C(O)C1-6алкил; R6 выбран из -C1-6алкила и -C0-3алкиленарила; и R7 представляет собой H. В одном варианте осуществления каждое кольцо в Ar и арил в R6, атом углерода в X, и каждый алкил и каждый арил в R1, R3, и R5-6, необязательно, являются замещенными, как определено для формулы I.
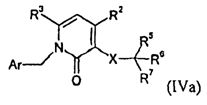
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле IVa:
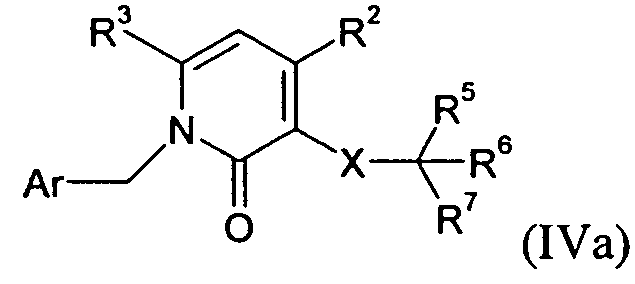 ,
,
где Ar, R2-3, X и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли. В одном конкретном варианте осуществления Ar представляет собой:
R1 представляет собой -COOR1a, где R1a представляет собой H или -C1-6алкил; R2 представляет собой H; R3 представляет собой -C1-10алкил; X представляет собой -CH2-NHC(O)-; R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)N(OH)H; R5a представляет собой H или -C(O)C1-6алкил; R6 выбран из -C1-6алкила и -C0-3алкиленарила; и R7 представляет собой H. В одном варианте осуществления каждое кольцо в Ar и арил в R6, атом углерода в X, и каждый алкил и каждый арил в R1, R3, и R5-6, необязательно, являются замещенными, как определено для формулы I.
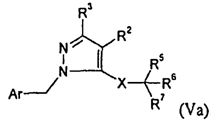
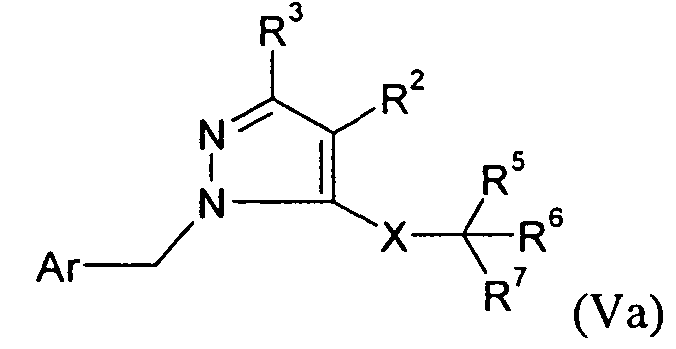
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле Va:
 ,
,
где Ar, R2-3, X и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли. В одном конкретном варианте осуществления Ar представляет собой:
R1 представляет собой -COOR1a, где R1a представляет собой H или -C1-6алкил; R2 представляет собой H; R3 представляет собой -C1-10алкил; X представляет собой -C(O)NH-; R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)N(OH)H; R5a представляет собой H или -C(O)C1-6алкил; R6 представляет собой -C0-3алкиленарил; и R7 представляет собой H. В одном варианте осуществления кольцо в Ar и арил в R6, и каждый алкил и каждый арил в R1, R3 и R5-6, необязательно, являются замещенными, как определено для формулы I.
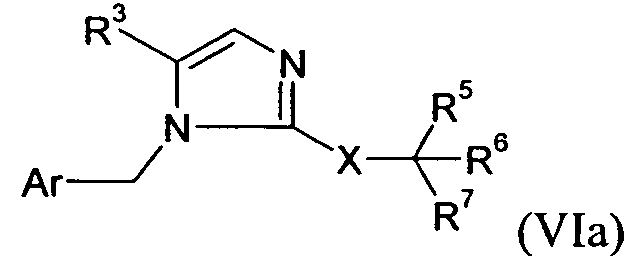
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле VIa:
 ,
,
где Ar, R3, X и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли. В одном конкретном варианте осуществления Ar выбран из
 и
и  ;
;
R1 представляет собой -COOR1a, где R1a представляет собой H или -C1-6алкил; R3 представляет собой -C1-10алкил; X представляет собой -C(O)NH- или -CH2-NHC(O)-; R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)N(OH)H; R5a представляет собой H или -C(O)C1-6алкил; R6 выбран из -C1-6алкила и -C0-3алкиленарила; и R7 представляет собой H. В одном варианте осуществления каждое кольцо в Ar и арил в R6, атом углерода в X, и каждый алкил и каждый арил в R1, R3, и R5-6, необязательно, являются замещенными, как определено для формулы I.
В одном варианте осуществления изобретения соединение формулы I представляет собой тип, описанный в формуле VII:
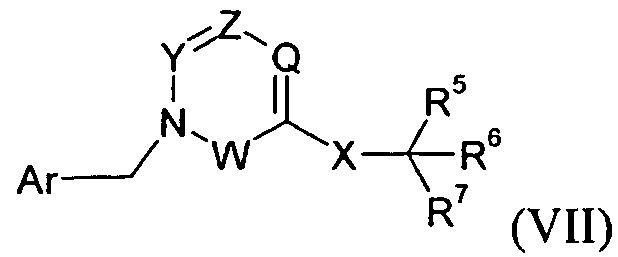 ,
,
где Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -C(R2)- и W представляет собой связь; Y представляет собой -N-, Z представляет собой -C(R3)-, Q представляет собой -C(R2)- и W представляет собой связь; Y представляет собой -C(R3)-, Z представляет собой -N-, Q представляет собой -N- и W представляет собой связь; или Y представляет собой -C(R3)-, Z представляет собой -CH-, Q представляет собой -C(R2)- и W представляет собой -C(O)-; и R2-3, Ar, X и R5-7 являются такими, как определено для формулы I; и его фармацевтически приемлемые соли.
В другом конкретном варианте осуществления Ar выбран из
 и
и  ;
;
R1 выбран из -COOR1a, -NHSO2R1b, -SO2NHR1d, -SO2OH, -O-CH(R1e)-COOH и тетразол-5-ила; где R1a представляет собой H, -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa, или
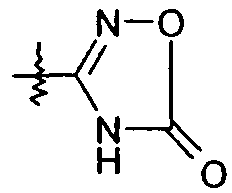
R1aa представляет собой -O-C1-6алкил или -O-C3-7циклоалкил; R1b представляет собой R1c; R1c представляет собой -C1-6алкил или -C0-4алкиленарил; R1d представляет собой H, -C(O)R1c или -C(O)NHR1c; R1e представляет собой -C1-4алкил; R2 выбран из H, галогена, -C1-6алкила, -C3-6циклоалкила и -C0-5алкилен-OR2b; где R2b выбран из H и -C1-6алкила; R3 выбран из -C1-10алкила и -C0-5алкилен-O-C0-5алкилен-R3b; где R3b представляет собой -C1-6алкил; X представляет собой -C1-11алкилен-, где 1-4 группы -CH2- в алкилене являются замененными группой -NR4a-C(O)- или -C(O)-NR4a-, где R4a выбран из H и -OH; R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-2алкилен-CHR5g-COOH и -C0-3алкилен-C(O)NR5h-CHR5i-COOH; R5a представляет собой H или -C(O)-R5aa; R5aa представляет собой -C1-6алкил, -C0-6алкилен-C3-7циклоалкил, -C0-6алкиленарил или -C0-6алкиленморфолин; R5b представляет собой H, -OH, -OC(O)R5ba, -CH2COOH или -OC(S)NR5bbR5bc; R5ba представляет собой -OCH2-арил или -CH2O-арил; R5bb и R5bc независимо представляют собой -C1-4алкил; R5c представляет собой H; R5e представляет собой H; R5g представляет собой -CH2-O-(CH2)2-O-CH3; R5h представляет собой H; и R5i представляет собой -C0-3алкиленарил; R6 выбран из -C1-6алкила, -C0-3алкиленарила, -C0-3алкиленгетероарила и -C0-3алкилен-C3-7циклоалкила; и R7 представляет собой H или является взятым вместе с R6 с образованием -C3-8циклоалкила. В одном варианте осуществления каждое кольцо в Ar и каждый арил в R1-3 и R5-6, каждый атом углерода в X, и каждый алкил и каждый арил в R1-3, R4a-4d и R5-6, необязательно, являются замещенными, как определено для формулы I. В другом варианте осуществления каждое кольцо в Ar и каждый арил в R1 и R5-6, необязательно, является замещенным 1-2 заместителями, независимо выбранными из -C1-6алкила, -CN, галогена, -O-C1-6алкила и -NO2, где каждый алкил, необязательно, является замещенным 1-5 атомами фтора; каждый атом углерода в X, необязательно, замещен одной R4b группой, и одну группу -CH2- в X можно замещать группой, выбранной из -C4-8циклоалкилена-, -CR4d=CH- и -CH=CR4d-; где R4b представляет собой -C0-5алкилен-COOR4c или бензил; R4c представляет собой H; и R4d представляет собой -CH2-тиофен; и каждый алкил и каждый арил в R1 и R6, необязательно, является замещенным 1-7 атомами фтора. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В другом конкретном варианте осуществления X выбран из группы: -C(O)NH-; -CH2-NHC(O)-; -C(O)NH-CH2-; -C(O)NH-NHC(O)-; -CH=C(-CH2-2-тиофен)-C(O)NH-; -(CH2)2-NHC(O)-; -C(O)NH-CH2-CH(COOH)-CH2-; -C(O)NH-CH(бензил)-CH2-NHC(O)-; -C(O)NH-CH(бензил)-CH2-C(O)NH-; -CH2-NHC(O)-CH2-NHC(O)-; -CH2-NHC(O)-циклогексилен-NHC(O)-; -CH2-N(OH)C(O)-циклогексилен-NHC(O)-; -CH2-NHC(O)-CH2-CH(COOH)-NHC(O)-; -CH2-NHC(O)-(CH2)2-NHC(O)-; -C(O)NH-(CH2)2-C(O)N(OH)-CH2-; -C(O)NH-(CH2)2-CH(COOH)-NHC(O)-; -C(O)NH-(CH2)4-NHC(O)-; -CH2-NHC(O)-(CH2)2-CH(COOH)-NHC(O)-; -C(O)NH-(CH2)3-CH(COOH)-NHC(O)-; -C(O)NH-(CH2)2-NHC(O)-CH2-NHC(O)-; -C(O)NH-(CH2)2-NHC(O)-циклогексилен-NHC(O)-; -CH2-NHC(O)-(CH2)4-NHC(O)-; -C(O)NH-(CH2)4-CH(COOH)-NHC(O)-; -CH2-NHC(O)-(CH2)2-NHC(O)-циклогексилен-NHC(O)-; -CH2-C(O)NH-(CH2)2-NHC(O)-циклогексилен-NHC(O)-; -C(O)NH-(CH2)4-NHC(O)-CH2-NHC(O)-; -C(O)NH-(CH2)4-NHC(O)-циклогексилен-NHC(O)-; -CH2-NHC(O)-(CH2)6-NHC(O)-; -CH2-NHC(O)-(CH2)4-NHC(O)-циклогексилен-NHC(O)-; -C(O)NH-(CH2)6-NHC(O)-циклогексилен-NHC(O)- и -CH2-NHC(O)-(CH2)6-NHC(O)-циклогексилен-NHC(O)-. В другом аспекте этот вариант осуществления обладает формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В одном конкретном варианте осуществления Ar выбран из
 и
и 
В другом аспекте этот вариант осуществления обладает формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В другом конкретном варианте осуществления R1 выбран из -COOH, -NHSO2R1b, -SO2NHR1d, -SO2OH, -C(O)NH-SO2R1c, -P(O)(OH)2, -CN, -O-CH(R1e)-COOH, тетразол-5-ила,
 и
и 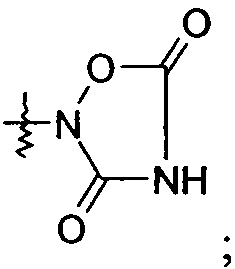
где R1b, R1c, R1d и R1e, являются такими, как определено для формулы I. В одном конкретном варианте осуществления R1 выбран из -COOR1a, -SO2NHR1d и тетразол-5-ила. В другом варианте осуществления R1 выбран из -COOH, -SO2NHC(O)-C1-6алкила и тетразол-5-ила. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В одном конкретном варианте осуществления R1 представляет собой -COOR1a, где R1a представляет собой -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa, -C0-6алкиленморфолин,
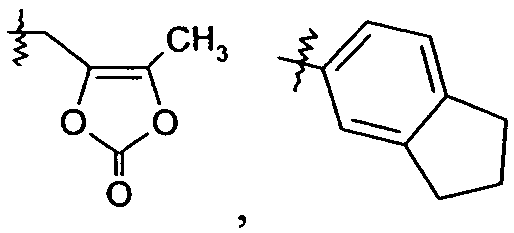 или
или 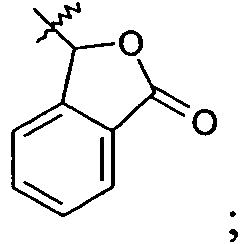
где R1aa является таким, как определено для формулы I. В одном аспекте изобретения эти соединения могут находить особенную полезность в качестве пролекарств или в качестве промежуточных соединений в способах синтеза, описанных в настоящем описании. В одном конкретном варианте осуществления R1 представляет собой -COOR1a и R1a представляет собой -C1-6алкил. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В одном конкретном варианте осуществления R1 выбран из -COOR1a и тетразол-5-ила, где R1a представляет собой H или -C1-6алкил. В другом аспекте этот вариант осуществления обладает формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В одном варианте осуществления R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c и -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f, -C0-2алкилен-CHR5g-COOH и -C0-3алкилен-C(O)NR5h-CHR5i-COOH; где R5a представляет собой H, R5b представляет собой -OH, R5c представляет собой H, R5d представляет собой H, R5e представляет собой H; и R5f, R5g, R5h, R5i являются такими, как определено для формулы I. Более конкретно, в одном варианте осуществления R5 выбран из -C0-1алкилен-SH, -C0-1алкилен-C(O)-N(OH)H и -C0-3алкилен-N(OH)-C(O)H. В другом варианте осуществления R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)NR5bR5c, где R5a представляет собой H; R5b представляет собой -OH. В одном конкретном варианте осуществления R5c представляет собой H. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В другом варианте осуществления R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f и -C0-3алкилен-S-SR5j; где R5a представляет собой -C(O)-R5aa; R5b представляет собой H, -OC(O)R5ba, -CH2COOH, -O-бензил, -пиридил или -OC(S)NR5bbR5bc; R5e представляет собой -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(CH3)-O-C(O)R5ea,
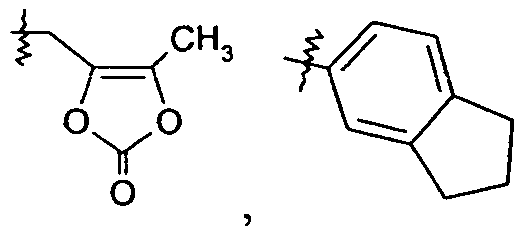 или
или 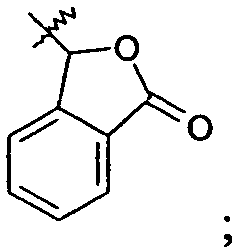
и где R5aa, R5ba, R5bb, R5bc, R5c, R5d, R5ea, R5f и R5j являются такими, как определено для формулы I. В одном аспекте изобретения эти соединения могут находить особенную полезность в качестве пролекарств или в качестве промежуточных соединений в способах синтеза, описанных в настоящем описании. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В одном конкретном варианте осуществления R5 выбран из -C0-3алкилен-SR5a и -C0-3алкилен-C(O)NR5bR5c; где R5a выбран из H и -C(O)-C1-6алкила; R5b выбран из H, -OH и -OC(O)-C1-6алкила; и R5c выбран из H и -C1-6алкила. В другом аспекте этот вариант осуществления обладает формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В другом варианте осуществления R1 выбран из -COOR1a, где R1a представляет собой H, -NHSO2R1b, -SO2NHR1d, -SO2OH, -C(O)NH-SO2R1c, -P(O)(OH)2, -CN, -O-CH(R1e)-COOH, тетразол-5-ил,
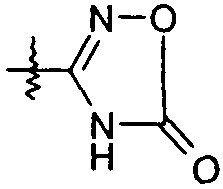 и
и 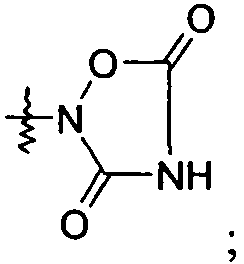
R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c и -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f, -C0-2алкилен-CHR5g-COOH и -C0-3алкилен-C(O)NR5h-CHR5i-COOH; R5a представляет собой H, R5b представляет собой -OH, R5c представляет собой H, R5d представляет собой H, R5e представляет собой H; и R5f, R5g, R5h, R5i являются такими, как определено для формулы I. В одном конкретном варианте осуществления R1 выбран из -COOH, -SO2NHR1d и тетразол-5-ила; и R5 выбран из -C0-3алкилен-SH, и -C0-3алкилен-C(O)N(OH)H. В другом аспекте эти варианты осуществления обладают формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
В другом варианте осуществления R1 представляет собой -COOR1a, где R1a представляет собой -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(C1-4алкил)OC(O)R1aa, -C0-6алкиленморфолин,
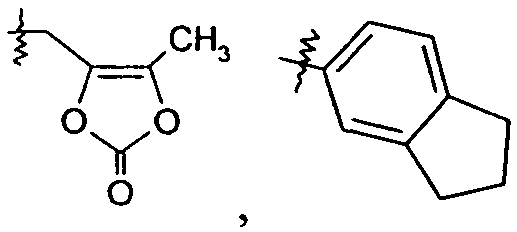 или
или 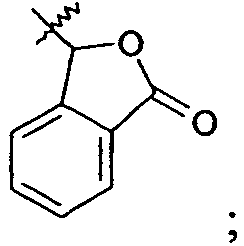
R5 выбран из -C0-3алкилен-SR5a, -C0-3алкилен-C(O)NR5bR5c, -C0-3алкилен-NR5b-C(O)R5d, -NH-C0-1алкилен-P(O)(OR5e)2, -C0-3алкилен-P(O)OR5eR5f и -C0-3алкилен-S-SR5j; где R5a представляет собой -C(O)-R5aa; R5b представляет собой H, -OC(O)R5ba, -CH2COOH, -O-бензил, -пиридил или -OC(S)NR5bbR5bc; R5e представляет собой -C1-6алкил, -C1-3алкиленарил, -C1-3алкиленгетероарил, -C3-7циклоалкил, -CH(CH3)-O-C(O)R5ea,
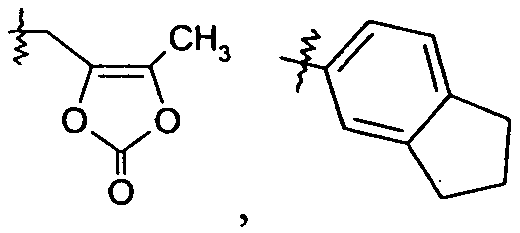 или
или 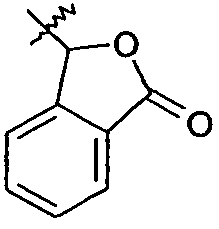
и где R5aa, R5ba, R5bb, R5bc, R5c, R5d, R5ea, R5f и R5j являются такими, как определено для формулы I. В другом аспекте этот вариант осуществления обладает формулами II, IIa, III, IIIa, IV, IVa, V, Va, VI, VIa или VII.
Конкретная группа соединений формулы I представляет собой соединения, описанные в предварительной заявке США № 60/925931, поданной 24 апреля 2007 года. Эта группа включает соединения формулы (I'):
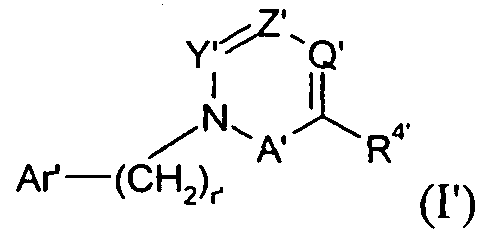
где Y' представляет собой -C(R3')-, Z' представляет собой -N-, Q' представляет собой -C(R2')- и A' представляет собой связь; Y' представляет собой -N-, Z' представляет собой -C(R3')-, Q' представляет собой -C(R2')- и A' представляет собой связь; Y' представляет собой -C(R3')-, Z' представляет собой -N-, Q' представляет собой -N- и A' представляет собой связь; Y' представляет собой -C(R3')-, Z' представляет собой -CH-, Q' представляет собой -N- и A' представляет собой связь; или Y' представляет собой -C(R3')-, Z' представляет собой -CH-, Q' представляет собой -C(R2')- и A' представляет собой -C(O)-; r' представляет собой 0, 1 или 2; Ar' представляет собой арильную группу, выбранную из
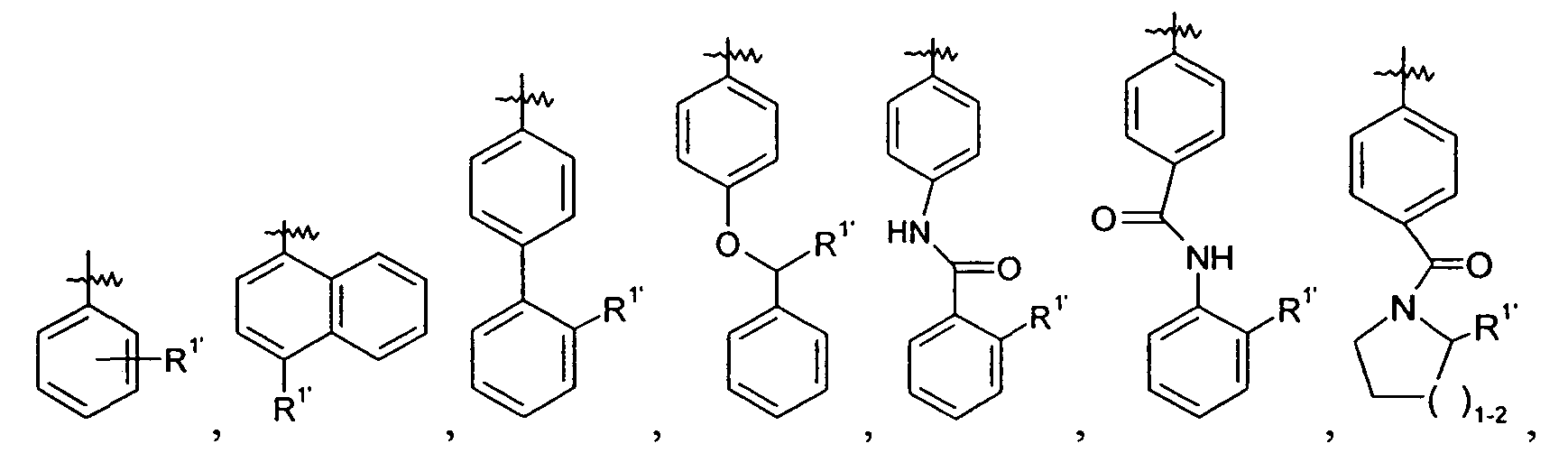
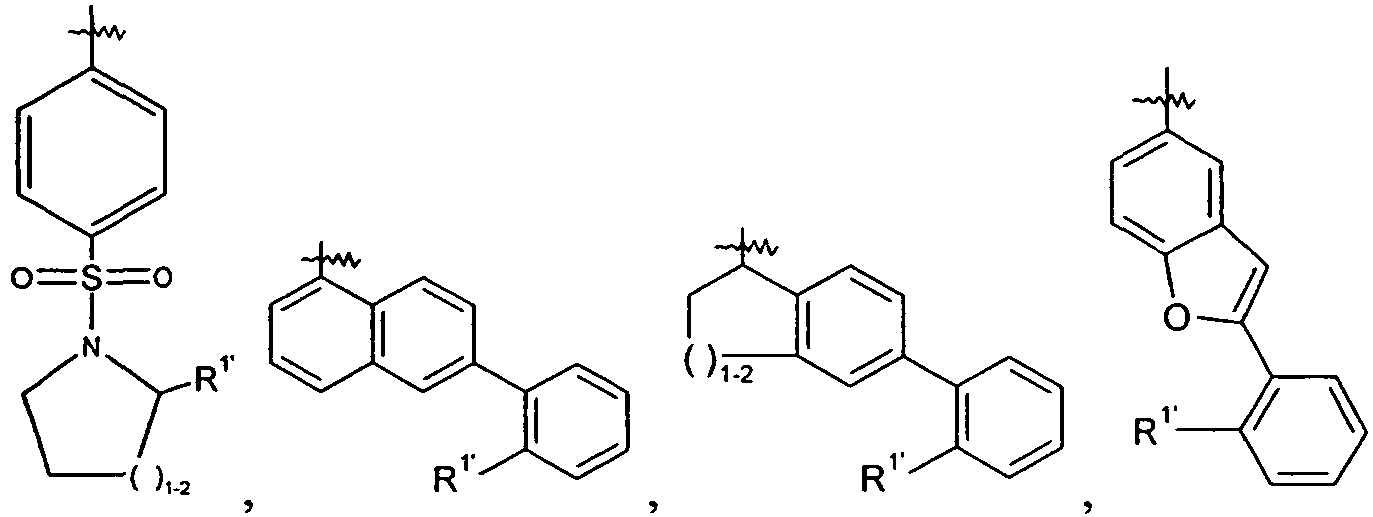 и
и 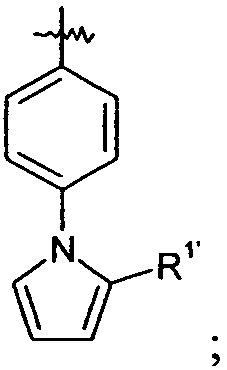
R1' выбран из -COOR1a', -NHSO2-C1-6алкила, -NHSO2арила, -NHSO2NHC(O)-C1-6алкила, -NHSO2NHC(O)-арила, -SO2NHC(O)-C1-6алкила, -SO2NHC(O)-арила, -SO2NHC(O)NH-C1-6алкила, -SO2NHC(O)NH-арила, -SO2OH, -SO2NH2, -SO2NH-C1-6алкила, -SO2NH-арила, -C(O)NH-SO2-C1-6алкила, -C(O)NH-SO2-арила, -P(O)(OH)2, -CN, -OCH(CH3)-COOH, -OCH(арил)-COOH, тетразол-5-ила,
 и
и 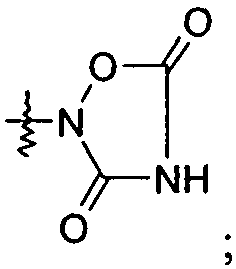
где R1a' выбран из H, -C1-6алкила, бензила, -C1-3алкиленгетероарила, циклоалкила, -CH(CH3)OC(O)R1b',
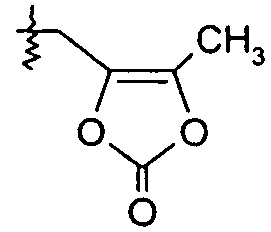 и
и 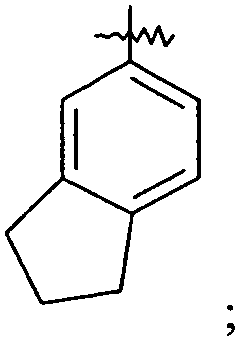
R1b' выбран из -O-C1-6алкила, -O-циклоалкила, -NR1c'R1d', -CH(NH2)CH2COOCH3; и R1c' и R1d' независимо выбраны из H, -C1-6алкила и бензила, или взяты вместе как -(CH2)3-6-; R2' выбран из H, -CH2OH, галогена, -NO2, -C1-6алкила, -C2-6алкенила, -C3-6циклоалкила, -CN, -C(O)R2a и -C0-3алкиленарила; где R2a' выбран из H, -C1-6алкила, -C3-6циклоалкила, -C0-3алкиленфенила, -OR2b' и -NR2c'R2d'; R2b' выбран из H, -C1-6алкила, -C3-6циклоалкила, фенила и бензила; и R2c' и R2d' независимо выбраны из H, -C1-4алкила и -C0-1алкиленфенила; R3' выбран из -C1-10алкила, -C2-10алкенила, -C3-10алкинила, -C3-7циклоалкила, -C0-3алкилен-C3-7циклоалкила, -C0-3алкенилен-C3-7циклоалкила, -C0-3алкинилен-C3-7циклоалкила, -(CH2)0-5NR3a'(CH2)0-5R3b', -(CH2)0-5O(CH2)1-5R3b', -(CH2)1-5S(CH2)1-5R3b' и -C0-3алкиленарила; где R3a' выбран из H, -C1-6алкила, -C3-6циклоалкила и -C0-1алкиленфенила; и R3b' выбран из H, -C1-6алкила, -C3-6циклоалкила, -C2-4алкенила, -C2-4алкинила и фенила; R4' представляет собой -X'-CR5'R6'R7'; X' представляет собой C1-12алкилен, где по меньшей мере одна группа -CH2- в алкилене заменена на группу -NR4a'-C(O)- или -C(O)-NR4a'-, где R4a' выбран из H, -OH и -C1-4алкила; R5' выбран из -C0-3алкилен-SR5a', -C0-3алкилен-C(O)NR5b'R5c', -C0-3алкилен-NR5b'-C(O)R5d', -C0-1алкилен-NHC(O)CH2SH, -NH-C0-1алкилен-P(O)(OH)2, -C0-3алкилен-P(O)OH-R5e', -C0-2алкилен-CHR5f'-COOH и -C0-3алкилен-C(O)NR5g'-CHR5h'-COOH; где R5a' выбран из H, -C(O)-C1-6алкила, -C(O)-C0-6алкилен-C3-7циклоалкила, -C(O)-C0-6алкиленарила и -C(O)-C0-6алкиленгетероарила; R5b' выбран из H, -OH, -OC(O)C1-6алкила, -CH2COOH, -O-бензила, -пиридила, -OC(O)OCH2-фенила, -OC(O)CH2O-фенила, -OC(O)N(CH3)2 и -OC(S)N(CH3)2; R5c' выбран из H, -C1-6алкила и -C(O)-R5c'', где R5c'' выбран из -C1-6алкила, -C3-7циклоалкила, арила и гетероарила; R5d' выбран из H, -C1-4алкила, -C0-3алкиленарила, -NR5d''R5d''' и -O-C1-6алкила, где R5d'' и R5d''' независимо выбраны из H и -C1-4алкила; R5e' выбран из H, -C1-4алкила, -C0-3алкиленарила, -C1-3алкилен-NR5e''R5e''' и -C1-3алкилен(арил)-C0-3алкилен-NR5e''R5e''', где R5e'' и R5e''' независимо выбраны из H и -C1-4алкила; R5f' выбран из H, -C1-6алкила, -C1-3алкиленарила и -CH2-O-(CH2)2-OCH3; R5g' выбран из H и -C1-4алкила; и R5h' выбран из H, -C1-4алкила и -C0-3алкиленарила; R6' выбран из -C1-6алкила, -CH2O(CH2)2OCH3, -C1-6алкилен-O-C1-6алкила, -C0-3алкиленарила, -C0-3алкиленгетероарила и -C0-3алкилен-C3-7циклоалкила; и R7' представляет собой H или является взятым вместе с R6' с образованием -C3-8циклоалкила; где каждая группа -CH2- в -(CH2)r'-, необязательно, является замещенной 1 или 2 заместителями, независимо выбранными из -C1-4алкила и фтора; каждый алкил и каждый арил в R1'-4', необязательно, является замещенным 1-7 атомами фтора; каждое кольцо в Ar' и каждый арил в R1'-4', необязательно, является замещенным 1-3 заместителями, независимо выбранными из -OH, -C1-6алкила, -C2-4алкенила, -C2-4алкинила, -CN, галогена, -O(C1-6алкил), -S(C1-6алкил), -S(O)(C1-6алкил), -S(O)2(C1-4алкил), -фенила, -NO2, -NH2, -NH(C1-6алкил) и -N(C1-6алкил)2, где каждый алкил, алкенил и алкинил, необязательно, является замещенным 1-5 атомами фтора; и каждый атом углерода в алкиленовой группе в X', необязательно, является замещенным еще одной из групп R4b', и одна группа -CH2- в X' может являться замещенной -C4-8циклоалкиленом; где R4b' выбран из -C0-5алкилен-COOH, -C1-6алкила, -C0-1алкилен-CONH2, -C1-2алкилен-OH, -C0-3алкилен-C3-7циклоалкила и бензила; и их фармацевтически приемлемые соли.
В одном конкретном варианте осуществления соединения формулы (I') Y' представляет собой -C(R3')-, Z' представляет собой -N-, Q' представляет собой -C(R2')-, и A' представляет собой связь, что можно представить как:
 .
.
Кроме того, конкретные представляющие интерес соединения формулы I включают соединения, описанные в примерах ниже, так же как их фармацевтически приемлемые соли.
ОПРЕДЕЛЕНИЯ
При описании соединений, композиций, способов и процессов по изобретению следующие термины обладают следующими значениями, если нет иных указаний. Кроме того, как применяют в настоящем описании, формы единственного числа включают соответствующие формы множественного числа, если контекст использования явно не требует иного. Термины «содержащий», «включающий» и «обладающий» предназначены, чтобы являться охватывающими, и подразумевают, что могут существовать дополнительные элементы, отличные от перечисленных элементов.
Термин «фармацевтически приемлемый» относится к материалу, который не является биологически или иным образом нежелательным. Например, термин «фармацевтически приемлемый носитель» относится к материалу, который можно включать в композицию и вводить пациенту, не вызывая нежелательных биологических эффектов или взаимодействия вредным образом с другими компонентами композиции. Такие фармацевтически приемлемые материалы, как правило, соответствуют стандартам токсикологического и производственного тестирования и включают материалы, идентифицированные как подходящие неактивные ингредиенты Управлением по контролю за качеством пищевых продуктов и лекарственных средств США.
Термин «фармацевтически приемлемая соль» обозначает соль, полученную из основания или кислоты, являющейся приемлемой для введения пациенту, такому как млекопитающее (например, соли, обладающие приемлемой безопасностью для млекопитающего для данного режима дозирования). Однако, понятно, что соли, предусмотренные изобретением, необязательно должны представлять собой фармацевтически приемлемые соли, например соли промежуточных соединений, не предназначенные для введения пациенту. Фармацевтически приемлемые соли можно получать из фармацевтически приемлемых неорганических или органических оснований и из фармацевтически приемлемых неорганических или органических кислот. Кроме того, когда соединение формулы I содержит как основную группу, такую как амин, пиридин или имидазол, так и кислотную группу, такую как карбоновая кислота или тетразол, могут образовываться цвиттерионы, и они включены в термин «соль», как применяют в настоящем описании. Соли, полученные из фармацевтически приемлемых неорганических оснований, включают соли аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия и цинка, и т.п. Соли, полученные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и т.п., такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперадин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Соли, полученные из фармацевтически приемлемых неорганических кислот, включают соли борной, угольной, галогенводородной (бромистоводородной, хлористоводородной, фтористоводородной или йодистоводородной), азотной, фосфорной, сульфаминовой и серной кислот. Соли, полученные из фармацевтически приемлемых органических кислот, включают соли кислот с алифатическим гидроксилом (например, лимонной, глюконовой, гликолевой, молочной, лактобионовой, яблочной и виннокаменной кислот), алифатических монокарбоновых кислот (например, уксусной, масляной, муравьиной, пропионовой и трифторуксусной кислот), аминокислот (например, аспарагиновой и глутаминовой кислот), ароматических карбоновых кислот (например, бензойной, п-хлорбензойной, дифенилуксусной, гентизиновой, гиппуровой и трифенилуксусной кислот), кислот с ароматическим гидроксилом (например, о-гидроксибензойной, п-гидроксибензойной, 1-гидроксинафталин-2-карбоновой и 3-гидроксинафталин-2-карбоновой кислот), аскорбиновой, дикарбоновых кислот (например, фумаровой, малеиновой, щавелевой и янтарной кислот), глюкуроновой, миндальной, муциновой, никотиновой, оротовой, памовой, пантотеновой, сульфоновой кислот (например, бензолсульфоновой, камфосульфоновой, этан-1,2-дисульфоновой, этансульфоновой, изэтионовой, метансульфоновой, нафталинсульфоновой, нафталин-1,5-дисульфоновой, нафталин-2,6-дисульфоновой и п-толуолсульфоновой кислот), 1-гидрокси-2-нафтойной кислоты и т.п.
Как применяют в настоящем описании, термин «пролекарство» предназначен, чтобы обозначать неактивный (или значительно менее активный) предшественник лекарственного средства, который преобразуется в активную форму в организме при физиологических условиях, например, посредством нормальных метаболических процессов. Термин предназначен также, чтобы включать конкретные защищенные производные соединений формулы I, которые могут быть получены перед конечной стадией снятия защиты. Такие соединения могут не обладать фармакологической активностью по отношению к AT1 и/или NEP, однако, могут быть введены перорально или парентерально и затем подвергаться метаболизму в организме с образованием соединений по изобретению, являющихся фармакологически активными по отношению к AT1 и/или NEP. Таким образом, все защищенные производные и пролекарства соединений формулы I включены в объем изобретения. Пролекарства соединений формулы I, обладающие свободной карбоксильной, сульфгидрильной или гидроксигруппой, можно легко синтезировать способами, хорошо известными в данной области. Эти производные пролекарства затем переводят сольволизом или при физиологических условиях в соединения со свободной карбоксильной, сульфгидрильной и/или гидроксигруппой. Примеры пролекарств включают сложные эфиры, включая C1-6алкилэфиры и арил-C1-6алкилэфиры, карбонатные сложные эфиры, сложные полуэфиры, фосфатные сложные эфиры, нитроэфиры, сульфатные сложные эфиры, сульфоксиды, амиды, карбаматы, азосоединения, фосфамиды, гликозиды, простые эфиры, ацетали, кетали и дисульфиды. В одном варианте осуществления соединения формулы I обладают свободным сульфгидрилом или свободным карбоксилом и пролекарство представляет собой производное сложного эфира.
Термин «сольват» обозначает комплекс или агрегат, образованный одной или несколькими молекулами растворенного вещества, например, соединения формулы I или его фармацевтически приемлемой соли, и одной или несколькими молекулами растворителя. Такие сольваты, как правило, представляют собой кристаллические твердые вещества, обладающие по существу фиксированным молярным соотношением растворенного вещества и растворителя. Репрезентативные растворители включают, в качестве примера, воду, метанол, этанол, изопропанол, уксусную кислоту и т.п. Когда растворитель представляет собой воду, образованный сольват представляет собой гидрат.
Термин «терапевтически эффективное количество» обозначает количество, достаточное для эффекта лечения при введении нуждающемуся в этом пациенту, то есть, количество лекарственного средства, необходимое для получения желательного терапевтического эффекта. Например, терапевтически эффективное количество для лечения гипертензии может представлять собой количество лекарственного средства, необходимое для уменьшения кровяного давления, или количество лекарственного средства, необходимое для поддержания нормального кровяного давления. С другой стороны, термин «эффективное количество» обозначает количество, достаточное для получения желательного результата, который необязательно представляет собой терапевтический результат. Например, при изучении системы, содержащей рецептор AT1, «эффективное количество» может представлять собой количество, необходимое для антагонизма рецептора.
Термин «лечение» или «терапия», как применяют в настоящем описании, обозначает лечение или терапию заболевания или медицинского состояния (такого как гипертензия) у пациента, такого как млекопитающее (в частности, человек), которое включает (a) предотвращение возникновения заболевания или медицинского состояния, то есть, профилактическое лечение пациента; (b) улучшение заболевания или медицинского состояния, например, прекращением или вызовом ремиссии заболевания или медицинского состояния у пациента; (c) супрессию заболевания или медицинского состояния, например, замедлением или остановкой развития заболевания или медицинского состояния у пациента; или (d) облегчение симптомов заболевания или медицинского состояния у пациента. Например, термин «лечение гипертензии» включает предотвращение возникновения гипертензии, улучшение гипертензии, супрессию гипертензии и облегчение симптомов гипертензии (например, снижение кровяного давления). Термин «пациент» предназначен, чтобы включать тех млекопитающих, таких как человека, которые нуждаются в лечении или предотвращении заболевания, или которых в настоящее время лечат для предотвращения заболевания или лечения конкретного заболевания или медицинского состояния. Термин «пациент» включает также тестируемых субъектов, для которых оценивают соединения по изобретению, или тестируемых субъектов, используемых в анализе, например, в модели на животных.
Термин «алкил» обозначает одновалентную насыщенную углеводородную группу, которая может являться линейной или разветвленной. Если не определено иначе, такие алкильные группы, как правило, содержат от 1 до 10 атомов углерода и включают, например, -C1-4алкил, -C1-6алкил и -C1-10алкил. Репрезентативные алкильные группы включают, в качестве примера, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и т.п.
Когда конкретное число атомов углерода предназначено для конкретного термина, указанного в настоящем описании, число атомов углерода показано перед термином как подстрочный индекс. Например, термин «-C1-6алкил» обозначает алкильную группу, обладающую от 1 до 6 атомами углерода, и термин «-C3-6циклоалкил» обозначает циклоалкильную группу, обладающую от 3 до 6 атомами углерода, где атомы углерода присутствуют в любой приемлемой конфигурации.
Термин «алкилен» обозначает двухвалентную насыщенную углеводородную группу, которая может являться линейной или разветвленной. Если не определено иначе, такие алкиленовые группы, как правило, содержат от 0 до 10 атомов углерода и включают, например, -C0-1алкилен-, -C0-2алкилен-, -C0-3алкилен-, -C0-5алкилен-, -C0-6алкилен-, -C1-2алкилен- и -C1-12алкилен-. Репрезентативные алкиленовые группы включают, в качестве примера, метилен, этан-1,2-диил («этилен»), пропан-1,2-диил, пропан-1,3-диил, бутан-1,4-диил, пентан-1,5-диил и т.п. Понятно, что когда термин «алкилен» включает ноль атомов углерода, например, -C0-1алкилен- или -C0-5алкилен-, такие термины предназначены, чтобы включать одинарную связь.
Термин «алкилтио» обозначает одновалентную группу формулы -S-алкил, где алкил является таким, как определено в настоящем описании. Если не определено иначе, такие алкилтиогруппы, как правило, содержат от 1 до 10 атомов углерода и включают, например, -S-C1-4алкил и -S-C1-6алкил. Репрезентативные алкилтиогруппы включают, в качестве примера, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио и трет-бутилтио.
Термин «алкенил» обозначает одновалентную ненасыщенную углеводородную группу, которая может являться линейной или разветвленной и которая обладает по меньшей мере одной, и как правило, 1, 2 или 3, двойными связями углерод-углерод. Если не определено иначе, такие алкенильные группы, как правило, содержат от 2 до 10 атомов углерода и включают, например, -C2-4алкенил и -C2-10алкенил. Репрезентативные алкенильные группы включают, в качестве примера, этенил, н-пропенил, изопропенил, н-бут-2-енил, н-гекс-3-енил и т.п. Термин «алкенилен» обозначает двухвалентную алкенильную группу и включает такие группы, как -C2-3алкенилен-.
Термин «алкокси» обозначает одновалентную группу формулы -O-алкил, где алкил является таким, как определено в настоящем описании. Если не определено иначе, такие алкоксигруппы, как правило, содержат от 1 до 10 атомов углерода и включают, например, -O-C1-4алкил и -O-C1-6алкил. Репрезентативные алкоксигруппы включают, в качестве примера, метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси, трет-бутокси и т.п.
Термин «алкинил» обозначает одновалентную ненасыщенную углеводородную группу, которая может являться линейной или разветвленной и которая обладает по меньшей мере одной, и как правило, 1, 2 или 3, тройными связями углерод-углерод. Если не определено иначе, такие алкинильные группы, как правило, содержат от 2 до 10 атомов углерода и включают, например, -C2-4алкинил и -C3-10алкинил. Репрезентативные алкинильные группы включают, в качестве примера, этинил, н-пропинил, н-бут-2-инил, н-гекс-3-инил и т.п. Термин «алкинилен» обозначает двухвалентную алкинильную группу и включает такие группы, как -C2-3алкинилен.
Аминокислотные остатки часто обозначают как -C(O)-CHR-NH-, где группа R обозначает «боковую цепь аминокислоты». Таким образом, для аминокислоты валина, HO-C(O)-CH[-CH(CH3)2]-NH2, боковая цепь представляет собой -CH(CH3)2. Термин «боковая цепь аминокислоты» предназначен, чтобы включать боковые цепи двадцати широко распространенных природных аминокислот: аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина. Особенный интерес представляют боковые цепи неполярных аминокислот, таких как изолейцин, лейцин и валин.
Термин «арил» обозначает одновалентный ароматический углеводород, имеющий одно кольцо (например, фенил) или конденсированные кольца. Системы конденсированных колец включают полностью ненасыщенные (например, нафталин), так же как частично ненасыщенные (например, 1,2,3,4-тетрагидронафталин). Если не определено иначе, такие арильные группы, как правило, содержат от 6 до 10 атомов углерода кольца и включают, например, -C6-10арил. Репрезентативные арильные группы включают, в качестве примера, фенил и нафталин-1-ил, нафталин-2-ил и т.п. Термин «арилен» обозначает двухвалентную арильную группу, такую как как фенилен.
Термин «циклоалкил» обозначает одновалентную насыщенную карбоциклическую углеводородную группу. Если не определено иначе, такие циклоалкильные группы, как правило, содержат от 3 до 10 атомов углерода и включают, например, -C3-5циклоалкил, -C3-6циклоалкил и -C3-7циклоалкил. Репрезентативные циклоалкильные группы включают, в качестве примера, циклопропил, циклобутил, циклопентил, циклогексил и т.п. Термин «циклоалкилен» обозначает двухвалентную арильную группу, такую как -C4-8циклоалкилен.
Термин «галоген» обозначает фтор, хлор, бром и йод.
Термин «гетероарил» обозначает одновалентную ароматическую группу, имеющую одно кольцо или два конденсированных кольца и содержащую в кольце(кольцах) по меньшей мере один гетероатом (как правило, 1-3), выбранный из азота, кислорода или серы. Если не определено иначе, такие гетероарильные группы, как правило, содержат всего от 5 до 10 атомов кольца и включают, например, -C2-9гетероарил. Репрезентативные гетероарильные группы включают, в качестве примера, одновалентные типы пиррола, имидазола, тиазола, оксазола, фурана, тиофена, триазола, пиразола, изоксазола, изотиазола, пиридина, пиразина, пиридазина, пиримидина, триазина, индола, бензофурана, бензотиофена, бензоимидазола, бензтиазола, хинолина, изохинолина, хиназолина, хиноксалина и т.п., где точкой присоединения является любой доступный атом углерода или азота кольца.
Термин «необязательно замещенный» означает, что рассматриваемая группа может являться незамещенной или может являться замещенной один или несколько раз, например, 1-3 раза или 1-5 раз. Например, алкильная группа, которая является «необязательно замещенной» 1-5 атомами фтора, может являться незамещенной или может содержать 1, 2, 3, 4 или 5 атомов фтора.
Термин «его защищенные производные» обозначает производное указанного соединения, в котором одна или несколько функциональных групп соединения являются защищенными или блокированными от вступления в нежелательные реакции с помощью защитной или блокирующей группы. Функциональные группы, которые можно защищать, включают, в качестве примера, карбоксигруппы, аминогруппы, гидроксильные группы, тиольные группы, карбонильные группы и т.п. Репрезентативные защитные группы для карбоксигрупп включают сложные эфиры (такие как сложный эфир п-метоксибензила), амиды и гидразиды; для аминогруппы - карбаматы (такие как трет-бутоксикарбонил) и амиды; для гидроксильных групп - простые и сложные эфиры; для тиольных групп - простые и сложные тиоэфиры; для карбонильных групп - ацетали и кетали; и т.п. Такие защитные группы хорошо известны специалистам в данной области и описаны, например, в T.W.Greene and G.M.Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999 и процитированных в нем ссылках.
Все другие термины, применяемые в настоящем описании, предназначены, чтобы иметь свои обычные значения, как понятно обычному специалисту в области, к которой они относятся.
ОБЩИЕ СПОСОБЫ СИНТЕЗА
Соединения по изобретению можно получать из легко доступных исходных веществ с использованием следующих общих способов, способов, указанных в примерах, или с использованием других способов, реагентов и исходных веществ, известных специалистам в данной области. Хотя следующие способы могут иллюстрировать конкретный вариант осуществления изобретения, понятно, что другие варианты осуществления изобретения можно получать подобным образом с использованием таких же или подобных способов или с использованием других способов, реагентов и исходных веществ, известных средним специалистам в данной области. Следует понимать также, что где приведены типичные или предпочтительные условия процесса (например, температуры реакции, периоды времени, молярные соотношения реагентов, растворители, давление и т.д.), другие условия процесса также можно использовать, если нет иных указаний. В то время как оптимальные условия реакции, как правило, могут меняться в зависимости от различных параметров реакции, таких как используемые конкретные реагенты, растворители и количества, обычные специалисты в данной области могут легко определить подходящие условия реакции с использованием общепринятых способов оптимизации.
Кроме того, как очевидно специалистам в данной области, общепринятые защитные группы могут являться необходимыми или желательными для предотвращения вступления конкретных функциональных групп в нежелательные реакции. Выбор подходящей защитной группы для конкретной функциональной группы, так же как подходящих условий и реагентов для защиты и снятия защиты таких функциональных групп, хорошо известен в данной области. Защитные группы, отличные от групп, проиллюстрированных в способах, описанных в настоящем описании, можно использовать, если желательно. Например, многочисленные защитные группы, их введение и удаление описаны в T.W. Greene and G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999 и процитированных в нем ссылках. Более конкретно, следующие сокращения и реагенты используют в схемах, представленных ниже:
P1 представляет собой «группу для защиты аминогруппы», термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций аминогруппы. Репрезентативные группы для защиты аминогруппы включают в качестве неограничивающих примеров, трет-бутоксикарбонил (BOC), тритил (Tr), бензилоксикарбонил (Cbz), 9-флуоренилметоксикарбонил (Fmoc), формил, триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS) и т.п. Общепринятые способы снятия защиты используют для удаления группы P1. Например, снятие защиты группы N-BOC может включать такие реагенты, как TFA в DCM или HCl в 1,4-диоксане, в то время как группу Cbz можно удалять применением условий каталитической гидрогенизации, таких как H2 (1 атм (101325 Па)), 10% Pd/C в спиртовом растворителе.
P2 представляет собой «группу для защиты карбоксигруппы», термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций карбоксигруппы. Репрезентативные группы для защиты карбоксигруппы включают в качестве неограничивающих примеров метил, этил, трет-бутил, бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), дифенилметил (бензгидрил, DPM) и т.п. Общепринятые способы снятия защиты используют для удаления группы P2, и они могут меняться в зависимости от используемой группы. Например, NaOH является общепринятым, когда P2 представляет собой метил, кислота, такая как TFA или HCl, является общепринятой, когда P2 представляет собой трет-бутил, и условия каталитической гидрогенизации, такие как H2 (1 атм (101325 Па)) и 10% Pd/C в спиртовом растворителе («H2/Pd/C»), можно использовать, когда P2 представляет собой бензил.
P3 представляет собой «группу для защиты тиола», термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций тиоловой группы. Репрезентативные тиолзащитные группы включают в качестве неограничивающих примеров, простые эфиры, сложные эфиры, такие как -C(O)CH3, и т.п. Общепринятые способы снятия защиты и реагенты, такие как NaOH, первичные алкиламины и гидразин, можно использовать для удаления группы P3.
P4 представляет собой «группу для защиты тетразола», термин применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций тетразольной группы. Репрезентативные группы для защиты тетразола включают в качестве неограничивающих примеров тритил и дифенилметил. Общепринятые способы снятия защиты и такие реагенты, как TFA в DCM или HCl в 1,4-диоксане, можно использовать для удаления группы P4.
P5 представляет собой «группу для защиты гидроксила», a термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций гидроксильной группы. Репрезентативные группы для защиты гидроксила включают в качестве неограничивающих примеров C1-6алкилы, силильные группы, включая группы триC1-6алкилсилила, такие как триметилсилил (TMS), триэтилсилил (TES) и трет-бутилдиметилсилил (TBDMS); сложные эфиры (ацильные группы), включая C1-6алканоильные группы, такие как формил, ацетил и пивалоил, и ароматические ацильные группы, такие как бензоил; арилметильные группы, такие как бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); и т.п. Общепринятые способы и реагенты для снятия защиты используют для удаления группы P5, и они могут меняться в зависимости от используемой группы. Например, H2/Pd/C является общепринятым, когда P5 представляет собой бензил, в то время как NaOH является общепринятым, когда P5 представляет собой ацильную группу.
P6 представляет собой «группу для защиты сульфонамида», термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций сульфонамидной группы. Репрезентативные группы для защиты сульфонамида включают в качестве неограничивающих примеров трет-бутильные и ацильные группы. Примеры ацильных групп включают алифатические низшие ацильные группы, такие как формил, ацетил, фенилацетил, бутирильную, изобутирильную, валерильные, изовалерильные и пивалоильные группы, и ароматические ацильные группы, такие как бензоил и 4-ацетоксибензоил. Общепринятые способы и реагенты для снятия защиты используют для удаления группы P6, и они могут меняться в зависимости от используемой группы. Например, HCl является общепринятым, когда P6 представляет собой трет-бутил, в то время как NaOH является общепринятым, когда P6 представляет собой ацильную группу.
P7 представляет собой «группу для защиты фосфата или группу для защиты фосфината», термин, применяемый в настоящем описании для обозначения защитной группы, подходящей для предотвращения нежелательных реакций фосфатной или фосфинатной группы. Репрезентативные защитные группы для фосфата и фосфината включают в качестве неограничивающих примеров C1-4алкилы, арил (например, фенил) и замещенные арилы (например, хлорфенил и метилфенил). Защищенную группу можно представить -P(O)(OR)2, где R представляет собой такую группу, как C1-6алкил или фенил. Общепринятые способы снятия защиты и реагенты, такие как TMS-I/2,6-лутидин, и H2/Pd/C используют для удаления группы P7, такой как этил и бензил, соответственно.
Кроме того, L используют для обозначения «уходящей группы», термин, применяемый в настоящем описании для обозначения функциональной группы или атома, которую можно замещать другой функциональной группой или атомом в реакции замещения, такой как реакция нуклеофильного замещения. В качестве примера, репрезентативные уходящие группы включают группы хлора, брома и йода; группы сульфонового сложного эфира, такие как мезилат, трифлат, тозилат, брозилат, нозилат и т.п.; и ацилоксигруппы, такие как ацетокси, трифторацетокси и т.п.
Подходящие основания для использования в этих схемах включают, в качестве иллюстрации, а не ограничения, карбонат калия, карбонат кальция, карбонат натрия, триэтиламин, пиридин, 1,8-диазабицикло-[5.4.0]ундец-7-ен (DBU), N,N-диизопропилэтиламин (DIPEA), гидроксид натрия, гидроксид калия, трет-бутоксид калия, и гидриды металлов.
Подходящие инертные разбавители или растворители для использования в этих схемах включают, в качестве иллюстрации, а не ограничения, тетрагидрофуран (THF), ацетонитрил (MeCN), N,N-диметилформамид (DMF), диметилсульфоксид (DMSO), толуол, дихлорметан (DCM), хлороформ (CHCl3), тетрахлорметан (CCl4), 1,4-диоксан, метанол, этанол, воду и т.п.
Подходящие реагенты для сочетания карбоновой кислоты/амина включают гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония (PyBOP), гексафторфосфат O-(7-азабензотриазол-1-ил-N,N,N',N'-тетраметилурония (HATU), дициклогексилкарбодиимид (DCC), N-(3-диметиламинопропил)-N'-этилкарбодиимид (EDC), карбонилдиимидазол (CDI) и т.п. Реакции сочетания проводят в инертном разбавителе в присутствии основания и проводят в общепринятых условиях для формирования амидной связи.
Все реакции, как правило, проводят при температуре в диапазоне от приблизительно -78°C до 100°C, например, при комнатной температуре. Реакции можно мониторировать с использованием тонкослойной хроматографии (TLC), высокоэффективной жидкостной хроматографии (HPLC), и/или LCMS до завершения. Реакции могут завершаться за минуты или могут занимать часы, как правило, от 1-2 часов и вплоть до 48 часов. После завершения полученную смесь или продукт реакции можно обрабатывать далее с получением желаемого продукта. Например, полученную смесь или продукт реакции можно подвергать одной или нескольким из следующих процедур: концентрированию или разделению (например, между EtOAc и водой или между 5% THF в EtOAc и 1 М фосфорной кислотой); экстракции (например, с помощью EtOAc, CHCl3, DCM, HCl); промывке (например, насыщенным водным NaCl, насыщенным NaHCO3, Na2CO3 (5%), CHCl3 или 1 М NaOH); высушиванию (например, над MgSO4, над Na2SO4 или в вакууме); фильтрации; кристаллизации (например, из EtOAc и гексана); и/или концентрации (например, в вакууме).
В качестве иллюстрации, соединения формулы I, так же как их соли, сольваты и пролекарства можно получать одним или несколькими из следующих приведенных в качестве примера способов.
Схема I: Реакция сочетания пептидов и необязательное снятие защиты
Группа X содержит одну или несколько амидных групп, и таким образом, соединения по изобретению можно получать реакцией сочетания в общепринятых условиях формирования амидной связи с последующей стадией снятия защиты, если необходимо. В схеме I группы A и B сочетают с образованием X, и сумма a и b лежит в диапазоне от 0 до 11. Таким образом, одна группа содержит аминогруппу и одна группа содержит группу карбоновой кислоты, т.е. A представляет собой -NH2 и B представляет собой -COOH, или A представляет собой -COOH, и B представляет собой -NH2.
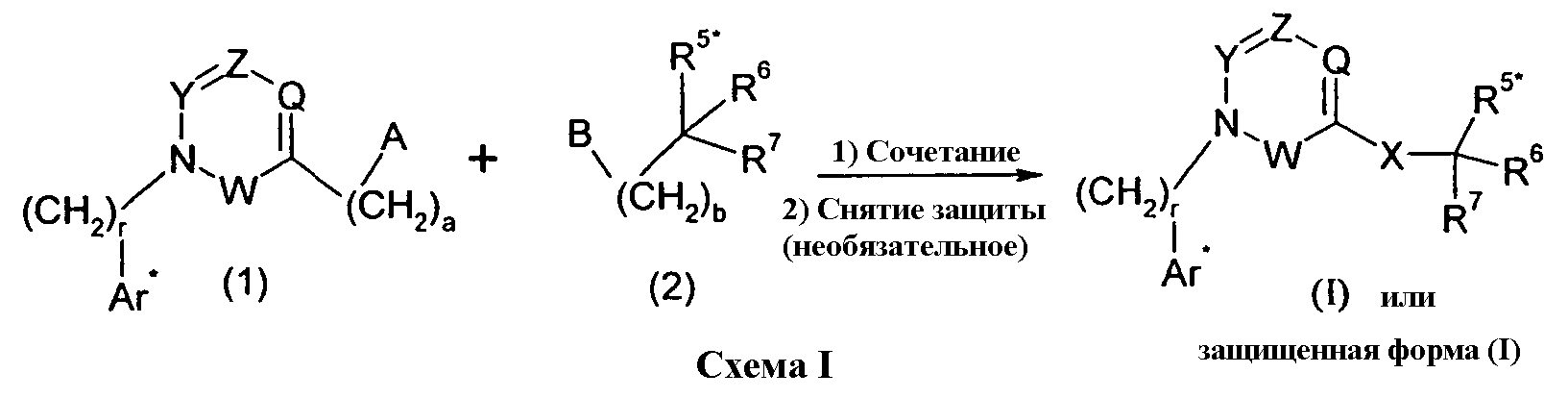
Например, чтобы синтезировать соединение формулы I, где X представляет собой -CONH-, A может представлять собой -COOH и B может представлять собой -NH2. Подобным образом, A в виде -NH2 и B в виде -COOH можно сочетать с образованием -NHCO- в качестве группы X. A и B можно легко модифицировать, если более длинный X является желательным, содержит ли он алкиленовую часть или дополнительные амидные группы. Например, A в виде -CH2NH2 и B в виде -COOH можно сочетать с образованием -CH2NHCO- в качестве группы X.
Понятно, что атомы углерода в группах -(CH2)a и -(CH2)b составляют линкер «X». Таким образом, эти атомы углерода можно замещать одной или несколькими группами R4b. Более того, одну группу -CH2- в группе -(CH2)a или -(CH2)b можно замещать группой -C4-8циклоалкилена-, -CR4d=CH-, или -CH=CR4d-.
Ar* представляет собой Ar-R1*, где R1* может представлять собой R1, как определено в настоящем описании, или защищенную форму R1 (например, -тетразол-5-ил-P4 или -C(O)O-P2, например, -C(O)O-C1-6алкил), или предшественник R1 (например, -CN, которую затем превращают в тетразол, или нитро-, который затем превращают в амино-, из которого получают желаемый R1). R5* представляет собой R5, как определено в настоящем описании, или защищенную форму R5. Таким образом, когда R1* представляет собой R1 и R5* представляет собой R5, реакция завершается после стадии сочетания.
С другой стороны, когда R1* представляет собой защищенную форму R1 и/или R5* представляет собой защищенную форму R5, на последующей стадии общего или последовательного снятия защиты можно получить незащищенное соединение. Подобным образом, когда R1* представляет собой предшественник R1, на последующей стадии превращения можно получить желательное соединение. Реагенты и условия для снятия защиты могут меняться в зависимости от природы защитных групп в соединении. Типичные условия снятия защиты, когда R5* представляет собой C0-3алкилен-S-P3, включают обработку соединения NaOH в спиртовом растворителе при 0°C или комнатной температуре с получением незащищенного соединения. Типичные условия снятия защиты, когда R1* представляет собой C(O)O-P2, где P2 относится к трет-бутилу, включают обработку соединения с помощью TFA в DCM при комнатной температуре с получением незащищенного соединения. Таким образом, один способ получения соединений по изобретению включает сочетание соединений (1) и (2) с необязательной стадией снятия защиты, когда R1* представляет собой защищенную форму R1 и/или R5* представляет собой защищенную форму R5, таким образом, получение соединения формулы I или его фармацевтически приемлемой соли.
Примеры соединения (1) включают трет-бутиловый эфир 4'-(5-аминометил-2-бутил-4-хлоримидазол-1-илметил)бифенил-2-карбоновой кислоты; 2-бутил-3-(4-метоксикарбонилбензил)-3H-имидазол-4-карбоновую кислоту; метиловый эфир 4-(5-аминометил-2-бутилимидазол-1-илметил)-2,3-дифторбензойной кислоты; C-{2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-ил}метиламин; 4'-(3-аминометил-5-пропил[1,2,4]триазол-4-илметил)бифенил-2-карбоновую кислоту; 4'-(3-аминометил-6-бутил-2-оксо-2H-пиридин-1-илметил)бифенил-2-карбоновую кислоту; трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)бифенил-2-карбоновой кислоты; трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты; трет-бутиловый эфир 4'-(5-аминометил-2-пропокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты и трет-бутиловый эфир 4'-(5-аминометил-4-хлор-2-этоксиимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты.
Примеры соединения (2) включают (R)-1-бензил-2-гидроксикарбамоилэтил)карбаминовую кислоту; (R)-2-((R)-2-амино-3-фенилпропилдисульфанил)-1-бензилэтиламин; (S)-2-ацетилсульфанил-4-метилпентановую кислоту; 2-ацетилсульфанилметил-4-метилпентановую кислоту и (S)-2-ацетилсульфанилметил-4-метилпентановую кислоту и 1-метиловый эфир (R)-2-(2-бензилоксикарбамоил-3-фенилпропиониламино)янтарной кислоты.
Соединение (1)
Соединение (1) можно получить следующей реакцией:
Соединения (1a) и (1b) сочетают с K2CO3 в растворителе, таком как DMF, с образованием промежуточного соединения (1c), которое затем преобразуют в оксим посредством реакции с гидрохлоридом гидроксиламина (NH2OH·HCl) в пиридине с образованием промежуточного соединения (1d). Проводят реакцию промежуточного соединения (1d) с NaBH3CN, NH4OAc и TiCl3 в таком растворителе, как MeOH, с образованием соединения (1), где A представляет собой -NH(R4a). Соединение (1), где A представляет собой -COOH, можно получить реакцией промежуточного соединения (1c) с 2-метил-2-бутеном, дигидрофосфатом натрия и хлоритом натрия.
Соединение (1a)
Соединение (1a) можно легко получить способами, которые хорошо известны в данной области и/или являются коммерчески доступными. Примеры соединения (1a) включают 2-бутил-5-хлор-3H-имидазол-4-карбальдегид, 5-бром-2-бутил-3H-имидазол-4-карбальдегид, 5-бром-2-этокси-3H-имидазол-4-карбальдегид, бром-2-пропокси-3H-имидазол-4-карбальдегид и 5-хлор-2-этокси-3H-имидазол-4-карбальдегид, которые все либо являются коммерчески доступными, либо их можно легко синтезировать способами, хорошо известными в данной области. Например: 5-бром-2-бутил-3H-имидазол-4-карбальдегид можно получить реакцией 2-бутил-3H-имидазол-4-карбальдегида с N-бромсукцинимидом в подходящем растворителе, таком как DMF; 5-бром-2-этокси-3H-имидазол-4-карбальдегид можно получить реакцией 2,4,5-трибром-1H-имидазола с [β-(триметилсилил)этокси]метилхлоридом с последующей реакцией с трет-бутоксидом калия в этаноле, затем с н-бутиллитием и DMF, с конечной стадией снятия защиты; и 5-хлор-2-этокси-3H-имидазол-4-карбальдегид можно получить реакцией 4,5-дибром-2-этокси-1-(2-триметилсиланилэтоксиметил)-1H-имидазола и гексахлорэтана, затем DMF, где обе стадии проводят с н-бутиллитием, N,N,N',N'-тетраметилэтилендиамином и подходящими растворителями, с конечной стадией снятия защиты.
Соединение (1b)
Исходное вещество (1e) можно получить с использованием способов синтеза, опубликованных в литературе, например, в Duncia et al. (1991) J. Org. Chem. 56: 2395-400, и в процитированных в нем ссылках. Альтернативно, исходное вещество в защищенной форме (1f) может являться коммерчески доступным. С использованием коммерчески доступного незащищенного исходного вещества (1e) группу R1 сначала защищают с образованием защищенного промежуточного соединения (1f), тогда уходящую группу (L) добавляют с образованием соединения (1b), например, реакцией галогенирования. Например, реакция бромирования метильной группы N-трифенилметил-5-[4'-метилбифенил-2-ил]тетразола описана в Chao et al. (2005) J. Chinese Chem. Soc. 52:539-544. Кроме того, когда Ar* обладает группой -CN, ее можно затем переводить в желательную тетразолильную группу, которую можно защищать. Превращения нитрильной группы легко достигают реакцией с подходящим азидом, таким как азид натрия, азид триалкилолова (в частности, азид трибутилолова) или азид триарилолова. Соединение (1b), когда Ar обладает одной из остальных формул, легко синтезировать с использованием сходных способов или других способов, как хорошо известно в данной области.
Примеры способов получения соединения (1b) включают следующие. Раствор исходного вещества (1e) и тионилхлорида перемешивают при комнатной температуре. После завершения реакции реакционную смесь концентрируют в вакууме с получением твердого вещества, которое растворяют в растворителе, таком как THF, и охлаждают до 0°C. Затем добавляют трет-бутоксид калия. После завершения реакции реакционную смесь разделяют между EtOAc и водой. Органический слой промывают насыщенным водным NaCl, высушивают над MgSO4, фильтируют и концентрируют с получением соединения (1f). Альтернативно, к раствору исходного вещества (1e) добавляют HCl и растворитель, такой как метанол. Реакционную смесь нагревают до кипения с обратным холодильником и перемешивают до завершения реакции (~48 часов), затем охлаждают и концентрируют. Выделенное вещество высушивают в вакууме с получением промежуточного соединения (1f). Промежуточное соединение (1f), бензоилпероксид и N-бромсукцинимид растворяют в CCl4 или бензоле, нагревают до кипения с обратным холодильником. Реакционную смесь перемешивают до завершения реакции, охлаждают до комнатной температуры, фильтруют и концентрируют в вакууме. Полученный осадок кристаллизуют из диэтилового эфира и гексана или подвергают флэш-хроматографии с получением соединения (1b). Примеры соединения (1e) включают 4'-метилбифенил-2-карбоновую кислоту; 2,3-дифтор-4-метилбензойную кислоту и 2-фтор-4-метилбензойную кислоту. Примеры соединения (1f) включают N-трифенилметил-5-[4'-метилбифенил-2-ил]тетразол.
Соединение (1b), где R1 представляет собой -SO2NHR1d, можно синтезировать следующим образом:
Исходное вещество, 2-бромбензол-1-сульфонамид, является коммерчески доступным. Реакцией 2-бромбензол-1-сульфонамида в растворителе, таком как DMF, с 1,1-диметокси-N,N-диметилметанамином, с последующим добавлением гидросульфата натрия в воде, получают 2-бром-N-[1-диметиламиномет-(E)-илиден]бензолсульфонамид. Проводят реакцию этого соединения с 4-метилфенилбороновой кислотой с получением 1-диметиламиномет-(E)-илиденамида 4'-метилбифенил-2-сульфоновой кислоты, затем добавляют группу -(CH2)r-L1, например, реакцией галогенирования, с образованием соединения (1b).
Соединение (1b), где группа Ar является замещенной, можно синтезировать следующим образом:
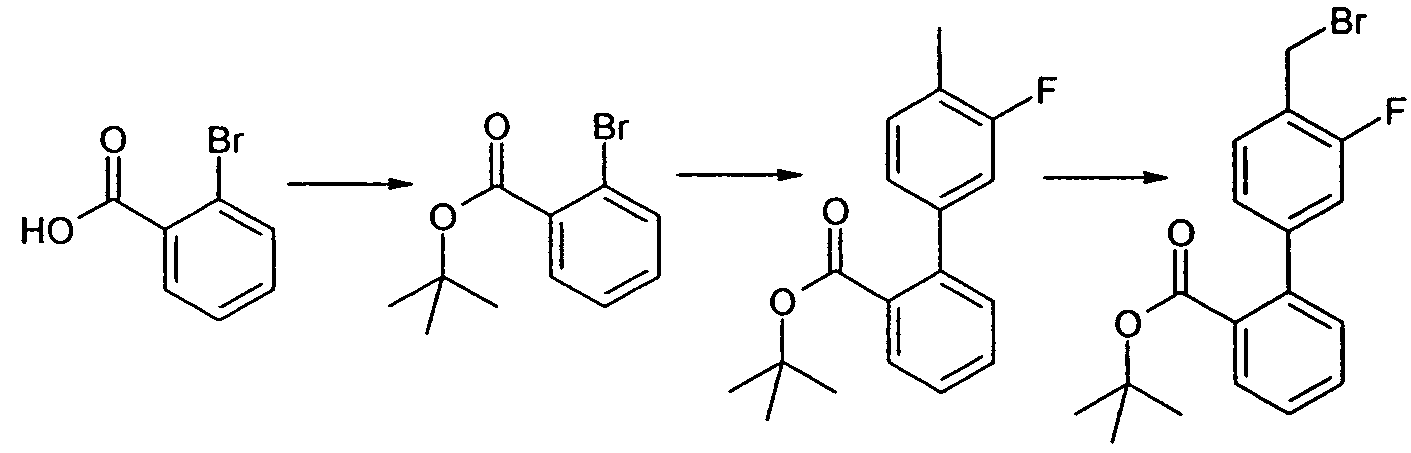
Исходное вещество, 2-бромбензойная кислота, является коммерчески доступным. Реакцией 2-бромбензойной кислоты в подходящем растворителе с трет-бутиловым спиртом, DCC и DMAP получают трет-бутиловый эфир 2-бромбензойной кислоты. Проводят реакцию этого соединения с 3-фтор-4-метилфенилбороновой кислотой с получением трет-бутилового эфира 3'-фтор-4'-метилбифенил-2-карбоновой кислоты, затем добавляют группу -(CH2)r-L1, например, реакцией галогенирования, с образованием соединения (1b).
Примеры соединения (1b) включают 5-(4'-бромметилбифенил-2-ил)-1-тритил-1H-тетразол; трет-бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты; метиловый эфир 4-бромметилбензойной кислоты; метиловый эфир 4-бромметил-2,3-дифторбензойной кислоты; трет-бутиламид 4'-формилбифенил-2-сульфоновой кислоты; трет-бутиловый эфир 4'-аминометилбифенил-2-карбоновой кислоты и трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты.
Соединение (2)
Соединение (2) легко синтезировать, следуя способам, описанным в литературе, например, в Neustadt et al. (1994) J. Med. Chem. 37:2461-2476 и Moree et al. (1995) J. Org. Chem. 60: 5157-69, так же как с использованием приведенных в качестве примера способов, описанных ниже. Примеры соединения (2), изображенные без хиральности, включают:
 и
и 
Поскольку соединение (2) обладает хиральным центром, может являться желательным синтезировать конкретный стереоизомер, и примеры представлены следующим образом.
Получение хирального аминогидроксаматного соединения (2 i )
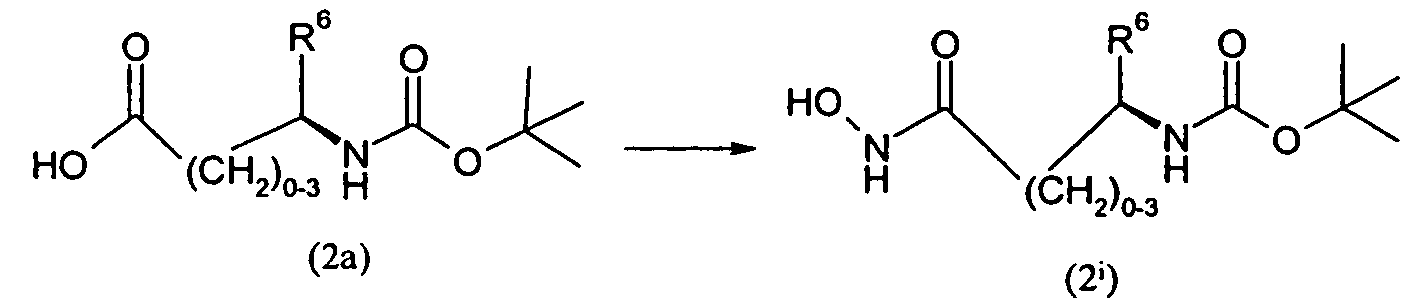
Основание, такое как DIPEA, и средство для сочетания, такое как EDC, добавляют к раствору соединения (2a) в DMF, содержащем HOBt и гидрохлорид гидроксиламина. Смесь перемешивают при комнатной температуре до завершения реакции (~12 часов), затем концентрируют в вакууме. Полученное вещество разделяют между 5% THF в EtOAc и 1 М фосфорной кислотой. Органический слой собирают и промывают основанием, таким как 1 М NaOH. Затем щелочной водный слой подкисляют, например, 1 М фосфорной кислотой, и экстрагируют EtOAc. Органический слой выпаривают и осадок очищают хроматографией на силикагеле с получением соединения (2i). Примеры соединения (2a) включают (R)-3-трет-бутоксикарбониламино-4-фенилмасляную кислоту.
Получение хирального аминосульфгидрильного димерного соединения (2 ii )
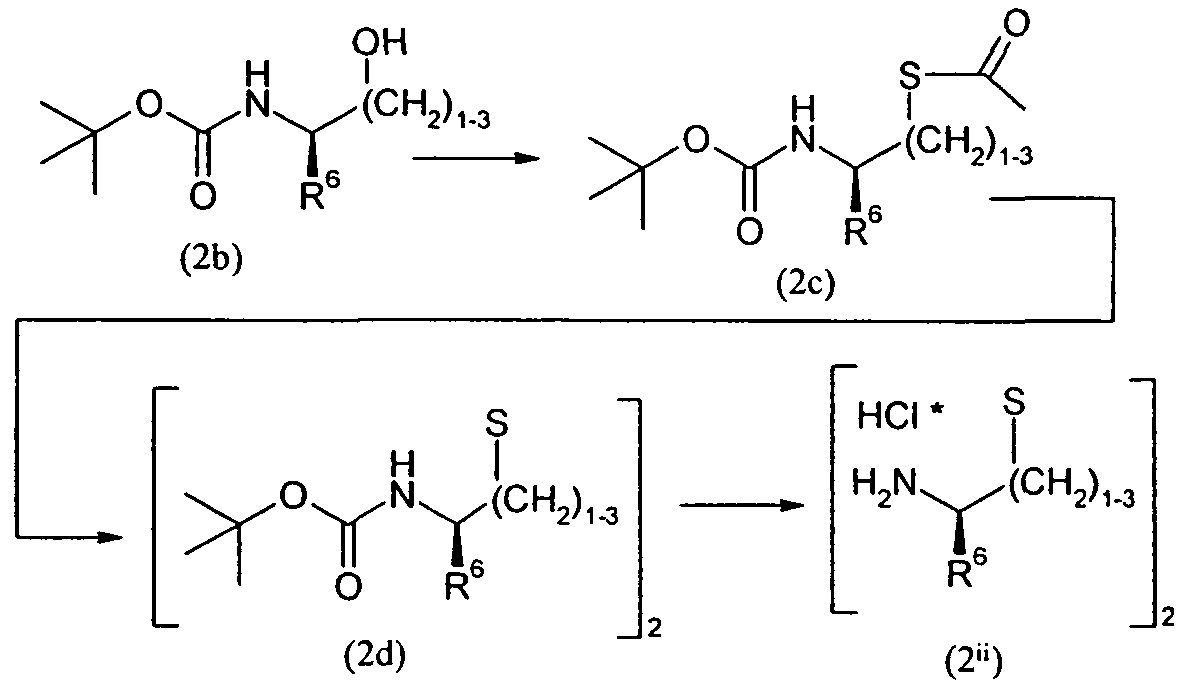
Диизопропилазодикарбоксилат добавляют к раствору трифенилфосфина в растворителе, таком как THF, охлаждают в ледяной бане. Раствор перемешивают и добавляют соединение (2b) и тиоуксусную кислоту. Смесь перемешивают при 0°C в течение 1 часа, затем перемешивают при комнатной температуре до завершения реакции (~12 часов). Смесь подвергают отгонке, разводят EtOAc и промывают холодным насыщенным раствором NaHCO3. Органический слой сушат над MgSO4, и фильтрат выпаривают досуха. Полученный материал подвергают флэш-хроматографии с получением соединения (2c). Соединение (2c) растворяют в растворителе с последующим добавлением основания, такого как 1 М LiOH. Раствор барботируют воздухом в течение 1 часа с последующим добавлением растворителя. Реакционную смесь перемешивают при комнатной температуре до завершения реакции (~24 часа). Затем раствор подкисляют до pH~5, например, с помощью уксусной кислоты. Преципитат фильтруют и промывают деионизированной водой, получая димер соединения (2d). Твердое вещество суспендируют в MeCN, затем концентрируют под пониженным давлением. Выделенный материал растворяют в 4 М HCl в 1,4-диоксане и перемешивают при комнатной температуре до завершения реакции (~2 часа). Затем реакционную смесь концентрируют под пониженным давлением и растирают в порошок с EtOAc. Продукт фильтруют, промывают EtOAc и высушивают в вакууме с получением соединения (2ii). Примеры соединения (2b) включают трет-бутиловый эфир ((R)-1-бензил-2-гидроксиэтил)карбаминовой кислоты.
Получение хирального соединения сульфанильной кислоты (2 iii )
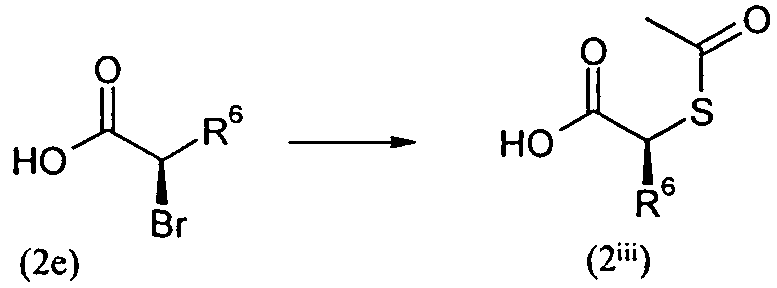
Соединение (2e) получают растворением такого соединения, как D-лейцин (для R6 = изобутил, например), в 3 М HBr (водной) и охлаждением до 0°C. Добавляют раствор NaNO2 в воде, и реакционную смесь перемешивают при 0°C до завершения реакции (~2,5 часа). Затем реакционную смесь экстрагируют EtOAc, промывают насыщенным водным NaCl, высушивают над MgSO4, фильтруют и концентрируют с получением соединения (2e). Соединение (2e) объединяют с тиоацетатом калия или тиоацетатом натрия и DMF и реакционную смесь перемешивают при комнатной температуре до завершения реакции (~1 час). Добавляют воду. Затем реакционную смесь экстрагируют EtOAc, промывают насыщенным водным NaCl, высушивают над MgSO4, фильтруют и концентрируют с получением соединения (2iii). Продукт очищают хроматографией на силикагеле. Примеры соединения (2e) включают (R)-2-бром-4-метилпентановую кислоту. Примеры соединения (2iii) включают (S)-2-ацетилсульфанил-4-метилпентановую кислоту.
Получение соединения сульфанильной кислоты (2 iv )
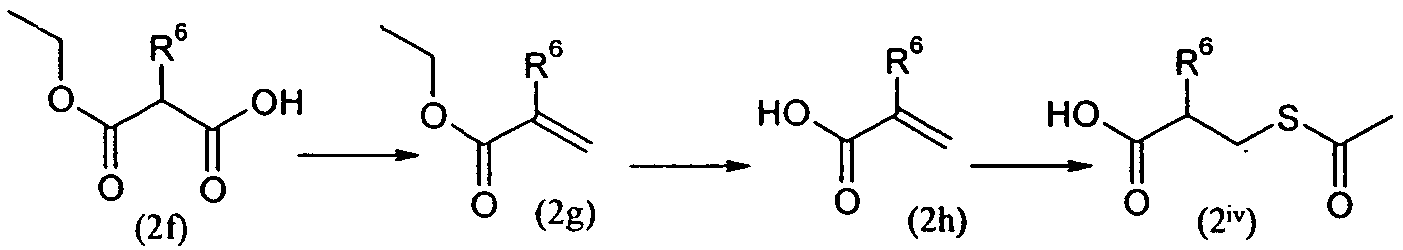
Соединение (2f) смешивают с диэтиламином и охлаждают в ледяной бане. Затем добавляют водный раствор формальдегида (37%) и смесь перемешивают при 0°C в течение приблизительно 2 часов, подогревают до комнатной температуры и перемешивают в течение ночи. Затем смесь экстрагируют эфиром, промывают, высушивают и выпаривают досуха с получением соединения (2g). Затем соединение (2g) растворяют в 1,4-диоксане и добавляют раствор 1 М NaOH. Смесь перемешивают при комнатной температуре до завершения реакции (приблизительно 2 суток). Органический растворитель удаляют в вакууме, и водный остаток промывают EtOAc и подкисляют приблизительно до pH 1 концентрированной HCl. Продукт экстрагируют EtOAc, высушивают и выпаривают досуха с получением соединения (2h). Соединение (2h) объединяют с тиолуксусной кислотой (10 мл), и смесь перемешивают при 80°C до завершения реакции (приблизительно 2 часа), затем концентрируют досуха с получением соединения (2iv), которое растворяют в толуоле и концентрируют для удаления всех остатков тиолуксусной кислоты. Примеры соединения (2f) включают моноэтиловый эфир 2-бензилмалоновой кислоты (R6 = бензил) и моноэтиловый эфир 2-изобутилмалоновой кислоты (R6 = изобутил).
Получение хирального соединения сульфанильной кислоты (2 v )
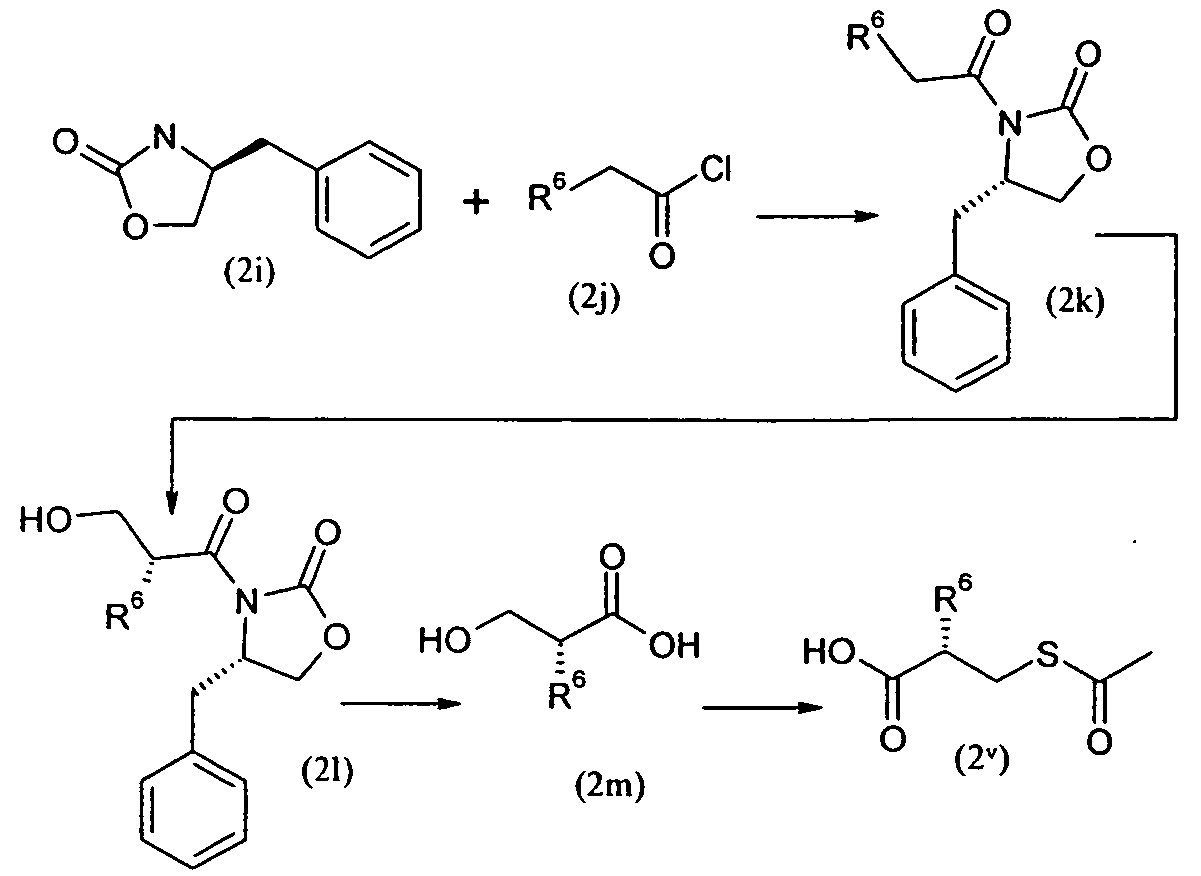
Соединение (2i), (S)-4-бензил-2-оксазолидинон, является коммерчески доступным. Соединение (2j) также, как правило, является коммерчески доступным или его можно легко синтезировать. Например, R6-CH2-COOH (например, изокапроновую кислоту или 3-фенилпропионовую кислоту) растворяют в метиленхлориде и добавляют тионилхлорид. Смесь перемешивают при комнатной температуре до завершения реакции (например, в течение ночи) и затем концентрируют с получением (2j). Примеры соединения (2j) включают 4-метилпентаноилхлорид и 3-фенилпропионилхлорид.
Соединение (2i) растворяют в подходящем растворителе и охлаждают (-78°C) в атмосфере азота. По каплям добавляют н-бутиллитий в гексанах и перемешивают, с последующим добавлением по каплям (2j). Смесь перемешивают при -78°C, затем нагревают до 0°C. Добавляют насыщенный NaHCO3 и смесь нагревают до комнатной температуры. Смесь экстрагируют, промывают, сушат, фильтруют и концентрируют с получением (2k). Соединение (2k) растворяют в DCM и перемешивают при 0°C в атмосфере азота. Добавляют 1 М тетрахлорид титана, затем 1,3,5-триоксан, все в подходящих растворителях. Добавляют второй эквивалент 1 М тетрахлорида титана и смесь перемешивают при 0°C до завершения реакции. Затем реакцию останавливают насыщенным хлоридом аммония. Добавляют подходящие растворители, водную фазу экстрагируют и органические слои объединяют, высушивают, фильтруют и концентрируют с получением (2l), которое затем можно очищать хроматографией на силикагеле или использовать на следующей стадии без дополнительной очистки. Соединение (2l) растворяют в растворителе, к которому добавляют 9 M пероксид водорода в воде, с последующим добавлением по каплям 1,5 M моногидрата гидроксида лития в воде. Смесь нагревают до комнатной температуры и перемешивают. Необязательно, можно добавлять гидроксид калия и нагревать смесь до 60°C, затем охлаждать при комнатной температуре. К этому добавляют водный раствор сульфита натрия, затем воду и хлороформ. Водный слой экстрагируют, подкисляют и снова экстрагируют. Органический слой промывают, высушивают, фильтруют и выпаривают в роторном испарителе с получением (2m). Трифенилфосфин растворяют в подходящем растворителе и охлаждают до 0°C (ледяная баня). Диизопропилазодикарбоксилат добавляют по каплям и смесь перемешивают. Соединение (2m) и тиоуксусную кислоту, растворенную в подходящем растворителе, добавляют в смесь по каплям. После добавления смесь удаляют из ледяной бани и перемешивают при комнатной температуре до завершения реакции (приблизительно 3,5 часа), концентрируют и затем разделяют. Органический слой экстрагируют и объединенные водные экстракты промывают, подкисляют и экстрагируют. Органический слой снова промывают, высушивают, фильтруют и выпаривают в роторном испарителе с получением соединения (2v). Примеры соединения (2v) включают (S)-2-ацетилсульфанилметил-4-метилпентановую кислоту.
Схема II: Реакция сочетания пептидов
Соединения формулы I можно также получать сочетанием соединения (3) и соединения (1), где A представляет собой -COOH, с последующей реакцией с соединением (4). В соединениях (1) и (3), сумма a и b лежит в диапазоне 0-11. В соединениях (3) и (4) группы [R5] и [[R5]] представляют собой части группы R5. Например, если R5 представляет собой -CH2C(O)N(OH)H, тогда [R5] может представлять собой -CH2C(O)-, и [[R5]] может представлять собой -N(OH)H.
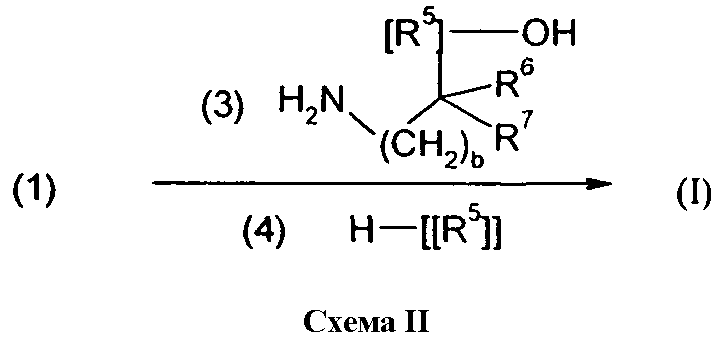
Амидное сочетание соединений (1) и (3), как правило, проводят при комнатной температуре с реагентами для сочетания, такими как пентафторфенол в сочетании с EDC и DIPEA в растворителях, таких как DMF. Соединения (3) и (4) являются коммерчески доступными, или их можно легко синтезировать способами, хорошо известными в данной области. Примеры соединения (3) включают 3-амино-4-(3-хлорфенил)масляную кислоту. Примеры соединения (4) включают H2NOH, H2NO-бензил и H2NO-трет-бутил.
Схема III: Реакция сочетания пептидов
Соединения формулы I можно также получать сочетанием соединений (1) и (5) в общепринятых для формирования амидной связи условиях. Этот синтез является, в частности, применимым с получением соединений формулы I, где более одной группы -CH2- в алкилене заменяют на -NR4a-C(O)- или -C(O)-NR4a-. В описанных ниже соединениях b может, как правило, составлять по меньшей мере 1, и сумма a, b и c лежит в диапазоне 1-10.
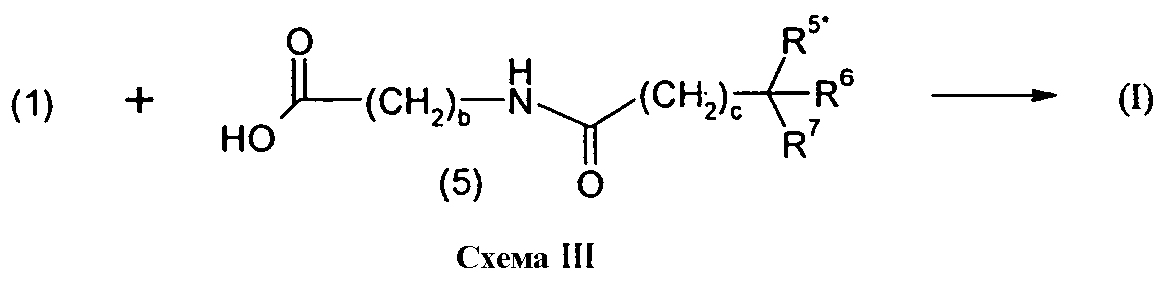
Соединение (5) получают превращением сложноэфирного соединения (6) в кислоту с помощью основания, превращением кислоты в сложный эфир диоксопирролидинила с помощью N-гидроксисукцинимида, затем превращением сложного эфира диоксопирролидинила с помощью соединения (7) с образованием соединения (5). Соединение (5) может обладать одним или несколькими R4b заместителями у атомов углерода в частях -(CH2)b- и/или -(CH2)c-.
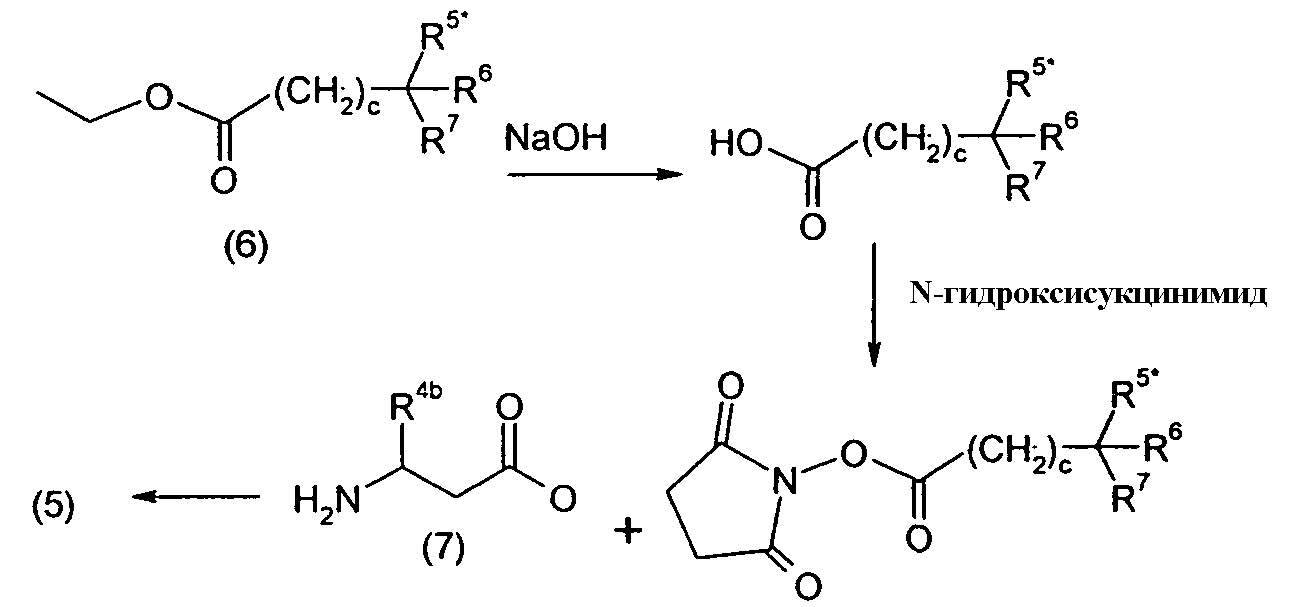
Соединение (6) можно легко синтезировать, следуя способам, описанным в литературе, например, в Fournie-Zaluski et al. (1985) J. Med. Chem. 28(9):1158-1169). Примеры соединения (6) включают этиловый эфир 2-бензил-N-бензилоксималонамовой кислоты. Соединение (7) является коммерчески доступным, или его можно легко синтезировать способами, хорошо известными в данной области. Этот реагент является, в частности, применимым, когда атом углерода в алкиленовой группе в X является замещенным группой R4b. Например, 1-метиловый эфир 2-аминоянтарной кислоты представляет собой пример соединения (7), который применяют при получении соединений, где R4b представляет собой -COOH, где группа R4b представляет собой защищенную форму, -COOMe.
Схема IV: Двухстадийная реакция
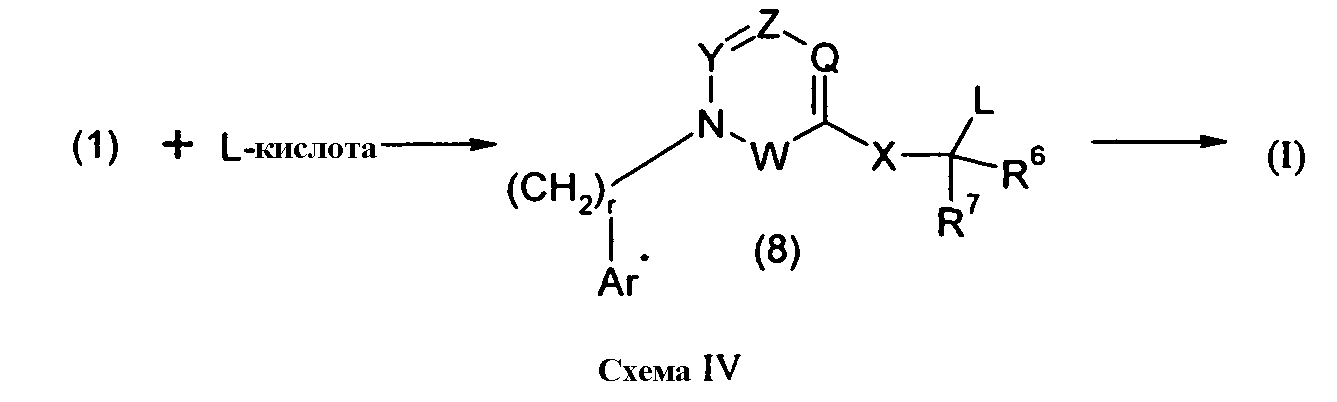
Соединения формулы I можно также получать двухстадийным способом, где первая стадия включает добавление замещенной галогеном алкановой кислоты («L-кислоты»), такой как α-бромизокапроновая кислота, к соединению (1), получая промежуточное соединение (8), где L представляет собой уходящую группу, такую как бром. Затем проводят реакцию промежуточного соединения (8) с содержащим тиол или серу нуклеофильным реагентом, который содержит желательную группу R5*, например, тиоацетатом калия или тиомочевиной.
Если желательно, фармацевтически приемлемые соли соединений формулы I можно получить приведением в контакт формы свободной кислоты или основания соединения формулы I с фармацевтически приемлемым основанием или кислотой.
Схема V: Синтез пролекарства
Пролекарства можно легко синтезировать с использованием описанных выше способов. Кроме того, пролекарства можно получать дополнительной модификацией активных соединений формулы I, где Ar**-COOH представляет собой Ar-R1 и R5 представляет собой -C0-3алкилен-SH, как показано ниже:
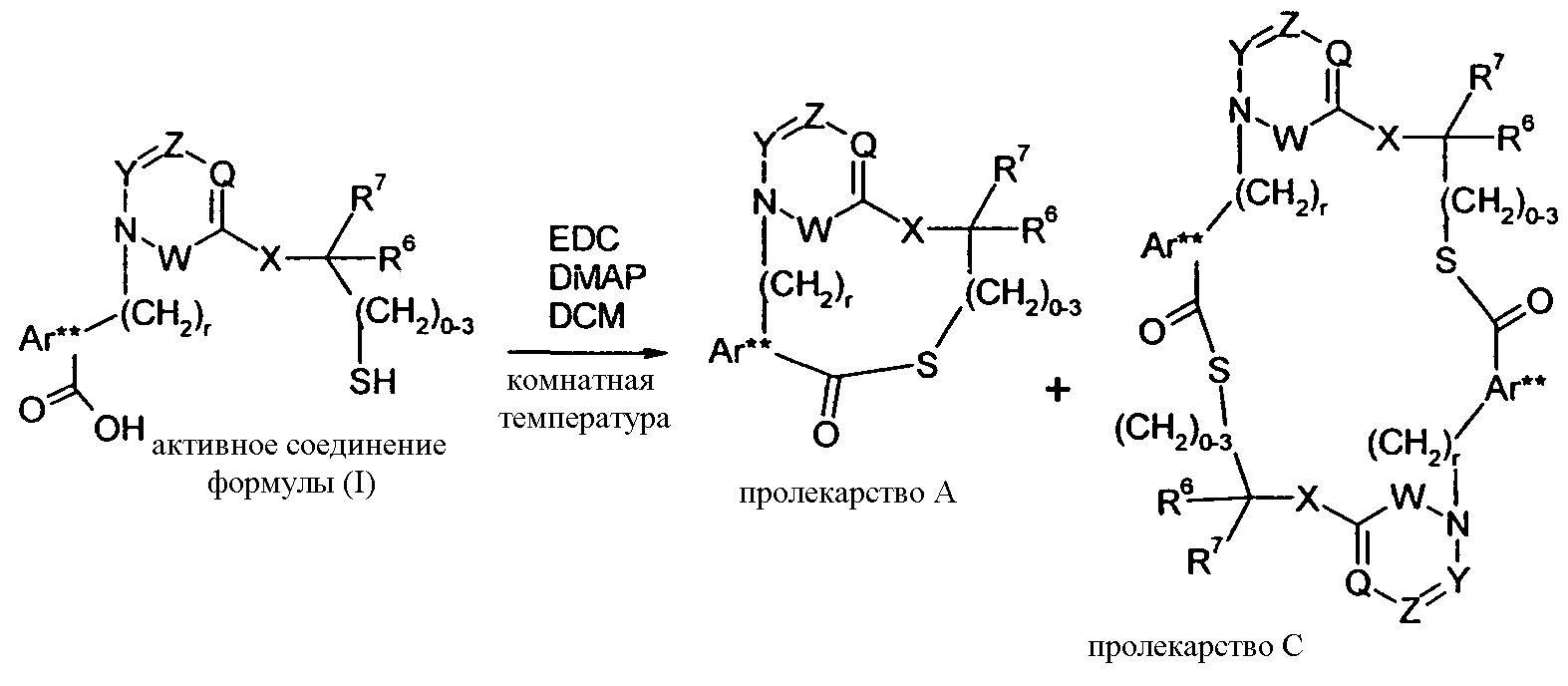
Таким образом, как пролекарство A, так и пролекарство C можно легко синтезировать из соответствующего активного пролекарства.
Считают, что конкретные промежуточные соединения, описанные в настолящем описании, являются новыми и, соответственно, такие соединения предусмотрены как дополнительные аспекты изобретения, включая, например, соединения формул VIII, IX и X, и их соли:
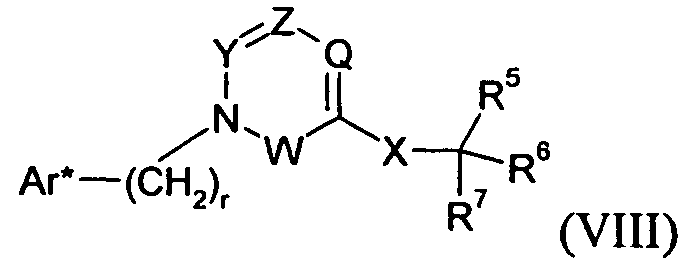
где Ar* представляет собой Ar-R1*; Ar, r, Y, Z, Q, W, X и R5-7 являются такими, как определено для формулы I; и R1* выбран из -C(O)O-P2, -SO2O-P5, -SO2NH-P6, -P(O)(O-P7)2, -OCH(CH3)-C(O)O-P2, -OCH(арил)-C(O)O-P2 и тетразол-5-ил-P4; где P2 представляет собой группу для защиты карбоксигруппы, P4 представляет собой группу для защиты тетразола, P5 представляет собой группу для защиты гидроксила, P6 представляет собой группу для защиты сульфонамида, и P7 представляет собой группу для защиты фосфата;
где Ar, r, Y, Z, Q, W, X и R6-7 являются такими, как определено для формулы I; R5* выбран из -C0-3алкилен-S-P3, -C0-3алкилен-C(O)NH(O-P5), -C0-3алкилен-N(O-P5)-C(O)R5d, -C0-1алкилен-NHC(O)CH2S-P3, -NH-C0-1алкилен-P(O)(O-P7)2, -C0-3алкилен-P(O)(O-P7)-R5e, -C0-2алкилен-CHR5f-C(O)O-P2 и -C0-3алкилен-C(O)NR5g-CHR5h-C(O)O-P2; и R5d-h являются такими, как определено для формулы I; где P2 представляет собой группу для защиты карбоксигруппы, P3 представляет собой группу для защиты тиола, P5 представляет собой группу для защиты гидроксила и P7 представляет собой группу для защиты фосфата; и
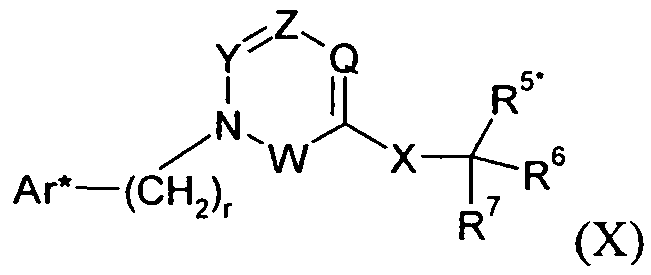
где Ar* представляет собой Ar-R1*; Ar, r, Y, Z, Q, W, X и R6-7 являются такими, как определено для формулы I; R1* выбран из -C(O)O-P2, -SO2O-P5, -SO2NH-P6, -P(O)(O-P7)2, -OCH(CH3)-C(O)O-P2, -OCH(арил)-C(O)O-P2 и тетразол-5-ил-P4; R5* выбран из -C0-3алкилен-S-P3, -C0-3алкилен-C(O)NH(O-P5), -C0-3алкилен-N(O-P5)-C(O)R5d, -C0-1алкилен-NHC(O)CH2S-P3, -NH-C0-1алкилен-P(O)(O-P7)2, -C0-3алкилен-P(O)(O-P7)-R5e, -C0-2алкилен-CHR5f-C(O)O-P2 и -C0-3алкилен-C(O)NR5g-CHR5h-C(O)O-P2; и R5d-h являются такими, как определено для формулы I; где P2 представляет собой группу для защиты карбоксигруппы, P3 представляет собой группу для защиты тиола, P4 представляет собой группу для защиты тетразола, P5 представляет собой группу для защиты гидроксила, P6 представляет собой группу для защиты сульфонамида и P7 представляет собой группу для защиты фосфата. Таким образом, другой способ получения соединения по изобретению включает снятие защиты для соединения формул VIII, IX или X.
Дополнительные подробности относительно конкретных условий реакции и других способов получения репрезентативных соединений по изобретению или их промежуточных соединений описаны в примерах, изложенных ниже.
ПРИМЕНИМОСТЬ
Соединения по изобретению обладают активностью антагониста рецептора 1 типа ангиотензина II (AT1). В одном варианте осуществления соединения по изобретению являются избирательными для ингибирования рецептора AT1 по сравнению с рецептором AT2. Соединения по изобретению также обладают активностью ингибирования неприлизина (NEP), то есть, соединения являются способными ингибировать фермент-субстратную активность. В другом варианте осуществления соединения не обладают значительной ингибирующей активностью для ангиотензинпревращающего фермента. Соединения формулы I могут являться активными лекарственными средствами, так же как пролекарствами. Таким образом, при обсуждении активности соединений по изобретению, понятно, что любые такие пролекарства обладают ожидаемой активностью после метаболизма.
Одним из показателей аффинности соединения для рецептора AT1 является константа ингибирования (Ki) для связывания с рецептором AT1. Значение pKi представляет собой отрицательный логарифм с основанием 10 от Ki. Одним из показателей способности соединения ингибировать активность NEP является ингибирующая концентрация (IC50), которая представляет собой концентрацию соединения, приводящую к половине максимального ингибирования превращения субстрата ферментом NEP. Значение pIC50 представляет собой отрицательный логарифм с основанием 10 от IC50. Соединения формулы I и их фармацевтически приемлемые соли, обладающие как активностью антагонизма к рецептору AT1, так и активностью ингибирования фермента NEP, представляют особенный интерес, включая соединения, обладающие pKi для рецептора AT1, большей или равной приблизительно 5,0, и обладающие pIC50 для NEP, большей или равной приблизительно 5,0.
В одном варианте осуществления представляющие интерес соединения обладают pKi для рецептора AT1 ≥ приблизительно 6,0, pKi для рецептора AT1 ≥ приблизительно 7,0, или pKi для рецептора AT1 ≥ приблизительно 8,0. Представляющие интерес соединения включают также соединения, обладающие pIC50 для NEP ≥ приблизительно 6,0 или pIC50 для NEP ≥ приблизительно 7,0. В другом варианте осуществления представляющие интерес соединения обладают pKi для рецептора AT1 в диапазоне приблизительно 8,0-10,0 и pIC50 для NEP в диапазоне приблизительно 7,0-10,0.
В другом варианте осуществления представляющие особенный интерес соединения обладают pKi для связывания с рецептором AT1, большей или равной приблизительно 7,5, и pIC50 для фермента NEP, большей или равной приблизительно 7,0. В другом варианте осуществления представляющие интерес соединения обладают pKi, большей или равной приблизительно 8,0, и pIC50, большей или равной приблизительно 8,0.
Следует отметить, что в некоторых случаях соединения по изобретению, в то время как все еще обладают двойной активностью, могут обладать либо слабой активностью антагониста рецептора AT1, либо слабой активностью ингибирования NEP. В таких случаях специалистам в данной области понятно, что эти соединения еще обладают полезностью в качестве в первую очередь ингибитора NEP или антагониста рецептора AT1, соответственно, или обладают полезностью в качестве инструментов исследования.
Примеры анализов для определения свойств соединений по изобретению, таких как активность связывания рецептора AT1 и/или ингибирования NEP, описаны в примерах и включают, в качестве иллюстрации, а не ограничения, анализы для измерения связывания AT1 и AT2 (описаны в анализе 1) и ингибирования NEP (описаны в анализе 2). Применимые вторичные анализы включают анализы для измерения ингибирования ACE (также описаны в анализе 2) и ингибирования аминопептидазы P (APP) (описаны в Sulpizio et al. (2005) JPET 315:1306-1313). Фармакодинамический анализ для оценки силы ингибирования ACE, AT1 и NEP in vivo у крыс после анестезии описаны в анализе 3 (см. также Seymour et al. Hypertension 7 (Suppl I):I-35-I-42, 1985 и Wigle et al. Can. J. Physiol. Pharmacol. 70:1525-1528, 1992), где ингибирование AT1 измеряли как процент ингибирования прессорной реакции на ангиотензин II, ингибирование ACE измеряли как процент ингибирования прессорной реакции на ангиотензин I, и ингибирование NEP измеряли как увеличенный выход с мочой циклического гуанозин-3',5'-монофосфата (cGMP). Применимые анализы in vivo включают контролируемую модель на спонтанно гипертензивных крысах (SHR), которая представляет собой модель зависимой от ренина гипертензии, применимую для измерения блокирования рецептора AT1 (описана в анализе 4; см. также Intengan et al. (1999) Circulation 100(22):2267-2275 и Badyal et al. (2003) Indian Journal of Pharmacology 35:349-362), и контролируемую ацетат дезоксикортикостерона - солевую (DOCA-солевую) модель на крысах, которая представляет собой модель объемзависимой гипертензии, применимую для измерения активности NEP (описана в анализе 5; см. также Trapani et al. (1989) J. Cardiovasc. Pharmacol. 14:419-424, Intengan et al. (1999) Hypertension 34(4):907-913, и Badyal et al. (2003) выше). Как SHR, так и DOCA-солевая модели являются применимыми для оценки способности тестируемого соединения уменьшать кровяное давление. DOCA-солевая модель является применимой также для измерения способности тестируемого соединения предотвращать или задерживать повышение кровяного давления. Ожидают, что соединения по изобретению могут проявлять антагонизм к рецептору AT1 и/или ингибировать фермент NEP в любом из анализов, перечисленных выше, или в анализах сходного характера. Таким образом, вышеупомянутые анализы являются применимыми для определения терапевтической полезности соединений по изобретению, например, их полезности в качестве антигипертензивных средств. Другие свойства и применения соединений по изобретению можно показать с использованием других анализов in vitro и in vivo, хорошо известных специалистам в данной области.
Ожидают, что соединения по изобретению могут являться применимыми для лечения и/или предотвращения медицинских состояний, отвечающих на антагонизм рецептора AT1 и/или ингибирование NEP. Таким образом, ожидают, что пациентов, страдающих от заболевания или нарушения, которое лечат посредством антагонизма рецептора AT1 и/или ингибирования фермента NEP, можно лечить введением терапевтически эффективного количества соединения по изобретению. Например, ожидают, что посредством антагонизма рецептора AT1 и, таким образом, создания помех воздействию ангиотензина II на его рецепторы, эти соединения могут найти применение для предотвращения увеличения кровяного давления, вызываемого ангиотензином II, сильным сосудосуживающим средством. Кроме того, ожидают, что посредством ингибирования NEP, соединения также могут усиливать биологические эффекты эндогенных пептидов, подвергающихся метаболизму посредством NEP, таких как натрийуретические пептиды, бомбезин, брадикинины, кальцитонин, эндотелины, энкефалины, нейротензин, вещество P и вазоактивный интестинальный пептид. Например, ожидают, что посредством усиления эффектов натрийуретических пептидов, соединения по изобретению могут являться применимыми для лечения глаукомы. Ожидают также, что эти соединения могут оказывать другие физиологические воздействия, например, на почечную, центральную нервную, репродуктивную и желудочно-кишечную системы.
Ожидают, что соединения по изобретению могут найти применение для лечения и/или предотвращения таких медицинских состояний, как сердечно-сосудистые и почечные заболевания. Сердечно-сосудистые заболевания, представляющие особенный интерес, включают сердечную недостаточность, такую как застойная сердечная недостаточность, острая сердечная недостаточность, хроническая сердечная недостаточность и острая и хроническая декомпенсированная сердечная недостаточность. Почечные заболевания, представляющие особенный интерес, включают диабетическую нефропатию и хроническую почечную недостаточность. Один из вариантов осуществления изобретения относится к способу лечения гипертензии, включающему введение пациенту терапевтически эффективного количества соединения по изобретению. Как правило, терапевтически эффективное количество представляет собой количество, достаточное для снижения кровяного давления пациента. В одном варианте осуществления соединение вводят в виде пероральной лекарственной формы.
Другой вариант осуществления изобретения относится к способу лечения сердечной недостаточности, включающему введение пациенту терапевтически эффективного количества соединения по изобретению. Как правило, терапевтически эффективное количество представляет собой количество, достаточное для снижения кровяного давления и/или улучшения функций почек. В одном варианте осуществления соединение вводят в виде внутривенной лекарственной формы. При применении для лечения сердечной недостаточности соединение можно вводить в сочетании с другими лекарственными средствами, такими как диуретики, натрийуретические пептиды и антагонисты рецептора аденозина.
Ожидают также, что соединения по изобретению могут являться применимыми для предупредительной терапии, например, для предотвращения прогрессирования сердечной недостаточности после инфаркта миокарда, предотвращения рестеноза артерий после ангиопластики, предупреждения утолщения стенок кровеносного сосуда после операций на сосудах, предотвращения атеросклероза и предотвращения диабетической ангиопатии.
Кроме того, ожидают, что в качестве ингибиторов NEP соединения по изобретению могут ингибировать энкефалиназу, которая может ингибировать деградацию эндогенных энкефалинов, и таким образом, такие соединения могут также находить применение в качестве анальгетиков. Ожидают также, что благодаря своим свойствам ингибирования NEP, соединения по изобретению могут являться применимыми в качестве антитуссивных средств и антидиарейных средств (например, для лечения водянистой диареи), так же как находить применение для лечения менструальных нарушений, преждевременных родов, преэклампсии, эндометриоза, репродуктивных нарушений (например, мужского и женского бесплодия, синдрома поликистозных яичников, невозможности имплантации), и мужской и женской сексуальной дисфункции, включая мужскую эректильную дисфункцию и женское нарушение полового возбуждения. Более конкретно, ожидают, что соединения по изобретению могут являться применимыми для лечения женской сексуальной дисфункции, которую часто определяют как трудность или неспособность женщины-пациента получать удовлетворение в сексуальном выражении. Это охватывает множество различных женских сексуальных нарушений, включая, в качестве иллюстрации, а не ограничения, нарушение со снижением полового влечения, нарушение полового возбуждения, нарушение оргазма и нарушение с болевыми ощущениями при сексе. При применении для лечения таких нарушений, особенно женской сексуальной дисфункции, соединения по изобретению можно сочетать с одним или несколькими из следующих вторичных средств: ингибиторы PDE5, агонисты дофамина, агонисты и/или антагонисты рецептора эстрогена, андрогены и эстрогены.
Количество соединения по изобретению, вводимого на дозу, или общее количество, вводимое в сутки, может являться предопределенным, или его можно определить с учетом индивидуального пациента, принимая во внимание многочисленные факторы, включая характер и тяжесть состояния пациента, состояние, подлежащее лечению, возраст, массу и общее состояние здоровья пациента, переносимость пациентом активного средства, способ введения, фармакологические факторы, такие как активность, эффективность, фармакокинетику и токсикологические профили соединения и любого вторичного средства, подлежащего введению, и т.п. Лечение пациента, страдающего от заболевания или медицинского состояния (такого как гипертензия), можно начинать с предопределенной дозы или дозы, определенной лечащим врачом, и продолжать в течение периода времени, необходимого для предотвращения, улучшения, супрессии, или облегчения симптомов заболевания или медицинского состояния. Пациентов, подвергающихся такому лечению, как правило, контролируют в рабочем порядке для определения эффективности терапии. Например, при лечении гипертензии измерения кровяного давления можно использовать для определения эффективности лечения. Подобные показатели для других заболеваний и состояний, описанных здесь, хорошо известны и легко доступны лечащему врачу. Непрерывный контроль терапевта гарантирует, что оптимальное количество соединения по изобретению вводят в любое данное время, а также облегчает определение продолжительности лечения. Это особенно важно, когда вводят также вторичные средства, поскольку их выбор, доза и продолжительность лечения также могут требовать уточнения. Таким образом, режим терапии и расписание дозирования можно регулировать в течение курса терапии, так что вводят самое низкое количество активного средства, обладающее желательной эффективностью, и, кроме того, введение продолжают только так долго, как необходимо для успешного лечения заболевания или медицинского состояния.
Поскольку соединения по изобретению обладают активностью антагониста рецептора AT1 и/или активностью ингибирования фермента NEP, такие соединения являются также применимыми в качестве инструментов исследования для исследования или изучения биологических систем или образцов, обладающих рецепторами AT1 или ферментом NEP, например, для изучения заболеваний, где рецептор AT1 или фермент NEP играют роль. Любую подходящую биологическую систему или образец, обладающие рецепторами AT1 и/или ферментом NEP, можно применять в таких исследованиях, которые можно проводить либо in vitro, либо in vivo. Репрезентативные биологические системы или образцы, подходящие для таких исследований, включают в качестве неограничивающих примеров, клетки, экстракты клеток, плазматические мембраны, образцы тканей, выделенные органы, млекопитающих (таких как мыши, крысы, морские свинки, кролики, собаки, свиньи, люди и т.д.), и т.п., где млекопитающие представляют особенный интерес. В одном конкретном варианте осуществления изобретения антагонизм рецептора AT1 у млекопитающего осуществляют введением антагонизирующего для AT1 количества соединения по изобретению. В другом конкретном варианте осуществления активность фермента NEP у млекопитающего ингибируют введением ингибирующего NEP количества соединения по изобретению. Соединения по изобретению можно также использовать в качестве инструментов исследования для проведения биологических анализов с использованием таких соединений.
При применении в качестве инструмента исследования биологическую систему или образец, содержащие рецептор AT1 и/или фермент NEP, как правило, приводят в контакт с антагонизирующим для рецептора AT1 или ингибирующим фермент NEP количеством соединения по изобретению. После того, как биологическую систему или образец подвергали воздействию соединения, эффекты антагонизма рецептора AT1 и/или ингибирования фермента NEP определяют с использованием общепринятых способов и оборудования, таких как измерение связывания рецептора в анализе связывания или измерение опосредованных лигандом изменений в функциональном анализе. Подвергание воздействию включает контактирование клеток или ткани с соединением, введение соединения млекопитающему, например посредством i.p., i.v. или s.c. введения, и т.д. Эта стадия определения может включать измерение ответа (количественный анализ) или может включать проведение наблюдений (качественный анализ). Измерение ответа включает, например, определение эффектов соединения на биологическую систему или образец с использованием общепринятых способов и оборудования, таких как анализы связывания радиоактивного лиганда и измерение опосредованных лигандом измерений в функциональных анализах. Результаты анализов можно использовать для определения уровня активности, так же как количества соединения, необходимого для достижения желаемого результата, то есть, антагонизирующего для рецептора AT1 и/или ингибирующего фермент NEP количества. Как правило, стадия определения включает определение опосредованных лигандом рецептора AT1 эффектов и/или определение эффектов ингибирования фермента NEP.
Кроме того, соединения по изобретению можно использовать в качестве инструментов исследования для оценки других химических соединений, и таким образом, они также являются применимыми в анализах скрининга для обнаружения, например, новых соединений, обладающих активностью антагонизма рецептора AT1 и/или активностью ингибирования NEP. По этому способу соединение по изобретению используют в качестве стандарта в анализе, чтобы позволять сравнение результатов, полученных с помощью тестируемого соединения и с помощью соединений по изобретению, для идентификации таких тестируемых соединений, обладающих такой же или превосходящей активностью, если какие-либо присутствуют. Например, данные Ki (как определяют, например, анализом связывания) для тестируемого соединения или группы тестируемых соединений сравнивают с данными Ki для соединения по изобретению для идентификации таких тестируемых соединений, которые обладают желаемыми свойствами, например, тестируемых соединений, обладающих значением Ki, приблизительно равным или превосходящим значение для соединения по изобретению, если какие-либо присутствуют. Этот аспект изобретения включает, в качестве отдельных вариантов осуществления, как получение данных для сравнения (с использованием подходящих анализов), так и анализ данных тестирования для идентификации интересующих тестируемых соединений. Таким образом, тестируемое соединение можно оценивать биологическим анализом, способом, включающим стадии (a) проведения биологического анализа с тестируемым соединением с получением первого результата анализа; (b) проведения биологического анализа с соединением по изобретению с получением второго результата анализа; где стадию (a) проводят до, после или одновременно со стадией (b); и (c) сравнения первого результата анализа со стадии (a) с вторым результатом анализа со стадии (b). Примеры биологических анализов включают анализ связывания рецептора AT1 и анализ ингибирования фермента NEP.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СОСТАВЫ
Соединения по изобретению, как правило, вводят пациенту в форме фармацевтической композиции или состава. Такие фармацевтические композиции можно вводить пациенту любым приемлемым способом введения, включая, в качестве неограничивающих примеров, пероральный, ректальный, вагинальный, назальный, ингаляционный, местный (включая чрескожный), глазной и парентеральный способы введения. Кроме того, соединения по изобретению можно вводить, например, перорально, в множественных дозах в сутки (например, два, три или четыре раза в сутки), в однократной ежесуточной дозе или в однократной еженедельной дозе. Понятно, что любую форму соединений по изобретению (то есть свободное основание, свободную кислоту, фармацевтически приемлемую соль, сольват и т.д.), пригодную для конкретного способа введения, можно использовать в фармацевтических композициях, обсуждаемых в настоящем описании.
Соответственно, в одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по изобретению. Композиции могут содержать другие терапевтические и/или составляющие средства, если желательно. При обсуждении композиций, на «соединение по изобретению» могут также ссылаться в настоящем описании как на «активное средство», чтобы отличать его от других компонентов в составе, таких как носитель. Таким образом, понятно, что термин «активное средство» включает соединения формулы I, так же как фармацевтически приемлемые соли, сольваты и пролекарства этого соединения.
Фармацевтические композиции по изобретению, как правило, содержат терапевтически эффективное количество соединения по изобретению. Специалистам в данной области понятно, однако, что фармацевтическая композиция может содержать количество, большее терапевтически эффективного количества, например, нерасфасованные композиции, или менее терапевтически эффективного количества, например, отдельные однократные дозы, предназначенные для множественного введения для достижения терапевтически эффективного количества. Как правило, композиция содержит приблизительно 0,01-95% мас. активного средства, включая, приблизительно 0,01-30% мас., например, приблизительно 0,01-10% мас., где действительное количество зависит от самого состава, способа введения, частоты дозирования, и т.д. В одном варианте осуществления композиция, пригодная для пероральной лекарственной формы, например, может содержать приблизительно 5-70% мас., или приблизительно 10-60% мас. активного средства.
Любой общепринятый носитель или наполнитель можно использовать в фармацевтических композициях по изобретению. Выбор конкретного носителя или наполнителя, или сочетаний носителей или наполнителей, зависит от способа введения, предназначенного для лечения конкретного пациента или медицинского состояния или заболевания. В этом отношении, получение подходящей композиции для конкретного способа введения полностью находится в компетенции специалистов в области фармацевтики. Кроме того, носители или наполнители, применяемые в таких композициях, являются коммерчески доступными. В качестве дополнительного примера, общепринятые способы составления описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Репрезентативные примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают в качестве неограничивающих примеров, следующие: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу, такую как микрокристаллическая целлюлоза и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразная трагакантовая камедь; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; забуферивающие средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; растворы фосфатного буфера; газы-пропелленты под давлением, такие как хлорфторуглероды и гидрофторуглероды; и другие нетоксичные совместимые вещества, применяемые в фармацевтических композициях.
Фармацевтические композиции, как правило, получают тщательным и непосредственным перемешиванием или измельчением активного средства с фармацевтически приемлемым носителем и одним или несколькими необязательными ингредиентами. Полученную однородную измельченную смесь можно затем формовать или загружать в таблетки, капсулы, пилюли, контейнеры, картриджи, распылители и т.п. с использованием общепринятых способов и оборудования.
В составах, где соединение по изобретению содержит тиоловую группу, можно уделять дополнительное внимание минимизации или исключению окисления тиола до образования дисульфида. В твердых составах этого можно достигать уменьшением времени высушивания, уменьшением содержания влажности в составе и включением таких материалов, как аскорбиновая кислота, аскорбат натрия, сульфит натрия и бисульфит натрия, так же как таких материалов, как смесь лактозы и микрокристаллической целлюлозы. В жидких составах стабильность тиола можно улучшать добавлением аминокислот, антиоксидантов или сочетания диэдетата натрия и аскорбиновой кислоты.
В одном варианте осуществления фармацевтические композиции пригодны для перорального введения. Подходящие для перорального введения композиции могут существовать в форме капсул, таблеток, пилюль, пастилок, саше, драже, порошков, гранул; растворов или суспензий в водной или неводной жидкости; жидких эмульсий масло-в-воде или вода-в-масле; эликсиров или сиропов; и т.п.; где каждое содержит предопределенное количество активного средства.
При предназначении для перорального введения в твердой лекарственной форме (капсулы, таблетки, пилюли и т.п.) композиция будет, как правило, содержать активное средство и один или несколько фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Твердые лекарственные формы могут также содержать: наполнители или расширители, такие как крахмалы, микрокристаллическую целлюлозу, лактозу, сахарозу, глюкозу, маннит и/или кремниевую кислоту; связующие вещества, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; увлажнители, такие как глицерин; дезинтегрирующие средства, такие как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновую кислоту, определенные силикаты и/или карбонат натрия; замедляющие растворение средства, такие как парафин; ускорители абсорбции, такие как соединения четвертичного аммония; увлажняющие средства, такие как цетиловый спирт и/или глицеринмоностеарат; абсорбенты, такие как каолиновая и бентонитовая глина; смазывающие средства, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; подкрашивающие средства и забуферивающие средства.
Высвобождающие средства, увлажняющие средства, покрывающие средства, подсластители, средства для придания вкуса и запаха, консерванты и антиоксиданты также могут присутствовать в фармацевтических композициях. Примеры покрывающих средств для таблеток, капсул, пилюль и т.п. включают средства, применяемые для энтеросолюбильного покрытия, такие как фталат ацетата целлюлозы, фталат поливинилацетата, фталат гидроксипропилметилцеллюлозы, сополимеры метакриловой кислоты - сложного эфира метакриловой кислоты, тримеллитат ацетата целлюлозы, карбоксиметилэтилцеллюлоза, сукцинат ацетата гидроксипропилметилцеллюлозы и т.п. Примеры фармацевтически приемлемых антиоксидантов включают растворимые в воде антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол, и т.п.; и хелатирующие металл средства, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, виннокаменная кислота, фосфорная кислота, и т.п.
Композиции можно составлять также, чтобы обеспечить замедленное или контролируемое высвобождение активного средства, с использованием, в качестве примера, гидроксипропилметилцеллюлозы в различных соотношениях или других полимерных матриц, липосом и/или микросфер. Кроме того, фармацевтические композиции по изобретению могут содержать опалесцирующие средства, и их можно составлять так, чтобы они высвобождали активное средство, только или предпочтительно, в конкретной части желудочно-кишечного тракта, необязательно, замедленным образом. Примеры композиций с вкраплениями, которые можно использовать, включают полимерные вещества и воски. Активное средство может присутствовать также в микроинкапсулированной форме, необязательно, с одним или несколькими из описанных выше наполнителей.
Подходящие для перорального введения жидкие лекарственные формы включают, в качестве иллюстрации, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы, как правило, содержат активное средство и инертный разбавитель, например, такой как вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (например, хлопковое, арахисовое, кукурузное масло, масло из проростков, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Суспензии могут содержать суспендирующие средства, например, такие как этоксилированные изостеариловые спирты, полиоксиэтиленовые сложные эфиры сорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакантовая камедь и их смеси.
При предназначении для перорального введения фармацевтические композиции по изобретению можно упаковывать в единичную дозированную форму. Термин «единичная дозированная форма» относится к физически дискретной единице, подходящей для дозирования пациенту, то есть, каждая единица содержит предопределенное количество активного средства, рассчитанное с получением желательного терапевтического эффекта, либо отдельно, либо в сочетании с одной или несколькими дополнительными единицами. Например, такие единичные дозированные формы могут представлять собой капсулы, таблетки, пилюли и т.п.
В другом варианте осуществления композиции по изобретению подходят для ингаляционного введения, и как правило, присутствуют в форме аэрозоля или порошка. Такие композиции, как правило, вводят с использованием хорошо известных средств для доставки, таких как распылитель, ингалятор для сухого порошка или отмеряющий дозу ингалятор. Устройства для распыления производят поток воздуха с высокой скоростью, который вызывает распыление композиции в виде тумана, который вводят в дыхательные пути пациента. Пример состава для распылителя содержит активное средство, растворенное в носителе с образованием раствора, или тонко измельченное и объединенное с носителем с образованием суспензии тонко измельченных частиц пригодного для вдыхания размера. Ингаляторы для сухого порошка вводят активное средство в виде сыпучего порошка, который распределяется в потоке воздуха при вдохе пациента. Приведенный в качестве примера состав сухого порошка содержит активное средство в сухой смеси с наполнителем, таким как лактоза, крахмал, маннит, декстроза, полимолочная кислота, сополимер полимолочной и гликолевой кислот и их сочетания. Ингаляторы, отмеряющие дозу, выбрасывают отмеренное количество активного средства с использованием газа-пропеллента под давлением. Приведенная в качестве примера отмеренная доза состава содержит раствор или суспензию активного средства в сжиженном пропелленте, таком как хлорфторуглерод или гидрофторалкан. Необязательные компоненты таких составов включают сорастворители, такие как этанол или пентан, и поверхностно-активные вещества, такие как триолеат сорбитана, олеиновая кислота, лецитин, глицерин и лаурилсульфат натрия. Такие композиции, как правило, получают добавлением охлажденного или находящегося под давлением гидрофторалкана в подходящий контейнер, содержащий активное средство, этанол (если присутствует) и поверхностно-активное вещество (если присутствует). С получением суспензии активное средство тонко измельчают и затем объединяют с пропеллентом. Альтернативно, суспензионный состав можно получить сушкой распылением покрытия из поверхностно-активного вещества на мелкодисперсных частицах активного средства. Затем состав загружают в контейнер для аэрозоля, который составляет часть ингалятора.
Соединения по изобретению можно также вводить парентерально (например, подкожной, внутривенной, внутримышечной или внутрибрюшинной инъекцией). Для такого введения активное средство предоставляют в стерильном растворе, суспензии или эмульсии. Примеры растворителей с получением таких составов включают воду, солевой раствор, низкомолекулярные спирты, такие как пропиленгликоль, полиэтиленгликоль, масла, желатин, сложные эфиры жирных кислот, такие как этилолеат, и т.п. Парентеральные составы могут также содержать один или несколько антиокислителей, солюбилизаторов, стабилизаторов, консервантов, увлажняющих средств, эмульгаторов и диспергирующих средств. Поверхностно-активные вещества, дополнительные стабилизаторы или регулирующие pH средства (кислоты, основания или буферы) и антиокислители являются, в частности, применимыми для придания стабильности составу, например, чтобы минимизировать или прекратить гидролиз сложноэфирных и амидных связей или димеризацию тиолов, которые могут присутствовать в соединении. Эти составы можно стерилизовать посредством использования стерильной пригодной для инъекции среды, стерилизующего средства, фильтрации, облучения или нагревания. В одном конкретном варианте осуществления парентеральный состав содержит водный раствор циклодекстрина в качестве фармацевтически приемлемого носителя. Подходящие циклодекстрины включают циклические молекулы, содержащие шесть или более единиц α-D-глюкопиранозы, связанных в положениях 1,4 такими связями, как в амилазе, β-циклодекстрине или циклогептаамилозе. Примеры циклодекстринов включают производные циклодекстрина, такие как гидроксипропиловый и сульфобутиловый эфир циклодекстринов, такой как гидроксипропил-β-циклодекстрин и сульфобутиловый эфир β-циклодекстрина. Примеры буферов для таких составов включают буферы на основе карбоновой кислоты, такие как растворы цитратного, лактатного и малеатного буфера.
Соединения по изобретению можно также вводить чрескожно с использованием известных систем и наполнителей для чрескожной доставки. Например, соединение можно смешивать с усилителями проницаемости, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны и т.п., и включать в пластырь или подобную систему доставки. Дополнительные наполнители, включая желирующие средства, эмульгаторы и буферы, можно использовать в таких чрескожных композициях, если желательно.
Если желательно, соединения по изобретению можно вводить в сочетании с одним или несколькими другими лекарственными средствами. Таким образом, в одном варианте осуществления фармацевтические композиции по изобретению содержат другие лекарственные средства, которые вводят совместно с соединением по изобретению. Например, композиция может дополнительно содержать одно или несколько лекарственных средств (обозначаемых также как «вторичное средство(средства)»), выбранных из группы из диуретиков, блокаторов β1-адренергического рецептора, блокаторов кальциевых каналов, ингибиторов ангиотензинпревращающего фермента, антагонистов рецепторов AT1, ингибиторов неприлизина, нестероидных противовоспалительных средств, простагландинов, антилипидных средств, противодиабетических средств, антитромботических средств, ингибиторов ренина, антагонистов рецепторов эндотелина, ингибиторов эндотелинпревращающего фермента, антагонистов альдостерона, ингибиторов ангиотензинпревращающего фермента/неприлизина и их сочетаний. Такие лекарственные средства хорошо известны в данной области, и примеры описаны ниже. Объединением соединения по изобретению с вторичным средством можно достигать тройной терапии; активности антагониста рецептора AT1, активности ингибирования NEP и активности, связанной со вторичным средством (например, блокатора β1-адренергических рецепторов), можно достигать с использованием только двух активных компонентов. Поскольку композиции, содержащие два активных компонента, как правило, легче составлять, чем композиции, содержащие три активных компонента, такие двухкомпонентные композиции обеспечивают значительное преимущество по сравнению с композициями, содержащими три активных компонента. Соответственно, в другом аспекте изобретения фармацевтическая композиция содержит соединение по изобретению, второе активное средство и фармацевтически приемлемый носитель. Третье, четвертое и т.д. активные средства также можно включать в композицию. При комбинированной терапии количество соединения по изобретению, которое вводят, так же как количество вторичных средств, может быть меньше, чем количество, которое, как правило, вводят при монотерапии.
Соединения по изобретению можно физически смешивать со вторым активным средством с получением композиции, содержащей оба средства; или каждое средство может присутствовать в отдельной и разделенной композиции, которые вводят пациенту одновременно или в разное время. Например, соединение по изобретению можно объединять со вторым активным средством с использованием общепринятых способов и оборудования с получением сочетания активных средств, содержащего соединение по изобретению и второе активное средство. Кроме того, активные средства можно объединять с фармацевтически приемлемым носителем с получением фармацевтической композиции, содержащей соединение по изобретению, второе активное средство и фармацевтически приемлемый носитель. В этом варианте осуществления компоненты композиции, как правило, смешивают или измельчают с получением физической смеси. Затем физическую смесь вводят в терапевтически эффективном количестве с использованием любого из способов, описанных в настоящем описании.
Альтернативно, активные средства могут оставаться отдельными и разделенными перед введением пациенту. В этом варианте осуществления средства физически не смешивают вместе перед введением, но вводят одновременно или в разное время в отдельных композициях. Такие композиции можно упаковывать отдельно или можно упаковывать вместе в наборе. При введении в разное время второе средство, как правило, можно вводить менее чем через 24 часа после введения соединения по изобретению, в любом диапазоне, от одновременного с введением соединения по изобретению до приблизительно 24 часов после дозы. Это относится также к последовательному введению. Таким образом, соединение по изобретению можно ввводить перорально одновременно или последовательно с другим активным средством с использованием двух таблеток, с одной таблеткой для каждого активного средства, где последовательно может означать вводимое немедленно после введения соединения по изобретению или в некоторое предопределенное время позже (например, через один час или через три часа). Альтернативно, комбинацию можно вводить различными способами введения, то есть, одну часть перорально, а другую ингаляцией.
В одном варианте осуществления набор содержит первую лекарственную форму, содержащую соединение по изобретению, и по меньшей мере одну дополнительную лекарственную форму, содержащую одно или несколько из вторичных средств, указанных в настоящем описании, в количествах, достаточных для осуществления способов по изобретению. Первая лекарственная форма и вторая (или третья, и т.д.) лекарственная форма вместе содержат терапевтически эффективное количество активных средств для лечения или предотвращения заболевания или медицинского состояния у пациента.
Вторичное средство(средства), когда включены, присутствуют в терапевтически эффективном количестве, так что их, как правило, вводят в количестве, оказывающем терапевтически выгодный эффект при совместном введении с соединением по изобретению. Вторичное средство может присутствовать в форме фармацевтически приемлемой соли, сольвата, оптически чистого стереоизомера и т.д. Вторичное средство может также присутствовать в форме пролекарства, например, соединение, обладающее группой карбоновой кислоты, превращенной в сложный эфир. Таким образом, вторичные средства, перечисленные ниже, предназначены, чтобы включать все такие формы, и являются коммерчески доступными, или их можно получать с использованием общепринятых способов и реагентов.
В одном варианте осуществления соединение по изобретению вводят в сочетании с диуретиком. Репрезентативные диуретики включают в качестве неограничивающих примеров ингибиторы карбоангидразы, такие как ацетазоламид и дихлорфенамид; петлевые диуретики, включающие производные сульфонамида, такие как ацетазоламид, амбузид, азосемид, буметанид, бутазоламид, хлораминофенамид, клофенамид, клопамид, клорексолон, дисульфамид, этоксоламид, фуросемид, мефрусид, метазоламид, пиретанид, торсемид, трипамид и ксипамид, так же как несульфонамидные диуретики, такие как этакриновая кислота и другие соединения феноксиуксусной кислоты, такие как тиениловая кислота, индакринон и хинкарбат; осмотические диуретики, такие как маннит; калийсберегающие диуретики, включающие антагонисты альдостерона, такие как спиронолактон, и ингибиторы Na+ каналов, такие как амилорид и триамтерен; тиазид и тиазидоподобные диуретики, такие как алтиазид, бендрофлуметиазид, бензилгидрохлортиазид, бензтиазид, бутиазид, хлорталидон, хлортиазид, циклопентиазид, циклотиазид, эпитиазид, етиазид, фенхизон, флуметиазид, гидрохлортиазид, гидрофлуметиазид, индапамид, метилклотиазид, метикран, метолазон, парафлутизид, политиазид, хинетазон, теклотиазид и трихлорметиазид; и их сочетания. В конкретном варианте осуществления диуретик выбран из амилорида, буметанида, хлортиазида, хлорталидона, дихлорфенамида, этакриновой кислоты, фуросемида, гидрохлортиазида, гидрофлуметиазида, индапамида, метилклотиазида, метолазона, торсемида, триамтерена и их сочетаний. Диуретик можно вводить в количестве, достаточном, чтобы обеспечивать приблизительно 5-50 мг в сутки, более конкретно, 6-25 мг в сутки, где общепринятые дозы составляют 6,25 мг, 12,5 мг или 25 мг в сутки.
Соединения по изобретению можно вводить также в сочетании с блокатором β1-адренергических рецепторов. Репрезентативные блокаторы β1-адренергических рецепторов включают в качестве неограничивающих примеров ацебутолол, алпренолол, амосулалол, аротинолол, атенолол, бефунолол, бетоксалол, бевантолол, бизопролол, бопиндолол, буциндолол, букумолол, буфетолол, буфуралол, бунитролол, бупранолол, бубридин, бутофилолол, каразолол, картеолол, карведилол, целипролол, цетамолол, клоранолол, дилевалол, эпанолол, эсмолол, инденолол, лабетолол, левобунолол, мепиндолол, метипранолол, метопролол, такой как сукцинат метопролола и тартрат метопролола, мопролол, надолол, надоксолол, небивалол, нипрадиол, окспренолол, пентбутолол, пербутолол, пиндолол, практолол, пронеталол, пропранолол, соталол, суфиналол, талиндол, тертатолол, тилизолол, тимолол, толипролол, ксибенолол и их сочетания. В одном конкретном варианте осуществления блокатор β1-адренергических рецепторов выбран из атенолола, бизопролола, метопролола, пропранолола, соталола и их сочетаний.
В одном варианте осуществления соединение по изобретению вводят в сочетании с блокатором кальциевых каналов. Репрезентативные блокаторы кальциевых каналов включают в качестве неограничивающих примеров, амлодипин, анипамил, аранипин, барнидипин, бенциклан, бенидипин, бепридил, клентиазем, килнидипин, циннаризин, дилтиазем, эфонидипин, элгодипин, этафенон, фелодипин, фендилин, флунаризин, галлопамил, израдипин, лацидипин, лерканидипин, лидофлазин, ломеризин, манидипин, мибефрадил, никардипин, нифедипин, нигулдипин, нилудипин, нилвадипин, нимодипин, низолдипин, нитрендипин, нивалдипин, пергексилин, прениламин, риозидин, семотиадил, теродилин, тиапамил, верапамил и их сочетания. В конкретном варианте осуществления блокатор кальциевых каналов выбран из амлодипина, бепридила, дилтиазема, фелодипина, израдипина, лацидипина, никардипин, нифедипин, нигулдипина, нилудипина, нимодипина, низолдипина, риозидина, верапамила и их сочетаний.
Соединения по изобретению можно вводить также в сочетании с с ингибитором ангиотензинпревращающего фермента (ACE). Репрезентативные ингибиторы ACE включают в качестве неограничивающих примеров аккуприл, алацеприл, беназеприл, беназеприлат, каптоприл, церанаприл, цилазаприл, делаприл, эналаприл, эналаприлат, фосиноприл, фосиноприлат, имидаприл, лизиноприл, моэксиприл, моноприл, мовелтоприл, пентоприл, периндоприл, квинаприл, квинаприлат, рамиприл, рамиприлат, ацетат саралазина, спираприл, темокаприл, трандолаприл, зофеноприл и их сочетания. В конкретном варианте осуществления ингибитор ACE выбран из беназеприла, эналаприла, лизиноприла, рамиприла и их сочетаний.
В одном варианте осуществления соединение по изобретению вводят в сочетании с антагонистами рецептора AT1, известными также как блокаторы рецептора 1 типа ангиотензина II (ARB). Репрезентативные ARB включают в качестве неограничивающих примеров, абитезартан, бензиллозартан, кандесартан, цилексетил кандесартана, элизартан, эмбузартан, энолтазозартан, эпросартан, фонсартан, форазартан, глициллозартан, ирбесартан, изотеолин, лозартан, медоксимил, милфазартан, олмесартан, опомизартан, пратосартан, рипизартан, саприсартан, саралазин, сармезин, тасосартан, телмисартан, валсартан, золазартан и их сочетания. В конкретном варианте осуществления, ARB выбран из кандесартана, эпросартана, ирбесартана, лозартана, олмесартана, ирбесартана, саприсартана, тасосартана, телмисартана и их сочетаний. Примеры солей включают мезилат эпросартана, калиевую соль лозартана и медоксимил олмесартана. Как правило, ARB вводят в количестве, достаточном для обеспечения приблизительно 4-600 мг на дозу, где иллюстративные ежесуточные дозы лежат в диапазоне 20-320 мг в сутки.
В другом варианте осуществления соединение по изобретению вводят в сочетании с ингибитором неприлизина (NEP). Репрезентативные ингибиторы NEP включают в качестве неограничивающих примеров кандоксатрил; кандоксатрилат; дексекадотрил (бензиловый эфир (+)-N-[2(R)-(ацетилтиометил)-3-фенилпропионил]глицина); CGS-24128 (3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]пропионовая кислота); CGS-24592 ((S)-3-[3-(бифенил-4-ил)-2-(фосфонометиламино)пропионамидо]пропионовая кислота); CGS-25155 (бензиловый эфир N-[9(R)-(ацетилтиометил)-10-оксо-1-азациклодекан-2(S)-илкарбонил]-4(R)-гидрокси-L-пролина); производные 3-(1-карбамоилциклогексил)пропионовой кислоты, описанные в WO 2006/027680 от Hepworth et al. (Pfizer Inc.); JMV-390-1 (2(R)-бензил-3-(N-гидроксикарбамоил)пропионил-L-изолейцил-L-лейцин); экадотрил; фосфорамидон; ретротиорфан; RU-42827 (2-(меркаптометил)-N-(4-пиридинил)бензолпропионамид); RU-44004 (N-(4-морфолинил)-3-фенил-2-(сульфанилметил)пропионамид); SCH-32615 ((S)-N-[N-(1-карбокси-2-фенилэтил)-L-фенилаланил]-β-аланин) и его пролекарство SCH-34826 ((S)-N-[N-[1-[[(2,2-диметил-1,3-диоксолан-4-ил)метокси]карбонил]-2-фенилэтил]-L-фенилаланил]-β-аланин); сиалорфин; SCH-42495 (этиловый эфир N-[2(S)-(ацетилсульфанилметил)-3-(2-метилфенил)пропионил]-L-метионина); спинорфин; SQ-28132 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]лейцин); SQ-28603 (N-[2-(меркаптометил)-1-оксо-3-фенилпропил]-β-аланин); SQ-29072 (7-[[2-(меркаптометил)-1-оксо-3-фенилпропил]амино]гептановая кислота); тиорфан и его пролекарство рацекадотрил; UK-69578 (цис-4-[[[1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентил]карбонил]амино]циклогексанкарбоновая кислота); UK-447841 (2-{1-[3-(4-хлорфенил)пропилкарбамоил]циклопентилметил}-4-метоксимасляная кислота); UK-505749 ((R)-2-метил-3-{1-[3-(2-метилбензотиазол-6-ил)пропилкарбамоил]циклопентил}пропионовая кислота); этиловый эфир 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановой кислоты и 5-бифенил-4-ил-4-(3-карбоксипропиониламино)-2-метилпентановой кислоты (WO 2007/056546); даглутрил [(3S,2'R)-3-{1-[2'-(этоксикарбонил)-4'-фенилбутил]циклопентан-1-карбониламино}-2,3,4,5-тетрагидро-2-оксо-1H-1-бензазепин-1-уксусная кислота], описанная в WO 2007/106708 от Khder et al. (Novartis AG); и их сочетания. В конкретном варианте осуществления ингибитор NEP выбран из кандоксатрила, кандоксатрилата, CGS-24128, фосфорамидона, SCH-32615, SCH-34826, SQ-28603, тиорфана и их сочетаний. Ингибитор NEP вводят в количестве, достаточном для обеспечения приблизительно 20-800 мг в сутки, где типичные ежесуточные дозы лежат в диапазоне 50-700 мг в сутки, более обычно, 100-600 или 100-300 мг в сутки.
В другом варианте осуществления соединение по изобретению вводят в сочетании с нестероидным противовоспалительным средством (NSAID). Репрезентативные NSAID включают в качестве неограничивающих примеров ацеметацин, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, амиприлозу, амоксиприн, аниролак, апазон, азапропазон, бенорилат, беноксапрофен, бензпиперилон, броперамол, буклоксовую кислоту, карпрофен, клиданак, диклофенак, дифлунизал, дифталон, эноликам, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклозовую кислоту, фенопрофен, фентиазак, фепразон, флуфенамовую кислоту, флуфенисал, флупрофен, флубипрофен, фурофенак, ибуфенак, ибупрофен, индометацин, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лофемизол, лорноксикам, меклофенамат, меклофенамовую кислоту, мефенамовую кислоту, мелоксикам, месаламин, миропрофен, мофебутазон, набуметон, напроксен, нифлумовую кислоту, оксапрозин, окспинак, оксифенбутазон, фенилбутазон, пироксикам, пирпрофен, пранопрофен, салсалат, судоксикам, сульфасалазин, сулиндак, супрофен, теноксикам, тиопинак, тиапрофеновую кислоту, тиоксапрофен, толфенамовую кислоту, толметин, трифлумидат, зидометацин, зомепирак и их сочетания. В конкретном варианте осуществления NSAID выбран из этодолака, флубипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, мелоксикама, напроксена, оксапрозина, пироксикама и их сочетаний.
В другом варианте осуществления соединение по изобретению вводят в сочетании с антилипидным средством. Репрезентативные антилипидные средства включают в качестве неограничивающих примеров статины, такие как аторвастатин, флувастатин, ловастатин, правастатин, розувастатин и симвастатин; переносящие сложный эфир холестерила белки (CETP); и их сочетания.
В другом варианте осуществления соединение по изобретению вводят в сочетании с противодиабетическими средствами. Репрезентативные противодиабетические средства включают в качестве неограничивающих примеров пригодные для инъекции лекарственные средства, такие как инсулин и производные инсулина; эффективные при пероральном введении лекарственные средства, включая бигуаниды, такие как метформин, антагонисты глюкагона, ингибиторы α-глюкозидазы, такие как акарбоза и миглитол, меглитиниды, такие как репаглинид, оксадиазолидиндионы, сульфонилмочевины, такие как хлорпропамид, глимепирид, глипизид, глибурид и толазамид, тиазолидиндионы, такие как пиоглитазон и розиглитазон; и их сочетания.
В одном варианте осуществления соединение по изобретению вводят в сочетании с антитромботическим средством. Репрезентативные антитромботические средства включают в качестве неограничивающих примеров аспирин, антитромбоцитарные средства, гепарин и их сочетания. Соединения по изобретению можно вводить также в сочетании с ингибитором ренина, включающим в качестве неограничивающих примеров, алискирен, эналкирен, ремикирен и их сочетания. В другом варианте осуществления соединение по изобретению вводят в сочетании с антагонистом рецепторов эндотелина, включающим в качестве неограничивающих репрезентативных примеров босентан, дарусентан, тезосентан, и их сочетания. Соединения по изобретению можно вводить также в сочетании с ингибитором эндотелинпревращающего фермента, включающим в качестве неограничивающих примеров фосфорамидон, CGS 26303 и их сочетания. В другом варианте осуществления соединение по изобретению вводят в сочетании с антагонистом альдостерона, включающим в качестве неограничивающих репрезентативных примеров, эплеренон, спиронолактон и их сочетания.
Комбинированные лекарственные средства могут также являться полезными при дополнительной комбинированной терапии с соединениями по изобретению. Например, комбинацию ингибитора ACE эналаприла (в форме соли малеата) и диуретика гидрохлортиазида, продаваемую под маркой Vaseretic®, или комбинацию блокатора кальциевых каналов амлодипина (в форме соли безилата) и ARB олмесартана (в форме пролекарства медоксомила), или комбинацию блокатора кальциевых каналов и статина, все можно также использовать с соединениями по изобретению. Средства двойного действия могут также являться полезными при комбинированной терапии с соединениями по изобретению. Например, можно также включать ингибиторы ангиотензинпревращающего фермента/неприлизина (ACE/NEP), такие как AVE-0848 ((4S,7S,12bR)-7-[3-метил-2(S)-сульфанилбутирамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); AVE-7688 (илепатрил) и его родительское соединение; BMS-182657 (2-[2-оксо-3(S)-[3-фенил-2(S)-сульфанилпропионамидо]-2,3,4,5-тетрагидро-1H-1-бензазепин-1-ил]уксусная кислота); CGS-26303 ([N-[2-(бифенил-4-ил)-1(S)-(1H-тетразол-5-ил)этил]амино]метилфосфоновая кислота); CGS-35601 (N-[1-[4-метил-2(S)-сульфанилпентанамидо]циклопентилкарбонил]-L-триптофан); фазидотрил; фазидотрилат; эналаприлат; ER-32935 ((3R,6S,9aR)-6-[3(S)-метил-2(S)-сульфанилпентанамидо]-5-оксопергидротиазоло[3,2-a]азепин-3-карбоновая кислота); гемпатрилат; MDL-101264 ((4S,7S,12bR)-7-[2(S)-(2-морфолиноацетилтио)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); MDL-101287 ([4S-[4α,7α(R*),12bβ]]-7-[2-(карбоксиметил)-3-фенилпропионамидо]-6-оксо-1,2,3,4,6,7,8,12b-октагидропиридо[2,1-a][2]бензазепин-4-карбоновая кислота); омапатрилат; RB-105 (N-[2(S)-(меркаптометил)-3(R)-фенилбутил]-L-аланин); сампатрилат; SA-898 ((2R,4R)-N-[2-(2-гидроксифенил)-3-(3-меркаптопропионил)тиазолидин-4-илкарбонил]-L-фенилаланин); Sch-50690 (N-[1(S)-карбокси-2-[N2-(метансульфонил)-L-лизиламино]этил]-L-валил-L-тирозин); и их сочетания. В одном конкретном варианте осуществления ингибитор ACE/NEP выбран из AVE-7688, эналаприлата, фазидотрила, фазидотрилата, омапатрилата, сампатрилата и их сочетаний.
Другие лекарственные средства, такие как агонисты α2-адренергического рецептора и антагонисты рецептора вазопрессина, могут также являться полезными при комбинированной терапии. Примеры агонистов α2-адренергических рецепторов включают клонидин, дексмедетомидин и гуанфацин. Примеры антагонистов рецепторов вазопрессина включают толваптан.
Следующие составы иллюстрируют репрезентативные фармацевтические композиции по изобретению.
Пример твердых желатиновых капсул для перорального введения
Соединение по изобретению (50 г), 440 г высушенной распылением лактозы и 10 г стеарата магния тщательно перемешивают. Затем полученную композицию загружают в твердые желатиновые капсулы (500 мг композиции на капсулу).
Альтернативно, соединение по изобретению (20 мг) тщательно смешивают с крахмалом (89 мг), микрокристаллической целлюлозой (89 мг) и стеаратом магния (2 мг). Затем смесь пропускают через сито с решеткой No. 45 U.S. и загружают в твердые желатиновые капсулы (200 мг композиции на капсулу).
Пример желатиновых капсул для перорального введения
Соединение по изобретению (100 мг) тщательно смешивают с моноолеатом полиоксиэтиленсорбитана (50 мг) и порошком крахмала (250 мг). Затем смесь загружают в желатиновые капсулы (300 мг композиции на капсулу).
Альтернативно, соединение по изобретению (40 мг) тщательно смешивают с микрокристаллической целлюлозой (Avicel PH 103; 260 мг) и стеаратом магния (0,8 мг). Затем смесь загружают в желатиновые капсулы (размер #1, белые, непрозрачные) (300 мг композиции на капсулу).
Пример состава таблетки для перорального введения
Соединение по изобретению (10 мг), крахмал (45 мг) и микрокристаллическую целлюлозу (35 мг) пропускают через сито с решеткой No. 20 U.S. и тщательно перемешивают. Полученные таким образом гранулы высушивают при 50-60°C и пропускают через сито с решеткой No. 16 U.S. Раствор поливинилпирролидона (4 мг в виде 10% раствора в стерильной воде) смешивают с карбоксиметилкрахмалом натрия (4,5 мг), стеаратом магния (0,5 мг) и тальком (1 мг), и эту смесь затем пропускают через сито с решеткой No. 16 U.S. Затем в гранулы добавляют карбоксиметилкрахмал натрия, стеарат магния и тальк. После перемешивания смесь прессуют в аппарате для изготовления таблеток с получением таблеток массой 100 мг.
Альтернативно, соединение по изобретению (250 мг) тщательно смешивают с микрокристаллической целлюлозой (400 мг), парами диоксида кремния (10 мг) и стеариновой кислотой (5 мг). Затем смесь прессуют с получением таблеток (665 мг композиции на таблетку).
Альтернативно, соединение по изобретению (400 мг) тщательно смешивают с кукурузным крахмалом (50 мг), натрий-кроскармеллозой (25 мг), лактозой (120 мг) и стеаратом магния (5 мг). Затем смесь прессуют с получением таблетки с одной бороздкой (600 мг композиции на таблетку).
Альтернативно, соединение по изобретению (100 мг) тщательно смешивают с кукурузным крахмалом (100 мг) с водным раствором желатина (20 мг). Смесь высушивают и размалывают в тонкий порошок. Затем микрокристаллическую целлюлозу (50 мг) и стеарат магния (5 мг) смешивают с желатиновым составом, гранулируют и полученную смесь прессуют с получением таблеток (100 мг активного вещества на таблетку).
Пример состава суспензии для перорального введения
Следующие ингредиенты смешивают с получением суспензии, содержащей 100 мг активного средства на 10 мл суспензии:
|
Пример жидкого состава для перорального введения
Подходящий жидкий состав представляет собой состав с буфером на основе карбоновой кислоты, таким как растворы цитратного, лактатного и малеатного буферов. Например, соединение по изобретению (которое можно предварительно смешивать с DMSO) смешивают с буфером 100 мМ цитратом аммония, и pH доводят до pH 5, или смешивают с раствором 100 мМ лимонной кислоты, и pH доводят до pH 2. Такие растворы могут включать также солюбилизирующий наполнитель, такой как циклодекстрин, например, раствор может включать 10% мас. гидроксипропил-β-циклодекстрина.
Другие подходящие составы содержат раствор 5% NaHCO3, с циклодекстрином или без.
Пример пригодного для инъекции состава для введения посредством инъекции
Соединение по изобретению (0,2 г) смешивают с буферным раствором 0,4 M ацетата натрия (2,0 мл). pH полученного раствора доводят до pH 4 с использованием 0,5 N водной соляной кислоты или 0,5 N водного гидроксида натрия, по необходимости, и затем добавляют достаточно воды для инъекций с получением общего объема 20 мл. Затем смесь фильтруют через стерильный фильтр (0,22 мкм) с получением стерильного раствора, пригодного для введения посредством инъекции.
Пример композиций для введения посредством ингаляции
Соединение по изобретению (0,2 мг) тонко измельчают и затем смешивают с лактозой (25 мг). Затем эту измельченную смесь загружают в желатиновый картридж для ингаляции. Содержимое картриджа вводят, например, с использованием ингалятора для сухого порошка.
Альтернативно, тонко измельченное соединение по изобретению (10 г) диспергируют в растворе, полученном растворением лецитина (0,2 г) в деминерализованной воде (200 мл). Полученную суспензию высушивают распылением и затем тонко измельчают с получением тонко измельченной композиции, содержащей частицы, обладающие средним диаметром менее приблизительно 1,5 мкм. Затем тонко измельченную композицию загружают в картриджи для отмеряющего дозы ингалятора, содержащие 1,1,1,2-тетрафторэтан под давлением, в количестве, достаточном для обеспечения от приблизительно 10 мкг до приблизительно 500 мкг соединения по изобретению на дозу при введении посредством ингалятора.
Альтернативно, соединение по изобретению (25 мг) растворяют в забуференном цитратом (pH 5) изотоническом солевом растворе (125 мл). Смесь перемешивают и обрабатывают ультразвуком до растворения соединения. pH раствора проверяют и доводят, если необходимо, до pH 5 медленным добавлением водного 1 N гидроксида натрия. Раствор вводят с использованием устройства для распыления, обеспечивающего от приблизительно 10 мкг до приблизительно 500 мкг соединения по изобретению на дозу.
ПРИМЕРЫ
Следующие препараты и примеры представлены для иллюстрации конкретных вариантов осуществления по изобретению. Эти конкретные варианты осуществления, однако, не предназначены для ограничения объема изобретения каким-либо образом, если это не указано конкретно.
Следующие сокращения обладают следующими значениями, если нет иных указаний, и любые другие сокращения, применяемые в настоящем документе и не получившие определения, обладают своими стандартными, общепринятыми значениями:
ACE ангиотензинпревращающий фермент
APP аминопептидаза P
AT1 ангиотензин II 1 типа (рецептор)
AT2 ангиотензин II 2 типа (рецептор)
BSA бычий сывороточный альбумин
DCM дихлорметан или метиленхлорид
DIPEA N,N-диизопропилэтиламин
DMAP 4-диметиламинопиридин
DMF N,N-диметилформамид
DMSO диметилсульфоксид
Dnp 2,4-динитрофенил
DOCA ацетат дезоксикортикостерона
EDC N-(3-диметиламинопропил)-N'-этилкарбодиимид
ЭДТА этилендиаминтетрауксусная кислота
EGTA этиленгликоль-бис(β-аминоэтиловый эфир)-N,N,N'N'-тетрауксусной кислоты
EtOAc этилацетат
HATU гексафторфосфат N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония
Mca (7-метоксикумарин-4-ил)ацил
MeCN ацетонитрил
MeOH метанол
NaBH3CN цианоборгидрид натрия
NBS N-бромсукцинимид
NEP неприлизин (EC 3.4.24.11)
PBS фосфатно-солевой буфер
SHR крысы со спонтанной гипертензией
TFA трифторуксусная кислота
THF тетрагидрофуран
Трис трис(гидроксиметил)аминометан
Tween-20 сорбитанмонолаурат полиэтиленгликоля
Если не указано иначе, все материалы, такие как реагенты, исходные вещества и растворители, закуплены у коммерческих производителей (таких как Sigma-Aldrich, Fluka Riedel-de Haen и т.п.) и использованы без дополнительной очистки.
Реакции проводили в атмосфере азота, если не указано иначе. Прогресс реакций мониторировали тонкослойной хроматографией (TLC), аналитической высокоэффективной жидкостной хроматографией (аналитической HPLC) и масс-спектрометрией, подробности которых приведены в конкретных примерах. Растворители, применяемые для аналитической HPLC, являлись следующими: растворитель A представлял собой 98% воды/2% MeCN /1,0 мл/л TFA; растворитель B представлял собой 90% MeCN/10% воды/1,0 мл/л TFA.
Реакции подготавливали, как описано конкретно в каждом получении или примере; обычно реакционные смеси очищали экстракцией и другими способами очистки, такими как зависимая от температуры и растворителя кристаллизация и осаждение. Кроме того, реакционные смеси очищали общепринятым образом препаративной HPLC, как правило, с использованием наполнителей для колонок Microsorb C18 и Microsorb BDS и общепринятых элюентов. Характеризацию продуктов реакции проводили общепринятым образом по массе и 1H-ЯМР-спектрометрии. Для измерения ЯМР образцы растворяли в дейтерированном растворителе (CD3OD, CDCl3 или DMSO-d6), и спектры 1H-ЯМР получали в аппарате Varian Gemini 2000 (400 МГц) в общепринятых условиях наблюдения. Масс-спектрометрическую идентификацию соединений, как правило, проводили с использованием способа ионизации электрораспылением (ESMS) с помощью аппарата модели API 150 EX Applied Biosystems (Foster City, CA) или аппарата модели 1200 LC/MSD Agilent (Palo Alto, CA).
ПОЛУЧЕНИЕ 1
4-метилпентаноилхлорид
Изокапроновую кислоту (10,0 г, 86,1 ммоль) растворяли в метиленхлориде (30,0 мл, 468,0 ммоль) и добавляли тионилхлорид (18,8 мл, 258 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, затем выпаривали в роторном испарителе с получением названного в заголовке соединения, которое немедленно использовали в следующей реакции.
ПОЛУЧЕНИЕ 2
(S)-2-ацетилсульфанилметил-4-метилпентановая кислота
(S)-4-бензил-3-(4-метилпентаноил)оксазолидин-2-он (2a): (S)-4-бензил-2-оксазолидинон (15,1 г, 85,0 ммоль) растворяли в THF (200 мл, 2,5 моль), охлаждали до -78°C в атмосфере азота и перемешивали в течение 10 минут. 1,6 M н-бутиллитий в гексане (53,1 мл) добавляли по каплям и перемешивали в течение 15 минут. 4-метилпентаноилхлорид (12,6 г, 93,5 ммоль) добавляли по каплям, перемешивали в течение 30 минут при -78°C, затем нагревали до 0°C в течение 2 часов. Добавляли 150 мл насыщенного NaHCO3 и смесь нагревали до комнатной температуры в течение 30 минут. Смесь экстрагировали с помощью DCM, промывали Na2CO3 (5%) и насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Избыток оксазолидинона удаляли с использованием гексанов, получая промежуточное соединение (2a) (14,5 г).
(S)-4-бензил-3-((R)-2-гидроксиметил-4-метилпентаноил)оксазолидин-2-он (2b): Промежуточное соединение (2a) (14,5 г, 46,3 ммоль) растворяли в DCM (151 мл, 2,4 моль) и перемешивали при 0°C в атмосфере азота. Добавляли 1 M тетрахлорид титана в DCM (48,6 мл) и перемешивали в течение 15 минут. DIPEA (8,9 мл, 51,0 ммоль) добавляли по каплям при 0°C и смесь перемешивали в течение 75 минут. Затем добавляли 1,3,5-триоксан (4,6 г, 51,0 ммоль) в DCM (30 мл). Через 10 минут добавляли второй эквивалент 1 M тетрахлорида титана в DCM (48,6 мл) и смесь перемешивали при 0°C в течение 5 часов. Затем реакцию останавливали с помощью 250 мл насыщенного хлорида аммония. Добавляли воду и DCM, и водную фазу экстрагировали еще дважды с помощью DCM. Органические слои объединяли, высушивали над MgSO4, фильтровали и концентрировали. Полученный материал очищали хроматографией на силикагеле (0-60% EtOAc:гексаны), получая промежуточное соединение (2b) (13,9 г).
(R)-2-гидроксиметил-4-метилпентановая кислота (2c): Промежуточное соединение (2b) (13,9 г, 40,8 ммоль) растворяли в THF (200 мл, 2 моль) и перемешивали при 0°C. Добавляли 9 M пероксид водорода в воде (46,3 мл), с последующим добавлением по каплям 1,5 M моногидрата гидроксида лития в воде (54,4 мл). Затем смесь нагревали до комнатной температуры и перемешивали в течение 2,5 часов. Добавляли гидроксид калия (4,6 г, 81,6 ммоль), и смесь нагревали при 60°C в течение 30 минут и затем охлаждали при комнатной температуре. К этому добавляли раствор сульфита натрия (10 г в 200 мл воды), затем воду и хлороформ (200 мл каждого). Водный слой экстрагировали еще дважды с помощью CHCl3 (150 мл), подкисляли и экстрагировали с помощью EtOAc. Затем органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и выпаривали в роторном испарителе, получая промежуточное соединение (2c) (5,4 г).
Трифенилфосфин (19,5 г, 74,3 ммоль) растворяли в THF (200 мл, 2 моль) и охлаждали до 0°C. Диизопропилазодикарбоксилат (14,6 мл, 74,3 ммоль) добавляли по каплям и смесь перемешивали в течение 10 минут при 0°C. Промежуточное соединение (2c) (5,4 г, 37,1 ммоль) и тиоуксусную кислоту (8,0 мл, 111 ммоль) растворяли в THF (20 мл) и по каплям добавляли в реакционную смесь. После добавления смесь удаляли с ледяной бани и перемешивали при комнатной температуре. Смесь перемешивали в течение 3,5 часов, концентрировали приблизительно до трети объема и затем разделяли между EtOAc и насыщенным NaHCO3. Органический слой экстрагировали еще трижды насыщенным NaHCO3 и объединенные водные экстракты промывали дважды CHCl3, подкисляли с помощью 1 N HCl и экстрагировали трижды с помощью EtOAc. Органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и выпаривали в роторном испарителе с получением названного в заголовке соединения (выход 33%).
ПОЛУЧЕНИЕ 3
трет-Бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты
трет-Бутиловый эфир 4'-метилбифенил-2-карбоновой кислоты (3a): Раствор 4'-метилбифенил-2-карбоновой кислоты (48,7 г, 230 ммоль) и тионилхлорид (150 мл) перемешивали при комнатной температуре. Через 5,5 часов смесь концентрировали в вакууме. Избыток тионилхлорида удаляли совместной перегонкой с толуолом до получения желтого твердого вещества (52,6 г). Материал затем растворяли в THF (500 мл) и охлаждали до 0°C, трет-бутоксид калия (15,0 г, 130 ммоль) добавляли по порциям, с последующим добавлением 1 М раствора трет-бутоксида калия в THF (250 мл). Добавляли дополнительный твердый трет-бутоксид калия (21,4 г, 100 ммоль) и смесь перемешивали при 0°C в течение 1,5 часов. Затем смесь разделяли между EtOAc и водой, и органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения промежуточного соединения (3a) в виде желтого масла (62,3 г), которое использовали непосредственно на следующей стадии.
Бензоилпероксид (3,9 г, 16,0 ммоль) добавляли к раствору промежуточного соединения (3a) (62 г, 230 ммоль) и NBS (41,2 г, 230 ммоль) в бензоле (800 мл). Затем смесь нагревали при кипячении с обратным холодильником. Через 4,5 часа добавляли бензоилпероксид (1 г), затем через 30 минут NBS (16 г, 66,0 ммоль). Смесь перемешивали всего в течение 6 часов, охлаждали, фильтровали и концентрировали в вакууме. Затем полученный осадок кристаллизовали из диэтилового эфира и гексана при 4°C в течение ночи с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (40,7 г). 1H-ЯМР (DMSO): δ (м.д.) 1,1 (с, 9H), 4,6 (с, 2H), 7,1-7,6 (м, 8H).
ПОЛУЧЕНИЕ 4
трет-Бутиловый эфир 4'-(5-аминометил-2-бутил-4-хлоримидазол-1-илметил)бифенил-2-карбоновой кислоты
трет-Бутиловый эфир 4'-(2-бутил-4-хлор-5-формилимидазол-1-илметил)бифенил-2-карбоновой кислоты (4a): 2-бутил-5-хлор-3H-имидазол-4-карбальдегид (9,9 г, 53,3 ммоль), трет-бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты (18,5 г, 53,3 ммоль) и K2CO3 (7,4 г, 53,3 ммоль) объединяли в DMF (200 мл) и перемешивали при комнатной температуре в течение ночи. Реакцию останавливали водой, экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Неочищенную смесь очищали флэш-хроматографией (0-40% EtOAc:гексаны) с получением 21,5 г промежуточного соединения (4a).
трет-Бутиловый эфир 4'-[2-бутил-4-хлор-5-(гидроксииминометил)имидазол-1-илметил]бифенил-2-карбоновой кислоты (4b): Промежуточное соединение (4a) (12,1 г, 26,7 ммоль) и NH2OH·HCl (2,4 г, 34,7 ммоль) объединяли в 80 мл воды и 160 мл пиридина и перемешивали при комнатной температуре в течение ночи. Добавляли воду (80 мл) и смесь перемешивали в течение 1 часа. Преципитат фильтровали и высушивали с получением 11,7 г промежуточного соединения (4b), которое использовали на следующей стадии без дополнительной очистки.
Промежуточное соединение (4b) (8,8 г, 19 ммоль), NaBH3CN (5,3 г, 84,6 ммоль) и NH4OAc (3,2 г, 41,4 ммоль) растворяли в MeOH (100 мл) и охлаждали до 0°C. Через 15 минут TiCl3 (8,70 г, 56,4 ммоль) добавляли тремя частями и смесь перемешивали при 0°C в течение 10 минут. Затем смесь удаляли из ледяной бани и позволяли нагреться до комнатной температуры, при перемешивании, в течение 3 часов. Смесь охлаждали до 0°C, реакцию останавливали с помощью NH4OH (100 мл) и смесь перемешивали в течение 15 минут. Полученный с помощью соли титана осадок отфильтровывали и промывали MeOH несколько раз. Фильтрат концентрировали. Полученный осадок поглощали в смеси 3:1 CHCl3 и изопропанола. Добавляли насыщенный водный NaCl и насыщенный водный NaHCO3. Продукт экстрагировали дважды смесью 3:1 CHCl3 и изопропанола, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения 8,2 г названного в заголовке соединения.
ПРИМЕР 1
трет-Бутиловый эфир 4'-5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутил-4-хлоримидазол-1-илметилбифенил-2-карбоновой кислоты (1a; R 1a = трет-бутил; R 5a = -C(O)CH 3 ); 4'-5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутил-4-хлоримидазол-1-илметилбифенил-2-карбоновая кислота (1b; R 1a = H; R 5a = -C(O)CH 3 ); и 4'-2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметилбифенил-2-карбоновая кислота (1c; R 1a = H; R 5a = H)
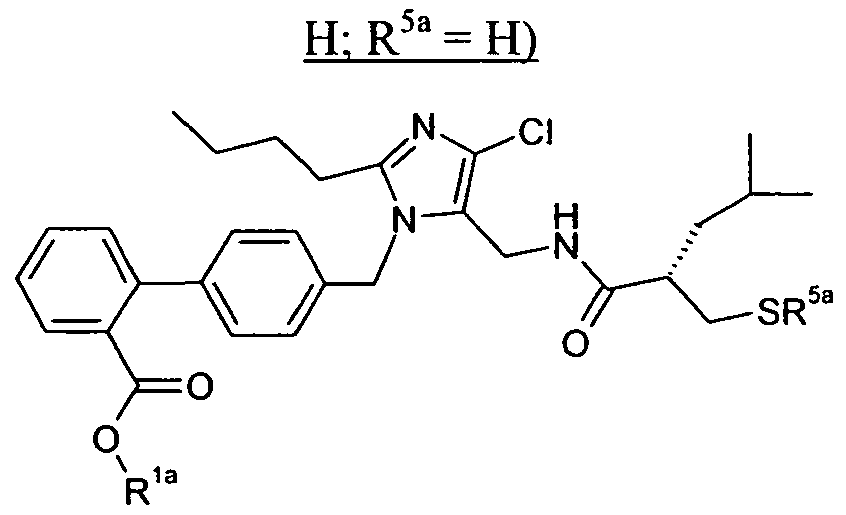
(S)-2-ацетилсульфанилметил-4-метилпентановую кислоту (371 мг, 1,8 ммоль) и HATU (691 мг, 1,8 ммоль) растворяли в DMF (5 мл, 60 ммоль) и перемешивали при комнатной температуре в течение 15 минут. Затем добавляли DIPEA (0,3 мл, 2 ммоль) и смесь перемешивали в течение 1 часа. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-бутил-4-хлоримидазол-1-илметил)бифенил-2-карбоновой кислоты (750 мг, 1,7 ммоль) и DIPEA (0,3 мл, 2 ммоль) в DMF (2 мл), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакцию останавливали водой и смесь экстрагировали с помощью EtOAc. Органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Реакционную смесь очищали хроматографией на силикагеле (1:1 EtOAc:гексаны), получая промежуточное соединение ацетилсульфанилового эфира (1a). Это промежуточное соединение растворяли в DCM:TFA (1:1) (3 мл каждого) и перемешивали при комнатной температуре в течение 3,5 часов и затем концентрировали до получения промежуточного соединения ацетилсульфаниловой кислоты (1b). Это промежуточное соединение повторно растворяли в 1:1 MeOH:NaOH (1 N) (2 мл каждого) и перемешивали при комнатной температуре в атмосфере азота в течение 1 часа, реакцию останавливали уксусной кислотой и смесь концентрировали. Полученный материал очищали препаративной HPLC (30-70%) с получением 360 мг конечного продукта (1c). MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено, 542,4, 1H-ЯМР (DMSO): 8,4 (1H, т), 7,69 (1H, д), 7,53 (1H, т), 7,42 (1H, т), 7,33 (1H, д), 7,27 (2H, д), 7,01 (2H, д), 5,23 (2H, с), 4,18 (2H, м), 2,35 (1H, м), 2,05 (1H, т), 1,45 (2H, м), 1,38 (2H, м), 1,2 (3H, м), 0,77 (9H, м).
ПОЛУЧЕНИЕ 5
(S)-2-ацетилсульфанил-4-метилпентановая кислота
(R)-2-бром-4-метилпентановая кислота (5a): D-лейцин (9,9 г, 75,2 ммоль) растворяли в 3,0 M HBr в воде (120 мл) и охлаждали до 0°C. Добавляли раствор NaNO2 (8,3 г, 120 ммоль) в воде (20 мл, 100 ммоль). Реакционную смесь перемешивали при 0°C в течение 2,5 часов и затем экстрагировали дважды с помощью EtOAc, промывали дважды насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения 12,6 г промежуточного соединения (5a) в виде бледно-желтого масла. Это брали для следующей стадии без дополнительной очистки. 1H-ЯМР (DMSO): 4,31 (1H, т), 1,75 (2H, м), 1,65 (1H, м), 0,82 (6H, дд).
Промежуточное соединение (5a) (12,5 г, 64,1 ммоль), тиоацетат калия (11,0 г, 96,1 ммоль) и DMF (100 мл, 1,0 моль) объединяли, и смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли воду (100 мл) и смесь экстрагировали трижды с помощью EtOAc, промывали дважды насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Продукт очищали хроматографией на силикагеле (0-40% EtOAc:гексаны с 5% уксусной кислотой) с получением 6,8 г названного в заголовке соединения в виде бледно-желтого масла. 1H-ЯМР (DMSO): 3,96 (1H, т), 2,45 (3H, с), 1,70 (1H, м), 1,55 (1H, м), 1,42 (1H, м), 0,84 (6H, дд).
Альтернативный синтез указанного в заголовке соединения
(R)-2-бром-4-метилпентановая кислота (5a): При перемешивании, D-лейцин (76,6 г, 584 ммоль, 1,0 экв.) растворяли в 920 мл водной 3,0 M HBr (2,8 моль, 4,7 экв.) и охлаждали до 0°C. Раствор NaNO2 (64,5 г, 934 ммоль, 1,6 экв.) в 200 мл воды медленно добавляли в течение 20 минут и смесь перемешивали при 0°C в течение 3 часов. Смесь экстрагировали 2× с помощью 500 мл EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением с получением (R)-2-бром-4-метилпентановой кислоты в виде желтого масла (103 г). 1H-ЯМР (DMSO) δ (м.д.): 0,9 (м, 6H), 1,6-1,7 (м, 1H), 1,7-1,9 (м, 2H), 4,3 (т, 1H).
Промежуточное соединение (5a) (103 г, 528 ммоль, 1,0 экв.) растворяли в 800 мл DMF и охлаждали до 0°C. Медленно добавляли тиоацетат калия (90,5 г, 792 ммоль, 1,5 экв.), и смеси позволяли медленно нагреваться до комнатной температуры. Через 8 часов реакцию останавливали с помощью 600 мл воды, экстрагировали 3× с помощью 500 мл EtOAc, промывали насыщенным водным NaCl и высушивали над MgSO4. Органическую фазу фильтровали и концентрировали под пониженным давлением, получая неочищенное названное в заголовке соединение в виде коричневого масла. Неочищенный продукт (85 г) растворяли в 350 мл диизопропилового эфира и охлаждали до 0°C во льду. Медленно добавляли 1,0 экв. диизопропиламина и полученную смесь перемешивали в течение 1 часа. Раствор фильтровали и твердое вещество промывали с помощью 250 мл холодного диизопропилового эфира. Затем твердое вещество суспендировали в 500 мл EtOAc и промывали с помощью 900 мл 5% KHSO4 (водн.). Органическую фазу сушили над MgSO4 и концентрировали под пониженным давлением с получением названного в заголовке соединения в виде желтого масла (39,6 г). 1H-ЯМР (CDCl3) δ (м.д.): 0,9 (м, 6H), 1,6 (м, 1H), 1,7 (м, 1H), 1,8 (м, 1H), 2,3 (с, 3H), 4,2 (т, 1H).
Альтернативно, объединяли тиоуксусную кислоту (13,7 г, 180 ммоль) и DMF (300 мл), и смесь охлаждали в ледяной бане. Добавляли карбонат натрия (19,0 г, 180 ммоль). Через 30 минут добавляли по каплям промежуточное соединение (5a) (33,4 г, 171 ммоль) в 20 мл DMF и смесь перемешивали от 0°C до комнатной температуры в течение 7 часов. Реакционную смесь разводили 200 мл EtOAc и промывали с помощью 200 мл 1:1 раствора насыщенного водного NaCl:1 N HCl. Слои разделяли и водную фазу снова экстрагировали с помощью 200 мл EtOAc. Органические фазы объединяли, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением. Выделенное масло растворяли в диизопропиловом эфире (150 мл, 1,1 моль) и охлаждали до 0°C. Дициклогексиламин (33,4 мл, 168 ммоль) добавляли по каплям и твердому веществу позволяли отделяться от раствора. После перемешивания в течение дополнительных 30 минут материал фильтровали и промывали с помощью 150 мл холодного диизопропилового эфира. Выделенное твердое вещество (41 г) суспендировали в 300 мл EtOAc. Добавляли 500 мл 5% KHSO4 и слои разделяли. Органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали под пониженным давлением до получения названного в заголовке соединения в виде желтого масла (20,7 г). 1H ЯМР (CDCl3) δ (м.д.): 0,9 (м, 6H), 1,6 (м, 1H), 1,7 (м, 1H), 1,8 (м, 1H), 2,3 (с, 3H), 4,2 (т, 1H).
ПОЛУЧЕНИЕ 6
5-бром-2-бутил-3H-имидазол-4-карбальдегид
2-бутил-3H-имидазол-4-карбальдегид (30,0 г, 197 ммоль) растворяли в DMF (220 мл, 2,8 моль). Добавляли NBS (36,8 г, 207 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Затем смесь концентрировали и поглощали в EtOAc и воде. Водный слой экстрагировали трижды с помощью EtOAc и объединеные органические экстракты промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Смесь очищали хроматографией на силикагеле (0-50% EtOAc:гексаны) до получения 7,8 г названного в заголовке соединения в виде серого твердого вещества. MS m/z: [M+H+] рассчитано для C8H11BrNa2O, 232,09; обнаружено 233,0. 1H-ЯМР (DMSO): 13,3 (1H, уш.), 9,48 (1H, с), 2,66 (2H, т), 1,59 (2H, м), 1,25 (2H, м), 0,85 (3H, т).
ПОЛУЧЕНИЕ 7
Метиловый эфир 4-бромметил-2,3-дифторбензойной кислоты
Метиловый эфир 2,3-дифтор-4-метилбензойной кислоты (7a): 2,3-дифтор-4-метилбензойную кислоту (10,0 г, 58,1 ммоль) растворяли в MeOH (200 мл, 6,0 моль) и серной кислоте (1,00 мл, 19,0 ммоль), и нагревали при кипячении с обратным холодильником в течение ночи. Затем смесь охлаждали и концентрировали под пониженным давлением. Полученный осадок поглощали в EtOAc и промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения 9,0 г промежуточного соединения (7a) в виде белого твердого вещества. 1H-ЯМР (CDCl3): 7,61 (1H, т), 7,00 (1H, т), 3,93 (3H, с), 2,35 (3H, с).
Промежуточное соединение (7a) (9,0 г, 48,4 ммоль), NBS (8,6 г, 48,4 ммоль) и бензоилпероксид (100 мг, 0,5 ммоль) растворяли в бензоле (200 мл, 2,0 моль), и смесь нагревали при кипячении с обратным холодильником в течение ночи. Затем смесь охлаждали и концентрировали под пониженным давлением. Полученный осадок поглощали в EtOAc и промывали водой и насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Неочищенную реакционную смесь очищали хроматографией на силикагеле (0-10% EtOAc:гексаны) до получения 4,6 г названного в заголовке соединения в виде светло-желтого твердого вещества. MS m/z: [M+H+] рассчитано для C9H7BrF2O2, 266,05; обнаружено 267,1. 1H-ЯМР (CDCl3): 7,70 (1H, т), 7,28 (1H, т), 4,48 (2H, с), 3,95 (3H, с).
ПОЛУЧЕНИЕ 8
Соль дигидрохлорид метилового эфира 4-(5-аминометил-2-бутилимидазол-1-илметил)-2,3-дифторбензойной кислоты
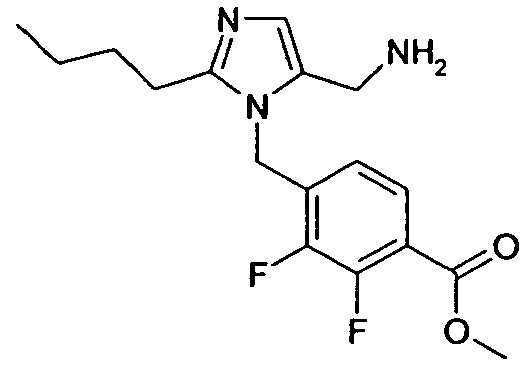
Метиловый эфир 4-(4-бром-2-бутил-5-формилимидазол-1-илметил)-2,3-дифторбензойной кислоты (8a): метиловый эфир 4-бромметил-2,3-дифторбензойной кислоты (3,5 г, 13,2 ммоль), 5-бром-2-бутил-3H-имидазол-4-карбальдегид (3,1 г, 13,2 ммоль) и карбонат калия (1,8 г, 13,2 ммоль) объединяли и растворяли в DMF (20 мл, 300 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Затем смесь разводили в воде и экстрагировали с помощью EtOAc. Органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Неочищенную реакционную смесь очищали хроматографией на силикагеле (0-50% EtOAc:гексаны) до получения 4,16 г промежуточного соединения (8a) в виде желтого твердого вещества. MS m/z: [M+H+] рассчитано для C17H17BrF2N2O3, 416,23; обнаружено 417,1. 1H ЯМР (CDCl3): 9,68 (1H, с), 7,64 (1H, т), 6,55 (1H, т), 5,64 (2H, с), 3,95 (3H, с), 2,63 (2H, т), 1,69 (2H, м), 1,36 (2H, м), 0,90 (3H, т).
Метиловый эфир 4-[4-бром-2-бутил-5-(гидроксииминометил)имидазол-1-илметил]-2,3-дифторбензойной кислоты (8b): Промежуточное соединение (8a) (4,1 г, 10 ммоль) растворяли в пиридине (20 мл, 200 ммоль) и воде (10 мл, 600 ммоль). Добавляли NH2OH·HCl (898 мг, 12,9 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали добавлением воды (20 мл), и смесь перемешивали в течение 20 минут. Полученное твердое вещество фильтровали и высушивали с получением 3,6 г промежуточного соединения (8b) в виде светло-желтого твердого вещества. MS m/z: [M+H+] рассчитано для C17H18BrF2N3O3, 431,24; обнаружено 432,2.
Объединяли промежуточное соединение (8b) (3,6 г, 8,2 ммоль), гидроксид палладия (0,58 г, 4,1 ммоль), 1 M HCl в воде (16,5 мл) и MeOH (190 мл, 4,7 моль). Смесь дегазировали и затем перемешивали под водородом в течение 4 часов. Палладий отфильтровывали и затем раствор концентрировали до получения 3,3 г названного в заголовке соединения в виде желто-оранжевого твердого вещества. MS m/z: [M+H+] рассчитано для C17H21F2N3O2, 338,16; обнаружено 338,2. 1H-ЯМР (DMSO): 9,69 (2H, уш.), 7,84 (1H, с), 7,67 (1H, м), 6,94 (1H, м), 5,80 (2H, с), 4,10 (2H, д), 3,88 (3H, с), 2,98 (2H, т), 1,56 (2H, м), 1,29 (2H, м), 0,84 (3H, т).
ПРИМЕР 2
4-{2-бутил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота
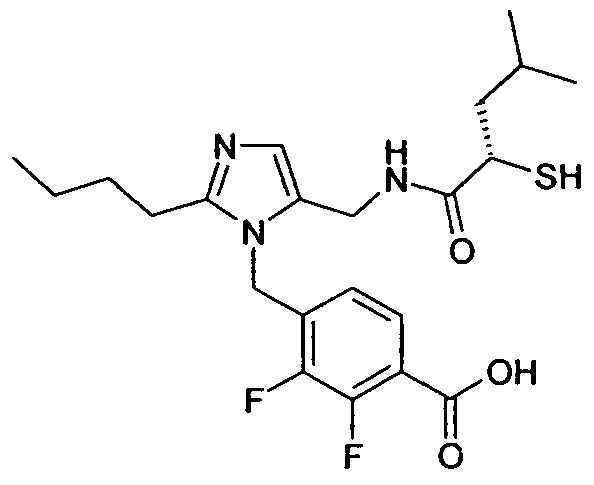
(S)-2-ацетилсульфанил-4-метилпентановую кислоту (205 мг, 1,1 ммоль) растворяли в DMF (8,1 мл, 104 ммоль). Добавляли HATU (409 мг, 1,1 ммоль) и DIPEA (170 мкл, 1,0 ммоль) и смесь перемешивали при комнатной температуре в течение 30 минут. Соль дигидрохлорид метилового эфира 4-(5-аминометил-2-бутилимидазол-1-илметил)-2,3-дифторбензойной кислоты (401 мг, 1,0 ммоль) растворяли в DMF (1 мл) с DIPEA (170 мкл, 1,0 ммоль) и добавляли в смесь. Смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакцию останавливали водой, и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Затем неочищенный осадок поовторно растворяли в 1:1 MeOH:NaOH (4 мл) и перемешивали при комнатной температуре в атмосфере азота в течение 1 часа. Реакцию останавливали уксусной кислотой и смесь концентрировали. Продукт очищали препаративной HPLC (2-90%) с получением 108 мг названного в заголовке соединения в виде белого твердого вещества. MS m/z: [M+H+] рассчитано для C22H29F2N3O3S, 454,19; обнаружено 454,2. 1H-ЯМР (DMSO): 8,44 (1H, т), 7,59 (1H, т), 7,25 (1H, с), 6,62 (1H, т), 5,56 (2H, с), 4,24 (2H, м), 3,14 (2H, кв), 2,79 (2H, т), 2,72 (1H, д), 1,2-1,6 (7H, м), 0,78 (6H, д), 0,71 (3H, д).
ПОЛУЧЕНИЕ 9
2-бутил-3-(4-метоксикарбонилбензил)-3H-имидазол-4-карбоновая кислота (соль TFA)
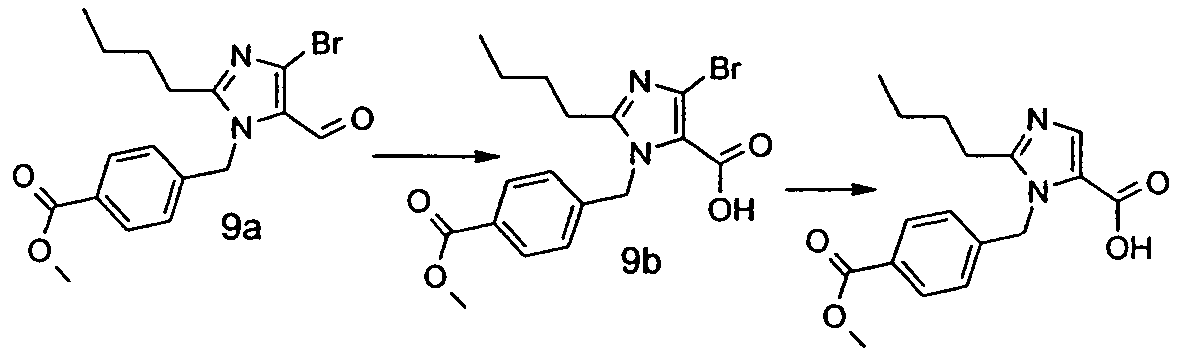
Метиловый эфир 4-(4-бром-2-бутил-5-формилимидазол-1-илметил)бензойной кислоты (9a): 5-Бром-2-бутил-3H-имидазол-4-карбальдегид (38 г, 160 ммоль) растворяли в DMF (400 мл, 5 моль). Добавляли карбонат калия (27 г, 200 ммоль), затем метил-4-бромметилбензоат (38 г, 160 ммоль) и раствор перемешивали при комнатной температуре в течение ночи. Затем смесь концентрировали и очищали хроматографией на силикагеле (0-50% EtOAc:гексаны), получая промежуточное соединение (9a) (32,2 г, 62,2 ммоль). MS m/z: [M+H+] рассчитано для C17H19N2O3Br, 379,3; обнаружено 379,1. 1H-ЯМР (400 МГц, CD3OD) δ (м.д.): 0,82 (т, 3H, J=5 Гц), 1,28 (м, 2H), 1,54 (кв, 2H, J=5 Гц), 2,70 (т, 2H, J=5 Гц), 5,69 (с, 2H), 7,15 (д, 2H, J=5 Гц), 7,96 (д, 2H, J=5 Гц), 9,66 (с, 1H).
5-бром-2-бутил-3-(4-метоксикарбонилбензил)-3H-имидазол-4-карбоновая кислота (9b): Промежуточное соединение (9a) (20 г, 50 ммоль) растворяли в 1-бутаноле (580 мл, 6,3 моль). К этому добавляли 2,0 M 2-метил-2-бутен в THF (295 мл), дигидрофосфат натрия (50,6 г, 422 ммоль) и хлорит натрия (50,6 г, 559 ммоль) в воде (780 мл, 43 моль). Смесь перемешивали при комнатной температуре в течение ночи, затем экстрагировали с помощью 500 мл EtOAc и промывали дважды с помощью 250 мл раствора насыщенного сульфита натрия. Органический экстракт сушили над MgSO4, концентрировали, затем очищали хроматографией на силикагеле (0-50% EtOAc:гексаны), получая промежуточное соединение (9b) (20 г, 50 моль). MS m/z: [M+H+] рассчитано для C17H19N2O4Br, 395,3; обнаружено 397,2. 1H-ЯМР (400 МГц, CD3OD): δ (м.д.) 0,82 (т, 3H, J=5 Гц), 1,27 (м, 2H), 1,53 (кв, 2H, J=5 Гц), 2,64 (т, 2H, J=5 Гц), 5,71 (с, 2H), 7,10 (д, 2H, J=5 Гц), 7,96 (д, 2H, J=5 Гц).
Промежуточное соединение (9b) (20 г, 50 ммоль) растворяли в MeOH (390 мл, 9,6 моль). TFA (4,33 мл, 56,2 ммоль) добавляли для солюбилизации материала. Смесь дегазировали в атмосфере азота и добавляли палладий-на-углероде, 10% по массе (0,54 г, 5 ммоль). Смесь помещали под водород и перемешивали при комнатной температуре в течение 4 часов. Затем смесь фильтровали через слой Целита® и концентрировали. Полученный осадок растирали в порошок с EtOAc и фильтровали для выделения названного в заголовке соединения в виде соли TFA (15,9 г, 36,9 ммоль). MS m/z: [M+H+] рассчитано для C17H20N2O4, 316,4; обнаружено 317,3. 1H-ЯМР (400 МГц, CD3OD): δ (м.д.) 0,85 (т, 3H, J=5 Гц), 1,32 (м, 2H), 1,55 (кв, 2H, J=5 Гц), 2,96 (т, 2H, J=5 Гц), 5,92 (с, 2H), 7,26 (д, 2H, J=5 Гц), 8,00 (д, 2H, J=5 Гц), 8,2 (с, 1H).
ПРИМЕР 3
4-{2-бутил-5-[(R)-1-(3-хлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота (соль TFA)
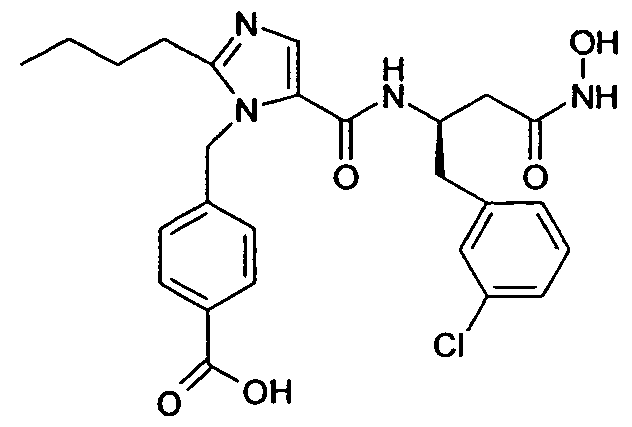
Соль TFA 2-бутил-3-(4-метоксикарбонилбензил)-3H-имидазол-4-карбоновой кислоты (2,7 г, 6,3 ммоль) растворяли в DMF (30 мл). Раствор перемешивали при комнатной температуре и добавляли пентафторфенол (1,2 г, 6,3 ммоль), EDC (1,2 г, 6,3 ммоль) и DIPEA (1,1 мл, 6,3 ммоль). Раствору позволяли перемешаться при комнатной температуре в течение ночи. К этому добавляли соль HCl (R)-3-амино-4-(3-хлорфенил)масляной кислоты (0,8 г, 6,3 ммоль) и DIPEA (1,1 мл, 6,3 ммоль), и раствор перемешивали при 60°C в течение 4 часов. Затем неочищенной реакционной смеси позволяли охлаждаться до комнатной температуры, концентрировали под пониженным давлением, затем разводили EtOAc. Органический раствор промывали 1 М фосфорной кислотой, насыщенным раствором NaCl, затем высушивали над MgSO4. После фильтрации органический раствор концентрировали под пониженным давлением с получением неочищенной кислоты.
Затем неочищенную кислоту растворяли в DMF (30 мл). Раствор перемешивали при комнатной температуре и добавляли пентафторфенол (1,2 г, 6,3 ммоль), EDC (1,2 г, 6,3 ммоль) и DIPEA (1,1 мл, 6,3 ммоль). Полученному раствору позволяли перемешиваться при комнатной температуре в течение ночи. К этому добавляли соль HCl гидроксиламина (450 мг, 6,3 ммоль) и DIPEA (1,1 мл, 6,3 ммоль), и раствор перемешивали при 40°C в течение 4 часов. Неочищенной реакционной смеси позволяли охлаждаться до комнатной температуры, концентрировали под пониженным давлением и разводили EtOAc. Затем органический слой промывали 1 М фосфорной кислотой, насыщенным раствором NaCl и затем высушивали над MgSO4. После фильтрации смесь концентрировали под пониженным давлением с получением неочищенного гидроксамата.
Неочищенный гидроксамат растворяли в THF (10 мл) с последующим добавлением 1 М NaOH (31,6 мл, 31,6 ммоль). Смесь перемешивали при 40°C в течение 4 часов и затем подкисляли до pH 4 с помощью 1 M HCl. Водный раствор экстрагировали трижды EtOAc, и объединенные органические экстракты концентрировали под пониженным давлением с получением неочищенного материала, который очищали обращенно-фазовой хроматографией (1:1 вода:MeCN с 0,1% TFA) с получением названного в заголовке соединения в виде соли TFA (279 мг, 0,23 ммоль). MS m/z: [M+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 513,5. 1H-ЯМР (400 МГц, (CD3)2SO): δ (м.д.) 0,74 (т, 3H, J=5 Гц), 1,18 (кв, 2H, J=5 Гц), 1,41 (м, 2H), 2,20 (д, 2H, J=5 Гц), 2,68 (м, 3H), 4,36 (м, 2H), 5,71 (м, 2H), 7,11 (м, 5H, J=5 Гц), 7,86 (м, 2H), 8,00 (с, 1H), 8,59 (с, 1H).
ПОЛУЧЕНИЕ 10
5-(4'-бромметилбифенил-2-ил)-1-тритил-1H-тетразол
К насыщенной азотом суспензии N-трифенилметил-5-[4'-метилбифенил-2-ил]тетразола (10 г, 20,9 ммоль) в DCM добавляли NBS (3,7 г, 20,9 ммоль) и каталитическое количество бензоилпероксида (60 мг, 0,24 ммоль). Смесь перемешивали при кипячении с обратным холодильником в течение 15 часов. После охлаждения до комнатной температуры преципитат фильтровали и органический раствор концентрировали в вакууме. Хроматографией на силикагеле (EtOAc:гексаны) получали названное в заголовке соединение в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6): δ (м.д.) 4,61 (с, 2H), 6,80 (д, 6H), 7,01 (д, 2H), 7,24 (д, 2H), 7,28-7,35 (м, 9H), 7,43-7,45 (дд, 1H), 7,50-7,56 (тд, 1H), 7,58-7,60 (тд, 1H), 7,77-7,79 (дд, 1H).
ПОЛУЧЕНИЕ 11
C-{2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-ил}метиламин·2[C 2 HF 3 O 2 ]
2-бутил-5-хлор-3-[2'-(1-тритил-1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбальдегид (11a): К раствору 5-(4'-бромметилбифенил-2-ил)-1-тритил-1H-тетразола (30 г, 53,8 ммоль) в DMF (150 мл) добавляли 2-бутил-5-хлор-3H-имидазол-4-карбальдегид (10 г, 53,8 ммоль) и K2CO3 (7,4 г, 53,8 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли EtOAc (500 мл) и органическую фазу промывали трижды раствором NaHCO3 (200 мл), затем насыщенным водным NaCl (200 мл). Растворитель удаляли и очистки достигали хроматографией на силикагеле (50:50 EtOAc:гексаны) с использованием изократического градиента, получая промежуточное соединение (11a), белого твердого вещества (41 г). MS m/z: [M+H+] рассчитано для C41H35ClN6O, 663,26; обнаружено 663,4. 1H-ЯМР (d4-MeOH): 0,83 (м, 3H), 1,26 (м, 2H), 1,53 (м, 2H), 2,53 (м, 2H), 5,56 (с, 2H), 6,87-6,96 (м, 8H), 7,05 (м, 2H), 7,25-7,43 (м, 10H), 7,53-7,58 (м, 2H), 7,84 (д, 1H), 9,73 (с, 1H).
{2-бутил-5-хлор-3-[2'-(1-тритил-1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-ил}метанол (11b): К раствору промежуточного соединения (11a) (41,0 г, 61,8 ммоль) в EtOH (500 мл) добавляли твердый NaBH4 (2,8 г, 74,1 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. После охлаждения до 0°C реакцию останавливали добавлением по каплям 50/50 раствора уксусной кислоты/воды, пока не прекращали наблюдать бурное выделение газа. Добавляли EtOAc (500 мл) и органическую фазу промывали трижды насыщенным водным NaCl (100 мл). Растворитель удаляли и очистки достигали хроматографией на силикагеле (50:50 EtOAc:гексаны) с использованием изократического градиента, получая промежуточное соединение (11b) в виде белого твердого вещества (37 г). MS m/z: [M+H+] рассчитано для C41H37ClN6O, 665,28; обнаружено 665,3. 1H-ЯМР (d4-MeOH): 0,79 (м, 3H), 1,20 (м, 2H), 1,46 (м, 2H), 2,45 (м, 2H), 4,30 (с, 2H), 5,19 (с, 2H), 6,83-6,90 (м, 8H), 7,05 (д, 2H), 7,23-7,33 (м, 10H), 7,53 (м, 2H), 7,81 (д, 1H).
2-бутил-5-хлор-3-[2'-(1-тритил-1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметиловый эфир метансульфоновой кислоты (11c): К раствору промежуточного соединения (11b) (13,6 г, 20,4 ммоль) в DCM (200 мл), охлажденному до -78°C, добавляли метансульфонилхлорид (6,3 мл, 81,6 ммоль). Смесь перемешивали при -78°C в течение 15 минут. Насыщенный раствор NaHCO3 (100 мл) и EtOAc (500 мл) добавляли к охлажденной смеси, которой затем позволяли достигать комнатной температуры. Органическую фазу промывали дополнительные три раза насыщенным водным NaCl (100 мл). После высушивания над сульфатом натрия и фильтрации удалением растворителя получали промежуточное соединение (11c) в виде желтого масла (15 г), которое использовали непосредственно на следующей стадии. MS m/z: [M+H+] рассчитано для C42H39ClN6O3S, 743,26; из-за реакционно-способного характера промежуточного соединения (11c) только замещенный метанолом продукт наблюдали при проведении масс-спектрометрии образца после растворения в метаноле; для замещенного метанолом продукта [M+H+]=679,6.
5-[4'-(5-азидометил-2-бутил-4-хлоримидазол-1-илметил)бифенил-2-ил]-1-тритил-1H-тетразол (11d): К раствору промежуточного соединения (11c) (15 г, 20 ммоль) в диметилсульфоксиде (100 мл) добавляли азид натрия (3,9 г, 60 ммоль). Смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли EtOAc (500 мл) и насыщенный водный NaCl (100 мл), и слои разделяли, сохраняя органический слой. Органический слой промывали дополнительные три раза насыщенным водным NaCl (100 мл). После высушивания над сульфатом натрия и фильтрации удалением растворителя получали промежуточное соединение (11d) в виде желтого твердого вещества (12 г), которое использовали непосредственно на следующей стадии. MS m/z: [M+H+] рассчитано для C41H36ClN9, 690,29; обнаружено 690,5.
C-{2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-ил}метиламин·2[C2HF3O2] (11e): К раствору в MeOH (150 мл) промежуточного соединения (11d) (12 г, 17 ммоль) добавляли палладий-на-углероде (6,0 г; 10% Pd мас./мас.). Раствор сначала дегазировали и повторно насыщали газом азотом (1 атм (101325 Па)) с последующим дополнительным дегазированием и повторным насыщением газом водородом (1 атм (101325 Па)). Затем раствор перемешивали при комнатной температуре в течение 2-3 часов, в течение которых восстановление азида завершалось на 50%. Добавляли дополнительный палладий-на-углероде (1,0 г; 10% Pd мас./мас.) и раствор перемешивали под водородом. Через 1,5 часа реакция завершалась, смесь дегазировали и повторно насыщали азотом перед фильтрацией через целит. Объем фильтрата уменьшали до 50 мл. В фильтрат медленно добавляли 6 N HCl (150 мл), раствор перемешивали в течение 4 часов и затем выпаривали досуха. Очистку осуществляли препаративной HPLC (обращенно-фазовой), получая промежуточное соединение (11e) в виде белого твердого вещества соли бис-TFA (4,0 г). MS m/z: [M+H+] рассчитано для C22H24ClN7, 422,19; обнаружено, 422,0. 1H-ЯМР (d4-MeOH): 0,89 (м, 3H), 1,35 (м, 2H), 1,59 (м, 2H), 2,88 (м, 2H), 4,20 (с, 2H), 5,58 (с, 2H), 7,10 (д, 2H), 7,19 (д, 2H), 7,52-7,67 (м, 4H).
К раствору в MeOH (195 мл) промежуточного соединения (11e) (2,34 г, 5,5 ммоль), добавляли 1 N NaOH (58 мл) и палладий-на-углероде (1,9 г; 10% Pd мас./мас.). Раствор сначала дегазировали и повторно насыщали газом азотом (1 атм (101325 Па)) с последующим дополнительным дегазированием и повторным насыщением газом водородом (1 атм (101325 Па)). Затем раствор перемешивали при комнатной температуре в течение 2-3 часов. Раствор дегазировали и повторно насыщали азотом перед фильтрацией через целит. В фильтрат медленно добавляли 1 N HCl (58 мл) и нейтрализованный раствор выпаривали досуха. Очистку осуществляли препаративной HPLC (обращенно-фазовой) с получением названного в заголовке соединения в виде белого твердого вещества соли бис-TFA (1,90 г). MS m/z: [M+H+] рассчитано для C22H25N7 388,22; обнаружено 388,2. 1H-ЯМР (d4-MeOH): 0,91 (м, 3H), 1,38 (м, 2H), 1,63 (м, 2H), 3,00 (м, 2H), 4,21 (с, 2H), 5,61 (с, 2H), 7,10 (д, 2H), 7,19 (д, 2H), 7,52-7,67 (м, 4H), 7,74 (с, 1H).
ПОЛУЧЕНИЕ 12
1-метиловый эфир (R)-2-(2-бензилоксикарбамоил-3-фенипропиониламино)янтарной кислоты
Этиловый эфир 2-бензил-N-бензилоксималонамовой кислоты получали, как описано в Fournie-Zaluski et al. (1985) J. Med. Chem. 28(9):1158-1169).
2-бензил-N-бензилоксималонамовая кислота (12a): К раствору этилового эфира 2-бензил-N-бензилоксималонамовой кислоты (19 г, 58,1 ммоль), растворенной в смеси THF (70 мл) и MeOH (200 мл), добавляли раствор NaOH (5,4 г, 135 ммоль) в воде (100 мл). Смесь перемешивали при комнатной температуре в течение 24 часов и выпаривали для удаления летучих органических растворителей. Водный остаток разводили водой (200 мл) и промывали с помощью DCM (200 мл). Водный слой сохраняли и подкисляли до pH~4 добавлением концентрированной HCl. Желаемый продукт преципитировали, промывали водой, растворяли в ацетоне (200 мл) и высушивали досуха, получая промежуточное соединение (12a) в виде белого твердого вещества (14,2 г). 1H-ЯМР (300 МГц, CD3OD): δ (м.д.) 7,20-7,06 (м, 5H), 4,60-4,56 (д, 1H), 4,42-4,38 (д, 1H), 3,10-2,98 (м, 2H).
2,5-диоксопирролидин-1-иловый эфир 2-бензил-N-бензилоксималонамовой кислоты (12b): Промежуточное соединение (12a) (0,5 г, 1,7 ммоль) добавляли к N-гидроксисукцинимиду (290 мг, 2,6 ммоль) и EDC (320 мг, 1,7 ммоль) и растворяли в MeCN (6 мл). Смесь перемешивали в течение ночи при комнатной температуре и затем разделяли между EtOAc и 10% водной лимонной кислотой. Органический слой отделяли, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали, получая промежуточное соединение (12b) в виде пены (0,8 г, 2 ммоль).
Промежуточное соединение (12b) (170 мг, 420 мкмоль) растворяли в MeCN (4 мл) и добавляли H-D-Asp-OMe (0,09 г, 0,63 ммоль), затем твердый NaHCO3 (110 мг, 1,3 ммоль) и воду (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем разделяли EtOAc и водной HCl (0,01 N). Органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали, концентрировали и затем очищали препаративной HPLC с получением названного в заголовке соединения (80 мг, 190 мкмоль).
ПРИМЕР 4
(R)-N-{2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-2-(2-гидроксикарбамоил-3-фенилпропиониламино)сукцинамовая кислота
1-метиловый эфир (R)-2-(2-бензилоксикарбамоил-3-фенилпропиониламино)янтарной кислоты (70 мг, 160 мкмоль) смешивали с DMF (1 мл). К этому раствору добавляли HATU (60 мг, 160 мкмоль) и раствор перемешивали в течение 20 минут. Затем добавляли {2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-ил}метиламин (60 мг, 160 мкмоль), затем триэтиламин (70 мкл, 480 мкмоль). После приблизительно 5 часов реакционную смесь разделяли между EtOAc и 0,01 N HCl. Водный слой разделяли и экстрагировали с помощью EtOAc, и объединенные органические слои промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения 140 мг прозрачного масла. Полученное масло растворяли в MeOH (10 мл) и добавляли 1 N NaOH (0,5 мл). Затем смесь перемешивали при комнатной температуре в течение ночи и затем кратко нагревали при 45°C в течение 90 минут. Затем смесь охлаждали и добавляли уксусную кислоту (20 капель), затем 10% палладий-на-углероде (25 мг) в инертной атмосфере. Затем реакционную смесь насыщали водородом (1 атм (101325 Па)) и перемешивали в течение 29 часов. Затем раствор фильтровали, концентрировали и очищали препаративной HPLC (обращенно-фазовой) с получением указанного в заголовке соединения в виде соли TFA (18 мг, 20 мкмоль). MS m/z: [M+H+] рассчитано для C36H39N9O6, 694,30; обнаружено 694,4.
ПРИМЕР 5
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 5-1 - 5-42, обладающие следующей формулой, где R представляет собой необязательный заместитель:
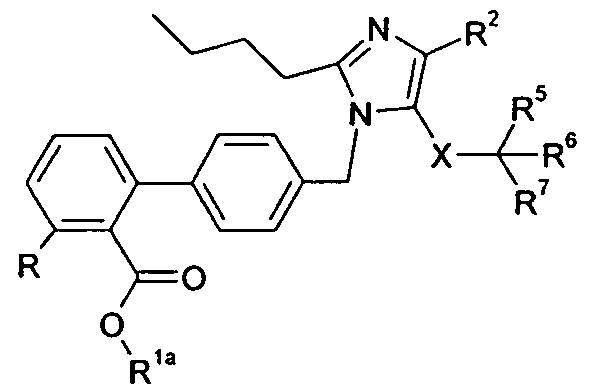
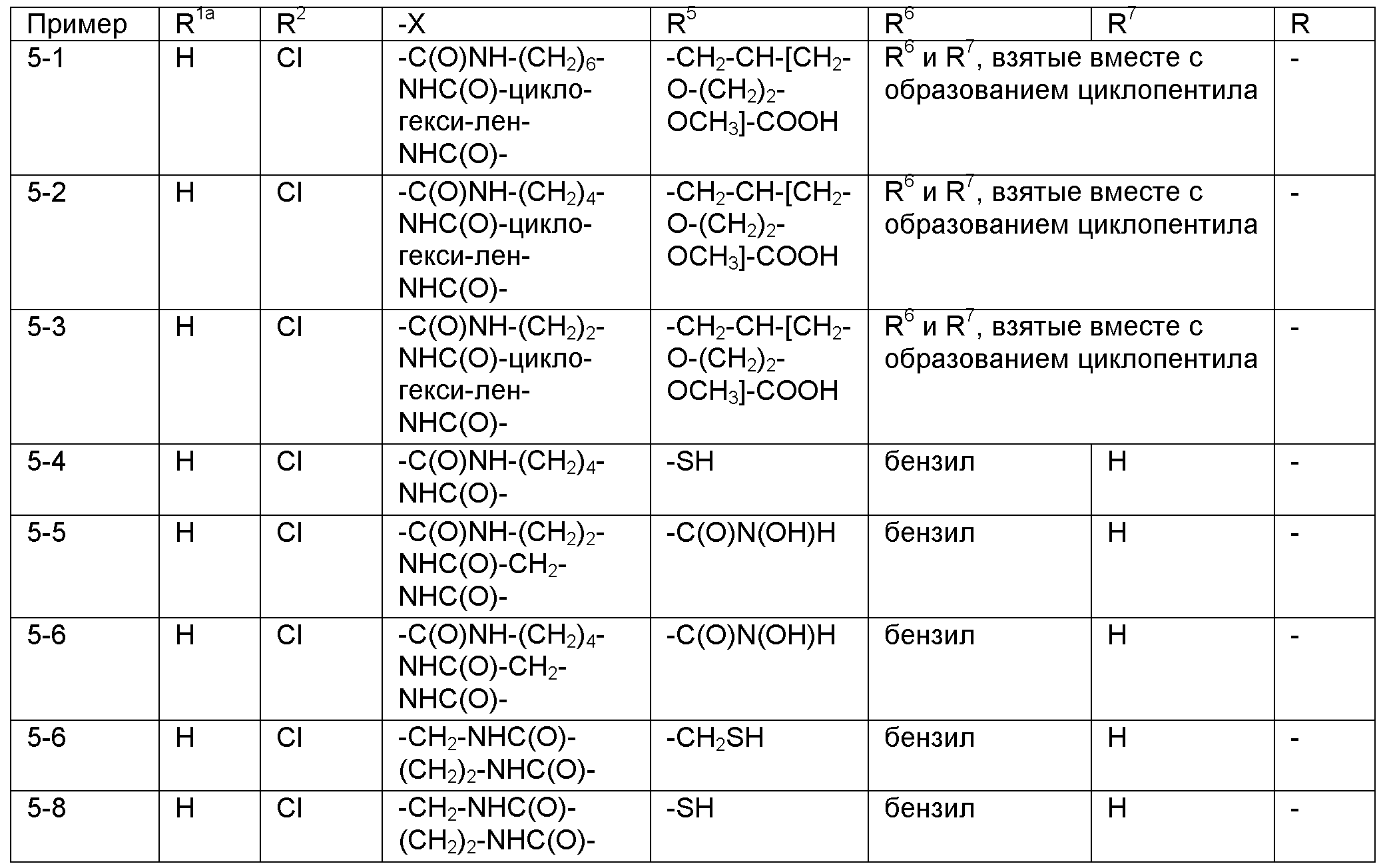
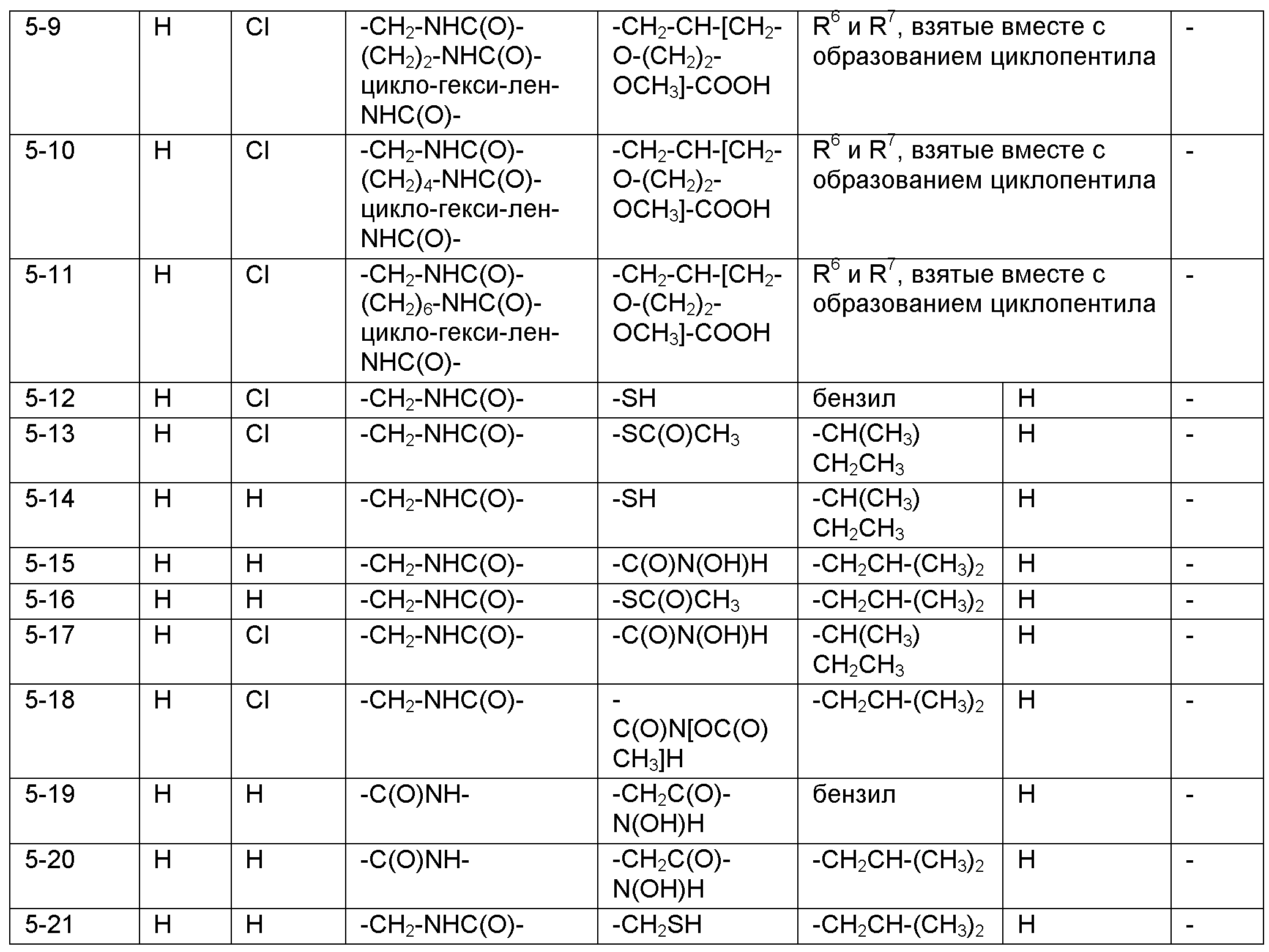
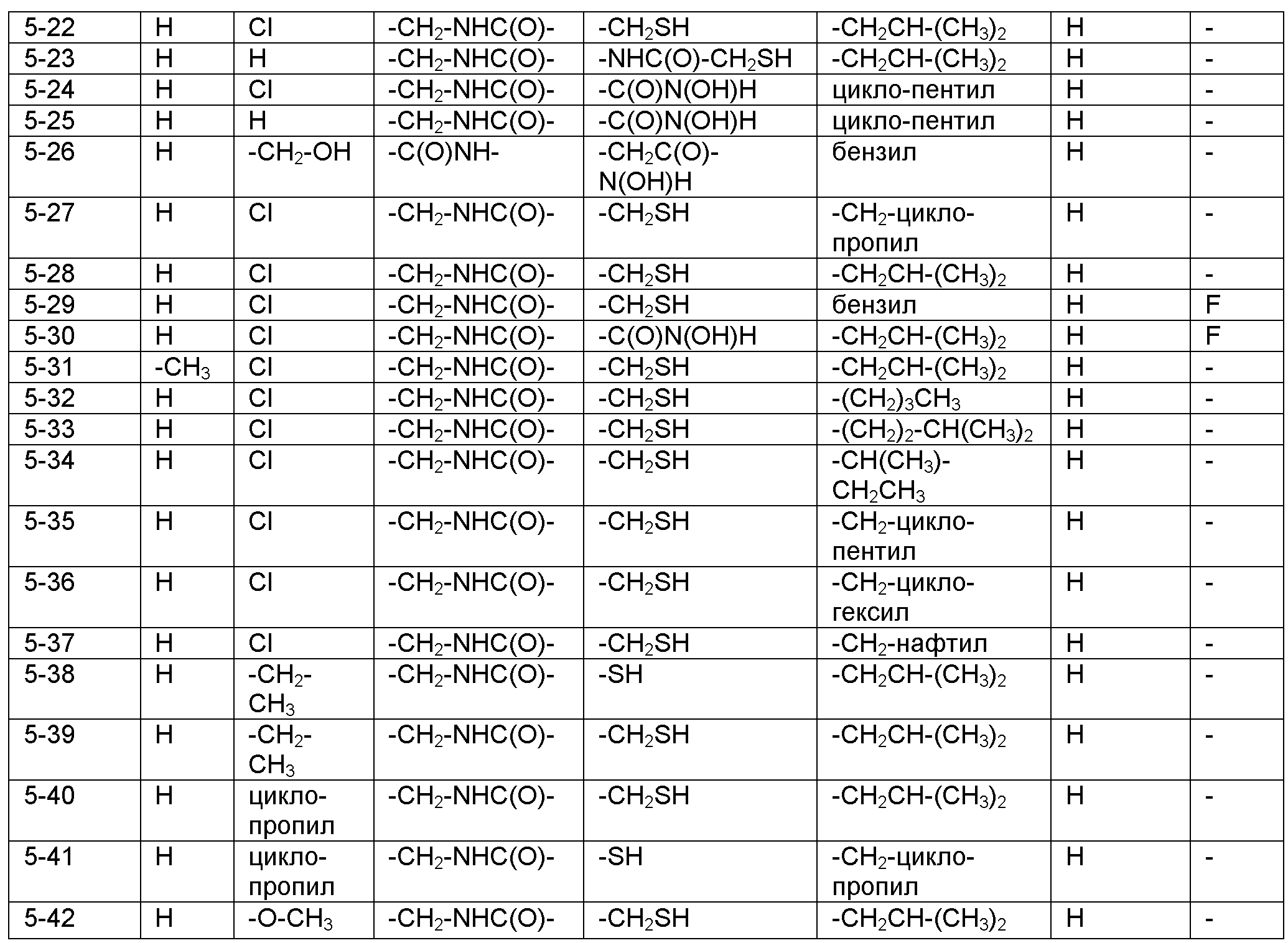
(5-1) 4'-[2-бутил-5-(6-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)циклогексанкарбонил]амино}гексилкарбамоил)-4-хлоримидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C48H66ClN5O9, 892,46; обнаружено 892,2.
(5-2) 4'-[2-бутил-5-(4-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)циклогексанкарбонил]амино}бутилкарбамоил)-4-хлоримидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C46H62ClN5O9, 864,42; обнаружено 864,4.
(5-3) 4'-[2-бутил-5-(2-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)циклогексанкарбонил]амино}этилкарбамоил)-4-хлоримидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C44H58ClN5O9, 836,39; обнаружено 836,4.
(5-4) 4'-{2-бутил-4-хлор-5-[4-((S)-2-меркапто-3-фенилпропиониламино)бутилкарбамоил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C35H39ClN4O4S, 647,24; обнаружено 648,2.
(5-5) 4'-(2-бутил-4-хлор-5-{2-[2-(2-гидроксикарбамоил-3-фенилпропиониламино)ацетиламино]этилкарбамоил}имидазол-1-илметил)бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C36H39ClN6O7, 703,26; обнаружено 704,2.
(5-6) 4'-(2-бутил-4-хлор-5-{4-[2-(2-гидроксикарбамоил-3-фенилпропиониламино)ацетиламино]бутилкарбамоил}имидазол-1-илметил)бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C38H43ClN6O7, 731,29; обнаружено 732,2.
(5-7) 4'-(5-{[3-(2-бензил-3-меркаптопропиониламино)пропиониламино]метил}-2-бутил-4-хлоримидазол-1-илметил)бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C35H39ClN4O4S, 647,24; обнаружено 647,2.
(5-8) 4'-(2-бутил-4-хлор-5-{[3-((s)-2-меркапто-3-фенилпропиониламино)пропиониламино]метил}имидазол-1-илметил)бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C34H37ClN4O4S, 633,22; обнаружено 633,2.
(5-9) 4'-{2-бутил-5-[(3-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)-циклогексанкарбонил]амино}пропиониламино)метил]-4-хлоримидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C45H60ClN5O9, 850,41; обнаружено 850,4.
(5-10) 4'-{2-бутил-5-[(5-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)циклогексанкарбонил]амино}пентаноиламино)метил]-4-хлоримидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C47H64ClN5O9, 878,44; обнаружено 878,4.
(5-11) 4'-{2-бутил-5-[(7-{[4-({1-[2-карбокси-3-(2-метоксиэтокси)пропил]циклопентанкарбонил}амино)циклогексанкарбонил]амино}гептаноиламино)метил]-4-хлоримидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C49H68ClN5O9, 906,47; обнаружено 906,4.
(5-12) 4'-{2-бутил-4-хлор-5-[((s)-2-меркапто-3-фенилпропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H32ClN3O3S, 562,19; обнаружено 562,3.
(5-13) 4'-{5-[(2-ацетилсульфанил-3-метилпентаноиламино)метил]-2-бутил-4-хлоримидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36ClN3O4S, 570,21; обнаружено 570,3.
(5-14) 4'-{2-бутил-5-[(2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H35N3O3S, 494,24; обнаружено 494,2.
(5-15) 4'-{2-бутил-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36N4O5, 521,27; обнаружено 521,2. 1H-ЯМР (DMSO): 10,6 (1H, с), 8,28 (1H, т), 7,71 (1H, д), 7,56 (1H, т), 7,44 (1H, д), 7,41 (1H, д), 7,31 (3H, т), 7,15 (2H, д), 5,49 (2H, с), 4,24 (2H, д), 2,98 (1H, т), 2,89 (2H, т), 1,45 (5H, м), 1,2 (2H, кв), 0,77 (9H, м).
(5-16) 4'-{5-[(2-ацетилсульфанил-3-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H37N3O4S, 536,25; обнаружено 536,5.
(5-17) 4'-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35ClN4O5, 555,23; обнаружено 555,4.
(5-18) 4'-{5-[(2-ацетоксикарбамоил-4-метилпентаноиламино)метил]-2-бутил-4-хлоримидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H37ClN4O6, 597,24; обнаружено 597,2.
(5-19) 4'-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H34N4O5, 555,25; обнаружено 556,4.
(5-20) 4'-[2-бутил-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36N4O5, 521,27; обнаружено 522,4.
(5-21) 4'-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H37N3O3S, 508,26; обнаружено 508,2.
(5-22) 4'-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено 542,4. 1H-ЯМР (DMSO): 8,4 (1H, т), 7,69 (1H, д), 7,53 (1H, т), 7,42 (1H, т), 7,33 (1H, д), 7,27 (2H, д), 7,01 (2H, д), 5,23 (2H, с), 4,18 (2H, м), 2,35 (1H, м), 2,05 (1H, т), 1,45 (2H, м), 1,38 (2H, м), 1,2 (3H, м), 0,77 (9H, м).
(5-23) 4'-(2-бутил-5-{[2-(2-меркаптоацетиламино)-4-метилпентаноиламино]метил}имидазол-1-илметил)бифенил-2-карбоновая кислота. MS m/z: [M+Н+] рассчитано для C30H38N4O4S, 551,26; обнаружено 551,3.
(5-24) 4'-{2-бутил-4-хлор-5-[(2-циклопентил-2-гидроксикарбамоилацетиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H35ClN4O5, 567,23; обнаружено 567,3.
(5-25) 4'-{2-бутил-5-[(2-циклопентил-2-гидроксикарбамоилацетиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36N4O5, 533,27; обнаружено 533,3.
(5-26) 4'-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)-4-гидроксиметилимидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C33H36N4O6, 585,26; обнаружено 585,2.
(5-27) 4'-{2-бутил-4-хлор-5-[(2-циклопропилметил-3-меркаптопропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H34ClN3O3S, 540,20; обнаружено 540,0.
(5-28) 4'-{2-бутил-4-хлор-5-[((r)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено 542,4, 1H-ЯМР (DMSO) 8,4 (1H, т), 7,69 (1H, д), 7,53 (1H, т), 7,42 (1H, т), 7,33 (1H, д), 7,27 (2H, д), 7,01 (2H, д), 5,23 (2H, с), 4,18 (2H, м), 2,35 (1H, м), 2,05 (1H, т), 1,45 (2H, м), 1,38 (2H, м), 1,2 (3H, м), 0,77 (9H, м).
(5-29) 4'-{5-[(2-бензил-3-меркаптопропиониламино)метил]-2-бутил-4-хлоримидазол-1-илметил}-3-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H33ClFN3O3S, 594,19; обнаружено 594,4.
(5-30) 4'-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H34ClFN4O5, 573,22; обнаружено 574.
(5-31) метиловый эфир 4'-{2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C30H38ClN3O3S, 556,23; обнаружено 556,2.
(5-32) 4'-{2-бутил-4-хлор-5-[(2-меркаптометилгексаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено 542,2.
(5-33) 4'-{2-бутил-4-хлор-5-[(2-меркаптометил-5-метилгексаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38ClN303S, 556,23; обнаружено 556,2.
(5-34) 4'-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено 542,2.
(5-35) 4'-{2-бутил-4-хлор-5-[(3-циклопентил-2-меркаптометилпропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H38ClN3O3S, 568,23; обнаружено 568,2.
(5-36) 4'-{2-бутил-4-хлор-5-[(3-циклогексил-2-меркаптометилпропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H40ClN3O3S, 582,25; обнаружено 582,2.
(5-37) 4'-{2-бутил-4-хлор-5-[(2-меркаптометил-3-нафталин-1-илпропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C36H36ClN3O3S, 626,22; обнаружено 626,2.
(5-38) 4'-{2-бутил-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H39N3O3S, 522,27; обнаружено 522,4.
(5-39) 4'-{2-бутил-4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H41N3O3S, 536,29; обнаружено 536,4.
(5-40) 4'-{2-бутил-4-циклопропил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H41N3O3S, 548,29; обнаружено 548,4.
(5-41) 4'-{2-бутил-4-циклопропил-5-[((S)-3-циклопропил-2-меркаптопропиониламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H37N3O3S, 532,26; обнаружено 532,2.
(5-42) 4'-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]-4-метоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H39N3O4S, 538,27; обнаружено 538,6.
ПРИМЕР 6
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 6-1 - 6-44, обладающие следующей формулой:
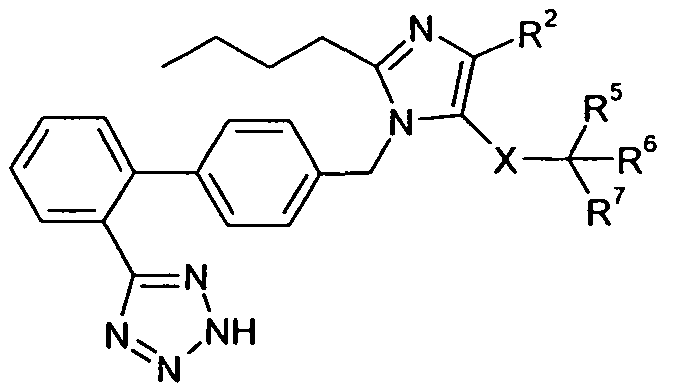
|
|
|
(6-1) 3-{1-[4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)циклогексилкарбамоил]циклопентил}-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C42H55ClN8O6, 803,39; обнаружено 803,0.
(6-2) 3-(1-{4-[2-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)этилкарбамоил]циклогексилкарбамоил}-циклопентил)-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C44H58ClN9O7, 860,42; обнаружено 860,2.
(6-3) 3-(1-{4-[4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)бутилкарбамоил]циклогексилкарбамоил}циклопентил)-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C46H62ClN9O7, 888,45; обнаружено 888,4.
(6-4) 3-(1-{4-[6-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)гексилкарбамоил]циклогексилкарбамоил}циклопентил)-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C48H66ClN9O7, 916,48; обнаружено 916,4.
(6-5) [4-(2-бензил-3-меркаптопропиониламино)бутил]амид 2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C36H41ClN8O2S, 685,28; обнаружено 685,2.
(6-6) [4-((R)-2-меркапто-3-фенилпропиониламино)бутил]амид 2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C35H39ClN8O2S, 671,26; обнаружено 671,2.
(6-7) N-[2-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)этил]-2-меркаптометил-3-фенилпропионамид. MS m/z: [M+H+] рассчитано для C35H39ClN8O2S, 671,26; обнаружено 671,2.
(6-8) {2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид 5-(2-меркаптометил-3-фенилпропиониламино)пентановой кислоты. MS m/z: [M+H+] рассчитано для C37H43ClN8O2S, 699,29; обнаружено 699,2.
(6-9) {2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид 7-(2-меркаптометил-3-фенилпропиониламино)гептановой кислоты. MS m/z: [M+H+] рассчитано для C39H47ClN8O2S, 727,32; обнаружено 727,2.
(6-10) [2-({[3-({2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)пропионил]гидроксиамино}метил)-3-фенилпропиониламино]уксусная кислота. MS m/z: [M+H+] рассчитано для C37H40ClN9O6, 742,28; обнаружено 742,2.
(6-11) (S)-6-({2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)гексановая кислота. MS m/z: [M+H+] рассчитано для C38H42ClN9O6, 756,30; обнаружено 756,2.
(6-12) (S)-2-(2-бензил-3-меркаптопропиониламино)-6-({2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)гексановая кислота. MS m/z: [M+H+] рассчитано для C38H43ClN8O4S, 743,28; обнаружено 743,2.
(6-13) 3-(1-{4-[2-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)этилкарбамоил]циклогексилкарбамоил}циклопентил)-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C45H60ClN9O7, 874,43; обнаружено 874,6.
(6-14) 3-(1-{4-[4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)бутилкарбамоил]циклогексилкарбамоил}циклопентил)-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C47H64ClN9O7, 902,46; обнаружено 902,5.
(6-15) 3-{1-[4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}гидроксикарбамоил)циклогексилкарбамоил]циклопентил}-2-(2-метоксиэтоксиметил)пропионовая кислота. MS m/z: [M+H+] рассчитано для C42H55ClN8O7, 819,39; обнаружено 819,5.
(6-16) 2-[({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)метил]-3-[1-(карбоксиметилкарбамоил)циклопентил]пропионовая кислота. MS m/z: [M+H+] рассчитано для C34H39ClN8O6, 691,27; обнаружено 692,2.
(6-17) (R)-N-{2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-2-(2-гидроксикарбамоил-3-фенилпропиониламино)сукцинамовая кислота. MS m/z: [M+H+] рассчитано для C36H38ClN9O6, 728,26; обнаружено 728,5.
(6-18) (S)-N-{2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-2-(2-гидроксикарбамоил-3-фенилпропиониламино)сукцинамовая кислота. MS m/z: [M+H+] рассчитано для C36H39N9O6, 694,30; обнаружено 694,5.
(6-19) (R)-4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)масляная кислота. MS m/z: [M+H+] рассчитано для C37H40ClN9O6, 742,28; обнаружено 742,5.
(6-20) 2-[({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)метил]-3-{1-[(S)-1-карбокси-2-(4-гидроксифенил)этилкарбамоил]циклопентил}пропионовая кислота. MS m/z: [M+H+] рассчитано для C41H45ClN8O7, 797,31; обнаружено 797,2.
(6-21) (S)-5-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)пентановая кислота. MS m/z: [M+H+] рассчитано для C37H40ClN9O6, 742,28; обнаружено 742,5.
(6-22) (S)-4-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)масляная кислота. MS m/z: [M+H+] рассчитано для C36H38C1N9O6, 728,26; обнаружено 728,5.
(6-23) (S)-2-(2-бифенил-4-илметил-3-меркаптопропиониламино)-6-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)гексановая кислота. MS m/z: [M+H+] рассчитано для C44H47C1N8O4S, 819,31; обнаружено 819,7.
(6-24) (S)-2-(3-бифенил-4-ил-2-гидроксикарбамоилпропиониламино)-6-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)гексановая кислота. MS m/z: [M+H+] рассчитано для C44H46ClN9O6, 832,33; обнаружено 832,7.
(6-25) (S)-4-({2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)масляная кислота. MS m/z: [M+H+] рассчитано для C36H39N9O6, 694,30; обнаружено 694,5.
(6-26) (S)-2-[(S)-3-бифенил-4-ил-2-(фосфонометиламино)пропиониламино]-N-{2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}сукцинамовая кислота. MS m/z: [M+H+] рассчитано для C42H46N9O7P, 820,33; обнаружено 820,3.
(6-27) (S)-6-({2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбонил}амино)-2-(2-гидроксикарбамоил-3-фенилпропиониламино)гексановая кислота. MS m/z: [M+H+] рассчитано для C38H43N9O6, 722,33; обнаружено 722,3.
(6-28) (R)-N-{2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-2-(2-карбамоил-3-фенилпропиониламино)сукцинамовая кислота. MS m/z: [M+H+] рассчитано для C36H39N9O5, 678,31; обнаружено 679,4.
(6-29) S-[1-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)-2-фенилэтил]эфир тиоуксусной кислоты. MS m/z: [M+H+] рассчитано для C33H34ClN7O2S, 628,22; обнаружено 628,5.
(6-30) S-[2-({2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)-3-метилбутил]эфир тиоуксусной кислоты. MS m/z: [M+H+] рассчитано для C30H36ClN7O2S, 594,23; обнаружено 594,5.
(6-31) N-{2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-N'-гидрокси-2-изобутилмалонамид. MS m/z: [M+H+] рассчитано для C29H35ClN8O3, 579,25; обнаружено 579,4.
(6-32) (1-гидроксикарбамоилметил-2-фенилэтил)амид 2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+Н+] рассчитано для C32H33ClN8O3, 613,24; обнаружено 614,4.
(6-33) (1-гидроксикарбамоилметил-3-метилбутил)амид 2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C29H36N8O3, 545,29; обнаружено 545,4.
(6-34) {2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид 2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H36ClN7OS, 566,24; обнаружено 566,4.
(6-35) ((R)-1-гидроксикарбамоилметил-2-фенилэтил)амид 2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C32H34N8O3, 579,28; обнаружено 580,0.
(6-36) {2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид 2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H37N7OS, 532,28; обнаружено 532,2.
(6-37) N-{2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}-N'-гидрокси-2-изобутилмалонамид. MS m/z: [M+H+] рассчитано для C29H36N8O3, 545,29; обнаружено 545,5.
(6-38) {2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (R)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H36ClN7OS, 566,24; обнаружено 567.
(6-39) {2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (R)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H37N7OS, 532,28; обнаружено 532.
(6-40) [(R)-1-гидроксикарбамоилметил-2-(2-трифторметилфенил)этил]амид 2-бутил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C33H33F3N8O3, 647,26; обнаружено 647,4.
(6-41) {2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H37N7OS, 532,28; обнаружено 533.
(6-42) {2-бутил-5-хлор-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H36ClN7OS, 566,24; обнаружено 567.
(6-43) ((R)-1-меркаптометил-3-метилбутил)амид 2-бутил-3-[2'-(2H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C28H35N7OS, 518,26; обнаружено 518,4.
(6-44) {2-бутил-5-хлор-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркапто-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C28H34ClN7OS, 552,22; обнаружено 552,4.
ПРИМЕР 7
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 7-1 - 7-8, обладающие следующей формулой, где R представляет собой необязательный заместитель:
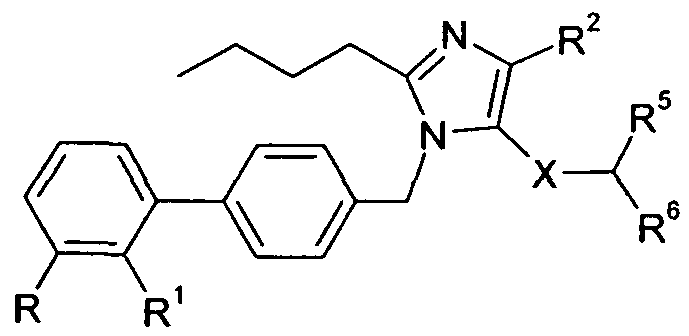
|
(7-1) 4'-{2-бутил-4-хлор-5-[(2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34ClN3O3S, 528,20; обнаружено 528,3.
(7-2) трет-Бутиловый эфир 4'-{5-[(2-ацетилсульфанил-3-метилпентаноиламино)метил]-2-бутил-4-хлоримидазол-1-илметил}бифенил-2-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C34H44ClN3O4S, 626,27; обнаружено 626,5.
(7-3) 2-бутил-N-(4-(гидроксиамино)-4-оксо-1-фенилбутан-2-ил)-1-((2'-(N-(пропилкарбамоил)сульфамоил)бифенил-4-ил)метил)-1H-имидазол-5-карбоксамид. MS m/z: [M+H+] рассчитано для C35H42N6O6S, 675,29; обнаружено 675,2.
(7-4) ((R)-1-бензил-2-гидроксикарбамоилэтил)амид 2-бутил-3-(2'-трифторметансульфониламинобифенил-4-илметил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C32H34F3N5O5S, 658,22; обнаружено 658,2.
(7-5) ((R)-1-бензил-2-гидроксикарбамоилэтил)амид 3-(2'-ацетилсульфамоилбифенил-4-илметил)-2-бутил-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C33H37N5O6S, 632,25; обнаружено 632,4.
(7-6) (R)-2-бутил-N-(4-(гидроксиамино)-4-оксо-1-фенилбутан-2-ил)-1-((2'-(N-(пропилкарбамоил)сульфамоил)бифенил-4-ил)метил)-1H-имидазол-5-карбоксамид. MS m/z: [M+H+] рассчитано для C35H42N6O6S, 675,29; обнаружено 675,4.
(7-7) ((S)-1-бензил-2-гидроксикарбамоилэтил)амид 3-(2'-ацетилсульфамоилбифенил-4-илметил)-2-бутил-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C33H37N5O6S, 632,25; обнаружено 632,4.
(7-8) 4'-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35ClFN3O3S, 560,21; обнаружено 561.
ПРИМЕР 8
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 8-1 - 8-77, обладающие следующей формулой:
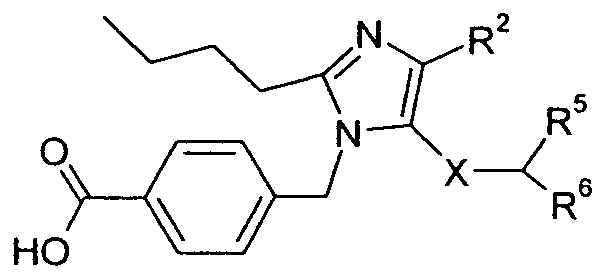
|
|
|
|
(8-1) 4-{2-бутил-5-[(S)-5-карбокси-5-(2-гидроксикарбамоил-3-фенилпропиониламино)пентилкарбамоил]-4-хлоримидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C32H38ClN5O8, 656,24; обнаружено 656,2.
(8-2) 4-{2-бутил-5-[(S)-3-карбокси-3-(2-гидроксикарбамоил-3-фенилпропиониламино)пропилкарбамоил]-4-хлоримидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C30H34ClN5O8, 628,21; обнаружено 629,2.
(8-3) 4-{2-бутил-4-хлор-5-[(2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C22H30ClN3O3S, 452,17; обнаружено 452,2.
(8-4) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H31ClN4O5, 479,20; обнаружено 479,2.
(8-5) 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,3.
(8-6) 4-[2-бутил-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32N4O5, 445,24; обнаружено 445,2.
(8-7) 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутил-4-хлоримидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 513,3.
(8-8) 4-[5-((R)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,4.
(8-9) 4-[5-((S)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,3. Для соли TFA: 1H-ЯМР (400 МГц, (CD3)2SO): δ (м.д.) 0,74 (т, 3H, J=5 Гц), 1,20 (кв, 2H, J=5 Гц), 1,41 (м, 2H), 2,19 (д, 2H, J=5 Гц), 2,73 (м, 3H), 5,69 (м, 4H), 7,11 (м, 7H, J=5 Гц), 7,85 (м, 2H), 8,50 (с, 1H).
(8-10) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30ClN3O3S, 500,17; обнаружено 501.
(8-11) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 467.
(8-12) 4-(2-бутил-4-хлор-5-{[2-(2-меркаптоацетиламино)-3-фенилпропиониламино]метил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C27H31ClN4O4S, 543,18; обнаружено 544.
(8-13) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилбутириламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C22H30ClN3O3S, 452,17; обнаружено 453.
(8-14) 4-{2-бутил-4-хлор-5-[((S)-3-меркапто-2-метилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C20H26ClN3O3S, 424,14; обнаружено 425.
(8-15) 4-(5-{[2-(2-бензил-3-меркаптопропиониламино)ацетиламино]метил}-2-бутил-4-хлоримидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C28H33ClN4O4S, 557,19; обнаружено 558.
(8-16) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоилметил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C24H33ClN4O5, 493,21; обнаружено 494.
(8-17) 4-{2-бутил-5-[(S)-2-гидроксикарбамоил-1-(4-метилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,4.
(8-18) 4-{2-бутил-5-[(S)-1-(3,4-дифторбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28F2N4O5, 515,20; обнаружено 515,2.
(8-19) 4-[2-бутил-5-(2-гидроксикарбамоил-3-фенилпропилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 480,2.
(8-20) 4-[2-бутил-4-хлор-5-((R)-2-гидроксикарбамоил-1-пиридин-4-илметилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C25H28ClN5O5, 514,18; обнаружено 515,2.
(8-21) 4-[2-бутил-5-((R)-2-гидроксикарбамоил-1-нафталин-2-илметилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C30H32N4O5, 529,24; обнаружено 529,4.
(8-22) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(4-метилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,4.
(8-23) 4-{2-бутил-5-[(R)-1-(4-хлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 514,2.
(8-24) (S)-4-((5-(4-(бензилоксикарбонилоксиамино)-4-оксо-1-фенилбутан-2-илкарбамоил)-2-бутил-1H-имидазол-1-ил)метил)бензойная кислота. MS m/z: [M+H+] рассчитано для C34H36N4O7, 613,26; обнаружено 613,2.
(8-25) 4-(2-бутил-5-{(S)-1-[(2-феноксиацетоксикарбамоил)метил]-2-фенилэтилкарбамоил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C34H36N4O7, 613,26; обнаружено 613,4.
(8-26) 4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H33N3O3S, 432,22; обнаружено 433. 1H-ЯМР (DMSO) 8,07 (2H, д), 7,6 (1H, с), 7,2 (2H, д), 5,6 (2H, с), 4,45 (1H, д), 4,32 (1H, д), 2,9 (2H, т), 2,55 (2H, м), 2,4 (1H, м), 1,58 (2H, м), 1,35 (5H, м), 0,83 (9H, м).
(8-27) 4-[2-бутил-5-((R)-1-гидроксикарбамоилметил-3-фенилпропилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,5.
(8-28) 4-[2-бутил-5-((R)-2-гидроксикарбамоил-1-тиофен-3-илметилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C24H28N4O5S, 485,18; обнаружено 485,5.
(8-29) 4-[2-бутил-5-((R)-1-фуран-2-илметил-2-гидроксикарбамоилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C24H28N4O6, 469,20; обнаружено 469,5.
(8-30) 4-{2-бутил-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32N4O5, 445,24; обнаружено 445,2. 1H-ЯМР (DMSO) 10,6 (1H, с), 8,92 (1H, с), 8,15 (1H, т), 7,91 (2H, д), 7,41 (1H, с), 7,15 (2H, д), 5,53 (2H, с), 4,19 (2H, д), 2,89 (1H, т), 2,81 (2H, т), 1,48 (3H, м), 1,21 (4H, м), 0,74 (9H, м).
(8-31) 4-{2-бутил-5-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,0.
(8-32) (S)-4-((2-бутил-5-(4-(диметилкарбамоилтиоилоксиамино)-4-оксо-1-фенилбутан-2-илкарбамоил)-1H-имидазол-1-ил)метил)бензойная кислота. MS m/z: [M+H+] рассчитано для C29H35N5O5S, 566,24; обнаружено 566,2.
(8-33) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(4-трифторметилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H29F3N4O5, 547,21; обнаружено 547,7.
(8-34) 4-[2-бутил-5-((R)-2-гидроксикарбамоил-1-нафталин-2-илметилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C30H32N4O5, 529,24; обнаружено 529,7.
(8-35) 4-{2-бутил-5-[(R)-1-(4-фторбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29FN4O5, 497,21; обнаружено 497,6.
(8-36) 4-{2-бутил-5-[(R)-1-(3-фторбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29FN4O5, 497,21; обнаружено 497,7.
(8-37) 4-{5-[(R)-1-(4-бромбензил)-2-гидроксикарбамоилэтилкарбамоил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29BrN4O5, 557,13; обнаружено 558,5.
(8-38) 4-{5-[(R)-1-(2-бромбензил)-2-гидроксикарбамоилэтилкарбамоил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29BrN4O5 557,13; обнаружено 558,4.
(8-39) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(4-нитробензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29N5O7, 524,212; обнаружено 524,7.
(8-40) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(2-метилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,8.
(8-41) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(3-метилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,7.
(8-42) 4-[2-бутил-5-((R)-2-гидроксикарбамоил-1-пентафторфенилметилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C26H25F5N4O5, 569,17; обнаружено 569,7.
(8-43) 4-{2-бутил-5-[(S)-1-(2,4-дихлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28Cl2N4O5, 547,14; обнаружено 548,4.
(8-44) 4-{2-бутил-5-[(R)-1-(2,4-дихлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z:[M+H+] рассчитано для C26H28Cl2N4O5, 547,14; обнаружено 548,5.
(8-45) 4-{2-бутил-5-[(R)-1-(3,4-дихлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28Cl2N4O5, 547,14; обнаружено 548,6.
(8-46) 4-{2-бутил-5-[(S)-2-гидроксикарбамоил-1-(4-йодбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29IN4O5, 605,12; обнаружено 605,5.
(8-47) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(4-йодбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29IN4O5, 605,12; обнаружено 605,5.
(8-48) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(2-трифторметилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H29F3N4O5, 547,21; обнаружено 547,6.
(8-49) 4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(3-трифторметилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H29F3N4O5, 547,21; обнаружено 547,6.
(8-50) 4-{2-бутил-5-[(R)-1-(2-цианобензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H29N5O5, 504,22; обнаружено 504,7.
(8-51) 4-{2-бутил-5-[(R)-1-(3,4-дифторбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28F2N4O5, 515,20; обнаружено 515,8.
(8-52) 4-{2-бутил-5-[(R)-1-(2-хлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 514,3.
(8-53) 4-{2-бутил-5-[(R)-1-(2-фторбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H29FN4O5, 497,21; обнаружено 497,5.
(8-54) 4-(2-бутил-5-{(S)-1-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]-2-фенилэтилкарбамоил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C35H39N5O6, 626,29; обнаружено 626,4.
(8-55) 4-(2-бутил-5-{(S)-1-[(2-меркаптометил-3-фенилпропиониламино)метил]-2-фенилэтилкарбамоил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C35H40N4O4S, 613,28; обнаружено 613,4.
(8-56) 4-(2-бутил-5-{(S)-1-[(2-меркаптометил-4-метилпентаноиламино)метил]-2-фенилэтилкарбамоил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C32H42N4O4S, 579,29; обнаружено 579,4.
(8-57) 4-(2-бутил-5-{(S)-1-[(2-меркаптометил-3-метилбутириламино)метил]-2-фенилэтилкарбамоил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C31H40N4O4S, 565,28; обнаружено 565,2.
(8-58) 4-{2-бутил-4-хлор-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 466,3.
(8-59) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H33N3O3S, 432,22; обнаружено 432,3. 1H-ЯМР (DMSO) 8,52 (1H, т), 7,92 (2H, д), 7,48 (1H, с), 7,18 (2H, д), 5,55 (2H, с), 4,21 (2H, м), 2,84 (2H, т), 2,16 (1H, т), 1,46 (2H, м), 1,22 (5H, м), 0,76 (9H, м).
(8-60) 4-{5-[(S)-1-бензил-2-((R)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)этилкарбамоил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C36H41N5O6, 640,31; обнаружено 640,3.
(8-61) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H33N3O3S, 432,22; обнаружено 432.
(8-62) 4-{5-[(S)-1-бензил-2-((R)-1-меркаптометил-2-фенилэтилкарбамоил)этилкарбамоил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C35H40N4O4S, 613,28; обнаружено 613,4.
(8-63) 4-[5-((R)-1-бензил-2-меркаптоэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C25H29N3O3S, 452,19; обнаружено 452,2.
(8-64) 4-{2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 467,2.
(8-65) 4-{2-бутил-5-[(2-меркаптобутириламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C20H27N3O3S, 390,18; обнаружено 390,2.
(8-66) 4-[2-бутил-5-((R)-1-меркаптометил-3-метилбутилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C22H31N3O3S, 418,21; обнаружено 418,2.
(8-67) 4-{2-бутил-5-[N'-(2-меркаптометил-4-метилпентаноил)гидразинокарбонил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32N4O4S, 461,21; обнаружено 461,4.
(8-68) 4-{5-[N'-(2-бензил-3-меркаптопропионил)гидразинокарбонил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H30N4O4S, 495,20; обнаружено 495,4.
(8-69) 4-{5-[2-(2-бензил-3-меркаптопропиониламино)этил]-2-бутил-4-хлоримидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H32ClN3O3S, 514,19; обнаружено 514,2.
(8-70) 4-{2-бутил-5-[(2-меркаптометилгексаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H33N3O3S, 432,22; обнаружено 432,2.
(8-71) 4-{2-бутил-5-[(2-меркаптометил-5-метилгексаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C24H35N3O3S, 446,24; обнаружено 446,2.
(8-72) 4-{2-бутил-5-[(2-меркаптометил-3-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H33N3O3S, 432,22; обнаружено 432,2.
(8-73) 4-{2-бутил-5-[(3-циклопентил-2-меркаптометилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C25H35N3O3S, 458,24; обнаружено 458,2.
(8-74) 4-{2-бутил-5-[(3-циклогексил-2-меркаптометилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H37N3O3S, 472,26; обнаружено 472,2.
(8-75) 4-{2-бутил-5-[(2-меркаптометил-3-нафталин-1-илпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C30H33N3O3S, 516,22; обнаружено 517,2.
(8-76) 4-{5-[(E)-2-((R)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)-3-тиофен-2-илпропенил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C33H36N4O5S, 601,24; обнаружено 602,5.
(8-77) 4-{5-[(E)-2-((R)-2-ацетилсульфанил-1-бензилэтилкарбамоил)-3-тиофен-2-илпропенил]-2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C34H37N3O4S2, 616,22; обнаружено 616,4.
ПРИМЕР 9
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 9-1 - 9-63, обладающие следующей формулой, где, необязательно, присутствуют одна или две группы R. Для соединений 9-1 - 9-60 R3 представляет собой -(CH2)3CH3. Для соединений 9-61 - 9-63 R3 представляет собой -(CH2)2CH3.
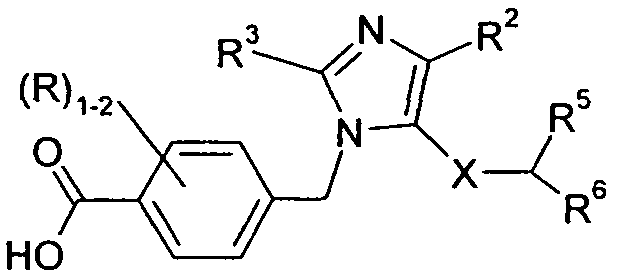
|
|
|
|
(9-1) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-метоксибензойная кислота. MS m/z: [М+Н+] рассчитано для C24H34ClN3O4S, 496,20; обнаружено 497,2.
(9-2) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-фенилпропиониламино)метил]имидазол-1-илметил}-3-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C27H32ClN3O4S, 530,18; обнаружено 531,2.
(9-3) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилбутириламино)метил]имидазол-1-илметил}-3-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O4S, 482,18; обнаружено 483,2.
(9-4) 4-(5-{[2-(2-бензил-3-меркаптопропиониламино)ацетиламино]метил}-2-бутил-4-хлоримидазол-1-илметил)-3-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C29H35ClN4O5S, 587,20; обнаружено 588,2.
(9-5) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C24H33ClN4O6, 509,21; обнаружено 509,6.
(9-6) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]имидазол-1-илметил}-3-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C27H31ClN4O6, 543,19; обнаружено 543,6.
(9-7) 2-бром-4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H30BrClN4O5, 557,11; обнаружено 558,2.
(9-8) 2-бром-4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28BrClN4O5, 591,09; обнаружено 593,2.
(9-9) 2-бром-4-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H31BrClN3O3S, 544,10; обнаружено 546,2.
(9-10) 5-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O3S, 542,22; обнаружено 543,2.
(9-11) 2-бром-4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32BrN3O3S, 510,13; обнаружено 510,4. 1H-ЯМР (DMSO) 8,53 (1H, т), 7,72 (1H, д), 7,48 (2H, д), 7,07 (1H, д), 5,51 (2H, с), 4,23 (2H, м), 2,86 (2H, т), 2,34 (1H, м), 2,17 (1H, т), 1,44, (2H, м), 1,25 (5H, м), 0,76 (9H, м).
(9-12) 2-бром-4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32BrN3O3S, 510,13; обнаружено 510,4. 1H-ЯМР (DMSO) 8,53 (1H, т), 7,72 (1H, д), 7,48 (2H, д), 7,07 (1H, д), 5,51 (2H, с), 4,23 (2H, м), 2,86 (2H, т), 2,34 (1H, м), 2,17 (1H, т), 1,44, (2H, м), 1,25 (5H, м), 0,76 (9H, м).
(9-13) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 451,2. 1H-ЯМР (DMSO) 8,48 (1H, т), 7,83 (1H, т), 7,38 (1H, с), 6,95 (2H, д), 5,48 (2H, с), 4,19 (2H, м), 2,75 (2H, т), 2,30 (1H, м), 2,14 (1H, т), 1,46 (2H, м), 1,23 (5H, м), 0,76 (9H, м).
(9-14) 2-бром-4-{5-[(R)-1-(2-бромбензил)-2-гидроксикарбамоилэтилкарбамоил]2-бутилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C26H28Br2N4O5, 635,04; обнаружено 636,0.
(9-15) 2-бром-4-{2-бутил-5-[(R)-2-гидроксикарбамоил-1-(2-метилбензил)этилкарбамоил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H31BrN4O5, 571,15; обнаружено 572,2.
(9-16) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 451,2. 1H-ЯМР (DMSO) 8,48 (1H, т), 7,73 (2H, м), 7,46 (1H, с), 5,59 (2H, с), 4,22 (2H, м), 2,85 (2H, т), 2,3 (1H, т), 2,16 (1H, т), 1,47 (2H, м), 1,22 (5H, м), 0,75 (9H, м).
(9-17) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,6-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 469,2. 1H-ЯМР (DMSO) 8,49 (1H, т), 7,38 (1H, с), 6,93 (2H, д), 5,46 (2H, с), 4,21 (2H, м), 2,77 (2H, т), 2,31 (1H, м), 2,18 (1H, т), 1,47 (2H, м), 1,23 (5H, м), 0,78 (9H, м).
(9-18) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 451,2. 1H-ЯМР (DMSO) 8,48 (1H, т), 7,73 (2H, м), 7,46 (1H, с), 5,59 (2H, с), 4,22 (2H, м), 2,85 (2H, т), 2,3 (1H, т), 2,16 (1H, т), 1,47 (2H, м), 1,22 (5H, м), 0,75 (9H, м).
(9-19) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,6-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 469. 1H-ЯМР (DMSO) 8,49 (1H, т), 7,38 (1H, с), 6,93 (2H, д), 5,46 (2H, с), 4,21 (2H, м), 2,77 (2H, т), 2,31 (1H, м), 2,18 (1H, т), 1,47 (2H, м), 1,23 (5H, м), 0,78 (9H, м).
(9-20) 2-бром-4-(2-бутил-5-{[2-(4-метоксибензоилсульфанилметил)-4-метилпентаноиламино]метил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C31H38BrN3O5S, 644,17; обнаружено 645,2.
(9-21) 4-{5-[(2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-бромбензойная кислота. MS m/z: [M+H+] рассчитано для C25H34BrN3O4S, 552,15; обнаружено 553,2.
(9-22) 2-бром-4-{2-бутил-5-[(2-изобутирилсульфанилметил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C27H38BrN3O4S, 580,18; обнаружено 581,2.
(9-23) 2-бром-4-(2-бутил-5-{[2-(2,2-диметилпропионилсульфанилметил)-4-метилпентаноиламино]метил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C28H40BrN3O4S, 594,19; обнаружено 595,2.
(9-24) 2-бром-4-(2-бутил-5-{[4-метил-2-(3-метилбутирилсульфанилметил)пентаноиламино]метил}имидазол-1-илметил)бензойная кислота. MS m/z: [M+H+] рассчитано для C28H40BrN3O4S, 594,19; обнаружено 595,2.
(9-25) 2-бром-4-{2-бутил-5-[(2-циклогексанкарбонилсульфанилметил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C30H42BrN3O4S, 620,21; обнаружено 621,2.
(9-26) 4-{5-[(2-бензоилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-бромбензойная кислота. MS m/z: [M+H+] рассчитано для C30H36BrN3O4S, 614,16; обнаружено 615,2.
(9-27) 4-[5-((R)-1-бензил-2-меркаптоэтилкарбамоил)-2-бутилимидазол-1-илметил]-2-бромбензойная кислота. MS m/z: [M+H+] рассчитано для C25H28BrN3O3S, 530,10; обнаружено 530,2.
(9-28) 2-бром-4-[2-бутил-5-((R)-1-меркаптометил-3-метилбутилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [M+H+] рассчитано для C22H30BrN3O3S, 496,12; обнаружено 496,4.
(9-29) 4-{2-бутил-5-[(2-меркаптопропиониламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C19H24FN3O3S, 394,15; обнаружено 394,2.
(9-30) 4-{2-бутил-5-[(2-меркаптобутириламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C20H26FN3O3S, 408,17; обнаружено 408,2.
(9-31) 4-{2-бутил-5-[(2-меркаптопентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C21H28FN3O3S, 422,18; обнаружено 422,2.
(9-32) 4-{2-бутил-5-[(2-меркаптогексаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H30FN3O3S, 436,20; обнаружено 436,2.
(9-33) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 450,2. 1H-ЯМР (DMSO) 8,48 (1H, т), 7,83 (1H, т), 7,38 (1H, с), 6,95 (2H, д), 5,48 (2H, с), 4,19 (2H, м), 2,75 (2H, т), 2,30 (1H, м), 2,14 (1H, т), 1,46 (2H, м), 1,23 (5H, м), 0,76 (9H, м).
(9-34) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-метилбензойная кислота. MS m/z: [M+H+] рассчитано для C24H35N3O3S, 446,24; обнаружено 446,6.
(9-35) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-метоксибензойная кислота. MS m/z: [M+H+] рассчитано для C24H35N3O4S, 462,24; обнаружено 462,6.
(9-36) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-хлорбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 466,2.
(9-37) 3-бром-4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32BrN3O3S, 510,13; обнаружено 510,4.
(9-38) 4-{2-бутил-5-[(2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H30FN3O3S, 436,20; обнаружено 436,2.
(9-39) 4-{2-бутил-5-[(2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H30FN3O3S, 436,20; обнаружено 436,2.
(9-40) 4-{2-бутил-5-[(2-меркаптогептаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 450,2.
(9-41) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3-хлорбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 466,4.
(9-42) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-хлорбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 466,4.
(9-43) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,5-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,3. 1H-ЯМР (DMSO) 8,50 (1H, т), 7,70 (1H, м), 7,46 (1H, с), 6,86 (1H, м), 5,55 (2H, с), 4,24 (2H, м), 2,83 (2H, т), 2,30 (1H, м), 2,16 (1H, м), 1,52 (2H, м), 1,23 (5H, м), 0,76 (9H, м).
(9-44) 4-{2-бутил-5-[(2-меркапто-2-фенилацетиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C24H26FN3O3S, 456,17; обнаружено 456,2.
(9-45) 4-(2-бутил-5-{[2-(4-фторфенил)-2-меркаптоацетиламино]метил}имидазол-1-илметил)-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C24H25F2N3O3S, 474,16; обнаружено 474,2.
(9-46) 4-{2-бутил-5-[(2-меркапто-4,4-диметилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H32FN3O3S, 450,22; обнаружено 450,2.
(9-47) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,5-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,4.
(9-48) 4-{2-бутил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,4.
(9-49) 4-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,4, 1Н-ЯМР (DMSO) 8,45 (1H, м), 7,62 (1H, т), 7,42 (1H, с), 6,71 (1H, т), 5,59 (2H, с), 4,21 (2H, м), 2,83 (2H, т), 2,28 (1H, м), 2,16 (1H, т), 2,51 (2H, м), 1,24 (5H, м), 0,75 (9H, м).
(9-50) 4-{2-бутил-4-хлор-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31ClFN3O3S, 484,18; обнаружено 484,4.
(9-51) 4-{2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31ClFN3O3S, 484,18; обнаружено 484,4.
(9-52) 4-{2-бутил-5-[((R)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H30FN3O3S, 436,20; обнаружено 436,2. 1H-ЯМР (DMSO) 8,50 (1H, т), 7,83 (1H, т), 7,42 (1H, с), 6,96 (2H, т), 5,45 (2H, с), 4,23 (2H, м), 3,18 (2H, м), 2,75 (1H, м), 1,18-1,50 (7H, м), 0,74 (9H, м).
(9-53) 4-{2-бутил-5-[((S)-2-меркапто-3-фенилпропиониламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C25H28FN3O3S, 470,18; обнаружено 470,4.
(9-54) 4-{2-бутил-5-[(2-меркапто-4,4-диметилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,3.
(9-55) 4-{2-бутил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H30FN3O3S, 436,20; обнаружено 436,4.
(9-56) 4-{2-бутил-5-[((R)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C22H29F2N3O3S, 454,19; обнаружено 454,2.
(9-57) 4-{2-бутил-5-[(2-меркаптометил-3-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,2.
(9-58) 4-{2-бутил-5-[(4,4,4-трифтор-2-меркаптобутириламино)метил]имидазол-1-илметил}-2-фторбензойная кислота. MS m/z: [M+H+] рассчитано для C20H23F4N3O3S, 462,14; обнаружено 462,4.
(9-59) 4-{2-бутил-5-[((S)-2-меркапто-4,4-диметилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,5.
(9-60) 4-{2-бутил-5-[((R)-2-меркапто-4,4-диметилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,5.
(9-61) 4-{4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C24H33F2N3O3S, 482,22; обнаружено 482,3.
(9-62) -{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C23H31F2N3O3S, 468,21; обнаружено 468,4.
(9-63) 2,3-дифтор-4-{5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C21H27F2N3O3S, 440,17; обнаружено 440,2,
ПРИМЕР 10
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 10-1 - 10-5, обладающие следующей формулой:
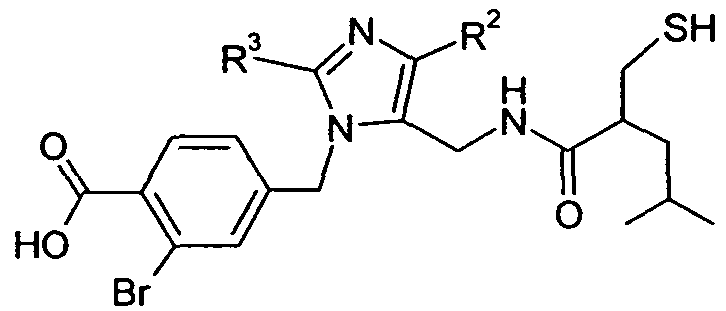
|
(10-1) 2-бром-4-{5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C22H30BrN3O3S, 496,12; обнаружено 497,2.
(10-2) 2-бром-4-{5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C22H30BrN3O3S, 496,12; обнаружено 497,2.
(10-3) 2-бром-4-{2-этил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C21H28BrN3O3S, 482,10; обнаружено 483,2.
(10-4) 2-бром-4-{2-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C21H28BrN3O3S 482,10; обнаружено 483,2. 1H-ЯМР (MeOH) 8,67 (1H, т), 7,83 (1H, д), 7,51 (2H, д), 7,10 (1H, д), 5,57 (2H, д), 4,47 (1H, дд), 4,61 (1H, дд), 2,93 (2H, кв), 2,56 (2H, м), 2,38 (1H, м), 1,36 (7H, м), 0,83 (6H, дд).
(10-5) 2-бром-4-{4-хлор-2-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C21H27BrClN3O3S, 516,06; обнаружено 518,0.
ПРИМЕР 11
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 11-1 - 11-20, обладающие следующей формулой:
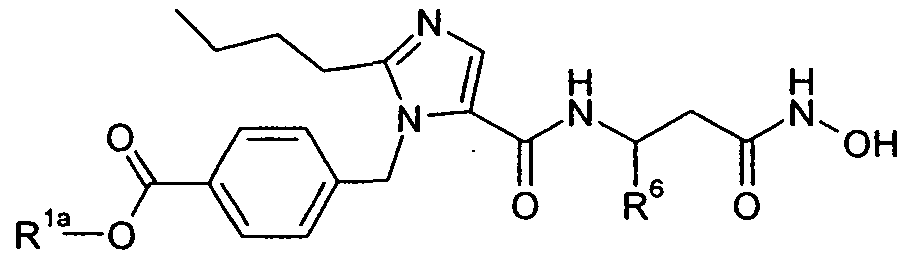
|
(11-1) 1-этоксикарбонилоксиэтиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C31H38N4O8, 595,27; обнаружено 595,5.
(11-2) метиловый эфир 4-[2-бутил-5-((R)-1-гидроксикарбамоилметил-3-фенилпропилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C28H34N4O5, 507,25; обнаружено 508,1.
(11-3) метиловый эфир 4-[2-бутил-5-((R)-2-гидроксикарбамоил-1-тиофен-3-илметилэтилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C25H30N4O5S, 499,19; обнаружено 500,1.
(11-4) метиловый эфир 4-[2-бутил-5-((R)-1-фуран-2-илметил-2-гидроксикарбамоилэтилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C25H30N4O6, 483,22; обнаружено 483,9.
(11-5) метиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C27H32N4O5, 493,24; обнаружено 493,2.
(11-6) этиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C28H34N4O5, 507,25; обнаружено 507,2.
(11-7) пропиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C29H36N4O5, 521,27; обнаружено 521,2.
(11-8) 2,2,2-трифтор-1-метилэтиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C29H33F3N4O5, 575,24; обнаружено 575.
(11-9) 3,3,4,4,4-пентафторбутиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C30H33F5N4O5, 625,24; обнаружено 625.
(11-10) 2-фтор-1-фторметилэтиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C29H34F2N4O5, 557,25; обнаружено 557.
(11-11) 1-изопропоксикарбонилоксиэтиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C32H40N4O8, 609,28; обнаружено 609,4.
(11-12) 1-циклогексилоксикарбонилоксиэтиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C35H44N4O8, 649,32; обнаружено 649,4.
(11-13) циклопентиловый эфир 4-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C31H38N4O5, 547,28; обнаружено 547.
(11-14) изопропиловый эфир 4-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C29H36N4O5, 521,27; обнаружено 521.
(11-15) пиридин-4-илметиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C32H35N5O5, 570,26; обнаружено 570,6.
(11-16) бензиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C33H36N4O5, 569,27; обнаружено 569,4.
(11-17) 4-фторбензиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C33H35FN4O5, 587,26; обнаружено 587,0.
(11-18) 4-трифторметилбензиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C34H35F3N4O5, 637,26; обнаружено 638,0.
(11-19) 4-трифторметоксибензиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C34H35F3N4O6, 653,25; обнаружено 653,2.
(11-20) индан-5-иловый эфир 4-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойной кислоты. MS m/z: [M+H+] рассчитано для C35H38N4O5, 595,28; обнаружено 595,2.
ПРИМЕР 12
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 12-1 - 12-20, обладающие следующей формулой, где R представляет собой необязательный заместитель:
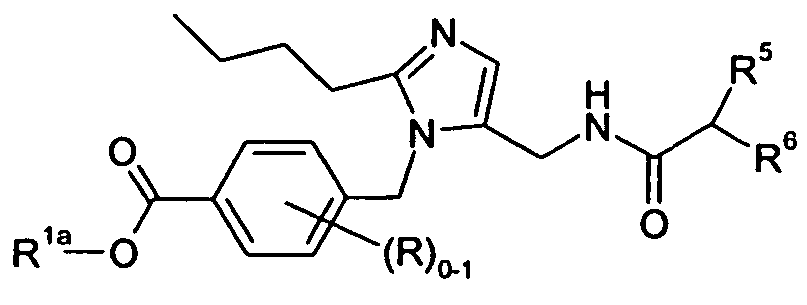
|
(12-1) метиловый эфир 4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C24H35N3O3S, 446,24; обнаружено 446,3.
(12-2) 2-бром-4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C23H32BrN3O3S, 510,13; обнаружено 511.
(12-3) метиловый эфир 2-бром-4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C24H34BrN3O3S, 524,15; обнаружено 524,4.
(12-4) метиловый эфир 4-{5-[(2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-бромбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36BrN3O4S, 566,16; обнаружено 566,1.
(12-5) этиловый эфир 2-бром-4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C25H36BrN3O3S, 538,17; обнаружено 539,2.
(12-6) изопропиловый эфир 2-бром-4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C26H38BrN3O3S, 552,18; обнаружено 553,2.
(12-7) бутиловый эфир 2-бром-4-{2-бутил-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C27H40BrN3O3S, 566,20; обнаружено 567,2.
(12-8) метиловый эфир 4-{5-[((R)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36FN3O4S, 506,24; обнаружено 506,2.
(12-9) метиловый эфир 4-{5-[((R)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-метилбензойной кислоты. MS m/z: [M+H+] рассчитано для C27H39N3O4S, 502,27; обнаружено 502,2.
(12-10) метиловый эфир 4-{5-[((R)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-метоксибензойной кислоты. MS m/z: [M+H+] рассчитано для C27H39N3O5S, 518,26; обнаружено 518,2.
(12-11) метиловый эфир 4-{5-[((R)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-хлорбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36ClN3O4S, 522,21; обнаружено 522,1.
(12-12) метиловый эфир 4-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-3-хлорбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36ClN3O4S, 522,21; обнаружено 523,2.
(12-13) метиловый эфир 4-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-хлорбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36ClN3O4S, 522,21; обнаружено 523,2.
(12-14) метиловый эфир 4-{5-[(2-ацетилсульфанил-2-фенилацетиламино)метил]-2-бутилимидазол-1-илметил}-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C27H30FN3O4S, 512,19; обнаружено 512,2.
(12-15) метиловый эфир 4-(5-{[2-ацетилсульфанил-2-(2-хлорфенил)ацетиламино]метил}-2-бутилимидазол-1-илметил)-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C27H29ClFN3O4S, 546,16; обнаружено 546,2.
(12-16) метиловый эфир 4-(5-{[2-ацетилсульфанил-2-(4-фторфенил)ацетиламино]метил}-2-бутилимидазол-1-илметил)-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C27H29F2N3O4S, 530,18; обнаружено 530,2.
(12-17) метиловый эфир 4-(5-{[2-ацетилсульфанил-2-(4-хлорфенил)ацетиламино]метил}-2-бутилимидазол-1-илметил)-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C27H29ClFN3O4S, 546,16; обнаружено 546,2.
(12-18) метиловый эфир 4-{5-[(2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C25H34FN3O4S, 492,23; обнаружено 492,2.
(12-19) метиловый эфир 4-{5-[(2-ацетилсульфанил-3-метилбутириламино)метил]-2-бутилимидазол-1-илметил}-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C24H32FN3O4S, 478,21; обнаружено 478,2.
(12-20) метиловый эфир 4-{5-[(2-ацетилсульфанил-4,4-диметилпентаноиламино)метил]-2-бутилимидазол-1-илметил}-2-фторбензойной кислоты. MS m/z: [M+H+] рассчитано для C26H36FN3O4S, 506,24; обнаружено 506,2.
ПРИМЕР 13
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также следующее соединение:
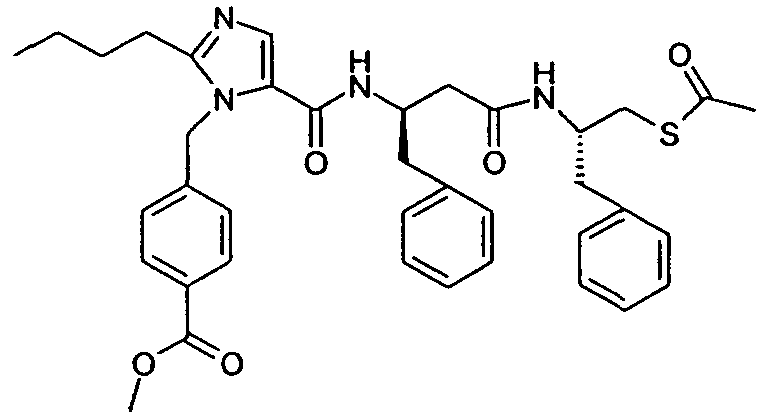
Метиловый эфир 4-{5-[(R)-2-((S)-2-ацетилсульфанил-1-бензилэтилкарбамоил)-1-бензилэтилкарбамоил]-2-бутилимидазол-1-илметил}бензойной кислоты. MS m/z: [M+H+] рассчитано для C38H44N4O5S, 669,30; обнаружено 669,5.
ПРИМЕР 14
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 14-1 - 14-24, обладающие следующей формулой:
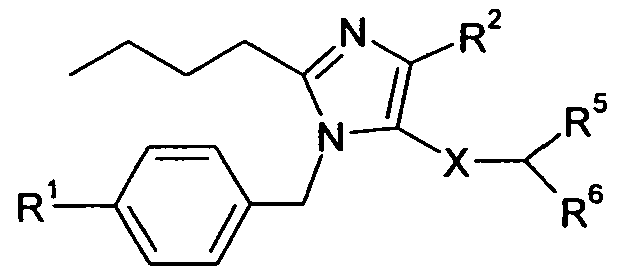
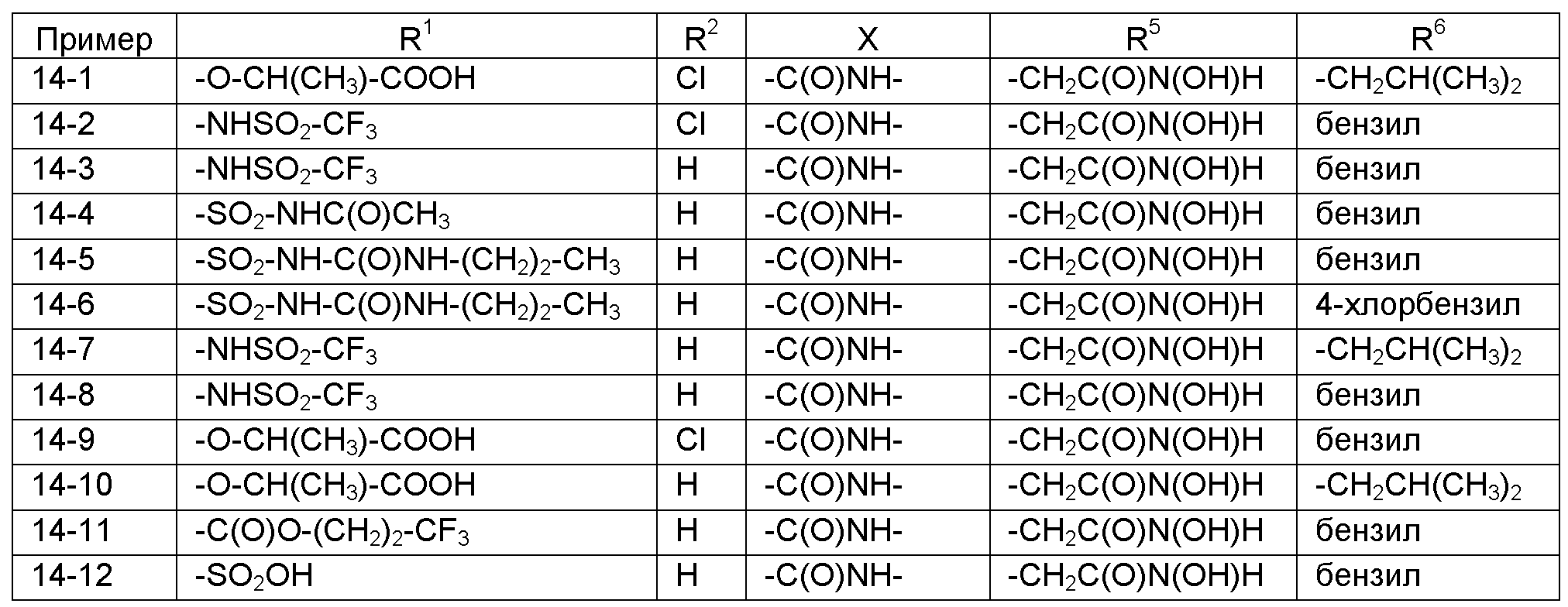
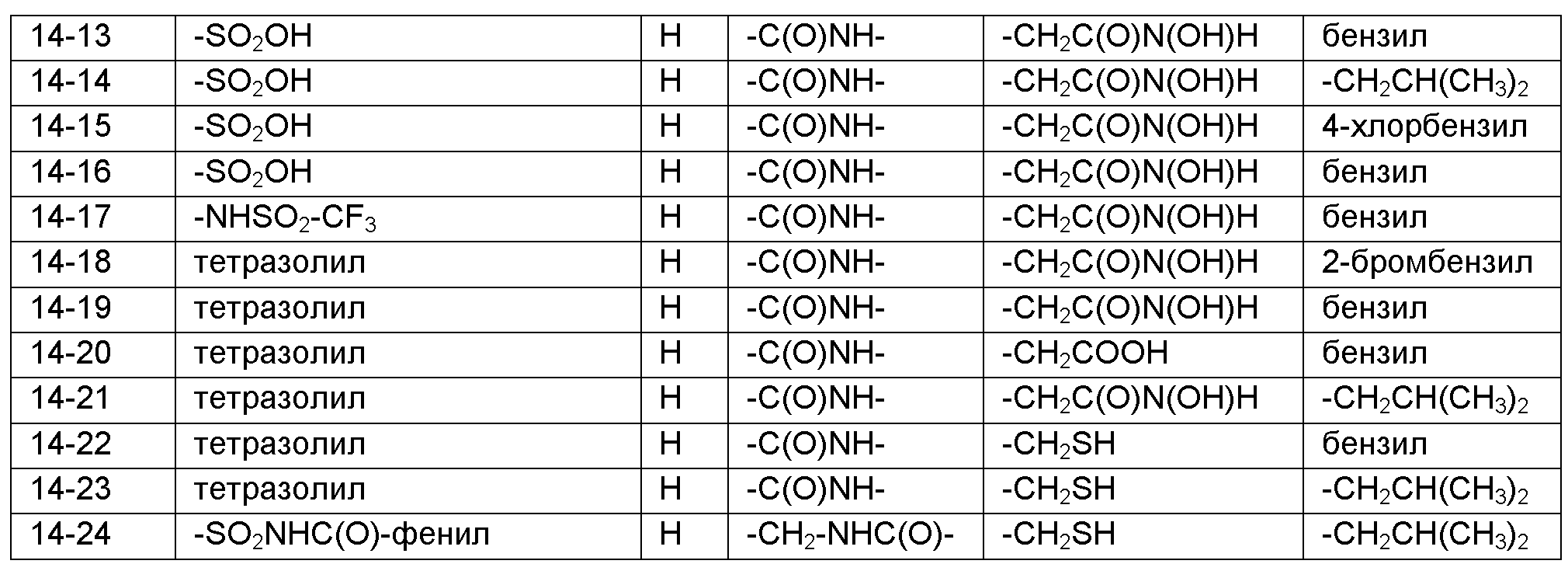
(14-1) 2-{4-[2-бутил-4-хлор-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]фенокси}пропионовая кислота. MS m/z: [М+H+] рассчитано для C25H35ClN4O6, 523,22; обнаружено 523,4.
(14-2) (1-гидроксикарбамоилметил-2-фенилэтил)амид 2-бутил-5-хлор-3-(4-трифторметансульфониламинобензил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H29ClF3N5O5S, 616,15; обнаружено 616,4.
(14-3) (1-гидроксикарбамоилметил-2-фенилэтил)амид 2-бутил-3-(4-трифторметансульфониламинобензил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H30F3N5O5S, 582,19; обнаружено 582,4.
(14-4) (1-гидроксикарбамоилметил-2-фенилэтил)амид 3-(4-ацетилсульфамоилбензил)-2-бутил-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C27H33N5O6S, 556,22; обнаружено 556,3.
(14-5) 2-бутил-N-(4-(гидроксиамино)-4-оксо-1-фенилбутан-2-ил)-1-(4-(N-(пропилкарбамоил)сульфамоил)бензил)-1H-имидазол-5-карбоксамид. MS m/z: [М+H+] рассчитано для C29H38N6O6S, 599,26; обнаружено 599,4.
(14-6) (S)-2-бутил-N-(1-(4-хлорфенил)-4-(гидроксиамино)-4-оксобутан-2-ил)-1-(4-(N-(пропилкарбамоил)сульфамоил)бензил)-1H-имидазол-5-карбоксамид. MS m/z: [М+H+] рассчитано для C29H37ClN6O6S, 633,22; обнаружено 634,2.
(14-7) ((S)-1-гидроксикарбамоилметил-3-метилбутил)амид 2-бутил-3-(4-трифторметансульфониламинобензил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C23H32F3N5O5S, 548,21 ; обнаружено 548,3.
(14-8) ((S)-1-бензил-2-гидроксикарбамоилэтил)амид 2-бутил-3-(4-трифторметансульфониламино-бензил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H30F3N5O5S, 582,19; обнаружено 582,3.
(14-9) 2-{4-[2-бутил-4-хлор-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]фенокси}пропионовая кислота. MS m/z: [М+H+] рассчитано для C28H33ClN4O6, 557,21; обнаружено 557,0.
(14-10) 2-{4-[2-бутил-5-((S)-1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]фенокси}пропионовая кислота. MS m/z: [М+H+] рассчитано для C25H36N4O6, 489,26; обнаружено 489,4.
(14-11) 3,3,3-трифторпропиловый эфир 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензойной кислоты. MS m/z: [М+H+] рассчитано для C29H33F3N4O5, 575,24; обнаружено 575,4.
(14-12) 4-[5-(1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензолсульфоновая кислота. MS m/z: [М+H+] рассчитано для C25H30N4O6S, 515,19; обнаружено 515,5.
(14-13) 4-[5-((S)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензолсульфоновая кислота. MS m/z: [М+H+] рассчитано для C25H30N4O6S, 515,19; обнаружено 515,5.
(14-14) 4-[2-бутил-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]бензолсульфоновая кислота. MS m/z: [М+H+] рассчитано для C22H32N4O6S, 481,20; обнаружено 481,2.
(14-15) 4-{2-бутил-5-[(S)-1-(4-хлорбензил)-2-гидроксикарбамоилэтилкарбамоил]имидазол-1-илметил}бензолсульфоновая кислота. MS m/z: [М+H+] рассчитано для C25H29ClN4O6S, 549,15; обнаружено 550,2.
(14-16) 4-[5-((R)-1-бензил-2-гидроксикарбамоилэтилкарбамоил)-2-бутилимидазол-1-илметил]бензолсульфоновая кислота. MS m/z: [М+H+] рассчитано для C25H3ON4O6S, 515,19; обнаружено 515,2.
(14-17) ((R)-1-бензил-2-гидроксикарбамоилэтил)амид 2-бутил-3-(4-трифторметансульфониламинобензил)-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H30F3N5O5S, 582,19; обнаружено 582,2.
(14-18) [(R)-2-(2-бромфенил)-1-гидроксикарбамоилметилэтил]амид 2-бутил-3-[4-(1H-тетразол-5-ил)бензил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H29BrN8O3, 581,15; обнаружено 583,3.
(14-19) ((R)-1-гидроксикарбамоилметил-2-фенилэтил)амид 2-бутил-3-[4-(1H-тетразол-5-ил)бензил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C26H30N8O3, 503,24; обнаружено 503,5.
(14-20) (R)-3-({2-бутил-3-[4-(1H-тетразол-5-ил)бензил]-3H-имидазол-4-карбонил}амино)-4-фенилмасляная кислота. MS m/z: [М+H+] рассчитано для C26H29N7O3, 488,23; обнаружено 488,3.
(14-21) ((R)-1-гидроксикарбамоилметил-3-метилбутил)амид 2-бутил-3-[4-(1H-тетразол-5-ил)бензил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C23H32N8O3, 469,26; обнаружено 469,2.
(14-22) ((R)-1-меркаптометил-2-фенилэтил)амид 2-бутил-3-[4-(2H-тетразол-5-ил)бензил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C25H29N7OS, 476,22; обнаружено 476,4.
(14-23) ((R)-1-меркаптометил-3-метилбутил)амид 2-бутил-3-[4-(2H-тетразол-5-ил)бензил]-3H-имидазол-4-карбоновой кислоты. MS m/z: [М+H+] рассчитано для C22H31N7OS, 442,23; обнаружено 442,4.
(14-24) [3-(4-бензоилсульфамоилбензил)-2-бутил-3H-имидазол-4-илметил]амид 2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H38N4O4S2, 571,23; обнаружено 571,2.
ПРИМЕР 15
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 15-1 - 15-12, обладающие следующей формулой:
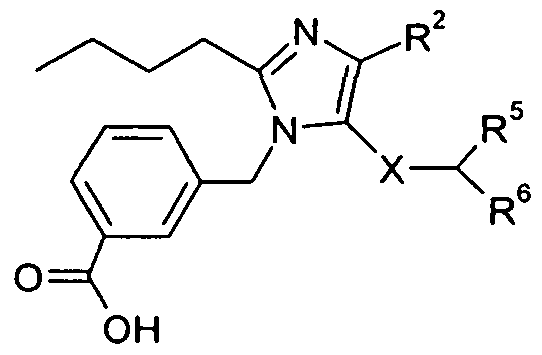
|
(15-1) 3-[2-бутил-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [М+H+] рассчитано для C23H32N4O5, 445,24; обнаружено 445,2.
(15-2) 3-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 466,2.
(15-3) 3-{2-бутил-4-хлор-5-[(2-меркаптометил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C26H30ClN3O3S, 500,17; обнаружено 500,2.
(15-4) 3-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилбутириламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C22H30ClN3O3S, 452,17; обнаружено 452,2.
(15-5) 3-{2-бутил-4-хлор-5-[(2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C22H30ClN3O3S, 452,17; обнаружено 452,2.
(15-6) 3-(5-{[2-(2-бензил-3-меркаптопропиониламино)ацетиламино]метил}-2-бутил-4-хлоримидазол-1-илметил)бензойная кислота. MS m/z: [М+H+] рассчитано для C28H33ClN4O4S, 557,19; обнаружено 557,2.
(15-7) 3-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C23H31ClN4O5, 479,20; обнаружено 479,2.
(15-8) 3-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 513,2.
(15-9) 3-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [М+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,4.
(15-10) 3-[2-бутил-5-((R)-1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [М+H+] рассчитано для C26H30N4O5, 479,22; обнаружено 479,4.
(15-11) 3-[2-бутил-4-хлор-5-((R)-1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [М+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 514,2.
(15-12) 3-[2-бутил-4-хлор-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]бензойная кислота. MS m/z: [М+H+] рассчитано для C26H29ClN4O5, 513,18; обнаружено 514,2.
ПРИМЕР 16
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 16-1 - 16-4, обладающие следующей формулой:
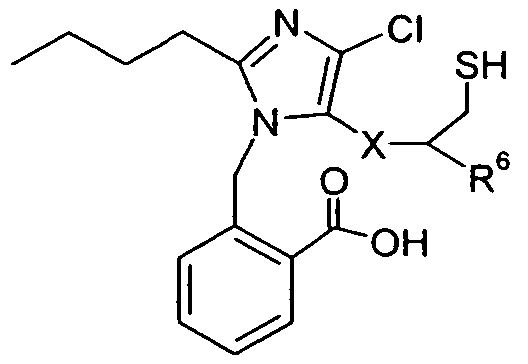
|
(16-1) 2-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C23H32ClN3O3S, 466,19; обнаружено 467.
(16-2) 2-{2-бутил-4-хлор-5-[(2-меркаптометил-3-фенилпропиониламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C26H30ClN3O3S, 500,17; обнаружено 501.
(16-3) 2-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилбутириламино)метил]имидазол-1-илметил}бензойная кислота. MS m/z: [М+H+] рассчитано для C22H30ClN3O3S, 452,17; обнаружено 453.
(16-4) 2-(5-{[2-(2-бензил-3-меркаптопропиониламино)ацетиламино]метил}-2-бутил-4-хлоримидазол-1-илметил)бензойная кислота. MS m/z: [М+H+] рассчитано для C28H33ClN4O4S, 557,19; обнаружено 558.
ПРИМЕР 17
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 17-1 - 17-14, обладающие следующей формулой:
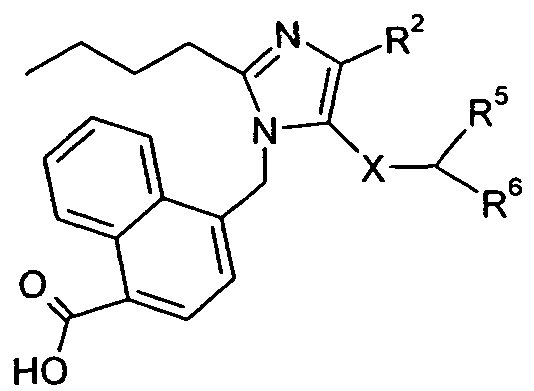
|
(17-1) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C27H34ClN3O3S, 516,20; обнаружено 517,2.
(17-2) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-фенилпропиониламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H32ClN3O3S, 550,19; обнаружено 551,2.
(17-3) 4-{2-бутил-4-хлор-5-[(2-меркаптометил-3-метилбутириламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C26H32ClN3O3S, 502,19; обнаружено 502,2.
(17-4) 4-(5-{[2-(2-бензил-3-меркаптопропиониламино)ацетиламино]метил}-2-бутил-4-хлоримидазол-1-илметил)нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C32H35ClN4O4S, 607,21; обнаружено 607,2.
(17-5) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C27H33ClN4O5, 529,21; обнаружено 529,2.
(17-6) 4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-3-метилбутириламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C26H31ClN4O5, 515,20; обнаружено 515,2.
(17-7) 4-[2-бутил-5-(1-гидроксикарбамоилметил-3-метилбутилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C27H34N4O5, 495,25; обнаружено 495,4.
(17-8) 4-[2-бутил-4-хлор-5-((S)-1-гидроксикарбамоил-2-фенилэтилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C29H29ClN4O5, 549,18; обнаружено 549,2.
(17-9) 4-[2-бутил-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H32N4O5, 529,24; обнаружено 529,4.
(17-10) 4-[2-бутил-4-хлор-5-(1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H31ClN4O5, 563,20; обнаружено 563,4.
(17-11) 4-[2-бутил-5-((R)-1-гидроксикарбамоилметил-2-фенилэтилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H32N4O5, 529,24; обнаружено 529,5.
(17-12) 4-{5-[(R)-2-(2-бромфенил)-1-гидроксикарбамоилметилэтилкарбамоил]-2-бутилимидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H31BrN4O5, 607,15; обнаружено 608,2.
(17-13) 4-[2-бутил-5-((R)-1-карбоксиметил-2-фенилэтилкарбамоил)имидазол-1-илметил]нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H31N3O5, 514,23; обнаружено 514,2.
(17-14) 4-{2-бутил-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}нафталин-1-карбоновая кислота. MS m/z: [М+H+] рассчитано для C27H34N4O5 495,25; обнаружено 495,2.
ПРИМЕР 18
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также следующее соединение:
(4-{2-бутил-4-хлор-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}фенокси)фенилуксусная кислота. MS m/z: [М+H+] рассчитано для C30H37ClN4O6, 585,24; обнаружено 585,4.
ПОЛУЧЕНИЕ 13
5-бром-2-этокси-3H-имидазол-4-карбальдегид
2,4,5-трибром-1H-имидазол (13a) (98,7 г, 324 ммоль, 1,0 экв.) растворяли в 1,20 л метиленхлорида и охлаждали до 0°C. К этому добавляли DIPEA (62 мл, 360 ммоль, 1,1 экв.) с последующим медленным добавлением [β-(триметилсилил)этокси]метилхлорида (60,2 мл, 340 ммоль, 1,05 экв.). Раствор медленно нагревали до комнатной температуры. Через 2 часа смесь промывали 2× с помощью 600 мл 1 М H3PO4/насыщенного водного NaCl (1/10 мл). Органический слой сушили над MgSO4 и высушивали досуха, получая промежуточное соединение (13b) в виде бледно-желтой жидкости, затвердевающей при стоянии (137 г).
Промежуточное соединение (13b) (130 г, 290 ммоль, 1,0 экв.) растворяли в 650 мл безводного этанола. К этому медленно добавляли трет-бутоксид калия (98,6 г, 879 ммоль, 3,0 экв.), и смесь нагревали при кипячении с обратным холодильником в течение 16 часов. Затем смесь охлаждали до комнатной температуры, фильтровали и концентрировали. Полученное масло растворяли в 800 мл EtOAc и промывали с помощью 400 мл насыщенного NaHCO3. Слои разделяли и органический слой промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали, получая промежуточное соединение (13c) в виде коричневого масла (115,3 г). MS m/z: [М+H+] рассчитано для C11H20Br2N2O2Si, 401,9, обнаружено 401,2.
Промежуточное соединение (13c) (69,5 г, 174 ммоль, 1,0 экв.) растворяли в 600 мл безводного THF и охлаждали до -78°C в атмосфере азота. 2,5 M раствор н-бутиллития в гексанах (72,9 мл, 180 ммоль, 1,05 экв.) добавляли по каплям и смесь перемешивали при -78°C в течение 10 минут. Затем добавляли DMF (40 мл, 520 ммоль, 3,0 экв.) и смесь перемешивали при -78°C в течение 15 минут и затем нагревали до комнатной температуры. Реакцию останавливали с помощью 10 мл воды, разводили 600 мл EtOAc и промывали с помощью 100 мл воды, насыщенного водного NaCl, высушивали над MgSO4 и концентрировали под пониженным давлением. Выделенный материал очищали хроматографией на силикагеле (15-30% EtOAc:гексаны), получая промежуточное соединение (13d) в виде бледно-желтого масла (45 г).
Промежуточное соединение (13d) (105,8 г, 303 ммоль, 1,0 экв.) охлаждали при 0°C во льду. Добавляли TFA (300 мл) и смесь перемешивали при 0°C в течение 15 минут, затем нагревали до комнатной температуры. Через 90 минут смесь концентрировали под пониженным давлением и повторно растворяли в 700 мл EtOAc. Органический слой промывали 2×600 мл насыщенного бикарбоната, насыщенного водного NaCl, высушивали над MgSO4 и концентрировали под пониженным давлением с получением желтого твердого вещества. Материал суспендировали в 300 мл гексана и перемешивали при 0°C в течение 30 минут. Материал фильтровали и твердое вещество промывали с помощью 150 мл холодного гексана с получением названного в заголовке соединения в виде тусклого белого твердого вещества (61,2 г). 1H-ЯМР (CDCl3) δ (м.д.): 1,4 (м, 3H), 4,5 (м, 2H), 5,2 (с, 1Н), 9,2 (д, 1Н).
ПОЛУЧЕНИЕ 14
трет-Бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты
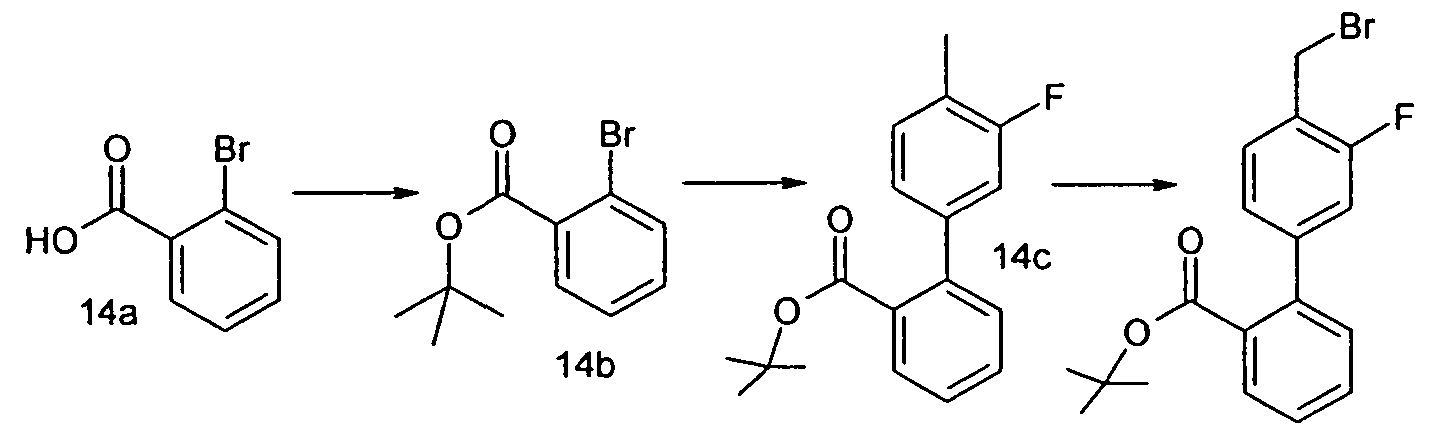
К раствору 1,0 M DCC в метиленхлориде (505 мл, 505 ммоль, 1,0 экв.), охлажденному до 0°C, добавляли 2-бромбензойную кислоту (14a) (101,6 г, 505 ммоль, 1,0 экв.), затем DMAP (5,7 г, 470 ммоль, 0,09 экв.) и трет-бутиловый спирт (53,2 мл, 560 ммоль, 1,1 экв.). Смесь перемешивали при комнатной температуре в течение 18 часов и затем фильтровали. Органический слой промывали с помощью 400 мл насыщенного NaHCO3, насыщенного водного NaCl, высушивали над MgSO4, фильтровали и концентрировали с получением неочищенного промежуточного соединения (14b) в виде масла (141,8 г).
Неочищенное промежуточное соединение (14b) (111,2 г, 433 ммоль, 1,0 экв.) и 3-фтор-4-метилфенилбороновую кислоту (73,2 г, 476 ммоль, 1,1 экв.) суспендировали в изопропиловом спирте (370 мл). Добавляли 2,0 M раствор карбоната натрия в воде (370 мл) и смесь дегазировали в атмосфере азота. Затем добавляли тетракис(трифенилфосфин)палладий(0) (5,0 г, 4,3 ммоль, 0,01 экв.) и смесь перемешивали при 90°C в течение 46 часов. Смесь охлаждали до комнатной температуры, разводили 800 мл EtOAc и разделяли слои. Органический слой промывали насыщенным водным NaCl и концентрировали под пониженным давлением. Выделенное масло очищали хроматографией на силикагеле (4-6% EtOAc:гексаны), получая промежуточное соединение (14c) в виде масла (97,4 г).
Промежуточное соединение (14c) (89,8 г, 314 ммоль, 1,0 экв.) растворяли в CCl4 (620 мл) и дегазировали в атмосфере азота. Добавляли NBS (55,8 г, 314 ммоль, 1,0 экв.), затем бензоилпероксид (1,5 г, 6,3 ммоль, 0,02 экв.) и смесь нагревали при 90°C в атмосфере азота в течение 16 часов. Реакционную смесь охлаждали в ледяной бане, фильтровали и концентрировали под пониженным давлением. Выделенное масло растирали с 150 мл 3% EtOAc:гексанов. Раствор охлаждали до -20°C в течение 2 часов, затем фильтровали и промывали с помощью 200 мл холодного раствора 3% EtOAc:гексанов с получением названного в заголовке соединения в виде грязно-белого твердого вещества (88,9 г). 1H-ЯМР (CDCl3) δ (м.д.): 1,3 (м, 9H), 4,6 (с, 2H), 7,0-7,1 (м, 2H), 7,3 (дд, 1Н), 7,4 (м, 1Н), 7,5 (м, 1Н), 7,8 (дд, 1Н).
ПОЛУЧЕНИЕ 15
трет-Бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты
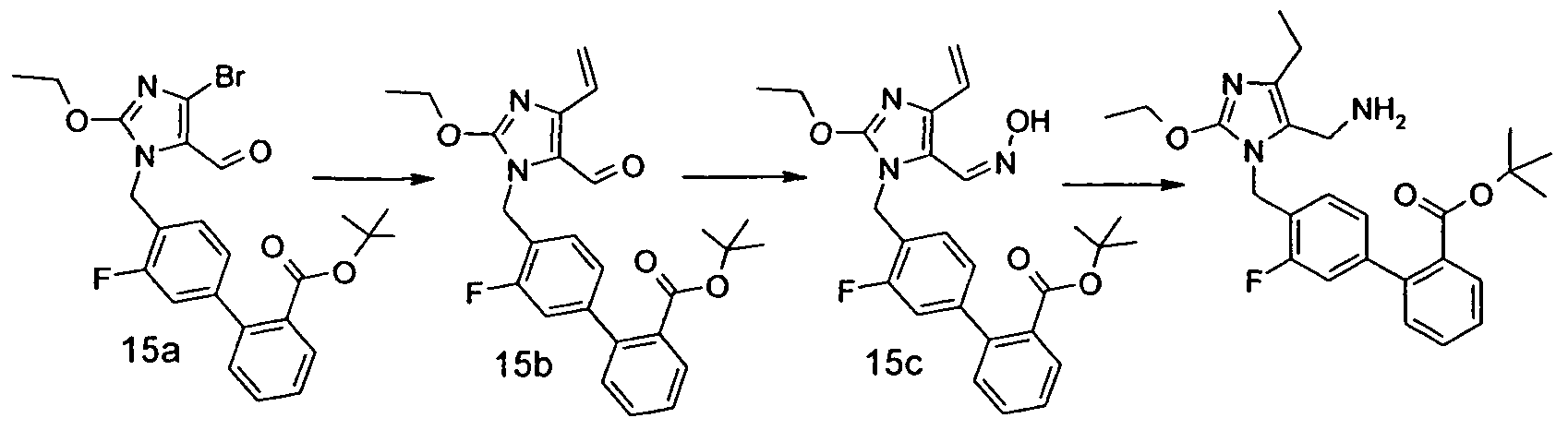
трет-Бутиловый эфир 4'-(4-бром-2-этокси-5-формилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (15a): 5-бром-2-этокси-3H-имидазол-4-карбальдегид (15,0 г, 68,5 ммоль), трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты (25,0 г, 68,5 ммоль) и карбонат калия (9,5 г, 68,5 ммоль) растворяли в DMF (958 мл, 12,4 моль) и перемешивали при комнатной температуре в течение 2 часов. Реакцию останавливали с помощью воды и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Смесь очищали хроматографией на силикагеле (0-30% EtOAc:гексаны), получая промежуточное соединение (15a) (25 г). MS m/z: [M+H+] рассчитано для C24H24BrFN2O4, 503,3; обнаружено 503,2. 1H-ЯМР (CDCl3): 9,57 (1Н, с), 7,80 (1Н, д), 7,48 (2H, м), 7,27 (1Н, с), 7,11 (1Н, т), 7,01 (2H, д), 5,47 (2H, с), 4,33 (2H, кв), 1,41 (3H, т), 1,24 (9H, с).
трет-Бутиловый эфир 4'-(2-этокси-5-формил-4-винилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (15b): промежуточное соединение (15a) (11,0 г, 21,8 ммоль) растворяли в 1,2-диметоксиэтане (100 мл, 1 моль). Добавляли тетракис(трифенилфосфин)палладий(0) (252 мг, 218 мкмоль) и смесь перемешивали в атмосфере азота в течение 20 минут. Затем добавляли воду (48 мл, 2,6 моль), комплекс 2,4,6-тривинилциклотрибороксана с пиридином (2,1 г, 8,7 ммоль) и карбонат калия (3,0 г, 21,8 ммоль), и смесь нагревали при 90°C в атмосфере азота. Через 2 часа смесь охлаждали до комнатной температуры, разводили EtOAc, промывали с помощью воды и насыщенного водного NaCl, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Смесь очищали хроматографией на силикагеле (0-50% EtOAc:гексаны), получая промежуточное соединение (15b) (9,8 г). MS m/z: [M+H+] рассчитано для C26H27FN2O4, 451,2; обнаружено 451,0. 1H-ЯМР (CDCl3): 8,17 (1Н, с), 7,79 (1Н, д), 7,48 (1Н, т), 7,40 (1Н, т), 7,28 (1Н, с), 7,01 (2H, м), 6,86 (1Н, т), 6,67 (1Н, м), 5,95 (1Н, д), 5,41 (2H, с), 5,27 (1Н, д), 4,48 (2H, кв), 1,38 (3H, т), 1,25 (9H, с).
трет-Бутиловый эфир 4'-[2-этокси-5-(гидроксииминометил)-4-винилимидазол-1-илметил]-3'-фторбифенил-2-карбоновой кислоты (15c): промежуточное соединение (15b) (19,5 г, 43,4 ммоль) растворяли в пиридине (100 мл, 1 моль). Добавляли гидрохлорид гидроксиламина (9,0 г, 130 ммоль), затем воду (50 мл, 3 моль) и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли воду (100 мл) и смесь перемешивали в течение 20 минут. Преципитат отфильтровывали и высушивали, получая промежуточное соединение (15c) (13,5 г). MS m/z: [M+H+] рассчитано для C26H28FN3O4, 466,2; обнаружено 466,4. 1H-ЯМР (CDCl3): 9,78 (1Н, с), 7,81 (1Н, д), 7,48 (2H, м), 7,26 (1Н, с), 7,0 (4H, м), 6,20 (1Н, д), 5,53 (1Н, д), 5,50 (2H, с), 4,55 (2H, кв), 1,43 (3H, т), 1,25 (9H, с).
Промежуточное соединение (15c) (4,0 г, 8,6 ммоль) растворяли в этаноле (250 мл, 4,3 моль) и серной кислоте (0,50 мл, 9,4 ммоль) и подвергали обработке ультразвуком. После полного растворения смесь добавляли к 10% Pd/C, типа Degussa, влажность 50% (0,05:0,45:0,5, палладий:высокочистый углерод:вода, 3,0 г, 1,4 ммоль) в 20 мл этанола. Раствор дегазировали и перемешивали при комнатной температуре под водородом в течение 5 часов. Палладий отфильтровывали и смесь концентрировали до получения названного в заголовке соединения (3,3 г). MS m/z: [M+H+] рассчитано для C26H32FN3O3, 454,3; обнаружено 454,2. 1H-ЯМР (CDCl3): 7,82 (1Н, д), 7,50 (1Н, т), 7,42 (1Н, т), 7,35 (1Н, д), 7,27 (1Н, д), 7,12 (1Н, с), 7,04 (1Н, д), 5,34 (1Н, ушир.), 4,65 (2H, с), 4,40 (2H, кв), 4,12 (2H, кв), 2,70 (1Н, ушир.), 1,50 (3H, т), 1,28 (9H, с), 1,17 (3H, т).
Альтернативный синтез промежуточного соединения (15a)
5-бром-2-этокси-3H-имидазол-4-карбальдегид (19,8 г, 90,6 ммоль) и трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты (33,1 г, 90,6 ммоль) растворяли в DMF (400 мл). Смесь охлаждали в ледяной бане и добавляли карбонат калия (12,5 г, 90,6 ммоль) в течение 5 минут. Температуру медленно повышали в течение ночи. Затем реакцию останавливали водой. Смесь экстрагировали с помощью 300 мл EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Продукт очищали хроматографией на силикагеле (0-30% EtOAc:гексаны), получая промежуточное соединение (15a) в виде белого твердого вещества (34,2 г). MS m/z: [M+H+] рассчитано для C24H24BrFN2O4, 503,3; обнаружено 503,2. 1H ЯМР (CDCl3) 9,57 (1H, с), 7,80 (1Н, д), 7,48 (2H, м), 7,27 (1Н, с), 7,11 (1Н, т), 7,01 (2H, д), 5,47 (2H, с), 4,33 (2H, кв), 1,41 (3H, т), 1,24 (9H, с).
Альтернативный синтез названного в заголовке соединения
Промежуточное соединение (15c) (4,5 г, 9,7 ммоль) растворяли в уксусной кислоте (100 мл, 2000 ммоль) и перемешивали в течение 10 минут при комнатной температуре. Затем добавляли цинковую пыль (5,9 г, 90,2 ммоль) и смесь перемешивали в течение 45 минут. Цинк отфильтровали и уксусную кислоту концентрировали. Осадок поглощали в EtOAc и промывали с помощью бикарбоната натрия и насыщенного водного NaCl. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Осадок добавляли к 10% Pd/C, типа Degussa, влажность 50% (0,05:0,45:0,5, палладий:высокоочищенный углерод:вода, 400 мг, 0,2 ммоль) в этаноле (200 мл, 3 моль). Смесь дегазировали и перемешивали под водородом в течение 1,5 часов. Палладий отфильтровывали, и растворитель концентрировали с получением названного в заголовке соединения (4,6 г). MS m/z: [M+H+] рассчитано для C26H32FN3O3, 454,3; обнаружено 454,2. 1H-ЯМР (CDCl3): 7,82 (1Н, д), 7,50 (1Н, т), 7,42 (1Н, т), 7,35 (1Н, д), 7,27 (1Н, д), 7,12 (1Н, с), 7,04 (1Н, д), 5,34 (1Н, ушир.), 4,65 (2H, с), 4,40 (2H, кв), 4,12 (2H, кв), 2,70 (1Н, ушир.), 1,50 (3H, т), 1,28 (9H, с), 1,17 (3H, т).
Альтернативный синтез названного в заголовке соединения
Промежуточное соединение (15c) (5,1 г, 11 ммоль) растворяли в уксусной кислоте (100 мл) и серной кислоте (640 мкл, 12 ммоль). Смесь дегазировали в атмосфере азота и добавляли 10% Pd/C, типа Degussa, влажность 50% (0,05:0,45:0,5, палладий:высокоочищенный углерод:вода, 1,5 г, 723 мкмоль). Затем смесь дегазировали под водородом при 50 psi (344737,95 Па) во встряхивателе Parr и встряхивали при комнатной температуре. Через 12 часов смесь фильтровали и концентрировали под пониженным давлением. Выделенный материал растворяли в 50 мл EtOAc, промывали с помощью 50 мл насыщенного бикарбоната, насыщенного водного NaCl и выпаривали. Материал очищали хроматографией на силикагеле (0-10% MeOH:DCM) с получением названного в заголовке соединения в виде прозрачного масла (4,6 г). MS m/z: [M+H+] рассчитано для C26H32FN3O3, 454,3; обнаружено 454,2. 1H ЯМР (CDCl3) 7,82 (1Н, д), 7,50 (1Н, т), 7,42 (1Н, т), 7,35 (1Н, д), 7,27 (1Н, д), 7,12 (1Н, с), 7,04 (1Н, д), 5,34 (1Н, ушир.), 4,65 (2H, с), 4,40 (2H, кв), 4,12 (2H, кв), 2,70 (1Н, ушир.), 1,50 (3H, т), 1,28 (9H, с), 1,17 (3H, т).
ПРИМЕР 19
трет-Бутиловый эфир 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (19a; R 1a = трет-бутил; R 5a = -C(O)CH 3 ); 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (19b; R 1a = H; R 5a = -C(O)CH 3 ); и 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (19c; R 1a = H; R 5a = H)
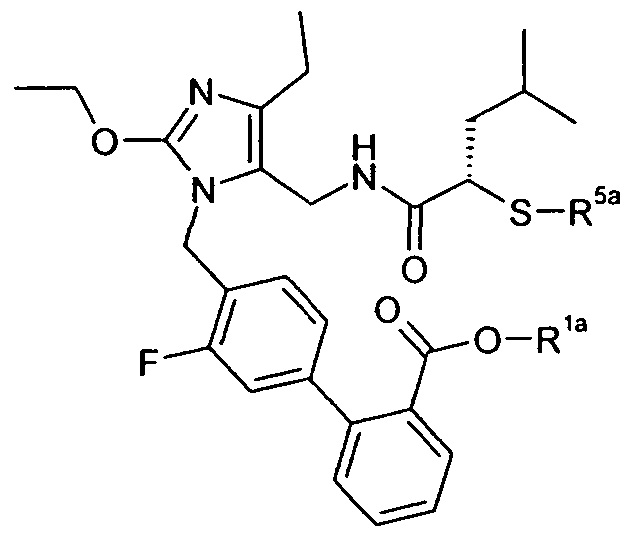
(S)-2-ацетилсульфанил-4-метилпентановую кислоту (877 мг, 4,6 ммоль) растворяли в DMF (20 мл, 300 ммоль). Добавляли HATU (1,8 г, 4,6 ммоль) и DIPEA (0,8 мл, 4,6 ммоль) и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (1,9 г, 4,2 ммоль) в DMF (20 мл, 300 ммоль) с DIPEA (0,8 мл, 4,6 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию останавливали водой, экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Смесь очищали хроматографией на силикагеле (0-50% EtOAc:гексаны), получая промежуточное соединение ацетилсульфанильного эфира (19a) (2,4 г). MS m/z: [M+H+] рассчитано для C34H44FN3O5S, 626,3; обнаружено 626,2. 1H-ЯМР (CDCl3): 7,80 (1Н, д), 7,48 (1Н, т), 7,40 (1Н, т), 7,25 (1Н, д), 7,06 (2H, д), 6,88 (1Н, т), 6,08 (1H, т), 4,96 (2H, с), 4,38 (2H, кв), 4,22 (2H, м), 3,86 (1Н, т), 2,50 (2H, кв), 2,32 (3H, с), 1,82 (1Н, м), 1,64 (1Н, м), 1,52 (1Н, м), 1,34 (3H, т), 1,26 (9H, с), 1,18 (3H, т), 0,87 (6H, дд).
Промежуточное соединение (19a) растворяли в DCM:TFA (1:1) (5 мл каждого) и перемешивали при комнатной температуре в течение 3 часов, затем концентрировали и продолжали, получая промежуточное соединение ацетилсульфанильной кислоты (19b). MS m/z: [M+H+] рассчитано для C30H36FN3O5S, 570,2; обнаружено 570,4. 1H-ЯМР (DMSO): 8,64 (1Н, ушир.), 7,72 (1Н, д), 7,55 (1Н, т), 7,44 (1Н, т), 7,33 (1Н, д), 7,16 (1Н, д), 7,07 (1Н, д), 6,95 (1Н, ушир.), 5,05 (2H, с), 4,35 (2H, д), 4,12 (2H, т), 40,5 (2H, т), 2,26 (3H, с), 1,64 (1Н, м), 1,40 (2H, м), 1,28 (3H, т), 1,10 (3H, т), 0,80 (6H, дд).
Промежуточное соединение (19b) растворяли в MeOH (20 мл) и добавляли 10 N NaOH (2 мл). Смесь перемешивали при комнатной температуре в течение 25 минут в атмосфере азота перед тем, как реакцию останавливали уксусной кислотой и смесь концентрировали. Полученный материал очищали препаративной HPLC (10-70%) с получением конечного продукта (19c) в виде соли TFA (1,6 г; чистота 98%). MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,2; обнаружено 528,2. 1H-ЯМР (DMSO): 8,40 (1Н, с), 7,74 (1Н, д), 7,57 (1Н, т), 7,47 (1Н, т), 7,35 (1Н, д), 7,18 (1Н, д), 7,09 (1Н, д), 7,02 (2H, ушир.), 5,11 (2H, с), 4,40 (2H, д), 4,18 (2H, д), 3,28 (1Н, кв), 2,68 (1Н, д), 2,48 (1Н, д), 1,58 (2H, м), 1,44 (1Н, м), 1,26 (3H, т), 1,14 (3H, т), 0,79 (6H, дд).
Альтернативный синтез названного в заголовке соединения (19c)
Альтернативно, промежуточное соединение (19a) получали следующим способом: К холодному раствору трет-бутилового эфира 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (1,2 г, 2,7 ммоль), растворенного в DCM (45 мл), охлажденному в водно-солевой бане (-5°C), добавляли (S)-2-ацетилсульфанил-4-метилпентановую кислоту (хиральная чистота 97,3% S: 531 мг, 2,8 ммоль) в 5 мл DCM и EDC (535 мг, 2,8 ммоль). Смесь перемешивали при -5°C в течение 1 часа в атмосфере азота. Реакцию останавливали добавлением смеси 1 М H3PO4 и насыщенного водного NaCl (1:3; 50 мл) и разводили DCM (200 мл). После встряхивания в делительной воронке органический слой собирали и промывали насыщенным NaHCO3. После высушивания над MgSO4 органический слой выпаривали досуха, получая промежуточное соединение (19a) в виде бледно-желтого масла. Неочищенный продукт (2,1 г) использовали на следующей стадии без дополнительной очистки. ESMS [M+H+] рассчитано для C34H44FN3O5S, 626,31; обнаружено 626,4. Время удержания при аналитической HPLC = 3,62 мин; условия градиента = 25-95% MeCN/H2O в течение 5 мин. Полным снятием защиты группы как трет-бутилового эфира, так и меркаптоацетила обработкой TFA/DCM (2:1), в течение 1 часа при комнатной температуре и 1 М NaOH в MeOH в течение 5 минут при комнатной температуре на двух отдельных стадиях получали конечный продукт (19c) в виде соли TFA. Определили, что ее хиральная чистота составляет 97,1% отдельного изомера S по аналитической HPLC на хиральной неподвижной фазе.
Альтернативный синтез названного в заголовке соединения (19c)
трет-Бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (4,0 г, 8,8 ммоль), (S)-2-ацетилсульфанил-4-метилпентановую кислоту (1,7 г, 8,8 ммоль), 4-метилморфолин (970 мкл, 8,82 ммоль) и 1-гидрокси-7-азабензотриазол (1,2 г, 8,8 ммоль) объединяли в колбе, растворяли в DMF (100 мл, 1,300 моль) и охлаждали при 0°C в течение 10 минут. Затем добавляли EDC (1,6 мл, 8,8 ммоль) и смесь перемешивали при 0°C в течение 1 часа и затем при комнатной температуре в течение 1 часа и 15 минут. Реакцию останавливали водой (100 мл), экстрагировали с помощью EtOAc (100 мл) и концентрировали. Смесь очищали колоночной хроматографией (0-50% EtOAc:гексаны) с получением 4,2 г промежуточного соединения (19a). Промежуточное соединение (19a) растворяли в DCM:TFA (10 мл каждого) и смесь перемешивали при комнатной температуре в течение 3 часов, и затем концентрировали. Осадок поглощали в EtOAc, промывали с помощью насыщенного раствора NaHCO3, высушивали над MgSO4 и концентрировали до получения 3,7 г промежуточного соединения (19b). Промежуточное соединение (19b) растворяли в 30 мл MeOH. Раствор дегазировали, перемешивали в атмосфере азота и охлаждали до 0°C. Добавляли 25 мл 0,5 M метоксида натрия в MeOH (2 экв.) и смесь перемешивали при 0°C в атмосфере азота в течение 20 минут. Затем смесь подкисляли с помощью 1 N HCl (15 мл). Смесь концентрировали, растворяли в EtOAc, промывали водой, высушивали над MgSO4, фильтровали и затем концентрировали. Продукт очищали препаративной HPLC 10-70% MeCN:вода с 0,5% TFA (70-минутный способ). Продукт растворяли в ~4 мл MeCN, 3 мл воды и 0,5 мл TFA для инъекции на колонку. 2 г конечного продукта (19c) выделяли как чистый на 98%, 93,6% э.и.
Синтез названного в заголовке соединения (19c) в виде соли HCl
Названное в заголовке соединение (19c) получали также в виде соли HCl следующим образом. Получение ионообменной колонки: 40 г смолы амберлит IRA-900 (Aldrich) суспендировали в 400 мл 1 М HCl. Смесь встряхивали в течение 60 минут и основной объем супернатанта декантировали с получением влажных смол, которые затем переносили в 100 мл пластиковую колонку. Небольшое количество порошка добавляли к верхнему слою смолы. Колонку промывали элюцией водой (200 мл) и 50% водным MeCN (200 мл), пока pH протекающего элюента не составлял ~5. Соль TFA 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (945 мг) растворяли в 50% водном MeCN (5 мл) и наносили на полученную колонку. Соединение элюировали с помощью 50% водного MeCN самотеком. Фракции собирали в объеме 5 мл и анализировали посредством HPLC и LCMS. Фракции, обладающие желаемой массой, объединяли и лиофилизировали, получая названное в заголовке соединение (19c) в виде соли HCl (700 мг). Анализом ионного содержания с использованием ионной хроматографии получили 7,1% Cl (мас./мас.).
Получение энантиомера (R) названного в заголовке соединения (19c)
Энантиомер (R) названного в заголовке соединения (19c) получали следующим способом.
трет-Бутиловый эфир 4'-{5-[((R)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (19a'): трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (128 мг, 282 мкмоль), (R)-2-ацетилсульфанил-4-метилпентановую кислоту (53,7 мг, 282 мкмоль), 1-гидрокси-7-азабензотриазол (38,4 мг, 282 мкмоль) и 4-метилморфолин (31,0 мкл, 282 мкмоль) объединяли, растворяли в DMF (2,5 мл, 32,3 ммоль) и охлаждали до 0°C в течение 10 минут. Добавляли EDC (50,0 мкл, 282 мкмоль). Через 20 минут смесь нагревали до комнатной температуры. Реакция завершалась через 90 минут, как определяли посредством HPLC и LCMS, и добавляли воду (5 мл). Смесь экстрагировали 2× с помощью EtOAc, промывали с помощью 1 N HCl (10 мл), воды и насыщенного водного NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения желтого масла (164 мг). Этот материал очищали хроматографией на силикагеле (12 г, 0-100% EtOAc:гексаны) с получением первой партии промежуточного соединения ацетилсульфанильного эфира (19a') в виде бесцветного масла (46 мг).
трет-Бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (120,0 мг, 265 мкмоль) и (R)-2-ацетилсульфанил-4-метилпентановую кислоту (50,3 мг, 264 мкмоль) растворяли в метиленхлориде (2,0 мл, 31,2 ммоль) и охлаждали до 0°C в течение 10 минут. Добавляли EDC (46,8 мкл, 264 мкмоль). Смесь нагревали до комнатной температуры в течение 2 часов. Затем смесь охлаждали до 0°C и добавляли DIPEA (46,1 мкл, 264 мкмоль). Эту смесь перемешивали при 0°C в течение 5 минут, затем нагревали до комнатной температуры. Через 30 минут добавляли воду (5 мл). Смесь экстрагировали 2× с помощью DCM, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения желтого масла (164 мг). Этот материал очищали хроматографией на силикагеле (12 г, 0-100% EtOAc:гексаны) с получением второй партии промежуточного соединения ацетилсульфанильного эфира (19a') в виде бесцветного масла (68 мг).
4'-{5-[((R)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (19b'): Объединенные партии промежуточного соединения (19a') (114 мг, 182 мкмоль) растворяли в метиленхлориде (2,0 мл, 31 ммоль). Добавляли TFA (2,0 мл, 26 ммоль). Через 60 минут смесь концентрировали. Добавляли насыщенный бикарбонат (5 мл) и смесь экстрагировали 3× с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали с получением 90 мг неочищенного промежуточного соединения ацетилсульфанильной кислоты (19b').
Промежуточное соединение (19b') поглощали в MeOH (2,0 мл) и охлаждали до 0°C в атмосфере азота. Добавляли 0,50 M метоксид натрия в MeOH (729 мкл, 364 мкмоль). Через 30 минут смесь подкисляли с помощью 6 N HCl (90 мкл) и концентрировали. Продукт очищали препаративной HPLC с получением 4'-{2-этокси-4-этил-5-[((R)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты в виде белого твердого вещества соли TFA (59,4 мг; чистота 96,0%). Продукт анализировали по хиральной чистоте и обнаружили, что она составляет 99% э.и. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,2.
ПОЛУЧЕНИЕ 16
трет-Бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты
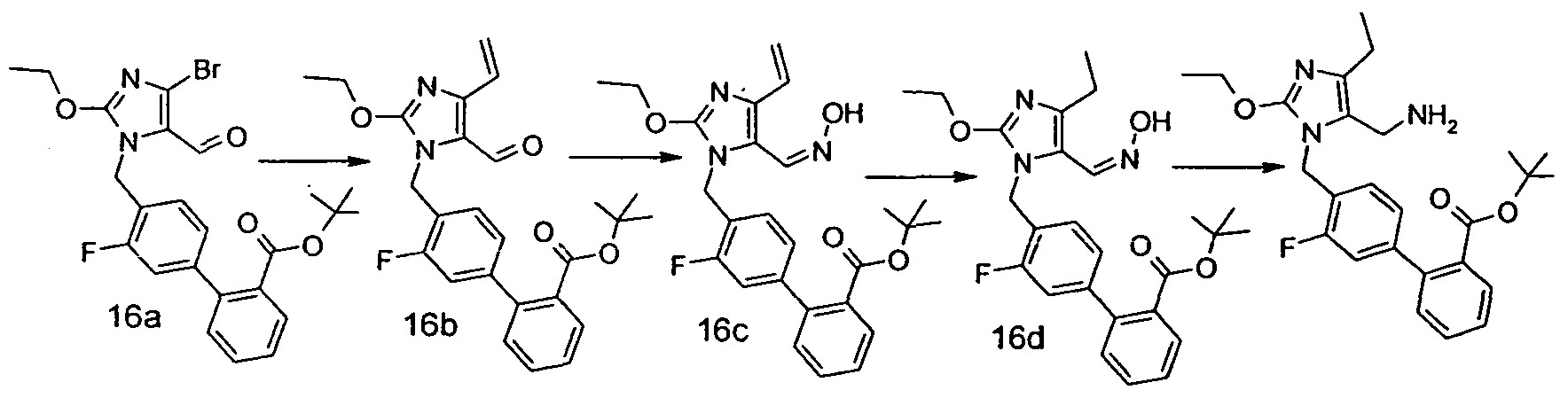
трет-Бутиловый эфир 4'-(4-бром-2-этокси-5-формилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (16a): 5-бром-2-этокси-3H-имидазол-4-карбальдегид (6,0 г, 27,4 ммоль), трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты (10,0 г, 27,4 ммоль) и карбонат калия (3,8 г, 27,4 ммоль) растворяли в DMF (383 мл, 4950 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию останавливали водой и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Полученный материал очищали хроматографией на силикагеле (0-30% EtOAc:гексаны), получая промежуточное соединение (16a) (9,5 г). MS m/z: [M+H+] рассчитано для C24H24BrFN2O4, 503,3; обнаружено 503,2. 1H-ЯМР (CDCl3): 9,57 (1H, с), 7,80 (1Н, д), 7,48 (2H, м), 7,27 (1Н, с), 7,11 (1Н, т), 7,01 (2H, д), 5,47 (2H, с), 4,33 (2H, кв), 1,41 (3H, т), 1,24 (9H, с).
трет-Бутиловый эфир 4'-(2-этокси-5-формил-4-винилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (16b): Промежуточное соединение (16a) (9,5 г, 18,9 ммоль), тетракис(трифенилфосфин)палладий(0) (1,0 г, 0,9 ммоль), (2-этенил)три-н-бутилолово (11,0 мл, 37,8 ммоль) растворяли в DMF (70 мл, 900 ммоль) и нагревали при 90°C в течение 1,5 часов. Смесь охлаждали до комнатной температуры и добавляли 300 мл EtOAc. Органический слой промывали с использованием 20% раствора фторида калия (2×100 мл) и насыщенного водного NaCl. Полученный материал очищали хроматографией на силикагеле (0-60% EtOAc:гексаны), получая промежуточное соединение (16b) (7,7 г). MS m/z: [M+H+] рассчитано для C26H27FN2O4, 451,2; обнаружено 451,0. 1H-ЯМР (CDCl3): 8,17 (1Н, с), 7,79 (1Н, д), 7,48 (1Н, т), 7,40 (1Н, т), 7,28 (1Н, с), 7,01 (2H, м), 6,86 (1Н, т), 6,67 (1Н, м), 5,95 (1Н, д), 5,41 (2H, с), 5,27 (1Н, д), 4,48 (2H, кв), 1,38 (3H, т), 1,25 (9H, с).
трет-Бутиловый эфир 4'-[2-этокси-5-(гидроксииминометил)-4-винилимидазол-1-илметил]-3'-фторбифенил-2-карбоновой кислоты (16c): Промежуточное соединение (16b) (7,7 г, 17,2 ммоль) растворяли в пиридине (40 мл, 500 ммоль). Добавляли гидрохлорид гидроксиламина (3,6 г, 51,5 ммоль) с последующим добавлением воды (20 мл, 1 моль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (50 мл) и смесь перемешивали в течение 20 минут. Преципитат отфильтровывали и высушивали, получая промежуточное соединение (16c) (7,8 г). MS m/z: [M+H+] рассчитано для C26H28FN3O4, 466,2; обнаружено 466,4. 1H-ЯМР (CDCl3): 9,78 (1Н, с), 7,81 (1Н, д), 7,48 (2H, м), 7,26 (1Н, с), 7,0 (4H, м), 6,20 (1Н, д), 5,53 (1Н, д), 5,50 (2H, с), 4,55 (2H, кв), 1,43 (3 H, т), 1,25 (9H, с).
трет-Бутиловый эфир 4'-[2-Этокси-4-этил-5-(гидроксииминометил)имидазол-1-илметил]-3'-фторбифенил-2-карбоновой кислоты (16d): Промежуточное соединение (16c) (7,8 г, 16,6 ммоль) растворяли в этаноле (420 мл, 7,2 моль). Добавляли катализатор Перлмана, влажный (0,1:0,4:0,5, гидроксид палладия:высокоочищенный углерод:вода, 6 г, 4 ммоль). Смесь дегазировали и перемешивали под водородом в течение 2 часов. Палладий отфильтровывали и растворитель концентрировали до получения промежуточного соединения (16d) (7,7 г). MS m/z: [M+H+] рассчитано для C26H30FN3O4, 468,2; обнаружено 468,4.
Промежуточное соединение (16d) (7,9 г, 16,8 ммоль), NaBH3CN (4,8 г, 75,7 ммоль) и ацетат аммония (2,9 г, 37,0 ммоль) растворяли в MeOH. Смесь охлаждали до 0°C и перемешивали в течение 15 минут перед добавлением хлорида титана (III) (7,8 г, 50,4 ммоль). Смесь перемешивали при 0°C в течение 10 минут, затем нагревали до комнатной температуры и перемешивали в течение 4 часов. Добавляли гидроксид аммония (75 мл), чтобы остановить реакцию, и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли 75 мл насыщенного бикарбоната натрия. Полученную смесь экстрагировали 4 раза с помощью DCM, высушивали над MgSO4, фильтровали и концентрировали. Полученный материал очищали хроматографией на силикагеле (0-10% MeOH в DCM) с получением названного в заголовке соединения (4,7 г). MS m/z: [M+H+] рассчитано для C26H32FN3O3, 454,3; обнаружено 454,4. 1H-ЯМР (CDCl3): 7,82 (1Н, д), 7,50 (1Н, т), 7,42 (1Н, т), 7,35 (1Н, д), 7,27 (1Н, д), 7,12 (1Н, с), 7,04 (1Н, д), 5,34 (1Н, ушир.), 4,65 (2H, с), 4,40 (2H, кв), 4,12 (2H, кв), 2,70 (1Н, ушир.), 1,50 (3H, т), 1,28 (9H, с), 1,17 (3H, т).
ПРИМЕР 20
трет-Бутиловый эфир 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (20a; R 1a = трет-бутил; R 5a = -C(O)CH 3 ); 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (20b; R 1a = H; R 5a = -C(O)CH 3 ); 4'-{2-этокси-4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (20c; R 1a =H; R 5a =H)
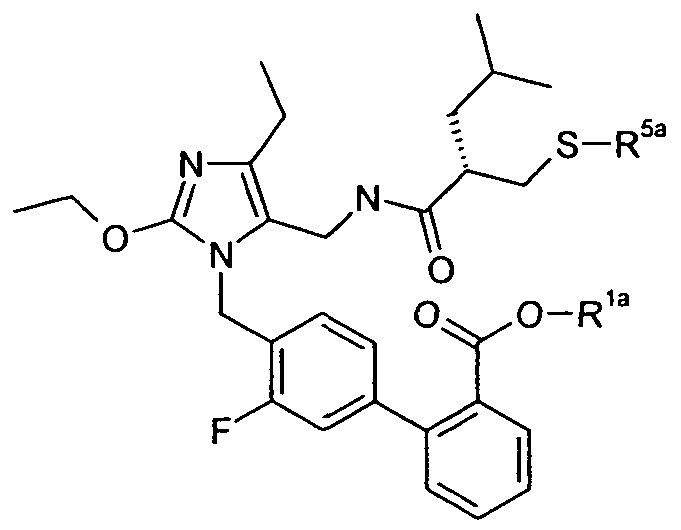
(S)-2-ацетилсульфанилметил-4-метилпентановую кислоту (2 г, 9,7 ммоль) растворяли в DMF (100 мл, 1000 ммоль). Добавляли HATU (3,7 г, 9,7 ммоль) и DIPEA (1,5 мл, 8,8 ммоль) и смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (4,0 г, 8,8 ммоль) в DMF (20 мл, 200 ммоль) с DIPEA (1,5 мл, 8,8 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали водой и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения промежуточного соединения ацетилсульфанильного эфира (20a). Это промежуточное соединение поглощали в DCM:TFA (4 мл каждого), перемешивали при комнатной температуре в течение 4 часов и затем концентрировали до получения промежуточного соединения ацетилсульфанильной кислоты (20b). Это промежуточное соединение растворяли в 1:1 MeOH:1 N NaOH (4 мл каждого) и перемешивали при комнатной температуре в атмосфере азота в течение 1 часа перед остановкой реакции уксусной кислотой и концентрированием смеси. Осадок очищали препаративной HPLC (10-70% MeCN в воде с 0,05% TFA) с получением конечного продукта (20c) (2,8 г; чистота 98%). MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,2; обнаружено 542,4. 1H-ЯМР (DMSO): 8,39 (1Н, с), 7,75 (1Н, д), 7,58 (1Н, т), 7,45 (1Н, т), 7,34 (1Н, д), 7,19 (1Н, д), 7,10 (2H, м), 5,16 (2H, с), 4,43 (2H, м), 4,18 (2H, м), 2,58 (2H, м), 2,41 (1Н, м), 2,32 (2H, м), 2,10 (1Н, т), 1,24 (8H, м), 0,78 (6H, дд).
ПОЛУЧЕНИЕ 17
трет-Бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)бифенил-2-карбоновой кислоты
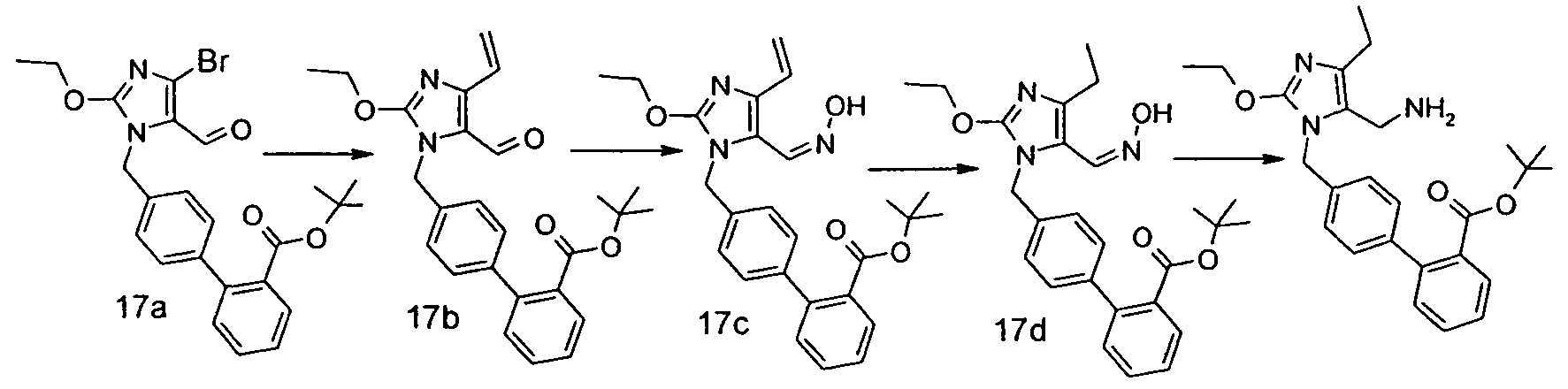
трет-Бутиловый эфир 4'-(4-бром-2-этокси-5-формилимидазол-1-илметил)бифенил-2-карбоновой кислоты (17a): 5-бром-2-этокси-3H-имидазол-4-карбальдегид (3,0 г, 13,7 ммоль), трет-бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты (4,8 г, 13,7 ммоль) и карбонат калия (1,9 г, 13,7 ммоль) растворяли в DMF (60 мл, 780 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали водой и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали. Полученный материал очищали хроматографией на силикагеле (0-30% EtOAc:гексаны), получая промежуточное соединение (17a) (5,6 г). MS m/z: [M+H+] рассчитано для C24H25BrN2O4, 485,1; обнаружено 485,3. 1H-ЯМР (CDCl3): 9,58 (1Н, с), 7,80 (1Н, д), 7,50 (1Н, т), 7,40 (1Н, т), 7,30 (5H, м), 5,42 (2H, с), 4,57 (2H, кв), 1,46 (3H, т), 1,18 (9H, с).
трет-Бутиловый эфир 4'-(2-этокси-5-формил-4-винилимидазол-1-илметил)бифенил-2-карбоновой кислоты (17b): Промежуточное соединение (17a) (5,6 г, 11,5 ммоль), тетракис(трифенилфосфин)палладий(0) (2,1 г, 1,8 ммоль) и (2-этенил)три-н-бутилолово (13,5 мл, 46,2 ммоль) растворяли в DMF (70 мл, 900 ммоль) и нагревали при 90°C в течение 1,5 часов. Смесь охлаждали до комнатной температуры и добавляли 300 мл EtOAc. Органический слой промывали с использованием 20% раствора фторида калия (2×100 мл) и насыщенного водного NaCl. Полученный материал очищали хроматографией на силикагеле (0-60% EtOAc:гексаны), получая промежуточное соединение (17b) (4,3 г). MS m/z: [M+H+] рассчитано для C26H28N2O4, 433,2; обнаружено 433,4.
трет-Бутиловый эфир 4'-[2-этокси-5-(гидроксииминометил)-4-винилимидазол-1-илметил]бифенил-2-карбоновой кислоты (17c): Промежуточное соединение (17b) (4,3 г, 10 ммоль) растворяли в пиридине (40 мл, 500 ммоль). Добавляли гидрохлорид гидроксиламина (1,7 г, 25 ммоль) с последующим добавлением воды (20 мл, 1000 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (30 мл) и смесь перемешивали в течение 20 минут. Преципитат отфильтровывали и высушивали, получая промежуточное соединение (17c) (3,5 г). MS m/z: [M+H+] рассчитано для C26H29N3O4, 448,2; обнаружено 448,3.
трет-Бутиловый эфир 4'-[2-этокси-4-этил-5-(гидроксииминометил)имидазол-1-илметил]бифенил-2-карбоновой кислоты (17d): Промежуточное соединение (17c) (3,5 г, 7,7 ммоль) растворяли в этаноле (100 мл, 2 моль). Добавляли катализатор Перлмана, влажный (0,1:0,4:0,5, гидроксид палладия: высокоочищенный углерод:вода, 660 мг). Смесь дегазировали и перемешивали при комнатной температуре под водородом в течение 3 часов. Палладий отфильтровали и раствор концентрировали до получения промежуточного соединения (17d) (3,3 г). MS m/z: [M+H+] рассчитано для C26H31N3O4, 450,2; обнаружено 450,3.
Промежуточное соединение (17d) (3,5 г, 7,7 ммоль), NaBH3CN (1,9 г, 30,5 ммоль) и ацетат аммония (1150 мг, 14,9 ммоль) растворяли в MeOH (30 мл, 700 ммоль). Смесь охлаждали до 0°C и перемешивали в течение 15 минут перед добавлением хлорида титана(III) (3,1 г, 20,3 ммоль). Смесь перемешивали при 0°C в течение 10 минут, затем нагревали до комнатной температуры и перемешивали в течение 3 часов. Добавляли гидроксид аммония (75 мл) и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли 75 мл насыщенного бикарбоната натрия. Полученную смесь экстрагировали с помощью DCM и органический слой сушили над MgSO4, фильтровали и концентрировали с получением названного в заголовке соединения (2,5 г). MS m/z: [M+H+] рассчитано для C26H33N3O3, 436,3; обнаружено 436,6.
ПРИМЕР 21
трет-Бутиловый эфир 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}бифенил-2-карбоновой кислоты (21a; R 1a = трет-бутил; R 5a = -C(O)CH 3 ); 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}бифенил-2-карбоновая кислота (21b; R 1a = H; R 5a = -C(O)CH 3 ); 4'-{2-этокси-4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота (21c; R 1a =H; R 5a =H)
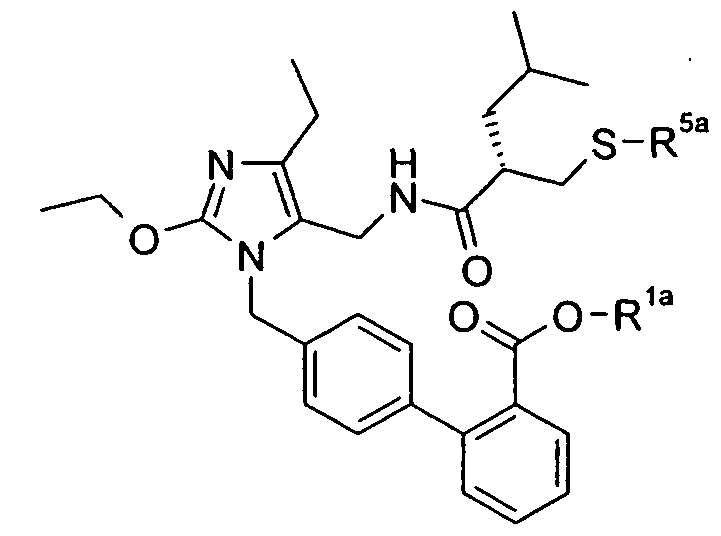
(S)-2-ацетилсульфанилметил-4-метилпентановую кислоту (1,0 г, 5,1 ммоль) растворяли в DMF (50 мл, 600 ммоль). Добавляли HATU (1,8 г, 4,8 ммоль) и DIPEA (800 мкл, 4,6 ммоль), и смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-этокси-4-этилимидазол-1-илметил)бифенил-2-карбоновой кислоты (2,0 г, 4,6 ммоль) в DMF (25 мл, 300 ммоль) с DIPEA (800 мкл, 4,6 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакцию останавливали водой и смесь экстрагировали с помощью EtOAc, промывали насыщенным водным NaCl, высушивали над MgSO4, фильтровали и концентрировали до получения ацетилсульфанильного эфира промежуточного соединения (21a). Это промежуточное соединение поглощали в DCM:TFA (4 мл каждого), перемешивали при комнатной температуре в течение 4 часов, затем концентрировали до получения промежуточного соединения ацетилсульфанильной кислоты (21b). Это промежуточное соединение растворяли в 1:1 MeOH:1 N NaOH (5 мл каждого) и перемешивали при комнатной температуре в атмосфере азота в течение 1 часа перед останавкой реакции уксусной кислотой и концентрированием смеси. Осадок очищали препаративной HPLC (10-70% MeCN в воде с 0,05% TFA) с получением конечного продукта (20c) (822 мг). MS m/z: [M+H+] рассчитано для C29H37N3O4S, 524,6; обнаружено 524,4. 1H-ЯМР (DMSO): 8,33 (1Н, с), 7,65 (1Н, д), 7,49 (1Н, т), 7,38 (1Н, т), 7,24 (3H, м), 7,16 (2H, д), 5,05 (2H, с), 4,41 (2H, д), 4,10 (2H, м), 2,41 (3H, м), 2,29 (1Н, м), 2,06 (1Н, т), 1,20 (8H, м), 0,74 (6H, дд).
ПОЛУЧЕНИЕ 18
трет-Бутиловый эфир 4'-(5-аминометил-2-пропокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты
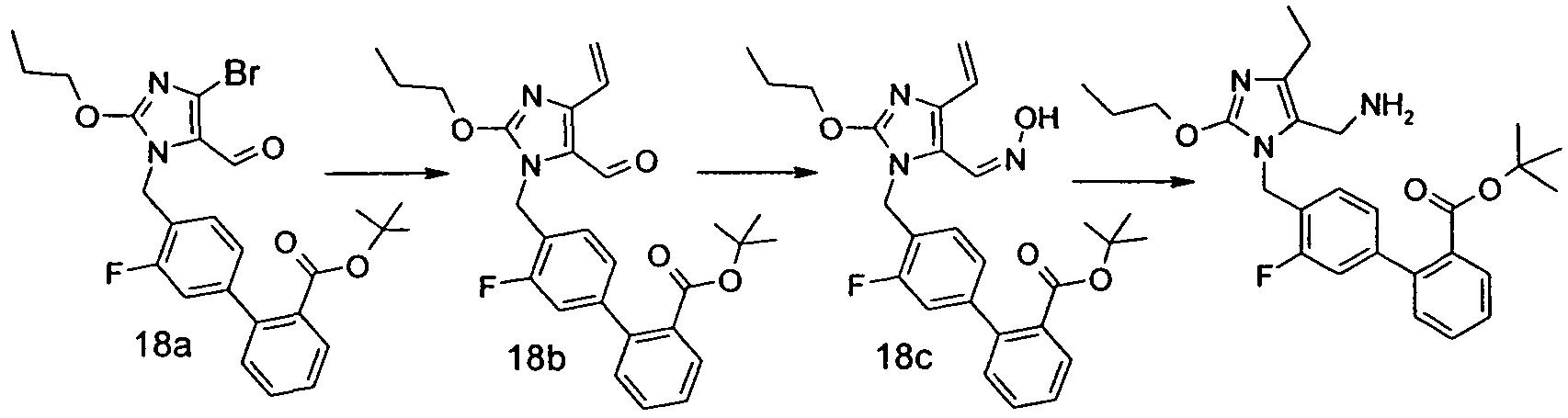
трет-Бутиловый эфир 4'-(4-бром-2-пропокси-5-формилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (18a): Бром-2-пропокси-3H-имидазол-4-карбальдегид (4,5 г, 19,3 ммоль), трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты (7,1 г, 19,5 ммоль) и карбонат калия (8,0 г, 57,9 ммоль) растворяли в DMF (100 мл). Раствор перемешивали при комнатной температуре в течение ночи. Реакцию останавливали водой, экстрагировали с помощью 200 мл EtOAc, промывали 4×100 мл насыщенного водного NaCl, высушивали над MgSO4, фильтровали и концентрировали в вакууме, получая промежуточное соединение (18a) в виде бесцветного масла (10 г), которое использовали без дополнительной очистки. Время удержания при аналитической HPLC = 5,0 минут. Условия градиента: 25% растворитель B/75% растворитель A - 95% растворитель B/5% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C25H26BrFN2O4, 517,11; обнаружено 555,2, [M+K+] 1H-ЯМР (CDCl3) 9,55 (1Н, с), 7,77 (1Н, д), 7,46 (2H, м), 7,41 (2H, м), 7,12 (1Н, т), 6,99 (2H, д), 5,45 (2H, с), 1,78 (2H, м), 1,28 (2H, м), 1,24 (9H, с), 0,98 (3H, с).
трет-Бутиловый эфир 4'-(2-пропокси-5-формил-4-винилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (18b): промежуточное соединение (18a) (10,0 г, 19,3 ммоль) растворяли в DMF (100 мл). Добавляли тетракис(трифенилфосфин)палладий(0) (400 мг, 0,4 ммоль), затем (2-этенил)три-н-бутилолово (8,5 мл, 29,0 ммоль). Реакционный сосуд оборудовали обратным холодильником и нагревали до 110°C с перемешиванием в течение 1 часа, в атмосфере азота. Смесь охлаждали и добавляли 200 мл EtOAc. Органический слой промывали 20% раствором фторида калия (2×50 мл), затем насыщенным водным NaCl (100 мл), затем высушивали над MgSO4, фильтровали и концентрировали в вакууме. Полученный материал очищали хроматографией на силикагеле (0-80% EtOAc:гексаны), получая промежуточное соединение (18b) в виде бесцветного масла (7,2 г). Время удержания при аналитической HPLC = 4,9 минут. Условия градиента: 25% растворитель B/75% растворитель A - 95% растворитель B/5% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C27H29FN2O4, 465,22; обнаружено 465,6.
трет-Бутиловый эфир 4'-[2-пропокси-5-(гидроксииминометил)-4-винилимидазол-1-илметил]-3'-фторбифенил-2-карбоновой кислоты (18c): Промежуточное соединение (18b) (7,2 г, 15,5 ммоль) растворяли в пиридине (30 мл). Добавляли гидрохлорид гидроксиламина (4,0 г, 57,9 ммоль), затем воду (20 мл) и смесь перемешивали при 40°C в течение 2 часов. Реакцию останавливали водой, экстрагировали с помощью 200 мл EtOAc, промывали с помощью 3×100 мл 1 М фосфорной кислоты, 1×100 мл насыщенного раствора бикарбоната натрия и 2×100 мл насыщенного водного NaCl, затем высушивали над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (0-80% EtOAc:гексаны), получая промежуточное соединение (18c) в виде белого твердого вещества (7,4 г). Время удержания при аналитической HPLC = 4,9 минут. Условия градиента: 25% растворитель B/75% растворитель A - 95% растворитель B/5% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C27H30FN3O4, 480,23; обнаружено 480,4. 1H-ЯМР (DMSO-d6) 10,99 (1Н, с), 8,21 (1Н, с), 7,67 (1Н, д), 7,54 (1Н, м), 7,44 (1Н, с), 7,34 (1Н, м), 7,11 (2H, м), 6,81 (2H, м), 5,73 (1Н, д), 5,36 (2H, с), 5,10 (1Н, д), 1,66 (2H, м), 1,13 (9H, с), 0,85 (4H, м).
Промежуточное соединение (18c) (7,4 г, 15,0 ммоль) растворяли в EtOAc (200 мл) с последующим добавлением серной кислоты (1,50 мл). Затем добавляли 10% Pd/C, типа Degussa, влажность 50% (0,05:0,45:0,5, палладий:высокоочищенный углерод:вода, 16,0 г), смесь дегазировали с помощью азота и затем перемешивали при комнатной температуре под водородом в течение 2 часов. Затем смесь дегазировали с помощью азота, палладий отфильтровали в атмосфере азота и полученный материал концентрировали с получением названного в заголовке соединения в виде бледно-желтого масла (6,5 г). Время удержания при аналитической HPLC = 3,2 минуты. Условия градиента: 10% растворитель B/90% растворитель A - 90% растворитель B/10% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C27H34FN3O3, 468,27; обнаружено 468,4. 1H-ЯМР (DMSO-d6) 7,67 (1Н, д), 7,54 (1Н, т), 7,33 (1Н, т), 7,10 (1Н, д), 7,03 (2H, д), 6,87 (1Н, с), 5,08 (1Н, с), 4,12 (2H, м), 4,00 (2H, с), 3,99 (2H, с), 3,48 (2H, с), 2,32 (2H, м), 1,62 (3H, м), 1,14 (9H, с), 0,85 (3H, т).
ПРИМЕР 22
трет-Бутиловый эфир 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-4-этил-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (22a; R1a = трет-бутил; R5a = -C(O)CH 3 ); 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-4-этил-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (22b; R 1a = H; R 5a = -C(O)CH 3 ); 4'-{4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота · C 2 HF 3 O 2 (22c; R 1a =H; R 5a =H)
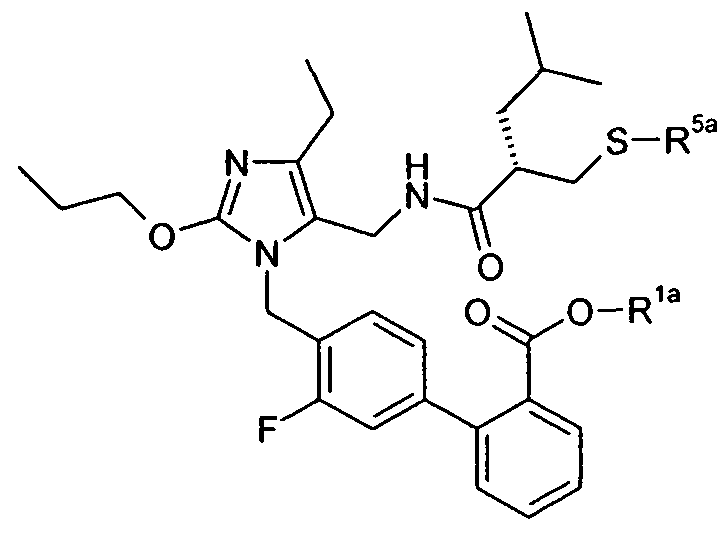
HATU (3,1 г, 8,2 ммоль) добавляли к раствору (S)-2-ацетилсульфанилметил-4-метилпентановой кислоты (1,7 г, 8,2 ммоль) в DMF (60 мл) и перемешивали в течение 5 минут при комнатной температуре. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-пропокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (3,5 г, 7,5 ммоль) в виде раствора в DMF (5 мл) с последующим добавлением DIPEA (2,6 мл, 15,0 ммоль). Смесь перемешивали в течение 15 минут, затем добавляли 200 мл EtOAc. Органический слой промывали с помощью 4×100 мл насыщенного водного NaCl, высушивали над MgSO4 в течение 10 минут, фильтровали и выпаривали досуха в вакууме. Затем материал концентрировали и полученное неочищенное твердое вещество очищали хроматографией на силикагеле (EtOAc/гексаны, 10-70% EtOAc), получая промежуточное соединение ацетилсульфанильного эфира (22a). Время удержания при аналитической HPLC = 4,4 минуты. Условия градиента: 10% растворитель B/90% растворитель A - 90% растворитель B/10% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C36H48FN3O5S, 654,34; обнаружено 654,5.
4N HCl в диоксане (10 мл) добавляли к промежуточному соединению (22a) и смесь перемешивали в течение ночи при комнатной температуре. Летучие компоненты удаляли в вакууме, получая промежуточное соединение ацетилсульфанильной кислоты (22b) в виде оранжевого масла, которое использовали без дополнительной очистки. Время удержания при аналитической HPLC = 3,9 минуты. Условия градиента: 10% растворитель B/90% растворитель A - 90% растворитель B/10% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C32H40FN3O5S, 598,28; обнаружено 598,5.
10 N NaOH (2,0 мл) добавляли к метанольному (50 мл) раствору промежуточного соединения (22b). Раствор перемешивали при комнатной температуре в течение 30 минут в атмосфере азота, после чего добавляли уксусную кислоту (2,0 мл). Раствор концентрировали и очищали препаративной HPLC (обращенно-фазовой): градиент 20-65% (в течение 60 минут); скорость потока 15 мл/мин; детекция при 280 нм. Очищенные фракции объединяли и лиофилизировали в 50/50 воде/MeCN с получением конечного продукта (22c) в виде белого твердого вещества соли TFA (1,4 г). Время удержания при аналитической HPLC = 3,9 минуты. Условия градиента: 10% растворитель B/90% растворитель A - 90% растворитель B/10% растворитель A в течение 6 минут. MS m/z: [М+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,2. 1H-ЯМР (d4-MeOH) 8,57 (1Н, т), 7,86 (1Н, д), 7,55 (1Н, т), 7,46 (1Н, т), 7,32 (1Н, д), 7,22 (2H, т), 7,12 (2H, м), 5,32 (1Н, с), 4,42 (2H, м), 4,3-4,4 (1H, м), 2,73 (2H, м), 2,55 (2H, м), 2,42 (1Н, м), 1,80 (2H, м), 1,48 (2H, м), 1,26 (2H, м), 0,94 (3H, т), 0,86 (3H, м).
ПРИМЕР 23
трет-Бутиловый эфир 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-4-этил-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты (23a; R 1a = трет-бутил; R 5a = -C(O)CH 3 ); 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-4-этил-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота (23b; R 1a = H; R 5a = -C(O)CH 3 ); 4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота · C 2 HF 3 O 2 (23c; R 1a =H; R 5a =H)
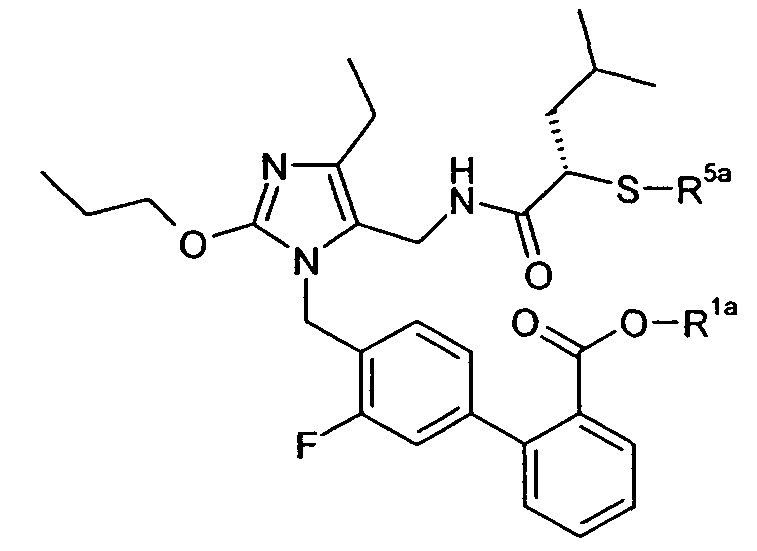
HATU (4,3 г, 11,3 ммоль) добавляли к раствору (S)-2-ацетилсульфанил-4-метилпентановой кислоты (2,2 г, 11,3 ммоль) в DMF (80 мл) и перемешивали в течение 5 минут при комнатной температуре. Добавляли трет-бутиловый эфир 4'-(5-аминометил-2-пропокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (4,8 г, 10,3 ммоль) в виде раствора в DMF (5 мл), затем DIPEA (3,6 мл, 20,5 ммоль). Смесь перемешивали в течение 15 минут, затем добавляли 200 мл EtOAc. Органический слой промывали с помощью 4×100 мл насыщенного водного NaCl, высушивали над MgSO4 в течение 10 минут, фильтровали и выпаривали досуха. Смесь концентрировали и полученное неочищенное твердое вещество очищали флэш-хроматографией (EtOAc/гексаны, 10-70% EtOAc), получая промежуточное соединение ацетилсульфанильного эфира (23a). Время удержания при аналитической HPLC = 3,4 минуты. Условия градиента: 25% растворитель B/75% растворитель A - 95% растворитель B/5% растворитель A в течение 6 минут. MS m/z: [M+Н+] рассчитано для C35H46FN3O5S, 640,32; обнаружено 640,0.
4 N HCl в диоксане (10 мл) добавляли к промежуточному соединению (23a), и смесь перемешивали в течение ночи при комнатной температуре. Летучие компоненты удаляли в вакууме, получая промежуточное соединение ацетилсульфанильной кислоты (23b) в виде оранжевого масла, которое использовали без дополнительной очистки. Время удержания при аналитической HPLC = 2,9 минуты. Условия градиента: 25% растворитель B/75% растворитель A - 95% растворитель B/5% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C31H38FN3O5S, 584,26; обнаружено 584,0.
10 N NaOH (2,0 мл) добавляли к метанольному (50 мл) раствору промежуточного соединения (23b). Раствор перемешивали при комнатной температуре в течение 30 минут в атмосфере азота, после чего добавляли уксусную кислоту (2,0 мл). Раствор концентрировали и очищали препаративной HPLC (обращенно-фазовой): градиент 20-65% (в течение 60 минут); скорость потока 15 мл/мин; детекция при 280 нм. Очищенные фракции объединяли и лиофилизировали в 50/50 воде/MeCN с получением конечного продукта (23c) в виде белой твердой соли TFA (1,0 г). Время удержания при аналитической HPLC = 3,9 минуты. Условия градиента: 10% растворитель B/90% растворитель A - 90% растворитель B/10% растворитель A в течение 6 минут. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,25; обнаружено 542,6. 1H-ЯМР (d4-MeOH) 8,53 (1Н, т), 7,86 (1Н, д), 7,56 (1Н, т), 7,46 (1Н, т), 7,32 (1Н, д), 7,20 (2H, т), 7,12 (2H, м), 5,29 (1Н, с), 4,42 (2H, м), 4,3-4,4 (1Н, м), 2,73 (2H, м), 2,55 (2H, м), 1,80 (2H, м), 1,48 (2H, м), 1,26 (2H, м), 0,94 (3 H, т), 0,86 (3H, м).
ПРИМЕР 24
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 24-1 - 24-3, обладающие следующей формулой:
|
(24-1) 2,3-дифтор-4-{5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C21H27F2N3O4S, 456,17; обнаружено 456,2.
(24-2) 4-{2-этокси-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2,3-дифторбензойная кислота. MS m/z: [M+H+] рассчитано для C21H27F2N3O4S, 456,17; обнаружено 456,2.
(24-3) 2,3-дифтор-4-{5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бензойная кислота. MS m/z: [M+H+] рассчитано для C22H29F2N3O4S, 470,18; обнаружено 470,4.
ПРИМЕР 25
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 25-1 - 25-70, обладающие следующей формулой, где, необязательно, присутствуют одна или две группы R.
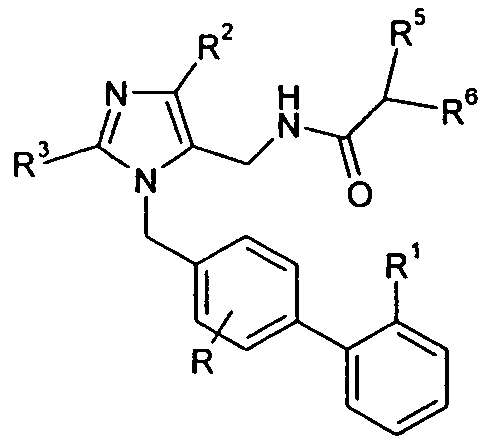
|
|
|
|
(25-1) 4'-{5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H35N3O4S, 510,24; обнаружено 510,5.
(25-2) 4'-{2-этокси-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [М+H+] рассчитано для C27H33N3O4S, 496,22; обнаружено 496,3.
(25-3) 4'-{4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H39N3O4S, 538,27; обнаружено 538,5.
(25-4) 4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H37N3O4S, 524,25; обнаружено 524,6.
(25-5) 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H35N3O4S, 510,24; обнаружено 510,5.
(25-6) [3-(2'-ацетилсульфамоилбифенил-4-илметил)-2-пропокси-3H-имидазол-4-илметил]амид (S)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H38N4O5S2, 587,23; обнаружено 587,5.
(25-7) [3-(2'-ацетилсульфамоилбифенил-4-илметил)-5-этил-2-пропокси-3H-имидазол-4-илметил]амид (S)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C31H42N4O5S2, 615,26; обнаружено 615,4.
(25-8) (S)-N-((1-((2'-(N-(этилкарбамоил)сульфамоил)бифенил-4-ил)метил)-2-пропокси-1H-имидазол-5-ил)метил)-2-(меркаптометил)-4-метилпентанамид. MS m/z: [M+H+] рассчитано для C30H41N5O5S2, 616,26; обнаружено 616,4.
(25-9) 4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,6.
(25-10) 4'-{4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,2.
(25-11) 4'-{4-этил-5-[((R)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,6.
(25-12) 4'-{4-этил-5-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,2.
(25-13) 2'-хлор-4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O4S, 558,21; обнаружено 558,2.
(25-14) 3'-хлор-4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36ClN3O4S, 558,21; обнаружено 558,4.
(25-15) 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H39N3O5S, 566,26; обнаружено 566,6.
(25-16) 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36FN3O5S, 570,24; обнаружено 570,4.
(25-17) 4'-{2-этокси-4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,6.
(25-18) 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,4.
(25-19) 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-4-этил-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H38FN3O5S, 584,25; обнаружено 584,0.
(25-20) 4'-{4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,4.
(25-21) 4'-{4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C27H32FN3O4S, 514,21; обнаружено 514,6.
(25-22) 4'-{5-[(2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36FN3O5S, 570,24; обнаружено 570,4.
(25-23) 4'-{5-[((S)-2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H38FN3O5S, 584,25; обнаружено 584,5.
(25-24) 4'-{4-циклопропил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H37N3O4S, 536,25; обнаружено 536,4.
(25-25) 4'-{4-циклопропил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H39N3O4S, 550,27; обнаружено 550,4.
(25-26) 4'-{4-циклопропил-2-этокси-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H37N3O4S, 536,25; обнаружено 536,4.
(25-27) 4'-{5-[((S)-3-циклопропил-2-меркаптопропиониламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H32FN3O4S, 526,21; обнаружено 526,4.
(25-28) 4'-{4-циклопропил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36FN3O4S, 554,24; обнаружено 554,2.
(25-29) [2-этокси-5-этил-3-(3-фтор-2'-трифторметансульфониламинобифенил-4-илметил)-3H-имидазол-4-илметил]амид (S)-2-меркапто-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C28H34F4N4O4S2, 631,20; обнаружено 631,4.
(25-30) [3-(2'-ацетилсульфамоилбифенил-4-илметил)-2-этокси-5-этил-3H-имидазол-4-илметил]амид (S)-2-меркапто-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H38N4O5S2, 587,23; обнаружено 587,2.
(25-31) [3-(2'-ацетилсульфамоил-3-фторбифенил-4-илметил)-5-этил-2-метокси-3H-имидазол-4-илметил]амид (S)-2-меркаптометил-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C29H37FN4O5S2, 605,22; обнаружено 605,4.
(25-32) 4'-{2-этокси-4-этил-5-[((S)-2-меркаптопентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C27H32FN3O4S, 514,21; обнаружено 514,4.
(25-33) 4'-{2-этокси-4-этил-5-[(2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 529,0.
(25-34) 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4,4-диметилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,4.
(25-35) 4'-{5-[((S)-2-бензоилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C35H38FN3O5S, 632,25; обнаружено 632,4.
(25-36) 4'-(2-этокси-4-этил-5-{[(S)-4-метил-2-(2-морфолин-4-ил-ацетилсульфанил)пентаноиламино]метил}имидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+Н+] рассчитано для C34H43FN4O6S, 655,29; обнаружено 655,6.
(25-37) 4'-(2-этокси-4-этил-5-{[(S)-4-метил-2-(3-морфолин-4-илпропионилсульфанил)пентаноиламино]метил}имидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C35H45FN4O6S, 669,30; обнаружено 669,5.
(25-38) 4'-{2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-4-метилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C27H33N3O4S, 496,22; обнаружено 496,6.
(25-39) 4'-{2-этокси-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-4-метилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H35N3O4S, 510,24; обнаружено 510,6.
(25-40) 4'-{2-этокси-4-этил-5-[((S)-2-меркаптобутириламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C26H30FN3O4S, 500,19; обнаружено 500,4.
(25-41) 4'-{2-этокси-4-этил-5-[((2S,3S)-2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,4.
(25-42) 4'-{2-этокси-4-этил-5-[((S)-4-метил-2-пропионилсульфанилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H38FN3O5S, 584,25; обнаружено 584,2.
(25-43) 4'-{2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-4-метилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C27H32FN3O4S, 514,21; обнаружено 514,6.
(25-44) 4'-{2-этокси-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-4-метилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,2.
(25-45) 4'-{5-[((S)-3-циклопентил-2-меркаптопропиониламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H36FN3O4S, 554,24; обнаружено 554,4.
(25-46) 4'-{4-циклопропил-2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35N3O4S, 522,24; обнаружено 522,4.
(25-47) 4'-{2-бутил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-4-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,2.
(25-48) 4'-{2-бутил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-4-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,2.
(25-49) 4'-{2-бутил-5-[((2S,3S)-2-меркапто-3-метилпентаноиламино)метил]-4-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H36FN3O4S, 542,24; обнаружено 542,2.
(25-50) 4'-{2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35ClFN3O3S, 560,21; обнаружено 560,2.
(25-51) 4'-{4-циклопропил-2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+Н+] рассчитано для C29H34FN3O4S, 540,23; обнаружено 540,4.
(25-52) 4'-[2-этокси-4-этил-5-({2-[(формилгидроксиамино)метил]-4-метилпентаноиламино}метил)имидазол-1-илметил]-3'-фторбифенил-2-карбоновая кислота. MS m/z: [М+H+] рассчитано для C30H37FN4O6, 569,27; обнаружено 569,6.
(25-53) 4'-(5-{[2-бензил-3-(формилгидроксиамино)пропиониламино]метил}-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C33H35FN4O6, 603,25; обнаружено 603,4.
(25-54) 4'-{2-бутил-4-хлор-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H33ClFN3O3S, 546,19; обнаружено 546,6.
(25-55) 4'-{2-бутил-4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35ClFN3O3S, 560,21; обнаружено 560,2.
(25-56) 4'-{2-этокси-4-гидроксиметил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C27H32FN3O5S, 530,20; обнаружено 530,4.
(25-57) 4'-{2-этокси-4-гидроксиметил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+Н+] рассчитано для C28H34FN3O5S, 544,22; обнаружено 544,4.
(25-58) {2-этокси-5-этил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркапто-4-метилпентановой кислоты. MS m/z: [M+H+] рассчитано для C28H35N7O2S, 534,26; обнаружено 534,4.
(25-59) 3'-фтор-4'-{4-(1-гидрокси-1-метилэтил)-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,4.
(25-60) 3'-фтор-4'-{4-(1-гидрокси-1-метилэтил)-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H40FN3O4S, 570,27; обнаружено 570,4.
(25-61) 4'-{2-этокси-4-этил-5-[(2-меркапто-4-фенилбутириламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H34FN3O4S, 576,23; обнаружено 576,4.
(25-62) 4'-{2-этокси-4-этил-5-[((2S,3R)-2-меркапто-3-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H34FN3O4S, 528,23; обнаружено 528,4.
(25-63) 4'-{2-этокси-4-этил-5-[(2-меркапто-2-фенилацетиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H30FN3O4S, 548,19; обнаружено 548,4.
(25-64) 4'-(5-{[2-(2-хлорфенил)-2-меркаптоацетиламино]метил}-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H29ClFN3O4S, 582,16; обнаружено 582,2.
(25-65) 4'-{5-[((S)-3-циклогексил-2-меркаптопропиониламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C31H38FN3O4S, 568,26; обнаружено 568,4.
(25-66) 4'-{5-[((S)-2-циклопентил-2-меркаптоацетиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H34FN3O4S, 540,23; обнаружено 540,4.
(25-67) 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-4-хлор-2-этоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C28H31ClFN3O5S, 576,17; обнаружено 576,4.
(25-68) 4'-{2-этокси-4-этил-5-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C32H33FN4O6, 589,24; обнаружено 589,4.
(25-69) 4'-{2-этокси-4-этил-5-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H35FN4O6, 555,25; обнаружено 555,2.
(25-70) 4'-{5-[((S)-3-циклобутил-2-меркаптопропиониламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H34FN3O4S, 540,23; обнаружено 540,5.
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, можно также легко получить соединения 25-71 - 25-95.
|
|
(25-71) 4'-{4-хлор-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-72) 4'-{4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропилимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-73) 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-2',5'-дифторбифенил-2-карбоновая кислота.
(25-74) 4'-{2-этокси-4-этил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-2',5'-дифторбифенил-2-карбоновая кислота.
(25-75) 4'-{2-этокси-4-фторметил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-76) 4'-{2-этокси-4-фторметил-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-77) 4'-{2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-4-трифторметилимидазол-1-илметил}бифенил-2-карбоновая кислота.
(25-78) 4'-{4-бром-2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}бифенил-2-карбоновая кислота.
(25-79) S-[(S)-1-({2-этокси-5-этил-3-[2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}карбамоил)-3-метилбутил]эфир тиоуксусной кислоты.
(25-80) {5-хлор-2-этокси-3-[3-фтор-2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркапто-4-метилпентановой кислоты.
(25-81) {5-циклопропил-2-этокси-3-[3-фтор-2'-(1H-тетразол-5-ил)бифенил-4-илметил]-3H-имидазол-4-илметил}амид (S)-2-меркапто-4-метилпентановой кислоты.
(25-82) 4'-{4-хлор-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-83) 4'-{4-хлор-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-84) 4'-{4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-метоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-85) 4'-{4-хлор-5-[((S)-2-меркаптометил-4-метилпентаноиламино)метил]-2-пропоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-86) метиловый эфир 4'-{5-[((S)-2-ацетилсульфанил-4-метилпентаноиламино)метил]-2-этокси-4-этилимидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты.
(25-87) метиловый эфир 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты.
(25-88) [2-этокси-5-этил-3-(3-фтор-2'-трифторметансульфониламинокарбонилбифенил-4-илметил)-3H-имидазол-4-илметил]амид (S)-2-меркапто-4-метилпентановой кислоты.
(25-89) 4'-{2-этокси-4-этил-5-[((R)-2-меркапто-3-фенилпропиониламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-90) 4'-{2-этокси-4-этил-5-[(4,4,4-трифтор-2-меркаптобутириламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-91) 4'-{2-этокси-4-этил-5-[(5,5,5-трифтор-2-меркаптопентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота.
(25-92) 4'-(2-этокси-4-этил-5-{[2-(2-фторфенил)-2-меркаптоацетиламино]метил}-имидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота.
(25-93) 4'-(5-{[3-(4-хлорфенил)-2-меркаптопропиониламино]метил}-2-этокси-4-этилимидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота.
(25-94) 4'-(2-этокси-4-этил-5-{[3-(2-фторфенил)-2-меркаптопропиониламино]метил}имидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота.
(25-95) 4'-(2-этокси-4-этил-5-{[3-(3-фторфенил)-2-меркаптопропиониламино]метил}имидазол-1-илметил)-3'-фторбифенил-2-карбоновая кислота.
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, можно также легко получить соединение 25-96:
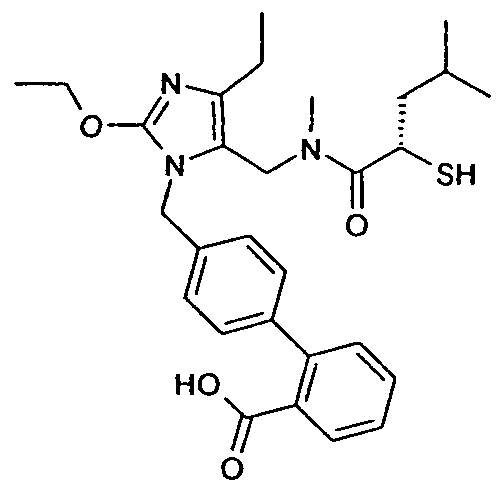
(25-96) 4'-(2-этокси-4-этил-5-{[((S)-2-меркапто-4-метилпентаноил)метиламино]метил}имидазол-1-илметил)бифенил-2-карбоновая кислота.
ПРИМЕР 26
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 26-1 - 26-10, обладающие следующей формулой:
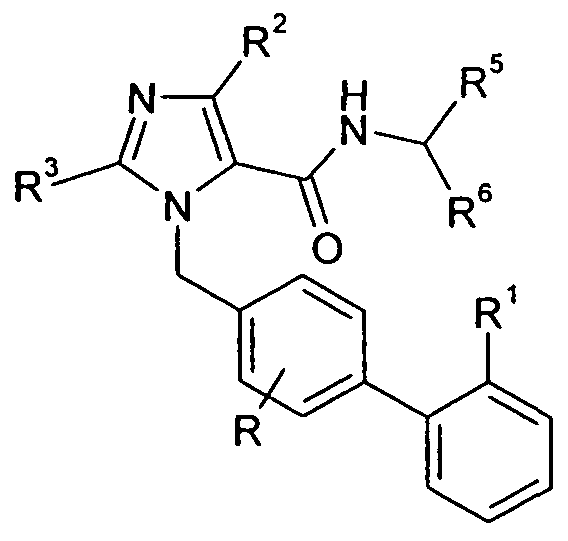
|
(26-1) ((R)-1-бензил-2-меркаптоэтил)амид 3-(2'-ацетилсульфамоил-3-фторбифенил-4-илметил)-2-этокси-3H-имидазол-4-карбоновой кислоты. MS m/z: [M+H+] рассчитано для C30H31FN4O5S2, 611,17; обнаружено 611,4.
(26-2) 4'-{5-[(R)-1-(3,5-дифторбензил)-2-меркаптоэтилкарбамоил]-2-этоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H26F3N3O4S, 570,16; обнаружено 570,6.
(26-3) 4'-{2-этокси-5-[(R)-1-(2-фторбензил)-2-меркаптоэтилкарбамоил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H27F2N3O4S, 552,17; обнаружено 552,8.
(26-4) 4'-{2-этокси-5-[(R)-1-(3-фторбензил)-2-меркаптоэтилкарбамоил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H27F2N3O4S, 552,17; обнаружено 552,8.
(26-5) 4'-{5-[(R)-1-(2-хлорбензил)-2-меркаптоэтилкарбамоил]-2-этоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H27ClFN3O4S, 568,14; обнаружено 568,3.
(26-6) 4'-{5-[(R)-1-(3-хлорбензил)-2-меркаптоэтилкарбамоил]-2-этоксиимидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H27ClFN3O4S, 568,14; обнаружено 568,2.
(26-7) 4'-{2-этокси-5-[(R)-2-(4-фторфенил)-1-меркаптометилэтилкарбамоил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C29H27F2N3O4S, 552,17; обнаружено 552,8.
(26-8) 4'-[2-этокси-5-((R)-1-меркаптометил-2-o-толилэтилкарбамоил)имидазол-1-илметил]-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H30FN3O4S, 548,19; обнаружено 548,6.
(26-9) 4'-[5-((R)-1-бензил-2-меркаптоэтилкарбамоил)-4-(1-гидрокси-1-метилэтил)-2-пропилимидазол-1-илметил]-3'-фторбифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C33H36FN3O4S, 590,24; обнаружено 590,4.
(26-10) 3'-фтор-4'-[4-(1-гидрокси-1-метилэтил)-5-((R)-1-меркаптометил-3-метилбутилкарбамоил)-2-пропилимидазол-1-илметил]бифенил-2-карбоновая кислота. MS m/z: [M+H+] рассчитано для C30H38FN3O4S, 556,26; обнаружено 556,4.
ПОЛУЧЕНИЕ 19
1-(4-трет-бутоксикарбонилбензил)-5-пропил-1H-пиразол-3-карбоновая кислота
трет-Бутиловый эфир 4-бромметилбензойной кислоты (19a): к 50 мл DCM добавляли 4-бромметилбензоилбромид (13,9 г, 50 ммоль, 1,0 экв.), затем трет-бутанол (9,6 мл, 100 ммоль, 2,0 экв.), и смесь медленно нагревали до комнатной температуры. Через 20 часов реакционную смесь концентрировали под пониженным давлением, растворяли в 350 мл EtOAc, промывали с помощью 400 мл насыщенного бикарбоната и 200 мл насыщенного водного NaCl. Органический слой сушили над MgSO4, фильтровали и концентрировали под пониженным давлением, получая промежуточное соединение (19a) в виде полутвердого вещества (7,3 г).
Этиловый эфир 1-(4-трет-бутоксикарбонилбензил)-5-пропил-1H-пиразол-3-карбоновой кислоты (19b): К выделенному промежуточному соединению (19a) (1,4 г, 5 ммоль, 1,0 экв.), растворенному в 15 мл DMF, добавляли этиловый эфир 5-пропил-1H-пиразол-3-карбоновой кислоты (910 мг, 5,0 ммоль, 1,0 экв.) и карбонат калия (0,8 г, 5,5 ммоль, 1,1 экв.), и смесь перемешивали при комнатной температуре в течение 16 часов. Затем смесь добавляли к 50 мл 10% водного раствора LiCl и экстрагировали с помощью 50 мл EtOAc. Органический слой сушили над MgSO4 и концентрировали под пониженным давлением, получая промежуточное соединение (19b) и его региоизомер в соотношении 1:1. Выделенные региоизомеры растворяли в 25 мл MeOH. К этому добавляли 10 мл 1 М NaOH и смесь перемешивали при комнатной температуре в течение ночи. Смесь подкисляли уксусной кислотой и концентрировали под пониженным давлением. Выделенное масло очищали препаративной HPLC, получая желаемый региоизомер названного в заголовке соединения в виде белой твердой соли TFA после лиофилизации (230 мг). 1H ЯМР (DMSO) 0,89 (т, 3H), 1,52 (с, 9H), 5,71 (с, 2H), 6,71 (с, 1Н), 7,15 (д, 2H), 7,83 (д, 2H), 13,28 (ушир.с, 1Н).
ПОЛУЧЕНИЕ 20
S-((S)-2-амино-3-фенилпропил)эфир тиоуксусной кислоты
трет-Бутиловый эфир ((S)-1-бензил-2-гидроксиэтил)карбаминовой кислоты (20a): (S)-2-амино-3-фенилпропан-1-ол (5 г, 33 ммоль, 1,0 экв.) растворяли в 100 мл MeOH. К этому добавляли ди-трет-бутилдикарбонат (7,6 г, 35 ммоль, 1,1 экв.) и смесь перемешивали при комнатной температуре в течение 4 часов. Затем смесь концентрировали под пониженным давлением, растворяли в EtOAc и промывали с помощью 1 М H3PO4 и насыщенного водного NaCl. После высушивания над MgSO4, органический слой фильтровали и концентрировали под пониженным давлением с получением неочищенного промежуточного соединения (20a) (8,5 г).
(S)-2-трет-бутоксикарбониламино-3-фенилпропиловый эфир толуол-4-сульфоновой кислоты (20b): Выделенное промежуточное соединение (20a) (8,5 г, 33 ммоль, 1,0 экв.) растворяли в 70 мл пиридина, содержащего гидроксид калия (2,1 г, 37 ммоль, 1,1 экв.), и смесь охлаждали в ледяной бане. Добавляли тозилхлорид (7,1 г, 37 ммоль, 1,1 экв.), и смесь перемешивали при 0°C в течение 2 часов, затем охлаждали в течение ночи. Смесь фильтровали, и фильтрат концентрировали под пониженным давлением. Выделенный осадок растворяли в 300 мл EtOAc, промывали с помощью 2×200 мл 1 М H3PO4, насыщенного бикарбоната и насыщенного водного NaCl. Органический слой сушили над MgSO4 и концентрировали под пониженным давлением, получая промежуточное соединение (20b) (10,3 г) в виде светло-коричневого масла.
Промежуточное соединение (20b) (10,3 г, 25 ммоль, 1,0 экв.) добавляли к раствору тиоуксусной кислоты (2,2 мл, 30 ммоль, 1,2 экв.) и KOH (1,7 г, 30 ммоль, 1,2 экв.) в 80 мл DMF, охлажденному до 0°C. Смесь перемешивали при 0°C в течение 2 часов, медленно нагревали до комнатной температуры, затем перемешивали в течение 48 часов. Смесь разводили водой и экстрагировали с помощью EtOAc. Материал промывали 2× насыщенным бикарбонатом и насыщенным водным NaCl, затем высушивали над MgSO4. Органический слой фильтровали и концентрировали под пониженным давлением с получением масла (7,1 г). Это масло затем растворяли в 30 мл 1:1 TFA:DCM и перемешивали при комнатной температуре в течение 1 часа. Смесь концентрировали с получением названного в заголовке соединения с количественным выходом.
ПРИМЕР 27
4-[5-((S)-1-бензил-2-меркаптоэтилкарбамоил)-3-пропилпиразол-1-илметил]бензойная кислота (соединение 27-1; R 5 = -CH 2 SH)
1-(4-трет-бутоксикарбонилбензил)-5-пропил-1H-пиразол-3-карбоновую кислоту (460 мг, 0,1 ммоль, 1,0 экв.) растворяли в 1,0 мл DMF. К этому добавляли HATU и смесь встряхивали в течение 10 минут. Добавляли S-((S)-2-амино-3-фенилпропил)эфир тиоуксусной кислоты (320 мг, 0,1 ммоль, 1,0 экв.), затем DIPEA (520 мкл, 0,3 ммоль, 3,0 экв.). Смесь встряхивали в течение ночи, концентрировали под пониженным давлением и осадок повторно растворяли в 3 мл 4 N HCl в диоксане и встряхивали в течение 4 часов. Смесь снова концентрировали под пониженным давлением и растворяли в 2,0 мл MeOH. Смесь продували азотом, добавляли 1,0 мл 3 М NaOH и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь подкисляли 0,5 мл уксусной кислоты и концентрировали под пониженным давлением. Выделенное масло очищали обращенно-фазовой HPLC с получением соединения 27-1 в виде белого твердого вещества (1,3 мг). MS m/z: [M+Н+] рассчитано для C24H27N3O3S, 438,2; обнаружено 438.
Соединение (27-2) получали сходным способом: 4-[5-((S)-1-гидроксикарбамоил-2-фенилэтилкарбамоил)-3-пропилпиразол-1-илметил]бензойная кислота (R5=-C(O)N(OH)H). MS m/z: [М+H+] рассчитано для C24H26N4O5, 451,19; обнаружено 451.
ПОЛУЧЕНИЕ 21
трет-Бутиловый эфир [1-этоксибут-(E)-илиденгидразинокарбонилметил]карбаминовой кислоты
Этилбутиримидат·HCl (21a): 1-цианопропан (20 г, 290 ммоль) смешивали с бутилэфиром (250 мл) и охлаждали до 0°C. Добавляли этанол (18,6 мл, 320 ммоль) и газообразную HCl барботировали через смесь в течение 45 минут. Затем смесь герметично закрывали и сохраняли при 5°C в течение ночи. Отбирали аликвоту смеси 100 мл и концентрировали с получением масла, которое растворяли в MeCN и концентрировали до начала кристаллизации. Добавляли EtOAc и смесь поддерживали при -20°C в течение ночи. Полученную отвержденную смесь разводили EtOAc, фильтровали и промывали диэтиловым эфиром в атмосфере азота с получением 7,8 г соединения (21a) в виде белого твердого вещества. 1H-ЯМР (DMSO): 11,5 м.д. (ушир.с, 2H), 4,45 м.д. (кв, 2H), 2,6 м.д. (т, 2H), 1,65 м.д. (м, 2H), 1,3 м.д. (т, 3H), 0,9 м.д. (т, 3H).
Соединение (21a) (3,0 г, 19,9 ммоль) растворяли в этаноле (10 мл) и охлаждали до -78°C. трет-Бутиловый эфир гидразинокарбонилметилкарбаминовой кислоты в этаноле (10 мл) добавляли по каплям в течение 20 минут. Затем смесь закрывали крышкой и сохраняли при 4°C в течение 4 суток. Преципитат отфильтровывали и растворитель концентрировали с получением названного в заголовке соединения (4,0 г).
ПОЛУЧЕНИЕ 22
трет-Бутиловый эфир 4'-аминометилбифенил-2-карбоновой кислоты
трет-Бутиловый эфир 4'-(1,3-диоксо-1,3-дигидроизоиндол-2-илметил)бифенил-2-карбоновой кислоты (22a): трет-бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты (4,0 г, 11,5 ммоль) и фталимид калия объединяли и растворяли в DMF (30 мл), и смесь нагревали при 50°C в течение двух суток. Затем смесь охлаждали до комнатной температуры и реакцию останавливали водой (30 мл). Затем смесь экстрагировали с помощью EtOAc и промывали с помощью 10% водного раствора хлорида лития. Органический слой сушили над MgSO4, фильтровали и концентрировали, получая промежуточное соединение (22a) (4,8 г). MS m/z: [M+H+] рассчитано для C26H23NO4, 414,5; обнаружено 414,3.
Промежуточное соединение (22a) (4,8 г, 11,5 ммоль) и гидразин (5,0 мл, 100 ммоль) растворяли в этаноле (50 мл) и нагревали при 80°C в течение 5 часов. Затем смесь охлаждали до комнатной температуры, преципитат отфильтровывали и растворитель концентрировали с получением названного в заголовке соединения (3,4 г). MS m/z: [M+H+] рассчитано для C18H21NO2, 284,4; обнаружено 284,3.
ПОЛУЧЕНИЕ 23
4'-(3-аминометил-5-пропил[1,2,4]триазол-4-илметил)бифенил-2-карбоновая кислота
трет-Бутиловый эфир 4'-[3-(трет-бутоксикарбониламинометил)-5-пропил-[1,2,4]триазол-4-илметил]бифенил-2-карбоновой кислоты (23a): трет-бутиловый эфир 4'-аминометилбифенил-2-карбоновой кислоты (1,5 г, 5,2 ммоль) и трет-бутиловый эфир [1-этоксибут-(E)-илиденгидразинокарбонилметил]карбаминовой кислоты (1,0 г, 3,5 ммоль) объединяли и растворяли в этаноле (50 мл). Смесь нагревали при 50°C в течение 2 часов и затем при 70°C в течение ночи. Затем смесь охлаждали и концентрировали. Продукт очищали хроматографией на силикагеле (0-20% MeOH:DCM), получая промежуточное соединение (23a) (400 г). MS m/z: [M+H+] рассчитано для C29H38N4O4, 507,6; обнаружено 507,3.
Промежуточное соединение (23a) (400 мг, 790 мкмоль) растворяли в смеси TFA (1 мл) и DCM (2 мл). Смесь перемешивали при комнатной температуре в течение 4 часов и затем концентрировали. Продукт очищали препаративной HPLC (10-50% MeCN в воде с 0,05% TFA) с получением названного в заголовке соединения (120 мг). MS m/z: [M+H+] рассчитано для C20H22N4O2, 351,4; обнаружено 351,2.
ПРИМЕР 28
4'-{3-[(2-ацетилсульфанилметил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (28a; R 5a = -C(O)CH 3 ) и 4'-{3-[(2-меркаптометил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (28b; R 5a =H)
2-ацетилсульфанилметил-4-метилпентановую кислоту (66,0 мг, 0,314 ммоль) и HATU (119 мг, 314 мкмоль) объединяли и растворяли в DMF (2 мл) и перемешивали в течение 15 минут. Затем добавляли DIPEA (50 мкл, 290 мкмоль) и смесь перемешивали при комнатной температуре в течение 30 минут. 4'-(3-аминометил-5-пропил-1,2,4-триазол-4-илметил)бифенил-2-карбоновую кислоту (100 мг, 290 мкмоль) в DMF (1 мл) добавляли к смеси, с последующим добавлением второго эквивалента DIPEA (50 мкл, 290 мкмоль). Смесь перемешивали при комнатной температуре в течение ночи. Воду (5 мл) добавляли для остановки реакции, и затем смесь экстрагировали с помощью EtOAc и промывали с помощью 10% водного раствора хлорида лития. Органический слой сушили над MgSO4, фильтровали и концентрировали, получая промежуточное соединение (28a) (50 мг), которое переносили непосредственно в следующую реакционную смесь. MS m/z: [M+H+] рассчитано для C29H36N4O4S, 537,7; обнаружено 537,3.
Промежуточное соединение (28a) (50 мг, 930 мкмоль) растворяли в MeOH (2 мл) и 1 N бикарбонате натрия (2 мл) и перемешивали при комнатной температуре в атмосфере азота в течение 30 минут. Реакцию останавливали уксусной кислотой и полученную смесь концентрировали. Продукт очищали препаративной HPLC (30-70% MeCN в воде с 0,05% TFA) с получением названного в заголовке соединения (9 мг). MS m/z: [M+H+] рассчитано для C27H34N4O3S, 494,7; обнаружено 494,4.
ПРИМЕР 29
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 29-1 - 29-4, обладающие следующей формулой:
(29-1) 4'-{3-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (R5=-C(O)N(OH)H; R6=-CH2CH(CH3)2). MS m/z: [М+H+] рассчитано для C27H33N5O5, 508,25; обнаружено 508,4.
(29-2) 4'-{3-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (R5=-C(O)N(OH)H; R6=бензил). MS m/z: [М+H+] рассчитано для C30H31N5O5, 542,23; обнаружено 542,2.
(29-3) 4'-{3-[(2-меркаптометил-3-фенилпропиониламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (R5=-CH2SH; R6=бензил). MS m/z: [M+H+] рассчитано для C30H32N4O3S, 529,22; обнаружено 529.
(29-4) 4'-{3-[((R)-2-меркаптометил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бифенил-2-карбоновая кислота (R5=-CH2SH; R6=-CH2CH(CH3)2). MS m/z: [М+H+] рассчитано для C27H34N4O3S, 495,24; обнаружено 495,2.
ПРИМЕР 30
Следуя способам, описанным в примерах выше, и заменяя соответствующие исходные материалы и реагенты, получали также соединения 30-1 - 30-4, обладающие следующей формулой:
(30-1) 4-{3-[(2-меркаптометил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бензойная кислота (R5=-CH2SH; R6=-CH2CH(CH3)2). MS m/z: [М+H+] рассчитано для C21H30N4O3S, 419,20; обнаружено 419,2.
(30-2) 4-{3-[(2-меркаптометил-3-фенилпропиониламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бензойная кислота (R5=-CH2SH; R6=бензил). MS m/z: [М+H+] рассчитано для C24H28N4O3S, 453,19; обнаружено 453,2.
(30-3) 4-{3-[(2-гидроксикарбамоил-4-метилпентаноиламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бензойная кислота (R5=-C(O)N(OH)H; R6=-CH2CH(CH3)2). MS m/z: [M+H+] рассчитано для C21H29N5O5, 432,22; обнаружено 432,2.
(30-4) 4-{3-[(2-гидроксикарбамоил-3-фенилпропиониламино)метил]-5-пропил[1,2,4]триазол-4-илметил}бензойная кислота (R5=-C(O)N(OH)H; R6=бензил). MS m/z: [М+H+] рассчитано для C24H27N5O5, 466,20; обнаружено 466,2.
ПОЛУЧЕНИЕ 24
трет-Бутиловый эфир (6-бутил-2-оксо-1,2-дигидропиридин-3-илметил)карбаминовой кислоты
6-бутил-2-оксо-1,2-дигидропиридин-3-карбонитрил (24a): Раствор диизопропиламина (20,5 мл, 2 экв.) в THF (200 мл) охлаждали до -5°C. н-Бутиллитий (53,5 мл, 2,9 M в гексанах, 2 экв.) добавляли в течение 10 минут. Раствору позволяли нагреться до 0°C, перемешивали в течение 0,5 часов, затем снова охлаждали до -30°C. 3-циано-6-метил-2(1H)пиридинон (10 г, 75 ммоль) добавляли порционно, и смеси позволяли нагреться до комнатной температуры и перемешивали в течение 2 часов. Затем раствор охлаждали до -50°C и добавляли 1-бромпропан (6,8 мл, 1 экв.). Раствору позволяли нагреться до комнатной температуры, перемешивали в течение 1 часа и затем останавливали реакцию насыщенным раствором хлорида аммония. THF выпаривали и водную фазу экстрагировали с помощью DCM (2×100 мл). Органические фазы промывали насыщенным водным NaCl, высушивали над Na2SO4 и выпаривали, получая промежуточное соединение (24a) в виде оранжевого твердого вещества (10,8 г, 61 ммоль), которое использовали без дополнительной очистки. MS m/z: [M+H+] рассчитано для C10H12N2O, 177,2; обнаружено 177,0. 1H-ЯМР (DMSO) 7,87 (1Н, д), 6,05 (1Н, д), 2,38 (2H, т), 1,41 (2H, м), 1,15 (2H, м), 0,93 (1Н, д), 0,73 (3H, т).
3-аминометил-6-бутил-1H-пиридин-2-он (24b): промежуточное соединение (24a) (180 мг, 1 ммоль) растворяли в MeOH (10 мл). Добавляли водный аммиак (1 мл), затем влажный никель Ренея (100 мг). Смесь перемешивали при комнатной температуре под водородом в течение 3 часов. Затем смесь фильтровали и фильтрат выпаривали, получая промежуточное соединение (24b) (157 мг, 870 мкмоль), которое использовали без дополнительной очистки. MS m/z: [M+H+] рассчитано для C10H17N2O, 181,3; обнаружено 181,3.
Промежуточное соединение (24b) (157 мг, 0,87 ммоль) растворяли в DCM (10 мл). Добавляли триэтиламин (121 мкл, 1 экв.), затем ди-трет-бутилдикарбонат (189 мг, 1 экв.). Смесь перемешивали при комнатной температуре в течение 16 часов. Затем растворитель выпаривали и осадок очищали хроматографией на силикагеле (1:1 EtOAc:гексан) с получением названного в заголовке соединения (200 мг, 710 мкмоль). MS m/z: [M+H+] рассчитано для C15H25N2O3, 281,4; обнаружено 281,3.
ПОЛУЧЕНИЕ 25
4'-(3-аминометил-6-бутил-2-оксо-2H-пиридин-1-илметил)бифенил-2-карбоновая кислота·HCl
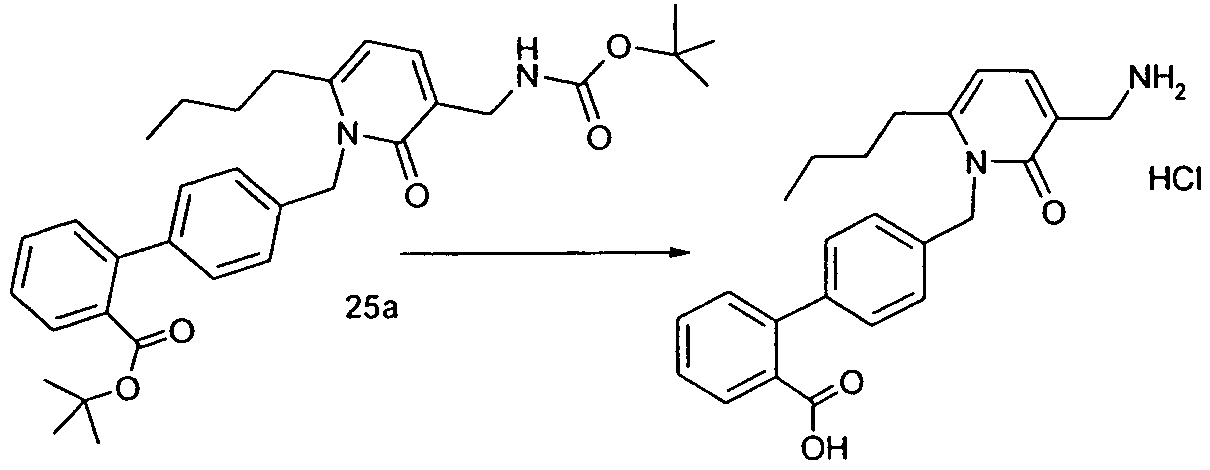
трет-Бутиловый эфир 4'-[3-(трет-бутоксикарбониламинометил)-6-бутил-2-оксо-2H-пиридин-1-илметил]бифенил-2-карбоновой кислоты (25a): трет-бутиловый эфир (6-бутил-2-оксо-1,2-дигидропиридин-3-илметил)карбаминовой кислоты (200 мг, 0,71 ммоль) растворяли в THF (5 мл) и охлаждали до -5°C. Добавляли н-бутиллитий (285 мкл, 2,5 М раствор в гексанах, 1 экв.) и смесь перемешивали при -5°C в течение 5 минут. Добавляли трет-бутиловый эфир 4'-бромметилбифенил-2-карбоновой кислоты (247 мг, 1 экв.), и раствор нагревали при кипячении с обратным холодильником и перемешивали в течение 72 часов. Раствору позволяли охлаждаться, растворитель выпаривали и осадок очищали хроматографией на силикагеле (3:1 гексаны:EtOAc), получая промежуточное соединение (25a) в виде белого твердого вещества (180 мг, 330 мкмоль). MS m/z: [M+Н+] рассчитано для C33H43N2O5, 547,7; обнаружено 547,3.
Промежуточное соединение (25a) (180 мг, 0,33 ммоль) растворяли в DCM (3 мл) и TFA (3 мл). Смесь перемешивали при комнатной температуре в течение 16 часов и затем высушивали досуха. Осадок растворяли в MeCN и воде и добавляли HCl (1 М, 0,5 мл). Раствор лиофилизировали с получением названного в заголовке соединения (133 мг, 310 мкмоль) в виде белого твердого вещества, которое использовали без дополнительной очистки. MS m/z: [M+H+] рассчитано для C24H27N2O3, 391,5; обнаружено 391,3.
ПРИМЕР 31
4'-{6-бутил-3-[(2-меркаптометил-4-метилпентаноиламино)метил]-2-оксо-2H-пиридин-1-илметил}бифенил-2-карбоновая кислота (соединение 31-1; R 6 = -CH 2 CH(CH 3 ) 2 )
2-ацетилсульфанилметил-4-метилпентановую кислоту (24 мг, 1,1 экв.) и HATU (44 мг, 1,1 экв.) растворяли в DMF (2 мл). Добавляли DIPEA (740 мкл, 4 экв.), и смесь перемешивали при комнатной температуре в течение 15 минут. Добавляли 4'-(3-аминометил-6-бутил-2-оксо-2H-пиридин-1-илметил)бифенил-2-карбоновую кислоту·HCl (45 мг, 0,1 ммоль), и раствор перемешивали при комнатной температуре в течение 4 часов. Реакцию останавливали водой (8 мл) и концентрированной HCl (3 капли), и смесь экстрагировали с помощью EtOAc (10 мл). Органический слой сушили над Na2SO4 и выпаривали. Осадок растворяли в MeOH (1 мл) и 1 М NaOH (3 мл). Раствор перемешивали в атмосфере азота в течение 20 минут и затем реакцию останавливали уксусной кислотой (2 мл). MeOH выпаривали и водный компонент экстрагировали с помощью EtOAc (10 мл). Растворитель выпаривали и осадок очищали обращенно-фазовой хроматографией с получением названного в заголовке соединения (7,5 мг, 140 мкмоль). MS m/z: [M+H+] рассчитано для C31H39N2O4S, 535,7; обнаружено 535,2.
Соединение (31-2) получали подобным способом: 4'-{3-[(2-бензил-3-меркаптопропиониламино)метил]-6-бутил-2-оксо-2H-пиридин-1-илметил}бифенил-2-карбоновая кислота (R6=бензил). MS m/z: [М+H+] рассчитано для C34H36N2O4S, 569,24; обнаружено 570,2.
ПОЛУЧЕНИЕ 26
4-хлор-2-этоксиимидазол-5-карбоксальдегид
4-бром-5-хлор-2-этокси-1-(2-триметилсиланилэтоксиметил)-1H-имидазол (26a): н-бутиллитий (2,5 М в гексанах, 3,3 мл) добавляли к раствору 4,5-дибром-2-этокси-1-(2-триметилсиланилэтоксиметил)-1H-имидазола (3,0 г, 7,5 ммоль) и N,N,N',N'-тетраметилэтилендиамина (1,2 мл, 8,3 ммоль) в THF (20 мл) при -78°C. Через 3 минуты добавляли раствор гексахлорэтана (2,3 г, 9,7 ммоль) в THF (8 мл) при -78°C. Смесь перемешивали при -78°C в течение 1 часа и затем позволяли нагреться до комнатной температуры. Добавляли насыщенный водный NH4Cl (3 мл), и смесь концентрировали в вакууме. Смесь экстрагировали с помощью EtOAc (2×100 мл) и насыщенного водного NaHCO3 (30 мл). Объединенные органические фракции высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Хроматографией на силикагеле (EtOAc:гексан) получали промежуточное соединение (26a) (2,3 г).
5-хлор-2-этокси-1-(2-триметилсиланилэтоксиметил)-1H-имидазол-4-карбальдегид (26b): н-бутиллитий (2,5 М в гексанах, 1,2 мл) добавляли к раствору промежуточного соединения (26a) (1,0 г, 2,8 ммоль) и N,N,N',N'-тетраметилэтилендиамина (0,5 мл, 3,1 ммоль) в THF (8 мл) при -78°C. DMF (0,3 мл, 3,4 ммоль) добавляли через 3 минуты. Смесь перемешивали при -78°C в течение 1 часа. Смеси позволяли нагреться до комнатной температуры в течение 30 минут. Добавляли насыщенный водный NH4OH (1 мл) и смесь концентрировали в вакууме. Смесь экстрагировали с помощью DCM (2×30 мл) и 0,5 М PO3H4 (10 мл). Объединенные органические фракции промывали насыщенным водным NaHCO3 (20 мл), высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Хроматографией на силикагеле (EtOAc:гексан) получали промежуточное соединение (26b) (600 мг).
Раствор промежуточного соединения (26b) (500 мг, 2,0 ммоль) в DCM (2 мл) и TFA (4 мл) перемешивали при комнатной температуре в течение 3 часов. Смесь концентрировали в вакууме. Концентрат экстрагировали с помощью DCM (2×8 мл) и насыщенного водного NaHCO3 (5 мл). Объединенные органические фракции высушивали над Na2SO4, фильтровали и концентрировали в вакууме с получением неочищенного названного в заголовке соединения (298 мг).
ПОЛУЧЕНИЕ 27
трет-Бутиловый эфир 4'-(5-аминометил-4-хлор-2-этоксиимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты
трет-Бутиловый эфир 4'-(4-хлор-2-этокси-5-формилимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (27a): Раствор 4-хлор-2-этоксиимидазол-5-карбоксальдегида (295,0 мг, 1,7 ммоль), трет-бутиловый эфир 4'-бромметил-3'-фторбифенил-2-карбоновой кислоты (617 мг, 1,7 ммоль) и карбонат калия (467 мг, 3,4 ммоль) в DMF (6 мл) перемешивали в течение ночи. Смесь фильтровали и концентрировали в вакууме. Хроматографией на силикагеле (гексан:EtOAc) получали промежуточное соединение (27a) (598 мг).
трет-Бутиловый эфир 4'-[4-хлор-2-этокси-5-(гидроксииминометил)имидазол-1-илметил]-3'-фторбифенил-2-карбоновой кислоты (27b): Гидрохлорид гидроксиламина (185 мг) добавляли к раствору промежуточного соединения (27) (610,0 мг, 1,3 ммоль) в пиридине (8 мл) и воде (3 мл). Через 1 час добавляли воду (20 мл) и полученный преципитат фильтровали. Твердое вещество сушили в вакууме с получением неочищенного промежуточного соединения (27b) (468 мг).
Хлорид титана(III) (448 мг, 2,90 ммоль) добавляли к раствору промежуточного соединения (27b) (459,0 мг, 1,0 ммоль), NaBH3CN (274 мг, 4,4 ммоль) и ацетата аммония (164 мг, 2,1 ммоль) в MeOH (8 мл) при 0°C. Смесь перемешивали при комнатной температуре в течение 3 часов. Смесь добавляли к раствору насыщенного водного аммиака (15 мл) и MeOH (15 мл). Раствор фильтровали и концентрировали в вакууме. Концентрат экстрагировали с помощью DCM (2×80 мл) и насыщенного водного NaHCO3 (50 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Хроматографией на силикагеле [DCM:MeOH (5% триэтиламин)] получали названное в заголовке соединение (85 мг).
ПРИМЕР 32
4'-{4-хлор-2-этокси-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновая кислота·C 2 HF 3 O 2
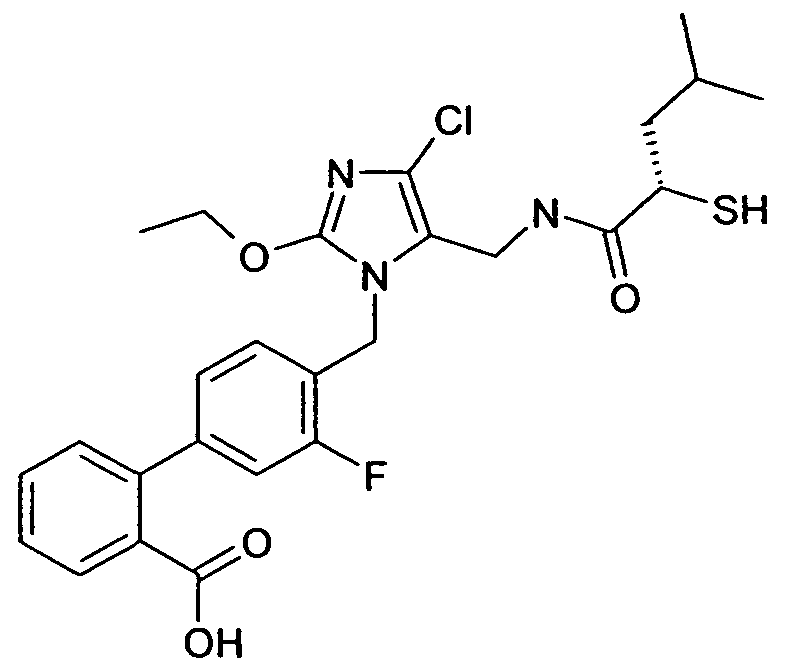
EDC (30 мкл, 0,2 ммоль) добавляли к раствору трет-бутилового эфира 4'-(5-аминометил-4-хлор-2-этоксиимидазол-1-илметил)-3'-фторбифенил-2-карбоновой кислоты (80,0 мг, 0,2 ммоль), (S)-2-ацетилсульфанил-4-метилпентановой кислоты (33,1 мг, 0,2 ммоль), 1-гидрокси-7-азабензотриазола (23,7 мг, 0,2 ммоль) и 4-метилморфолина (19,1 мкл, 0,2 ммоль) в DMF (1 мл) при 0°C. Смесь перемешивали в течение ночи при комнатной температуре. Смесь экстрагировали с помощью EtOAc (2×10 мл) и 0,5 М водной HCl (10 мл). Объединенные органические фракции высушивали над сульфатом натрия и концентрировали в вакууме с получением масла. Раствор масла в DCM (2 мл) и TFA (4 мл) перемешивали при комнатной температуре. Через 2 часа смесь концентрировали в вакууме с получением масла. Раствор масла в MeOH (2 мл) и 1 М водного NaOH (3 мл) перемешивали в атмосфере азота в течение 1,5 часов. Смесь нейтрализовали с помощью 6M водной HCl и концентрировали в вакууме. Обращенно-фазовой HPLC получали названное в заголовке соединение (9,7 мг). MS m/z: [М+H+] рассчитано для C26H29ClFN3O4S, 534,16; обнаружено: 534,0.
ПРИМЕР 33
Циклизация 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты с получением циклических пролекарств (33-1) и (33-2)
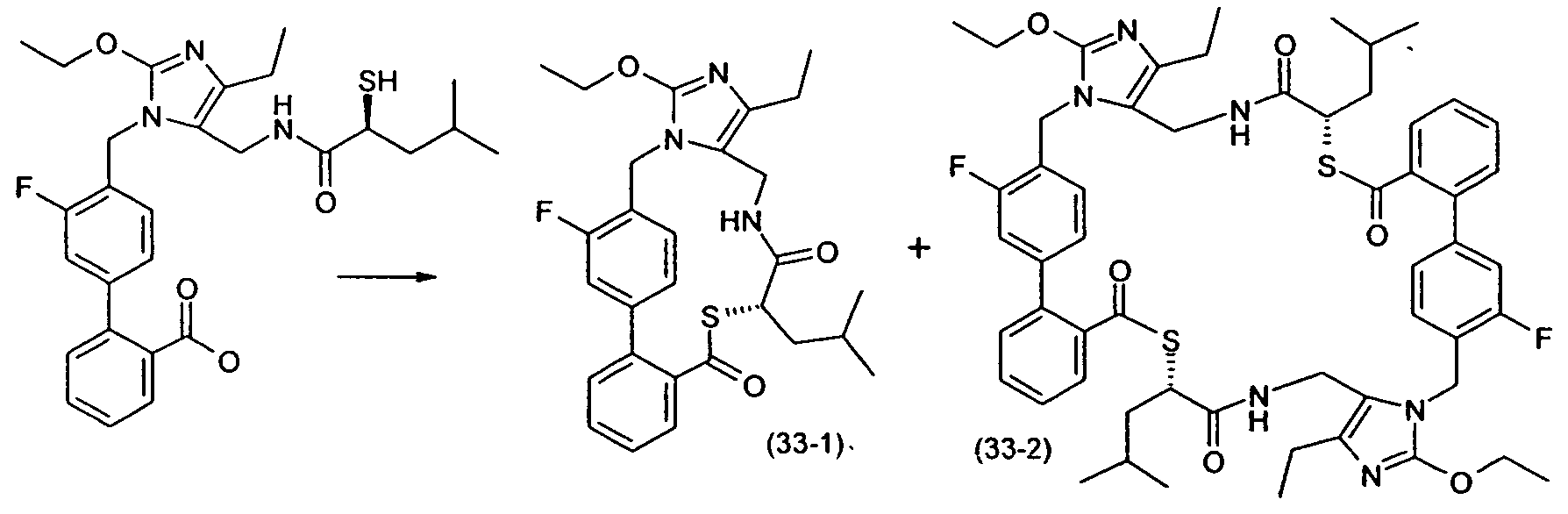
К раствору 4'-{2-этокси-4-этил-5-[((S)-2-меркапто-4-метилпентаноиламино)метил]имидазол-1-илметил}-3'-фторбифенил-2-карбоновой кислоты·C2HF3O2 (138 мг, 215 мкмоль) в метиленхлориде (20 мл, 0,3 моль) добавляли DMAP (27,6 мг, 0,226 ммоль) и EDC (43,3 мг, 0,226 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. После выпаривания летучих растворителей осадок очищали препаративной HPLC с получением циклических тиоэфиров в виде мономера (33-1) и димера (33-2) в чистой форме (>95%).
(33-1) ESMS [M+H+] рассчитано для C28H32FN3O3S, 510,22; обнаружено 510,6. Время удержания при аналитической HPLC = 3,86 мин; условия градиента = 25-95% MeCN/H2O в течение 5 мин. 1H-ЯМР (CD3OD, 300 МГц) δ (м.д.) 7,60 (м, 1Н), 7,54 (м, 1Н), 7,52-7,48 (м, 2H), 7,40 (м, 1Н), 7,36-7,38 (м, 1Н), 6,89-6,92 (д, 1Н), 4,71 (м, 2H), 4,30-4,35 (ушир.д, 1Н), 4,20 (ушир.д, 1Н), 4,05 (т, 1Н), 2,60-2,68 (м, 2H), 1,60-1,75 (м, 1Н), 1,55-1,60 (м, 4H), 1,43 (м, 1H), 1,23 (т, 3H), 0,90 (д, 6H).
(33-2) ESMS [M+H+] рассчитано для C56H64F2N6O6S2, 1019,44; обнаружено 1019,8. Время удержания при аналитической HPLC = 4,19 мин; условия градиента 25-95% MeCN/H2O в течение 5 мин.
АНАЛИЗ 1
Анализы связывания радиоактивного лиганда AT 1 и AT 2
Эти анализы in vitro использовали для оценки способности тестируемых соединений связываться с рецепторами AT1 и AT2.
Получение мембран из клеток, экспрессирующих рецепторы AT 1 или AT 2 человека
Полученные из клеток яичника китайского хомячка (CHO-K1) линии клеток, стабильно экспрессирующие клонированные рецепторы AT1 или AT2 человека, соответственно, выращивали на среде Хэма-F12, дополненной 10% эмбриональной бычьей сывороткой, 10 мкг/мл пенициллина/стрептомицина и 500 мкг/мл генетицина в увлажненном инкубаторе с 5% CO2 при 37°C. Экспрессирующие рецептор AT2 клетки выращивали при дополнительном присутствии 100 нМ PD123,319 (антагониста AT2). Когда культуры достигали 80-95% конфлюентности, клетки тщательно промывали в PBS и поднимали с помощью 5 мМ ЭДТА. Клетки осаждали центрифугированием и быстро замораживали в MeOH-сухом льду и хранили при -80°C до дальнейшего использования.
С получением мембран осадки клеток ресуспендировали в буфере для лизиза (25 мМ Трис/HCl pH 7,5 при 4°C, 1 мМ ЭДТА, и одна таблетка полного коктейля ингибиторов протеаз с 2 мМ ЭДТА на 50 мл буфера (Roche кат.# 1697498, Roche Molecular Biochemicals, Indianapolis, IN)) и гомогенизировали с использованием плотно подогнанного стеклянного гомогенизатора Даунса (10 ударов) на льду. Гомогенат центрифугировали при 1000×g, супернатант собирали и центрифугировали при 20000×g. Конечный осадок ресуспендировали в буфере для мембран (75 мМ Трис/HCl pH 7,5, 12,5 мМ MgCl2, 0,3 мМ ЭДТА, 1 мМ ЭГТА, 250 мМ сахароза при 4°C) и гомогенизировали продавливанием через иглу калибра 20 G (0,9 мм). Концентрацию белка в суспензии мембран определяли способом, описанным в Bradford (1976) Anal. Biochem. 72:248-54. Мембраны быстро замораживали в MeOH-сухом льду и сохраняли при -80°C до последующего использования.
Анализ связывания лиганда для определения аффинностей соединения для рецепторов ангиотензина AT1 и AT2 человека
Анализы связывания проводили в 96-луночных планшетах с фильтрами Acrowell (Pall Inc., кат.# 5020) в общем объеме для анализа 100 мкл с 0,2 мкг белка мембран для мембран, содержащих рецептор AT1 человека, или с 2 мкг белка мембран для мембран, содержащих рецептор AT2 человека, в буфере для анализа (50 мМ Трис/HCl pH 7,5 при 20°C, 5 мМ MgCl2, 25 мкм ЭДТА, 0,025% BSA). Исследования насыщения связывания для определения значений Kd лиганда проводили с использованием меченного по N-концу европием ангиотензина-II ([Eu]AngII, H-(Eu-N1)-Ahx-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-OH; PerkinElmer, Boston, MA) в 8 различных концентрациях, лежащих в диапазоне от 0,1 нМ до 30 нМ. Анализы вытеснения для определения значений pKi тестируемых соединений проводили с [Eu]AngII при 2 нМ и 11 различными концентрациями лекарственного средства, лежащими в диапазоне от 1 пМ до 10 мкм. Лекарственные средства растворяли до концентрации 1 мМ в DMSO и из этого серийно разводили в буфере для анализа. Неспецифическое связывание определяли в присутствии 10 мкМ немеченого ангиотензина-II. Смеси для анализа инкубировали в течение 120 минут в темноте, при комнатной температуре или 37°C, и реакции связывания останавливали быстрой фильтрацией через планшеты с фильтром Acrowell с последующими тремя промывками с помощью 200 мкл ледяного буфера для промывки (50 мМ Трис/HCl pH 7,5 при 4°C, 5 мМ MgCl2) с использованием коллектора для водной фильтрации. Из планшетов выпускали жидкость досуха и инкубировали их с 50 мкл усиливающего раствора DELFIA (PerkinElmer кат.# 4001-0010) при комнатной температуре в течение 5 минут на встряхивателе. Связанный с фильтром [Eu]AngII немедленно оценивали количественно на считывателе для планшетов Fusion (PerkinElmer) с использованием флуоресценции с разрешением по времени (TRF). Данные связывания анализировали нелинейным регрессионным анализом с помощью пакета программного обеспечения GraphPad Prism (GraphPad Software, Inc., San Diego, CA) с использованием 3-параметрической модели для конкуренции по одному участку. BOTTOM (минимум кривой) фиксировали на значении для неспецифического связывания, как определяли в присутствии 10 мкм ангиотензина II. Значения Ki для лекарственных средств рассчитывали из наблюдаемых значений IC50 и значения Kd [Eu]AngII согласно уравнению Ченга-Прусова, описанному в Cheng et al. (1973) Biochem Pharmacol. 22(23):3099-108. Избирательности тестируемых соединений для рецептора AT1 по сравнению с рецептором AT2 рассчитывали как соотношение AT2Ki/AT1Ki. Аффинности связывания тестируемых соединений выражали как отрицательные десятичные логарифмы значений Ki (pKi).
В этом анализе более высокое значение pKi показывает, что тестируемое соединение обладает более высокой аффинностью связывания для тестированного рецептора. Обнаружено, что иллюстративные соединения по изобретению, которые тестируют в этом анализе, как правило, обладают pKi на рецепторе AT1, большей или равной приблизительно 5,0. Например, обнаружено, что соединение из примера 1 обладает значением pKi, большим чем приблизительно 7,0.
АНАЛИЗ 2
Анализы in vitro для количественной оценки силы ингибиторов (IC 50 ) для NEP человека и крысы, и ACE человека
Ингибирующие активности соединений для NEP человека и крысы, и ACE человека определяли с использованием анализов in vitro, как описано ниже.
Выделение активного NEP почек крысы
NEP крысы получали из почек взрослых крыс Sprague Dawley. Цельные почки промывали в холодном PBS и переносили в ледяной буфер для лизиса (1% Triton X-114, 150 мМ NaCl, 50 мМ Трис pH 7,5; Bordier (1981) J. Biol. Chem. 256: 1604-1607) в соотношении 5 мл буфера на каждый грамм почки. Образцы гомогенизировали с использованием ручного гомогенизатора тканей polytron на льду. Гомогенаты центрифугировали при 1000×g в роторе с качающимися стаканами в течение 5 минут при 3°C. Осадок ресуспендировали в 20 мл ледяного буфера для лизиса и инкубировали на льду в течение 30 минут. Затем образцы (15-20 мл) наслаивали на подушку 25 мл ледяного буфера (6% мас./об. сахарозы, 50 мМ pH 7,5 Трис, 150 мМ NaCl, 0,06%, Triton X-114), нагревали до 37°C в течение 3-5 минут и центрифугировали при 1000×g в роторе с качающимися стаканами при комнатной температуре в течение 3 минут. Два верхних слоя отсасывали, оставляя вязкий масляный преципитат, содержащий обогащенную мембранную фракцию. Глицерин добавляли до концентрации 50%, и образцы сохраняли при -20°C. Концентрации белка оценивали количественно с использованием системы детекции BCA с BSA в качестве стандарта.
Анализы ингибирования ферментов
Рекомбинантный человеческий NEP и рекомбинантный человеческий ACE получали из коммерческих источников (R&D Systems, Minneapolis, MN, каталожные номера 1182-ZN и 929-ZN, соответственно). Флуорогенный пептидный субстрат Mca-BK2 (Mca-Arg-Pro-Pro-Gly-Phe-Ser-Ala-Phe-Lys(Dnp)-OH; Johnson et al. (2000) Anal. Biochem. 286: 112-118) использовали для анализов NEP и ACE человека, и Mca-RRL (Mca-DArg-Arg-Leu-(Dnp)-OH; Medeiros et al. (1997) Braz. J. Med. Biol. Res. 30:1157-1162) использовали для анализа NEP крысы (оба из Anaspec, San Jose, CA).
Анализы проводили в 384-луночных непрозрачных белых планшетах при комнатной температуре с использованием соответствующих флуорогенных пептидов в концентрации 10 мкм в буфере для анализа (50 мМ Трис/HCl при 25°C, 100 мМ NaCl, 0,01% Tween-20, 1 мкм Zn, 0,025% BSA). NEP человека и ACE человека использовали в концентрациях, приводящих к количественному протеолизу 5 мкм Mca-BK2 в течение 20 минут при комнатной температуре. Препарат фермента NEP крысы использовали в концентрации, приводящей к количественному протеолизу 3 мкм Mca-RRL в течение 20 минут при комнатной температуре.
Анализы начинали добавлением 25 мкл фермента к 12,5 мкл тестируемого соединения в 12 концентрациях (10 мкМ - 20 пМ). Ингибиторам позволяли приходить в равновесие с ферментом в течение 10 минут перед добавлением 12,5 мкл флуорогенных субстратов для инициации реакции. Реакции останавливали добавлением 10 мкл 3,6% ледяной уксусной кислоты через 20 минут инкубации. Планшеты считывали на флуориметре с длинами волны возбуждения и испускания, установленными на 320 нм и 405 нм, соответственно.
Исходные данные (относительные единицы флуоресценции) нормализовали по % активности из среднего высоких считываний (отсутствие ингибирования, 100% ферментативная активность) и среднего низких считываний (полное ингибирование, самая высокая концентрация ингибитора, 0% ферментативная активность) с использованием трех стандартных ингибиторов NEP и ACE, соответственно. Нелинейную регрессию нормализованных данных проводили с использованием модели конкуренции для одного участка (GraphPad Software, Inc., San Diego, CA). Данные представляли как значения pIC50.
Обнаружили, что иллюстративные соединения по изобретению, которые тестировали в этом анализе, как правило, обладают pIC50 для фермента NEP, большей или равной приблизительно 5,0. Например, соединение из примера 1 обладает значением pIC50, большим или равным приблизительно 7,0.
АНАЛИЗ 3
Фармакодинамический (PD) анализ активности ACE, AT 1 и NEP у подвергнутых анестезии крыс
Самцов нормотензивных крыс, Sprague Dawley, подвергали анестезии с помощью 120 мг/кг (i.p.) инактина. После анестезии вставляли канюли в яремную вену, сонную артерию (трубки PE 50) и мочевой пузырь (URI-1 силиконовый катетер для мочи) и проводили трахеотомию (тефлоновая игла, калибр 14 (2,1 мм)) для облегчения самостоятельного дыхания. Затем животным предоставляли период стабилизации 60 минут и содержали их при постоянной инфузии по всем отделам 5 мл/кг/час солевого раствора (0,9%), чтобы поддерживать их гидратацию и обеспечивать продукцию мочи. Температуру тела поддерживали на протяжении эксперимента с использованием грелки-подушки. В конце периода стабилизации 60 минут животным вводили внутривенно (i.v.) две дозы ангиотензина (AngI, 1,0 мкг/кг, в случае активности ингибитора ACE; AngII, 0,1 мкг/кг, в случае активности антагониста рецептора AT1) с интервалом 15 минут. Через 15 минут после второй дозы ангиотензина (AngI или AngII) животных обрабатывали носителем или тестируемым соединением. Через пять минут животных дополнительно обрабатывали с помощью болюсной i.v. инъекции предсердного натрийуретического пептида (ANP; 30 мкг/кг). Сбор мочи (в предварительно взвешенные пробирки eppendorf) начинали немедленно после обработки ANP и продолжали в течение 60 минут. На 30 и 60 минутах при сборе мочи животных повторно стимулировали ангиотензином (AngI или AngII). Измерения кровяного давления проводили с использованием системы Notocord (Kalamazoo, MI). Образцы мочи замораживали при -20°C до использования для анализа cGMP. Концентрации cGMP в моче определяли иммуноферментным анализом с использованием коммерческого набора (Assay Designs, Ann Arbor, Michigan, Cat. No. 901-013). Объем мочи определяли гравиметрически. Выход cGMP с мочой рассчитывали как выход продукции мочи и концентрацию cGMP в моче. Ингибирование ACE или антагонизм AT1 оценивали количественным определением % ингибирования прессорной реакции на AngI или AngII, соответственно. Ингибирование NEP оценивали количественным определением стимуляции индуцированного ANP-повышения выхода cGMP с мочой.
АНАЛИЗ 4
Оценка in vivo антигипертензивных эффектов на модели контролируемой гипертензии SHR
Спонтанно гипертензивным крысам (SHR, возраст 14-20 недель) позволяли адаптацию минимум 48 часов после прибытия на место тестирования. За семь суток до тестирования животных либо переводили на диету с низким содержанием соли с пищей, содержащей 0,1% натрий, для SHR с недостатком натрия (SD-SHR), либо переводили на нормальную диету для SHR с достаточным количеством натрия (SR-SHR). За двое суток до тестирования животным в сонную артерию и яремную вену хирургически вводили катетеры (полиэтиленовые трубки PE50), присоединенные посредством полиэтиленовых трубок PE10 к выбранным силиконовым трубкам (размер 0,020 ID×0,037 OD×0,008 стенка) для измерения кровяного давления и доставки тестируемого соединения, соответственно. Животным позволяли восстановиться при соотвествующем послеоперационном уходе.
На сутки эксперимента животных помещали в их клетки и катетеры соединяли посредством поворотного механизма с откалиброванным датчиком кровяного давления. Через 1 час адаптации получали измерение фона в течение периода по меньшей мере пять минут. Затем животным вводили i.v. носитель или тестируемое соединение в повышающихся накапливающихся дозах каждые 60 минут, затем 0,3 мл солевой раствор для очистки катетера после каждой дозы. Данные записывали непрерывно в течение продолжительности исследования с использованием программного обеспечения Notocord (Kalamazoo, MI) и сохраняли в виде электронных цифровых сигналов. В некоторых исследованиях эффекты однократной внутривенной или пероральной (через желудочный зонд) дозы мониторировали в течение по меньшей мере 6 часов после дозирования. Измеряемые параметры представляли собой кровяное давление (систолическое, диастолическое и среднее артериальное давление) и частоту сердечных сокращений.
АНАЛИЗ 5
Оценка in vivo антигипертензивных эффектов на DOCA-солевой модели контролируемой гипертензии на крысах
Крысам CD (самцы, взрослые, 200-300 г, Charles River Laboratory, USA) позволяли адаптацию 48 часов при прибытии на место тестирования перед тем, как их переводили на высокосолевую диету.
Через неделю после начала высокосолевой диеты шарик DOCA-соли (100 мг, время высвобождения 21 сутки, Innovative Research of America, Sarasota, FL) имплантировали подкожно и проводили одностороннюю нефректомию. На 16 или 17 сутки после имплантации шарика DOCA-соли животным в сонную артерию и яремную вену хирургически имплантировали катетеры с полиэтиленовыми трубками PE50, которые, в свою очередь, присоединяли посредством полиэтиленовых трубок PE10 к выбранным силиконовым трубкам (размер 0,020 ID×0,037 OD×0,008 стенка) для измерения кровяного давления и доставки тестируемого соединения, соответственно. Животным позволяли восстановиться при соответствующем послеоперационном уходе.
На сутки эксперимента каждое животное помещали в свою клетку и соединяли их посредством поворотного механизма с откалиброванным датчиком кровяного давления. Через 1 час адаптации получали измерение фона в течение периода по меньшей мере пяти минут. Затем животным вводили i.v. носитель или тестируемое соединение в повышающихся накапливающихся дозах каждые 60 минут, затем 0,3 мл солевого раствора для промывки катетера после каждой дозы. В некоторых исследованиях эффекты однократной внутривенной или пероральной (через желудочный зонд) дозы тестировали и мониторировали в течение по меньшей мере 6 часов после дозирования. Данные записывали непрерывно в течение продолжительности исследования с использованием программного обеспечения Notocord (Kalamazoo, MI) и сохраняли в виде электронных цифровых сигналов. Измеряемые параметры представляли собой кровяное давление (систолическое, диастолическое и среднее артериальное давление) и частоту сердечных сокращений. Для накапливающегося и однократного дозирования процентное изменение среднего артериального давления (MAP, мм рт.ст.) или частоту сердечных сокращений (HR, ударов в минуту) определяли, как описано для анализа 4.
В то время как настоящее изобретение описано по отношению к его конкретным аспектам или вариантам осуществления, специалистам в данной области понятно, что можно осуществлять различные изменения или можно заменять эквиваленты без отклонения от истинной сущности и объема изобретения. Кроме того, до степени, допустимой применимыми патентными законодательными актами и нормативами, полное содержание всех публикаций, патентов и патентных заявок, процитированных в настоящем документе, таким образом, приведено в качестве ссылки до такой же степени, как если бы каждый документ являлся отдельно приведенным в качестве ссылки в настоящем документе.