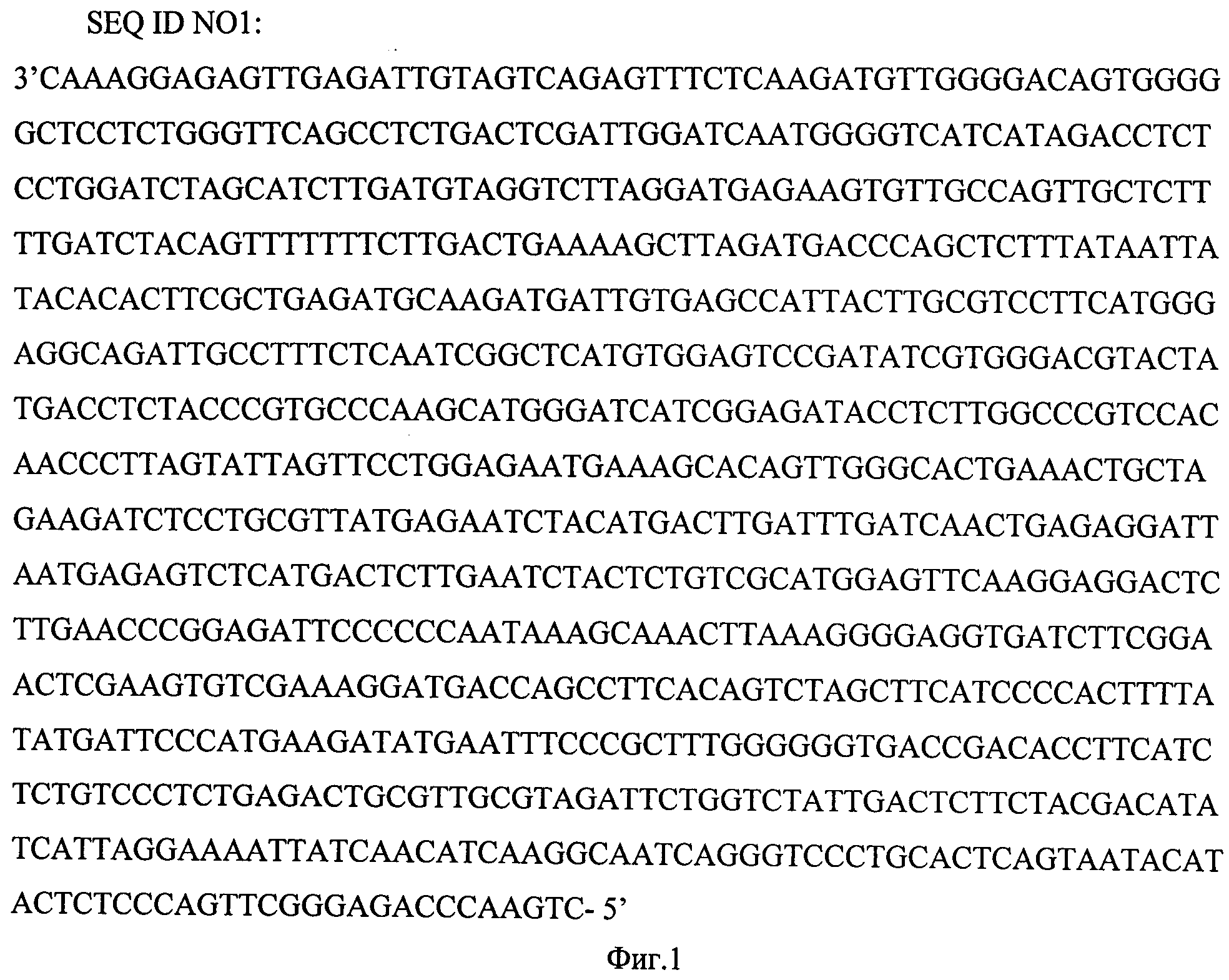Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli TG1(pRVMoscow3253G-L) ДЛЯ ПОЛУЧЕНИЯ НАБОРА ПЦР-СТАНДАРТОВ И НАБОР ПЦР-СТАНДАРТОВ ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ШТАММА ВИРУСА БЕШЕНСТВА "Москва 3253" В РАБИЧЕСКОМ АНТИГЕНЕ
Вид РИД
Изобретение
Изобретение относится к биотехнологии и касается конструирования рекомбинантного штамма Escherichia coli, несущего клонированную последовательность фрагмента G-L области генома штамма вируса бешенства «Москва 3253» и набора ПНР-стандартов для количественной ПЦР, и может быть использовано при производстве антирабического иммуноглобулина.
Неблагоприятная эпидемиологическая ситуация по бешенству, сложившаяся практически во всех регионах Российской Федерации из-за повышения заболеваемости диких и домашних животных, обусловливает резко возросший уровень численности людей, ежегодно обращающихся за антирабической помощью, что диктует необходимость совершенствования антирабических препаратов, повышение их качества [4].
Антирабический иммуноглобулин получают из гипериммунной сыворотки продуцентов, иммунизированных рабическим антигеном. Отсутствие количественных методов определения содержания вируса бешенства в рабическом антигене при иммунизации препятствует стандартизации антигенного материала.
Одним из перспективных подходов к определению фиксированного вируса бешенства штамма «Москва 3253» в материале для иммунизации является использование количественной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов в режиме реального времени с применением ПЦР-стандартов с определенным количеством геном-эквивалентов вирусных частиц или фрагментов генома вируса.
Известны ПЦР-стандарты (EBVQ-PCR Standard, кат. №STD020; HSV1Q-PCR Standard, кат. №STD031; HSV2Q-PCR Standard, кат. №STD032; HHV6Q-PCR Standard, кат. №STD036), представляющие собой раствор плазмид с различной концентрацией для определения количества вируса Эпштейн-Барра, простого вируса герпеса первого и второго типа, других вирусов в биологическом материале методом ПЦР с учетом результатов в режиме реального времени, которые выпускает фирма NaNogen Advanced Diagnostics (Италия) [10, 12].
Известны ПЦР-стандарты (Colibrator) для количественной диагностики гепатита С (кат. №01N30-070), ВИЧ-1 (кат. №6L18-70), гепатита В (кат. №02N40-70) и др. методом ПЦР с учетом результатов в режиме реального времени, выпускаемые фирмой Abbott Molecular (США) [2, 3]. Однако ПЦР-стандарты для количественного определения вируса бешенства методом ПЦР с учетом результатов в режиме реального времени эти фирмы не выпускают.
По результатам проведенного поиска сведений о наличии ПЦР-стандартов для количественного учета фиксированного вируса бешенства штамма «Москва 3253» в материале для иммунизации методом ПЦР с учетом результатов в режиме реального времени не найдено.
Для создания ПЦР-стандартов, используемых при постановке количественной ПЦР, с учетом результатов в режиме реального времени необходим штамм-продуцент специфического фрагмента определенной области генома вируса бешенства. На сегодняшний день отсутствуют сведения о рекомбинантных штаммах с определенным фрагментом области генома вируса бешенства для его количественной оценки.
Для конструирования рекомбинантного штамма требуется выбор уникальной области ДНК-мишеней, обладающей высокой стабильностью во всех пассажах вируса, необходимых в производственных условиях и достаточной специфичностью.
В литературе описано использование в качестве ДНК-мишени N-области генома вируса. Этот локус характеризуется высокой консервативностью [1]. Отмечено несколько аллелей данного локуса, которые специфичны для определенных генотипов лиссавирусов [6, 7, 8, 9, 11, 13]. При изучении вариабельности N-локуса вируса бешенства показано, что данный участок не может быть использован в качестве матрицы для определения с помощью амплификационных технологий отдельных штаммов вируса. Для выявления методом ПЦР с обратной транскрипцией кДНК фиксированного вируса бешенства штамма «Москва 3253» в качестве ДНК-мишени в наибольшей степени подходит G-локус и G-L область генома вируса бешенства, характеризующиеся высоким полиморфизмом и частотой возникновения мутаций [1] и отличающиеся у отдельных штаммов вируса бешенства.
По результатам проведенного патентного поиска и литературным данным, сведения о наличии рекомбинантных штаммов, несущих фрагмент G-L области генома вируса бешенства штамма «Москва 3253», не обнаружены.
Задачей настоящего изобретения является конструирование штамма E. coli, несущего рекомбинантную плазмиду с клонированной последовательностью фрагмента G-L области генома фиксированного вируса бешенства штамма «Москва 3253», для получения ПЦР-стандартов и создание на его основе набора ПЦР-стандартов для количественного определения кДНК вируса бешенства штамма «Москва 3253» в рабическом антигене, используемого при производстве антирабического иммуноглобулина, методом ПЦР с учетом результатов в режиме реального времени.
Технический результат заключается в стандартизации этапа технологического процесса приготовления рабического антигена в производстве гетерологичного антирабического иммуноглобулина, за счет создания рекомбинантного штамма E. coli KM 229 для производства ПЦР-стандартов и набора ПЦР-стандартов на его основе, позволяющих количественно охарактеризовать рабический антиген методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени.
Технический результат достигается тем, что сконструирован рекомбинантный штамм E. coli, несущий плазмиду pRVMoscow3253G-L, содержащую фрагмент G-L области генома фиксированного вируса бешенства штамма «Москва 3253», имеющего размер 881 п.н., последовательность SEQ ID NO1, предназначенный для получения набора ПЦР-стандартов.
Последовательность SEQ ID NO1 представлена на фиг.1.
Для конструирования рекомбинантного штамма выбрана нуклеотидная последовательность фрагмента G-L области генома у штамма «Москва 3253» размером 881 н.п., фланкированного праймерами BeshG 5'-gacttgggtctcccgaactgggg-3' и BeshL 5'-caaaggagagttgagattgtagtc-3' (с 5543 по 4663 нуклеотид по последовательности генома штамма вируса RV-97, GenBank NCBI №EF542830).
Процедура клонирования состояла из следующих этапов.
1. Амплифицированный фрагмент очищали от невключившихся в реакции мононуклеотидов на колонке «Gentry-sep colounins» (Pirseton Separations INC, USA) в соответствии с инструкцией фирмы-изготовителя.
2. Фрагмент лигировали в плазмиду pGem-T с помощью коммерческого набора pGem-T Vector Sistems (Promega USA) согласно инструкции производителя.
3. Проводили трансформацию клеток штамма E. coli TG1 аликвотой дотированной смеси. Для этого к 20±5 мкл лигированной смеси добавляли 200±30 мкл свежеприготовленных компетентных клеток. После инкубации при 42°С в течение 90 секунд смесь выдерживали на льду 2 минуты и подращивали 1 час при 37°С Клетки высевали на агаризованную среду с ампициллином в концентрации 100 мкг/ мл в чашки Петри и инкубировали 18±2 часа при 37°С.
4. Выросшие колонии проверяли на наличие фрагмента G-L области генома фиксированного вируса бешенства штамма «Москва 3253», имеющего последовательность SEQ ID NO1, методом ПЦР с праймерами BeshG 5'-gacttgggtctcccgaactgggg-3' и BeshL 5'-caaaggagagttgagattgtagtc-3'5.
Колонии E. coli TG1 (pRVMoscow3253G-L) выращивали на жидкой питательной среде LB с ампициллином в пробирках в течение 18±2 часов при температуре 37 С при постоянном покачивании на качалке. Полученную биомассу собирали центрифугированием в микропробирках в объеме 1,5 мл.
6. Выделяли плазмиду из полученной биомассы методом мембранной фильтрации с помощью набора PureYield Plasmid Miniprep Sistems (Промега, США) или аналогичного.
7. Подтверждали наличие фрагмента методом ПЦР с праймерами BeshG и BeshL, специфичность оценивали сиквенированием на генетическом анализаторе, например «СеО-800», с использованием стандартных протоколов пробоподготовки и программного обеспечения прибора.
Рекомбинантный штамм, несущий плазмиду pRVMoscow3253G-L, содержащую в своем составе фрагмент G-L области генома фиксированного вируса бешенства штамма «Москва 3253» размером 881 п.н, имеющего последовательность SEQ ID NO1, характеризуется следующими признаками.
Культурально-морфологические свойства: представлен грамотрицательными палочками, дающими на питательной среде LB с ампициллином гладкие, с ровным краем колонии диаметром (2+0,5) мм.
Физиолого-биохимические свойства: сохраняет основные культурально-морфологические и биохимические свойства E. coli TG1.
Плазмида pRVMoscow3253G-L с клонированным фрагментом G-L области генома фиксированного вируса бешенства штамма «Москва 3253», имеющего последовательность SEQ ID NO1, является исходным продуктом для получения ПЦР-стандартов, используемых при выполнении количественной ПЦР с учетом результатов в режиме реального времени для определения количества фиксированного вируса бешенства штамма «Москва 3253» в рабическом антигене при производстве антирабического иммуноглобулина.
Заявляемый рекомбинантный штамм E. coli TG1 (pRVMoscow3253G-L) депонирован в Государственной коллекции патогенных бактерий при ФКУЗ РосНИПЧИ «Микроб», под номером КМ 229.
Полученный рекомбинантный штамм Escherichia coli KM 229 предназначен для получения набора ПЦР-стандартов, применяемых при количественном определении в ПЦР с учетом результатов в режиме реального времени фиксированного вируса бешенства штамма «Москва 3253» в рабическом антигене при производстве антирабического иммуноглобулина.
Технический результат достигается также получением на основе плазмиды pRVMoscow3253G-L, продуцируемой рекомбинантным штаммом E. coli КМ 229, набора ПЦР-стандартов. ПЦР-стандарты представляют собой раствор ДНК плазмиды pRVMoscow3253G-L в концентрации от 108 до 103 ГЭ/мл.
Набор для количественного определения кДНК фиксированного вируса бешенства штамма «Москва 3253» в рабическом антигене состоит из ПЦР-стандартов с аббревиатурой (Rabies virus) RV1, RV2, RV3, RV4, обозначающей различную концентрацию ДНК плазмиды: от RV1 - максимальной концентрации до RV4 - минимальной. Для выявления высоких концентраций вируса бешенства используют сочетание ПЦР-стандартов RV1, RV2, RV3; для определения низких концентраций - сочетание ПЦР-стандартов RV2, RV3, RV4.
ПЦР-стандарты RV1, RV2, RV3, RV4 готовили из раствора ДНК pRVMoscow3253G-L, концентрацию которой определяли спектрофотометрически при длине волн 260 и 280 нм. Оптическая плотность D=1 соответствует - 50 мкг/мл двухцепочечной ДНК. Чистоту препарата ДНК определяли по соотношению оптической плотности раствора при 260 и 280 нм. Для приготовления ПЦР-стандартов использовали исходный раствор ДНК плазмиды pRVMoscow3253G-L с концентрацией не менее 10 мкг/мл при соотношении D260/D280 не менее 1,5.
Количественная характеристика ПЦР-стандартов RV1, RV2, RV3, RV4 выражается количеством геном-эквивалентов плазмиды pRVMoscow3253G-L в растворе, которое вычисляли по формуле:
KpRVMoscow3253G-L=А×0,234×1012 [ГЭ/МЛ],
Где А - концентрация ДНК плазмидны pRVMoscow3253G-L в мкг/мл.
ПЦР-стандарт RV1 содержит n×108 ГЭ/мл pRVMoscow3253G-L
ПЦР-стандарт RV2 содержит n×107 ГЭ/мл pRVMoscow3253G-L
ПЦР-стандарт RV3 содержит n×105 ГЭ/мл pRVMoscow3253G-L
ПЦР-стандарт RV4 содержит n×103 ГЭ/мл pRVMoscow3253G-L
Набор предназначен для количественного определения кДНК фиксированного вируса бешенства штамма «Москва 3253» в вируссодержащем материале на этапах приготовления рабического антигена, применяемого в производстве гетерологичного антирабического иммуноглобулина.
Использование набора позволяет контролировать и стандартизировать технологические операции, проводимые на этапе приготовления рабического антигена при производстве гетерологичного антирабического иммуноглобулина, что отвечает требованиям GMP к проведению технологического процесса и способствует повышению качества производимого препарата.
Практическое применение ПЦР-стандартов, созданных на основе рекомбинантного штамма, иллюстрируется следующими примерами.
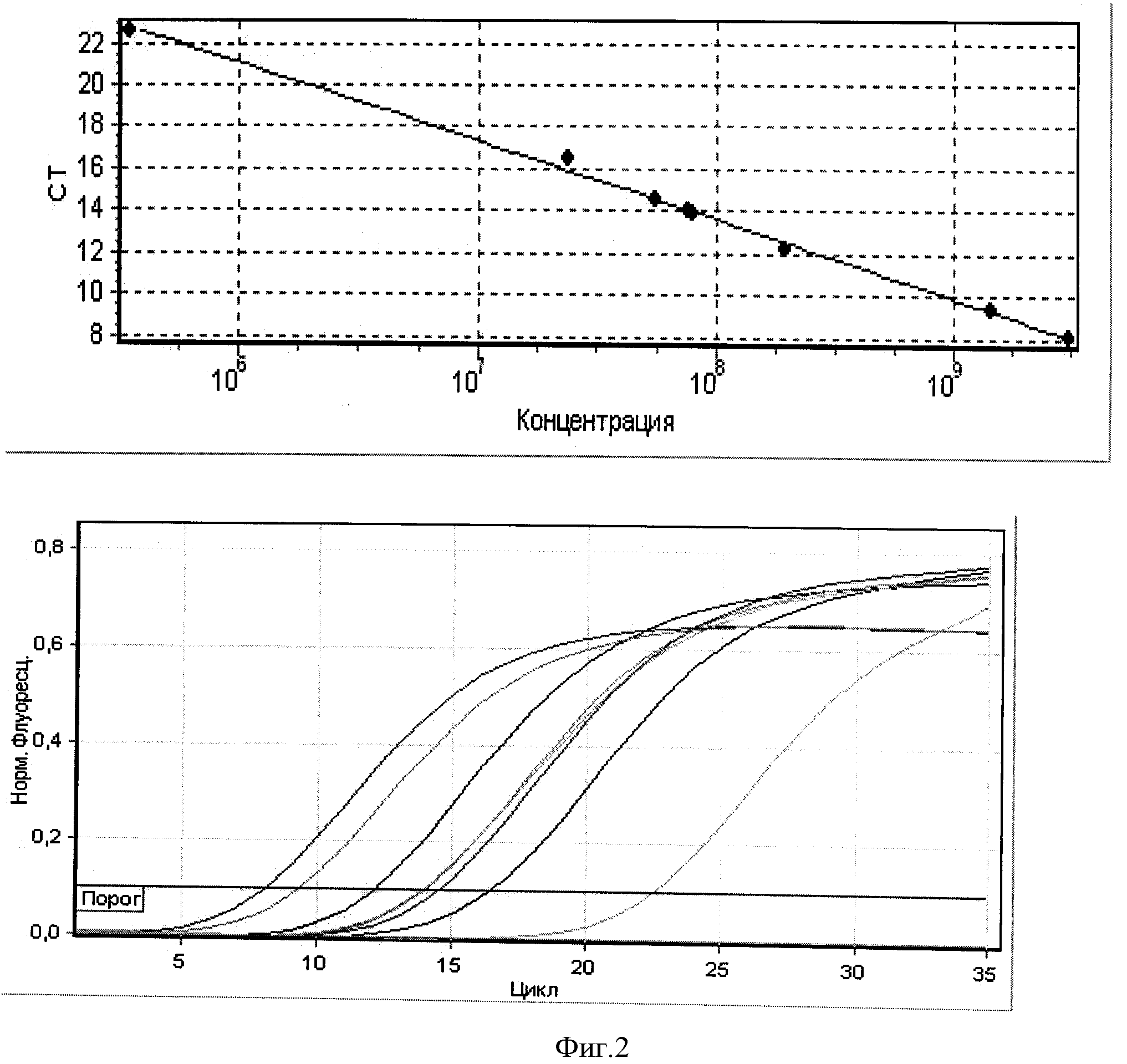
Пример 1. Количественное определение высоких концентраций вируса бешенства штамма «Москва 3253» с использованием набора ПЦР-стандартов на примере рабического антигена органо-тканевого происхождения.
Рабический антиген органо-тканевого происхождения получали из мозговой суспензии кроликов, которым предварительно ввели вирус бешенства штамма «Москва 3253». Из антигенного материала (мозговой суспензии кроликов), обеззараженного согласно МУ 1.3.2569-09 [5], готовили пробы для анализа.
Определение концентрации вируса бешенства выполняли в несколько этапов.
Пробы рабического антигена органо-тканевого происхождения отбирали по 100 мкл и переносили в 5 микроцентрифужных пробирок объемом 1,5 мл. Дополнительно в отдельную микроцентрифужную пробирку объемом 1,5 мл вносили 100 мкл ТЕ-буфера - отрицательного контроля выделения ДНК/РНК (ОКВ).
Выделение РНК. Для выделения РНК использовали «комплект реагентов для выделения РНК/ДНК из клинического материала «РИБО-сорб», выпускаемый фирмой (ООО «ИнтерЛабСервис», Россия). Комплект реагентов для выделения РНК состоит из лизирующего раствора, раствора для отмывки 1, раствора для отмывки 3, раствора для отмывки 4, сорбента и РНК-буфера. В 5 микроцентрифужных пробирок со 100 мкл обеззараженного рабического антигена органо-тканевого происхождения и 1 пробирку ОКВ добавляли по 450 мкл предварительно прогретого при температуре (62±2)°С в течение 5-10 мин лизирующего раствора и тщательно перемешивали. Оставляли в штативе на 5-8 мин, 3-4 раза перемешивая. Центрифугировали в течение 5 с при 3000-5000 об/мин. Сорбент тщательно ресуспендировали и добавляли по 30 мкл в каждую пробирку. Перемешивали, оставляли в штативе на 1 мин, еще раз перемешивали и оставляли на 5 мин. Центрифугировали пробирки при 10000 об/мин в течение 45 с. Супернатант удаляли, а к осадку добавляли по 400 мкл раствора для отмывки 1. Перемешивали до полного ресуспендирования сорбента, центрифугировали в течение 45 с при 10000 об/мин. После удаления супернатанта добавляли в пробирки по 500 мкл раствора для отмывки 3. Сорбент тщательно ресуспендировали и пробирки центрифугировали в течение 45 с при 10000 об/мин. После удаления супернатанта операцию повторяли еще раз. Затем в пробирки добавляли по 400 мкл раствора для отмывки 4, тщательно ресуспендировали и центрифугировали в течение 45 с при 10000 об/мин. Надосадочную жидкость удаляли и помещали пробирки в термостат при температуре 60°С на 10 мин, при этом крышки оставляли открытыми.
После сушки в каждую пробирку добавляли по 50 мкл РНК-буфера, перемешивали и помещали в твердотельный термостат при температуре 60°С на 3 мин. Перемешивали и центрифугировали в течение 1 мин при 13000 об/мин. Надосадочная жидкость содержала очищенную РНК вируса.
Проведение реакции обратной транскрипции.
Для постановки реакции обратной транскрипции использовали комплект реагентов для получения кДНК на матрице РНК «Реверта-L» (ООО «ИнтерЛабСервис», Россия). Комплект реагентов для получения кДНК на матрице РНК содержит RT-G-mix-1, RT-mix - 0,125 мл, ревертазу (MMLv) и ДНК-буфер.
Перед началом работы из морозильной камеры извлекали пробирки с RT-mix и RT-G-mix-1 (RT-G-mix-2) и размораживали содержимое пробирок при комнатной температуре. Затем их тщательно перемешивали и центрифугировали в течение 5 с при 3000-5000 об/мин, для осаждения капель со стенок. Для приготовления реакционной смеси в пробирку с RT-mix вносили по 5 мкл RT-G-mix-1 (RT-G-mix-2), тщательно перемешивали, центрифугировали в течение 5 с при 3000-5000 об/мин, для осаждения капель со стенок. К полученному раствору добавляли 6 мкл ревертазы MMLv, аккуратно перемешивали и центрифугировали в течение 5 с при 3000-5000 об/мин, для осаждения капель со стенок.
Отбирали 5 микроцентрифужных пробирок объемом 0,6 мл, соответствующие числу исследуемых проб и ОКВ. В каждую пробирку вносили по 10 мкл полученной реакционной смеси, затем в пробирки добавляли по 10 мкл препарата РНК и 10 мкл ТЕ-буфера в ОКВ. Пробирки инкубировали в амплификаторе или твердотельном термостате в течение 30 мин при температуре 37°С. Во все пробирки добавляли по 20 мкл ДНК-буфера и аккуратно 8-10 раз перемешивали. Полученную кДНК использовали для постановки ПЦР с гибридизационно-флуоресцентным учетом результатов.
Постановка ПЦР.
Из морозильной камеры извлекали микропробирки объемом 0,2 мл, содержащие ПЦР-смесь - 1, ПЦР-смесь - 2, ТЕ-буфер, фермент Taq ДНК-полимеразу с активностью 5 ед/мкл, набор ПЦР-стандартов RV1, RV2, RV3 для учета высоких концентраций антигена вируса бешенства в пробе. Содержимое пробирок полностью размораживали.
ПЦР-смесь-1 в объеме 5 мкл содержала раствор праймеров RV8 5'-ACGTACTATGACCTCTACCC-3', RV9 5' - CCAGGAACTAATACTAAGGG-3' и зонда RV10 5'-FAM-CTCCGATGATCCCATGCTTG-BHQ1-3', обеспечивающих амплификацию фрагмента G-L области генома фиксированного вируса бешенства штамма «Москва 3253», в количестве 8 и 4 пМоль, соответственно, 1 мМоль каждого из четырех дНТФ, 0,025% раствор азида натрия и воду, свободную от нуклеаз. ПЦР-смесь-1 переносили по 5 мкл в 9 микроцентрифужных пробирок объемом 0,2 мл. В каждую пробирку на поверхность ПЦР-смеси-1 наслаивали расплавленный 20% раствор парафина в минеральном масле.
ПЦР-смесь-2 в объеме 10 мкл, содержащую 2,5×Taq буфер с сульфатом аммония, 6,25 мМоль магния хлорида, фермент Taq ДНК-полимеразу, воду, свободную от нуклеаз, перемешивали на микроцентирифуге/встряхивателе и переносили по 10 мкл в 5 микропробирок с ПЦР-смесью-1, не повреждая слой парафина.
В 5 микропробирок вносили по 10 мкл пробы кДНК, в 3 микропробирки вносили по 10 мкл каждого ПЦР-стандарта RV1, RV2, RV3, в 1 микропробирку вносили 10 мкл из ОКВ-пробы, содержащей ТЕ-буфер, исследование которой происходит вместе с анализируемыми образцами, начиная с этапа выделения ДНК. В 1 микропробирку с отрицательным контролем амплификации (К-) вносили 10 мкл ТЕ-буфера.
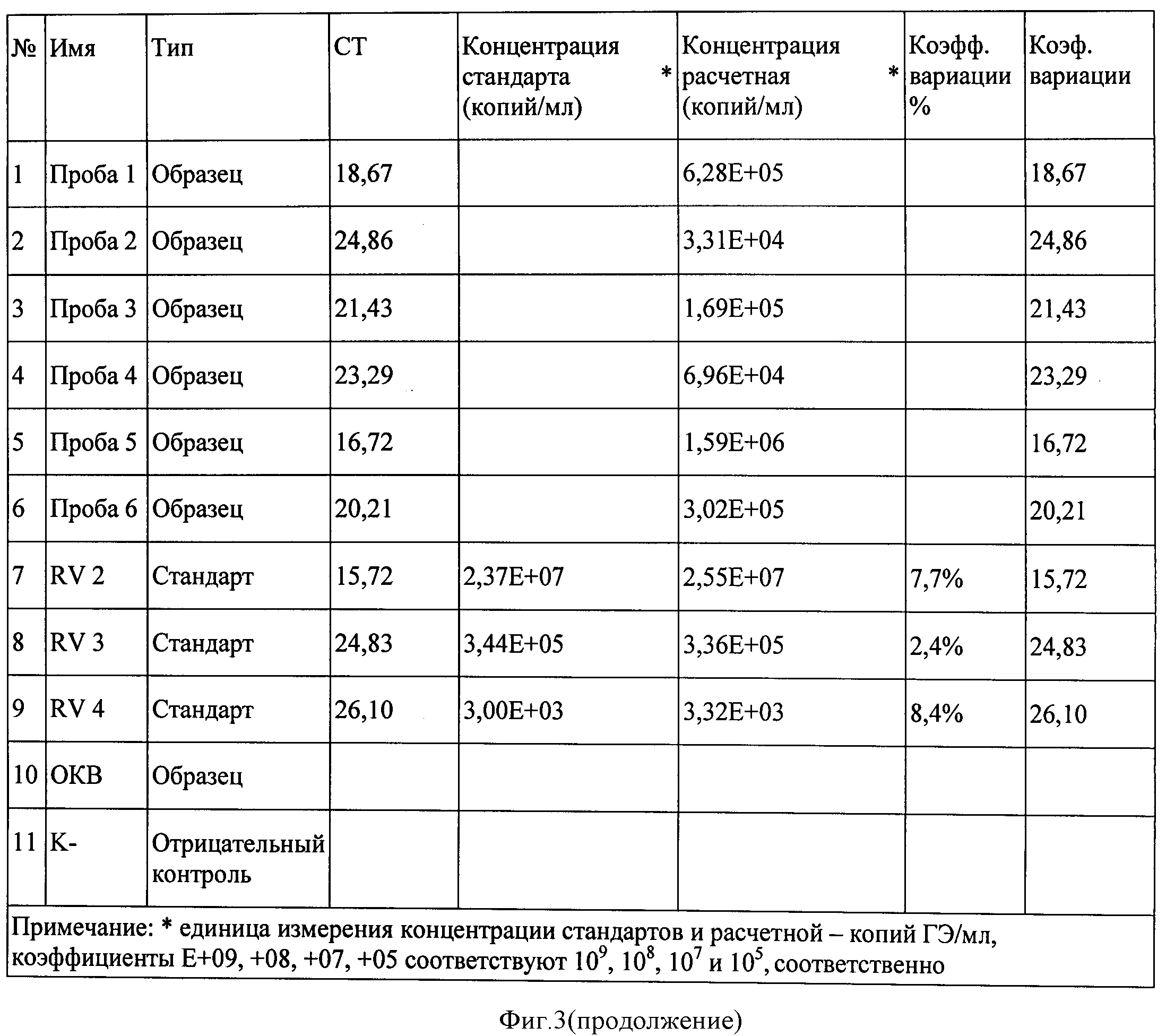
Подготовленные микропробирки помещали в термоциклер RotorGene 6000 и проводили ПЦР с гибридизационно-флуоресцентным учетом результатов при режиме отжига праймеров при температуре 55°С в течение 10 циклов, затем при 51°С в течение 35 циклов. Учет флуоресценции по каналу FAM осуществляли при температуре 51°С.
Учет результатов.
Количественную оценку содержания кДНК вируса бешенства в антигенном материале проводили по значению интенсивности флуоресценции сигнала путем сравнения исследуемого образца с ПЦР-стандартами RV1, RV2, RV3 с помощью программного обеспечения термоциклера RotorGene 6000, при наличии отрицательного результата в пробах К- и ОКВ.
Концентрации фиксированного вируса бешенства штамма «Москва 3253» в 5 исследуемых пробах мозговой суспензии кроликов составила от 5,57×107 копий/мл до 3,07×109 копий/мл (фигура 2). Значения коэффициента корреляции составили 0,99086, эффективности реакции - 0,85949.
Пример 2. Количественное определение низких концентраций вируса бешенства штамма «Москва 3253» на примере культуральной жидкости на этапе выращивания вируса в культуре клеток с использованием набора ПЦР-стандартов.
Для исследования взяты 6 проб вируссодержащей культуральной жидкости, полученной при суспензионном способе выращивания Virus fixe на культуре клеток Vero до этапа концентрирования. Обеззараживание вируссодержащего материала, выделение РНК, реакцию обратной транскрипции и ПЦР проводили аналогично примеру 1, только при проведении ПЦР использовали набор ПЦР-стандартов RV2, RV3, RV4 для учета низких концентраций вируса бешенства в пробе.
Концентрации фиксированного вируса бешенства штамма «Москва 3253» в исследуемых пробах составила от 3,31×104 копий/мл до 1,59×106 копий/мл (фигура 3). Значения коэффициента корреляции составили 0,99959, эффективности реакции - 0,90885.
Таким образом, заявляемый рекомбинантный штамм E. coli TGl(pRVMoscow3253G-L) для получения набора ПЦР-стандартов и набор ПЦР-стандартов для количественного определения кДНК фиксированного вируса бешенства штамма «Москва 3253» в рабическом антигене позволяют определить различные степени концентрации фиксированного вируса бешенства «Москва 3253» в вируссодержащем материале, контролировать и стандартизировать технологические операции, проводимые на этапе приготовления рабического антигена при производстве гетерологичного антирабического иммуноглобулина, что отвечает требованиям GMP к проведению технологического процесса и способствует повышению качества производимого препарата.
Литература
1. Груздев К.Н., Недосеков В.В. Бешенство животных. М.: 2001. 25-26 с.; 44 с.
2. Каталог http://www.nadspa.com/ дата обращения 23.05.2012 г.
3. Каталог http://www.abbottmolecular.com/home.html дата обращения 23.05.2012 г.
4. Онищенко Г.Г. О санитарно-эпидемиологической обстановке в Российской Федерации в 2009 году: Государственный доклад. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора. 2010. 334-336 с.
5. Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности // Методические указания МУ 1.3.2569-09, Москва, 2009. - С.37-40.
6. Bordignon J., Brazil-dos-Anjos G., Bumo C.R. et al. Detection and characterization of rabies virus in Southern Brazil by PCR amplification and sequencing of the nucleoprotein gene // Arch Virol. - 2005. - Vol.150. - P.695-708.
7. Bourhy H., Kissi В., Tordo N. Molecular diversity of the Lyssavirus genus // Virology. - 1993. - Vol.l94. - P.70-81.
8. Dantasjunior J.V., Kimura L.M.S., Ferreira M.S.R. et al. Reverse transcription polymerase chain reaction assay for rabies virus detection // Arq. Bras. Med. Vet. Zootec. - 2004. - Vol.56. - P.398-400.
9. Heaton P.R., Johnsbone P., McElhinney L.M. et al. Heminested PCR assay for detection of six genotypes of rabies and rabies-related viruses // J. Clin. Microbiol. - 1997. - Vol.35. - P.2762-2766.
10. Kosinova E. et al. Real-time PCR for quantitation of bovine viral diarrhea virus RNA using SYBR Green I fluorimetry. Veterinarian medicine, 52, 2007; 6: 259-261 p.
11. Nagaraj Т., Vasanth J.P., Desai A. et al. Ante mortem diagnosis of human rabies using saliva samples: comparison of real-time and conventional RT-PCR techniques // J. Clin. Virol. - 2006. - Vol.36. - P.17-23.
12. Radonic A., Thuike S. et al. Reference gene selection for quantitative real-time PCR analysis in virus infected cells: SARS corona virus. Yellow fever virus. Human Herpesvirus-6, Cameplox virus and Cytomegalovirus infections. Virology. 2005; 7: Tab2.
13. Saengseesom W., Mitmoonpitak C., Kasempimolpom S., Sitprija V. Real-time PCR analysis of dog cerebrospinal fluid and saliva samples for ante-mortem diagnosis of rabies // Southeast Asian J. Trop. Med. Public Health. - 2007. - Vol.38. - P.53-57.