Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МЕЗОПОРИСТОГО НАНОРАЗМЕРНОГО ПОРОШКА ДИОКСИДА ЦЕРИЯ (ВАРИАНТЫ)
Вид РИД
Изобретение
Настоящее изобретение относится к химической промышленности, к производству наноматериалов, к технологическим процессам получения ультрадисперсных порошков оксидов металлов, в частности - к получению наноразмерного кристаллического диоксида церия, являющегося полупродуктом для получения мелкозернистой керамики широкого спектра назначения, наноструктурированных и мезопористых катализаторов, композиционных и фоточувствительных материалов, твердооксидных топливных элементов и др.
Современная технология мелкозернистых керамических материалов предъявляет особые требования к физико-химическим свойствам исходных полупродуктов, ультрадисперсных порошков оксидов металлов. Они должны обладать определенными текстурными и морфологическими характеристиками: фазовым составом и фазовой чистотой, наличием или отсутствием дефектов кристаллической решетки, степенью стехиометричности, дисперсностью, распределением по размеру кристаллитов, удельной поверхностью, характером пористости.
Отличительным признаком мелкозернистой керамики является размер зерна не более 5 (по некоторым источникам - 3) мкм и узкое распределение по размеру. Для получения материалов с такими характеристиками необходимо создание соответствующих полупродуктов, к которым относятся ультрадисперсные (или нано) порошки оксидов металлов. Размер кристаллитов в них не должен превышать 100 нм. Это позволяет при компактировании и спекании керамических материалов получать зерна с размером 0,5-5,0 мкм с узким распределением по размеру. Использование ультрадисперсных порошков для получения керамических материалов позволяет получать более равномерное распределение компонентов в объеме смесей для компактирования. Особенно это важно в многокомпонентных смесях, где содержание отдельных оксидов может составлять всего несколько процентов или даже доли процента.
Является общепризнанным фактом, что традиционными методами получения порошков, связанными с измельчением крупных кусков массива, практически невозможно добиться требуемых характеристик исходных порошков-полупродуктов для мелкозернистой керамики. Для получения ультрадисперсных порошков оксидов металлов наиболее приемлемыми являются методы так называемой «мокрой» химии (wet chemistry), где в качестве основной реакционной среды используются растворы и коллоиды. Это осаждение, гидротермальный, микроэмульсионный и золь-гель методы.
Наиболее дешевый и простой в организации метод осаждения редко позволяет достичь требуемой дисперсности. Гидротермальный и микроэмульсионный методы дороги и трудно переносимы в промышленные условия. Практика показала, что по экономическим показаниям для технологического воплощения наиболее приемлемым является золь-гель метод. Для его реализации в производстве возможно использовать несложное отечественное оборудование.
Золь-гель метод относится к методам «мокрой» химии и реализуется в «мягких» условиях: при низких температурах и атмосферном давлении. Предлагаемый способ на основе модифицированного золь-гель метода позволяет контролировать рост кристаллитов на атомно-молекулярном уровне путем подбора качественного и количественного состава реакционной смеси: концентрации каждого из исходных металлсодержащих реагентов, мольные отношения сорастворителей, комплексообразователя и стабилизатора золя к металлам.
Наноразмерный кристаллический диоксид церия является высоковостребованным полупродуктом для производства широкого спектра керамических и квазикерамических материалов для оптических устройств [Sujana M.G., Chattopadyay K.K., Anand S. // Appl. Surf. Sci 254 (2008) 7405-7409], твердооксидных топливных элементов [Steele B.C.H. // Solid State lonics 129 (2000) 95-110], сенсоров кислорода [Izu N., Shin W., Matsubara I., Murayama N. // Sensors Actual. B: Chem. 113 (2006) 207-213], полупроводниковых материалов [Panhans M.A., Blumenthal R.N. // Solid State lonics 60 (1993) 279-298], электрохромных устройств [Baundry P., Rodrigues A.C.M., Aegerter M.A., Bulhoes L.O. // J. Non-Cryst. Solids 121 (1990) 319-322], широкого спектра материалов для малоразмерных электронных устройств [Feng X., Sayle D.C., Wang Z.L. et al. // Science. 312 (2006) 1504-1508], наноструктурированных катализаторов для нефтехимии и экологического катализа [Kirn G. // Ind. Eng. Chem. Prod. Res. Dev. 21 (1982) 267-274], мембран как каталитических, так и со смешанной проводимостью [Fu Y.-P. // Ceram. Int. 35 (2009) 653-659], а также известно, что биосовместимые формы СеO2 являются важным компонентом керамических материалов для эндопротезов [Е.V.Dudnik, A.V.Shevchenko, A.K.Ruban, V.P.Red'ko, L.M.Lopato; Microstructural design of ZrO2-Y2O3-СеO2-Аl2O3 materials; powder metallurgy and metal ceramics, vol. 49, Nos. 9-10, 2011 // W.Rieger, S.Leyen, S.Kobel, W.Weber; The use ofbioceramics in dental and medical applications; Digital dental news, 3, 6-13, 2009].
Высокая востребованность диоксида церия обусловлена уникальными электронными свойствами его решетки, высокой подвижностью в ней ионов кислорода. При этом в наноразмерном кристаллическом диоксиде церия отмечено наличие размерного эффекта, вызванного увеличением параметров кристаллической решетки при уменьшении кристаллита до размеров менее 10 нм. В результате происходящих изменений в решетке образуются кислородные вакансии, а у части ионов церия степень окисления понижается до +3. Наноразмерный кристаллический СеО2 получают различными методами: осаждением [Abi-aad E., Bechara R., Grimblot J., Aboukais A. // Chem. Mater. 5 (1993) 793-797], сольвотермальным методом [Hosokawa S., Shimamura К., Inoue M. // Mater. Res. Bull. 46 (2011) 1928-1932], микроэмульсионным [Roderick E., Schrage C., Grigas A., Geiger D., Kaskel S. // J. Solid State Chem. 181 (2008) 1614-1620], при нагревании микроволновым излучением [Иванов В.К., Полежаева О.С., Гиль Д.О., Копица Г.П., Третьяков Ю.Д. // ДАН, 2009, т.426, №5, 632-634], ультразвуковой обработкой [Zhang D., Fu H., Shi L, Pan C., Li Q., Chu Y., Yu W. // Inorg. Chem. 46 (2007) 2446-2451], гидротермальным [Xu J., Li G., Li L. // Mater. Res. Bull. 43 (2008) 990-995].
Известны попытки получить наноразмерные кристаллические порошки оксидов металлов, в том числе диоксид церия, методами «мокрой» химии.
US Pat 8,029,754. Порошок оксида церия и способ его получения, 2011 г.
Nho Jun-seok, Kim Jang-yul, Oh Myoung-hwan, Kim Jong-pil, Cho Seung-beom гидротермальным синтезом были получены высокодисперсные порошки СеO2 с размером сферических частиц 10-500 нм. В качестве исходных церий-содержащих реагентов были использованы карбонат, хлорид, сульфат и гидроксид церия. В качестве флюсов использовали хлориды натрия или калия (или фторид), доля которых в реакционной смеси составляла 0,5-10,0 вес.%. В качестве диспергирующих агентов использовали неионные полимерные добавки с молекулярным весом до 4000: поливиниловый спирт, этиленгликоль, глицерин, полиэтиленгликоль, полипропиленгликоль, поливинилпирролидон, полиакрилаты, аммоний полиакрилат, полиакрилмалеат. Продолжительность синтеза достигала 12 ч. Термообработку проводили в интервале температур 70-1200°С в две стадии. Сначала полученный продукт сушили при температуре 70-200°С, затем подвергали прокаливанию при 600-1200°С в течение 2-3 ч. Особенностью метода является использование сильно разбавленных растворов исходных реагентов.
К недостаткам этого способа следует отнести большие объемы жидкости, необходимые для получения порошков диоксида церия. При этом в способе используются высокомолекулярные компоненты, удаление которых требует высоких температур термообработки и соответственно высоких энергозатрат на единицу продукта при промышленной реализации процесса. Последнее обстоятельство приведет к большим объемам отходящих газов, большому расходу воздуха на окисление углеводородной составляющей ксерогеля и увеличит расходы на защиту окружающей среды.
US Pat 7,473,408. Метод получения монокристаллических порошков оксида церия. 2009 г.
Jun-Seok Noh, Tae-Hyun Kwon, Seung-Beom Cho, Hye-Jeong Hong, Dae-Gon Han сообщали о гидротермальном методе получения высокодисперсных порошков СеO2 с размером монокристаллов 30-300 нм. Синтез проводили в щелочной среде, для создания которой использовали NaOH, КОН или NI-LiOH. В качестве исходных солей церия использовали нитрат или ацетат. В качестве органических сорастворителей использовали спирты С1-4, этиленгликоль, пропиленгликоль, бутиленгликоль, ацетон, глицерин, этилацетат или их смеси. Гидротермальный синтез проводили при температурах 180-300°С, и его продолжительность составляла 1-12 ч. В качестве осадителей использовали хлорид натрия, азотную кислоту, лимонную кислоту или мочевину.
К недостаткам способа можно отнести необходимость промывки продукта дистиллированной водой и то, что не всегда удается получить нанопорошки, более того, не удается получить порошки с размером кристаллитов менее 30 нм.
Патент республики Корея №10-2010-0098927. Способ получения нанопорошка оксида церия, имеющий узкое распределение по размеру частиц. 2010 г.
Yoido-Dong с соавторами сообщали о получении высокодисперсных порошков СеO2, в которых частицы с размером до 100 нм составляют менее 50 вес.%. В качестве дисперсионной среды были использованы полиакриловая кислота, а также аммонийные соли полиакриловых кислот. В реакционной среде рН составлял 5-10.
К недостаткам способа можно отнести использование высокомолекулярных соединений для составления реакционной смеси, большой объем отходящих газов при термообработке и удорожание мероприятий по защите окружающей среды.
Патент КНР CN 101164889 В. Наноструктурированный оксид церия со структурой «ядро-оболочка» и методы их приготовления. 2010 г.
Li Xing, Lu Bin с соавт. разработан способ получение частиц СеO2 типа «ядро-оболочка» с размером зерна 400-1000 нм и размером ядра 200-700 нм. В качестве исходного использована смешанная соль аммония. Удельная поверхность полученных порошков составляла 70-120 м2/г. Это изобретение имеет преимущества: низкая стоимость, организация процесса в промышленности не требует больших затрат, технологически процесс легко управляем.
К недостаткам этого метода следует отнести то, он не обеспечивает получения нанокристаллического диоксида церия.
Патент КНР CN 101407331 А. Метод получения нанопластин оксида церия. 2009 г. Zhang Dengsong с соавт. гидротермальным методом получили наночастицы диоксида церия. В качестве исходного реагента использовали водорастворимые соли церия, в качестве ПАВ - гексадецилтриметилбромид, и осаждение проводили с использованием аммиака. При охлаждении реакционную смесь подвергали ультразвуковому воздействию для того, чтобы избежать и уменьшить вероятность укрупнения частиц. Гидротермальный синтез проводили в течение 1-3 суток при температуре 100-180°С. Продукт сушили при температуре 60°С. Полученные частицы имели форму четырех- или шестигранников с размерами 20-80 нм и толщиной 3-5 нм.
К недостаткам этого метода следует отнести большую продолжительность синтеза и низкую производительность процесса, а также использование высокомолекулярного ПАВ и аммиака. Использование первого удорожает процесс, а присутствие в технологической схеме второго делает производство менее экологически приемлемым.
Патент Украины №93073. Способ получения композиции, содержащей водорастворимые наночастицы диоксида церия. 2011 г. А.В.Усатенко, А.Б.Щербаков, В.К.Иванов предложили способ получения ультрадисперсных частиц диоксида церия со средним размером 2 нм в составе коллоидной композиции с добавлением полиакриловой кислоты. Композиция предназначена для разработки на ее основе и фармацевтических и косметических композиций.
К ограничениям применимости этого метода следует отнести его неприемлемость для использования для создания технологии производства больших количеств диоксида церия в качестве полупродукта для мелкозернистой керамики.
Taekyung Yu и др. (Aqueous-Phase Synthesis of Single-Crystal Ceria Nanosheets. Angewandte Chemie International Edition, Volume 49, Issue 26, pages 4484-4487, June 14, 2010) был предложен простой, по утверждению авторов, метод синтеза ультратонких монокристаллических пластинок СеO2 толщиной примерно 2,2 нм и шириной до 4 мкм. Этот метод весьма интересен с точки зрения постановки эксперимента, имеет высокий теоретический потенциал и значение для фундаментальных исследований, однако в настоящее время он далек от промышленного воплощения, так как остается открытым вопрос его масштабирования.
Alexander E.Baranchikov (Lattice expansion and oxygen non-stoichiometry of nanocrystalline ceria. CrystEngComm, 2010, 12, 3531-3533) с соавторами сообщали о сравнении текстуры порошков СеО2, полученных различными методами «мягкой» химии: термического разложения, гидротермальным, а также с использованием микроволновой обработки жидких субстратов. В качестве исходных были использованы водорастворимые минеральные соли: нитрат, хлорид и сульфат церия, а также нитрат аммония-церия. Установлено влияние размера наночастиц СеO2 на параметры его элементарной ячейки и кислородную нестехиометрию.
К ограничениям предложенных методов следует отнести существенные трудности их промышленной адаптации, так как предложенные методики часто ориентированы на использование нетривиальных подходов (ультразвуковой метод), больших объемов растворов (гидротермальный) или неспособны обеспечить высокую воспроизводимость при масштабировании процесса.
Наиболее близким способом к предлагаемому является способ, предложенный в патенте RU 2375153, Новый способ крупномасштабного производства монодисперсных наночастиц, 2009 г.
Хиеон Таегхван, Парк Джонгнам сообщали о способе получения монодисперсных наночастиц металлов, сплавов металлов, оксидов металлов и оксидов нескольких металлов из следующего ряда: Fe, Co, Ti, V, Cr, Mn, Ni, Сu, Zn, Y, Zr, Mo, Ru, Rh, Pd, Ag, Cd, Ce, Pt, Au, Ba, Sr, Pb, Hg, Al, Ga, In, Sn и Ge. Ключевым моментом формирования металл-содержащих наночастиц являлось формирование карбоксилатного комплекса с участием алифатических углеводородов С6-25 или амина С6-25; а также ароматических углеводородов С6-25 или простых эфиров С6-25. В качестве источников металлов использовали водорастворимые соли. Синтезы проводили при температурах 200-380°С. Молярное отношение карбоксилатного комплекса металла к поверхностно-активному веществу выбирают в пределах 1:0,1-1:100, предпочтительнее 1:0,1-1:20. В заявке сообщалось о получении 100 г порошков с размером кристаллитов 5-22 нм, и это количество оценивается как большое.
К недостаткам этого способа можно отнести использование высококипящих высокомолекулярных органических соединений, растворимых при температурах выше 100°С, что требовало создавать в реакторе синтеза температуры 320-370°С. Это требует высоких энергетических затрат на производство. Использование ароматических компонентов при составлении реакционных смесей также усиливает нагрузку на окружающую среду, увеличивает затраты на обеспечение экологической безопасности производства. Кроме того, из данных патента не следует, что полученные частицы являются кристаллическим диоксидом церия. Кроме того, по предлагаемому в патенте способу, получение 100 г оценивается как крупномасштабное. По-видимому, внедрение такого способа в производство потребует использования реакторов большого объема для получения нескольких килограммов продукции.
Принципиальное отличие предлагаемого в заявке способа заключается в том, что в нем использованы только низкомолекулярные органические компоненты, которые формируют олигомерный гель, включающий центры формирования будущей фазы диоксида церия.
Задача предлагаемого изобретения заключается в создании экологически приемлемого низкотемпературного способа получения ультрадисперсных порошков СеO2.
Технический результат изобретения заключается в создании способа получения ультрадисперсных порошков диоксида церия (размер кристаллитов менее 80 нм) с преимущественно мезопористой структурой (размер пор - 2-20 нм).
Предлагаемый способ легкоадаптируем к промышленным условиям, и при его технологической реализации решается задача создания экологически приемлемой технологии. Кроме того, он обеспечивает создание экономичной технологии получения больших количеств ультрадисперсных порошков с заданными физико-химическими характеристиками: пористость, дисперсность, фазовый состав.
Эти преимущества технологии достигаются благодаря следующим особенностям предлагаемого способа: недорогие исходные реагенты, такие как нитрат церия и низкомолекулярные органические N-содержащие соединения - N,N-диметилоктиламин, тетраэтиламмоний гидроксид, моноэтаноламин, а в отдельных случаях - ацетилацетон (1), на стадии термообработки главными компонентами отходящих газов являются углекислый газ и водяной пар (2), отсутствие стадии фильтрации и промывки упрощает технологическую схему, сокращает расходы материальных и энергетических ресурсов (3), проведение процесса синтеза геля при низких температурах (ниже 100°С) и последующая термообработка при температурах до 500°С также снижает энергозатраты на единицу продукта (4).
Технический результат позволяет получать с выходом 95-99% ультрадисперсные порошки мезопористого диоксида церия с заданными морфологическими характеристиками: удельной поверхностью до 120 м2/г, мезопористой структурой с размером пор 2-20 нм и размерами кристаллитов менее 80 нм. На долю микропор приходится не более 10% общего объема пор и не более 15% удельной поверхности. Микродеформации полученных кристаллитов флюорита не превышают 0,5%.
Технический результат достигается двумя вариантами способа получения мезопористого наноразмерного порошка диоксида церия (варианты).
По первому варианту технический результат достигается тем, что в способе получения мезопористого наноразмерного порошка диоксида церия (варианты), включающем следующие стадии: получение водных 0,05М растворов нитрата или ацетата церия; получение спиртовых растворов органических N-coдержащих соединений: N,N-диметилоктиламина, тетраэтиламмоний гидроксида или моноэтаноламина с концентрацией 0,45-3,30М, 0,37М и 0,016М соответственно; получение золя в водно-органической системе; упаривание водно-органической системы; формирование геля и термообработку геля в интервале температур 95-500°С по ступенчатому графику, который включает несколько промежуточных изотермических участков, согласно изобретению в качестве стабилизаторов золя используют следующие низкомолекулярные органические N-содержащие соединения (N): N,N-диметилоктиламин, тетраэтиламмоний гидроксид или моноэтаноламин в виде спиртового раствора при мольном отношении N/металл, равном 1-20.
По второму варианту технический результат достигается тем, что в способе получения мезопористого наноразмерного порошка диоксида церия (варианты), включающем следующие стадии: получение водного 0,05М раствора исходного нитрата церия; получение спиртового раствора N,N-диметилоктиламина и ацетилацетона с концентрацией 0,29-0,69М и 0,69-1,65М соответственно; получение золя в водно-органической системе путем соединения составленных растворов; упаривание водно-органической системы; формирование гелей и термообработку геля в интервале температур 95-500°С по ступенчатому графику, который включает несколько промежуточных изотермических участков; согласно изобретению в качестве стабилизаторов золя используют N,N-диметилоктиламин при мольном отношении N,N-диметилоктиламин/металл, равном 1-20, а также используют в качестве дополнительного комплексообразователя ацетилацетон при мольном отношении ацетилацетон/металл, равном 2-5.
Сущность изобретения
Сущность изобретения заключается в использовании модифицированного золь-гель метода для получения наноразмерного кристаллического диоксида церия. Особенностью предлагаемого способа является то, что в качестве стабилизаторов золя использованы следующие органические N-coдержащие соединения: N,N-диметилоктиламин, тетраэтиламмоний гидроксид, моноэтаноламин. Процесс формирования частиц золя происходит в водно-органической среде, на границе фаз. Предлагаемый способ позволяет получать ультрадисперсные порошки диоксида церия с размером кристаллитов менее 60 нм с узким распределением по размеру.
Созданный способ позволяет получать ультрадисперсные порошки диоксида церия с размером кристаллитов менее 80 нм и полностью или преимущественно (более 50%) с мезопористой структурой (размер пор - 2-20 нм). Такие морфологические характеристики достигаются благодаря тому, что
- при осуществлении модифицированного золь-гель синтеза в качестве стабилизаторов золя используются следующие низкомолекулярные органические N-содержащие соединения (N): N,N-диметилоктиламин, тетраэтиламмоний гидроксид, моноэтаноламин в виде спиртовых растворов при мольном отношении N/металл, равном 1-20;
- в качестве стабилизаторов золя используются низкомолекулярные органические N-содержащие соединения: N,N-диметилоктиламин, тетраэтиламмоний гидроксид, моноэтаноламин в виде спиртового раствора (мольное отношение N/металл=1-20), однако кроме этого дополнительно используют в качестве дополнительного комплексообразователя ацетилацетон (мольное отношении ацетилацетон /металл=2-5). В обоих случаях
- золообразование проводят при температуре 70°С и перемешивании;
- гелеобразование проводят при температуре 93-95°С и перемешивании;
- термообработку полученного геля проводят по ступенчатому графику в интервале температур 98-500°С, при 500°С порошок выдерживают в течение 1 ч.
ПРИМЕРЫ
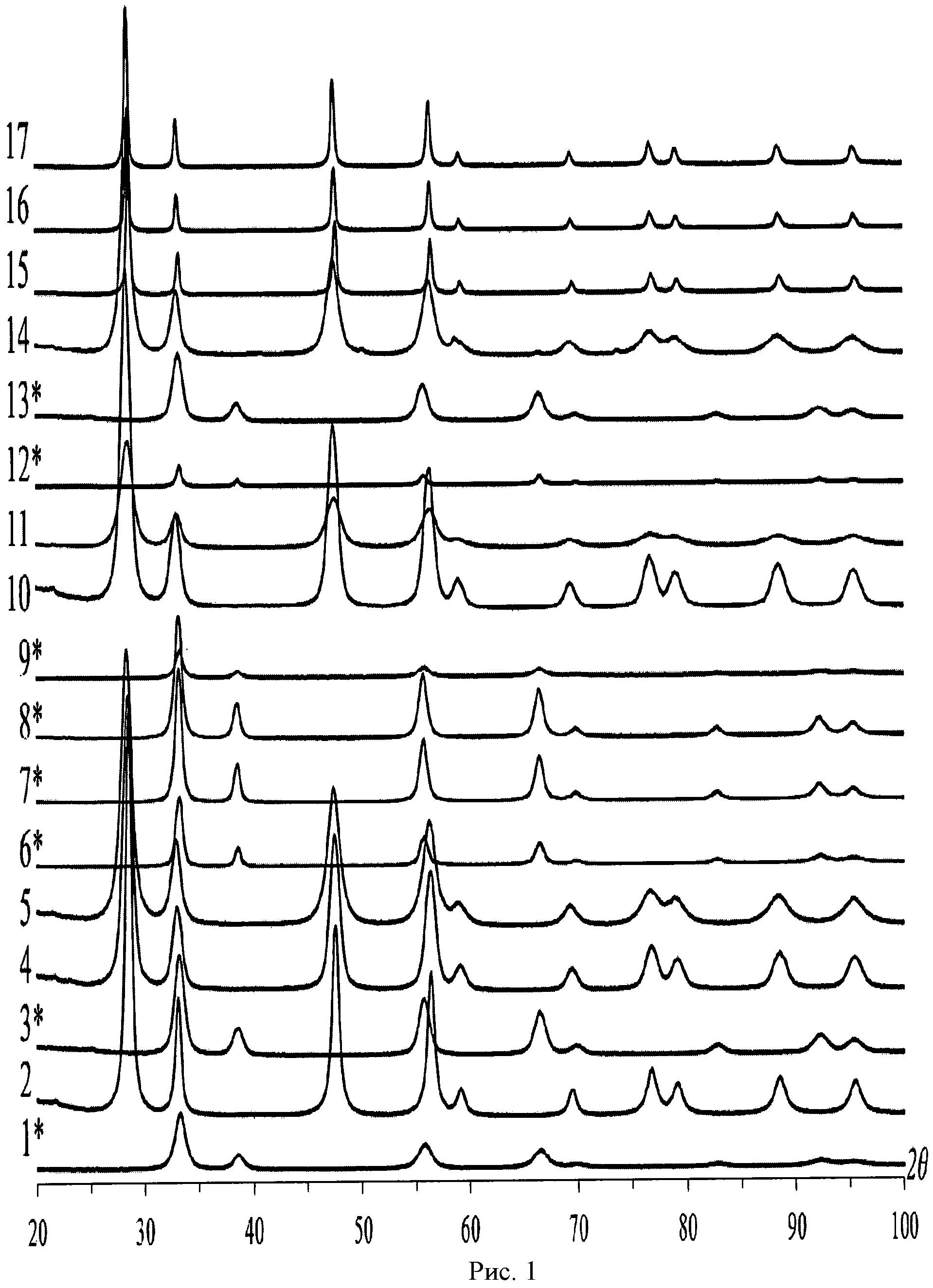
На рисунке 1 показаны дифрактограммы порошков диоксида церия, полученные на дифрактометрах ДРОН-3 и ДРОН-3М с использованием СuKα-излучения. *Дифрактограммы получены с использованием СоKα-излучения. Размер кристаллитов рассчитывали с использованием метода Ритвельда.
Исследование поверхности и пористости порошков проводили с помощью анализатора удельной поверхности NOVA 2200. Удельную поверхность определяли методом Бранаура-Эммета-Теллера (БЭТ), а распределение пор по размерам - методом Баррета-Джойнера-Халенда (БДХ) при температуре -196°С.
ПРИМЕР 1.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,23 г (0.013 моля) порошка СеО2.
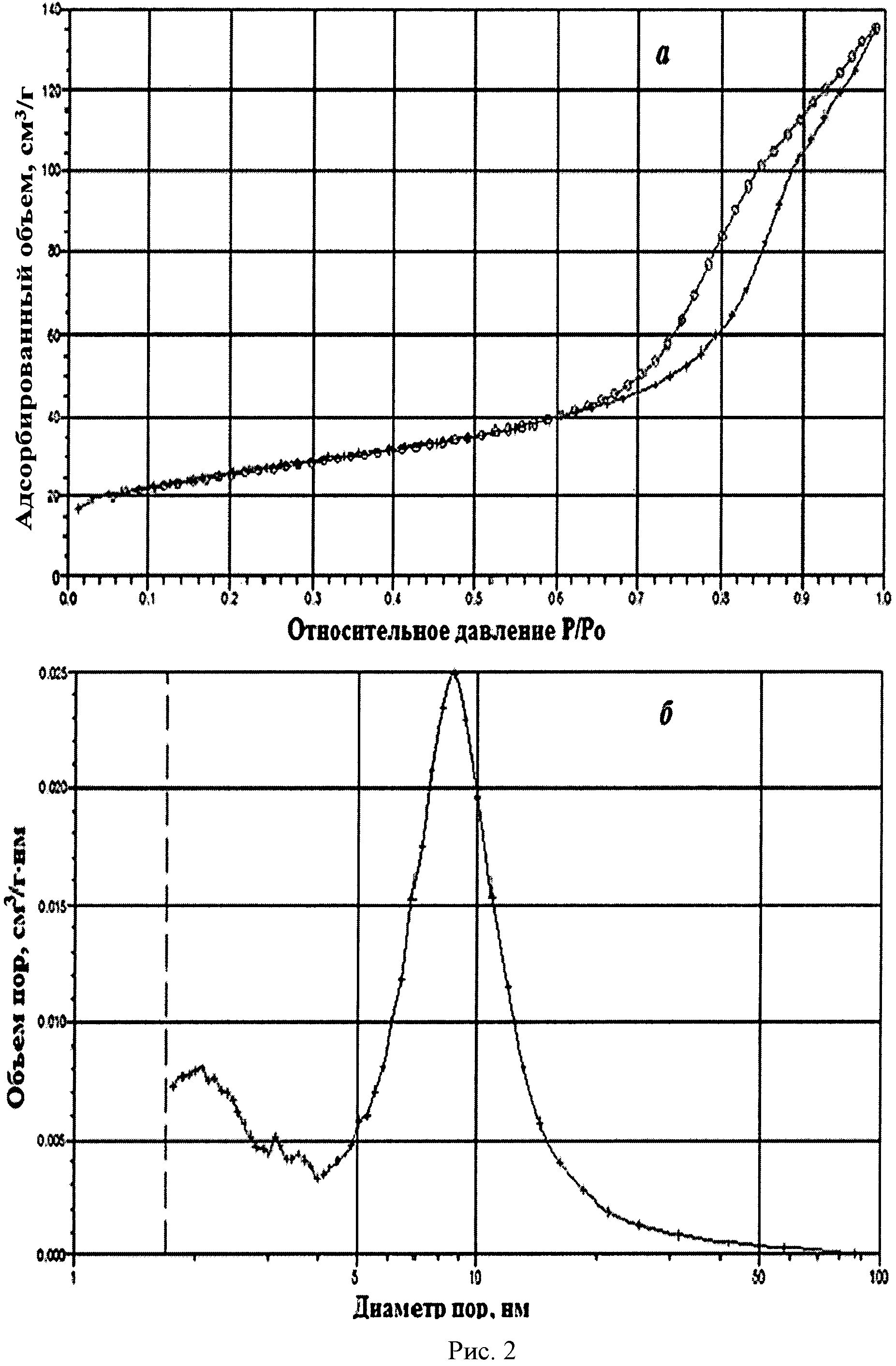
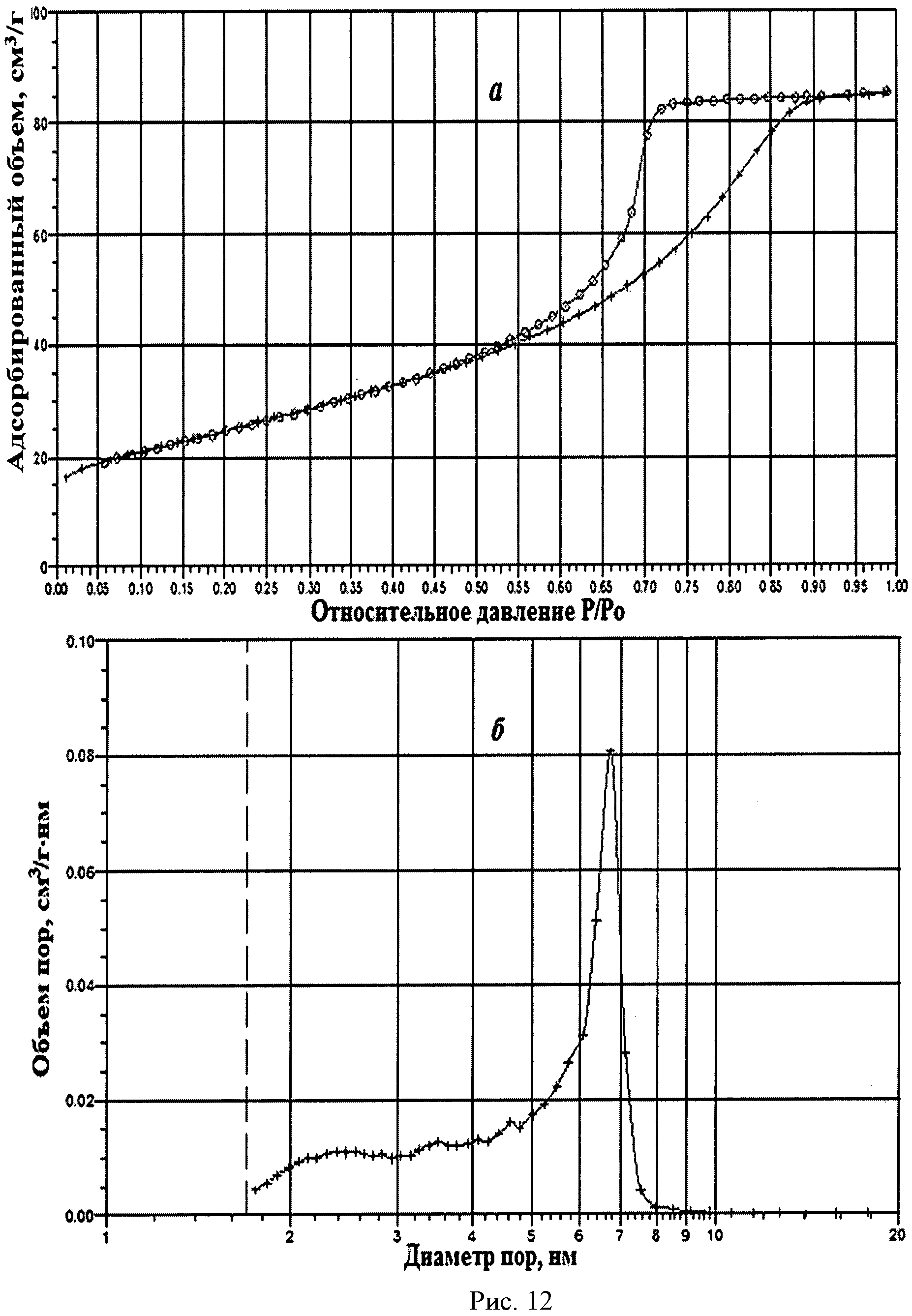
На рисунке 1 дифрактограмма 1 соответствует образцу порошка диоксида церия №1. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 12 нм. На рисунке 2 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №1. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 2а), и не более 10% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 90,8 м2/г при узком распределении по размеру пор в интервале 5-12 нм (рисунок 2б).
ПРИМЕР 2.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (400 об/мин) при температуре 90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (400 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку при 500°С без предварительного подъема температуры (быстрое закаливание) в течение 2 ч. Было получено 2,24 г (0,013 моля) CeO2.
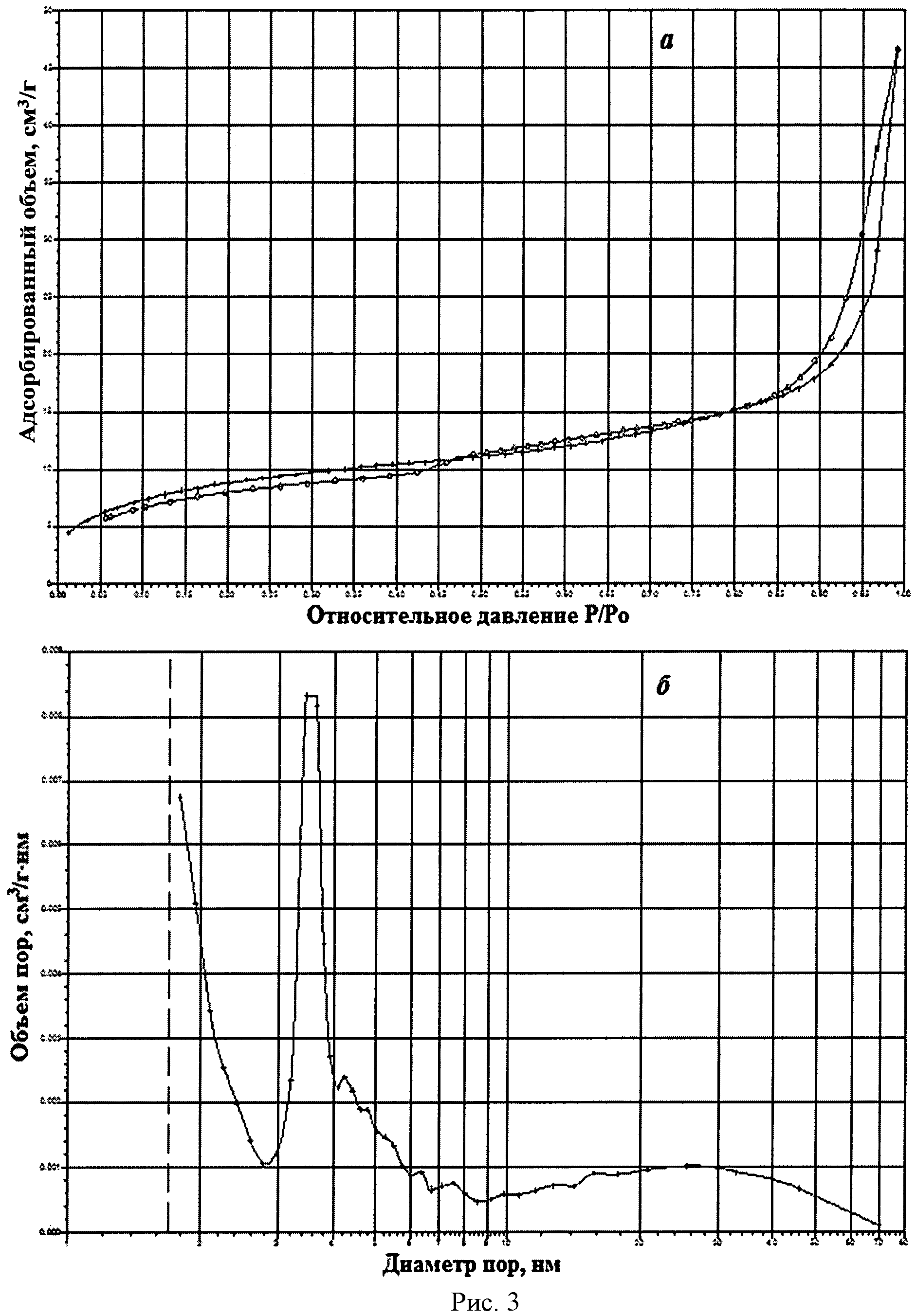
На рисунке 1 дифрактограмма 2 соответствует образцу порошка диоксида церия №2. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 17 нм. На рисунке 3 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №2. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 3а), и не более 5% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 30,7 м2/г при узком распределении по размеру пор в интервале 3,5-4,0 нм (рисунок 3б).
ПРИМЕР 3.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 90°С.
В 30 мл этанола (0,515 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 5 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С. Далее раствор помещали в автоклав и перемешивали (1000 об/мин) при 95-98°С и аутогенном давлении (~2,5 атм) в течение 12 ч. Затем реакционную смесь фильтровали.
Полученный осадок переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,24 г (0,013 моля) порошка СеO2.
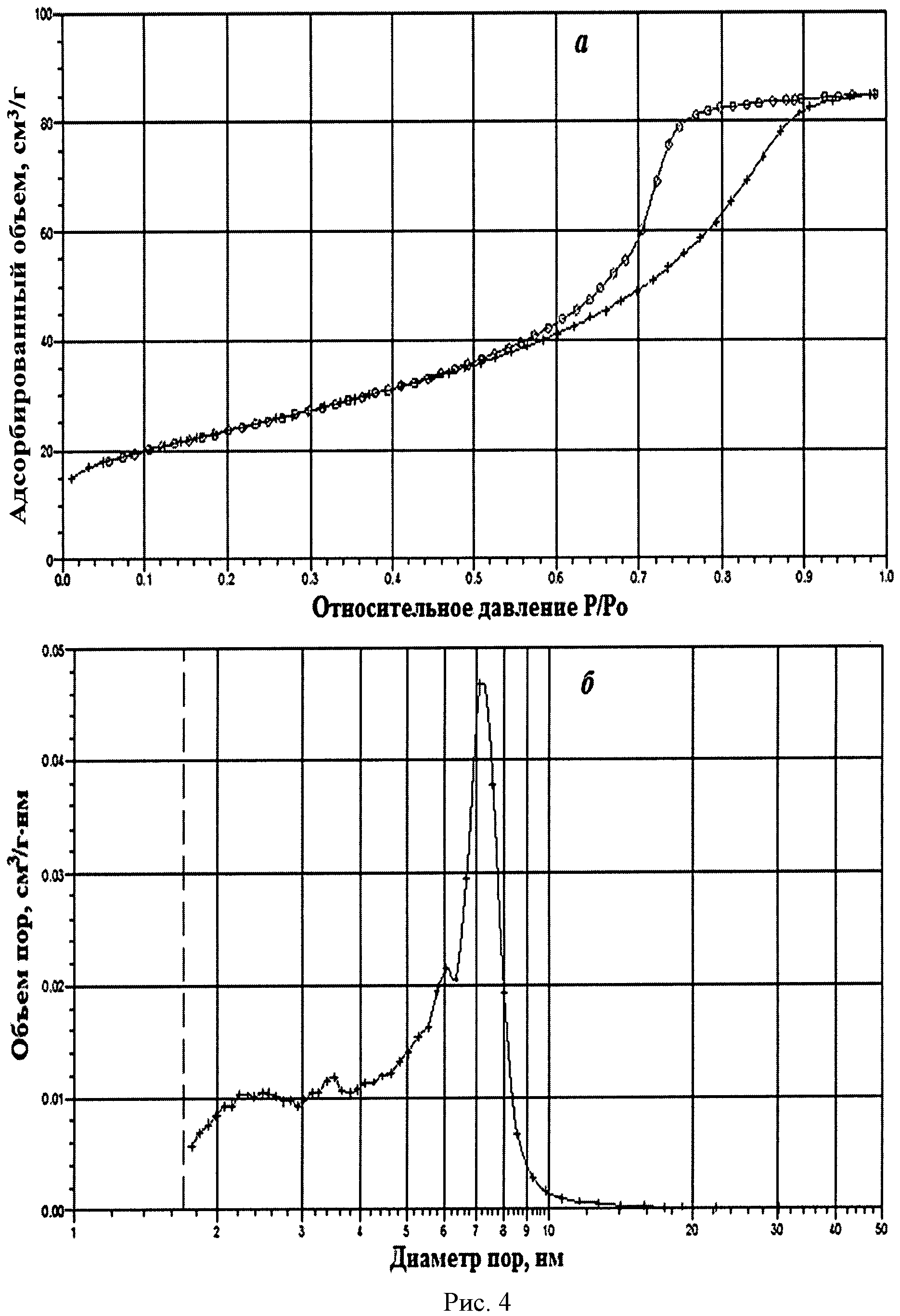
На рисунке 1 дифрактограмма 3 соответствует образцу порошка диоксида церия №3. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 12 нм. На рисунке 4 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №3. По данным адсорбции-десорбции N2, его пористая структура была практически полностью мезопористой (рисунок 4а). Удельная поверхность порошка составляла 84,7 м2/г при узком распределении по размеру пор в интервале 5-8 нм (рисунок 4б).
ПРИМЕР 4.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 90°С.
В 30 мл этанола (0,515 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 5 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С. Далее раствор помещали в автоклав и подвергали гидротермальной обработке (800 об/мин) при 127-130°С и аутогенном давлении в течение 3 ч. Затем реакционную смесь фильтровали.
Полученный осадок переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,23 г (0,013 моля) порошка СеО2.
На рисунке 1 дифрактограмма 4 соответствует образцу порошка диоксида церия №4. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 12 нм.
ПРИМЕР 5.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 5,16 г (0,015 моль) моногидрата ацетата церия (Се(СН3СОО)3·Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (500 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,23 г (0,013 моля) порошка СеO2.
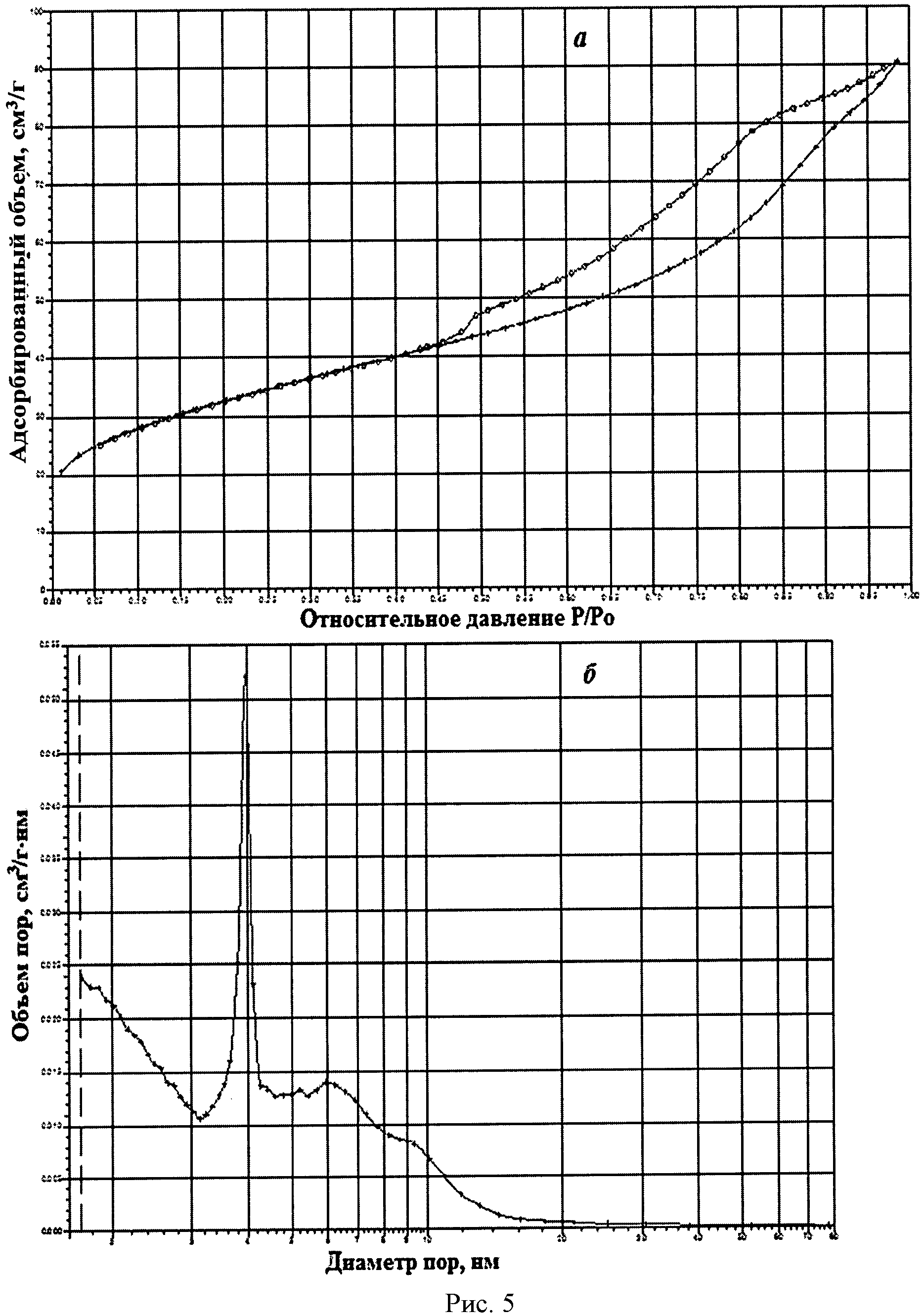
На рисунке 1 дифрактограмма 5 соответствует образцу порошка диоксида церия №5. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 9 нм. На рисунке 5 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №5. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 5а), и не более 10% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 113,1 м2/г при узком распределении по размеру пор в интервале 3,5-4,0 нм (рисунок 5б).
ПРИМЕР 6.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 15,39 мл N,N-диметилоктиламина (0,075 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,15 г (0,0125 моля) порошка СеO2.
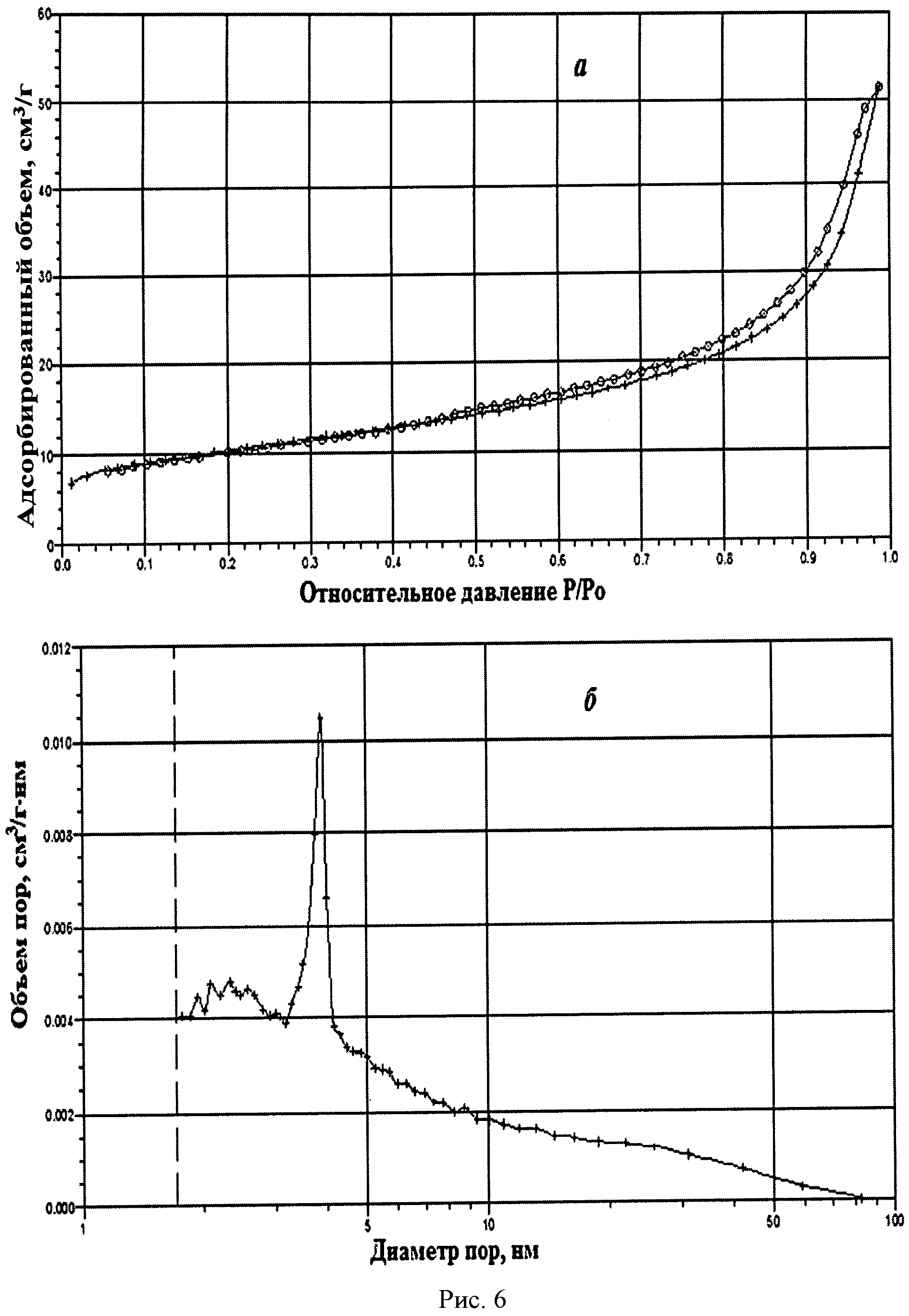
На рисунке 1 дифрактограмма 6 соответствует образцу порошка диоксида церия №6. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 25 нм. На рисунке 6 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №6. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 6а), и не более 20% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 35,5 м2/г при узком распределении по размеру пор в интервале 3-5 нм (рисунок 6б).
ПРИМЕР 7.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NO3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 30,78 мл N,N-диметилоктиламина (0,150 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустением смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,23 г (0,013 моля) порошка СеO2.
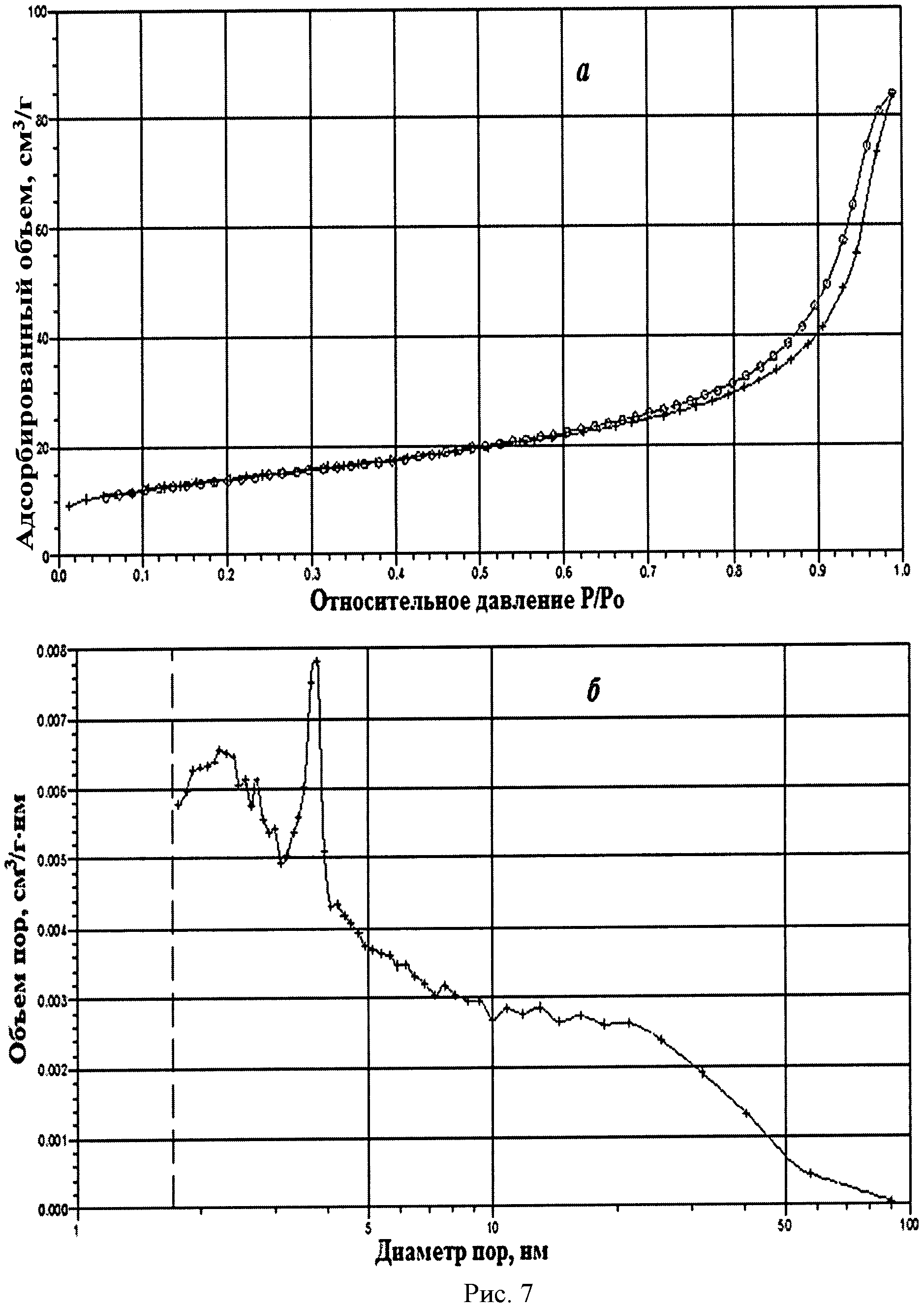
На рисунке 1 дифрактограмма 7 соответствует образцу порошка диоксида церия №7. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 22 нм. На рисунке 7 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №7. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 7а), и не более 10% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 48,8 м2/г при узком распределении по размеру пор в интервале 3-5 нм (рисунок 7б).
ПРИМЕР 8.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 61,56 мл N,N-диметилоктиламина (0,300 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,15 г (0,0125 моля) порошка СеO2.
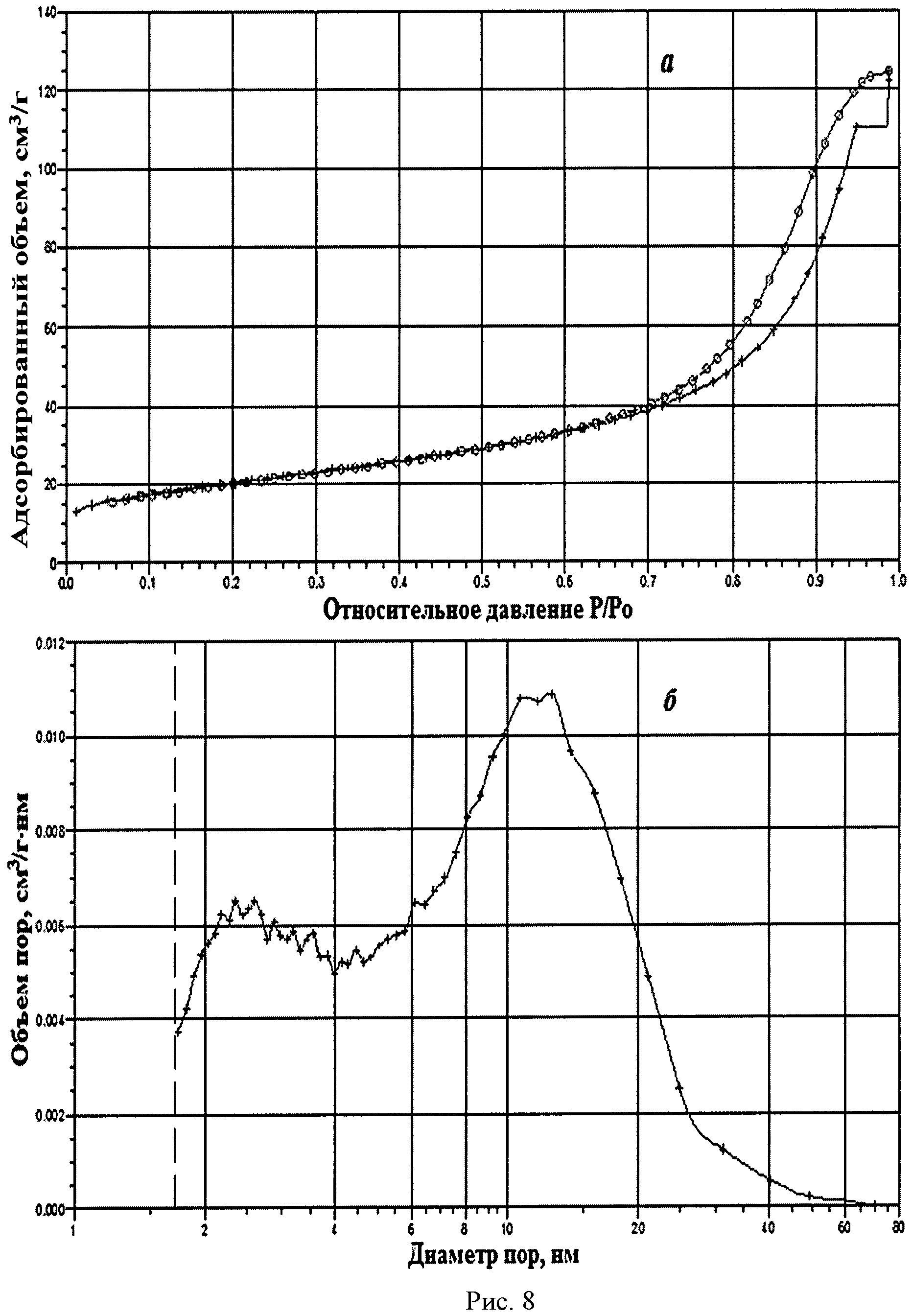
На рисунке 1 дифрактограмма 8 соответствует образцу порошка диоксида церия №8. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 18 нм. На рисунке 8 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №8. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 8а) с диаметром пор 2-3 и 10-12 нм (рисунок 8б), и не более 10% поверхности было обеспечено микропорами. Удельная поверхность порошка составляла 71,4 м2/г.
ПРИМЕР 9.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 90°С.
В 30 мл этанола (0,515 моль) растворяли 10,6 мл 20% водного раствора тетраэтиламмоний гидроксида (0,015 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,15 г (0,0125 моля) порошка СеО2.
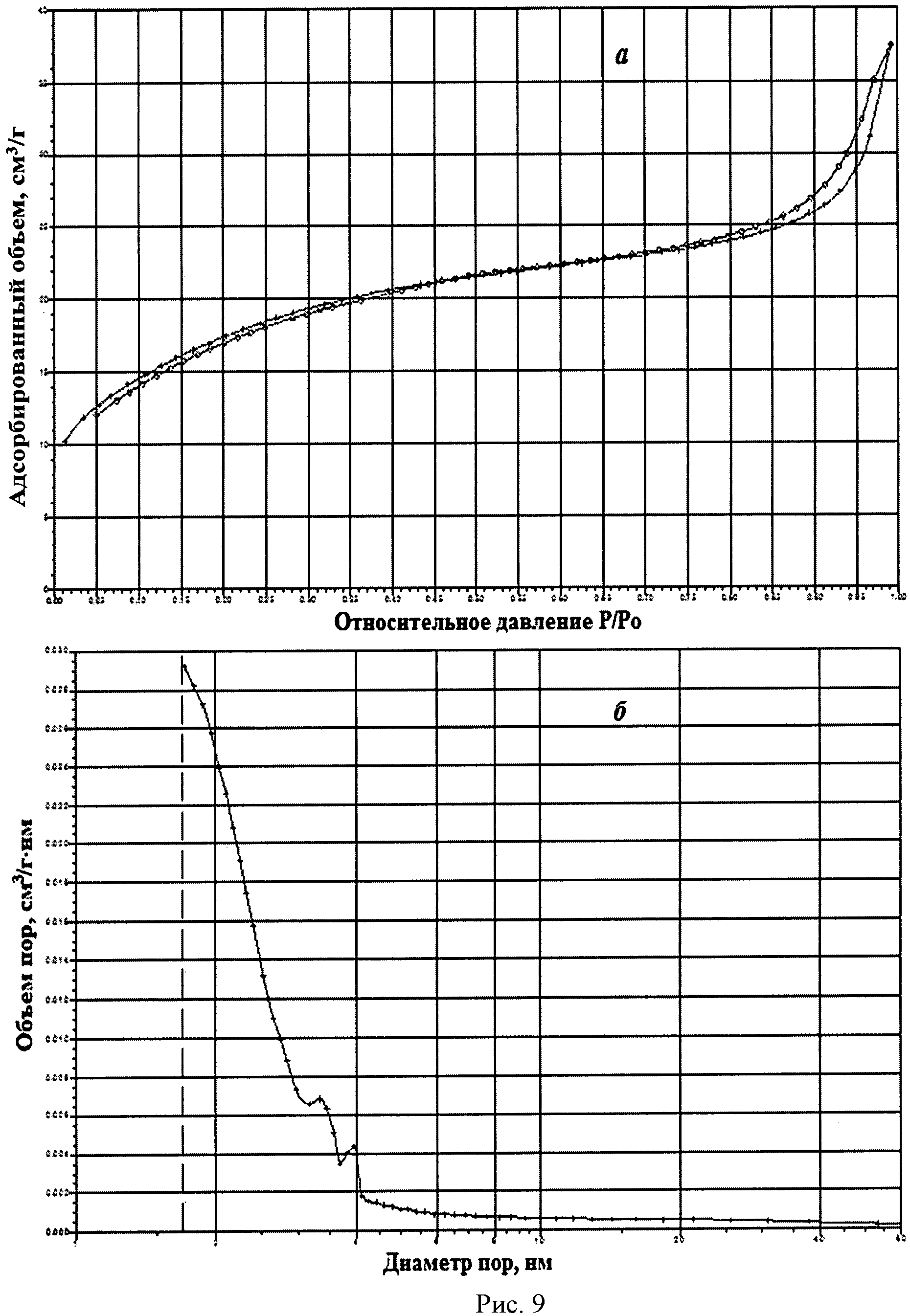
На рисунке 1 дифрактограмма 9 соответствует образцу порошка диоксида церия №9. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 15 нм. На рисунке 9 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №9. По данным адсорбции-десорбции N2, порошок имел мезопористую структуру (рисунок 9а), его удельная поверхность составляла 60,6 м2/г при размерах пор в интервале 2-4 нм (рисунок 9б). Не более 5% поверхности было обеспечено микропорами.
ПРИМЕР 10.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 10,6 мл 20%-ного водного раствора тетраэтиламмоний гидроксида (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 5 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С. Далее раствор помещали в автоклав и подвергали гидротермальной обработке (800 об/мин) при 127-130°С и аутогенном давлении в течение 3 ч. Затем реакционную смесь фильтровали.
Полученный осадок переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получали 2,14 г (0,0125 моля) порошка СеO2.
На рисунке 1 дифрактограмма 10 соответствует образцу порошка диоксида церия №10. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 11 нм.
ПРИМЕР 11.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 5,16 г (0,015 моль) моногидрата ацетата церия (Се(СН3СОО)3·Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 10,6 мл 20% водного раствора тетраэтиламмоний гидроксида (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (500 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Было получено 2,12 г (0,0125 моля) порошка СеO2.
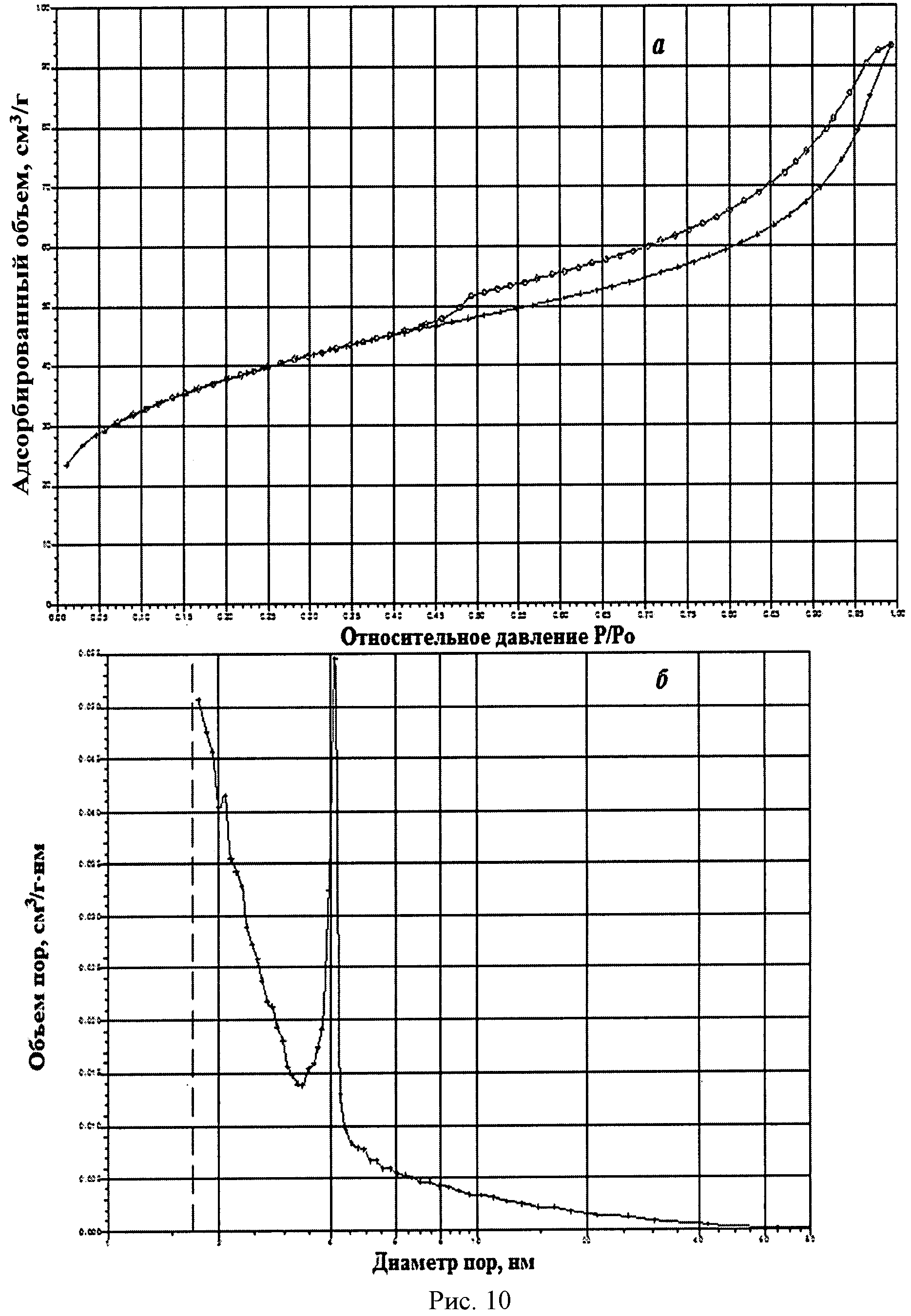
На рисунке 1 дифрактограмма 11 соответствует образцу порошка диоксида церия №11. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 8 нм. На рисунке 10 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №11. По данным адсорбции-десорбции N2, порошок имел мезопористую структуру (рисунок 10а), его удельная поверхность составляла 129,0 м2/г при размерах пор в интервале 4,0-4,2 нм (рисунок 10б). Не более 15% поверхности было обеспечено микропорами.
ПРИМЕР 12.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 0,9 мл моноэтаноламина (0,015 моль) при перемешивании на магнитной мешалке (400 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (600 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (600 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получали 2,13 г (0,0125 моля) порошка СеО2.
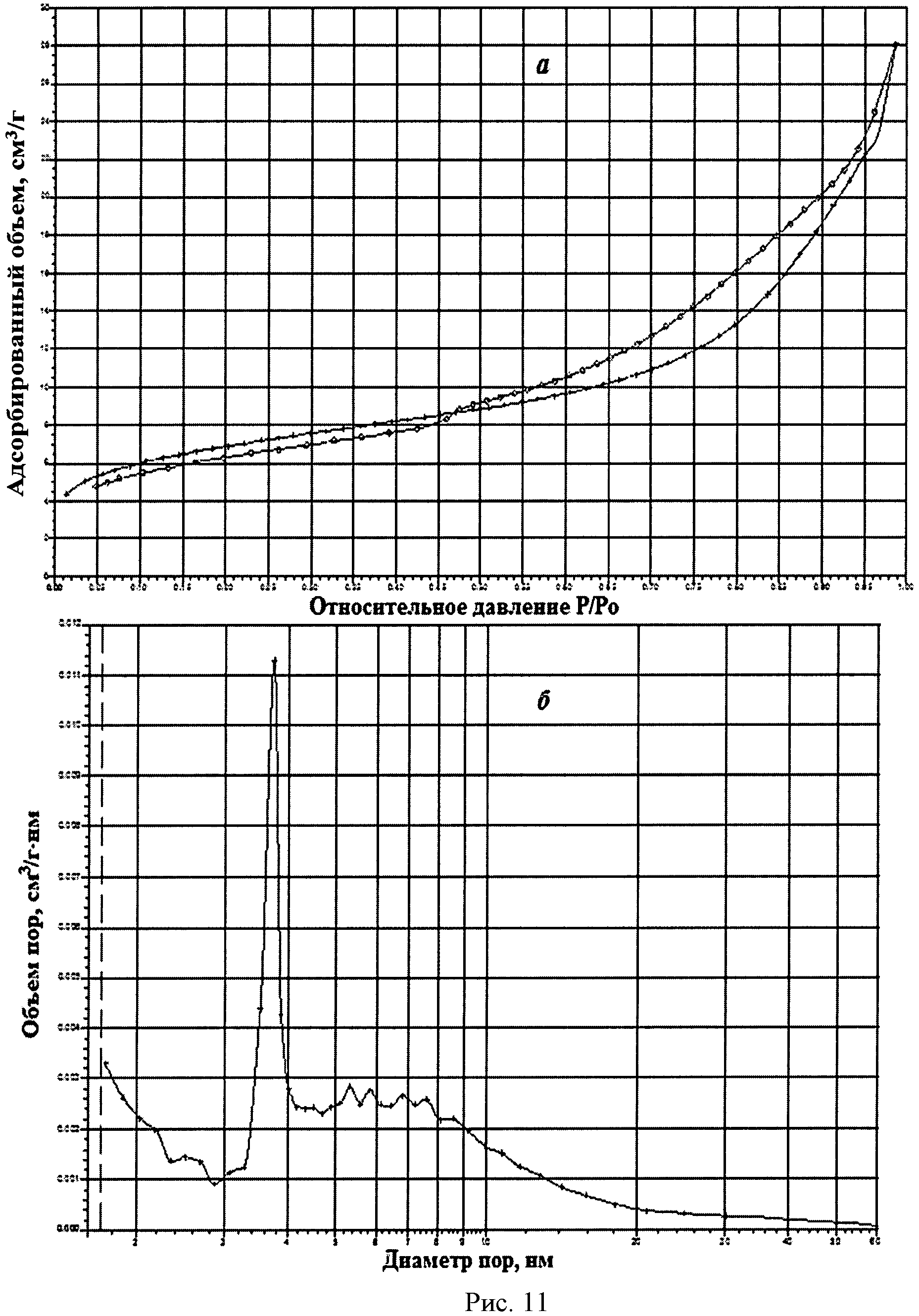
На рисунке 1 дифрактограмма 12 соответствует образцу порошка диоксида церия №12. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 21 нм. На рисунке 11 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №12. По данным адсорбции-десорбции N2, порошок имел мезопористую структуру (рисунок 11а), его удельная поверхность составляла 23,4 м2/г при размерах пор в интервале 3,5-4,0 нм (рисунок 11б). Не более 20% поверхности было обеспечено микропорами.
ПРИМЕР 13.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 0,9 мл моноэтаноламина (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 5 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С. Далее раствор помещали в автоклав и подвергали гидротермальной обработке (800 об/мин) при 128-130°С и аутогенном давлении (~2,5 атм) в течение 3 ч. Затем реакционную смесь фильтровали.
Полученный осадок переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика повышения температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получали 2,12 г (0,0125 моля) порошка CeO2.
На рисунке 1 дифрактограмма 13 соответствует образцу порошка диоксида церия №13. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 12 нм. На рисунке 12 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №13. По данным адсорбции-десорбции N2, порошок имел мезопористую структуру (рисунок 12а), его удельная поверхность составляла 88,9 м2/г при размерах пор в интервале 6-7 нм (рисунок 126). Не более 3% поверхности было обеспечено микропорами.
ПРИМЕР 14.
Порошок диоксида церия получен по 1 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 5,16 г (0,015 моль) моногидрата ацетата церия (Се(СН3СОО)3·Н2O) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 88-90°С.
В 30 мл этанола (0,515 моль) растворяли 0,9 мл моноэтаноламина (0,015 моль) при перемешивании на магнитной мешалке (500 об/мин) в течение 40 мин при температуре 69-70°С.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (500 об/мин) при температуре 88-90°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (500 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получили 2,13 г (0,0125 моля) порошка СеO2.
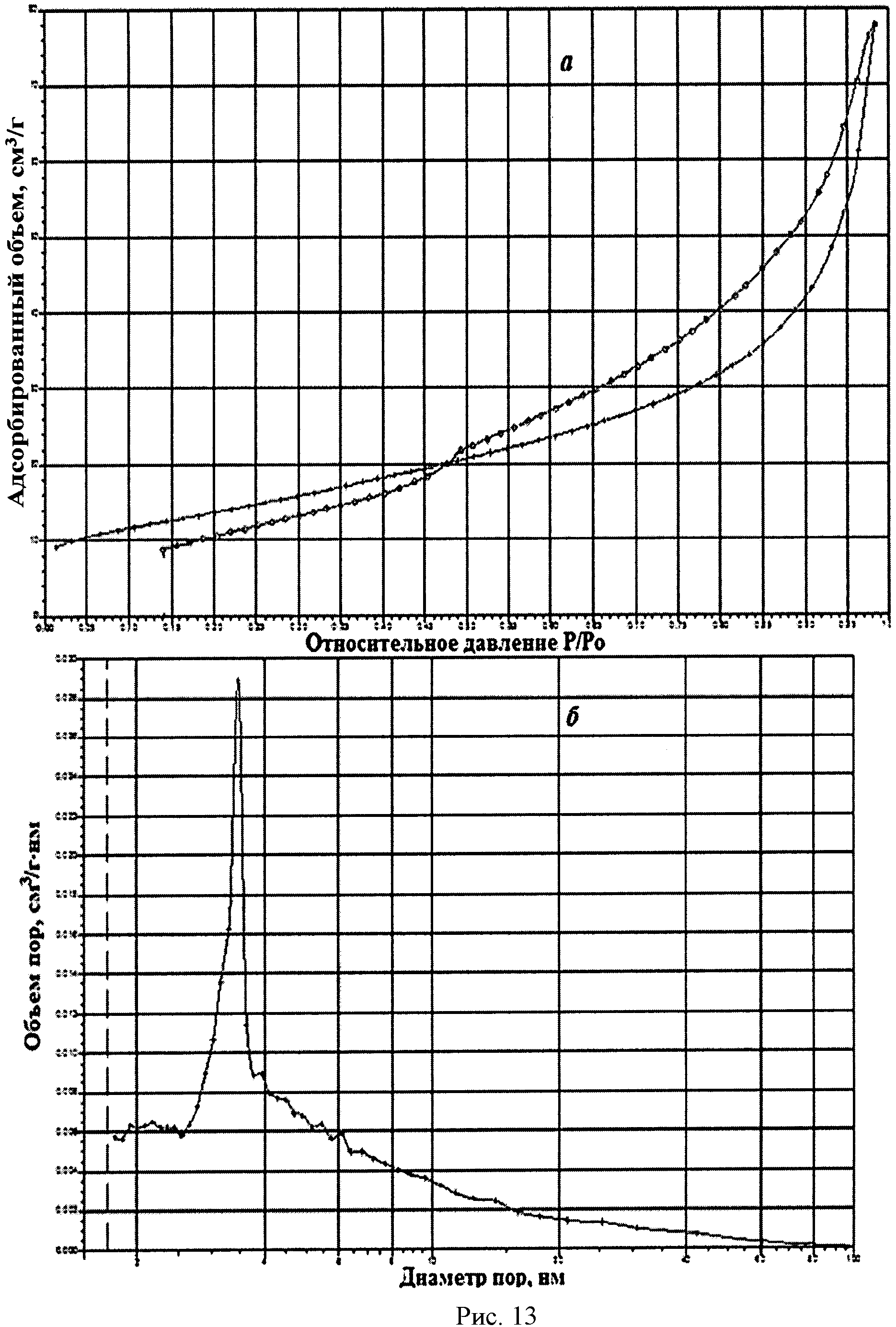
На рисунке 1 дифрактограмма 14 соответствует образцу порошка диоксида церия №14. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 11 нм. На рисунке 13 показаны кривые адсорбции-десорбции N2 (а) и распределение по размеру пор (б) для порошка диоксида церия №14. По данным адсорбции-десорбции N2, порошок имел полностью мезопористую структуру (рисунок 13a), его удельная поверхность составляла 49,2 м2/г при размерах пор в интервале 3,0-3,5 нм (рисунок 13б).
ПРИМЕР 15.
Порошок диоксида церия получен по 2 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NO3)3·6Н2O) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 40 мин при температуре 88-90°С.
К 7,4 мл ацетилацетона (0,072 моль) добавляли 6,16 мл N,N-диметилоктиламина (0,03 моль) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 20 мин при температуре 88-90°С. Раствор охлаждали до 70°С, после чего в него добавляли 30 мл этанола (0,515 моль) и перемешивали в течение 20 мин.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (200-300 об/мин) при температуре 69-70°С
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (200-300 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получено 2,32 г (0,013 моля) диоксида церия.
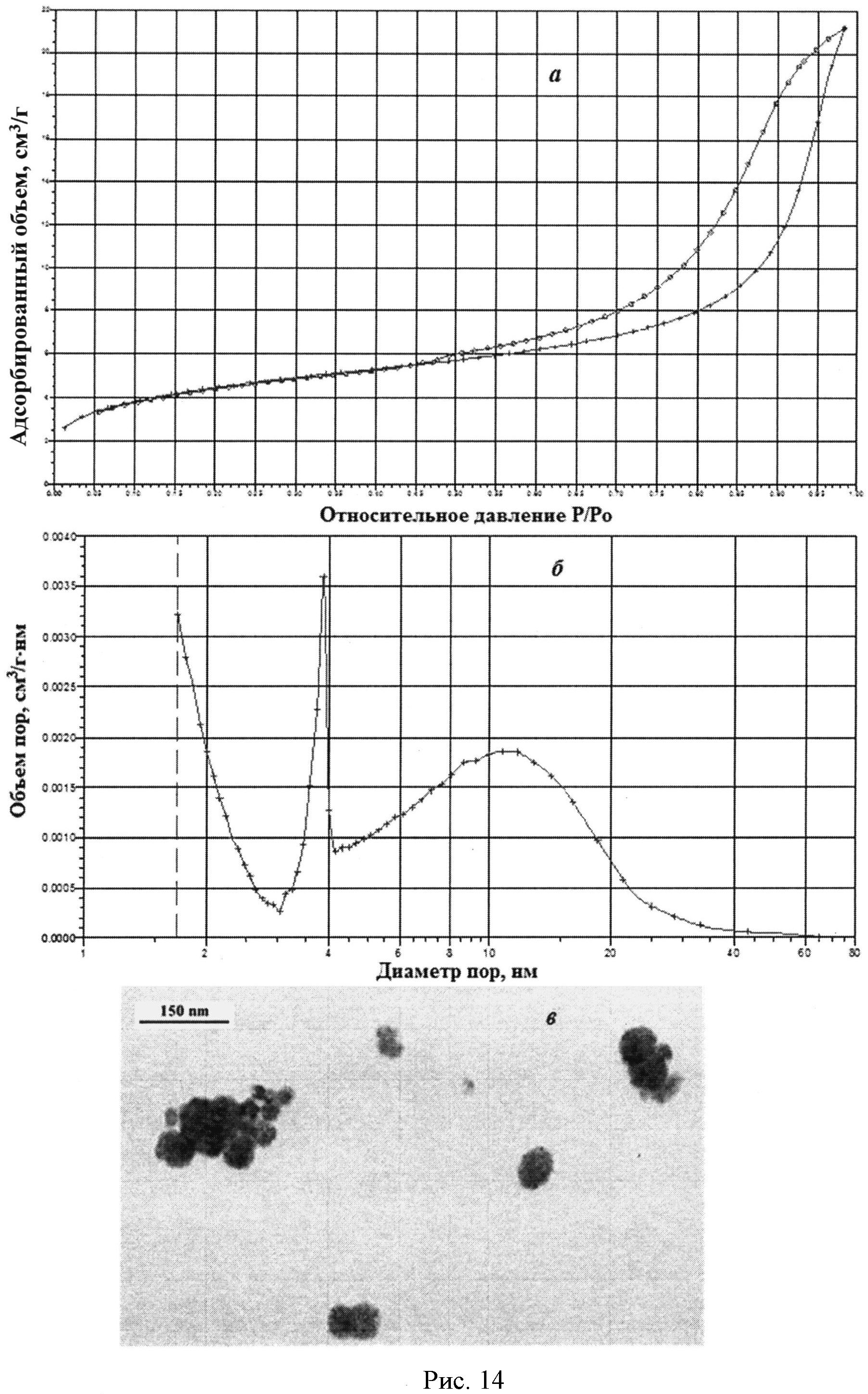
На рисунке 1 дифрактограмма 15 соответствует образцу порошка диоксида церия №15. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 36 нм. На рисунке 14 показаны кривые адсорбции-десорбции N2 (a) и кривая распределения по размеру пор (б) для порошка диоксида церия №15. По данным адсорбции-десорбции N2, его пористая структура была представлена, главным образом, мезопорами (рисунок 14а) с размером 3,5-30 нм (рисунок 14б). Удельная поверхность порошка составляла 15,4 м2/г, и не более 10% поверхности было обеспечено микропорами. На рисунке 14в представлена микрофотография порошка диоксида церия №15, полученная на просвечивающем электронном микроскопе ЕМ-301 фирмы Philips. Можно видеть, что размер частиц составляет 10-100 нм, наиболее часто их размер не превышает 40 нм.
ПРИМЕР 16.
Порошок диоксида церия получен по 2 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 40 мин при температуре 88-90°С.
В 3,7 мл ацетилацетона (0,036 моль) растворяли 3,08 мл N,N-диметилоктиламина (0,015 моль) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 20 мин при температуре 90°С. Раствор охлаждали до 70°С, после чего в него добавляли 30 мл этанола (0,515 моль) и перемешивали в течение 20 мин.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (200-300 об/мин) при температуре 69-70°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (200-300 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получено 2,34 г (0,014 моля) диоксида церия.
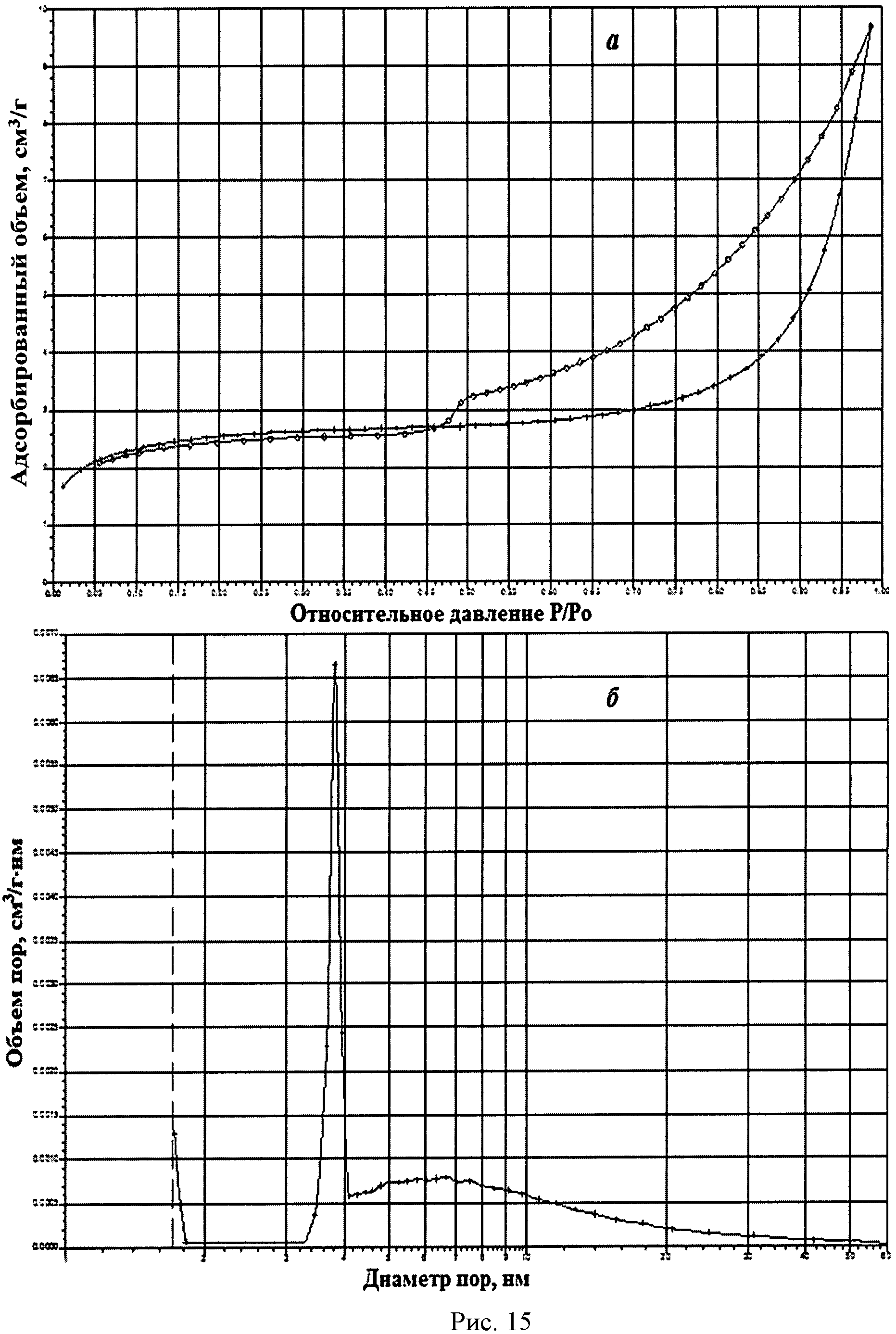
На рисунке 1 дифрактограмма 16 соответствует образцу порошка диоксида церия №16. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 46 нм. На рисунке 15 показаны кривые адсорбции-десорбции N2 (а) и кривая распределения по размеру пор (б) для порошка диоксида церия №16. По данным адсорбции-десорбции N2, в его пористой структуре большую долю составляли мезопоры (рисунок 15а) с размером 3,5-4,0 нм (рисунок 156). Удельная поверхность порошка составляла 8,0 м2/г, и не более 50% поверхности было обеспечено микропорами.
ПРИМЕР 17.
Порошок диоксида церия получен по 2 варианту.
Для получения растворов была использована деионизованная вода, полученная с помощью установки обратного осмоса Raifil.
В 300 мл деионизованной воды (16,670 моль) растворяли 6,51 г (0,015 моль) гексагидрата нитрата церия (Се(NО3)3·6Н2O) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 40 мин при температуре 88-90°С.
К 2,5 мл ацетилацетона (0,024 моль) добавляли 2,05 мл N,N-диметилоктиламина (0,010 моль) при перемешивании на магнитной мешалке (200-300 об/мин) в течение 20 мин при температуре 88-90°С. Раствор охлаждали до 70°С, после чего в него добавляли 30 мл этанола (0,515 моль) и перемешивали в течение 20 мин.
Полученные растворы соединяли и перемешивали полученную смесь в течение 30 мин на магнитной мешалке (200-300 об/мин) при температуре 69-70°С.
Затем реакционную смесь упаривали при 93-95°С при постоянном перемешивании на магнитной мешалке (200-300 об/мин). Упаривание проводили до тех пор, пока не начинался резкий подъем температуры (экзотермический эффект), который сопровождался загустеванием смеси с образованием геля.
Полученный гель переносили в фарфоровую или корундовую чашку и помещали в муфельную печь, где проводили термообработку с использованием ступенчатого графика подъема температуры. При 500°С полученный продукт выдерживали в течение 1 ч. Получено 2,33 г (0,014 моля).
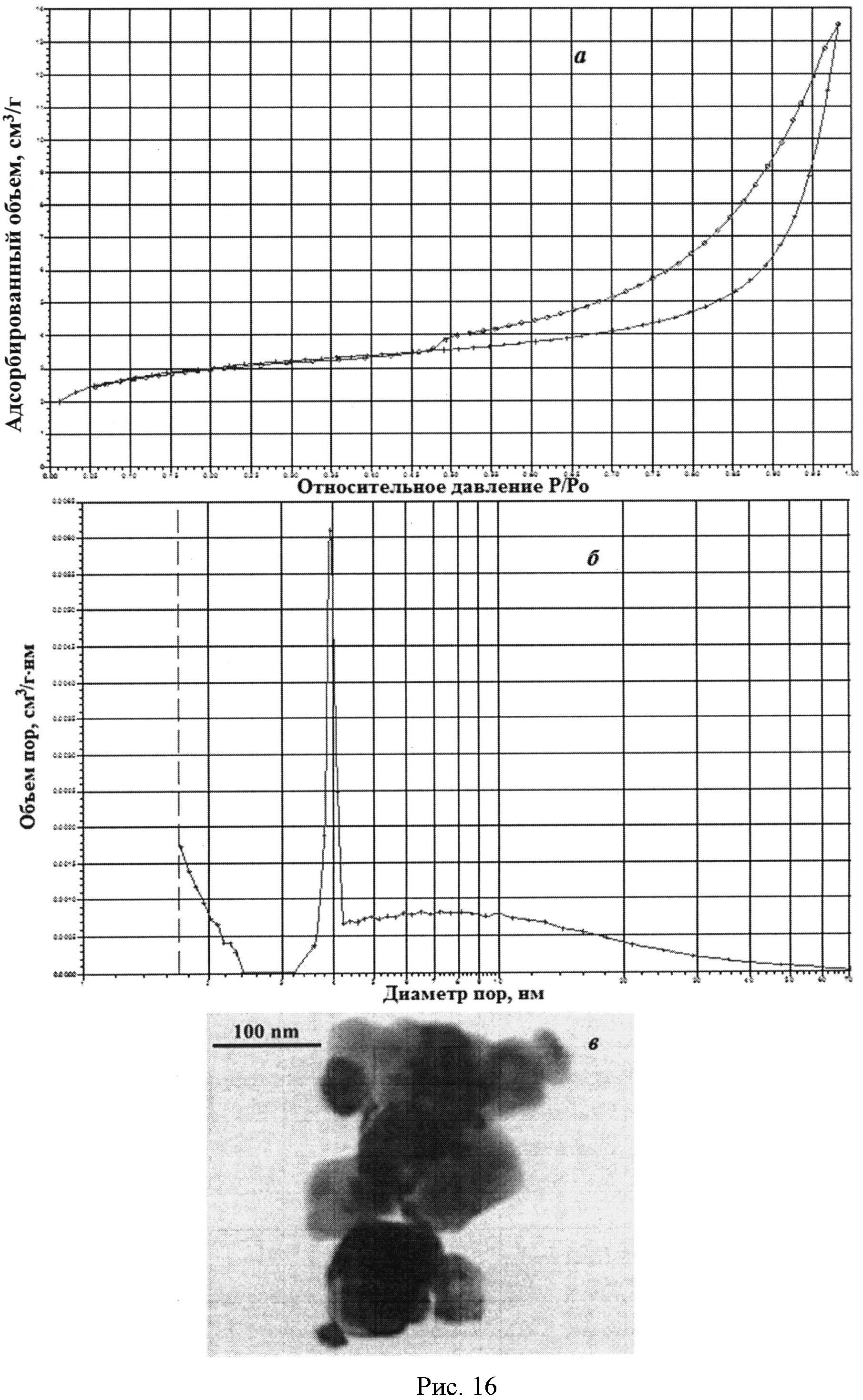
На рисунке 1 дифрактограмма 17 соответствует образцу порошка диоксида церия №17. По данным рентгеновской дифракции, порошок диоксида церия со структурой флюорита имел средний размер кристаллитов 44 нм. На рисунке 16 показаны кривые адсорбции-десорбции N2 (а) и кривая распределения по размеру пор (б) для порошка диоксида церия №17. По данным адсорбции-десорбции N2, в его пористой структуре преобладали мезопоры (рисунок 16а) с размером 3,5-4,0 нм (рисунок 16б). Удельная поверхность порошка составляла 9,9 м2/г, и не более 30% поверхности было обеспечено микропорами. На рисунке 16в представлена микрофотография порошка диоксида церия №17, полученная на просвечивающем электронном микроскопе ЕМ-301 фирмы Philips. Можно видеть, что размер частиц составляет 20-80 нм, наиболее часто их размер не превышает 50 нм.
В таблице 1 приведены морфологические характеристики полученных порошков диоксида церия (по данным рентгеновской дифракции и адсорбции-десорбции N2).
|