Результат интеллектуальной деятельности: ВЕКТОР ЭКСПРЕССИИ МЛЕКОПИТАЮЩИХ
Вид РИД
Изобретение
Настоящее изобретение относится к вектору экспрессии млекопитающих для экспрессии целевого полипептида, а также к способам экспрессии целевого полипептида в клетках-хозяевах млекопитающих с применением соответствующего вектора и клеток-хозяев, включающих указанный вектор.
Способность клонировать и экспрессировать рекомбинантные пептиды и белки в больших количествах в последние годы стала особенно актуальной. Способность очищать белки до высокой степени очистки важна в области фармацевтики человека и биотехнологии, например, для получения белковых лекарственных средств, а также для исследований, например, для кристаллизации белков для определения их трехмерной структуры. С другой стороны, белки, которые трудно получить в значительном количестве, могут быть подвергнуты сверхэкспрессии в клетках-хозяевах, затем выделены и очищены.
Выбор системы сверхэкспрессии для получения рекомбинантных белков зависит от многих факторов, включая показатели роста клеток, уровни экспрессии, внутриклеточную и внеклеточную экспрессию, посттрансляционные модификации и биологическое действие целевого белка, а также результаты регуляции и экономические соображения при получении терапевтических белков. Ключевыми преимуществами клеток млекопитающих по сравнению с другими системами экспрессии, например, бактериями или дрожжами, являются способность осуществлять правильное сворачивание белка, сложное N-связанное гликозилирование и аутентичное O-связанное гликозилирование, а также широкий спектр других посттрансляционных модификаций. Ввиду указанных преимуществ, клетки млекопитающих в настоящее время являются предпочтительной системой экспрессии для получения сложных лекарственных белков, например, моноклональных антител. Первой стадией получения линии рекомбинантных клеток является конструкция вектора экспрессии. Вектор экспрессии является ключевым элементом для стимуляции экспрессии гетерологичного гена в клетках-хозяевах и для обеспечения селективных маркеров для получения линии рекомбинантных клеток. Важными элементами векторов экспрессии млекопитающих обычно являются конститутивный или индуцибельный промотор, способный проявлять сильное транскрипционное действие; сигналы оптимизированного процессинга иРНК и трансляции, которые обычно включают последовательность Kozak, кодон терминации трансляции, сигналы расщепления иРНК и полиаденилирования, а также сигналы сплайсинга иРНК; терминатор транскрипции; селективные маркеры для получения стабильных линий клеток и для амплификации гена; прокариотический репликатор и селективные маркеры размножения вектора в бактериях.
В последние годы разработки в данной области были сосредоточены на конструировании улучшенных векторов для экспрессии генов в клетках млекопитающих. Несмотря на избыток имеющихся векторов, устойчивая выработка полипептида/белка в клетках млекопитающих все еще требует приложения сил. Некоторые факторы могут влиять на рекомбинантную экспрессию в клетках млекопитающих, в том числе сила промотора, окружение 5' нетранслируемой области и области инициации трансляции, эффективность 3' нетранслируемой области, на полиаденилирование и терминацию транскрипции, сайт инсерции беспорядочно интегрированного рекомбинантного гена в хромосому хозяина и число интегрированных копий подвергаемого экспрессии гена. Повышение числа генных копий в большинстве случаев достигается амплификацией гена при использовании линии клеток, недостаточных по ферменту, например, дигидрофолатредуктазе (DHFR; dihydrofolate reductase - DHFR) или глутаминсинтетазе (СГ), в соединении с векторами экспрессии, содержащими гены, которые кодируют некоторые ферменты и агенты, например, метотрексат (МТ), ингибирующий DHFR, и метионинсульфоксамин (МСА), который ингибирует СГ. Используя векторы экспрессии, содержащие рекомбинантный ген под контролем сильного промотора и гены, кодирующие DHFR или ГС, трансфектанты DHFR+ или ГС+, соответственно, получены впервые и генную амплификацию затем достигают выращиванием трансфектантов при постепенно повышающихся концентрациях МТ или MAC.
Задачей настоящего изобретения является получение улучшенного экспрессирующего вектора, а также системы экспрессии для экспрессии целевого полипептида в клетках млекопитающего.
Таким образом, предусмотрена нуклеиновая кислота вектора для экспрессии по меньшей мере одного целевого полипептида в клетках млекопитающего, включающая:
(а) по меньшей мере одну кассету экспрессии (POI) для экспрессии целевого полипептида (polypeptide of interest - POI);
(б) кассету экспрессии (MSM), включающую ген селективного маркера млекопитающих (mammalian selectable marker gene - MSM);
(в) кассету экспрессии (MASM), включающую амплифицируемый ген селективного маркера млекопитающих (mammalian amplifiable, selectable marker gene - MASM);
причем кассета экспрессии (POI) фланкирована с 5'-конца кассетой экспрессии (MASM), кассета экспрессии (MSM) локализована с 3'-конца от кассеты экспрессии (POI), причем в указанной нуклеиновой кислоте кассеты экспрессии (MASM), (POI) и (MSM) расположены в той же ориентации от 5' к 3'.
Понятие «нуклеиновая кислота вектора» по настоящему изобретению относится к полинуклеотиду, который несет по меньшей мере один чужеродный фрагмент нуклеиновой кислоты. Нуклеиновая кислота вектора функционирует в качестве «молекулярного носителя», высвобождающего фрагменты нуклеиновых кислот, соответственно полинуклеотидов, в клетке-хозяине. Она включает по меньшей мере одну кассету экспрессии, включающую регуляторные и кодирующие последовательности. Кассета экспрессии осуществляет правильную экспрессию инкорпорированного полинуклеотида. Кассеты экспрессии, применимые в настоящем изобретении, подробно описаны ниже. Чужеродные полинуклеоиды, например, кодирующие целевой полипептид, могут быть инсертированы в кассеты экспрессии нуклеиновой кислоты вектора для экспрессии. Нуклеиновая кислоты вектора по настоящему изобретению может быть в кольцевой или линейной форме. Указанный сайт может быть, например, сайтом множественного клонирования (multiple cloning site - MCS).
Экспрессирующая кассета (POI) означает экспрессирующую кассету для экспрессии целевого полипептида (polypeptide of interest - POI). Указанная кассета экспрессии (POI) включает или полинуклеотид, кодирующий целевой полипептид, или сайт, пригодный для инсерции соответствующего полинуклеотида, кодирующего целевой полипептид.
Понятие «полипептид» относится к молекуле, представляющий полимер из аминокислот, объединенных пептидными связями. Полипептиды могут быть какой-либо длины, в том числе белки (например, имеющие более 50 аминокислот) и пептиды (например, из 2-49 аминокислот). К полипептидам относятся белки и/или пептиды какого-либо действия или биологической активности. Соответствующие примеры рассматриваются ниже.
Кассета экспрессии (MSM) означает кассету экспрессии, включающую ген селективного маркера млекопитающих (mammalian selectable marker gene - MSM). Гены селективного маркера млекопитающих позволяют отбирать клетки-хозяева млекопитающих, включающие указанные гены, и таким образом клетки-хозяева млекопитающих, включающие вектор. Соответствующие примеры подробно описаны ниже.
Кассета экспрессии (MASM) означает кассету экспрессии, включающую амплифицируемый ген селективного маркера млекопитающих (mammalian amplifiable, selectable marker gene - MASM). Амплифицируемые гены селективных маркеров млекопитающих позволяют отбирать содержащие вектор клетки-хозяева млекопитающих, а также генную амплификацию. Соответствующие примеры подробно описаны ниже.
Обозначения «5'» и «3'» традиционно используются для описания свойств последовательности нуклеиновой кислоты, касающихся или положения генетических элементов, и/или направления (от 5' до 3'), например, транскрипции РНК полимеразой, или осуществляемой рибосомой трансляции, которая происходит в направлении от 5' к 3'. Синонимами являются понятия «расположенный выше по цепи» или «5'» и «расположенный ниже по цепи» или «3'». Условно последовательности ДНК, генные карты, карты векторов и последовательности РНК показаны от 5'-конца к 3'-концу слева направо, или в направлении от 5' к 3', обозначенном стрелками, причем наконечники стрелок указывают в направлении к 3'. Таким образом, 5' (выше по цепи) означает генетические элементы, расположенные с левой стороны, а 3' (ниже по цепи) означает генетические элементы, расположенные с правой стороны, при соблюдении принятого условного правила.
Сборка и ориентация кассет экспрессии в векторах по настоящему изобретению имеют большое значение. По настоящему изобретению кассета экспрессии (POI) фланкирована 5' кассетой экспрессии (MASM). Таким образом, кассета экспрессии (MASM) локализована 5' рядом с кассетой экспрессии (POI) и в тесной близости к ней. Безусловно, последовательности основы векторов могут разделять кассеты экспрессии (MASM) и (POI). Однако, предпочтительно, когда между кассетой экспрессии (MASM) и кассетой экспрессии (POI) нет других кассет экспрессии. Кассета экспрессии (MSM) локализована 3' от кассеты экспрессии (POI). Другие кассеты экспрессии могут быть инсертированы между кассетами экспрессии (POI) и (MSM), например, дополнительная кассета экспрессии (POI') для экспрессии дополнительного целевого полипептида (подробно описанного ниже). Все кассеты экспрессии (MASM), (POI) и (MSM) расположены в той же от 5' к 3' ориентации. В настоящем изобретении установлено, что такая конкретная конфигурация нуклеиновой кислоты вектора позволяет быстро размножить линии высокопродуктивных клеток.
В другом варианте осуществления настоящего изобретения кассета экспрессии (POI) не включает полинуклеотид, кодирующий целевой полипептид. Таким образом, предусмотрен вектор экспрессии с «пустой» кассетой экспрессии (POI). Однако, указанный полинуклеотид, кодирующий целевой полипептид, может быть инкорпорирован в кассету экспрессии (POI), используя соответствующие методы клонирования, например, используя ферменты рестрикции для инсерции полинуклеотида, кодирующего целевой полипептид в кассете экспрессии (POI). Для этой цели кассета экспрессии (POI) может включать, например, сайтом множественного клонирования (MCS), который может, например, применяться во всех рамках считывания. Соответствующие сайты MCS подробно описаны ниже. Соответствующая нуклеиновая кислота «пустого» вектора может, например, быть получена пользователями, которые затем инсертируют подвергаемые экспрессии специфические целевые полинуклеотиды в кассету экспрессии (POI). Кассета экспрессии (POI) также может включать замещающий полинуклеотид или ложную последовательность нуклеиновой кислоты, которая может быть иссечена и замещена полинуклеотидом, кодирующим целевой полипептид. Настоящее изобретение также предусматривает нуклеиновую кислоту вектора, описанную выше, включающую кассету экспрессии (POI), включающую полинуклеотид, кодирующий целевой полипептид. Такой вариант осуществления настоящего изобретения принадлежит в основном к получаемой в итоге нуклеиновой кислоте вектора, которую трансфецируют для экспрессии в клетке-хозяине.
Полинуклеотид является полимером из нуклеотидов, которые обычно связаны между одной и другой дезоксирибозой (или рибозой). Понятие «полинуклеотид» не подразумевает какие-либо ограничения по размеру и кроме того охватывает полинуклеотиды, включающие модификации, в частности модифицированные нуклеотиды.
В одном из вариантов осуществления настоящего изобретения нуклеиновая кислота вектора является кольцевой и кассета экспрессии (MSM) расположена в направлении 3' от кассеты экспрессии (POI) и кассета экспрессии (MASM) расположена в направлении 3' от кассеты экспрессии (MSM). В другом варианте описание кольцевого вектора по настоящему изобретению касается кольцевой нуклеиновой кислоты вектора для экспрессии по меньшей мере одного целевого полипептида в клетках млекопитающих, включающей:
(а) по меньшей мере одну кассету экспрессии (POI) для экспрессии целевого полипептида;
(б) кассету экспрессии (MSM), включающую ген селективного маркера млекопитающих;
(в) кассету экспрессии (MASM), включающую амплифицируемый ген селективного маркера млекопитающих;
причем кассета экспрессии (MSM) расположена в направлении 3' от кассеты экспрессии (POI) и кассета экспрессии (MASM) расположена в направлении 3' от кассеты экспрессии (MSM), причем кассеты экспрессии (MASM), (POI) и (MSM) расположены в той же ориентации от 5' к 3'.
Нуклеиновая кислота вектора может быть трансфецирована в клетки-хозяева в кольцевой форме. Суперскрученные молекулы векторов обычно могут быть конвертированы в линейные молекулы в ядре из-за действия эндо- и экзонуклеаз. Однако линеаризация нуклеиновой кислоты вектора перед трансфекцией часто улучшает эффективность стабильной трансфекции. На эту эффективность также влияет контроль точки линеаризации, если вектор линеаризируют перед трансфекцией.
Таки образом, по одному из вариантов осуществления настоящего изобретения вектор экспрессии включает заранее определенный сайт рестрикции, который можно использовать для линеаризации нуклеиновой кислоты вектора перед трансфекцией. Продуманное размещение указанного сайта рестрикции для линеаризации имеет важное значение, поскольку указанный сайт рестрикции определяет, где нуклеиновая кислота вектора открывается/линеаризируется и таким образом определяет порядок/сборку кассет экспрессии, когда конструкцию интегрируют в геном клеток млекопитающих.
Таким образом, нуклеиновая кислота вектора может включать сайт рестрикции для линеаризации вектора, причем указанный сайт рестрикции для линеаризации локализован между кассетами экспрессии (MSM) и (MASM). Предпочтительно указанный сайт рестрикции для линеаризации является уникальным и один раз содержится в нуклеиновой кислоте вектора экспрессии. Например, может использоваться сайт рестрикции для линеаризации, который распознается ферментом рестрикции, имеющим низкую частоту разрезания, для того, чтобы обеспечить расщепление вектора только по сайту рестрикции для линеаризации, но не расщепления (или такое расщепление происходит редко), например, в кассетах (кассете) экспрессии или в основе вектора. Такое положение может поддерживаться, например, путем обеспечения сайта рестрикции для фермента рестрикции, который распознает последовательность из более шести пар оснований или который распознает последовательности, которые недостаточно представлены в хромосомальной ДНК. Соответствующим примером является фермент SwaI, и, следовательно, вектор может включать сайт распознавания ферментом SwaI в качестве уникального сайта рестрикции для линеаризации. Если указанный сайт линеаризации содержится более одного раза в последовательности нуклеиновой кислоты вектора (включая полинуклеотиды, кодирующие целевой полипептид), или если используют фермент рестрикции, который разрезает несколько раз последовательность нуклеиновой кислоты вектора, эти случаи также входят в рамки охвата настоящего изобретения, например, для изменения/мутирования сайтов рестрикции помимо сайта рестрикции для линеаризации, который локализован~между кассетами экспрессии (MSM) и (MASM), для элиминации таких дополнительных сайтов рестрикции и для получения уникального или по меньшей мере редкого сайта рестрикции для линеаризации.
Если вектор применяют в качестве стандартного вектора экспрессии, предназначенного, например, для использования в качестве инструмента для экспрессии нескольких разных полипептидов, целесообразно обеспечить сайт рестрикции для линеаризации, включая сайты множественного распознавания для ферментов с низкой частотой разрезания. Ферменты рестрикции, выбранные для линеаризации, предпочтительно не должны разрезать внутри кассет экспрессии для селективных маркеров или других последовательностей основы вектора, чтобы убедиться, что фермент разрезает только один раз для правильной линеаризации вектора. Путем обеспечения сайта рестрикции для линеаризации, включая сайты множественного распознавания для ферментов рестрикции, имеющих низкую частоту разрезания, может быть выбран соответствующий фермент рестрикции для линеаризации из имеющихся возможностей, чтобы надежно избежать рестрикции внутри полинуклеотида, кодирующего целевой полипептид. Однако, согласно описанному выше, дополнительные сайты рестрикции могут быть мутированы или может быть осуществлена частичная рестрикция.
Размещение сайта рестрикции для линеаризации между кассетой экспрессии (MSM) и кассетой экспрессии (MASM) приводит к тому, что кассета экспрессии (POI) (и другие кассеты экспрессии для экспрессии целевых полипептидов, если они имеются) фланкирована в направлении 5' кассетой экспрессии (MASM). Кассета экспрессии (MSM) локализована в направлении 3' от кассеты экспрессии (POI) при линеаризации. Таким образом, кассеты экспрессии (MSM) и (MASM) разделены при линеаризации кольцевой нуклеиновой кислоты вектора. Если имеется кассета экспрессии (PSM) бактериального селективного маркера (см. ниже), сайт рестрикции для линеаризации предпочтительно размещен между кассетами экспрессии (PSM) и (MASM). При этом бактериальный ген селективного маркера расположен ниже по цепи (3') и поэтому находится «вне» частей линеаризованной нуклеиновой кислоты вектора «млекопитающего». Такая сборка предпочтительна, поскольку бактериальные гены по-видимому не несут преимуществ при экспрессии в млекопитающих, поскольку бактериальные последовательности могут привести к повышенному метилированию или другим эффектам сайленсинга в клетках млекопитающих.
К неограничительным примерам генов селективных маркеров млекопитающих, которые могут быть включены в кассету экспрессии (MSM), относятся гены устойчивости к антибиотикам, например, гены, обеспечивающий устойчивость к антибиотикам: G418; гигромицину (hyg или hph, коммерческий продукт фирмы Life Technologies, Inc. Gaithesboro, Мерилэнд.); неомицину (пео, коммерческий продукт фирмы Life Technologies, Inc. Gaithesboro, Md.); зеоцину (Sh Ble, коммерческий продукт фирмы Pharmingen, Сан-Диего, Калифорния); пуромицину (рас, пуромицин-N-ацетилтрансфераза, продукт фирмы Clontech, Palo Alto Calif.), уабаину (oua, продукт фирмы Pharmingen) и бластицидину (фирма Invitrogen). Соответствующие гены селективных маркеров млекопитающих известны и позволяют отбирать клетки-хозяева млекопитающих, включающих указанные гены, и таким образом, клетки-хозяева, включающие вектор. Понятие «ген» в контексте настоящего изобретения относится к природному или синтетическому полинуклеотиду, кодирующему функциональный вариант селективного маркера, обеспечивающего обозначенную устойчивость. Поэтому к данному понятию относятся также усеченные или мутантные версии гена дикого типа или синтетические полинуклеотиды до тех пор, пока они обеспечивают соответствующую устойчивость. Согласно предпочтительному варианту осуществления настоящего изобретения указанная кассета экспрессии (MSM) включает ген, кодирующий ферментативно функциональную неомицинфосфотрансферазу (I или II). Данный вариант осуществления настоящего изобретения высоко эффективен в сочетании с применением гена, кодирующего ферментативно функциональную DHFR, в качестве амплифицируемого гена селективного маркера.
Амплифицируемые гены селективных маркеров млекопитающих позволяют проводить отбор клеток-хозяев млекопитающих, содержащих вектор, и выявлять амплификацию гена. Неограничительным примером амплифицируемого гена селективного маркера млекопитающих является ген дигидрофолатредуктазы (DHFR). Другие используемые в настоящее время системы применяют наряду с системой глутаминсинтетазы (ГС) (Bebbington и др., 1992) и производной от гистидинола системой селекции (Hartmann и Mulligan, 1988). Такие амплифицируемые маркеры также являются селективными маркерами и, следовательно, могут применяться для отбора тех клеток, которые приобрели вектор. DHFR и глутаминсинтетаза обеспечивают хорошие результаты. В обоих случаях отбор обычно происходит в отсутствии соответствующего метаболита (гипоксантина и тимидина в случае DHFR, глутамина в случае ГС), предотвращающего рост нетрансформированных клеток. С такими системами амплификации, например, системой DHFR, экспрессия рекомбинантного белка может быть повышена путем экспозиции клеток определенными агентами, стимулирующими генную амплификацию, например, антифолатами (например, метотрексатом (МТ)) в случае системы DHFR. Соответствующим ингибитором амплификации гена индукции ГС является метионинсульфоксимин (MAC). Экспозиция MAC также приводит к генной амплификации. По одному из вариантов осуществления настоящего изобретения указанная кассета экспрессии (MASM) включает ген, кодирующий ферментативно функциональную глутаминсинтетазу (ГС) или дигидрофолатредуктазу (DHFR).
По одному из вариантов осуществления настоящего изобретения указанная кассета экспрессии (MSM) включает ген, кодирующий ферментативно функциональную неомицинфосфотрансферазу, и указанная кассета экспрессии (MASM) включает ген, кодирующий ферментативно функциональную дигидрофолатредуктазу (DHFR).
Вектор может включать по меньшей мере одну дополнительную кассету экспрессии (POI') для экспрессии дополнительного целевого полипептида. Указанная дополнительная кассета экспрессии (POI') расположена между кассетой экспрессии (POI) и кассетой экспрессии (MSM). Указанная кассета экспрессии (POI') расположена в той же ориентации от 5' к 3', что и кассеты экспрессии (POI) и (MSM). По одному из вариантов осуществления настоящего изобретения она включает полинуклеотид, кодирующий дополнительный целевой полипептид.
Таким образом, нуклеиновая кислота вектора по настоящему изобретению может включать более одной кассеты экспрессии для экспрессии целевых полипептидов. Следовательно, может быть несколько кассет экспрессии ((POI), (POI'), (POI") и др.) для экспрессии разных целевых полипептидов, расположенных в нуклеиновую кислоту вектора экспрессии по настоящему изобретению. Такие кассеты экспрессии фланкированы в направлении 5' кассетой экспрессии (MASM) и в направлении 3' кассетой экспрессии (MSM). Следовательно, настоящее изобретение также предусматривает нуклеиновую кислоту вектора, включающую более одной кассеты экспрессии, кодирующей, например, субъединицы димерных или в более высокой степени мультимерных белков. Кассеты экспрессии, кодирующие разные субъединицы мультимерных белков, причем каждая инкорпорирована в отдельную кассету экспрессии, могут быть размещены рядом друг с другом. Для мультимерных белков, кодируемых по меньшей мере двумя разными генами (например, легкой и тяжелой цепей иммуноглобулина или их функциональных фрагментов, например, по меньшей мере вариабельных областей легкой и тяжелой цепей иммуноглобулина), полинуклеотиды, кодирующие требуемые субъединицы целевого полипептида, инсертированы в кассеты экспрессии (POI) и (POI'). Соответствующий вариант осуществления настоящего изобретения, с использованием по меньшей мере двух кассет экспрессии (POI) и (POI') для экспрессии целевых полипептидов, особенно предпочтителен для экспрессии молекул иммуноглобулина, например, антибиотиков или их функциональных фрагментов. Таким образом, нуклеиновая кислота вектора предусмотрена для экспрессии молекулы иммуноглобулина, включающая в каждой кассете экспрессии (POI) и (POI') полинуклеотид, кодирующий и легкую, и тяжелую цепь молекулы иммуноглобулина или ее фрагментов, причем каждая кассета экспрессии (POI) и (POI') включает один из указанных полинуклеотидов. Таким образом, кассета экспрессии (POI) может включать или полинуклеотид для экспрессии легкой цепи, или полинуклеотид для экспрессии тяжелой цепи молекулы иммуноглобулина.
По одному из предпочтительных вариантов осуществления настоящего изобретения кассета экспрессии (POI) включает полинуклеотид, кодирующий по меньшей мере часть легкой цепи указанной молекулы иммуноглобулина или ее функционального фрагмента, и кассета экспрессии (POI') включает полинуклеотид, кодирующий часть тяжелой цепи указанной молекулы иммуноглобулина или ее функционального фрагмента. Подтверждено, что сборка кассеты экспрессии для легкой цепи в направлении 5' к кассете экспрессии тяжелой цепи, полезно в плане уровня экспрессии молекул иммуноглобулина. По одному из вариантов осуществления настоящего изобретения нуклеиновая кислота вектора экспрессии сконструирована таким образом, что кассета (кассеты) экспрессии уже включает полинуклеотид, кодирующий по меньшей мере часть константных областей молекулы иммуноглобулина. Фрагменты полинуклеотида, кодирующие вариабельные части молекул иммуноглобулина, могут быть инсертированы пользователем в кассеты экспрессии, используя соответствующие стратегии клонирования для получения итогового вектора экспрессии.
Кассеты экспрессии, содержащиеся в векторе экспрессии по настоящему изобретению, сконструированы таким образом, что они допускают экспрессию инкорпорированных полинуклеотидов/генов в клетках млекопитающих. Для этой цели кассеты экспрессии обычно включают необходимые регуляторные последовательности, например, последовательность промотора и/или терминатора транскрипции, например, сайта полиА.
Векторы, используемые для экспрессии целевых полипептидов, обычно содержат элементы контроля транскрипции, применимые для индукции транскрипции, например, промоторы, энхансеры, сигналы полиаденилирования, сигналы паузы или терминации транскрипции, например, элементы кассеты экспрессии. Для правильной экспрессии полипептидов соответствующие элементы контроля трансляции предпочтительно включают в вектор, например, 5' нетранслируемые области, приводящие к структурам 5' кэп с, пригодным для рекрутинга рибосом и стоп-кодоны для терминации процесса трансляции. В частности полинуклеотид, который выступает в качестве генов селективных маркеров, кроме того, полинуклеотида, кодирующего целевой полипептид, может транскрибироваться под контролем элементов транскрипции, имеющихся в соответствующих промоторах. Получаемые транскрипты генов селективных маркеров и генов целевого полипептида сохраняют элементы функциональной трансляции, которые существенно облегчают уровни экспрессии белка (т.е. трансляцию) и должную терминацию трансляции. Функциональная единица экспрессии, способная должным образом осуществлять экспрессию инкорпорированного полинуклеотида, в настоящем изобретении также относится к «кассете экспрессии». Предпочтительно она включает 3' нетранслируемую область (3' UTR).
Таким образом, предусмотрены нуклеиновые кислоты векторов, в которых кассеты экспрессии включают по меньшей мере один элемент промотора, и/или промотора/энхансера. Хотя физические границы между такими двумя контрольными элементами не всегда ясны, понятие «промотор» обычно относится к сайту молекулы нуклеиновой кислоты, с которым связываются РНК-полимераза и/или какие-либо ассоциированные факторы и с которого начинается транскрипция. Энхансеры усиливают действие промотора во времени и в пространстве. Многие промоторы обладают способностью индуцировать транскрипцию в широком диапазоне типов клеток. Промоторы можно разделить на два класса, а именно, на конститутивные и те, которые регулируются индукцией или дерепрессией. Промоторы, которые используют для осуществления на высоком уровне выработки белков в клетках млекопитающих, должны быть сильными и предпочтительно действующими в широком диапазоне типов клеток для осуществления качественной и количественной оценки рекомбинантного полипептида. Промотор может быть выбран из группы, состоящей из промотора SV40, промотора ЦМВ, промотора EF1 альфа, промотора RSV, промотора BROAD3, промотора murine rosa 26, промотора pCEFL и промотора β-актина. Сильные конститутивные промоторы, которые индуцируют экспрессию в клетках многих типов, включают, но ими не ограничиваются, главный поздний промотор аденовируса, сверхранний промотор цитомегаловируса человека, промотор вируса SV40 и вируса саркомы Рауша, промотор 3-фосфоглицераткиназы грызунов и EF1a. Хорошие результаты получены с вектором экспрессии по настоящему изобретению, если промотор и/или энхансер получены из ЦМВ и/или SV40.
В одном из вариантов осуществления настоящего изобретения кассета (кассеты) экспрессии для экспрессии целевого полипептида (полипептидов) включает усиленный промотор и/или энхансер по сравнению с кассетами экспрессии для экспрессии селективных маркеров. Такая сборка приводит к тому, что вырабатывается больше транскрипта целевого полипептида, а не селективных маркеров. Преимущество заключается в том, что получение целевого полипептида, который секретируется, является доминантом относительно выработки селективных маркеров, поскольку способность к выработке отдельными клетками гетерологичных белков не ограничена и может таким образом сосредотачиваться на целевом полипептиде.
В одном из вариантов осуществления настоящего изобретения кассеты экспрессии (POI) и (POI') (при наличии), которые используют для экспрессии целевого полипептида, включают промотор/энхансер ЦМВ. Конкретные примеры подробно описаны ниже. Кассеты экспрессии (MSM) и (MASM), которые предпочтительно экспрессируют DHFR и гены-маркеры неомицина, включают промотор SV40 или промотор/энхансер SV40. Известно, что промотор ЦМВ является одним из наиболее сильных промоторов, пригодных для экспрессии у млекопитающих, и приводит к очень хорошей степени экспрессии. Полагают, что он дает существенно большее количество транскрипта, чем промотор SV40.
Кроме того, кассеты экспрессии могут включать соответствующий сайт терминации транскрипции. Так непрерывная транскрипция с расположенного выше по цепи промотора через вторую единицу транскрипции может ингибировать функцию расположенного ниже по цепи промотора - явление, называемое окклюзией промотора или интерференцией транскрипции. Это явление было описано и у прокариот, и у эукариот. Правильное размещение сигналов терминации транскрипции между двумя единицами транскрипции может предупредить окклюзию промотора. Сайты терминации транскрипции описаны и показано, что их инкорпорация в векторы экспрессии обладает множественными полезными воздействиями на генную экспрессию.
Большинство возникающих эукариотических иРНК имеет полиА хвост с 3'-конца, который добавляется во время комплексного процесса, который включает расщепление первичного траснкрипта и спаренную реакцию полиаденилирования. Хвост полиА является благоприятным для стабильности и перемещаемости иРНК. Следовательно, кассеты экспрессии вектора по настоящему изобретению обычно включают сайт полиаденилирования. Имеется несколько эффективных сигналов полиА, которые могут применяться в векторах экспрессии млекопитающих, включая производные генов от гормона роста крупного рогатого скота (bovine growth hormone - bgh), бета-глобина мыши, ранней единицы транскрпции SV40 и тимидинкиназы вируса Herpes simplex. Однако, также известны синтетические сайты полиаденилирования (см., например, вектор экспрессии pCI-neo фирмы Promega по работе Levitt и др., Genes Dev. 3, (7), 1989, сс.1019-1025). Сайт полиаденилирования может быть выбран из группы, состоящей из сайта 8У40полиА, например, позднего и раннего поли-А сайта SV40 (см., например, плазмиду pSV2-DHFR в описании Subramani и др., Mol. Cell. Biol. 1981, сс.854-864), синтетического сайта полиА (см., например, вектор экспрессии pCI-neo фирмы Promega по работе Levitt и др., Genes Dev. 1989, 3, (7), сс.1019-1025) и сайта bgh полиА (гормона роста крупного рогатого скота).
Кассеты экспрессии могут включать энхансер (см. выше) и/или интрон. По одному из вариантов осуществления настоящего изобретения кассета (кассеты) экспрессии для экспрессии целевого полипептида включает интрон. Большинство генов высших эукариот содержат интроны, которые удаляют при процессировании РНК. Установлено, что геномные конструкции экспрессируются более эффективно в трансгенных системах по сравнению с идентичными конструкциями, утратившими интроны. Обычно интроны помещают с 5'-конца открытой рамки считывания. Таким образом, интрон может быть включен в кассету (кассеты) экспрессии для экспрессии целевого полипептида (полипептидов) для повышения степени экспрессии. Указанный интрон может быть локализован между элементом (элементами) промотора и/или промотора/энхансера и 5'-концом открытой рамки считывания экспрессируемого полипептида. Следовательно, предусмотрена нуклеиновая кислота вектора, причем по меньшей мере кассета экспрессии (POI) включает интрон, который расположен между промотором и стартовым кодоном полинуклеотида для экспрессии целевого полипептида. Известно несколько соответствующих интронов в данной области, которые могут использоваться в связи с настоящим изобретением.
В одном из вариантов осуществления настоящего изобретения интрон, используемый в кассетах экспрессии для экспрессии целевых полипептидов, является синтетическим интроном, например, SIS или RK интроном. RK интрон является сильным синтетическим интроном, который предпочтительно помещен перед стартовым кодоном ATG целевого гена. RK интрон состоит из сайта сплайсинга донора интрона промотора ЦМВ и сайта сплайсинг акцептора вариабельной области тяжелой цепи IgG мыши (см., например, Eaton и др., Biochemistry 25, 1986, сс.8343-8347, Neuberger и др., ЕМВО J. 2 (8), 1983, сс.1373-1378; он может быть получен от вектора pRK-5 (фирма BD PharMingen)).
Кроме того, неожиданно было установлено, что помещение интрона с 3'-конца открытой рамки считывания гена DHFR оказывает полезные воздействия на степень экспрессии/амплификации конструкции. Интрон, используемый в кассете экспрессии DHFR, приводит к меньшему, но функциональному варианту гена DHFR (Grillari и др., J. Biotechnol. 87, 2001, сс.59-65). Таким образом понижается уровень экспрессии гена DHFR. Это приводит к повышенной чувствительности к МТ и более жестким условиям отбора. Таким образом, предусмотрена нуклеиновая кислота вектора, в которой кассета экспрессии (MASM) включает интрон, который локализован в направлении 3' амплифицируемого гена селективного маркера. Соответствующий интрон может быть получен из вектора pSV2-DHFR (например, описанного выше).
Указанный вектор может включать по меньшей мере одну дополнительную кассету экспрессии (PSM), содержащую ген прокариотического селективного маркера. Указанная кассета экспрессии (PSM) локализована между кассетами экспрессии (MSM) и (MASM). Указанный селективный маркер может обеспечить устойчивость к антибиотикам, например, ампициллину, канамицину, тетрациклину и/или хлорамфениколу. Указанная кассета экспрессии (PSM) предпочтительно расположена в ориентации от 5' к 3' подобно другим кассетам экспрессии (POI), (MSM) и (MASM).
Ген DHFR действует в качестве маркера и гена генной амплификации. Отбор может осуществляться путем культивирования клеток в отсутствии соответствующих метаболитов (гипоксантина и тимидина), тем самым препятствуя росту нетрансформированных клеток. С системой DHFR экспрессия целевых полипептидов может быть повышена путем обработки клеток антифолатами, например, метотрексатом (МТ) - лекарственным средством, которое блокирует действие DHFR. Через некоторое время обработки МТ большинство клеток погибает, но небольшое число клеток с повышенной выработкой DHFR обычно выживает. При обработке МТ с повышением концентрации выжившие клетки могут часто содержать от нескольких сотен до нескольких тысяч копий интегрированного вектора, погруженного в хромосомы, которые часто удлинены. Большинство соответственно амплифицируемых клеток вырабатывает больше рекомбинантного белка, чем неамплифицируемые клетки.
Несколько ферментов DHFR и, следовательно, генов, известно в предшествующем уровне техники и они могут применяться в связи с настоящим изобретением. Фермент DHFR может быть DHFR дикого типа, или функциональным вариантом, или его производным. Понятие «вариант» или «производное» включает ферменты DHFR, имеющие одну или несколько замен в аминокислотных последовательностях (например, делеций, замещений или дополнений), а именно аминокислотной последовательности соответствующего фермента DHFR, гибридные белки, включающие фермент DHFR или его функциональный фрагмент, и ферменты DHFR, которые могут быть модифицированы для обеспечения дополнительной структуры и/или функции, а также функциональные фрагменты вышеупомянутых соединений, которые все еще обладают по меньшей мере одной функцией фермента DHFR. Ген DHFR предпочтительно выбран из группы, состоящей из DHFR дикого типа, варианта DHFR, имеющего пониженную чувствительность к МТ по сравнению с DHFR дикого типа, и варианта DHFR с повышенной чувствительностью к МТ по сравнению с DHFR дикого типа. По одному из вариантов осуществления настоящего изобретения ген DHFR является геном DHFR дикого типа. По другому варианту осуществления настоящего изобретения ген DHFR кодирует мало функциональный вариант DHFR. Это приводит к повышенной чувствительности к МТ и условиям более строгого отбора. Такое положение может быть достигнуто, например, помещением интрона с 3'-конца гена DHFR (см. выше). Другой вариант может основываться на применении мутанта/варианта DHFR, имеющего повышенную чувствительность к МТ по сравнению с DHFR дикого типа. Такие варианты осуществления настоящего изобретения особенно полезны в том случае, когда используют вектор в DHFR клетках-хозяевах.
Если нужно использовать систему DHFR в клетках-хозяевах, включающих копию гена DHFR в их собственном геноме (например, СНО DHFR), предпочтительно, чтобы был использован мутант/вариант гена DHFR, который менее чувствителен к антифолатам, например, МТ, по сравнению с DHFR дикого типа, и таким образом до определенной степени антифолатной, соответственно, МТ-устойчивости. Например, из-за мутаций в гене чувствительность гена DHFR к МТ может быть существенно снижена таким образом, что указанный вариант может применяться при повышенных концентрациях антифолата (МТ). Указанная низкая чувствительность варианта DHFR к антифолату, в частности к МТ, может, например, обусловить пониженное связывающее сродство антифолата/МТ. Соответствующие варианты DHFR могут применяться для «повышенного титрования» эндогенной DHFR экспрессии в линиях клеток дикого типа. Соответствующая «устойчивость» или меньшая чувствительность вариантов DHFR известны в предшествующем уровне техники.
Вектор экспрессии может быть выбран из группы, состоящей из:
(а) кольцевой или линейной нуклеиновой кислоты вектора, включающей следующие генетические элементы в указанном порядке, причем направление от 5' к 3' выражено стрелкой →:
I. Промотор кассеты экспрессии (MASM) (→)
II. Ген, кодирующий амплифицируемый селективный маркер млекопитающих кассеты экспрессии (MASM) (→)
III. Необязательно интрон кассеты экспрессии (MASM) (→)
IV. ПолиА сайт кассеты экспрессии (MASM) (→)
V. Промотор кассеты экспрессии (POI) (→)
VI. Интрон кассеты экспрессии (POI) (→)
VII. Полинуклеотид, кодирующий целевой полипептид, инвертированный в кассету экспрессии (POI) (→)
VIII. ПолиА сайт кассеты экспрессии (POI) (→)
IX. Промотор кассеты экспрессии (РОГ) (→)
X. Интрон кассеты экспрессии (РОГ) (→)
XI. Полинуклеотид, кодирующий дополнительный целевой полипептид, который инсертирован в кассету экспрессии (POI') (→)
XII. ПолиА сайт кассеты экспрессии (POI') (→)
XIII. Промотор кассеты экспрессии (MSM) (→)
XIV. Ген, кодирующий селективный маркер млекопитающих кассеты экспрессии (MSM) (→)
XV. ПолиА сайт кассеты экспрессии (MSM) (→)
XVI. Кассета экспрессии PSM (→) или (←)
XVII. Сайт линеаризации рестрикции, если нуклеиновая кислота вектора кольцевая;
(б) нуклеиновая кислота вектора, показанная в виде Seq. ID No.1, или Seq. ID No.16, или их производного, представляющая ту же конфигурацию относительно сборки генетических элементов.
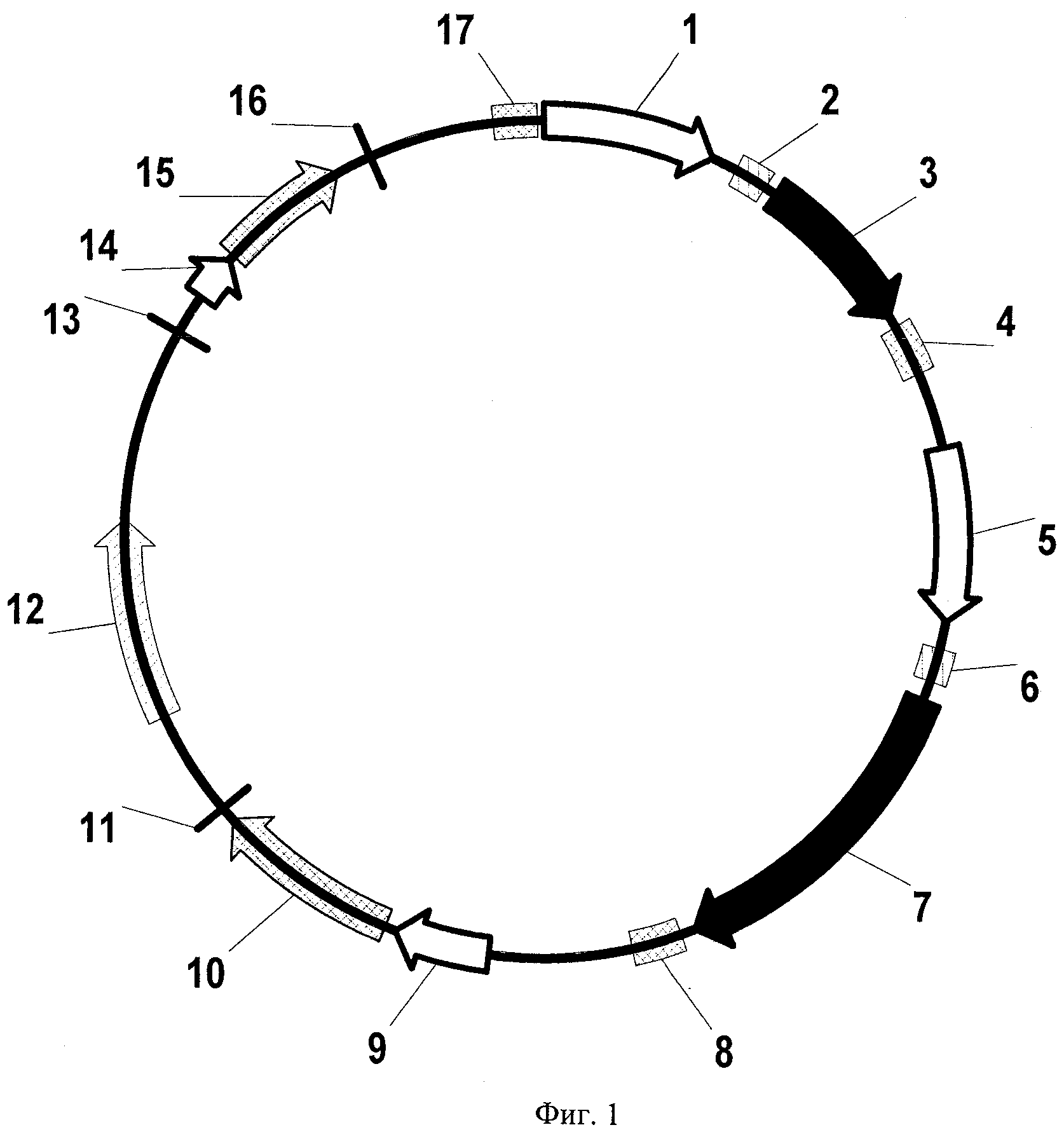
Предпочтительный вариант осуществления настоящего изобретения по варианту (а) в его кольцевой форме, показан на фиг.1 и в соответствующей табл.1.
Вектор по настоящему изобретению может быть получен путем сборки кассет экспрессии в требуемом порядке и ориентации, подробно описанных выше. Сборка кассет экспрессии/генетических элементов может быть произведена, используя соответствующие ферменты рестрикции и стратегии клонирования в порядке сборки вектора экспрессии. Таким образом, также предусмотрен способ получения нуклеиновой кислоты вектора, согласно описанному выше, причем указанный способ включает сборку по меньшей мере следующих генетических элементов:
(а) по меньшей мере одной кассеты экспрессии (POI) для экспрессии целевого полипептида;
(б) кассеты экспрессии (MSM), включающей ген селективного маркера млекопитающих;
(в) кассеты экспрессии (MASM), включающей амплифицируемый ген селективного маркера млекопитающих;
причем кассета экспрессии (POI) фланкирована в направлении 5' кассетой экспрессии (MASM), кассетой экспрессии (MSM) локализованной в направлении 3' от кассеты экспрессии (POI), причем кассеты экспрессии (MASM), (POI) и (MSM) расположены в той же ориентации от 5' к 3'.
В случае получения кольцевой нуклеиновой кислоты вектора, генетические элементы собраны таким образом, что кассета экспрессии (MSM) соответственно локализована в направлении 3' относительно кассеты экспрессии (POI) и кассета экспрессии (MASM) локализована в направлении 3' кассеты экспрессии (MSM).
Вектор по настоящему изобретению может применяться для экспрессии целевого полипептида во многих разных клетках-хозяевах млекопитающих. Вектор экспрессии по настоящему изобретению обычно интегрирован в геном и поддерживается в нем. Есть два основных типа клеток-хозяев - культуры прикрепленных к субстрату клеток и суспендированные культуры. Суспендированные культуры предпочтительны. Наиболее сильно прикрепившиеся лини клеток поддерживают свой рост на «якорной» подложке, несмотря на предпринятые усилия для их адаптации к росту в виде суспензии. Коммерчески доступные составы сред облегчают такой переход. В сущности, какие-либо клетки-хозяева млекопитающих могут применяться в связи с настоящим изобретением в той степени, в которой они допускают экспрессию полипептида. К клеткам-хозяевам млекопитающих, применимым для целей настоящего изобретения, относятся, но ими не ограничиваются, клетки, полученные из мышей (например, СОР, L, С127, Sp2/0, NS-0, NS-1, At20 или NIH3T3), крыс (PC 12, PC12h, GH3, MtT), хомяков (например, ВНК, СНО и клетки СНО, недостаточные по гену DHFR), обезьян (например, COS1, COS3, COS7, CV1 и Vero) и людей (например, Hela, HEK-293, производные от сетчатки клетки PER-C6, производные от диплоидных фибробластов клетки, клетки миеломы и HepG2). Предпочтительно клетками-хозяевами являются клетки СНО. Конструкция вектора по настоящему изобретению особенно применима для получения полипептидов в клетках грызунов, например, СНО и клетках СНО, недостаточных по гену DHFR.
Также предусмотрены клетки-хозяева млекопитающих, включающие вектор экспрессии по настоящему изобретению. Также предусмотрена стабильная линия клеток, включающих в геном вектор экспрессии по настоящему изобретению или его фрагмент. Сегмент должен включать по меньшей мере кассеты экспрессии, необходимые по настоящему изобретению. Поскольку векторы и их свойства, а также соответствующие клетки-хозяева подробно описаны выше, следует обратиться к приведенному выше описанию. Таким образом, также предусмотрен способ получения клеток-хозяев, описанный выше, причем клетки-хозяева трансфецированы нуклеиновой кислотой вектора по меньшей мере по одному из п.п.1-16.
Имеется несколько соответствующих методов в предшествующем уровне техники для интродукции вектора экспрессии в клетки-хозяева млекопитающих. К таким методам относятся, но ими не ограничиваются, трансфекция с кальцием фосфатом, электропорация, липофекция, биологическая баллистика и полимер-опосредованные перенос генов. Соответствующие клетки-хозяева описаны выше.
После интродукции нуклеиновой кислоты вектора экспрессии в клетки-хозяева полученные трансформанты культивируют в селективных условиях, пригодных для исследования экспрессии гена селективного маркера млекопитающих, включенного в кассету экспрессии (MSM). Это означает, что, например, если ген селективного маркера млекопитающих является геном устойчивости к антибиотику, трансформанты культивируют в среде, содержащей соответствующий антибиотик, действующий в клетках млекопитающих, и трансформанты, которые жизнеспособны в выбранных условиях, таким образом, способны получать трансформанты, которые экспрессируют маркерный ген и, следовательно, инкорпорированный вектор. Кроме того, вторая стадия отбора может быть выполнена путем культивирования трансформантов в селективной среде, адаптированной для отбора амплифицируемого гена селективного маркера, включенного в кассету экспрессии (MASM). Например, в случае применения DHFR в качестве амплифицируемого гена селективного маркера, можно культивировать трансформанты в среде без нуклеотида или пурина в присутствии ингибитора DHFR.
При использовании индуцируемого промотора по меньшей мере в одной кассете экспрессии, соответствующий сигнал индукции должен быть предусмотрен для того, чтобы начать экспрессию полипептида.
Для применения системы DHFR селекции/амплификации указанные клетки-хозяева могут культивироваться в присутствии ингибитора DHFR. Соответствующими ингибиторами DHFR являются антифолаты, например, МТ. Концентрация применяемого антифолата/МТ зависит от клеток-хозяев и варианта DHFR, инкорпорированного в вектор. Диапазон концентрации может быть выбран для процедур многоступенчатой амплификации в DHFR клетках-хозяевах, например, при величинах примерно 5-20 нМ, достигая величин 500-1000 нМ или даже более для вторичных и дополнительных стадий амплификации. Для клеток DHFR стартовые концентрации обычно выше в диапазоне 100-750 нМ, предпочтительно 500 нМ на первой стадии и 500-1000 нМ и более для других стадий амплификации. Соответствующие варианты DHFR описаны выше.
Для применения системы ГС селекции/амплификации указанные клетки-хозяева могут культивироваться в присутствии, например, MAC. Применяемая концентрация MAC зависит от клеток-хозяев. Диапазон концентрации может быть выбран, составляющий примерно 15-150 мкМ, 20-100 мкМ и 25-50 мкМ. Эти диапазоны особенно применимы для клеток NSO и СНО.
С помощью вектора экспрессии по настоящему изобретению несколько разных целевых полипептидов может быть экспрессировано/продуцировано. Понятие полипептида относится к молекуле, представляющей полимер аминокислот, связанных между собой пептидными связями (связью). Полипептиды включают полипептиды какой-либо длины, в том числе белки (например, имеющие более 50 аминокислот) и пептиды (например, 2-49 аминокислот). К полипептидам относятся белки и/или пептиды с каким-либо действием или биологической активностью, включая, например, биологически активные полипептиды, например, ферментные белки или пептиды (например, протеазы, киназы, фосфатазы), рецепторные белки или пептиды, транспортные белки или пептиды, бактерицидные и/или эндотоксин-связывающие белки, структурные белки или пептиды, иммунные полипептиды, токсины, антибиотики, гормоны, факторы роста, вакцины и др. Указанный полипептид может быть выбран из группы, состоящей из пептидных гормонов, интерлейкинов, активаторов тканевого плазминогена, цитокинов, иммуноглобулинов, в частности антител или их фрагментов или вариантов. Указанный иммуноглобулин может быть какого-либо изотипа. Очень часто молекулы IgG (например, IgG1) вырабатываются/являются необходимыми в качестве терапевтических белков. Фрагментом антитела является какой-либо фрагмент антитела, включающий по меньшей мере 20 аминокислот из указанного целого антитела, предпочтительно по меньшей мере 100 аминокислот, которые по меньшей мере все еще обладают антиген-связывающей способностью. Фрагмент антитела может включать связывающую область антитела, например, фрагмент Fab, фрагмент F(ab)2, мультивалентные антитела, включающие множественные домены связывания, например, двухвалентные антитела, трехвалентные антитела или четырехвалентные антитела, однодоменные антитела или амфитела. Вариант антитела является производным антитела или фрагмента антитела, обладающего той же связывающей функцией, но, например, измененную аминокислотную последовательность. Указанное антитело и/или фрагмент антитела может включать легкую цепь грызунов, легкую цепь человека, гуманизированную легкую цепь, тяжелую цепь человека и/или тяжелую цепь грызунов, а также их действующие фрагменты или производные. Поэтому вариант антитела может быть вариантом грызуна, человека, химерным или гуманизированным.
Настоящее изобретение также предусматривает способы получения целевого полипептида, причем указанные способы включают культивирование по меньшей мере одной клетки-хозяина, включающей нуклеиновую кислоту вектора по настоящему изобретению в среде для культивирования клеток в условиях, допускающих экспрессию указанного целевого полипептида.
На следующей стадии указанный полипептид может быть выделен/собран из культуры клеток. Экспрессированный целевой полипептид может быть получен путем разрушения клеток-хозяев. Полипептиды также могут быть экспрессированы, например, секретированы в культуральную среду и могут быть из нее выделены. Также возможны комбинации соответствующих способов. Следовательно, продукты, в частности полипептиды, могут быть эффективно выработаны и получены/выделены с высоким выходом. Полученный полипептид также может быть субъектом последующих стадий переработки, например, стадий очистки и/или модификаций для получения целевого продукта в желаемом количестве.
По одному из других вариантов указанный целевой полипептид секретируется в среду для культивирования клеток, и, следовательно, его выделяют из культуральной среды клеток. Полипептидом предпочтительно является молекула иммуноглобулина, например, антитело или его функциональный фрагмент. Для индукции секреции целевого полипептида может применяться лидерная последовательность. Предпочтительно используют лидерную последовательность молекулы иммуноглобулина.
Вектор экспрессии по настоящему изобретению, а также соответствующие клетки-хозяева и целевые полипептиды, подробно описаны выше.
Способ получения целевого полипептида может включать по меньшей мере одну из следующих стадий:
- выделения целевого полипептида из указанной культуральной клеточной среды и/или из указанных клеток-хозяев; и/или
- процессинг выделенного целевого полипептида.
Целевой полипептид по настоящему изобретению может быть восстановлен, затем очищен, выделен и/или модифицирован способами, известными в данной области. Например, продукт может быть восстановлен из питательной среды традиционными способами, включая, но ими не ограничиваясь, центрифугирование, фильтрацию, ультрафильтрацию, экстракцию или преципитацию. Очистка может проводиться по разным методикам, известным в данной области, включая, но ими не ограничиваясь, хроматографию (например, ионообменную, аффинную, гидрофобную, хроматофокусирование и эксклюзионную хроматографию), методики электрофореза (например, препаративного изоэлектрофокусирования), дифференциальное растворение (например, осаждение сульфатом аммония) или экстракцию.
По одному из вариантов осуществления настоящего изобретения, которое особенно предпочтительно для получения фармацевтических белков/пептидов, клетки-хозяева культивируют в суспензии в условиях без сыворотки. Полученный полипептид может затем быть очищен, например, очисткой полипептидов, имеющихся в супернатанте культуры клеток, хроматографическими способами (например, аффинной очисткой).
Полипептиды, полученные по способу настоящего изобретения, демонстрируют хорошую стабильность. Эти результаты также показывают, что полипептиды экспрессируются в функциональной форме и, следовательно, в правильной конформации. Таким образом, настоящее изобретение также предусматривает полипептиды, полученные способом по настоящему изобретению, используя вектор экспрессии, подробно описанный выше. Выше отмечено, что полипептиды получают с высоким выходом. Полипептид предпочтительно является молекулой иммуноглобулина, например, антителом или его функциональным фрагментом.
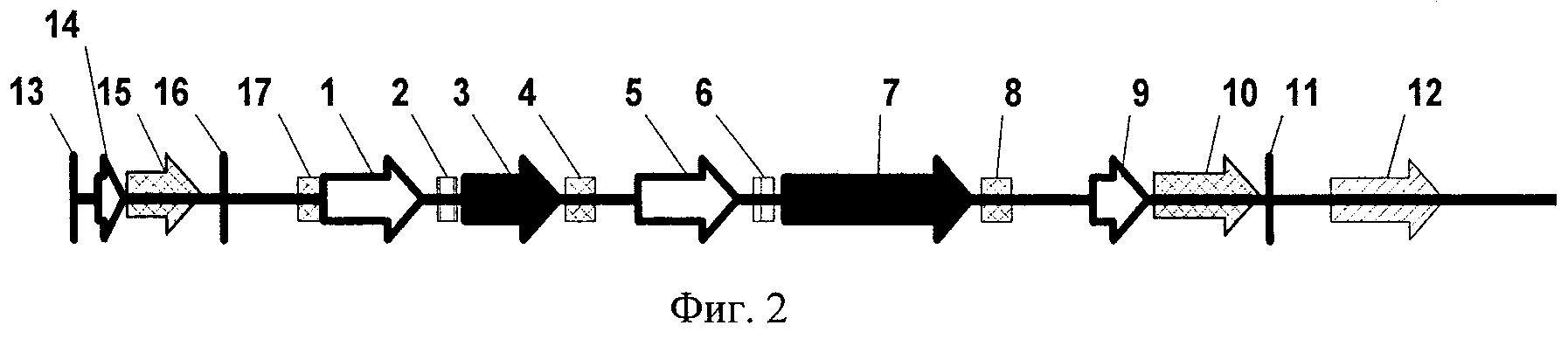
Фиг.1 показывает кольцевую нуклеиновую кислоту вектора по предпочтительному варианту осуществления настоящего изобретения.
Фиг.2 показывает линеаризованную версию нуклеиновой кислоты вектора по фиг.1 для демонстрации влияния положения сайта рестрикции для линеаризации.
Номера с 1 по 17 на фиг.1 и 2 показывают генетические элементы/свойства нуклеиновой кислоты вектора, которые подробно описаны в представленной далее табл.1. Если не указано иначе, белые стрелки показывают элементы промоторов или промоторов/энхансеров; заштрихованные рамки описывают элементы интронов, черные стрелки обозначают полинуклеотиды для экспрессии целевого полипептида; рамки с двойной штриховкой обозначают сайт полиА; стрелки с двойной штриховкой обозначают кассеты экспрессии (MSM) и (MASM) генов маркеров млекопитающих; заштрихованные стрелки обозначают прокариотический ген селективного маркера. Из фигуры следует, что все генетические элементы расположены в той же ориентации от 5' к 3' (указанная направлением стрелок). Соответственно построены нуклеиновые кислоты векторов pBW147, pBW154 и pBW160, подробно описанных ниже.
|
Далее приводятся соответствующие примеры элементов описанного вектора, однако они не являются ограничительными для настоящего изобретения.
В качестве амплифицируемого селективного маркера млекопитающих предпочтительно применение DHFR. Соответствующий пример полинуклеотида дикого типа DHFR мыши представлен в виде последовательности Seq. ID No.5, который предпочтительно используют в связи с DHFR клетками-хозяевами. Соответствующая мутантная форма DHFR представлена в виде последовательности Seq. ID No.6. Соответствующую мутантную форму предпочтительно используют вместе с DHFR клетками. Seq. ID No.12 представляет мутантную DHFR, включающую интрон, применимую для дальнейшего повышения селективного давления (см. выше). Также можно применять функциональные варианты или фрагменты указанных выше соединений.
В качестве гена селективного маркера млекопитающих предпочтительно использовать ген neo. Соответствующая последовательность предусмотрена with Seq. ID No.7. Кроме того, могут применяться ее функциональные варианты или фрагменты.
В качестве последовательности промотора для индукции экспрессии целевого полипептида предпочтительно применение промотора ЦМВ. Предусмотрена соответствующая последовательность Seq. ID No.8. Также могут применяться ее функциональные варианты или фрагменты.
В качестве последовательности промотора для индукции экспрессии генов селективного маркера MSM и MASM предпочтительно применение промотора SV40. Предусмотрена соответствующая последовательность Seq. ID No.9. Также могут применяться ее функциональные варианты или фрагменты.
В качестве последовательности полиаденилирования для целевых полипептидов и/или MASM может применяться сайт полиА вируса SV40. Соответствующая последовательность показана в виде Seq. ID No.10. Также могут применяться ее функциональные варианты или фрагменты или ее вариант в обратной ориентации (поздний или ранний полиА сайт SV40).
Может применяться последовательность интрона для кассеты экспрессии (POI), кодирующей целевой полипептид Rk-интрона. Соответствующая последовательность предусмотрена в виде Seq. ID No.11. Также могут применяться его функциональные варианты или фрагменты.
Синтетический сайт полиаденилирования, который может применяться, например, вместе с селективным маркером млекопитающих (MSM), показан в виде последовательности Seq. ID No.13. Также могут применяться его функциональные варианты или фрагменты.
Соответствующим бактериальным селективным маркером (PSM) является, например, ген бета-лактамазы, который обеспечивает устойчивость к ампициллину. Предусмотрена соответствующая последовательность Seq. ID No.14. Также могут применяться его функциональные варианты или фрагменты.
Кроме того, нуклеиновая кислота вектора может включать по меньшей мере один сайт множественного клонирования (MCS) для инсерции, например, полинуклеотида, кодирующего целевой полипептид. Может быть получен MCS 3' и 5' полинуклеотида, кодирующего целевой полипептид. Соответствующие сайты MCS представлены в виде Seq. ID No.4 (последовательность предпочтительно расположена по 5' сайту/области) и Seq. ID No.15 (последовательность предпочтительно расположена по 3' сайту/области). Сайты MCS могут применяться, например, для интродукции полинуклеотида, кодирующего целевой полипептид.
Нуклеиновые кислоты особенно предпочтительных векторов показаны в виде последовательностей Seq. ID No.1 (включающей ген DHFR дикого типа, указанный вектор особенно применим для DHFR' системы) и Seq. ID No.16 (включающей мутантный ген DHFR, указанный вектор особенно применим для DHFR системы).
Все цитируемые работы представлены в виде ссылок и таким образом представляют часть настоящего описания.
Примеры
Настоящее изобретение ниже поясняется примерами, которые не ограничивают его области охвата, однако представляют предпочтительные варианты его осуществления.
I. Способы культивирования клеток и трансфекция
Соответствующие методы трансфекции и культивирования клеток-хозяев по настоящему изобретению для экспрессии целевого полипептида описаны с помощью примеров.
Пример 1. Культивирование клеток
Клетки СНО культивируют в соответствующей среде СНО, например, ExCell81134 (получены от фирмы SAFC Biosciences). Клетки пересевают 2-3 раза в неделю в свежую среду и поддерживают на стадии логарифмического роста на протяжении исследования.
Пример 2. Стратегия трансфекции
Для трансфекции используют родительские клетки СНО в экспоненциальной фазе роста с выживаемостью более 90%. Трансфекции проводят методом липофекции, используя реагент DMRIE-C по инструкциям производителя (фирма Invitrogen). Количество клеток доводят до величины 1×106 клеток в среде OptiMEM I (фирма Invitrogen). Для липофекции 2 мкг или 4 мкг вектора экспрессии и 4 мкл реагента DMRIE-C перемешивают в течение 28 мин при комнатной температуре и добавляют к клеткам в течение 4 ч при 37°С. Затем клетки разводят до величины 2×105 клеток/мл культуральной среды и инкубируют в течение 2 суток при 37°С и 5% СО2.
Пример 3. Отбор по неомицину и амплификация гена
Неомициновый селективный маркер, расположенный в нуклеиновой кислоте вектора экспрессии, позволяет отбирать по устойчивости к G418. Для отбора трансфектантов клетки культивируют в присутствии 0,8 мг/мл G418 (фирма Invitrogen) примерно в течение двух недель. Через две недели после трансфекции и отбора по G418, появляется совокупность популяций, включающих преимущественно клетки с устойчивостью к антибиотику G418. Клетки затем культивируют в отсутствии нуклеотидов в течение примерно двух недель. Амплификацию гена затем инициируют дополнением 20 нМ МТ к культуральной среде. Через три недели культивирования получают совокупность амплифицируемых гетерогенных клеток. Маркер DHFR (дигидрофалатредуктазы) селекции/амплификации допускает амплификацию гена DHFR, а также трансгена, добавлением аналога фолиевой кислоты метотрексата (МТ) в культуральные среды, получая повышенные титры совокупности клеток в результате трансфекции. После критического выделения совокупности клеток подвергают второй и третьей стадии амплификации, используя повышенную концентрацию МТ, каждую в течение примерно двух недель (100 нМ и 500 нМ МТ). На каждой стадии клетки замораживают после выделения совокупности клеток.
Пример 4. Создание линий клоновых клеток
Для получения линии клонированных клеток (т.е. линии клеток, происходящей из единственной клетки), совокупность стабильно трансфецированных клеток может быть разведена и высеяна в 96-луночные планшеты с плотностью клеток 0,3-0,5 клеток на лунку (предельное разведение). Клетки, формирующие отдельные колонии, размножают, используя стандартные методы. В конечном счете, отдельные клоны оценивают по экспрессии рекомбинантного полипептида, причем после культивирования и анализа оставляют продуцентов с наивысшими уровнями. Из таких клеток-кандидатов выбирают для получения рекомбинантного белка линию клеток с соответствующим ростом и продуктивностью. Уровень продуктивности может быть дополнительно улучшен выбором/адаптацией условий культивирования, т.е. внесением добавок, например, пептонов.
II. Конструкции векторов
Осуществимы несколько сборок векторов по способам настоящего изобретения. Поскольку отдельные элементы вектора известны в предшествующем уровне техники, соответствующие векторы могут быть собраны, например, секвенированием или амплификацией и соответствующего клонирования основных генетических элементов и кассет экспрессии в нужной ориентации. Соответствующие способы клонирования описаны в данной области, а также последовательности генетических элементов, описанных выше, известны в предшествующем уровне техники. Впоследствии выработку нескольких векторных конструкций описывают с помощью примера. Однако, специалистам в данной области известно, что некоторые другие варианты осуществления и способы получения соответствующих векторов могут применяться и легко доступны.
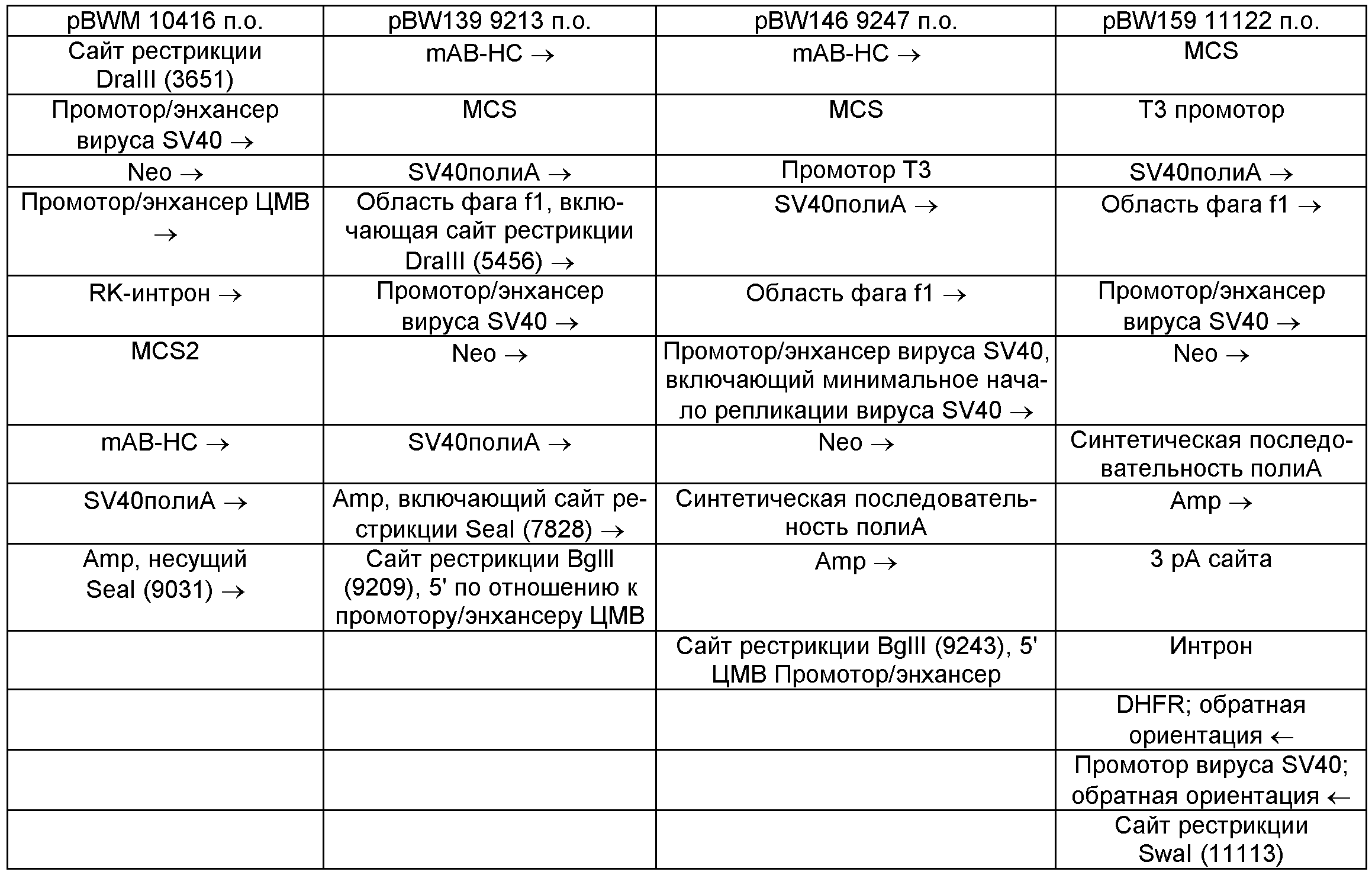
Для облегчения понимания сборки конструкций вектора, описанных в настоящем изобретении с помощью примеров, и их векторов-предшественников, предусмотрены таблицы 1 и 2, в которых приводят основные генетические элементы, включенные в эти векторы, их порядок и ориентацию. Безусловно, показаны только основные элементы, но векторы могут, однако, включать дополнительные генетические элементы или каркасные последовательности. Каждая колонка в таблице представляет одну конструкцию вектора. С верхнего ряда до нижнего перечислены генетические элементы кассет экспрессии в порядке их расположения и указана их ориентация в векторе. Если описанные векторы кольцевые, элемент, показанный в последнем ряду каждой колонки соседствует с генетическим элементом из первого ряда (безусловно, могут присутствовать опорные элементы последовательностей). Ориентация каждого генетического элемента показана стрелами. Наконечники стрелок указывают в направлении 3' соответствующего генетического элемента.

|
Аббревиатуры, приведенные выше в табл.1-3 и на фиг.1 и 2, имеют общепризнанные значения, известные специалистам в данной области и описанные выше:
MCS = сайт множественного клонирования
mAB-HC = тяжелая цепь моноклонального антитела (monoclonal antibody heavy chain)
mAB-LC = легкая цепь моноклонального антитела (monoclonal antibody light chain)
интрон = см. Grillari и др., Biotechnol. 87, 3, 2001, сс.59-65
Пример 5. Конструкция вектора экспрессии pBW147
В указанной конструкции исследуют тандемную конфигурацию генов mAB и DHFR* (мутантаый вариант, имеющий пониженную чувствительность к МТ по сравнению с DHFR дикого типа) скомбинированы с bgh рА-сайтом. Кассету DHFR* помещают в направлении 5' перед кассетой экспрессии (POI), включающей mAB-LC таким образом, что все открытые рамки считывания помещены в одном направлении считывания. Сборка pBW147 показана в табл.3.
Вектор pBW147 может быть сконструирован из pBW133 (см. ссылку к табл.2). Конструкция pBW147 описана в настоящем изобретении.
Конструкция pBW133
Конструкции векторов, описанные ниже, основаны на коммерчески доступном векторе экспрессии pCI-neo (фирма Promega Cooperation, США). Полная последовательность ДНК общедоступна (фирма GenBank/EMBL, номер в каталоге: U47120). Новый сайт множественного клонирования интродуцируют в pCIneo.
Две цепи сайта множественного клонирования синтезируют de novo. pCIneo разрезают ферментами NheI и XmaI. Старый сайт MCS удаляют гель-электрофорезом. Новый сайт множественного клонирования синтезируют таким образом, что концевые 4 нуклеотида с 5' конца антисмысловой цепи и 3' конец of верхней цепи не синтезируется. После выравнивания обеих цепей создают совместимые концы NheI и XmaI.
Последовательность нового сайта множественного клонирования следующая (см. Seq. ID No. 2):
|
Получаемая плазмида в результате лигирования вектора pCIneo с новым сайтом MCS обозначают pCI-neo-2 для целей настоящего описания. Вектор pCI-пео-2 дополнительно модифицируют путем интродукции pRK интрона из вектора pRK5 (фирма BD PharMingen). Поэтому pCI-neo-2 расщепляют ферментом ApaI. Тупые концы создают обработкой полимеразой Т4. Затем плазмиду расщепляют ферментом NdeI. pRK5 расщепляют ферментами NdeI и NruI (резчики тупых кнцов). фрагмент, содержащий RK-интрон, выделен и лигирован с основой вектора pCIneo2. Получаемой плазмидой является плазмида pCIneo2RK.
Для привнесения обеих кассет экспрессии в один вектор, может быть получен вектор pCIneoDGFR*-RK. Вектор pCIneoDGFR*-RK получают следующим образом:
Кассету экспрессии DHFR* амплифицируют методом ПЦР из вектора pCHI-LC (Simulect SP2/0 вектор экспрессии легкой цепи). Праймерами являются ВВ35 (GGGCACTACGTGCCGCGGATTTAAATGCGGCCGCATATGGTGCACT - Seq. ID No.3) и ВВ36 (GGGCACGTAGTGTTTATTAGGGGAGCAGAGAACTTGAA - Seq. ID No.4).
ПЦР-фрагмент клонируют в pCIneoRK через рестрикционное расщепление DraIII, получая вектор pCIneoDHFR*-RK. Вектор pCIneoDHFR*-RK раскрывают расщеплением ферментом Есо01091. Для получения тупых концов затем обрабатывают ферментом Кленова.
КассетЕ экспрессии из pCIneo2RK вырезают путем расщепления плазмиды ферментами BglII, NgoMIV и StuI. После лигирования двух фрагментов создают «пустой» вектор экспрессии pCHO2neoN. В вектор pCHO2neoN инсертируют ген легкой цепи антитела по сайту рестрикции MluI и SalI, тем самым создавая конструкцию вектора, обозначаемого pBW108. Поэтому ген антитела амплифицируют, используя праймеры, которые содержат два сайта рестрикции.
Тяжелую цепь mAB инсертируют в pBW108 через расщепление PmeI и AscI вектора, тем самым получая векторную конструкцию, называемую вектором pBW111 для целей описания. Тяжелую цепь амплифицируют методом ПЦР с 5'-конца, получая тупые концы и 3'-конец гена, содержащего сайт рестрикции AscI.
В pBW111 нетранслируемую область 5'-конца легкой цепи заменяют, поскольку дополнительный кодон ATG присутствует перед легкой цепью кДНК. Это достигается путем исключения BglII/MluI фрагмента из pBW111 и его замещения на скорректированный фрагмент. Новая плазмида обозначается pBW133. Вектор pBW133 представляет первый вектор со всеми генами на плазмиде. Сборка генов следующая: LC - DHFR (противоположное направление) - neo - НС (см. также табл.2). Этот вектор является одним из исходных материалов, которые могут применяться для получения векторов по методам настоящего изобретения. Однако, очевидно, что имеется несколько других способов получения соответствующих векторов.
Конструкция pBW139
Вторая векторная конструкция, которую можно использовать для получения pBW147, имеет конфигурацию pBW139. pBW139 может быть создана из pBW115. Для конструкции pBW115 ген тяжелой цепи клонируют в pCIneoRK. (см. выше). Для этого pCIneoRK расщепляют ферментами MluI и NruI (резчики тупых концов), причем ПЦР-фрагмент тяжелой цепи расщепляют с помощью фермента Asci. (3') (совместимого с MluI) и получают тупой конец 5'. Полученную плазмиду обозначают «pBW115».
Вектор pBW115 расщепляют ферментами ScaI и BglII. Затем вносят фермент Klenow для получения тупых концов. Кассету экспрессии иссекают из pBW133 ферментами Seal и DraIII. Для получения тупых концов обрабатывают Т4-ДНК-полимеразой. В результате лигирования получают вектор с конфигурацией типа вектора pBW139 (см. табл.2).
Сборка pBW147
Для получения pBW147, pBW133 расщепляют ферментами SpeI, XhoI. Фрагмент, содержащий части промотора ЦМВ и первую часть тяжелой цепи выделяют и лигируют в pBW139, который также разрезают ферментами SpeI, XhoI. Установлено, что в получаемом векторе кассета тяжелой цепи не имеет разрушения дополнительного кодона ATG. Чтобы вернуть легкую цепь в вектор, pBW139 расщепляют ферментом SpeI. Содержащий LC фрагмент инсертируют в pBW148, который раскрывают ферментом SpeI. Получаемая плазмида имеет конфигурацию типа вектора pBW146 (см. табл.2).
В pBW146 ген DHFR инсертирован из pBW112 (вектор экспрессии из другого проекта). Однако ген DHFR также может быть получен из другого источника, в зависимости от типа желаемого варианта DHFR. Вектор pBW146 расщепляют ферментом BglII. Затем кассету DHFR амплифицируют реакцией ПЦР с праймерами, содержащими сайты рестрикции BglII и BamHI. Фрагмент ПЦР расщепляют двумя ферментами и инсертируют в соответствующий сайт BglII вектора pBW146. Получаемая плазмида имеет конфигурацию типа вектора pBW147, причем все кассеты экспрессии имеют одинаковую ориентацию. Структура показана в табл.3.
Вектор экспрессии может применяться для получения стабильных трансфекций. Для дальнейшего повышения продуктивности экспрессии может быть выбран высоко чувствительный к МТХ вариант DHFR, причем также в достаточной степени следует адаптировать к концентрации МТХ.
Пример 6. Конструкция вектора экспрессии pBW154
Для этого вектора исследуют тандемную конфигурацию генов mAB и генной кассеты DHFR из pSV2DHFR (версия DHFR дикого типа с высокой чувствительностью к МТ). Кассету экспрессии DHFR из вектора pSV2DHFR (АТСС#374146) амплифицируют методом ПЦР. Фрагмент содержит промотор и сайты полиА. По-прежнему олигонуклеотиды имеют сайты рестрикции BglII/BamHI. Кассета экспрессии DHFR инсертирована в сайт рестрикции BglII вектора pBW146, в результате получается векторная конструкция с той же структурой, что и у вектора pBW154. Структура pBW154 показана в табл.3 и может быть получена из фиг.1 и 2, которые демонстрируют общий пример векторной конструкции, имеющей соответствующую общую структуру/конфигурацию генетических элементов. Последовательность pBW154 представлена в виде Seq. ID No 1. Полинуклеотид легкой цепи маркирован буквой n (в приоритетной заявке обозначен буквой V), полинуклеотид тяжелой цепи маркирован буквой n (в приоритетной заявке обозначен буквой Y) в Seq. ID No.1. Свойства pBW154 суммированы в табл.4. Безусловно, могут применяться также другие элементы векторов, например, разные промоторы, разные энхансеры, разные сайты полиА и другие элементы, например, разные регуляторные гены oris. Кроме того, можно переключить кассеты экспрессии на легкую и тяжелую цепь молекулы иммуноглобулина. Однако показанный выбор и сборка элементов вектора предпочтительны. Согласно отмеченному выше, также могут использоваться функциональные фрагменты молекул иммуноглобулина. Таким образом, обозначение «nnn» приведено только для иллюстрирования и не показывает какого либо размера рестрикции, поскольку более короткие или более длинные последовательности иммуноглобулина могут присутствовать в соответствующем положении. Для облегчения сравнения с фиг.1 и 2, которые показывают общую конструкцию векторов по предпочтительным вариантам осуществления настоящего изобретения, приводят нумерацию соответствующих элементов на фиг.1 и 2.

Все генетические элементы расположены в той же ориентации от 5' к 3'. С помощью данной векторной конструкции, используя DHFR дикого типа, амплификация гена, описанная выше, действует весьма эффективно. Титр в стандартном эксперименте может быть повышен в 10-20 раз. В настоящем изобретении существенное повышение титра экспрессированного антитела наблюдают при амплификации МТ. Начиная с обработки G418 помимо обработки без нуклеотидов до нескольких разных концентраций МТ (20 и 100 нМ МТ), титр постоянно и существенно повышается. Однако, использование таких повышенных концентраций МТ (например, 500 нМ МТ) обычно не дает дополнительных преимуществ в клетках СНО, даже при использовании относительно высоких концентраций. Титры антител, полученные для совокупностей на протяжении процесса селекции/амплификации, варьируют от 2 до более чем 60 мг/л при использовании методов стандартного культивирования. Титры экспрессии могут быть дополнительно повышены при получении линий клональных клеток из совокупностей клеток используя специальные среды для повышения клеточной экспрессии, поскольку получаемый титр также зависит от используемой среды.
Пример 7. Конструкция вектора экспрессии pBW160
Эксперименты также показывают, что ориентация гена DHFR в векторе имеет решающее значение. В pBW146 (см. выше) имеется сайт рестрикции EcoRI. Чтобы иметь сайт EcoRI в качестве единственного сайта рестрикции в итоговом векторе экспрессии, сайт может быть удален расщеплением вектора pBW146 ферментом EcoRI, ферментом Klenow и удалением. В результате получают плазмиду с конфигурацией, подобной конфигурации pBW158 (данные не представлены). Кассета DHFR может быть интегрирована в pBW158, согласно описанному выше. Поскольку обе ориентации (ориентация подобна ориентации в векторах pBW159 и pBW160, см. табл.2 и 3) получают автоматически, обе могут быть протестированы по уровням экспрессии. Эти результаты показывают более совершенное выполнение конфигурации со всеми открытыми рамками считывания, ориентированными в одном направлении считывания от 5' к 3'.
Векторы с конфигурацией как у вектора pBW159 (см. табл.2), в котором ориентация DHFR находится в обратном порядке с генами mAB, обычно показывают только очень низкие титры экспрессии, даже после амплификации МТ (обычно менее 1 мг/л). Векторы с конструкцией как у вектора pBW160 (см. табл.3), у которых ориентация гена DHFR в рамке с генами mAB, могут обеспечить повышенные титры антител более 5 мг/л, и даже более 10, или даже более 15 мг/л (получаемые из совокупностей). К тому же путем получения линии клональных клеток и высокопродуктивных сред выходы титров могут быть дополнительно повышены при использовании конструкций векторов по настоящему изобретению.
Эти эксперименты могут показать преимущество «конфигурации в рамке» селективных маркеров и генов, кодирующих mAB, применяемых по настоящему изобретению. Этот результат поддерживает то обстоятельство, что ориентация элементов вектора от 5' к 3' представляет важный фактор для векторов высокого уровня экспрессии. Кроме того, стабильность экспрессии весьма удобна с векторами экспрессии по настоящему изобретению.
Конфигурация векторов по настоящему изобретению способна непосредственно направлять генерацию совокупности клеток с высокой специфической клеточной продуктивностью. Ключевые элементы имеют ориентацию от 5' к 3', выбранные варианты DHFR и помещение селективного маркера DHFR в вектор, а также сборка генов антитела и второй селективный маркер (neo) на плазмиде. Вектор также может применяться для получения белков или пептидов, не являющихся антителами. Согласно описанному выше, при незначительных адаптациях кассеты DHFR эта система также применима для генной амплификации в DHFR-положительной линии клеток CHO-K1PD. Для амплификации гена в DHFR+ клетках-хозяевах используют мутантную версию гена DHFR (см. выше). Вектор кассеты экспрессии полного DHFR expression, включающего мутантную версию гена DHFR, например, pBW117, может быть амплифицирован методом ПЦР с праймерами, инкорпорированными в сайт BamHI. Этот вектор затем клонируют по сайту BglII вектора pBW158 с формированием вектора pBW165. С векторами, имеющими конфигурацию, например, типа pBW165, включающими мутантный ген DHFR (и затем с другими антителами), высокопродуктивные линии клеток могут быть получены в клетках-хозяевах CHO-K1-PD, которые являются DHFR+ линией клеток. Пример соответствующей последовательности вектора предусмотрен в виде последовательности Seq. ID No.16. Безусловно могут применяться также другие элементы векторов помимо перечисленных, например, разные промоторы, разные энхансеры, разные сайты полиА и/или другие элементы, например, различные регуляторные гены oris. Кроме того, можно переключить кассеты экспрессии на легкую и тяжелую цепь молекулы иммуноглобулина. Однако, показанная селекция и сборка элементов вектора предпочтительна. Согласно указанному выше, молекулы иммуноглобулина полной длины, а также функциональные фрагменты молекул иммуноглобулина, могут экспрессироваться с вектора. В Seq. ID No.16 единственный сайт обозначен сайтом инсерции, где соответствующая последовательность иммуноглобулина может быть локализована/инсертирована в итоговый вектор экспрессии. Какие-либо последовательности иммуноглобулина могут присутствовать в соответствующем положении. Кроме того, согласно указанному выше, также можно экспрессировать разные целевые полипептиды.
Пример 8. Выработка в небольшом количестве антител с помощью трансфецированных клеток СНО
Для тестирования в культурах суспензий клеток клетки засевают в количестве 1×105 клеток/мл в 50 мл среды ExCell81134 (фирма SAFC Biosciences) в круглодонные колбы объемом 250 мл с фильтрующим колпачком. Клетки встряхивают с частотой 65 об/мин в шейкере Klihner ISF-4-W/инкубаторе при 37°С в атмосфере 10% СО2 на протяжении исследования. Отдельное питание патентованными растворами подают по схеме фиксированной подачи питания, начиная с 4-х суток размножения клеток. На 13-е сутки отбирают по 1 мл образцов и определяют титры, используя стандартные методы ВЭЖХ и колонку с белком А. Супернатанты культур клеток из качалочных колб с культурами лучших клонов очищают колоночной хроматографией с белком А.
Пример 9. Очистка экспрессированного антитела с применением белка А
Для очистки с белком А примерно 27 мл супернатанта без клеток, содержащего примерно 32,4 мг антитела, загружают в аффинную колонку размером 0,5×10 см MabSelect. После загрузки колонку интенсивно ополаскивают и промывают. Затем антитело элюируют при рН 3-4. Элюат анализируют стандартным методом ВЭЖХ, используя колонку с белком А. Получают примерно 30,5 мг антитела.
III. Примеры продуктивности конкретных клеток и выход продукта
Клоны, отобранные после размножения клонов, исследуют по уровню продуктивности.
Пример 10. Экспрессия IgG1 антитела
Экспрессируют антитело IgG1. Клоны выращивают в коммерческой среде Ex-Cell81134 (фирма SAFC Biosciences). Добавляют питательные растворы и традиционные добавки, например, пептон. Высокая продуктивность может быть достигнута при использовании вектора по настоящему изобретению:
|
Пример 11. Экспрессия IgG1 антитела и IgG4 антитела
Экспрессируют антитело IgG1 и антитело IgG4. Клоны выращивают в соответствующей культуральной среде. Добавляют питательные растворы и традиционные добавки, например, пептон. Высокая продуктивность может быть достигнута при использовании вектора по настоящему изобретению:
|
Пример 12. Выработка в большом количестве полипептидов с помощью трансфецированных клеток СНО
Получение больших количеств полипептидов может быть проведено, например, в стеклянных или из нержавеющей стали биореакторах фирмы Wave. Для этой цели клетки размножают, обычно начиная с одной замороженной ампулы, например, ампулы от фирмы Master Cell Bank. Клетки оттаивают и размножают в несколько стадий. Биореакторы разного объема инокулируют соответствующими количествами клеток. Плотность клеток может быть повышена добавлением питательных растворов и добавок в биореактор. Клетки хранят в высокой степени жизнеспособными на протяжении продолжительного времени. Титры продуктов в реакторе варьируют от нескольких сотен миллиграмм на литр до нескольких грамм на литр, получаемых в большом масштабе. Очистка может проводиться стандартными методами хроматографии, которые могут включать стадии аффинной, ионообменной, гидрофобного взаимодействия или эксклюзионной хроматографии. Размер биореактора может быть увеличен до нескольких тысяч литров на конечной стадии (также см., например, F. Wurm, Nature Biotechnology 22, 11, 2004, сс.1393-1398).
Пример 13. Стратегия клонирования для интродукции генов новых антител в векторы
Одна из стратегий, наряду с другими, по инсерции новых целевых полипептидов, следующая (объясняемая с помощью примера, используя вектор с конфигурацией как у pBW154):
Клонирование гена легкой цепи
Ген легкой цепи может быть амплифицирован методом ПЦР с праймерами, интродуцируя сайт MluI в направлении 5' кодона ATG и сайта Sail в направлении 3' гена. Продукт ПЦР внедряют в pBW154 через указанные два фермента рестрикции. Это приводит к промежуточному вектору, включающему именно легкую цепь.
Клонирование гена тяжелой цепи
Ген тяжелой цепи может быть амплифицирован методом ПЦР с праймерами, интродуцируя тупой конец для применения векторного сайта NruI 5' кодона ATG и XbaI 3' и сайта гена. Продукт ПЦР внедряют в pBW154 через указанные два фермента рестрикции. Это приводит к промежуточному вектору со старой легкой цепью и новой тяжелой цепью.
Конечная сборка вектора
Новый содержащий mAB-НС фрагмент вырезают из вектора НС через расщепление ферментом SalI. Затем его инсертируют в LC-промежуточный вектор через SalI для получения в итоге нового вектора LC-HC.