Результат интеллектуальной деятельности: СПОСОБ ГРАНУЛЯЦИИ ИЗ РАСПЛАВА
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к способу получения твердых лекарственных форм для перорального введения, содержащих в качестве лекарственного средства соединение хинолина. Признаком указанного способа является применение грануляции из расплава в экструдере. Такие твердые лекарственные формы для перорального введения можно использовать для лечения и профилактики пролиферативных заболеваний, включая рак.
Предпосылки создания изобретения
Краткое изложение сущности изобретения
Настоящее изобретение относится к фармацевтическому способу грануляции, который позволяет превращать нежелательные полиморфные модификации или смесь различных физических форм активного фармацевтического ингредиента в требуемую форму и обеспечить присутствие только требуемой формы в лекарственном продукте. В случае лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она при получении клинически требуемой безводной формы наблюдается образование моногидрата в качестве примеси, который характеризуется более низкой растворимостью. Однако, моногидрат может полностью и необратимо превращаться в безводную форму при температуре выше 140°C. В настоящем изобретении используют грануляцию из расплава при высокой температуре, что позволяет получать гранулы в чистой безводной форме, не зависимо от состава композиции исходного материала, включающего моногидрат или смесь моногидрата и безводной формы.
Подробное описание изобретения
Настоящее изобретение относится к способу получения фармацевтических композиций, прежде всего твердых лекарственных форм для перорального применения на основе соединения хинолина, прежде всего лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она. Признаком способа по изобретению является грануляция из расплава в экструдере.
Термин «фармацевтическая композиция», использованный в данном контексте, обозначает смесь, содержащую лекарственное соединение, предназначенное для введения млекопитающему, например, человеку, с целью профилактики, лечения и контроля конкретного заболевания или состояния у млекопитающего.
Термин «фармацевтически приемлемый», использованный в данном контексте, обозначает такие соединения, материалы и композиции и/или лекарственные формы, которые, в соответствии с мнением медицинского персонала, являются пригодными для контактирования с тканями млекопитающих, прежде всего человека, при отсутствии избыточной токсичности, раздражения, аллергической ответной реакции и других осложнений в соответствии с приемлемым соотношением польза/риск.
Термин «лекарственное соединение», использованный в данном контексте, обозначает любое соединение, вещество, лекарственное средство; препарат или активный ингредиент, обладающий терапевтическим или фармакологическим действием, таким как ингибирование рецепторных тирозинкиназ, и которое является пригодным для введения млекопитающим, например, человеку, в составе композиции, которая прежде всего пригодна для перорального введения. Термин «лекарственное соединение», использованный в данном контексте, включает соединения хинолина, описанные в US 6774237 и WO 2006/127926. Предпочтительным соединением является 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-он формулы (I):
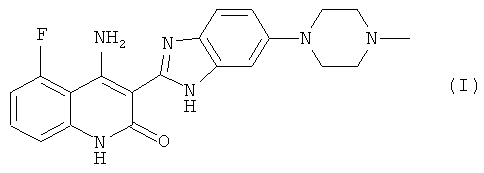
Более предпочтительным соединением является соединение формулы (I) в виде соли молочной кислоты, т.е. лактат 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она.
В WO 2006/127926 приводится информация о полиморфных формах и сольватах 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она.
Настоящее изобретение также относится к способу лечения заболевания, которое чувствительно к ингибированию рецепторных тирозинкиназ, описанных в US 6774237 и WO 2006/127926. Указанные способы включают, но не ограничиваясь только ими, ингибирование активности VEGFR2 и FGFR3, и включают стадию введения субъекту, который нуждается в таком лечении, терапевтически эффективного количества лекарственных соединений.
Термин «эксципиент для грануляции», использованный в данном контексте, обозначает любой фармацевтически приемлемый материал или соединение, которые можно подвергать грануляции из расплава в смеси с лекарственным соединением, как описано ниже. Например, эксципиент для грануляции может представлять собой полимер или неполимерный материал.
Термин «полимер», использованный в данном контексте, обозначает полимер или смесь полимеров, температура стеклования, температура размягчения или плавления которых в отдельности или в комбинации не превышает температуру плавления (или интервал температуры плавления) лекарственного соединения. Температура стеклования («Тст») представляет собой температуру, при которой происходит изменение характеристик такого полимера, например, из массы высокой вязкости образуется масса относительно более низкой вязкости. Типы полимеров включают, но не ограничиваясь только ими, водораствримые, водонабухающие, водонерастворимые полимеры и комбинации вышеперечисленных типов.
Примеры полимеров включают, но не ограничиваясь только ими,
гомополимеры и сополимеры N-виниллактамов, например гомополимеры и сополимеры N-винилпирролидона(например, поливинилпирролидон), сополимеры N-винилпирролидона и винилцетата или винилпропионата,
сложные и простые эфиры целлюлозы (например, метилцеллюлоза и этилцеллюлоза), гидроксиалкилцеллюлозы (например, гидроксипропилцеллюлоза), гидроксиалкилалкилцеллюлозы (например, гидроксипропилметилцеллюлоза), фталаты целлюлозы (например, фталат-ацетат целлюлозы и фталат гидроксилпропилметилцеллюлозы) и сукцинаты целлюлозы (например, сукцинат гидроксипропилметилцеллюлозы или сукцинат-ацетат гидроксипропилметилцеллюлозы),
высокомолекулярные полиалкиленоксиды, такие как полиэтиленоксид и полипропиленоксид и сополимеры этиленоксида и пропиленоксида,
полиакрилаты и полиметакрилаты (например, сополимеры метакриловой кислоты и этилакрилата, сополимеры метакриловой кислоты и метилметакрилата, сополимеры бутилметакрилата и 2-диметиламиноэтилметакрилата, поли(гидроксиалкилакрилаты), поли(гидроксиалкилметакрилаты)),
полиакриламиды,
полимеры винилацетата, такие как сополимеры винилацетата и кротоновой кислоты, частично гидролизованный поливинилацетат,
поливиниловый спирт, и
олиго- и полисахариды, такие как каррагинаны, галактоманнаны и ксантановая камедь, или смеси одного или более указанных полимеров.
Термин «пластификатор», использованный в данном контексте, обозначает материал, который можно включать в фармацевтическую композицию с целью понижения температуры стеклования и вязкости расплава полимера благодаря увеличению свободного объема между цепями полимера. Пластификаторами являются, но не ограничиваясь только ими, вода, сорбит, сложные эфиры лимонной кислоты (например, триэтилцитрат, триацетин), низкомолекулярные полиалкиленоксиды (например, полиэтиленгликоли, полипропиленгликоли, полиэтилен/пропиленгликоли), глицерин, пентаэритрит, моноацетат, диацетат или триацетат глицерина, пропиленгликоль, диэтилсульфосукцинат натрия, и само лекарственное вещество. Пластификатор может присутствовать в концентрации приблизительно 0-15%, например 0,5-5% в расчете на массу фармацевтической композиции. Примеры пластификаторов описаны также в справочнике The Handbook of Pharmaceutical Additives, Ash и др., Gower Publishing (2000).
Неполимерными эксципиентами для грануляции являются, но не ограничиваясь только ими, сложные эфиры, гидрированные масла, масла, природные воски, синтетические воски, углеводороды, жирные спирты, жирные кислоты, моноглицериды, диглицериды, триглицериды и их смеси.
Примеры сложных эфиров, таких как сложные эфиры глицерина, включают, но не ограничиваясь только ими, моностеарат глицерина, например, CAPMUL GMS (фирма Abitec Corp, Columbus, ОН), падьмитостеарат глицерина, ацетилированный моностеарат глицерина, моностеарат сорбита, например, ARLACEL 60 (фирма Uniqema, New Castle, Германия), цетилпальмитат, например, CUTINA СР (фирма Cognis Corp, Дюссельдорф, Германия), стеарат магния и стеарат кальция.
Примеры гидрированных масел включают, но не ограничиваясь только ими, гидрированное касторовое масло, гидрированное хлопковое масло, гидрированное соевое масло, гидрированное пальмовое масло. Пример масла включает кунжутное масло.
Примеры восков включают, но не ограничиваясь только ими, карнаубский воск, пчелиный воск и спермацетовый воск. Примеры углеводородов включают, но не ограничиваясь только ими, микрокристаллический воск и парафин, Примеры жирных спиртов, т.е. высокомолекулярных нелетучих спиртов, содержащих от приблизительно 14 до приблизительно 31 атомов углерода, включают, но не ограничиваясь только ими, цетиловый спирт, например, CRODACOL С-70 (фирма Croda Corp, Edison, NJ), стеариловый спирт, например, CRODACOL S-95 (фирма Croda Corp), лауриловый спирт, миристиловый спирт.
Примеры жирных кислот, которые могут содержать от приблизительно 10 до приблизительно 22 атомов углерода, включают, но не ограничиваясь только ими, стеариновую кислоту, например, HYSTRENE 5016 (фирма Crompton Corp., Middlebury, СТ), декановую кислоту, пальмитиновую кислоту, лауриновую кислоту и миристиновую кислоту.
Термин «грануляция из расплава», использованный в данном контексте, относится к способу обработки, который включает следующие стадии:
(а) получение смеси лекарственного вещества по крайней мере с одним эксципиентом для грануляции,
(б) грануляция смеси с использованием экструдера при нагревании смеси до температуры, которая ниже или приблизительно равна температуре плавления (интервала температуры плавления) лекарственного соединения, и
(в) охлаждение экструдата до комнатной температуры, например, при контролируемой скорости.
Нагревание и смешивание лекарственного соединения с эксципиентом для грануляции с образованием внутренней фазы в виде гранул (т.е. из экструдата) проводят в экструдере. Например, эксципиент для грануляции может присутствовать в количестве от приблизительно 1 до приблизительно 50% в расчете на массу композиции, В одном варианте эксципиент для грануляции может присутствовать в количестве от приблизительно 3 до приблизительно 25% в расчете на массу композиции. В отличие от гранул, полученных влажной грануляцией, при осуществлении способа грануляции из расплава по настоящему изобретению не требуется присутствие в ходе грануляции жидкости, например, воды, метанола, этанола, изопропанола или ацетона.
Полученные гранулы представляют собой, например, частицы лекарственного вещества, полностью или в значительной степени покрытые оболочкой из эксципиента для грануляции, или, в другом варианте, частицы лекарственного вещества, включенные полностью или в значительной мере в состав частиц эксципиента для грануляции или в смеси с ним.
В общем случае, экструдер состоит из вращающегося шнека (шнеков), установленного в неподвижном цилиндре, на одном из концов которого необязательно установлена профилирующая головка. Равномерное перемешивание материалов по всей длине шнека (например, лекарственного вещества, компонента, замедляющего скорость высвобождения, и любых других необходимых эксципиентов) обеспечивается за счет вращения шнека внутри цилиндра. Соответственно, экструдер можно разделить по крайней мере на три зоны: зона питания, зона нагрева, зона дозирования. В зоне питания исходные материалы подают в экструдер, например, из бункера. В зоне нагрева исходные материалы нагревают до температуры ниже температуры плавления лекарственного вещества. За зоной нагрева расположена зона дозирования, в которой смешанные материалы подвергают экструзии через необязательную профилирующую головку, при этом получают продукт определенной формы, например, в виде гранул или ленты. Типы экструдеров, которые прежде всего можно использовать в настоящем изобретении включают одно-, двух- и многошнековые экструдеры, которые необязательно оснащены перемешивающими лопастями.
Полученные гранулы можно перерабатывать в формы для перорального применения, например, твердые пероральные лекарственные формы, такие как таблетки, пилюли, пастилки, микротаблетки, капсулы или пакетики, при добавлении стандартных эксципиентов, которые представляют собой внешнюю фазу фармацевтической композиции. Внешняя фаза фармацевтической композиции может также содержать дополнительное лекарственное соединение. Указанными твердыми пероральными лекарственными формами являются, например, стандартные пероральные лекарственные формы. Примеры указанных эксципиентов включают, но не ограничиваясь только ими, замедлители высвобождения, пластификаторы, дезинтегрирующие агенты, связующие агенты, смазывающие вещества, скользящие вещества, стабилизирующие агенты, наполнители и разбавители. Специалист в данной области техники может выбрать один или более указанных эксципиентов в зависимости от конкретных требуемых свойств твердой пероральной лекарственной формы с использованием простых стандартных экспериментов без дополнительных затрат. Количество каждого эксципиента можно изменять в известном интервале. Методики и эксципиенты, которые используются при получения пероральных лекарственных форм, описаны в следующих публикациях, которые включены в описание заявки в качестве ссылок (см. The Handbook of Pharmaceutical Excipients, 4 изд. Ред. Rowe, American Pharmaceuticals Association (2003), Remington, the Science and Practice of Pharmacy, 20-е изд., ред. Gennaro, Lippincott Williams & Wilkins (2003).
Термин «замедлитель высвобождения», использованный в данном контексте, обозначает любой материал или соединение, которые замедляют высвобождение лекарственного соединения из фармацевтической композиции при пероральном введении. С использованием компонента, замедляющего высвобождение, можно получить различные системы с замедленным высвобождением, известные в данной области техники, например, диффузионную систему, систему на основе растворения и/или осмотическую систему. Замедлитель высвобождения может представлять собой полимер или неполимерное вещество. Фармацевтические композиции с замедленным высвобождением по настоящему изобретению могут содержать, например, по крайней мере 5% замедлителя высвобождения в расчете на массу композиции.
Примеры фармацевтически приемлемых дезинтегрирующих агентов включают, но не ограничиваясь только ими, крахмалы, целлюлозы, натриевую соль гликолята, сшитые полимеры, например, сшитый поливинилпирролидон или кросповидон, например, POLYPLASDONE XL (фирма International Specialty Products, Wayne, NJ), сшитая натриевая соль карбоксиметилцеллюлозы или натриевая соль кроскармеллозы, например AC-DI-SOL (фирма FMC), сшитая кальциевая соль карбоксиметилцеллюлозы и гуаровая камедь. Дезинтегрирующий агент может присутствовать в количестве от приблизительно 0% до приблизительно 10% в расчете на массу композиции. В одном варианте дезинтегрирующий агент присутствует в количестве от приблизительно 0,1% до приблизительно 8% в расчете на массу композиции.
Примеры фармацевтически приемлемых связующих агентов включают, но не ограничиваясь только ими, крахмалы, целлюлозы и их производные, например, микрокристаллическая целлюлоза, например AVICEL РН (фирма FMC, Philadelphia, PA), повидон, кополивидон, гидроксипропилцеллюлоза, гидроксилэтилцеллюлоза и гидроксилпропилметилцеллюлоза METHOCEL (фирма Dow Chemical Corp., Midland, MI) и желатин. Связующий агент может присутствовать в количестве от приблизительно 0% до приблизительно 50% в расчете на массу композиции, например 10-40% в расчете на массу композиции.
Примеры фармацевтически приемлемых смазывающих веществ и фармацевтически приемлемых скользящих веществ включают, но не ограничиваясь только ими, крахмалы, тальк, трехзамещенный фосфат кальция, стеарат кальция, стеариновая кислота, стеарилфумарат натрия, гидрированные масла, компритол, полиэтиленгликоль. Смазывающее вещество может присутствовать в количестве от приблизительно 0% до приблизительно 10% в расчете на массу композиции. В одном варианте смазывающее вещество может присутствовать в количестве от приблизительно 0,1% до приблизительно 1,5% в расчете на массу композиции. Скользящее вещество может присутствовать в количестве от приблизительно 0,1% до приблизительно 10% в расчете на массу композиции.
Примеры фармацевтически приемлемых наполнителей и фармацевтически приемлемых разбавителей включают, но не ограничиваясь только ими, сахар, декстраты, декстрин, декстрозу, лактозу, маннит, микрокристаллическую целлюлозу, порошковую целлюлозу, сорбит, сахарозу и тальк. Наполнитель и/или разбавитель, например, может присутствовать в количестве от приблизительно 15% до приблизительно 40% в расчете на массу композиции.
Для получения фармацевтических композиций по настоящему изобретению лекарственное соединение и эксципиент для грануляции смешивают в соотношении в интервале от 99:1 до 1:1 (в расчете на сухую массу) до или после добавления в бункер экструдера. В одном варианте соотношение лекарственного соединения и эксципиента для грануляции находится в интервале от 97:3 до 40:60 (в расчете на сухую массу). В другом варианте соотношение компонентов может находиться в интервале от 97:3 до 75:25 (в расчете на сухую массу). Необязательно во внутреннюю фазу можно добавлять пластификатор.
Смесь нагревают до температуры ниже температуры плавления лекарственного соединения. При нагревании смеси ее перемешивают шнеком (шнеками) экструдера. Смесь выдерживают при повышенной температуре и размешивают в течение времени, достаточного для получения гранулированного продукта. После прохождения смеси вдоль всей длины цилиндра экструдера, образуется гранулированный продукт (который является экструдатом), и гранулированную смесь охлаждают.
После охлаждения экструдат можно измельчить и затем просеивать через сито. Затем гранулы (которые представляют собой внутреннюю фазу фармацевтической композиции) смешивают с эксципиентами для твердой пероральной лекарственной формы (внешняя фаза лекарственной композиции), т.е. с наполнителями, связующими веществами, дезинтегрирующими агентами, смазывающими веществами и т.п. Полученную смесь можно затем перемешивать, например, в смесителе V-blender, а затем прессовать или формировать в таблетки, например, в монолитные таблетки, или смесью заполнять капсулы.
На таблетки необязательно можно наносить функциональное или нефункциональное покрытие, известное в области техники. Примеры методик нанесения покрытий включают, но не ограничиваясь только ими, сахарное покрытие, пленочное покрытие, нанесение покрытий микроинкапсулированием или прессованием. Примеры покрытий включают, но не ограничиваясь только ими, энтеросолюбильные покрытия, покрытия для замедленного высвобождения, покрытия для контролируемого высвобождения.
Эффективность всех фармацевтических композиций по настоящему изобретению можно оценивать в ходе стандартных клинических испытаний, например, при введении известных доз лекарственного средства для известных показаний, которые обеспечивают терапевтически эффективный уровень лекарственного соединения в крови, например, при введении доз в интервале 2,5-1000 мг лекарственного соединения в сутки млекопитающему массой 75 кг, например, взрослому человеку и стандартным моделям животных.
В настоящем изобретении предлагается способ лечения субъекта, страдающего от заболевания, состояния или нарушения, которое поддается лечению лекарственным соединением, причем указанный способ заключается в том, что субъекту, который нуждается в таком лечении, вводят терапевтически эффективное количество фармацевтической композиции по настоящему изобретению.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Примеры приводятся для иллюстрации способа применения настоящего изобретения на практике.
|
Ингредиенты внутренней фазы, т.е. моногидрат лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она и гидроксипропилцеллюлозу Klusel EXF (фирма Aqualon) смешивали и перемешивали в бункерном смесителе в течение приблизительно 200 оборотов. Смесь направляли в зону загрузки или в бункер двухшнекового экструдера. Пригодным двухшнековым экструдером является фармацевтический двухшнековый экструдер PRISM 16 мм (фирма Thermo Electron Corp., Waltham, Massachusetts).
На одном из концов двухшнекового экструдера расположена профилирующая головка с размером отверстия приблизительно 3 мм, Двухшнековый экструдер состоит из пяти отдельных зон или секций цилиндра, в которых можно независимо устанавливать различные параметры. По направлению от бункера к профилирующей головке, зоны в указанном порядке нагревали до следующих температур: 145°C, 145°C, 120°C, 80°C и 40°C. Скорость вращения шнека устанавливали на 150 об/мин, но можно использовать и более высокие скорости до 400 об/мин.
Экструдат или гранулы, поступающие из экструдера, охлаждали до комнатной температуры, выдерживая их в течение 15-20 мин. Затем охлажденные гранулы просеивали через сито с размером ячеек 18 меш. Охлажденные гранулы содержат безводную форму лактата 4-амино-5-фтор-3-[5-(4-метилпиперазин-1-ил)-1Н-бензимидазол-2-ил]хинолин-2(1Н)-она.
Для получения внешней фазы авицел и натриевую соль кроскармеллозы смешивали с полученными гранулами в пригодном бункерном смесителе, в течение приблизительно 200 оборотов. Стеарат магния сначала просеивали через сито с размером ячеек 30 меш. Затем стеарат магния перемешивали со смесью в течение приблизительно 60 оборотов. Конечную смесь прессовали в таблетки в стандартной ротационной машине для таблетирования (фирма Manesty Beta Press) при силе прессования в интервале от 6 кН до 40 кН или в прессе Claver, при силе прессования в интервале 5-15 кН. Получали монолитные таблетки твердость которых находится в интервале 100-400 Н, с приемлемой хрупкостью менее 1,0 мас.% после 500 падений.
Следующие таблетки получали аналогичным способом.
|
Следует понимать, что настоящее изобретение описано достаточно подробно, и настоящее описание предназначено для иллюстрации и не ограничивает объем изобретения, который определяется прилагаемыми пунктами формулы изобретения. Другие объекты, преимущества и модификации изобретения включены в объем прилагаемых пунктов формулы изобретения.

