Результат интеллектуальной деятельности: ПРОСТАМИДЫ И ИХ АНАЛОГИ, ОБЛАДАЮЩИЕ НЕЙРОЗАЩИТНЫМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
Изобретение относится к области биохимии и может найти применение в медицине при терапии ишемических поражений мозга и нейродегенеративных заболеваний путем введения веществ, обладающих нейрозащитным действием.
Нейропротекторы (син. церебропротекторы) - это лекарственные средства, которые купируют и ограничивают повреждение ткани мозга, развивающееся вследствие возникающей острой ишемии (гипоксии). В качестве нейрозащитных веществ применяют соединения различных классов как природного происхождения, так и синтезированные химическим способом. Среди таких препаратов можно отметить следующие лекарственные средства, применяемые в клинике (Виленский Б.С. (2010) Принципы доказательной медицины применительно к назначению нейропротективной терапии при ишемическом инсульте. Поликлиника. 2010. №2. С.28-32).
Церебролизин - гидролизат головного мозга молодых свиней, содержащий 85% аминокислот и 15% пептидов; молекулярная масса пептидов, входящих в состав данного препарата, не превышает 10 кДа, что обеспечивает быстрое проникновение церебролизина через гематоэнцефалический барьер.
Кортексин - препарат, содержащий комплекс левовращающих аминокислот и полипептидов с молекулярной массой от 1 до 10 кДа и сбалансированный витаминный и минеральный состав, экстрагируется из коры головного мозга телят (свиней), обладает органоспецифическим действием, свободно проникает через ГЭБ; регулирует соотношение тормозных и возбуждающих аминокислот, уровень серотонина и дофамина, обладает антиоксидантной активностью, снижает содержание антител к общему белку миелина и способствует нормализации биоэлектрической активности головного мозга.
Цитиколин - метаболический предшественник фосфолипидов, стабилизирует нейрометаболическую функцию; ведущим механизмом нейропротективной активности препарата является прерывание ведущих звеньев «ишемического каскада» и сохранность пенумбры, то есть блокада основного механизма гибели клеток и формирования неврологического дефицита.
Семакс - синтетический нейропептид, обладающий выраженным ноотропным действием; увеличивает адаптационные возможности мозга, повышает его устойчивость к стрессорным повреждениям, гипоксии и ишемии, оказывает выраженное антиоксидантное, антигипоксическое, ангиопротекторное и нейротрофическое действие.
Эти и другие препараты способны улучшить состояние пациентов с ишемическим инсультом, однако они малоэффективны при терапии других нейродегенеративных заболеваний, таких как болезни Паркинсона и Альцгеймера и др.
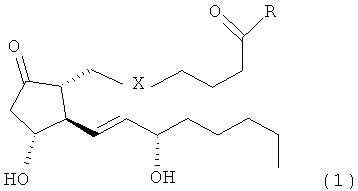
Данное изобретение решает задачу расширения номенклатуры веществ, обладающих нейрозащитным действием. Поставленная задача решается за счет использования простамидов и их аналогов, обладающих нейрозащитным действием, общей формулы:
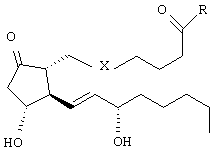
где X=CH2-CH2 или цис-CH==CH
и R - присоединенный амидной связью остаток 2-гидроксиэтиламина, или 2-нитроксиэтиламина, или глицина, или гамма-аминомасляной кислоты, или 4-гидроксифенилэтиламина (тирамина), или 3,4-дигидроксифенилэтиламина (дофамина).
Близким по структуре к заявляемым соединениям является природный простагландин E2, образующийся в организме из арахидоновой кислоты под действием ферментов циклооксигеназы и простагландин E синтазы. Простагландин E2 оказывает множественное физиологическое действие, активируя специфические рецепторы EP1, EP2, EP3 и EP4. Простагландин E2 при взаимодействии с рецептором EP2 проявляет нейрозащитные свойства (McCullough L, et al. (2004) Neuroprotective function of the PGE2 EP2 receptor in cerebral ischemia. J Neurosci 24:257-268). Однако его взаимодействие с другим подтипом рецепторов - EP1 оказывает нейротоксическое действие (Kawano Т, et al. (2006) Prostaglandin E2 EP1 receptors: downstream effectors of COX-2 neurotoxicity. Nature Med. 12:225-229), что исключает возможность использования данного соединения в качестве нейропротектора.
Простамид E2, представляющий собой этаноламид простагландина E2, является продуктом метаболизма этаноламида арахидоновой кислоты - эндогенного лиганда каннабиноидных рецепторов. В отличие от простагландина E2, простамид E2 не связывается с EP-рецепторами и его действие опосредовано еще неизвестными механизмами. Известной и хорошо документированной биологической активностью простамида E2 является его способность вызывать сокращение радужной оболочки глаза у подопытных животных (Matias J., et al. (2004) Prostaglandin Ethanolamides (Prostamides): In Vitro Pharmacology and Metabolism // J. Pharmacol. Exp. Ther. 309:745-757). Свойство простамида E2 оказывать нейрозащитное действие не было известно. Также не были описаны нейрозащитные свойства у амида простагландина E2 и гамма-аминомасляной кислоты и глицинамида простагландина E2. Амиды простагландина E2 и нитроэтаноламина, тирамина и дофамина являются новыми соединениями, обладающими нейрозащитными свойствами.
Все указанные соединения получают стандартными способами химического синтеза, включающими активацию карбоксильной группы подходящими реагентами и конденсацию с амином или спиртом. Биологическая активность заявляемых соединений подтверждена в опытах на культурах нервных клеток, подвергаемых действию различных токсических факторов, имитирующих процессы, происходящие в организме при развитии нейродегенеративных процессов. Во всех экспериментах эти соединения показывали значимый нейрозащитный эффект в диапазоне концентраций 1-20 мкМ. Кроме того, данные соединения в указанных концентрациях не оказывали токсического действия на нервные клетки в моделях первичных и линейных культур.
Таким образом, заявляемые соединения решают задачу расширения номенклатуры веществ, обладающих нейрозащитным действием, которые могут быть использованы в медицине в качестве нейропротекторов.
Изобретение иллюстрируют примеры.
Пример 1. Амид простагландина E2 и моноэтаноламина (PGE2-EA) (X=цис-CH=CH, R=2-гидроксиэтиламин). К 100 мг (0.28 ммоль) простагландина E2 в 2.5 мл ацетонитрила прибавляли 43 мкл (0.3 ммоль) триэтиламина и охлаждали в течение 15 мин до +4°С, затем прибавляли 38 мкл (0.3 ммоль) изобутилхлорформиата и перемешивали при +4°С в течение 30 мин. К полученному смешанному ангидриду прибавляли 26 мкл (0.42 ммоль) моноэтаноламина и перемешивали 30 мин. Реакционную смесь разбавляли 10 мл этилацетата, промывали водой, насыщенным водным раствором NaCl, высушивали над безводным Na2SO4. Осушитель отфильтровывали, фильтрат упаривали в вакууме, остаток очищали колоночной хроматографией на силикагеле в градиентной системе хлороформ-метанол. Фракции, содержащие продукт (контроль с помощью ТСХ), объединяли, растворитель упаривали в вакууме. Получали 71 мг PGE2-EA, выход 64%. Масс-спектр: m/z 396.113 [М+Н], 413.132 [М+H2O], 791.171 [2М+Н].
Пример 2. Амид простагландина Е2 и дофамина (PGE2-DA) (X=цис-СН=СН, R=3,4-дигидроксифенилэтиламин). К 121 мг (0.34 ммоль) простагландина Е2 в 5 мл ацетонитрила добавляли 52.2 мкл (0.377 ммоль) триэтиламина и охлаждали солью с торосом в течение 5 мин, затем добавляли 48.8 мкл (0.377 ммоль) изобутилхлорформиата. Перемешивали 20 мин, затем добавляли 78 мг (0.41 ммоль) гидрохлорида дофамина в 600 мкл ДМФА и 52 мкл (0.377 ммоль) триэтиламина и перемешивали еще 18 ч. Выпавший осадок отфильтровали, растворитель упаривали. Остаток растворяли в 10 мл этилацетата, промывали 2 н водным раствором NaHSO4, водой, насыщенным водным раствором NaCl, высушивали над безводным Na2SO4. Осушитель отфильтровывали, фильтрат упаривали в вакууме, остаток очищали колоночной хроматографией на силикагеле в градиентной системе хлороформ-метанол. Фракции, содержащие продукт (контроль с помощью ТСХ), объединяли, растворитель упаривали в вакууме. Получали 103 мг PGE2-DA, выход 61%. Масс-спектр: m/z 488.077 [М+Н], 505.096 [М+Н2О].
Пример 3. Амид простагландина Е2 и гамма-аминомасляной кислоты (GABA) (PGE2-GABA) (X=цис-СН=СН, R=гамма-аминомасляная кислота). Синтез PGE2-GABA осуществляли как описано в примере 2. Выход 79%. Масс-спектр: m/z 438.094 [М+Н], 460.021 [M+Na].
Пример 4. Амид простагландина E1 и моноэтаноламина (PGE1-EA) (X=СН2-СН2, R=2-гидроксиэтиламин). Синтез PGE1-EA осуществляли как описано в примере 1. Выход 76%. Масс-спектр: m/z 398.103 [М+Н], 415.112 [М+H2O], 793.169 [2М+Н].
Пример 5. Амид простагландина E2 и нитроэтаноламина (PGE2-NEA) (X=цис-CH=CH, R=2-нитроксиэтиламин). Синтез PGE2-NEA осуществляли как описано в примере 1. Выход 75%. Масс-спектр: m/z 396.103 [M-NO2], 441.065 [М+Н], 458.084 [М+Н2О].
Пример 6. Амид простагландина E1 и нитроэтаноламина (PGE1-NEA) (X=СН2-СН2, R=2-нитроксиэтиламин). Синтез PGE1-NEA осуществляли как описано в примере 2. Выход 74%. Масс-спектр: m/z 398.103 [M-NO2], 443.065 [М+Н], 460.084 [М+Н2О].
Пример 7. Амид простагландина E1 и дофамина (PGE1-DA) (X=CH2-CH2, R=3,4-дигидроксифенилэтиламин). Синтез PGE1-DA осуществляли как описано в примере 2. Выход 69%. Масс-спектр: m/z 490.077 [М+Н], 507.096 [М+Н2О].
Пример 8. Амид простагландина Е2 и тирамина (PGE2-ТА) (X=цис-СН=СН, R=4-гидроксифенилэтиламин). Синтез PGE2-ТА осуществляли как описано в примере 2. Выход 66.5%. Масс-спектр: m/z 472.017 [М+Н], 494.953 [M+Na].
Пример 9. Амид простагландина E1 и тирамина (PGE1-ТА) (X=СН2-СН2, R=3,4-дигидроксифенилэтиламин). Синтез PGE1-TA осуществляли как описано в примере 2. Выход 58.3%. Масс-спектр: m/z 474.017 [М+Н], 496.953 [M+Na].
Пример 10. Амид простагландина Е2 и глицина (PGE2-Gly) (X=цис-СН=СН, R=глицин). Синтез PGE2-Gly осуществляли как описано в примере 2. Выход 83%. Масс-спектр: m/z 410.106 [М+Н], 432.073 [M+Na], 448.029[M+K].
Пример 11. Амид простагландина E1 и глицина (PGE1-Gly) (X=CH2-CH2, R=глицин). Синтез PGE1-Gly осуществляли как описано в примере 2. Выход 65%. Масс-спектр: m/z 412.106 [М+Н], 434.074 [M+Na], 450.03 [M+K].
Пример 12. Амид простагландина E1 и гамма-аминомасляной кислоты (PGE1-GABA) (X=CH2-CH2, R=гамма-аминомасляная кислота). Синтез PGE1-GABA осуществляли как описано в примере 2. Выход 77%. Масс-спектр: m/z 440.096 [М+Н], 462.023 [M+Na].
Пример 13. Выделение и культивирование гранулярных нейронов мозжечка крысы.
Клетки выделяли из мозжечка 7-дневных крысят. Выделенный мозжечок освобождали от внешних оболочек, измельчали и помещали в раствор Трипсина-ЭДТА 1:250 без Са2+ и Mg2+. Инкубировали 10 мин при температуре 37°С. К полученной суспензии добавляли среду MEM (ПанЭко), содержащую 10% телячьей сыворотки, и тщательно ресуспендировали. Из суспензии клетки осаждали центрифугированием в течение 10 минут с ускорением 1000g. Клетки ресуспендировали в среде MEM с KCl (25 мМ) и 10% телячьей сыворотки; после этого клетки помещали в планшеты, предварительно обработанные полиэтиленимином, при плотности 350 тыс. клеток/см2.
Пример 14. Оценка нейропротективного действия в модели глутаматной токсичности. После культивации в течение 7 дней клетки первичной культуры гранулярных нейронов мозжечка крысы, полученной как указано в примере 10, инкубировали 15 минут в буфере (NaCl 154 мМ, KCl 25 мМ, CaCl2 3 мМ, MgCl2 2 мМ, Na2HPO4 0.4 мМ, HEPES 5 мМ, D-глюкоза 10 мМ, NaHCO3 3.6 мМ), содержащем 100 мкМ глутамата натрия. После этого к культуре добавляли растворы исследуемых веществ в кондиционированной среде. Через 3 часа оценивали количество живых клеток с помощью МТТ-теста.
Среди исследуемых соединений простамид PGE2-ЕА оказывал выраженный защитный эффект, который при концентрации 2 мкМ достигал 50% выживших клеток по сравнению с контролем, а при 5 мкМ 100%. Нитропроизводное PGE2-EA (PGE2-NEA) также защищало нейроны коры от токсического действия глутамата. Причем при концентрации PGE2-NEA 2 мкМ наблюдали выживание 90% клеток, что почти в 2 раза выше, чем при той же концентрации PGE2-EA. Производное PGE2 с глицином (PGE2-Gly) демонстрировало сходный с PGE2-ЕА профиль активности: в концентрациях 5 мкМ и 10 мкМ наблюдали 60% и 100% выживших клеток, соответственно. Активность PGE2-GABA составила 50% выживших клеток при 10 мкМ. Амид PGE2 с тирамином защищал нейроны, начиная с концентрации 2 мкМ (40% выживших клеток). При концентрации 5 мкМ наблюдалось выживание 70% клеток, при 10 мкМ - 100% выживание нейронов. Производные простагландина E1 проявляли сходную с амидами простагландина Е2 нейрозащитную активность. В контрольных экспериментах без добавления глутамата все заявляемые соединения не проявляли токсического действия вплоть до концентрации 50 мкМ.
Пример 15. Оценка нейропротективного действия веществ в модели К+ - депривации.
Модель К+ - депривации применима для гранулярных нейронов мозга, поскольку они нуждаются в повышенной концентрации ионов К+ (25 мМ). Понижение концентрации ионов К+ вызывает апоптоз в данной культуре клеток.
Первичную культуру гранулярных нейронов мозжечка крысы получали, как описано в примере 10, и культивировали в течение 7 дней. Кондиционированную среду собирали, разводили в 5 раз средой (MEM), не содержащей сыворотки. Финальная концентрация ионов К+ составляла 9 мМ, сыворотки - 2%. При таких условиях через 24 часа погибало примерно 50% клеток нейрональной культуры. Исходные растворы веществ готовили в среде с содержанием ионов К+ 9 мМ. Количество живых клеток оценивали с помощью МТТ-теста.
Простамид Е2 (PGE2-EA) проявлял выраженное защитное действие в интервале концентраций 0.1-1 мкМ (максимальный эффект 77% выживших клеток наблюдали при концентрации 1 мкМ). Нитропростамид PGE2-NEA при концентрации 1 мкМ проявлял 100% защитный эффект.
Пример 16. Оценка токсичности в культуре трансформированных глиальных клеток крысы С6.
Линия клеток глиомы крысы С6 была получена клонированем из индуцированной глиомы крысы. Клетки рассаживали в лунки 96-луночного планшета по 2×104 клеток в 100 мкл среды. Донья лунок предварительно покрывали раствором полиэтиленимина в воде (0,5 мг/мл) не менее 30 минут, после чего лунки промывали стерилизованной водой. Через 24 часа культивирования к клеткам добавляли исследуемые вещества, одна концентрация на три лунки. Исходные растворы соединений были приготовлены в среде, использующейся для культивации клеток. Содержание в среде сыворотки (10%) способствует лучшему растворению соединений липидной природы. Инкубацию с веществами проводили 48 часов. По окончании инкубации выживаемость клеток оценивали с помощью МТТ-теста.
Практически все заявляемые соединения, например амиды простагландина E2 и этаноламина (простамид Е2), нитроэтаноламина, гамма-аминомасляной кислоты и др., не проявляли цитотоксического действия вплоть до концентрации 50 мкМ. Единственным соединением, оказавшим цитотоксическое действие на клетки глиомы С6, был амид простагландина Е2 и дофамина (снижение жизнеспособности клеток на 93% при концентрации 50 мкМ), однако это вещество было нетоксично на первичных культурах нейронов мозжечка.
Средство, обладающее нейрозащитным действием, представляющее собой простамид общей формулы: ,где X=CH-CH или цис-CH=CHи R - присоединенный амидной связью остаток 2-гидроксиэтиламина, или 2-нитроксиэтиламина, или глицина, или гамма-аминомасляной кислоты, или 4-гидроксифенилэтиламина (тирамина), или 3,4-дигидроксифенилэтиламина (дофамина).