Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРЕДШЕСТВЕННИКОВ Т-КЛЕТОК
Вид РИД
Изобретение
Изобретение относится к области клеточной терапии, в частности к трансплантации гемопоэтических стволовых клеток, трансформированных или нет, а более конкретно - к восстановлению иммунитета после такой трансплантации.
Трансплантация клеток-предшественников и гемопоэтических стволовых клеток/клеток-предшественников (HSPC) считается лучшим вариантом терапии для лечения наиболее тяжелых наследственных иммунодефицитов, многих злокачественных гемопатий, а также для ряда солидных опухолей.
В настоящее время в ситуациях аллотрансплантации с частичной HLA-несовместимостью инъекции ранее кондиционированным реципиентам увеличивающихся доз отсортированных CD34+ HSPC позволяют выполнять трансплантацию донорских клеток с эффективным предотвращением болезни «трансплантат против хозяина» (ТПХ). Тем не менее для дифференцировки новых Т-лимфоцитов из инъецированных CD34+ клеток требуется как минимум 4 месяца, и число этих Т-лимфоцитов становится достаточным для того, чтобы они могли играть защитную роль против инфекций, лишь через несколько месяцев после их появления.
Эта низкая скорость восстановления иммунитета приводит к многочисленным инфекционным осложнениям, особенно вирусным, а также к рецидивам, которые влияют на долгосрочный прогноз подвергнутых трансплантации пациентов.
Кроме того, в других терапевтических протоколах используют генно-терапевтический подход, а именно аутотрансплантацию трансдуцированных HSPC, который, как было показано, эффективен в лечении некоторых наследственных иммунодефицитов. Преимущество этой стратегии перед аллогенной трансплантацией CD34+HSPC с точки зрения выживаемости и частоты осложнений, когда нет доступного HLA-совместимого донора, бесспорно. Тем не менее клинический опыт показал, что для некоторых пациентов с тяжелыми инфекциями восстановление компартмента Т-лимфоцитов происходит медленно и никогда не достигает нормального уровня циркулирующих Т-лимфоцитов. Частота осложнений и смертность, ассоциированные с этим конкретным контекстом, имеют важное значение.
Из-за высокой частоты осложнений и смертности, ассоциированных с этим типом трансплантации, разработка новых терапевтических средств для снижения периода иммунодефицита после трансплантации полностью оправдана.
В частности, важно ускорить получение Т-лимфоцитов путем введения пациенту предшественников, уже вовлеченных в путь дифференцировки Т-лимфоцитов, (предшественников Т-клеток).
Эти предшественники Т-клеток получают путем дифференцировки CD34+ HSPC, и они имеют, в частности, маркер CD7+ , который является маркером дифференцировки в пути Т-клеток. Они могут также иметь другие маркеры. Awong et al (Blood 2009; 114: 972-982) описали следующие предшественники Т-лимфоцитов: ранний тимусный предшественник (ЕТР), которые имеют маркеры (CD34+/CD45RA+/CD7+), клетки-предшественники на стадии proT1 (CD7++/CD5-), клетки-предшественники на стадии proT2 (CD7++/CD5+) и клетки на стадии preT (CD7++/CD5+ CD1a+). HSPC приобретают эти маркеры последовательно при переходе от одной стадии к другой по пути развития Т-клеток. Также известно, что у людей антиген CD1a отличает переход от совершенно незрелого тимусного предшественника к предшественнику, явно вовлеченному в Т-путь (Cavazzana-Calvo et al, MEDECINE/SCIENCES 2006; 22: 151-9).
Трансплантация предшественников Т-клеток, одновременно с трансплантацией (пересадкой) HSPC, дала бы возможность быстрого получения компартмента зрелых и функциональных Т-лимфоцитов и, таким образом, помогла бы предотвратить риск тяжелых инфекций, позволив пациенту получать пользу от некоторого иммунитета до полного восстановления иммунной системы.
Кроме того, важно иметь возможность использовать взрослые клетки, а не клетки пуповинной крови, поскольку взрослые клетки получать проще и дешевле, чем клетки пуповинной крови, и поскольку взрослые клетки чаще используют в аллотрансплантации.
Тем не менее данные, опубликованные в литературе, полученные на людях и мышах, показывают принципиальныен различия между гемопоэтическими клетками плода (включая пуповинную кровь) и клетками взрослых. Эти различия относятся к выживаемости, способности восстанавливать повреждение ДНК, пролиферативной способности и способности дифференцироваться (см., например, Yuan et al., (2012 Mar 9; 335 (6073): 1195-200), где говорится о меньшей эффективности клеток костного мозга взрослых по сравнению с клетками плода, с точки зрения их способности генерировать различные типы клеток: Lansdorp et al. (J Exp Med 1993 Sep 1; 178 (3): 787-91); Szilvassy et al. (Blood, 2001 Oct. 1, 98 (7): 2108-15), Frassoni et al. (Blood, 2003 Aug. 1, 102 (3): 1138-41), Liang et al. 106 (4): 1479-87), Six et al. (J Exp Med 2007 Dec 24, 204 (13): 3085-93)).
В WO 2016/055396 описано, что возможно получать предшественники Т-клеток путем культивирования CD34+ клеток в присутствии иммобилизованного лиганда Notch (в частности, растворимого домена дельта-подобного лиганда, слитого с Fc- областью белка IgG) и фрагмента фибронектина, содержащего домены RGDS (SEQ ID NO: 3, аргинин-глицин-аспартат-серин) и CS-1, а также гепаринсвязывающий домен (в частности, в присутствии Ретронектина®). Используемый лиганд Notch может обозначаться DL4/FC.
Следует отметить, что этот документ раскрывает, что присутствие как иммобилизованного лиганда Notch, так и фибронектина позволяет увеличить генерацию предшественников Т-лимфоцитов (CD7+ клеток), что уже является улучшением в данной области, но этот процент CD7+ CD34- клеток остается довольно низким, как показано на Фигуре 3 в WO 2016/055396. Однако интересно и особенно важно увеличить этот процент, чтобы иметь возможность вводить большее количество предшественника пациенту, нуждающемуся в этом. С другой стороны, также важно, чтобы клетки оставались на ранней стадии дифференцировки, чтобы они могли обеспечить надлежащий иммунитет.
Следует помнить, что белки Notch являются трансмембранными рецепторами, которые регулируют клеточный ответ на большое количество сигналов окружающей среды. У млекопитающих были описаны четыре рецептора Notch (Notch 1-4) и пять лигандов (дельта-подобный-1, 3 и 4, Jagged1, Jagged2) (Weinmaster Curr Opin Genet Dev 2000: 10: 363-369).
Дельта-подобный лиганд 4 может обозначаться как:
(ii) Дельта-подобный лиганд 4 (соответствующий названию гена DLL4)
(iii) Дельта-подобный-4 или дельта-лиганд 4 (сокращение DL-4).
В настоящей заявке дельта-подобный-1 и дельта-подобный-4 лиганд Notch могут обозначаться соответственно DL1 и DL4 или DL-1 и DL-4. Последовательности лигандов DL-1 и DL-4 приведены как SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
В работе Ohishi et al. (BLOOD, vol. 98, №5, 2001, p. 1402-1407) описано влияние передачи сигналов Notch на дифференцировку моноцитов в макрофаги и дендритные клетки. Клетки моноцитов, использованные в экспериментах, раскрытых в этом документе, представляли собой либо моноциты периферической крови, очищенные путем отрицательного отбора, либо моноциты, полученные после дифференцировки in vitro стволовых CD34+ клеток. Таким образом, клетки, используемые в этом документе, вступили на путь дифференцировки моноцитов/макрофагов/дендритных клеток, потеряли маркер CD34 (который является маркером гемопоэтических стволовых клеток) и презентируют маркер CD14. Эти клетки культивируют в присутствии внеклеточного домена дельта-1 и ГМ-КСФ, ФНО-альфа (который используется для индукции дифференцировки клеток CD1a-CD14+ , полученных из CD34+ клеток, в дендритные клетки). В этой работе не используются CD34+ клетки в присутствии лиганда Notch и ФНО-альфа, и она не относится к получению предшественников Т-клеток (предшественников Т-лимфоцитов CD7+).
В работе SHUKLA et al. (NATURE METHODS, vol. 14, no. 5, 2017, 531-538) и в WO 2017/173551 раскрыт способ получения Т-клеток-предшественников из стволовых клеток и/или клеток-предшественников, включающий воздействие на стволовые клетки и/или клетки-предшественники лигандом Notch, дельта-подобным-4 (DL4) и молекулой адгезии сосудистого эндотелия 1 (VCAM-1).
Способ, описанный в настоящей заявке, позволяет осуществить получение и увеличение числа (пролиферацию) предшественников CD7+ Т-лимфоцитов из стволовых CD34+ клеток без использования клеточной стромы (что нелегко представить себе в клиническом контексте). Кроме того, этот способ адаптирован, в частности, для осуществления с CD34+ клетками, полученными от взрослых доноров.
Кроме того, клетки, полученные с помощью описанного в настоящем документе способа, содержат маркер Bcl11b, который является важным фактором транскрипции, включаемым исключительно после коммитирования Т-клеток (Kueh et al., 2016, Nat Immunol. 2016 Aug;17(8):956-65. doi: 10.1038/ni.3514).
Авторы изобретения также показали отсутствие реаранжировки локусов Т-клеточных рецепторов (TCR-бета, TCR-гамма или TCR-дельта) в предшественниках, полученных с помощью раскрытого в настоящем документе способа.
Кроме того, для полученных описанным в настоящем документе способом предшественников было показано снижение маркеров апоптоза по сравнению со способом, описанным в WO 2016/055396.
Таким образом, описанный в настоящем документе способ позволяет получить достаточно большое количество предшественников Т-клеток, чтобы их можно было эффективно использовать для взрослых, получающих трансплантацию стволовых клеток.
Этот способ также может применяться для получения трансформированных (трансдуцированных) предшественников Т-клеток для генной терапии, когда вектор, содержащий интересующий ген, используют в некоторый момент в процессе, описанном в настоящем документе.
Клетки, полученные описанным в настоящем документе способом, могут быть получены для CD34+ клеток взрослых и могут применяться для аллогенных трансплантатов или аутотрансплантатов, даже когда для таких трансплантатов используют клетки пуповинной крови.
Следует отметить, что этот способ, хотя и очень эффективный для CD34+ клеток взрослых, может также использоваться с CD34+ клетками пуповинной крови.
Таким образом в частном варианте реализации описанный в настоящем документе способ ускоряет генерацию Т-клеток in vivo после инъекции предшественников Т-клеток, полученных из HSPC, в системе культивирования in vitro, объединяющей иммобилизованный гибридный белок, полученный из лиганда Notch, дельта-4, Ретронектин® и комбинацию цитокинов.
Эта система позволяет в течение 7 дней генерировать предшественники Т-клеток, которые фенотипически и молекулярно сходны с предшественниками клеток тимуса человека. Кроме того, эти предшественники Т-клеток давать зрелые и разнообразные Т-клетки человека у мышей NSG с более быстрой кинетикой, чем HSPC.
Представленные в настоящем документе результаты были получены как с HSPC пуповинной крови (ПК), так и с HSPC взрослых (мобилизованная периферическая кровь (mPB, мПК) от взрослых доноров).
Авторы изобретения показали, что количество предшественников Т-клеток можно увеличить по сравнению с CD34+ клетками, подвергая указанные CD34+ клетки воздействию лиганда Notch и в присутствии растворимого ФНО-альфа (фактор некроза опухолей альфа, Uniprot Р01375, RefSeq NP_000585, SEQ ID NO:8). Указанное воздействие осуществляют в условиях, подходящих для генерирования Т-клеток-предшественников. Необязательно клетки также подвергают воздействию фрагмента фибронектина, содержащего мотив RDGS, и/или мотив CS-1, и необязательно гепаринсвязывающий домен. Предпочтительно указанный фрагмент фибронектина содержит мотив RDGS, мотив CS-1 и гепаринсвязывающий домен.
ФНО в основном продуцируется в виде трансмембранного белка типа II длиной 233 аминокислоты, организованных вв стабильные гомотримеры. Секретируемая форма человеческого ФНО-альфа принимает форму треугольной пирамиды и весит приблизительно 17 кДа.
Как описано в WO 2016/055396, можно осуществить способ, изложенный в данном документе, с применением пептида RGDS и/или пептид CS-1 вместо фрагмента фибронектина. Предпочтительным является комбинированное применение пептидов RGDS и CS-1, в частности, слитых в одном и том же белке. Таким образом, пептиды RGDS и/или CS-1 могут присутствовать как таковые в культуральной среде или внутри полипептида или белка, присутствующего в культуральной среде. Когда культуральная среда содержит только пептид RGDS и/или CS-1 как таковой, их можно отнести к «свободному» пептиду (-ам) в культуральной среде, если такие пептиды не иммобилизованы на внутренней поверхности сосуда для культивирования. Действительно, пептид(-ы) может находиться в растворе или быть иммобилизованным на внутренней поверхности сосуда, в котором CD34+ клетки подвергаются воздействию иммобилизованного лиганда Notch.
Однако, как указано выше, предпочтительно использовать фрагмент фибронектина, который содержит паттерны RGDS и CS-1, а также гепаринсвязывающий домен. Фрагмент фибронектина может быть свободным в растворе или иммобилизованным на внутренней поверхности культурального контейнера.
Процесс осуществляют in vitro в контейнере, таком как планшет для культивирования клеток (чашка Петри, 24-луночная матрица или тому подобное), предпочтительно с лигандом Notch, иммобилизованным на его внутренней поверхности. Однако лиганд Notch может быть иммобилизован на любом другом носителе, присутствующем в культуральной среде, например, на поверхности сфер (гранул) (в частности, микросфер). Иммобилизация лиганда Notch, по существу, предназначена для стабилизации лиганда, чтобы обеспечить возможность активации рецептора Notch CD34+ клеток.
Термин «предшественник Т-клеток» предназначен для обозначения любой клетки, участвующей в пути дифференцировки к Т-лимфоидному пути из CD34+ HSPC. Соответственно эта клетка характеризуется тем, что она экспрессирует маркер CD7, который, как известно, является одним из самых ранних маркеров во время лимфопоэза Т-клеток. В зависимости от статуса дифференцировки в Т-лимфоидном пути, она может экспрессировать или не экспрессировать маркер CD34 (потеря CD34 в ходе дифференцировки). Такой предшественник Т-клеток также может экспрессировать или не экспрессировать маркер CD5.
К числу «предшественников Т-клеток» относятся те клетки, которые можно найти в постнатальном тимусе, т.е. ранний тимусный предшественник (ЕТР) (CD34+/CD45RA +/CD7+), клетки proT1 (CD34+ CD45RA + CD7++CD5-CD1a-), клетки proT2 (CD34+CD45RA+CD7++CD5+CD1a-) и клетки preT (CD34-CD7++/CD5+CD1a+). Локусы Т-клеточного рецептора (TCR) реаранжированы высокоупорядоченным образом (TCRδ-TCRγ-TCRβ-TCRα). Следует отметить, что первые функциональные реаранжировки TCR происходят на стадии CD34-CD7++/CD5+CD1a+ preT клетки (Dik et al. J Exp Med 2005; 201: 1715-1723). Предшественники Т-клеток хорошо известны в данной области. Они упомянуты, в частности, Reimann et al (STEM CELLS 2012;30:1771-1780.) и Awong et al (2009, op.cit.).
Термин «пептид RGDS» предназначен для обозначения любого пептида или белка, который содержит образец RGDS, так что он может связывать интегрин VLA-5. Такой пептид или белок можно проверить на его способность связывать интегрин VLA-5 способами, известными и описанными в данной области техники. Пептид RGDS связывается с интегрином VLA-5 (Very Late Antigen-5), который представляет собой димер, состоящий из CD49e (альфа5) и CD29 (бета1).
Гепаринсвязывающие домены известны в данной области техники и присутствуют в многочисленных белках, которые связываются с гепарином. Их последовательность обычно представляет собой ХВВХВХ или ХВВВХХВХ (В = основная аминокислота; X = гидрофобная аминокислота; Cardin and Weintraub, Arterioscler Thromb Vasc Biol. 1989;9:21-32, SEQ ID NO: 4 и SEQ ID NO: 5).
Присутствие такого гепаринсвязывающего домена является особенно полезным, когда CD34+ клетки подвергаются воздействию вирусного (особенно ретровирусного) вектора для их трансдукции и получения предшественников Т-клеток, экспрессирующих трансген.
Пептид CS-1 или паттерн CS-1 представляет собой пептид из 25 аминокислот (DELPQLVTLPHPNLHGPEILDVPST, SEQ ID NO: 6), описанный Wayner et al., 1989, J. Cell Biol. 109: 1321). Этот паттерн CS-1 связывается с рецептором VLA-4 (Very Late Antigen-4). Этот антиген представляет собой димерный интегрин, состоящий из CD49d (альфа 4) и CD29 (бета 1).
В частном варианте реализации фрагмент фибронектина присутствует в культуральной среде или иммобилизован на внутренней (в частности, на нижней) стенке контейнера. Фибронектин - белок, который в своей природной форме представляет собой V-образный крупный димер длиной 100 нм и массой 460 кДа. Два мономера соединены двумя дисульфидными мостиками на своих С-концах. Под термином «фибронектин» или «фрагмент фибронектина» понимается природный белок фибронектин (т.е. любая изоформа, образующаяся в результате альтернативного сплайсинга), но также мономер этого белка или фрагмент этого белка (но содержащий пептид RGDS, а также пептид CS-1 и гепаринсвязывающий сайт).
Фибронектином, особенно подходящим для осуществления описанного в настоящем документе способа, является Ретронектин®. Этот белок соответствует фрагменту человеческого фибронектина (фрагмент СН-296, Kimizuka et al., J Biochem., 1991 Aug. 110 (2): 284-91, Chono et al., J Biochem 2001 Sep 130 (3):331-4) и содержит три функциональных домена, которые являются предпочтительными для осуществления данного способа (клеточно-связывающий С-домен, содержащий пептид RGDS, гепаринсвязывающий домен и последовательность CS-1). Этот белок продается, в частности, компанией Takara Bio Inc. (Шига, Япония).
В частном варианте реализации фрагмент фибронектина иммобилизован (то есть связан с твердой подложкой и не присутствует в растворе в свободном виде (хотя возможно, что определенные элементы могут присутствовать в растворе)). Этой твердой подложкой предпочтительно является нижняя стенка контейнера, в котором осуществляют процесс. Однако также возможно предусмотреть связывание фрагмента фибронектина с микросферами, такими как полимерные или магнитные микросферы (с диаметром, обычно составляющим от 1 до 5 мкм). Связывание белка или пептида с этими микросферами может быть или не быть ковалентным. Способы прикрепления белка или пептида к микросферам известны в данной области техники. Также фрагмент фибронектина можно вводить в полутвердую среду, такую как агар или гель.
Когда фрагмент фибронектина иммобилизован на носителе (в частности, на нижней стенке контейнера, в котором осуществляют процесс), эта иммобилизация также может быть ковалентной или нековалентной. В предпочтительном варианте реализации эту иммобилизацию осуществляют нековалентно, позволяя фрагменту фибронектина абсорбироваться на стекле или пластике, составляющих нижнюю стенку контейнера.
В частном варианте реализации, как показано выше, дифференцировку CD34+ клеток в предшественники Т-клеток осуществляют вместе с трансдукцией или трансфекцией (включая нуклеофекцию (nucleofection™), систему специфической электропорации, разработанную компанией Lonza) CD34+ клеток посредством вектора (такого как вирусный вектор или фрагмент нуклеиновой кислоты, такой как плазмида или последовательности плазмидной РНК или ДНК), чтобы ввести интересующий ген (или систему для редактирования гена) в эти клетки. Это означает, что клетки, которые подвергли воздействию лиганда Notch и фрагмента фибронектина, с ФНО-альфа, также подвергают воздействию вирусного супернатанта в течение, по меньшей мере, части времени воздействия на них фрагмента лиганда Notch и фрагмента фибронектина, с ФНО-альфа.
Идеи WO 2016/055396 в отношении рабочих условий для выполнения клеточной трансдукции прямо применимы к настоящему способу и, таким образом, считаются явно описанными в этой заявке. Можно привести, в частности:
(iv) Воздействие на клетки лиганда Notch, фрагмента фибронектина и ФНО-альфа в течение некоторого времени (предпочтительно более 4 часов, более предпочтительно более 6 часов или более 8 часов или 10 часов, но менее 36 часов, более предпочтительно менее 30 часов или менее 24 часов) с соответствующими цитокинами, известными в данной области техники и раскрытыми в WO 2016/055396, и добавление вирусного супернатанта на соответствующий промежуток времени (предпочтительно более 4 часов, более предпочтительно более 6 часов, 8 часов) или 10 часов, предпочтительно менее 30 часов, более предпочтительно менее 24 часов, более предпочтительно приблизительно 16 часов).
(v) Вторая трансдукция, если требуется, как указано в WO 2016/055396
(vi) Применение этого протокола для трансплантации аутологичных гемопоэтических стволовых клеток в протоколах генной терапии, чтобы трансген мог добавить белок, отсутствующий или дефицитный, что обеспечивает терапевтическую пользу.
(vii) Подходящие для применения трансгены: гены, корректирующие иммунодефициты (в частности, тяжелые комбинированные иммунодефициты SCID или не SCID, CID), ВИЧ, Х-сцепленная адренолейкодистрофия, гемоглобинопатии, в частности β-талассемия или серповидноклеточная анемия. В качестве трансгена можно также применять ген, кодирующий химерный антигенный рецептор (CAR), то есть белок клеточной поверхности, распознающий белок клеточной поверхности, который специфически экспрессируется раковыми клетками, чтобы вызвать иммунный ответ против этих раковых клеток, посредством сконструированных клеток.
(viii) Предпочтительное применение вирусного супернатанта для обеспечения возможности введения трансгена в геном клетки с применением, в частности, известных лентивирусов, описанных в данной области техники.
(ix) Введение вирусного вектора в среду для культивирования клеток после предварительной активации CD34+ клеток от 4 до 36 часов, предпочтительно от 6 до 24 часов.
(x) Воздействие на клетки вирусного вектора от 4 до 30 часов, предпочтительно от 12 до 24 часов, более предпочтительно приблизительно 16 часов, и удаление вирусного вектора (сбор и промывание клеток и ресуспендирование этих клеток в присутствии лиганда Notch, фрагмента фибронектина и ФНО-альфа).
Как указано выше, в другом варианте реализации CD34+ клетки подвергают воздействию системы, позволяющей выполнять редактирование генов. Такие системы в настоящее время широко известны и описаны в данной области техники и в основном основаны на репарации нуклеиновых кислот с двойным разрывом. В такой системе редактирования генома может применяться нуклеаза, выбранная из группы, состоящей из мегануклеаз, нуклеаз цинковых пальцев (ZFN), эффекторных нуклеаз, подобных активатору транскрипции (TALEN), и нуклеаз CRISPR-Cas. Тот факт, что CD34+ клетки пролиферируют во время воздействия элементов, указанных выше, и, следовательно, в присутствии ФНО-альфа, делает возможным применение этих систем редактирования генов, которые требуют пролиферации клеток.
В частном варианте реализации изобретения лиганд Notch представляет собой дельта-подобный белок 1 (SEQ ID NO: 1) или его фрагмент (растворимый домен).
В другом и предпочтительном варианте реализации изобретения лиганд Notch представляет собой дельта-подобный белок 4 (SEQ ID NO: 2).
В частном варианте реализации указанный лиганд Notch представляет собой слитый белок, содержащий растворимый домен природного лиганда Notch, слитый с Fc-областью белка IgG. Как известно в данной области техники, растворимый домен лиганда Notch представляет собой внеклеточную часть указанного лиганда. Varnum-Finney et al. (J Cell Sci., 2000 Dec; 113 Pt 23: 4313-8) описали слитый белок растворимой части DL-1 с Fc-частью IGg1 Reimann et al. (цит. соч.) описали слитый белок растворимой части DL-4 (аминокислоты 1-526) с Fc-фрагментом иммуноглобулина IgG2b. Таким образом, предпочтительно, когда белок IgG представляет собой IgG2. В предпочтительном варианте реализации последовательность лиганда Notch, используемого в раскрытом в настоящем документе способе, представляет собой SEQ ID NO: 7. Коммерчески доступный продукт (Sino Biologicals), содержащий внеклеточный домен (Met 1-Pro 524) DLL4 человека (полноразмерный DLL4, номер доступа (NP_061947.1), слитый с Fc-областью IgG 1 человека на С-конце, представляет собой белок DL4, также пригодный для применения в настоящем документе.
Культуральная среда, применяемого в контексте раскрытого в настоящем документе способа, представляет собой любую среду, адаптированную для культивирования CD34+ клеток и Т-клеток. В частности, можно упомянуть α-МЕМ, DMEM, RPMI 1640, IMDM, ВМЕ, McCoy's 5А, StemSpan™, в частности SFII (StemCell Technologies) или среду Фишера. Среда StemSpan™ SFII содержит, в частности, Ismove's MDM, бычий сывороточный альбумин, рекомбинантный человеческий инсулин, человеческий трансферрин (насыщенный железом), 2-меркаптоэтанол.
Подходящей и предпочтительной культуральной средой для осуществления описанного в настоящем документе способа является среда X-VIVOTM (Lonza, Базель, Швейцария). Эта среда использовалась, в частности, Jonuleit et al. (Eur J Immunol, 1997, 27, 12, 3135-42) и Luft et al. (J Immunol, 1998, 161, 4, 1947-53).
Предпочтительно используют базальную среду (то есть среду, которая обеспечивает рост клеток без внесения добавок), в которую тем не менее предпочтительно добавлять сыворотку и/или факторы роста и цитокины.
Таким образом, в базальную культуральную среду предпочтительно добавляют фетальную бычью сыворотку (ФБС) или фетальную телячью сыворотку (ФТС), аутологичную сыворотку человека или АВ-сыворотку человека. Предпочтительно в эту среду добавляют по меньшей мере 15% эмбриональной сыворотки, более предпочтительно по меньшей мере 20%. ФБС особенно подходит для реализации способа. В частности, предпочтительно использовать стандартную ФБС. Стандартная ФБС представляет собой высококачественную сыворотку, которая была исследована и отфильтрована для исключения присутствия вирусных частиц. Она продается в этом качестве многими поставщиками, например Стандартная фетальная бычья сыворотка (ФБС) HyClone™ производителя Thermo Scientific™.
В дополнение к ФНО-альфа культуральная среда также предпочтительно дополнена цитокинами и факторами роста. Эти цитокины и факторы роста в частности выбраны из группы, состоящей из SCF (фактор роста стволовых клеток), тромбопоэтина (ТРО, также называемый фактором роста и развития мегакариоцитов, MGDF), Flt3-лиганда (который является гемопоэтическим фактором роста), интерлейкина 3 (IL-3), интерлейкина 7 (IL-7) и SCF (фактор стволовых клеток). В частном варианте реализации культуральная среда содержит по меньшей мере три, предпочтительно по меньшей мере четыре из этих цитокинов или факторов роста, в дополнение к ФНО-альфа.
В предпочтительном варианте и, в частности, для генерации предшественников Т-клеток, которые не трансдуцируются вирусным вектором, добавляют по меньшей мере или ровно три цитокина. Предпочтительно этими тремя цитокинами являются интерлейкин-7 (IL-7), SCF (фактор роста стволовых клеток) и лиганд Flt-3 (гемопоэтический фактор роста).
В другом предпочтительном варианте реализации изобретения добавляют четыре цитокина, то есть три упомянутых выше цитокина и ТРО (тромбопоэтин).
В другом частном варианте реализации и, в частности, для генерации предшественников Т-клеток, трансдуцированных вирусным вектором, природу цитокинов и факторов роста можно варьировать в процессе реализации способа.
Так, IL-3, IL-7, SCF, ТРО и Flt3-L можно применять в среде на этапе предварительной активации клеток перед добавлением вирусного вектора, а затем дополнять среду только IL-7, SCF, ТРО и Flt3-L после удаления вектора.
Вышеупомянутые смеси цитокинов и факторов роста достаточны для индукции дифференцировки CD34+ клеток в предшественники Т-клеток, и обычно культуральная среда не содержит других цитокинов или факторов роста, кроме ФНО-альфа, что, как описано в примерах, позволяет увеличить количество предшественников Т-клеток.
В предусмотренном в настоящем документе способе общая продолжительность воздействия в присутствии лиганда Notch на CD34+ клетки белка или пептида, экспонирующего мотив RGDS, и ФНО-альфа, обычно составляет предпочтительно более 3 дней и менее 10 дней.
Это воздействие может варьировать в зависимости от того, трансдуцированы ли клетки. Таким образом, для не трансдуцированных стволовых клеток взрослых может быть достаточным время воздействия три дня, тогда как для стволовых клеток ранней стадии (приблизительно 7 дней) или при выполнении трансдукции оно обычно будет больше.
CD34+ клетки получают с помощью пункции костного мозга, из пуповинной крови или из периферической крови от взрослых доноров, после мобилизации, в частности, с помощью G-CSF или любого другого мобилизующего агента, известного в данной области техники. Способы сортировки CD34+ клеток известны в данной области техники. В частности, для этой цели можно применять магнитные микросферы, имеющие на своей поверхности антитело, распознающее CD34.
Предпочтительно сосуд для культивирования клеток готовят путем иммобилизации лиганда Notch и фрагмента фибронектина на внутренней (предпочтительно нижней) поверхности перед воздействием на CD34+ клетки. Ретронектин® или другой фибронектин естественным образом адгезируют к пластику бокса для культивирования клеток (чашки Петри или 24-луночного бокса или другого). Аналогично, если лиганд Notch используют в форме белка слияния с Fc-фрагментом иммуноглобулина, этот Fc-фрагмент также адгезирует на пластике. Поэтому достаточно оставить контейнер в присутствии этих соединений на несколько часов, чтобы получить соответствующее покрытие. Способ покрытия такого культурального контейнера лигандом Notch и фрагментом фибронектина подробно описан в WO 2016/055396 и может применяться для реализации способа, раскрытого в настоящем документе.
Следует напомнить, что в соответствии с WO 2016/055396 к поверхности контейнера будет адгезировать приблизительно 75% DL-4 при применении концентрации 5 мкг/мл; оптимальная доза должна быть выше или равна 1,25 мкг/мл и предпочтительно от 2,5 до 5 мкг/мл.
Что касается фрагмента фибронектина, особенно подходит концентрация 25 мкг/мл (особенно при использовании Ретронектина®), хотя можно использовать другие концентрации (выше или ниже).
При осуществлении описанного в настоящем документе способа CD34+ клетки добавляют в концентрации, составляющей от 106 до 107 клеток/мл, в частности, приблизительно 2×106 CD34+ клеток/мл в сосуд для культивирования.
В зависимости от того, осуществляют ли трансдукцию клеток, и от концентрации CD34+ клеток, можно использовать планшет от 2 до 10 см2 (то есть планшет от 24 до 6 лунок). При использовании 24-луночного планшета, добавляют от 104 до 106 CD34+ клеток в каждую лунку, предпочтительно от 2×104 до 4×105 CD34+ клеток на лунку. При использовании 6-луночного планшета, добавляют от 8×104 до 2×106 клеток на лунку.
Количество добавляемых клеток подбирается специалистом в соответствии с используемым контейнером.
Клетки помещают в лунку, в выбранную базальную среду, с добавлением ФНО-альфа и предпочтительно с добавлением факторов роста и цитокинов, как указано выше.
Концентрация цитокинов или факторов роста составляет от 2 до 300 нг/мл. Предпочтительно концентрация составляет выше 40 нг/л и ниже 300 нг/мл или 200 нг/л, более предпочтительно приблизительно 100 нг/мл.
Тем не менее, если желательно получить трансдуцированные предшественники Т-клеток, и если клетки предварительно активированы перед воздействием вирусного вектора, можно применять более высокие концентрации (приблизительно 300-400 нг/мл). В этом варианте реализации SCF и Flt3-L можно использовать в концентрациях в диапазоне 300 нг/мл, ТРО и IL-7 в диапазоне 100 нг/мл и IL-3 в концентрации приблизительно 40 нг/мл.
ФНО-альфа предпочтительно применяют в концентрации, равной или превышающей 5 нг/мл. Действительно, как показано в примерах, этой низкой концентрации достаточно для получения пролиферации предшественников Т-клеток без изменения пути дифференцировки.
Тем не менее, также можно применять более высокие концентрации. В частности, концентрация ФНО-альфа может достигать 300 нг/мл или 200 нг/мл. Подходящая концентрация составляет приблизительно 100 нг/мл. Однако также подходят другие концентрации, такие как 10 нг/мл, 20 нг/мл или 50 нг/мл.
Таким образом, изобретение относится к in vitro способу получения предшественников Т-клеток, включающему этап культивирования CD34+ клеток в подходящей среде, содержащей ФНО-альфа, и в присутствии иммобилизованного лиганда Notch и, необязательно, фрагмента фибронектина, как описано выше.
Таким образом, изобретение относится к in vitro способу размножения предшественников Т-клеток, включающему этап культивирования CD34+ клеток в подходящей среде, содержащей ФНО-альфа, и в присутствии иммобилизованного лиганда Notch и, необязательно, фрагмента фибронектина, как описано выше.
Термин "размножение предшественников Т-клеток" означает, что предшественников Т-клеток больше, чем без применения ФНО-альфа, и/или что предшественников Т-клеток больше, чем количество CD34+ клеток, введенных в контейнер.
В частности, предшественники Т-клеток, полученные вышеуказанными способами, представляют собой предшественники CD34-/CD7+/CD5-.
Обычно эти клетки также не содержат маркера CD1a.
В предпочтительном варианте реализации предшественники Т-клеток, полученные вышеуказанными способами, являются предшественниками, экспрессирующими CD34-/CD7+/CD1a-.
Это означает, что популяция предшественников Т-клеток, полученная данным способом, экспрессирует маркер CD7, и что более 80% клеток, экспрессирующих этот маркер, имеют вышеуказанный фенотип (не экспрессирующий
- CD34 и CD1a, или
- CD34 и CD5, или
- CD34 и CD1a и CD5),
по данным анализа методом проточной цитометрии. Этот фенотип обычно получают после 7 дней культивирования.
Как указано, CD34+ клетки предпочтительно не являются клетками пуповинной крови. Тем не менее этот способ также может применяться с CD34+ клетками пуповинной крови и применим к ним, и в этом случае также дает улучшенные результаты.
Этот способ особенно интересен при реализации на CD34+ клетках, выделенных из организма взрослого пациента. Указанным пациентом может быть здоровый донор или донор с заболеванием, в частности, для которого клетки будут корректироваться путем вирусной трансдукции.
Клетки можно культивировать в течение более 3 дней и предпочтительно в течение по меньшей мере 5 дней, более предпочтительно в течение по меньшей мере или ровно 6 дней, наиболее предпочтительно в течение по меньшей мере или ровно 7 дней, хотя продолжительность культивирования может быть и больше.
В раскрытом в настоящем документе способе ФНО-альфа предпочтительно добавляют в культуральную среду начиная с дня 0 (то есть в начале культивирования CD34+ клеток), и он должен оставаться в культуральной среде в течение по меньшей мере трех дней и предпочтительно в течение всего времени культивирования клеток (т.е. предпочтительно приблизительно 7 дней).
При реализации способа, описанного в настоящем документе, можно дополнительно добавить StemRegenin 1 (SR1, 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9Н-пурин-6-иламино)этил)фенол, CAS 1227633-49-10) в культуральную среду, уже содержащую ФНО-альфа.
Изобретение также относится к способу получения предшественников Т-клеток, включающему этапы
a. осуществления способа, описанного выше, и
b. очистки полученных предшественников Т-клеток, произведенных таким образом.
Очистка может быть выполнена путем промывания клеток и ресуспендирования в базальной среде.
Этот способ может также включать этап кондиционирования клеток-предшественников Т-клеток в пакете для инъекции пациенту.
В этом случае предпочтительным является восстановление этих клеток в физиологическом растворе, содержащем 5% ЧСА, например, Albunorm™ 5% 50 г/л (Octopharma, Лингольсхайм, Франция).
Эти клетки также можно заморозить в соответствии со способами, известными в данной области техники.
Изобретение также относится к пакету для внутривенной инъекции, содержащему популяцию предшественников Т-клеток (которые могут быть получены или которые получены способом, описанным выше), для которых доля CD7+ клеток в этой популяции превышает 80%, более предпочтительно выше 85%.
Изобретение также относится к пакету для внутривенной инъекции, содержащему популяцию клеток-предшественников CD7+ Т-клеток (которые могут быть получены или которые получены способом, описанным выше), где доля клеток CD34- и CD5- (клеток с экспрессией CD7+ и как CD34-, так и CD5-) в этой популяции выше 80%, более предпочтительно выше 85%.
Изобретение также относится к пакету для внутривенной инъекции, содержащему популяцию предшественников CD7+ Т-клеток (которые могут быть получены или которые получены способом, описанным выше), где доля CD34- клеток (клеток с CD7+ и CD34-) в этой популяции выше 50%, более предпочтительно выше 60%. Кроме того, по меньшей мере, 80% и более предпочтительно, по меньшей мере, 85% клеток в этой популяции с являются CD1a- клетками.
Изобретение также относится к in vitro способу получения трансформированных предшественников Т-клеток, включающему этапы:
a. культивирования CD34+ клеток в подходящей среде, содержащей ФНО-альфа, и в присутствии иммобилизованного лиганда Notch
b. воздействия на клетки вектором, предназначенным для трансфекции или трансдукции CD34+ клеток.
Как описано выше, и после этапов промывания и повторного культивирования клеток получают трансформированные предшественники Т-клеток (экспрессирующие трансген, интегрированный в их геном).
Изобретение также относится к способу получения модифицированных предшественников Т-клеток in vitro, включающему следующие этапы:
a. культивирование CD34+ клеток в среде, содержащей ФНО-альфа, и в присутствии иммобилизованного лиганда Notch
b. воздействие на клетки вектора или последовательности нуклеиновой кислоты, содержащих элемент, подходящий для редактирования генов, по меньшей мере, в течение некоторого времени в процессе культивирования клеток.
Таким образом получают Т-клетки-предшественники, модифицированные путем редактирования генов, после возможных этапов промывания и культивирования.
Изобретение также относится к предшественникам Т-клеток, в частности, полученным описанным в настоящем документе способом, для их применения у пациента с иммунодефицитом, в частности для обеспечения возможности восстановления иммунитета у этого пациента и/или получения иммунной защиты от инфекций у указанного пациента в течение периода в несколько месяцев (не менее двух месяцев, предпочтительно не менее шести месяцев).
В частном варианте реализации пациентом является пациент с иммунодефицитом. Причин дефицита может быть несколько: наследственный иммунодефицит, химиотерапия лейкемии, кондиционирование, трансплантат, содержащий только стволовые клетки, лечение после трансплантации для профилактики ТПХ (болезнь трансплантат против хозяина), возраст пациента и такие осложнения, как инфекции.
В частности, у пациента может наблюдаться иммуносупрессия из-за истощения его иммунных клеток после терапии перед трансплантацией гемопоэтических стволовых клеток. В этом варианте реализации трансплантат может быть аллотрансплантатом (в этом случае предшественники Т-клеток предпочтительно получены от частично HLA-совместимого донора) или аутотрансплантатом (в этом случае предшественники Т-клеток предпочтительно трансформированы вектором для экспрессии гена и/или белка, позволяющего исправить генетический дефект у указанного пациента).
Предшественники Т-клеток предпочтительно представляют собой популяцию CD7+ клеток (то есть популяцию, в которой по меньшей мере 75%, более предпочтительно по меньшей мере 80% клеток в популяции экспрессируют маркер CD7). Эта популяция также является частью изобретения. В частности, она может быть получена описанным в настоящем документе способом. В частном варианте реализации ее получают описанным в настоящем документе способом.
Более конкретно, предшественники Т-клеток предпочтительно представляют собой популяцию CD7+ клеток (т.е. популяцию, в которой по меньшей мере 75%, более предпочтительно по меньшей мере 80% клеток в популяции экспрессируют маркер CD7), в которой доля клеток CD34- и CD5- (клетки с экспрессией CD7+ , и как CD34-, так и CD5-) в этой популяции выше 80%, более предпочтительно, выше 85%. Эта популяция также является частью изобретения. В частности, она может быть получена описанным в настоящем документе способом. В частном варианте реализации ее получают описанным в настоящем документе способом.
В другом варианте реализации предшественники Т-клеток предпочтительно представляют собой популяцию CD7+ клеток (то есть популяцию, в которой по меньшей мере 75%, более предпочтительно по меньшей мере 80% клеток в популяции экспрессируют маркер CD7). В этой популяции более 50%, более предпочтительно, более 60% клеток не экспрессируют маркер CD34. В этой популяции, по меньшей мере 80%, более предпочтительно, по меньшей мере 85% клеток не экспрессируют маркер CD1a. Доля CD7+ CD1a- клеток в этой популяции предпочтительно составляет по меньшей мере 80%. Эта популяция также является частью изобретения. В частности, она может быть получена описанным в настоящем документе способом. В частном варианте реализации ее получают описанным в настоящем документе способом.
Чтобы определить, является ли клетка положительной или нет в отношении поверхностного маркера (CD7, CD34, CD5 или CD1a), следует использовать любой метод, известный в данной области техники, и, в частности, проточную цитометрию, после маркировки клеток флуоресцентными антителами, направленными против этого поверхностного антигена. Принцип заключается в том, что для каждой клетки популяции будет излучаться сигнал с заданной интенсивностью, и клетки считаются положительными в отношении данного антигена, если сигнал выше заданного порога.
Для CD34: для определения соответствующих пороговых значений используют контрольную популяцию, состоящую из популяции HSPC (такой как выделенная из пуповинной крови или из мобилизованной периферической крови). В этой клеточной популяции клетки являются CD34+ CD7- CD5- или CD34+ CD7- CD1a-. С этим контролем можно определить порог для каждого антигена, который будет использоваться для определения того, являются ли клетки в другой популяции положительными или нет в отношении этих антигенов.
Контрольная популяция обычно содержит приблизительно 90% гемопоэтических стволовых CD34+ CD7- CD5- или CD34+ CD7- CD1a- клеток. Порог представляет собой уровень интенсивности сигнала, для которого клетки популяции могут быть отсортированы в пропорции 90/10.
Для CD7 (соответственно CD5 или CD1a): применяют контрольную популяцию, полученную путем выделения мононуклеаров периферической крови (РВМС) с помощью любой методики, известной в данной области техники, и, в частности, методики градиента плотности, такой как фиколл-пак Ficoll-Paque PLUS (GE Healthcare Life Sciences). Положительные по CD7 (соответственно CD5 или CD1a) клетки выделяют с применением любой методики, известной в данной области техники, такого как метод MACS® (магнитная изоляция клеток и разделение клеток, Miltenyi Biotec), в котором используют магнитные микросферы с анти-CD7 (соответственно анти-CD5 или анти-CD1a) антителом. В этой популяции клетки большей частью будут CD7+ (соответственно CD5+ или CD1a+), и считается, что эта пропорция будет приблизительно 90/10.
Пороговые значения для оценки того, является ли клетка положительной в отношении поверхностного антигена, определяют с применением контрольной популяции для этого антигена, и они будут соответствовать интенсивности, для которой более 90% клеток контрольной популяции имеют более высокую интенсивность сигнала.
Следовательно, клетка считается положительной в отношении антигена, если сигнал интенсивности для этого антигена выше порогового значения, определенного выше, и отрицательной в отношении антигена, если сигнал интенсивности для этого антигена ниже порогового значения, определенного выше.
Тот факт, что подавляющее большинство предшественников Т-клеток в популяции не экспрессируют маркер CD1a, может оказаться полезным, поскольку клетки, экспрессирующие этот маркер CD1a, могут быть не очень эффективными в достижении тимуса и, следовательно, могут быть столь же эффективными, как CD1a- клетки, для репопуляции in vivo. Поскольку потенциал восстановления клеток CD1a+ является неопределенным, предпочтительно снизить количество таких клеток в популяции.
Изобретение также относится к способу лечения пациента с иммуносупрессией, в частности, с целью обеспечения возможности восстановления иммунитета, по меньшей мере, временно, у этого пациента, включающему этап введения указанным пациентам предшественников Т-клеток, как описано выше.
Этот способ может также включать этап получения таких предшественников путем воздействия на CD34+ клетки лиганда Notch в присутствии ФНО-альфа (как описано выше) и предпочтительно белка или пептида, имеющего мотив RGDS и/или мотив CS1, в особом фрагменте фибронектина, как описано выше, в условиях, указанных выше.
В частности, пациенту назначают терапевтически эффективное количество, то есть порядка от 1 до 5×106 предшественников на кг, что позволяет обеспечить пациента клетками, способными играть защитную роль в отношении инфекций в течение нескольких месяцев (порядка 6 месяцев).
Предпочтительно, это введение пациенту предшественников Т-клеток выполняют непосредственно перед, сразу после или одновременно с трансплантацией гемопоэтических стволовых клеток у указанного пациента. Как видно выше, инъецированные клетки могут быть трансформированы вектором, предназначенным для коррекции генетического дефекта у указанного пациента.
В другом варианте реализации предшественники Т-клеток инъецируют пациенту, которому не требуется трансплантация гемопоэтических стволовых клеток. Более того, можно применять трансформированные или трансдуцированные предшественники Т-клеток для лечения некоторых иммунодефицитов, при которых поражены только Т-клетки, пациентов с ВИЧ или раком (с применением предшественников, модифицированных для получения клеток CAR-T), без необходимости выполнять химиотерапию, истощающую иммунную систему.
Следует отметить, что идеи изобретения, описанные для случая применения ФНО-альфа, также можно применять с пуриновым производным StemRegenin 1 (SR1, описан в работе Boitano et al., Science. 2010 Sep 10; 329 (5997): 1345-8). Таким образом, SR1 может быть заменой ФНО-альфа (т.е. использоваться вместо ФНО-альфа) для получения предшественников Т-клеток из CD34+ клеток, с началом дифференцировки и размножения клеток (увеличением числа клеток). Концентрация SR1 предпочтительно находится в районе 750 нМ (30 нг/мл); также может быть предусмотрена более высокая концентрация, такая как 1500 нМ или 2500 нМ (100 нг/мл), или даже 5000 нМ (200 нг/мл) или ниже, такая как 500 нМ. (20 нг/мл). При применении отдельно, но особенно в комбинации с ФНО-альфа, можно использовать гораздо более низкие концентрации, вплоть до 3 нг/мл или 10 нг/мл. Подходящие концентрации также включают 30 нг/мл или 100 нг/мл. Соответственно, для повышения дифференцировки CD34+ клеток в предшественники Т-клеток подходит любая концентрация выше 3 нг/мл или выше 10 нг/мл.
SR1 является лигандом (антагонистом) арилуглеводородного/диоксинового рецептора (AhR). Другие антагонисты AhR можно применять отдельно или в комбинации с ФНО-альфа, чтобы стимулировать дифференцировку CD34+ клеток в линию предшественников Т-клеток. Можно упомянуть резвератрол, омепразол, лютеолин, альфа-нафтофлавон, мексилетин, траниласт, 6,2',4'-триметоксифлавон, СН 223191 (1-метил-N-[2-метил-4-[2-(2-метилфенил)диазенил]фенил-1Н-пиразол-5-карбоксамид, CAS 301326-22-7). Количество антагониста AhR определяет в каждом конкретном случае специалист в данной области техники, принимая во внимание IC50 антагониста (SR1 имеет IC50 127 нМ, тогда как СН 223191 имеет IC50 30 нМ) и тот факт, что некоторые продукты могут обладать агонистической активностью в отношении AhR при применении в высоких концентрациях (например, альфа-нафтофлавон) или в зависимости от клеточного контекста (например, омепразол). Принимая во внимание разницу в IC50 между SR1 и СН 223191, предполагается, что эффективная концентрация СН 223191 будет значительно ниже эффективной концентрации SR1, раскрытой в настоящем документе.
Таким образом, изобретение также относится к следующему:
(i) in vitro пособ получения предшественников Т-клеток, включающий этап культивирования CD34+ клеток в среде, содержащей антагонист арилуглеводородного/диоксинового рецептора, в частности StemRegenin 1 (SR1), и в присутствии иммобилизованного лиганда Notch,
(ii) In vitro способ, приведенный выше, в котором культуральная среда дополнительно содержит ФНО-альфа.
(iii) In vitro способ, указанный выше, в котором антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, присутствует в культуральной среде со дня 0 культивирования.
(iv) In vitro способ по любому из вышеприведенных вариантов, в котором CD34+ клетки были выделены из взрослого донора или из пуповинной крови.
(v) In vitro способ по любому из вышеприведенных вариантов, в котором клетки культивируют в присутствии антагониста арилуглеводородного/диоксинового рецептора, в частности SR1, в течение не более 10 дней.
(vi) In vitro способ по любому из вышеприведенных вариантов, в котором клетки культивируют в присутствии антагониста арилуглеводородного/диоксинового рецептора, в частности SR1, в течение 3-7 дней.
(vii) In vitro способ по любому из вышеприведенных вариантов, в котором антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, добавляют в среду культуры в концентрации от 1 нг/мл до 300 нг/мл и предпочтительно выше или равной 1 нг/мл, или выше или равной 3 нг/мл, или выше или равной 10 нг/мл и предпочтительно ниже 200 нг/мл или 150 нг/мл и обычно от 3 нг/мл до 100 нг/мл.
(viii) In vitro способ по любому из вышеприведенных вариантов, в котором лиганд Notch представляет собой растворимый домен дельта-подобного лиганда 4, слитый с Fc-областью белка IgG, предпочтительно белка IgG2.
(ix) In vitro способ по любому из приведенных выше, в котором клетки также подвергают воздействию фрагмента фибронектина, где указанный фрагмент содержит структуры RGDS и CS-1, а также гепаринсвязывающий домен, предпочтительно иммобилизованный на внутренней поверхности культурального сосуда.
(x) In vitro способ, приведенный выше, в котором фрагмент фибронектина представляет собой Ретронектин®, как описано выше.
(xi) In vitro способ по любому из вышеприведенных вариантов, в котором культуральная среда также содержит вектор, предназначенный для трансфекции или трансдукции CD34+ клеток, в течение, по меньшей мере, некоторого времени воздействия на CD34+ клетки лигандом Notch.
(xii) In vitro способ по любому из вышеприведенных вариантов, в котором культуральная среда содержит, по меньшей мере три, а предпочтительно все четыре, цитокина или фактора роста, выбранных из группы, состоящей из интерлейкина 7 (IL-7), SCF (фактора стволовых клеток), тромбопоэтина (ТРО) и лиганда Flt3 (FLT3L).
(xiii) (In vitro) способ получения предшественников Т-клеток, включающий этапы
a. осуществления способа по любому из вышеприведенных вариантов и
b. очистки полученных предшественников Т-клеток,
c. необязательно кондиционирования клеток-предшественников Т-клеток в пакете для инъекции пациенту.
(xiv) In vitro способ получения трансформированных предшественников Т-клеток, включающий этапы
a. культивирования CD34+ клеток в среде, содержащей антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, и в присутствии иммобилизованного лиганда Notch
b. воздействия на клетки вектором, предназначенным для трансфекции или трансдукции CD34+ клеток.
(xv) In vitro способ получения модифицированных предшественников Т-клеток, включающий этапы
a. культивирования CD34+ клеток в среде, содержащей антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, и в присутствии иммобилизованного лиганда Notch
b. воздействия на клетки вектором или последовательностями нуклеиновой кислоты, содержащими элемент, подходящий для редактирования генов.
Изобретение также относится к набору для осуществления любого способа, как описано выше, включающему:
(i) покровную среду, содержащую лиганд Notch (в частности, растворимый домен дельта-подобного лиганда, слитый с Fc-областью белка IgG, в частности белка IgG2) и, необязательно, фрагмент фибронектина;
(ii) среду, адаптированную для культивирования (и/или размножения) CD34+ клеток и Т-клеток, такую как α-МЕМ, DMEM, RPMI 1640, IMDM, ВМЕ, МсСоу5А, StemSpan™ SFII (StemCell Technologies), среду X-VIVOTM или среду Фишера;
(iii) среду для размножения предшественников, содержащую ФНО-альфа и предпочтительно три цитокина, в частности, выбранные из SCF, ТРО, Flt3L и IL-7. Предпочтительно, когда среда для размножения предшественников содержит ФНО-альфа и все четыре цитокина SCF, ТРО, Flt3L и IL-7.
В другом варианте реализации изобретение относится к набору, содержащему те же элементы (i) и (ii), как указано выше, и к среде размножения предшественников (iii), которая содержит антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, и предпочтительно три цитокина, в частности, выбранных из SCF, ТРО, Flt3L и IL-7. Предпочтительно, когда среда для размножения предшественников содержит SR1 и все четыре цитокина SCF, ТРО, Flt3L и IL-7.
В другом варианте реализации среда для размножения предшественников (iii) содержит ФНО-альфа и антагонист арилуглеводородного/диоксинового рецептора, в частности SR1, и предпочтительно три цитокина, в частности, выбранных из SCF, ТРО, Flt3L и IL-7. Предпочтительно, когда среда для размножения предшественников содержит ФНО-альфа, SR1 и все четыре цитокина SCF, ТРО, Flt3L и IL-7.
Такой набор адаптирован и предназначен в частности для осуществления способов, раскрытых в данном документе.
Сначала применяют покровную среду для (i) для покрытия стенок культурального сосуда.
Затем используют среду (ii) для культивирования CD34+ клеток (полученных из пуповинной крови или из мобилизованной периферической крови, в частности, от взрослого человека). Такую среду обычно и предпочтительно применяют в концентрации 1х (то есть ее можно использовать без разбавления).
Среду (iii) обычно используют в 10-кратном разведении (т.е. для применения ее нужно разбавить в среде (ii)). Восстановленную среду из сред (ii) и (iii) затем используют для стимуляции дифференцировки CD34+ клеток в предшественники Т-клеток, в линии Т-клеток, как описано выше.
Изобретение также относится к способу увеличения числа Т-клеток у нуждающегося в этом субъекта, причем способ включает введение субъекту эффективного количества предшественников Т-клеток, полученных способом, раскрытым в данном документе.
Изобретение также относится к предшественникам Т-клеток, полученным любым способом, раскрытым в данном документе, для их применения для лечения субъекта, нуждающегося в увеличенном количестве Т-клеток.
В частности, субъектом является человек.
В частности, введенные предшественники Т-клеток являются аутологичными. В другом варианте реализации вводимые предшественники Т-клеток являются аллогенными.
В частности, субъект, нуждающийся в увеличенном количестве Т-клеток, имеет заболевание, вызывающее или приводящее к лимфопении, в частности при раке, ВИЧ-инфекции, частичной тимэктомии, аутоиммунном заболевании и/или трансплантации органов.
Описание фигур
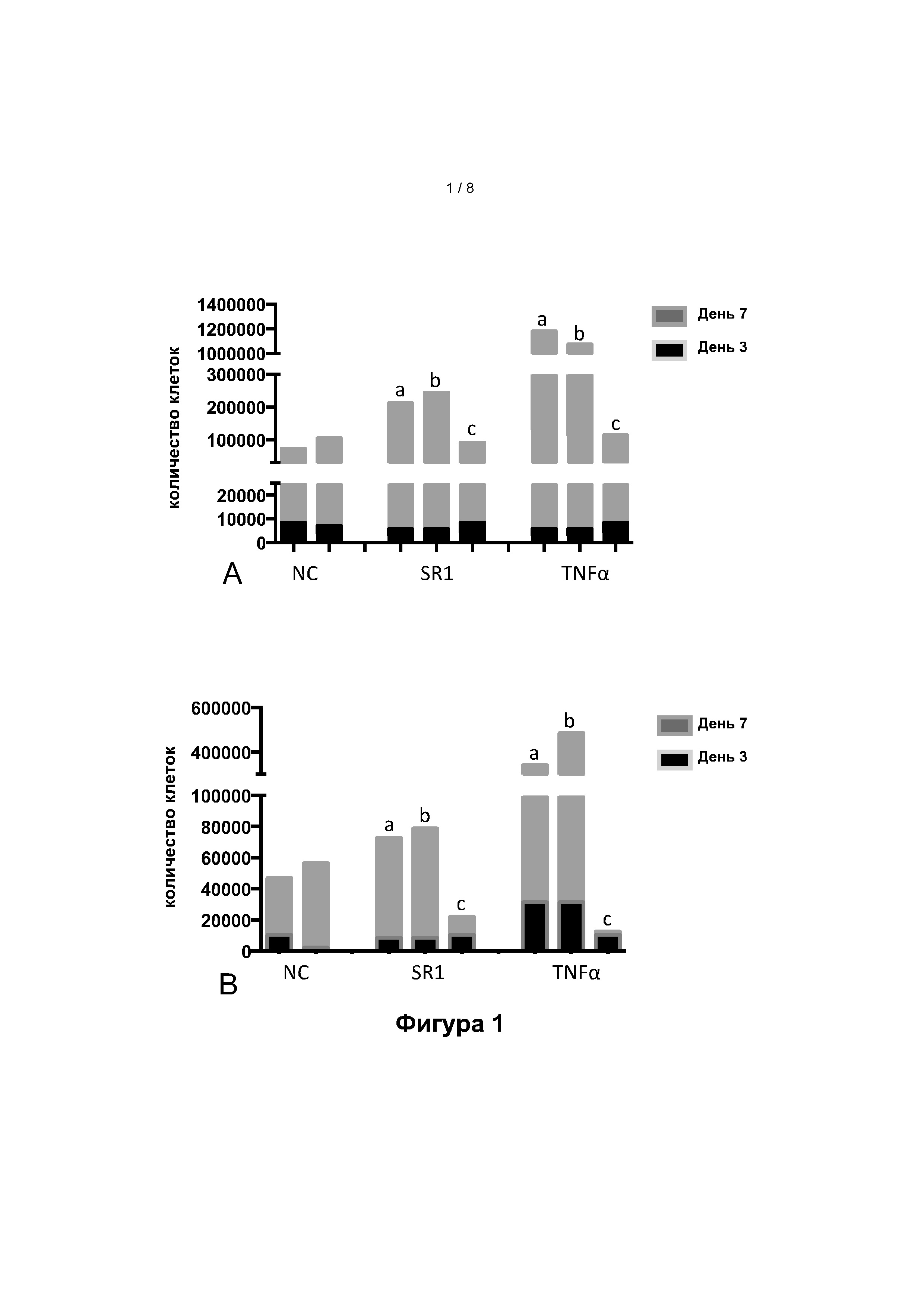
Фигура 1: Общее количество ядерных клеток, полученное из исходных 20000 CD34+ клеток из пуповинной крови (ПК, рисунок 1.А) или мобилизованной периферической крови (мПК, рисунок 1.В), через 3 дня (черные столбики) и 7 дней (черные и серые столбики в совокупности) культивирования. NC (нормальный контроль): без добавок; SR1: добавление StemRegenin 1 (750 нМ); ФНО-альфа: добавление ФНО-альфа (100 нг/мл);+ (а), (b), (с): количество клеток, наблюдаемых при введении добавок через 0-3 дня культивирования (а), 0-7 дней культивирования (b) или 4-7 дней культивирования (с).
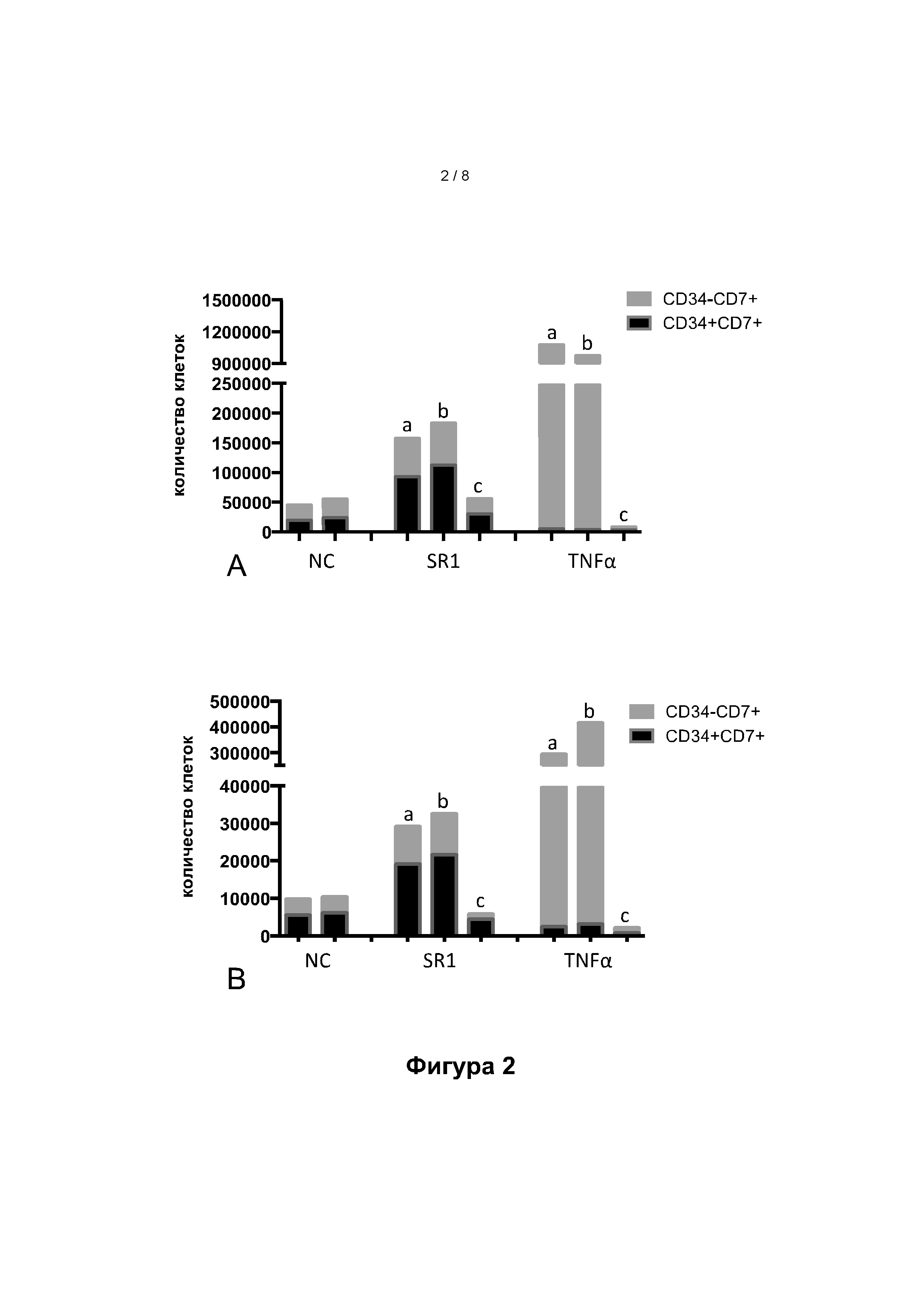
Фигура 2: Количество CD7+ Т-клеток-предшественников, полученных на 7-й день, из исходных 20000 CD34+ клеток из пуповинной крови (ПК, рисунок 2.А) или мобилизованной периферической крови (мПК, рисунок 2.В). Черные столбики: CD34+ CD7+ клетки; серые столбики: CD34-CD7+ клетки, (а), (b), (с): количество клеток, наблюдаемых при введении добавок через 0-3 дня культивирования (а), 0-7 дней культивирования (b) или 4-7 дней культивирования (с).
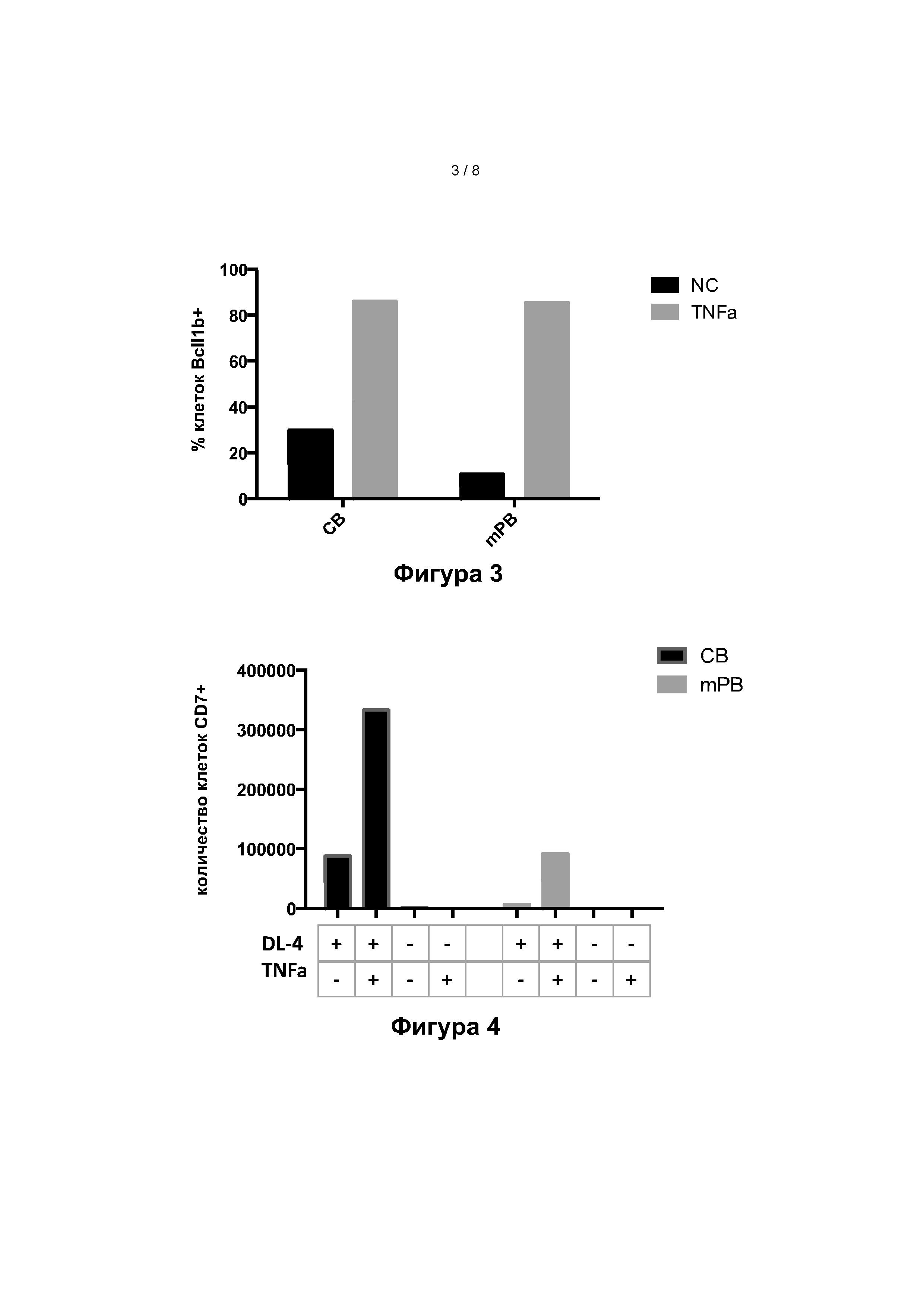
Фигура 3: Экспрессию Bcl11b анализировали на живых клетках после 7 дней культивирования, полученных из исходных CD34+ клеток из пуповинной крови (ПК) или мобилизованной периферической крови (мПК), культивируемых в присутствии (серые столбики) или в отсутствие (черные столбики) ФНО-альфа.
Фигура 4: Комбинированное влияние ФНО-альфа и лиганда Notch DL4 на количество CD7+ клеток, полученных на 7-й день, из исходных клеток пуповинной крови CD34+ (ПК, черные столбики, слева) или мобилизованной периферической крови (мПК, серые столбики, справа). (+/- означает присутствие или отсутствие DL4 или ФНО-альфа).
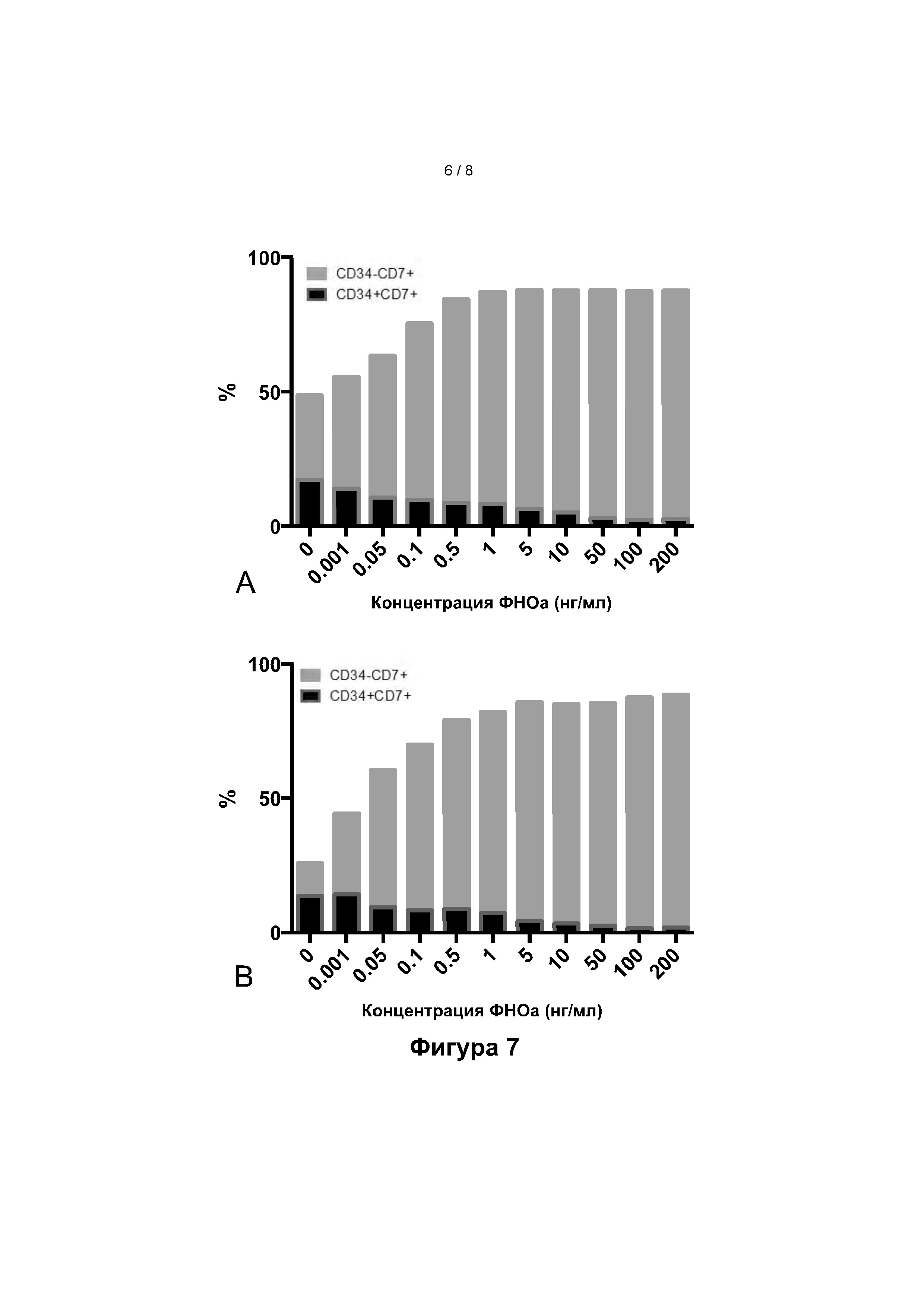
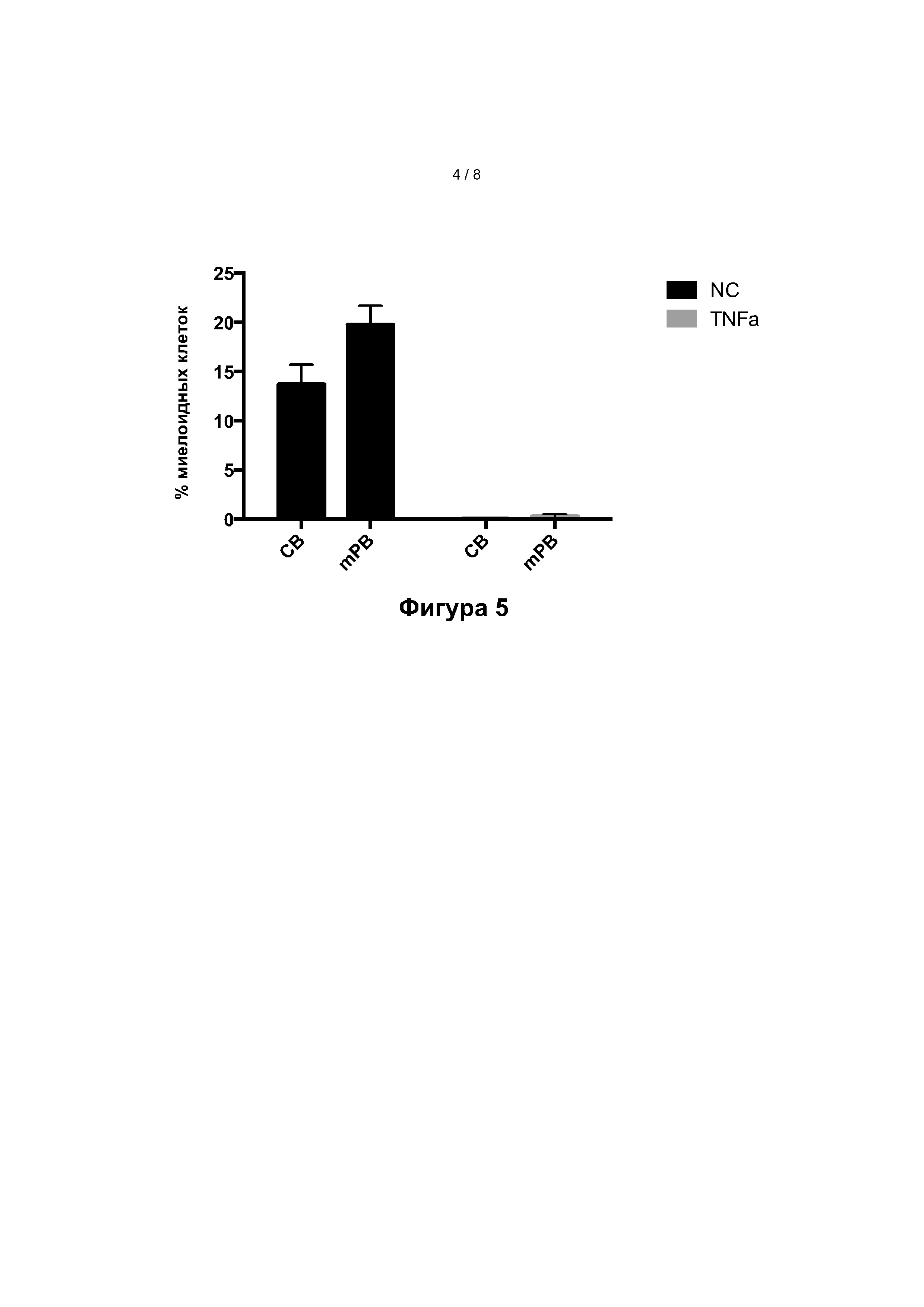
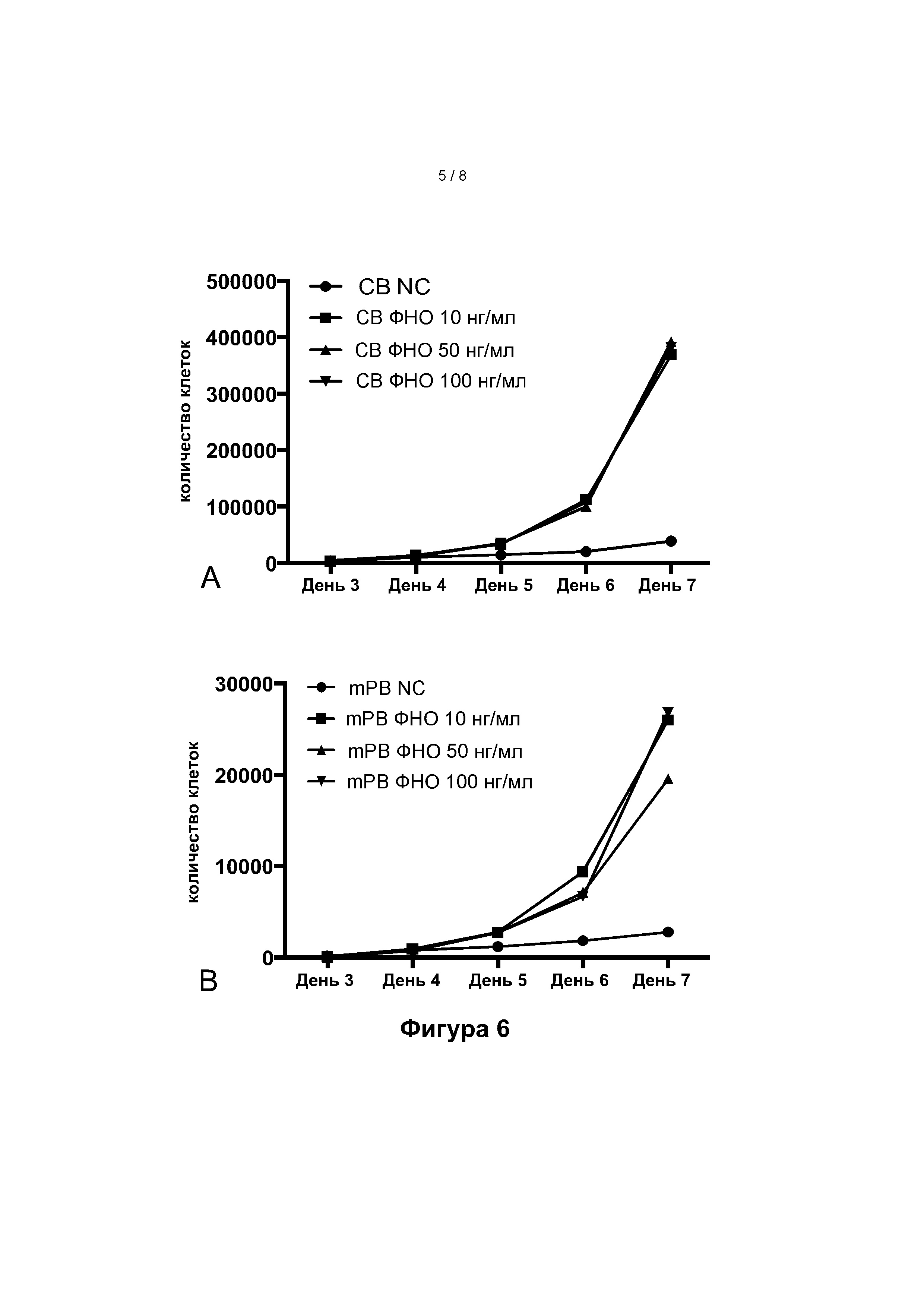
Фигура 5: Частота миелоидных клеток, полученных на 7-й день, из исходных CD34+ клеток клеток из пуповинной крови (ПК) или мобилизованной периферической крови (мПК), в присутствии (серые столбики) или в отсутствие (черные столбики) ФНО-альфа (среднее значение ± SEM). Фигура 6: Общее количество CD7+ клеток, полученных с 3 по 7 день в анализе доза-эффект ФНО-альфа из исходных CD34+ клеток из пуповинной крови (ПК, фигура 6.А) или мобилизованной периферической крови (мПК, фигура 6.В).
Фигура 7: Доля клеток CD34-CD7+ (серые столбики) по сравнению с CD34+ клетками CD7+ (черные столбики) в анализе доза-эффект ФНО-альфа из исходных CD34+ клеток из пуповинной крови (ПК, фигура 7.А) или мобилизованной периферической крови (мПК, рисунок 7.В). Фигура 8: Доля клеток в разных фазах клеточного цикла. А. ПК: клетки, дифференцированные из пуповинной крови; В. клетки, дифференцированные из мобилизованных клеток периферической крови. NC: без комплементов; ФНО-альфа: культивированные в присутствии ФНО-альфа (20 нг/мл); SR1: культивированные в присутствии SR1 (30 нг/мл).
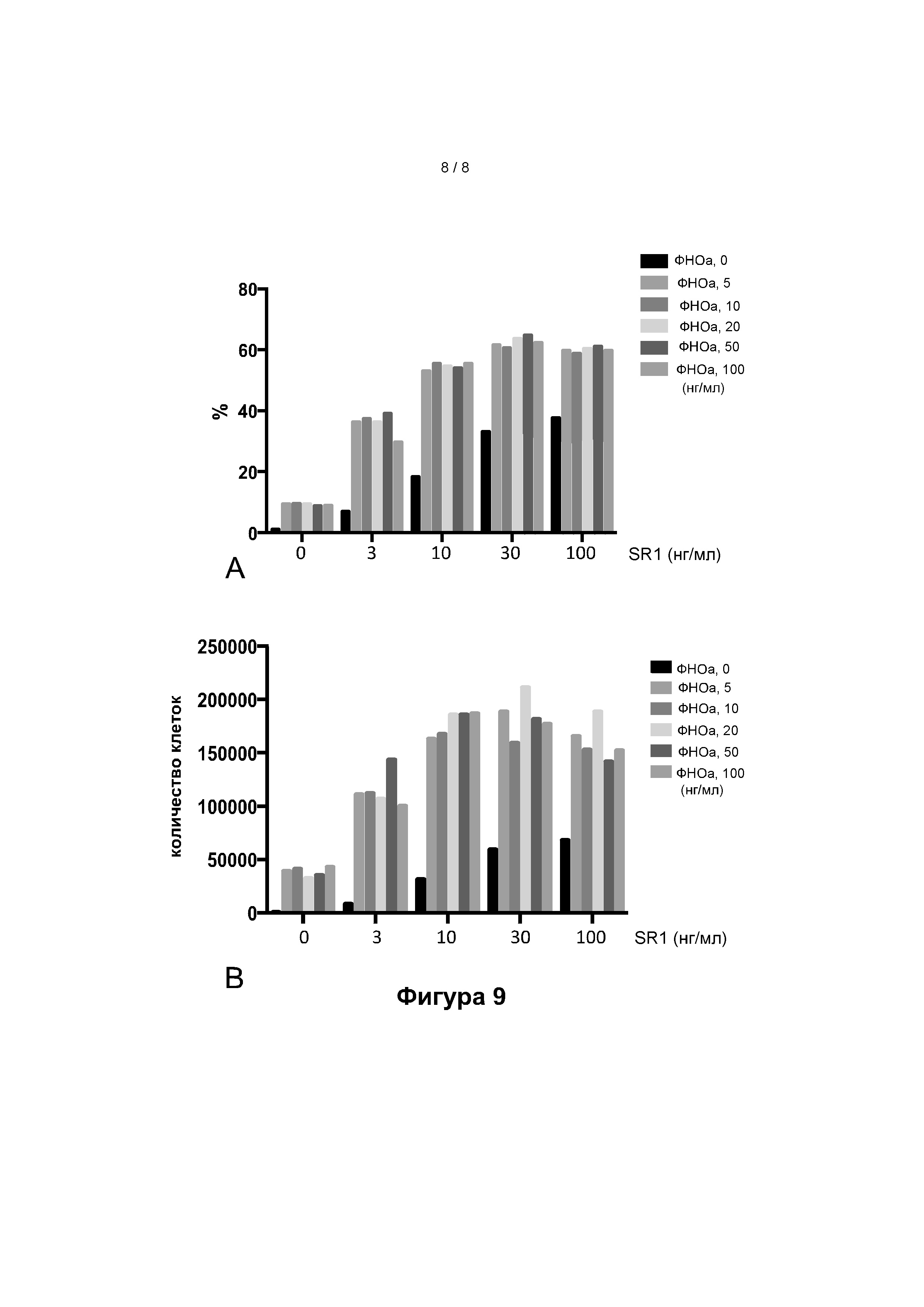
Фигура 9: процент (А) и общее количество (В) CD5+ клеток CD7+ , культивируемых из исходных CD34+ клеток из пуповинной крови в присутствии ФНО-альфа и/или SR1 в различных концентрациях, после 7 дней культивирования.
Примеры
Пример 1 - Материал и методы
Клетки человека
Образцы пуповинной крови, не пригодные для помещения в банк, использовали в исследовательских целях после получения информированного согласия матери ребенка. Образцы мобилизованной периферической крови (мПК) отбирали у здоровых доноров после мобилизации колониестимулирующим фактором гранулоцитов (G-CSF). Образцы непосредственно обогащались CD34+ клетками. Информированное согласие было дано каждым донором (Отделение биотерапии, госпиталь Неккер, Париж).
Воздействие на клеток-предшественников CD34+ лигандом Notch DL-4
CD34+ клетки из образцов ПК человека или мобилизованной периферической крови культивировали в 24-луночных планшетах или 6-луночных планшетах, которые были покрыты рекомбинантным фибронектином человека (Ретронектин, RetroNectin®, Clontech/Takara) и DL-4 (5 мкг/мл, PX'Therapeutics, Гренобль, Франция). Покрытие выполняли в течение 2 ч при 37°С, затем лунки, покрытые DL-4, блокировали бычьим сывороточным альбумином 2% (БСА) в фосфатно-солевом буфере (ФСБ) в течение 30 минут при 37°С и промывали фосфатно-солевым буфером. Культивирование начинали в концентрации 2×104 клеток/лунку или 1×105 клеток/лунку (для 24-луночных и 6-луночных планшетов соответственно) в среде α-МЕМ (Gibco, Life Technology), с добавлением NaHCO3 (7,5%). (Gibco, Life Technology), и 20% стандартной фетальной телячьей сыворотки (Hyclone, Thermo Fisher Scientific, Illkirch, France) и рекомбинантных человеческих цитокинов интерлейкина-7 (IL-7), Flt3-лиганда (Flt-3), фактора стволовых клеток (SCF) и тромбопоэтина (ТРО) (все в концентрации 100 нг/мл и все закуплено у PeproTech Inc, Роки Хилл, Нью-Джерси) с ФНО-α (R&D Systems, США) или без него. Через 3 дня культивирования клетки наполовину заменяли свежей средой. Культивируемые клетки анализировали методом флуоресцентно-активированной сортировки клеток (FACS) после 3 и 7 дней культивирования на DL-4 соответственно, чтобы исключить CD34-/CD7- миелоидные клетки из последующих анализов.
Анализ дифференцировки Т-клеток in vitro на клетках OP9/DL1
Т-лимфоидный потенциал нативных CD34+ клеток из ПК и ФНО-α-индуцированных предшественников Т-клеток, генерируемых при воздействии DL-4, оценивали в совместных культурах OP9/DL-1, как описано ранее (Six et al, Blood Cells Mol Dis. 2011 Jun 15;47(1):72-8 и Six J Exp Med. 2007 Dec 24;204(13):3085-93).
Количественные полимеразные цепные реакции в реальном времени с применением матрицы RT2 Profiler
Клетки CD7+ сортировали на цитометре Ariall после 7 дней культивирования. Общую РНК отсортированных клеточных фракций из дня 3 и дня 7 выделяли с помощью набора Rneasy Micro Kit (Qiagen, Куртабеф, Франция). Анализы на ПЦР-чипах RT2 Profiler выполняли в соответствии с протоколом, подробно описанным в Руководстве по ПЦР-чипам RT2 Profiler (SA Biosciences, Фредерик, Мэриленд).
Анализ проточной цитометрией и сортировка клеток
Моноклональные антитела против CD34 (АС136), CD3 (BW264/56), CD45 (5В1) человека были приобретены у Miltenyi Biotech (Бергиш Гладбах, Германия), a CD4 (SK4), CD7 (М-Т701), CD25 (М-А251), 7-аминоактиномицин D (7AAD) - у BD Biosciences (Сан-Хосе, Калифорния). Антитело против CD8 человека (RPAT8) было приобретено у Sony Biotechnology (Сан-Хосе, США). Антитело против Ctip2 (Bcl11b) человека было приобретено у Abcam (Кембридж, Великобритания).
Клетки человека окрашивали и анализировали с применением анализатора Gallios (Beckman Coulter, Крефельд, Германия). Клетки от ксеногенных реципиентов анализировали на приборе MACSQuant® (Miltenyi Biotech, Бергиш Гладбах, Германия). Данные были проанализированы с применением программного обеспечения FlowJo (Treestar, Ашленд, Орегон) после отбора жизнеспособных 7AAD-негативных клеток. Субпопуляции клеток были отсортированы в системе ARIA II.
Анализы пролиферации клеток
Для анализов пролиферации клеток CD34+ клетки из ПК и мПК метили с применением набора CellTraceTM CFSE (Life Technologies, Карлсбад, Калифорния) перед культивированием с DL-4 и ФНО-альфа (Life Technologies). Интенсивность окрашивания клеток измеряли перед культивированием ежедневно с 3 по 7 день. CFSE-положительные клетки анализировали на цитометре Gallios (Beckman Coulter).
Анализы клеточного цикла
Для анализа клеточного цикла клетки окрашивали Hoechst33342 (Life technology) и Ki67-PC5 (BD Bioscience) после фиксирования реагентом Fixative из набора PerFix-nc (Beckman Coulter) при комнатной температуре в течение 15 минут и добавляли реагент для пермеабилизации. Данные были проанализированы с применением программного обеспечения FlowJo (версия 10.2, Treestar, Ашленд, Орегон) после отбора жизнеспособных 7AAD-негативных клеток.
Адоптивный перенос полученных in vitro предшественников Т-клеток, полученных из HSPC взрослых, в новорожденных мышей NSG
Все эксперименты и процедуры на животных проводились в соответствии с правилами Министерства сельского хозяйства Франции по экспериментам на животных. Инъекция созданных in vitro человеческих предшественников Т-клеток мышам NSG была одобрена Министерством высшего образования и исследований (APAFIS 2101-2015090411495178v4).
Мышей NSG (NOD-Scid(IL2Rgnull)) (полученных из Jackson Laboratory, Бар-Харбор, Мэн, http://www.jax.org) содержали в стерильных условиях. Потомство, полученное из мПК CD34+ HSPC в 7-дневных культурах DL-4 с или без ФНО-α (3×105 или 1×106), инъецировали внутрипеченочно новорожденным NSG-мышам (0-4 дня). Контрольным мышам вводили 3×105 некультивированных клеток CD34+ из мПК или 100 мкл ФСБ.
Средние значения частоты приживления трансплантата у NSG-мышей определяли через 4-12 недель после трансплантации. Анализ методом проточной цитометрии выполняли на свежих клетках, собранных из бедренной кости, тимуса, периферической крови и селезенки. Клетки обрабатывали 1х буфером для лизиса эритроцитов (Biolegend, США) и промывали перед окрашиванием антителами.
Анализ разнообразия рецепторов Т-клеток
Анализ реаранжировки гена TCR проводили в двух повторностях и на двух независимо очищенных субпопуляциях (показано среднее значение).
Количественное определение TCR-δ (D δ2-D δ3, D δ2-J δ1 и D δ3-J δ1) проводили с применением перечисленных наборов праймеров и зондов.
Следующие праймеры и зонд были использованы для реаранжировок D δ2-D δ3:
D δ2, 5'-CAAGGAAAGGGAAAAAGGAAGAA-3' (SEQ ID NO: 9);
D δ3, 5'-TTGCCCCTGCAGTTTTTGTAC-3' (SEQ ID NO: 10);
и зонд D'3, 5'-ATACGCACAGTGCTACAAAACCTACAGAGACCT-3' (SEQ ID NO: 11).
Следующие праймеры и зонд использовали для реаранжировок D δ2-J δ1:
D δ2, 5'-AGCGGGTGGTGATGGCAAAGT-3' (SEQ ID NO: 12);
J δ1, 5'-TTAGATGGAGGATGCCTTAACCTTA-3' (SEQ ID NO: 13);
и зонд J δ1, 5'-CCCGTGTGACTGTGGAACCAAGTAAGTAACTC-3' (SEQ ID NO: 14)
Следующие праймеры и зонд использовали для реаранжировок D δ3-J δ1:
D δ3, 5'-GACTTGGAGAAAACATCTGGTTCTG-3' (SEQ ID NO: 15);
Праймер J δ1 и зонд J δ1.
Анализ реаранжировок TCR методом мультиплексной флуоресцентной ПЦР проводили путем разделения меченных флуорохромом одноцепочечных ПЦР-продуктов в капиллярном секвенирующем полимере и детектировали с помощью автоматического лазерного сканирования.
Анализы на апоптоз
Клетки промывали холодным ФСБ и ресуспендировали в связывающем буфере в концентрации 1 млн клеток/мл. После добавления 5 мкл аннексина V-PE (BD Bioscience) и 2 мкл 7AAD клетки инкубировали в темноте при комнатной температуре в течение 15 мин. Затем клетки промывали 500 мкл связывающего буфера и ресуспендировали в 100 мкл связывающего буфера для выполнения анализа в течение 1 часа.
Пример 2. Улучшение размножения и дифференцировки предшественников Т-клеток
На фигуре 1 показано, что при культивировании CD34+ клеток с DL-4, добавление ФНО-альфа в среду для культивирования клеток позволяет увеличить общее количество клеток, полученных на 7-й день, 10-кратно по сравнению с культурой без ФНО-альфа, при использовании в качестве исходных CD34+ клеток, извлеченных из пуповинной крови (рисунок 1.А), либо из РВ (рисунок 1.В).
На фигуре 2 показано, что добавление ФНО-альфа в среду для культивирования клеток позволяет увеличить число CD7+ клеток в 20-40 раз, при использовании в качестве исходных CD34+ клеток, извлеченных из пуповинной крови (рисунок 2.А), либо из РВ (рисунок 2.В). Это улучшение особенно велико для популяции клеток CD34-CD7+.
Пример 3: Анализ поверхностных маркеров предшественников Т-клеток
Поверхностные маркеры, присутствующие на поверхности клеток, полученных после 7 дней культивирования, определяли проточной цитометрией.
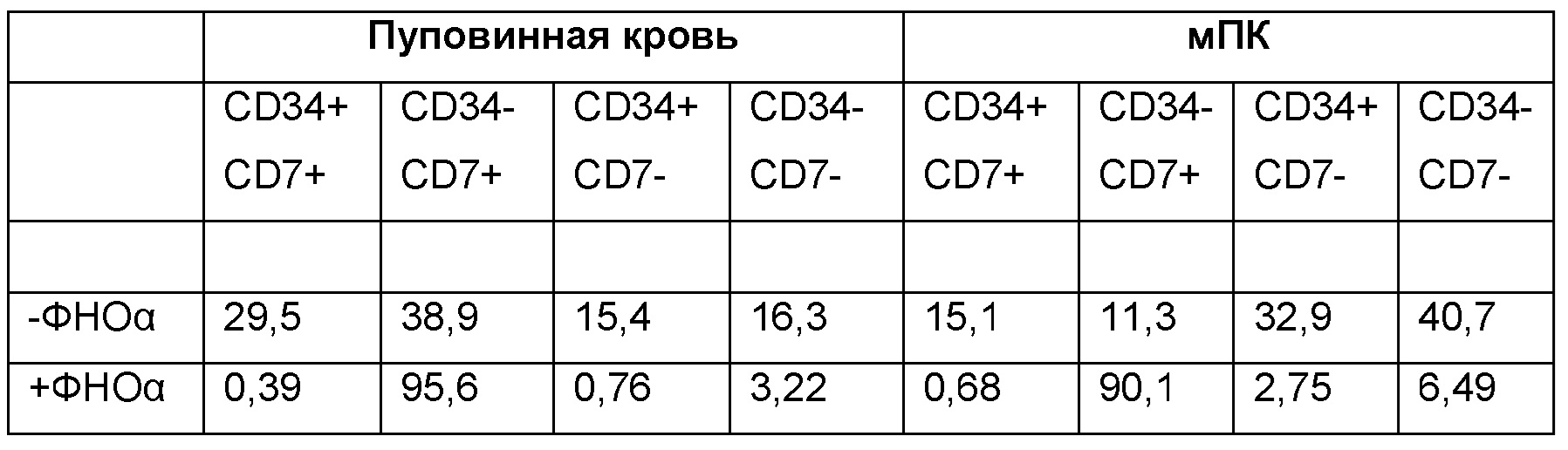
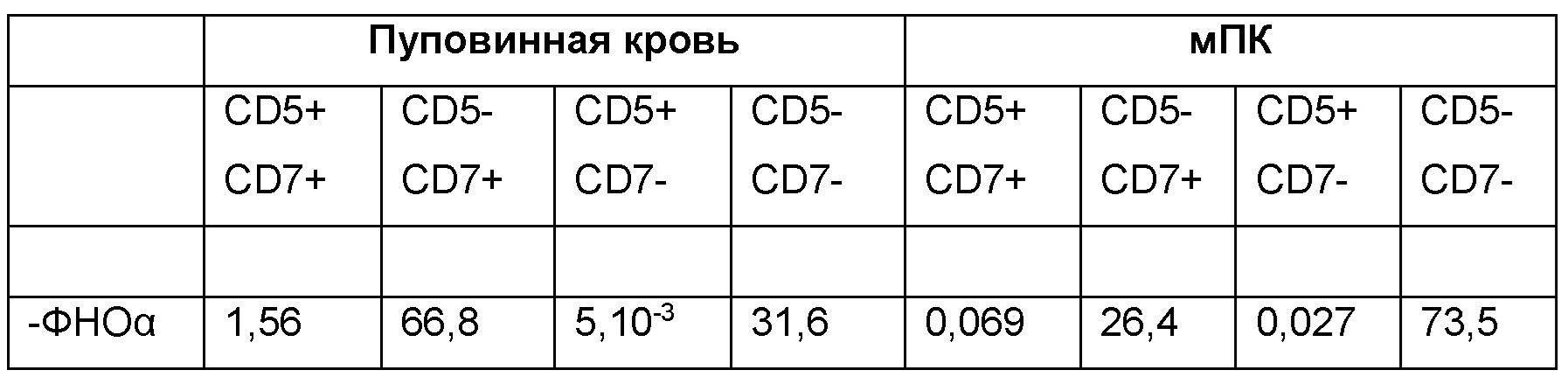
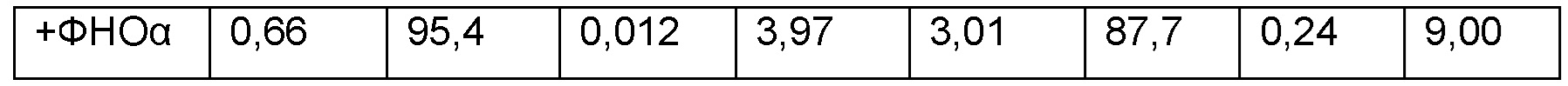
Эти таблицы показывают, что добавление ФНО-альфа приводит к увеличению доли CD7+ клеток без существенного увеличения доли.
После 7-дневного культивирования HSPC дифференцируются в предшественники Т-клеток CD34-CD7+ CD5-.
Поверхностные маркеры, присутствующие на поверхности клеток, полученные после 10 дней культивирования, также определяли с помощью проточной цитометрии.
Экспрессии CD1a обнаружено не было (данные не показаны).
Была изучена кинетика модификации поверхностных маркеров, и было обнаружено, что присутствие ФНО-альфа в культуральной среде увеличивает долю CD7+ со дня 4 до дня 7 (данные не показаны).
Пример 4: Реаранжировка Т-клеточных рецепторов
Предшественники Т-клеток DL-4 не проявляют каких-либо признаков реаранжировки TCR с или без ФНО-альфа или SR1 после 7 дней культивирования (данные не показаны).
Был проведен специфический анализ реаранжировки:
Результаты анализа реаранжировок TCR-дельта
Обнаружение реаранжировок Dδ2-Dδ3 в CB-NC и CB-SR1. Других реаранжировок TCR-дельта обнаружено не было. Результаты оказались в соответствии с количественной оценкой RQ-PCR (Количественная ПЦР в реальном времени)
Результаты анализа реаранжировок TCR-гамма
Никаких реаранжировок TCR-гамма обнаружено не было.
Результаты анализа реаранжировок TCR-бета
Никаких реаранжировок TCR-бета обнаружено не было.
Пример 5: Т-коммитирование ФНОα-индуцированных предшественников Т-клеток
Bcl11b является важным транскрипционным фактором, включаемым исключительно после коммитирования Т-клеток и абсолютно необходимым для дифференцировки Т-клеток.
Внутриклеточное окрашивание на предшественниках Т-клеток, культивированных с ФНО-альфа, показало положительную экспрессию Bcl11b для CD34+ клеток, полученных как из пуповинной крови, так и из мПК. На фиг. 3 показано, что ФНО-альфа увеличивает долю общих клеток, экспрессирующих транскрипционный фактор Bcl11b. При культивировании с ФНО-альфа доля экспрессирующих Bcl11b клеток увеличивалась.
Пример 6: Исследование дифференцировки по другим линиям клеток
Было оценено наличие других маркеров клеточной поверхности (CD14 и CD33), специфичных для других линий.
На фигуре 5 показано, что культивирование в присутствии ФНО-альфа снижает количество таких клеток ниже уровня обнаружения, тогда как при культивировании CD34+ клеток без ФНО-альфа их доля составляет менее 22%.
Пример 7: ФНО-альфа уменьшает апоптоз клеток
Были изучены маркеры апоптоза (7 AAD и аннексин 5).
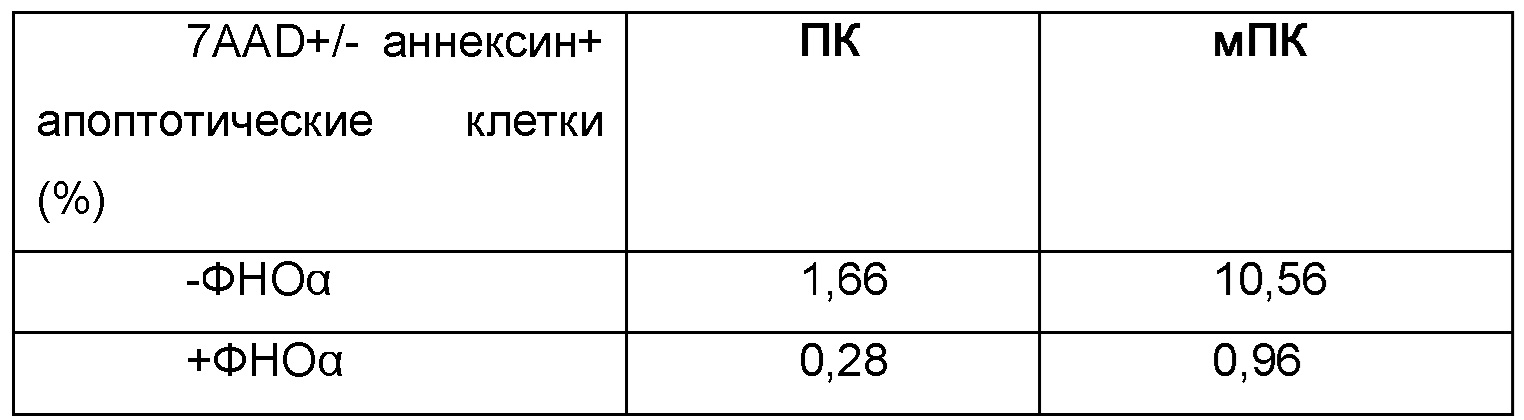
Эта таблица показывает, что культивирование в присутствии ФНО-альфа уменьшает присутствие маркеров апоптоза. Это особенно очевидно для мПК.
Пример 8. Анализ доза-эффект ФНО-альфа
Были использованы различные дозы ФНО-альфа.
На фигуре 6 показано, что ФНОа может увеличивать количество CD7+ клеток во время культивирования при концентрации более 10 нг/мл, либо для клеток из ПК (фигура 6.А), либо для клеток из мПК (фигура 6.В).
Кинетика дозозависимости показала, что ФНО-альфа увеличивает дифференцировку Т-клеток только после 4 дней культивирования в DL-4. Никакой разницы между концентрациями 10, 50 и 100 нг/мл обнаружено не было (не показано).
Для определения порога эффективной концентрации был проведен анализ более низких концентраций (0,01-10 нг/мл).
Было обнаружено, что влияние ФНО-альфа на дифференцировку Т-клеток ПК и мПК (процентное содержание клеток CD34-CD7+) зависит от концентрации при низкой концентрации (фиг. 7). Общее количество CD7+ предшественников Т-клеток не различалось в диапазоне концентраций от 5 нг/мл до 100 нг/мл.
Пример 9: Анализ пролиферации во время культивирования
Было обнаружено, что ФНО-альфа увеличивает пролиферацию CD34+ CD7+ предшественников Т-клеток со дня 3 в культуре с DL-4 по сравнению с условиями культивирования без ФНО-альфа (данные не показаны).
Пример 10: Синергия между ФНО-альфа и лигандом Notch
На рисунке 4 показано, что без DL4 ни клетки, ни из ПК, ни из мПК, не могли дифференцироваться в предшественники CD7+ Т-клеток. Даже добавление среды с ФНО-альфа не смогло изменить эту ситуацию.
Когда в среде присутствуют как ФНО-альфа, так и лиганд Notch, наблюдаемый эффект очень высок. Таким образом, по-видимому существует синергия между этими двумя соединениями и влияние ФНО-альфа на дифференцировку Т-клеток, вероятно, зависит от присутствия Notch.
Пример 11. Добавление ФНО-альфа увеличивает пролиферацию CD7+ предшественников
Через 7 дней культивирования в присутствии ФНО-альфа субпопуляции CD34+ CD7-, CD34+ CD7+ и CD34-CD7+ сортировали, окрашивали CFSE (карбоксифлуоресцеин сукцинимидиловый эфир) и следили за разбавлением CFSE (суррогатный маркер пролиферации клеток) с 8 по 10 день.
Только CD34+ клетки CD7+ и CD34-CD7+ демонстрируют повышенную пролиферацию при культивировании с ФНО-альфа. (Данные не показаны)
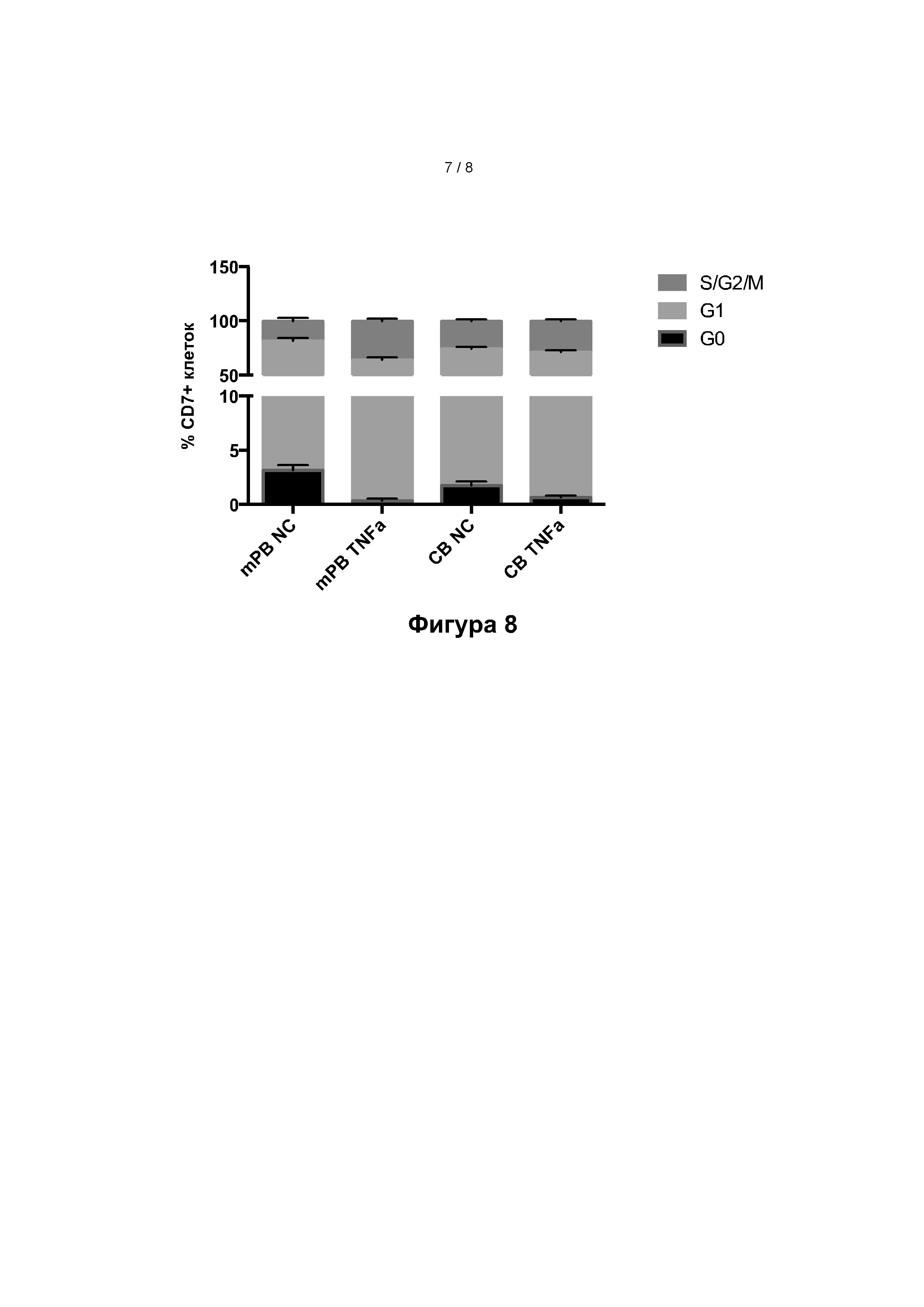
Пример 12: Анализ клеточного цикла
Был проведен анализ клеточного цикла. Было обнаружено, что из фазы G0 в присутствии ФНО-альфа выходило больше клеток в случае CD7+ предшественников, полученных как из ПК, так и из мПК (фигура 8).
Пример 13: Сочетание SR1 и ФНОа
SR1 ускоряет дифференцировку Т-клеток, о чем свидетельствует присутствие CD5+ CD7+ клеток на 7-й день. Количество CD5+ CD7+ клеток увеличивается под воздействием как ФНО-альфа, так и SR1 (фигура 9).
Пример 14: Данные in vivo
Предшественники Т-клеток, индуцированные в присутствии ФНО-альфа, могут в значительной степени ускорять восстановление Т-линии in vivo.
Действительно, через 4 недели после трансплантации у мышей-реципиентов, которым инъецировали мПК-предшественники Т-клеток, полученные в присутствии ФНО-альфа, наблюдали тимус большего размера, чем у мышей, которым инъецировали мПК-предшественники Т-клеток, полученные без ФНО-альфа. Предшественники Т-клеток, индуцированные в присутствии ФНО-альфа, могут дифференцироваться в активированные Т-клетки TCRαβ в течение 4 недель in vivo. (Данные не показаны)
Таким образом, добавление ФНО-альфа с 0-го дня в систему культивирования, содержащую DL4, приводит к увеличению количества предшественников Т-клеток (определяемых поверхностной экспрессией CD7) в 40 раз для HSPC из мПК и в 20 раз для HSPC из ПК в день 7.
Предшественники CD7+ Т-клеток, полученные как из ПК, так и из мПК, были в основном CD34- и были CD1a-отрицательными. Также клетки были в основном CD5-отрицательными.
Они экспрессировали Bcl11b, который является важной молекулой тонкой настройки для Т-коммитирования и дальнейшей дифференцировки Т-клеток.
У этих клеток не было никаких признаков реаранжировки Т-клеточный рецепторов.
Их фенотип и молекулярные характеристики были сходны с таковыми у предшественников CD34-CD7+ Т-клеток, полученных без ФНО-альфа.
Что касается механизмов, участвующих в активности ФНО-альфа, ФНО-альфа уменьшает экспрессию маркеров апоптоза и увеличивает пролиферацию клеток во время культивирования. Он также подавляет выработку миелоидных клеток.
Применение ФНО-альфа в системе культивирования, содержащей DL4, в огромной степени увеличивает количество предшественников Т-клеток, производимых из HSPC как взрослого человека, так и из пуповинной крови. Таким образом, его применение может преодолеть трудность получения больших количеств предшественников Т-клеток из HSPC взрослого человека. Оно также может уменьшить исходное количество HSPC, необходимое в будущих клинических испытаниях, и количество реагентов GMP-качества и других необходимых реагентов, тем самым уменьшая затраты на производство этих предшественников Т-клеток.